JP4283989B2 - 光学式二酸化炭素センサ - Google Patents
光学式二酸化炭素センサ Download PDFInfo
- Publication number
- JP4283989B2 JP4283989B2 JP2000510020A JP2000510020A JP4283989B2 JP 4283989 B2 JP4283989 B2 JP 4283989B2 JP 2000510020 A JP2000510020 A JP 2000510020A JP 2000510020 A JP2000510020 A JP 2000510020A JP 4283989 B2 JP4283989 B2 JP 4283989B2
- Authority
- JP
- Japan
- Prior art keywords
- alkyl
- group
- sensor according
- sensor
- photosensitive layer
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- CURLTUGMZLYLDI-UHFFFAOYSA-N Carbon dioxide Chemical compound O=C=O CURLTUGMZLYLDI-UHFFFAOYSA-N 0.000 title claims abstract description 28
- 239000001569 carbon dioxide Substances 0.000 title claims abstract description 14
- 229910002092 carbon dioxide Inorganic materials 0.000 title claims abstract description 14
- 230000003287 optical effect Effects 0.000 title claims abstract description 11
- 229920000642 polymer Polymers 0.000 claims abstract description 31
- 239000007850 fluorescent dye Substances 0.000 claims abstract description 23
- 229940031826 phenolate Drugs 0.000 claims abstract description 16
- 239000007788 liquid Substances 0.000 claims abstract description 8
- 125000000129 anionic group Chemical group 0.000 claims abstract description 5
- -1 polyethylene Polymers 0.000 claims description 43
- 125000000217 alkyl group Chemical group 0.000 claims description 33
- 238000005259 measurement Methods 0.000 claims description 21
- 239000001257 hydrogen Substances 0.000 claims description 13
- 229910052739 hydrogen Inorganic materials 0.000 claims description 13
- 238000000034 method Methods 0.000 claims description 13
- 125000004432 carbon atom Chemical group C* 0.000 claims description 11
- 150000002431 hydrogen Chemical class 0.000 claims description 10
- 239000000523 sample Substances 0.000 claims description 10
- 239000000463 material Substances 0.000 claims description 9
- 239000001856 Ethyl cellulose Substances 0.000 claims description 8
- ZZSNKZQZMQGXPY-UHFFFAOYSA-N Ethyl cellulose Chemical compound CCOCC1OC(OC)C(OCC)C(OCC)C1OC1C(O)C(O)C(OC)C(CO)O1 ZZSNKZQZMQGXPY-UHFFFAOYSA-N 0.000 claims description 8
- 239000004793 Polystyrene Substances 0.000 claims description 8
- 229920001249 ethyl cellulose Polymers 0.000 claims description 8
- 235000019325 ethyl cellulose Nutrition 0.000 claims description 8
- 239000000203 mixture Substances 0.000 claims description 8
- 229920002223 polystyrene Polymers 0.000 claims description 8
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims description 7
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 claims description 6
- 229910052757 nitrogen Inorganic materials 0.000 claims description 5
- IJGRMHOSHXDMSA-UHFFFAOYSA-N nitrogen Substances N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 claims description 5
- WSSSPWUEQFSQQG-UHFFFAOYSA-N 4-methyl-1-pentene Chemical compound CC(C)CC=C WSSSPWUEQFSQQG-UHFFFAOYSA-N 0.000 claims description 4
- 239000012190 activator Substances 0.000 claims description 4
- 229920000058 polyacrylate Polymers 0.000 claims description 4
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 claims description 3
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 claims description 3
- 125000001453 quaternary ammonium group Chemical group 0.000 claims description 3
- NLHHRLWOUZZQLW-UHFFFAOYSA-N Acrylonitrile Chemical compound C=CC#N NLHHRLWOUZZQLW-UHFFFAOYSA-N 0.000 claims description 2
- 229930040373 Paraformaldehyde Natural products 0.000 claims description 2
- 239000004698 Polyethylene Substances 0.000 claims description 2
- 239000004743 Polypropylene Substances 0.000 claims description 2
- 229920006243 acrylic copolymer Polymers 0.000 claims description 2
- 229920002678 cellulose Polymers 0.000 claims description 2
- 239000001913 cellulose Substances 0.000 claims description 2
- 229920001577 copolymer Polymers 0.000 claims description 2
- 150000001993 dienes Chemical class 0.000 claims description 2
- 239000004417 polycarbonate Substances 0.000 claims description 2
- 229920000515 polycarbonate Polymers 0.000 claims description 2
- 229920000728 polyester Polymers 0.000 claims description 2
- 229920000573 polyethylene Polymers 0.000 claims description 2
- 229920001195 polyisoprene Polymers 0.000 claims description 2
- 229920006324 polyoxymethylene Polymers 0.000 claims description 2
- 229920001155 polypropylene Polymers 0.000 claims description 2
- 229920001343 polytetrafluoroethylene Polymers 0.000 claims description 2
- 239000004810 polytetrafluoroethylene Substances 0.000 claims description 2
- 229920002635 polyurethane Polymers 0.000 claims description 2
- 239000004814 polyurethane Substances 0.000 claims description 2
- 229920002689 polyvinyl acetate Polymers 0.000 claims description 2
- 239000011118 polyvinyl acetate Substances 0.000 claims description 2
- 239000004800 polyvinyl chloride Substances 0.000 claims description 2
- 229920000915 polyvinyl chloride Polymers 0.000 claims description 2
- 229920002994 synthetic fiber Polymers 0.000 claims description 2
- 239000012780 transparent material Substances 0.000 claims description 2
- 239000000126 substance Substances 0.000 abstract description 10
- ISWSIDIOOBJBQZ-UHFFFAOYSA-M phenolate Chemical compound [O-]C1=CC=CC=C1 ISWSIDIOOBJBQZ-UHFFFAOYSA-M 0.000 abstract description 2
- 239000000243 solution Substances 0.000 description 29
- 229910052736 halogen Inorganic materials 0.000 description 28
- 150000002367 halogens Chemical class 0.000 description 28
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 26
- 150000004707 phenolate Chemical class 0.000 description 23
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 23
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 21
- 125000004093 cyano group Chemical group *C#N 0.000 description 21
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 20
- 125000003118 aryl group Chemical group 0.000 description 19
- 150000001875 compounds Chemical class 0.000 description 19
- 229920006395 saturated elastomer Polymers 0.000 description 18
- 239000011550 stock solution Substances 0.000 description 14
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 13
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 13
- 239000002904 solvent Substances 0.000 description 13
- 125000004453 alkoxycarbonyl group Chemical group 0.000 description 10
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 10
- 125000003545 alkoxy group Chemical group 0.000 description 9
- 125000003710 aryl alkyl group Chemical group 0.000 description 9
- 238000004519 manufacturing process Methods 0.000 description 9
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 description 8
- 239000011248 coating agent Substances 0.000 description 7
- 238000000576 coating method Methods 0.000 description 7
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 7
- 125000000094 2-phenylethyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])C([H])([H])* 0.000 description 6
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 6
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 6
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 6
- 125000000623 heterocyclic group Chemical group 0.000 description 6
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 6
- 150000004010 onium ions Chemical group 0.000 description 6
- VDZOOKBUILJEDG-UHFFFAOYSA-M tetrabutylammonium hydroxide Chemical compound [OH-].CCCC[N+](CCCC)(CCCC)CCCC VDZOOKBUILJEDG-UHFFFAOYSA-M 0.000 description 6
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 5
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 5
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 5
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 5
- 125000002914 sec-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 5
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 5
- KSXCJYZTFRJZMD-UHFFFAOYSA-M 3-(3,5-diphenylpentyl)phenolate;tetrabutylazanium Chemical compound CCCC[N+](CCCC)(CCCC)CCCC.[O-]C1=CC=CC(CCC(CCC=2C=CC=CC=2)C=2C=CC=CC=2)=C1 KSXCJYZTFRJZMD-UHFFFAOYSA-M 0.000 description 4
- 125000003342 alkenyl group Chemical group 0.000 description 4
- 125000000304 alkynyl group Chemical group 0.000 description 4
- 230000015556 catabolic process Effects 0.000 description 4
- 239000006059 cover glass Substances 0.000 description 4
- 238000006731 degradation reaction Methods 0.000 description 4
- 150000004679 hydroxides Chemical group 0.000 description 4
- 239000000047 product Substances 0.000 description 4
- 239000011541 reaction mixture Substances 0.000 description 4
- 238000004528 spin coating Methods 0.000 description 4
- 125000000547 substituted alkyl group Chemical group 0.000 description 4
- 125000004343 1-phenylethyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])(*)C([H])([H])[H] 0.000 description 3
- ZWEHNKRNPOVVGH-UHFFFAOYSA-N 2-Butanone Chemical compound CCC(C)=O ZWEHNKRNPOVVGH-UHFFFAOYSA-N 0.000 description 3
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 3
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 3
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 3
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 3
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N Phenol Chemical compound OC1=CC=CC=C1 ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 description 3
- 239000000654 additive Substances 0.000 description 3
- 239000012876 carrier material Substances 0.000 description 3
- 239000000460 chlorine Substances 0.000 description 3
- 229910052801 chlorine Inorganic materials 0.000 description 3
- 238000001704 evaporation Methods 0.000 description 3
- 150000002500 ions Chemical class 0.000 description 3
- 125000001570 methylene group Chemical group [H]C([H])([*:1])[*:2] 0.000 description 3
- 125000003884 phenylalkyl group Chemical group 0.000 description 3
- 239000011780 sodium chloride Substances 0.000 description 3
- 125000001424 substituent group Chemical group 0.000 description 3
- 125000003107 substituted aryl group Chemical group 0.000 description 3
- VAOBNUXIUILSCN-UHFFFAOYSA-M tetrabutylazanium;phenoxide Chemical compound [O-]C1=CC=CC=C1.CCCC[N+](CCCC)(CCCC)CCCC VAOBNUXIUILSCN-UHFFFAOYSA-M 0.000 description 3
- IMFACGCPASFAPR-UHFFFAOYSA-N tributylamine Chemical compound CCCCN(CCCC)CCCC IMFACGCPASFAPR-UHFFFAOYSA-N 0.000 description 3
- VXNZUUAINFGPBY-UHFFFAOYSA-N 1-Butene Chemical compound CCC=C VXNZUUAINFGPBY-UHFFFAOYSA-N 0.000 description 2
- 238000005160 1H NMR spectroscopy Methods 0.000 description 2
- WMPDAIZRQDCGFH-UHFFFAOYSA-N 3-methoxybenzaldehyde Chemical compound COC1=CC=CC(C=O)=C1 WMPDAIZRQDCGFH-UHFFFAOYSA-N 0.000 description 2
- OBJOZRVSMLPASY-UHFFFAOYSA-N 8-hydroxypyrene-1,3,6-trisulfonic acid Chemical compound C1=C2C(O)=CC(S(O)(=O)=O)=C(C=C3)C2=C2C3=C(S(O)(=O)=O)C=C(S(O)(=O)=O)C2=C1 OBJOZRVSMLPASY-UHFFFAOYSA-N 0.000 description 2
- KWOLFJPFCHCOCG-UHFFFAOYSA-N Acetophenone Chemical compound CC(=O)C1=CC=CC=C1 KWOLFJPFCHCOCG-UHFFFAOYSA-N 0.000 description 2
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 2
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 2
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 description 2
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 2
- MZRVEZGGRBJDDB-UHFFFAOYSA-N N-Butyllithium Chemical compound [Li]CCCC MZRVEZGGRBJDDB-UHFFFAOYSA-N 0.000 description 2
- 238000005481 NMR spectroscopy Methods 0.000 description 2
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 2
- 239000003570 air Substances 0.000 description 2
- 239000007864 aqueous solution Substances 0.000 description 2
- 229910052785 arsenic Chemical group 0.000 description 2
- 230000002238 attenuated effect Effects 0.000 description 2
- ILAHWRKJUDSMFH-UHFFFAOYSA-N boron tribromide Chemical compound BrB(Br)Br ILAHWRKJUDSMFH-UHFFFAOYSA-N 0.000 description 2
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 2
- 229910052794 bromium Inorganic materials 0.000 description 2
- 238000006243 chemical reaction Methods 0.000 description 2
- 239000012043 crude product Substances 0.000 description 2
- 239000000975 dye Substances 0.000 description 2
- 230000008030 elimination Effects 0.000 description 2
- 238000003379 elimination reaction Methods 0.000 description 2
- 239000003480 eluent Substances 0.000 description 2
- 230000008020 evaporation Effects 0.000 description 2
- 239000011737 fluorine Substances 0.000 description 2
- 229910052731 fluorine Inorganic materials 0.000 description 2
- 239000011521 glass Substances 0.000 description 2
- SHFJWMWCIHQNCP-UHFFFAOYSA-M hydron;tetrabutylazanium;sulfate Chemical compound OS([O-])(=O)=O.CCCC[N+](CCCC)(CCCC)CCCC SHFJWMWCIHQNCP-UHFFFAOYSA-M 0.000 description 2
- 229920001600 hydrophobic polymer Polymers 0.000 description 2
- 239000003068 molecular probe Substances 0.000 description 2
- 125000001624 naphthyl group Chemical group 0.000 description 2
- 238000010534 nucleophilic substitution reaction Methods 0.000 description 2
- 239000012074 organic phase Substances 0.000 description 2
- 229910052698 phosphorus Inorganic materials 0.000 description 2
- 239000000843 powder Substances 0.000 description 2
- 238000002360 preparation method Methods 0.000 description 2
- BDERNNFJNOPAEC-UHFFFAOYSA-N propan-1-ol Chemical compound CCCO BDERNNFJNOPAEC-UHFFFAOYSA-N 0.000 description 2
- 150000003839 salts Chemical class 0.000 description 2
- 230000035945 sensitivity Effects 0.000 description 2
- 239000000741 silica gel Substances 0.000 description 2
- 229910002027 silica gel Inorganic materials 0.000 description 2
- NDVLTYZPCACLMA-UHFFFAOYSA-N silver oxide Chemical compound [O-2].[Ag+].[Ag+] NDVLTYZPCACLMA-UHFFFAOYSA-N 0.000 description 2
- RKHXQBLJXBGEKF-UHFFFAOYSA-M tetrabutylphosphanium;bromide Chemical compound [Br-].CCCC[P+](CCCC)(CCCC)CCCC RKHXQBLJXBGEKF-UHFFFAOYSA-M 0.000 description 2
- WGTYBPLFGIVFAS-UHFFFAOYSA-M tetramethylammonium hydroxide Chemical compound [OH-].C[N+](C)(C)C WGTYBPLFGIVFAS-UHFFFAOYSA-M 0.000 description 2
- RIOQSEWOXXDEQQ-UHFFFAOYSA-N triphenylphosphine Chemical compound C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 RIOQSEWOXXDEQQ-UHFFFAOYSA-N 0.000 description 2
- HRXKRNGNAMMEHJ-UHFFFAOYSA-K trisodium citrate Chemical compound [Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O HRXKRNGNAMMEHJ-UHFFFAOYSA-K 0.000 description 2
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 1
- CXVOIIMJZFREMM-UHFFFAOYSA-N 1-(2-nitrophenoxy)octane Chemical compound CCCCCCCCOC1=CC=CC=C1[N+]([O-])=O CXVOIIMJZFREMM-UHFFFAOYSA-N 0.000 description 1
- AZUYLZMQTIKGSC-UHFFFAOYSA-N 1-[6-[4-(5-chloro-6-methyl-1H-indazol-4-yl)-5-methyl-3-(1-methylindazol-5-yl)pyrazol-1-yl]-2-azaspiro[3.3]heptan-2-yl]prop-2-en-1-one Chemical compound ClC=1C(=C2C=NNC2=CC=1C)C=1C(=NN(C=1C)C1CC2(CN(C2)C(C=C)=O)C1)C=1C=C2C=NN(C2=CC=1)C AZUYLZMQTIKGSC-UHFFFAOYSA-N 0.000 description 1
- 125000005939 1-azabicyclo[2.2.1]heptyl group Chemical group 0.000 description 1
- 125000004973 1-butenyl group Chemical group C(=CCC)* 0.000 description 1
- ZYVYEJXMYBUCMN-UHFFFAOYSA-N 1-methoxy-2-methylpropane Chemical compound COCC(C)C ZYVYEJXMYBUCMN-UHFFFAOYSA-N 0.000 description 1
- YBYIRNPNPLQARY-UHFFFAOYSA-N 1H-indene Natural products C1=CC=C2CC=CC2=C1 YBYIRNPNPLQARY-UHFFFAOYSA-N 0.000 description 1
- 125000004974 2-butenyl group Chemical group C(C=CC)* 0.000 description 1
- 125000000069 2-butynyl group Chemical group [H]C([H])([H])C#CC([H])([H])* 0.000 description 1
- 125000006176 2-ethylbutyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(C([H])([H])*)C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000006040 2-hexenyl group Chemical group 0.000 description 1
- 125000004493 2-methylbut-1-yl group Chemical group CC(C*)CC 0.000 description 1
- 125000005916 2-methylpentyl group Chemical group 0.000 description 1
- 125000006024 2-pentenyl group Chemical group 0.000 description 1
- WMPPDTMATNBGJN-UHFFFAOYSA-N 2-phenylethylbromide Chemical compound BrCCC1=CC=CC=C1 WMPPDTMATNBGJN-UHFFFAOYSA-N 0.000 description 1
- 125000003903 2-propenyl group Chemical group [H]C([*])([H])C([H])=C([H])[H] 0.000 description 1
- 125000001494 2-propynyl group Chemical group [H]C#CC([H])([H])* 0.000 description 1
- 125000004975 3-butenyl group Chemical group C(CC=C)* 0.000 description 1
- 125000000474 3-butynyl group Chemical group [H]C#CC([H])([H])C([H])([H])* 0.000 description 1
- 125000006041 3-hexenyl group Chemical group 0.000 description 1
- 125000005917 3-methylpentyl group Chemical group 0.000 description 1
- 125000006042 4-hexenyl group Chemical group 0.000 description 1
- RMCDNCKVVHTEQK-UHFFFAOYSA-M 4-methylphenolate;tetrabutylazanium Chemical compound CC1=CC=C([O-])C=C1.CCCC[N+](CCCC)(CCCC)CCCC RMCDNCKVVHTEQK-UHFFFAOYSA-M 0.000 description 1
- 125000000590 4-methylphenyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1*)C([H])([H])[H] 0.000 description 1
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 1
- NIXOWILDQLNWCW-UHFFFAOYSA-M Acrylate Chemical compound [O-]C(=O)C=C NIXOWILDQLNWCW-UHFFFAOYSA-M 0.000 description 1
- DKPFZGUDAPQIHT-UHFFFAOYSA-N Butyl acetate Natural products CCCCOC(C)=O DKPFZGUDAPQIHT-UHFFFAOYSA-N 0.000 description 1
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 1
- UGFAIRIUMAVXCW-UHFFFAOYSA-N Carbon monoxide Chemical compound [O+]#[C-] UGFAIRIUMAVXCW-UHFFFAOYSA-N 0.000 description 1
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 1
- NTIZESTWPVYFNL-UHFFFAOYSA-N Methyl isobutyl ketone Chemical compound CC(C)CC(C)=O NTIZESTWPVYFNL-UHFFFAOYSA-N 0.000 description 1
- UIHCLUNTQKBZGK-UHFFFAOYSA-N Methyl isobutyl ketone Natural products CCC(C)C(C)=O UIHCLUNTQKBZGK-UHFFFAOYSA-N 0.000 description 1
- FXHOOIRPVKKKFG-UHFFFAOYSA-N N,N-Dimethylacetamide Chemical compound CN(C)C(C)=O FXHOOIRPVKKKFG-UHFFFAOYSA-N 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical group [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 description 1
- BUGBHKTXTAQXES-UHFFFAOYSA-N Selenium Chemical compound [Se] BUGBHKTXTAQXES-UHFFFAOYSA-N 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- 239000002253 acid Substances 0.000 description 1
- 230000003213 activating effect Effects 0.000 description 1
- 150000001298 alcohols Chemical class 0.000 description 1
- 150000001408 amides Chemical class 0.000 description 1
- 150000001412 amines Chemical class 0.000 description 1
- 239000012491 analyte Substances 0.000 description 1
- 238000004458 analytical method Methods 0.000 description 1
- 239000012300 argon atmosphere Substances 0.000 description 1
- RQNWIZPPADIBDY-UHFFFAOYSA-N arsenic atom Chemical group [As] RQNWIZPPADIBDY-UHFFFAOYSA-N 0.000 description 1
- 239000012298 atmosphere Substances 0.000 description 1
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical group [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 1
- XABJJJZIQNZSIM-UHFFFAOYSA-N azane;phenol Chemical compound [NH4+].[O-]C1=CC=CC=C1 XABJJJZIQNZSIM-UHFFFAOYSA-N 0.000 description 1
- YOUGRGFIHBUKRS-UHFFFAOYSA-N benzyl(trimethyl)azanium Chemical compound C[N+](C)(C)CC1=CC=CC=C1 YOUGRGFIHBUKRS-UHFFFAOYSA-N 0.000 description 1
- NDKBVBUGCNGSJJ-UHFFFAOYSA-M benzyltrimethylammonium hydroxide Chemical compound [OH-].C[N+](C)(C)CC1=CC=CC=C1 NDKBVBUGCNGSJJ-UHFFFAOYSA-M 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- 239000008280 blood Substances 0.000 description 1
- 210000004369 blood Anatomy 0.000 description 1
- 238000004159 blood analysis Methods 0.000 description 1
- 229910052799 carbon Inorganic materials 0.000 description 1
- 125000005708 carbonyloxy group Chemical group [*:2]OC([*:1])=O 0.000 description 1
- CZPLANDPABRVHX-UHFFFAOYSA-N cascade blue Chemical compound C=1C2=CC=CC=C2C(NCC)=CC=1C(C=1C=CC(=CC=1)N(CC)CC)=C1C=CC(=[N+](CC)CC)C=C1 CZPLANDPABRVHX-UHFFFAOYSA-N 0.000 description 1
- 238000004587 chromatography analysis Methods 0.000 description 1
- 239000008199 coating composition Substances 0.000 description 1
- 238000000354 decomposition reaction Methods 0.000 description 1
- 238000003795 desorption Methods 0.000 description 1
- 238000003745 diagnosis Methods 0.000 description 1
- 125000005046 dihydronaphthyl group Chemical group 0.000 description 1
- 238000004821 distillation Methods 0.000 description 1
- 238000001035 drying Methods 0.000 description 1
- 238000011067 equilibration Methods 0.000 description 1
- 150000002148 esters Chemical class 0.000 description 1
- 150000002170 ethers Chemical class 0.000 description 1
- 239000000835 fiber Substances 0.000 description 1
- 239000000706 filtrate Substances 0.000 description 1
- 238000003818 flash chromatography Methods 0.000 description 1
- 239000003546 flue gas Substances 0.000 description 1
- GNBHRKFJIUUOQI-UHFFFAOYSA-N fluorescein Chemical compound O1C(=O)C2=CC=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 GNBHRKFJIUUOQI-UHFFFAOYSA-N 0.000 description 1
- 239000007789 gas Substances 0.000 description 1
- 150000004820 halides Chemical group 0.000 description 1
- 150000008282 halocarbons Chemical class 0.000 description 1
- WJLUBOLDZCQZEV-UHFFFAOYSA-M hexadecyl(trimethyl)azanium;hydroxide Chemical compound [OH-].CCCCCCCCCCCCCCCC[N+](C)(C)C WJLUBOLDZCQZEV-UHFFFAOYSA-M 0.000 description 1
- FUZZWVXGSFPDMH-UHFFFAOYSA-N hexanoic acid Chemical compound CCCCCC(O)=O FUZZWVXGSFPDMH-UHFFFAOYSA-N 0.000 description 1
- 230000002209 hydrophobic effect Effects 0.000 description 1
- XLYOFNOQVPJJNP-UHFFFAOYSA-M hydroxide Chemical compound [OH-] XLYOFNOQVPJJNP-UHFFFAOYSA-M 0.000 description 1
- 150000002440 hydroxy compounds Chemical class 0.000 description 1
- 125000003392 indanyl group Chemical group C1(CCC2=CC=CC=C12)* 0.000 description 1
- 125000003454 indenyl group Chemical group C1(C=CC2=CC=CC=C12)* 0.000 description 1
- 239000012442 inert solvent Substances 0.000 description 1
- 229910010272 inorganic material Inorganic materials 0.000 description 1
- 239000011147 inorganic material Substances 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- 239000011630 iodine Substances 0.000 description 1
- 229910052740 iodine Inorganic materials 0.000 description 1
- 125000004491 isohexyl group Chemical group C(CCC(C)C)* 0.000 description 1
- 125000001972 isopentyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])C([H])([H])* 0.000 description 1
- 150000002576 ketones Chemical class 0.000 description 1
- 239000004922 lacquer Substances 0.000 description 1
- 230000007774 longterm Effects 0.000 description 1
- 229910044991 metal oxide Inorganic materials 0.000 description 1
- 150000004706 metal oxides Chemical class 0.000 description 1
- 125000005394 methallyl group Chemical group 0.000 description 1
- 229940088644 n,n-dimethylacrylamide Drugs 0.000 description 1
- YLGYACDQVQQZSW-UHFFFAOYSA-N n,n-dimethylprop-2-enamide Chemical compound CN(C)C(=O)C=C YLGYACDQVQQZSW-UHFFFAOYSA-N 0.000 description 1
- 125000003136 n-heptyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000001280 n-hexyl group Chemical group C(CCCCC)* 0.000 description 1
- 125000000740 n-pentyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000001971 neopentyl group Chemical group [H]C([*])([H])C(C([H])([H])[H])(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 239000012454 non-polar solvent Substances 0.000 description 1
- 238000000655 nuclear magnetic resonance spectrum Methods 0.000 description 1
- 125000005740 oxycarbonyl group Chemical group [*:1]OC([*:2])=O 0.000 description 1
- 239000001301 oxygen Substances 0.000 description 1
- 229910052760 oxygen Inorganic materials 0.000 description 1
- LVLZXBIWQHFREA-UHFFFAOYSA-N phenol;phosphane Chemical group [PH4+].[O-]C1=CC=CC=C1 LVLZXBIWQHFREA-UHFFFAOYSA-N 0.000 description 1
- PMOIAJVKYNVHQE-UHFFFAOYSA-N phosphanium;bromide Chemical compound [PH4+].[Br-] PMOIAJVKYNVHQE-UHFFFAOYSA-N 0.000 description 1
- 235000021317 phosphate Nutrition 0.000 description 1
- 150000003013 phosphoric acid derivatives Chemical class 0.000 description 1
- 239000011574 phosphorus Chemical group 0.000 description 1
- 229920002587 poly(1,3-butadiene) polymer Polymers 0.000 description 1
- 229920001483 poly(ethyl methacrylate) polymer Polymers 0.000 description 1
- 229920003229 poly(methyl methacrylate) Polymers 0.000 description 1
- 229920000120 polyethyl acrylate Polymers 0.000 description 1
- 229920000139 polyethylene terephthalate Polymers 0.000 description 1
- 239000005020 polyethylene terephthalate Substances 0.000 description 1
- 239000004926 polymethyl methacrylate Substances 0.000 description 1
- 229920000098 polyolefin Polymers 0.000 description 1
- 150000003856 quaternary ammonium compounds Chemical class 0.000 description 1
- 150000004023 quaternary phosphonium compounds Chemical class 0.000 description 1
- 230000000171 quenching effect Effects 0.000 description 1
- 238000010992 reflux Methods 0.000 description 1
- 230000000241 respiratory effect Effects 0.000 description 1
- 230000029058 respiratory gaseous exchange Effects 0.000 description 1
- 229910052711 selenium Inorganic materials 0.000 description 1
- 239000011669 selenium Substances 0.000 description 1
- 229910001923 silver oxide Inorganic materials 0.000 description 1
- 159000000000 sodium salts Chemical class 0.000 description 1
- 239000011877 solvent mixture Substances 0.000 description 1
- 238000005507 spraying Methods 0.000 description 1
- 238000013112 stability test Methods 0.000 description 1
- 239000007858 starting material Substances 0.000 description 1
- 239000000725 suspension Substances 0.000 description 1
- 150000003512 tertiary amines Chemical class 0.000 description 1
- 238000012360 testing method Methods 0.000 description 1
- DZLFLBLQUQXARW-UHFFFAOYSA-N tetrabutylammonium Chemical compound CCCC[N+](CCCC)(CCCC)CCCC DZLFLBLQUQXARW-UHFFFAOYSA-N 0.000 description 1
- JRMUNVKIHCOMHV-UHFFFAOYSA-M tetrabutylammonium bromide Chemical compound [Br-].CCCC[N+](CCCC)(CCCC)CCCC JRMUNVKIHCOMHV-UHFFFAOYSA-M 0.000 description 1
- YNJQKNVVBBIPBA-UHFFFAOYSA-M tetrabutylazanium;trifluoromethanesulfonate Chemical compound [O-]S(=O)(=O)C(F)(F)F.CCCC[N+](CCCC)(CCCC)CCCC YNJQKNVVBBIPBA-UHFFFAOYSA-M 0.000 description 1
- 229940073455 tetraethylammonium hydroxide Drugs 0.000 description 1
- LRGJRHZIDJQFCL-UHFFFAOYSA-M tetraethylazanium;hydroxide Chemical compound [OH-].CC[N+](CC)(CC)CC LRGJRHZIDJQFCL-UHFFFAOYSA-M 0.000 description 1
- 125000001712 tetrahydronaphthyl group Chemical group C1(CCCC2=CC=CC=C12)* 0.000 description 1
- STCOOQWBFONSKY-UHFFFAOYSA-N tributyl phosphate Chemical compound CCCCOP(=O)(OCCCC)OCCCC STCOOQWBFONSKY-UHFFFAOYSA-N 0.000 description 1
- RYVBINGWVJJDPU-UHFFFAOYSA-M tributyl(hexadecyl)phosphanium;bromide Chemical compound [Br-].CCCCCCCCCCCCCCCC[P+](CCCC)(CCCC)CCCC RYVBINGWVJJDPU-UHFFFAOYSA-M 0.000 description 1
- ZEQNRFCMIQBXTM-UHFFFAOYSA-K trisodium;4-hydroxypyrene-1,2,3-trisulfonate Chemical compound [Na+].[Na+].[Na+].[O-]S(=O)(=O)C1=C(S([O-])(=O)=O)C(S([O-])(=O)=O)=C2C(O)=CC3=CC=CC4=CC=C1C2=C34 ZEQNRFCMIQBXTM-UHFFFAOYSA-K 0.000 description 1
- 125000004417 unsaturated alkyl group Chemical group 0.000 description 1
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 1
- 229920002554 vinyl polymer Polymers 0.000 description 1
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N31/00—Investigating or analysing non-biological materials by the use of the chemical methods specified in the subgroup; Apparatus specially adapted for such methods
- G01N31/22—Investigating or analysing non-biological materials by the use of the chemical methods specified in the subgroup; Apparatus specially adapted for such methods using chemical indicators
- G01N31/223—Investigating or analysing non-biological materials by the use of the chemical methods specified in the subgroup; Apparatus specially adapted for such methods using chemical indicators for investigating presence of specific gases or aerosols
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10S—TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10S436/00—Chemistry: analytical and immunological testing
- Y10S436/80—Fluorescent dyes, e.g. rhodamine
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10T—TECHNICAL SUBJECTS COVERED BY FORMER US CLASSIFICATION
- Y10T436/00—Chemistry: analytical and immunological testing
- Y10T436/16—Phosphorus containing
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10T—TECHNICAL SUBJECTS COVERED BY FORMER US CLASSIFICATION
- Y10T436/00—Chemistry: analytical and immunological testing
- Y10T436/17—Nitrogen containing
- Y10T436/173845—Amine and quaternary ammonium
Landscapes
- Life Sciences & Earth Sciences (AREA)
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Biochemistry (AREA)
- General Physics & Mathematics (AREA)
- Molecular Biology (AREA)
- Physics & Mathematics (AREA)
- Analytical Chemistry (AREA)
- Dispersion Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Biophysics (AREA)
- Immunology (AREA)
- Pathology (AREA)
- Investigating Or Analysing Materials By The Use Of Chemical Reactions (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Investigating Or Analyzing Non-Biological Materials By The Use Of Chemical Means (AREA)
- Glass Compositions (AREA)
- Measurement Of The Respiration, Hearing Ability, Form, And Blood Characteristics Of Living Organisms (AREA)
- Investigating, Analyzing Materials By Fluorescence Or Luminescence (AREA)
Description
本発明は、液体および気体媒体中の二酸化炭素の蛍光による光学的測定のための、キャリヤーおよびそれに適用される感光層から実質的になるセンサ、感光性組成物、液体および気体媒体中の二酸化炭素の蛍光による定性的および定量的光学的測定の方法、ならびに気体および液体媒体中の二酸化炭素の定性的および定量的測定のためのセンサの使用に関する。
【0002】
気体および液体媒体、たとえば空気、煙道ガス、呼吸気、水、水溶液および血液の中の二酸化炭素の蛍光による光学的測定は、前記媒体中の二酸化炭素の定性的および定量的測定における貴重な支援であり、特に呼吸気および血液の分析に特に多大な診断上の意義を有している。その方法は、その高い感度および特異性故に注目に値し、したがって、分析、特に診断の分野で広く使用されている。
【0003】
多くの蛍光染料は、低い極性の媒体、たとえば非極性溶媒またはポリマーの中では、蛍光を示さないか、実質的に減衰した蛍光しか示さないことが知られている。まず、この挙動は、ポリマーおよびその中に分散した蛍光染料から実質的になる感光層にこれらの蛍光染料を使用できなくする。他方、これらの感光層およびこれらの感光層を含むセンサこそが、製造の簡素さおよび水性プローブに対する安定性の理由で特に望まれる。
【0004】
米国特許第5,387,523号には、蛍光染料を第四級オニウム化合物とともに使用することによってこの問題が解消されることが提示されている。第四級オニウム化合物は、具体的に記載されている第四級アンモニウム化合物だけでなく、第四級ホスホニウム化合物、たとえばテトラブチルホスホニウムブロマイドでもあると理解されよう。他方、すべてのオニウム化合物は、低い極性の媒体中に存在する蛍光染料に対して同様に作用するわけではないことが強調されている。活性化作用をほとんど、またはまったくもたないオニウム化合物は、たとえば、n−ヘキサデシルトリブチルホスホニウムブロマイド、テトラブチルアンモニウムトリフルオロメチルスルホネート、テトラブチルアンモニウムテトラフェニルボレート、硫酸水素テトラブチルアンモニウム、テトラブチルホスホニウムブロマイドおよびテトラブチルアンモニウムブロマイドである。同時に、きわめて重要な要因として、反対の電荷をもつイオンの重要性が言及されている。具体的に挙げられている活性化合物は、水酸化テトラブチルアンモニウム、水酸化ヘキサデシルトリメチルアンモニウム、水酸化テトラエチルアンモニウム、水酸化テトラメチルアンモニウム、水酸化ベンジルトリメチルアンモニウムおよびベンジルトリメチルアンモニウムメチラートのみである。
【0005】
これらの第四級水酸化物は、実際、低い極性の媒体中で染料の蛍光を活性化することができるが、反対の電荷をもつイオンの高い塩基度のため、ホフマン脱離によって第三級アミン、1−アルケンおよび水に分解するか、求核置換によって第三級アミンおよびヒドロキシ化合物に分解するという欠点を抱えている。この理由のため、このような第四級水酸化物を蛍光染料とともに低い極性のポリマー中に含有するセンサは、安定性が低い。その結果、このようなセンサ混合物は長期間貯蔵することができず、これらのセンサを含有する装置は、分解によって生じる感度の変化を補償するため、絶えず較正し直さなければならない。
【0006】
かなりの期間にわたって感度が一定のままであり、長期間貯蔵することができる良好な安定性をもつセンサが得られ、ポリマーおよびポリアニオン性蛍光染料に加えて第四級オニウムフェノラートを活性化剤として含有する感光層がキャリヤーに適用されるならば、そのようなセンサを有する装置を絶えず較正しなくてもよいことがわかった。
【0007】
本発明の第一の目的は、気体および液体媒体中の二酸化炭素の蛍光による光学的測定のための、キャリヤーおよびそれに適用される感光層から実質的になるセンサであって、感光層が、ポリマーおよびアニオン性蛍光染料に加えて、第四級オニウムフェノラートをも含有することを特徴とするセンサである。
【0008】
本発明に関して理解される第四級オニウムフェノラート類は、第四級アンモニウムフェノラート類、第四級ホスホニウムフェノラート類および第四級アルソニウムフェノラート類である。本発明のセンサは、好ましくは、アンモニウムフェノラートを含有する。
【0009】
第四級フェノラートは、好ましくは、式I
【0010】
【化2】
【0011】
(式中、Xは、窒素、リンまたはヒ素であり、基R1、R2、R3およびR4は、互いに独立して、直鎖状または分岐鎖状の、飽和または不飽和の、非置換または置換されているアルキル、あるいは非置換または置換されているアラルキルをそれぞれ表し、基R5、R6、R7、R8およびR9は、互いに独立して、水素、または直鎖状または分岐鎖状の、飽和または不飽和の、非置換または置換されているアルキル、非置換または置換されているモノ−もしくはジアリールアルキル、あるいは非置換または置換されているアリールをそれぞれ表し;それによって、基R1、R2、R3およびR4の2個だけがそれぞれアリールを表すことができ、そして基R1、R2、R3およびR4の2または3個がいっしょになって、個々の環の中に5〜7個の環員をもつ複素環系を形成することができ;そしてそれによって、基R5、R6、R7、R8およびR9のうち2個の隣接する基がいっしょになって、5〜7個の環員をもつ飽和、不飽和または芳香族性の環(フェニル基にオルト縮合(anellate)されている)を形成することができる)
に対応する。
【0012】
式I中、Xは好ましくは窒素を表す。
【0013】
本発明に関してハロゲンとは、フッ素、塩素、臭素またはヨウ素をいう。ハロゲンは、好ましくはフッ素、塩素または臭素であり、もっとも好ましくは塩素である。
【0014】
表現「飽和または不飽和アルキル」は、炭素原子1〜30個を有するアルキル基ならびに対応するアルケニル基およびアルキニル基を含む。基R1、R2、R3およびR4に関して、アルキルは、特に、炭素原子1〜8個を有するアルキル基、もっとも好ましくは、炭素原子1〜6個を有するアルキル基、ならびに対応するアルケニル基およびアルキニル基を表す。基R5、R6、R7、R8およびR9に関して、アルキルは、特に、炭素原子1〜10個を有するアルキル基、もっとも好ましくは、炭素原子1〜4個を有するアルキル基、ならびに対応するアルケニル基およびアルキニル基を表す。以下のアルキル基を例として挙げることができる。メチル、エチル、n−プロピル、イソプロピル、n−ブチル、イソブチル、sec−ブチル、tert−ブチル、n−ペンチル、2−メチルブチル、3−メチルブチル、2,2−ジメチルプロピル、n−ヘキシル、2−メチルペンチル、3−メチルペンチル、4−メチルペンチル、5−メチルペンチル、2−エチルブチル、3−エチルブチル、n−ヘプチル、n−オクチル、イソ−オクチル、n−ノニル、n−デシル、n−ウンデシル、n−ドデシル、n−ヘキサデシルおよびn−オクタデシル。以下のアルケニル基を例として挙げることができる。ビニル、アリル、メタリル、1−ブテニル、2−ブテニル、3−ブテニル、2−ペンテニル、3−ペンテニル、4−ペンテニル、2−ヘキセニル、3−ヘキセニル、4−ヘキセニル、2−、3−、4−、5−および6−ヘプテニル、2−、3−、4−、5−、6−および7−オクテニル。以下のアルキニル基を例として挙げることができる。プロパルギル、2−ブチニル、3−ブチニルおよび3−フェニルプロパルギル。
【0015】
基R1、R2、R3およびR4に関して、置換アルキルは、特に、ヒドロキシ、ハロゲン、シアノ、C1〜C4アルコキシまたはC1〜C4アルコキシカルボニルによって1〜3回置換されているアルキル基であることができ、多置換の場合、置換基は同じであっても異なっていてもよい。基R5、R6、R7、R8およびR9に関して、置換アルキルは、特に、ヒドロキシ、ハロゲン、シアノまたはC1〜C4アルコキシによって1〜3回置換されているアルキル基であることができ、多置換の場合、置換基は同じであっても異なっていてもよい。
【0016】
アリールは、好ましくはフェニルまたはナフチルを表し、好ましくはフェニルを表す。
【0017】
基R1、R2、R3およびR4に関して、置換アリールは、特に、C1〜C4アルキル、C1〜C4アルコキシ、C1〜C4アルキル−C1〜C4アルコキシ、フェニル−C1〜C4アルキル、ハロゲン、ハロゲン−C1〜C4アルキル、ヒドロキシ、シアノまたはC1〜C4アルコキシカルボニルによって1〜3回置換されているアリール基であることができ、アリールは好ましくはフェニルを表す。C1〜C4アルキル基は、メチル、エチル、n−プロピル、イソプロピル、n−ブチル、イソブチル、sec−ブチルおよびtert−ブチルである。基R1、R2、R3およびR4の置換基としてのアリール基として存在することができる好ましいフェニル−C1〜C4アルキル基は、アルキル基中に炭素原子1〜2個を有するもの、たとえばベンジル、1−フェニルエチルおよび2−フェニルエチルである。フェニルアルキルは、特にベンジル基を表す。
【0018】
アラルキル基として、基R1、R2、R3およびR4は、好ましくはアリール−C1〜C4アルキル基を表し、もっとも好ましくはフェニル−C1〜C4アルキル基を表す。アラルキル基として、基R1、R2、R3およびR4は、特に、アルキル基中に炭素原子1〜2個を有するフェニルアルキル基、たとえばベンジル、1−フェニルエチルおよび2−フェニルエチルを表す。アラルキル基として、基R1、R2、R3およびR4は、もっとも好ましくはベンジル基を表す。置換アラルキル基として、基R1、R2、R3およびR4は、特に、C1〜C4アルキル、C1〜C4アルコキシ、C1〜C4アルキル−C1〜C4アルコキシ、フェニル−C1〜C4アルキル、ハロゲン、ハロゲン−C1〜C4アルキル、ヒドロキシ、シアノまたはC1〜C4アルコキシカルボニルによってアリール基に1〜3回置換されているものを表す。C1〜C4アルキル基は、メチル、エチル、n−プロピル、イソプロピル、n−ブチル、イソブチル、sec−ブチルおよびtert−ブチルである。好ましい置換アラルキル基は、アリールが、C1〜C4アルキル、C1〜C4アルコキシ、C1〜C4アルキル−C1〜C4アルコキシ、フェニル−C1〜C4アルキル、ハロゲン、ハロゲン−C1〜C4アルキル、ヒドロキシ、シアノまたはC1〜C4アルコキシカルボニルによって1〜3回置換されているフェニル基を表し、アルキル基が炭素原子1〜2個を含むものである。アラルキル基として、基R1、R2、R3およびR4は、もっとも好ましくは、アルキル基中に炭素原子1〜2個を有するフェニルアルキル基、たとえばベンジル、1−フェニルエチルおよび2−フェニルエチルを表す。アラルキル基として、基R1、R2、R3およびR4は、もっとも好ましくはベンジル基を表す。
【0019】
基R5、R6、R7、R8およびR9に関して、置換アリールは、特に、C1〜C4アルキル、C1〜C4アルコキシ、ハロゲン、ヒドロキシまたはシアノによって1〜3回置換されているアリール基であることができ、アリールは好ましくはフェニルを表す。C1〜C4アルキル基は、メチル、エチル、n−プロピル、イソプロピル、n−ブチル、イソブチル、sec−ブチルおよびtert−ブチルである。
【0020】
アラルキル基として、基R5、R6、R7、R8およびR9は、好ましくはモノ−またはジアリール−C1〜C6アルキル基、もっとも好ましくはモノ−またはジフェニル−C1〜C6アルキル基を表す。置換モノ−またはジアラルキル基として、基R5、R6、R7、R8およびR9は、特に、C1〜C4アルキル、C1〜C4アルコキシ、C1〜C4アルコキシ−C1〜C4アルキル、ハロゲン、ハロゲン−C1〜C4アルキル、ヒドロキシ、シアノまたはC1〜C4アルコキシカルボニルによってアリール基に1〜3回置換されているものを表す。C1〜C4アルキル基は、メチル、エチル、n−プロピル、イソプロピル、n−ブチル、イソブチル、sec−ブチルおよびtert−ブチルである。好ましい置換モノ−またはジアラルキル基は、アリールが、C1〜C4アルキル、C1〜C4アルコキシ、C1〜C4アルキル−C1〜C4アルコキシ、フェニル−C1〜C4アルキル、ハロゲン、ハロゲン−C1〜C4アルキル、ヒドロキシ、シアノまたはC1〜C4アルコキシカルボニルによって1〜3回置換されているフェニル基を表し、アルキル基が炭素原子1〜2個を含むものである。
【0021】
基R1、R2、R3およびR4の2または3個がXといっしょになって形成することができる複素環系は、たとえば下記の構造を含む。
【0022】
【化3】
【0023】
基R1、R2、R3およびR4の2個を結合することによって形成することができる好ましい複素環系は、ピロリジノ、ピペリジノおよびアゼピノである。基R1、R2、R3およびR4の3個から形成することができる好ましい複素環系は、1−アザビシクロ〔4.3.0〕ノニル、1−アザビシクロ〔4.4.0〕デシル、1−アザビシクロ〔5.4.0〕ウンデシル、1−アザビシクロ〔2.1.1〕ヘキシル、1−アザビシクロ〔2.2.1〕ヘプチル、1−アザビシクロ〔2.2.2〕オクチル、1−アザビシクロ〔3.2.1〕オクチルおよび1−アザビシクロ〔3.2.2〕ノニルである。
【0024】
隣接する2個の基R 5 、R 6 、R 7 、R 8 およびR 9 によって形成される、オルト縮合された飽和、不飽和または芳香族性の環を有するフェノレーション(phenolation)は、たとえば、下記の構造
【0025】
【化4】
【0026】
および3,4−位置でオルト縮合されたそれらの異性体を含み、それによって、オルト縮合された環を形成するために必要のない基R 5 、R 6 、R 7 、R 8 およびR 9 の意味はそれぞれ同じままである。加えて、オルト縮合された環では、1個のメチレン基が酸素によって置換され、隣接する2個のメチレン基がオキシカルボニル基およびカルボニルオキシ基によって置換されていることができる。オルト縮合された飽和、不飽和または芳香族性の環を有する好ましいフェノレーションは、インダニル、インデニル、ナフチル、ジヒドロナフチルまたはテトラヒドロナフチル基を含み、それによって、オルト縮合された環は、2,3−または3,4−位置で結合することができ、オルト縮合された環を形成するために必要のない基R 5 、R 6 、R 7 、R 8 およびR 9 は、式Iで与えた意味を有する。
【0027】
感光層は、好ましくは、式Iの第四級フェノラートを含み、ここで、XがN、PまたはAsであり、R1、R2、R3およびR4が、互いに独立して、直鎖状または分岐鎖状の、飽和または不飽和の、非置換C1〜C30アルキルまたは、C1〜C4アルコキシ、ハロゲン、ヒドロキシ、シアノもしくはC1〜C4アルコキシカルボニルによって1〜3回置換されているC1〜C30アルキル、あるいは非置換アリール−C1〜C4アルキルまたは、C1〜C4アルキル、C1〜C4アルコキシ、C1〜C4アルコキシ−C1〜C4アルキル、アリール−C1〜C4アルキル、ハロゲン、ハロゲン−C1〜C4アルキル、ヒドロキシ、シアノもしくはC1〜C4アルコキシカルボニルによって1〜3回置換されているアリール−C1〜C4アルキル、あるいは非置換アリールまたは、C1〜C4アルキル、C1〜C4アルコキシ、C1〜C4アルコキシ−C1〜C4アルキル、アリール−C1〜C4アルキル、ハロゲン、ハロゲン−C1〜C4アルキル、ヒドロキシ、シアノもしくはC1〜C4アルコキシカルボニルによって1〜3回置換されているアリールをそれぞれ表し、そしてR5、R6、R7、R8およびR9が、互いに独立して、水素、直鎖状または分岐鎖状の、飽和または不飽和の、非置換C1〜C10アルキルまたは、ハロゲン、C1〜C4アルコキシ、ヒドロキシもしくはシアノによって1〜3回置換されているC1〜C10アルキル、あるいは非置換アリールまたは、C1〜C4アルキル、C1〜C4アルコキシ、C1〜C4アルコキシ−C1〜C4アルキル、ハロゲン、ハロゲン−C1〜C4アルキル、ヒドロキシ、シアノもしくはC1〜C4アルコキシカルボニルによって1〜3回置換されているアリール、あるいは非置換モノ−もしくはジアリール−C1〜C6アルキルまたは、C1〜C4アルキル、C1〜C4アルコキシ、C1〜C4アルコキシ−C1〜C4アルキル、ハロゲン、ハロゲン−C1〜C4アルキル、ヒドロキシ、シアノもしくはC1〜C4アルコキシカルボニルによって1〜3回置換されているモノ−もしくはジアリール−C1〜C6アルキルをそれぞれ表し、それによって、基R1、R2、R3およびR4の2個だけがそれぞれアリールを表すことができ、基R1、R2、R3およびR4の2または3個がいっしょになって、個々の環中に5〜7個の環員をもつ複素環系を形成することができ、そしてそれによって、基R5、R6、R7、R8およびR9のうち2個の隣接する基がいっしょになって、5〜7個の環員をもつ飽和、不飽和または芳香族性の環(フェニル基にオルト縮合されている)を形成することができる。好ましい化合物は、Xが窒素である化合物である。
【0028】
さらに好ましいものは、式Iの化合物を含むセンサであり、ここで、R1、R2、R3およびR4が、互いに独立して、直鎖状または分岐鎖状の、飽和または不飽和の、非置換C2〜C8アルキルまたは、C1〜C4アルコキシ、ハロゲン、ヒドロキシ、シアノもしくはC1〜C4アルコキシカルボニルによって1〜3回置換されているC2〜C8アルキル、あるいは非置換フェニル−C1〜C4アルキルまたは、C1〜C4アルキル、C1〜C4アルコキシ、C1〜C4アルコキシ−C1〜C4アルキル、ハロゲン、ハロゲン−C1〜C4アルキル、フェニル−C1〜C4アルキル、ヒドロキシ、シアノもしくはC1〜C4アルコキシカルボニルによって1〜3回置換されているフェニル−C1〜C4アルキル、あるいは非置換フェニルまたは、C1〜C4アルキル、C1〜C4アルコキシ、C1〜C4アルコキシ−C1〜C4アルキル、ハロゲン、ハロゲン−C1〜C4アルキル、フェニル−C1〜C4アルキル、ヒドロキシ、シアノもしくはC1〜C4アルコキシカルボニルによって1〜3回置換されているフェニルをそれぞれ表し、それによって、基R1、R2、R3およびR4の2個だけがそれぞれフェニルを表すことができ、基R1、R2、R3およびR4の2または3個がいっしょになって、個々の環中に5〜7個の環員をもつ複素環系を形成することができる。
【0029】
さらに好ましい本発明のセンサは、式Iの化合物を含むセンサであり、ここで、R1、R2、R3およびR4が、互いに独立して、直鎖状または分岐鎖状の、飽和または不飽和の、C2〜C6アルキル、フェニル−C1〜C4アルキルまたはフェニルをそれぞれ表し、それによって、基R1、R2、R3およびR4の2個だけがそれぞれフェニルを表すことができ、基R1、R2、R3およびR4の2または3個がいっしょになって、個々の環中に5〜7個の環員をもつ複素環系を形成することができる。
【0030】
他に好ましい本発明のセンサは、式Iの化合物を含み、ここで、R1、R2、R3およびR4が、互いに独立して、直鎖状または分岐鎖状の、C2〜C6アルキル、ベンジルまたはフェニルをそれぞれ表す。
【0031】
さらには、本発明によると、R5、R6、R7、R8およびR9が、互いに独立して、水素、直鎖状または分岐鎖状の、飽和または不飽和の、非置換C1〜C4アルキルまたは、ハロゲン、C1〜C4アルコキシ、ヒドロキシもしくはシアノによって1〜3回置換されているC1〜C4アルキル、あるいは非置換フェニルまたは、C1〜C4アルキル、ハロゲン、C1〜C4アルコキシ、ヒドロキシもしくはシアノによって1〜3回置換されているフェニル、あるいは非置換モノ−もしくはジフェニル−C1〜C6アルキルまたは、C1〜C4アルキル、ハロゲン、C1〜C4アルコキシ、ヒドロキシもしくはシアノによって1〜3回置換されているモノ−もしくはジフェニル−C1〜C6アルキルをそれぞれ表す式Iの化合物を含むセンサが好ましい。
【0032】
さらには、本発明によると、R5、R6、R7、R8およびR9が、互いに独立して、水素、直鎖状または分岐鎖状の、飽和または不飽和の、C1〜C4アルキル、フェニルまたは2−フェニルエチルをそれぞれ表す式Iの化合物を含むセンサが好ましい。
【0033】
さらに好ましい本発明のセンサは、式Iの化合物を含むセンサであり、ここで、XがNであり、R1、R2、R3およびR4が、互いに独立して、直鎖状または分岐鎖状の、飽和または不飽和の、非置換C2〜C6アルキルまたは、C1〜C4アルコキシ、ハロゲン、ヒドロキシ、シアノもしくはC1〜C4アルコキシカルボニルによって1〜3回置換されているC2〜C6アルキル、あるいは非置換フェニル−C1〜C4アルキルまたは、C1〜C4アルキル、C1〜C4アルコキシ、C1〜C4アルコキシ−C1〜C4アルキル、ハロゲン、ハロゲン−C1〜C4アルキル、フェニル−C1〜C4アルキル、ヒドロキシ、シアノもしくはC1〜C4アルコキシカルボニルによって1〜3回置換されているフェニル−C1〜C4アルキル、あるいは非置換フェニルまたは、C1〜C4アルキル、C1〜C4アルコキシ、C1〜C4アルコキシ−C1〜C4アルキル、ハロゲン、ハロゲン−C1〜C4アルキル、フェニル−C1〜C4アルキル、ヒドロキシ、シアノもしくはC1〜C4アルコキシカルボニルによって1〜3回置換されているフェニルをそれぞれ表し、R5、R6、R7、R8およびR9が、互いに独立して、水素、直鎖状または分岐鎖状の、飽和または不飽和の、非置換C1〜C4アルキルまたは、ハロゲン、C1〜C4アルコキシ、ヒドロキシもしくはシアノによって1〜3回置換されているC1〜C4アルキル、あるいは非置換フェニルまたは、C1〜C4アルキル、ハロゲン、C1〜C4アルコキシ、ヒドロキシもしくはシアノによって1〜3回置換されているフェニル、あるいは非置換モノ−もしくはジフェニル−C1〜C6アルキルまたは、C1〜C4アルキル、ハロゲン、C1〜C4アルコキシ、ヒドロキシもしくはシアノによって1〜3回置換されているモノ−もしくはジフェニル−C1〜C6アルキルをそれぞれ表す。
【0034】
さらには、本発明によると、XがNであり、R1、R2、R3およびR4が、互いに独立して、直鎖状または分岐鎖状の、飽和または不飽和のC2〜C6アルキル、フェニル−C1〜C4アルキルまたはフェニルをそれぞれ表し、R5、R6、R7、R8およびR9が、互いに独立して、水素、直鎖状または分岐鎖状の、飽和または不飽和のC1〜C4アルキル、フェニルまたは2−フェニルエチルをそれぞれ表す式Iの化合物を含むセンサが好ましい。
【0035】
他の好ましい本発明のセンサは、XがNであり、R1、R2、R3およびR4が、互いに独立して、直鎖状または分岐鎖状のC2〜C6アルキル、ベンジルまたはフェニルをそれぞれ表し、R5、R6、R7、R8およびR9が、互いに独立して、水素、直鎖状または分岐鎖状の、飽和または不飽和のC1〜C4アルキル、フェニルまたは2−フェニルエチルをそれぞれ表す式Iの化合物を含む。
【0036】
本発明にしたがって使用される式Iのオニウムフェノラート類は、6〜12のpKa値を有することができる。8〜12のpKa値を有する式Iのオニウムフェノラート類が好ましい。8〜10のpKa値を有する式Iのオニウムフェノラート類が特に好ましい。
【0037】
本発明のセンサのキャリヤー材料として、好ましくは透明な材料が使用される。適当なキャリヤー材料は、合成材料、たとえばポリカーボネートもしくはアクリルガラスまたは無機材料、金属酸化物もしくは無機ガラスである。好ましいキャリヤー材料は有機または無機ガラスである。キャリヤーはいかなる形態であってもよい。適当な形態は、たとえば、シート、円筒、管、リボンまたは繊維である。
【0038】
本発明のセンサの感光層は、ベース物質として、蛍光染料、少なくとも1種の式Iの化合物、および場合によってはさらなる添加物、たとえば軟化剤が分散されているところのポリマーを含有する。H+イオンに対して不透過性であり、2〜10、好ましくは2〜6の誘電定数を有する疎水性ポリマーが一般に適している。蛍光染料および式Iの第四級フェノラートを組み込むことができる適当なポリマーは、特に、キャリヤー上に透明またはわずかに不透明な塗膜を形成させることができるポリマーである。ここで考慮することができるポリマーは、特に、アクリルポリマー類、たとえばポリ−N,N−ジメチルアクリルアミド、ポリエチルアクリレート、ポリエチルメタクリレート、ポリエチルヘキシルアクリレートおよびアクリルコポリマー類である。さらなる適当なポリマーは、ポリ塩化ビニル、ポリ酢酸ビニル、ポリアルケン類、たとえばポリエチレン、ポリプロピレン、ポリ−(イソブテン−コ−イソプレン)、ポリ−(4−メチルペンテン)、ポリウレタン類、セルロース誘導体類、ポリスチレン、ポリテトラフルオロエチレン、ポリオキシメチレン、ポリエステル類、たとえばポリエチレンテレフタレート、ポリジエン類およびジエン類とアクリロニトリルとのコポリマー類、たとえばポリ−1,3−ブタジエン、ポリジメチルブタジエン、ポリ−(1,3−ブタジエン−コ−アクリロニトリル)ならびにポリイソプレンである。
【0039】
好ましいポリマーはポリスチレンおよびエチルセルロースである。
【0040】
考慮することができる蛍光染料は、主として、低い極性の媒体の中では蛍光を示さないか、ひどく減衰した蛍光しか示さないものである。このような蛍光染料の例は、フルオレセイン、セミ−ナフトフルオレセイン、2′,7′−ジメチルロドル、HPTS(ヒドロキシピレントリスルホン酸のナトリウム塩)、CASCADE BLUE(エチレンジアミンピレントリスルホン酸のナトリウム塩)であり、それらの構造を以下に示す。
【0041】
【化5】
【0042】
本発明のセンサの感光層に含めることができる適当な軟化剤は、たとえば、リン酸トリアルキル、たとえばリン酸トリブチルおよびオクチルニトロフェニルエーテルである。
【0043】
感光層では、蛍光染料(発蛍光団)と式Iの第四級フェノラートとの比は、1:500〜1:50であることができる。発蛍光団と式Iの第四級フェノラートとの比は、好ましくは1:250〜1:100である。
【0044】
キャリヤーに適用される感光層の厚さは、0.01〜100μm、好ましくは0.1〜50μm、特に0.1〜30μm、もっとも好ましくは0.1〜10μmであることができる。キャリヤーに適用される該層は、透明であっても、またわずかに不透明であってもよい。該層は好ましくは透明である。また、疎水性の層が好ましい。
【0045】
そのような層の調製は、それ自体が既知の方法、たとえば蛍光染料、式Iの化合物および適当なポリマーを溶媒に溶解したのち、その溶液をキャリヤーに適用し、溶媒を除去することによって実施することができる。溶液は、流し込みによって適用することもできるし、ラッカ塗付技術から知られる方法を用いることによって適用することもできる。挙げることができるそのような方法は、特に、スピンコーティーング、スプレーイングおよびスクリーン法である。該層は、好ましくは、スピンコーティーングによって適用する。
【0046】
考慮することができる溶媒は、水、アルコール類、エーテル類、エステル類、酸アミド類、ハロゲン化炭化水素およびケトン類である。そのような溶媒の例は、メタノール、エタノール、n−プロパノール、イソプロパノール、ジエチルエーテル、メチルイソブチルエーテル、テトラヒドロフラン、ジオキサン、酢酸エチル、酢酸ブチル、ジメチルホルムアミド、ジメチルアセトアミド、塩化メチレン、クロロホルム、アセトン、メチルエチルケトンおよびメチルイソブチルケトンである。易揮発性の溶媒、特にテトラヒドロフラン、塩化メチレンおよびアセトンを使用することが好ましい。一つの特に好ましい溶媒はテトラヒドロフランである。上述の溶媒は、単独で使用することもできるし、溶媒混合物として使用することもできる。コーティーングに適当な、本発明のコーティーング組成物の粘度は、それぞれ使用される溶媒の適量を使用することによって設定することができる。
【0047】
本発明のセンサの感光層は、巨視的には均質に見えるが、第四級オニウムイオンとポリアニオン性蛍光染料との相互作用によって形成される微小区域を有している。大きさが5μm〜100μmの領域にあるこれらの微小区域は、ポリマーによって形成される周囲部よりも高い極性を有する。したがって、より高い極性のこれらの微小区域の蛍光染料は、低い極性でのポリマーの蛍光消衰作用から保護される。
【0048】
本発明のさらなる目的は、ポリマー、低い極性の媒体の中で活性化され得るアニオン性蛍光染料および活性化剤としての式Iの第四級フェノラートを含有する感光性組成物である。これらの感光性組成物についても、そこに含まれるポリマー、蛍光染料および式Iの第四級フェノラートに関して、上記の定義および選択が相応に当てはまる。これらの感光性組成物を使用して本発明のセンサを製造することができる。これらは、感光層をキャリヤーに適用するためのコーティーング素材として働く。一つの実施態様によると、これらのコーティーング素材は、適切なポリマー、低い極性の媒体の中で活性化され得る蛍光染料、活性化剤としての式Iの化合物、および場合によってはさらなる添加物、を精細に分散させた形態で含有する粉末の形態で存在することができる。適当な添加物は、たとえば親油性塩および軟化剤である。別の実施態様によると、コーティーング素材は、溶液、たとえば上述の粉末混合物を上述の溶媒の1種に溶解することによって得られる溶液の形態で存在することができる。
【0049】
本発明にしたがって使用される式Iの第四級フェノラート類には、多くの既知の化合物が包含される。
【0050】
式Iの第四級フェノラート類は、対応する第四級水酸化物から出発し、それらを引き続く平衡により当量のフェノールと反応させる簡単な方法で得ることができる。反応は、有利には、不活性溶媒、たとえば低級アルカノール、特にメタノール中で実施される。反応が終了した時点で、溶媒を留去すると、第四級フェノラートが定量収率で得られる。出発原料として必要な第四級水酸化物は、逆に、既知の方法で、対応する第四級塩から、たとえば第四級ハロゲン化物を酸化銀と反応させることによって製造される。
【0051】
本発明のさらなる対象は、測定プローブにおける二酸化炭素の蛍光による光学的測定の方法であって、本発明のセンサを、検査する前記測定プローブと接触させたのち、感光層中の発蛍光団の蛍光の変化を測定する方法である。
【0052】
本発明の方法は、たとえば、活性ポリマー層を有するキャリヤーが光学セル中に固定され、そこで活性層が測定プローブと接触するような方法で実施することができる。光学セルはウインドーを含み、このウインドーを介して活性層を光照射によって励起することができ、放出される蛍光光線を分光蛍光度計によって測定することができる。波長は、光照射には吸収極大、蛍光の測定には放出極大に設定することができる。強度は、濃度の関数として測定される。測定システムは、測定が不連続に実施されるように設計することもできるし、測定が連続的に実施されるように設計することもできる。連続測定は、たとえば、液体または気体分析対象物を測定セルに流し込むことによって実施することができる。未知の二酸化炭素濃度を検量するためには、システムをまず、既知の濃度の測定プローブで較正し、それによって、蛍光の強さを濃度の関数としてプロットする。
【0053】
本発明はさらに、蛍光によって二酸化炭素を定性的および定量的に測定するための、本発明のセンサの使用に関する。
【0054】
本発明により、二酸化炭素の定性的および定量的測定のためのセンサが調製される。センサは、それらに含まれるポリアニオン性蛍光染料が疎水性ポリマー層に埋め込まれるため、水性プローブに対する優れた安定性が注目に値する。この方法では、センサが水性プローブと接触した時に、染料の染み出しが防止される。加えて、本発明にしたがって使用されるフェノレーションの、ヒドロキシルイオンよりも低い塩基度の結果として、ホフマン脱離または求核置換による第四級オニウムイオンの分解が起こらないため、本発明のセンサは優れた長期的安定性を有する。
【0055】
以下の例によって本発明をより詳細に説明する。
A)第四級フェノラート類の製造
例1:下記のものの製造
【0056】
【化6】
【0057】
a)下記のものの製造
【0058】
【化7】
【0059】
KOHの15%水溶液3.8mlを、メタノール120ml中にアセトフェノン23.2mlおよび3−メトキシベンズアルデヒド24.3mlを含む溶液に、室温で滴下した。反応混合物を室温で夜通し攪拌し、次いで、2N HCl 100mlを加えることによって酸性化した。メタノールを蒸発させたのち、水性残渣をエーテルで3回抽出した。有機相を水および塩化ナトリウム溶液で洗浄し、MgSO4上で乾燥し、溶媒を蒸発させた。粗生成物を、高真空下、蒸留によって精製した。
Bp0.055mbar:162℃;収量:30.4g(理論値の64%)
【0060】
b)下記のものの製造
【0061】
【化8】
【0062】
トリフェニルホスフィン6.9gおよび2−フェニルエチルブロマイド5.0gをトルエン35mlに溶解し、還流下で24時間加熱した。その後、溶媒を蒸発させ、結晶質の残渣をエーテルで精製した。収率:理論値の93%
【0063】
c)下記のものの製造
【0064】
【化9】
【0065】
無水テトラヒドロフラン120ml中に、b)にしたがって製造したホスホニウムブロマイド4.5gを含む懸濁液に、アルゴン雰囲気下、−18℃で、ブチルリチウムの1.6M溶液8.2mlを滴下した。得られた明澄な溶液に、無水テトラヒドロフラン20ml中に、例1aの化合物2.4gを含む溶液を加えた。反応混合物を室温まで加熱し、4日間攪拌した。その後、水およびエーテルを加え、有機相を分離し、塩化ナトリウム溶液で洗浄し、乾燥し、蒸発によって濃縮した。油状の残渣を、シリカゲル上、CH2Cl2/ヘキサンを溶離剤として使用するクロマトグラフィーに付した。収量:1.85g(理論値の57%);1H−NMR(CDCl3):3.35(m,2H,CH2);3.78(s,3H,OCH3);6.0〜6.1(m,2H,2C=CH)
【0066】
d)下記のものの製造
【0067】
【化10】
【0068】
テトラヒドロフラン15ml中、c)にしたがって製造した化合物0.5gおよびカーボンに担持したPd(10%)0.05gを、水素雰囲気下で12時間激しく攪拌した。その後、反応混合物をろ過し、ろ液を蒸発乾固し、それによって、目的生成物を定量的収率で得た。1H−NMR(CDCl3):1.80〜2.05(m,4H,2CH2);2.35〜2.50(m,4H,2CH2);2.55〜2.65(m,1H,CH);3.78(s,3H,OCH3);6.60〜7.40(m,14arom.H)
【0069】
e)下記のものの製造
【0070】
【化11】
【0071】
d)にしたがって製造した化合物7.83gをジクロロメタン200mlに溶解し、−78℃に冷却した。三臭化ホウ素3.4mlをこの溶液に滴下した。反応混合物を室温で17時間攪拌し、氷に注加した。混合物のpH値を1にし、エーテルで抽出し、塩化ナトリウム溶液で洗浄し、MgSO4で乾燥し、溶媒を蒸発させたのち、得られた粗生成物を、シリカゲル上、ジクロロメタン/ヘキサン(1:1)を溶離剤として使用するフラッシュクロマトグラフィーによって精製した。MS:316
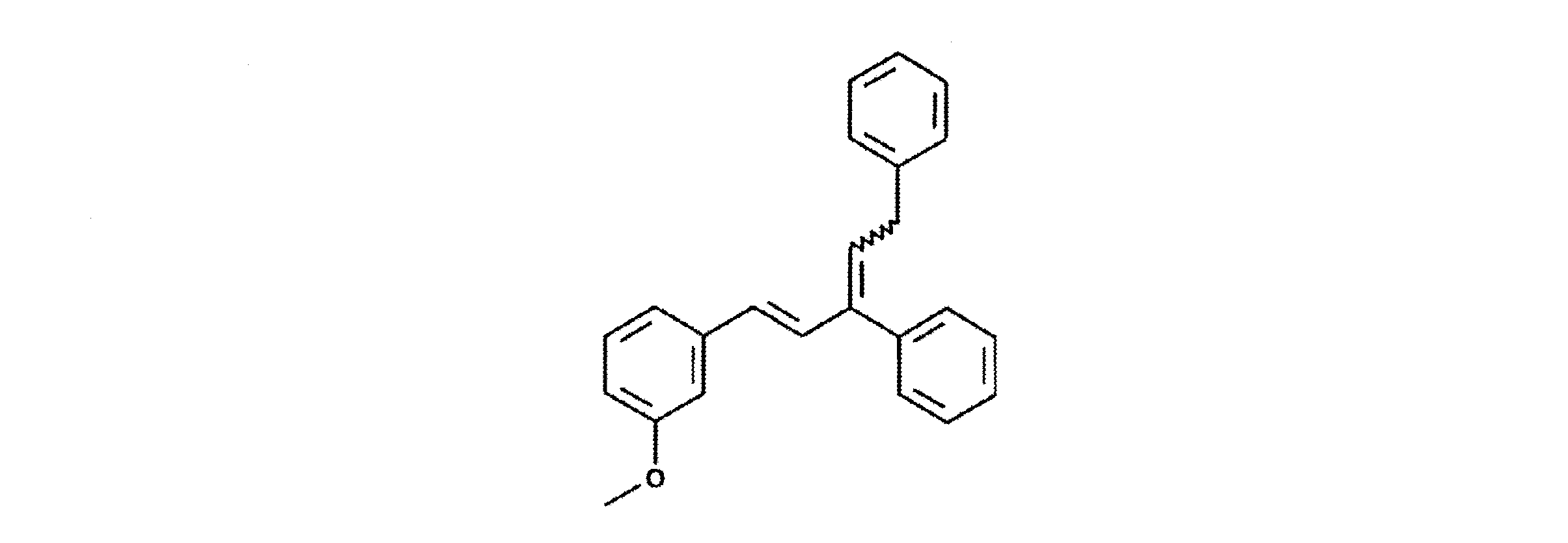
【0072】
f)テトラブチルアンモニウム〔3−(3,5−ジフェニルペンチル)フェノラート〕の製造
【0073】
【化12】
【0074】
メタノール中水酸化テトラブチルアンモニウムの新鮮な1M溶液10mlに、e)にしたがって製造したフェノール10mmolを加えた。得られた溶液を蒸発乾固した。得られた結晶質の化合物をエーテルで洗浄し、40℃で乾燥した。収率:定量的
【0075】
他の第四級フェノラート類を同様な方法で製造することができる。油状の生成物が得られるならば、バルブチューブオーブン中、40℃で乾燥させることが有利である。
【0076】
B)安定性試験
下記式
【0077】
【化13】
【0078】
にしたがったホフマン脱離により、溶液中の水酸化テトラブチルアンモニウムおよびテトラブチルアンモニウム−p−メチルフェノラートが、時間に依存して、トリブチルアミン、1−ブテン、および水またはフェノール(X=Hまたはp−メチルフェニル)に分解する程度に関して調査を実施した。
【0079】
各試験物質3・10-2Mのペル重水素トルエン溶液を調製した。これらの溶液各1mlに、ヒドロキシピレン−トリ−Na−スルホネート(HPTS)の溶液(1mlあたりHPTS1mg/ml(1.91mmol)を含有する)160μlを加えた。このようにして調製した各溶液のサンプルをNMRチューブに封入し、35℃で貯蔵した。該物質の分解は、全52日間にわたる測定プローブのNMR分光分析によって測定し、その結果、分解の基準は、全NMRスペクトルの見かけに加えて、その特徴的な信号によって検出されるトリブチルアミンの形成であった。測定結果を以下の表にまとめる。表中、%値は、元々存在していた量に対する得られたトリブチルアミンの量を示す。
【0080】
【表1】
【0081】
C)センサの製造
a)ポリスチレン中のテトラブチルアンモニウムフェノラート
ポリスチレン(カタログNo. 039A、米国Scientific Polymer Products社製)600mgをテトラヒドロフラン(含量6%)6mlに溶解することにより、ポリマーの貯蔵溶液を製造した。加えて、8−ヒドロキシピレン−1,3,6−トリスルホン酸の三ナトリウム塩:HPTS(Molecular Probes社、米国オレゴン州)6.6mgをメタノール(2.5・10-3mol/l)5mlに溶解することにより、発蛍光団の貯蔵溶液を製造し、また、テトラブチルアンモニウムフェノラート150mgを0.3ml(1mol/l溶液)に溶解することにより、第四級フェノラートの貯蔵溶液を製造した。その後、発蛍光団の貯蔵溶液0.067mlおよび第四級フェノラートの貯蔵溶液0.042mlをポリマーの貯蔵溶液2mlに加えることにより、スピンコーティーング法におけるコーティーングのための出発溶液(濃度−HPTS:8.37・10-5mol/l;第四級フェノラート:2.09・10-2mol/l)を製造した。この溶液0.2mlを取り出し、ピペットを使用して、直径18mmの清浄化した丸いカバーガラスに適用した。該カバーガラスを、まず2000rpmで20秒間回転させ、次に9000rpmで30秒間回転させた。センサを、光から保護し、室温で夜通し乾燥した。以下の表は、該センサを用いて得られた測定結果を示す。
【0082】
【表2】
【0083】
b)ポリスチレン中のテトラブチルアンモニウム〔3−(3,5−ジフェニルペンチル)フェノラート〕(化合物f)
ポリスチレン(カタログNo. 039A、米国Scientific Polymer Products社製)600mgをテトラヒドロフラン(含量6%)6mlに溶解することにより、ポリマーの貯蔵溶液を製造した。加えて、8−ヒドロキシピレン−1,3,6−トリスルホン酸の三ナトリウム塩:HPTS(Molecular Probes社、米国オレゴン州)6.6mgをメタノール(2.5・10-3mol/l)5mlに溶解することにより、発蛍光団の貯蔵溶液を製造し、また、テトラブチルアンモニウム〔3−(3,5−ジフェニルペンチル)フェノラート〕167mgを0.3ml(1M溶液)に溶解することにより、第四級フェノラートの貯蔵溶液を製造した。その後、発蛍光団の貯蔵溶液0.067mlおよび第四級フェノラートの貯蔵溶液0.042mlをポリマーの貯蔵溶液2mlに加えることにより、スピンコーティーング法におけるコーティーングのための出発溶液(濃度−HPTS:8.37・10-5mol/l;第四級フェノラート:2.09・10-2mol/l)を製造した。この溶液0.2mlを取り出し、ピペットを使用して、直径18mmの清浄化した丸いカバーガラスに適用した。該カバーガラスを、まず2000rpmで20秒間回転させ、次に9000rpmで30秒間回転させた。該センサを、光から保護し、室温で夜通し乾燥した。以下の表は、該センサを用いて得られた測定結果を示す。
【0084】
【表3】
【0085】
c)エチルセルロース中のテトラブチルアンモニウムフェノラート
エチルセルロースの5%溶液をポリマーの貯蔵溶液として使用したことを除き、上述した手法と同様にしてセンサを製造した。該溶液は、エチルセルロース(Aldrich社、米国ウィスコンシン州ミルウォーキー)300mgをテトラヒドロフラン6mlに溶解することによって製造した。
【0086】
【表4】
【0087】
d)エチルセルロース中のテトラブチルアンモニウム〔3−(3,5−ジフェニルペンチル)−フェノラート〕
エチルセルロースの5%溶液をポリマーの貯蔵溶液として使用したことを除き、上述した手法と同様にしてセンサを製造した。該溶液は、エチルセルロース(Aldrich社、米国ウィスコンシン州ミルウォーキー)300mgをテトラヒドロフラン6mlに溶解することによって製造した。
【0088】
【表5】
Claims (11)
- 該キャリヤーが透明な材料からなる、請求項1記載のセンサ。
- 該キャリヤーが、ポリカーボネート類またはポリアクリレート類から選択される合成材料からなる、請求項1または2記載のセンサ。
- 該感光層が、ベース物質として、アクリルポリマー類、アクリルコポリマー類、ポリ塩化ビニル、ポリ酢酸ビニル、ポリエチレン、ポリプロピレン、ポリ−(イソブテン−コ−イソプレン)、ポリ−(4−メチルペンテン)、ポリウレタン類、セルロース誘導体類、ポリスチレン、ポリテトラフルオロエチレン、ポリオキシメチレン、ポリエステル類、ポリジエン類、ジエン類とアクリロニトリルとのコポリマー類、およびポリイソプレンを含む群より選択されるポリマーを含有する、請求項1〜3のいずれか1項記載のセンサ。
- 該感光層が、ベース物質として、ポリスチレンおよびエチルセルロースを含む群より選択されるポリマーを含有する、請求項1〜4のいずれか1項記載のセンサ。
- 基R 1 、R 2 、R 3 およびR 4 が、n−ブチルを表す、請求項1〜5のいずれか1項記載のセンサ。
- 基R 5 、R 6 、R 7 、R 8 およびR 9 が、互いに独立して、水素、C 1 〜C 10 アルキルまたは3,5−ジフェニルペンチルをそれぞれ表す、請求項1〜5のいずれか1項記載のセンサ。
- 基R 5 、R 6 、R 7 、R 8 およびR 9 が、互いに独立して、水素、メチルまたはモノ−もしくはジフェニル−C 1 〜C 6 アルキル基をそれぞれ表す、請求項1〜5のいずれか1項記載のセンサ。
- 基R 5 、R 7 、R 8 およびR 9 が、それぞれ水素を表し、基R 6 は、3,5−ジフェニルペンチルを意味するか、または、基R 5 、R 6 、R 7 およびR 8 が、それぞれ水素を表し、基R 9 は、メチルを意味する、請求項1〜8のいずれか1項記載のセンサ。
- ベース物質としてのポリマー、2〜10の誘電定数の媒体中で活性化され得るアニオン性蛍光染料および活性化剤としての請求項1で定義された式Iの第四級アンモニウムフェノラートの含有を特徴とする感光性組成物。
- 測定プローブにおける二酸化炭素の蛍光による光学的測定の方法であって、請求項1〜9のいずれか1項記載のセンサを測定プローブと接触させたのち、感光層中の発蛍光団の蛍光の変化を測定することを特徴とする方法。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP97810576.5 | 1997-08-18 | ||
| EP97810576 | 1997-08-18 | ||
| PCT/EP1998/005167 WO1999009406A1 (en) | 1997-08-18 | 1998-08-14 | Optical carbon dioxide sensors |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2001516026A JP2001516026A (ja) | 2001-09-25 |
| JP2001516026A5 JP2001516026A5 (ja) | 2006-01-05 |
| JP4283989B2 true JP4283989B2 (ja) | 2009-06-24 |
Family
ID=8230346
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2000510020A Expired - Fee Related JP4283989B2 (ja) | 1997-08-18 | 1998-08-14 | 光学式二酸化炭素センサ |
Country Status (7)
| Country | Link |
|---|---|
| US (1) | US6338822B1 (ja) |
| EP (1) | EP1005645B1 (ja) |
| JP (1) | JP4283989B2 (ja) |
| AT (1) | ATE294387T1 (ja) |
| AU (1) | AU9262698A (ja) |
| DE (1) | DE69829977T2 (ja) |
| WO (1) | WO1999009406A1 (ja) |
Families Citing this family (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE19858967C1 (de) * | 1998-12-21 | 2000-07-13 | Bayer Ag | Flüssige Formulierung von Tetrabutylammoniumphenolat |
| DE10031555B4 (de) * | 2000-06-28 | 2010-04-15 | Robert Bosch Gmbh | Optischer Sensor |
| US7807473B2 (en) * | 2005-10-26 | 2010-10-05 | General Electric Company | Material compositions for sensors for determination of chemical species at trace concentrations and method of using sensors |
| WO2008095960A1 (en) * | 2007-02-08 | 2008-08-14 | Dsm Ip Assets B.V. | Gas sensor |
| EP1965198A1 (en) * | 2007-02-27 | 2008-09-03 | F. Hoffmann-La Roche AG | Dry optical-chemical carbon-dioxide sensor |
| US7883898B2 (en) | 2007-05-07 | 2011-02-08 | General Electric Company | Method and apparatus for measuring pH of low alkalinity solutions |
| DE102008017521A1 (de) | 2008-04-04 | 2009-10-15 | Rheinmetall Landsysteme Gmbh | ABC-dichtes Fahrzeug mit CO2-Sensoren sowie Verfahren zur Innenraumluftgüteregelung |
| US9545530B2 (en) | 2012-07-11 | 2017-01-17 | B/E Aerospace, Inc. | Aircraft crew member protective breathing apparatus |
| US9498656B2 (en) | 2012-07-11 | 2016-11-22 | B/E Aerospace, Inc. | Aircraft crew member protective breathing apparatus |
| JP6239105B2 (ja) * | 2013-07-10 | 2017-11-29 | ビーイー・エアロスペース・インコーポレーテッドB/E Aerospace, Inc. | 航空機乗務員の保護呼吸装置 |
| EP3168603B1 (en) | 2015-11-11 | 2019-06-19 | ams AG | Method for manufacturing a semiconductor component |
| US20210285877A1 (en) * | 2020-03-10 | 2021-09-16 | SciLogica Corp. | Polymer matrix for sensing |
Family Cites Families (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB9200431D0 (en) | 1992-01-09 | 1992-02-26 | Abbey Biosystems Ltd | Carbon dioxide detector |
| US5387525A (en) | 1993-09-03 | 1995-02-07 | Ciba Corning Diagnostics Corp. | Method for activation of polyanionic fluorescent dyes in low dielectric media with quaternary onium compounds |
| GB9426053D0 (en) | 1994-12-19 | 1995-02-22 | Trigon Ind Ltd | A carbon dioxide sensitive material |
| SE504069C2 (sv) | 1995-02-03 | 1996-10-28 | Icor Ab | Kolorimetrisk anordning för att indikera koldioxid |
| ES2103197B1 (es) | 1995-08-04 | 1998-01-16 | Univ Alcala Henares | Pasta conductora, electrodos y sensores electroquimicos que comprenden dicha pasta conductora, y su metodo de preparacion. |
-
1998
- 1998-08-14 AU AU92626/98A patent/AU9262698A/en not_active Abandoned
- 1998-08-14 AT AT98945244T patent/ATE294387T1/de not_active IP Right Cessation
- 1998-08-14 US US09/485,995 patent/US6338822B1/en not_active Expired - Fee Related
- 1998-08-14 WO PCT/EP1998/005167 patent/WO1999009406A1/en not_active Ceased
- 1998-08-14 JP JP2000510020A patent/JP4283989B2/ja not_active Expired - Fee Related
- 1998-08-14 EP EP98945244A patent/EP1005645B1/en not_active Expired - Lifetime
- 1998-08-14 DE DE69829977T patent/DE69829977T2/de not_active Expired - Lifetime
Also Published As
| Publication number | Publication date |
|---|---|
| US6338822B1 (en) | 2002-01-15 |
| EP1005645A1 (en) | 2000-06-07 |
| JP2001516026A (ja) | 2001-09-25 |
| DE69829977T2 (de) | 2005-10-06 |
| DE69829977D1 (de) | 2005-06-02 |
| WO1999009406A1 (en) | 1999-02-25 |
| AU9262698A (en) | 1999-03-08 |
| EP1005645B1 (en) | 2005-04-27 |
| ATE294387T1 (de) | 2005-05-15 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP4283989B2 (ja) | 光学式二酸化炭素センサ | |
| JP2688549B2 (ja) | 1,2−ジオキセタン製造用のアルケン化合物 | |
| EP0490631A2 (en) | Ion-selective electrodes | |
| JPH10338695A (ja) | インダセン誘導体 | |
| US5599913A (en) | Chromoionophores, optical sensors containing them and a method for determining the presence of alkali metal cations or of a base | |
| JP2017504574A (ja) | ボロンジピロメテン蛍光プローブ、その製造方法及び応用 | |
| JP6177931B2 (ja) | 選択的にマグネシウムイオンを決定するための多層デバイス | |
| Chen et al. | A novel single-fluorophore-based ratiometric fluorescent probe for detection of formaldehyde in air | |
| WO1999051586A1 (en) | Reagent for singlet oxygen determination | |
| EP0306802B1 (en) | Chiral crown ethers | |
| US5136033A (en) | Ion selective fluorogenic reagents | |
| CN106608862A (zh) | 一种长波长检测肼的荧光探针及其合成方法与应用 | |
| Das et al. | A concentration dependent auto-relay-recognition by the same analyte: a dual fluorescence switch-on by hydrogen sulfide via Michael addition followed by reduction and staining for bio-activity | |
| US6207461B1 (en) | Process for the preparation of platinum or palladium benzoporphyrins and platinum or palladium cyclohexenoporphyrins, intermediates, and an oxygen sensor comprising platinum or palladium cyclohexenoporphyrin | |
| CN106008510A (zh) | 用于检测Hg2+的聚集诱导发光型荧光传感器及其制备方法和应用 | |
| JP3364313B2 (ja) | ポルフィリン/インジウム錯体及び陰イオン感応膜 | |
| CN120157647A (zh) | 一种检测水合肼的近红外荧光探针及其制备方法与应用 | |
| CN118290599A (zh) | 一种用于次氯酸检测的纤维素基荧光探针及其制备方法与应用 | |
| US5133934A (en) | Ionosphere and reporter substance incorporated into a hydrophobic carrier | |
| JP2005514405A (ja) | カリウムフルオロイオノフォア | |
| CN113354662B (zh) | 一种上/下转换荧光探针四溴代荧光素螺环内硫酯及其制备方法与应用 | |
| CN103923017B (zh) | 双丹酰基组氨酸及其应用 | |
| JP3093069B2 (ja) | 光応答性カリックスアレーン誘導体を用いるイオン選択性電極 | |
| Burden et al. | Isomerism in bicyclic diacetals. Part I. 1, 3: 2, 4-and 1, 4: 2, 3-di-O-methylene-erythritol | |
| CN115677657B (zh) | 噻蒽衍生物、使用其制备的氧气传感薄膜器件及其应用 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20050804 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20050804 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20080502 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20080701 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20080925 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20081002 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20081030 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20081031 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20090224 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20090323 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20120327 Year of fee payment: 3 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20130327 Year of fee payment: 4 |
|
| LAPS | Cancellation because of no payment of annual fees |