JP4138024B2 - マクロモノマーの合成方法 - Google Patents
マクロモノマーの合成方法 Download PDFInfo
- Publication number
- JP4138024B2 JP4138024B2 JP54609998A JP54609998A JP4138024B2 JP 4138024 B2 JP4138024 B2 JP 4138024B2 JP 54609998 A JP54609998 A JP 54609998A JP 54609998 A JP54609998 A JP 54609998A JP 4138024 B2 JP4138024 B2 JP 4138024B2
- Authority
- JP
- Japan
- Prior art keywords
- group
- polymer
- macromonomer
- halogen
- ampoule
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Classifications
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08F—MACROMOLECULAR COMPOUNDS OBTAINED BY REACTIONS ONLY INVOLVING CARBON-TO-CARBON UNSATURATED BONDS
- C08F290/00—Macromolecular compounds obtained by polymerising monomers on to polymers modified by introduction of aliphatic unsaturated end or side groups
- C08F290/02—Macromolecular compounds obtained by polymerising monomers on to polymers modified by introduction of aliphatic unsaturated end or side groups on to polymers modified by introduction of unsaturated end groups
- C08F290/04—Polymers provided for in subclasses C08C or C08F
- C08F290/046—Polymers of unsaturated carboxylic acids or derivatives thereof
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08F—MACROMOLECULAR COMPOUNDS OBTAINED BY REACTIONS ONLY INVOLVING CARBON-TO-CARBON UNSATURATED BONDS
- C08F2/00—Processes of polymerisation
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08F—MACROMOLECULAR COMPOUNDS OBTAINED BY REACTIONS ONLY INVOLVING CARBON-TO-CARBON UNSATURATED BONDS
- C08F2/00—Processes of polymerisation
- C08F2/38—Polymerisation using regulators, e.g. chain terminating agents, e.g. telomerisation
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08F—MACROMOLECULAR COMPOUNDS OBTAINED BY REACTIONS ONLY INVOLVING CARBON-TO-CARBON UNSATURATED BONDS
- C08F265/00—Macromolecular compounds obtained by polymerising monomers on to polymers of unsaturated monocarboxylic acids or derivatives thereof as defined in group C08F20/00
- C08F265/04—Macromolecular compounds obtained by polymerising monomers on to polymers of unsaturated monocarboxylic acids or derivatives thereof as defined in group C08F20/00 on to polymers of esters
- C08F265/06—Polymerisation of acrylate or methacrylate esters on to polymers thereof
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08F—MACROMOLECULAR COMPOUNDS OBTAINED BY REACTIONS ONLY INVOLVING CARBON-TO-CARBON UNSATURATED BONDS
- C08F212/00—Copolymers of compounds having one or more unsaturated aliphatic radicals, each having only one carbon-to-carbon double bond, and at least one being terminated by an aromatic carbocyclic ring
- C08F212/02—Monomers containing only one unsaturated aliphatic radical
- C08F212/04—Monomers containing only one unsaturated aliphatic radical containing one ring
- C08F212/06—Hydrocarbons
- C08F212/08—Styrene
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08F—MACROMOLECULAR COMPOUNDS OBTAINED BY REACTIONS ONLY INVOLVING CARBON-TO-CARBON UNSATURATED BONDS
- C08F218/00—Copolymers of compounds having one or more unsaturated aliphatic radicals, each having only one carbon-to-carbon double bond, and at least one being terminated by an acyloxy radical of a saturated carboxylic acid, of carbonic acid or of a haloformic acid
- C08F218/02—Esters of monocarboxylic acids
- C08F218/04—Vinyl esters
- C08F218/06—Vinyl formate
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08F—MACROMOLECULAR COMPOUNDS OBTAINED BY REACTIONS ONLY INVOLVING CARBON-TO-CARBON UNSATURATED BONDS
- C08F220/00—Copolymers of compounds having one or more unsaturated aliphatic radicals, each having only one carbon-to-carbon double bond, and only one being terminated by only one carboxyl radical or a salt, anhydride ester, amide, imide or nitrile thereof
- C08F220/02—Monocarboxylic acids having less than ten carbon atoms; Derivatives thereof
- C08F220/04—Acids; Metal salts or ammonium salts thereof
- C08F220/06—Acrylic acid; Methacrylic acid; Metal salts or ammonium salts thereof
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08F—MACROMOLECULAR COMPOUNDS OBTAINED BY REACTIONS ONLY INVOLVING CARBON-TO-CARBON UNSATURATED BONDS
- C08F220/00—Copolymers of compounds having one or more unsaturated aliphatic radicals, each having only one carbon-to-carbon double bond, and only one being terminated by only one carboxyl radical or a salt, anhydride ester, amide, imide or nitrile thereof
- C08F220/02—Monocarboxylic acids having less than ten carbon atoms; Derivatives thereof
- C08F220/10—Esters
- C08F220/12—Esters of monohydric alcohols or phenols
- C08F220/14—Methyl esters, e.g. methyl (meth)acrylate
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08F—MACROMOLECULAR COMPOUNDS OBTAINED BY REACTIONS ONLY INVOLVING CARBON-TO-CARBON UNSATURATED BONDS
- C08F220/00—Copolymers of compounds having one or more unsaturated aliphatic radicals, each having only one carbon-to-carbon double bond, and only one being terminated by only one carboxyl radical or a salt, anhydride ester, amide, imide or nitrile thereof
- C08F220/02—Monocarboxylic acids having less than ten carbon atoms; Derivatives thereof
- C08F220/10—Esters
- C08F220/12—Esters of monohydric alcohols or phenols
- C08F220/16—Esters of monohydric alcohols or phenols of phenols or of alcohols containing two or more carbon atoms
- C08F220/18—Esters of monohydric alcohols or phenols of phenols or of alcohols containing two or more carbon atoms with acrylic or methacrylic acids
- C08F220/1804—C4-(meth)acrylate, e.g. butyl (meth)acrylate, isobutyl (meth)acrylate or tert-butyl (meth)acrylate
Landscapes
- Chemical & Material Sciences (AREA)
- Health & Medical Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Medicinal Chemistry (AREA)
- Polymers & Plastics (AREA)
- Organic Chemistry (AREA)
- Addition Polymer Or Copolymer, Post-Treatments, Or Chemical Modifications (AREA)
- Macromonomer-Based Addition Polymer (AREA)
- Polymerisation Methods In General (AREA)
Description
本発明は、一置換ビニルモノマーに基づいた一般構造1で表される分枝ω−不飽和ポリマー(マクロモノマー)を製造するためのフリーラジカル重合方法に関する。
一置換ビニルモノマーに基づいたマクロモノマーの合成は、付加−分断連鎖移動剤を用いることにより、以前に行われている。例えば、硫化アリル連鎖移動剤の存在下におけるアクリレートモノマーの重合によるものである(Rizzardo他、Macomol、Symp.、111巻、1頁、1996年)。マクロモノマーの合成は、コバルト触媒連鎖移動剤の存在下で、ある一置換モノマーと、アルファ−メチルビニルモノマー(例えばメタクリレートモノマー)との共重合によっても行われている。例えば、WO9731030を参照のこと。本発明の方法は、重合開始剤以外に試薬を加えることを必用としないものである。
反応条件を選択して変換率を最大にし、かつ分子量を制御する、種々のモノマー(特に、アクリルモノマー)の重合が、以前に行われている。例えば、米国特許第4,546,160号には、高い反応温度で反応を行って分子量を制限する、アクリルモノマーまたはメタクリルモノマーに基づいたポリマーの合成方法が記載されている。しかしながら、マクロモノマーの純度または分枝構造を最適にする反応条件を設計することには、注意を払っていない。
米国特許第5,710,227には、アクリル酸およびそれの塩に基づいたマクロモノマーの合成が記載されている。この方法は、高い反応温度(典型的には、225℃より大きい)で行っており、マクロモノマーの純度または分枝形成度を制御するのに必要な条件は記載されていない。さらに、特許権者は、重合温度が200℃より低くなるにしたがい、マクロモノマーの純度が低下することを報告している。この方法はさらに、アクリル酸およびそれの塩のモノマーを含有するポリマーに限定されている。
慣用的な実施において、重合を高い反応温度で行うときには、開始剤由来ラジカルのフラックス(flux)が高い条件下で一般に行われる。これらの条件は、高純度マクロモノマーの合成に適していない。本明細書中に開示する方法は、マクロモノマーの分子量と、該マクロモノマー中の分枝度とを制御することができる指針を規定している。本明細書中に記載する方法では、高純度(90%より大きい)マクロモノマーを、100℃より低い温度を含む任意の重合温度で調製するものである。本明細書中に記載する方法は、アリクリレート、スチレン、およびビニルエステルのω−不飽和ホモポリマーの調製に用いることができる。さらに、該方法は、1つもしくは複数の一置換ビニルモノマーに基づいた、または1つもしくは複数のアルファ−置換ビニルモノマーに基づいた、高純度ω−不飽和ランダムコポリマーの調製指針を開示する。
本発明の要旨
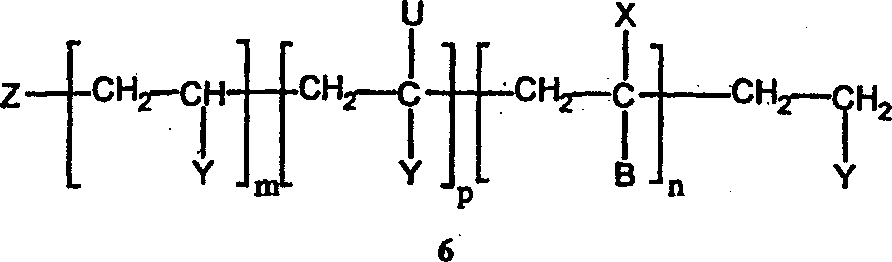
本発明は、一般構造(1)で表されるポリマーの合成方法に関するものであって、
(A)
(a)CH2=CHYと、
(b)任意選択で、CH2=CXBと、
(c)フリーラジカル供給源から生成したフリーラジカルと
を接触させることと、
(上式で、
Xは、ハロゲン、または任意選択で置換されたC1〜C4アルキル(この場合、該置換基は、ヒドロキシ、アルコキシもしくはアリールオキシ(OR)、カルボキシ、アシルオキシもしくはアロイルオキシ(O2CR)、アルコキシカルボニルもしくはアリールオキシカルボニル(CO2R)から成る群から独立して選択される)から成る群から独立して選択され、
Yは、R、CO2H、CO2R、COR、CN、CONH2、CONHR、CONR2、O2CR、OR、またはハロゲンから成る群から独立して選択され、
Bは、R、CO2H、CO2R、COR、CN、CONH2、CONHR、CONR2、O2CR、OR、ハロゲン、またはポリマー鎖から成る群から選択され、
Rは、任意選択で置換された、C1〜C18アルキル、C2〜C18アルケニル、アリール、複素環基、アラルキル、またはアルカリール(alkaryl)から成る群(この場合、該置換基は、エポキシ、ヒドロキシ、アルコキシ、アシル、アシルオキシ、カルボキシ(および塩)、スルホン酸(および塩)、アルコキシカルボニルもしくはアリールオキシカルボニル、イソシアナト、シアノ、シリル、ハロ、およびジアルキルアミノから成る群から独立して選択される)から選択され、
Zは、Hと、任意選択で置換された、アルキル、シクロアルキル、アリール、アラルキル、アルカリール、有機シリル、アルコキシアルキル、アルコシキアリール、ヒドロキシ、ヒドロペルオキシ、アルキルペルオキシ、アルコキシ、アロイルオキシの基のフリーラジカル開始剤誘導フラグメント(この場合、置換基は、R、OR、O2CR、ハロゲン、CO2H(および塩)、CO2R、CN、CONH2、CONHR、CONR2、スルフェート、
から選択される)とから成る群から選択され、
m≧1であり、
n≧0であり、
p≧0であり、
mおよびnの一方または両方が1より大きい場合、繰り返し単位は同じかまたは相違し、
[CH2−CUY]p部分は、分枝点Uを含有し、そしてUが、構造(1)に由来し、ランダム構造(2)中に存在する。)
(B)次の可変要素を調整することにより、ポリマーの特性を制御すること、
(i) (a)/(b)のモル比を増加させることにより、ビニル末端ポリマーの割合を増加させること、
(ii) (c)/(a)+(b)のモル比を減少させることにより、ビニル末端ポリマーの割合を増加させること、
(iii) 次のようにして、分枝度(pの値)を制御すること、
(d) 温度を上げることにより、pを減少すること、
(e) モノマー濃度を減少することにより、pを減少すること、
(f) 変換率を増加することにより、pを増加すること、
(iv) 次のようにして、分子量を制御すること、
(g) モノマー濃度を減少することにより、分子量を減少させること、
(h) 温度を上げることにより、分子量を減少させること
とを含む、方法に関する。
ビニル末端ポリマーの割合は、50%以上であることが好ましく、70%より大きいことがより好ましい。分枝度は、平均して、鎖あたり10以下の分枝であることが好ましい。重合度(m+n+p)は、1から約500であることが好ましい。
発明の詳細な説明
我々は、反応条件を適当に選択した一置換モノマーの重合を行うことにより、マクロモノマー(1)を合成できることを見出した。モノマーCH2=CHYおよびCH2=CXBは、重合可能なモノマーまたは共重合可能なモノマーである。当業者は理解していることであるが、モノマーの選択は、その立体特性および電気特性により決められる。種々のモノマーの重合能(polymerizability)および共重合能を決定する要素は、当該技術分野における文書に詳しく示されている。例えば、Greenley、in Polymer Handbook 第3版(BrandupおよびImmergut編)、ニューヨーク州Wiley、pII/53、1989年)を参照のこと。
好ましい一置換モノマー(CH2=CHY)は、1つまたは複数の次のものである:アクリル酸メチル、アクリル酸エチル、アクリル酸プロピル(すべての異性体)、アクリル酸ブチル(すべての異性体)、アクリル酸2−エチルヘキシル、アクリル酸イソボルニル、アクリル酸、アクリル酸ベンジル、アクリル酸フェニル、アクリロニトリル、スチレン、官能性アクリレート(アクリル酸グリシジル、アクリル酸2−ヒドロキシエチル、アクリル酸ヒドロキシプロピル(すべての異性体)、アクリル酸ヒドロキシブチル(すべての異性体)、アクリル酸ジエチルアミノエチル、アクリル酸トリエチレングリコールから選択されるもの)、N−tert−ブチルアクリルアミド、N−n−ブチルアクリルアミド、N−n−メチロールアクリルアミド、N−エチロールアクリルアミド、ビニル安息香酸(すべての異性体)、ジエチルアミノスチレン(すべての異性体)、p−ビニルベンゼンスルホン酸、アクリル酸トリメトキシシリルプロピル、アクリル酸トリエトキシシリルプロピル、アクリル酸トリブトキシシリルプロピル、アクリル酸ジメトキシメチルシリルプロピル、アクリル酸ジエトキシメチルシリルプロピル、アクリル酸ジブトキシメチルシリルプロピル、アクリル酸ジイソプロポキシメチルシリルプロピル、アクリル酸ジメトキシシリルプロピル、アクリル酸ジエトキシシリルプロピル、アクリル酸ジブトキシシリルプロピル、アクリル酸ジイソプロポキシシリルプロピル、酢酸ビニル、酪酸ブチル、塩化ビニル、フッ化ビニル、臭化ビニル、およびプロペン。
好ましいニ置換モノマー(CH2=CXB)は、1つまたは複数の次のものである:メタクリル酸メチル、メタクリル酸エチル、メタクリル酸プロピル(すべての異性体)、メタクリル酸ブチル(すべての異性体)、メタクリル酸2−エチルヘキシル、メタクリル酸イソボルニル、メタクリル酸、メタクリル酸ベンジル、メタクリル酸フェニル、メタクリロニトリル、メタクリル酸グリシジル、メタクリル酸2−ヒドロキシエチル、メタクリル酸ヒドロキシプロピル(すべての異性体)、メタクリル酸ヒドロキシブチル(すべての異性体)、メタクリル酸ジエチルアミノエチル、メタクリル酸トリエチレングリコール、メタクリル酸トリメトキシシリルプロピル、メタクリル酸トリエトキシシリルプロピル、メタクリル酸トリブトキシシリルプロピル、メタクリル酸ジメトキシメチルシリルプロピル、メタクリル酸ジエトキシメチルシリルプロピル、メタクリル酸ジブトキシメチルシリルプロピル、メタクリル酸ジイソプロポキシメチルシリルプロピル、メタクリル酸ジメトキシシリルプロピル、メタクリル酸ジエトキシシリルプロピル、メタクリル酸ジブトキシシリルプロピル、メタクリル酸ジイソプロポキシシリルプロピル、無水イタコン酸、イタコン酸、メタクリルアミド、N−tert−ブチルメタクリルアミド、N−ブチルメタクリルアミド、N−n−メチロールメタクリルアミド、N−エチロールメタクリルアミド、アルファ−メチルスチレン、アルファメチルビニル安息香酸(すべての異性体)、ジエチルアミノアルファ−メチルスチレン(すべての異性体)、およびイソブチレン。
開始ラジカルの供給源は、適当な化合物(過酸化物またはアゾ化合物などの熱開始剤)の熱誘導ホモリテック開裂、モノマー(例えば、スチレン)からの自然発生、レドックス開始系、光化学開始系、または電子ビーム、X−放射線、もしくはγ−放射線などの高エネルギー照射などの、フリーラジカル発生方法のいずれにもよることができる。開始剤はさらに、反応媒体およびモノマー混合物中で可溶でなければならない。
重合温度において適当な半減期を有するように熱開始剤を選択する。これらの開始剤には、1つまたは複数の次の化合物が含まれ得る:2,2’−アゾビス(イソブチロニトリル)、2,2’−アゾビス(2−シアノ−2−ブタン)、ジメチル2,2’−アゾビスジメチルイソブチレート、4,4’−アゾビス(4−シアノペンタン酸)、1,1’−アゾビス(シクロヘキサンカルボニトリル)、2−(t−ブチルアゾ)−2−シアノプロパン、2,2’−アゾビス[2−メチル−N−(1,1)−ビス(ヒドロキシメチル)−2−ヒドロキシエチル]プロピオンアミド、2,2’−アゾビス[2−メチル−N−ヒドロキシエチル)]−プロピオンアミド、2,2’−アゾビス(N,N’−ジメチレンイソブチルアミジン)ジヒドロクロリド、2,2’−アゾビス(2−アミジノプロパン)ジヒドロクロリド、2,2’−アゾビス(N,N’−ジメチレンイソブチルアミン)、2,2’−アゾビス(2−メチル−N−[1,1−ビス(ヒドロキシメチル)−2−ヒドロキシエチル]プロピオンアミド)、2,2’−アゾビス(2−メチル−N−[1,1−ビス(ヒドロキシメチル)−エチル]プロピオンアミド)、2,2’−アゾビス[2−メチル−N−(2−ヒドロキシエチル)プロピオンアミド]、2,2’−アゾビス(イソブチルアミド)2水和物、2,2’−アゾビス(2,2,4−トリメチルペンタン)、2,2’−アゾビス(2−メチルプロパン)、t−ブチルペルオキシアセテート、t−ブチルペルオキシベンゾエート、t−ブチルペルオキシオクトエート、t−ブチルペルオキシネオデカノエート、t−ブチルペルオキシイソブチレート、t−アミルペルオキシピバレート、t−ブチルペルオキシピバレート、ジ−イソプロピルペルオキシジカルボネート、ジシクロヘキシルペルオキシジカルボネート、ジクミルペルオキシド、過酸化ジベンゾイル、過酸化ジラウロイル、ペルオキソ二硫酸カリウム、ペルオキソ二硫酸アンモニウム、次亜硝酸ジ−t−ブチル(di−t−butyl−hyponitrite)、次亜硝酸ジクミル、クミルヒドロペルキシド、t−ブチルヒドロペルキシド。
いかなる特定の機構に限定することを意図するものではないが、マクロモノマー形成過程は、スキーム1に概要するように起こり、主鎖メチン水素を引き抜いて構造3のラジカルを得ることを伴うと考えられている。アクリレート重合におけるポリマーへのこのような連鎖移動は既知である(Lovell他、Polym.Commun.、32巻、98頁、1991年)。しかしながら、当該技術分野では、この過程によって分枝ポリマーが形成されることが示唆されている。我々は、形成されたラジカル3が分断されて、マクロモノマーおよび新規な生長化学種を与える一連の条件を提供する。
主鎖からの水素の引抜きは、原則として、分子間過程(ポリマーへの移動)または分子内過程(バックバイティング)のいずれかの過程により行うことができる。バックバイティングによる主鎖水素の引抜きの機構をスキーム2に示す。この機構により分子量が変換率よって変動することとなる観測挙動がうまく説明される(実施例1を参照のこと)。この機構では、2つの可能な分断経路が存在する。原則として、トリマーマクロモノマー4(経路A)またはダイマー生長ラジカル5(経路B)へと導かれる、経路Aまたは経路Bのいずれによっても分断は可能である。
請求の範囲に記載された方法の条件下において、ラジカル3(任意の機構により形成されたもの)すべてが分断されるならば、ポリマーの分子量は、主鎖引抜きの発生率により決定される。エチレンの重合では、高い反応温度がバックバイティングに好ましいことが知られている。同様の状況がアクリル酸の重合に適用できると思われる。結果として、高い反応温度により、主鎖メチン水素引抜きの発生率が増加し、分断の発生率が増加する。このことにより、ポリマー分子量が減少するという全体的な効果を有する(実施例7を参照のこと)。同様に、モノマー濃度が低いと、重合の生長速度が減少し、主鎖水素原子引抜きの発生率の増加と、これによる分断の増加との機会が与えられることとなる。結果として、低分子量が観測される(実施例10および実施例11を参照のこと)。
要約すると、分子量は、次により制御することができる。(a)反応温度を制御すること。反応温度を高くすると、分子量は低くなる。本明細書中に記載された方法を用い、重合温度60℃でマクロモノマーを調製した(実施例9、番号2を参照のこと)。重合温度は80℃より高いことが好ましく(実施例9、番号1を参照のこと)、100℃より高いことが最も好ましい(実施例4、番号3を参照のこと)。および(b)モノマー濃度を制御すること。モノマーの濃度をより低くすると、分子量はより低くなる。
高温で行われる重合に関しては、実験結果により、モノマー濃度が比較的高くても、ラジカル3の分断はモノマーとの2分子反応よりも優勢であることが示される。150℃(実施例10)と比較して170℃(実施例11)では低分子量となっている実施例10および実施例11の結果を比較のこと。反応温度を低くした場合、ラジカル3の分断と、ラジカル3およびモノマーの反応との間で競合があるのだろう。反応温度が低いと、結果的に、分枝度が高いポリマーとなる(実施例12を参照のこと)。さらに、モノマー濃度を増加することにより、ラジカル3との2分子反応速度が増加し、分枝度がより高いポリマーが生成する(実施例13を参照のこと)。分枝産物は、それでもなおもマクロモノマーであることができる。マクロモノマーへの変換率が増加するにしたがい、マクロモノマーが反応してより分枝度が高いポリマーとなる可能性がより大きくなる(実施例14を参照のこと)。
要約すると、分枝度は、次のものにより制御することができる。(a)反応温度を制御すること。反応温度を高くすると、分枝度は低くなる。(b)モノマー濃度を調整すること。モノマー濃度を低くすると、分枝度は低くなる。(c)モノマーからポリマーへの変換度。モノマーのポリマーへの変換度を増加させることにより、分枝度を増加させることができる。
本発明の方法により形成されたマクロモノマーは、実験条件下で、反応性に富んでいるようである。しかしながら、開始産物は、構造3で表される別のラジカルであり、好ましい反応条件下では、ほとんどの場合、これらのラジカルは分断されるであろう。したがって、この過程は、不純物を形成することとはならない。この反応では、連鎖長を均等にする機会が与えられる。したがって、これらの重合により、これ以外で観測されるものよりも、多分散性をより狭くすることができる。
反応条件を設計するときには、連鎖の停止過程(すなわち、結合、不均化反応)により形成する鎖の数が、マクロモノマーの形成で生じる鎖の数に対して少なくなるように、開始剤濃度(ラジカルフラックス)を用いることが重要である。
マクロモノマーの純度は、1つには、開始剤濃度と、動力学的鎖長(連鎖移動なしに形成されたポリマー鎖の長さ)を決める開始剤由来ラジカルの発生速度とにより決められる。
必要とされるマクロモノマーの純度を与える開始剤濃度の許容範囲は、マクロモノマーの分子量に依存する。上の表式において、モノマー、溶媒、開始剤などへの移動がないことが要件となる。これらが起こるならば、純度は低くなるであろう。モノマーに対する開始剤濃度は、好ましくは1モルパーセントより低く、0.1モルパーセントより低いことがより好ましい。
マクロモノマーの形成機構が、(バックバイティングでなく)ポリマーからの分子内引抜きを伴う場合には、構造6で表される非マクロモノマー産物が、最高で等量形成される。最適条件下でマクロモノマーの純度が90%より大きいことが観測されたことより、この経路の重要性はより低いことを示唆している。
したがって、一般に、マクロモノマーの純度は、全モノマーに対する開始剤のモル比を低下するにより、増加する(実施例4を参照のこと)。
これまで強調した機構および一般的改良条件は、一置換ビニルモノマー(例えば、アクリレート、ビニルエステル、およびスチレンなど)と、他の一置換ビニルモノマーとの共重合にも適用することができる(実施例15、16、23から26を参照のこと)。2つ以上の一置換ビニルモノマーを用いて調製したコポリマーの例では、2種以上の末端基を有するマクロモノマーが得られる。例えば、本発明で詳述した条件下におけるアクリル酸ブチルとスチレンとの共重合では、BMA誘導末端基7を有するω−不飽和ポリマーおよびAMS誘導末端基8を有するω−不飽和ポリマーが得られる(実施例15の1H−NMRを参照のこと)。
これまで強調した機構および一般的改良条件は、一置換ビニルモノマー(例えば、アクリレート、ビニルエステル、およびスチレンなど)と、他のアルファ置換ビニルモノマーとの共重合にも適用することができる。1つもしくは複数のアルファ置換ビニルモノマーを用いて調製したコポリマーの例では、一置換ビニルモノマーに由来するビニル末端基を有するω−不飽和ポリマーが形成される(実施例17から19、27、28を参照のこと)。請求の範囲に記載された方法の開示条件下においては、主鎖からの水素原子の引抜きは、アルファ置換モノマー単位から起こらず、一置換モノマー単位からのみ起こることができる。これにより、スキーム3に示すように、一般構造9のラジカルを生成し、これはフラグメントになると思われる。
これにより、一置換ビニルモノマーに由来する末端基を有するマクロモノマーとなる。このことは、ω−不飽和ポリマーがアルファ置換ビニルモノマーに専ら由来する末端基を有する、WO97/31030の開示事項と対照的である。
さらに、1つもしくは複数のアルファ置換ビニルモノマーを用いて調製されたコポリマーの実施例では、形成されるω-不飽和ポリマーの純度は、用いるアルファ置換ビニルモノマーの相対量に依存する(実施例17から19を参照のこと)。ポリマー鎖中のアルファ置換ビニルモノマー単位の相対量が増加するにつれ、主鎖水素原子の引抜きの起こる可能性はより低くなる。これにより、ポリマーの分子量が増加するという効果を有し、これに従って、デッドポリマーに導く停止過程において生長ラジカルが関与する可能性が増加し、したがって形成されるマクロモノマーの純度が低下する。
一置換ビニルモノマーとアルファ置換ビニルモノマーとから成るコポリマーでは、コポリマーマクロモノマーの純度は、アルファ置換ビニルポリマーの相対量により影響される。アルファ置換ビニルモノマーの割合が減少するにしたがい、コポリマーマクロモノマーの純度は増加する。
本方法を拡張して、開示条件を用いて、一置換ビニルモノマーに基づいた1種類のビニル末端基を含有する一般構造10で表されるω−不飽和ホモポリマーを調製する。
本方法をさらに拡張して、1つの一置換ビニルモノマーと1つもしくは複数のアルファ置換ビニルポリマーとから成る一般構造11で表されるω−不飽和コポリマーを調製することができ、該コポリマーは、一置換ビニルモノマーだけに専ら由来するビニル末端基を有している。
構造1で表されるマクロモノマーは、ブロックコポリマーおよびグラフトコポリマーにも応用することができる。この有用性の例については、米国第5,362,826号およびWO96/15157を参照のこと。逐次的なマクロモノマーの合成およびブロックコポリマーまたはグラフトコポリマーの合成に関する「1ポット」手順は、本発明の範囲に属する。
実施例
一般的な実験条件
すべての実施例において、モノマーを精製し(阻害剤を除去するため)、使用直前にフラッシュ蒸留した。開始剤の量は、全モノマー量に基づいて計算した。アンプル中で行った重合では、凍結−排気−融解のサイクルを繰り返すことにより、脱気を行った。脱気をひとたび完了したら、真空下でアンプルのフレーム密封し、指定温度で指定時間、油浴中で完全に浸した。真空中で揮発成分を除去することにより、すべての反応混合物をワークアップした。回分反応器(機器の記載については、Rainor,K.D.、Strauss,C.R.、Thorn,T.S.、およびTrainor,R.W.、PCT−AU94−00659、1994年;Rainor,K.D.、Strauss,C.R.、Trainor,R.W.、およびThorn,T.S.、J.Org.Chem.、60巻、2456頁、1995年を参照のこと)中で、マイクロ波照射下、加熱した。変換百分率は、特に指示しない限り、重量測定で計算した。
ポリマーおよびグラフトコポリマーの構造は、適当なクロマトグラフィー法および分光法を用いることにより確かめた。ゲル透過クロマトグラフィー(GPC)を用いて、ポリマーの分子量および分子量分散性(多分散性)を測定した。特記しない限り、差動屈折計と、105nm、104nm、103nm、102nm、50nmおよび10nmのウルトラスチラゲルカラムとを備えたウォーターアソーシエイト液体クロマトグラフィーを用いた。テトラヒドロフラン(流速1.0mL/分)を溶離液として用いた。分子量はポリスチレン等量として得た。Mn、Mw、およびMw/Mn(PD)という用語はそれぞれ、数平均分子量、重量平均分子量、および多分散性を表す。
マクロモノマーの純度は、次式で計算した:
[1−(|Mn(計算値)−Mn(観測値)|/Mn(観測値))]×100%
Mn(観測値)は、GPC測定から得られたMnである。
Mn(計算値)は、ポリマーの1H−NMRスペクトルから決定したものである。
ポリ(アクリル酸)マクロモノマーを、以下のようにしてポリ(アクリル酸)マクロモノマーをメチル化することにより誘導されるポリ(アクリル酸メチル)として特性を決定した:
ヤングの容器中で、ポリ(アクリル酸)マクロモノマーをメタノール(4mL/0.1g)中に溶かした。これに続いて、(メタノール中25質量%の)水酸化テトラメチルアンモニウム(1.1モル等量)およびヨウ化メチル(2モル等量)を加えた。この容器を密封し、100℃で2時間加熱した。反応混合物を蒸発乾固して乾燥させ、残渣を酢酸エチルに溶かした。有機溶液を水および飽和塩化ナトリウム溶液で洗浄し、次いで無水硫酸マグネシウムで乾燥した。有機溶液を蒸発乾固すると、油状の残渣としてポリ(アクリル酸メチル)を得た。
別段の言明がない限り、マクロモノマーの13C−NMRおよび1H−NMRは、重クロロホルムで行った。ポリ(アクリル酸ブチル)マクロモノマーの1H−NMRケミカルシフトデータは、別段の言明がない限り、次の通りである;1H−NMR(CDCl3):δ6.3および5.55、ブロード一重線、2H、ビニルのH;4.0、ブロード一重線、2H、OCH2。
次の実施例において、VAZO(登録商標)52は、2,2’−アゾビス−(2,4−ジメチルバレロニトリル)であり、VAZO(登録商標)67は、2,2’−アゾビス−(2−メチルブチロニトリル)であり、VAZO(登録商標)88は、1,1’−アゾビス−(シアノシクロヘキサン)である。VR110は、2,2’−アゾビス−(2,4,4−トリメチルペンタン)であり、VR160は、アゾブタンである。
実施例1
バッチ重合条件下での、変換率の高いポリ(アクリル酸ブチル)(BA)マクロモノマー(マクロ)の調製
アクリル酸ブチル(1g)、酢酸n−ブチル(9g)、およびVR160(100ppm)から成る反応混合物を、6つのアンプルの各々に入れた。溶液を脱気し、アンプルを密封し、150℃で指定時間加熱した。
実施例2
バッチ重合条件下での、変換率の高いポリスチレン(STY)マクロモノマーの調製
スチレン(0.5g)、酢酸n−アミル(9g)、およびVR160(1000ppm)の混合物を、アンプル中に入れた。溶液を脱気し、アンプルを密封し、170℃で7時間加熱した。1H−NMR(アセトン−d6):δ7.6〜7.2、多重線、5H、ArH;δ5.2および4.8、ブロード一重線、2H、ビニルのH。
実施例3
マイクロ波反応器を用いた、バッチ重合条件下での、ポリ(安息香酸ビニル)(VBz)マクロモノマーの調製
安息香酸ビニル(10g)のN,N−ジメチルホルムアミド(90g)保存液(stock solution)、およびクメンヒドロペルオキシド(1000ppm)を反応容器中に入れ、マイクロ波照射下、30分間220℃に加熱した。1H−NMR(アセトン−d6):δ8.0〜7.5、多重線、および7.4〜6.9、多重線、5H、ArH、5.5〜5.4、および5.35〜5.1、ブロード一重線、ビニルのH、および主鎖メチン。
実施例4
バッチ重合条件下でのポリ(アクリル酸ブチル)マクロモノマーの調製−開始剤濃度への−マクロ純度の依存性
番号1と番号2について
アクリル酸ブチル(0.5g)、トルエン(9.2g)、およびVAZO(登録商標)88(9000ppm)を含有する反応混合物を、2つのアンプルの各々に入れた。溶液を脱気し、アンプルを密封し、110℃で指定時間加熱した。
番号3について
アクリル酸n−ブチル(0.5g)、トルエン(10g)、およびVAZO(登録商標)88(100ppm)の混合物を、アンプル中に入れた。溶液を脱気し、アンプルを密封し、110℃で70分間加熱した。
実施例5
バッチ重合条件下でのポリ(アクリル酸ブチル)マクロモノマーの調製−マクロモノマー純度に対する変換率の効果。
アクリル酸ブチル(1g)、酢酸n−ブチル(3g)、およびVR110(400ppm)を含有する反応混合物を、4つのアンプルの各々に入れた。溶液を脱気し、アンプルを密封し、150℃で指定時間加熱した。
実施例6
マイクロ波反応器中におけるバッチ重合条件下でのポリ(アクリル酸メチル)(MA)マクロモノマーの調製
アクリル酸メチル(15g)のN,N−ジメチルホルムアミド(44.6g)保存液、およびクメンヒドロペルオキシド(100ppm)を反応容器中に入れ、マイクロ波照射下、240℃で20分間加熱した。
1H−NMR:δ6.2および5.55、ブロード一重線、2H、ビニルのH;3.65、ブロード一重線、3H、OCH3。
実施例7
バッチ重合条件下でのポリ(アクリル酸ブチル)マクロモノマーの調製−数平均分子量に対する反応温度の効果
番号1について
アクリル酸ブチル(1g)、酢酸n−ブチル(3g)、およびVR110(400ppm)を含有する反応混合物をアンプル中に入れた。アンプルを脱気し、密封し、150℃で指定時間加熱した。
番号2〜4について
アクリル酸ブチル(15g)の酢酸n−ブチル(44.6g)保存液、およびクメンヒドロペルオキシド(100ppm)を反応容器中に入れ、マイクロ波照射下、指定時間で指定温度まで加熱した。
実施例8
バッチ重合条件下でのポリ(アクリル酸ブチル)マクロモノマーの調製−種々の溶媒中で行った重合
アクリル酸ブチル(15g)の下記で指定した溶媒(44.6g)保存液、およびクメンヒドロペルオキシド(100ppm)を反応容器中に入れ、マイクロ波照射下、指定時間220℃に加熱した。
実施例9
バッチ重合条件下でのポリ(アクリル酸ブチル)マクロモノマーの調製−反応温度およびモノマー濃度へのマクロモノマー純度の依存性。
80℃について
アクリル酸ブチル(0.5g)、トルエン(10g)、およびVAZO(登録商標)52(100ppm)の混合物をアンプル中に入れた。反応混合物を脱気し、アンプルを密封し、90分間80℃に加熱した。
60℃について
アクリル酸ブチル(0.3g)、トルエン(10g)、およびVAZO(登録商標)52(200ppm)の混合物をアンプル中に入れた。反応混合物を脱気し、アンプルを密封し、3時間60℃に加熱した。
これらの結果は、マクロモノマー純度に対するポリマー分子量の効果をも示している。動力学的鎖長が長いほど、副反応(すなわち、不純物の生成)が起こる機会が多くなる。
実施例10
バッチ重合条件下でのポリ(アクリル酸ブチル)マクロモノマーの調製−モノマー濃度への数平均分子量の依存性
酢酸n−ブチル中、25、40、60、80および100質量%のモノマー濃度であるアクリル酸ブチルの2つのアンプル各々を調製した。該アンプルに、VR110(100ppm)を加えた。アンプルを脱気し、密封し、それぞれ10分間と20分間150℃で加熱した。
実施例11
バッチ重合条件下でのポリ(アクリル酸ブチル)マクロモノマーの調製−モノマー濃度への数平均分子量の依存性
酢酸n−ブチル中、25、40、60、80および100質量%のモノマー濃度であるアクリル酸ブチルの2つのアンプル各々を調製した。該アンプルに、ジtert−ブチルペルオキシド(100ppm)を加えた。アンプルを脱気し、密封し、それぞれ10分間と20分間170℃で加熱した。
実施例12
ポリアクリレートマクロモノマーの調製−温度への分枝度の依存性
番号1について
アクリル酸ブチル(1g)、酢酸n−ブチル(3g)、およびVR110(400ppm)を含有する反応混合物を、アンプルに入れた。アンプルを脱気し、密封し、150℃で10分間加熱した。
番号2について
アクリル酸メチル(15g)のN,N−ジメチルホルムアミド(44.6g)保存液、およびクメンヒドロペルオキシド(100ppm)を反応容器中に入れ、マイクロ波照射下、20分間240℃に加熱した。
実施例13
ポリ(アクリル酸ブチル)マクロモノマーの調製−モノマー濃度への分枝度の依存性
番号1について
アクリル酸ブチル(1.28g)、酢酸n−ブチル(8.87g)、およびVR160(1000ppm)を含有する反応混合物を、アンプルに入れた。アンプルを脱気し、密封し、150℃で16時間加熱した。
番号2〜6について
実施例12(番号2)および実施例10(番号3〜6)と同様にして、ポリ(アクリル酸ブチル)マクロモノマーを調製した。
実施例14
アクリレートマクロモノマーの調製−変換率への分枝度の依存性
実施例5と同様にして、ポリ(アクリル酸ブチル)マクロモノマーを調製した。
実施例15
ポリアクリレートマクロモノマーの調製−コモノマー比への分枝度の依存性
番号1について
アクリル酸ブチル(0.13g)、スチレン(0.94g)、酢酸n−ブチル(8.8g)、およびVR−110(200ppm)の混合物を、アンプル中に入れた。反応混合物を脱気し、アンプルを密封し、150℃で40分間加熱した。
番号2について
アクリル酸ブチル(1.15g)、スチレン(0.1g)、酢酸n−ブチル(8.8g)、およびVR−110(200ppm)の混合物を、アンプル中に入れた。反応混合物を脱気し、アンプルを密封し、150℃で40分間加熱した。
1H−NMR(アセトン−d6):δ7.4〜6.95、ブロード多重線、5H、ArH;6.15および5.5、ブロード一重線、2H、BMAビニルのH;5.3および5.05、ブロード一重線、2H、AMSビニルのH;4.0、ブロード一重線、2H、OCH2。
番号3について
実施例12と同様にして、ポリ(アクリル酸ブチル)マクロモノマーを調製した。
実施例16
官能性コポリマーマクロモノマーの調製−コモノマー比への分枝度の依存性
番号1について
アクリル酸ブチル(0.64g)、アクリル酸ヒドロキシエチル(0.58g)(HEA)、酢酸n−ブチル(8.8g)、およびVR−110(200ppm)の混合物を、アンプル中に入れた。反応混合物を脱気し、アンプルを密封し、150℃で40分間加熱した。
番号2について
アクリル酸ブチル(1.15g)、アクリル酸ヒドロキシエチル(0.17g)、酢酸n−ブチル(8.8g)、およびVR−110(200ppm)の混合物を、アンプル中に入れた。反応混合物を脱気し、アンプルを密封し、150℃で40分間加熱した。
1H−NMR:δ6.25〜6.15、ブロード多重線、1H、ビニルのH;5.65〜5.5、ブロード一重線、H、ビニルのH;3.9〜4.4、ブロード一重線、OCH2;3.9〜3.55、ブロード一重線、HOCH2。
番号3について
実施例12と同様にして、ポリ(アクリル酸ブチル)マクロモノマーを調製した。
実施例17
官能性コポリマーマクロモノマーの調製−モノマー/コモノマー比へのマクロモノマー純度の依存性
番号1および番号2について
アクリル酸ブチル(1.28g)、メタクリル酸グリシジル(0.15g)(GMA)、酢酸n−ブチル(6.9g)、およびVR−110(200ppm)の混合物を、2つの各々のアンプル中に入れた。反応混合物を脱気し、アンプルを密封し、それぞれ10分間と40分間150℃で加熱した。
番号3および番号4について
アクリル酸ブチル(0.64g)、メタクリル酸グリシジル(0.71g)、酢酸n−ブチル(5.0g)、およびVR−110(200ppm)の混合物を、2つの各々のアンプル中に入れた。反応混合物を脱気し、アンプルを密封し、それぞれ10分間と40分間150℃で加熱した。
1H−NMR:δ6.25〜6.15、ブロード多重線、ビニルのH;5.65〜5.5、ブロード一重線、ビニルのH;4.5〜4.15、ブロード多重線、OCH2;4.1〜3.65、ブロード多重線、OCH2;3.25、ブロード一重線、CHO;2.85、ブロード一重線、CHO;2.6、ブロード一重線、CHO。
実施例18
コポリマーマクロモノマーの調製−モノマー/コモノマー比へのマクロモノマー純度の依存性。
番号1について
アクリル酸ブチル(1.0g)、α−メチルスチレン(AMS)(0.1g)、酢酸n−ブチル(10.7g)、およびVR−110(100ppm)の混合物を、アンプル中に入れた。反応混合物を脱気し、アンプルを密封し、150℃で40分間加熱した。
番号2について
アクリル酸ブチル(0.5g)、AMS(0.46g)、酢酸n−ブチル(9.0g)、およびVR−110(100ppm)の混合物を、アンプル中に入れた。反応混合物を脱気し、アンプルを密封し、150℃で40分間加熱した。
番号3について
アクリル酸ブチル(0.3g)、AMS(0.69g)、酢酸n−ブチル(8.92g)、およびVR−110(100ppm)の混合物を、アンプル中に入れた。反応混合物を脱気し、アンプルを密封し、150℃で40分間加熱した。
1H−NMR(アセトン−d6):δ7.4〜7.4、ブロード多重線、5H、ArH;5.65〜5.4、ブロード多重線、1H、ビニルのH;4.25〜3.8、ブロード多重線、OCH2;3.8〜3.1、ブロード多重線、OCH2。
番号4について
アクリル酸ブチル(1.0g)、酢酸n−ブチル(9.0g)、およびVR−110(100ppm)の混合物を、アンプル中に入れた。反応混合物を脱気し、アンプルを密封し、150℃で40分間加熱した。
実施例19
官能性コポリマーマクロモノマーの調製−モノマー/コモノマー比へのマクロモノマー純度の依存性。
番号1について
アクリル酸ブチル(1.28g)、メタクリル酸メチル(0.1g)(MMA)、酢酸n−ブチル(14.9g)、およびVR−110(100ppm)の混合物を、アンプル中に入れた。反応混合物を脱気し、アンプルを密封し、150℃で40分間加熱した。
番号2について
アクリル酸ブチル(0.5g)、メタクリル酸メチル(0.39g)、酢酸n−ブチル(8.9g)、およびVR−110(100ppm)の混合物を、アンプル中に入れた。反応混合物を脱気し、アンプルを密封し、150℃で40分間加熱した。
番号3について
アクリル酸ブチル(0.3g)、メタクリル酸メチル(0.59g)、酢酸n−ブチル(8.8g)、およびVR−110(100ppm)の混合物を、アンプル中に入れた。反応混合物を脱気し、アンプルを密封し、150℃で40分間加熱した。
1H−NMR:δ6.25〜6.1、ブロード多重線、ビニルのH;5.55〜5.45、ブロード一重線、ビニルのH;4.2〜3.85、ブロード多重線、OCH2;3.65〜3.5、ブロード一重線、OCH3。
番号4について
実施例18と同様にして、ポリ(アクリル酸ブチル)マクロを調製した。
実施例20
バッチマイクロ波条件下でのポリ(アクリル酸)マクロモノマーの調製
アクリル酸(5g)(AA)のN,N−ジメチルホルムアミド(96g)(DMF)保存液、およびクメンヒドロペルオキシド(750ppm)を反応容器中に入れ、マイクロ波照射下、20分間240℃に加熱した。
実施例21
バッチマイクロ波条件下でのポリ(アクリル酸)マクロモノマーの調製
アクリル酸(5g)の水(100g)保存液、およびtert−ブチルヒドロペルオキシド(90,000ppm、この量は、約750ppmの開始剤が1時間の反応時間後に消費されるように選択したものである。)を厚壁の容器中に入れ、溶液を脱気して、60分間150℃に加熱した。
実施例22
バッチマイクロ波条件下でのポリ(アクリル酸)マクロモノマーの調製
アクリル酸(5g)のN,N−ジメチルホルムアミド(96g)(DMF)保存液、およびVR−110(750ppm)を厚壁の容器中に入れ、溶液を脱気し、30分間150℃に加熱した。
実施例23
バッチ重合条件下でのポリ(アクリル酸ブチル/スチレン)コポリマーマクロモノマーの調製
アクリル酸ブチル(0.64g)、スチレン(0.52g)、酢酸n−ブチル(3.8g)、およびVR−110(200ppm)の混合物を、3つの各々のアンプル中に入れた。反応混合物を脱気し、アンプルを密封し、150℃で指定時間加熱した。
実施例24
バッチ重合条件下でのポリ(アクリル酸ブチル/スチレン)コポリマーマクロモノマーの調製
番号1について
アクリル酸ブチル(0.64g)、スチレン(0.52g)、酢酸n−ブチル(3.8g)、およびVR−110(200ppm)の混合物を、アンプル中に入れた。反応混合物を脱気し、アンプルを密封し、150℃で40分間加熱した。
番号2について
アクリル酸ブチル(1.15g)、スチレン(0.1g)、酢酸n−ブチル(8.8g)、およびVR−110(200ppm)の混合物を、アンプル中に入れた。反応混合物を脱気し、アンプルを密封し、150℃で40分間加熱した。
番号3について
アクリル酸ブチル(0.13g)、スチレン(0.94g)、酢酸n−ブチル(8.8g)、およびVR−110(200ppm)の混合物を、アンプル中に入れた。反応混合物を脱気し、アンプルを密封し、150℃で40分間加熱した。
実施例25
バッチ重合条件下でのポリ(アクリル酸ブチル/アクリル酸ヒドロキシエチル)コポリマーマクロモノマーの調製
番号1について
アクリル酸ブチル(1.15g)、アクリル酸ヒドロキシエチル(0.17g)、酢酸n−ブチル(8.8g)、およびVR−110(200ppm)の混合物を、アンプル中に入れた。反応混合物を脱気し、アンプルを密封し、150℃で40分間加熱した。
番号2について
アクリル酸ブチル(0.64g)、アクリル酸ヒドロキシエチル(0.58g)、酢酸n−ブチル(8.8g)、およびVR−110(200ppm)の混合物を、アンプル中に入れた。反応混合物を脱気し、アンプルを密封し、150℃で40分間加熱した。
実施例26
バッチ重合条件下でのポリ(アクリル酸ブチル/アクリル酸ヒドロキシエチル)コポリマーマクロモノマーの調製
アクリル酸ブチル(0.64g)、アクリル酸ヒドロキシエチル(0.58g)、酢酸n−ブチル(3.8g)、およびVR−110(200ppm)の混合物を、3つの各々のアンプル中に入れた。反応混合物を脱気し、アンプルを密封し、150℃で指定時間加熱した。
実施例27
バッチ重合条件下でのポリ(アクリル酸ブチル/メタクリル酸)コポリマーマクロモノマーの調製
アクリル酸ブチル(1.28g)、メタクリル酸(0.17g)(MAA)、酢酸n−ブチル(7.0g)、およびVR−110(200ppm)の混合物を、2つの各々のアンプル中に入れた。反応混合物を脱気し、アンプルを密封し、それぞれ10分間と40分間150℃で加熱した。
実施例28
バッチ重合条件下でのポリ(アクリル酸ブチル/メタクリル酸グリシジル)コポリマーマクロモノマーの調製
アクリル酸ブチル(1.28g)、メタクリル酸グリシジル(0.15g)、酢酸n−ブチル(6.9g)、およびVR−110(200ppm)の混合物を、2つの各々のアンプル中に入れた。反応混合物を脱気し、アンプルを密封し、それぞれ10分間と40分間150℃で加熱した。
実施例29
バッチマイクロ波条件下での低分子量ポリ(アクリル酸ブチル)マクロモノマーの調製
アクリル酸ブチル(5g)のN,N−ジメチルホルムアミド(100g)保存液、およびクメンヒドロペルオキシド(100ppm)を反応容器中に入れ、マイクロ波照射下、20分間240℃に加熱した。
実施例30
バッチマイクロ波条件下での低分子量ポリ(アクリル酸ブチル)マクロモノマーの調製
アクリル酸ブチル(1.6g)のN,N−ジメチルホルムアミド(100g)保存液、およびクメンヒドロペルオキシド(100ppm)を反応容器中に入れ、マイクロ波照射下、20分間240℃に加熱した。
実施例31
ポリ(アクリル酸ブチル)マクロモノマーを用いた、ポリ(アクリル酸ブチル)−グラフト−アクリル酸メチルの調製
1.ポリ(アクリル酸ブチル)マクロモノマーの調製
攪拌棒、コンデンサー、窒素送込管、および窒素排出管を備える3頸丸底フラスコに、酢酸n−アミル(160mL)を加えた。40分間、溶媒に窒素ガスをバブリングすることにより、脱気を行った。容器を150℃として、アクリル酸n−ブチル(20g、0.2mole)を加えた。VR−160開始剤(18mg)を添加する前にさらに5分間脱気を続け、続いて窒素流を上記の溶媒レベルまで増加した。穏やかな還流をさらに8時間行った。真空下で揮発成分を除去して、ポリ(アクリル酸ブチル)マクロモノマー(19g、95%)(Mn2250、PD2.07)を得た。
2.ポリ(アクリル酸ブチル)−グラフト−アクリル酸メチルの調製
攪拌棒、コンデンサー、窒素送込管、窒素排出管、および熱電対を備える100mL反応容器に、初期装填物としてポリ(アクリル酸ブチル)マクロモノマー(5g)、アセトン(20g)、およびアクリル酸メチル(24.5g)を加えた。40分間、窒素をバブリングすることにより、該混合物を脱気した。該混合物を穏やかに還流し、VAZO(登録商標)52(119mg)のアセトン(1g)溶液を次に加えた。15分後、反応混合物は粘性となり、アセトンのアリコート(20mL)をさらに加えて攪拌しやすくした。合計で2時間、反応混合物を還流した。アセトンのアリコート(5mL)をさらに加え、続いてVAZO(登録商標)52(19mg)のアセトン(1g)溶液を加えた。さらに2時間還流した後、VAZO(登録商標)67(10mg)のアセトン(1g)溶液を加え、さらに3時間混合物を還流した。真空下で揮発成分を除去して、柔らかいガラス質の固体(32g)(Mn127,705、PD2.77)を得た。1H−NMRおよびGPCデータにより、ポリ(アクリル酸メチル)が消費されたことが示された。
実施例32
バッチ重合条件下でのアクリル酸イソボルニルマクロモノマーの調製
0.8%のVAZO(登録商標)88を含有する、アクリル酸イソボルニルとジクロロエタンとの50%混合物を、アンプル中に入れ、脱気し、そして90℃で48時間加熱した。ポリ(アクリル酸イソボルニル)マクロモノマーでは、GPC(THF中)でMn=9670が得られた。1H−NMR(アセトン−d6):6.1および5.5、ブロード一重線、2H、ビニルのH。
実施例33
本実施例は、スターブフィード条件下でのアクリル酸ブチルマクロモノマー合成におけるフィード時間の効果を説明する。次の構成成分を、加熱マントル、還流コンデンサー、温度計、窒素送込口、および攪拌子を備える反応容器に装填した。
分画1を、反応容器に装填し、15分間溶液に窒素をバブリングすることにより脱酸素化し、次いで窒素ブランケット下で加熱還流した。分画2をフラスコに装填し、15分間混合物を通して窒素をバブリングすることにより脱酸素化した。次いで、表31に示した3つの時間間隔にわたって、分画1を含有する容器に該混合物を加えた。
実施例34
本実施例は、スターブフィード条件下でのアクリル酸ブチル(BA)マクロモノマー合成における開始剤濃度の効果を説明する。次の構成成分を、加熱マントル、還流コンデンサー、温度計、窒素送込口、および攪拌子を備える反応容器に装填した。
分画1を、反応容器に装填し、15分間溶液を通して窒素をバブリングすることにより脱酸素化し、次いで窒素ブランケット下で加熱還流した。分画2をフラスコに装填し、15分間混合物を通して窒素をバブリングすることにより脱酸素化した。次いで、4時間にわたって、分画1を含有する容器に該混合物を加えた。
実施例35
本実施例は、スターブフィード条件下でのアクリル酸ブチルマクロモノマー合成における反応温度の効果を説明する。次の構成成分を、加熱マントル、還流コンデンサー、温度計、窒素送込口、および攪拌子を備える反応容器に装填した。
分画1を、反応容器に装填し、15分間溶液を通して窒素をバブリングすることにより脱酸素化し、次いで窒素ブランケット下で加熱還流した。分画2をフラスコに装填し、15分間混合物を通して窒素をバブリングすることにより脱酸素化した。次いで、4時間にわたって、分画1を含有する容器に該混合物を加えた。
Claims (10)
- 一般構造(1)で表されるポリマーの合成方法であって、
(A)
(a)CH2=CHYと、
(b)任意選択で、CH2=CXBと、
(c)フリーラジカル供給源から生成したフリーラジカルと
を接触させることと、
(上式で、
Xは、ハロゲン、または任意選択で置換されたC1〜C4アルキル(この場合、該置換基は、ヒドロキシ、アルコキシもしくはアリールオキシ(OR)、カルボキシ、アシルオキシもしくはアロイルオキシ(O2CR)、アルコキシカルボニルもしくはアリールオキシカルボニル(CO2R)から成る群から独立して選択される)から成る群から独立して選択され、
Yは、R、CO2H、CO2R、COR、CN、CONH2、CONHR、CONR2、O2CR、OR、またはハロゲンから成る群から独立して選択され、
Bは、R、CO2H、CO2R、COR、CN、CONH2、CONHR、CONR2、O2CR、OR、ハロゲン、またはポリマー鎖から成る群から選択され、
Rは、任意選択で置換された、C1〜C18アルキル、C2〜C18アルケニル、アリール、複素環基、アラルキル、またはアルカリール(alkaryl)から成る群(この場合、該置換基は、エポキシ、ヒドロキシ、アルコキシ、アシル、アシルオキシ、カルボキシ(および塩)、スルホン酸(および塩)、アルコキシカルボニルもしくはアリールオキシカルボニル、イソシアナト、シアノ、シリル、ハロ、およびジアルキルアミノから成る群から独立して選択される)から選択され、
Zは、Hと、任意選択で置換された、アルキル、シクロアルキル、アリール、アラルキル、アルカリール、有機シリル、アルコキシアルキル、アルコシキアリール、ヒドロキシ、ヒドロペルオキシ、アルキルペルオキシ、アルコキシ、アロイルオキシの基のフリーラジカル開始剤誘導フラグメント(この場合、置換基は、R、OR、O2CR、ハロゲン、CO2H(および塩)、CO2R、CN、CONH2、CONHR、CONR2、スルフェート、
から選択される)とから成る群から選択され、
m≧1であり、
n≧0であり、
p≧0であり、
mおよびnの一方または両方が1より大きい場合、繰り返し単位は同じかまたは相違し、
[CH2−CUY]p部分は、分枝点Uを含有し、そしてUが、構造(1)に由来し、ランダム構造(2)中に存在する。)
(B)次の可変要素を調整することにより、ポリマーの特性を制御すること、
(i) (a)/(b)のモル比を増加させることにより、ビニル末端ポリマーの割合を増加させること、
(ii) (c)/(a)+(b)のモル比を減少させることにより、ビニル末端ポリマーの割合を増加させること、
(iii) 次のようにして、分枝度(pの値)を制御すること、
(d) 温度を上げることにより、pを減少すること、
(e) モノマー濃度を減少することにより、pを減少すること、
(f) 変換率を増加することにより、pを増加すること、
(iv) 次のようにして、分子量を制御すること、
(g) モノマー濃度を減少することにより、分子量を減少させること、
(h) 温度を上げることにより、分子量を減少させること
とを含むことを特徴とする方法。 - 下記の一般構造(11)で表されるランダムコポリマーを生成する請求項1に記載の方法であって、
上式で、
Xは、ハロゲン、または任意選択で置換されたC 1 〜C 4 アルキル(この場合、該置換基は、ヒドロキシ、アルコキシもしくはアリールオキシ(OR)、カルボキシ、アシルオキシもしくはアロイルオキシ(O 2 CR)、アルコキシカルボニルもしくはアリールオキシカルボニル(CO 2 R)から成る群から独立して選択される)から成る群から独立して選択され、
Yは、R、CO2H、CO2R、COR、CN、CONH2、CONHR、CONR2、O2CR、OR、またはハロゲンから成る群から選択され、
Bは、R、CO2H、CO2R、COR、CN、CONH2、CONHR、CONR2、O2CR、OR、ハロゲン、またはポリマー鎖から成る群から独立して選択され、
Rは、任意選択で置換された、C 1 〜C 18 アルキル、C 2 〜C 18 アルケニル、アリール、複素環基、アラルキル、またはアルカリール(alkaryl)から成る群(この場合、該置換基は、エポキシ、ヒドロキシ、アルコキシ、アシル、アシルオキシ、カルボキシ(および塩)、スルホン酸(および塩)、アルコキシカルボニルもしくはアリールオキシカルボニル、イソシアナト、シアノ、シリル、ハロ、およびジアルキルアミノから成る群から独立して選択される)から選択され、
Zは、Hと、任意選択で置換された、アルキル、シクロアルキル、アリール、アラルキル、アルカリール、有機シリル、アルコキシアルキル、アルコキシアリール、ヒドロキシ、ヒドロペルオキシ、アルキルペルオキシ、アルコキシ、アロイルオキシの基のフリーラジカル開始剤誘導フラグメント(この場合、置換基は、R、OR、O 2 CR、ハロゲン、CO 2 H(および塩)、CO 2 R、CN、CONH 2 、CONHR、CONR 2 、スルフェート、
から選択される)とから成る群から選択され、
m≧1であり、
n≧1であり、
p≧0であり、
mおよびnの一方または両方が1より大きい場合、繰り返し単位は同じかまたは相違し、
[CH 2 −CUY] p 部分は、分枝点Uを含有し、そしてUが、構造(11)に由来し、ランダム構造(2)中に存在する。)
ことを特徴とする方法。 - 工程(B)(i)によりポリマーの特性を制御することを含むことを特徴とする請求項1に記載の方法。
- 工程(B)(ii)によりポリマーの特性を制御することを含むことを特徴とする請求項1に記載の方法。
- 工程(B)(iii)によりポリマーの特性を制御することを含むことを特徴とする請求項1に記載の方法。
- 工程(B)(iii)(d)を用いることを特徴とする請求項6に記載の方法。
- 工程(B)(iii)(e)を用いることを特徴とする請求項6に記載の方法。
- 工程(B)(iii)(f)を用いることを特徴とする請求項6に記載の方法。
- 工程(B)(iv)を用いて分子量を制御することによりポリマーの特性を制御することを含むことを特徴とする請求項1に記載の方法。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US4565397P | 1997-04-23 | 1997-04-23 | |
| US60/045,653 | 1997-04-23 | ||
| PCT/US1998/007069 WO1998047927A1 (en) | 1997-04-23 | 1998-04-09 | Method of macromonomer synthesis |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2001522386A JP2001522386A (ja) | 2001-11-13 |
| JP2001522386A5 JP2001522386A5 (ja) | 2005-11-24 |
| JP4138024B2 true JP4138024B2 (ja) | 2008-08-20 |
Family
ID=21939162
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP54609998A Expired - Fee Related JP4138024B2 (ja) | 1997-04-23 | 1998-04-09 | マクロモノマーの合成方法 |
Country Status (9)
| Country | Link |
|---|---|
| US (1) | US6376626B1 (ja) |
| EP (1) | EP0977782A1 (ja) |
| JP (1) | JP4138024B2 (ja) |
| KR (1) | KR100672873B1 (ja) |
| CN (1) | CN1252813A (ja) |
| AU (1) | AU752670B2 (ja) |
| BR (1) | BR9809294A (ja) |
| CA (1) | CA2284026A1 (ja) |
| WO (1) | WO1998047927A1 (ja) |
Families Citing this family (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6433098B1 (en) | 1994-06-13 | 2002-08-13 | Rohm And Haas Company | Process of preparing curable compositions and compositions therefrom |
| US6566549B1 (en) | 1994-06-13 | 2003-05-20 | Rohm And Haas Company | Continuous polymerization process and products therefrom |
| ES2226345T3 (es) * | 1998-03-12 | 2005-03-16 | Lucite International Uk Limited | Composicion polimerica. |
| US6258275B1 (en) * | 1999-10-01 | 2001-07-10 | Ecole Polytechnique Federale De Lausanne | Affinity macroligands |
| JP3941692B2 (ja) | 2001-03-15 | 2007-07-04 | 東亞合成株式会社 | 共重合体の製造方法 |
| WO2003004543A1 (fr) * | 2001-07-03 | 2003-01-16 | Toagosei Co., Ltd. | Procede de preparation de copolymere, copolymere obtenu au moyen de ce procede et produit durci et film de revetement associes |
| US20050003094A1 (en) * | 2003-07-02 | 2005-01-06 | Grady Michael Charles | Thermally initiated polymerization process |
| US20070066777A1 (en) * | 2004-09-03 | 2007-03-22 | Bzowej Eugene I | Methods for producing crosslinkable oligomers |
| PH12014500214A1 (en) | 2011-08-26 | 2019-03-22 | Arrowhead Res Corporation | Poly (vinyl ester) polymers for in vivo nucleic acid delivery |
| JP2015515530A (ja) | 2012-04-18 | 2015-05-28 | アローヘッド リサーチ コーポレイション | インビボ核酸送達のためのポリ(アクリラート)ポリマー |
| EP3902887A4 (en) | 2018-12-28 | 2022-11-02 | Saint-Gobain Performance Plastics Corporation | ADHESIVE COMPOSITION AND METHODS OF FORMING IT |
Family Cites Families (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4546160A (en) | 1984-02-29 | 1985-10-08 | S. C. Johnson & Son, Inc. | Bulk polymerization process for preparing high solids and uniform copolymers |
| US5385996A (en) * | 1986-12-05 | 1995-01-31 | Commonwealth Scientific And Industrial Research Organisation | Control of molecular weight and end-group functionality of polymers |
| CA2151112A1 (en) * | 1994-06-13 | 1995-12-14 | Michael Bennett Freeman | High temperature polymerization process and products therefrom |
| AUPM930394A0 (en) * | 1994-11-09 | 1994-12-01 | Commonwealth Scientific And Industrial Research Organisation | Block copolymer synthesis |
| DE69725557T2 (de) | 1996-02-23 | 2004-04-29 | E.I. Du Pont De Nemours And Co., Wilmington | Synthese verzweigter polymerer |
-
1998
- 1998-04-09 CN CN98804422A patent/CN1252813A/zh active Pending
- 1998-04-09 BR BR9809294-4A patent/BR9809294A/pt not_active IP Right Cessation
- 1998-04-09 KR KR1019997009759A patent/KR100672873B1/ko not_active Expired - Fee Related
- 1998-04-09 WO PCT/US1998/007069 patent/WO1998047927A1/en not_active Ceased
- 1998-04-09 AU AU71056/98A patent/AU752670B2/en not_active Ceased
- 1998-04-09 CA CA002284026A patent/CA2284026A1/en not_active Abandoned
- 1998-04-09 US US09/403,333 patent/US6376626B1/en not_active Expired - Fee Related
- 1998-04-09 JP JP54609998A patent/JP4138024B2/ja not_active Expired - Fee Related
- 1998-04-09 EP EP98918065A patent/EP0977782A1/en not_active Withdrawn
Also Published As
| Publication number | Publication date |
|---|---|
| CA2284026A1 (en) | 1998-10-29 |
| KR100672873B1 (ko) | 2007-01-24 |
| CN1252813A (zh) | 2000-05-10 |
| BR9809294A (pt) | 2000-07-04 |
| EP0977782A1 (en) | 2000-02-09 |
| WO1998047927A1 (en) | 1998-10-29 |
| US6376626B1 (en) | 2002-04-23 |
| KR20010020184A (ko) | 2001-03-15 |
| JP2001522386A (ja) | 2001-11-13 |
| AU752670B2 (en) | 2002-09-26 |
| AU7105698A (en) | 1998-11-13 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR100479628B1 (ko) | 리빙 특성을 갖는 중합 방법 | |
| JP4886109B2 (ja) | リビング性を有する重合方法およびその方法で製造されるポリマー | |
| Moad et al. | Advances in RAFT polymerization: the synthesis of polymers with defined end-groups | |
| CA2277164C (en) | Method of controlling polymer molecular weight and structure | |
| AU770550B2 (en) | Synthesis of dithioester chain transfer agents and use of bis(thioacyl) disulfides or dithioesters as chain transfer agents | |
| EP1950232A1 (en) | Process for the preparation of graft copolymers by Reversible Addition Fragmentation Chain Transfer (RAFT) and Ring Opening Polymerisation (ROP) | |
| JP2003522816A (ja) | 制御されたラジカル重合のための開始剤、連鎖移動剤または連鎖停止剤としてのS,S’−ビス−(α,α’−ジ置換−α”−酢酸)−トリチオカーボネート類およびその誘導体並びにそれらの製法 | |
| JP4138024B2 (ja) | マクロモノマーの合成方法 | |
| JP2018522999A (ja) | チオカルボニルチオ不含raftポリマーおよびその製造方法 | |
| US7205362B2 (en) | Method for controlled radical polymerization | |
| WO2004056880A1 (en) | Process for the preparation of a multiblock copolymer | |
| JP4961707B2 (ja) | 樹脂の合成法 | |
| AU3603397A (en) | Polymerization with living characteristics | |
| MXPA01002844A (es) | Metodo para la preparacion de copolimeros en bloques mediante polimerizacion radicalica cuasi-.viviente basada en nuevos agentes de transferencia de cadena. |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20050310 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20050310 |
|
| RD01 | Notification of change of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7426 Effective date: 20050310 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20050310 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20071107 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20071204 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20080304 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20080507 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20080605 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20110613 Year of fee payment: 3 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20110613 Year of fee payment: 3 |
|
| S111 | Request for change of ownership or part of ownership |
Free format text: JAPANESE INTERMEDIATE CODE: R313117 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20110613 Year of fee payment: 3 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| LAPS | Cancellation because of no payment of annual fees |