JP4115366B2 - 核酸分子の高次構造変化検出方法 - Google Patents
核酸分子の高次構造変化検出方法 Download PDFInfo
- Publication number
- JP4115366B2 JP4115366B2 JP2003323024A JP2003323024A JP4115366B2 JP 4115366 B2 JP4115366 B2 JP 4115366B2 JP 2003323024 A JP2003323024 A JP 2003323024A JP 2003323024 A JP2003323024 A JP 2003323024A JP 4115366 B2 JP4115366 B2 JP 4115366B2
- Authority
- JP
- Japan
- Prior art keywords
- nucleic acid
- acid molecule
- factor
- detecting
- change
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Images
Landscapes
- Investigating Or Analysing Biological Materials (AREA)
- Investigating Or Analysing Materials By The Use Of Chemical Reactions (AREA)
- Apparatus Associated With Microorganisms And Enzymes (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
Description
(1)実質的に直線状に固定化された核酸分子に、核酸分子の高次構造を変化させる因子を接触させる工程と、上記核酸分子における塩基対をなす結合の配向変化を検出する工程とを有する核酸分子の高次構造変化検出方法。
(2)上記固定化した核酸分子に予め色素をインターカレートさせ、上記配向変化を検出する工程では、上記色素を励起する励起光の偏光角を変化させながら励起光を上記核酸分子に照射し、上記色素から生じた蛍光を検出することを特徴とする(1)記載の核酸分子の高次構造変化検出方法。
(3)上記配向変化を検出する工程では、上記因子により高次構造を変化させた核酸分子を染色し、核酸分子から生ずる蛍光を検出することを特徴とする(1)記載の核酸分子の高次構造変化検出方法。
(4)上記配向変化を検出する工程では、上記核酸分子の塩基対の吸収強度の励起光偏光角依存性を測定することを特徴とする(1)記載の核酸分子の高次構造変化検出方法。
(5)上記因子を接触させる工程では、上記因子を含む溶液を、上記核酸分子を固定化した領域に供給することを特徴とする(1)記載の核酸分子の高次構造変化検出方法。
(7)上記配向変化を検出する工程では、上記固定化した核酸分子における配向変化を生じた箇所を特定し、特定した箇所と上記因子とが相互作用したものと同定することを特徴とする(1)記載の核酸分子の高次構造変化検出方法。
(8)上記核酸分子は、塩基対を構成する塩基間を結ぶ方向が実質的に平行或いはねじれの位置となるように固定化されたことを特徴とする(1)記載の核酸分子の高次構造変化検出方法。
(9)実質的に直線状に固定化された核酸分子に、解析対象の因子を接触させる工程と、上記核酸分子における塩基対をなす結合の配向変化を検出する工程とを有する因子機能解析方法。
(10)上記核酸分子における塩基対をなす結合の配向変化を検出した場合に上記因子が核酸分子に対する作用機能を有すると判断することを特徴とする(9)記載の因子機能解析方法。
(12)上記固定化した核酸分子に予め色素をインターカレートさせ、上記配向変化を検出する工程では、上記色素を励起する励起光の偏光角を変化させながら励起光を上記核酸分子に照射し、上記色素から生じた蛍光を検出することを特徴とする(9)記載の因子機能解析方法。
(13)上記配向変化を検出する工程では、上記因子により高次構造を変化させた核酸分子を染色し、核酸分子から生ずる蛍光を検出することを特徴とする(9)記載の因子機能解析方法。
(14)上記配向変化を検出する工程では、上記核酸分子の塩基対の吸収強度の励起光偏光角依存性を測定することを特徴とする(9)記載の因子機能解析方法。
(15)上記因子を接触させる工程では、上記因子を含む溶液を、上記核酸分子を固定化した領域に供給することを特徴とする(9)記載の因子機能解析方法。
(17)上記配向変化を検出する工程では、上記固定化した核酸分子における配向変化を生じた箇所を特定し、特定した箇所と上記因子とが相互作用したものと同定することを特徴とする(9)記載の候補物質機能解析方法。
(18)上記核酸分子は、塩基対を構成する塩基間を結ぶ方向が実質的に平行或いはねじれの位置となるように固定化されたことを特徴とする(9)記載の因子機能解析方法。
(19)実質的に直線上に固定化した核酸分子に、核酸分子の高次構造を変化させる因子を接触させる工程と、上記因子により高次構造が変化した核酸分子に、候補物質を接触させる工程と、上記核酸分子の高次構造を検出し、当該高次構造が更に変化した場合には上記候補物質を、上記因子と上記核酸分子との相互作用に影響を与える物質としてスクリーニングする工程とを備えるスクリーニング方法。
(20)実質的に直線上に固定化した核酸分子に、核酸分子の高次構造を変化させる因子と当該因子及び核酸分子の間の相互作用に影響を与えうる候補物質とを接触させる工程と、
上記核酸分子の高次構造を検出し、検出した高次構造が上記因子と上記核酸分子との相互作用により変化する高次構造と異なる場合には、上記候補物質を上記因子と上記核酸分子との相互作用に影響を与える物質としてスクリーニングする工程とを備えるスクリーニング方法。
(22)上記配向変化を検出する工程で検出した配向変化と機能既知の物質による配向変化との類似度に基づいて上記解析対象の物質の機能を特定することを特徴とする(19)又は(20)記載のスクリーニング方法。
(23)上記固定化した核酸分子に予め色素をインターカレートさせ、上記配向変化を検出する工程では、上記色素を励起する励起光の偏光角を変化させながら励起光を上記核酸分子に照射し、上記色素から生じた蛍光を検出することを特徴とする(19)又は(20)記載のスクリーニング方法。
(24)上記配向変化を検出する工程では、上記候補物質により高次構造を変化させた核酸分子を染色し、核酸分子から生ずる蛍光を検出することを特徴とする(19)又は(20)記載のスクリーニング方法。
(25)上記配向変化を検出する工程では、上記核酸分子の塩基対の吸収強度の励起光偏光角依存性を測定することを特徴とする(19)又は(20)記載のスクリーニング方法。
(27)上記候補物質はタンパク質であることを特徴とする(19)又は(20)記載のスクリーニング方法。
(28)上記配向変化を検出する工程では、上記固定化した核酸分子における配向変化を生じた箇所を特定し、特定した箇所と上記候補物質とが相互作用したものと同定することを特徴とする(19)又は(20)記載のスクリーニング方法。
(29)上記核酸分子は、塩基対を構成する塩基間を結ぶ方向が実質的に平行或いはねじれの位置となるように固定化されたことを特徴とする(19)又は(20)記載のスクリーニング方法。
(30)基材と、実質的に直線上に上記基材に固定化された核酸分子とを備える核酸分子の高次構造変化検出用素子。
(32)上記核酸分子は、不溶化された当該核酸分子を含む溶液を上記基材上に供給し、上記基材上で上記溶液を乾燥させることによって固定化されたのもであることを特徴とする(30)記載の核酸分子の高次構造変化検出用素子。
(33)異なる塩基配列を有する複数の上記核酸分子を固定化したことを特徴とする(30)記載の核酸分子の高次構造変化検出用素子。
(34)上記核酸分子は、タンパク質結合領域を含むことを特徴とする(30)記載の核酸分子の高次構造変化検出用素子。
(35)上記核酸分子は、塩基対を構成する塩基間を結ぶ方向が実質的に平行或いはねじれの位置となるように固定化されたことを特徴とする(30)記載の核酸分子の高次構造変化検出用素子。
本発明は、タンパク質等の因子或いは解析対象の因子若しくは候補物質が核酸分子に作用することによって生じる当該核酸分子の高次構造の変化を検出する方法に関するものである。本発明において、核酸分子とは、デオキシリボ核酸(DNA)、リボ核酸(RNA)、ペプチド核酸及び核酸類似体を含む意味である。また、核酸分子は、二本鎖であっても一本鎖であってもよい。以下の説明においては、核酸分子として二本鎖DNA分子を例示して説明するが、一本鎖DNA分子及びRNA分子であっても全く同様に本発明を適用することができる。
ここで因子とは、代表的にはタンパク質を意味するが、タンパク質に限定されず低分子化合物、高分子化合物及び溶液中のイオン等の物質、並びにpHなどに代表される環境変化等を意味する。すなわち、因子としては、DNA分子に作用するといった機能を有する全ての物質及び環境を含む意味である。作用とは、代表的にはDNA分子に対する結合を意味するが、これに限定されず、DNA分子に対する接触、核酸に接触している他の因子を介した接触、環境変化による自己組織化等によるDNA分子の高次構造を変化させる作用を意味する。
DNA修復に関与するタンパク質;uracil N-glycosylase、UvrA
遺伝子転写に関与するタンパク質(転写因子);UBP、TBP(TATA box binding protein)、Cro protein、Trp repressor、homeodomain protein、CREB
mRNAの翻訳に関与するタンパク質;peptidyl transferase
DNA組換えに関与するタンパク質;RecA、RecBC
DNAの立体構造に関与するタンパク質;histone、hSWI/SNF(chromatin modeling factor)、gyrase、topoisomerase、histone
ここで、本方法においては、実質的に直線状に固定化された二本鎖DNA分子を使用する。詳細には、塩基対を構成する塩基間を結ぶ方向が実質的に平行或いはねじれの位置となるように固定化された二本鎖DNA分子を使用する。ここで、塩基対を構成する塩基間を結ぶ方向とは、一方の一本鎖DNA分子におけるアデニンと他方の一本鎖DNA分子におけるチミンとの間の2つの水素結合及び一方の一本鎖DNA分子におけるグアニンと他方の一本鎖DNA分子におけるシトシンとの間の3つの水素結合を便宜的に直線で表したときの当該直線の方向を意味する。
先ず、多価陽イオンを含む電解質に固定化対象の二本鎖DNA分子を加え、当該二本鎖DNA分子を不溶化した溶液を調製する。具体的に、溶液の組成としては、色素であるTOTO-1を結合させた12.5 nM lDNA(塩基対:TOTO-1=6:1)、3 mM Tris-HCl (pH 8.0)、0.1 mM EDTA及び17 mM CaCl2とすることができる。次に、この溶液を例えばガラス基板等の基材上に滴下する。そして、所定の条件で放置することによって、基材上に、実質的に直線状に二本鎖DNA分子を固定化することができる。
色素としては、特に限定されないが、例えば、EtBr(エチジウムブロマイド)、AO(アクリジンオレンジ)、YOYO-1、TOTO-1等を使用することができる。
アビジン−ビオチン結合を利用する方法では、先ず二本鎖DNA分子の一端をビオチン標識する。例えば、ビオチン標識されたヌクレオチドを他のヌクレオチドと混ぜ、Klenow Fragmant酵素を用いてDNAの末端に取り込ませることによりビオチン標識が可能である。一方、基板表面をアビジンでコートする。例えば、基板表面を水酸化カリウムで処理することにより親水化し、アビジンを作用させることによりアビジンコートが可能である。
まず、基板表面をジメチルジクロロシランの蒸気コーティングなどの方法を用いて疎水化し、DNAが疎水的相互作用で吸着しやすいようにしておく。次に、基板表面に二本鎖DNA分子を含む溶液を滴下する。溶液の組成は、例えば、色素であるTOTO-1を結合させた12.5 nM lDNA(塩基対 :TOTO-1=6:1)、3 mM Tris-HCl (pH 8.0)及び0.1 mM EDTAとすることができる。このとき二本鎖DNA分子の一部が、疎水化した基板表面に吸着すると、滴下直後であるため揺動している溶液の流体力学的な力により二本鎖DNA分子が引き伸ばされることとなり、基板に接触した部分から順次基板上に吸着固定する。この方法では二本鎖DNA分子の引き伸ばし固定が容易である一方、二本鎖DNA分子を引き伸ばす力や方向を制御しにくい欠点がある。
実質的に直線状に固定化された二本鎖DNA分子を用いて、当該二本鎖DNA分子の高次構造変化を検出する原理を説明する。
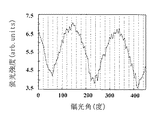
直接的には、二本鎖DNA分子の塩基対を構成する結合の吸収強度をシグナルとして測定し、励起光の偏光面に依存した吸収強度の変化により二本鎖DNA分子の高次構造変化を検出することができる。すなわち、この方法においては、固定化した二本鎖DNA分子の塩基対を構成する結合が吸収できる波長の励起光を、その偏光角を変化させながら、固定化した二本鎖DNA分子に対して照射する。二本鎖DNA分子の高次構造が変化していない場合には、DNA分子による吸収度が励起光の偏光面に強く依存することとなる。これに対して、二本鎖DNA分子の高次構造が変化している場合には、励起光源の偏光角に依存せずに蛍光強度が不規則に変動する或いは蛍光強度が振動しないこととなる。このように、二本鎖DNA分子の塩基対を構成する結合の吸収強度をシグナルとして検出することによって、固定化された二本鎖DNA分子の高次構造変化を検出することができる。
このとき、照射する励起光の波長としては、260〜280nmとすることが好ましい。
間接的には、固定化された二本鎖DNA分子の塩基対の間にインターカレートさせた色素に基づく蛍光をシグナルとして測定し、励起光の偏光面に依存した蛍光強度の変化により二本鎖DNA分子の高次構造変化を検出することができる。すなわち、この方法においては、色素を励起する励起光源を、その偏光角を変化させながら二本鎖DNA分子に照射する。二本鎖DNA分子の高次構造が変化していない場合には、励起光源の偏光角に依存して蛍光強度が規則的に振動することとなる。これに対して、二本鎖DNA分子の高次構造が変化している場合には、励起光源の偏光角に依存せずに蛍光強度が不規則に変動する或いは蛍光強度が振動しないこととなる。このように、色素に由来する蛍光強度をシグナルとして測定することによって、固定化された二本鎖DNA分子の高次構造変化を検出することができる。
<シグナル測定方法2>と同様に、固定化された二本鎖DNA分子の塩基対の間にインターカレートさせた色素に基づく蛍光をシグナルとして測定し、励起光の偏光面に依存した蛍光強度の変化により二本鎖DNA分子の高次構造変化を検出する。検出装置として走査型近接場光学顕微鏡(Scanning Near-field Optical Microscope; 以下SNOM)を用いる。<シグナル測定方法2>では、光学顕微鏡の分解能の限界は、500nmの可視光を用いた場合、約800nm程度であるが、SNOMは光学顕微鏡の約10倍の分解能をもつ。SNOMのチップに偏光させた励起光を導入し、チップの先端から染み出す光(近接場光)を励起光源に用いるので、数十nm四方の領域だけを照射できる。そして、ここから出てくる蛍光を別の集光器、例えば対物レンズを用いて検出する。また別のSNOMの方法として、試料全体を偏光させた励起光で照射した後、目的の位置にチップの先端を近づけ、数十nm四方の領域からの蛍光をチップの先端から集光して検出する。
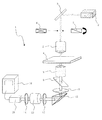
上述した<シグナル測定方法2>は、例えば、図1に示すような、検出装置1によって実施することができる。検出装置1は、所定の波長のレーザ光を出射するアルゴンイオンレーザ出射装置2と、アルゴンイオンレーザ出射装置2から出射したレーザの光路上に配設された反射ミラー3と、反射ミラー3で反射したレーザ光を所定のスポット径で高次構造変化検出用素子4に照射する第1の対物レンズ5と、反射ミラー3と対物レンズ5との間のレーザ光路上に配設された偏光解消板6及びλ/2波長板7とを備える。なお、図示しないが、検出装置1は、λ/2波長板7を回転駆動するモーターを有している。また、検出装置1は、高次構造変化検出用素子4で生じた蛍光を集光するための第2の対物レンズ8と、第2の対物レンズ8で集光した蛍光の光路上に配設されたダイクロイック(2色性)ミラー9及びフィルター10と、所定の波長の蛍光のみを反射するプリズム11と、プリズム11で反射した蛍光の光路上に配設された第1のレンズ12と、第1のレンズ12を介して入射した蛍光を増強するイメージ増強装置13と、イメージ増強装置13から出射される蛍光の光路上に配設された第2のレンズ14と、第2のレンズ14を介して入射する蛍光を検出するCCD装置15と、CCD装置15で検出した蛍光に基づいて画像を生成する画像処理装置16とを備える。
上記1〜4で説明したように、固定化した二本鎖DNA分子の高次構造変化を検出することができるため、解析対象の物質の機能を解析することができる。上記「3.高次構造変化の検出原理」で説明したように、解析対象の物質を固定化された二本鎖DNA分子に接触させ、その後、二本鎖DNA分子の高次構造に基づくシグナルを検出する。これにより、解析対象の物質が二本鎖DNA分子の高次構造を変化させる機能を有するか否かを検出することができる。この方法によれば、固定化した二本鎖DNA分子に対する物質の作用を直接、且つ、単一分子レベルで検出することができる。また、この方法においては、電気泳動やメンブレンへの転写といった煩雑な操作を必要としないため、非常に簡易にDNA分子と物質との相互作用を検出することができる。
上記1〜4で説明したように、固定化した二本鎖DNA分子の高次構造変化を検出することができるため、DNA分子の高次構造を変化させる因子とDNA分子との相互作用に対して、影響を与える物質をスクリーニングすることができる。ここで、DNA分子の高次構造を変化させる因子とDNA分子との相互作用とは、例えば、タンパク質とDNAとの結合等に代表されるDNA分子の高次構造変化を伴うあらゆる作用を意味する。また、相互作用に対する影響とは、例えば、タンパク質とDNAとの結合を解離させたり、タンパク質とDNAとの結合を変化させるといった、DNA分子の高次構造変化を誘発する影響を意味する。
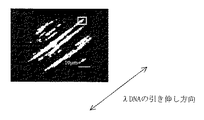
本例では、先ず、高次構造変化検出用素子を作製した。固定化する二本鎖DNA分子として、λDNA(入手先 東洋紡績(株))を使用した。先ず、色素であるTOTO-1を結合させた12.5 nM lDNA(塩基対:TOTO-1 dye =6:1)、3 mM Tris-HCl (pH 8.0)、0.1 mM EDTA及び17 mM CaCl2からなる溶液を調製した。本例においては、この段階で、TOTO-1色素をλDNAの塩基対の間にインターカレートさせた。
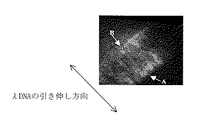
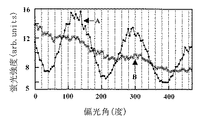
ヒストンタンパク質を含む溶液を滴下してから1時間放置後の蛍光顕微鏡像を、図1に示す検出装置を用いて記録した結果を図4に示す。さらに図4の中の領域Aと領域Bにおける蛍光強度の励起光偏光面角度依存性を解析した結果を図5に示す。図5からわかるように、領域Aでは図3に示した結果と同様なプロファイルを示し、偏光角依存性が見られるが、領域Bでは偏光角依存性が消失していることがわかる。この結果から、領域Bにおいて、塩基対の間にインターカレートさせたTOTO-1色素の配向が変化し、λDNAの高次構造が変化していることが明らかとなった。すなわち、領域Bにおいて、ヒストンタンパク質は、糸巻きのようにその外周面にλDNAをまきつけ、λDNAを不規則な向きに高次構造変化させ、図3に示すような偏光面依存性が消失したことが明らかとなった。
Claims (29)
- 引き延ばされた状態で固定化された核酸分子に、核酸分子の高次構造を変化させる因子を接触させる工程と、
上記核酸分子における塩基対をなす結合の配向変化を検出する工程と、
を有する核酸分子の高次構造変化検出方法。 - 上記固定化した核酸分子に予め色素をインターカレートさせ、
上記配向変化を検出する工程では、上記色素を励起する励起光の偏光角を変化させながら励起光を上記核酸分子に照射し、上記色素から生じた蛍光を検出することを特徴とする請求項1記載の核酸分子の高次構造変化検出方法。 - 上記配向変化を検出する工程では、上記因子により高次構造を変化させた核酸分子を染色し、核酸分子から生ずる蛍光を検出することを特徴とする請求項1記載の核酸分子の高次構造変化検出方法。
- 上記配向変化を検出する工程では、上記核酸分子の塩基対の吸収強度の励起光偏光角依存性を測定することを特徴とする請求項1記載の核酸分子の高次構造変化検出方法。
- 上記因子を接触させる工程では、上記因子を含む溶液を、上記核酸分子を固定化した領域に供給することを特徴とする請求項1記載の核酸分子の高次構造変化検出方法。
- 上記因子はタンパク質であることを特徴とする請求項1記載の核酸分子の高次構造変化検出方法。
- 上記配向変化を検出する工程では、上記固定化した核酸分子における配向変化を生じた箇所を特定し、特定した箇所と上記因子とが相互作用したものと同定することを特徴とする請求項1記載の核酸分子の高次構造変化検出方法。
- 上記核酸分子は、塩基対を構成する塩基間を結ぶ方向が平行或いはねじれの位置となるように固定化されたことを特徴とする請求項1記載の核酸分子の高次構造変化検出方法。
- 引き延ばされた状態で固定化された核酸分子に、解析対象の因子を接触させる工程と、
上記核酸分子における塩基対をなす結合の配向変化を検出する工程と、
上記核酸分子における塩基対をなす結合の配向変化が検出された場合には、上記因子が核酸分子の高次構造に変化を与える機能を有する因子であると判断する工程と
を有する因子機能解析方法。 - 上記機能は核酸分子に対する作用機能であることを特徴とする請求項9記載の因子機能解析方法。
- 上記判断する工程では、上記配向変化を検出する工程で検出した配向変化と機能既知の因子による配向変化との類似度に基づいて、上記解析対象の因子における核酸分子の高次構造に変化を与える機能を更に特定することを特徴とする請求項9記載の因子機能解析方法。
- 上記固定化した核酸分子に予め色素をインターカレートさせ、
上記配向変化を検出する工程では、上記色素を励起する励起光の偏光角を変化させながら励起光を上記核酸分子に照射し、上記色素から生じた蛍光を検出することを特徴とする請求項9記載の因子機能解析方法。 - 上記配向変化を検出する工程では、上記因子により高次構造を変化させた核酸分子を染色し、核酸分子から生ずる蛍光を検出することを特徴とする請求項9記載の因子機能解析方法。
- 上記配向変化を検出する工程では、上記核酸分子の塩基対の吸収強度の励起光偏光角依存性を測定することを特徴とする請求項9記載の因子機能解析方法。
- 上記因子を接触させる工程では、上記因子を含む溶液を、上記核酸分子を固定化した領域に供給することを特徴とする請求項9記載の因子機能解析方法。
- 上記解析対象の因子はタンパク質であることを特徴とする請求項9記載の因子機能解析方法。
- 上記配向変化を検出する工程では、上記固定化した核酸分子における配向変化を生じた箇所を特定し、特定した箇所と上記因子とが相互作用したものと同定することを特徴とする請求項9記載の因子機能解析方法。
- 上記核酸分子は、塩基対を構成する塩基間を結ぶ方向が平行或いはねじれの位置となるように固定化されたことを特徴とする請求項9記載の因子機能解析方法。
- 引き延ばされた状態で固定化した核酸分子に、核酸分子の高次構造を変化させる因子を接触させる工程と、
上記因子により高次構造が変化した核酸分子に、候補物質を接触させる工程と、
上記核酸分子の高次構造を検出し、当該高次構造が更に変化した場合には上記候補物質を、上記因子と上記核酸分子との相互作用に影響を与える物質としてスクリーニングする工程と
を備えるスクリーニング方法。 - 引き延ばされた状態で固定化した核酸分子に、核酸分子の高次構造を変化させる因子と当該因子及び核酸分子の間の相互作用に影響を与えうる候補物質とを接触させる工程と、
上記核酸分子の高次構造を検出し、検出した高次構造が上記因子と上記核酸分子との相互作用により変化する高次構造と異なる場合には、上記候補物質を上記因子と上記核酸分子との相互作用に影響を与える物質としてスクリーニングする工程と
を備えるスクリーニング方法。 - 上記核酸分子における塩基対をなす結合の配向変化を検出した場合に、上記候補物質が上記因子と上記核酸分子との相互作用に対する作用機能を有すると判断することを特徴とする請求項19又は20記載のスクリーニング方法。
- 上記配向変化を検出する工程で検出した配向変化と機能既知の物質による配向変化との類似度に基づいて上記解析対象の物質の機能を特定することを特徴とする請求項19又は20記載のスクリーニング方法。
- 上記固定化した核酸分子に予め色素をインターカレートさせ、
上記配向変化を検出する工程では、上記色素を励起する励起光の偏光角を変化させながら励起光を上記核酸分子に照射し、上記色素から生じた蛍光を検出することを特徴とする請求項19又は20記載のスクリーニング方法。 - 上記配向変化を検出する工程では、上記候補物質により高次構造を変化させた核酸分子を染色し、核酸分子から生ずる蛍光を検出することを特徴とする請求項19又は20記載のスクリーニング方法。
- 上記配向変化を検出する工程では、上記核酸分子の塩基対の吸収強度の励起光偏光角依存性を測定することを特徴とする請求項19又は20記載のスクリーニング方法。
- 上記候補物質を接触させる工程では、上記候補物質を含む溶液を、上記核酸分子を固定化した領域に供給することを特徴とする請求項19又は20記載のスクリーニング方法。
- 上記候補物質はタンパク質であることを特徴とする請求項19又は20記載のスクリーニング方法。
- 上記配向変化を検出する工程では、上記固定化した核酸分子における配向変化を生じた箇所を特定し、特定した箇所と上記候補物質とが相互作用したものと同定することを特徴とする請求項19又は20記載のスクリーニング方法。
- 上記核酸分子は、塩基対を構成する塩基間を結ぶ方向が平行或いはねじれの位置となるように固定化されたことを特徴とする請求項19又は20記載のスクリーニング方法。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2003323024A JP4115366B2 (ja) | 2003-09-16 | 2003-09-16 | 核酸分子の高次構造変化検出方法 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2003323024A JP4115366B2 (ja) | 2003-09-16 | 2003-09-16 | 核酸分子の高次構造変化検出方法 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2005087057A JP2005087057A (ja) | 2005-04-07 |
| JP4115366B2 true JP4115366B2 (ja) | 2008-07-09 |
Family
ID=34454221
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2003323024A Expired - Fee Related JP4115366B2 (ja) | 2003-09-16 | 2003-09-16 | 核酸分子の高次構造変化検出方法 |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP4115366B2 (ja) |
Families Citing this family (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP1963500B1 (en) | 2005-12-23 | 2013-02-13 | Nanostring Technologies, Inc. | Compositions comprising oriented, immobilized macromolecules and methods for their preparation |
| AU2007268027B2 (en) * | 2006-05-22 | 2012-08-09 | Bruker Spatial Biology, Inc. | Systems and methods for analyzing nanoreporters |
| US8142072B2 (en) | 2008-05-13 | 2012-03-27 | Toyo Boseki Kabushiki Kaisha | External stimulus indicator and indication method using the same |
| JP5200069B2 (ja) * | 2010-07-27 | 2013-05-15 | トヨタ自動車株式会社 | 三次元dnaネットワーク |
-
2003
- 2003-09-16 JP JP2003323024A patent/JP4115366B2/ja not_active Expired - Fee Related
Also Published As
| Publication number | Publication date |
|---|---|
| JP2005087057A (ja) | 2005-04-07 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5260339B2 (ja) | 核酸分析デバイス、及び核酸分析装置 | |
| JP4495767B2 (ja) | 顕微鏡的イメージングにより核酸の物理的特性を測定する方法 | |
| US20050227231A1 (en) | Device for sequencing nucleic acid molecules | |
| CN1323355A (zh) | 光学鉴定聚合物 | |
| JP2009540326A (ja) | 結合及び非結合ラベルの測定による検体検出の増加した特異性 | |
| JP3496389B2 (ja) | 生体分子のコード配列を確認する装置 | |
| CN101241078A (zh) | Serrs活性微粒 | |
| CN104535769B (zh) | 经高密度纳米坑制备生物大分子单分子芯片的方法 | |
| US9365891B2 (en) | Nucleic acid analysis device, method for producing same, and nucleic acid analyzer | |
| Peterson et al. | Competitive assays of label-free DNA hybridization with single-molecule fluorescence imaging detection | |
| CN102971629B (zh) | 微阵列 | |
| JP2007525977A (ja) | 単一分子の分離、配置、およびシークエンシング | |
| JP4997181B2 (ja) | 核酸分析デバイス及び核酸分析装置 | |
| JP4115366B2 (ja) | 核酸分子の高次構造変化検出方法 | |
| CN108444969B (zh) | 一种基于表面增强拉曼光谱检测核酸结构的方法 | |
| JP5309092B2 (ja) | 核酸分析用デバイス,核酸分析装置、及び核酸分析用デバイスの製造方法 | |
| Shin et al. | Truncated TALE-FP as DNA staining dye in a high-salt buffer | |
| JP5026359B2 (ja) | 核酸分析デバイス、核酸分析装置及び核酸分析方法 | |
| WO2002055993A2 (en) | Use of electrostatic fields to enhance surface plasmon resonance spectroscopy | |
| JP5456355B2 (ja) | Ito層を有する生体物質固定化用担体 | |
| Sevenler | Development of a digital microarray with interferometric reflectance imaging | |
| Grosbart et al. | Imaging of DNA and Protein by SFM and Combined SFM-TIRF Microscopy | |
| Fukai et al. | Engineered acetylation patterns drive large-scale chromatin organization in vitro | |
| JP2011200141A (ja) | 反応基板および分析装置 | |
| DS | A general approach to visualize protein binding and DNA conformation without protein labeling |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20060619 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20070828 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20071026 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20080408 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20080415 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20110425 Year of fee payment: 3 |
|
| R151 | Written notification of patent or utility model registration |
Ref document number: 4115366 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R151 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20110425 Year of fee payment: 3 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20120425 Year of fee payment: 4 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20120425 Year of fee payment: 4 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20130425 Year of fee payment: 5 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20130425 Year of fee payment: 5 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20140425 Year of fee payment: 6 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| LAPS | Cancellation because of no payment of annual fees |