JP4092893B2 - 二価フェノールの製造法 - Google Patents
二価フェノールの製造法 Download PDFInfo
- Publication number
- JP4092893B2 JP4092893B2 JP2001189208A JP2001189208A JP4092893B2 JP 4092893 B2 JP4092893 B2 JP 4092893B2 JP 2001189208 A JP2001189208 A JP 2001189208A JP 2001189208 A JP2001189208 A JP 2001189208A JP 4092893 B2 JP4092893 B2 JP 4092893B2
- Authority
- JP
- Japan
- Prior art keywords
- zeolite
- reaction
- dihydric phenol
- catechol
- hydroquinone
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Classifications
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02P—CLIMATE CHANGE MITIGATION TECHNOLOGIES IN THE PRODUCTION OR PROCESSING OF GOODS
- Y02P20/00—Technologies relating to chemical industry
- Y02P20/50—Improvements relating to the production of bulk chemicals
- Y02P20/52—Improvements relating to the production of bulk chemicals using catalysts, e.g. selective catalysts
Landscapes
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Low-Molecular Organic Synthesis Reactions Using Catalysts (AREA)
Description
【発明の属する技術分野】
本発明は、ケトン及び燐酸の存在下、一価フェノールを過酸化物で酸化して二価フェノールを製造する方法に関するものである。
【0002】
【従来の技術】
一価フェノールを触媒存在下に過酸化物で酸化して二価フェノールを製造する方法としては、以下の方法が知られている。例えば、ケトン及び燐酸の存在下、過酸化物として過酸化水素を用い、硫酸を触媒とする方法が、特開昭52−65232号公報及び特開昭52−65233号公報などに記載されている。この方法で触媒として用いられる硫酸は腐食性であり、これに代わる触媒の開発が求められている。硫酸に代わる触媒としては、例えば、リンタングステン酸、ケイタングステン酸が特開昭52−78843号公報に、各種硫酸塩が特開昭50−130727号公報に、さらに粘土鉱物が特開昭52−142026号公報にそれぞれ記載されている。しかしながら、これらの方法では過酸化物基準の収率が低く、さらなる高活性触媒の開発が待たれていた。
【0003】
【発明が解決しようとする課題】
本発明の課題は、腐食性の無い高活性酸触媒を開発し、ケトン及び燐酸の存在下、一価フェノールを過酸化物で酸化して高収率で二価フェノールを製造する方法を提供することである。
【0004】
【課題を解決するための手段】
本発明者らは、前記の課題を解決するために検討した結果、ケトン及び燐酸の存在下、一価フェノールを過酸化物で酸化して、二価フェノールを製造する際に、腐食性が無いβゼオライトを触媒として用いることによって、二価フェノールを高収率で製造できることを見出し、本発明を完成した。
【0005】
【発明の実施の形態】
以下に本発明を詳しく説明する。
本発明で使用される一価フェノールとしては、例えば、フェノール、一価モノアルキルフェノール、一価ハロゲン化フェノール、一価ポリアルキルフェノールが挙げられる。
【0006】
一価モノアルキルフェノールが有するアルキル基としては、直鎖又は分岐状の炭素原子数1〜6個のアルキル基が挙げられる。アルキル基の位置は、反応に関与しなければ特に限定されない。これら化合物としては、例えば、o−,m−又はp−クレゾール、o−,m−又はp−エチルフェノール、o−プロピルフェノール、p−イソプロピルフェノール、m−ブチルフェノール、p−イソブチルフェノール、p−t−ブチルフェノール、m−イソブチルフェノール、p−ペンチルフェノール、p−ヘキシルフェノールが挙げられる。
【0007】
一価ハロゲン化フェノールが有するハロゲン原子としては、フッ素、塩素、臭素、ヨウ素が挙げられる。ハロゲン原子の数及び位置は、反応に関与しなければ特に限定されない。これら化合物としては、例えば、o−,m−又はp−フルオロフェノール、o−,m−又はp−クロロフェノール、o−,m−又はp−ブロモフェノール、o−,m−又はp−ヨウ化フェノール、2,3−、2,4−、2,5−、2,6−、3,4−又は3,5−ジクロロフェノール、2,3−、2,4−、2,5−、2,6−、3,4−又は3,5−ジブロモロフェノール、2,3,4−、2,3,5−、2,3,6−、2,4,5−、2,4,6−又は3,4,5−トリクロロフェノールが挙げられる。
【0008】
一価ポリアルキルフェノールが有するアルキル基としては、直鎖又は分岐状の炭素原子数1〜6個のアルキル基が挙げられる。アルキル基の数及び位置は、反応に関与しなければ特に限定されない。これら化合物としては、例えば、2,3−、2,4−、2,5−、2,6−、3,5−又は3,4−ジメチルフェノール、2,3,4−トリメチルフェノール、2,3,5−、2,3,6−又は3,4,5−トリメチルフェノール、2,4,5−トリメチルフェノール、2,3,4,5−又は2,3,5,6−テトラメチルフェノール、2−エチル−3−メチルフェノール、3−t−ブチル−4−メチルフェノール、2−イソプロピル−5−メチルフェノール、2−ペンチル−6−メチルフェノール、3−ヘキシル−5−メチルフェノールが挙げられる。
【0009】
本発明で使用されるケトンとしては、例えば、モノケトン、ジケトンが挙げられる。モノケトンとしては、非環式又は環式モノケトンが挙げられる。非環式モノケトンとしては、例えば、炭素原子数3〜20個、好ましくは3〜10個の直鎖状又は分岐状脂肪族モノケトンや芳香族モノケトンを挙げることができる。これら化合物の水素原子はハロゲン原子(フッ素、塩素、臭素又はヨウ素)で置換されてもよい。ハロゲン原子の数及び位置は、反応に関与しなければ特に限定されない。
【0010】
直鎖状脂肪族モノケトンとしては、例えば、アセトン、メチルエチルケトン、2−ペンタノン、3−ペンタノン、2−ヘキサノン、2−ヘプタノン、3−ヘプタノン、4−ヘプタノン、2−オクタノン、2−ノナノン、3−デカンノン、6−ウンデカノン、2−トリデカノン、7−トリデカノン、2−テトラデカノン、2−ペンタデカノン、2−ヘキサデカノン、2−ヘプタデカノン、3−オクタデカノン、4−ノナデカノン、1−クロロ−2−プロパノン、1−クロロ−3−ヘプタノン、1−ブロモ−3−ヘプタノンが挙げられる。
【0011】
分岐状脂肪族モノケトンとしては、例えば、3−メチル−2−ブタノン、3−メチル−2−ペンタノン、4−メチル−2−ペンタノン、3,3−ジメチル−2−ブタノン、2,4−ジメチル−3−ペンタノン、6−メチル−2−ヘプタノン、2,6−ジメチル−4−ヘプタノン、2,2,4,4−テトラメチル−3−ヘプタノンが挙げられる。芳香族モノケトンとしては、例えば、アセトフェノン、ベンゾフェノン、1−フェニル−3−プロパノン、1−フェニル−1−ブタノン、1−フェニル−3−ブタノン、1−フェニル−3−ペンタノン、1,3−ジフェニル−2−プロパノンが挙げられる。
【0012】
環式モノケトンとしては、例えば、炭素原子数5〜12個のシクロアルキルモノケトンを挙げることができる。これら化合物の水素原子はハロゲン原子(フッ素、塩素、臭素又はヨウ素)、或いは炭素原子数1〜6個の直鎖状又は分岐状のアルキル基などの置換基で置換されてもよい。置換基の数及び位置は、反応に関与しなければ特に限定されない。これら化合物としては、例えば、シクロペンタノン、シクロヘキサノン、シクロドデカノン、2−クロロシクロヘキサノン、2−エチル−1−シクロペンタノン、2−メチル−1−シクロヘキサノンを挙げることができる。
【0013】
ジケトンとしては、非環式又は環式ジケトンが挙げられる。非環式ジケトンとしては、例えば、炭素原子数5〜21個、好ましくは5〜12個の直鎖状又は分岐状脂肪族ジケトンや芳香族ジケトンを挙げることができる。これら化合物の水素原子はハロゲン原子(フッ素、塩素、臭素又はヨウ素)で置換されてもよい。ハロゲン原子の数及び位置は、反応に関与しなければ特に限定されない。直鎖状脂肪族ジケトンとしては、例えば、2,3−ブタンジオン、2,4−ペンタンジオン、2,5−ヘキサンジオンが挙げられる。分岐状脂肪族ジケトンとしては、例えば、2,5−ジメチル−3,4−ヘキサンジオンが挙げられる。芳香族ジケトンとしては、例えば、1,2−ジフェニルエタン−1,2−ジオンが挙げられる。
【0014】
環式ジケトンとしては、例えば、炭素原子数5〜12個の環式ジケトンを挙げることができる。これら化合物の水素原子はハロゲン原子(フッ素、塩素、臭素又はヨウ素)、又は炭素原子数1〜6個の直鎖状又は分岐状のアルキル基などの置換基で置換されてもよい。置換基の数及び位置は、反応に関与しなければ特に限定されない。環式ジケトンとしては、例えば、1,4−シクロヘキサンジオンが挙げられる。
【0015】
本発明で使用されるケトンとして好ましいものは、直鎖状又は分岐状脂肪族モノケトン、或いは環式モノケトンであり、更に好ましいものは、直鎖状又は分岐状脂肪族モノケトンであり、その中でも4−メチル−2−ペンタノン、3−ペンタノンが特に好ましい。
ケトンの使用量は、過酸化物に対するケトンのモル比(ケトン:過酸化物)が0.2:1〜5:1になるような割合であることが好ましい。
【0016】
本発明で使用される燐酸としては、オルト燐酸、ピロ燐酸、メタ燐酸、三燐酸、四燐酸、ポリ燐酸、無水燐酸、燐酸水溶液が挙げられるが、燐酸水溶液が好ましい。燐酸水溶液の濃度としては、0.001〜100重量%が好ましい。
燐酸の使用量は、一価フェノールに対する燐酸の重量比(燐酸:一価フェノール)が0.0001:1〜0.05:1になるような割合であることが好ましい。
【0017】
本発明で使用される過酸化物は、過酸化水素などの無機過酸化物、又は、ケトンパーオキサイド、脂肪族過カルボン酸などの有機過酸化物が挙げられる。
【0018】
ケトンパーオキサイドとしては、例えば、炭素原子数が3〜20個、好ましくは3〜10個であるジアルキルケトンパーオキサイドが挙げられる。これら化合物としては、例えば、ジメチルケトンパーオキサイド、ジエチルケトンパーオキサイド、メチルエチルケトンパーオキサイド、メチル−n−プロピルケトンパーオキサイド、メチルイソプロピルケトンパーオキサイド、及びメチルイソブチルケトンパーオキサイドなどを挙げられる。
脂肪族過カルボン酸としては、過酢酸、過プロピオン酸などを挙げられる。
過酸化水素としては、0.1重量%以上、好ましくは0.1〜90重量%の過酸化水素水を使用することができるが、30〜80重量%のものが更に好ましい。
【0019】
本発明で使用される過酸化物としては、過酸化水素またはケトンパーオキサイドか好ましい。このケトンパーオキサイドはケトンと過酸化水素の接触により合成可能であり、ここで使用されるケトンは前記と同様のものである。
過酸化物の使用量は、一価フェノールに対する過酸化物のモル比(過酸化物:一価フェノール)が1:1〜1:100、更には1:5〜1:20になるような範囲であることが好ましい。
【0020】
本発明では、触媒としてβゼオライトが使用される。βゼオライトとしては、プロトン型βゼオライトが好ましいが、中でもアルカリ土類金属担持プロトン型βゼオライトが特に好ましい。βゼオライト中のアルミニウムの含有量は、Al:Si(原子比)が1:10〜1:10000になるような割合であることが好ましい。
βゼオライトの使用量は、一価フェノールに対するβゼオライトの重量比(βゼオライト:一価フェノール)が1:1〜1:500、更には1:5〜1:100になるような範囲であることが好ましい。
【0021】
βゼオライトはJournal of Physical Chemistry,104(2000),2853〜2859に記載の方法により調製してもよく、市販のものを好適に使用することもできる。
プロトン型βゼオライトは、前記文献記載の方法などで調製される。例えば、βゼオライトを硝酸アンモニウム,塩化アンモニウムなどのアンモニウムイオン含有水溶液(アンモニウム塩濃度:0.1〜40重量%)中、20〜120℃で1〜20時間加熱処理し、イオン交換水などで洗浄して、20〜150℃で乾燥後、300〜650℃、1〜10時間焼成することによって得られる。
【0022】
アルカリ土類金属担持プロトン型βゼオライトとしては、上記プロトン型βゼオライトにアルカリ土類金属を担持させて焼成したものが使用できる。アルカリ土類金属としては、ベリリウム、マグネシウム、カルシウム、ストロンチウム、バリウムが挙げられるが、好ましくはマグネシウム、カルシウム、ストロンチウム、バリウムである。金属の担持方法としては、通常のイオン交換法、含浸法、化学蒸着(CVD)法、機械的混練法などの金属担持手法が適用可能であるが、イオン交換法が好ましい。
【0023】
イオン交換法によるアルカリ土類金属担持プロトン型βゼオライトの調製は、生産研究、21,7,(1969)453〜454に記載の方法などで行うことができる。例えば、プロトン型βゼオライトをアルカリ土類金属の硝酸塩、塩酸塩又は硫酸塩などのアルカリ土類金属イオン含有水溶液(アルカリ土類金属塩濃度:0.1〜40重量%)中、20〜120℃で1〜20時間加熱処理し、イオン交換水などで洗浄して、20〜150℃で5分〜24時間乾燥後、300〜650℃、1〜10時間焼成することによって得られる。プロトン型βゼオライトに導入されたアルカリ土類金属イオンは、M2+/Alが0.0001〜10、更には0.01〜1(M2+はアルカリ土類金属イオンを表す。)の比(原子比)になるような範囲であることが好ましい。
【0024】
本発明で使用されるβゼオライトの形状は、粉体、粒体、ペレットなどを挙げることができる。
二価フェノールの製造法に応じた形状としては、例えば、液相バッチ式反応器を用いて製造する時には粉体、粒体などを使用するのが好ましく、液相流通式反応器を用いた時にはペレットなどが好ましい。
【0025】
本発明の二価フェノールの製造では、反応温度は、20〜250℃、更には40〜150℃であることが好ましい。反応時間は、触媒の種類や反応温度によって異なるが、特に制限は無い。また、反応は大気圧で行えるが減圧又は加圧下で行ってもよい。反応は、液相で、バッチ式、流通式、トリクルベッド方式などで行うことができる。
【0026】
なお、本発明では、金属イオンに対する錯化剤(例えば、燐酸モノアルキルエステル、燐酸ジアルキルエステルなどの燐酸系錯化剤)を併用することもできる。
【0027】
本発明における反応としては、例えば、一価フェノール、過酸化水素、ケトン及び燐酸をβ−ゼオライトを入れた反応器に供給して、一価フェノールを酸化してニ価フェノールを生成させ、反応器から反応混合物を排出させる反応などが挙げられる。
【0028】
本発明で製造される二価フェノールは、原料の一価フェノールの構造に対応し、1種類あるいは数種類のものの混合物として得られる。また、これらの二価フェノールは、常法にて分離、精製して得ることができる。
【0029】
【実施例】
以下、本発明を実施例及び比較例によって具体的に説明する。なお、本発明はこれら実施例で制限されるものではない。
実施例及び比較例で使用した試薬は、和光純薬製の特級品を使用した。
二価フェノールの収率は、次式に従って求めたものである。なお、分析はガスクロマトグラフィーにより行った。
【0030】
【数1】
【0031】
参考例1(ストロンチウムイオン担持プロトン型βゼオライトの調製)
硝酸ストロンチウム0.47gを超純水20mlに溶解させることにより、ストロンチウムイオン含有水溶液20mlを調製した。得られた水溶液にゼオリストインターナショナル製のプロトン型βゼオライト2gを浸漬し、85℃、14時間保温でプロトンとストロンチウムイオンのイオン交換を行った。得られた懸濁液を吸引濾過し、110℃で乾燥後、550℃で2.5時間焼成することにより、ストロンチウムイオン担持プロトン型βゼオライト1.9gを得た。ICP発光分析により該βゼオライト中に導入されたストロンチウムイオンとAlの原子比(Sr2+/Al)は0.31であった。
【0032】
参考例2(バリウムイオン担持プロトン型βゼオライトの調製)
硝酸バリウム0.58gを使用した以外は、参考例1と同様に調製した。
その結果、バリウムイオン担持プロトン型βゼオライト1.9gを得た。ICP発光分析により該βゼオライト中に導入されたバリウムイオンとAlの原子比(Ba2+/Al)は0.34であった。
【0033】
参考例3(マグネシウムイオン担持プロトン型βゼオライトの調製)
硝酸マグネシウム六水和物0.57gを使用した以外は、参考例1と同様に調製した。
その結果、マグネシウムイオン担持プロトン型βゼオライト1.9gを得た。ICP発光分析により該βゼオライト中に導入されたマグネシウムイオンとAlの原子比(Mg2+/Al)は0.29であった。
【0034】
参考例4(カルシウムイオン担持プロトン型βゼオライトの調製)
硝酸カルシウム四水和物0.52gを使用した以外は、参考例2と同様に調製した。
その結果、カルシウムイオン担持プロトン型βゼオライト1.9gを得た。ICP発光分析により該βゼオライト中の導入されたカルシウムイオンとAlの原子比(Ca2+/Al)は0.28であった。
【0035】
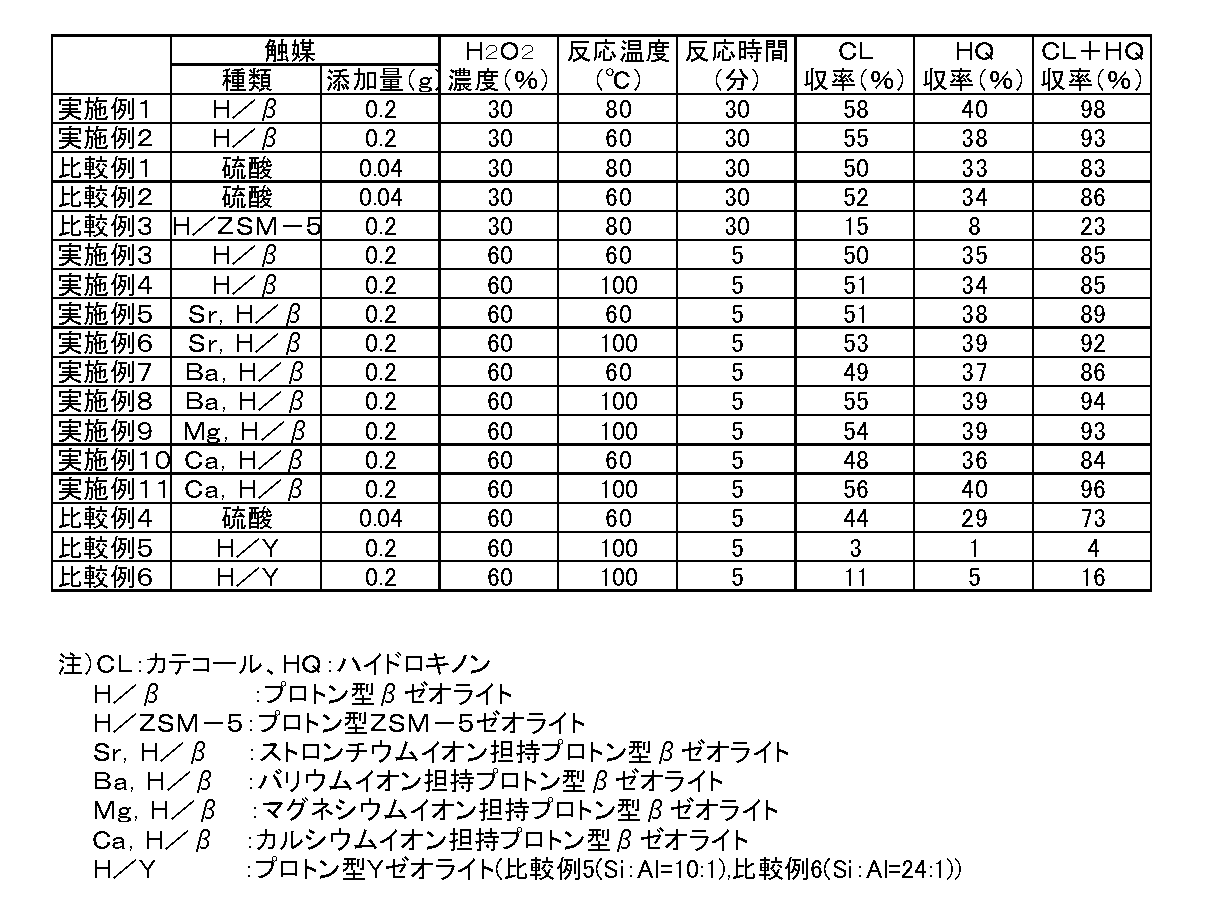
実施例1
ゼオリストインターナショナル製のプロトン型βゼオライト0.20g,フェノール10.00g、4−メチル−2−ペンタノン0.60g,85重量%燐酸水溶液0.03gを300mlのフラスコに入れ、窒素雰囲気に置換した後、攪拌しながら80℃まで昇温した。次いで、この温度において、30重量%過酸化水素水0.62gを滴下した後、その温度を30分間維持して反応を行った。
その結果、二価フェノールの収率は、カテコールが58%、ハイドロキノンが40%で、ハイドロキノンとカテコールの合計収率は98%であった。反応液は薄い黄色に着色したのみであり、タール分の蓄積は殆ど観察されなかった。
【0036】
実施例2
反応温度を60℃とした以外は、実施例1と同様に反応を行なった。
二価フェノールの収率は、カテコールが55%、ハイドロキノンが38%で、ハイドロキノンとカテコールの合計収率は93%であった。反応液はごく薄い黄色に着色したのみであり、タール分の蓄積は殆ど観察されなかった。
【0037】
比較例1
95重量%硫酸0.04g、フェノール10.00g、4−メチル−2−ペンタノン0.60g、85重量%燐酸水溶液0.03gを300mlフラスコに入れ、窒素雰囲気に置換した後、攪拌しながら80℃まで昇温した。次いで、この温度において、30重量%過酸化水素水0.63gを滴下した後、その温度を30分間維持して反応を行った。
その結果、二価フェノールの収率は、カテコールが50%、ハイドロキノンが33%で、ハイドロキノンとカテコールの合計収率は83%であった。反応液は黒褐色に強く着色し、タール分の蓄積が観察された。
【0038】
比較例2
反応温度を60℃とした以外は、比較例1と同様に反応を行なった。
その結果、二価フェノールの収率は、カテコールが52%、ハイドロキノンが34%で、ハイドロキノンとカテコールの合計の収率は86%であった。反応液は黒褐色に強く着色し、タール分の蓄積が観察された。
【0039】
比較例3
触媒をプロトン型ZSM−5ゼオライト0.20gに代えた以外は、実施例1と同様に反応を行った。
その結果、二価フェノールの収率は、カテコールが15%、ハイドロキノンが8%で、ハイドロキノンとカテコールの合計収率は23%であった。反応液は黒褐色に強く着色し、タール分の蓄積が観察された。
【0040】
実施例3
ゼオリストインターナショナル製のプロトン型βゼオライト0.20g、フェノール10.00g、3−ペンタノン0.27g,85重量%燐酸水溶液0.02gを300mlのフラスコに入れ、窒素雰囲気に置換した後、攪拌しながら60℃まで昇温した。この温度において、0.10gの60重量%過酸化水素水を滴下し、1.5分後更に0.10g、3分後更に0.10g滴下して、最初の滴下から5分になるまで反応させた。
その結果、二価フェノールの収率は、カテコールが50%、ハイドロキノンが35%で、ハイドロキノンとカテコールの合計収率は85%であった。反応液はごく薄い黄色に着色したのみであり、タール分の蓄積は殆ど観察されなかった。
【0041】
実施例4
反応温度を100℃とした以外は、実施例3と同様に反応を行なった。
二価フェノールの収率は、カテコールが51%、ハイドロキノンが34%で、ハイドロキノンとカテコールの合計収率は85%であった。反応液はごく薄い黄色に着色したのみであり、タール分の蓄積は殆ど観察されなかった。
【0042】
実施例5
触媒を参考例1のストロンチウムイオン担持プロトン型βゼオライト0.20gに代えた以外は、実施例3と同様に反応を行った。
その結果、二価フェノールの収率は、カテコールが51%、ハイドロキノンが38%で、ハイドロキノンとカテコールの合計収率は89%であった。反応液はごく薄い黄色に着色したのみであり、タール分の蓄積は殆ど観察されなかった。
【0043】
実施例6
反応温度を100℃とした以外は、実施例5と同様に反応を行なった。
その結果、二価フェノールの収率は、カテコールが53%、ハイドロキノンが39%で、ハイドロキノンとカテコールの合計収率は92%であった。反応液はごく薄い赤褐色に着色したのみであり、タール分の蓄積は殆ど観察されなかった。
【0044】
実施例7
触媒を参考例2のバリウムイオン担持プロトン型βゼオライト0.20gとした以外は、実施例3と同様に反応を行なった。
その結果、二価フェノールの収率は、カテコールが49%、ハイドロキノンが37%で、ハイドロキノンとカテコールの合計収率は86%であった。反応液はごく薄い黄色に着色したのみであり、タール分の蓄積は殆ど観察されなかった。
【0045】
実施例8
反応温度を100℃とした以外は、実施例7と同様に反応を行なった。
その結果、二価フェノールの収率は、カテコールが55%、ハイドロキノンが39%で、ハイドロキノンとカテコールの合計収率は94%であった。反応液はごく薄い赤褐色に着色したのみであり、タール分の蓄積は殆ど観察されなかった。
【0046】
実施例9
触媒を参考例3のマグネシウムイオン担持プロトン型βゼオライト0.20gとした以外は、実施例8と同様に反応を行なった。
その結果、二価フェノールの収率は、カテコールが54%、ハイドロキノンが39%で、ハイドロキノンとカテコールの合計収率は93%であった。反応液はごく薄い赤褐色に着色したのみであり、タール分の蓄積は殆ど観察されなかった。
【0047】
実施例10
触媒を参考例4のカルシウムイオン担持プロトン型βゼオライト0.20gとした以外は、実施例3と同様に反応を行なった。
その結果、二価フェノールの収率は、カテコールが48%、ハイドロキノンが36%で、ハイドロキノンとカテコールの合計収率は84%であった。反応液はごく薄い黄色に着色したのみであり、タール分の蓄積は殆ど観察されなかった。
【0048】
実施例11
反応温度を100℃とした以外は、実施例10と同様に反応を行なった。
その結果、二価フェノールの収率は、カテコールが56%、ハイドロキノンが40%で、ハイドロキノンとカテコールの合計収率は96%であった。反応液はごく薄い赤褐色に着色したのみであり、タール分の蓄積は殆ど観察されなかった。
【0049】
比較例4
触媒を95重量%硫酸0.04gとした以外は、実施例3と同様に反応を行った。
その結果、二価フェノールの収率は、カテコール44%、ハイドロキノン29%で、ハイドロキノンとカテコールの合計収率は73%であった。反応液は黒褐色に強く着色し、タール分の蓄積が観察された。
【0050】
比較例5
触媒を日揮ユニバーサル製のプロトン型のYゼオライト(Si:Al=10:1)0.20gとした以外は、実施例4と同様に反応を行った。
その結果、二価フェノールの収率は、カテコール3%、ハイドロキノン1%で、ハイドロキノンとカテコールの合計収率は4%であった。反応液は黒褐色に強く着色し、タール分の蓄積が観察された。
【0051】
比較例6
触媒を日揮ユニバーサル製のプロトン型のYゼオライト(Si:Al=24:1)0.20gとした以外は、実施例4と同様に反応を行った。
その結果、二価フェノールの収率は、カテコール11%、ハイドロキノン5%で、ハイドロキノンとカテコールの合計収率は16%であった。反応液は黒褐色に強く着色し、タール分の蓄積が観察された。
実施例1〜11及び比較例1〜6の結果を表1に示す。
【0052】
【表1】
【発明の効果】
本発明の腐食性の無いβゼオライトを触媒として用いる方法により、ケトン及び燐酸の存在下、一価フェノールを過酸化物で酸化する際に、タール分の蓄積も引き起こすことなく、二価フェノールを高収率で得ることができる。
Claims (5)
- βゼオライト、ケトン及び燐酸の存在下、一価フェノールを過酸化物で酸化することを特徴とする二価フェノールの製造法。
- βゼオライトとしてプロトン型βゼオライトを用いる、請求項1記載の二価フェノールの製造法。
- プロトン型βゼオライトがアルカリ土類金属担持プロトン型βゼオライトである、請求項2記載の二価フェノールの製造法。
- 過酸化物が過酸化水素またはケトンパーオキサイドである、請求項1記載の二価フェノールの製造法。
- 一価フェノール、過酸化水素、ケトン及び燐酸をβ−ゼオライトを入れた反応器に供給して、一価フェノールを酸化してニ価フェノールを生成させることを特徴とする二価フェノールの製造法。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2001189208A JP4092893B2 (ja) | 2000-06-22 | 2001-06-22 | 二価フェノールの製造法 |
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2000-188095 | 2000-06-22 | ||
| JP2000188095 | 2000-06-22 | ||
| JP2001-136055 | 2001-05-07 | ||
| JP2001136055 | 2001-05-07 | ||
| JP2001189208A JP4092893B2 (ja) | 2000-06-22 | 2001-06-22 | 二価フェノールの製造法 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2003026623A JP2003026623A (ja) | 2003-01-29 |
| JP4092893B2 true JP4092893B2 (ja) | 2008-05-28 |
Family
ID=27343812
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2001189208A Expired - Fee Related JP4092893B2 (ja) | 2000-06-22 | 2001-06-22 | 二価フェノールの製造法 |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP4092893B2 (ja) |
Families Citing this family (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| NO20042200L (no) | 2003-05-30 | 2004-11-30 | Ube Industries | Novel proton type B zeolite, preparation method thereof and process for preparing phenol compound using the same |
| JP2005060384A (ja) * | 2003-07-30 | 2005-03-10 | Ube Ind Ltd | フェノール化合物の製造方法 |
-
2001
- 2001-06-22 JP JP2001189208A patent/JP4092893B2/ja not_active Expired - Fee Related
Also Published As
| Publication number | Publication date |
|---|---|
| JP2003026623A (ja) | 2003-01-29 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JPH0729962B2 (ja) | フェノール類の製造方法 | |
| JPH0529374B2 (ja) | ||
| JP4092893B2 (ja) | 二価フェノールの製造法 | |
| JPWO2019225549A1 (ja) | 変性アルミノシリケートの製造方法、変性アルミノシリケート及びそれを用いた芳香族ジヒドロキシ化合物の製造方法 | |
| JP4540761B2 (ja) | 芳香族化合物のヒドロキシ芳香族化合物への酸化方法 | |
| US7285688B2 (en) | Proton type β zeolite, preparation method thereof and process for preparing phenol compound using the same | |
| US3943179A (en) | Hydroxylation of aromatic compounds | |
| EP1167332B1 (en) | Process for producing dihydric phenols | |
| JP2008510002A (ja) | シクロアルカン類の酸化およびシクロアルキルヒドロパーオキシドの分解のための触媒 | |
| JP4169070B2 (ja) | フェノールの製造方法 | |
| JP2005230672A (ja) | 成型体プロトン型βゼオライトの賦活方法 | |
| JP4059022B2 (ja) | 二価フェノールの製造法 | |
| JP2009073736A (ja) | 新規プロトン型βゼオライト | |
| JP2004352578A (ja) | 新規プロトン型βゼオライト | |
| JP2005060384A (ja) | フェノール化合物の製造方法 | |
| JP4292392B2 (ja) | ヒドロキシフェニルエーテルの製造方法 | |
| PL85551B1 (ja) | ||
| EP4512773A1 (en) | Production method for modified aluminosilicate, production method for catalyst including modified aluminosilicate, production method for aromatic polyhydroxide compound using said catalyst, and modified aluminosilicate | |
| JP4254009B2 (ja) | 芳香族ヒドロキシ化合物の製造方法 | |
| JP2003055287A (ja) | 二価フェノールの製造法 | |
| EP4328183A1 (en) | Method for manufacturing modified aluminosilicate, and modified aluminosilicate and method for manufacturing aromatic polyhydroxide compound using same | |
| CN118475406A (zh) | 用于过氧化氢异丙苯分解的催化剂及其制备方法 | |
| DE19829515A1 (de) | Metallmodifizierten Zeolith enthaltender Katalysator | |
| JP2004107251A (ja) | 2,3,5−トリメチルハイドロキノンの製造法 | |
| JPH02298350A (ja) | 芳香族化合物のヒドロキシル化反応用触媒 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20080212 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20080225 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20110314 Year of fee payment: 3 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 4092893 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20120314 Year of fee payment: 4 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20120314 Year of fee payment: 4 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20130314 Year of fee payment: 5 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20130314 Year of fee payment: 5 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20130314 Year of fee payment: 5 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20140314 Year of fee payment: 6 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| LAPS | Cancellation because of no payment of annual fees |