JP2022017518A - 化学療法による心毒性を阻止するための医薬組成物および方法 - Google Patents
化学療法による心毒性を阻止するための医薬組成物および方法 Download PDFInfo
- Publication number
- JP2022017518A JP2022017518A JP2021181693A JP2021181693A JP2022017518A JP 2022017518 A JP2022017518 A JP 2022017518A JP 2021181693 A JP2021181693 A JP 2021181693A JP 2021181693 A JP2021181693 A JP 2021181693A JP 2022017518 A JP2022017518 A JP 2022017518A
- Authority
- JP
- Japan
- Prior art keywords
- cancer
- agent
- pharmaceutical composition
- protective agent
- subject
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 0 CCOC(C(C1=C(*)C2C)=*)=C(c(cc3OC*[C@@]4OC[C@](*)[C@](*)C4)cc(OC)c3O*)OC1=CC2O Chemical compound CCOC(C(C1=C(*)C2C)=*)=C(c(cc3OC*[C@@]4OC[C@](*)[C@](*)C4)cc(OC)c3O*)OC1=CC2O 0.000 description 5
- ARSRJFRKVXALTF-UHFFFAOYSA-N Oc(cc1OC(c(cc2O)cc(O)c2O)=C2)cc(O)c1C2=O Chemical compound Oc(cc1OC(c(cc2O)cc(O)c2O)=C2)cc(O)c1C2=O ARSRJFRKVXALTF-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/335—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin
- A61K31/35—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having six-membered rings with one oxygen as the only ring hetero atom
- A61K31/352—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having six-membered rings with one oxygen as the only ring hetero atom condensed with carbocyclic rings, e.g. methantheline
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/13—Amines
- A61K31/135—Amines having aromatic rings, e.g. ketamine, nortriptyline
- A61K31/136—Amines having aromatic rings, e.g. ketamine, nortriptyline having the amino group directly attached to the aromatic ring, e.g. benzeneamine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/335—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin
- A61K31/35—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having six-membered rings with one oxygen as the only ring hetero atom
- A61K31/352—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having six-membered rings with one oxygen as the only ring hetero atom condensed with carbocyclic rings, e.g. methantheline
- A61K31/353—3,4-Dihydrobenzopyrans, e.g. chroman, catechin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/4427—Non condensed pyridines; Hydrogenated derivatives thereof containing further heterocyclic ring systems
- A61K31/4439—Non condensed pyridines; Hydrogenated derivatives thereof containing further heterocyclic ring systems containing a five-membered ring with nitrogen as a ring hetero atom, e.g. omeprazole
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/445—Non condensed piperidines, e.g. piperocaine
- A61K31/4523—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems
- A61K31/4545—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems containing a six-membered ring with nitrogen as a ring hetero atom, e.g. pipamperone, anabasine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/47—Quinolines; Isoquinolines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/496—Non-condensed piperazines containing further heterocyclic rings, e.g. rifampin, thiothixene or sparfloxacin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/506—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim not condensed and containing further heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/517—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim ortho- or peri-condensed with carbocyclic ring systems, e.g. quinazoline, perimidine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7028—Compounds having saccharide radicals attached to non-saccharide compounds by glycosidic linkages
- A61K31/7034—Compounds having saccharide radicals attached to non-saccharide compounds by glycosidic linkages attached to a carbocyclic compound, e.g. phloridzin
- A61K31/704—Compounds having saccharide radicals attached to non-saccharide compounds by glycosidic linkages attached to a carbocyclic compound, e.g. phloridzin attached to a condensed carbocyclic ring system, e.g. sennosides, thiocolchicosides, escin, daunorubicin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7042—Compounds having saccharide radicals and heterocyclic rings
- A61K31/7048—Compounds having saccharide radicals and heterocyclic rings having oxygen as a ring hetero atom, e.g. leucoglucosan, hesperidin, erythromycin, nystatin, digitoxin or digoxin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/005—Enzyme inhibitors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/04—Peptides having up to 20 amino acids in a fully defined sequence; Derivatives thereof
- A61K38/05—Dipeptides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/3955—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against proteinaceous materials, e.g. enzymes, hormones, lymphokines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0053—Mouth and digestive tract, i.e. intraoral and peroral administration
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/08—Solutions
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/10—Dispersions; Emulsions
- A61K9/127—Synthetic bilayered vehicles, e.g. liposomes or liposomes with cholesterol as the only non-phosphatidyl surfactant
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2300/00—Mixtures or combinations of active ingredients, wherein at least one active ingredient is fully defined in groups A61K31/00 - A61K41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/40—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil
- A61K31/403—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil condensed with carbocyclic rings, e.g. carbazole
- A61K31/404—Indoles, e.g. pindolol
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Epidemiology (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Molecular Biology (AREA)
- Immunology (AREA)
- Organic Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Gastroenterology & Hepatology (AREA)
- Physiology (AREA)
- Nutrition Science (AREA)
- Dermatology (AREA)
- Dispersion Chemistry (AREA)
- Mycology (AREA)
- Microbiology (AREA)
- Cardiology (AREA)
- Heart & Thoracic Surgery (AREA)
- Oncology (AREA)
- Endocrinology (AREA)
- Hematology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Medicinal Preparation (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Biochemistry (AREA)
- Biophysics (AREA)
- Genetics & Genomics (AREA)
Abstract
Description
本出願は、2016年2月4日出願の米国特許仮出願第62/291,480号、および2016年6月9日出願の米国特許仮出願第62/348,102号の優先権を主張するものであり、それらの出願は、全ての目的で全体として参照により本明細書に組み入れられる。
心毒性およびうっ血性心不全は、腫瘍治療、最も顕著なものとして1年あたり100万人を超える癌患者と、全ての小児癌患者の半数に投与されるアントラサイクリン系を含む腫瘍治療による重篤な副作用である。有害な心臓副作用は、プロテインキナーゼ阻害剤、およびプロテインキナーゼを標的とする抗体系生物製剤で処置された患者でも観察される。心不全率の特定の低下が、最大用量のアントラサイクリン系をキャッピングすることにより、そして投与計画を変更することにより実現されたが、それらの全てがこれらの抗癌剤の治療効力を重度に限定する。抗癌剤の心毒性はまた、心臓の既往症を有するそれらの患者が処置を受けるのを妨げる可能性がある。
本開示は、アントラサイクリン系、プロテインキナーゼ阻害剤および/または生物製剤で処置された患者において心臓を保護するため、そして心不全を予防するための組成物、キット、および方法を提供する。化学療法の下で癌患者の心不全を潜在的に増悪させるリスクを最小限にすることにより、従来の癌処置が本明細書に記載された発明で改善された有効性および安全性を実現することができる。
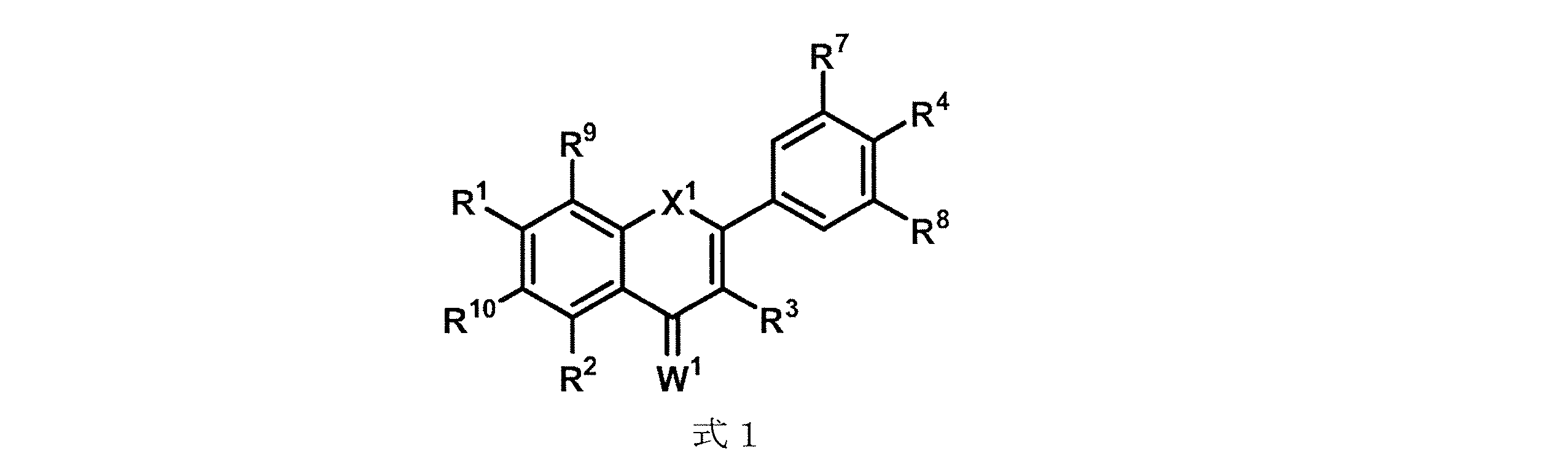
(式中、
X1は、CR5R6、NR5、O、S、C=O、またはC=Sであり;
R1、R2、R3、R5、R6、R9、およびR10のそれぞれは、独立して、アルキル、アルケニル、アルキニル、アルコキシ、アシル、アシルオキシ、カルボン酸、エステル、アミン、アミド、カルボナート、カルバマート、ニトロ、チオエーテル、チオエステル、シクロアルキル、ヘテロアルキル、ヘテロシクリル、単糖、アリール、またはヘテロアリールであり、それらのいずれも置換または非置換であり、ハロゲン、ヒドロキシル、スルフヒドリル、ニトロ、ニトロソ、シアノ、アジドまたはHであり;
R4、R7およびR8は、アルコキシ、ヒドロキシル、またはHであり;
W1は、OまたはSである)に従う保護剤、またはその塩を含む医薬組成物を提供する。
(a)式2
(式中、
X1は、CR5R6、NR5、O、S、C=O、またはC=Sであり;
R1、R2、R3、R5、R6、R9、およびR10のそれぞれは、独立して、アルキル、アルケニル、アルキニル、アルコキシ、アシル、アシルオキシ、カルボン酸、エステル、アミン、アミド、カルボナート、カルバマート、ニトロ、チオエーテル、チオエステル、シクロアルキル、ヘテロアルキル、ヘテロシクリル、アリール、またはヘテロアリールであり、それらのいずれも置換または非置換であり、ハロゲン、ヒドロキシル、スルフヒドリル、ニトロ、ニトロソ、シアノ、アジドまたはHであり;
R4、R7およびR8は、ヒドロキシルであり;
W1は、OまたはSである)に従う化合物またはその塩からなる群から選択される保護剤と;
(b)化学療法剤または生物製剤と、
を含む医薬組成物を提供する。
特定の抗癌剤(例えば、アントラサイクリン薬、プロテインキナーゼ阻害剤)および他の治療薬は、患者において心毒性を誘発し得る。例えばアントラサイクリンによる心毒性は、ドキソルビシンなどの薬物がトポイソメラーゼII酵素によるDNA断裂の際にDNAに挿入され、それによりTOPOIIαまたはTOPOIIβが断裂された鎖を互いに再度ライゲートするのを効果的に防止する時に生じる。
本明細書で提供されるのは、癌処置剤(例えば、化学療法剤、生物製剤、または放射線療法剤)により誘導される心毒性を低減、排除、または予防し得る医薬組成物を、患者、特に癌患者に投与するための方法である。本明細書で提供される方法はまた、本明細書で提供される組成物の少なくとも1種を用いて、患者の癌を処置することを含む。幾つかの例において、該患者は、心臓が健常であり得、幾つかの例において、該患者は、心臓病のリスクがある。
本明細書に開示された方法および組成物は一般に、対象において癌処置による心毒性を予防、低減、処置、または排除するために用いられる。該対象は、任意のヒト患者、特に癌患者、癌のリスクがある患者、または癌の家族歴もしくは個人の癌病歴を有する患者であり得る。幾つかの例において、該患者は、癌処置の特定のステージにいる。例えば、本明細書に記載された医薬組成物は、癌処置により誘発される心毒性を低減するために、早期または後期癌を有するヒト患者に投与され得る。
本明細書で提供される開示は、式1、式2またはそれらの誘導体もしくは塩の1種または複数の保護剤を患者に投与することにより、患者の癌処置剤による心毒性を予防、低減、または排除する方法を記載する。本明細書の開示は、ミリセチン、ビテキシン、ロビネチン、トリセチン、フィセチン、7,3’,4’,5’-テトラヒドロキシフラボン、ジヒドロロビネチン、およびミリシトリン(またはその誘導体もしくは塩)からなる群から選択される1種または複数の保護剤を患者に投与することにより、患者の癌処置剤による心毒性を予防、低減、または排除する方法も記載する。本明細書で提供された開示は、癌処置が対象において心毒性および臓器損傷を誘発する可能性がある、癌を有する対象に投与すること、およびミリセチン、ビテキシン、ロビネチン、トリセチン、フィセチン、7,3’,4’,5’-テトラヒドロキシフラボン、ジヒドロロビネチン、およびミリシトリンからなる群から選択される1種または複数の保護剤(またはその誘導体もしくは塩)を投与すること、の方法であって、該保護剤が該対象における心毒性を予防、低減または排除する、方法も記載する。
本明細書で提供される方法および組成物は、化学療法剤、生物製剤、または放射線療法剤により誘発された患者の心毒性を予防、低減、または排除する。さらに、本明細書に開示された医薬組成物を患者に投与することはまた、癌処置による臓器損傷(例えば、心組織損傷、電気生理学的機能不全、ミトコンドリア毒性、アポトーシス、または酸化ストレスにより誘発された臓器損傷)を予防、低減または排除し得る。
本明細書に開示された医薬組成物は、式1または式2に開示された保護剤(例えば、ミリセチン、ビテキシン、ロビネチン、トリセチン、フィセチン、7,3’,4’,5’-テトラヒドロキシフラボン、ジヒドロロビネチン、ミリシトリン、および/またはそれらの誘導体もしくは塩)を含み得る。該医薬組成物は、任意の組み合わせで1種または複数の保護剤を、任意の組み合わせで2種以上の薬剤を、任意の組み合わせで3種以上の保護剤を、または任意の組み合わせで4種以上の保護剤を含み得る。幾つかの例において、該医薬組成物は、少なくとも2種の保護剤(例えば、ミリセチン、ビテキシン、ロビネチン、トリセチン、フィセチン、7,3’,4’,5’-テトラヒドロキシフラボン、ミリセチン(ミリシトリン)、デクスラゾキサン、および/またはそれらの誘導体もしくは塩)の共配合剤、または少なくとも1種の保護剤と癌処置剤(例えば、化学療法剤、生物製剤、プロテインキナーゼ阻害剤または放射線療法剤)との共配合剤であり得る。該医薬組成物中の該保護剤は、癌処置剤により誘導される心毒性を低減、排除または予防し得る。加えて該医薬組成物中の該保護剤はまた、癌処置剤による臓器損傷を低減、排除または予防し得る。一例において、本開示は、ミリセチンおよびデクスラゾキサンを含む共配合剤を提供する。別の例において、本開示は、化学療法剤ドキソルビシンおよびミリセチンを含む共配合剤を提供する。
(式中、
X1は、CR5R6、NR5、O、S、C=O、またはC=Sであり;
R1、R2、R3、R5、R6、R9、およびR10のそれぞれは、独立して、アルキル、アルケニル、アルキニル、アルコキシ、アシル、アシルオキシ、カルボン酸、エステル、アミン、アミド、カルボナート、カルバマート、ニトロ、チオエーテル、チオエステル、シクロアルキル、ヘテロアルキル、ヘテロシクリル、単糖、アリール、またはヘテロアリールであり、それらのいずれも置換または非置換であり、ハロゲン、ヒドロキシル、スルフヒドリル、ニトロ、ニトロソ、シアノ、アジドまたはHであり;
R4、R7およびR8は、アルコキシ、ヒドロキシル、またはHであり;
W1は、OまたはSである)に従う化合物、またはその塩を含み得る。
(式中、
X1は、CR5R6、NR5、O、S、C=O、またはC=Sであり;
R1、R2、R3、R5、R6、R9、およびR10のそれぞれは、独立して、アルキル、アルケニル、アルキニル、アルコキシ、アシル、アシルオキシ、カルボン酸、エステル、アミン、アミド、カルボナート、カルバマート、ニトロ、チオエーテル、チオエステル、シクロアルキル、ヘテロアルキル、ヘテロシクリル、単糖、アリール、またはヘテロアリールであり、それらのいずれも置換または非置換であり、ハロゲン、ヒドロキシル、スルフヒドリル、ニトロ、ニトロソ、シアノ、アジドまたはHであり;
R4、R7およびR8は、ヒドロキシルであり;
W1は、OまたはSである)に従う化合物またはその塩を含み得る。
本明細書に開示された医薬組成物は、式1または式2で示される化合物を含む固体配合剤をはじめとする任意のタイプの配合剤であり得る。
幾つかの例において、本明細書に開示された医薬組成物は、キットに構成させられ得る。幾つかの例において、該キットは、キット内の別の物体として、または共配合剤として存在し得る保護剤を含み得る。例えば該キットは、ミリセチン、トリセチン、ロビネチン、フィセチン、ビテキシン、ジヒドロロビネチン、7,3’,4’,5’-テトラヒドロキシフラボン、ミリシトリン、およびデクスロゾキサン(dexrozoxane)からなる群から選択される1種または複数の保護剤を含み得る。幾つかの例において、該キットは、キット内の別の物体として、または共配合剤として存在し得る少なくとも2種の保護剤を含み得る。例えば該キットは、ミリセチン、トリセチン、ロビネチン、フィセチン、ビテキシン、ジヒドロロビネチン、7,3’,4’,5’-テトラヒドロキシフラボン、ミリシトリン、およびデクスロゾキサンからなる群から選択される少なくとも2種の保護剤を含み得る。特別な例において、該キットは、ミリセチンとデクスラゾキサンの共配合剤を含み得る。幾つかの例において、該キットは、キット内の別の物体として、または共配合剤として存在し得る、癌処置剤および少なくとも1種の保護剤を含み得る。例えば該キットは、癌処置剤と、ミリセチンおよび/またはその誘導体とを含み得る。例えば該キットは、癌処置剤と、ロビネチンおよび/またはその誘導体とを含み得る。例えば該キットは、癌処置剤と、ジヒドロロビネチンおよび/またはその誘導体とを含み得る。例えば該キットは、癌処置剤と、トリセチンおよび/またはその誘導体とを含み得る。例えば該キットは、癌処置剤と、フィセチンおよび/またはその誘導体とを含み得る。例えば該キットは、癌処置剤と、7,3’,4’,5’-テトラヒドロキシフラボンおよび/またはその誘導体とを含み得る。
実施例1.ミリセチンは長期心保護を提供する(細胞生存率)
人工多能性幹細胞を心筋細胞に分化させることにより、細胞試料を調製した。細胞を分化後4日間培養し、3日目に培地を交換した後、実験を実施した。試料を72時間、偽処置するか、1.25μMドキソルビシンで処置するか、ミリセチンで処置するか、または1.25μMドキソルビシンとミリセチンで同時処置した。処置後に、試料を、細胞核を示すHoeschst 33342と共にインキュベートした。INCell Analyzer2200を用いて細胞を撮像し、画像を分析して細胞総数を定量し、対照に対して正規化された細胞総数に対する割合としてプロットした(各データポイントは、3つの生物学的反復測定から得た)(左)。代表的画像(図3の右)を各試料で示しているが、Hoechst 33342シグナルの上昇は、イオン細胞生存率の上昇を表している。
人工多能性幹細胞を心筋細胞に分化させることにより、ヒトiPSC由来心筋細胞を調製した。細胞を分化後4日間培養し、3日目に培地を交換した後、実験を実施した。心筋細胞を2日間、1.25μMドキソルビシンで処置するか(図4A)、または1.25μMドキソルビシンと79μMミリセチンで同時処置した(図4B)。処置後に、試料を、ミトコンドリア健常性を示すテトラメチルローダミンメチルエステル(TMRM)色素、および細胞核を同定するHoechst 33342と共にインキュベートした。INCell Analyzer2200を用いて細胞を撮像した。代表的な画像を各試料で示しているが、TMRMシグナルの低下は、ミトコンドリア毒性の増加を示す。ミリセチンの非存在下で1.25μMドキソルビシンにより処置された細胞(図4A)に比較して、1.25μMドキソルビシンと79μMミリセチンで同時処置された細胞(図4B)でTMRMシグナルがより大きかったことに示される通り、ミリセチンは、ドキソルビシンによるミトコンドリア毒性に対して強力な保護剤となった。
ヒトiPSC由来心筋細胞を、上記の通り調製した。試料を72時間、偽処置するか、1.25μMドキソルビシンで処置するか、79μMミリセチンで処置するか、または1.25μMドキソルビシンと79μMミリセチンで同時処置した。処置後に、Pulseを用いて拍動する心筋細胞のビデオを撮影し、分析して細胞収縮のプロットから心拍数を定量した(図5左)(各データポイントは、3つの生物学的反復測定から得た)。細胞収縮の代表的なプロット(図5右)を、各試料で示している。ミリセチンは、細胞収縮性の強力な保護剤であった。偽処置心筋細胞は、1分あたり33.33回収縮したが、ミリセチンの非存在下での1.25μMドキソルビシンによる処置は、収縮を完全に阻害した。ミリセチンで処置された、またはミリセチンと1.25μMドキソルビシンで同時処置された心筋細胞は、それぞれ1分あたり39.33または37.33回収縮した。図6A~Cは、図3に示された実験の生データ(6A)もしくは正規化データ(6B)、または図5に示された実験の生データ(6C)を提供するチャートを示す。
心筋細胞を、上記の通り調製した。細胞を3日間、1μMのドキソルビシンと、ミリセチン(図7A)、ミリセトリン(図7B)またはジヒドロミリセチン(図7C)のいずれかと、で同時処置した。処置後に、試料を、アポトーシス陽性細胞を示すCellEvent色素、および細胞核を同定する第二の色素と共にインキュベートした。INCell Analyzer2200を用いて細胞を撮像し、画像を分析して、アポトーシス細胞の割合%を定量した。データは、2つの独立したスクリーニングセットから示され、各データポイントは、三重測定から得られた。
DOXによる細胞障害性に対するMYRの影響を評定するために、ヒトiPSC由来心筋細胞を72時間、偽処置するか(三角形)、または100μMミリセチン(MYR;円形)および上昇濃度のドキソルビシン(DOX)で処置し、その後、ミトコンドリア健常性を示す色素(TMRM、Life Technologies)および細胞核を示す色素(Hoechst33342、Life Technologies)と共にインキュベートした。INCell Analyzer2200(GE)を用いて、細胞を撮像した。健常細胞の総数を計数し、偽処置対照に対する割合%としてプロットした。ドキソルビシンにより細胞の50%が死滅された致死濃度(LC50)は、iPSC心筋細胞で偽処置の0.41μMからMYR処置状態の1.29μMにシフトした(図8)。データは、複数の独立したスクリーニングセットから示され、各データポイントは、三重測定(n=3)から得られた。Y軸:細胞生存率の割合%;X軸:上昇濃度のDOX(図8)。
心筋細胞のDOXによる細胞死からの救済率を測定するために、ミリセチンの保護効果を、デクスラキソザン(DEX;標準治療)と直接比較した。ヒトiPSC由来心筋細胞を、0.5μMドキソルビシンと、上昇濃度のミリセチン(MYR、円形)またはデクスラキソザン(DEX、正方形)で処置した。処置の72時間後に、細胞を、ミトコンドリア健常性を示す色素(TMRM、Life Technologies)および細胞核を示す色素(Hoechst33342、Life Technologies)と共にインキュベートした。INCell Analyzer2200(GE)を用いて、細胞を撮像した。健常細胞の総数を計数し、ドキソルビシン処置対照に対する割合%としてプロットした。MYRの半数効果濃度(EC50)は、7.50μMであった(図9)。これに対してDEXは、DOXによる細胞障害性からの任意の有意な救済を示さなかった(n=3)。
心臓細胞の収縮性に及ぼすミリセチンの保護効果を評定するために、人工多能性幹細胞を心筋細胞に分化させることにより細胞試料を調製した。細胞を分化後4日間培養して、3日目に培地を交換した後、実験を実施した。ヒトiPSC由来心筋細胞をその後、DMSO、DOX(0.5μM)、DOX+DEX(100μM)、またはDOX+MYR(100μM)で処置した。処置の48時間後に、拍動する心筋細胞のビデオを、Pulse(Cellogy)で撮影した。拍動、持続時間、およびピーク高の減少により示される通り、DOX処置は、心筋細胞収縮の機能不全を誘導した。この収縮機能不全は、DEXに比較して、MYRにより有意に修正された(図10)。データは、複数の独立した実験セットから示され、各データポイントは、6つの試料(n=6)から得られた。スチューデントT検定(対応のない両側検体)を利用して、差の有意性を決定した。
DOXによる細胞死は多くの場合、心筋細胞組織化(例えば、サルコメア)の構造破壊の重症度により発現される。DOXによるサルコメア破壊に対するMYRの保護効果を評定するために、ヒトiPSC由来心筋細胞を、DMSO、DOX(0.5μM)、またはDOX+MYR(100μM)で処置した。処置の72時間後に、心臓細胞のサルコメア組織化を示すCardiac Troponin Tに対する抗体(Abcam)で、細胞を免疫染色した。図12に示される通り、MYRは、心筋細胞のDOXによるサルコメア破壊に対して有意な保護を付与しており、DOXによる細胞死に対するMYRの保護効果が、心筋細胞の構造的完全性により十分に発現されることが示唆された。
心保護に及ぼすミリセチン(MYR)の分子機構およびデクスラキソザン(DEX)の分子機構への見識を高めるために、DOXの明白な標的であるトポイソメラーゼII(即ち、TOPOIIαおよびβ)に及ぼすこれらの2種の化合物の影響を評定した。
MYRの分子機構とDEXの分子機構をさらに識別するため、そして先の脱連環アッセイで観察されたTOPOIIに及ぼすMYRの阻害効果がTOPOIIタンパク質の分解によるものか否かを決定するためにも、ヒトiPSC由来心筋細胞を、DMSO、DEX(100μM)、またはMYR(100μM)で24時間処置し、トポイソメラーゼIIβに対する抗体(BD Biosciences)で免疫染色した。
DOXによる毒性に対する心保護を付与するMYRの能力は、DEXと独立しているため、他のフラボノイド化合物がMYRのようなトポイソメラーゼII活性に類似の影響を有するか否かを決定するためにさらに調査した。
次に、MYRおよびDHMは、これらの構造およびTOPOII阻害活性において特有の性質を示すため、心保護を付与するMYRの能力を、DHMの能力と直接比較した。人工多能性幹細胞を心筋細胞に分化させることにより、細胞試料を調製した。細胞を分化後4日間培養し、3日目に培地を交換した後、実験を実施した。ヒトiPSC由来心筋細胞を、0.5μMドキソルビシンと、上昇濃度のミリセチン(MYR、円形)またはジヒドロミリセチン(DHM、三角形)で処置した。処置の72時間後に、細胞を、ミトコンドリア健常性および細胞核を示す色素と共にインキュベートした。その後、細胞を撮像し、健常細胞の総数を計数し、先に記載された通りドキソルビシン処置対照に対する割合%としてプロットした。
構造(例えば、フラボン/フラボノール骨格)と生物活性(例えば、心保護、TOPOII阻害など)の関連性をさらに調査するために、ミリセチンに関係する追加的フラボノイド化合物の群を同定して、それらの活性をテストした。
アントラサイクリンによる心毒性は、ドキソルビシンなどの薬物が、トポイソメラーゼII酵素によるDNAの断裂の際にDNAに挿入され、それによりTOPOIIαまたはβが断裂されたDNA鎖を互いに再度ライゲートするのを効果的に防止する時に生じる。それゆえ、トポイソメラーゼIIαおよびβ(TOPOIIαおよびTOPOIIβ)阻害を介するフラボノイドの心保護特性に基づいて、作業仮説が提案された。
+ 各生物学的特性に対してプラス効果を示した化合物
- 各生物学的特性に対してマイナス効果を示した化合物
† 最初のスクリーニングで10μMまたは100μMで最大保護効果の30%を超えることができなかった化合物
* 100μMで細胞障害性を示した化合物
N/A 化合物が細胞障害性を示し、心保護活性を示さなかったため、実験を実施しなかった
先の表1に示された通り、TOPOIIβ阻害剤(1~5)の共通の特徴により、フラボノイド化合物がTOPOIIβを阻害するために3、7、3’、および4’位でヒドロキシル置換基が必要となるという推論が可能になった。唯一の例外が、3-ヒドロキシル置換基を有さないトリセチン(3)であり、他の4種のTOPOIIβ阻害剤は全て、3、7、3’、および4’位にヒドロキシル置換基を有する。さらに、先の表1の心保護化合物(1~12)の共通の特徴により、心保護活性のためにB環の4’ヒドロキシル置換基が、3、7、および3’位の他の3つのヒドロキシル置換基のうちの2つと共に本質的特徴であり得、7位のヒドロキシルが好ましい、という推論が可能になったが、唯一の例外が、3および7位にヒドロキシルを有さないが、B環の3’、4’、および5’位の3つのヒドロキシル置換基全てを有する化合物8である。さらに、被験化合物の毒性を考慮すると(表1参照)、B環の3つの3’、4’、および5’ヒドロキシル置換基の全てを有する心保護化合物(1~12)は、100μM未満の濃度で毒性作用を示さないが、3’および4’位のみにヒドロキシル置換基を有するそれらの心保護化合物は、100μM未満の濃度で実際に毒性作用を示す、という傾向を推測することができる。再び、この傾向の1つの例外が、B環の3つのヒドロキシル置換基全てを含みながら100μM未満の濃度で若干の毒性作用を示すトリセチン(3)であった。B環に4’ヒドロキシル置換基を有するのみの2種の心保護化合物(ケンペロール7およびレソケンペロール10)のうち、ケンペロールは、100μM未満で毒性作用を示さなかったが、レソケンペロールは、100μM未満の濃度で毒性作用を示した。この分析に基づき、以下のように結論づけられた:
(1)心保護については、B環の4’ヒドロキシル置換基が、以下のもの(a)3、7、および3’位の3つのヒドロキシル置換基のうちの2つであり、7位が好ましい、または(b)B環の3’、4’、および5’位の3つのヒドロキシル置換基全て、のうちの一方と共に必要となる;
(2)心毒性については、100μM未満の濃度で毒性作用を緩和するために、B環の3’、4’および5’ヒドロキシル置換基がB環の3’および4’ヒドロキシル置換基よりも、またはA/C環系の3つの3、5、および7ヒドロキシル置換基全てとB環の4’ヒドロキシルのみよりも好ましい;そして
(3)TOPOIIβ阻害については、3、7、3’および4’位の4つのヒドロキシル置換基全てが必要である。トリセチン(3)は、これらの要件に従わず、アウトライヤである。
B環の4’位が心保護のためにヒドロキシル置換基を必要とすることが、表1に列挙された化合物から即座に明白となる。初期スクリーニングを通過した12種の化合物(1~12)のうち、それらの全てが、4’-ヒドロキシル置換基を有する。その上、初期スクリーニングを通過しなかった16種の化合物(13~28)のうち11種(18~28)は、4’-ヒドロキシル置換基が存在しない。初期スクリーニングを通過しなかった残りの5種の4’-ヒドロキシル化合物(13~17)は、最小置換、例えば化合物17のように唯一の4’-ヒドロキシル、または化合物14、15および16のように4’-ヒドロキシルと唯一の他のヒドロキシル置換基、を有する。化合物13は、先に記載された3、7、および3’の組み合わせのうち必要となるヒドロキシル置換基の1つを有するのみで、それゆえ化合物13もまた、心保護活性のための最小要件を満たさない。要約すると、B環の4’位のヒドロキシル置換基の存在は、フラボノイド化合物が心保護性になるための必要条件ではあるが、十分条件ではない。この構造要件は、生物学的ターゲットとの複合体における保護剤のB環の4’-ヒドロキシル間の水素結合の存在を強く暗示している。
フラボン-フラボノール骨格の複素二環式A/C環系の置換基を、心保護活性について評定した。B環で行われた観察に基づき、A-C環の3、5、7位の-OHと様々に組み合わせたB環のヒドロキシルを有する化合物のサブセットをテストした。
1.アントラサイクリン系
MYRはエピルビシンによる細胞死およびイダルビシンによる細胞死から保護する
エピルビシンおよびイダルビシンは、患者の心不全に関連するアントラサイクリン系である。先に記載されたドキソルビシンに加えて、MYRの効果を、エピルビシンおよびイダルビシンによる心臓傷害についてテストした。図19に示される通り、ヒトiPSC由来心筋細胞を72時間、偽処置するか(三角形)、またはMYR100μMおよび上昇濃度のエピルビシンもしくはイダルビシンで処置し(円形)、その後、先に記載された通りミトコンドリア健常性および細胞核を示す色素と共にインキュベートした。細胞を撮像し、健常細胞の総数を計数して、偽処置対照に対する割合%としてプロットした。
MYRは、ボルテゾミブ、スニチニブおよびソラフェニブによる細胞死から保護する
心毒性は、様々な抗癌剤により誘発されるレドックスサイクルを通して毒性活性酸素種(ROS)の形成から起こり得る。活性酸素種(ROS)は、アポトーシス経路を活性化して、癌細胞および正常細胞の両方の細胞死に導き得る。心筋細胞は、酸化ストレスに対して特に感受性があり、心臓ミトコンドリアは、アントラサイクリン、TKIまたはプロテアソーム阻害剤のような抗癌剤によって容易に破壊され得る。先に提示されたデータにより、心臓細胞を保護する本明細書に記載されたMYRおよびその類似体の可能性が(1)アントラサイクリン系と同様に心臓細胞内でTOPOII酵素と相互作用することによる保護;および(2)TOPOIIの分子機構と独立して発揮される効果(例えば、ROSキレート化、ミトコンドリアの完全性促進)、と多面的であり得ると仮定した。MYRが非アントラサイクリン薬で心保護を付与するか否かを決定するために、該化合物を、プロテインキナーゼ阻害剤による細胞障害性に対して心臓細胞を保護する能力についてテストした。
ビスジオキソピペラジンのデクスラゾキサン(DEX)は、抗癌剤を受ける癌患者の心不全の発症率を低減するために利用可能な唯一の薬物である。その臨床効果にもかかわらず、DEXは、アントラサイクリン系の抗腫瘍効力を妨害すること、続発性悪性腫瘍を誘導すること、ならびに血液および骨髄障害を誘発すること、など複数の副作用に関連する。これらの限定は、特定の癌患者での使用を大きく限定する。
急性のアントラサイクリンによる心毒性モデルを、The Jackson Laboratoryから得られた9~10週齢C57BL/6マウスで樹立した。動物を、生理食塩水処置(n=8)、ドキソルビシン処置(n=16)またはドキソルビシン+MYR処置(n=17)の3群に分割した。ドキソルビシン(20mg/kg)、MYR(40mg/kg)および生理食塩水を、単一の腹腔内注射を介して投与した。MYRを、ドキソルビシン処置の30分前に投与した。動物の一般的健康状態を、試験経過中に1日1回ベースでモニタリングした。マウスにイソフルラン(約1.0%)を用いて麻酔をかけ、経胸壁心エコー法を、VevoLAZR Imaging System(VisualSonics Inc.、カナダ トロント所在)を用いて、ベースライン測定を得るために-4日目に、そして処置後5日目に実施した。左心室(LV)M-モード画像を、乳頭筋付近の二次元短軸像で得た。収縮期および拡張期の心内膜組織のトレーシングを、オフラインに設定した。その後、これらのデータを、収縮機能の総合指数である短縮率(FS)および駆出率(EF)を計算するために用いた。
人工多能性幹細胞を心筋細胞に分化させることにより、細胞試料を調製した。細胞を分化後4日間培養し、3日目に培地を交換した後、実験を実施した。試料を48時間、偽処置するか、1μMドキソルビシンで処置するか、または1μMドキソルビシンと示された薬物で処置した。処置後に、試料を、ミトコンドリア健常性を示すテトラメチルローダミンメチルエステル(TMRM)色素、および細胞核を同定する第二の色素と共にインキュベートした。INCell Analyzer2200を用いて細胞を撮像し、TMRM陰性細胞の割合%を定量するために画像をCellProfilerにより分析した。代表的なデータを、2つの独立したスクリーニングセットから保護剤について示し、各データポイントは、3つの生物学的反復測定から得た。データの正規化を、偽処置試料(0%ミトコンドリア毒性)および1μMドキソルビシン処置試料(100%ミトコンドリア毒性)に基づいてデータを再較正することにより実施した。
人工多能性幹細胞を心筋細胞に分化させることにより、細胞試料を調製した。細胞を分化後4日間培養し、3日目に培地を交換した後、実験を実施した。試料を48時間、偽処置するか、1μMドキソルビシンで処置するか、または1μMドキソルビシンと示された薬物で処置した。処置後に、試料を、アポトーシス陽性細胞を示すTUNEL色素、および細胞核を同定する第二の色素と共にインキュベートした。INCell Analyzer2200を用いて細胞を撮像し、アポトーシス陽性細胞の割合%を定量するために画像をCellProfilerにより分析した。代表的なデータを、2つの独立したスクリーニングセットから保護剤について示し、各データポイントは、3つの生物学的反復測定から得た。データの正規化を、偽処置試料(0%アポトーシス)および1μMドキソルビシン処置試料(100%アポトーシス)に基づいてデータを再較正することにより実施した。
人工多能性幹細胞を心筋細胞に分化させることにより、細胞試料を調製した。細胞を分化後4日間培養し、3日目に培地を交換した後、実験を実施した。試料を7日間、偽処置するか(図27A)、1μMドキソルビシンで処置するか(図27B)、1μMドキソルビシンと16μMデクスラゾキサンで同時処置するか(図27C)、または1μMドキソルビシンと116μMデクスラゾキサンで同時処置した(図27D)。処置後に、試料を、ミトコンドリア健常性を示すテトラメチルローダミンメチルエステル(TMRM)色素と共にインキュベートした。INCell Analyzer2200を用いて細胞を撮像し、TMRM陰性細胞の割合%を定量するために画像をCellProfilerにより分析した。代表的な画像を、各試料について示すが、TMRMシグナルの損失は、ミトコンドリア毒性を表す。
人工多能性幹細胞を心筋細胞に分化させることにより、細胞試料を調製した。細胞を分化後4日間培養し、3日目に培地を交換した後、実験を実施した。試料を、0.1%DMSOで偽処置するか、1μMドキソルビシンで処置するか、または1μMドキソルビシンと様々な濃度のビテキシン(例えば、11.6μM、37μM、または116μM)で同時処置した。処置後に、各試料の活性電極の割合%を、72時間測定した。活性電極の割合%を、タイムコースで定量してグラフ化した(図28A)。ウェルあたりの活性電極の平均数を、処置後30時間目に定量してグラフ化した(図28B、n=6、標準偏差をエラーバーとして示す)。
MDA-MB-231細胞(転移乳癌)を1日間培養した後、実験を実施した。試料を72時間、上昇濃度のドキソルビシン(例えば、0μM、0.016μM、0.05μM、0.16μM、0.5μM、1.6μM、5μM、16μM、または50μM)で処置するか、または上昇濃度のドキソルビシンと示された保護剤で同時処置した。次に細胞を、CellTiter-Glo試薬で溶解して、代謝活性(例えば、生存性)細胞を同定した(溶解された細胞懸濁液から測定された発光は、培養物中に存在する生存性細胞の数と正比例する)。%細胞死を、発光の減少を測定することにより定量した。XLFitを、カーブフィッティングに用いた。三重測定の平均をグラフ化し、標準偏差をエラーバーで示す。
A549細胞(肺癌)を、1日間培養した後、実験を実施した。試料を72時間、上昇濃度のドキソルビシン(例えば、0μM、0.016μM、0.05μM、0.16μM、0.5μM、1.6μM、5μM、16μM、または50μM)で処置するか、または上昇濃度のドキソルビシンと示された保護剤で同時処置した。次に細胞を、CellTiter-Glo試薬で溶解して、代謝活性(例えば、生存性)細胞を同定した(溶解された細胞懸濁液から測定された発光は、培養物中に存在する生存性細胞の数と正比例する)。%細胞死を、発光の減少を測定することにより定量した。XLFitを、カーブフィッティングに用いた。三重測定の平均をグラフ化し、標準偏差をエラーバーで示す。
人工多能性幹細胞を心筋細胞に分化させることにより、細胞試料を調製した。細胞を分化後4日間培養し、3日目に培地を交換した後、実験を実施した。試料を少なくとも20分間、0.1%DMSOで偽処置するか、または上昇濃度の示された薬物で処置した。対照として、心筋細胞をhERGカリウムチャネルブロッカーE4031で処置した。処置後に、MEAを用いて、心拍周期およびフィールド電位間隔(FPD)を各試料で測定した。
人工多能性幹細胞を心筋細胞に分化させることにより、細胞試料を調製した。細胞を分化後4日間培養し、3日目に培地を交換した後、実験を実施した。試料を、0.1%DMSOで偽処置するか、または様々な濃度の示された薬物で処置した。処置後に、各試料の活性電極の割合%を、少なくとも5日間測定した。活性電極の割合%を、タイムコースで定量してグラフ化した。
心臓疾患の病歴を有する患者が、乳癌と診断される。心不全のリスク増大のため、患者は、心毒性を誘導することが知られるドキソルビシンの標準処置レジメンを受けることができない。代わりに介護者が、ドキソルビシン(10mg)およびビテキシン(100mg)の共配合剤を投与する。心エコーを実施し、血流速度を測定して、該治療が患者において心毒性作用を有するか否かを決定する。患者は、心機能不全の指標を示さない。心毒性の兆候を示さないため、患者は次の数週間、高用量の処置を受けることができる。次に患者は、組織生検を受けるが、乳癌の指標を示していない。
患者は、肝臓癌と診断される。介護者が、ドキソルビシン(5mg/mL)およびデクスラゾキサン(50mg/mL)の共配合剤を患者に投与する。心電図検査を実施して、デクスラゾキサンが患者における心毒性作用の鎮静に成功するか否かを決定する。患者は、20msのQT延長を示す。デクスラゾキサンの活性を増強するために、介護者は、ドキソルビシン(5mg/mL)およびビテキシン(100mg/mL)の共配合剤を患者に投与する。処置後に、心電図検査を実施し、患者はQT延長の兆候を示さない。患者は、数週間にわたり処置を受け続けることができ、その後、組織生検を実施し、肝臓癌が根絶されたことを確認する。
患者は、ステージIIの肺癌と診断され、徐脈を有する。心不全のリスク増大のため、患者は、心収縮に影響を及ぼし、徐脈を誘導することで知られるドキソルビシンの標準処置レジメンを受けることができない。代わりに介護者が、ドキソルビシン(10mg)およびミリセチン(100mg)の共配合剤を投与する。心電図を利用して、患者の心拍数をモニタリングする。患者は、心機能不全の指標を示さない。心毒性の兆候を示さないため、患者は次の数週間、高用量の処置を受けることができる。肺癌は、ステージ1にダウンステージし、癌の手術による除去に成功する。経過観察時に、組織生検を実施し、癌の兆候を示していない。
患者は、肝臓癌と診断される。介護者が、ドキソルビシン(5mg/mL)およびデクスラゾキサン(50mg/mL)の共配合剤を患者に投与する。処置後に、心電図検査を実施し、デクスラゾキサンが患者における心毒性作用の鎮静に成功するか否かを決定する。患者は、20msのQT延長を示す。デクスラゾキサンの活性を増強するために、介護者は、ドキソルビシン(5mg/mL)およびミリセチン(50mg/mL)の共配合剤を患者に投与する。処置後に、心電図検査を実施し、患者はQT延長の兆候を示さない。患者は、数週間にわたり処置を受け続けることができ、その後、組織生検を実施して、肝臓癌が根絶されたことを確認している。
患者は、ステージIIの肺癌と診断され、徐脈を有する。心不全のリスク増大のため、患者は、心収縮に影響を及ぼし、徐脈を誘導することで知られるドキソルビシンの標準処置レジメンを受けることができない。代わりに介護者が、ドキソルビシン(10mg)投与の24時間前に、ミリセチン(100mg)を投与する。心電図を利用して、患者の心拍数をモニタリングする。患者は、心機能不全の指標を示さない。心毒性の兆候を示さないため、患者は次の数週間、高用量の処置を受けることができる。肺癌は、ステージ1にダウンステージし、癌の手術による除去に成功する。経過観察時に、組織生検を実施し、癌の兆候を示していない。
患者は、肝臓癌と診断される。介護者が、ドキソルビシン(5mg/mL)およびデクスラゾキサン(50mg/mL)の共配合剤を患者に投与する。心電図検査を実施して、デクスラゾキサンが患者における心毒性作用の鎮静に成功するか否かを決定する。患者は、20msのQT延長を示す。デクスラゾキサンの活性を増強するために、介護者は、ドキソルビシン(5mg/mL)および(100mg/mL)の静脈内投与前に24時間、ミリセチン(100mg)を患者に投与する。処置後に、心電図検査を実施し、患者はQT延長の兆候を示していない。患者は、数週間にわたり処置を受け続けることができ、その後、組織生検を実施して、肝臓癌が根絶されたことを確認している。
Claims (116)
- 抗癌剤と、式1
(式中、
X1は、CR5R6、NR5、O、S、C=O、またはC=Sであり;
R1、R2、R3、R5、R6、R9、およびR10のそれぞれは、独立して、アルキル、アルケニル、アルキニル、アルコキシ、アシル、アシルオキシ、カルボン酸、エステル、アミン、アミド、カルボナート、カルバマート、ニトロ、チオエーテル、チオエステル、シクロアルキル、ヘテロアルキル、ヘテロシクリル、アリール、またはヘテロアリールであり、それらのいずれも置換または非置換であり、ハロゲン、ヒドロキシル、スルフヒドリル、ニトロ、ニトロソ、シアノ、アジドまたはHであり;
R4、R7およびR8は、アルコキシ、ヒドロキシル、またはHであり;
W1は、OまたはSである)に従う保護剤またはその塩と
を含む医薬組成物。 - X1が、OまたはSであり;
R1、R2、R3、R9、およびR10のそれぞれが、独立して、アルコキシ、シクロアルキル、ヘテロシクリル、ハロゲン、ヒドロキシル、スルフヒドリル、ニトロ、ニトロソ、シアノ、アジドまたはHであり;
R4、R7およびR8のそれぞれが、アルコキシ、ヒドロキシルまたはHである、
請求項1に記載の医薬組成物。 - X1が、Oであり;
R1、R2、R3、R9、およびR10のそれぞれが、独立して、アルコキシ、シクロアルキル(akyl)、ヘテロシクリル、ハロゲン、ヒドロキシル、スルフヒドリル、ニトロ、ニトロソ、シアノ、アジドまたはHであり;
R4、R7およびR8のそれぞれが、アルコキシ、ヒドロキシルまたはHである、
請求項2に記載の医薬組成物。 - X1が、Oであり;
R1、R2、およびR3のそれぞれが、独立して、ヒドロキシルまたはHであり;
R9およびR10のそれぞれが、シクロアルキル、ヘテロシクリルまたはHであり;
R4が、ヒドロキシルであり;
R7およびR8が、メトキシ、ヒドロキシルまたはHである、
請求項3に記載の医薬組成物。 - X1が、Oであり;
R1が、ヒドロキシルであり;
R2およびR3のそれぞれが、独立して、ヒドロキシルまたはHであり;
R9およびR10が、Hであり;
R4が、ヒドロキシルであり;
R7およびR8が、ヒドロキシルまたはHである、
請求項4に記載の医薬組成物。 - 前記保護剤が、ミリセチン、ビテキシン、ロビネチン、トリセチン、フィセチン、7,3’,4’,5’-テトラヒドロキシフラボン、およびミリシトリンからなる群から選択される、請求項1に記載の医薬組成物。
- 前記保護剤が、ケンペロールまたはケルセチンである、請求項1に記載の医薬組成物。
- 錠剤である、請求項1~11のいずれか1項に記載の医薬組成物。
- 液体組成物である、請求項1~11のいずれか1項に記載の医薬組成物。
- カプセル、ゲルカプセル、またはリポソームである、請求項1~11のいずれか1項に記載の医薬組成物。
- 前記保護剤が、トポイソメラーゼIIαおよびβ阻害剤である、請求項1に記載の医薬組成物。
- 少なくとも10mgの少なくとも1種の保護剤を含む、請求項1に記載の医薬組成物。
- 少なくとも50mgの少なくとも1種の保護剤を含む、請求項1に記載の医薬組成物。
- 少なくとも100mgの前記保護剤を含む、請求項1に記載の医薬組成物。
- 少なくとも200mgの少なくとも1種の保護剤を含む、請求項1に記載の医薬組成物。
- 0.1mg~50mgの間の式1で示される少なくとも2種の保護剤を含む、請求項1に記載の医薬組成物。
- 前記抗癌剤が、アントラサイクリンまたはその塩である、請求項1~20のいずれか1項に記載の医薬組成物。
- 前記アントラサイクリンが、ダウノルビシン、ドキソルビシン、エピルビシン、イダルビシン、ミトキサントロン、またはバルルビシンである、請求項21に記載の医薬組成物。
- 前記アントラサイクリンが、ドキソルビシンである、請求項22に記載の医薬組成物。
- 前記アントラサイクリンが、エピルビシンである、請求項22に記載の医薬組成物。
- 前記抗癌剤が、プロテインキナーゼ阻害剤である、請求項1~20のいずれか1項に記載の医薬組成物。
- 前記プロテインキナーゼ阻害剤が、アファチニブ、アキシチニブ、ボスチニブ、カボザンチニブ、カルフィルゾミブ、セリチニブ、コビメタニブ、クリゾチニブ、ダブラフェニブ、ダサチニブ、エルロチニブ、エベロリムス、ゲフィチニブ、イブルチニブ、イマチニブ、ラパチニブ、レンバチニブ、ニロチニブ、ニンテダニブ、オシメルチニブ、パルボシクリブ、パゾパニブ、ペガプタニブ、ポナチニブ、レゴラフェニブ、ルキソリチニブ、シロリムス、ソラフェニブ、スニチニブ、トファシチニブ、トファシチニブ、テムシロリムス、トラメチニブ、バンデタニブ、ベムラフェニブ、またはビスモデギブである、請求項25に記載の医薬組成物。
- 前記抗癌剤が、ボルテゾミブである、請求項1~20のいずれか1項に記載の医薬組成物。
- 前記プロテインキナーゼ阻害剤が、チロシンキナーゼ阻害剤である、請求項25に記載の医薬組成物。
- 前記チロシンキナーゼ阻害剤が、ソラフェニブ、スニチニブ、ボスチニブ、ゲフィチニブ、ダサチニブ、ダブラフェニブ、ベムラフェニブ、イマチニブ、ラパチニブ、メシラートおよびニロチニブからなる群から選択される、請求項28に記載の医薬組成物。
- 前記チロシンキナーゼ阻害剤が、ソラフェニブである、請求項29に記載の医薬組成物。
- 前記チロシンキナーゼ阻害剤が、スニチニブである、請求項29に記載の医薬組成物。
- 前記抗癌剤が、生物製剤である、請求項1~20のいずれか1項に記載の医薬組成物。
- 前記生物製剤が、抗体である、請求項32に記載の医薬組成物。
- 前記抗体が、アドトラスツズマブエムタンシン、アレムツズマブ、ベバシズマブ、ブリナツモマブ、ブレンツキシマブ・ベドチン、カツマキソマブ、セツキシマブ、ゲムツズマブ・オゾガマイシン、イブリツモマブ・チウキセタン、イピリムマブ、ネシツムマブ、ニボルマブ、オビヌツズマブ、オファツムマブ、パニツムマブ、ペムブロリズマブ、ペルツズマブ、ラムシルマブ、リツキシマブ、トシツモマブ-I131、またはトラスツズマブである、請求項33に記載の医薬組成物。
- 前記抗体が、トラスツズマブである、請求項34に記載の医薬組成物。
- デクスラゾキサンである第二の保護剤をさらに含む、請求項1に記載の医薬組成物。
- 癌に罹患した対象を処置する方法であって、請求項1~36のいずれか1項に記載の医薬組成物を前記対象に投与することを含む、方法。
- 対象において抗癌剤または生物製剤により誘導される心毒性を予防、低減、または排除するための方法であって、有効量の式1に従う少なくとも1種の保護剤と、前記抗癌剤または生物製剤と、を前記対象に投与し、それにより前記対象において化学療法剤または生物製剤により誘導される前記心毒性を予防、低減、または排除することを含む、方法。
- 前記抗癌剤または生物製剤が、前記式1に従う少なくとも1種の保護剤の投与の前に前記対象に投与される、請求項38に記載の方法。
- 前記抗癌剤または生物製剤が、前記式1に従う少なくとも1種の保護剤の投与に続いて前記対象に投与される、請求項38に記載の方法。
- 前記抗癌剤または生物製剤が、前記式1に従う少なくとも1種の保護剤と同時に前記対象に投与される、請求項38に記載の方法。
- 前記抗癌剤または生物製剤、および前記少なくとも1種の保護剤が、1つの液体組成物中に配合される、請求項38に記載の方法。
- 前記抗癌剤または生物製剤、および前記少なくとも1種の保護剤が、錠剤に配合される、請求項38に記載の方法。
- 前記少なくとも1種の保護剤が、経口投与される、請求項38に記載の方法。
- 前記少なくとも1種の保護剤が、静脈内投与される、請求項38に記載の方法。
- 前記対象が、癌に罹患している、請求項38に記載の方法。
- 前記対象が、ヒト対象である、請求項46に記載の方法。
- 前記癌が、膀胱癌、骨癌、脳腫瘍、乳癌、食道癌、大腸癌、白血病、肝臓癌、肺癌、リンパ腫、骨髄腫、卵巣癌、前立腺癌、肉腫、胃癌、または甲状腺癌である、請求項46に記載の方法。
- 前記癌が、乳癌である、請求項48に記載の方法。
- 前記癌が、白血病である、請求項48に記載の方法。
- 前記癌が、肉腫である、請求項48に記載の方法。
- 前記肉腫が、カポジ肉腫である、請求項51に記載の方法。
- 前記抗癌剤が、プロテインキナーゼ阻害剤である、請求項38に記載の方法。
- 前記プロテインキナーゼ阻害剤が、アファチニブ、アキシチニブ、ボスチニブ、カボザンチニブ、カルフィルゾミブ、セリチニブ、コビメタニブ、クリゾチニブ、ダブラフェニブ、ダサチニブ、エルロチニブ、エベロリムス、ゲフィチニブ、イブルチニブ、イマチニブ、ラパチニブ、レンバチニブ、ニロチニブ、ニンテダニブ、オシメルチニブ、パルボシクリブ、パゾパニブ、ペガプタニブ、ポナチニブ、レゴラフェニブ、ルキソリチニブ、シロリムス、ソラフェニブ、スニチニブ、トファシチニブ、トファシチニブ、テムシロリムス、トラメチニブ、バンデタニブ、ベムラフェニブ、またはビスモデギブである、請求項53に記載の方法。
- 前記プロテインキナーゼ阻害剤が、チロシンキナーゼ阻害剤である、請求項53に記載の方法。
- 前記チロシンキナーゼ阻害剤が、ソラフェニブ、スニチニブ、ボスチニブ、ゲフィチニブ、ダサチニブ、ダブラフェニブ、ベムラフェニブ、イマチニブ、ラパチニブ、メシラートおよびニロチニブからなる群から選択される、請求項55に記載の方法。
- 前記チロシンキナーゼ阻害剤が、ソラフェニブである、請求項56に記載の方法。
- 前記チロシンキナーゼ阻害剤が、スニチニブである、請求項56に記載の方法。
- 前記抗癌剤が、プロテアソーム阻害剤(例えば、ボルテゾミブ)である、請求項38に記載の方法。
- 前記抗癌剤が、生物製剤である、請求項38に記載の方法。
- 前記生物製剤が、抗体である、請求項60に記載の方法。
- 前記抗体が、アドトラスツズマブエムタンシン、アレムツズマブ、ベバシズマブ、ブリナツモマブ、ブレンツキシマブ・ベドチン、カツマキソマブ、セツキシマブ、ゲムツズマブ・オゾガマイシン、イブリツモマブ・チウキセタン、イピリムマブ、ネシツムマブ、ニボルマブ、オビヌツズマブ、オファツムマブ、パニツムマブ、ペムブロリズマブ、ペルツズマブ、ラムシルマブ、リツキシマブ、トシツモマブ-I131、またはトラスツズマブである、請求項61に記載の方法。
- 前記抗体が、トラスツズマブである、請求項62に記載の方法。
- 第二の保護剤を投与することをさらに含む、請求項38に記載の方法。
- 前記第二の保護剤が、デクスラゾキサンである、請求項64に記載の方法。
- 前記式1に従う少なくとも1種の保護剤が、前記抗癌剤または生物製剤の投与の少なくとも24時間前に前記対象に投与される、請求項38に記載の方法。
- 前記式1に従う少なくとも1種の保護剤が、前記抗癌剤または生物製剤の投与の少なくとも1、2、3、4、5、6、6、7、9、10、11 12、13、14、15、16、17、18、19、20、21、22、23、24、または48時間前に前記対象に投与される、請求項38に記載の方法。
- 前記式1に従う少なくとも1種の保護剤が、前記抗癌剤または生物製剤と同時に前記対象に投与される、請求項38に記載の方法。
- 前記式1に従う少なくとも1種の保護剤が、前記抗癌剤または生物製剤の投与の少なくとも1、2、3、4、5、6、6、7、9、10、11 12、13、14、15、16、17、18、19、20、21、22、23、24、または48時間後に前記対象に投与される、請求項38に記載の方法。
- 前記式1に従う少なくとも1種の保護剤が、前記抗癌剤と前記保護剤のモル比を少なくとも1:5単位として前記対象に投与される、請求項38に記載の方法。
- 前記少なくとも1種の保護剤が、トポイソメラーゼIIαまたはβ阻害剤である、請求項38に記載の方法。
- 前記少なくとも1種の保護剤が、トポイソメラーゼIIαおよびトポイソメラーゼβ阻害剤である、請求項71に記載の方法。
- 前記抗癌剤が、アントラサイクリンまたはその塩である、請求項38に記載の方法。
- 前記アントラサイクリンが、ダウノルビシン、ドキソルビシン、エピルビシン、イダルビシン、ミトキサントロン、またはバルルビシンである、請求項73に記載の方法。
- 前記アントラサイクリンが、ドキソルビシンである、請求項74に記載の方法。
- 前記アントラサイクリンが、エピルビシンである、請求項74に記載の方法。
- 前記アントラサイクリンが、イダルビシンである、請求項74に記載の方法。
- 前記少なくとも1種の保護剤が、トポイソメラーゼIIαまたはβ阻害剤である、請求項74に記載の方法。
- 前記少なくとも1種の保護剤が、ミリセチン、ビテキシン、ロビネチン、トリセチン、フィセチン、7,3’,4’,5’-テトラヒドロキシフラボン、およびミリシトリンからなる群から選択される、請求項38に記載の方法。
- (a)癌に罹患していて、対象において心毒性を誘発することが知られる化学療法剤または生物製剤を受けている前記対象に、前記化学療法剤または生物製剤を投与すること;および
(b)有効量の式1に従う保護剤またはその医薬的に許容し得る塩を前記対象に投与し、前記保護剤が前記対象における前記心毒性を予防、低減または排除すること
を含む、癌を処置して1種または複数の抗癌剤からの心毒性を予防するための方法。 - 前記化学療法剤が、アントラサイクリンまたはその塩である、請求項80に記載の方法。
- 前記アントラサイクリンが、ダウノルビシン、ドキソルビシン、エピルビシン、イダルビシン、ミトキサントロン、またはバルルビシンである、請求項81に記載の方法。
- 前記アントラサイクリンが、ドキソルビシンである、請求項82に記載の方法。
- 前記アントラサイクリンが、エピルビシンである、請求項82に記載の方法。
- 前記アントラサイクリンが、イダルビシンである、請求項82に記載の方法。
- 前記保護剤が、トポイソメラーゼII阻害剤である、請求項80に記載の方法。
- 前記保護剤が、トポイソメラーゼIIαまたはβ阻害剤である、請求項86に記載の方法。
- 前記保護剤が、ミリセチン、ビテキシン、ロビネチン、トリセチン、フィセチン、7,3’,4’,5’-テトラヒドロキシフラボン、およびミリシトリンからなる群から選択される、請求項80に記載の方法。
- 前記対象が、ヒト対象である、請求項80に記載の方法。
- 前記癌が、膀胱癌、骨癌、脳腫瘍、乳癌、食道癌、大腸癌、白血病、肝臓癌、肺癌、リンパ腫、骨髄腫、卵巣癌、前立腺癌、肉腫、胃癌、または甲状腺癌である、請求項80に記載の方法。
- 前記癌が、乳癌である、請求項90に記載の方法。
- 前記癌が、白血病である、請求項90に記載の方法。
- 前記癌が、肉腫である、請求項90に記載の方法。
- 前記肉腫が、カポジ肉腫である、請求項93に記載の方法。
- 前記ヒト対象が、心臓病を有するか、または心臓病の病歴を有する、請求項80に記載の方法。
- 前記心毒性が、心組織損傷、電気生理学的機能不全、ミトコンドリア毒性、アポトーシス、および酸化ストレスを含む、請求項80に記載の方法。
- 前記心毒性が、心組織損傷である、請求項96に記載の方法。
- 前記化学療法剤が、プロテインキナーゼ阻害剤である、請求項80に記載の方法。
- 前記プロテインキナーゼ阻害剤が、アファチニブ、アキシチニブ、ボスチニブ、カボザンチニブ、カルフィルゾミブ、セリチニブ、コビメタニブ、クリゾチニブ、ダブラフェニブ、ダサチニブ、エルロチニブ、エベロリムス、ゲフィチニブ、イブルチニブ、イマチニブ、ラパチニブ、レンバチニブ、ニロチニブ、ニンテダニブ、オシメルチニブ、パルボシクリブ、パゾパニブ、ペガプタニブ、ポナチニブ、レゴラフェニブ、ルキソリチニブ、シロリムス、ソラフェニブ、スニチニブ、トファシチニブ、トファシチニブ、テムシロリムス、トラメチニブ、バンデタニブ、ベムラフェニブ、またはビスモデギブである、請求項98に記載の方法。
- 前記プロテインキナーゼ阻害剤が、チロシンキナーゼ阻害剤である、請求項80に記載の方法。
- 前記チロシンキナーゼ阻害剤が、ソラフェニブ、スニチニブ、ボスチニブ、ゲフィチニブ、ダサチニブ、ダブラフェニブ、ベムラフェニブ、イマチニブ、ラパチニブ、メシラートおよびニロチニブからなる群から選択される、請求項100に記載の方法。
- 前記チロシンキナーゼ阻害剤が、ソラフェニブである、請求項101に記載の方法。
- 前記チロシンキナーゼ阻害剤が、スニチニブである、請求項101に記載の方法。
- 前記抗癌剤が、プロテアソーム阻害剤(例えば、ボルテゾミブ)である、請求項80に記載の方法。
- 前記生物製剤が、抗体である、請求項80に記載の方法。
- 前記抗体が、アドトラスツズマブエムタンシン、アレムツズマブ、ベバシズマブ、ブリナツモマブ、ブレンツキシマブ・ベドチン、カツマキソマブ、セツキシマブ、ゲムツズマブ・オゾガマイシン、イブリツモマブ・チウキセタン、イピリムマブ、ネシツムマブ、ニボルマブ、オビヌツズマブ、オファツムマブ、パニツムマブ、ペムブロリズマブ、ペルツズマブ、ラムシルマブ、リツキシマブ、トシツモマブ-I131、またはトラスツズマブである、請求項105に記載の方法。
- 前記抗体が、トラスツズマブである、請求項106に記載の方法。
- 前記対象が、前記保護剤を投与した後に減少したQTc時間を有する、請求項80に記載の方法。
- 前記化学療法剤および前記式1で示される保護剤が、前記対象に同時に投与される、請求項80に記載の方法。
- 前記化学療法剤および前記式1で示される保護剤が、前記対象に連続で投与される、請求項80に記載の方法。
- 前記保護剤が、前記化学療法剤の投与の前に前記対象に投与される、請求項110に記載の方法。
- 前記保護剤が、前記化学療法剤の投与の後に前記対象に投与される、請求項110に記載の方法。
- アントラサイクリン、チロシンキナーゼ阻害剤、またはトラスツズマブのうちの少なくとも1種を含む抗癌剤を受けている対象に有効な量の式1で示される保護剤を前記対象に投与することを含む、対象における臓器損傷を処置または予防するための方法。
- ミリセチン、ビテキシン、ロビネチン、トリセチン、フィセチン、7,3’,4’,5’-テトラヒドロキシフラボン、およびミリシトリンからなる群から選択される保護剤の有効量を対象に投与することを含む、対象における臓器損傷または心不全を予防するための方法。
- a.ミリセチン、ビテキシン、ロビネチン、トリセチン、フィセチン、7,3’,4’,5’-テトラヒドロキシフラボン、およびミリシトリンからなる群から選択される保護剤と、
b.心毒性を誘発する化学療法剤または生物製剤と
を含むキット。 - デクスラゾキサンをさらに含む、請求項115に記載のキット。
Applications Claiming Priority (6)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201662291480P | 2016-02-04 | 2016-02-04 | |
| US62/291,480 | 2016-02-04 | ||
| US201662348102P | 2016-06-09 | 2016-06-09 | |
| US62/348,102 | 2016-06-09 | ||
| PCT/US2017/016582 WO2017136774A1 (en) | 2016-02-04 | 2017-02-03 | Pharmaceutical compositions and methods for countering chemotherapy induced cardiotoxicity |
| JP2018540781A JP7058396B2 (ja) | 2016-02-04 | 2017-02-03 | 化学療法による心毒性を阻止するための医薬組成物および方法 |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2018540781A Division JP7058396B2 (ja) | 2016-02-04 | 2017-02-03 | 化学療法による心毒性を阻止するための医薬組成物および方法 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| JP2022017518A true JP2022017518A (ja) | 2022-01-25 |
Family
ID=59496710
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2018540781A Active JP7058396B2 (ja) | 2016-02-04 | 2017-02-03 | 化学療法による心毒性を阻止するための医薬組成物および方法 |
| JP2021181693A Pending JP2022017518A (ja) | 2016-02-04 | 2021-11-08 | 化学療法による心毒性を阻止するための医薬組成物および方法 |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2018540781A Active JP7058396B2 (ja) | 2016-02-04 | 2017-02-03 | 化学療法による心毒性を阻止するための医薬組成物および方法 |
Country Status (18)
| Country | Link |
|---|---|
| US (5) | US10806716B2 (ja) |
| EP (1) | EP3411017A4 (ja) |
| JP (2) | JP7058396B2 (ja) |
| KR (1) | KR20180116298A (ja) |
| CN (4) | CN117045793A (ja) |
| AU (1) | AU2017214668B2 (ja) |
| CA (1) | CA3013768A1 (ja) |
| CO (1) | CO2018009132A2 (ja) |
| HK (1) | HK1257954A1 (ja) |
| IL (2) | IL284341B2 (ja) |
| MX (4) | MX2018009338A (ja) |
| MY (1) | MY197069A (ja) |
| NZ (1) | NZ745881A (ja) |
| PH (1) | PH12018501387A1 (ja) |
| RU (2) | RU2021103727A (ja) |
| SG (1) | SG11201805375PA (ja) |
| WO (1) | WO2017136774A1 (ja) |
| ZA (1) | ZA201805741B (ja) |
Families Citing this family (28)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US8933078B2 (en) | 2011-07-14 | 2015-01-13 | Research Cancer Institute Of America | Method of treating cancer with combinations of histone deacetylase inhibitors (HDAC1) substances |
| HK1257954A1 (zh) | 2016-02-04 | 2019-11-01 | 奥润沙股份有限公司 | 用於抵抗化学疗法诱导的心脏毒性的药物组合物和方法 |
| EP3464275B1 (en) | 2016-05-26 | 2024-05-08 | Recurium IP Holdings, LLC | Egfr inhibitor compounds |
| US11040027B2 (en) | 2017-01-17 | 2021-06-22 | Heparegenix Gmbh | Protein kinase inhibitors for promoting liver regeneration or reducing or preventing hepatocyte death |
| US11890292B2 (en) | 2017-02-27 | 2024-02-06 | Research Cancer Institute Of America | Compositions, methods, systems and/or kits for preventing and/or treating neoplasms |
| WO2018170457A1 (en) | 2017-03-17 | 2018-09-20 | Research Cancer Institute Of America | Compositions, methods, systems and/or kits for preventing and/or treating neoplasms |
| US12213958B2 (en) | 2017-11-17 | 2025-02-04 | Research Cancer Institute Of America | Compositions, methods, systems and/or kits for preventing and/or treating neoplasms |
| AU2019261329B2 (en) * | 2018-04-23 | 2024-09-05 | Inspirmed Corp. | Inhalable liposomal sustained release composition for use in treating pulmonary diseases |
| PL429672A1 (pl) * | 2019-04-17 | 2020-10-19 | Bioxan Spółka Z Ograniczoną Odpowiedzialnością | Preparat zawierający ksantohumol i zastosowanie ksantohumolu |
| KR102349477B1 (ko) * | 2019-08-30 | 2022-01-10 | (주)프론트바이오 | 바이구아나이드 계열 화합물 및 플라본, 하이드록시플라본, 플라바논, 플라본 유도체, 하이드록시플라본 유도체, 플라바논 유도체의 복합제를 유효성분으로 함유하는 암 예방 또는 치료용 약학적 조성물 |
| AU2020404930A1 (en) * | 2019-12-15 | 2022-08-04 | Baruch S. Blumberg Institute | Methods, kits and compositions for reducing cardiotoxicity associated with cancer therapies |
| CN111228271A (zh) * | 2020-03-31 | 2020-06-05 | 青岛泱深生物医药有限公司 | 含拉帕替尼的药物组合物及其应用 |
| CN113880897B (zh) * | 2020-10-30 | 2023-06-02 | 杭州拉林智能科技有限公司 | 黄酮苷-有机胺类酪氨酸激酶抑制剂复盐化合物及其制备方法和应用 |
| CN112386704B (zh) * | 2020-11-23 | 2023-07-04 | 中国科学院西北高原生物研究所 | 一种包括化合物f-c的抗癌联合用药组合物 |
| CN112353944A (zh) * | 2020-11-23 | 2021-02-12 | 湖州师范学院求真学院 | 一种包括化合物f-b的抗癌联合用药组合物 |
| CN112438977B (zh) * | 2020-12-02 | 2023-05-19 | 贵州大学 | 一种含苯并咪唑的杨梅素衍生物、制备方法及用途 |
| CN112870194B (zh) * | 2021-01-06 | 2022-06-21 | 广州医科大学附属肿瘤医院 | 治疗肝癌的组合物及其应用 |
| CN113143925B (zh) * | 2021-04-16 | 2022-03-25 | 浙江大学智能创新药物研究院 | 盐酸二甲双胍在制备治疗克唑替尼心脏毒性制剂中的应用 |
| CN113304275B (zh) * | 2021-06-04 | 2023-04-11 | 仲恺农业工程学院 | 一种二氢杨梅素修饰dna药物递送系统、纳米载药系统及制备方法和应用 |
| US11938127B2 (en) | 2021-09-28 | 2024-03-26 | Wayne State University | Methods and compositions relating to steroid hormone receptor-dependent proliferative disorders |
| EP4426329A2 (en) * | 2021-11-05 | 2024-09-11 | Bimyo GmbH | Amelioration and treatment of infarction damage |
| US20230165831A1 (en) * | 2021-11-19 | 2023-06-01 | Impact Biolife Science, Inc. | Method and composition for rendering cancer cells susceptible to treatment by targeted oncogenetic drivers |
| CN115290608B (zh) * | 2021-12-22 | 2024-08-13 | 温州医科大学 | 快速检测米托蒽醌或阿霉素的试剂及检测方法 |
| US11903944B1 (en) | 2023-05-30 | 2024-02-20 | King Faisal University | Experimental model using pazopanib-induced cardiotoxicity |
| CN116606273B (zh) * | 2023-07-19 | 2023-09-26 | 云南中医药大学 | 具有美白作用的黄花夹竹桃黄酮的制备方法 |
| WO2025117853A1 (en) * | 2023-11-29 | 2025-06-05 | The Board Of Trustees Of The Leland Stanford Junior University | Compositions and methods to ameliorate drug-induced long qt syndrome |
| CN117958187A (zh) * | 2024-01-10 | 2024-05-03 | 青岛大学 | 阿霉素和拉帕替尼在构建斑马鱼心脏毒性损伤模型中的应用及药物筛选方法 |
| CN119499237A (zh) * | 2024-12-10 | 2025-02-25 | 阜外华中心血管病医院 | 羟基芫花素在制备防治抗肿瘤药物诱导的心脏毒性的药物中的应用 |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20020147353A1 (en) * | 1999-09-23 | 2002-10-10 | Vereniging Christelijk Wetenschappelijk Anderwijs | Novel flavonoids |
| WO2014077409A1 (ja) * | 2012-11-19 | 2014-05-22 | 国立大学法人東京大学 | スニチニブの副作用軽減剤 |
| JP7058396B2 (ja) * | 2016-02-04 | 2022-04-22 | エスシーティー ツー エルエルシー | 化学療法による心毒性を阻止するための医薬組成物および方法 |
Family Cites Families (13)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2001080855A1 (en) * | 2000-04-27 | 2001-11-01 | Geron Corporation | Telomerase inhibitors and methods of their use |
| WO2002056823A2 (en) * | 2001-01-18 | 2002-07-25 | Arnold Hoffman | Redox therapy for tumors |
| US20070185069A1 (en) | 2005-11-14 | 2007-08-09 | Plum Stacy M | Anti-angiogenic activity of 2-methoxyestradiol in combination with anti-cancer agents |
| EP2265126A4 (en) | 2008-03-10 | 2011-06-29 | Univ Louisville Res Found | PROCESS AND COMPOSITIONS FOR THE CONTROLLED DELIVERY OF PHYTOCHEMICALS |
| EP2271350A4 (en) * | 2008-04-03 | 2011-05-18 | Cognate3 Llc | COMPOSITIONS AND METHODS FOR IMMUNOTHERAPY |
| CN101485655B (zh) | 2009-02-12 | 2012-08-22 | 华南理工大学 | 二氢杨梅素在制备防治肿瘤放化疗不良反应的药物的应用 |
| KR101742332B1 (ko) * | 2009-04-20 | 2017-05-31 | 갈렌바이오 인코포레이티드 | 생체분자로 세포를 형질감염시키기 위한 조성물 |
| CN102697795B (zh) * | 2011-07-01 | 2014-06-18 | 成都医学院 | 一种抗肿瘤联合用药物 |
| US20150018294A1 (en) * | 2012-02-07 | 2015-01-15 | Arrigo DE BENEDETTI | Modulators of tousled kinase in cellular processes |
| CN103315993A (zh) * | 2013-06-22 | 2013-09-25 | 浙江大学 | 二氢杨梅素在制备抑制阿霉素心脏毒性药物中的应用 |
| KR20150084535A (ko) * | 2014-01-14 | 2015-07-22 | 건국대학교 산학협력단 | 피세틴의 수용성 및 생체이용률을 개선하는 조성물 및 그 방법 |
| WO2015138186A2 (en) * | 2014-03-12 | 2015-09-17 | Wake Forest University Health Sciences | Methods and compositions for treating anthracycline-induced cardiomyopathy using neurokinin-1 receptor antagonists |
| CN107595802B (zh) * | 2017-09-27 | 2021-04-23 | 浙江海洋大学 | 杨梅素在制备抗阿霉素心脏毒性保护制剂中的应用 |
-
2017
- 2017-02-03 HK HK19100316.6A patent/HK1257954A1/zh unknown
- 2017-02-03 NZ NZ745881A patent/NZ745881A/en unknown
- 2017-02-03 CN CN202310925303.3A patent/CN117045793A/zh active Pending
- 2017-02-03 US US16/075,569 patent/US10806716B2/en active Active
- 2017-02-03 RU RU2021103727A patent/RU2021103727A/ru unknown
- 2017-02-03 MY MYPI2018702719A patent/MY197069A/en unknown
- 2017-02-03 CN CN202310925314.1A patent/CN117100734A/zh active Pending
- 2017-02-03 JP JP2018540781A patent/JP7058396B2/ja active Active
- 2017-02-03 CN CN201780009774.2A patent/CN108697646A/zh active Pending
- 2017-02-03 CN CN202310925308.6A patent/CN117159571A/zh active Pending
- 2017-02-03 MX MX2018009338A patent/MX2018009338A/es unknown
- 2017-02-03 RU RU2018130330A patent/RU2743433C2/ru active
- 2017-02-03 EP EP17748307.0A patent/EP3411017A4/en active Pending
- 2017-02-03 IL IL284341A patent/IL284341B2/en unknown
- 2017-02-03 US US15/424,743 patent/US20170224654A1/en not_active Abandoned
- 2017-02-03 WO PCT/US2017/016582 patent/WO2017136774A1/en not_active Ceased
- 2017-02-03 CA CA3013768A patent/CA3013768A1/en active Pending
- 2017-02-03 KR KR1020187025265A patent/KR20180116298A/ko not_active Ceased
- 2017-02-03 MX MX2021009540A patent/MX2021009540A/es unknown
- 2017-02-03 SG SG11201805375PA patent/SG11201805375PA/en unknown
- 2017-02-03 AU AU2017214668A patent/AU2017214668B2/en active Active
-
2018
- 2018-06-27 PH PH12018501387A patent/PH12018501387A1/en unknown
- 2018-07-31 MX MX2022001541A patent/MX2022001541A/es unknown
- 2018-07-31 MX MX2022001540A patent/MX2022001540A/es unknown
- 2018-08-02 IL IL260972A patent/IL260972B/en unknown
- 2018-08-28 ZA ZA2018/05741A patent/ZA201805741B/en unknown
- 2018-08-30 CO CONC2018/0009132A patent/CO2018009132A2/es unknown
-
2020
- 2020-01-08 US US16/737,849 patent/US10874633B2/en active Active
- 2020-10-06 US US17/064,576 patent/US11166936B2/en active Active
-
2021
- 2021-10-07 US US17/450,258 patent/US11786503B2/en active Active
- 2021-11-08 JP JP2021181693A patent/JP2022017518A/ja active Pending
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20020147353A1 (en) * | 1999-09-23 | 2002-10-10 | Vereniging Christelijk Wetenschappelijk Anderwijs | Novel flavonoids |
| WO2014077409A1 (ja) * | 2012-11-19 | 2014-05-22 | 国立大学法人東京大学 | スニチニブの副作用軽減剤 |
| JP7058396B2 (ja) * | 2016-02-04 | 2022-04-22 | エスシーティー ツー エルエルシー | 化学療法による心毒性を阻止するための医薬組成物および方法 |
Non-Patent Citations (8)
| Title |
|---|
| ANTI-CANCER DRUGS, vol. 22, no. 2, JPN6020051018, 2011, pages 176 - 184, ISSN: 0004961007 * |
| BIOMEDICINE & PHARMACOTHERAPY, vol. 68, no. 8, JPN6020051019, 2014, pages 1149 - 1159, ISSN: 0004961008 * |
| JACC, vol. 64, no. 9, JPN6021025448, 2014, pages 938 - 945, ISSN: 0004961012 * |
| MUTATION RESEARCH, vol. 696, JPN6021025447, 2010, pages 41 - 47, ISSN: 0004961014 * |
| NATURE MEDICINE, vol. 18, no. 11, JPN6021025445, 2012, pages 1639 - 1642, ISSN: 0004961013 * |
| TOXICOLOGY LETTERS, vol. 92, JPN6020051020, 1997, pages 1 - 7, ISSN: 0004961009 * |
| TOXICOLOGY, vol. 292, JPN6021025449, 2012, pages 53 - 62, ISSN: 0004961011 * |
| 日本臨牀, JPN6020051022, 2010, pages 68 - 10, ISSN: 0004961010 * |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7058396B2 (ja) | 化学療法による心毒性を阻止するための医薬組成物および方法 | |
| RU2640115C2 (ru) | Фармацевтические композиции замещенных хиназолинонов | |
| EP3703755A1 (en) | Combination comprising at least one spliceosome modulator and at least one inhibitor chosen from bcl2 inhibitors, bcl2/bclxl inhibitors, and bclxl inhibitors and methods of use | |
| CN113329749B (zh) | 用于治疗葡萄膜黑色素瘤的联合疗法 | |
| JP7357386B2 (ja) | 化合物又はその薬学的に許容される塩、二量体又は三量体のがん治療用医薬品の調製における応用 | |
| BR112018015979B1 (pt) | Composições farmacêuticas e métodos para combater a cardiotoxicidade induzida por quimioterapia | |
| CA3222727A1 (en) | E3 ligase inhibitors and methods of use thereof | |
| KR20250033298A (ko) | 아조포도필로톡신 유도체 su056의 거울상이성질체 | |
| CN121240859A (zh) | 用于治疗健康状况的组合物和制备和使用小分子的方法 | |
| EA039396B1 (ru) | Лечение рака молочной железы с тройным негативным фенотипом ингибиторами tor-киназы |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20211207 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20211207 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20230110 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20230407 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20230407 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20230620 |