JP2021073305A - 慢性腎障害治療のための多能性幹細胞 - Google Patents
慢性腎障害治療のための多能性幹細胞 Download PDFInfo
- Publication number
- JP2021073305A JP2021073305A JP2021019341A JP2021019341A JP2021073305A JP 2021073305 A JP2021073305 A JP 2021073305A JP 2021019341 A JP2021019341 A JP 2021019341A JP 2021019341 A JP2021019341 A JP 2021019341A JP 2021073305 A JP2021073305 A JP 2021073305A
- Authority
- JP
- Japan
- Prior art keywords
- cells
- negative
- muse
- cell
- pluripotent stem
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 210000001778 pluripotent stem cell Anatomy 0.000 title claims abstract description 31
- 208000020832 chronic kidney disease Diseases 0.000 title abstract description 27
- 210000004027 cell Anatomy 0.000 claims abstract description 355
- 238000002360 preparation method Methods 0.000 claims abstract description 60
- 208000017169 kidney disease Diseases 0.000 claims abstract description 30
- 210000001519 tissue Anatomy 0.000 claims abstract description 24
- 210000003734 kidney Anatomy 0.000 claims abstract description 15
- 230000001684 chronic effect Effects 0.000 claims description 26
- 230000000694 effects Effects 0.000 claims description 16
- 210000001185 bone marrow Anatomy 0.000 claims description 13
- 206010061481 Renal injury Diseases 0.000 claims description 10
- 108010017842 Telomerase Proteins 0.000 claims description 10
- 206010018367 Glomerulonephritis chronic Diseases 0.000 claims description 7
- 102100033725 Tumor necrosis factor receptor superfamily member 16 Human genes 0.000 claims description 7
- 210000001654 germ layer Anatomy 0.000 claims description 7
- 210000001635 urinary tract Anatomy 0.000 claims description 7
- 210000003556 vascular endothelial cell Anatomy 0.000 claims description 7
- 102100031573 Hematopoietic progenitor cell antigen CD34 Human genes 0.000 claims description 6
- 101000777663 Homo sapiens Hematopoietic progenitor cell antigen CD34 Proteins 0.000 claims description 6
- 206010028980 Neoplasm Diseases 0.000 claims description 6
- 208000007342 Diabetic Nephropathies Diseases 0.000 claims description 4
- 208000033679 diabetic kidney disease Diseases 0.000 claims description 4
- 201000009925 nephrosclerosis Diseases 0.000 claims description 4
- 208000026292 Cystic Kidney disease Diseases 0.000 claims description 3
- 208000005777 Lupus Nephritis Diseases 0.000 claims description 3
- 101100154912 Mus musculus Tyrp1 gene Proteins 0.000 claims description 3
- 201000005857 malignant hypertension Diseases 0.000 claims description 3
- 230000000414 obstructive effect Effects 0.000 claims description 3
- 201000008158 rapidly progressive glomerulonephritis Diseases 0.000 claims description 3
- 206010038433 renal dysplasia Diseases 0.000 claims description 3
- 101150077014 sox10 gene Proteins 0.000 claims description 3
- 201000008827 tuberculosis Diseases 0.000 claims description 3
- 210000005232 distal tubule cell Anatomy 0.000 claims description 2
- 230000006355 external stress Effects 0.000 claims description 2
- 210000001707 glomerular endothelial cell Anatomy 0.000 claims description 2
- 210000003584 mesangial cell Anatomy 0.000 claims description 2
- 210000005234 proximal tubule cell Anatomy 0.000 claims description 2
- 208000029584 urinary system neoplasm Diseases 0.000 claims description 2
- 208000008839 Kidney Neoplasms Diseases 0.000 claims 2
- 229940028444 muse Drugs 0.000 abstract description 207
- 210000005084 renal tissue Anatomy 0.000 abstract description 30
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 abstract description 25
- 201000010099 disease Diseases 0.000 abstract description 20
- 239000003814 drug Substances 0.000 abstract description 3
- 230000001172 regenerating effect Effects 0.000 abstract description 3
- 230000017423 tissue regeneration Effects 0.000 abstract description 3
- 230000007246 mechanism Effects 0.000 abstract description 2
- DDRJAANPRJIHGJ-UHFFFAOYSA-N creatinine Chemical compound CN1CC(=O)NC1=N DDRJAANPRJIHGJ-UHFFFAOYSA-N 0.000 description 68
- 229940109239 creatinine Drugs 0.000 description 34
- 241000699666 Mus <mouse, genus> Species 0.000 description 26
- 230000003907 kidney function Effects 0.000 description 24
- 210000005239 tubule Anatomy 0.000 description 24
- 210000002966 serum Anatomy 0.000 description 23
- 230000001434 glomerular Effects 0.000 description 20
- 108010043121 Green Fluorescent Proteins Proteins 0.000 description 18
- 102000004144 Green Fluorescent Proteins Human genes 0.000 description 18
- 239000005090 green fluorescent protein Substances 0.000 description 18
- 241000699670 Mus sp. Species 0.000 description 17
- 239000003550 marker Substances 0.000 description 16
- 238000002073 fluorescence micrograph Methods 0.000 description 13
- 238000010172 mouse model Methods 0.000 description 13
- 210000004369 blood Anatomy 0.000 description 12
- 239000008280 blood Substances 0.000 description 12
- MWWSFMDVAYGXBV-RUELKSSGSA-N Doxorubicin hydrochloride Chemical compound Cl.O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 MWWSFMDVAYGXBV-RUELKSSGSA-N 0.000 description 11
- 229960002918 doxorubicin hydrochloride Drugs 0.000 description 11
- GMVPRGQOIOIIMI-DWKJAMRDSA-N prostaglandin E1 Chemical compound CCCCC[C@H](O)\C=C\[C@H]1[C@H](O)CC(=O)[C@@H]1CCCCCCC(O)=O GMVPRGQOIOIIMI-DWKJAMRDSA-N 0.000 description 11
- 238000002054 transplantation Methods 0.000 description 11
- 210000002919 epithelial cell Anatomy 0.000 description 10
- 108090000623 proteins and genes Proteins 0.000 description 10
- 210000000130 stem cell Anatomy 0.000 description 10
- 108010063290 Aquaporins Proteins 0.000 description 9
- 102000010637 Aquaporins Human genes 0.000 description 9
- PNNCWTXUWKENPE-UHFFFAOYSA-N [N].NC(N)=O Chemical compound [N].NC(N)=O PNNCWTXUWKENPE-UHFFFAOYSA-N 0.000 description 9
- 238000000502 dialysis Methods 0.000 description 9
- 210000000557 podocyte Anatomy 0.000 description 9
- 210000000512 proximal kidney tubule Anatomy 0.000 description 9
- 210000003462 vein Anatomy 0.000 description 9
- 238000011579 SCID mouse model Methods 0.000 description 8
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical group [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 8
- 239000000427 antigen Substances 0.000 description 8
- 102000036639 antigens Human genes 0.000 description 8
- 108091007433 antigens Proteins 0.000 description 8
- 238000000034 method Methods 0.000 description 8
- 230000004069 differentiation Effects 0.000 description 7
- 210000000585 glomerular basement membrane Anatomy 0.000 description 7
- 230000005012 migration Effects 0.000 description 7
- 238000013508 migration Methods 0.000 description 7
- 102000004169 proteins and genes Human genes 0.000 description 7
- 230000008439 repair process Effects 0.000 description 7
- 239000011780 sodium chloride Substances 0.000 description 7
- 230000001225 therapeutic effect Effects 0.000 description 7
- 102000014823 calbindin Human genes 0.000 description 6
- 108060001061 calbindin Proteins 0.000 description 6
- 230000006870 function Effects 0.000 description 6
- 238000005259 measurement Methods 0.000 description 6
- 239000002504 physiological saline solution Substances 0.000 description 6
- 210000003491 skin Anatomy 0.000 description 6
- 230000002485 urinary effect Effects 0.000 description 6
- 210000002700 urine Anatomy 0.000 description 6
- 208000035475 disorder Diseases 0.000 description 5
- 238000011156 evaluation Methods 0.000 description 5
- 229960003444 immunosuppressant agent Drugs 0.000 description 5
- 230000001861 immunosuppressant effect Effects 0.000 description 5
- 239000003018 immunosuppressive agent Substances 0.000 description 5
- 210000003866 melanoblast Anatomy 0.000 description 5
- 210000002901 mesenchymal stem cell Anatomy 0.000 description 5
- 230000035755 proliferation Effects 0.000 description 5
- 238000004114 suspension culture Methods 0.000 description 5
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 4
- 230000000735 allogeneic effect Effects 0.000 description 4
- 238000002474 experimental method Methods 0.000 description 4
- 239000012530 fluid Substances 0.000 description 4
- 238000001727 in vivo Methods 0.000 description 4
- 239000013642 negative control Substances 0.000 description 4
- 210000000056 organ Anatomy 0.000 description 4
- 210000004786 perivascular cell Anatomy 0.000 description 4
- 241000282412 Homo Species 0.000 description 3
- 241000124008 Mammalia Species 0.000 description 3
- 241001465754 Metazoa Species 0.000 description 3
- 102100024616 Platelet endothelial cell adhesion molecule Human genes 0.000 description 3
- 208000001647 Renal Insufficiency Diseases 0.000 description 3
- 210000000988 bone and bone Anatomy 0.000 description 3
- 230000007423 decrease Effects 0.000 description 3
- 230000003247 decreasing effect Effects 0.000 description 3
- 230000006872 improvement Effects 0.000 description 3
- 238000000338 in vitro Methods 0.000 description 3
- 201000006370 kidney failure Diseases 0.000 description 3
- 230000002265 prevention Effects 0.000 description 3
- 208000037157 Azotemia Diseases 0.000 description 2
- AOJJSUZBOXZQNB-TZSSRYMLSA-N Doxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-TZSSRYMLSA-N 0.000 description 2
- 201000005569 Gout Diseases 0.000 description 2
- 206010035226 Plasma cell myeloma Diseases 0.000 description 2
- 102000040945 Transcription factor Human genes 0.000 description 2
- 108091023040 Transcription factor Proteins 0.000 description 2
- 239000000654 additive Substances 0.000 description 2
- 230000001464 adherent effect Effects 0.000 description 2
- 210000000577 adipose tissue Anatomy 0.000 description 2
- 239000003242 anti bacterial agent Substances 0.000 description 2
- 229940088710 antibiotic agent Drugs 0.000 description 2
- 230000001707 blastogenic effect Effects 0.000 description 2
- 230000012292 cell migration Effects 0.000 description 2
- 239000003795 chemical substances by application Substances 0.000 description 2
- 210000002808 connective tissue Anatomy 0.000 description 2
- 238000007796 conventional method Methods 0.000 description 2
- 238000012258 culturing Methods 0.000 description 2
- 230000006378 damage Effects 0.000 description 2
- 238000001514 detection method Methods 0.000 description 2
- 210000000981 epithelium Anatomy 0.000 description 2
- 210000004700 fetal blood Anatomy 0.000 description 2
- 210000002950 fibroblast Anatomy 0.000 description 2
- 238000001914 filtration Methods 0.000 description 2
- 239000007850 fluorescent dye Substances 0.000 description 2
- 230000024924 glomerular filtration Effects 0.000 description 2
- 206010061989 glomerulosclerosis Diseases 0.000 description 2
- 238000012744 immunostaining Methods 0.000 description 2
- 210000001161 mammalian embryo Anatomy 0.000 description 2
- 108010082117 matrigel Proteins 0.000 description 2
- 239000007758 minimum essential medium Substances 0.000 description 2
- 210000003205 muscle Anatomy 0.000 description 2
- 201000000050 myeloid neoplasm Diseases 0.000 description 2
- 239000003755 preservative agent Substances 0.000 description 2
- 239000000047 product Substances 0.000 description 2
- 230000009467 reduction Effects 0.000 description 2
- 239000000243 solution Substances 0.000 description 2
- 238000010186 staining Methods 0.000 description 2
- 208000024891 symptom Diseases 0.000 description 2
- 210000001550 testis Anatomy 0.000 description 2
- 230000007704 transition Effects 0.000 description 2
- 208000009852 uremia Diseases 0.000 description 2
- 239000002699 waste material Substances 0.000 description 2
- 208000009304 Acute Kidney Injury Diseases 0.000 description 1
- 102100032959 Alpha-actinin-4 Human genes 0.000 description 1
- 101710115256 Alpha-actinin-4 Proteins 0.000 description 1
- 206010001939 Aminoaciduria Diseases 0.000 description 1
- 208000012639 Balance disease Diseases 0.000 description 1
- 208000019838 Blood disease Diseases 0.000 description 1
- 208000020084 Bone disease Diseases 0.000 description 1
- 241000283690 Bos taurus Species 0.000 description 1
- VYLJAYXZTOTZRR-BTPDVQIOSA-N CC(C)(O)[C@H]1CC[C@@]2(C)[C@H]1CC[C@]1(C)[C@@H]2CC[C@@H]2[C@@]3(C)CCCC(C)(C)[C@@H]3[C@@H](O)[C@H](O)[C@@]12C Chemical compound CC(C)(O)[C@H]1CC[C@@]2(C)[C@H]1CC[C@]1(C)[C@@H]2CC[C@@H]2[C@@]3(C)CCCC(C)(C)[C@@H]3[C@@H](O)[C@H](O)[C@@]12C VYLJAYXZTOTZRR-BTPDVQIOSA-N 0.000 description 1
- 241000282472 Canis lupus familiaris Species 0.000 description 1
- 241000283707 Capra Species 0.000 description 1
- 208000024172 Cardiovascular disease Diseases 0.000 description 1
- 241000700198 Cavia Species 0.000 description 1
- 241000282693 Cercopithecidae Species 0.000 description 1
- 206010053567 Coagulopathies Diseases 0.000 description 1
- PMATZTZNYRCHOR-CGLBZJNRSA-N Cyclosporin A Chemical compound CC[C@@H]1NC(=O)[C@H]([C@H](O)[C@H](C)C\C=C\C)N(C)C(=O)[C@H](C(C)C)N(C)C(=O)[C@H](CC(C)C)N(C)C(=O)[C@H](CC(C)C)N(C)C(=O)[C@@H](C)NC(=O)[C@H](C)NC(=O)[C@H](CC(C)C)N(C)C(=O)[C@H](C(C)C)NC(=O)[C@H](CC(C)C)N(C)C(=O)CN(C)C1=O PMATZTZNYRCHOR-CGLBZJNRSA-N 0.000 description 1
- 108010036949 Cyclosporine Proteins 0.000 description 1
- 208000017701 Endocrine disease Diseases 0.000 description 1
- 241000283086 Equidae Species 0.000 description 1
- 241000283074 Equus asinus Species 0.000 description 1
- 208000011514 Familial renal glucosuria Diseases 0.000 description 1
- 208000026019 Fanconi renotubular syndrome Diseases 0.000 description 1
- 201000006328 Fanconi syndrome Diseases 0.000 description 1
- 241000282326 Felis catus Species 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Chemical compound OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- 101000828886 Homo sapiens GTP-binding protein 4 Proteins 0.000 description 1
- 206010062016 Immunosuppression Diseases 0.000 description 1
- 208000012659 Joint disease Diseases 0.000 description 1
- 241000282339 Mustela Species 0.000 description 1
- 108700019961 Neoplasm Genes Proteins 0.000 description 1
- 102000048850 Neoplasm Genes Human genes 0.000 description 1
- 102100023195 Nephrin Human genes 0.000 description 1
- 208000013901 Nephropathies and tubular disease Diseases 0.000 description 1
- 108010032605 Nerve Growth Factor Receptors Proteins 0.000 description 1
- 241000283973 Oryctolagus cuniculus Species 0.000 description 1
- 241001494479 Pecora Species 0.000 description 1
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical compound [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 description 1
- 241000288906 Primates Species 0.000 description 1
- 108010014608 Proto-Oncogene Proteins c-kit Proteins 0.000 description 1
- 102000016971 Proto-Oncogene Proteins c-kit Human genes 0.000 description 1
- 241000700159 Rattus Species 0.000 description 1
- 208000033626 Renal failure acute Diseases 0.000 description 1
- 206010062237 Renal impairment Diseases 0.000 description 1
- 208000026980 Renal tubular disease Diseases 0.000 description 1
- 241000283984 Rodentia Species 0.000 description 1
- 102000007562 Serum Albumin Human genes 0.000 description 1
- 108010071390 Serum Albumin Proteins 0.000 description 1
- 241000282887 Suidae Species 0.000 description 1
- 102000004142 Trypsin Human genes 0.000 description 1
- 108090000631 Trypsin Proteins 0.000 description 1
- 208000027418 Wounds and injury Diseases 0.000 description 1
- 230000005856 abnormality Effects 0.000 description 1
- 238000009825 accumulation Methods 0.000 description 1
- 239000002253 acid Substances 0.000 description 1
- 230000001154 acute effect Effects 0.000 description 1
- 201000011040 acute kidney failure Diseases 0.000 description 1
- 208000012998 acute renal failure Diseases 0.000 description 1
- 239000000853 adhesive Substances 0.000 description 1
- 230000001070 adhesive effect Effects 0.000 description 1
- 210000001789 adipocyte Anatomy 0.000 description 1
- 229940009456 adriamycin Drugs 0.000 description 1
- 238000010171 animal model Methods 0.000 description 1
- 239000002246 antineoplastic agent Substances 0.000 description 1
- 229940041181 antineoplastic drug Drugs 0.000 description 1
- 230000001580 bacterial effect Effects 0.000 description 1
- 230000004888 barrier function Effects 0.000 description 1
- 230000033228 biological regulation Effects 0.000 description 1
- 230000000903 blocking effect Effects 0.000 description 1
- 208000015294 blood coagulation disease Diseases 0.000 description 1
- 210000004204 blood vessel Anatomy 0.000 description 1
- 230000037396 body weight Effects 0.000 description 1
- 210000002449 bone cell Anatomy 0.000 description 1
- 239000000872 buffer Substances 0.000 description 1
- 239000007853 buffer solution Substances 0.000 description 1
- 239000007975 buffered saline Substances 0.000 description 1
- 244000309466 calf Species 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 238000004113 cell culture Methods 0.000 description 1
- 230000024245 cell differentiation Effects 0.000 description 1
- 230000003915 cell function Effects 0.000 description 1
- 230000004663 cell proliferation Effects 0.000 description 1
- 239000002458 cell surface marker Substances 0.000 description 1
- 208000015114 central nervous system disease Diseases 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 229960001265 ciclosporin Drugs 0.000 description 1
- 230000009852 coagulant defect Effects 0.000 description 1
- 238000011109 contamination Methods 0.000 description 1
- 229930182912 cyclosporin Natural products 0.000 description 1
- 210000003074 dental pulp Anatomy 0.000 description 1
- 210000004207 dermis Anatomy 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 230000018109 developmental process Effects 0.000 description 1
- 230000001079 digestive effect Effects 0.000 description 1
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 1
- 239000007884 disintegrant Substances 0.000 description 1
- 208000024637 distal renal tubular acidosis Diseases 0.000 description 1
- 230000004064 dysfunction Effects 0.000 description 1
- 230000002500 effect on skin Effects 0.000 description 1
- 239000003792 electrolyte Substances 0.000 description 1
- 210000001671 embryonic stem cell Anatomy 0.000 description 1
- 210000002257 embryonic structure Anatomy 0.000 description 1
- 239000003995 emulsifying agent Substances 0.000 description 1
- 210000001900 endoderm Anatomy 0.000 description 1
- 230000003511 endothelial effect Effects 0.000 description 1
- 230000029142 excretion Effects 0.000 description 1
- 208000030533 eye disease Diseases 0.000 description 1
- 239000000706 filtrate Substances 0.000 description 1
- 238000012757 fluorescence staining Methods 0.000 description 1
- 238000001943 fluorescence-activated cell sorting Methods 0.000 description 1
- 201000005206 focal segmental glomerulosclerosis Diseases 0.000 description 1
- 238000001415 gene therapy Methods 0.000 description 1
- 210000005086 glomerual capillary Anatomy 0.000 description 1
- 239000001963 growth medium Substances 0.000 description 1
- 238000001631 haemodialysis Methods 0.000 description 1
- 210000002216 heart Anatomy 0.000 description 1
- 208000014951 hematologic disease Diseases 0.000 description 1
- 208000018706 hematopoietic system disease Diseases 0.000 description 1
- 230000000322 hemodialysis Effects 0.000 description 1
- 210000003494 hepatocyte Anatomy 0.000 description 1
- VYLJAYXZTOTZRR-UHFFFAOYSA-N hopane-6alpha,7beta,22-triol Natural products C12CCC3C4(C)CCCC(C)(C)C4C(O)C(O)C3(C)C1(C)CCC1C2(C)CCC1C(C)(O)C VYLJAYXZTOTZRR-UHFFFAOYSA-N 0.000 description 1
- 102000049363 human GTPBP4 Human genes 0.000 description 1
- 210000005260 human cell Anatomy 0.000 description 1
- 208000026278 immune system disease Diseases 0.000 description 1
- 230000001506 immunosuppresive effect Effects 0.000 description 1
- 230000001939 inductive effect Effects 0.000 description 1
- 239000004615 ingredient Substances 0.000 description 1
- 208000014674 injury Diseases 0.000 description 1
- 230000000968 intestinal effect Effects 0.000 description 1
- 238000010253 intravenous injection Methods 0.000 description 1
- 230000009545 invasion Effects 0.000 description 1
- 210000003041 ligament Anatomy 0.000 description 1
- 210000004185 liver Anatomy 0.000 description 1
- 239000011159 matrix material Substances 0.000 description 1
- 239000002609 medium Substances 0.000 description 1
- 238000010232 migration assay Methods 0.000 description 1
- 230000001617 migratory effect Effects 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 239000003147 molecular marker Substances 0.000 description 1
- 230000035772 mutation Effects 0.000 description 1
- 108010027531 nephrin Proteins 0.000 description 1
- 230000001537 neural effect Effects 0.000 description 1
- 210000002569 neuron Anatomy 0.000 description 1
- 235000015097 nutrients Nutrition 0.000 description 1
- 230000007170 pathology Effects 0.000 description 1
- 230000010412 perfusion Effects 0.000 description 1
- 208000033808 peripheral neuropathy Diseases 0.000 description 1
- 239000008194 pharmaceutical composition Substances 0.000 description 1
- 239000000546 pharmaceutical excipient Substances 0.000 description 1
- 239000002953 phosphate buffered saline Substances 0.000 description 1
- 229910052698 phosphorus Inorganic materials 0.000 description 1
- 239000011574 phosphorus Substances 0.000 description 1
- 208000030761 polycystic kidney disease Diseases 0.000 description 1
- 239000011148 porous material Substances 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- 230000000750 progressive effect Effects 0.000 description 1
- 230000022558 protein metabolic process Effects 0.000 description 1
- 201000001474 proteinuria Diseases 0.000 description 1
- 238000011084 recovery Methods 0.000 description 1
- 230000008929 regeneration Effects 0.000 description 1
- 238000011069 regeneration method Methods 0.000 description 1
- 208000007278 renal glycosuria Diseases 0.000 description 1
- 201000010384 renal tubular acidosis Diseases 0.000 description 1
- 208000014318 renal tubule disease Diseases 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 230000004044 response Effects 0.000 description 1
- 230000028327 secretion Effects 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 210000002027 skeletal muscle Anatomy 0.000 description 1
- 210000002363 skeletal muscle cell Anatomy 0.000 description 1
- 208000017520 skin disease Diseases 0.000 description 1
- 238000003307 slaughter Methods 0.000 description 1
- 210000000329 smooth muscle myocyte Anatomy 0.000 description 1
- 230000000392 somatic effect Effects 0.000 description 1
- 210000000278 spinal cord Anatomy 0.000 description 1
- 239000003381 stabilizer Substances 0.000 description 1
- 230000000638 stimulation Effects 0.000 description 1
- 230000035882 stress Effects 0.000 description 1
- 239000000126 substance Substances 0.000 description 1
- 230000001629 suppression Effects 0.000 description 1
- 239000000725 suspension Substances 0.000 description 1
- 230000002459 sustained effect Effects 0.000 description 1
- 210000001258 synovial membrane Anatomy 0.000 description 1
- 210000002435 tendon Anatomy 0.000 description 1
- 238000002560 therapeutic procedure Methods 0.000 description 1
- 239000012588 trypsin Substances 0.000 description 1
- 230000004304 visual acuity Effects 0.000 description 1
Images
Abstract
Description
[1]生体の間葉系組織又は培養間葉系細胞から分離されたSSEA−3陽性の多能性幹細胞を含む、慢性腎障害を予防及び/又は治療するための細胞製剤。
[2]外部ストレス刺激によりSSEA−3陽性の多能性幹細胞が、濃縮された細胞画分を含む、上記[1]に記載の細胞製剤。
[3]慢性腎障害が、慢性糸球体腎炎、腎硬化症、糖尿病性腎症、嚢胞腎、慢性腎盂腎炎、急速進行性糸球体腎炎、悪性高血圧症、SLE腎炎、アミロイド腎、腎・尿路腫瘍、骨髄腫、閉塞性尿路生涯、痛風腎、腎形成不全、及び腎・尿路結核からなる群から選択される、上記[1]及び[2]に記載の細胞製剤。
[4]前記多能性幹細胞が、CD105陽性である、上記[1]〜[3]に記載の細胞製剤。
[5]前記多能性幹細胞が、CD117陰性及びCD146陰性である、上記[1]〜[4]に記載の細胞製剤。
[6]前記多能性幹細胞が、CD117陰性、CD146陰性、NG2陰性、CD34陰性、vWF陰性、及びCD271陰性である、上記[1]〜[5]に記載の細胞製剤。
[7]前記多能性幹細胞が、CD34陰性、CD117陰性、CD146陰性、CD271陰性、NG2陰性、vWF陰性、Sox10陰性、Snai1陰性、Slug陰性、Tyrp1陰性、及びDct陰性である、上記[1]〜[6]に記載の細胞製剤。
[8]前記多能性幹細胞が、以下の性質の全てを有する多能性幹細胞である、上記[1]〜[7]に記載の細胞製剤:
(i)テロメラーゼ活性が低いか又は無い;
(ii)三胚葉のいずれの胚葉の細胞に分化する能力を持つ;
(iii)腫瘍性増殖を示さない;及び
(iv)セルフリニューアル能を持つ。
[9]前記多能性幹細胞が、腎障害部位に集積する能力を有する、上記[1]〜[8]に記載の細胞製剤。
[10]前記多能性幹細胞が、足細胞、メサンギウム細胞、糸球体内皮細胞、傍糸球体細胞、近位尿細管細胞、遠位尿細管細胞、血管内皮細胞、ヘンレわな、及び/又は集合管の細胞からなる群から選択される1つ以上の細胞に分化する能力を有する、上記[1]〜[9]に記載の細胞製剤。
本発明は、SSEA−3陽性の多能性幹細胞(Muse細胞)を含む細胞製剤を用いて、慢性腎障害の予防及び/又は治療を目指す。ここで、「慢性腎障害」とは、長期間(例えば、数週間、数ヶ月間、数年間、又は数十年間)にわたって発生し、腎尿細管細胞機能又は糸球体濾過率(GFR)が持続的に低下し、この期間に発症する、あらゆる腎臓の病的な状態、機能不全又は障害を意味する。しかしながら、本発明は、適用疾患として、急性腎不全などのより短時間(例えば、数分間、数時間、又は数日間)に発症する腎疾患を排除することを意図しない。したがって、本発明によれば、糸球体及び尿細管等の組織における慢性若しくは急性障害を適用疾患としてもよい。慢性腎障害としては、限定されないが、慢性糸球体腎炎、腎硬化症、糖尿病性腎症、嚢胞腎、慢性腎盂腎炎、急速進行性糸球体腎炎、悪性高血圧症、SLE腎炎、アミロイド腎、腎・尿路腫瘍、骨髄腫、閉塞性尿路生涯、痛風腎、腎形成不全、及び腎・尿路結核などが挙げられる。
(1)多能性幹細胞(Muse細胞)
本発明の細胞製剤に使用される多能性幹細胞は、本発明者らの一人である出澤が、ヒト生体内にその存在を見出し、「Muse(Multilineage−differentiating Stress Enduring)細胞」と命名した細胞である。Muse細胞は、骨髄液、脂肪組織(Ogura,F.,et al.,Stem Cells Dev.,Nov 20,2013(Epub)(published on Jan 17,2014))や真皮結合組織等の皮膚組織から得ることができ、各臓器の結合組織にも散在する。また、この細胞は、多能性幹細胞と間葉系幹細胞の両方の性質を有する細胞であり、例えば、それぞれの細胞表面マーカーである「SSEA−3(Stage−specific embryonic antigen−3)」と「CD105」のダブル陽性として同定される。したがって、Muse細胞又はMuse細胞を含む細胞集団は、例えば、これらの抗原マーカーを指標として生体組織から分離することができる。Muse細胞の分離法、同定法、及び特徴などの詳細は、国際公開第WO2011/007900号に開示されている。また、Wakaoら(2011、上述)によって報告されているように、骨髄、皮膚などから間葉系細胞を培養し、それをMuse細胞の母集団として用いる場合、SSEA−3陽性細胞の全てがCD105陽性細胞であることが分かっている。したがって、本発明における細胞製剤においては、生体の間葉系組織又は培養間葉系幹細胞からMuse細胞を分離する場合は、単にSSEA−3を抗原マーカーとしてMuse細胞を精製し、使用することができる。なお、本明細書においては、慢性腎障害を治療するための細胞製剤において使用され得る、SSEA−3を抗原マーカーとして、生体の間葉系組織又は培養間葉系組織から分離された多能性幹細胞(Muse細胞)又はMuse細胞を含む細胞集団を単に「SSEA−3陽性細胞」と記載することがある。また、本明細書においては、「非Muse細胞」とは、生体の間葉系組織又は培養間葉系組織に含まれる細胞であって、「SSEA−3陽性細胞」以外の細胞を指す。
(i)テロメラーゼ活性が低いか又は無い;
(ii)三胚葉のいずれの胚葉の細胞に分化する能力を持つ;
(iii)腫瘍性増殖を示さない;及び
(iv)セルフリニューアル能を持つ
からなる群から選択される少なくとも1つの性質を有してもよい。本発明の一局面では、本発明の細胞製剤に使用されるMuse細胞は、上記性質を全て有する。ここで、上記(i)について、「テロメラーゼ活性が低いか又は無い」とは、例えば、TRAPEZE XL telomerase detection kit(Millipore社)を用いてテロメラーゼ活性を検出した場合に、低いか又は検出できないことをいう。テロメラーゼ活性が「低い」とは、例えば、体細胞であるヒト線維芽細胞と同程度のテロメラーゼ活性を有しているか、又はHela細胞に比べて1/5以下、好ましくは1/10以下のテロメラーゼ活性を有していることをいう。上記(ii)について、Muse細胞は、in vitro及びin vivoにおいて、三胚葉(内胚葉系、中胚葉系、及び外胚葉系)に分化する能力を有し、例えば、in vitroで誘導培養することにより、肝細胞、神経細胞、骨格筋細胞、平滑筋細胞、骨細胞、脂肪細胞等に分化し得る。また、in vivoで精巣に移植した場合にも三胚葉に分化する能力を示す場合がある。さらに、静注により生体に移植することで損傷を受けた臓器(心臓、皮膚、脊髄、肝、筋肉等)に遊走及び生着し、組織に応じた細胞に分化する能力を有する。上記(iii)について、Muse細胞は、浮遊培養では増殖速度約1.3日で増殖するが、浮遊培養では1細胞から増殖し、胚様体様細胞塊を作り14日間程度で増殖が止まる、という性質を有するが、これらの胚様体様細胞塊を接着培養に持っていくと、再び細胞増殖が開始され、細胞塊から増殖した細胞が広がっていく。さらに精巣に移植した場合、少なくとも半年間は癌化しないという性質を有する。また、上記(iv)について、Muse細胞は、セルフリニューアル(自己複製)能を有する。ここで、「セルフリニューアル」とは、1個のMuse細胞から浮遊培養で培養することにより得られる胚様体様細胞塊に含まれる細胞から3胚葉性の細胞への分化が確認できると同時に、胚様体様細胞塊の細胞を再び1細胞で浮遊培養に持っていくことにより、次の世代の胚様体様細胞塊を形成させ、そこから再び3胚葉性の分化と浮遊培養での胚様体様細胞塊が確認できることをいう。セルフリニューアルは1回又は複数回のサイクルを繰り返せばよい。
本発明の細胞製剤は、限定されないが、上記(1)で得られたMuse細胞又はMuse細胞を含む細胞集団を生理食塩水や適切な緩衝液(例えば、リン酸緩衝生理食塩水)に懸濁させることによって得られる。この場合、自家又は他家の組織から分離したMuse細胞数が少ない場合には、細胞移植前に細胞を培養して、所定の細胞濃度が得られるまで増殖させてもよい。なお、すでに報告されているように(国際公開第WO2011/007900号パンフレット)、Muse細胞は、腫瘍化しないため、生体組織から回収した細胞が未分化のまま含まれていても癌化の可能性が低く安全である。また、回収したMuse細胞の培養は、特に限定されないが、通常の増殖培地(例えば、10%仔牛血清を含むα−最少必須培地(α−MEM))において行うことができる。より詳しくは、上記国際公開第WO2011/007900号パンフレットを参照して、Muse細胞の培養及び増殖において、適宜、培地、添加物(例えば、抗生物質、血清)等を選択し、所定濃度のMuse細胞を含む溶液を調製することができる。ヒト対象に本発明の細胞製剤を投与する場合には、ヒトの腸骨から数ml程度の骨髄液を採取し、例えば、骨髄液からの接着細胞として骨髄間葉系幹細胞を培養して有効な治療量のMuse細胞を分離できる細胞量に達するまで増やした後、Muse細胞をSSEA−3の抗原マーカーを指標として分離し、自家又は他家のMuse細胞を細胞製剤として調製することができる。あるいは、例えば、Muse細胞をSSEA−3の抗原マーカーを指標として分離後、有効な治療量に達するまで細胞を培養して増やした後、自家又は他家のMuse細胞を細胞製剤として調製することができる。
gのBalb/cマウス又はSCIDマウスに対しては、SSEA3陽性細胞を2×104細胞/頭で投与することにより、非常に優れた効果が得られた。この結果から哺乳動物一個体あたり6.6〜10×105細胞/kgを体重換算した細胞量を投与することで優れた効果が得られることが期待される。なお、対象とする個体はマウス、ヒトを含むがこれに限定されない。また、本発明の細胞製剤は、所望の治療効果が得られるまで、複数回(例えば、2〜10回)、適宜、間隔(例えば、1日に2回、1日に1回、1週間に2回、1週間に1回、2週間に1回、1カ月に1回、2カ月に1回、3カ月に1回、6カ月に1回)をおいて投与されてもよい。したがって、対象の状態にもよるが、治療上有効量としては、例えば、一個体あたり1×103細胞〜1×107細胞で1〜10回の投与量が好ましい。一個体における投与総量としては、限定されないが、1×103細胞〜1×108細胞、1×104細胞〜5×107細胞、2×104細胞〜2×107細胞、5×104細胞〜5×106細胞、1×105細胞〜1×106細胞などが挙げられる。
本明細書においては、本発明の細胞製剤による慢性腎障害の治療効果を検討するためにマウス慢性腎障害モデルを構築し、使用することができる。該モデルとして使用されるマウスには、限定されないが、一般的に、Balb/cマウス、SCIDマウスが挙げられる。慢性腎障害モデルは、これらのマウスに抗ガン剤(例えば、塩酸ドキソルビシン)を静脈投与することによって作製され得る。塩酸ドキソルビシンは、アドリアマイシン(慣用名)としても知られ、過剰投与により腎障害(ヒトの単状糸球体硬化症に類似した慢性腎障害)を引き起こすことは広く知られている。本発明によれば、塩酸ドキソルビシンの投薬量は、好ましくは個体1gあたり11.5μgである。
本実施例におけるマウスを用いた実験プロトコールは、「国立大学法人東北大学動物実験等に関する規定」を遵守し、実験動物は、東北大学動物実験センターの監督下において該規定に沿って作製された。より具体的には、マウス慢性腎障害モデルは、Balb/cマウス及びSCIDマウス(雄性11〜13週齢)の尾静脈に塩酸ドキソルビシン(Sigma)を11.5μg/gマウスを投与することによって作製した。これらは、ヒト慢性腎不全の原因疾患の一つである単状糸球体硬化症(FSGS)様の病像を呈するモデルである。
ヒトMuse細胞の調製は、国際公開第WO2011/007900号に記載された方法に従って行った。より具体的には、ヒト骨髄液から接着性を有する間葉系細胞を培養し、増殖を経て、Muse細胞又はMuse細胞を含む細胞集団をSSEA−3陽性細胞としてFACSにて分離した。また、非Muse細胞は、上記間葉系細胞のうち、SSEA−3陰性の細胞群であり、対照として用いた。その後、リン酸緩衝生理食塩水又は培養液を用いて、所定濃度に調整し、以下の慢性腎障害マウスモデルにおけるMuse細胞による腎機能評価等に使用した。なお、骨髄間葉系細胞などの間葉系細胞を培養して得たものをMuse細胞の母集団として用いる場合、Wakaoら(2011、上述)によって報告されているように、SSEA−3陽性細胞は全て、CD105陽性細胞であることが分かっている。
実施例1で作製した慢性腎障害マウス(Balb/c)を3群に分け、塩酸ドキソルビシン投与の1週間後に各群のマウスにMuse細胞(2×104個、200μl)、ヒト骨髄由来の非Muse細胞(2×104個、200μl)、又は生理食塩水(200μl)を尾静脈に投与した。その後、所定期間経過後に、各マウスについて、クレアチニンクリアランス、血清クレアチニン、血中尿素窒素(BUN)、及び尿タンパクを常法に従って測定し、慢性腎障害マウスに対するMuse細胞の治療効果を評価した。なお、投与に使用した細胞はいずれもヒト由来であるが、該細胞のマウスへの投与に際して、実験期間中、免疫抑制剤を用いていない。
上記マウスモデル群のそれぞれについて、塩酸ドキソルビシン投与から6週間後のクレアチニンクリアランス(μl/分)の測定結果を図1右に示す。Muse細胞の投与群におけるクレアチニンクリアランスは、非Muse細胞及び生理食塩水の投与群と比較して有意に高かった。Muse細胞の投与群と非Muse又は生理食塩水の投与群は、それぞれ有意差があった。これにより、非Muse細胞及び生理食塩水の投与群と比較して、Muse細胞を投与された慢性腎障害マウスでは、腎臓において血清中のクレアチニンを排泄する機能が回復していることがわかる。さらに、上記のマウスモデルのそれぞれについて、血清クレアチニン濃度(mg/dl)を測定した(図1左)。Muse細胞の投与群の血清クレアチニン濃度は、生理食塩水の投与群と比較して低く、統計的有意差を示した。一方、非Muse細胞の投与群は、生理食塩水の投与群と比較して統計的有意差を示さなかった。
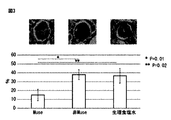
腎臓による尿の排泄機能を調べるために、塩酸ドキソルビシン投与から6週間後の血中の尿素窒素(BUN)濃度(mg/dl)を測定した。図2左に示すように、Muse細胞の投与群では、非Muse細胞の投与群及び生理食塩水の投与群と比較して、血中の尿素窒素濃度が低下した。さらに、排泄尿中の尿タンパク/クレアチニン比を測定すると、Muse細胞の投与群では、他の群と比較して該比が低く、腎機能が改善されていることを示唆した(図2右)。
塩酸ドキソルビシン投与から6週間後に、慢性腎障害に伴う糸球体硬化に対するMuse細胞の糸球体修復効果を検討した(図3)。各マウスを屠殺後、腎組織切片を作製し、PAS染色を行った。この染色によって、糸球体基底膜の変化から、糸球体硬化の程度を観察した。図3の上段に、Muse細胞、非Muse細胞、及び生理食塩水の投与群における各マウスの腎組織(糸球体)切片を示す。Muse細胞の投与群(左)では、糸球体基底膜が非常に明確であることがわかる。一方、非Muse細胞及び生理食塩水の投与群(中央及び右)では、糸球体硬化が進行し、糸球体基底膜の輪郭が不鮮明である。さらに、各モデル群の1個体あたり連続する20個の糸球体を観察し、糸球体硬化の面積比を画像解析ソフトNISelement(登録商標)(Nicon社)を用いて、1糸球体におけるPAS陽性面積を解析した(下段)。Muse細胞の投与群では、他の投与群と比較して、糸球体硬化の面積比が小さかった。これにより、Muse細胞は、糸球体硬化の進行を防ぎ、さらに糸球体の再建及び修復を促すことが示唆された。
(a)Muse細胞の腎組織における生着
尾静脈投与されたMuse細胞及び非Muse細胞の挙動を調べるために、これらの細胞が腎組織に生着するかどうかを検討した。最初に、GFP陽性のMuse細胞及び非Muse細胞を作製し、これらを投与8週後のマウスを用い、実施例3と同様に腎組織切片を調製し、蛍光顕微鏡下で観察した。単位面積あたりの移植細胞数をカウントして、Muse細胞及び非Muse細胞の生着について検討した。図4に示されるように、投与されたMuse細胞は、腎組織に生着しているのに対して、非Muse細胞はほとんど生着しなかった。
腎組織に生着したMuse細胞が分化するかどうかを検討した。本実験では、緑色蛍光タンパク質(GFP)の遺伝子が導入されたGFP陽性のMuse細胞を用いた。また、遠位尿細管の上皮細胞において特異的に発現しているカルビンジンに対する抗体を用いて、Muse細胞の上皮細胞への分化について検討した。図6中央は、遠位尿細管に生着したMuse細胞(GFP陽性)を示す。一方、図6右は、カルビンジンに対する抗体染色による上皮細胞を示す。これらの画像を重ね合わせた画像を図6左に示す。特に蛍光が強い領域を拡大すると、GFP蛍光とカルビンジン蛍光が同一細胞群において観察されたことから、Muse細胞は、遠位尿細管に集積し、遠位尿細管の細胞に分化していることが示唆された。さらに、Muse細胞は、近位尿細管に生着し、近位尿細管の上皮細胞に分化するかどうかをアクアポリン(AQP1)の発現に基づいて検討した。図7上段は、Muse細胞を投与した場合にGFP蛍光画像(中央)、AQP1染色画像(右)、及び両者を重ね合わせた画像(左)を示す。重ね合わせた画像から分かるように、GFP陽性のMuse細胞は、近位尿細管の上皮細胞の分子マーカーであるアクアポリンを発現していることから、投与されたMuse細胞は、近位尿細管に集積し、近位尿細管の細胞に分化していることが示唆された。なお、陰性対照としてGFP及びAQP1に対する1次抗体で染色していないものを用いた(図7下段)。
上記の通り、慢性腎障害マウスモデルの尾静脈に投与されたMuse細胞は、腎障害部位に集積し、糸球体、遠位尿細管、及び近位尿細管の再建及び修復に大いに寄与していることが示唆された。次に、Muse細胞の腎障害部位への集積に関して、インビトロにおいてボイデンチャンバー法により、Muse細胞の遊走能を検討した。具体的には、使用したボイデンチャンバーは、BDマトリゲルインベージョンチャンバー(登録商標)(BD Biosceince−Discovery Labware)であり、チャンバー内に8.0μmのポアサイズを有するBDファルコンセルカルチャーインサートを含む。該インサートの上面にはマトリゲルマトリックスが塗布されている。インサートの下部に疾患モデルマウス血清を添加し、インサート内にMuse細胞(3.5×104個/ウェル)又は非Muse細胞(3.5×104個/ウェル)を播種した。培養20時間後、インサートを通過した細胞数を顕微鏡下で求めた。結果を図8に示す。縦軸は、顕微鏡下で拡大した観察した1視野あたりに存在する細胞数を表す。陰性対照として用いたMuse細胞+疾患モデルマウス血清不含、又は非Muse+疾患モデルマウス血清不含の系では、インサートを通過する細胞はほとんど観察されなかった。これに対して、疾患モデルマウス血清が添加された系では、Muse細胞は非常に高い遊走性を示し、これは、非Muse細胞+疾患モデルマウス血清の件と比較しても顕著であった。このことから、疾患モデルマウス血清には、Muse細胞を遊走させるための何らかの因子を含むことが示唆された。
慢性腎障害マウスモデルにおける腎障害部位へのMuse細胞の移動性を検討した。Muse細胞及び非Muse細胞をそれぞれ培養ディッシュに接着させ、一晩培養後、Hoechest 33342(Sigma)を用いて、これらの細胞核を染色した。続いて、トリプシン処理後、細胞数をカウントし、2×104個を慢性腎障害マウスモデルに尾静脈投与した。投与の24時間後、常法に従って、腎組織を固定し、蛍光顕微鏡下で観察した。Muse細胞を投与した系の蛍光画像を図9に示し、非Muse細胞を投与した系の蛍光画像を図10に示す。いずれの画像においても、各染色されたMuse細胞及び非Muse細胞の核は強いシグナルのスポットとして特定される(矢印部分)。尾静脈に投与されたMuse細胞は、糸球体、尿細管、間質部等に広く分布していたが、非Muse細胞は、尿細管及び間質部にのみ観察された。このことから、Muse細胞は、非Muse細胞と比較して、疾患部位に対して高い遊走性及び生着能を有していると考えられる。
ヒト細胞を拒絶しない免疫不全のSCIDマウスを用いて、腎機能評価の1つとしてクレアチニンクリアランスを経時的に測定した。実験手順は、実施例3と同様に、実施例1で作製した慢性腎障害マウス(SCID)を3群に分け、塩酸ドキソルビシン投与の1週間後に各群のマウスにMuse細胞(2×104個、200μl)、ヒト骨髄由来の非Muse細胞(2×104個、200μl)、又は生理食塩水(200μl)を尾静脈に投与した。その後、各マウスについて、クレアチニンクリアランスを経時的に測定し、結果を図11に示す。ヒトMuse細胞の投与群におけるクレアチニンクリアランスは、測定開始から6週目まで減少するが、測定期間中、非Muse細胞及び生理食塩水の投与群と比較して、有意に高かった。また、Muse細胞の投与群では、Balb/c慢性腎障害モデルと同様に、腎機能が顕著に回復していることが示唆された。
Claims (10)
- 生体の間葉系組織又は培養間葉系細胞から分離されたSSEA−3陽性の多能性幹細胞を含む、慢性腎障害を予防及び/又は治療するための細胞製剤。
- 外部ストレス刺激によりSSEA−3陽性の多能性幹細胞が濃縮された細胞画分を含む、請求項1に記載の細胞製剤。
- 慢性腎障害が、慢性糸球体腎炎、腎硬化症、糖尿病性腎症、嚢胞腎、慢性腎盂腎炎、急速進行性糸球体腎炎、悪性高血圧症、SLE腎炎、アミロイド腎、腎・尿路腫瘍、骨髄腫、閉塞性尿路生涯、痛風腎、腎形成不全、及び腎・尿路結核からなる群から選択される、請求項1又は2に記載の細胞製剤。
- 前記多能性幹細胞が、CD105陽性である、請求項1〜3のいずれか1項に記載の細胞製剤。
- 前記多能性幹細胞が、CD117陰性及びCD146陰性である、請求項1〜4のいずれか1項に記載の細胞製剤。
- 前記多能性幹細胞が、CD117陰性、CD146陰性、NG2陰性、CD34陰性、vWF陰性、及びCD271陰性である、請求項1〜5のいずれか1項に記載の細胞製剤。
- 前記多能性幹細胞が、CD34陰性、CD117陰性、CD146陰性、CD271陰性、NG2陰性、vWF陰性、Sox10陰性、Snai1陰性、Slug陰性、Tyrp1陰性、及びDct陰性である、請求項1〜6のいずれか1項に記載の細胞製剤。
- 前記多能性幹細胞が、以下の性質の全てを有する多能性幹細胞である、請求項1〜7のいずれか1項に記載の細胞製剤:
(i)テロメラーゼ活性が低いか又は無い;
(ii)三胚葉のいずれの胚葉の細胞に分化する能力を持つ;
(iii)腫瘍性増殖を示さない;及び
(iv)セルフリニューアル能を持つ。 - 前記多能性幹細胞が、腎障害部位に集積する能力を有する、請求項1〜8のいずれか1項に記載の細胞製剤。
- 前記多能性幹細胞が、足細胞、メサンギウム細胞、糸球体内皮細胞、傍糸球体細胞、近位尿細管細胞、遠位尿細管細胞、血管内皮細胞、ヘンレわな、及び/又は集合管の細胞からなる群から選択される1つ以上の細胞に分化する能力を有する、請求項1〜9のいずれか1項に記載の細胞製剤。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2021019341A JP2021073305A (ja) | 2021-02-09 | 2021-02-09 | 慢性腎障害治療のための多能性幹細胞 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2021019341A JP2021073305A (ja) | 2021-02-09 | 2021-02-09 | 慢性腎障害治療のための多能性幹細胞 |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2018126976A Division JP7072777B2 (ja) | 2018-07-03 | 2018-07-03 | 慢性腎障害治療のための多能性幹細胞 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2021073305A true JP2021073305A (ja) | 2021-05-13 |
| JP2021073305A5 JP2021073305A5 (ja) | 2021-08-05 |
Family
ID=75802451
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2021019341A Pending JP2021073305A (ja) | 2021-02-09 | 2021-02-09 | 慢性腎障害治療のための多能性幹細胞 |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP2021073305A (ja) |
Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2003013588A1 (fr) * | 2001-08-08 | 2003-02-20 | Kaken Pharmaceutical Co., Ltd. | Materiau de regeneration de rein comprenant des cellules et un facteur de croissance cellulaire |
| JP2012100662A (ja) * | 2011-12-05 | 2012-05-31 | Sapporo Medical Univ | 細胞増殖方法ならびに組織の修復および再生のための医薬 |
| JP2012139246A (ja) * | 2009-07-15 | 2012-07-26 | Mari Idesawa | 生体組織から単離できる多能性幹細胞 |
| WO2014027684A1 (ja) * | 2012-08-17 | 2014-02-20 | 株式会社Clio | 心筋梗塞の修復再生を誘導する多能性幹細胞 |
| JP2018162308A (ja) * | 2018-07-03 | 2018-10-18 | 株式会社生命科学インスティテュート | 慢性腎障害治療のための多能性幹細胞 |
-
2021
- 2021-02-09 JP JP2021019341A patent/JP2021073305A/ja active Pending
Patent Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2003013588A1 (fr) * | 2001-08-08 | 2003-02-20 | Kaken Pharmaceutical Co., Ltd. | Materiau de regeneration de rein comprenant des cellules et un facteur de croissance cellulaire |
| JP2012139246A (ja) * | 2009-07-15 | 2012-07-26 | Mari Idesawa | 生体組織から単離できる多能性幹細胞 |
| JP2012100662A (ja) * | 2011-12-05 | 2012-05-31 | Sapporo Medical Univ | 細胞増殖方法ならびに組織の修復および再生のための医薬 |
| WO2014027684A1 (ja) * | 2012-08-17 | 2014-02-20 | 株式会社Clio | 心筋梗塞の修復再生を誘導する多能性幹細胞 |
| JP2018162308A (ja) * | 2018-07-03 | 2018-10-18 | 株式会社生命科学インスティテュート | 慢性腎障害治療のための多能性幹細胞 |
Non-Patent Citations (3)
| Title |
|---|
| AM. J. PHYSIOL. RENAL PHYSIOL., 2012, VOL.303, PP.F1370-F1381, JPN6021012019, ISSN: 0004873363 * |
| PERIPHERAL NERVE, 2012, VOL.23, NO.2, PP.135-139, JPN6017034978, ISSN: 0004873362 * |
| 東北医学雑誌, 2013, VOL.125, NO.1, PP.107-109, JPN6017032532, ISSN: 0004873361 * |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5968442B2 (ja) | 心筋梗塞の修復再生を誘導する多能性幹細胞 | |
| US10293003B2 (en) | Multilineage-differentiating stress enduring (MUSE) cells for treatment of chronic kidney disease | |
| JP6452107B2 (ja) | 糖尿病性皮膚潰瘍治療のための多能性幹細胞 | |
| JP2015159895A (ja) | 脳梗塞治療のための多能性幹細胞 | |
| WO2012156968A2 (en) | Use of mesenchymal stem cells for the improvement of affective and cognitive function | |
| JP7072777B2 (ja) | 慢性腎障害治療のための多能性幹細胞 | |
| KR102360990B1 (ko) | 혈관장해의 예방 또는 치료제 | |
| JP6604492B2 (ja) | 脳梗塞治療のための多能性幹細胞 | |
| JP2021073305A (ja) | 慢性腎障害治療のための多能性幹細胞 | |
| US20230270790A1 (en) | Pluripotent stem cells effective for treatment of motor neuron disease (mnd) | |
| WO2021085639A1 (ja) | 多能性幹細胞による間質性膀胱炎の治療 | |
| WO2021029346A1 (ja) | 脳血管性認知症の治療または予防剤 | |
| US20220323509A1 (en) | Therapeutic agent for myocarditis | |
| WO2018025973A1 (ja) | 多能性幹細胞による慢性肺疾患の改善及び治療 | |
| KR102513507B1 (ko) | 장기 섬유증의 예방 또는 치료제 | |
| WO2021201286A1 (ja) | ハイポテンシャル多能性幹細胞 | |
| WO2019216380A1 (ja) | 脊髄損傷の治療剤 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20210311 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20210628 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20220315 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20220513 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20220913 |