JP2020536953A - デキストロメトルファン経皮送達デバイス - Google Patents
デキストロメトルファン経皮送達デバイス Download PDFInfo
- Publication number
- JP2020536953A JP2020536953A JP2020540680A JP2020540680A JP2020536953A JP 2020536953 A JP2020536953 A JP 2020536953A JP 2020540680 A JP2020540680 A JP 2020540680A JP 2020540680 A JP2020540680 A JP 2020540680A JP 2020536953 A JP2020536953 A JP 2020536953A
- Authority
- JP
- Japan
- Prior art keywords
- dextromethorphan
- application
- day
- average
- transdermal delivery
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- MKXZASYAUGDDCJ-SZMVWBNQSA-N LSM-2525 Chemical compound C1CCC[C@H]2[C@@]3([H])N(C)CC[C@]21C1=CC(OC)=CC=C1C3 MKXZASYAUGDDCJ-SZMVWBNQSA-N 0.000 title claims abstract description 373
- 229960001985 dextromethorphan Drugs 0.000 title claims abstract description 365
- 230000037317 transdermal delivery Effects 0.000 title claims abstract description 254
- 238000000034 method Methods 0.000 claims abstract description 173
- 239000012790 adhesive layer Substances 0.000 claims abstract description 130
- 239000010410 layer Substances 0.000 claims abstract description 123
- 239000000853 adhesive Substances 0.000 claims abstract description 105
- 230000001070 adhesive effect Effects 0.000 claims abstract description 104
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims abstract description 99
- 239000003961 penetration enhancing agent Substances 0.000 claims abstract description 66
- 230000004907 flux Effects 0.000 claims abstract description 58
- 208000035475 disorder Diseases 0.000 claims abstract description 55
- 238000000338 in vitro Methods 0.000 claims abstract description 31
- LOUPRKONTZGTKE-LHHVKLHASA-N quinidine Chemical compound C([C@H]([C@H](C1)C=C)C2)C[N@@]1[C@H]2[C@@H](O)C1=CC=NC2=CC=C(OC)C=C21 LOUPRKONTZGTKE-LHHVKLHASA-N 0.000 claims description 86
- LOUPRKONTZGTKE-UHFFFAOYSA-N cinchonine Natural products C1C(C(C2)C=C)CCN2C1C(O)C1=CC=NC2=CC=C(OC)C=C21 LOUPRKONTZGTKE-UHFFFAOYSA-N 0.000 claims description 43
- 229960001404 quinidine Drugs 0.000 claims description 42
- 230000001186 cumulative effect Effects 0.000 claims description 25
- NIXOWILDQLNWCW-UHFFFAOYSA-M Acrylate Chemical compound [O-]C(=O)C=C NIXOWILDQLNWCW-UHFFFAOYSA-M 0.000 claims description 21
- 206010010904 Convulsion Diseases 0.000 claims description 21
- 239000013464 silicone adhesive Substances 0.000 claims description 17
- 208000012902 Nervous system disease Diseases 0.000 claims description 15
- 208000002193 Pain Diseases 0.000 claims description 13
- 230000008482 dysregulation Effects 0.000 claims description 13
- 206010011224 Cough Diseases 0.000 claims description 12
- 208000018737 Parkinson disease Diseases 0.000 claims description 12
- 239000012848 Dextrorphan Substances 0.000 claims description 9
- JAQUASYNZVUNQP-PVAVHDDUSA-N dextrorphan Chemical compound C1C2=CC=C(O)C=C2[C@@]23CCN(C)[C@@H]1[C@H]2CCCC3 JAQUASYNZVUNQP-PVAVHDDUSA-N 0.000 claims description 9
- 229950006878 dextrorphan Drugs 0.000 claims description 9
- 206010003805 Autism Diseases 0.000 claims description 8
- 208000020706 Autistic disease Diseases 0.000 claims description 8
- 230000000954 anitussive effect Effects 0.000 claims description 8
- 239000000935 antidepressant agent Substances 0.000 claims description 8
- 229940124584 antitussives Drugs 0.000 claims description 8
- 150000001875 compounds Chemical class 0.000 claims description 8
- 230000003166 hypermetabolic effect Effects 0.000 claims description 8
- 206010029350 Neurotoxicity Diseases 0.000 claims description 7
- 206010044221 Toxic encephalopathy Diseases 0.000 claims description 7
- 231100000228 neurotoxicity Toxicity 0.000 claims description 7
- 230000007135 neurotoxicity Effects 0.000 claims description 7
- FBOZXECLQNJBKD-ZDUSSCGKSA-N L-methotrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FBOZXECLQNJBKD-ZDUSSCGKSA-N 0.000 claims description 6
- 208000006011 Stroke Diseases 0.000 claims description 6
- 229960001058 bupropion Drugs 0.000 claims description 6
- SNPPWIUOZRMYNY-UHFFFAOYSA-N bupropion Chemical compound CC(C)(C)NC(C)C(=O)C1=CC=CC(Cl)=C1 SNPPWIUOZRMYNY-UHFFFAOYSA-N 0.000 claims description 6
- 229960000485 methotrexate Drugs 0.000 claims description 6
- 208000030886 Traumatic Brain injury Diseases 0.000 claims description 5
- 230000009529 traumatic brain injury Effects 0.000 claims description 5
- 239000000651 prodrug Substances 0.000 claims description 4
- 229940002612 prodrug Drugs 0.000 claims description 4
- AKOAEVOSDHIVFX-UHFFFAOYSA-N Hydroxybupropion Chemical compound OCC(C)(C)NC(C)C(=O)C1=CC=CC(Cl)=C1 AKOAEVOSDHIVFX-UHFFFAOYSA-N 0.000 claims description 3
- ZZVUWRFHKOJYTH-UHFFFAOYSA-N diphenhydramine Chemical compound C=1C=CC=CC=1C(OCCN(C)C)C1=CC=CC=C1 ZZVUWRFHKOJYTH-UHFFFAOYSA-N 0.000 claims 1
- 201000010099 disease Diseases 0.000 abstract description 44
- 239000000203 mixture Substances 0.000 abstract description 36
- 238000013461 design Methods 0.000 abstract description 12
- 238000001727 in vivo Methods 0.000 abstract description 6
- 238000010586 diagram Methods 0.000 abstract description 2
- 210000003491 skin Anatomy 0.000 description 135
- 239000003814 drug Substances 0.000 description 39
- 229940079593 drug Drugs 0.000 description 36
- 239000004820 Pressure-sensitive adhesive Substances 0.000 description 30
- 238000009472 formulation Methods 0.000 description 24
- 239000003795 chemical substances by application Substances 0.000 description 21
- 238000012360 testing method Methods 0.000 description 21
- 239000003623 enhancer Substances 0.000 description 20
- 230000036470 plasma concentration Effects 0.000 description 20
- 235000014113 dietary fatty acids Nutrition 0.000 description 18
- 239000000194 fatty acid Substances 0.000 description 18
- 229930195729 fatty acid Natural products 0.000 description 18
- 229920001577 copolymer Polymers 0.000 description 17
- HIQIXEFWDLTDED-UHFFFAOYSA-N 4-hydroxy-1-piperidin-4-ylpyrrolidin-2-one Chemical compound O=C1CC(O)CN1C1CCNCC1 HIQIXEFWDLTDED-UHFFFAOYSA-N 0.000 description 16
- -1 polydimethylsiloxane Polymers 0.000 description 16
- MRUNQKQTAMUPRF-PUTLROBFSA-N nuedexta Chemical compound Br.OS(O)(=O)=O.C([C@@H]12)CCC[C@]11CCN(C)[C@H]2CC2=CC=C(OC)C=C21.C1C([C@H](C2)C=C)CCN2[C@H]1[C@@H](O)C1=CC=NC2=CC=C(OC)C=C21.C1C([C@H](C2)C=C)CCN2[C@H]1[C@@H](O)C1=CC=NC2=CC=C(OC)C=C21 MRUNQKQTAMUPRF-PUTLROBFSA-N 0.000 description 14
- 208000007220 Cytochrome P-450 CYP2D6 Inhibitors Diseases 0.000 description 12
- ZQPPMHVWECSIRJ-KTKRTIGZSA-N oleic acid Chemical compound CCCCCCCC\C=C/CCCCCCCC(O)=O ZQPPMHVWECSIRJ-KTKRTIGZSA-N 0.000 description 12
- 206010002026 amyotrophic lateral sclerosis Diseases 0.000 description 11
- 208000024827 Alzheimer disease Diseases 0.000 description 10
- 208000036864 Attention deficit/hyperactivity disease Diseases 0.000 description 10
- YZCKVEUIGOORGS-OUBTZVSYSA-N Deuterium Chemical compound [2H] YZCKVEUIGOORGS-OUBTZVSYSA-N 0.000 description 10
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 10
- 229920002367 Polyisobutene Polymers 0.000 description 10
- 229910052805 deuterium Inorganic materials 0.000 description 10
- 208000002320 spinal muscular atrophy Diseases 0.000 description 10
- WRIDQFICGBMAFQ-UHFFFAOYSA-N (E)-8-Octadecenoic acid Natural products CCCCCCCCCC=CCCCCCCC(O)=O WRIDQFICGBMAFQ-UHFFFAOYSA-N 0.000 description 9
- LQJBNNIYVWPHFW-UHFFFAOYSA-N 20:1omega9c fatty acid Natural products CCCCCCCCCCC=CCCCCCCCC(O)=O LQJBNNIYVWPHFW-UHFFFAOYSA-N 0.000 description 9
- QSBYPNXLFMSGKH-UHFFFAOYSA-N 9-Heptadecensaeure Natural products CCCCCCCC=CCCCCCCCC(O)=O QSBYPNXLFMSGKH-UHFFFAOYSA-N 0.000 description 9
- 206010008025 Cerebellar ataxia Diseases 0.000 description 9
- 239000005642 Oleic acid Substances 0.000 description 9
- ZQPPMHVWECSIRJ-UHFFFAOYSA-N Oleic acid Natural products CCCCCCCCC=CCCCCCCCC(O)=O ZQPPMHVWECSIRJ-UHFFFAOYSA-N 0.000 description 9
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 9
- 239000002585 base Substances 0.000 description 9
- 230000007850 degeneration Effects 0.000 description 9
- 150000004665 fatty acids Chemical class 0.000 description 9
- QXJSBBXBKPUZAA-UHFFFAOYSA-N isooleic acid Natural products CCCCCCCC=CCCCCCCCCC(O)=O QXJSBBXBKPUZAA-UHFFFAOYSA-N 0.000 description 9
- 239000011159 matrix material Substances 0.000 description 9
- 229940037869 nuedexta Drugs 0.000 description 9
- 229920000191 poly(N-vinyl pyrrolidone) Polymers 0.000 description 9
- 238000002360 preparation method Methods 0.000 description 9
- RZRNAYUHWVFMIP-KTKRTIGZSA-N 1-oleoylglycerol Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OCC(O)CO RZRNAYUHWVFMIP-KTKRTIGZSA-N 0.000 description 8
- 208000006096 Attention Deficit Disorder with Hyperactivity Diseases 0.000 description 8
- 208000020925 Bipolar disease Diseases 0.000 description 8
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical group [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 8
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 8
- 206010026749 Mania Diseases 0.000 description 8
- YKPUWZUDDOIDPM-SOFGYWHQSA-N capsaicin Chemical compound COC1=CC(CNC(=O)CCCC\C=C\C(C)C)=CC=C1O YKPUWZUDDOIDPM-SOFGYWHQSA-N 0.000 description 8
- 239000002775 capsule Substances 0.000 description 8
- 210000004027 cell Anatomy 0.000 description 8
- RZRNAYUHWVFMIP-HXUWFJFHSA-N glycerol monolinoleate Natural products CCCCCCCCC=CCCCCCCCC(=O)OC[C@H](O)CO RZRNAYUHWVFMIP-HXUWFJFHSA-N 0.000 description 8
- BARWIPMJPCRCTP-UHFFFAOYSA-N oleic acid oleyl ester Natural products CCCCCCCCC=CCCCCCCCCOC(=O)CCCCCCCC=CCCCCCCCC BARWIPMJPCRCTP-UHFFFAOYSA-N 0.000 description 8
- BARWIPMJPCRCTP-CLFAGFIQSA-N oleyl oleate Chemical compound CCCCCCCC\C=C/CCCCCCCCOC(=O)CCCCCCC\C=C/CCCCCCCC BARWIPMJPCRCTP-CLFAGFIQSA-N 0.000 description 8
- 230000001148 spastic effect Effects 0.000 description 8
- 208000011580 syndromic disease Diseases 0.000 description 8
- 208000027534 Emotional disease Diseases 0.000 description 7
- 208000001089 Multiple system atrophy Diseases 0.000 description 7
- 229940005513 antidepressants Drugs 0.000 description 7
- 208000015802 attention deficit-hyperactivity disease Diseases 0.000 description 7
- PCHPORCSPXIHLZ-UHFFFAOYSA-N diphenhydramine hydrochloride Chemical compound [Cl-].C=1C=CC=CC=1C(OCC[NH+](C)C)C1=CC=CC=C1 PCHPORCSPXIHLZ-UHFFFAOYSA-N 0.000 description 7
- 230000000694 effects Effects 0.000 description 7
- 150000002148 esters Chemical class 0.000 description 7
- 208000005264 motor neuron disease Diseases 0.000 description 7
- 229920005573 silicon-containing polymer Polymers 0.000 description 7
- 208000011117 substance-related disease Diseases 0.000 description 7
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 6
- UGJMXCAKCUNAIE-UHFFFAOYSA-N Gabapentin Chemical compound OC(=O)CC1(CN)CCCCC1 UGJMXCAKCUNAIE-UHFFFAOYSA-N 0.000 description 6
- 229920003083 Kollidon® VA64 Polymers 0.000 description 6
- 208000019022 Mood disease Diseases 0.000 description 6
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 6
- 208000010112 Spinocerebellar Degenerations Diseases 0.000 description 6
- GWEVSGVZZGPLCZ-UHFFFAOYSA-N Titan oxide Chemical compound O=[Ti]=O GWEVSGVZZGPLCZ-UHFFFAOYSA-N 0.000 description 6
- 238000005266 casting Methods 0.000 description 6
- 230000006870 function Effects 0.000 description 6
- 208000024714 major depressive disease Diseases 0.000 description 6
- 239000012528 membrane Substances 0.000 description 6
- 230000004060 metabolic process Effects 0.000 description 6
- 239000008194 pharmaceutical composition Substances 0.000 description 6
- 229920000642 polymer Polymers 0.000 description 6
- 208000020016 psychiatric disease Diseases 0.000 description 6
- TVYLLZQTGLZFBW-ZBFHGGJFSA-N (R,R)-tramadol Chemical compound COC1=CC=CC([C@]2(O)[C@H](CCCC2)CN(C)C)=C1 TVYLLZQTGLZFBW-ZBFHGGJFSA-N 0.000 description 5
- 208000019901 Anxiety disease Diseases 0.000 description 5
- 206010008027 Cerebellar atrophy Diseases 0.000 description 5
- 108010001237 Cytochrome P-450 CYP2D6 Proteins 0.000 description 5
- 206010012289 Dementia Diseases 0.000 description 5
- 208000023105 Huntington disease Diseases 0.000 description 5
- 208000025966 Neurological disease Diseases 0.000 description 5
- 206010057852 Nicotine dependence Diseases 0.000 description 5
- 208000025569 Tobacco Use disease Diseases 0.000 description 5
- XTXRWKRVRITETP-UHFFFAOYSA-N Vinyl acetate Chemical compound CC(=O)OC=C XTXRWKRVRITETP-UHFFFAOYSA-N 0.000 description 5
- 230000001430 anti-depressive effect Effects 0.000 description 5
- 239000008280 blood Substances 0.000 description 5
- 210000004369 blood Anatomy 0.000 description 5
- 206010013663 drug dependence Diseases 0.000 description 5
- 206010015037 epilepsy Diseases 0.000 description 5
- 208000013403 hyperactivity Diseases 0.000 description 5
- 208000035231 inattentive type attention deficit hyperactivity disease Diseases 0.000 description 5
- 230000002503 metabolic effect Effects 0.000 description 5
- 201000006417 multiple sclerosis Diseases 0.000 description 5
- 208000004296 neuralgia Diseases 0.000 description 5
- 208000021722 neuropathic pain Diseases 0.000 description 5
- 229920001296 polysiloxane Polymers 0.000 description 5
- 238000004088 simulation Methods 0.000 description 5
- 229960004380 tramadol Drugs 0.000 description 5
- TVYLLZQTGLZFBW-GOEBONIOSA-N tramadol Natural products COC1=CC=CC([C@@]2(O)[C@@H](CCCC2)CN(C)C)=C1 TVYLLZQTGLZFBW-GOEBONIOSA-N 0.000 description 5
- 206010054196 Affect lability Diseases 0.000 description 4
- 102100021704 Cytochrome P450 2D6 Human genes 0.000 description 4
- 208000020401 Depressive disease Diseases 0.000 description 4
- 208000012661 Dyskinesia Diseases 0.000 description 4
- 206010019233 Headaches Diseases 0.000 description 4
- 208000002972 Hepatolenticular Degeneration Diseases 0.000 description 4
- 208000016285 Movement disease Diseases 0.000 description 4
- WHNWPMSKXPGLAX-UHFFFAOYSA-N N-Vinyl-2-pyrrolidone Chemical group C=CN1CCCC1=O WHNWPMSKXPGLAX-UHFFFAOYSA-N 0.000 description 4
- 208000004550 Postoperative Pain Diseases 0.000 description 4
- 208000005793 Restless legs syndrome Diseases 0.000 description 4
- 208000028552 Treatment-Resistant Depressive disease Diseases 0.000 description 4
- 201000004810 Vascular dementia Diseases 0.000 description 4
- 208000018839 Wilson disease Diseases 0.000 description 4
- 239000013543 active substance Substances 0.000 description 4
- 230000006978 adaptation Effects 0.000 description 4
- 208000028683 bipolar I disease Diseases 0.000 description 4
- 230000005978 brain dysfunction Effects 0.000 description 4
- 206010008118 cerebral infarction Diseases 0.000 description 4
- ZPUCINDJVBIVPJ-LJISPDSOSA-N cocaine Chemical compound O([C@H]1C[C@@H]2CC[C@@H](N2C)[C@H]1C(=O)OC)C(=O)C1=CC=CC=C1 ZPUCINDJVBIVPJ-LJISPDSOSA-N 0.000 description 4
- 230000007812 deficiency Effects 0.000 description 4
- 238000012377 drug delivery Methods 0.000 description 4
- 231100000869 headache Toxicity 0.000 description 4
- 239000003112 inhibitor Substances 0.000 description 4
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 4
- 230000000670 limiting effect Effects 0.000 description 4
- 238000002156 mixing Methods 0.000 description 4
- 201000003631 narcolepsy Diseases 0.000 description 4
- 230000004770 neurodegeneration Effects 0.000 description 4
- 208000015122 neurodegenerative disease Diseases 0.000 description 4
- 201000001119 neuropathy Diseases 0.000 description 4
- 230000007823 neuropathy Effects 0.000 description 4
- 208000033808 peripheral neuropathy Diseases 0.000 description 4
- 150000003839 salts Chemical class 0.000 description 4
- 201000000980 schizophrenia Diseases 0.000 description 4
- AHOUBRCZNHFOSL-YOEHRIQHSA-N (+)-Casbol Chemical compound C1=CC(F)=CC=C1[C@H]1[C@H](COC=2C=C3OCOC3=CC=2)CNCC1 AHOUBRCZNHFOSL-YOEHRIQHSA-N 0.000 description 3
- XMAYWYJOQHXEEK-OZXSUGGESA-N (2R,4S)-ketoconazole Chemical compound C1CN(C(=O)C)CCN1C(C=C1)=CC=C1OC[C@@H]1O[C@@](CN2C=NC=C2)(C=2C(=CC(Cl)=CC=2)Cl)OC1 XMAYWYJOQHXEEK-OZXSUGGESA-N 0.000 description 3
- YQSHYGCCYVPRDI-UHFFFAOYSA-N (4-propan-2-ylphenyl)methanamine Chemical compound CC(C)C1=CC=C(CN)C=C1 YQSHYGCCYVPRDI-UHFFFAOYSA-N 0.000 description 3
- AXTGDCSMTYGJND-UHFFFAOYSA-N 1-dodecylazepan-2-one Chemical compound CCCCCCCCCCCCN1CCCCCC1=O AXTGDCSMTYGJND-UHFFFAOYSA-N 0.000 description 3
- VHVPQPYKVGDNFY-DFMJLFEVSA-N 2-[(2r)-butan-2-yl]-4-[4-[4-[4-[[(2r,4s)-2-(2,4-dichlorophenyl)-2-(1,2,4-triazol-1-ylmethyl)-1,3-dioxolan-4-yl]methoxy]phenyl]piperazin-1-yl]phenyl]-1,2,4-triazol-3-one Chemical compound O=C1N([C@H](C)CC)N=CN1C1=CC=C(N2CCN(CC2)C=2C=CC(OC[C@@H]3O[C@](CN4N=CN=C4)(OC3)C=3C(=CC(Cl)=CC=3)Cl)=CC=2)C=C1 VHVPQPYKVGDNFY-DFMJLFEVSA-N 0.000 description 3
- 208000000044 Amnesia Diseases 0.000 description 3
- 208000031091 Amnestic disease Diseases 0.000 description 3
- AXRYRYVKAWYZBR-UHFFFAOYSA-N Atazanavir Natural products C=1C=C(C=2N=CC=CC=2)C=CC=1CN(NC(=O)C(NC(=O)OC)C(C)(C)C)CC(O)C(NC(=O)C(NC(=O)OC)C(C)(C)C)CC1=CC=CC=C1 AXRYRYVKAWYZBR-UHFFFAOYSA-N 0.000 description 3
- 108010019625 Atazanavir Sulfate Proteins 0.000 description 3
- 206010003694 Atrophy Diseases 0.000 description 3
- 208000010482 CADASIL Diseases 0.000 description 3
- 208000033221 Cerebral autosomal dominant arteriopathy with subcortical infarcts and leukoencephalopathy Diseases 0.000 description 3
- 208000033935 Cerebral autosomal dominant arteriopathy-subcortical infarcts-leukoencephalopathy Diseases 0.000 description 3
- 206010008748 Chorea Diseases 0.000 description 3
- 206010008874 Chronic Fatigue Syndrome Diseases 0.000 description 3
- HCYAFALTSJYZDH-UHFFFAOYSA-N Desimpramine Chemical compound C1CC2=CC=CC=C2N(CCCNC)C2=CC=CC=C21 HCYAFALTSJYZDH-UHFFFAOYSA-N 0.000 description 3
- LTMHDMANZUZIPE-AMTYYWEZSA-N Digoxin Natural products O([C@H]1[C@H](C)O[C@H](O[C@@H]2C[C@@H]3[C@@](C)([C@@H]4[C@H]([C@]5(O)[C@](C)([C@H](O)C4)[C@H](C4=CC(=O)OC4)CC5)CC3)CC2)C[C@@H]1O)[C@H]1O[C@H](C)[C@@H](O[C@H]2O[C@@H](C)[C@H](O)[C@@H](O)C2)[C@@H](O)C1 LTMHDMANZUZIPE-AMTYYWEZSA-N 0.000 description 3
- 206010020710 Hyperphagia Diseases 0.000 description 3
- 208000008589 Obesity Diseases 0.000 description 3
- 229940127450 Opioid Agonists Drugs 0.000 description 3
- 206010033799 Paralysis Diseases 0.000 description 3
- AHOUBRCZNHFOSL-UHFFFAOYSA-N Paroxetine hydrochloride Natural products C1=CC(F)=CC=C1C1C(COC=2C=C3OCOC3=CC=2)CNCC1 AHOUBRCZNHFOSL-UHFFFAOYSA-N 0.000 description 3
- 239000004698 Polyethylene Substances 0.000 description 3
- 201000009916 Postpartum depression Diseases 0.000 description 3
- 229920003081 Povidone K 30 Polymers 0.000 description 3
- 102000029797 Prion Human genes 0.000 description 3
- 108091000054 Prion Proteins 0.000 description 3
- 208000009106 Shy-Drager Syndrome Diseases 0.000 description 3
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 3
- KLBQZWRITKRQQV-UHFFFAOYSA-N Thioridazine Chemical compound C12=CC(SC)=CC=C2SC2=CC=CC=C2N1CCC1CCCCN1C KLBQZWRITKRQQV-UHFFFAOYSA-N 0.000 description 3
- 208000010641 Tooth disease Diseases 0.000 description 3
- 208000021017 Weight Gain Diseases 0.000 description 3
- NIXOWILDQLNWCW-UHFFFAOYSA-N acrylic acid group Chemical group C(C=C)(=O)O NIXOWILDQLNWCW-UHFFFAOYSA-N 0.000 description 3
- 230000001919 adrenal effect Effects 0.000 description 3
- 230000016571 aggressive behavior Effects 0.000 description 3
- 230000006986 amnesia Effects 0.000 description 3
- 229940035676 analgesics Drugs 0.000 description 3
- 239000000730 antalgic agent Substances 0.000 description 3
- AXRYRYVKAWYZBR-GASGPIRDSA-N atazanavir Chemical compound C([C@H](NC(=O)[C@@H](NC(=O)OC)C(C)(C)C)[C@@H](O)CN(CC=1C=CC(=CC=1)C=1N=CC=CC=1)NC(=O)[C@@H](NC(=O)OC)C(C)(C)C)C1=CC=CC=C1 AXRYRYVKAWYZBR-GASGPIRDSA-N 0.000 description 3
- 229960003277 atazanavir Drugs 0.000 description 3
- 230000037444 atrophy Effects 0.000 description 3
- 208000025748 atypical depressive disease Diseases 0.000 description 3
- 208000025307 bipolar depression Diseases 0.000 description 3
- 208000025434 cerebellar degeneration Diseases 0.000 description 3
- 208000016886 cerebral arteriopathy with subcortical infarcts and leukoencephalopathy Diseases 0.000 description 3
- 239000003610 charcoal Substances 0.000 description 3
- 229960002626 clarithromycin Drugs 0.000 description 3
- AGOYDEPGAOXOCK-KCBOHYOISA-N clarithromycin Chemical compound O([C@@H]1[C@@H](C)C(=O)O[C@@H]([C@@]([C@H](O)[C@@H](C)C(=O)[C@H](C)C[C@](C)([C@H](O[C@H]2[C@@H]([C@H](C[C@@H](C)O2)N(C)C)O)[C@H]1C)OC)(C)O)CC)[C@H]1C[C@@](C)(OC)[C@@H](O)[C@H](C)O1 AGOYDEPGAOXOCK-KCBOHYOISA-N 0.000 description 3
- 230000001054 cortical effect Effects 0.000 description 3
- 229960003914 desipramine Drugs 0.000 description 3
- 229960003782 dextromethorphan hydrobromide Drugs 0.000 description 3
- 229960005156 digoxin Drugs 0.000 description 3
- LTMHDMANZUZIPE-PUGKRICDSA-N digoxin Chemical compound C1[C@H](O)[C@H](O)[C@@H](C)O[C@H]1O[C@@H]1[C@@H](C)O[C@@H](O[C@@H]2[C@H](O[C@@H](O[C@@H]3C[C@@H]4[C@]([C@@H]5[C@H]([C@]6(CC[C@@H]([C@@]6(C)[C@H](O)C5)C=5COC(=O)C=5)O)CC4)(C)CC3)C[C@@H]2O)C)C[C@@H]1O LTMHDMANZUZIPE-PUGKRICDSA-N 0.000 description 3
- LTMHDMANZUZIPE-UHFFFAOYSA-N digoxine Natural products C1C(O)C(O)C(C)OC1OC1C(C)OC(OC2C(OC(OC3CC4C(C5C(C6(CCC(C6(C)C(O)C5)C=5COC(=O)C=5)O)CC4)(C)CC3)CC2O)C)CC1O LTMHDMANZUZIPE-UHFFFAOYSA-N 0.000 description 3
- 208000024732 dysthymic disease Diseases 0.000 description 3
- 230000010483 emotional dysregulation Effects 0.000 description 3
- 239000012458 free base Substances 0.000 description 3
- 229960002870 gabapentin Drugs 0.000 description 3
- CBVCZFGXHXORBI-PXQQMZJSSA-N indinavir Chemical compound C([C@H](N(CC1)C[C@@H](O)C[C@@H](CC=2C=CC=CC=2)C(=O)N[C@H]2C3=CC=CC=C3C[C@H]2O)C(=O)NC(C)(C)C)N1CC1=CC=CN=C1 CBVCZFGXHXORBI-PXQQMZJSSA-N 0.000 description 3
- 229960001936 indinavir Drugs 0.000 description 3
- 229960004130 itraconazole Drugs 0.000 description 3
- 229960004125 ketoconazole Drugs 0.000 description 3
- 201000010901 lateral sclerosis Diseases 0.000 description 3
- 208000036546 leukodystrophy Diseases 0.000 description 3
- 239000000463 material Substances 0.000 description 3
- 239000002207 metabolite Substances 0.000 description 3
- 230000036651 mood Effects 0.000 description 3
- 208000029766 myalgic encephalomeyelitis/chronic fatigue syndrome Diseases 0.000 description 3
- 235000020824 obesity Nutrition 0.000 description 3
- 229940127240 opiate Drugs 0.000 description 3
- 229960002296 paroxetine Drugs 0.000 description 3
- 230000035515 penetration Effects 0.000 description 3
- 239000000546 pharmaceutical excipient Substances 0.000 description 3
- YVUQSNJEYSNKRX-UHFFFAOYSA-N pimozide Chemical compound C1=CC(F)=CC=C1C(C=1C=CC(F)=CC=1)CCCN1CCC(N2C(NC3=CC=CC=C32)=O)CC1 YVUQSNJEYSNKRX-UHFFFAOYSA-N 0.000 description 3
- 229960003634 pimozide Drugs 0.000 description 3
- 229920000728 polyester Polymers 0.000 description 3
- 229920000573 polyethylene Polymers 0.000 description 3
- 239000003379 purinergic P1 receptor agonist Substances 0.000 description 3
- 230000001932 seasonal effect Effects 0.000 description 3
- 239000000377 silicon dioxide Substances 0.000 description 3
- 235000012239 silicon dioxide Nutrition 0.000 description 3
- 239000007787 solid Substances 0.000 description 3
- 238000006467 substitution reaction Methods 0.000 description 3
- 239000004094 surface-active agent Substances 0.000 description 3
- 229960002784 thioridazine Drugs 0.000 description 3
- 239000004408 titanium dioxide Substances 0.000 description 3
- 230000004584 weight gain Effects 0.000 description 3
- 235000019786 weight gain Nutrition 0.000 description 3
- GJHKWLSRHNWTAN-UHFFFAOYSA-N 1-ethoxy-4-(4-pentylcyclohexyl)benzene Chemical compound C1CC(CCCCC)CCC1C1=CC=C(OCC)C=C1 GJHKWLSRHNWTAN-UHFFFAOYSA-N 0.000 description 2
- VOXZDWNPVJITMN-ZBRFXRBCSA-N 17β-estradiol Chemical compound OC1=CC=C2[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3CCC2=C1 VOXZDWNPVJITMN-ZBRFXRBCSA-N 0.000 description 2
- KWTWDQCKEHXFFR-UHFFFAOYSA-N 3-[1-(dimethylamino)-2-methylpentan-3-yl]phenol Chemical class CN(C)CC(C)C(CC)C1=CC=CC(O)=C1 KWTWDQCKEHXFFR-UHFFFAOYSA-N 0.000 description 2
- JOOXCMJARBKPKM-UHFFFAOYSA-N 4-oxopentanoic acid Chemical compound CC(=O)CCC(O)=O JOOXCMJARBKPKM-UHFFFAOYSA-N 0.000 description 2
- 206010003591 Ataxia Diseases 0.000 description 2
- 206010010071 Coma Diseases 0.000 description 2
- 206010012335 Dependence Diseases 0.000 description 2
- 206010013654 Drug abuse Diseases 0.000 description 2
- 206010013952 Dysphonia Diseases 0.000 description 2
- 201000011240 Frontotemporal dementia Diseases 0.000 description 2
- 241000282412 Homo Species 0.000 description 2
- 208000004454 Hyperalgesia Diseases 0.000 description 2
- HOKKHZGPKSLGJE-GSVOUGTGSA-N N-Methyl-D-aspartic acid Chemical compound CN[C@@H](C(O)=O)CC(O)=O HOKKHZGPKSLGJE-GSVOUGTGSA-N 0.000 description 2
- SECXISVLQFMRJM-UHFFFAOYSA-N N-Methylpyrrolidone Chemical compound CN1CCCC1=O SECXISVLQFMRJM-UHFFFAOYSA-N 0.000 description 2
- 208000009905 Neurofibromatoses Diseases 0.000 description 2
- 241000208125 Nicotiana Species 0.000 description 2
- 235000002637 Nicotiana tabacum Nutrition 0.000 description 2
- 206010061334 Partial seizures Diseases 0.000 description 2
- 208000010366 Postpoliomyelitis syndrome Diseases 0.000 description 2
- 206010036618 Premenstrual syndrome Diseases 0.000 description 2
- 208000032319 Primary lateral sclerosis Diseases 0.000 description 2
- LOUPRKONTZGTKE-WZBLMQSHSA-N Quinine Chemical compound C([C@H]([C@H](C1)C=C)C2)C[N@@]1[C@@H]2[C@H](O)C1=CC=NC2=CC=C(OC)C=C21 LOUPRKONTZGTKE-WZBLMQSHSA-N 0.000 description 2
- 206010039966 Senile dementia Diseases 0.000 description 2
- 201000001880 Sexual dysfunction Diseases 0.000 description 2
- 229920002125 Sokalan® Polymers 0.000 description 2
- 208000013200 Stress disease Diseases 0.000 description 2
- MUMGGOZAMZWBJJ-DYKIIFRCSA-N Testostosterone Chemical compound O=C1CC[C@]2(C)[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3CCC2=C1 MUMGGOZAMZWBJJ-DYKIIFRCSA-N 0.000 description 2
- 206010044565 Tremor Diseases 0.000 description 2
- 206010046298 Upper motor neurone lesion Diseases 0.000 description 2
- XSQUKJJJFZCRTK-UHFFFAOYSA-N Urea Chemical compound NC(N)=O XSQUKJJJFZCRTK-UHFFFAOYSA-N 0.000 description 2
- 206010047700 Vomiting Diseases 0.000 description 2
- 239000002253 acid Substances 0.000 description 2
- 239000012190 activator Substances 0.000 description 2
- 230000002730 additional effect Effects 0.000 description 2
- 150000001298 alcohols Chemical class 0.000 description 2
- 238000004458 analytical method Methods 0.000 description 2
- 239000003963 antioxidant agent Substances 0.000 description 2
- 229960002504 capsaicin Drugs 0.000 description 2
- 235000017663 capsaicin Nutrition 0.000 description 2
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 2
- 210000003169 central nervous system Anatomy 0.000 description 2
- 230000002490 cerebral effect Effects 0.000 description 2
- 208000026106 cerebrovascular disease Diseases 0.000 description 2
- 238000006243 chemical reaction Methods 0.000 description 2
- 208000012601 choreatic disease Diseases 0.000 description 2
- 229960003920 cocaine Drugs 0.000 description 2
- 230000002920 convulsive effect Effects 0.000 description 2
- 239000013078 crystal Substances 0.000 description 2
- 238000002425 crystallisation Methods 0.000 description 2
- 230000008025 crystallization Effects 0.000 description 2
- MWKFXSUHUHTGQN-UHFFFAOYSA-N decan-1-ol Chemical compound CCCCCCCCCCO MWKFXSUHUHTGQN-UHFFFAOYSA-N 0.000 description 2
- 230000006735 deficit Effects 0.000 description 2
- 208000037765 diseases and disorders Diseases 0.000 description 2
- 208000002173 dizziness Diseases 0.000 description 2
- 238000001035 drying Methods 0.000 description 2
- 210000002615 epidermis Anatomy 0.000 description 2
- 235000020937 fasting conditions Nutrition 0.000 description 2
- 239000013020 final formulation Substances 0.000 description 2
- 229920002313 fluoropolymer Polymers 0.000 description 2
- 239000004811 fluoropolymer Substances 0.000 description 2
- 150000002334 glycols Chemical class 0.000 description 2
- 230000010224 hepatic metabolism Effects 0.000 description 2
- 238000004128 high performance liquid chromatography Methods 0.000 description 2
- 239000004615 ingredient Substances 0.000 description 2
- 210000004185 liver Anatomy 0.000 description 2
- 230000003387 muscular Effects 0.000 description 2
- 201000004931 neurofibromatosis Diseases 0.000 description 2
- 239000004745 nonwoven fabric Substances 0.000 description 2
- 229940049964 oleate Drugs 0.000 description 2
- 229920000058 polyacrylate Polymers 0.000 description 2
- 239000004584 polyacrylic acid Substances 0.000 description 2
- 229920006264 polyurethane film Polymers 0.000 description 2
- 201000002212 progressive supranuclear palsy Diseases 0.000 description 2
- 229960004482 quinidine sulfate Drugs 0.000 description 2
- 230000002829 reductive effect Effects 0.000 description 2
- 238000005070 sampling Methods 0.000 description 2
- 229920006395 saturated elastomer Polymers 0.000 description 2
- 231100000872 sexual dysfunction Toxicity 0.000 description 2
- 239000002356 single layer Substances 0.000 description 2
- 201000009032 substance abuse Diseases 0.000 description 2
- 150000003462 sulfoxides Chemical class 0.000 description 2
- 208000024891 symptom Diseases 0.000 description 2
- DUXYWXYOBMKGIN-UHFFFAOYSA-N trimyristin Chemical compound CCCCCCCCCCCCCC(=O)OCC(OC(=O)CCCCCCCCCCCCC)COC(=O)CCCCCCCCCCCCC DUXYWXYOBMKGIN-UHFFFAOYSA-N 0.000 description 2
- 230000008673 vomiting Effects 0.000 description 2
- SNICXCGAKADSCV-JTQLQIEISA-N (-)-Nicotine Chemical compound CN1CCC[C@H]1C1=CC=CN=C1 SNICXCGAKADSCV-JTQLQIEISA-N 0.000 description 1
- ZHNFLHYOFXQIOW-AHSOWCEXSA-N (s)-[(2r,4s,5r)-5-ethenyl-1-azabicyclo[2.2.2]octan-2-yl]-(6-methoxyquinolin-4-yl)methanol;sulfuric acid;dihydrate Chemical compound O.O.OS(O)(=O)=O.C([C@H]([C@H](C1)C=C)C2)CN1[C@H]2[C@@H](O)C1=CC=NC2=CC=C(OC)C=C21.C([C@H]([C@H](C1)C=C)C2)CN1[C@H]2[C@@H](O)C1=CC=NC2=CC=C(OC)C=C21 ZHNFLHYOFXQIOW-AHSOWCEXSA-N 0.000 description 1
- MISZALMBODQYFT-URVXVIKDSA-N 125-69-9 Chemical compound Br.C([C@@H]12)CCC[C@]11CCN(C)[C@H]2CC2=CC=C(OC)C=C21 MISZALMBODQYFT-URVXVIKDSA-N 0.000 description 1
- IUWVYVOQTFVXKL-UHFFFAOYSA-N 4-decyl-1,3-oxazolidin-2-one Chemical compound CCCCCCCCCCC1COC(=O)N1 IUWVYVOQTFVXKL-UHFFFAOYSA-N 0.000 description 1
- 206010000087 Abdominal pain upper Diseases 0.000 description 1
- 206010001540 Akathisia Diseases 0.000 description 1
- 206010002329 Aneurysm Diseases 0.000 description 1
- 200000000007 Arterial disease Diseases 0.000 description 1
- 208000006820 Arthralgia Diseases 0.000 description 1
- 102100022548 Beta-hexosaminidase subunit alpha Human genes 0.000 description 1
- 206010006542 Bulbar palsy Diseases 0.000 description 1
- 206010058019 Cancer Pain Diseases 0.000 description 1
- 241000218236 Cannabis Species 0.000 description 1
- 244000025254 Cannabis sativa Species 0.000 description 1
- 235000012766 Cannabis sativa ssp. sativa var. sativa Nutrition 0.000 description 1
- 235000012765 Cannabis sativa ssp. sativa var. spontanea Nutrition 0.000 description 1
- 208000001573 Cataplexy Diseases 0.000 description 1
- 206010065559 Cerebral arteriosclerosis Diseases 0.000 description 1
- 206010008111 Cerebral haemorrhage Diseases 0.000 description 1
- 206010008138 Cerebral venous thrombosis Diseases 0.000 description 1
- 235000001258 Cinchona calisaya Nutrition 0.000 description 1
- 208000006561 Cluster Headache Diseases 0.000 description 1
- 208000023890 Complex Regional Pain Syndromes Diseases 0.000 description 1
- 208000033001 Complex partial seizures Diseases 0.000 description 1
- 208000022540 Consciousness disease Diseases 0.000 description 1
- 239000004821 Contact adhesive Substances 0.000 description 1
- 208000020406 Creutzfeldt Jacob disease Diseases 0.000 description 1
- 208000003407 Creutzfeldt-Jakob Syndrome Diseases 0.000 description 1
- 208000010859 Creutzfeldt-Jakob disease Diseases 0.000 description 1
- 208000011231 Crohn disease Diseases 0.000 description 1
- 108010081668 Cytochrome P-450 CYP3A Proteins 0.000 description 1
- 102000004328 Cytochrome P-450 CYP3A Human genes 0.000 description 1
- 208000024254 Delusional disease Diseases 0.000 description 1
- 201000004624 Dermatitis Diseases 0.000 description 1
- 208000032131 Diabetic Neuropathies Diseases 0.000 description 1
- 206010012735 Diarrhoea Diseases 0.000 description 1
- 206010013710 Drug interaction Diseases 0.000 description 1
- 208000010228 Erectile Dysfunction Diseases 0.000 description 1
- 206010015150 Erythema Diseases 0.000 description 1
- 208000034347 Faecal incontinence Diseases 0.000 description 1
- 208000002091 Febrile Seizures Diseases 0.000 description 1
- 208000011688 Generalised anxiety disease Diseases 0.000 description 1
- 201000004311 Gilles de la Tourette syndrome Diseases 0.000 description 1
- 238000010268 HPLC based assay Methods 0.000 description 1
- 206010019196 Head injury Diseases 0.000 description 1
- 239000004831 Hot glue Substances 0.000 description 1
- 208000035154 Hyperesthesia Diseases 0.000 description 1
- 206010021639 Incontinence Diseases 0.000 description 1
- 206010061218 Inflammation Diseases 0.000 description 1
- 206010065390 Inflammatory pain Diseases 0.000 description 1
- 201000006347 Intellectual Disability Diseases 0.000 description 1
- VQTUBCCKSQIDNK-UHFFFAOYSA-N Isobutene Chemical group CC(C)=C VQTUBCCKSQIDNK-UHFFFAOYSA-N 0.000 description 1
- 208000006264 Korsakoff syndrome Diseases 0.000 description 1
- 201000006792 Lennox-Gastaut syndrome Diseases 0.000 description 1
- 208000009829 Lewy Body Disease Diseases 0.000 description 1
- 201000002832 Lewy body dementia Diseases 0.000 description 1
- 241000124008 Mammalia Species 0.000 description 1
- 208000026139 Memory disease Diseases 0.000 description 1
- 241001465754 Metazoa Species 0.000 description 1
- 208000019695 Migraine disease Diseases 0.000 description 1
- 208000034578 Multiple myelomas Diseases 0.000 description 1
- 208000007101 Muscle Cramp Diseases 0.000 description 1
- 206010028391 Musculoskeletal Pain Diseases 0.000 description 1
- 206010028813 Nausea Diseases 0.000 description 1
- 206010028980 Neoplasm Diseases 0.000 description 1
- 201000004404 Neurofibroma Diseases 0.000 description 1
- 208000001294 Nociceptive Pain Diseases 0.000 description 1
- 229920005987 OPPANOL® Polymers 0.000 description 1
- 206010030124 Oedema peripheral Diseases 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 208000037158 Partial Epilepsies Diseases 0.000 description 1
- 208000000609 Pick Disease of the Brain Diseases 0.000 description 1
- 206010035226 Plasma cell myeloma Diseases 0.000 description 1
- 208000000474 Poliomyelitis Diseases 0.000 description 1
- 201000004681 Psoriasis Diseases 0.000 description 1
- 208000006262 Psychological Sexual Dysfunctions Diseases 0.000 description 1
- 208000001431 Psychomotor Agitation Diseases 0.000 description 1
- 208000021811 Sandhoff disease Diseases 0.000 description 1
- 229910020175 SiOH Inorganic materials 0.000 description 1
- 206010040703 Simple partial seizures Diseases 0.000 description 1
- 206010041250 Social phobia Diseases 0.000 description 1
- 206010041349 Somnolence Diseases 0.000 description 1
- 208000005392 Spasm Diseases 0.000 description 1
- 206010066218 Stress Urinary Incontinence Diseases 0.000 description 1
- 208000027522 Sydenham chorea Diseases 0.000 description 1
- 208000022292 Tay-Sachs disease Diseases 0.000 description 1
- 208000008548 Tension-Type Headache Diseases 0.000 description 1
- 208000009205 Tinnitus Diseases 0.000 description 1
- 206010043994 Tonic convulsion Diseases 0.000 description 1
- 208000000323 Tourette Syndrome Diseases 0.000 description 1
- 208000016620 Tourette disease Diseases 0.000 description 1
- 102000004357 Transferases Human genes 0.000 description 1
- 108090000992 Transferases Proteins 0.000 description 1
- 229940123445 Tricyclic antidepressant Drugs 0.000 description 1
- 206010046543 Urinary incontinence Diseases 0.000 description 1
- 208000036142 Viral infection Diseases 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- 239000003522 acrylic cement Substances 0.000 description 1
- 239000004480 active ingredient Substances 0.000 description 1
- 208000005298 acute pain Diseases 0.000 description 1
- 238000009098 adjuvant therapy Methods 0.000 description 1
- 238000013019 agitation Methods 0.000 description 1
- 239000000556 agonist Substances 0.000 description 1
- 206010053552 allodynia Diseases 0.000 description 1
- 230000004075 alteration Effects 0.000 description 1
- 229940082992 antihypertensives mao inhibitors Drugs 0.000 description 1
- 230000036506 anxiety Effects 0.000 description 1
- 238000013459 approach Methods 0.000 description 1
- 230000006793 arrhythmia Effects 0.000 description 1
- 206010003119 arrhythmia Diseases 0.000 description 1
- 206010003246 arthritis Diseases 0.000 description 1
- 238000003556 assay Methods 0.000 description 1
- 206010003549 asthenia Diseases 0.000 description 1
- 229920005601 base polymer Polymers 0.000 description 1
- 230000036765 blood level Effects 0.000 description 1
- 238000004364 calculation method Methods 0.000 description 1
- 201000011510 cancer Diseases 0.000 description 1
- 239000004202 carbamide Substances 0.000 description 1
- 208000015114 central nervous system disease Diseases 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 238000002512 chemotherapy Methods 0.000 description 1
- 230000001055 chewing effect Effects 0.000 description 1
- 208000013116 chronic cough Diseases 0.000 description 1
- 235000019506 cigar Nutrition 0.000 description 1
- 208000018912 cluster headache syndrome Diseases 0.000 description 1
- 208000010877 cognitive disease Diseases 0.000 description 1
- 238000002648 combination therapy Methods 0.000 description 1
- 230000000052 comparative effect Effects 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 230000003111 delayed effect Effects 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 238000009792 diffusion process Methods 0.000 description 1
- 239000004205 dimethyl polysiloxane Substances 0.000 description 1
- SZXQTJUDPRGNJN-UHFFFAOYSA-N dipropylene glycol Chemical compound OCCCOCCCO SZXQTJUDPRGNJN-UHFFFAOYSA-N 0.000 description 1
- 238000004090 dissolution Methods 0.000 description 1
- 239000003937 drug carrier Substances 0.000 description 1
- 238000002651 drug therapy Methods 0.000 description 1
- 230000008030 elimination Effects 0.000 description 1
- 238000003379 elimination reaction Methods 0.000 description 1
- 230000002996 emotional effect Effects 0.000 description 1
- 201000003104 endogenous depression Diseases 0.000 description 1
- 231100000321 erythema Toxicity 0.000 description 1
- 201000006517 essential tremor Diseases 0.000 description 1
- 229960005309 estradiol Drugs 0.000 description 1
- 238000002474 experimental method Methods 0.000 description 1
- 210000000744 eyelid Anatomy 0.000 description 1
- 238000010579 first pass effect Methods 0.000 description 1
- 206010016766 flatulence Diseases 0.000 description 1
- 239000004446 fluoropolymer coating Substances 0.000 description 1
- 235000013305 food Nutrition 0.000 description 1
- 125000000524 functional group Chemical group 0.000 description 1
- 239000000499 gel Substances 0.000 description 1
- 208000029364 generalized anxiety disease Diseases 0.000 description 1
- 230000035876 healing Effects 0.000 description 1
- 229920001519 homopolymer Polymers 0.000 description 1
- 150000002430 hydrocarbons Chemical group 0.000 description 1
- 125000004435 hydrogen atom Chemical group [H]* 0.000 description 1
- 125000004356 hydroxy functional group Chemical group O* 0.000 description 1
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 1
- 239000003326 hypnotic agent Substances 0.000 description 1
- 230000000147 hypnotic effect Effects 0.000 description 1
- 230000001771 impaired effect Effects 0.000 description 1
- 201000001881 impotence Diseases 0.000 description 1
- 239000000411 inducer Substances 0.000 description 1
- 230000004968 inflammatory condition Effects 0.000 description 1
- 230000004054 inflammatory process Effects 0.000 description 1
- 206010022000 influenza Diseases 0.000 description 1
- 230000002401 inhibitory effect Effects 0.000 description 1
- 230000010354 integration Effects 0.000 description 1
- 201000005851 intracranial arteriosclerosis Diseases 0.000 description 1
- 230000000366 juvenile effect Effects 0.000 description 1
- 229960003639 laurocapram Drugs 0.000 description 1
- 229940040102 levulinic acid Drugs 0.000 description 1
- 230000007774 longterm Effects 0.000 description 1
- 210000003141 lower extremity Anatomy 0.000 description 1
- 238000007726 management method Methods 0.000 description 1
- 238000004519 manufacturing process Methods 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 238000002483 medication Methods 0.000 description 1
- 230000005906 menstruation Effects 0.000 description 1
- 229960001252 methamphetamine Drugs 0.000 description 1
- MYWUZJCMWCOHBA-VIFPVBQESA-N methamphetamine Chemical compound CN[C@@H](C)CC1=CC=CC=C1 MYWUZJCMWCOHBA-VIFPVBQESA-N 0.000 description 1
- 239000012982 microporous membrane Substances 0.000 description 1
- 206010027599 migraine Diseases 0.000 description 1
- 239000003607 modifier Substances 0.000 description 1
- 239000002899 monoamine oxidase inhibitor Substances 0.000 description 1
- 239000000178 monomer Substances 0.000 description 1
- 210000002161 motor neuron Anatomy 0.000 description 1
- 210000003205 muscle Anatomy 0.000 description 1
- 201000006938 muscular dystrophy Diseases 0.000 description 1
- 230000003274 myotonic effect Effects 0.000 description 1
- 230000008693 nausea Effects 0.000 description 1
- 229960002715 nicotine Drugs 0.000 description 1
- SNICXCGAKADSCV-UHFFFAOYSA-N nicotine Natural products CN1CCCC1C1=CC=CN=C1 SNICXCGAKADSCV-UHFFFAOYSA-N 0.000 description 1
- 150000002826 nitrites Chemical class 0.000 description 1
- 231100000344 non-irritating Toxicity 0.000 description 1
- 230000036963 noncompetitive effect Effects 0.000 description 1
- 231100000252 nontoxic Toxicity 0.000 description 1
- 230000003000 nontoxic effect Effects 0.000 description 1
- 201000003077 normal pressure hydrocephalus Diseases 0.000 description 1
- 239000003921 oil Substances 0.000 description 1
- 229960002969 oleic acid Drugs 0.000 description 1
- 229940005483 opioid analgesics Drugs 0.000 description 1
- 230000004783 oxidative metabolism Effects 0.000 description 1
- 208000019906 panic disease Diseases 0.000 description 1
- 208000002851 paranoid schizophrenia Diseases 0.000 description 1
- 230000037361 pathway Effects 0.000 description 1
- 230000002085 persistent effect Effects 0.000 description 1
- 208000022821 personality disease Diseases 0.000 description 1
- 229940124531 pharmaceutical excipient Drugs 0.000 description 1
- 239000002831 pharmacologic agent Substances 0.000 description 1
- 239000010452 phosphate Substances 0.000 description 1
- 125000002467 phosphate group Chemical group [H]OP(=O)(O[H])O[*] 0.000 description 1
- 239000000902 placebo Substances 0.000 description 1
- 229940068196 placebo Drugs 0.000 description 1
- 239000004014 plasticizer Substances 0.000 description 1
- 229920000435 poly(dimethylsiloxane) Polymers 0.000 description 1
- 229920006267 polyester film Polymers 0.000 description 1
- 229920006254 polymer film Polymers 0.000 description 1
- 235000010482 polyoxyethylene sorbitan monooleate Nutrition 0.000 description 1
- 229920000136 polysorbate Polymers 0.000 description 1
- 229920000053 polysorbate 80 Polymers 0.000 description 1
- 208000028173 post-traumatic stress disease Diseases 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- 238000012545 processing Methods 0.000 description 1
- 201000002241 progressive bulbar palsy Diseases 0.000 description 1
- 230000000750 progressive effect Effects 0.000 description 1
- 201000008752 progressive muscular atrophy Diseases 0.000 description 1
- 108090000623 proteins and genes Proteins 0.000 description 1
- 230000005997 psychological dysfunction Effects 0.000 description 1
- 208000026961 psychosexual disease Diseases 0.000 description 1
- 239000003368 psychostimulant agent Substances 0.000 description 1
- HNJBEVLQSNELDL-UHFFFAOYSA-N pyrrolidin-2-one Chemical compound O=C1CCCN1 HNJBEVLQSNELDL-UHFFFAOYSA-N 0.000 description 1
- 150000004040 pyrrolidinones Chemical class 0.000 description 1
- 229960000948 quinine Drugs 0.000 description 1
- 239000002464 receptor antagonist Substances 0.000 description 1
- 229940044551 receptor antagonist Drugs 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- DCKVNWZUADLDEH-UHFFFAOYSA-N sec-butyl acetate Chemical compound CCC(C)OC(C)=O DCKVNWZUADLDEH-UHFFFAOYSA-N 0.000 description 1
- 229940124834 selective serotonin reuptake inhibitor Drugs 0.000 description 1
- 230000001235 sensitizing effect Effects 0.000 description 1
- 208000012201 sexual and gender identity disease Diseases 0.000 description 1
- 208000015891 sexual disease Diseases 0.000 description 1
- 125000005372 silanol group Chemical group 0.000 description 1
- 231100000245 skin permeability Toxicity 0.000 description 1
- 230000000391 smoking effect Effects 0.000 description 1
- 239000002904 solvent Substances 0.000 description 1
- 241000894007 species Species 0.000 description 1
- 208000027765 speech disease Diseases 0.000 description 1
- 238000007619 statistical method Methods 0.000 description 1
- 239000000021 stimulant Substances 0.000 description 1
- 238000003860 storage Methods 0.000 description 1
- 239000000126 substance Substances 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- 230000002459 sustained effect Effects 0.000 description 1
- 230000009885 systemic effect Effects 0.000 description 1
- 150000003505 terpenes Chemical class 0.000 description 1
- 235000007586 terpenes Nutrition 0.000 description 1
- 229960003604 testosterone Drugs 0.000 description 1
- TUNFSRHWOTWDNC-HKGQFRNVSA-N tetradecanoic acid Chemical class CCCCCCCCCCCCC[14C](O)=O TUNFSRHWOTWDNC-HKGQFRNVSA-N 0.000 description 1
- 229940124597 therapeutic agent Drugs 0.000 description 1
- 239000003029 tricyclic antidepressant agent Substances 0.000 description 1
- 208000019206 urinary tract infection Diseases 0.000 description 1
- 230000009385 viral infection Effects 0.000 description 1
- 230000001755 vocal effect Effects 0.000 description 1
- 230000003442 weekly effect Effects 0.000 description 1
- 239000000080 wetting agent Substances 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/70—Web, sheet or filament bases ; Films; Fibres of the matrix type containing drug
- A61K9/7023—Transdermal patches and similar drug-containing composite devices, e.g. cataplasms
- A61K9/703—Transdermal patches and similar drug-containing composite devices, e.g. cataplasms characterised by shape or structure; Details concerning release liner or backing; Refillable patches; User-activated patches
- A61K9/7038—Transdermal patches of the drug-in-adhesive type, i.e. comprising drug in the skin-adhesive layer
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/13—Amines
- A61K31/135—Amines having aromatic rings, e.g. ketamine, nortriptyline
- A61K31/137—Arylalkylamines, e.g. amphetamine, epinephrine, salbutamol, ephedrine or methadone
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/47—Quinolines; Isoquinolines
- A61K31/4709—Non-condensed quinolines and containing further heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/47—Quinolines; Isoquinolines
- A61K31/485—Morphinan derivatives, e.g. morphine, codeine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/47—Quinolines; Isoquinolines
- A61K31/49—Cinchonan derivatives, e.g. quinine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/70—Web, sheet or filament bases ; Films; Fibres of the matrix type containing drug
- A61K9/7023—Transdermal patches and similar drug-containing composite devices, e.g. cataplasms
- A61K9/703—Transdermal patches and similar drug-containing composite devices, e.g. cataplasms characterised by shape or structure; Details concerning release liner or backing; Refillable patches; User-activated patches
- A61K9/7038—Transdermal patches of the drug-in-adhesive type, i.e. comprising drug in the skin-adhesive layer
- A61K9/7046—Transdermal patches of the drug-in-adhesive type, i.e. comprising drug in the skin-adhesive layer the adhesive comprising macromolecular compounds
- A61K9/7053—Transdermal patches of the drug-in-adhesive type, i.e. comprising drug in the skin-adhesive layer the adhesive comprising macromolecular compounds obtained by reactions only involving carbon to carbon unsaturated bonds, e.g. polyvinyl, polyisobutylene, polystyrene
- A61K9/7061—Polyacrylates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/70—Web, sheet or filament bases ; Films; Fibres of the matrix type containing drug
- A61K9/7023—Transdermal patches and similar drug-containing composite devices, e.g. cataplasms
- A61K9/703—Transdermal patches and similar drug-containing composite devices, e.g. cataplasms characterised by shape or structure; Details concerning release liner or backing; Refillable patches; User-activated patches
- A61K9/7038—Transdermal patches of the drug-in-adhesive type, i.e. comprising drug in the skin-adhesive layer
- A61K9/7046—Transdermal patches of the drug-in-adhesive type, i.e. comprising drug in the skin-adhesive layer the adhesive comprising macromolecular compounds
- A61K9/7069—Transdermal patches of the drug-in-adhesive type, i.e. comprising drug in the skin-adhesive layer the adhesive comprising macromolecular compounds obtained otherwise than by reactions only involving carbon to carbon unsaturated bonds, e.g. polysiloxane, polyesters, polyurethane, polyethylene oxide
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2300/00—Mixtures or combinations of active ingredients, wherein at least one active ingredient is fully defined in groups A61K31/00 - A61K41/00
Landscapes
- Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Veterinary Medicine (AREA)
- Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Epidemiology (AREA)
- Dermatology (AREA)
- Emergency Medicine (AREA)
- Biomedical Technology (AREA)
- Neurology (AREA)
- Neurosurgery (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Organic Chemistry (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicinal Preparation (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
Abstract
Description
本出願は、2017年10月4日出願の米国仮出願第62/568,028号及び2018年6月4日出願の同第62/680,182号の利益を主張するものであり、そのそれぞれの内容は参照によりその全体が本明細書に組み込まれる。
種々の実施形態では、本発明は一般に、例えば神経疾患などの疾患または障害の処置に使用するための、デキストロメトルファンを含む経皮送達デバイス、及びその調製方法及び使用に関する。
経皮投与の予測不可能性は、悪評が高い。発明者の経験では、テストステロンは、促進剤なしで、ベータエストラジオールよりも3桁高い速度で経皮的に送達することができる。構造上及び計算されたLogPにより、これらの化合物は非常に類似しているため、この違いを予測することはできなかった。2017年10月4日出願の米国仮出願第62/568,028号を参照のこと、その内容は、参照によりその全体が組み込まれている。
本開示のある種の実施形態は、デキストロメトルファンを含む新規経皮送達デバイスを目的とする。
いくつかの実施形態では、リザーバ層を、本明細書の経皮送達デバイスに任意に含めることができる。例えば、高い1日用量及び/または長期間(例えば、1日以上)の適用のために、リザーバ層は、使用者にデキストロメトルファンのより持続的なフラックスを提供することができる。
実施例セクションにおいて詳述されるように、接着剤成分を変えることは、デキストロメトルファンを含む経皮送達デバイスのフラックス特性に影響を与え得る。したがって、いくつかの実施形態では、本開示は、接着剤層を含み、接着剤層が2つ以上の接着剤を含む経皮送達デバイスも提供する。典型的には、接着剤層は、2つ以上の接着剤中に分散したデキストロメトルファンを含む。
皮膚透過促進剤(経皮促進剤)は、皮膚を通るデキストロメトルファンの皮膚透過性を増強することができ、本明細書の経皮送達デバイス中に任意に含めることができる。種々の皮膚透過促進剤を挙げることができる。非限定的であり有用な皮膚透過促進剤としては、例えば、スルホキシド(例えば、ジメチルスルホキシド、DMSO)、アゾン(Azone)(例えば、ラウロカプラム)、ピロリドン(例えば、2−ピロリドン、2P)、アルコール及びアルカノール(例えば、エタノールまたはデカノール)、エステル、グリコール(例えば、プロピレングリコール(PG))、界面活性剤(例えば、Tween 80)、テルペン、ならびにそれらの組合せが挙げられる。例えば、Williams et al., Adv Drug Deliv Rev. 27;56(5):603−18 (2004)を参照のこと。いくつかの実施形態では、透過促進剤は、スルホキシド、アルコール、アルカノール、エステル、グリコール、及び界面活性剤から選択される1つまたは複数の化合物を含む。いくつかの実施形態では、透過促進剤は、ジメチルスルホキシド(DMSO)、オレイン酸アルコール、オレイン酸オレイル、オレイン酸、レブリン酸、他の脂肪酸及び脂肪酸エステル、プロピレングリコール、ジプロピレングリコール、エタノール、ならびにTween 80などの界面活性剤から選択される1つまたは複数の化合物を含む。いくつかの実施形態では、経皮デバイスは、DMSO、N−メチル−2−ピロリドン、アゾン、ミリスチン酸、セスキテルペン油、4−デシルオキサゾリジン−2−オン、尿素などから選択される1つまたは複数の化合物を含むことができる。いくつかの実施形態では、皮膚透過促進剤は、ミリスチン酸イソプロピル、オレイン酸オレイル、オレイン酸、モノオレイン酸グリセロール、炭素鎖長がC12〜C18の他の脂肪酸及び脂肪酸エステル、ならびにそれらの組合せから選択される。いくつかの特定の実施形態では、皮膚透過促進剤はミリスチン酸イソプロピルである。
いくつかの実施形態では、本明細書の経皮送達デバイスは、例えば、ヒトの死体皮膚を使用してインビトロで試験した場合、ある種のインビトロデキストロメトルファンフラックスプロファイルを提供するように構成される。例えば、いくつかの実施形態では、本明細書の経皮送達デバイスのいずれかは、ヒトの死体皮膚を使用してインビトロで試験した場合、1)適用24時間後に、少なくとも約200ug/cm2(ugはマイクログラムを指す)(例えば、約200ug/cm2〜約2000ug/cm2)の透過した平均累積デキストロメトルファン;及び/または、2)ヒトの死体皮膚を使用してインビトロで試験した場合、適用8時間〜24時間後に、少なくとも約5ug/cm2*h(例えば、約5ug/cm2*h〜約20ug/cm2*h、約10ug/cm2*h〜約18ug/cm2*h)のデキストロメトルファンの平均フラックス、を提供するように構成され得る。
いくつかの実施形態では、経皮送達デバイスは、異なる放出速度を有する2つの異なるゾーンを含むことができる。
種々の実施形態では、本発明は、例えば、デキストロメトルファンを、それを必要とする対象、例えば、本明細書に記載の疾患または障害に罹患している対象に投与するために、本明細書に記載の経皮送達デバイスまたは医薬組成物を使用する方法を提供する。
デキストロメトルファンは、様々な疾患または障害の処置に有用であることが知られている。例えば、Nguyen, L. et al., Pharmacology & Therapeutics 159:1022 (2016)を参照のこと。したがって、いくつかの実施形態では、本開示はまた、疾患または障害の処置を必要とする対象における疾患または障害を処置する方法を目的とする。いくつかの実施形態では、方法は、治療有効量のデキストロメトルファンを対象に経皮投与することを含む。いくつかの実施形態では、投与は、経皮送達デバイスを対象の皮膚に適用することを含む。いくつかの実施形態では、投与により、本明細書に記載のPKプロファイルがもたらされる。いくつかの実施形態では、対象は咳に罹患しておらず、及び/または鎮咳剤を必要としていない。いくつかの実施形態では、対象はデキストロメトルファンの高代謝群である。いくつかの実施形態では、対象はデキストロメトルファンの低代謝群である。いくつかの実施形態では、対象は、例えばQTc延長を伴い、キニジンに対して感受性であるか、またはそうでなければ不耐性である。
いくつかの実施形態では、本明細書の方法は、デキストロメトルファン以外の活性剤を対象に投与することをさらに含むことができる。例えば、いくつかの実施形態では、方法は、対象に抗うつ薬を投与することをさらに含む。いくつかの実施形態では、抗うつ薬は、ブプロピオン、ヒドロキシブプロピオン、エリスロヒドロキシブプロピオン、トレオヒドロキシブプロピオン、これらの化合物のいずれかの代謝物またはプロドラッグ、及びそれらの組合せから選択される。他の好適な抗うつ薬は、例えば、その内容全体が参照により組み込まれている、米国特許第9,861,595号に記載されている。いくつかの実施形態では、方法は、対象にキニジンを投与することをさらに含む。いくつかの実施形態では、方法は、対象にCYP2D6阻害剤を投与することをさらに含む。いくつかの実施形態では、本明細書に記載の方法は、アムロジピン、カプサイシノイド(例えば、カプサイシンまたはそのエステル)、オピオイド作動薬(例えば、μ−オピエート鎮痛剤(例えば、トラマドール))、アデノシン作動性(adenosinergic)作動薬、3−(3−ジメチルアミノ−1−エチル−2−メチル−プロピル)−フェノール、ガバペンチン、及びそれらの薬学的に許容される塩から選択される1つまたは複数の追加の活性剤を対象に投与することをさらに含む。これらの追加の薬剤を、同時にまたは順次に投与することができる。さらに、これらの追加の薬剤を、同じかまたは異なる経路を介して、投与することができる。例えば、いくつかの実施形態では、追加の薬剤を、経皮投与または経口投与することができる。しかし、いくつかの実施形態では、追加の薬剤は、同じ経皮送達デバイス内でデキストロメトルファンと組み合わせることもできる。
本明細書で使用する場合、本発明に関連する量を修飾する「約」という用語は、例えば、日常的な試験及び取り扱いを通じて;そのような試験及び処理における不注意によるエラーを通じて;本発明にて使用される成分/材料の製造、供給源、または純度の違いを通じて;などにより起こり得る数量における変動を指す。本明細書で使用する場合、「約」特定の値は特定の値も含み、例えば、約10%は10%を含む。「約」という用語によって修飾されているかどうかに関係なく、特許請求の範囲は、記載量の同等物を含む。一実施形態では、「約」という用語は、報告された数値の20%以内を意味する。
例示的な実施形態A1〜55
1.a.接着剤を含み、接着剤層の約2重量%〜約12重量%の量で前記接着剤中に分散したデキストロメトルファンを任意に含む前記接着剤層と;
b.リザーバ層の少なくとも10重量%(例えば、約20重量%〜約60重量%)の量のデキストロメトルファンを含む前記リザーバ層と、を含む経皮送達デバイス。
1.デキストロメトルファンを、それを必要とするヒト対象に投与する方法であって、デキストロメトルファンを含む経皮送達デバイスを前記対象の皮膚に1日1回適用することを含み、前記適用により、前記ヒト対象における以下の薬物動態プロファイル:
a.適用1日後で、少なくとも約3ng/ml(例えば、約3ng/ml〜約12ng/ml)のデキストロメトルファンの平均Cmax;
b.適用1日後で、少なくとも約40ng*h/ml(例えば、約40ng*h/ml〜約150ng*h/ml)のデキストロメトルファンの平均AUC0−24;
c.適用1日後で、約1.5以下(例えば、約1〜約1.5)のデキストロメトルファンのC24h/C12hの平均比;
d.適用1日後で、少なくとも約1.2(例えば、約1.5〜約2.5)のデキストロメトルファンのC24h/C6hの平均比;
e.適用1日後で、約0.85〜約1.3のデキストロメトルファンのC24h/C18hの平均比;
f.適用1日後で、2ng/ml以下(例えば、2ng/ml以下、1ng/ml以下、または0.5ng/ml以下)のデキストロルファンの平均Cmax;
g.適用1日後で、10ng*h/ml(例えば、10ng*h/ml以下、または5ng*h/ml以下)のデキストロルファンの平均AUC0−24;
h.適用1日後で、少なくとも約5(少なくとも約10、少なくとも約15、少なくとも約20)の、デキストロルファンのCmaxに対するデキストロメトルファンのCmaxの平均比;
i.適用1日後で、少なくとも約5(少なくとも約10、少なくとも約15、少なくとも約20、または少なくとも約25)の、デキストロルファンのAUC0−24に対するデキストロメトルファンのAUC0−24の平均比
のうちの1つまたは複数がもたらされる、前記方法。
a.適用7日後で、少なくとも約8ng/ml(例えば、約8ng/ml〜約20ng/ml)のデキストロメトルファンの平均Cmax;及び
b.適用7日後で、2ng/ml以下(例えば、2ng/ml以下、1ng/ml以下、または0.5ng/ml以下)のデキストロルファンの平均Cmax、
のうちの1つまたは両方がもたらされる、実施形態B1〜8のいずれか1つに記載の方法。
a.適用1日後で、少なくとも約3ng/ml(例えば、約3ng/ml〜約12ng/ml)のデキストロメトルファンの平均Cmax;
b.適用1日後で、少なくとも約40ng*h/ml(例えば、約40ng*h/ml〜約150ng*h/ml)のデキストロメトルファンの平均AUC0−24;
c.適用1日後で、約1.5以下(例えば、約1〜約1.5)のデキストロメトルファンのC24h/C12hの平均比;
d.適用1日後で、少なくとも約1.2(例えば、約1.5〜約2.5)のデキストロメトルファンのC24h/C6hの平均比;
e.適用1日後で、約0.85〜約1.3のデキストロメトルファンのC24h/C18hの平均比;
f.適用1日後で、2ng/ml以下(例えば、2ng/ml以下、1ng/ml以下、または0.5ng/ml以下)のデキストロルファンの平均Cmax;
g.適用1日後で、10ng*h/ml以下(例えば、10ng*h/ml以下、または5ng*h/ml以下)のデキストロルファンの平均AUC0−24;
h.適用1日後で、少なくとも約5(少なくとも約10、少なくとも約15、少なくとも約20)の、デキストロルファンのCmaxに対するデキストロメトルファンのCmaxの平均比;及び
i.適用1日後で、少なくとも約5(少なくとも約10、少なくとも約15、少なくとも約20、または少なくとも約25)の、デキストロルファンのAUC0−24に対するデキストロメトルファンのAUC0−24の平均比、
のうちの1つまたは複数がもたらされる、方法。
a.適用7日後で、少なくとも約8ng/ml(例えば、約8ng/ml〜約20ng/ml)のデキストロメトルファンの平均Cmax;及び
b.適用7日後で、2ng/ml以下(例えば、2ng/ml以下、1ng/ml以下、または0.5ng/ml)のデキストロルファンの平均Cmax、
のうちの1つまたは両方がさらにもたらされる、実施形態B11に記載の方法。
1.アクリレート接着剤及びシリコーン接着剤を含む接着剤中に分散したデキストロメトルファンを含む接着剤層を含み、
前記アクリレート接着剤対前記シリコーン接着剤の重量比は、約20:1〜約1:20の範囲である、
経皮送達デバイス。
前記接着剤層は、ヒトの死体皮膚を使用してインビトロで試験した場合、皮膚透過促進剤を含まないが他の点では同等の経皮送達デバイスの平均累積デキストロメトルファンよりも、少なくとも約25%(例えば、約25%、約50%、約100%、約150%、約200%、または前記記載値間の任意の範囲)高い、適用24時間後に透過した平均累積デキストロメトルファンを提供する量で、前記皮膚透過促進剤を含む、
経皮送達デバイス。
この実施例は、デキストロメトル薬物含有接着剤パッチを調整するための1つの手順を示す。デキストロメトルファン塩基は、一般に市販されている。あるいは、デキストロメトルファン塩基は、例えば、モル比1:1のNaOHを使用して、臭化水素酸デキストロメトルファンを遊離塩基に変換することによって調製することができる。
パッチからのデキストロメトルファンの経皮フラックスを、フランツ拡散セル法によりヒト死体表皮を使用して試験した。
・フランツセル組立体−Logan Instruments(6セルユニット)
・各セルには12mLの容積、1.5cmの直径のオリフィスがある。
・レセプター媒体はリン酸緩衝液(PBS)pH7.4である。
・セル温度を37℃に維持する。
・サンプリング方法:HPLCアッセイ用に1.5mLを取り、セルを空にし、未使用の媒体と交換する。
・サンプリング時点:4、8、12、24、及び48時間目
・死体皮膚を使用し、New York Fire Fighters Skin Bankから入手する。皮膚番号MM07116、白人、58歳、男性、皮膚部位:左後脚。
・媒体のアッセイ方法:HPLCベース。
製剤D0〜D2も、実施例2に記載されたのと同じプロトコルに従って、それらのインビトロフラックス特性について試験した。結果を表4に示した(図3も参照のこと)。
(表4)
この実施例は、空腹条件下で、NUEDEXTA(登録商標)(臭化水素酸デキストロメトルファン及び硫酸キニジン)カプセル、20mg/10mg(Avanir Pharmaceuticals、Inc.)に対する、15mg/24時間、試験用デキストロメトルファンパッチの比較生物学的利用能を評価するために、16人の健康な成人男性と女性対象により実施された、オープンラベル、ランダム化、2処置、2期間、2シーケンスのクロスオーバー試験に関する。この試験の16人の対象はすべて遺伝子型決定されて、CYP2D6遺伝子型を決定した。16人の対象すべてを、デキストロメトルファンの高代謝群として特徴付けることができる。例えば、Treducu A.L.D. et al. Frontiers in Pharmacology, vol. 9, Article 305 (April 2018)を参照のこと。
血液サンプルはこれらの時点で収集した(小投薬量に対して):投与前(0時間)及び投与0.5、1.0、1.5、2.0、3.0、4.0、5.0、6.0、7.0、9.0、12.0、13.0、14.0、15.0、16.0、17.0、18.0、20.0、24.0、24.5、25.0、26.0、30.0、36.0、48.0*、72.0*及び96.0*時間後(*戻りサンプル)。次に、サンプルを処理し、検証済みの分析方法を使用して、デキストロメトルファンとデキストロファンの両方の濃度を分析した。SAS(登録商標)、バージョン9.4以降を、すべての薬物動態計算及び統計計算に使用した。
この実施例では、新規な多層設計について説明する。
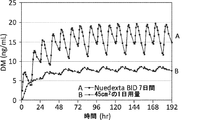
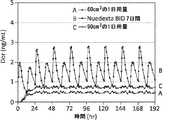
この実施例は、異なるサイズのパッチを毎日適用した後の、7日間にわたるデキストロメトルファン(DXMまたはDM)血漿プロファイル及びデキストロルファン(DOR)血漿プロファイルのシミュレーションを示している。
Claims (29)
- その必要があるヒト対象における神経疾患または神経障害を処置する方法であって、前記神経疾患または前記神経障害が、情動調節障害、うつ病、脳卒中、外傷性脳損傷、発作、疼痛、メトトレキサート神経毒性、パーキンソン病、自閉症、またはそれらの組合せであり、デキストロメトルファンを含む経皮送達デバイスを前記対象の皮膚に適用することを含み、前記適用により、前記ヒト対象における以下の薬物動態プロファイル:
a.適用1日後で、少なくとも約3ng/ml(例えば、約3ng/ml〜約12ng/ml)のデキストロメトルファンの平均Cmax;
b.適用1日後で、少なくとも約40ng*h/ml(例えば、約40ng*h/ml〜約150ng*h/ml)のデキストロメトルファンの平均AUC0−24;
c.適用1日後で、約1.5以下(例えば、約1〜約1.5)のデキストロメトルファンのC24h/C12hの平均比;
d.適用1日後で、少なくとも約1.2(例えば、約1.5〜約2.5)のデキストロメトルファンのC24h/C6hの平均比;
e.適用1日後で、約0.85〜約1.3のデキストロメトルファンのC24h/C18hの平均比;
f.適用1日後で、2ng/ml以下(例えば、2ng/ml以下、1ng/ml以下、または0.5ng/ml以下)のデキストロルファンの平均Cmax;
g.適用1日後で、10ng*h/ml以下(例えば、10ng*h/ml以下、または5ng*h/ml以下)のデキストロルファンの平均AUC0−24;
h.適用1日後で、少なくとも約5(少なくとも約10、少なくとも約15、少なくとも約20)の、デキストロルファンのCmaxに対するデキストロメトルファンのCmaxの平均比;
i.適用1日後で、少なくとも約5(少なくとも約10、少なくとも約15、少なくとも約20、または少なくとも約25)の、デキストロルファンのAUC0−24に対するデキストロメトルファンのAUC0−24の平均比
のうちの1つまたは複数がもたらされる、前記方法。 - 前記経皮送達デバイスを、1日1回適用する、請求項1に記載の方法。
- 前記経皮送達デバイスが、約5mg〜約100mgのデキストロメトルファンを含む、請求項2に記載の方法。
- 前記適用により、
a).適用1日後で、約3ng/ml〜約12ng/mlのデキストロメトルファンの平均Cmax;及び/または
b).適用1日後で、約40ng*h/ml〜約150ng*h/mlのデキストロメトルファンの平均AUC0−24
を含むPKプロファイルがもたらされる、請求項1〜3のいずれか1項に記載の方法。 - 前記適用により、
c).適用1日後で、約1〜約1.5のデキストロメトルファンのC24h/C12hの平均比;
d).適用1日後で、約1.5〜約2.5のデキストロメトルファンのC24h/C6hの平均比;及び/または
e).適用1日後で、約0.85〜約1.3のデキストロメトルファンのC24h/C18hの平均比
を含むPKプロファイルがもたらされる、請求項1〜4のいずれか1項に記載の方法。 - 前記適用により、
f).適用1日後で、2ng/ml以下のデキストロルファンの平均Cmax;及び/または
g).適用1日後で、10ng*h/ml以下のデキストロルファンの平均AUC0−24
を含むPKプロファイルがもたらされる、請求項1〜5のいずれか1項に記載の方法。 - 前記適用により、
h).適用1日後で、少なくとも約5の、デキストロルファンのCmaxに対するデキストロメトルファンのCmaxの平均比;及び/または
i).適用1日後で、少なくとも約5の、デキストロルファンのAUC0−24に対するデキストロメトルファンのAUC0−24の平均比
を含むPKプロファイルがもたらされる、請求項1〜6のいずれか1項に記載の方法。 - 前記適用により、
1)適用1日後に測定した場合、20mgのデキストロメトルファンと10mgのキニジンとの組合せを1日に2回、前記ヒト対象に経口投与することから観察されるデキストロメトルファンの平均Cmaxの少なくとも約30%(例えば、約30%〜約80%)のデキストロメトルファンの平均Cmax;及び/または
2)適用1日後に測定した場合、20mgのデキストロメトルファンと10mgのキニジンとの組合せを1日に2回、前記ヒト対象に経口投与することから観察されるデキストロメトルファンの平均AUC0−24の少なくとも約30%(例えば、約30%〜約80%)のデキストロメトルファンの平均AUC0−24
がもたらされる、請求項1〜7のいずれか一項に記載の方法。 - 前記適用により、
1)適用1日後に測定した場合、20mgのデキストロメトルファンと10mgのキニジンとの組合せを1日に2回、前記ヒト対象に経口投与することから観察されるデキストロルファンの平均Cmaxの約50%以下(例えば、約10%〜約30%)のデキストロルファンの平均Cmax;及び/または
2)適用1日後に測定した場合、20mgのデキストロメトルファンと10mgのキニジンとの組合せを1日に2回、前記ヒト対象に経口投与することから観察されるデキストロルファンの平均AUC0−24の約50%以下(例えば、約10%〜約30%)のデキストロルファンの平均AUC0−24
がもたらされる、請求項1〜8のいずれか1項に記載の方法。 - 前記経皮送達デバイスを、最長7日間の期間または少なくとも7日間または任意の所望の期間、1日に1回適用することを含み、前記適用により、前記ヒト対象における以下の薬物動態プロファイル:
a.適用7日後で、少なくとも約8ng/ml(例えば、約8ng/ml〜約20ng/ml)のデキストロメトルファンの平均Cmax;及び
b.適用7日後で、2ng/ml以下(例えば、2ng/ml以下、1ng/ml以下、または0.5ng/ml以下)のデキストロルファンの平均Cmax
のうちの一方または両方がもたらされる、請求項1〜9のいずれか1項に記載の方法。 - 前記経皮送達デバイスを、週に1回、週に2回、週に3回、週に4回、週に5回、または週に6回適用する、請求項1に記載の方法。
- 前記経皮送達デバイスが、約50mg〜約700mgのデキストロメトルファンを含む、請求項11に記載の方法。
- 前記適用により、
a).適用1日後で、約3ng/ml〜約12ng/mlのデキストロメトルファンの平均Cmax;及び/または
b).適用1日後で、約40ng*h/ml〜約150ng*h/mlのデキストロメトルファンの平均AUC0−24
を含むPKプロファイルがもたらされる、請求項11〜12のいずれか1項に記載の方法。 - 前記適用により、
c).適用1日後で、約1〜約1.5のデキストロメトルファンのC24h/C12hの平均比;
d).適用1日後で、約1.5〜約2.5のデキストロメトルファンのC24h/C6hの平均比;及び/または
e).適用1日後で、約0.85〜約1.3のデキストロメトルファンのC24h/C18hの平均比
を含むPKプロファイルがもたらされる、請求項11〜13のいずれか1項に記載の方法。 - 前記適用により、
f).適用1日後で、2ng/ml以下のデキストロルファンの平均Cmax;及び/または
g).適用1日後で、10ng*h/ml以下のデキストロルファンの平均AUC0−24
を含むPKプロファイルがもたらされる、請求項11〜14のいずれか1項に記載の方法。 - 前記適用により、
h).適用1日後で、少なくとも約5の、デキストロルファンのCmaxに対するデキストロメトルファンのCmaxの平均比;及び/または
i).適用1日後で、少なくとも約5の、デキストロルファンのAUC0−24に対するデキストロメトルファンのAUC0−24の平均比
を含むPKプロファイルがもたらされる、請求項11〜15のいずれか1項に記載の方法。 - 前記適用により、前記ヒト対象における以下の薬物動態プロファイル:
a.適用7日後で、少なくとも約8ng/ml(例えば、約8ng/ml〜約20ng/ml)のデキストロメトルファンの平均Cmax;及び
b.適用7日後で、2ng/ml以下(例えば、2ng/ml以下、1ng/ml以下、または0.5ng/ml以下)のデキストロルファンの平均Cmax
のうちの一方または両方がさらにもたらされる、請求項11〜16のいずれか1項に記載の方法。 - 前記適用により、
1)適用7日後に測定した場合、20mgのデキストロメトルファンと10mgのキニジンとの組合せを1日に2回、7日間、前記ヒト対象に経口投与することから観察されるデキストロメトルファンの平均Cmaxの少なくとも約30%(例えば、約30%〜約80%)のデキストロメトルファンの平均Cmax;及び/または
適用7日後に測定した場合、20mgのデキストロメトルファンと10mgのキニジンとの組合せを1日に2回、7日間、前記ヒト対象に経口投与することから観察されるデキストロメトルファンの平均AUC0−24の少なくとも約30%(例えば、約30%〜約80%)のデキストロメトルファンの平均AUC0−24
がもたらされる、請求項11〜17のいずれか1項に記載の方法。 - 前記適用により、
1)適用7日後に測定した場合、20mgのデキストロメトルファンと10mgのキニジンとの組合せを1日に2回、7日間、前記ヒト対象に経口投与することから観察されるデキストロルファンの平均Cmaxの約50%以下(例えば、約10%〜約30%)のデキストロルファンの平均Cmax;及び/または
2)適用7日後に測定した場合、20mgのデキストロメトルファンと10mgのキニジンとの組合せを1日に2回、7日間、前記ヒト対象に経口投与することから観察されるデキストロルファンの平均AUC0−24の約50%以下(例えば、約10%〜約30%)のデキストロルファンの平均AUC0−24
がもたらされる、請求項11〜18のいずれか1項に記載の方法。 - 前記ヒト対象が咳に罹患しておらず、及び/または鎮咳薬を必要としていない、請求項1〜19のいずれか1項に記載の方法。
- 前記ヒト対象が、高代謝群として特徴付けられる、請求項1〜20のいずれか1項に記載の方法。
- 前記ヒト対象にキニジンを投与しない、請求項1〜21のいずれか1項に記載の方法。
- 前記ヒト対象に、デシプラミン、パロキセチン、チオリダジン、ピモジド、ジゴキシン、アタザナビル、クラリスロマイシン、インジナビル、イトラコナゾール、ケトコナゾール、及びそれらの組合せのいずれも投与しない、請求項1〜22のいずれか1項に記載の方法。
- 前記ヒト対象に、ブプロピオン、ヒドロキシブプロピオン、エリスロヒドロキシブプロピオン、トレオヒドロキシブプロピオン、これらの化合物のいずれかの代謝物またはプロドラッグ、及びそれらの組合せから選択される、抗うつ薬をさらに投与する、請求項1〜23のいずれか1項に記載の方法。
- 接着剤を含む接着剤層であって、前記接着剤層の約2重量%〜約12重量%の量で前記接着剤に分散したデキストロメトルファンを任意に含む、前記接着剤層と;
リザーバ層であって、前記リザーバ層の少なくとも10重量%(例えば、約20%〜約60%)の量のデキストロメトルファンを含む、前記リザーバ層と
を含む、経皮送達デバイス。 - アクリレート接着剤及びシリコーン接着剤を含む接着剤中に分散したデキストロメトルファンを含む接着剤層を含む経皮送達デバイスであって、前記アクリレート接着剤対前記シリコーン接着剤の重量比は、約20:1〜約1:20の範囲である、前記経皮送達デバイス。
- 接着剤中に分散したデキストロメトルファンを含む接着剤層を含む経皮送達デバイスであって、前記接着剤層は、ヒトの死体皮膚を使用してインビトロで試験した場合、皮膚透過促進剤を含まないが他の点では同等の経皮送達デバイスの平均累積デキストロメトルファンよりも、少なくとも約25%(例えば、約25%、約50%、約100%、約150%、約200%、または記載値間の任意の範囲)高い、適用24時間後に透過した平均累積デキストロメトルファンを提供する量で、前記皮膚透過促進剤を含む、前記経皮送達デバイス。
- デキストロメトルファンを、それを必要とする対象に投与する方法であって、
経皮送達デバイスを、前記対象の皮膚に適用することを含み、
前記経皮送達デバイスは接着剤層を含み、前記接着剤層は、接着剤中に分散したデキストロメトルファンと、皮膚透過促進剤とを含み、
前記皮膚透過促進剤は、前記適用により、前記皮膚透過促進剤を含まないが他の点では同等の経皮送達デバイスを適用してもたらされる平均累積デキストロメトルファンよりも、少なくとも約25%(例えば、約25%、約50%、約100%、約150%、約200%、または記載値間の任意の範囲)高い、適用24時間後に透過した平均累積デキストロメトルファンがもたらされる量である、
前記方法。 - デキストロメトルファンを、それを必要とする対象に投与する方法であって、
経皮送達デバイスを、前記対象の皮膚に適用することを含み、
前記経皮送達デバイスは、前記適用により、約2mg/日〜約50mg/日のデキストロメトルファンを前記対象に経皮送達するようなフラックス特性を有するように構成される、
前記方法。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2023136898A JP2023159366A (ja) | 2017-10-04 | 2023-08-25 | デキストロメトルファン経皮送達デバイス |
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201762568028P | 2017-10-04 | 2017-10-04 | |
| US62/568,028 | 2017-10-04 | ||
| US201862680182P | 2018-06-04 | 2018-06-04 | |
| US62/680,182 | 2018-06-04 | ||
| PCT/US2018/054178 WO2019070864A1 (en) | 2017-10-04 | 2018-10-03 | DEVICE FOR TRANSDERMAL DEXTROMETHORPHAN DELIVERY |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2023136898A Division JP2023159366A (ja) | 2017-10-04 | 2023-08-25 | デキストロメトルファン経皮送達デバイス |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2020536953A true JP2020536953A (ja) | 2020-12-17 |
| JP2020536953A5 JP2020536953A5 (ja) | 2021-11-04 |
Family
ID=65994772
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2020540680A Pending JP2020536953A (ja) | 2017-10-04 | 2018-10-03 | デキストロメトルファン経皮送達デバイス |
| JP2023136898A Pending JP2023159366A (ja) | 2017-10-04 | 2023-08-25 | デキストロメトルファン経皮送達デバイス |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2023136898A Pending JP2023159366A (ja) | 2017-10-04 | 2023-08-25 | デキストロメトルファン経皮送達デバイス |
Country Status (12)
| Country | Link |
|---|---|
| US (2) | US11382869B2 (ja) |
| EP (1) | EP3691641A4 (ja) |
| JP (2) | JP2020536953A (ja) |
| KR (1) | KR20200062254A (ja) |
| CN (1) | CN111343980B (ja) |
| AU (1) | AU2018345723A1 (ja) |
| BR (1) | BR112020006723A2 (ja) |
| CA (1) | CA3078369A1 (ja) |
| IL (1) | IL273735B1 (ja) |
| MX (1) | MX2020003044A (ja) |
| TW (1) | TWI795446B (ja) |
| WO (1) | WO2019070864A1 (ja) |
Families Citing this family (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| AU2021249031A1 (en) * | 2020-03-30 | 2022-11-10 | Shinkei Therapeutics, Inc | Transdermal delivery of dextromethorphan |
| CN117100750A (zh) * | 2020-07-20 | 2023-11-24 | 深圳信立泰药业股份有限公司 | 一种药物组合物及其应用 |
| CN113720944B (zh) * | 2021-09-30 | 2023-04-28 | 珠海润都制药股份有限公司 | 一种氢溴酸右美沙芬硫酸奎尼丁胶囊含量的检测方法 |
| WO2024077133A1 (en) * | 2022-10-06 | 2024-04-11 | Shinkei Therapeutics, Inc. | Transdermal delivery of dextromethorphan |
Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH04297415A (ja) * | 1991-03-27 | 1992-10-21 | Mitsui Petrochem Ind Ltd | 薬物投与用粘着剤 |
| JP2000509037A (ja) * | 1996-04-23 | 2000-07-18 | フアーマシア・アンド・アツプジヨン・アー・ベー | 鎮咳剤として経皮投与されるデキストロメトルファン |
| JP2009525343A (ja) * | 2006-02-03 | 2009-07-09 | アバニール・ファーマシューティカルズ | 鬱病、不安および神経変性疾患を治療するためのデキストロメトルファンおよびキニジンを含む薬剤組成物 |
| US20160038464A1 (en) * | 2012-04-16 | 2016-02-11 | Antecip Bioventures Ii Llc | Compositions and Methods Comprising Celecoxib or Related Compounds and Dextromethorphan |
| JP2016535786A (ja) * | 2013-11-05 | 2016-11-17 | アンテシップ バイオベンチャーズ トゥー エルエルシー | ブプロピオンまたは関連組成物およびデキストロメトルファンを含む組成物および方法 |
Family Cites Families (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5206248A (en) * | 1992-03-27 | 1993-04-27 | Smith Richard A | Method for reducing emotional lability |
| CN1131018C (zh) * | 1994-03-07 | 2003-12-17 | 瑟拉技术有限公司 | 含药物的粘着复合的透皮给药药贴及其制备方法 |
| TWI326214B (en) | 2002-07-17 | 2010-06-21 | Avanir Pharmaceuticals Inc | Pharmaceutical compositions comprising dextromethorphan and quinidine for the treatment of neurological disorders |
| US20060223786A1 (en) * | 2005-04-01 | 2006-10-05 | Smith David J | Transdermal pain control method and device |
| US20070248657A1 (en) * | 2006-04-25 | 2007-10-25 | Smith David J | Multi-compartment transdermal pain control device |
| EP2184986A4 (en) * | 2007-08-06 | 2010-12-15 | Trinity Lab Inc | PHARMACEUTICAL COMPOSITIONS FOR THE TREATMENT OF CHRONIC PAIN AND PAIN RELATING TO NEUROPATHY |
| EP2397159A3 (en) * | 2008-10-30 | 2012-02-22 | Concert Pharmaceuticals, Inc. | Combination of morphinan compounds and antidepressant for the treatment of intractable and chronic pain |
| KR101452788B1 (ko) * | 2009-04-24 | 2014-10-21 | 헨켈 유에스 아이피 엘엘씨 | 실리콘 아크릴 혼성 중합체-기재 접착제 |
-
2018
- 2018-10-02 TW TW107134828A patent/TWI795446B/zh active
- 2018-10-03 WO PCT/US2018/054178 patent/WO2019070864A1/en unknown
- 2018-10-03 BR BR112020006723-7A patent/BR112020006723A2/pt unknown
- 2018-10-03 US US16/753,471 patent/US11382869B2/en active Active
- 2018-10-03 KR KR1020207011696A patent/KR20200062254A/ko not_active Application Discontinuation
- 2018-10-03 AU AU2018345723A patent/AU2018345723A1/en active Pending
- 2018-10-03 JP JP2020540680A patent/JP2020536953A/ja active Pending
- 2018-10-03 CN CN201880072989.3A patent/CN111343980B/zh active Active
- 2018-10-03 MX MX2020003044A patent/MX2020003044A/es unknown
- 2018-10-03 EP EP18864063.5A patent/EP3691641A4/en active Pending
- 2018-10-03 CA CA3078369A patent/CA3078369A1/en active Pending
- 2018-10-03 IL IL273735A patent/IL273735B1/en unknown
-
2022
- 2022-07-06 US US17/858,471 patent/US20220331264A1/en not_active Abandoned
-
2023
- 2023-08-25 JP JP2023136898A patent/JP2023159366A/ja active Pending
Patent Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH04297415A (ja) * | 1991-03-27 | 1992-10-21 | Mitsui Petrochem Ind Ltd | 薬物投与用粘着剤 |
| JP2000509037A (ja) * | 1996-04-23 | 2000-07-18 | フアーマシア・アンド・アツプジヨン・アー・ベー | 鎮咳剤として経皮投与されるデキストロメトルファン |
| JP2009525343A (ja) * | 2006-02-03 | 2009-07-09 | アバニール・ファーマシューティカルズ | 鬱病、不安および神経変性疾患を治療するためのデキストロメトルファンおよびキニジンを含む薬剤組成物 |
| US20160038464A1 (en) * | 2012-04-16 | 2016-02-11 | Antecip Bioventures Ii Llc | Compositions and Methods Comprising Celecoxib or Related Compounds and Dextromethorphan |
| JP2016535786A (ja) * | 2013-11-05 | 2016-11-17 | アンテシップ バイオベンチャーズ トゥー エルエルシー | ブプロピオンまたは関連組成物およびデキストロメトルファンを含む組成物および方法 |
Also Published As
| Publication number | Publication date |
|---|---|
| US20220331264A1 (en) | 2022-10-20 |
| CN111343980A (zh) | 2020-06-26 |
| JP2023159366A (ja) | 2023-10-31 |
| EP3691641A1 (en) | 2020-08-12 |
| AU2018345723A1 (en) | 2020-04-16 |
| BR112020006723A2 (pt) | 2020-10-06 |
| RU2020115169A (ru) | 2021-11-08 |
| WO2019070864A1 (en) | 2019-04-11 |
| IL273735B1 (en) | 2024-04-01 |
| RU2020115169A3 (ja) | 2022-02-16 |
| AU2018345723A8 (en) | 2020-04-23 |
| US11382869B2 (en) | 2022-07-12 |
| TWI795446B (zh) | 2023-03-11 |
| EP3691641A4 (en) | 2021-04-07 |
| CA3078369A1 (en) | 2019-04-11 |
| IL273735A (en) | 2020-05-31 |
| US20200323788A1 (en) | 2020-10-15 |
| KR20200062254A (ko) | 2020-06-03 |
| CN111343980B (zh) | 2024-02-27 |
| TW201922232A (zh) | 2019-06-16 |
| MX2020003044A (es) | 2020-08-13 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2023519959A (ja) | デキストロメトルファンの経皮送達 | |
| US20220331264A1 (en) | Dextromethorphan transdermal delivery device | |
| JP5795264B2 (ja) | 抗認知症薬物の経皮吸収製剤 | |
| CN110913844A (zh) | 用于氯胺酮的透皮药物递送系统 | |
| US11559497B2 (en) | Transdermal drug delivery system for ketamine | |
| JP2023537675A (ja) | パーキンソン病の治療のための医薬組成物及びその治療方法 | |
| NZ301197A (en) | Transdermal formulation of xanomeline for treating alzeheimers disease | |
| JP2006525317A (ja) | 認知および記憶を改善するための組成物 | |
| EP3498272B1 (en) | Oxybutynin-containing transdermal absorption preparation | |
| EP4076382B1 (en) | Transdermal therapeutic system containing agomelatine | |
| RU2795729C2 (ru) | Устройство для трансдермальной доставки декстрометорфана | |
| Walters et al. | Dermal and Transdermal Drug Delivery Systems: An Overview and Recent Advancements | |
| US20170100481A1 (en) | Transdermal pharmaceutical compositions with reduced skin irritation | |
| Munoz | OESCLIM®: an advanced delivery system for HRT | |
| WO2024077133A1 (en) | Transdermal delivery of dextromethorphan | |
| JP2016216500A (ja) | 結晶化を阻害する保護フィルムを有する経皮治療システム(剥離ライナー | |
| TWI757253B (zh) | 普拉克索經皮貼片系統與用法 | |
| JP6978417B2 (ja) | プラミペキソール経皮送達系及びその使用 | |
| Walters et al. | 1 Dermal Drug Delivery and Transdermal Systems |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20210222 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20210922 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20210922 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20220914 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20221206 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20230314 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20230426 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20230821 |
|
| RD02 | Notification of acceptance of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7422 Effective date: 20230821 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20230822 |