JP2020517727A - 安定なカンナビノイド製剤 - Google Patents
安定なカンナビノイド製剤 Download PDFInfo
- Publication number
- JP2020517727A JP2020517727A JP2019558668A JP2019558668A JP2020517727A JP 2020517727 A JP2020517727 A JP 2020517727A JP 2019558668 A JP2019558668 A JP 2019558668A JP 2019558668 A JP2019558668 A JP 2019558668A JP 2020517727 A JP2020517727 A JP 2020517727A
- Authority
- JP
- Japan
- Prior art keywords
- cannabidiol
- formulation
- patient
- administering
- dose
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 239000000203 mixture Substances 0.000 title claims description 289
- 238000009472 formulation Methods 0.000 title claims description 285
- 229930003827 cannabinoid Natural products 0.000 title abstract description 54
- 239000003557 cannabinoid Substances 0.000 title abstract description 54
- QHMBSVQNZZTUGM-ZWKOTPCHSA-N cannabidiol Chemical compound OC1=CC(CCCCC)=CC(O)=C1[C@H]1[C@H](C(C)=C)CCC(C)=C1 QHMBSVQNZZTUGM-ZWKOTPCHSA-N 0.000 claims abstract description 310
- ZTGXAWYVTLUPDT-UHFFFAOYSA-N cannabidiol Natural products OC1=CC(CCCCC)=CC(O)=C1C1C(C(C)=C)CC=C(C)C1 ZTGXAWYVTLUPDT-UHFFFAOYSA-N 0.000 claims abstract description 309
- 229950011318 cannabidiol Drugs 0.000 claims abstract description 306
- QHMBSVQNZZTUGM-UHFFFAOYSA-N Trans-Cannabidiol Natural products OC1=CC(CCCCC)=CC(O)=C1C1C(C(C)=C)CCC(C)=C1 QHMBSVQNZZTUGM-UHFFFAOYSA-N 0.000 claims abstract description 305
- PCXRACLQFPRCBB-ZWKOTPCHSA-N dihydrocannabidiol Natural products OC1=CC(CCCCC)=CC(O)=C1[C@H]1[C@H](C(C)C)CCC(C)=C1 PCXRACLQFPRCBB-ZWKOTPCHSA-N 0.000 claims abstract description 305
- 238000000034 method Methods 0.000 claims abstract description 216
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 claims description 102
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 claims description 72
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 claims description 31
- 150000002632 lipids Chemical class 0.000 claims description 29
- 239000003981 vehicle Substances 0.000 claims description 27
- GVJHHUAWPYXKBD-IEOSBIPESA-N α-tocopherol Chemical compound OC1=C(C)C(C)=C2O[C@@](CCC[C@H](C)CCC[C@H](C)CCCC(C)C)(C)CCC2=C1C GVJHHUAWPYXKBD-IEOSBIPESA-N 0.000 claims description 24
- 208000024891 symptom Diseases 0.000 claims description 22
- WWZKQHOCKIZLMA-UHFFFAOYSA-N octanoic acid Chemical compound CCCCCCCC(O)=O WWZKQHOCKIZLMA-UHFFFAOYSA-N 0.000 claims description 20
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 claims description 19
- 229920001223 polyethylene glycol Polymers 0.000 claims description 19
- 229940068918 polyethylene glycol 400 Drugs 0.000 claims description 19
- 239000008203 oral pharmaceutical composition Substances 0.000 claims description 17
- 239000002202 Polyethylene glycol Substances 0.000 claims description 15
- 201000010769 Prader-Willi syndrome Diseases 0.000 claims description 15
- 101800000414 Corticotropin Proteins 0.000 claims description 14
- IDLFZVILOHSSID-OVLDLUHVSA-N corticotropin Chemical compound C([C@@H](C(=O)N[C@@H](CO)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC=1NC=NC=1)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)NCC(=O)N[C@@H](CCCCN)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](C(C)C)C(=O)NCC(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CC(N)=O)C(=O)NCC(=O)N[C@@H](C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CO)C(=O)N[C@@H](C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC=1C=CC=CC=1)C(O)=O)NC(=O)[C@@H](N)CO)C1=CC=C(O)C=C1 IDLFZVILOHSSID-OVLDLUHVSA-N 0.000 claims description 14
- 229960000258 corticotropin Drugs 0.000 claims description 14
- 206010021750 Infantile Spasms Diseases 0.000 claims description 13
- QAQJMLQRFWZOBN-LAUBAEHRSA-N L-ascorbyl-6-palmitate Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](O)[C@H]1OC(=O)C(O)=C1O QAQJMLQRFWZOBN-LAUBAEHRSA-N 0.000 claims description 13
- 239000011786 L-ascorbyl-6-palmitate Substances 0.000 claims description 13
- 201000006791 West syndrome Diseases 0.000 claims description 13
- 235000010385 ascorbyl palmitate Nutrition 0.000 claims description 13
- PJDFLNIOAUIZSL-UHFFFAOYSA-N vigabatrin Chemical compound C=CC(N)CCC(O)=O PJDFLNIOAUIZSL-UHFFFAOYSA-N 0.000 claims description 13
- 229960005318 vigabatrin Drugs 0.000 claims description 13
- 229940087168 alpha tocopherol Drugs 0.000 claims description 12
- 125000003976 glyceryl group Chemical group [H]C([*])([H])C(O[H])([H])C(O[H])([H])[H] 0.000 claims description 12
- 229960000984 tocofersolan Drugs 0.000 claims description 12
- 239000002076 α-tocopherol Substances 0.000 claims description 12
- 235000004835 α-tocopherol Nutrition 0.000 claims description 12
- GHVNFZFCNZKVNT-UHFFFAOYSA-N decanoic acid Chemical compound CCCCCCCCCC(O)=O GHVNFZFCNZKVNT-UHFFFAOYSA-N 0.000 claims description 9
- 235000011187 glycerol Nutrition 0.000 claims description 9
- 208000032841 Bulimia Diseases 0.000 claims description 7
- 206010006550 Bulimia nervosa Diseases 0.000 claims description 7
- 125000005456 glyceride group Chemical group 0.000 claims description 7
- 229960002446 octanoic acid Drugs 0.000 claims description 7
- 235000011803 sesame oil Nutrition 0.000 claims description 7
- 239000008159 sesame oil Substances 0.000 claims description 7
- 239000005635 Caprylic acid (CAS 124-07-2) Substances 0.000 claims description 6
- GHVNFZFCNZKVNT-UHFFFAOYSA-M decanoate Chemical compound CCCCCCCCCC([O-])=O GHVNFZFCNZKVNT-UHFFFAOYSA-M 0.000 claims description 6
- 239000005632 Capric acid (CAS 334-48-5) Substances 0.000 claims description 4
- 239000000275 Adrenocorticotropic Hormone Substances 0.000 claims description 3
- 201000001913 Childhood absence epilepsy Diseases 0.000 claims description 3
- 208000003554 absence epilepsy Diseases 0.000 claims description 3
- 102100027467 Pro-opiomelanocortin Human genes 0.000 claims 1
- 239000008194 pharmaceutical composition Substances 0.000 abstract description 6
- 238000011282 treatment Methods 0.000 description 95
- CYQFCXCEBYINGO-UHFFFAOYSA-N THC Natural products C1=C(C)CCC2C(C)(C)OC3=CC(CCCCC)=CC(O)=C3C21 CYQFCXCEBYINGO-UHFFFAOYSA-N 0.000 description 76
- CYQFCXCEBYINGO-IAGOWNOFSA-N delta1-THC Chemical compound C1=C(C)CC[C@H]2C(C)(C)OC3=CC(CCCCC)=CC(O)=C3[C@@H]21 CYQFCXCEBYINGO-IAGOWNOFSA-N 0.000 description 76
- 206010010904 Convulsion Diseases 0.000 description 54
- 241000699670 Mus sp. Species 0.000 description 45
- 229960004242 dronabinol Drugs 0.000 description 42
- 230000000694 effects Effects 0.000 description 41
- 241001465754 Metazoa Species 0.000 description 38
- 239000000796 flavoring agent Substances 0.000 description 38
- XXGMIHXASFDFSM-UHFFFAOYSA-N Delta9-tetrahydrocannabinol Natural products CCCCCc1cc2OC(C)(C)C3CCC(=CC3c2c(O)c1O)C XXGMIHXASFDFSM-UHFFFAOYSA-N 0.000 description 32
- 229940079593 drug Drugs 0.000 description 32
- 239000003814 drug Substances 0.000 description 32
- GVJHHUAWPYXKBD-UHFFFAOYSA-N (±)-α-Tocopherol Chemical compound OC1=C(C)C(C)=C2OC(CCCC(C)CCCC(C)CCCC(C)C)(C)CCC2=C1C GVJHHUAWPYXKBD-UHFFFAOYSA-N 0.000 description 28
- 235000013305 food Nutrition 0.000 description 27
- 206010028980 Neoplasm Diseases 0.000 description 26
- 238000012360 testing method Methods 0.000 description 26
- 208000004296 neuralgia Diseases 0.000 description 25
- 208000021722 neuropathic pain Diseases 0.000 description 25
- 229930012538 Paclitaxel Natural products 0.000 description 22
- 239000003963 antioxidant agent Substances 0.000 description 22
- 235000006708 antioxidants Nutrition 0.000 description 22
- 239000012535 impurity Substances 0.000 description 22
- 229960001592 paclitaxel Drugs 0.000 description 22
- RCINICONZNJXQF-MZXODVADSA-N taxol Chemical compound O([C@@H]1[C@@]2(C[C@@H](C(C)=C(C2(C)C)[C@H](C([C@]2(C)[C@@H](O)C[C@H]3OC[C@]3([C@H]21)OC(C)=O)=O)OC(=O)C)OC(=O)[C@H](O)[C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)O)C(=O)C1=CC=CC=C1 RCINICONZNJXQF-MZXODVADSA-N 0.000 description 22
- 235000019634 flavors Nutrition 0.000 description 21
- 238000004458 analytical method Methods 0.000 description 20
- 238000012216 screening Methods 0.000 description 20
- 239000000243 solution Substances 0.000 description 20
- ZELUXPWDPVXUEI-ZWKOTPCHSA-N 7-hydroxycannabidiol Chemical compound OC1=CC(CCCCC)=CC(O)=C1[C@H]1[C@H](C(C)=C)CCC(CO)=C1 ZELUXPWDPVXUEI-ZWKOTPCHSA-N 0.000 description 19
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 18
- 229940065144 cannabinoids Drugs 0.000 description 18
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 18
- 229940100688 oral solution Drugs 0.000 description 18
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 17
- 235000013355 food flavoring agent Nutrition 0.000 description 17
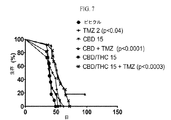
- BPEGJWRSRHCHSN-UHFFFAOYSA-N Temozolomide Chemical compound O=C1N(C)N=NC2=C(C(N)=O)N=CN21 BPEGJWRSRHCHSN-UHFFFAOYSA-N 0.000 description 16
- 230000003078 antioxidant effect Effects 0.000 description 16
- 229960004964 temozolomide Drugs 0.000 description 16
- 230000004083 survival effect Effects 0.000 description 15
- 229930003427 Vitamin E Natural products 0.000 description 14
- 235000003599 food sweetener Nutrition 0.000 description 14
- WIGCFUFOHFEKBI-UHFFFAOYSA-N gamma-tocopherol Natural products CC(C)CCCC(C)CCCC(C)CCCC1CCC2C(C)C(O)C(C)C(C)C2O1 WIGCFUFOHFEKBI-UHFFFAOYSA-N 0.000 description 14
- 230000009467 reduction Effects 0.000 description 14
- 239000002904 solvent Substances 0.000 description 14
- 239000003765 sweetening agent Substances 0.000 description 14
- 229940046009 vitamin E Drugs 0.000 description 14
- 235000019165 vitamin E Nutrition 0.000 description 14
- 239000011709 vitamin E Substances 0.000 description 14
- 102400000739 Corticotropin Human genes 0.000 description 13
- 231100000673 dose–response relationship Toxicity 0.000 description 13
- 238000011160 research Methods 0.000 description 13
- 238000003556 assay Methods 0.000 description 12
- 206010015037 epilepsy Diseases 0.000 description 12
- LXCFILQKKLGQFO-UHFFFAOYSA-N methylparaben Chemical compound COC(=O)C1=CC=C(O)C=C1 LXCFILQKKLGQFO-UHFFFAOYSA-N 0.000 description 12
- QELSKZZBTMNZEB-UHFFFAOYSA-N propylparaben Chemical compound CCCOC(=O)C1=CC=C(O)C=C1 QELSKZZBTMNZEB-UHFFFAOYSA-N 0.000 description 12
- 230000008901 benefit Effects 0.000 description 11
- 230000037396 body weight Effects 0.000 description 11
- 230000036461 convulsion Effects 0.000 description 11
- 208000035475 disorder Diseases 0.000 description 11
- 238000000537 electroencephalography Methods 0.000 description 11
- 239000003623 enhancer Substances 0.000 description 11
- 208000005017 glioblastoma Diseases 0.000 description 11
- 240000004308 marijuana Species 0.000 description 11
- 239000000055 Corticotropin-Releasing Hormone Substances 0.000 description 10
- 201000010915 Glioblastoma multiforme Diseases 0.000 description 10
- 239000002953 phosphate buffered saline Substances 0.000 description 10
- 230000035945 sensitivity Effects 0.000 description 10
- 208000011580 syndromic disease Diseases 0.000 description 10
- VTAJIXDZFCRWBR-UHFFFAOYSA-N Licoricesaponin B2 Natural products C1C(C2C(C3(CCC4(C)CCC(C)(CC4C3=CC2)C(O)=O)C)(C)CC2)(C)C2C(C)(C)CC1OC1OC(C(O)=O)C(O)C(O)C1OC1OC(C(O)=O)C(O)C(O)C1O VTAJIXDZFCRWBR-UHFFFAOYSA-N 0.000 description 9
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 9
- 239000002253 acid Substances 0.000 description 9
- 235000010323 ascorbic acid Nutrition 0.000 description 9
- 229960005070 ascorbic acid Drugs 0.000 description 9
- 239000011668 ascorbic acid Substances 0.000 description 9
- LPLVUJXQOOQHMX-UHFFFAOYSA-N glycyrrhetinic acid glycoside Natural products C1CC(C2C(C3(CCC4(C)CCC(C)(CC4C3=CC2=O)C(O)=O)C)(C)CC2)(C)C2C(C)(C)C1OC1OC(C(O)=O)C(O)C(O)C1OC1OC(C(O)=O)C(O)C(O)C1O LPLVUJXQOOQHMX-UHFFFAOYSA-N 0.000 description 9
- 239000001685 glycyrrhizic acid Substances 0.000 description 9
- 229960004949 glycyrrhizic acid Drugs 0.000 description 9
- UYRUBYNTXSDKQT-UHFFFAOYSA-N glycyrrhizic acid Natural products CC1(C)C(CCC2(C)C1CCC3(C)C2C(=O)C=C4C5CC(C)(CCC5(C)CCC34C)C(=O)O)OC6OC(C(O)C(O)C6OC7OC(O)C(O)C(O)C7C(=O)O)C(=O)O UYRUBYNTXSDKQT-UHFFFAOYSA-N 0.000 description 9
- 235000019410 glycyrrhizin Nutrition 0.000 description 9
- LPLVUJXQOOQHMX-QWBHMCJMSA-N glycyrrhizinic acid Chemical compound O([C@@H]1[C@@H](O)[C@H](O)[C@H](O[C@@H]1O[C@@H]1C([C@H]2[C@]([C@@H]3[C@@]([C@@]4(CC[C@@]5(C)CC[C@@](C)(C[C@H]5C4=CC3=O)C(O)=O)C)(C)CC2)(C)CC1)(C)C)C(O)=O)[C@@H]1O[C@H](C(O)=O)[C@@H](O)[C@H](O)[C@H]1O LPLVUJXQOOQHMX-QWBHMCJMSA-N 0.000 description 9
- 239000007924 injection Substances 0.000 description 9
- 229940090044 injection Drugs 0.000 description 9
- 238000002347 injection Methods 0.000 description 9
- 239000002207 metabolite Substances 0.000 description 9
- 239000003002 pH adjusting agent Substances 0.000 description 9
- 239000008389 polyethoxylated castor oil Substances 0.000 description 9
- 230000008685 targeting Effects 0.000 description 9
- 229960003965 antiepileptics Drugs 0.000 description 8
- 238000007917 intracranial administration Methods 0.000 description 8
- 230000007774 longterm Effects 0.000 description 8
- 229920000609 methyl cellulose Polymers 0.000 description 8
- 239000001923 methylcellulose Substances 0.000 description 8
- 238000010984 neurological examination Methods 0.000 description 8
- 230000036470 plasma concentration Effects 0.000 description 8
- 230000000638 stimulation Effects 0.000 description 8
- OGWKCGZFUXNPDA-XQKSVPLYSA-N vincristine Chemical compound C([N@]1C[C@@H](C[C@]2(C(=O)OC)C=3C(=CC4=C([C@]56[C@H]([C@@]([C@H](OC(C)=O)[C@]7(CC)C=CCN([C@H]67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)C[C@@](C1)(O)CC)CC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-XQKSVPLYSA-N 0.000 description 8
- 229960004528 vincristine Drugs 0.000 description 8
- OGWKCGZFUXNPDA-UHFFFAOYSA-N vincristine Natural products C1C(CC)(O)CC(CC2(C(=O)OC)C=3C(=CC4=C(C56C(C(C(OC(C)=O)C7(CC)C=CCN(C67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)CN1CCC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-UHFFFAOYSA-N 0.000 description 8
- 208000001654 Drug Resistant Epilepsy Diseases 0.000 description 7
- 235000016623 Fragaria vesca Nutrition 0.000 description 7
- 235000011363 Fragaria x ananassa Nutrition 0.000 description 7
- 240000007651 Rubus glaucus Species 0.000 description 7
- 235000011034 Rubus glaucus Nutrition 0.000 description 7
- 235000009122 Rubus idaeus Nutrition 0.000 description 7
- BGNXCDMCOKJUMV-UHFFFAOYSA-N Tert-Butylhydroquinone Chemical compound CC(C)(C)C1=CC(O)=CC=C1O BGNXCDMCOKJUMV-UHFFFAOYSA-N 0.000 description 7
- 238000010241 blood sampling Methods 0.000 description 7
- 150000001875 compounds Chemical class 0.000 description 7
- DWAFYCQODLXJNR-BNTLRKBRSA-L oxaliplatin Chemical compound O1C(=O)C(=O)O[Pt]11N[C@@H]2CCCC[C@H]2N1 DWAFYCQODLXJNR-BNTLRKBRSA-L 0.000 description 7
- 229960001756 oxaliplatin Drugs 0.000 description 7
- 239000012071 phase Substances 0.000 description 7
- 239000003755 preservative agent Substances 0.000 description 7
- 230000009885 systemic effect Effects 0.000 description 7
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 6
- 206010006187 Breast cancer Diseases 0.000 description 6
- 208000026310 Breast neoplasm Diseases 0.000 description 6
- 206010064012 Central pain syndrome Diseases 0.000 description 6
- 206010008342 Cervix carcinoma Diseases 0.000 description 6
- 206010014733 Endometrial cancer Diseases 0.000 description 6
- 206010014759 Endometrial neoplasm Diseases 0.000 description 6
- 240000009088 Fragaria x ananassa Species 0.000 description 6
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 6
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 6
- ILRKKHJEINIICQ-OOFFSTKBSA-N Monoammonium glycyrrhizinate Chemical compound N.O([C@@H]1[C@@H](O)[C@H](O)[C@H](O[C@@H]1O[C@H]1CC[C@]2(C)[C@H]3C(=O)C=C4[C@@H]5C[C@](C)(CC[C@@]5(CC[C@@]4(C)[C@]3(C)CC[C@H]2C1(C)C)C)C(O)=O)C(O)=O)[C@@H]1O[C@H](C(O)=O)[C@@H](O)[C@H](O)[C@H]1O ILRKKHJEINIICQ-OOFFSTKBSA-N 0.000 description 6
- 206010033128 Ovarian cancer Diseases 0.000 description 6
- 206010061535 Ovarian neoplasm Diseases 0.000 description 6
- CWRVKFFCRWGWCS-UHFFFAOYSA-N Pentrazole Chemical compound C1CCCCC2=NN=NN21 CWRVKFFCRWGWCS-UHFFFAOYSA-N 0.000 description 6
- ZTHYODDOHIVTJV-UHFFFAOYSA-N Propyl gallate Chemical compound CCCOC(=O)C1=CC(O)=C(O)C(O)=C1 ZTHYODDOHIVTJV-UHFFFAOYSA-N 0.000 description 6
- 239000006146 Roswell Park Memorial Institute medium Substances 0.000 description 6
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 6
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 6
- 231100000288 TD50 Toxicity 0.000 description 6
- 208000006105 Uterine Cervical Neoplasms Diseases 0.000 description 6
- 230000002411 adverse Effects 0.000 description 6
- 150000003863 ammonium salts Chemical group 0.000 description 6
- 230000006399 behavior Effects 0.000 description 6
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 6
- 210000004369 blood Anatomy 0.000 description 6
- 239000008280 blood Substances 0.000 description 6
- 210000004027 cell Anatomy 0.000 description 6
- 201000010881 cervical cancer Diseases 0.000 description 6
- 201000010099 disease Diseases 0.000 description 6
- 230000009246 food effect Effects 0.000 description 6
- 235000021471 food effect Nutrition 0.000 description 6
- 238000005259 measurement Methods 0.000 description 6
- 235000010270 methyl p-hydroxybenzoate Nutrition 0.000 description 6
- 239000004292 methyl p-hydroxybenzoate Substances 0.000 description 6
- 229960002216 methylparaben Drugs 0.000 description 6
- 208000028173 post-traumatic stress disease Diseases 0.000 description 6
- 235000010232 propyl p-hydroxybenzoate Nutrition 0.000 description 6
- 239000004405 propyl p-hydroxybenzoate Substances 0.000 description 6
- 229960003415 propylparaben Drugs 0.000 description 6
- 239000011780 sodium chloride Substances 0.000 description 6
- 210000002700 urine Anatomy 0.000 description 6
- YCBKSSAWEUDACY-IAGOWNOFSA-N 11-hydroxy-Delta(9)-tetrahydrocannabinol Chemical compound C1=C(CO)CC[C@H]2C(C)(C)OC3=CC(CCCCC)=CC(O)=C3[C@@H]21 YCBKSSAWEUDACY-IAGOWNOFSA-N 0.000 description 5
- CYQFCXCEBYINGO-DLBZAZTESA-N Dronabinol Natural products C1=C(C)CC[C@H]2C(C)(C)OC3=CC(CCCCC)=CC(O)=C3[C@H]21 CYQFCXCEBYINGO-DLBZAZTESA-N 0.000 description 5
- 208000016285 Movement disease Diseases 0.000 description 5
- 208000002193 Pain Diseases 0.000 description 5
- 241000700159 Rattus Species 0.000 description 5
- 239000004376 Sucralose Substances 0.000 description 5
- 208000030886 Traumatic Brain injury Diseases 0.000 description 5
- 230000005856 abnormality Effects 0.000 description 5
- 230000001154 acute effect Effects 0.000 description 5
- LGEQQWMQCRIYKG-DOFZRALJSA-N anandamide Chemical compound CCCCC\C=C/C\C=C/C\C=C/C\C=C/CCCC(=O)NCCO LGEQQWMQCRIYKG-DOFZRALJSA-N 0.000 description 5
- 239000001961 anticonvulsive agent Substances 0.000 description 5
- LGEQQWMQCRIYKG-UHFFFAOYSA-N arachidonic acid ethanolamide Natural products CCCCCC=CCC=CCC=CCC=CCCCC(=O)NCCO LGEQQWMQCRIYKG-UHFFFAOYSA-N 0.000 description 5
- 230000036772 blood pressure Effects 0.000 description 5
- 230000008859 change Effects 0.000 description 5
- CXOXHMZGEKVPMT-UHFFFAOYSA-N clobazam Chemical compound O=C1CC(=O)N(C)C2=CC=C(Cl)C=C2N1C1=CC=CC=C1 CXOXHMZGEKVPMT-UHFFFAOYSA-N 0.000 description 5
- 229960001403 clobazam Drugs 0.000 description 5
- 238000009826 distribution Methods 0.000 description 5
- 239000007788 liquid Substances 0.000 description 5
- 239000002609 medium Substances 0.000 description 5
- 208000033808 peripheral neuropathy Diseases 0.000 description 5
- 238000002360 preparation method Methods 0.000 description 5
- 238000011084 recovery Methods 0.000 description 5
- 235000010378 sodium ascorbate Nutrition 0.000 description 5
- PPASLZSBLFJQEF-RKJRWTFHSA-M sodium ascorbate Substances [Na+].OC[C@@H](O)[C@H]1OC(=O)C(O)=C1[O-] PPASLZSBLFJQEF-RKJRWTFHSA-M 0.000 description 5
- 229960005055 sodium ascorbate Drugs 0.000 description 5
- 239000001509 sodium citrate Substances 0.000 description 5
- NLJMYIDDQXHKNR-UHFFFAOYSA-K sodium citrate Chemical compound O.O.[Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O NLJMYIDDQXHKNR-UHFFFAOYSA-K 0.000 description 5
- PPASLZSBLFJQEF-RXSVEWSESA-M sodium-L-ascorbate Chemical compound [Na+].OC[C@H](O)[C@H]1OC(=O)C(O)=C1[O-] PPASLZSBLFJQEF-RXSVEWSESA-M 0.000 description 5
- 238000003860 storage Methods 0.000 description 5
- 235000019408 sucralose Nutrition 0.000 description 5
- BAQAVOSOZGMPRM-QBMZZYIRSA-N sucralose Chemical compound O[C@@H]1[C@@H](O)[C@@H](Cl)[C@@H](CO)O[C@@H]1O[C@@]1(CCl)[C@@H](O)[C@H](O)[C@@H](CCl)O1 BAQAVOSOZGMPRM-QBMZZYIRSA-N 0.000 description 5
- 230000009529 traumatic brain injury Effects 0.000 description 5
- 238000007492 two-way ANOVA Methods 0.000 description 5
- AOYYFUGUUIRBML-IAGOWNOFSA-N (6ar,10ar)-6,6-dimethyl-9-methylidene-3-pentyl-7,8,10,10a-tetrahydro-6ah-benzo[c]chromen-1-ol Chemical compound C1C(=C)CC[C@H]2C(C)(C)OC3=CC(CCCCC)=CC(O)=C3[C@@H]21 AOYYFUGUUIRBML-IAGOWNOFSA-N 0.000 description 4
- 208000024827 Alzheimer disease Diseases 0.000 description 4
- 208000019901 Anxiety disease Diseases 0.000 description 4
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 4
- 206010003805 Autism Diseases 0.000 description 4
- 208000020706 Autistic disease Diseases 0.000 description 4
- 208000003174 Brain Neoplasms Diseases 0.000 description 4
- VBGLYOIFKLUMQG-UHFFFAOYSA-N Cannabinol Chemical compound C1=C(C)C=C2C3=C(O)C=C(CCCCC)C=C3OC(C)(C)C2=C1 VBGLYOIFKLUMQG-UHFFFAOYSA-N 0.000 description 4
- 102000004328 Cytochrome P-450 CYP3A Human genes 0.000 description 4
- 108010081668 Cytochrome P-450 CYP3A Proteins 0.000 description 4
- 206010012335 Dependence Diseases 0.000 description 4
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 4
- GVGLGOZIDCSQPN-PVHGPHFFSA-N Heroin Chemical compound O([C@H]1[C@H](C=C[C@H]23)OC(C)=O)C4=C5[C@@]12CCN(C)[C@@H]3CC5=CC=C4OC(C)=O GVGLGOZIDCSQPN-PVHGPHFFSA-N 0.000 description 4
- 241000282412 Homo Species 0.000 description 4
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 4
- 206010071082 Juvenile myoclonic epilepsy Diseases 0.000 description 4
- 235000014766 Mentha X piperi var citrata Nutrition 0.000 description 4
- 244000007703 Mentha citrata Species 0.000 description 4
- 235000007421 Mentha citrata Nutrition 0.000 description 4
- 235000008660 Mentha x piperita subsp citrata Nutrition 0.000 description 4
- 235000002431 Monarda citriodora Nutrition 0.000 description 4
- 208000008589 Obesity Diseases 0.000 description 4
- 208000028017 Psychotic disease Diseases 0.000 description 4
- 208000006011 Stroke Diseases 0.000 description 4
- 208000026911 Tuberous sclerosis complex Diseases 0.000 description 4
- 235000009754 Vitis X bourquina Nutrition 0.000 description 4
- 235000012333 Vitis X labruscana Nutrition 0.000 description 4
- 240000006365 Vitis vinifera Species 0.000 description 4
- 235000014787 Vitis vinifera Nutrition 0.000 description 4
- 150000007513 acids Chemical class 0.000 description 4
- 230000036506 anxiety Effects 0.000 description 4
- YZXBAPSDXZZRGB-DOFZRALJSA-N arachidonic acid Chemical compound CCCCC\C=C/C\C=C/C\C=C/C\C=C/CCCC(O)=O YZXBAPSDXZZRGB-DOFZRALJSA-N 0.000 description 4
- 210000004556 brain Anatomy 0.000 description 4
- 229960003453 cannabinol Drugs 0.000 description 4
- 238000002512 chemotherapy Methods 0.000 description 4
- ZPUCINDJVBIVPJ-LJISPDSOSA-N cocaine Chemical compound O([C@H]1C[C@@H]2CC[C@@H](N2C)[C@H]1C(=O)OC)C(=O)C1=CC=CC=C1 ZPUCINDJVBIVPJ-LJISPDSOSA-N 0.000 description 4
- HCAWPGARWVBULJ-IAGOWNOFSA-N delta8-THC Chemical compound C1C(C)=CC[C@H]2C(C)(C)OC3=CC(CCCCC)=CC(O)=C3[C@@H]21 HCAWPGARWVBULJ-IAGOWNOFSA-N 0.000 description 4
- 238000003745 diagnosis Methods 0.000 description 4
- 229960002069 diamorphine Drugs 0.000 description 4
- 235000013399 edible fruits Nutrition 0.000 description 4
- 230000037406 food intake Effects 0.000 description 4
- 235000012631 food intake Nutrition 0.000 description 4
- 238000004128 high performance liquid chromatography Methods 0.000 description 4
- 230000003993 interaction Effects 0.000 description 4
- 230000000366 juvenile effect Effects 0.000 description 4
- 210000003141 lower extremity Anatomy 0.000 description 4
- 238000002483 medication Methods 0.000 description 4
- 239000008368 mint flavor Substances 0.000 description 4
- GECBBEABIDMGGL-RTBURBONSA-N nabilone Chemical compound C1C(=O)CC[C@H]2C(C)(C)OC3=CC(C(C)(C)CCCCCC)=CC(O)=C3[C@@H]21 GECBBEABIDMGGL-RTBURBONSA-N 0.000 description 4
- 229960002967 nabilone Drugs 0.000 description 4
- 230000001537 neural effect Effects 0.000 description 4
- 231100000189 neurotoxic Toxicity 0.000 description 4
- 230000002887 neurotoxic effect Effects 0.000 description 4
- 230000036407 pain Effects 0.000 description 4
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical group [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 4
- 230000002335 preservative effect Effects 0.000 description 4
- 230000004224 protection Effects 0.000 description 4
- 230000029058 respiratory gaseous exchange Effects 0.000 description 4
- CVHZOJJKTDOEJC-UHFFFAOYSA-N saccharin Chemical compound C1=CC=C2C(=O)NS(=O)(=O)C2=C1 CVHZOJJKTDOEJC-UHFFFAOYSA-N 0.000 description 4
- 235000019204 saccharin Nutrition 0.000 description 4
- 229940081974 saccharin Drugs 0.000 description 4
- 239000000901 saccharin and its Na,K and Ca salt Substances 0.000 description 4
- 201000000980 schizophrenia Diseases 0.000 description 4
- QZAYGJVTTNCVMB-UHFFFAOYSA-N serotonin Chemical compound C1=C(O)C=C2C(CCN)=CNC2=C1 QZAYGJVTTNCVMB-UHFFFAOYSA-N 0.000 description 4
- 239000011734 sodium Substances 0.000 description 4
- 229910052708 sodium Inorganic materials 0.000 description 4
- 239000004250 tert-Butylhydroquinone Substances 0.000 description 4
- 235000019281 tert-butylhydroquinone Nutrition 0.000 description 4
- 208000009999 tuberous sclerosis Diseases 0.000 description 4
- 235000019786 weight gain Nutrition 0.000 description 4
- NOOLISFMXDJSKH-UTLUCORTSA-N (+)-Neomenthol Chemical compound CC(C)[C@@H]1CC[C@@H](C)C[C@@H]1O NOOLISFMXDJSKH-UTLUCORTSA-N 0.000 description 3
- QIJRTFXNRTXDIP-UHFFFAOYSA-N (1-carboxy-2-sulfanylethyl)azanium;chloride;hydrate Chemical compound O.Cl.SCC(N)C(O)=O QIJRTFXNRTXDIP-UHFFFAOYSA-N 0.000 description 3
- IIZPXYDJLKNOIY-JXPKJXOSSA-N 1-palmitoyl-2-arachidonoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCC\C=C/C\C=C/C\C=C/C\C=C/CCCCC IIZPXYDJLKNOIY-JXPKJXOSSA-N 0.000 description 3
- 208000002874 Acne Vulgaris Diseases 0.000 description 3
- 102100026423 Adhesion G protein-coupled receptor E5 Human genes 0.000 description 3
- ATRRKUHOCOJYRX-UHFFFAOYSA-N Ammonium bicarbonate Chemical compound [NH4+].OC([O-])=O ATRRKUHOCOJYRX-UHFFFAOYSA-N 0.000 description 3
- 108010011485 Aspartame Proteins 0.000 description 3
- 208000023275 Autoimmune disease Diseases 0.000 description 3
- 239000005711 Benzoic acid Substances 0.000 description 3
- WVDDGKGOMKODPV-UHFFFAOYSA-N Benzyl alcohol Chemical class OCC1=CC=CC=C1 WVDDGKGOMKODPV-UHFFFAOYSA-N 0.000 description 3
- 235000019499 Citrus oil Nutrition 0.000 description 3
- 208000032065 Convulsion neonatal Diseases 0.000 description 3
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 3
- NOOLISFMXDJSKH-UHFFFAOYSA-N DL-menthol Natural products CC(C)C1CCC(C)CC1O NOOLISFMXDJSKH-UHFFFAOYSA-N 0.000 description 3
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 3
- 208000014094 Dystonic disease Diseases 0.000 description 3
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 3
- 208000009329 Graft vs Host Disease Diseases 0.000 description 3
- 101000718243 Homo sapiens Adhesion G protein-coupled receptor E5 Proteins 0.000 description 3
- 235000019501 Lemon oil Nutrition 0.000 description 3
- 229930195725 Mannitol Natural products 0.000 description 3
- 241000699666 Mus <mouse, genus> Species 0.000 description 3
- 206010028813 Nausea Diseases 0.000 description 3
- 235000019502 Orange oil Nutrition 0.000 description 3
- 208000018737 Parkinson disease Diseases 0.000 description 3
- 208000004983 Phantom Limb Diseases 0.000 description 3
- 206010056238 Phantom pain Diseases 0.000 description 3
- 208000037012 Psychomotor seizures Diseases 0.000 description 3
- 208000032140 Sleepiness Diseases 0.000 description 3
- 206010041250 Social phobia Diseases 0.000 description 3
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 3
- UIIMBOGNXHQVGW-DEQYMQKBSA-M Sodium bicarbonate-14C Chemical compound [Na+].O[14C]([O-])=O UIIMBOGNXHQVGW-DEQYMQKBSA-M 0.000 description 3
- 206010041349 Somnolence Diseases 0.000 description 3
- 208000007271 Substance Withdrawal Syndrome Diseases 0.000 description 3
- 229930006000 Sucrose Natural products 0.000 description 3
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 3
- 206010042458 Suicidal ideation Diseases 0.000 description 3
- 210000001744 T-lymphocyte Anatomy 0.000 description 3
- PPWHTZKZQNXVAE-UHFFFAOYSA-N Tetracaine hydrochloride Chemical compound Cl.CCCCNC1=CC=C(C(=O)OCCN(C)C)C=C1 PPWHTZKZQNXVAE-UHFFFAOYSA-N 0.000 description 3
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 3
- 238000001793 Wilcoxon signed-rank test Methods 0.000 description 3
- TVXBFESIOXBWNM-UHFFFAOYSA-N Xylitol Natural products OCCC(O)C(O)C(O)CCO TVXBFESIOXBWNM-UHFFFAOYSA-N 0.000 description 3
- 206010000496 acne Diseases 0.000 description 3
- 208000024340 acute graft versus host disease Diseases 0.000 description 3
- 239000001099 ammonium carbonate Substances 0.000 description 3
- 235000012501 ammonium carbonate Nutrition 0.000 description 3
- 239000002246 antineoplastic agent Substances 0.000 description 3
- 239000000605 aspartame Substances 0.000 description 3
- 235000010357 aspartame Nutrition 0.000 description 3
- IAOZJIPTCAWIRG-QWRGUYRKSA-N aspartame Chemical compound OC(=O)C[C@H](N)C(=O)N[C@H](C(=O)OC)CC1=CC=CC=C1 IAOZJIPTCAWIRG-QWRGUYRKSA-N 0.000 description 3
- 229960003438 aspartame Drugs 0.000 description 3
- 230000003542 behavioural effect Effects 0.000 description 3
- 235000010233 benzoic acid Nutrition 0.000 description 3
- 229960004365 benzoic acid Drugs 0.000 description 3
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 3
- 230000036760 body temperature Effects 0.000 description 3
- -1 cannabidiol Natural products 0.000 description 3
- 239000007958 cherry flavor Substances 0.000 description 3
- 208000017760 chronic graft versus host disease Diseases 0.000 description 3
- 239000010630 cinnamon oil Substances 0.000 description 3
- 229960004316 cisplatin Drugs 0.000 description 3
- DQLATGHUWYMOKM-UHFFFAOYSA-L cisplatin Chemical compound N[Pt](N)(Cl)Cl DQLATGHUWYMOKM-UHFFFAOYSA-L 0.000 description 3
- 239000010500 citrus oil Substances 0.000 description 3
- 230000002566 clonic effect Effects 0.000 description 3
- 208000028502 clonic seizure Diseases 0.000 description 3
- 206010009887 colitis Diseases 0.000 description 3
- 229960001305 cysteine hydrochloride Drugs 0.000 description 3
- 230000034994 death Effects 0.000 description 3
- 230000006735 deficit Effects 0.000 description 3
- 239000008121 dextrose Substances 0.000 description 3
- 235000005911 diet Nutrition 0.000 description 3
- 230000037213 diet Effects 0.000 description 3
- 235000014113 dietary fatty acids Nutrition 0.000 description 3
- 208000037765 diseases and disorders Diseases 0.000 description 3
- 206010013663 drug dependence Diseases 0.000 description 3
- 238000002651 drug therapy Methods 0.000 description 3
- 208000010118 dystonia Diseases 0.000 description 3
- BEFDCLMNVWHSGT-UHFFFAOYSA-N ethenylcyclopentane Chemical compound C=CC1CCCC1 BEFDCLMNVWHSGT-UHFFFAOYSA-N 0.000 description 3
- 239000000194 fatty acid Substances 0.000 description 3
- 229930195729 fatty acid Natural products 0.000 description 3
- 229960003472 felbamate Drugs 0.000 description 3
- WKGXYQFOCVYPAC-UHFFFAOYSA-N felbamate Chemical compound NC(=O)OCC(COC(N)=O)C1=CC=CC=C1 WKGXYQFOCVYPAC-UHFFFAOYSA-N 0.000 description 3
- 239000001530 fumaric acid Substances 0.000 description 3
- 229960001031 glucose Drugs 0.000 description 3
- 208000024908 graft versus host disease Diseases 0.000 description 3
- LHGVFZTZFXWLCP-UHFFFAOYSA-N guaiacol Chemical class COC1=CC=CC=C1O LHGVFZTZFXWLCP-UHFFFAOYSA-N 0.000 description 3
- 210000004209 hair Anatomy 0.000 description 3
- 230000036541 health Effects 0.000 description 3
- 210000002216 heart Anatomy 0.000 description 3
- 238000003384 imaging method Methods 0.000 description 3
- 238000011503 in vivo imaging Methods 0.000 description 3
- 238000007918 intramuscular administration Methods 0.000 description 3
- 239000007928 intraperitoneal injection Substances 0.000 description 3
- 238000001990 intravenous administration Methods 0.000 description 3
- 235000020887 ketogenic diet Nutrition 0.000 description 3
- 238000009533 lab test Methods 0.000 description 3
- 239000000787 lecithin Substances 0.000 description 3
- 235000010445 lecithin Nutrition 0.000 description 3
- 229940067606 lecithin Drugs 0.000 description 3
- 239000010501 lemon oil Substances 0.000 description 3
- FFVXQGMUHIJQAO-BFKQJKLPSA-N levonantradol Chemical compound C([C@@H](C)OC=1C=C(OC(C)=O)C=2[C@@H]3C[C@H](O)CC[C@H]3[C@H](C)NC=2C=1)CCC1=CC=CC=C1 FFVXQGMUHIJQAO-BFKQJKLPSA-N 0.000 description 3
- 229950005812 levonantradol Drugs 0.000 description 3
- 210000004072 lung Anatomy 0.000 description 3
- 230000014759 maintenance of location Effects 0.000 description 3
- 239000000594 mannitol Substances 0.000 description 3
- 235000010355 mannitol Nutrition 0.000 description 3
- 229960001855 mannitol Drugs 0.000 description 3
- 239000001525 mentha piperita l. herb oil Substances 0.000 description 3
- 239000001683 mentha spicata herb oil Substances 0.000 description 3
- 229940041616 menthol Drugs 0.000 description 3
- HEBKCHPVOIAQTA-UHFFFAOYSA-N meso ribitol Natural products OCC(O)C(O)C(O)CO HEBKCHPVOIAQTA-UHFFFAOYSA-N 0.000 description 3
- 201000006417 multiple sclerosis Diseases 0.000 description 3
- 230000002151 myoclonic effect Effects 0.000 description 3
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 3
- 230000008693 nausea Effects 0.000 description 3
- 201000001119 neuropathy Diseases 0.000 description 3
- 230000007823 neuropathy Effects 0.000 description 3
- FBUKVWPVBMHYJY-UHFFFAOYSA-N nonanoic acid Chemical compound CCCCCCCCC(O)=O FBUKVWPVBMHYJY-UHFFFAOYSA-N 0.000 description 3
- 235000020824 obesity Nutrition 0.000 description 3
- 239000003921 oil Substances 0.000 description 3
- 235000019198 oils Nutrition 0.000 description 3
- 238000001543 one-way ANOVA Methods 0.000 description 3
- 239000010502 orange oil Substances 0.000 description 3
- 235000019477 peppermint oil Nutrition 0.000 description 3
- 239000000546 pharmaceutical excipient Substances 0.000 description 3
- WVDDGKGOMKODPV-ZQBYOMGUSA-N phenyl(114C)methanol Chemical compound O[14CH2]C1=CC=CC=C1 WVDDGKGOMKODPV-ZQBYOMGUSA-N 0.000 description 3
- XAEFZNCEHLXOMS-UHFFFAOYSA-M potassium benzoate Chemical group [K+].[O-]C(=O)C1=CC=CC=C1 XAEFZNCEHLXOMS-UHFFFAOYSA-M 0.000 description 3
- 235000010388 propyl gallate Nutrition 0.000 description 3
- 239000000473 propyl gallate Substances 0.000 description 3
- 229940075579 propyl gallate Drugs 0.000 description 3
- 238000001959 radiotherapy Methods 0.000 description 3
- 230000004044 response Effects 0.000 description 3
- 238000012552 review Methods 0.000 description 3
- 230000001953 sensory effect Effects 0.000 description 3
- WXMKPNITSTVMEF-UHFFFAOYSA-M sodium benzoate Chemical compound [Na+].[O-]C(=O)C1=CC=CC=C1 WXMKPNITSTVMEF-UHFFFAOYSA-M 0.000 description 3
- 235000010234 sodium benzoate Nutrition 0.000 description 3
- 239000004299 sodium benzoate Substances 0.000 description 3
- 229960003885 sodium benzoate Drugs 0.000 description 3
- WBHQBSYUUJJSRZ-UHFFFAOYSA-M sodium bisulfate Chemical compound [Na+].OS([O-])(=O)=O WBHQBSYUUJJSRZ-UHFFFAOYSA-M 0.000 description 3
- 229910000342 sodium bisulfate Inorganic materials 0.000 description 3
- 229940100996 sodium bisulfate Drugs 0.000 description 3
- 229910000029 sodium carbonate Inorganic materials 0.000 description 3
- HRZFUMHJMZEROT-UHFFFAOYSA-L sodium disulfite Chemical compound [Na+].[Na+].[O-]S(=O)S([O-])(=O)=O HRZFUMHJMZEROT-UHFFFAOYSA-L 0.000 description 3
- 229940001584 sodium metabisulfite Drugs 0.000 description 3
- 235000010262 sodium metabisulphite Nutrition 0.000 description 3
- 229910052938 sodium sulfate Inorganic materials 0.000 description 3
- 229960003010 sodium sulfate Drugs 0.000 description 3
- 235000011152 sodium sulphate Nutrition 0.000 description 3
- 235000010199 sorbic acid Nutrition 0.000 description 3
- 239000004334 sorbic acid Substances 0.000 description 3
- 229940075582 sorbic acid Drugs 0.000 description 3
- 235000019721 spearmint oil Nutrition 0.000 description 3
- 238000012430 stability testing Methods 0.000 description 3
- 238000007920 subcutaneous administration Methods 0.000 description 3
- 239000005720 sucrose Substances 0.000 description 3
- 229960004793 sucrose Drugs 0.000 description 3
- 230000002195 synergetic effect Effects 0.000 description 3
- 238000004448 titration Methods 0.000 description 3
- 230000001988 toxicity Effects 0.000 description 3
- 231100000419 toxicity Toxicity 0.000 description 3
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 3
- 238000002562 urinalysis Methods 0.000 description 3
- 230000004584 weight gain Effects 0.000 description 3
- 239000000811 xylitol Substances 0.000 description 3
- 235000010447 xylitol Nutrition 0.000 description 3
- HEBKCHPVOIAQTA-SCDXWVJYSA-N xylitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)CO HEBKCHPVOIAQTA-SCDXWVJYSA-N 0.000 description 3
- 229960002675 xylitol Drugs 0.000 description 3
- WRIDQFICGBMAFQ-UHFFFAOYSA-N (E)-8-Octadecenoic acid Natural products CCCCCCCCCC=CCCCCCCC(O)=O WRIDQFICGBMAFQ-UHFFFAOYSA-N 0.000 description 2
- KWTSXDURSIMDCE-QMMMGPOBSA-N (S)-amphetamine Chemical compound C[C@H](N)CC1=CC=CC=C1 KWTSXDURSIMDCE-QMMMGPOBSA-N 0.000 description 2
- LQJBNNIYVWPHFW-UHFFFAOYSA-N 20:1omega9c fatty acid Natural products CCCCCCCCCCC=CCCCCCCCC(O)=O LQJBNNIYVWPHFW-UHFFFAOYSA-N 0.000 description 2
- QSBYPNXLFMSGKH-UHFFFAOYSA-N 9-Heptadecensaeure Natural products CCCCCCCC=CCCCCCCCC(O)=O QSBYPNXLFMSGKH-UHFFFAOYSA-N 0.000 description 2
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 2
- 244000025254 Cannabis sativa Species 0.000 description 2
- 235000012766 Cannabis sativa ssp. sativa var. sativa Nutrition 0.000 description 2
- 235000012765 Cannabis sativa ssp. sativa var. spontanea Nutrition 0.000 description 2
- DLGOEMSEDOSKAD-UHFFFAOYSA-N Carmustine Chemical compound ClCCNC(=O)N(N=O)CCCl DLGOEMSEDOSKAD-UHFFFAOYSA-N 0.000 description 2
- 208000022497 Cocaine-Related disease Diseases 0.000 description 2
- 208000023890 Complex Regional Pain Syndromes Diseases 0.000 description 2
- CMSMOCZEIVJLDB-UHFFFAOYSA-N Cyclophosphamide Chemical compound ClCCN(CCCl)P1(=O)NCCCO1 CMSMOCZEIVJLDB-UHFFFAOYSA-N 0.000 description 2
- UHDGCWIWMRVCDJ-CCXZUQQUSA-N Cytarabine Chemical compound O=C1N=C(N)C=CN1[C@H]1[C@@H](O)[C@H](O)[C@@H](CO)O1 UHDGCWIWMRVCDJ-CCXZUQQUSA-N 0.000 description 2
- 206010012735 Diarrhoea Diseases 0.000 description 2
- 241000004297 Draba Species 0.000 description 2
- 201000007547 Dravet syndrome Diseases 0.000 description 2
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 2
- 241000196324 Embryophyta Species 0.000 description 2
- GHASVSINZRGABV-UHFFFAOYSA-N Fluorouracil Chemical compound FC1=CNC(=O)NC1=O GHASVSINZRGABV-UHFFFAOYSA-N 0.000 description 2
- 244000307700 Fragaria vesca Species 0.000 description 2
- 208000032612 Glial tumor Diseases 0.000 description 2
- 206010018338 Glioma Diseases 0.000 description 2
- 208000002927 Hamartoma Diseases 0.000 description 2
- 241000725303 Human immunodeficiency virus Species 0.000 description 2
- FBOZXECLQNJBKD-ZDUSSCGKSA-N L-methotrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FBOZXECLQNJBKD-ZDUSSCGKSA-N 0.000 description 2
- 201000006792 Lennox-Gastaut syndrome Diseases 0.000 description 2
- GQYIWUVLTXOXAJ-UHFFFAOYSA-N Lomustine Chemical compound ClCCN(N=O)C(=O)NC1CCCCC1 GQYIWUVLTXOXAJ-UHFFFAOYSA-N 0.000 description 2
- 108060001084 Luciferase Proteins 0.000 description 2
- 239000005089 Luciferase Substances 0.000 description 2
- 206010028347 Muscle twitching Diseases 0.000 description 2
- 208000036572 Myoclonic epilepsy Diseases 0.000 description 2
- 208000002033 Myoclonus Diseases 0.000 description 2
- RRTVVRIFVKKTJK-UHFFFAOYSA-N N-Desmethylclobazam Chemical compound C12=CC(Cl)=CC=C2NC(=O)CC(=O)N1C1=CC=CC=C1 RRTVVRIFVKKTJK-UHFFFAOYSA-N 0.000 description 2
- ZDZOTLJHXYCWBA-VCVYQWHSSA-N N-debenzoyl-N-(tert-butoxycarbonyl)-10-deacetyltaxol Chemical compound O([C@H]1[C@H]2[C@@](C([C@H](O)C3=C(C)[C@@H](OC(=O)[C@H](O)[C@@H](NC(=O)OC(C)(C)C)C=4C=CC=CC=4)C[C@]1(O)C3(C)C)=O)(C)[C@@H](O)C[C@H]1OC[C@]12OC(=O)C)C(=O)C1=CC=CC=C1 ZDZOTLJHXYCWBA-VCVYQWHSSA-N 0.000 description 2
- 206010057852 Nicotine dependence Diseases 0.000 description 2
- 239000005642 Oleic acid Substances 0.000 description 2
- ZQPPMHVWECSIRJ-UHFFFAOYSA-N Oleic acid Natural products CCCCCCCCC=CCCCCCCCC(O)=O ZQPPMHVWECSIRJ-UHFFFAOYSA-N 0.000 description 2
- 235000019482 Palm oil Nutrition 0.000 description 2
- 206010061334 Partial seizures Diseases 0.000 description 2
- 206010073677 Severe myoclonic epilepsy of infancy Diseases 0.000 description 2
- 208000025569 Tobacco Use disease Diseases 0.000 description 2
- 102000004142 Trypsin Human genes 0.000 description 2
- 108090000631 Trypsin Proteins 0.000 description 2
- 230000002159 abnormal effect Effects 0.000 description 2
- 238000009825 accumulation Methods 0.000 description 2
- 229960000583 acetic acid Drugs 0.000 description 2
- 230000000996 additive effect Effects 0.000 description 2
- 229940025084 amphetamine Drugs 0.000 description 2
- 230000003698 anagen phase Effects 0.000 description 2
- 230000000202 analgesic effect Effects 0.000 description 2
- 230000000259 anti-tumor effect Effects 0.000 description 2
- 229940034982 antineoplastic agent Drugs 0.000 description 2
- 230000036528 appetite Effects 0.000 description 2
- 235000019789 appetite Nutrition 0.000 description 2
- 229940114079 arachidonic acid Drugs 0.000 description 2
- 235000021342 arachidonic acid Nutrition 0.000 description 2
- 230000002238 attenuated effect Effects 0.000 description 2
- 230000002567 autonomic effect Effects 0.000 description 2
- VSRXQHXAPYXROS-UHFFFAOYSA-N azanide;cyclobutane-1,1-dicarboxylic acid;platinum(2+) Chemical compound [NH2-].[NH2-].[Pt+2].OC(=O)C1(C(O)=O)CCC1 VSRXQHXAPYXROS-UHFFFAOYSA-N 0.000 description 2
- 230000004888 barrier function Effects 0.000 description 2
- 230000033228 biological regulation Effects 0.000 description 2
- 208000029028 brain injury Diseases 0.000 description 2
- 229960004562 carboplatin Drugs 0.000 description 2
- 229960005243 carmustine Drugs 0.000 description 2
- 206010008118 cerebral infarction Diseases 0.000 description 2
- 208000026106 cerebrovascular disease Diseases 0.000 description 2
- 239000003795 chemical substances by application Substances 0.000 description 2
- 229960004106 citric acid Drugs 0.000 description 2
- 229960003920 cocaine Drugs 0.000 description 2
- 201000006145 cocaine dependence Diseases 0.000 description 2
- 229940124301 concurrent medication Drugs 0.000 description 2
- 239000003433 contraceptive agent Substances 0.000 description 2
- 230000002254 contraceptive effect Effects 0.000 description 2
- 230000002920 convulsive effect Effects 0.000 description 2
- 229960004397 cyclophosphamide Drugs 0.000 description 2
- 229960000684 cytarabine Drugs 0.000 description 2
- 230000006378 damage Effects 0.000 description 2
- 238000011161 development Methods 0.000 description 2
- 230000018109 developmental process Effects 0.000 description 2
- 150000002009 diols Chemical class 0.000 description 2
- 235000021186 dishes Nutrition 0.000 description 2
- 229960003668 docetaxel Drugs 0.000 description 2
- POULHZVOKOAJMA-UHFFFAOYSA-N dodecanoic acid Chemical compound CCCCCCCCCCCC(O)=O POULHZVOKOAJMA-UHFFFAOYSA-N 0.000 description 2
- 230000002526 effect on cardiovascular system Effects 0.000 description 2
- 230000008030 elimination Effects 0.000 description 2
- 238000003379 elimination reaction Methods 0.000 description 2
- 230000002996 emotional effect Effects 0.000 description 2
- 201000002491 encephalomyelitis Diseases 0.000 description 2
- 230000002124 endocrine Effects 0.000 description 2
- VJJPUSNTGOMMGY-MRVIYFEKSA-N etoposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@H](C)OC[C@H]4O3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 VJJPUSNTGOMMGY-MRVIYFEKSA-N 0.000 description 2
- 229960005420 etoposide Drugs 0.000 description 2
- 238000011156 evaluation Methods 0.000 description 2
- 230000007717 exclusion Effects 0.000 description 2
- 230000029142 excretion Effects 0.000 description 2
- 150000004665 fatty acids Chemical class 0.000 description 2
- 239000012091 fetal bovine serum Substances 0.000 description 2
- 239000012530 fluid Substances 0.000 description 2
- 229960002949 fluorouracil Drugs 0.000 description 2
- 210000003194 forelimb Anatomy 0.000 description 2
- 239000010460 hemp oil Substances 0.000 description 2
- KEMQGTRYUADPNZ-UHFFFAOYSA-N heptadecanoic acid Chemical compound CCCCCCCCCCCCCCCCC(O)=O KEMQGTRYUADPNZ-UHFFFAOYSA-N 0.000 description 2
- MNWFXJYAOYHMED-UHFFFAOYSA-N heptanoic acid Chemical compound CCCCCCC(O)=O MNWFXJYAOYHMED-UHFFFAOYSA-N 0.000 description 2
- IPCSVZSSVZVIGE-UHFFFAOYSA-N hexadecanoic acid Chemical compound CCCCCCCCCCCCCCCC(O)=O IPCSVZSSVZVIGE-UHFFFAOYSA-N 0.000 description 2
- FUZZWVXGSFPDMH-UHFFFAOYSA-N hexanoic acid Chemical compound CCCCCC(O)=O FUZZWVXGSFPDMH-UHFFFAOYSA-N 0.000 description 2
- 210000003016 hypothalamus Anatomy 0.000 description 2
- HOMGKSMUEGBAAB-UHFFFAOYSA-N ifosfamide Chemical compound ClCCNP1(=O)OCCCN1CCCl HOMGKSMUEGBAAB-UHFFFAOYSA-N 0.000 description 2
- 229960001101 ifosfamide Drugs 0.000 description 2
- 230000006872 improvement Effects 0.000 description 2
- 239000000411 inducer Substances 0.000 description 2
- 230000005764 inhibitory process Effects 0.000 description 2
- 238000011221 initial treatment Methods 0.000 description 2
- 210000000936 intestine Anatomy 0.000 description 2
- 208000037906 ischaemic injury Diseases 0.000 description 2
- QXJSBBXBKPUZAA-UHFFFAOYSA-N isooleic acid Natural products CCCCCCCC=CCCCCCCCCC(O)=O QXJSBBXBKPUZAA-UHFFFAOYSA-N 0.000 description 2
- 210000003734 kidney Anatomy 0.000 description 2
- 231100001231 less toxic Toxicity 0.000 description 2
- 230000000670 limiting effect Effects 0.000 description 2
- 229960002247 lomustine Drugs 0.000 description 2
- 238000004519 manufacturing process Methods 0.000 description 2
- 230000004060 metabolic process Effects 0.000 description 2
- 229960000485 methotrexate Drugs 0.000 description 2
- 231100000324 minimal toxicity Toxicity 0.000 description 2
- 208000001022 morbid obesity Diseases 0.000 description 2
- 210000003205 muscle Anatomy 0.000 description 2
- 208000010125 myocardial infarction Diseases 0.000 description 2
- 230000004112 neuroprotection Effects 0.000 description 2
- 229910052757 nitrogen Inorganic materials 0.000 description 2
- 230000001473 noxious effect Effects 0.000 description 2
- ZQPPMHVWECSIRJ-KTKRTIGZSA-N oleic acid Chemical compound CCCCCCCC\C=C/CCCCCCCC(O)=O ZQPPMHVWECSIRJ-KTKRTIGZSA-N 0.000 description 2
- 239000004006 olive oil Substances 0.000 description 2
- 235000008390 olive oil Nutrition 0.000 description 2
- IRMPFYJSHJGOPE-UHFFFAOYSA-N olivetol Chemical compound CCCCCC1=CC(O)=CC(O)=C1 IRMPFYJSHJGOPE-UHFFFAOYSA-N 0.000 description 2
- 229940005483 opioid analgesics Drugs 0.000 description 2
- 239000002540 palm oil Substances 0.000 description 2
- 230000002085 persistent effect Effects 0.000 description 2
- 229910052697 platinum Inorganic materials 0.000 description 2
- 238000013105 post hoc analysis Methods 0.000 description 2
- 230000003389 potentiating effect Effects 0.000 description 2
- CPTBDICYNRMXFX-UHFFFAOYSA-N procarbazine Chemical compound CNNCC1=CC=C(C(=O)NC(C)C)C=C1 CPTBDICYNRMXFX-UHFFFAOYSA-N 0.000 description 2
- 229960000624 procarbazine Drugs 0.000 description 2
- GHBFNMLVSPCDGN-UHFFFAOYSA-N rac-1-monooctanoylglycerol Chemical compound CCCCCCCC(=O)OCC(O)CO GHBFNMLVSPCDGN-UHFFFAOYSA-N 0.000 description 2
- 230000005855 radiation Effects 0.000 description 2
- 230000000306 recurrent effect Effects 0.000 description 2
- 230000008439 repair process Effects 0.000 description 2
- 230000002441 reversible effect Effects 0.000 description 2
- 150000003839 salts Chemical class 0.000 description 2
- 229960001790 sodium citrate Drugs 0.000 description 2
- 239000007787 solid Substances 0.000 description 2
- 239000000934 spermatocidal agent Substances 0.000 description 2
- 230000002269 spontaneous effect Effects 0.000 description 2
- 230000007480 spreading Effects 0.000 description 2
- 238000003892 spreading Methods 0.000 description 2
- 238000013112 stability test Methods 0.000 description 2
- 238000007619 statistical method Methods 0.000 description 2
- 150000003431 steroids Chemical class 0.000 description 2
- 239000000126 substance Substances 0.000 description 2
- 201000009032 substance abuse Diseases 0.000 description 2
- 208000011117 substance-related disease Diseases 0.000 description 2
- 239000000758 substrate Substances 0.000 description 2
- 238000003786 synthesis reaction Methods 0.000 description 2
- 229960002494 tetracaine hydrochloride Drugs 0.000 description 2
- 231100001274 therapeutic index Toxicity 0.000 description 2
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 2
- 230000001256 tonic effect Effects 0.000 description 2
- 231100000331 toxic Toxicity 0.000 description 2
- 230000002588 toxic effect Effects 0.000 description 2
- 231100000048 toxicity data Toxicity 0.000 description 2
- UFTFJSFQGQCHQW-UHFFFAOYSA-N triformin Chemical compound O=COCC(OC=O)COC=O UFTFJSFQGQCHQW-UHFFFAOYSA-N 0.000 description 2
- 239000012588 trypsin Substances 0.000 description 2
- 210000004881 tumor cell Anatomy 0.000 description 2
- 230000007384 vagal nerve stimulation Effects 0.000 description 2
- SNICXCGAKADSCV-JTQLQIEISA-N (-)-Nicotine Chemical compound CN1CCC[C@H]1C1=CC=CN=C1 SNICXCGAKADSCV-JTQLQIEISA-N 0.000 description 1
- SSNHGLKFJISNTR-FWUPRJFYSA-N (6ar,10ar)-6,6,9-trimethyl-3-pentyl-6a,7,8,10a-tetrahydrobenzo[c]chromen-1-ol;2-[(6r)-3-methyl-6-prop-1-en-2-ylcyclohex-2-en-1-yl]-5-pentylbenzene-1,3-diol Chemical compound OC1=CC(CCCCC)=CC(O)=C1C1[C@H](C(C)=C)CCC(C)=C1.C1=C(C)CC[C@H]2C(C)(C)OC3=CC(CCCCC)=CC(O)=C3[C@@H]21 SSNHGLKFJISNTR-FWUPRJFYSA-N 0.000 description 1
- OYHQOLUKZRVURQ-NTGFUMLPSA-N (9Z,12Z)-9,10,12,13-tetratritiooctadeca-9,12-dienoic acid Chemical compound C(CCCCCCC\C(=C(/C\C(=C(/CCCCC)\[3H])\[3H])\[3H])\[3H])(=O)O OYHQOLUKZRVURQ-NTGFUMLPSA-N 0.000 description 1
- GYSCBCSGKXNZRH-UHFFFAOYSA-N 1-benzothiophene-2-carboxamide Chemical compound C1=CC=C2SC(C(=O)N)=CC2=C1 GYSCBCSGKXNZRH-UHFFFAOYSA-N 0.000 description 1
- WECGLUPZRHILCT-GSNKCQISSA-N 1-linoleoyl-sn-glycerol Chemical compound CCCCC\C=C/C\C=C/CCCCCCCC(=O)OC[C@@H](O)CO WECGLUPZRHILCT-GSNKCQISSA-N 0.000 description 1
- FRPZMMHWLSIFAZ-UHFFFAOYSA-N 10-undecenoic acid Chemical compound OC(=O)CCCCCCCCC=C FRPZMMHWLSIFAZ-UHFFFAOYSA-N 0.000 description 1
- KRQUFUKTQHISJB-YYADALCUSA-N 2-[(E)-N-[2-(4-chlorophenoxy)propoxy]-C-propylcarbonimidoyl]-3-hydroxy-5-(thian-3-yl)cyclohex-2-en-1-one Chemical compound CCC\C(=N/OCC(C)OC1=CC=C(Cl)C=C1)C1=C(O)CC(CC1=O)C1CCCSC1 KRQUFUKTQHISJB-YYADALCUSA-N 0.000 description 1
- NFIHXTUNNGIYRF-UHFFFAOYSA-N 2-decanoyloxypropyl decanoate Chemical compound CCCCCCCCCC(=O)OCC(C)OC(=O)CCCCCCCCC NFIHXTUNNGIYRF-UHFFFAOYSA-N 0.000 description 1
- CTOMLSZKMNQAOD-UHFFFAOYSA-N 2-tert-butylbenzene-1,4-diol 3-sulfanylpropane-1,2-diol Chemical compound C(C)(C)(C)C1=C(O)C=CC(=C1)O.SCC(O)CO CTOMLSZKMNQAOD-UHFFFAOYSA-N 0.000 description 1
- IOJPUZYGYNQZBZ-UHFFFAOYSA-N 5-methyl-2-propan-2-ylcyclohexa-1,5-dien-1-ol Chemical compound CC(C)C1=C(O)C=C(C)CC1 IOJPUZYGYNQZBZ-UHFFFAOYSA-N 0.000 description 1
- YCBKSSAWEUDACY-UHFFFAOYSA-N 7-Hydroxy-Delta1-THC Natural products C1=C(CO)CCC2C(C)(C)OC3=CC(CCCCC)=CC(O)=C3C21 YCBKSSAWEUDACY-UHFFFAOYSA-N 0.000 description 1
- ZELUXPWDPVXUEI-UHFFFAOYSA-N 7-Hydroxy-cannabidiol Natural products OC1=CC(CCCCC)=CC(O)=C1C1C(C(C)=C)CCC(CO)=C1 ZELUXPWDPVXUEI-UHFFFAOYSA-N 0.000 description 1
- 206010000117 Abnormal behaviour Diseases 0.000 description 1
- 206010001605 Alcohol poisoning Diseases 0.000 description 1
- 235000019489 Almond oil Nutrition 0.000 description 1
- 206010002091 Anaesthesia Diseases 0.000 description 1
- 208000031648 Body Weight Changes Diseases 0.000 description 1
- 102000009132 CB1 Cannabinoid Receptor Human genes 0.000 description 1
- 108010073366 CB1 Cannabinoid Receptor Proteins 0.000 description 1
- 235000019492 Cashew oil Nutrition 0.000 description 1
- 208000009132 Catalepsy Diseases 0.000 description 1
- 208000017667 Chronic Disease Diseases 0.000 description 1
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 description 1
- 206010053398 Clonic convulsion Diseases 0.000 description 1
- 206010009346 Clonus Diseases 0.000 description 1
- 206010010144 Completed suicide Diseases 0.000 description 1
- 206010010774 Constipation Diseases 0.000 description 1
- 208000000130 Cytochrome P-450 CYP3A Inducers Diseases 0.000 description 1
- 208000009011 Cytochrome P-450 CYP3A Inhibitors Diseases 0.000 description 1
- 206010012559 Developmental delay Diseases 0.000 description 1
- 208000012239 Developmental disease Diseases 0.000 description 1
- 208000007342 Diabetic Nephropathies Diseases 0.000 description 1
- 208000032131 Diabetic Neuropathies Diseases 0.000 description 1
- 206010012689 Diabetic retinopathy Diseases 0.000 description 1
- 208000000632 Experimental Neoplasms Diseases 0.000 description 1
- 208000034308 Grand mal convulsion Diseases 0.000 description 1
- 102000018997 Growth Hormone Human genes 0.000 description 1
- 108010051696 Growth Hormone Proteins 0.000 description 1
- 206010056438 Growth hormone deficiency Diseases 0.000 description 1
- 241000711549 Hepacivirus C Species 0.000 description 1
- 241000700721 Hepatitis B virus Species 0.000 description 1
- 208000005176 Hepatitis C Diseases 0.000 description 1
- 235000017309 Hypericum perforatum Nutrition 0.000 description 1
- 244000141009 Hypericum perforatum Species 0.000 description 1
- 206010020751 Hypersensitivity Diseases 0.000 description 1
- 206010058359 Hypogonadism Diseases 0.000 description 1
- 208000001953 Hypotension Diseases 0.000 description 1
- 238000010824 Kaplan-Meier survival analysis Methods 0.000 description 1
- 239000005639 Lauric acid Substances 0.000 description 1
- OYHQOLUKZRVURQ-HZJYTTRNSA-N Linoleic acid Chemical compound CCCCC\C=C/C\C=C/CCCCCCCC(O)=O OYHQOLUKZRVURQ-HZJYTTRNSA-N 0.000 description 1
- 206010025476 Malabsorption Diseases 0.000 description 1
- 208000004155 Malabsorption Syndromes Diseases 0.000 description 1
- 238000000585 Mann–Whitney U test Methods 0.000 description 1
- 102000029749 Microtubule Human genes 0.000 description 1
- 108091022875 Microtubule Proteins 0.000 description 1
- 208000029578 Muscle disease Diseases 0.000 description 1
- 208000021642 Muscular disease Diseases 0.000 description 1
- 150000001200 N-acyl ethanolamides Chemical class 0.000 description 1
- 208000012902 Nervous system disease Diseases 0.000 description 1
- 208000025966 Neurological disease Diseases 0.000 description 1
- 235000021314 Palmitic acid Nutrition 0.000 description 1
- 235000019483 Peanut oil Nutrition 0.000 description 1
- 239000005643 Pelargonic acid Substances 0.000 description 1
- 206010034620 Peripheral sensory neuropathy Diseases 0.000 description 1
- CXOFVDLJLONNDW-UHFFFAOYSA-N Phenytoin Chemical compound N1C(=O)NC(=O)C1(C=1C=CC=CC=1)C1=CC=CC=C1 CXOFVDLJLONNDW-UHFFFAOYSA-N 0.000 description 1
- 229920005372 Plexiglas® Polymers 0.000 description 1
- 208000000474 Poliomyelitis Diseases 0.000 description 1
- 229920002565 Polyethylene Glycol 400 Polymers 0.000 description 1
- 206010037660 Pyrexia Diseases 0.000 description 1
- 235000019484 Rapeseed oil Nutrition 0.000 description 1
- 206010038583 Repetitive speech Diseases 0.000 description 1
- 206010057190 Respiratory tract infections Diseases 0.000 description 1
- 235000019774 Rice Bran oil Nutrition 0.000 description 1
- 235000019485 Safflower oil Nutrition 0.000 description 1
- 208000034189 Sclerosis Diseases 0.000 description 1
- 208000020221 Short stature Diseases 0.000 description 1
- 241000497386 Silveira Species 0.000 description 1
- 235000021355 Stearic acid Nutrition 0.000 description 1
- 238000000692 Student's t-test Methods 0.000 description 1
- 208000010513 Stupor Diseases 0.000 description 1
- 206010042464 Suicide attempt Diseases 0.000 description 1
- 235000019486 Sunflower oil Nutrition 0.000 description 1
- 206010070863 Toxicity to various agents Diseases 0.000 description 1
- 206010044565 Tremor Diseases 0.000 description 1
- 206010046306 Upper respiratory tract infection Diseases 0.000 description 1
- 206010047631 Vitamin E deficiency Diseases 0.000 description 1
- 235000019498 Walnut oil Nutrition 0.000 description 1
- 206010047853 Waxy flexibility Diseases 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- 230000016571 aggressive behavior Effects 0.000 description 1
- 125000001931 aliphatic group Chemical group 0.000 description 1
- 230000000172 allergic effect Effects 0.000 description 1
- 208000030961 allergic reaction Diseases 0.000 description 1
- 239000008168 almond oil Substances 0.000 description 1
- OBETXYAYXDNJHR-UHFFFAOYSA-N alpha-ethylcaproic acid Natural products CCCCC(CC)C(O)=O OBETXYAYXDNJHR-UHFFFAOYSA-N 0.000 description 1
- 230000037005 anaesthesia Effects 0.000 description 1
- 230000003444 anaesthetic effect Effects 0.000 description 1
- 208000007502 anemia Diseases 0.000 description 1
- 239000005557 antagonist Substances 0.000 description 1
- 230000001773 anti-convulsant effect Effects 0.000 description 1
- 230000003556 anti-epileptic effect Effects 0.000 description 1
- 230000000573 anti-seizure effect Effects 0.000 description 1
- 238000013459 approach Methods 0.000 description 1
- 239000008346 aqueous phase Substances 0.000 description 1
- 230000001174 ascending effect Effects 0.000 description 1
- 208000006673 asthma Diseases 0.000 description 1
- 208000010668 atopic eczema Diseases 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- 230000004579 body weight change Effects 0.000 description 1
- 230000006931 brain damage Effects 0.000 description 1
- 231100000874 brain damage Toxicity 0.000 description 1
- 210000000481 breast Anatomy 0.000 description 1
- 201000011510 cancer Diseases 0.000 description 1
- KHAVLLBUVKBTBG-UHFFFAOYSA-N caproleic acid Natural products OC(=O)CCCCCCCC=C KHAVLLBUVKBTBG-UHFFFAOYSA-N 0.000 description 1
- 229960000623 carbamazepine Drugs 0.000 description 1
- FFGPTBGBLSHEPO-UHFFFAOYSA-N carbamazepine Chemical compound C1=CC2=CC=CC=C2N(C(=O)N)C2=CC=CC=C21 FFGPTBGBLSHEPO-UHFFFAOYSA-N 0.000 description 1
- 125000004432 carbon atom Chemical group C* 0.000 description 1
- 239000010467 cashew oil Substances 0.000 description 1
- 229940059459 cashew oil Drugs 0.000 description 1
- 239000004359 castor oil Substances 0.000 description 1
- 235000019438 castor oil Nutrition 0.000 description 1
- 239000003054 catalyst Substances 0.000 description 1
- 230000002490 cerebral effect Effects 0.000 description 1
- 229940044683 chemotherapy drug Drugs 0.000 description 1
- 230000001055 chewing effect Effects 0.000 description 1
- 230000001684 chronic effect Effects 0.000 description 1
- 208000022371 chronic pain syndrome Diseases 0.000 description 1
- 238000003759 clinical diagnosis Methods 0.000 description 1
- 229940000425 combination drug Drugs 0.000 description 1
- 238000011284 combination treatment Methods 0.000 description 1
- 230000002301 combined effect Effects 0.000 description 1
- 208000012696 congenital leptin deficiency Diseases 0.000 description 1
- 235000005687 corn oil Nutrition 0.000 description 1
- 239000002285 corn oil Substances 0.000 description 1
- 230000001186 cumulative effect Effects 0.000 description 1
- 125000003074 decanoyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C(*)=O 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 239000003599 detergent Substances 0.000 description 1
- 206010012601 diabetes mellitus Diseases 0.000 description 1
- 208000033679 diabetic kidney disease Diseases 0.000 description 1
- 238000010586 diagram Methods 0.000 description 1
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 1
- 230000008034 disappearance Effects 0.000 description 1
- 239000008151 electrolyte solution Substances 0.000 description 1
- 239000002621 endocannabinoid Substances 0.000 description 1
- 230000001747 exhibiting effect Effects 0.000 description 1
- 238000002474 experimental method Methods 0.000 description 1
- 230000021824 exploration behavior Effects 0.000 description 1
- 238000000605 extraction Methods 0.000 description 1
- 238000013213 extrapolation Methods 0.000 description 1
- 210000003414 extremity Anatomy 0.000 description 1
- 239000012837 first-line chemotherapeutic agent Substances 0.000 description 1
- 230000006870 function Effects 0.000 description 1
- 230000005021 gait Effects 0.000 description 1
- 230000002496 gastric effect Effects 0.000 description 1
- 238000011902 gastrointestinal surgery Methods 0.000 description 1
- 210000001035 gastrointestinal tract Anatomy 0.000 description 1
- 230000014509 gene expression Effects 0.000 description 1
- 230000002068 genetic effect Effects 0.000 description 1
- ZEMPKEQAKRGZGQ-XOQCFJPHSA-N glycerol triricinoleate Natural products CCCCCC[C@@H](O)CC=CCCCCCCCC(=O)OC[C@@H](COC(=O)CCCCCCCC=CC[C@@H](O)CCCCCC)OC(=O)CCCCCCCC=CC[C@H](O)CCCCCC ZEMPKEQAKRGZGQ-XOQCFJPHSA-N 0.000 description 1
- 229940087068 glyceryl caprylate Drugs 0.000 description 1
- 230000036449 good health Effects 0.000 description 1
- 230000012010 growth Effects 0.000 description 1
- 239000000122 growth hormone Substances 0.000 description 1
- 239000000380 hallucinogen Substances 0.000 description 1
- 210000003128 head Anatomy 0.000 description 1
- 230000002440 hepatic effect Effects 0.000 description 1
- 208000002672 hepatitis B Diseases 0.000 description 1
- 235000021070 high sugar diet Nutrition 0.000 description 1
- 238000013537 high throughput screening Methods 0.000 description 1
- 208000013403 hyperactivity Diseases 0.000 description 1
- 230000036543 hypotension Effects 0.000 description 1
- 230000002267 hypothalamic effect Effects 0.000 description 1
- 239000012729 immediate-release (IR) formulation Substances 0.000 description 1
- 230000001771 impaired effect Effects 0.000 description 1
- 238000001727 in vivo Methods 0.000 description 1
- 208000015181 infectious disease Diseases 0.000 description 1
- 239000004615 ingredient Substances 0.000 description 1
- 239000003112 inhibitor Substances 0.000 description 1
- 230000002452 interceptive effect Effects 0.000 description 1
- 230000007794 irritation Effects 0.000 description 1
- 238000002955 isolation Methods 0.000 description 1
- 235000020778 linoleic acid Nutrition 0.000 description 1
- 229960004232 linoleic acid Drugs 0.000 description 1
- OYHQOLUKZRVURQ-IXWMQOLASA-N linoleic acid Natural products CCCCC\C=C/C\C=C\CCCCCCCC(O)=O OYHQOLUKZRVURQ-IXWMQOLASA-N 0.000 description 1
- 125000002669 linoleoyl group Chemical group O=C([*])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])/C([H])=C([H])\C([H])([H])/C([H])=C([H])\C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 239000000944 linseed oil Substances 0.000 description 1
- 235000021388 linseed oil Nutrition 0.000 description 1
- 230000033001 locomotion Effects 0.000 description 1
- 238000011866 long-term treatment Methods 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 210000004688 microtubule Anatomy 0.000 description 1
- 230000003278 mimic effect Effects 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 238000010172 mouse model Methods 0.000 description 1
- 230000004220 muscle function Effects 0.000 description 1
- WQEPLUUGTLDZJY-UHFFFAOYSA-N n-Pentadecanoic acid Natural products CCCCCCCCCCCCCCC(O)=O WQEPLUUGTLDZJY-UHFFFAOYSA-N 0.000 description 1
- 210000003739 neck Anatomy 0.000 description 1
- 230000007658 neurological function Effects 0.000 description 1
- 229960002715 nicotine Drugs 0.000 description 1
- SNICXCGAKADSCV-UHFFFAOYSA-N nicotine Natural products CN1CCCC1C1=CC=CN=C1 SNICXCGAKADSCV-UHFFFAOYSA-N 0.000 description 1
- 125000001196 nonadecyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- QIQXTHQIDYTFRH-UHFFFAOYSA-N octadecanoic acid Chemical compound CCCCCCCCCCCCCCCCCC(O)=O QIQXTHQIDYTFRH-UHFFFAOYSA-N 0.000 description 1
- OQCDKBAXFALNLD-UHFFFAOYSA-N octadecanoic acid Natural products CCCCCCCC(C)CCCCCCCCC(O)=O OQCDKBAXFALNLD-UHFFFAOYSA-N 0.000 description 1
- 125000002811 oleoyl group Chemical group O=C([*])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])/C([H])=C([H])\C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 239000006186 oral dosage form Substances 0.000 description 1
- 210000001672 ovary Anatomy 0.000 description 1
- 229940104914 oxaliplatin injection Drugs 0.000 description 1
- 238000010979 pH adjustment Methods 0.000 description 1
- 229940108949 paclitaxel injection Drugs 0.000 description 1
- 230000036961 partial effect Effects 0.000 description 1
- 239000000312 peanut oil Substances 0.000 description 1
- 229960002036 phenytoin Drugs 0.000 description 1
- 239000000902 placebo Substances 0.000 description 1
- 229940068196 placebo Drugs 0.000 description 1
- 230000004983 pleiotropic effect Effects 0.000 description 1
- 239000004926 polymethyl methacrylate Substances 0.000 description 1
- 229920000136 polysorbate Polymers 0.000 description 1
- 238000011176 pooling Methods 0.000 description 1
- 230000001144 postural effect Effects 0.000 description 1
- 239000000843 powder Substances 0.000 description 1
- 238000009597 pregnancy test Methods 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- 230000001737 promoting effect Effects 0.000 description 1
- 229940116422 propylene glycol dicaprate Drugs 0.000 description 1
- 210000004129 prosencephalon Anatomy 0.000 description 1
- 230000002829 reductive effect Effects 0.000 description 1
- 230000001172 regenerating effect Effects 0.000 description 1
- 230000001105 regulatory effect Effects 0.000 description 1
- 210000005227 renal system Anatomy 0.000 description 1
- 230000000241 respiratory effect Effects 0.000 description 1
- 230000036387 respiratory rate Effects 0.000 description 1
- 208000020029 respiratory tract infectious disease Diseases 0.000 description 1
- 206010039073 rheumatoid arthritis Diseases 0.000 description 1
- 239000008165 rice bran oil Substances 0.000 description 1
- 235000005713 safflower oil Nutrition 0.000 description 1
- 239000003813 safflower oil Substances 0.000 description 1
- 238000005070 sampling Methods 0.000 description 1
- 201000005572 sensory peripheral neuropathy Diseases 0.000 description 1
- 239000000952 serotonin receptor agonist Substances 0.000 description 1
- 210000002966 serum Anatomy 0.000 description 1
- 230000001568 sexual effect Effects 0.000 description 1
- 230000011664 signaling Effects 0.000 description 1
- 235000012424 soybean oil Nutrition 0.000 description 1
- 239000003549 soybean oil Substances 0.000 description 1
- 238000009987 spinning Methods 0.000 description 1
- 230000000087 stabilizing effect Effects 0.000 description 1
- 230000005477 standard model Effects 0.000 description 1
- 238000000528 statistical test Methods 0.000 description 1
- 239000008117 stearic acid Substances 0.000 description 1
- 235000021012 strawberries Nutrition 0.000 description 1
- 231100000736 substance abuse Toxicity 0.000 description 1
- 239000002600 sunflower oil Substances 0.000 description 1
- 238000001356 surgical procedure Methods 0.000 description 1
- 238000007910 systemic administration Methods 0.000 description 1
- 238000012353 t test Methods 0.000 description 1
- 229960002372 tetracaine Drugs 0.000 description 1
- 238000002560 therapeutic procedure Methods 0.000 description 1
- 230000001550 time effect Effects 0.000 description 1
- 230000009466 transformation Effects 0.000 description 1
- 229960002703 undecylenic acid Drugs 0.000 description 1
- 235000015112 vegetable and seed oil Nutrition 0.000 description 1
- 239000008158 vegetable oil Substances 0.000 description 1
- 239000008170 walnut oil Substances 0.000 description 1
- 230000004580 weight loss Effects 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0053—Mouth and digestive tract, i.e. intraoral and peroral administration
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/045—Hydroxy compounds, e.g. alcohols; Salts thereof, e.g. alcoholates
- A61K31/05—Phenols
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/08—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite containing oxygen, e.g. ethers, acetals, ketones, quinones, aldehydes, peroxides
- A61K47/10—Alcohols; Phenols; Salts thereof, e.g. glycerol; Polyethylene glycols [PEG]; Poloxamers; PEG/POE alkyl ethers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/08—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite containing oxygen, e.g. ethers, acetals, ketones, quinones, aldehydes, peroxides
- A61K47/14—Esters of carboxylic acids, e.g. fatty acid monoglycerides, medium-chain triglycerides, parabens or PEG fatty acid esters
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/44—Oils, fats or waxes according to two or more groups of A61K47/02-A61K47/42; Natural or modified natural oils, fats or waxes, e.g. castor oil, polyethoxylated castor oil, montan wax, lignite, shellac, rosin, beeswax or lanolin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/08—Solutions
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/08—Antiepileptics; Anticonvulsants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/04—Anorexiants; Antiobesity agents
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Epidemiology (AREA)
- General Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Oil, Petroleum & Natural Gas (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Organic Chemistry (AREA)
- Obesity (AREA)
- Hematology (AREA)
- Diabetes (AREA)
- Pain & Pain Management (AREA)
- Neurosurgery (AREA)
- Neurology (AREA)
- Biomedical Technology (AREA)
- Physiology (AREA)
- Nutrition Science (AREA)
- Child & Adolescent Psychology (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Medicinal Preparation (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Abstract
Description
一態様において、本発明は、プラダー−ウィリー症候群を治療する方法であって、
カンナビジオール;
脂質からなる又は水、エタノール、グリセリン、プロピレングリコール、ポリエチレングリコール400及びこれらの組合せからなる群から選択されるビヒクル
を含む、有効量の経口医薬製剤を投与することを含む、方法を対象とする。
約8%〜約31%w/wのカンナビジオール;並びに
約60%〜約90%w/wの脂質からなるビヒクル又は約40%〜約60%w/wのエタノール、約1%〜約5%w/wのポリエチレングリコール、約5%〜約10%w/wのプロピレングリコール及び約20%〜約40%w/wの水の組合せ
を含む。
カンナビジオール;
脂質からなる又は水、エタノール、グリセリン、プロピレングリコール、ポリエチレングリコール400及びこれらの組合せからなる群から選択されるビヒクル
を含む有効量の経口医薬製剤を投与することを含む、方法を対象とする。
カンナビジオール;並びに
脂質、水、エタノール、グリセリン、プロピレングリコール、ポリエチレングリコール400及びこれらの組合せからなる群から選択されるビヒクル
を含む有効量の経口医薬製剤を、これを必要とする患者に投与することを含む、方法を対象とする。
実質的に純粋な、好ましくは98%より高い純度を有するカンナビジオール及び/又は合成のカンナビジオール;並びに
脂質、水、エタノール、グリセリン、プロピレングリコール、ポリエチレングリコール400及びこれらの組合せからなる群から選択されるビヒクル
を含む有効量の経口医薬製剤を投与することを含む、方法を対象とする。
<アルコール不含製剤>
別の実施形態において、本発明は、約0.1〜約40%のカンナビノイド、約0.1〜約25%のポリエチレングリコール、約0.1〜約40%のプロピレングリコール、任意選択的に約0.1〜約50%の水、及び約0.1〜約70%のアルコールを含む、経口投与のための安定な医薬製剤を対象とし、ここで、製剤は約5〜約8のpHを有する。
別の実施形態において、本発明は、約0.1〜約40%のカンナビノイド及び約10〜約95%の脂質を含む、経口投与のための安定な医薬製剤を対象とする。
本発明の製剤は、多くの疾患若しくは障害又は疾患及び障害の症状の治療に殊に適当である。さらに、合成的に合成されるとともに実質的に純粋であるカンナビジオールは、疾患又はこれらの疾患の症状の治療にいっそう有効及び適当である。
本明細書で使用される場合、「患者」は、単一の患者を指し、患者集団を指していない。
下記の表1における製剤を以下の通りに調製した。全ての溶媒を窒素でパージした後に、製造に使用する。ビタミンE、メチルパラベン、プロピルパラベンをプロピレングリコール中に溶解させた。ポリエチレングリコール400(PEG400)及び香味剤をこのプロピレングリコール溶液に添加し、徹底的に混合した。スクラロース及びアスコルビン酸ナトリウムを水中に溶解させることによって、水相を調製した。次に、これらの溶液を合わせ、pH改変剤を使用することによってpHを調整した。カンナビノイドをこの賦形剤溶液に添加し、溶解するまで混合した。
表1に列挙されている製剤を、75%±5%の相対湿度下にて55℃±2℃、40℃±2℃、及び60%±5%の相対湿度下にて25℃±2℃で安定性試験にかけた。製剤の安定性を、特定時点で、これらの効力(アッセイ値)及び不純物レベルについて評価することによって分析した。紫外線検出器を用いた高速液体クロマトグラフィーを使用して、アッセイ及び不純物を検出した。アッセイを228nmで行い、初濃度の%として示した。全ての不純物について、分析を228nmで行い、%面積として表した。特別な不純物の量は、総不純物の量と一緒に各製剤の面積の百分率として表2〜13に列挙されている。相対的保持時間(RRT)は各不純物について示されている。
下記の表14及び15における製剤を以下の通りに調製した。全ての溶媒を窒素でパージした後に、製造に使用した。ビタミンE、パルミチン酸アスコルビル、メチルパラベン、プロピルパラベン、スクラロースをエタノール中に溶解させた。プロピレングリコール、ポリエチレングリコール400、グリセロール、香味剤及び水をこの溶液に添加し、徹底的に混合した。次いで、適用可能ならば、pH改変剤を使用して溶液のpHを調整した。カンナビノイドをこの賦形剤溶液に添加し、完全に溶解するまで混合した。
表14及び表15に列挙されている製剤を60%±5%の相対湿度下にて25℃±2℃、及び75%±5%の相対湿度下にて40℃±2℃で安定性試験にかけた。製剤の安定性を、特定の時点で、これらの効力(アッセイ値)及び不純物レベルを評価することによって分析した。紫外線検出器を用いる高速液体クロマトグラフィーを使用して、アッセイ及び不純物を検出した。アッセイを228nmで行い、初濃度の%として示した。全ての不純物について、分析を228nmで行い、%面積として表した。特別な不純物の量は、総不純物の量と一緒に各製剤の面積の百分率として表16〜22に列挙されている。相対的保持時間(RRT)は各不純物について示されている。
全ての固体及び液体賦形剤を脂質中で混合することによって、表24における製剤を創出した。カンナビジオールを次いで溶解させた。合成的に合成された実質的に純粋なカンナビジオールをカンナビノイドの供給源として使用した。イチゴを香味付けの供給源として使用した。
製剤#LF1を60%±5%の相対湿度下にて25℃±2℃、及び75%±5%の相対湿度下にて40℃±2℃で安定性試験にかけた。製剤#LF10及び#LF11を75%±5%の相対湿度下にて55℃±2℃及び40℃±2℃で安定性試験にかけた。製剤#LF8、#LF9及び#LF12〜#LF15を全ての3つの貯蔵条件で安定性試験にかけた。製剤の安定性を、特定の時点で、効力(アッセイ値)及び不純物レベルを評価することによって分析した。紫外線検出器を用いる高速液体クロマトグラフィーを使用して、アッセイ及び不純物を検出した。アッセイを228nmで行い、初濃度の%として示した。全ての不純物について、分析を228nmで行い、%面積として表した。特別な不純物の量は、総不純物の量と一緒に各製剤の面積の百分率として表25に列挙されている。相対的保持時間(RRT)は各不純物について示されている。
パクリタキセルは、卵巣、乳房、肺及び頭頸部を含めたいくつかの型のがんに対する活性を有する抗新生物剤である。パクリタキセルは、有毒な副作用としてニューロパチーをもたらす微小管集合を促進することによって働く。末梢感覚ニューロパチーは、パクリタキセルの最も共通して報告されている神経毒性副作用であり、単独で又はシスプラチンのような他の神経毒性抗新生物剤との組合せで与えられる場合、パクリタキセルの高い及び累積の用量を用いる治療を制限する。現在では、この型の疼痛のための高度に有効な治療がない。そのため、パクリタキセル誘発ニューロパチーの症状を緩和するための高度に有効な治療が必要である。
1)1.25mg/kgのカンナビジオールが疼痛効果の100%軽減を生み出し、1.25mg/kgのデルタ−9−テトラヒドロカンナビノールが0%効果を生み出すならば、一緒に添加されたこれらの用量は完全に有効であるはずである(2.5mg/kgのカンナビジオール+2.5mg/kgのデルタ−9−テトラヒドロカンナビノールがそうであるように)。
方法
ベースラインの機械的感受性に続く1日目、3日目に、5日目及び7日目に、パクリタキセルを投与し、各パクリタキセル注射の15分前に、カンナビノイドを投与した。機械的感受性を次いで、9日目、14日目及び21日目に再判定した。機械的感受性試験のため、マウスを個々の透明なプレキシガラスチャンバーの内側の金網表面に置き、それらの後足の足底表面を、それらが刺激からそれらの足を退避させるまで、厚みが増加するフォンフレイフィラメント(0.16〜2.0グラムの力)と接触させる。フォンフレイの毛は、マウスの足底表面に対して湾曲「C」形状に6秒間押し付けられている一連の微細な較正フィラメントである。各処置群について、最終試料サイズは8匹の動物であった。CBD及びTHC処置の有意な効果を決定するため、2元配置ANOVAを使用した。
CBD又はTHCを用いる前処置は、パクリタキセル誘発機械的感受性を有意に減弱させ、各薬剤についてP<0.0001であった。図2を参照されたい。CBDは、CBDについての最小有効用量が1.25mg/kg IPであったが、THCについての最小有効用量が2.5mg/kg IPであったという点で、より高い効力でこの効果を生み出した。2元配置ANOVAもCBDとTHC用量応答曲線との間の有意な差異を明らかにし、CBDの1.25mg/kg用量は、THCの1.25mg/kg用量と比較した場合に有意に高い%ベースラインスコアを生み出した。両薬物が効力あるように思われた。
方法
1:1用量比から外れるCBD+THC組合せの効力を試験するように、研究を設計した。6つの追加の組合せ:4:1、3:1、2:1、1:2、1:3及び1:4を試験した。各処置組合せの4つの用量を、パクリタキセルで処置されたマウス群において試験した。各処置群について、最終試料サイズは8匹の動物であった。
CBD対THCの4:1組合せは、単独のCBDと同様の効果を生み出し、他方、CBD対THCの2:1及び3:1比は、単独のCBDよりも強力であった。図5を参照されたい。2元配置ANOVAは、処置及び用量の全体的効果(p<0.05)を明らかにしたが、有意な相互作用は明らかにしなかった。CBDよりもTHCにおけるほうが高い組合せは、単独のTHCと同様の効果を生み出し、用量の有意な効果はあったが(p<0.05)、主な処置効果及び有意な相互作用はなかった。
方法
オキサリプラチン又はビンクリスチン誘発末梢ニューロパチーを予防する際のCBDの効力を試験するように、研究を設計した。CBD及びビヒクルの2つの用量を、これらの第一選択の化学療法剤の各々に対して試験した。オキサリプラチンを6mg/kgの用量で1回投与した。CBDを単一のオキサリプラチン注射の15分前に投与した。ビンクリスチンを0.1mg/kgの用量で1日1回7日間投与した。CBDを各ビンクリスチン注射の15分前に投与した。各処置群について、最終試料サイズは8匹の動物であった。
CBDを用いる前処置は、オキサリプラチン誘発機械的感受性を減弱させたが、ビンクリスチン誘発機械的感受性を減弱させなかった。図6を参照されたい。オキサリプラチンについての2元配置ANOVAは、有意な時間効果及び有意な処置効果を明らかにし(p<0.05)、有意な相互作用を明らかにしなかった。ビンクリスチンについての2元配置ANOVAは、有意な時間効果を明らかにしたが(p<0.05)、主な処置効果及び相互作用を明らかにしなかった。
最大電気ショック試験(「MES」)、最小間代性発作(「6Hz」)試験及び毒性の評価(「TOX」)を含めて、抗けいれん薬スクリーニングのための標準的モデルに従って、この研究を以下の通りに行った。データを試験された動物の数(F)のうちの保護された動物の数(N)として記録しており、下記の表26〜29を参照されたい。試験を1回反復した。マウス及びラットに投与されたカンナビジオールは、98%より高い純度を有する実質的に純粋な合成的に合成されたカンナビジオールであった。カンナビジオールを0.5%メチルセルロース、又は1:1:18比のエタノール:ポリエトキシ化ヒマシ油:リン酸緩衝生理食塩水中に溶解させた(「PBS」)。
この研究を行うことで、長期周波数(6Hz)刺激によって誘発された精神運動発作を遮断するという合成的に合成された実質的に純粋なカンナビジオールの能力を決定した。これは、治療耐性部分発作のための研究モデルである。
最大電気ショック発作(「MES」)及び皮下メトラゾール(「sc Met」)試験は、調査用抗発作薬物の初期同定及びハイスループットスクリーンのための2つの最も広く用いられる前臨床発作モデルである。これらの試験は、ヒトの全身性強直間代性発作及び全身性ミオクローヌス性発作の治療に有用であり得る新たな抗発作薬を同定する際に極めて有効である。MES試験は、脳における全てのニューロン回路が最大活性である場合、発作拡散を防止するというCBDの能力の指標を提供する。s.c.Met試験は、動物の化学的けいれん薬誘発発作閾値を上げ、したがって、間代性前脳発作を呈することからそれを保護するというCBDの能力を検出する。
カンナビジオール又はカンナビジオールプラスデルタ−9−テトラヒドロカンナビノール(カンナビジオール/デルタ−9−テトラヒドロカンナビノール1:1)の全身投与が、多形神経膠芽腫進行を抑制し、U87細胞を利用する多形神経膠芽腫の同所性マウスモデルにおいて、化学療法薬のテモゾロマイドの活性を増強することができる程度を決定するために、研究を行った。カンナビジオールプラスデルタ−9−テトラヒドロカンナビノールの組合せが、U87血清誘導多形神経膠芽腫細胞から誘導される腫瘍を標的化するための最も有効な処置であることが予め示唆された。
10%ウシ胎児血清を有するRoswell Park Memorial Institute培地中で、ヒトU251ルシフェラーゼ標識化細胞を成長させ、次いで、0.1%トリプシン/エチレンジアミン四酢酸を用いて培養中のそれらの指数成長期における間に皿から収集し、血清不含Roswell Park Memorial Institute培地で2回洗浄した。頭蓋内モデルのため、4μlのRoswell Park Memorial Institute培地において0.3×106のU251細胞の頭蓋内注射によって、腫瘍を雌性胸腺欠損nu/nuマウスに発生させた。このモデルを使用して、薬効性(インビボ画像化)、並びに同じ動物群における生存を判定することができる。実験の新生物に関与する国立衛生研究所のガイドライン及び我々の承認された動物実験委員会プロトコールに従って、生存研究を実施した。全ての群における動物は、丸まった背中、全身的活動の持続性減少、又は体重の著しい減少を含めて、著しい腫瘍負荷発達を示す任意の単一の兆候を実証した場合に研究から外す。腫瘍が頭蓋内腔から逃れることができた限られた場合において、外部腫瘍がノギスによって判定された場合に5mmを超えると測定された時に、マウスを安楽死させた。追加として、放射輝度が>500×106と測定された腫瘍を有するマウスは、発作に関連した自発的死が大きな頭蓋内腫瘍の存在により発生しなかったことを保障するため、症状が観察されなくても研究から外した。1群当たり12匹のマウスで、合計72匹のマウスであった。処置割合は以下の通りであった:カンナビジオール(15mg/kg);テモゾロマイド(1.5mg/kgの腹腔内注射);及びカンナビジオール/テモゾロマイド(10:1、16.5mg/kgで一緒)。
プロトコール
処置耐性発作を経験している小児対象に対する複数用量のカンナビジオール経口溶液の効果を評価するために、第1/2相非盲検複数漸増用量研究を行う。研究は、逐次様式で投与されるカンナビジオール経口溶液の3つの用量(1日当たり1キログラム当たり10ミリグラム、20ミリグラム及び40ミリグラム(「mg/kg/日」))の薬物動態、安全性、忍容性及び予備的効力を判定する。具体的には、20人の対象は、以下の各用量コホートに登録される、A)以下の基準に適合する用量コホート:1.対象及び/又は親(単数又は複数)/介護者(単数又は複数)は、インフォームドコンセント形態(ICF)及び承認形態を完全に理解し、全ての研究手順を理解し、調査者及び研究コーディネーターと十分に意思伝達することができる;2.準拠法、規則及び現地要件に従って対象及び/又は親(単数又は複数)/介護者(単数又は複数)のインフォームドコンセント及び/又は承認(適用可能な場合)を提供する;3.コンセント時に1〜17歳の間(包含的)の男性又は女性;4.a.≧3種の抗てんかん薬(「AED」)の適切なトライアル、及びb.組合せで(即ち、同時に)≧2種のAEDを用いる≧1回の事前の適切な処置クールにもかかわらず、調査者の見解で及び継続発作として定義されている通りの処置耐性発作障害と診断されている;5.確立されたAED(0日目の前の≧30日間、及び研究の持続期間全体にわたる安定な投薬)に留まる意思、a.迷走神経刺激(VNS)術もケトン食療法も、この研究の目的ではAEDと考えられない;6.治療期間中にケトン食療法を開始しない又はすでに食療法中ならば、研究中に食療法を変更しない意思;7.女性対象が、a.初経前である又はb.スクリーニング訪問時に及び0日目に尿妊娠試験陰性で妊娠可能性であるならば、研究参加に適格である。性的に活発ならば、彼女は、以下の要件の1つを満たすことに同意しなければならない:i.調査用生成物の初回用量の投与の≧4週前、処置期間全体にわたって、及び完了後又は調査用生成物からの早期中断後4週の完全な性交禁欲、並びに性的に活発になったならば二重障壁方法を使用するという同意;ii.研究全体にわたって、及び完了後又は調査用生成物からの早期中断後4週、許容される避妊方法の使用。二重障壁方法(即ち、コンドームプラス殺精子薬又はコンドームプラスペッサリー)は許容される避妊方法である;8.性的に活発な男性対象は、研究全体にわたって、及び研究参加の完了又は調査用生成物からの早期中断後4週間、許容される避妊方法を使用する意思がなければならない。許容される産児制限方法は、禁欲又は二重障壁産児制限(即ち、コンドームプラス殺精子薬又はコンドームプラスペッサリー)である;9.調査者の見解で、親(単数又は複数)/介護者(単数又は複数)は、静脈穿刺、研究センターでの入院患者滞在、研究センターでの投薬(外来患者の間に必要とされる場合に1日2回)、及び追跡調査訪問(適用可能ならば)を含めて、研究手順及び訪問スケジュールに従う意思があるとともに従うことができる;10.物理的及び神経学的検査、病歴、及びスクリーニング訪問中に完了した臨床検査値(血液学、化学及び検尿)に基づく良好な全身的健康(調査者によって決定される場合の任意の臨床関連異常の非存在として定義されている。);及び11.≧9kgの体重;並びにB)以下の基準を満たしていない用量コホート:1.対象又は親(単数又は複数)/介護者(単数又は複数)は、研究持続期間中、全ての研究訪問に参加することに干渉するという日常的責任を有する;2.現在、強いシトクロムP450 3A4(「CYP3A4」)抑制剤若しくは誘発物又は狭い治療指数を有するCYP3A4感受性基質である併用薬物療法を行っている;3.現在、任意の他の許可されていない薬物療法を行っている;4.現在、フェルバメートを、スクリーニング訪問前に<6カ月間受けていなかった場合に服用している;5.調査者の見解で、任意の臨床的に重要な不安定な医学的異常性、慢性疾患、又は心血管系、胃腸系、呼吸系、肝臓系若しくは腎系の臨床的に重要な異常性の履歴;6.薬物の吸収、分布、代謝又は排泄に干渉し得る状態(例えば、吸収不良又は胃腸手術)の任意の障害又は履歴;7.調査者の見解で臨床的に重要である異常心電図の履歴又は存在(「ECG」);8.適切な対象について、行動する意図が多少あるが特定の計画がない能動的自殺念慮に関する質問への肯定的回答、又はスクリーニング訪問でのColumbia Suicide Severity格付けスケール(「C−SSRS」)判定で特定の計画及び意図がある能動的自殺念慮、C−SSRSによって判定された場合の自殺念慮について重要な所見を有する対象は、追跡調査評価のために調査者に委ねられなければならない;9.自殺未遂の履歴;10.血液試料を収集する際に困難の原因となる静脈穿刺の不十分な耐容性又は不十分な静脈アクセスの履歴;11.現在又はスクリーニング訪問の前の30日若しくは調査用生成物の5半減期(t1/2)(どちらか長いほう)以内の任意の調査研究の参加;12.スクリーニング訪問の前30日内の任意のカンナビノイド(カンナビジオール、Δ9−テトラヒドロカンナビノール[Δ9−THC]、麻油、レアルム油(Realm Oil)又はマリファナ)の摂取;13.調査用生成物製剤に含有されている任意の物質に対するアレルギー反応の履歴又は感受性が知られている若しくは疑われている;14.B型肝炎、C型肝炎又はヒト免疫不全ウイルス(HIV)の感染症が知られている;15.調査者の見解で、対象は、いかなる他のやり方でも、この研究に参加するのに不適当である;並びに16.>90kgの体重。
研究のエンドポイントは以下を含む:(1)治療期間中に発生する有害事象(「AE」)(即ち、治療下出現性有害事象[「TEAE」])及び重篤な有害事象(「SAE」)の発生率、型及び重症度;(2)バイタルサインにおけるベースラインからの変化;(3)ECG所見におけるベースラインからの変化;(4)臨床検査値(血液学、化学及び検尿)におけるベースラインからの変化;(5)適切な場合にカンナビジオール(親化合物)及びこれの7−OH代謝物についての血漿PK変数:(a)最大血漿濃度(Cmax)及び用量正規化Cmax(Cmax/D)(b)Cmax(tmax)までの時間;(c)半減期(t1/2);(d)排出速度;(e)経口クリアランス(カンナビジオールのみ);(f)分布体積(カンナビジオールのみ);(g)1日目での0時間〜12時間の血漿濃度−時間曲線下の面積[AUC(0〜12)]及び用量正規化AUC(0〜12)[AUC(0〜12)/D];(h)1日目での時間0から最終定量化可能濃度の曲線下の面積[AUC(0−last)]:(i)≧2歳の研究対象について1日目での0から無限の血漿濃度−時間曲線下の面積(AUC(0−inf))及び用量正規化AUC(0−inf)[AUC(0−inf)/D];(j)1日目及び10日目でのCmax、AUC(0−inf)、AUC(0〜12)についての代謝物対親比;(k)10日目でのAUC(0〜12)及びAUC(0〜12)/D;(l)10日目での最小血漿濃度(Cmin);(m)10日目での平均血漿濃度(Cavg);(n)10日目でのCmax及びAUC(0〜12)についての蓄積比;(o)時間直線性;(6)11日目での臨床全般改善印象(「CGI−I」)判定;並びに(7)スクリーニング訪問から11日目の臨床全般重症度印象(「CGI−S」)判定におけるベースラインからの変化。
対象を、バイタルサイン及び神経学的検査の測定によって毎日判定する。理学的検査を、スクリーニング訪問、並びに0日目、11日目及び14日目に完了する。12誘導ECGを、スクリーニング訪問、並びに1日目、4日目、8日目、11日目及び14日目に(臨床的に指示されるならば)完了する。血液学分析、化学分析及び尿分析は、スクリーニング訪問、並びに1日目、4日目、8日目及び11日目に行う。血液学分析、化学分析及び尿分析は、臨床的に指示されるならば14日目にも行う。
血漿におけるカンナビジオール及びこれの7−OH代謝物についてのPK濃度及びパラメータを、適切な場合に記述統計学及び図示を使用して研究日、試料採取時間(適切な場合)及び用量によって要約する。これらの結果を、適切な場合、年齢及びmg/kg用量によって図示する。年齢及び体重との曝露関係を、適切な場合に回帰及び/又は推論分析を使用して評価する。カンナビジオール及びこれの7−OH代謝物曝露の用量比例を、適切な場合に、図式方法を使用するとともにパワーモデル手法を統計的に使用して調査する。カンナビジオール及びこれの7−OH代謝物の蓄積を、曝露PKパラメータのための変動モデルの適切な分析を使用して判定する。時間直線性も判定する。予定されている時点で投薬する前に収集されるトラフ濃度試料を、定常状態の達成について図表で判定する。その上、定常状態に達するまでの時間を、段階的直線傾向分析で判定する。クロバザム及びノルクロバザムのレベルを、≧2歳であるとともに現在クロバザムを服用している対象について、1日目(ベースライン)、8日目及び10日目(用量前)に、用量前に採取された試料から測定し、時点及び治療によって要約する。AE、臨床検査評価、バイタルサイン、12誘導ECG、C−SSRS、並びに物理的及び神経学的検査を含めて、全ての安全性判定を列挙する。適切な場合、これらを、年齢及び用量コホートによって記述統計学を用いて要約する。CGI−I、CGI−S、及び毎日の発作日誌判定の結果を、適切な場合に記述統計学によって要約する。
予備的結果は、下記の表61に示されている。コホート#1に、アルコールベースの製剤5mg/kgの単回用量及び次いで5mg/kg BID(10mg/kg/日)を7日間投与した。コホート#2に、脂質ベースの製剤10mg/kgの単回用量及び次いで10mg/kg BID(20mg/kg/日)を7日間投与した。コホート#1に対して、単回投薬は、59.029ng/mLの平均Cmax、3.0時間の平均Tmax及び276.95h*ng/mLのAUCinfをもたらした。コホート#2に対して、単回投薬は、110.522ng/mLの平均Cmax、4.45時間の平均Tmax及び879.273h*ng/mLのAUCinfをもたらした。実証されている通り、脂質ベースの製剤は2倍の投与量及び単回投薬で、アルコールベースの製剤の最大血漿濃度のほぼ2倍を、ほぼ1時間半超で達成した。
非盲検無作為化単一用量2期間2元配置交差食物効果研究を健康な対象に対して行った。研究は、絶食又は摂食条件下で投与された20mg/kg/日のカンナビジオールの単一用量(即ち、上記表25からの製剤#LF10)の薬物動態及び安全性を判定した。二十四(24)人の対象を研究に登録し、各々を別々の期間で絶食及び摂食処置アームに、続いて、7日の洗い出し期間にかけた。薬物動態学的分析のため、公称時間及びデフォルトラムダz選択を使用した。全ての定量化可能な限界未満値をゼロに設定し、全ての対象を分析に含めた。
以下のパラメータを使用して安全性を判定した:包含/除外基準、病歴及び人口統計学、病歴更新、継続している適格性、理学的検査、臨床検査試験、12誘導心電図(ECG)、尿薬物及びアルコールスクリーン、前の薬歴、併用薬物療法、座位血圧、脈拍、呼吸速度及び口腔温度、並びに有害事象(AE)判定。
絶食治療から13人の対象及び摂食治療から24人の対象からのデータを、薬物動態学的及び統計的分析に含めた。
本発明の経口カンナビノイド溶液についての薬物動態学的及び統計的分析の結果は、表62〜67に示されている。表62〜64は、絶食又は摂食条件にある対象への投与を比較した、カンナビジオールの薬物動態学的パラメータを示している。
複数製剤の非盲検無作為化単一用量4治療4期間、4元配置交差食物効果研究を、健康な対象に行った。研究は、摂食条件下で投与された3種の別々のカンナビジオール製剤(上記の表26から#LF41及び#LF42、並びに上記の表15から#A11)及び絶食条件下での1種のカンナビジオール製剤(上記の#LF42)の10mg/kgの単一用量の薬物動態を判定した。対象を研究に登録し、各々を別々の期間で絶食及び摂食処置アームに、続いて、7日の洗い出し期間にかけた。薬物動態学的分析のため、公称時間及びデフォルトラムダz選択を使用した。全ての定量化可能な限界未満値をゼロに設定し、全ての対象を分析に含めた。
i.摂食対絶食でのカンナビジオール経口溶液ゴマ油製剤#LF42
ln(Cmax)、ln(AUC0−t)及びln(AUC0−inf)に基づくカンナビジオール及び7−OH−カンナビジオール最大曝露及び総曝露の両方における実質的増加は、絶食条件下で投与された10mg/kgでの製剤#LF42と比較して、食物を用いる10mg/kgでの製剤#LF42の投与後に観察された。カンナビジオールCmaxは、絶食条件下での投与と比較して、食物を用いる投与後におよそ10.5倍高かった。カンナビジオールAUC0−t及びAUC0−infは、絶食条件下での投与と比較して、食物を用いる投与後にそれぞれおよそ7.5倍及び3.3倍高かった。7−OH−カンナビジオールCmaxは、絶食条件下での投与と比較して、食物を用いる投与後におよそ4.5倍高かった。7−OH−カンナビジオールAUC0−t及びAUC0−infは、絶食条件下での投与と比較して、食物を用いる投与後にそれぞれおよそ4.3倍及び3.7倍高かった。したがって、本発明の脂質製剤を投与する場合に実質的な食物効果がある。
ln(Cmax)、ln(AUC0−t)及びln(AUC0−inf)に基づくカンナビジオール及び7−OH−カンナビジオール最大曝露及び総曝露の両方における実質的増加は、絶食条件下で投与された10mg/kgでの製剤#LF42と比較して、食物を用いる10mg/kgでの製剤#A11の投与後に観察された。カンナビジオールCmaxは、絶食条件下での投与と比較して、食物を用いる投与後におよそ9.5倍高かった。カンナビジオールAUC0−t及びAUC0−infは、絶食条件下での投与と比較して、食物を用いる投与後にそれぞれおよそ6.9倍及び4.0倍高かった。7−OH−カンナビジオールCmaxは、絶食条件下での投与と比較して、食物を用いる投与後におよそ3.8倍高かった。7−OH−カンナビジオールAUC0−t及びAUC0−infは、絶食条件下での投与と比較して、食物を用いる投与後にそれぞれおよそ4.6倍及び4.0倍高かった。したがって、本発明のヒドロ−アルコール製剤を投与する場合、実質的な食物効果がある。
治療耐性発作障害を有する小児対象において複数用量の医薬品カンナビジオール経口溶液(MCT製剤、300mg/mL、BIDで投与)の薬物動態及び安全性を判定するため、第1/2相薬物動態学的研究に以前に参加したことがある難治性てんかんを有する小児患者において、長期安全性研究を行った。これは、難治性てんかんを有する1歳〜17歳の小児対象についての長期非盲検48週研究であった。この研究は、上記において実施例16で詳述されている。
長期安全性研究からのデータの予備的検討は、体重損失を示した。体重における中央値パーセント変化の分析は、24週目で体重変化における用量依存減少を示した。用量依存性は、研究の過程にわたって(最大48週目まで)顕著でなくなった。これは、分析に含まれる患者の少ない数及び後期の時間期間中の投薬の頻繁なシフトによるものであり得る。
以下の研究が進行中であり、結果はまだ記録されていない。
当初治療としてのビガバトリン又は副腎皮質刺激ホルモン(「ACTH」)のいずれかを用いる、幼児痙攣患者における補助治療としてのカンナビジオール経口溶液の効力、安全性を判定するために、第2相多施設無作為化プラセボ制御平行群研究が行われる。
1)ビガバトリン、2)ビガバトリンプラス1日当たり1キログラム当たり20ミリグラム(「mg/kg/日」)のカンナビジオール経口溶液3)ビガバトリンプラス40mg/kg/日のカンナビジオール経口溶液ビガバトリン、4)ACTH、5)ACTHプラス1日当たり1キログラム当たり20ミリグラム(「mg/kg/日」)のカンナビジオール経口溶液、及び6)ACTHプラス40mg/kg/日のカンナビジオール経口溶液。
一次効力エンドポイントは、独立セントラルリーダーによって決定される場合にビデオ−EEGによって確認された痙攣及びヒプスアリスミアの完全消散として定義されている、14日目に完全応答者であると考えられる対象のパーセントである。
方法
一旦患者が研究について承認されると、彼らは、医師がビガバトリン又はACTHのいずれかを処方する研究クリニックに戻り、患者は、適切な研究アームに無作為化される。以下の活動は完了される:1.包含及び除外基準の審査;2)検尿のための尿試料を得る;3.併用薬物療法及び併用手順を記録する;4.バイタルサイン(血圧、脈拍数、呼吸速度及び体温の測定)を記録する;5.身長及び体重を含めた完全な理学的検査を行う。この訪問中に得られた体重は、用量体積を算出するために使用される。投薬体積は、滴定及び治療期間の全体にわたって一定のままである。;6.血液学及び化学のための血液試料を採取する;7.簡易な神経学検査を行う、並びに8.AE及び重篤なAE(「SAE」)を記録する。
一旦、処方ACTH又はビガバトリンが分注される準備が整うと、対象を、0日目に入院患者として研究センターに入所させる。以下の手順及び判定は、1日目のIP投与の前に全ての対象について0日目に行われなければならない;1.併用薬物療法及び併用手順を記録する;2.簡易な神経学検査を行う;3.バイタルサイン(血圧、脈拍数、呼吸速度及び体温の測定)を記録する、4.毎日の発作日誌を記録及び審査する;5.AE及びSAEを記録する、並びに6.24時間ビデオ−EEGを行う。
患者は、対象の割り当てコホートに従って1日目〜14日目まで1日2回(即ち、0mg/kg/日、20mg/kg/日又は40mg/kg/日の全日用量)投薬される。用量は、およそ12時間間隔で投与される。患者は、判定後に研究センターから解放され、6時間の薬物動態採血が完了する。調査用生成物の最終用量は、14日目の夕方に投与される。患者を、24時間ビデオEEGを含む14日目の治療訪問の終了のために入所させる。
以下の活動は、治療期間終了後1カ月、2カ月、3カ月、6カ月及び9カ月で発生する各パートB訪問中に完了される:1.併用薬物療法及び併用手順を記録する;2.バイタルサイン(血圧、脈拍数、呼吸速度及び体温の測定)を記録する;4.毎日の発作及び食物日誌を記録及び審査する;5.身長及び体重を含めた理学的検査を行う;6.簡易な神経学検査を行う、並びに7.AE及びSAEを記録する。
Claims (22)
- プラダー−ウィリー症候群を治療する方法であって、
カンナビジオール;並びに
脂質、水、エタノール、グリセリン、プロピレングリコール、ポリエチレングリコール400及びこれらの組合せからなる群から選択されるビヒクル
を含む、有効量の経口医薬製剤を投与することを含む、方法。 - カンナビジオールが、98%より高い純度を有する、請求項1に記載の方法。
- ビヒクルが中鎖グリセリドである、請求項1に記載の方法。
- 中鎖グリセリドが、トリ(カプリル酸/カプリン酸)グリセリルである、請求項3に記載の製剤。
- アルファ−トコフェロールをさらに含む、請求項4に記載の方法。
- ビヒクルがゴマ油である、請求項1に記載の方法。
- ビヒクルが、エタノール、ポリエチレングリコール、プロピレングリコール及び水の組合せである、請求項1に記載の方法。
- アルファ−トコフェロール及びパルミチン酸アスコルビルをさらに含む、請求項7に記載の方法。
- 製剤が、
約8%〜約31%w/wのカンナビジオール;並びに
約60%〜約90%w/wの脂質からなるビヒクル、又は約40%〜約60%w/wのエタノール、約1%〜約5%w/wのポリエチレングリコール、約5%〜約10%w/wのプロピレングリコール及び約20%〜約40%w/wの水の組合せからなるビヒクル
を含み、ここでw/wが、製剤の重量に対する重量を示す、請求項1に記載の方法。 - カンナビジオールが、約10%w/wの濃度であり、ビヒクルが、約89%w/wの濃度のトリ(カプリル酸/カプリン酸)グリセリルである、請求項9に記載の方法。
- カンナビジオールが、約31%w/wの濃度であり、ビヒクルが、約68%w/wの濃度のトリ(カプリル酸/カプリン酸)グリセリルである、請求項10に記載の方法。
- カンナビジオールが、約11%w/wの濃度であり、ビヒクルが、約80%w/wの濃度のゴマ油である、請求項9に記載の製剤。
- カンナビジオールが、約8.8%w/wの濃度であり、ビヒクルが、約50%w/wの濃度のエタノール、約3%w/wの濃度のポリエチレングリコール、約7.5%w/wの濃度のプロピレングリコール及び約30%w/wの濃度の水の組合せである、請求項9に記載の製剤。
- 有効量が、1日当たり1キログラム当たり約0.5〜約100ミリグラムである、請求項1に記載の方法。
- 有効量が、1日当たり1キログラム当たり約10〜約40ミリグラムである、請求項1に記載の方法。
- プラダー−ウィリー症候群の1つ以上の症状を治療する方法であって、
カンナビジオール;並びに
脂質、水、エタノール、グリセリン、プロピレングリコール、ポリエチレングリコール400及びこれらの組合せからなる群から選択されるビヒクル
を含む、有効量の経口医薬製剤を投与することを含む、方法。 - プラダー−ウィリー症候群の症状が、過食症である、請求項16に記載の方法。
- 幼児痙攣を治療する方法であって、
カンナビジオール;並びに
脂質、水、エタノール、グリセリン、プロピレングリコール、ポリエチレングリコール400及びこれらの組合せからなる群から選択されるビヒクル
を含む、有効量の経口医薬製剤を、これを必要とする患者に投与することを含む、方法。 - 経口医薬製剤の投与の前に、ビガバトリン又は副腎皮質刺激ホルモンが患者に投与される、請求項18に記載の方法。
- 小児欠神てんかんを治療する方法であって、
実質的に純粋なカンナビジオール;並びに
脂質、水、エタノール、グリセリン、プロピレングリコール、ポリエチレングリコール400及びこれらの組合せからなる群から選択されるビヒクル
を含む、有効量の経口医薬製剤を投与することを含む、方法。 - カンナビジオールが、98%より高い純度を有する、請求項19に記載の方法。
- カンナビジオールが合成カンナビジオールである、請求項19に記載の方法。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2022089421A JP2022130390A (ja) | 2017-04-27 | 2022-06-01 | 安定なカンナビノイド製剤 |
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US15/499,178 US20170224634A1 (en) | 2014-05-29 | 2017-04-27 | Stable cannabinoid formulations |
| US15/499,178 | 2017-04-27 | ||
| PCT/US2017/052897 WO2018200024A1 (en) | 2017-04-27 | 2017-09-22 | Stable cannabinoid formulations |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2022089421A Division JP2022130390A (ja) | 2017-04-27 | 2022-06-01 | 安定なカンナビノイド製剤 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2020517727A true JP2020517727A (ja) | 2020-06-18 |
| JP2020517727A5 JP2020517727A5 (ja) | 2020-11-12 |
Family
ID=63920361
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2019558668A Pending JP2020517727A (ja) | 2017-04-27 | 2017-09-22 | 安定なカンナビノイド製剤 |
| JP2022089421A Pending JP2022130390A (ja) | 2017-04-27 | 2022-06-01 | 安定なカンナビノイド製剤 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2022089421A Pending JP2022130390A (ja) | 2017-04-27 | 2022-06-01 | 安定なカンナビノイド製剤 |
Country Status (4)
| Country | Link |
|---|---|
| EP (1) | EP3615079A4 (ja) |
| JP (2) | JP2020517727A (ja) |
| CA (1) | CA3062814C (ja) |
| WO (1) | WO2018200024A1 (ja) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2022130390A (ja) * | 2017-04-27 | 2022-09-06 | フレッシュ・カット・ディベロップメント・エル・エル・シー | 安定なカンナビノイド製剤 |
Families Citing this family (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB2530001B (en) | 2014-06-17 | 2019-01-16 | Gw Pharma Ltd | Use of cannabidiol in the reduction of convulsive seizure frequency in treatment-resistant epilepsy |
| EP4272731A3 (en) | 2018-12-11 | 2024-02-14 | Disruption Labs Inc. | Compositions for the delivery of therapeutic agents and methods of use and making thereof |
| GB2584140A (en) * | 2019-05-23 | 2020-11-25 | Gw Res Ltd | Use of cannabidiol in the treatment of epileptic spasms |
| EP4028059A4 (en) * | 2019-09-09 | 2023-05-24 | Cardiol Therapeutics Inc. | STABLE MEDICINAL COMPOSITIONS OF CANNABIDIOL |
| GB2588461A (en) * | 2019-10-25 | 2021-04-28 | Gw Res Ltd | Use of cannabidiol preparations in the treatment of absence epilepsy |
| EP4376820A1 (en) * | 2021-07-28 | 2024-06-05 | GW Research Limited | Use of cannabidiol in the treatment of epilepsy |
| WO2024079542A1 (en) * | 2022-10-12 | 2024-04-18 | Leiutis Pharmaceuticals Llp | Novel liquid oral formulations of cannabidiol |
| CN116444351A (zh) * | 2022-11-18 | 2023-07-18 | 中国人民解放军军事科学院军事医学研究院 | 一种核辐射损伤中对小肠有保护作用的天然小分子化合物 |
| CN116172988A (zh) * | 2022-11-18 | 2023-05-30 | 中国人民解放军军事科学院军事医学研究院 | 大麻二酚用于制备急性放射病的药物的用途 |
| CN115887426A (zh) * | 2022-11-18 | 2023-04-04 | 中国人民解放军军事科学院军事医学研究院 | 大麻二酚在制备核辐射损伤后骨髓恢复药物中的应用 |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2009538893A (ja) * | 2006-06-01 | 2009-11-12 | ジーダブリュー・ファーマ・リミテッド | カンナビノイドの新規な使用 |
| WO2016191651A1 (en) * | 2015-05-28 | 2016-12-01 | Insys Development Company, Inc. | Stable cannabinoid formulations |
Family Cites Families (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2007103313A (ru) * | 2004-08-03 | 2008-09-10 | ОРЕКСИДЖЕН ТЕРАПЬЮТИКС, ИНК. (Канада/США) (US) | Комбинация бупропина и другого состава для эффективной потери веса |
| NZ568400A (en) * | 2005-11-23 | 2011-11-25 | Ironwood Pharmaceuticals Inc | Methods and compositions for the treatment of gastrointestinal disorders |
| WO2011057199A1 (en) * | 2009-11-06 | 2011-05-12 | Adenios, Inc. | Compositions for treating cns disorders |
| WO2011150338A1 (en) * | 2010-05-27 | 2011-12-01 | Zafgen Corporation | Methods of treating obesity |
| US20160367496A1 (en) * | 2014-05-29 | 2016-12-22 | Insys Development Company, Inc. | Stable cannabinoid formulations |
| CN106999598B (zh) | 2014-05-29 | 2022-02-08 | 鲜切发展有限责任公司 | 稳定的大麻素类化合物制剂 |
| US11331279B2 (en) | 2014-05-29 | 2022-05-17 | Radius Pharmaceuticals, Inc. | Stable cannabinoid formulations |
| US20160271252A1 (en) | 2014-05-29 | 2016-09-22 | Insys Development Company, Inc. | Stable cannabinoid formulations |
| CA3062814C (en) * | 2017-04-27 | 2023-11-14 | Insys Development Company, Inc. | Stable cannabinoid formulations |
-
2017
- 2017-09-22 CA CA3062814A patent/CA3062814C/en active Active
- 2017-09-22 JP JP2019558668A patent/JP2020517727A/ja active Pending
- 2017-09-22 WO PCT/US2017/052897 patent/WO2018200024A1/en unknown
- 2017-09-22 EP EP17907335.8A patent/EP3615079A4/en active Pending
-
2022
- 2022-06-01 JP JP2022089421A patent/JP2022130390A/ja active Pending
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2009538893A (ja) * | 2006-06-01 | 2009-11-12 | ジーダブリュー・ファーマ・リミテッド | カンナビノイドの新規な使用 |
| WO2016191651A1 (en) * | 2015-05-28 | 2016-12-01 | Insys Development Company, Inc. | Stable cannabinoid formulations |
Non-Patent Citations (2)
| Title |
|---|
| "History of Changes for Study: NCT02844933, Cannabidiol Oral Solution for The Treatment of Subjects W", CLINICAL TRIALS.GOV ARCHIVE [ONLINE], JPN6022029773, 31 March 2017 (2017-03-31), ISSN: 0004826038 * |
| PHARMACOLOGY, BIOCHEMISTRY AND BEHAVIOR, vol. 98, JPN6021023816, 2011, pages 268 - 272, ISSN: 0004826037 * |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2022130390A (ja) * | 2017-04-27 | 2022-09-06 | フレッシュ・カット・ディベロップメント・エル・エル・シー | 安定なカンナビノイド製剤 |
Also Published As
| Publication number | Publication date |
|---|---|
| CA3062814A1 (en) | 2018-11-01 |
| EP3615079A1 (en) | 2020-03-04 |
| EP3615079A4 (en) | 2020-09-23 |
| WO2018200024A1 (en) | 2018-11-01 |
| CA3062814C (en) | 2023-11-14 |
| JP2022130390A (ja) | 2022-09-06 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7374951B2 (ja) | 安定なカンナビノイド製剤 | |
| JP2020517727A (ja) | 安定なカンナビノイド製剤 | |
| US20220125932A1 (en) | Stable cannabinoid formulations | |
| US20220280446A1 (en) | Stable cannabinoid formulations | |
| US20170224634A1 (en) | Stable cannabinoid formulations | |
| US20160367496A1 (en) | Stable cannabinoid formulations | |
| US20160271252A1 (en) | Stable cannabinoid formulations | |
| CA3025702C (en) | Stable cannabinoid formulations | |
| US20220054450A1 (en) | Stable cannabinoid formulations |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20200923 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20200923 |
|
| A711 | Notification of change in applicant |
Free format text: JAPANESE INTERMEDIATE CODE: A711 Effective date: 20210419 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20210614 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20210629 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20210924 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20211227 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20220201 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20220601 |
|
| C60 | Trial request (containing other claim documents, opposition documents) |
Free format text: JAPANESE INTERMEDIATE CODE: C60 Effective date: 20220601 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20220620 |
|
| C21 | Notice of transfer of a case for reconsideration by examiners before appeal proceedings |
Free format text: JAPANESE INTERMEDIATE CODE: C21 Effective date: 20220621 |
|
| A912 | Re-examination (zenchi) completed and case transferred to appeal board |
Free format text: JAPANESE INTERMEDIATE CODE: A912 Effective date: 20220715 |
|
| C211 | Notice of termination of reconsideration by examiners before appeal proceedings |
Free format text: JAPANESE INTERMEDIATE CODE: C211 Effective date: 20220726 |
|
| A711 | Notification of change in applicant |
Free format text: JAPANESE INTERMEDIATE CODE: A711 Effective date: 20221003 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20240410 |