JP2020508995A - 癌の処置のためのsmarca2の阻害 - Google Patents
癌の処置のためのsmarca2の阻害 Download PDFInfo
- Publication number
- JP2020508995A JP2020508995A JP2019544887A JP2019544887A JP2020508995A JP 2020508995 A JP2020508995 A JP 2020508995A JP 2019544887 A JP2019544887 A JP 2019544887A JP 2019544887 A JP2019544887 A JP 2019544887A JP 2020508995 A JP2020508995 A JP 2020508995A
- Authority
- JP
- Japan
- Prior art keywords
- smarca2
- activity
- cancer
- smarca4
- subject
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/4427—Non condensed pyridines; Hydrogenated derivatives thereof containing further heterocyclic ring systems
- A61K31/4439—Non condensed pyridines; Hydrogenated derivatives thereof containing further heterocyclic ring systems containing a five-membered ring with nitrogen as a ring hetero atom, e.g. omeprazole
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7088—Compounds having three or more nucleosides or nucleotides
- A61K31/713—Double-stranded nucleic acids or oligonucleotides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7088—Compounds having three or more nucleosides or nucleotides
- A61K31/7105—Natural ribonucleic acids, i.e. containing only riboses attached to adenine, guanine, cytosine or uracil and having 3'-5' phosphodiester links
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/47—Quinolines; Isoquinolines
- A61K31/4709—Non-condensed quinolines and containing further heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/47—Quinolines; Isoquinolines
- A61K31/4738—Quinolines; Isoquinolines ortho- or peri-condensed with heterocyclic ring systems
- A61K31/4745—Quinolines; Isoquinolines ortho- or peri-condensed with heterocyclic ring systems condensed with ring systems having nitrogen as a ring hetero atom, e.g. phenantrolines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/4995—Pyrazines or piperazines forming part of bridged ring systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/529—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim forming part of bridged ring systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/55—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having seven-membered rings, e.g. azelastine, pentylenetetrazole
- A61K31/551—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having seven-membered rings, e.g. azelastine, pentylenetetrazole having two nitrogen atoms, e.g. dilazep
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6876—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes
- C12Q1/6883—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes for diseases caused by alterations of genetic material
- C12Q1/6886—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes for diseases caused by alterations of genetic material for cancer
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/5005—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells
- G01N33/5008—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells for testing or evaluating the effect of chemical or biological compounds, e.g. drugs, cosmetics
- G01N33/5011—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells for testing or evaluating the effect of chemical or biological compounds, e.g. drugs, cosmetics for testing antineoplastic activity
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/574—Immunoassay; Biospecific binding assay; Materials therefor for cancer
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/574—Immunoassay; Biospecific binding assay; Materials therefor for cancer
- G01N33/57484—Immunoassay; Biospecific binding assay; Materials therefor for cancer involving compounds serving as markers for tumor, cancer, neoplasia, e.g. cellular determinants, receptors, heat shock/stress proteins, A-protein, oligosaccharides, metabolites
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/68—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving proteins, peptides or amino acids
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/68—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving proteins, peptides or amino acids
- G01N33/6893—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving proteins, peptides or amino acids related to diseases not provided for elsewhere
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/113—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/10—Type of nucleic acid
- C12N2310/20—Type of nucleic acid involving clustered regularly interspaced short palindromic repeats [CRISPRs]
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2600/00—Oligonucleotides characterized by their use
- C12Q2600/106—Pharmacogenomics, i.e. genetic variability in individual responses to drugs and drug metabolism
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2600/00—Oligonucleotides characterized by their use
- C12Q2600/156—Polymorphic or mutational markers
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2600/00—Oligonucleotides characterized by their use
- C12Q2600/158—Expression markers
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2500/00—Screening for compounds of potential therapeutic value
- G01N2500/04—Screening involving studying the effect of compounds C directly on molecule A (e.g. C are potential ligands for a receptor A, or potential substrates for an enzyme A)
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2800/00—Detection or diagnosis of diseases
- G01N2800/52—Predicting or monitoring the response to treatment, e.g. for selection of therapy based on assay results in personalised medicine; Prognosis
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Immunology (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Molecular Biology (AREA)
- Biomedical Technology (AREA)
- Hematology (AREA)
- Urology & Nephrology (AREA)
- Pharmacology & Pharmacy (AREA)
- Veterinary Medicine (AREA)
- Animal Behavior & Ethology (AREA)
- Epidemiology (AREA)
- Public Health (AREA)
- Biochemistry (AREA)
- Pathology (AREA)
- Analytical Chemistry (AREA)
- Cell Biology (AREA)
- Biotechnology (AREA)
- Physics & Mathematics (AREA)
- Microbiology (AREA)
- Food Science & Technology (AREA)
- General Physics & Mathematics (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Oncology (AREA)
- Hospice & Palliative Care (AREA)
- Organic Chemistry (AREA)
- Genetics & Genomics (AREA)
- Wood Science & Technology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Zoology (AREA)
- General Engineering & Computer Science (AREA)
- Tropical Medicine & Parasitology (AREA)
- Biophysics (AREA)
- Toxicology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Peptides Or Proteins (AREA)
Abstract
Description
本出願は、2017年2月28日に出願された米国仮特許出願第62/464,811号明細書、及び2017年8月7日に出願された同62,542,241号明細書に基づく利益及び優先権を主張し、それぞれの内容全体を参照により本明細書に援用する。
本開示の態様の一部は、SMARCA2は、SMARCA4が変異した癌、又はSMARCA4の活性若しくは機能の低下若しくは喪失に関連する癌における、合成致死性の標的であるという知見に基づいている。したがって、本開示の態様の一部は、SMARCA4の機能が喪失している癌細胞においてSMARCA2を阻害することによって、そうした癌細胞の生存及び/又は増殖を低下又は消失させる方法又は医薬品を提供する。
SMARCA2アンタゴニストは当該技術分野において公知であり、たとえば、下の表2に示す化合物を含む。
本開示は又、本開示の化合物又はその薬学的に許容される塩と、本明細書に開示されている1種又は複数種の他の治療剤とを、薬学的に好適なキャリア又は賦形剤と混合して、本明細書に記載の疾患又は状態を処置又は予防するための用量で含む医薬組成物も提供する。本開示の医薬組成物は又、他の治療剤又は治療法と併用して、同時に、逐次的に又は交互に投与することもできる。
「癌細胞」又は「癌性細胞」は、癌である細胞増殖性障害を発現している細胞である。任意の再現可能な測定手段を用いて、癌細胞又は前癌性細胞を同定することができる。癌細胞又は前癌性細胞は、組織サンプル(たとえば、生検標本)の組織学的分類又はグレード分類により同定してもよい。癌細胞又は前癌性細胞は、適切な分子マーカーの使用により同定してもよい。
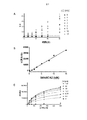
CRISPR/Cas9媒介性遺伝子ノックアウトによるSMARCA2のノックアウトに対する感受性を、CRISPR/Cas9プール型スクリーニングによって判定した。大規模細胞集団を、バーコードをつけた、目的遺伝子へのsgRNAガイドのプール化ライブラリーに感染させた。増殖ベースのスクリーニングについては、実験の開始時と終了時に、ゲノムDNAのシークエンシングにより、バーコード/CRISPR表示を測定し、CRISPR sgRNAにおける相対的な濃縮/減少によって、ノックアウトにより増殖速度が変更された遺伝子を確認した。600超のエピジェネティック遺伝子を標的とする6500の小ガイドRNAを含むカスタムCRISPRレンチウイルスライブラリーを作製し、195の細胞株に対し、40日までの期間にわたってスクリーニングした。KRasを陽性対照としてCRISPR/Cas9ライブラリーに含め、KRasノックアウトに対する感受性は、KRasの変異型と相関性が高いことが観察された。A549肺癌細胞株及びNCIH1299肺癌細胞株を含む、SMARCA4の欠損細胞又は変異型細胞は、SMARCA2ノックアウトに感受性があることが判明した(図1)。SMARCA2とSMARCA4の間の合成致死性の関係は、文献でさらに検証された(Hoffman et al.PNAS,2013,111(8),3128−3133;Wilson et al,Mol.Cell Biol.,2014,34(6),1136−44;Vangamundi et al.Cancer Res.2015,75(18):3865−78;及びOike et al.,Cancer Res.2013 Sep 1;73(17),5508−18;これらの各々の内容は、その全体を参照により本明細書に援用する)。
226の非小細胞肺癌腫瘍サンプルのパネルをスクリーニングして、SMARCA2及びSMACRA4の検出用に最適化された免疫組織化学(IHC)アッセイによってSMARCA2/4タンパク質発現を調査した。IHCスライドが図3A〜3Eに示されている。結果を表3に要約している。
SMARCA4変異型細胞株におけるSMARCA2ノックアウト又は阻害の抗増殖効果は、実施例1に記載したCRISPRプール型スクリーニングの結果により示唆され、これを3種の標的検証アッセイ:遺伝子型シークエンシングアッセイ、蛍光競合アッセイ、及びCRISPRドメインを中心としたスクリーニングでさらに評価した。
ブロモドメインを標的とする既知の阻害剤は、SMARCA2のATPアーゼ活性に対して効果がないことが判明した(表4を参照されたい)。SMARCA2のATPアーゼ及び非ブロモドメイン機能は、SMARCA4機能喪失細胞の生存能に必要である。このため、実行可能なアンタゴニスト又は阻害剤(すなわち、ATPアーゼ阻害剤)の開発にはATPアーゼ活性をモニターする方法が必要である。
Claims (30)
- SMARCA4の活性又は機能が低下している細胞においてSMARCA2活性を調節することを含む方法。
- 前記細胞が、インビボ、エクスビボ、インビトロ又はインサイチュにある、請求項1に記載の方法。
- 前記細胞が対象の中にあり、前記方法がSMARCA2アンタゴニストを前記対象に投与することを含む、請求項1又は2に記載の方法。
- 前記細胞がエクスビボ又はインビトロにあり、前記細胞が、腫瘍を有する対象から単離されるか、又は腫瘍を有する対象に由来する、請求項1〜3のいずれか一項に記載の方法。
- 前記腫瘍が悪性である、請求項4に記載の方法。
- 前記腫瘍が転移性である、請求項4又は5に記載の方法。
- 癌を処置する方法を必要とする対象における癌を処置する方法であって、前記方法が、治療有効量のSMARCA2アンタゴニストを前記対象又は前記対象の細胞に投与することを含み、前記対象又は前記対象の細胞は、SMARCA4の活性又は機能が、SMARCA4の活性又は機能の対照レベルと比較した際に低下している、方法。
- 前記対照レベルが、癌を有していない対象におけるSMARCA4の活性又は機能のレベルである、請求項7に記載の方法。
- 前記細胞又は前記対象のSMARCA4の活性又は機能の低下に基づいて、前記SMARCA2アンタゴニストを前記細胞又は前記対象に投与することを含む、請求項1〜8のいずれか一項に記載の方法。
- 癌を有する対象を、SMARCA2アンタゴニストでの処置を受ける候補として識別する方法であって、前記方法が、
前記対象の癌細胞中のSMARCA4の活性又は機能のレベルを検出すること、
前記癌細胞中に検出されたSMARCA4の活性又は機能のレベルを対照レベル又は参照レベルと比較することを含み、
前記癌細胞中のSMARCA4の活性又は機能のレベルが前記対照レベル又は参照レベルと比較した際に低下している場合に、前記対象が、SMARCA2アンタゴニストでの処置を受ける候補として識別される、方法。 - 前記対象から癌細胞を含むサンプルを取得することを含む、請求項10に記載の方法。
- 癌細胞を、SMARCA2アンタゴニストでの処置に感受性があるとして識別する方法であって、前記方法が、
前記癌細胞中のSMARCA4の活性又は機能のレベルを検出すること、
前記癌中に検出されたSMARCA4の活性又は機能のレベルを対照レベル又は参照レベルと比較することを含み、
前記SMARCA4の活性又は機能のレベルが前記対照レベル又は参照レベルと比較して低下している場合に、前記細胞が、SMARCA2アンタゴニストでの処置に感受性があるとして識別される、方法。 - SMARCA4の活性又は機能の前記対照レベル又は参照レベルが、前記癌細胞と同源の健常な細胞中に観察又は予測されるSMARCA4のレベルである、請求項10〜12のいずれか一項に記載の方法。
- 前記SMARCA2アンタゴニストが、SMARCA2のヘリカーゼ活性を、少なくとも10%、少なくとも20%、少なくとも30%、少なくとも40%、少なくとも50%、少なくとも60%、少なくとも70%、少なくとも80%、少なくとも90%、少なくとも95%、少なくとも98%、若しくは少なくとも99%阻害し、又はSMARCA2活性を消失させる、請求項1〜13のいずれか一項に記載の方法。
- 前記SMARCA2アンタゴニストが、SMARCA2のATPアーゼ活性を、少なくとも10%、少なくとも20%、少なくとも30%、少なくとも40%、少なくとも50%、少なくとも60%、少なくとも70%、少なくとも80%、少なくとも90%、少なくとも95%、少なくとも98%、若しくは少なくとも99%阻害し、又はSMARCA2活性を消失させる、請求項1〜14のいずれか一項に記載の方法。
- 前記SMARCA2アンタゴニストが選択的SMARCA2アンタゴニストである、請求項1〜15のいずれか一項に記載の方法。
- 前記SMARCA2アンタゴニストが、SMARCA2活性を、SMARCA4活性より少なくとも2倍、少なくとも5倍、少なくとも10倍、少なくとも20倍、少なくとも50倍、少なくとも100倍、少なくとも1000倍、少なくとも10000倍、又は少なくとも100000倍効率的に阻害する、請求項1〜16のいずれか一項に記載の方法。
- 前記SMARCA2アンタゴニストがSMARCA4を阻害しない、請求項16又は17に記載の方法。
- 前記SMARCA2アンタゴニストが、SMARCA2のヘリカーゼドメインを標的とする、請求項1〜18のいずれか一項に記載の方法。
- 前記SMARCA2アンタゴニストがSMARCA2のATPアーゼドメインを標的とする、請求項1〜19のいずれか一項に記載の方法。
- 前記SMARCA2アンタゴニストがSMARCA2のブロモドメイン活性を標的としない、請求項1〜20のいずれか一項に記載の方法。
- 前記SMARCA4の活性の低下が、遺伝子変異によって引き起こされる、請求項1〜21のいずれか一項に記載の方法。
- 前記SMARCA4の活性の低下が、エピジェネティックな変化によって引き起こされる、請求項1〜22のいずれか一項に記載の方法。
- 前記SMARCA4の活性の低下が、SMARCA4遺伝子転写の低下により、SMARCA4遺伝子転写産物翻訳の低下により、翻訳後修飾により、タンパク質−タンパク質相互作用の消失により、又はこれらの組合せにより、引き起こされる、請求項1〜23のいずれか一項に記載の方法。
- 前記SMARCA2アンタゴニストがSMARCA2阻害剤である、請求項1〜24のいずれか一項に記載の方法。
- 前記SMARCA2アンタゴニストが、アンチセンスRNA、shRNA、siRNA、CRISPR/Cas9、転写活性化因子様エフェクターヌクレアーゼ(TALEN)、ジンクフィンガーヌクレアーゼ(ZFN)、抗体、抗体フラグメント及び抗体ミメティックからなる群から選択される、請求項1〜25のいずれか一項に記載の方法。
- 前記SMARCA2アンタゴニストがPFI−3である、請求項1〜15及び22〜26のいずれか一項に記載の方法。
- 癌の処置に使用するためのSMARCA2アンタゴニストを必要とする対象における、癌の処置に使用するためのSMARCA2アンタゴニストであって、前記対象又は前記対象の細胞は、SMARCA4の活性又は機能が、SMARCA4の活性又は機能の対照レベルと比較した際に低下している、癌の処置に使用するためのSMARCA2アンタゴニスト。
- 癌の処置用の医薬品として使用するためのSMARCA2アンタゴニストを必要とする対象における、癌の処置用の医薬品として使用するためのSMARCA2アンタゴニストであって、前記対象又は前記対象の細胞は、SMARCA4の活性又は機能が、SMARCA4の活性又は機能の対照レベルと比較した際に低下している、癌の処置用の医薬品として使用するためのSMARCA2アンタゴニスト。
- 癌の処置用の医薬品の製造におけるSMARCA2アンタゴニストの使用を必要とする対象における、癌の処置用の医薬品の製造におけるSMARCA2アンタゴニストの使用であって、前記対象又は前記対象の細胞は、SMARCA4の活性又は機能が、SMARCA4の活性又は機能の対照レベルと比較した際に低下している、癌の処置用の医薬品の製造におけるSMARCA2アンタゴニストの使用。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2022116375A JP2022136149A (ja) | 2017-02-28 | 2022-07-21 | 癌の処置のためのsmarca2の阻害 |
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201762464811P | 2017-02-28 | 2017-02-28 | |
| US62/464,811 | 2017-02-28 | ||
| US201762542241P | 2017-08-07 | 2017-08-07 | |
| US62/542,241 | 2017-08-07 | ||
| PCT/US2018/020124 WO2018160636A1 (en) | 2017-02-28 | 2018-02-28 | Inhibition of smarca2 for treatment of cancer |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2022116375A Division JP2022136149A (ja) | 2017-02-28 | 2022-07-21 | 癌の処置のためのsmarca2の阻害 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2020508995A true JP2020508995A (ja) | 2020-03-26 |
| JP2020508995A5 JP2020508995A5 (ja) | 2021-04-08 |
Family
ID=63371135
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2019544887A Pending JP2020508995A (ja) | 2017-02-28 | 2018-02-28 | 癌の処置のためのsmarca2の阻害 |
| JP2022116375A Pending JP2022136149A (ja) | 2017-02-28 | 2022-07-21 | 癌の処置のためのsmarca2の阻害 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2022116375A Pending JP2022136149A (ja) | 2017-02-28 | 2022-07-21 | 癌の処置のためのsmarca2の阻害 |
Country Status (13)
| Country | Link |
|---|---|
| US (2) | US20200069669A1 (ja) |
| EP (1) | EP3589289A4 (ja) |
| JP (2) | JP2020508995A (ja) |
| KR (1) | KR20190140438A (ja) |
| CN (1) | CN110366418A (ja) |
| AU (2) | AU2018227774A1 (ja) |
| BR (1) | BR112019017851A2 (ja) |
| CA (1) | CA3054682A1 (ja) |
| CL (1) | CL2019002427A1 (ja) |
| IL (1) | IL268676A (ja) |
| MX (1) | MX2019010149A (ja) |
| SG (2) | SG10202109335TA (ja) |
| WO (1) | WO2018160636A1 (ja) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2022136149A (ja) * | 2017-02-28 | 2022-09-15 | エピザイム,インコーポレイティド | 癌の処置のためのsmarca2の阻害 |
Families Citing this family (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN112153984A (zh) | 2018-01-30 | 2020-12-29 | 福宏治疗公司 | 化合物及其用途 |
| WO2020106915A1 (en) * | 2018-11-21 | 2020-05-28 | Foghorn Therapeutics Inc. | Methods of treating cancers |
| CN114390924A (zh) * | 2019-06-27 | 2022-04-22 | 达纳-法伯癌症研究公司 | 用于蛋白质降解的化合物、组合物和方法 |
| MX2022002244A (es) | 2019-09-12 | 2022-03-22 | Aurigene Discovery Tech Ltd | Metodo para identificar respondedores a degradantes de smarca2/4. |
| JP2023512039A (ja) * | 2020-01-29 | 2023-03-23 | フォグホーン セラピューティクス インコーポレイテッド | 化合物及びその使用 |
| JP2023535124A (ja) * | 2020-05-20 | 2023-08-16 | フォグホーン セラピューティクス インコーポレイテッド | がんを治療する方法 |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2015005473A1 (ja) * | 2013-07-12 | 2015-01-15 | 独立行政法人国立がん研究センター | がんの治療への応答性を予測する方法 |
Family Cites Families (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP2971094B1 (en) * | 2013-03-15 | 2021-09-15 | Novartis AG | Biomarkers associated with brm inhibition |
| WO2015103431A1 (en) * | 2013-12-31 | 2015-07-09 | Memorial Sloan-Kettering Cancer Center | Compositions and methods for the diagnosis and treatment of ovarian cancers that are associated with reduced smarca4 gene expression or protein function |
| MA41598A (fr) * | 2015-02-25 | 2018-01-02 | Constellation Pharmaceuticals Inc | Composés thérapeutiques de pyridazine et leurs utilisations |
| JP2019527037A (ja) * | 2016-06-08 | 2019-09-26 | ジェネンテック, インコーポレイテッド | がんのための診断及び治療方法 |
| CN110366418A (zh) * | 2017-02-28 | 2019-10-22 | 埃皮兹姆公司 | 抑制smarca2用于治疗癌症 |
| BR112021001263A2 (pt) * | 2018-07-24 | 2021-04-27 | Epizyme, Inc. | compostos, seus usos, método para tratar câncer e método para modular uma atividade de smarca2 |
-
2018
- 2018-02-28 CN CN201880014651.2A patent/CN110366418A/zh active Pending
- 2018-02-28 WO PCT/US2018/020124 patent/WO2018160636A1/en unknown
- 2018-02-28 SG SG10202109335T patent/SG10202109335TA/en unknown
- 2018-02-28 CA CA3054682A patent/CA3054682A1/en active Pending
- 2018-02-28 BR BR112019017851A patent/BR112019017851A2/pt unknown
- 2018-02-28 MX MX2019010149A patent/MX2019010149A/es unknown
- 2018-02-28 JP JP2019544887A patent/JP2020508995A/ja active Pending
- 2018-02-28 KR KR1020197028241A patent/KR20190140438A/ko not_active Application Discontinuation
- 2018-02-28 AU AU2018227774A patent/AU2018227774A1/en not_active Abandoned
- 2018-02-28 EP EP18760511.8A patent/EP3589289A4/en not_active Withdrawn
- 2018-02-28 SG SG11201907420VA patent/SG11201907420VA/en unknown
- 2018-02-28 US US16/489,489 patent/US20200069669A1/en not_active Abandoned
-
2019
- 2019-08-13 IL IL26867619A patent/IL268676A/en unknown
- 2019-08-23 CL CL2019002427A patent/CL2019002427A1/es unknown
-
2022
- 2022-06-24 US US17/848,885 patent/US20230000849A1/en active Pending
- 2022-07-21 JP JP2022116375A patent/JP2022136149A/ja active Pending
-
2024
- 2024-04-12 AU AU2024202398A patent/AU2024202398A1/en active Pending
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2015005473A1 (ja) * | 2013-07-12 | 2015-01-15 | 独立行政法人国立がん研究センター | がんの治療への応答性を予測する方法 |
Non-Patent Citations (2)
| Title |
|---|
| CANCER RES. (2013) VOL.73, ISSUE 17,P.5508-5518, JPN6022002114, ISSN: 0004689652 * |
| PROC. NATL. ACAD. SCI. U.S.A. (2014) VOL.111, NO .8, P.3128-3133, JPN6022002113, ISSN: 0004689653 * |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2022136149A (ja) * | 2017-02-28 | 2022-09-15 | エピザイム,インコーポレイティド | 癌の処置のためのsmarca2の阻害 |
Also Published As
| Publication number | Publication date |
|---|---|
| SG10202109335TA (en) | 2021-10-28 |
| US20200069669A1 (en) | 2020-03-05 |
| SG11201907420VA (en) | 2019-09-27 |
| IL268676A (en) | 2019-10-31 |
| CN110366418A (zh) | 2019-10-22 |
| EP3589289A4 (en) | 2020-12-02 |
| AU2024202398A1 (en) | 2024-05-02 |
| JP2022136149A (ja) | 2022-09-15 |
| CA3054682A1 (en) | 2018-09-07 |
| CL2019002427A1 (es) | 2020-01-31 |
| KR20190140438A (ko) | 2019-12-19 |
| US20230000849A1 (en) | 2023-01-05 |
| AU2018227774A1 (en) | 2019-09-19 |
| BR112019017851A2 (pt) | 2020-04-14 |
| MX2019010149A (es) | 2020-02-05 |
| EP3589289A1 (en) | 2020-01-08 |
| WO2018160636A1 (en) | 2018-09-07 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2020508995A (ja) | 癌の処置のためのsmarca2の阻害 | |
| JP7472080B2 (ja) | メラノーマの処置および診断 | |
| JP6295081B2 (ja) | フラザノベンゾイミダゾールに対する薬物応答のバイオマーカーとしてのアセチル化チューブリンの使用 | |
| JP6109951B2 (ja) | 結腸癌の処置および診断 | |
| KR20120093049A (ko) | Parp 억제제 및 백금 약물을 사용하는 화학요법적 치료에 대한 암 세포의 반응성을 결정하는 msh3 발현 상태 | |
| Abboud-Jarrous et al. | Protein S drives oral squamous cell carcinoma tumorigenicity through regulation of AXL | |
| US20210025893A1 (en) | Sting levels as a biomarker for cancer immunotherapy | |
| JP2022061987A (ja) | 癌細胞に結合するdnaアプタマー | |
| Menon et al. | Ligand modulation of a dinuclear platinum compound leads to mechanistic differences in cell cycle progression and arrest | |
| JP2010521657A (ja) | 有糸分裂阻害剤に対する腫瘍細胞の感受性を検出してモジュレートするための方法 | |
| US20200080155A1 (en) | Dot1l inhibitors and uses thereof | |
| US8598188B2 (en) | Method for predicting therapeutic efficacy of chemotherapy on non-small-cell lung cancer | |
| Alifano et al. | Neurotensin expression and outcome of malignant pleural mesothelioma | |
| WO2023091990A1 (en) | Compositions and methods targeting gaba signaling pathway for solid tumor cancer treatment | |
| WO2016029127A1 (en) | Dot1l inhibitors and uses thereof | |
| WO2015134603A2 (en) | Methods for treating cancer | |
| US20230121867A1 (en) | Compositions and methods for treating diseases and conditions by depletion of mitochondrial or genomic dna from circulation | |
| US20180346988A1 (en) | Znf532 for diagnosis and treatment of cancer | |
| KR20220152287A (ko) | 투카티닙으로 her2 돌연변이 암을 치료하는 방법 | |
| JP2022532667A (ja) | Gpcrヘテロマー阻害剤及びその使用 | |
| US20240156800A1 (en) | Ep300 degrader and uses thereof in neuroblastoma | |
| US20220193056A1 (en) | Compositions and methods of treating pik3ca helical domain mutant cancers | |
| US20220307030A1 (en) | Uses of synthetic lethal partners for treatment of cancer | |
| Thornton | The 78 kDa glucose regulated protein (GRP78) as a potential treatment predictive biomarker and therapeutic target in colorectal cancer adjuvant chemotherapy |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| RD03 | Notification of appointment of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7423 Effective date: 20191105 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20191108 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20210224 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20210224 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20220125 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20220128 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20220927 |