JP2017525766A - アルキル化インフルエンザワクチン - Google Patents
アルキル化インフルエンザワクチン Download PDFInfo
- Publication number
- JP2017525766A JP2017525766A JP2017529592A JP2017529592A JP2017525766A JP 2017525766 A JP2017525766 A JP 2017525766A JP 2017529592 A JP2017529592 A JP 2017529592A JP 2017529592 A JP2017529592 A JP 2017529592A JP 2017525766 A JP2017525766 A JP 2017525766A
- Authority
- JP
- Japan
- Prior art keywords
- alkylating agent
- influenza
- influenza virus
- strain
- influenza vaccine
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 229960003971 influenza vaccine Drugs 0.000 title claims abstract description 128
- 101710154606 Hemagglutinin Proteins 0.000 claims abstract description 263
- 101710093908 Outer capsid protein VP4 Proteins 0.000 claims abstract description 263
- 101710135467 Outer capsid protein sigma-1 Proteins 0.000 claims abstract description 263
- 101710176177 Protein A56 Proteins 0.000 claims abstract description 263
- 239000000185 hemagglutinin Substances 0.000 claims abstract description 258
- 239000002168 alkylating agent Substances 0.000 claims abstract description 151
- 229940100198 alkylating agent Drugs 0.000 claims abstract description 150
- 125000000151 cysteine group Chemical group N[C@@H](CS)C(=O)* 0.000 claims abstract description 65
- 238000004519 manufacturing process Methods 0.000 claims abstract description 33
- 238000003556 assay Methods 0.000 claims abstract description 29
- 230000005855 radiation Effects 0.000 claims abstract description 6
- 241000712461 unidentified influenza virus Species 0.000 claims description 179
- 108091007433 antigens Proteins 0.000 claims description 92
- 239000000427 antigen Substances 0.000 claims description 91
- 102000036639 antigens Human genes 0.000 claims description 91
- 238000000034 method Methods 0.000 claims description 90
- PGLTVOMIXTUURA-UHFFFAOYSA-N iodoacetamide Chemical compound NC(=O)CI PGLTVOMIXTUURA-UHFFFAOYSA-N 0.000 claims description 78
- 241000700605 Viruses Species 0.000 claims description 66
- 210000004027 cell Anatomy 0.000 claims description 66
- 230000029936 alkylation Effects 0.000 claims description 47
- 238000005804 alkylation reaction Methods 0.000 claims description 47
- 229960005486 vaccine Drugs 0.000 claims description 44
- WSFSSNUMVMOOMR-UHFFFAOYSA-N Formaldehyde Chemical compound O=C WSFSSNUMVMOOMR-UHFFFAOYSA-N 0.000 claims description 35
- XUJNEKJLAYXESH-REOHCLBHSA-N L-Cysteine Chemical group SC[C@H](N)C(O)=O XUJNEKJLAYXESH-REOHCLBHSA-N 0.000 claims description 26
- 239000000126 substance Substances 0.000 claims description 26
- 235000018102 proteins Nutrition 0.000 claims description 23
- 108090000623 proteins and genes Proteins 0.000 claims description 23
- 102000004169 proteins and genes Human genes 0.000 claims description 23
- 239000002245 particle Substances 0.000 claims description 21
- 230000002779 inactivation Effects 0.000 claims description 20
- 230000003612 virological effect Effects 0.000 claims description 18
- 241000271566 Aves Species 0.000 claims description 14
- 230000008569 process Effects 0.000 claims description 14
- 238000011026 diafiltration Methods 0.000 claims description 12
- 230000011987 methylation Effects 0.000 claims description 12
- 238000007069 methylation reaction Methods 0.000 claims description 12
- GPRLSGONYQIRFK-MNYXATJNSA-N triton Chemical group [3H+] GPRLSGONYQIRFK-MNYXATJNSA-N 0.000 claims description 12
- 229960003964 deoxycholic acid Drugs 0.000 claims description 11
- 230000000415 inactivating effect Effects 0.000 claims description 10
- 239000004094 surface-active agent Substances 0.000 claims description 9
- LZZYPRNAOMGNLH-UHFFFAOYSA-M Cetrimonium bromide Chemical compound [Br-].CCCCCCCCCCCCCCCC[N+](C)(C)C LZZYPRNAOMGNLH-UHFFFAOYSA-M 0.000 claims description 8
- 210000004102 animal cell Anatomy 0.000 claims description 8
- PGLTVOMIXTUURA-HQMMCQRPSA-N 2-iodoacetamide Chemical group N[14C](=O)CI PGLTVOMIXTUURA-HQMMCQRPSA-N 0.000 claims description 7
- 241000238631 Hexapoda Species 0.000 claims description 7
- 230000002152 alkylating effect Effects 0.000 claims description 7
- 238000004113 cell culture Methods 0.000 claims description 7
- 239000003795 chemical substances by application Substances 0.000 claims description 7
- 229960000380 propiolactone Drugs 0.000 claims description 7
- 238000006731 degradation reaction Methods 0.000 claims description 6
- 210000004962 mammalian cell Anatomy 0.000 claims description 6
- BSSNZUFKXJJCBG-UPHRSURJSA-N (z)-but-2-enediamide Chemical compound NC(=O)\C=C/C(N)=O BSSNZUFKXJJCBG-UPHRSURJSA-N 0.000 claims description 5
- FSSPGSAQUIYDCN-UHFFFAOYSA-N 1,3-Propane sultone Chemical compound O=S1(=O)CCCO1 FSSPGSAQUIYDCN-UHFFFAOYSA-N 0.000 claims description 5
- ACGVKXZPAUDGMM-UHFFFAOYSA-N 2-(4-methylphenyl)sulfonylacetamide Chemical compound CC1=CC=C(S(=O)(=O)CC(N)=O)C=C1 ACGVKXZPAUDGMM-UHFFFAOYSA-N 0.000 claims description 5
- JUIKUQOUMZUFQT-UHFFFAOYSA-N 2-bromoacetamide Chemical compound NC(=O)CBr JUIKUQOUMZUFQT-UHFFFAOYSA-N 0.000 claims description 5
- KGIGUEBEKRSTEW-UHFFFAOYSA-N 2-vinylpyridine Chemical compound C=CC1=CC=CC=N1 KGIGUEBEKRSTEW-UHFFFAOYSA-N 0.000 claims description 5
- 241000195493 Cryptophyta Species 0.000 claims description 5
- 241000233866 Fungi Species 0.000 claims description 5
- HDFGOPSGAURCEO-UHFFFAOYSA-N N-ethylmaleimide Chemical compound CCN1C(=O)C=CC1=O HDFGOPSGAURCEO-UHFFFAOYSA-N 0.000 claims description 5
- HANVEJJSIBVHGH-GEMLJDPKSA-N NC(=O)CBr.N[C@@H](CCC(=O)N[C@@H](CS)C(=O)NCC(O)=O)C(O)=O Chemical compound NC(=O)CBr.N[C@@H](CCC(=O)N[C@@H](CS)C(=O)NCC(O)=O)C(O)=O HANVEJJSIBVHGH-GEMLJDPKSA-N 0.000 claims description 5
- 230000015556 catabolic process Effects 0.000 claims description 5
- WBJINCZRORDGAQ-UHFFFAOYSA-N ethyl formate Chemical compound CCOC=O WBJINCZRORDGAQ-UHFFFAOYSA-N 0.000 claims description 5
- YLEAHEKEZRNPIM-UHFFFAOYSA-N ethyl-hydroxy-oxo-sulfanylidene-$l^{6}-sulfane Chemical compound CCS(O)(=O)=S YLEAHEKEZRNPIM-UHFFFAOYSA-N 0.000 claims description 5
- JDNTWHVOXJZDSN-UHFFFAOYSA-N iodoacetic acid Chemical compound OC(=O)CI JDNTWHVOXJZDSN-UHFFFAOYSA-N 0.000 claims description 5
- 238000004949 mass spectrometry Methods 0.000 claims description 5
- 238000012545 processing Methods 0.000 claims description 5
- 210000005253 yeast cell Anatomy 0.000 claims description 5
- IEORSVTYLWZQJQ-UHFFFAOYSA-N 2-(2-nonylphenoxy)ethanol Chemical compound CCCCCCCCCC1=CC=CC=C1OCCO IEORSVTYLWZQJQ-UHFFFAOYSA-N 0.000 claims description 4
- GHAZCVNUKKZTLG-UHFFFAOYSA-N N-ethyl-succinimide Natural products CCN1C(=O)CCC1=O GHAZCVNUKKZTLG-UHFFFAOYSA-N 0.000 claims description 4
- 229920000847 nonoxynol Polymers 0.000 claims description 4
- 229940045946 sodium taurodeoxycholate Drugs 0.000 claims description 4
- YXHRQQJFKOHLAP-FVCKGWAHSA-M sodium;2-[[(4r)-4-[(3r,5r,8r,9s,10s,12s,13r,14s,17r)-3,12-dihydroxy-10,13-dimethyl-2,3,4,5,6,7,8,9,11,12,14,15,16,17-tetradecahydro-1h-cyclopenta[a]phenanthren-17-yl]pentanoyl]amino]ethanesulfonate Chemical compound [Na+].C([C@H]1CC2)[C@H](O)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H]([C@@H](CCC(=O)NCCS([O-])(=O)=O)C)[C@@]2(C)[C@@H](O)C1 YXHRQQJFKOHLAP-FVCKGWAHSA-M 0.000 claims description 4
- 239000000592 Artificial Cell Substances 0.000 claims description 3
- 229940124873 Influenza virus vaccine Drugs 0.000 claims description 3
- 230000000593 degrading effect Effects 0.000 claims description 3
- FDGBKPKLBZGFKU-UHFFFAOYSA-N methyl (methyldisulfanyl)formate Chemical compound COC(=O)SSC FDGBKPKLBZGFKU-UHFFFAOYSA-N 0.000 claims description 3
- 238000009792 diffusion process Methods 0.000 claims description 2
- PEEHTFAAVSWFBL-UHFFFAOYSA-N Maleimide Chemical compound O=C1NC(=O)C=C1 PEEHTFAAVSWFBL-UHFFFAOYSA-N 0.000 claims 2
- KXGVEGMKQFWNSR-LLQZFEROSA-N deoxycholic acid Chemical compound C([C@H]1CC2)[C@H](O)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H]([C@@H](CCC(O)=O)C)[C@@]2(C)[C@@H](O)C1 KXGVEGMKQFWNSR-LLQZFEROSA-N 0.000 claims 2
- 230000003247 decreasing effect Effects 0.000 claims 1
- 238000003860 storage Methods 0.000 abstract description 19
- 230000000951 immunodiffusion Effects 0.000 abstract description 5
- 241000283073 Equus caballus Species 0.000 description 86
- 241000287828 Gallus gallus Species 0.000 description 70
- 235000013330 chicken meat Nutrition 0.000 description 70
- 241001500351 Influenzavirus A Species 0.000 description 59
- 241000197306 H1N1 subtype Species 0.000 description 50
- 206010022000 influenza Diseases 0.000 description 49
- 239000000203 mixture Substances 0.000 description 49
- 241000282898 Sus scrofa Species 0.000 description 47
- 241000725681 Swine influenza virus Species 0.000 description 44
- 102000004196 processed proteins & peptides Human genes 0.000 description 29
- 108090000765 processed proteins & peptides Proteins 0.000 description 29
- 229920001184 polypeptide Polymers 0.000 description 25
- 241001465754 Metazoa Species 0.000 description 20
- 150000001413 amino acids Chemical class 0.000 description 19
- 230000002163 immunogen Effects 0.000 description 19
- 239000000523 sample Substances 0.000 description 18
- 241000272525 Anas platyrhynchos Species 0.000 description 17
- 239000002671 adjuvant Substances 0.000 description 16
- 238000005259 measurement Methods 0.000 description 16
- 241001506042 Duck influenza virus Species 0.000 description 15
- 229960004279 formaldehyde Drugs 0.000 description 14
- 230000005847 immunogenicity Effects 0.000 description 14
- 241000712431 Influenza A virus Species 0.000 description 13
- 235000013601 eggs Nutrition 0.000 description 13
- 235000018417 cysteine Nutrition 0.000 description 12
- 238000009472 formulation Methods 0.000 description 12
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 11
- 230000028993 immune response Effects 0.000 description 11
- 208000015181 infectious disease Diseases 0.000 description 11
- 241000272814 Anser sp. Species 0.000 description 10
- 241000282412 Homo Species 0.000 description 10
- 125000000217 alkyl group Chemical group 0.000 description 10
- 241000713196 Influenza B virus Species 0.000 description 9
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 9
- 238000004458 analytical method Methods 0.000 description 9
- 230000009467 reduction Effects 0.000 description 9
- FHHPUSMSKHSNKW-SMOYURAASA-M sodium deoxycholate Chemical compound [Na+].C([C@H]1CC2)[C@H](O)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H]([C@@H](CCC([O-])=O)C)[C@@]2(C)[C@@H](O)C1 FHHPUSMSKHSNKW-SMOYURAASA-M 0.000 description 9
- 230000015572 biosynthetic process Effects 0.000 description 8
- 239000003814 drug Substances 0.000 description 8
- 239000000499 gel Substances 0.000 description 8
- 230000007774 longterm Effects 0.000 description 8
- 239000000047 product Substances 0.000 description 8
- 239000000243 solution Substances 0.000 description 8
- 238000002255 vaccination Methods 0.000 description 8
- 239000003981 vehicle Substances 0.000 description 8
- 241000196324 Embryophyta Species 0.000 description 7
- 241000699670 Mus sp. Species 0.000 description 7
- 235000001014 amino acid Nutrition 0.000 description 7
- 201000010099 disease Diseases 0.000 description 7
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 7
- 229940079593 drug Drugs 0.000 description 7
- 238000002474 experimental method Methods 0.000 description 7
- 238000007918 intramuscular administration Methods 0.000 description 7
- 230000007246 mechanism Effects 0.000 description 7
- 238000004062 sedimentation Methods 0.000 description 7
- 239000011780 sodium chloride Substances 0.000 description 7
- 201000010740 swine influenza Diseases 0.000 description 7
- 150000003573 thiols Chemical class 0.000 description 7
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 6
- VEZXCJBBBCKRPI-UHFFFAOYSA-N beta-propiolactone Chemical compound O=C1CCO1 VEZXCJBBBCKRPI-UHFFFAOYSA-N 0.000 description 6
- 238000006243 chemical reaction Methods 0.000 description 6
- 238000011161 development Methods 0.000 description 6
- 230000018109 developmental process Effects 0.000 description 6
- 239000012530 fluid Substances 0.000 description 6
- 239000012528 membrane Substances 0.000 description 6
- 244000144977 poultry Species 0.000 description 6
- 235000013594 poultry meat Nutrition 0.000 description 6
- 239000000725 suspension Substances 0.000 description 6
- 241000283086 Equidae Species 0.000 description 5
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 5
- 241000282887 Suidae Species 0.000 description 5
- 241000607479 Yersinia pestis Species 0.000 description 5
- 239000003599 detergent Substances 0.000 description 5
- 239000008121 dextrose Substances 0.000 description 5
- 239000003937 drug carrier Substances 0.000 description 5
- 239000000839 emulsion Substances 0.000 description 5
- 208000037797 influenza A Diseases 0.000 description 5
- 230000003993 interaction Effects 0.000 description 5
- 238000001990 intravenous administration Methods 0.000 description 5
- 230000000670 limiting effect Effects 0.000 description 5
- 230000003472 neutralizing effect Effects 0.000 description 5
- -1 polyethylene Polymers 0.000 description 5
- 238000007920 subcutaneous administration Methods 0.000 description 5
- 238000012546 transfer Methods 0.000 description 5
- 241000282472 Canis lupus familiaris Species 0.000 description 4
- 241000283153 Cetacea Species 0.000 description 4
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 4
- 241000282326 Felis catus Species 0.000 description 4
- 241000286209 Phasianidae Species 0.000 description 4
- 206010035148 Plague Diseases 0.000 description 4
- 229920004890 Triton X-100 Polymers 0.000 description 4
- 241000251539 Vertebrata <Metazoa> Species 0.000 description 4
- 239000002253 acid Substances 0.000 description 4
- 239000008186 active pharmaceutical agent Substances 0.000 description 4
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 4
- 210000004369 blood Anatomy 0.000 description 4
- 239000008280 blood Substances 0.000 description 4
- 150000001875 compounds Chemical class 0.000 description 4
- WQOXQRCZOLPYPM-UHFFFAOYSA-N dimethyl disulfide Chemical compound CSSC WQOXQRCZOLPYPM-UHFFFAOYSA-N 0.000 description 4
- 229940088679 drug related substance Drugs 0.000 description 4
- 230000000694 effects Effects 0.000 description 4
- IZWSFJTYBVKZNK-UHFFFAOYSA-N lauryl sulfobetaine Chemical compound CCCCCCCCCCCC[N+](C)(C)CCCS([O-])(=O)=O IZWSFJTYBVKZNK-UHFFFAOYSA-N 0.000 description 4
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 4
- 230000004048 modification Effects 0.000 description 4
- 238000012986 modification Methods 0.000 description 4
- 230000001717 pathogenic effect Effects 0.000 description 4
- 229920001223 polyethylene glycol Polymers 0.000 description 4
- 238000011002 quantification Methods 0.000 description 4
- 230000002829 reductive effect Effects 0.000 description 4
- 230000004044 response Effects 0.000 description 4
- 238000004007 reversed phase HPLC Methods 0.000 description 4
- 230000006641 stabilisation Effects 0.000 description 4
- 238000011105 stabilization Methods 0.000 description 4
- 238000011144 upstream manufacturing Methods 0.000 description 4
- 230000009385 viral infection Effects 0.000 description 4
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 4
- NHBKXEKEPDILRR-UHFFFAOYSA-N 2,3-bis(butanoylsulfanyl)propyl butanoate Chemical compound CCCC(=O)OCC(SC(=O)CCC)CSC(=O)CCC NHBKXEKEPDILRR-UHFFFAOYSA-N 0.000 description 3
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 3
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical group [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 3
- 206010069767 H1N1 influenza Diseases 0.000 description 3
- 108060003951 Immunoglobulin Proteins 0.000 description 3
- OFOBLEOULBTSOW-UHFFFAOYSA-N Malonic acid Chemical compound OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 3
- 241000124008 Mammalia Species 0.000 description 3
- 108010052285 Membrane Proteins Proteins 0.000 description 3
- 102000018697 Membrane Proteins Human genes 0.000 description 3
- 241000699666 Mus <mouse, genus> Species 0.000 description 3
- 241000282339 Mustela Species 0.000 description 3
- 102000005348 Neuraminidase Human genes 0.000 description 3
- 108010006232 Neuraminidase Proteins 0.000 description 3
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 3
- 241000282373 Panthera pardus Species 0.000 description 3
- 241000282376 Panthera tigris Species 0.000 description 3
- KWYUFKZDYYNOTN-UHFFFAOYSA-M Potassium hydroxide Chemical compound [OH-].[K+] KWYUFKZDYYNOTN-UHFFFAOYSA-M 0.000 description 3
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 3
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 3
- 210000001744 T-lymphocyte Anatomy 0.000 description 3
- WNROFYMDJYEPJX-UHFFFAOYSA-K aluminium hydroxide Chemical compound [OH-].[OH-].[OH-].[Al+3] WNROFYMDJYEPJX-UHFFFAOYSA-K 0.000 description 3
- 230000002238 attenuated effect Effects 0.000 description 3
- 210000003719 b-lymphocyte Anatomy 0.000 description 3
- 238000006664 bond formation reaction Methods 0.000 description 3
- 229910052799 carbon Inorganic materials 0.000 description 3
- 230000001086 cytosolic effect Effects 0.000 description 3
- 239000003995 emulsifying agent Substances 0.000 description 3
- 235000021472 generally recognized as safe Nutrition 0.000 description 3
- 102000018358 immunoglobulin Human genes 0.000 description 3
- 230000016784 immunoglobulin production Effects 0.000 description 3
- 238000000338 in vitro Methods 0.000 description 3
- 238000001727 in vivo Methods 0.000 description 3
- 238000002347 injection Methods 0.000 description 3
- 239000007924 injection Substances 0.000 description 3
- 210000001161 mammalian embryo Anatomy 0.000 description 3
- 239000011159 matrix material Substances 0.000 description 3
- 239000012022 methylating agents Substances 0.000 description 3
- 229940035032 monophosphoryl lipid a Drugs 0.000 description 3
- 238000010172 mouse model Methods 0.000 description 3
- 239000002736 nonionic surfactant Substances 0.000 description 3
- 150000007523 nucleic acids Chemical class 0.000 description 3
- 244000052769 pathogen Species 0.000 description 3
- 238000002360 preparation method Methods 0.000 description 3
- 239000003755 preservative agent Substances 0.000 description 3
- 150000003839 salts Chemical class 0.000 description 3
- 210000002966 serum Anatomy 0.000 description 3
- 230000004936 stimulating effect Effects 0.000 description 3
- 239000004575 stone Substances 0.000 description 3
- 238000012360 testing method Methods 0.000 description 3
- 238000009736 wetting Methods 0.000 description 3
- 239000000080 wetting agent Substances 0.000 description 3
- DGVVWUTYPXICAM-UHFFFAOYSA-N β‐Mercaptoethanol Chemical compound OCCS DGVVWUTYPXICAM-UHFFFAOYSA-N 0.000 description 3
- 229920000936 Agarose Polymers 0.000 description 2
- 244000068687 Amelanchier alnifolia Species 0.000 description 2
- 235000009027 Amelanchier alnifolia Nutrition 0.000 description 2
- 241000283690 Bos taurus Species 0.000 description 2
- 241000282832 Camelidae Species 0.000 description 2
- 241000282465 Canis Species 0.000 description 2
- 241000282693 Cercopithecidae Species 0.000 description 2
- 241000631130 Chrysophyllum argenteum Species 0.000 description 2
- 238000011537 Coomassie blue staining Methods 0.000 description 2
- 241000938605 Crocodylia Species 0.000 description 2
- 108090000695 Cytokines Proteins 0.000 description 2
- 102000004127 Cytokines Human genes 0.000 description 2
- 108020004414 DNA Proteins 0.000 description 2
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 2
- AEMRFAOFKBGASW-UHFFFAOYSA-N Glycolic acid Chemical compound OCC(O)=O AEMRFAOFKBGASW-UHFFFAOYSA-N 0.000 description 2
- 241000282375 Herpestidae Species 0.000 description 2
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 2
- 108700005091 Immunoglobulin Genes Proteins 0.000 description 2
- 206010061218 Inflammation Diseases 0.000 description 2
- 241001551462 Influenza A virus (A/equine/Kentucky/1/1991(H3N8)) Species 0.000 description 2
- 244000061176 Nicotiana tabacum Species 0.000 description 2
- 235000002637 Nicotiana tabacum Nutrition 0.000 description 2
- 108091034117 Oligonucleotide Proteins 0.000 description 2
- 241001494479 Pecora Species 0.000 description 2
- 241000283216 Phocidae Species 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 2
- 241000700159 Rattus Species 0.000 description 2
- 101100269369 Saccharomyces cerevisiae (strain ATCC 204508 / S288c) AGE1 gene Proteins 0.000 description 2
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 2
- 101001039853 Sonchus yellow net virus Matrix protein Proteins 0.000 description 2
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 2
- 230000005867 T cell response Effects 0.000 description 2
- 102000008234 Toll-like receptor 5 Human genes 0.000 description 2
- 108010060812 Toll-like receptor 5 Proteins 0.000 description 2
- 230000003044 adaptive effect Effects 0.000 description 2
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 2
- 229910052782 aluminium Inorganic materials 0.000 description 2
- ILRRQNADMUWWFW-UHFFFAOYSA-K aluminium phosphate Chemical group O1[Al]2OP1(=O)O2 ILRRQNADMUWWFW-UHFFFAOYSA-K 0.000 description 2
- 230000005875 antibody response Effects 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- 238000003766 bioinformatics method Methods 0.000 description 2
- 239000000872 buffer Substances 0.000 description 2
- 239000007975 buffered saline Substances 0.000 description 2
- 238000012754 cardiac puncture Methods 0.000 description 2
- 239000000969 carrier Substances 0.000 description 2
- 230000008859 change Effects 0.000 description 2
- 238000012512 characterization method Methods 0.000 description 2
- 239000003638 chemical reducing agent Substances 0.000 description 2
- 238000003776 cleavage reaction Methods 0.000 description 2
- 230000007423 decrease Effects 0.000 description 2
- 238000001212 derivatisation Methods 0.000 description 2
- 239000003085 diluting agent Substances 0.000 description 2
- 238000010790 dilution Methods 0.000 description 2
- 239000012895 dilution Substances 0.000 description 2
- XBDQKXXYIPTUBI-UHFFFAOYSA-N dimethylselenoniopropionate Natural products CCC(O)=O XBDQKXXYIPTUBI-UHFFFAOYSA-N 0.000 description 2
- 238000005538 encapsulation Methods 0.000 description 2
- 238000005516 engineering process Methods 0.000 description 2
- 239000012634 fragment Substances 0.000 description 2
- 230000006870 function Effects 0.000 description 2
- 230000035931 haemagglutination Effects 0.000 description 2
- 230000036541 health Effects 0.000 description 2
- 230000007062 hydrolysis Effects 0.000 description 2
- 238000006460 hydrolysis reaction Methods 0.000 description 2
- DOUYETYNHWVLEO-UHFFFAOYSA-N imiquimod Chemical compound C1=CC=CC2=C3N(CC(C)C)C=NC3=C(N)N=C21 DOUYETYNHWVLEO-UHFFFAOYSA-N 0.000 description 2
- 230000001900 immune effect Effects 0.000 description 2
- 210000000987 immune system Anatomy 0.000 description 2
- 230000036039 immunity Effects 0.000 description 2
- 230000003053 immunization Effects 0.000 description 2
- 238000002649 immunization Methods 0.000 description 2
- 238000000099 in vitro assay Methods 0.000 description 2
- 230000000937 inactivator Effects 0.000 description 2
- 230000001939 inductive effect Effects 0.000 description 2
- 230000004054 inflammatory process Effects 0.000 description 2
- 208000037798 influenza B Diseases 0.000 description 2
- 230000005764 inhibitory process Effects 0.000 description 2
- 230000015788 innate immune response Effects 0.000 description 2
- 229910052500 inorganic mineral Inorganic materials 0.000 description 2
- 238000007912 intraperitoneal administration Methods 0.000 description 2
- 210000003734 kidney Anatomy 0.000 description 2
- JVTAAEKCZFNVCJ-UHFFFAOYSA-N lactic acid Chemical compound CC(O)C(O)=O JVTAAEKCZFNVCJ-UHFFFAOYSA-N 0.000 description 2
- 239000003446 ligand Substances 0.000 description 2
- 150000002632 lipids Chemical class 0.000 description 2
- 238000004895 liquid chromatography mass spectrometry Methods 0.000 description 2
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 2
- 238000001840 matrix-assisted laser desorption--ionisation time-of-flight mass spectrometry Methods 0.000 description 2
- BDAGIHXWWSANSR-UHFFFAOYSA-N methanoic acid Natural products OC=O BDAGIHXWWSANSR-UHFFFAOYSA-N 0.000 description 2
- WSFSSNUMVMOOMR-NJFSPNSNSA-N methanone Chemical compound O=[14CH2] WSFSSNUMVMOOMR-NJFSPNSNSA-N 0.000 description 2
- 125000001160 methoxycarbonyl group Chemical group [H]C([H])([H])OC(*)=O 0.000 description 2
- 239000011707 mineral Substances 0.000 description 2
- 210000003205 muscle Anatomy 0.000 description 2
- 231100000252 nontoxic Toxicity 0.000 description 2
- 230000003000 nontoxic effect Effects 0.000 description 2
- 108020004707 nucleic acids Proteins 0.000 description 2
- 102000039446 nucleic acids Human genes 0.000 description 2
- 229920002113 octoxynol Polymers 0.000 description 2
- 239000006179 pH buffering agent Substances 0.000 description 2
- 238000007911 parenteral administration Methods 0.000 description 2
- 238000012510 peptide mapping method Methods 0.000 description 2
- VLTRZXGMWDSKGL-UHFFFAOYSA-N perchloric acid Chemical compound OCl(=O)(=O)=O VLTRZXGMWDSKGL-UHFFFAOYSA-N 0.000 description 2
- 239000000546 pharmaceutical excipient Substances 0.000 description 2
- 239000000843 powder Substances 0.000 description 2
- 229930182490 saponin Natural products 0.000 description 2
- 235000017709 saponins Nutrition 0.000 description 2
- 150000007949 saponins Chemical class 0.000 description 2
- 230000007017 scission Effects 0.000 description 2
- 238000000926 separation method Methods 0.000 description 2
- 239000008159 sesame oil Substances 0.000 description 2
- 235000011803 sesame oil Nutrition 0.000 description 2
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 2
- 239000007787 solid Substances 0.000 description 2
- 230000000087 stabilizing effect Effects 0.000 description 2
- 238000007619 statistical method Methods 0.000 description 2
- 238000006467 substitution reaction Methods 0.000 description 2
- 229940031626 subunit vaccine Drugs 0.000 description 2
- 230000009885 systemic effect Effects 0.000 description 2
- 239000003826 tablet Substances 0.000 description 2
- 230000001225 therapeutic effect Effects 0.000 description 2
- ZMZDMBWJUHKJPS-UHFFFAOYSA-N thiocyanic acid Chemical compound SC#N ZMZDMBWJUHKJPS-UHFFFAOYSA-N 0.000 description 2
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 2
- 230000009261 transgenic effect Effects 0.000 description 2
- 238000000825 ultraviolet detection Methods 0.000 description 2
- 210000000689 upper leg Anatomy 0.000 description 2
- MZOFCQQQCNRIBI-VMXHOPILSA-N (3s)-4-[[(2s)-1-[[(2s)-1-[[(1s)-1-carboxy-2-hydroxyethyl]amino]-4-methyl-1-oxopentan-2-yl]amino]-5-(diaminomethylideneamino)-1-oxopentan-2-yl]amino]-3-[[2-[[(2s)-2,6-diaminohexanoyl]amino]acetyl]amino]-4-oxobutanoic acid Chemical compound OC[C@@H](C(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CC(O)=O)NC(=O)CNC(=O)[C@@H](N)CCCCN MZOFCQQQCNRIBI-VMXHOPILSA-N 0.000 description 1
- YYGNTYWPHWGJRM-UHFFFAOYSA-N (6E,10E,14E,18E)-2,6,10,15,19,23-hexamethyltetracosa-2,6,10,14,18,22-hexaene Chemical compound CC(C)=CCCC(C)=CCCC(C)=CCCC=C(C)CCC=C(C)CCC=C(C)C YYGNTYWPHWGJRM-UHFFFAOYSA-N 0.000 description 1
- BMYNFMYTOJXKLE-UHFFFAOYSA-N 3-azaniumyl-2-hydroxypropanoate Chemical compound NCC(O)C(O)=O BMYNFMYTOJXKLE-UHFFFAOYSA-N 0.000 description 1
- OSWFIVFLDKOXQC-UHFFFAOYSA-N 4-(3-methoxyphenyl)aniline Chemical compound COC1=CC=CC(C=2C=CC(N)=CC=2)=C1 OSWFIVFLDKOXQC-UHFFFAOYSA-N 0.000 description 1
- JYCQQPHGFMYQCF-UHFFFAOYSA-N 4-tert-Octylphenol monoethoxylate Chemical compound CC(C)(C)CC(C)(C)C1=CC=C(OCCO)C=C1 JYCQQPHGFMYQCF-UHFFFAOYSA-N 0.000 description 1
- XZIIFPSPUDAGJM-UHFFFAOYSA-N 6-chloro-2-n,2-n-diethylpyrimidine-2,4-diamine Chemical compound CCN(CC)C1=NC(N)=CC(Cl)=N1 XZIIFPSPUDAGJM-UHFFFAOYSA-N 0.000 description 1
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 1
- 108010042708 Acetylmuramyl-Alanyl-Isoglutamine Proteins 0.000 description 1
- 241000251468 Actinopterygii Species 0.000 description 1
- 229920001817 Agar Polymers 0.000 description 1
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 1
- 239000005995 Aluminium silicate Substances 0.000 description 1
- VHUUQVKOLVNVRT-UHFFFAOYSA-N Ammonium hydroxide Chemical compound [NH4+].[OH-] VHUUQVKOLVNVRT-UHFFFAOYSA-N 0.000 description 1
- 241000272522 Anas Species 0.000 description 1
- 239000004475 Arginine Substances 0.000 description 1
- 102100025218 B-cell differentiation antigen CD72 Human genes 0.000 description 1
- 241000894006 Bacteria Species 0.000 description 1
- 241000588832 Bordetella pertussis Species 0.000 description 1
- 244000026811 Brassica nipposinica Species 0.000 description 1
- 235000007294 Brassica nipposinica Nutrition 0.000 description 1
- 241000589562 Brucella Species 0.000 description 1
- 102100035875 C-C chemokine receptor type 5 Human genes 0.000 description 1
- 101710149870 C-C chemokine receptor type 5 Proteins 0.000 description 1
- 108010084313 CD58 Antigens Proteins 0.000 description 1
- 241000282836 Camelus dromedarius Species 0.000 description 1
- 241000283707 Capra Species 0.000 description 1
- 241000272161 Charadriiformes Species 0.000 description 1
- 102000001327 Chemokine CCL5 Human genes 0.000 description 1
- 108010055166 Chemokine CCL5 Proteins 0.000 description 1
- 102000019034 Chemokines Human genes 0.000 description 1
- 108010012236 Chemokines Proteins 0.000 description 1
- 241000288673 Chiroptera Species 0.000 description 1
- 241000195585 Chlamydomonas Species 0.000 description 1
- 241000254173 Coleoptera Species 0.000 description 1
- 241000557626 Corvus corax Species 0.000 description 1
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 1
- BWGNESOTFCXPMA-UHFFFAOYSA-N Dihydrogen disulfide Chemical compound SS BWGNESOTFCXPMA-UHFFFAOYSA-N 0.000 description 1
- 241000255581 Drosophila <fruit fly, genus> Species 0.000 description 1
- 238000002965 ELISA Methods 0.000 description 1
- LVGKNOAMLMIIKO-UHFFFAOYSA-N Elaidinsaeure-aethylester Natural products CCCCCCCCC=CCCCCCCCC(=O)OCC LVGKNOAMLMIIKO-UHFFFAOYSA-N 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- 108010040721 Flagellin Proteins 0.000 description 1
- 108090000288 Glycoproteins Proteins 0.000 description 1
- 102000003886 Glycoproteins Human genes 0.000 description 1
- 108010017080 Granulocyte Colony-Stimulating Factor Proteins 0.000 description 1
- 102000004269 Granulocyte Colony-Stimulating Factor Human genes 0.000 description 1
- 102000004457 Granulocyte-Macrophage Colony-Stimulating Factor Human genes 0.000 description 1
- 108010017213 Granulocyte-Macrophage Colony-Stimulating Factor Proteins 0.000 description 1
- 241000252870 H3N2 subtype Species 0.000 description 1
- 101000934359 Homo sapiens B-cell differentiation antigen CD72 Proteins 0.000 description 1
- 101000764263 Homo sapiens Tumor necrosis factor ligand superfamily member 4 Proteins 0.000 description 1
- 102000008394 Immunoglobulin Fragments Human genes 0.000 description 1
- 108010021625 Immunoglobulin Fragments Proteins 0.000 description 1
- 241000713297 Influenza C virus Species 0.000 description 1
- 241001500350 Influenzavirus B Species 0.000 description 1
- 102100037850 Interferon gamma Human genes 0.000 description 1
- 108010074328 Interferon-gamma Proteins 0.000 description 1
- 102000014150 Interferons Human genes 0.000 description 1
- 108010050904 Interferons Proteins 0.000 description 1
- 108010002350 Interleukin-2 Proteins 0.000 description 1
- 102000000588 Interleukin-2 Human genes 0.000 description 1
- 108090000862 Ion Channels Proteins 0.000 description 1
- 102000004310 Ion Channels Human genes 0.000 description 1
- 241001138401 Kluyveromyces lactis Species 0.000 description 1
- 241000235058 Komagataella pastoris Species 0.000 description 1
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 1
- 241000272168 Laridae Species 0.000 description 1
- 206010024774 Localised infection Diseases 0.000 description 1
- 229930195725 Mannitol Natural products 0.000 description 1
- 108010090054 Membrane Glycoproteins Proteins 0.000 description 1
- 102000012750 Membrane Glycoproteins Human genes 0.000 description 1
- 241000187479 Mycobacterium tuberculosis Species 0.000 description 1
- 241000772415 Neovison vison Species 0.000 description 1
- GRYLNZFGIOXLOG-UHFFFAOYSA-N Nitric acid Chemical compound O[N+]([O-])=O GRYLNZFGIOXLOG-UHFFFAOYSA-N 0.000 description 1
- 108091005461 Nucleic proteins Proteins 0.000 description 1
- 241000712464 Orthomyxoviridae Species 0.000 description 1
- 208000009620 Orthomyxoviridae Infections Diseases 0.000 description 1
- 241000283973 Oryctolagus cuniculus Species 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 241000845082 Panama Species 0.000 description 1
- 108091005804 Peptidases Proteins 0.000 description 1
- 239000004698 Polyethylene Substances 0.000 description 1
- 239000002202 Polyethylene glycol Substances 0.000 description 1
- 241000288906 Primates Species 0.000 description 1
- 239000004365 Protease Substances 0.000 description 1
- 241000508269 Psidium Species 0.000 description 1
- 235000001630 Pyrus pyrifolia var culta Nutrition 0.000 description 1
- 240000002609 Pyrus pyrifolia var. culta Species 0.000 description 1
- 101000697856 Rattus norvegicus Bile acid-CoA:amino acid N-acyltransferase Proteins 0.000 description 1
- 102100037486 Reverse transcriptase/ribonuclease H Human genes 0.000 description 1
- 241000283984 Rodentia Species 0.000 description 1
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 1
- 241000233671 Schizochytrium Species 0.000 description 1
- VMHLLURERBWHNL-UHFFFAOYSA-M Sodium acetate Chemical compound [Na+].CC([O-])=O VMHLLURERBWHNL-UHFFFAOYSA-M 0.000 description 1
- 241000256251 Spodoptera frugiperda Species 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- KDYFGRWQOYBRFD-UHFFFAOYSA-N Succinic acid Natural products OC(=O)CCC(O)=O KDYFGRWQOYBRFD-UHFFFAOYSA-N 0.000 description 1
- 108010008038 Synthetic Vaccines Proteins 0.000 description 1
- BHEOSNUKNHRBNM-UHFFFAOYSA-N Tetramethylsqualene Natural products CC(=C)C(C)CCC(=C)C(C)CCC(C)=CCCC=C(C)CCC(C)C(=C)CCC(C)C(C)=C BHEOSNUKNHRBNM-UHFFFAOYSA-N 0.000 description 1
- 108060008682 Tumor Necrosis Factor Proteins 0.000 description 1
- 102000000852 Tumor Necrosis Factor-alpha Human genes 0.000 description 1
- 102100026890 Tumor necrosis factor ligand superfamily member 4 Human genes 0.000 description 1
- 244000274883 Urtica dioica Species 0.000 description 1
- 235000009108 Urtica dioica Nutrition 0.000 description 1
- 108010003533 Viral Envelope Proteins Proteins 0.000 description 1
- 240000008042 Zea mays Species 0.000 description 1
- 235000005824 Zea mays ssp. parviglumis Nutrition 0.000 description 1
- 235000002017 Zea mays subsp mays Nutrition 0.000 description 1
- UZQJVUCHXGYFLQ-AYDHOLPZSA-N [(2s,3r,4s,5r,6r)-4-[(2s,3r,4s,5r,6r)-4-[(2r,3r,4s,5r,6r)-4-[(2s,3r,4s,5r,6r)-3,5-dihydroxy-6-(hydroxymethyl)-4-[(2s,3r,4s,5s,6r)-3,4,5-trihydroxy-6-(hydroxymethyl)oxan-2-yl]oxyoxan-2-yl]oxy-3,5-dihydroxy-6-(hydroxymethyl)oxan-2-yl]oxy-3,5-dihydroxy-6-(hy Chemical compound O([C@H]1[C@H](O)[C@@H](CO)O[C@H]([C@@H]1O)O[C@H]1[C@H](O)[C@@H](CO)O[C@H]([C@@H]1O)O[C@H]1CC[C@]2(C)[C@H]3CC=C4[C@@]([C@@]3(CC[C@H]2[C@@]1(C=O)C)C)(C)CC(O)[C@]1(CCC(CC14)(C)C)C(=O)O[C@H]1[C@@H]([C@@H](O[C@H]2[C@@H]([C@@H](O[C@H]3[C@@H]([C@@H](O[C@H]4[C@@H]([C@@H](O[C@H]5[C@@H]([C@@H](O)[C@H](O)[C@@H](CO)O5)O)[C@H](O)[C@@H](CO)O4)O)[C@H](O)[C@@H](CO)O3)O)[C@H](O)[C@@H](CO)O2)O)[C@H](O)[C@@H](CO)O1)O)[C@@H]1O[C@H](CO)[C@@H](O)[C@H](O)[C@H]1O UZQJVUCHXGYFLQ-AYDHOLPZSA-N 0.000 description 1
- JLCPHMBAVCMARE-UHFFFAOYSA-N [3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-hydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methyl [5-(6-aminopurin-9-yl)-2-(hydroxymethyl)oxolan-3-yl] hydrogen phosphate Polymers Cc1cn(C2CC(OP(O)(=O)OCC3OC(CC3OP(O)(=O)OCC3OC(CC3O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c3nc(N)[nH]c4=O)C(COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3CO)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cc(C)c(=O)[nH]c3=O)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3cc(C)c(=O)[nH]c3=O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)O2)c(=O)[nH]c1=O JLCPHMBAVCMARE-UHFFFAOYSA-N 0.000 description 1
- 235000011054 acetic acid Nutrition 0.000 description 1
- 238000005903 acid hydrolysis reaction Methods 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- 239000000654 additive Substances 0.000 description 1
- 239000008272 agar Substances 0.000 description 1
- 229940060265 aldara Drugs 0.000 description 1
- 230000004075 alteration Effects 0.000 description 1
- 229940037003 alum Drugs 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- 235000012211 aluminium silicate Nutrition 0.000 description 1
- 239000000908 ammonium hydroxide Substances 0.000 description 1
- 238000010171 animal model Methods 0.000 description 1
- 239000003242 anti bacterial agent Substances 0.000 description 1
- 230000000890 antigenic effect Effects 0.000 description 1
- 239000003963 antioxidant agent Substances 0.000 description 1
- 238000013459 approach Methods 0.000 description 1
- 239000008365 aqueous carrier Substances 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- 239000003125 aqueous solvent Substances 0.000 description 1
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 1
- 150000004982 aromatic amines Chemical class 0.000 description 1
- 206010064097 avian influenza Diseases 0.000 description 1
- 239000003855 balanced salt solution Substances 0.000 description 1
- SQVRNKJHWKZAKO-UHFFFAOYSA-N beta-N-Acetyl-D-neuraminic acid Natural products CC(=O)NC1C(O)CC(O)(C(O)=O)OC1C(O)C(O)CO SQVRNKJHWKZAKO-UHFFFAOYSA-N 0.000 description 1
- 239000008364 bulk solution Substances 0.000 description 1
- KDYFGRWQOYBRFD-NUQCWPJISA-N butanedioic acid Chemical compound O[14C](=O)CC[14C](O)=O KDYFGRWQOYBRFD-NUQCWPJISA-N 0.000 description 1
- 239000002775 capsule Substances 0.000 description 1
- TWFZGCMQGLPBSX-UHFFFAOYSA-N carbendazim Chemical compound C1=CC=C2NC(NC(=O)OC)=NC2=C1 TWFZGCMQGLPBSX-UHFFFAOYSA-N 0.000 description 1
- 210000000170 cell membrane Anatomy 0.000 description 1
- 230000001413 cellular effect Effects 0.000 description 1
- 230000007969 cellular immunity Effects 0.000 description 1
- 238000005119 centrifugation Methods 0.000 description 1
- 239000002738 chelating agent Substances 0.000 description 1
- 210000004978 chinese hamster ovary cell Anatomy 0.000 description 1
- 238000013375 chromatographic separation Methods 0.000 description 1
- 238000005352 clarification Methods 0.000 description 1
- 230000022472 cold acclimation Effects 0.000 description 1
- 238000004440 column chromatography Methods 0.000 description 1
- 239000012141 concentrate Substances 0.000 description 1
- 239000013068 control sample Substances 0.000 description 1
- 235000005822 corn Nutrition 0.000 description 1
- 230000002596 correlated effect Effects 0.000 description 1
- 230000000139 costimulatory effect Effects 0.000 description 1
- 238000004132 cross linking Methods 0.000 description 1
- 239000013078 crystal Substances 0.000 description 1
- 230000006378 damage Effects 0.000 description 1
- 238000000354 decomposition reaction Methods 0.000 description 1
- 238000010586 diagram Methods 0.000 description 1
- BQYJATMQXGBDHF-UHFFFAOYSA-N difenoconazole Chemical compound O1C(C)COC1(C=1C(=CC(OC=2C=CC(Cl)=CC=2)=CC=1)Cl)CN1N=CN=C1 BQYJATMQXGBDHF-UHFFFAOYSA-N 0.000 description 1
- 238000010494 dissociation reaction Methods 0.000 description 1
- 230000005593 dissociations Effects 0.000 description 1
- PRAKJMSDJKAYCZ-UHFFFAOYSA-N dodecahydrosqualene Natural products CC(C)CCCC(C)CCCC(C)CCCCC(C)CCCC(C)CCCC(C)C PRAKJMSDJKAYCZ-UHFFFAOYSA-N 0.000 description 1
- 231100000673 dose–response relationship Toxicity 0.000 description 1
- 241001493065 dsRNA viruses Species 0.000 description 1
- 239000003792 electrolyte Substances 0.000 description 1
- 210000002919 epithelial cell Anatomy 0.000 description 1
- 150000002169 ethanolamines Chemical class 0.000 description 1
- LVGKNOAMLMIIKO-QXMHVHEDSA-N ethyl oleate Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OCC LVGKNOAMLMIIKO-QXMHVHEDSA-N 0.000 description 1
- 229940093471 ethyl oleate Drugs 0.000 description 1
- 238000001914 filtration Methods 0.000 description 1
- 235000019253 formic acid Nutrition 0.000 description 1
- 239000001530 fumaric acid Substances 0.000 description 1
- 238000002825 functional assay Methods 0.000 description 1
- 230000004927 fusion Effects 0.000 description 1
- 210000001035 gastrointestinal tract Anatomy 0.000 description 1
- 230000002068 genetic effect Effects 0.000 description 1
- 238000010353 genetic engineering Methods 0.000 description 1
- 239000008187 granular material Substances 0.000 description 1
- 210000005260 human cell Anatomy 0.000 description 1
- 230000004727 humoral immunity Effects 0.000 description 1
- 229960002751 imiquimod Drugs 0.000 description 1
- 229940072221 immunoglobulins Drugs 0.000 description 1
- 230000003308 immunostimulating effect Effects 0.000 description 1
- 238000011534 incubation Methods 0.000 description 1
- 239000011261 inert gas Substances 0.000 description 1
- 208000037799 influenza C Diseases 0.000 description 1
- 239000003112 inhibitor Substances 0.000 description 1
- 150000007529 inorganic bases Chemical class 0.000 description 1
- 229940047124 interferons Drugs 0.000 description 1
- 238000007913 intrathecal administration Methods 0.000 description 1
- 238000011835 investigation Methods 0.000 description 1
- 239000011630 iodine Substances 0.000 description 1
- 229910052740 iodine Inorganic materials 0.000 description 1
- 238000002955 isolation Methods 0.000 description 1
- NLYAJNPCOHFWQQ-UHFFFAOYSA-N kaolin Chemical compound O.O.O=[Al]O[Si](=O)O[Si](=O)O[Al]=O NLYAJNPCOHFWQQ-UHFFFAOYSA-N 0.000 description 1
- 210000003292 kidney cell Anatomy 0.000 description 1
- 239000004310 lactic acid Substances 0.000 description 1
- 235000014655 lactic acid Nutrition 0.000 description 1
- 239000008101 lactose Substances 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 210000004698 lymphocyte Anatomy 0.000 description 1
- 210000002540 macrophage Anatomy 0.000 description 1
- 235000019359 magnesium stearate Nutrition 0.000 description 1
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 1
- 239000011976 maleic acid Substances 0.000 description 1
- 239000000594 mannitol Substances 0.000 description 1
- 235000010355 mannitol Nutrition 0.000 description 1
- 239000012092 media component Substances 0.000 description 1
- 210000004779 membrane envelope Anatomy 0.000 description 1
- 230000034217 membrane fusion Effects 0.000 description 1
- 244000005700 microbiome Species 0.000 description 1
- 230000005012 migration Effects 0.000 description 1
- 238000013508 migration Methods 0.000 description 1
- 239000002480 mineral oil Substances 0.000 description 1
- 235000010446 mineral oil Nutrition 0.000 description 1
- 150000007522 mineralic acids Chemical class 0.000 description 1
- 239000000178 monomer Substances 0.000 description 1
- 210000005088 multinucleated cell Anatomy 0.000 description 1
- BSOQXXWZTUDTEL-ZUYCGGNHSA-N muramyl dipeptide Chemical compound OC(=O)CC[C@H](C(N)=O)NC(=O)[C@H](C)NC(=O)[C@@H](C)O[C@H]1[C@H](O)[C@@H](CO)O[C@@H](O)[C@@H]1NC(C)=O BSOQXXWZTUDTEL-ZUYCGGNHSA-N 0.000 description 1
- 239000005445 natural material Substances 0.000 description 1
- 230000007935 neutral effect Effects 0.000 description 1
- 229910017604 nitric acid Inorganic materials 0.000 description 1
- 239000012457 nonaqueous media Substances 0.000 description 1
- 239000000346 nonvolatile oil Substances 0.000 description 1
- 230000000269 nucleophilic effect Effects 0.000 description 1
- 235000015097 nutrients Nutrition 0.000 description 1
- 239000003921 oil Substances 0.000 description 1
- 239000004006 olive oil Substances 0.000 description 1
- 235000008390 olive oil Nutrition 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 235000005985 organic acids Nutrition 0.000 description 1
- 150000007530 organic bases Chemical class 0.000 description 1
- 150000002895 organic esters Chemical class 0.000 description 1
- 230000008520 organization Effects 0.000 description 1
- 230000003204 osmotic effect Effects 0.000 description 1
- 235000006408 oxalic acid Nutrition 0.000 description 1
- 239000008194 pharmaceutical composition Substances 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 1
- 239000010452 phosphate Substances 0.000 description 1
- 150000003904 phospholipids Chemical class 0.000 description 1
- 235000011007 phosphoric acid Nutrition 0.000 description 1
- 239000006187 pill Substances 0.000 description 1
- 229920000724 poly(L-arginine) polymer Polymers 0.000 description 1
- 108010011110 polyarginine Proteins 0.000 description 1
- 229920000573 polyethylene Polymers 0.000 description 1
- 108091033319 polynucleotide Proteins 0.000 description 1
- 102000040430 polynucleotide Human genes 0.000 description 1
- 239000002157 polynucleotide Substances 0.000 description 1
- 239000002244 precipitate Substances 0.000 description 1
- 230000003449 preventive effect Effects 0.000 description 1
- 230000035755 proliferation Effects 0.000 description 1
- 230000002035 prolonged effect Effects 0.000 description 1
- 235000019260 propionic acid Nutrition 0.000 description 1
- 230000001681 protective effect Effects 0.000 description 1
- 108010030416 proteoliposomes Proteins 0.000 description 1
- 239000001397 quillaja saponaria molina bark Substances 0.000 description 1
- IUVKMZGDUIUOCP-BTNSXGMBSA-N quinbolone Chemical compound O([C@H]1CC[C@H]2[C@H]3[C@@H]([C@]4(C=CC(=O)C=C4CC3)C)CC[C@@]21C)C1=CCCC1 IUVKMZGDUIUOCP-BTNSXGMBSA-N 0.000 description 1
- 102000005962 receptors Human genes 0.000 description 1
- 108020003175 receptors Proteins 0.000 description 1
- 238000010188 recombinant method Methods 0.000 description 1
- 229940124551 recombinant vaccine Drugs 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 210000002345 respiratory system Anatomy 0.000 description 1
- 230000002441 reversible effect Effects 0.000 description 1
- 102200126728 rs587777863 Human genes 0.000 description 1
- 230000028327 secretion Effects 0.000 description 1
- 230000011218 segmentation Effects 0.000 description 1
- SQVRNKJHWKZAKO-OQPLDHBCSA-N sialic acid Chemical compound CC(=O)N[C@@H]1[C@@H](O)C[C@@](O)(C(O)=O)OC1[C@H](O)[C@H](O)CO SQVRNKJHWKZAKO-OQPLDHBCSA-N 0.000 description 1
- 239000000377 silicon dioxide Substances 0.000 description 1
- 239000001632 sodium acetate Substances 0.000 description 1
- 235000017281 sodium acetate Nutrition 0.000 description 1
- 239000001488 sodium phosphate Substances 0.000 description 1
- 229910000162 sodium phosphate Inorganic materials 0.000 description 1
- 239000008247 solid mixture Substances 0.000 description 1
- 229940035044 sorbitan monolaurate Drugs 0.000 description 1
- 241000894007 species Species 0.000 description 1
- 238000003892 spreading Methods 0.000 description 1
- 230000007480 spreading Effects 0.000 description 1
- 229940031439 squalene Drugs 0.000 description 1
- TUHBEKDERLKLEC-UHFFFAOYSA-N squalene Natural products CC(=CCCC(=CCCC(=CCCC=C(/C)CCC=C(/C)CC=C(C)C)C)C)C TUHBEKDERLKLEC-UHFFFAOYSA-N 0.000 description 1
- 238000013112 stability test Methods 0.000 description 1
- 239000008107 starch Substances 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- 238000011146 sterile filtration Methods 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- ZZIZZTHXZRDOFM-XFULWGLBSA-N tamsulosin hydrochloride Chemical compound [H+].[Cl-].CCOC1=CC=CC=C1OCCN[C@H](C)CC1=CC=C(OC)C(S(N)(=O)=O)=C1 ZZIZZTHXZRDOFM-XFULWGLBSA-N 0.000 description 1
- 238000010998 test method Methods 0.000 description 1
- 230000004797 therapeutic response Effects 0.000 description 1
- 125000003396 thiol group Chemical group [H]S* 0.000 description 1
- 238000004448 titration Methods 0.000 description 1
- 230000000699 topical effect Effects 0.000 description 1
- 239000013638 trimer Substances 0.000 description 1
- RYFMWSXOAZQYPI-UHFFFAOYSA-K trisodium phosphate Chemical compound [Na+].[Na+].[Na+].[O-]P([O-])([O-])=O RYFMWSXOAZQYPI-UHFFFAOYSA-K 0.000 description 1
- 235000015112 vegetable and seed oil Nutrition 0.000 description 1
- 239000008158 vegetable oil Substances 0.000 description 1
- 210000003501 vero cell Anatomy 0.000 description 1
- 230000007501 viral attachment Effects 0.000 description 1
- 230000017613 viral reproduction Effects 0.000 description 1
- 239000013603 viral vector Substances 0.000 description 1
- 230000000007 visual effect Effects 0.000 description 1
- 239000003643 water by type Substances 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/12—Viral antigens
- A61K39/145—Orthomyxoviridae, e.g. influenza virus
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
- A61P31/16—Antivirals for RNA viruses for influenza or rhinoviruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/04—Immunostimulants
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N7/00—Viruses; Bacteriophages; Compositions thereof; Preparation or purification thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/51—Medicinal preparations containing antigens or antibodies comprising whole cells, viruses or DNA/RNA
- A61K2039/525—Virus
- A61K2039/5252—Virus inactivated (killed)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/70—Multivalent vaccine
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2760/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssRNA viruses negative-sense
- C12N2760/00011—Details
- C12N2760/16011—Orthomyxoviridae
- C12N2760/16034—Use of virus or viral component as vaccine, e.g. live-attenuated or inactivated virus, VLP, viral protein
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2760/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssRNA viruses negative-sense
- C12N2760/00011—Details
- C12N2760/16011—Orthomyxoviridae
- C12N2760/16061—Methods of inactivation or attenuation
- C12N2760/16063—Methods of inactivation or attenuation by chemical treatment
Abstract
本発明は、とりわけ、1つ以上のアルキル化システイン残基を含むヘマグルチニンに基づく改良型インフルエンザワクチンを提供する。特に、本発明は、アルキル化剤で処理したヘマグルチニンを含有するインフルエンザワクチンおよびその製造方法を提供する。本発明が提供する本発明のインフルエンザワクチンは、貯蔵に際しても一元放射免疫拡散(SRID)アッセイによる測定力価を保持する優れた性能を有する。
Description
関連出願への相互参照
本出願は、2014年8月18日に出願された米国仮出願第62/038,753号の優先権を主張し、当該出願の全体を参照として本明細書において援用する。
本出願は、2014年8月18日に出願された米国仮出願第62/038,753号の優先権を主張し、当該出願の全体を参照として本明細書において援用する。
流行性および新型インフルエンザは毎年発生し、世界中で深刻な罹患および死亡の原因となっている。インフルエンザウイルスは、2つの表面糖タンパク質、ヘマグルチニン(HA)およびノイラミニダーゼ(NA)からなる高度に多形性の粒子である。HAは、宿主細胞へのウイルスの付着、およびウイルスが細胞内へ浸透する際のウイルス‐細胞膜間の融合を媒介する。したがって、インフルエンザワクチンは、通常、疾患株に適合した有効量のHAを含み、疾患株に対する中和抗体の産生を誘導する。
一元放射免疫拡散(SRID)アッセイは、インフルエンザワクチン中のヘマグルチニン(HA)含量を測定するために用いられ、1978年以来、食品医薬品局によって米国内での使用を認可されたインフルエンザウイルスワクチンの力価を測定する目的で使用されている。具体的には、SRIDは、特異的抗HA抗体を用いてインフルエンザワクチン中のHA含量を測定する。ワクチン試料を、株特異的抗血清を含有する寒天プレート上に塗布する。通常、プレートを湿室内にて室温下でインキュベートし、抗原が拡散できるようにする。抗原と抗体との反応は、沈降ゾーンを生成する(沈降輪の形態で)。ワクチン試料中のHA含量は、試料の環径を、濃度既知の参照用HAタンパク質の環径と比較することによって定量できる。前記HA含量に基づいて、検査したワクチンの力価を得ることができる。
本発明は、とりわけ、貯蔵に際してもSRID測定による力価を保持する性能に優れた改良型インフルエンザワクチンを提供する。本発明は、HA抗原をアルキル化剤(例えば、2‐ヨードアセトアミド(IOAM))に曝すと、貯蔵後におけるSRID測定によるHA力価の喪失が有意に低減するという驚くべき発見に部分的に基づく。例えば、実施例の節に記載するように、本発明者らは、いくつかのIOAM処理したHA抗原に関して、SRIDアッセイによって測定した力価が、6ヶ月の貯蔵の後にもわずかに約1〜5%の喪失しか示さなかったことを実証した。特定の理論に拘泥するわけではないが、HA力価の経時的な喪失に関しての予想されるメカニズムは、分子間システイン結合の形成であると考えられる。これらの共有結合は、zwittergentによる前処理時のHAロゼットマクロ構造の解離を妨げ、それによってゲルマトリックスを介しての移動を制限し、結果として抗血清との相互作用を減少させる。アルキル化剤による処理は、HA抗原の反応性システイン基のアルキル化をもたらし、分子間ジスルフィド結合の形成を防止する。結果として、本発明が提供するアルキル化HA抗原は、貯蔵後におけるSRID測定による力価をより良好に保持し得る。SRIDは、インフルエンザワクチンに対して最も一般的に使用されるHA力価の測定方法であり、FDAおよび他の主要な保健医療当局に現在受け入れられている唯一の試験法であることから、本発明により、必要とされる力価をワクチンの耐用期間中に保持可能なワクチンを製造することが可能になる。
一態様では、本発明は、1つ以上のアルキル化システイン残基を含むヘマグルチニンを含むインフルエンザワクチンを提供する。いくつかの実施形態では、ヘマグルチニンは、1〜5、1〜4、1〜3、2〜5、2〜4、2〜3、3〜5、3〜4、または4〜5個のアルキル化システイン残基を含む。いくつかの実施形態では、ヘマグルチニンは、1、2、3、4、または5個のアルキル化システイン残基を含む。いくつかの実施形態では、ヘマグルチニン中に存在する全システイン残基の約1〜50%、1〜40%、1〜30%、1〜20%または1〜10%が、1つ以上のアルキル化システイン残基で構成される。いくつかの実施形態では、ヘマグルチニンに存在する全システイン残基の約10%、20%、30%、40%または50%が、1つ以上のアルキル化システイン残基で構成される。いくつかの実施形態では、実質的に全ての遊離システイン残基がアルキル化される。いくつかの実施形態では、アルキル化システイン残基はメチル化システイン残基を含む。いくつかの実施形態において、ヘマグルチニンは、非特異的なアルキル化および/または遍在性のメチル化を有さない。いくつかの実施形態において、アルキル化システイン残基は、質量分析によって決定する。
別の態様では、本発明は、アルキル化剤で処理したヘマグルチニンを含むインフルエンザワクチンを提供する。本明細書で使用する場合、本発明に適したアルキル化剤は、システインスルフヒドリル基をアルキル化できる任意の化合物であってもよい。いくつかの実施形態において、アルキル化剤は、2‐ヨードアセトアミド(IOAM)、ヨード酢酸、2‐ブロモアセトアミド、グルタチオンブロモアセトアミド、ブロモ酢酸、1,3‐プロパンスルトン、メチルメタンチオスルホン酸、メトキシカルボニルメチルジスルフィド、マレアミド、マレイミド‐PEG、ビニルピリジン、N‐エチルマレイミド、トシルアセトアミド、およびそれらの組合せからなる群から選択される。いくつかの実施形態では、アルキル化剤は2‐ヨードアセトアミド(IOAM)である。
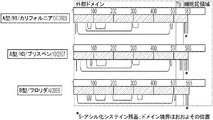
様々な実施形態において、本発明に適したヘマグルチニンは、カリフォルニアもしくはソロモン株に存在するH1タンパク質、ブリスベン、フロリダ、オハイオ、江蘇もしくは香港株に存在するBタンパク質、および/または、あるいはビクトリア、パース、ブリスタンもしくはウィスコンシン株に存在するH3タンパク質である。
いくつかの実施形態では、本発明が提供するインフルエンザワクチンは、スプリットインフルエンザウイルスワクチンである。いくつかの実施形態では、本発明が提供するインフルエンザワクチンは、遺伝子組換えインフルエンザワクチンである。いくつかの実施形態では、本発明が提供するインフルエンザワクチンは、卵ベースのインフルエンザワクチンである。いくつかの実施形態では、本発明が提供するインフルエンザワクチンは、動物細胞、植物細胞、酵母細胞、ウイルス細胞、真菌もしくは藻類、または合成細胞において産生する。いくつかの実施形態では、適切な動物細胞として、昆虫細胞、哺乳類細胞、ならびに、発育鶏卵、ニワトリ胚細胞、およびアヒル細胞株などの鳥類細胞が挙げられるが、必ずしもこれらに限定するものではない。
いくつかの実施形態では、本発明が提供するインフルエンザワクチンは、1価、2価、3価または4価のインフルエンザワクチンである。
いくつかの実施形態では、本発明が提供するインフルエンザワクチンは、1〜30℃の温度範囲で約6ヶ月貯蔵した場合に、一元放射免疫拡散(SRID)アッセイで測定する力価の約90%以上(例えば、少なくとも約95%、96%、97%、98%、99%)を保持する。
いくつかの実施形態では、本発明が提供するインフルエンザワクチンは、アルキル化剤を実質的に含まない。
さらに別の態様において、本発明は、精製ヘマグルチニン抗原またはヘマグルチニン含有ウイルス粒子をアルキル化剤で処理する工程を含むヘマグルチニンのアルキル化方法を提供する。いくつかの実施形態では、本発明に適したヘマグルチニン含有ウイルス粒子はスプリットウイルスである。いくつかの実施形態では、本発明に適した精製ヘマグルチニン抗原は、精製した表面抗原である。いくつかの実施形態では、本発明に適した精製ヘマグルチニン抗原は、精製組換えヘマグルチニンタンパク質である。いくつかの実施形態では、本発明に適したヘマグルチニンは、カリフォルニアもしくはソロモン株に存在するH1タンパク質、ブリスベン、フロリダ、オハイオ、江蘇もしくは香港株に存在するBタンパク質、またはビクトリア、パース、ブリスタンもしくはウィスコンシン株に存在するH3タンパク質から選択される。
さらに別の態様では、本発明は、卵ベースまたは細胞培養ベースの産生系により産生したインフルエンザウイルスから得られるウイルス粒子をアルキル化剤で処理する工程を含むインフルエンザワクチンの製造方法を提供する。いくつかの実施形態において、本発明に適したウイルス粒子は、インフルエンザウイルスを分解することによって得られる。
さらなる態様において、本発明は、インフルエンザワクチンの製造方法を提供し、前記方法は、卵ベースまたは細胞培養ベースの産生系からインフルエンザウイルスを採集し、インフルエンザウイルスを分解(スプリット)し、スプリットインフルエンザウイルスをアルキル化剤で処理し、処理したスプリットインフルエンザウイルスを不活化することを含む。
様々な実施形態において、前記分解工程は、インフルエンザウイルスを界面活性剤で処理する工程を含む。いくつかの実施形態では、適切な界面活性剤は、Triton(登録商標)(親水性ポリエチレン鎖を有する非イオン性界面活性剤)、タウロデオキシコール酸ナトリウム、ノニルフェノールエトキシレート、臭化セチルトリメチルアンモニウム(CTAB)、および/またはデオキシコール酸ナトリウムから選択される。いくつかの実施形態では、界面活性剤はTriton(登録商標)(例えば、Triton(登録商標)X‐100、Triton(登録商標)N‐101、Triton(登録商標)720および/またはTriton(登録商標)X‐200)である。
いくつかの実施形態において、適切なアルキル化剤は、2‐ヨードアセトアミド(IOAM)、ヨード酢酸、2‐ブロモアセトアミド、グルタチオンブロモアセトアミド、ブロモ酢酸、1,3‐プロパンスルトン、メチルメタンチオスルホン酸、メトキシカルボニルメチルジスルフィド 、マレアミド、マレイミド‐PEG、ビニルピリジン、N‐エチルマレイミド、トシルアセトアミド、およびそれらの組合せからなる群から選択される。いくつかの実施形態において、適切なアルキル化剤は、2‐ヨードアセトアミド(IOAM)である。
いくつかの実施形態では、本発明に適したインフルエンザウイルスは、卵ベースの産生系により産生する。いくつかの実施形態では、適切なインフルエンザウイルスは、動物細胞、植物細胞、酵母細胞、ウイルス細胞、真菌または藻類において産生する。いくつかの実施形態において、適切な動物細胞として、昆虫細胞、哺乳類細胞、ならびに、発育鶏卵、ニワトリ胚細胞、およびアヒル細胞株などの鳥類細胞が挙げられるが、必ずしもこれらに限定するものではない。
いくつかの実施形態において、前記処理工程は、1〜30℃の範囲の温度で、本明細書に記載の精製ヘマグルチニン抗原、ヘマグルチニン含有ウイルス粒子、ウイルス粒子、またはスプリットインフルエンザウイルスをアルキル化剤とともにインキュベートする工程を含む。いくつかの実施形態において、適切な温度は室温である。いくつかの実施形態では、適切な温度範囲は、1〜5℃、2〜8℃、5〜10℃、10〜15℃、15〜20℃、20〜25℃、または25〜30℃である。
いくつかの実施形態では、前記処理工程は、本明細書に記載の精製ヘマグルチニン抗原、ヘマグルチニン含有ウイルス粒子、ウイルス粒子、またはスプリットインフルエンザウイルスを、アルキル化剤とともに、約24時間、20時間、18時間、16時間、14時間、12時間、10時間、8時間、6時間、4時間、2時間、1.5時間、1時間、50分間、40分間、30分間、20分間、または10分間の時間にわたってインキュベートすることを含む。
いくつかの実施形態では、アルキル化剤は、ヘマグルチニン(HA)‐システイン濃度に対して約1倍モル過剰の濃度で存在する。いくつかの実施形態では、アルキル化剤は、ヘマグルチニン(HA)‐システイン濃度に対して約1倍〜100倍、5倍〜85倍、1倍〜50倍、または5倍〜50倍モル過剰の濃度範囲で存在する。
いくつかの実施形態では、アルキル化剤は、約1mM〜1M、1mM〜500mM、1mM〜400mM、1mM〜300mM、1mM〜200mM、または1mM〜100mMの濃度範囲で存在する。いくつかの実施形態では、アルキル化剤は、約1mM、10mM、20mM、30mM、40mM、50mM、100mM、200mM、300mM、400mM、または500mMの濃度で存在する。いくつかの実施形態では、アルキル化剤は、約1μg/ml〜1,000μg/ml、1μg/ml〜500μg/ml、1μg/ml〜400μg/ml、1μg/ml〜300μg/ml、1μg/ml〜200μg/ml、または1μg/ml〜100μg/mlの濃度範囲で存在する。いくつかの実施形態では、アルキル化剤は、約1μg/ml、10μg/ml、20μg/ml、30μg/ml、40μg/ml、50μg/ml、60μg/ml、70μg/ml、80μg/ml、90μg/ml、100μg/ml、200μg/ml、300μg/ml、400μg/ml、または500μg/mlである。
いくつかの実施形態では、アルキル化剤で処理する工程は、ヘマグルチニンの1つ以上のシステイン残基のアルキル化をもたらす。いくつかの実施形態において、アルキル化剤で処理する工程は、1〜5、1〜4、1〜3、2〜5、2〜4、2〜3、3〜5、3〜4、または4〜5個のシステイン残基のアルキル化をもたらす。いくつかの実施形態において、アルキル化剤で処理する工程は、1、2、3、4、または5個のシステイン残基のアルキル化をもたらす。いくつかの実施形態では、アルキル化剤で処理する工程は、ヘマグルチニン中に存在する全システイン残基の約1〜50%、1〜40%、1〜30%、または1〜20%のアルキル化をもたらす。いくつかの実施形態では、アルキル化剤で処理する工程は、ヘマグルチニンを提示するシステイン残基全体の約10%、20%、30%、40%または50%のアルキル化をもたらす。いくつかの実施形態では、アルキル化剤で処理する工程は、ヘマグルチニンに存在する実質的に全ての遊離システイン残基のアルキル化をもたらす。いくつかの実施形態では、アルキル化剤による処理は、非特異的なアルキル化をもたらさない。いくつかの実施形態では、アルキル化剤による処理は、遍在性のメチル化をもたらさない。
様々な実施形態において、アルキル化剤によって処理することにより、同一のインフルエンザワクチンをアルキル化剤で処理しない場合と比較して、一元放射免疫拡散(SRID)法によって測定するインフルエンザワクチンの力価の喪失は減少する。
いくつかの実施形態では、アルキル化剤によって処理することにより、インフルエンザワクチンを30日間1〜30℃で貯蔵した場合に、SRID測定による力価の喪失は約50%以下(例えば、約40%、30%、20%、10%、5%、4%、3%、2%、または1%以下)であった。
いくつかの実施形態において、アルキル化剤で処理する工程は、インフルエンザウイルスを不活化する工程の前に実施する。別の実施形態では、アルキル化剤で処理する工程は、インフルエンザウイルスを不活化する工程と同時に実施する。
いくつかの実施形態において、不活化工程は、インフルエンザウイルスを紫外線または化学的不活化剤で処理する工程を含む。いくつかの実施形態では、不活化工程は、インフルエンザウイルスを、β‐プロピオラクトン、デオキシコール酸ナトリウムおよび/またはホルマリンから選択される化学的不活化剤で処理することを含む。特定の実施形態では、不活化工程は、インフルエンザウイルスをホルマリンで処理する工程を含む。
いくつかの実施形態において、本発明による方法は、アルキル化剤を除去する工程をさらに含む。いくつかの実施形態では、アルキル化剤をダイアフィルトレーションによって除去する。いくつかの実施形態では、アルキル化剤を化学的不活化剤と共に除去する。
とりわけ、本発明は、本明細書に記載の方法に従って製造するインフルエンザワクチンを提供する。様々な実施形態において、本発明が提供するインフルエンザワクチンは、1価、2価、3価または4価のインフルエンザワクチンである。様々な実施形態において、本発明のインフルエンザワクチンは、単一用量、複数用量、成人用量または小児用量のワクチンとして提供することができる。いくつかの実施形態では、各個別用量を、バイアル、小児用注射器などのシリンジ、または他のタイプの容器内に存在させてもよい。様々な実施形態において、本発明のインフルエンザワクチンを、皮内、筋肉内、皮下、静脈内、および他の投与方式のために製剤化してもよい。さらなる投薬、製剤、投与経路を、本明細書の例えば「免疫原性ワクチン組成物」の節に記載する。
本明細書で使用する、一元放射免疫拡散(SRID)アッセイによって測定する「力価」または「安定性」は、それぞれ「見なし力価」または「見なし安定性」を包含する。
本発明の他の特徴、目的、および利点は、以下の詳細な説明、図面および特許請求の範囲において明らかである。しかしながら、これらの詳細な説明、図面、および特許請求の範囲は、本発明の実施形態を示すものの、それらは例示としてのみ与えられ、制限するものではないことは理解すべきである。本発明の範囲内における様々な変更および修正は、当業者に明らかなものとなる。
図面は単に説明を目的とするものであり、制限することを意図するものではない。
定義
本発明の理解をより容易なものとするために、最初にいくつかの用語を以下で定義する。以下の用語および他の用語に関するさらなる定義は、本明細書の随所において明示する。
本発明の理解をより容易なものとするために、最初にいくつかの用語を以下で定義する。以下の用語および他の用語に関するさらなる定義は、本明細書の随所において明示する。
アジュバント:本明細書中で使用する場合、用語「アジュバント」は、抗原に対する免疫応答を非特異的に高める物質またはビヒクルを指す。アジュバントは、抗原を吸着する無機物(ミョウバン、水酸化アルミニウム、またはリン酸塩)の懸濁液、または、抗原溶液をミネラルオイル(例えば、フロイント不完全アジュバント)中に乳化させ、時には死滅させたマイコバクテリアを含有させて(フロイント完全アジュバント)抗原性をさらに高めた油中水型エマルジョンを含むことができる。免疫刺激性オリゴヌクレオチド(例えば、CpGモチーフを含むもの)もアジュバントとして使用することができる(例えば、米国特許第6,194,388号、第6,207,646号、第6,214,806号、第6,218,371号、第6,239,116号、第6,339,068号、第6,406,705号、および第6,429,199号を参照)。アジュバントは、共刺激分子のような生物学的分子も含む。生物学的アジュバントの例として、IL‐2、RANTES、GM‐CSF、TNF‐α、IFN‐γ、G‐CSF、LFA‐3、CD72、B7‐1、B7‐2、OX‐40Lおよび41BBLが挙げられる。
投与:本明細書中で使用する場合、組成物を対象に「投与」するとは、組成物を対象に与える、塗布する、または接触をもたらすことを意味する。投与は、例えば、局所、経口、皮下、筋肉内、腹腔内、静脈内、くも膜下腔内および皮内などの多くの経路のいずれかによって行うことができる。
およそ(Approximately)または約(about):本明細書中で使用する場合、関心対象の1つ以上の値に付記する「およそ(Approximately)」または「約(about)」という用語は、記載する基準値に類似する値を指す。ある実施形態では、「およそ(Approximately)」または「約(about)」という用語は、特段の記載がない限り、または文脈から明らかでない限り、記載の値のいずれかの方向(より大きいまたはより小さい方向)に、25%、20%、19%、18%、17%、16%、15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2%、1%、またはそれ未満に収まるような範囲を指す(そのような数が可能な値の100%を超える場合を除く)。
アルキル化剤:本明細書中で使用する場合、用語「アルキル化剤」は、ある分子から別の分子へアルキル基を転移できる任意の化学物質または非化学物質を指す。アルキル基は、アルキルカルボカチオン、カルバニオン、フリーラジカル、カルビン、およびメチル基を含むことができる。アルキル化は、その最も単純な形態であるメチル化、すなわち炭素基1個のみの転移を包含し得る。いくつかの実施形態において、用語「アルキル化剤」は、メチル化剤を含む。
動物:本明細書中で使用する場合、用語「動物」は、動物界の任意のメンバーを指す。いくつかの実施形態では、「動物」は任意の発達段階にあるヒトを指す。いくつかの実施形態では、「動物」は任意の発達段階にある非ヒト動物を指す。ある実施形態では、非ヒト動物は哺乳類(例えば、げっ歯類、マウス、ラット、ウサギ、サル、イヌ、ネコ、ヒツジ、ウシ、霊長類、および/またはブタ)である。いくつかの実施形態において、動物として、哺乳類、鳥類、爬虫類、両生類、魚類、昆虫、および/または虫類が挙げられるが、必ずしもこれらに限定するものではない。いくつかの実施形態では、動物は、トランスジェニック動物、遺伝子組換え動物、および/またはクローン体であってもよい。
抗体:本明細書中で使用する場合、用語「抗体」は、特定のアミノ酸配列を有するBリンパ球細胞によって産生する免疫グロブリン分子を指す。いくつかの実施形態において、抗体は、ヒトまたは他の動物において特異的抗原(免疫原)によって誘発される。抗体は、いくつかの実証可能な方式で抗原と特異的に反応することを特徴とし、抗体と抗原はそれぞれ他方との関係において規定される。「抗体応答を誘発する」とは、抗原または他の分子が抗体の産生を誘導する能力を指す。いくつかの実施形態では、用語「抗体」は、SRIDアッセイなどのインビトロアッセイで使用する任意の組換え抗体を指し、前記抗体は、免疫グロブリン遺伝子または免疫グロブリン遺伝子のフラグメントによって実質的にコードされる1つ以上のポリペプチドを含む。そのような抗体は、インタクトな免疫グロブリン、または免疫グロブリンクラス、IgG、IgM、IgA、IgDおよびIgEフラグメントの形態でそれぞれ存在してもよい。抗体フラグメントの例として、F(ab)’2、Fab’、および一本鎖Fv(scFv)が挙げられるが、必ずしもこれらに限定するものではない。
抗原:本明細書中で使用する場合、用語「抗原」は、動物に注入または吸収させる組成物を含有し、動物体内において抗体産生またはT細胞応答を刺激することができる化合物、組成物、または物質を指す。抗原は、特異的な液性免疫または細胞性免疫の産物と反応する。これには、異種免疫原によって誘導される免疫産物が含まれる。開示する組成物および方法のいくつかの実施形態において、インフルエンザHAタンパク質は抗原である。
改変:本明細書中で使用する場合、用語「改変」とは、人工的にアミノ酸配列を改変したポリペプチドを指す。例えば、改変したHAポリペプチドは、天然のインフルエンザ分離株中に見出されるHAポリペプチドのアミノ酸配列とは異なるアミノ酸配列を有する。いくつかの実施形態では、改変HAポリペプチドは、NCBIデータベースに含まれるHAポリペプチドのアミノ酸配列とは異なるアミノ酸配列を有する。
H1ポリペプチド:本明細書中で使用する「H1ポリペプチド」は、そのアミノ酸配列中に、H1を特徴づけるとともにH1を他のHAサブタイプと区別する少なくとも1つの配列要素を含むHAポリペプチドである。
H3ポリペプチド:本明細書中で使用する「H3ポリペプチド」は、そのアミノ酸配列中に、H3を特徴づけるとともにH3を他のHAサブタイプと区別する少なくとも1つの配列要素を含むHAポリペプチドである。
H5ポリペプチド:本明細書中で使用する「H5ポリペプチド」は、そのアミノ酸配列中に、H5を特徴づけるとともにH5を他のHAサブタイプと区別する少なくとも1つの配列要素を含むHAポリペプチドである。
ヘマグルチニン(HA):本明細書中で使用する場合、用語「ヘマグルチニン」、「ヘマグルチニンポリペプチド」または「ヘマグルチニンタンパク質」は、天然型または改変を含む組換え型ヘマグルチニンを指す。インフルエンザ分離株由来の多種多様なHA配列が当該分野で公知である。実際、国立バイオテクノロジー情報センター(NCBI)は、本出願の出願時点において、少なくとも9796種類のHA配列を含むデータベース(http://www.ncbi.nlm.nih.gov/genomes/FLU/)を保有している。このデータベースを参照する当業者は、HAポリペプチド全般に特徴的な配列および/または特定のHAポリペプチド(例えば、H1、H2、H3、H4、H5、H6、H7、H8、H9、H10、H11、H12、H13、H13、H14、H15、もしくはH16ポリペプチド、または、例えば鳥類、ラクダ、イヌ、ネコ、シベット、エンビロンメント(environment)、ウマ、ヒト、ヒョウ、ミンク、マウス、アザラシ、ストーンマーティン(stone martin)、ブタ、トラ、クジラなどの特定の宿主の感染を媒介するHA)に特徴的な配列を容易に同定することができる。
免疫応答:本明細書で使用する用語「免疫応答」は、B細胞、T細胞、マクロファージまたは多核球などの免疫系細胞の、抗原またはワクチンなどの刺激に対する応答を指す。免疫応答は、例えば、インターフェロンまたはサイトカインを分泌する上皮細胞などの、生体防御応答に関与する体内の任意の細胞を含み得る。免疫応答としては、自然免疫応答または炎症が挙げられるが、必ずしもこれらに限定するものではない。本明細書中で使用する場合、防御免疫応答は、対象を感染から保護する(感染を予防するか、または感染に関連する疾患の発症を予防する)免疫応答を指す。免疫応答を測定する方法は、当該分野で公知であり、例えば、リンパ球(B細胞またはT細胞など)の増殖および/または活性、サイトカインまたはケモカインの分泌、炎症、抗体産生などを測定することを含む。
免疫原:本明細書中で使用する場合、用語「免疫原」は、動物に注入または吸収させる組成物を含有し、適切な条件下で、動物体内における抗体産生またはT細胞応答などの免疫応答を刺激することができる化合物、組成物または物質を指す。本明細書中で使用する場合、「免疫原性組成物」は、免疫原(HAポリペプチドなど)を含む組成物である。本明細書中で使用する場合、「免疫する」とは、ワクチン接種などによって対象に感染症からの保護を与えることを意味する。
インビトロ:本明細書中で使用する場合、用語「インビトロ」は、多細胞生物内ではなく、人工環境、例えば試験管または反応容器中、細胞培養中などで生じる事象を指す。
インビボ:本明細書中で使用する場合、用語「インビボ」は、多細胞生物、例えばヒトおよび非ヒト動物体内で起こる事象を指す。細胞ベースの系においては、この用語は、(例えば、インビトロの系とは対照的に)生細胞内で起こる事象を指すために使用してもよい。
インフルエンザウイルス:本明細書で使用する場合、用語「インフルエンザウイルス」は、オルトミクソウイルス科に属する分節マイナス鎖RNAウイルスを指す。インフルエンザウイルスには、A型、B型、C型の3タイプが存在する。インフルエンザA型ウイルスは、ヒト、ウマ、海洋哺乳類、ブタ、フェレット、およびニワトリなどの様々な鳥類および哺乳類に感染する。動物においては、インフルエンザA型ウイルスは、その多くが呼吸器および腸管に対して軽度の限局性感染を引き起こす。しかしながら、H5N1などの高病原性インフルエンザA株は、家禽類への全身感染を引き起こし、その死亡率は100%に達する。2009年においては、ヒトインフルエンザ発症の最も主要な原因はH1N1型インフルエンザであった。2009年にブタ起源の新型インフルエンザH1N1が出現し、世界保健機関(WHO)はパンデミックを宣言した。この株は「ブタインフルエンザ」と呼称された。H1N1インフルエンザA型ウイルスは、1918年のスペイン風邪のパンデミック、1976年のフォートディックスのアウトブレイク、1977〜1978年のソ連風邪のパンデミックの原因ともなった。
インフルエンザワクチン:本明細書中で使用する場合、用語「インフルエンザワクチン」は、インフルエンザウイルス感染などの疾患の予防、改善または治療のために投与し、免疫応答を刺激できる免疫原性物質の調製物を指す。免疫原性物質としては、例えば、弱毒化もしくは死滅させた微生物(弱毒ウイルスなど)、または抗原性タンパク質、それらに由来するペプチドもしくはDNA、またはそのような免疫原性物質の任意の組換体が挙げられる。
分離:本明細書中で使用する場合、用語「分離」は、(i)初期生成時に(天然もしくは実験的な設定下で)関連する成分の少なくともいくつかから分離させるか、または(ii)人工的に生成する薬剤または実体を指す。分離した薬剤または実体は、初期時の関連する他の成分に対して、少なくとも約10%、少なくとも約20%、少なくとも約30%、少なくとも約40%、少なくとも約50%、少なくとも約60%、少なくとも約70% 少なくとも約80%、少なくとも約90%、またはそれを上回る量で存在する。いくつかの実施形態において、分離した薬剤は、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%超の純度である。
アウトブレイク:本明細書中で使用する場合、インフルエンザウイルスの「アウトブレイク」とは、特定の年における単一の国に由来するウイルス分離株の集団を指す。
薬学的に許容可能なビヒクル:本開示において有用な薬学的に許容可能な担体(ビヒクル)は、公知である。Remington’s Pharmaceutical Sciences,by E.W.Martin,Mack Publishing Co.,Easton,PA,15th Edition(1975)には、1つ以上の治療用組成物、例えば1つ以上のインフルエンザワクチンと追加の医薬品を医学的に送達するのに適した組成物および製剤が記載されている。一般に、担体の性質は、採用する特定の投与方式に依存する。例えば、非経口製剤は、通常、ビヒクルとして、水、生理食塩水、平衡塩類溶液、水性デキストロース、グリセロールなどの薬学的および生理学的に許容可能な流体を含む注射液を含む。固体組成物(例えば、粉末、丸剤、錠剤またはカプセル剤)の場合、従来の非毒性固体担体は、例えば、医薬グレードのマンニトール、ラクトース、デンプン、またはステアリン酸マグネシウムを含むことができる。生物学的に中性の担体に加えて、投与する医薬組成物は、例えば湿潤剤または乳化剤、防腐剤、およびpH緩衝剤などの少量の非毒性の補助物質、例えば酢酸ナトリウムまたはソルビタンモノラウレートを含有することができる。
組換体:本明細書中で使用する場合、用語「組換体」は、天然に存在しない配列を有するか、または離れた2つの別個の配列部分の人工的な組合せによって作製する配列を有する組換え核酸もしくはタンパク質を指す。この人工的な組合せは、多くの場合、化学合成、またはより一般的には、単離した核酸部分の人為的操作、例えば遺伝子工学技術によって達成する。
組換えインフルエンザワクチン:本明細書中で使用する場合、用語「組換えインフルエンザワクチン」は、逆遺伝学的方法を用いて作製したインフルエンザワクチンを指し、ウイルス様粒子、ならびにDNAおよびウイルスベクターに基づくワクチンを含むが、必ずしもこれらに限定するものではない。
SRIDアッセイ:本明細書中で使用する場合、用語「SRID」(一元放射免疫拡散)アッセイは、試料中のHA抗原の量を定量するためのプロトコールを指す。一般に、SRIDアッセイは、界面活性剤で可溶化したウイルスを配置したウェルの周囲に沈殿する抗原/抗体の量を測定し、A型/カリフォルニア/07/2009のような公式標準抗原と比較することによりHA濃度を決定することができる。具体的には、所定量のポリクローナル抗体を含有するアガロース溶液を、3〜4mmの穴があけられた薄いゲル層中にプレーティングする。HA標準抗原の希釈物を、濃度未知のHA試料とともにウェルに入れる。ゲルをインキュベートし、得られた沈降環を、ゲルのクーマシーブルー染色により可視化する。インフルエンザワクチンのHA力価を計算するために、環径を測定し、標準曲線と比較する。
対象:本明細書中で使用する場合、用語「対象」は、生きている多細胞脊椎動物を指し、このカテゴリーは、ヒト、および非ヒト霊長類のような非ヒト哺乳類の両方を含む。
実質的に:本明細書中で使用する場合、用語「実質的に」は、総量の80%、85%、90%、95%、96%、97%、98%、99%より大きい量を指す。
ワクチン接種:本明細書中で使用する場合、用語「ワクチン接種」は、例えば病原体に対して免疫応答を起こすことを意図した組成物を投与することを指す。本発明の目的のために、ワクチン接種は、病原体への曝露の前、曝露中、および/または曝露の後に投与することができる。いくつかの実施形態では、病原体への曝露の前、曝露中、および/または曝露の直後に投与することができる。いくつかの実施形態では、ワクチン接種は、適切に間隔を空けた複数回のワクチン接種組成物の投与を含む。
野生型:当該技術分野で理解されているように、用語「野生型」は、自然界に見出されるような通常の形態のタンパク質または核酸を一般に指す。例えば、野生型HAポリペプチドは、インフルエンザウイルスの天然分離株中に見出される。様々な異なる野生型HA配列を、NCBIインフルエンザウイルス配列データベースに見出すことができる(ワールドワイドウェブncbi.nlm.nih.gov/genomes/FLU/FLUから入手可能)。
詳細な説明
本発明は、とりわけ、1つ以上のアルキル化システイン残基を含むヘマグルチニンに基づく改良型インフルエンザワクチンを提供する。特に、本発明は、アルキル化剤で処理したヘマグルチニンを含有するインフルエンザワクチンおよびその製造方法を提供する。本発明が提供する本発明のインフルエンザワクチンは、貯蔵に際しても一元放射免疫拡散(SRID)アッセイによる測定力価を保持する優れた性能を有する。
本発明の様々な態様を、以下のサブセクションにおいてさらに詳細に説明する。サブセクションの使用は、本発明を制限することを意図するものではない。各サブセクションは、本発明の任意の態様に適用してもよい。本出願において、「or」の使用は、他に特段の記載がない限り、「and/or」を意味する。
本発明は、とりわけ、1つ以上のアルキル化システイン残基を含むヘマグルチニンに基づく改良型インフルエンザワクチンを提供する。特に、本発明は、アルキル化剤で処理したヘマグルチニンを含有するインフルエンザワクチンおよびその製造方法を提供する。本発明が提供する本発明のインフルエンザワクチンは、貯蔵に際しても一元放射免疫拡散(SRID)アッセイによる測定力価を保持する優れた性能を有する。
本発明の様々な態様を、以下のサブセクションにおいてさらに詳細に説明する。サブセクションの使用は、本発明を制限することを意図するものではない。各サブセクションは、本発明の任意の態様に適用してもよい。本出願において、「or」の使用は、他に特段の記載がない限り、「and/or」を意味する。
インフルエンザワクチン
本発明は、任意のインフルエンザワクチンに適用可能である。一般に、インフルエンザウイルスは、抗原の違いによってA型、B型およびC型に分類される。インフルエンザウイルスA型は、例えば、A型/北京/353/89のように、サブタイプまたはタイプ、地理的起源、菌株番号、および分離した年を含む命名法によって記述する。少なくとも18種のサブタイプのHA(H1〜H18)および11種のサブタイプのNA(N1〜N11)が存在する。H1〜H3およびN1〜N2などのいくつかのサブタイプは、ヒトにおいて一般的に認められる(Murphy and Webster,“Orthomyxoviruses”,in Virology,ed.Fields,B.N.,Knipe,D.M.,Chanock,R.M.,1091‐1152(Raven Press,New York,(1990))。
本発明は、任意のインフルエンザワクチンに適用可能である。一般に、インフルエンザウイルスは、抗原の違いによってA型、B型およびC型に分類される。インフルエンザウイルスA型は、例えば、A型/北京/353/89のように、サブタイプまたはタイプ、地理的起源、菌株番号、および分離した年を含む命名法によって記述する。少なくとも18種のサブタイプのHA(H1〜H18)および11種のサブタイプのNA(N1〜N11)が存在する。H1〜H3およびN1〜N2などのいくつかのサブタイプは、ヒトにおいて一般的に認められる(Murphy and Webster,“Orthomyxoviruses”,in Virology,ed.Fields,B.N.,Knipe,D.M.,Chanock,R.M.,1091‐1152(Raven Press,New York,(1990))。
HAに対する抗体は、ウイルスを中和し、インフルエンザによる感染に対する自然免疫の基礎を形成する(Clements,“Influenza Vaccines”,in Vaccines:New Approaches to Immunological Problems,ed.Ronald W.Ellis,pp.129‐150(Butterworth‐Heinemann,Stoneham,Mass.1992))。インフルエンザワクチンは、通常、中和抗体を誘発するのに適した有効量のHAを含有する。
インフルエンザHA特異的中和IgGおよびIgA抗体の存在は、感染および病気に対する耐性と関連している(Clements,1992)。不活化した全ウイルスまたは部分的に精製した(スプリットサブユニットの)インフルエンザワクチンを、各株のHA量に対して標定する。認可されたインフルエンザワクチンの多くは、インフルエンザA型の2種のサブタイプウイルス(H1N1およびH3N2)ならびに1種のインフルエンザB型のサブタイプウイルスに由来し、ホルマリンで不活化した全ウイルスまたは化学的に分解したサブユニット調製物を含む。
いくつかの実施形態では、インフルエンザA型およびB型ワクチンの種ウイルスは、鶏卵の尿膜腔液中に高力価で蓄積する天然起源の株である。あるいは、インフルエンザA型成分用の株は、適合する表面抗原遺伝子を有するリアソータントなウイルスである。リアソータントなウイルスとは、ウイルスゲノムのセグメント化により、各親株の特徴を有するウイルスである。2つ以上のインフルエンザウイルス株が細胞に感染すると、これらのウイルスセグメントは混合し、両方の親株由来の様々な種類の遺伝子を含む子孫ウイルス粒子が生成する。
本発明は、A型、B型またはC型の任意のインフルエンザ株の様々なワクチンに適用してもよい。特に、本発明は、過去に存在したもの、現在に存在するもの、将来発生するものを含め、ヒトへの感染が可能な任意のA型、B型またはC型インフルエンザ株の様々なワクチンに適用してもよい。いくつかの実施形態において、本発明は、異なる株のワクチンを含む様々なインフルエンザワクチンに適用してもよく、例として、H1、H2、H3、H4、H5、H6、H7、H8、H9、H10、H11、H12、H13、H14、H15、H16、H17、およびH18が挙げられるが、必ずしもこれらに限定するものではない。いくつかの実施形態において、本発明の実施形態は、パンデミックまたは風土病菌株の様々なインフルエンザワクチンに適用することができ、例として、H1N1、H2N2、H3N2、H3N8、H5N1、H7N7、H7N9、H1N2、H9N2、H7N2、H10N7、H17N10、およびH18N11が挙げられるが、必ずしもこれらに限定するものではない。
非限定的な例として、本発明は、シチメンチョウインフルエンザウイルスA株/シチメンチョウ/アイルランド/1378/83(H5N8)、シチメンチョウインフルエンザウイルスA株/シチメンチョウ/イングランド/63(H7N3)、シチメンチョウインフルエンザウイルスA株/シチメンチョウ/イングランド/66(H6N2)、A株/シチメンチョウ/イングランド/69(H7N2)、A株/シチメンチョウ/スコットランド/70(H6N2)、シチメンチョウインフルエンザウイルスA株/シチメンチョウ/イングランド/N28/73(H5N2)、シチメンチョウインフルエンザウイルスA株/シチメンチョウ/イングランド/110/77(H6N2)、シチメンチョウインフルエンザウイルスA株/シチメンチョウ/イングランド/647/77(H1N1)、シチメンチョウインフルエンザウイルスA株/シチメンチョウ/オンタリオ/7732/66(H5N9)、シチメンチョウインフルエンザウイルスA株/シチメンチョウ/イングランド/199/79(H7N7)、シチメンチョウインフルエンザウイルスA株/シチメンチョウ/オンタリオ/7732/66(H5N9)、シチメンチョウインフルエンザウイルスA株/シチメンチョウ/アイルランド/1378/85(H5N8)、シチメンチョウインフルエンザウイルスA株/シチメンチョウ/イングランド/50‐92/91(H5N1)、シチメンチョウインフルエンザウイルスA株/シチメンチョウ/ウィスコンシン/68(H5N9)、シチメンチョウインフルエンザウイルスA株/シチメンチョウ/マサチューセッツ/65(H6N2)、シチメンチョウインフルエンザウイルスA株/シチメンチョウ/オレゴン/71(H7N3)、シチメンチョウインフルエンザウイルスA株/シチメンチョウ/オンタリオ/6228/67(H8N4)、シチメンチョウインフルエンザウイルスA株/シチメンチョウ/ウィスコンシン/66(H9N2)、シチメンチョウインフルエンザウイルスA株/シチメンチョウ/イングランド/647/77(H1N1)、シチメンチョウインフルエンザウイルスA株/シチメンチョウ/オンタリオ/6118/68(H8N4)、シチメンチョウインフルエンザウイルスA株/シチメンチョウ/ドイツ/3/91、シチメンチョウインフルエンザウイルスA株/シチメンチョウ/ミネソタ/833/80(H4N2)ニワトリインフルエンザウイルスA株/ニワトリ/インドネシア/03(H5N1)、ニワトリインフルエンザウイルスA株/ニワトリ/FPV/ロストック/1934、ニワトリインフルエンザウイルスA株/ニワトリ/テキサス/298313/04、ニワトリインフルエンザウイルスA株/ニワトリ/テキサス/167280‐4‐/02、ニワトリインフルエンザウイルスA株/ニワトリ/香港/220/97、ニワトリインフルエンザウイルスA株/ニワトリ/イタリア/8/98、ニワトリインフルエンザウイルスA株/ニワトリ/ビクトリア州/7/6(H7N7)、ニワトリインフルエンザウイルスA株/ニワトリ/ドイツ/79(H7N7)、ニワトリインフルエンザウイルスA株/ニワトリ/スコットランド/59(H5N1)、ニワトリインフルエンザウイルスA株/ニワトリ/ペンシルバニア/1370/83(H5N2)、ニワトリインフルエンザウイルスA株/ニワトリ/ケレタロ‐19/95(H5N2)、ニワトリインフルエンザウイルスA株/ニワトリ/ケレタロ‐20/95(H5N2)、ニワトリインフルエンザウイルスA株/ニワトリ/香港/258/97(H5N1)、ニワトリインフルエンザウイルスA株/ニワトリ/イタリア/1487/97(H5N2)、ニワトリインフルエンザウイルスA株/ニワトリ/ライプツィヒ/79(H7N7)、ニワトリインフルエンザウイルスA株/ニワトリ/ビクトリア/185(H7N7)、ニワトリインフルエンザウイルスA株/ニワトリ/ビクトリア/92(H7N3)、ニワトリインフルエンザウイルスA株/ニワトリ/クイーンズランド/95株(H7N3)、ニワトリインフルエンザウイルスA株/ニワトリ/パキスタン/1369/95(H7N2)、ニワトリインフルエンザウイルスA株/ニワトリ/パキスタニ(Pakistani)447‐4/95(H7N3)、ニワトリインフルエンザウイルスA株/ニワトリ/香港/G9/97(H9N2)、ニワトリインフルエンザウイルスA株/ニワトリ/ナコーン・パトム/タイ/CU‐K2/2004(H5N1)、ニワトリインフルエンザウイルスA株/ニワトリ/香港/31.2/2002(H5N11)、ニワトリインフルエンザウイルスA株/ニワトリ/ベトナム/C58/04(H5N1)、ニワトリインフルエンザウイルスA株/ニワトリ/ベトナム/38/2004(H5N1)、ニワトリインフルエンザウイルスA株/ニワトリ/アラバマ/7395/75(H4N8)、ニワトリインフルエンザウイルスA株/ニワトリ/ドイツ/N/49(H10N7)、ニワトリインフルエンザウイルスA株/ニワトリ/北京/1/94(H9N2)、ニワトリインフルエンザウイルスA株/ニワトリ/香港/G23/97(H9N2)、ニワトリインフルエンザウイルスA株/ニワトリ/ペンシルバニア/8125/83(H5N2)、ニワトリインフルエンザウイルスA株/ニワトリ/香港/97(H5N1)、アヒルインフルエンザウイルスA株/アヒル/安陽/AVL‐1/01、アヒルインフルエンザウイルスA株/アヒル/ニューヨーク/17542‐4/86(H9N1)、アヒルインフルエンザウイルスA株/アヒル/アルバータ/28/76(H4N6)、アヒルインフルエンザウイルスA株/アヒル/南昌/4‐165/2000(H4N6)、アヒルインフルエンザウイルスA株/アヒル/ドイツ/49(H10N7)、アヒルインフルエンザウイルスA株/ブラックダック/オーストラリア/702/78(H3N8)、アヒルインフルエンザウイルスA株/アヒル/ベトナム/11/2004(H5N1)、アヒルインフルエンザウイルスA株/アヒル/アルバータ/60/76(H12N5)、アヒルインフルエンザウイルスA株/アヒル/香港/196/77(H1)、アヒルインフルエンザウイルスA株/アヒル/ウィスコンシン/1938/80(H1N1)、アヒルインフルエンザウイルスA株/アヒル/バイエルン/2/77(H1N1N1)、アヒルインフルエンザウイルスA株/アヒル/バイエルン/1/77(H1N1)、アヒルインフルエンザウイルスA株/アヒル/オーストラリア/749/80(H1N1)、アヒルインフルエンザウイルスA株/アヒル/香港/Y280/97(H9N2)、アヒルインフルエンザウイルスA株/アヒル/アルバータ/35/76H1N1)(例えばAustin eta!.,1990参照)トリインフルエンザウイルスA株/マガモ/グリエフ/263/82(H14N5)、トリインフルエンザウイルスA株/マガモ/PA/10218/84(H5N2)、トリインフルエンザウイルスA株/マガモ/アストラハン/244/82(H14N6)、ガチョウインフルエンザウイルスA株/ガチョウ/広東/1/96、ガチョウインフルエンザウイルスA株/ガチョウ/ライプツィヒ/137‐8/79(H7N7)、ガチョウインフルエンザウイルスA株/ガチョウ/香港/W222/97(H6N7)、ガチョウインフルエンザウイルスA株/ガチョウ/ライプツィヒ/187‐7/79(H7N7)、ガチョウインフルエンザウイルスA株/ガチョウ/ライプツィヒ/192‐7/79(H7N7)、トリインフルエンザウイルスA株/Env/香港/437‐4/99、トリインフルエンザウイルスA株/Env/香港/437‐6/99、トリインフルエンザウイルスA株/Env/香港/43 7‐8/99、トリインフルエンザウイルスA株/Env/香港/437‐10/99、トリインフルエンザウイルスA株/家禽ペストウイルス株/オランダ/27(H7N7)、トリインフルエンザウイルスA株/家禽ペストウイルス株/ドブソン/27(H7N7)(例えばHorimoto eta!.,2001参照)トリインフルエンザウイルスA株/家禽ペストウイルス株/ロストック/34(H7N1)、トリインフルエンザウイルスA株/家禽ペストウイルス株/エジプト/45(H7N1)、トリインフルエンザウイルスA株/家禽ペストウイルス株/ウェーブリッジ(H7N7)、トリインフルエンザウイルスA株/アジサシ/南アフリカ/61(H5N3)、トリインフルエンザウイルスA株/アジサシ/オーストラリア/G70C/75(H11N9)、トリインフルエンザウイルスA株/ウズラ/ベトナム/36/04(H5N1)、トリインフルエンザウイルスA株/カモメ/メリーランド/704/77(H13N6)、トリインフルエンザウイルスA株/ユリカモメ/スウェーデン/5/99(H16N3)、トリインフルエンザウイルスA株/セグロカモメ/DE/677/88(H2N8)、トリインフルエンザウイルスA株/ハクチョウ/イタリア/179/06(H5N1)、トリインフルエンザウイルスA株/香港/156/97(A/香港/156/97)、トリインフルエンザウイルスA株/ウズラ/香港/G1/97(H9N2)、トリインフルエンザウイルスA株/ウズラ/香港/AF157/93(H9N2)、トリインフルエンザウイルスA株/コガモ/香港/W312/97(H6N1)、トリインフルエンザウイルスA株/ミズナギドリ/西オーストラリア/2576/79(H15N9)、トリインフルエンザウイルスA株/ミズナギドリ/オーストラリア/72(H6N5)、トリインフルエンザウイルスA株/香港/212/03、トリインフルエンザウイルスA株/イングランド/321/77(H3N2)、トリ由来トリH5N1型インフルエンザウイルスのトリパンデミックインフルエンザA型ウイルス、トリH7N1インフルエンザ株、トリH9N2インフルエンザウイルス、ならびにトリインフルエンザウイルス低温馴化(ca)および温度感受性(ts)マスタードナー株A型/レニングラード/134/17/57(H2N2)などのインフルエンザ株に適用してもよく、それらの開示を参照として援用するが、必ずしもこれらに限定するものではない。本発明の方法に使用してもよい他のインフルエンザ株としては、ウマインフルエンザウイルス(A型/ウマ2型(H3N8)、ニューマーケット1/93)、ウマ2型インフルエンザウイルス(EIV、サブタイプH3N8)、ウマ2型インフルエンザウイルス、A型/ウマ/ケンタッキー/1/91(H3N8)、ウマインフルエンザウイルス株A型/ウマ/ベルリン/2/91(H3N8)、ウマインフルエンザウイルス株A型/ウマ/ケンブリッジ/1/63(H7N7)、ウマインフルエンザウイルス株A型/ウマ/プラハ/1/56(H7N7)、ウマインフルエンザウイルス株A型/ウマ/ケンタッキー/98、ウマインフルエンザウイルス株A型/ウマ2型(Kentucky 81)、ウマインフルエンザウイルス株A型/ウマ/ケンタッキー/1/81(Eq/Ky)ウマインフルエンザウイルス株A型/ウマケンタッキー/1/81(H3N8)、ウマインフルエンザウイルス株A型/ウマ/ケンタッキー/1/91(H3N8)、ウマインフルエンザウイルス株A型/ウマ/ケンタッキー/1277/90(Eq/Kentucky)、ウマインフルエンザウイルス株A型/ウマ/ケンタッキー/2/91(H3N8)、ウマインフルエンザウイルス株A型/ウマ/ケンタッキー/79(H3N8)、ウマインフルエンザウイルス株A型/ウマ/ケンタッキー/81、ウマインフルエンザウイルス株A型/ウマ/ケンタッキー/91(H3N8)、ウマインフルエンザウイルス株A型/ウマ2型/ケンタッキー/95(H3N8)およびウマインフルエンザウイルス株A型/ウマ2型/ケンタッキー/98、ウマインフルエンザウイルス株A型/ウマ/ニューマーケット/1/77、ウマインフルエンザウイルス株A型/ウマ/ニューマーケット/5/03、ウマインフルエンザ
ウイルス株A型/ウマ2型(H3N8)、ニューマーケット1/93、ウマインフルエンザウイルス株A型/ウマ2型/ニューマーケット1/93、ウマインフルエンザウイルス株A型/ウマ/ニューマーケット/2/93、ウマインフルエンザウイルス株A型/ウマ/ニューマーケット/79(H3N8)、ウマインフルエンザウイルス株A型/ウマ/ニューマーケット/1/77(H7N7)およびウマインフルエンザウイルス株A型/ウマ2型/ニューマーケット‐2/93、ウマインフルエンザウイルス株A型/ウマ/マイアミ/63(H3N8)、A型/ウマ1型(プラハ株)、ウマインフルエンザウイルス株A型/ウマ2型(マイアミ)、ウマインフルエンザウイルス株A型/ウマ1型/プラハ/56(Pr/56)、ウマインフルエンザウイルス株A型/ウマ2型/サフォーク/89(Suf/89)、ウマインフルエンザウイルス株A型/ウマ2型/サセックス/89(H3N8)、ウマインフルエンザウイルス株A型/ウマ/サセックス/89、ウマインフルエンザウイルス株A型/ウマ2型/サスカトゥーン/90、ウマインフルエンザウイルス株A型/ウマ/プラハ/1/56(H7N7)、ウマインフルエンザウイルス株A型/ウマ/マイアミ/1/63(H3N8)、A型/愛知/2/68(H3N2)、ウマインフルエンザウイルス株A型/ウマ/東京/2/71(H3N8)、ウマインフルエンザウイルス株A型/ウマ/ラプラタ/1/88、ウマインフルエンザウイルス株A型/ウマ/吉林/1/89(Eq/吉林)、ウマインフルエンザウイルス株A型/ウマ/アラスカ/1/91(H3N8)、ウマインフルエンザウイルス株A型/ウマ/サスカトゥーン/1/91(H3N8)、ウマインフルエンザウイルス株A型/ウマ/ローマ/5/91(H3N8)、ウマインフルエンザウイルス株A型/ウマ/ラプラタ/1/93(H3N8)、ウマインフルエンザウイルス株A型/ウマ/ラプラタ/1/93(LP/93)、ウマインフルエンザウイルス株A型/ウマ/オランダ/1/95(H3N8)、ウマインフルエンザウイルス株A型/ウマ/オランダ/2/95(H3N8)、ヒトインフルエンザウイルスA型(H3N2)分離株、ヒトインフルエンザウイルスA型/メンフィス/1/71(H3N2)、ヒトインフルエンザウイルスA型/南昌/933/95(H3N2)ウイルス、ヒトインフルエンザウイルスA型/PR/8/34(H1N1)ウイルス、ヒトインフルエンザウイルスA型/シンガポール/57(H2N2)ウイルス、インフルエンザウイルスA型、インフルエンザウイルスA型/香港/213/03、インフルエンザウイルス株A型/香港/483/97株、インフルエンザウイルス株A型/タイ/S(KK‐494)/2004(H5N1)、インフルエンザウイルス株A型 PR/8/34(PR8)ウイルス株(H1N1サブタイプ)、インフルエンザウイルス株A型/愛知/2/68(H3N2)、インフルエンザウイルス株AI型 アナーバー/6/60 低温馴化ウイルス株、インフルエンザウイルス株A型/北京 32/92(H3N2)、インフルエンザウイルス株A型/シャーロッツビル/31/95(H1N1)、インフルエンザウイルス株A型/川崎/86(H1N1)ウイルス株、インフルエンザウイルス株A型/韓国/82株(H3N2)、インフルエンザウイルス株A型/レニングラード/134/57株、インフルエンザウイルス株A型/NWS/33(H1N1)、インフルエンザウイルス株A型/PR/8/34(H1N1)、インフルエンザウイルス株A型/PR 8/34株、インフルエンザウイルス株A型/プエルトリコ(PR)/8/34、インフルエンザウイルス株A型/プエルトリコ/8‐シナイ山、インフルエンザウイルス株A型/山東 9/93(H3N2)、インフルエンザウイルス株A型/シンガポール/1/57(H2N2)、インフルエンザウイルス株A型/シンガポール6/86(H1N1)、インフルエンザウイルス株A型/シンガポール/1/57(H2N2)、インフルエンザウイルス株A型/テキサス36/91(H1N1)、インフルエンザウイルス株A型/テキサス/36/91(H1N1)ウイルス株、インフルエンザウイルス株A型/テキサス/36/91(H1N1)、インフルエンザウイルス株A型/ウドン/72ウイルス感染、インフルエンザウイルスA型/ビクトリア/3/75(H3N2)、インフルエンザウイルスA型/バージニア/88(H3N2)、インフルエンザウイルスA型/WSN/33(H1N1)インフルエンザウイルスA型/WSN/33、インフルエンザウイルスB型、インフルエンザウイルスB型/アナーバー1/86、インフルエンザウイルスB型/ハルビン/7/94、インフルエンザウイルスB型/香港/5/72、インフルエンザウイルスB型/リー/40、インフルエンザウイルスB型ナマガタ(Namagata)16/88、インフルエンザウイルスB型/山形グループ、インフルエンザウイルスBナマナシ(Namanashi)/166/98、インフルエンザウイルスC型、インフルエンザウイルス株A型/ウマ/2/キルデア/89、インフルエンザウイルスB型/パナマ45/90、低温馴化温度感受性(ca/ts)ロシア型インフルエンザA型生ワクチン、ブタH1およびH3インフルエンザウイルス、ブタインフルエンザAウイルス、ブタインフルエンザウイルス(SIV)、ブタインフルエンザウイルスA型/ブタ/ドイツ 2/81、ブタインフルエンザウイルスA型/ブタ/ドイツ 8533/91、ブタインフルエンザウイルス株A型/ブタ/ウィスコンシン/125/97(H1N1)、ブタインフルエンザウイルス株A型/ブタ/ウィスコンシン/136/97(H1N1)、ブタインフルエンザウイルス株A型/ブタ/ウィスコンシン/63/97(H1N1)、ブタインフルエンザウイルス株A型/ブタ/ウィスコンシン/164/97(H1N1)、ブタインフルエンザウイルス株A型/ブタ/ウィスコンシン/166/97(H1N1)、ブタインフルエンザウイルス株A型/ブタ/ウィスコンシン/168/97(H1N1)、ブタインフルエンザウイルス株A型/ブタ/ウィスコンシン/235/97(H1N1)、ブタインフルエンザウイルス株A型/ブタ/ウィスコンシン/238/97(H1N1)、ブタインフルエンザウイルス株A型/ブタ/ウィスコンシン/457/98(H1N1)、ブタインフルエンザウイルス株A型/ブタ/ウィスコンシン/458/98(H1N1)、ブタインフルエンザウイルス株A型/ブタ/ウィスコンシン/464/98(H1N1)、ブタインフルエンザウイルス株A型/ブタ/インディアナ/1726/88(H1N1)、ブタインフルエンザウイルス株A型/ブタ/インディアナ/9K035/99(H1N2)、ブタインフルエンザウイルス株A型/ブタ/ネブラスカ/1/92(H1N1)、ブタインフルエンザウイルス株A型/ブタ/ケベック/91(H1N1)、ブタインフルエンザウイルス株A型/ブタ/ケベック/81(H1N1)、ブタインフルエンザウイルス株A型/ブタ/ニュージャージー/11/76(H1N1)、ブタインフルエンザウイルス株A型/ブタ/愛媛/1/80(H1N2)、ブタインフルエンザウイルス株A型/ブタ/イングランド/283902/93(H1N1)、ブタインフルエンザウイルス株A型/ブタ/イングランド/195852/92(H1N1)、ブタインフルエンザウイルス株A型/ブタ/ドイツ/8533/91(H1N1)、ブタインフルエンザウイルス株A型/ブタ/ドイツ/2/81(H1N1)、ブタインフルエンザウイルス株A型/ブタ/ネブラスカ/209/98(H3N2)、A型/ブタ/アイオワ/533/99(H3N2)、ブタインフルエンザウイルス株A型/ブタ/アイオワ/569/99(H3N2)、ブタインフルエンザウイルス株A型/ブタ/ミネソタ/593/99(H3N2)、ブタインフルエンザウイルス株A型/ブタ/アイオワ/8548‐1/98(H3N2)、ブタインフルエンザウイルス株A型/ブタ/ミネソタ/9088‐2/98(H3N2)、ブタインフルエンザウイルス株A型/ブタ/テキサス/4199‐2/98(H3N2)、ブタインフルエンザウイルス株A型/ブタ/オンタリオ/41848/97(H3N2)、ブタインフルエンザウイルス株A型/ブタ/ノースカロライナ/35922/98(H3N2)、A型/ブタ/コロラド/1/77(H3N2)、ブタインフルエンザウイルス株A型/ブタ/香港/3/76(H3N2)、ブタインフルエンザウイルス株A型/ブタ/香港/13/77(H3N2)、ブタインフルエンザウイルス株A型/ブタ/長崎/1/90(H1N2)、ブタインフルエンザウイルス株A型/ブタ/長崎/1/89(H1N2)、ブタインフルエンザウイルス株A型/ブタ/ウィスコンシン/1915/88(H1N1)、ブタインフルエンザウイルス株A型/ブタ/アイオワ/17672/88(H1N1)、ブタインフルエンザウイルス株A型/ブタ/テネシー/24/77(H1N1)、ブタインフルエンザウイルス株A型/ブタ/オンタリオ/2/81(H N1)、ブタインフルエンザウイルス株A型/ブタ/ウィスコンシン/1/67(H1N1)、ブタインフルエンザウイルス株A型/ブタ/イタリア/1521/98(H1N2)、ブタインフルエンザウイルス株A型/ブタ/イタリア/839/89(H1N1)、ブタインフルエンザウイルス株A型/ブタ/香港/126/82(H3N2)、インフルエンザウイルス株A型/アイダホ/4/95(H3N2)、インフルエンザウイルス株A型/ヨハネスブルグ/33/94(H3N2)、インフルエンザウイルス株A型/バンコク/1/79(H3N2)、インフルエンザウイルス株A型/ウドン/72(H3N2)、インフルエンザウイルス株A型/北海道/2/92(H1N1)、インフルエンザウイルス株A型/タイ/KAN‐1/04、インフルエンザウイルス株A型/イングランド/1/53、インフルエンザウイルス株A型/ベトナム/3046/2004(H5N1)、インフルエンザウイルス株A型/ベトナム/1203/2004(H5N1)、インフルエンザウイルス株A型/トラ/タイ/SPB‐1(H5N1)、インフルエンザウイルス株A型/日本/305/57(H2N2)、インフルエンザウイルス株A型/足立/2/57(H2N2)、インフルエンザウイルス株A型/ラクダ/モンゴル/82(H1N1)、インフルエンザウイルス株A型/RI/5/57(H2N2)、インフルエンザウイルス株A型/クジラ/メイン/1/84(H13N9)、インフルエンザウイルス株A型/台湾/1/86(H1N1)、インフルエンザウイルス株A型/バイエルン/7/95(H1N1)、インフルエンザウイルス株A型/USSR/90/77(H1N1)、インフルエンザウイルス株A型/武漢/359/95(H3N2)、インフルエンザウイルス株A型/香港/5/83(H3N2)、インフルエンザウイルス株A型/メンフィス/8/88(H3N2)、インフルエンザウイルス株A型/北京/337/89(H3N2)、インフルエンザウイルス株A型/上海/6/90(H3N2)、インフルエンザウイルス株A型/秋田/1/94(H3N2)、インフルエンザウイルス株A型/秋田/11/95(H3N2)、インフルエンザウイルス株A型/メンフィス/6/90(H3N2)、インフルエンザウイルス株A型/ウドン/307/72(H3N2)、インフルエンザウイルス株A型/シンガポール/1/57(H2N2)、インフルエンザウイルス株A型/オハイオ/4/83(H1N1)、インフルエンザウイルス株メイディン・ダービー・イヌ腎臓(MDCK)由来細胞株、マウス適応型インフルエンザウイルス株A型/貴州/54/89(H3N2サブタイプ)、マウス適応型インフルエンザウイルスA型/PR/8/34(A型/PR8)、マウス適応型インフルエンザウイルスB型/茨城/2/85、ロシア弱毒インフルエンザ生ワクチンドナー株A型/レニングラード/13
4/17/57、A型/レニングラード/134/47/57、B型/USSR/60/69、ならびにA型/上海/2/2013 H7N9が挙げられるが、必ずしもこれらに限定するものではない。
ウイルス株A型/ウマ2型(H3N8)、ニューマーケット1/93、ウマインフルエンザウイルス株A型/ウマ2型/ニューマーケット1/93、ウマインフルエンザウイルス株A型/ウマ/ニューマーケット/2/93、ウマインフルエンザウイルス株A型/ウマ/ニューマーケット/79(H3N8)、ウマインフルエンザウイルス株A型/ウマ/ニューマーケット/1/77(H7N7)およびウマインフルエンザウイルス株A型/ウマ2型/ニューマーケット‐2/93、ウマインフルエンザウイルス株A型/ウマ/マイアミ/63(H3N8)、A型/ウマ1型(プラハ株)、ウマインフルエンザウイルス株A型/ウマ2型(マイアミ)、ウマインフルエンザウイルス株A型/ウマ1型/プラハ/56(Pr/56)、ウマインフルエンザウイルス株A型/ウマ2型/サフォーク/89(Suf/89)、ウマインフルエンザウイルス株A型/ウマ2型/サセックス/89(H3N8)、ウマインフルエンザウイルス株A型/ウマ/サセックス/89、ウマインフルエンザウイルス株A型/ウマ2型/サスカトゥーン/90、ウマインフルエンザウイルス株A型/ウマ/プラハ/1/56(H7N7)、ウマインフルエンザウイルス株A型/ウマ/マイアミ/1/63(H3N8)、A型/愛知/2/68(H3N2)、ウマインフルエンザウイルス株A型/ウマ/東京/2/71(H3N8)、ウマインフルエンザウイルス株A型/ウマ/ラプラタ/1/88、ウマインフルエンザウイルス株A型/ウマ/吉林/1/89(Eq/吉林)、ウマインフルエンザウイルス株A型/ウマ/アラスカ/1/91(H3N8)、ウマインフルエンザウイルス株A型/ウマ/サスカトゥーン/1/91(H3N8)、ウマインフルエンザウイルス株A型/ウマ/ローマ/5/91(H3N8)、ウマインフルエンザウイルス株A型/ウマ/ラプラタ/1/93(H3N8)、ウマインフルエンザウイルス株A型/ウマ/ラプラタ/1/93(LP/93)、ウマインフルエンザウイルス株A型/ウマ/オランダ/1/95(H3N8)、ウマインフルエンザウイルス株A型/ウマ/オランダ/2/95(H3N8)、ヒトインフルエンザウイルスA型(H3N2)分離株、ヒトインフルエンザウイルスA型/メンフィス/1/71(H3N2)、ヒトインフルエンザウイルスA型/南昌/933/95(H3N2)ウイルス、ヒトインフルエンザウイルスA型/PR/8/34(H1N1)ウイルス、ヒトインフルエンザウイルスA型/シンガポール/57(H2N2)ウイルス、インフルエンザウイルスA型、インフルエンザウイルスA型/香港/213/03、インフルエンザウイルス株A型/香港/483/97株、インフルエンザウイルス株A型/タイ/S(KK‐494)/2004(H5N1)、インフルエンザウイルス株A型 PR/8/34(PR8)ウイルス株(H1N1サブタイプ)、インフルエンザウイルス株A型/愛知/2/68(H3N2)、インフルエンザウイルス株AI型 アナーバー/6/60 低温馴化ウイルス株、インフルエンザウイルス株A型/北京 32/92(H3N2)、インフルエンザウイルス株A型/シャーロッツビル/31/95(H1N1)、インフルエンザウイルス株A型/川崎/86(H1N1)ウイルス株、インフルエンザウイルス株A型/韓国/82株(H3N2)、インフルエンザウイルス株A型/レニングラード/134/57株、インフルエンザウイルス株A型/NWS/33(H1N1)、インフルエンザウイルス株A型/PR/8/34(H1N1)、インフルエンザウイルス株A型/PR 8/34株、インフルエンザウイルス株A型/プエルトリコ(PR)/8/34、インフルエンザウイルス株A型/プエルトリコ/8‐シナイ山、インフルエンザウイルス株A型/山東 9/93(H3N2)、インフルエンザウイルス株A型/シンガポール/1/57(H2N2)、インフルエンザウイルス株A型/シンガポール6/86(H1N1)、インフルエンザウイルス株A型/シンガポール/1/57(H2N2)、インフルエンザウイルス株A型/テキサス36/91(H1N1)、インフルエンザウイルス株A型/テキサス/36/91(H1N1)ウイルス株、インフルエンザウイルス株A型/テキサス/36/91(H1N1)、インフルエンザウイルス株A型/ウドン/72ウイルス感染、インフルエンザウイルスA型/ビクトリア/3/75(H3N2)、インフルエンザウイルスA型/バージニア/88(H3N2)、インフルエンザウイルスA型/WSN/33(H1N1)インフルエンザウイルスA型/WSN/33、インフルエンザウイルスB型、インフルエンザウイルスB型/アナーバー1/86、インフルエンザウイルスB型/ハルビン/7/94、インフルエンザウイルスB型/香港/5/72、インフルエンザウイルスB型/リー/40、インフルエンザウイルスB型ナマガタ(Namagata)16/88、インフルエンザウイルスB型/山形グループ、インフルエンザウイルスBナマナシ(Namanashi)/166/98、インフルエンザウイルスC型、インフルエンザウイルス株A型/ウマ/2/キルデア/89、インフルエンザウイルスB型/パナマ45/90、低温馴化温度感受性(ca/ts)ロシア型インフルエンザA型生ワクチン、ブタH1およびH3インフルエンザウイルス、ブタインフルエンザAウイルス、ブタインフルエンザウイルス(SIV)、ブタインフルエンザウイルスA型/ブタ/ドイツ 2/81、ブタインフルエンザウイルスA型/ブタ/ドイツ 8533/91、ブタインフルエンザウイルス株A型/ブタ/ウィスコンシン/125/97(H1N1)、ブタインフルエンザウイルス株A型/ブタ/ウィスコンシン/136/97(H1N1)、ブタインフルエンザウイルス株A型/ブタ/ウィスコンシン/63/97(H1N1)、ブタインフルエンザウイルス株A型/ブタ/ウィスコンシン/164/97(H1N1)、ブタインフルエンザウイルス株A型/ブタ/ウィスコンシン/166/97(H1N1)、ブタインフルエンザウイルス株A型/ブタ/ウィスコンシン/168/97(H1N1)、ブタインフルエンザウイルス株A型/ブタ/ウィスコンシン/235/97(H1N1)、ブタインフルエンザウイルス株A型/ブタ/ウィスコンシン/238/97(H1N1)、ブタインフルエンザウイルス株A型/ブタ/ウィスコンシン/457/98(H1N1)、ブタインフルエンザウイルス株A型/ブタ/ウィスコンシン/458/98(H1N1)、ブタインフルエンザウイルス株A型/ブタ/ウィスコンシン/464/98(H1N1)、ブタインフルエンザウイルス株A型/ブタ/インディアナ/1726/88(H1N1)、ブタインフルエンザウイルス株A型/ブタ/インディアナ/9K035/99(H1N2)、ブタインフルエンザウイルス株A型/ブタ/ネブラスカ/1/92(H1N1)、ブタインフルエンザウイルス株A型/ブタ/ケベック/91(H1N1)、ブタインフルエンザウイルス株A型/ブタ/ケベック/81(H1N1)、ブタインフルエンザウイルス株A型/ブタ/ニュージャージー/11/76(H1N1)、ブタインフルエンザウイルス株A型/ブタ/愛媛/1/80(H1N2)、ブタインフルエンザウイルス株A型/ブタ/イングランド/283902/93(H1N1)、ブタインフルエンザウイルス株A型/ブタ/イングランド/195852/92(H1N1)、ブタインフルエンザウイルス株A型/ブタ/ドイツ/8533/91(H1N1)、ブタインフルエンザウイルス株A型/ブタ/ドイツ/2/81(H1N1)、ブタインフルエンザウイルス株A型/ブタ/ネブラスカ/209/98(H3N2)、A型/ブタ/アイオワ/533/99(H3N2)、ブタインフルエンザウイルス株A型/ブタ/アイオワ/569/99(H3N2)、ブタインフルエンザウイルス株A型/ブタ/ミネソタ/593/99(H3N2)、ブタインフルエンザウイルス株A型/ブタ/アイオワ/8548‐1/98(H3N2)、ブタインフルエンザウイルス株A型/ブタ/ミネソタ/9088‐2/98(H3N2)、ブタインフルエンザウイルス株A型/ブタ/テキサス/4199‐2/98(H3N2)、ブタインフルエンザウイルス株A型/ブタ/オンタリオ/41848/97(H3N2)、ブタインフルエンザウイルス株A型/ブタ/ノースカロライナ/35922/98(H3N2)、A型/ブタ/コロラド/1/77(H3N2)、ブタインフルエンザウイルス株A型/ブタ/香港/3/76(H3N2)、ブタインフルエンザウイルス株A型/ブタ/香港/13/77(H3N2)、ブタインフルエンザウイルス株A型/ブタ/長崎/1/90(H1N2)、ブタインフルエンザウイルス株A型/ブタ/長崎/1/89(H1N2)、ブタインフルエンザウイルス株A型/ブタ/ウィスコンシン/1915/88(H1N1)、ブタインフルエンザウイルス株A型/ブタ/アイオワ/17672/88(H1N1)、ブタインフルエンザウイルス株A型/ブタ/テネシー/24/77(H1N1)、ブタインフルエンザウイルス株A型/ブタ/オンタリオ/2/81(H N1)、ブタインフルエンザウイルス株A型/ブタ/ウィスコンシン/1/67(H1N1)、ブタインフルエンザウイルス株A型/ブタ/イタリア/1521/98(H1N2)、ブタインフルエンザウイルス株A型/ブタ/イタリア/839/89(H1N1)、ブタインフルエンザウイルス株A型/ブタ/香港/126/82(H3N2)、インフルエンザウイルス株A型/アイダホ/4/95(H3N2)、インフルエンザウイルス株A型/ヨハネスブルグ/33/94(H3N2)、インフルエンザウイルス株A型/バンコク/1/79(H3N2)、インフルエンザウイルス株A型/ウドン/72(H3N2)、インフルエンザウイルス株A型/北海道/2/92(H1N1)、インフルエンザウイルス株A型/タイ/KAN‐1/04、インフルエンザウイルス株A型/イングランド/1/53、インフルエンザウイルス株A型/ベトナム/3046/2004(H5N1)、インフルエンザウイルス株A型/ベトナム/1203/2004(H5N1)、インフルエンザウイルス株A型/トラ/タイ/SPB‐1(H5N1)、インフルエンザウイルス株A型/日本/305/57(H2N2)、インフルエンザウイルス株A型/足立/2/57(H2N2)、インフルエンザウイルス株A型/ラクダ/モンゴル/82(H1N1)、インフルエンザウイルス株A型/RI/5/57(H2N2)、インフルエンザウイルス株A型/クジラ/メイン/1/84(H13N9)、インフルエンザウイルス株A型/台湾/1/86(H1N1)、インフルエンザウイルス株A型/バイエルン/7/95(H1N1)、インフルエンザウイルス株A型/USSR/90/77(H1N1)、インフルエンザウイルス株A型/武漢/359/95(H3N2)、インフルエンザウイルス株A型/香港/5/83(H3N2)、インフルエンザウイルス株A型/メンフィス/8/88(H3N2)、インフルエンザウイルス株A型/北京/337/89(H3N2)、インフルエンザウイルス株A型/上海/6/90(H3N2)、インフルエンザウイルス株A型/秋田/1/94(H3N2)、インフルエンザウイルス株A型/秋田/11/95(H3N2)、インフルエンザウイルス株A型/メンフィス/6/90(H3N2)、インフルエンザウイルス株A型/ウドン/307/72(H3N2)、インフルエンザウイルス株A型/シンガポール/1/57(H2N2)、インフルエンザウイルス株A型/オハイオ/4/83(H1N1)、インフルエンザウイルス株メイディン・ダービー・イヌ腎臓(MDCK)由来細胞株、マウス適応型インフルエンザウイルス株A型/貴州/54/89(H3N2サブタイプ)、マウス適応型インフルエンザウイルスA型/PR/8/34(A型/PR8)、マウス適応型インフルエンザウイルスB型/茨城/2/85、ロシア弱毒インフルエンザ生ワクチンドナー株A型/レニングラード/13
4/17/57、A型/レニングラード/134/47/57、B型/USSR/60/69、ならびにA型/上海/2/2013 H7N9が挙げられるが、必ずしもこれらに限定するものではない。
本発明は、あらゆるタイプのインフルエンザワクチンに適用することができ、例として、スプリットウイルスのような不活化インフルエンザウイルスに基づくワクチンおよび/または組換えワクチンが挙げられるが、必ずしもこれらに限定するものではない。本発明は、様々なワクチンの製造システムから製造したインフルエンザワクチンに対しても適用することができ、例えば卵ベース、植物ベース、および細胞培養ベースのワクチンが挙げられるが、必ずしもこれらに限定するものではない。卵ベースのインフルエンザワクチンを作製するために、病原体フリーの卵に種ウイルスを接種する。種ウイルスは、天然型ウイルスまたは組換え型ウイルスであってもよい。尿膜腔液からウイルスを採取した後、HA抗原を下記のようにアルキル化剤で処理することができる。
細胞培養ベースのワクチンとして、動物細胞、植物細胞、酵母細胞、ウイルス細胞、真菌または藻類、または合成細胞から産生するワクチンを挙げてもよい。本発明に適した動物細胞としては、昆虫細胞、哺乳類細胞、および鳥類細胞が挙げられるが、必ずしもこれらに限定するものではない。インフルエンザワクチンの製造に適した昆虫細胞の例として、SF細胞、イモムシ細胞、チョウ細胞、ガ細胞、SF9細胞、SF21細胞、ショウジョウバエ細胞、S2細胞、High Five(商標)細胞(ライフテクノロジーズ社)、ツマジロクサヨトウ細胞、イラクサギンウワバ細胞、Spodoptera frugiperda細胞、およびTrichoplasia ni細胞が挙げられるが、必ずしもこれらに限定するものではない。インフルエンザワクチンの製造に適した哺乳類細胞の例として、MRC‐5細胞、WI‐38細胞、CV‐1細胞、COS細胞、LLC‐MK2細胞、293細胞、293T細胞、MDBK細胞、CHO細胞、CAP(登録商標)細胞(CEVEC Pharmaceuticals社)、メイディン・ダービー・イヌ腎臓(MDCK)細胞、VERO細胞、EBx細胞、サル腎細胞、形質転換ヒト細胞株、およびPer.C6細胞が挙げられるが、必ずしもこれらに限定するものではない。インフルエンザワクチンの製造に適した鳥類細胞の例として、胚発育卵、ニワトリ胚細胞、EB66(Valneva社)、AGE1.CRおよびAGE1.CR.pIX(Probiogen社)などのアヒル細胞株が挙げられるが、必ずしもこれらに限定するものではない。インフルエンザワクチンの製造に適した植物細胞の例として、タバコおよびトウモロコシが挙げられるが、必ずしもこれらに限定するものではない。インフルエンザワクチンの製造に適した酵母株の例として、Pichia pastorisおよびKluyveromyces lactisが挙げられるが、必ずしもこれらに限定するものではない。インフルエンザワクチンを製造するのに適した藻類株の例として、Schizochytrium種およびChlamydomonasが挙げられるが、必ずしもこれらに限定するものではない。
さらに、インフルエンザワクチンは、植物などの生物全体において産生してもよく、植物としては例えばタバコ植物全体が挙げられるが、必ずしもこれに限定するものではない。
本発明によるインフルエンザワクチンは、1価または多価であってもよい。例えば、本発明によるインフルエンザワクチンは、2価、3価、または4価であってもよい。
インフルエンザヘマグルチニン(HA)のアルキル化
本発明によれば、本明細書中に記載する様々なインフルエンザ株由来のヘマグルチニン(HA)を、アルキル化剤で処理するか、またはアルキル化剤に曝露してもよい。本明細書で使用する場合、用語「アルキル化剤」は、ある分子から別の分子へアルキル基を転移できる任意の化学物質または非化学物質を指す。アルキル基の例として、アルキルカルボカチオン、カルバニオン、フリーラジカル、カルビンおよびメチル基を挙げてもよい。いくつかの実施形態において、アルキル化は、メチル化、すなわち炭素基1個のみの転移を包含する。したがって、いくつかの実施形態において、用語「アルキル化剤」は、メチル化剤を含む。HAの処理は、遊離システイン残基(すなわち、遊離スルフヒドリル基を有するシステイン残基)などの反応性システイン基のアルキル化またはメチル化をもたらすと考えられる。特定の理論に拘泥するわけではないが、貯蔵中にインフルエンザHAは、通常、ロゼット構造を形成すると考えられ、SRIDアッセイの際にこれをzwittergentによる前処理によって破壊し、HA抗原の拡散および抗血清との相互作用を促進して沈降環を形成させる必要がある。経時的なSRID測定によるHAの見なし力価の喪失に対しての予想されるメカニズムは、近位システイン残基間に分子間共有システイン結合が形成し、それがSRIDアッセイの標準的な前処理中におけるzwittergentによるロゼット構造の破壊を妨げ、その結果としてゲルマトリックス内でのロゼットマクロ構造の移動が制限され、抗血清との相互作用が低下するというものである。反応性システイン基のアルキル化またはメチル化は、分子間ジスルフィド結合の形成を妨げ、それによりSRIDアッセイ中のHA抗原の拡散および抗血清との相互作用を促進する。
本発明によれば、本明細書中に記載する様々なインフルエンザ株由来のヘマグルチニン(HA)を、アルキル化剤で処理するか、またはアルキル化剤に曝露してもよい。本明細書で使用する場合、用語「アルキル化剤」は、ある分子から別の分子へアルキル基を転移できる任意の化学物質または非化学物質を指す。アルキル基の例として、アルキルカルボカチオン、カルバニオン、フリーラジカル、カルビンおよびメチル基を挙げてもよい。いくつかの実施形態において、アルキル化は、メチル化、すなわち炭素基1個のみの転移を包含する。したがって、いくつかの実施形態において、用語「アルキル化剤」は、メチル化剤を含む。HAの処理は、遊離システイン残基(すなわち、遊離スルフヒドリル基を有するシステイン残基)などの反応性システイン基のアルキル化またはメチル化をもたらすと考えられる。特定の理論に拘泥するわけではないが、貯蔵中にインフルエンザHAは、通常、ロゼット構造を形成すると考えられ、SRIDアッセイの際にこれをzwittergentによる前処理によって破壊し、HA抗原の拡散および抗血清との相互作用を促進して沈降環を形成させる必要がある。経時的なSRID測定によるHAの見なし力価の喪失に対しての予想されるメカニズムは、近位システイン残基間に分子間共有システイン結合が形成し、それがSRIDアッセイの標準的な前処理中におけるzwittergentによるロゼット構造の破壊を妨げ、その結果としてゲルマトリックス内でのロゼットマクロ構造の移動が制限され、抗血清との相互作用が低下するというものである。反応性システイン基のアルキル化またはメチル化は、分子間ジスルフィド結合の形成を妨げ、それによりSRIDアッセイ中のHA抗原の拡散および抗血清との相互作用を促進する。
ヘマグルチニン(HA)
インフルエンザHAは、インフルエンザウイルスの表面に見出される糖タンパク質である。HAは2つの機能を有する:1)シアル酸含有受容体への結合を介した標的脊椎動物細胞の認識、および2)宿主エンドソーム膜へのウイルス膜の融合による標的細胞へのウイルスゲノムの侵入。インフルエンザHAはウイルス粒子の三量体である。インフルエンザHAは、ウイルスの感染後に細胞内においてHA0として合成され、細胞性プロテアーゼによって塩基性切断部位で切断され、成熟型のHA1およびHA2となる。これは、この表面タンパク質が適切に機能するために必要であり、また、ウイルスのライフサイクルにとっても必要である。M2タンパク質は、イオンチャネルタンパク質である。HA、NA、およびM2タンパク質は、宿主細胞の細胞膜に由来するウイルスエンベロープ中に存在する。
インフルエンザHAは、インフルエンザウイルスの表面に見出される糖タンパク質である。HAは2つの機能を有する:1)シアル酸含有受容体への結合を介した標的脊椎動物細胞の認識、および2)宿主エンドソーム膜へのウイルス膜の融合による標的細胞へのウイルスゲノムの侵入。インフルエンザHAはウイルス粒子の三量体である。インフルエンザHAは、ウイルスの感染後に細胞内においてHA0として合成され、細胞性プロテアーゼによって塩基性切断部位で切断され、成熟型のHA1およびHA2となる。これは、この表面タンパク質が適切に機能するために必要であり、また、ウイルスのライフサイクルにとっても必要である。M2タンパク質は、イオンチャネルタンパク質である。HA、NA、およびM2タンパク質は、宿主細胞の細胞膜に由来するウイルスエンベロープ中に存在する。
18種の公知のHAサブタイプが存在する。アミノ酸配列の同一性および結晶構造の比較に基づいて、HAサブタイプは2つの主要な群および4つのより小規模なクレードに分類される。異なるHAサブタイプは強いアミノ酸配列同一性を必ずしも共有しないが、異なるHAサブタイプの全体的な立体構造は互いに類似しており、分類目的に用いることができるいくつかの微妙な相違点を有する。例えば、中心のα‐ヘリックスに関連する膜遠位側サブドメインの特定の配向は、HAサブタイプを決定するために一般的に使用される一つの構造的特徴である(Russell et al.,2004,Virology,325:287;参考として本明細書に援用する)。HAは、H1〜H18と呼ばれる18種のサブタイプのうちの1種のホモ三量体として膜中に存在する。これらのサブタイプのうちの3つ(H1、H2、およびH3)のみが、これまでにヒト感染に適合するようになっている。
適切なHAは、天然型または改変型HAを含む任意の組換え体HAであってよい。適切なHAは、野生型の天然由来配列または改変したアミノ酸配列を有し得る。インフルエンザ分離株由来の多種多様なHA配列が当該分野で公知である。実際、国立バイオテクノロジー情報センター(NCBI)は、9,500種以上のHA配列を含むデータベースを保有している(ワールドワイドウェブncbi.nlm.nih.gov/genomes/FLU/fluから入手可能)。このデータベースを参照する当業者は、HAポリペプチド全般に特徴的な配列および/または特定のHAポリペプチド(例えば、H1、H2、H3、H4、H5、H6、H7、H8、H9、H10、H11、H12、H13、H14、H15、もしくはH16ポリペプチド、または、例えば鳥類、ラクダ、イヌ、ネコ、シベット、エンビロンメント(environment)、ウマ、ヒト、ヒョウ、ミンク、マウス、アザラシ、ストーンマーティン(stone martin)、ブタ、トラ、クジラなどの特定の宿主の感染を媒介するHA)に特徴的な配列を容易に同定することができる。
本発明に適したHAの非限定的な例として、カリフォルニアまたはソロモン株(限定するものではないが、例えばカリフォルニア/07/2009株もしくはソロモン諸島/03/2006株など)から分離したH1タンパク質、ブリスベン、フロリダ、オハイオ、江蘇もしくは香港株(限定するものではないが、例えばブリスベン/60/2008株、フロリダ/04/2006株、オハイオ/01/2005株、江蘇/10/2003株もしくは香港/330/2001株など)から分離したBタンパク質、またはビクトリア、パース、ブリスベンもしくはウィスコンシン株から分離したH3タンパク質(限定するものではないが、例えばビクトリア/361/2011株、パース/16/2009株、ブリスベン/16/2007株もしくはA型/ウィスコンシン/67/05株など)が挙げられる。
本発明のアルキル化剤で処理するのに適したHAは、任意の形態で存在してもよい。例として、HAは、例えば紫外線または化学物質によって不活化したインフルエンザウイルスのような、不活化インフルエンザウイルスの形態で存在してもよい。インフルエンザウイルスの不活化に適した化学物質としては、ホルマリン、β‐プロピオラクトン、デオキシコール酸ナトリウム、ホルムアルデヒド、および界面活性剤が挙げられるが、必ずしもこれらに限定するものではない。したがって、不活化インフルエンザウイルスは、不活化した全ウイルスまたはスプリットウイルス(スプリットウイルス粒子とも呼ぶ)であってもよい。スプリットウイルスを作製するために、ウイルス全体を、通常、界面活性剤で破壊し、ウイルス膜を可溶化する。分解に使用する化学物質としては、オクチルフェノールエトキシレート(Triton(登録商標)、特にTriton(登録商標)X‐100、Triton(登録商標)N‐101、Triton(登録商標)720および/またはTriton(登録商標)X‐200)、タウロデオキシコール酸ナトリウム、ノニルフェノールエトキシレート、臭化セチルトリメチルアンモニウム(CTAB)、およびデオキシコール酸ナトリウムなどの非イオン性界面活性剤が挙げられるが、必ずしもこれらに限定するものではない。
いくつかの実施形態では、本発明に適したHAは、精製または部分的に精製してもよい。例えば、HAは、表面抗原を精製、または標準的な組換え技術を用いて産生したHAポリペプチドを精製もしくは分離した形態であってもよい。いくつかの実施形態では、精製HA抗原を生成するために、沈降速度の違いに基づいて表面タンパク質からウイルスの内部サブウイルスコアを分離する。
アルキル化剤
インフルエンザHAを安定化するために様々なアルキル化剤を使用してもよい。一般的に、アルキル化は、メチル基を含めたアルキル基をある分子から別の分子へと転移させる。本発明に従って、アルキル化剤は、アルキル基(メチル基も含まれる)を、インフルエンザHA中に存在するシステイン残基の遊離チオールへ転移させる。アルキル基は、アルキルカルボカチオン、フリーラジカル、カルバニオンまたはカルベン(またはそれらの同等物)として転移させてもよい。
インフルエンザHAを安定化するために様々なアルキル化剤を使用してもよい。一般的に、アルキル化は、メチル基を含めたアルキル基をある分子から別の分子へと転移させる。本発明に従って、アルキル化剤は、アルキル基(メチル基も含まれる)を、インフルエンザHA中に存在するシステイン残基の遊離チオールへ転移させる。アルキル基は、アルキルカルボカチオン、フリーラジカル、カルバニオンまたはカルベン(またはそれらの同等物)として転移させてもよい。
したがって、本発明に適したアルキル化剤は、システインスルフヒドリル基をアルキル化できる任意の化合物であってもよい。本発明に適したアルキル化剤の例として、2‐ヨードアセトアミド(IOAM)、ヨード酢酸、2‐ブロモアセトアミド、グルタチオンブロモアセトアミド、ブロモ酢酸、1,3‐プロパンスルトン、メチルメタンチオスルホン酸、メトキシカルボニルメチルジスルフィド、マレアミド 、マレイミド‐PEG、ビニルピリジン、n‐エチルマレミド(n‐ethylmalemide)(NEM)、トシルアセトアミド、およびそれらの任意の組合せが挙げられるが、必ずしもこれらに限定するものではない。いくつかの実施形態において、本発明に適したアルキル化剤は、2‐ヨードアセトアミド(IOAM)である。
ヘマグルチニンのアルキル化
実施例の節に記載するように、本出願の発明者らは、遊離チオールの経時的喪失がSRID測定によるHA力価の喪失と強く相関することを発見した。図1参照。本発明者らはまた、2000〜2012年のWHO推奨のインフルエンザ株のバイオインフォマティクス解析により、システイン残基が高度に保存されていることを発見した。図2参照。H1およびB株では、HAの保存領域に16個のシステイン残基が存在し、一方、H3株においては、18個のシステイン残基がやはり保存領域に存在する。一般的には、図2に示すように、これらの残基のほとんどはジスルフィド結合として存在する。しかしながら、3〜5個(サブタイプによって異なる)は、特に膜貫通領域および細胞質領域において、不対合であることが認められる。不対システイン残基の一部または全部は、発現中にアセチル化する可能性がある。しかしながら、ウイルス不活化、特に界面活性剤を用いるウイルス分解のプロセスにより、アセチル化システイン残基が不適切に反応して、例えば近傍の他の遊離システイン残基と望ましくない結合を形成することがある。さらに、ワクチン製造プロセス中に使用する他の方法によってもまた、アセチル化システイン残基が不適切に反応性になる可能性がある。製造プロセス中にジスルフィド結合の還元が起こり、もともと対合していたシステイン残基までもが反応性になることもあり得る。このように、インフルエンザHAは、一般的には、株のタイプに応じて、最大5つの遊離システイン残基を含む。具体的には、インフルエンザHAは、1、2、3、4、または5個の遊離システイン残基を含み得る。しかしながら、いくつかの状況下では、インフルエンザHAは、株のタイプに応じて、最大16または18個の遊離システイン残基を含み得る。具体的には、インフルエンザHAは、5、6、7、8、9、10、11、12、13、14、15、16、17または18個の遊離システイン残基を含み得る。
実施例の節に記載するように、本出願の発明者らは、遊離チオールの経時的喪失がSRID測定によるHA力価の喪失と強く相関することを発見した。図1参照。本発明者らはまた、2000〜2012年のWHO推奨のインフルエンザ株のバイオインフォマティクス解析により、システイン残基が高度に保存されていることを発見した。図2参照。H1およびB株では、HAの保存領域に16個のシステイン残基が存在し、一方、H3株においては、18個のシステイン残基がやはり保存領域に存在する。一般的には、図2に示すように、これらの残基のほとんどはジスルフィド結合として存在する。しかしながら、3〜5個(サブタイプによって異なる)は、特に膜貫通領域および細胞質領域において、不対合であることが認められる。不対システイン残基の一部または全部は、発現中にアセチル化する可能性がある。しかしながら、ウイルス不活化、特に界面活性剤を用いるウイルス分解のプロセスにより、アセチル化システイン残基が不適切に反応して、例えば近傍の他の遊離システイン残基と望ましくない結合を形成することがある。さらに、ワクチン製造プロセス中に使用する他の方法によってもまた、アセチル化システイン残基が不適切に反応性になる可能性がある。製造プロセス中にジスルフィド結合の還元が起こり、もともと対合していたシステイン残基までもが反応性になることもあり得る。このように、インフルエンザHAは、一般的には、株のタイプに応じて、最大5つの遊離システイン残基を含む。具体的には、インフルエンザHAは、1、2、3、4、または5個の遊離システイン残基を含み得る。しかしながら、いくつかの状況下では、インフルエンザHAは、株のタイプに応じて、最大16または18個の遊離システイン残基を含み得る。具体的には、インフルエンザHAは、5、6、7、8、9、10、11、12、13、14、15、16、17または18個の遊離システイン残基を含み得る。
HA抗原は、インフルエンザワクチン製造プロセス中の任意の時点でアルキル化することができる。つまり、インフルエンザワクチン製造プロセス中の任意の時点でアルキル化剤を加え、HA抗原を安定化することができる。卵ベースのインフルエンザウイルスでは、通常、卵から尿膜腔液を除去してウイルスを採取する。流体を遠心分離し、細胞破片を除去する。続いて、ウイルス全体の浄化、濃縮および不活化を行う。カラムクロマトグラフィーまたは密度勾配下でのゾーン遠心分離などの方法により、ウイルスを精製する。いくつかの実施形態では、次いで化学物質または薬剤による不活化を行う。不活化に使用する化学物質としては、ホルムアルデヒド、デオキシコール酸ナトリウム、β‐プロピオラクトンおよびホルマリンが挙げられるが、必ずしもこれらに限定するものではない。さらに、ウイルスは紫外線で不活化することもできる。スプリットウイルスまたはサブユニットワクチンを生成するために、ウイルス全体を界面活性剤で破壊してウイルス膜を可溶化する。分解に使用する適切な化学物質としては、オクチルフェノールエトキシレート(Triton(登録商標)X‐100)、タウロデオキシコール酸ナトリウム、ノニルフェノールエトキシレート、臭化セチルトリメチルアンモニウム(CTAB)、およびデオキシコール酸ナトリウムなどの非イオン性界面活性剤が挙げられるが、必ずしもこれらに限定するものではない。スプリットウイルスワクチンにおいて、界面活性剤を選択および使用することにより、確実にサブウイルスコア自体を分解できる。サブユニットワクチンについては、沈降速度の違いに基づいて表面タンパク質からウイルスの内部サブウイルスコアを分離する。
いくつかの実施形態では、不活化/スプリットウイルスをさらに精製し、次いでリン酸ナトリウム緩衝生理食塩水に懸濁する。一般的には、ダイアフィルトレーションを使用して、界面活性剤および他の媒体または化学成分を生産物から除去し、最後に滅菌濾過工程を行って処理を終え、1価バルク溶液を得る。
アルキル化剤は、上流のインフルエンザウイルス産生および処理、採集、分解、濃縮、清澄、不活化、ダイアフィルトレーションおよび/または製剤化の前、最中または後に添加してもよい。
いくつかの実施形態では、ウイルスを分解した後にアルキル化剤を添加する。アルキル化剤(例えば、IOAM)処理の工程を組み込んだ例示的なスキームを図7に示す。
一般的には、HAのアルキル化は、HAをアルキル化剤とともに一定時間、所定温度でインキュベートすることによって行うことができる。いくつかの実施形態では、HAおよびアルキル化剤を、約37℃か、またはそれ未満の温度(例えば、約30℃、25℃、20℃、15℃、10℃、もしくは5℃か、またはそれ未満)でインキュベートする。いくつかの実施形態において、HAおよびアルキル化剤を、約0〜5℃、2〜8℃、5〜10℃、10〜15℃、15〜20℃、20〜25℃、25〜30℃、または30〜37℃の範囲でインキュベートする。いくつかの実施形態では、HAおよびアルキル化剤を室温(周囲温度とも呼ばれる)でインキュベートする。いくつかの実施形態において、HAおよびアルキル化剤を貯蔵温度(例えば、約0〜5℃、約2〜8℃、または約0〜10℃)でインキュベートする。
HAおよびアルキル化剤は、任意の期間インキュベートしてもよい。いくつかの実施形態において、HAおよびアルキル化剤を、最大で約24時間、約20時間、約18時間、約16時間、約14時間、約12時間、約10時間、約8時間、約6時間、約4時間、約2時間、約1.5時間、約1時間、約50分間、約40分間、約30分間、約20分間、約10分間、または約5分間インキュベートする。いくつかの実施形態において、HAおよびアルキル化剤を、少なくとも約1分、約5分、約10分、約30分、約1時間、約1.5時間、約2時間、約3時間、約4時間、約5時間、約6時間、約8時間、約10時間、約12時間、約14時間、約16時間、約18時間、約20時間、または約24時間インキュベートする。いくつかの実施形態において、HAおよびアルキル化剤を、約0〜2時間、約0〜1.5時間、約0〜1時間、約0.1〜5.0時間、約0.1〜4時間、約0.1〜3時間、約0.1〜2時間、約0.1〜1時間、約0.1〜0.5時間、約0.5〜3時間、または約0.5〜2時間インキュベートする。
HAおよびアルキル化剤は、相対濃度の範囲内で存在してもよい。例えば、アルキル化剤は、HA‐システイン濃度に対して1倍モル過剰を上回る濃度(例えばHA‐システイン濃度に対して、2倍、3倍、4倍、5倍、10倍、15倍、20倍、25倍、30倍、35倍、40倍、45倍、50倍、55倍、60倍、65倍、70倍、75倍、80倍、85倍、90倍、95倍、または100倍モル過剰)で存在してもよい。いくつかの実施形態では、アルキル化剤は、HA‐システイン濃度に対して、1倍〜100倍、1倍〜90倍、1倍〜85倍、1倍〜75倍、1倍〜50倍、5倍〜85倍、5倍〜80倍、 5倍〜75倍、5倍〜50倍、5倍〜40倍、5倍〜30倍、5倍〜20倍、または5倍〜10倍モル過剰で存在してもよい。
いくつかの実施形態では、アルキル化剤は、約1mM〜1M、1mM〜900mM、1mM〜800mM、1mM〜700mM、1mM〜600mM、1mM〜500mM、1mM〜400mM、1mM〜300mM、1mM〜200mM、1mM〜100mM、1mM〜50mM、5mM〜1M、10mM〜900mM、20mM〜800mM、30mM〜700mM、40mM〜600mM、50mM〜500mM、60mM〜400mM、70mM〜300mM、80mM〜200mM、90mM〜100mM、10mM〜50mM、10mM〜100mM、10mM〜500mM、50mM〜1000mM、100mM〜900mM、200mM〜800mM、または300mM〜700mMの範囲の濃度で存在してもよい。いくつかの実施形態では、アルキル化剤は、約1μg/ml〜1,000μg/ml、1μg/ml〜900μg/ml、1μg/ml〜800μg/ml、1μg/ml〜700μg/ml、1μg/ml〜600μg/ml、1μg/ml〜500μg/ml、1μg/ml〜400μg/ml、1μg/ml〜300μg/ml、1μg/ml〜200μg/ml、1μg/ml〜100μg/ml、5μg/ml〜50μg/ml、5μg/ml〜100μg/ml、5μg/ml〜200μg/ml、5μg/ml〜300μg/ml、または5μg/ml〜500μg/ml、10μg/ml〜1,000μg/ml、20μg/ml〜900μg/ml、30μg/ml〜800μg/ml、40μg/ml〜700μg/ml、50μg/ml〜600μg/ml、60μg/ml〜500μg/ml、70μg/ml〜400μg/ml、80μg/ml〜300μg/ml、または90μg/ml〜200μg/mlの範囲の濃度で存在してもよい。いくつかの実施形態では、アルキル化剤は、約1mM、2mM、3mM、4mM、5mM、6mM、7mM、8mM、9mM、10mM、11mM 、12mM。 13mM、14mM、15mM、20mM、30mM、40mM、50mM、100mM、200mM、300mM、400mM、もしくは500mMか、またはそれより高い濃度で存在してもよい。いくつかの実施形態において、アルキル化剤は、約1μg/ml、2μg/ml、3μg/ml、4μg/ml、5μg/ml、6μg/ml、7μg/ml、8μg/ml、9μg/ml、10μg/ml、11μg/ml、12μg/ml、13μg/ml、14μg/ml、15μg/ml、20μg/ml、30μg/ml、40μg/ml、50μg/ml、60μg/ml、70μg/ml、80μg/ml、90μg/ml、100μg/ml、200μg/ml、300μg/ml、400μg/ml、もしくは500μg/ml、またはそれより高い濃度で存在してもよい。
いくつかの実施形態では、処理したワクチン組成物からアルキル化剤を除去し、最終原体がアルキル化剤を実質的に含まないようにする。任意の方法を用いてアルキル化剤を除去してもよい。いくつかの実施形態では、ダイアフィルトレーションによってアルキル化剤を除去する。アルキル化剤の分子量に応じて、適切なカットオフサイズを有するフィルターを使用してもよい。
一般的には、ダイアフィルトレーションは、上流プロセスに由来する界面活性剤および他の培地成分または化学化合物を除去し、HA抗原を精製および/または濃縮するために使用する。いくつかの実施形態では、不活化工程(例えば、図7)に続いてダイアフィルトレーション工程を実施する。一般的には、ダイアフィルトレーション前の不活化工程中に、不活化剤(例えば、ホルマリン、β‐プロピオラクトン、デオキシコール酸ナトリウム、またはホルムアルデヒド)を添加する。いくつかの実施形態では、不活化工程中に添加した不活化剤とともにアルキル化剤を除去し、このことによってプロセス効率を保証する。したがって、いくつかのそのような実施形態では、不活化剤(例えば、ホルマリン、β‐プロピオラクトン、デオキシコール酸ナトリウムまたはホルムアルデヒド)の添加の前または添加と同時にアルキル化剤を添加する。いくつかの実施形態では、不活化剤(例えば、ホルマリン、β‐プロピオラクトン、デオキシコール酸ナトリウム、またはホルムアルデヒド)添加の約30分、1時間、1.5時間、2時間、2.5時間、3時間、3.5時間、4時間、4.5時間、5時間、5.5時間、または6時間前にアルキル化剤を加える。
本発明の方法により、HA抗原のアルキル化を様々なレベルで達成することができる。一般に、HA抗原をアルキル化剤で処理すると、HAの1つ以上のシステイン残基がアルキル化する。いくつかの実施形態において、HA抗原をアルキル化剤で処理すると、1〜5、1〜4、1〜3または1〜2個のシステイン残基のアルキル化が生じる。特定の実施形態において、HA抗原をアルキル化剤で処理すると、1、2、3、4、または5個のシステイン残基がアルキル化する。出発時のHA抗原中の遊離システイン残基の数に応じて、いくつかの実施形態では、HA抗原をアルキル化剤で処理することによって最大16または18個までのシステイン残基をアルキル化することができる。より具体的には、HA抗原をアルキル化剤で処理することにより、最大5、6、7、8、9、10、11、12、13、14、15、16、17または18個のシステイン残基をアルキル化することができる。いくつかの実施形態では、HA抗原をアルキル化剤で処理すると、約1〜100%、1〜90%、1〜80%、1〜70%、1〜60%、1〜50%、1〜40% 1〜30%、1〜20%、または1〜10%のシステイン残基がアルキル化する。いくつかの実施形態において、HA抗原をアルキル化剤で処理すると、約10%、20%、30%、40%、50%、60%、70%、80%または90%以上のシステイン残基がアルキル化する。いくつかの実施形態では、HA抗原をアルキル化剤で処理すると、実質的に全ての遊離システイン残基がアルキル化する。様々な実施形態において、本発明によるアルキル化剤でHA抗原を処理しても、非特異的なアルキル化は生じない。上記のように、本明細書で使用するアルキル化は、メチル化を包含する。いくつかの実施形態において、本発明のアルキル化剤でHA抗原を処理しても、遍在性のメチル化は生じない。
アルキル化レベルを測定する方法は、当該技術分野において公知である。いくつかの実施形態では、本明細書に記載のアルキル化レベルを、遊離システイン残基の減少度によって測定する。アルキル化レベルまたは遊離システイン残基の減少度を測定する例示的な方法を実施例の節に記載する。様々な追加の方法が当該技術分野において公知であり、それらを、本発明を実施するために使用することができる。例えば、非還元条件下でのドデシル硫酸ナトリウム‐ポリアクリルアミドゲル電気泳動(SDS‐PAGE)は、タンパク質の質量およびジスルフィド架橋結合の大きな変化を検出することができる。質量分析法を使用して、タンパク質の質量の変化を検出することによって、アルキル化レベルを決定してもよい。質量分析とペプチドマッピングを組み合わせて用い、特定のシステイン残基のアルキル化を特徴付けてもよい。例えば、HAタンパク質を最初に1つ以上の酵素で消化し、一次配列中の切断部位に基づいたペプチドの特定のセットを生成してもよい。これらのペプチドを、次に、質量分析法(すなわち、マトリックス支援レーザー脱離イオン化飛行時間型質量分析法、MALDI‐TOF)により直接に、またはクロマトグラフィー分離の後に(すなわち、液体クロマトグラフィー‐マススペクトロメトリー、LC‐MSにより)、分析することができる。ペプチドの質量電荷比(m/z)の変化はアルキル化の指標となり得る(Biotechniques.2006;40:790‐798)。いくつかの実施形態では、本明細書に記載のアルキル化レベルを、アミノ酸分析を用いたシステインの定量によって決定してもよい。
SRIDを用いたHA抗原力価の測定および免疫原性
SRIDアッセイは、インフルエンザワクチン中のHA含量を測定するために使用され、また、1978年以来、食品医薬品局によって米国内での使用を認可されたインフルエンザウイルスワクチンの力価を測定する目的で使用されている。具体的には、SRIDは、特異的抗HA抗体を用いてインフルエンザワクチン中のHA含量を測定する。例として、界面活性剤で可溶化したワクチンの試料を、例えば、株特異的抗血清を含む3〜4mmの穴を開けた薄いゲル層を有するアガロースプレート上に塗布する。標準HA抗原の希釈物を、抗原濃度未知の試料とともにウェルに入れる。通常、プレートを湿室内にて室温下でインキュベートし、抗原が拡散できるようにする。抗原と抗体との反応により、沈降ゾーンが生成する(沈降輪の形態で)。いくつかの実施形態では、得られる抗原‐抗体の沈降輪を、クーマシーブルー染色で増強する。ワクチン試料中のHA含量は、試料の環径を濃度既知の参照用HA抗原の直径と比較することによって定量することができる。試験したワクチンの力価は、HA含量に基づいて得ることができる。いくつかの実施形態では、SRIDアッセイによる測定力価を、見なし力価または見なし安定性とも呼ぶ。
SRIDアッセイは、インフルエンザワクチン中のHA含量を測定するために使用され、また、1978年以来、食品医薬品局によって米国内での使用を認可されたインフルエンザウイルスワクチンの力価を測定する目的で使用されている。具体的には、SRIDは、特異的抗HA抗体を用いてインフルエンザワクチン中のHA含量を測定する。例として、界面活性剤で可溶化したワクチンの試料を、例えば、株特異的抗血清を含む3〜4mmの穴を開けた薄いゲル層を有するアガロースプレート上に塗布する。標準HA抗原の希釈物を、抗原濃度未知の試料とともにウェルに入れる。通常、プレートを湿室内にて室温下でインキュベートし、抗原が拡散できるようにする。抗原と抗体との反応により、沈降ゾーンが生成する(沈降輪の形態で)。いくつかの実施形態では、得られる抗原‐抗体の沈降輪を、クーマシーブルー染色で増強する。ワクチン試料中のHA含量は、試料の環径を濃度既知の参照用HA抗原の直径と比較することによって定量することができる。試験したワクチンの力価は、HA含量に基づいて得ることができる。いくつかの実施形態では、SRIDアッセイによる測定力価を、見なし力価または見なし安定性とも呼ぶ。
本発明は、SRID測定による力価の喪失を低減するインフルエンザワクチンを提供する。いくつかの実施形態において、本発明によるアルキル化剤での処理は、アルキル化剤の処理を加えないことを除いて他の点で同一のインフルエンザワクチンと比較して、SRIDによって測定するインフルエンザワクチンの見なし力価の喪失を低減する。例えば、本発明によるアルキル化剤での処理は、アルキル化剤の処理を加えないことを除いて他の点で同一のインフルエンザワクチンと比較して、インフルエンザワクチンのSRID測定による力価のみなし喪失の、少なくとも約10%、20%、30%、40%、50%、60%、70%、80%、90%、1倍、2倍、3倍、4倍または5倍の低減をもたらしてもよい。
したがって、本発明によるアルキル化剤で処理した、またはアルキル化剤に曝したHA抗原を含有するインフルエンザワクチンは、標準的な条件下での短期間または長期間の貯蔵後に、優れた安定性および有意な力価喪失の低減を示すことを特徴とする。いくつかの実施形態では、アルキル化剤で処理した、またはアルキル化剤に曝したHA抗原を含有するインフルエンザワクチンは、標準的な条件下での短期間または長期間の貯蔵後に、SRID測定による約50%以下(例えば、40%、30%、20%、10%、5%、または1%以下)の見なし力価の喪失を示す。いくつかの実施形態では、アルキル化剤で処理した、またはアルキル化剤に曝したHA抗原を含むインフルエンザワクチンは、標準的な条件下での短期間または長期間の貯蔵後に、SRID測定による約10%以下(例えば、約9%、8%、7%、6%、5%、4%、3%、2%、または1%以下)の見なし力価の喪失を示す。いくつかの実施形態では、アルキル化剤で処理した、またはアルキル化剤に曝したHA抗原を含有するインフルエンザワクチンは、標準的な条件下での短期間または長期間の貯蔵後に、SRID測定による約1%以下(例えば、約0.9%、0.8%、0.7%、0.6%、0.5%、0.4%、0.3%、0.2%、または0.1%以下)の見なし力価の喪失を示す。いくつかの実施形態では、アルキル化剤で処理した、またはアルキル化剤に曝したHA抗原を含有するインフルエンザワクチンは、標準的な条件下での短期間または長期間の貯蔵後に、SRID測定による見なし力価の喪失を実質的に示さない。様々な実施形態において、HAの見なし力価の喪失を、標準的な条件下での短期間の貯蔵後に測定してもよい。標準的な条件下での短期間の貯蔵は、例えば、1〜30℃、1〜25℃、1〜20℃、1〜15℃、1〜10℃、1〜5℃、2〜10℃、2〜8℃、2〜6℃、2〜4℃、10〜30℃、10〜25℃、10〜20℃、15〜25℃、15〜20℃、20〜25℃、または室温において、最長30日、60日、または90日間にわたって貯蔵することを含む。様々な実施形態において、HAの見なし力価の喪失を、標準的な条件下での長期間の貯蔵後に測定してもよい。標準的な条件下での長期間の貯蔵は、例えば、1〜30℃、1〜25℃、1〜20℃、1〜15℃、1〜10℃、1〜5℃、2〜10℃、2〜8℃、2〜6℃、2〜4℃、10〜30℃、10〜25℃、10〜20℃、15〜25℃、15〜20℃、20〜25℃、または室温において、3ヶ月、4ヶ月、5ヶ月、6ヶ月、7ヶ月、8ヶ月、9ヶ月、10ヶ月、11ヶ月、12ヶ月、1.5年、2年、2.5年、3年、3.5年、4年、4.5年または5年より長期にわたって貯蔵することを含む。
本発明によるアルキル化剤で処理した、またはアルキル化剤に曝したHA抗原を含有するインフルエンザワクチンは、さらなる特徴として、アルキル化剤で処理しない、またはアルキル化剤に曝さないことを除いて他の点で同一のインフルエンザワクチンと比較して、少なくとも同等の免疫原性および向上したSRID測定による力価を有すると考えられる。免疫原性を測定するための様々な方法が当該分野で公知であり、本発明を実施するために使用することができる。例えば、HA抗原の免疫原性は、インビトロアッセイ(ELISAおよびT細胞アッセイが挙げられるが、必ずしもこれらに限定するものではない)によって試験してもよい。いくつかの実施形態では、HA抗原の免疫原性は、動物の対象にHA抗原を投与し、インビボで中和抗体応答を誘発する能力を測定することによって試験してもよい。HA抗原の免疫原性を試験するための動物モデルとしては、マウス、ラット、フェレット、ブタ、トリ、コウモリ、および非ヒト霊長類が挙げられるが、必ずしもこれらに限定するものではない。いくつかの実施形態では、HA抗原の免疫原性を、ヒト患者にHA抗原を投与することによって試験してもよい。
免疫原性ワクチン組成物
本発明によるアルキル化HA抗原は、製剤化してインフルエンザワクチンの免疫原性組成物を形成することができる。アルキル化HA抗原は、単独で製剤化してもよく、または、同種もしくは異種インフルエンザ株由来の他の安定化もしくは非安定化インフルエンザ抗原と組み合わせて製剤化してもよい。したがって、本発明の免疫原性組成物は、1価または多価(例えば、2価、3価、または4価)であってもよい。
本発明によるアルキル化HA抗原は、製剤化してインフルエンザワクチンの免疫原性組成物を形成することができる。アルキル化HA抗原は、単独で製剤化してもよく、または、同種もしくは異種インフルエンザ株由来の他の安定化もしくは非安定化インフルエンザ抗原と組み合わせて製剤化してもよい。したがって、本発明の免疫原性組成物は、1価または多価(例えば、2価、3価、または4価)であってもよい。
本発明の免疫原性組成物は、追加の物質、例えばワクチンの有効性を高めるためのアジュバント、および、必ずしも限定するものではないが、湿潤剤もしくは乳化剤、または緩衝剤を含む薬学的に許容可能な担体を含有することができる(Remington’s Pharmaceutical Sciences,18th edition,Mack Publishing Company,(ed.)1980)。
適切なアジュバントとしては、ミネラル塩(AlK(SO4)2、AlNa(SO4)2、AlNH(SO4)2、シリカ、アルミニウム、Ca3(PO4)2、カオリン、または炭素など)、免疫刺激複合体(ISCOM)を含むかまたは含まないポリヌクレオチド(例えば、Chuang,T.H.et al,(2002)J.Leuk.Biol.71(3):538‐44;Ahmad‐Nejad,P.et al(2002)Eur.J.Immunol.32(7):1958‐68に記載されるようなCpGオリゴヌクレオチド、ポリICまたはポリAU酸、CpGを有するかまたは有さないポリアルギニン(当該技術分野ではIC31としても公知である。Schellack,C.et al(2003)Proceedings of the 34th Annual Meeting of the German Society of Immunology;Lingnau,K.et al(2002)Vaccine 20(29‐30):3498‐508参照)、JuvaVax(商標)(米国特許第6,693,086号)、特定の天然物質(例えば、Mycobacterium tuberculosis由来のワックスD、Cornyebacterium parvum、Bordetella pertussis、またはBrucella属ファミリーに見出される物質)、フラジェリン(Toll様受容体5リガンド、McSorley,S.J.et al(2002)J.Immunol.169(7):3914‐9参照)、QS21、QS17、およびQS7のようなサポニン(米国特許第5,057,540号、第5,650,398号、第6,524,584号、第6,645,495号)、モノホスホリルリピドA、特に3‐脱‐O‐アシル化モノホスホリルリピドA(3D‐MPL)、イミキモド(当該技術分野においてIQMとしても公知であり、Aldara(登録商標)として市販、米国特許第4,689,338号、5,238,944号、Zuber,A.K.et al(2004)22(13‐14):1791‐8)、CCR5阻害剤CMPD167(Veazey,R.S.et al(2003)J.Exp.Med.198:1551‐1562参照)、およびスクアレンエマルジョン、すなわちMF59が挙げられるが、必ずしもこれらに限定するものではない。
ヒトにおいて広範に使用されるアジュバントは、アルミニウムである。いくつかの実施形態において、適切なアジュバントはリン酸アルミニウムである。いくつかの実施形態では、適切なアジュバントは水酸化アルミニウムである。いくつかの実施形態では、適切なアジュバントは、リン酸アルミニウムと水酸化アルミニウムとの組合せである。サポニンおよびその精製成分であるQuil A、フロイント完全アジュバントならびに他のアジュバントは、通常、研究および獣医学用途に使用する。しかしながら、Goodman‐Snitkoff et al.J.Immunol.147:410‐415(1991)に記載され、参照として本明細書に援用するようなムラミルジペプチド、モノホスホリルリピドAなどのリン脂質複合体の化学的に定義した新規調製物、Miller et al.,J.Exp.Med.176:1739‐1744(1992)に記載され、本明細書に参照として援用するようなプロテオリポソーム中へのタンパク質のカプセル封入物、およびNOVASOME(商標)脂質小胞(Micro Vescular Systems社、ナシュア、ニューハンプシャー)のような脂質小胞中へのタンパク質のカプセル封入物もまた、ヒトへの投与に有用である。
一般的に、本発明の免疫原性ワクチン組成物は、薬学的に許容可能な担体を含む。一般的に、薬学的に許容可能な担体として、生理食塩水、緩衝生理食塩水、デキストロース、水、グリセロール、エタノール、およびそれらの組合せが挙げられるが、必ずしもこれらに限定するものではない。担体および組成物は滅菌することができ、製剤は投与方式に適合する。組成物はまた、少量の湿潤剤もしくは乳化剤、またはpH緩衝剤を含有することができる。滅菌生理食塩水またはゴマ油のような任意の一般的な医薬担体を使用できる。媒体はまた、浸透圧を調整するための薬学的に許容可能な塩、緩衝剤、防腐剤などのような従来の薬学的補助剤を含有することができる。本明細書で提供する組成物および方法と共に使用することができる他の媒体は、生理食塩水およびゴマ油である。
薬学的に許容可能な担体は、投与する特定の組成物、ならびに組成物を投与するために使用する特定の方法にある程度従って決定する。したがって、本発明の免疫原性組成物に適した様々な製剤が存在する。
本発明の免疫原性ワクチン組成物は、インフルエンザワクチンを対象に導入するために通常使用する任意の経路により対象に投与することができる。投与方法としては、皮内、筋肉内、腹腔内、非経口、静脈内、皮下、膣内、直腸内、鼻腔内、吸入または経口が挙げられるが、必ずしもこれらに限定するものではない。皮下、静脈内または筋肉内投与のような非経口投与は、一般に注射によって行う。注射剤は、溶液もしくは懸濁液、注射前に液体に溶解もしくは懸濁するのに適した固体形態、または乳濁液のいずれかの従来の形態で調製することができる。注射溶液および懸濁液は、前述の種類の滅菌粉末、顆粒、および錠剤から調製することができる。投与は、全身性または局所性のいずれも可能である。
いくつかの実施形態では、免疫原性ワクチン組成物を、非経口(すなわち、筋肉内、皮内もしくは皮下)投与または鼻咽頭内(すなわち、鼻腔内)投与用に製剤化する。一般的には、非経口投与用製剤は、滅菌した水性または非水性溶液、懸濁液、および乳濁液を含む。非水性溶媒の例としては、プロピレングリコール、ポリエチレングリコール、オリーブ油のような植物油、およびオレイン酸エチルのような注射可能な有機エステルが挙げられる。水性担体は、水、アルコール/水溶液、乳濁液または懸濁液を含み、これには生理食塩水および緩衝媒体が含まれる。非経口ビヒクルは、塩化ナトリウム溶液、リンガーデキストロース、デキストロースおよび塩化ナトリウム、乳酸加リンガー、または不揮発性油を含む。静脈内ビヒクルは、液体および栄養補充液、電解質補充液(リンガーデキストロースに基づくものなど)などを含む。防腐剤および他の添加剤、例えば抗菌剤、酸化防止剤、キレート剤、および不活性ガスなどを含有してもよい。
免疫原性組成物のいくつかは、塩酸、臭化水素酸、過塩素酸、硝酸、チオシアン酸、硫酸、およびリン酸などの無機酸、ならびにギ酸、酢酸、プロピオン酸、グリコール酸、乳酸、ピルビン酸、シュウ酸、マロン酸、コハク酸、マレイン酸、およびフマル酸などの有機酸との反応によって、または水酸化ナトリウム、水酸化アンモニウム、水酸化カリウムなどの無機塩基、ならびにモノ、ジ、トリアルキルおよびアリールアミンおよび置換エタノールアミンなどの有機塩基との反応によって形成される薬学的に許容可能な酸または塩基付加塩として潜在的に投与してもよい。
投与は、単回または複数回の投与によって達成することができる。本開示の文脈において対象に投与する用量は、時間の経過とともに対象内で有効な治療応答を誘導するか、またはインフルエンザウイルス感染を阻害もしくは予防するのに十分な量である必要がある。必要となる用量は、対象の種、年齢、体重および全身状態、治療対象の感染の重篤度、使用する特定の組成物およびその投与方式に応じて対象ごとに異なる。適切な用量は、当業者によって通例の実験のみを用いて決定することができる。
本発明の免疫原性組成物を適切に適用することにより、予防用ワクチン接種として疾患を予防したり、治療用ワクチン接種として疾患を治療したりすることができる。記載のヒトワクチンのみならず、本発明の組成物および方法を用いて動物株を免疫することができる。用語「動物」は、ヒトを含むすべての動物を意味する。動物の例としては、ヒト、ウシ、イヌ、ネコ、ヤギ、ヒツジ、ウマ、ブタ、シチメンチョウ、アヒル、ニワトリなどが挙げられる。すべての脊椎動物の免疫系は同様に作用するため、記載する適用は全ての脊椎動物系において実施することができる。
本発明およびその利点を詳細に説明してきたが、添付の特許請求の範囲に規定する本発明の精神および範囲を逸脱することなく、様々な変更、置換および変形が可能であることを理解すべきである。
本発明は、以下の実施例を参照することにより、より深く理解される。しかしながら、それらは、本発明の範囲を限定するものとして解釈すべきではない。全ての引用文献を参照として本明細書に援用する。
実施例1:SRID測定によるインフルエンザワクチン力価喪失の特徴付け
本実施例は、一元放射免疫拡散(SRID)によって測定するインフルエンザヘマグルチニン(HA)力価の低い安定特性の背後にあるメカニズムを特徴づけ、理解するために実施した実験を記載する。以下に示すように、本明細書に記載の実験は、SRID測定による力価の喪失と、HA中の遊離チオールの減少との間の相関性を示した。
本実施例は、一元放射免疫拡散(SRID)によって測定するインフルエンザヘマグルチニン(HA)力価の低い安定特性の背後にあるメカニズムを特徴づけ、理解するために実施した実験を記載する。以下に示すように、本明細書に記載の実験は、SRID測定による力価の喪失と、HA中の遊離チオールの減少との間の相関性を示した。
具体的には、本実施例は、HA抗原において認められる力価喪失に関与する因子を探索する。逆相高速液体クロマトグラフィー(RP‐HPLC)アッセイを行い、SRIDがHA力価の有意な喪失を示す同じ期間にわたって、全HA含量には減少が生じなかったことを実証した。このことを裏付けるために、SRID分析の前に2‐メルカプトエタノール(BME)で処理した試料に対して観察を行った。これらの前処理した試料では、力価の喪失は観察されなかった。これらの結果は、SRIDによって測定するHA力価は経時的に低下するが、全体的なHA含量は変化しないことを示している。これと同じ現象は、多価の医薬品でも観察された。
次に、遊離チオールの分析結果を時間に対して評価した。図1に示すように、経時的な遊離チオールシグナルの消失が、異なる株に基づく様々なインフルエンザワクチンにおけるSRIDによるHA力価の喪失と良く相関することを見出した。これらの結果は、HAの見なし力価の喪失のメカニズムに、ジスルフィド結合形成が関与していることを示唆している。
次に、すべてのインフルエンザ株のHA抗原間で保存されている特徴について調べた。システインは、HA抗原中の遊離チオールの供給源である可能性が高い。HAシステイン残基の存在および役割をよりよく理解するために、2000〜2012年のWHO推奨のインフルエンザ株すべてのバイオインフォマティクス調査を実施した(図2参照)。本調査は、システイン残基がサブタイプ間で完全に保存されており、H1およびB株と比較してH3株のみに差異が認められたことを示した。H1およびB株では、保存領域において16個のシステイン残基を同定し、一方、H3株では、保存領域において18個のシステイン残基を同定した。これらの残基の大部分は既知の対合のジスルフィド結合として存在し、膜貫通領域および細胞質領域において3〜5残基(サブタイプにより異なる)のみが不対である。これらの残基はアセチル化し、したがって発現中にジスルフィド結合を形成できないと考えられるが、例えばTriton(登録商標)X‐100を用いるウイルス分解のプロセスにより、それらが反応性となり、さらなるジスルフィド結合を形成する可能性がある。
特定の理論に拘泥するわけではないが、HA力価喪失におけるシステインの関与は、HAロゼット形成におけるそれらの役割に関連すると考えられる。HAロゼット形成は、膜貫通領域および細胞質領域の疎水性を介して起こる。ロゼット形態では、HAモノマーは密接に接触し、分子間共有結合形成が起こりやすくなる。この情報に基づけば、経時的なHA力価の喪失のメカニズムとして可能性が高いのは、分子間共有システイン結合が形成し、SRID分析の標準的な前処理を行う際に、それがzwittergentによるロゼット構造の破壊を妨げ、その結果、ゲルマトリックス内でのロゼットマクロ構造の移動が制限され、抗血清との相互作用が低下するというものである。これを図3に示す。時間経過とともに、HA抗原中のシステイン残基は分子間結合を形成し、これらが共に作用してロゼット構造を固定化し、SRIDゲル中のHA抗原の移動を遅延させる。
実施例2:アルキル化剤による処理は、HAの見なし力価の喪失を低減する
本実施例は、インフルエンザワクチンをアルキル化剤で処理することにより、SRID測定によるHA力価が安定化、すなわち喪失度が低減することを実証した。
本実施例は、インフルエンザワクチンをアルキル化剤で処理することにより、SRID測定によるHA力価が安定化、すなわち喪失度が低減することを実証した。
実施例1に記載の機構的理解を踏まえ、様々なGRAS(一般的に安全と認められる)賦形剤、いくつかの還元剤、および1つの汎用アルキル化/メチル化剤2‐ヨードアセトアミド(IOAM)を加えた薬剤物質の安定性試験を実施した。濾過後、A型/カリフォルニアまたはB型/ブリスベン由来のHA抗原を、それぞれ0.1mg/mLのアルギニン、10uMのシステイン、1uMのDTT、100uMのDTTおよび1000uMのIOAMに曝し、次いでSRIDアッセイによって試験した。全体的な目的は、SRID測定による力価の喪失を遅らせることであった。本研究の例示的な結果を図4に示す。驚くべきことに、IOAMの添加のみがHAの見なし力価の喪失を安定化させた。
本研究で観察されたHA力価の安定化は、分子間ジスルフィド結合形成を妨げる反応性システイン基のアルキル化によって引き起こされると考えられる。ヨウ素は優れた脱離基として作用し、反応性システインのIOAMへの求核攻撃の反応を起こしやすくする。例示的な機構を図5に示す。
実施例3:インフルエンザワクチン製造プロセスにおけるIOAMの添加点
本実施例は、製造プロセス中のIOAMのようなアルキル化剤の適切な添加点を同定し、安定化効果を最適化し、コストを削減し、臨床試験を容易にするために設計した実験をまとめたものである。
本実施例は、製造プロセス中のIOAMのようなアルキル化剤の適切な添加点を同定し、安定化効果を最適化し、コストを削減し、臨床試験を容易にするために設計した実験をまとめたものである。
第一の開発研究は、1価の原体の製造プロセス中で、HAをIOAMのようなアルキル化剤に曝す適切な添加点を特定することに焦点を当てた。初期の研究は、IOAMを最終原体に直接添加することによって実施した。しかしながら、臨床で使用するためには、アルキル化剤の残留物を除去することが望ましい。IOAMが低分子量であることを考慮すると、これはダイアフィルトレーションで達成可能である。しかしながら、プロセスに第二のダイアフィルトレーションを追加してロットの処理時間を長引かせることは避けることが望ましい。そのようなことから、既存のダイアフィルトレーションおよび濃縮工程の上流で添加することを目標とした。ホルマリンによる不活化と化学的には類似しているため、第一の選択肢は、プロセスの長さに影響を与えないように、IOAMとホルマリンを同時に添加することであった。しかしながら、試料に対し、アルキル化および不活化を連続的に処理した場合に比べ、アルキル化および不活化を両方同時に処理した場合では、結果は異なっていた。
これらの結果を踏まえ、IOAM存在下でのインキュベーションをホルマリン添加の2時間前に組み込むようにプロセスを変更した。IOAM添加の順序がA株の力価に及ぼす影響を示す例示的な結果を図6に示す。
製造プロセス中に抗原をIOAMに曝すタイミングに応じて、HA抗原は異なるレベルの安定化を示し得る。アルキル化剤の添加をダイアフィルトレーションの上流で実施するのが理想的であり、こうすることにより、結果として生じる原体にアルキル化剤(例えば、IOAM)関連の残留物を残すことなく、残留物を一掃することができる。例示的なインフルエンザ製造プロセスを図7に示す。
実施例4:HA安定化のためのIOAMの最適濃度範囲
本実施例は、HA力価を安定化するためのIOAMの最適濃度範囲、特に、非特異的なアルキル化を許容することなくHAを安定化させるIOAMの濃度範囲を探索する。
本実施例は、HA力価を安定化するためのIOAMの最適濃度範囲、特に、非特異的なアルキル化を許容することなくHAを安定化させるIOAMの濃度範囲を探索する。
これは、IOAM濃度範囲を選択し、それによって得られたHA力価の安定性を評価し、次いで、調べた各濃度について、この情報とアミノ酸分析のオーバーレイとを相互参照することによって実施した。本研究では、IOAMの濃度範囲を、IOAMがHA‐システインに対して5倍、50倍および85倍モル過剰となるように設定した。 図8に示すように、B型/ブリスベン株は、3つすべてのIOAMレベルで実質的に安定しており、視覚的傾向にもかかわらず、14%のSRID変動性基準を超える差異は観察されなかった。A型/ビクトリアの場合、本研究では50倍レベルは試験しなかった。しかしながら、5倍と85倍レベルとの間に差が認められ、より高い85倍レベルにおいて力価の喪失はより少なかった。この結果は、HA力価を安定化するために広い濃度範囲でアルキル化剤を使用し得ることを示す。
次いで、IOAM処理後のアミノ酸アルキル化またはメチル化の状態を分析した。具体的には、試料を酸加水分解し、次いでUV検出のためにプレカラム誘導体化法を用いたRP‐HPLCにより分離した。IOAM処理した試料の例示的なアミノ酸分析結果を図9に示す。明らかなように、IOAM処理試料のデータは対照試料と同様であり、遍在性のメチル化を示す新たなピークを全く含まなかった。残念なことに、本分析を通してシステイン残基は安定ではなく、したがってこれらの特定の加水分解状態を用いてアルキル化をモニターするのに十分なほど良好に回復していない。本アッセイのさらなる開発が、システイン残基をモニターし得る加水分解状態をもたらした。
実施例5:IOAM処理したインフルエンザワクチン中のシステインの定量
本実施例は、アルキル化剤(例えば、IOAM)で処理したインフルエンザワクチンが含有する遊離システインのレベルが、未処理対照に比べて低いことを示す。
本実施例は、アルキル化剤(例えば、IOAM)で処理したインフルエンザワクチンが含有する遊離システインのレベルが、未処理対照に比べて低いことを示す。
具体的には、IOAM処理したA型/カリフォルニア株由来HA抗原の遊離システイン濃度を測定し、未処理対照と比較した。本アッセイにおいて、まず、タンパク質を真空および加熱(例えば、150℃)下で約1時間、酸加水分解に供して遊離アミノ酸に分解した。アミノ酸は、ウォーターズ社製AccQ‐Tag Ultra誘導体化キットを使用して誘導体化した。次いで、誘導体をRP‐HPLCにより分離し、UV検出に基づいて定量した。例示的な結果を図10に示す。図10に示すように、IOAM処理した試料は、未処理対照と比較しておよそ30〜35%の遊離システイン残基の減少を示した。このことは、IOAM処理したワクチン試料中で約30〜35%のシステイン残基がアルキル化されていることを示す。
同様の実験をIOAM処理したB型/ブリスベンのワクチン試料を分析するために行った。例示的な結果を図11に示す。A型/カリフォルニア株と同様に、IOAM処理したB型/ブリスベンの試料は、未処理対照に比べて約30〜38%の遊離システインの減少を示した。このことは、IOAM処理したワクチン試料中で約30〜38%のシステイン残基がアルキル化されていることを同様に示している。
これらの実験において、A型/カリフォルニアおよびB型/ブリスベンのグラフに示すIOAM処理試料は、50倍のIOAM‐HA比を用いて調製した。
実施例6:IOAMによる処理は長期安定性を改善する
本実施例は、アルキル化剤(例えば、IOAM)での処理がSRIDアッセイにおけるHA抗原の長期安定性を有意に改善することを示す。
本実施例は、アルキル化剤(例えば、IOAM)での処理がSRIDアッセイにおけるHA抗原の長期安定性を有意に改善することを示す。
本研究のために50倍のIOAM濃度を選択した。本実験の6ヶ月HA安定性の結果の一例を図12に示す。A型/カリフォルニアおよびB型/ブリスベン両方の対照群と比較して、IOAM処理群は、SRIDアッセイによる測定において有意により安定していた。このデータは、IOAM処理したHA抗原が6ヶ月後に安定であり、SRIDアッセイで測定する力価の喪失がおよそ1〜5%であることを示す。
IOAM処理した試料の免疫原性試験を、標準プロトコールに従ってマウスモデルを用いて行った。簡単に述べると、A型/カリフォルニア/07/2009 NYMC X‐179AおよびB型/ブリスベン/60/2008(IOAM処理もしくは未処理)を含有する24、12、10、3.0、1.0、0.30、0.030μgHA/株(SRID力価によって決定)の各2価製剤化バルク製剤、または希釈剤のみの対照を用いて、メスのBALB/cマウス(ハーラン研究室)を免疫した。免疫物を、0日目および21日目に、筋肉内投与経路(50μl/尾部大腿筋)を介して、100μlの総容量で送達した。血液試料を、−2日目(採血前)、21日目(追加免疫前)については後眼窩採血によって、および42日目(追加免疫後)については心臓穿刺によって、採集した。血球凝集阻害(HAI)アッセイの力価測定のために、血清を分離し、−20℃で貯蔵した。JMPソフトウェア(SASソフトウェア社)を用いて統計解析を行った。別の実験では、A型/カリフォルニア/07/2009 NYMC X‐179A(A/Cal)、A型/テキサス/50/2012 X223A(A/Tex)、B型/ブリスベン/60/2008(B/Bris)およびB型/マサチューセッツ/02/2012について、4価(QIV)すべてもしくは3価(TIV)インフルエンザ株(IOAM処理もしくは未処理)の組合せを含有する12、6.0、3.0、1.5、0.75、0.38もしくは0.19ugHA/株(SRID力価アッセイによって決定)の各3価(TIV)もしくは4価(QIV)の製剤化バルク製剤、または希釈剤のみの対照を用いて、7〜8週齢のメスのBALB/cマウス(チャールス・リバー社)を免疫した。同様に、筋肉内投与経路(50μl/尾大腿筋)を介して、100μlの総容量で0日目および21日目に免疫物を送達した。血液試料を、−2日目または−1日目(採血前)、20日目(追加免疫前)については後眼窩採血によって、および35日目(追加免疫後)については心臓穿刺によって、採集した。HAI力価を測定するために、血清を分離し、−20℃で貯蔵した。SAS(登録商標)バージョン9.2ソフトウェア(SASソフトウェア社)を用いて統計分析を行った。
例示的なデータを図13に示す。明らかなように、IOAM処理したHA抗原を含有するインフルエンザワクチンは、IOAM処理をしない対照ワクチンと比較して、全般的に少なくとも同等の免疫原性を示した。
IOAM処理したワクチン試料に関する追加の免疫学的および製品特徴付けの研究も実施することができる。例えば、LC/MSペプチドマッピング法を用いて、影響を受けたアルキル化部位を同定する。さらに、Biacore技術を使用して、IOAM処理試料と比較しての対照試料のエピトープ結合の調査を、保護に関連する抗体を用いて研究することができる。
実施例7:アルキル化処理は免疫原性に影響を与えない
本実施例は、アルキル化剤(例えば、IOAM)による処理が免疫原性に変化を与えないことを示す。HA抗原を含むインフルエンザワクチンのアルキル化の効果を、B型/ブリスベン/60/2008(B/Bris)およびA型/テキサス/50/2012のマウスモデルで分析した。異なるTriton:HA比の製剤を、8週齢のメスのBALB/cマウス(n=15マウス/群)において試験した。用量(100μL)を調製し、0日目(D(day)0)および21日目に投与した。35日目で血清を採取した。
本実施例は、アルキル化剤(例えば、IOAM)による処理が免疫原性に変化を与えないことを示す。HA抗原を含むインフルエンザワクチンのアルキル化の効果を、B型/ブリスベン/60/2008(B/Bris)およびA型/テキサス/50/2012のマウスモデルで分析した。異なるTriton:HA比の製剤を、8週齢のメスのBALB/cマウス(n=15マウス/群)において試験した。用量(100μL)を調製し、0日目(D(day)0)および21日目に投与した。35日目で血清を採取した。
インフルエンザウイルス中和抗体力価の測定のための機能的アッセイである血球凝集阻害(HAI)アッセイを用いて、インフルエンザウイルスワクチンの免疫原性を測定した。用量範囲にわたるHAIアッセイ力価の曲線下面積(AUC)を、各製剤に対してベイラー法を用いて計算した。図14は、アルキル化ヘマグルチニンのAUC反応が、現在認可されている高用量3価不活化インフルエンザワクチン(TIV‐HD)に匹敵することを示す。X軸はTriton:HA比を表す。Y軸は、各製剤の用量反応曲線から生成したAUC(曲線下面積)を表す。これらの結果は、アルキル化処理が免疫原性に影響を与えないことを示している。
均等物および範囲
当業者であれば、通常の実験を行うだけで、本明細書に記載の本発明の具体的な実施形態に対する多くの均等物を認識し、または確認することができる。本発明の範囲は上記の記載に制限されるものではなく、むしろ添付の特許請求の範囲に記載されている。
当業者であれば、通常の実験を行うだけで、本明細書に記載の本発明の具体的な実施形態に対する多くの均等物を認識し、または確認することができる。本発明の範囲は上記の記載に制限されるものではなく、むしろ添付の特許請求の範囲に記載されている。
特許請求の範囲において、「a」、「an」および「the」などの文言は、そうではないと示されない限り、または文脈から明らかでない限り、1つまたは1つ以上を意味する場合がある。したがって、例えば、「抗体(an antibody)」への言及は、複数のそのような抗体を含み、「細胞(the cell)」への言及は、当業者に公知の1つまたは1つ以上の細胞への言及を含む。グループ構成要素の1つまたは1つ以上の構成要素間に「or」を含む請求項または記載は、そうではないと示されない限り、または文脈から明らかでない限り、1つ、1つ以上、またはすべてのグループ構成要素が特定の製品またはプロセスに、存在し、用いられ、または関連することを満たすと見なされる。本発明は、ただ1つのグループ構成要素が、所与の製品またはプロセスに、存在し、用いられ、または関連する実施形態を含む。本発明は、グループの1つ以上またはすべての構成要素が、所与の製品またはプロセスに、存在し、用いられ、または関連する実施形態を含む。さらに、本発明は、列挙した1つ以上の請求項からの1つ以上の限定、要素、句、説明用語などを別の請求項に導入する、すべての変形、組合せ、および置換を包含するものと理解すべきである。例えば、別の請求項に基づく任意の請求項は、同一の基本請求項に基づく任意の他の請求項に記載される1つ以上の制限を含むように変更することができる。さらに、請求項に組成物を列挙する場合、特段の記載がない限り、または矛盾もしくは不整合が生じることが当業者にとって明らかでない限り、それは本明細書に開示する目的のいずれかのための組成物の使用方法を含み、および本明細書に開示する方法のいずれかによる組成物の製造方法、または当業者に周知の他の方法を含むことを理解すべきである。
要素をリストとして、例えばマーカッシュグループ形式で提示する場合、要素の各サブグループも開示し、任意の要素(複数可)をグループから除去し得ることを理解すべきである。一般に、本発明、または本発明の態様が特定の要素、特徴などを含むものと言及する場合、それは、本発明の特定の実施形態または本発明の態様が、そのような要素、特徴などからなるか、または本質的にそれらからなることを理解すべきである。簡潔にするために、本明細書において、これらの実施形態をかかる文言で特段に記載することはしていない。用語「含む(comprising)」は、非制限であることを意図しており、追加の要素または工程を含み得ることに留意すべきである。
範囲を指定する場合、それは端点を含むものとする。さらに、範囲として表す値は、そうではないと示されない限り、または文脈および当業者の理解により明らかでない限り、本発明の異なる実施形態における状態範囲内の任意の特定の値、または文脈上明確に指定されない限り、前記範囲の下限の10分の1までの部分範囲を取り得ることを理解すべきである。
さらに、先行技術に含まれる本発明の任意の特定の実施形態は、特許請求の範囲のいずれか1つまたは1つ以上から明白に除外し得ることを理解すべきである。そのような実施形態は当業者に公知であるとみなされるため、除外について本明細書に明示的な記載がなくても除外してよい。本発明の組成物の任意の特定の実施形態は、先行技術の存在の有無に関わらず、任意の理由により、任意の1つ以上の請求項から除外することができる。
上記および本明細書全体にわたって記載する刊行物は、本出願の出願日前のそれらの開示についてのみ提供する。本明細書中のいかなるものも、先行開示が存在することを理由にそのような開示よりも先行する資格を有さないことを発明者が認めるものとして解釈すべきではない。
Claims (67)
- 1つ以上のアルキル化システイン残基を有するヘマグルチニンを含むインフルエンザワクチン。
- 前記ヘマグルチニンが、1〜5、1〜4、1〜3または1〜2個のアルキル化システイン残基を有する、請求項1に記載のインフルエンザワクチン。
- 前記ヘマグルチニンが、1、2、3、4、または5個のアルキル化システイン残基を有する、請求項1または2に記載のインフルエンザワクチン。
- 前記1つ以上のアルキル化システイン残基が、前記ヘマグルチニン中に存在する全システイン残基の約1〜50%、1〜40%、1〜30%、1〜20%または1〜10%を構成する、先行請求項のいずれか1項に記載のインフルエンザワクチン。
- 前記1つ以上のアルキル化システイン残基が、前記ヘマグルチニン中に存在する全システイン残基の約10%、20%、30%、40%または50%を構成する、先行請求項のいずれか1項に記載のインフルエンザワクチン。
- 実質的に全ての遊離システイン残基がアルキル化されている、先行請求項のいずれか1項に記載のインフルエンザワクチン。
- 前記アルキル化システイン残基がメチル化システイン残基を含む、先行請求項のいずれか1項に記載のインフルエンザワクチン。
- 前記ヘマグルチニンが非特異的なアルキル化および/または遍在性のメチル化を有さない、先行請求項のいずれか1項に記載のインフルエンザワクチン。
- アルキル化システイン残基の数が質量分析によって決定される、先行請求項のいずれか1項に記載のインフルエンザワクチン。
- アルキル化剤で処理したヘマグルチニンを含むインフルエンザワクチン。
- 前記アルキル化剤が、2‐ヨードアセトアミド(IOAM)、ヨード酢酸、2‐ブロモアセトアミド、グルタチオンブロモアセトアミド、ブロモ酢酸、1,3‐プロパンスルトン、メチルメタンチオスルホン酸、メトキシカルボニルメチルジスルフィド、マレアミド、マレイミド‐PEG、ビニルピリジン、N‐エチルマレイミド、トシルアセトアミド、およびそれらの組合せからなる群から選択される、請求項10に記載のインフルエンザワクチン。
- 前記アルキル化剤が2‐ヨードアセトアミド(IOAM)である、請求項10または11に記載のインフルエンザワクチン。
- 前記ヘマグルチニンが、カリフォルニアもしくはソロモン株に存在するH1タンパク質、ブリスベン、フロリダ、オハイオ、江蘇もしくは香港株に存在するBタンパク質、および/または、あるいはビクトリア、パース、ブリスタンもしくはウィスコンシン株に存在するH3タンパク質である、先行請求項のいずれか1項に記載のインフルエンザワクチン。
- 前記ワクチンが、スプリットインフルエンザウイルスワクチンである、先行請求項のいずれか1項に記載のインフルエンザワクチン。
- 組換えインフルエンザワクチンである、請求項1〜13のいずれか1項に記載のインフルエンザワクチン。
- 卵ベースのインフルエンザワクチンである、先行請求項のいずれか1項に記載のインフルエンザワクチン。
- 昆虫細胞、哺乳類細胞、酵母細胞、ウイルス細胞、真菌または藻類において産生される、請求項1〜15のいずれか1項に記載のインフルエンザワクチン。
- 1価、2価、3価または4価のインフルエンザワクチンである、先行請求項のいずれか1項に記載のインフルエンザワクチン。
- 1〜30℃の範囲の温度で約6ヶ月間貯蔵した場合に、一元放射免疫拡散(SRID)アッセイによる測定において少なくとも約90%の力価を保持する、先行請求項のいずれか1項に記載のインフルエンザワクチン。
- 前記アルキル化剤を実質的に含まない、先行請求項のいずれか1項に記載のインフルエンザワクチン。
- 精製ヘマグルチニン抗原またはヘマグルチニン含有ウイルス粒子をアルキル化剤で処理する工程を含む、ヘマグルチニンのアルキル化方法。
- 前記ヘマグルチニン含有ウイルス粒子がスプリットウイルスである、請求項21に記載の方法。
- 前記精製ヘマグルチニン抗原が、精製した表面抗原である、請求項21に記載の方法。
- 前記精製ヘマグルチニン抗原が、精製した組換えヘマグルチニンタンパク質である、請求項21に記載の方法。
- 前記ヘマグルチニンが、カリフォルニアもしくはソロモン株に存在するH1タンパク質、ブリスベン、フロリダ、オハイオ、江蘇もしくは香港株に存在するBタンパク質、またはビクトリア、パース、ブリスタンもしくはウィスコンシン株に存在するH3タンパク質から選択される、請求項21〜24のいずれか1項に記載の方法。
- 卵ベースまたは細胞培養ベースの産生系から産生したインフルエンザウイルスから得られたウイルス粒子をアルキル化剤で処理する工程を含む、インフルエンザワクチンの製造方法。
- 前記ウイルス粒子を、前記インフルエンザウイルスを分解することによって取得する、請求項26に記載の方法。
- インフルエンザワクチンの製造方法であって、
卵ベースまたは細胞培養ベースの産生系からインフルエンザウイルスを回収し、
前記インフルエンザウイルスを分解し、
前記スプリットインフルエンザウイルスをアルキル化剤で処理し、および、
前記処理したスプリットインフルエンザウイルスを不活化する
ことを含む、前記インフルエンザワクチンの製造方法。 - 前記分解工程が、前記インフルエンザウイルスを界面活性剤で処理することを含む、請求項27または28に記載の方法。
- 前記界面活性剤が、Triton(登録商標)、タウロデオキシコール酸ナトリウム、ノニルフェノールエトキシレート、臭化セチルトリメチルアンモニウム(CTAB)、および/またはデオキシコール酸ナトリウムから選択される、請求項29に記載の方法。
- 前記アルキル化剤が、2‐ヨードアセトアミド(IOAM)、ヨード酢酸、2‐ブロモアセトアミド、グルタチオンブロモアセトアミド、ブロモ酢酸、1,3‐プロパンスルトン、メチルメタンチオスルホン酸、メトキシカルボニルメチルジスルフィド、マレアミド、マレイミド‐PEG、ビニルピリジン、N‐エチルマレイミド、トシルアセトアミド、およびそれらの組合せからなる群から選択される、請求項21〜30のいずれか1項に記載の方法。
- 前記アルキル化剤が2‐ヨードアセトアミド(IOAM)である、請求項31に記載の方法。
- 前記インフルエンザウイルスを、卵ベースの産生系において産生する、請求項21〜32のいずれか1項に記載の方法。
- 前記インフルエンザウイルスを、動物細胞、植物細胞、酵母細胞、ウイルス細胞、真菌もしくは藻類、または合成細胞で産生する、請求項21〜32のいずれか1項に記載の方法。
- 前記動物細胞が、昆虫細胞、哺乳類細胞および/または鳥類細胞から選択される、請求項34に記載の方法。
- 前記処理工程が、前記精製ヘマグルチニン抗原、前記ヘマグルチニン含有ウイルス粒子、前記ウイルス粒子、または前記スプリットインフルエンザウイルスを、前記アルキル化剤とともに、1〜30℃の範囲の温度でインキュベートすることを含む、請求項21〜35のいずれか1項に記載の方法。
- 前記温度が室温である、請求項36に記載の方法。
- 前記温度が、1〜5℃、2〜8℃、5〜10℃、10〜15℃、15〜20℃、20〜25℃、または25〜30℃の範囲である、請求項36に記載の方法。
- 前記処理工程が、前記精製ヘマグルチニン抗原、前記ヘマグルチニン含有ウイルス粒子、前記ウイルス粒子、または前記スプリットインフルエンザウイルスを、前記アルキル化剤とともに、最大約24、20、18、16、14、12、10、8、6、4、2、1.5時間、1時間、50分間、40分間、30分間、20分間、または10分間インキュベートすることを含む、請求項21〜38のいずれか1項に記載の方法。
- 前記アルキル化剤が、ヘマグルチニン(HA)‐システイン濃度に対して1倍モル過剰を超える濃度で存在する、請求項21〜39のいずれか1項に記載の方法。
- 前記アルキル化剤が、ヘマグルチニン(HA)‐システイン濃度に対して、1倍〜100倍、5倍〜85倍、1倍〜50倍、または5倍〜50倍モル過剰の範囲の濃度で存在する、請求項21〜40のいずれか1項に記載の方法。
- 前記アルキル化剤が、1mM〜1M、1mM〜500mM、1mM〜400mM、1mM〜300mM、1mM〜200mM、または1mM〜100mMの範囲の濃度で存在する、請求項21〜41のいずれか1項に記載の方法。
- 前記アルキル化剤が、約1mM、10mM、20mM、30mM、40mM、50mM、100mM、200mM、300mM、400mM、または500mMの濃度で存在する、請求項21〜42のいずれか1項に記載の方法。
- 前記アルキル化剤が、1μg/ml〜1,000μg/ml、1μg/ml〜500μg/ml、1μg/ml〜400μg/ml、1μg/ml〜300μg/ml、1μg/ml〜200μg/ml、または1μg/ml〜100μg/mlの範囲の濃度で存在する、請求項21〜43のいずれか1項に記載の方法。
- 前記アルキル化剤が、約1μg/ml、10μg/ml、20μg/ml、30μg/ml、40μg/ml、50μg/ml、60μg/ml、70μg/ml、80μg/ml、90μg/ml、100μg/ml、200μg/ml、300μg/ml、400μg/ml、または500μg/mlの濃度で存在する、請求項44に記載の方法。
- 前記アルキル化剤で処理する工程が、ヘマグルチニンの1つ以上のシステイン残基のアルキル化をもたらす、請求項21〜45のいずれか1項に記載の方法。
- 前記アルキル化剤で処理する工程が、1〜5、1〜4、1〜3または1〜2個のシステイン残基のアルキル化をもたらす、請求項21〜46のいずれか1項に記載の方法。
- 前記アルキル化剤で処理する工程が、1、2、3、4、または5個のシステイン残基のアルキル化をもたらす、請求項21〜47のいずれか1項に記載の方法。
- 前記アルキル化剤で処理する工程が、存在する全システイン残基の約1〜50%、1〜40%、1〜30%、または1〜20%のアルキル化をもたらす、請求項21〜48のいずれか1項に記載の方法。
- 前記アルキル化剤で処理する工程が、存在する全システイン残基の約10%、20%、30%、40%または50%のアルキル化をもたらす、請求項21〜49のいずれか一項に記載の方法。
- 前記アルキル化剤で処理する工程が、実質的に全ての遊離システイン残基のアルキル化をもたらす、請求項21〜50のいずれか1項に記載の方法。
- 前記アルキル化剤による処理が非特異的なアルキル化をもたらさない、請求項21〜51のいずれか1項に記載の方法。
- 前記アルキル化剤による処理が遍在性のメチル化をもたらさない、請求項21〜52のいずれか1項に記載の方法。
- 前記アルキル化剤による処理が、アルキル化剤の処理をしないことを除いて他の点で同一のインフルエンザワクチンと比較して、一元放射免疫拡散(SRID)によって測定するインフルエンザワクチンの力価の喪失を減少させる、請求項21〜53のいずれか1項に記載の方法。
- 前記アルキル化剤による処理が、前記インフルエンザワクチンを1〜30℃で30日間貯蔵した場合に、SRIDによって測定する力価の喪失を50%以下に減少させる、請求項21〜54のいずれか1項に記載の方法。
- 前記アルキル化剤で処理する工程が、前記インフルエンザワクチンを1〜30℃で30日間貯蔵した場合に、SRIDによって測定する力価の喪失を30%以下に減少させる、請求項21〜55のいずれか1項に記載の方法。
- 前記アルキル化剤で処理する工程が、前記インフルエンザワクチンを1〜30℃で30日間貯蔵した場合に、SRIDによって測定する力価の喪失を10%以下に減少させる、請求項21〜56のいずれか1項に記載の方法。
- 前記アルキル化剤で処理する工程を、前記インフルエンザウイルスを不活化する工程の前に実施する、請求項21〜57のいずれか1項に記載の方法。
- 前記アルキル化剤で処理する工程を、前記インフルエンザウイルスを不活化する工程と同時に実施する、請求項21〜57のいずれか1項に記載の方法。
- 前記不活化工程が、前記インフルエンザウイルスを、紫外線または化学的不活化剤で処理することを含む、請求項58または59に記載の方法。
- 前記不活化工程が、前記インフルエンザウイルスを、β‐プロピオラクトン、デオキシコール酸ナトリウムおよび/またはホルマリンから選択される化学的不活化剤で処理することを含む、請求項60に記載の方法。
- 前記不活化工程が、前記インフルエンザウイルスをホルマリンで処理することを含む、請求項61に記載の方法。
- 前記アルキル化剤を除去する工程をさらに含む、請求項21〜62のいずれか1項に記載の方法。
- 前記アルキル化剤をダイアフィルトレーションによって除去する、請求項63に記載の方法。
- 前記アルキル化剤を前記化学的不活化剤とともに除去する、請求項64に記載の方法。
- 前記インフルエンザワクチンが、1価、2価、3価または4価のインフルエンザワクチンである、請求項21〜65のいずれか1項に記載の方法。
- 請求項21〜66のいずれか1項に記載の方法に従って製造されるインフルエンザワクチン。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201462038753P | 2014-08-18 | 2014-08-18 | |
| US62/038,753 | 2014-08-18 | ||
| PCT/US2015/045689 WO2016028776A1 (en) | 2014-08-18 | 2015-08-18 | Alkylated influenza vaccines |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2017525766A true JP2017525766A (ja) | 2017-09-07 |
| JP2017525766A5 JP2017525766A5 (ja) | 2018-09-20 |
Family
ID=54008038
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2017529592A Pending JP2017525766A (ja) | 2014-08-18 | 2015-08-18 | アルキル化インフルエンザワクチン |
Country Status (9)
| Country | Link |
|---|---|
| US (1) | US10124056B2 (ja) |
| EP (1) | EP3182998A1 (ja) |
| JP (1) | JP2017525766A (ja) |
| KR (1) | KR20170042605A (ja) |
| CN (1) | CN106794241A (ja) |
| AU (1) | AU2015305690A1 (ja) |
| CA (1) | CA2957570A1 (ja) |
| SG (1) | SG11201701279VA (ja) |
| WO (1) | WO2016028776A1 (ja) |
Families Citing this family (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2019045090A1 (ja) * | 2017-09-04 | 2019-03-07 | 公益財団法人ヒューマンサイエンス振興財団 | インフルエンザhaスプリットワクチンの製造方法 |
| JP7403733B2 (ja) | 2017-09-04 | 2023-12-25 | 国立感染症研究所長 | インフルエンザhaスプリットワクチンの製造方法 |
| CN112618709B (zh) * | 2019-09-24 | 2023-11-03 | 华南理工大学 | 一种猪口服接种疫苗缓释佐剂及其制备方法与应用 |
| CN112708599B (zh) * | 2019-10-25 | 2022-02-18 | 中国农业大学 | 一株禽流感病毒疫苗株及其应用 |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20060051742A1 (en) * | 2004-03-17 | 2006-03-09 | Kapteyn Johan C | Novel assay for the separation and quantification of hemagglutinin antigens |
| JP2006257102A (ja) * | 1997-12-26 | 2006-09-28 | Jean-Francois Zagury | 抗レトロウイルス免疫原、調製および使用 |
| JP2008530067A (ja) * | 2005-02-11 | 2008-08-07 | ナショナル インスティテュート フォー バイオロジカル スタンダーズ アンド コントロール(エヌアイビーエスシー) | 新規無毒化方法 |
Family Cites Families (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS62221636A (ja) | 1986-03-20 | 1987-09-29 | Chemo Sero Therapeut Res Inst | B型肝炎ウイルス抗原蛋白の可溶化方法 |
| WO2003014338A1 (fr) | 2001-08-02 | 2003-02-20 | Anges Mg, Inc. | Procede de production d'enveloppes virales inactivees |
| EP1481985A1 (en) | 2003-05-28 | 2004-12-01 | Innogenetics N.V. | Modified hepatitis C virus (HCV) NS3 for medical treatment |
| CN101161285A (zh) * | 2007-09-06 | 2008-04-16 | 上海荣盛生物技术有限公司 | 流感病毒裂解疫苗 |
| BR112012027643A2 (pt) | 2010-05-03 | 2016-08-16 | Glaxosmithkline Biolog Sa | métodos para a inativação de um orthomixovírus, para a preparação de uma vacina, e , composição imunogênica |
| WO2011154976A2 (en) | 2010-06-08 | 2011-12-15 | Panacea Biotec Limited | Improved influenza vaccine |
| CN102406931B (zh) * | 2011-11-25 | 2014-02-05 | 成都康华生物制品有限公司 | 大流行流感病毒裂解疫苗 |
-
2015
- 2015-08-18 KR KR1020177004533A patent/KR20170042605A/ko unknown
- 2015-08-18 SG SG11201701279VA patent/SG11201701279VA/en unknown
- 2015-08-18 JP JP2017529592A patent/JP2017525766A/ja active Pending
- 2015-08-18 CN CN201580044445.2A patent/CN106794241A/zh active Pending
- 2015-08-18 CA CA2957570A patent/CA2957570A1/en not_active Abandoned
- 2015-08-18 US US14/829,158 patent/US10124056B2/en not_active Expired - Fee Related
- 2015-08-18 AU AU2015305690A patent/AU2015305690A1/en not_active Abandoned
- 2015-08-18 WO PCT/US2015/045689 patent/WO2016028776A1/en active Application Filing
- 2015-08-18 EP EP15754404.0A patent/EP3182998A1/en not_active Withdrawn
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2006257102A (ja) * | 1997-12-26 | 2006-09-28 | Jean-Francois Zagury | 抗レトロウイルス免疫原、調製および使用 |
| US20060051742A1 (en) * | 2004-03-17 | 2006-03-09 | Kapteyn Johan C | Novel assay for the separation and quantification of hemagglutinin antigens |
| JP2008530067A (ja) * | 2005-02-11 | 2008-08-07 | ナショナル インスティテュート フォー バイオロジカル スタンダーズ アンド コントロール(エヌアイビーエスシー) | 新規無毒化方法 |
Non-Patent Citations (1)
| Title |
|---|
| J.PHARM.SCI.2014 MAR,103(3),P.821-827, JPN6019020637, ISSN: 0004182800 * |
Also Published As
| Publication number | Publication date |
|---|---|
| CN106794241A (zh) | 2017-05-31 |
| AU2015305690A1 (en) | 2017-03-02 |
| CA2957570A1 (en) | 2016-02-25 |
| KR20170042605A (ko) | 2017-04-19 |
| SG11201701279VA (en) | 2017-03-30 |
| US10124056B2 (en) | 2018-11-13 |
| US20160045590A1 (en) | 2016-02-18 |
| EP3182998A1 (en) | 2017-06-28 |
| WO2016028776A1 (en) | 2016-02-25 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US10130700B2 (en) | Polyvalent influenza virus-like particles (VLPS) and use as vaccines | |
| JP2018134107A (ja) | インフルエンザウイルスワクチン及びその使用 | |
| CN107949636B (zh) | 活减毒病毒以及生产和使用方法 | |
| US20170114103A9 (en) | Vaccines for use in the prophylaxis and treatment of influenza virus disease | |
| WO2019032463A1 (en) | IMMUNOGENIC COMPOSITIONS COMPRISING INFLUENZA VIRUS AND AS01 CHIMERIC POLYPEPTIDES OF HEMAGGLUTININ AND USES THEREOF | |
| US10124056B2 (en) | Alkylated influenza vaccines | |
| JP7479424B2 (ja) | 改変インフルエンザヘマグルチニンポリペプチドの修飾 | |
| JP2016514674A (ja) | ヘマグルチニンの改善された安定性及び効能 | |
| US11369675B2 (en) | Broadly protective inactivated influenza virus vaccine | |
| Takeyama et al. | Detection of highly pathogenic avian influenza virus infection in vaccinated chicken flocks by monitoring antibodies against non-structural protein 1 (NS1) | |
| CA3064760A1 (en) | Universal influenza vaccine | |
| WO2008157203A2 (en) | Methods of protecting animals from avian influenza infection | |
| US20230055468A1 (en) | Broadly reactive viral antigens as immunogens, compositions and methods of use thereof | |
| WO2021139810A1 (en) | Recombinant viruses expressing alpha-1, 3-galactosyltransferase and uses thereof | |
| RU2323740C1 (ru) | ШТАММ "НОВОСИБИРСКИЙ" ВИРУСА ГРИППА ПТИЦ Influenzae virus avicum ДЛЯ КОНТРОЛЯ ИММУНОГЕННОЙ И АНТИГЕННОЙ АКТИВНОСТИ ВАКЦИН И ИЗГОТОВЛЕНИЯ БИОПРЕПАРАТОВ ДЛЯ ДИАГНОСТИКИ И СПЕЦИФИЧЕСКОЙ ПРОФИЛАКТИКИ ГРИППА ПТИЦ | |
| Nuwarda et al. | An Overview of Influenza Viruses and Vaccines. Vaccines 2021, 9, 1032 | |
| Hinostroza | Examining the role of adaptive heterosubtypic immunity in the epidemiology of low pathogenic avian influenza viruses in mallards |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20180807 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20180807 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20190605 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20191225 |