JP2016507249A - ナノ構造ベースの核酸配列決定のための方法および組成物 - Google Patents
ナノ構造ベースの核酸配列決定のための方法および組成物 Download PDFInfo
- Publication number
- JP2016507249A JP2016507249A JP2015558959A JP2015558959A JP2016507249A JP 2016507249 A JP2016507249 A JP 2016507249A JP 2015558959 A JP2015558959 A JP 2015558959A JP 2015558959 A JP2015558959 A JP 2015558959A JP 2016507249 A JP2016507249 A JP 2016507249A
- Authority
- JP
- Japan
- Prior art keywords
- nucleic acid
- acid molecule
- target nucleic
- sequencing
- nanostructure
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6869—Methods for sequencing
Abstract
Description
本願は、2013年2月20日出願の米国出願第61/766,925号の恩典を主張する。
本開示は、概して、核酸配列決定システムおよび方法ならびにそのようなシステムおよび方法において使用され得る組成物に関する。
ナノ構造DNA配列決定は、費用対効果の優れた、長い読み取りの、かつ正確な全ヒトゲノム配列決定および効率的な細菌ゲノム配列決定ならびにその他の配列決定用途を実現できるDNA配列決定の1つの方法である。本開示は、既存のナノ構造配列決定技術に対して多くの改善を提供し、例えば臨床応用および高スループット環境でのナノ構造ベースの配列決定方法の使用を制限している多くの制約に対処する。
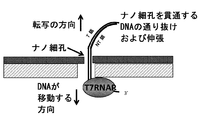
ナノ構造ベースの配列決定は、ナノ構造の近くで固体表面に対して固定されているポリメラーゼに基づく。塩基の組み込みおよびポリメラーゼによる伸長の結果として、核酸はポリメラーゼ酵素内を、そしてその結果として、ナノ構造を貫通して(through)、ナノ構造上で(on)またはナノ構造の上方で(over)転位する。酵素依存的な転位の結果として、ナノ構造にわたる電気信号の変化が観察される。本明細書に記載される配列決定方法は、2つのアプローチを含む。第1のアプローチは、既知の塩基を添加し、単一塩基重合およびナノ構造を貫通する、ナノ構造上でのまたはナノ構造の上方での転位(すなわち、移動)を行わせるベース・バイ・ベース(base-by-base)の配列決定である。第2のアプローチにおいては、4つのヌクレオチドすべてが存在し、そのヌクレオチドのうちの1つが律速量で存在する。4つのヌクレオチドのうちの3つの組み込みおよびその後のポリメラーゼによる伸長、ナノ構造を貫通する、ナノ構造上でのまたはナノ構造の上方での核酸の移動は、その酵素の通常の速度で起こる。しかし、律速ヌクレオチドに対応する核酸内位置では、伸長/転位、したがってナノ構造を貫通する、ナノ構造上でのまたはナノ構造の上方での移動が、低速になるかまたは休止する。律速濃度の各ヌクレオチドを用いて反応を繰り返すことにより、完全な配列決定をバイオインフォマティクス的に構築することが可能となる。
本開示は、複雑さ、費用、拡張性ならびに究極的にはより長い読み取り長、より高いスループットおよび向上した精度を含む、既存の単一分子配列決定システムの制約の多くが軽減された単一分子ナノ構造ベースの配列決定システムについて説明する。本明細書に記載されるリアルタイム、単一分子ナノ構造ベースの配列決定方法およびシステムは、高処理性の酵素およびナノ構造技術の使用により非常に短い時間の間に高い精度で数千のヌクレオチドを配列決定することができる。
ナノ構造ベースの配列決定は、ポリメラーゼ酵素による標的核酸分子の伸長および転位に基づくものであり、これはまた、ナノ構造を貫通する、ナノ構造上でのまたはナノ構造の上方での標的核酸分子の転位を引き起こす。1つの態様において、ポリメラーゼは固体表面に固定され、そして標的核酸がポリメラーゼの一端に結び付けられ、他端は、ナノ構造を貫通して、ナノ構造上でまたはナノ構造の上方で通される。ソリッドステートナノ構造、例えばナノ細孔またはナノチューブは、典型的に、生物学的ナノ構造よりも大きな開口を有し、したがって二本鎖核酸を収容することができる。ナノ構造は、ナノ構造を貫通する、ナノ構造上でのまたはナノ構造の上方での核酸の移動中に非対称的イオン応答を検出することができ、これがヌクレオチド塩基の伸長および転位を示す。
本明細書に記載されるナノ構造ベースの配列決定方法のために、酵素(RNAポリメラーゼまたはDNAポリメラーゼ)は固体表面に固定される。本明細書に記載されるいくつかの態様において、固体表面は、シリカベースのガラス(例えば、ホウケイ酸ガラス、溶融石英または石英)製である。他の態様において、酸化アルミニウム、シリコン、グラフェンまたは半導体分野で基材または基材上の層として使用される他の表面。しかし、他の材料(例えば、ポリプロピレン、ポリスチレン、シリコン、シリコン窒化物および他のポリマーまたはそれらの複合材料)もまた、それらが本明細書に記載される配列決定において使用するのに適している限り、使用され得る。
本明細書に記載されるナノ構造ベースの配列決定方法は、任意のタイプのポリメラーゼ酵素を利用し得る。ポリメラーゼ(EC 2.7.7.6;EC 2.7.7.7;EC 2.7.7.19;EC 2.7.7.48;またはEC 2.7.7.49)は、一本鎖または二本鎖の鋳型DNAまたはRNAから1つまたは2つの新しいDNAまたはRNA鎖を合成する。適当なポリメラーゼは、例えば、DNAポリメラーゼおよびRNAポリメラーゼを含む。
ナノ構造ベースの配列決定のための核酸分子は、真核生物、細菌および古細菌を含む実質的に任意の供給源から入手され得る。真核生物核酸は、ヒトおよび他の哺乳動物(例えば、霊長類、ウマ、ウシ、イヌ、ネコおよびげっ歯類)または非哺乳動物(例えば、鳥類、爬虫類(例えば、ヘビ、カメ、ワニ等)および魚類)由来であり得、原核生物核酸は、細菌(例えば、病原性細菌、例えば、非限定的に、連鎖球菌(Streptococcus)、大腸菌、シュードモナス菌(Pseudomonas)およびサルモネラ菌(Salmonella))または古細菌(例えば、クレンアーキオータおよびユリアーキオータ)由来であり得る。
長い核酸分子は折りたたまれ得るまたはそれ自身の上に倒壊し得るので、標的核酸分子に対する張力は、より長い標的核酸分子ほど重要となる。標的核酸分子の任意のタイプの異常ならせん構造が、ナノ構造を貫通する、ナノ構造上でのまたはナノ構造の上方での移動を、したがって配列決定信号を鈍らせ得るまたは遮蔽し得る。
本明細書で考察されるように、ポリメラーゼ酵素は、鋳型核酸と複合体化される前または後に、ナノ構造上に直接またはナノ構造の近くで固体表面に固定され得る。鋳型核酸およびナノ構造が互いに近接状態にされた後、核酸は、例えば拡散または電流を含む任意の多くの方法を用いてナノ構造内に導入または通され得る。エントロピー力がナノ構造に進入する試料の能力に影響し得ること、および拡散とエントロピーの間の相互関係が核酸の長さおよびナノ構造のサイズ等のパラメータに依存することが当業者に理解されるであろう。例えば、その手引きとしてHe et al., (2013, ACS Nano, 7:538-46)を参照のこと。
ナノ構造は、当技術分野で周知であり、非限定的に、ナノ細孔、ナノチューブおよびナノワイヤを含む。ナノ構造は、生物学的物質(例えば、タンパク質、例えば細孔形成タンパク質)、合成もしくはソリッドステート物質(例えば、シリコン、グラフェン、シリコン窒化物、酸化アルミニウム)またはそれらの組み合わせを用いて作製され得る。ナノ構造の背景にある原理は、電圧が印加された際のナノ構造、ナノ構造上またはナノ構造の上方を通過するイオン電流のモニタリングに基づいている。分子の通過または本発明においては核酸分子の移動は、電流レベルの妨害または変化をもたらす。当業者は、ナノ構造が存在する緩衝液のイオン濃度により、電流の増加または減少が観察されるかどうかが決定され得ることを理解するであろう(例えば、Smeets et al., 2006, NanoLett., 6:89-95を参照のこと)。したがって、いくつかの態様において、低いイオン濃度が使用され得;いくつかの態様において、高いイオン濃度が使用され得る。
ナノ構造ベースの配列決定複合体は、任意の多くの異なる様式で生成され得ることが当業者に理解されるであろう。1つの態様において、プロモーターが結合した標的核酸分子(鋳型または鋳型核酸とも称される)が、ポリメラーゼが固定された固体表面に提供され得る。この態様において、標的核酸分子は、標的核酸分子が固定されたポリメラーゼと複合体を形成する前または後に、ナノ構造を貫通して、ナノ構造上にまたはナノ構造の上方に供給され得る。別の態様において、ポリメラーゼおよびプロモーターが結合した標的核酸分子は、組み合わされ、そしてその後にポリメラーゼが固体表面に固定され得る。これまでの態様と同様に、標的核酸分子は、ポリメラーゼが提供されその後に固定される前または後にナノ構造を貫通して、ナノ構造上にまたはナノ構造の上方に供給され得る。複合体形成の順は、例えば、非限定的に、さらなる部分がプロモーター結合末端の反対側にある標的核酸分子の末端に結び付けられるかどうかを含む様々な要因に依存するであろう。
本明細書に記載されるナノ構造ベースの配列決定法は、ヌクレオチドの非同期組み込みに基づき標的核酸を配列決定するのに使用することができる。非同期態様における、初期反応を行う配列決定条件(すなわち、第1の配列決定条件)は、その少なくとも1つが律速であり少なくとも1つが非律速である、異なる量で存在する4つのヌクレオシド三リン酸の存在を含む。例えば、4つのヌクレオシド三リン酸のうちの1つが律速量(例えば、他の3つのヌクレオシド三リン酸の量よりも少ない量)で提供される。そのような反応において、ポリメラーゼは、律速量で提供されたヌクレオシド三リン酸を転写物に組み込もうとするごとに効果的に休止し、そしてそのような休止は、本明細書に記載されるような移動のパターンで観察することができる。
本明細書に記載されるナノ構造ベースの配列決定方法は、他ではベース・バイ・ベース配列決定として公知となっていることもある、同期パターンで核酸を配列決定するために使用され得る。同期またはベース・バイ・ベース態様の場合、初期反応を行う配列決定条件(すなわち、第1の配列決定条件)は、単一のヌクレオシド三リン酸の存在を含む。そのような反応において、ポリメラーゼによる転写は、標的核酸がその位置に相補的な塩基を含んでいる場合に限り進行し、それは、本明細書に記載されるように核酸の移動の変化として観察され得る。そのような反応条件は、移動が変化しなくなるまで継続される。移動の累積変化は、第1のヌクレオシド三リン酸が新生鎖に(例えば、標的核酸分子のホモポリマー領域に)連続的に組み込まれた回数を正確に決定するのに使用され得ることが理解されるであろう。
本明細書に記載されるナノ構造ベースの配列決定方法は、例えば、非限定的に、配列決定情報の精度をさらに向上させるためおよび配列決定反応において得られる情報量をさらに増大させるために利用することができる、多くの異なるバリエーションおよび慣用的な改変を受け入れることができる。
製造物品(例えば、キット)が本明細書に提供される。製造物品は、本明細書で考察されているような、複数のポリメラーゼ酵素が固定された固体基材を含み得る。複数のポリメラーゼ酵素は、少なくとも10個のポリメラーゼ(例えば、少なくとも20、50、75もしくは100個の酵素)、少なくとも100個のポリメラーゼ(例えば、少なくとも200、500もしくは1,000個の酵素)または少なくとも1,000個のポリメラーゼ(例えば、少なくとも約2,500、5,000、10,000、50,000個もしくはそれ以上の酵素)を表す。
本明細書に記載されるナノ構造ベースの配列決定システムは、配列決定モジュールを少なくとも含む。標的核酸分子を配列決定するための配列決定モジュールは、典型的に、固体基材を受け入れるための収容構造、有向性の力を提供するための張力源、およびナノ構造を横断する電流の変化を決定するための手段を含む。固体基材および張力源は、上で考察されており、電流の変化を決定または検出するための手段は当技術分野で周知である。そのような手段は、例えば、(例えば、電圧固定増幅器(例えば、Axopatch)を用いる)イオン電流測定の使用または横電場(例えば、ドラッギング、トンネリング)の使用を含み得る(例えば、Tsutsui et al., 2012, Sci. Rep., 2:394)。固体基材を受け入れるための収容構造は、例えば、凹型チャンバーとして構成され得る。配列決定モジュールはまた、コンピュータープロセッサまたはコンピュータープロセッサと連動する手段を含み得る。さらに、配列決定モジュールの一部として一次分析ソフトウェアが提供され得る。
図4は、標的核酸分子の配列を決定するプロセス例1100を説明する流れ図である。いくつかの例において、プロセス1100は、1つまたは複数のコンピューターデバイスを用いて実行される1つまたは複数のコンピュータープログラムアプリケーションを用いて実施され得る。説明の目的で、ポリメラーゼによる標的核酸分子の伸長の間に得られるデータに基づく標的核酸分子の配列の決定に関する非限定的な例が提供される。
NTA単層を、記載されたようにして調製した(Paik et al., 2005, Chem. Commun., 15: 1956-58を参照のこと。Ni-NTA表面は、このNTA官能化基材を、0.1 M NiCl2を含む10 mM Tris-HCl緩衝液(pH 8.0)に30分間浸漬することによって得た。次いでこの基材をMilli-Q水で数回すすぎ、そして窒素流下で乾燥させた。
38アミノ酸のSBPタグをコードするDNAフラグメントを、鋳型としてpTAGk19ならびにプライマーとして合成DNAオリゴマーRP46およびRP47(以下を参照のこと)を用いるPCRにより合成した。このフラグメントをNcoIで消化し、pBH16117にライゲートして、pRP6を得た。
Si(III)へのRNAポリメラーゼ分子の固定のために、以下の反応スキームを行った:(a)40% NH4F、10分間、25℃;(b)Cl2ガス、20分間、100℃;(c)mPEG、一晩、真空、150℃;(d)DSC、DEIDA、DMAP、DMF、一晩、25℃;(f)BBTO、ジエチルエーテル、6時間、25℃;(g)CuSO4、エタノール 20分間、25℃;(h)6x Hisタグ付きタンパク質のインキュベーション。
ポリ(ジメチルシロキサン)(PDMS)と硬化剤(Sylgard 184、Dow Corning)の10:1(v/v)混合物を、パターン構造化シリコンマスターに対してキャストし、5ミクロンの線の特徴、3および10ミクロンの間隔の線の特徴ならびに5ミクロンの間隔を有するPDMSスタンプを調製した。非酸化PDMSスタンプを、約1時間、0.1 M NiCl2を含む10 mM Tris-HCl緩衝液(pH 8.0)中でインキュベートし、次いで窒素流下で乾燥させた。このスタンプを、3分間、NTA末端化基材と接触させた。スタンプを剥がした後、Ni(II)プリントされた基材を、30分間、100 nMのHis-T7 RNAPと共にds-DNA、プロモーターおよびストレプトアビジン・ビオチン結合を介して結び付けられた磁気タグを含む約200μLの25 mM Tris-HCl緩衝液(pH 7.5)中でインキュベートし、次いで過剰なタンパク質を除去するために10 mM Tris-HCl緩衝液(pH 8.0)およびMilli−Q水ですすいだ。
2.8ミクロンのSAコンジュゲートビーズ(Dynal)および1.0ミクロンのビオチニル化ビーズをPBSで希釈し(それぞれ、1:20および1:200)、室温で15分間混合した。以前に記載されたようにしてカバースリップをNi2+-NTA HRPコンジュゲート(Qiagen)でコーティングし、そしてカバースリップをわずかに離して整列させることによってフローチャンバーを構築した(Noji et al., 1997, Nature, 386: 299-302を参照のこと)。
転写による配列決定のためのDNA鋳型は、T7プロモーターを保有する4.6 kbファージT7 DNAフラグメントとラムダDNAの0.5 kbビオチニル化フラグメントを1つに接合することによって調製した。4.6 kbフラグメントは、#T7pPK13フォワードプライマーおよび3'末端にXbaI認識部位を含む#T7phi17REVプライマーを用いるPCRによって作製した。0.5 kb PCRフラグメントは、ビオチン-16-dUTP(Roche)の存在下で#F3および#R3プライマーを用いるPCRによって作製した。PCRが完了した後、精製されたPCR産物をNheIで消化し、そしてQIAquick PCR Purification Kit(Qiagen)で清浄化した。
下線はT7プロモーター配列であり、太字のGは+1であり、太字のCは+20位の休止部位である);
Xba部位を含む);
5'末端にNheI制限部位を含む);および
。
PEG-Cu++官能化ガラススライド(MicroSurfaces, Inc)を、緩衝液B + 1% BSAによって不動態化させた。
Claims (61)
- ポリメラーゼと標的核酸分子を配列決定条件下で接触させる工程であって、配列決定条件が少なくとも1つのヌクレオシド三リン酸の存在を含み、ポリメラーゼが固体基材に固定されている、工程;
ナノ構造を貫通する(through)、ナノ構造上での(on)またはナノ構造の上方での(over)標的核酸分子および/または1つもしくは複数の新生鎖の移動を検出する工程;
前記接触させる工程および前記検出する工程を複数回繰り返す工程;ならびに
少なくとも1つのヌクレオシド三リン酸の存在下での前記移動の変化の存在または非存在に連続的に基づき標的核酸分子の配列を決定する工程
を含む、標的核酸分子の配列を決定する方法。 - 配列決定条件が、単一のヌクレオシド三リン酸の存在を含む、請求項1記載の方法。
- 配列決定条件が、4つのヌクレオシド三リン酸の存在を含み、4つのヌクレオシド三リン酸のうちの第1のヌクレオシド三リン酸が律速量で存在する、請求項1記載の方法。
- 固体基材がガラスである、請求項1記載の方法。
- ポリメラーゼが、RNAポリメラーゼである、請求項1記載の方法。
- RNAポリメラーゼが、バクテリオファージRNAポリメラーゼおよび細菌RNAポリメラーゼからなる群より選択される、請求項5記載の方法。
- バクテリオファージRNAポリメラーゼが、T7 RNAポリメラーゼおよびT3 RNAポリメラーゼからなる群より選択される、請求項6記載の方法。
- 細菌RNAポリメラーゼが、大腸菌(E.coli)RNAポリメラーゼである、請求項6記載の方法。
- ポリメラーゼが、DNAポリメラーゼである、請求項1記載の方法。
- DNAポリメラーゼが、phi29、T7 DNAポリメラーゼ、枯草菌(Bacillus subtilis)DNAポリメラーゼおよびTaq DNAポリメラーゼからなる群より選択される、請求項9記載の方法。
- ポリメラーゼが、Hisタグを介して固体表面に固定される、請求項1記載の方法。
- ポリメラーゼが、1つまたは複数のビオチン-ストレプトアビジン結合を介して固体表面に固定される、請求項1記載の方法。
- 標的核酸分子が、真核生物性である、請求項1記載の方法。
- 標的核酸分子が、二本鎖である、請求項1記載の方法。
- 標的核酸分子が、一本鎖である、請求項1記載の方法。
- 標的核酸分子が、生物学的試料中に含まれる、請求項1記載の方法。
- 標的核酸分子が、ポリメラーゼプロモーター配列を含む、請求項1記載の方法。
- 標的核酸分子が、磁気タグをさらに含む、請求項1記載の方法。
- ナノ構造が、ナノ細孔、ナノチューブおよびナノワイヤからなる群より選択される、請求項1記載の方法。
- ナノ構造が、生物学的ナノ構造、ソリッドステートナノ構造またはそれらの組み合わせからなる群より選択される、請求項1記載の方法。
- 検出する工程が、ナノ構造の電流の変化の測定を含む、請求項1記載の方法。
- 検出する工程が、ナノ構造のイオン伝導の変化の測定を含む、請求項1記載の方法。
- 検出する工程が、CMOSベースの人工ナノ構造および電子機器上での移動の捕捉をさらに含む、請求項1記載の方法。
- 標的核酸分子に有向性の力を適用する工程をさらに含む、請求項1記載の方法。
- 有向性の力が、磁石によって生成される、請求項24記載の方法。
- 有向性の力が、流動または圧によって生成される、請求項24記載の方法。
- ポリメラーゼがその上に固定された固体基材を提供する工程;
ポリメラーゼと標的核酸分子を第1の配列決定条件下で接触させる工程であって、第1の配列決定条件が4つのヌクレオシド三リン酸の存在を含み、4つのヌクレオシド三リン酸のうちの第1のヌクレオシド三リン酸が律速量で存在する、工程;
第1の配列決定条件下での、ナノ構造を貫通する、ナノ構造上でのまたはナノ構造の上方での標的核酸分子および/または1つもしくは複数の新生鎖の移動を検出する工程;ならびに
前記移動の変化に基づき標的核酸分子に沿った第1のヌクレオシド三リン酸の位置情報を決定する工程
を含む、標的核酸分子の配列を決定する方法。 - ポリメラーゼがその上に固定された固体基材を提供する工程;
ポリメラーゼと標的核酸分子を第2の配列決定条件下で接触させる工程であって、第2の配列決定条件が4つのヌクレオシド三リン酸の存在を含み、4つのヌクレオシド三リン酸のうちの第2のヌクレオシド三リン酸が律速量で存在する、工程;
第2の配列決定条件下での、ナノ構造を貫通する、ナノ構造上でのまたはナノ構造の上方での標的核酸分子および/または1つもしくは複数の新生鎖の移動を検出する工程;ならびに
前記移動の変化に基づき標的核酸分子に沿った第2のヌクレオシド三リン酸の位置情報を決定する工程
をさらに含む、請求項27記載の方法。 - 第2の配列決定条件下での接触させる工程および検出する工程が、第1の配列決定条件下での接触させる工程および検出する工程と同時に行われる、請求項28記載の方法。
- 第2の配列決定条件下での接触させる工程および検出する工程が、第1の配列決定条件下での接触させる工程および検出する工程の前または後に順に実施される、請求項28記載の方法。
- ポリメラーゼがその上に固定された固体基材を提供する工程;
ポリメラーゼと標的核酸分子を第3の配列決定条件下で接触させる工程であって、第3の配列決定条件が4つのヌクレオシド三リン酸の存在を含み、4つのヌクレオシド三リン酸のうちの第3のヌクレオシド三リン酸が律速量で存在する、工程;
第3の配列決定条件下での、ナノ構造を貫通する、ナノ構造上でのまたはナノ構造の上方での標的核酸分子および/または1つもしくは複数の新生鎖の移動を検出する工程;ならびに
前記移動の変化に基づき標的核酸分子に沿った第3のヌクレオシド三リン酸の位置情報を決定する工程
をさらに含む、請求項28記載の方法。 - 標的核酸分子内での第1、第2および第3のヌクレオシド三リン酸の位置情報から標的核酸分子の配列を決定する工程
をさらに含む、請求項31記載の方法。 - ポリメラーゼがその上に固定された固体基材を提供する工程;
ポリメラーゼと標的核酸分子を第4の配列決定条件下で接触させる工程であって、第4の配列決定条件が4つのヌクレオシド三リン酸の存在を含み、4つのヌクレオシド三リン酸のうちの第4のヌクレオシド三リン酸が律速量で存在する、工程;
第4の配列決定条件下での標的核酸分子および/または1つもしくは複数の新生鎖の移動を検出する工程;ならびに
前記移動の変化に基づき標的核酸分子に沿った第4のヌクレオシド三リン酸の位置情報を決定する工程
をさらに含む、請求項31記載の方法。 - 1つまたは複数のポリメラーゼがその上に固定された固体基材を提供する工程;
1つまたは複数のポリメラーゼと標的核酸分子を第1の配列決定条件下で接触させる工程であって、第1の配列決定条件が4つのヌクレオシド三リン酸のうちの第1のヌクレオシド三リン酸の存在を含む、工程;
第1の配列決定条件下で、ナノ構造を貫通する、ナノ構造上でのまたはナノ構造の上方での標的核酸分子および/または1つもしくは複数の新生鎖の移動の変化が起こるかどうかを検出する工程であって、
前記移動の変化が起こる場合、方法は、前記接触させる工程およびそれ以降の工程を第1の配列決定条件下で繰り返す工程をさらに含み、
前記移動の変化が起こらない場合、方法は、前記接触させる工程およびそれ以降の工程を第2の配列決定条件下で繰り返す工程をさらに含み、第2の配列決定条件は、4つのヌクレオシド三リン酸のうちの第2のヌクレオシド三リン酸の存在を含み、
ここで、前記移動の変化が起こる場合、方法は、前記接触させる工程およびそれ以降の工程を第1の配列決定条件で繰り返す工程をさらに含み、
前記移動の変化が起こらない場合、方法は、前記接触させる工程およびそれ以降の工程を第3の配列決定条件下で繰り返す工程をさらに含み、第3の配列決定条件は、4つのヌクレオシド三リン酸のうちの第3のヌクレオシド三リン酸の存在を含む、工程;ならびに
第1、第2または第3の配列決定条件下での移動の変化の発生に連続的に基づき標的核酸分子の配列を決定する工程
を含む、標的核酸分子の配列を決定する方法。 - 複数のポリメラーゼがその上に固定されている固体基材であって、複数のナノ構造を含む、固体基材
を含む、製造物品。 - 固体基材が銅およびPEGでコーティングされている、請求項35記載の製造物品。
- 固体基材がニッケルおよびPEGでコーティングされている、請求項35記載の製造物品。
- 固体基材がNi-NTAでコーティングされている、請求項35記載の製造物品。
- 固体基材がCMOSまたはCCDである、請求項35記載の製造物品。
- 複数のポリメラーゼが、RNAポリメラーゼ、DNAポリメラーゼまたはそれらの組み合わせを含む、請求項35記載の製造物品。
- ポリメラーゼプロモーター配列をさらに含む、請求項35記載の製造物品。
- ビオチニル化核酸係留配列をさらに含む、請求項35記載の製造物品。
- 1つまたは複数のヌクレオシド三リン酸をさらに含む、請求項35記載の製造物品。
- ナノ構造が、ナノ細孔、ナノチューブおよびナノワイヤからなる群より選択される、請求項35記載の製造物品。
- ナノ構造を貫通する、ナノ構造上でのまたはナノ構造の上方での標的核酸分子および/または1つもしくは複数の新生鎖の移動を同定する;
前記移動およびヌクレオシド三リン酸の存在に基づき標的核酸分子の配列をコンパイルする;または
有向性の力を適用する
ための説明書をさらに含む、請求項35記載の製造物品。 - 説明書が電子形態で提供される、請求項45記載の製造物品。
- その上に固定された複数のポリメラーゼおよび複数のナノ構造を含む固体基材を受け入れるための収容構造と、
固体表面に固定された複数のポリメラーゼによって重合される標的核酸分子に張力を適用するのに十分でありかつそのような方向に向けられている有向性の力を提供するための供給源と、
ナノ構造の電流/イオン伝導の変化を決定するための手段と
を含む配列決定モジュール
を含む、標的核酸分子の単一塩基配列決定のための装置。 - コンピュータープロセッサをさらに含む、請求項47記載の装置。
- 核酸の配列決定に関係する試薬および緩衝液を収容および輸送するための流体工学手段(fluidics)
をさらに含む、請求項47記載の装置。 - 試薬が、ヌクレオシド三リン酸からなる群より選択される、請求項49記載の装置。
- 緩衝液が、洗浄緩衝液、酵素結合緩衝液および配列決定緩衝液からなる群より選択される、請求項49記載の装置。
- 有向性の力を提供するための供給源が磁石を含む、請求項47記載の装置。
- 有向性の力を提供するための供給源が液体の流動を含む、請求項47記載の装置。
- 生物学的試料を受け入れるための収容構造と、
配列決定する核酸の単離および調製に関係する試薬および緩衝液を収容および輸送するための流体工学手段と
を含む試料調製モジュール
をさらに含む、請求項47記載の装置。 - 試薬が、細胞溶解試薬および切断酵素からなる群より選択される、請求項54記載の装置。
- 緩衝液が、溶解緩衝液および洗浄緩衝液からなる群より選択される、請求項54記載の装置。
- ポリメラーゼプロモーター配列を核酸分子に結び付けるのに関係する試薬および緩衝液を収容および輸送するための流体工学手段を含む、鋳型仕上げモジュール
をさらに含む、請求項54記載の装置。 - 試薬が、リガーゼ酵素、分子モーター結合配列および係留手段(tether)からなる群より選択される、請求項57記載の装置。
- 緩衝液が、リガーゼ緩衝液、磁気タグ結合緩衝液および酵素結合緩衝液からなる群より選択される、請求項57記載の装置。
- 標的核酸分子の第1位置に関して第1データを受け取る工程であって、第1データが、ナノ構造を貫通する、ナノ構造上でのもしくはナノ構造の上方での標的核酸分子および/もしくは1つもしくは複数の新生鎖の移動の存在もしくは不存在ならびに/またはナノ構造を貫通する、ナノ構造上でのもしくはナノ構造の上方での前記鎖の移動速度を示す、工程;
標的核酸分子の第1位置に関して第2データを受け取る工程であって、第2データが、重合時に利用可能な1つまたは複数のヌクレオシド三リン酸の存在および/または量を示す、工程;
標的核酸分子の第2位置に関して別の第1データおよび別の第2データを受け取る工程;
標的核酸分子の第3位置に関してさらに別の第1データおよびさらに別の第2データを受け取る工程;
第1データを受け取る工程および第2データを受け取る工程を、標的核酸分子の第4位置およびそれ以降の位置に関して繰り返す工程;ならびに
各位置に関して受け取った第1データおよび第2データに基づき標的核酸分子の配列を決定する工程
を含む、標的核酸分子の重合時に得られるデータに基づき標的核酸分子の配列を決定する方法。 - 第1データおよび第2データが、示された位置のヌクレオチドとして記録される、請求項60記載の方法。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201361766925P | 2013-02-20 | 2013-02-20 | |
| US61/766,925 | 2013-02-20 | ||
| PCT/US2014/017419 WO2014130686A2 (en) | 2013-02-20 | 2014-02-20 | Methods and compositions for nanostructure-based nucleic acid sequencing |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2016507249A true JP2016507249A (ja) | 2016-03-10 |
| JP2016507249A5 JP2016507249A5 (ja) | 2017-03-16 |
Family
ID=51351616
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2015558959A Pending JP2016507249A (ja) | 2013-02-20 | 2014-02-20 | ナノ構造ベースの核酸配列決定のための方法および組成物 |
Country Status (10)
| Country | Link |
|---|---|
| US (2) | US9725763B2 (ja) |
| EP (1) | EP2958927A4 (ja) |
| JP (1) | JP2016507249A (ja) |
| KR (1) | KR20150119353A (ja) |
| CN (1) | CN105308062A (ja) |
| AU (1) | AU2014218911B2 (ja) |
| CA (1) | CA2900921A1 (ja) |
| HK (1) | HK1221227A1 (ja) |
| RU (1) | RU2015139609A (ja) |
| WO (1) | WO2014130686A2 (ja) |
Families Citing this family (14)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP6480183B2 (ja) | 2011-05-27 | 2019-03-06 | オックスフォード ナノポール テクノロジーズ リミテッド | 結合方法 |
| WO2014182630A1 (en) | 2013-05-06 | 2014-11-13 | Pacific Biosciences Of California , Inc. | Real-time electronic sequencing |
| GB201406155D0 (en) | 2014-04-04 | 2014-05-21 | Oxford Nanopore Tech Ltd | Method |
| WO2015150786A1 (en) | 2014-04-04 | 2015-10-08 | Oxford Nanopore Technologies Limited | Method for characterising a double stranded nucleic acid using a nano-pore and anchor molecules at both ends of said nucleic acid |
| GB201418469D0 (en) * | 2014-10-17 | 2014-12-03 | Oxford Nanopore Tech Ltd | Method |
| WO2017024049A1 (en) | 2015-08-06 | 2017-02-09 | Pacific Biosciences Of California, Inc. | Single-molecule nanofet sequencing systems and methods |
| CN105170209B (zh) * | 2015-10-15 | 2017-05-10 | 华中科技大学 | 一种表面图案化修饰的基片及其制备方法 |
| US11624725B2 (en) * | 2016-01-28 | 2023-04-11 | Roswell Blotechnologies, Inc. | Methods and apparatus for measuring analytes using polymerase in large scale molecular electronics sensor arrays |
| WO2018026141A1 (ko) * | 2016-08-04 | 2018-02-08 | 주식회사 옵티팜 | 퀀타매트릭스 어세이 플랫폼 기반 결핵 및 비결핵 항산균의 검출 및 동정과 결핵균의 리팜핀 내성여부를 동시 확인할 수 있는 진단법 및 그 키트 |
| CN110520517A (zh) * | 2017-01-19 | 2019-11-29 | 罗斯威尔生命技术公司 | 包括二维层材料的固态测序装置 |
| JP6559814B2 (ja) * | 2018-01-26 | 2019-08-14 | 株式会社日立ハイテクノロジーズ | 生体分子測定方法 |
| CN112673087A (zh) * | 2019-06-18 | 2021-04-16 | 伊鲁米纳公司 | 聚合酶至导电通道的附接 |
| CN110452817A (zh) * | 2019-07-08 | 2019-11-15 | 广东工业大学 | 一种dna测序装置及测序方法 |
| CN111455034B (zh) * | 2020-04-09 | 2024-04-09 | 苏州罗岛纳米科技有限公司 | 一种基于固态纳米孔机构的单分子检测方法和系统 |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2012083249A2 (en) * | 2010-12-17 | 2012-06-21 | The Trustees Of Columbia University In The City Of New York | Dna sequencing by synthesis using modified nucleotides and nanopore detection |
| WO2012164270A1 (en) * | 2011-05-27 | 2012-12-06 | Oxford Nanopore Technologies Limited | Coupling method |
Family Cites Families (25)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5693489A (en) | 1984-03-30 | 1997-12-02 | Associated Universities, Inc. | Cloning and expression of the gene for bacteriophage T7 RNA polymerase |
| US5795782A (en) * | 1995-03-17 | 1998-08-18 | President & Fellows Of Harvard College | Characterization of individual polymer molecules based on monomer-interface interactions |
| US20020172953A1 (en) * | 1996-07-29 | 2002-11-21 | Mirkin Chad A. | Movement of biomolecule-coated nanoparticles in an electric field |
| DE69930310T3 (de) | 1998-12-14 | 2009-12-17 | Pacific Biosciences of California, Inc. (n. d. Ges. d. Staates Delaware), Menlo Park | Kit und methode zur nukleinsäuresequenzierung einzelner moleküle durch polymerase synthese |
| US6529240B2 (en) | 1999-11-18 | 2003-03-04 | Agilent Technologies, Inc. | Random access memory integrated with CMOS sensors |
| US7238477B2 (en) * | 2001-09-24 | 2007-07-03 | Intel Corporation | Methods to increase nucleotide signals by Raman scattering |
| ATE432365T1 (de) * | 2003-02-21 | 2009-06-15 | Geneform Technologies Ltd | Verfahren, kits und reagenzien zur nukleinsäuresequenzierung |
| US20070077575A1 (en) | 2004-03-05 | 2007-04-05 | Mcallister William T | Use of rna polymerase as an information-dependent molecular motor |
| US7238485B2 (en) * | 2004-03-23 | 2007-07-03 | President And Fellows Of Harvard College | Methods and apparatus for characterizing polynucleotides |
| US7556922B2 (en) | 2006-03-23 | 2009-07-07 | The Board Of Trustees Of The Leland Stanford Junior University | Motion resolved molecular sequencing |
| US20110005918A1 (en) * | 2007-04-04 | 2011-01-13 | Akeson Mark A | Compositions, devices, systems, and methods for using a nanopore |
| WO2008124706A2 (en) * | 2007-04-06 | 2008-10-16 | Arizona Board Of Regents Acting For And On Behalf Of Arizona State University | Devices and methods for target molecule characterization |
| WO2009073201A2 (en) | 2007-12-04 | 2009-06-11 | Pacific Biosciences Of California, Inc. | Alternate labeling strategies for single molecule sequencing |
| US8815576B2 (en) | 2007-12-27 | 2014-08-26 | Lawrence Livermore National Security, Llc. | Chip-based sequencing nucleic acids |
| WO2009117522A2 (en) * | 2008-03-18 | 2009-09-24 | Reinhart, Kevin | Nanopore and carbon nanotube based dna sequencer and a serial recognition sequencer |
| US8603792B2 (en) * | 2009-03-27 | 2013-12-10 | Life Technologies Corporation | Conjugates of biomolecules to nanoparticles |
| US9017937B1 (en) * | 2009-04-10 | 2015-04-28 | Pacific Biosciences Of California, Inc. | Nanopore sequencing using ratiometric impedance |
| EP4268944A3 (en) * | 2010-02-23 | 2024-03-20 | University of Washington | Analyte sequencing with nanopores |
| US20140051068A1 (en) * | 2010-09-07 | 2014-02-20 | The Regents Of The University Of California | Control of dna movement in a nanopore at one nucleotide precision by a processive enzyme |
| CN103534357B (zh) * | 2011-02-23 | 2016-05-18 | 伊芙生物医学股份有限公司 | 旋转依赖性转录测序系统及使用方法 |
| AU2012288629B2 (en) * | 2011-07-25 | 2017-02-02 | Oxford Nanopore Technologies Limited | Hairpin loop method for double strand polynucleotide sequencing using transmembrane pores |
| US9164053B2 (en) * | 2011-09-26 | 2015-10-20 | The Regents Of The University Of California | Electronic device for monitoring single molecule dynamics |
| WO2013096692A1 (en) * | 2011-12-21 | 2013-06-27 | Illumina, Inc. | Apparatus and methods for kinetic analysis and determination of nucleic acid sequences |
| WO2013185137A1 (en) * | 2012-06-08 | 2013-12-12 | Pacific Biosciences Of California, Inc. | Modified base detection with nanopore sequencing |
| US20140147833A1 (en) * | 2012-11-28 | 2014-05-29 | International Business Machines Corporation | Base recognition based on the conformation change of a motor molecule |
-
2014
- 2014-02-20 RU RU2015139609A patent/RU2015139609A/ru not_active Application Discontinuation
- 2014-02-20 EP EP14754640.2A patent/EP2958927A4/en not_active Withdrawn
- 2014-02-20 CA CA2900921A patent/CA2900921A1/en not_active Abandoned
- 2014-02-20 AU AU2014218911A patent/AU2014218911B2/en not_active Ceased
- 2014-02-20 US US14/185,469 patent/US9725763B2/en active Active
- 2014-02-20 WO PCT/US2014/017419 patent/WO2014130686A2/en active Application Filing
- 2014-02-20 KR KR1020157025411A patent/KR20150119353A/ko not_active Application Discontinuation
- 2014-02-20 CN CN201480022008.6A patent/CN105308062A/zh active Pending
- 2014-02-20 JP JP2015558959A patent/JP2016507249A/ja active Pending
-
2016
- 2016-08-03 HK HK16109275.9A patent/HK1221227A1/zh unknown
-
2017
- 2017-08-02 US US15/666,671 patent/US20180010181A1/en not_active Abandoned
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2012083249A2 (en) * | 2010-12-17 | 2012-06-21 | The Trustees Of Columbia University In The City Of New York | Dna sequencing by synthesis using modified nucleotides and nanopore detection |
| WO2012164270A1 (en) * | 2011-05-27 | 2012-12-06 | Oxford Nanopore Technologies Limited | Coupling method |
Also Published As
| Publication number | Publication date |
|---|---|
| WO2014130686A3 (en) | 2014-10-09 |
| KR20150119353A (ko) | 2015-10-23 |
| WO2014130686A2 (en) | 2014-08-28 |
| US9725763B2 (en) | 2017-08-08 |
| EP2958927A4 (en) | 2016-09-14 |
| HK1221227A1 (zh) | 2017-05-26 |
| US20140235462A1 (en) | 2014-08-21 |
| RU2015139609A (ru) | 2017-03-24 |
| EP2958927A2 (en) | 2015-12-30 |
| AU2014218911B2 (en) | 2018-07-12 |
| CN105308062A (zh) | 2016-02-03 |
| US20180010181A1 (en) | 2018-01-11 |
| AU2014218911A1 (en) | 2015-08-27 |
| CA2900921A1 (en) | 2014-08-28 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| AU2014218911B2 (en) | Methods and compositions for nanostructure-based nucleic acid sequencing | |
| US20230084931A1 (en) | Methods and systems for characterizing analytes using nanopores | |
| CN107109489B (zh) | 纳米孔rna表征方法 | |
| JP6018092B2 (ja) | 回転依存転写配列決定システムおよび使用方法 | |
| EP3464624B1 (en) | Method of nanopore sequencing of concatenated nucleic acids | |
| CN105705656B (zh) | 方法 | |
| JP2021040646A (ja) | ポリヌクレオチド配列決定のための組成物及び方法 | |
| US11920193B2 (en) | Method of characterizing a polynucleotide | |
| JP6325027B2 (ja) | ハイブリダイゼーションによるdna配列決定法 | |
| JP2017503517A (ja) | 1つまたは複数のポリヌクレオチド結合タンパク質を標的ポリヌクレオチドに付着させる方法 | |
| Myllykangas et al. | Overview of sequencing technology platforms | |
| CN116334198A (zh) | 分析物的测定和表征方法及试剂盒 | |
| CN109196116A (zh) | 方法 | |
| JP2015516814A (ja) | 標的化されたdnaの濃縮および配列決定 | |
| JP2022513574A (ja) | ポリヌクレオチドを配列決定する方法 | |
| CN116323974A (zh) | 多路复用covid-19锁式测定 | |
| JP2022533916A (ja) | 自家発光に基づく単一チャネルシーケンシング法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20151023 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20170203 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20170203 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20180129 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20180423 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20180912 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20181211 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20190508 |