JP2016136102A - バイオセンサ、及びその製造方法 - Google Patents
バイオセンサ、及びその製造方法 Download PDFInfo
- Publication number
- JP2016136102A JP2016136102A JP2015011168A JP2015011168A JP2016136102A JP 2016136102 A JP2016136102 A JP 2016136102A JP 2015011168 A JP2015011168 A JP 2015011168A JP 2015011168 A JP2015011168 A JP 2015011168A JP 2016136102 A JP2016136102 A JP 2016136102A
- Authority
- JP
- Japan
- Prior art keywords
- intermediate layer
- hydroxyapatite
- biosensor
- electrode
- film
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Granted
Links
Images
Landscapes
- Investigating Or Analyzing Materials By The Use Of Electric Means (AREA)
- Piezo-Electric Or Mechanical Vibrators, Or Delay Or Filter Circuits (AREA)
Abstract
【解決手段】水晶振動子上に金からなる電極を有し、電極上に吸着された対象物の質量を測定するバイオセンサであって、電極の表面上にチタンを含む第1の中間層と、第1の中間層上にチタンがドープされたハイドロキシアパタイトから第2の中間層と、第2の中間層上に結晶化されたハイドロキシアパタイト膜とを備えることを特徴とする。
【選択図】図1
Description
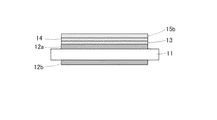
まず、図1(a)に示すように、バイオセンサ10を準備する。バイオセンサ10は、水晶振動子11の上に金からなる電極12を有し、電極12に吸着された測定対象物の質量を水晶振動子11の共振周波数の変化により測定するQCM型バイオセンサである。なお、電極12としては、金のほかに、白金やチタンなども用いることができるが、十分なセンサ精度を確保するには金を用いることが好ましい。
次に、図1(b)に示すように、バイオセンサ10の電極12の表面に第1の中間層13を形成する。第1の中間層13はチタンを含むため、金からなる電極12と安定的に結合する。なお、第1の中間層13は測定対象物を吸着させたい側の電極12にのみ形成すればよい。
次に、図1(c)に示すように、第1の中間層13上に第2の中間層14を形成する。第2の中間層14はチタンがドープされたハイドロキシアパタイトからなり、第1の中間層14とハイドロキシアパタイト膜との密着性を向上させる。
次に、図1(d)に示すように、第2の中間層14の上に、ハイドロキシアパタイト膜15aを形成する。なお、第1の中間層13や第2の中間層14がむき出しになると、第1の中間層13や第2の中間層14に測定対象物が吸着しセンサ精度が悪化する恐れがあるため、第1の中間層13上の略すべてに第2の中間層14が形成され、第2の中間層14上の略すべてにハイドロキシアパタイト膜15aが形成されることが好ましい。
・RFスパッタリング法
・スパッタリング圧力:0.06Pa
・スパッタリング電力:300W
上記条件によれば、成膜レート6.7nm/minでハイドロキシアパタイト膜15aを成膜することができた。
次に、図1(d)に示すように、第2の中間層14上に形成されたハイドロキシアパタイト膜15aを結晶化させる。結晶化の方法としては、水熱処理や電気炉による加熱等が挙げられる。この結晶化工程により、それまでアモルファス(非晶質)状態だったハイドロキシアパタイトが結晶化される。ハイドロキシアパタイト膜を結晶化させると表面が帯電するため、測定対象物を吸着しやすくなる。このようにして、結晶化されたハイドロキシアパタイト膜15bにより電極12表面がコーティングされたバイオセンサ20を得ることができる。なお、電気炉による加熱で結晶化させるとバイオセンサが不安定になり十分な精度が得られない可能性があるため、水熱処理による結晶化が望ましい。
上述の製造方法により製造されたバイオセンサ20による対象物の質量測定方法について、図3を用いて説明する。
[式1] Sauerbreyの式
ΔF:共振周波数変化量
F:水晶振動子の固有周波数
A:電極の表面積
Δm:電極表面の質量変化量
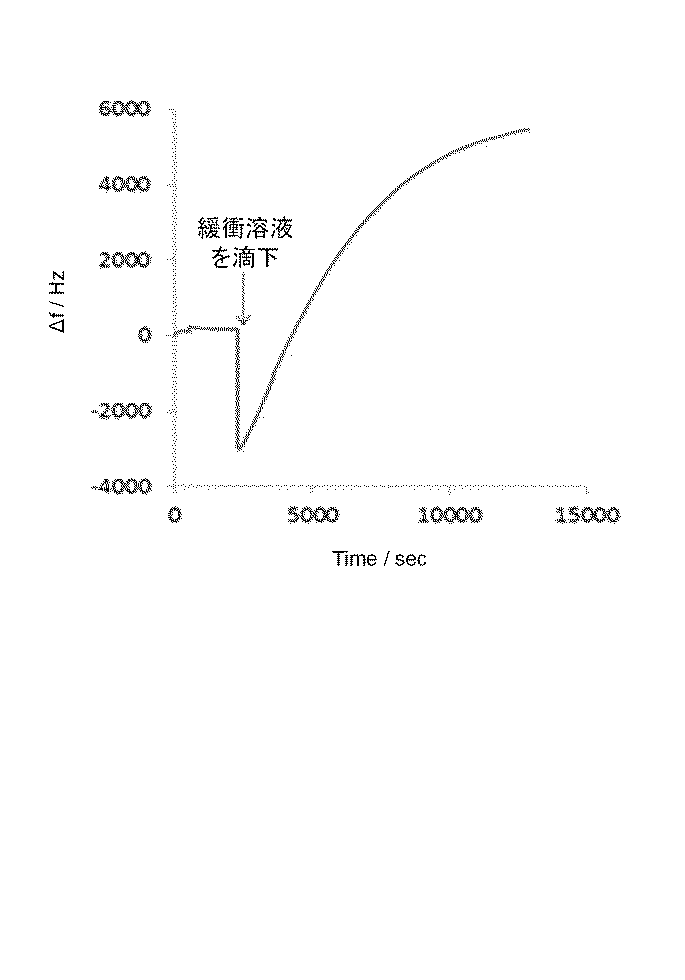
本実験例では、金からなる電極上に、チタンからなる第1の中間層、及びチタンがドープされたハイドロキシアパタイトからなる第2の中間層を介してハイドロキシアパタイト膜が形成されたバイオセンサを製作し、その性能を検証した。その結果を図4に示す。
なお、比較例として、金からなる電極上に、酸化亜鉛からなる中間層を介してハイドロキシアパタイト膜が形成されたバイオセンサを製作し、その性能を検証した。その結果を図5に示す。なお、酸化亜鉛からなる中間層、及びハイドロキシアパタイト膜は、いずれもスパッタリング法により形成した。
11 水晶振動子
12(12a,12b) 電極
13 第1の中間層
14 第2の中間層
15a ハイドロキシアパタイト膜(アモルファス状態)
15b ハイドロキシアパタイト膜(結晶状態)
Claims (11)
- 水晶振動子上に金からなる電極を有し、前記電極上に吸着された対象物の質量を測定するバイオセンサであって、
前記電極の表面上に、チタンを含む第1の中間層と、
前記第1の中間層上に、チタンがドープされたハイドロキシアパタイトからなる第2の中間層と、
前記第2の中間層上に、結晶化されたハイドロキシアパタイト膜と、を備える
バイオセンサ。 - 前記ハイドロキシアパタイト膜の膜厚は200nm〜400nmである、
請求項1に記載のバイオセンサ。 - 前記第1の中間層の膜厚は40〜50nmである、
請求項1または2に記載のバイオセンサ。 - 前記第2の中間層の膜厚は20〜50nmである
請求項1〜3のいずれか1項に記載のバイオセンサ。 - 前記チタンがドープされたハイドロキシアパタイトにおけるチタン原子に対するカルシウム原子の割合は2.3〜2.5である
請求項1〜4のいずれか1項に記載のバイオセンサ。 - 水晶振動子上に金からなる電極を有し、前記電極上に吸着された対象物の質量を測定するバイオセンサを準備する工程と、
前記電極上に、チタンを含む第1の中間層を形成する工程と、
前記第1の中間層上に、チタンがドープされたハイドロキシアパタイトからなる第2の中間層を形成する工程と、
前記第2の中間層上に、ハイドロキシアパタイト膜を形成する工程と、
前記ハイドロキシアパタイト膜を結晶化させる工程と、を備える
バイオセンサの製造方法。 - 前記ハイドロキシアパタイト膜は、スパッタリング法により形成される、
請求項6に記載のバイオセンサの製造方法。 - 前記ハイドロキシアパタイト膜の膜厚は200nm〜400nmである、
請求項6または7に記載バイオセンサの製造方法。 - 前記第1の中間層の膜厚は40〜50nmである、
請求項6〜8のいずれか1項に記載のバイオセンサの製造方法。 - 前記第2の中間層の膜厚は20〜50nmである
請求項6〜9のいずれか1項に記載のバイオセンサの製造方法。 - 前記チタンがドープされたハイドロキシアパタイトにおけるチタン原子に対するカルシウム原子の割合は2.3〜2.5である
請求項6〜10のいずれか1項に記載のバイオセンサの製造方法。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2015011168A JP6280877B2 (ja) | 2015-01-23 | 2015-01-23 | バイオセンサ、及びその製造方法 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2015011168A JP6280877B2 (ja) | 2015-01-23 | 2015-01-23 | バイオセンサ、及びその製造方法 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2016136102A true JP2016136102A (ja) | 2016-07-28 |
| JP6280877B2 JP6280877B2 (ja) | 2018-02-14 |
Family
ID=56512093
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2015011168A Expired - Fee Related JP6280877B2 (ja) | 2015-01-23 | 2015-01-23 | バイオセンサ、及びその製造方法 |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP6280877B2 (ja) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2023145434A1 (ja) * | 2022-01-31 | 2023-08-03 | 太陽誘電株式会社 | 検出装置 |
Citations (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH0995787A (ja) * | 1995-09-20 | 1997-04-08 | Nitta Gelatin Inc | アパタイト−チタン系複合材料、その製造方法およびその複合材料用組成物 |
| JPH101375A (ja) * | 1996-06-13 | 1998-01-06 | Ngk Spark Plug Co Ltd | リン酸カルシウム系多孔質複合体及びその製造方法 |
| JPH11222607A (ja) * | 1997-12-03 | 1999-08-17 | Asahi Optical Co Ltd | セラミックスと金属との接合方法およびその接合体 |
| JP2001269357A (ja) * | 2000-03-27 | 2001-10-02 | Kyocera Corp | 生体インプラント材とその製法 |
| JP2004033589A (ja) * | 2002-07-05 | 2004-02-05 | Tama Tlo Kk | ヒドロキシアパタイト膜の作製方法 |
| WO2006025358A1 (ja) * | 2004-08-31 | 2006-03-09 | Japan Science And Technology Agency | 化学センサ装置用の検出子およびその利用 |
| JP2009150747A (ja) * | 2007-12-20 | 2009-07-09 | Fujitsu Ltd | 雰囲気分析用センサユニット、雰囲気分析装置、及び、雰囲気分析方法 |
| JP2014098607A (ja) * | 2012-11-14 | 2014-05-29 | Kinki Univ | 化学センサおよび化学センサの製造方法 |
| JP2016065726A (ja) * | 2014-09-22 | 2016-04-28 | 尾池工業株式会社 | バイオセンサ、及びその製造方法 |
-
2015
- 2015-01-23 JP JP2015011168A patent/JP6280877B2/ja not_active Expired - Fee Related
Patent Citations (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH0995787A (ja) * | 1995-09-20 | 1997-04-08 | Nitta Gelatin Inc | アパタイト−チタン系複合材料、その製造方法およびその複合材料用組成物 |
| JPH101375A (ja) * | 1996-06-13 | 1998-01-06 | Ngk Spark Plug Co Ltd | リン酸カルシウム系多孔質複合体及びその製造方法 |
| JPH11222607A (ja) * | 1997-12-03 | 1999-08-17 | Asahi Optical Co Ltd | セラミックスと金属との接合方法およびその接合体 |
| JP2001269357A (ja) * | 2000-03-27 | 2001-10-02 | Kyocera Corp | 生体インプラント材とその製法 |
| JP2004033589A (ja) * | 2002-07-05 | 2004-02-05 | Tama Tlo Kk | ヒドロキシアパタイト膜の作製方法 |
| WO2006025358A1 (ja) * | 2004-08-31 | 2006-03-09 | Japan Science And Technology Agency | 化学センサ装置用の検出子およびその利用 |
| JP2009150747A (ja) * | 2007-12-20 | 2009-07-09 | Fujitsu Ltd | 雰囲気分析用センサユニット、雰囲気分析装置、及び、雰囲気分析方法 |
| JP2014098607A (ja) * | 2012-11-14 | 2014-05-29 | Kinki Univ | 化学センサおよび化学センサの製造方法 |
| JP2016065726A (ja) * | 2014-09-22 | 2016-04-28 | 尾池工業株式会社 | バイオセンサ、及びその製造方法 |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2023145434A1 (ja) * | 2022-01-31 | 2023-08-03 | 太陽誘電株式会社 | 検出装置 |
Also Published As
| Publication number | Publication date |
|---|---|
| JP6280877B2 (ja) | 2018-02-14 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP4162094B2 (ja) | 常温接合によるデバイス、デバイス製造方法ならびに常温接合装置 | |
| US8496870B2 (en) | Lead-free piezoelectric ceramic films and a method for making thereof | |
| WO1995013100A1 (en) | Bone substitute material and process for producing the same | |
| JP6161164B2 (ja) | バイオセンサ、及びその製造方法 | |
| JP2013179162A (ja) | サーミスタ用金属窒化物材料及びその製造方法並びにフィルム型サーミスタセンサ | |
| JP6280877B2 (ja) | バイオセンサ、及びその製造方法 | |
| JP2014123647A (ja) | サーミスタ用金属窒化物材料及びその製造方法並びにフィルム型サーミスタセンサ | |
| Kusunoki et al. | Orientation control for a-axis or c-axis oriented crystal films of hydroxyapatite, and a possible growth mechanism derived from X-ray diffraction | |
| JP6062218B2 (ja) | 化学センサおよび化学センサの製造方法 | |
| US20130153924A1 (en) | Piezoelectric devices and methods for their preparation and use | |
| JP5940901B2 (ja) | 電極膜を有する素子の製造方法 | |
| Garcia-Gancedo et al. | ZnO-based FBAR resonators with carbon nanotube electrodes | |
| US8569864B2 (en) | Piezo-acoustic thin film resonator having a crystalline zinc oxide layer | |
| JP4328664B2 (ja) | 化学バイオセンサおよびその製造方法 | |
| JP6823187B2 (ja) | ガスセンサー、ガス検出装置及びガス検出方法 | |
| TW201122125A (en) | Method for preparing zirconium based metallic glass coated film using multi-independent targets and product thereof. | |
| TWI881623B (zh) | 具有生物壓電性之植入材、及其製備方法 | |
| JP4967343B2 (ja) | 圧電薄膜素子 | |
| JP2008181906A (ja) | 薄膜電極の製造方法 | |
| EP3276687B1 (en) | Ferroelectric thin-film laminate substrate, ferroelectric thin-film element, and manufacturing method of ferroelectric thin-film laminate substrate | |
| Mamun et al. | Nanomechanical properties of tungsten trioxide (WO3) grown by atomic layer deposition | |
| JP6804615B2 (ja) | 圧電膜を有する積層基板、圧電膜を有する素子および圧電膜を有する積層基板の製造方法 | |
| JP2024134527A (ja) | 圧電薄膜、及び圧電薄膜素子 | |
| CN118678867A (zh) | 压电薄膜及压电薄膜元件 | |
| JP6601614B2 (ja) | サーミスタ用金属窒化物材料及びその製造方法並びにフィルム型サーミスタセンサ |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20161013 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20170829 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20170831 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20170913 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20171226 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20180122 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6280877 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| LAPS | Cancellation because of no payment of annual fees |