JP2015508816A - Ox40アゴニスト/il−2二重癌治療法 - Google Patents
Ox40アゴニスト/il−2二重癌治療法 Download PDFInfo
- Publication number
- JP2015508816A JP2015508816A JP2014559875A JP2014559875A JP2015508816A JP 2015508816 A JP2015508816 A JP 2015508816A JP 2014559875 A JP2014559875 A JP 2014559875A JP 2014559875 A JP2014559875 A JP 2014559875A JP 2015508816 A JP2015508816 A JP 2015508816A
- Authority
- JP
- Japan
- Prior art keywords
- cells
- agonist
- tumor
- lymphocytes
- antigen
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/39558—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against tumor tissues, cells, antigens
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/19—Cytokines; Lymphokines; Interferons
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/177—Receptors; Cell surface antigens; Cell surface determinants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/19—Cytokines; Lymphokines; Interferons
- A61K38/20—Interleukins [IL]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/19—Cytokines; Lymphokines; Interferons
- A61K38/20—Interleukins [IL]
- A61K38/2013—IL-2
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/19—Cytokines; Lymphokines; Interferons
- A61K38/20—Interleukins [IL]
- A61K38/2026—IL-4
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/19—Cytokines; Lymphokines; Interferons
- A61K38/20—Interleukins [IL]
- A61K38/2046—IL-7
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/3955—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against proteinaceous materials, e.g. enzymes, hormones, lymphokines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/16—Drugs for disorders of the alimentary tract or the digestive system for liver or gallbladder disorders, e.g. hepatoprotective agents, cholagogues, litholytics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/08—Drugs for disorders of the urinary system of the prostate
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/12—Drugs for disorders of the urinary system of the kidneys
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/08—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/04—Antineoplastic agents specific for metastasis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/04—Immunostimulants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/24—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against cytokines, lymphokines or interferons
- C07K16/244—Interleukins [IL]
- C07K16/246—IL-2
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2875—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the NGF/TNF superfamily, e.g. CD70, CD95L, CD153, CD154
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/75—Agonist effect on antigen
Abstract
Description
古典的なB7-CD28共刺激経路に加えて、最近の研究は、OX40(CD134)、4-1BB(CD 137)、およびCD27を含めた腫瘍壊死因子受容体(TNFR)スーパーファミリーのメンバーが、CD4+およびCD8+T細胞応答を増進させ得ることを示している(Watts TH, Annu Rev Immunol 2005; 23: 23-68;Croft M, Nat Rev Immunol 2003; 3: 609-20;Redmond WL and Weinberg AD, Crit Rev Immunol 2007; 27: 415-36)。具体的には、本発明者らの研究室および他の研究室からの研究により、OX40ライゲーションは、CD4+およびCD8+T細胞分化、サイトカイン産生、メモリーT細胞の産出を増進することが実証されており、かつ制御性CD4+T細胞の産出および機能に影響を及ぼすことも示されている(Watts TH, Annu Rev Immunol 2005; 23: 23-68;Croft M, Annu Rev Immunol 2010; 28: 57-78;Redmond WL, et al. Crit Rev Immunol 2009; 29: 187-201)。前臨床試験により、アゴニスト抗OX40 mAb、OX40L-Ig融合タンパク質、またはOX40L発現APCを介したOX40のライゲーションは、様々な腫瘍に対する強固なT細胞介在性抗腫瘍免疫を推進し得ることが示されている(Watts TH, Annu Rev Immunol 2005; 23: 23-68;Redmond WL and Weinberg AD, Crit Rev Immunol 2007; 27: 415-36;Croft M, Annu Rev Immunol 2010; 28: 57-78)。これらおよび他のデータに基づき、癌を有する患者の治療のための、アゴニスト抗ヒトOX40 mAbを用いた第1相臨床試験が実施された。さらなる試験は、OX40標的療法と、化学療法または放射線療法などの他の治療様式とを組み合わせることの有効性を検証中である。
本開示は、OX40発現が、JAK3ならびにその下流標的である転写因子STAT3およびSTAT5の活性化に依存している、TCR/共通γcサイトカイン依存的二重シグナル伝達経路を介して推進されることを実証する。ある特定の局面において、本開示は、OX40アゴニストおよびIL-2を用いた併用療法が腫瘍退縮を増強し得ることをさらに実証する。他の局面において、本開示は、抗OX40/IL-2二重療法が、例えば長期間十分に確立された腫瘍を有するマウスにおいて、アネルギー性腫瘍反応性CD8 T細胞の機能をさらに回復させ得、生存率の増加をもたらすことを示す。本開示は、抗OX40/γcサイトカイン(例えば、IL-2)に向けられた併用療法が、癌を有する患者の治療のための、腫瘍免疫療法を改善し得、かつ腫瘍反応性CD8 T細胞の機能を復活させ得ることを示す。
I.定義
1つの(「a」または「an」)実体という用語は、その実体の1つまたは複数を指し;例えば「1つのOX40アゴニスト」は、1つまたは複数のOX40アゴニストを表すと理解されるということに留意すべきである。そのため、「1つ(「a」または「an」)」、「1つまたは複数」、および「少なくとも1つ」という用語は、本明細書において代替可能に用いられ得る。
OX40アゴニストは、抗原によるプライミングの間または直後に、CD4+T細胞上でOX40受容体と相互作用し、抗原に対するCD4+T細胞の応答の増大をもたらす。本開示の文脈において、「アゴニスト」という用語は、OX40受容体に結合し、かつOX40受容体によって仲介される少なくとも1種の活性を刺激する分子を指す。例えば、抗原特異的CD4+T細胞上でOX40受容体と相互作用するOX40アゴニストは、抗原のみに対する応答と比較して、T細胞増殖を増大させ得る。抗原に対する上昇した応答は、OX40アゴニストの非存在下において実質的により長い期間維持され得る。ゆえに、OX40アゴニストを介した刺激は、抗原、例えば腫瘍細胞のT細胞認識を強化することによって、抗原特異的免疫応答を増強する。OX40アゴニストは、参照によりそれらの全体として本明細書に組み入れられる、例えば米国特許第6,312,700号、第7.504,101号、第7,622,444号、および第7,959,925号に記載されている。
ある特定の局面において、癌を治療する方法を提供し、該方法は、インターロイキン-2または活性を有するその断片、変種、類似体、もしくは誘導体を伴うOX40アゴニストの投与を含む。インターロイキン-2(IL-2)は、他の作用の中でもとりわけ、T細胞の増殖および活性化を増強し得、かつ様々なサイトカインの分泌を誘導し得る(例えば、Bachmann, MF, and Oxenius, A. EMBO Rep 8: 1142-1148 (2007)を参照されたい)。IL-2療法(アルデスロイキン)は、転移性腎細胞癌腫および転移性黒色腫の治療に対してFDAによって認可されている。例えば、Jeal W Goa KL. BioDrugs. 1997 Apr;7(4):285-317を参照されたい。開発中の他のIL-2関連薬には、NK細胞を上回ってTリンパ球を選択的に標的とする高親和性IL-2類似体であるBAY 50-4798(Shanafelt A. et al., Nature Biotechnology 18, 1197-1202 (2000))、IL-2R選択的IL-2変異体であるEMD 521873(例えば、Gillies SD, et al., Clin Cancer Res. 17:3673-85 (2011)を参照されたい)、およびIL-2/抗IL-2抗体複合体(例えば、Letourneau S, et al., Proc Natl Acad Sci U S A. 107:2171-6 (2010)を参照されたい)が含まれるが、それらに限定されるわけではない。
癌を治療するための方法を本明細書において提供し、該方法は、他の癌治療と任意で組み合わせた、有効量のOX40アゴニスト、および有効量の共通γ鎖(γc)サイトカインまたは活性を有するその断片、変種、類似体、もしくは誘導体の投与を含む。OX40の活性化は、Tリンパ球の抗原刺激に呼応して機能を果たす一方で、それ自体は抗原または細胞特異的ではないため、OX40アゴニストの投与は、様々な癌細胞上の抗原に対するTリンパ球応答の増強をもたらす。共通γ鎖(γc)サイトカインまたは活性を有するその断片、変種、類似体、もしくは誘導体との共投与は、OX40発現を増強する。
マウス
野生型およびCD25+/- CD57BL/6マウスをJackson Labs (Bar Harbor, ME)から購入した。OT-I Thy1.1 TCR Tg、(前立腺オボアルブミンを発現するトランスジェニック)POET-1 Tg、OX40-/- OT-I TCR Tg、およびSTAT5a/b+/- マウスを、それぞれDr. Charles Surh (The Scripps Research Institute, La Jolla, CA)、Dr. Timothy Ratliff (Purdue University, West Lafayette, IN)、Dr. Michael Croft (La Jolla Institute for Allergy and Immunology, La Jolla, CA)、およびDr. Brad Nelson (BC Cancer Agency, Victoria, BC, Canada)から入手した。C57BL/6 OX40-CreマウスをDr. Nigel Killeen (UCSF, San Francisco, CA)から入手し、Rosa26-loxP-STOP-loxP-YFP対立遺伝子を保有しているマウス(Srinivas S, et al. BMC Dev Biol 2001; 1: 4)と交配した。STAT3-/- OT-I TCR Tgマウス由来の脾細胞を、Dr. Hua Yu (City of HopeのBeckman Research Institute, Duarte, CA)から入手した。すべてのマウスを、Providence Portland Medical Center動物施設において特定病原体を含まない条件下で繁殖させかつ維持した。アメリカ国立衛生研究所の実験動物の管理と使用に関する指針(Guide for the Care and Use of Laboratory Animals)に従って、実験手順を実施した。
OT-I Thy1.1 TCR Tgマウスのリンパ節および脾臓から、単一細胞懸濁物を調製した。Dynal マウスCD8細胞陰性単離キット(Invitrogen, Carlsbad, CA)を用いて、細胞懸濁物からCD4+、CD11b+、CD45R+、DX5+、およびTer-119+細胞を欠失させた。OT-I T細胞は、メーカーの指示どおり陰性選択によって精製され、フローサイトメトリーによって示される(データ示さず)ナイーブ表現型(CD25陰性、CD44低、CD62L高、およびCD69陰性)を有した。200μlのPBS中のドナーOT-I T細胞を、レシピエントマウスに静脈内(i.v.)注射した。
リンパ節を摘出しかつ処理して、単一細胞懸濁物を得た。ACK溶解バッファー(Lonza, Walkersville, MD)を室温で5分間添加して、赤血球を溶解した。次いで、1M HEPES、非必須アミノ酸、ピルビン酸ナトリウム(すべてLonzaから)、およびペニシリン−ストレプトマイシン(pen-strep)グルタミン(Invitrogen)を補充した、10% FBS(Lonza)を含有しているRPMI 1640培地(Lonza)(10% cRPMI)で細胞をリンスした。
健常ドナー由来のヒトPBMCを、Ficoll-Paque PLUS(GE Healthcare)上のヘパリン化血液の遠心分離によって単離した。Providence Health System施設内倫理委員会により本調査は認可され、かつすべての血液ドナーからインフォームドコンセントを得た。新鮮なヒトPBMCを、CD4またはCD8のT細胞陰性単離キット(Miltenyi Biotec)を用いた陰性選択によってCD4+およびCD8+T細胞を富化し、かつ10% cRPMI中に懸濁し(5×105細胞/ml)、かつ5,000U/mlのrhIL-2(プロロイキン)を含むまたは含まない96ウェルプレート中で、1μg/mlのプレートに結合した抗CD3(クローンOKT-3)で刺激した。48時間後、細胞を洗浄し、再懸濁し、次いで5,000 IU/mlのrhIL-2を含むまたは含まない96ウェルプレート中にプレーティングした。24時間後、フローサイトメトリーによって細胞を染色しかつ解析した。
野生型、CD25-/-、STAT3-/-、またはSTAT5-/-マウスのリンパ節および脾臓から単一細胞懸濁物を調製し、次いでDynalマウスCD4またはCD8 T細胞陰性単離キット(Invitrogen)を用いてCD4+またはCD8+T細胞を精製した。プレートに結合した抗CD3(1μg/ml;クローン145-2C11)および抗CD28(5μg/ml;クローン37.51)を含有している96ウェル内に、1ウェルあたり3×105個の細胞を播種した。抗原特異的CD8+T細胞活性化のために、精製したナイーブ野生型またはOX40-/-のOT-I T細胞(2×105/ウェル)を、96ウェルプレート中で、OVAペプチド(SIINFEKL)パルス照射(20,000ラド)されたDC2.4細胞(2×103/ウェル)で刺激した。あるいは、精製したナイーブ野生型OT-I、STAT3-/- OT-I、またはOX40-/- OT-I T細胞(1×106/ウェル)を、24ウェルプレート中で、野生型同種(SIINFEKL)または変更ペプチドリガンド(SIITFEKL)OVAペプチドパルス照射(2,000ラド)された同系脾細胞(6×106/ウェル)で刺激した。48時間後、活性化されたOT-I T細胞を採取し、新鮮な10% cRPMIに再播種する前に、Ficoll-paque勾配で生細胞を富化した(5×105細胞/ml)。
MCA-205腫瘍を野生型C57BL/6マウスに移植し、次いで10日後にマウスは、IL-2cの存在または非存在下で(d10〜13)、250μgの抗OX40または対照ラットIg(d10、14)を受けた。7日後(腫瘍移植後d21)、脾臓を摘出し、RBC溶解し、かつCD4+CD25+制御性T細胞(CD8−/MHC II−/B220−)を細胞選別によって単離した(>99%純度)。96ウェル丸底プレート中にTregを5×104細胞/ウェルで三つ組で播種した。Dynal CD8 T細胞陰性選択キット(Invitrogen)を用いて、野生型マウスの脾臓からナイーブレスポンダ(Teff)CD8細胞を調製し、CFSE標識し、かつ培地(陽性対照)またはTreg細胞を含有している三つ組ウェルに、1ウェルあたり5×104個の細胞を添加した。照射(4,000ラド)によりT細胞欠失した(Dynal beads、Invitrogen)2×105個のアクセサリー細胞を調製し、1μg/mlの抗CD3で処理し、かつすべてのウェルに添加した。96時間後に細胞を採取し、CD8について染色し、かつCD8レスポンダ細胞におけるCFSE希釈の程度をフローサイトメトリーによって判定した。
組換えマウスIL-2、IL-4、IL-7、IL-9、またはIL-21をeBioscienceまたはPeprotech(Rocky Hill, NJ)から購入した。組換えヒトIL-15はNational Cancer InstituteのBiological Resources Branchから提供され、抗mIL-2 mAb(クローンS4B6)をBio-X-Cellから入手した。2.5μgのIL-2と7μgの抗IL-2 mAbとを37℃で20分間混合することによってIL-2/抗IL-2 mAb複合体(IL-2c)を産出し、次いでマウスは200μlのPBS中IL-2cの注射を毎日受けた(腹腔内)。示されている場合、T細胞はJAK3阻害剤(100ng/ml;PF-956980;Pfizerから入手)でインビトロ処理された。
1×106個のMCA-205肉腫腫瘍細胞を野生型C57BL/6マウスに移植した(皮下)(Spiess PJ, et al. J Natl Cancer Inst 1987; 79: 1067-75)。以前に記載されているように(Redmond WL, et al. J Immunol 2007; 179: 7244-53)、TRAMP-C1-mOVA(TC1-OVA)細胞を改変して、膜結合型OVA(mOVA)を発現させた。いくつかの実験において、2.5×106個のTC1-OVA細胞をオスのPOET Tgマウスに注射した(皮下)。腫瘍が約50mm2に達した時点で(腫瘍接種の20日後)、マウスは5×105個の野生型またはOX40-/-のOT-1 Thy1.1 T細胞を受けた。CD8 T細胞養子移入の17日後、担腫瘍マウスのアネルギー性ドナー細胞に、上記に記載されるように、可溶性OVA、抗OX40または対照Ab、およびLPSを再負荷した(皮下)。腫瘍成長(面積)をマイクロキャリパーで2〜3日おきに査定し、腫瘍が>150mm2に達した時点でマウスを犠牲にした。
同系脾細胞から構成される標的細胞を、1×PBS中5μMのカルボキシフルオレセインジアセテートスクシンイミジルエステル(CFSE)(CFSE高)または0.5μMのCFSE(CFSE低)で37℃にて10分間標識し、次いで10% cRPMIで2回洗浄した。次に、CFSE低およびCFSE高細胞を、それぞれ5μg/mlの対照(HA)または同種(OVA)ペプチドで37℃にて1時間パルスした。細胞を10% cRPMIで2回洗浄し、次いで1×PBS中1:1混合のCFSE低/CFSE高標的細胞(それぞれ5×106個)を、レシピエントマウスに静脈内注射した。4時間後、脾細胞を採取し、フローサイトメトリーによるCFSE標識細胞の検出および定量化のために単一細胞懸濁物を解析した。
HALTプロテアーゼインヒビターカクテル(Thermo Fisher Scientific, Rockford, IL)を含有しているRIPA溶解バッファー(Bio-Rad, Hercules, CA)を4℃で30分間用いて、ホールセル溶解物を調製した。溶解物を14,000×g/4℃で遠心分離し、上清を回収し、タンパク質濃度をBradfordアッセイキット(ISC BioExpress, Kaysville, UT)によって判定し、かつ50μgのアリコートを-80℃で保存した。溶解物を、2-MEを含有しているLaemmliバッファー(Invitrogen)中で100℃にて5分間ボイルし、12%プレキャストゲル(Bio-Rad)でSDS-PAGEによって分離し、次いでニトロセルロース膜(Invitrogen)に転写した。Odysseyブロッキングバッファー(Li-Cor, Lincoln, NE)と1×PBSとの1:1混合物または1×PBS中5%脱脂粉乳で室温にて1時間ブロッキングすることによって、非特異的結合を低下させた。ブロットを、Odyssey(Li-Cor)ブロッキングバッファー中のpJAK1、pJAK2、pSTAT1、pSTAT3、pSTAT5、pSTAT6、JAK1、JAK2、STAT1、STAT3、STAT4、STAT5、STAT6(すべてCell Signaling, Danvers, MAから)、pJAK3、JAK3(Santa Cruz Biotechnology, Santa Cruz, CA)、pSTAT4(Invitrogen)、GAPDH(Sigma)、またはβ-アクチン(Li-Cor)に対するAbと4℃で一晩インキュベートした。ブロットをPBS-Tween(1×PBS+0.2% Tween-20)で室温にて4×5分間洗浄し、次いでIRDye 800CWヤギ抗ウサギIgG(H+L)、IRDye 680LTヤギ抗マウスIgG(H+L)、またはIRDye 680LTロバ抗ヤギIgG(H+L)(Li-Cor)と室温で60分間インキュベートした。ブロットをPBS-Tweenで室温にて4×5分間洗浄し、次いでLi-Cor Odyssey infrared imager(Li-Cor)での可視化の前に、1×PBSで短くリンスした。
GraphPad InStatまたはPrismソフトウェア(GraphPad, San Diego, CA)を用いた、対応のないスチューデントt検定(2群間の比較用)、一元ANOVA(>2群間の比較用)、またはKaplan-Meier生存(腫瘍生存調査用)によって統計的有意性を決定し、<0.05のP値は有意であると見なされた。
TCR刺激の強さがOX40発現に影響を及ぼす程度、ナイーブCD8 T細胞の活性化後のOX40上方制御の反応速度を以下のように査定した。精製したナイーブ野生型またはOX40-/-のOT-I T細胞(2×105/ml)を、漸増用量(0.5ng、50ng、または5000ng)のOVAペプチドSIINFEKLでパルスされた同系抗原提示細胞(APC)(2×103/ml)で活性化した。1〜3日後、活性化されたOT-I T細胞を採取し、OX40およびCD25の発現をフローサイトメトリーによって判定した。OX40が発現しているかどうかにかかわらず、CD25は急速に上方制御され、最高用量のAg(5000ng/ml)でのTCR刺激後24時間以内に最大発現に達した(図1A、1B)。最大のOX40発現は、用量依存的様式で同様に誘導され、その際ピークのOX40発現はOX40発現細胞において刺激の3日後に観察された(図1A、1B)。図1Bおよび1Cにおける棒グラフは、平均±SD(n=2〜3/群)を表現している。データは、同様の結果を有する2〜3回の独立した実験のうちの代表的な1つである。
外因性rIL-2の添加が、活性化T細胞上のOX40を上方制御するのに十分であるかどうかを以下のように判定した。精製したナイーブ野生型またはOX40-/-のOT-I T細胞(1×106/ml)を、同種ペプチドでパルスされた同系脾細胞(6×106/ml)で活性化した。2日後、活性化されたOT-I T細胞を採取し、組換えマウスIL-2(100ng/ml)の存在または非存在下で再培養した(5×105細胞/ml)。CD25およびOX40の発現の程度をフローサイトメトリーによって判定した。外因性rIL-2の添加は、培地のみと比較して、CD25およびOX40の発現の両方の統計的に有意な増大をもたらし(図2A)、IL-2シグナル伝達は、活性化されたマウスT細胞上のこれらの分子の上方制御を推進するのに十分であることが実証された。
チロシンキナーゼJAK3は共通γcサブユニットに結合し、そのリン酸化は、γcサイトカインによる刺激後の隣接下流シグナル伝達における決定的因子である(Kovanen PE, and Leonard WJ. Immunol Rev 2004; 202: 67-83;Rochman Y, et al. Nat Rev Immunol 2009; 9: 480-90)。JAK3活性化がOX40発現を誘導するために必要であるかどうかを以下のように調べた。まず、インビトロで刺激されたCD8+T細胞におけるJAKタンパク質の発現を査定した。OT-1トランスジェニックマウス由来の抗原特異的CD8+T細胞(実施例1および2にあるような)をこれらの調査に用いて、TCR刺激の程度および持続時間をより正確にコントロールした。上記のように、ナイーブ野生型またはOX40-/-のOT-I T細胞を、ペプチドパルスされたAPCで2日間活性化した。次いで、活性化されたOT-I T細胞を採取し、培地または組換えマウスIL-2(100ng/ml)で再培養し(5×105細胞/ml)、かつリン酸化JAK1、JAK2、およびJAK3、ならびに全JAK3の発現をウェスタンブロットによって査定した。rIL-2による刺激は、JAK3のリン酸化の増大をもたらしたが、JAK1またはJAK2リン酸化には影響を及ぼさず、JAK3シグナル伝達がOX40の上方制御に関与していることを示唆した(図3A)。JAK3特異的小分子阻害剤(PF-956980、100ng/ml)(Changelian PS, et al. Blood 2008; 111: 2155-7;Steele AJ, et al. Blood 2010)の存在下または非存在下で、活性化CD8+T細胞を培地またはIL-2と培養することによって、JAK3の必要性を確認した。24時間後、細胞を採取し、CD25およびOX40の発現の程度をフローサイトメトリーによって判定した。JAK3阻害剤での処理は、対照処理した細胞(DMSO)と比較して、活性化CD8+T細胞上でのOX40のIL-2介在性誘導を取り消した(図3B)。
多数の前臨床調査は、アゴニスト抗OX40 mAbを用いた治療が強力な抗腫瘍免疫を促進することを実証している(Watts TH, Annu Rev Immunol 2005; 23: 23-68;Redmond WL and Weinberg AD, Crit Rev Immunol 2007; 27: 415-36;Croft M. Annu Rev Immunol 2010; 28: 57-78)。インビトロでOX40を強力に誘導し得る外因性IL-2の能力に基づき(図2)、抗OX40 mAbと併せたIL-2療法の提供が、相乗作用を与えてインビボで抗腫瘍免疫を増進するかどうかを評価した。まず、IL-2刺激が担腫瘍マウスにおけるCD8+T細胞上のOX40を上方制御し得るかどうかに関してインビトロ評価を行った。rIL-2全身療法に関連した有害な副作用を最小限に抑えるために、サイトカイン/mAb複合体(IL-2c)を介してIL-2を提供した(Boyman O, et al. Science 2006; 311: 1924-7;Krieg C, et al. Proc Natl Acad Sci USA 2010; 107: 11906-11)。
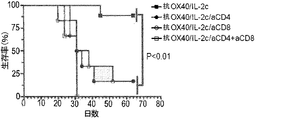
腫瘍誘導性T細胞アネルギーは、強力な抗腫瘍免疫の産出を制限する重要なバリアであるため(Rabinovich GA, et al. Annu Rev Immunol 2007; 25: 267-96)、本実施例は、TCR/IL-2cシグナル伝達の存在下でのOX40ライゲーションが、担腫瘍宿主におけるアネルギー性CD8 T細胞の機能を回復させ得るかどうかを探索する。用いたモデルシステムを図9Aに示す。TRAMP-C1-mOVA発現(TC1-mOVA)前立腺腫瘍細胞(2.5×106細胞/マウス)を、膜結合型OVA(mOVA)の前立腺特異的発現がラットプロバシンプロモーターのコントロール下においてアンドロゲン依存的様式で推進される(Lees JR, et al. Immunology 2006; 117: 248-61;Lees JR, et al. Prostate 2006; 66: 578-90)、オスのPOET-1トランスジェニックマウスに移植した。20日後に、担腫瘍マウス(約50mm2腫瘍)は、5×105個の養子移入されたナイーブOT-I T細胞を受けた。以前の調査により、これらの腫瘍反応性ドナーCD8 T細胞は、インビボでアネルギー化されるようになることが示されているRedmond WL, et al. Eur J Immunol 2009; 39: 2184-94。T細胞養子移入の17日後(腫瘍接種の37日後)、アネルギー性ドナーOT-I T細胞を、抗OX40または対照(ラットIgG)Ab(37〜38日目)、500μgのOVA(37日目)、10μgのLPS(37日目)、+/- IL-2サイトカイン/mAb複合体(37〜44日目)で再刺激した。このモデルは、代理腫瘍関連抗原に対する抗原特異的CD8+T細胞の応答を追跡することを可能にした。マウスは、TCR刺激の供給源を提供するAg/TLRリガンド(LPS)を与えられた。
Claims (59)
- 治療を必要としている対象に、OX40アゴニスト、および共通γ鎖(γc)サイトカインまたは活性を有するその断片、変種、類似体、もしくは誘導体を投与する工程を含む、癌を治療する方法。
- 投与が、OX40アゴニストまたはγcサイトカイン単独よりもより大幅にTリンパ球介在性抗癌免疫を刺激する、請求項1記載の方法。
- 投与が、アネルギー性腫瘍反応性CD8+Tリンパ球の機能を回復させ得る、請求項1または請求項2のいずれか一項記載の方法。
- アネルギー性腫瘍反応性CD8+Tリンパ球の増殖が回復する、請求項3記載の方法。
- アネルギー性腫瘍反応性CD8+Tリンパ球の分化が回復する、請求項3または請求項4記載の方法。
- T細胞受容体(TCR)刺激したTリンパ球を、γcサイトカインまたは活性を有するその断片、変種、類似体、もしくは誘導体と組み合わせたOX40アゴニストと接触させる工程を含む、Tリンパ球介在性癌免疫療法に対するOX40アゴニストの効果を増強する方法。
- TCRライゲーションを介してTリンパ球を刺激する工程と、TCR刺激したTリンパ球を、γcサイトカインまたは活性を有するその断片、変種、類似体、もしくは誘導体と組み合わせたOX40アゴニストと接触させる工程とを含む、Tリンパ球介在性癌免疫療法に対するOX40アゴニストの効果を増強する方法。
- 癌免疫療法が、CD4+Tリンパ球およびCD8+Tリンパ球の両方を必要とする、請求項6または請求項7記載の方法。
- 接触が、OX40アゴニストまたはγcサイトカイン単独よりもより大幅にTリンパ球介在性癌免疫療法を刺激する、請求項6〜8のいずれか一項記載の方法。
- 接触が、アネルギー性腫瘍反応性CD8+T細胞の機能を回復させ得る、請求項6〜9のいずれか一項記載の方法。
- TCR刺激したTリンパ球を、γcサイトカインまたは活性を有するその断片、変種、類似体、もしくは誘導体と組み合わせたOX40アゴニストと接触させる工程を含む、TCR刺激に応答したTリンパ球増殖のOX40アゴニスト介在性増進を増強する方法。
- TCRライゲーションを介してTリンパ球を刺激する工程と、TCR刺激したTリンパ球を、γcサイトカインまたは活性を有するその断片、変種、類似体、もしくは誘導体と組み合わせたOX40アゴニストと接触させる工程とを含む、Tリンパ球増殖のOX40アゴニスト介在性増進を増強する方法。
- Tリンパ球分化が増強される、請求項11または請求項12記載の方法。
- TCRライゲーションが、Tリンパ球を抗原/MHC複合体と接触させることにより達成される、請求項7〜10、12、または13のいずれか一項記載の方法。
- 抗原が癌細胞特異的抗原である、請求項14記載の方法。
- TCRライゲーションが、Tリンパ球を抗CD3と接触させることにより達成される、請求項7〜10、12、または13のいずれか一項記載の方法。
- 抗CD3が固体の基体に結合している、請求項16記載の方法。
- Tリンパ球を抗CD28と接触させる工程をさらに含む、請求項16または請求項17記載の方法。
- 接触がインビボである、請求項6〜15のいずれか一項記載の方法。
- 接触がインビトロまたはエクスビボである、請求項6〜18のいずれか一項記載の方法。
- γcサイトカインが、IL-2、IL4、IL7、IL-21、活性を有するそれらの任意の断片、変種、類似体、または誘導体、およびそれらの組み合わせからなる群より選択される、請求項1〜20のいずれか一項記載の方法。
- γcサイトカインが、IL-2または活性を有するその断片、変種、類似体、もしくは誘導体、およびそれらの組み合わせである、請求項21記載の方法。
- γcサイトカインが、Tリンパ球におけるOX40発現を上方制御する、請求項1〜22のいずれか一項記載の方法。
- 上方制御が、JAK3リン酸化を介して仲介される、請求項23記載の方法。
- 上方制御が、STAT5、STAT3、またはSTAT5およびSTAT3の両方のJAK3活性化を介して仲介される、請求項23または請求項24記載の方法。
- 上方制御が、STAT5のJAK3活性化を介して仲介される、請求項25記載の方法。
- OX40アゴニストが、OX40に特異的に結合する結合分子である、請求項1〜26のいずれか一項記載の方法。
- 結合分子が、OX40に特異的に結合する抗体またはその抗原結合断片を含む、請求項27記載の方法。
- 抗体またはその抗原結合断片がモノクローナル抗体である、請求項28記載の方法。
- 抗体またはその抗原結合断片がキメラ抗体である、請求項29記載の方法。
- 抗体またはその抗原結合断片がヒト化抗体である、請求項29記載の方法。
- 抗体またはその抗原結合断片がヒト抗体である、請求項28または請求項29記載の方法。
- 抗原結合断片がFab断片である、請求項28〜32のいずれか一項記載の方法。
- 抗原結合断片がFab'断片である、請求項28〜32のいずれか一項記載の方法。
- 抗原結合断片がF(ab)2断片である、請求項28〜32のいずれか一項記載の方法。
- 抗原結合断片が一本鎖Fv断片である、請求項28〜32のいずれか一項記載の方法。
- 抗原結合断片が一本鎖抗体である、請求項28〜32のいずれか一項記載の方法。
- 抗体またはその抗原結合断片が、mAb 9B12と同じOX40エピトープに結合する、請求項28〜37のいずれか一項記載の方法。
- 結合分子が、OX40リガンドまたはそのOX40結合断片を含む、請求項27記載の方法。
- 結合分子が、それに融合した異種ポリペプチドをさらに含む、請求項27〜39のいずれか一項記載の方法。
- 結合分子が、治療剤、プロドラッグ、ペプチド、タンパク質、酵素、ウイルス、脂質、生体応答修飾物質、薬学的作用物質、またはPEGからなる群より選択される作用物質にコンジュゲートされている、請求項27〜39のいずれか一項記載の方法。
- 結合分子が、
Fcドメインを含む免疫グロブリンドメイン、
コイルドコイル三量化ドメインを含む三量化ドメイン、および
OX40受容体結合ドメインである受容体結合ドメイン
をN末からC末方向に含む融合ポリペプチドを含み、かつ該融合ポリペプチドが三量体融合タンパク質へと自己会合する、請求項27または39〜41のいずれか一項記載の方法。 - 融合ポリペプチドが、OX40受容体に結合することができ、かつ少なくとも1種のOX40介在性活性を刺激することができる、請求項42記載の方法。
- 融合ポリペプチドのOX40受容体結合ドメインが、OX40リガンド(OX40L)の細胞外ドメインを含む、請求項42または請求項43記載の方法。
- 三量化ドメインが、TRAF2三量化ドメイン、マトリリン-4三量化ドメイン、またはそれらの組み合わせを含む、請求項42〜44のいずれか一項記載の方法。
- 三量化ドメインが、TRAF2三量化ドメインを含む、請求項45記載の方法。
- 癌が固形腫瘍またはその転移である、請求項1〜10または14〜46のいずれか一項記載の方法。
- 癌が、黒色腫、消化管癌、腎細胞癌腫、前立腺癌、肺癌、乳癌、およびそれらの任意の組み合わせからなる群より選択される、請求項47記載の方法。
- 転移の部位が、リンパ節、肺、肝臓、骨、およびそれらの任意の組み合わせからなる群より選択される、請求項47記載の方法。
- 対象がヒト患者である、請求項1〜5または21〜49のいずれか一項記載の方法。
- 治療が、患者における少なくとも1箇所の腫瘍または転移の退縮をもたらす、請求項50記載の方法。
- 治療により、患者における腫瘍または転移の成長が遅延するかまたは増大しない、請求項50または請求項51記載の方法。
- 治療が、患者における疾患の安定をもたらす、請求項50〜52のいずれか一項記載の方法。
- 治療が、患者の生存の延長をもたらす、請求項50〜53のいずれか一項記載の方法。
- 投与が、長期間確立された腫瘍またはその転移の成長を遅延、失速、または減少させ得る、請求項50〜54のいずれか一項記載の方法。
- γcサイトカインが、OX40アゴニストの投与前に対象に投与される、請求項1〜5または21〜55のいずれか一項記載の方法。
- γcサイトカインが、OX40アゴニストの投与と同時に対象に投与される、請求項1〜5または21〜55のいずれか一項記載の方法。
- γcサイトカインが、OX40アゴニストの投与後に対象に投与される、請求項1〜5または21〜55のいずれか一項記載の方法。
- IL-2が、アルデスロイキン、BAY 50-4798、NHS-EMD 521873、IL-2/抗IL-2複合体、またはそれらの任意の組み合わせである、請求項22記載の方法。
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| PCT/US2012/027496 WO2013130102A2 (en) | 2012-03-02 | 2012-03-02 | Dual ox40 agonist/il-2 cancer therapy methods |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2015508816A true JP2015508816A (ja) | 2015-03-23 |
| JP2015508816A5 JP2015508816A5 (ja) | 2015-07-16 |
Family
ID=49083426
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2014559875A Pending JP2015508816A (ja) | 2012-03-02 | 2012-03-02 | Ox40アゴニスト/il−2二重癌治療法 |
Country Status (7)
| Country | Link |
|---|---|
| US (1) | US20150157710A1 (ja) |
| EP (1) | EP2819693A4 (ja) |
| JP (1) | JP2015508816A (ja) |
| AU (1) | AU2012371610A1 (ja) |
| CA (1) | CA2865899A1 (ja) |
| HK (1) | HK1205691A1 (ja) |
| WO (1) | WO2013130102A2 (ja) |
Families Citing this family (16)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2013119202A1 (en) | 2012-02-06 | 2013-08-15 | Providence Health & Services - Oregon | Cancer treatment and monitoring methods using ox40 agonists |
| US10307472B2 (en) * | 2014-03-12 | 2019-06-04 | Curevac Ag | Combination of vaccination and OX40 agonists |
| US10478491B2 (en) * | 2014-04-03 | 2019-11-19 | Augusta University Research Institute, Inc. | Methods for enhancing the efficacy of a tumor-directed immune response |
| EP3148573A4 (en) * | 2014-05-29 | 2017-11-15 | Medimmune, LLC | Ox40l fusion proteins and uses thereof |
| TW201619200A (zh) * | 2014-10-10 | 2016-06-01 | 麥迪紐有限責任公司 | 人類化抗-ox40抗體及其用途 |
| JP6687612B2 (ja) | 2014-10-24 | 2020-04-22 | アストラゼネカ アクチボラグ | 組合せ |
| SI3265123T1 (sl) | 2015-03-03 | 2023-02-28 | Kymab Limited | Protitelesa, uporabe in postopki |
| CN115109158A (zh) | 2015-05-07 | 2022-09-27 | 阿吉纳斯公司 | 抗ox40抗体及其使用方法 |
| US20160347848A1 (en) | 2015-05-28 | 2016-12-01 | Medimmune Limited | Therapeutic combinations and methods for treating neoplasia |
| MX2018006477A (es) | 2015-12-02 | 2018-09-03 | Agenus Inc | Anticuerpos y metodos de uso de estos. |
| EP3534947A1 (en) | 2016-11-03 | 2019-09-11 | Kymab Limited | Antibodies, combinations comprising antibodies, biomarkers, uses & methods |
| WO2018089628A1 (en) | 2016-11-09 | 2018-05-17 | Agenus Inc. | Anti-ox40 antibodies, anti-gitr antibodies, and methods of use thereof |
| AU2017357042A1 (en) * | 2016-11-10 | 2019-05-30 | Board Of Regents, The University Of Texas System | Immunotherapeutic tumor treatment method |
| TW202028222A (zh) | 2018-11-14 | 2020-08-01 | 美商Ionis製藥公司 | Foxp3表現之調節劑 |
| EP4037693A1 (en) | 2019-09-30 | 2022-08-10 | Astrazeneca AB | Combination treatment for cancer |
| CN114437228B (zh) * | 2020-10-30 | 2024-02-06 | 中国科学院生物物理研究所 | 一种il-2与抗体亚单位构成的双功能融合蛋白 |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2005206563A (ja) * | 2003-12-22 | 2005-08-04 | Hokkaido Technology Licence Office Co Ltd | 標的化t細胞の製造方法及び医薬 |
Family Cites Families (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5225539A (en) | 1986-03-27 | 1993-07-06 | Medical Research Council | Recombinant altered antibodies and methods of making altered antibodies |
| CA2050918A1 (en) | 1990-01-12 | 1991-07-13 | Raju Kucherlapati | Generation of xenogeneic antibodies |
| US5639641A (en) | 1992-09-09 | 1997-06-17 | Immunogen Inc. | Resurfacing of rodent antibodies |
| US5595756A (en) * | 1993-12-22 | 1997-01-21 | Inex Pharmaceuticals Corporation | Liposomal compositions for enhanced retention of bioactive agents |
| US20030035790A1 (en) * | 1999-01-15 | 2003-02-20 | Shu-Hsia Chen | Combination therapy for the prevention or treatment of cancer, inflammatory disorders or infectious diseases in a subject |
| US20030040477A1 (en) * | 2002-09-23 | 2003-02-27 | Anthony Montgomery | Methods and compositions for modulating t cell activation and uses thereof |
| US20110008368A1 (en) * | 2006-01-13 | 2011-01-13 | Board Of Regents, The University Of Texas System | Methods of modulating the ox40 receptor to treat cancer |
| GB0620894D0 (en) * | 2006-10-20 | 2006-11-29 | Univ Southampton | Human immune therapies using a CD27 agonist alone or in combination with other immune modulators |
| WO2009094273A2 (en) * | 2008-01-15 | 2009-07-30 | Yale University | Compositions and methods for adoptive and active immunotherapy |
-
2012
- 2012-03-02 JP JP2014559875A patent/JP2015508816A/ja active Pending
- 2012-03-02 WO PCT/US2012/027496 patent/WO2013130102A2/en active Application Filing
- 2012-03-02 AU AU2012371610A patent/AU2012371610A1/en not_active Abandoned
- 2012-03-02 EP EP12869998.0A patent/EP2819693A4/en not_active Withdrawn
- 2012-03-02 CA CA2865899A patent/CA2865899A1/en not_active Abandoned
- 2012-03-02 US US14/381,785 patent/US20150157710A1/en not_active Abandoned
-
2015
- 2015-07-02 HK HK15106316.7A patent/HK1205691A1/xx unknown
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2005206563A (ja) * | 2003-12-22 | 2005-08-04 | Hokkaido Technology Licence Office Co Ltd | 標的化t細胞の製造方法及び医薬 |
Non-Patent Citations (5)
| Title |
|---|
| JPN6015052223; Eur.J.Immunol. 34, 2004, p.752-761 * |
| JPN6015052224; J.Immunol. 167, 2001, p.6669-6677 * |
| JPN6015052226; J.Immunol. 173, 2004, p.3002-3012 * |
| JPN6015052227; J.Immunol. 178, 2007, p.7694-7702 * |
| JPN6015052229; Biotherapy 21(suppl.1), 2007, p.85,O-5-3 * |
Also Published As
| Publication number | Publication date |
|---|---|
| US20150157710A1 (en) | 2015-06-11 |
| HK1205691A1 (en) | 2015-12-24 |
| WO2013130102A2 (en) | 2013-09-06 |
| EP2819693A2 (en) | 2015-01-07 |
| EP2819693A4 (en) | 2015-10-28 |
| CA2865899A1 (en) | 2013-09-06 |
| WO2013130102A3 (en) | 2014-04-17 |
| AU2012371610A1 (en) | 2014-10-02 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2015508816A (ja) | Ox40アゴニスト/il−2二重癌治療法 | |
| US11944647B2 (en) | Articles of manufacture and methods for treatment using adoptive cell therapy | |
| JP2020200346A (ja) | 腫瘍療法のためのil−12とt細胞阻害分子遮断薬とを含む医薬組成物 | |
| US9828432B2 (en) | Cancer treatment and monitoring methods using OX40 agonists | |
| ES2961666T3 (es) | Métodos para determinar la dosificación de células CAR-T | |
| US20220008477A1 (en) | Methods and combinations for treatment and t cell modulation | |
| JP2023093469A (ja) | 抗cd16a抗体のサイトカインとの組み合わせ | |
| JP2013100297A (ja) | Il−2媒介性免疫応答の有効性を高める組成物および方法 | |
| AU2016270996A1 (en) | Methods to induce conversion of regulatory T cells into effector T cells for cancer immunotherapy | |
| JP6682438B2 (ja) | 癌治療のための改善された細胞組成物および方法 | |
| JP2018512397A (ja) | 癌治療の有効性を高めるための組成物及び方法 | |
| JP2021513570A (ja) | サイトカインをコードするrnaを用いた治療 | |
| JP2023534808A (ja) | 養子細胞療法のための標的共刺激を提供する受容体 | |
| WO2012012737A2 (en) | Stable tregs and related materials and methods | |
| Mason et al. | Development of a fully canine anti-canine CTLA4 monoclonal antibody for comparative translational research in dogs with spontaneous tumors | |
| US11951131B2 (en) | Anti-SLAMF7 chimeric antigen receptors | |
| JP6980196B2 (ja) | Hla−b57オープンコンフォーマー | |
| US20220152109A1 (en) | A2/ny-eso-1 specific t cell receptors and uses thereof | |
| Lim et al. | Tumor cell clone expressing the membrane-bound form of IL-12p35 subunit stimulates antitumor immune responses dominated by CD8+ T cells | |
| Hnízdilová | Antitumor activity of IL-2 and IL-7 immunocomplexes in combination with αCTLA-4 and αPD-1 mAbs | |
| JP2022524994A (ja) | T細胞受容体及びその使用方法 | |
| KR20210149048A (ko) | T 세포 수용체 및 이의 사용 방법 | |
| KR20210144740A (ko) | T 세포 수용체 및 이의 사용 방법 | |
| KR20210144739A (ko) | T 세포 수용체 및 이의 사용 방법 | |
| US20170198026A1 (en) | Compositions And Methods For Treating Tumors And Immune Based Inflammatory Diseases |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20150106 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20150227 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20150527 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20150602 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20150701 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20160106 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20160727 |