当該技術分野では、植物及び/又はその他のセルロース性材料又はヘミセルロース性材料を、発酵性糖質ヘと変換し得る効率が十分であるか若しくは向上している、発酵性糖質の収率が向上している、及び/又は様々なセルロース性材料又はヘミセルロース性材料に対する作用性能が向上している酵素及び/又は酵素組成物を特定することが必要とされている。
本開示は、セルロース系及び/又はヘミセルロース系バイオマス材料の糖化に利益を提供するポリペプチドであって、セルラーゼ活性又はセルロース分解活性を有する、例えば、特定のβ−グルコシダーゼ及びエンドグルカナーゼポリペプチドなどの、特定のポリペプチド、並びにヘミセルロース分解活性を有する、例えば、キシラナーゼ(例えば、エンドキシラナーゼ)、キシロシダーゼ(例えば、β−キシロシダーゼ)、アラビノフラノシダーゼ(例えば、L−α−アラビノフラノシダーゼ)などの、特定のポリペプチド、を提供する。本開示は、これらのポリペプチドをコードしている核酸、これらの核酸を発現している組み換え細胞、これらの核酸を含むベクター及び発現カセットも提供する。更に、本開示は、ポリペプチド及び核酸の製造及び使用方法を提供する。本開示は、本開示のポリペプチドから選択された2種以上(例えば、2種以上、3種以上、4種以上、5種以上など)の酵素の配合物又は混合物を含む組成物、並びに糖化を実施するための又は糖化活性及び/若しくは効率を向上させるための、組成物中に存在するポリペプチドの好適な比率又は相対重量も提供する。本開示の1種以上又は全ての酵素は宿主細胞に対して異種性のものであってよい。その一方で、本開示の1種以上又は全ての酵素は、対応する野生型宿主細胞と比較して異なるレベルで発現されるよう、遺伝子操作されていても、又は改変されていてもよい。更に、本開示は、実験室環境、工業環境(例えば、バイオ燃料の製造)、又は商業環境での使用法を提供する。
本開示の目的に際し、酵素は、当業者により分類される酵素分類に基づき参照することができる。酵素は、各酵素活性に基づき参照することもできる。例えば、キシラナーゼは、キシラナーゼ活性を有するポリペプチドとして参照され、あるいは互換的にキシラナーゼポリペプチドとして参照される。したがって、本開示は、キシラナーゼ活性、β−キシロシダーゼ活性、L−α−アラビノフラノシダーゼ活性、β−グルコシダーゼ活性、及び/又はエンドグルカナーゼ活性を有する、特定の新規酵素及び変異体の発見に一部基づくものである。本開示は、これらのヘミセルロース分解活性及び/又はセルロース分解活性を有するポリペプチドを、セルロース系材料及びヘミセルロース系材料の効率的な糖化を可能にするしかるべき特定の配合物として含む又は重量比で含む、新規酵素組成物の同定に基づくものでもある。
本開示の酵素及び/又は酵素組成物を使用して、バイオマスから発酵性糖質を製造する。次に、この糖は、例えば、発酵又はその他の培養法によるエタノール生産の際に、微生物に利用させることができ、あるいはその他の有用な生物製剤又は生物材料の製造に使用することができる。本開示は、本明細書に記載の酵素及び/又は酵素組成物を用いる工業用途(例えば、糖化工程、エタノール生産工程)を提供する。本開示の酵素及び/又は酵素組成物は、様々な用途の数多くの工業工程において、例えば、バイオ燃料の生産において、酵素にかかる費用を有利に削減することができる。
関連して、本開示は、商業的環境での本発明の酵素及び/又は酵素組成物の使用を提供する。本開示の酵素及び/又は酵素組成物は、酵素及び/又は組成物の典型的な又は好ましい使用方法についての指示書と組み合わせて適切な市場で販売することができる。したがって、本開示の酵素及び/又は酵素組成物は、商用酵素供給モデルにより使用又は市販することができる。このモデルでは、本開示の酵素及び/又は酵素組成物は、バイオエタノール製造業者、燃料精製業者、又は燃料若しくはバイオ製品を製造する事業を行っているバイオケミカル製造業者若しくはバイオマテリアル製造業者に販売される。一部の態様では、本開示の酵素及び/又は酵素組成物は、オン・サイト・バイオリファイナリーモデルを用い市販又は商品化され、酵素及び/又は酵素組成物は、燃料精製施設又はバイオケミカル/バイオマテリアル製造施設又は施設の付近にて製造又は調製され、本発明の酵素及び/又は酵素組成物は、燃料精製施設又はバイオケミカル/バイオマテリアル製造業者の具体的な要求に合わせてリアルタイムで調整される。更に、本開示は、所望のバイオ産物(例えば、バイオ燃料、バイオケミカル、バイオ材料など)を製造し、市販することのできる酵素及び/又は酵素組成物の使用時に、これらの製造業者に技術的な支援及び/又は指示を提供する工程に関する。
したがって、第一態様では、本発明は、グリコシルヒドロラーゼ活性を有する数多くのポリペプチド(これらの変異体を含む)に関係する。本発明は、単離ポリペプチド、変異体、並びにポリペプチド及び変異体をコードしている核酸に関係する。
一部の態様では、本開示は、配列番号44、54、56、58、60、62、64、66、68、70、72、74、76、78、79、93、及び95のうちのいずれか1つの配列と、少なくとも約10(例えば、少なくとも約10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、225、250、275、300)残基にわたって、又は触媒ドメイン(CD)の全長にわたって、又は糖結合ドメイン(CBM)の全長にわたって、少なくとも約60%(例えば、少なくとも約60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%)の配列同一性を有するアミノ酸配列の、単離、合成又は組み換えポリペプチドを提供する。特定の実施形態では、単離、合成、又は組み換えポリペプチドは、β−グルコシダーゼ活性を有する。特定の実施形態では、単離、合成、又は組み換えポリペプチドは、β−グルコシダーゼポリペプチドであり、例えば、β−グルコシダーゼポリペプチドの変異体(variants)、変異体(mutants)、及び融合/ハイブリッド/キメラ体を包含する。本開示に関し、用語「融合」、「ハイブリッド」及び「キメラ」は、互換的に、互いに等価なものとして使用される。特定の実施形態では、本開示は、2種以上のβ−グルコシダーゼ配列からなるハイブリッド体又はキメラ体であり、β−グルコシダーゼ活性を有するポリペプチドを提供する。例えば、2種以上のβ−グルコシダーゼ配列のうち第1の配列は、少なくともアミノ酸残基約200個分(例えば、少なくとも約200、250、300、350、400、又は500個分)の長さであり、配列番号96〜108のアミノ酸配列モチーフのうち1種以上又は全てを含む。一部の実施形態では、2種以上のβ−グルコシダーゼ配列のうち第2の配列は、少なくともアミノ酸残基約50個分(例えば、少なくとも約50、75、100、125、150、175、又は200個分)の長さであり、配列番号109〜116のアミノ酸配列モチーフのうち1種以上又は全てを含む。詳細には、2つ以上のβ−グルコシダーゼ配列のうち1つ目の配列は、少なくともアミノ酸残基約200個分の長さであり、配列番号197〜202のアミノ酸配列モチーフのうち少なくとも2つ(例えば、少なくとも2、3、4、又は全て)を含み、かつ2つ以上のβ−グルコシダーゼ配列のうち2つ目の配列は、少なくともアミノ酸残基約50個分の長さであり、配列番号203を含む。一部の実施形態では、第1の配列はβ−グルコシダーゼのキメラ又はハイブリッドポリペプチドのN末端に位置するのに対し、第2の配列はC末端に位置する。一部の実施形態では、第1の配列のC末端残基と第2の配列のN末端残基とが連結されている。例えば、第1の配列は第2の配列の直後に隣接して又は直接連結されている。他の実施形態では、第1の配列は第2の配列の直後に隣接しておらず、第1の配列はリンカードメインを介して第2の配列に連結されている。一部の実施形態では、第1の配列、第2の配列、又は両方の配列は、1箇所以上にグリコシル化部位を含む。一部の実施形態では、第1又は第2の配列は、ループ配列又はループ様の構造をコードしている配列を含む。ループ配列は、アミノ酸残基約3、4、5、6、7、8、9、10、又は11個分の長さであり、FDRRSPG(配列番号204)、又はFD(R/K)YNIT(配列番号205)の配列を含んでよい。他の実施形態では、第1の及び第2の配列を連結しているリンカードメインは、ループ配列を含む。一部の実施形態では、β−グルコシダーゼポリペプチドのハイブリッド又はキメラポリペプチドは、第1の配列、第2の配列又はリンカードメイン配列の各々が由来する、対応するβ−グルコシダーゼポリペプチドと比較して、向上した安定性を有する。安定性の向上、例えば、タンパク質分解耐性の向上は、標準的な保存条件下での保存時、あるいは標準的な発現/生産条件下での発現及び/又は生産中の、タンパク質の切断に対する、安定性又は耐性の向上という点で反映される。例えば、ハイブリッド/キメラポリペプチドは、ループ配列内の残基、又はループ配列内のものではない残基若しくは位置でのタンパク質の切断を受けにくくなる。
特定の実施形態では、本開示は、β−グルコシダーゼ活性を有する単離、合成、組み換えポリペプチドを提供し、このポリペプチドは、少なくとも2種(例えば、2、3、又は更には4種)のβ−グルコシダーゼ配列のハイッブリッド体であり、少なくとも2種のβ−グルコシダーゼ配列のうちの第1の配列は、少なくともアミノ酸残基約200(例えば、少なくとも約200、250、300、350、又は400)個分の長さであり、かつ配列番号44、54、56、58、62、64、66、68、70、72、74、76、78、及び79のうちのいずれか1つの相当する長さの配列と少なくとも約60%(例えば、少なくとも約65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%)配列同一性を有する配列を含み、それに対し少なくとも2種のβ−グルコシダーゼ配列のうちの第2の配列は、少なくともアミノ酸残基約50(例えば、少なくとも約50、75、100、125、150、又は200個)個分の長さであり、かつ配列番号60の相当する長さの配列と少なくとも約60%(例えば、少なくとも約65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%)配列同一性を有する。代替的な実施形態では、本開示は、β−グルコシダーゼ活性を有するポリペプチドをコードする単離、合成、組み換えポリペプチドを提供し、このポリペプチドは、少なくとも2種(例えば、2、3、又は更には4種)のβ−グルコシダーゼ配列のハイッブリッド体であり、少なくとも2種のβ−グルコシダーゼ配列のうちの第1の配列は、少なくともアミノ酸残基約200(例えば、少なくとも約200、250、300、350、又は400)個分の長さであり、かつ配列番号60の相当する長さの配列と少なくとも約60%(例えば、少なくとも約65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%)配列同一性を有する配列を含み、それに対し少なくとも2種のβ−グルコシダーゼ配列のうちの第2の配列は、少なくともアミノ酸残基約50(例えば、少なくとも約50、75、100、125、150、又は200個)個分の長さであり、配列番号44、54、56、58、62、64、66、68、70、72、74、76、78、及び79のうちのいずれか1つの相当する長さの配列と少なくとも約60%(例えば、少なくとも約65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%)同一性を有する配列を含む。詳細には、2つ以上のβ−グルコシダーゼ配列のうち1つ目の配列は、少なくともアミノ酸残基約200個分の長さであり、配列番号197〜202のアミノ酸配列モチーフのうち少なくとも2つ(例えば、少なくとも2、3、4、又は全て)を含み、かつ2つ以上のβ−グルコシダーゼ配列のうち2つ目の配列は、少なくともアミノ酸残基約50個分の長さであり、配列番号203を含む。一部の実施形態では、第1の配列はβ−グルコシダーゼのキメラ又はハイブリッドポリペプチドのN末端に位置するのに対し、第2の配列はC末端に位置する。一部の実施形態では、第1の配列のC末端残基と第2の配列のN末端残基とが連結されている。例えば、第1の配列は第2の配列の直後に隣接して又は直接連結されている。他の実施形態では、第1の配列は第2の配列の直後に隣接しておらず、第1の配列はリンカードメインを介して第2の配列に連結されている。第1の配列、第2の配列、又は両方の配列には、1箇所以上にグリコシル化部位を含ませることができる。一部の実施形態では、第1又は第2の配列は、ループ配列又はループ様の構造をコードしている配列を含む。特定の実施形態では、ループ配列は第3のβ−グルコシダーゼポリペプチドに由来し、アミノ酸残基約3、4、5、6、7、8、9、10、又は11個分の長さであり、FDRRSPG(配列番号204)、又はFD(R/K)YNIT(配列番号205)の配列を含んでよい。特定の実施形態では、第1の及び第2の配列を連結しているリンカードメインは、ループ配列を含む。
代表的な実施形態では、本開示は、2種以上のβ−グルコシダーゼ配列に由来するβ−グルコシダーゼポリペプチドのハイブリッド又はキメラポリペプチドを提供し、第1のβ−グルコシダーゼ配列はFv3Cに由来し、かつ少なくともアミノ酸残基約200個分の長さであり、第2のβ−グルコシダーゼ配列はT.リーゼイ(T. reesei)Bgl3(又は「Tr3B」)ポリペプチドに由来し、少なくともアミノ酸残基約50個分の長さである。一部の実施形態では、第1の配列のC末端残基と第2の配列のN末端残基とが連結されている。したがって、第1の配列は第2の配列の直後に隣接して又は直接連結されている。他の実施形態では、第1の配列は、リンカードメイン配列を介して第2の配列に連結されている。一部の実施形態では、第1又は第2の配列のいずれかがループ配列を含む。一部の実施形態では、ループ配列は、第3のβ−グルコシダーゼポリペプチドに由来する。特定の実施形態では、ループ配列は、アミノ酸残基約3、4、5、6、7、8、9、10、又は11個分の長さでありFDRRSPG(配列番号204)、又はFD(R/K)YNIT(配列番号205)の配列を含む。第1の配列と第2の配列を連結しているリンカードメイン配列は、このようなループ配列を含む。特定の実施形態では、ループ配列は、Te3Aポリペプチドに由来する。一部の実施形態では、β−グルコシダーゼポリペプチドのハイブリッド又はキメラポリペプチドは、各キメラ部位が由来する対応するβ−グルコシダーゼポリペプチドと比較して、例えばFv3Cポリペプチド、Te3Aポリペプチド、及び/又はTr3Bポリペプチドと比較して、向上した安定性を有する。一部の実施形態では、安定性の向上とは、標準的な保存条件下での保存時、又は標準的な発現/生産条件下での発現及び/又は生産時の、ループ配列中の残基での、又はループ配列の外側の残基又は位置でのタンパク質の切断を受けにくくするという点で反映される。
特定の態様では、本開示は、配列番号44、54、56、58、60、62、64、66、68、70、72、74、76、78、79、93、及び95のうちのいずれか1つの配列と、少なくとも約10(例えば、少なくとも約10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、225、250、275、300)残基の領域にわたって、又は触媒ドメイン(CD)の全長にわたって、又は糖結合ドメイン(CBM)の全長にわたって、少なくとも60%(例えば、少なくとも約60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%)の配列同一性を有するβ−グルコシダーゼポリペプチドをコードしている単離、合成、又は組み換えヌクレオチドを提供する。一部の実施形態では、単離、合成又は組み換えヌクレオチドは、2種以上のβ−グルコシダーゼ配列のハイッブリッド又はキメラ体であるβ−グルコシダーゼポリペプチドをコードしている。一部の実施形態では、β−グルコシダーゼのハイッブリッド/キメラポリペプチドは、少なくともアミノ酸残基約200(例えば、少なくとも約200、250、300、350、400、又は500)個からなる第1の配列と、配列番号96〜108のアミノ酸配列モチーフのうちの1つ以上又は全てを含む。一部の実施形態では、β−グルコシダーゼのハイッブリッド/キメラポリペプチドは、少なくともアミノ酸残基約50(例えば、少なくとも約50、75、100、125、150、175、又は200)個を含み、かつ配列番号109〜116のアミノ酸配列モチーフのうちの1つ以上又は全てを含む第2のβ−グルコシダーゼ配列を含む。詳細には、2つ以上のβ−グルコシダーゼ配列のうち1つ目の配列は、少なくともアミノ酸残基約200個分の長さであり、配列番号197〜202のアミノ酸配列モチーフのうち少なくとも2つ(例えば、少なくとも2、3、4、又は全て)を含み、かつ2つ以上のβ−グルコシダーゼ配列のうち2つ目の配列は、少なくともアミノ酸残基約50個分の長さであり、配列番号203を含む。特定の実施形態では、第1のβ−グルコシダーゼ配列のC末端は、第2のβ−グルコシダーゼ配列のN末端に連結される。あるいは、第1の及び第2のβ−グルコシダーゼ配列は、リンカードメインをコードしている第3のヌクレオチド配列を介して連結される。第1のドメイン、第2のドメイン又はリンカードメインは、約3、4、5、6、7、8、9、10、又は11個のアミノ酸残基からなりかつFDRRSPG(配列番号204)又はFD(R/K)YNIT(配列番号205)のアミノ酸配列を有するループ配列を含んでよい。一部の実施形態では、ループ配列は、第3のβ−グルコシダーゼポリペプチドに由来する。
特定の態様では、本開示は、β−グルコシダーゼ活性を有し、少なくとも2つ(例えば、2、3、又は更には4つ)β−グルコシダーゼ配列からなるハイブリッド体である、ポリペプチドをコードしている単離、合成、又は組み換えヌクレオチドを提供し、少なくとも2つのβ−グルコシダーゼ配列のうちの1つ目の配列は、アミノ酸残基少なくとも約200個(例えば、少なくとも約200、250、300、350、又は400個)分であり、かつ配列番号44、54、56、58、62、64、66、68、70、72、74、76、78、及び79のうちのいずれか1つの相当する長さの配列と少なくとも約60%(例えば、少なくとも約65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%)同一性を有する配列を含み、一方少なくとも2つのβ−グルコシダーゼ配列のうちの2つ目の配列は、アミノ酸残基少なくとも約50個(例えば、少なくとも約50、75、100、125、150、又は200個)分であり、配列番号60の相当する長さの配列と少なくとも約60%(例えば、少なくとも約65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%)配列同一性を有する。あるいは、本開示は、少なくとも2つ(例えば、2、3、又は更には4つ)のβ−グルコシダーゼ配列からなるハイブリッド体であるβ−グルコシダーゼ活性を有するポリペプチドをコードしている単離、合成、又は組み換えヌクレオチドを提供し、少なくとも2つのβ−グルコシダーゼ配列のうちの1つ目の配列は、少なくともアミノ酸残基約200個分(例えば、少なくとも約200、250、300、350、又は400個分)の長さであり、配列番号60の相当する長さの配列と少なくとも約60%(例えば、少なくとも約65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%)同一性を有する配列を含み、少なくとも2つのβ−グルコシダーゼ配列のうちの2つ目の配列は、少なくともアミノ酸残基約50個分(例えば、少なくとも約50、75、100、125、150、又は200個分)の長さであり、配列番号44、54、56、58、62、64、66、68、70、72、74、76、78、及び79のうちのいずれか1つの相当する長さの配列と少なくとも約60%(例えば、少なくとも約65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%)同一性を有する配列を含む。詳細には、2つ以上のβ−グルコシダーゼ配列のうち1つ目の配列は、少なくともアミノ酸残基約200個分の長さであり、配列番号197〜202のアミノ酸配列モチーフのうち少なくとも2つ(例えば、少なくとも2、3、4、又は全て)を含み、かつ2つ以上のβ−グルコシダーゼ配列のうちの2つ目の配列は、少なくともアミノ酸残基約50個分の長さであり、配列番号203を含む。一部の実施形態では、ヌクレオチドは、β−グルコシダーゼのキメラ又はハイブリッドポリペプチドのN末端に位置する第1のアミノ酸配列と、C末端に位置する第2のアミノ酸配列をコードする。一部の実施形態では、第1のアミノ酸配列のC末端残基は、第2のアミノ酸配列のN端末残基と連結されている。あるいは、第1のアミノ酸配列は第2のアミノ酸配列の直後に隣接しておらず、第1の配列はリンカードメインを介して第2の配列に連結されている。一部の実施形態では、第1のアミノ酸配列、第2のアミノ酸配列、又はリンカードメインは、ループ配列を含むアミノ酸配列、あるいはアミノ酸残基約3、4、5、6、7、8、9、10、又は11個分の長さであり、アミノ酸配列FDRRSPG(配列番号204)、又はFD(R/K)YNIT(配列番号205)を有するループ様の構造を示す配列を含む。特定の実施形態では、ループ配列は第3のβ−グルコシダーゼポリペプチドに由来する。
一部の態様では、本開示は、配列番号53、55、57、59、61、63、65、67、69、71、73、75、77、92又は94のうちのいずれか1つの配列又はこれらの少なくとも約300残基分、(例えば、少なくとも約300、400、500、又は600残基分)の長さの断片と少なくとも60%(例えば、少なくとも約60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%)配列同一性を有する単離、合成、又は組み換えヌクレオチド、を提供する。特定の実施形態では、厳密度の低い条件下、厳密度の中程度の条件下、厳密度の高い条件下、厳密度の非常に高い条件下で、配列番号53、55、57、59、61、63、65、67、69、71、73、75、77、92又は94のいずれか1つの配列、あるいはこれらの少なくとも約300残基分の長さの断片、あるいはこれらの相補鎖と、ハイブリッド形成し得る単離、合成、又は組み換えヌクレオチドを提供する。
特定の実施形態では、本開示は、配列番号44、54、56、58、60、62、64、66、68、70、72、74、76、78、79、93、及び95のいずれか1つの配列と、触媒ドメイン(CD)若しくは糖結合ドメイン(CBM)の全長にわたって少なくとも約60%(例えば、少なくとも約60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%)同一性を有する単離、合成又は組み換えポリペプチドを提供する。単離、合成、又は組み換えポリペプチドはβ−グルコシダーゼ活性を有し得る。
一部の態様では、本開示は、配列番号52、80〜81、206〜207のうちのいずれか1つの配列と、少なくとも約10(例えば、少なくとも約10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、225、250、275、300)残基の領域にわたって、又は触媒ドメイン(CD)若しくは糖結合ドメイン(CBM)の全長にわたって、少なくとも約60%(例えば、少なくとも約60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%)配列同一性を有する単離、合成又は組み換えポリペプチドを提供する。特定の実施形態では、単離、合成、又は組み換えポリペプチドは、GH61/エンドグルカナーゼ活性を有する。「GH61/エンドグルカナーゼ活性」は、ポリペプチドが、グリコシルヒドロラーゼファミリー61の酵素活性を有すること、及び/又はエンドグルカナーゼ活性を有することを意味する。一部の実施形態では、本開示は、少なくともアミノ酸残基約50個分(例えば、少なくとも約50、100、150、200、250、又は300個分)の長さであり、(1)配列番号84、及び88;(2)配列番号85、及び88;(3)配列番号86;(4)配列番号87;(5)配列番号84、88、及び89;(6)配列番号85、88、及び89;(7)配列番号84、88、及び90;(8)配列番号85、88、及び90;(9)配列番号84、88、及び91;(10)配列番号85、88、及び91;(11)配列番号84、88、89、及び91;(12)配列番号84、88、90、及び91;(13)配列番号85、88、89、及び91:及び(14)配列番号85、88、90、及び91からなる群から選択される配列モチーフのうちの1つ以上を含む、単離、合成又は組み換えポリペプチドを提供する。特定の実施形態では、ポリペプチドはGH61エンドグルカナーゼポリペプチドである(例えば、微生物又は他の好適な種由来の、限定するものではないがT.リーゼイ(T. reesei)Eg4酵素などのEG IV型ポリペプチド)。一部の実施形態では、GH61エンドグルカナーゼポリペプチドは、T.リーゼイ(T. reesei)Eg4由来の変異体(variant)、変異体(mutant)、又は融合ポリペプチドである(例えば、ポリペプチドは、配列番号52と少なくとも約60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%配列同一性を有する)。
一部の態様では、本開示は、配列番号52、80〜81、及び206〜207のいずれか1つの配列と、少なくとも約10残基(例えば、少なくとも約10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、225、250、275、300残基)の領域にわたって、又は触媒ドメイン(CD)全長若しくは糖結合ドメイン(CBM)の全長にわたって、少なくとも約60%(例えば、少なくとも約60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%)同一性を有するポリペプチドをコードしている、単離、合成、又は組み換えヌクレオチドを提供する。例えば、単離、合成、又は組み換えヌクレオチドは、GH61/エンドグルカナーゼ活性を有するポリペプチドをコードする。一部の実施形態では、本開示は、少なくともアミノ酸残基約50個分(例えば、少なくとも約50、100、150、200、250、又は300個分)の長さであり、(1)配列番号84、及び88;(2)配列番号85、及び88;(3)配列番号86;(4)配列番号87;(5)配列番号84、88、及び89;(6)配列番号85、88、及び89;(7)配列番号84、88、及び90;(8)配列番号85、88、及び90;(9)配列番号84、88、及び91;(10)配列番号85、88、及び91;(11)配列番号84、88、89、及び91;(12)配列番号84、88、90、及び91;(13)配列番号85、88、89、及び91:及び(14)配列番号85、88、90、及び91からなる群から選択される配列モチーフのうちの1種以上を含むポリペプチドをコードしている単離、合成又は組み換えヌクレオチドを提供する例えば、ヌクレオチドは、配列番号52に対して少なくとも約60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%配列同一性を有するポリペプチドをコードしているヌクレオチドである。一部の実施形態では、ヌクレオチドは、GH61エンドグルカナーゼポリペプチドをコードする(例えば、限定するものではないが、T.リーゼイ(T. reesei)Eg4などの、好適な生物に由来するEG IV型ポリペプチド)。
一部の態様では、本開示は、配列番号2、4、6、8、10、12、14、16、18、20、22、24、26、28、30、32、34、36、38、40、42、43、及び45のうちのいずれか1つのポリペプチドと、少なくとも約10残基、例えば、少なくとも約15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、225、250、275、300、325、若しくは350残基にわたって、又は未熟なポリペプチド、成熟ポリペプチド、触媒ドメイン(CD)若しくは糖結合ドメイン(CBM)の全長にわたって少なくとも約70%、例えば、少なくとも約71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%、又は完全に(100%)配列同一性を有する単離、合成、組み換えポリペプチドを提供する。
一部の態様では、本開示は、配列番号2、4、6、8、10、12、14、16、18、20、22、24、26、28、30、32、34、36、38、40、42、43、及び45の配列のいずれか1つと、少なくとも約10残基、例えば、少なくとも約15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、225、250、275、300、325、若しくは350残基の領域にわたって、又は未熟なポリペプチド、成熟ポリペプチド、触媒ドメイン(CD)若しくは糖結合ドメイン(CBM)の全長にわたって少なくとも約70%(例えば、少なくとも約71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%、又は完全に(100%))配列同一性を有するポリペプチドをコードしている単離、合成、又は組み換えヌクレオチドを提供する。一部の態様では、本開示は、配列番号1、3、5、7、9、11、13、15、17、19、21、23、25、27、29、31、33、35、37、39、及び41のうちのいずれか1つの配列、又はこれらの断片と、少なくとも約70%(例えば、少なくとも約71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%、又は完全に(100%))配列同一性を有する単離、合成、又は組み換えヌクレオチドを提供する。この断片は、少なくとも約10、20、30、40、50、60、70、80、90、100残基の長さであってよい。一部の実施形態では、本開示は、厳密度の低い条件下、厳密度の中程度の条件下、厳密度の高い条件下、又は厳密度の非常に高い条件下で、配列番号1、3、5、7、9、11、13、15、17、19、21、23、25、27、29、31、33、35、37、39、及び41のいずれか1つの配列、又はこれらの断片若しくは下位配列とハイブリッド形成する単離、合成、又は組み換えヌクレオチドを提供する。
本開示のポリペプチド配列は、本開示の核酸(例えば以降第5.1節で記載される核酸)によりコードされる配列も含む。
本開示は、少なくとも1つのポリペプチドドメイン(例えば、CD、CBM、又はこれらのいずれも)を含む、キメラ又は融合タンパク質も提供する。少なくとも1つのドメインは、第2のアミノ酸配列、例えばシグナルペプチド配列に操作可能に連結させることができる。したがって、本開示は、本開示のポリペプチドに関するシグナル配列を含むヌクレオチド配列を、第2の異なるポリペプチド、例えば天然ではシグナル配列と関係のない異種ポリペプチドをコードしている第2のヌクレオチド配列と操作可能に連結させて発現させることにより、第1の種類のキメラ又は融合酵素を提供する。本開示は、例えば、例えば、配列番号2、4、6、8、10、12、14、16、18、20、22、24、26、28、30、32、34、36、38、40、42、43、45、52、54、56、58、60、62、64、66、68、70、72、74、76、78〜83、93、又は95の配列の、残基1〜13、1〜14、1〜15、1〜16、1〜17、1〜18、1〜19、1〜20、1〜21、1〜22、1〜23、1〜24、1〜25、1〜26、1〜27、1〜28、1〜28、1〜30、1〜31、1〜32、1〜33、1〜34、1〜35、1〜36、1〜37、1〜38、又は1〜40を含み、天然には関連付けられないポリペプチドを有する、組み換えポリペプチドを提供する。その他のキメラ又は融合ポリペプチドを以降の節5.1.1.に記載する。
本開示は、第1の連続して延びるアミノ酸残基からなる第1のポリペプチド配列を含み、第2の連続して延びるアミノ酸残基からなる第2のポリペプチド配列と操作可能に連結されている、第2の種類のキメラ又は融合酵素を提供する。第1の及び/又は第2の連続して延びる配列には、場合によりシグナルペプチドを含ませることができる。適宜に、この種類のキメラ又は融合酵素は、第1の連続して延びるアミノ酸残基からなる第1のポリペプチド配列をコードしている第1の遺伝子、及び第2の連続して延びるアミノ酸残基からなる第2のポリペプチド配列をコードしている第2の遺伝子を含むポリヌクレオチドを発現させることにより得られ、第1の遺伝子及び第2の遺伝子は直接及び操作可能に連結されている。その他の特定の実施形態では、キメラ又は融合法を使用して、異なる酵素から得られた2種以上の連続して延びるアミノ酸残基を操作可能に連結させることができる。連続して延びるアミノ酸残基は天然に由来するものではなく、又は天然に連結されるもの若しくは関連付けられるものではない。特定の実施形態では、操作可能に連結されている連続して延びるアミノ酸残基は、類似する酵素活性を有するものの互いに及び/又は宿主細胞に対して異種性のものである酵素から得ることができる。更に追加的な実施形態では、操作可能に連結されている2種以上の連続して延びるアミノ酸残基は、更に、本明細書に記載されるような好適なシグナルペプチドと連結させることができる。更に他の実施形態では、第1の連続して延びるアミノ酸残基、及び第2の連続して延びるアミノ酸残基はリンカードメインを介して連結される。一部の実施形態では、第1の連続して延びるアミノ酸残基、第2の連続して延びるアミノ酸残基、又はリンカー配列は、例えば、アミノ酸残基約3、4、5、6、7、8、9、10、又は11個分の長さであり、FDRRSPG(配列番号204)又はFD(R/K)YNIT(配列番号205)のアミノ酸配列を有するループ配列を含み得る。特定の実施形態では、ループ配列は第1の及び第2の連続して延びるアミノ酸残基の由来する酵素とは異なる酵素に由来する。一部の実施形態では、得られるキメラ又は融合酵素は向上した安定性を有しており、例えば、安定性の向上は、キメラ部位の由来する対応する各酵素と比較した場合の、標準的な貯蔵条件下での保管中の、又は標準的な発現若しくは生産条件下での発現/生産中の、タンパク質の加水分解又はタンパク質の分解に対する安定性という点で反映される。
本開示に関し、キメラ又は融合酵素は、キメラ配列の由来する酵素のうちの1つを起源とする酵素活性により定義される。例えば、キメラ配列のうち1つの配列がβ−グルコシダーゼに由来するか又はβ−グルコシダーゼの変異体である場合、ハイブリッド/キメラ酵素は、このポリペプチドに含まれる他のキメラ配列の由来する酵素とは無関係に、β−グルコシダーゼポリペプチドとして参照される。本開示の目的に際し、「Xポリペプチド」は、X酵素活性を有する、変異体(variant)、変異体(mutant)、又はXポリペプチドのキメラ/融合体、を包含する。
したがって、本開示は、ヘミセルロース分解活性又はセルロース分解活性を有する、ポリペプチド及び/又はポリペプチドをコードしているヌクレオチド若しくは核酸を提供する。ヘミセルロース分解活性としては、限定するものではないが、キシラナーゼ、β−キシロシダーゼ、及び/又はL−α−アラビノフラノシダーゼ活性が挙げられる。ヘミセルロース分解活性を有するポリペプチドとしては、限定するものではないが、キシラナーゼ、β−キシロシダーゼ、及び/又はL−α−アラビノフラノシダーゼが挙げられる。セルラーゼ活性を有するポリペプチドとしては、限定するものではないがβ−グルコシダーゼ活性又はβ−グルコシダーゼに富む全セルラーゼ活性、及びGH61/エンドグルカナーゼ活性又はエンドグルカナーゼに富むセルラーゼ活性が挙げられる。
本開示は、本開示の核酸又はこれらの下位配列を含む発現カセットを更に提供する。例えば、核酸は、配列番号53、55、57、59、61、63、65、69、71、73、75、77、92、94の核酸配列と、少なくとも約10残基、例えば、少なくとも約10、20、30、40、50、75、90、100、150、200、250、300、350、400、又は500残基にわたって少なくとも約60%、例えば、少なくとも約61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%配列同一性を有する。一部の態様では、β−グルコシダーゼポリペプチドをコードしている核酸は、例えば、2種以上のβ−グルコシダーゼポリペプチドに由来する2種以上のβ−グルコシダーゼ配列を含むキメラ/融合ポリペプチドであってよく、第1の配列は少なくともアミノ酸残基約200個分の長さであり、かつ配列番号96〜108のうちの1つ以上又は全てを含み、一方で第2の配列は少なくともアミノ酸残基約50個分の長さであり、かつ配列番号109〜116のうちの1つ以上又は全てを含み、及び同様に場合により第3の配列は、第1又は第2のβ−グルコシダーゼポリペプチドとは異なる第3のβ−グルコシダーゼポリペプチドに由来し、アミノ酸残基約3、4、5、6、7、8、9、10、又は11個分の長さであり、かつアミノ酸配列FDRRSPG(配列番号204)又はFD(R/K)YNIT(配列番号205)を有する。詳細には、2つ以上のβ−グルコシダーゼ配列のうち1つ目の配列は、少なくともアミノ酸残基約200個分の長さであり、配列番号197〜202のアミノ酸配列モチーフのうち少なくとも2つ(例えば、少なくとも2、3、4、又は全て)を含み、及び2つ以上のβ−グルコシダーゼ配列のうち2つ目の配列は、少なくともアミノ酸残基約50個分の長さであり、配列番号203を含み、及び同様に場合により第3の配列は、第1又は第2のβ−グルコシダーゼポリペプチドとは異なる第3のβ−グルコシダーゼポリペプチドに由来し、アミノ酸残基約3、4、5、6、7、8、9、10、又は11個分の長さであり、かつアミノ酸配列FDRRSPG(配列番号204)又はFD(R/K)YNIT(配列番号205)を有する。
一部の態様では、本開示は、配列番号52、80〜81、206〜207のうちのいずれか1つの配列と、又は(1)配列番号84、及び88;(2)配列番号85、及び88;(3)配列番号86;(4)配列番号87;(5)配列番号84、88、及び89;(6)配列番号85、88、及び89;(7)配列番号84、88、及び90;(8)配列番号85、88、及び90;(9)配列番号84、88、及び91;(10)配列番号85、88、及び91;(11)配列番号84、88、89、及び91;(12)配列番号84、88、90、及び91;(13)配列番号85、88、89、及び91:及び(14)配列番号85、88、90、及び91からなる群から選択される配列モチーフのうちのいずれか1つと少なくとも約60%(例えば、少なくとも約60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%配列同一性を有するポリペプチドをコードしている核酸を含む発現カセットを提供する。
一部の態様では、本開示は、配列番号2、4、6、8、10、12、14、16、18、20、22、24、26、28、30、32、34、36、38、40、42、43、及び45のうちのいずれか1つの配列と、少なくとも約10残基、例えば、少なくとも約10、20、30、40、50、75、90、100、150、200、250、300、350、400、又は500残基の領域にわたって、少なくとも約70%(例えば、少なくとも約70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%)配列同一性を有するポリペプチドをコードしている核酸を含む発現カセットを提供する。一部の態様では、本開示は、厳密度の低い条件下、厳密度の中程度の条件下、又は厳密度の高い条件下で、配列番号1、3、5、7、9、11、13、15、17、19、21、23、25、27、29、31、33、35、37、39、及び41のうちのいずれか1つの配列と、又はこれらの断片又は下位配列とハイブリッド形成する核酸を含む、発現カセットを提供する。断片又は下位配列は、例えば、少なくとも約10、20、30、40、50、75、100、125、150、200、250残基分の長さである。
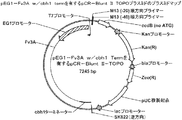
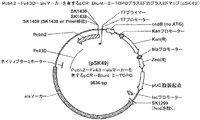
一部の態様では、発現カセットの核酸は、所望により操作可能なようにプロモーターに連結されている。プロモーターは、例えば、真菌、ウイルス、バクテリア、哺乳類、又は植物のプロモーターであってよい。プロモーターは、例えば、糸状菌で発現させることのできる常時発現型プロモーター又は誘導型プロモーターであってよい。糸状菌に由来するプロモーターが好適なである場合がある。例えば、プロモーターはT.リーゼイ由来のセロビオヒドロラーゼ1(「cbh1」)遺伝子プロモーターであってよい。
一部の態様では、本開示は、本開示の核酸、又は本開示の発現カセットを発現するよう遺伝子操作された組み換え細胞を提供する。組み換え細胞は、所望により、バクテリア細胞、哺乳類細胞、真菌細胞、酵母細胞、昆虫細胞、又は植物細胞である。例えば、組み換え細胞は、組み換え糸状菌細胞、例えばトリコデルマ(Trichoderma)、ヒュミコラ(Humicola)、フザリウム(Fusarium)、アスペルギルス(Aspergillus)、ニューロスポラ(Neurospora)、ペニシリウム(Penicillium)、セファロスポラム(Cephalosporium)、アキルヤ(Achlya)、ポドスポラ(Podospora)、エンドチア(Endothia)、ムコール(Mucor)、コクリオボラス(Cochliobolus)、ピリクラリア(Pyricularia)、又はクリソスポリウム(Chrysosporium)細胞である。
本開示は、(a)本開示のポリペプチドを発現するよう遺伝子操作した宿主細胞を培養する工程;及び(b)ポリペプチドを回収する工程、を含む、組み換えポリペプチドを生産する方法も提供する。ポリペプチドの回収法としては、例えば、ポリペプチドを含む発酵ブロスの回収が挙げられる。発酵ブロスは、生産後に例えば、精製、限外濾過、細胞殺傷工程などの最小限の加工を行い使用してもよく、及びこのような場合、発酵ブロスは全ブロス製剤として使用されると言われる。あるいは、ポリペプチドは更なる精製工程を用い回収することもできる。
更なる態様では、本発明は、本発明の2種以上、3種以上、4種以上、又は5種以上のポリペプチド(好適な変異体(variants)、変異体(mutants)、又は融合/キメラポリペプチドなど)を含む遺伝子操作型酵素組成物に関し、酵素組成物は、リグノセルロース系バイオマス材料に含まれる1種以上の成分を加水分解し得る。このような組成物としては、例えば、ヘミセルロース、及び場合によりセルロースが挙げられる。好適なリグノセルロース系バイオマス材料としては、限定するものではないが、種子、穀類、塊茎、植物性廃棄物、すなわち食品加工又は工業加工に関係する副産物(例えば、茎など)、トウモロコシ(例えば、穂軸、及びまぐさなど)、草本類(例えば、ソルガストラム・ヌタンス(Sorghastrum nutans)などのインディアングラス、又は例えば、キビ(Panicum)種などパニクム・バーガタム(Panicum virgatum)といったスイッチグラス)、多年生植物のケーン類(例えば、暖竹(giant reeds))、木材(例えば、木片、加工廃棄物など)、紙、パルプ、及び再生紙(例えば、新聞紙)が挙げられる。酵素配合物/組成物を使用することで、植物間で異なる複雑な構造体を形成するβ−1,4−結合型グルコースからなる直鎖を含むセルロース又はヘミセルロースを加水分解することができる。
本発明の遺伝子操作型酵素組成物は、例えば、ヘミセルラーゼ活性又はセルラーゼ活性を有する数多くの異なるポリペプチドを含み得る。ヘミセルラーゼ活性は、キシラナーゼ活性、アラビノフラノシダーゼ活性、又はキシロシダーゼ活性であってよい。セルラーゼ活性は、グルコシダーゼ活性、セロビオヒドロラーゼ活性、又はエンドグルカナーゼ活性であってよい。本発明の酵素組成物のポリペプチドは、ヘミセルラーゼ活性及び/又はセルラーゼ活性のうちの1種以上を有するものであってよい。例えば、酵素組成物のポリペプチドは、β−キシロシダーゼ活性及びL−α−アラビノフラノシダーゼ活性をいずれも有していてよい。同様に、所定の酵素組成物に含まれる2種以上のポリペプチドの酵素活性は同様のもの、又は類似したものであってよい。例えば、組成物に含まれる1種以上のポリペプチドは、独立してエンドグルカナーゼ、β−キシロシダーゼ、又はβ−グルコシダーゼ活性を有し得る。
本発明の好適なポリペプチドは、天然由来の資源から単離することができる。例えば、1種以上のポリペプチドは、天然由来の資源から精製され、又は実質的に精製される。他の例では、1種以上のポリペプチドは、遺伝子組換え型バクテリア又は真菌などのように生物に遺伝子操作を行い生産させてよい。1種以上のポリペプチドを組み換え生物により過剰発現させてもよい。1種以上のポリペプチドを、1種以上の異種(すなわち、同様の生物から天然には生じない)ポリペプチドと共に発現又は共発現させることもできる。本発明の1種以上のポリペプチドをコードしている遺伝子を、組み換え宿主生物、例えば、宿主真菌細胞又は宿主バクテリア細胞の遺伝物質に組み込み、次いで遺伝子産物を生産させるのに使用することができる。
本発明の酵素組成物は、天然型又は遺伝子操作型組成物であってよい。用語「天然型酵素組成物」は、天然に存在する組成物、例えば、その天然の環境条件下で増殖させた未改変の生物から直接誘導された組成物を指す。用語「遺伝子操作型組成物」は、少なくとも1種の酵素が(1)遺伝子組み換えにより生産される;(2)異種遺伝子の発現を介し微生物により生産される;及び/又は(3)同一又は類似する種類の酵素を含む天然に得られる酵素組成物中に存在するよりも多いか少ないかする量若しくは相対的な重量%で存在する組成物を指す。「遺伝子組み換えにより生産された」酵素は、遺伝子組換えを介し生産された酵素である。遺伝子組み換えにより生産された酵素は、混合物として存在させることができ、この場合、遺伝子組み換えにより生産された酵素は、天然には同時に存在しない他の酵素との混合物として存在する。更に、遺伝子操作した組成物は、天然に見られる生物(すなわち、未改変の生物)により、これらの生物が天然に生息する場所で見られる条件とは異なる条件下で生産させることもできる。
本発明のポリペプチド、これらの混合物、及び/又は遺伝子操作型酵素組成物を使用して、バイオマス材料又は他の好適な原材料を加水分解することができる。酵素組成物は、望ましくはキシラナーゼ、キシロシダーゼ、セロビオヒドロラーゼ、エンドグルカナーゼ、グルコシダーゼ、及び場合によりアラビノフラノシダーゼから選択される本発明の2種以上、3種以上、4種以上、若しくは更には5種以上のポリペプチド、及び/又はヘミセルロース材料の発酵性糖質への消化又は変換を触媒し得る若しくは補助し得るその他の酵素との混合物を含む。好適なグルコシダーゼとしては、例えば、限定するものではないが、配列番号54、56、58、60、62、64、66、68、70、72、74、76、78、79、93、及び95のいずれか1つの配列と、少なくとも約10残基(例えば、少なくとも約10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、225、250、275、300残基)の領域にわたって少なくとも約60%(例えば、少なくとも約60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%)同一性を有する数多くのβ−グルコシダーゼが挙げられる。同様に好適なグルコシダーゼとしては、例えば、2つ以上のβ−グルコシダーゼ配列を含むキメラ/融合β−グルコシダーゼポリペプチドが挙げられ、第1のβ−グルコシダーゼに由来する第1の配列は、少なくともアミノ酸残基約200個分の長さであり、配列番号96〜108のアミノ酸配列モチーフのうち1種以上又は全てを含むのに対し、第2のβ−グルコシダーゼに由来する第2の配列は、少なくともアミノ酸残基約50個分の長さであり、配列番号109〜116のアミノ酸配列モチーフのうち1種以上又は全てを含み、及び同様に場合により第3の配列は、第3のβ−グルコシダーゼに由来するループ配列をアミノ酸残基約3、4、5、6、7、8、9、10、又は11個分の長さでコードしており、かつアミノ酸配列FDRRSPG(配列番号204)又はFD(R/K)YNIT(配列番号205)を有する。詳細には、2つ以上のβ−グルコシダーゼ配列のうち1つ目の配列は、少なくともアミノ酸残基約200個分の長さであり、配列番号197〜202のアミノ酸配列モチーフのうち少なくとも2つ(例えば、少なくとも2、3、4、又は全て)を含み、及び2つ以上のβ−グルコシダーゼ配列のうち2つ目の配列は、少なくともアミノ酸残基約50個分の長さであり、配列番号203を含み、及び同様に場合により第3の配列は、第1又は第2のβ−グルコシダーゼポリペプチドとは異なる第3のβ−グルコシダーゼポリペプチドに由来し、アミノ酸残基約3、4、5、6、7、8、9、10、又は11個分の長さであり、かつアミノ酸配列FDRRSPG(配列番号204)又はFD(R/K)YNIT(配列番号205)を有する。
好適なエンドグルカナーゼとしては、例えば、限定するものではないが、配列番号52、80〜81、206〜207のうちのいずれか1つの配列と、少なくとも約10残基(例えば、少なくとも約10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、225、250、275、300残基)の領域にわたって少なくとも約60%(例えば、少なくとも約60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%)配列同一性を有する1種以上のGH61エンドグルカナーゼが挙げられる。同様に好適なエンドグルカナーゼとしては、(1)配列番号84、及び88;(2)配列番号85、及び88;(3)配列番号86;(4)配列番号87;(5)配列番号84、88、及び89;(6)配列番号85、88、及び89;(7)配列番号84、88、及び90;(8)配列番号85、88、及び90;(9)配列番号84、88、及び91;(10)配列番号85、88、及び91;(11)配列番号84、88、89、及び91;(12)配列番号84、88、90、及び91;(13)配列番号85、88、89、及び91:及び(14)配列番号85、88、90、及び91からなる群から選択される1種以上の配列モチーフを含むポリペプチドも挙げられる。
ヘミセルロースを発酵性糖質へと分解することができる他の酵素としては、限定するものではないが、セルラーゼ、ヘミセルラーゼ、又はセルラーゼ若しくはヘミセルラーゼを含む組成物が挙げられる。同様に存在させることのできる好適な他のポリペプチドとしては、例えば、セロビオースデヒドロゲナーゼが挙げられる。本発明の遺伝子操作型酵素組成物は、キシラナーゼ、キシロシダーゼ、アラビノフラノシダーゼ、及びセルラーゼ群から選択された本発明の2種以上、3種以上、4種以上、又は更には5種以上のポリペプチドの混合物を含ませることができる。遺伝子操作型酵素組成物には、場合により1種以上のセロビオースデヒドロゲナーゼを含ませてもよい。全セルラーゼ組成物は、β−グルコシダーゼポリペプチドに富むもの、又はエンドグルカナーゼポリペプチドに富むもの、又はβ−グルコシダーゼポリペプチド及びエンドグルカナーゼポリペプチドのいずれもに富むものであってよい。一部の実施形態では、エンドグルカナーゼポリペプチドは、例えば、配列番号52、80〜81、206〜207のいずれか1つの配列と、少なくとも約10残基(例えば、少なくとも約10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、225、250、275、300残基)の領域にわたって少なくとも約60%(例えば、少なくとも約60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%)配列同一性を有する、GH61ファミリーのメンバーであってよい。エンドグルカナーゼポリペプチドは、(1)配列番号84、及び88;(2)配列番号85、及び88;(3)配列番号86;(4)配列番号87;(5)配列番号84、88、及び89;(6)配列番号85、88、及び89;(7)配列番号84、88、及び90;(8)配列番号85、88、及び90;(9)配列番号84、88、及び91;(10)配列番号85、88、及び91;(11)配列番号84、88、89、及び91;(12)配列番号84、88、90、及び91;(13)配列番号85、88、89、及び91:及び(14)配列番号85、88、90、及び91からなる群から選択される1種以上の配列モチーフを含むものであってよい。例えば、エンドグルカナーゼポリペプチドは、T.リーゼイEg4などの好適な生物由来のEGIVであってよい。一部の実施形態では、β−グルコシダーゼポリペプチドは、配列番号54、56、58、60、62、64、66、68、70、72、74、76、78、79、93、及び95のいずれか1つの配列と、少なくとも約10残基(例えば、少なくとも約10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、225、250、275、又は300残基)の領域にわたって、少なくとも約60%(例えば、少なくとも約60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%)同一性を有するものであってよい。
本発明の遺伝子操作型酵素組成物の第1の非限定例は、4種のポリペプチド、すなわち:(1)キシラナーゼ活性を有する第1のポリペプチド、(2)キシロシダーゼ活性を有する第2のポリペプチド、(3)アラビノフラノシダーゼ活性を有する第3のポリペプチド、及び(4)β−グルコシダーゼ活性を有する第4のポリペプチドを含む。特定の実施形態では、β−グルコシダーゼ活性を有する第4のポリペプチドは、配列番号54、56、58、60、62、64、66、68、70、72、74、76、78、79、93、及び95のうちのいずれか1つの配列と、少なくとも約10残基(例えば、少なくとも約10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、225、250、275、300残基)の領域にわたって少なくとも約60%(例えば、少なくとも約60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%)配列同一性を有する。特定の実施形態では、β−グルコシダーゼを有する第4のポリペプチドは、2種以上のβ−グルコシダーゼ配列を含むキメラ/融合ポリペプチドであり、第1のβ−グルコシダーゼに由来する第1の配列は、少なくともアミノ酸残基約200個分の長さであり、及び配列番号96〜108の配列モチーフのうちの1つ以上又は全てを含み、一方で第2のβ−グルコシダーゼに由来する第2の配列は、少なくともアミノ酸残基約50個分の長さであり、及び配列番号109〜116の配列モチーフのうちの1つ以上又は全てを含み、及び同様に場合により第3の配列は、第3のβ−グルコシダーゼに由来するループ配列をアミノ酸残基約3、4、5、6、7、8、9、10、又は11個分の長さでコードしておりアミノ酸配列FDRRSPG(配列番号204)又はFD(R/K)YNIT(配列番号205)を有する。詳細には、2つ以上のβ−グルコシダーゼ配列のうち1つ目の配列は、少なくともアミノ酸残基約200個分の長さであり、配列番号197〜202のアミノ酸配列モチーフのうち少なくとも2つ(例えば、少なくとも2、3、4、又は全て)を含み、及び2つ以上のβ−グルコシダーゼ配列のうち2つ目の配列は、少なくともアミノ酸残基約50個分の長さであり、配列番号203を含み、及び同様に場合により第3の配列は、第1又は第2のβ−グルコシダーゼポリペプチドとは異なる第3のβ−グルコシダーゼポリペプチドに由来し、アミノ酸残基約3、4、5、6、7、8、9、10、又は11個分の長さであり、かつアミノ酸配列FDRRSPG(配列番号204)又はFD(R/K)YNIT(配列番号205)を有する。例えば、β−グルコシダーゼ活性を有する第4のポリペプチドは、少なくとも200残基長のFv3C(配列番号60)に対して、例えば、Fv3C(配列番号60)のN末端から少なくとも200残基に対して、すなわちN末端付近の位置のアミノ酸に対して少なくとも約60%配列同一性を有する第1の配列、並びに少なくとも50残基長のT.リーゼイ(T. reesei)Bgl3(Tr3B,配列番号64)に対して、例えば、配列番号64のC末端若しくはC末端付近の残基から少なくとも50残基長に対して、少なくとも約60%配列同一性を有する第2の配列、を含む。第4のポリペプチドは、更に、Te3A(配列番号66)の相当する長さの配列に由来するアミノ酸残基約3、4、5、6、7、8、9、10、又は11個からなる第3の配列を含んでもよく、又はFDRRSPG(配列番号204)若しくはFD(R/K)YNIT(配列番号205)のアミノ酸配列を含んでもよい。一部の実施形態では、第4のポリペプチドは、配列番号93又は95に対して、あるいは配列番号93又は95の少なくとも約20、30、40、50、60、又は70個以上の残基からなる下位配列又は断片に対して少なくとも約60%配列同一性を有する配列を含む。
一部の実施形態では、遺伝子操作型酵素組成物は、GH61/エンドグルカナーゼ活性を有する第5のポリペプチド、あるいはGH61エンドグルカナーゼに富む全セルラーゼを更に含む。例えば、GH61/エンドグルカナーゼ活性を有するポリペプチドは、T.リーゼイ(T. reesei)Eg4などのEGIVポリペプチドである。GH61エンドグルカナーゼに富む全セルラーゼは、例えば、T.リーゼイ(T. reesei)Eg4などのEGIVポリペプチドに富む全セルラーゼである。一部の実施形態では、第5のポリペプチドは、配列番号52、80〜81、206〜207のうちのいずれか1つの配列と、少なくとも約10残基(例えば、少なくとも約10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、225、250、275、300残基)の領域にわたって少なくとも約60%(例えば、少なくとも約60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%)配列同一性を有し、又は(1)配列番号84、及び88;(2)配列番号85、及び88;(3)配列番号86;(4)配列番号87;(5)配列番号84、88、及び89;(6)配列番号85、88、及び89;(7)配列番号84、88、及び90;(8)配列番号85、88、及び90;(9)配列番号84、88、及び91;(10)配列番号85、88、及び91;(11)配列番号84、88、89、及び91;(12)配列番号84、88、90、及び91;(13)配列番号85、88、89、及び91;及び(14)配列番号85、88、90、及び91からなる群から選択される1種以上の配列モチーフを含む。一部の実施形態では、酵素組成物は、セロビオースデヒドロゲナーゼを更に含む。
一部の実施形態では、キシラナーゼ活性を有する第1のポリペプチドは、配列番号24、26、42、及び43のいずれか1つに対し、あるいはこれらの成熟配列に対し少なくとも約70%配列同一性を有する。例えば、第1のポリペプチドは、AfuXyn2、AfuXyn5、T.リーゼイ(T. reesei)Xyn3、又はT.リーゼイ(T. reesei)Xyn2である。
一部の実施形態では、キシロシダーゼ活性を有する第2のポリペプチドは、第1群又は第2群のβ−キシロシダーゼポリペプチドから選択される。第1群のβ−キシロシダーゼポリペプチドは、配列番号2及び10のいずれか1つに対し、あるいはこれらの成熟配列に対し少なくとも約70%配列同一性を有する。例えば、第1群のβ−キシロシダーゼはFv3A又はFv43Aであり得る。第2群のβ−キシロシダーゼポリペプチドは、配列番号4、6、8、10、12、14、16、18、28、30及び45のいずれか1つの配列に対し、又はこれらの成熟配列に対し少なくとも約70%配列同一性を有する。例えば、第2群のβ−キシロシダーゼは、Pf43A、Fv43E、Fv39A、Fv43B、Pa51A、Gz43A、Fo43A、Fv43D、Pf43B、又はT.リーゼイ(T. reesei)Bxl1であってよい。
一部の実施形態では、アラビノフラノシダーゼ活性を有する第3のポリペプチドは、配列番号12、14、20、22及び32のいずれか1つに対し、又はこれらの成熟配列に対し少なくとも約70%配列同一性を有する。例えば、第3のポリペプチドは、Fv43B、Pa51A、Af43A、Pf51A、又はFv51Aであってよい。
第1、第2、第3、第4又は第5のポリペプチドは、天然に得られる資源から単離されたものであっても又は精製されたものであってもよい。あるいは、組み換え宿主細胞により発現又は過剰発現させることもできる。これらのペプチドは、単離又は精製形態で酵素組成物に加える事ができる。これらは、培養混合物、例えば、発酵ブロスの一部として、宿主生物又は宿主細胞により発現又は過剰発現させることもできる。一部の実施形態では、このようなポリペプチドをコードしている遺伝子は、コードさせたポリペプチドを宿主生物により発現させることのできる、宿主生物の遺伝子物質に組み込むことができる。
本発明の遺伝子操作型酵素組成物の第2の非限定例は、(1)キシラナーゼ活性を有する第1のポリペプチド、(2)キシロシダーゼ活性を有する第2のポリペプチド、(3)アラビノフラノシダーゼ活性を有する第3のポリペプチド、及び(4)β−グルコシダーゼに富む全セルラーゼ組成物を含む。特定の実施形態では、β−グルコシダーゼに富む全セルラーゼ組成物は、配列番号54、56、58、60、62、64、66、68、70、72、74、76、78、79、93、及び95のうちのいずれか1つの配列と、少なくとも約10残基(例えば、少なくとも約10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、225、250、275、300残基)の領域にわたって少なくとも約60%(例えば、少なくとも約60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%)配列同一性を有するβ−グルコシダーゼポリペプチドに富む。特定の実施形態では、β−グルコシダーゼに富む全セルラーゼ組成物は、2種以上のβ−グルコシダーゼ配列を含むβ−グルコシダーゼのキメラ/融合ポリペプチドに富み、第1のβ−グルコシダーゼに由来する第1の配列は、少なくともアミノ酸残基200個分の長さであり、かつ配列番号96〜108の配列モチーフのうちの1つ以上又は全てを含み、一方、第2のβ−グルコシダーゼに由来する第2の配列は、少なくともアミノ酸残基約50個分の長さであり、かつ配列番号109〜116の配列モチーフのうちの1つ以上又は全てを含み、及び同様に場合により第3の配列は、第3のβ−グルコシダーゼに由来するループ配列をアミノ酸残基約3、4、5、6、7、8、9、10、又は11個分の長さでコードしており、かつアミノ酸配列FDRRSPG(配列番号204)又はFD(R/K)YNIT(配列番号205)を有する。詳細には、2つ以上のβ−グルコシダーゼ配列のうち1つ目の配列は、少なくともアミノ酸残基約200個分の長さであり、配列番号197〜202のアミノ酸配列モチーフのうち少なくとも2つ(例えば、少なくとも2、3、4、又は全て)を含み、及び2つ以上のβ−グルコシダーゼ配列のうち2つ目の配列は、少なくともアミノ酸残基約50個分の長さであり、配列番号203を含み、及び同様に場合により第3の配列は、第1又は第2のβ−グルコシダーゼポリペプチドとは異なる第3のβ−グルコシダーゼポリペプチドに由来し、アミノ酸残基約3、4、5、6、7、8、9、10、又は11個分の長さであり、かつアミノ酸配列FDRRSPG(配列番号204)又はFD(R/K)YNIT(配列番号205)を有する。例えば、β−グルコシダーゼに富む全セルラーゼ組成物は、少なくとも200残基長のFv3C(配列番号60)と、例えば、配列番号60のN末端又はN末端近傍から少なくとも200残基と、少なくとも約60%配列同一性を有する第1の配列、並びに少なくとも50残基長のT.リーゼイ(T. reesei)Bgl3(Tr3B、配列番号64)と、並びに少なくとも50残基のT.リーゼイ(T. reesei)Bgl3(Tr3B、配列番号64)と、例えば、配列番号64のC末端又はC末端近傍の残基から少なくとも50残基と、少なくとも約60%配列同一性を有する第2の配列とを含むβ−グルコシダーゼポリペプチドに富む。β−グルコシダーゼに富む全セルラーゼ組成物は、Te3A(配列番号66)の相当する長さの配列に由来する又はアミノ酸配列FDRRSPG(配列番号204)若しくはFD(R/K)YNIT(配列番号205)を有する、約3、4、5、6、7、8、9、10、又は11個のアミノ酸残基からなる第3の配列を更に含む、β−グルコシダーゼポリペプチドに富む。一部の実施形態では、第4のポリペプチドは、配列番号93又は95に対し、あるいは配列番号93又は95の少なくとも約20、30、40、50、60、又は70個以上の残基を含む下位配列若しくは断片に対し、少なくとも約60%の配列同一性を有する配列を含む。
一部の実施形態では、遺伝子操作型酵素組成物は、GH61/エンドグルカナーゼ活性を有する第4のポリペプチド、あるいはGH61エンドグルカナーゼに富む全セルラーゼを更に含む。例えば、GH61/エンドグルカナーゼ活性を有するポリペプチドは、T.リーゼイ(T. reesei)Eg4ポリペプチドなどのEGIVポリペプチドである。一部の実施形態では、GH61エンドグルカナーゼに富む全セルラーゼは、例えば、T.リーゼイ(T. reesei)Eg4ポリペプチドなどのEGIVポリペプチドに富む全セルラーゼである。
一部の実施形態では、第4のポリペプチドは、配列番号52、80〜81、206〜207と、少なくとも約10残基(例えば、少なくとも約10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、225、250、275、300残基)の領域にわたって少なくとも約60%(例えば、少なくとも約60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%)同一性を有するものであるか、あるいは(1)配列番号84、及び88;(2)配列番号85、及び88;(3)配列番号86;(4)配列番号87;(5)配列番号84、88、及び89;(6)配列番号85、88、及び89;(7)配列番号84、88、及び90;(8)配列番号85、88、及び90;(9)配列番号84、88、及び91;(10)配列番号85、88、及び91;(11)配列番号84、88、89、及び91;(12)配列番号84、88、90、及び91;(13)配列番号85、88、89、及び91:及び(14)配列番号85、88、90、及び91からなる群から選択される配列モチーフを1つ以上含むものである。一部の実施形態では、酵素組成物は更に、セロビオースデヒドロゲナーゼを含む。
一部の実施形態では、キシラナーゼ活性を有する第1のポリペプチドは、配列番号24、26、42、及び43のいずれか1つに対し、あるいはこれらの成熟配列に対し少なくとも約70%配列同一性を有する。例えば、第1のポリペプチドは、AfuXyn2、AfuXyn5、T.リーゼイ(T. reesei)Xyn3、又はT.リーゼイ(T. reesei)Xyn2である。
一部の実施形態では、キシロシダーゼ活性を有する第2のポリペプチドは、第1群又は第2群のいずれかのβ−キシロシダーゼポリペプチドから選択される。第1群のβ−キシロシダーゼポリペプチドは、配列番号2及び10のいずれか1つに対し、あるいはこれらの成熟配列に対し少なくとも約70%配列同一性を有する。例えば、第1群のβ−キシロシダーゼはFv3A又はFv43Aである。第2群のβ−キシロシダーゼポリペプチドは、配列番号4、6、8、10、12、14、16、18、28、30及び45のいずれか1つの配列に対し、又はこれらの成熟配列に対し少なくとも約70%配列同一性を有する。例えば、第2群のβ−キシロシダーゼは、Pf43A、Fv43E、Fv39A、Fv43B、Pa51A、Gz43A、Fo43A、Fv43D、Pf43B、又はT.リーゼイ(T. reesei)Bxl1であってよい。
一部の実施形態では、アラビノフラノシダーゼ活性を有する第3のポリペプチドは、配列番号12、14、20、22及び32のいずれか1つに対し、又はこれらの成熟配列に対し少なくとも約70%配列同一性を有する。例えば、第3のポリペプチドは、Fv43B、Pa51A、Af43A、Pf51A、又はFv51Aであってよい。
第1、第2、第3、又は第4のポリペプチドは、天然に得られる資源から単離されたものであっても又は精製されたものであってもよい。あるいは、組み換え宿主細胞により発現又は過剰発現させることもできる。これらのペプチドは、単離又は精製形態で酵素組成物に加える事ができる。これらは、培養混合物、例えば、発酵ブロスの一部として、宿主生物又は宿主細胞により発現又は過剰発現させることもできる。一部の実施形態では、このようなポリペプチドをコードしている遺伝子は、コードさせたポリペプチドを宿主生物により発現させることのできる、宿主生物の遺伝子物質に組み込むことができる。
本発明の遺伝子操作型酵素組成物の第3の非限定例は、(1)キシラナーゼ活性を有する第1のポリペプチド;(2)キシロシダーゼ活性を有する第2のポリペプチド;(3)アラビノフラノシダーゼ活性を有する第3のポリペプチド;及び(4)GH61/エンドグルカナーゼ活性を有する第4のポリペプチド、又はGH61エンドグルカナーゼに富む全セルラーゼを含む。一部の実施形態では、GH61/エンドグルカナーゼ活性を有する第4のポリペプチドはEGIVポリペプチドである。一部の実施形態では、GH61/エンドグルカナーゼ活性を有するポリペプチドは、好適な微生物から得られる、例えば、T.リーゼイ(T. reesei)Eg4ポリペプチドなどのEGIVポリペプチドである。一部の実施形態では、GH61エンドグルカナーゼに富む全セルラーゼは、例えば、T.リーゼイ(T. reesei)Eg4ポリペプチドなどのEGIVポリペプチドに富む全セルラーゼである。一部の実施形態では、第4のポリペプチドは、配列番号52、80〜81、206〜207のうちのいずれか1つの配列と、少なくとも約10残基(例えば、少なくとも約10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、225、250、275、300残基)の領域にわたって少なくとも約60%(例えば、少なくとも約60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%)配列同一性を有するものであるか、あるいは(1)配列番号84、及び88;(2)配列番号85、及び88;(3)配列番号86;(4)配列番号87;(5)配列番号84、88、及び89;(6)配列番号85、88、及び89;(7)配列番号84、88、及び90;(8)配列番号85、88、及び90;(9)配列番号84、88、及び91;(10)配列番号85、88、及び91;(11)配列番号84、88、89、及び91;(12)配列番号84、88、90、及び91;(13)配列番号85、88、89、及び91:及び(14)配列番号85、88、90、及び91からなる群から選択される1つ以上の配列モチーフを含むものである。組成物には更にセロビオースデヒドロゲナーゼを含ませることもできる。
一部の実施形態では、キシラナーゼ活性を有する第1のポリペプチドは、配列番号24、26、42、及び43のいずれか1つに対し、あるいはこれらの成熟配列に対し少なくとも約70%配列同一性を有する。例えば、第1のポリペプチドは、AfuXyn2、AfuXyn5、T.リーゼイ(T. reesei)Xyn3、又はT.リーゼイ(T. reesei)Xyn2であってよい。
一部の実施形態では、キシロシダーゼ活性を有する第2のポリペプチドは、第1群又は第2群のいずれかのβ−キシロシダーゼポリペプチドから選択されてよい。第1群のβ−キシロシダーゼポリペプチドは、配列番号2及び10のいずれか1つの配列又はこれらの成熟配列に対し少なくとも約70%配列同一性を有する。例えば、第1群のβ−キシロシダーゼはFv3A又はFv43Aであってよい。第2群のβ−キシロシダーゼポリペプチドは、配列番号4、6、8、10、12、14、16、18、28、30及び45のいずれか1つの配列に対し、又はこれらの成熟配列に対し少なくとも約70%配列同一性を有する。例えば、第2群のβ−キシロシダーゼは、Pf43A、Fv43E、Fv39A、Fv43B、Pa51A、Gz43A、Fo43A、Fv43D、Pf43B、又はT.リーゼイ(T. reesei)Bxl1であってよい。
一部の実施形態では、アラビノフラノシダーゼ活性を有する第3のポリペプチドは、配列番号12、14、20、22及び32のいずれか1つに対し、又はこれらの成熟配列に対し少なくとも約70%配列同一性を有する。例えば、第3のポリペプチドは、Fv43B、Pa51A、Af43A、Pf51A、又はFv51Aであってよい。
第1、第2、第3、第4又はその他のポリペプチドは、天然に得られる資源から単離されたものであっても又は精製されたものであってもよい。あるいは、組み換え宿主細胞により発現又は過剰発現させることもできる。これらのペプチドは、単離又は精製形態で酵素組成物に加える事ができる。これらは、培養混合物、例えば、発酵ブロスの一部として、宿主生物又は宿主細胞により発現又は過剰発現させることもできる。一部の実施形態では、このようなポリペプチドをコードしている遺伝子は、コードさせたポリペプチドを宿主生物により発現させることのできる、宿主生物の遺伝子物質に組み込むことができる。
本発明の遺伝子操作酵素組成物の第4の非限定例は、(1)キシロシダーゼ活性を有する第1のポリペプチド、(2)キシロシダーゼ活性(第1のポリペプチドとは異なる)を有する第2のポリペプチド、(3)アラビノフラノシダーゼ活性を有する第3のポリペプチド、及び(4)β−グルコシダーゼ活性を有する第4のポリペプチドを含む。特定の実施形態では、第4のポリペプチドは、配列番号54、56、58、60、62、64、66、68、70、72、74、76、78、79、93、及び95のいずれか1つの配列と、少なくとも約10残基(例えば、少なくとも約10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、225、250、275、300残基)の領域にわたって少なくとも約60%(例えば、少なくとも約60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%)同一性を有する。特定の実施形態では、β−グルコシダーゼ活性を有する第4のポリペプチドは、2種以上のβ−グルコシダーゼ配列を含むキメラ/融合ポリペプチドβ−グルコシダーゼであり、第1のβ−グルコシダーゼに由来する第1の配列は、少なくともアミノ酸残基約200個分の長さであり、及び配列番号96〜108の配列モチーフのうちの1つ以上又は全てを含み、一方で第2のβ−グルコシダーゼに由来する第2の配列は、少なくともアミノ酸残基約50個分の長さであり、及び配列番号109〜116の配列モチーフのうちの1つ以上又は全てを含み、及び同様に場合により第3の配列は、第3のβ−グルコシダーゼに由来するループ配列をアミノ酸残基約3、4、5、6、7、8、9、10、又は11個分の長さでコードしており、かつアミノ酸配列FDRRSPG(配列番号204)又はFD(R/K)YNIT(配列番号205)を有する。詳細には、2つ以上のβ−グルコシダーゼ配列のうち1つ目の配列は、少なくともアミノ酸残基約200個分の長さであり、配列番号197〜202のアミノ酸配列モチーフのうち少なくとも2つ(例えば、少なくとも2、3、4、又は全て)を含み、及び2つ以上のβ−グルコシダーゼ配列のうち2つ目の配列は、少なくともアミノ酸残基約50個分の長さであり、配列番号203を含み、及び同様に場合により第3の配列は、第1又は第2のβ−グルコシダーゼポリペプチドとは異なる第3のβ−グルコシダーゼポリペプチドに由来し、アミノ酸残基約3、4、5、6、7、8、9、10、又は11個分の長さであり、かつアミノ酸配列FDRRSPG(配列番号204)又はFD(R/K)YNIT(配列番号205)を有する。例えば、第4のポリペプチドは、少なくとも200残基長のFv3C(配列番号60)と、例えば、配列番号60のN末端又はN末端近傍から少なくとも200残基と、少なくとも約60%配列同一性を有する第1の配列、並びに少なくとも50残基長のT.リーゼイ(T. reesei)Bgl3(Tr3B、配列番号64)と、例えば、配列番号64のC末端又はC末端付近の残基から少なくとも50残基と、少なくとも約60%配列同一性を有する第2の配列を含む。第4のポリペプチドは、相当する長さのTe3A配列(配列番号66)に由来する約3、4、5、6、7、8、9、10、又は11個のアミノ酸残基からなる第3の配列を更に含み、あるいはFDRRSPG(配列番号204)又はFD(R/K)YNIT(配列番号205)のアミノ酸配列を有する。一部の実施形態では、第4のポリペプチドは、配列番号93又は95に対して、あるいは配列番号93又は95の少なくとも約20、30、40、50、60、又は70個以上の残基からなる下位配列又は断片に対して少なくとも約60%配列同一性を有する。
一部の実施形態では、酵素組成物は、GH61/エンドグルカナーゼ活性を有する第5のポリペプチド、あるいはGH61エンドグルカナーゼに富む全セルラーゼを更に含み得る。例えば、GH61/エンドグルカナーゼ活性を有するポリペプチドは、例えば、T.リーゼイ(T. reesei)Eg4などのバクテリア又は真菌といった好適な微生物由来のEGIVポリペプチドである。一部の実施形態では、第5のポリペプチドはGH61エンドグルカナーゼポリペプチドであり、配列番号52、80〜81、206〜207のうちのいずれか1つの配列と、少なくとも約10残基(例えば、少なくとも約10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、225、250、275、300残基)の領域にわたって少なくとも約60%(例えば、少なくとも約60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%)配列同一性を有し、あるいは(1)配列番号84、及び88;(2)配列番号85、及び88;(3)配列番号86;(4)配列番号87;(5)配列番号84、88、及び89;(6)配列番号85、88、及び89;(7)配列番号84、88、及び90;(8)配列番号85、88、及び90;(9)配列番号84、88、及び91;(10)配列番号85、88、及び91;(11)配列番号84、88、89、及び91;(12)配列番号84、88、90、及び91;(13)配列番号85、88、89、及び91:及び(14)配列番号85、88、90、及び91からなる群から選択される1つ以上の配列モチーフを含む。酵素組成物には更にセロビオースデヒドロゲナーゼを含ませることもできる。
特定の実施形態では、キシロシダーゼ活性を有する第1ポリペプチドは、第1群のβ−キシロシダーゼポリペプチドから選択されたものである。第1群のβ−キシロシダーゼポリペプチドは、配列番号2及び10のいずれか1つに対し、あるいはこれらの成熟配列に対し少なくとも約70%配列同一性を有する。例えば、β−キシロシダーゼ群はFv3A又はFv43Aであってよい。
特定の実施形態では、キシロシダーゼ活性を有する第2ポリペプチドは、第2群のβ−キシロシダーゼポリペプチドから選択されたものである。第2群のβ−キシロシダーゼポリペプチドは、配列番号4、6、8、10、12、14、16、18、28、30及び45のいずれか1つの配列に対し、又はこれらの成熟配列に対し少なくとも約70%配列同一性を有する。例えば、第2群のβ−キシロシダーゼは、Pf43A、Fv43E、Fv39A、Fv43B、Pa51A、Gz43A、Fo43A、Fv43D、Pf43B、又はT.リーゼイ(T. reesei)Bxl1であってよい。
一部の実施形態では、アラビノフラノシダーゼ活性を有する第3のポリペプチドは、配列番号12、14、20、22及び32のいずれか1つに対し、又はこれらの成熟配列に対し少なくとも約70%配列同一性を有する。例えば、第3のポリペプチドは、Fv43B、Pa51A、Af43A、Pf51A、又はFv51Aであってよい。
第1、第2、第3、第4、第5又はその他のポリペプチドは、天然に得られる資源から単離されたものであっても又は精製されたものであってもよい。あるいは、組み換え宿主細胞により発現又は過剰発現させることもできる。これらのペプチドは、単離又は精製形態で酵素組成物に加える事ができる。これらは、培養混合物、例えば、発酵ブロスの一部として、宿主生物又は宿主細胞により発現又は過剰発現させることもできる。一部の実施形態では、このようなポリペプチドをコードしている遺伝子は、コードさせたポリペプチドを宿主生物により発現させることのできる、宿主生物の遺伝子物質に組み込むことができる。
酵素組成物の第5の非限定例は、(1)キシロシダーゼ活性を有する第1のポリペプチド、(2)キシロシダーゼ活性を有する第2のポリペプチド(第1のポリペプチドとは異なる)、及び(3)アラビノフラノシダーゼ活性を有する第3のポリペプチド、及び(4)β−グルコシダーゼに富む全セルラーゼ、を含む。特定の実施形態では、β−グルコシダーゼに富む全セルラーゼ組成物は、配列番号54、56、58、60、62、64、66、68、70、72、74、76、78、79、93、及び95のうちのいずれか1つの配列と、少なくとも約10残基(例えば、少なくとも約10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、225、250、275、300残基)の領域にわたって少なくとも約60%(例えば、少なくとも約60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%)配列同一性を有するポリペプチドに富む。特定の実施形態では、β−グルコシダーゼに富む全セルラーゼは、2つ以上のβ−グルコシダーゼ配列からなるβ−グルコシダーゼのキメラ/融合ポリペプチドに富み、第1のβ−グルコシダーゼに由来する第1の配列は、少なくともアミノ酸残基約200個分の長さであり、配列番号96〜108のアミノ酸配列モチーフのうち1種以上又は全てを含むのに対し、第2のβ−グルコシダーゼに由来する第2の配列は、少なくともアミノ酸残基約50個分の長さであり、配列番号109〜116のアミノ酸配列モチーフのうち1種以上又は全てを含み、及び同様に場合により、第3の配列は、第3のβ−グルコシダーゼに由来するループ配列をアミノ酸残基3、4、5、6、7、8、9、10、又は11個分の長さでコードしており、アミノ酸配列FDRRSPG(配列番号204)又はFD(R/K)YNIT(配列番号205)を有する。例えば、β−グルコシダーゼに富む全セルラーゼは、少なくとも200残基長のFv3C(配列番号60)と、例えば、配列番号60のN末端又はN末端近傍から少なくとも200残基と、少なくとも約60%配列同一性を有する第1の配列、並びに少なくとも50残基長のT.リーゼイ(T. reesei)Bgl3(Tr3B、配列番号64)と、例えば、配列番号64のC末端又はC末端近傍の残基から少なくとも50残基と、少なくとも約60%配列同一性を有する第2の配列を含む。特定の実施形態では、β−グルコシダーゼに富む全セルラーゼは、Te3A(配列番号66)の相当する長さの配列に由来する又はアミノ酸配列FDRRSPG(配列番号204)若しくはFD(R/K)YNIT(配列番号205)を有する配列に由来する、約3、4、5、6、7、8、9、10、又は11個のアミノ酸残基からなる第3の配列を更に含む、ポリペプチドに富む。例えば、β−グルコシダーゼに富む全セルラーゼは、配列番号93又は95と、あるいは配列番号93又は95の少なくとも約20、30、40、50、60、又は70残基以上からなる下位配列又は断片と、少なくとも約60%配列同一性を有するポリペプチドに富む。
特定の実施形態では、酵素組成物は、GH61/エンドグルカナーゼ活性を有する第4のポリペプチド、あるいはGH61エンドグルカナーゼに富む全セルラーゼを更に含み得る。例えば、GH61/エンドグルカナーゼ活性を有するポリペプチドは、例えば、T.リーゼイ(T. reesei)Eg4などのバクテリア又は真菌といった好適な微生物由来のEGIVポリペプチドである。一部の実施形態では、第5のポリペプチドはGH61エンドグルカナーゼポリペプチドであり、配列番号52、80〜81、206〜207のうちのいずれか1つの配列と、少なくとも約10残基(例えば、少なくとも約10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、225、250、275、300残基)の領域にわたって少なくとも約60%(例えば、少なくとも約60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%)配列同一性を有し、あるいは(1)配列番号84及び88;(2)配列番号85及び88;(3)配列番号86;(4)配列番号87;(5)配列番号84、88及び89;(6)配列番号85、88、及び89;(7)配列番号84、88、及び90;(8)配列番号85、88及び90;(9)配列番号84、88及び91;(10)配列番号85、88及び91;(11)配列番号84、88、89及び91;(12)配列番号84、88、90及び91;(13)配列番号85、88、89及び91:並びに(14)配列番号85、88、90及び91からなる群から選択される1つ以上の配列モチーフを含む。酵素組成物には更にセロビオースデヒドロゲナーゼを含ませることもできる。
特定の実施形態では、キシロシダーゼ活性を有する第1ポリペプチドは、第1群のβ−キシロシダーゼポリペプチドから選択されたものである。第1群のβ−キシロシダーゼポリペプチドは、配列番号2及び10のいずれか1つに対し、あるいはこれらの成熟配列に対し少なくとも約70%配列同一性を有する。例えば、β−キシロシダーゼ群はFv3A又はFv43Aであってよい。
特定の実施形態では、キシロシダーゼ活性を有する第2ポリペプチドは、第2群のβ−キシロシダーゼポリペプチドから選択されたものである。第2群のβ−キシロシダーゼポリペプチドは、配列番号4、6、8、10、12、14、16、18、28、30及び45のいずれか1つの配列に対し、又はこれらの成熟配列に対し少なくとも約70%配列同一性を有する。例えば、第2群のβ−キシロシダーゼは、Pf43A、Fv43E、Fv39A、Fv43B、Pa51A、Gz43A、Fo43A、Fv43D、Pf43B、又はT.リーゼイ(T. reesei)Bxl1であってよい。
一部の実施形態では、アラビノフラノシダーゼ活性を有する第3のポリペプチドは、配列番号12、14、20、22及び32のいずれか1つに対し、又はこれらの成熟配列に対し少なくとも約70%配列同一性を有する。例えば、第3のポリペプチドは、Fv43B、Pa51A、Af43A、Pf51A、又はFv51Aであってよい。
第1、第2、第3、第4又はその他のポリペプチドは、天然に得られる資源から単離されたものであっても又は精製されたものであってもよい。あるいは、組み換え宿主細胞により発現又は過剰発現させることもできる。これらのペプチドは、単離又は精製形態で酵素組成物に加える事ができる。これらは、培養混合物、例えば、発酵ブロスの一部として、宿主生物又は宿主細胞により発現又は過剰発現させることもできる。一部の実施形態では、このようなポリペプチドをコードしている遺伝子は、コードさせたポリペプチドを宿主生物により発現させることのできる、宿主生物の遺伝子物質に組み込むことができる。
本発明の遺伝子操作型酵素組成物の第6の非限定例は、(1)キシロシダーゼ活性を有する第1のポリペプチド;(2)キシロシダーゼ活性を有する第2のポリペプチド(第1のポリペプチドとは異なる);(3)アラビノフラノシダーゼ活性を有する第3のポリペプチド;及び(4)GH61/エンドグルカナーゼ活性を有する第4のポリペプチド、又はEGIVに富む全セルラーゼを含む。例えば、GH61/エンドグルカナーゼ活性を有するポリペプチドは、例えば、T.リーゼイ(T. reesei)Eg4などのバクテリア又は真菌といった好適な微生物由来のEGIVポリペプチドである。一部の実施形態では、第5のポリペプチドはGH61エンドグルカナーゼポリペプチドであり、配列番号52、80〜81、206〜207のうちのいずれか1つの配列と、少なくとも約10残基(例えば、少なくとも約10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、225、250、275、300残基)の領域にわたって少なくとも約60%(例えば、少なくとも約60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%)配列同一性を有し、あるいは(1)配列番号84、及び88;(2)配列番号85、及び88;(3)配列番号86;(4)配列番号87;(5)配列番号84、88、及び89;(6)配列番号85、88、及び89;(7)配列番号84、88、及び90;(8)配列番号85、88、及び90;(9)配列番号84、88、及び91;(10)配列番号85、88、及び91;(11)配列番号84、88、89、及び91;(12)配列番号84、88、90、及び91;(13)配列番号85、88、89、及び91:及び(14)配列番号85、88、90、及び91からなる群から選択される1つ以上の配列モチーフを含む。酵素組成物には更にセロビオースデヒドロゲナーゼを含ませることもできる。
特定の実施形態では、キシロシダーゼ活性を有する第1ポリペプチドは、第1群のβ−キシロシダーゼポリペプチドから選択されたものである。第1群のβ−キシロシダーゼポリペプチドは、配列番号2及び10のいずれか1つに対し、あるいはこれらの成熟配列に対し少なくとも約70%配列同一性を有する。例えば、β−キシロシダーゼ群はFv3A又はFv43Aであってよい。
特定の実施形態では、キシロシダーゼ活性を有する第2ポリペプチドは、第2群のβ−キシロシダーゼポリペプチドから選択されたものである。第2群のβ−キシロシダーゼポリペプチドは、配列番号4、6、8、10、12、14、16、18、28、30及び45のいずれか1つの配列に対し、又はこれらの成熟配列に対し少なくとも約70%配列同一性を有する。例えば、第2群のβ−キシロシダーゼは、Pf43A、Fv43E、Fv39A、Fv43B、Pa51A、Gz43A、Fo43A、Fv43D、Pf43B、又はT.リーゼイ(T. reesei)Bxl1であってよい。
一部の実施形態では、アラビノフラノシダーゼ活性を有する第3のポリペプチドは、配列番号12、14、20、22及び32のいずれか1つに対し、又はこれらの成熟配列に対し少なくとも約70%配列同一性を有する。例えば、第3のポリペプチドは、Fv43B、Pa51A、Af43A、Pf51A、又はFv51Aであってよい。
第1、第2、第3、第4又はその他のポリペプチドは、天然に得られる資源から単離されたものであっても又は精製されたものであってもよい。あるいは、組み換え宿主細胞により発現又は過剰発現させることもできる。これらのペプチドは、単離又は精製形態で酵素組成物に加える事ができる。これらは、培養混合物、例えば、発酵ブロスの一部として、宿主生物又は宿主細胞により発現又は過剰発現させることもできる。一部の実施形態では、このようなポリペプチドをコードしている遺伝子は、コードさせたポリペプチドを宿主生物により発現させることのできる、宿主生物の遺伝子物質に組み込むことができる。
本発明の遺伝子操作型酵素組成物の第7の非限定例は、(1)キシラナーゼ活性を有する第1のポリペプチド、(2)キシロシダーゼ活性を有する第2のポリペプチド、(3)キシロシダーゼ活性を有する第3のポリペプチド(第2のポリペプチドとは異なる)、及び(4)β−グルコシダーゼ活性を有する第4のポリペプチドを含む。特定の実施形態では、第4のポリペプチドは、配列番号54、56、58、60、62、64、66、68、70、72、74、76、78、79、93、及び95のいずれか1つの配列と、少なくとも約10残基(例えば、少なくとも約10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、225、250、275、300残基)の領域にわたって少なくとも約60%(例えば、少なくとも約60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%)同一性を有する。特定の実施形態では、第4のポリペプチドは、2つ以上のβ−グルコシダーゼ配列からなるβ−グルコシダーゼのキメラ/融合ポリペプチドであり、第1のβ−グルコシダーゼに由来する第1の配列は、少なくともアミノ酸残基約200個分の長さであり、配列番号96〜108のアミノ酸配列モチーフのうち1種以上又は全てを含むのに対し、第2のβ−グルコシダーゼに由来する第2の配列は、少なくともアミノ酸残基約50個分の長さであり、配列番号109〜116のアミノ酸配列モチーフのうち1種以上又は全てを含み、及び同様に場合により第3の配列は、第3のβ−グルコシダーゼに由来するループ配列をアミノ酸残基3、4、5、6、7、8、9、10、又は11個分の長さでコードしておりアミノ酸配列FDRRSPG(配列番号204)又はFD(R/K)YNIT(配列番号205)を有する。詳細には、2つ以上のβ−グルコシダーゼ配列のうち1つ目の配列は、少なくともアミノ酸残基約200個分の長さであり、配列番号197〜202のアミノ酸配列モチーフのうち少なくとも2つ(例えば、少なくとも2、3、4、又は全て)を含み、及び2つ以上のβ−グルコシダーゼ配列のうち2つ目の配列は、少なくともアミノ酸残基約50個分の長さであり、配列番号203を含み、及び同様に場合により第3の配列は、第1又は第2のβ−グルコシダーゼポリペプチドとは異なる第3のβ−グルコシダーゼポリペプチドに由来し、アミノ酸残基約3、4、5、6、7、8、9、10、又は11個分の長さであり、かつアミノ酸配列FDRRSPG(配列番号204)又はFD(R/K)YNIT(配列番号205)を有する。例えば、第4のポリペプチドは、少なくとも200残基長のFv3C(配列番号60)と、例えば、配列番号60のN末端又はN末端近傍から少なくとも200残基と、少なくとも約60%配列同一性を有する第1の配列、並びに少なくとも50残基長のT.リーゼイ(T. reesei)Bgl3(Tr3B、配列番号64)と、例えば、配列番号64のC末端又はC末端近傍の残基から少なくとも50残基と、少なくとも約60%配列同一性を有する第2の配列を含む。特定の実施形態では、第4のポリペプチドは、相当する長さのTe3A配列(配列番号66)に由来する約3、4、5、6、7、8、9、10、又は11個のアミノ酸残基からなる第3の配列を更に含み、あるいはFDRRSPG(配列番号204)又はFD(R/K)YNIT(配列番号205)のアミノ酸配列を有する。例えば、第4のポリペプチドは、配列番号93又は95に対して、あるいは配列番号93又は95の少なくとも約20、30、40、50、60、又は70個以上の残基からなる下位配列又は断片に対して少なくとも約60%配列同一性を有する配列を含む。
酵素組成物は、GH61/エンドグルカナーゼ活性を有する第5のポリペプチド、あるいはGH61エンドグルカナーゼに富む全セルラーゼを更に含み得る。例えば、GH61/エンドグルカナーゼ活性を有するポリペプチドは、例えば、T.リーゼイ(T. reesei)Eg4などのバクテリア又は真菌といった好適な微生物由来のEGIVポリペプチドである。一部の実施形態では、第5のポリペプチドはGH61エンドグルカナーゼポリペプチドであり、配列番号52、80〜81、206〜207のうちのいずれか1つの配列と、少なくとも約10残基(例えば、少なくとも約10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、225、250、275、300残基)の領域にわたって少なくとも約60%(例えば、少なくとも約60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%)配列同一性を有し、あるいは(1)配列番号84、及び88;(2)配列番号85、及び88;(3)配列番号86;(4)配列番号87;(5)配列番号84、88、及び89;(6)配列番号85、88、及び89;(7)配列番号84、88、及び90;(8)配列番号85、88、及び90;(9)配列番号84、88、及び91;(10)配列番号85、88、及び91;(11)配列番号84、88、89、及び91;(12)配列番号84、88、90、及び91;(13)配列番号85、88、89、及び91:及び(14)配列番号85、88、90、及び91からなる群から選択される1つ以上の配列モチーフを含む。酵素組成物には更にセロビオースデヒドロゲナーゼを含ませることもできる。
一部の実施形態では、キシラナーゼ活性を有する第1のポリペプチドは、配列番号24、26、42、及び43のいずれか1つに対し、あるいはこれらの成熟配列に対し少なくとも約70%配列同一性を有する。例えば、第1のポリペプチドは、AfuXyn2、AfuXyn5、T.リーゼイ(T. reesei)Xyn3、又はT.リーゼイ(T. reesei)Xyn2であってよい。
特定の実施形態では、キシロシダーゼ活性を有する第2のポリペプチドは、第1群のβ−キシロシダーゼポリペプチドから選択されたものである。第1群のβ−キシロシダーゼポリペプチドは、配列番号2及び10のいずれか1つに対し、あるいはこれらの成熟配列に対し少なくとも約70%配列同一性を有する。例えば、β−キシロシダーゼ群はFv3A又はFv43Aであってよい。
特定の実施形態では、キシロシダーゼ活性を有する第3ポリペプチドは、第2群のβ−キシロシダーゼポリペプチドから選択されたものである。第2群のβ−キシロシダーゼポリペプチドは、配列番号4、6、8、10、12、14、16、18、28、30及び45のいずれか1つの配列に対し、又はこれらの成熟配列に対し少なくとも約70%配列同一性を有する。例えば、第2群のβ−キシロシダーゼは、Pf43A、Fv43E、Fv39A、Fv43B、Pa51A、Gz43A、Fo43A、Fv43D、Pf43B、又はT.リーゼイ(T. reesei)Bxl1であってよい。
第1、第2、第3、第4、第5又はその他のポリペプチドは、天然に得られる資源から単離されたものであっても又は精製されたものであってもよい。あるいは、組み換え宿主細胞により発現又は過剰発現させることもできる。これらのペプチドは、単離又は精製形態で酵素組成物に加える事ができる。これらは、培養混合物、例えば、発酵ブロスの一部として、宿主生物又は宿主細胞により発現又は過剰発現させることもできる。一部の実施形態では、このようなポリペプチドをコードしている遺伝子は、コードさせたポリペプチドを宿主生物により発現させることのできる、宿主生物の遺伝子物質に組み込むことができる。
本発明の遺伝子操作型酵素組成物の第8の非限定例は、(1)キシラナーゼ活性を有する第1のポリペプチド、(2)キシロシダーゼ活性を有する第2のポリペプチド、(3)キシロシダーゼ活性を有する第3のポリペプチド(第2のポリペプチドとは異なる)、及びβ−グルコシダーゼに富む全セルラーゼ組成物を含む。特定の実施形態では、β−グルコシダーゼに富む全セルラーゼは、配列番号54、56、58、60、62、64、66、68、70、72、74、76、78、79、93、及び95のうちのいずれか1つの配列と、少なくとも約10残基(例えば、少なくとも約10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、225、250、275、300残基)の領域にわたって少なくとも約60%(例えば、少なくとも約60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%)同一性を有するポリペプチドに富む。特定の実施形態では、β−グルコシダーゼに富む全セルラーゼは、2つ以上のβ−グルコシダーゼ配列を含むβ−グルコシダーゼのキメラ/融合ポリペプチドに富み、第1のβ−グルコシダーゼに由来する第1の配列は、少なくともアミノ酸残基約200個分の長さであり、配列番号96〜108のアミノ酸配列モチーフのうち1種以上又は全てを含むのに対し、第2のβ−グルコシダーゼに由来する第2の配列は、少なくともアミノ酸残基約50個分の長さであり、配列番号109〜116のアミノ酸配列モチーフのうち1種以上又は全てを含み、及び同様に場合により第3の配列は、第3のβ−グルコシダーゼに由来するループ配列をアミノ酸残基約3、4、5、6、7、8、9、10、又は11個分の長さでコードしており、かつアミノ酸配列FDRRSPG(配列番号204)又はFD(R/K)YNIT(配列番号205)を有する。詳細には、2つ以上のβ−グルコシダーゼ配列のうち1つ目の配列は、少なくともアミノ酸残基約200個分の長さであり、配列番号197〜202のアミノ酸配列モチーフのうち少なくとも2つ(例えば、少なくとも2、3、4、又は全て)を含み、及び2つ以上のβ−グルコシダーゼ配列のうち2つ目の配列は、少なくともアミノ酸残基約50個分の長さであり、配列番号203を含み、及び同様に場合により第3の配列は、第1又は第2のβ−グルコシダーゼポリペプチドとは異なる第3のβ−グルコシダーゼポリペプチドに由来し、アミノ酸残基約3、4、5、6、7、8、9、10、又は11個分の長さであり、かつアミノ酸配列FDRRSPG(配列番号204)又はFD(R/K)YNIT(配列番号205)を有する。例えば、β−グルコシダーゼに富む全セルラーゼは、少なくとも200残基長のFv3C(配列番号60)と、例えば、配列番号60のN末端又はN末端近傍から少なくとも200残基と、少なくとも約60%配列同一性を有する第1の配列、並びに少なくとも50残基長のT.リーゼイ(T. reesei)Bgl3(Tr3B、配列番号64)と、例えば、配列番号64のC末端又はC末端近傍の残基から少なくとも50残基と、少なくとも約60%配列同一性を有する第2の配列を含む。一部の実施形態では、β−グルコシダーゼに富む全セルラーゼは、Te3A(配列番号66)の相当する長さの配列に由来する約3、4、5、6、7、8、9、10、又は11個のアミノ酸残基からなる第3の配列を更に含む、又はアミノ酸配列FDRRSPG(配列番号204)若しくはFD(R/K)YNIT(配列番号205)を有する、ポリペプチドに富む。例えば、β−グルコシダーゼに富む全セルラーゼは、配列番号93又は95と、あるいは配列番号93又は95の少なくとも約20、30、40、50、60、又は70残基以上からなる下位配列又は断片と、少なくとも約60%配列同一性を有する配列を含むポリペプチドに富む。
酵素組成物は、GH61/エンドグルカナーゼ活性を有する第4のポリペプチド、あるいはGH61エンドグルカナーゼに富む全セルラーゼを更に含み得る。例えば、GH61/エンドグルカナーゼ活性を有するポリペプチドは、例えば、T.リーゼイ(T. reesei)Eg4などのバクテリア又は真菌といった好適な微生物由来のEGIVポリペプチドである。一部の実施形態では、第4のポリペプチドはGH61エンドグルカナーゼポリペプチドであり、配列番号52、80〜81、206〜207のうちのいずれか1つの配列と、少なくとも約10残基(例えば、少なくとも約10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、225、250、275、300残基)の領域にわたって少なくとも約60%(例えば、少なくとも約60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%)配列同一性を有し、あるいは(1)配列番号84、及び88;(2)配列番号85、及び88;(3)配列番号86;(4)配列番号87;(5)配列番号84、88、及び89;(6)配列番号85、88、及び89;(7)配列番号84、88、及び90;(8)配列番号85、88、及び90;(9)配列番号84、88、及び91;(10)配列番号85、88、及び91;(11)配列番号84、88、89、及び91;(12)配列番号84、88、90、及び91;(13)配列番号85、88、89、及び91:及び(14)配列番号85、88、90、及び91からなる群から選択される1つ以上の配列モチーフを含む。酵素組成物には更にセロビオースデヒドロゲナーゼを含ませることもできる。
一部の実施形態では、キシラナーゼ活性を有する第1のポリペプチドは、配列番号24、26、42、及び43のいずれか1つに対し、あるいはこれらの成熟配列に対し少なくとも約70%配列同一性を有する。例えば、第1のポリペプチドは、AfuXyn2、AfuXyn5、T.リーゼイ(T. reesei)Xyn3、又はT.リーゼイ(T. reesei)Xyn2であってよい。
特定の実施形態では、キシロシダーゼ活性を有する第2のポリペプチドは、第1群のβ−キシロシダーゼポリペプチドから選択されたものである。第1群のβ−キシロシダーゼポリペプチドは、配列番号2及び10のいずれか1つに対し、あるいはこれらの成熟配列に対し少なくとも約70%配列同一性を有する。例えば、β−キシロシダーゼ群はFv3A又はFv43Aであってよい。
特定の実施形態では、キシロシダーゼ活性を有する第3ポリペプチドは、第2群のβ−キシロシダーゼポリペプチドから選択されたものである。第2群のβ−キシロシダーゼポリペプチドは、配列番号4、6、8、10、12、14、16、18、28、30及び45のいずれか1つの配列に対し、又はこれらの成熟配列に対し少なくとも約70%配列同一性を有する。例えば、第2群のβ−キシロシダーゼは、Pf43A、Fv43E、Fv39A、Fv43B、Pa51A、Gz43A、Fo43A、Fv43D、Pf43B、又はT.リーゼイ(T. reesei)Bxl1であってよい。
第1、第2、第3、第4又はその他のポリペプチドは、天然に得られる資源から単離されたものであっても又は精製されたものであってもよい。あるいは、組み換え宿主細胞により発現又は過剰発現させることもできる。これらのペプチドは、単離又は精製形態で酵素組成物に加える事ができる。これらは、培養混合物、例えば、発酵ブロスの一部として、宿主生物又は宿主細胞により発現又は過剰発現させることもできる。一部の実施形態では、このようなポリペプチドをコードしている遺伝子は、コードさせたポリペプチドを宿主生物により発現させることのできる、宿主生物の遺伝子物質に組み込むことができる。
本発明の遺伝子操作型酵素組成物の第9の非限定例は、(1)キシラナーゼ活性を有する第1のポリペプチド、(2)キシロシダーゼ活性を有する第2のポリペプチド、(3)キシロシダーゼ活性を有する第3のポリペプチド(第2のポリペプチドとは異なる)、及び(4)GH61/エンドグルカナーゼ活性を有する第4のポリペプチド、又はGH61エンドグルカナーゼに富む全セルラーゼ、を含む。一部の実施例では、GH61/エンドグルカナーゼ活性を有する第4のポリペプチドは、例えば、T.リーゼイ(T. reesei)Eg4などのバクテリア又は真菌といった好適な微生物由来のEGIVポリペプチドである。一部の実施形態では、第5のポリペプチドはGH61エンドグルカナーゼポリペプチドであり、配列番号52、80〜81、206〜207のうちのいずれか1つの配列と、少なくとも約10残基(例えば、少なくとも約10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、225、250、275、300残基)の領域にわたって少なくとも約60%(例えば、少なくとも約60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%)配列同一性を有し、あるいは(1)配列番号84及び88;(2)配列番号85及び88;(3)配列番号86;(4)配列番号87;(5)配列番号84、88及び89;(6)配列番号85、88、及び89;(7)配列番号84、88、及び90;(8)配列番号85、88及び90;(9)配列番号84、88及び91;(10)配列番号85、88及び91;(11)配列番号84、88、89及び91;(12)配列番号84、88、90及び91;(13)配列番号85、88、89及び91:並びに(14)配列番号85、88、90及び91からなる群から選択される1つ以上の配列モチーフを含む。酵素組成物には更にセロビオースデヒドロゲナーゼを含ませることもできる。
一部の実施形態では、キシラナーゼ活性を有する第1のポリペプチドは、配列番号24、26、42、及び43のいずれか1つに対し、あるいはこれらの成熟配列に対し少なくとも約70%配列同一性を有する。例えば、第1のポリペプチドは、AfuXyn2、AfuXyn5、T.リーゼイ(T. reesei)Xyn3、又はT.リーゼイ(T. reesei)Xyn2であってよい。
特定の実施形態では、キシロシダーゼ活性を有する第2のポリペプチドは、第1群のβ−キシロシダーゼポリペプチドから選択されたものである。第1群のβ−キシロシダーゼポリペプチドは、配列番号2及び10のいずれか1つに対し、あるいはこれらの成熟配列に対し少なくとも約70%配列同一性を有する。例えば、β−キシロシダーゼ群はFv3A又はFv43Aであってよい。
特定の実施形態では、キシロシダーゼ活性を有する第3ポリペプチドは、第2群のβ−キシロシダーゼポリペプチドから選択されたものである。第2群のβ−キシロシダーゼポリペプチドは、配列番号4、6、8、10、12、14、16、18、28、30及び45のいずれか1つの配列に対し、又はこれらの成熟配列に対し少なくとも約70%配列同一性を有する。例えば、第2群のβ−キシロシダーゼは、Pf43A、Fv43E、Fv39A、Fv43B、Pa51A、Gz43A、Fo43A、Fv43D、Pf43B、又はT.リーゼイ(T. reesei)Bxl1であってよい。
第1、第2、第3、第4又はその他のポリペプチドは、天然に得られる資源から単離されたものであっても又は精製されたものであってもよい。あるいは、組み換え宿主細胞により発現又は過剰発現させることもできる。これらのペプチドは、単離又は精製形態で酵素組成物に加える事ができる。これらは、培養混合物、例えば、発酵ブロスの一部として、宿主生物又は宿主細胞により発現又は過剰発現させることもできる。一部の実施形態では、このようなポリペプチドをコードしている遺伝子は、コードさせたポリペプチドを宿主生物により発現させることのできる、宿主生物の遺伝子物質に組み込むことができる。
本発明の遺伝子操作型酵素組成物の第10の非限定例は、(1)キシラナーゼ活性を有する第1のポリペプチド、(2)キシロシダーゼ活性を有する第2のポリペプチド、及び(3)β−グルコシダーゼ活性を有する第3のポリペプチドを含む。特定の実施形態では、第3のポリペプチドは、配列番号54、56、58、60、62、64、66、68、70、72、74、76、78、79、93、及び95のいずれか1つの配列と、少なくとも約10残基(例えば、少なくとも約10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、225、250、275、300残基)の領域にわたって少なくとも約60%(例えば、少なくとも約60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%)同一性を有する。特定の実施形態では、第3のポリペプチドは、2つ又はそれ以上のβ−グルコシダーゼ配列からなるβ−グルコシダーゼのキメラ/融合ポリペプチドであり、第1のβ−グルコシダーゼに由来する第1の配列は、少なくともアミノ酸残基約200個分の長さであり、配列番号96〜108のアミノ酸配列モチーフのうち1種以上又は全てを含むのに対し、第2のβ−グルコシダーゼに由来する第2の配列は、少なくともアミノ酸残基約50個分の長さであり、配列番号109〜116のアミノ酸配列モチーフのうち1種以上又は全てを含み、及び同様に場合により第3の配列は、第3のβ−グルコシダーゼに由来するループ配列をアミノ酸残基約3、4、5、6、7、8、9、10、又は11個分の長さでコードしており、かつアミノ酸配列FDRRSPG(配列番号204)又はFD(R/K)YNIT(配列番号205)を有する。詳細には、2つ以上のβ−グルコシダーゼ配列のうち1つ目の配列は、少なくともアミノ酸残基約200個分の長さであり、配列番号197〜202のアミノ酸配列モチーフのうち少なくとも2つ(例えば、少なくとも2、3、4、又は全て)を含み、及び2つ以上のβ−グルコシダーゼ配列のうち2つ目の配列は、少なくともアミノ酸残基約50個分の長さであり、配列番号203を含み、及び同様に場合により第3の配列は、第1又は第2のβ−グルコシダーゼポリペプチドとは異なる第3のβ−グルコシダーゼポリペプチドに由来し、アミノ酸残基約3、4、5、6、7、8、9、10、又は11個分の長さであり、かつアミノ酸配列FDRRSPG(配列番号204)又はFD(R/K)YNIT(配列番号205)を有する。例えば、第3のポリペプチドは、少なくとも200残基長のFv3C(配列番号60)と、例えば、配列番号60のN末端又はN末端近傍から少なくとも200残基と、少なくとも約60%配列同一性を有する第1の配列、並びに少なくとも50残基長のT.リーゼイ(T. reesei)Bgl3(Tr3B、配列番号64)と、例えば、配列番号64のC末端又はC末端近傍の残基から少なくとも50残基と、少なくとも約60%配列同一性を有する第2の配列を含む。特定の実施形態では、第3のポリペプチドは、相当する長さのTe3A配列(配列番号66)に由来する約3、4、5、6、7、8、9、10、又は11個のアミノ酸残基からなる第3の配列を更に含み、あるいはFDRRSPG(配列番号204)又はFD(R/K)YNIT(配列番号205)のアミノ酸配列を含む。例えば、第3のポリペプチドは、配列番号93又は95に対して、あるいは配列番号93又は95の少なくとも約20、30、40、50、60、又は70個以上の残基からなる下位配列又は断片に対して少なくとも約60%配列同一性を有する配列を含む。
酵素組成物は、GH61/エンドグルカナーゼ活性を有する第4のポリペプチド、あるいはGH61エンドグルカナーゼに富む全セルラーゼを更に含み得る。例えば、GH61/エンドグルカナーゼ活性を有するポリペプチドは、例えば、T.リーゼイ(T. reesei)Eg4などのバクテリア又は真菌といった好適な微生物由来のEGIVポリペプチドである。一部の実施形態では、第4のポリペプチドはGH61エンドグルカナーゼポリペプチドであり、配列番号52、80〜81、206〜207のうちのいずれか1つの配列と、少なくとも約10残基(例えば、少なくとも約10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、225、250、275、300残基)の領域にわたって少なくとも約60%(例えば、少なくとも約60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%)配列同一性を有し、あるいは(1)配列番号84及び88;(2)配列番号85及び88;(3)配列番号86;(4)配列番号87;(5)配列番号84、88及び89;(6)配列番号85、88、及び89;(7)配列番号84、88、及び90;(8)配列番号85、88及び90;(9)配列番号84、88及び91;(10)配列番号85、88及び91;(11)配列番号84、88、89及び91;(12)配列番号84、88、90及び91;(13)配列番号85、88、89及び91:並びに(14)配列番号85、88、90及び91からなる群から選択される1つ以上の配列モチーフを含む。酵素組成物には更にセロビオースデヒドロゲナーゼを含ませることもできる。
一部の実施形態では、キシラナーゼ活性を有する第1のポリペプチドは、配列番号24、26、42、及び43のいずれか1つに対し、あるいはこれらの成熟配列に対し少なくとも約70%配列同一性を有する。例えば、第1のポリペプチドは、AfuXyn2、AfuXyn5、T.リーゼイ(T. reesei)Xyn3、又はT.リーゼイ(T. reesei)Xyn2であってよい。
一部の実施形態では、キシロシダーゼ活性を有する第2のポリペプチドは、第1群又は第2群のいずれかのβ−キシロシダーゼポリペプチドから選択されてよい。第1群のβ−キシロシダーゼポリペプチドは、配列番号2及び10のいずれか1つに対し、あるいはこれらの成熟配列に対し少なくとも約70%配列同一性を有する。例えば、第1群のβ−キシロシダーゼはFv3A又はFv43Aであり得る。第2群のβ−キシロシダーゼポリペプチドは、配列番号4、6、8、10、12、14、16、18、28、30及び45のいずれか1つの配列に対し、又はこれらの成熟配列に対し少なくとも約70%配列同一性を有する。例えば、第2群のβ−キシロシダーゼは、Pf43A、Fv43E、Fv39A、Fv43B、Pa51A、Gz43A、Fo43A、Fv43D、Pf43B、又はT.リーゼイ(T. reesei)Bxl1であってよい。
第1、第2、第3、第4又はその他のポリペプチドは、天然に得られる資源から単離されたものであっても又は精製されたものであってもよい。あるいは、組み換え宿主細胞により発現又は過剰発現させることもできる。これらのペプチドは、単離又は精製形態で酵素組成物に加える事ができる。これらは、培養混合物、例えば、発酵ブロスの一部として、宿主生物又は宿主細胞により発現又は過剰発現させることもできる。一部の実施形態では、このようなポリペプチドをコードしている遺伝子は、コードさせたポリペプチドを宿主生物により発現させることのできる、宿主生物の遺伝子物質に組み込むことができる。
本発明の遺伝子操作型酵素組成物の第11の非限定例は、(1)キシラナーゼ活性を有する第1のポリペプチド、(2)キシロシダーゼ活性を有する第2のポリペプチド、及びβ−グルコシダーゼに富む全セルラーゼを含む。一部の実施形態では、β−グルコシダーゼに富む全セルラーゼ組成物は、配列番号54、56、58、60、62、64、66、68、70、72、74、76、78、79、93、及び95のうちのいずれか1つの配列と、少なくとも約10残基(例えば、少なくとも約10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、225、250、275、300残基)の領域にわたって少なくとも約60%(例えば、少なくとも約60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%)同一性を有するポリペプチドに富む。特定の実施形態では、β−グルコシダーゼに富む全セルラーゼは、2つ以上のβ−グルコシダーゼ配列を含むβ−グルコシダーゼのキメラ/融合ポリペプチドに富み、第1のβ−グルコシダーゼに由来する第1の配列は、少なくともアミノ酸残基約200個分の長さであり、配列番号96〜108のアミノ酸配列モチーフのうち1種以上又は全てを含むのに対し、第2のβ−グルコシダーゼに由来する第2の配列は、少なくともアミノ酸残基約50個分の長さであり、配列番号109〜116のアミノ酸配列モチーフのうち1種以上又は全てを含み、及び同様に場合により第3の配列は、第3のβ−グルコシダーゼに由来するループ配列をアミノ酸残基約3、4、5、6、7、8、9、10、又は11個分の長さでコードしており、かつアミノ酸配列FDRRSPG(配列番号204)又はFD(R/K)YNIT(配列番号205)を有する。詳細には、2つ以上のβ−グルコシダーゼ配列のうち1つ目の配列は、少なくともアミノ酸残基約200個分の長さであり、配列番号197〜202のアミノ酸配列モチーフのうち少なくとも2つ(例えば、少なくとも2、3、4、又は全て)を含み、及び2つ以上のβ−グルコシダーゼ配列のうち2つ目の配列は、少なくともアミノ酸残基約50個分の長さであり、配列番号203を含み、及び同様に場合により第3の配列は、第1又は第2のβ−グルコシダーゼポリペプチドとは異なる第3のβ−グルコシダーゼポリペプチドに由来し、アミノ酸残基約3、4、5、6、7、8、9、10、又は11個分の長さであり、かつアミノ酸配列FDRRSPG(配列番号204)又はFD(R/K)YNIT(配列番号205)を有する。例えば、β−グルコシダーゼに富む全セルラーゼは、少なくとも200残基長のFv3C(配列番号60)と、例えば、配列番号60のN末端又はN末端近傍から少なくとも200残基と、少なくとも約60%配列同一性を有する第1の配列、並びに少なくとも50残基長のT.リーゼイ(T. reesei)Bgl3(Tr3B、配列番号64)と、例えば、配列番号64のC末端又はC末端近傍の残基から少なくとも50残基と、少なくとも約60%配列同一性を有する第2の配列を含む。一部の実施形態では、β−グルコシダーゼに富む全セルラーゼは、Te3A(配列番号66)の相当する長さの配列に由来する約3、4、5、6、7、8、9、10、又は11個のアミノ酸残基からなる第3の配列を更に含む、又はアミノ酸配列FDRRSPG(配列番号204)若しくはFD(R/K)YNIT(配列番号205)を含む、ポリペプチドに富む。例えば、β−グルコシダーゼに富む全セルラーゼは、配列番号93又は95と、あるいは配列番号93又は95の少なくとも約20、30、40、50、60、又は70残基以上からなる下位配列又は断片と、少なくとも約60%配列同一性を有する配列を含むポリペプチドに富む。
酵素組成物は、GH61/エンドグルカナーゼ活性を有する第3のポリペプチド、あるいはGH61エンドグルカナーゼに富む全セルラーゼを更に含み得る。例えば、GH61/エンドグルカナーゼ活性を有するポリペプチドは、例えば、T.リーゼイ(T. reesei)Eg4などのバクテリア又は真菌といった好適な微生物由来のEGIVポリペプチドである。一部の実施形態では、第3のポリペプチドはGH61エンドグルカナーゼポリペプチドであり、配列番号52、80〜81、206〜207のうちのいずれか1つの配列と、少なくとも約10残基(例えば、少なくとも約10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、225、250、275、300残基)の領域にわたって少なくとも約60%(例えば、少なくとも約60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%)の同一性を有し、あるいは(1)配列番号84及び88;(2)配列番号85及び88;(3)配列番号86;(4)配列番号87;(5)配列番号84、88及び89;(6)配列番号85、88、及び89;(7)配列番号84、88、及び90;(8)配列番号85、88及び90;(9)配列番号84、88及び91;(10)配列番号85、88及び91;(11)配列番号84、88、89及び91;(12)配列番号84、88、90及び91;(13)配列番号85、88、89及び91:並びに(14)配列番号85、88、90及び91からなる群から選択される1つ以上の配列モチーフを含む。酵素組成物には更にセロビオースデヒドロゲナーゼを含ませることもできる。
一部の実施形態では、キシラナーゼ活性を有する第1のポリペプチドは、配列番号24、26、42、及び43のいずれか1つに対し、あるいはこれらの成熟配列に対し少なくとも約70%配列同一性を有する。例えば、第1のポリペプチドは、AfuXyn2、AfuXyn5、T.リーゼイ(T. reesei)Xyn3、又はT.リーゼイ(T. reesei)Xyn2であってよい。
一部の実施形態では、キシロシダーゼ活性を有する第2のポリペプチドは、第1群又は第2群のいずれかのβ−キシロシダーゼポリペプチドから選択されてよい。第1群のβ−キシロシダーゼポリペプチドは、配列番号2及び10のいずれか1つに対し、あるいはこれらの成熟配列に対し少なくとも約70%配列同一性を有する。例えば、第1群のβ−キシロシダーゼはFv3A又はFv43Aであり得る。第2群のβ−キシロシダーゼポリペプチドは、配列番号4、6、8、10、12、14、16、18、28、30及び45のいずれか1つの配列に対し、又はこれらの成熟配列に対し少なくとも約70%配列同一性を有する。例えば、第2群のβ−キシロシダーゼは、Pf43A、Fv43E、Fv39A、Fv43B、Pa51A、Gz43A、Fo43A、Fv43D、Pf43B、又はT.リーゼイ(T. reesei)Bxl1であってよい。
第1、第2、又はその他のポリペプチドは、天然に得られる資源から単離されたものであっても又は精製されたものであってもよい。あるいは、組み換え宿主細胞により発現又は過剰発現させることもできる。これらのペプチドは、単離又は精製形態で酵素組成物に加える事ができる。これらは、培養混合物、例えば、発酵ブロスの一部として、宿主生物又は宿主細胞により発現又は過剰発現させることもできる。一部の実施形態では、このようなポリペプチドをコードしている遺伝子は、コードさせたポリペプチドを宿主生物により発現させることのできる、宿主生物の遺伝子物質に組み込むことができる。
遺伝子操作型酵素組成物の第12の非限定例は、(1)キシラナーゼ活性を有する第1のポリペプチド、(2)キシロシダーゼ活性を有する第2のポリペプチド、及び(3)GH61/エンドグルカナーゼ活性を有する第3のポリペプチド、又はGH61エンドグルカナーゼに富む全セルラーゼ、を含む。一部の実施例では、GH61/エンドグルカナーゼ活性を有するポリペプチドは、例えば、T.リーゼイ(T. reesei)Eg4などのバクテリア又は真菌といった好適な微生物由来のEGIVポリペプチドである。一部の実施形態では、第3のポリペプチドはGH61エンドグルカナーゼポリペプチドであり、配列番号52、80〜81、206〜207のうちのいずれか1つの配列と、少なくとも約10残基(例えば、少なくとも約10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、225、250、275、300残基)の領域にわたって少なくとも約60%(例えば、少なくとも約60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%)の同一性を有し、あるいは(1)配列番号84及び88;(2)配列番号85及び88;(3)配列番号86;(4)配列番号87;(5)配列番号84、88及び89;(6)配列番号85、88、及び89;(7)配列番号84、88、及び90;(8)配列番号85、88及び90;(9)配列番号84、88及び91;(10)配列番号85、88及び91;(11)配列番号84、88、89及び91;(12)配列番号84、88、90及び91;(13)配列番号85、88、89及び91:並びに(14)配列番号85、88、90及び91からなる群から選択される1つ以上の配列モチーフを含む。酵素組成物には更にセロビオースデヒドロゲナーゼを含ませることもできる。
一部の実施形態では、キシラナーゼ活性を有する第1のポリペプチドは、配列番号24、26、42、及び43のいずれか1つに対し、あるいはこれらの成熟配列に対し少なくとも約70%配列同一性を有する。例えば、第1のポリペプチドは、AfuXyn2、AfuXyn5、T.リーゼイ(T. reesei)Xyn3、又はT.リーゼイ(T. reesei)Xyn2であってよい。
一部の実施形態では、キシロシダーゼ活性を有する第2のポリペプチドは、第1群又は第2群のいずれかのβ−キシロシダーゼポリペプチドから選択されてよい。第1群のβ−キシロシダーゼポリペプチドは、配列番号2及び10のいずれか1つに対し、あるいはこれらの成熟配列に対し少なくとも約70%配列同一性を有する。例えば、第1群のβ−キシロシダーゼはFv3A又はFv43Aであり得る。第2群のβ−キシロシダーゼポリペプチドは、配列番号4、6、8、10、12、14、16、18、28、30及び45のいずれか1つの配列に対し、又はこれらの成熟配列に対し少なくとも約70%配列同一性を有する。例えば、第2群のβ−キシロシダーゼは、Pf43A、Fv43E、Fv39A、Fv43B、Pa51A、Gz43A、Fo43A、Fv43D、Pf43B、又はT.リーゼイ(T. reesei)Bxl1であってよい。
第1、第2、第3、又はその他のポリペプチドは、天然に得られる資源から単離されたものであっても又は精製されたものであってもよい。あるいは、組み換え宿主細胞により発現又は過剰発現させることもできる。これらのペプチドは、単離又は精製形態で酵素組成物に加える事ができる。これらは、培養混合物、例えば、発酵ブロスの一部として、宿主生物又は宿主細胞により発現又は過剰発現させることもできる。一部の実施形態では、このようなポリペプチドをコードしている遺伝子は、コードさせたポリペプチドを宿主生物により発現させることのできる、宿主生物の遺伝子物質に組み込むことができる。
本明細書に記載の遺伝子操作型酵素組成物は、例えば、発酵ブロスである。発酵ブロスは、例えば、微生物から得られるものである。微生物は、糸状菌又は酵母などのバクテリア又は真菌であってよい。好適な糸状菌としては、限定するものではないが、トリコデルマ(Trichoderma)、ヒュミコラ(Humicola)、フザリウム(Fusarium)、アスペルギルス(Aspergillus)、ニューロスポラ(Neurospora)、ペニシリウム(Penicillium)、セファロスポリウム(Cephalosporium)、アキラ(Achlya)、ポドスポラ(Podospora)、エンドチア(Endothia)、ムコール(Mucor)、コクリオボーラス(Cochliobolus)、ピリクラリア(Pyricularia)、又はクリソスポリウム(Chrysosporium)が挙げられる。好適な真菌のうちトリコデルマ菌種(Trichoderma spp.)の一例としては、トリコデルマ・リーゼイ(Trichoderma reesei)が挙げられる。好適な真菌のうちペニシリウム菌種(Penicillium spp. )の一例としては、ペニシリウム・フニクロサム(Penicillium funiculosum)が挙げられる。発酵ブロスは、例えば、無細胞発酵ブロス又は全ブロス製剤であってよい。
本明細書に記載の酵素組成物が、セルラーゼ活性(例えば、セロビオヒドロラーゼ活性、エンドグルカナーゼ活性、GH61/エンドグルカナーゼ活性、又はβ−グルコシダーゼ活性)を有する酵素を含む場合、あるいは全セルラーゼを含む場合、本発明の酵素組成物はセルラーゼ組成物である。セルラーゼは、例えば、バクテリア又は真菌由来のセルラーゼ組成物であってよい。例えば、糸状菌由来のセルラーゼ組成物は、トリコデルマ・リーゼイ(Trichoderma reesei)、アスペルギルス・ニガー(Aspergillus niger)、コウジカビ(Aspergillus oryzae)、又はクリソスポリウム・ラックノウエンス(Chrysosporium lucknowence)などのトリコデルマ(Trichoderma)、アスペルギルス(Aspergillus)、又はクリソスポリウム(Chrysosporium)由来のセルラーゼ組成物であってよい。セルラーゼ組成物は、糸状菌により好適に製造することができ、例えば、トリコデルマ(Trichoderma)(トリコデルマ・リーゼイなど)、アスペルギルス(Aspergillus)(アスペルギルス・ニガー(Aspergillus niger)又はコウジカビ(Aspergillus oryzae)など)、又はクリソスポリウム(Chrysosporium)(クリソスポリウム・ラックノウエンス(Chrysosporium lucknowence)など)により製造することができる。あるいは、酵素組成物は、酵母などの組み換え生物で製造することもできる。
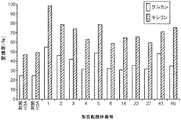
本明細書に記載の酵素組成物の成分は、当該技術分野で既知の手法により測定することができる。例えば、SDS−PAGEを用い、成分の相対量を測定することもできるが、この場合の測定値は正確なものではなく、せいぜいで半定量的なものである。HPLCは、一般的に、より正確な酵素成分測定方法であると見なされているものの、その正確さは多くの場合、測定量で組み合わせることのできる品質の良い酵素標準を入手できるかどうか、及び混合物の清浄度、並びに特定の共溶出成分を分離させるのに使用されるカラムの性能に依存する。互いから特定のタンパク質を溶出するにあたって制限があるものの、これらの制限はタンパク質の異なる組に対して生じる傾向のある、HPLCなどの超高速液体クロマトグラフィー(UPLC)を用い成分を測定することもできる。したがって、HPLCでは溶出されないタンパク質でも、UPLCでは溶出させることができる場合もあれば、その逆もある。これらの手法を用いる測定に使用する条件は、本明細書において実施例に記載する。SDS−PAGE、HPLC、又はUPLCのいずれかにより測定した場合に、遺伝子操作組成物に含まれる、キシラナーゼ活性を有するポリペプチドの合計重量は、酵素組成物中の合計タンパク質重量又は総タンパク質重量の約0.05重量%〜約80重量%(例えば、約0.05重量%〜約75重量%、約0.1重量%〜約70重量%、約1重量%〜約60重量%、約5重量%〜約50重量%、約10重量%〜約40重量%、約0.5重量%〜約40重量%、約1重量%〜約35重量%、約5重量%〜約25重量%、約9重量%〜約17重量%、約5重量%〜約15重量%、約10重量%〜約15重量%、約10重量%〜約25重量%、約10重量%〜約35重量%など)であるとして表すことができる。特定の実施例では、キシラナーゼ活性を有するポリペプチドの合計重量は、T.リーゼイ(T. reesei)Xyn2、及びT.リーゼイ(T. reesei)Xyn3を含む組成物中の、例えば、本明細書に記載の任意の遺伝子操作酵素組成物中の、これらのキシラナーゼ量として測定される。混合物中のキシラナーゼの総重量は、本明細書に記載の手法によりSDS−PAGE、HPLC、又はUPLCを用い測定した場合、組成物中のタンパク質の総重量の約10重量%〜約20重量%、又は約14重量%〜約18重量%である。
SDS−PAGE、HPLC又はUPLCにより測定した場合にβ−キシロシダーゼ活性を有するポリペプチドの合計重量は、遺伝子操作酵素組成物中の総タンパク質の約0.05重量%〜約75重量%(例えば、約0.05重量%〜約70重量%、約0.1重量%〜約60重量%、約1重量%〜約50重量%、約10重量%〜約40重量%、約20重量%〜約30重量%、約2重量%〜約45重量%、約5重量%〜約40重量%、約10重量%〜約35重量%、約2重量%〜約30重量%、約5重量%〜約25重量%、約5重量%〜約10重量%、約9重量%〜約15重量%、約10重量%〜約20重量%など)に相当する。特定の実施例では、β−キシロシダーゼ活性を有するポリペプチドの合計重量は、第1群のβ−キシロシダーゼ及び第2群のβ−キシロシダーゼ(例えば、Fv3A及びFv43D)を含む組成物(例えば、本明細書に記載の任意の遺伝子操作型酵素組成物)中のこれらのβ−キシロシダーゼの量として測定される。混合物中のβ−キシロシダーゼの総重量は、約3重量%〜約20重量%であり、例えば、本明細書に記載の方法に従い、HPLCを用い測定した場合に約4重量%〜約6重量%、UPLCを用い測定した場合に約10重量%〜約14重量%、及びSDS−PAGEを用い測定した場合に約15重量%〜約18重量%である。
本発明の遺伝子操作酵素組成物がβ−キシロシダーゼ活性を有する第1群のポリペプチド、及びβ−キシロシダーゼ活性を有する第2群のポリペプチドを含む場合、第1群のポリペプチドの合計重量は、組成物中の総タンパク質重量の約0.1重量%〜約30重量%(例えば、約0.2重量%〜約25重量%、約0.5重量%〜約20重量%、約4重量%〜約10重量%、約4重量%〜約8重量%など)に相当し、一方、第2群のポリペプチドの合計重量は、組成物中の総タンパク質重量の約0.1重量%〜20重量%(例えば、約0.2重量%〜約18重量%、約0.5重量%〜約15重量%、約5重量%〜約10重量%など)に相当する。第1群のβ−キシロシダーゼポリペプチドと第2群のβ−キシロシダーゼポリペプチドの重量比は、約1:10〜約10:1であってよく、例えば、約1:8〜約8:1、約1:6〜約6:1、約1:4〜約4:1、約1:2〜約2:1、又は約1:1であってよい。
存在させる場合、L−α−アラビノフラノシダーゼ活性を有するポリペプチドの合計重量は、SDS−PAGE、HPLC、又はUPLCを用い測定した場合、遺伝子操作酵素組成物の合計又は総タンパク質重量の約0.05重量%〜約20重量%(例えば、0.1重量%〜約15重量%、1重量%〜約10重量%、2重量%〜約12重量%、4重量%〜約10重量%、3重量%〜約9重量%、5重量%〜約9重量%など)に相当し得る。L−α−アラビノフラノシダーゼ活性を有するポリペプチドの合計重量は、例えば、このL−α−アラビノフラノシダーゼを含む組成物(例えば、本明細書に記載の任意の遺伝子操作型酵素組成物)中のFv51Aの量として測定される。混合物中のL−α−アラビノフラノシダーゼの総重量は、約0.2重量%〜約2重量%であり、例えば、本明細書に記載の方法に従い、HPLCを用い測定した場合に約0.3重量%〜約0.5重量%であり、UPLC及びSDS−PAGEを用い測定した場合に約0.8重量%〜約1.2重量%である。
SDS−PAGE、UPLC、又はHPLCのいずれかにより測定した場合に、β−グルコシダーゼ活性を有するポリペプチド(変異体(variants)、変異体(mutants)、又はβ−グルコシダーゼのキメラ/融合ポリペプチドなど)の合計重量は、遺伝子操作型酵素組成物中の合計タンパク質重量又は総タンパク質重量の、約0.05重量%〜約50重量%(例えば、約0.1重量%〜約45重量%、約1重量%〜約42重量%、約2重量%〜約45重量%、約2重量%〜約40重量%、約2重量%〜約30重量%、約2重量%〜約25重量%、約5重量%〜約50重量%、約9重量%〜約17重量%、約10重量%〜約50重量%、約20重量%〜約50重量%、約25重量%〜約50重量%、約30重量%〜約50重量%など)に相当する。特定の実施例では、β−グルコシダーゼ活性を有するポリペプチドの合計重量は、例えば、配列番号92及びT.リーゼイ(T. reesei)Bgl1からなるβ−グルコシダーゼのハイブリッド/キメラ体を含む組成物(例えば、本明細書に記載の任意の遺伝子操作型酵素組成物)中のこれらの酵素の量として測定される。混合物中のβ−グルコシダーゼの総重量は、約18重量%〜約28重量%であり、例えば、本明細書に記載の方法に従い、SDS−PAGE及びUPLCを用い測定した場合に約22重量%〜約25重量%、及びHPLCを用い測定した場合に約18重量%〜約22重量%である。
GH61エンドグルカナーゼポリペプチドの総重量は、SDS−PAGE、HPLC又はUPLCにより測定した場合に、遺伝子操作型酵素組成物中の合計又は総タンパク質重量の約2重量%〜約50重量%(例えば、約2重量%〜約45重量%、約2重量%〜約40重量%、約2重量%〜約30重量%、約2重量%〜約25重量%、約4重量%〜約16重量%、約5重量%〜約50重量%、約10重量%〜約50重量%、約20重量%〜約50重量%、約25重量%〜約50重量%、約30重量%〜約50重量%など)として表すことができ、又はこれらの重量に相当する。特定の実施例では、GH61/エンドグルカナーゼ活性を有するポリペプチドの合計重量は、T.リーゼイ(T. reesei)Eg4ポリペプチドを含む組成物(例えば、本明細書に記載の任意の遺伝子操作型酵素組成物)中のこのような酵素の量として測定される。混合物中のT.リーゼイ(T. reesei)Eg4の総重量は、約6重量%〜約20重量%であり、例えば、本明細書に記載の方法に従い、HPLCを用い測定した場合に約6重量%〜約10重量%であり、及びUPLC又はSDS−PAGEを用い測定した場合に約6重量%〜約18重量%である。
本発明の遺伝子操作型酵素組成物の一例は、本明細書の実施例に記載の条件を用いHPLCにより測定した場合に、第1群のβ−キシロシダーゼポリペプチドを約4重量%〜約6重量%、第2群のβ−キシロシダーゼポリペプチド及びL−α−アラビノフラノシダーゼポリペプチドを合計重量で約5重量%〜約9重量%、β−グルコシダーゼポリペプチドを約9重量%〜約17重量%、キシラナーゼを約9重量%〜約17重量%、GH61エンドグルカナーゼを約4重量%〜約16重量%含む。酵素組成物は、更に1種以上のセロビオヒドロラーゼを約25重量%〜約45重量%含む。酵素組成物は、その他のセルラーゼも約7重量%〜約20重量%含む。
本発明の遺伝子操作型酵素組成物の一例は、本明細書の実施例に記載の条件を用いUPLCにより測定した場合に、第1群のβ−キシロシダーゼポリペプチドを約4重量%〜約6重量%、第2群のβ−キシロシダーゼポリペプチドを約5重量%〜約9重量%、L−α−アラビノフラノシダーゼポリペプチドを約0.5重量%〜約2重量%、β−グルコシダーゼポリペプチドを約18重量%〜約22重量%、キシラナーゼポリペプチドを約13重量%〜約15重量%、及びGH61エンドグルカナーゼを約8重量%〜約20重量%含む。酵素組成物には、更に、セロビオヒドロラーゼ(例えば、T.リーゼイ(T. reesei)CBH1及びCBH2)を約15重量%〜約25重量%含ませることができる。酵素組成物には、その他のセルラーゼも約2重量%〜約8重量%含ませることができる。
本発明の遺伝子操作型酵素組成物の少なくとも1種の(例えば、1種以上、2種以上、3種以上、4種以上、5種以上、又は更には6種以上の)酵素は、異種生物資源などに、例えば、宿主細胞とは異なる微生物に由来する。非限定例では、遺伝子操作型酵素組成物中の1種の酵素は糸状菌のフザリウム菌種(Fusarium spp.)であるのに対し、遺伝子操作型酵素組成物はフザリウム菌種(Fusarium spp.)以外の微生物、真菌から製造される。他の例では、遺伝子操作型酵素組成物中の1種の酵素は糸状菌のトリコデルマ菌種(Trichoderma spp.)に由来するのに対し、遺伝子操作型酵素組成物は、真菌のトリコデルマ菌種(Trichoderma spp.)以外の微生物、例えば、アスペルギルス(Aspergillus)又はクリソスポリウム(Chrysosporium)から製造される。
本明細書に記載の遺伝子操作型酵素組成物中の少なくとも2種の酵素は、異なる生物資源に由来する。代表的な遺伝子操作型酵素組成物では、1種以上の酵素はフザリウム菌種(Fusarium spp.)に由来するのに対し、他の1種以上の酵素はフザリウム菌種(Fusarium spp.)以外の真菌に由来する。
遺伝子操作型酵素組成物は、例えば、適切な発酵ブロス組成物である。発酵ブロスは、例えば、糸状菌によるものであり、限定するものではないが、トリコデルマ(Trichoderma)、ヒュミコラ(Humicola)、フザリウム(Fusarium)、アスペルギルス(Aspergillus)、ニューロスポラ(Neurospora)、ペニシリウム(Penicillium)、セファロスポリウム(Cephalosporium)、アクルヤ(Achlya)、ポドスポラ(Podospora)、エンドチア(Endothia)、ムコール(Mucor)、コクリオボーラス(Cochliobolus)、ピリクラリア(Pyricularia)、又はクリソスポリウム(Chrysosporium)のものである。好適な真菌のうちトリコデルマ菌種(Trichoderma spp.)の一例としては、トリコデルマ・リーゼイ(Trichoderma reesei)が挙げられる。真菌のうちペニシリウム菌種(Penicillium spp. )の一例としては、ペニシリウム・フニクロサム(ペニシリウム(Penicillium funiculosum)が挙げられる。真菌のうちアスペルギルス菌種(Aspergilllus spp.)の一例としては、アスペルギルス・ニガー(Aspergillus niger)又はコウジカビ(Aspergillus oryzae)が挙げられる。真菌のうちクリソスポリウム菌種(Chrysosporium spp.)の一例としては、クリソスポリウム・ラックノウエンス(Chrysosporium lucknowence)が挙げられる。発酵ブロスは、例えば、無細胞発酵ブロスであってよく、所望により、例えば、限外濾過、精製、細胞の殺傷などの最小限の生産後加工を行ってよく、例えば、全ブロス製剤に使用することができる。
遺伝子操作型酵素組成物はセルラーゼ組成物であってよく、例えば、真菌由来のセルラーゼ組成物又はバクテリア由来のセルラーゼ組成物であってよい。セルラーゼ組成物は、例えば、トリコデルマ(Trichoderma)、アスペルギルス(Aspergillus)、クリソスポリウム(Chrysosporium)などの糸状菌、サッカロマイセス・セレビシエ(Saccharomyces cerevisiae)などの酵母により製造することができる。
本開示の酵素又は遺伝子操作型酵素組成物は、食品産業に(例えば、焼成食品、果物、及び野菜の加工時)、農業廃棄物の分解時に、動物用飼料の製造時に、パルプ及び紙の製造時に、布地の製造時に、又は家庭用及び工業用洗浄剤に使用することができる。本明細書に記載の酵素は、例えば、それぞれ別個に真菌又はバクテリアなどの微生物により製造することができる。
本明細書に記載の酵素又は遺伝子操作型酵素組成物は、植物バイオマス、例えば、トウモロコシ、穀類、草本類(例えば、ソルガストラム・ヌタンス(Sorghastrum nutans)などのインディアングラス、又は例えば、キビ(Panicum)菌種などパニクム・バーガタム(Panicum virgatum)といったスイッチグラス)、多年生植物のケーン類(例えば、暖竹)、又は木材若しくは木材加工副産物、例えば、木材加工、パルプ及び/又は製紙工業時、繊維製造時、家事、及び工業用洗浄剤、及び/又は廃棄バイオマスの加工時の副産物などの、全ての生物資源が挙げられる、任意の好適な資源に含まれるリグノセルロースの消化にも使用することができる。本開示は、セロオリゴ糖、アラビノキシランオリゴマー又はグルカン若しくはセルロースを含む組成物を、加水分解、切断又は破壊する方法を提供するものであり、好適な条件下で、組成物を本開示の酵素又は酵素組成物と接触させる工程を包含し、酵素又は酵素組成物が、セロオリゴ糖、アラビノキシランオリゴマー又はグルカン若しくはセルロースを含む組成物を加水分解、切断又は破壊する。
本開示は、本明細書に記載のポリペプチド又は本明細書に記載の核酸によりコードされるポリペプチドを含む遺伝子操作型酵素組成物を提供する。一部の実施形態では、ポリペプチドは、キシラナーゼ、キシロシダーゼ、L−α−アラビノフラノシダーゼ、β−グルコシダーゼ、及び/又はGH61/エンドグルカナーゼ活性から選択される1種以上の活性を有する。遺伝子操作型酵素組成物は、セルロース系及びヘミセルロース系ポリマーを代謝可能な炭素基へと脱重合させる際に使用され、又は脱重合させる際に有用である。遺伝子操作型酵素組成物は、好適には、例えば、製造製品の形態である。組成物は、例えば製剤であってよく、及び例えば液体又は固体などの物理形態をとってよい。
本明細書に記載の遺伝子操作型酵素組成物は、更に場合によりセルラーゼを含み、例えば、少なくとも(1)エンドグルカナーゼ、(2)セロビオヒドロラーゼ、及び(3)β−グルコシダーゼ、から選択される3種の異なる酵素を含む全セルラーゼを含むか、あるいは(1)セルロース系又はヘミセルロース系材料内部のβ−1,4結合の切断を触媒し、より短いグルコオリゴ糖を生成するエンドグルカナーゼ活性、(2)「エキソ」型でのセロビオース単位(例えば、β−1,4グルコース−グルコース二糖)の切断及び生成を触媒するセロビオヒドロラーゼ活性、並びに(3)短鎖セロオリゴ糖(例えば、セロビオース)からのグルコースモノマーの生成を触媒するβ−グルコシダーゼ活性、から選択される少なくとも3種の異なる酵素活性を有する。全セルラーゼは、1種以上のβ−グルコシダーゼポリペプチドに富むものであってよい。特定の実施形態では、全セルラーゼは、例えば、T.リーゼイ(T. reesei)Eg4などのEGIVポリペプチドといったGH61エンドグルカナーゼポリペプチドに富むものであってもよい。特定の実施形態では、全セルラーゼは、β−グルコシダーゼポリペプチド、及びGH61エンドグルカナーゼポリペプチドに富むものであってよい。本開示の遺伝子操作型酵素組成物は、更に以降の第5.3節で記載する。
他の態様では、本開示は、リグノセルロース及び/又は発酵性糖を含む組成物を、本明細書に記載の任意の酵素、本明細書に記載の核酸によりコードされるポリペプチド又は本明細書に記載の遺伝子操作型酵素組成物(例えば、製造製品又は製剤)と接触させる工程を含む、バイオマス材料の加工法を提供する。リグノセルロースを含む好適なバイオマス材料は、例えば、農作物、食品又は飼料製造時の副産物、リグノセルロース系廃棄物、植物残渣、又は古紙若しくは古紙製品に由来する。ポリペプチドは、好適には、セルラーゼ、エンドグルカナーゼ、セロビオヒドロラーゼ、β−グルコシダーゼ、キシラナーゼ、マンナナーゼ、β−キシロシダーゼ、アラビノフラノシダーゼ、及び他のヘミセルラーゼ活性から選択される1種以上の酵素活性を有し得る。好適な植物残渣には、穀類、種子、茎、葉、外皮、トウモロコシの皮、トウモロコシ穂軸、トウモロコシ茎葉、麦わら、草本類、ケーン類、葦、木材、木片、木材パルプ、及びおがくずが含まれ得る。草本類は、例えば、インディアングラス(Indian grass)又はスイッチグラスであってよい。葦は、例えば、暖竹などの多年生のケーン類であってよい。代表的な古紙としては、廃棄された又は使用済みコピー用紙、コンピュータープリンター用紙、ノートブック、メモ帳、タイプライター用紙、新聞紙、雑誌、ダンボール及び紙製包装材が挙げられる。
本開示は、ヘミセルロース加水分解酵素及びセルロース加水分解酵素と、少なくとも1種のバイオマス材料との混合物を含む組成物(酵素又は遺伝子操作型酵素組成物など、例えば、製造製品又は配合物)を提供する。場合により、バイオマス材料は、農作物に由来するリグノセルロース系材料を含み、あるいは食品又は飼料製造時の副産物である。リグノセルロース系廃棄物、植物残渣、古紙又は古紙製品も好適なバイオマス材料になる場合があり、すなわち好適なバイオマス材料は植物残渣を含むものである。例えば、植物残渣は、穀類、種子、茎、葉、外皮、トウモロコシの皮、トウモロコシ穂軸、トウモロコシ茎葉、草本類、麦わら、葦、木材、木片、木材パルプ、又はおがくずを含むものであってよい。代表的な草本類としては、限定するものではないが、インディアングラス又はスイッチグラスが挙げられる。代表的な葦としては、限定するものではないが、暖竹などの特定の多年生ケーン類が挙げられる。代表的な古紙としては、限定するものではないが、廃棄された又は使用済みコピー用紙、コンピュータープリンター用紙、ノートブック紙、メモ帳、タイプライター用紙、新聞紙、雑誌、ダンボール及び紙製包装材が挙げられる。
したがって、本開示はヘミセルロース系材料を加水分解し、酵素機能による好適なバイオマス基質の発酵性糖質への変換を触媒するのに有用な組成物(酵素又は遺伝子操作型酵素組成物など、例えば、製造製品又は配合物)を提供する。本開示は、このような組成物を製造する方法、並びに研究環境、工業環境又は商業環境でこのような組成物を用いる若しくは適用する方法も提供する。
本明細書に引用される、出願日以降の現在公的に入手可能な全ての情報、例えば、公報、特許、特許出願、GenBank配列、及びATCC受入番号は、参照により本明細書に例示的に組み込まれる。
従来、酵素は、基質特異性及び反応産物により分類されてきた。プレゲノム時代では、酵素を比較する際、機能は最も適した(かつおそらく最も有用な)基準であると見なされ、各種酵素活性についてのアッセイが長年にわたって広く開発され、お馴染みのEC分類スキームが誕生した。2つの糖残基間(又は、ニトロフェノール−グリコシド誘導体に生じるものなどのように、糖及び非糖残基間)のグリコシド結合に対し作用する、セルラーゼ及びその他のグリコシルヒドロラーゼは、この分類スキーム下ではEC 3.2.1.−として命名され、名前の最後に記される数字により、切断させる結合の正確な種類が示される。例えば、このスキームに従うと、エンド型セルラーゼ(1,4−β−エンドグルカナーゼ)は、EC 3.2.1.4と表記される。多様なゲノム配列決定プロジェクトの出現に伴い、配列決定データをもとに、関係する遺伝子とタンパク質とを解析及び比較することが容易になってきている。更に、糖残基に作用し得る酵素(すなわち、カルボヒドラーゼ)が数多く結晶化され、その3次元構造が明らかにされている。このような解析から、関係する配列を有しており、アミノ酸配列に基づき予測することのできる3次元構造が保存されている、各酵素のファミリーが同定されている。更に、同様の又は類似する3次元構造を有する酵素は、異なる反応を触媒する場合であってさえも、加水分解の際に同様の又は類似の立体特異性を示すことが明らかになっている(Henrissat et al.,FEBS Lett 1998,425(2):352〜4;Coutinho and Henrissat,Genetics,biochemistry and ecology of cellulose degradation,1999,T.Kimura.Tokyo,Uni Publishers Co:15〜23.)。これらの発見がもととなって、配列に基づくカルボヒドラーゼモジュールの分類がなされており、この分類は、インターネットデータベースの形態(Carbohydrate−Active enZYmeサーバー(CAZy))で、afmb.cnrs−mrs.fr/CAZY/index.htmlで利用することができる(カルボヒドラーゼ活性酵素:データベースアプローチに組み込まれる。Cantarel et al.,2009,Nucleic Acids Res.37(Database issue):D233−38を参照されたい)。
CAZyは、触媒される反応の種類に基づきカルボヒドラーゼを識別することのできる、4つの主要な分類:グリコシルヒドロラーゼ(GH’s)、糖転移酵素(GT’s)、多糖除去付加酵素(PL’s)、及び糖エステラーゼ(CE’s)を定義している。本開示の酵素は、グリコシルヒドロラーゼである。GH’sは、2つの糖間の、又は糖と非糖残基との間のグリコシド結合を加水分解する酵素群である。配列類似性によりグリコシルヒドロラーゼをグループ分けする分類系では、85を超える異なるファミリーが定義されている。この分類はCAZyウェブサイトで利用できる。
本開示の酵素は、特にグリコシルヒドロラーゼファミリー3、10、11、30、39、43、51、及び/又は61に属する。
グリコシドヒドロラーゼファミリー3(「GH3」)の酵素としては、例えば、β−グルコシダーゼ(EC:3.2.1.21);β−キシロシダーゼ(EC:3.2.1.37);N−アセチルβ−グルコサミニダーゼ(EC:3.2.1.52);グルカンβ−1,3−グルコシダーゼ(EC:3.2.1.58);セロデキストリナーゼ(EC:3.2.1.74);exo−1,3−1,4−グルカナーゼ(EC:3.2.1);及びβ−ガラクトシダーゼ(EC 3.2.1.23)が挙げられる。例えば、GH3酵素は、β−グルコシダーゼ、β−キシロシダーゼ、N−アセチルβ−グルコサミニダーゼ、グルカンβ−1,3−グルコシダーゼ、セロデキストリナーゼ、exo−1,3−1,4−グルカナーゼ、及び/又はβ−ガラクトシダーゼの活性を有する酵素であってよい。一般的に、GH3酵素は球状タンパク質であり、2つ以上のサブドメインからなる。β−グルコシダーゼでは、第3ペプチドのN末端に位置するアスパラギン酸残基が触媒残基として同定されており、この残基はアミノ酸フラグメントSDW内部に位置している(Li et al.2001,Biochem.J.355:835〜840)。T.リーゼイ(T. reesei)由来のBgl1に相当する配列は、T266D267W268(開始位置のメチオニンから計数)であり、触媒残基のアスパラギン酸残基としてはD267を備える。試験されたGH3 β−キシロシダーゼでは、ヒドロキシル/アスパルテート配列も保存されている。例えば、T.リーゼイ(T. reesei)Bxl1で相当する配列はS310D311であり、かつFv3Aで相当する配列はS290D291である。
グリコシドヒドロラーゼファミリー39(「GH39」)酵素は、α−L−イズロニダーゼ(EC:3.2.1.76)又はβ−キシロシダーゼ(EC:3.2.1.37)活性を有する。T.サッカロリチカム(T. saccharolyticum)(Uniprot受入番号P36906)及びG.s.ステアロサーモフィルス(G. s stearothermophilus)(Uniprot受入番号Q9ZFM2)由来の2種のGH39 β−キシロシダーゼの三次元構造は解明されている(Yang et al.J.Mol.Biol.2004,335(1):155〜65、及びCzjzek et al.,J.Mol.Biol.2005,353(4):838〜46を参照されたい)。これらの酵素において高度に保存されている領域のうち大部分はN端末領域に位置しており、N端末領域は、第4番目(酸/塩基)及び第7番目の(求核)のβ鎖のC末端に2つの重要な活性部位を備える古典的な(α/β)8 TIMバレルフォールドを有する。Fv39Aの残基E168及びE272は、それぞれFv39Aを有するT.サッカロリチカム(T. saccharolyticum)及びG.ステアロサーモフィルス(G. stearothermophilus)由来のGH39β−キシロシダーゼの配列アラインメントに基づき、酸塩基触媒及び求核触媒として機能するものと予測される。
グリコシドヒドロラーゼファミリー43(「GH43」)酵素としては、例えば、L−α−アラビノフラノシダーゼ(EC 3.2.1.55);β−キシロシダーゼ(EC 3.2.1.37);endo−アラビナナーゼ(EC 3.2.1.99);及び/又はガラクタン1,3−β−ガラクトシダーゼ(EC 3.2.1.145)が挙げられる。例えば、GH43酵素は、L−α−アラビノフラノシダーゼ活性、β−キシロシダーゼ活性、endo−アラビナナーゼ活性、及び/又はガラクタン1,3−β−ガラクトシダーゼ活性を有し得る。GH43ファミリー酵素は、5枚羽のβ−プロペラ構造を示す。プロペラ様構造は、4本鎖からなる一般的なβ−シートが5回繰り返し折り畳まれ形成される羽からなる。一般塩基のpKaを調節する、一般塩基触媒のアスパラギン酸、一般酸触媒のグルタミン酸及びアスパラギン酸が、C.ジャポニクス(C. japonicus)CjAbn43Aの結晶構造により同定されており、かつ部位特異的変異導入により確認されている(Nurizzo et al.Nat.Struct.Biol.2002,9(9)665〜8を参照されたい)。触媒残基は、アミノ酸配列中に広範囲に広がる3つの保存ブロックに配置される(Pons et al.Proteins:Structure,Function and Bioinformatics,2004,54:424〜432)。GH43ファミリーの複数種の酵素を、バイオマスの加水分解に有用な活性について試験した。図93の配列中で予測触媒残基をボールド体で示し、下線を付した。G.ステアロサーモフィルス(G. stearothermophylus)キシロシダーゼ(Brux et al.J.Mol.Bio.,2006,359:97〜109)の結晶構造によると、この酵素と基質との結合にはその他のいくつかの残基も重要であることが示唆される。バイオマスの加水分解について試験したGH43ファミリー酵素は異なる基質選択性を有していたため、これらの残基は図93に整列させた配列において完全に保存されているわけではない。しかしながら試験したキシロシダーゼ間では、疎水性相互作用又は水素結合のいずれかを介する基質結合に寄与する残基が複数保存されており、これらについては図93において一重下線を付して示す。
グリコシドヒドロラーゼファミリー51(「GH51」)酵素はL−α−アラビノフラノシダーゼ(EC 3.2.1.55)及び/又はエンドグルカナーゼ(EC 3.2.1.4)活性を有する。G.s.ステアロサーモフィルス(G. s stearothermophilus)T−6由来のGH51 L−α−アラビノフラノシダーゼの高解像度の結晶構造解析により、この酵素が六量体であり、各モノマーが2つのドメイン:8バレル(β/α)と、ジェリーロール様のトポロジーを持つ12−ストランドのβサンドウィッチを形成していることが示される(Hovel et al.EMBO J.2003,22(19):4922〜4932を参照されたい)。触媒残基は酸性であり、及びファミリー内の酵素配列間で保存されているものと予測することができる。Fv51A、Pf51A及びPa51Aのアミノ酸配列を、より配列が異なるGH51酵素と整列させたところ、8つの酸性残基が保存されていた。これらを図94にボールド体で示し、下線を付す。
グリコシドヒドロラーゼファミリー10(「GH10」)酵素も8バレル(β/α)構造を有する。この酵素は、一般的に酸/塩基の触媒する工程において、少なくとも1つの酸性触媒残基を使用するという機序を保有しており、エンド型の様式で加水分解を行う(Pell et al.,J.Biol.Chem.,2004,279(10):9597〜9605)。活性部位において基質を結合している、P.シンプリシシマム(P. simplicissimum)(Uniprot P56588)、及びT.アウランティアカス(T. aurantiacus)(Uniprot P23360)のGH10キシラナーゼの結晶構造が判明している(Schmidt et al.Biochem.,1999,38:2403〜2412;及びLo Leggio et al.FEBS Lett.2001,509:303〜308を参照されたい)。T.リーゼイ(T. reesei)Xyn3の、基質に結合し触媒作用を行う際に重要となる残基は、P.シンプリシシマム(P. simplicissimum)、及びT.アウランティアカス(T. aurantiacus)由来の上記GH10キシラナーゼの配列とのアラインメントにより得ることができる(図95A)。T.リーゼイ(T. reesei)Xyn3の残基E282は、求核性触媒残基であるものと予測されるのに対し、残基E91、N92、K95、Q97、S98、H128、W132、Q135、N175、E176、Y219、Q252、H254、W312及び/又はW320は、基質の結合及び/又は触媒に関与するものと予測される。
グリコシドヒドロラーゼファミリー11(「GH11」)酵素は、βジェリーロール構造を有する。この酵素は、一般的に酸/塩基触媒工程において少なくとも1種の酸性触媒残基を使用する、関係する機序により、エンド型の様式で加水分解を行う。構造内に分布するいくつかの他の残基は、構造内の、加水分解により切断されるキシロースモノマー対に隣接するキシロース単位の安定化に寄与する。3つのGH11ファミリーエンドキシラナーゼを試験した。これらの配列のアラインメントを図95Bに示す。E118(又はT.リーゼイ(T. reesei)Xyn2の成熟配列ではE86)及びE209(又はT.リーゼイ(T. reesei)Xyn2の成熟配列ではE177)は、T.リーゼイ(T. reesei)Xyn2において、それぞれ求核性の触媒残基及び一般/酸塩基性残基として同定されている(Havukainen et al.Biochem.,1996,35:9617〜24を参照されたい)。
グリコシドヒドロラーゼファミリー30(「GH30」)酵素は、グリコシルセラミダーゼ(EC 3.2.1.45);β−1,6−グルカナーゼ(EC 3.2.1.75);β−キシロシダーゼ(EC 3.2.1.37);β−グルコシダーゼ(3.2.1.21)活性を有する酵素を包含する。GH30の結晶構造は、Grabowski,et al.により、ゴーシェ病に関係するヒトβグルコセレブロシダーゼのものが最初に明らかにされた(Crit Rev Biochem Mol Biol 1990;25(6)385−414)。GH30は、β鎖のC末端の第4番目(酸/塩基触媒残基)及び第7番目(求核触媒残基)に位置する2つの重要なグルタミン酸活性部位を備える、(α/β)8 TIMバレル様の折りたたみを有する(Henrissat B,et al.Proc Natl Acad Sci U S A,92(15):7090〜4,1995;Jordan et al.,Applied Microbiol Biotechnol,86:1647,2010)。14種類のGH30タンパク質の全てをアラインメントさせたところ(13種は微生物由来のタンパク質であり、1種は真菌のバイオスポラ(Biospora)由来のエンド−b−キシラナーゼ(受入番号ADG62369)である)、アラインメントさせた14種類のタンパク質においてFv30Aのグルタメート162が保存されており、10種類ではFv30Aのグルタメート250が保存されていた。中程度に保存されている他の酸性残基も存在していたが、それ以外のものは広範には保存されていなかった。
グリコシドヒドロラーゼ61(「GH61」)酵素は真核生物で同定されている。H.ジェコリナ(H. jecorina)のCel61Aには、弱いエンドグルカナーゼ活性が観察されている(Karlsson et al,Eur J Biochem,2001,268(24):6498〜6507)。GH61ポリペプチドは、セルラーゼによるリグノセルロース系基質の酵素加水分解を増強する(Harris et al,2010,Biochemistry,49(15),3305〜16)。キチン分解に関与する内在性ポリペプチドに対する研究により、GH61ポリペプチドは、電子供与基質を必要とするものであり二価の金属イオンが関与する、酸化的加水分解機序を採用するものと予測されている(Vaaje−Kolstad,2010,Science,330(6001),219〜22)。この予測は、GH61ポリペプチドは、リグノセルロース系基質の分解時に二価のイオンに依存して相乗効果を示すという観察結果と一致する(Harris et al,2010,Biochemistry,49(15),3305〜16)。加えて、利用可能な構造を持つGH61ポリペプチドは、完全に保存されている多くのアミノ酸残基により二価の原子と結合している(Karkehabadi,2008,J.Mol.Biol.,383(1),144〜54;Harris et al,2010,Biochemistry,49(15),3305〜16)。GH61ポリペプチドは、保存残基により形成されかつ基質の結合に関与するものと考えられる金属結合部位において、平坦な表面を有する(Karkehabadi,2008,J.Mol.Biol.,383(1),144〜54)。
本明細書において、DNA又はRNAなどの核酸について使用するとき、用語「単離」は、それぞれ、核酸に関係する天然資源中に存在する他のDNA又はRNAから分離された分子を指す。更に、「単離核酸」は、天然には断片として生じず、天然環境では見出されない、核酸断片を包含することを意図する。ポリペプチドについて使用するとき、用語「単離」は、他の細胞タンパク質から単離されている単離物又は精製されている単離物、及び組み換えポリペプチドを指す。用語「単離」は、組み換えDNA法により生産させた際の細胞成分、ウイルス成分又は培養培地を実質的に含まない、核酸又はペプチドも指す。本明細書で使用するとき、用語「単離」は、化合した際の化学的な前駆体又は他の化合物を実質的に含まない、核酸又はペプチドも指す。
別途記載のない限り、本明細書で使用される全ての技術及び科学用語は、本開示の属する技術分野の業者により一般に理解される意味と同様の意味を持つ。Singleton,et al.,DICTIONARY OF MICROBIOLOGY AND MOLECULAR BIOLOGY,2D ED.、John Wiley and Sons,New York(1994)、並びにHale & Marham,THE HARPER COLLINS DICTIONARY OF BIOLOGY,Harper Perennial,N.Y.(1991)を、本発明に使用される多くの用語に関し一般的な辞書として、当業者に提供する。本明細書に記載のものと同様の、又は本明細書に記載のものに相当する任意の方法及び材料を、本開示を実施又は試験するために使用できるが、好ましい方法及び材料が記載される。数範囲は、範囲を定義する数を包括する。本発明は、記述されている特定の方法論、プロトコル、及び試薬に限定されるものではなく、これらは変更し得るものであることが理解されるべきである。
本開示で提供される表題は本発明の様々な態様又は実施形態を制限するものではなく、総じて本明細書において参照として用いられるものである。したがって、以降で定義される用語は、総じて本明細書を参照することでより詳しく定義される。
本開示は、グリコシルヒドロラーゼファミリー61(「GH61」)/エンドグルカナーゼ活性を有するポリペプチド、提供されるポリペプチドをコードしているヌクレオチド、提供されるヌクレオチドを含有しているベクター、並びに提供されるヌクレオチド及び/又はベクターを含有している細胞、を含む組成物を提供する。本開示は、バイオマス材料を加水分解する方法及び/又は提供された組成物を用いバイオマス混合物の粘度を低下させる方法、も提供する。
本明細書で使用するとき、ポリペプチドXの「変異体(variant)」は、1箇所以上のアミノ酸残基が変更されているポリペプチドXのアミノ酸配列を有するポリペプチドを指す。変異体は保存的又は非保存的な変更を有し得る。生物活性に影響を及ぼさずに、置換、挿入又は欠失させるアミノ酸残基を決定する際の指針は、当該技術分野において周知のコンピュータ・プログラム、例えば、LASERGENEソフトウェア(DNASTAR)を用い見つけることができる。本発明の変異体は、酵素前駆体のアミノ酸配列と比較してアミノ酸配列が変更されているポリペプチドを包含し、酵素変異体は、酵素前駆体がもつセルロース分解特性を保持しつつ、例えば、酵素前駆体と比較して、至適pHの上昇又は下降、酸化安定性の増大又は低下;熱安定性の増大又は低下、及び1種以上の基質に対する非活性の増大及び減少を示すなど、一部の特定の点で特性が変更されていてよい。
ポリヌクレオチド配列についての文脈で使用する際、用語「変異体(variant)」は、遺伝子又はこれらのコード配列に関連するポリヌクレオチド配列を包含し得る。この定義には、例えば、「対立遺伝子」、「スプライス」、「種」、又は「多型」変異体も包含される。スプライス変異体は、参照ポリヌクレオチドと非常に高い同一性を有するものの、一般的に、mRNAのプロセシング時のエキソンの選択的スプライシングに起因し、残基数が多くなっているか、又は少なくなっている。対応するポリペプチドは、更なる機能ドメインを保有していたり、あるいはドメインを欠損していたりする。種変異体は、ポリヌクレオチド配列が種によって異なる変異体である。得られるポリペプチドは、一般的に、互いに非常に高いアミノ酸同一性を有する。多型変異体は、所与のそれぞれの種間で、ポリヌクレオチド配列の特定の遺伝子において生じる、偏差である。
本明細書で使用するとき、ポリペプチドXの「変異体(mutant)」は、1種以上のアミノ酸残基に対し、アミノ酸置換が生じているものの、天然の酵素活性(すなわち、特定の加水分解反応を触媒する能力)を保持しているポリペプチドを指す。そのため、ポリペプチドX変異体は、本明細書で用語が定義されるとおり、特定の種類のポリペプチドXを構成する。ポリペプチドX変異体は、ポリペプチドのネイティブな又は野生型アミノ酸配列中の1つ以上のアミノ酸を置換することで作成できる。一部の態様では、本発明は、酵素前駆体のアミノ酸配列と比較してアミノ酸配列が変更されているポリペプチドを包含し、酵素変異体は、酵素前駆体がもつセルロース分解特性又はヘミセルロース分解特性を保持しつつ、例えば、酵素前駆体と比較して、至適pHの上昇又は下降、酸化安定性の増大又は低下;熱安定性の増大又は低下、及び1種以上の基質に対する非活性の増大及び減少を示すなど、一部の特定の点で特性が変更されていてよい。生物活性に影響を及ぼさずに、置換、挿入又は欠失させるアミノ酸残基を決定する際の指針は、当該技術分野において周知のコンピュータ・プログラム、例えば、LASERGENEソフトウェア(DNASTAR)を用い見つけることができる。アミノ酸置換は、保存的なものであっても非保存的なものであってもよく、アミノ酸残基の置換は遺伝子暗号によりコードされていてもコードされていなくてもよい。アミノ酸置換は、ポリペプチドの糖質結合ドメイン(CBMs)、ポリペプチドの触媒ドメイン(CD)、並びに/又はCBM及びCDのいずれもに局在させることができる。標準的な20個のアミノ酸「記号(alphabet)」を、側鎖の類似性に基づき化学的なファミリーに分けた。これらのファミリーとしては、塩基性側鎖(例えば、リシン、アルギニン、ヒスチジン)、酸性側鎖(例えば、アスパラギン酸、グルタミン酸)、極性無電荷側鎖(例えば、グリシン、アスパラギン、グルタミン、セリン、トレオニン、チロシン、システイン)、非極性側鎖(例えば、アラニン、バリン、ロイシン、イソロイシン、プロリン、フェニルアラニン、メチオニン、トリプトファン)、β分岐側鎖(例えば、トレオニン、バリン、イソロイシン)、及び芳香族側鎖(例えば、チロシン、フェニルアラニン、トリプトファン、ヒスチジン)を持つアミノ酸が挙げられる。「保存的アミノ酸置換」では、アミノ酸残基は、化学的に類似の側鎖を有するアミノ酸残基で置換される(すなわち、塩基性側鎖を有するアミノ酸は、塩基性側鎖を有する別のアミノ酸により置換される)。「非保存的アミノ酸置換」では、アミノ酸残基は、化学的に異なる側鎖を有するアミノ酸残基で置換される(すなわち、塩基性側鎖を有するアミノ酸は、芳香族側鎖を有する別のアミノ酸により置換される)。
本明細書で使用するとき、宿主細胞に対し「異種性」のポリペプチド又は核酸とは、宿主細胞において天然には生じないポリペプチド又は核酸を指す。
本明細書において値又はパラメータに付く「約」には、その値又はパラメータ自体を目的とする変動を含む(及び説明する)。例えば、「約X」を参照する記載には、「X」についての記載を含む。
本明細書及び添付の特許請求の範囲において使用するとき、単数冠詞「a」、「an」、及び「the」には、文脈上明記されない限り複数形も含む。
本明細書に記載の方法及び組成物の態様及び変形には、態様及び変形「からなる」及び/又は「から本質的になる」ものが含まれることは理解される。用語「含む(comprising)」は、「からなる(consisting)」又は「から本質的になる(consisting essentially)」よりも幅広い。
本明細書で使用するとき、用語「操作可能に連結された」は、選択されたDNAの発現を制御するために、選択したヌクレオチド配列(例えば、本明細書に記載のポリペプチドをコードしている)を制御配列(例えば、プロモーター)に近接させていることを意味する。例えば、プロモーターは、転写及び翻訳の向きの観点から、選択されたヌクレオチド配列の上流に位置する。「操作可能に連結された」は、適切な分子(例えば、転写活性化因子)が制御配列に結合した際に、遺伝子発現が可能になるような様式で、ヌクレオチド配列及び制御配列が連結されていることを意味する。
本明細書で使用するとき、用語「厳密度の低い条件下、中程度に厳密な条件下、厳密度の高い条件下、又は厳密度の非常に高い条件下」は、ハイブリッド形成及び洗浄についての条件を示す。ハイブリッド形成を実施する際の指針は、現行のプロトコル「Molecular Biology(John Wiley & Sons,N.Y.(1989),6.3.1〜6.3.6)」に見出すことができる。文献には、水を使用する方法及び使用しない方法が記載されており、これらのいずれをも使用することができる。本明細書で参照する具体的なハイブリダイゼーション条件は次のとおりのものである。1)厳密度の低いハイブリダイゼーション条件:約45℃下で6X塩化ナトリウム/クエン酸ナトリウム(SSC)中で行った後、少なくとも50℃下で0.2X SSC、0.1% SDS中で2回洗浄(厳密度の低いハイブリダイゼーション条件では、洗浄温度は55℃にまで上昇させることができる);2)厳密度が中程度のハイブリダイゼーション条件:約45℃下で6X SSC中で行った後、60℃下で、0.2X SSC、0.1% SDS中で1回以上洗浄;3)厳密度の高いハイブリダイゼーション条件:約45℃下で6X SSC中で行った後、65℃下で0.2X SSC、0.1% SDSで1回以上洗浄;及び好ましくは4)厳密度の非常に高いハイブリダイゼーション条件:65℃下で0.5Mリン酸ナトリウム、7% SDS中で行った後、65℃下で0.2 XSSC、1% SDS中で1回以上洗浄する。(4)「厳密度の非常に高い条件」は、別途記載のない限り好ましい条件である。
5.1 本開示のポリペプチド
本開示は、配列番号54、56、58、60、62、64、66、68、70、72、74、76、78、79、93、及び95のうちのいずれか1つの配列と、少なくとも約10(例えば、少なくとも約10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、225、250、275、300)残基の領域にわたって、又は触媒ドメイン(CD)の全長にわたって、又は糖結合ドメイン(CBM)の全長にわたって、少なくとも約60%(例えば、少なくとも約60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%)の配列同一性を有するアミノ酸配列の、単離、合成又は組み換えポリペプチドを提供する。単離、合成、又は組み換えポリペプチドはβ−グルコシダーゼ活性を有し得る。特定の実施形態では、単離、合成、又は組み換えポリペプチドは、β−グルコシダーゼポリペプチドであり、例えば、β−グルコシダーゼポリペプチドの変異体(variants)、変異体(mutants)、及び融合/ハイブリッド/キメラ体を包含する。特定の実施形態では、本開示は、2種以上のβ−グルコシダーゼ配列からなるハイブリッド/キメラ体である、β−グルコシダーゼ活性を有するポリペプチドを提供し、2種以上のβ−グルコシダーゼ配列のうち第1の配列は少なくともアミノ酸残基約200個分(例えば、少なくとも約200、250、300、350、400、又は500個分)の長さであり、配列番号96〜108のアミノ酸配列モチーフのうち1種以上又は全てを含み、2種以上のβ−グルコシダーゼ配列のうち第2の配列は、少なくともアミノ酸残基約50個分(例えば、少なくとも約50、75、100、125、150、175、又は200個分)の長さであり、配列番号109〜116のアミノ酸配列モチーフのうちの1種以上を含む。詳細には、2つ以上のβ−グルコシダーゼ配列のうち1つ目の配列は、少なくともアミノ酸残基約200個分の長さであり、配列番号197〜202のアミノ酸配列モチーフのうち少なくとも2つ(例えば、少なくとも2、3、4、又は全て)を含み、かつ2つ以上のβ−グルコシダーゼ配列のうち2つ目の配列は、少なくともアミノ酸残基約50個分の長さであり、配列番号203を含む。一部の実施形態では、第1の配列はβ−グルコシダーゼのキメラ/ハイブリッドポリペプチドのN末端に位置するのに対し、第2の配列はβ−グルコシダーゼのキメラ/ハイブリッドポリペプチドのC末端に位置する。一部の実施形態では、第1の配列のC末端残基と第2の配列のN末端残基とが連結されている。例えば、第1の配列は第2の配列の直後に隣接して又は直接連結されている。あるいは、第1の配列は第2の配列の直後に隣接しておらず、第1及び第2の配列はリンカードメインを介して連結されている。特定の実施形態では、第1の配列、第2の配列、又は第1の配列及び第2の配列の両方には、1箇所以上にグリコシル化部位を含ませることができる。一部の実施形態では、第1又は第2の配列は、ループ配列又はループ様の構造をコードしている配列を含む。特定の実施形態では、ループ配列は、アミノ酸残基約3、4、5、6、7、8、9、10、又は11個分の長さでありアミノ酸配列FDRRSPG(配列番号204)、又はFD(R/K)YNIT(配列番号205)を含む。特定の実施形態では、第1の及び第2の配列はいずれもループ配列を含まず、むしろ第1の及び第2の配列を連結しているリンカードメインがループ配列を含む。β−グルコシダーゼポリペプチドのハイブリッド/キメラポリペプチドは、第1の配列、第2の配列又はリンカードメイン配列の各々が由来する、対応するβ−グルコシダーゼポリペプチドと比較して、向上した安定性を有する。一部の実施形態では、安定性の向上とは、標準的な保存条件下での保存時あるいは標準条件下での発現及び/又は生産時のタンパク質の切断(例えば、ループ配列中の残基又はループ配列の外側の残基の切断)に対するタンパク質の安定性又は抵抗性が向上していることを意味する。
特定の態様では、本開示は、β−グルコシダーゼの単離、合成、組み換えポリペプチドを提供し、このポリペプチドは、少なくとも2種(例えば、2、3、又は更には4種)のβ−グルコシダーゼ配列のハイッブリッド体であり、少なくとも2種のβ−グルコシダーゼ配列のうちの第1の配列は、少なくともアミノ酸残基約200個分(例えば、少なくとも約200、250、300、350、又は400個分)の長さであり、かつ配列番号54、56、58、62、64、66、68、70、72、74、76、78、及び79のうちのいずれか1つの相当する長さの配列と少なくとも約60%(例えば、少なくとも約65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%)同一性を有する配列を含み、それに対し少なくとも2種のβ−グルコシダーゼ配列のうちの第2の配列は、少なくともアミノ酸残基約50個分(例えば、少なくとも約50、75、100、125、150、又は200個分)の長さであり、かつ配列番号60の相当する長さの配列と少なくとも約60%(例えば、少なくとも約65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%)同一性を有する配列を含む。本開示は、β−グルコシダーゼ活性を有する単離、合成、組み換えポリペプチドを提供し、このポリペプチドは、少なくとも2種(例えば、2、3、又は更には4種)のβ−グルコシダーゼ配列のハイブリッド体であり、少なくとも2種のβ−グルコシダーゼ配列のうちの第1の配列は、少なくともアミノ酸残基約200個分の長さであり、かつ配列番号60の相当する長さの配列と少なくとも約60%同一性を有する配列を含み、それに対し少なくとも2種のβ−グルコシダーゼ配列のうちの第2の配列は、少なくともアミノ酸残基約50個分の長さであり、かつ配列番号54、56、58、62、64、66、68、70、72、74、76、78、及び79の相当する長さの配列と少なくとも約60%同一性を有する配列を含む。詳細には、2つ以上のβ−グルコシダーゼ配列のうち1つ目の配列は、少なくともアミノ酸残基約200個分の長さであり、配列番号197〜202のアミノ酸配列モチーフのうち少なくとも2つ(例えば、少なくとも2、3、4、又は全て)を含み、かつ2つ以上のβ−グルコシダーゼ配列のうち2つ目の配列は、少なくともアミノ酸残基約50個分の長さであり、配列番号203を含む。一部の実施形態では、第1の配列はβ−グルコシダーゼのキメラ又はハイブリッドポリペプチドのN末端に位置するのに対し、第2の配列はβ−グルコシダーゼのキメラ又はハイブリッドポリペプチドのC末端に位置する。一部の実施形態では、第1の配列のC末端残基と第2の配列のN末端残基とが連結されており、例えば、第1の配列は第2の配列と隣接して又は直接連結されている。あるいは、第1の配列は第2の配列と隣接しておらず、第1の配列及び第2の配列はリンカードメインを介して連結されている。第1の配列、第2の配列、又は第1の配列及び第2の配列の両方には、1箇所以上にグリコシル化部位を含ませることができる。第1又は第2の配列には、ループ配列を含ませてよく、あるいは第3のβ−グルコシダーゼポリペプチドに由来し、アミノ酸残基約3、4、5、6、7、8、9、10、又は11個分の長さであり、アミノ酸配列FDRRSPG(配列番号204)又はFD(R/K)YNIT(配列番号205)を含むループ様の構造をコードする配列を含ませてよい。特定の実施形態では、第1の及び第2の配列はいずれもループ配列を含まず、むしろ第1の及び第2の配列を連結しているリンカードメインがループ配列を含む。一部の実施形態では、β−グルコシダーゼポリペプチドのハイブリッド/キメラポリペプチドは、第1の配列、第2の配列又はリンカードメイン配列の各々が由来する、対応するβ−グルコシダーゼポリペプチドと比較して、向上した安定性を有する。一部の実施形態では、安定性の向上とは、タンパク質の安定性が向上することを意味し、これにより、融合/キメラポリペプチドは、標準的な保存条件下での保存時、あるいは標準的な発現/生産条件下での発現及び/又は生産時の、ループ配列中の残基での、又はループ配列の外側の残基又は位置でのタンパク質の切断を受けにくくなる。
特定の態様では、本開示は、2種以上のβ−グルコシダーゼ配列に由来するβ−グルコシダーゼの融合/キメラポリペプチドを提供し、第1の配列はFv3Cに由来し、かつ少なくともアミノ酸残基約200個分の長さであり、第2の配列はT.リーゼイ(T. reesei)Bgl3(又は「Tr3B」)に由来し、少なくともアミノ酸残基約50個分の長さである。一部の実施形態では、例えば、第1の配列が第2の配列の直後に隣接して又は直接連結されているなど、第1の配列のC末端は第2の配列のN末端と連結される。あるいは、第1の配列は、リンカードメイン配列を介して第2の配列に連結されている。一部の実施形態では、第1又は第2の配列のいずれもがループ配列を含み、このループ配列は第3のβ−グルコシダーゼポリペプチドに由来し、アミノ酸残基約3、4、5、6、7、8、9、10、又は11個分の長さであり、アミノ酸配列FDRRSPG(配列番号204)又はFD(R/K)YNIT(配列番号205)を含む。特定の実施形態では、第1の及び第2の配列を連結しているリンカードメインは、ループ配列を含む。特定の実施形態では、ループ配列は、Te3Aに由来する。一部の実施形態では、β−グルコシダーゼの融合/キメラポリペプチドは、各キメラ部位の由来する、対応するβ−グルコシダーゼポリペプチド(例えば、Fv3C、Te3A、及び/又はTr3B)と比較して向上された安定性を有する。一部の実施形態では、安定性の向上とは、タンパク質の安定性が向上することを意味し、これにより、融合/キメラポリペプチドは、標準的な保存条件下での保存時、あるいは標準的な発現/生産条件下での発現及び/又は生産時の、ループ配列中の残基での、又はループ配列の外側の残基又は位置でのタンパク質の切断を受けにくくなる。例えば、融合/キメラポリペプチドは、ループ配列のC末端上流の残基での切断を、例えば、キメラ及びFv3Cポリペプチドを整列させた場合にFv3Cポリペプチドの同じ部位にある残基と比較して受けにくい。
本開示は、β−グルコシダーゼ活性を有し、かつ配列番号54、56、58、60、62、64、66、68、70、72、74、76、78、79、93、及び95のうちのいずれか1つの配列と、又は触媒ドメイン(CD)の全長にわたって、又は糖結合ドメイン(CBM)の全長にわたって、少なくとも約60%(例えば、少なくとも約60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%)の配列同一性を有するアミノ酸配列を含む、単離、合成又は組み換えポリペプチドも提供する。
一部の態様では、本開示は、配列番号52、80〜81、206〜207のうちのいずれか1つの配列の少なくとも約10(例えば、少なくとも約10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、225、250、275、300)残基にわたって、又は触媒ドメイン(CD)の全長にわたって、又は糖結合ドメイン(CBM)の全長にわたって、少なくとも約60%(例えば、少なくとも約60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%)の配列同一性を有するアミノ酸配列の、単離、合成又は組み換えポリペプチドを提供する。特定の実施形態では、単離、合成、又は組み換えポリペプチドは、GH61/エンドグルカナーゼ活性を有する。一部の実施形態では、本開示は、少なくともアミノ酸残基約50個分(例えば、少なくとも約50、100、150、200、250、又は300個分)の長さであり、(1)配列番号84、及び88;(2)配列番号85、及び88;(3)配列番号86;(4)配列番号87;(5)配列番号84、88、及び89;(6)配列番号85、88、及び89;(7)配列番号84、88、及び90;(8)配列番号85、88、及び90;(9)配列番号84、88、及び91;(10)配列番号85、88、及び91;(11)配列番号84、88、89、及び91;(12)配列番号84、88、90、及び91;(13)配列番号85、88、89、及び91:及び(14)配列番号85、88、90、及び91からなる群から選択される配列モチーフのうちの1つ以上を含む、単離、合成又は組み換えポリペプチドも提供する。特定の実施形態では、ポリペプチドは、例えば、T.リーゼイ(T. reesei)Eg4といった好適な微生物由来のEG IVポリペプチドなどの、GH61エンドグルカナーゼポリペプチドである。一部の実施形態では、GH61エンドグルカナーゼポリペプチドは、T.リーゼイ(T. reesei)Eg4由来の変異体(variant)、変異体(mutant)、又は融合ポリペプチドである(例えば、ポリペプチドは、配列番号52と少なくとも約60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%配列同一性を有する)。
一部の態様では、本開示は、配列番号2、4、6、8、10、12、14、16、18、20、22、24、26、28、30、32、34、36、38、40、42、43、及び45のうちのいずれか1つのポリペプチドと、少なくとも約10残基、例えば、例えば、少なくとも約15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、225、250、275、300、325、若しくは350残基残基にわたって、又は未熟なポリペプチド、成熟ポリペプチド、触媒ドメイン(CD)若しくは糖結合ドメイン(CBM)の全長にわたって少なくとも約70%、例えば、少なくとも約71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%、又は完全に(100%)同一性を有する単離、合成、組み換えポリペプチドも提供する。
特定の態様では、本開示は、配列番号54、56、58、60、62、64、66、68、70、72、74、76、78、79、93、及び95のうちのいずれか1つの配列と、少なくとも約10残基(例えば、少なくとも約10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、225、250、275、300残基)の領域にわたって、又は触媒ドメイン(CD)若しくは糖結合ドメイン(CBM)の全長にわたって、少なくとも60%(例えば、少なくとも約60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%)の配列同一性を有するβ−グルコシダーゼポリペプチドをコードしている単離、合成、又は組み換えヌクレオチドを提供する。一部の実施形態では、単離、合成又は組み換えヌクレオチドは、少なくともアミノ酸残基約200個分(例えば、少なくとも約200、250、300、350、400、又は500個分)の長さである、配列番号96〜108のアミノ酸配列モチーフのうちの1つ以上又は全てを含む第1の配列、及び少なくともアミノ酸残基約50個分(例えば、少なくとも約50、75、100、125、150、175、又は200個分)の長さである、配列番号109〜116のアミノ酸配列モチーフのうちの1つ以上又は全てを含む第2の配列、を含む、β−グルコシダーゼ活性を有する融合/キメラポリペプチドをコードする。詳細には、2つ以上のβ−グルコシダーゼ配列のうち1つ目の配列は、少なくともアミノ酸残基約200個分の長さであり、配列番号197〜202のアミノ酸配列モチーフのうち少なくとも2つ(例えば、少なくとも2、3、4、又は全て)を含み、かつ2つ以上のβ−グルコシダーゼ配列のうち2つ目の配列は、少なくともアミノ酸残基約50個分の長さであり、配列番号203を含む。特定の実施形態では、第1の配列のC末端残基と第2の配列のN末端残基とが連結されている。他の実施形態では、第1及び第2のβ−グルコシダーゼ配列は、アミノ酸残基約3、4、5、6、7、8、9、10、又は11個分の長さのループ配列を含んでよく、かつアミノ酸配列FDRRSPG(配列番号204)又はFD(R/K)YNIT(配列番号205)を含む第3のβ−グルコシダーゼポリペプチドに由来する、リンカードメインを介して連結される。
特定の態様では、本開示は、β−グルコシダーゼポリペプチドをコードしているの単離、合成又は組み換えヌクレオチドを提供し、このヌクレオチドは、少なくとも2種(例えば、2、3、又は更には4種)のβ−グルコシダーゼ配列のハイッブリッド体であり、第1のβ−グルコシダーゼ配列は、少なくともアミノ酸残基約200個分(例えば、少なくとも約200、250、300、350、又は400個分)の長さであり、かつ配列番号54、56、58、62、64、66、68、70、72、74、76、78、及び79のうちのいずれか1つの相当する長さの配列と少なくとも約60%(例えば、少なくとも約65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%)同一性を有する配列を含むものであり、それに対し第2のβ−グルコシダーゼ配列は、少なくともアミノ酸残基約50個分(例えば、少なくとも約50、75、100、125、150、又は200個分)の長さであり、かつ配列番号60の相当する長さの配列と少なくとも約60%(例えば、少なくとも約65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%)同一性を有する配列を含むものである。本開示は、β−グルコシダーゼ活性を有するポリペプチドをコードしている単離、合成、又は組み換えヌクレオチドも提供し、このヌクレオチドは、少なくとも2種(例えば、2、3、又は更には4種)のβ−グルコシダーゼ配列のハイッブリッド又は融合体であり、第1の配列は、少なくともアミノ酸残基約200個分(例えば、少なくとも約200、250、300、350、又は400個分)であり、かつ配列番号60の相当する長さの配列と少なくとも約60%(例えば、少なくとも約65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%)同一性を有する配列を含むものであり、それに対し第2の配列は、少なくともアミノ酸残基約50個分(例えば、少なくとも約50、75、100、125、150、又は200個分)の長さであり、かつ配列番号54、56、58、62、64、66、68、70、72、74、76、78、及び79のうちのいずれか1つの相当する長さの配列と少なくとも約60%(例えば、少なくとも約65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%)同一性を有する配列を含むものである。詳細には、2つ以上のβ−グルコシダーゼ配列のうち1つ目の配列は、少なくともアミノ酸残基約200個分の長さであり、配列番号197〜202のアミノ酸配列モチーフのうち少なくとも2つ(例えば、少なくとも2、3、4、又は全て)を含み、かつ2つ以上のβ−グルコシダーゼ配列のうち2つ目の配列は、少なくともアミノ酸残基約50個分の長さであり、配列番号203を含む。一部の実施形態では、ヌクレオチドは、β−グルコシダーゼのキメラ/融合ポリペプチドのN端末に位置する第1のアミノ酸配列と、β−グルコシダーゼのキメラ/融合ポリペプチドのC末端に位置する第2のアミノ酸配列とをコードし、第1の配列のC末端は、第2の配列のN末端と連結されている。あるいは、第1の配列は、リンカードメイン配列を介して第2の配列に連結されている。一部の実施形態では、第1のアミノ酸配列、第2のアミノ酸配列又はリンカードメインは、ループ様の構造を示す配列を含むアミノ酸配列を含みループ様の構造は、第3のβ−グルコシダーゼポリペプチドに由来し、アミノ酸残基約3、4、5、6、7、8、9、10、又は11個分の長さであり、かつアミノ酸配列FDRRSPG(配列番号204)又はFD(R/K)YNIT(配列番号205)を含む。
一部の態様では、本開示は、配列番号52、55、57、59、61、63、65、67、69、71、73、75、77、92又は94のうちのいずれか1つの配列又は少なくとも約300残基(例えば、少なくとも約300、400、500、又は600残基)の長さのこれらの断片と、少なくとも60%(例えば、少なくとも約60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%)同一性を有する、単離、合成、又は組み換えヌクレオチドを提供する。特定の実施形態では、本開示は、厳密度の低い条件下、厳密度の中程度の条件下、厳密度の高い条件下、厳密度の非常に高い条件下で、配列番号53、55、57、59、61、63、65、67、69、71、73、75、77、92又は94のいずれか1つの配列、これらの少なくとも約300残基分の長さの断片、あるいはこれらの相補鎖とハイブリッド形成し得る単離、合成、又は組み換えヌクレオチドを提供する。
本開示は、特定の態様では、GH61/エンドグルカナーゼ活性を有し、配列番号52、80〜81、206〜207のうちのいずれか1つの配列と少なくとも約10残基(例えば、少なくとも約10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、225、250、275、300)残基にわたって、又は触媒ドメイン(CD)の全長にわたって、又は糖結合ドメイン(CBM)の全長にわたって、少なくとも約60%(例えば、少なくとも約60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%)同一性を有するポリペプチドをコードしている、単離、合成、又は組み換えヌクレオチドも提供する。一部の実施形態では、本開示は、少なくともアミノ酸残基約50個分(例えば、少なくとも約50、100、150、200、250、又は300個分)の長さであり、(1)配列番号84及び88;(2)配列番号85及び88;(3)配列番号86;(4)配列番号87;(5)配列番号84、88及び89;(6)配列番号85、88、及び89;(7)配列番号84、88、及び90;(8)配列番号85、88及び90;(9)配列番号84、88及び91;(10)配列番号85、88及び91;(11)配列番号84、88、89及び91;(12)配列番号84、88、90及び91;(13)配列番号85、88、89及び91:並びに(14)配列番号85、88、90及び91からなる群から選択される配列モチーフのうちの1種以上を含むポリペプチドをコードしている単離、合成又は組み換えヌクレオチドを提供する。特定の実施形態では、ポリヌクレオチドは、配列番号52に対して少なくとも約60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%配列同一性を有するポリペプチドをコードしているポリヌクレオチドである。一部の実施形態では、ポリヌクレオチドは、GH61エンドグルカナーゼポリペプチドをコードする(例えば、限定するものではないが、T.リーゼイ(T. reesei)Eg4などの、好適な生物に由来するEG IV型ポリペプチド)。
一部の態様では、本開示は、配列番号2、4、6、8、10、12、14、16、18、20、22、24、26、28、30、32、34、36、38、40、42、43、及び45のうちのいずれか1つのポリペプチドと、少なくとも約10残基、例えば、少なくとも約15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、225、250、275、300、325、若しくは350残基の領域にわたって、又は未熟なポリペプチド、成熟ポリペプチド、触媒ドメイン(CD)若しくは糖結合ドメイン(CBM)の全長にわたって少なくとも約70%(例えば、少なくとも約71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%、又は完全に(100%))同一性を有するポリペプチドをコードしている、単離、合成、又は組み換えポリヌクレオチドを提供する。一部の態様では、本開示は、配列番号1、3、5、7、9、11、13、15、17、19、21、23、25、27、29、31、33、35、37、39、及び41のいずれか1つと、又は少なくとも約10、20、30、40、50、60、70、80、90、100残基の長さのこれらの断片と、少なくとも約70%(例えば、少なくとも約71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%、又は完全に(100%))同一性を有する単離、合成、又は組み換えポリヌクレオチドを提供する。一部の実施形態では、本開示は、厳密度の低い条件下、厳密度の中程度の条件下、厳密度の高い条件下、又は厳密度の非常に高い条件下で、配列番号1、3、5、7、9、11、13、15、17、19、21、23、25、27、29、31、33、35、37、39、及び41のいずれか1つの配列、又はこれらの断片若しくは下位配列とハイブリッド形成する単離、合成、又は組み換えポリヌクレオチドを提供する。
本明細書に記載の任意のアミノ酸配列は、特定(specified)のアミノ酸配列の各C−及び/又はN端末に隣接した少なくとも1個、例えば、少なくとも2、3、5、10、又は20個の異種アミノ酸と共に、あるいはこのようなアミノ酸と複合させて製造することができ、及び/あるいは本開示の酵素のC末端及び/又はN端末のから少なくとも1個、例えば、少なくとも2、3、5、10、又は20個のアミノ酸を欠失させて製造することができる。
他の変形も同様に本開示の範囲内のものである。例えば、1種以上のアミノ酸残基を改変させて、酵素のpIを上昇させても低下させても良い。pI値の変更は、グルタメート残基を除去するか、又はこの残基の他のアミノ酸残基で置き換えることでなすことができる。
本開示は、具体的には、例えば、Fv3C、Pa3D、Fv3G、Fv3D、Tr3A(又はT.リーゼイ(T. reesei)Bgl1)、Tr3B(又はT.リーゼイ(T. reesei)Bgl3)、Te3A、An3A、Fo3A、Gz3A、Nh3A、Vd3A、Pa3G、及びTn3Bポリペプチドなどのβ−グルコシダーゼポリペプチドを提供する。一部の実施形態では、β−グルコシダーゼポリペプチドは、β−グルコシダーゼの融合/キメラ体であり、上記のβ−グルコシダーゼポリペプチド(変異体(variants)又は変異体(mutants)を含む)のいずれかに由来する2種以上のβ−グルコシダーゼ配列を含む。例えば、β−グルコシダーゼポリペプチドは、Tr3Bの一部に操作可能に連結されているFv3C部位を含むキメラ/融合ポリペプチドである。例えば、β−グルコシダーゼポリペプチドはキメラ/融合ポリペプチドであり、このポリペプチドは、Fv3CのN端末配列から連続的に延びる少なくとも約200残基を含む第1領域、ループ配列を含むリンカードメインを含み、ループ配列が約3、4、5、6、7、8、9、10、又は11残基分の長さであり、Te3Aに由来する配列(例えば、アミノ酸配列FDRRSPG(配列番号204)又はFD(R/K)YNIT(配列番号205)を含む)を含む、第2領域、並びにTr3BのC端末配列に由来する連続的に延びる少なくとも約50残基を含む第3領域、を含む。
本開示は、更に、例えば、T.リーゼイ(T. reesei)Eg4(「TrEG4」とも呼ばれる)、T.リーゼイ(T. reesei)Eg7(「TrEG7」又は「TrEGb」とも呼ばれる)、TtEGなどの、数多くのGH61エンドグルカナーゼポリペプチドを提供する。特定の実施形態では、本発明のGH61エンドグルカナーゼポリペプチドは、少なくとも100残基の長さであり、(1)配列番号84及び88;(2)配列番号85及び88;(3)配列番号86;(4)配列番号87;(5)配列番号84、88及び89;(6)配列番号85、88、及び89;(7)配列番号84、88、及び90;(8)配列番号85、88及び90;(9)配列番号84、88及び91;(10)配列番号85、88及び91;(11)配列番号84、88、89及び91;(12)配列番号84、88、90及び91;(13)配列番号85、88、89及び91:並びに(14)配列番号85、88、90及び91からなる群から選択される配列モチーフのうちの1種以上を含む。
本開示は、例えば、Fv3A、Pf43A、Fv43E、Fv39A、Fv43A、Fv43B、Pa51A、Gz43A、Fo43A、Af43A、Pf51A、AfuXyn2、AfuXyn5、Fv43D、Pf43B、Fv43B、Fv51A、T.リーゼイ(T. reesei)Xyn3、T.リーゼイ(T. reesei)Xyn2、及びT.リーゼイ(T. reesei)Bxl1などの、多様なセルラーゼポリペプチド及びヘミセルラーゼポリペプチドを提供する。
これらの酵素を1種以上(例えば、2種以上、3種以上、4種以上、5種以上、又は更には6種以上)組み合わせたものが、本発明の遺伝子操作型酵素組成物中に適切に存在しており、酵素のうちの少なくとも2種は異なる生物資源に由来する。本発明の遺伝子操作型酵素組成物中の酵素のうちの少なくとも1種以上は、組成物中のタンパク質の合計重量に対し、天然に生じる組成物の場合の割合(重量%)とは異なる割合(重量%)で適切に存在し、例えば、酵素のうちの少なくとも1種は過剰発現又は低発現させることができる。
Fv3A:Fv3A(配列番号2)のアミノ酸配列を図16B及び91に示す。配列番号2は、未成熟なFv3A配列である。Fv3Aは配列番号2の残基1〜23に相当する予測シグナル配列を有しており、このシグナル配列が切断されることで配列番号2の残基24〜766に相当する配列を有する成熟タンパク質が生成されるものと予測される。予測保存ドメインを、図16B中にボールド体で示す。Fv3Aは、例えば、基質としてp−ニトフェニル(nitophenyl)−β−キシロピラノシド、キシロビオース、直鎖キシロオリゴマーの混合物、ヘミセルロース由来の分岐アラビノキシランオリゴマー、又は希アンモニアで前処理したトウモロコシ穂軸を用いた酵素機能アッセイにおいて、β−キシロシダーゼ活性を有することが示された。予測触媒残基がD291であったのに対し、フランキング残基S290及びC292は基質結合に関与するものと予測された。E175及びE213は他の酵素GH3及びGH39間で保存されており、触媒機能を有するものと予測される。本明細書で使用するとき、用語、「Fv3Aポリペプチド」は、配列番号2の残基24〜766間の、少なくとも50個、例えば、少なくとも75、100、125、150、175、200、250、300、350、400、450、500、550、600、650、又は700個の連続するアミノ酸残基と、少なくとも85%、例えば、少なくとも86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%配列同一性を有する配列を含む、ポリペプチド及び/又はその変異体を指す。好ましいFv3Aポリペプチドは、ネイティブなFv3Aと比較したときに、残基D291、S290、C292、E175、及びE213において変更が存在しない。好ましくは、Fv3Aポリペプチドは、図91のアラインメントに示すとおり、Fv3A、T.リーゼイ(T. reesei)Bxl1及び/又はT.リーゼイ(T. reesei)Bgl1間で保存されているアミノ酸残基の少なくとも70%、75%、80%、85%、90%、95%、98%、又は99%が未改変である。Fv3Aポリペプチドは、好適には、図16Bに示すようなネイティブなFv3Aの、予測保存ドメインの全長を含む。本発明のFv3Aポリペプチドはβ−キシロシダーゼ活性を有し、配列番号2のアミノ酸配列、又は配列番号2の残基(i)24〜766、(ii)73〜321、(iii)73〜394、(iv)395〜622、(v)24〜622、又は(vi)73〜622と少なくとも90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%配列同一性を有する。
Pf43A:Pf43A(配列番号4)のアミノ酸配列を図17B及び93に示す。配列番号4は、未成熟なPf43A配列である。Pf43Aは配列番号4の残基1〜20に相当する予測シグナル配列を有しており、このシグナル配列が切断されることで配列番号4の残基21〜445に相当する配列を有する成熟タンパク質が生成されるものと予測される。図17B中、予測保存ドメインはボールド体で記載し、予測CBMは大文字で記載し、CD及びCBMを分離する予測リンカーはイタリック体で記載する。Pf43Aは、例えば、基質としてp−ニトフェニル(nitophenyl)−β−キシロピラノシド、キシロビオース、直鎖キシロオリゴマーの混合物、又はアンモニアで前処理したトウモロコシ穂軸を用いた酵素機能アッセイにおいて、β−キシロシダーゼ活性を有することが示された。予測触媒残基としては、D32又はD60のいずれか、D145、及びE206が挙げられる。図93において、C末端中で下線を付して示される領域が予測CBMである。本明細書で使用するとき、用語、「Pf43Aポリペプチド」は、配列番号4の残基21〜445間の、少なくとも50、75、100、125、150、175、200、250、300、350、又は400個の連続するアミノ酸残基と、少なくとも85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%配列同一性を有する配列を含む、ポリペプチド及び/又はその変異体を指す。好ましいPf43Aポリペプチドは、ネイティブなPf43Aと比較したときに残基D32又はD60、D145、及びE206において変更はなされていない。好ましくは、Pf43Aポリペプチドは、Pf43Aファミリーのタンパク質間、及び図93のアラインメント中のその他の1、2、3、4、5、6、7、又は8種全てのアミノ酸配列間で保存されていることが判明しているアミノ酸残基の、少なくとも70%、80%、90%、95%、98%、又は99%が未改変である。本発明のPf43Aポリペプチドは、次のドメイン:図17Bに示すとおりPf43Aの(1)予測CBM、(2)予測保存ドメイン、及び(3)リンカーのうちの2つ以上又は全てを適宜含む本発明のPf43Aポリペプチドはβ−キシロシダーゼ活性を有し、配列番号4のアミノ酸配列、又は配列番号4の残基(i)21〜445、(ii)21〜301、(iii)21〜323、(iv)21〜444、(v)302〜444、(vi)302〜445、(vii)324〜444、又は(viii)324〜445と少なくとも90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%配列同一性を有する。好適なポリペプチドは、β−キシロシダーゼ活性を有する。
Fv43E:Fv43E(配列番号6)のアミノ酸配列を図18B及び93に示す。配列番号6は、未成熟なFv43E配列である。Fv43Eは配列番号6の残基1〜18に相当する予測シグナル配列を有しており、このシグナル配列が切断されることで配列番号6の残基19〜530に相当する配列を有する成熟タンパク質が生成されるものと予測される。予測保存ドメインを、図18B中にボールド体で示す。Fv43Eは、例えば、基質として4−ニトフェニル(nitophenyl)−β−D−キシロピラノシド、キシロビオース、及び混合物、直鎖キシロオリゴマー、又はアンモニアで前処理したトウモロコシ穂軸を用いた酵素機能アッセイにおいて、β−キシロシダーゼ活性を有することが示された。予測触媒残基と、D40又はD71のいずれか、D155、及びE241が挙げられる。本明細書で使用するとき、「Fv43Eポリペプチド」は、配列番号6の残基19〜530間の連続する少なくとも50、75、100、125、150、175、200、250、300、350、400、450、又は500個の残基と少なくとも85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%配列同一性を有する配列を含む、ポリペプチド及び/又はこれらの変異体を指す。好ましいFv43Eポリペプチドは、ネイティブなFv43Eと比較したときに残基D40又はD71、D155、及びE241において変更はなされていない。好ましくは、Fv43Eポリペプチドは、Fv43E酵素ファミリー間、及び図93のアラインメント中のその他の1、2、3、4、5、6、7、又は8種全てのアミノ酸配列間で保存されていることが判明しているアミノ酸残基の、少なくとも70%、80%、90%、95%、98%、又は99%が未改変である。本発明のFv43Eポリペプチドは、好ましくはβ−キシロシダーゼ活性を有し、配列番号6のアミノ酸配列又は配列番号6の残基(i)19〜530、(ii)29〜530、(iii)19〜300若しくは(iv)29〜300に対し少なくとも90%、91%、92%、93%、94%、95%、96%、97%、98%、99%又は100%配列同一性を有する。
Fv39A:Fv39A(配列番号8)のアミノ酸配列を図19B及び92に示す。配列番号8は、未成熟なFv39A配列である。Fv39Aは配列番号8の残基1〜19に相当する予測シグナル配列を有しており、このシグナル配列が切断されることで配列番号8の残基20〜439に相当する配列を有する成熟タンパク質が生成されるものと予測される。予測保存ドメインを、図19B中にボールド体で示す。Fv39Aは、例えば、基質としてp−ニトフェニル(nitophenyl)−β−キシロピラノシド、キシロビオース、又は直鎖キシロオリゴマーの混合物を用いた酵素機能アッセイにおいて、β−キシロシダーゼ活性を有することが示された。Fv39Aの残基E168及びE272は、それぞれ、Fv39Aを有するT.サッカロリエィカム(T. saccharolyticum)(Uniprot受入番号P36906)及びG.ステアロサーモフィルス(G. stearothermophilus)(Uniprot受入番号Q9ZFM2)に由来する、上記GH39キシロシダーゼの配列アラインメントに基づき、酸塩基性触媒及び求核性触媒として機能するものと予測される。本明細書で使用するとき、「Fv39Aポリペプチド」は、配列番号8の残基20〜439間の連続するアミノ酸残基の少なくとも50、75、100、125、150、175、200、250、300、350、又は400個の残基と少なくとも85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%配列同一性を有する配列を含む、ポリペプチド及び/又はこれらの変異体を指す。好ましいFv39Aポリペプチドは、ネイティブなFv39Aと比較したときに、残基E168及びE272において変更は存在しない。好ましくは、Fv39Aポリペプチドは、Fv39A、並びにT.サッカロリティカム(T. saccharolyticum)及びG.ステアロサーモフィルス(G. stearothermophilus)由来のキシロシダーゼ(上記を参照のこと)のファミリー又は酵素間で保存されているアミノ酸残基の少なくとも70%、80%、90%、95%、98%、又は99%が未改変である。Fv39Aポリペプチドは、好適には、図19Bに示すようなネイティブなFv39Aの、予測保存ドメインの全長を含む。本発明のFv39Aポリペプチドは、好ましくはβ−キシロシダーゼ活性を有し、配列番号8のアミノ酸配列又は配列番号8の残基(i)20〜439、(ii)20〜291、(iii)145〜291、若しくは(iv)145〜439に対し少なくとも90%、91%、92%、93%、94%、95%、96%、97%、98%、99%又は100%配列同一性を有する。
Fv43A:Fv43A(配列番号10)のアミノ酸配列を図20B及び93に提供する。配列番号10は、未成熟なFv43A配列である。Fv43Aは配列番号10の残基1〜22に相当する予測シグナル配列を有しており、このシグナル配列が切断されることで配列番号10の残基23〜449に相当する配列を有する成熟タンパク質が生成されるものと予測される。図20B中、予測保存ドメインはボールド体で記載し、予測CBMは大文字で記載し、CD及びCBMを分離する予測リンカーはイタリック体で記載する。Fv43Aは、例えば、基質として4−ニトフェニル(nitophenyl)−β−D−キシロピラノシド、キシロビオース、直鎖キシロオリゴマーの混合物、ヘミセルロース由来の分岐アラビノキシランオリゴマー、及び/又は希直鎖キシロオリゴマーを用いた酵素機能アッセイにおいて、β−キシロシダーゼ活性を有することが示された。予測触媒残基としては、D34又はD62のいずれか、D148、及びE209が挙げられる。本明細書で使用するとき、「Fv43Aポリペプチド」は、配列番号10の残基23〜449間の連続する少なくとも50、75、100、125、150、175、200、250、300、350、又は400個のアミノ酸残基と少なくとも85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%配列同一性を有する配列を含む、ポリペプチド及び/又はこれらの変異体を指す。好ましくは、Fv43Aポリペプチドは、ネイティブなFv43Aと比較して、残基D34又はD62、D148、及びE209において変更はなされていない。好ましくは、Fv43Aポリペプチドは、Fv43A酵素ファミリー間、及び図93のアラインメント中のその他の1、2、3、4、5、6、7、8又は9種全てのアミノ酸配列間で保存されているアミノ酸残基の、少なくとも70%、80%、90%、95%、98%、又は99%が未改変である。Fv43Aポリペプチドは、図20Bに示すネイティブなFv43Aの予測CBMの全長、及び/又はネイティブなFv43Aの予測保存ドメインの全長、及び/又はFv43Aのリンカーを適切に含む。本発明のFv45Aポリペプチドは、好ましくはβ−キシロシダーゼ活性を有し、配列番号10のアミノ酸配列又は配列番号10の残基(i)23〜449、(ii)23〜302、(iii)23〜320、(iv)23〜448、(v)303〜448、(vi)303〜449、(vii)321〜448若しくは(viii)321〜449に対し少なくとも90%、91%、92%、93%、94%、95%、96%、97%、98%、99%又は100%配列同一性を有する。
Fv43B:Fv43B(配列番号12)のアミノ酸配列を図21B及び93に示す。配列番号12は、未成熟なFv43B配列である。Fv43Bは配列番号12の残基1〜16に相当する予測シグナル配列を有しており、このシグナル配列が切断されることで配列番号12の残基17〜574に相当する配列を有する成熟タンパク質が生成されるものと予測される。予測保存ドメインを、図21B中にボールド体で示す。Fv43Bは、例えば、基質として4−ニトフェニル(nitophenyl)−β−D−キシロピラノシド及びp−ニトロフェニル−α−L−アラビノフラノシドを用いる第1酵素機能アッセイにおいて、β−キシロシダーゼ及びL−α−アラビノフラノシダーゼ活性の両方を有することが示された。Fv43Bは、第2酵素アッセイにおいては、分枝アラビノキシロオリゴマーからのアラビノースの生成を触媒し、かつ他のキシロシダーゼ酵素の存在下では、オリゴマー混合物からキシロースをより多量に生成させるよう触媒することが示された。予測触媒残基としては、D38又はD68の(登録商標)いずれか、D151、及びE236が挙げられる。本明細書で使用するとき、「Fv43Bポリペプチド」は、配列番号12の残基17〜574間の連続する少なくとも50、75、100、125、150、175、200、250、300、350、400、450、500、又は550個の残基と少なくとも85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%配列同一性を有する配列を含む、ポリペプチド及び/又はこれらの変異体を指す。好ましくは、Fv43Bポリペプチドは、ネイティブなFv43Bと比較して、残基D38又はD68、D151、及びE236において変更はなされていない。好ましくは、Fv43Bポリペプチドは、Fv43B酵素ファミリー間、及び図93のアラインメント中のその他の1、2、3、4、5、6、7、8又は9種全てのアミノ酸配列間で保存されているアミノ酸残基の、少なくとも70%、80%、90%、95%、98%、又は99%が未改変である。Fv43Bポリペプチドは、好適には、図21B及び93に示すようなネイティブなFv43Bの、予測保存ドメインの全長を含む。本発明のFv43Bポリペプチドは、好ましくはβ−キシロシダーゼ活性、L−α−アラビノフラノシダーゼ活性、又はβ−キシロシダーゼ及びL−α−アラビノフラノシダーゼ活性のいずれもを有し、配列番号12のアミノ酸配列又は配列番号12の残基(i)17〜574、(ii)27〜574、(iii)17〜303若しくは(iv)27〜303に対し少なくとも90%、91%、92%、93%、94%、95%、96%、97%、98%、99%又は100%配列同一性を有する。
Pa51A:Pa51A(配列番号14)のアミノ酸配列を図22B及び94に示す。配列番号14は、未成熟なPa51A配列である。Pa51Aは配列番号14の残基1〜20に相当する予測シグナル配列を有しており、このシグナル配列が切断されることで配列番号14の残基21〜676に相当する配列を有する成熟タンパク質が生成されるものと予測される。図22Bでは、L−α−アラビノフラノシダーゼの予測保存ドメインをボールド体で示す。Pa51Aは、例えば、人工基質のp−ニトロフェニル−β−キシロピラノシド及びp−ニトフェニル(nitophenyl)−α−L−アラビノフラノシドを用いた酵素機能アッセイにおいて、β−キシロシダーゼ活性及びL−α−アラビノフラノシダーゼ活性の両方を有することが示された。Pa51Aは、分枝アラビノキシロオリゴマーからのアラビノースの生成を触媒し、かつ他のキシロシダーゼ酵素の存在下では、オリゴマー混合物からキシロースをより多量に生成させるよう触媒することが示された。保存されている酸性残基としては、E43、D50、E257、E296、E340、E370、E485、及びE493が挙げられる。本明細書で使用するとき、用語、「Pa51Aポリペプチド」は、配列番号14の残基21〜676間の、少なくとも50個、例えば、少なくとも50、75、100、125、150、175、200、250、300、350、400、450、500、550、600,、又は650個の連続するアミノ酸残基と、少なくとも85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%配列同一性を有する配列を含む、ポリペプチド及び/又はその変異体を指す。好ましくは、Pa51Aポリペプチドは、ネイティブなPa51Aと比較して、残基E43、D50、E257、E296、E340、E370、E485及びE493において変更はなされていない。好ましくは、Pa51Aポリペプチドは、Pa51Aファミリーの酵素間、及び図94のアラインメント中に示すとおり、Pa51A、Fv51A、及びPf51Aなどの酵素群間で保存されているアミノ酸残基の、少なくと70%、80%、90%、95%、98%、又は99%が未改変である。Pa51Aポリペプチドは、図22Bに示すとおりの、ネイティブなPa51Aの予測保存ドメインを適切に含む。本発明のPa51Aポリペプチドは、好ましくはβ−キシロシダーゼ活性、L−α−アラビノフラノシダーゼ活性、又はβ−キシロシダーゼ及びL−α−アラビノフラノシダーゼ活性のいずれもを有し、配列番号14のアミノ酸配列又は配列番号14の残基(i)21〜676、(ii)21〜652、(iii)469〜652若しくは(iv)469〜676に対し少なくとも90%、91%、92%、93%、94%、95%、96%、97%、98%、99%又は100%配列同一性を有する。
Gz43A:Gz43A(配列番号16)のアミノ酸配列を図23B及び93に示す。配列番号16は、未成熟なGz43A配列である。Gz43Aは配列番号16の残基1〜18に相当する予測シグナル配列を有しており、このシグナル配列が切断されることで配列番号16の残基19〜340に相当する配列を有する成熟タンパク質が生成されるものと予測される。予測保存ドメインを、図23B中にボールド体で示す。Gz43Aは、例えば、基質としてp−ニトフェニル(nitophenyl)−β−キシロピラノシド、キシロビオース、又は混合及び/若しくは直鎖キシロオリゴマーを用いた酵素機能アッセイにおいて、β−キシロシダーゼ活性を有することが示された。予測触媒残基としては、D33又はD68のいずれか、D154、及びE243が挙げられる。本明細書で使用するとき、用語、「Gz43Aポリペプチド」は、配列番号16の残基19〜340間の、少なくとも50、75、100、125、150、175、200、250、又は300個の連続するアミノ酸残基と、少なくとも85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%同一性を有する配列を含む、ポリペプチド及び/又はその変異体を指す。好ましくは、Gz43Aポリペプチドは、ネイティブなGz43Aと比較して、残基D33又はD68、D154、及びE243において変更はなされていない。好ましくは、Gz43Aポリペプチドは、Gz43Aファミリーの酵素間、及び図93のアラインメント中のその他の1、2、3、4、5、6、7、8又は9種全てのアミノ酸配列間で保存されているアミノ酸残基の、少なくとも70%、80%、90%、95%、98%、又は99%が未改変である。Gz43Aポリペプチドは、図23Bに示すネイティブなGz43Aの予測保存ドメインを適宜含む。本発明のGz43Aポリペプチドは、好ましくは、β−キシロシダーゼ活性を有し、配列番号16のアミノ酸配列又は配列番号16の残基(i)19〜340、(ii)53〜340、(iii)19〜383若しくは(iv)53〜383に対し少なくとも90%、91%、92%、93%、94%、95%、96%、97%、98%、99%又は100%配列同一性を有する。
Fo43A:Fo43A(配列番号18)のアミノ酸配列を図24B及び93に示す。配列番号18は、未成熟なFo43A配列である。Fo43Aは配列番号18の残基1〜20に相当する予測シグナル配列を有しており、このシグナル配列が切断されることで配列番号18の残基21〜348に相当する配列を有する成熟タンパク質が生成されるものと予測される。予測保存ドメインを、図24B中にボールド体で示す。Fo43Aは、例えば、基質としてp−ニトフェニル(nitophenyl)−β−キシロピラノシド、キシロビオース、及び/又は直鎖キシロオリゴマーの混合物を用いた酵素機能アッセイにおいて、β−キシロシダーゼ活性を有することが示された。予測触媒残基としては、D37又はD72のいずれか、D159、及びE251が挙げられる。本明細書で使用するとき、用語、「Fo43Aポリペプチド」は、配列番号18の残基18〜344間の連続する少なくとも50、75、100、125、150、175、200、250、又は300個のアミノ酸残基と少なくとも85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%配列同一性を有する配列を含む、ポリペプチド及び/又はその変異体を指す。好ましくは、Fo43Aポリペプチドは、ネイティブなFo43Aと比較して、残基D37又はD72、D159、及びE251において変更はなされていない。好ましくは、Fo43Aポリペプチドは、Fo43Aファミリーの酵素間、及び図93のアラインメント中のその他の1、2、3、4、5、6、7、8又は9種全てのアミノ酸配列間で保存されているアミノ酸残基の、少なくとも70%、80%、90%、95%、98%、又は99%が未改変である。本発明のFo43Aポリペプチドは、好ましくはβ−キシロシダーゼ活性を有し、配列番号18のアミノ酸配列又は配列番号18の残基(i)21〜341、(ii)107〜341、(iii)21〜348、又は(iv)107〜348に対し少なくとも90%、91%、92%、93%、94%、95%、96%、97%、98%、99%又は100%配列同一性を有する。
Af43A:Af43A(配列番号20)のアミノ酸配列を図25B及び93に示す。配列番号20は、未成熟なAf43A配列である。予測保存ドメインを、図25B中にボールド体で示す。Af43Aは、例えば、基質としてp−ニトフェニル(nitophenyl)−α−L−アラビノフラノシドを用いる酵素機能アッセイにおいて、L−α−アラビノフラノシダーゼ活性を有することが示された。Af43Aは、エンドキシラナーゼの作用を介してヘミセルロースから生成される一連のオリゴマーからアラビノースを生成させるよう触媒することが示された。予測触媒残基としては、D26又はD58のいずれか、D139、及びE227が挙げられる。本明細書で使用するとき、「Af43Aポリペプチド」は、配列番号20の連続する少なくとも50、75、100、125、150、175、200、250、又は300個のアミノ酸残基と少なくとも85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%配列同一性を有する配列を含むポリペプチド及び/又はこれらの変異体を指す。好ましくは、Af43Aポリペプチドは、ネイティブなAf43Aと比較して、残基D26又はD58、D139、及びE227において変更はなされていない。好ましくは、Af43Aポリペプチドは、Af43Aファミリーの酵素間、及び図93のアラインメント中のその他の1、2、3、4、5、6、7、8又は9種全てのアミノ酸配列間で保存されているアミノ酸残基の、少なくとも70%、80%、90%、95%、98%、又は99%が未改変である。Af43Aポリペプチドは、図25Bに示すとおりの、ネイティブなAf43Aの予測保存ドメインを適切に含む。本発明のAf43Aポリペプチドは、好ましくはL−α−アラビノフラノシダーゼ活性を有し、配列番号20のアミノ酸配列又は配列番号20の残基(i)15〜558若しくは(ii)15〜295に対し少なくとも90%、91%、92%、93%、94%、95%、96%、97%、98%、99%又は100%配列同一性を有する。
Pf51A:Pf51A(配列番号22)のアミノ酸配列を図26B及び94に示す。配列番号22は、未成熟なPf51A配列である。Pf51Aは配列番号22の残基1〜20に相当する予測シグナル配列を有しており、このシグナル配列が切断されることで配列番号22の残基21〜642に相当する配列を有する成熟タンパク質が生成されるものと予測される。図26Bでは、L−α−アラビノフラノシダーゼの予測保存ドメインをボールド体で示す。Pf51Aは、例えば、基質として4−ニトロフェニル−α−L−アラビノフラノシドを用いる酵素機能アッセイにおいて、L−α−アラビノフラノシダーゼ活性を有することが示された。Pf51Aは、エンドキシラナーゼの作用を介してヘミセルロースから生成される一連のオリゴマーからアラビノースを生成させるよう触媒することが示された。予測される、保存されている酸性残基としては、E43、D50、E248、E287、E331、E360、E472、及びE480が挙げられる。本明細書で使用するとき、用語、「Pf51Aポリペプチド」は、配列番号22の残基21〜642間の、少なくとも50、75、100、125、150、175、200、250、300、350、400、450、500、550、又は600個の連続するアミノ酸残基と、少なくとも85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%配列同一性を有する配列を含む、ポリペプチド及び/又はその変異体を指す。好ましくは、Pf51Aポリペプチドは、ネイティブなPf51Aと比較して、残基E43、D50、E248、E287、E331、E360、E472、及びE480において変更はなされていない。好ましくは、Pf51Aポリペプチドは、図94のアラインメントに示すとおり、Pf51A、Pa51A、及びFv51A間で保存されているアミノ酸残基の少なくとも70%、80%、90%、95%、98%、又は99%が未改変である。本発明のPf51Aポリペプチドは、好ましくは、L−α−アラビノフラノシダーゼ活性を有し、配列番号22のアミノ酸配列又は配列番号22の残基(i)21〜632、(ii)461〜632、(iii)21〜642若しくは(iv)461〜642に対し少なくとも90%、91%、92%、93%、94%、95%、96%、97%、98%、99%又は100%配列同一性を有する。
AfuXyn2:AfuXyn2(配列番号24)のアミノ酸配列を図27B及び95Bに示す。配列番号24は、未成熟なAfuXyn2配列である。この配列は配列番号24の残基1〜18に相当する予測シグナル配列を有しており、このシグナル配列が切断されることで配列番号24の残基19〜228に相当する配列を有する成熟タンパク質が生成されるものと予測される。予測保存ドメインGH11を、図27B中にボールド体で示す。AfuXyn2は、前処理したバイオマス又は単離ヘミセルロースに、キシロビオシダーゼの存在下で酵素を作用させた場合に、キシロースモノマーの生産を上昇させるよう触媒する能力が観察されたことから、間接的にエンドキシラナーゼ活性を有することを示した。保存されていた触媒残基としては、E124、E129、及びE215が挙げられる。本明細書で使用するとき、「AfuXyn2ポリペプチド」は、一部の態様では、配列番号24の残基19〜228間の連続する少なくとも50、75、100、125、150、175、又は200個の残基と少なくとも85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%配列同一性を有する配列を含む、ポリペプチド及び/又はこれらの変異体を指す。好ましくは、AfuXyn2ポリペプチドは、ネイティブなAfuXyn2と比較して、残基E124、E129、及びE215において変更はなされていない。好ましくは、AfuXyn2ポリペプチドは、図95Bのアラインメントに示すとおり、AfuXyn2、AfuXyn5、及びT.リーゼイ(T. reesei)Xyn2間で保存されているアミノ酸残基の少なくとも70%、80%、90%、95%、98%、又は99%が未改変である。AfuXyn2ポリペプチドは、図27Bに示す、ネイティブなAfuXyn2の予測保存ドメインの全長を適切に含む。本発明のAfuXyn2ポリペプチドは、好ましくはキシラナーゼ活性を有する。
AfuXyn5:AfuXyn5(配列番号26)のアミノ酸配列を図28B及び95Bに示す。配列番号26は、未成熟なAfuXyn5配列である。AfuXyn5は配列番号26の残基1〜19に相当する予測シグナル配列を有しており、このシグナル配列が切断されることで配列番号26の残基20〜313に相当する配列を有する成熟タンパク質が生成されるものと予測される。予測保存ドメインGH11を、図28B中にボールド体で示す。AfuXyn5は、前処理したバイオマス又は単離ヘミセルロースに、キシロビオシダーゼの存在下で作用させた場合に、キシロースモノマーの生産を上昇させるよう触媒する能力が観察されたことから、間接的にエンドキシラナーゼ活性を有することを示した。保存されていた触媒残基としては、E119、E124、及びE210が挙げられる。予測CBMは、セリン、スレオニンに富むアミノ酸長鎖に続いてC末端付近に存在し、多数の疎水性残基が存在することを特徴とする。図95B中に下線を付してこの領域を示す。本明細書で使用するとき、「AfuXyn5ポリペプチド」は、配列番号26の残基20〜313間の連続する少なくとも50、75、100、125、150、175、200、250、又は275個の残基と少なくとも85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%配列同一性を有する配列を含む、ポリペプチド及び/又はこれらの変異体を指す。好ましくは、AfuXyn5ポリペプチドは、ネイティブなAfuXyn5と比較して、残基E119、E120、及びE210において変更はなされていない。AfuXyn5ポリペプチドは、図95Bのアラインメントに示すとおり、AfuXyn5、AfuXyn2、及びT.リーゼイ(T. reesei)Xyn2間で保存されているアミノ酸残基の少なくとも70%、80%、90%、95%、98%、又は99%が未改変である。AfuXyn5ポリペプチドは、図28Bに示すネイティブなAfuXyn5の予測CBMの全長、及び/又はネイティブなAfuXyn5の予測保存ドメインの全長(下線部)を適切に含む。本発明のAfuXyn5ポリペプチドは、好ましくはキシラナーゼ活性を有する。
Fv43D:Fv43D(配列番号28)のアミノ酸配列を図29B及び93に示す。配列番号28は、未成熟なFv43D配列である。Fv43Dは配列番号28の残基1〜20に相当する予測シグナル配列を有しており、このシグナル配列が切断されることで配列番号28の残基21〜350に相当する配列を有する成熟タンパク質が生成されるものと予測される。予測保存ドメインを、図29B中にボールド体で示す。Fv43Dは、例えば、基質としてp−ニトフェニル(nitophenyl)−β−キシロピラノシド、キシロビオース、及び/又は直鎖キシロオリゴマーの混合物を用いた酵素機能アッセイにおいて、β−キシロシダーゼ活性を有することが示された。予測触媒残基としては、D37又はD72のいずれか、D159、及びE251が挙げられる。本明細書で使用するとき、「Fv43Dポリペプチド」は、配列番号28の残基21〜350間の連続する少なくとも50、75、100、125、150、175、200、250、300、又は320個の残基と少なくとも85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%配列同一性を有する配列を含む、ポリペプチド及び/又はこれらの変異体を指す。好ましくは、Fv43Dポリペプチドは、ネイティブなFv43Dと比較して、残基D37又はD72、D159、及びE251において変更はなされていない。好ましくは、Fv43Dポリペプチドは、Fv43Dファミリーの酵素間、及び図93のアラインメント中のその他の1、2、3、4、5、6、7、8又は9種全てのアミノ酸配列間で保存されているアミノ酸残基の、少なくとも70%、80%、90%、95%、98%、又は99%が未改変である。Fv43Dポリペプチドは、図29Bに示す、ネイティブなFv43Dの予測CDの全長を適切に含む。Fv43Dポリペプチドは、好ましくは、β−キシロシダーゼ活性を有し、配列番号28のアミノ酸配列又は配列番号28の残基(i)20〜341、(ii)21〜350、(iii)107〜341若しくは(iv)107〜350に対し少なくとも90%、91%、92%、93%、94%、95%、96%、97%、98%、99%又は100%配列同一性を有する。
Pf43B:Pf43B(配列番号30)のアミノ酸配列を図30B及び93に示す。配列番号30は、未成熟なPf43B配列である。Pf43Bは配列番号30の残基1〜20に相当する予測シグナル配列を有しており、このシグナル配列が切断されることで配列番号30の残基21〜321に相当する配列を有する成熟タンパク質が生成されるものと予測される。予測保存ドメインを、図30B中にボールド体で示す。保存ドメイン内の保存酸残基としては、D32、D61、D148、及びE212が挙げられる。Pf43Bは、例えば、基質としてp−ニトロフェニル−β−キシロピラノシド、キシロビオース、及び/又は直鎖キシロオリゴマーの混合物を用いた酵素機能アッセイにおいて、β−キシロシダーゼ活性を有することが示された。本明細書で使用するとき、用語、「Pf43Bポリペプチド」は、配列番号30の残基21〜321間の、少なくとも50、75、100、125、150、175、200、250、又は280個の連続するアミノ酸残基と、少なくとも85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%同一性を有する配列を含む、ポリペプチド及び/又はその変異体を指す。好ましくは、Pf43Bポリペプチドは、ネイティブなPf43Bと比較して、残基D32、D61、D148、及びE212において変更はなされていない。好ましくは、Pf43Bポリペプチドは、Pf43Bファミリーの酵素間、及び図93のアラインメント中のその他の1、2、3、4、5、6、7、8又は9種全てのアミノ酸配列間で保存されているアミノ酸残基の、少なくとも70%、80%、90%、95%、98%、又は99%%が未改変である。Pf43Bポリペプチドは、図30Bに示すとおりの、ネイティブなPf43Bの予測保存ドメインを適切に含む。本発明のPf43Bポリペプチドは、好ましくはβ−キシロシダーゼ活性を有し、配列番号30のアミノ酸配列に対し少なくとも90%、91%、92%、93%、94%、95%、96%、97%、98%、99%又は100%配列同一性を有する。
Fv51A:Fv51A(配列番号32)のアミノ酸配列を図31B及び94に示す。配列番号32は、未成熟なFv51A配列である。Fv51Aは配列番号32の残基1〜19に相当する予測シグナル配列を有しており、このシグナル配列が切断されることで配列番号32の残基20〜660に相当する配列を有する成熟タンパク質が生成されるものと予測される。図31Bでは、L−α−アラビノフラノシダーゼの予測保存ドメインをボールド体で示す。Fv51Aは、例えば、基質として4−ニトロフェニル−α−L−アラビノフラノシドを用いる酵素機能アッセイにおいて、L−α−アラビノフラノシダーゼ活性を有することが示された。Fv51Aは、エンドキシラナーゼの作用を介してヘミセルロースから生成される一連のオリゴマーからアラビノースを生成させるよう触媒することが示された。保存残基としては、E42、D49、E247、E286、E330、E359、E479、及びE487が挙げられる。本明細書で使用するとき、用語、「Fv51Aポリペプチド」は、配列番号32の残基20〜660間の連続する少なくとも50、75、100、125、150、175、200、250、300、350、400、450、500、550、600、又は625個のアミノ酸残基と少なくとも85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%同一性を有する配列を含む、ポリペプチド及び/又はその変異体を指す。好ましくは、Fv51Aポリペプチドは、ネイティブなFv51Aと比較して、残基E42、D49、E247、E286、E330、E359、E479、及びE487において変更はなされていない。好ましくは、Fv51Aポリペプチドは、図94のアラインメントに示すとおり、Fv51A、Pa51A、及びPf51A間で保存されているアミノ酸残基の少なくとも70%、80%、90%、95%、98%%、又は99%が未改変である。Fv51Aポリペプチドは、図31Bに示すとおりの、ネイティブなFv51Aの予測保存ドメインを適切に含む。本発明のFv51Aポリペプチドは、好ましくは、L−α−アラビノフラノシダーゼ活性を有し、配列番号32のアミノ酸配列又は配列番号32の残基(i)21〜660、(ii)21〜645、(iii)450〜645若しくは(iv)450〜660に対し少なくとも90%、91%、92%、93%、94%、95%、96%、97%、98%、99%又は100%配列同一性を有する。
Xyn3:T.リーゼイ(T. reesei)Xyn3(配列番号42)のアミノ酸配列を図36B及び95Aに示す。配列番号42は、未成熟なT.リーゼイXyn3配列である。T.リーゼイ(T. reesei)Xyn3は配列番号42の残基1〜16に相当する予測シグナル配列を有しており、このシグナル配列が切断されることで配列番号42の残基17〜347に相当する配列を有する成熟タンパク質が生成されるものと予測される。予測保存ドメインを、図36B中にボールド体で示す。T.リーゼイ(T. reesei)Xyn3は、前処理したバイオマス又は単離ヘミセルロースに、キシロビオシダーゼの存在下で作用させた場合に、キシロースモノマーの生産を上昇させるよう触媒する能力が観察されたことから、間接的にエンドキシラナーゼ活性を有することを示した。保存されていた触媒残基としては、GH10ファミリーの別の酵素、すなわちストレプトミセス・ハルステディ(Streptomyces halstedii)由来のXys1 δ(Canals et al.,2003,Act Crystalogr.D Biol.59:1447〜53)(T.リーゼイ(T. reesei)Xyn3とは33%の配列同一性を有する)とのアラインメントにより示されるとおり、E91、E176、E180、E195、及びE282が挙げられる。本明細書で使用するとき、用語、「T.リーゼイ(T. reesei)Xyn3ポリペプチド」は、配列番号42の残基17〜347間の、少なくとも50、75、100、125、150、175、200、250、又は300個の連続するアミノ酸残基と、少なくとも85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%配列同一性を有する配列を含む、ポリペプチド及び/又はその変異体を指す。好ましくは、T.リーゼイ(T. reesei)Xyn3ポリペプチドの残基E91、E176、E180、E195、及びE282は、ネイティブなT.リーゼイ(T. reesei)Xyn3のものから改変されていない。好ましくは、T.リーゼイ(T. reesei)Xyn3ポリペプチドは、T.リーゼイ(T. reesei)Xyn3及びXys1 δ間で保存されているアミノ酸残基の少なくとも70%、80%、90%、95%、98%、又は99%が未改変である。T.リーゼイ(T. reesei)Xyn3ポリペプチドは、好適には、図36Bに示すようなネイティブなT.リーゼイ(T. reesei)Xyn3の予測保存ドメインの全長を適切に含む。本発明のT.リーゼイ(T. reesei)Xyn3ポリペプチドは、好ましくはキシラナーゼ活性を有する。
Xyn2:T.リーゼイ(T. reesei)Xyn2(配列番号43)のアミノ酸配列を図37及び95Bを示す。配列番号43は、未成熟なT.リーゼイ(T. reesei)Xyn2配列である。T.リーゼイ(T. reesei)Xyn2は、配列番号43の残基1〜33に相当する予測プレプロペプチド配列を有する。残基16及び17間の予測シグナル配列が切断されることで、プロペプチドが生成されるものと予測され、このプロペプチドはケキシン様プロテアーゼにより残基32及び33間にプロセシングを受け、配列番号43の残基33〜222に相当する配列を有する成熟タンパク質を生成する。予測保存ドメインを、図37B中にボールド体で示す。T.リーゼイ(T. reesei)Xyn2は、前処理したバイオマス又は単離ヘミセルロースに、キシロビオシダーゼの存在下で酵素を作用させた場合に、キシロースモノマーの生産を上昇させるよう触媒する能力が観察されたことから、間接的にエンドキシラナーゼ活性を有することを示した。保存されていた酸性残基としては、E118、E123、及びE209が挙げられる。本明細書で使用するとき、用語、「T.リーゼイ(T. reesei)Xyn2ポリペプチド」は、配列番号43の残基33〜222間の、少なくとも50、75、100、125、150、又は175個の連続するアミノ酸残基と、少なくとも85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%配列同一性を有する配列を含む、ポリペプチド及び/又はその変異体を指す。好ましくは、T.リーゼイ(T. reesei)Xyn2ポリペプチドの残基E118、E123、及びE209は、ネイティブなT.リーゼイ(T. reesei)Xyn2のものから改変されていない。好ましくは、T.リーゼイ(T. reesei)Xyn2ポリペプチドは、図95Bのアラインメントに示すとおり、T.リーゼイ(T. reesei)Xyn2、AfuXyn2、及びAfuXyn5間で保存されているアミノ酸残基の少なくとも70%、80%、90%、95%、98%、又は99%が未改変である。T.リーゼイ(T. reesei)Xyn2ポリペプチドは、図37に示す、ネイティブなT.リーゼイ(T. reesei)Xyn2の予測保存ドメインの全長を適切に含む。本発明のT.リーゼイ(T. reesei)Xyn2ポリペプチドは、好ましくはキシラナーゼ活性を有する。
Bxl1:T.リーゼイ(T. reesei)Bxl1(配列番号45)のアミノ酸配列を図38及び91に示す。配列番号45は、未成熟なT.リーゼイ(T. reesei)Bxl1配列である。T.リーゼイ(T. reesei)Bxl1は配列番号45の残基1〜18に相当する予測シグナル配列を有しており、このシグナル配列が切断されることで配列番号45の残基19〜797に相当する配列を有する成熟タンパク質が生成されるものと予測される。予測保存ドメインを、図38中にボールド体で示す。T.リーゼイ(T. reesei)Bxl1は、例えば、基質としてp−ニトフェニル(nitophenyl)−β−キシロピラノシド、キシロビオース、及び/又は直鎖キシロオリゴマーの混合物を用いた酵素機能アッセイにおいて、β−キシロシダーゼ活性を有することが示された。保存されていた酸性残基としては、E193、E234及びD310が挙げられる。本明細書で使用するとき、用語、「T.リーゼイ(T. reesei)Bxl1ポリペプチド」は、配列番号45の残基17〜797間の少なくとも50、75、100、125、150、175、200、250、300、350、400、450、500、550、600、650、700、又は750個の連続するアミノ酸残基と、少なくとも85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%配列同一性を有する配列を含む、ポリペプチド及び/又はその変異体を指す。好ましくは、T.リーゼイ(T. reesei)Bxl1ポリペプチドの残基E193、E234及びD310は、ネイティブなT.リーゼイ(T. reesei)Bxl1のものから改変されていない。T.リーゼイ(T. reesei)Bxl1ポリペプチドは、図91のアラインメントに示すとおり、T.リーゼイ(T. reesei)Bxl1及びFv3A間で保存されているアミノ酸残基の少なくとも少なくとも70%、80%、90%、95%、98%、又は99%が未改変である。T.リーゼイ(T. reesei)Bxl1ポリペプチドは、好適には、図38に示すようなネイティブなT.リーゼイ(T. reesei)Bxl1の予測保存ドメインの全長を適切に含む。T.リーゼイ(T. reesei)Bxl1ポリペプチドは、好ましくは、β−キシロシダーゼ活性を有し、配列番号45のアミノ酸配列に対し少なくとも90%、91%、92%、93%、94%、95%、96%、97%、98%、99%又は100%配列同一性を有する。
T.リーゼイ(T. reesei)Eg4:T.リーゼイ(T. reesei)Eg4(配列番号52)のアミノ酸配列を図40B及び56に示す。配列番号52は、未成熟なT.リーゼイ(T. reesei)Eg4配列である。T.リーゼイ(T. reesei)Eg4は配列番号52の残基1〜21に相当する予測シグナル配列を有しており、このシグナル配列が切断されることで配列番号52の残基22〜344に相当する配列を有する成熟タンパク質が生成されるものと予測される。予測保存ドメインは配列番号52の残基22〜256及び307〜343に相当し、後者については糖結合ドメイン(CBM)であるものと予測される。T.リーゼイ(T. reesei)Eg4は、例えば、基質としてカルボキシメチルセルロースを用いる酵素アッセイにおいて、エンドグルカナーゼ活性を有することが示されている。既知のエンドグルカナーゼ、例えば、T.テレストリス(T. terrestris)由来のエンドグルカナーゼ(受入番号ACE10234、本明細書において「TtEG」としても参照する)、及びT.リーゼイ(T. reesei)由来のその他のエンドグルカナーゼEg7(受入番号ADA26043.1)(本明細書において「TtEG7」又は「TrEGb」としても参照する)と、T.リーゼイ(T. reesei)Eg4(図56を参照されたい)とのアミノ酸配列のアラインメントによると、T.リーゼイ(T. reesei)Eg4の残基H22、H107、H184、Q193、Y195は、金属配位子として機能するものと予測され、残基D61及びG63は表面保存残基であると予測され、かつ残基Y232は活性に関与するものと予測された。本明細書で使用するとき、用語、「T.リーゼイ(T. reesei)Eg4ポリペプチド」は、配列番号52の残基22〜344間の少なくとも50、75、100、125、150、175、200、250、又は300個の連続するアミノ酸残基と、少なくとも85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%同一性を有する配列を含む、ポリペプチド及び/又はその変異体を指す。好ましくは、T.リーゼイ(T. reesei)Eg4ポリペプチドの残基H22、H107、H184、Q193、Y195、D61、G63、及びY232は、ネイティブなT.リーゼイ(T. reesei)Eg4ものから改変されていない。好ましくは、T.リーゼイ(T. reesei)Eg4ポリペプチドは、図56のアラインメントに示すとおり、TrEG7、TtEG及びTrEG4間で保存されているアミノ酸残基の少なくとも70%、80%、90%、95%、98%、又は99%が未改変である。T.リーゼイ(T. reesei)Eg4ポリペプチドは、好適には、図56に示すようなネイティブなT.リーゼイ(T. reesei)Eg4の予測保存ドメインの全長を適切に含む。T.リーゼイ(T. reesei)Eg4ポリペプチドは、好ましくは、エンドグルカナーゼIV(EGIV)活性を有し、配列番号52のアミノ酸配列又は配列番号52の残基(i)22〜255、(ii)22〜343、(iii)307〜343、(iv)307〜344、又は(v)22〜344に対し少なくとも90%、91%、92%、93%、94%、95%、96%、97%、98%、99%又は100%配列同一性を有する。
Pa3D:Pa3D(配列番号54)のアミノ酸配列を図41B及び55に示す。配列番号54は、未成熟なPa3D配列である。Pa3Dは配列番号2の残基1〜17に相当する予測シグナル配列を有しており、このシグナル配列が切断されることで配列番号54の残基18〜733に相当する配列を有する成熟タンパク質が生成されるものと予測される。本開示のこの及びその他のポリペプチドに対するシグナル配列予測は、本明細書においてはSignalP−NNアルゴリズム(http://www.cbs.dtu.dk)により行った。図41Bにおいて、予測保存ドメインはボールド体で示す。本開示のこの及びその他のポリペプチドに対するドメイン予測は、Pfam、SMART、又はNCBIデータベースを基に行った。Pa3Dの残基E463、及びD262は、それぞれ、例えば、P.アンセリア(P. anserina)(受入番号XP_001912683)、V.ダフリアエ(V. dahliae)、N.ハエマトコッカ(N. haematococca)(受入番号XP_003045443)、G.ゼアエ(G. zeae)(受入番号XP_386781)、F.オキシスポラム(F. oxysporum)(受入番号BGL FOXG_02349)、A.ニガー(A. niger)(受入番号CAK48740)、T.エマーソニィ(T. emersonii)(受入番号AAL69548)、T.リーゼイ(T. reesei)(受入番号AAP57755)、T.リーゼイ(T. reesei)(受入番号AAA18473)、F.バーティシリオイド(F. verticillioides)、及びT.ネアポリタナ(T. neapolitana)(受入番号Q0GC07)などに由来する数多くのGH3ファミリーβグルコシダーゼの配列アラインメントに基づき、酸塩基性及び求核性触媒として機能するものと予測される(図55を参照されたい)。本明細書で使用するとき、用語、「Pa3Dポリペプチド」は、配列番号54の残基18〜733間の、少なくとも50、75、100、125、150、175、200、250、300、350、400、450、500、550、600、650又は700個の連続するアミノ酸残基と、少なくとも85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%配列同一性を有する配列を含む、ポリペプチド及び/又はその変異体を指す。好ましくは、Pa3Dポリペプチドは、ネイティブなPa3Dと比較して、残基E463及びD262において変更はなされていない。好ましくは、Pa3Dポリペプチドは、図55のアラインメントに示すとおり、本明細書に記載のGH3ファミリーβ−グルコシダーゼ間で保存されているアミノ酸残基の少なくとも70%、80%、90%、95%、98%、又は99%が未改変である。Pa3Dポリペプチドは、図41Bに示すネイティブなPa3Dの予測保存ドメイン全長を適切に含む。Pa3Dポリペプチドは、好ましくは、β−グルコシダーゼ活性を有し、配列番号54のアミノ酸配列又は配列番号54の残基(i)18〜282、(ii)18〜601、(iii)18〜733、(iv)356〜601、又は(v)356〜733と少なくとも90%、91%、92%、93%、94%、95%、96%、97%、98%、99%又は100%配列同一性を有する。
特定の実施形態では、Pa3Dポリペプチドは、2種以上のβ−グルコシダーゼ配列を含む融合又はキメラポリペプチドであってよく、β−グルコシダーゼ配列のうち少なくとも1つはPa3Dポリペプチドに由来する。例えば、Pa3Dポリペプチドは、Pa3Dポリペプチド又はこれらの変異体のN端末由来の同じ長さの配列に由来し配列番号54と少なくとも約60%配列同一性を有する、少なくともアミノ酸残基約200個分の長さのポリペプチドを含むキメラ/融合ポリペプチドであってよい。あるいは、Pa3Dキメラ/融合ポリペプチドは、Pa3Dポリペプチド又はこれらの変異体のC端末由来の同じ長さの配列に由来し配列番号54と少なくとも約60%配列同一性を有する、少なくともアミノ酸残基約50個分の長さのポリペプチドを含むポリペプチドであってよい。特定の実施形態では、Pa3Dキメラ/融合ポリペプチドは、アミノ酸残基約3、4、5、6、7、8、9、10、又は11個分の長さでありアミノ酸配列FDRRSPG(配列番号204)又はFD(R/K)YNIT(配列番号205)を含むループ配列を含んでよい。
Fv3G:Fv3G(配列番号56)のアミノ酸配列を図42B及び55に示す。配列番号56は、未成熟なFv3G配列である。Fv3Gは配列番号56の残基1〜21に相当する予測シグナル配列を有しており、このシグナル配列が切断されることで配列番号56の残基22〜780に相当する配列を有する成熟タンパク質が生成されるものと予測される。上記のように、シグナル配列の予測は、本開示のその他のポリペプチドに対して行ったとおり、SignalP−NNアルゴリズム(http://www.cbs.dtu.dk)を用い行った。予測保存ドメインを、図42B中にボールド体で示す。ドメイン予測は、本明細書においてその他のポリペプチドに対して行ったように、Pfam、SMART、又はNCBIデータベースに基づいて実施した。Fv3Gの残基E509、及びD272は、それぞれ、例えば、P.アンセリア(P. anserina)(受入番号XP_001912683)、V.ダフリアエ(V. dahliae)、N.ハエマトコッカ(N. haematococca)(受入番号XP_003045443)、G.ゼアエ(G. zeae)(受入番号XP_386781)、F.オキシスポラム(F. oxysporum)(受入番号BGL FOXG_02349)、A.ニガー(A. niger)(受入番号CAK48740)、T.エマーソニィ(T. emersonii)(受入番号AAL69548)、T.リーゼイ(T. reesei)(受入番号AAP57755)、T.リーゼイ(T. reesei)(受入番号AAA18473)、F.バーティシリオイド(F. verticillioides)、及びT.ネアポリタナ(T. neapolitana)(受入番号Q0GC07)などに由来する上記GH3グルコシダーゼの配列アラインメントに基づき、酸塩基性及び求核性触媒として機能するものと予測される(図55を参照されたい)。本明細書で使用するとき、用語、「Fv3Gポリペプチド」は、配列番号56の残基20〜780間の少なくとも50、75、100、125、150、175、200、250、300、350、400、450、500、550、600、650、700、又は750個の連続するアミノ酸残基と、少なくとも85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%配列同一性を有する配列を含む、ポリペプチド及び/又はその変異体を指す。好ましくは、Fv3Gポリペプチドは、ネイティブなFv3Gと比較して、残基E509及びD272において変更はなされていない好ましくは、Fv3Gポリペプチドは、図55のアラインメントに示すとおり、本明細書に記載のGH3ファミリーβ−グルコシダーゼ間で保存されているアミノ酸残基の少なくとも70%、80%、90%、95%、98%、又は99%が未改変である。Fv3Gポリペプチドは、図42Bに示すネイティブなFv3Gの予測保存ドメイン全長を適切に含む。Fv3Gポリペプチドは、好ましくは、β−グルコシダーゼ活性を有し、配列番号56のアミノ酸配列又は配列番号56の残基(i)22〜292、(ii)22〜629、(iii)22〜780、(iv)373〜629又は(v)373〜780と少なくとも90%、91%、92%、93%、94%、95%、96%、97%、98%、99%又は100%配列同一性を有する。
特定の実施形態では、Fv3Gポリペプチドは、2種以上のβ−グルコシダーゼ配列を含む融合/キメラポリペプチドであり、少なくとも1種のβ−グルコシダーゼ配列は、Fv3Gポリペプチドに由来する。例えば、Fv3Gキメラ/融合ポリペプチドは、Fv3Gポリペプチド又はこれらの変異体のN端末の同じ長さの配列に由来し、かつ配列番号56に対し少なくとも約60%配列同一性を有する、少なくともアミノ酸残基約200個分の長さのポリペプチドを含んでよい。例えば、Fv3Gキメラ/融合ポリペプチドは、Fv3Gポリペプチド又はこれらの変異体のC端末の同じ長さの配列に由来し、かつ配列番号56に対し少なくとも約60%配列同一性を有する、少なくともアミノ酸残基約50個分の長さのポリペプチドを含んでよい。特定の実施形態では、Fv3Gポリペプチドは更に、アミノ酸残基約3、4、5、6、7、8、9、10、又は11個分の長さのループ配列を含み、ループ配列は、同じ長さのFv3Gポリペプチド又はこれらの変異体の配列に由来し、アミノ酸配列FDRRSPG(配列番号204)又はFD(R/K)YNIT(配列番号205)を含む。
Fv3D:Fv3D(配列番号58)のアミノ酸配列を図43B及び55に示す。配列番号58は、未成熟なFv3D配列である。Fv3Dは配列番号58の残基1〜19に相当する予測シグナル配列を有しており、このシグナル配列が切断されることで配列番号58の残基20〜811に相当する配列を有する成熟タンパク質が生成されるものと予測される。シグナル配列の予測は、SignalP−NNアルゴリズムにより行った。予測保存ドメインを、図43B中にボールド体で示す。ドメイン予測は、Pfam、SMART、又はNCBIデータベースに基づいて実施した。Fv3Dの残基E534、及びD301は、それぞれ、例えば、P.アンセリア(P. anserina)(受入番号XP_001912683)、V.ダフリアエ(V. dahliae)、N.ハエマトコッカ(N. haematococca)(受入番号XP_003045443)、G.ゼアエ(G. zeae)(受入番号XP_386781)、F.オキシスポラム(F. oxysporum)(受入番号BGL FOXG_02349)、A.ニガー(A. niger)(受入番号CAK48740)、T.エマーソニィ(T. emersonii)(受入番号AAL69548)、T.リーゼイ(T. reesei)(受入番号AAP57755)、T.リーゼイ(T. reesei)(受入番号AAA18473)、F.バーティシリオイド(F. verticillioides)、及びT.ネアポリタナ(T. neapolitana)(受入番号Q0GC07)などに由来する上記GH3グルコシダーゼの配列アラインメントに基づき、酸塩基性及び求核性触媒として機能するものと予測される(図55を参照されたい)。本明細書で使用するとき、用語、「Fv3Dポリペプチド」は、配列番号58の残基20〜811間の連続する少なくとも50、75、100、125、150、175、200、250、300、350、400、450、500、550、600、650、700、又は750個のアミノ酸残基と、少なくとも85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%配列同一性を有する配列を含む、ポリペプチド及び/又はその変異体を指す。好ましくは、Fv3Dポリペプチドは、ネイティブなFv3Dと比較して、残基E534及びD301において変更はなされていない。好ましくは、Fv3Dポリペプチドは、図55のアラインメントに示すとおり、本明細書に記載のGH3ファミリーβ−グルコシダーゼ間で保存されているアミノ酸残基の少なくとも70%、80%、90%、95%、98%、又は99%が未改変である。Fv3Dポリペプチドは、図43Bに示すネイティブなFv3Dの予測保存ドメイン全長を適切に含む。Fv3Dポリペプチドは、好ましくは、β−グルコシダーゼ活性を有し、配列番号58のアミノ酸配列又は配列番号58の残基(i)20〜321、(ii)20〜651、(iii)20〜811、(iv)423〜651、又は(v)423〜811と少なくとも90%、91%、92%、93%、94%、95%、96%、97%、98%、99%又は100%配列同一性を有する。好適なポリペプチドは、β−グルコシダーゼ活性を有する。
特定の実施形態では、Fv3Dポリペプチドは、2種以上のβ−グルコシダーゼ配列を含む融合/キメラポリペプチドであってよく、少なくとも1種のβ−グルコシダーゼ配列は、Fv3Dポリペプチドに由来する。例えば、Fv3Dキメラ/融合ポリペプチドは、Fv3Dポリペプチド又はこれらの変異体のN端末の同じ長さの配列に由来し、かつ配列番号58に対し少なくとも約60%配列同一性を有する、少なくともアミノ酸残基約200個分の長さのポリペプチドを含んでよい。例えば、Fv3Dキメラ/融合ポリペプチドは、Fv3Dポリペプチド又はこれらの変異体のC端末の同じ長さの配列に由来し、かつ配列番号58に対し少なくとも約60%配列同一性を有する、少なくともアミノ酸残基約50個分の長さのポリペプチドを含んでよい。特定の実施形態では、Fv3Dポリペプチドは更に、アミノ酸残基約3、4、5、6、7、8、9、10、又は11個分の長さのループ配列を含み、ループ配列は、同じ長さのFv3Dポリペプチド又はこれらの変異体の配列に由来し、アミノ酸配列FDRRSPG(配列番号204)又はFD(R/K)YNIT(配列番号205)を含む。
Fv3C:Fv3C(配列番号60)のアミノ酸配列を図44B及び55に示す。配列番号60は、未成熟なFv3C配列である。Fv3Cは配列番号60の残基1〜19に相当する予測シグナル配列を有しており、このシグナル配列が切断されることで配列番号60の残基20〜899に相当する配列を有する成熟タンパク質が生成されるものと予測される。シグナル配列の予測は、SignalP−NNアルゴリズムにより行った。予測保存ドメインを、図44B中にボールド体で示す。ドメイン予測は、Pfam、SMART、又はNCBIデータベースに基づいて実施した。Fv3Cの残基E536及びD307は、それぞれ、例えば、P.アンセリア(P. anserina)(受入番号XP_001912683)、V.ダフリアエ(V. dahliae)、N.ハエマトコッカ(N. haematococca)(受入番号XP_003045443)、G.ゼアエ(G. zeae)(受入番号XP_386781)、F.オキシスポラム(F. oxysporum)(受入番号BGL FOXG_02349)、A.ニガー(A. niger)(受入番号CAK48740)、T.エマーソニィ(T. emersonii)(受入番号AAL69548)、T.リーゼイ(T. reesei)(受入番号AAP57755)、T.リーゼイ(T. reesei)(受入番号AAA18473)、F.バーティシリオイド(F. verticillioides)、及びT.ネアポリタナ(T. neapolitana)(受入番号Q0GC07)などに由来する上記GH3グルコシダーゼの配列アラインメントに基づき、酸塩基性及び求核性触媒として機能するものと予測される(図55を参照されたい)。本明細書で使用するとき、用語、「Fv3Cポリペプチド」は、配列番号60の残基20〜899間の連続する少なくとも50、75、100、125、150、175、200、250、300、350、400、450、500、550、600、650、700、750、又は800個のアミノ酸残基と少なくとも60%、65%、70%、75%、80%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%配列同一性を有する配列を含む、ポリペプチド及び/又はその変異体を指す。好ましくは、Fv3Cポリペプチドは、ネイティブなFv3Cと比較して、残基E536及びD307において変更はなされていない。好ましくは、Fv3Cポリペプチドは、図55のアラインメントに示すとおり、本明細書に記載のGH3ファミリーβ−グルコシダーゼ間で保存されているアミノ酸残基の少なくとも60%、70%、80%、90%、95%、98%、又は99%が未改変である。Fv3Cポリペプチドは、図44Bに示すネイティブなFv3Cの予測保存ドメイン全長を適切に含む。本発明のFv3Cポリペプチドは、好ましくは、β−グルコシダーゼ活性を有し、配列番号60のアミノ酸配列又は配列番号60の残基(i)20〜327、(ii)22〜600、(iii)20〜899、(iv)428〜899、又は(v)428〜660に対し少なくとも90%、91%、92%、93%、94%、95%、96%、97%、98%、99%又は100%配列同一性を有する。
特定の実施形態では、Fv3Cポリペプチドは、2種以上のβ−グルコシダーゼ配列を含む融合/キメラポリペプチドであってよく、少なくとも1種のβ−グルコシダーゼ配列は、Fv3Cポリペプチドに由来する。例えば、Fv3Cキメラ/融合ポリペプチドは、Fv3Cポリペプチド又はこれらの変異体のN端末の同じ長さの配列に由来し、かつ配列番号60に対し少なくとも約60%配列同一性を有する、少なくともアミノ酸残基約200個分の長さのポリペプチドを含んでよい。例えば、Fv3Cキメラ/融合ポリペプチドは、Fv3Cポリペプチド又はこれらの変異体のC端末の同じ長さの配列に由来し、かつ配列番号60に対し少なくとも約60%配列同一性を有する、少なくともアミノ酸残基約50個分の長さのポリペプチドを含んでよい。特定の実施形態では、Fv3Cキメラ/融合ポリペプチドは更に、アミノ酸残基約3、4、5、6、7、8、9、10、又は11個分の長さのループ配列を含み、ループ配列は、同じ長さのFv3Cポリペプチド又はこれらの変異体の配列に由来し、アミノ酸配列FDRRSPG(配列番号204)又はFD(R/K)YNIT(配列番号205)を含む。
Tr3A:Tr3A(配列番号62)のアミノ酸配列を図45B及び55に示す。配列番号62は、未成熟なTr3A配列である。Tr3Aは配列番号62の残基1〜19に相当する予測シグナル配列を有しており、このシグナル配列が切断されることで配列番号62の残基20〜744に相当する配列を有する成熟タンパク質が生成されるものと予測される。シグナル配列の予測は、SignalP−NNアルゴリズムにより行った。予測保存ドメインを、図45B中にボールド体で示す。ドメイン予測は、Pfam、SMART、又はNCBIデータベースに基づいて実施した。Tr3Aの残基E472、及びD267は、それぞれ、例えば、P.アンセリア(P. anserina)(受入番号XP_001912683)、V.デフリアエ(V. dahliae)、N.ハエマトコッカ(N. haematococca)(受入番号XP_003045443)、G.ゼアエ(G. zeae)(受入番号XP_386781)、F.オキシスポラム(F. oxysporum)(受入番号BGL FOXG_02349)、A.ニガー(A. niger)(受入番号CAK48740)、T.エマーソニィ(T. emersonii)(受入番号AAL69548)、T.リーゼイ(T. reesei)(受入番号AAP57755)、T.リーゼイ(T. reesei)(受入番号AAA18473)、F.バーティシリオイド(F. verticillioides)、及びT.ネアポリタナ(T. neapolitana)(受入番号Q0GC07)などに由来する上記GH3グルコシダーゼの配列アラインメントに基づき、酸塩基性及び求核性触媒として機能するものと予測される(図55を参照されたい)。本明細書で使用するとき、用語、「Tr3Aポリペプチド」は、配列番号62の残基20〜744間の、少なくとも50、75、100、125、150、175、200、250、300、350、400、450、500、550、600、650、又は700個の連続するアミノ酸残基と少なくとも85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%配列同一性を有する配列を含む、ポリペプチド及び/又はその変異体を指す。好ましくは、Tr3Aポリペプチドは、ネイティブなTr3Aと比較して、残基E472及びD267において変更はなされていない。好ましくは、Tr3Aポリペプチドは、図55のアラインメントに示すとおり、本明細書に記載のGH3ファミリーβ−グルコシダーゼ間で保存されているアミノ酸残基の少なくとも70%、80%、90%、95%、98%、又は99%が未改変である。Tr3Aポリペプチドは、図45Bに示すネイティブなTr3Aの予測保存ドメイン全長を適切に含む。Tr3Aポリペプチドは、好ましくは、β−グルコシダーゼ活性を有し、配列番号62のアミノ酸配列又は配列番号62の残基(i)20〜287、(ii)22〜611、(iii)20〜744、(iv)362〜611、又は(v)362〜744と少なくとも90%、91%、92%、93%、94%、95%、96%、97%、98%、99%又は100%配列同一性を有する。
特定の実施形態では、Tr3Aポリペプチドは、2種以上のβ−グルコシダーゼ配列を含む融合又はキメラポリペプチドであってよく、β−グルコシダーゼ配列のうち少なくとも1つはTr3Aポリペプチドに由来する。例えば、Tr3Aキメラ/融合ポリペプチドは、少なくともアミノ酸残基約200個分の長さのポリペプチドを含んでよく、このポリペプチドはTr3Aポリペプチド又はこれらの変異体のN端末に由来する同じ長さの配列に由来し、配列番号62に対し少なくとも約60%配列同一性を有する。例えば、Tr3Aキメラ/融合ポリペプチドには、少なくともアミノ酸残基約50個分の長さのポリペプチドを含んでよく、このポリペプチドはTr3Aポリペプチド又はこれらの変異体のC端末に由来する同じ長さの配列に由来し、配列番号62に対し少なくとも約60%配列同一性を有する。特定の実施形態では、Tr3Aポリペプチドは更に、アミノ酸残基約3、4、5、6、7、8、9、10、又は11個分の長さのループ配列を含み、ループ配列は、同じ長さのTr3Aポリペプチド又はこれらの変異体の配列に由来し、アミノ酸配列FDRRSPG(配列番号204)又はFD(R/K)YNIT(配列番号205)を含む。
Tr3B:Tr3B(配列番号64)のアミノ酸配列を図46B及び55に示す。配列番号64は、未成熟なTr3B配列である。Tr3Bは配列番号64の残基1〜18に相当する予測シグナル配列を有しており、このシグナル配列が切断されることで配列番号64の残基19〜874に相当する配列を有する成熟タンパク質が生成されるものと予測される。シグナル配列の予測は、SignalP−NNアルゴリズムにより行った。予測保存ドメインを、図46B中にボールド体で示す。ドメイン予測は、Pfam、SMART、又はNCBIデータベースに基づいて実施した。Tr3Bの残基E516、及びD287は、それぞれ、例えば、P.アンセリア(P. anserina)(受入番号XP_001912683)、V.ダフリアエ(V. dahliae)、N.ハエマトコッカ(N. haematococca)(受入番号XP_003045443)、G.ゼアエ(G. zeae)(受入番号XP_386781)、F.オキシスポラム(F. oxysporum)(受入番号BGL FOXG_02349)、A.ニガー(A. niger)(受入番号CAK48740)、T.エマーソニィ(T. emersonii)(受入番号AAL69548)、T.リーゼイ(T. reesei)(受入番号AAP57755)、T.リーゼイ(T. reesei)(受入番号AAA18473)、F.バーティシリオイド(F. verticillioides)、及びT.ネアポリタナ(T. neapolitana)(受入番号Q0GC07)などに由来する上記GH3グルコシダーゼの配列アラインメントに基づき、酸塩基性及び求核性触媒として機能するものと予測される(図55を参照されたい)。本明細書で使用するとき、用語、「Tr3Bポリペプチド」は、配列番号64の残基19〜874間の、少なくとも50、75、100、125、150、175、200、250、300、350、400、450、500、550、600、650、700、750、800、又は850個の連続するアミノ酸残基と、少なくとも85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%同一性を有する配列を含む、ポリペプチド及び/又はその変異体を指す。好ましくはTr3Bポリペプチドは、ネイティブなTr3Bと比較して、残基E516及びD287において変更はなされていない。好ましくは、Tr3Bポリペプチドは、図55のアラインメントに示すとおり、本明細書に記載のGH3ファミリーβ−グルコシダーゼ間で保存されているアミノ酸残基の少なくとも70%、80%、90%、95%、98%、又は99%が未改変である。Tr3Bポリペプチドは、図46Bに示すネイティブなTr3Bの予測保存ドメイン全長を適切に含む。本発明のTr3Bポリペプチドは、好ましくは、β−グルコシダーゼ活性を有し、配列番号64のアミノ酸配列又は配列番号64の残基(i)19〜307、(ii)19〜640、(iii)19〜874、(iv)407〜640、又は(v)407〜874と少なくとも90%、91%、92%、93%、94%、95%、96%、97%、98%、99%又は100%同一性を有する。
特定の実施形態では、Tr3Bポリペプチドは、2種以上のβ−グルコシダーゼ配列を含む融合又はキメラポリペプチドであってよく、β−グルコシダーゼ配列のうち少なくとも1つはTr3Bポリペプチドに由来する。例えば、Tr3Bキメラ/融合ポリペプチドは、少なくともアミノ酸残基約200個分の長さのポリペプチドを含んでよく、このポリペプチドはTr3Bポリペプチド又はこれらの変異体のN端末に由来する同じ長さの配列に由来し、配列番号64に対し少なくとも約60%配列同一性を有する。例えば、Tr3Bキメラ/融合ポリペプチドには、少なくともアミノ酸残基約50個分の長さのポリペプチドを含んでよく、このポリペプチドはTr3Bポリペプチド又はこれらの変異体のC端末に由来する同じ長さの配列に由来し、配列番号64に対し少なくとも約60%配列同一性を有する。特定の実施形態では、Tr3Bポリペプチドは更に、アミノ酸残基約3、4、5、6、7、8、9、10、又は11個分の長さのループ配列を含み、ループ配列は、同じ長さのTr3Bポリペプチド又はこれらの変異体の配列に由来し、アミノ酸配列FDRRSPG(配列番号204)又はFD(R/K)YNIT(配列番号205)を含む。
Te3A:Te3A(配列番号66)のアミノ酸配列を図47B及び55に示す。配列番号66は、未成熟なTe3A配列である。Te3Aは配列番号66の残基1〜19に相当する予測シグナル配列を有しており、このシグナル配列が切断されることで配列番号66の残基20〜857に相当する配列を有する成熟タンパク質が生成されるものと予測される。シグナル配列の予測は、SignalP−NNアルゴリズムにより行った。予測保存ドメインを、図47B中にボールド体で示す。ドメイン予測は、Pfam、SMART、又はNCBIデータベースに基づいて実施した。Te3Aの残基E505、及びD277は、それぞれ、例えば、P.アンセリア(P. anserina)(受入番号XP_001912683)、V.デフリアエ(V. dahliae)、N.ハエマトコッカ(N. haematococca)(受入番号XP_003045443)、G.ゼアエ(G. zeae)(受入番号XP_386781)、F.オキシスポラム(F. oxysporum)(受入番号BGL FOXG_02349)、A.ニガー(A. niger)(受入番号CAK48740)、T.エマーソニィ(T. emersonii)(受入番号AAL69548)、T.リーゼイ(T. reesei)(受入番号AAP57755)、T.リーゼイ(T. reesei)(受入番号AAA18473)、F.バーティシリオイド(F. verticillioides)、及びT.ネアポリタナ(T. neapolitana)(受入番号Q0GC07)などに由来する上記GH3グルコシダーゼの配列アラインメントに基づき、酸塩基性及び求核性触媒として機能するものと予測される(図55を参照されたい)。本明細書で使用するとき、用語、「Te3Aポリペプチド」は、配列番号66の残基20〜857間の、少なくとも50、75、100、125、150、175、200、250、300、350、400、450、500、550、600、650、700、750、又は800個の連続するアミノ酸残基と、少なくとも85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%同一性を有する配列を含む、ポリペプチド及び/又はその変異体を指す。好ましくは、Te3Aポリペプチドは、ネイティブなTe3Aと比較して、残基E505及びD277において変更はなされていない。好ましくは、Te3Aポリペプチドは、図55のアラインメントに示すとおり、本明細書に記載のGH3ファミリーβ−グルコシダーゼ間で保存されているアミノ酸残基の少なくとも70%、80%、90%、95%、98%、又は99%が未改変である。Te3Aポリペプチドは、図47Bに示すネイティブなTe3Aの予測保存ドメイン全長を適切に含む。本発明のTe3Aポリペプチドは、好ましくは、β−グルコシダーゼ活性を有し、配列番号66のアミノ酸配列又は配列番号66の残基(i)20〜297、(ii)20〜629、(iii)20〜857、(iv)396〜629、又は(v)396〜857と少なくとも90%、91%、92%、93%、94%、95%、96%、97%、98%、99%又は100%同一性を有する。
特定の実施形態では、Te3Aポリペプチドは、2種以上のβ−グルコシダーゼ配列を含む融合又はキメラポリペプチドであってよく、β−グルコシダーゼ配列のうち少なくとも1つはTe3Aポリペプチドに由来する。例えば、Te3Aキメラ/融合ポリペプチドは、少なくともアミノ酸残基約200個分の長さのポリペプチドを含んでよく、このポリペプチドはTe3Aポリペプチド又はこれらの変異体のN端末に由来する同じ長さの配列に由来し、配列番号62に対し少なくとも約60%配列同一性を有する。例えば、Te3Aキメラ/融合ポリペプチドには、少なくともアミノ酸残基約50個分の長さのポリペプチドを含んでよく、このポリペプチドはTe3Aポリペプチド又はこれらの変異体のC端末に由来する同じ長さの配列に由来し、配列番号62に対し少なくとも約60%配列同一性を有する。特定の実施形態では、Te3Aポリペプチドは更に、アミノ酸残基約3、4、5、6、7、8、9、10、又は11個分の長さのループ配列を含み、ループ配列は、同じ長さのTe3Aポリペプチド又はこれらの変異体の配列に由来し、アミノ酸配列FDRRSPG(配列番号204)又はFD(R/K)YNIT(配列番号205)を含む。
An3A:An3A(配列番号68)のアミノ酸配列を図48B及び55に示す。配列番号6は、未成熟なAn3A配列である。An3Aは配列番号68の残基1〜19に相当する予測シグナル配列を有しており、このシグナル配列が切断されることで配列番号68の残基20〜860に相当する配列を有する成熟タンパク質が生成されるものと予測される。シグナル配列の予測は、SignalP−NNアルゴリズムにより行った。予測保存ドメインを、図48B中にボールド体で示す。ドメイン予測は、Pfam、SMART、又はNCBIデータベースに基づいて実施した。An3Aの残基E509、及びD277は、それぞれ、例えば、P.アンセリア(P. anserina)(受入番号XP_001912683)、V.ダフリアエ(V. dahliae)、N.ハエマトコッカ(N. haematococca)(受入番号XP_003045443)、G.ゼアエ(G. zeae)(受入番号XP_386781)、F.オキシスポラム(F. oxysporum)(受入番号BGL FOXG_02349)、A.ニガー(A. niger)(受入番号CAK48740)、T.エマーソニィ(T. emersonii)(受入番号AAL69548)、T.リーゼイ(T. reesei)(受入番号AAP57755)、T.リーゼイ(T. reesei)(受入番号AAA18473)、F.バーティシリオイド(F. verticillioides)、及びT.ネアポリタナ(T. neapolitana)(受入番号Q0GC07)などに由来する上記GH3グルコシダーゼの配列アラインメントに基づき、酸塩基性及び求核性触媒として機能するものと予測される(図55を参照されたい)。本明細書で使用するとき、用語、「An3Aポリペプチド」は、配列番号68の残基20〜860間の連続する少なくとも50、75、100、125、150、175、200、250、300、350、400、450、500、550、600、650、700、750、又は800個のアミノ酸残基と、少なくとも85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%同一性を有する配列を含む、ポリペプチド及び/又はその変異体を指す。好ましくはAn3Aポリペプチドは、ネイティブなAn3Aと比較して、残基E509及びD277において変更はなされていない。好ましくは、An3Aポリペプチドは、図55のアラインメントに示すとおり、本明細書に記載のGH3ファミリーβ−グルコシダーゼ間で保存されているアミノ酸残基の少なくとも70%、80%、90%、95%、98%、又は99%が未改変である。An3Aポリペプチドは、図48Bに示すネイティブなAn3Aの予測保存ドメイン全長を適切に含む。An3Aポリペプチドは、好ましくは、β−グルコシダーゼ活性を有し、配列番号68のアミノ酸配列又は配列68の残基(i)20〜300、(ii)20〜634、(iii)20〜860、(iv)400〜634、又は(v)400〜860と少なくとも90%、91%、92%、93%、94%、95%、96%、97%、98%、99%又は100%同一性を有する。
特定の実施形態では、An3Aポリペプチドは、2種以上のβ−グルコシダーゼ配列を含む融合/キメラポリペプチドであってよく、少なくとも1種のβ−グルコシダーゼ配列は、An3Aポリペプチドに由来する。例えば、An3Aキメラ/融合ポリペプチドは、少なくともアミノ酸残基約200個分の長さのポリペプチドを含んでよく、このポリペプチドは、An3Aポリペプチド又はこれらの変異体のN端末の同じ長さの配列に由来し、配列番号68に対し少なくとも約60%配列同一性を有する。例えば、An3Aキメラ/融合ポリペプチドは、少なくともアミノ酸残基約50個分の長さのポリペプチドを含んでよく、このポリペプチドは、An3Aポリペプチド又はこれらの変異体のC端末の同じ長さの配列に由来し、配列番号68に対し少なくとも約60%配列同一性を有する。特定の実施形態では、An3A融合/キメラポリペプチドは更に、アミノ酸残基約3、4、5、6、7、8、9、10、又は11個分の長さのループ配列を含み、ループ配列は、同じ長さのAn3Aポリペプチド又はこれらの変異体の配列に由来し、アミノ酸配列FDRRSPG(配列番号204)又はFD(R/K)YNIT(配列番号205)を含む。
Fo3A:Fo3A(配列番号70)のアミノ酸配列を図49B及び55に示す。配列番号70は、未成熟なFo3A配列である。Fo3Aは配列番号70の残基1〜19に相当する予測シグナル配列を有しており、このシグナル配列が切断されることで配列番号70の残基20〜899に相当する配列を有する成熟タンパク質が生成されるものと予測される。シグナル配列の予測は、SignalP−NNアルゴリズムにより行った。予測保存ドメインを、図49B中にボールド体で示す。ドメイン予測は、Pfam、SMART、又はNCBIデータベースに基づいて実施した。Fo3Aの残基E536及びD307は、それぞれ、例えば、P.アンセリア(P. anserina)(受入番号XP_001912683)、V.ダフリアエ(V. dahliae)、N.ハエマトコッカ(N. haematococca)(受入番号XP_003045443)、G.ゼアエ(G. zeae)(受入番号XP_386781)、F.オキシスポラム(F. oxysporum)受入番号BGL FOXG_02349)、A.ニガー(A. niger)(受入番号CAK48740)、T.エマーソニィ(T. emersonii)(受入番号AAL69548)、T.リーゼイ(T. reesei)(受入番号AAP57755)、T.リーゼイ(T. reesei)(受入番号AAA18473)、F.バーティシリオイド(F. verticillioides)、及びT.ネアポリタナ(T. neapolitana)(受入番号Q0GC07)などに由来する上記GH3グルコシダーゼの配列アラインメントに基づき、酸塩基性及び求核性触媒として機能するものと予測される(図55を参照されたい)。本明細書で使用するとき、用語、「Fo3Aポリペプチド」は、配列番号70の残基20〜899間の連続する少なくとも50、75、100、125、150、175、200、250、300、350、400、450、500、550、600、650、700、750、800、又は850個のアミノ酸残基と、少なくとも85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%同一性を有する配列を含む、ポリペプチド及び/又はその変異体を指す。好ましくは、Fo3Aポリペプチドは、ネイティブなFo3Aと比較して、残基E536及びD307において変更はなされていない。好ましくは、Fo3Aポリペプチドは、図55のアラインメントに示すとおり、本明細書に記載のGH3 β−グルコシダーゼ間で保存されているアミノ酸残基の少なくとも70%、80%、90%、95%、98%、又は99%が未改変である。Fo3Aポリペプチドは、図49Bに示すネイティブなFo3Aの予測保存ドメイン全長を適切に含む。Fo3Aポリペプチドは、好ましくは、β−グルコシダーゼ活性を有し、配列番号70のアミノ酸配列又は配列番号70の残基(i)20〜327、(ii)20〜660、(iii)20〜899、(iv)428〜660、又は(v)428〜899と少なくとも90%、91%、92%、93%、94%、95%、96%、97%、98%、99%又は100%同一性を有する。
特定の実施形態では、Fo3Aポリペプチドは、2種以上のβ−グルコシダーゼ配列を含む融合/キメラポリペプチドであってよく、少なくとも1種のβ−グルコシダーゼ配列は、Fo3Aポリペプチドに由来する。例えば、Fo3Aキメラ/融合ポリペプチドは、少なくともアミノ酸残基約200個分の長さのポリペプチドを含んでよく、このポリペプチドは、Fo3Aポリペプチド又はこれらの変異体のN端末の同じ長さの配列に由来し、配列番号70に対し少なくとも約60%配列同一性を有する。例えば、Fo3Aキメラ/融合ポリペプチドは、少なくともアミノ酸残基約50個分の長さのポリペプチドを含んでよく、このポリペプチドは、Fo3Aポリペプチド又はこれらの変異体のC端末の同じ長さの配列に由来し、かつ配列番号70に対し少なくとも約60%配列同一性を有する。特定の実施形態では、Fo3A融合/キメラポリペプチドは更に、アミノ酸残基約3、4、5、6、7、8、9、10、又は11個分の長さのループ配列を含み、ループ配列は、同じ長さのFo3Aポリペプチド又はこれらの変異体の配列に由来し、アミノ酸配列FDRRSPG(配列番号204)又はFD(R/K)YNIT(配列番号205)を含む。
Gz3A:Gz3A(配列番号72)のアミノ酸配列を図50B及び55に示す。配列番号72は、未成熟なGz3A配列である。Gz3Aは配列番号72の残基1〜18に相当する予測シグナル配列を有しており、このシグナル配列が切断されることで配列番号72の残基19〜886に相当する配列を有する成熟タンパク質が生成されるものと予測される。シグナル配列の予測は、SignalP−NNアルゴリズムにより行った。予測保存ドメインを、図50B中にボールド体で示す。ドメイン予測は、Pfam、SMART、又はNCBIデータベースに基づいて実施した。Gz3Aの残基E523及びD294は、それぞれ、例えば、P.アンセリア(P. anserina)(受入番号XP_001912683)、V.ダフリアエ(V. dahliae)、N.ハエマトコッカ(N. haematococca)(受入番号XP_003045443)、G.ゼアエ(G. zeae)(受入番号XP_386781)、F.オキシスポラム(F. oxysporum)(受入番号BGL FOXG_02349)、A.ニガー(A. niger)(受入番号CAK48740)、T.エマーソニィ(T. emersonii)(受入番号AAL69548)、T.リーゼイ(T. reesei)(受入番号AAP57755)、T.リーゼイ(T. reesei)(受入番号AAA18473)、F.バーティシリオイド(F. verticillioides)、及びT.ネアポリタナ(T. neapolitana)(受入番号Q0GC07)などに由来する上記GH3グルコシダーゼの配列アラインメントに基づき、酸塩基性及び求核性触媒として機能するものと予測される(図55を参照されたい)。本明細書で使用するとき、用語、「Gz3Aポリペプチド」は、配列番号72の残基19〜886間の、少なくとも50、75、100、125、150、175、200、250、300、350、400、450、500、550、600、650、700、750、800、又は850個の連続するアミノ酸残基と、少なくとも85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%同一性を有する配列を含む、ポリペプチド及び/又はその変異体を指す。好ましくは、Gz3Aポリペプチドは、ネイティブなGz3Aと比較して、残基E536及びD307において変更はなされていない。好ましくは、Gz3Aポリペプチドは、図55のアラインメントに示すとおり、本明細書に記載のGH3ファミリーβ−グルコシダーゼ間で保存されているアミノ酸残基の少なくとも70%、80%、90%、95%、98%、又は99%が未改変である。Gz3Aポリペプチドは、図50Bに示すネイティブなGz3Aの予測保存ドメイン全長を適切に含む。Gz3Aポリペプチドは、好ましくは、β−グルコシダーゼ活性を有し、配列番号72のアミノ酸配列又は配列番号72の残基(i)19〜314、(ii)19〜647、(iii)19〜886、(iv)415〜647、又は(v)415〜886と少なくとも90%、91%、92%、93%、94%、95%、96%、97%、98%、99%又は100%同一性を有する。
特定の実施形態では、Gz3Aポリペプチドは、2種以上のβ−グルコシダーゼ配列を含む融合又はキメラポリペプチドであってよく、β−グルコシダーゼ配列のうち少なくとも1つはGz3Aポリペプチドに由来する。例えば、Gz3Aキメラ/融合ポリペプチドは、少なくともアミノ酸残基約200個分の長さのポリペプチドを含んでよく、このポリペプチドはGz3Aポリペプチド又はこれらの変異体のN端末に由来する同じ長さの配列に由来し、配列番号72に対し少なくとも約60%配列同一性を有する。例えば、Gz3Aキメラ/融合ポリペプチドには、少なくともアミノ酸残基約50個分の長さのポリペプチドを含んでよく、このポリペプチドはGz3Aポリペプチド又はこれらの変異体のC端末に由来する同じ長さの配列に由来し、配列番号72に対し少なくとも約60%配列同一性を有する。特定の実施形態では、Gz3Aポリペプチドは更に、アミノ酸残基約3、4、5、6、7、8、9、10、又は11個分の長さのループ配列を含み、ループ配列は、同じ長さのGz3Aポリペプチド又はこれらの変異体の配列に由来し、アミノ酸配列FDRRSPG(配列番号204)又はFD(R/K)YNIT(配列番号205)を含む。
Nh3A:Nh3A(配列番号74)のアミノ酸配列を図51B及び55に示す。配列番号74は、未成熟なNh3A配列である。Nh3Aは配列番号74の残基1〜19に相当する予測シグナル配列を有しており、このシグナル配列が切断されることで配列番号74の残基20〜880に相当する配列を有する成熟タンパク質が生成されるものと予測される。シグナル配列の予測は、SignalP−NNアルゴリズムにより行った。予測保存ドメインを、図51B中にボールド体で示す。ドメイン予測は、Pfam、SMART、又はNCBIデータベースに基づいて実施した。Nh3Aの残基E523及びD294は、それぞれ、例えば、P.アンセリア(P. anserina)(受入番号XP_001912683)、V.デフリアエ(V. dahliae)、N.ハエマトコッカ(N. haematococca)(受入番号XP_003045443)、G.ゼアエ(G. zeae)(受入番号XP_386781)、F.オキシスポラム(F. oxysporum)(受入番号BGL FOXG_02349)、A.ニガー(A. niger)(受入番号CAK48740)、T.エマーソニィ(T. emersonii)(受入番号AAL69548)、T.リーゼイ(T. reesei)(受入番号AAP57755)、T.リーゼイ(T. reesei)(受入番号AAA18473)、F.バーティシリオイド(F. verticillioides)、及びT.ネアポリタナ(T. neapolitana)(受入番号Q0GC07)などに由来する上記GH3グルコシダーゼの配列アラインメントに基づき、酸塩基性及び求核性触媒として機能するものと予測される(図55を参照されたい)。本明細書で使用するとき、用語、「Nh3Aポリペプチド」は、配列番号74の残基20〜880間の連続する少なくとも50、75、100、125、150、175、200、250、300、350、400、450、500、550、600、650、700、750、800、又は850個のアミノ酸残基と少なくとも85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%同一性を有する配列を含む、ポリペプチド及び/又はその変異体を指す。好ましくは、Nh3Aポリペプチドは、ネイティブなNh3Aと比較して、残基E523及びD294において変更はなされていない。好ましくは、Nh3Aポリペプチドは、図55のアラインメントに示すとおり、本明細書に記載のGH3ファミリーβ−グルコシダーゼ間で保存されているアミノ酸残基の少なくとも70%、80%、90%、95%、98%、又は99%が未改変である。Nh3Aポリペプチドは、図51Bに示すネイティブなNh3Aの予測保存ドメイン全長を適切に含む。Nh3Aポリペプチドは、好ましくは、β−グルコシダーゼ活性を有し、配列番号76のアミノ酸配列又は配列番号76の残基(i)20〜295、(ii)20〜647、(iii)20〜880、(iv)414〜647、又は(v)414〜880と少なくとも90%、91%、92%、93%、94%、95%、96%、97%、98%、99%又は100%同一性を有する。
特定の実施形態では、Nh3Aポリペプチドは、2種以上のβ−グルコシダーゼ配列を含む融合/キメラポリペプチドであってよく、少なくとも1種のβ−グルコシダーゼ配列は、Nh3Aポリペプチドに由来する。例えば、Nh3Aキメラ/融合ポリペプチドは、Nh3Aポリペプチド又はこれらの変異体のN端末の同じ長さの配列に由来し、かつ配列番号74に対し少なくとも約60%配列同一性を有する、少なくともアミノ酸残基約200個分の長さのポリペプチドを含んでよい。例えば、Nh3Aキメラ/融合ポリペプチドは、Nh3Aポリペプチド又はこれらの変異体のC端末の同じ長さの配列に由来し、かつ配列番号74に対し少なくとも約60%配列同一性を有する、少なくともアミノ酸残基約50個分の長さのポリペプチドを含んでよい。特定の実施形態では、Nh3Aポリペプチドは更に、アミノ酸残基約3、4、5、6、7、8、9、10、又は11個分の長さのループ配列を含み、ループ配列は、同じ長さのNh3Aポリペプチド又はこれらの変異体の配列に由来し、アミノ酸配列FDRRSPG(配列番号204)又はFD(R/K)YNIT(配列番号205)を含む。
Vd3A:Vd3A(配列番号76)のアミノ酸配列を図52B及び55に示す。配列番号76は、未成熟なVd3A配列である。Vd3Aは配列番号76の残基1〜18に相当する予測シグナル配列を有しており、このシグナル配列が切断されることで配列番号76の残基19〜890に相当する配列を有する成熟タンパク質が生成されるものと予測される。シグナル配列の予測は、SignalP−NNアルゴリズムにより行った。予測保存ドメインを、図52B中にボールド体で示す。ドメイン予測は、Pfam、SMART、又はNCBIデータベースに基づいて実施した。Vd3Aは、例えば、cNPG及びセロビオースを用いる酵素アッセイにおいて、並びに希アンモニアで前処理したトウモロコシ穂軸を基質として加水分解する際に、β−グルコシダーゼ活性を有することが示された。Vd3Aの残基E524及びD295は、それぞれ、例えば、P.アンセリア(P. anserina)(受入番号XP_001912683)、V.ダフリアエ(V. dahliae)、N.ハエマトコッカ(N. haematococca)(受入番号XP_003045443)、G.ゼアエ(G. zeae)(受入番号XP_386781)、F.オキシスポラム(F. oxysporum)(受入番号BGL FOXG_02349)、A.ニガー(A. niger)(受入番号CAK48740)、T.エマーソニィ(T. emersonii)(受入番号AAL69548)、T.リーゼイ(T. reesei)(受入番号AAP57755)、T.リーゼイ(T. reesei)(受入番号AAA18473)、F.バーティシリオイド(F. verticillioides)、及びT.ネアポリタナ(T. neapolitana)(受入番号Q0GC07)などに由来する上記GH3グルコシダーゼの配列アラインメントに基づき、酸塩基性及び求核性触媒として機能するものと予測される(図55を参照されたい)。本明細書で使用するとき、用語、「Vd3Aポリペプチド」は、配列番号76の残基19〜890間の、少なくとも50、75、100、125、150、175、200、250、300、350、400、450、500、550、600、650、700、750、800、又は850個の連続するアミノ酸残基と、少なくとも85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%同一性を有する配列を含む、ポリペプチド及び/又はその変異体を指す。好ましくは、Vd3Aポリペプチドは、ネイティブなVd3Aと比較して、残基E524及びD295において変更はなされていない。好ましくは、Vd3Aポリペプチドは、図55のアラインメントに示すとおり、本明細書に記載のGH3ファミリーβ−グルコシダーゼ間で保存されているアミノ酸残基の少なくとも70%、80%、90%、95%、98%、又は99%が未改変である。Vd3Aポリペプチドは、図52Bに示すネイティブなVd3Aの予測保存ドメイン全長を適切に含む。本発明のVd3Aポリペプチドは、好ましくは、β−グルコシダーゼ活性を有し、配列番号76のアミノ酸配列又は配列番号76の残基(i)19〜296、(ii)19〜649、(iii)19〜890、(iv)415〜649、又は(v)415〜890と少なくとも90%、91%、92%、93%、94%、95%、96%、97%、98%、99%又は100%同一性を有する。
特定の実施形態では、Vd3Aポリペプチドは、2種以上のβ−グルコシダーゼ配列を含む融合又はキメラポリペプチドであってよく、β−グルコシダーゼ配列のうち少なくとも1つはVd3Aポリペプチドに由来する。例えば、Vd3Aキメラ/融合ポリペプチドは、少なくともアミノ酸残基約200個分の長さのポリペプチドを含んでよく、このポリペプチドはVd3Aポリペプチド又はこれらの変異体のN端末に由来する同じ長さの配列に由来し、配列番号76に対し少なくとも約60%配列同一性を有する。例えば、Vd3Aキメラ/融合ポリペプチドには、少なくともアミノ酸残基約50個分の長さのポリペプチドを含んでよく、このポリペプチドはVd3Aポリペプチド又はこれらの変異体のC端末に由来する同じ長さの配列に由来し、配列番号76に対し少なくとも約60%配列同一性を有する。特定の実施形態では、Vd3Aポリペプチドは更に、アミノ酸残基約3、4、5、6、7、8、9、10、又は11個分の長さのループ配列を含み、ループ配列は、同じ長さのVd3Aポリペプチド又はこれらの変異体の配列に由来し、アミノ酸配列FDRRSPG(配列番号204)又はFD(R/K)YNIT(配列番号205)を含む。
Pa3G:Pa3G(配列番号78)のアミノ酸配列を図53B及び55に示す。配列番号78は、未成熟なPa3G配列である。Pa3Gは配列番号78の残基1〜19に相当する予測シグナル配列を有しており、このシグナル配列が切断されることで配列番号78の残基20〜805に相当する配列を有する成熟タンパク質が生成されるものと予測される。シグナル配列の予測は、SignalP−NNアルゴリズムにより行った。予測保存ドメインを、図53B中にボールド体で示す。ドメイン予測は、Pfam、SMART、又はNCBIデータベースに基づいて実施した。Pa3Gの残基E517及びD289は、それぞれ、例えば、例えば、P.アンセリア(P. anserina)(受入番号XP_001912683)、V.デフリアエ(V. dahliae)、N.ハエマトコッカ(N. haematococca)(受入番号XP_003045443)、G.ゼアエ(G. zeae)(受入番号XP_386781)、F.オキシスポラム(F. oxysporum)(受入番号BGL FOXG_02349)、A.ニガー(A. niger)(受入番号CAK48740)、T.エマーソニィ(T. emersonii)(受入番号AAL69548)、T.リーゼイ(T. reesei)(受入番号AAP57755)、T.リーゼイ(T. reesei)(受入番号AAA18473)、F.バーティシリオイド(F. verticillioides)、及びT.ネアポリタナ(T. neapolitana)(受入番号Q0GC07)などに由来する上記GH3グルコシダーゼの配列アラインメントに基づき、酸塩基性及び求核性触媒として機能するものと予測される(図55を参照されたい)。本明細書で使用するとき、用語、「Pa3Gポリペプチド」は、配列番号78の残基20〜805間の、少なくとも50、75、100、125、150、175、200、250、300、350、400、450、500、550、600、650、700、又は750個の連続するアミノ酸残基と、少なくとも85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%同一性を有する配列を含む、ポリペプチド及び/又はその変異体を指す。好ましくは、Pa3Gポリペプチドは、ネイティブなPa3Gと比較して、残基E517及びD289において変更はなされていない。好ましくは、Pa3Gポリペプチドは、図55のアラインメントに示すとおり、本明細書に記載のGH3ファミリーβ−グルコシダーゼ間で保存されているアミノ酸残基の少なくとも70%、80%、90%、95%、98%、又は99%が未改変である。Pa3Gポリペプチドは、図53Bに示すネイティブなPa3Gの予測保存ドメイン全長を適切に含む。本発明のPa3Gポリペプチドは、好ましくは、β−グルコシダーゼ活性を有し、配列番号78のアミノ酸配列又は配列番号78の残基(i)20〜354、(ii)20〜660、(iii)20〜805、(iv)449〜660、又は(v)449〜805と少なくとも90%、91%、92%、93%、94%、95%、96%、97%、98%、99%又は100%同一性を有する。
特定の実施形態では、Pa3Gポリペプチドは、2種以上のβ−グルコシダーゼ配列を含む融合又はキメラポリペプチドであってよく、β−グルコシダーゼ配列のうち少なくとも1つはPa3Gポリペプチドに由来する。例えば、Pa3Gキメラ/融合ポリペプチドは、少なくともアミノ酸残基約200個分の長さのポリペプチドを含んでよく、このポリペプチドはPa3Gポリペプチド又はこれらの変異体のN端末に由来する同じ長さの配列に由来し、配列番号78に対し少なくとも約60%配列同一性を有する。例えば、Pa3Gキメラ/融合ポリペプチドには、少なくともアミノ酸残基約50個分の長さのポリペプチドを含んでよく、このポリペプチドはPa3Gポリペプチド又はこれらの変異体のC端末に由来する同じ長さの配列に由来し、配列番号78に対し少なくとも約60%配列同一性を有する。特定の実施形態では、Pa3Gポリペプチドは更に、アミノ酸残基約3、4、5、6、7、8、9、10、又は11個分の長さのループ配列を含み、ループ配列は、同じ長さのPa3Gポリペプチド又はこれらの変異体の配列に由来し、アミノ酸配列FDRRSPG(配列番号204)又はFD(R/K)YNIT(配列番号205)を含む。
Tn3B:Tn3B(配列番号79)のアミノ酸配列を図54及び55に示す。配列番号79は、未成熟なTn3B配列である。SignalP−NNアルゴリズム(http://www.cbs.dtu.dk)では予測シグナル配列は得られなかった。Tn3Bの残基E458及びD242は、それぞれ、例えば、P.アンセリア(P. anserina)(受入番号XP_001912683)、V.ダフリアエ(V. dahliae)、N.ハエマトコッカ(N. haematococca)(受入番号XP_003045443)、G.ゼアエ(G. zeae)(受入番号XP_386781)、F.オキシスポラム(F. oxysporum)(受入番号BGL FOXG_02349)、A.ニガー(A. niger)(受入番号CAK48740)、T.エマーソニィ(T. emersonii)(受入番号AAL69548)、T.リーゼイ(T. reesei)(受入番号AAP57755)、T.リーゼイ(T. reesei)(受入番号AAA18473)、F.バーティシリオイド(F. verticillioides)、及びT.ネアポリタナ(T. neapolitana)(受入番号Q0GC07)などに由来する上記GH3グルコシダーゼの配列アラインメントに基づき、酸塩基性及び求核性触媒として機能するものと予測される(図55を参照されたい)。本明細書で使用するとき、用語、「Tn3Bポリペプチド」は、配列番号79の残基少なくとも50、75、100、125、150、175、200、250、300、350、400、450、500、550、600、650、700、又は750個の連続するアミノ酸残基と、少なくとも85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%同一性を有する配列を含む、ポリペプチド及び/又はその変異体を指す。好ましくは、Tn3Bポリペプチドは、ネイティブなTn3Bと比較して、残基E458及びD242において変更はなされていない。好ましくは、Tn3Bポリペプチドは、図55のアラインメントに示すとおり、本明細書に記載のGH3ファミリーβ−グルコシダーゼ間で保存されているアミノ酸残基の少なくとも70%、80%、90%、95%、98%、又は99%が未改変である。Tn3Bポリペプチドは、図54に示すネイティブなTn3Bの予測保存ドメイン全長を適切に含む。本発明のTn3Bポリペプチドは、好ましくはβ−グルコシダーゼ活性を有する。
特定の実施形態では、Tn3Bポリペプチドは、2種以上のβ−グルコシダーゼ配列を含む融合又はキメラポリペプチドであってよく、β−グルコシダーゼ配列のうち少なくとも1つはTn3Bポリペプチドに由来する。例えば、Tn3Bキメラ/融合ポリペプチドは、少なくともアミノ酸残基約200個分の長さのポリペプチドを含んでよく、このポリペプチドはTn3Bポリペプチド又はこれらの変異体のN端末に由来する同じ長さの配列に由来し、配列番号79に対し少なくとも約60%配列同一性を有する。例えば、Tn3Bキメラ/融合ポリペプチドには、少なくともアミノ酸残基約50個分の長さのポリペプチドを含んでよく、このポリペプチドはTn3Bポリペプチド又はこれらの変異体のC端末に由来する同じ長さの配列に由来し、配列番号79に対し少なくとも約60%配列同一性を有する。特定の実施形態では、Tn3Bキメラ/融合ポリペプチドは更に、アミノ酸残基約3、4、5、6、7、8、9、10、又は11個分の長さのループ配列を含み、ループ配列は、同じ長さのTn3Bポリペプチド又はこれらの変異体の配列に由来し、アミノ酸配列FDRRSPG(配列番号204)又はFD(R/K)YNIT(配列番号205)を含む。
したがって、本開示は、下記:
(1)(i)配列番号2の24〜766;(ii)配列番号2の73〜321;(iii)配列番号2の73〜394;(iv)配列番号2の395〜622;(v)配列番号2の24〜622;又は(iv)配列番号2の73〜622の位置に相当するアミノ酸配列に対し少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%同一性を有し、β−キシロシダーゼ活性を有するポリペプチド;又は
(2)(i)配列番号4の21〜445;(ii)配列番号4の21〜301;(iii)配列番号4の21〜323;(iv)配列番号4の21〜444;(v)配列番号4の302〜444;(vi)配列番号4の302〜445;(vii)配列番号4の324〜444;又は(viii)配列番号4の324〜445の位置に相当するアミノ酸配列に対し少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%同一性を有し、β−キシロシダーゼ活性を有するポリペプチド;又は
(3)(i)配列番号6の19〜530;(ii)配列番号6の29〜530;(iii)配列番号6の19〜300;又は(iv)配列番号6の29〜300の位置に相当するアミノ酸配列に対し少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%同一性を有し、β−キシロシダーゼ活性を有するポリペプチド;又は
(4)(i)配列番号8の20〜439;(ii)配列番号8の20〜291;(iii)配列番号8の145〜291;又は(iv)配列番号8の145〜439の位置に相当するアミノ酸配列に対し少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%同一性を有し、β−キシロシダーゼ活性を有するポリペプチド;又は
(5)(i)配列番号10の23〜449;(ii)配列番号10の23〜302;(iii)配列番号10の23〜320;(iv)配列番号10の23〜448;(v)配列番号10の303〜448;(vi)配列番号10の303〜449;(vii)配列番号10の321〜448;又は(viii)配列番号10の321〜449の位置に相当するアミノ酸配列に対し少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%同一性を有し、β−キシロシダーゼ活性を有するポリペプチド;又は
(6)(i)配列番号12の17〜574;(ii)配列番号12の27〜574;(iii)配列番号12の17〜303;又は(iv)配列番号12の27〜303の位置に相当するアミノ酸配列に対し少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%同一性を有し、β−キシロシダーゼ活性及びL−α−アラビノフラノシダーゼ活性を有するポリペプチド;又は
(7)(i)配列番号14の21〜676;(ii)配列番号14の21〜652;(iii)配列番号14の469〜652;又は(iv)配列番号14の469〜676の位置に相当するアミノ酸配列に対し少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%同一性を有し、β−キシロシダーゼ活性及びL−α−アラビノフラノシダーゼ活性をいずれも有するポリペプチド;又は
(8)(i)配列番号16の19〜340;(ii)配列番号16の53〜340;(iii)配列番号16の19〜383;又は(iv)配列番号16の53〜383の位置に相当するアミノ酸配列に対し少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%同一性を有し、β−キシロシダーゼ活性を有するポリペプチド;又は
(9)(i)配列番号18の21〜341;(ii)配列番号18の107〜341;(iii)配列番号18の21〜348;又は(iv)配列番号18の107〜348の位置に相当するアミノ酸配列に対し少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%同一性を有し、β−キシロシダーゼ活性を有するポリペプチド;又は、
(10)(i)配列番号20の15〜558;又は(ii)配列番号20の15〜295の位置に相当するアミノ酸配列に対し少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%同一性を有し、L−α−アラビノフラノシダーゼ活性を有するポリペプチド;又は
(11)(i)配列番号22の21〜632;(ii)配列番号22の461〜632;(iii)配列番号22の21〜642;又は(iv)配列番号22の461〜642の位置に相当するアミノ酸配列に対し少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%同一性を有し、L−α−アラビノフラノシダーゼ活性を有するポリペプチド;又は
(12)(i)配列番号28の20〜341;(ii)配列番号28の21〜350;(iii)配列番号28の107〜341;又は(iv)配列番号28の107〜350の位置に相当するアミノ酸配列に対し少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%同一性を有し、β−キシロシダーゼ活性を有するポリペプチド;又は、
(13)(i)配列番号32の21〜660;(ii)配列番号32の21〜645;(iii)配列番号32の450〜645;又は(iv)配列番号32の450〜660の位置に相当するアミノ酸配列に対し少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%同一性を有し、L−α−アラビノフラノシダーゼ活性を有するポリペプチド;又は
(14)配列番号52のアミノ酸配列に対し、又は配列番号52の残基(i)22〜255、(ii)22〜343、(iii)307〜343、(iv)307〜344、若しくは(v)22〜344に対し少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%同一性を有し、GH61/エンドグルカナーゼ活性を有するポリペプチド;又は
(15)配列番号54のアミノ酸配列に対し、又は配列番号54の残基(i)18〜282、(ii)18〜601、(iii)18〜733、(iv)356〜601、若しくは(v)356〜733に対し少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%同一性を有し、β−グルコシダーゼ活性を有するポリペプチド;又は
(16)配列番号56のアミノ酸配列に対し、又は配列番号56の残基(i)22〜292、(ii)22〜629、(iii)22〜780、(iv)373〜629、若しくは(v)373〜780に対し少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%同一性を有し、β−グルコシダーゼ活性を有するポリペプチド;又は
(17)配列番号58のアミノ酸配列に対し、又は配列番号58の残基(i)20〜321、(ii)20〜651、(iii)20〜811、(iv)423〜651、若しくは(v)423〜811に対し少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%同一性を有し、β−グルコシダーゼ活性を有するポリペプチド;又は
(18)配列番号60のアミノ酸配列に対し、又は配列番号60のアミノ酸配列の残基(i)20〜327、(ii)22〜600、(iii)20〜899、(iv)428〜899、若しくは(v)428〜660に対し、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%同一性を有し、β−グルコシダーゼ活性を有するポリペプチド;又は
(19)配列番号62のアミノ酸配列に対し、又は配列番号62の残基(i)20〜287、(ii)22〜611、(iii)20〜744、(iv)362〜611、若しくは(v)362〜744に対し、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%同一性を有し、β−グルコシダーゼ活性を有するポリペプチド;又は
(20)配列番号64のアミノ酸配列に対し、又は配列番号64の残基(i)19〜307、(ii)19〜640、(iii)19〜874、(iv)407〜640、若しくは(v)407〜874に対し、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%同一性を有し、β−グルコシダーゼ活性を有するポリペプチド;又は
(21)配列番号66のアミノ酸配列に対し、又は配列番号66の残基(i)20〜297、(ii)20〜629、(iii)20〜857、(iv)396〜629、若しくは(v)396〜857に対し、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%同一性を有し、β−グルコシダーゼ活性を有するポリペプチド;又は
(22)配列番号68のアミノ酸配列に対し、又は配列番号68の残基(i)20〜300、(ii)20〜634、(iii)20〜860、(iv)400〜634、若しくは(v)400〜860に対し、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%を有し、β−グルコシダーゼ活性を有するポリペプチド;又は
(23)配列番号70のアミノ酸配列に対し、又は配列番号70の残基(i)20〜327、(ii)20〜660、(iii)20〜899、(iv)428〜660、若しくは(v)428〜899に対し、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%同一性を有し、β−グルコシダーゼ活性を有するポリペプチド;又は
(24)配列番号72のアミノ酸配列に対し、又は配列番号72の残基(i)19〜314、(ii)19〜647、(iii)19〜886、(iv)415〜647、若しくは(v)415〜886に対し、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%同一性を有し、β−グルコシダーゼ活性を有するポリペプチド;又は
(25)配列番号74のアミノ酸配列、又は配列番号74の残基(i)20〜295、(ii)20〜647、(iii)20〜880、(iv)414〜647若しくは(v)414〜880少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%同一性を有し、β−グルコシダーゼ活性を有するポリペプチド;又は
(26)配列番号76のアミノ酸配列に対し、又は配列番号76の残基(i)19〜296、(ii)19〜649、(iii)19〜890、(iv)415〜649、若しくは(v)415〜890に対し、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%同一性を有し、β−グルコシダーゼ活性を有するポリペプチド;又は
(27)配列番号78のアミノ酸配列、又は配列番号78の残基(i)20〜354、(ii)20〜660、(iii)20〜805、(iv)449〜660、若しくは(v)449〜805に対し、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%同一性を有し、β−グルコシダーゼ活性を有するポリペプチド;又は
(28)配列番号79のアミノ酸配列に対し少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%同一性を有し、β−グルコシダーゼ活性を有するポリペプチド;又は
(29)アミノ酸残基少なくとも約100(例えば、少なくとも約150、175、200、225、又は250)個分の長さであり、(1)配列番号84、及び88;(2)配列番号85、及び88;(3)配列番号86;(4)配列番号87;(5)配列番号84、88、及び89;(6)配列番号85、88、及び89;(7)配列番号84、88、及び90;(8)配列番号85、88、及び90;(9)配列番号84、88、及び91;(10)配列番号85、88、及び91;(11)配列番号84、88、89、及び91;(12)配列番号84、88、90、及び91;(13)配列番号85、88、89、及び91:並びに(14)配列番号85、88、90、及び91からなる群から選択される配列モチーフのうちの1種以上を含み、GH61/エンドグルカナーゼ活性を有する、ポリペプチド;又は
(30)少なくとも2種以上β−グルコシダーゼ配列を含むポリペプチドであって、第1のβ−グルコシダーゼ配列の長さは少なくとも約200残基分(例えば、少なくとも約200、220、240、260、280、300、320、340、360、380、又は400残基分)であり、かつ配列番号197〜202のうちの1つ以上又は全てを含むのに対し、第2のβ−グルコシダーゼ配列の長さは少なくともアミノ酸残基約50個分(例えば、少なくとも約55、60、65、70、75、80、85、90、95、100、120、140、160、180、200個分)であり、かつ配列番号203を含み、同様に場合により第3のβ−グルコシダーゼ配列、すなわちアミノ酸残基約3、4、5、6、7、8、9、10、又は11個分の長さであり、配列番号66のループ配列に由来する又はアミノ酸配列FDRRSPG(配列番号204)若しくはFD(R/K)YNIT(配列番号205)を含む第3のβ−グルコシダーゼ配列を含み、β−グルコシダーゼ活性を有する、ポリペプチド;のとおりの数多くの単離、合成、又は組み換えポリペプチド又は変異体を提供する。
本開示は、遺伝子操作型酵素組成物(例えば、セルラーゼ組成物)、又は上記の1つ以上のポリペプチドが濃縮された発酵ブロスも提供する。セルラーゼ組成物は、例えば、糸状菌セルラーゼ組成物(トリコデルマ(Trichoderma)、クリソスポリウム(Chrysosporium)、又はアスペルギルス(Aspergillus)セルラーゼ組成物など);酵母セルラーゼ組成物(サッカロミセス・セレビシエ(Saccharomyces cerevisiae)セルラーゼ組成物など)、又はバクテリアセルラーゼ組成物(例えば、枯草菌(Bacillus)セルラーゼ組成物など)であってよい。発酵ブロスは糸状菌の発酵ブロスであってよく、例えば、トリコデルマ(Trichoderma)、ヒュミコラ(Humicola)、フザリウム(Fusarium)、アスペルギルス(Aspergillus)、ニューロスポラ(Neurospora)、ペニシリウム(Penicillium)、セファロスポリウム(Cephalosporium)、アクルヤ(Achlya)、ポドスポラ(Podospora)、エンドチア(Endothia)、ムコール(Mucor)、コクリオボーラス(Cochliobolus)、ピリクラリア(Pyricularia)、又はクリソスポリウム(Chrysosporium)の発酵ブロスであってよい。特に、発酵ブロスは、例えば、T.リーゼイ(T. reesei)などのトリコデルマ菌種(Trichoderma spp)、又はP.フニクロサム(P. funiculosum)などのペニシリウム菌種(Penicillium spp.)のものであってよい。発酵ブロスは、好適には生産後加工工程、例えば、精製、濾過、限外濾過、又は細胞殺傷工程などの多少の処理を行った後で全ブロス製剤に使用することもできる。
本開示は、上記のポリペプチドを発現するよう遺伝子組み換えを施した宿主細胞も提供する。例えば、宿主細胞は、真菌宿主細胞又はバクテリア宿主細胞であってよい。真菌宿主細胞は、例えば、糸状菌宿主細胞であってよく、トリコデルマ(Trichoderma)、ヒュミコラ(Humicola)、フザリウム(Fusarium)、アスペルギルス(Aspergillus)、ニューロスポラ(Neurospora)、ペニシリウム(Penicillium)、セファロスポリウム(Cephalosporium)、アクルヤ(Achlya)、ポドスポラ(Podospora)、エンドチア(Endothia)、ムコール(Mucor)、コクリオボーラス(Cochliobolus)、ピリクラリア(Pyricularia)、又はクリソスポリウム(Chrysosporium)細胞などであってよい。詳細には、宿主細胞は、例えば、トリコデルマ菌種(Trichoderma spp.)細胞(T.リーゼイ(T. reesei)細胞など)、又はペニシリウム(Penicillium)細胞(P.フニクロサム(P. funiculosum)細胞)、アスペルギルス(Aspergillus)細胞(コウジカビ(A. oryzae)又はA.ニデュランス(A. nidulans)細胞など)、又はフザリウム(Fusarium)細胞(F.バーティシリオイド(F. verticilloides)又はF.オキシスポラム(F. oxysporum)細胞など)であってよい。
5.1.1 融合又はキメラタンパク質
本開示は、典型的には、本開示のタンパク質にとって異種性のものである(すなわち、本開示のタンパク質とは異なる供給源に由来する)1つ以上の融合断片に取り付けた本開示のタンパク質ドメインを含む、融合/キメラタンパク質を提供する。好適な融合/キメラ断片としては、限定するものではないが、タンパク質の安定性を高める、その他の望ましい生物活性を提供する又は望ましい生物活性を高める、及び/又はタンパク質の精製(例えば、アフィニティークロマトグラフィーによる精製)を容易にすることのできる断片が挙げられる。好適な融合断片は所望の機能(例えば、安定性、溶解度特性、作用又は生物活性を向上させる;及び/又はタンパク質の生成を簡略化させるなど)を有する任意の大きさのドメインであってよい。融合/ハイブリッドタンパク質は、2つ以上の融合/キメラ断片から構成することができ、各断片又は少なくとも2つの断片は異なる供給源又は微生物に由来する。本開示のタンパク質のドメインのアミノ及び/又はカルボキシ末端に、融合/ハイブリッド断片を組み合わせることもできる。融合断片を切断されやすいものにすることもできる。キメラ断片を切断されやすいものにすることで、例えば、対象とするタンパク質を簡単に回収できるようになる。融合タンパク質は、好ましくは、タンパク質のカルボキシ又はアミノ末端のいずれかに取り付けた融合断片、あるいはタンパク質のカルボキシ及びアミノ末端の両方に取り付けた融合断片、あるいはこれらのドメイン、を包含するタンパク質をコードしている融合核酸を形質移入させた、組み換え細胞を培養することで生産される。
一部の態様では、本開示は、分類の異なる2種以上の酵素あるいは分類が同じであるか又は類似するものの異なる生物に由来する2種以上の酵素に由来する、2種以上の配列を含むよう遺伝子操作された特定のキメラ/融合タンパク質を提供する。特定の態様では、本開示は、特定の特性が向上するよう、例えば、キメラ/融合ポリペプチドが、望ましい工業用途に(例えば、バイオマス材料の加水分解時に使用する際に)より適したものになるよう遺伝子操作された、特定のキメラ/融合タンパク質又はポリペプチドを提供する。一部の態様では、改良される特性としては、例えば、安定性の改良が挙げられる。安定性の向上は、タンパク質分解耐性の向上に反映され、例えば、標準的な保存条件下での一定期間の保存後に観察されるタンパク質の切断の程度が低減する、好適な発現条件下での発現工程中に宿主細胞によりタンパク質を発現させた後に観察されるタンパク質の切断の程度が軽減する、又は例えば、標準的な生産条件下で、遺伝子操作した宿主細胞により遺伝子組み換え的にタンパク質を生産させた後に観察されるタンパク質の切断の程度が軽減するという点で反映される。
特定の実施形態では、本開示は、β−グルコシダーゼのキメラ/融合ポリペプチドを提供する。一部の態様では、キメラ/融合β−グルコシダーゼは2種以上のβ−グルコシダーゼ配列を含み、第1の配列は少なくともアミノ酸残基約200個分(例えば、少なくとも約200、250、300、350、又は400個分)の長さであり、配列番号54、56、58、62、64、66、68、70、72、74、76、78、及び79のうちのいずれか1つの相当する長さの配列と少なくとも約60%(例えば、少なくとも約65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%)同一性を有する配列を含むのに対し、第2の配列は少なくとも約50(例えば、少なくとも約50、75、100、125、150、又は200個)の長さであり、配列番号60の相当する長さの配列と少なくとも約60%(例えば、少なくとも約65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%)同一性を有する配列を含む。一部の態様では、キメラ/融合β−グルコシダーゼは2種以上のβ−グルコシダーゼ配列を含み、第1の配列は少なくともアミノ酸残基約200個分(例えば、少なくとも約200、250、300、350、又は400個分)の長さであり、配列番号60の相当する長さの配列と少なくとも約60%(例えば、少なくとも約65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%)同一性を有する配列を含むのに対し、第2の配列は少なくともアミノ酸残基約50個分(例えば、少なくとも約50、75、100、125、150、又は200個)の長さであり、配列番号54、56、58、62、64、66、68、70、72、74、76、78、及び79のうちのいずれか1つの相当する長さの配列と少なくとも約60%(例えば、少なくとも約65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%)同一性を有する配列を含む。詳細には、2つ以上のβ−グルコシダーゼ配列のうち1つ目の配列は、少なくともアミノ酸残基約200個分の長さであり、配列番号197〜202のアミノ酸配列モチーフのうち少なくとも2つ(例えば、少なくとも2、3、4、又は全て)を含み、かつ2つ以上のβ−グルコシダーゼ配列のうち2つ目の配列は、少なくともアミノ酸残基約50個分の長さであり、配列番号203を含む。特定の実施形態では、β−グルコシダーゼの融合/キメラポリペプチドはβ−グルコシダーゼ活性を有する。一部の実施形態では、第1の配列はβ−グルコシダーゼのキメラ/融合ポリペプチドのN末端に位置するのに対し、第2の配列はβ−グルコシダーゼのキメラ/融合ポリペプチドのC末端に位置する。一部の実施形態では、例えば、第1の配列が第2の配列の直後に隣接して又は直接連結されているなど、第1の配列のC末端は第2の配列のN末端と連結される。他の実施形態では、第1の配列は、リンカードメインを介して第2の配列に連結されている。特定の実施形態では、第1の配列、第2の配列、又は第1の配列及び第2の配列の両方には、1箇所以上にグリコシル化部位を含ませることができる。一部の実施形態では、第1又は第2の配列のいずれかはループ配列を含み、あるいは第3のβ−グルコシダーゼポリペプチドに由来する、アミノ酸残基約3、4、5、6、7、8、9、10、又は11個分の長さである、アミノ酸配列FDRRSPG(配列番号204)又はFD(R/K)YNIT(配列番号205)を含む、ループ様の構造をコードする配列を含む。特定の実施形態では、第1の及び第2の配列はいずれもループ配列を含まず、むしろ第1の及び第2の配列を連結しているリンカードメインがループ配列を含む。一部の実施形態では、β−グルコシダーゼポリペプチドの融合/キメラポリペプチドは、第1の配列、第2の配列又はリンカードメイン配列の各々が由来する、対応するβ−グルコシダーゼポリペプチドと比較して、向上した安定性を有する。一部の実施形態では、安定性の向上は、標準的な保存条件下での保存時、あるいは標準的な発現/生産条件下での発現及び/又は生産時の、ループ配列中の残基での、又はループ配列の外側の残基又は位置での、タンパク質の切断を受けにくくするという点で反映される。
代表的な実施形態では、本開示は、2種以上のβ−グルコシダーゼ配列に由来するβ−グルコシダーゼの融合/キメラポリペプチドを提供し、第1の配列はFv3Cに由来し、かつ少なくともアミノ酸残基約200個分の長さであり、第2の配列はTr3Bに由来し、少なくともアミノ酸残基約50個分の長さである。一部の実施形態では、例えば、第1の配列が第2の配列の直後に隣接して又は直接連結されているなど、第1の配列のC末端は第2の配列のN末端と連結される。他の実施形態では、第1の配列は、リンカー配列を介して第2の配列に連結されている。一部の実施形態では、第1又は第2の配列のいずれもがループ配列を含み、このループ配列は第3のβ−グルコシダーゼポリペプチドに由来し、アミノ酸残基約3、4、5、6、7、8、9、10、又は11個分の長さであり、アミノ酸配列FDRRSPG(配列番号204)又はFD(R/K)YNIT(配列番号205)を含む。特定の実施形態では、第1の配列又は第2の配列はいずれもループ配列を含まず、むしろ第1の配列及び第2の配列を連結するリンカー配列が、かかるループ配列を含む。特定の実施形態では、ループ配列は、Te3Aポリペプチドに由来する。一部の実施形態では、β−グルコシダーゼの融合/キメラポリペプチドは、各キメラ部位の由来する、対応する各β−グルコシダーゼポリペプチドと比較して向上された安定性を有する。例えば、安定性の向上とは、Fv3Cポリペプチド、Te3Aポリペプチド、及び/又はTr3Bポリペプチドに対し向上することを意味する。一部の実施形態では、安定性の向上とは、標準的な保存条件下での保存時、又は標準的な発現/生産条件下での発現/生産時の、ループ配列中の残基での、又はループ配列の外側の残基又は位置での、タンパク質の切断を受けにくくするという点で反映される。例えば、融合/キメラポリペプチドは、ループ配列のC末端上流の残基又は位置での切断を、例えば、キメラ及びFv3Cポリペプチドを整列させた場合にFv3Cポリペプチドの同じ部位にある残基と比較して受けにくい。
したがって、本開示のタンパク質には、融合遺伝子(例えば、過剰発現させた、可溶性の、活性型組み換えタンパク質)、変異導入遺伝子(例えば、転写及び翻訳が増大するようコドンに変更が加えられた遺伝子)、及びトランケート型遺伝子(例えば、シグナル配列が除去されている、又は異種シグナル配列により置換されている遺伝子)の発現産物も包含する。
多くの場合、不溶性の基質を利用するグリコシルヒドロラーゼはモジュラー酵素である。これらは通常、1つ以上の非触媒性糖質結合ドメイン(CBM)が付加された触媒モジュールからなる。従来、CBMは、グリコシルヒドロラーゼと、その標的基質の多糖類との相互作用を促進するものであると考えられている。したがって、本開示は、例えば、異種CBMをスプライシング時に転写させた(“spliced-in”)結果として複数の基質をもつなど、基質特異性に変更が加えられたキメラ酵素を提供する。本開示のキメラ酵素の異種CBMは、同様に、グリコシルヒドロラーゼと異種又は同種であってよい触媒モジュール又は触媒ドメイン(「CD」、例えば、活性部位)に取り付けられるようなモジュラーとして設計することもできる。したがって、本開示は、CBM/CDモジュールからなる、又はこのモジュールを含む、ペプチド及びポリペプチドを提供し、本モジュールは、相同的に対を形成するか、又は結合してキメラ/異種CBM/CD対を形成する。このキメラポリペプチド/ペプチドを使用して、対象とする酵素の性能を向上又は変更することができる。
したがって、本開示は、例えば、配列番号54、56、58、60、62、64、66、68、70、72、74、76、78、79、93、及び95のうちのいずれか1つの配列と、少なくとも約10残基(例えば、少なくとも約10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、225、250、275、300残基)の領域にわたって、少なくとも約60%(例えば、少なくとも約60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%)同一性を有する酵素又はポリペプチドの少なくとも1つのCBMを含む、キメラ酵素を提供する。一部の態様では、本開示は、例えば、配列番号52、80〜81、206〜207のうちのいずれか1つの配列と、少なくとも約10残基(例えば、少なくとも約10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、225、250、275、300残基)の領域にわたって、少なくとも約60%(例えば、少なくとも約60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%)同一性を有する酵素又はポリペプチドの少なくとも1つのCBMを含む、キメラ酵素を提供する。一部の態様では、本開示は、例えば、少なくとも(1)配列番号84、及び88;(2)配列番号85、及び88;(3)配列番号86;(4)配列番号87;(5)配列番号84、88、及び89;(6)配列番号85、88、及び89;(7)配列番号84、88、及び90;(8)配列番号85、88、及び90;(9)配列番号84、88、及び91;(10)配列番号85、88、及び91;(11)配列番号84、88、89、及び91;(12)配列番号84、88、90、及び91;(13)配列番号85、88、89、及び91:及び(14)配列番号85、88、90、及び91からなる群から選択される配列モチーフの1種以上を含み、少なくともアミノ酸残基約50個分(例えば、少なくとも約50、100、150、200、250、又は300個分)の長さを有する酵素又はポリペプチドの少なくとも1つのCBMを含む、キメラ酵素を提供する。一部の態様では、本開示は、例えば、配列番号2、4、6、8、10、12、14、16、18、20、22、24、26、28、30、32、34、36、38、40、42、43、及び45のうちのいずれか1つのポリペプチドと、少なくとも約10残基、例えば、少なくとも約15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、225、250、275、300、325、若しくは350残基にわたって、少なくとも約70%、例えば、少なくとも約71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%、又は完全に(100%)同一性を有する酵素又はポリペプチドの少なくとも1つのCBMを含む、キメラ酵素を提供する。
したがって、本開示のポリペプチドは、2種以上の異なるタンパク質に由来する機能ドメインを含む(例えば、あるタンパク質に由来するCBMが、他のタンパク質に由来するCDと連結されている)適切な融合タンパク質であってよい。
本開示のポリペプチドは、「実質的に純粋な」状態で得る及び/又は使用するのに好適である。例えば、本開示のポリペプチドは、所定の組成物に含まれる総タンパク質のうち少なくとも約80重量%(例えば、少なくとも約85重量%、90重量%、91重量%、92重量%、93重量%、94重量%、95重量%、96重量%、97重量%、98重量%、又は99重量%)を構成する。この組成物は、緩衝液又は溶液などのその他の成分も含む。
同様に、本開示のポリペプチドは、適宜得ることができ、及び/又は培養ブロス(例えば、糸状菌培養ブロス)に使用することができる。培養ブロスは、遺伝子操作型酵素組成物であってもよく、例えば、培養ブロスは、本開示の異種ポリペプチドを発現するよう遺伝子操作された宿主細胞により、又は内在性ポリペプチドの発現レベルをより増大させて又は抑制させて(例えば、内在性ポリペプチドの発現レベルの約1、2、3、4、又は5倍以上の量で、あるいは内在性ポリペプチドの発現量未満の量sで)本開示の内在性ポリペプチドを発現するよう遺伝子操作された組み換え宿主細胞により産生させることができる。更に、本発明の培養ブロスは、本開示の複数のポリペプチドを所望の比で発現するよう遺伝子操作を施した、特定の「遺伝子組み換え型」宿主細胞株により生産させることもできる。代表的な望ましい比については、本明細書において、例えば、以下第5.3節において記載する。
5.2 核酸及び宿主細胞
本開示は、本開示のポリペプチドをコードしている核酸、例えば、上記第5.1節に記載の核酸を提供する。
一部の態様では、本開示は、配列番号54、56、58、60、62、64、66、68、70、72、74、76、78、79、93、及び95のうちのいずれか1つの配列と、少なくとも約10残基(例えば、少なくとも約10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、225、250、275、300残基)の領域にわたって、又は触媒ドメイン(CD)の全長にわたって、又は糖結合ドメイン(CBM)の全長にわたって、少なくとも60%(例えば、少なくとも約60%(例えば、少なくとも約60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%)配列同一性を有するβ−グルコシダーゼポリペプチドをコードしている単離、合成、又は組み換えヌクレオチドを提供する。一部の実施形態では、単離、合成又は組み換えヌクレオチドは、2種以上のβ−グルコシダーゼ配列の融合/キメラ体であるβ−グルコシダーゼポリペプチドをコードしている。β−グルコシダーゼの融合/キメラポリペプチドは、少なくともアミノ酸残基約200個分(例えば、少なくとも約200、250、300、350、400、又は500個分)の長さの第1の配列を含んでよく、かつ配列番号96〜108のアミノ酸配列モチーフのうちの1つ以上又は全てを含んでよい。β−グルコシダーゼのハイッブリッド/キメラポリペプチドは、少なくともアミノ酸残基約50個分(例えば、少なくとも約50、75、100、125、150、175、又は200個分)の長さの第2のβ−グルコシダーゼ配列を含んでよく、かつ配列番号109〜116のアミノ酸配列モチーフのうちの1つ以上又は全てを含んでもよい。詳細には、2つ以上のβ−グルコシダーゼ配列のうち1つ目の配列は、少なくともアミノ酸残基約200個分の長さであり、配列番号197〜202のアミノ酸配列モチーフのうち少なくとも2つ(例えば、少なくとも2、3、4、又は全て)を含み、かつ2つ以上のβ−グルコシダーゼ配列のうち2つ目の配列は、少なくともアミノ酸残基約50個分の長さであり、配列番号203を含む。第1のβ−グルコシダーゼ配列のC末端は、第2のβ−グルコシダーゼ配列のN末端に連結されてもよい。他の実施形態では、第1の及び第2のβ−グルコシダーゼ配列は、リンカー配列を介して連結される。リンカー配列にはアミノ酸残基約3、4、5、6、7、8、9、10、又は11個分の長さのループ配列を含ませることができ、このループ配列は、第3のβ−グルコシダーゼポリペプチドに由来し、アミノ酸配列FDRRSPG(配列番号204)又はFD(R/K)YNIT(配列番号205)を含む。
特定の態様では、本開示は、β−グルコシダーゼの単離、合成、組み換えポリペプチドをコードしているヌクレオチドを提供し、このポリペプチドは、少なくとも2種(例えば、2、3、又は更には4種)のβ−グルコシダーゼ配列のハイッブリッド体であり、少なくとも2種のβ−グルコシダーゼ配列のうちの第1の配列は、少なくともアミノ酸残基約200個分(例えば、少なくとも約200、250、300、350、又は400個分)の長さであり、かつ配列番号54、56、58、62、64、66、68、70、72、74、76、78、及び79のうちのいずれか1つの相当する長さの配列と少なくとも約60%(例えば、少なくとも約65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%)同一性を有する配列を含み、それに対し少なくとも2種のβ−グルコシダーゼ配列のうちの第2の配列は、少なくともアミノ酸残基約50個分(例えば、少なくとも約50、75、100、125、150、又は200個分)の長さであり、かつ配列番号60の相当する長さの配列と少なくとも約60%(例えば、少なくとも約65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%)同一性を有する配列を含む。代替的な実施形態では、本開示は、β−グルコシダーゼポリペプチドをコードしている単離、合成、又は組み換えヌクレオチドを提供し、このヌクレオチドは、少なくとも2種(例えば、2、3、又は更には4種)のβ−グルコシダーゼ配列のハイブリッドであり、少なくとも2種のβ−グルコシダーゼ配列のうちの第1の配列は、少なくともアミノ酸残基約200個分(例えば、少なくとも約200、250、300、350、又は400個分)の長さであり、かつ配列番号60の相当する長さの配列と少なくとも約60%(例えば、少なくとも約65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%)同一性を有する配列を含み、それに対し少なくとも2種のβ−グルコシダーゼ配列のうちの第2の配列は、少なくともアミノ酸残基約50個分(例えば、少なくとも約50、75、100、125、150、又は200個分)の長さであり、かつ配列番号54、56、58、62、64、66、68、70、72、74、76、78、及び79のうちのいずれか1つの相当する長さの配列と少なくとも約60%(例えば、少なくとも約65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%)同一性を有する配列を含む。特定の実施形態では、ヌクレオチドは、β−グルコシダーゼ活性を有する融合/キメラβ−グルコシダーゼポリペプチドをコードする。詳細には、2つ以上のβ−グルコシダーゼ配列のうち1つ目の配列は、少なくともアミノ酸残基約200個分の長さであり、配列番号197〜202のアミノ酸配列モチーフのうち少なくとも2つ(例えば、少なくとも2、3、4、又は全て)を含み、かつ2つ以上のβ−グルコシダーゼ配列のうち2つ目の配列は、少なくともアミノ酸残基約50個分の長さであり、配列番号203を含む。一部の実施形態では、ヌクレオチドは第1のアミノ酸配列をコードし、この第1のアミノ酸配列は、β−グルコシダーゼのキメラ/融合ポリペプチドのN端末に位置する。一部の実施形態では、ヌクレオチドは第2のアミノ酸配列をコードし、この第1のアミノ酸配列は、β−グルコシダーゼのキメラ/融合ポリペプチドのC端末に位置する。第1のアミノ酸配列のC末端は、第2のアミノ酸配列のN末端に連結されてもよい。他の実施形態では、第1のアミノ酸配列は第2のアミノ酸配列の直後に隣接しておらず、第1の配列はリンカードメインを介して第2の配列に連結されている。一部の実施形態では、第1のアミノ酸配列、第2のアミノ酸配列又はリンカードメインは、ループ配列を含むアミノ酸配列又はループ様の構造を示す配列を含む。特定の実施形態では、ループ配列は第3のβ−グルコシダーゼポリペプチドに由来し、アミノ酸残基約3、4、5、6、7、8、9、10、又は11個分の長さであり、アミノ酸配列FDRRSPG(配列番号204)、又はFD(R/K)YNIT(配列番号205)を含む。
一部の態様では、本開示は、配列番号52、55、57、59、61、63、65、67、69、71、73、75、77、92、又は94のうちのいずれか1つの配列と、あるいは配列番号53、55、57、59、61、63、65、67、69、71、73、75、77、92、又は94のうちのいずれか1つの配列の少なくとも約300残基(例えば、少なくとも約300、400、500、又は600残基)の長さの断片と、少なくとも60%(例えば、少なくとも約60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%)配列同一性を有する単離、合成、又は組み換えヌクレオチドを提供する。特定の実施形態では、本開示は、厳密度の低い条件下、厳密度の中程度の条件下、厳密度の高い条件下、厳密度の非常に高い条件下で、配列番号53、55、57、59、61、63、65、67、69、71、73、75、77、92又は94のいずれか1つの配列、これらの少なくとも約300残基分の長さの断片、あるいはこれらの相補鎖とハイブリッド形成し得る単離、合成、又は組み換えヌクレオチドを提供する。
一部の態様では、本開示は、配列番号52、80〜81、206〜207のうちのいずれか1つの配列と少なくとも約10残基(例えば、少なくとも約10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、225、250、275、300残基)にわたって、又は触媒ドメイン(CD)の全長にわたって、又は糖結合ドメイン(CBM)の全長にわたって、少なくとも約60%(例えば、少なくとも約60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%)配列同一性を有するアミノ酸配列を含むポリペプチドをコードしている、単離、合成、又は組み換えヌクレオチドを提供する。特定の実施形態では、単離、合成、又は組み換えヌクレオチドは、GH61/エンドグルカナーゼ活性を有するポリペプチドをコードする。一部の実施形態では、本開示は、少なくともアミノ酸残基約50個分(例えば、少なくとも約50、100、150、200、250、又は300個分)の長さであり、(1)配列番号84及び88;(2)配列番号85及び88;(3)配列番号86;(4)配列番号87;(5)配列番号84、88及び89;(6)配列番号85、88、及び89;(7)配列番号84、88、及び90;(8)配列番号85、88及び90;(9)配列番号84、88及び91;(10)配列番号85、88及び91;(11)配列番号84、88、89及び91;(12)配列番号84、88、90及び91;(13)配列番号85、88、89及び91:並びに(14)配列番号85、88、90及び91からなる群から選択される配列モチーフのうちの1種以上を含むポリペプチドをコードしている単離、合成又は組み換えヌクレオチドを提供する。特定の実施形態では、ポリヌクレオチドは、配列番号52に対して少なくとも約60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%配列同一性を有するポリペプチドをコードしているポリヌクレオチドである。一部の実施形態では、ポリヌクレオチドは、GH61エンドグルカナーゼポリペプチドをコードする(例えば、限定するものではないが、T.リーゼイ(T. reesei)Eg4などの、好適な生物に由来するEG IV型ポリペプチド)。
一部の態様では、本開示は、配列番号2、4、6、8、10、12、14、16、18、20、22、24、26、28、30、32、34、36、38、40、42、43、及び45の配列のうちのいずれか1つと、少なくとも約10残基、例えば、少なくとも約15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、225、250、275、300、325、若しくは350残基の領域にわたって、又は未熟なポリペプチド、成熟ポリペプチド、触媒ドメイン(CD)若しくは糖結合ドメイン(CBM)の全長にわたって、少なくとも約70%(例えば、少なくとも約71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%、又は完全に(100%))配列同一性を有するポリペプチドをコードしている、単離、合成、又は組み換えポリヌクレオチドを提供する。一部の態様では、本開示は、配列番号1、3、5、7、9、11、13、15、17、19、21、23、25、27、29、31、33、35、37、39、及び41のうちのいずれか1つの配列、又はこれらの断片と、少なくとも約70%(例えば、少なくとも約71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%、又は完全に(100%))配列同一性を有する単離、合成、又は組み換えポリヌクレオチドを提供する。例えば、この断片は、少なくとも約10、20、30、40、50、60、70、80、90、100残基の長さであってよい。一部の実施形態では、本開示は、厳密度の低い条件下、厳密度の中程度の条件下、厳密度の高い条件下、又は厳密度の非常に高い条件下で、配列番号1、3、5、7、9、11、13、15、17、19、21、23、25、27、29、31、33、35、37、39、及び41のいずれか1つの配列、又はこれらの断片若しくは下位配列とハイブリッド形成する単離、合成、又は組み換えポリヌクレオチドを提供する。
したがって、本開示は、特に、Fv3A、Pf43A、Fv43E、Fv39A、Fv43A、Fv43B、Pa51A、Gz43A、Fo43A、Af43A、Pf51A、AfuXyn2、AfuXyn5、Fv43D、Pf43B、Fv43B、Fv51A、T.リーゼイ(T. reesei)Xyn3、T.リーゼイ(T. reesei)Xyn2、T.リーゼイ(T. reesei)Bxl1、T.リーゼイ(T. reesei)Eg4、Pa3D、Fv3G、Fv3D、Fv3C、Tr3A、Tr3B、Te3A、An3A、Fo3A、Gz3A、Nh3A、Vd3A、Pa3G、又はTn3Bポリペプチド(これらの変異体(variant)、変異体(mutant)、又は融合/キメラ体を含む)をコードしている核酸を提供する。本開示は、Fv3Cの一部及びTr3Bの一部を含むキメラ又は融合酵素をコードしている核酸を更に提供する。一部の実施形態では、キメラ又は融合ポリペプチドには、更にリンカードメインを含ませることができ、このリンカードメインは、Te3Aに由来する少なくともアミノ酸残基約3、4、5、6、7、8、9、10、又は11個からなるループ配列を含む。例えば、本開示は、配列番号92又は94と少なくとも約60%同一性を有する単離ヌクレオチドを提供する。
例えば、本開示は、単離核酸分子を提供し、本核酸分子は、
(1)(i)配列番号2の24〜766;(ii)配列番号2の73〜321;(iii)配列番号2の73〜394;(iv)配列番号2の395〜622;(v)配列番号2の24〜622;又は(iv)配列番号2の73〜622;の位置に相当するアミノ酸配列に対し少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%配列同一性を有するアミノ酸配列を含み、好ましくはβ−キシロシダーゼ活性を有する、ポリペプチド;又は
(2)(i)配列番号4の21〜445;(ii)配列番号4の21〜301;(iii)配列番号4の21〜323;(iv)配列番号4の21〜444;(v)配列番号4の302〜444;(vi)配列番号4の302〜445;(vii)配列番号4の324〜444;又は(viii)配列番号4の324〜445;の位置に相当するアミノ酸配列に対し少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%配列同一性を有するアミノ酸配列を含み、好ましくはβ−キシロシダーゼ活性を有する、ポリペプチド;又は
(3)(i)配列番号6の19〜530;(ii)配列番号6の29〜530;(iii)配列番号6の19〜300;又は(iv)配列番号6の29〜300;の位置に相当するアミノ酸配列に対し少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%配列同一性を有するアミノ酸配列を含み、好ましくはβ−キシロシダーゼ活性を有する、ポリペプチド;又は
(4)(i)配列番号8の20〜439;(ii)配列番号8の20〜291;(iii)配列番号8の145〜291;又は(iv)配列番号8の145〜439;の位置に相当するアミノ酸配列に対し、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%配列同一性を有するアミノ酸配列を含み、好ましくはβ−キシロシダーゼ活性を有する、ポリペプチド;又は
(5)(i)配列番号10の23〜449;(ii)配列番号10の23〜302;(iii)配列番号10の23〜320;(iv)配列番号10の23〜448;(v)配列番号10の303〜448;(vi)配列番号10の303〜449;(vii)配列番号10の321〜448;又は(viii)配列番号10の321〜449;の位置に相当するアミノ酸配列に対し、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%配列同一性を有するアミノ酸配列を含み、好ましくはβ−キシロシダーゼ活性を有する、ポリペプチド;又は
(6)(i)配列番号12の17〜574;(ii)配列番号12の27〜574;(iii)配列番号12の17〜303;又は(iv)配列番号12の27〜303;の位置に相当するアミノ酸配列に対し、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%配列同一性を有するアミノ酸配列を含み、好ましくはβ−キシロシダーゼ活性及びL−α−アラビノフラノシダーゼ活性を両方有する、ポリペプチド;又は
(7)(i)配列番号14の21〜676;(ii)配列番号14の21〜652;(iii)配列番号14の469〜652;又は(iv)配列番号14の469〜676;の位置に相当するアミノ酸配列に対し、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%配列同一性を有するアミノ酸配列を含み、好ましくはβ−キシロシダーゼ活性及びL−α−アラビノフラノシダーゼ活性を有するポリペプチド;又は
(8)(i)配列番号16の19〜340;(ii)配列番号16の53〜340;(iii)配列番号16の19〜383;又は(iv)配列番号16の53〜383;の位置に相当するアミノ酸配列に対し少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%配列同一性を有するアミノ酸配列を含み、好ましくはβ−キシロシダーゼ活性を有する、ポリペプチド;又は
(9)(i)配列番号18の21〜341;(ii)配列番号18の107〜341;(iii)配列番号18の21〜348;又は(iv)配列番号18の107〜348;の位置に相当するアミノ酸配列に対し少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%配列同一性を有するアミノ酸配列を含み、好ましくはβ−キシロシダーゼ活性を有する、ポリペプチド;又は
(10)(i)配列番号20の15〜558;又は(ii)配列番号20の15〜295;の位置に相当するアミノ酸配列に対し、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%配列同一性を有するアミノ酸配列を含み、好ましくはL−α−アラビノフラノシダーゼ活性を有する、ポリペプチド;又は
(11)(i)配列番号22の21〜632;(ii)配列番号22の461〜632;(iii)配列番号22の21〜642;又は(iv)配列番号22の461〜642;の位置に相当するアミノ酸配列に対し、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%配列同一性を有するアミノ酸配列を含み、好ましくはL−α−アラビノフラノシダーゼ活性を有する、ポリペプチド;又は
(12)(i)配列番号28の20〜341;(ii)配列番号28の21〜350;(iii)配列番号28の107〜341;又は(iv)配列番号28の107〜350;の位置に相当するアミノ酸配列に対し、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%配列同一性を有するアミノ酸配列を含み、β−キシロシダーゼ活性を有する、ポリペプチド;又は、
(13)(i)配列番号32の21〜660;(ii)配列番号32の21〜645;(iii)配列番号32の450〜645;又は(iv)配列番号32の450〜660;の位置に相当するアミノ酸配列に対し、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%配列同一性を有するアミノ酸配列を含み、好ましくはL−α−アラビノフラノシダーゼ活性を有する、ポリペプチド;又は
(14)配列番号52のアミノ酸配列に対し、又は配列番号52の残基(i)22〜255、(ii)22〜343、(iii)307〜343、(iv)307〜344、若しくは(v)22〜344;に対し、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%配列同一性を有するアミノ酸配列を含み、好ましくはGH61/エンドグルカナーゼ活性を有する、ポリペプチド;又は
(15)配列番号54のアミノ酸配列に対し、又は配列番号54の残基(i)18〜282、(ii)18〜601、(iii)18〜733、(iv)356〜601、若しくは(v)356〜733;に対し、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%配列同一性を有するアミノ酸配列を含み、好ましくはβ−グルコシダーゼ活性を有する、ポリペプチド;又は
(16)配列番号56のアミノ酸配列に対し、又は配列番号56の残基(i)22〜292、(ii)22〜629、(iii)22〜780、(iv)373〜629、若しくは(v)373〜780;に対し、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%配列同一性を有するアミノ酸配列を含み、好ましくはβ−グルコシダーゼ活性を有する、ポリペプチド;又は
(17)配列番号58のアミノ酸配列に対し、又は配列番号58の残基(i)20〜321、(ii)20〜651、(iii)20〜811、(iv)423〜651、若しくは(v)423〜811;に対し、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%配列同一性を有するアミノ酸配列を含み、好ましくはβ−グルコシダーゼ活性を有する、ポリペプチド;又は
(18)配列番号60のアミノ酸配列に対し、又は配列番号60の残基(i)20〜327、(ii)22〜600、(iii)20〜899、(iv)428〜899、若しくは(v)428〜660;に対し、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%配列同一性を有するアミノ酸配列を含み、好ましくはβ−グルコシダーゼ活性を有する、ポリペプチド;又は
(19)配列番号62のアミノ酸配列に対し、又は配列番号62の残基(i)20〜287、(ii)22〜611、(iii)20〜744、(iv)362〜611、若しくは(v)362〜744;に対し、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%配列同一性を有するアミノ酸配列を含み、好ましくはβ−グルコシダーゼ活性を有する、ポリペプチド;又は
(20)配列番号64のアミノ酸配列に対し、又は配列番号64の残基(i)19〜307、(ii)19〜640、(iii)19〜874、(iv)407〜640、若しくは(v)407〜874;に対し、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%配列同一性を有するアミノ酸配列を含み、好ましくはβ−グルコシダーゼ活性を有する、ポリペプチド;又は
(21)配列番号66のアミノ酸配列に対し、又は配列番号66の残基(i)20〜297、(ii)20〜629、(iii)20〜857、(iv)396〜629、若しくは(v)396〜857に対し、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%配列同一性を有するアミノ酸配列を含み、好ましくはβ−グルコシダーゼ活性を有する、ポリペプチド;又は
(22)配列番号68のアミノ酸配列に対し、又は配列番号68の残基(i)20〜300、(ii)20〜634、(iii)20〜860、(iv)400〜634、若しくは(v)400〜860に対し、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%配列同一性を有するアミノ酸配列を含み、好ましくはβ−グルコシダーゼ活性を有する、ポリペプチド;又は
(23)配列番号70のアミノ酸配列に対し、又は配列番号70の残基(i)20〜327、(ii)20〜660、(iii)20〜899、(iv)428〜660、若しくは(v)428〜899;に対し、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%配列同一性を有するアミノ酸配列を含み、好ましくはβ−グルコシダーゼ活性を有する、ポリペプチド;又は
(24)配列番号72のアミノ酸配列に対し、又は配列番号72の残基(i)19〜314、(ii)19〜647、(iii)19〜886、(iv)415〜647、若しくは(v)415〜886;に対し、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%配列同一性を有するアミノ酸配列を含み、好ましくはβ−グルコシダーゼ活性を有する、ポリペプチド;又は
(25)配列番号74のアミノ酸配列に対し、又は配列番号74の残基(i)20〜295、(ii)20〜647、(iii)20〜880、(iv)414〜647、若しくは(v)414〜880;に対し、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%配列同一性を有するアミノ酸配列を含み、好ましくはβ−グルコシダーゼ活性を有する、ポリペプチド;又は
(26)配列番号76のアミノ酸配列に対し、又は配列番号76の(i)19〜296、(ii)19〜649、(iii)19〜890、(iv)415〜649、若しくは(v)415〜890の残基;に対し、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%配列同一性を有するアミノ酸配列を含み、好ましくはβ−グルコシダーゼ活性を有する、ポリペプチド;又は
(27)配列番号78のアミノ酸配列に対し、又は配列番号78の残基(i)20〜354、(ii)20〜660、(iii)20〜805、(iv)449〜660、又は(v)449〜805;に対し、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%配列同一性を有するアミノ酸配列を含み、好ましくはβ−グルコシダーゼ活性を有する、ポリペプチド;又は
(28)配列番号79のアミノ酸配列に対し、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、又は100%配列同一性を有するアミノ酸配列を含み、好ましくはβ−グルコシダーゼ活性を有する、ポリペプチド;又は
(29)少なくとも約100残基(例えば、少なくとも約150、175、200、225、又は250残基)の長さであり、(1)配列番号84、及び88;(2)配列番号85、及び88;(3)配列番号86;(4)配列番号87;(5)配列番号84、88、及び89;(6)配列番号85、88、及び89;(7)配列番号84、88、及び90;(8)配列番号85、88、及び90;(9)配列番号84、88、及び91;(10)配列番号85、88、及び91;(11)配列番号84、88、89、及び91;(12)配列番号84、88、90、及び91;(13)配列番号85、88、89、及び91:及び(14)配列番号85、88、90、及び91;からなる群から選択される配列モチーフを1つ以上含み、好ましくはGH61/エンドグルカナーゼ活性を有する、ポリペプチド;又は
(30)少なくとも2種以上のβ−グルコシダーゼ配列を含むポリペプチドであって、第1のβ−グルコシダーゼ配列は少なくとも約200残基分(例えば、少なくとも約200、220、240、260、280、300、320、340、360、380、又は400残基分)の長さであり、かつ配列番号96〜108のうちの1つ以上又は全てを含むのに対し、第2のβ−グルコシダーゼ配列は少なくとも約50残基分(例えば、少なくとも約55、60、65、70、75、80、85、90、95、100、120、140、160、180、200残基分)の長さであり、かつ配列番号109〜116のうちの1つ以上又は全てを含み、同様に場合により第3のβ−グルコシダーゼ配列、すなわちアミノ酸残基約3、4、5、6、7、8、9、10、又は11個分の長さであり、配列番号66のループ配列に由来する第3のβ−グルコシダーゼ配列を含み、好ましくはβ−グルコシダーゼ活性を有する、ポリペプチド;を提供する。
本開示は:
(1)配列番号1と少なくとも80%(例えば、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%以上)配列同一性を有する核酸、すなわち厳密度の高い条件下で、配列番号1又はその断片の相補鎖とハイブリッド形成することのできる核酸;又は
(2)配列番号3と少なくとも80%(例えば、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%以上)配列同一性を有する核酸、すなわち厳密度の高い条件下で、配列番号3又はその断片の相補鎖とハイブリッド形成することのできる核酸;又は
(3)配列番号5と少なくとも80%(例えば、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%種以上)配列同一性を有する核酸、すなわち厳密度の高い条件下で、配列番号5又はその断片の相補鎖とハイブリッド形成することのできる核酸;又は
(4)配列番号7と少なくとも80%(例えば、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%以上)配列同一性を有する核酸、すなわち厳密度の高い条件下で、配列番号7又はその断片の相補鎖とハイブリッド形成することのできる核酸;又は
(5)配列番号9と少なくとも80%(例えば、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%以上)配列同一性を有する核酸、すなわち厳密度の高い条件下で、配列番号9又はその断片の相補鎖とハイブリッド形成することのできる核酸;又は
(6)配列番号11と少なくとも80%(例えば、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%以上)配列同一性を有する核酸、すなわち厳密度の高い条件下で、配列番号11又はその断片の相補鎖とハイブリッド形成することのできる核酸;又は
(7)配列番号13と少なくとも80%(例えば、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%以上)配列同一性を有する核酸、すなわち厳密度の高い条件下で、配列番号13又はその断片の相補鎖とハイブリッド形成することのできる核酸;又は
(8)配列番号15と少なくとも80%(例えば、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%以上)配列同一性を有する核酸、すなわち厳密度の高い条件下で、配列番号15又はその断片の相補鎖とハイブリッド形成することのできる核酸;又は
(9)配列番号17と少なくとも80%(例えば、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%以上)配列同一性を有する核酸、すなわち厳密度の高い条件下で、配列番号17又はその断片の相補鎖とハイブリッド形成することのできる核酸;又は
(10)配列番号19と少なくとも80%(例えば、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%以上)配列同一性を有する核酸、すなわち厳密度の高い条件下で、配列番号19又はその断片の相補鎖とハイブリッド形成することのできる核酸;又は
(11)配列番号21と少なくとも80%(例えば、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%以上)配列同一性を有する核酸、すなわち厳密度の高い条件下で、配列番号21又はその断片の相補鎖とハイブリッド形成することのできる核酸;又は
(12)配列番号27と少なくとも80%(例えば、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%以上)配列同一性を有する核酸、すなわち厳密度の高い条件下で、配列番号27又はその断片の相補鎖とハイブリッド形成することのできる核酸;又は
(13)配列番号31と少なくとも80%(例えば、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%以上)配列同一性を有する核酸、すなわち厳密度の高い条件下で、配列番号31又はその断片の相補鎖とハイブリッド形成することのできる核酸;又は
(14)配列番号51と少なくとも80%(例えば、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%以上)配列同一性を有する核酸、すなわち厳密度の高い条件下で、配列番号51又はその断片の相補鎖とハイブリッド形成することのできる核酸;又は
(15)配列番号53と少なくとも80%(例えば、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%以上)配列同一性を有する核酸、すなわち厳密度の高い条件下で、配列番号53又はその断片の相補鎖とハイブリッド形成することのできる核酸;又は
(16)配列番号55と少なくとも80%(例えば、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%以上)配列同一性を有する核酸、すなわち厳密度の高い条件下で、配列番号55又はその断片の相補鎖とハイブリッド形成することのできる核酸;又は
(17)配列番号57と少なくとも80%(例えば、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%以上)配列同一性を有する核酸、すなわち厳密度の高い条件下で、配列番号57又はその断片の相補鎖とハイブリッド形成することのできる核酸;又は
(18)配列番号59と少なくとも80%(例えば、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%以上)配列同一性を有する核酸、すなわち厳密度の高い条件下で、配列番号59又はその断片の相補鎖とハイブリッド形成することのできる核酸;又は
(19)配列番号61と少なくとも80%(例えば、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%以上)配列同一性を有する核酸、すなわち厳密度の高い条件下で、配列番号61又はその断片の相補鎖とハイブリッド形成することのできる核酸;又は
(20)配列番号63と少なくとも80%(例えば、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%以上)配列同一性を有する核酸、すなわち厳密度の高い条件下で、配列番号63又はその断片の相補鎖とハイブリッド形成することのできる核酸;又は
(21)配列番号65と少なくとも80%(例えば、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%以上)配列同一性を有する核酸、すなわち厳密度の高い条件下で、配列番号65又はその断片の相補鎖とハイブリッド形成することのできる核酸;又は
(22)配列番号67と少なくとも80%(例えば、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%以上)配列同一性を有する核酸、すなわち厳密度の高い条件下で、配列番号67又はその断片の相補鎖とハイブリッド形成することのできる核酸;又は
(23)配列番号69と少なくとも80%(例えば、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%以上)配列同一性を有する核酸、すなわち厳密度の高い条件下で、配列番号69又はその断片の相補鎖とハイブリッド形成することのできる核酸;又は
(24)配列番号71と少なくとも80%(例えば、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%以上)配列同一性を有する核酸、すなわち厳密度の高い条件下で、配列番号71又はその断片の相補鎖とハイブリッド形成することのできる核酸;又は
(25)配列番号73と少なくとも80%(例えば、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%以上)配列同一性を有する核酸、すなわち厳密度の高い条件下で、配列番号73又はその断片の相補鎖とハイブリッド形成することのできる核酸;又は
(26)配列番号75と少なくとも80%(例えば、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%以上)配列同一性を有する核酸、すなわち厳密度の高い条件下で、配列番号75又はその断片の相補鎖とハイブリッド形成することのできる核酸;又は
(27)配列番号77と少なくとも80%(例えば、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%以上)配列同一性を有する核酸、すなわち厳密度の高い条件下で、配列番号77又はその断片の相補鎖とハイブリッド形成することのできる核酸;又は
(28)配列番号92と少なくとも80%(例えば、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%以上)配列同一性を有する核酸、すなわち厳密度の高い条件下で、配列番号92又はその断片の相補鎖とハイブリッド形成することのできる核酸;又は
(29)配列番号94と少なくとも80%(例えば、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%以上)配列同一性を有する核酸、すなわち厳密度の高い条件下で、配列番号94又はその断片の相補鎖とハイブリッド形成することのできる核酸;も提供する。
本開示は、上記の核酸を含む、発現カセット及び/又はベクターも提供する。好適には、本開示の酵素をコードしている核酸は、操作可能にプロモーターに連結される。特に、糸状菌宿主に組み換え体を発現させることが望ましい場合、プロモーターは糸状菌のプロモーターであってよい。核酸は、異種プロモーターの調節下のものであってよい。核酸は、常時発現型又は誘導型プロモーターの調節下で発現させることもできる。使用することができるプロモーターの例としては、限定するものではないが、セルラーゼのプロモーター、キシラナーゼのプロモーター、1818プロモーター(これまでに、ESTマッピングしたトリコデルマ(Trichoderma)により高発現されるタンパク質として同定されている)が挙げられる。例えば、プロモーターは、セロビオヒドロラーゼ、エンドグルカナーゼ、又はβ−グルコシダーゼのプロモーターであってよい。特に好適なプロモーターは、例えば、T.リーゼイ(T. reesei)のセロビオヒドロラーゼ、エンドグルカナーゼ、又はβ−グルコシダーゼのプロモーターである場合がある。例えば、プロモーターは、セロビオヒドロラーゼI(cbh1)プロモーターである。プロモーターの非限定例としては、cbh1、cbh2、egl1、egl2、egl3、egl4、egl5、pki1、gpd1、xyn1、又はxyn2プロモーターが挙げられる。その他のプロモーターの非限定例としては、T.リーゼイ(T. reesei)cbh1、cbh2、egl1、egl2、egl3、egl4、egl5、pki1、gpd1、xyn1、又はxyn2プロモーターが挙げられる。
本明細書で使用するとき、用語「操作可能に連結された」は、選択されたDNAの発現をプロモーターにより制御するために、選択したヌクレオチド配列(例えば、本明細書に記載のポリペプチドをコードしている)をプロモーターに近接させていることを意味する。加えて、プロモーターは、転写及び翻訳の方向の観点から、選択されたヌクレオチド配列の上流に位置する。ヌクレオチド配列と調節配列は、適切な分子(例えば、転写活性化因子)が調節配列に結合したときに遺伝子が発現されるよう、連結される。
本開示は、本開示の1つ以上の酵素を発現するよう遺伝子操作された宿主細胞を提供する。好適な宿主細胞としては、任意の微生物(例えば、バクテリア細胞、原生生物、藻類、真菌(例えば、酵母又は糸状菌)、又はその他の微生物)が挙げられ、好ましくは宿主細胞はバクテリア細胞、酵母細胞、又は糸状菌細胞である。
好適な細菌属宿主細胞としては、限定するものではないが、大腸菌(Escherichia)、バチルス(Bacillus)、ラクトバチルス(LactoBacillus)、シュードモナス(Pseudomonas)、及びストレプトマイセス(Streptomyces)が挙げられる。好適なバクテリア種の細胞としては、限定するものではないが、大腸菌(E. coli)、枯草菌(B. subtilis)、B.リケニフォルミス(B. licheniformis)、L.ブレビス(L. brevis)、P.アエルギノサ(P. aeruginosa)、及びS.リビダンス(S. lividans)が挙げられる。
酵母族の好適な宿主細胞としては、限定するものではないが、サッカロマイセス(Saccharomyces)、シゾサッカロマイセス(Schizosaccharomyces)、カンジダ(Candida)、ハンゼヌラ(Hansenula)、ピキア(Pichia)、クリヴェロミセス(Kluyveromyces)、及びファフィナ(Phaffia)細胞が挙げられる。好適な酵母種細胞としては、限定するものではないが、サッカロマイセス・セレヴィシエ(Saccharomyces cerevisiae)、シゾサッカロマイセス・ポンベ(Schizosaccharomyces pombe)、カンジダ・アルビカンス(Candida albicans)、ハンセヌラ・ポリモルファ(Hansenula polymorpha)、ピキア・パストリス(Pichia pastoris)、P.カナデンシス(P. canadensis)、クリヴェロマイセス・マルキシアヌス(Kluyveromyces marxianus)及びファフィア・ロードザイマ(Phaffia rhodozyma)細胞が挙げられる。
好適な糸状菌宿主細胞としては、エウミコチニア(Eumycotina)亜門の全ての糸状菌が挙げられる。好適な糸状菌属の細胞としては、例えば、アクレモニウム(Acremonium)、アスペルギルス(Aspergillus)、アウレオバシディウム(Aureobasidium)、ブジェルカンデラ(Bjerkandera)、セリポリオプシス(Ceriporiopsis)、クリソポリウム(Chrysoporium)、コプリナス(Coprinus)、コリオラス(Coriolus)、コリナスカス(Corynascus)、ケトミウム(Chaertomium)、クリプトコッカス(Cryptococcus)、フィロバシジウム(Filobasidium)、フザリウム(Fusarium)、ジベレラ(Gibberella)、ヒュミコラ(Humicola)、マグナポルテ(Magnaporthe)、ムコール(Mucor)、マイセリオフトラ(Myceliophthora)、ムコール(Mucor)、ネオカリマスティクス(Neocallimastix)、ニューロスポラ(Neurospora)、パエシロマイセス(Paecilomyces)、ペニシリウム(Penicillium)、ファネロカエテ(Phanerochaete)、フレビア(Phlebia)、ピロマイセス(Piromyces)、プレウロタス(Pleurotus)、スキタリジウム(Scytaldium)、シゾフィラム(Schizophyllum)、スポロトリカム(Sporotrichum)、タラロマイセス(Talaromyces)、サーモアスカス(Thermoascus)、チエラビア(Thielavia)、トリポクラジウム(Tolypocladium)、トラメテス(Trametes)、及びトリコデルマ(Trichoderma)細胞が挙げられる。
好適な糸状菌種細胞としては、限定するものではないが、アワモリコウジカビ(Aspergillus awamori)、アスペルギルス・フミガーツス(Aspergillus fumigatus)、アスペルギルス・フォエチダス(Aspergillus foetidus)、アスペルギルス・ジャポニカス(Aspergillus japonicus)、アスペルギルス・ニデュランス(Aspergillus nidulans)、アスペルギルス・ニガー(Aspergillus niger)、こうじ菌(Aspergillus oryzae)、クリソスポリウム・ラックノウエンス(Chrysosporium lucknowense)、フザリウム・バクトリジオイドス(Fusarium bactridioides)、フザリウム・セレアリス(Fusarium cerealis)、フザリウム・クルックウェレンス(Fusarium crookwellense)、フザリウム・クルモラム(Fusarium culmorum)、フザリウム・グラミネアラム(Fusarium graminearum)、フザリウム・グラミナム(Fusarium graminum)、フザリウム・ヘテロスポラム(Fusarium heterosporum)、フザリウム・ネグンジ(Fusarium negundi)、フザリウム・オキシスポラム(Fusarium oxysporum)、フザリウム・レティクラタム(Fusarium reticulatum)、フザリウム・ロゼウム(Fusarium roseum)、フザリウム・サンブキナム(Fusarium sambucinum)、フザリウム・サルコクロウム(Fusarium sarcochroum)、フザリウム・スポロトリキオイド(Fusarium sporotrichioides)、フザリウム・サルフレウム(Fusarium sulphureum)、フザリウム・トルロサム(Fusarium torulosum)、フザリウム・トルコテキオイド(Fusarium trichothecioides)、フザリウム・ベネナタム(Fusarium venenatum)、ブジャカンデラ・アダスタ(Bjerkandera adusta)、セリポリオシス・アネイリナ(Ceriporiopsis aneirina)、セリポリオシス・アネイリナ(Ceriporiopsis aneirina)、セリポリオシス・カレジエア(Ceriporiopsis caregiea)、セリポリオシス・ギルベッセンス(Ceriporiopsis gilvescens)、セリポリオシス・パンノキンタ(Ceriporiopsis pannocinta)、セリポリオシス・リブロサ(Ceriporiopsis rivulosa)、セリポリオシス・サブルファ(Ceriporiopsis subrufa)、セリポリオシス・サブバーミスポラ(Ceriporiopsis subvermispora)、コプリナス・キネレウス(Coprinus cinereus)、コリオラス・ハースタス(Coriolus hirsutus)、ヒュミコラ・インソレンス(Humicola insolens)、ヒュミコラ・ラヌギノーサ(Humicola lanuginosa)、ムコール・ミエヘイ(Mucor miehei)、マイセリオフトラ・サーモフィラ(Myceliophthora thermophila)、ニューロスポラ・クラッサ(Neurospora crassa)、ニューロスポラ・インターメディア(Neurospora intermedia)、ペニシリウム・パープロゲナム(Penicillium purpurogenum)、ペニシリウム・カネッセンス(Penicillium canescens)、ペニシリウム・ソルタム(Penicillium solitum)、ペニシリウム・フニクロサム(Penicillium funiculosum)、白色腐朽菌(Phanerochaete chrysosporium)、フレビア・ラジエート(Phlebia radiate)、エリンギ(Pleurotus eryngii)、タラロマイセス・フラブス(Talaromyces flavus)、チエラビア・サーモフィラ(Thielavia thermophila)、トラメテス・ビローサ(Trametes villosa)、カワラタケ(Trametes versicolor)、トリコデルマ・ハルジアナム(Trichoderma harzianum)、トリコデルマ・コニンギ(Trichoderma koningii)、トリコデルマ・ロンギブラキアタム(Trichoderma longibrachiatum)、トリコデルマ・リーゼイ(Trichoderma reesei)、又はトリコデルマ・ビリデ(Trichoderma viride)細胞が挙げられる。
本開示は、第1態様では、更に、(1)キシラナーゼ活性を有する第1のポリペプチド、(2)キシロシダーゼ活性を有する第2のポリペプチド、(3)アラビノフラノシダーゼ活性を有する第3のポリペプチド、及び(4)β−グルコシダーゼ活性を有する第4のポリペプチド、を発現するよう遺伝子操作された組み換え宿主細胞を提供する。本開示は、第2態様では、更に、(1)キシラナーゼ活性を有する第1のポリペプチド、(2)キシロシダーゼ活性を有する第2のポリペプチド、(3)アラビノフラノシダーゼ活性を有する第3のポリペプチド、及び(4)β−グルコシダーゼに富む全セルラーゼ組成物、を発現するよう遺伝子操作された組み換え宿主細胞を提供する。本開示は、第3態様では、更に、(1)キシラナーゼ活性を有する第1のポリペプチド、(2)キシロシダーゼ活性を有する第2のポリペプチド、(3)アラビノフラノシダーゼ活性を有する第3のポリペプチド;及び(4)GH61/エンドグルカナーゼ活性を有する第4のポリペプチド又はGH61エンドグルカナーゼに富む全セルラーゼ、を発現するよう遺伝子操作された組み換え宿主細胞を提供する。
本開示は、第4態様では、(1)キシロシダーゼ活性を有する第1のポリペプチド、(2)キシロシダーゼ活性を有する第2のポリペプチド(第1のポリペプチドとは異なる)、(3)アラビノフラノシダーゼ活性を有する第3のポリペプチド、及び(4)β−グルコシダーゼ活性を有する第4のポリペプチド、を発現するよう遺伝子操作された組み換え宿主細胞を提供する。本開示は、第5態様では、(1)キシロシダーゼ活性を有する第1のポリペプチド、(2)キシロシダーゼ活性を有する第2のポリペプチド(第1のポリペプチドとは異なる)、(3)アラビノフラノシダーゼ活性を有する第3のポリペプチド、及び(4)β−グルコシダーゼに富む全セルラーゼ、を発現するよう遺伝子操作された組み換え宿主細胞を提供する。本開示は、第6態様では、(1)キシロシダーゼ活性を有する第1のポリペプチド、(2)キシロシダーゼ活性を有する第2のポリペプチド(第1のポリペプチドとは異なる)、(3)アラビノフラノシダーゼ活性を有する第3のポリペプチド;(4)GH61/エンドグルカナーゼ活性を有する第4のポリペプチド、あるいは、EGIVに富む全セルラーゼ、を発現するよう遺伝子操作された宿主細胞を提供する。
本開示は、第7態様では、(1)キシラナーゼ活性を有する第1のポリペプチド、(2)キシロシダーゼ活性を有する第2のポリペプチド、(3)キシロシダーゼ活性を有する第3のポリペプチド(第2のポリペプチドとは異なる)、及び(4)β−グルコシダーゼ活性を有する第4のポリペプチド、を発現するよう遺伝子操作された組み換え宿主細胞を提供する。本開示は、第8態様では、(1)キシラナーゼ活性を有する第1のポリペプチド、(2)キシロシダーゼ活性を有する第2のポリペプチド、(3)キシロシダーゼ活性を有する第3のポリペプチド(第2のポリペプチドとは異なる)、及びβ−グルコシダーゼに富む全セルラーゼ、を発現するよう遺伝子操作された組み換え宿主細胞を提供する。本開示は、第9態様では、(1)キシラナーゼ活性を有する第1のポリペプチド、(2)キシロシダーゼ活性を有する第2のポリペプチド、(3)キシロシダーゼ活性を有する第3のポリペプチド(第2のポリペプチドとは異なる)、及び(4)GH61/エンドグルカナーゼ活性を有する第4のポリペプチド、あるいは、GH61エンドグルカナーゼに富む全セルラーゼ、を発現するよう遺伝子操作された組み換え宿主細胞を提供する。
本開示は、第10態様では、(1)キシラナーゼ活性を有する第1のポリペプチド、(2)キシロシダーゼ活性を有する第2のポリペプチド、及び(3)β−グルコシダーゼ活性を有する第3のポリペプチド、を発現するよう遺伝子操作された組み換え宿主細胞を提供する。本開示は、第11態様では、(1)キシラナーゼ活性を有する第1のポリペプチド、(2)キシロシダーゼ活性を有する第2のポリペプチド、及びβ−グルコシダーゼに富む全セルラーゼ、を発現するよう遺伝子操作された組み換え宿主細胞を提供する。本開示は、第12態様では、(1)キシラナーゼ活性を有する第1のポリペプチド、(2)キシロシダーゼ活性を有する第2のポリペプチド、及び(3)GH61/エンドグルカナーゼ活性を有する第3のポリペプチド、あるいは、GH61エンドグルカナーゼに富む全セルラーゼ、を発現するよう遺伝子操作された組み換え宿主細胞を提供する。
上記第1〜第12態様のうちのいずれかの組み換え宿主細胞では、β−グルコシダーゼ活性を有するポリペプチドは、配列番号54、56、58、60、62、64、66、68、70、72、74、76、78、79、93、及び95のうちのいずれか1つの配列と、少なくとも約10残基(例えば、少なくとも約10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、225、250、275、300残基)の領域にわたって少なくとも約60%(例えば、少なくとも約60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%)配列同一性を有する。特定の実施形態では、β−グルコシダーゼを有するポリペプチドは、2つ以上のβ−グルコシダーゼ配列を含むβ−グルコシダーゼのキメラ/融合ポリペプチドであり、第1のβ−グルコシダーゼに由来する第1の配列は、少なくともアミノ酸残基約200個分の長さであり、配列番号96〜108のアミノ酸配列モチーフのうち1種以上又は全てを含むのに対し、第2のβ−グルコシダーゼに由来する第2の配列は、少なくともアミノ酸残基約50個分の長さであり、配列番号109〜116のアミノ酸配列モチーフのうち1種以上又は全てを含む、融合又はキメラβ−グルコシダーゼポリペプチドであり、及び同様に場合により、第3のβ−グルコシダーゼに由来する、アミノ酸残基3、4、5、6、7、8、9、10、又は11個分の長さである、アミノ酸配列FDRRSPG(配列番号204)又はFD(R/K)YNIT(配列番号205)を有するループ配列をコードしている、第3の配列も含む。詳細には、2つ以上のβ−グルコシダーゼ配列のうち1つ目の配列は、少なくともアミノ酸残基約200個分の長さであり、配列番号197〜202のアミノ酸配列モチーフのうち少なくとも2つ(例えば、少なくとも2、3、4、又は全て)を含み、及び2つ以上のβ−グルコシダーゼ配列のうち2つ目の配列は、少なくともアミノ酸残基約50個分の長さであり、配列番号203を含み、及び同様に場合により第3の配列は、第1又は第2のβ−グルコシダーゼポリペプチドとは異なる第3のβ−グルコシダーゼポリペプチドに由来し、アミノ酸残基約3、4、5、6、7、8、9、10、又は11個分の長さであり、かつアミノ酸配列FDRRSPG(配列番号204)又はFD(R/K)YNIT(配列番号205)を有する。特定の実施形態では、β−グルコシダーゼ活性を有するポリペプチドは、少なくとも200残基長のFv3C(配列番号60)と、例えば、配列番号60のN末端から少なくとも200残基と、少なくとも約60%配列同一性を有する第1の配列、並びに少なくとも50残基長のT.リーゼイ(T. reesei)Bgl3(Tr3B、配列番号64)と、例えば、配列番号64のC末端の残基から少なくとも50残基と、少なくとも約60%配列同一性を有する第2の配列を含む。特定の実施形態では、上記のとおり第1及び第2の配列を含みβ−グルコシダーゼ活性を有するポリペプチドは、更に、相当する長さのTe3A(配列番号66)配列に由来する約3、4、5、6、7、8、9、10、又は11個のアミノ酸残基からなる、すなわち相当する長さのTe3A配列(配列番号66)に由来する、例えば、アミノ酸配列FDRRSPG(配列番号204)又はFD(R/K)YNIT(配列番号205)を有する第3の配列を含む。一部の実施形態では、ポリペプチドは、配列番号93又は95に対して、あるいは配列番号93又は95の少なくとも約20、30、40、50、60、又は70個以上の残基からなる下位配列又は断片に対して少なくとも約60%配列同一性を有する配列を含む。
上記第1〜第12態様のうちのいずれかの組み換え宿主細胞では、組み換え宿主細胞は、GH61/エンドグルカナーゼ活性を有するポリペプチドを発現するよう遺伝子操作されている。一部の実施形態では、GH61/エンドグルカナーゼ活性を有するポリペプチドは、例えば、T.リーゼイ(T. reesei)Eg4ポリペプチドなどのEGIVポリペプチドである。一部の実施形態では、ポリペプチドは、配列番号52、80〜81、206〜207のうちのいずれか1つの配列と、少なくとも約10残基(例えば、少なくとも約10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、225、250、275、300残基)の領域にわたって少なくとも約60%(例えば、少なくとも約60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%)配列同一性を有するものであるか、あるいは(1)配列番号84、及び88;(2)配列番号85、及び88;(3)配列番号86;(4)配列番号87;(5)配列番号84、88、及び89;(6)配列番号85、88、及び89;(7)配列番号84、88、及び90;(8)配列番号85、88、及び90;(9)配列番号84、88、及び91;(10)配列番号85、88、及び91;(11)配列番号84、88、89、及び91;(12)配列番号84、88、90、及び91;(13)配列番号85、88、89、及び91:及び(14)配列番号85、88、90、及び91からなる群から選択される1つ以上の配列モチーフを含むものである。特定の実施形態では、組み換え宿主細胞は、セロビオースデヒドロゲナーゼも発現するよう遺伝子操作することもできる。
上記第1〜第12態様のうちのいずれかの組み換え宿主細胞では、組み換え宿主細胞は、キシロシダーゼ活性を有する、第1群のβ−キシロシダーゼポリペプチドから選択されたポリペプチドを発現するよう、遺伝子操作される。第1群のβ−キシロシダーゼポリペプチドは、配列番号2及び10のいずれか1つに対し、あるいはこれらの成熟配列に対し少なくとも約70%配列同一性を有する。例えば、β−キシロシダーゼ群はFv3A又はFv43Aであってよい。組み換え宿主細胞は、キシロシダーゼ活性を有する、第2群のβ−キシロシダーゼポリペプチドから選択されたポリペプチドを発現するよう、遺伝子操作することもできる。第2群のβ−キシロシダーゼポリペプチドは、配列番号4、6、8、10、12、14、16、18、28、30及び45のいずれか1つの配列に対し、又はこれらの成熟配列に対し少なくとも約70%配列同一性を有する。例えば、第2群のβ−キシロシダーゼは、Pf43A、Fv43E、Fv39A、Fv43B、Pa51A、Gz43A、Fo43A、Fv43D、Pf43B、又はT.リーゼイ(T. reesei)Bxl1であってよい。
上記第1、第2及び第3態様のうちのいずれかの組み換え宿主細胞では、キシラナーゼ活性を有するポリペプチドは、配列番号24、26、42、及び43のいずれか1つの配列に対し、又はこれらの成熟配列に対し少なくとも約70%配列同一性を有する。例えば、キシラナーゼポリペプチドは、AfuXyn2、AfuXyn5、T.リーゼイ(T. reesei)Xyn3、又はT.リーゼイ(T. reesei)Xyn2であってよい。
上記第4、第5及び第6態様のうちのいずれかの組み換え宿主細胞では、宿主細胞は、アラビノフラノシダーゼ活性を有し、配列番号12、14、20、22、及び32のいずれか1つの配列に対し、又はこれらの成熟配列に対し少なくとも約70%配列同一性を有するポリペプチドを発現するよう遺伝子操作することもできる。例えば、第3のポリペプチドは、Fv43B、Pa51A、Af43A、Pf51A、又はFv51Aであってよい。
本開示の組み換え宿主細胞は、例えば、適宜、組み換えT.リーゼイ(T. reesei)などの糸状菌といった、組み換え真菌宿主細胞又は組み換え生物であってよい。例えば、組み換え宿主細胞は好適にはトリコデルマ・リーゼイ(Trichoderma reesei)宿主細胞である。組み換え真菌は、好適には組み換えトリコデルマ・リーゼイ(Trichoderma reesei)である。本開示は、例えば、T.リーゼイ(T. reesei)宿主細胞を提供する。
更に、本開示は、糖化に好適な比で好適な酵素を含む酵素配合物を発現するよう遺伝子操作された組み換え宿主細胞又は組み換え真菌を提供する。組み換え宿主細胞は、例えば、真菌宿主細胞である。組み換え真菌としては、例えば、組み換えトリコデルマ・リーゼイ(Trichoderma reesei)、アスペルギルス・ニガー(Aspergillus niger)若しくはコウジカビ(Aspergillus oryzae)、又はクリソスポリウム・ラックノウエンス(Chrisosporium lucknowence)が挙げられる。組み換え宿主バクテリア細胞はバチルス(Bacillus)であってよい。酵素配合物中に存在する好適な酵素比/量の例については、第5.3.4.節に記載する。
5.3 糖化用酵素組成物
本開示は、リグノセルロース材料を分解することのできる酵素組成物を提供する。本発明の酵素組成物は、典型的には複数種の酵素の配合物であり、本開示の1種以上の酵素又はポリペプチドを含む。本発明の酵素組成物には、微生物、植物、又は生物に由来する1種以上の更なる酵素を好適に含有させ得ることができる。相乗的な酵素の組み合わせ及び関連する方法が想到される。本開示は、各種リグノセルロース系材料を分解するために酵素組成物に含有させる酵素の最適比を特定する方法を包含する。これらの方法としては、例えば、各種リグノセルロース系基質をそれらの構成成分の発酵性糖質へと効率的に変換させるのにあたって、本発明の酵素組成物に含有させる酵素の最適比又は比重を特定するための試験が挙げられる。以下の実施例には、糖化工程において、各種リグノセルロース系材料を効率的に加水分解又は分解させる酵素組成物中の、酵素の最適比/比重を特定するために使用することのできるアッセイが包含される。
5.3.1.バックグラウンド
高等植物の細胞壁は、様々な糖ポリマー(CP)成分から構成される。これらのCPは、共有結合及び非共有結合により相互作用し、堅固な細胞壁を形成し、かつ膨圧に耐えるのに必要とされる構造一体性を植物にもたらす。植物に見られる主なCPはセルロースであり、セルロースは細胞壁の構造骨格を形成する。セルロースの生合成時に、ポリ−β−1,4−D−グルコース鎖は水素結合及び疎水性相互作用により自己集合してセルロースミクロフィブリルを形成し、セルロースミクロフィブリルは更に自己集合してより大きな繊維を形成する。セルロースミクロフィブリルは、多くの場合不規則な形状であり、及び結晶化度の異なる領域を含有する。セルロースフィブリルの結晶化度は、これらのセルロース鎖構成要素間の水素結合が、どれだけ緊密であるかによって変化する。結合密度がより疎である、すなわちグルコース鎖をより利用しやすい領域は、非晶質領域と呼ばれる。
セルロースをグルコースへと解重合する際に一般的なモデルは、最低限で3つの異なる酵素活性を包含する。工程において、エンドグルカナーゼはセルロース鎖の内部を切断し、より短い鎖を生成することから、接近可能な末端の数が増加し、セルロース鎖を未処理である場合と比較してエキソグルカナーゼ活性が作用しやすくなる。これらのエキソグルカナーゼ(例えば、セロビオヒドロラーゼ)は、多くの場合、セロビオース、グルコース二量体において遊離(liberating)する還元末端又は非還元末端のいずれかに特異的なものである。次に、蓄積させたセロビオースをセロビアーゼ(例えば、β−1,4−グルコシダーゼ)により切断させて、グルコースを生成する。
セルロースは無水グルコースのみを含有する。対照的に、ヘミセルロースは数多くの異なる糖モノマーを含有する。例えば、ヘミセルロース中の、グルコース以外の糖モノマーとしては、キシロース、マンノース、ガラクトース、ラムノース、及びアラビノースを挙げることもできる。多くの場合、ヘミセルロースはD型五炭糖を含有しており、場合により少量のL型糖を含有する。キシロースは典型的には最も多量に存在するが、マンヌロン酸及びガラクツロン酸も存在する傾向がある。ヘミセルロースとしては、キシラン、グルクロンオキシラン、アラビノキシラン、グルコマンナン、及びキシログルカンが挙げられる。
本開示の酵素及び多酵素組成物は、ヘミセルロース材料、例えば、キシラン、アラビノキシラン、及びキシラン含有物質若しくはアラビノキシラン含有物質の糖化に有用である。アラビノキシランはキシロース及びアラビノースからなる多糖であり、L−α−アラビノフラノース残基が分岐点としてβ−(1,4)−結合キシロースポリマー主鎖に結合している。
大部分のバイオマス資源はより複雑であり、数ある成分の中でも特にセルロース、ヘミセルロース、ペクチン、リグニン、タンパク質、及びトネリコを含有する。したがって、特定の態様では、本開示は、最も効果的な様式で一緒に作用させてバイオマスを発酵性糖質へと分解させる際に幅広く又は多様な基質特異性を付与する酵素を含有している、酵素配合物/組成物を提供する。本発明の多酵素配合物/組成物の一例としては、セロビオヒドロラーゼ、キシラナーゼ、エンドグルカナーゼ、β−グルコシダーゼ、β−キシロシダーゼ、及び所望によりアクセサリータンパク質、の混合物が挙げられる。酵素配合物/組成物は、適宜非天然に得られる組成物である。
したがって、本開示は、キシラン加水分解酵素、ヘミセルロース酵素及び/又はセルロース加水分解酵素の混合物を含む酵素配合物/組成物(製造製品など)を提供し、酵素配合物/組成物は、グルカナーゼ;セロビオヒドロラーゼ;L−α−アラビノフラノシダーゼ;キシラナーゼ;β−グルコシダーゼ;及びβ−キシロシダーゼなどのセルラーゼのうちの少なくとも1種、複数種、又は全てを含有する。好ましくは、本開示の各酵素配合物/組成物は、本開示の少なくとも1種の酵素を含む。本開示は、非天然に得られる組成物である、酵素配合物/組成物も提供する。本明細書で使用するとき、用語「酵素配合物/組成物」は:(1)発酵ブロス形態のあるいは一部若しくは完全に単離又は精製した形態のいずれかの酵素成分を組み合わせて調製した組成物;(2)酵素成分を1種以上発現するよう改質された生物により生産された組成物;特定の実施形態では、1種以上の酵素成分を発現させるために使用する生物は、1つ以上の遺伝子を欠失するよう改質させてもよい;特定の実施形態では、生物はキシラン加水分解、ヘミセルロース加水分解及び/又はセルロース加水分解に影響を与えるタンパク質タンパク質を更に含み得る;(3)糖化又は発酵反応中に、同時に、別個に、又は連続的に酵素成分を組み合わせて製造した組成物;(4)インサイツで、例えば、糖化又は発酵反応中に製造した酵素混合物;及び(5)これら(1)〜(4)のうちのいずれか又は全てに従って製造した組成物;を指す。
本明細書で使用するとき、用語「発酵ブロス」は、発酵により生産され、発酵後に全く又はほとんど回復操作及び/又は精製されない酵素調製物を指す。例えば、微生物培養物を炭素制限条件下でインキュベートし、定常状態になるまで増殖させて、タンパク質を合成させる(例えば、酵素を発現させる)。次に、酵素が細胞培養培地に分泌されたら発酵ブロスを使用することができる。本開示の発酵ブロスは、発酵終了時に得られる発酵材料の、分画されていない又は分画された内容物を含有し得る。例えば、本発明の発酵ブロスは未分画のものであり、使用した培養培地と、及び微生物細胞(例えば、糸状真菌細胞)を発酵工程にかけた後に存在する細胞片とを含む。発酵ブロスは、好適には、使用した細胞培養培地、細胞外酵素及び微生物の生又は死細胞を含有し得る。あるいは、発酵ブロスを分画して、微生物細胞を除去することもできる。これらの場合、例えば、発酵ブロスは、使用した細胞培養培地と、細胞外酵素とを含み得る。
本明細書に具体的に記載される任意の酵素を、本明細書に記載の任意の1つ以上の酵素又は任意のその他の利用可能でかつ好適な酵素と組み合わせて、好適な多酵素配合物/組成物を生成することができる。本開示は、以下に列挙される特定の例示的な組み合わせに制限されず、すなわち限定されない。
5.3.2.バイオマス
本開示は、本開示の酵素、酵素配合物/組成物を用いバイオマスを糖化させるための、方法及び工程を提供する。本明細書で使用するとき、用語「バイオマス」は、セルロース及び/又はヘミセルロースを含む(場合により、リグノセルロース系バイオマス材料中のリグニンも含む)任意の組成物を指す。本明細書で使用するとき、バイオマスとしては、限定するものではないが、種子、穀類、塊茎、植物性廃棄物、すなわち食品加工又は工業加工に関係する副産物(例えば、茎など)、トウモロコシ(例えば、穂軸、及びまぐさなど)、草本類(例えば、ソルガストラム・ヌタンス(Sorghastrum nutans)などのインディアングラス、又は例えば、キビ(Panicum)種などパニクム・バーガタム(Panicum virgatum)といったスイッチグラス)、多年生植物のケーン類(例えば、暖竹)、木材(例えば、木片、加工廃棄物など)、紙、パルプ、及び再生紙(例えば、新聞紙、及び印刷紙など)が挙げられる。他のバイオマス材料としては、限定するものではないが、ジャガイモ、マメ科植物(例えば、菜種)、大麦、ライ麦、オーツ麦、小麦、ビート、及びサトウキビバガスが挙げられる。
本開示は、バイオマス材料、例えば、キシラン、ヘミセルロース、セルロース、及び/又は発酵性糖質を含む材料を、本開示のポリペプチド、又は本開示の核酸によりコードされるポリペプチド、又は酵素配合物/組成物のうちのいずれか1つ、又は本開示の製造製品と接触させる工程を含む、糖化方法を提供する。
糖化させたバイオマス(例えば、本開示の酵素により加工したリグノセルロース系材料)に、例えば、微生物による発酵及び/又は化学合成などの加工を行うことで、数多くのバイオ系製品を製造することができる。本明細書で使用するとき、「微生物による発酵」は、好適な条件下で発酵微生物を増殖及び回収するプロセスを指す。発酵微生物は、バイオ系産物を生産するための所望の発酵プロセスで使用するのに好適な任意の微生物であり得る。好適な発酵微生物としては、限定するものではないが、菌類(例えば、糸状菌)、酵母、及びバクテリアが挙げられる。糖化させたバイオマスを、発酵及び/又は化学合成により燃料(例えば、バイオエタノール、バイオブタノール、バイオメタノール、バイオプロパノール、バイオディーゼル、ジェット燃料、又は同様物などのバイオ燃料)にすることができる。糖化させたバイオマスを、発酵により及び/又は化学合成により、汎用化学物質(例えば、アスコルビン酸、イソプレン、1,3−プロパンジオール)、脂質、アミノ酸、タンパク質及び酵素にすることができる。
5.3.3.前処理
糖化前に、好ましくは、バイオマス(例えば、リグノセルロース系材料)には、キシラン、ヘミセルロース、セルロース及び/又はリグニン材料を、酵素がより接近しやすく又は作用しやすい状態にするために、ひいては、本開示の酵素及び/又は酵素配合物/組成物により加水分解されやすい状態にするために、1つ以上の前処理工程を行う。
特定の実施形態では、前処理は、反応器内で、バイオマス材料を、強酸及び金属塩の希釈溶液からなる触媒に曝露することを伴う。バイオマス材料は、例えば、原材料又は乾燥させた材料であってよい。この前処理により、セルロースの加水分解にまつわる活性化エネルギー、又は温度を低くすることができ、最終的にはより多量の発酵性糖質を生成できるようになる。例えば、米国特許第6,660,506号、同第6,423,145号を参照されたい。
他の例示的な前処理法は、大部分のセルロースをグルコースへと脱重合させずに、ヘミセルロースの一次脱重合を実施するために選択される温度及び圧力レベルにて、バイオマス材料に対し、水性媒質中での第1の加水分解工程を実施することで、バイオマスを加水分解する工程を伴う。この工程により、スラリーには、ヘミセルロースの脱重合から得られる単糖が溶解している液体水相並びにセルロース及びリグニンを含有する固相が生じる。次に、セルロースの大部分を脱重合させ、セルロースが溶解している/セルロースの可溶性脱重合産物を含有している液体水相を生成することのできる条件下で、スラリーに第2の加水分解工程を行う。例えば、米国特許第5,536,325号を参照のこと。
更なる方法例は、約0.4%〜約2%の強酸を使用する1段階以上の希酸加水分解工程によりバイオマス材料を加工し、続いて酸加水分解させた材料のうち、未反応の固体リグノセルロース系成分をアルカリ系脱リグニン化処理する工程を含む。例えば、米国特許第6,409,841号を参照のこと。
他の方法例は、前加水分解反応容器中で、バイオマス(例えば、リグノセルロース系材料)を予め加水分解する工程;酸性の液体をリグノセルロース系固形材料に添加して、混合物を作製する工程;混合物を反応温度に加熱する工程;リグノセルロース系材料を、リグノセルロース系材料由来のリグニンを少なくとも約20%含有している可溶性画分及びセルロースを含有している固体画分へと分画するのに十分な時間にわたり、反応温度を維持する工程;固体画分から可溶性画分を分離させ、可溶性画分を反応温度にて、又は反応温度付近にて取り出す工程;並びに、可溶性タンパク質を回収する工程、を含む。固形画分中のセルロースを、酵素による消化を受けやすい状態にする。例えば、米国特許第5,705,369号を参照のこと。
その他の前処理方法は、過酸化水素H2O2の使用を伴うものである。Gould,1984,Biotech,and Bioengr.26:46〜52を参照されたい。
前処理は、バイオマス材料を、非常に低濃度の化学量論の水酸化ナトリウム及び水酸化アンモニウムと接触させる工程も含む。Teixeira et al.,1999,Appl.Biochem.and Biotech.77〜79:19〜34を参照されたい。前処理には、リグノセルロースを、温和な温度、圧力及びpHで、例えばpH約9〜約14の化学物質(例えば、炭酸ナトリウム又は水酸化カリウムなどの塩基)と接触させる工程を含有させることもできる。国際公開第2004/081185号を参照されたい。
例えば、好ましい前処理方法ではアンモニアを使用する。例えば、前処理方法は、固形分濃度の高い条件下で、バイオマス材料を低濃度のアンモニアに晒すことを含む。例えば、米国特許第20070031918号、及び国際公開第06110901号を参照されたい。
5.3.4.酵素組成物
本開示は、本開示の酵素を複数(すなわち、1種以上)含む数多くの酵素組成物を提供する。本発明の各酵素組成物に関し少なくとも1種の酵素は組み換え宿主細胞又は組み換え生物により生産させることができる。酵素組成物の少なくとも1種の酵素は異種性酵素であってよく、例えば、宿主細胞又は宿主生物において異種遺伝子を発現させることで生産させた異種酵素であってよい。酵素組成物の少なくとも1種の酵素は、宿主細胞又は宿主生物で内在性遺伝子を過剰発現又は低発現させた結果として生産されてもよい。酵素組成物は、適宜非天然に得られる組成物である。本開示は、4種のポリペプチド:(1)キシラナーゼ活性を有する第1のポリペプチド、(2)キシロシダーゼ活性を有する第2のポリペプチド、(3)アラビノフラノシダーゼ活性を有する第3のポリペプチド、及び(4)β−グルコシダーゼ活性を有する第4のポリペプチド、を含む、本発明の遺伝子操作型酵素組成物の、第1の非限定例を提供する。本開示は、(1)キシラナーゼ活性を有する第1のポリペプチド、(2)キシロシダーゼ活性を有する第2のポリペプチド、(3)アラビノフラノシダーゼ活性を有する第3のポリペプチド、及び(4)β−グルコシダーゼに富む全セルラーゼ組成物、を含む、本発明の遺伝子操作型酵素組成物の、第2の非限定例を提供する。本開示は、(1)キシラナーゼ活性を有する第1のポリペプチド;(2)キシロシダーゼ活性を有する第2のポリペプチド;(3)アラビノフラノシダーゼ活性を有する第3のポリペプチド;及び(4)GH61/エンドグルカナーゼ活性を有する第4のポリペプチド、又はGH61エンドグルカナーゼに富む全セルラーゼ組成物、を含む、本発明の遺伝子操作型酵素組成物の、第3の非限定例を提供する。本開示は、(1)キシロシダーゼ活性を有する第1のポリペプチド、(2)キシロシダーゼ活性を有する第2のポリペプチド(第1のポリペプチドとは異なる)、(3)アラビノフラノシダーゼ活性を有する第3のポリペプチド、及び(4)β−グルコシダーゼ活性を有する第4のポリペプチド、を含む、本発明の遺伝子操作型酵素組成物の、第4の非限定例を提供する。本開示は、(1)キシロシダーゼ活性を有する第1のポリペプチド、(2)キシロシダーゼ活性を有する第2のポリペプチド(第1のポリペプチドとは異なる)、(3)アラビノフラノシダーゼ活性を有する第3のポリペプチド、及び(4)β−グルコシダーゼに富む全セルラーゼ、を含む、本発明の遺伝子組み換え型酵素組成物の、第5の非限定例を提供する。本開示は、(1)キシロシダーゼ活性を有する第1のポリペプチド、(2)キシロシダーゼ活性を有する第2のポリペプチド(第1のポリペプチドとは異なる)、(3)アラビノフラノシダーゼ活性を有する第3のポリペプチド;及び(4)GH61/エンドグルカナーゼ活性を有する第4のポリペプチド、あるいは、EGIVに富む全セルラーゼ組成物、を含む、本発明の遺伝子操作型酵素組成物の、第6の非限定例を提供する。本開示は、(1)キシラナーゼ活性を有する第1のポリペプチド、(2)キシロシダーゼ活性を有する第2のポリペプチド、(3)キシロシダーゼ活性を有する第3のポリペプチド(第2のポリペプチドとは異なる)、及び(4)β−グルコシダーゼ活性を有する第4のポリペプチド、を含む、本発明の遺伝子操作型酵素組成物の、第7の非限定例を提供する。本開示は、(1)キシラナーゼ活性を有する第1のポリペプチド、(2)キシロシダーゼ活性を有する第2のポリペプチド、(3)キシロシダーゼ活性を有する第3のポリペプチド(第2のポリペプチドとは異なる)、及びβ−グルコシダーゼに富む全セルラーゼ、を含む、第8の非限定例を提供する。本開示は、(1)キシラナーゼ活性を有する第1のポリペプチド、(2)キシロシダーゼ活性を有する第2のポリペプチド、(3)キシロシダーゼ活性を有する第3のポリペプチド(第2のポリペプチドとは異なる)、及び(4)GH61/エンドグルカナーゼ活性を有する第4のポリペプチド、あるいは、GH61エンドグルカナーゼに富む全セルラーゼ組成物、を含む、本発明の遺伝子操作型酵素組成物の、第9の非限定例を提供する。本開示は、(1)キシラナーゼ活性を有する第1のポリペプチド、(2)キシロシダーゼ活性を有する第2のポリペプチド、及び(3)β−グルコシダーゼ活性を有する第3のポリペプチド、を含む、本発明の遺伝子操作型酵素組成物の、第10の非限定例を提供する。本開示は、(1)キシラナーゼ活性を有する第1のポリペプチド、(2)キシロシダーゼ活性を有する第2のポリペプチド及びβ−グルコシダーゼに富む全セルラーゼ、を含む、本発明の遺伝子組み換え型酵素組成物の、第11の非限定例を提供する。本開示は、(1)キシラナーゼ活性を有する第1のポリペプチド、(2)キシロシダーゼ活性を有する第2のポリペプチド、及び(3)GH61/エンドグルカナーゼ活性を有する第3のポリペプチド、あるいは、GH61エンドグルカナーゼに富む全セルラーゼ組成物を含む、本発明の遺伝子操作型酵素組成物の、第12の非限定例を提供する。
上記の代表的な酵素組成物のうちの任意のものでは、β−グルコシダーゼ活性を有するポリペプチドは、配列番号54、56、58、60、62、64、66、68、70、72、74、76、78、79、93、及び95のうちのいずれか1つの配列と、少なくとも約10残基(例えば、少なくとも約10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、225、250、275、300残基)の領域にわたって少なくとも約60%(例えば、少なくとも約60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%)配列同一性を有する。特定の実施形態では、β−グルコシダーゼを有するポリペプチドは、2つ以上のβ−グルコシダーゼ配列からなるβ−グルコシダーゼのキメラ/融合ポリペプチドであり、第1のβ−グルコシダーゼに由来する第1の配列は、少なくともアミノ酸残基約200個分の長さであり、配列番号96〜108のアミノ酸配列モチーフのうち1種以上又は全てを含むのに対し、第2のβ−グルコシダーゼに由来する第2の配列は、少なくともアミノ酸残基約50個分の長さであり、配列番号109〜116のアミノ酸配列モチーフのうち1種以上又は全てを含み、及び同様に場合により第3の配列は、第3のβ−グルコシダーゼに由来するループ配列をアミノ酸残基約3、4、5、6、7、8、9、10、又は11個分の長さでコードしている、β−グルコシダーゼの融合又はキメラポリペプチドである。特定の実施形態では、β−グルコシダーゼ活性を有するポリペプチドは、少なくとも200残基長のFv3C(配列番号60)と、例えば、配列番号60のN末端から少なくとも200残基と、少なくとも約60%配列同一性を有する第1の配列、並びに少なくとも50残基長のT.リーゼイ(T. reesei)Bgl3(Tr3B、配列番号64)と、例えば、配列番号64のC末端の残基から少なくとも50残基と、少なくとも約60%配列同一性を有する第2の配列を含む。特定の実施形態では、上記のとおり第1及び第2の配列を含みβ−グルコシダーゼ活性を有するポリペプチドは、更に、Te3A(配列番号66)の相当する長さの配列に由来する、約3、4、5、6、7、8、9、10、又は11個のアミノ酸残基からなる第3の配列を含む。一部の実施形態では、ポリペプチドは、配列番号93又は95に対して、あるいは配列番号93又は95の少なくとも約20、30、40、50、60、又は70個以上の残基からなる下位配列又は断片に対して少なくとも約60%配列同一性を有する配列を含む。
本明細書に記載の酵素組成物のうちの任意のものでは、GH61/エンドグルカナーゼ活性を有するポリペプチドはEGIVポリペプチドであり、例えば、T.リーゼイ(T. reesei)Eg4ポリペプチドである。一部の実施形態では、ポリペプチドは、配列番号52、80〜81、206〜207のうちのいずれか1つの配列と、少なくとも約10残基(例えば、少なくとも約10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、225、250、275、300残基)の領域にわたって少なくとも約60%(例えば、少なくとも約60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%)配列同一性を有するものであるか、あるいは(1)配列番号84、及び88;(2)配列番号85、及び88;(3)配列番号86;(4)配列番号87;(5)配列番号84、88、及び89;(6)配列番号85、88、及び89;(7)配列番号84、88、及び90;(8)配列番号85、88、及び90;(9)配列番号84、88、及び91;(10)配列番号85、88、及び91;(11)配列番号84、88、89、及び91;(12)配列番号84、88、90、及び91;(13)配列番号85、88、89、及び91:及び(14)配列番号85、88、90、及び91からなる群から選択される1つ以上の配列モチーフを含むものである。特定の実施形態では、組成物は更にセロビオースデヒドロゲナーゼを含む。
本明細書に記載の酵素組成物のうちの任意のものでは、キシラナーゼ活性を有するポリペプチドは、配列番号24、26、42、及び43のうちのいずれか1つに対し、又はこれらの成熟配列に対し少なくとも約70%配列同一性を有するものであってよい。例えば、キシラナーゼポリペプチドは、AfuXyn2、AfuXyn5、T.リーゼイ(T. reesei)Xyn3、又はT.リーゼイ(T. reesei)Xyn2であってよい。
本明細書に記載の酵素組成物のうちの任意のものでは、キシロシダーゼ活性を有するポリペプチドは、第1群の又は第2群のβ−キシロシダーゼポリペプチドから選択されたものであってよい。組成物が第1の及び第2のβ−キシロシダーゼを含む場合、第1のβ−キシロシダーゼは第1群のβ−キシロシダーゼポリペプチドであり、配列番号2及び10のうちの1つに対し、又はこれらの成熟配列に対し、少なくとも約70%配列同一性を有するものであってよいことが企図される。例えば、第1群のβ−キシロシダーゼはFv3A又はFv43Aであり得る。第2のβ−キシロシダーゼは、第2群のβ−キシロシダーゼポリペプチドであり、配列番号4、6、8、10、12、14、16、18、28、30、及び45のうちの1つに対し、又はこれらの成熟配列に対し、少なくとも約70%配列同一性を有するものであってよいことも企図される。例えば、第2群のβ−キシロシダーゼは、Pf43A、Fv43E、Fv39A、Fv43B、Pa51A、Gz43A、Fo43A、Fv43D、Pf43B、又はT.リーゼイ(T. reesei)Bxl1であってよい。
上記の酵素組成物の例のうち任意のものでは、アラビノフラノシダーゼ活性を有するポリペプチドは、配列番号12、14、20、22及び32のうちの1つに対し、又はこれらの成熟配列に対し、少なくとも約70%配列同一性を有するものであってよい。例えば、第3のポリペプチドは、Fv43B、Pa51A、Af43A、Pf51A、又はFv51Aであってよい。
キシラナーゼ:キシラナーゼは、本開示の酵素組成物の約3重量%〜約35重量%を適宜構成する。重量%は、所定の組成物中の全ての酵素の合計重量に対する、キシラナーゼの合計重量を意味する。キシラナーゼは、3重量%、4重量%、5重量%、6重量%、7重量%、8重量%、9重量%、10重量%、12重量%、15重量%を下限とし、及び5重量%、10重量%、15重量%、20重量%、25重量%、30重量%、35重量%を上限とする範囲で存在させることができる。好適には、本発明の酵素組成物中の1種以上のキシラナーゼの合計重量は、例えば、酵素組成物中の全ての酵素の合計重量の約3重量%〜約30重量%(例えば、3重量%〜20重量%、5重量%〜18重量%、8重量%〜18重量%、10重量%〜20重量%など)を占める。本開示の酵素組成物に含有させるのに好適なキシラナーゼの例を、第5.3.7.節に記載する。
L−α−アラビノフラノシダーゼ:L−α−アラビノフラノシダーゼは、本開示の酵素組成物の酵素の総重量の約0.1%重量%〜約5重量%を適宜構成する。ここで、重量%は、所定の組成物中の全ての酵素の合計重量に対する、L−α−アラビノフラノシダーゼの合計重量を意味する。L−α−アラビノフラノシダーゼは、0.1重量%、0.2重量%、0.5重量%、0.7重量%、0.8重量%、1重量%、2重量%、3重量%、4重量%を下限とし、及び2重量%、3重量%、4重量%、又は5重量%を上限とする範囲で存在させることができる。例えば、1種以上のL−α−アラビノフラノシダーゼは、本開示の酵素組成物の酵素の総重量の約0.2重量%〜約5重量%(例えば、0.2重量%〜3重量%、0.4重量%〜2重量%、0.4重量%〜1重量%など)を適宜構成し得る。本開示の酵素配合物組成物に含有させるのに好適なL−α−アラビノフラノシダーゼの例を、第5.3.8.節に記載する。
β−キシロシダーゼ:β−キシロシダーゼは、酵素配合物/組成物中の酵素の総重量の約0重量%〜約40重量%を適宜構成する。この量は、既知の手法を用い、例えば、実施例に記載のように、SDS−PAGE、HPLC、及びUPLCなどの手法を用い算出することができる。任意に組み合わせたタンパク質の、互いに対する比は、容易に算出することができる。本明細書で開示される重量%から導かれる任意の重量比で酵素を含む配合物/組成物が企図される。β−グルコシダーゼ含量は、下限が、配合物/組成物に含まれる酵素の総重量の約0重量%、1重量%、2重量%、3重量%、4重量%、5重量%、6重量%、7重量%、8重量%、9重量%、10重量%、12重量%、15重量%、20重量%、25重量%、30重量%、35重量%であり、かつ上限が、組成物に含まれる酵素の総重量の約10重量%、15重量%、20重量%、25重量%、30重量%、35重量%、又は40重量%である範囲であってよい。例えば、β−キシロシダーゼは、配合物/組成物中の酵素の総重量の2重量%〜30重量%;10重量%〜20重量%;又は5重量%〜10重量%を適宜示す。好適なβ−キシロシダーゼについては、本明細書において、例えば、第5.3.7.節にに記載する。
5.3.5.セルラーゼ
本開示の酵素配合物組成物は、1つ以上のセルラーゼを含み得る。セルラーゼは、セルロース(β−1,4−グルカン又はβ−D−グルコシド結合)を加水分解し、グルコース、セロビオース、セロオリゴ糖等を生成する酵素である。セルラーゼは、従来的に、3つの主要なクラス:エンドグルカナーゼ(EC 3.2.1.4)(「EG」)、エキソグルカナーゼ又はセロビオヒドロラーゼ(EC 3.2.1.91)(「CBH」)、及びβ−グルコシダーゼ(β−D−グルコシドグルコヒドラーゼ;EC 3.2.1.21)(「BG」)に分類されてきた(Knowles et al.,1987,Trends in Biotechnology 5(9):255〜261;Shulein,1988,Methods in Enzymology,160:234〜242)。エンドグルカナーゼが主にセルロース繊維の非晶質部位に作用する一方で、セロビオヒドロラーゼは結晶質セルロースも分解することができる。
本開示の方法及び組成物に好適なセルラーゼは次の微生物のうちの1種以上から得ることができ、又はこれらの微生物の組み換えにより生産することができる:クリニペリス・スカペラ(Crinipellis scapella)、マクロフォミア・ファセオリナ(Macrophomina phaseolina)、ミセリオフィソーラ・サーモフィラ(Myceliophthora thermophila)、ソルダリア・フィミコラ(Sordaria fimicola)、ボルテラ・セロトリコイド(Volutella colletotrichoides)、チェラビア・テレストリス(Thielavia terrestris)、アクレモニウム菌種(Acremonium sp.)、エキシジア・グランデュロサ(Exidia glandulosa)、フォムス・フォメンタリウス(Fomes fomentarius)、スポンジペリス菌種(Spongipellis sp.)、リゾフィリクティス・ロセア(Rhizophlyctis rosea)、リゾムコール・プシラス(Rhizomucor pusillus)、フィコマイセス・ニテウス(Phycomyces niteus)、カエトスチラム・フレセニィ(Chaetostylum fresenii)、ディプロディア・ゴシピナ(Diplodia gossypina)、ウロスポラ・ビルグラミイ(Ulospora bilgramii)、サッコボラス・ジルテラス(Saccobolus dilutellus)、ペニシリウム・ベルクロサム(Penicillium verruculosum)、アオカビ(Penicillium chrysogenum)、サーモマイセス・ベルコサス(Thermomyces verrucosus)、ジアポルテ・シンゲネシア(Diaporthe syngenesia)、コレトトリカム・ラゲナリウム(Colletotrichum lagenarium)、ニグロスポラ菌種(Nigrospora sp.)、キシラリア・ヒポキシロン(Xylaria hypoxylon)、ネクトリア・ピネア(Nectria pinea)、ソルダリア・マクロスポラ(Sordaria macrospora)、チエラビア・サーモフィラ(Thielavia thermophila)、カエトミウム・モロラム(Chaetomium mororum)、カエトミウム・バーセンス(Chaetomium virscens)、カエトミウム・ブラシリエンシス(Chaetomium brasiliensis)、カエトミウム・クニコロラム(Chaetomium cunicolorum)、シスパストスポラ・ボニネンシス(Syspastospora boninensis)、クラドリナム・フォエカンヂシマム(Cladorrhinum foecundissimum)、スキタリジウム・サーモフィラ(Scytalidium thermophila)、グリオクラジウム・カテヌラタム(Gliocladium catenulatum)、フザリウム・オキシスポラム菌種・リコペルシキ(Fusarium oxysporum ssp. lycopersici)、フザリウム・オキシスポラム菌種パッシフローラ(Fusarium oxysporum ssp. passiflora)、フザリウム・ソラニ(Fusarium solani)、フザリウム・アングイオイド(Fusarium anguioides)、フザリウム・ポアエ(Fusarium poae)、ヒュミコラ・ニグレッセンス(Humicola nigrescens)、ヒュミコラ・グリセア(Humicola grisea)、パナエオラス・レチルギス(Panaeolus retirugis)、トラメテス・サングイネア(Trametes sanguinea)、シゾフィラム・コミューン(Schizophyllum commune)、トリコテキウム・ロゼウム(Trichothecium roseum)、ミクロスファロシス菌種(Microsphaeropsis sp.)、アクソボロス・スチクトイデウス(Acsobolus stictoideus spej.)、ポロニア・パンクタタ(Poronia punctata)、ノデュリスポラム菌種(Nodulisporum sp.)、トリコデルマ菌種(Trichoderma sp.)(例えば、T.リーゼイ(T. reesei))、及びシリンドロカルポン菌種(Cylindrocarpon sp.)。
例えば、本開示の方法及び/又は組成物に使用するセルラーゼは全セルラーゼであり、及び/又は以下の第6.1.11.に記載するカルコフローアッセイにより測定した場合に少なくとも0.1画分(例えば、0.1〜0.4画分)を得ることのできるものである。
5.3.5.1.β−グルコシダーゼ
本開示の酵素配合物/組成物には、場合により1種以上のβ−グルコシダーゼを含有させてもよい。本明細書で使用するとき、用語「β−グルコシダーゼ」は、EC 3.2.1.21として分類されるβ−D−グルコシドグルコヒドロラーゼ、及び/又は特定のGHファミリーのメンバー(限定するものではないが、セロビオースの加水分解を触媒してβ−D−グルコースを生成するGHファミリー1、3、9又は48のメンバーなど)を指す。
好適なβ−グルコシダーゼは、遺伝子組換え法により数多くの微生物から得ることができ、あるいは供給業者から購入することができる。微生物由来のβ−グルコシダーゼの例としては、限定するものではないが、バクテリア及び真菌に由来するものが挙げられる。例えば、本開示のβ−グルコシダーゼは、糸状菌から得ることもできる。
β−グルコシダーゼは、とりわけ、A.アキュレタス(A. aculeatus)(Kawaguchi et al.Gene 1996,173:287〜288)、カワチコウジカビ(A. kawachi)(Iwashita et al.Appl.Environ.Microbiol.1999,65:5546〜5553)、ニホンコウジカビ(A. oryzae)(国際公開第2002/095014号)、C.ビアゾテア(C. biazotea)(Wong et al.Gene,1998,207:79〜86)、P.フニクロサム(P. funiculosum)(国際公開第2004/078919号)、S.フィブリゲラ(S. fibuligera)(Machida et al.Appl.Environ.Microbiol.1988,54:3147〜3155)、S.ポンベ(S. pombe)(Wood et al.Nature 2002,415:871〜880)、T.リーゼイ(T. reesei)(例えば、β−グルコシダーゼ1(米国特許第6,022,725号)、β−グルコシダーゼ3(米国特許第6,982,159号)、β−グルコシダーゼ4(米国特許第7,045,332号)、β−グルコシダーゼ5(米国特許第7,005,289号)、β−グルコシダーゼ6(米国特許第20060258554号)、β−グルコシダーゼ7(米国特許第20060258554号))から得ることができ、又は遺伝子組み換えにより産生することができる。
β−グルコシダーゼは、β−グルコシダーゼをコードしている内在性又は外来性遺伝子を発現させることで生産できる。例えば、β−グルコシダーゼは、グラム陽性細菌(例えば、バチルス(Bacillus)又はアクチノマイセス(Actinomycetes)など)、又は真核生物宿主(例えば、トリコデルマ、アスペルギルス、サッカロマイセス、又はピキア)により、細胞外の空間に分泌させることができる。β−グルコシダーゼは、一定の条件下で、過剰発現又は低発現させることができる。
β−グルコシダーゼは、供給業者から入手することもできる。本開示に使用するのに好適なβ−グルコシダーゼ調製物の市販例としては、例えば、Accellerase(登録商標)BG(Danisco US Inc.,Genencor)に含まれるT.リーゼイ(T. reesei)のβ−グルコシダーゼ;NOVOZYM(商標)188(A.ニガー(A. niger)由来のβ−グルコシダーゼ);Megazyme(Megazyme International Ireland Ltd.,Ireland.)の、アグロバクテリウム菌種(Agrobacterium sp.)のβ−グルコシダーゼ、及びT.マリティマ(T. maritima)のβ−グルコシダーゼが挙げられる。
更に、β−グルコシダーゼは、以下、第5.3.6.節に記載のような全セルラーゼの成分であり得る。
本開示は、2種以上のβ−グルコシダーゼ配列を含む融合/キメラポリペプチドである、所定のβ−グルコシダーゼポリペプチドを提供する。例えば、第1のβ−グルコシダーゼ配列は、少なくともアミノ酸残基約200個分の長さの配列を含み、かつ配列番号96〜108の配列モチーフのうちの1つ又は全てを含んでよい。第2のβ−グルコシダーゼ配列は、少なくともアミノ酸残基約50個分の長さの配列を含み、かつ配列番号配列番号109〜116の配列モチーフのうちの1つ又は全てを含んでよい。特定の実施形態では、第1のβ−グルコシダーゼ配列は、融合/キメラポリペプチドのN端末に位置するのに対し、第2のβ−グルコシダーゼ配列は融合/キメラポリペプチドのC末端に位置する。特定の実施形態では、第1及び第2のβ−グルコシダーゼ配列は、直接隣接している。例えば、第1のβ−グルコシダーゼ配列のC末端は、第2のβ−グルコシダーゼ配列のN末端に連結される。他の実施形態では、第1及び第2のβ−グルコシダーゼ配列は直接隣接していないものの、第1の及び第2のβ−グルコシダーゼ配列はリンカードメインを介して連結されている。一部の実施形態では、第1のβ−グルコシダーゼ配列、第2のβ−グルコシダーゼ配列又はリンカードメインは、アミノ酸残基約3、4、5、6、7、8、9、10又は11個分の長さの配列を含んでよい。特定の実施形態では、第1のβ−グルコシダーゼ配列は、少なくともアミノ酸残基約200個分の長さであり、かつFv3C配列の同じ長さのN端末に対し、少なくとも約60%配列同一性を有する。特定の実施形態では、第2のβ−グルコシダーゼ配列は、少なくともアミノ酸残基約50個分の長さであり、かつ配列番号54、56、62、64、66、68、70、72、74、76、78、及び79のうちのいずれか1つの同じ長さのC末端に対し、少なくとも約60%配列同一性を有する。特定の実施形態では、β−グルコシダーゼの融合/キメラポリペプチドは向上した安定性を有しており、例えば、キメラ/融合ポリペプチドのキメラ部の由来する酵素のいずれか1つと比較して安定性が向上している。特定の実施形態では、第2のβ−グルコシダーゼ配列は、少なくともアミノ酸残基約50個分の長さであり、かつTr3Bの同じ長さのC末端配列に対し、少なくとも約60%配列同一性を有する。特定の実施形態では、第1のβ−グルコシダーゼ配列、第2のβ−グルコシダーゼ配列又はリンカーモチーフ中のループ配列は、Te3Aに由来し、アミノ酸残基3、4、5、6、7、8、9、10、又は11個分の長さである。
β−グルコシダーゼ活性は、当該技術分野において既知の、Chen et al.,in Biochimica et Biophysica Acta 1992,121:54〜60に記載のアッセイ(ここで、1 pNPGは、50℃(122°F)及びpH 4.8にて10分間に4−ニトロフェニル−β−D−グルコピラノシドから1μmoLのニトロフェノールが遊離することを意味する)などの、数多くの適した手法により決定することができる。
β−グルコシダーゼは、本発明の酵素配合物/組成物中の酵素の総重量の約0重量%〜約55重量%を適宜構成する。この量は、既知の手法を用い、例えば、実施例に記載のように、SDS−PAGE、HPLC、及びUPLCなどの手法を用い算出することができる。任意に組み合わせたタンパク質の、互いに対する比は、算出することができる。本明細書で開示される重量%から導かれる任意の重量比で酵素を含む配合物/組成物が企図される。β−グルコシダーゼ含量は、下限が、配合物/組成物に含まれる酵素の総重量の約0重量%、1重量%、2重量%、3重量%、4重量%、5重量%、6重量%7重量%、8重量%、9重量%、10重量%、12重量%、15重量%、20重量%、25重量%、30重量%、40重量%、45重量%、又は50重量%であり、かつ上限が、組成物に含まれる酵素の総重量の約10重量%、15重量%、20重量%、25重量%、30重量%、35重量%、40重量%、50重量%、55重量%である範囲であってよい。例えば、β−グルコシダーゼは、配合物/組成物中の酵素の総重量の2重量%〜30重量%;10重量%〜20重量%;又は5重量%〜10重量%を適宜示す。
5.3.5.2.エンドグルカナーゼ
本開示の酵素配合物/組成物は、場合により、本明細書に記載のGH61エンドグルカナーゼIV(EGIV)ポリペプチドに加えて1種以上のエンドグルカナーゼを含む。本開示の方法及び組成物には、EGIVポリペプチドに加えて任意のエンドグルカナーゼ(EC 3.2.1.4)を使用することができる。このようなエンドグルカナーゼは、内在性又は外来性エンドグルカナーゼ遺伝子を発現させて生産することができる。エンドグルカナーゼは、一定の条件下で過剰発現又は低発現させることができる。
例えば、本開示の方法及び組成物には、T.リーゼイ(T. reesei)EG1(Penttila et al.,1986,Gene 63:103〜112)及び/又はEG2(Saloheimo et al.,Gene 1988,63:11〜21)が適宜使用される。熱安定性のT.テレスティス(T. terrestris)エンドグルカナーゼ(Kvesitadaze et al.,Applied Biochem.Biotech.1995,50:137〜143)が、例えば、本開示の方法及び組成物に使用される。更に、T.リーゼイ(T. reesei)EG3(Okada et al.Appl.Environ.Microbiol.1988,64:555〜563)、EG5(Saloheimo et al.Molecular Microbiology 1994,13:219〜228)、EG6(米国特許第20070213249号)又はEG7(米国特許第20090170181号)、A.セルロリチカス(A. cellulolyticus)EIエンドグルカナーゼ(米国特許第5,536,655号)、H.インソレンス(H. insolens)エンドグルカナーゼV(EGV)(Protein Data Bank entry 4ENG)、S.コッコスポラム(S. coccosporum)エンドグルカナーゼ(米国特許第20070111278号)、A.アキュレアタス(A. aculeatus)エンドグルカナーゼF1−CMC(Ooi et al.Nucleic Acid Res.1990,18:5884)、A.カワチイ(A. kawachii)IFO 4308エンドグルカナーゼCMCase−1(Sakamoto et al.Curr.Genet.1995,27:435〜439)、E.カロトバラ(E. carotovara)(Saarilahti et al.Gene 1990,90:9〜14);又はA.サーモフィラム(A. thermophilum)ALKO4245エンドグルカナーゼ(米国特許第20070148732)も使用することができる。その他の好適なエンドグルカナーゼは、例えば、国際公開第91/17243号、同第91/17244号、同第91/10732号、米国特許第6,001,639号に記載のものである。
GH61/エンドグルカナーゼ活性を有する好適なポリペプチドを、本開示により提供する。一部の実施形態では、GH61/エンドグルカナーゼ活性を有するポリペプチドは、例えば、T.リーゼイ(T. reesei)Eg4ポリペプチドなどのEGIVポリペプチドである。一部の実施形態では、ポリペプチドは、配列番号52、80〜81、206〜207のうちのいずれか1つの配列と、少なくとも約10残基(例えば、少なくとも約10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、125、150、175、200、225、250、275、300残基)の領域にわたって少なくとも約60%(例えば、少なくとも約60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%)配列同一性を有するものであるか、あるいは(1)配列番号84、及び88;(2)配列番号85、及び88;(3)配列番号86;(4)配列番号87;(5)配列番号84、88、及び89;(6)配列番号85、88、及び89;(7)配列番号84、88、及び90;(8)配列番号85、88、及び90;(9)配列番号84、88、及び91;(10)配列番号85、88、及び91;(11)配列番号84、88、89、及び91;(12)配列番号84、88、90、及び91;(13)配列番号85、88、89、及び91:及び(14)配列番号85、88、90、及び91からなる群から選択される1つ以上の配列モチーフを含むものである。特定の実施形態では、組成物は更にセロビオースデヒドロゲナーゼを含む。
GH61エンドグルカナーゼは、酵素配合物/組成物中の酵素の総重量の約0.1重量%〜約50重量%を適宜構成する。この量は、既知の手法を用い、例えば、実施例に記載のように、SDS−PAGE、HPLC、及びUPLCなどの手法を用い算出することができる。タンパク質の互いに対する比は、これらの測定法に基づき容易に算出することができる。本明細書で開示される重量%から導かれる任意の重量比で酵素を含む配合物/組成物が企図される。GH61エンドグルカナーゼ含量は、下限が、配合物/組成物に含まれる酵素の総重量の約0重量%、1重量%、2重量%、3重量%、4重量%、5重量%、6重量%7重量%、8重量%、9重量%、10重量%、12重量%、15重量%、20重量%、25重量%、30重量%、40重量%、45重量%であり、かつ上限が、組成物に含まれる酵素の総重量の約10重量%、15重量%、16重量%、20重量%、25重量%、30重量%、35重量%、40重量%、50重量%である範囲であってよい。例えば、GH61エンドグルカナーゼは、セルラーゼ組成物に含まれる酵素の総重量の約2重量%〜約30重量%;約8重量%〜約20重量%;約3重量%〜約18重量%、約4重量%〜約19重量%、又は約5重量%〜約20重量%を適宜示す。
5.3.5.3.セロビオヒドロラーゼ
本開示の方法及び配合物/組成物には、所望により、任意のセロビオヒドロラーゼ(EC 3.2.1.91)(「CBH」)を使用することができる。セロビオヒドロラーゼは、内在性又は外来性セロビオヒドロラーゼ遺伝子を発現させて生産することもできる。一部の状況では、セロビオヒドロラーゼは、過剰発現又は低発現させることができる。
例えば、本開示の方法及び配合物/組成物にはT.リーゼイ(T. reesei)CBHI(Shoemaker et al.Bio/Technology 1983,1:691〜696)及び/又はCBHII(Teeri et al.Bio/Technology 1983,1:696〜699)を使用することができる。
好適なCBHは、A.ビスポラス(A. bisporus)CBH1(Swiss Prot受入番号Q92400)、A.アキュレアタス(A. aculeatus)CBH1(Swiss Prot受入番号O59843)、A.ニデュランス(A. nidulans)CBHA(GenBank受入番号AF420019)又はCBHB(GenBank受入番号AF420020)、A.ニガー(A. niger)CBHA(GenBank受入番号AF156268)又はCBHB(GenBank受入番号AF156269)、C.パープレア(C. purpurea)CBH1(Swiss Prot受入番号O00082)、C.カルボナラム(C. carbonarum)CBH1(Swiss Prot受入番号Q00328)、C.パラシチカ(C. parasitica)CBH1(Swiss Prot受入番号Q00548)、F.オキシスポラム(F. oxysporum)CBH1(Cel7A)(Swiss Prot受入番号P46238)、H.グリセア(H. grisea)CBH1.2(GenBank受入番号U50594)、H.グリセア変種サーモイデア(H. grisea var. thermoidea)CBH1(GenBank受入番号D63515)CBHI.2(GenBank受入番号AF123441)、又はexo 1(GenBank受入番号AB003105)、M.アルボマイセス(M. albomyces)Cel7B(GenBank受入番号AJ515705)、N.クラッサ(N. crassa)CBHI(GenBank受入番号X77778)、P.フニクロサム(P. funiculosum)CBHI(Cel7A)(米国特許第20070148730号)、P.ジャンチネラム(P. janthinellum)CBHI(GenBank受入番号S56178)、P.クリソスポラム(P. chrysosporium)CBH(GenBank受入番号M22220)、又はCBHI−2(Cel7D)(GenBank受入番号L22656)、T.エマーソニィ(T. emersonii)CBH1A(GenBank受入番号AF439935)、T.ビリデ(T. viride)CBH1(GenBank受入番号X53931)、又はV.ボルバセア(V. volvacea)V14CBH1(GenBank受入番号AF156693)から選択することができる。
5.3.6.全セルラーゼ
本開示の酵素配合物/組成物には、更に全セルラーゼを含有させてよい。本明細書で使用するとき、「全セルラーゼ」は、少なくとも3種の異なる酵素型:(1)エンドグルカナーゼ、(2)セロビオヒドロラーゼ、及び(3)β−グルコシダーゼを含むか、あるいは少なくとも3種の異なる酵素活性:(1)エンドグルカナーゼ活性(β−1,4結合の内部の切断を触媒し、より短いグルコオリゴ糖を生成する)、(2)セロビオヒドロラーゼ活性(セロビオース単位(β−1,4グルコース−グルコース二糖)の「エキソ」型の生成を触媒する)、及び(3)β−グルコシダーゼ活性(短鎖セロオリゴ糖(例えば、セロビオース)からのグルコースモノマーの生成を触媒する)、を含む、天然に得られる又は非天然に得られるセルラーゼ含有組成物のいずれかを指す。
「天然に生じるセルラーゼ含有」組成物は、セロビオヒドロラーゼ型の成分又は活性物質を1つ以上、エンドグルカナーゼ型の成分又は活性物質を1つ以上、及びβ−グルコシダーゼ型の成分又は活性物質を1つ以上含む、天然に生じる供給源により生成される組成物であり、これらの成分又は活性物質のそれぞれは、人工的に加工されていない、天然に生じる比及び濃度で見出される。したがって、天然に生じるセルラーゼ含有組成物は、例えば、セルロース分解酵素に関する改質を受けていない微生物(天然微生物により天然に生成される場合と比べて酵素成分の比又は濃度が変更されていないものなど)により生成される。「非天然に生じるセルラーゼ含有組成物」は、(1)セルロース分解酵素成分を、天然に生じる比、又は非天然に生じる、すなわち変更された比のいずれかで組み合わせること、あるいは、(2)セルロース分解酵素を1つ以上過剰発現するよう、あるいは過小発現するよう微生物を改変すること、あるいは、(3)セルロース分解性酵素を少なくとも1つ欠失するよう微生物を改変すること、により生成される組成物を指す。「非天然に生じるセルラーゼ含有」組成物は、天然に生じる微生物を非天然条件下で増殖させ、濃度又は比を変更させて酵素を生成させるよう、天然に生じる微生物のための培養条件を調整することで得られる組成物も指す。したがって、一部の実施形態では、本開示の全セルラーゼ調製物では、1つ以上のEG及び/又はCBH及び/又はβ−グルコシダーゼが欠失しており、及び/又は過剰発現している。
全セルラーゼ調製物は、セルロース系材料を加水分解することのできる任意の微生物由来のものであってよい。例えば、全セルラーゼ調製物は、糸状菌の全セルラーゼである。例えば、全セルラーゼ調製物は、アクレモニウム(Acremonium)、アスペルギルス(Aspergillus)、エメリセラ(Emericella)、フザリウム(Fusarium)、ヒュミコラ(Humicola)、ムコール(Mucor)、マイセリオフトラ(Myceliophthora)、ニューロスポラ(Neurospora)、ペニシリウム(Penicillium)、スシタリジウム(Scytalidium)、チエラビア(Thielavia)、トリポクラジウム(Tolypocladium)、又はトリコデルマ属由来のものであり得る。全セルラーゼ調製物は、例えば、アスペルギルス・アキュリタス(Aspergillus aculeatus)、アスペルギルス・アワモリ(Aspergillus awamori)、アスペルギルス・フォエチダス(Aspergillus foetidus)、アスペルギルス・ジャポニクス(Aspergillus japonicus)、アスペルギルス・ニデュランス(Aspergillus nidulans)、アスペルギルス・ニガー(Aspergillus niger)、又はコウジカビ(Aspergillus oryzae)の全セルラーゼである。全セルラーゼ製剤は、フザリウム・バクトリジオイデス(Fusarium bactridioides)、フザリウム・セレアリス(Fusarium cerealis)、(フザリウム・クルックウェレンス(Fusarium crookwellense)、フザリウム・カルモラム(Fusarium culmorum)、フザリウム・グラミネアラム(Fusarium graminearum)、フザリウム・グラミナム(Fusarium graminum)、フザリウム・ヘテロスポラム(Fusarium heterosporum)、フザリウム・ネグンジ(Fusarium negundi)、フザリウム・オキシスポラム、フザリウム・レティクラタム(Fusarium reticulatum)、フザリウム・ロゼウム(Fusarium roseum)、フザリウム・サムブシナム(Fusarium sambucinum)、フザリウム・サルコクロム(Fusarium sarcochroum)、フザリウム・スポロトリキオイド(Fusarium sporotrichioides)、フザリウム・サルフレウム(Fusarium sulphureum)、フザリウム・トルロサム(Fusarium torulosum)、フザリウム・トリコテシオイド(Fusarium trichothecioides)、又はフザリウム・ベネナタム(Fusarium venenatum)の全セルラーゼ調製物であり得る。全セルラーゼ調製物は、ヒュミコラ・インソレンス(Humicola insolens)、ヒュミコラ・ラヌギノサ(Humicola lanuginosa)、ムコール・ミエヘイ(Mucor miehei)、マイセリオフトラ・サーモフィラ(Myceliophthora thermophila)、ニューロスポラ・クラッサ(Neurospora crassa)、ペニシリウム・パープロゲナム(Penicillium purpurogenum)、ペニシリウム・フニクロサム(Penicillium funiculosum)、スシタリジウム・サーモフィラム(Scytalidium thermophilum)、クリソスポリウム・ラックノウエンス(Chrysosporium lucknowence)又はチエラビア・テレストリス(Thielavia terrestris)の全セルラーゼ調製物でもあり得る。更に、全セルラーゼ調製物は、トリコデルマ・ハルジアナム(Trichoderma harzianum)、トリコデルマ・コニンギ(Trichoderma koningii)、トリコデルマ・ロンギブラキアタム(Trichoderma longibrachiatum)、トリコデルマ・リーゼイ(Trichoderma reesei)(例えば、RL−P37(Sheir−Neiss G et al.Appl.Microbiol.Biotechnology,1984,20,pp.46〜53)、QM9414(ATCC No.26921)、NRRL 15709、ATCC 13631、56764、56466、56767)、又はトリコデルマ・ビリデ(Trichoderma viride)(例えば、ATCC 32098及び32086)の全セルラーゼ調製物であってよい。
特に好適な全セルラーゼ調製物は、American Type Culture Collectionからトリコデルマ・リーゼイ(Trichoderma reesei)ATCC 56765として入手可能な、T.リーゼイRutC30全セルラーゼ調製物であり得る。American Type Culture CollectionからP.フニクロサムATCC番号:10446として入手可能な、P.フニクロサムの全セルラーゼも、好適な全セルラーゼ調製物であり得る。更に、全セルラーゼ調製物は、微生物由来の全セルラーゼ調製物であってよく、例えば、バチルス(Bacillus)又は大腸菌(E. coli)由来のものであってよい。
全セルラーゼ調製物は、供給業者から入手することもできる。本開示の方法及び組成物での使用に好適な市販のセルラーゼ調製物の例としては、例えば、CELLUCLAST(商標)及びCellic(商標)(Novozymes A/S)、並びにLAMINEX(商標)BG、IndiAge(商標)44L、Primafast(商標)100、Primafast(商標)200、Spezyme(商標)CP、Accellerase(登録商標)1000、及びAccellerase(登録商標)1500(Danisco US.Inc.,Genencor)が挙げられる。
全セルラーゼ調製物は、セルロース系材料を加水分解することのできる酵素を発現させる、既知の任意の微生物培養法を用い調製することができる。本明細書で使用するとき、用語、「発酵」は、フラスコ振とう培養法、並びに対象とするセルラーゼ及び/又は酵素を発現させる及び/又は単離するような好適な培地及び条件下で実験室用発酵槽又は工業発酵槽で実施される、連続式、バッチ式、フェドバッチ式又は固体状態での発酵などの小規模又は大規模発酵、を指す。
概して、微生物は、セルロース系材料を加水分解することのできる酵素の生成に好適な細胞培養培地で培養される。培養は、当該技術分野において既知の手順及び変法を用いて、炭素源及び窒素源並びに無機塩類を含む好適な栄養培地中で行なわれる。増殖及びセルラーゼ生成に好適な培地、温度範囲及び他の条件が既知である。例えば、T.リーゼイ(T. reesei)にセルラーゼを生産させる際の典型的な温度範囲は24℃〜28℃である。
全セルラーゼ調製物は、全く又はほとんど回復操作及び/又は精製せずに、発酵により生成されたものとして使用することができる。例えば、細胞培養培地にセルラーゼが分泌されたならば、このセルラーゼ含有細胞培養培地を直接使用することができる。全セルラーゼ調製物は、馴化培地(spent cell culture medium)、細胞外酵素及び細胞を含む、未分画の発酵材料成分を含み得る。その一方で、全セルラーゼ調製物は更に、例えば、沈殿、遠心沈降、アフィニティクロマトグラフィー、ろ過、又は同様の操作などの多数の所定の工程で加工することもできる。例えば、全セルラーゼ調製物は、濃縮し、次いで更に精製せずに使用することができる。全セルラーゼ調製物には、例えば、細胞生存率を低下させる、すなわち発酵後に細胞を死滅させる特定の化学製剤を配合することができる。例えば、当該技術分野において既知の方法を用い、細胞を溶解又は透過処理することができる。
全セルラーゼ調製物のエンドグルカナーゼ活性は、基質としてカルボキシメチルセルロース(CMC)を用い測定することができる。好適なアッセイは、酵素混合物がCMCに対して作用することで生成される、還元末端の生成量を測定する。ここで、1ユニットは1μmoL生成物/分を遊離する酵素量である(Ghose,T.K.、Pure & Appl.Chem.1987,59,pp.257〜268)。
全セルラーゼは、β−グルコシダーゼ濃縮セルラーゼ(β-glucosidase-enriched cellulase)であり得る。β−グルコシダーゼ濃縮全セルラーゼは、概してβ−グルコシダーゼと、全セルラーゼ調製物を含む。β−グルコシダーゼ濃縮全セルラーゼ組成物は、組み換え法により生成することができる。例えば、このような全セルラーゼ調製物は全セルラーゼを生産することのできる微生物でβ−グルコシダーゼを発現させることで得ることができる。例えば、β−グルコシダーゼに富む全セルラーゼ組成物は、同様に全セルラーゼ調製物及びβ−グルコシダーゼを含み得る。本明細書に記載の任意のβ−グルコシダーゼポリペプチド、例えば、β−グルコシダーゼのキメラ/融合ポリペプチドなどが好適なものであり得る。例えば、β−グルコシダーゼ濃縮全セルラーゼ組成物は、配合物/組成物中のタンパク質の総重量に基づいて、少なくとも約5重量%、7重量%、9重量%、10重量%、又は14重量%、及び最大で約17重量%、約20重量%、25重量%、30重量%、35重量%、40重量%、又は50重量%のβ−グルコシダーゼを適宜含み得る。
5.3.7.キシラナーゼ& β−キシロシダーゼ
本開示の酵素配合物/組成物は、例えば、1種以上のキシラナーゼを含んでよく、このキシラナーゼはT.リーゼイ(T. reesei)Xyn2、T.リーゼイ(T. reesei)Xyn3、AfuXyn2、又はAfuXyn5であってもよい。好適なT.リーゼイ(T. reesei)Xyn2、T.リーゼイ(T. reesei)Xyn3、AfuXyn2、又はAfuXyn5ポリペプチドを本明細書に記載する。
本開示の酵素配合物/組成物は、所望により1種以上のキシラナーゼに加え、又はこれの代わりに1種以上のキシラナーゼを含む。任意のキシラナーゼ(EC 3.2.1.8)を1種以上の追加のキシラナーゼとして加えてよい。好適なキシラナーゼとしては、例えば、C.サッカロリティカム(C. saccharolyticum)・キシラナーゼ(Luthi et al.1990,Appl.Environ.Microbiol.56(9):2677〜2683)、T.マリティマ(T. maritima)キシラナーゼ(Winterhalter & Liebel,1995,Appl.Environ.Microbiol.61(5):1810〜1815)、サーマトガ菌種(Thermatoga Sp.)FJSS−B.1株キシラナーゼ(Simpson et al.1991,Biochem.J.277,413〜417)、B.サーキュランス(B. circulans)・キシラナーゼ(BcX)(米国特許第5,405,769号)、A.ニガー(A. niger)キシラナーゼ(Kinoshita et al.1995,Journal of Fermentation and Bioengineering 79(5):422〜428)、S.リビダンス(S. lividans)・キシラナーゼ(Shareck et al.1991,Gene 107:75〜82;Morosoli et al.1986 Biochem.J.239:587〜592;Kluepfel et al.1990,Biochem.J.287:45〜50)、枯草菌(B. subtilis)キシラナーゼ(Bernier et al.1983,Gene 26(1):59〜65)、C.フィミ(C. fimi)・キシラナーゼ(Clarke et al.,1996,FEMS Microbiology Letters 139:27〜35)、P.フルオレッセンス(P. fluorescens)・キシラナーゼ(Gilbert et al.1988,Journal of General Microbiology 134:3239〜3247)、C.サーモセラム(C. thermocellum)・キシラナーゼ(Dominguez et al.,1995,Nature Structural Biology 2:569〜576)、B.プミラス(B. pumilus)・キシラナーゼ(Nuyens et al.Applied Microbiologyand Biotechnology 2001,56:431〜434;Yang et al.1998,Nucleic Acids Res.16(14B):7187)、C.アセトブチリカム(C. acetobutylicum)P262・キシラナーゼ(Zappe et al.1990,Nucleic Acids Res.18(8):2179)、又はT.ハルジアナム(T. harzianum)キシラナーゼ(Rose et al.1987,J.Mol.Biol.194(4):755〜756)が挙げられる。
キシラナーゼは、キシラナーゼをコードしている内在性又は外来性遺伝子を発現させることで生産できる。例えば、キシラナーゼは、過剰発現又は低発現させることができる。
本開示の酵素配合物/組成物には、例えば、1種以上のβ−キシロシダーゼを適宜含有させることができる。例えば、β−キシロシダーゼは、第1群のβ−キシロシダーゼ酵素(例えば、Fv3A又はFv43A)又は第2群のβ−キシロシダーゼ酵素(例えば、Pf43A、Fv43D、Fv39A、Fv43E、Fo43A、Fv43B、Pa51A、Gz43A、又はT.リーゼイ(T. reesei)Bxl1)である。例えば、本開示の酵素配合物/組成物には、1種以上の第1群のβ−キシロシダーゼ及び1種以上の第2群のβ−キシロシダーゼを適宜含有させることができる。
本開示の酵素配合物/組成物には、所望により、上記の第1群の及び/若しくは第2群のβ−キシロシダーゼに加えて又はこれの代わりに1種以上のβ−キシロシダーゼを含有させることができる。任意のβ−キシロシダーゼ(EC 3.2.1.37)を追加のβ−キシロシダーゼとして使用することができる。好適なβ−キシロシダーゼとしては、例えば、T.エマーソニィ(T. emersonii)Bxl1(Reen et al.2003,Biochem Biophys Res Commun.305(3):579〜85)、G.ステアロサーモフィルス(G. stearothermophilus)β−キシロシダーゼ(Shallom et al.2005,Biochemistry 44:387〜397)、S.サーモフィラム(S. thermophilum)β−キシロシダーゼ(Zanoelo et al.2004,J.Ind.Microbiol.Biotechnol.31:170〜176)、T.リグノラム(T. lignorum)β−キシロシダーゼ(Schmidt,1998,Methods Enzymol.160:662〜671)、アワモリコウジカビ(A. awamori)β−キシロシダーゼ(Kurakake et al.2005,Biochim.Biophys.Acta 1726:272〜279)、A.バーシカラー(A. versicolor)β−キシロシダーゼ(Andrade et al.2004,Process Biochem.39:1931〜1938)、ストレプトマイセス菌種(Streptomyces sp.)β−キシロシダーゼ(Pinphanichakarn et al.2004,World J.Microbiol.Biotechnol.20:727〜733)、T.マリティマ(T. maritima)β−キシロシダーゼ(Xue and Shao,2004,Biotechnol.Lett.26:1511〜1515)、トリコデルマ菌種(Trichoderma sp.)SY β−キシロシダーゼ(Kim et al.2004,J.Microbiol.Biotechnol.14:643〜645)、A.ニガー(A. niger)β−キシロシダーゼ(Oguntimein and Reilly,1980,Biotechnol.Bioeng.22:1143〜1154)、又はP.ウォルトマニ(P. wortmanni)β−キシロシダーゼ(Matsuo et al.1987,Agric.Biol.Chem.51:2367〜2379)が挙げられる。
β−キシロシダーゼは、β−キシロシダーゼをコードしている内在性又は外来性遺伝子を発現させることで生産できる。β−キシロシダーゼは、一定の条件下で、過剰発現又は低発現させることができる。
5.3.8.L−α−アラビノフラノシダーゼ
本開示の酵素配合物/組成物には、例えば、1種以上のL−α−アラビノフラノシダーゼを適宜含有させることができる。L−α−アラビノフラノシダーゼは、例えば、Af43A、Fv43B、Pf51A、Pa51A、Fv51A、Af43A、Fv43B、Pf51A、Pa51A又はFv51Aポリペプチドである。
本開示の酵素配合物/組成物は、所望により、前述のL−α−アラビノフラノシダーゼに加えて、又はこれの代わりに1種以上のL−α−アラビノフラノシダーゼを含む。任意の好適な生物由来のL−α−アラビノフラノシダーゼ(EC 3.2.1.55)を追加のL−α−アラビノフラノシダーゼとして使用することができる。好適なL−α−アラビノフラノシダーゼとしては、例えば、ニホンコウジカビ(A. oryzae)(Numan & Bhosle,J.Ind.Microbiol.Biotechnol.2006,33:247〜260)、ショウユコウジカビ(A. sojae)(Oshima et al.J.Appl.Glycosci.2005,52:261〜265)、B.ブレビス(B. brevis)(Numan & Bhosle,J.Ind.Microbiol.Biotechnol.2006,33:247〜260)、B.ステアロサーモフィルス(B. stearothermophilus)(Kim et al.,J.Microbiol.Biotechnol.2004,14:474〜482)、B.ブレビ(B. brevei)(Shin et al.,Appl.Environ.Microbiol.2003,69:7116〜7123)、B.ロンガム(B. longum)(Margolles et al.,Appl.Environ.Microbiol.2003,69:5096〜5103)、C.サーモセラム(C. thermocellum)(Taylor et al.,Biochem.J.2006,395:31〜37)、F.オキシスポラム(F. oxysporum)(Panagiotou et al.,Can.J.Microbiol.2003,49:639〜644)、F.オキシスポラムf.菌種ジアンチ(F. oxysporum f. sp. dianthi)(Numan & Bhosle,J.Ind.Microbiol.Biotechnol.2006,33:247〜260)、G.ステアロサーモフィルス(G. stearothermophilus)T−6(Shallom et al.,J.Biol.Chem.2002,277:43667〜43673)、大麦(H. vulgare)(Lee et al.,J.Biol.Chem.2003,278:5377〜5387)、アオカビ(P. chrysogenum)(Sakamoto et al.,Biophys.Acta 2003,1621:204〜210)、ペニシリウム菌種(Penicillium sp.)(Rahman et al.,Can.J.Microbiol.2003,49:58〜64)、Pセルローサ(P. cellulosa)(Numan & Bhosle,J.Ind.Microbiol.Biotechnol.2006,33:247〜260)、R.プシラス(R. pusillus)(Rahman et al.,Carbohydr.Res.2003,338:1469〜1476)、S.シャトリューシス(S. chartreusis)、S.サーモビオラカム(S. thermoviolacus)、T.エタノリカス(T. ethanolicus)、T.キシラニリティカス(T. xylanilyticus)(Numan & Bhosle,J.Ind.Microbiol.Biotechnol.2006,33:247〜260)、T.フスカ(T. fusca)(Tuncer and Ball,Folia Microbiol.2003,(Praha)48:168〜172)、T.マリティマ(T. maritima)(Miyazaki,Extremophiles 2005,9:399〜406)、トリコデルマ菌種(Trichoderma sp.)SY(Jung et al.Agric.Chem.Biotechnol.2005,48:7〜10)、カワチコウジカビ(A. kawachii)(Koseki et al.,Biochim.Biophys.Acta 2006,1760:1458〜1464)、F.オキシスポラムf.菌種ジアンチ(F. oxysporum f. sp. dianthi)(Chacon−Martinez et al.,Physiol.Mol.Plant Pathol.2004,64:201〜208)、T.キシラニリティカス(T. xylanilyticus)(Debeche et al.,Protein Eng.2002,15:21〜28)、H.インソレンス(H. insolens)、M.ギガンテウス(M. giganteus)(Sorensen et al.,Biotechnol.Prog.2007,23:100〜107)、又はR.サチバス(R. sativus)(Kotake et al.J.Exp.Bot.2006,57:2353〜2362)のL−α−アラビノフラノシダーゼが挙げられる。
L−α−アラビノフラノシダーゼは、L−α−アラビノフラノシダーゼをコードしている内在性又は外来性遺伝子を発現させることで生産できる。L−α−アラビノフラノシダーゼは、一定の条件下で過剰発現又は低発現させることができる。
5.3.9.セロビオースデヒドロゲナーゼ
用語「セロビオースデヒドロゲナーゼ」は、アクセプターの存在下でセロビオノ−1,5−ラクトンの還元型アクセプターセロビオースへの変換を触媒する、E.C.1.1.99.18の酸化還元酵素を指す。2,6−ジクロロインドフェノールは、鉄、酸素分子、ユビキノン、又はシトクロムC、又はその他のポリフェノール同様、アクセプターとして機能することができる。セロビオースデヒドロゲナーゼの基質としては、限定するものではないが、セロビオース、セロオリゴ糖、ラクトース、及びD−グルコシル−1,4−β−D−マンノース、グルコース、マルトース、マンノビオース、チオセロビオース、ガラクトシル−マンノース、キシロビオース、及びキシロースが挙げられる。電子供与体としては、還元末端にグルコース又はマンノースを有するβ−1−4ジヘキソン、α−1−4−ヘキソシド、ヘキソース、ペントース、及びβ−1−4−ペントマーが挙げられる。Henriksson et al.,1998,Biochimica et Biophysica Acta−Protein Structure、及びMolecular Enzymology,1383:48〜54;Schou et al.,1998,Biochem.J.330:565〜571を参照されたい。
セロビオースデヒドロゲナーゼの2つのファミリーは、本開示の酵素組成物に適宜含有させることができ、又は本明細書に記載の遺伝子操作を施した宿主細胞ファミリー1及びファミリー2により発現させることができる。この2つのファミリーは、ファミリー1にはセルロース結合モチーフが存在するのに対しファミリー2にはそれが存在しないという点で異なっている。セロビオースデヒドロゲナーゼの3次元構造は2つの球状ドメインを示し、その各々は補因子のヘム又はフラビンのうちのいずれかを含有している。活性部位は2つのドメイン間の間隙に存在する。セロビオースデヒドロゲナーゼの触媒するサイクルは、規則正しく連続する機序に従う。セロビオースからフラビンへの2つの電子の移動により、セロビオースが酸化され、セロビオノ−1,5−ラクトン及び還元型フラビンが生成される。次に、ヘム基への電子の移動により活性型FADが生成され、還元型のヘムが残される。第2の活性部位で基質を酸化させる反応により、天然状態のヘムが再生される。
酸化させる基質は、フェリシアン化鉄、シトクロムC、又は酸化型フェノール化合物であってよく、例えば、比色分析に一般的に使用される基質のジクロロインドフェノール(DCIP)であってよい。金属イオン及びO2も酵素に好適な基質であるものの、これらの基質を使用した場合、セロビオースデヒドロゲナーゼの反応速度は、鉄又は酸化型有機化合物を基質として使用した場合と比較してかなり遅くなる。セロビオノラクトンの生成後、生成物には自発的に開環させて、セロビオン酸を生成することもできる。Hallberg et al.,2003,J.Biol.Chem.278:7160〜66を参照されたい。
5.3.10.他の成分
本開示の遺伝子操作型酵素配合物/組成物は、例えば、更に好ましくはアクセサリタンパク質を1つ以上含む。アクセサリタンパク質の例としては、限定するものではないが、マンナナーゼ(例えば、エンドマンナナーゼ、エキソマンナナーゼ、及びβ−マンノシダーゼ)、ガラクタナーゼ(例えば、エンド型及びエキソ型ガラクタナーゼ)、アラビナーゼ(例えばエンド型アラビナーゼ及びエキソ型アラビナーゼ)、リグニナーゼ、アミラーゼ、グルクロニダーゼ、プロテアーゼ、エステラーゼ(例えば、フェルラ酸エステラーゼ、アセチルキシランエステラーゼ、クマリン酸エステラーゼ又はペクチンメチルエステラーゼ)、リパーゼ、その他グリコシドヒドロラーゼ、キシログルカナーゼ、CIP1、CIP2、スオレニン(swollenins)、エクスパンシン(expansins)、及びセルロース破壊タンパク質が上げられる。特定の実施形態では、セルロース破壊タンパク質はセルロース結合モジュールである。
5.4.方法及び工程
したがって、本開示は、ヘミセルロース及び場合によりセルロースを含む、バイオマス材料の糖化工程を更に提供する。代表的なバイオマス材料としては、限定するものではないが、トウモロコシ穂軸、スイッチグラス、サトウモロコシ、及び/又はバガスが挙げられる。したがって、本開示は、ヘミセルロース及び場合によりセルロースを含む本明細書に記載のバイオマス材料を、本明細書に記載されるとおりの酵素配合物/組成物により処理する工程を含む、糖化工程を提供する。本発明のこのような工程で使用される酵素配合物/組成物は、キシラナーゼ活性を有するポリペプチドを、バイオマス材料中のヘミセルロース1kgにつき、1g〜40g(例えば、2g〜20g、3g〜7g、1g〜5g、又は2g〜5g)含有する。このような工程で使用される酵素配合物/組成物には、β−キシロシダーゼ活性を有するポリペプチドを、バイオマス材料中のヘミセルロース1kgあたり1g〜50g(例えば、2g〜40g、4g〜20g、4g〜10g、2g〜10g、3g〜7g)含有させてもよい。このような工程で使用される酵素配合物/組成物には、L−α−アラビノフラノシダーゼ活性を有するポリペプチドを、バイオマス材料中のヘミセルロース1kgあたり0.5g〜20g(例えば、1g〜10g、1g〜5g、2g〜6g、0.5g〜4g、又は1g〜3g)含有させてもよい。酵素配合物/組成物には、セルラーゼ活性を有するポリペプチドを、バイオマス材料中のセルロース1kgあたり1g〜100g(例えば、3g〜50g、5g〜40g、10g〜30g、又は12g〜18g)含有させてもよい。所望により、β−グルコシダーゼ活性を有するポリペプチドの量は、セルラーゼ活性を有するポリペプチドの総重量の最大で50%を構成する。
本発明の好適な工程は、好ましくは、処理されるバイオマス材料のヘミセルロースキシランから、収率60%〜90%でキシロースを生成する。好適なバイオマス材料としては、例えば、トウモロコシ穂軸、スイッチグラス、サトウモロコシ、及び/又はバガスのうちの1種以上が挙げられる。このようなものとして(As suich)、本発明の工程は、好ましくは、これらの1種以上のバイオマス材料由来のヘミセルロースキシランから、少なくとも収率70%(例えば、少なくとも75%、少なくとも80%)でキシロースを生成する。例えば、本工程により、限定するものではないが、トウモロコシ穂軸、スイッチグラス、サトウモロコシ、及び/又はバガスなどの、ヘミセルロースを含むバイオマス材料のヘミセルロースキシランから、収率60%〜90%でキシロースが生成される。
本発明の工程には、所望により、更に単糖を回収する工程を包含させる。バイオマスの糖化だけではなく、本開示の酵素及び/又は酵素配合物は、工業用、農業用、食品及び飼料、並びに食品及び飼料用サプリメントの加工工程に使用することができる。適用例を以下に記載する。
5.4.1.木材、紙材及びパルプ処理
本開示の酵素、酵素配合物/組成物及び方法は、木材、木製品、木材廃棄物又は副産物、紙材、紙製品、紙パルプ若しくは木材パルプ、クラフトパルプ、又は木材若しくは紙材の再利用処理又は工業加工に使用することができる。これらの工程には、例えば、木材、木材パルプ、古紙、紙材、若しくはパルプを処理する工程又は木材若しくは紙材に脱インキさせる工程が包含される。本開示の酵素、酵素配合物/組成物は、例えば、紙パルプ、又は再生紙若しくは再生紙パルプなどの処理/前処理に使用することができる。紙材、パルプ、再生紙又は紙パルプの処理/前処理材に含有させる場合、本開示の酵素、酵素配合物/組成物は、紙の輝度を上昇させるために利用することができる。紙材の等級がより高くなるにつれ輝度はより高くなるものと見なせる。輝度は、光学走査装置による走査性能を付与する。このような場合、酵素、酵素配合物/組成物及び方法/工程は、インクジェット紙、レーザー用紙、及びフォトプリント用紙などの高級「上白」紙(“bright” papers)を製造するのに使用できる。
本開示の酵素、酵素配合物/組成物は、例えば、木材、綿、麻、亜麻又はリネン由来の繊維などの、数多くのその他のセルロース材料を加工又は処理するのに使用できる。
したがって、本開示は、本開示の酵素、酵素配合物/組成物を用いる木材、木材パルプ、紙材、紙パルプ、古紙、又は木材若しくは紙材の再生利用処理工程を提供する。
本開示の酵素、酵素配合物/組成物は、例えば新聞紙などの、印刷面を持つ古紙の脱インキ、又は非接触式に印刷された印刷面を持つ古紙、例えば、乾式電子写真方式でレーザープリントされた印刷面を持つ古紙の脱インキ、並びに接触式及び非接触式の印刷を組み合わせて印刷された印刷面を持つ古紙の脱インキに使用することができる(米国特許第6,767,728号又は同第6,426,200号;Neo,J.Wood Chem.Tech.1986,6(2):147)。また、パルプが含有しているキシランを液相に抽出し、得られた液相中のキシランを、キシランをキシロースに加水分解するのに十分な条件で処理し、キシロースを回収する工程を包含する手順において、製紙等級の広葉樹材製パルプからキシロースを生成する際にも使用することができる。例えば、抽出工程には、パルプ又はアルカリ可溶性材料の水性懸濁液を酵素又は酵素配合物/組成物により少なくとも1回処理することを包含させることができる(米国特許第6,512,110号を参照されたい)。本開示の酵素、酵素配合物/組成物は、広葉樹繊維、広葉樹繊維及び針葉樹繊維の混合物、古紙、例えば、米国特許第6,254,722号に記載されるような、未印刷の封筒、脱インキした封筒、未印刷の帳簿用紙、脱インキした帳簿用紙、及び同様物、からなる再生紙製品などのセルロース系繊維から、パルプを溶解させるために使用することができる。
5.4.2.繊維類及び繊維製品の処理
本開示は、本開示の酵素、酵素配合物/組成物を1種以上用い、繊維類及び布地を処理する方法を提供する。酵素、酵素配合物/組成物は、当該技術分野において既知である任意の繊維又は布地処理法に使用することもできる。例えば、米国特許第6,261,828号;同第6,077,316号;同第6,024,766号;同第6,021,536号;同第6,017,751号;同第5,980,581号;米国特許公報第20020142438(A1)号を参照されたい。例えば、本開示の酵素、酵素配合物/組成物は、繊維及び/又は布地の湯通し(desizing)に使用できる。例えば、溶液中で、布地を本開示の酵素又は酵素配合物/組成物と接触させる工程を含む方法により、布地の手触り及び外観を向上させることができる。所望により、布地は圧力下で溶液により処理される。本開示の酵素、酵素配合物/組成物は、染みを除去させる際にも使用できる。
本開示の酵素、酵素配合物/組成物は、繊維(例えば、綿、麻、亜麻又はリネン製繊維)、縫製した布地及び未縫製の布地、例えば、編物、織布、デニム生地、糸、並びに綿製の、綿混の、又は天然の若しくは人工のセルロース若しくはこれらのブレンドから製造されたタオルを含む、その他の数多くのセルロース系材料を処理するために使用することができる。繊維製品の処理工程は、例えば、こすり洗い及び/又は漂白などの、繊維製品のその他の処理法と共に使用することができる。例えば、こすり洗いは、綿繊維から非セルロース系材料、例えば、角質(主にワックスからなる)及び一次細胞壁(主にペクチン、タンパク質及びキシログルカンからなる)を除去する。
5.4.3.食品処理及び食品加工
本開示の酵素、酵素配合物/組成物は、食品加工業において数多くの用途を有する。例えば、含油量の多い植物材料からの、例えば、含油量の多い種からの油の抽出を向上するのに使用できる。本開示の酵素、酵素配合物/組成物は、大豆由来の大豆油、オリーブ由来のオリーブ油、菜種由来の菜種油、又はヒマワリ由来のヒマワリ油を抽出するのに使用できる。
本開示の酵素、酵素配合物/組成物は、植物細胞材料の成分を分離する際にも使用できる。例えば、植物細胞の各成分を分離する際に使用できる。本開示の酵素、酵素配合物/組成物は、作物からタンパク質、油、及び外皮画分を分離する際にも使用できる。分離工程は、既知の手法を用い実施することができる。
本開示の酵素、酵素配合物/組成物は、上記の使用法に加え、果汁又は野菜汁、シロップ、及び抽出液などの調製時の収率を向上させるために使用することができる。植物細胞壁に由来する様々な材料、又は廃棄物、例えば、穀類(cereals)、穀物(grains)、ワイン、又はジュース製品、又は農業廃棄物、例えば、野菜のへた(hull)、豆のさや、サトウダイコンパルプ、オリーブパルプ、ポテトパルプ、及び同様物の酵素処理に使用することもできる。更に、加工した果実又は野菜の稠度及び/又は外観を改良するために使用することができる。植物材料を処理する際に、植物材料(例えば、食品など)の加工、植物成分の精製又は抽出を容易にするために使用することができる。本開示の酵素及び配合物/組成物を使用することで、栄養価を改良すること、水結合能を低下させること、排水プラント内での分解性能を改良すること、及び/又は植物材料をエンシレージに変換する変換効率を改良することなどが可能になる。
本明細書に記載の酵素、酵素配合物/組成物は、焼成用途に使用できる。例えば、機械による取り扱い及びビスケット大への成形が難しくない、粘り気の少ないパン生地を作製する際に使用できる。焼成した製品が急速に再水和され、サクサク感が損なわれたり及び品質保持期限が短縮されたりするのを防ぐ目的で、アラビノキシランを加水分解するために使用することもできる。例えば、パン生地の加工時に添加剤として使用される。
5.4.4.動物用飼料及び食品又は飼料添加物又は食品添加物
本開示の酵素及び配合物/組成物を用い、動物用飼料/食品及び食品又は食品添加物(サプリメント)を処理する際の方法が提供される。動物には、哺乳動物(例えば、ヒト)、鳥類、及び魚類などが包含される。本開示は、本開示の酵素及び酵素配合物/組成物を含む動物用飼料、食品及び添加物(サプリメント)を提供する。酵素を用い動物用飼料、食料及び添加物を処理することで、動物用飼料又は添加物(サプリメント)中の栄養素の、例えば、デンプン、タンパク質、及び同様物の利用効率を増加させることができる。難分解性タンパク質を消化することで、又は間接的に若しくは直接的にデンプン(又は他の栄養素)を脱マスキングすることで、酵素及び配合物/組成物は、栄養素を他の内在性又は外来性の酵素にとって利用しやすいものにする。これらの酵素は、容易に消化できかつ容易に吸収することのできる栄養素及び糖を、単に生成することもできる。
動物用飼料に添加する場合、本開示の酵素、酵素配合物/組成物は、腸の粘度を低下させることによりインビボでの植物細胞壁材料の分解性を改善し(例えば、Bedfordet al.、Proceedings of the 1st Symposium on Enzymes in Animal Nutrition,1993,pp.73〜77を参照されたい)、これにより植物栄養素を動物にとってより利用しやすいものにする。したがって、飼料に本開示の酵素、酵素配合物/組成物を使用することで、動物の成長速度及び/又は飼料効率(すなわち、体重増加に対する飼料摂取重量)を改良することができる。
本開示の動物用飼料用添加物は、飼料成分と容易に混合することのできる粒状酵素製品であり得る。あるいは、本開示の食事用添加物は、プレミックス成分を形成し得る。本開示の粒状酵素製品は、コーティングしてもしなくてもよい。酵素粒剤の粒径は、飼料及び/又はプレミックス成分の粒径と混合可能なものである。このような酵素粒剤は、酵素を飼料に組み込むのに安全でかつ容易な手段を提供する。あるいは、本開示の動物用飼料添加物は、安定化された液体組成物であり得る。この液体組成物は、水系又は油系スラリーであり得る。例えば、米国特許第6,245,546号を参照されたい。
本開示の酵素、酵素配合物/組成物は、例えば、穀物、穀類、トウモロコシ、大豆、ナタネ、ルピナス及び同様物などの、遺伝子組み換え飼料作物(例えば、遺伝子組み換え植物、種及び同様物など)で直接発現させた酵素により供給され得る。上記のように、本開示は、本開示のポリペプチドをコードしている核酸配列を含む遺伝子組み換え植物、植物部位及び植物細胞を提供する。核酸は、本開示の酵素が回収可能な量で産生されるように発現する。キシラナーゼは、任意の植物、又は植物部位から回収することができる。あるいは、組み換えポリペプチドを含有している植物、又は植物部位は、それ自体が、食品、又は飼料の品質の改善のために、例えば、栄養価、味、及びレオロジー特性が改善のために、又は栄養のない要素を破壊するために使用することもできる。
本開示は、動物種により消費される前に、本開示の酵素、酵素配合物/組成物を用いて飼料からオリゴ糖を除去するような方法を提供する。このプロセスでは、代謝可能なエネルギー価が増加した飼料が作製される。本開示の酵素、酵素配合物/組成物に加えて、ガラクトシダーゼ、セルラーゼ及びこれらの組み合わせを使用できる。
他の態様では、本開示は、本開示の組み換え酵素を含有している栄養補助サプリメントを調製し、栄養補助サプリメントを動物に投与することで、動物により消化される食物中に含有されているヘミセルラーゼの利用を増加させることにより、本開示の酵素酵素配合物/組成物を、栄養サプリメントとして動物用飼料に利用する方法を提供する。
5.4.5廃棄物処理
本開示の酵素、酵素配合物/組成物は、その他の各種工業用途、例えば、廃棄物処理に使用できる。例えば、一態様では、本開示は、本開示の酵素、酵素配合物/組成物を用いる固体ゴミの消化工程を提供する。この方法は、実質的に未処理の固体ゴミの質量及び体積を減少させることを含み得る。固体ゴミは、酵素溶液の存在下で(本開示の酵素、酵素配合物/組成物を含む)、制御温度下での、酵素による消化プロセスにより処理することができる。この処理は、添加した微生物に由来する、感知され得るようなバクテリア発酵以外の反応によるものである。固体ゴミを、液化ゴミ及び残渣固形ゴミに変換させる。生じる液化ゴミを、前述の任意の残渣固化ゴミから分離することができる。例えば、米国特許第5,709,796号を参照のこと。
5.4.6洗剤、殺菌剤及びクリーニング組成物
本開示は、本開示の酵素、酵素配合物/組成物を1種以上含む洗剤、殺菌剤、又はクレンザー(クリーニング、又はクレンジング)組成物、並びにこれらの組成物の製造方法及び使用方法を提供する。本開示は、洗剤、殺菌剤、又はクレンザー組成物の全ての既知の製造方法及び使用方法を組み込むものであり、例えば、米国特許第6,413,928号;同第6,399,561号;同第6,365,561号;同第6,380,147号を参照されたい。
特定の実施形態では、洗剤、殺菌剤、又はクレンザー組成物は、1部及び2部式の水性組成物、非水性液体組成物、鋳造固体、顆粒形態、粒子形態、圧縮錠、ゲル及び/又はペースト並びにスラリー形態であり得る。本開示の酵素、酵素配合物/組成物は、固体、又は液体形態の、洗剤、殺菌剤、又はクレンザー添加剤製品として使用することもできる。このような添加剤製品は、従来の洗剤組成物の性能を補う、又は強化することが意図されるものであり、クリーニングプロセスの任意の工程で添加することができる。
本開示は、硬質表面をクリーニングするための洗剤組成物、布地クリーニング用の洗剤組成物、食器洗浄用組成物、口腔洗浄用組成物、義歯洗浄用組成物、及びコンタクトレンズ洗浄液を包含するクリーニング組成物を提供する。
本開示の酵素が、洗濯機による洗浄法に使用するのに好適な組成物の成分である場合、組成物は、本開示の酵素、酵素配合物/組成物に加え、界面活性剤及びビルダー化合物の両方を含み得る。これらには更に、1種以上の洗剤成分、例えば、有機高分子化合物、漂白剤、追加の酵素、抑泡剤、分散剤、酸化カルシウム石鹸分散剤(lime-soap dispersants)、汚れ懸濁剤及び再付着防止剤、並びに腐食防止剤を含み得る。
本開示の洗濯用組成物には、追加の洗剤成分として柔軟剤を含有させることもできる。カルボヒドラーゼを含有しているこのような組成物は、洗濯洗剤組成物として処方された場合に布地洗浄、染み除去、白色度の維持、柔軟化、顕色、移染防止及び衛生化を提供し得る。
5.4.7.工業用方法、商用方法及びビジネス方法
本開示のセルラーゼ及び/又はヘミセルラーゼ組成物は、更に、工業的及び/又は商業的環境に使用できる。したがって、方法、すなわちインスタント式セルラーゼ及び非天然に得られるセルラーゼ及び/又はヘミセルラーゼ組成物の製造、販売、あるいは市販方法も企図される。
特定の実施形態では、セルラーゼポリペプチドとしては、例えば、エンドグルカナーゼポリペプチド(例えば、T.リーゼイ(T. reesei)Eg4ポリペプチドなどのGH61エンドグルカナーゼ)、β−グルコシダーゼポリペプチド(例えば、本明細書に記載のPa3D、Fv3G、Fv3D、Fv3C、Tr3A、Tr3B、Te3A、An3A、Fo3A、Gz3A、Nh3A、Vd3A、Pa3G及びTn3Bポリペプチド、このポリペプチドは、配列番号54、56、58、60、62、64、66、68、70、72、74、76、78、及び79のうちの任意の配列と少なくとも約60%配列同一性を有する、及び/又は少なくとも2種のβ−グルコシダーゼ配列を含む融合/キメラポリペプチド、このポリペプチドの第1のβ−グルコシダーゼ配列は少なくともアミノ酸残基約200個分の長さであり、かつ配列番号96〜108のうちの1つ以上又は全てを含むのに対し、第2のβ−グルコシダーゼ配列は、少なくともアミノ酸残基約50個分の長さであり、かつ配列番号109〜116のうちの1つ以上又は全てを含む)、セロビオヒドロラーゼポリペプチド、及びヘミセルロースポリペプチド、例えばβ−キシロシダーゼポリペプチド、キシラナーゼポリペプチド、及びL−α−アラビノフラノシダーゼポリペプチド、が挙げられ、並びに上記ポリペプチドを含むセルラーゼ組成物及び/又はヘミセルラーゼ組成物は、特定のエタノール(バイオエタノール)精製業者又はその他のバイオケミカル又はバイオマテリアル製造業者に供給又は販売することができる。第1の例では、非天然に得られるセルラーゼ及び/又はヘミセルラーゼ組成物は、工業規模での酵素の製造に特化した酵素製造施設で製造することができる。次に、非天然に得られるセルラーゼ及び/又はヘミセルラーゼ組成物は包装することができ、又は酵素製造業に関係する顧客に販売することができる。本明細書では、この運用戦略を「商用酵素供給モデル」と呼ぶ。
他の運用戦略では、本発明の非天然に得られるセルラーゼ及びヘミセルラーゼ組成物は、バイオエタノール精製所又はバイオケミカル/バイオマテリアル製造所(「オン・サイト」)に又はその周辺に位置する施設で酵素製造業者により構築される酵素生産系に関係する形態で生産することができる。一部の実施形態では、酵素の供給契約は、酵素製造業者と、バイオエタノール精製業者又は生化学的/バイオマテリアル製造業者とにより締結される。酵素製造業者は、本明細書に記載されるとおりの、現場で宿主細胞を用いる酵素生産系、発現方法、及び生産方法を設計し、制御し、操作して、非天然に得られるセルラーゼ及び/又はヘミセルラーゼ組成物を生産する。特定の実施形態では、好適なバイオマスに対し好ましくは本明細書に記載のとおりに適切に前処理を行い、バイオエタノール精製所又は生化学的/バイオマテリアル製造施設にて、又はその付近で、糖化方法並びに本明細書の酵素及び/又は酵素組成物を用いて加水分解することができる。次に、得られる発酵性糖質を用い、同じ施設で、又は近隣の施設で発酵を行うことができる。この運用戦略を、本明細書では「オン・サイト・バイオリファイナリーモデル」と呼ぶ。
オン・サイト・バイオリファイナリーモデルは、例えば、酵素供給業者から購入する必要のある酵素を最小限に抑える自給自足型運用法を提供するなど、酵素の商用供給モデルに対し一定の利点を提供する。その他に、このモデルにより、バイオエタノール精製所又は生化学的/バイオマテリアル製造施設は、リアルタイムでの又はほぼリアルタイムでの要求に応じ酵素の供給をより良好に調節しやすくなる。特定の実施形態では、互いに近接している2箇所以上のバイオエタノール精製所及び/又は生化学的/バイオマテリアル製造所間で共有することのできる、オン・サイトの酵素生産設備が企図され、この様な設備により、酵素の輸送及び貯蔵費用が削減される。更に、このモデルでは、オン・サイトの酵素生産設備を改良した、より近接した「差し込み(drop-in)」法が可能になり、この手法では、酵素組成物を改良してから、発酵性糖質、究極的にはバイオエタノール又はバイオケミカルをより高収率で生産するまでのタイムラグが減少する。
オン・サイト・バイオリファイナリーモデルは、本明細書に記載のセルラーゼ及び非天然に得られるヘミセルラーゼ組成物だけでなく、デンプン(例えば、トウモロコシ)をより効率的にかつ有効に加工してバイオエタノール/バイオケミカルへと直接変換させることのできるこれらの酵素及び酵素組成物も、製造、供給、及び生産に使用することのできる、バイオエタノール及びバイオケミカルの工業生産及び商業化においてより一般的な適用法を有する。特定の実施形態では、デンプン加工酵素は、オン・サイト・バイオリファイナリーで製造した後、バイオエタノールを製造する目的で容易にバイオエタノール精製所又は生化学的/生物材料製造施設に組み入れることができる。
したがって、特定の態様では、本発明は、特定のバイオエタノール、バイオ燃料、バイオケミカル又はその他のバイオマテリアルの製造及び市販時に、本明細書に記載の酵素(例えば、特定のβ−グルコシダーゼポリペプチド(変異体(variants)、変異体(mutants)又はキメラポリペプチド)、及び特定のGH61エンドグルカナーゼ(変異体(variants)、及び変異体(mutants)など))、細胞、組成物、並びに工程を提供する、特定のビジネス方法にも関係する。一部の実施形態では、本発明は、オン・サイト・バイオリファイナリーモデルでのこのような酵素、細胞、組成物及びプロセスの利用に関する。他の実施形態では、本発明は、商用酵素供給モデルでのこのような酵素、細胞、組成物及びプロセスの利用に関する。
6.1 実施例1:アッセイ/方法
以下のアッセイ/方法を、概して、以降に記載の実施例において使用した。以下に提供するプロトコルに由来する任意の変法を、具体例に示す。
6.1.1.A.バイオマス基質の前処理
酵素により加水分解する前に、国際公開第06110901(A)号に記載の方法及び加工条件により、トウモロコシ穂軸、トウモロコシ茎葉、及びスイッチグラスを前処理した(別途記載がない限りこの手法による)。前処理についてのこれらの参照は、米国特許第2007−0031918(A1)号、同第2007−0031919(A1)号、同第2007−0031953(A1)号、及び/又は同第2007−0037259(A1)号の開示にも包含される。
アンモニア繊維爆砕した(AFEX)トウモロコシ茎葉を、国際ミシガン・バイオテクノロジー協会(Michigan Biotechnology Institute International(MBI))から得た。トウモロコシ茎葉の組成は、国際再生可能エネルギー機関(National Renewable Energy Laboratory)(NREL)の手法(NREL LAP−002)を用い測定した(Teymouri,F et al.Applied Biochemistry and Biotechnology,2004,113:951〜963)。NRELの手順は:http://www.nrel.gov/biomass/analytical_procedures.htmlにて利用できる。
FPPパルプ及び紙材基質は、SMURFIT KAPPA CELLULOSE DU PIN(フランス)から得た。
蒸気爆砕させたサトウキビバガス(SEB)をSunOptaから得た(Glasser,WG et al.Biomass and Bioenergy 1998,14(3):219〜235;Jollez,P et al.Advances in thermochemical biomass conversion,1994,2:1659〜1669)。
6.1.2.B.バイオマスの組成分析
「バイオマス中の糖及びリグニンの構造決定」[National Renewable Energy Laboratory,Golden,CO 2008(http://www.nrel.gov/biomass/pdfs/42618.pdf)]に記載の2段階酸加水分解法を使用し、バイオマス基質の組成を測定した。変換率(%)を基質の初期グルカン及びキシラン含量を元にした理論収量と比較して、上記手法を用いた酵素加水分解の結果を本明細書に報告する。
6.1.3.C.総タンパク質のアッセイ
BCAタンパク質アッセイは、タンパク質濃度を分光光度計により測定する比色分析法である。製造元の指示に従って、BCAタンパク質アッセイキット(Pierce Chemical、製品番号23227)を使用した。50mM酢酸ナトリウム緩衝液(pH 5)を用い、試験チューブに酵素希釈物を調製した。15%トリクロロ酢酸(TCA)1mLを含有させた2mLのエッペンドルフ遠心分離チューブに、希釈酵素溶液(0.1mL)を加えた。チューブをボルテックスにかけ、10分間アイスバスに置いた。次にこのサンプルを、14000rpmで6分遠心分離させた。上清を除去し、ペレットを1mLの0.1N NaOHに再懸濁し、ペレットが溶解するまでこのチューブをボルテックスにかけた。2mg/mL原液からBSA標準液を調製した。0.5mLの試薬Bと25mLの試薬Aとを混合し、BCA希釈溶液を調製した。酵素を再懸濁させたサンプルを、3本のエッペンドルフ遠心分離チューブに0.1mLずつ分注した。サンプルを入れた各エッペンドルフチューブと、BSA標準を入れたエッペンドルフチューブに、2mLのPierce BCA working solutionを加えた。全てのチューブを37℃のウォーターバスで30分インキュベートした。次にサンプルを室温に冷却し(15分)、分光光度計により562nmで吸光度を測定した。
各標準に関し、タンパク質吸光度の平均値を算出した。吸光度をx軸にとり、濃度(mg/mL)をy軸にとって、タンパク質標準の平均値をプロットした。各点は等式:
y=mx+bと一致した。
未希釈濃度の酵素サンプルに関しては、x軸の吸光度を減算して算出した。総タンパク濃度は、希釈係数を乗じて算出した。
精製試料に含まれる総タンパク質量は、A280により測定した(Pace,CN,et al.Protein Science,1995,4:2411〜2423)。
ヴァイクセルバウム(Weichselbaum)及びゴルナール(Gornall)により改変されたビウレット法により、ウシ血清アルブミンを標準物質として用い、一部のタンパク質サンプルを測定した(Weichselbaum,T.Amer.J.Clin.Path.1960,16:40;Gornall,A.et al.J.Biol.Chem.1949,177:752)。
発酵産物中の総タンパク含量は、場合により、ケルダール法(rtech laboratories,www.rtechlabs.com)又は研究室内でDUMAS法(TruSpec CN,www.leco.com)(Sader,A.P.O.et al.,Archives of Veterinary Science,2004,9(2):73〜79)のいずれかを用い、燃焼、並びに放出窒素の捕捉及び測定により総窒素量として測定した。タンパク質を含有している複雑なサンプル(例えば、発酵ブロスなど)については、平均N含量は16%とし、窒素からタンパク質への平均係数は6.25とした。場合によっては、総沈殿タンパク質を測定し、タンパク質以外に由来する窒素による干渉を除外した。最終濃度が12.5%になるようTCAを用い、タンパク質を含有しているTCAペレットを0.1M NaOHに再懸濁した。
場合によっては、製造元の推奨に従って、ベターブラッドフォードアッセイ(Better Bradford Assay)(Thermo Scientific,Rockford,IL製品番号23238)としても知られるクーマシープラスを使用した。
6.1.4 D.ABTSを用いるグルコース測定
グルコース測定用の、ABTS(2,2’−アジノ−ビス(3−エチレンチアゾリン−6)−スルホン酸)アッセイは、グルコース酸化酵素が、O2の存在下では、グルコースの酸化を触媒しつつ化学量論量の過酸化水素(H2O2)を生成するという原理に基づくものであった。この反応後、西洋ワサビペルオキシダーゼ(HRP)によりABTSの酸化を触媒する。この反応はH2O2の濃度に直接相関する。酸化ABTSの発生は、緑色の発色により示される。この発色をOD 405nmで定量する。暗所で、50mM酢酸ナトリウム緩衝液(pH 5.0)に2.74mg/mLのABTS粉末(Sigma)と0.1U/mLのHRP(Sigma)と1U/mLのグルコース酸化酵素(OxyGO(登録商標)HP L5000,Genencor,Danisco USA)とを混合した混合液を調製し、保管した。50mMの酢酸ナトリウム緩衝液(pH 5.0)を用い、グルコース標準(0、2、4、6、8、10nmol)を調製した。各96ウェル平底マイクロタイタープレートに、10μLの標準を3ウェルずつ加えた。段階希釈したサンプル10μLもプレートに加えた。各ウェルに100μLのABTS基質溶液を加え、プレートを分光光度式プレートリーダーに配置した。ABTSの酸化を405nmで5分読み取りした。
あるいは、50mMの酢酸ナトリウム緩衝液(pH 5.0)及び2% SDSを含有させた停止液を用い反応を停止させた後、15〜30分インキュベートし、サンプルの405nmでのODを測定した。
6.1.5.E.HPLCによる糖分析
0.22μmナイロンSpin−X遠心チューブフィルタ(Corning,Corning,NY)による遠心ろ過を用い不溶性の成分を除去し、蒸留水を用い可溶性糖類を所望の濃度に希釈して、トウモロコシ穂軸の糖化加水分解物からサンプルを調製した。6×50mm SH−1011Pガードカラム(www.shodex.net)を取り付けたShodex Sugar SH−G SH1011,8×300mmで単糖類を測定した。0.01NのH2SO4を溶媒として使用し、流速0.6mL/minでクロマトグラフィーを実施した。カラム温度は50℃に維持し、屈折率を基に検出を行った。あるいは、糖の量は、Biorad Aminex HPX−87Hカラムを取り付けたWaters 2410屈折率検出器を用い分析した。分析時間は約20分であり、注入体積は20μLであり、移動相には、0.2μmフィルタによりろ過し脱気した0.01Nの硫酸を流速0.6mL/minで用い、カラム温度は60℃に維持した。グルコース、キシロース、及びアラビノースの外部標準を各サンプルセットに関し溶出させた。
分子ふるいクロマトグラフィーを用い糖を分離し、オリゴ糖を同定した。Tosoh Biosep G2000PWカラム(7.5mm×60cm)を使用した。蒸留水を使用して糖を溶出させた。流速は0.6mL/minとし、室温のカラムで実施した。六炭糖の標準としては、スタキオース、ラフィノース、セロビオース及びグルコースが挙げられ;五炭糖の標準としては、キシロヘキソース、キシロペントース、キシロテトロース、キシロトリオース、キシロビオース、及びキシロースが挙げられる。キシロオリゴマー標準は購入した(Megazyme)。屈折率を基に検出を行った。結果の記録には、ピーク面積単位又は相対的なピーク面積のいずれかを使用した。
遠心分離及びろ過清澄(上記のとおり)したサンプルを加水分解し、可溶性糖類の総量を測定した。清澄化させた試料は、0.8NのH2SO4により1:1希釈した。得られた溶液をバイアル瓶に入れ、蓋をし、121℃で1時間オートクレーブ処理した。加水分解時の単糖類の損失について補正を行わずに結果を報告する。
6.1.6.F.穂軸からのオリゴマーの調製及び酵素アッセイ
希アンモニアで前処理した乾燥重量250gのトウモロコシ穂軸と、8mgのT.リーゼイ(T. reesei)Xyn3と、1gのグルカン+キシランと、を50mMの酢酸ナトリウム緩衝液(pH 5.0)に加え、インキュベートして、トウモロコシ穂軸をT.リーゼイ(T. reesei)Xyn3により加水分解させ、オリゴマーを調製した。180rpmで回転振とうさせながら、48℃で72時間反応を進行させた。上清を9,000×Gで濃縮させ、次に0.22μm Nalgeneフィルタによりろ過し、可溶性糖類を回収した。
6.1.7.G.トウモロコシ穂軸の糖化アッセイ
特定の変法を示す特定の実施例を除き、本明細書における典型例では、以降の手順に従って、マイクロタイタープレート形式でトウモロコシ穂軸の糖化アッセイを実施した。バイオマス基質、例えば、希アンモニアで前処理したトウモロコシ穂軸を水に希釈し、硫酸によりpH 5に調整して7%セルローススラリーを調製し、更なる加工は行わずに本アッセイに使用した。トウモロコシ穂軸中のセルロース1gあたりの総タンパク質量(mg)を基に、酵素サンプルを充填した(上掲の従来の組成解析法を用い測定した)。50mMの酢酸ナトリウム(pH 5.0)により酵素を希釈し、所望の充填濃度を得た。希アンモニアで前処理したトウモロコシ穂軸70mg(各ウェル7%セルロース)に、40μLの酵素溶液を加えた(各ウェルのセルロースの最終濃度は4.5%相当になる)。次に、アッセイプレートをアルミニウム製プレートシーラーで覆い、室温で混合し、50℃、200rpmで3日間インキュベートした。インキュベーション時間の終了時に、各ウェルに100mMグリシン緩衝液(pH10.0)を100μL加え、糖化反応を停止させ、プレートを3,000rpmで5分遠心分離した。96ウェルHPLCプレート中で、10μLの上清に200μLのミリQ水を添加し、可溶性糖類をHPLCにより測定した。
6.1.8.H.セロビオース加水分解アッセイ
Ghose,T.K.Pure and Applied Chemistry,1987,59(2),257〜268の手法を用い、セロビアーゼ活性を測定した。セロビオース単位(Ghoseが記載のとおりに誘導)は、アッセイ条件下で0.1mgグルコースを生成させるのに必要な酵素量により除算し、0.815として定義した。
6.1.9.I.クロロ−ニトロ−フェニル−グルコシド(CNPG)加水分解アッセイ
マイクロタイタープレートの各ウェルに、50mMの酢酸ナトリウム緩衝液(pH 5)200μLを加えたプレートを覆い、エッペンドルフ・サーモミキサーにおいて37℃で15分平衡化させた。個々のウェルに、50mMの酢酸ナトリウム緩衝液(pH 5)で希釈した5μLの酵素も加えた。プレートを再度覆い、37℃で5分間平衡化させた。ミリポア水を用い、2mMの2−クロロ−4−ニトロフェニル−β−D−グルコピラノシド(CNPG,Rose Scientific Ltd.,Edmonton,CA)20μLを調製し、各ウェルに加え、プレートを手早く分光光度計(SpectraMax 250,Molecular Devices)に移した。OD 405nmで15分間動態を読み取り、データをVmaxとして記録した。CNPの吸光係数を用い、Vmaxの単位をOD/secからμM CNP/secへと変換した。μM CNP/secを、本アッセイで使用したタンパク質酵素量(mg)で除算し、比活性(μM CNP/sec/タンパク質(mg))を割り出した。
6.1.10.J.マイクロタイタープレートを用いる糖化アッセイ
基質に含まれるセルロース1gごとの総タンパク質量(mg)に基づき、精製セルラーゼ及び全セルラーゼの無細胞産物を糖化アッセイに組み入れた。基質のキシラン含量に基づき、精製ヘミセルラーゼを充填した。バイオマス基質としては、例えば、希酸で前処理したトウモロコシ葉茎(PCS)、アンモニア繊維膨潤(AFEX)トウモロコシ葉茎、アンモニアで前処理したトウモロコシ穂軸、水酸化ナトリウム(NaOH)で前処理したトウモロコシ穂軸、及びアンモニアで前処理したスイッチグラスを記載の固形分濃度(%)で混合し、混合物のpHを5.0に調節した。プレートをアルミニウム製プレートシーラーで覆い、予め50℃に設定しておいたインキュベーターに入れた。振とうさせながら2日間インキュベートした。各ウェルに100mMのグリシン(pH 10)100μLを加え、反応を停止させた。十分混合した後、プレートを遠心分離し、10mMグリシン緩衝液(pH 10)を100μL含有させたHPLCプレートで上清を10倍希釈した。生成された可溶性糖類の濃度を、セロビオース加水分解アッセイ(下記)について記載されるとおりにHPLCを用い測定した。グルカン変換率(%)は、[グルコース(mg)+(セロビオース(mg)×1.056+セロトリオース(mg)×1.056)]/[基質中セルロース(mg)×1.111]として定義し、キシラン変換率(%)は、[キシロース(mg)+(キシロビオース(mg)×1.06)]/[基質中キシラン(mg)×1.136]と定義する。
6.1.11.K.カルコフローアッセイ
全ての化合物は分析等級のものを使用した。FMC BioPolymer(Philadelphia,PA)からAvicel PH−101を購入した。セロビオース及びカルコフローホワイトは、Sigma(St.Louise,MO)から購入した。Walseth,TAPPI 1971,35:228 and Wood,Biochem.J.1971,121:353〜362のプロトコールに変更を加え、Avicel PH−101によりリン酸膨潤セルロース(PASC)を調製した。簡潔に述べると、Avicelを濃リン酸で可溶化させ、次に冷脱イオン水により沈殿させた。セルロースを回収し、多量の水で洗浄してpHを中和させた後、50mM酢酸ナトリウム(pH5)で固形分1%に希釈した。
全ての酵素希釈液は、50mMの酢酸ナトリウム緩衝液(pH5.0)を用い調製した。GC220セルラーゼ(Danisco US Inc.,Genencor)を2.5、5、10、及び15mgのタンパク質/G PASCへと希釈し、線形の較正曲線を作成した。試験する試料は、較正曲線の範囲内に収まるよう(すなわち、0.1〜0.4フラクション生成物に相当するよう)希釈した。96ウェルマイクロタイタープレート中で、20μLの酵素溶液に150μLの1%冷PASCを加えた。プレートを覆い、Innovaインキュベーター/振とう器において、50℃、200rpmで2時間インキュベートした。50μg/mLカルコフロー/100mMのグリシン(pH10)100μLを用い反応を停止させた。励起波長Ex=365nm、放出波長Em=435nmにて、蛍光マイクロプレートリーダー(SpectraMax M5(Molecular Devices))で、蛍光を読み取りした。この結果を、等式:
FP=1−(Flサンプル−Fl緩衝液重量/セロビオース)/(Fl酵素不含有−Fl緩衝液重量/セロビオース)
(式中、FPはフラクション生成物であり、Fl=蛍光単位である)に従うフラクション生成物として表現する。
6.1.12.L.ソホロース加水分解アッセイ
β−グルコシダーゼのもつソホラーゼ活性を試験するために、Sigma Aldrichから購入したソホロース(S1404)を用い、マイクロタイタープレートでアッセイを行った。ソホロースを50mM酢酸ナトリウム(pH 5.0)に懸濁して5mg/mL原液を調製し、室温で30分回転ミキサーに設置した。非結合性96ウェルマイクロタイタープレート(corning,04809009)の平底ウェルにソホロース(ウェルあたり50μL)を分注した。分注した基質を室温で5分保管した。2枚目の平底96ウェルマイクロタイタープレート(corning,04809009)では、50mM酢酸ナトリウム(pH 5.0)によりβ−グルコシダーゼ分子を10倍連続希釈した。反応プレートをアルミニウム製プレートシーラー(E&K scientific)で覆い、600rpmで振とうさせながら37℃で30分インキュベートした(ThermoCycler)。インキュベートの終了時に、プレート中で、50mM酢酸ナトリウム(pH 5.0)により反応物を連続的に2倍希釈した。3枚目の平底96ウェルマイクロタイタープレート(Corning,04809009)に10μLの希釈酵素サンプル又はグルコース標準を入れ、90μLのABTS試薬を加えた。5分にわたり、反応動態を15秒毎に420nmで観察した。グルコース標準(5mg/mL)を利用してグルコース濃度を測定した。
6.2 実施例2:T.リーゼイ(T. reesei)組み込み発現株の構築
5種の遺伝子:T.リーゼイ(T. reesei)β−グルコシダーゼ遺伝子bgl1、T.リーゼイ(T. reesei)エンドキシラナーゼ遺伝子xyn3、F.バーティシリオイド(F. verticillioides)β−キシロシダーゼ遺伝子fv3A、F.バーティシリオイド(F. verticillioides)β−キシロシダーゼ遺伝子fv43D、及びF.バーティシリオイド(F. verticillioides)α−アラビノフラノシダーゼ遺伝子fv51Aを共発現させて、T.リーゼイ(T. reesei)の組み込み型発現株を構築した。
これらの異なる遺伝子の発現カセットの構築、及びT.リーゼイ(T. reesei)の形質転換を以下に記載する。
6.2.1.A.β−グルコシダーゼ発現ベクターの構築
ネイティブなT.リーゼイ(T. reesei)β−グルコシダーゼ遺伝子bgl1のN末端領域のコドンをDNA 2.0により(Menlo Park,USA)最適化させた。この合成領域は、コード領域の最初の447塩基からなる。プライマーSK943及びSK941を使用し、この断片をPCR増幅させた。T.リーゼイ(T. reesei)株RL−P37(Sheir−Neiss,G et al.Appl.Microbiol.Biotechnol.1984,20:46〜53)から抽出したゲノムDNAサンプルから、ネイティブなbgl1遺伝子の残りの領域を、プライマーSK940及びSK942を使用しPCR法により増幅させた。プライマーSK943及びSK942を用い、bgl1遺伝子のこれらの2つのPCR産物を、融合PCR反応により融合させた。
順方向プライマーSK943:(5’−CACCATGAGATATAGAACAGCTGCCGCT−3’)(配列番号118)
逆方向プライマーSK941:(5’−CGACCGCCCTGCGGAGTCTTGCCCAGTGGTCCCGCGACAG−3’)(配列番号119)
順方向プライマー(SK940):(5’−CTGTCGCGGGACCACTGGGCAAGACTCCGCAGGGCGGTCG−3’)(配列番号120)
逆方向プライマー(SK942):(5’−CCTACGCTACCGACAGAGTG−3’)(配列番号121)
得られる融合PCR産物をGateway(登録商標)エントリーベクターpENTR(商標)/D−TOPO(登録商標)にクローン化し、大腸菌(E. coli)One Shot(登録商標)TOP10ケミカルコンピテントセル(Invitrogen)を形質転換させ、中間ベクターpENTR TOPO−Bgl1(943/942)(図90B)を得た。挿入したDNAのヌクレオチド配列を確認した。正しいbgl1配列を有するpENTR−943/942ベクターを、Invitrogenによりプロトコルの概要されたLRクロナーゼ(登録商標)反応により、pTrex3gで組み替えた。LRクロナーゼ反応混合物により大腸菌(E. coli)One Shot(登録商標)TOP10ケミカルコンピテントセル(Invitrogen)を形質転換させ、最終的な発現ベクターpTrex3g 943/942を得た(図90Cを参照されたい)。ベクターには、形質転換したT.リーゼイ(T. reesei)の選択マーカーとして、アセトアミダーゼをコードしているアスペルギルス・ニデュランス(Aspergillus nidulans)のamdS遺伝子も含有させた。プライマーSK745及びSK771を使用してこの発現カセットをPCR増幅させ、T.リーゼイ(T. reesei)の形質転換体を作製した。
順方向プライマーSK771:(5’−GTCTAGACTGGAAACGCAAC−3’)(配列番号122)
逆方向プライマーSK745:(5’−GAGTTGTGAAGTCGGTAATCC−3’)(配列番号123)
6.2.2 B.エンドキシラナーゼ発現カセットの構築
プライマーxyn3F−2及びxyn3R−2を用い、T.リーゼイ(T. reesei)から抽出したゲノムDNAサンプルからネイティブなT.リーゼイ(T. reesei)エンドキシラナーゼ遺伝子xyn3をPCR増幅させた。
順方向プライマーxyn3F−2:(5’−CACCATGAAAGCAAACGTCATCTTGTGCCTCCTGG−3’)(配列番号124)
逆方向プライマーxyn3R−2:(5’−CTATTGTAAGATGCCAACAATGCTGTTATATGCCGGCTTGGGG−3’)(配列番号125)
得られるPCR産物をGateway(登録商標)EntryベクターpENTR(商標)/D−TOPO(登録商標)にクローン化し、大腸菌(E. coli)One Shot(登録商標)TOP10ケミカルコンピテントセルを形質転換させ、ベクターを得た(図90Dを参照されたい)。挿入したDNAのヌクレオチド配列を確認した。正しいxyn3配列を有するpENTR/Xyn3ベクターを、Invitrogenによりプロトコルの概要されたLRクロナーゼ(登録商標)反応により、pTrex3gで組み替えた。LRクロナーゼ反応混合物により大腸菌(E. coli)One Shot(登録商標)TOP10ケミカルコンピテントセル(Invitrogen)を形質転換させ、最終的な発現ベクターpTrex3g/Xyn3を得た(図90Eを参照されたい)。ベクターには、形質転換したT.リーゼイ(T. reesei)の選択マーカーとして、アセトアミダーゼをコードしているアスペルギルス・ニデュランス(Aspergillus nidulans)のamdS遺伝子も含有させた。プライマーSK745及びSK822を使用してこの発現カセットをPCR増幅させ、T.リーゼイ(T. reesei)の形質転換体を作製した。
順方向プライマーSK745:(5’−GAGTTGTGAAGTCGGTAATCC−3’)(配列番号126)
逆方向プライマーSK822:(5’−CACGAAGAGCGGCGATTC−3’)(配列番号127)
6.2.3.C.β−キシロシダーゼFv3A発現ベクターの構築
プライマーMH124及びMH125を用い、F.バーティシリオイド(F. verticillioides)ゲノムDNAサンプルからF.バーティシリオイド(F. verticillioides)β−キシロシダーゼfv3Aの遺伝子を増幅させた。
順方向プライマーMH124:(5’−CAC CCA TGC TGC TCA ATC TTC AG−3’)(配列番号128)
逆方向プライマーMH125:(5’−TTA CGC AGA CTT GGG GTC TTG AG−3’)(配列番号129)
PCR産物をGateway(登録商標)エントリーベクターpENTR(商標)/D−TOPO(登録商標)にクローン化し、大腸菌(E. coli)One Shot(登録商標)TOP10ケミカルコンピテントセル(Invitrogen)を形質転換させ、中間ベクターpENTR−Fv3A(図90Fを参照されたい)を得た。挿入したDNAのヌクレオチド配列を確認した。正しいfv3A配列を有するpENTR−Fv3Aベクターを、Invitrogenによりプロトコルの概要されたLRクロナーゼ(登録商標)反応により、pTrex6g(図79A)で組み替えた。LRクロナーゼ反応混合物により大腸菌(E. coli)One Shot(登録商標)TOP10ケミカルコンピテントセル(Invitrogen)を形質転換させ、最終的な発現ベクターpTrex6g/Fv3Aを得た(図90Gを参照されたい)。ベクターはまた、alsRと表記される、ネイティブなT.リーゼイ(T. reesei)アセト乳酸合成酵素(als)遺伝子のクロリムロンエチル耐性変異体も、そのネイティブなプロモーター及びターミネーターとともに、T.リーゼイ(T. reesei)形質転換体の選択マーカーとして含有する(国際公開第2008/039370(A1)号)。プライマーSK1334、SK1335及びSK1299を使用してこの発現カセットをPCR増幅させ、T.リーゼイ(T. reesei)の形質転換体を作製した。
順方向プライマーSK1334:(5’−GCTTGAGTGTATCGTGTAAG−3’)(配列番号130)
順方向プライマーSK1335:(5’−GCAACGGCAAAGCCCCACTTC−3’)(配列番号131)
逆方向プライマーSK1299:(5’−GTAGCGGCCGCCTCATCTCATCTCATCCATCC−3’)(配列番号132)
6.2.4.D.β−キシロシダーゼFv43D発現カセットの構築
F.バーティシリオイド(F. verticillioides)β−キシロシダーゼFv43D発現カセットを構築するため、プライマーSK1322及びSK1297を用い、F.バーティシリオイド(F. verticillioides)ゲノムDNAサンプルからfv43D遺伝子産物を増幅させた。RL−P37株から抽出したT.リーゼイ(T. reesei)ゲノムDNAサンプルのエンドグルカナーゼ遺伝子egl1のプロモーター領域を、プライマーSK1236及びSK1321を使用しPCR増幅させた。続いて、PCR増幅させたこれら2種のDNA断片を、プライマーSK1236及びSK1297を使用して融合PCR反応により一緒に融合させた。得られる融合PCR産物をpCR−Blunt II−TOPOベクター(Invitrogen)にクローン化し、プラスミドTOPO Blunt/Pegl1−Fv43D(図90Hを参照されたい)を作成し、このプラスミドを用い、大腸菌(E. coli)One Shot(登録商標)TOP10ケミカルコンピテントセル(Invitrogen)を形質転換させた。複数のE.coliクローンからプラスミドDNAを抽出し、制限酵素で消化して確認した。
順方向プライマーSK1322:(5’−CACCATGCAGCTCAAGTTTCTGTC−3’)(配列番号133)
逆方向プライマーSK1297:(5’−GGTTACTAGTCAACTGCCCGTTCTGTAGCGAG−3’)(配列番号134)
順方向プライマーSK1236:(5’−CATGCGATCGCGACGTTTTGGTCAGGTCG−3’)(配列番号135)
逆方向プライマーSK1321:(5’−GACAGAAACTTGAGCTGCATGGTGTGGGACAACAAGAAGG−3’)(配列番号136)
プライマーSK1236及びSK1297を使用してこの発現カセットをTOPO Blunt/Pegl1−Fv43DからPCR増幅させ、T.リーゼイ(T. reesei)の形質転換体を作製した。
6.2.5.E.α−アラビノフラノシダーゼ発現カセットの構築
F.バーティシリオイド(F. verticillioides)α−アラビノフラノシダーゼ遺伝子fv51A発現カセットの構築の際、プライマーSK1159及びSK1289を用い、F.バーティシリオイド(F. verticillioides)ゲノムDNAサンプルからfv51A遺伝子産物を増幅させた。RL−P37株から抽出したT.リーゼイ(T. reesei)ゲノムDNAサンプルのエンドグルカナーゼ遺伝子egl1のプロモーター領域を、プライマーSK1236及びSK1262を使用しPCR増幅させた。続いて、PCR増幅させたこれら2種のDNA断片を、プライマーSK1236及びSK1289を使用して融合PCR反応により一緒に融合させた。得られる融合PCR産物をpCR−Blunt II−TOPOベクター(Invitrogen)にクローン化し、プラスミドTOPO Blunt/Pegl1−Fv51A(図90Iを参照されたい)を作成し、このプラスミドを用い、大腸菌(E. coli)One Shot(登録商標)TOP10ケミカルコンピテントセル(Invitrogen)を形質転換させた。
順方向プライマーSK1159:(5’−CACCATGGTTCGCTTCAGTTCAATCCTAG−3’)(配列番号137)
逆方向プライマーSK1289:(5’−GTGGCTAGAAGATATCCAACAC−3’)(配列番号138)
順方向プライマーSK1236:(5’−CATGCGATCGCGACGTTTTGGTCAGGTCG−3’)(配列番号139)
逆方向プライマーSK1262:(5’−GAACTGAAGCGAACCATGGTGTGGGACAACAAGAA GGAC−3’)(配列番号140)
プライマーSK1298及びSK1289を使用してこの発現カセットをPCR増幅させ、T.リーゼイ(T. reesei)の形質転換体を作製した。
順方向プライマーSK1298:(5’−GTAGTTATGCGCATGCTAGAC−3’)(配列番号141)
逆方向プライマーSK1289:(5’−GTGGCTAGAAGATATCCAACAC−3’)(配列番号142)
6.2.6.F.β−グルコシダーゼ及びエンドキシラナーゼ発現カセットによるT.リーゼイ(T. reesei)の同時形質転換
RL−P37(Sheir−Neiss,G et al.Appl.Microbiol.Biotechnol.1984,20:46〜53.)に由来し、かつ高セルラーゼ生産であるものとして選択したT.リーゼイ(T. reesei)変異株を、PEGによる形質転換方法(Penttila,M et al.Gene 1987,61(2):155〜64)を用い、β−グルコシダーゼ発現カセット(cbh1プロモーター、T.リーゼイ(T. reesei)β−グルコシダーゼ1遺伝子、cbh1ターミネーター、及びamdSマーカー)、及びエンドキシラナーゼ発現カセット(cbh1プロモーター、T.リーゼイ(T. reesei)xyn3、及びcbh1ターミネーター)を利用して同時形質転換させた。多数の形質転換体を単離し、β−グルコシダーゼ生成及びエンドキシラナーゼ生成について試験した。他の発現カセットによる形質転換に際し、形質転換体のT.リーゼイ(T. reesei)株#229を使用した。
6.2.7.G.2種類のβ−キシロシダーゼ及びα−アラビノフラノシダーゼを備える発現カセットによるT.リーゼイ(T. reesei)株229の同時形質転換
例えば、電気穿孔法(国際公開第08153712号を参照されたい)を用い、T.リーゼイ(T. reesei)株#229を、β−キシロシダーゼfv3A発現カセット(cbh1プロモーター、fv3A遺伝子、cbh1ターミネーター、及びalsRマーカー)、β−キシロシダーゼfv43D発現カセット(egl1プロモーター、fv43D遺伝子、ネイティブ型fv43Dターミネーター)、及びfv51A α−アラビノフラノシダーゼ発現カセット(egl1プロモーター、fv51A遺伝子、fv51Aネイティブ型ターミネーター)により同時形質転換させた。形質転換体は、クロリムロンエチル(80ppm)を含有しているフォーゲル寒天プレートで選択した。フォーゲル寒天プレートを1Lにつき次のとおりに調製した。
多数の形質転換体を単離し、β−キシロシダーゼ及びL−α−アラビノフラノシダーゼ生成について試験した。実施例1(上掲)に記載の穂軸糖化アッセイに従って、バイオマスの変換率についても形質転換体を選択した。本明細書に記載のT.リーゼイ(T. reesei)組み込み発現株の例としては、H3A、39A、A10A、11A、及びG9Aが挙げられ、これらはT.リーゼイ(T. reesei)Bgl1、T.リーゼイ(T. reesei)Xyn3、Fv3A、Fv51A、及びFv43Dを異なる比でこれらの遺伝子の全てを発現する。他の組み込み型T.リーゼイ(T. reesei)株としては、T.リーゼイ(T. reesei)Bgl1、T.リーゼイ(T. reesei)Xyn3、Fv3A、Fv51A、及びFv43Dの遺伝子の殆ど異なる比率で発現していたものが挙げられる。例えば、ある株はT.リーゼイ(T. reesei)Xyn3の過剰発現を欠損し;他の株はウェスタンブロットにより測定したときにFv51Aを欠損しており;その他の2株はFv3Aを欠損しており、1株はBgl1の過剰発現を欠損していた(例えば、H3A−5株)。
6.2.8.H.T.リーゼイ(T. reesei)組み込み株H3Aの組成
T.リーゼイ(T. reesei)組み込み株H3Aの発酵により、下記実施例2、Iに記載されかつ本明細書において図4に示されるとおりに測定される比で、次のタンパク質、T.リーゼイ(T. reesei)Xyn3、T.リーゼイ(T. reesei)Bgl1、Fv3A、Fv51A及びFv43Dが生成される。
6.2.9.I.HPLCによるタンパク質アッセイ
液体クロマトグラフィー(LC)及びマススペクトロスコピー(MS)を実施して、発酵ブロスに含まれている酵素を分離し、同定し、定量した。始めに、遺伝子組換えによりS.プリカタス(S. plicatus)(例えば、NEB P0702L)に発現させたエンドHグリコシダーゼにより酵素サンプルを処理した。サンプルの総タンパク質量1μgに対し0.01〜0.03μg endoHタンパク質の比率となるようEndoHを使用し、pH 4.5〜6.0にて37℃で3時間インキュベートし、HPLC解析前にN結合型糖鎖を酵素作用により除去した。次に疎水性相互作用クロマトグラフィーを行うため、HIC−フェニルカラムを取り付けたAgilent 1100 HPLCシステムに約50μgのタンパク質を注入し、35分かけて高塩濃度から低塩濃度への勾配溶出を行った。勾配は、高塩濃度の緩衝液A:4Mの硫酸アンモニウム/20mMのリン酸カリウム(pH 6.75)と、低塩濃度の緩衝液B:20mMのリン酸カリウム(pH 6.75)とを用い得た。UV光により222nmにてピークを検出し、画分を回収し、マススペクトロスコピーにより同定した。タンパク質濃度を、クロマトグラム面積の総積分値に占める割合(%)として報告する。
6.2.10.J.T.リーゼイ(T. reesei)組み込み株H3Aの発酵ブロスに精製タンパク質を添加することにより希アンモニアで前処理したトウモロコシ穂軸の糖化に対し生じる効果
精製タンパク質(及び1種の未精製タンパク質)を原液から連続希釈し、T.リーゼイ(T. reesei)組み込み株H3Aの発酵ブロスに加え、前処理したバイオマスの糖化に対し生じる効果を評価した。希アンモニアで前処理したトウモロコシ穂軸を、固形分重量20%(pH 5)でマイクロタイタープレート(MTP)ウェルに充填した(ウェルあたり約5mgのセルロース)。各ウェルに、セルロース1gあたり20mgずつH3Aタンパク質(発酵ブロスの形態)を加えた。各ウェルに各希釈タンパク質(図5)を10、5、2、及び1μLずつ加え、各ウェルに対する液体の添加が合計10μLになるよう水を加えた。参照ウェルには水10μL、又は追加のH3A発酵ブロス希釈物のいずれかを添加した。ホイルによりMTPをシーリングし、Innova恒温振とう器にて200RPMで振とうしながら50℃で3日間インキュベートした。100mMグリシン(pH 10)100μLによりサンプルの反応を停止した。停止したサンプルをプラスチックシールで覆い、4℃にて3000rpmで5分遠心分離した。停止した反応液のアリコート(5μL)を100μLの水で希釈し、反応により生産されたグルコースの濃度をHPLCにより測定した。H3A 1gあたり20mgとなるよう添加したタンパク質濃度の関数として、グルコースデータをプロットした(タンパク質の添加濃度は、異なる開始濃度及び添加する用量に応じ変動し得る)。結果を図58A〜58Dに示す。
6.3.実施例3:T.リーゼイ(T. reesei)株の構築
6.3.1.A.T.リーゼイ(T. reesei)株H3A/EG4#27の構築及び選択
T.リーゼイ(T. reesei)egl1(「Cel 7B」とも呼ばれる)プロモーター、T.リーゼイ(T. reesei)eg4(「TrEG4」又は「Cel 61A」とも呼ばれる)翻訳領域、及びT.リーゼイ(T. reesei)の転写終結配列cbh1(Cel 7A)(図59A)、並びにA.ニガー(A. niger)のsucA選択マーカー(Boddy et al.,Curr.Genet.1993,24:60〜66を参照されたい)を収容させた発現カセットを、pCR Blunt II TOPO(Invitrogen)にクローン化した(図59B)。
次のプライマーを使用し、発現カセットPegl1−eg4−sucAをPCRにより増幅させた:
SK1298:5’−GTAGTTATGCGCATGCTAGAC−3’(配列番号143)
214:5’−CCGGCTCAGTATCAACCACTAAGCACAT−3’(配列番号144)
PCR反応用のポリメラーゼとしてはPfu Ultra II(Stratagene)を使用した。製造元のプロトコルに従ってQIAquick PCR精製キット(Qiagen)を使用し、PCRの反応産物を精製した。次に、speed vacを用い、PCRの反応産物を1〜3μg/μLに濃縮させた。形質転換させたT.リーゼイ(T. reesei)宿主株(H3A)を、ポテトデキストロース寒天プレート上で28℃にて5日間生育させ、一面に胞子を形成させた。ミリQ水を用い、2枚のプレートから胞子を回収し、40μMセルストレイナー(BD Falcon)に通してろ過した。胞子を50mLのコニカルチューブに移し、50mLの水を加え繰り返し3回遠心分離を行い洗浄した。最後に1.1Mソルビトール溶液を用い洗浄を行った。1.1Mのソルビトール溶液を用い、胞子を少量(ペレット体積の2倍未満)再懸濁した。胞子懸濁液を氷上に置いた。胞子懸濁液(60μL)を10〜20μgのDNAと混合し、電気穿孔用キュベット(E−shot,0.1cm電気穿孔用標準キュベット(Invitrogen))に移した。BioradジーンパルサーXcell(16kV/cm,25μF,400Ωに設定)を用い、胞子に電気穿孔を行った。電気穿孔後、胞子懸濁液に1mLの1.1.Mのソルビトール溶液を添加した。炭素源として2%スクロースを含有させたフォーゲル寒天培地(実施例2Gを参照されたい)に胞子懸濁液を蒔いた。
形質転換プレートを30℃で5〜7日間インキュベートした。スクロースを含有させた2枚目のフォーゲル寒天プレートに一次形質転換体を再画線し、30℃にて更に5〜7日間生育させた。次に、2枚目の選択プレートで生育させた単一コロニーを、国際公開第2009/114380号に記載の方法を用いマイクロタイタープレートのウェル内で生育させた。糖化性能選択に先立ち上清をSDS−PAGEにより解析し、発現レベルを確認した。
H3A株では合計94の形質転換体がEG4を過剰発現していた。H3A/EG4株と同様に、2株のH3A対照株をマイクロタイタープレート上で生育させた。アンモニアで前処理したトウモロコシ穂軸を用い、EG4タンパク質を発現しているT.リーゼイ(T. reesei)株の性能選択を実施した。希アンモニアで前処理したトウモロコシ穂軸を水に再懸濁し、硫酸によりpH 5.0に調整し、7%セルロースを得た。スラリーを平底96ウェルマイクロタイタープレート(Nunc,269787)に分注し、3,000rpmで5分遠心分離した。
基質を入れた各ウェルに、H3A又はH3A/EG4株の培養ブロスを20μL加え、トウモロコシ穂軸の糖化反応を開始した。トウモロコシ穂軸の糖化反応物をアルミニウム(E&K scientific)でシーリングし、24℃かつ650rpmで5分間混合した。次に、50℃かつ200rpmに設定したInnovaインキュベーターにプレートを72時間設置した。72時間の糖化後、100μLの100mMのグリシン(pH 10.0)を加え、反応を停止させた。次にプレートを十分に混合し、3000rpmで5分遠心分離した。HPLC 96ウェルマイクロタイタープレート(Agilent,5042〜1385)中の水200μLに上清(10μL)を添加した。ガードカラムを予め装着させたAminex HPX−87Pカラム(300mm×7.8mm,125〜0098)を使用し、HPLCにより、グルコース、キシロース、セロビオース、及びキシロビオース濃度を測定した。
トウモロコシの穂軸に対する選択により、H3A対照株と比較してグルカン及びキシラン変換率が向上している次のH3A/EG4株:1、2、3、4、5、6、14、22、27、43、及び49が同定された(図60)。
選択したH3A/EG4株を再度生育させた。株毎に、振とうフラスコあたり、合計30mLの培養タンパク質ろ液を回収した。10kDaの限外ろ過濃縮用遠心チューブ(Sartorious,VS2001)を使用し、培養ろ液を10倍濃縮し、実施例1Cに記載のとおりに総タンパク質濃度をBCAにより測定した。トウモロコシ穂軸基質のウェル毎に、セルロース1gにつき、H3A/EG4株サンプルのタンパク質を2.5、5、10、又は20mg使用し、トウモロコシの穂軸の糖化反応を実施した。14L発酵スケールでH3A株を生産した。対照としては、振とうフラスコスケールで生産させた際に低性能であることが予め同定されているサンプル(H3A/EG4株#20)を包含させた。実施例4(下記)に記載されるとおりに糖化反応を実施した。EG4発現株に由来する培養上清の全てで、タンパク質添加量を増加させるにつれグルカン変換率が上昇していたことが観察された(図61)。追加の糖化反応にT.リーゼイ(T. reesei)組み込み株H3A/EG4#27を使用し、シングルコロニーをポテトデキストリンプレート上に画線し、そこから単独コロニーを単離し、株を精製した。
6.4.実施例4:希アンモニアで前処理したトウモロコシ穂軸の糖化を向上させるためのT.リーゼイ(T. reesei)EG4の濃度範囲
好ましい添加量を決定するため、T.リーゼイ(T. reesei)組み込み株H3A/EG4 #27又はH3Aのいずれかの発酵ブロスを用い、精製EG4を反応混合物に添加し、希アンモニアで前処理したトウモロコシ穂軸(固形分25%、セルロース8.7%、キシラン7.3%)の加水分解をpH 5.3で実施した。T.リーゼイ(T. reesei)組み込み株H3A/EG4 #27又はH3Aの総添加タンパク質量は、グルカン(G)及びキシラン(X)1gあたり14mgとした。図6、7A及び7Bの添加チャートに従い、20mLシンチレーションバイアルに総反応用量5mLで反応混合物(総質量5g)を充填した。
実験1の設定を図6に示す。コニカルチューブ中でミリQ水及び6N硫酸を混合し、各バイアル瓶に加え、このバイアル瓶を振って内容物を混合した。バイアル瓶に酵素サンプルを加え、50℃にて6時間インキュベートした。様々な時点でバイアル瓶のサンプルのうち100μLを900μLの5mMの硫酸に加え、ボルテックスにかけ、遠心分離し、上清を使用して、生成された可溶性糖類の濃度をHPLCにより測定した。グルカン転換率についての結果を図64に、及びキシラン転換率についての結果を図65に示す。
実験2の設定を図7Aに示す。好ましいEG4濃度を決定するために、T.リーゼイ(T. reesei)組み込み株H3A/EG4 #27又はH3Aのいずれかの発酵ブロスを使用して、精製EG4(G+X 1gあたり0.05〜1.0mgの範囲)を反応混合物に添加し、希釈アンモニアで前処理したトウモロコシの穂軸(固形分25%、セルロース8.7%、キシラン7.3%)の糖化をpH 5.3で行った。T.リーゼイ(T. reesei)組み込み株H3A/EG4 #27又はH3Aの総充填量は、グルカン+キシラン1gあたり14mgであった。
実験結果を図66Aに示す。
実験3の設定を図7Bに示す。T.リーゼイ(T. reesei)Eg4のその他の好ましい濃度範囲を特定するため、T.リーゼイ(T. reesei)組み込み株H3A/EG4#27又はH3Aを用い、G+X 1gあたり0.1〜0.5mgの濃度で精製EG4を添加し、希アンモニアで前処理したトウモロコシ茎葉(固形分25%、セルロース8.7%及びキシラン7.3%)をpH 5.3にて加水分解した。T.リーゼイ(T. reesei)組み込み株H3A/EG4 #27又はH3Aの総充填量は、グルカン及びキシラン1gあたり14mgであった。
結果を図66Bに示す。
6.5 実施例5希アンモニアで前処理したトウモロコシ茎葉の糖化に対する様々な濃度のT.リーゼイ(T. reesei)Eg4の効果
希アンモニアで前処理したトウモロコシ茎葉を、T.リーゼイ(T. reesei)組み込み株H3A又はH3A/EG4#27(グルカン及びキシラン1gあたり14mg)の発酵ブロスとともに、固形分7、10、15、20、及び25%(%S)で、pH 5.3かつ50℃にて3日間インキュベートした(20mLバイアル瓶中、総湿潤バイオマス量は5g)。上記実施例4に記載されるとおりに反応を実施した。グルコース及びキシロースをHPLCにより解析した。結果を図67に示す。全ての試料は、1日目に、最大固形分20%で見かけ上、液化された。
6.6 実施例6希アンモニアで前処理したトウモロコシ穂軸の加水分解に対するT.リーゼイ(T. reesei)EG4の過剰発現の効果
H3A株においてT.リーゼイ(T. reesei)Eg4を過剰発現させた場合に、希アンモニアで前処理したトウモロコシ穂軸の糖化に対し示される効果を、H3A/EG4 # 27株及びH3A株由来の発酵ブロスを使用し試験した。20mLのガラス製バイアル瓶中で、次のとおりに3gスケールでトウモロコシ穂軸の糖化を実施した。酵素製剤、1Nの硫酸及び50mMの酢酸ナトリウム緩衝液(pH 5.0)(0.01%アジ化ナトリウム及び5mMのMnCl2を含有)を添加し、グルコース+キシラン1gあたり総タンパク質1.7及び21.0mgの間で添加量を変化させて酵素を用い、総反応量3gの、固形分22%の最終的なスラリーを得た。全ての糖化バイアル瓶を、180rpmで振とうさせながら48℃でインキュベートした。72時間後に、各バイアル瓶にろ過ミリQ水12mLを加えて、糖化反応物を5倍希釈した。サンプルを14,000×gで5分間遠心分離し、次に0.22μmのナイロンフィルタ(Spin−X遠心管フィルタ,Corning Incorporated,Corning,NY)を通してろ過し、ろ過ミリQ水により更に4倍希釈して、最終的に20倍希釈液を調製した。20μLのサンプルを注入し、HPLC解析して、生成されている糖類を測定した。
T.リーゼイ(T. reesei)Eg4の過剰発現又は添加により、H3A単独の場合と比較してキシロース及びグルコースモノマーの生成が向上していた(図9及び10)。様々な量でH3A/EG4#27を添加した所、H3A株単独の場合、あるいはグルカン+キシラン1gに対しEg4+1.12mg一定Xyn3の場合と比較して、キシロースの収率が向上していた(図9)。
様々な量でH3A/EG4#27を添加した場合には、H3A株単独の場合、あるいはグルカン+キシラン1gに対しEg4+1.12mg一定Xyn3の場合と比較して、グルコースの収率が向上していた(図10)。
発酵性モノマー(キシロース、グルコース、及びアラビノース)の総生成量に対する、組み込み株H3A/EG4# 27又はH3AによるT.リーゼイ(T. reesei)Eg4の効果を図11に記載する。H3A/EG4#27組み込み株では、組み込みH3A株の場合、あるいはEg4+1.12mg Xyn3/gグルコース+キシランの場合と比較して、発酵性モノマーの総生成量が向上していた。
6.7 実施例7:精製T.リーゼイ(T. reesei)EG4による希アンモニアで前処理したトウモロコシ穂軸からのグルコース生成
グルコース+キシラン1gあたり0.53mのXyn3の存在下又は非存在下で、希アンモニアで前処理したトウモロコシ穂軸を使用し、生成糖濃度に対する精製T.リーゼイ(T. reesei)Eg4の効果を試験した。実験は実施例6に記載のとおりに実施した。結果を図12に示す。
このデータからは、精製T.リーゼイ(T. reesei)Eg4は、エンドグルカナーゼ、セロビオヒドロラーゼ及びβ−グルコシダーゼなどのその他のセルラーゼの作用が存在せずともグルコースモノマーの生成を促すことが示される。希アンモニアで前処理したトウモロコシ穂軸と、精製Eg4単独(Xyn3は添加しない)とを組み合わせて用いる糖化実験も実施した。872μLの50mMの酢酸ナトリウム緩衝液(pH 5.0)(0.01%アジ化ナトリウム及び5mMのMnCl2を含有)、165mgの希アンモニアで前処理したトウモロコシ穂軸(67.3%乾燥固形分,111mg乾燥固形分を添加)及び16.5μLの1Nの硫酸を入れた5mLバイアル瓶に、3.3μLの精製Eg4(15.3mg/mL)を加えた。バイアル瓶を48℃でインキュベートし、かつ180rpmで振とうさせた。定期的に20μLのアリコートを取り出し、ろ過滅菌した二重蒸留水より10倍希釈し、ナイロンフィルタによりろ過した後、Dionexイオンクロマトグラフィーシステムでグルコース生成について解析した。グルコース標品溶液を外部標準として使用した。結果を図68に示す。この図により、精製Eg4を添加することで、他のセルラーゼ又はエンドキシラナーゼの非存在下かつ48℃下で、72時間にわたってインキュベートすると、希アンモニアで前処理したトウモロコシ穂軸からグルコースモノマーが生成されたことが示される。
6.8 実施例8:様々な基質に対するT.リーゼイ(T. reesei)組み込み株H3A及びH3A/EG4 #27の糖化性能
この実験では、グルコース+キシラン1gに対しタンパク質14mgになるようT.リーゼイ(T. reesei)組み込みH3A株又はH3A/EG4#27株由来の発酵ブロスを用い、希アンモニアで前処理したトウモロコシ穂軸、希アンモニアで前処理し、洗浄したトウモロコシ穂軸、アンモニア繊維爆砕(AFEX)前処理したトウモロコシ茎葉(CS)、蒸気爆砕したサトウキビバガス(SEB)、及び予めクラフト処理を行った紙パルプFPP27(工業用針葉樹材無漂白パルプ脱リグニン化−κ 13.5、グルカン81.9%、キシラン8.0%、Klasonリグニン1.9%)、FPP−31(広葉樹材無漂白パルプ脱リグニン化−κ 10.1、グルカン75.1%、キシラン19.1%、Klasonリグニン2.2%)、及びFPP−37(針葉樹無漂白パルプ風乾−κ 82、グルカン71.4%、キシラン8.7%、Klasonリグニン11.3%)などの異なる基質に対する糖化性能について試験した。
糖化反応は、25mLガラス製バイアル瓶を用い、0.1Mクエン酸ナトリウム緩衝液(pH 5.0)中最終質量10gで設定し、200rpmで振とうさせながら50℃で6日間インキュベートした。6日目の終了時に、100μLのアリコートを5mMの硫酸で1:10希釈し、サンプルをHPLCにより解析して、グルコース及びキシロース組成を測定した。結果を図69に示す。
6.9 実施例9:酸で前処理したトウモロコシ茎葉の糖化に対するT.リーゼイ(T. reesei)EG4の効果
酸で前処理したトウモロコシ茎葉の糖化に対するEg4の効果を試験した。希硫酸で前処理したトウモロコシ茎葉(Schell,DJ,et al.,Appl.Biochem.Biotechnol.2003,105(1〜3):69〜85)をNRELから得て、固形分20%に調節し、ソーダ灰を添加してpH 5.0に調整した。前処理した基質の糖化を、マイクロタイタープレートで総固形分20%で実施した。発酵ブロス中の総タンパク質量をビウレット・アッセイにより測定した(上記実施例1を参照されたい)。基質に対し加えるT.リーゼイ(T. reesei)組み込み株H3A/EG4 #27及びH3Aの発酵ブロスの量を増量させ、200RPMで振とうさせながら50℃にて5日間インキュベートした後、糖化性能を測定した。HPLCによりグルコース生成(mg/g)を測定した。結果を図70に示す。
6.10 実施例10:希アンモニアで前処理したトウモロコシ葉、茎及び穂軸に対するT.リーゼイ(T. reesei)組み込み株H3A及びH3A/EG4#27の糖化性能
本実験では、希アンモニアで前処理したトウモロコシ茎葉、葉、茎又は穂軸に対するT.リーゼイ(T. reesei)組み込み株H3A及びH3A/EG4#27の糖化性能を比較した。前処理は国際公開第06110901A号に記載のとおりに実施した。20mLバイアル瓶を用い、グルカン+キシラン1gに対しタンパク質を14mg使用し、総質量5g(固形分7%)をpH 5.3(pHは6NのH2SO4を添加して調節した)にて加水分解させた。50℃にて糖化反応を実施し、4日目に、生成されたグルコース及びキシロースについてHPLCよりサンプル解析を行った。結果を図71に示す。
6.11.実施例11:T.リーゼイ(T. reesei)にEG4を過剰発現させることによる希アンモニアで前処理したトウモロコシ穂軸に対する糖化性能
希アンモニアで前処理したトウモロコシ穂軸を使用し、3gスケールで糖化反応を実施した。20mLのガラス製バイアル瓶に、十分に前処理した穂軸調製物の乾燥固形分を0.75g量りとった。酵素調製物、1Nの硫酸及び50mMの酢酸ナトリウム緩衝液(pH 5.0)(0.01%アジ化ナトリウム添加)を加え、総反応物3g(25%乾燥固形分、pH 5.0)の最終スラリーを得た。Eg4を過剰発現させたT.リーゼイ(T. reesei)株(Δcbh1 Δcbh2 Δeg1 Δeg2)(国際公開第05/001036号を参照されたい)の未精製の培養上清として、14mgのタンパク質を更に5%添加し又は添加せずに、T.リーゼイ(T. reesei)組み込み株H3Aの細胞外タンパク質(発酵ブロス)を、グルカン+キシラン1gに対し14mg添加した。糖化反応物を50℃で72時間インキュベートした。インキュベート後、反応物を3倍希釈し、ろ過し、グルコース及びキシロース濃度についてHPLC解析を行った。結果を図73に示す。H3Aと比較してタンパク質を過剰発現させたT.リーゼイ(T. reesei)株由来の細胞外タンパク質の形態でEg4タンパク質を添加した所、グルコースモノマーの生成量が実質的に上昇し、かつキシロースモノマーの生成量がわずかに上昇した。
6.12 実施例12:アンモニアで前処理したスイッチグラスに対するH3A/EG4#27株の糖化性能
タンパク質添加量を増量させ、希アンモニアで前処理したスイッチグラス(国際公開06110901A号)に対するH3A/Eg4株#27の糖化性能を、H3A株と比較した(18.5%固形分)。20mLのガラス製バイアル瓶に、前処理したスイッチグラス調製物の乾燥固形分を0.925g量りとった。1Nの硫酸及び50mMの酢酸ナトリウム緩衝液(pH 5.3)(0.01%アジ化ナトリウム添加)を加え、総反応物5gの最終スラリーを得た。H3Aの酵素添加量は14、20、及び30mg/g(グルカン+キシラン)で試験し、H3A−EG4 #27の添加量は5、8、11、14、20、及び30mg/g(グルカン+キシラン)で試験した。反応物を50℃で3日間インキュベートした。インキュベート後、反応物を3倍希釈し、ろ過し、グルコース及びキシロース濃度についてHPLC解析を行った。スイッチグラス基質の組成に基づきグルカン及びキシラン変換率を算出した。結果を図74に示す。この図により、酵素添加量が同じである場合、H3A−EG4#27のグルカン変換性能は、H3Aよりも有効であることが示される。
6.13 実施例13.トウモロコシの穂軸の糖化並びにCMC及びセロビオースの加水分解に対するT.リーゼイ(T. reesei)EG4の効果
6.13.1 A.トウモロコシ穂軸の糖化
希アンモニアで前処理したトウモロコシ穂軸を20%固形分、7%セルロースに調節し、マイクロタイタープレートのウェルに65mgずつ分注した。グルカン1gあたり5mg(最終濃度)のT.リーゼイ(T. reesei)CBH1と、グルカン1gあたり0、1、2、3、4及び5mgの最終濃度で関連する酵素(CBH1又はEg4)を含有している、35μLの50mMの酢酸ナトリウム(pH 5.0)緩衝を添加し、糖化反応を開始した。Eg4対照には、同様の添加量でEG4のみを投与したため、これらのウェル中の総添加タンパク質量は少なかった。マイクロタイタープレートをアルミニウム製プレートシール(E&K scientific)でシーリングし、24℃で、600rpmで2分間混合した。次に、50℃かつ200rpmに設定したInnovaインキュベーターにプレートを72時間設置した。
72時間の糖化後、プレートには100μLの100mMのグリシン(pH 10.0)を加え、反応を停止させた。次にプレートを3000rpmで5分遠心分離した。HPLC 96ウェルマイクロタイタープレート(Agilent,5042〜1385)中の水100μLに上清(20μL)を添加した。ガードカラムを予め装着させたAminexHPX−87Pカラム(300mm×7.8mm,125−0098)を使用し、HPLCにより、グルコース及びセロビオース濃度を測定した。100×(mgセロビオース+mgグルコース)/基質中総グルカンとしてグルカン変換率(%)を算出した(図75)。
6.13.2 B.CMC加水分解
カルボキシメチルセルロース(CMC,Sigma C4888)を、50mMの酢酸ナトリウム(pH 5.0)により1%に希釈した。3種のT.リーゼイ(T. reesei)精製酵素のEg4、EG1及びCBH1を最終濃度20、10、5、2.5、1.25及び0mg/gで、それぞれ別個に96ウェルマイクロタイタープレート(NUNC #269787)中の100μLの1% CMCに添加し、加水分解反応を開始した。各ウェルにpH 5.0の50mMの酢酸ナトリウムを加えて最終用量150μLを得た。CMC加水分解反応物をアルミニウム製プレートシール(E&K scientific)でシーリングし、24℃で、600rpmで2分間混合した。次に、50℃かつ200rpmに設定したInnovaインキュベーターにプレートを30分設置した。
30分間のインキュベート終了後、プレートを氷水上に10分間置いて反応を停止させ、サンプルをエッペンドルフチューブに移した。各チューブに375μLのジニトロサリチル酸(DNS)溶液(以下参照)を加えた。次にサンプルを10分間沸騰させ、SpectraMAX 250(Molecular Devices)により540nmでO.Dを測定した。結果を図76に示す。
DNS溶液:
40gの3.5−ジニトロサリチル酸(Sigma,D0550)
8gのフェノール
2gの亜硫酸ナトリウム(Na2SO3)
800gのNa−K酒石酸塩(ロッシェル塩)。これらの全てを2Lの2%のNaOHに加える。アルミ箔で覆い、一晩撹拌する。脱イオン蒸留水を加え、最終用量4Lにする。十分に混合する。暗色瓶に入れ冷蔵保存する。
6.13.3.C.セロビオース加水分解
セロビオースを50mMの酢酸ナトリウム(pH 5.0)により5g/Lに希釈した。最終濃度20、10、5、2.5及び0mg/gで2種類の酵素EG4及びBGL1をそれぞれ別個に5g/Lの100μLのセロビオース溶液に添加し、加水分解反応を開始した。各ウェルに酢酸ナトリウム(pH 5.0)を加え、最終用量120μLを得た。反応プレートをアルミニウム製プレートシール(E&K scientific)でシーリングし、24℃で、600rpmで2分間混合した。次に、50℃かつ200rpmに設定したInnovaインキュベーターにプレートを2時間設置した。
2時間の加水分解工程後、プレートには100μLの100mMのグリシン(pH 10.0)を加え、反応を停止させた。次にプレートを3000rpmで5分遠心分離した。ABTS(2,2’−アジノ−ビス3−エチルベンゾチアゾリン−6−スルホン酸)アッセイ(実施例1)によりグルコース濃度を測定した。96ウェルマイクロタイタープレート(Corning costar 9017 EIA/RIAプレート,96ウェル平底,培地結合型)内で、90μLのABTS溶液に10μLの上清を添加した。SpectraMAX 250(Molecular Devices)によりO.D.420nmを測定した。結果を図77に示す。
6.14.実施例14:精製Eg4は各種セルラーゼ混合物と混合させた場合に希アンモニアで前処理したトウモロコシ穂軸から生成されるグルコース量を向上させる
希アンモニアで前処理したトウモロコシ穂軸を使用し、グルカン+キシラン1gあたり0.53mgのT.リーゼイXyn3の存在下で、精製Eg4と精製セルラーゼ(T.リーゼイ(T. reesei)EG1、EG2、CBH1、CBH2、及びBgl1)とを組み合わせることで、糖生成濃度に生じる効果を試験した。0.111g乾燥穂軸固形分(10.5%固形分)を含有させた5mLバイアル瓶中で1.06gの反応物を調製した。酵素調製物(図72A)、1Nの硫酸、及び50mMの酢酸ナトリウム緩衝液(pH 5.0)(0.01%のアジ化ナトリウム及び5mMのMnCl2を含有)を添加し、最終反応重量を得た。反応バイアル瓶を、180rpmで振とうさせながら48℃でインキュベートした。72時間後、ろ過したミリQ水を各糖化反応物に加え5倍希釈した。サンプルを14,000xgで5分間遠心分離し、次に0.22μmのナイロンフィルタ(Spin−X遠心管フィルタ,Corning Incorporated,Corning,NY)を通してろ過し、ろ過ミリQ水により更に4倍希釈して、最終的に20倍希釈液を調製した。20μLのサンプルをHPLCにより解析し、生成された糖類(グルコース、セロビオース及びキシロース)を測定した。
図72Bは、各組み合わせにより生成された、グルコース(図72B−1)、グルコース+セロビオース(図72B−2)、又はキシロース(図72B−3)を示す。精製Eg4は、各セルラーゼ及び混合物の性能を向上させた。全ての精製セルラーゼを存在させた場合、グルコース+キシラン1gに対し0.53mgのEg4を添加することで、変換効率はほぼ40%近く向上した。この向上は、CBH1と、Egl1と、Bgl1との組み合わせにEg4を添加した場合にも見られた。別個のセルラーゼをトウモロコシ穂軸と共に存在させた場合、グルコースの総生成量は、セルラーゼ組み合わせてトウモロコシ穂軸と存在させた実験から得られる結果と比較して実質的に少なかったものの、各事例において、Eg4の存在下での向上率は有意なものであった。Eg4を精製セルラーゼに添加した所、総グルコース生成量において次のような変換率の向上が得られた−Bgl1(121%)、Egl2(112%)、CBH2(239%)、及びCBH1(71%)。この結果から、Eg4は、バイオマスに対するセルラーゼの性能の向上に対し、有意であり、かつ幅広い効果を有していたことが示される。
6.15.実施例15:EG4を基質のCBH1、CBH2、及びEG2−希アンモニアで前処理したトウモロコシ穂軸−と混合した場合に観察される相乗効果
96ウェルMTPs(VWR)において、酵素混合物を次のとおりに(20%固形分、7%セルロースのウェルあたり65mg)トウモロコシの穂軸に加え、希アンモニアで前処理したトウモロコシ穂軸の糖化反応物を調製した。各ウェルには80μLの50mMの酢酸ナトリウム(pH 5.0)、グルカン1gあたり1mgのBgl1、及びグルカンバックグラウンド1gあたり0.5mgのXyn3も加えた。
Eg4を別個にCBH1、CBH2及びEG2と混合した場合の効果について試験するために、各ウェルに、CBH1、CBH2及びEG2の各々を、グルカン1gに対し0、1.25、2.5、5、10及び20mg加え、かつEG4をグルカン1gに対し20、18.75、17.5、15、10、及び0mgとなる濃度で加え、それぞれのウェルの総タンパク質量をグルカン1gに対し20mgとした。対照ウェルには、これらのウェルに対するタンパク質の総添加量が20mg/g未満になるように、同量のCBH1又はCBH2又はEG2又はEG4のみを添加した。
セルラーゼの組み合わせに対するEg4の効果を試験するために、異なる比でのCBH1、CBH2及びEG2の混合物(図8Aを参照されたい)を、グルカン1gに対し0、1.25、2.5、5、10、及び20mg加え、かつEG4をグルカン1gに対し20、18.75、17、5、15、10、及び0mgとなる濃度で混合物に加え、それぞれのウェルの総タンパク質量をグルカン1gに対し20mgとした。上記のとおり、対照ウェルには、総タンパク質添加量が20mg/g未満になるように1種類のタンパク質のみを添加した。
トウモロコシ穂軸の糖化反応物を、アルミニウム(E&K scientific)でシーリングし、600rpmで振とうさせながら24℃で2分間混合した。次にこのプレートを、200rpm、50℃に設定したInnova 44インキュベーター振とう器(New Brunswick Scientific)に72時間設置した。72時間の糖化工程後、プレートには100μLの100mMのグリシン(pH 10.0)を加え、反応を停止させた。次に、このプレートを3000rpmで5分間遠心分離した(Rotanta 460R Centrifuge,Hettich Zentrifugen)。HPLC 96ウェルマイクロタイタープレート(Agilent,5042〜1385)中の水100μLに上清20μLを添加した。Aminex HPX−87Pカラム(300mm×7.8mm,125−0098)とガードカラム(BioRad)を使用し、HPLCにより、グルコース及びセロビオース濃度を測定した。
結果を図8Bの表に示す。表中、グルカン変換率(%)は、(グルコース+セロビオース)/総グルカン(%)として定義される。
本実験により、希アンモニアで前処理したトウモロコシ穂軸の糖化を向上させるには、CBH1、CBH2及び/又はEG2にEg4を追加することが有効であったことが示される。更に、特にCBH2を含む混合物にEg4を加えた場合には相乗効果が観察された。これに加え、Eg4とその他の酵素(CBH1、CBH2又はEG2)を当量で糖化混合物に加えた場合に、最も大幅な向上が観察された。CBH1とCBH2の混合物に対してもEg4のかなりの効果が観察された。Eg4による最適な向上は、Eg4量がCBH1及びCBH2に対し1:1である場合に観察された。結果を図8Bに示す。
6.16.実施例16:EG4は様々なヘミセルラーゼ組成物の糖化性能を向上させる。
ビウレットアッセイの変法(本明細書に記載)により、市販のセルラーゼ酵素製剤Spezyme(登録商標)CP、Accellerase(登録商標)1500、及びAccellerase(登録商標)DUET(Genencor Division,Danisco US)の総タンパク質濃度を測定した。
精製T.リーゼイ(T. reesei)EG4を各酵素製剤に加え、次に、基質グルカン及びキシラン1gに対し総タンパク質が14mgになるよう、希アンモニアで前処理した固形分25%のトウモロコシ穂軸を使用して、糖化性能についてサンプルを解析した(グルカン及びキシラン1gに対し5mgのEG4に加え、グルカン及びキシラン1gに対し全セルラーゼ9mg)。20mLバイアル瓶に反応混合物(pH 5)を計5g入れ、200rpmに設定した回転振盪器により50℃で7日間インキュベートし、糖化反応を実施した。5mMの硫酸により糖化サンプルを10倍希釈し、0.2μmフィルタを通してろ過した後、HPLCに注入した。BioRad Aminex HPX−87Hイオン交換カラム(300mm×7.8mm)を使用しHPLC解析を実施した。
精製Eg4を全セルラーゼに組み入れたところ、図63Aに示されるように試験した全てのセルラーゼ産物においてグルカン変換率が向上した。図63Bに示されるように、キシラン変換率はEg4の組み入れによる明らかな影響を受けてはいなかった。
6.17 実施例17:Fv3Cのクローン化、発現及び精製
6.17.1.A.Fv3Cクローニング及び発現
Broad Instituteデータベース(http://www.broadinstitute.org/)のフザリウム・バーティシリオイド(Fusarium verticillioides)ゲノムに対しGH3のβ−グルコシダーゼ相同体について検索を行い、Fv3C配列(配列番号60)を得た。テンプレートとしてフザリウム・バーティシリオイド(Fusarium verticillioides)由来のゲノムDNAを用い、PCRによりFv3C翻訳領域を増幅させた。DNA Engine Tetrad 2 Peltier Thermal Cycler(Bio−Rad Laboratories)をPCRサーモサイクラーとして使用した。PfuUltra II Fusion HS DNAポリメラーゼ(Stratagene)をDNAポリメラーゼとして使用した。翻訳領域を増幅する際に使用したプライマーは次のとおりのものである:
順方向プライマーMH234(5’−CACCATGAAGCTGAATTGGGTCGC−3’)(配列番号145)
逆方向プライマーMH235(5’−TTACTCCAACTTGGCGCTG−3’)(配列番号146)
順方向プライマーには、4つの追加のヌクレオチド(配列−CACC)を5’末端に含有させて、pENTR/D−TOPO(Invitrogen、Carlsbad、CA)への定方向クローニングを促進させた。翻訳領域を増幅する際のPCR条件は以下の次のとおりのものである。工程1:94℃で2分。工程2:94℃で30秒。工程3:57℃で30秒。工程4:72℃で60秒。工程2、3及び4を更に29サイクル繰り返した。工程5:72℃で2分。Fv3C翻訳領域のPCR産物を、Qiaquick PCR精製キット(Qiagen)により精製した。生成したPCR産物を、最初にpENTR/D−TOPOベクターにクローン化し、TOP10ケミカルコンピテント大腸菌(E. coli)細胞(Invitrogen)を形質転換させ、50ppmのカナマイシンを含有させたLAプレートに播種した。QIAspinプラスミド調製キット(Qiagen)を用い、大腸菌(E. coli)形質転換体からプラスミドDNAを得た。pENTR/D−TOPOベクターに挿入されたDNAの配列を、M13順方向及び逆方向プライマーと、次のその他の配列プライマーとを用い確認した:
MH255(5’−AAGCCAAGAGCTTTGTGTCC−3’)(配列番号147)
MH256(5’−TATGCACGAGCTCTACGCCT−3’)(配列番号148)
MH257(5’−ATGGTACCCTGGCTATGGCT−3’)(配列番号149)
MH258(5’−CGGTCACGGTCTATCTTGGT−3’)(配列番号150)
Fv3C翻訳領域(図78)の正しいDNA配列を有するpENTR/D−TOPOベクターを、LRクロナーゼ(登録商標)反応混合物(Invitrogen)を用い、pTrex6g(図79A)デスティネーションベクターに組み込んだ。
続いて、LRクロナーゼ(登録商標)による反応産物により、TOP10ケミカルコンピテント大腸菌(E. coli)細胞(Invitrogen)を形質転換させ、次に、50ppmカルベニシリンを含有させたLAプレートに播種した。Fv3C翻訳領域と、T.リーゼイ(T. reesei)変異型アセト乳酸合成酵素選択マーカー(als)とを含有しているpTrex6g/Fv3C(図79B)を発現コンストラクト(pExpression construct)として得た。Qiagenミニプレップキットを用い、Fv3C翻訳領域を含有している発現コンストラクト(pExpression construct)のDNAを単離し、遺伝子銃によるT.リーゼイ(T. reesei)芽胞の形質転換に使用した。
遺伝子銃を用い、適切なFv3C翻訳領域を含有しているpTrex6g発現ベクターにより、T.リーゼイ(T. reesei)の形質転換を行った。特に、cbh1、cbh2、eg1、eg2、eg3、及びbgl1の欠失していた(すなわち、6欠失株、国際公開第05/001036号を参照されたい)T.リーゼイ(T. reesei)株を、製造元の指示に従ってBiolistic(登録商標)PDS−1000/he粒子デリバリーシステム(Bio−Rad)を用いヘリウムイオンビームにより形質転換させた(米国特許第2006/0003408号を参照されたい)。形質転換体を、新しいクロリムロンエチル選択培地に移植した。滅菌後に炭素供給源として約2%のグルコース/ソホロース混合物と、10mL/Lの100g/LのCaCl2、2.5mL/Lの400X T.リーゼイ(T. reesei)微量元素溶液(175g/Lの無水クエン酸;200g/LのFeSO4・7H2O;16g/LのZnSO4・7H2O;3.2g/LのCuSO4・5H2O;1.4g/LのMnSO4・H2O;0.8g/LのH3BO3を含有)を添加した200μL/ウェルのグリシン最少培地(6.0g/Lのグリシン;4.7g/L(NH4)2SO4;5.0g/LのKH2PO4;1.0g/LのMgSO4・7H2O;33.0g/LのPIPPS(pH 5.5)を含有)を、フィルタマイクロタイタープレート(Corning)に含有させ、好適な形質転換体を播種した。形質転換体を液体培地で5日間生育させた(28℃インキュベーター)。真空マニホールドで、フィルタマイクロタイタープレートから上清サンプルを回収した。上清サンプルを4〜12% NuPAGEゲルで電気泳動させ、Simply Blue stain(Invitrogen)により染色した。
6.17.2.B.Fv3Cの精製
振とうフラスコ濃縮物から、25mMのTES緩衝液(pH 6.8)にFv3Cを一晩透析した。透析した酵素溶液を、分取用SEC HiLoad Superdex 200架橋アガロース及びデキストランカラム(GE Healthcare)に流速1mL/minで充填した。カラムは前もって25mMのTES/0.1Mの塩化ナトリウム(pH 6.8)で平衡化させておいた。SDS−PAGEを用い、SEC分離により得られた画分にFv3Cが存在していることを同定及び確認した。Fv3Cを含有している画分をプールし、濃縮した。SEC精製も用い、低分子量及び高分子量の夾雑物からFv3Cを分離した。SDS/PAGEゲルをクーマシーブルー染色し、酵素調製物の純度を確認した。SDS/PAGEでは、単一の主要なバンドが97kDaに検出された。
6.17.3.C.Fv3Cの選択的翻訳
Fv3C遺伝子を発現させる際、フザリウム(Fusarium)データベースにおいて注釈されるとおりにORFを含有しているゲノム配列を使用した(www.broadinstitute.org/annotation/genome/fusarium_group/MultiHome.html)。予測コード領域はイントロンを3つ含有し、最初のイントロンはシグナルペプチド配列中に介在している(図80)。
3’末端では、最初のイントロンは、同様にシグナルペプチド用のコードとして予測される成熟配列のフレーム中に選択的ORFを含有していた(図80)。N末端配列解析により決定されるとおり、いずれの翻訳においても、成熟タンパク質(図81A下線部)の開始部位は、どちらも推定シグナルペプチド切断部位(矢印により示す)の下流から開始していた。すなわち、翻訳推定開始コドンとしてどちらのATGを用いた場合にも、Fv3Cを効果的に発現させることができることが示された(図81B)。
6.18.実施例18:セロビオース及びCNPGに対するβ−グルコシダーゼ活性
本実験では、セロビオース及びCNPGに対する、T.リーゼイ(T. reesei)Bgl1(Tr3A)、A.ニガー(A. niger)Bglu(An3A)(Megazyme International Ireland Ltd.、Wicklow、Ireland)、Fv3C(配列番号60)、Fv3D(配列番号58)、及びPa3C(配列番号44)のβ−グルコシダーゼの活性を試験した。T.リーゼイ(T. reesei)Bgl1及びA.ニガー(A. niger)Bglu(「An3A」)は精製タンパク質であった。Fv3C、Fv3D及びPa3Cは未精製タンパク質である。これらのタンパク質はT.リーゼイ(T. reesei)6欠失株(上記を参照のこと)で発現させたが、バックグラウンドにタンパク質活性が幾分存在していた。図13に示すとおり、セロビオースに対しては、Fv3CはT.リーゼイ(T. reesei)Bgl1と比較して約2倍の活性を有すること、それに対しA.ニガー(A. niger)Bgluは、T.リーゼイ(T. reesei)Bgl1と比較して約12倍もの活性を有することが判明した。
CNPG基質に対しては、Fv3C活性はT.リーゼイ(T. reesei)Bgl1のものと概ね等しかったが、A.ニガー(A. niger)BgluではT.リーゼイ(T. reesei)Bglu1の活性の約14%であった(図13)。Fv3Cと同様に発現させた、その他のフザリウム・バーティシリオイド(Fusarium verticillioides)β−グルコシダーゼのFv3Dの場合、セロビアーゼ活性は検出されなかったものの、CNPGに対する活性はT.リーゼイ(T. reesei)Bgl1の約5倍であった。更に、同様に生成したポドスポラ・アンセリナ(Podospora anserina)β−グルコシダーゼ相同体のPa3Cの場合、セロビオース又はCNPG基質に対する活性は測定されなかった。これらの試験により、セロビオース及びCNPGに対するFv3Cの活性は分子自体によるものであり、バックグラウンドのタンパク質の活性によるものではないことが示された。
6.19.実施例19:Fv3Cによる様々なバイオマス基質の糖化
6.19.1.A.PASCに対するFv3Cの糖化性能
本実験では、PASCに対する、T.リーゼイ(T. reesei)Bgl1、Fv3C、及び数種のFv3C相同体の糖化性能を試験する。96ウェルHPLCプレートに、セルロース1gあたりタンパク質量が5mg〜10mgになるよう各β−グルコシダーゼ20μLを加え、T.リーゼイ(T. reesei)Bgl1抑制株由来の全セルラーゼを充填した。固形分0.7%のPASCスラリー150μLを各ウェルに加え、プレートをアルニウム製プレートシーラーで覆い、50℃に設定したインキュベーターに設置し、2時間振とうした。100mMのグリシン緩衝液(pH10)100μLを各ウェルに加え、反応を停止させた。十分に混合した後、プレートを遠心分離し、上清を、各ウェルに10mMのグリシン(pH 10)100μLを含有させた他のHPLCプレートで10倍希釈した。生成された可溶性糖類の濃度を、HPLCを用い測定した(図82)。
T.リーゼイ(T. reesei)Bgl1を含有させた混合物と比較して、同じ条件下ではFv3Cを含有させた混合物の方が、グルコースの収率が高いことが示された。これにより、Fv3Cの有するセロビアーゼ活性はT.リーゼイ(T. reesei)Bgl1のものよりも高いことが示される(同様に図13を参照されたい)。Fv3G、Pa3D及びPa3GはPASC加水分解に対し何ら効果を示さなかったことから、PASC加水分解に対し、6遺伝子を欠失させたバックグラウンド(各種Fv3C相同体をクローン化し発現させた)による影響はなかったことが示された。
6.19.2.B.希酸で前処理したトウモロコシ葉茎(PCS)に対するFv3Cの糖化性能
本実験では、固形分13%のPCSの糖化の向上に対するT.リーゼイ(T. reesei)Bgl1、Fv3C、及び数種のFv3C相同体の性能を、マイクロタイタープレート糖化アッセイ(上掲)を用い試験した。各酵素を試験する際、セルロース1gあたり5mgのβ−グルコシダーゼに、T.リーゼイ(T. reesei)−Bgl1欠損株に由来する、セルロース1gあたり10mgの全セルラーゼを添加した。
具体的には、セルロース1gあたり5mgの各β−グルコシダーゼ(Bgl1、Fv3C、及び相同体)に、T.リーゼイ(T. reesei)Bgl1欠損株に由来する、セルロース1gあたり10mgの全セルラーゼ、又はセルロース1gあたり8mgの精製ヘミセルラーゼ混合物(成分を図14に示す)を添加した。酵素混合物と基質とを50℃で2日間インキュベートした後、グルカン変換率(%)を測定した。
結果を図83に示す。T.リーゼイ(T. reesei)Bgl1と比較して、Fv3Cは、グルカン変換率(%)に対して明らかに効果を示す。更に、Fv3Cも、グルコース及び糖の合計収率がT.リーゼイ(T. reesei)Bgl1よりも高かった。
この結果により、宿主細胞由来のバックグラウンドのタンパク質の影響は、あったとしてもわずかなものであることが示された。
6.19.3.C.アンモニアで前処理したトウモロコシ穂軸に対する、Fv3Cの糖化性能
本実験では、T.リーゼイ(T. reesei)Bgl1、Fv3C、及びA.ニガー(A. niger)Bglu(An3A)が、アンモニアで前処理した固形分20%のトウモロコシ穂軸の糖化を向上させる性能について、マイクロタイタープレート糖化アッセイ(上掲)に従って試験した。特に、セルロース1gあたり5mgのβ−グルコシダーゼ(例えば、T.リーゼイ(T. reesei)Bgl1、Fv3C、及び相同体)に、希アンモニアで前処理したトウモロコシ穂軸基質と、T.リーゼイ(T. reesei)Bgl1欠損株に由来するセルロース1gあたり10mgの全セルラーゼとを添加した。更に、Xyn3、Fv3A、Fv43D及びFv51Aを含有している精製ヘミセルラーゼミックス(図14)も、セルロース1gあたり8mgとなるよう混合物に添加した。50℃下で2日間、酵素混合物と基質をインキュベートした後、グルカン変換率(%)を測定した。
結果を図84に示す。Fv3Cの性能は、T.リーゼイ(T. reesei)Bgl1(Tr3A)などのその他のβ−グルコシダーゼと比較して明らかに良好である。A.ニガー(A. niger)Bglu(An3A)を、セルロース1gあたり2.5mgを上回る量で酵素混合物に加えた場合、糖化が阻害されることも観察された。
6.19.4.D.水酸化ナトリウム(NaOH)で前処理したトウモロコシ穂軸に対するFv3Cの糖化性能
各種基質の前処理方法が、Fv3C性能に対し示す影響を試験するために、T.リーゼイ(T. reesei)Bgl1(Tr3Aとも呼ぶ)、Fv3C、及びA.ニガー(A. niger)Bglu(An3A)が、NaOHで前処理した固形分12%のトウモロコシ穂軸の糖化を向上させる性能について、マイクロタイタープレート糖化アッセイ(上掲)に記載の方法に従って測定した。水酸化ナトリウムによるトウモロコシの穂軸の前処理は次のとおりに実施した:1,000gのトウモロコシの穂軸を約2mm大に挽き、次に4Lの5%の水酸化ナトリウム水溶液に懸濁し、110℃で16時間加熱した。実験室において、高熱真空下で暗褐色の液体をろ過した。溶出液に呈色が観察されなくなるまで、フィルタ上の固体残渣を水で洗浄した。固体を、実験室において真空下で24時間乾燥させた。100gのサンプルを700mLの水に懸濁し、撹拌した。溶液のpHを測定したところ、11.2であった。クエン酸水溶液(10%)を添加してpHを5.0に下げ、この懸濁液を30分撹拌した。次に固形分をろ過し、水で洗浄し、室温にて真空下で24時間乾燥させた。乾燥後、多糖類に富む86.2gのバイオマスを得た。このバイオマスの湿分含量は約7.3重量%であった。糖解析用のNREL法により、水酸化ナトリウム処理の前後に、グルカン、キシラン、リグニン、及び総糖含量を測定した。前処理によりバイオマスを脱リグニン化させつつ、グルカン/キシランの重量比を未処理のバイオマスの15%以内に維持した。
セルロース1gに対し約5mgのβ−グルコシダーゼ(Fv3C及び相同体)を、NaOHで前処理した基質に加え、それとともに、特にBgl1を低発現している株について選択した、遺伝子組み込み型T.リーゼイ(T. reesei)株H3A(「H3A−5株」)に由来する全セルラーゼを、セルロース1gに対し8.7mg加えた。本実験では、全セルラーゼバックグラウンドには、その他の精製ヘミセルラーゼ(例えば、図14の混合物)を添加しなかった。50℃下で2日間、酵素混合物と基質をインキュベートした後、グルカン変換率(%)を測定した。
結果を図85に示す。T.リーゼイ(T. reesei)Bgl1(Tr3A)、An3A及びTe3Aなどのその他のβ−グルコシダーゼと比較して、Fv3Cはある程度良好な性能を有することが観察された。セルロース1gあたり4mg以上のA.ニガー(A. niger)Bglu(An3A)を加えた場合、変換率が低くなることも観察された。
6.19.5.E.希アンモニアで前処理したスイッチグラスに対するFv3Cの糖化性能
本実験では、T.リーゼイ(T. reesei)Bgl1、Fv3C、及びA.ニガー(A. niger)Bglu(An3A)が、希アンモニアで前処理した固形分17%のスイッチグラスの糖化を向上させる性能について、マイクロタイタープレート糖化アッセイ(上掲)に従って試験した。希アンモニアで前処理したスイッチグラスをDuPontから得た。National Renewable Energy Laboratory(NREL)の手法(NREL LAP−002)(www.nrel.gov/biomass/analytical_procedures.htmlで利用可能)により、組成を測定した。
乾燥重量に基づき、組成は、グルカン(36.82%)、キシラン(26.09%)、アラビナン(3.51%)、酸不溶性リグニン(24.7%)、及びアセチル(2.98%)であった。1mmスクリーンを通過させ、この原材料をナイフで細断した。細断した材料を、6重量%(乾燥固形分)アンモニアの存在下で、約160℃で90分前処理した。初期固形充填量は、乾物約50%であった。処理したバイオマスを、使用時まで4℃で保管した。
この実験では、β−グルコシダーゼを低発現しているものの中から選択した遺伝子組み込み型T.リーゼイ(T. reesei)株(H3A)に由来する、セルロース1gあたり10mgの全セルラーゼの存在下で、希アンモニアで前処理したスイッチグラスにセルロース1gあたり5mgのβ−グルコシダーゼ(例えば、T.リーゼイ(T. reesei)Bgl1、Fv3C、及び相同体)を添加した。50℃下で2日間、酵素混合物と基質をインキュベートした後、グルカン変換率(%)を測定した。結果を図86に示す。
Fv3Cは、スイッチグラス基質に対して、T.リーゼイ(T. reesei)Bgl1及びA.ニガー(A. niger)Bgluよりも良好に機能した。
6.19.6.F.AFEXトウモロコシ葉茎に対するFv3Cの糖化性能
本実験では、T.リーゼイ(T. reesei)Bgl1、Fv3C、及びA.ニガー(A. niger)Bglu(An3A)が、固形分14%のAFEXトウモロコシ葉茎の糖化を向上させる性能について、マイクロタイタープレート糖化アッセイ(上掲)に従って試験した。AFEXで前処理したトウモロコシ茎葉は、ミシガン・バイオテクノロジー・国際研究所(Michigan Biotechnology Institute International)(MBI)より得た。トウモロコシ茎葉の組成は、National Renewable Energy Laboratory(NREL)の手法LAP−002により測定した(www.nrel.gov/biomass/analytical_procedures.htmlで利用可能)。
乾燥重量に基づき、組成は、グルカン(31.7%)、キシラン(19.1%)、ガラクタン(1.83%)、及びアラビナン(3.4%)であった。5ガロンの圧力反応器(Parr)において、90℃、湿分含量60%、バイオマス量対アンモニア充填量1:1で、この原材料を30分AFEX処理した。処理したバイオマスを反応器から取り出し、ドラフト内に置き、残存しているアンモニアを蒸発させた。処理したバイオマスを、使用時まで4℃で保管した。
本実験では、前処理した基質に、β−グルコシダーゼを発現している遺伝子組み込み型T.リーゼイ(T. reesei)株に由来する、セルロース1gあたり10mgの全セルラーゼの存在下で、セルロース1gあたり5mgのβ−グルコシダーゼ(Fv3C及び相同体)を加えた。50℃下で2日間、酵素混合物と基質をインキュベートした後、グルカン変換率(%)を測定した。結果を図87に示す。
グルカンの変換において、Fv3Cが、T.リーゼイ(T. reesei)Bgl1よりも良好に機能した。上記条件下で、セルロース1gあたり10mgのFv3Cと、セルロース1gあたり10mgのH3A全セルラーゼにより、完全に又は一見したところ完全にグルカンが変換されたことにも留意した。セルロース1gあたり1mg未満の濃度では、A.ニガー(A. niger)Bglu(An3A)は、見たところ、Fv3C及びT.リーゼイ(T. reesei)Bgl1と比較してグルコース変換率及び総グルカン変換率が高いものの、セルロース1gあたり2.5mg超の濃度になると、Fv3C及びT.リーゼイ(T. reesei)Bgl1の方が、A.ニガー(A. niger)Bgluよりもグルコース変換率(An3A)及び総グルカン変換率が高くなることが示された。
6.20 実施例20:アンモニアで前処理したトウモロコシ穂軸を糖化する際のFv3C対全セルラーゼ比の最適化
本実験では、Fv3C対全セルラーゼ比を変えて、ヘミセルラーゼ組成物におけるFv3C対全セルラーゼの最適比を決定した。アンモニアで前処理したトウモロコシ穂軸を基質として使用した。β−グルコシダーゼ(例えば、T.リーゼイ(T. reesei)Bgl1(Tr3A)、Fv3C、A.ニガー(A. niger)Bglu)対T.リーゼイ(T. reesei)組み込み株(H3A)由来の全セルラーゼ比を、ヘミセルラーゼ組成物において0〜50%で変化させた。アンモニアで前処理した固形分20%のトウモロコシ穂軸を、タンパク質濃度がセルロース1gあたり20mgとなるよう混合物に添加し、加水分解させた。結果を図88A〜88Cに示す。
T.リーゼイ(T. reesei)Bgl1(Tr3A)対全セルラーゼの最適比には幅があり、中央値が約10%であり、混合物濃度が50%になると、全セルラーゼを単独で充填した場合と同様の結果が得られる。対照的に、A.ニガー(A. niger)Bglu(又はAn3A)は約5%で最適になり、ピークはよりシャープであった。ピーク/最適濃度では、A.ニガー(A. niger)Bglu(又はAn3A)は、T.リーゼイ(T. reesei)Bglu(Tr3A)を含有している最適な混合物よりも変換率が高かった。
Fv3C対全セルラーゼの最適比は約25%であることが判明した。この場合、セルロース1gあたり総タンパク質20mgの混合物により、96%超のグルカンが変換されることになる。したがって、全セルラーゼ中の酵素のうち25%を、単独の酵素Fv3Cで置き換えることで、糖化性能を向上させることができる。
6.21 実施例21:異なる酵素配合物によるアンモニアで前処理したトウモロコシ穂軸の糖化
T.リーゼイ(T. reesei)組み込み株(H3A)由来の25% Fv3C/75%全セルラーゼ混合物を、用量反応実験において、その他の高性能なセルラーゼ混合物と比較した。T.リーゼイ(T. reesei)組み込み株(H3A)単独に由来する全セルラーゼ、T.リーゼイ(T. reesei)組み込み株(H3A)混合物に由来する25% Fv3C/75%全セルラーゼ、及びAccellerase(登録商標)1500+Multifect(登録商標)キシラナーゼを、希アンモニアで前処理した固形分20%のトウモロコシ穂軸に対する糖化性能に関し比較した。反応時には、セルロース1gあたり2.5〜40mgとなるよう酵素配合物を投与した。結果を図89に示す。
T.リーゼイ(T. reesei)組み込み株(H3A)混合物由来の25%Fv3C/75%全セルラーゼは、Accellerase(登録商標)1500+Multifect(登録商標)キシラナーゼ配合物と比較して劇的に良好であり、T.リーゼイ(T. reesei)組み込み株(H3A)由来の全セルラーゼと比較して大幅な向上を示した。70、80、又は90%のグルカンを変換させるのに必要とされる投与量を図15に掲載する。グルカン変換率70%では、T.リーゼイ(T. reesei)組み込み株(H3A)混合物由来の25% Fv3C/75%全セルラーゼは、Accellerase(登録商標)1500+Multifect(登録商標)キシラナーゼ配合物と比較して投与量が3.2倍削減される。70、80、又は90%のグルカン変換率では、T.リーゼイ(T. reesei)組み込み株(H3A)混合物由来の25%Fv3C/75%全セルラーゼは、T.リーゼイ(T. reesei)組み込み株(H3A)単独に由来する全セルラーゼと比較して、必要とされる酵素が約1.8倍削減される。
6.22 実施例22:アスペルギルス・ニガー(Aspergillus niger)株でのFv3Cの発現
A.ニガー(A. niger)においてFv3Cを発現させるために、米国特許第7459299号に記載のとおりにGateway LR組み換え反応(Invitrogen)を用い、デスティネーションベクターpRAXdest2によりpEntry−Fv3Cプラスミドを組み換えた。発現プラスミドには、A.ニガー(A. niger)グルコアミラーゼのプロモーター及びターミネーターの調節下のFv3Cゲノム配列、選択マーカー用のA.ニデュランス(A. nidulans)pyrG遺伝子、真菌細胞での自律複製用のA.ニデュランス(A. nidulans)ama1配列を含有させた。生成された組み換え産物により大腸菌(E. coli) Max Efficiency DH5α(Invitrogen)を形質転換させ、発現コンストラクトpRAX2−Fv3C(図90A)を含有しているクローンを2xYT寒天プレート(16g/Lのバクトトリプトン(Difco)、10g/Lのバクト酵母エキス(Difco)、5g/LのNaCl、16g/Lのバクトアガー(Difco)、及び100μg/mLのアンピシリン含有)で選択した。
約50〜100mgの発現プラスミドによりA.ニガー(A. niger)変異体アワモリ(awamori)株を形質転換させた(米国特許第7459299号を参照されたい)。内在性グルコアミラーゼglaA遺伝子をこの株から欠失させ、かつウリジン要求性の形質転換体を選択するためにpyrG遺伝子に変異を生じさせた。A.ニガー(A. niger)形質転換体をMMの培地(T.リーゼイ(T. reesei)の形質転換に使用したものと同様の最少培地だが、アセトアミドの代わりに10mMのNH4Clを窒素供給源として使用した)で37℃で4〜5日生育させ、異なる形質転換体のプレート由来の総芽胞集団を使用して(約106芽胞/mL)、産生培地(1Lあたり):12gのトリプトン;8gのソイトン;15gの(NH4)2SO4;12.1gのNaH2PO4xH2O;2.19gのNa2HPO4x2H2O;1gのMgSO4x7H2O;1mLのTween 80;150gのマルトース;(pH 5.8)を入れた振とうフラスコに接種した。200rpmで振とうさせながら30℃で3日間発酵させた後、形質転換体におけるFv3Cの発現をSDS−PAGEにより確認した。
6.23.実施例23:その他のT.リーゼイ(T. reesei)組み込み株の構築及び選択
6.23.1.A.CB#201株の生成
RL−P37(Sheir−Neiss,G.and B.S.Montenecourt,Appl.Microbiol.Biotechnol.1984,20:46〜53)に由来し、かつ高セルラーゼ生産性について選択したT.リーゼイ(T. reesei)変異株を、F.バーティシリオイド(F. verticillioides)の3種のヘミセルラーゼ遺伝子(Fv3A、Fv43D及びFv51A)により同時形質転換させた。これらは、T.リーゼイ(T. reesei)egl1プロモーター(Pegl1)、T.リーゼイ(T. reesei)cbh2プロモーター(Pcbh2)又はT.リーゼイ(T. reesei)cbh1プロモーター(Pcbh1)、及びアセト乳酸合成酵素(als)マーカー(米国特許第2007/020484号、国際公開第2009/114380号)を含有する3種の異なる組み合わせで電気穿孔法により同時形質転換を行った。3種の組み合わせは次のとおりのものである:1)Pegl1−fv51a、Pcbh2−fv43d−als及びPegl1−fv3a、2)Pcbh1−fv3a−alsマーカー、Pegl1−fv51a及びPcbh2−fv43d、及び3)Pegl1−fv51a、Pcbh1−fv43d−als及びPegl1−fv3a。電気穿孔法後に、クロリムロンエチルを含有させた選択寒天培地に形質転換混合物を蒔いた。次に、形質転換体を、国際公開第/2009/114380号に記載のとおりにマイクロタイタープレート中で生育させた。得られた形質転換体を、これまでに記載したとおりのMTPスケールでのトウモロコシ穂軸の糖化性能アッセイにより選択した。選択により、グルコース及びキシロースの高変換率を示した株(CB #201)が同定された。
発現カセットの増幅には、次のプライマー対を使用した:
Pegl1−fv51aプライマー対:
SK1298 5’−GTAGTTATGCGCATGCTAGAC−3’(配列番号151)
SK1289 5’−GTGGCTAGAAGATATCCAACAC−3’(配列番号152)
Pcbh2−fv43d−alsプライマー対:
SK1438 5’−CGTCTAACTCGAACATCTGC−3’(配列番号153)
SK1299 5’−GTAgcggccgcCTCATCTCATCTCATCCATCC−3’(配列番号154)
Pegl1−fv3aプライマー対
SK1298 5’−GTAGTTATGCGCATGCTAGAC−3’(配列番号155)
SK822−5’−CACGAAGAGCGGCGATTC−3’(配列番号156)
Pcbh1−fv3a−alsプライマー対:
SK1335 5’−GCAACGGCAAAGCCCCACTTC−3’(配列番号157)
SK1299 5’−GTAgcggccgcCTCATCTCATCTCATCCATCC−3’(配列番号158)
Pcbh2−fv43dプライマー対:
SK1438 5’−CGTCTAACTCGAACATCTGC−3’(配列番号159)
SK1449 5’−CATggcgcgccCAACTGCCCGTTCTGTAGC−3’(配列番号160)
Pcbh1−fv43d−alsプライマー対:
SK 1335 5’−GCAACGGCAAAGCCCCACTTC−3’(配列番号157)
SK1299 5’−GTAgcggccgcCTCATCTCATCTCATCCATCC−3’(配列番号161)
図62A〜62Gに示すプラスミドから発現カセットを増幅させた。
6.23.2 B.CB#201株の形質転換
プライマーSK1597及びSK1603を用い増幅させたT.リーゼイ(T. reesei)eg4、プライマーSK1438及びSK1603を用い増幅させたT.リーゼイ(T. reesei)xyn3並びにプライマーRPG159及びRPG163(下記実施例23を参照のこと)を用い増幅させたF.バーティシリオイド(F. verticillioides)のFv3C β−グルコシダーゼキメラ体、を収容しているPCR産物を用いて電気穿孔法(国際公開第2009114380号)を行い、T.リーゼイ(T. reesei)CB#201株を更に形質転換させた。形質転換の際には、プライマーRPG159及びRPG163により増幅させた発現カセットに収容させたA.ニデュランス(A. nidulans)のamdS遺伝子を選択マーカーとして使用した。アセトアミドを含有させた選択培地で形質転換体を生育させた(国際公開第2009114380号)。(国際公開第2009114380号)に記載のとおりに発現させるために、安定した形態を示す形質転換体をマイクロタイタープレートで培養した。培養上清をSDS−PAGE及びcNPGアッセイ(上記)により解析した。トウモロコシ穂軸の糖化アッセイにおいて性能について選択した形質転換を選択する(下記第F節)。
T.リーゼイ(T. reesei)を形質転換させるための発現カセットの増幅には、次のプライマー対を使用した:
Pegl1−Tr egl4−cbh1 terminatorプライマー対:
SK1597 5’−GTAGTTATGCGCATGCTAGACTGCTCC−3’(配列番号162)
SK1603 5’−GCAGGCCGCATCTCCAGTGAAAG−3’(配列番号163)
Pcbh2−Tr xyn3−cbh1 terminatorプライマー対:
SK1438 5’−CGTCTAACTCGAACATCTGC−3’(配列番号164)
SK1603 5’−GCAGGCCGCATCTCCAGTGAAAG−3’(配列番号165)
Pcbh1−fab−cbh1 terminator−amdSプライマー対:
RPG159 5’−AGTTGTGAAGTCGGTAATCCCGCTGTAT−3’(配列番号166)
RPG163 5’−TCGTAGCATGGCATGGTCACTTCA−3’(配列番号167)
6.23.3.C.エンドキシラナーゼ(Xyn3)発現カセットの構築
T.リーゼイ(T. reesei)株から抽出したゲノムDNAサンプルから、ネイティブなT.リーゼイ(T. reesei)エンドキシラナーゼ遺伝子xyn3(GenBank:BAA89465.2)を、プライマーxyn3F−2及びxyn3R−2を使用しPCRにより増幅させた。
順方向プライマー(xyn3F−2):
[配列表1]
(下線を付した残基CACCは、ENTR(商標)/D−TOPO(登録商標)へのクローン化を容易にするために使用した)
逆方向プライマー(xyn3R−2):5’−CTATTGTAAGATGCCAACAATGCTGTTATATGCCGGCTTGGGG−3’(配列番号169)
得られたPCR産物をGateway(登録商標)ベクターpENTR(商標)/D−TOPO(登録商標)にクローン化し、大腸菌(E. coli)One Shot(登録商標)TOP10ケミカルコンピテントセル(Invitrogen)を形質転換させ、中間ベクターpENTR/Xyn3を得た。挿入したDNAのヌクレオチド配列を確認した。
正しいxyn3配列を有するpENTR/Xyn3ベクターを、Invitrogenによりプロトコルの概要されたLRクロナーゼ(登録商標)反応により、pTrex3gで組み替えた。LRクロナーゼ反応混合物により大腸菌(E. coli)One Shot(登録商標)TOP10ケミカルコンピテントセル(Invitrogen)を形質転換させ、発現ベクターpTrex3g/Xyn3を得た。ベクターには、形質転換したT.リーゼイ(T. reesei)の選択マーカーとして、アセトアミダーゼをコードしているアスペルギルス・ニデュランス(Aspergillus nidulans)のamdS遺伝子も含有させた。プライマーxyn3−F−SOE及びSK822を使用し、xyn3翻訳領域、cbh1ターミネーター及びamdS配列を増幅させた。プライマーSK1019及びcbh2P−R−SOEによりT.リーゼイ(T. reesei)野生株QM6AのゲノムDNAからcbh2のプロモーターを増幅させた。続いてプライマーSK1019及びSK822により、2つの断片の融合PCRを実施し、Pcbh2−xyn3−及びcbh1ターミネーターからなるカセットを得た。この融合PCR産物を次にpCR−Blunt−II−TOPO(Invitrogen)にクローン化し、大腸菌(E. coli)One Shot(登録商標)TOP10ケミカルコンピテントセル(Invitrogen)を形質転換させ、発現ベクターpCR−Blunt II−TOPO/Pcbh2−xyn3−cbh1 terminatorを得た(図103Bを参照されたい)。挿入したDNAのヌクレオチド配列を確認した。
順方向プライマー(xyn3−F−SOE)5’−AGATCACCCTCTGTGTATTGCACCATGAAA GCAAACGTCA−3’(配列番号170)
逆方向プライマー(cbh2P−R−SOE)5’−TGACGTTTGCTTTCATGGTGCAATACACAGAG GGTGATCT−3’(配列番号171)
順方向プライマー(SK1019):5’−GAGTTGTGAAGTCGGTAATCC−3’(配列番号172)
逆方向プライマー(SK822):5’−CACGAAGAGCGGCGATTC−3’(配列番号173)
6.23.4.D.エンドグルカナーゼのT.リーゼイ(T. reesei)Eg4の発現カセットの構築
T.リーゼイ(T. reesei)株から抽出したゲノムDNAサンプルから、ネイティブなT.リーゼイ(T. reesei)エンドグルカナーゼ遺伝子eg4(GenBank受入番号ADJ57703.1)を、プライマーSK1430及びSK1431を使用しPCRにより増幅させた。
順方向プライマー(SK1430):
[配列表2]
(下線を付した「CACC」は、pENTR(商標)/D−TOPO(登録商標)へのクローン化を容易にするために使用した)。
逆方向プライマー(SK1431):5’−CTAGTTAAGGCACTGGGCGTA−3’(配列番号175)
得られたPCR産物をGateway(登録商標)エントリーベクターpENTR(商標)/D−TOPO(登録商標)にクローン化し、大腸菌(E. coli)One Shot(登録商標)TOP10ケミカルコンピテントセル(Invitrogen)を形質転換させ、中間ベクターpENTR/Egl4を得た。挿入したDNAのヌクレオチド配列を確認した。
正しいegl4配列を有するpENTR/EG4ベクターを、Invitrogenにより概説されたLRクロナーゼ(登録商標)反応プロトコルを使用しpTrex9gMで組み替えた。LRクロナーゼ反応混合物により大腸菌(E. coli)One Shot(登録商標)TOP10ケミカルコンピテントセル(Invitrogen)を形質転換させ、発現ベクターpTrex9gM/Egl4を得た。ベクターには、形質転換したT.リーゼイ(T. reesei)の選択マーカーとして、スクラーゼをコードしているA.ニガー(A. niger)sucA遺伝子も含有させた。プライマーSK1430及びSK1432を使用し、egl4翻訳領域、cbh1ターミネーター及びsucA配列を増幅させた。プライマーSK1236及びSK1433を使用し、T.リーゼイ(T. reesei)野生株QM6AのゲノムDNAからegl1プロモーターをPCR増幅させた。続いて、2種のDNA断片を、プライマーSK1298及びSK1432を使用して融合PCR反応により一緒に融合させた。得られる融合PCR産物をpCR−Blunt II−TOPOベクター(Invitrogen)にクローン化してTOPO Blunt II−TOPO w/Pegl1−egl4−sucA(図103Cを参照されたい)を作成し、大腸菌(E. coli)One Shot(登録商標)TOP10ケミカルコンピテントセル(Invitrogen)を形質転換させた。挿入したDNAのヌクレオチド配列を確認した。
順方向プライマー(SK1236):5’−CATGCGATCGCGACGTTTTGGTCAGGTCG−3’(配列番号176)
逆方向プライマー(SK1433):5’−GTTGGAAAGCTTCTGGATCATGGTGTGGGACAACAA GAAGG−3’(配列番号177)
順方向プライマー(SK1430):
[配列表3]
(下線を付した残基は、pENTR(商標)/D−TOPO(登録商標)へのクローン化を容易にするために使用した)。
逆方向プライマー(SK1432):5’−GCTCAGTATCAACCACTAAGC−3’(配列番号179)
順方向プライマー(SK1298):5’−GTAGTTATGCGCATGCTAGAC−3’(配列番号180)
プライマーSK1597及びSK1603を使用してこの発現カセットをPCR増幅させ、T.リーゼイ(T. reesei)の形質転換体を作製した。
順方向プライマー(SK1597):5’−GTAGTTATGCGCATGCTAGACTGCTCC−3’(配列番号181)
逆方向プライマー(SK1603):5’−GCAGGCCGCATCTCCAGTGAAAG−3’(配列番号182)
6.23.5.E.β−グルコシダーゼキメラポリペプチドFv3C/Te3A/T.リーゼイ(T. reesei)Bgl3発現ベクターの構築
Fv3Cの構造データ及びBgl3に予測されるモデルをもとに、Fv3C全長の第692番目の位置のアミノ酸(aa)で2つの分子が融合するよう設計を行った。すなわち、Fv3Cの最初の第1番目〜第691番目のアミノ酸残基を、Bgl3の第668番目〜第874番目のアミノ酸領域と融合させた。融合PCR法によりキメラ分子を構築した。Fv3C及びBgl3をコードしているゲノム配列のエントリークローンをPCRのテンプレートとして使用した。いずれのエントリークローンも、供給元の推奨に従いpDonor221ベクター(Invitrogen,Carlsbad,CA,USA)で構築した。2段階で融合産物を組み立てた。まず始めに、pEntry Fv3Cクローンをテンプレートとして使用し、かつ次の特異的なオリゴヌクレオチド:
pDonor順方向5’GCTAGCATGGATGTTTTCCCAGTCACGACGTTGTA AAACGACGGC−3’(配列番号183);及び
Fv3C/Bgl3逆方向5’GGAGGTTGGAGAACTTGAACGTCGACCAAGATAGACC GTGACCGAACTCGTAG−3’(配列番号184)、を使用し、Fv3Cに特異的な配列をPCR反応により増幅させた。
次のオリゴヌクレオチド:
pDonor逆方向:5’−TGCCAGGAAACAGCTATGACCATGTAATACGACTCACTATAGG−3’(配列番号185);及び
Fv3C/Bgl3順方向:5’−CTACGAGTTCGGTCACGGTCTATCTTGGTCGACGTTC AAGTTCTCCAACCTCC−3’(配列番号186)、を使用し、同様の反応により、pENTR Bg3ベクターからBgl3の3’末端領域を増幅させた。
次の工程では、ネストプライマー対:
Att L1順方向5’TAAGCTCGGGCCCCAAATAATGATTTTATTTTGACTGATAGT−3’(配列番号187);及び
AttL2逆方向5’GGGATATCAGCTGGATGGCAAATAATGATTTTATTTTGACTGATA−3’(配列番号188)、を使用する、続く融合PCR反応のため、各PCR産物(第1工程のPCR反応からそれぞれ約1μL及び0.2μL)をテンプレートとして当量加えた。
全てのPCRには高忠実性融合Phusion DNAポリメラーゼ(Finnzymes OY(Espoo,Finland))を使用し、供給元により推奨される標準条件下で実施した。融合させた最終的なPCR産物は、インタクトなGateway特異的attL1、attL2組み換え部位を両末端に含有しており、Gateway LR組み換え反応(Invitrogen(Carlsbad,CA,USA))により最終的なデスティネーションベクターに直接クローニングすることができた。
0.8%アガロースゲルで特定のDNA断片を分離させた後、この断片をNucleospin(登録商標)Extract PCR clean−upキット(Macherey−Nagel GmbH & co.KG,Duren,Germany)により精製し、このうち100ngを、Invitrogenのプロトコルに従いLRクロナーゼ(商標)II酵素ミックスを使用してpTTT−pyrG13(国際公開第2009/048488号を参照されたい)デスティネーションベクターに組み込んだ。生成した組み換え産物により、供給元(Invitrogen)による記載のとおりに、大腸菌(E. coli)Max Efficiency DH5αを形質転換させ、発現コンストラクトpTTT−pyrG13−Fv3C/Bgl3 fusion(図100)とβ−グルコシダーゼキメラを含有しているクローンを、100μg/mlのアンピシリンを添加した2xYT寒天プレート(16g/Lのバクトトリプトン(Difco,USA)、10g/Lのバクト酵母エキス(Difco,USA)、5g/LのNaCl、16g/Lのバクトアガー(Difco,USA))で選択した。バクテリア培養物を、100μg/mlのアンピシリンを添加した2xYT培地で生育させた後、制限酵素のBglI又はEcoRVのいずれかを使用して単離プラスミドを切断し、解析し、ABI3100配列解析器(Applied Biosystems)を使用して、Fv3C/Bgl3(「FB」)に特異的な領域を配列決定した。
キメラの、Bgl3に由来する領域に、2つのN−グリコシル化部位、S725N及びS751Nを導入した。Fv3Cでは相当する部位をグリコシル化し、Bgl3ではグリコシル化を行わなかった。第1工程のPCR反応で、pTTT−pyrG13−Fv3C/Bgl3融合プラスミド(図100)をテンプレートとして使用したことを除き、上記のものと本質的に同様のPCR融合法により、Fv3C/Bgl3(FB)骨格にグリコシル化変異(mutation)を導入した。次のプライマーを使用し、PCR産物を1種類生成した:
Pr CbhI順方向:5’CGGAATGAGCTAGTAGGCAAAGTCAGC−3’配列番号189);及び
725/751逆方向:5’−CTCCTTGATGCGGCGAACGTTCTTGGGGAAGCCATAGTCCTTAAG GTTCTTGCTGAAGTTGCCCAGAGAG−3’(配列番号190)
第2のPCR産物は、次のオリゴヌクレオチド対を使用して増幅させた:
725/751順方向:5’−GGCTTCCCCAAGAACGTTCGCCGCATCAAGGAGTTTATCTACCCCTA CCTGAACACCACTACCTC−3’(配列番号191);及び
Ter CbhI逆方向:5’GATACACGAAGAGCGGCGATTCTACGG−3’(配列番号192)
最後に、Pr CbhI順方向及びTer CbhI逆方向プライマーを使用し、得られた第1及び第2のPCR産物を上記のとおりに一緒に融合させた。2箇所にグリコシル化変異を導入した融合産物には、供給元の推奨に従いGateway BP recombination reaction(Invitrogen,Carlsbad,CA,USA)を使用してpDonor221ベクターにより組み換えを行うために、attB1及びattB2部位を含有させた。2箇所に過剰なグリコシル化変異S725N S751Nを有するFv3C/Bgl3キメラβ−グルコシダーゼを収容しているpENTRクローンを含有している大腸菌(E. coli)DH5αコロニーを、50μg/mlのカナマイシンを添加した2xYT寒天プレートで選択した。バクテリア細胞からプラスミドを単離し、制限酵素認識パターンをもとに挿入の有無について解析し、かつABI3100配列アナライザ(Applied Biosystems)を使用して配列解析を行い変異を確認した。これにより、更に改変を行うためのpEntry−Fv3C/Bgl3/S725N S751Nクローンを得た。
上記のFv3C/Bgl3ハイブリッド体の第665番目〜第683番目のアミノ酸残基を、タラロマイセス・エマーソニィ(Talaromyces emersonii)の相当する配列により置き換え、融合/キメラ体Fv3C/Te3A/Bgl3/S713N S739Nを得た(使用したプラスミドについては図103Aを参照されたい)。Te3A(配列番号66)として参照されるT.エマーソニィ(T. emersonii)β−グルコシダーゼ配列を導入するため、次のプライマー:
第1組:
pDonor順方向:5’−GCTAGCATGGATGTTTTCCCAGTCACGACGTTGTAAAACGACGGC−3’(配列番号193);及び
ABG2逆方向:5’−GATAGACCGTGACCGAACTCGTAGATAGGCGTGATGTTGTAC TTGTCGAAGTGACGGTAGTCGATGAAGAC−3’(配列番号194);
第2組:
ABG2順方向:5’−GTCTTCATCGACTACCGTCACTTCGACAAGTACAACATCACGCCTATCTACGAGTTCGGTCACGGTCTATC−3’(配列番号195);及び
pDonor逆方向:5’TGCCAGGAAACAGCTATGACCATGTAATACGACTCACTATAGG−3’(配列番号196)、を使用し、第1のPCR反応を実施した。
6.23.6.F.バイオマスの選択手順
希アンモニアで前処理したトウモロコシ穂軸を使用し、バイオマス性能について、マイクロタイタープレートスケールで形質転換体を選択した。前処理したトウモロコシ穂軸を水に懸濁し、硫酸によりpH 5.0に調整し、8.7%セルロース(25.2%固形分)を得た。スラリーを平底96ウェルマイクロタイタープレート(Nunc)に分注し(70mg/ウェル)、3,000rpmで5分遠心分離させた。形質転換細胞株を、振とうフラスコ形式で生育させた。新しい株をSDS−PAGEにより解析して発現レベルについて確認した後、トウモロコシ穂軸基質とインキュベートした。各サンプルの総タンパク質量を測定し、サンプルを2mg/mLに希釈した。
トウモロコシ穂軸を入れたウェルに、株産物を5、10、20、又は30μL添加し、トウモロコシ穂軸の糖化反応を開始した。この形式に従って、形質転換株はトウモロコシ穂軸基質に対し、幅広い用量応答を示した。
トウモロコシ穂軸の糖化反応物をアルミニウム製プレートシール(E&K scientific)でシーリングし、室温で450rpmで1分混合した。次に、50℃かつ200rpmに設定したInnovaインキュベーターにプレートを72時間設置した。
72時間の糖化工程後、プレートには100μLの100mMのグリシン(pH 10.0)を加え、反応を停止させた。次にプレートを十分に混合し、3,000rpmで5分遠心分離させた(Rotanta 460R Centrifuge from Hettich Zentrifugen)。
HPLC 96ウェルマイクロタイタープレート(Agilent,5042−1385)中の水100μLに上清(10μL)を添加した。ガードカラムを予め装着させたAminex HPX−87Pカラム(300mm×7.8mm,125−0098)を使用し、HPLCにより、グルコース、キシロース、セロビオース、及びキシロビオース濃度を測定した。
11種の株:A4、C3、C8、D9、D12、E12、F5、F7、G2、H1、H7の性能を図104に示す。これらの株のグルカン(セロビオース及びグルコース)及びキシラン(キシロビオース+キシロース)変換率を示す。
実施例24:UPLCによる酵素組成物のタンパク質定量
タンパク質定量用のAgilent HPLC 1290 Infinityシステム。A Waters ACQUITY UPLC BEH C4カラム(1.7μm,1×50mm)を使用した。初期勾配5%〜33%アセトニトリル(Sigma−Aldrich)を0.5分、続いて33%〜48%の勾配を4.5分、次に90%アセトニトリルへの勾配を用いる6分間のプログラムを使用した。対象とするタンパク質を、33%〜48%アセトニトリル間で溶出させた。CBH1、CBH2、エンドグルカナーゼs、キシラナーゼ、β−グルコシダーゼなどの精製タンパク質の保持時間を標準として使用した。任意の酵素配合物中の各タンパク質のピーク面積に基づき、配合物中の総タンパク質に対する各タンパク質の割合(%)を算出した。本明細書で使用した酵素配合物例は、図106A〜Bに示すとおりのものである。