JP2013530965A - 増殖性疾患の治療 - Google Patents
増殖性疾患の治療 Download PDFInfo
- Publication number
- JP2013530965A JP2013530965A JP2013515634A JP2013515634A JP2013530965A JP 2013530965 A JP2013530965 A JP 2013530965A JP 2013515634 A JP2013515634 A JP 2013515634A JP 2013515634 A JP2013515634 A JP 2013515634A JP 2013530965 A JP2013530965 A JP 2013530965A
- Authority
- JP
- Japan
- Prior art keywords
- seq
- cancer
- nad1
- nucleic acid
- plant defensin
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/5005—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells
- G01N33/5008—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells for testing or evaluating the effect of chemical or biological compounds, e.g. drugs, cosmetics
- G01N33/5014—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells for testing or evaluating the effect of chemical or biological compounds, e.g. drugs, cosmetics for testing toxicity
- G01N33/5017—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells for testing or evaluating the effect of chemical or biological compounds, e.g. drugs, cosmetics for testing toxicity for testing neoplastic activity
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/168—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from plants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/16—Drugs for disorders of the alimentary tract or the digestive system for liver or gallbladder disorders, e.g. hepatoprotective agents, cholagogues, litholytics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/18—Drugs for disorders of the alimentary tract or the digestive system for pancreatic disorders, e.g. pancreatic enzymes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/08—Drugs for disorders of the urinary system of the prostate
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P5/00—Drugs for disorders of the endocrine system
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2333/00—Assays involving biological materials from specific organisms or of a specific nature
- G01N2333/415—Assays involving biological materials from specific organisms or of a specific nature from plants
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2500/00—Screening for compounds of potential therapeutic value
- G01N2500/10—Screening for compounds of potential therapeutic value involving cells
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Engineering & Computer Science (AREA)
- Chemical & Material Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Veterinary Medicine (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Pharmacology & Pharmacy (AREA)
- Organic Chemistry (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Immunology (AREA)
- Biomedical Technology (AREA)
- Urology & Nephrology (AREA)
- Hematology (AREA)
- Molecular Biology (AREA)
- Gastroenterology & Hepatology (AREA)
- Epidemiology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Toxicology (AREA)
- Food Science & Technology (AREA)
- Biotechnology (AREA)
- Pathology (AREA)
- Microbiology (AREA)
- Cell Biology (AREA)
- General Physics & Mathematics (AREA)
- Biochemistry (AREA)
- Analytical Chemistry (AREA)
- Physics & Mathematics (AREA)
- Botany (AREA)
- Tropical Medicine & Parasitology (AREA)
- Endocrinology (AREA)
- Neurology (AREA)
- Physical Education & Sports Medicine (AREA)
- Oncology (AREA)
- Zoology (AREA)
Abstract
【選択図】図3E
Description
本発明は、2010年6月24日出願の米国特許仮出願第61/358,126号の優先権を主張するものであり、これはその全体を参考として本明細書に含めるものとする。
該当なし
「ディフェンシン」という用語は、多種多様な種によって産生される分子であって、細菌、真菌、酵母およびウイルスなどの病原体に対する生得の防御において機能を果たす前記分子の、多様なファミリーを表すために、当技術分野ですでに使用されている。
植物ディフェンシン(γチオニンとも称される)は、CysI-CysVIII、CysII-CysIV、CysIII-CysVI、およびCysV-CysVIIの配置をとる4つの厳密に保存されたジスルフィド結合を形成する8個のシステイン残基を有する、小型で(約5 kDa、45-54アミノ酸)塩基性のタンパク質である。植物ディフェンシンの中には、これら4つの厳密に保存されたジスルフィド結合だけでなく、追加のジスルフィド結合を有するものもある(Lay et al., 2003a, 2003b; Janssen et al., 2003)。
哺乳類ディフェンシンは、α、β、およびθディフェンシンとして知られる3つの異なる構造的サブファミリーを構成する。植物ディフェンシンとは異なり、3つのサブファミリーはすべて、システイン残基を6個だけ含有するが、それらのサイズ、それらのシステインの配置および関係性、それらの前駆体の性質、およびそれらの発現部位については差異がある(Selsted et al., 1993; Hancock and Lehrer, 1998; Tang et al., 1999a, b; Lehrer and Ganz, 2002)。すべてのサブファミリーは、自然宿主免疫に関係する役割を有するが、最近になって適応免疫にも、免疫促進物質として関連付けられた(Tang et al., 1999b; Lehrer and Ganz, 2002)。「ディフェンシン」という名称はそもそも、それらの防御的役割との関連で作られた(Ganz et al., 1985; Selsted et al., 1985)。
数多くのディフェンシンおよびディフェンシン様タンパク質が昆虫で同定された。これらのタンパク質は、脂肪体(哺乳類の肝臓に相当する)で産生され、その後脂肪体から血リンパ中に放出される(Lamberty et al., 1999)。ほとんどの昆虫ディフェンシンは、3つのジスルフィド結合を有する。しかしながら、いくつかの関連タンパク質、すなわちキイロショウジョウバエ(Drosophila melanogaster)由来のドロソマイシンは、4つのジスルフィドを有する(Fehlbaum et al., 1994; Landon et al., 1997)(表2)。
植物ディフェンシンは、cDNAクローンから予想される前駆体タンパク質の構造にしたがって2つの主要なクラスに分けることができる(Lay et al., 2003a)(図8)。第1の、しかも最大のクラスでは、前駆体タンパク質は小胞体(ER)シグナル配列および成熟ディフェンシンドメインからなる。これらのタンパク質は分泌経路に入り、翻訳後修飾または細胞内標的化のための明白なシグナルはない(図8A)。
生物学的活性の中には植物ディフェンシンに起因するものもあり、これには、真菌(Broekaert et al., 1997; Lay et al., 2003a; Osborn et al., 1995; Terras et al., 1993)、ならびにグラム陽性およびグラム陰性細菌(Segura et al., 1998; Moreno et al., 1994; Zhang and Lewis, 1997)に対する増殖阻害効果が含まれる。ディフェンシンには、αアミラーゼ(Zhang et al., 1997; Bloch et al., 1991)およびセリンプロテアーゼ(Wijaya et al., 2000; Melo et al., 2002)などの消化酵素の、効果的な阻害剤となるものもあり、2つの機能は、昆虫の植食性からの防御における役割と一致する。これは、細菌で発現された緑豆ディフェンシン、VrCRPが、人工飼料に0.2%(w/w)入れられると、マメゾウムシ科のアズキゾウムシ(Callosobruchus chinensis)に対して致死的であるという観察によって支持される(Chen et al., 2002)。ディフェンシンには、タンパク質翻訳を阻害するものもあり(Mendez et al., 1990; Colilla et al., 1990; Mendez et al., 1996)、イオンチャンネルと結合するものもある(Kushmerick et al., 1998)。ハクサンハタザオ(Arabidopsis halleri)由来のディフェンシンは亜鉛耐性も与えるが、これはストレス適応における役割を示唆する(Mirouze et al., 2006)。最近になって、ヒマワリディフェンシンは、ハマウツボ属寄生植物において細胞死を誘導することが示された(de Zelicourt et al., 2007)。
植物ディフェンシンのすべてではないが一部についてもっともよく特徴が明らかにされている活性は、それらが、さまざまな効力で、多数の真菌種を抑制する能力である(たとえば、Broekaert et al., 1997; Lay et al., 2003a; Osborn et al., 1995を参照されたい)。たとえばRs-AFP2は、1μg/mLで蛇の目病菌(Phoma betae)の生育を阻害するが、菌核病菌(Sclerotinia sclerotiorum)に対しては100μg/mLで無効である(Terras et al., 1992)。真菌である赤かび病菌(Fusarium culmorum)の生育および形態に及ぼす影響に基づいて、ディフェンシンの2つのグループを識別することができる。「形態形成」植物ディフェンシンは、菌糸伸長の減少を引き起こし、同時に菌糸分岐の増加をもたらすが、「非形態形成」植物ディフェンシンは、菌糸伸長の速度を低下させるものの、顕著な形態的歪みは生じさせない(Osborn et al., 1995)。
ヒト疾患の治療における小型のシステインリッチ/カチオン性抗菌ペプチドの使用
がん、腫瘍形成、血管形成、および浸潤のさまざまな態様でのヒトαおよびβディフェンシンに関する文献が増えている。哺乳類ディフェンシンの使用は、ウイルスおよび真菌感染症の治療のためにも、細菌感染症の抗生物質治療の代替または追加としても、提案されている。しかしながら、それらのヒト細胞に対する細胞毒性は依然として深刻な障壁である。Mossら(米国特許第7,511,015号)は、アルギニン残基のリボシル化もしくはADPリボシル化によるディフェンシンペプチドの修飾が、ペプチドの毒性を改善し、その抗菌性を高めることを明らかにした。
2004年以来、いくつかの独立した報告は、植物ディフェンシン(様)タンパク質がやはり、in vitroで、さまざまなヒト腫瘍細胞株に対して(さまざまな効力で)増殖抑制作用を示す可能性があることを示唆している(たとえば、Wong and Ng (2005), Ngai and Ng (2005), Ma et al. (2009) and Lin et al. (2009)を参照されたい)。これらのタンパク質は、大部分がマメ科植物(たとえばマメ)から単離された。これらのタンパク質の植物ディフェンシンクラスへの割り当ては、推定分子量(〜5 kDa)に基づいて行われたが、場合によっては、既知のディフェンシン配列に対する限定されたN末端アミノ酸の類似性に基づいて行われた。しかしながら、上記参考文献に記載のタンパク質は、ディフェンシンを特徴付ける厳密に保存されたシステイン残基およびシステイン間隔を欠いている。それに加えて、こうした参考文献に記載のタンパク質は、クラスIIディフェンシンではなく、ナス科由来でもない。
本発明の第1の態様において、増殖性疾患の予防もしくは治療用の植物ディフェンシンが与えられる。
「導き出せる」という用語は、「得られる」および「分離できる」という用語を含み、これらと互換的に使用することができる。特定の起源またはプロセスから「導き出せる」、「得られる」または「分離できる」本発明の組成物または他の事柄は、その起源またはプロセスから導き出された、得られた、または分離された組成物または他の事柄を含むだけでなく、同じ組成物または事柄であればどのように調達され、または生産されてもこれを含む。
配列番号1は、クラスII植物ディフェンシンの成熟ドメインのアミノ酸コンセンサス配列である。
驚くべきことに、本発明者らは、γチオニンとしても知られるディフェンシンが、強力な細胞毒性作用を有することを見いだした。これらの重要な知見は、増殖性疾患を予防および治療することができる新規の重要な方法を説明する。したがって、これらの知見は、がんなどの増殖性疾患の予防もしくは治療のための方法、ならびに関連する使用、システムおよびキットを提供する。
本発明は増殖性疾患の予防もしくは治療に使用するための植物ディフェンシンを提供する。
本発明の組成物がポリペプチドを含有する実施形態において、本発明はまた、そうしたポリペプチドをコードする核酸、またはその断片もしくは相補体を提供する。そのような核酸は、天然に存在することもあるが、合成または組換えであることもある。
本発明はまた、本明細書に記載の核酸を含有するベクターを提供する。ベクターは、外来配列の挿入、細胞内への導入、および導入された配列の発現に適した、プラスミドベクター、ウイルスベクター、または他の任意の適当な伝達体とすることができる。ベクターは真核生物発現ベクターであってもよく、プロモーターのような発現調節およびプロセシング配列、エンハンサー、リボソーム結合部位、ポリアデニル化シグナル、ならびに転写終結配列を含んでいてもよい。好ましい実施形態において、ベクターは、本明細書に記載の植物ディフェンシンのうち任意の1つもしくは複数を機能しうるようコードする、1つもしくは複数の核酸を含有する。
本発明はまた、増殖性疾患の予防もしくは治療用の医薬組成物を提供するが、この医薬組成物は、本明細書に記載の植物ディフェンシン、核酸、ベクター、宿主細胞、または発現産物を、製薬上許容される担体、賦形剤もしくは添加剤とともに含有する。
任意の個別の患者に対する「治療上有効な」用量レベルは、さまざまな要因に応じて決まってくるが、こうした要因には、治療すべき疾患、疾患の重篤度、用いられる化合物もしくは薬剤の活性、用いられる組成物、患者の年齢、体重、全身健康状態、性別、および食習慣、投与時間、投与経路、植物ディフェンシンまたは組成物の除去率、治療の持続期間、および治療と併用して、または治療と同時に使用される任意の薬物が、当技術分野でよく知られているほかの関連要因とともに、含まれる。したがって、当業者は、通常の実験によって、適用可能な疾患を治療するために必要とされる、有効で毒性のない植物ディフェンシンもしくは組成物の量を決定することが可能となる。
本発明の組成物は、標準的な経路で投与することができる。一般に、組成物は非経口(たとえば、静脈内、脊髄内、皮下、もしくは筋肉内)、経口、または局所経路で投与することができる。
担体、添加剤、および賦形剤は、組成物の他成分と融和性であって、レシピエントにとって有害でないという点で「許容できる」ものでなければならない。こうした担体、添加剤および賦形剤は、本発明の組成物の完全性を高め、半減期を増やすために使用することができる。これらはまた、本発明の組成物の生物学的活性を増強または保護するために使用することができる。
本発明は、増殖性疾患を予防もしくは治療するための方法を提供するが、その方法は、本明細書に記載のように、治療上有効な量の植物ディフェンシン、核酸、ベクター、宿主細胞、発現産物、または医薬組成物を被験体に投与し、それによって増殖性疾患を予防もしくは治療することを含む。
本発明は、増殖性疾患を予防もしくは治療するためのキットを提供するが、このキットは、本明細書に記載の、治療上有効な量の植物ディフェンシン、核酸、ベクター、宿主細胞、発現産物、または医薬組成物を含む。
本発明は、哺乳類腫瘍細胞に対する植物ディフェンシンの細胞毒性をスクリーニングするための方法を提供するが、その方法は、本明細書に記載の植物ディフェンシン、核酸、ベクター、宿主細胞、発現産物もしくは医薬組成物を、哺乳類細胞株と接触させること、ならびに植物ディフェンシンとの接触に起因する、哺乳類細胞株に対する細胞毒性をアッセイすることを含む。
本発明は、溶血作用の低下した植物ディフェンシンを作製するための方法を提供するが、その方法は、少なくとも1つのアラニン残基をディフェンシンのN末端で、またはその近傍で、植物ディフェンシンに導入することを含む。当業者には当然であるが、そうしたN末端アラニンの付加を達成するために、いくつかの方法、たとえば、部位特異的変異誘発、相同組換え、トランスポゾン、および非相同末端結合などを使用することができる。
当業者には当然のことながら、本明細書に記載のポリペプチド、核酸、ベクター、宿主細胞、発現産物、および組成物は、本明細書に記載の1つもしくは複数のポリペプチド、核酸、ベクター、宿主細胞、発現産物、および組成物を本明細書に記載の方法への他の治療アプローチと併せて使用する、併用療法アプローチの一環として投与することができる。こうした併用療法のために、併用の各成分は、望ましい治療効果を与えるように、同時に投与しても、任意の順序で順次投与しても、別の時に投与してもよい。別々に投与される場合、成分は、同じ投与経路で投与されることが好ましいかもしれないが、ただし、これがその通りであることは必要ではない。あるいはまた、成分は、併用製品として、1回分の投与単位の中に一緒に製剤されていてもよい。本発明の組成物と併用して使用することができる適当な薬剤は、当業者に知られており、たとえば、化学療法剤、ラジオアイソトープ、および抗体などの標的療法が含まれる。
当業者には当然のことながら、本明細書に記載のポリペプチド、ポリヌクレオチド、ベクター、宿主細胞、発現産物、および組成物は、そうした治療のために現在用いられている治療法の補完として、診断時に、またはその後に、たとえば追跡治療もしくは地固め療法として、単独の薬剤として投与してもよいが、本明細書に記載の方法への併用療法アプローチの一部として投与してもよい。本明細書に記載のポリペプチド、ポリヌクレオチド、ベクター、宿主細胞、発現産物、および組成物はまた、遺伝的または環境的にそうした疾患を発症しやすい被験体に対する予防的治療として使用することもできる。
材料および方法
ハナタバコ(Nicotiana alata)からのNaD1の精製
NaD1をその天然起源から単離するために、前述(Lay et al., 2003a)のように、花の発生の花弁呈色期までのハナタバコ(N. alata)の花全体を微粉末に粉砕し、希硫酸で抽出した。手短に述べると、花(湿重量760 g)を液体窒素中で凍結し、すり鉢とすりこぎで微粉末にまで粉砕し、50 mM硫酸中(生重量g当たり3 mL)で、5分間、Ultra-Turrax ホモジナイザー(Janke and Kunkel)を用いてホモジナイズした。4℃にて1時間撹拌した後、細胞残渣をMiracloth(Calbiochem, San Diego, CA)による濾過、および遠心分離(25,000 x g、15分、4℃)によって除去した。その後10 M NaOHを添加してpHを調整し、抽出物を4℃で1時間撹拌した後、遠心分離(25,000 x g、15分、4℃)して、沈殿したタンパク質を除去した。上清(1.8 L)を、10 mMリン酸ナトリウムバッファーであらかじめ平衡化したSP Sepharose(商標名)Fast Flow (GE Healthcare Bio-Sciences)カラム(2.5 x 2.5 cm)にアプライした。20カラム容の10 mMリン酸ナトリウムバッファー(pH 6.0)で洗浄することによって未結合タンパク質を除去し、結合したタンパク質は、500 mM NaClを含有する10 mMリン酸ナトリウムバッファー(pH 6.0)で、3 x 10 mL画分中に溶出された。各精製ステップのサンプルを、SDSポリアクリルアミドゲル電気泳動(SDS-PAGE)、および抗NaD1抗体によるイムノブロッティングによって分析した。SP Sepharoseカラムから得られたNaD1含有画分を、逆相高速液体クロマトグラフィー(RP-HPLC)にかけた。
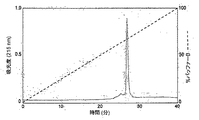
検出器(モデル166, Beckman)に接続したSystem Gold HPLC (Beckman)で、ガードカラムを付けた調製用C8カラム(22 x 250 mm, Vydac)を用いて、逆相高速液体クロマトグラフィー(RP-HPLC)を行った。タンパク質サンプルは、バッファーA(0.1% [v/v]トリフルオロ酢酸)でロードし、1-100% (v/v)バッファーB(0.089% [v/v] トリフルオロ酢酸中60% [v/v] アセトニトリル)の直線勾配で、40分かけて10 mL/分の流速で溶出した。タンパク質は、215 nmの吸光度をモニターすることで検出した(図1B)。タンパク質ピークを集め、SDS-PAGEで分析した。
ハナタバコの花からNaD1を精製するための本明細書に記載の手順を用いて、種子または花からディフェンシンを単離した。手短に述べると、種子(500 g)をUltra-Turrax ホモジナイザー(Janke and Kunkel)に入れ、微粉末に粉砕した後、50 mM硫酸を添加した(生重量g当たり4 mL)。液体窒素中で花を微粉末に粉砕した後、50 mM硫酸を添加した(生重量g当たり3 mL)。ホモジナイズを5分間続行した後、ホモジネートをビーカーに移し、4℃にて1時間撹拌した。細胞残渣をMiracloth (Calbiochem, San Diego, CA)による濾過および遠心分離(25,000 x g、15分、4℃)によって除去した。その後、10 M NaOHの添加によりpHを7.0に調整し、抽出物を4℃にて1時間撹拌した後、遠心分離して(25,000 x g、15分、4℃)、沈殿したタンパク質を除去した。上清を、10 mMリン酸ナトリウムバッファーであらかじめ平衡化したSP Sepharose(商標名)Fast Flow (GE Healthcare Bio-Sciences)カラム(2.5 x 2.5 cm)にアプライした。20カラム容の10 mMリン酸ナトリウムバッファー(pH 6.0)で洗浄することによって未結合タンパク質を除去し、結合したタンパク質は、500 mM NaClを含有する10 mMリン酸ナトリウムバッファー(pH 6.0)で、3 x 10 mL画分中に溶出された。
ピキア・パストリス発現系はよく知られており、Invitrogen(Carlsbad, CA;pPIC9発現ベクターの配列を記載するメーカーのPichia Expression Manual(ピキア発現マニュアル)を参照されたい)から市販されている。NaD1、TPP3、γ2-z、γ1-H、Dm-AMP1などの当該ディフェンシンを、pPIC9発現ベクター中にクローニングした(これらのクローンによってコードされるタンパク質は、それぞれrNaD1、rTPP3、rγ2-z、rγ1-H、rDm-AMP1と命名された)。次に、これらの構築物を用いてP. pastoris GS115細胞を形質転換した。各クローンのコロニーを用いて、100 mLフラスコ内の10 mL BMG培地(Invitrogen Pichia Expression Manualに記載)に接種し、30℃の振盪培養器(140 rpm)で一晩培養した。その培養物を用いて2 Lのバッフル付きフラスコ内の500 mL BMG培地に接種し、そのフラスコを30℃の振盪培養器(140 rpm)に入れた。OD600が2.0に達したら(約18時間)、細胞を遠心分離(2,500 x g、10分)によって集め、5L バッフル付きフラスコ内の1 L BMM培地中に再懸濁し(OD600 = 1.0)、28℃の振盪培養器で3日間培養した。発現培地を遠心分離(4750 rpm、20分)によって細胞から分離し、等量の20 mMリン酸カリウムバッファー(pH6.0)で希釈した。培地をNaOHでpH 6.0に調整した後、あらかじめ10 mMリン酸カリウムバッファー、pH 6.0で平衡化したSP Sepharoseカラム(1 cm x 1 cm、Amersham Biosciences)にかけた。その後、カラムを100 mLの10 mMリン酸カリウムバッファー、pH 6.0で洗浄し、結合したタンパク質を、500 mM NaCl含有10 mMリン酸カリウムバッファー10 mL中に溶出した(図1A)。溶出されたタンパク質を、本明細書書きの40分の直線勾配でRP-HPLCにかけた。タンパク質ピークを集め、SDS-PAGE、および抗DaN1抗体によるイムノブロッティングで分析した。ディフェンシンを含有する画分を凍結乾燥し、滅菌Milli-Q超純水中に再懸濁した。ピキア発現ディフェンシンのタンパク質濃度は、タンパク質標準としてウシ血清アルブミン(BSA)を用いたビシンコニン酸(BCA)タンパク質アッセイ(Pierce Chemical Co.)によって測定した。
P. pastorisから精製されたNaD1(rNaD1)が正しく折り畳まれているかどうかを調べるために、その遠紫外円二色性(CD)スペクトルを記録して、天然型NaD1のスペクトルと比較した(図1C)。2つのスペクトルの類似性は、rNaD1の構造が天然型NaD1と比べて有意に変化しなかったことを示す。
フザリウム・オキシスポルム(Fusarium oxysporum)f. sp. vasinfectum の増殖に及ぼすrNaD1の影響を天然型NaD1と比較した。組換えNaD1は、IC50が約1.6μMの低濃度で抗真菌活性を示した。NaD1はIC50が約1.0μMで、わずかに、より有効であった(図1D)。
凍結乾燥NaD1(500μg)を400μLストックバッファー(200 mM Tris-HCl pH 8.0、2 mM EDTA、6 M 塩酸グアニジン、0.02% [v/v] Tween(登録商標)-20)中に溶解した。還元バッファー(15 mMジチオスレイトール[DTT]を含有するストックバッファー)を添加した(44μL)後、40℃にて4.5時間インキュベートした。反応混合物を室温に冷却した後、ヨード酢酸(0.5 M、1 M NaOH中、55μL)を添加し、暗所で室温にて30分間インキュベートを続行した。Nanosep omega(登録商標)スピンカラム(3K分子量カットオフ、PALL Life Sciences)を用いて、塩、DTT、およびヨード酢酸を除去し、タンパク質濃度は、BCAタンパク質アッセイ(Pierce)を用いて測定した。Fovの増殖に及ぼす還元型およびアルキル化NaD1(NaD1R&A)の影響を本明細書に記載のように評価した。
イムノブロット分析のために、タンパク質をニトロセルロースに転写し、プロテインA-精製抗NaD1抗体(1:3000希釈を7.5 mg/mL)、続いて西洋ワサビペルオキシダーゼと結合したヤギ抗ウサギIgG(1:3500希釈:Amersham Pharmacia Biotech)で探索した。高感度ケミルミネッセンス法(ECL)検出試薬(Amersham Pharmacia Biotech)を用いて、ChemiGenius(商標名)バイオイメージングシステム (Syngene)によって、結合した抗体を可視化した。
ジャガイモ(Solanum tuberosum)から単離されたI型セリンプロテアーゼ阻害剤StPin1Aは、米国特許第7,462,695号" Insect chymotrypsin and inhibitors thereof” および第11/753,072号 "Multi-Gene Expression Vehicle"に(Pot1Aとして)すでに記載されており、参考として本明細書に組み入れられる。
本研究に使用した哺乳類細胞株は以下の通りである:ヒト黒色腫MM170細胞、不死化Tリンパ球Jurkat細胞、ヒト白血病単球リンパ腫U937細胞、ヒト前立腺がんPC3細胞、マウス黒色腫B16細胞、チャイニーズハムスター卵巣(CHO)細胞、GAG欠損CHO変異体pgsA-745 細胞、およびアフリカミドリザル腎臓線維芽細胞COS-7細胞。細胞は、組織培養フラスコ内で37℃にて5% CO2 / 95%空気の加湿環境で増殖させ、増殖速度に応じて週に2、3回、規定通りに継代した。哺乳類細胞はすべて、10%熱不活化ウシ胎児血清(FBS、Invitrogen)、100 U/mLペニシリン(Invitrogen)、および100μg/mLストレプトマイシン(Invitrogen)を添加したRPMI-1640培地(Invitrogen)中で培養したが、例外としてCHOおよびPGS細胞は10% FBS、100 U/mLペニシリン、および100μg/mLストレプトマイシンを添加したDMEM-F12培地(DMEM, Invitrogen)中で培養した。接着細胞株は、0.25% トリプシンおよび0.5 μM EDTA (Invitrogen)を含有する混合物3-5 mLを添加することでフラスコから剥離した。
PBMCは、Ficoll-paque分離後に、細胞濃度1 × 106 PBMC/mLとなるよう再懸濁した。手短に述べると、ヘパリン添加チューブに血液を採取し、滅菌1 × PBS / 0.5% BSA (D-PBS、Ca2+ およびMg2+ を含まない、Invitrogen)で、1→2に希釈した。50 mL滅菌チューブを用いて、希釈した血液(35 mL)を15 mL ficoll-paqueに重層し、続いて、1800 rpmで30分間遠心分離した(ブレーキオフ)。上部の血漿層を未使用のチューブに取り出し、再度回転させた後、PBMC層を取り出し、1 × PBS / 0.5% BSAをいれた4つのチューブに細胞を分割した。細胞を室温にて1000 rpmで10分間回転させ、各チューブのペレットを50 mL 1 × PBS / 0.5% BSAで3回洗浄した。より多くの血小板を除去するために、800 rpmで15分間回転させた。
Ficoll-paque分離後、RBCを集め、1 × PBSで洗浄し、1000 × g、10分間でペレットとした。RBCは処理のために1→10に希釈し、ディフェンシンの濃度を増加させて(0-100μM)、5% CO2 / 95%空気の加湿環境で一晩インキュベートした。24時間インキュベート後、細胞を2000 rpmで10分間遠心分離し、上清を1 × PBSで1→10に希釈した。赤血球溶解の程度を412 nmの吸光度で評価した。
腫瘍細胞を4連で、平底96ウェルマイクロタイタープレートのウェル(50μL)に、2 × 106 細胞個/mLから始めてさまざまな密度で接種した。完全培地のみを入れた4つのウェルを、各アッセイにおいてバックグラウンド対照として含めた。マイクロタイタープレートを37℃にて、5% CO2 / 95%空気を含有する加湿環境下で、一晩インキュベートした後、完全培地(100μL)を各ウェルに添加し、さらに48時間37℃にてインキュベートした。細胞生死判別アッセイに最適な細胞密度(30-50%培養密度)は、光学顕微鏡によって、各細胞株について決定された。
ATPバイオルミネッセンスアッセイ(Roche Diagnostics, NSW Australia)を用いて、透過化された腫瘍細胞によるATPの放出を定量した。ルシフェラーゼ試薬をメーカーの説明書通りに溶解し、4℃にて5分間インキュベートした。手短に述べると、細胞を1×PBS / 0.1% BSA中に1 × 106細胞個/mLの濃度で再懸濁し、10μLタンパク質サンプルを入れた空のマイクロタイタープレート(Nunc(商標名))のルシフェラーゼ試薬(50μL/ウェル)に加えた(40μL/ウェル)。一斉にマルチチャンネルピペットを用いて、その混合物を加え(90μL/ウェル)、サンプルは直ちにマイクロタイタープレートリーダーで、562 nmで30分間読み取り、読み取りは30分間隔で行った。データはSoftMaxPro 4.0ソフトウェア(Molecular Devices Company)で解析した。
特に指示のない限り、細胞は、10% FBS、100 U/mLペニシリン、および100μg/mLストレプトマイシンを添加した完全培地RPMI-1640中に4 × 105 細胞個/mLの細胞濃度で再懸濁して、V底96ウェルプレートまたは微量遠心管に加えた。細胞は、さまざまな濃度の、または10μMの設定濃度のタンパク質を添加する際に、特に指示のない限り37℃に維持した。典型的には、細胞は当該タンパク質と混合し、37℃で30分間インキュベートした。また、ある実施形態において、細胞は、フローサイトメトリー分析前に4℃または37℃ののいずれかで、2-60分間インキュベートした。等量の2μg/mLヨウ化プロピジウム(PI, Annexin V-FITC Apoptosis Detection Kit, Invitrogen)含有完全培地に細胞を添加し、直ちにFACSCantoセルソーター(Becton Dickson, Fanklin Lakes, NJ)およびCell Quest Pro Software (Becton Dickson)を用いてフローサイトメトリーで分析した。典型的には、サンプル当たり5000-10000個の事象を収集し、得られたデータをFlowJoソフトウェア(Tree Star, Ashland, OR)を用いて解析した。細胞は前方散乱(FSC)および側方散乱(SSC)に基づいて適切に流路を制御し、生存細胞はPIを排除する能力によって測定された。分析するために、全データは対照に対して標準化された(正常細胞%は約0-7%の範囲であった)。
走査型電子顕微鏡法を本研究に用いて、NaD1(10μM)で処理した場合のPC3細胞を未処理対照と比較して可視化した。細胞は、いったんインキュベーターから取り出したら、必要になるまで氷上に保持した。小型のガラス製シャーレを、蒸留水に浸した濾紙と重ねて、その後カバーガラスをシャーレ上に載せた。最初の固定の前にサンプルを洗浄バッファー(0.2 Mリン酸ナトリウム (pH 7.2) および5.4% (w/v) グルコース)で洗浄し、サンプルを4℃にて30分間,等量の1.25% グルタルアルデヒドおよび0.5%四酸化オスミウム固定剤中に浸漬した。サンプルは、洗浄バッファーで2回15分間洗浄した後、氷上、遮光/気密ガラス製シャーレ内で1時間2%オスミウム中に浸漬した。その後の脱水手順の前に、サンプルを洗浄バッファーで3回5分間洗浄した。次にプロトコールの中の脱水ステップを実施したが、これはエタノール(EtOH)濃度を増加させて、次々と浸漬することを必要とした:50% EtOH中1 × 10分、70% EtOH中1× 10分、90% EtOH中1 × 10分、95% EtOH中1 × 10分、および最後に100% EtOH中2 × 10分。サンプルの固定および脱水に続いて、凍結乾燥したが、このサンプルは数秒間液体窒素中に浸漬した後、真空蒸発装置(Dynavac)中の銅製のブロックに入れた。48時間凍結乾燥した後、金属スタブ上にマウントし、デシケーター内に保存した。最後に自動化スパッタ塗布装置(SC7640 Polaron)を用いて、サンプルを金属(金およびパラジウム)の薄層でコーティングした。高分解能デジタル電界放射型走査電子顕微鏡、FE-SEM (JSM-6340F, JEOL Ltd, Japan)を用いてサンプルを分析した。
膜脂質ストリップ(Membrane Lipid Strips(商標名))、PIPストリップ(PIP Strips(商標名))およびスフィンゴストリップ(Sphingo Strips(商標名))(Echelon Biosciences, Salt Lake City, UT)をPBS / 3% BSAとともに室温で1-2時間インキュベートし、非特異的な結合をブロックした。次に膜ストリップを、PBS / 1% BSA中に希釈したディフェンシン(0.12μM)とともに、4℃にて一晩インキュベートした後、PBS / 0.1% Tween-20で室温にて60分間完全に洗浄した。ウサギ抗NaD1ポリクローナル抗体(NaD1、NsD1、NsD2、rTPP3、またはPhD1A検出用)またはウサギ抗NaD2抗体(NaD2またはNsD3検出用)(いずれの場合もPBS / 1% BSAで1:2000希釈)を用いて4℃にて1時間、続いてHRP標識ロバ抗ウサギIgG抗体(PBS / 1% BSAで1:2000希釈)を用いて4℃にて1時間、膜ストリップを探索することによって、膜に結合したタンパク質を検出した。それぞれ抗体とインキュベートした後、膜ストリップを室温にてPBS / 0.1% Tween-20で60分間十分に洗浄した。高感度化学発光(ECL)ウェスタンブロッティング試薬(GE Healthcare BioSciences, NSW Australia)を用いて化学発光を検出し、Hyperfilm (GE Healthcare BioSciences, NSW, Australia)に露光して、Xomat (All-Pro-Imaging)を用いて現像した。
実施例1:序論
腫瘍細胞株および初代ヒト細胞分離株の生存能力に及ぼすNaD1(ハナタバコ(N. alata)の花由来の精製天然型タンパク質またはP. pastorisで作製された精製組換えタンパク質)の影響を、3-(4,5-ジメチル-2-チアゾリル)-2,5-ジフェニル-2H-テトラゾリウムブロミド(MTT)in vitro細胞培養生死判別アッセイによって判定した。テストした腫瘍細胞株は、HCT-116(ヒト結腸がん)、乳がんMCF-7(ヒト乳がん)、MM170(ヒト黒色腫)、PC3(ヒト前立腺がん)、および)、B16-F1(マウス黒色腫)、CASMC(ヒト冠動脈平滑筋細胞)およびHUVEC(ヒト臍帯静脈内皮細胞)である。NaD1は、精製植物タンパク質組換えStPin1A(rStPin1A)またはNaD2と並行してテストした。細胞を、次の細胞数で96ウェル平底マイクロタイタープレートに播種し:MM170 (2x 104/ウェル)、MCF-7 (2x104/ウェル)、HCT-116 (5x103/ウェル)、PC3 (5x103/ウェル)、B16-F1 (2x103/ウェル)、HUVEC (3x103/ウェル)、CASMC (5x103/ウェル)、一晩培養した。その後NaD1、rNaD1またはrStPin1Aを終濃度1〜100μMとなるよう細胞に添加し、48時間インキュベートしたが、そこで「材料および方法」に記載のようにMTTアッセイを行った。
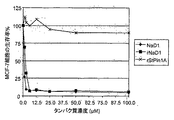
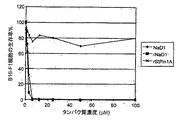
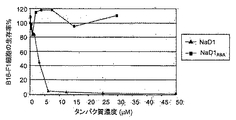
NaD1およびrNaD1は調べたすべての腫瘍細胞株の生存率を劇的に低下させ、IC50の値は低いμM濃度(2-5μM)であった(図2A-2E)。2つの型のNaD1はいずれも非常によく似た阻害効果を示したが、NaD1はrNaD1よりわずかに大きい活性を有していた(図2F)。これに対して、植物タンパク質rStPin1Aは、腫瘍細胞の細胞生存に対し有意な影響を示さなかった(図2A-2E)。NaD2(同様にハナタバコ(N. alata)の花から分離されたナス科クラスIディフェンシン)もMM170細胞について調べたが、細胞生存への有意な影響は観察されなかった(図2G)。NaD1およびrNaD1は、正常なヒトCASMCおよびHUVECの細胞生存も低下させることが明らかになったが、IC50値は腫瘍細胞株に対する値より高かった(7.5-12μM)(図2Hおよび2I)。NaD2またはrStPin1Aは、CASMCおよびHUVECの細胞生存に対して有意な影響を示さなかった(図2Hおよび2I)。NaD1と比べて、還元型およびアルキル化型NaD1(NaD1R&A)は、マウス黒色腫B16-F1でテストしたとき、腫瘍細胞生存への影響を示さなかった(図2J)。これらのデータは、NaD1が天然型も組換え型も、低いμM濃度で腫瘍細胞を選択的に死滅させることを示す。
実施例2:序論
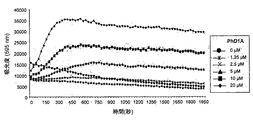
NaD1は、F. oxysporum f. sp. vasinfectumの菌糸を透過性にする能力を有することがすでに示されている(van-der-Weerden et al., 2008)。NaD1が真菌と同様の様式で腫瘍細胞を死滅させるのかどうかを判断するために、NaD1が腫瘍細胞を透過化する能力を、2つの異なるアプローチによって評価した。第1は、細胞内ATPの放出を測定するためにバイオルミネッセンスアッセイを利用した。4x104 U937 (ヒト骨髄単球腫瘍細胞) またはMM170 (ヒト黒色腫)細胞を、天然型NaD1の濃度を増加させて(0-20μM)処理し、ATPの放出を、562 nmで吸光度を測定することにより、30秒間隔で全体として30分間測定した。第2のアプローチは、NaD1の濃度を増加させて(0-100μM)30分間細胞を処理した後の、U937およびMM170細胞(4x105/mL)による蛍光色素ヨウ化プロピジウム(PI)(2 μg/mL)の取り込みを測定するために、フローサイトメトリーを用いた。
U937およびMM170細胞は、NaD1で処理すると、時間依存性、および濃度依存性のATP放出を示した(図3Cおよび3D)。いずれの場合も、ATPは、NaD1に暴露してほとんどすぐに、細胞から放出された。NaD1R&Aは、U937もしくはMM170を透過性にする能力を示さなかった(図3D)。これらの結果は、NaD1のインタクトな構造が、細胞透過化に必須であって、実施例2に示すように腫瘍細胞を死滅させるNaD1の能力と相関することを示す。
実施例3:序論
濃度を増加させたNaD1(0-100μM)とともに107 RBCを37℃にて16時間インキュベートすること、ならびに412 nmでの吸光度を測定することによりヘモグロビン放出を測定することによって、天然型NaD1またはrNaD1がヒト赤血球を溶解する能力を調べた。
低濃度(<12.5μM)のNaD1は、PBSのみの対照と比較して、RBC溶解に影響しなかった。しかしながら、もっと高濃度(12.5-100μM)のNaD1はRBC溶解を引き起こし、放出されるヘモグロビンのレベルは、(水で100%完全に溶解を生じさせた陽性対照に対して)100μMで最大約50%の溶解に達した。これに対して、rNaD1は、100μMに至るまでの濃度で、RBCの溶解能力を示さなかった(図4)。
実施例4:序論
血清存在下で腫瘍細胞を透過性にするNaD1の能力を評価するために、PI取り込みフローサイトメトリーアッセイを実施例2に記載のように利用したが下記を変更した:4x105/mL U937細胞を10μM天然型NaD1とともに、ウシ胎児血清(FCS)存在下でその濃度を増加させて(0-40%)60分間インキュベートし、続いて2mg/mL PIを添加した。その後PI+細胞のパーセンテージをフローサイトメトリーによって決定した。
NaD1は、40% FCS存在下で70%のPI+細胞が検出されたことから実証されるように、血清存在下でU937細胞を透過性にする能力を保有したが、それは0% FCSでの90% PI+細胞よりごくわずかに低かった。
実施例5:序論
マウスにおける固形黒色腫増殖のin vivoモデルで、腫瘍増殖に及ぼすNaD1の影響を評価した。C57BL/6マウスに5x105 B16-F1腫瘍細胞を皮下注射し、固形腫瘍を直径約10 mmまで増殖させた。次に、50μL PBS中の1 mg/体重kgのNaD1またはNaD1R&A、または50μL PBSのみを2日ごとに、マウスを屠殺するまで腫瘍内に注射した。2日ごとの注射の前に、腫瘍サイズを測定した。各群6匹のマウスを使用した。
1 mg/体重kgのNaD1の腫瘍内注入は、NaD1R&AおよびPBS単独の対照と比較して、腫瘍増殖の有意な減少をもたらした。4日までに、腫瘍サイズは、NaD1R&AまたはPBS単独処理マウスについてそれぞれ4.0 ± 0.4または3.7 ± 0.6であったのと比較して NaD1処理マウスについてはわずか1.8±0.2に達していた(腫瘍サイズは0日の各マウスについて1に標準化した)。B16-F1腫瘍は、処置が開始されたとき、高度に進行した段階となっていたことに留意すべきである。
実施例6:序論
本研究は、OECD Test Guideline(テストガイドライン)423 (OECD [経済協力開発機構] 2001. Guideline(ガイドライン)423: Acute Oral Toxicity(急性経口毒性) - Acute Toxic Class Method(急性毒性等級法)、Paris: OECD)に基づいて行った。
すべての動物は外見上健康であって、肉眼的毒性、薬理学的悪影響、または行動変化の兆候を示さず、研究の終了まで生存した。治療に関係する体重への影響はなく、体重は、研究開始時の絶食前の体重に厳密に一致した。
実施例7:序論
Echelon(商標名)の3つの異なる市販の脂質ストリップ(Membrane、PIP、およびスフィンゴ脂質ストリップ(Sphingolipid Strip))を用いて固体脂質結合アッセイを実施することにより、NaD1およびNaD2と細胞脂質との相互作用を調べた。これらのストリップには、各脂質100 pmolが生物学的に活性な形でスポットされている。NaD1、もしくはNaD2、rNaD1もしくはrNaD2(0.12μM)を脂質ストリップとともに4℃にて一晩インキュベートし、NaD1もしくはNaD2に対する特異的ウサギポリクローナル抗体、続いてHRP標識ロバ抗ウサギ抗体で、結合を検出した。NaD1もしくはNaD2結合は、発色した脂質ストリップ上でデンシトメトリーを行うことによって定量した。
NaD1は、PtdIns(3,5)P2、PtdIns(3,5)P2、PtdIns(4,5)P2、およびPtdIns(3,4,5)P3などのホスホイノシチドPtdIns(PIP2)および(PIP3)ともっとも強く結合したが、PtdIns(3)P、PtdIns(4)P2、およびPtdIns(5)Pなどの、カルジオリピンおよびPtdIns(PIP)に対しても強い結合を示した(図7Aおよび7B)。NaD1は、ホスファチジルセリン、ホスファチジルアラニン、ホスファチジルグリセロール、およびスルファチドに対しても弱い結合を示した(図7A、BおよびC)。組換えNaD1はNaD1と同様の脂質結合特異性を示したが、例外は、ホスファチジルセリン、ホスファチジルアラニン、およびホスファチジルグリセロールに対してもっと強い結合が観察されたことである(図7G)。NaD1R&Aはいかなる細胞脂質にも結合を示さなかった(図7G)。
実施例8:序論
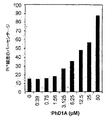
ナス科植物の他のディフェンシンも哺乳類腫瘍細胞をNaD1と同様に透過化することができるかどうかを判定するために、ペチュニア(Petunia hybrida)ディフェンシンPhD1Aまたはトマト(Solanum lycopersicum)ディフェンシンTPP3がU937細胞を透過性にする能力を、2つのアプローチによって評価した。第1は、細胞内ATPの放出を測定するためにバイオルミネッセンスアッセイを利用した。4x104 U937 (ヒト骨髄単球腫瘍細胞)をPhD1AまたはrTPP3とともに、その濃度を増加させて(0-20μM)処理し、ATPの放出を、562 nmで吸光度を測定することにより、30秒間隔で全体として30分間測定した。第2のアプローチは、濃度を増加させたPhD1A(0-50μM)またはrTPP3(0-40μM)で30分間、細胞を処理した後、U937(4x105/mL)による蛍光色素ヨウ化プロピジウム(PI)(2μg/mL)の取り込みを測定するために、フローサイトメトリーを用いた。
U937細胞は、PhD1A(図9B)またはrTPP3(図9D)で処理すると、時間依存性、および濃度依存性のATP放出を示した。NaD1と同様に、ATPは、PhD1AまたはrTPP3に暴露してほとんどすぐに、細胞から放出された。PhD1AまたはrTPP3による腫瘍細胞の透過化をさらに調べるために、U937細胞を、PhD1A(0-50μM)またはrTPP3(0-50μM)の濃度を増加させて37℃にて30分間処理した後、PI取り込みをフローサイトメトリーで測定した。PhD1AまたはrTPP3によってもたらされるATPの放出について記載したように、U937細胞によるPIの取り込みは、PhD1AまたはrTPP3の濃度増加に伴って増加した。図9Aに記載のように、PI+のU937細胞数は、6.25μMで約35% であるが、50μMでは約90% PI+に増加した。TPP3については、PI+U937細胞は5μMで約35%であるが、40μMでは約90% PI+に増加した。
実施例9:序論
ナス科クラスIIディフェンシン(NaD1、PhD1A、およびTPP3)が腫瘍細胞を透過化する能力を、非ナス科ディフェンシンおよび関連γチオニン(フジイロテンジクボタン(Dahlia merckii)ディフェンシンDm-AMP1、オオムギ(Hordeum vulgare)γチオニンγ1-H、トウモロコシγチオニンγ2-Z)と比較して評価するために、PI取り込みフローサイトメトリーアッセイを、下記の変更を行って実施例2に記載のように行った:4x104 U937細胞を10μMの各植物ディフェンシン/γチオニン(NaD1、PhD1A、組換えTPP3、組換えγ1-H、および組換えγ2-Z)とともに60分間(血清なしで)インキュベートした後、2μg/mL PIを添加した。次にPI+細胞のパーセンテージをフローサイトメトリーによって決定した。
3つのナス科クラスIIディフェンシン、NaD1、PhD1AおよびrTPP3はすべて、U937細胞を透過化する能力を示し、それは細胞のみの対照と比較してPI+細胞数が有意に増加したことで示された;10μMのNaD1、PhD1AおよびrTPP3処理の結果、56.07 ± 3.65%、57.07 ± 2.76%、および49.97 ± 2.93% PI+細胞(対照27.03 ± 0.52)となった。これに対して、Dm-AMP1、γ1-H、またはγ2-Zについては、細胞のみの対照と比べて有意な活性は観察されなかった。
実施例10:序論
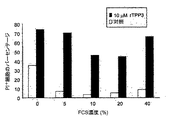
血清存在下で腫瘍細胞を透過性にするPhD1AまたはrTPP3の能力を評価するために、PI取り込みフローサイトメトリーアッセイを実施例2に記載のように用いたが、下記の変更を加えた:4x105/mL U937細胞を、ウシ胎仔血清(FCS)存在下でその濃度を増加させて(0-40%)、10μM PhD1AまたはrTPP3とともに60分間インキュベートした後、2μg/mL PIを添加した。その後PI+細胞のパーセンテージをフローサイトメトリーによって測定した。
PhD1AおよびrTPP3はいずれも血清存在下でU937細胞を透過性にする能力を、活性は低下するものの保持していた。PhD1Aに関して、0% FCSでは90% PI+細胞であるのに対して、40% FCS存在下では40% PI+細胞が検出された(図11A)。組換えTPP3は、5-40% FCSの存在下で最大70%の活性を保持することで示されるように、血清存在下でPhD1Aより強い活性を示すと思われた(図11B)。0% FCSでPI陽性細胞レベルが高いのは、血清がまったく存在しないことの結果である点に留意すべきである。
実施例11:序論
ナス科の他のクラスIIディフェンシンもNaD1と同様に哺乳類腫瘍細胞を透過化することができるかどうか、ならびに他のクラスIディフェンシンはできないかどうかをさらに調べるために、Nicotiana suaveolensクラスIIディフェンシンNsD1およびNsD2、またはクラスIディフェンシンNsD3の、U937細胞を透過性にする能力を、2つのアプローチによって、NaD1と比較して評価した。第1のアプローチは、バイオルミネッセンスアッセイを用いて、細胞内ATPの放出を測定した。4x104U937を10μMの各ディフェンシンで処理し、562 nmで吸光度を測定することにより、ATP放出を30秒間隔で全体として30分間測定した。第2のアプローチは、細胞を10μMの各ディフェンシンで30分間処理した後、フローサイトメトリーを用いて、U937(4x105/mL)による蛍光色素ヨウ化プロピジウム(PI)(2μg/mL)の取り込みを測定した。
U937細胞は、天然型NsD1およびNsD2で処理すると、時間依存性および濃度依存性のATP放出を示した(図12A)。NaD1と同様に、ATPは、NsD1およびNsD2に暴露するとほとんどすぐに細胞から放出された。これとは対照的に、天然型NsD3は、細胞のみの対照と比較して、ATPの放出をもたらさなかった(図12A)。NsD1およびNsD2による腫瘍細胞透過化を、NsD3と対比してさらに調べるために、U937細胞を10μMの各ディフェンシンで37℃にて30分間処理した後、PI取り込みをフローサイトメトリーで測定した。NsD1およびNsD2はNaD1と同レベルで、U937細胞によるPIの取り込みをもたらした(10μMで約60% PI+)のに対して、NsD3は低いPI取り込みしかもたらさなかった(10μMで約10% PI+)(図12B)。
実施例12:序論
NaD1がヒト赤血球(RBC)を溶解する能力のないことが、他のナス科クラスIIディフェンシンにも保存されているかどうかを判定するために、107 RBCを10μMまたは30μMの各ディフェンシンとともに37℃にて16時間インキュベートし、412 nm吸光度測定でヘモグロビン放出を測定することによって、天然型NsD1、NsD2およびPhD1AのPBC溶解能力を調べた。
NsD1およびPhD1Aはともに10μMおよび30μMで、PBCのみの対照と比較してPBCの溶解に影響を及ぼさなかった。それに比べて、NsD2は10μMおよび30μMで、低い溶血作用を示した(それぞれ約17%溶解、および約23%溶解)(図13)。
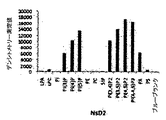
実施例13:序論
EchelonTM PIPストリップを用いた固体脂質結合アッセイで、ナス科クラスIおよびクラスIIディフェンシンと細胞脂質との相互作用をさらに調べた。クラスIディフェンシンNsD3、またはクラスIIディフェンシンNsD1、NsD2、PhD1A、およびrTPP3(0.12μM)を脂質ストリップとともに4℃にて一晩インキュベートし、NaD2もしくはNaD1に対する特異的ウサギポリクローナル抗体(これらの抗体はそれぞれクラスIもしくはクラスIIディフェンシンと交差反応する)、続いてHRP標識ロバ抗ウサギ抗体を用いて、結合を検出した。ディフェンシン結合は、発色した脂質ストリップのデンシトメトリーによって定量した。
NaD1について説明したように、概してクラスIIディフェンシンはすべて、ホスホイノシチドPtdIns(PIP2)および(PIP3)、たとえばPtdIns(3,4)P2、PtdIns(3,5)P2、PtdIns(4,5)P2、およびPtdIns(3,4,5)P3などともっとも強く結合したが、PtdIns(PIP)、たとえばPtdIns(3)P、PtdIns(4)P、およびPtdIns(5)Pなどとの結合も示した(図14A、14B、14C、および14D)。例外はPhD1Aであって、これはホスファチジン酸とも強く結合した(図14E)。クラスIディフェンシンNsD3も細胞脂質と結合することが判明したが、特異性はクラスIIディフェンシンの特異性と明確に異なっていた。クラスIIディフェンシン(PhD1Aを除く)とは対照的に、NsD3はホスファチジン酸に対して強い結合を示し、PtdIns(PIP)、(PIP2)、および(PIP3)に対して弱い結合を示した(図14E)。まとめると、これらのデータは、ナス科クラスIおよびクラスIIディフェンシンが、重なり合うが異なる特異性で細胞リン脂質と結合するものであって、クラスIディフェンシンはホスファチジン酸と優先的に結合し、クラスIIディフェンシンはPtdIns (PIP)、(PIP2)、および(PIP3)と結合することを示唆する(図7G)。
Aluru et al. (1999) Plant Physiol 120: 633
Anaya-Lopez et al. (2006) Biotechnol Lett 28: 1101-8.
Baker et al. (2005) Methods Enzymol 398: 540-554
Bensch et al. (1995) FEBS Let. 368:331-335
Bloch et al. (1991) FEBS Lett 279: 101-104
Bohlmann (1994) Crit Rev Plant Sci 13: 1-16
Bohlmann and Apel (1991) Annu Rev Plant Physiol Plant Mol Biol 42: 227-240
Bonmatin et al. (1992) J Biomol NMR 2: 235-256
Brandstadter et al. (1996) Mol Gen Genet 252: 146-154
Broekaert et al. (1992) Biochemistry 32: 4308-4314
Broekaert et al. (1995) Plant Physiol 108: 1353-1358
Broekaert et al. (1997) Crit Rev Plant Sci 16: 297-323
Bruix et al. (1993) Biochemistry 32: 715-724
Cammue et al. (1992) J Biol Chem 267: 2228-2233
Catanzariti et al. (2004) Protein Sci 13: 1331-1339
Chen et al. (2002) J Agric Food Chem 50: 7258-63
Colilla et al. (1990) FEBS Lett 270: 191-4
Cornet et al., (1995) Structure 3: 435-448
Craik et al. (1999) J Mol Biol 294: 1327-1336
Craik (2001) Toxicon 39: 1809-1813
Craik et al. (2004) Curr Prot Pept Sci 5: 297-315
Da Silva et al. (2003) Protein Sci 12: 438-446
de Zelicourt et al. (2007) Planta 226: 591-600
Diamond et al. (1996) Proc Natl Acad Sci USA 93: 5156-5160
Fehlbaum et al. (1994) J Biol Chem 269: 33159-33163
Ganz et al. (1985) J Clin Invest 76: 1427-1435
Gu et al. (1992) Mol Gen Genet 234: 89-96
Gustafson et al. (1994) J Am Chem Soc 116: 9337-9338
Hancock and Lehrer (1998) Trends Biotech 16: 82-88
Hanzawa et al. (1990) FEBS Lett 269: 413-420
Harlow and Lane (1988) Antibodies: A Laboratory Manual. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York
Harwig et al. (1992) Blood 79: 1532-1537
Janssen et al. (2003) Biochemistry 42: 8214-8222
Jennings et al. (2001) Proc Natl Acad Sci U.S.A. 98: 10614-10619
Kader (1996) Annu Rev Plant Physiol Plant Mol Biol 47: 627-654
Kader (1997) Trends Plant Sci 2: 66-70
Komori et al. (1997) Plant Physiol 115: 314
Kushmerick et al. (1998) FEBS Lett 440: 302-306
Lamberty et al. (1999) J Biol Chem 274: 9320-9326
Lamberty et al. (2001) Biochemistry 40: 11995-12003
Landon et al. (1997) Protein Sci 6: 1878-1884
Lay and Anderson (2005) Curr Protein Pept Sci 6: 85-101
Lay et al. (2003a) Plant Physiol.131: 1283-1293
Lay et al. (2003b) J Mol Biol 325: 175-188
Lehrer and Ganz (2002) Curr Opin Immunol 14: 96-102
Lin et al. (2009) Biosci Rep 30: 101-109
Lobo et al. (2007) Biochemistry 46: 987-96
Loenza-Angeles et al. (2008) 30: 1713-1719
Ma et al. (2009) Peptides 30: 2089-2094
Mader and Hoskin (2006) Expert Opin Investig Drugs 15: 933-46. Review
Marcus et al. (1997) Eur J Biochem 244: 743-749
McManus et al. (1999) J Mol Biol 293: 629-638
Melo et al. (2002) Proteins 48: 311-319
Mendez et al. (1990) Eur J Biochem 194: 533-539
Mendez et al. (1996) Eur J Biochem 239: 67-73
Milligan et al. (1995) Plant Mol Biol 28: 691-711
Mirouze et al. (2006) Plant J 47: 329-342
Moreno et al. (1994) Eur J Biochem 223: 135-139
Ngai and Ng (2005) Biochem Cell Biol 83: 212-20
Osborn et al. (1995) FEBS Lett 368: 257-262
Patel et al. (1998) Biochemistry 37: 983-990
Pelegrini and Franco (2005) Int J Biochem Cell Biol 37: 2239-53
Ramamoorthy et al. (2007) Mol Microbiol 66: 771-786
Russell et al. (1996) Infect Immun 64: 1565-1568
Segura et al. (1998) FEBS Lett 435: 159-162
Selsted et al. (1985) J Clin Invest 76: 1436-1439
Selsted et al. (1993) J Biol Chem 268: 6641-6648
Tailor et al. (1997) J Biol Chem 272: 24480-24487
Tam et al. (1999) Proc Natl Acad Sci U.S.A. 96: 8913-8918
Tang and Selsted (1993) J Biol Chem 268: 6649-6653
Tang et al. (1999a) Science 286: 498-502
Tang et al. (1999b) Infect Immun 67: 6139-6144
Tarver et al. (1998) Infect Immun 66: 1045-1056
Terras et al. (1992) J Biol Chem 267: 15301-15309
Terras et al. (1993) FEBS Lett 316: 233-240
Terras et al. (1995) Plant Cell 7: 573-588
Thomma et al. (2003) Curr Drug Targets - Infect. Dis. 3: 1-8
Trabi et al. (2001) Biochemistry 40: 4211-4221
van der Weerden (2008) J Biol Chem 283: 14445-14452
Wijaya et al. (2000) Plant Sci 159: 243-255
Wong and Ng (2005) Int J Biochem Cell Biol 37: 1626-32
Yamada et al. (1997) Plant Physiol 115: 314
Zhang and Lewis (1997) FEMS Microbiol Lett 149: 59-64
Zhang et al. (1997) Cereal Chem 74: 119-122
Claims (29)
- 増殖性疾患を予防または治療するための方法であって、その方法が治療上有効な量の:
(a) ナス科クラスII植物ディフェンシン;
(b) ナス科クラスII植物ディフェンシンをコードする核酸;
(c) 前記核酸を含有するベクター;
(d) 前記ベクターを含有する宿主細胞;
(e) 前記宿主細胞によって産生される発現産物;または
(f) 前記植物ディフェンシン、核酸、ベクター、宿主細胞、もしくは発現産物を、製薬上許容される担体、賦形剤、もしくは添加剤とともに含有する医薬組成物;
を被験体に投与することを含んでおり、それによって増殖性疾患を予防もしくは治療する、前記方法。 - 前記植物ディフェンシンがハナタバコ(Nicotiana alata)、ニコチアナ・スアベオレンス(Nicotiana suaveolens)、ペチュニア(Petunia hybrida)またはトマト(Solanum lycopersicum)に由来し、またはそれらから得ることができる、請求項1に記載の方法。
- 前記植物ディフェンシンがNaD1、NsD1、NsD2、PhD1A、およびTPP3からなる1群から選択される、請求項1に記載の方法。
- 前記植物ディフェンシンが、配列番号1、配列番号2、配列番号4、配列番号6、配列番号8、配列番号10、配列番号12、配列番号14、配列番号16、配列番号18、配列番号20、配列番号22、配列番号24、もしくは配列番号26、またはそれらの機能的断片からなる一群から選択されるアミノ酸配列を含む、請求項1に記載の方法。
- 前記植物ディフェンシンが、配列番号3、配列番号5、配列番号7、配列番号9、配列番号11、配列番号13、配列番号15、配列番号17、配列番号19、配列番号21、配列番号23、配列番号25、もしくは配列番号27、またはそれらの機能的断片からなる1群から選択される核酸配列、または前記核酸配列のいずれかに対して70%同一性を有する機能的核酸配列によってコードされる、請求項1に記載の方法。
- 増殖性疾患ががんである、請求項1〜5のいずれか1つに記載の方法。
- がんが、基底細胞がん、骨肉腫、大腸がん、脳腫瘍、乳がん、子宮頸がん、白血病、肝がん、肺がん、リンパ腫、黒色腫、卵巣がん、膵がん、前立腺がん、または甲状腺がんからなる1群から選択される、請求項6に記載の方法。
- 増殖性疾患を予防または治療するための薬剤の調製における
(a) ナス科クラスII植物ディフェンシン;
(b) ナス科クラスII植物ディフェンシンをコードする核酸;
(c) 前記核酸を含有するベクター;
(d) 前記ベクターを含有する宿主細胞;または
(e) 前記宿主細胞によって産生される発現産物;
の使用。 - 前記植物ディフェンシンがハナタバコ(Nicotiana alata)、ニコチアナ・スアベオレンス(Nicotiana suaveolens)、ペチュニア(Petunia hybrida)またはトマト(Solanum lycopersicum)に由来し、またはそれらから得ることができる、請求項8に記載の使用。
- 前記植物ディフェンシンがNaD1、NsD1、NsD2、PhD1A、およびTPP3からなる1群から選択される、請求項8に記載の使用。
- 前記植物ディフェンシンが、配列番号1、配列番号2、配列番号4、配列番号6、配列番号8、配列番号10、配列番号12、配列番号14、配列番号16、配列番号18、配列番号20、配列番号22、配列番号24、もしくは配列番号26、またはそれらの機能的断片からなる一群から選択されるアミノ酸配列を含む、請求項8に記載の使用。
- 前記植物ディフェンシンが、配列番号3、配列番号5、配列番号7、配列番号9、配列番号11、配列番号13、配列番号15、配列番号17、配列番号19、配列番号21、配列番号23、配列番号25、もしくは配列番号27、またはそれらの機能的断片からなる1群から選択される核酸配列、または前記核酸配列のいずれかに対して70%同一性を有する機能的核酸配列によってコードされる、請求項8に記載の使用。
- 増殖性疾患ががんである、請求項8〜12のいずれか1つに記載の使用。
- がんが、基底細胞がん、骨肉腫、大腸がん、脳腫瘍、乳がん、子宮頸がん、白血病、肝がん、肺がん、リンパ腫、黒色腫、卵巣がん、膵がん、前立腺がん、または甲状腺がんからなる1群から選択される、請求項13に記載の使用。
- 増殖性疾患を予防または治療するために使用されるキットであって、そのキットが治療上有効な量の:
(a) ナス科クラスII植物ディフェンシン;
(b) ナス科クラスII植物ディフェンシンをコードする核酸;
(c) 前記核酸を含有するベクター;
(d) 前記ベクターを含有する宿主細胞;
(e) 前記宿主細胞によって産生される発現産物;または
(f) 前記植物ディフェンシン、核酸、ベクター、宿主細胞、もしくは発現産物を、製薬上許容される担体、賦形剤、もしくは添加剤とともに含有する医薬組成物;
を含んでなる、前記キット。 - 前記植物ディフェンシンがハナタバコ(Nicotiana alata)、ニコチアナ・スアベオレンス(Nicotiana suaveolens)、ペチュニア(Petunia hybrida)またはトマト(Solanum lycopersicum)に由来し、またはそれらから得ることができる、請求項15に記載のキット。
- 前記植物ディフェンシンがNaD1、NsD1、NsD2、PhD1A、およびTPP3からなる1群から選択される、請求項15に記載のキット。
- 前記植物ディフェンシンが、配列番号1、配列番号2、配列番号4、配列番号6、配列番号8、配列番号10、配列番号12、配列番号14、配列番号16、配列番号18、配列番号20、配列番号22、配列番号24、もしくは配列番号26、またはそれらの機能的断片からなる一群から選択されるアミノ酸配列を含む、請求項15に記載のキット。
- 前記植物ディフェンシンが、配列番号3、配列番号5、配列番号7、配列番号9、配列番号11、配列番号13、配列番号15、配列番号17、配列番号19、配列番号21、配列番号23、配列番号25、もしくは配列番号27、またはそれらの機能的断片からなる1群から選択される核酸配列、または前記核酸配列のいずれかに対して70%同一性を有する機能的核酸配列によってコードされる、請求項15に記載のキット。
- 増殖性疾患ががんである、請求項15〜19のいずれか1つに記載のキット。
- がんが、基底細胞がん、骨肉腫、大腸がん、脳腫瘍、乳がん、子宮頸がん、白血病、肝がん、肺がん、リンパ腫、黒色腫、卵巣がん、膵がん、前立腺がん、または甲状腺がんからなる1群から選択される、請求項20に記載のキット。
- 増殖性疾患を予防または治療するための請求項15〜21のいずれか1つに記載のキットの使用であって、治療上有効な量の:
(a) ナス科クラスII植物ディフェンシン;
(b) ナス科クラスII植物ディフェンシンをコードする核酸;
(c) 前記核酸を含有するベクター;
(d) 前記ベクターを含有する宿主細胞;
(e) 前記宿主細胞によって産生される発現産物;または
(f) 前記植物ディフェンシン、核酸、ベクター、宿主細胞、もしくは発現産物を、製薬上許容される担体、賦形剤、もしくは添加剤とともに含有する医薬組成物;
が被験体に投与され、それによって増殖性疾患を予防または治療する、前記使用。 - 増殖性疾患を予防または治療するために使用される医薬組成物であって、その医薬組成物が:
(a) ナス科クラスII植物ディフェンシン;
(b) ナス科クラスII植物ディフェンシンをコードする核酸;
(c) 前記核酸を含有するベクター;
(d) 前記ベクターを含有する宿主細胞;または
(e) 前記宿主細胞によって産生される発現産物;
を、製薬上許容される担体、賦形剤、もしくは添加剤とともに含有する、前記医薬組成物。 - 増殖性疾患を予防または治療するために使用される、ナス科クラスII植物ディフェンシン。
- ナス科クラスII植物ディフェンシンの哺乳類腫瘍細胞に対する細胞毒性についてスクリーニングするための方法であって、その方法が、
(a) ナス科クラスII植物ディフェンシン;
(b) ナス科クラスII植物ディフェンシンをコードする核酸;
(c) 前記核酸を含有するベクター;
(d) 前記ベクターを含有する宿主細胞;または
(e) 前記宿主細胞によって産生される発現産物;
を、哺乳類細胞株とともにインキュベートすること、ならびに植物ディフェンシンとの接触に起因する哺乳類細胞株に対する細胞毒性についてアッセイすることを含み、それによって、ナス科クラスII植物ディフェンシンの哺乳類腫瘍細胞に対する細胞毒性についてスクリーニングする、前記方法。 - 請求項25に記載の方法でスクリーニングされたナス科クラスII植物ディフェンシン。
- 溶血作用の低下したナス科クラスII植物ディフェンシンを作製するための方法であって、その方法が少なくとも1つのアラニン残基を、植物ディフェンシンのN末端もしくはその近傍に導入することを含む、前記方法。
- 請求項27に記載の方法により作製された、溶血作用の低下したナス科クラスII植物ディフェンシン。
- 実施例のいずれか1つもしくはいくつかに準拠して実質的に本明細書に記載される、溶血作用の低下したナス科クラスII植物ディフェンシン。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US35812610P | 2010-06-24 | 2010-06-24 | |
| US61/358,126 | 2010-06-24 | ||
| PCT/AU2011/000760 WO2011160174A1 (en) | 2010-06-24 | 2011-06-23 | Treatment of proliferative diseases |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2013530965A true JP2013530965A (ja) | 2013-08-01 |
| JP2013530965A5 JP2013530965A5 (ja) | 2013-10-10 |
Family
ID=45370753
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2013515634A Pending JP2013530965A (ja) | 2010-06-24 | 2011-06-23 | 増殖性疾患の治療 |
Country Status (12)
| Country | Link |
|---|---|
| US (1) | US20120172313A1 (ja) |
| EP (1) | EP2585095A4 (ja) |
| JP (1) | JP2013530965A (ja) |
| KR (1) | KR20140003316A (ja) |
| CN (1) | CN103037888A (ja) |
| AU (1) | AU2011269726B2 (ja) |
| CA (1) | CA2803027A1 (ja) |
| MX (1) | MX2012014711A (ja) |
| NZ (1) | NZ603442A (ja) |
| SG (1) | SG186385A1 (ja) |
| WO (1) | WO2011160174A1 (ja) |
| ZA (1) | ZA201208389B (ja) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2018520121A (ja) * | 2015-05-29 | 2018-07-26 | ヘキシマ リミテッドHexima Limited | インビボ治療の方法 |
| KR102371762B1 (ko) * | 2020-12-29 | 2022-03-07 | 중앙대학교 산학협력단 | Brca1 매개 nsd2 유비퀴틴화를 통한 세포 분화 및 세포사멸 조절 용도 |
Families Citing this family (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| ES2660965T3 (es) | 2011-02-07 | 2018-03-26 | Hexima Limited | Defensinas vegetales modificadas útiles como agentes antipatógenos |
| US9464124B2 (en) | 2011-09-12 | 2016-10-11 | Moderna Therapeutics, Inc. | Engineered nucleic acids and methods of use thereof |
| WO2013039861A2 (en) * | 2011-09-12 | 2013-03-21 | modeRNA Therapeutics | Engineered nucleic acids and methods of use thereof |
| BR112014009277A2 (pt) | 2011-10-19 | 2019-09-24 | Balmoral Australia Pty Ltd | novas defensinas de planta e uso no tratamento de doenças proliferativas |
| CN111751345A (zh) * | 2020-07-08 | 2020-10-09 | 深圳海关动植物检验检疫技术中心 | 一种苜蓿黄萎病菌活性检测方法 |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2002063011A1 (en) * | 2001-02-08 | 2002-08-15 | Hexima Ltd | Plant-derived molecules and genetic sequences encoding same and uses therefor |
Family Cites Families (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CA2420413C (en) * | 2000-08-25 | 2012-02-21 | Oswaldo Da Costa E Silva | Plant polynucleotides encoding novel vacuolar na+/h+ antiporters |
| US20070207209A1 (en) * | 2004-08-27 | 2007-09-06 | Murphy Christopher J | Trophic factor combinations for nervous system treatment |
| AR072910A1 (es) * | 2008-08-05 | 2010-09-29 | Hexima Ltd | Sistemas anti -patogeno |
-
2011
- 2011-06-23 MX MX2012014711A patent/MX2012014711A/es unknown
- 2011-06-23 US US13/166,960 patent/US20120172313A1/en not_active Abandoned
- 2011-06-23 NZ NZ603442A patent/NZ603442A/xx not_active IP Right Cessation
- 2011-06-23 AU AU2011269726A patent/AU2011269726B2/en not_active Ceased
- 2011-06-23 WO PCT/AU2011/000760 patent/WO2011160174A1/en active Application Filing
- 2011-06-23 CN CN2011800312370A patent/CN103037888A/zh active Pending
- 2011-06-23 KR KR1020127032033A patent/KR20140003316A/ko not_active Application Discontinuation
- 2011-06-23 SG SG2012093050A patent/SG186385A1/en unknown
- 2011-06-23 JP JP2013515634A patent/JP2013530965A/ja active Pending
- 2011-06-23 EP EP11797388.3A patent/EP2585095A4/en not_active Withdrawn
- 2011-06-23 CA CA2803027A patent/CA2803027A1/en not_active Abandoned
-
2012
- 2012-11-08 ZA ZA2012/08389A patent/ZA201208389B/en unknown
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2002063011A1 (en) * | 2001-02-08 | 2002-08-15 | Hexima Ltd | Plant-derived molecules and genetic sequences encoding same and uses therefor |
Non-Patent Citations (3)
| Title |
|---|
| JPN6015019746; Carvalho, Ade. O1. et al., Peptides, 2009, vol.30, no.5, p.1007-20 * |
| JPN6015019747; Anaya-Lo'pez, J. L. et al., Biotechnol. Lett., 2006, vol.28, no.14, p.1101-8 * |
| JPN6015019748; Lay, F. T., et al., Curr. Protein. Pept. Sci., 2005, vol.6, no.1, p.85-101 * |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2018520121A (ja) * | 2015-05-29 | 2018-07-26 | ヘキシマ リミテッドHexima Limited | インビボ治療の方法 |
| KR102371762B1 (ko) * | 2020-12-29 | 2022-03-07 | 중앙대학교 산학협력단 | Brca1 매개 nsd2 유비퀴틴화를 통한 세포 분화 및 세포사멸 조절 용도 |
Also Published As
| Publication number | Publication date |
|---|---|
| SG186385A1 (en) | 2013-01-30 |
| CN103037888A (zh) | 2013-04-10 |
| NZ603442A (en) | 2013-09-27 |
| KR20140003316A (ko) | 2014-01-09 |
| CA2803027A1 (en) | 2011-12-29 |
| EP2585095A4 (en) | 2013-11-13 |
| AU2011269726B2 (en) | 2013-11-28 |
| ZA201208389B (en) | 2013-06-26 |
| MX2012014711A (es) | 2013-03-21 |
| WO2011160174A1 (en) | 2011-12-29 |
| EP2585095A1 (en) | 2013-05-01 |
| US20120172313A1 (en) | 2012-07-05 |
| AU2011269726A1 (en) | 2012-11-29 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| Cools et al. | Antifungal plant defensins: increased insight in their mode of action as a basis for their use to combat fungal infections | |
| JP2013530965A (ja) | 増殖性疾患の治療 | |
| Vidal-Dupiol et al. | Innate immune responses of a scleractinian coral to vibriosis | |
| Kim et al. | In vitro activities of native and designed peptide antibiotics against drug sensitive and resistant tumor cell lines | |
| Nair et al. | Antimicrobial activity of omwaprin, a new member of the waprin family of snake venom proteins | |
| Silva et al. | Defensins: antifungal lessons from eukaryotes | |
| Petersen et al. | Peanut defensins: Novel allergens isolated from lipophilic peanut extract | |
| CN107529761B (zh) | 使用台湾假单孢菌控制昆虫及微生物的组合物及方法 | |
| CN103987728B (zh) | 抗癌融合蛋白 | |
| Chen et al. | Novel cationic antimicrobial peptide GW-H1 induced caspase-dependent apoptosis of hepatocellular carcinoma cell lines | |
| Ravipati et al. | Lysine-rich cyclotides: A new subclass of circular knotted proteins from violaceae | |
| Palavalli et al. | Imbibition of soybean seeds in warm water results in the release of copious amounts of Bowman–Birk protease inhibitor, a putative anticarcinogenic agent | |
| Mangoni et al. | Functional characterisation of the 1–18 fragment of esculentin-1b, an antimicrobial peptide from Rana esculenta | |
| Zhang et al. | Secretion expression of human neutrophil peptide 1 (HNP1) in Pichia pastoris and its functional analysis against antibiotic-resistant Helicobacter pylori | |
| El-Defrawy et al. | G-protein-coupled receptors in fungi | |
| Marcos et al. | Antifungal peptides: exploiting non-lytic mechanisms and cell penetration properties | |
| US9540423B2 (en) | Plant defensins and use in the treatment of proliferative diseases | |
| Xu et al. | Eukaryotic expression and antimicrobial spectrum determination of the peptide tachyplesin II | |
| EP3419994B1 (en) | Peptide inhibitors of calcium channels | |
| Rádis-Baptista et al. | Vipericidins, snake venom cathelicidin-related peptides, in the milieu of reptilian antimicrobial polypeptides | |
| TWI634210B (zh) | 抑制熱休克蛋白質表現之胜肽及包含其之組成物 | |
| Barkhuizen | Mode of action studies of defensin peptides from native South African Brassicaceae species | |
| He et al. | Gut expressed vitellogenin is hijacked by a virus to facilitate its spread | |
| Jones | Novel antifungal properties of high mannose binding lectins with particular emphasis on scytovirin and cryptococcus | |
| Wu et al. | Identification and molecular cloning of novel antimicrobial peptides from skin secretions of Odorrana versabilis and Rana palustris |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20130510 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20130822 |
|
| RD01 | Notification of change of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7426 Effective date: 20131010 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20131010 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20140620 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20150526 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20151027 |