JP2012532191A - [4,6−ビス(ジメチルアミノ)−2−(4−{[4−(トリフルオロメチル)ベンゾイル]アミノ}ベンジル)ピリミジン−5−イル]の多形体 - Google Patents
[4,6−ビス(ジメチルアミノ)−2−(4−{[4−(トリフルオロメチル)ベンゾイル]アミノ}ベンジル)ピリミジン−5−イル]の多形体 Download PDFInfo
- Publication number
- JP2012532191A JP2012532191A JP2012519596A JP2012519596A JP2012532191A JP 2012532191 A JP2012532191 A JP 2012532191A JP 2012519596 A JP2012519596 A JP 2012519596A JP 2012519596 A JP2012519596 A JP 2012519596A JP 2012532191 A JP2012532191 A JP 2012532191A
- Authority
- JP
- Japan
- Prior art keywords
- ethylenediamine salt
- salt type
- ethylenediamine
- pharmaceutical composition
- compound
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D239/00—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings
- C07D239/02—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings
- C07D239/24—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings having three or more double bonds between ring members or between ring members and non-ring members
- C07D239/28—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings having three or more double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, directly attached to ring carbon atoms
- C07D239/46—Two or more oxygen, sulphur or nitrogen atoms
- C07D239/48—Two nitrogen atoms
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/02—Nasal agents, e.g. decongestants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/06—Antiasthmatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/08—Antiallergic agents
Landscapes
- Health & Medical Sciences (AREA)
- Organic Chemistry (AREA)
- Chemical & Material Sciences (AREA)
- Pulmonology (AREA)
- General Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Engineering & Computer Science (AREA)
- Public Health (AREA)
- Immunology (AREA)
- Otolaryngology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicinal Preparation (AREA)
Abstract
[4,6-ビス(ジメチルアミノ)-2-(4-{[4-(トリフルオロメチル)ベンゾイル]アミノ}ベンジル)ピリミジン-5-イル]酢酸のエチレンジアミン塩の結晶形、その調製方法、その結晶形を含む医薬組成物、CRTH2が仲介する障害又は疾病の1つ以上の徴候を治療、予防又は改善するために前記医薬組成物を使用する方法が提供される。
Description
本発明は、[4,6-ビス(ジメチルアミノ)-2-(4-{[4-(トリフルオロメチル)ベンゾイル]アミノ}ベンジル)ピリミジン-5-イル]酢酸のエチレンジアミン塩の結晶性非水和物(anhydrate)及び非溶媒和物(ansolvate)に関する。 本発明のエチレンジアミン塩は、医薬調剤の有効成分として有用であり、CRTH2の活性と関連した疾病の予防及び治療に使用することができる。
CRTH2は、Th2細胞、エオシノフィル(eosinophils)及びバソフィル(basophils)に発現するGタンパク質と結合した化学走性誘因物質受容体である(Nagata et al., J. Immunol. 1999, 162, 1278-1286; Hirai et al., J. Exp. Med. 2001, 193, 255-261)。プロスタグランジンD2(PGD2)はマスト細胞から生成される主要な炎症メディエーターであるが、CRTH2の天然リガンドである。近年、PGD2によりCRTH2が活性化することで、Th2細胞やエオシノフィルが遊走、活性化することがわかってきた。これは、アレルギー性疾患においてCRTH2が炎症を誘発する役割を果たしていることを示唆する(Hirai et al., J. Exp. Med. 2001, 193, 255-261; Gervais et al., J. Allergy Clin. Immunol. 2001, 108, 982-988)。また、アトピー性皮膚炎においても、CRTH2を発現する循環T細胞が増加することが疾患の重篤性と相関していることがわかってきた(Cosmi et al., Eur. J. Immunol. 2000, 30, 2972-2979; Iwazaki et al., J. Investigative Dermatology 2002, 119, 609-616)。生体内でのPGD2合成酵素によるPGD2の過剰生成が気道炎症を悪化させることがわかり、喘息のマウスモデルにおいて、アレルギー性炎症が始まり継続する際のPGD2の役割が更に実証されてきた(Fujitani et al., J. Immunol. 2002, 168, 443-449)。そのため、CRTH2を仲介とする障害又は疾病、例えばアレルギー性鼻炎、アレルギー性喘息、気管支収縮、アトピー性皮膚炎又は全身性の炎症性疾患等の治療に、CRTH2拮抗薬は潜在的な有用性がある。
国際特許公開WO2008/15678号は、式(I)で表わされる[4,6-ビス(ジメチルアミノ)-2-(4-{[4-(トリフルオロメチル)ベンゾイル]アミノ}ベンジル)ピリミジン-5-イル]酢酸の遊離酸を開示し、この化合物がCRTH2拮抗薬として有用であることを報告している。
国際特許公開WO2008/15678号は、式(I)で表わされる[4,6-ビス(ジメチルアミノ)-2-(4-{[4-(トリフルオロメチル)ベンゾイル]アミノ}ベンジル)ピリミジン-5-イル]酢酸の遊離酸を開示し、この化合物がCRTH2拮抗薬として有用であることを報告している。
国際特許公開WO2008/156780号には、式(I)の化合物の遊離酸の2つの結晶性多形体が開示されている。
国際特許公開WO2008/156781号には、エタノール溶媒和物の結晶性エチレンジアミン塩を含む式(I)の化合物のアミン塩が開示されている。
本願明細書に開示するのは、式(I)で表わされる化合物のエチレンジアミン塩の新規な多形体であって、無水であり、有機溶媒を実質的に含まず、かつ、加温しても安定している新規な多形体である。
国際特許公開WO2008/156781号には、エタノール溶媒和物の結晶性エチレンジアミン塩を含む式(I)の化合物のアミン塩が開示されている。
本願明細書に開示するのは、式(I)で表わされる化合物のエチレンジアミン塩の新規な多形体であって、無水であり、有機溶媒を実質的に含まず、かつ、加温しても安定している新規な多形体である。
本発明の最も広い範囲の態様においては、式(I)で表わされる化合物のエチレンジアミン塩の、無水であり、溶媒和化されていない結晶性多形体に関する。本発明の多形体塩には、エチレンジアミン1モル当量に、式(I)の化合物が約2モル当量含まれる。更に、本発明の多形体塩は、2θの約11.1、約13.8、約16.0、約21.8、約22.2、約23.1、約24.4、約26.0及び約26.5度を有する粉末X線回折パターンによって特徴づけられる。本願出願人は、式(I)で表わされる化合物のエチレンジアミン塩の無水及び溶媒和化されていない形が、新規な結晶性多形体として存在することを発見した。これを便宜上本願明細書では「エチレンジアミン塩タイプII」と称する。
本発明の別の態様は、医薬的有効量のエチレンジアミン塩タイプIIと、少なくとも1種の医薬的に許容できる担体又は賦形剤とを含み、さらに1種以上の活性化合物を含んでいてもよい医薬組成物(「本発明の医薬組成物」)に関する。
更に本発明の別の態様は、CRTH2が介在する疾病又は疾患の1つ以上の徴候の治療又は予防方法であって、治療上有効量のエチレンジアミン塩タイプIIを患者に投与することを含む方法に関する。
本発明の別の態様は、エチレンジアミン塩タイプIIの製造方法に関する。
本発明の別の態様は、医薬的有効量のエチレンジアミン塩タイプIIと、少なくとも1種の医薬的に許容できる担体又は賦形剤とを含み、さらに1種以上の活性化合物を含んでいてもよい医薬組成物(「本発明の医薬組成物」)に関する。
更に本発明の別の態様は、CRTH2が介在する疾病又は疾患の1つ以上の徴候の治療又は予防方法であって、治療上有効量のエチレンジアミン塩タイプIIを患者に投与することを含む方法に関する。
本発明の別の態様は、エチレンジアミン塩タイプIIの製造方法に関する。
本願明細書で使用のごとく、式(I)の化合物に関する用語「遊離酸」は、式(I)の化合物の塩ではない形態を指す。
本願明細書で使用のごとく、式(I)の化合物に関する「非溶媒和物」という用語は、有機溶媒を実質的に含まない式(I)の化合物の形態を指す(例えば、式(I)の化合物において存在しうる対イオンを含む全質量を基準として有機溶媒が1質量%未満)。
上記のとおり、本出願人は、式(I)で表わされる化合物のエチレンジアミン塩で、無水かつ溶媒和化されていない新規な結晶形(エチレンジアミン塩タイプII)を発見した。このエチレンジアミン塩タイプIIの特性を以下に記載する。
本出願人は、本発明の新規なエチレンジアミン塩タイプIIが、WO2008/156781号に記載の式(I)で表わされる化合物のエチレンジアミン塩のエタノール付加物(本願明細書で便宜上「エチレンジアミン塩タイプI」と呼ぶ)に比べ、熱安定性が高く、吸湿性が低いことを発見した。
実施形態の1つであるが、エチレンジアミン塩タイプIIは、約11.1、13.8、16.0、21.8、22.2、23.1、24.4、26.0及び26.5度の2θの角度を有する粉末X線回折パターンによって特徴づけられる。
別の実施形態では、エチレンジアミン塩タイプIIは、表1に示すのと実質的に同じ2θの角度を有する粉末X線回折パターンにより特徴づけられる。
別の実施形態では、エチレンジアミン塩タイプIIの粉末X線回折パターンは実質的に図1に示すパターンであり、及び/又は、示差走査熱量サーモグラムは実質的に図3に示すものである。
本願明細書で使用のごとく、式(I)の化合物に関する「非溶媒和物」という用語は、有機溶媒を実質的に含まない式(I)の化合物の形態を指す(例えば、式(I)の化合物において存在しうる対イオンを含む全質量を基準として有機溶媒が1質量%未満)。
上記のとおり、本出願人は、式(I)で表わされる化合物のエチレンジアミン塩で、無水かつ溶媒和化されていない新規な結晶形(エチレンジアミン塩タイプII)を発見した。このエチレンジアミン塩タイプIIの特性を以下に記載する。
本出願人は、本発明の新規なエチレンジアミン塩タイプIIが、WO2008/156781号に記載の式(I)で表わされる化合物のエチレンジアミン塩のエタノール付加物(本願明細書で便宜上「エチレンジアミン塩タイプI」と呼ぶ)に比べ、熱安定性が高く、吸湿性が低いことを発見した。
実施形態の1つであるが、エチレンジアミン塩タイプIIは、約11.1、13.8、16.0、21.8、22.2、23.1、24.4、26.0及び26.5度の2θの角度を有する粉末X線回折パターンによって特徴づけられる。
別の実施形態では、エチレンジアミン塩タイプIIは、表1に示すのと実質的に同じ2θの角度を有する粉末X線回折パターンにより特徴づけられる。
別の実施形態では、エチレンジアミン塩タイプIIの粉末X線回折パターンは実質的に図1に示すパターンであり、及び/又は、示差走査熱量サーモグラムは実質的に図3に示すものである。
別の実施形態は、エチレンジアミン塩タイプIIの粉末X線回折パターンが実質的に図1に示すパターンである。
更に別の実施形態は、エチレンジアミン塩タイプIIの示差走査熱量サーモグラムは実質的に図3に示すものである。
更に別の実施形態では、エチレンジアミン塩タイプIIは、ピーク温度が約192℃で開始温度が約160℃の吸熱量を示すDSCサーモグラムを有する。更に別の実施形態では、エチレンジアミン塩タイプIIは、ピーク温度が約232℃で開始温度が約225℃の吸熱量を示すDSCサーモグラムを有する。
別の実施形態では、エチレンジアミン塩タイプIIは、約140℃から約210℃に加熱すると約5.5%から約6.5%の質量損失を示すTGAサーモグラム、又は、約140℃から約210℃に加熱すると約5.75%から約6.25%の質量損失を示すTGAサーモグラム、又は、約140℃から約210℃に加熱すると約5.75%から約6%の質量損失を示すTGAサーモグラムを有する。
エチレンジアミン塩タイプIIは、この後すぐに説明する方法及び実施例に記載の方法によって調製することができる。
本発明の態様の1つは、(a):式(I)で表わされる化合物のエチレンジアミン塩を含む好適な極性溶媒の混合物を作成する工程(「混合工程」)と、(b):エチレンジアミン塩タイプIIを前記混合物から析出させる工程(「結晶化工程」)とを有する、エチレンジアミン塩タイプIIの製造方法に関する。
前記混合工程で使用する式(I)で表わされる化合物のエチレンジアミン塩は、結晶性溶媒和物及び/又は水和物、非晶質溶媒和物及び/又は水和物、非晶質非水和物、非晶質非溶媒和物、又はこれらの混合物であってもよい。
更に別の実施形態は、エチレンジアミン塩タイプIIの示差走査熱量サーモグラムは実質的に図3に示すものである。
更に別の実施形態では、エチレンジアミン塩タイプIIは、ピーク温度が約192℃で開始温度が約160℃の吸熱量を示すDSCサーモグラムを有する。更に別の実施形態では、エチレンジアミン塩タイプIIは、ピーク温度が約232℃で開始温度が約225℃の吸熱量を示すDSCサーモグラムを有する。
別の実施形態では、エチレンジアミン塩タイプIIは、約140℃から約210℃に加熱すると約5.5%から約6.5%の質量損失を示すTGAサーモグラム、又は、約140℃から約210℃に加熱すると約5.75%から約6.25%の質量損失を示すTGAサーモグラム、又は、約140℃から約210℃に加熱すると約5.75%から約6%の質量損失を示すTGAサーモグラムを有する。
エチレンジアミン塩タイプIIは、この後すぐに説明する方法及び実施例に記載の方法によって調製することができる。
本発明の態様の1つは、(a):式(I)で表わされる化合物のエチレンジアミン塩を含む好適な極性溶媒の混合物を作成する工程(「混合工程」)と、(b):エチレンジアミン塩タイプIIを前記混合物から析出させる工程(「結晶化工程」)とを有する、エチレンジアミン塩タイプIIの製造方法に関する。
前記混合工程で使用する式(I)で表わされる化合物のエチレンジアミン塩は、結晶性溶媒和物及び/又は水和物、非晶質溶媒和物及び/又は水和物、非晶質非水和物、非晶質非溶媒和物、又はこれらの混合物であってもよい。
或いは、前記混合工程で使用する式(I)で表わされる化合物のエチレンジアミン塩は、式(I)の化合物の遊離酸をエチレンジアミンと好適な極性溶媒中で反応させて現場で生成又は形成してもよく、式(I)の化合物のエチレンジアミン塩を形成する。 この現場での塩形成は、式(I)の化合物の遊離酸の現場での塩形成に使用するエチレンジアミンに対するモル比が3:1〜1:3、約2.5:1〜約2.25:1又は約1:1に変えることができる。その結果、式(I)で表わされる化合物のエチレンジアミン塩の結晶では、式(I)の化合物の遊離酸:エチレンジアミンのモル比が約2:1となる。現場での塩形成に使用する式(I)の化合物は、式(I)で表わされる化合物の遊離酸の溶媒和物又は水和物であってもよく、非晶質又は結晶性のいずれでもよく、例えば、WO2008156780号に記載の「Form I」が挙げられる。或いは、塩形成工程で使用する式(I)の遊離酸化合物は、非晶質の非水和物及び/又は非溶媒和物であってもよい。
そこで、本発明の別の態様はエチレンジアミン塩タイプIIの製造方法であって、(a):式(I)の化合物の遊離酸とエチレンジアミンと好適な極性溶媒とを、式(I)の化合物のエチレンジアミン塩を含む混合物を形成するのに十分な条件下で混合する工程(混合工程)と、(b):エチレンジアミン塩タイプIIを前記混合物から析出させる工程(結晶化工程)とを有する製造方法に関する。
そこで、本発明の別の態様はエチレンジアミン塩タイプIIの製造方法であって、(a):式(I)の化合物の遊離酸とエチレンジアミンと好適な極性溶媒とを、式(I)の化合物のエチレンジアミン塩を含む混合物を形成するのに十分な条件下で混合する工程(混合工程)と、(b):エチレンジアミン塩タイプIIを前記混合物から析出させる工程(結晶化工程)とを有する製造方法に関する。
本願明細書で使用の「好適な極性溶媒」という用語は、式(I)の化合物、エチレンジアミン及びエチレンジアミン塩タイプIIの少なくとも一部を溶解することができ、式(I)の化合物の結晶形と一緒になって配位化合物(coordination complex)又は溶媒和物を形成することのない有機溶媒を指す。好適な極性溶媒の非制限的例として、アセトニトリル、酢酸エチル、酢酸イソプロピル、酢酸n-ブチル、メチルイソブチルケトンが挙げられる。実施形態の1つでは、極性溶媒は、アセトニトリル、酢酸エチル、酢酸イソプロピル、メチルイソブチルケトン及び酢酸n-ブチルからなる群から選択される。
前記態様における混合工程は、式(I)で表わされる化合物のエチレンジアミン塩の少なくとも一部を溶解させるのに十分な時間と温度で行われる。別の実施形態では、前記態様における混合工程が、式(I)で表わされる化合物のエチレンジアミン塩の少なくとも大半を、また、別の実施形態では、 式(I)の化合物のエチレンジアミン塩の実質的にすべてを、混合工程で溶解するのに十分な時間と温度で行われる。
混合工程の好適な温度は約25℃から極性溶媒の還流温度あたりである。別の実施形態では、約25℃〜約40℃、別の実施形態では、約40℃〜約65℃で、更に別の実施形態では約40℃である。混合工程の好適な時間は、一般に約15分〜約24時間、又は約15分〜約5時間、又は約15分〜約2時間である。混合工程では、温度がある時間一定に保たれる平坦域を含む温度ランプが1つ以上あってもよいと理解されよう。
前記態様における混合工程は、式(I)で表わされる化合物のエチレンジアミン塩の少なくとも一部を溶解させるのに十分な時間と温度で行われる。別の実施形態では、前記態様における混合工程が、式(I)で表わされる化合物のエチレンジアミン塩の少なくとも大半を、また、別の実施形態では、 式(I)の化合物のエチレンジアミン塩の実質的にすべてを、混合工程で溶解するのに十分な時間と温度で行われる。
混合工程の好適な温度は約25℃から極性溶媒の還流温度あたりである。別の実施形態では、約25℃〜約40℃、別の実施形態では、約40℃〜約65℃で、更に別の実施形態では約40℃である。混合工程の好適な時間は、一般に約15分〜約24時間、又は約15分〜約5時間、又は約15分〜約2時間である。混合工程では、温度がある時間一定に保たれる平坦域を含む温度ランプが1つ以上あってもよいと理解されよう。
前記態様の結晶化工程は、式(I)の化合物のエチレンジアミン塩の少なくとも大半を結晶化させるか、又は、エチレンジアミン塩タイプIIに変換させるのに十分な時間と温度で行われる。結晶化工程の好適な温度は約25℃から極性溶媒の還流温度あたりである。別の実施形態では、約40℃から極性溶媒の還流温度あたり、さらに別の実施形態では、約40℃〜約65℃、別の実施形態では約65℃、別の実施形態では極性溶媒の還流温度あたり、さらに別の実施形態では約40℃である。結晶化工程の好適な時間は、通常約1時間〜約72時間、約1時間〜約48時間、約2時間〜約24時間である。結晶化工程では、温度がある時間一定に保たれる平坦域を含む温度ランプが1つ以上あってもよいと理解されよう。
前記のエチレンジアミン塩タイプII製造の態様は、工程(b)の組成物を工程(b)で使用した温度よりも低い温度まで更に冷却する追加の工程(c)(「冷却工程」)を有してもよい。この任意の冷却工程で使用する温度は、ある実施形態では約0℃〜約40℃、別の実施形態では約15℃〜約40℃、更に別の実施形態では約20℃〜約40℃である。この任意の冷却工程では、温度がある時間一定に保たれる平坦域を含む温度ランプが1つ以上あってもよいと理解されよう。
前記態様において、エチレンジアミン塩タイプIIの製造方法は、一般に、結晶化工程開始前又は開始中に反応混合物に種結晶を加える工程を更に含んでいてもよい。そこで実施形態の1つでは、エチレンジアミン塩タイプIIの製造方法が、混合工程最中及び/又は結晶化工程最中に混合物に種結晶を加える工程を更に含む。種結晶を使用する場合、種結晶はエチレンジアミン塩タイプIIである。
結晶化及び任意の冷却工程終了後、エチレンジアミン塩タイプIIを液相から分離する。分離方法は限定されないが、濾過やデカンテーションが挙げられる。エチレンジアミン塩タイプIIは一旦分離後、極性溶媒で洗浄し乾燥させるとよい。
特性表示: 前述のとおり、本発明のエチレンジアミン塩タイプIIは、表1及び図1に示すような粉末X線回折パターン(XRPD)により特徴づけられる。
前記のエチレンジアミン塩タイプII製造の態様は、工程(b)の組成物を工程(b)で使用した温度よりも低い温度まで更に冷却する追加の工程(c)(「冷却工程」)を有してもよい。この任意の冷却工程で使用する温度は、ある実施形態では約0℃〜約40℃、別の実施形態では約15℃〜約40℃、更に別の実施形態では約20℃〜約40℃である。この任意の冷却工程では、温度がある時間一定に保たれる平坦域を含む温度ランプが1つ以上あってもよいと理解されよう。
前記態様において、エチレンジアミン塩タイプIIの製造方法は、一般に、結晶化工程開始前又は開始中に反応混合物に種結晶を加える工程を更に含んでいてもよい。そこで実施形態の1つでは、エチレンジアミン塩タイプIIの製造方法が、混合工程最中及び/又は結晶化工程最中に混合物に種結晶を加える工程を更に含む。種結晶を使用する場合、種結晶はエチレンジアミン塩タイプIIである。
結晶化及び任意の冷却工程終了後、エチレンジアミン塩タイプIIを液相から分離する。分離方法は限定されないが、濾過やデカンテーションが挙げられる。エチレンジアミン塩タイプIIは一旦分離後、極性溶媒で洗浄し乾燥させるとよい。
特性表示: 前述のとおり、本発明のエチレンジアミン塩タイプIIは、表1及び図1に示すような粉末X線回折パターン(XRPD)により特徴づけられる。
*測定した2θ値には、±0.1°の不確実性がある。
**d値は原子格子の面間隔であり、測定した2θの値からブラッグの法則:nλ= 2d・sin(θ)(式中、nは整数、λは放射線の波長である(ここでは1.54059Å))を用いて計算する。
前記のとおり、WO2008/156781号には式(I)で表わされる化合物のエチレンジアミン塩のエタノレートの形態が記載されており、本願明細書ではエチレンジアミン塩タイプIと呼ばれている。WO2008/156781号には式(I)のエチレンジアミン塩のエタノール溶媒和物の熱重量分析が記載されているが、約30〜約75℃での僅かな質量損失と、エタノールの消失による125〜150℃での大きな質量損失とを示す。エチレンジアミン塩タイプIの粉末X線回折パターンは表2及び図2に報告されている。
**d値は原子格子の面間隔であり、測定した2θの値からブラッグの法則:nλ= 2d・sin(θ)(式中、nは整数、λは放射線の波長である(ここでは1.54059Å))を用いて計算する。
前記のとおり、WO2008/156781号には式(I)で表わされる化合物のエチレンジアミン塩のエタノレートの形態が記載されており、本願明細書ではエチレンジアミン塩タイプIと呼ばれている。WO2008/156781号には式(I)のエチレンジアミン塩のエタノール溶媒和物の熱重量分析が記載されているが、約30〜約75℃での僅かな質量損失と、エタノールの消失による125〜150℃での大きな質量損失とを示す。エチレンジアミン塩タイプIの粉末X線回折パターンは表2及び図2に報告されている。
*測定した2θ値には、±0.1°の不確実性がある。
**d値は原子格子の面間隔であり、測定した2θの値からブラッグの法則:nλ= 2d・sin(θ)(式中、nは整数、λは放射線の波長である(ここでは1.54059Å))を用いて計算する。
エチレンジアミン塩タイプIIが示すXRPDの反射パターン(表1及び図1)は、エチレンジアミン塩タイプIが示すもの(表2及び図2)とは異なる。結果、エチレンジアミン塩タイプIIは、本願明細書及びWO2008/156781号に記載のエチレンジアミン塩タイプIとは異なる多形体であることがわかる。
本出願人は、以下に記載のとおり、本発明のエチレンジアミン塩タイプIIがエチレンジアミン塩タイプIに比べ熱安定性が高く吸湿性が低いことを発見した。
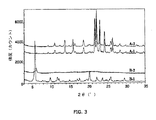
熱処理による結晶度への影響:本出願人は、エチレンジアミン塩タイプI及びタイプIIを加温(80℃)した試料のXRPD分析を行った。結果を図3に示す。図3では、XRPD反射測定に先立ち約25℃で大気圧に保ったエチレンジアミン塩タイプIIの試料から、トップパターンA-1が得られた。XRPD反射測定に先立って減圧下80℃で15時間加熱したエチレンジアミン塩タイプIIの試料から、パターンA-2が得られた。図3に示すように、80℃の熱処理の結果として、エチレンジアミン塩タイプIIの結晶度には明確な変化はなかった。そこで、エチレンジアミン塩タイプIIは、少なくとも約80℃では結晶度を保持していることがわかる。
**d値は原子格子の面間隔であり、測定した2θの値からブラッグの法則:nλ= 2d・sin(θ)(式中、nは整数、λは放射線の波長である(ここでは1.54059Å))を用いて計算する。
エチレンジアミン塩タイプIIが示すXRPDの反射パターン(表1及び図1)は、エチレンジアミン塩タイプIが示すもの(表2及び図2)とは異なる。結果、エチレンジアミン塩タイプIIは、本願明細書及びWO2008/156781号に記載のエチレンジアミン塩タイプIとは異なる多形体であることがわかる。
本出願人は、以下に記載のとおり、本発明のエチレンジアミン塩タイプIIがエチレンジアミン塩タイプIに比べ熱安定性が高く吸湿性が低いことを発見した。
熱処理による結晶度への影響:本出願人は、エチレンジアミン塩タイプI及びタイプIIを加温(80℃)した試料のXRPD分析を行った。結果を図3に示す。図3では、XRPD反射測定に先立ち約25℃で大気圧に保ったエチレンジアミン塩タイプIIの試料から、トップパターンA-1が得られた。XRPD反射測定に先立って減圧下80℃で15時間加熱したエチレンジアミン塩タイプIIの試料から、パターンA-2が得られた。図3に示すように、80℃の熱処理の結果として、エチレンジアミン塩タイプIIの結晶度には明確な変化はなかった。そこで、エチレンジアミン塩タイプIIは、少なくとも約80℃では結晶度を保持していることがわかる。
XRPD反射測定に先立ち約25℃で大気圧に保ったエチレンジアミン塩タイプIの試料では、ボトムパターンB-1が得られた。XRPD反射測定に先立って減圧下80℃で15時間加熱したエチレンジアミン塩タイプIの試料から、パターンB-2が得られた。図3に示すように、この塩の結晶度には著しい変化があった。この結果から、エチレンジアミン塩タイプIは、加熱(例えば80℃)で結晶度が失われることがわかる。
XRPDの試験結果から、エチレンジアミン塩タイプIIは、エチレンジアミン塩タイプIに比べて熱安定性があることがわかる。
加温による質量損失:示差走査熱量測定(DSC)、熱重量分析(TGA)、動的蒸気吸着(DVS)の試験により、エチレンジアミン塩タイプIとタイプIIとの熱特性の違いも観察された。表3は、エチレンジアミン塩多形体タイプI及びタイプIIそれぞれの特徴的な熱的事象 (DSC及びTGA)を示す。
XRPDの試験結果から、エチレンジアミン塩タイプIIは、エチレンジアミン塩タイプIに比べて熱安定性があることがわかる。
加温による質量損失:示差走査熱量測定(DSC)、熱重量分析(TGA)、動的蒸気吸着(DVS)の試験により、エチレンジアミン塩タイプIとタイプIIとの熱特性の違いも観察された。表3は、エチレンジアミン塩多形体タイプI及びタイプIIそれぞれの特徴的な熱的事象 (DSC及びTGA)を示す。
エチレンジアミン塩タイプII のDSC及びTGAサーモグラム(図4)から、100℃に至るまでは残留溶媒の消失が最小であることがわかる(約0.16%であるが、これは更に徹底的な乾燥により調整可能である)。DSCサーモグラムには2つの吸熱事象が示されている。第1の吸熱ピークは約192℃で現れ、相当する温度範囲(140〜210℃)においてTGAは総質量損失の約5.6%の質量損失が見られる。この質量損失は、式(I)で表わされる化合物のエチレンジアミン塩からのエチレンジアミンの理論的な質量損失(5.99質量%)におおよそ相当する(エチレンジアミン塩には0.50当量モルのエチレンジアミンが含まれる)。この結果は、第1の吸熱事象がエチレンジアミンの解離/消失に関連していることを示唆する。次の吸熱ピークは232℃に現れるが、これは式(I)の化合物の遊離酸の融点と同じである。
エチレンジアミン塩タイプIのDSC及びTGAサーモグラム(図5)は、不安定な熱挙動を示す。20〜70℃で約3.8%の質量損失があるが、これは水の消失に対応する。118〜134℃の一番大きな吸熱は、エチレンジアミン塩が蒸発しながら溶融していることに対応するもので、エタノール及び幾分かのエチレンジアミン(約4.4%)の消失に対応する。約147〜160℃でエチレンジアミンが更に消失する。165℃を超えると、式(I)の化合物の遊離酸の溶融及び分解が起きる。
エチレンジアミン塩タイプIのDSC及びTGAサーモグラム(図5)は、不安定な熱挙動を示す。20〜70℃で約3.8%の質量損失があるが、これは水の消失に対応する。118〜134℃の一番大きな吸熱は、エチレンジアミン塩が蒸発しながら溶融していることに対応するもので、エタノール及び幾分かのエチレンジアミン(約4.4%)の消失に対応する。約147〜160℃でエチレンジアミンが更に消失する。165℃を超えると、式(I)の化合物の遊離酸の溶融及び分解が起きる。
水分の吸着/脱着のグラフ:エチレンジアミン塩タイプIIの水分の吸着/脱着のグラフを図6に示す。エチレンジアミン塩タイプIIは、温度25℃で相対湿度が85%に至るまでに約0.08%の水分吸着を示し、この分析で用いた条件においては非吸湿性であることがわかる。エチレンジアミン塩タイプIについて、同様な水分吸着/脱着の試験を行った(図7)。タイプIの塩の場合、著しい水分吸着が観察された。即ち、相対湿度70%で〜6%の水分吸着、相対湿度85%で〜7%の水分吸着である。水分吸着はエチレンジアミン塩タイプIの形態の変化を起こしたが、これはXRPD分析を用いて観察されている。
これらの試験結果から、エチレンジアミン塩タイプIIがエチレンジアミン塩タイプIに比べて水和しにくいことが分かる。
これらの試験結果から、エチレンジアミン塩タイプIIがエチレンジアミン塩タイプIに比べて水和しにくいことが分かる。
医薬組成物
本発明の医薬組成物は、吸入、経口、静脈内、局所、皮下、筋肉内、腹腔内、鼻内、経皮、直腸投与に適した形態に調製することができる。
A)経口製剤
本発明の実施形態の1つは、エチレンジアミン塩タイプIIと1種以上の医薬的に許容できる担体又は賦形剤とを含む、経口投与に適した本発明の医薬組成物に関する。
本発明の別の実施形態は、エチレンジアミン塩タイプIIから本質的になる経口投与に適した医薬組成物に関する。
経口製剤の非制限的例として、錠剤、被覆錠剤、丸剤、顆粒剤もしくは粉末剤、シロップ剤、エマルジョン、懸濁液又は溶液が挙げられるが、不活性で毒性のない医薬的に許容できる賦形剤又は溶媒を共に含んでもよい。
本発明の医薬組成物は、吸入、経口、静脈内、局所、皮下、筋肉内、腹腔内、鼻内、経皮、直腸投与に適した形態に調製することができる。
A)経口製剤
本発明の実施形態の1つは、エチレンジアミン塩タイプIIと1種以上の医薬的に許容できる担体又は賦形剤とを含む、経口投与に適した本発明の医薬組成物に関する。
本発明の別の実施形態は、エチレンジアミン塩タイプIIから本質的になる経口投与に適した医薬組成物に関する。
経口製剤の非制限的例として、錠剤、被覆錠剤、丸剤、顆粒剤もしくは粉末剤、シロップ剤、エマルジョン、懸濁液又は溶液が挙げられるが、不活性で毒性のない医薬的に許容できる賦形剤又は溶媒を共に含んでもよい。
好適な錠剤は、例えば、有効成分を公知の賦形剤と一緒に混合して得られるが、賦形剤としては、例えば炭酸カルシウム、リン酸カルシウム又はラクトースなどの不活性希釈剤、コーンスターチ又はアルギン酸などの崩壊剤、デンプン又はゼラチンなどのバインダー、ステアリン酸マグネシウム又はタルクなどの潤滑剤及び/又はカルボキシメチルセルロース、酢酸フタル酸セルロース又はポリ酢酸ビニルなどの放出遅延物質が挙げられる。また、錠剤はいくつかの層を有していてもよい。
被覆錠剤は、前記錠剤と同様にして作製されたコアを錠剤被覆剤用に通常使用される物質で被覆することによって調製でき、被覆剤としては例えばコリドン(collidone)又はセラック、アラビアゴム、タルク、二酸化チタン又は糖が挙げられる。放出を遅らせるため、または、不相溶にならないようにするために、コアは多数の層からなるものでもよい。同様に、放出を遅らせるために錠剤被覆も、錠剤用として記載した賦形剤を用いるなどして多数の層を有していてもよい。
本発明による有効成分又はその組み合わせを含有するシロップ剤は、さらに、サッカリン、シクラマート、グリセリン又は糖などの甘味剤、及び、例えばバニラ又はオレンジ抽出物などの香味料をはじめとする香味相乗剤を含んでもよい。また、カルボキシメチルセルロースナトリウムのような懸濁助剤又は増粘剤、例えば脂肪酸アルコールとエチレンオキシドとの縮合物などの湿潤剤、又はp−ヒドロキシ安息香酸エステルなどの防腐剤を含んでもよい。
1種以上の有効成分又はその組み合わせを含有するカプセル剤は、例えば、有効成分をラクトース又はソルビトールなどの不活性担体と混合して、ゼラチンカプセルに充填することによって調製することができる。
被覆錠剤は、前記錠剤と同様にして作製されたコアを錠剤被覆剤用に通常使用される物質で被覆することによって調製でき、被覆剤としては例えばコリドン(collidone)又はセラック、アラビアゴム、タルク、二酸化チタン又は糖が挙げられる。放出を遅らせるため、または、不相溶にならないようにするために、コアは多数の層からなるものでもよい。同様に、放出を遅らせるために錠剤被覆も、錠剤用として記載した賦形剤を用いるなどして多数の層を有していてもよい。
本発明による有効成分又はその組み合わせを含有するシロップ剤は、さらに、サッカリン、シクラマート、グリセリン又は糖などの甘味剤、及び、例えばバニラ又はオレンジ抽出物などの香味料をはじめとする香味相乗剤を含んでもよい。また、カルボキシメチルセルロースナトリウムのような懸濁助剤又は増粘剤、例えば脂肪酸アルコールとエチレンオキシドとの縮合物などの湿潤剤、又はp−ヒドロキシ安息香酸エステルなどの防腐剤を含んでもよい。
1種以上の有効成分又はその組み合わせを含有するカプセル剤は、例えば、有効成分をラクトース又はソルビトールなどの不活性担体と混合して、ゼラチンカプセルに充填することによって調製することができる。
使用できる担体又は賦形剤としては、例えば、水;パラフィン類(例:石油留分)、植物油(例:ラッカセイ油又はゴマ油)、一官能性もしくは多官能性アルコール(例:エタノール又はグリセロール)などの製薬学的に許容できる有機溶剤;天然鉱物粉末(例:カオリン、クレー、タルク、チョーク)、合成鉱物粉末(例:高分散性ケイ酸及びケイ酸塩)、糖類(例:蔗糖、ラクトース及びグルコース)、乳化剤(例:リグニン、亜硫酸パルプ廃液、メチルセルロース、デンプン及びポリビニルピロリドン)ならびに潤滑剤(例:ステアリン酸マグネシウム、タルク、ステアリン酸及びラウリル硫酸ナトリウム)などの担体が含まれる。
錠剤には、クエン酸ナトリウム、炭酸カルシウム及びリン酸二カルシウムなどの添加剤を、デンプン、好ましくはジャガイモデンプンやゼラチンなどの様々な添加物質と一緒に更に含有してもよい。また、ステアリン酸マグネシウム、ラウリル硫酸ナトリウム及びタルクなどの潤滑剤も錠剤形成工程時に使用してもよい。
水性懸濁液は、前記賦形剤に加えて様々な香味相乗剤又は着色剤と混合することができる。
エチレンジアミン塩タイプIIを含む各経口製剤には、後述の更なる活性化合物1種以上を任意で含んでいてもよいことは理解できよう。
錠剤には、クエン酸ナトリウム、炭酸カルシウム及びリン酸二カルシウムなどの添加剤を、デンプン、好ましくはジャガイモデンプンやゼラチンなどの様々な添加物質と一緒に更に含有してもよい。また、ステアリン酸マグネシウム、ラウリル硫酸ナトリウム及びタルクなどの潤滑剤も錠剤形成工程時に使用してもよい。
水性懸濁液は、前記賦形剤に加えて様々な香味相乗剤又は着色剤と混合することができる。
エチレンジアミン塩タイプIIを含む各経口製剤には、後述の更なる活性化合物1種以上を任意で含んでいてもよいことは理解できよう。
B)吸入製剤
本発明の実施形態の1つは、エチレンジアミン塩タイプIIと1種以上の医薬的に許容できる担体又は賦形剤とを含む、吸入に適した医薬組成物に関する。
本発明の別の実施形態は、エチレンジアミン塩タイプIIと少なくとも1種の製薬用担体又は賦形剤とから実質的になる、吸入に適した医薬組成物に関する。
吸入に適した調剤の非制限的例としては、吸入可能粉末、噴射剤含有定量エアロゾル、及び噴射剤を含有しない吸入可能な溶液が挙げられる。吸入製剤は、下記に記載のような不活性で毒性のない医薬的に許容できる賦形剤又は溶媒を任意で含んでもよい。
B.1)粉末製剤
本発明の医薬組成物は、1つの実施形態として吸入粉末の形態であってもよく、医薬的に許容できる賦形剤を任意で含んでいてもよい。
粉末製剤に有用な医薬的に許容できる賦形剤の非制限的例として、単糖類(例えば、グルコース又はアラビノース)、二糖類(例えば、ラクトース、サッカロース、マルトース、トレハロース)、オリゴ糖類及び多糖類(例えば、デキストラン)、多価アルコール類(例えば、ソルビトール、マンニトール、キシリトール)、シクロデキストリン類(例えば、α−シクロデキストリン、β−シクロデキストリン、χ−シクロデキストリン、メチル−β−シクロデキストリン、ヒドロキシプロピル−β−シクロデキストリン)、塩類(例えば、塩化ナトリウム、炭酸カルシウム)、あるいはこれら賦形剤相互の混合物が挙げられる。好ましくは、単糖類又は二糖類が使用され、なかでもラクトース、トレハロース又はグルコースの使用が好ましく、限定はされないが、その水和物の形が特に好ましい。
本発明の実施形態の1つは、エチレンジアミン塩タイプIIと1種以上の医薬的に許容できる担体又は賦形剤とを含む、吸入に適した医薬組成物に関する。
本発明の別の実施形態は、エチレンジアミン塩タイプIIと少なくとも1種の製薬用担体又は賦形剤とから実質的になる、吸入に適した医薬組成物に関する。
吸入に適した調剤の非制限的例としては、吸入可能粉末、噴射剤含有定量エアロゾル、及び噴射剤を含有しない吸入可能な溶液が挙げられる。吸入製剤は、下記に記載のような不活性で毒性のない医薬的に許容できる賦形剤又は溶媒を任意で含んでもよい。
B.1)粉末製剤
本発明の医薬組成物は、1つの実施形態として吸入粉末の形態であってもよく、医薬的に許容できる賦形剤を任意で含んでいてもよい。
粉末製剤に有用な医薬的に許容できる賦形剤の非制限的例として、単糖類(例えば、グルコース又はアラビノース)、二糖類(例えば、ラクトース、サッカロース、マルトース、トレハロース)、オリゴ糖類及び多糖類(例えば、デキストラン)、多価アルコール類(例えば、ソルビトール、マンニトール、キシリトール)、シクロデキストリン類(例えば、α−シクロデキストリン、β−シクロデキストリン、χ−シクロデキストリン、メチル−β−シクロデキストリン、ヒドロキシプロピル−β−シクロデキストリン)、塩類(例えば、塩化ナトリウム、炭酸カルシウム)、あるいはこれら賦形剤相互の混合物が挙げられる。好ましくは、単糖類又は二糖類が使用され、なかでもラクトース、トレハロース又はグルコースの使用が好ましく、限定はされないが、その水和物の形が特に好ましい。
本発明による吸入粉末の範囲において、実施形態の1つとして、賦形剤の最大平均粒径は約250μmまで、別の実施形態では約10〜約250μm、別の実施形態では約10〜約150μm、別の実施形態では約15〜約80μmである。
吸入粉末は、平均粒径1〜9μmのより微細な賦形剤画分を上記賦形剤に加えて更に含んでもよい。より微細な賦形剤も、前記に列挙した使用可能な賦形剤の群から選択される。本発明の吸入粉末を調製するために、好ましくは平均粒径0.5〜10μm、さらに好ましくは1〜6μmの微粉化したエチレンジアミン塩タイプII(及び、使用する場合は1種以上の更なる活性化合物)を、賦形剤混合物に添加する。粉砕、微粉化し、最終的に各成分を混合することによる本発明の吸入粉末の製造方法は従来技術より公知である。
本発明の実施形態の1つは、エチレンジアミン塩タイプIIのみを有効成分として含有する吸入粉末の剤形の医薬組成物に関する。
本発明の吸入粉末は、従来技術から公知の吸入器を用いて投与することができる。医薬的に許容できる1種以上の賦形剤を含む本発明の吸入粉末は、例えば、US4570630Aに記載されているような計量チャンバーを用いた供給源から一回分の投与量を放出する吸入器によって、あるいは、DE3625685Aに記載されているような他の手段によって投与することができる。エチレンジアミン塩タイプIIと、医薬的に許容できる賦形剤を任意で一緒に含有してもよい本発明の吸入粉末は、例えば「タービュヘイラー(Turbuhaler)(登録商標)」という商品名で公知の吸入器を用いて、あるいは、例えばEP237507Aに開示されているような吸入器を用いて投与することができる。好ましくは、医薬的に許容できる賦形剤を含む本発明の吸入粉末は、例えばWO94/28958に記載の吸入器で使用するカプセル内に充填(所謂インハレット(inhalettes)を形成)する。本発明の吸入粉末を使用するのに特に好ましい吸入器は、「ハンディーヘイラー(Handyhaler)(登録商標)」という商品名で公知の吸入器である。
上記の好ましい使用のためのカプセル(吸入器)に本発明の吸入粉末を充填する場合、各カプセルに充填する量は1〜30mg/カプセルであるとよい。
吸入粉末は、平均粒径1〜9μmのより微細な賦形剤画分を上記賦形剤に加えて更に含んでもよい。より微細な賦形剤も、前記に列挙した使用可能な賦形剤の群から選択される。本発明の吸入粉末を調製するために、好ましくは平均粒径0.5〜10μm、さらに好ましくは1〜6μmの微粉化したエチレンジアミン塩タイプII(及び、使用する場合は1種以上の更なる活性化合物)を、賦形剤混合物に添加する。粉砕、微粉化し、最終的に各成分を混合することによる本発明の吸入粉末の製造方法は従来技術より公知である。
本発明の実施形態の1つは、エチレンジアミン塩タイプIIのみを有効成分として含有する吸入粉末の剤形の医薬組成物に関する。
本発明の吸入粉末は、従来技術から公知の吸入器を用いて投与することができる。医薬的に許容できる1種以上の賦形剤を含む本発明の吸入粉末は、例えば、US4570630Aに記載されているような計量チャンバーを用いた供給源から一回分の投与量を放出する吸入器によって、あるいは、DE3625685Aに記載されているような他の手段によって投与することができる。エチレンジアミン塩タイプIIと、医薬的に許容できる賦形剤を任意で一緒に含有してもよい本発明の吸入粉末は、例えば「タービュヘイラー(Turbuhaler)(登録商標)」という商品名で公知の吸入器を用いて、あるいは、例えばEP237507Aに開示されているような吸入器を用いて投与することができる。好ましくは、医薬的に許容できる賦形剤を含む本発明の吸入粉末は、例えばWO94/28958に記載の吸入器で使用するカプセル内に充填(所謂インハレット(inhalettes)を形成)する。本発明の吸入粉末を使用するのに特に好ましい吸入器は、「ハンディーヘイラー(Handyhaler)(登録商標)」という商品名で公知の吸入器である。
上記の好ましい使用のためのカプセル(吸入器)に本発明の吸入粉末を充填する場合、各カプセルに充填する量は1〜30mg/カプセルであるとよい。
B.2)噴射剤ガス含有吸入エアロゾル
本発明の別の実施形態は、噴射剤ガス含有吸入エアロゾルの形態の医薬組成物に関する。このような製剤は、エチレンアミン塩タイプIIと、さらに任意であるが1種以上の更なる有効成分とを溶解及び/又は分散状態で含む。
噴射剤含有吸入エアロゾルに有用な噴射剤ガスの非制限的例として、n−プロパン、n−ブタン又はイソブタン等の炭化水素化合物、或いは、メタン、エタン、プロパン、ブタン、シクロプロパン又はシクロブタンの塩素化及び/又はフッ素化誘導体等のハロ炭化水素化合物が挙げられる。
別の実施形態では、噴射剤ガス含有吸入エアロゾルに使用される噴射剤ガスが、TG11(トリクロロフルオロメタン)、TG12(ジクロロジフルオロメタン)、TG134a(1,1,1,2-テトラフルオロエタン)、TG227(1,1,1,2,3,3,3-ヘプタフルオロプロパン)及びこれらの混合物である。別の実施形態では、噴射剤ガスがTG134a、TG227又はこれらの混合物である。
また、本発明の噴射剤ガス含有吸入エアロゾルには、補助溶剤、安定剤、界面活性剤、酸化防止剤、滑剤及びpH調節剤等の他の成分も含ませることができる。これらの成分はすべて、当分野において公知である。
本発明による噴射剤ガス含有吸入エアロゾルには、エチレンジアミン塩タイプIIを5質量%までと、更なる活性化合物1種以上を任意で含有させるとよい。例えば、本発明のエアロゾルは、エチレンジアミン塩タイプIIを0.002〜5質量%、0.01〜3質量%、0.015〜2質量%、0.1〜2質量%、0.5〜2質量%又は0.5〜1質量%と、任意の更なる活性化合物とを含む。
エチレンジアミン塩タイプIIと任意の更なる活性化合物が分散状態で存在する場合、該有効成分粒子の平均粒子径は、実施形態の1つでは10μmまで、別の実施形態では約0.1〜約6μm、更に別の実施形態では約1〜約5μmである。
本発明の別の実施形態は、噴射剤ガス含有吸入エアロゾルの形態の医薬組成物に関する。このような製剤は、エチレンアミン塩タイプIIと、さらに任意であるが1種以上の更なる有効成分とを溶解及び/又は分散状態で含む。
噴射剤含有吸入エアロゾルに有用な噴射剤ガスの非制限的例として、n−プロパン、n−ブタン又はイソブタン等の炭化水素化合物、或いは、メタン、エタン、プロパン、ブタン、シクロプロパン又はシクロブタンの塩素化及び/又はフッ素化誘導体等のハロ炭化水素化合物が挙げられる。
別の実施形態では、噴射剤ガス含有吸入エアロゾルに使用される噴射剤ガスが、TG11(トリクロロフルオロメタン)、TG12(ジクロロジフルオロメタン)、TG134a(1,1,1,2-テトラフルオロエタン)、TG227(1,1,1,2,3,3,3-ヘプタフルオロプロパン)及びこれらの混合物である。別の実施形態では、噴射剤ガスがTG134a、TG227又はこれらの混合物である。
また、本発明の噴射剤ガス含有吸入エアロゾルには、補助溶剤、安定剤、界面活性剤、酸化防止剤、滑剤及びpH調節剤等の他の成分も含ませることができる。これらの成分はすべて、当分野において公知である。
本発明による噴射剤ガス含有吸入エアロゾルには、エチレンジアミン塩タイプIIを5質量%までと、更なる活性化合物1種以上を任意で含有させるとよい。例えば、本発明のエアロゾルは、エチレンジアミン塩タイプIIを0.002〜5質量%、0.01〜3質量%、0.015〜2質量%、0.1〜2質量%、0.5〜2質量%又は0.5〜1質量%と、任意の更なる活性化合物とを含む。
エチレンジアミン塩タイプIIと任意の更なる活性化合物が分散状態で存在する場合、該有効成分粒子の平均粒子径は、実施形態の1つでは10μmまで、別の実施形態では約0.1〜約6μm、更に別の実施形態では約1〜約5μmである。
本発明による噴射剤駆動型吸入エアロゾルは、当該分野において公知の吸入器(定量噴霧吸入器(MDI))を用いて投与することができる。したがって、本発明の別の態様としては、噴射剤駆動型エアロゾルを投与するのに適した1種以上の吸入器と組み合わせた、本願明細書で記載したような噴射剤駆動型エアロゾルの形態の医薬組成物に関する。更に、本発明は、本発明による前記噴射剤ガス含有エアロゾルを収容することを特徴とする吸入器に関するものである。また、本発明は、適切なバルブが設けられ、適当な吸入器内で使用可能であり、かつ、本発明による上記噴射剤ガス含有吸入エアロゾルの1種を収容する、カートリッジに関する。好適なカートリッジ、さらには本発明の噴射剤ガス含有吸入エアロゾルをカートリッジに充填する方法については、従来技術から公知である。
B.3.噴射剤を含有しない吸入可能なエアロゾル
本発明の別の実施形態は、噴射剤を含有しない吸入可能なエアロゾルの状態の医薬組成物である。
本発明の噴射剤を含有しない吸入可能なエアロゾルは、溶液又は懸濁液の状態である。本発明の噴射剤を含有しない吸入用溶液又は懸濁液は、例えば、水性又はアルコール系溶媒、好ましくはエタノール性溶媒を含有するが、エタノール性溶媒と水性溶媒とを混合してもよい。水性/エタノール性溶媒混合物を使用する場合、水に対するエタノールの相対的割合は限定されないが、最大でエタノールが70容量%まで、より好ましくは60容量%までである。残りの容量を水で構成する。エチレンジアミン塩タイプII及び任意の更なる活性化合物を別々又は一緒に含有する溶液又は懸濁液は、適当な酸を用いてpH値を2〜7、好ましくは2〜5に調整する。pH値は無機酸又は有機酸から選択される酸を用いて調整すればよい。特に好適な無機酸の例としては、塩酸、臭化水素酸、硝酸、硫酸及び/又はリン酸が挙げられる。特に好適な有機酸の例としては、アスコルビン酸、クエン酸、リンゴ酸、酒石酸、マレイン酸、コハク酸、フマル酸、酢酸、ギ酸及び/又はプロピオン酸等が挙げられる。好適な無機酸は塩酸及び硫酸である。また、有効成分の1つとともに酸付加塩を既に形成している酸を使用することも可能である。有機酸の中では、アスコルビン酸、フマル酸及びクエン酸が好ましい。所望であれば、上記の酸の混合物を用いることもでき、特に、酸性化特性に加えて、例えば香料、酸化防止剤又は錯化剤としての特性を有する酸、例えばクエン酸又はアスコルビン酸等の場合は、酸を混合して用いるとよい。本発明によると、塩酸を用いてpH値を調整することが特に好ましい。
B.3.噴射剤を含有しない吸入可能なエアロゾル
本発明の別の実施形態は、噴射剤を含有しない吸入可能なエアロゾルの状態の医薬組成物である。
本発明の噴射剤を含有しない吸入可能なエアロゾルは、溶液又は懸濁液の状態である。本発明の噴射剤を含有しない吸入用溶液又は懸濁液は、例えば、水性又はアルコール系溶媒、好ましくはエタノール性溶媒を含有するが、エタノール性溶媒と水性溶媒とを混合してもよい。水性/エタノール性溶媒混合物を使用する場合、水に対するエタノールの相対的割合は限定されないが、最大でエタノールが70容量%まで、より好ましくは60容量%までである。残りの容量を水で構成する。エチレンジアミン塩タイプII及び任意の更なる活性化合物を別々又は一緒に含有する溶液又は懸濁液は、適当な酸を用いてpH値を2〜7、好ましくは2〜5に調整する。pH値は無機酸又は有機酸から選択される酸を用いて調整すればよい。特に好適な無機酸の例としては、塩酸、臭化水素酸、硝酸、硫酸及び/又はリン酸が挙げられる。特に好適な有機酸の例としては、アスコルビン酸、クエン酸、リンゴ酸、酒石酸、マレイン酸、コハク酸、フマル酸、酢酸、ギ酸及び/又はプロピオン酸等が挙げられる。好適な無機酸は塩酸及び硫酸である。また、有効成分の1つとともに酸付加塩を既に形成している酸を使用することも可能である。有機酸の中では、アスコルビン酸、フマル酸及びクエン酸が好ましい。所望であれば、上記の酸の混合物を用いることもでき、特に、酸性化特性に加えて、例えば香料、酸化防止剤又は錯化剤としての特性を有する酸、例えばクエン酸又はアスコルビン酸等の場合は、酸を混合して用いるとよい。本発明によると、塩酸を用いてpH値を調整することが特に好ましい。
本発明では、エデト酸(EDTA)又はその公知の塩の1つであるエデト酸ナトリウムを安定剤又は錯化剤として添加することは、本発明の処方においては不要である。実施形態によっては、この化合物を1種以上含んでもよい。推奨実施形態としては、エデト酸ナトリウムを基準とした含有量は、100mg/100ml未満、好ましくは50mg/100ml未満、さらに好ましくは20mg/100ml未満である。一般に、エデト酸ナトリウムの含有量が0〜10mg/100mlの範囲となる吸入溶液が好ましい。
本発明による噴射剤を含有しない吸入溶液には、補助溶剤及び/又は他の賦形剤を添加することができる。好ましい補助溶剤は、ヒドロキシル基又は他の極性基を含むもので、例えばアルコール類、特にイソプロピルアルコール、グリコール類、特にプロピレングリコール、ポリエチレングリコール、ポリプロピレングリコール、グリコールエーテル、グリセロール、ポリオキシエチレンアルコール類及びポリオキシエチレン脂肪酸エステル類である。本明細書における賦形剤及び添加剤という用語は、それ自体は活性物質ではないが、薬理学的に好適な溶媒中で1種またはそれより多くの活性物質と共に処方することができ、活性物質を含む調剤の定性的特性を改善することができる、薬理学的に許容できる任意の物質を意味する。これらの物質は薬理的作用を持たないことが好ましい。あるいは、所望の療法との関連において容易に認識できるような薬理作用は持たないか、少なくとも望ましくない薬理作用を有していないことが好ましい。賦形剤及び添加剤としては、例えば、大豆レシチン、オレイン酸、ポリソルベート等のソルビタンエステル類、ポリビニルピロリドンなどの界面活性剤、他の安定剤、錯化剤、最終的な医薬調剤の品質保持期間を保証又は延長する酸化防止剤及び/又は防腐剤、香味付与剤、ビタミン類及び/又は当分野において公知の他の添加剤が挙げられる。また、添加剤として、塩化ナトリウム等の薬理学的に許容できる塩も等張剤として挙げられる。
好ましい賦形剤としては、例えばpHの調整に使用されていなければアスコルビン酸、さらにはビタミンA、ビタミンE、トコフェロール類及び人体で産生する類似のビタミン類及びプロビタミン類等の酸化防止剤が挙げられる。
本発明による噴射剤を含有しない吸入溶液には、補助溶剤及び/又は他の賦形剤を添加することができる。好ましい補助溶剤は、ヒドロキシル基又は他の極性基を含むもので、例えばアルコール類、特にイソプロピルアルコール、グリコール類、特にプロピレングリコール、ポリエチレングリコール、ポリプロピレングリコール、グリコールエーテル、グリセロール、ポリオキシエチレンアルコール類及びポリオキシエチレン脂肪酸エステル類である。本明細書における賦形剤及び添加剤という用語は、それ自体は活性物質ではないが、薬理学的に好適な溶媒中で1種またはそれより多くの活性物質と共に処方することができ、活性物質を含む調剤の定性的特性を改善することができる、薬理学的に許容できる任意の物質を意味する。これらの物質は薬理的作用を持たないことが好ましい。あるいは、所望の療法との関連において容易に認識できるような薬理作用は持たないか、少なくとも望ましくない薬理作用を有していないことが好ましい。賦形剤及び添加剤としては、例えば、大豆レシチン、オレイン酸、ポリソルベート等のソルビタンエステル類、ポリビニルピロリドンなどの界面活性剤、他の安定剤、錯化剤、最終的な医薬調剤の品質保持期間を保証又は延長する酸化防止剤及び/又は防腐剤、香味付与剤、ビタミン類及び/又は当分野において公知の他の添加剤が挙げられる。また、添加剤として、塩化ナトリウム等の薬理学的に許容できる塩も等張剤として挙げられる。
好ましい賦形剤としては、例えばpHの調整に使用されていなければアスコルビン酸、さらにはビタミンA、ビタミンE、トコフェロール類及び人体で産生する類似のビタミン類及びプロビタミン類等の酸化防止剤が挙げられる。
防腐剤を使用して病原体による汚染から製剤を保護することができる。適当な防腐剤は当該分野において公知のものであり、特に、従来技術から公知の濃度の塩化セチルピリジニウム、塩化ベンザルコニウム又は安息香酸もしくは安息香酸ナトリウム等の安息香酸塩である。上記防腐剤は、好ましくは50mg/100mlまで、より好ましくは5〜20mg/100mlの範囲の濃度で存在していることが好ましい。
実施形態の1つでは、噴射剤を含まない吸入溶液が、水、エチレンジアミン塩タイプII、及び防腐剤を含有する。別の実施形態では、噴射剤を含まない吸入溶液が、水、エチレンジアミン塩タイプII、及び塩化ベンザルコニウム及びエデト酸ナトリウムから選択される防腐剤を含有する。更に別の実施形態では、噴射剤を含まない吸入溶液が、水、エチレンジアミン塩タイプII、及び塩化ベンザルコニウムを含有する。更に別の実施形態では、噴射剤を含まない吸入溶液が、水、エチレンジアミン塩タイプII、及びエデト酸ナトリウムではない防腐剤を含有する。
本発明の噴射剤を含有しない吸入溶液は、治療投与量の少量の液体調剤を数秒間以内で霧状にして治療用の吸入に適したエアロゾルを生成することができるタイプの吸入器を用いて投与される。本発明の範囲内において、100μL未満、好ましくは50μL未満、より好ましくは20〜30μLの量の有効成分溶液を、好ましくは1回のスプレー操作で霧状にすることができ、その結果、平均粒径が20μm未満、好ましくは10μm未満のエアロゾルを生成させ、エアロゾルの吸入可能な量が治療上の有効量に相当するように生成させることのできる吸入器が好ましい吸入器である。
吸入用液状医薬組成物の定量を噴射剤無しで放出するタイプの装置については、例えば国際特許出願WO91/14468号及び同WO97/12687号(特に図6a及び図6b参照)に記載されている。これらに記載されているネブライザー(装置)は、「Respimat(登録商標)」という商品名で知られている。
実施形態の1つでは、噴射剤を含まない吸入溶液が、水、エチレンジアミン塩タイプII、及び防腐剤を含有する。別の実施形態では、噴射剤を含まない吸入溶液が、水、エチレンジアミン塩タイプII、及び塩化ベンザルコニウム及びエデト酸ナトリウムから選択される防腐剤を含有する。更に別の実施形態では、噴射剤を含まない吸入溶液が、水、エチレンジアミン塩タイプII、及び塩化ベンザルコニウムを含有する。更に別の実施形態では、噴射剤を含まない吸入溶液が、水、エチレンジアミン塩タイプII、及びエデト酸ナトリウムではない防腐剤を含有する。
本発明の噴射剤を含有しない吸入溶液は、治療投与量の少量の液体調剤を数秒間以内で霧状にして治療用の吸入に適したエアロゾルを生成することができるタイプの吸入器を用いて投与される。本発明の範囲内において、100μL未満、好ましくは50μL未満、より好ましくは20〜30μLの量の有効成分溶液を、好ましくは1回のスプレー操作で霧状にすることができ、その結果、平均粒径が20μm未満、好ましくは10μm未満のエアロゾルを生成させ、エアロゾルの吸入可能な量が治療上の有効量に相当するように生成させることのできる吸入器が好ましい吸入器である。
吸入用液状医薬組成物の定量を噴射剤無しで放出するタイプの装置については、例えば国際特許出願WO91/14468号及び同WO97/12687号(特に図6a及び図6b参照)に記載されている。これらに記載されているネブライザー(装置)は、「Respimat(登録商標)」という商品名で知られている。
本発明の実施形態の1つは、他の補助溶剤及び/又は賦形剤を含んでいてもよい吸入溶液の状態の医薬組成物に関する。
本発明の別の実施形態は、ヒドロキシル基又は他の極性基を含む、少なくとも1種の補助溶剤、例えばアルコール類、特にイソプロピルアルコール、グリコール類、特にプロピレングリコール、ポリエチレングリコール、ポリプロピレングリコール、グリコールエーテル、グリセロール、ポリオキシエチレンアルコール類及びポリオキシエチレン脂肪酸エステル類を含有する、吸入溶液状態の医薬組成物に関する。
本発明の更に別の実施形態は、界面活性剤、安定剤、錯化剤、酸化防止剤及び/又は防腐剤、香味付与剤、薬理学的に許容できる塩及び/又はビタミン類から選択される賦形剤を含む、吸入溶液状態の医薬組成物に関する。
噴射剤を含有しない吸入エアロゾルが更なる活性化合物を含有する場合、本発明による組成物に適用する投与量とは、1回の投与ごとの投与量を指すものと理解されるべきである。しかしながら、本発明による組成物を多数回投与する可能性を除外するのではない。医療上必要があれば、患者は多数回の吸入投与を受けることもできる。例えば、本発明の組成物を治療日の朝2回又は3回(例えば粉末用吸入器、MDI等で2回又は3回の噴射)で投与してもよい。前記の投与量の例は1回の投与(即ち、1回の噴射)あたりの投与量の例としてのみ理解すべきなので、本発明の組成物の複数回投与は、前記例の倍数の投与量となる。本発明の組成物の投与は、例えば1日1回、又は、薬剤の活性持続時間に応じて1日2回又は2日もしくは3日に1回とすればよい。
前記の投与量は、計量した投与量の例としてのみ理解すべきである。即ち、前記投与量は、実際に肺に到達する本発明の組成物の有効量として理解すべきではない。肺に伝達される量が、有効成分の計量した投与量よりも通常少ないことは、この分野の当業者にとっては明らかである。
本発明の別の実施形態は、ヒドロキシル基又は他の極性基を含む、少なくとも1種の補助溶剤、例えばアルコール類、特にイソプロピルアルコール、グリコール類、特にプロピレングリコール、ポリエチレングリコール、ポリプロピレングリコール、グリコールエーテル、グリセロール、ポリオキシエチレンアルコール類及びポリオキシエチレン脂肪酸エステル類を含有する、吸入溶液状態の医薬組成物に関する。
本発明の更に別の実施形態は、界面活性剤、安定剤、錯化剤、酸化防止剤及び/又は防腐剤、香味付与剤、薬理学的に許容できる塩及び/又はビタミン類から選択される賦形剤を含む、吸入溶液状態の医薬組成物に関する。
噴射剤を含有しない吸入エアロゾルが更なる活性化合物を含有する場合、本発明による組成物に適用する投与量とは、1回の投与ごとの投与量を指すものと理解されるべきである。しかしながら、本発明による組成物を多数回投与する可能性を除外するのではない。医療上必要があれば、患者は多数回の吸入投与を受けることもできる。例えば、本発明の組成物を治療日の朝2回又は3回(例えば粉末用吸入器、MDI等で2回又は3回の噴射)で投与してもよい。前記の投与量の例は1回の投与(即ち、1回の噴射)あたりの投与量の例としてのみ理解すべきなので、本発明の組成物の複数回投与は、前記例の倍数の投与量となる。本発明の組成物の投与は、例えば1日1回、又は、薬剤の活性持続時間に応じて1日2回又は2日もしくは3日に1回とすればよい。
前記の投与量は、計量した投与量の例としてのみ理解すべきである。即ち、前記投与量は、実際に肺に到達する本発明の組成物の有効量として理解すべきではない。肺に伝達される量が、有効成分の計量した投与量よりも通常少ないことは、この分野の当業者にとっては明らかである。
単位剤形及び投与方法
前記のとおり、本発明の医薬組成物は、吸入、経口、静脈内、局所、皮下、筋肉内、腹腔内、鼻内、経皮、直腸投与に適した調剤の形態で投与することができる。本発明の医薬組成物は単位剤形として患者に投与する。
本願明細書で使用のごとく、「単位剤形」という語句は、本発明の医薬組成物が患者に投与される際の実際の製品を指す。単位剤形の非制限的例として、錠剤、薬用ドロップ、カプセル剤、吸入粉末カプセル、単位投与量のバイアル、定量噴霧吸入器(MDI)による定量投与、注射バイアル及び当業者に公知の他の剤形が挙げられる。
本発明の態様の1つは、本発明の医薬組成物を必要とする患者へ経口投与する方法に関する。経口投与は、患者にとっての1日の投与量を確保できるよう1日に1回以上行うことができる。別の実施形態では、エチレンジアミン塩タイプIIを1日2回経口投与する。別の実施形態では、エチレンジアミン塩タイプIIを1日1回経口投与する。
本発明の別の態様は、当該医薬組成物を必要とする患者へ投与するための吸入方法に関する。更に別の実施形態では、吸入方法が、吸入可能粉末、噴射剤含有定量エアロゾル及び噴射剤を含有しない吸入可能な溶液から選択される医薬組成物を包含する。別の実施形態では、吸入方法が吸入粉末を包含する。別の実施形態では、吸入方法が噴射剤含有定量エアロゾルを包含する。別の実施形態では、吸入方法が噴射剤を含有しない吸入溶液を包含する。
本発明の別な態様は、該医薬組成物を必要とする患者へ投与するための、坐剤の使用に関する。好適な坐剤は、例えば、坐剤用の担体で例えば中性脂肪又はポリエチレングリコールもしくはその誘導体等と混合することにより作製できる。
本発明の医薬組成物は、1回投与の単位剤形で、又は2回以上のサブ投与(sub-administration)の単位剤形を介して患者に投与することができる。実施形態の1つでは、本願明細書前記の1日の投与量を1日3回(t-d)投与のやり方で患者に投与し、別の実施形態では、本願明細書前記の1日の投与量を1日3回(t-d)投与のやり方で患者に投与し、別の実施形態では、本願明細書前記の1日の投与量を1日2回(b-i-d)投与のやり方で患者に投与し、別の実施形態では、本願明細書前記の1日の投与量を1日1回(q-d)投与のやり方で患者に投与する。
前記のとおり、本発明の医薬組成物は、吸入、経口、静脈内、局所、皮下、筋肉内、腹腔内、鼻内、経皮、直腸投与に適した調剤の形態で投与することができる。本発明の医薬組成物は単位剤形として患者に投与する。
本願明細書で使用のごとく、「単位剤形」という語句は、本発明の医薬組成物が患者に投与される際の実際の製品を指す。単位剤形の非制限的例として、錠剤、薬用ドロップ、カプセル剤、吸入粉末カプセル、単位投与量のバイアル、定量噴霧吸入器(MDI)による定量投与、注射バイアル及び当業者に公知の他の剤形が挙げられる。
本発明の態様の1つは、本発明の医薬組成物を必要とする患者へ経口投与する方法に関する。経口投与は、患者にとっての1日の投与量を確保できるよう1日に1回以上行うことができる。別の実施形態では、エチレンジアミン塩タイプIIを1日2回経口投与する。別の実施形態では、エチレンジアミン塩タイプIIを1日1回経口投与する。
本発明の別の態様は、当該医薬組成物を必要とする患者へ投与するための吸入方法に関する。更に別の実施形態では、吸入方法が、吸入可能粉末、噴射剤含有定量エアロゾル及び噴射剤を含有しない吸入可能な溶液から選択される医薬組成物を包含する。別の実施形態では、吸入方法が吸入粉末を包含する。別の実施形態では、吸入方法が噴射剤含有定量エアロゾルを包含する。別の実施形態では、吸入方法が噴射剤を含有しない吸入溶液を包含する。
本発明の別な態様は、該医薬組成物を必要とする患者へ投与するための、坐剤の使用に関する。好適な坐剤は、例えば、坐剤用の担体で例えば中性脂肪又はポリエチレングリコールもしくはその誘導体等と混合することにより作製できる。
本発明の医薬組成物は、1回投与の単位剤形で、又は2回以上のサブ投与(sub-administration)の単位剤形を介して患者に投与することができる。実施形態の1つでは、本願明細書前記の1日の投与量を1日3回(t-d)投与のやり方で患者に投与し、別の実施形態では、本願明細書前記の1日の投与量を1日3回(t-d)投与のやり方で患者に投与し、別の実施形態では、本願明細書前記の1日の投与量を1日2回(b-i-d)投与のやり方で患者に投与し、別の実施形態では、本願明細書前記の1日の投与量を1日1回(q-d)投与のやり方で患者に投与する。
実施形態の1つでは、単位剤形にエチレンジアミン塩タイプIIが約1mg〜約1000mg含まれ、他の実施形態では約5mg〜約800mg含まれ、他の実施形態では約10mg〜約700mg、また別の実施形態では約15mg〜約600mg、別の実施形態では約20mg〜約500mg、別の実施形態では約25mg〜約400mg含まれる。
医学的な適応症
エチレンジアミン塩タイプIIは優れたCRTH2拮抗作用を示す。そのため、CRTH2の作用に関連した疾病の予防と治療に適している。本願明細書に記載の医薬組成物が、気管支痙攣(bronchospasmolysis)及び気道の炎症緩和、口〜上咽頭、皮膚又は目のアレルギー性疾患、関節の炎症性疾患、炎症性の腸疾患に有用な効果があることがわかった。
本発明の実施形態の1つは、以下から選択される適応症(A)の治療に関する。
粘液の産生の増加又は変化を伴う気道や肺の疾患、及び/又は、気道の炎症性及び/又は閉塞性疾患、例えば、急性気管支炎、慢性気管支炎、慢性閉塞性気管支炎(COPD)、咳、肺気腫;
アレルギー性もしくは非アレルギー性鼻炎又は副鼻腔炎、慢性鼻炎又は副鼻腔炎;
鼻ポリープ、慢性鼻副鼻腔炎、急性鼻副鼻腔炎;
喘息、アレルギー性気管支炎、肺胞炎、農夫病、気道過敏症;
感染性の気管支炎又は間質性肺炎(例えば、細菌、ウイルス、蠕虫、菌類、原虫又は他の病原体による感染が原因);
小児喘息、気管支拡張症;
肺繊維症;
医学的な適応症
エチレンジアミン塩タイプIIは優れたCRTH2拮抗作用を示す。そのため、CRTH2の作用に関連した疾病の予防と治療に適している。本願明細書に記載の医薬組成物が、気管支痙攣(bronchospasmolysis)及び気道の炎症緩和、口〜上咽頭、皮膚又は目のアレルギー性疾患、関節の炎症性疾患、炎症性の腸疾患に有用な効果があることがわかった。
本発明の実施形態の1つは、以下から選択される適応症(A)の治療に関する。
粘液の産生の増加又は変化を伴う気道や肺の疾患、及び/又は、気道の炎症性及び/又は閉塞性疾患、例えば、急性気管支炎、慢性気管支炎、慢性閉塞性気管支炎(COPD)、咳、肺気腫;
アレルギー性もしくは非アレルギー性鼻炎又は副鼻腔炎、慢性鼻炎又は副鼻腔炎;
鼻ポリープ、慢性鼻副鼻腔炎、急性鼻副鼻腔炎;
喘息、アレルギー性気管支炎、肺胞炎、農夫病、気道過敏症;
感染性の気管支炎又は間質性肺炎(例えば、細菌、ウイルス、蠕虫、菌類、原虫又は他の病原体による感染が原因);
小児喘息、気管支拡張症;
肺繊維症;
成人呼吸窮迫症候群(ARDS)、気管支浮腫、肺浮腫;
誤嚥、毒性ガスの吸入等の様々な要因で起こる気管支炎、肺臓炎又は間質性肺炎;
心不全、X線、放射能、化学療法を原因とする気管支炎、肺臓炎又は間質性肺炎;
紅斑性狼瘡や全身性強皮症等の膠原病に関連した気管支炎、肺臓炎又は間質性肺炎;
石綿症、珪肺、M.ベックサルコイド、肉芽腫症をはじめとする様々な原因による肺線維症、特発性肺線維症(IPF)、間質性肺疾患又は間質性肺炎;
嚢胞性線維症又は膵線維症;或いは、
α1−アンチトリプシン欠乏症。
そこで、本発明の態様の1つは、前記適応症(A)から選択される呼吸系疾病及び疾患の治療用薬剤を製造するための、本発明の医薬組成物の使用に関する。
本発明の別の態様は、本発明の医薬組成物を必要とする患者に治療上有効量の医薬組成物を投与することを含む、前記(A)から選択される適応症の治療方法に関する。
本発明の更に別の態様は、慢性気管支炎、慢性閉塞性気管支炎(COPD)、慢性副鼻腔炎、鼻ポリープ、アレルギー性鼻炎、慢性鼻副鼻腔炎、急性鼻副鼻腔炎及び喘息から選択される適応症(A)の治療方法であって、本発明の医薬組成物を必要とする患者に治療上有効量の医薬組成物を投与することを含む、治療方法に関する。
本発明の態様の1つは、下記から選択される適応症(B)の治療に関する。
様々な原因による胃腸管の炎症性疾患で、炎症性偽ポリープ、クローン病、潰瘍性大腸炎等;
リウマチ様関節炎などの関節の炎症性疾患;又は
口〜上咽頭、皮膚もしくは目のアレルギー性炎症性疾患。
誤嚥、毒性ガスの吸入等の様々な要因で起こる気管支炎、肺臓炎又は間質性肺炎;
心不全、X線、放射能、化学療法を原因とする気管支炎、肺臓炎又は間質性肺炎;
紅斑性狼瘡や全身性強皮症等の膠原病に関連した気管支炎、肺臓炎又は間質性肺炎;
石綿症、珪肺、M.ベックサルコイド、肉芽腫症をはじめとする様々な原因による肺線維症、特発性肺線維症(IPF)、間質性肺疾患又は間質性肺炎;
嚢胞性線維症又は膵線維症;或いは、
α1−アンチトリプシン欠乏症。
そこで、本発明の態様の1つは、前記適応症(A)から選択される呼吸系疾病及び疾患の治療用薬剤を製造するための、本発明の医薬組成物の使用に関する。
本発明の別の態様は、本発明の医薬組成物を必要とする患者に治療上有効量の医薬組成物を投与することを含む、前記(A)から選択される適応症の治療方法に関する。
本発明の更に別の態様は、慢性気管支炎、慢性閉塞性気管支炎(COPD)、慢性副鼻腔炎、鼻ポリープ、アレルギー性鼻炎、慢性鼻副鼻腔炎、急性鼻副鼻腔炎及び喘息から選択される適応症(A)の治療方法であって、本発明の医薬組成物を必要とする患者に治療上有効量の医薬組成物を投与することを含む、治療方法に関する。
本発明の態様の1つは、下記から選択される適応症(B)の治療に関する。
様々な原因による胃腸管の炎症性疾患で、炎症性偽ポリープ、クローン病、潰瘍性大腸炎等;
リウマチ様関節炎などの関節の炎症性疾患;又は
口〜上咽頭、皮膚もしくは目のアレルギー性炎症性疾患。
そこで、本発明の態様の1つは、前記適応症(B)から選択される呼吸系疾病及び疾患の治療用薬剤を製造するための、本発明の医薬組成物の使用に関する。
本発明の別の態様は、本発明の医薬組成物を必要とする患者に治療上有効量の医薬組成物を投与することを含む、適応症の群(B)から選択される適応症の治療方法に関する。
本発明の更に別の態様は、口〜上咽頭、皮膚もしくは目のアレルギー性炎症性疾患、クローン病、潰瘍性大腸炎から選択される適応症(B)の治療方法に関する。
本発明の態様の1つは、1種以上の更なる活性化合物を含んでいてもよい本発明の医薬組成物を用いた、前記疾病及び疾患のいずれかの治療用薬剤の製造方法に関する。
本発明の態様の1つは、エチレンジアミンタイプIIを含み、更に1種以上の更なる活性化合物を含んでいてもよい医薬組成物を用いた、喘息ならびにアレルギー性及び非アレルギー性鼻炎の治療用薬剤の製造方法に関する。
更なる活性化合物
本発明の医薬組成物は1種以上の更なる活性化合物を含んでいてもよい。したがって、本発明の態様の1つは、治療上有効量のエチレンジアミン塩タイプIIと、少なくとも1種の医薬的に許容できる担体又は賦形剤と、少なくとも1種の更なる活性化合物とを含む医薬組成物(「混合組成物」)に関する。本発明の別の態様は、エチレンジアミン塩タイプIIと少なくとも1種の更なる活性化合物とを、それを必要とする患者に投与する方法に関する。
混合組成物の活性化合物の投与は、同時、別個、又は順次に行ってもよい。好適な投与経路は治療対象の適応症によって異なる。
本発明の別の態様は、本発明の医薬組成物を必要とする患者に治療上有効量の医薬組成物を投与することを含む、適応症の群(B)から選択される適応症の治療方法に関する。
本発明の更に別の態様は、口〜上咽頭、皮膚もしくは目のアレルギー性炎症性疾患、クローン病、潰瘍性大腸炎から選択される適応症(B)の治療方法に関する。
本発明の態様の1つは、1種以上の更なる活性化合物を含んでいてもよい本発明の医薬組成物を用いた、前記疾病及び疾患のいずれかの治療用薬剤の製造方法に関する。
本発明の態様の1つは、エチレンジアミンタイプIIを含み、更に1種以上の更なる活性化合物を含んでいてもよい医薬組成物を用いた、喘息ならびにアレルギー性及び非アレルギー性鼻炎の治療用薬剤の製造方法に関する。
更なる活性化合物
本発明の医薬組成物は1種以上の更なる活性化合物を含んでいてもよい。したがって、本発明の態様の1つは、治療上有効量のエチレンジアミン塩タイプIIと、少なくとも1種の医薬的に許容できる担体又は賦形剤と、少なくとも1種の更なる活性化合物とを含む医薬組成物(「混合組成物」)に関する。本発明の別の態様は、エチレンジアミン塩タイプIIと少なくとも1種の更なる活性化合物とを、それを必要とする患者に投与する方法に関する。
混合組成物の活性化合物の投与は、同時、別個、又は順次に行ってもよい。好適な投与経路は治療対象の適応症によって異なる。
実施形態の1つでは、少なくとも1種の更なる活性化合物が、以下からなる分類から選択される。β2-アドレノセプター作動薬(短時間作用型及び長時間作用型ベータ受容体刺激薬(beta mimetics))、抗コリン作動薬(短時間作用型及び長時間作用型)、抗炎症性ステロイド(経口及び局所コルチコステロイド)、解離型グルココルチコイドミメティクス(dissociated-glucocorticoidmimetics)、PDE3阻害薬、PDE4-阻害薬、PDE7-阻害薬、LTD4拮抗薬、EGFR-阻害薬、PAF拮抗薬、リポキシンA4誘導体、FPRL1モジュレータ、LTB4-受容体(BLT1、BLT2)拮抗薬、ヒスタミン受容体拮抗薬、PI3-キナーゼ阻害薬、非レセプター型チロシンキナーゼ類、例えばLYN、LCK、SYK、ZAP-70、FYN、BTK又はITKの阻害薬、MAPキナーゼ類、例えばp38、ERK1、ERK2、JNK1、JNK2、JNK3又はSAPの阻害薬、NF-κBシグナルパスウェイ、例えばIKK2キナーゼ阻害薬の阻害薬、iNOS阻害薬、MRP4阻害薬、ロイコトリエン生合成阻害薬、例えば5-リポキシゲナーゼ(5-LO)阻害薬、cPLA2阻害薬、ロイコトリエンA4ヒドロラーゼ阻害薬又はFLAP阻害薬、非ステロイド系抗炎症剤(NSAID)、DP1-受容体モジュレータ、トロンボキサン受容体拮抗薬、CCR1拮抗薬、CCR2拮抗薬、CCR3拮抗薬、CCR4拮抗薬、CCR5拮抗薬、CCR6拮抗薬、CCR7拮抗薬、CCR8拮抗薬、CCR9拮抗薬、CCR10拮抗薬、CXCR1拮抗薬、CXCR2拮抗薬、CXCR3拮抗薬、CXCR4拮抗薬、CXCR5拮抗薬、CXCR6拮抗薬、CX3CR1拮抗薬、ニューロキニン(NK1、NK2)拮抗薬、スフィンゴシン1-リン酸受容体モジュレータ、スフィンゴシン1-リン酸リアーゼ阻害薬、アデノシン受容体モジュレータ、例えばA2a-作動薬、プリン受容体のモジュレータ、例えばP2X7阻害薬、ヒストン脱アセチル化酵素(HDAC)活性剤、ブラジキニン(BK1、BK2)拮抗薬、TACE阻害薬、ピーピーエイアールガンマモジュレータ、Rho-キナーゼ阻害薬、インターロイキン1-β転換酵素(ICE)阻害薬、Toll様受容体(TLR)モジュレータ、HMG-CoA還元酵素阻害薬、VLA-4拮抗薬、ICAM-1阻害薬、SHIP作動薬、GABAa受容体拮抗薬、ENaC-阻害薬、メラノコルチン受容体(MC1R、MC2R、MC3R、MC4R、MC5R)モジュレータ、CGRP拮抗薬、エンドセリン拮抗薬、ムコレギュレータ(mucoregulators)、免疫療法薬、気道の腫れを抑える化合物、咳を抑える化合物、CB2作動薬、レチノイド、免疫抑制剤、マスト細胞安定化剤、メチルキサンチン、オピオイド受容体作動薬、緩下剤、消泡剤、鎮痙剤、5-HT4作動薬、及びこれらの組合せ。
別の実施形態では、少なくとも1種の更なる活性化合物がPDE4阻害薬である。別の実施形態では、少なくとも1種の更なる活性化合物がPDE4阻害薬ロフルミラストである。
別の実施形態では、少なくとも1種の更なる活性化合物がLTD4拮抗薬である。別の実施形態では、少なくとも1種の更なる活性化合物が、モンテルカスト、プランルカスト及びザフィルルカストから選択されるLTD4拮抗薬である。
別の実施形態では、少なくとも1種の更なる活性化合物がヒスタミン受容体拮抗薬である。別の実施形態では、少なくとも1種の更なる活性化合物が、アゼラスチン、セチリジン、デスロラチジン、エバスチン、エピナスチン、フェキソフェナジン、ヒドロキシジン、ケトチフェン、レボセチリジン、ロラタジン及びオロパタジンから選択されるヒスタミン受容体拮抗薬である。
別の実施形態では、少なくとも1種の更なる活性化合物が5-LO阻害薬である。別の実施形態では、少なくとも1種の更なる活性化合物が5-LO阻害薬ジロイトンである。
別の実施形態では、少なくとも1種の更なる活性化合物がCCR5拮抗薬である。別の実施形態では、少なくとも1種の更なる活性化合物がCCR5拮抗薬マラビロクである。
別の実施形態では、少なくとも1種の更なる活性化合物がCCR9拮抗薬である。別の実施形態では、少なくとも1種の更なる活性化合物がCCR9拮抗薬Trafficetである。
別の実施形態では、少なくとも1種の更なる活性化合物がスルホンアミドである。別の実施形態では、少なくとも1種の更なる活性化合物が、メサラジン及びスルファサラジンから選択されるスルホンアミドである。
別の実施形態では、少なくとも1種の更なる活性化合物がLTD4拮抗薬である。別の実施形態では、少なくとも1種の更なる活性化合物が、モンテルカスト、プランルカスト及びザフィルルカストから選択されるLTD4拮抗薬である。
別の実施形態では、少なくとも1種の更なる活性化合物がヒスタミン受容体拮抗薬である。別の実施形態では、少なくとも1種の更なる活性化合物が、アゼラスチン、セチリジン、デスロラチジン、エバスチン、エピナスチン、フェキソフェナジン、ヒドロキシジン、ケトチフェン、レボセチリジン、ロラタジン及びオロパタジンから選択されるヒスタミン受容体拮抗薬である。
別の実施形態では、少なくとも1種の更なる活性化合物が5-LO阻害薬である。別の実施形態では、少なくとも1種の更なる活性化合物が5-LO阻害薬ジロイトンである。
別の実施形態では、少なくとも1種の更なる活性化合物がCCR5拮抗薬である。別の実施形態では、少なくとも1種の更なる活性化合物がCCR5拮抗薬マラビロクである。
別の実施形態では、少なくとも1種の更なる活性化合物がCCR9拮抗薬である。別の実施形態では、少なくとも1種の更なる活性化合物がCCR9拮抗薬Trafficetである。
別の実施形態では、少なくとも1種の更なる活性化合物がスルホンアミドである。別の実施形態では、少なくとも1種の更なる活性化合物が、メサラジン及びスルファサラジンから選択されるスルホンアミドである。
エチレンジアミン塩タイプIIと少なくとも1種の更なる活性化合物は、例えば、複数の有効成分を1つの製剤中に一緒に含有する多剤混合薬として単一調剤中に混合することができる。或いは、例えば、同時に投与、別々に投与又は順次に投与するのに適合させたパーツからなるキットとして、2つ以上の別々の製剤に含有させてもよい。本発明の医薬組成物が更なる活性化合物を1種以上含む場合、単一調剤のほうが好ましい。
本発明の吸入粉末組成物は、更なる活性化合物と一緒に用いる場合、エチレンジアミン塩タイプIIと1種以上の更なる活性化合物の両方を含む単一粉末混合物の形態か、或いは、エチレンジアミン塩タイプII又は1種以上の更なる活性化合物のみをそれぞれに含む別々の吸入粉末の形態のいずれかに調製し投与することができる。
少なくとも1種の更なる活性化合物を用いる場合、その1日の投与量は約1mg〜約1000mgであり、別の実施形態では約2mg〜800mg、別の実施形態では約3mg〜約500mg、別の実施形態では約4mg〜約300mg、別の実施形態では約5mg〜約200mg、別の実施形態では約6mg〜約150mgである。
本発明の吸入粉末組成物は、更なる活性化合物と一緒に用いる場合、エチレンジアミン塩タイプIIと1種以上の更なる活性化合物の両方を含む単一粉末混合物の形態か、或いは、エチレンジアミン塩タイプII又は1種以上の更なる活性化合物のみをそれぞれに含む別々の吸入粉末の形態のいずれかに調製し投与することができる。
少なくとも1種の更なる活性化合物を用いる場合、その1日の投与量は約1mg〜約1000mgであり、別の実施形態では約2mg〜800mg、別の実施形態では約3mg〜約500mg、別の実施形態では約4mg〜約300mg、別の実施形態では約5mg〜約200mg、別の実施形態では約6mg〜約150mgである。
実験
核磁気共鳴(NMR)分光分析、粉末X線回折(XRPD)、示差走査熱量測定(DSC)、熱重量分析(TGA)、蒸気吸脱着測定、及び元素分析でエチレンジアミン塩タイプIIの特性を明らかにした。
NMRスペクトルはブルカーのNMRで400MHzで記録した。
XRPDデータは、粉末X線回折装置Rigaku Miniflex II(リガクアメリカ社製、The Woodlands、テキサス州)で記録した。CuKa(30kV、15mA)の放射を用いた。温度25℃において、角度3〜35度の2θで、角度0.02度ずつ1.67秒ごとに変えてデータ収集した。試料は、溶媒を使わない粉末材料の薄層にしてシリコーン(510)試料台に準備した。
DSCは、ティー・エイ・インスツルメント社の示差走査熱量計Q1000を用いて行った。分析用のアルミニウム製パンに試料を封入し、空のアルミニウムパンを基準とした。20〜300℃の温度範囲にわたり、加熱速度は10℃/分とした。
TGAは、ティー・エイ・インスツルメント社の熱重量分析装置Q500を使って行った。試料はプラチナ製の試料用パンに挿入した。25〜300℃の温度範囲にわたり、加熱速度は10℃/分とした。
蒸気吸脱着測定は、サーフェス・メジャーメント・システムズ社のDVS-HTを用いて行った。試料は、試料パン上の箔インサートの中にセットした。試料の水分吸着及び脱着は、温度25℃で吸着/脱着の2サイクルで相対湿度を5〜95%に段階的に変えて観察した。それぞれの段階での平衡点は質量変化が0.002%に達した時とした。
核磁気共鳴(NMR)分光分析、粉末X線回折(XRPD)、示差走査熱量測定(DSC)、熱重量分析(TGA)、蒸気吸脱着測定、及び元素分析でエチレンジアミン塩タイプIIの特性を明らかにした。
NMRスペクトルはブルカーのNMRで400MHzで記録した。
XRPDデータは、粉末X線回折装置Rigaku Miniflex II(リガクアメリカ社製、The Woodlands、テキサス州)で記録した。CuKa(30kV、15mA)の放射を用いた。温度25℃において、角度3〜35度の2θで、角度0.02度ずつ1.67秒ごとに変えてデータ収集した。試料は、溶媒を使わない粉末材料の薄層にしてシリコーン(510)試料台に準備した。
DSCは、ティー・エイ・インスツルメント社の示差走査熱量計Q1000を用いて行った。分析用のアルミニウム製パンに試料を封入し、空のアルミニウムパンを基準とした。20〜300℃の温度範囲にわたり、加熱速度は10℃/分とした。
TGAは、ティー・エイ・インスツルメント社の熱重量分析装置Q500を使って行った。試料はプラチナ製の試料用パンに挿入した。25〜300℃の温度範囲にわたり、加熱速度は10℃/分とした。
蒸気吸脱着測定は、サーフェス・メジャーメント・システムズ社のDVS-HTを用いて行った。試料は、試料パン上の箔インサートの中にセットした。試料の水分吸着及び脱着は、温度25℃で吸着/脱着の2サイクルで相対湿度を5〜95%に段階的に変えて観察した。それぞれの段階での平衡点は質量変化が0.002%に達した時とした。
実施例1
下記記載の手順により、エチレンジアミン塩タイプIIの種結晶を調製した。以下の(a)〜(d)で得られた種結晶はエチレンジアミン塩タイプIIであることが粉末X線回折で確認された(図1及び表1参照)。
(a)エチレンジアミン(93μL)をアセトニトリル(1mL)に溶解し原液を作成した。原液の一部(75μL)を、式(I)で表わされる化合物の遊離酸(50mg、0.1mmol)を含むアセトニトリル(1mL)の懸濁液に添加した。この混合物を40℃で3日間撹拌して濾過を行った。得られた固形物をアセトニトリルで洗浄し風乾し、エチレンジアミン塩タイプII(約40mg)を白色結晶固体で得た。
(b)アセトニトリルを酢酸エチルに代えた以外は、上記実施例1(a)と同様の手順で、エチレンジアミン塩タイプII(約40mg)を白色結晶固体で得た。
(c)アセトニトリルを酢酸イソプロピルに代えた以外は、上記実施例1(a)と同様の手順で、エチレンジアミン塩タイプII(約40mg)を白色結晶固体で得た。
(d)アセトニトリルを酢酸n-ブチルに代えた以外は、上記実施例1(a)と同様の手順で、エチレンジアミン塩タイプII(約40mg)を白色結晶固体で得た。
下記記載の手順により、エチレンジアミン塩タイプIIの種結晶を調製した。以下の(a)〜(d)で得られた種結晶はエチレンジアミン塩タイプIIであることが粉末X線回折で確認された(図1及び表1参照)。
(a)エチレンジアミン(93μL)をアセトニトリル(1mL)に溶解し原液を作成した。原液の一部(75μL)を、式(I)で表わされる化合物の遊離酸(50mg、0.1mmol)を含むアセトニトリル(1mL)の懸濁液に添加した。この混合物を40℃で3日間撹拌して濾過を行った。得られた固形物をアセトニトリルで洗浄し風乾し、エチレンジアミン塩タイプII(約40mg)を白色結晶固体で得た。
(b)アセトニトリルを酢酸エチルに代えた以外は、上記実施例1(a)と同様の手順で、エチレンジアミン塩タイプII(約40mg)を白色結晶固体で得た。
(c)アセトニトリルを酢酸イソプロピルに代えた以外は、上記実施例1(a)と同様の手順で、エチレンジアミン塩タイプII(約40mg)を白色結晶固体で得た。
(d)アセトニトリルを酢酸n-ブチルに代えた以外は、上記実施例1(a)と同様の手順で、エチレンジアミン塩タイプII(約40mg)を白色結晶固体で得た。
実施例2
以下の(a)又は(b)に記載の手順に従って、上記実施例1で得た種結晶からエチレンジアミン塩タイプIIの予備的結晶化を行った。
(a)エチレンジアミン(93μL)をアセトニトリル(1mL)に溶解して原液を作成した。原液の一部(207μL)を、式(I)で表わされる化合物の遊離酸(0.152g、0.3mmol)を含むアセトニトリル(2mL)の懸濁液に添加した。懸濁液を前記実施例1で得たエチレンジアミン塩タイプIIの種結晶の一部(約5mg)で処理した。混合物を65℃に加熱し、30分間撹拌して40℃に冷却した。混合物を40℃で3時間撹拌して、20℃に下げて濾過を行った。得られた固形物を集めてアセトニトリルで洗浄し、減圧下50℃で乾燥してエチレンジアミン塩タイプII(0.137g、0.26mmol)を白色粉末結晶で得た。収率:85.0%。元素分析: C25H26F3N5O3・1/2C2H8N2(溶媒和化されていない。無水。2:1の化学量論的塩)の計算値は、C:58.75%、H:5.69%、N:15.81%、F:10.7%、実測値は、C:58.01%、H:5.75%、N:15.74%、F:10.48%であった。NMR分析では、乾燥が不完全であったため2.7mole%の残留アセトニトリルを有する2:1の塩を示した。(0.21質量%に相当)
試料のNMR分析では、化学量論的2:1の塩(モル基準)と最小残留溶媒(<0.21%)とが示された。元素分析も、化学量論的2:1の塩(モル基準)を有する式(I)で表わされる化合物の無水かつ溶媒和化されていないエチレンジアミン塩の理論値と一致している。
以下の(a)又は(b)に記載の手順に従って、上記実施例1で得た種結晶からエチレンジアミン塩タイプIIの予備的結晶化を行った。
(a)エチレンジアミン(93μL)をアセトニトリル(1mL)に溶解して原液を作成した。原液の一部(207μL)を、式(I)で表わされる化合物の遊離酸(0.152g、0.3mmol)を含むアセトニトリル(2mL)の懸濁液に添加した。懸濁液を前記実施例1で得たエチレンジアミン塩タイプIIの種結晶の一部(約5mg)で処理した。混合物を65℃に加熱し、30分間撹拌して40℃に冷却した。混合物を40℃で3時間撹拌して、20℃に下げて濾過を行った。得られた固形物を集めてアセトニトリルで洗浄し、減圧下50℃で乾燥してエチレンジアミン塩タイプII(0.137g、0.26mmol)を白色粉末結晶で得た。収率:85.0%。元素分析: C25H26F3N5O3・1/2C2H8N2(溶媒和化されていない。無水。2:1の化学量論的塩)の計算値は、C:58.75%、H:5.69%、N:15.81%、F:10.7%、実測値は、C:58.01%、H:5.75%、N:15.74%、F:10.48%であった。NMR分析では、乾燥が不完全であったため2.7mole%の残留アセトニトリルを有する2:1の塩を示した。(0.21質量%に相当)
試料のNMR分析では、化学量論的2:1の塩(モル基準)と最小残留溶媒(<0.21%)とが示された。元素分析も、化学量論的2:1の塩(モル基準)を有する式(I)で表わされる化合物の無水かつ溶媒和化されていないエチレンジアミン塩の理論値と一致している。
XRPDでは、結晶がエチレンジアミン塩タイプIIであることを示した(図1及び表1参照)。
(b)エチレンジアミン(93μL)を酢酸エチル(1mL)に溶解して原液を作成した。原液の一部(241μL)を、式(I)で表わされる化合物の遊離酸(0.177g、0.35mmol)を含む酢酸エチル(10mL)の懸濁液に添加した。懸濁液を前記実施例1で得たエチレンジアミン塩タイプIIの種結晶の一部(約5mg)で処理した。混合物を65℃に加熱し、30分間65℃で撹拌し、30分間還流下で撹拌した。混合物を40℃に冷却し、40℃で15時間撹拌して濾過を行った。得られた固形物を酢酸エチルで洗浄し、減圧下70℃で15時間乾燥してエチレンジアミン塩タイプII(0.130g、0.24mmol)を白色粉末結晶で得た。収率:69.9%。元素分析: C25H26F3N5O3・1/2C2H8N2(溶媒和化されていない。無水。2:1化学量論的塩)の計算値は、C:58.75%、H:5.69%、N:15.81%、F:10.7%、実測値は、C:57.95%、H:5.76%、N:15.61%、F:10.81%であった。NMR分析では、残留酢酸エチルは検出されず、2:1の塩を示した。
XRPDでは、結晶がエチレンジアミン塩タイプIIであることを示した(図1及び表1参照)。
(b)エチレンジアミン(93μL)を酢酸エチル(1mL)に溶解して原液を作成した。原液の一部(241μL)を、式(I)で表わされる化合物の遊離酸(0.177g、0.35mmol)を含む酢酸エチル(10mL)の懸濁液に添加した。懸濁液を前記実施例1で得たエチレンジアミン塩タイプIIの種結晶の一部(約5mg)で処理した。混合物を65℃に加熱し、30分間65℃で撹拌し、30分間還流下で撹拌した。混合物を40℃に冷却し、40℃で15時間撹拌して濾過を行った。得られた固形物を酢酸エチルで洗浄し、減圧下70℃で15時間乾燥してエチレンジアミン塩タイプII(0.130g、0.24mmol)を白色粉末結晶で得た。収率:69.9%。元素分析: C25H26F3N5O3・1/2C2H8N2(溶媒和化されていない。無水。2:1化学量論的塩)の計算値は、C:58.75%、H:5.69%、N:15.81%、F:10.7%、実測値は、C:57.95%、H:5.76%、N:15.61%、F:10.81%であった。NMR分析では、残留酢酸エチルは検出されず、2:1の塩を示した。
XRPDでは、結晶がエチレンジアミン塩タイプIIであることを示した(図1及び表1参照)。
実施例3
エチレンジアミン塩タイプI(前記エタノール溶媒和物)(3.38g、6.36mmol)を含むアセトニトリル(50mL)の懸濁液を、上記実施例1で得た種結晶の一部(約20mg)で処理した。混合物を還流温度に加熱し、30分間撹拌した。その後、スラリーを40℃に冷却し、40℃で15時間熟成させた。20℃に冷却して濾過を行った。固形物をアセトニトリルで洗浄し減圧下80℃で15時間乾燥させ、エチレンジアミン塩タイプII(3.04g、5.72mmol)を白色粉末結晶で得た。収率:89.9%。XRPDでは、結晶がエチレンジアミン塩タイプIIのものであることを示した。
前記実施例は、当該分野の当業者に実施形態の作成方法と使用方法についての完全な開示と説明をするために記載するものであり、本開示範囲の限定を意図するものではない。この開示を実施するための前記に説明した形態の修正で、当業者にとって明らかなものは、本発明の範囲に入るものとする。本願明細書に引用されているすべての刊行物、特許及び特許出願については、内容を本願明細書に援用するために、それらの刊行物、特許及び特許出願それぞれを具体的かつ個々に示すものとして、引用により本願明細書の記載に含む。
エチレンジアミン塩タイプI(前記エタノール溶媒和物)(3.38g、6.36mmol)を含むアセトニトリル(50mL)の懸濁液を、上記実施例1で得た種結晶の一部(約20mg)で処理した。混合物を還流温度に加熱し、30分間撹拌した。その後、スラリーを40℃に冷却し、40℃で15時間熟成させた。20℃に冷却して濾過を行った。固形物をアセトニトリルで洗浄し減圧下80℃で15時間乾燥させ、エチレンジアミン塩タイプII(3.04g、5.72mmol)を白色粉末結晶で得た。収率:89.9%。XRPDでは、結晶がエチレンジアミン塩タイプIIのものであることを示した。
前記実施例は、当該分野の当業者に実施形態の作成方法と使用方法についての完全な開示と説明をするために記載するものであり、本開示範囲の限定を意図するものではない。この開示を実施するための前記に説明した形態の修正で、当業者にとって明らかなものは、本発明の範囲に入るものとする。本願明細書に引用されているすべての刊行物、特許及び特許出願については、内容を本願明細書に援用するために、それらの刊行物、特許及び特許出願それぞれを具体的かつ個々に示すものとして、引用により本願明細書の記載に含む。
Claims (12)
- 図1に示す粉末X線回折パターンと実質的に一致する粉末X線回折パターンを提供する、請求項1記載の多形体。
- 請求項1記載の前記多形体の治療上の有効量と、少なくとも1種の医薬的に許容できる担体又は賦形剤とを含む医薬組成物。
- 錠剤、被覆錠剤、丸剤、顆粒剤又は粉末剤、シロップ剤、エマルジョン、懸濁液及び溶液から選択される経口投与に適した請求項3記載の医薬組成物。
- 注入投与に適した請求項3記載の医薬組成物。
- 吸入可能粉末、噴霧剤含有定量エアロゾル、噴霧剤を含まない吸入溶液から選択される、吸入投与に適した請求項3記載の医薬組成物。
- CRTH2活性に関連した疾病の治療のために請求項1記載の多形体を使う方法で、治療上有効量の本発明の医薬組成物を、それを必要とする患者に投与することを含む方法。
- 慢性気管支炎、慢性閉塞性気管支炎(COPD)、慢性副鼻腔炎、鼻ポリープ、アレルギー性鼻炎、慢性鼻副鼻腔炎、急性鼻副鼻腔炎及び喘息から選択される疾病を治療するために請求項1記載の多形体を使う方法であって、該方法が、治療上有効量の本発明の医薬組成物を、それを必要とする患者に投与することを含む方法。
- (a)式(I)の化合物のエチレンジアミン塩を好適な極性溶媒に含む混合物を形成する工程と、
(b)エチレンジアミン塩タイプIIを前記混合物から析出させる工程とを含む、請求項1記載の多形体を調製する方法。 - (a)式(I)の化合物のエチレンジアミン塩を有する混合物を形成するのに十分な条件下で、式(I)の化合物の遊離酸とエチレンジアミンと適切な極性溶媒とを混合する工程と、
(b)エチレンジアミン塩タイプIIを前記混合物から析出させる工程とを含む、請求項1記載の多形体の調製方法。 - 前記工程(a)の混合物に種結晶を入れる工程を更に含む、請求項9又は10記載の方法。
- 前記極性の非プロトン性溶媒がアセトニトリル、酢酸エチル、酢酸プロピル及び酢酸n-ブチルから選択される、請求項9〜11のいずれか1項記載の方法。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US22316509P | 2009-07-06 | 2009-07-06 | |
| US61/223,165 | 2009-07-06 | ||
| PCT/US2010/040733 WO2011005645A1 (en) | 2009-07-06 | 2010-07-01 | Polymorph of [4,6-bis(dimethylamino)-2-(4-{[4-(trifluoromethyl)benzoyl]amino}benzyl)pyrimidin-5-yl] |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2012532191A true JP2012532191A (ja) | 2012-12-13 |
| JP2012532191A5 JP2012532191A5 (ja) | 2013-08-15 |
Family
ID=42352224
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2012519596A Pending JP2012532191A (ja) | 2009-07-06 | 2010-07-01 | [4,6−ビス(ジメチルアミノ)−2−(4−{[4−(トリフルオロメチル)ベンゾイル]アミノ}ベンジル)ピリミジン−5−イル]の多形体 |
Country Status (4)
| Country | Link |
|---|---|
| US (1) | US20120142715A1 (ja) |
| EP (1) | EP2451787B1 (ja) |
| JP (1) | JP2012532191A (ja) |
| WO (1) | WO2011005645A1 (ja) |
Families Citing this family (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN101715443A (zh) | 2007-03-14 | 2010-05-26 | 诺普神经科学股份有限公司 | 手性纯化的取代的苯并噻唑二胺的合成 |
| US20110190356A1 (en) | 2008-08-19 | 2011-08-04 | Knopp Neurosciences Inc. | Compositions and Methods of Using (R)- Pramipexole |
| WO2013096816A1 (en) | 2011-12-22 | 2013-06-27 | Biogen Idec Ma Inc. | Improved synthesis of amine substituted 4,5,6,7-tetrahydrobenzothiazole compounds |
| US9662313B2 (en) | 2013-02-28 | 2017-05-30 | Knopp Biosciences Llc | Compositions and methods for treating amyotrophic lateral sclerosis in responders |
| US9468630B2 (en) | 2013-07-12 | 2016-10-18 | Knopp Biosciences Llc | Compositions and methods for treating conditions related to increased eosinophils |
| US10828284B2 (en) | 2013-07-12 | 2020-11-10 | Knopp Biosciences Llc | Compositions and methods for treating conditions related to elevated levels of eosinophils and/or basophils |
| AU2014306597B2 (en) | 2013-08-13 | 2018-05-17 | Knopp Biosciences Llc | Compositions and methods for treating chronic urticaria |
| CA2921378A1 (en) | 2013-08-13 | 2015-02-19 | Knopp Biosciences Llc | Compositions and methods for treating plasma cell disorders and b-cell prolymphocytic disorders |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2008156781A1 (en) * | 2007-06-21 | 2008-12-24 | Actimis Pharmaceuticals, Inc. | Amine salts of a crth2 antagonist |
Family Cites Families (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4570630A (en) | 1983-08-03 | 1986-02-18 | Miles Laboratories, Inc. | Medicament inhalation device |
| NZ217006A (en) | 1985-07-30 | 1989-04-26 | Glaxo Group Ltd | Inhaler for finely divided medicament includes plunger to open medicament container |
| SE453566B (sv) | 1986-03-07 | 1988-02-15 | Draco Ab | Anordning vid pulverinhalatorer |
| SG45171A1 (en) | 1990-03-21 | 1998-01-16 | Boehringer Ingelheim Int | Atomising devices and methods |
| DE4318455A1 (de) | 1993-06-03 | 1994-12-08 | Boehringer Ingelheim Kg | Kapselhalterung |
| DE19536902A1 (de) | 1995-10-04 | 1997-04-10 | Boehringer Ingelheim Int | Vorrichtung zur Hochdruckerzeugung in einem Fluid in Miniaturausführung |
| CA2659189A1 (en) | 2006-08-03 | 2008-02-07 | Bromine Compounds Ltd. | Method, device and system for water treatment |
| WO2008156780A1 (en) | 2007-06-21 | 2008-12-24 | Actimis Pharmaceuticals, Inc. | Particulates of a crth2 antagonist |
-
2010
- 2010-07-01 EP EP10729777.2A patent/EP2451787B1/en not_active Not-in-force
- 2010-07-01 JP JP2012519596A patent/JP2012532191A/ja active Pending
- 2010-07-01 WO PCT/US2010/040733 patent/WO2011005645A1/en active Application Filing
- 2010-07-01 US US13/382,366 patent/US20120142715A1/en not_active Abandoned
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2008156781A1 (en) * | 2007-06-21 | 2008-12-24 | Actimis Pharmaceuticals, Inc. | Amine salts of a crth2 antagonist |
Also Published As
| Publication number | Publication date |
|---|---|
| EP2451787B1 (en) | 2013-04-24 |
| WO2011005645A1 (en) | 2011-01-13 |
| US20120142715A1 (en) | 2012-06-07 |
| EP2451787A1 (en) | 2012-05-16 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2012532191A (ja) | [4,6−ビス(ジメチルアミノ)−2−(4−{[4−(トリフルオロメチル)ベンゾイル]アミノ}ベンジル)ピリミジン−5−イル]の多形体 | |
| ES2292988T3 (es) | Derivados de nicotinamida utiles como inhibidores de pde4. | |
| US20110144075A1 (en) | Derivatives of 1-phenyl-2-pyridinyl alkyl alcohols as phosphodiesterase inhibitors | |
| US9745306B2 (en) | 2-((4-amino-3-(3-fluoro-5-hydroxyphenyl)-1H-pyrazolo[3,4-D]pyrimidin-1-yl)methyl)-3-(2-(trifluoromethyl)benzyl) quinazolin-4(3H)-one derivatives and their use as phosphoinositide 3-kinase inhibitors | |
| KR20100049688A (ko) | N4-(2,2-다이플루오로-4h-벤조[1,4]옥사진-3-온)-6-일]-5-플루오로-n2-[3-(메틸아미노카보닐메틸렌옥시)페닐]2,4-피리미딘다이아민의 지나포에이트 염 | |
| TW200806665A (en) | Organic compounds | |
| JPWO2004002964A1 (ja) | ジアミノピリミジンカルボキサミド誘導体 | |
| PL200551B1 (pl) | Pochodne 3-(3-izopropylo-5-metylo-4H-1,2,4-triazol-4-ilo)-egzo-8-azabicyklo[3.2.1]oktanu, środek farmaceutyczny, zastosowanie tych pochodnych oraz środka farmaceutycznego i związki pośrednie | |
| TW200823185A (en) | Sulfonamide derivatives | |
| US20110224229A1 (en) | Novel Crystalline Form | |
| JP2011528346A (ja) | ムスカリン受容体アンタゴニストとして活性のある新規化合物 | |
| US20120302584A1 (en) | Novel salts forms of pyrimidin-5-yl acetic acid derivative | |
| EP3554499A1 (en) | Aminopyrazoles as janus kinase inhibitors | |
| US20110294828A1 (en) | Process for preparing a polymorph of the choline salt of a pyrimidin-5-yl acetic acid derivative | |
| JP2006199700A (ja) | 結晶形態 | |
| US20230183185A1 (en) | Olaparib hydroxybenzoic acid cocrystals and their pharmaceutical use | |
| CA3040341C (en) | Crystalline form of (1r,2r)-2-[4-(3-methy1-1h-pyrazol-5-yl)benzoyl]-n-(4-oxo-4,5,6,7-tetrahydropyrazolo[1,5-a]pyrazin-3-yl)cyclohexanecarboxamide | |
| CA3180960A1 (en) | Therapeutic benzamide cocrystals | |
| CN113382995A (zh) | 作为crth2受体拮抗剂的杂环化合物的晶型 | |
| WO2016047741A1 (ja) | 置換ビアリール化合物及び他の医薬の組み合わせ | |
| JP2003119180A (ja) | ナフタレン化合物 | |
| TW201319058A (zh) | 新穎化合物 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20130628 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20130628 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20140908 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20150316 |