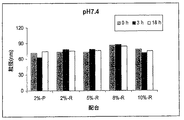
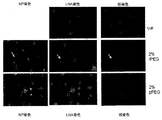
JP2012509366A - 核酸送達系のための放出可能ポリマー脂質 - Google Patents
核酸送達系のための放出可能ポリマー脂質 Download PDFInfo
- Publication number
- JP2012509366A JP2012509366A JP2011536581A JP2011536581A JP2012509366A JP 2012509366 A JP2012509366 A JP 2012509366A JP 2011536581 A JP2011536581 A JP 2011536581A JP 2011536581 A JP2011536581 A JP 2011536581A JP 2012509366 A JP2012509366 A JP 2012509366A
- Authority
- JP
- Japan
- Prior art keywords
- substituted
- compound
- alkyl
- group
- nhc
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Withdrawn
Links
- 0 CCC=CC1=CC1*(C)C(C)N Chemical compound CCC=CC1=CC1*(C)C(C)N 0.000 description 6
- GVXMROJPEJNCET-UHFFFAOYSA-N CCC(C)C(Nc1c(C)cccc1)=O Chemical compound CCC(C)C(Nc1c(C)cccc1)=O GVXMROJPEJNCET-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/74—Synthetic polymeric materials
- A61K31/785—Polymers containing nitrogen
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/69—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the conjugate being characterised by physical or galenical forms, e.g. emulsion, particle, inclusion complex, stent or kit
- A61K47/6905—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the conjugate being characterised by physical or galenical forms, e.g. emulsion, particle, inclusion complex, stent or kit the form being a colloid or an emulsion
- A61K47/6911—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the conjugate being characterised by physical or galenical forms, e.g. emulsion, particle, inclusion complex, stent or kit the form being a colloid or an emulsion the form being a liposome
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C233/00—Carboxylic acid amides
- C07C233/01—Carboxylic acid amides having carbon atoms of carboxamide groups bound to hydrogen atoms or to acyclic carbon atoms
- C07C233/45—Carboxylic acid amides having carbon atoms of carboxamide groups bound to hydrogen atoms or to acyclic carbon atoms having the nitrogen atom of at least one of the carboxamide groups bound to a carbon atom of a hydrocarbon radical substituted by carboxyl groups
- C07C233/46—Carboxylic acid amides having carbon atoms of carboxamide groups bound to hydrogen atoms or to acyclic carbon atoms having the nitrogen atom of at least one of the carboxamide groups bound to a carbon atom of a hydrocarbon radical substituted by carboxyl groups with the substituted hydrocarbon radical bound to the nitrogen atom of the carboxamide group by an acyclic carbon atom
- C07C233/49—Carboxylic acid amides having carbon atoms of carboxamide groups bound to hydrogen atoms or to acyclic carbon atoms having the nitrogen atom of at least one of the carboxamide groups bound to a carbon atom of a hydrocarbon radical substituted by carboxyl groups with the substituted hydrocarbon radical bound to the nitrogen atom of the carboxamide group by an acyclic carbon atom having the carbon atom of the carboxamide group bound to a carbon atom of an acyclic unsaturated carbon skeleton
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C237/00—Carboxylic acid amides, the carbon skeleton of the acid part being further substituted by amino groups
- C07C237/02—Carboxylic acid amides, the carbon skeleton of the acid part being further substituted by amino groups having the carbon atoms of the carboxamide groups bound to acyclic carbon atoms of the carbon skeleton
- C07C237/22—Carboxylic acid amides, the carbon skeleton of the acid part being further substituted by amino groups having the carbon atoms of the carboxamide groups bound to acyclic carbon atoms of the carbon skeleton having nitrogen atoms of amino groups bound to the carbon skeleton of the acid part, further acylated
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C251/00—Compounds containing nitrogen atoms doubly-bound to a carbon skeleton
- C07C251/02—Compounds containing nitrogen atoms doubly-bound to a carbon skeleton containing imino groups
- C07C251/24—Compounds containing nitrogen atoms doubly-bound to a carbon skeleton containing imino groups having carbon atoms of imino groups bound to carbon atoms of six-membered aromatic rings
Landscapes
- Chemical & Material Sciences (AREA)
- Health & Medical Sciences (AREA)
- Organic Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Medicinal Chemistry (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Epidemiology (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Dispersion Chemistry (AREA)
- Rheumatology (AREA)
- Pain & Pain Management (AREA)
- Oncology (AREA)
- Communicable Diseases (AREA)
- Virology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Saccharide Compounds (AREA)
- Medicinal Preparation (AREA)
- Polyethers (AREA)
Abstract
本発明は、核酸の送達のためのポリマー結合放出可能脂質、及び前記を含有するナノ粒子組成物、並びに前記を用いて遺伝子発現を調節する方法に関する。特に、本発明は、ケタール若しくはアセタール含有リンカー又はイミン含有リンカーに基づく酸不安定性リンカーを含有する放出可能ポリマー脂質に関する。
【選択図】なし
【選択図】なし
Description
関連出願の相互参照
本出願は、それぞれの内容が参照により本明細書に組み込まれている、2008年11月17日出願の米国仮特許出願第61/115,371号及び第61/115,379号の優先権の利益を主張するものである。
本出願は、それぞれの内容が参照により本明細書に組み込まれている、2008年11月17日出願の米国仮特許出願第61/115,371号及び第61/115,379号の優先権の利益を主張するものである。
核酸を使用する療法は、様々な疾患を治療するために提案されてきた。一つのこのような提案された核酸療法は、治療遺伝子により、疾患と関連する遺伝子発現が選択的に調節され、疾患を治療するための他の治療方式と関連し得る副作用を最小限に抑えることができるアンチセンス療法である。
しかし、核酸を使用する療法は、このような治療用核酸の送達及び安定性と関連した問題により限界があった。幾つかの遺伝子送達系が、上記の問題を克服し、インビトロ及びインビボで癌細胞若しくは他の細胞、又は癌組織等の標的領域に治療遺伝子を効果的に導入するために提案された。
それにもかかわらず、治療目的のために核酸を送達する新しい送達系及び方法が必要とされており、本明細書において提供される。
本発明は、核酸送達のための酸不安定性リンカーを含有する放出可能ポリマー脂質、及び前記脂質を含有するナノ粒子組成物を提供する。オリゴヌクレオチド等のポリ核酸は、本明細書に記載の放出可能ポリマー脂質、カチオン性脂質及び融合性脂質の混合物を含有するナノ粒子複合体中に封入される。
(式中、
Rは非抗原性ポリマーであり、
L1〜2は独立に選択される二官能性リンカーであり、
Mは酸不安定性リンカーであり、
Qは置換又は非置換、飽和又は不飽和のC4〜30含有部分であり、
(a)は0又は正の整数であり、
(b)は0又は正の整数であり、
標的基は非抗原性ポリマーに結合していてもよい)
を有する。
Rは非抗原性ポリマーであり、
L1〜2は独立に選択される二官能性リンカーであり、
Mは酸不安定性リンカーであり、
Qは置換又は非置換、飽和又は不飽和のC4〜30含有部分であり、
(a)は0又は正の整数であり、
(b)は0又は正の整数であり、
標的基は非抗原性ポリマーに結合していてもよい)
を有する。
本発明は、核酸送達のためのナノ粒子組成物も提供する。本発明によれば、核酸(即ち、オリゴヌクレオチド)送達のためのナノ粒子組成物は、
(i)カチオン性脂質、
(ii)融合性脂質及び
(iii)式(I)の化合物
を含む。
(i)カチオン性脂質、
(ii)融合性脂質及び
(iii)式(I)の化合物
を含む。
本発明の別の態様において、インビボ及びインビトロで細胞又は組織に核酸(好ましくはオリゴヌクレオチド)を送達する方法が提供される。本明細書に記載の方法で導入されるオリゴヌクレオチドは、標的遺伝子の発現を調節できる。
更なる態様において、本発明は、標的遺伝子、即ち、癌遺伝子、及び哺乳動物、好ましくはヒトの炎症性疾患と関連する遺伝子の発現を抑制する方法を提供する。該方法は、細胞、例えば癌細胞又は癌組織を、本明細書に記載のナノ粒子組成物から調製したナノ粒子と接触させることを含む。ナノ粒子中に封入されたオリゴヌクレオチドは放出され、処理される細胞又は組織におけるmRNA又はタンパク質のダウンレギュレーションを介在する。ナノ粒子での治療により、癌細胞の増殖の抑制等、疾患の治療において標的遺伝子発現の調節が可能となり、前記に伴う付帯利益が与えられる。このような療法は、単一の治療として、又は一つ若しくは複数の有用な及び/若しくは認可された治療との併用療法の一部として行うことができる。
更なる態様は、式(I)の化合物並びに前記化合物を含有するナノ粒子を製造する方法を含む。
本明細書に記載の放出可能ポリマー脂質は酸不安定性リンカーを含む。生物活性部分を含有するナノ粒子が、酸性pHの細胞内環境又は細胞外環境等の標的部位に到達したとき、放出可能ポリマー脂質が分解し始め、ナノ粒子が破裂し、標的部位に及び/又は標的部位中に治療薬が放出される。ケタール含有部分若しくはアセタール含有部分又はイミン含有部分を使用することにより、ナノ粒子は、中性又はわずかに塩基性の条件下で安定性を保持できる。しかし、通常低pHの標的部位、例えば腫瘍細胞では、ケタール部分及びアセタール部分が分解し、それによりオリゴヌクレオチド等の封入された治療薬が放出される。
放出可能ポリマー脂質を含有するナノ粒子は、細胞及び細胞内コンパートメントに侵入し、エンドソーム等の酸性細胞コンパートメントに到達した際、ナノ粒子中に封入された核酸の解離及び放出を補助する。任意の理論に拘束されずに、このような特徴は、酸不安定リンカーにある程度起因する。ケタール又はイミン系リンカーは、酸に不安定であり、エンドソーム等の酸性環境で加水分解される。リンカーは、ナノ粒子及びエンドソームの破壊を促進し、それにより核酸の細胞内放出を可能にする。
本発明の一つの利点は、本明細書に記載の放出可能ポリマー脂質を含有するナノ粒子組成物により、インビトロでの核酸の送達並びにインビボでの核酸の投与のための手段が提供されることである。この送達法により、体内での治療用オリゴヌクレオチドの安定性、トランスフェクション効率及びバイオアベイラビリティーを高めることができる。
放出可能ポリマー脂質は、ナノ粒子の循環を延長し、身体からのナノ粒子の早期排泄を防ぐ。また、ポリマー脂質により、免疫原性が低下する。
本明細書に記載の放出可能ポリマー脂質は、体液中でナノ粒子複合体及びナノ粒子複合体中の核酸を安定化する。任意の理論に拘束されずに、ナノ粒子複合体は、そのように封入された核酸の安定性を高め、少なくともある程度はヌクレアーゼから核酸を保護し、それにより例えば血液又は組織の存在下での分解から封入された核酸を保護すると考えられる。
本明細書に記載のナノ粒子により、有利には、例えばより高いトランスフェクション効率も得られる。本明細書に記載のナノ粒子は、トランスフェクション剤の補助なしにインビトロ及びインビボで細胞をトランスフェクションできる。該ナノ粒子は、トランスフェクション剤を必要とする当技術分野で公知のナノ粒子と同じ毒性作用を有していないため安全である。ナノ粒子の高いトランスフェクション効率により、治療用核酸を、細胞内の細胞質及び核に送達するための改善された手段も提供される。
本明細書に記載のナノ粒子により、有利には、ナノ粒子の調製における安定性及び柔軟性も得られる。ナノ粒子は、約2〜約12等の広範なpHで調製できる。本明細書に記載のナノ粒子は、約7.2〜約7.6等の望ましい生理的pHで臨床的に使用することもできる。
本明細書に記載のナノ粒子送達系により、十分な量の治療用オリゴヌクレオチドを、EPR(Enhanced Permeation and Retention)効果により癌細胞等の所望の標的領域で選択的に利用することも可能となる。したがって、ナノ粒子組成物は、癌細胞又は癌組織において特異的mRNAのダウンレギュレーションを改善する。
別の利点は、本明細書に記載の放出可能ポリマー脂質により、均一な大きさでナノ粒子を調製できることである。本明細書に記載の放出可能ポリマー脂質を含有するナノ粒子複合体は、緩衝液条件下で安定である。
更に別の利点は、本明細書に記載のナノ粒子により、一つ又は複数の異なる標的オリゴヌクレオチドの小分子化学療法薬等の生物活性分子の送達が可能となり、それにより疾患の治療において相乗効果が得られることである。
他の及びさらなる利点は、以下の説明から明らかとなろう。
本発明の目的のために、「残基」という用語は、例えば、別の化合物との置換反応を経た後に残るフェニルエチレングリコール等を指す、化合物の部分を意味すると理解されるものとする。
本発明の目的のために、「アルキル」という用語は、直鎖、分岐鎖及び環状のアルキル基を含む飽和脂肪族炭化水素を指す。「アルキル」という用語は、アルキルチオアルキル基、アルコキシアルキル基、シクロアルキルアルキル基、ヘテロシクロアルキル基及びC1〜6アルキルカルボニルアルキル基も含む。アルキル基は、1〜12個の炭素を有することが好ましい。アルキル基は、より好ましくは約1〜7個の炭素、さらにより好ましくは約1〜4個の炭素の低級アルキルである。アルキル基は、置換又は非置換であってよい。置換される場合、置換基(複数可)としては、好ましくはハロ基、オキシ基、アジド基、ニトロ基、シアノ基、アルキル基、アルコキシ基、アルキルチオ基、アルキルチオアルキル基、アルコキシアルキル基、アルキルアミノ基、トリハロメチル基、ヒドロキシル基、メルカプト基、ヒドロキシ基、シアノ基、アルキルシリル基、シクロアルキル基、シクロアルキルアルキル基、ヘテロシクロアルキル基、ヘテロアリール基、アルケニル基、アルキニル基、C1〜6ヒドロカルボニル基、アリール基及びアミノ基が挙げられる。
本発明の目的のために、「置換」という用語は、官能基又は化合物に含有される一つ又は複数の原子を、ハロ基、オキシ基、アジド基、ニトロ基、シアノ基、アルキル基、アルコキシ基、アルキルチオ基、アルキルチオアルキル基、アルコキシアルキル基、アルキルアミノ基、トリハロメチル基、ヒドロキシル基、メルカプト基、ヒドロキシ基、シアノ基、アルキルシリル基、シクロアルキル基、シクロアルキルアルキル基、ヘテロシクロアルキル基、ヘテロアリール基、アルケニル基、アルキニル基、C1〜6アルキルカルボニルアルキル基、アリール基及びアミノ基の群に由来する部分の一つに付加するか、又はそれと置き換えることを指す。
本発明の目的のために、「アルケニル」という用語は、直鎖、分岐鎖及び環状の基を含む、少なくとも一つの炭素−炭素二重結合を含有する基を指す。アルケニル基は、好ましくは約2〜12個の炭素を有する。アルケニル基は、より好ましくは約2〜7個の炭素、さらにより好ましくは約2〜4個の炭素の低級アルケニルである。アルケニル基は、置換又は非置換であってよい。置換される場合、置換基(複数可)としては、好ましくはハロ基、オキシ基、アジド基、ニトロ基、シアノ基、アルキル基、アルコキシ基、アルキルチオ基、アルキルチオアルキル基、アルコキシアルキル基、アルキルアミノ基、トリハロメチル基、ヒドロキシル基、メルカプト基、ヒドロキシ基、シアノ基、アルキルシリル基、シクロアルキル基、シクロアルキルアルキル基、ヘテロシクロアルキル基、ヘテロアリール基、アルケニル基、アルキニル基、C1〜6ヒドロカルボニル基、アリール基及びアミノ基が挙げられる。
本発明の目的のために、「アルキニル」という用語は、直鎖、分岐鎖及び環状の基を含む、少なくとも一つの炭素−炭素三重結合を含有する基を指す。アルキニル基は、好ましくは約2〜12個の炭素を有する。アルキニル基は、より好ましくは約2〜7個の炭素、さらにより好ましくは約2〜4個の炭素の低級アルキニルである。アルキニル基は、置換又は非置換であってよい。置換される場合、置換基(複数可)としては、好ましくはハロ基、オキシ基、アジド基、ニトロ基、シアノ基、アルキル基、アルコキシ基、アルキルチオ基、アルキルチオアルキル基、アルコキシアルキル基、アルキルアミノ基、トリハロメチル基、ヒドロキシル基、メルカプト基、ヒドロキシ基、シアノ基、アルキルシリル基、シクロアルキル基、シクロアルキルアルキル基、ヘテロシクロアルキル基、ヘテロアリール基、アルケニル基、アルキニル基、C1〜6ヒドロカルボニル基、アリール基及びアミノ基が挙げられる。「アルキニル」の例としては、プロパルギル、プロピン及び3−ヘキシンが挙げられる。
本発明の目的のために、「アリール」という用語は、少なくとも一つの芳香族環を含有する芳香族炭化水素環系を指す。芳香族環は、他の芳香族炭化水素環又は非芳香族炭化水素環と場合により縮合していてもよく、又はさもなければ結合していてもよい。アリール基の例としては、例えば、フェニル、ナフチル、1,2,3,4−テトラヒドロナフタレン及びビフェニルが挙げられる。アリール基の好ましい例としては、フェニル及びナフチルが挙げられる。
本発明の目的のために、「シクロアルキル」という用語は、C3〜8環状炭化水素を指す。シクロアルキルの例としては、シクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル、シクロヘプチル及びシクロオクチルが挙げられる。
本発明の目的のために、「シクロアルケニル」という用語は、少なくとも一つの炭素−炭素二重結合を含有するC3〜8環状炭化水素を指す。シクロアルケニルの例としては、シクロペンテニル、シクロペンタジエニル、シクロヘキセニル、1,3−シクロヘキサジエニル、シクロヘプテニル、シクロヘプタトリエニル及びシクロオクテニルが挙げられる。
本発明の目的のために、「シクロアルキルアルキル」という用語は、C3〜8シクロアルキル基で置換されたアルキル基を指す。シクロアルキルアルキルの例としては、シクロプロピルメチル及びシクロペンチルエチルが挙げられる。
本発明の目的のために、「アルコキシ」という用語は、酸素橋を介して親分子部分に結合した、示された数の炭素原子のアルキル基を指す。アルコキシ基の例としては、例えば、メトキシ、エトキシ、プロポキシ及びイソプロポキシが挙げられる。
本発明の目的のために、「アルキルアリール」基は、アルキル基で置換されたアリール基を指す。
本発明の目的のために、「アラルキル」基は、アリール基で置換されアルキル基を指す。
本発明の目的のために、「アルコキシアルキル」基は、アルコキシ基で置換されアルキル基を指す。
本発明の目的のために、「アルキルチオアルキル」基という用語は、アルキル−S−アルキルチオエーテル、例えばメチルチオメチル又はメチルチオエチルを指す。
本発明の目的のために、「アミノ」という用語は、一つ又は複数の水素ラジカルを有機ラジカルで置き換えることによってアンモニアから誘導される当技術分野で公知の窒素含有基を指す。例えば、「アシルアミノ」及び「アルキルアミノ」という用語は、各々、アシル置換基及びアルキル置換基を有する特定のN−置換有機ラジカルを指す。
本発明の目的のために、「アルキルカルボニル」という用語は、アルキル基で置換されたカルボニル基を指す。
本発明の目的のために、「ハロゲン」又は「ハロ」という用語は、フッ素、塩素、臭素及びヨウ素を指す。
本発明の目的のために、「ヘテロシクロアルキル」という用語は、窒素、酸素及び硫黄から選択される少なくとも一つのヘテロ原子を含有する非芳香族環系を指す。ヘテロシクロアルキル環は、他のヘテロシクロアルキル環及び/又は非芳香族炭化水素環と場合により縮合していてもよく、又はさもなければ結合していてもよい。好ましいヘテロシクロアルキル基は、3〜7員を有する。ヘテロシクロアルキル基の例としては、例えばピペラジン、モルホリン、ピペリジン、テトラヒドロフラン、ピロリジン及びピラゾールが挙げられる。好ましいヘテロシクロアルキル基としては、ピペリジニル、ピペラジニル、モルホリニル及びピロリジニルが挙げられる。
本発明の目的のために、「ヘテロアリール」という用語は、窒素、酸素及び硫黄から選択される少なくとも一つのヘテロ原子を含有する芳香族環系を指す。ヘテロアリール環は、一つ又は複数のヘテロアリール環、芳香族もしくは非芳香族炭化水素環、又はヘテロシクロアルキル環と縮合していてもよく、又はさもなければ結合していてもよい。ヘテロアリール環の例としては、例えばピリジン、フラン、チオフェン、5,6,7,8−テトラヒドロイソキノリン及びピリミジンが挙げられる。ヘテロアリール基の好ましい例としては、例えばチエニル、ベンゾチエニル、ピリジル、キノリル、ピラジニル、ピリミジル、イミダゾリル、ベンズイミダゾリル、フラニル、ベンゾフラニル、チアゾリル、ベンゾチアゾリル、イソキサゾリル、オキサジアゾリル、イソチアゾリル、ベンズイソチアゾリル、トリアゾリル、テトラゾリル、ピロリル、インドリル、ピラゾリル及びベンゾピラゾリルが挙げられる。
本発明の目的のために、「ヘテロ原子」という用語は、窒素、酸素及び硫黄を指す。
いくつかの実施形態において、置換アルキルとしては、カルボキシアルキル、アミノアルキル、ジアルキルアミノ、ヒドロキシアルキル及びメルカプトアルキルが挙げられ、置換アルケニルとしては、カルボキシアルケニル、アミノアルケニル、ジアルケニルアミノ、ヒドロキシアルケニル及びメルカプトアルケニルが挙げられ、置換アルキニルとしては、カルボキシアルキニル、アミノアルキニル、ジアルキニルアミノ、ヒドロキシアルキニル及びメルカプトアルキニルが挙げられ、置換シクロアルキルとしては、4−クロロシクロヘキシル等の部分が挙げられ、アリールとしては、ナフチル等の部分が挙げられ、置換アリールとしては、3−ブロモフェニル等の部分が挙げられ、アラルキルとしては、トリル等の部分が挙げられ、ヘテロアルキルとしては、エチルチオフェン等の部分が挙げられ、置換ヘテロアリールとしては、3−メトキシチオフェン等の部分が挙げられ、アルコキシとしては、メトキシ等の部分が挙げられ、フェノキシとしては、3−ニトロフェノキシ等の部分が挙げられる。ハロは、フルオロ、クロロ、ヨード及びブロモを含むと理解されるものとする。
本発明の目的のために、「正の整数」とは、1以上の整数を含むと理解されるものとし、当業者であれば、当業者の合理性の範囲内であることが理解されよう。
本発明の目的のために、「結合した」という用語は、一つの基の別の基への共有(好ましくは)結合又は非共有結合、即ち、化学反応による前記結合を含むと理解されるものとする。
本発明の目的のために、「有効量」及び「十分量」という用語は、所望の効果又は治療効果を達成する量を意味するものとし、このような効果は当業者により理解されている。
本明細書に記載のナノ粒子組成物を使用して形成される「ナノ粒子」及び/又は「ナノ粒子複合体」という用語は、脂質系ナノ複合体を指す。ナノ粒子は、カチオン性脂質、融合性脂質及びPEG脂質の混合物に封入されたオリゴヌクレオチド等の核酸を含有する。あるいは、ナノ粒子は、核酸なしで形成されていてもよい。
本発明の目的のために、「治療用オリゴヌクレオチド」とは、医薬品又は診断薬として使用するオリゴヌクレオチドを指す。
本発明の目的のために、「遺伝子発現の調節」という用語は、投与経路に関わらず、本明細書に記載のナノ粒子での処理なしに観察された遺伝子発現と比較して、好ましくは癌及び炎症と関連する任意の種類の遺伝子のダウンレギュレーション又はアップレギュレーションを広範に含むと理解されるものとする。
本発明の目的のために、「標的遺伝子の発現の抑制」とは、本明細書に記載のナノ粒子での処理なしに観察されたものと比較したとき、mRNA発現又は翻訳されたタンパク質の量を減少させるか、又は減弱させることを意味すると理解されるものとする。このような抑制の適切なアッセイとしては、例えばドットブロット、ノーザンブロット、in situハイブリダイゼーション、ELISA、免疫沈降、酵素機能、並びに当業者に公知の表現型アッセイ等の当業者に公知の技法を用いたタンパク質又はmRNAレベルの検査が挙げられる。処理した状態は、例えば細胞、好ましくは癌細胞又は癌組織のmRNAレベルの減少により確認できる。
大まかに言って、抑制又は処理の成功は、所望の反応が得られた場合に生じるとみなされるものとする。例えば、抑制又は処理の成功は、例えば、腫瘍増殖抑制と関連する遺伝子の10%以上(即ち、20%、30%、40%)のダウンレギュレーションを得ることと定義できる。あるいは、処理の成功は、本明細書に記載のナノ粒子での処理なしに観察されたものと比較したとき、当業者により企図される他の臨床的指標を含め、癌細胞又は癌組織における癌遺伝子mRNAレベルの少なくとも20%、好ましくは30%、より好ましくは40%以上(即ち、50%又は80%)の低下を得ることと定義できる。
さらに、説明の簡便性のための単数形の用語の使用は、それだけに限定されることは決して意図されない。したがって、例えば、オリゴヌクレオチド、コレステロール類似体、カチオン性脂質、融合性脂質、式(I)の放出可能ポリマー脂質、PEG脂質等を含む組成物についての言及は、オリゴヌクレオチド、コレステロール類似体、カチオン性脂質、融合性脂質、、放出可能ポリマー脂質、PEG脂質等の一つ又は複数の分子を指す。オリゴヌクレオチドは、同一又は異なる種類の遺伝子であってよいことも企図される。本明細書に開示された特定の構成、工程段階及び物質は若干変化し得るため、本発明はこのような構成、工程段階及び物質に限定されないことも理解されたい。
本発明の範囲は、添付の特許請求の範囲及びその等価物により限定されるため、本明細書で使用する専門用語は、特定の実施形態を記載する目的のためだけに使用され、限定することは意図されないことも理解されたい。
[式中、
Rは非抗原性ポリマーであり、
L1〜2は独立に選択される二官能性リンカーであり、
Mは酸不安定性リンカーであり、
Qは置換また非置換、飽和又は不飽和のC4〜30含有部分であり、
(a)は0又は正の整数、好ましくは0又は約1〜約10(例えば1、2、3、4、5、6)の整数であり、
(b)は0又は正の整数、好ましくは0又は約1〜約10(例えば1、2、3、4、5、6)の整数であり、
標的基は非抗原性ポリマーに結合していてもよい]
が提供される。
Rは非抗原性ポリマーであり、
L1〜2は独立に選択される二官能性リンカーであり、
Mは酸不安定性リンカーであり、
Qは置換また非置換、飽和又は不飽和のC4〜30含有部分であり、
(a)は0又は正の整数、好ましくは0又は約1〜約10(例えば1、2、3、4、5、6)の整数であり、
(b)は0又は正の整数、好ましくは0又は約1〜約10(例えば1、2、3、4、5、6)の整数であり、
標的基は非抗原性ポリマーに結合していてもよい]
が提供される。
(a)及び(b)が2以上であるとき、L1及びL2は独立に同一又は異なる。
[式中、
Y1は、O、S又はNR31、好ましくはO又はNR31であり、
Y’1はO、S又はNR31、好ましくは0であり、
(c)は0又は1であり、
(d)は0又は正の整数、好ましくは0又は約1〜約10(例えば1、2、3、4、5、6)の整数であり、
(e)は0又は1であり、
XはC、N又はPであり、
Q1はH、C1〜3アルキル、NR32、OH又は
Y1は、O、S又はNR31、好ましくはO又はNR31であり、
Y’1はO、S又はNR31、好ましくは0であり、
(c)は0又は1であり、
(d)は0又は正の整数、好ましくは0又は約1〜約10(例えば1、2、3、4、5、6)の整数であり、
(e)は0又は1であり、
XはC、N又はPであり、
Q1はH、C1〜3アルキル、NR32、OH又は
であるが、
但し、
(i)XがCであるとき、Q3は孤立電子対又は(=O)ではなく、
(ii)XがNであるとき、Q3は孤立電子対であり、
(iii)XがPであるとき、Q3は(=O)であり、(e)は0であり、
L11、L12及びL13は独立に選択される二官能性スペーサーであり、
Y11、Y12及びY13は独立にO、S又はNR35、好ましくはO又はNR35であり、
Y'11、Y'12、Y'13は独立にO、S又はNR35、好ましくはOであり、
R11、R12及びR13は独立に飽和又は不飽和のC4〜30であり、
(f1)、(f2)及び(f3)は独立に0又は1であり、
(g1)、(g2)及び(g3)は独立に0又は1であり、
(h1)、(h2)及び(h3)は独立に又は1であり、
R7〜8は水素、ヒドロキシル、アミン、置換アミン、C1〜6アルキル、C2〜6アルケニル、C2〜6アルキニル、C3〜19分岐アルキル、C3〜8シクロアルキル、C1〜6置換アルキル、C2〜6置換アルケニル、C2〜6置換アルキニル、C3〜8置換シクロアルキル、アリール、置換アリール、ヘテロアリール、置換ヘテロアリール、C1〜6ヘテロアルキル及び置換C1〜6ヘテロアルキル、好ましくは水素、メチル、エチル及びプロピルの中から独立に選択され、
R31〜35は水素、C1〜6アルキル、C2〜6アルケニル、C2〜6アルキニル、C3〜19分岐アルキル、C3〜8シクロアルキル、C1〜6置換アルキル、C2〜6置換アルケニル、C2〜6置換アルキニル、C3〜8置換シクロアルキル、アリール、置換アリール、ヘテロアリール、置換ヘテロアリール、C1〜6ヘテロアルキル及び置換C1〜6ヘテロアルキル、好ましくは水素、メチル、エチル及びプロピルの中から独立に選択されるが、
但し、QはR11、R12及びR13の少なくとも一つ又は二つ(例えば1、2、3)を含む]
を有する。
但し、
(i)XがCであるとき、Q3は孤立電子対又は(=O)ではなく、
(ii)XがNであるとき、Q3は孤立電子対であり、
(iii)XがPであるとき、Q3は(=O)であり、(e)は0であり、
L11、L12及びL13は独立に選択される二官能性スペーサーであり、
Y11、Y12及びY13は独立にO、S又はNR35、好ましくはO又はNR35であり、
Y'11、Y'12、Y'13は独立にO、S又はNR35、好ましくはOであり、
R11、R12及びR13は独立に飽和又は不飽和のC4〜30であり、
(f1)、(f2)及び(f3)は独立に0又は1であり、
(g1)、(g2)及び(g3)は独立に0又は1であり、
(h1)、(h2)及び(h3)は独立に又は1であり、
R7〜8は水素、ヒドロキシル、アミン、置換アミン、C1〜6アルキル、C2〜6アルケニル、C2〜6アルキニル、C3〜19分岐アルキル、C3〜8シクロアルキル、C1〜6置換アルキル、C2〜6置換アルケニル、C2〜6置換アルキニル、C3〜8置換シクロアルキル、アリール、置換アリール、ヘテロアリール、置換ヘテロアリール、C1〜6ヘテロアルキル及び置換C1〜6ヘテロアルキル、好ましくは水素、メチル、エチル及びプロピルの中から独立に選択され、
R31〜35は水素、C1〜6アルキル、C2〜6アルケニル、C2〜6アルキニル、C3〜19分岐アルキル、C3〜8シクロアルキル、C1〜6置換アルキル、C2〜6置換アルケニル、C2〜6置換アルキニル、C3〜8置換シクロアルキル、アリール、置換アリール、ヘテロアリール、置換ヘテロアリール、C1〜6ヘテロアルキル及び置換C1〜6ヘテロアルキル、好ましくは水素、メチル、エチル及びプロピルの中から独立に選択されるが、
但し、QはR11、R12及びR13の少なくとも一つ又は二つ(例えば1、2、3)を含む]
を有する。
好ましくは、QはR11、R12及びR13の少なくとも二つを含む。
(d)が2以上であるとき、各発生時にC(R7)(R8)は同一又は異なる。
本発明の範囲内で企図される二官能性リンカーと二官能性スペーサーとの組合せとしては、リンカー基及びスペーサー基の変数と置換基との組合せが許容されることにより、このような組合せにより式(I)の安定な化合物がもたらされるものが挙げられる。例えば、値と置換基との組合せは、酸素、窒素又はカルボニルをS-S又はイミンに直接隣接して配置させることを許容しない。
一つの好ましい実施形態において、Y'1は酸素である。
別の好ましい実施形態において、Y'11、Y'12及びY'13は酸素である。
別の好ましい実施形態において、Y11、Y12及びY13は独立に酸素又はNHである。
一実施形態において、(f1)、(f2)及び(f3)が同時に0であることはない。
別の実施形態において、(g1)、(g2)、(g3)、(h1)、(h2)及び(h3)が同時に0であることはない。
を有する。
一つの好ましい態様において、酸不安定性リンカーは、ケタール含有部分若しくはアセタール含有部分又はイミン含有部分である。
ケタール含有部分又はアセタール含有部分は次式、
-CR3R4-O-CR1R2-O-CR5R6-
[式中、
R1〜2は水素、C1〜6アルキル、C2〜6アルケニル、C2〜6アルキニル、C3〜19分岐アルキル、C3〜8シクロアルキル、C1〜6置換アルキル、C2〜6置換アルケニル、C2〜6置換アルキニル、C3〜8置換シクロアルキル、アリール、置換アリール、ヘテロアリール、置換ヘテロアリール、C1〜6ヘテロアルキル、置換C1〜6ヘテロアルキル、C1〜6アルコキシ、アリールオキシ、C1〜6ヘテロアルコキシ、ヘテロアリールオキシ、C2〜6アルカノイル、アリールカルボニル、C2〜6アルコキシカルボニル、アリールオキシカルボニル、C2〜6アルカノイルオキシ、アリールカルボニルオキシ、C2〜6置換アルカノイル、置換アリールカルボニル、C2〜6置換アルカノイルオキシ、置換アリールオキシカルボニル及び置換アリールカルボニルオキシ、好ましくは水素、メチル、エチル、プロピルの中から独立に選択され、
R3〜6は水素、アミン、置換アミン、アジド、カルボキシ、シアノ、ハロ、ヒドロキシル、ニトロ、シリルエーテル、スルホニル、メルカプト、C1〜6アルキルメルカプト、アリールメルカプト、置換アリールメルカプト、置換C1〜6アルキルチオ、C1〜6アルキル、C2〜6アルケニル、C2〜6アルキニル、C3〜19分岐アルキル、C3〜8シクロアルキル、C1〜6置換アルキル、C2〜6置換アルケニル、C2〜6置換アルキニル、C3〜8置換シクロアルキル、アリール、置換アリール、ヘテロアリール、置換ヘテロアリール、C1〜6ヘテロアルキル、置換C1〜6ヘテロアルキル、C1〜6アルコキシ、アリールオキシ、C1〜6ヘテロアルコキシ、ヘテロアリールオキシ、C2〜6アルカノイル、アリールカルボニル、C2〜6アルコキシカルボニル、アリールオキシカルボニル、C2〜6アルカノイルオキシ、アリールカルボニルオキシ、C2〜6置換アルカノイル、置換アリールカルボニル、C2〜6置換アルカノイルオキシ、置換アリールオキシカルボニル及び置換アリールカルボニルオキシ、好ましくは水素、メチル、エチル及びプロピルの中から独立に選択される]
を有する。
-CR3R4-O-CR1R2-O-CR5R6-
[式中、
R1〜2は水素、C1〜6アルキル、C2〜6アルケニル、C2〜6アルキニル、C3〜19分岐アルキル、C3〜8シクロアルキル、C1〜6置換アルキル、C2〜6置換アルケニル、C2〜6置換アルキニル、C3〜8置換シクロアルキル、アリール、置換アリール、ヘテロアリール、置換ヘテロアリール、C1〜6ヘテロアルキル、置換C1〜6ヘテロアルキル、C1〜6アルコキシ、アリールオキシ、C1〜6ヘテロアルコキシ、ヘテロアリールオキシ、C2〜6アルカノイル、アリールカルボニル、C2〜6アルコキシカルボニル、アリールオキシカルボニル、C2〜6アルカノイルオキシ、アリールカルボニルオキシ、C2〜6置換アルカノイル、置換アリールカルボニル、C2〜6置換アルカノイルオキシ、置換アリールオキシカルボニル及び置換アリールカルボニルオキシ、好ましくは水素、メチル、エチル、プロピルの中から独立に選択され、
R3〜6は水素、アミン、置換アミン、アジド、カルボキシ、シアノ、ハロ、ヒドロキシル、ニトロ、シリルエーテル、スルホニル、メルカプト、C1〜6アルキルメルカプト、アリールメルカプト、置換アリールメルカプト、置換C1〜6アルキルチオ、C1〜6アルキル、C2〜6アルケニル、C2〜6アルキニル、C3〜19分岐アルキル、C3〜8シクロアルキル、C1〜6置換アルキル、C2〜6置換アルケニル、C2〜6置換アルキニル、C3〜8置換シクロアルキル、アリール、置換アリール、ヘテロアリール、置換ヘテロアリール、C1〜6ヘテロアルキル、置換C1〜6ヘテロアルキル、C1〜6アルコキシ、アリールオキシ、C1〜6ヘテロアルコキシ、ヘテロアリールオキシ、C2〜6アルカノイル、アリールカルボニル、C2〜6アルコキシカルボニル、アリールオキシカルボニル、C2〜6アルカノイルオキシ、アリールカルボニルオキシ、C2〜6置換アルカノイル、置換アリールカルボニル、C2〜6置換アルカノイルオキシ、置換アリールオキシカルボニル及び置換アリールカルボニルオキシ、好ましくは水素、メチル、エチル及びプロピルの中から独立に選択される]
を有する。
好ましくは、R1及びR2は水素、C1〜6アルキル、C3〜8分岐アルキル、C3〜8シクロアルキル、C1〜6置換アルキル、C3〜8置換シクロアルキル、アリール、置換アリール及びアラルキル、好ましくは水素、メチル、エチル、プロピルの中から独立に選択される。
一つの好ましい実施形態において、R1及びR2がいずれも同時に水素であることはない。
別の好ましい実施形態において、R3〜6は水素、C1〜6アルキル、C3〜8分岐アルキル、C3〜8シクロアルキル、C1〜6置換アルキル、C3〜8置換シクロアルキル、アリール、置換アリール及びアラルキルの中から独立に選択される。より好ましくは、R3〜6は全て水素である。
より好ましくは、R1及びR2は同時又は異なる飽和又は不飽和のC1〜6アルキル、例えばエチル、メチル、プロピル及びブチルである。更により好ましくは、R1及びR2はいずれもメチルである。一つの特定の実施形態において、M基は-CH2-O-C(CH3)(CH3)-O-CH2-である。
を有する。
イミンリンカーは、次式:
-N=CR10-又はCR10=N-
(式中、R10は水素、C1〜6アルキル、C3〜8分岐アルキル、C3〜8シクロアルキル、C1〜6置換アルキル、C3〜8置換シクロアルキル、アリール及び置換アリール、好ましくは水素、アルキル、メチル又はプロピルである)
を有する。
-N=CR10-又はCR10=N-
(式中、R10は水素、C1〜6アルキル、C3〜8分岐アルキル、C3〜8シクロアルキル、C1〜6置換アルキル、C3〜8置換シクロアルキル、アリール及び置換アリール、好ましくは水素、アルキル、メチル又はプロピルである)
を有する。
好ましくは、R10は水素であり、酸不安定性リンカーは-N=CH-又は-CH=N-である。
を有する。
(式中、Aは標的基、好ましくは細胞表面標的基である)
を有する。
を有する。
標的基は、リンカー分子、例えばアミド(amide)、アミド(amido)、カルボニル、エステル、ペプチド、ジスルフィド、シラン、ヌクレオシド、脱塩基ヌクレオシド、ポリエーテル、ポリアミン、ポリアミド、ペプチド、炭水化物、脂質、ポリ炭化水素、リン酸エステル、ホスホルアミデート、チオホスフェート、アルキルホスフェート、マレイミジルのリンカー又は光解離性リンカーを用いて非抗原性ポリマーに結合できる。当技術分野で公知の任意の技法は、過度に実験するまでもなく、ポリエチレングリコール等のポリマーに標的基を結合させるために使用できる。例えば、標的基への結合のためのポリマーは、米国特許第5,122,614号及び第5,808,096号に記載の活性化法、並びに当技術分野で公知の他の技法を用いて過度に実験するまでもなく適切に活性化されたポリマーに変換される。標的基への結合に有用な活性化PEGの例としては、それだけに限らないが、ポリエチレングリコール-スクシネート、ポリエチレングリコール-スクシンイミジルスクシネート(PEG-NHS)、ポリエチレングリコール-酢酸(PEG-CH2COOH)、ポリエチレングリコールアミン(PEG-NH2)、ポリエチレングリコール-マレイミド及びポリエチレングリコールトレシレート(PEG-TRES)が挙げられる。
(式中、Aは標的基であり、(z1)は0又は1である)
を有する。
を有する。
(式中、Aは標的基であり、(z1)は0又は1である)
を有する。
を有する。
2.非抗原性ポリマー:R基
本明細書に記載の放出可能ポリマー脂質中で使用するポリマーは、ポリアルキレンオキシド(PAO)のように、好ましくは水溶性ポリマーであり、実質的に非抗原性である。
本明細書に記載の放出可能ポリマー脂質中で使用するポリマーは、ポリアルキレンオキシド(PAO)のように、好ましくは水溶性ポリマーであり、実質的に非抗原性である。
一つの好ましい態様において、ポリアルキレンオキシドとしては、ポリエチレングリコール及びポリプロピレングリコールが挙げられる。より好ましくは、ポリアルキレンオキシドとしては、ポリエチレングリコール(PEG)が挙げられる。
ポリアルキレンオキシドは約200〜約100000ダルトン、好ましくは約200〜約20000ダルトンの数平均分子量を有する。ポリアルキレンオキシドはより好ましくは約500〜約10000ダルトン、更により好ましくは約1000〜約5000ダルトンであってよい。一つの特定の実施形態において、ポリマー部分は、約2000ダルトンの総数平均分子量を有する。
好ましくは、ポリアルキレンは約200〜約20000ダルトン、より好ましくは約500〜約10000ダルトン、更により好ましくは約1000〜約5000ダルトン(即ち、約1500〜約3000ダルトン)の範囲の数平均分子量を有するポリエチレングリコールである。一つの特定の実施形態において、PEGは約2000ダルトンの分子量を有する。別の特定の実施形態において、PEGは約750ダルトンの分子量を有する。
PEGは、次の構造式:
-O-(CH2CH2O)n-
(式中、(n)は、PEG脂質のポリマー部分が約200〜約100000ダルトン、好ましくは約200〜約20000ダルトンの数平均分子量を有するように、約5〜約2300、好ましくは約5〜約460の正の整数である)で一般に表される。(n)は、ポリマーの重合度を表し、ポリマーの分子量に依存する。
-O-(CH2CH2O)n-
(式中、(n)は、PEG脂質のポリマー部分が約200〜約100000ダルトン、好ましくは約200〜約20000ダルトンの数平均分子量を有するように、約5〜約2300、好ましくは約5〜約460の正の整数である)で一般に表される。(n)は、ポリマーの重合度を表し、ポリマーの分子量に依存する。
或いは、ポリエチレングリコール(PEG)残基部分は、次の構造式:
-Y71-(CH2CH2O)n-CH2CH2Y71-、
-Y71-(CH2CH2O)n-CH2C(=Y72)-Y71-、
-Y71-C(=Y72)-(CH2)a12-Y73-(CH2CH2O)n-CH2CH2-Y73-(CH2)a12-C(=Y72)-Y71-及び
-Y71-(CR71R72)a12-Y73-(CH2)b12-O-(CH2CH2O)n-(CH2)b12-Y73-(CR71R72)a12-Y71-
[式中、
Y71及びY73は独立にO、S、SO、SO2、NR73又は結合であり、
Y72はO、S又はNR74であり、
R71〜74は水素、C1〜6アルキル、C2〜6アルケニル、C2〜6アルキニル、C3〜19分岐アルキル、C3〜8シクロアルキル、C1〜6置換アルキル、C2〜6置換アルケニル、C2〜6置換アルキニル、C3〜8置換シクロアルキル、アリール、置換アリール、ヘテロアリール、置換ヘテロアリール、C1〜6ヘテロアルキル、置換C1〜6ヘテロアルキル、C1〜6アルコキシ、アリールオキシ、C1〜6ヘテロアルコキシ、ヘテロアリールオキシ、C2〜6アルカノイル、アリールカルボニル、C2〜6アルコキシカルボニル、アリールオキシカルボニル、C2〜6アルカノイルオキシ、アリールカルボニルオキシ、C2〜6置換アルカノイル、置換アリールカルボニル、C2〜6置換アルカノイルオキシ、置換アリールオキシカルボニル、C2〜6置換アルカノイルオキシ及び置換アリールカルボニルオキシ、好ましくは水素、メチル、エチル又はプロピルから独立に選択され、
(a12)及び(b12)は独立に0又は正の整数、好ましくは0又は約1〜約6(例えば、1、2、3)の整数、より好ましくは1であり、
(n)は約5〜約2300、好ましくは約5〜約460の整数である]
で表すことができる。
-Y71-(CH2CH2O)n-CH2CH2Y71-、
-Y71-(CH2CH2O)n-CH2C(=Y72)-Y71-、
-Y71-C(=Y72)-(CH2)a12-Y73-(CH2CH2O)n-CH2CH2-Y73-(CH2)a12-C(=Y72)-Y71-及び
-Y71-(CR71R72)a12-Y73-(CH2)b12-O-(CH2CH2O)n-(CH2)b12-Y73-(CR71R72)a12-Y71-
[式中、
Y71及びY73は独立にO、S、SO、SO2、NR73又は結合であり、
Y72はO、S又はNR74であり、
R71〜74は水素、C1〜6アルキル、C2〜6アルケニル、C2〜6アルキニル、C3〜19分岐アルキル、C3〜8シクロアルキル、C1〜6置換アルキル、C2〜6置換アルケニル、C2〜6置換アルキニル、C3〜8置換シクロアルキル、アリール、置換アリール、ヘテロアリール、置換ヘテロアリール、C1〜6ヘテロアルキル、置換C1〜6ヘテロアルキル、C1〜6アルコキシ、アリールオキシ、C1〜6ヘテロアルコキシ、ヘテロアリールオキシ、C2〜6アルカノイル、アリールカルボニル、C2〜6アルコキシカルボニル、アリールオキシカルボニル、C2〜6アルカノイルオキシ、アリールカルボニルオキシ、C2〜6置換アルカノイル、置換アリールカルボニル、C2〜6置換アルカノイルオキシ、置換アリールオキシカルボニル、C2〜6置換アルカノイルオキシ及び置換アリールカルボニルオキシ、好ましくは水素、メチル、エチル又はプロピルから独立に選択され、
(a12)及び(b12)は独立に0又は正の整数、好ましくは0又は約1〜約6(例えば、1、2、3)の整数、より好ましくは1であり、
(n)は約5〜約2300、好ましくは約5〜約460の整数である]
で表すことができる。
PEGの末端部分(A'基)は、H、NH2、OH、CO2H、C1〜6アルキル(例えばメチル、エチル、プロピル)、C1〜6アルコキシ(例えば、メトキシ、エトキシ、プロピルオキシ)、アシル又はアリールで終わることができる。好ましい実施形態において、PEGの末端ヒドロキシル基は、メトキシ基又はメチル基で置換されている。一つの好ましい実施形態において、PEG脂質で使用するPEGはメトキシPEGである。
PEGは酸不安定性リンカーに直接結合していてもよく、又はリンカー部分を介して結合していてもよい。酸不安定性又は脂質構造への結合のためのポリマーは、米国特許第5,122,614号及び第5,808,096号に記載の活性化法、並びに当業者に公知の他の技法を用いて過度に実験するまでもなく適切に活性化されたポリマーに変換される。
PEG脂質の調製に有用な活性化PEGの例としては、例えばメトキシポリエチレングリコールスクシネート、メトキシポリエチレングリコールスクシンイミジルスクシネートmPEG-NHS、メトキシポリエチレングリコール酢酸(mPEG-CH2COOH)、メトキシポリエチレングリコールアミン(mPEG-NH2)及びメトキシポリエチレングリコールトレシレート(mPEG-TRES)が挙げられる。
ある種の態様において、末端カルボン酸基を有するポリマーは、本明細書に記載のPEG脂質のために使用できる。高純度で末端カルボン酸を有するポリマーを調製するための方法は、その内容が参照により本明細書に組み込まれている、米国特許出願第11/328,662号に記載されている。
別の態様において、末端アミン基を有するポリマーは、本明細書に記載のPEG脂質を製造するために使用できる。高純度で末端アミンを含有するポリマーを調製する方法は、それらの各々の内容が参照により組み込まれている、米国特許出願第11/508,507号及び第11/537,172号に記載されている。
本発明の更なる態様において、本明細書に含まれるポリマー物質は、室温で水溶性であることが好ましい。このようなポリマーの非限定的リストとしては、ポリアルキレンオキシドホモポリマー、例えばポリエチレングリコール(PEG)又はポリプロピレングリコール、ポリオキシエチレン化ポリオール、それらのコポリマー及びそれらのブロックコポリマーが挙げられるが、但し、ブロックコポリマーの水溶解性は維持されることとする。
更なる実施形態において、及びPEG等のPAO系ポリマーの代替物として、一つ又は複数の効果的な非抗原性物質、例えばデキストラン、ポリビニルアルコール、炭水化物系ポリマー、ヒドロキシプロピルメタクリルアミド(HPMA)、ポリアルキレンオキシド及び/又はそれらのコポリマーを使用できる。PEGの代わりに使用できる適切なポリマーの例としては、それだけに限らないが、ポリビニルピロリドン、ポリメチルオキサゾリン、ポリエチルオキサゾリン、ポリヒドロキシプロピルメタクリルアミド、ポリメタクリルアミド及びポリジメチルアクリルアミド、ポリ乳酸、ポリグリコール酸、並びに誘導体化セルロース、例えばヒドロキシメチルセルロース又はヒドロキシエチルセルロースが挙げられる。その内容が参照により本明細書に組み込まれている、同一出願人による米国特許第6,153,655号も参照のこと。当業者であれば、PEG等のPAOについて本明細書に記載されているように、同種の活性剤が使用されることを理解されよう。当業者であれば、前記リストは単に例示であり、本明細書に記載の特性を有する全てのポリマー材料が企図されることを更に理解されよう。本発明の目的のために、「実質的又は効果的な非抗原性」とは、非毒性であり、哺乳動物において感知できる免疫原性反応を誘発しないことが当技術分野で理解されている全ての物質を意味する。
3.二官能性リンカー:L1基及びL2基
本発明によれば、式(I)の化合物に含まれるL1基は、
−(CR21R22)t1−[C(=Y16)]a3−、
−(CR21R22)t1Y17−(CR23R24)t2−(Y18)a2−[C(=Y16)]a3−、
−(CR21R22CR23R24Y17)t1−[C(=Y16)]a3−、
−(CR21R22CR23R24Y17)t1(CR25R26)t4−(Y18)a2−[C(=Y16)]a3−、
−[(CR21R22CR23R24)t2Y17]t3(CR25R26)t4−(Y18)a2−[C(=Y16)]a3−、
−(CR21R22)t1−[(CR23R24)t2Y17]t3(CR25R26)t4−(Y18)a2−[C(=Y16)]a3−、
−(CR21R22)t1(Y17)a2[C(=Y16)]a3(CR23R24)t2−、
−(CR21R22)t1(Y17)a2[C(=Y16)]a3Y14(CR23R24)t2−、
−(CR21R22)t1(Y17)a2[C(=Y16)]a3(CR23R24)t2−Y15−(CR23R24)t3−、
−(CR21R22)t1(Y17)a2[C(=Y16)]a3Y14(CR23R24)t2−Y15−(CR23R24)t3−、
−(CR21R22)t1(Y17)a2[C(=Y16)]a3(CR23R24CR25R26Y19)t2(CR27CR28)t3−、
−(CR21R22)t1(Y17)a2[C(=Y16)]a3Y14(CR23R24CR25R26Y19)t2(CR27CR28)t3−、及び
本発明によれば、式(I)の化合物に含まれるL1基は、
−(CR21R22)t1−[C(=Y16)]a3−、
−(CR21R22)t1Y17−(CR23R24)t2−(Y18)a2−[C(=Y16)]a3−、
−(CR21R22CR23R24Y17)t1−[C(=Y16)]a3−、
−(CR21R22CR23R24Y17)t1(CR25R26)t4−(Y18)a2−[C(=Y16)]a3−、
−[(CR21R22CR23R24)t2Y17]t3(CR25R26)t4−(Y18)a2−[C(=Y16)]a3−、
−(CR21R22)t1−[(CR23R24)t2Y17]t3(CR25R26)t4−(Y18)a2−[C(=Y16)]a3−、
−(CR21R22)t1(Y17)a2[C(=Y16)]a3(CR23R24)t2−、
−(CR21R22)t1(Y17)a2[C(=Y16)]a3Y14(CR23R24)t2−、
−(CR21R22)t1(Y17)a2[C(=Y16)]a3(CR23R24)t2−Y15−(CR23R24)t3−、
−(CR21R22)t1(Y17)a2[C(=Y16)]a3Y14(CR23R24)t2−Y15−(CR23R24)t3−、
−(CR21R22)t1(Y17)a2[C(=Y16)]a3(CR23R24CR25R26Y19)t2(CR27CR28)t3−、
−(CR21R22)t1(Y17)a2[C(=Y16)]a3Y14(CR23R24CR25R26Y19)t2(CR27CR28)t3−、及び
[式中、
Y16はO、NR28又はS、好ましくは酸素であり、
Y14〜15及びY17〜19は独立にO、NR29又はS、好ましくはO又はNR29であり、
R21〜27は水素、ヒドロキシル、アミン、C1〜6アルキル、C3〜12分岐アルキル、C3〜8シクロアルキル、C1〜6置換アルキル、C3〜8置換シクロアルキル、アリール、置換アリール、アラルキル、C1〜6ヘテロアルキル、置換C1〜6ヘテロアルキル、C1〜6アルコキシ、フェノキシ及びC1〜6ヘテロアルコキシ、好ましくは水素、メチル、エチル又はプロピルの中から独立に選択され、
R28〜29は水素、C1〜6アルキル、C3〜12分岐アルキル、C3〜8シクロアルキル、C1〜6置換アルキル、C3〜8置換シクロアルキル、アリール、置換アリール、アラルキル、C1〜6ヘテロアルキル、置換C1〜6ヘテロアルキル、C1〜6アルコキシ、フェノキシ及びC1〜6ヘテロアルコキシ、好ましくは水素、メチル、エチル又はプロピルの中から独立に選択され、
(t1)、(t2)、(t3)及び(t4)は独立に0又は正の整数、好ましくは0又は約1〜約10(例えば1、2、3、4、5、6)の正の整数であり、
(a2)及び(a3)は独立に0又は1である]
の中から選択される。
Y16はO、NR28又はS、好ましくは酸素であり、
Y14〜15及びY17〜19は独立にO、NR29又はS、好ましくはO又はNR29であり、
R21〜27は水素、ヒドロキシル、アミン、C1〜6アルキル、C3〜12分岐アルキル、C3〜8シクロアルキル、C1〜6置換アルキル、C3〜8置換シクロアルキル、アリール、置換アリール、アラルキル、C1〜6ヘテロアルキル、置換C1〜6ヘテロアルキル、C1〜6アルコキシ、フェノキシ及びC1〜6ヘテロアルコキシ、好ましくは水素、メチル、エチル又はプロピルの中から独立に選択され、
R28〜29は水素、C1〜6アルキル、C3〜12分岐アルキル、C3〜8シクロアルキル、C1〜6置換アルキル、C3〜8置換シクロアルキル、アリール、置換アリール、アラルキル、C1〜6ヘテロアルキル、置換C1〜6ヘテロアルキル、C1〜6アルコキシ、フェノキシ及びC1〜6ヘテロアルコキシ、好ましくは水素、メチル、エチル又はプロピルの中から独立に選択され、
(t1)、(t2)、(t3)及び(t4)は独立に0又は正の整数、好ましくは0又は約1〜約10(例えば1、2、3、4、5、6)の正の整数であり、
(a2)及び(a3)は独立に0又は1である]
の中から選択される。
本発明の範囲内で企図される二官能性L1リンカーとしては、変数と置換基との組合せが許容されることにより、このような組合せにより式(I)の安定な化合物がもたらされるものが挙げられる。例えば、(a3)が0であるとき、Y17はY14に直接結合しない。
本発明の目的のために、二官能性リンカーの値が2以上の正の整数であるとき、同一又は異なる二官能性リンカーを使用できる。
(t1)、(t2)、(t3)及び(t4)が各々独立に2以上であるとき、各発生時にR21〜R28は独立に同一又は異なる。
一実施形態において、Y14〜15及びY17〜19はO又はNHであり、R21〜29は独立に水素又はメチルである。
別の実施形態において、Y16はOであり、Y14〜15及びY17〜19はO又はNHであり、R21〜29は水素である。
ある種の実施形態において、L1は、
−(CH2)t1−[C(=O)]a3−、
−(CH2)t1Y17−(CH2)t2−(Y18)a2−[C(=O)]a3−、
−(CH2CH2Y17)t1−[C(=O)]a3−、
−(CH2CH2Y17)t1(CH2)t4−(Y18)a2−[C(=O)]a3−、
−[(CH2CH2)t2Y17]t3(CH2)t4−(Y18)a2−[C(=O)]a3−、
−(CH2)t1−[(CH2)t2Y17]t3(CH2)t4−(Y18)a2−[C(=O)]a3−、
−(CH2)t1(Y17)a2[C(=O)]a3(CH2)t2−、
−(CH2)t1(Y17)a2[C(=O)]a3Y14(CH2)t2−、
−(CH2)t1(Y17)a2[C(=O)]a3(CH2)t2−Y15−(CH2)t3−、
−(CH2)t1(Y17)a2[C(=O)]a3Y14(CH2)t2−Y15−(CH2)t3−、
−(CH2)t1(Y17)a2[C(=O)]a3(CH2CH2Y19)t2(CH2)t3−、及び
−(CH2)t1(Y17)a2[C(=O)]a3Y14(CH2CH2Y19)t2(CH2)t3−
[式中、
Y14〜15及びY17〜19は独立にO又はNHであり、
(t1)、(t2)、(t3)及び(t4)は独立に0又は正の整数、好ましくは0又は約1〜約10(例えば1、2、3、4、5、6)の正の整数であり、
(a2)及び(a3)は独立に0又は1である]
の中から独立に選択される。
−(CH2)t1−[C(=O)]a3−、
−(CH2)t1Y17−(CH2)t2−(Y18)a2−[C(=O)]a3−、
−(CH2CH2Y17)t1−[C(=O)]a3−、
−(CH2CH2Y17)t1(CH2)t4−(Y18)a2−[C(=O)]a3−、
−[(CH2CH2)t2Y17]t3(CH2)t4−(Y18)a2−[C(=O)]a3−、
−(CH2)t1−[(CH2)t2Y17]t3(CH2)t4−(Y18)a2−[C(=O)]a3−、
−(CH2)t1(Y17)a2[C(=O)]a3(CH2)t2−、
−(CH2)t1(Y17)a2[C(=O)]a3Y14(CH2)t2−、
−(CH2)t1(Y17)a2[C(=O)]a3(CH2)t2−Y15−(CH2)t3−、
−(CH2)t1(Y17)a2[C(=O)]a3Y14(CH2)t2−Y15−(CH2)t3−、
−(CH2)t1(Y17)a2[C(=O)]a3(CH2CH2Y19)t2(CH2)t3−、及び
−(CH2)t1(Y17)a2[C(=O)]a3Y14(CH2CH2Y19)t2(CH2)t3−
[式中、
Y14〜15及びY17〜19は独立にO又はNHであり、
(t1)、(t2)、(t3)及び(t4)は独立に0又は正の整数、好ましくは0又は約1〜約10(例えば1、2、3、4、5、6)の正の整数であり、
(a2)及び(a3)は独立に0又は1である]
の中から独立に選択される。
(t1)又は(t3)が2以上であるとき、各発生時にY17は同一又は異なる。
(t2)が2以上であるとき、各発生時にY19は同一又は異なる。
さらなる実施形態及び/又は代替実施形態において、L1基の例示的例は、
−CH2−、−(CH2)2−、−(CH2)3−、−(CH2)4−、−(CH2)5−、−(CH2)6−、−NH(CH2)−、
−CH(NH2)CH2−、
−(CH2)4−C(=O)−、−(CH2)5−C(=O)−、−(CH2)6−C(=O)−、
−CH2CH2O−CH2O−C(=O)−、
−(CH2CH2O)2−CH2O−C(=O)−、
−(CH2CH2O)3−CH2O−C(=O)−、
−(CH2CH2O)2−C(=O)−、
−CH2CH2O−CH2CH2NH−C(=O)−、
−(CH2CH2O)2−CH2CH2NH−C(=O)−、
−CH2−O−CH2CH2O−CH2CH2NH−C(=O)−、
−CH2−O−(CH2CH2O)2−CH2CH2NH−C(=O)−、
−CH2−O−CH2CH2O−CH2C(=O)−、
−CH2−O−(CH2CH2O)2−CH2C(=O)−、
−(CH2)4−C(=O)NH−、−(CH2)5−C(=O)NH−、
−(CH2)6−C(=O)NH−、
−CH2CH2O−CH2O−C(=O)−NH−、
−(CH2CH2O)2−CH2O−C(=O)−NH−、
−(CH2CH2O)3−CH2O−C(=O)−NH−、
−(CH2CH2O)2−C(=O)−NH−、
−CH2CH2O−CH2CH2NH−C(=O)−NH−、
−(CH2CH2O)2−CH2CH2NH−C(=O)−NH−、
−CH2−O−CH2CH2O−CH2CH2NH−C(=O)−NH−、
−CH2−O−(CH2CH2O)2−CH2CH2NH−C(=O)−NH−、
−CH2−O−CH2CH2O−CH2C(=O)−NH−、
−CH2−O−(CH2CH2O)2−CH2C(=O)−NH−、
−(CH2CH2O)2−、−CH2CH2O−CH2O−、
−(CH2CH2O)2−CH2CH2NH−、
−(CH2CH2O)3−CH2CH2NH−、
−CH2CH2O−CH2CH2NH−、
−(CH2CH2O)2−CH2CH2NH−、
−CH2−O−CH2CH2O−CH2CH2NH−、
−CH2−O−(CH2CH2O)2−CH2CH2NH−、
−CH2−O−CH2CH2O−、
−CH2−O−(CH2CH2O)2−、
−CH2−、−(CH2)2−、−(CH2)3−、−(CH2)4−、−(CH2)5−、−(CH2)6−、−NH(CH2)−、
−CH(NH2)CH2−、
−(CH2)4−C(=O)−、−(CH2)5−C(=O)−、−(CH2)6−C(=O)−、
−CH2CH2O−CH2O−C(=O)−、
−(CH2CH2O)2−CH2O−C(=O)−、
−(CH2CH2O)3−CH2O−C(=O)−、
−(CH2CH2O)2−C(=O)−、
−CH2CH2O−CH2CH2NH−C(=O)−、
−(CH2CH2O)2−CH2CH2NH−C(=O)−、
−CH2−O−CH2CH2O−CH2CH2NH−C(=O)−、
−CH2−O−(CH2CH2O)2−CH2CH2NH−C(=O)−、
−CH2−O−CH2CH2O−CH2C(=O)−、
−CH2−O−(CH2CH2O)2−CH2C(=O)−、
−(CH2)4−C(=O)NH−、−(CH2)5−C(=O)NH−、
−(CH2)6−C(=O)NH−、
−CH2CH2O−CH2O−C(=O)−NH−、
−(CH2CH2O)2−CH2O−C(=O)−NH−、
−(CH2CH2O)3−CH2O−C(=O)−NH−、
−(CH2CH2O)2−C(=O)−NH−、
−CH2CH2O−CH2CH2NH−C(=O)−NH−、
−(CH2CH2O)2−CH2CH2NH−C(=O)−NH−、
−CH2−O−CH2CH2O−CH2CH2NH−C(=O)−NH−、
−CH2−O−(CH2CH2O)2−CH2CH2NH−C(=O)−NH−、
−CH2−O−CH2CH2O−CH2C(=O)−NH−、
−CH2−O−(CH2CH2O)2−CH2C(=O)−NH−、
−(CH2CH2O)2−、−CH2CH2O−CH2O−、
−(CH2CH2O)2−CH2CH2NH−、
−(CH2CH2O)3−CH2CH2NH−、
−CH2CH2O−CH2CH2NH−、
−(CH2CH2O)2−CH2CH2NH−、
−CH2−O−CH2CH2O−CH2CH2NH−、
−CH2−O−(CH2CH2O)2−CH2CH2NH−、
−CH2−O−CH2CH2O−、
−CH2−O−(CH2CH2O)2−、
−C(=O)NH(CH2)2−、−CH2C(=O)NH(CH2)2−、
−C(=O)NH(CH2)3−、−CH2C(=O)NH(CH2)3−、
−C(=O)NH(CH2)4−、−CH2C(=O)NH(CH2)4−、
−C(=O)NH(CH2)5−、−CH2C(=O)NH(CH2)5−、
−C(=O)NH(CH2)6−、−CH2C(=O)NH(CH2)6−、
−C(=O)O(CH2)2−、−CH2C(=O)O(CH2)2−、
−C(=O)O(CH2)3−、−CH2C(=O)O(CH2)3−、
−C(=O)O(CH2)4−、−CH2C(=O)O(CH2)4−、
−C(=O)O(CH2)5−、−CH2C(=O)O(CH2)5−、
−C(=O)O(CH2)6−、−CH2C(=O)O(CH2)6−、
−(CH2CH2)2NHC(=O)NH(CH2)2−、
−(CH2CH2)2NHC(=O)NH(CH2)3−、
−(CH2CH2)2NHC(=O)NH(CH2)4−、
−(CH2CH2)2NHC(=O)NH(CH2)5−、
−(CH2CH2)2NHC(=O)NH(CH2)6−、
−(CH2CH2)2NHC(=O)O(CH2)2−、
−(CH2CH2)2NHC(=O)O(CH2)3−、
−(CH2CH2)2NHC(=O)O(CH2)4−、
−(CH2CH2)2NHC(=O)O(CH2)5−、
−(CH2CH2)2NHC(=O)O(CH2)6−、
−(CH2CH2)2NHC(=O)(CH2)2−、
−(CH2CH2)2NHC(=O)(CH2)3−、
−(CH2CH2)2NHC(=O)(CH2)4−、
−(CH2CH2)2NHC(=O)(CH2)5−、及び
−(CH2CH2)2NHC(=O)(CH2)6−の中から選択される。
−C(=O)NH(CH2)3−、−CH2C(=O)NH(CH2)3−、
−C(=O)NH(CH2)4−、−CH2C(=O)NH(CH2)4−、
−C(=O)NH(CH2)5−、−CH2C(=O)NH(CH2)5−、
−C(=O)NH(CH2)6−、−CH2C(=O)NH(CH2)6−、
−C(=O)O(CH2)2−、−CH2C(=O)O(CH2)2−、
−C(=O)O(CH2)3−、−CH2C(=O)O(CH2)3−、
−C(=O)O(CH2)4−、−CH2C(=O)O(CH2)4−、
−C(=O)O(CH2)5−、−CH2C(=O)O(CH2)5−、
−C(=O)O(CH2)6−、−CH2C(=O)O(CH2)6−、
−(CH2CH2)2NHC(=O)NH(CH2)2−、
−(CH2CH2)2NHC(=O)NH(CH2)3−、
−(CH2CH2)2NHC(=O)NH(CH2)4−、
−(CH2CH2)2NHC(=O)NH(CH2)5−、
−(CH2CH2)2NHC(=O)NH(CH2)6−、
−(CH2CH2)2NHC(=O)O(CH2)2−、
−(CH2CH2)2NHC(=O)O(CH2)3−、
−(CH2CH2)2NHC(=O)O(CH2)4−、
−(CH2CH2)2NHC(=O)O(CH2)5−、
−(CH2CH2)2NHC(=O)O(CH2)6−、
−(CH2CH2)2NHC(=O)(CH2)2−、
−(CH2CH2)2NHC(=O)(CH2)3−、
−(CH2CH2)2NHC(=O)(CH2)4−、
−(CH2CH2)2NHC(=O)(CH2)5−、及び
−(CH2CH2)2NHC(=O)(CH2)6−の中から選択される。
ある種の実施形態において、L2は、
−(CR’21R’22)t’1−[C(=Y’16)]a’3(CR’27CR’28)t’2−、
−(CR’21R’22)t’1Y’14−(CR’23R’24)t’2−(Y’15)a’2−[C(=Y’16)]a’3(CR’27CR’28)t’3−、
−(CR’21R’22CR’23R’24Y’14)t’1−[C(=Y’16)]a’3(CR’27CR’28)t’2−、
−(CR’21R’22CR’23R’24Y’14)t’1(CR’25R’26)t’2−(Y’15)a’2−[C(=Y’16)]a’3(CR’27CR’28)t’3−、
−[(CR’21R’22CR’23R’24)t’2Y’14]t’1(CR’25R’26)t’2−(Y’15)a’2−[C(=Y’16)]a’3(CR’27CR’28)t’3−、
−(CR’21R’22)t’1−[(CR’23R’24)t’2Y’14]t’2(CR’25R’26)t’3−(Y’15)a’2−[C(=Y’16)]a’3(CR’27CR’28)t’4−
−(CR’21R’22)t’1(Y’14)a’2[C(=Y’16)]a’3(CR’23R’24)t’2−、
−(CR’21R’22)t’1(Y’14)a’2[C(=Y’16)]a’3Y’15(CR’23R’24)t’2−、
−(CR’21R’22)t’1(Y’14)a’2[C(=Y’16)]a’3(CR’23R’24)t’2−Y’15−(CR’23R’24)t’3−、
−(CR’21R’22)t’1(Y’14)a’2[C(=Y’16)]a’3Y’14(CR’23R’24)t’2−Y’15−(CR’23R’24)t’3−、
−(CR’21R’22)t’1(Y’14)a’2[C(=Y’16)]a’3(CR’23R’24CR’25R’26Y’15)t’2(CR’27CR’28)t’3−、
−(CR’21R’22)t’1(Y’14)a’2[C(=Y’16)]a’3Y’17(CR’23R’24CR’25R’26Y’15)t’2(CR’27CR’28)t’3−、及び
−(CR’21R’22)t’1−[C(=Y’16)]a’3(CR’27CR’28)t’2−、
−(CR’21R’22)t’1Y’14−(CR’23R’24)t’2−(Y’15)a’2−[C(=Y’16)]a’3(CR’27CR’28)t’3−、
−(CR’21R’22CR’23R’24Y’14)t’1−[C(=Y’16)]a’3(CR’27CR’28)t’2−、
−(CR’21R’22CR’23R’24Y’14)t’1(CR’25R’26)t’2−(Y’15)a’2−[C(=Y’16)]a’3(CR’27CR’28)t’3−、
−[(CR’21R’22CR’23R’24)t’2Y’14]t’1(CR’25R’26)t’2−(Y’15)a’2−[C(=Y’16)]a’3(CR’27CR’28)t’3−、
−(CR’21R’22)t’1−[(CR’23R’24)t’2Y’14]t’2(CR’25R’26)t’3−(Y’15)a’2−[C(=Y’16)]a’3(CR’27CR’28)t’4−
−(CR’21R’22)t’1(Y’14)a’2[C(=Y’16)]a’3(CR’23R’24)t’2−、
−(CR’21R’22)t’1(Y’14)a’2[C(=Y’16)]a’3Y’15(CR’23R’24)t’2−、
−(CR’21R’22)t’1(Y’14)a’2[C(=Y’16)]a’3(CR’23R’24)t’2−Y’15−(CR’23R’24)t’3−、
−(CR’21R’22)t’1(Y’14)a’2[C(=Y’16)]a’3Y’14(CR’23R’24)t’2−Y’15−(CR’23R’24)t’3−、
−(CR’21R’22)t’1(Y’14)a’2[C(=Y’16)]a’3(CR’23R’24CR’25R’26Y’15)t’2(CR’27CR’28)t’3−、
−(CR’21R’22)t’1(Y’14)a’2[C(=Y’16)]a’3Y’17(CR’23R’24CR’25R’26Y’15)t’2(CR’27CR’28)t’3−、及び
[式中、
Y’16はO、NR’28又はS、好ましくは酸素であり、
Y’14〜15及びY’17は独立にO、NR’29又はS、好ましくはO又はNR’29であり、
R’21〜27は水素、ヒドロキシル、アミン、C1〜6アルキル、C3〜12分岐アルキル、C3〜8シクロアルキル、C1〜6置換アルキル、C3〜8置換シクロアルキル、アリール、置換アリール、アラルキル、C1〜6ヘテロアルキル、置換C1〜6ヘテロアルキル、C1〜6アルコキシ、フェノキシ及びC1〜6ヘテロアルコキシ、好ましくは水素、メチル、エチル又はプロピルの中から独立に選択され、
R’28〜29は水素、C1〜6アルキル、C3〜12分岐アルキル、C3〜8シクロアルキル、C1〜6置換アルキル、C3〜8置換シクロアルキル、アリール、置換アリール、アラルキル、C1〜6ヘテロアルキル、置換C1〜6ヘテロアルキル、C1〜6アルコキシ、フェノキシ及びC1〜6ヘテロアルコキシ、好ましくは水素、メチル、エチル又はプロピルの中から独立に選択され、
(t’1)、(t’2)、(t’3)及び(t’4)は独立に0又は正の整数、好ましくは0又は約1〜約10(例えば1、2、3、4、5、6)の正の整数であり、
(a’2)及び(a’3)は独立に0又は1である]
の中から独立に選択される。
Y’16はO、NR’28又はS、好ましくは酸素であり、
Y’14〜15及びY’17は独立にO、NR’29又はS、好ましくはO又はNR’29であり、
R’21〜27は水素、ヒドロキシル、アミン、C1〜6アルキル、C3〜12分岐アルキル、C3〜8シクロアルキル、C1〜6置換アルキル、C3〜8置換シクロアルキル、アリール、置換アリール、アラルキル、C1〜6ヘテロアルキル、置換C1〜6ヘテロアルキル、C1〜6アルコキシ、フェノキシ及びC1〜6ヘテロアルコキシ、好ましくは水素、メチル、エチル又はプロピルの中から独立に選択され、
R’28〜29は水素、C1〜6アルキル、C3〜12分岐アルキル、C3〜8シクロアルキル、C1〜6置換アルキル、C3〜8置換シクロアルキル、アリール、置換アリール、アラルキル、C1〜6ヘテロアルキル、置換C1〜6ヘテロアルキル、C1〜6アルコキシ、フェノキシ及びC1〜6ヘテロアルコキシ、好ましくは水素、メチル、エチル又はプロピルの中から独立に選択され、
(t’1)、(t’2)、(t’3)及び(t’4)は独立に0又は正の整数、好ましくは0又は約1〜約10(例えば1、2、3、4、5、6)の正の整数であり、
(a’2)及び(a’3)は独立に0又は1である]
の中から独立に選択される。
本発明の範囲内で企図される二官能性L2リンカーとしては、リンカー基の変数と置換基との組合せが許容されることにより、このような組合せにより式(I)の安定な化合物がもたらされるものが挙げられる。例えば、(a’3)が0であるとき、Y’14はY’14又はY’17に直接結合しない。
本発明の目的のために、放出可能リンカーを含む二官能性L2リンカーの値が、2以上の正の整数であるとき、同一又は異なる二官能性リンカーを使用できる。
一実施形態において、Y’14〜15及びY’17はO又はNHであり、R’21〜29は独立に水素又はメチルである。
別の実施形態において、Y’16はOであり、Y’14〜15及びY’17はO又はNHであり、R’21〜29は水素である。
ある種の実施形態において、L2は、
−(CH2)t’1−[C(=O)]a’3(CH2)t’2−、
−(CH2)t’1Y’14−(CH2)t’2−(Y’15)a’2−[C(=O)]a’3(CH2)t’3−、
−(CH2CH2Y’14)t’1−[C(=O)]a’3(CH2)t’2−、
−(CH2CH2Y’14)t’1(CH2)t’2−(Y’15)a’2−[C(=O)]a’3(CH2)t’3−、
−[(CH2CH2)t’2Y’14]t’1(CH2)t’2−(Y’15)a’2−[C(=O)]a’3(CH2)t’3−、
−(CH2)t’1−[(CH2)t’2Y’14]t’2(CH2)t’3−(Y’15)a’2−[C(=O)]a’3(CH2)t’4−、
−(CH2)t’1(Y’14)a’2[C(=O)]a’3(CH2)t’2−、
−(CH2)t’1(Y’14)a’2[C(=O)]a’3Y’15(CH2)t’2−、
−(CH2)t’1(Y’14)a’2[C(=O)]a’3(CH2)t’2−Y’15−(CH2)t’3−、
−(CH2)t’1(Y’14)a’2[C(=O)]a’3Y’14(CH2)t’2−Y’15−(CH2)t’3−、
−(CH2)t’1(Y’14)a’2[C(=O)]a’3(CH2CH2Y’15)t’2(CH2)t’3−、及び
−(CH2)t’1(Y’14)a’2[C(=O)]a’3Y’17(CH2CH2Y’15)t’2(CH2)t’3−
[式中、
Y’14〜15及びY’17は独立にO又はNHであり、
(t’1)、(t’2)、(t’3)及び(t’4)は独立に0又は正の整数、好ましくは0又は約1〜約10(例えば1、2、3、4、5、6)の正の整数であり、
(a’2)及び(a’3)は独立に0又は1である]
の中から選択される。
−(CH2)t’1−[C(=O)]a’3(CH2)t’2−、
−(CH2)t’1Y’14−(CH2)t’2−(Y’15)a’2−[C(=O)]a’3(CH2)t’3−、
−(CH2CH2Y’14)t’1−[C(=O)]a’3(CH2)t’2−、
−(CH2CH2Y’14)t’1(CH2)t’2−(Y’15)a’2−[C(=O)]a’3(CH2)t’3−、
−[(CH2CH2)t’2Y’14]t’1(CH2)t’2−(Y’15)a’2−[C(=O)]a’3(CH2)t’3−、
−(CH2)t’1−[(CH2)t’2Y’14]t’2(CH2)t’3−(Y’15)a’2−[C(=O)]a’3(CH2)t’4−、
−(CH2)t’1(Y’14)a’2[C(=O)]a’3(CH2)t’2−、
−(CH2)t’1(Y’14)a’2[C(=O)]a’3Y’15(CH2)t’2−、
−(CH2)t’1(Y’14)a’2[C(=O)]a’3(CH2)t’2−Y’15−(CH2)t’3−、
−(CH2)t’1(Y’14)a’2[C(=O)]a’3Y’14(CH2)t’2−Y’15−(CH2)t’3−、
−(CH2)t’1(Y’14)a’2[C(=O)]a’3(CH2CH2Y’15)t’2(CH2)t’3−、及び
−(CH2)t’1(Y’14)a’2[C(=O)]a’3Y’17(CH2CH2Y’15)t’2(CH2)t’3−
[式中、
Y’14〜15及びY’17は独立にO又はNHであり、
(t’1)、(t’2)、(t’3)及び(t’4)は独立に0又は正の整数、好ましくは0又は約1〜約10(例えば1、2、3、4、5、6)の正の整数であり、
(a’2)及び(a’3)は独立に0又は1である]
の中から選択される。
(t’1)又は(t’2)が2以上であるとき、各発生時にY’14は同一又は異なる。
(t’2)が2以上であるとき、各発生時にY’15は同一又は異なる。
さらなる実施形態及び/又は代替実施形態において、L2基の例示的例は、
−CH2−、−(CH2)2−、−(CH2)3−、−(CH2)4−、−(CH2)5−、−(CH2)6−、−NH(CH2)−、
−CH(NH2)CH2−、
−O(CH2)2−、−C(=O)O(CH2)3−、−C(=O)NH(CH2)3−、
−C(=O)(CH2)2−、−C(=O)(CH2)3−、
−CH2−C(=O)−O(CH2)3−、
−CH2−C(=O)−NH(CH2)3−、
−CH2−OC(=O)−O(CH2)3−、
−CH2−OC(=O)−NH(CH2)3−、
−(CH2)2−C(=O)−O(CH2)3−、
−(CH2)2−C(=O)−NH(CH2)3−、
−CH2C(=O)O(CH2)2−O−(CH2)2−、
−CH2C(=O)NH(CH2)2−O−(CH2)2−、
−(CH2)2C(=O)O(CH2)2−O−(CH2)2−、
−(CH2)2C(=O)NH(CH2)2−O−(CH2)2−、
−CH2C(=O)O(CH2CH2O)2CH2CH2−、
−(CH2)2C(=O)O(CH2CH2O)2CH2CH2−、
−(CH2CH2O)2−、−CH2CH2O−CH2O−.
−(CH2CH2O)2−CH2CH2NH−、−(CH2CH2O)3−CH2CH2NH−、
−CH2CH2O−CH2CH2NH−、
−CH2−O−CH2CH2O−CH2CH2NH−、
−CH2−O−(CH2CH2O)2−CH2CH2NH−、
−CH2−O−CH2CH2O−、−CH2−O−(CH2CH2O)2−、
−CH2−、−(CH2)2−、−(CH2)3−、−(CH2)4−、−(CH2)5−、−(CH2)6−、−NH(CH2)−、
−CH(NH2)CH2−、
−O(CH2)2−、−C(=O)O(CH2)3−、−C(=O)NH(CH2)3−、
−C(=O)(CH2)2−、−C(=O)(CH2)3−、
−CH2−C(=O)−O(CH2)3−、
−CH2−C(=O)−NH(CH2)3−、
−CH2−OC(=O)−O(CH2)3−、
−CH2−OC(=O)−NH(CH2)3−、
−(CH2)2−C(=O)−O(CH2)3−、
−(CH2)2−C(=O)−NH(CH2)3−、
−CH2C(=O)O(CH2)2−O−(CH2)2−、
−CH2C(=O)NH(CH2)2−O−(CH2)2−、
−(CH2)2C(=O)O(CH2)2−O−(CH2)2−、
−(CH2)2C(=O)NH(CH2)2−O−(CH2)2−、
−CH2C(=O)O(CH2CH2O)2CH2CH2−、
−(CH2)2C(=O)O(CH2CH2O)2CH2CH2−、
−(CH2CH2O)2−、−CH2CH2O−CH2O−.
−(CH2CH2O)2−CH2CH2NH−、−(CH2CH2O)3−CH2CH2NH−、
−CH2CH2O−CH2CH2NH−、
−CH2−O−CH2CH2O−CH2CH2NH−、
−CH2−O−(CH2CH2O)2−CH2CH2NH−、
−CH2−O−CH2CH2O−、−CH2−O−(CH2CH2O)2−、
−(CH2)2NHC(=O)−(CH2CH2O)2−、
−C(=O)NH(CH2)2−、−CH2C(=O)NH(CH2)2−、
−C(=O)NH(CH2)3−、−CH2C(=O)NH(CH2)3−、
−C(=O)NH(CH2)4−、−CH2C(=O)NH(CH2)4−、
−C(=O)NH(CH2)5−、−CH2C(=O)NH(CH2)5−、
−C(=O)NH(CH2)6−、−CH2C(=O)NH(CH2)6−、
−C(=O)O(CH2)2−、−CH2C(=O)O(CH2)2−、
−C(=O)O(CH2)3−、−CH2C(=O)O(CH2)3−、
−C(=O)O(CH2)4−、−CH2C(=O)O(CH2)4−、
−C(=O)O(CH2)5−、−CH2C(=O)O(CH2)5−、
−C(=O)O(CH2)6−、−CH2C(=O)O(CH2)6−、
−(CH2CH2)2NHC(=O)NH(CH2)2−、
−(CH2CH2)2NHC(=O)NH(CH2)3−、
−(CH2CH2)2NHC(=O)NH(CH2)4−、
−(CH2CH2)2NHC(=O)NH(CH2)5−、
−(CH2CH2)2NHC(=O)NH(CH2)6−、
−(CH2CH2)2NHC(=O)O(CH2)2−、
−(CH2CH2)2NHC(=O)O(CH2)3−、
−(CH2CH2)2NHC(=O)O(CH2)4−、
−(CH2CH2)2NHC(=O)O(CH2)5−、
−(CH2CH2)2NHC(=O)O(CH2)6−、
−(CH2CH2)2NHC(=O)(CH2)2−、
−(CH2CH2)2NHC(=O)(CH2)3−、
−(CH2CH2)2NHC(=O)(CH2)4−、
−(CH2CH2)2NHC(=O)(CH2)5−、及び
−(CH2CH2)2NHC(=O)(CH2)6−の中から選択される。
−C(=O)NH(CH2)2−、−CH2C(=O)NH(CH2)2−、
−C(=O)NH(CH2)3−、−CH2C(=O)NH(CH2)3−、
−C(=O)NH(CH2)4−、−CH2C(=O)NH(CH2)4−、
−C(=O)NH(CH2)5−、−CH2C(=O)NH(CH2)5−、
−C(=O)NH(CH2)6−、−CH2C(=O)NH(CH2)6−、
−C(=O)O(CH2)2−、−CH2C(=O)O(CH2)2−、
−C(=O)O(CH2)3−、−CH2C(=O)O(CH2)3−、
−C(=O)O(CH2)4−、−CH2C(=O)O(CH2)4−、
−C(=O)O(CH2)5−、−CH2C(=O)O(CH2)5−、
−C(=O)O(CH2)6−、−CH2C(=O)O(CH2)6−、
−(CH2CH2)2NHC(=O)NH(CH2)2−、
−(CH2CH2)2NHC(=O)NH(CH2)3−、
−(CH2CH2)2NHC(=O)NH(CH2)4−、
−(CH2CH2)2NHC(=O)NH(CH2)5−、
−(CH2CH2)2NHC(=O)NH(CH2)6−、
−(CH2CH2)2NHC(=O)O(CH2)2−、
−(CH2CH2)2NHC(=O)O(CH2)3−、
−(CH2CH2)2NHC(=O)O(CH2)4−、
−(CH2CH2)2NHC(=O)O(CH2)5−、
−(CH2CH2)2NHC(=O)O(CH2)6−、
−(CH2CH2)2NHC(=O)(CH2)2−、
−(CH2CH2)2NHC(=O)(CH2)3−、
−(CH2CH2)2NHC(=O)(CH2)4−、
−(CH2CH2)2NHC(=O)(CH2)5−、及び
−(CH2CH2)2NHC(=O)(CH2)6−の中から選択される。
さらなる実施形態において、二官能性リンカーL1及びL2は、置換、飽和又は不飽和、分岐又は直鎖のC3〜50アルキル(即ち、C3〜40アルキル、C3〜20アルキル、C3〜15アルキル、C3〜10アルキル等)を有するスペーサーであってよく、一つ又は複数の炭素は、NR6、O、S又はC(=Y)、(好ましくはO又はNH)で場合により置き換えられるが、置き換えられる炭素は70%を超えない(即ち、60%、50%、40%、30%、20%、10%未満)。
4.二官能性スペーサー:L11基、L12基及びL13基
本発明によれば、二官能性スペーサーL11〜13は、
−(CR31R32)q1−及び
−Y26(CR31R32)q1−
[式中、
Y26はO、NR33又はS、好ましくは酸素又はNR33であり、
R31〜32は水素、ヒドロキシル、C1〜6アルキル、C3〜12分岐アルキル、C3〜8シクロアルキル、C1〜6置換アルキル、C3〜8置換シクロアルキル、C1〜6ヘテロアルキル、置換C1〜6ヘテロアルキル、C1〜6アルコキシ、フェノキシ及びC1〜6ヘテロアルコキシ、好ましくは水素、メチル、エチル又はプロピルの中から独立に選択され、
R33は水素、C1〜6アルキル、C3〜12分岐アルキル、C3〜8シクロアルキル、C1〜6置換アルキル、C3〜8置換シクロアルキル、C1〜6ヘテロアルキル、置換C1〜6ヘテロアルキル、C1〜6アルコキシ、フェノキシ及びC1〜6ヘテロアルコキシ、好ましくは水素、メチル、エチル又はプロピルの中から選択され、
(q1)は0又は正の整数であり、好ましくは0又は約1〜約10(例えば1、2、3、4、5、6)の整数である]
の中から独立に選択される。
本発明によれば、二官能性スペーサーL11〜13は、
−(CR31R32)q1−及び
−Y26(CR31R32)q1−
[式中、
Y26はO、NR33又はS、好ましくは酸素又はNR33であり、
R31〜32は水素、ヒドロキシル、C1〜6アルキル、C3〜12分岐アルキル、C3〜8シクロアルキル、C1〜6置換アルキル、C3〜8置換シクロアルキル、C1〜6ヘテロアルキル、置換C1〜6ヘテロアルキル、C1〜6アルコキシ、フェノキシ及びC1〜6ヘテロアルコキシ、好ましくは水素、メチル、エチル又はプロピルの中から独立に選択され、
R33は水素、C1〜6アルキル、C3〜12分岐アルキル、C3〜8シクロアルキル、C1〜6置換アルキル、C3〜8置換シクロアルキル、C1〜6ヘテロアルキル、置換C1〜6ヘテロアルキル、C1〜6アルコキシ、フェノキシ及びC1〜6ヘテロアルコキシ、好ましくは水素、メチル、エチル又はプロピルの中から選択され、
(q1)は0又は正の整数であり、好ましくは0又は約1〜約10(例えば1、2、3、4、5、6)の整数である]
の中から独立に選択される。
本発明の範囲内で企図される二官能性スペーサーとしては、変数と置換基との組合せが許容されることにより、このような組合せにより式(I)の安定な化合物がもたらされるものが挙げられる。
(q1)が2以上であるとき、各発生時にR31及びR32は独立に同一又は異なる。
一つの好ましい実施形態において、R’31〜33は独立に水素又はメチルである。
ある種の好ましい実施形態において、R31〜32は水素又はメチルであり、Y3はO又はNHである。
(q1)が2以上であるとき、C(R31)(R32)部分は同一又は異なる。
さらなる実施形態及び/又は代替実施形態において、L11〜13は、
−CH2−、−(CH2)2−、−(CH2)3−、−(CH2)4−、−(CH2)5−、−(CH2)6−、
−O(CH2)2−、−O(CH2)3−、−O(CH2)4−、−O(CH2)5−、−O(CH2)6−、CH(OH)−、
−(CH2CH2O)−CH2CH2−、
−(CH2CH2O)2−CH2CH2−、
−C(=O)O(CH2)3−、−C(=O)NH(CH2)3−、
−C(=O)(CH2)2−、−C(=O)(CH2)3−、
−CH2−C(=O)−O(CH2)3−、
−CH2−C(=O)−NH(CH2)3−、
−CH2−OC(=O)−O(CH2)3−、
−CH2−OC(=O)−NH(CH2)3−、
−(CH2)2−C(=O)−O(CH2)3−、
−(CH2)2−C(=O)−NH(CH2)3−、
−CH2C(=O)O(CH2)2−O−(CH2)2−、
−CH2C(=O)NH(CH2)2−O−(CH2)2−、
−(CH2)2C(=O)O(CH2)2−O−(CH2)2−、
−(CH2)2C(=O)NH(CH2)2−O−(CH2)2−、
−CH2C(=O)O(CH2CH2O)2CH2CH2−、及び
−(CH2)2C(=O)O(CH2CH2O)2CH2CH2−
の中から独立に選択される。
−CH2−、−(CH2)2−、−(CH2)3−、−(CH2)4−、−(CH2)5−、−(CH2)6−、
−O(CH2)2−、−O(CH2)3−、−O(CH2)4−、−O(CH2)5−、−O(CH2)6−、CH(OH)−、
−(CH2CH2O)−CH2CH2−、
−(CH2CH2O)2−CH2CH2−、
−C(=O)O(CH2)3−、−C(=O)NH(CH2)3−、
−C(=O)(CH2)2−、−C(=O)(CH2)3−、
−CH2−C(=O)−O(CH2)3−、
−CH2−C(=O)−NH(CH2)3−、
−CH2−OC(=O)−O(CH2)3−、
−CH2−OC(=O)−NH(CH2)3−、
−(CH2)2−C(=O)−O(CH2)3−、
−(CH2)2−C(=O)−NH(CH2)3−、
−CH2C(=O)O(CH2)2−O−(CH2)2−、
−CH2C(=O)NH(CH2)2−O−(CH2)2−、
−(CH2)2C(=O)O(CH2)2−O−(CH2)2−、
−(CH2)2C(=O)NH(CH2)2−O−(CH2)2−、
−CH2C(=O)O(CH2CH2O)2CH2CH2−、及び
−(CH2)2C(=O)O(CH2CH2O)2CH2CH2−
の中から独立に選択される。
5.Q基
本発明によれば、Q基は一つ又は複数の置換又は非置換、飽和又は不飽和のC4〜30含有部分を含有する。Q基は一つ又は複数のC4〜30の飽和又は不飽和脂肪族炭化水素を含む。
本発明によれば、Q基は一つ又は複数の置換又は非置換、飽和又は不飽和のC4〜30含有部分を含有する。Q基は一つ又は複数のC4〜30の飽和又は不飽和脂肪族炭化水素を含む。
であり、
L11、L12及びL13は独立に選択される二官能性スペーサーであり、
Y11、Y12、及びY13は独立にO、S又はNR8であり、好ましくは酸素又はNHであり、
Y’11、Y’12、及びY’13は独立にO、S又はNR8であり、好ましくは酸素であり、
R11、R12及びR13は独立に(置換又は非置換)飽和又は不飽和のC4〜30であり、
全ての他の変数は上に定義されたとおりであるが、
ただし、QはR11、R12及びR13の少なくとも一つ(一、二、三、好ましくは二つを含む]
により表される。
L11、L12及びL13は独立に選択される二官能性スペーサーであり、
Y11、Y12、及びY13は独立にO、S又はNR8であり、好ましくは酸素又はNHであり、
Y’11、Y’12、及びY’13は独立にO、S又はNR8であり、好ましくは酸素であり、
R11、R12及びR13は独立に(置換又は非置換)飽和又は不飽和のC4〜30であり、
全ての他の変数は上に定義されたとおりであるが、
ただし、QはR11、R12及びR13の少なくとも一つ(一、二、三、好ましくは二つを含む]
により表される。
一つの好ましい実施形態において、R11、R12及びR13は独立に飽和又は不飽和のC4〜30脂肪族炭化水素を含む。より好ましくは、各脂肪族炭化水素は、飽和又は不飽和のC8〜24炭化水素(さらにより好ましくは、C12〜22炭化水素、C12〜22アルキル、C12〜22アルケニル、C12〜22アルコキシ)である。脂肪族炭化水素の例としては、それだけに限らないが、ラウロイル(C12)、ミリストイル(C14)、パルミトイル(C16)、ステアロイル(C18)、オレオイル(C18)及びエルコイル(C22)、飽和又は不飽和のC12アルキルオキシ、C14アルキルオキシ、C16アルキルオキシ、C18アルキルオキシ、C20アルキルオキシ及びC22アルキルオキシ、並びに飽和又は不飽和のC12アルキル、C14アルキル、C16アルキル、C18アルキル、C20アルキル及びC22アルキルが挙げられる。
好ましくは、R11、R12及びR13の少なくとも二つは独立に飽和又は不飽和のC8〜24炭化水素(より好ましくはC12〜22炭化水素)を含む。
[式中、
Y1はO、S又はNR31、好ましくは酸素又はNHであり、
R11、R12及びR13は独立に置換又は非置換、飽和又は不飽和のC4〜30(アルキル、アルケニル、アルコキシ)であり、
R31は水素、メチル又はエチルであり、
(d)は0又は正の整数、好ましくは0又は約1〜約10(例えば1、2、3、4、5、6)の整数であり、
(f11)、(f12)及び(f13)は独立に0、1、2、3又は4であり、
(f21)及び(f22)は独立に1、2、3又は4である]
により表される。
Y1はO、S又はNR31、好ましくは酸素又はNHであり、
R11、R12及びR13は独立に置換又は非置換、飽和又は不飽和のC4〜30(アルキル、アルケニル、アルコキシ)であり、
R31は水素、メチル又はエチルであり、
(d)は0又は正の整数、好ましくは0又は約1〜約10(例えば1、2、3、4、5、6)の整数であり、
(f11)、(f12)及び(f13)は独立に0、1、2、3又は4であり、
(f21)及び(f22)は独立に1、2、3又は4である]
により表される。
ある種の実施形態において、Q基は、ジアシルグリセロール、ジアシルグリカミド、ジアルキルプロピル、ホスファチジルエタノールアミン又はセラミドを含む。適切なジアシルグリセロール又はジアシルグリカミドは、約C4〜約C30、好ましくは約C8〜約C24の飽和又は不飽和の炭素原子を独立に含有するアルキル鎖長を有する、ジアルキルグリセロール基又はジアルキルグリカミド基を含む。ジアルキルグリセロール基又はジアルキルグリカミド基は、一つ又は複数の置換アルキル基をさらに含むことができる。
本明細書で使用する「ジアシルグリセロール」(DAG)という用語は、二つの脂肪アシル鎖R111及びR112を有する化合物を指す。R111及びR112は、同一又は異なる約4〜約30個(好ましくは約8〜約24個)の炭素を有し、エステル結合によりグリセロールに結合している。アシル基は、飽和であってもよく、又は様々な不飽和度を含む不飽和であってもよい。DAGは次の一般式:
を有する。
DAGの例は、ジラウリルグリセロール(C12)、ジミリスチルグリセロール(C14、DMG)、ジパルミトイルグリセロール(C16、DPG)、ジステアリルグリセロール(C18、DSG)、ジオレオイルグリセロール(C18)、ジエルコイル(C22)、ジラウリルグリカミド(C12)、ジミリスチルグリカミド(C14)、ジパルミトイルグリカミド(C16)、ジステリルグリカミド(C18)、ジオレオイルグリカミド(C18)、ジエルコイルグリカミド(C22)の中から選択できる。当業者であれば、他のジアシルグリセロールも企図されることを容易に認識されよう。
「ジアルキルオキシプロピル」という用語は、二つのアルキル鎖R111及びR112を有する化合物を指す。R111及びR112アルキル基は、同一又は異なる約4〜約30個(好ましくは約8〜約24個)の炭素を含む。アルキル基は、飽和であってもよく、又は様々な不飽和度を有していてもよい。ジアルキルオキシプロピルは次の一般式:
[式中、R111及びR112アルキル基は約4〜約30個(好ましくは約8〜約24個)の炭素を有する同一又は異なるアルキル基である]を有する。アルキル基は、飽和であってもよく、又は不飽和であってもよい。適切なアルキル基としては、それだけに限らないがラウリル(C12)、ミリスチル(C14)、パルミチル(C16)、ステアリル(C18)及びオレオイル(C18)及びイコシル(C20)が挙げられる。
一実施形態において、R111及びR112はいずれも同一である。即ち、R111及びR112はいずれもミリスチル(C14)又はいずれもオレオイル(C18)等である。別の実施形態において、R111及びR112は異なる。即ち、R111はミリスチル(C14)であり、R112はステアリル(C18)である。
別の実施形態において、Q基は、ホスファチジルエタノールアミン(PE)を含むことができる。放出可能融合性脂質の結合に有用なホスファチジルエタノールアミンは、約4〜約30個(好ましくは約8〜約24個)の炭素の範囲の炭素鎖長を有する飽和又は不飽和の脂肪酸を含有できる。適切なホスファチジルエタノールアミンとしては、それだけに限らないがジミリストイルホスファチジルエタノールアミン(DMPE)、ジパルミトイルホスファチジルエタノールアミン(DPPE)、ジオレオイルホスファチジルエタノールアミン(DOPE)及びジステアロイルホスファチジルエタノールアミン(DSPE)が挙げられる。
さらに別の実施形態において、Q基は、セラミド(Cer)を含むことができる。セラミドは、一つだけアシル基を有する。セラミドは、約4〜約30個(好ましくは約8〜約24個)の炭素の範囲の炭素鎖長を有する飽和又は不飽和の脂肪酸を有することができる。
[式中、R11〜13は独立に同一又は異なるC12〜22の飽和又は不飽和の脂肪族炭素原子、例えばジラウリル(C12)、ジミリスチル(C14)、ジパルミトイル(C16)、ジステアリル(C18)、ジオレオイル(C18)及びジエルコイル(C22)であり、
(f11)、(f12)及び(f13)は独立に0、1、2、3又は4であり、
(f21)及び(f22)は独立に1、2、3又は4である]
を含む。
(f11)、(f12)及び(f13)は独立に0、1、2、3又は4であり、
(f21)及び(f22)は独立に1、2、3又は4である]
を含む。
B.式(I)の放出可能ポリマー脂質の調製
代表的な特定の化合物の合成を実施例に示す。しかし、一般に、本発明の化合物は、幾つかの方式で調製できる。一実施形態において、本明細書に記載の式(I)の化合物を調製する方法は、ケタール結合を有するポリマー誘導体と脂質誘導体とを反応させて、ケタール部分又はアセタール部分を有するポリマー脂質複合体を得ることを含む。或いは、該方法は、ポリマー誘導体とケタール部分又はアセタール部分を有する脂質誘導体とを反応させて、ポリマー脂質複合体を得ることを含む。
代表的な特定の化合物の合成を実施例に示す。しかし、一般に、本発明の化合物は、幾つかの方式で調製できる。一実施形態において、本明細書に記載の式(I)の化合物を調製する方法は、ケタール結合を有するポリマー誘導体と脂質誘導体とを反応させて、ケタール部分又はアセタール部分を有するポリマー脂質複合体を得ることを含む。或いは、該方法は、ポリマー誘導体とケタール部分又はアセタール部分を有する脂質誘導体とを反応させて、ポリマー脂質複合体を得ることを含む。
別の実施形態において、本明細書に記載の式(I)の化合物を調製する方法は、アミン含有化合物とアルデヒド含有化合物とを反応させて、イミン部分を有するポリマー脂質複合体を得ることを含む。アミンは第1級アミンであってよく、アルデヒドは脂肪族置換基又は芳香族置換基を更に含有できる。
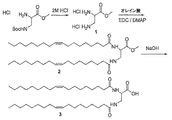
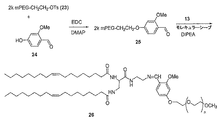
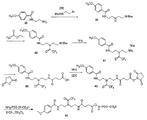
ケタール含有リンカーを有する放出可能ポリマー脂質の調製の一つの代表例は図1及び図2に示されている。最初に、カップリング剤、例えばEDC又はDIPCの存在下で、脂質を求核多官能性リンカーと結合させて化合物2を得る。反応は、不活性溶媒、例えば塩化メチレン、クロロホルム、トルエン、DMF又はそれらの混合物中で行われることが好ましい。反応は、塩基、例えばDMAP、DIEA、ピリジン、トリエチルアミン等の存在下で、-4℃〜約70℃(例えば、-4℃〜約50℃)の温度で行うことができる。一つの好ましい実施形態において、反応は、0℃〜約25℃又は0℃〜ほぼ室温の温度で行われる。化合物2のメチルエステルの鹸化により脂質誘導体(化合物3)が得られる。
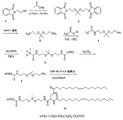
ケタール結合を含有する二官能性リンカー(化合物6)を調製する。ケタール含有二官能性リンカーのジアミンの一つは、エチルトリフルオロアセテートで保護される。SCmPEG等の活性化ポリマーを、二官能性リンカー中の残りの求核アミンと反応させて、次いでトリフルオロアセトアミド保護基を除去し、ケタール結合を含有するポリマーアミン(化合物9)を得る。ポリマーアミンを、カップリング剤の存在下で脂質誘導体(化合物3)と結合させて、ケタール部分を含有するPEG脂質を得る。
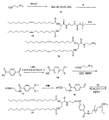
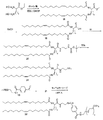
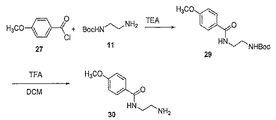
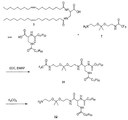
イミン部分を含有するポリマー脂質複合体を調製する別の代表例を図3に示す。ポリマーアミンを二官能性リンカーと反応させて、保護アルデヒドを含有するポリマー(化合物15)を得る。アルデヒド保護基を除去して、ポリマーアルデヒド(化合物16)を得る。脂質をアミン保護基を含有する求核多官能性リンカーと結合させて、アミン保護基を有する脂質誘導体を得る。アミン保護基を除去した後、末端アミンを有する脂質誘導体(化合物13)をポリマーアルデヒドと反応させて、イミン結合を含有するポリマー脂質を得る。
反応は、不活性溶媒、例えばメチレンクロリド、クロロホルム、トルエン、DMF又はそれらの混合物中で行われることが好ましい。反応は、塩基、例えばDMAP、DIEA、ピリジン、トリエチルアミン等の存在下で-4℃〜約70℃(例えば、-4℃〜約50℃)の温度にて行われることも好ましい。一つの好ましい実施形態において、反応は、0℃〜約25℃又は0℃〜ほぼ室温の温度で行われる。
アミンの酸への又はその逆の結合は、当業者に公知のカップリング剤、例えば1,3-ジイソプロピルカルボジイミド(DIPC)、ジアルキルカルボジイミド、2-ハロ-1-アルキルピリジニウムハロゲン化物、1-(3-ジメチルアミノプロピル)-3-エチルカルボジイミド(EDC)、プロパンホスホン酸環状無水物(PPACA)及びフェニルジクロロホスフェートを用いて、塩基の存在下で標準的な有機合成法を用いて行うことができる。
更なる実施形態において、NHSエステル又はPNPエステル等の活性化された酸を、化合物1(アミン、求核)と化合物3(酸、求電子剤)との結合、又は化合物9(アミン、求核)と化合物3(酸、求電子剤)との結合等、結合反応において求核と反応させるために使用してもよい。
酸又は求電子剤がNHS又はPNP等の離脱基で活性化される場合、カップリング剤は必要なく、反応は塩基の存在下で進められる。
アミン保護基の除去は、NaOH又はK2CO3等の塩基を用いて行うことができる。一実施形態において、トリフルオロアセチル基の脱保護は、K2CO3を用いて行われる。或いは、アミン保護基は、強酸、例えばトリフルオロ酢酸(TFA)、HCl、硫酸等、又は接触水素化、ラジカル反応等により除去できる。Boc基の脱保護は、ジオキサン中のHCl溶液で行われる。脱保護反応は、-4℃〜約50℃の温度で行うことができる。好ましくは、反応は0℃〜約25℃又は室温の温度で行われる。より好ましくは、Boc基の脱保護は室温で行われる。
[式中、
Aは標的基であり、
(x)は、ポリマー部分が約500〜約5000の平均分子量を有するような重合度であり、
(f11)は0、1、2、3又は4であり、
R11及びR12は独立にC8〜22アルキル、C8〜22アルケニル又はC8〜22アルコキシである]
を含む。
Aは標的基であり、
(x)は、ポリマー部分が約500〜約5000の平均分子量を有するような重合度であり、
(f11)は0、1、2、3又は4であり、
R11及びR12は独立にC8〜22アルキル、C8〜22アルケニル又はC8〜22アルコキシである]
を含む。
[式中、
mPEGはCH3O(CH2CH2O)n-CH2CH2O-であり、
PEGは-(CH2CH2O)n-CH2-又は-(CH2CH2O)n-CH2CH2O-であり、
(n)は約10〜約460の整数である]
を含む。
mPEGはCH3O(CH2CH2O)n-CH2CH2O-であり、
PEGは-(CH2CH2O)n-CH2-又は-(CH2CH2O)n-CH2CH2O-であり、
(n)は約10〜約460の整数である]
を含む。
が挙げられる。
C.ナノ粒子組成物
1.概要
本発明によれば、核酸の送達のための式(I)の化合物を含有するナノ粒子組成物が提供される。
1.概要
本発明によれば、核酸の送達のための式(I)の化合物を含有するナノ粒子組成物が提供される。
一態様において、ナノ粒子組成物は、式(I)の放出可能ポリマー脂質、カチオン性脂質及び融合性脂質を含有する。
一つの好ましい態様において、ナノ粒子組成物はコレステロールを含む。
本発明の更なる態様において、本明細書に記載のナノ粒子組成物は、当技術分野で公知のPEG脂質を含有できる。カチオン性脂質の混合物、異なる融合性脂質(非カチオン性脂質)の混合物及び/又は異なる任意選択のPEG脂質の混合物を含有するナノ粒子組成物も企図される。
別の好ましい態様において、ナノ粒子組成物は、ナノ粒子組成物中に存在する総脂質の約10%〜約99.9%の範囲のモル比でカチオン性脂質を含有する。
カチオン性脂質成分は、ナノ粒子組成物中に存在する総脂質の約2%〜約60%、約5%〜約50%、約10%〜約45%、約15%〜約25%又は約30%〜約40%の範囲であってよい。
一つの好ましい実施形態において、カチオン性脂質は、ナノ粒子組成物中に存在する総脂質の約15%〜約25%(即ち15、17、18、20又は25%)の量で存在する。
本発明によれば、ナノ粒子組成物は、ナノ粒子組成物中に存在する総脂質の約20%〜約85%、約25%〜約85%、約60%〜約80%(例えば65、75、78又は80%)のモル比で、コレステロール系及び/又は非コレステロール系融合性脂質を含む、総融合性脂質を含有する。一実施形態において、総融合性/非カチオン性脂質は、ナノ粒子組成物中に存在する総脂質の約80%である。
ある種の実施形態において、非コレステロール系融合性/非カチオン性脂質は、ナノ粒子組成物中に存在する総脂質の約25%〜約78%(25、35、47、60又は78%)又は約45〜約78%のモル比で存在する。一実施形態において、非コレステロール系融合性/非カチオン性脂質は、ナノ粒子組成物中に存在する総脂質の約60%である。
ある種の実施形態において、ナノ粒子組成物は、非コレステロール融合性脂質に加えて、ナノ粒子組成物中に存在する総脂質の約0%〜約60%、約10%〜約60%又は約20%〜約50%(例えば20、30、40又は50%)の範囲のモル比でコレステロールを含む。一実施形態において、コレステロールは、ナノ粒子組成物中に存在する総脂質の約20%である。
ある種の実施形態において、ナノ粒子組成物中に含有される式(I)の化合物を含むPEG脂質は、ナノ粒子組成物中に存在する総脂質の約0.5%〜約20%、約1.5%〜約18%のモル比の範囲である。ナノ粒子組成物の一実施形態において、PEG脂質は、総脂質の約2%〜約10%(例えば2、3、4、5、6、7、8、9又は10%)のモル比で含まれる。例えば、総PEG脂質は、ナノ粒子組成物中に存在する総脂質の約2%である。
本発明の目的のために、ナノ粒子組成物中に含有される放出可能融合性脂質の量は、ナノ粒子組成物中に存在する場合、本明細書に記載の放出可能ポリマー脂質単独の量、又は式(I)の放出可能ポリマー脂質と任意の追加の当技術分野で公知のポリマー脂質(放出可能又は放出不可能のいずれか)との総量を意味すると理解されるものとする。
2.ポリマー脂質:式(I)の放出可能ポリマー脂質及び任意選択のPEG脂質
本発明によれば、本明細書に記載のナノ粒子組成物はポリマー脂質を含有する。ポリマー脂質は、ナノ粒子の循環を延長し、身体からのナノ粒子の早期排出を防ぐ。ポリマー脂質は、体内での免疫応答の減少を可能にする。また、PEG脂質は、ナノ粒子の安定性を高める。
本発明によれば、本明細書に記載のナノ粒子組成物はポリマー脂質を含有する。ポリマー脂質は、ナノ粒子の循環を延長し、身体からのナノ粒子の早期排出を防ぐ。ポリマー脂質は、体内での免疫応答の減少を可能にする。また、PEG脂質は、ナノ粒子の安定性を高める。
一つの好ましい態様において、本明細書に記載のナノ粒子組成物は、式(I)の放出可能ポリマー脂質を含有する。任意の理論に拘束されずに、式(I)の放出可能ポリマー脂質は、ナノ粒子中に封入された核酸のエンドソームからの放出、及びナノ粒子が細胞に侵入した後、ナノ粒子からの放出を促す。
本発明の更なる態様において、本明細書に記載のナノ粒子組成物は、追加の当技術分野で公知のPEG脂質を含むことができる。ナノ粒子組成物で有用な追加の適切なPEG脂質としては、PEG化形態の融合性/非カチオン性脂質が挙げられる。PEG脂質としては、例えばジアシルグリセロールに結合したPEG(PEG-DAG)、ジアルキルオキシプロピルに結合したPEG(PEG-DAA)、リン脂質に結合したPEG、例えばホスファチジルエタノールアミンに結合したPEG(PEG-PE)、セラミドに結合したPEG(PEG-Cer)、コレステロール誘導体に結合したPEG(PEG-Chol)又はそれらの混合物が挙げられる。各々の内容が参照により本明細書に組み込まれている、米国特許第5,885,613号及び第5,820,873号、並びに米国特許出願第2006/051405号参照。
本明細書に記載の放出可能ポリマー脂質に加えて、本明細書に記載のナノ粒子組成物は、ポリエチレングリコール-ジアシルグリセロール又はポリエチレン-ジアシルグリカミド(PEG-DAG)を含むことができる。適切なポリエチレングリコール-ジアシルグリセロール複合体又はポリエチレングリコール-ジアシルグリカミド複合体としては、約C4〜約C30(好ましくは約C8〜約C24)の飽和又は不飽和の炭素原子を独立に含有するアルキル鎖長を有する、ジアルキルグリセロール基又はジアルキルグリカミド基が挙げられる。ジアルキルグリセロール基又はジアルキルグリカミド基は、一つ又は複数の置換アルキル基を更に含むことができる。
本明細書で使用する「ジアシルグリセロール」(DAG)という用語は、二つの脂肪アシル鎖R111及びR112を有する化合物を指す。R111及びR112は、約4〜約30個(好ましくは約8〜約24個)の炭素の長さの同一又は異なる炭素鎖を有し、エステル結合によりグリセロールに結合する。アシル基は、飽和であってもよく、又は様々な不飽和度を含む不飽和であってもよい。DAGは次の一般式:
を有する。
DAG-PEG複合体は、PEG-ジラウリルグリセロール(C12)、PEG-ジミリスチルグリセロール(C14、DMG)、PEG-ジパルミトイルグリセロール(C16、DPG)、PEG-ジステアリルグリセロール(C18、DSG)又はPEG-ジオレオイルグリセロール(C18)である。当業者であれば、他のジアシルグリセロールも、DAG-PEGで企図されることを容易に認識されよう。本明細書で使用する適切なDAG-PEG複合体及びそれを製造し使用する方法は、各々の内容が参照により本明細書に組み込まれている、米国特許出願公開第2003/0077829号及びPCT特許出願第CA02/00669号に記載されている。
PEG-DAG複合体の例としては、PEG-ジラウリルグリセロール(C12)、PEG-ジミリスチルグリセロール(C14)、PEG-ジパルミトイルグリセロール(C16)、PEG-ジステリルグリセロール(C18)、PEG-ジオレオイルグリセロール(C18)、PEG-ジラウリルグリカミド(C12)、PEG-ジミリスチルグリカミド(C14)、PEG-ジパルミトイルグリカミド(C16)、PEG-ジステリルグリカミド(C18)及びPEG-ジオレオイルグリカミド(C18)の中から選択できる。
別の実施形態において、本明細書に記載のポリマーナノ粒子は、ポリエチレングリコール-ジアルキルオキシプロピル複合体(PEG-DAG)を含むことができる。
「ジアルキルオキシプロピル」という用語は、二つのアルキル鎖R111及びR112を有する化合物を指す。R111及びR112アルキル基は、約4〜約30個(好ましくは約8〜約24個)の間の炭素の同一又は異なる炭素鎖長を含む。アルキル基は飽和であってもよく、又は様々な不飽和度を有していてもよい。ジアルキルオキシプロピルは次の一般式:
(式中、R111及びR112アルキル基は、約4〜約30個(好ましくは約8〜約24個)の炭素を有する同一又は異なるアルキル基である)を有する。アルキル基は、飽和であってもよく、又は不飽和であってもよい。適切なアルキル基の例としては、それだけに限らないがラウリル(C12)、ミリスチル(C14)、パルミチル(C16)、ステアリル(C18)、オレオイル(C18)及びイコシル(C20)が挙げられる。
一実施形態において、R111及びR112はいずれも同一である。即ち、R111及びR112はいずれもミリスチル(C14)、いずれもステアリル(C18)又はいずれもオレオイル(C18)等である。別の実施形態において、R111及びR112は異なる。即ち、R111はミリスチル(C14)であり、R112はステアリル(C18)である。一実施形態において、PEG-ジアルキルプロピル複合体は同一のR111及びR112を含む。
更に別の実施形態において、本明細書に記載のナノ粒子組成物は、本明細書に記載の放出可能ポリマー脂質に加えて、ホスファチジルエタノールアミンに結合したPEG(PEG-PE)を含むことができる。PEG脂質の結合に有用なホスファチジルエタノールアミンは、約4〜約30個(好ましくは約8〜約24個)の炭素の範囲の炭素鎖長を有する飽和又は不飽和の脂肪酸を含有できる。適切なホスファチジルエタノールアミンとしては、それだけに限らないが、ジミリストイルホスファチジルエタノールアミン(DMPE)、ジパルミトイルホスファチジルエタノールアミン(DPPE)、ジオレオイルホスファチジルエタノールアミン(DOPE)及びジステアロイルホスファチジルエタノールアミン(DSPE)が挙げられる。
更に別の実施形態において、本明細書に記載のナノ粒子組成物は、セラミドに結合したPEG(PEG-Cer)を含むことができる。セラミドはアシル基を一つだけ有する。セラミドは、約4〜約30個(好ましくは約8〜約24個)の炭素の範囲の炭素鎖長を有する飽和又は不飽和の脂肪酸を有することができる。
代替実施形態において、本明細書に記載のナノ粒子組成物は、コレステロール誘導体に結合したPEGを含むことができる。「コレステロール誘導体」という用語は、その修飾、即ち置換及び/又は欠失を含むコレステロール構造を含有する任意のコレステロール類似体を意味する。本明細書においてコレステロール誘導体という用語は、ステロイドホルモン及び胆汁酸も含む。
一つの好ましい態様において、PEGは約200〜約20000ダルトン、より好ましくは約500〜約10000ダルトン、更により好ましくは約1000〜約5000ダルトン(即ち、約1500〜約3000ダルトン)の範囲の数平均分子量を有するポリエチレングリコールである。一つの特定の実施形態において、PEGは約2000ダルトンの分子量を有する。別の特定の実施形態において、PEGは約750ダルトンの分子量を有する。
PEG脂質の例示的例としては、N-(カルボニルメトキシポリエチレングリコール)-1,2-ジミリストイル-sn-グリセロ-3-ホスホエタノールアミン(2kDamPEG-DMPE又は5kDamPEG-DMPE)、N-(カルボニルメトキシポリエチレングリコール)-1,2-ジパルミトイル-sn-グリセロ-3-ホスホエタノールアミン(2kDamPEG-DPPE又は5kDamPEG-DPPE)、N-(カルボニルメトキシポリエチレングリコール)-1,2-ジステアロイル-sn-グリセロ-3-ホスホエタノールアミン(750kDamPEG-DSPE750、2kDamPEG-DSPE2000、5kDamPEG-DSPE);それらの薬学的に許容される塩(即ち、ナトリウム塩)及びそれらの混合物が挙げられる。
ある種の実施形態において、本明細書に記載のナノ粒子組成物は、PEGが約200〜約20000、好ましくは約500〜約10000、より好ましくは約1000〜約5000の平均分子量を有する、PEG-DAG又はPEG-セラミドを有するPEG脂質を含むことができる。
PEG脂質は、PEG-DSPE、PEG-ジパルミトイルグリカミド(C16)、PEG-セラミド(C16)等及びそれらの混合物の中から選択される。PEG-DSPE、PEG-ジパルミトイルグリカミド(C16)及びPEG-セラミド(C16)の構造は以下のとおりである:
(式中、(n)は、約5〜約2300、好ましくは約5〜約460の整数である)。一実施形態において、(n)は約45である。
3.カチオン性脂質
本発明によれば、本明細書に記載のナノ粒子組成物は、カチオン性脂質を含むことができる。企図される適切な脂質としては、例えば、
N−[1−(2,3−ジオレオイルオキシ)プロピル]−N,N,N−トリメチルアンモニウムクロリド(DOTMA);
1,2−ビス(オレオイルオキシ)−3−3−(トリメチルアンモニウム)プロパン又はN−(2,3−ジオレオイルオキシ)プロピル)−N,N,N−トリメチルアンモニウムクロリド(DOTAP);
1,2−ビス(ジミルストイルオキシ)−3−3−(トリメチルアンモニア)プロパン(DMTAP);
1,2−ジミリスチルオキシプロピル−3−ジメチルヒドロキシエチルアンモニウムブロミド又はN−(1,2−ジミリスチルオキシプロパ−3−イル)−N,N−ジメチル−N−ヒドロキシエチルアンモニウムブロミド(DMRIE);
ジメチルジオクタデシルアンモニウムブロミド又はN,N−ジステアリル−N,N−ジメチルアンモニウムブロミド(DDAB);
3−(N−(N’,N’−ジメチルアミノエタン)カルバモイル)コレステロール(DC−コレステロール);
3β−[N’,N’−ジグアニジノエチル−アミノエタン)カルバモイルコレステロール(BGTC);
2−(2−(3−(ビス(3−アミノプロピル)アミノ)プロピルアミノ)アセトアミド)−N,N−ジテトラデシルアセトアミド(RPR209120);
1,2−ジアルケノイル−sn−グリセロ−3−エチルホスホコリン(即ち、1,2−ジオレオイル−sn−グリセロ−3−エチルホスホコリン、1,2−ジステアロイル−sn−グリセロ−3−エチルホスホコリン及び1,2−ジパルミトイル−sn−グリセロ−3−エチルホスホコリン);
テトラメチルテトラパルミトイルスペルミン(TMTPS);
テトラメチルテトラオレイルスペルミン(TMTOS);
テトラメトリテトララウリルスペルミン(TMTLS);
テトラメチルテトラミリスチルスペルミン(TMTMS);
テトラメチルジオレイルスペルミン(TMDOS);
2,5−ビス(3−アミノプロピルアミノ)−N−(2−(ジオクタデシルアミノ)−2−オキソエチル)ペンタンアミド(DOGS);
2,5−ビス(3−アミノプロピルアミノ)−N−(2−(ジ(Z)−オクタデカ−9−ジエニルアミノ)−2−オキソエチル)ペンタンアミド(DOGS−9−エン);
2,5−ビス(3−アミノプロピルアミノ)−N−(2−(ジ(9Z,12Z)−オクタデカ−9,12−ジエニルアミノ)−2−オキソエチル)ペンタンアミド(DLinGS);
N4−スペルミンコレステリルカルバメート(GL−67);
(9Z,9’Z)−2−(2,5−ビス(3−アミノプロピルアミノ)ペンタンアミド)プロパン−1,3−ジイル−ジオクタデカ−9−エノエート(DOSPER);
2,3−ジオレイルオキシ−N−[2(スペルミンカルボキサミド)エチル]−N,N−ジメチル−1−プロパンアミニウムトリフルオロアセテート(DOSPA);
1,2−ジミリストイル−3−トリメチルアンモニウム−プロパン;1,2−ジステアロイル−3−トリメチルアンモニウム−プロパン;
ジオクタデシルジメチルアンモニウム(DODMA);
ジステアリルジメチルアンモニウム(DSDMA);
N,N−ジオレイル−N,N−ジメチルアンモニウムクロリド(DODAC);それらの薬学的に許容される塩及び混合物が挙げられる。
本発明によれば、本明細書に記載のナノ粒子組成物は、カチオン性脂質を含むことができる。企図される適切な脂質としては、例えば、
N−[1−(2,3−ジオレオイルオキシ)プロピル]−N,N,N−トリメチルアンモニウムクロリド(DOTMA);
1,2−ビス(オレオイルオキシ)−3−3−(トリメチルアンモニウム)プロパン又はN−(2,3−ジオレオイルオキシ)プロピル)−N,N,N−トリメチルアンモニウムクロリド(DOTAP);
1,2−ビス(ジミルストイルオキシ)−3−3−(トリメチルアンモニア)プロパン(DMTAP);
1,2−ジミリスチルオキシプロピル−3−ジメチルヒドロキシエチルアンモニウムブロミド又はN−(1,2−ジミリスチルオキシプロパ−3−イル)−N,N−ジメチル−N−ヒドロキシエチルアンモニウムブロミド(DMRIE);
ジメチルジオクタデシルアンモニウムブロミド又はN,N−ジステアリル−N,N−ジメチルアンモニウムブロミド(DDAB);
3−(N−(N’,N’−ジメチルアミノエタン)カルバモイル)コレステロール(DC−コレステロール);
3β−[N’,N’−ジグアニジノエチル−アミノエタン)カルバモイルコレステロール(BGTC);
2−(2−(3−(ビス(3−アミノプロピル)アミノ)プロピルアミノ)アセトアミド)−N,N−ジテトラデシルアセトアミド(RPR209120);
1,2−ジアルケノイル−sn−グリセロ−3−エチルホスホコリン(即ち、1,2−ジオレオイル−sn−グリセロ−3−エチルホスホコリン、1,2−ジステアロイル−sn−グリセロ−3−エチルホスホコリン及び1,2−ジパルミトイル−sn−グリセロ−3−エチルホスホコリン);
テトラメチルテトラパルミトイルスペルミン(TMTPS);
テトラメチルテトラオレイルスペルミン(TMTOS);
テトラメトリテトララウリルスペルミン(TMTLS);
テトラメチルテトラミリスチルスペルミン(TMTMS);
テトラメチルジオレイルスペルミン(TMDOS);
2,5−ビス(3−アミノプロピルアミノ)−N−(2−(ジオクタデシルアミノ)−2−オキソエチル)ペンタンアミド(DOGS);
2,5−ビス(3−アミノプロピルアミノ)−N−(2−(ジ(Z)−オクタデカ−9−ジエニルアミノ)−2−オキソエチル)ペンタンアミド(DOGS−9−エン);
2,5−ビス(3−アミノプロピルアミノ)−N−(2−(ジ(9Z,12Z)−オクタデカ−9,12−ジエニルアミノ)−2−オキソエチル)ペンタンアミド(DLinGS);
N4−スペルミンコレステリルカルバメート(GL−67);
(9Z,9’Z)−2−(2,5−ビス(3−アミノプロピルアミノ)ペンタンアミド)プロパン−1,3−ジイル−ジオクタデカ−9−エノエート(DOSPER);
2,3−ジオレイルオキシ−N−[2(スペルミンカルボキサミド)エチル]−N,N−ジメチル−1−プロパンアミニウムトリフルオロアセテート(DOSPA);
1,2−ジミリストイル−3−トリメチルアンモニウム−プロパン;1,2−ジステアロイル−3−トリメチルアンモニウム−プロパン;
ジオクタデシルジメチルアンモニウム(DODMA);
ジステアリルジメチルアンモニウム(DSDMA);
N,N−ジオレイル−N,N−ジメチルアンモニウムクロリド(DODAC);それらの薬学的に許容される塩及び混合物が挙げられる。
カチオン性脂質の詳細は米国特許出願公開第2007/0293449号明細書及び米国特許第4,897,355号明細書、第5,279,833号明細書、第6,733,777号明細書、第6,376,248号明細書、第5,736,392号明細書、第5,686,958号明細書、第5,334,761号明細書、第5,459,127号明細書、第2005/0064595号明細書、第5,208,036号明細書、第5,264,618号明細書、第5,279,833号明細書、第5,283,185号明細書、第5,753,613号明細書及び第5,785,992号明細書にも記載されている。
一つの好ましい態様において、カチオン性脂質は、選択されたpH、例えばpH<13(例えばpH6〜12、pH6〜8)で正味の正電荷を担持するであろう。ナノ粒子組成物の一つの好ましい実施形態は、次の構造式を有する本明細書に記載のカチオン性脂質
(式中、R1はコレステロール又はその類似体である)。
を含む。
を含む。
カチオン性脂質の詳細は、その内容が参照により本明細書に組み込まれている、PCT/US09/52396にも記載されている。
さらに、カチオン性脂質を含む市販の製剤、例えばLIPOFECTIN(登録商標)(DOTMA及びDOPEを含有するカチオン性リポソーム、GIBCO/BRL、Grand Island、New York、USA製)、LIPOFECTAMINE(登録商標)(DOSPA及びDOPEを含有するカチオン性リポソーム、GIBCO/BRL、Grand Island、New York、USA製)及びTRANSFECTAM(登録商標)(DOGSを含有するカチオン性リポソーム、Promega Corp.、Madison、Wisconsin、USA製)を使用できる。
4.融合性/非カチオン性脂質
本発明によれば、ナノ粒子組成物は、融合性脂質を含有できる。融合性脂質としては、中性で帯電していない両性イオン性及びアニオン性の脂質等の非カチオン性脂質が挙げられる。本発明の目的のために、「融合性脂質」及び「非カチオン性脂質」という用語は互換的である。
本発明によれば、ナノ粒子組成物は、融合性脂質を含有できる。融合性脂質としては、中性で帯電していない両性イオン性及びアニオン性の脂質等の非カチオン性脂質が挙げられる。本発明の目的のために、「融合性脂質」及び「非カチオン性脂質」という用語は互換的である。
中性脂質としては、選択されたpH、好ましくは生理学的pHで非荷電又は中性いずれかの両性イオン形態で存在する脂質が挙げられる。このような脂質の例としては、ジアシルホスファチジルコリン、ジアシルホスファチジルエタノールアミン、セラミド、スフィンゴミエリン、セファリン、コレステロール、セレブロシド及びジアシルグリセロールが挙げられる。
アニオン性脂質としては、生理学的pHで負に帯電した脂質が挙げられる。これらの脂質としては、それだけに限らないが、ホスファチジルグリセロール、カルジオリピン、ジアシルホスファチジルセリン、ジアシルホスファチジン酸、N-ドデカノイルホスファチジルエタノールアミン、N-スクシニルホスファチジルエタノールアミン、N-グルタリルホスファチジルエタノールアミン、リジルホスファチジルグリセロール、パルミトイルオレイオイルホスファチジルグリセロール(POPG)及び他のアニオン性修飾基で修飾された中性脂質が挙げられる。
多くの融合性脂質としては、疎水性部分及び極性頭部基を一般に有する両親媒性脂質が挙げられ、水溶液中でベシクルを形成できる。
企図される融合性脂質としては、天然及び合成のリン脂質及び関連の脂質が挙げられる。
非カチオン性脂質の非限定的リストは、リン脂質及び非リン脂質系物質、例えばレシチン、リゾレシチン、ジアシルホスファチジルコリン、リゾホスファチジルコリン、ホスファチジルエタノールアミン、リゾホスファチジルエタノールアミン、ホスファチジルセリン、ホスファチジルイノシトール、スフィンゴミエリン、セファリン、セラミド、カルジオリピン、ホスファチジン酸、ホスファチジルグリセロール、セレブロシド、ジセチルホスフェート、
1,2-ジラウロイル-sn-グリセロール(DLG);
1,2-ジミリストイル-sn-グリセロール(DMG);
1,2-ジパルミトイル-sn-グリセロール(DPG);
1,2-ジステアロイル-sn-グリセロール(DSG);
1,2-ジラウロイル-sn-グリセロ-3-ホスファチジン酸(DLPA);
1,2-ジミリストイル-sn-グリセロ-3-ホスファチジン酸(DMPA);
1,2-ジパルミトイル-sn-グリセロ-3-ホスファチジン酸(DPPA);
1,2-ジステアロイル-sn-グリセロ-3-ホスファチジン酸(DSPA);
1,2-ジアラキドイル-sn-グリセロ-3-ホスホコリン(DAPC);
1,2-ジラウロイル-sn-グリセロ-3-ホスホコリン(DLPC);
1,2-ジミリストイル-sn-グリセロ-3-ホスホコリン(DMPC);
1,2-ジパルミトイル-sn-グリセロ-3-エチルホスホコリン(DPePC);
1,2-ジパルミトイル-sn-グリセロ-3-ホスホコリン又はジパルミトイルホスファチジルコリン(DPPC);
1,2-ジステアロイル-sn-グリセロ-3-ホスホコリン又はジステアロイルホスファチジルコリン(DSPC);
1,2-ジラウロイル-sn-グリセロ-3-ホスホエタノールアミン(DLPE);
1,2-ジミリストイル-sn-グリセロ-3-ホスホエタノールアミン又はジミリストイルホスホエタノールアミン(DMPE);
1,2-ジパルミトイル-sn-グリセロ-3-ホスホエタノールアミン又はジパルミトイルホスファチジル-エタノールアミン(DPPE);
1,2-ジステアロイル-sn-グリセロ-3-ホスホエタノールアミン又はジステアロイルホスファチジル-エタノールアミン(DSPE);
1,2-ジオレオイル-sn-グリセロ-3-ホスホエタノールアミン又はジオレオイルホスファチジルエタノールアミン(DOPE);
1,2-ジラウロイル-sn-グリセロ-3-ホスホグリセロール(DLPG);
1,2-ジミリストイル-sn-グリセロ-3-ホスホグリセロール(DMPG)又は1,2-ジミリストイル-sn-グリセロ-3-ホスホ-sn-1-グリセロール(DMP-sn-1-G);
1,2-ジパルミトイル-sn-グリセロ-3-ホスホグリセロール又はジパルミトイルホスファチジルグリセロール(DPPG);
1,2-ジステアロイル-sn-グリセロ-3-ホスホグリセロール(DSPG)又は1,2-ジステアロイル-sn-グリセロ-3-ホスホ-sn-1-グリセロール(DSP-sn-1-G);
1,2-ジパルミトイル-sn-グリセロ-3-ホスホ-L-セリン(DPPS);
1-パルミトイル-2-リノレオイル-sn-グリセロ-3-ホスホコリン(PLinoPC);
1-パルミトイル-2-オレオイル-sn-グリセロ-3-ホスホコリン又はパルミトイルオレオイルホスファチジルコリン(POPC);
1-パルミトイル-2-オレオイル-sn-グリセロ-3-ホスホグリセロール(POPG);
1-パルミトイル-2-lyso-sn-グリセロ-3-ホスホコリン(P-lyso-PC);
1-ステアロイル-2-lyso-sn-グリセロ-3-ホスホコリン(S-lyso-PC);
ジフィタノイルホスファチジルエタノールアミン(DPhPE);
1,2-ジオレオイル-sn-グリセロ-3-ホスホコリン又はジオレオイルホスファチジルコリン(DOPC);
1,2-ジフィタノイル-sn-グリセロ-3-ホスホコリン(DPhPC)、
ジオレオイルホスファチジルグリセロール(DOPG);
パルミトイルオレオイルホスファチジルエタノールアミン(POPE);
ジオレオイル-ホスファチジルエタノールアミン4-(N-マレイミドメチル)-シクロヘキサン-1-カルボキシレート(DOPE-mal);
16-O-モノメチルPE;
16-O-ジメチルPE;
18-1-trans PE;1-ステアロイル-2-オレオイル-ホスファチジエタノールアミン(SOPE);
1,2-ジエライドイル-sn-グリセロ-3-ホホエタノールアミン(transDOPE);及びそれらの薬学的に許容される塩及びそれらの混合物の中から選択される。融合性脂質の詳細は、米国特許出願公開第2007/0293449号及び第2006/0051405号に記載されている。
1,2-ジラウロイル-sn-グリセロール(DLG);
1,2-ジミリストイル-sn-グリセロール(DMG);
1,2-ジパルミトイル-sn-グリセロール(DPG);
1,2-ジステアロイル-sn-グリセロール(DSG);
1,2-ジラウロイル-sn-グリセロ-3-ホスファチジン酸(DLPA);
1,2-ジミリストイル-sn-グリセロ-3-ホスファチジン酸(DMPA);
1,2-ジパルミトイル-sn-グリセロ-3-ホスファチジン酸(DPPA);
1,2-ジステアロイル-sn-グリセロ-3-ホスファチジン酸(DSPA);
1,2-ジアラキドイル-sn-グリセロ-3-ホスホコリン(DAPC);
1,2-ジラウロイル-sn-グリセロ-3-ホスホコリン(DLPC);
1,2-ジミリストイル-sn-グリセロ-3-ホスホコリン(DMPC);
1,2-ジパルミトイル-sn-グリセロ-3-エチルホスホコリン(DPePC);
1,2-ジパルミトイル-sn-グリセロ-3-ホスホコリン又はジパルミトイルホスファチジルコリン(DPPC);
1,2-ジステアロイル-sn-グリセロ-3-ホスホコリン又はジステアロイルホスファチジルコリン(DSPC);
1,2-ジラウロイル-sn-グリセロ-3-ホスホエタノールアミン(DLPE);
1,2-ジミリストイル-sn-グリセロ-3-ホスホエタノールアミン又はジミリストイルホスホエタノールアミン(DMPE);
1,2-ジパルミトイル-sn-グリセロ-3-ホスホエタノールアミン又はジパルミトイルホスファチジル-エタノールアミン(DPPE);
1,2-ジステアロイル-sn-グリセロ-3-ホスホエタノールアミン又はジステアロイルホスファチジル-エタノールアミン(DSPE);
1,2-ジオレオイル-sn-グリセロ-3-ホスホエタノールアミン又はジオレオイルホスファチジルエタノールアミン(DOPE);
1,2-ジラウロイル-sn-グリセロ-3-ホスホグリセロール(DLPG);
1,2-ジミリストイル-sn-グリセロ-3-ホスホグリセロール(DMPG)又は1,2-ジミリストイル-sn-グリセロ-3-ホスホ-sn-1-グリセロール(DMP-sn-1-G);
1,2-ジパルミトイル-sn-グリセロ-3-ホスホグリセロール又はジパルミトイルホスファチジルグリセロール(DPPG);
1,2-ジステアロイル-sn-グリセロ-3-ホスホグリセロール(DSPG)又は1,2-ジステアロイル-sn-グリセロ-3-ホスホ-sn-1-グリセロール(DSP-sn-1-G);
1,2-ジパルミトイル-sn-グリセロ-3-ホスホ-L-セリン(DPPS);
1-パルミトイル-2-リノレオイル-sn-グリセロ-3-ホスホコリン(PLinoPC);
1-パルミトイル-2-オレオイル-sn-グリセロ-3-ホスホコリン又はパルミトイルオレオイルホスファチジルコリン(POPC);
1-パルミトイル-2-オレオイル-sn-グリセロ-3-ホスホグリセロール(POPG);
1-パルミトイル-2-lyso-sn-グリセロ-3-ホスホコリン(P-lyso-PC);
1-ステアロイル-2-lyso-sn-グリセロ-3-ホスホコリン(S-lyso-PC);
ジフィタノイルホスファチジルエタノールアミン(DPhPE);
1,2-ジオレオイル-sn-グリセロ-3-ホスホコリン又はジオレオイルホスファチジルコリン(DOPC);
1,2-ジフィタノイル-sn-グリセロ-3-ホスホコリン(DPhPC)、
ジオレオイルホスファチジルグリセロール(DOPG);
パルミトイルオレオイルホスファチジルエタノールアミン(POPE);
ジオレオイル-ホスファチジルエタノールアミン4-(N-マレイミドメチル)-シクロヘキサン-1-カルボキシレート(DOPE-mal);
16-O-モノメチルPE;
16-O-ジメチルPE;
18-1-trans PE;1-ステアロイル-2-オレオイル-ホスファチジエタノールアミン(SOPE);
1,2-ジエライドイル-sn-グリセロ-3-ホホエタノールアミン(transDOPE);及びそれらの薬学的に許容される塩及びそれらの混合物の中から選択される。融合性脂質の詳細は、米国特許出願公開第2007/0293449号及び第2006/0051405号に記載されている。
非カチオン性脂質としては、ステロール又はステロイドアルコール、例えばコレステロールが挙げられる。
追加の非カチオン性脂質としては、例えば、ステアリルアミン、ドデシルアミン、ヘキサデシルアミン、アセチルパルミテート、グリセロールリシノレート、ヘキサデシルステアレート、イソプロピルミリステート、両性アクリルポリマー、トリエタノールアミンラウリルサルフェート、アルキルアリールサルフェートポリエチルオキシル化脂肪酸アミド及びジオクタデシルジメチルアンモニウムブロミドがある。
企図されるアニオン性脂質としては、ホスファチジルセリン、ホスファチジン酸、ホスファチジルコリン、血小板活性化因子(PAF)、ホスファチジルエタノールアミン、ホスファチジル-DL-グリセロール、ホスファチジルイノシトール、ホスファチジルイノシトール、カルジオリピン、リゾホスファチジド、水素化リン脂質、スフィンゴ脂質、ガングリオシド、フィトスフィンゴシン、スフィンガニン、それらの薬学的に許容される塩及び混合物が挙げられる。
本明細書に記載のナノ粒子組成物の調製に有用な適切な非カチオン性脂質としては、ジアシルホスファチジルコリン(例えば、ジステアロイルホスファチジルコリン、ジオレオイルホスファチジルコリン、ジパルミトイルホスファチジルコリン及びジリノレオイルホスファチジルコリン)、ジアシルホスファチジルエタノールアミン(例えば、ジオレオイルホスファチジルエタノールアミン及びパルミトイルオレオイルホスファチジルエタノールアミン)、セラミド又はスフィンゴミエリンが挙げられる。これらの脂質中のアシル基は、飽和及び不飽和の炭素鎖を有する脂肪酸、例えばリノイル、イソステアリル、オレイル、エライジル、ペトロセリニル、リノレニル、エレオステアリル、アラキジル、ミリストイル、パルミトイル及びラウロイルであることが好ましい。アシル基は、ラウロイル、ミリストイル、パルミトイル、ステアロイル又はオレオイルであることがより好ましい。或いは/好ましくは、脂肪酸は、飽和及び不飽和のC8〜C30(好ましくはC10〜C24)炭素鎖を有する。
本明細書に記載のナノ粒子組成物で有用な様々なホスファチジルコリンとしては、
1,2-ジデカノイル-sn-グリセロ-3-ホスホコリン(DDPC、C10:0、C10:0);
1,2-ジラウロイル-sn-グリセロ-3-ホスホコリン(DLPC、C12:0、C12:0);
1,2-ジミリストイル-sn-グリセロ-3-ホスホコリン(DMPC、C14:0、C14:0);
1,2-ジパルミトイル-sn-グリセロ-3-ホスホコリン(DPPC、C16:0、C16:0);
1,2-ジステアロイル-sn-グリセロ-3-ホスホコリン(DSPC、C18:0、C18:0);
1,2-ジオレオイル-sn-グリセロ-3-ホスホコリン(DOPC、C18:1、C18:1);
1,2-ジエルコイル-sn-グリセロ-3-ホスホコリン(DEPC、C22:1、C22:1);
1,2-ジエイコサペンタエノイル-sn-グリセロ-3-ホスホコリン(EPA-PC、C20:5、C20:5);
1,2-ジドコサヘキサエノイル-sn-グリセロ-3-ホスホコリン(DHA-PC、C22:6、C22:6);
1-ミリストイル-2-パルミトイル-sn-グリセロ-3-ホスホコリン(MPPC、C14:0、C16:0);
1-ミリストイル-2-ステアロイル-sn-グリセロ-3-ホスホコリン(MSPC、C14:0、C18:0);
1-パルミトイル-2-ステアロイル-sn-グリセロ-3-ホスホコリン(PMPC、C16:0、C14:0);
1-パルミトイル-2-ステアロイル-sn-グリセロ-3-ホスホコリン(PSPC、C16:0、C18:0);
1-ステアロイル-2-ミリストイル-sn-グリセロ-3-ホスホコリン(SMPC、C18:0、C14:0);
1-ステアロイル-2-パルミトイル-sn-グリセロ-3-ホスホコリン(SPPC、C18:0、C16:0);
1,2-ミリストイル-オレオイル-sn-グリセロ-3-ホスホエタノールアミン(MOPC、C14:0、C18:0);
1,2-パルミトイル-オレオイル-sn-グリセロ-3-ホスホエタノールアミン(POPC、C16:0、C18:1);
1,2-ステアロイル-オレオイル-sn-グリセロ-3-ホスホエタノールアミン(POPC、C18:0、C18:1)、及びそれらの薬学的に許容される塩及びそれらの混合物が挙げられる。
1,2-ジデカノイル-sn-グリセロ-3-ホスホコリン(DDPC、C10:0、C10:0);
1,2-ジラウロイル-sn-グリセロ-3-ホスホコリン(DLPC、C12:0、C12:0);
1,2-ジミリストイル-sn-グリセロ-3-ホスホコリン(DMPC、C14:0、C14:0);
1,2-ジパルミトイル-sn-グリセロ-3-ホスホコリン(DPPC、C16:0、C16:0);
1,2-ジステアロイル-sn-グリセロ-3-ホスホコリン(DSPC、C18:0、C18:0);
1,2-ジオレオイル-sn-グリセロ-3-ホスホコリン(DOPC、C18:1、C18:1);
1,2-ジエルコイル-sn-グリセロ-3-ホスホコリン(DEPC、C22:1、C22:1);
1,2-ジエイコサペンタエノイル-sn-グリセロ-3-ホスホコリン(EPA-PC、C20:5、C20:5);
1,2-ジドコサヘキサエノイル-sn-グリセロ-3-ホスホコリン(DHA-PC、C22:6、C22:6);
1-ミリストイル-2-パルミトイル-sn-グリセロ-3-ホスホコリン(MPPC、C14:0、C16:0);
1-ミリストイル-2-ステアロイル-sn-グリセロ-3-ホスホコリン(MSPC、C14:0、C18:0);
1-パルミトイル-2-ステアロイル-sn-グリセロ-3-ホスホコリン(PMPC、C16:0、C14:0);
1-パルミトイル-2-ステアロイル-sn-グリセロ-3-ホスホコリン(PSPC、C16:0、C18:0);
1-ステアロイル-2-ミリストイル-sn-グリセロ-3-ホスホコリン(SMPC、C18:0、C14:0);
1-ステアロイル-2-パルミトイル-sn-グリセロ-3-ホスホコリン(SPPC、C18:0、C16:0);
1,2-ミリストイル-オレオイル-sn-グリセロ-3-ホスホエタノールアミン(MOPC、C14:0、C18:0);
1,2-パルミトイル-オレオイル-sn-グリセロ-3-ホスホエタノールアミン(POPC、C16:0、C18:1);
1,2-ステアロイル-オレオイル-sn-グリセロ-3-ホスホエタノールアミン(POPC、C18:0、C18:1)、及びそれらの薬学的に許容される塩及びそれらの混合物が挙げられる。
本明細書に記載のナノ粒子組成物で有用な様々なリゾホスファチジルコリンとしては、
1-ミリストイル-2-lyso-sn-グリセロ-3-ホスホコリン(M-LysoPC、C14:0);
1-パルミトイル-2-lyso-sn-グリセロ-3-ホスホコリン(P-LysoPC、C16:0);
1-ステアロイル-2-lyso-sn-グリセロ-3-ホスホコリン(S-LysoPC、C18:0)、及び
それらの薬学的に許容される塩及びそれらの混合物が挙げられる。
1-ミリストイル-2-lyso-sn-グリセロ-3-ホスホコリン(M-LysoPC、C14:0);
1-パルミトイル-2-lyso-sn-グリセロ-3-ホスホコリン(P-LysoPC、C16:0);
1-ステアロイル-2-lyso-sn-グリセロ-3-ホスホコリン(S-LysoPC、C18:0)、及び
それらの薬学的に許容される塩及びそれらの混合物が挙げられる。
本明細書に記載のナノ粒子組成物で有用な様々なホスファチジルグリセロールとしては、
水素化大豆ホスファチジルグリセロール(HSPG);
非水素化卵ホスファチジルグリセロール(EPG);
1,2-ジミリストイル-sn-グリセロ-3-ホスホグリセロール(DMPG、C14:0、C14:0);
1,2-ジパルミトイル-sn-グリセロ-3-ホスホグリセロール(DPPG、C16:0、C16:0);
1,2-ジステアロイル-sn-グリセロ-3-ホスホグリセロール(DSPG、C18:0、C18:0);
1,2-ジオレオイル-sn-グリセロ-3-ホスホグリセロール(DOPG、C18:1、C18:1);
1,2-ジエルコイル-sn-グリセロ-3-ホスホグリセロール(DEPG、C22:1、C22:1);
1-パルミトイル-2-オレオイル-sn-グリセロ-3-ホスホグリセロール(POPG、C16:0、C18:1)、及びそれらの薬学的に許容される塩及びそれらの混合物の中から選択される。
水素化大豆ホスファチジルグリセロール(HSPG);
非水素化卵ホスファチジルグリセロール(EPG);
1,2-ジミリストイル-sn-グリセロ-3-ホスホグリセロール(DMPG、C14:0、C14:0);
1,2-ジパルミトイル-sn-グリセロ-3-ホスホグリセロール(DPPG、C16:0、C16:0);
1,2-ジステアロイル-sn-グリセロ-3-ホスホグリセロール(DSPG、C18:0、C18:0);
1,2-ジオレオイル-sn-グリセロ-3-ホスホグリセロール(DOPG、C18:1、C18:1);
1,2-ジエルコイル-sn-グリセロ-3-ホスホグリセロール(DEPG、C22:1、C22:1);
1-パルミトイル-2-オレオイル-sn-グリセロ-3-ホスホグリセロール(POPG、C16:0、C18:1)、及びそれらの薬学的に許容される塩及びそれらの混合物の中から選択される。
本明細書に記載のナノ粒子組成物で有用な様々なホスファチジン酸としては、
1,2-ジミリストイル-sn-グリセロ-3-ホスファチジン酸(DMPA、C14:0、C14:0);
1,2-ジパルミトイル-sn-グリセロ-3-ホスファチジン酸(DPPA、C16:0、C16:0);
1,2-ジステアロイル-sn-グリセロ-3-ホスファチジン酸(DSPA、C18:0、C18:0)、及び
それらの薬学的に許容される塩及びそれらの混合物が挙げられる。
1,2-ジミリストイル-sn-グリセロ-3-ホスファチジン酸(DMPA、C14:0、C14:0);
1,2-ジパルミトイル-sn-グリセロ-3-ホスファチジン酸(DPPA、C16:0、C16:0);
1,2-ジステアロイル-sn-グリセロ-3-ホスファチジン酸(DSPA、C18:0、C18:0)、及び
それらの薬学的に許容される塩及びそれらの混合物が挙げられる。
本明細書に記載のナノ粒子組成物で有用な様々なホスファチジルエタノールアミンとしては、
水素化大豆ホスファチジルエタノールアミン(HSPE);
非水素化卵ホスファチジルエタノールアミン(EPE);
1,2-ジミリストイル-sn-グリセロ-3-ホスホエタノールアミン(DMPE、C14:0、C14:0);
1,2-ジパルミトイル-sn-グリセロ-3-ホスホエタノールアミン(DPPE、C16:0、C16:0);
1,2-ジステアロイル-sn-グリセロ-3-ホスホエタノールアミン(DSPE、C18:0、C18:0);
1,2-ジオレオイル-sn-グリセロ-3-ホスホエタノールアミン(DOPE、C18:1、C18:1);
1,2-ジオレオイル-sn-グリセロ-3-ホスホエタノールアミン(DEPE、C22:1、C22:1);
1,2-ジエルコイル-sn-グリセロ-3-ホスホエタノールアミン(POPE、C16:0、C18:1)、及びそれらの薬学的に許容される塩及びそれらの混合物が挙げられる。
水素化大豆ホスファチジルエタノールアミン(HSPE);
非水素化卵ホスファチジルエタノールアミン(EPE);
1,2-ジミリストイル-sn-グリセロ-3-ホスホエタノールアミン(DMPE、C14:0、C14:0);
1,2-ジパルミトイル-sn-グリセロ-3-ホスホエタノールアミン(DPPE、C16:0、C16:0);
1,2-ジステアロイル-sn-グリセロ-3-ホスホエタノールアミン(DSPE、C18:0、C18:0);
1,2-ジオレオイル-sn-グリセロ-3-ホスホエタノールアミン(DOPE、C18:1、C18:1);
1,2-ジオレオイル-sn-グリセロ-3-ホスホエタノールアミン(DEPE、C22:1、C22:1);
1,2-ジエルコイル-sn-グリセロ-3-ホスホエタノールアミン(POPE、C16:0、C18:1)、及びそれらの薬学的に許容される塩及びそれらの混合物が挙げられる。
本明細書に記載のナノ粒子組成物で有用な様々なホスファチジルセリンとしては、
1,2-ジミリストイル-sn-グリセロ-3-ホスホ-L-セリン(DMPS、C14:0、C14:0);
1,2-ジパルミトイル-sn-グリセロ-3-ホスホ-L-セリン(DPPS、C16:0、C16:0);
1,2-ジステアロイル-sn-グリセロ-3-ホスホ-L-セリン(DSPS、C18:0、C18:0);
1,2-ジオレオイル-sn-グリセロ-3-ホスホ-L-セリン(DOPS、C18:1、C18:1);
1-パルミトイル-2-オレオイル-sn-3-ホスホ-L-セリン(POPS、C16:0、C18:1)、及びそれらの薬学的に許容される塩及びそれらの混合物が挙げられる。
1,2-ジミリストイル-sn-グリセロ-3-ホスホ-L-セリン(DMPS、C14:0、C14:0);
1,2-ジパルミトイル-sn-グリセロ-3-ホスホ-L-セリン(DPPS、C16:0、C16:0);
1,2-ジステアロイル-sn-グリセロ-3-ホスホ-L-セリン(DSPS、C18:0、C18:0);
1,2-ジオレオイル-sn-グリセロ-3-ホスホ-L-セリン(DOPS、C18:1、C18:1);
1-パルミトイル-2-オレオイル-sn-3-ホスホ-L-セリン(POPS、C16:0、C18:1)、及びそれらの薬学的に許容される塩及びそれらの混合物が挙げられる。
一つの好ましい実施形態において、本明細書に記載のナノ粒子組成物の調製に有用な適切な中性脂質としては、例えば、
ジオレオイルホスファチジルエタノールアミン(DOPE)、
ジステアロイルホスファチジルエタノールアミン(DSPE)、
パルミトイルオレオイルホスファチジルエタノールアミン(POPE)、
卵ホスファチジルコリン(EPC)、
ジパルミトイルホスファチジルコリン(DPPC)、
ジステアロイルホスファチジルコリン(DSPC)、
ジオレオイルホスファチジルコリン(DOPC)、
パルミトイルオレオイルホスファチジルコリン(POPC)、
ジパルミトイルホスファチジルグリセロール(DPPG)、
ジオレオイルホスファチジルグリセロール(DOPG)、
ジオレオイルホスファチジルエタノールアミン4-(N-マレイミドメチル)-シクロヘキサン-1-カルボキシレート(DOPE-mal)、コレステロール、それらの薬学的に許容される塩及び混合物が挙げられる。
ジオレオイルホスファチジルエタノールアミン(DOPE)、
ジステアロイルホスファチジルエタノールアミン(DSPE)、
パルミトイルオレオイルホスファチジルエタノールアミン(POPE)、
卵ホスファチジルコリン(EPC)、
ジパルミトイルホスファチジルコリン(DPPC)、
ジステアロイルホスファチジルコリン(DSPC)、
ジオレオイルホスファチジルコリン(DOPC)、
パルミトイルオレオイルホスファチジルコリン(POPC)、
ジパルミトイルホスファチジルグリセロール(DPPG)、
ジオレオイルホスファチジルグリセロール(DOPG)、
ジオレオイルホスファチジルエタノールアミン4-(N-マレイミドメチル)-シクロヘキサン-1-カルボキシレート(DOPE-mal)、コレステロール、それらの薬学的に許容される塩及び混合物が挙げられる。
ある種の好ましい実施形態において、本明細書に記載のナノ粒子組成物は、DSPC、EPC、DOPE等及びそれらの混合物を含む。
本発明の更なる態様において、ナノ粒子組成物は、ステロール等の非カチオン性脂質を含有する。ナノ粒子組成物は、好ましくはコレステロール又はその類似体、より好ましくはコレステロールを含有する。
更なる実施形態において、ナノ粒子組成物は、酸不安定性イミンリンカー及び両性イオン含有部分に基づく放出可能融合性脂質を含有する。このような放出可能融合性脂質の更なる詳細は、各々の内容が参照により本明細書に組み込まれている、米国仮特許出願第61/115,378号、及び同日に出願された「Releasable Fusogenic Lipids For Nucleic Acids Delivery Systems」という表題のPCT特許出願第____号に記載されている。
5.核酸/オリゴヌクレオチド
本明細書に記載のナノ粒子組成物は、様々な核酸を細胞又は組織に送達するために使用できる。核酸としては、プラスミド及びオリゴヌクレオチドが挙げられる。好ましくは、本明細書に記載のナノ粒子組成物は、オリゴヌクレオチドの送達のために使用される。
本明細書に記載のナノ粒子組成物は、様々な核酸を細胞又は組織に送達するために使用できる。核酸としては、プラスミド及びオリゴヌクレオチドが挙げられる。好ましくは、本明細書に記載のナノ粒子組成物は、オリゴヌクレオチドの送達のために使用される。
本発明の範囲をより十分に理解するために、以下の用語を定義する。当業者は、「核酸」又は「ヌクレオチド」という用語が、別段の指示がない限り一本鎖であるか又は二本鎖であるデオキシリボ核酸(「DNA」)、リボ核酸(「RNA」)、並びにそれらの任意の化学修飾体又は類似体、例えばロック(Locked)核酸(LNA)に適用されることを認識されよう。当業者は、「核酸」という用語には、ポリ核酸、その誘導体、修飾体及び類似体が含まれることを容易に理解されよう。「オリゴヌクレオチド」とは、例えば約2〜約200ヌクレオチド長、好ましくは約8〜約50ヌクレオチド長、より好ましくは約8〜約30ヌクレオチド長、さらにより好ましくは約8〜約20ヌクレオチド長又は約15〜約28ヌクレオチド長の大きさがある、一般に比較的短いポリヌクレオチドである。本発明によるオリゴヌクレオチドは、別段の指示がない限り、一般に合成核酸であり、一本鎖である。「ポリヌクレオチド」及び「ポリ核酸」という用語は、本明細書において同義的にも使用できる。
オリゴヌクレオチド(類似体)は、一種類のオリゴヌクレオチドに限定されないが、その代わり、広範なこのような部分と連携するように設計されており、リンカーは、3’−又は5’−末端、通常ヌクレオチドのPO4基又はSO4基の一つ又は複数に結合できることが理解される。企図される核酸分子は、ホスホロチオエート、インターヌクレオチド結合修飾、糖修飾、核酸塩基修飾及び/又はホスフェート骨格修飾を挙げることができる。オリゴヌクレオチドは、天然のホスホロジエステル骨格又はホスホロチオエート骨格、又は任意の他の修飾骨格類似体、例えばLNA(ロック核酸)、PNA(ペプチド骨格を有する核酸)、CpGオリゴマー等を含有でき、それらは、その内容が参照により本明細書に組み込まれている、Tides 2002, Oligonucleotide and Peptide Technology Conferences, May 6-8, 2002, Las Vegas, NV及びOligonucleotide & Peptide Technologies, 18th & 19th November 2003, Hamburg, Germanyにて開示されている。
本発明で企図されるオリゴヌクレオチドの修飾は、例えば、追加の電荷、分極率、水素結合、静電相互作用及び官能性をオリゴヌクレオチドに取り込む官能性部分の付加又は置換を含む。このような修飾としては、それだけに限らないが、2’位糖修飾、5位ピリミジン修飾、8位プリン修飾、環外アミンでの修飾、4−チオウリジンの置換、5−ブロモウラシル又は5−ヨードウラシルの置換、骨格修飾、メチル化、イソ塩基のイソシチジン及びイソグアニジン等の塩基対合組合せ、並びに類似の組合せが挙げられる。本発明の範囲内で企図されるオリゴヌクレオチドとしては、3’及び/又は5’キャップ構造も挙げることができる。
本発明の目的のために、「キャップ構造」は、オリゴヌクレオチドのいずれかの末端で取り込まれた化学修飾を意味すると理解されるものとする。キャップは、5’−末端(5’−キャップ)又は3’−末端(3’−キャップ)に存在してもよく、又は両末端に存在してもよい。5’−キャップの非限定的例としては、脱塩基残基(部分)、4’,5’−メチレンヌクレオチド、1−(β−D−エリスロフラノシル)ヌクレオチド、4’−チオヌクレオチド、炭素環式ヌクレオチド、1,5−アンヒドロヘキシトールヌクレオチド、L−ヌクレオチド、αヌクレオチド、修飾塩基ヌクレオチド、ホスホロジチオエート結合、スレオペントフラノシルヌクレオチド、非環式3’,4’−セコヌクレオチド、非環式3,4−ジヒドロキシブチルヌクレオチド、非環式3,5−ジヒドロキシペンチルヌクレオチド、3’−3’−逆位ヌクレオチド部分、3’−3’−逆位脱塩基部分、3’−2’−逆位ヌクレオチド部分、3’−2’−逆位脱塩基部分、1,4−ブタンジオールホスフェート、3’−ホスホルアミデート、ヘキシルホスフェート、アミノヘキシルホスフェート、3’−ホスフェート、3’−ホスホロチオエート、ホスホロジチオエート又は架橋もしくは非架橋メチルホスホネート部分が挙げられる。詳細は、その内容が参照により本明細書に組み込まれている、WO97/26270に記載されている。3’−キャップとしては、例えば、4’、5’−メチレンヌクレオチド、1−(β−D−エリスロフラノシル)ヌクレオチド、4’−チオヌクレオチド、炭素環式ヌクレオチド、5’−アミノアルキルホスフェート、1,3−ジアミノ−2−プロピルホスフェート、3−アミノプロピルホスフェート、6−アミノヘキシルホスフェート、1,2−アミノドデシルホスフェート、ヒドロキシプロピルホスフェート、1,5−アンヒドロヘキトールヌクレオチド、L−ヌクレオチド、αヌクレオチド、修飾塩基ヌクレオチド、ホスホロジチオエート、スレオペントフラノシルヌクレオチド、非環式3’,4’−セコヌクレオチド、3,4−ジヒドロキシブチルヌクレオチド、3,5−ジヒドロキシペンチルヌクレオチド、5’−5’−逆位ヌクレオチド部分、5’−5’−逆位脱塩基部分、5’−ホスホルアミデート、5’−ホスホロチオエート、1,4−ブタンジオールホスフェート、5’−アミノ、架橋及び/もしくは非架橋5’−ホスホルアミデート、ホスホロチオエート及び/又はホスホロジチオエート、架橋もしくは非架橋メチルホスホネート及び5’−メルカプト部分を挙げることができる。その内容が参照により本明細書に組み込まれている、Beaucage and Iyer, 1993, Tetrahedron 49, 1925も参照のこと。
を有する。それらの各々の内容が、参照により本明細書に組み込まれている、Freier & Altmann; Nucl. Acid Res., 1997, 25, 4429-4443及びUhlmann; Curr. Opinion in Drug Development, 2000, 3(2), 293-213に記載のヌクレオシド類似体のさらなる例を参照のこと。
本明細書で使用する場合、「アンチセンス」という用語は、遺伝子産物をコードするか、又は調節配列をコードする特定のDNA配列又はRNA配列に相補的であるヌクレオチド配列を指す。「アンチセンス鎖」という用語は、「センス」鎖に相補的である核酸鎖に関して使用される。細胞代謝の通常の動作において、DNA分子のセンス鎖は、ポリペプチド及び/又は他の遺伝子産物をコードする鎖である。センス鎖は、メッセンジャーRNA(「mRNA」)転写物(アンチセンス鎖)の合成のためのテンプレートとしての役割を果たし、次いで任意のコードされた遺伝子産物の合成を導く。アンチセンス核酸分子は、合成を含む当技術分野で公知の任意の方法により調製できる。細胞へ一旦導入されると、この転写鎖は、細胞により産生される天然配列と組み合わさり、二本鎖を形成する。次いで、これらの二本鎖はmRNAのさらなる転写又はその翻訳のいずれかを阻害する。「負」又は(−)の呼称がアンチセンス鎖を指すことも当技術分野で公知であり、「正」又は(+)がセンス鎖を指すことも当技術分野で公知である。
本発明の目的のために、「相補的」とは、核酸配列が、別の核酸配列との水素結合(複数可)を形成することを意味すると理解されるものとする。パーセント相補性は、第2の核酸配列と水素結合、即ちワトソンクリック塩基対合を形成できる核酸分子中の隣接残基の割合を指す。即ち、10の内5、6、7、8、9、10は、50%、60%、70%、80%、90%及び100%相補性である。「完全な相補性」とは、核酸配列の全ての隣接残基が、第2の核酸配列中の同数の隣接残基と水素結合を形成することを意味する。
本明細書に記載のナノ粒子で有用な核酸(例えば一つ又は複数の同一又は異なるオリゴヌクレオチド又はオリゴヌクレオチド誘導体)は、約5〜約1000個の核酸、例えば好ましくは約8〜約50ヌクレオチド長(例えば、約8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29又は30)の大きさがある好ましくは比較的短いポリヌクレオチドを挙げることができる。
一態様において、本明細書に記載のナノ粒子中に封入される有用な核酸としては、天然のホスホロジエステル骨格もしくはホスホロチオエート骨格又は任意の他の修飾骨格類似体を有するオリゴヌクレオチド及びオリゴデオキシヌクレオチド、例えば
LNA(ロック核酸);
PNA(ペプチド骨格を有する核酸);
低分子干渉RNA(siRNA);
マイクロRNA(miRNA);
ペプチド骨格を有する核酸(PNA);
ホスホロジアミデートモルホリノオリゴヌクレオチド(PMO);
トリシクロ−DNA;
デコイODN(二本鎖オリゴヌクレオチド);
触媒RNA(RNAi);
リボザイム;
アプタマー;
シュピーゲルマー(L−立体配座オリゴヌクレオチド);
CpGオリゴマー等、例えば、
その内容が参照により本明細書に組み込まれている、Tides 2002, Oligonucleotide and Peptide Technology Conferences, May 6-8, 2002, Las Vegas, NV及びOligonucleotide & Peptide Technologies, 18th & 19th November, 2003, Hamburg, Germanyにて開示されているものが挙げられる。
LNA(ロック核酸);
PNA(ペプチド骨格を有する核酸);
低分子干渉RNA(siRNA);
マイクロRNA(miRNA);
ペプチド骨格を有する核酸(PNA);
ホスホロジアミデートモルホリノオリゴヌクレオチド(PMO);
トリシクロ−DNA;
デコイODN(二本鎖オリゴヌクレオチド);
触媒RNA(RNAi);
リボザイム;
アプタマー;
シュピーゲルマー(L−立体配座オリゴヌクレオチド);
CpGオリゴマー等、例えば、
その内容が参照により本明細書に組み込まれている、Tides 2002, Oligonucleotide and Peptide Technology Conferences, May 6-8, 2002, Las Vegas, NV及びOligonucleotide & Peptide Technologies, 18th & 19th November, 2003, Hamburg, Germanyにて開示されているものが挙げられる。
一つの好ましい態様において、ナノ粒子に封入された標的オリゴヌクレオチドとしては、例えばそれだけに限らないが、癌遺伝子、プロ血管新生経路遺伝子、プロ細胞増殖経路遺伝子、ウイルス感染因子遺伝子及びプロ炎症経路遺伝子が挙げられる。
一つの好ましい実施形態において、本明細書に記載のナノ粒子中に封入されたオリゴヌクレオチドは、腫瘍細胞を標的とするか、又は腫瘍細胞及び/もしくは抗癌療法に対する腫瘍細胞の耐性と関連する遺伝子もしくはタンパク質の発現のダウンレギュレートに関わる。例えば、癌と関連する任意の当技術分野で公知の細胞タンパク質をダウンレギュレートするためのアンチセンスオリゴヌクレオチド、例えばBCL−2は本発明で使用できる。その内容が参照により本明細書に組み込まれている、2004年4月9日に出願された米国特許出願公開第10/822,205号明細書を参照のこと。好ましい治療用オリゴヌクレオチドの非限定的例としては、アンチセンスbcl−2オリゴヌクレオチド、アンチセンスHIF−1αオリゴヌクレオチド、アンチセンススルビビンオリゴヌクレオチド、アンチセンスErbB3オリゴヌクレオチド、アンチセンスPIK3CAオリゴヌクレオチド、アンチセンスHSP27オリゴヌクレオチド、アンチセンスアンドロゲン受容体オリゴヌクレオチド、アンチセンスGli2オリゴヌクレオチド及びアンチセンスβカテニンオリゴヌクレオチドが挙げられる。
より好ましくは、本明細書に記載の本発明によるオリゴヌクレオチドとしては、ホスホロチオエート骨格及びLNAが挙げられる。
一つの好ましい実施形態において、オリゴヌクレオチドは、例えばアンチセンススルビビンLNA、アンチセンスErbB3LNA又はアンチセンスHIF1−αLNAであってよい。
別の好ましい実施形態において、オリゴヌクレオチドは、例えば、Genasense(登録商標)(別名オブリメルセンナトリウム、Genta Inc.、Berkeley Heights、NJ製)と同一又は実質的に同様のヌクレオチド配列を有するオリゴヌクレオチドあってよい。Genasense(登録商標)は、18−メルホスホロチオエートアンチセンスオリゴヌクレオチド(配列番号4)であり、ヒトbcl−2mRNAの開始配列の最初の六つのコドンに相補的である(ヒトbcl−2mRNAは当技術分野で公知であり、例えば配列番号19として参照により本明細書に組み込まれている米国特許第6,414,134号明細書に記載されている)。
企図される好ましい実施形態は、以下を含む:
(i)アンチセンススルビビンLNAオリゴマー(配列番号1)
mCs−Ts−mCs−As−as−ts−cs−as−ts−gs−gs−mCs−As−Gs−c;
大文字はLNAを表し、「s」はホスホロチオエート骨格を表す。
(i)アンチセンススルビビンLNAオリゴマー(配列番号1)
mCs−Ts−mCs−As−as−ts−cs−as−ts−gs−gs−mCs−As−Gs−c;
大文字はLNAを表し、「s」はホスホロチオエート骨格を表す。
(ii)アンチセンスBcl2siRNA:
SENSE5’−gcaugcggccucuguuugadTdT−3’(配列番号2)
ANTISENSE3’−dTdTcguacgccggagacaaacu−5’(配列番号3)
dTはDNAを表す。
SENSE5’−gcaugcggccucuguuugadTdT−3’(配列番号2)
ANTISENSE3’−dTdTcguacgccggagacaaacu−5’(配列番号3)
dTはDNAを表す。
(iii)Genasense(ホスホロチオエートアンチセンスオリゴヌクレオチド):(配列番号4)
ts−cs−ts−cs−cs−cs−as−gs−cs−gs−ts−gs−cs−gs−cs−cs−cs−as−t
小文字はDNAを表し、「s」はホスホロチオエート骨格を表す。
ts−cs−ts−cs−cs−cs−as−gs−cs−gs−ts−gs−cs−gs−cs−cs−cs−as−t
小文字はDNAを表し、「s」はホスホロチオエート骨格を表す。
(iv)アンチセンスHIF1αLNAオリゴマー(配列番号5)
TsGsGscsasasgscsastscscsTsGsTsa
大文字はLNAを表し、「s」はホスホロチオエート骨格を表す。
TsGsGscsasasgscsastscscsTsGsTsa
大文字はLNAを表し、「s」はホスホロチオエート骨格を表す。
(v)アンチセンスErbB3 LNAオリゴマー(配列番号6)
TsAsGscscstsgstscsascststs MeCsTs MeCs
大文字はLNAを表し、「s」はホスホロチオエート骨格を表す。
TsAsGscscstsgstscsascststs MeCsTs MeCs
大文字はLNAを表し、「s」はホスホロチオエート骨格を表す。
(vi)アンチセンスErbB3 LNAオリゴマー(配列番号7)
Gs MeCsTscscsasgsascsastscsas MeCsTs MeC
大文字はLNAを表し、「s」はホスホロチオエート骨格を表す。
Gs MeCsTscscsasgsascsastscsas MeCsTs MeC
大文字はLNAを表し、「s」はホスホロチオエート骨格を表す。
(vii)アンチセンスPIK3CA LNAオリゴマー(配列番号8)
AsGs MeCscsaststscsaststscscsAs MeCs MeC
大文字はLNAを表し、「s」はホスホロチオエート骨格を表す。
AsGs MeCscsaststscsaststscscsAs MeCs MeC
大文字はLNAを表し、「s」はホスホロチオエート骨格を表す。
(viii)アンチセンスPIK3CA LNAオリゴマー(配列番号9)
TsTsAststsgstsgscsastscsts MeCsAsG
大文字はLNAを表し、「s」はホスホロチオエート骨格を表す。
TsTsAststsgstsgscsastscsts MeCsAsG
大文字はLNAを表し、「s」はホスホロチオエート骨格を表す。
(ix)アンチセンスHSP27 LNAオリゴマー(配列番号10)
CsGsTsgstsastststscscsgscsGsTsG
大文字はLNAを表し、「s」はホスホロチオエート骨格を表す。
CsGsTsgstsastststscscsgscsGsTsG
大文字はLNAを表し、「s」はホスホロチオエート骨格を表す。
(x)アンチセンスHSP27 LNAオリゴマー(配列番号11)
GsGs MeCsascsasgscscsasgstsgsGs MeCsG
大文字はLNAを表し、「s」はホスホロチオエート骨格を表す。
GsGs MeCsascsasgscscsasgstsgsGs MeCsG
大文字はLNAを表し、「s」はホスホロチオエート骨格を表す。
(xi)アンチセンスアンドロゲン受容体LNAオリゴマー(配列番号12)
MeCs MeCs MeCsasasgsgscsascstsgscsAsGsA
大文字はLNAを表し、「s」はホスホロチオエート骨格を表す。
MeCs MeCs MeCsasasgsgscsascstsgscsAsGsA
大文字はLNAを表し、「s」はホスホロチオエート骨格を表す。
(xii)アンチセンスアンドロゲン受容体LNAオリゴマー(配列番号13)
As MeCs MeCsasasgstststscststscsAsGs MeC
大文字はLNAを表し、「s」はホスホロチオエート骨格を表す。
As MeCs MeCsasasgstststscststscsAsGs MeC
大文字はLNAを表し、「s」はホスホロチオエート骨格を表す。
(xiii)アンチセンスGLI2 LNAオリゴマー(配列番号14)
MeCsTs MeCscststsgsgstsgscsasgsTs MeCsT
大文字はLNAを表し、「s」はホスホロチオエート骨格を表す。
MeCsTs MeCscststsgsgstsgscsasgsTs MeCsT
大文字はLNAを表し、「s」はホスホロチオエート骨格を表す。
(xiv)アンチセンスGLI2 LNAオリゴマー(配列番号15)
Ts MeCsAsgsaststscsasasascs MeCs MeCsA
大文字はLNAを表し、「s」はホスホロチオエート骨格を表す。
Ts MeCsAsgsaststscsasasascs MeCs MeCsA
大文字はLNAを表し、「s」はホスホロチオエート骨格を表す。
(xv)アンチセンスβカテニンLNAオリゴマー(配列番号16)
GsTsGststscstsascsascscsasTsTsA
大文字はLNAを表し、「s」はホスホロチオエート骨格を表す。
GsTsGststscstsascsascscsasTsTsA
大文字はLNAを表し、「s」はホスホロチオエート骨格を表す。
小文字はDNA単位を表し、太字の大文字はLNA、例えばβ−D−オキシ−LNA単位を表す。LNAモノマー中の全てのシトシン塩基は、5−メチルシトシンである。下付き「s」はホスホロチオエート結合を表す。
各々の内容が参照により本明細書に組み込まれている、「LNA Oligonucleotides and the Treatment of Cancer」という表題の米国特許出願第11/272,124号及び「Oligomeric Compounds for the Modulation Survivin Expression」という表題の米国特許出願第10/776,934号に開示されているスルビビンLNAの詳細な説明を参照のこと。HIF−1α調節については、米国特許第7,589,190号明細書及び米国特許出願公開第2004/0096864号明細書、ErbB3調節については米国特許出願公開第2008/0318894号明細書及びPCT/US09/063357、PIK3CA調節については米国特許出願公開第2009/0192110号明細書、HSP28調節についてはPCT/IB09/052860号、アンドロゲン受容体調節については米国特許出願公開第2009/0181916号明細書、βカテニン調節については「RNA Antagonists Targeting GLI2」という表題の米国仮特許出願第61/081,135号及びPCT出願第PCT/IB09/006407号、並びに米国特許出願公開第2009/0005335号明細書及び第2009/0203137号明細書も参照のこと。適切な標的遺伝子のさらなる例は、その内容が参照により本明細書に組み込まれている、WO03/74654、PCT/US03/05028及び米国特許出願第10/923,536号に記載されている。
さらなる実施形態において、本明細書に記載のナノ粒子は、エンドソーム放出促進群に放出可能なように結合したオリゴヌクレオチドを含むことができる。エンドソーム放出促進群、例えば富ヒスチジンペプチドは、エンドソーム膜を不安定化/破壊し、それにより治療薬の細胞質送達を促進することができる。富ヒスチジンペプチドは、細胞質へのオリゴヌクレオチドのエンドソーム放出を促進する。次いで、細胞内に放出されたオリゴヌクレオチドは、核へ移行できる。オリゴヌクレオチド−富ヒスチジンペプチド複合体のさらなる詳細は、各々の内容が参照により本明細書に組み込まれている、2008年11月17日に出願された米国仮特許出願第61/115,350号及び第61/115,326号、並びに同日に出願された「Releasable Conjugates For Nucleic Acids Delivery Systems」という表題のPCT特許出願第____号に記載されている。
6.標的基
場合により/好ましくは、本明細書に記載のナノ粒子組成物は、特定の細胞型又は組織型に対する標的リガンドをさらに含む。標的基は、リンカー分子、例えばアミド(amide)、アミド(amido)、カルボニル、エステル、ペプチド、ジスルフィド、シラン、ヌクレオシド、脱塩基ヌクレオシド、ポリエーテル、ポリアミン、ポリアミド、ペプチド、炭水化物、脂質、ポリ炭化水素、リン酸エステル、ホスホルアミデート、チオホスフェート、アルキルホスフェート、マレイミジルリンカー又は光解離性リンカーを用いてナノ粒子組成物(例えば、融合性脂質、PEG脂質など、好ましくは式(I)の放出可能ポリマー脂質)の任意の成分に結合できる。当技術分野で公知の任意の技法は、過度に実験するまでもなくナノ粒子組成物の任意の成分に標的基を結合させるのに使用できる。
場合により/好ましくは、本明細書に記載のナノ粒子組成物は、特定の細胞型又は組織型に対する標的リガンドをさらに含む。標的基は、リンカー分子、例えばアミド(amide)、アミド(amido)、カルボニル、エステル、ペプチド、ジスルフィド、シラン、ヌクレオシド、脱塩基ヌクレオシド、ポリエーテル、ポリアミン、ポリアミド、ペプチド、炭水化物、脂質、ポリ炭化水素、リン酸エステル、ホスホルアミデート、チオホスフェート、アルキルホスフェート、マレイミジルリンカー又は光解離性リンカーを用いてナノ粒子組成物(例えば、融合性脂質、PEG脂質など、好ましくは式(I)の放出可能ポリマー脂質)の任意の成分に結合できる。当技術分野で公知の任意の技法は、過度に実験するまでもなくナノ粒子組成物の任意の成分に標的基を結合させるのに使用できる。
例えば、標的化剤を、式(I)の化合物を含むPEG脂質のポリマー部分に結合させて、ナノ粒子をインビボで標的領域に導くことができる。本明細書に記載のナノ粒子の標的送達は、治療用核酸を封入するナノ粒子の細胞取込みを促進し、それによりナノ粒子の治療効果を増強させる。ある種の態様において、いくつかの細胞透過性ペプチドを、腫瘍部位への標的送達のため様々な標的ペプチドと置き換えてもよい。
本発明の一つの好ましい態様において、標的部位、例えば一本鎖抗体(SCA)又は一本鎖抗原結合抗体、モノクローナル抗体、細胞接着性ペプチド、例えばRGDペプチド及びセレクチン、細胞透過性ペプチド(CPP)、例えばTAT、ペネトラチン及び(Arg)9、受容体リガンド、標的炭水化物分子又はレクチンにより、ナノ粒子は標的領域を特異的に対象とすることができる。その内容が参照により本明細書に組み込まれている、J Pharm Sci. 2006 Sep; 95(9): 1856-72 Cell adhesion molecules for targeted drug deliveryを参照のこと。
好ましい標的部分としては、一本鎖抗体(SCA)又は抗体の一本鎖可変フラグメント(sFv)が挙げられる。SCAは、標的腫瘍細胞の特異的分子を結合するか、又は認識することができる抗体のドメインを含有する。抗原結合部位を維持することに加えて、PEG脂質に結合したSCAは、抗原性を低下させ、血流中のSCAの半減期を増大することができる。
「一本鎖抗体」(SCA)、「一本鎖抗原結合分子又は抗体」又は「一本鎖Fv」(sFv)という用語は、互換的に用いられる。一本鎖抗体は、抗原に対する結合親和性を有する。一本鎖抗体(SCA)又は一本鎖Fvsは、いくつかの方法で構築でき、既に構築されている。一本鎖抗原結合タンパク質の理論及び産生の詳細は、それらの各々の内容が参照により本明細書に組み込まれている、同一出願人による米国特許出願第10/915,069号明細書及び米国特許第6,824,782号明細書において見出される。
通常、SCA又はFvドメインは、26−10、MOPC 315、741F8、520C9、McPC 603、D1.3、マウスphOx、ヒトphOx、RFL3.8 sTCR、1A6、Se155−4、18−2−3、4−4−20、7A4−1、B6.2、CC49、3C2、2c、MA−15C5/K12GO、Ox等として文献中でそれらの略語により知られているモノクローナル抗体の中から選択できる(Huston, J. S. et al., Proc. Natl. Acad. Sci. USA 85: 5879-5883(1988);Huston, J. S. et al., SIM News 38(4)(Supp): 11(1988);McCartney, J. et al., ICSU Short Reports 10: 114(1990);McCartney, J. E. et al., unpublished results(1990);Nedelman, M. A. et al., J. Nuclear Med. 32(Supp.): 1005(1991);Huston, J. S. et al., In: Molecular Design and Modeling: Concepts and Applications, PartB, edited by J. J. Langone, Methods in Enzymology 203: 46-88(1991);Huston, J. S. et al., In: Advancesin the Applications of Monoclonal Antibodies in Clinical Oncology, Epenetos、A. A. (Ed.), London, Chapman & Hall(1993);Bird, R. E. et al., Science 242: 423-426(1988);Bedzyk, W. D. et al., J. Biol. Chem. 265: 18615-18620(1990);Colcher, D. et al., J. Nat. Cancer Inst. 82: 1191-1197(1990);Gibbs, R. A. et al., Proc. Natl. Acad. Sci. USA 88: 4001-4004(1991);Milenic, D. E. et al., Cancer Research 51: 6363-6371(1991);Pantoliano, M. W. et al., Biochemistry 30: 10117-10125(1991);Chaudhary, V. K. et al., Nature 339: 394-397(1989);Chaudhary, V. K. et al., Proc. Natl. Acad. Sci. USA 87: 1066-1070(1990);Batra, J. K. et al., Biochem. Biophys. Res. Comm. 171: 1-6(1990);Batra, J. K. et al., J.Biol. Chem. 265: 15198-15202(1990);Chaudhary, V. K. et al., Proc. Natl. Acad Sci. USA 87: 9491-9494(1990);Batra, J. K. et al., Mol. Cell. Biol. 11: 2200-2205(1991);Brinkmann, U. et al., Proc. Natl. Acad. Sci. USA 88: 8616-8620(1991);Seetharam, S. et al., J. Biol. Chem. 266: 17376-17381(1991);Brinkmann, U. et al., Proc. Natl. Acad. Sci. USA 89: 3075-3079(1992);Glockshuber, R. et al., Biochemistry 29: 1362-1367(1990);Skerra, A. et al., Bio/Technol. 9: 273-278(1991);Pack, P. et al., Biochemistry 31: 1579-1534(1992);Clackson, T. et al., Nature 352: 624-628(1991);Marks, J. D. et al., J. Mol. Biol. 222: 581-597(1991);Iverson, B. L. et al., Science 249: 659-662(1990);Roberts, V. A. et al., Proc. Natl. Acad. Sci. USA 87: 6654-6658(1990);Condra, J. H. et al., J. Biol. Chem. 265: 2292-2295(1990);Laroche, Y. et al., J. Biol. Chem. 266: 16343-16349(1991);Holvoet, P. et al., J. Biol. Chem. 266: 19717-19724(1991);Anand, N. N. et al., J. Biol. Chem. 266: 21874-21879(1991);Fuchs, P. et al., Biol Technol. 9: 1369-1372(1991);Breitling, F. et al., Gene 104: 104-153(1991);Seehaus, T. et al., Gene 114: 235-237(1992);Takkinen, K. et al., Protein Engng. 4: 837-841(1991);Dreher, M. L. et al., J.Immunol. Methods 139: 197-205(1991);Mottez, E. et al., Eur. J. Immunol. 21: 467-471(1991);Traunecker, A. et al., Acad. Sci. USA 88: 8646-8650(1991);Traunecker, A.等、EMBOJ. 10:3655-3659(1991); Hoo, W. F. S. et al., Proc. Natl. Acad. Sci. USA 89: 4759-4763(1993)も参照のこと)。前記刊行物は各々参照により本明細書に組み込まれている。
標的基の非限定的リストは、血管内皮細胞増殖因子、FGF2、ソマトスタチン及びソマトスタチン類似体、トランスフェリン、メラノトロピン、ApoE及びApoEペプチド、フォンウィルブランド因子及びフォンウィルブランド因子ペプチド、アデノウイルスファイバータンパク質及びアデノウイルスファイバータンパク質ペプチド、PD1及びPD1ペプチド、EGF及びEGFペプチド、RGDペプチド、葉酸塩、アニサミド等を含む。当業者により認識される他の任意選択の標的化剤も、本明細書に記載のナノ粒子で使用できる。
一つの好ましい実施形態において、本明細書に記載の化合物に有用な標的化剤としては、一本鎖抗体(SCA)、RGDペプチド、セレクチン、TAT、ペネトラチン、(Arg)9、葉酸、アニサミド等が挙げられ、これらの薬剤の好ましい構造の一部は以下のとおりである:
C−TAT:(配列番号:17)CYGRKKRRQRRR;
C−(Arg)9:(配列番号:18)CRRRRRRRRR;
RGDは、直鎖又は環状の
C−TAT:(配列番号:17)CYGRKKRRQRRR;
C−(Arg)9:(配列番号:18)CRRRRRRRRR;
RGDは、直鎖又は環状の
の残基であり、
アニサミドは、p−MeO−Ph−C(=O)OHである。
アニサミドは、p−MeO−Ph−C(=O)OHである。
Arg9は、例えばCRRRRRRRRRを結合するためのシステインを含むことができ、TATは、CYGRKKRRQRRRC等のペプチドの末端でさらなるシステインを付加できる。
本発明の目的のために、明細書及び図面で使用する略語は、以下の構造を表す:
(i)C−diTAT(配列番号19)=CYGRKKRRQRRRYGRKKRRQRRR−NH2;
(ii)直鎖RGD(配列番号20)=RGDC;
(iii)環状RGD(配列番号21及び配列番号22)=c−RGDFC又はc−RGDFK;
(iv)RGD−TAT(配列番号23)=CYGRKKRRQRRRGGGRGDS−NH2及び
(v)Arg9(配列番号24)=RRRRRRRRR
(i)C−diTAT(配列番号19)=CYGRKKRRQRRRYGRKKRRQRRR−NH2;
(ii)直鎖RGD(配列番号20)=RGDC;
(iii)環状RGD(配列番号21及び配列番号22)=c−RGDFC又はc−RGDFK;
(iv)RGD−TAT(配列番号23)=CYGRKKRRQRRRGGGRGDS−NH2及び
(v)Arg9(配列番号24)=RRRRRRRRR
あるいは、標的基は、糖及び炭水化物、例えばガラクトース、ガラクトサミン及びN−アセチルガラクトサミン;ホルモン、例えばエストロゲン、テストステロン、プロゲステロン、グルココルチゾン、アドレナリン、インスリン、グルカゴン、コルチゾール、ビタミンD、甲状腺ホルモン、レチノイン酸及び成長ホルモン;成長因子、例えばVEGF、EGF、NGF及びPDGF;神経伝達物質、例えばGABA、グルタメート、アセチルコリン;NOGO;イノシトール三リン酸;エピネフリン;ノルエピネフリン;一酸化窒素、ペプチド、ビタミン、例えば葉酸及びピリドキシン、薬物、抗体及びインビボ又はインビトロで細胞表面受容体と相互作用し得る任意の他の分子が挙げられる。
D.ナノ粒子の調製
本明細書に記載のナノ粒子は、過度に実験するまでもなく当技術分野で公知の方法で調製できる。
本明細書に記載のナノ粒子は、過度に実験するまでもなく当技術分野で公知の方法で調製できる。
例えば、ナノ粒子は、第1の容器に水溶液(又は比較試験用に核酸なしの水溶液)中のオリゴヌクレオチド等の核酸を用意し、第2の容器に本明細書に記載のナノ粒子組成物を含有する有機脂質溶液を用意して、有機脂質溶液が水溶液と混ざり、核酸を封入するナノ粒子が製造されるように水溶液と有機脂質溶液とを混合することにより調製できる。該方法の詳細は、その内容が参照により本明細書に組み込まれている米国特許出願公開第2004/0142025号明細書に記載されている。
あるいは、本明細書に記載のナノ粒子は、有機溶媒を利用して成分の混合中に単相を得る、界面活性剤透析法又は変性逆相法等の当技術分野で公知の任意の方法により調製できる。界面活性剤透析法では、核酸(即ち、siRNA)をカチオン性脂質の洗浄溶液と接触させ、被覆核酸複合体を形成する。
本発明の一実施形態において、カチオン性脂質とオリゴヌクレオチド等の核酸とを合わせて、約1:20〜約20:1の電荷比、好ましくは約1:5〜約5:1の比、より好ましくは約1:2〜約2:1の比を得る。
一つの好ましい実施形態において、本明細書に記載のナノ粒子は、デュアルポンプシステムを用いて実行できる。一般に、該方法は、第1の容器に核酸を含有する水溶液及び第2の容器に記載のナノ粒子組成物を含有する脂質溶液を用意することを含む。二つの溶液をデュアルポンプシステムを用いて混合し、ナノ粒子を得る。次いで、得られた混合溶液を水性緩衝液で希釈し、形成したナノ粒子を透析により精製するか、且つ/又は単離することができる。ナノ粒子は、0.22μmのフィルターを介して濾過することにより滅菌されるように更に処理してもよい。
核酸を含有するナノ粒子は、直径約5〜約300nmの範囲である。好ましくは、ナノ粒子は、約150nm未満の中位径、より好ましくは約100nm未満の中位径を有する。ナノ粒子の大部分は、約30〜100nm(例えば59.5、66、68、76、80、93、96nm)、好ましくは60〜95nmの中位径を有する。本発明のナノ粒子は、多分散性により示されるように、実質的にサイズが均一であることが望ましい。
場合により、ナノ粒子は、当技術分野で公知の任意の方法によりサイジングできる。サイジングは、所望のサイズ範囲を得、ナノ粒子サイズの分布を比較的狭めるために行うことができる。ナノ粒子を所望のサイズにサイジングするために幾つかの技法を利用できる。その内容が参照により本明細書に組み込まれている、例えば、米国特許第4,737,323号参照。
本発明は、核酸(例えば、LNA又はsiRNA)が脂質二重層に封入され、分解から保護されるように、血清安定ナノ粒子を調製する方法を提供する。核酸は、本発明のナノ粒子中に存在する場合、ヌクレアーゼによる水溶液分解に耐性がある。
更に、本発明に従って調製されるナノ粒子は、生理的pHで中性であるか、又は正に帯電していることが好ましい。
本明細書に記載のナノ粒子組成物を用いて調製されるナノ粒子又はナノ粒子複合体は、(i)カチオン性脂質、(ii)中性脂質(融合性脂質)、(iii)式(I)の放出可能ポリマー脂質及び(iv)オリゴヌクレオチド等の核酸を含む。
一実施形態において、ナノ粒子組成物は、以下の混合物
カチオン性脂質、ジアシルホスファチジルエタノールアミン、式(I)の化合物及びコレステロールの混合物、
カチオン性脂質、ジアシルホスファチジルコリン、式(I)の化合物及びコレステロールの混合物、
カチオン性脂質、ジアシルホスファチジルエタノールアミン、ジアシルホスファチジルコリン、式(I)の化合物及びコレステロールの混合物、並びに
カチオン性脂質、ジアシルホスファチジルエタノールアミン、式(I)の化合物、セラミドに結合したPEG(PEG-Cer)及びコレステロールの混合物
を含む。
カチオン性脂質、ジアシルホスファチジルエタノールアミン、式(I)の化合物及びコレステロールの混合物、
カチオン性脂質、ジアシルホスファチジルコリン、式(I)の化合物及びコレステロールの混合物、
カチオン性脂質、ジアシルホスファチジルエタノールアミン、ジアシルホスファチジルコリン、式(I)の化合物及びコレステロールの混合物、並びに
カチオン性脂質、ジアシルホスファチジルエタノールアミン、式(I)の化合物、セラミドに結合したPEG(PEG-Cer)及びコレステロールの混合物
を含む。
更なるナノ粒子組成物は、当技術分野で公知のカチオン性脂質(複数可)を含有する組成物を修飾することにより調製できる。式(I)の化合物を含有するナノ粒子組成物は、当技術分野で公知のカチオン性脂質を加えることにより修飾できる。その内容が参照により本明細書に組み込まれている米国特許出願公開第2008/0020058号の表IVに記載の当技術分野で公知の組成物を参照のこと。
一実施形態において、ナノ粒子中のカチオン性脂質1:DOPE:コレステロール:化合物10は、各々約18%:52%:20%:10%のモル比で存在する(試料番号9)。
別の実施形態において、ナノ粒子は、カチオン性脂質1(化合物1)、DOPE、コレステロール及び化合物10をナノ粒子組成物中に存在する総脂質の約18%:57%:20%:5%のモル比で含有する(試料番号10)。
(式中、PEG脂質のポリマー部分は、約2000ダルトンの数平均分子量を有する)
を好ましくは含有する。
を好ましくは含有する。
を有する。
本明細書で使用するモル比は、ナノ粒子組成物中に存在する総脂質に対する量を指す。
E.治療方法
本明細書に記載のナノ粒子は、単独で、又は他の療法と組み合わせて、細胞又は組織における標的遺伝子の発現レベルに関連しているか、又はそれに反応する任意の特質、疾患又は状態を予防するか、抑制するか、低減するか又は治療するための治療において使用できる。該方法は、本明細書に記載のナノ粒子を、それを必要とする哺乳動物に投与することを含む。
本明細書に記載のナノ粒子は、単独で、又は他の療法と組み合わせて、細胞又は組織における標的遺伝子の発現レベルに関連しているか、又はそれに反応する任意の特質、疾患又は状態を予防するか、抑制するか、低減するか又は治療するための治療において使用できる。該方法は、本明細書に記載のナノ粒子を、それを必要とする哺乳動物に投与することを含む。
本発明の一態様は、治療薬、例えば核酸/オリゴヌクレオチドを哺乳動物細胞にインビボ及び/又はインビトロで導入するか、又は送達する方法を提供する。
本発明による方法は、細胞を本明細書に記載の化合物と接触させることを含む。送達は、インビボで適切な医薬組成物の一部として行われてもよく、又はエクスビボ環境もしくはインビトロ環境で細胞に対して直接行われてもよい。
本発明は、オリゴヌクレオチドを哺乳動物に導入するのに有用である。本明細書に記載の化合物は、哺乳動物、好ましくはヒトに投与できる。
本発明によれば、本発明は、哺乳動物の細胞又は組織において遺伝子発現を抑制するか、又はダウンレギュレート(もしくは調節)する方法を好ましくは提供する。遺伝子発現のダウンレギュレーション又は抑制は、インビボ、エクスビボ及び/又はインビトロで実現できる。該方法は、ヒトの細胞又は組織と核酸を封入するナノ粒子とを接触させるか、又はナノ粒子をそれを必要とする哺乳動物に投与することを含む。接触が起こると、本明細書に記載のナノ粒子なしで観察されたものと比較して、少なくとも約10%、好ましくは少なくとも約20%以上(例えば、少なくとも約25%、30%、40%、50%、60%)がインビボ、エクスビボ又はインビトロで実現された場合に、例えばmRNAレベル又はタンパク質レベルでの遺伝子発現の抑制又はダウンレギュレーションが成功したとみなされるものとする。
本発明の目的のために、「抑制する」又は「ダウンレギュレートする」は、一つ又は複数のタンパク質サブユニットをコードする標的遺伝子の発現、又はRNAもしくは等価RNAのレベル、あるいは一つ又は複数のタンパク質サブユニットの活性が、本明細書に記載のナノ粒子の不在化で観察されたものと比較して低減されることを意味すると理解されるものとする。
一つの好ましい実施形態において、標的遺伝子としては、例えばそれだけに限らないが、癌遺伝子、プロ血管新生経路遺伝子、プロ細胞増殖経路遺伝子、ウイルス感染因子遺伝子及びプロ炎症経路遺伝子が挙げられる。
好ましくは、標的遺伝子の遺伝子発現は、癌細胞又は癌組織、例えば脳腫瘍細胞、乳癌細胞、結腸直腸癌細胞、胃癌細胞、肺癌細胞、口腔癌細胞、膵臓癌細胞、前立腺癌細胞、皮膚癌細胞又は子宮頸癌細胞において抑制される。癌細胞又は癌組織は、以下のもの:固形腫瘍、リンパ腫、小細胞肺癌、急性リンパ性白血病(ALL)、膵臓癌、膠芽腫、卵巣癌、胃癌、乳癌、結腸直腸癌、前立腺癌、子宮頸癌、脳腫瘍、KB癌、肺癌、結腸癌、表皮癌等の一つ又は複数に由来するものであってよい。
一つの特定の実施形態において、本明細書に記載の方法によるナノ粒子は、例えばアンチセンスbcl−2オリゴヌクレオチド、アンチセンスHIF−1αオリゴヌクレオチド、アンチセンススルビビンオリゴヌクレオチド、アンチセンスErbB3オリゴヌクレオチド、アンチセンスPIK3CAオリゴヌクレオチド、アンチセンスHSP27オリゴヌクレオチド、アンチセンスアンドロゲン受容体オリゴヌクレオチド、アンチセンスGli2オリゴヌクレオチド及びアンチセンスβカテニンオリゴヌクレオチドを含む。
本発明によれば、ナノ粒子はオリゴヌクレオチド(各核酸が天然核酸又は修飾核酸である、配列番号1、配列番号2及び3、配列番号3、配列番号4、配列番号5、配列番号6、配列番号7、配列番号7、配列番号8、配列番号9、配列番号10、配列番号11、配列番号12、配列番号13、配列番号14、配列番号15並びに配列番号16)を含むことができ、それを使用できる。本明細書で企図される療法は、前記ナノ粒子に封入された核酸を使用する。一実施形態において、8個以上の連続アンチセンスヌクレオチドを含有する治療用ヌクレオチドを治療で使用できる。
あるいは、哺乳動物を治療する方法も提供される。該方法は、有効量の本明細書に記載のナノ粒子を含有する医薬組成物を、それを必要とする患者に投与することを含む。該方法の有効性は、治療される状態に対する核酸の有効性に依存するであろう。本発明は、哺乳動物における様々な医学的状態を治療する方法を提供する。該方法は、有効量の封入された治療用核酸を含有するナノ粒子を、このような治療を必要とする哺乳動物に投与することを含む。本明細書に記載のナノ粒子は、とりわけ、疾患、例えば(それだけに限らないが)癌、炎症性疾患及び自己免疫疾患を治療するのに有用である。
一実施形態において、有効量の本明細書に記載のナノ粒子を含有する医薬組成物を、それを必要とする患者に投与することを含む、悪性腫瘍又は癌を有する患者を治療する方法も提供される。治療される癌は、以下のもの:固形腫瘍、リンパ腫、小細胞肺癌、急性リンパ性白血病(ALL)、膵臓癌、膠芽腫、卵巣癌、胃癌、結腸直腸癌、前立腺癌、子宮頸癌、脳腫瘍、KB癌、肺癌、結腸癌、表皮癌等の一つ又は複数であってよい。ナノ粒子は、標的遺伝子の遺伝子発現をダウンレギュレートすることにより、新生物疾患を治療し、全身腫瘍組織量を減少させ、新生物の転移を予防し、哺乳動物における腫瘍/新生物の増殖の再発を予防するのに有用である。例えば、ナノ粒子は、転移性疾患(即ち、肺に転移する癌)の治療に有用である。
さらに別の態様において、本発明は、インビボ又はインビトロで癌細胞の増殖又は成長を抑制する方法を提供する。該方法は、癌細胞を本明細書に記載のナノ粒子と接触させることを含む。一実施形態において、本発明は、細胞がErbB3遺伝子を発現するインビボ又はインビトロで癌の増殖を抑制する方法を提供する。
別の態様において、本発明は、例えば核においてErbB3 mRNAに結合し得る、癌細胞内に核酸(例えば、アンチセンスErbB3 LNAオリゴヌクレオチド)を送達させる手段を提供する。結果として、ErbB3タンパク質発現が抑制され、それにより癌細胞の増殖が抑制される。該方法は、オリゴヌクレオチド(例えば、LNAを含むアンチセンスオリゴヌクレオチド)を癌細胞に導入し、癌細胞又は癌組織における標的遺伝子(例えばスルビビン、HIF−1α又はErbB3)発現を減少させる。
あるいは、本発明は、癌細胞のアポトーシスを調節する方法を提供する。さらに別の態様において、インビボ又はインビトロで化学療法剤に対する癌細胞又は癌組織の感受性を高める方法も提供される。
さらに別の態様において、インビボ又はインビトロで腫瘍細胞を殺滅する方法が提供される。該方法は、本明細書に記載の化合物を腫瘍細胞に導入して、ErbB3遺伝子等の遺伝子発現を減少させるステップと、腫瘍細胞と、腫瘍細胞の一部を殺滅するのに十分な量の少なくとも1種の抗癌剤(例えば、化学療法剤)とを接触させるステップとを含む。したがって、殺滅される腫瘍細胞部分は、本明細書に記載のナノ粒子の不在化で同量の化学療法剤により殺滅されるであろう部分よりも大きくてよい。
本発明のさらなる態様において、抗癌剤/化学療法剤は、本明細書に記載の化合物と組み合わせて、同時に又は順次に使用できる。本明細書に記載の化合物は、抗癌剤の前に、又はそれと同時に、あるいは抗癌剤の投与後に投与できる。したがって、本明細書に記載のナノ粒子は、化学療法剤の治療前、治療中又は治療後に投与できる。
さらにさらなる態様は、相乗的又は付加的な利益のために本明細書に記載の本発明の化合物と他の抗癌療法とを組み合わせることを含む。
あるいは、本明細書に記載のナノ粒子組成物は、哺乳動物に対して負電荷又は中性電荷を好ましくは有する、医薬活性剤を送達するために使用できる。医薬活性剤/化合物を封入するナノ粒子は、それを必要とする哺乳動物に投与できる。医薬活性剤/化合物は、低分子量の分子を含む。通常、医薬活性剤は、約1500ダルトン未満(即ち1000ダルトン未満)の分子量を有する。
さらなる実施形態において、本明細書に記載の化合物は、核酸、医薬活性剤又はそれらの組合せを送達するために使用できる。
さらにさらなる実施形態において、治療と関連するナノ粒子は、相乗効果の利用のために一つ又は複数の治療用核酸(同一又は異なるいずれか、例えば同一又は異なるオリゴヌクレオチド)及び/又は一つもしくは複数の医薬活性剤の混合物を含有できる。
F.ナノ粒子の医薬組成物/医薬製剤
本明細書に記載のナノ粒子を含む医薬組成物/医薬製剤は、薬学的に使用できる製剤への活性化合物の加工を促進する賦形剤及び補助剤を含む、一つ又は複数の生理学的に許容される担体と共に製剤化できる。適切な製剤は、選択される投与経路、即ち、局所治療であるか、又は全身治療であるかに依存する。
本明細書に記載のナノ粒子を含む医薬組成物/医薬製剤は、薬学的に使用できる製剤への活性化合物の加工を促進する賦形剤及び補助剤を含む、一つ又は複数の生理学的に許容される担体と共に製剤化できる。適切な製剤は、選択される投与経路、即ち、局所治療であるか、又は全身治療であるかに依存する。
適切な形態は、ある程度、経口、経皮又は注射等の使用又は侵入経路に依存する。適切な製剤を調製する当技術分野で公知の考慮因子としては、それだけに限らないが、組成物又は製剤がその効果を発揮することを妨げるであろう毒性及び任意の欠点が挙げられる。
本明細書に記載のナノ粒子の医薬組成物の投与は、経口、経肺、局所又は非経口であってよい。局所投与としては、それだけに限らないが、例えば膣送達及び直腸送達を含む、粘膜を介することを含む、表皮、経皮、眼の経路を介した投与が挙げられる。静脈内、動脈内、皮下、腹腔内又は筋肉内の注射又は注入を含む非経口投与も企図される。
一つの好ましい実施形態において、治療用オリゴヌクレオチドを含有するナノ粒子は、静脈内(i.v.)又は腹腔内(i.p.)に投与される。本発明の多くの態様において、非経口経路が好ましい。
それだけに限らないが静脈注射、筋肉内注射及び皮下注射を含む注射について、本発明のナノ粒子は、水溶液中で、好ましくは生理学的に相容性の緩衝液、例えば生理食塩水緩衝液中で、又はそれだけに限らないがピロリドン又はジメチルスルホキシドを含む極性溶媒中で製剤化できる。
ナノ粒子は、ボーラス注入又は連続注入用に製剤化されてもよい。注射用製剤は、単位剤形、例えばアンプル又は多用量容器中に存在できる。有用な組成物として、それだけに限らないが、油性又は水性ビヒクル中の懸濁液、溶液又はエマルジョンが挙げられ、賦形剤、例えば懸濁化剤、安定化剤及び/又は分散化剤を含有できる。非経口投与用の医薬組成物としては、水溶性形態の水溶液が挙げられる。水性注射用懸濁液は、カルボキシメチルセルロースナトリウム、ソルビトール又はデキストラン等の懸濁液の粘度を調節する物質を含有できる。懸濁液は、溶液中のナノ粒子の濃度を増加させる適切な安定剤及び/又は薬剤も場合により含有できる。あるいは、ナノ粒子は、適当なビヒクル、例えば滅菌パイロジェンフリー水により使用前に構成するために粉末形態であってもよい。
経口投与について、本明細書に記載のナノ粒子は、ナノ粒子と、当技術分野で周知の薬学的に許容される担体とを合わせることにより製剤化できる。このような担体により、本発明のナノ粒子を、患者の経口摂取用に錠剤、ピル、トローチ、糖衣錠、カプセル、液体、ゲル、シロップ、ペースト、スラリー、溶液、懸濁液、患者の飲料水での希釈用の濃縮液及び懸濁液、患者の食餌での希釈用の予混合剤等に製剤化できる。経口使用のための医薬製剤は、固体賦形剤を使用し、得られた混合物を場合により粉砕して、所望される場合、他の適切な補助剤を加えた後に顆粒の混合物を加工して、錠剤又は糖衣錠の核を得ることにより製造できる。有用な賦形剤としては、特に充填剤、例えば糖(例えばラクトース、スクロース、マンニトール又はソルビトール)、セルロース製剤、例えばトウモロコシデンプン、小麦デンプン、米デンプン及びジャガイモデンプン、並びに他の物質、例えばゼラチン、トラガカントゴム、メチルセルロース、ヒドロキシプロピルメチルセルロース、カルボキシメチルセルロースナトリウム及び/又はポリビニルピロリドン(PVP)がある。所望される場合、崩壊剤、例えば架橋ポリビニルピロリドン、寒天又はアルギン酸を加えてもよい。塩、例えばアルギン酸ナトリウムも使用できる。
吸入投与については、本発明のナノ粒子は、圧縮パック又はネブライザーを用いるエアロゾルスプレー、及び適切な噴射剤の形態で好都合に送達できる。
ナノ粒子は、例えば従来の座薬基剤、例えばココアバター又は他のグリセリドを用いて、直腸組成物、例えば座薬又は停留浣腸に製剤化してもよい。
先に記載の製剤に加えて、ナノ粒子は、デポー製剤として製剤化されてもよい。このような長時間作用型製剤は、移植(例えば皮下又は筋肉内)により又は筋肉内注射により投与できる。本発明のナノ粒子は、適切なポリマー材料又は疎水性材料(例えば、薬理学的に許容される油のエマルジョン)と共に、イオン交換樹脂と共に、又はそれだけに限らないが難溶性の塩等の難溶性誘導体としてこの投与経路用に製剤化できる。
さらに、ナノ粒子は、持続放出系、例えばナノ粒子を含有する固体疎水性ポリマーの半透過性マトリックスを用いて送達できる。様々な持続放出材料が確立されており、当業者に周知である。
さらに、抗酸化剤及び懸濁化剤は、本明細書に記載のナノ粒子の医薬組成物中で使用できる。
G.用量
一つ又は複数の予め選択された遺伝子の発現を抑制するのに適した用量、例えば臨床状況における治療有効量の決定は、特に本明細書の開示内容に照らして、十分当業者の能力の範囲内である。
一つ又は複数の予め選択された遺伝子の発現を抑制するのに適した用量、例えば臨床状況における治療有効量の決定は、特に本明細書の開示内容に照らして、十分当業者の能力の範囲内である。
本発明の方法で使用する任意の治療用核酸について、治療有効量は、最初にインビトロアッセイから推定できる。次いで、投与量は、有効な投与量を含む循環濃度範囲を得るために動物モデルでの使用に対して定式化できる。次いで、このような情報を使用して、患者に有用な投与量をより正確に決定できる。
投与される医薬組成物の量は、そこに含まれる核酸の有効性に依存するであろう。一般に、治療で使用する核酸を含有するナノ粒子の量は、哺乳動物において所望の治療結果を効果的に実現する量である。必然的に、様々なナノ粒子の投与量は、そこに封入された核酸(例えばオリゴヌクレオチド)(又は医薬活性剤)に応じて若干変化するであろう。さらに、投与量は、当然ながら、剤形及び投与経路に応じて変化し得る。しかし、一般に、本明細書に記載のナノ粒子に封入された核酸は、約0.1〜約1g/kg/週、好ましくは約1〜約500mg/kg、より好ましくは1〜約100mg/kg(即ち、約3〜約90mg/kg/用量)の範囲の量で投与できる。
上に示された範囲は、例示的であり、当業者は、臨床経験及び治療指示に基づき最適な用量を決定するであろう。さらに、正確な製剤、投与経路及び投与量は、患者の状態を考慮して個々の医師が選択できる。さらに、本明細書に記載のナノ粒子の毒性及び治療有効性は、当業者に周知の方法を用いて細胞培養又は実験動物において標準医薬操作により決定できる。
あるいは、約1〜約100mg/kg/用量(0.1〜100mg/kg/用量)の量を、核酸の有効性に応じて治療で使用してもよい。単位剤形は、一般に、活性剤、オリゴヌクレオチドの約1mg〜約60mgの範囲である。
一実施形態において、本発明の治療は、本明細書に記載のナノ粒子を、約1〜約60mg/kg/用量(約25〜60mg/kg/用量、約3〜約20mg/kg/用量)、例えば60、45、35、30、25、15、5又は3mg/kg/用量(単回投与計画又は多回投与計画のいずれか)の量で哺乳動物に投与することを含む。例えば、本明細書に記載のナノ粒子は、q3d×9で5、25、30又は60mg/kg/用量の量で静脈内に投与できる。別の例としては、治療プロトコルは、アンチセンスオリゴヌクレオチドを、毎週約4〜約18mg/kg/用量、又は毎週約4〜約9.5mg/kg/用量(例えば、6週間のサイクルで3週間毎週約8mg/kg/用量)で投与することを含む。
あるいは、本明細書に記載のナノ粒子中に封入されたオリゴヌクレオチドの送達は、約0.1〜約1000μM、好ましくは約10〜約1500μM(即ち、約10〜約1000μM、約30〜約1000μM)の濃度のオリゴヌクレオチドと腫瘍細胞又は腫瘍組織とをインビボ、エクスビボ又はインビトロで接触させることを含む。
組成物は、1日1回投与してもよく、複数週の治療プロトコルの一環として与えることができる複数回投与に分けてもよい。正確な用量は、当業者に認識されるように、状態の段階及び重症度、核酸に対する腫瘍等の疾患の感受性、及び治療される患者の個々の特性に依存するであろう。
ナノ粒子が投与される本発明の全ての態様において、言及された投与量は、投与されるナノ粒子の量ではなくオリゴヌクレオチドの分子量に基づいている。
治療は、所望の臨床結果が得られるまで1日又は数日行われることが企図される。治療用の核酸(又は医薬活性剤)を封入するナノ粒子の投与の正確な量、回数及び期間は、当然ながら、患者の性別、年齢及び医学的状態、並びに担当臨床医により決定された疾患の重症度に応じて変化するであろう。
さらにさらなる態様は、相乗的又は付加的な利益のために、本明細書に記載の本発明のナノ粒子と他の抗癌療法とを組み合わせることを含む。
実施例
以下の実施例は、本発明のさらなる理解を得るために利用されるが、本発明の有効な範囲を制限することを何ら意味するものではない。
以下の実施例は、本発明のさらなる理解を得るために利用されるが、本発明の有効な範囲を制限することを何ら意味するものではない。
実施例において、全ての合成反応は、乾燥窒素又は乾燥アルゴンの雰囲気下で行われる。N−(3−アミノプロピル)−1,3−プロパンジアミン)、BOC−ON、LiOCl4、コレステロール及び1H−ピラゾール−1−カルボキサミジンHClをAldrichから購入した。全ての他の試薬及び溶媒を、さらなる精製なしで使用した。スルビビン遺伝子を標的とするLNAオリゴ−1、ErB3遺伝子を標的とするオリゴ−2、及びオリゴ−3(スクランブルオリゴ−2)を社内で調製した。その配列を表4に示す。インターヌクレオチド結合はホスホロチオエートであり、mCはメチル化シトシンを表し、大文字はLNAを示す。
以下の略語、例えばLNA(ロック核酸)、BACC(2−[N,N’−ジ(2−グアニジンプロピル)]アミノエチルコレステリルカーボネート)、Chol(コレステロール)、DIEA(ジイソプロピルエチルアミン)、DMAP(4−N,N−ジメチルアミノピリジン)、DOPE(L−α−ジオレオイルホスファチジルエタノールアミン、Avanti Polar Lipids、USA又はNOF、Japan)、DLS(動的光散乱)、DSPC(1,2−ジステアロイル−sn−グリセロ−3−ホスホコリン)(NOF、Japan)、DSPE−PEG(1,2−ジステアロイル−sn−グリセロ−3−ホスホエタノールアミン−N−(ポリエチレングリコール)2000アンモニウム塩又はナトリウム塩、Avanti Polar Lipids、USA及びNOF、Japan)、KD(ノーンダウン)、EPC(卵ホスファチジルコリン、Avanti Polar Lipids、USA)及びC16 mPEG−セラミド(N−パルミトイル−スフィンゴシン−1−スクシニル(メトキシプロピルエチレングリコール)2000、Avanti Polar Lipids、USA)は、実施例全体で使用され得る。他の略語、例えばFAM(6−カルボキシフルオレセイン)、FBS(ウシ胎児血清)、GAPDH(グリセルアルデヒド−3−リン酸デヒドロゲナーゼ)、DMEM(ダルベッコの修飾イーグル培地)、MEM(修飾イーグル培地)、TEAA(テトラエチルアンモニウムアセテート)、TFA(トリフルオロ酢酸)、RT−qPCR(逆転写定量的ポリメラーゼ連鎖反応)も使用できる。
一般的NMR法
別段の指示がない限り、Varian Mercury 300NMR分光計及び溶媒として重水素化クロロホルムを用いて300MHzで1H NMRスペクトル及び75.46MHzで13C NMRスペクトルを得た。化学シフト(δ)を、テトラメチルシラン(TMS)からのダウンフィールドで100万分の一(ppm)で報告する。
別段の指示がない限り、Varian Mercury 300NMR分光計及び溶媒として重水素化クロロホルムを用いて300MHzで1H NMRスペクトル及び75.46MHzで13C NMRスペクトルを得た。化学シフト(δ)を、テトラメチルシラン(TMS)からのダウンフィールドで100万分の一(ppm)で報告する。
一般的なHPLC法
反応混合物、並びに中間体及び最終生成物の純度を、Beckman Coulter System Gold(登録商標)HPLC装置でモニターする。1mL/分の流量で0.05%TFA中のアセトニトリル10〜90%の勾配、又は1mL/分の流量で50mM TEAA緩衝液中のアセトニトリル25〜35%の勾配を用いて、168ダイオードアレイUV検出器を備えたZORBAX(登録商標)300SB C8逆相カラム(150×4.6mm)又はPhenomenex Jupiter(登録商標)300A C18逆相カラム(150×4.6mm)を使用する。アニオン交換クロマトグラフィーを、Waters製のAP−Emptyグラスカラムに充填したApplied Biosystems製のPoros50HQ強アニオン交換樹脂を用いてGE Healthcare(Amersham Bioscience)製のAKTAエクスプローラー100Aで行った。脱塩は、Amersham Biosciences製のHiPrep26/10脱塩カラム(PEG−オリゴ用)を用いて達成された。
反応混合物、並びに中間体及び最終生成物の純度を、Beckman Coulter System Gold(登録商標)HPLC装置でモニターする。1mL/分の流量で0.05%TFA中のアセトニトリル10〜90%の勾配、又は1mL/分の流量で50mM TEAA緩衝液中のアセトニトリル25〜35%の勾配を用いて、168ダイオードアレイUV検出器を備えたZORBAX(登録商標)300SB C8逆相カラム(150×4.6mm)又はPhenomenex Jupiter(登録商標)300A C18逆相カラム(150×4.6mm)を使用する。アニオン交換クロマトグラフィーを、Waters製のAP−Emptyグラスカラムに充填したApplied Biosystems製のPoros50HQ強アニオン交換樹脂を用いてGE Healthcare(Amersham Bioscience)製のAKTAエクスプローラー100Aで行った。脱塩は、Amersham Biosciences製のHiPrep26/10脱塩カラム(PEG−オリゴ用)を用いて達成された。
一般的なmRNAダウンレギュレーション法
細胞を完全培地(F−12K又はDMEM、10%FBSで補足)中で維持した。各ウェル中に2.5×105細胞を含有する12ウェルプレートを37℃で終夜インキュベートした。細胞をOpti−MEM(登録商標)で1回洗浄し、Opti−MEM(登録商標)400μLを各ウェルに加えた。次いで、オリゴヌクレオチドを含有するナノ粒子又はLipofectamine2000(登録商標)の溶液を各ウェルに加えた。細胞を4時間インキュベートし、次いで各ウェルに培地600μLを加え、24時間インキュベートした。処理の24時間後、ErB3遺伝子等の標的遺伝子及びGAPDH等のハウスキーピング遺伝子の細胞内mRNAレベルを、RT−qPCRで定量した。mRNAの発現レベルを正規化した。
細胞を完全培地(F−12K又はDMEM、10%FBSで補足)中で維持した。各ウェル中に2.5×105細胞を含有する12ウェルプレートを37℃で終夜インキュベートした。細胞をOpti−MEM(登録商標)で1回洗浄し、Opti−MEM(登録商標)400μLを各ウェルに加えた。次いで、オリゴヌクレオチドを含有するナノ粒子又はLipofectamine2000(登録商標)の溶液を各ウェルに加えた。細胞を4時間インキュベートし、次いで各ウェルに培地600μLを加え、24時間インキュベートした。処理の24時間後、ErB3遺伝子等の標的遺伝子及びGAPDH等のハウスキーピング遺伝子の細胞内mRNAレベルを、RT−qPCRで定量した。mRNAの発現レベルを正規化した。
一般的なRNA調製法
インビトロmRNAダウンレギュレーションスクリーニングのために、製造業者の使用説明書に従って全RNAをRNAqueous Kit(登録商標)(Ambion)を用いて調製した。RNA濃度を、ナノドロップを用いてOD260nmで決定した。
インビトロmRNAダウンレギュレーションスクリーニングのために、製造業者の使用説明書に従って全RNAをRNAqueous Kit(登録商標)(Ambion)を用いて調製した。RNA濃度を、ナノドロップを用いてOD260nmで決定した。
一般的なRT−qPCR法
全ての試薬はApplied Biosystems製であった: High Capacity cDNA Reverse Transcription Kit(登録商標)(4368813)、20×PCRマスターミックス(4304437)、並びにヒトGAPDH(Cat.#0612177)及びスルビビン(BIRK5 Hs00153353)用TaqMan(登録商標)遺伝子発現アッセイキット。全RNA2.0μgを、最終量50μLでのcDNA合成に使用した。反応を、PCRサーモサイクラーで25℃にて10分間、37℃にて120分間、85℃にて5秒間行い、次いで4℃で貯蔵すした。リアルタイムPCRを、50℃−2分間、95℃−10分間及び95℃−15秒間/60℃−1分間のプログラムで40サイクル行った。各qPCR反応については、cDNA1μLを最終量30μLで使用した。
全ての試薬はApplied Biosystems製であった: High Capacity cDNA Reverse Transcription Kit(登録商標)(4368813)、20×PCRマスターミックス(4304437)、並びにヒトGAPDH(Cat.#0612177)及びスルビビン(BIRK5 Hs00153353)用TaqMan(登録商標)遺伝子発現アッセイキット。全RNA2.0μgを、最終量50μLでのcDNA合成に使用した。反応を、PCRサーモサイクラーで25℃にて10分間、37℃にて120分間、85℃にて5秒間行い、次いで4℃で貯蔵すした。リアルタイムPCRを、50℃−2分間、95℃−10分間及び95℃−15秒間/60℃−1分間のプログラムで40サイクル行った。各qPCR反応については、cDNA1μLを最終量30μLで使用した。
H−Dap−OMe:2HClの調製(化合物1)
H−Dap−(Boc)−OMe:HCl(5g、19.63mmol)を1.4−ジオキサン(130mL)中の2M HClで室温にて30分間処理した。溶媒を30〜35℃にて真空下で除去した。残渣をジエチルエーテル中で再懸濁し、濾過した。単離した固体を真空下でP2O5で乾燥させ、生成物3.4g(90%)を得た。13C NMR (DMSO-d6) δ 40.05, 49.98, 53.47, 166.73。
H−Dap−(Boc)−OMe:HCl(5g、19.63mmol)を1.4−ジオキサン(130mL)中の2M HClで室温にて30分間処理した。溶媒を30〜35℃にて真空下で除去した。残渣をジエチルエーテル中で再懸濁し、濾過した。単離した固体を真空下でP2O5で乾燥させ、生成物3.4g(90%)を得た。13C NMR (DMSO-d6) δ 40.05, 49.98, 53.47, 166.73。
ジオレオイル−DAP−OMeの調製(化合物2)
無水DMF26mL中の化合物1(3.4g、17.8mmol)の溶液を無水DCM170mL中のオレイン酸(22.5mL、20.0g、71.1mmol)の溶液に加えた。混合物を0〜5℃まで冷却し、次いでEDC(20.5g、106.7mmol)及びDMAP(28.2g、231.1mmol)を加えた。反応混合物を終夜撹拌し、窒素下で室温まで昇温させた。反応の完了をTLC(DCM:MEOH=90:1、v/v)でモニターした。反応混合物を試薬等級のDCM200mLで希釈し、1N HCl(3×80mL)及び0.5%水性NaHCO3(3×80mL)で洗浄した。得られた有機層を分離し、無水硫酸マグネシウムで乾燥させ、30℃にて真空下で濃縮した。残渣をシリカゲルカラムクロマトグラフィー(DCM/MeOH/TEA=95:5:0.1、v/v/v)で精製し、生成物7.0g(61%)を生成した。13C NMR δ 14.15, 22.60, 25.55, 25.69, 27.20, 27.25, 29.18, 29.23, 29.29, 29.34, 29.55, 29.75, 29.78, 31.91, 36.43, 36.52, 41.53, 52.63, 53.58, 129.49, 129.54, 129.82, 129.85, 170.55, 173.59, 174.49。
無水DMF26mL中の化合物1(3.4g、17.8mmol)の溶液を無水DCM170mL中のオレイン酸(22.5mL、20.0g、71.1mmol)の溶液に加えた。混合物を0〜5℃まで冷却し、次いでEDC(20.5g、106.7mmol)及びDMAP(28.2g、231.1mmol)を加えた。反応混合物を終夜撹拌し、窒素下で室温まで昇温させた。反応の完了をTLC(DCM:MEOH=90:1、v/v)でモニターした。反応混合物を試薬等級のDCM200mLで希釈し、1N HCl(3×80mL)及び0.5%水性NaHCO3(3×80mL)で洗浄した。得られた有機層を分離し、無水硫酸マグネシウムで乾燥させ、30℃にて真空下で濃縮した。残渣をシリカゲルカラムクロマトグラフィー(DCM/MeOH/TEA=95:5:0.1、v/v/v)で精製し、生成物7.0g(61%)を生成した。13C NMR δ 14.15, 22.60, 25.55, 25.69, 27.20, 27.25, 29.18, 29.23, 29.29, 29.34, 29.55, 29.75, 29.78, 31.91, 36.43, 36.52, 41.53, 52.63, 53.58, 129.49, 129.54, 129.82, 129.85, 170.55, 173.59, 174.49。
ジオレオイル−Dap−OHの調製(化合物3)
水7mL中のNaOH(0.87g、21.63mmol)の溶液をエタノール70mL中の化合物2(7.0g、10.8mmol)の溶液に加えた。混合物を室温で終夜撹拌し、室温にて真空下で濃縮した。残渣を水63mLに懸濁し、溶液を0〜5℃にて1N HClで酸性化した。水溶液をDCMで3回抽出した。有機層を合わせて、無水硫酸マグネシウムで乾燥させた。溶媒を35℃にて真空下で除去し、生成物5.5g(80%)を生成した。13C NMR δ 14.19, 22.75, 25.51, 25.68, 27.25, 27.29, 29.21, 29.26, 29.32, 29.38, 29.59, 29.79, 29.82, 31.95, 36.30, 36.37, 41.58, 55.15, 129.53, 129.91, 171.49, 175.67, 176.19。
水7mL中のNaOH(0.87g、21.63mmol)の溶液をエタノール70mL中の化合物2(7.0g、10.8mmol)の溶液に加えた。混合物を室温で終夜撹拌し、室温にて真空下で濃縮した。残渣を水63mLに懸濁し、溶液を0〜5℃にて1N HClで酸性化した。水溶液をDCMで3回抽出した。有機層を合わせて、無水硫酸マグネシウムで乾燥させた。溶媒を35℃にて真空下で除去し、生成物5.5g(80%)を生成した。13C NMR δ 14.19, 22.75, 25.51, 25.68, 27.25, 27.29, 29.21, 29.26, 29.32, 29.38, 29.59, 29.79, 29.82, 31.95, 36.30, 36.37, 41.58, 55.15, 129.53, 129.91, 171.49, 175.67, 176.19。
化合物5の調製
N-(2-ヒドロキシエチル)フタルイミド(4、25g、130.8mmol、1等量)を乾燥ベンゼン500mLに溶解させて、1時間共沸させ、ベンゼン125mLを除去し、次いで室温まで冷却し、p-TsOH(0.240g、1.26mmol、0.0096等量)を加えた。混合物を0〜5℃まで冷却し、次いで2-メトキシプロペン(10.4g、13.8mL、143.8mmol、1.1等量)を添加漏斗から0〜5℃で15分かけて加えた。反応混合物を0〜5℃で1時間撹拌し、次いで89〜95℃まで加熱し、3時間共沸させ、MeOH/ベンゼンを除去した。溶媒の各除去後、溶液を冷却し、共沸を停止して、等量のベンゼンを加えた。3時間後、反応混合物を室温まで冷却し、TEA30mL及び無水酢酸5mLを加え、室温で終夜撹拌した。反応混合物を35℃にて真空下で濃縮し、2/3量のベンゼンを除去して、粗生成物をヘキサン300mLを滴下して沈殿させた。沈殿物を濾過し、ヘキサンで洗浄した。固体(8.5g)を65℃にてトルエン70mLに溶解させて、溶液を0℃まで冷却した。生成物を遠心分離で収集し、ヘキサンで洗浄し、真空下でCCl4で共蒸発させて、生成物4.9gを生成した:13C NMR δ 24.67, 38.09, 57.88, 100.39, 123.05, 131.92, 133.66, 167.88。
N-(2-ヒドロキシエチル)フタルイミド(4、25g、130.8mmol、1等量)を乾燥ベンゼン500mLに溶解させて、1時間共沸させ、ベンゼン125mLを除去し、次いで室温まで冷却し、p-TsOH(0.240g、1.26mmol、0.0096等量)を加えた。混合物を0〜5℃まで冷却し、次いで2-メトキシプロペン(10.4g、13.8mL、143.8mmol、1.1等量)を添加漏斗から0〜5℃で15分かけて加えた。反応混合物を0〜5℃で1時間撹拌し、次いで89〜95℃まで加熱し、3時間共沸させ、MeOH/ベンゼンを除去した。溶媒の各除去後、溶液を冷却し、共沸を停止して、等量のベンゼンを加えた。3時間後、反応混合物を室温まで冷却し、TEA30mL及び無水酢酸5mLを加え、室温で終夜撹拌した。反応混合物を35℃にて真空下で濃縮し、2/3量のベンゼンを除去して、粗生成物をヘキサン300mLを滴下して沈殿させた。沈殿物を濾過し、ヘキサンで洗浄した。固体(8.5g)を65℃にてトルエン70mLに溶解させて、溶液を0℃まで冷却した。生成物を遠心分離で収集し、ヘキサンで洗浄し、真空下でCCl4で共蒸発させて、生成物4.9gを生成した:13C NMR δ 24.67, 38.09, 57.88, 100.39, 123.05, 131.92, 133.66, 167.88。
化合物6の調製
化合物5(4.9g、11.6mmol)を6M NaOH(水38mL中のNaOH9.1g)に溶解させ、溶液を終夜還流した。得られた溶液を室温まで冷却し、次いでクロロホルム/IPA1:1(v/v)40mLで3回抽出し、無水硫酸ナトリウムで乾燥させて、真空下で35℃にて濃縮した。固体をヘキサンに2回、CCl4に1回懸濁し、真空下で35℃にて乾燥させて、生成物(1.8g、95%)を得た: 13C NMR δ 24.99, 42.08, 43.81, 62.82, 63.58, 77.41, 99.64。
化合物5(4.9g、11.6mmol)を6M NaOH(水38mL中のNaOH9.1g)に溶解させ、溶液を終夜還流した。得られた溶液を室温まで冷却し、次いでクロロホルム/IPA1:1(v/v)40mLで3回抽出し、無水硫酸ナトリウムで乾燥させて、真空下で35℃にて濃縮した。固体をヘキサンに2回、CCl4に1回懸濁し、真空下で35℃にて乾燥させて、生成物(1.8g、95%)を得た: 13C NMR δ 24.99, 42.08, 43.81, 62.82, 63.58, 77.41, 99.64。
化合物7の調製
化合物6(1.8g、11.1mmol、1等量)を無水THF36mLに溶解させ、乾燥氷浴/IPA浴中で-78℃まで冷却し、次いでエチルトリフルオロアセテートを加えた。溶媒を、ヘキサンで共蒸発させることにより真空下で除去する前に、反応混合物を室温で1.5時間撹拌し、粗生成物を得た。粗生成物をDCM及びMeOH(100:0.1〜98:2、v/v)を用いて不活性化アルミナ上のカラムクロマトグラフィーにより精製し、生成物1.30gを生成した:13C NMR δ 24.88, 40.68, 41.11, 42.13, 57.99, 60.26, 62.10, 99.83。
化合物6(1.8g、11.1mmol、1等量)を無水THF36mLに溶解させ、乾燥氷浴/IPA浴中で-78℃まで冷却し、次いでエチルトリフルオロアセテートを加えた。溶媒を、ヘキサンで共蒸発させることにより真空下で除去する前に、反応混合物を室温で1.5時間撹拌し、粗生成物を得た。粗生成物をDCM及びMeOH(100:0.1〜98:2、v/v)を用いて不活性化アルミナ上のカラムクロマトグラフィーにより精製し、生成物1.30gを生成した:13C NMR δ 24.88, 40.68, 41.11, 42.13, 57.99, 60.26, 62.10, 99.83。
化合物8(MW2000)の調製
mPEG-OH(MW2000、50g)を、65℃でIPA500mLから再結晶化し、乾燥mPEG-OH44gを得た。再結晶化したmPEG-OH(44g、22mmol、1等量)を無水DCM775mLに溶解させた。トリホスゲン(2.61g、8.8mmol、0.40等量)及びピリジン(2.1mL、2.1g、26.4mmol、1.20等量)を溶液に加え、反応混合物を室温で4時間撹拌した。得られた反応溶液に、NHS(3.4g、29.3mmol、1.33等量)及びピリジン(2.4mL、2.3g、29.3mmol、1.33等量)を加え、混合物を室温で終夜撹拌した。反応混合物を真空下で濃縮し、残渣をDCM88mLに溶解させた。エーテルを加えることにより、固体を沈殿させ、それをアセトニトリル44mL/IPA1600mLの混合物から再結晶化した。固体を濾過し、IPA及びエーテルで洗浄し、真空下で乾燥させて、SCmPEGを得た。SCmPEG(MW2000、5.76g、2.88mmol、1等量)及び化合物7(1.30g、5.0mmol、1.75等量)を乾燥DCM60mL及び乾燥DMF8mLに溶解させた。DIEA(0.60g、0.82mL、4.61mmol、1.6等量)を加え、反応混合物を室温で終夜撹拌した。得られた反応溶液を真空下で室温にて濃縮し、次いでエーテルを加えて、固体を氷浴中0〜5℃で沈殿させた。固体を遠心分離で収集し、アセトニトリル2mL及びIPA80mLの混合物から再結晶化した。生成物を遠心分離で収集し、IPA及びエーテルで洗浄し、真空炉で40℃にて乾燥させて、生成物5.5g、90%を生成した:13C NMR δ 24.72, 39.80, 40.95, 58.45, 58.73, 58.96, 59.74, 63.86, 69.49, 70.06, 70.45, 70.77, 71.83, 76.21, 77.20, 100.20, 113.80, 117.60, 156.25, 157.26。
mPEG-OH(MW2000、50g)を、65℃でIPA500mLから再結晶化し、乾燥mPEG-OH44gを得た。再結晶化したmPEG-OH(44g、22mmol、1等量)を無水DCM775mLに溶解させた。トリホスゲン(2.61g、8.8mmol、0.40等量)及びピリジン(2.1mL、2.1g、26.4mmol、1.20等量)を溶液に加え、反応混合物を室温で4時間撹拌した。得られた反応溶液に、NHS(3.4g、29.3mmol、1.33等量)及びピリジン(2.4mL、2.3g、29.3mmol、1.33等量)を加え、混合物を室温で終夜撹拌した。反応混合物を真空下で濃縮し、残渣をDCM88mLに溶解させた。エーテルを加えることにより、固体を沈殿させ、それをアセトニトリル44mL/IPA1600mLの混合物から再結晶化した。固体を濾過し、IPA及びエーテルで洗浄し、真空下で乾燥させて、SCmPEGを得た。SCmPEG(MW2000、5.76g、2.88mmol、1等量)及び化合物7(1.30g、5.0mmol、1.75等量)を乾燥DCM60mL及び乾燥DMF8mLに溶解させた。DIEA(0.60g、0.82mL、4.61mmol、1.6等量)を加え、反応混合物を室温で終夜撹拌した。得られた反応溶液を真空下で室温にて濃縮し、次いでエーテルを加えて、固体を氷浴中0〜5℃で沈殿させた。固体を遠心分離で収集し、アセトニトリル2mL及びIPA80mLの混合物から再結晶化した。生成物を遠心分離で収集し、IPA及びエーテルで洗浄し、真空炉で40℃にて乾燥させて、生成物5.5g、90%を生成した:13C NMR δ 24.72, 39.80, 40.95, 58.45, 58.73, 58.96, 59.74, 63.86, 69.49, 70.06, 70.45, 70.77, 71.83, 76.21, 77.20, 100.20, 113.80, 117.60, 156.25, 157.26。
化合物9の調製
水7mL中の炭酸カリウム(0.393g、2.84mmol、1.1等量)の溶液を、試薬等級のMeOH44mL中の化合物8(5.5g、2.59mmol、1等量)の溶液に加えた。反応溶液を室温で終夜撹拌し、次いで真空下でMeOHを除去した。残渣をDCM500mLに溶解させ、水25mL、塩水35mLで洗浄し、無水硫酸マグネシウムで乾燥させ、濾過し、真空下で室温にて濃縮した。残渣をアセトニトリル2.5mL及びIPA80mLの混合物から再結晶化した。生成物を遠心分離で収集し、IPA及びエーテルで洗浄し、真空炉で40℃にて乾燥させて、生成物3.38gを生成した: 13C NMR δ 24.93, 25.38, 41.22, 41.98, 59.00, 59.57, 62.97, 63.83, 69.61, 70.10, 70.50, 71.87, 75.78, 76.19, 77.20, 99.79, 156.27。
水7mL中の炭酸カリウム(0.393g、2.84mmol、1.1等量)の溶液を、試薬等級のMeOH44mL中の化合物8(5.5g、2.59mmol、1等量)の溶液に加えた。反応溶液を室温で終夜撹拌し、次いで真空下でMeOHを除去した。残渣をDCM500mLに溶解させ、水25mL、塩水35mLで洗浄し、無水硫酸マグネシウムで乾燥させ、濾過し、真空下で室温にて濃縮した。残渣をアセトニトリル2.5mL及びIPA80mLの混合物から再結晶化した。生成物を遠心分離で収集し、IPA及びエーテルで洗浄し、真空炉で40℃にて乾燥させて、生成物3.38gを生成した: 13C NMR δ 24.93, 25.38, 41.22, 41.98, 59.00, 59.57, 62.97, 63.83, 69.61, 70.10, 70.50, 71.87, 75.78, 76.19, 77.20, 99.79, 156.27。
化合物10の調製
化合物9(20mmol)を、無水DMF50mL及び無水DCM400mLに溶解させ、溶液を氷浴中で冷却した。DMAP(6.2g、51.2mmol)を溶液に加え、次いで化合物3(40mmol)及びEDC(40mmol)を加えた。溶媒を除去し、残渣をDCM及びエチルエーテルから2回再結晶化し、生成物を得た。
化合物9(20mmol)を、無水DMF50mL及び無水DCM400mLに溶解させ、溶液を氷浴中で冷却した。DMAP(6.2g、51.2mmol)を溶液に加え、次いで化合物3(40mmol)及びEDC(40mmol)を加えた。溶媒を除去し、残渣をDCM及びエチルエーテルから2回再結晶化し、生成物を得た。
BocNHCH2CH2NH2の調製(化合物11)
無水DCM150mL中のBoc無水物(60g、274.9mmol)の溶液を、無水THF250mL及び無水DCM200mL中のエタン-1,2-ジアミン(41.3g、687.3mmol)の溶液に0〜5℃で1.5時間かけて徐々に加えた。反応混合物を終夜撹拌しながら、室温まで昇温させた。水300mLを混合物に加え、それを30℃にて真空下で濃縮した。得られた水溶液をDCM(3×300mL)で洗浄し、有機層を合わせ、0.5N HCl(3×300mL)で抽出した。水層を合わせて、pHを9〜10に4N NaOH溶液で調整し、次いでDCM(3×500mL)で抽出した。有機層を合わせて、無水硫酸マグネシウムで乾燥させた。溶媒を35℃にて真空下で除去し、生成物17.6g(40%)を生成した。13C NMR δ 28.23, 41.67, 43.19, 78.77, 155.93。
無水DCM150mL中のBoc無水物(60g、274.9mmol)の溶液を、無水THF250mL及び無水DCM200mL中のエタン-1,2-ジアミン(41.3g、687.3mmol)の溶液に0〜5℃で1.5時間かけて徐々に加えた。反応混合物を終夜撹拌しながら、室温まで昇温させた。水300mLを混合物に加え、それを30℃にて真空下で濃縮した。得られた水溶液をDCM(3×300mL)で洗浄し、有機層を合わせ、0.5N HCl(3×300mL)で抽出した。水層を合わせて、pHを9〜10に4N NaOH溶液で調整し、次いでDCM(3×500mL)で抽出した。有機層を合わせて、無水硫酸マグネシウムで乾燥させた。溶媒を35℃にて真空下で除去し、生成物17.6g(40%)を生成した。13C NMR δ 28.23, 41.67, 43.19, 78.77, 155.93。
ジオレオイル-Dap-NHCH2CH2NHBocの調製(化合物12)
DMAP(6.2g、5.12mmol)を、無水DMF50mL及び無水DCM400mL中の化合物3(5.4g、8.53mmol)の溶液に加え、溶液を氷浴で冷却した。化合物11(2.73g、17.1mmol)及びEDC(6.6g、34.1mmol)を溶液に加え、溶液を室温まで昇温させながら終夜撹拌した。反応の完了をTLC(DCM/MeOH=9:1、v/v)でモニターし、反応混合物をDCM500mLで希釈し、0.2N HCl(3×500mL)及び水(3×500mL)で洗浄し、無水硫酸マグネシウムで乾燥させた。溶媒を35℃にて真空下で除去し、生成物5.6g(85%)を生成した。13C NMR δ 14.16, 22.72, 25.52, 25.77, 27.23, 27.26, 28.43, 29.24, 29.35, 29.56, 29.79, 31.92, 36.50, 40.25, 40.38, 41.99, 55.22, 76.57-77.42 (CDCl3), 79.41, 129.54, 129.86, 156.35, 170.44, 174.25, 175.35。
DMAP(6.2g、5.12mmol)を、無水DMF50mL及び無水DCM400mL中の化合物3(5.4g、8.53mmol)の溶液に加え、溶液を氷浴で冷却した。化合物11(2.73g、17.1mmol)及びEDC(6.6g、34.1mmol)を溶液に加え、溶液を室温まで昇温させながら終夜撹拌した。反応の完了をTLC(DCM/MeOH=9:1、v/v)でモニターし、反応混合物をDCM500mLで希釈し、0.2N HCl(3×500mL)及び水(3×500mL)で洗浄し、無水硫酸マグネシウムで乾燥させた。溶媒を35℃にて真空下で除去し、生成物5.6g(85%)を生成した。13C NMR δ 14.16, 22.72, 25.52, 25.77, 27.23, 27.26, 28.43, 29.24, 29.35, 29.56, 29.79, 31.92, 36.50, 40.25, 40.38, 41.99, 55.22, 76.57-77.42 (CDCl3), 79.41, 129.54, 129.86, 156.35, 170.44, 174.25, 175.35。
ジオレオイル-Dap-NHCH2CH2NH2の調製(化合物13)
化合物12(5.6g、7.2mmol)を、DCM95mLに溶解させ、溶液をトリフルオロ酢酸24mLで室温にて30分間処理した。溶媒を室温にて真空下で除去し、残渣をDCM200mLに再度溶解させた。溶液を、pHが8〜9になるまで水及び1%NaHCO3で数回洗浄した。有機層を無水硫酸マグネシウムで乾燥させ、溶媒を30℃にて真空下で除去し、生成物4.13g(85%)を生成した。13C NMR δ 14.15, 22.70, 25.62, 25.77, 27.25, 29.24, 29.35, 29.55, 29.78, 31.91, 36.43, 41.53, 54.95, 129.48, 129.85, 170.99, 174.43, 175.33。
化合物12(5.6g、7.2mmol)を、DCM95mLに溶解させ、溶液をトリフルオロ酢酸24mLで室温にて30分間処理した。溶媒を室温にて真空下で除去し、残渣をDCM200mLに再度溶解させた。溶液を、pHが8〜9になるまで水及び1%NaHCO3で数回洗浄した。有機層を無水硫酸マグネシウムで乾燥させ、溶媒を30℃にて真空下で除去し、生成物4.13g(85%)を生成した。13C NMR δ 14.15, 22.70, 25.62, 25.77, 27.25, 29.24, 29.35, 29.55, 29.78, 31.91, 36.43, 41.53, 54.95, 129.48, 129.85, 170.99, 174.43, 175.33。
4-(ジメチルアセタール)安息香酸の調製(化合物14)
4-ホルミル安息香酸(1.5g、10mmol)を無水メタノール30mLに溶解させ、次いでアセトニトリル(300μL、0.3mmol)中の1.0Mテトラフルオロホウ酸リチウム、オルトギ酸トリメチル(1.38g、10mmol)に加えた。反応混合物を終夜還流した。溶媒を除去し、残渣を沸騰ヘキサンに30分間懸濁した。混合物を室温まで冷却し、固体を濾過により単離し、生成物1.5g(77%)を生成した。13C NMR (CD3OD) δ 53.26, 103.88, 127.75, 130.47, 131.14, 144.29, 169.30。
4-ホルミル安息香酸(1.5g、10mmol)を無水メタノール30mLに溶解させ、次いでアセトニトリル(300μL、0.3mmol)中の1.0Mテトラフルオロホウ酸リチウム、オルトギ酸トリメチル(1.38g、10mmol)に加えた。反応混合物を終夜還流した。溶媒を除去し、残渣を沸騰ヘキサンに30分間懸濁した。混合物を室温まで冷却し、固体を濾過により単離し、生成物1.5g(77%)を生成した。13C NMR (CD3OD) δ 53.26, 103.88, 127.75, 130.47, 131.14, 144.29, 169.30。
4-(ジメチルアセタール)フェニルカルボキシアミノPEG(化合物15)の調製
mPEG-アミン(MW5000、3g、0.60mmol)及びDMAP(219.6mg、1.80mmol)を無水DCM30mLに溶解させた。混合物を0〜5℃まで冷却し、次いでEDC(345.6mg、1.80mmol)及び化合物14(352.8mg、1.80mmol)を加えた。反応混合物をN2下で0℃〜室温にて終夜撹拌した。溶媒を除去し、残渣をDMF/IPA(10mL/100mL)の混合溶媒から再結晶化し、生成物2.7g(82%)を得た: 13C NMR δ 39.60, 52.38, 58.79, 69.63-71.67 (PEG), 102.06 [-C(OMe)2], 126.50, 126.7, 134.30, 140.90, 166.72。
mPEG-アミン(MW5000、3g、0.60mmol)及びDMAP(219.6mg、1.80mmol)を無水DCM30mLに溶解させた。混合物を0〜5℃まで冷却し、次いでEDC(345.6mg、1.80mmol)及び化合物14(352.8mg、1.80mmol)を加えた。反応混合物をN2下で0℃〜室温にて終夜撹拌した。溶媒を除去し、残渣をDMF/IPA(10mL/100mL)の混合溶媒から再結晶化し、生成物2.7g(82%)を得た: 13C NMR δ 39.60, 52.38, 58.79, 69.63-71.67 (PEG), 102.06 [-C(OMe)2], 126.50, 126.7, 134.30, 140.90, 166.72。
4-ホルミルフェニルカルボキシアミノPEG(化合物16)の調製
クロロホルム6.75mL中の化合物15(2.4g、0.46mmol)を86%ギ酸1.68mLで室温にて終夜処理した。溶媒を除去し、残渣をDCMエチルエーテルから2回再結晶化し、生成物(2.3g、97%)を得た: 13C NMR δ 39.82, 58.79, 69.34-71.67 (PEG), 127.59, 129.34, 137.69, 139.43, 165.91, 191.21 (HC=O)。
クロロホルム6.75mL中の化合物15(2.4g、0.46mmol)を86%ギ酸1.68mLで室温にて終夜処理した。溶媒を除去し、残渣をDCMエチルエーテルから2回再結晶化し、生成物(2.3g、97%)を得た: 13C NMR δ 39.82, 58.79, 69.34-71.67 (PEG), 127.59, 129.34, 137.69, 139.43, 165.91, 191.21 (HC=O)。
4-ジオレオイル-Dap-NHCH2CH2-イミノメチルフェニルカルボキシアミノ-PEG(化合物17)の調製
化合物13(202.5mg、0.30mmol)を無水DCM10mL及び無水DMF2mLに溶解させ、次いで化合物16(1.0g、0.2mmol)、モレキュラーシーブ(2g)及びDIEA(25.8mg、0.2mmol)を加えた。反応混合物をN2下で室温にて終夜撹拌した。反応混合物を濾過し、濾過液を真空下で濃縮した。残渣をアセトニトリル-IPAから再結晶化した。非常に微細な固体を遠心分離で単離し、生成物0.6g(52%)を得た: 13C NMR δ 13.94, 22.20, 22.45, 25.42, 25.61, 26.96, 28.96, 29.07, 29.27, 29.51, 31.65, 36.17, 36.46, 38.20, 39.66, 39.82, 52.65, 58.73, 59.92, 69.40-71.64 (PEG), 127.11, 127.78, 129.30, 129.54, 136.20, 137.97, 161.44 (-C=N-), 166.45, 171.49, 173.01。
化合物13(202.5mg、0.30mmol)を無水DCM10mL及び無水DMF2mLに溶解させ、次いで化合物16(1.0g、0.2mmol)、モレキュラーシーブ(2g)及びDIEA(25.8mg、0.2mmol)を加えた。反応混合物をN2下で室温にて終夜撹拌した。反応混合物を濾過し、濾過液を真空下で濃縮した。残渣をアセトニトリル-IPAから再結晶化した。非常に微細な固体を遠心分離で単離し、生成物0.6g(52%)を得た: 13C NMR δ 13.94, 22.20, 22.45, 25.42, 25.61, 26.96, 28.96, 29.07, 29.27, 29.51, 31.65, 36.17, 36.46, 38.20, 39.66, 39.82, 52.65, 58.73, 59.92, 69.40-71.64 (PEG), 127.11, 127.78, 129.30, 129.54, 136.20, 137.97, 161.44 (-C=N-), 166.45, 171.49, 173.01。
ジオレオイル-Lys-エチルエーテル(化合物18)の調製
L-リジンエチルエステル(2.1g、8.55mmol)及びオレイン酸(14.5g、51.3mmol)を、無水DCM105mLに溶解させ、溶液を氷浴中で冷却した。EDC(9.9g、51.3mmol)を溶液に加え、次いでDMAP(15.5g、127.4mmol)を加えた。反応混合物を0℃〜室温で終夜撹拌した。反応混合物を、pHが2に調整されるまで希釈HClで洗浄した。粗生成物をDCM中の3.5%MeOHを用いてシリカゲルカラムクロマトグラフィーにより精製し、生成物3.9g(65%)を生成した: 13C NMR: δ 13.97, 14.03, 22.23, 22.53, 25.54, 25.72, 27.04, 28.37, 28.78, 29.04, 29.16, 29.37, 29.59, 31.59, 31.74, 36.21, 36.50, 38.42, 51.67, 53.25, 61.03,129.33, 129.59, 172.14, 172.96, 173.18。
L-リジンエチルエステル(2.1g、8.55mmol)及びオレイン酸(14.5g、51.3mmol)を、無水DCM105mLに溶解させ、溶液を氷浴中で冷却した。EDC(9.9g、51.3mmol)を溶液に加え、次いでDMAP(15.5g、127.4mmol)を加えた。反応混合物を0℃〜室温で終夜撹拌した。反応混合物を、pHが2に調整されるまで希釈HClで洗浄した。粗生成物をDCM中の3.5%MeOHを用いてシリカゲルカラムクロマトグラフィーにより精製し、生成物3.9g(65%)を生成した: 13C NMR: δ 13.97, 14.03, 22.23, 22.53, 25.54, 25.72, 27.04, 28.37, 28.78, 29.04, 29.16, 29.37, 29.59, 31.59, 31.74, 36.21, 36.50, 38.42, 51.67, 53.25, 61.03,129.33, 129.59, 172.14, 172.96, 173.18。
ジオレオイル-Lys-OH(化合物19)の調製
水3.5mL中のNaOH(0.393g、9.84mmol)の溶液をエタノール32mL中の化合物18(3.46g、4.92mmol)の溶液に加えた。反応混合物を室温で終夜撹拌し、0〜5℃まで冷却した。0.5N HCl20mL(氷冷却)を反応混合物に加え、pH2.5にし、次いでDCM(3×100mL)で抽出した。有機層を合わせ、硫酸マグネシウムで乾燥させ、溶媒を除去して、生成物3.23g(97%)を得た: 13C NMR: δ 14.12, 22.19, 22.68, 25.72, 25.86, 27.22, 28.83, 29.20, 29.32, 29.52, 29.75, 31.61, 31.89, 36.43, 36.66, 38.95, 51.96, 129.51, 129.82, 173.92, 174.17, 174.27。
水3.5mL中のNaOH(0.393g、9.84mmol)の溶液をエタノール32mL中の化合物18(3.46g、4.92mmol)の溶液に加えた。反応混合物を室温で終夜撹拌し、0〜5℃まで冷却した。0.5N HCl20mL(氷冷却)を反応混合物に加え、pH2.5にし、次いでDCM(3×100mL)で抽出した。有機層を合わせ、硫酸マグネシウムで乾燥させ、溶媒を除去して、生成物3.23g(97%)を得た: 13C NMR: δ 14.12, 22.19, 22.68, 25.72, 25.86, 27.22, 28.83, 29.20, 29.32, 29.52, 29.75, 31.61, 31.89, 36.43, 36.66, 38.95, 51.96, 129.51, 129.82, 173.92, 174.17, 174.27。
ジオレオイル-Lys-NHCH2CH2NHBoc(化合物20)の調製
化合物19(2.62g、3.88mmol)を、無水DMF75mL及び無水DCM200mLに溶解させ、溶液を0〜5℃まで冷却し、次いでDMAP(2.84g、23.29mmol)、化合物11(1.24g、7.76mmol)及びEDC(2.98g、15.53mmol)を加えた。反応混合物を窒素下で0℃〜室温にて終夜撹拌した。反応の完了をTLC(DCM:MeOH=9:1、v/v)でモニターした。反応混合物をDCM250mLで希釈し、0.2N HCl(3×250mL)及び水(3×200mL)で洗浄した。有機層を、無水硫酸マグネシウムで乾燥させ、溶媒を除去し、生成物2.81g(89%)を生成した: 13C NMR: δ 14.15, 22.50, 22.70, 25.70, 25.89, 27.22, 27.25, 28.44, 29.07, 29.23, 29.34, 29.53, 29.78, 31.91, 32.02, 36.52, 36.78, 38.68, 40.13, 52.80, 79.36, 129.53, 129.83, 156.36, 172.15, 173.39。
化合物19(2.62g、3.88mmol)を、無水DMF75mL及び無水DCM200mLに溶解させ、溶液を0〜5℃まで冷却し、次いでDMAP(2.84g、23.29mmol)、化合物11(1.24g、7.76mmol)及びEDC(2.98g、15.53mmol)を加えた。反応混合物を窒素下で0℃〜室温にて終夜撹拌した。反応の完了をTLC(DCM:MeOH=9:1、v/v)でモニターした。反応混合物をDCM250mLで希釈し、0.2N HCl(3×250mL)及び水(3×200mL)で洗浄した。有機層を、無水硫酸マグネシウムで乾燥させ、溶媒を除去し、生成物2.81g(89%)を生成した: 13C NMR: δ 14.15, 22.50, 22.70, 25.70, 25.89, 27.22, 27.25, 28.44, 29.07, 29.23, 29.34, 29.53, 29.78, 31.91, 32.02, 36.52, 36.78, 38.68, 40.13, 52.80, 79.36, 129.53, 129.83, 156.36, 172.15, 173.39。
ジオレオイル-Lys-NHCH2CH2NH2(化合物21)の調製
化合物20(2.82g、3.45mmol)を、試薬等級のDCM48mLに溶解させ、次いでトリフルオロ酢酸12mLを加えた。反応混合物を室温で30分間撹拌し、次いで真空下で室温にて濃縮した。油残渣をDCM100mLに再溶解させ、pHが8〜9になるまで1%NaHCO3水溶液で洗浄した。有機層を無水硫酸マグネシウムで乾燥させ、溶媒を除去し、生成物1.96g(80%)を生成した: 13C NMR: δ 14.18, 22.52, 22.73, 25.77, 25.89, 27.23, 27.26, 29.15, 29.23, 29.35, 29.56, 29.78, 31.81, 31.92, 36.55, 36.84, 38.59, 52.98, 129.54, 129.86, 172.05, 173.38, 173.53。
化合物20(2.82g、3.45mmol)を、試薬等級のDCM48mLに溶解させ、次いでトリフルオロ酢酸12mLを加えた。反応混合物を室温で30分間撹拌し、次いで真空下で室温にて濃縮した。油残渣をDCM100mLに再溶解させ、pHが8〜9になるまで1%NaHCO3水溶液で洗浄した。有機層を無水硫酸マグネシウムで乾燥させ、溶媒を除去し、生成物1.96g(80%)を生成した: 13C NMR: δ 14.18, 22.52, 22.73, 25.77, 25.89, 27.23, 27.26, 29.15, 29.23, 29.35, 29.56, 29.78, 31.81, 31.92, 36.55, 36.84, 38.59, 52.98, 129.54, 129.86, 172.05, 173.38, 173.53。
4-ジオレオイル-Lys-NHCH2CH2-イミノメチルフェニルカルボキシアミノ-PEG(化合物22)の調製
化合物21(286.8mg、0.40mmol)を、DCM10mL及びDMF2mLに溶解させ、次いで化合物16(1.0g、0.2mmol)、モレキュラーシーブ(2g)及びDIEA(25.8mg、0.2mmol)を加えた。反応混合物をN2下で室温にて終夜撹拌し、濾過した。溶媒を真空下で除去し、残渣をアセトニトリル-IPAから再結晶化した。非常に微細な固体を遠心分離で単離し、生成物0.6g(52%)を得た: 13C NMR δ 13.94, 22.20, 22.45, 25.42, 25.61, 26.96, 28.96, 29.07, 29.27, 29.51, 31.65, 36.17, 36.46, 38.20, 39.66, 39.82, 52.65, 58.73, 59.92, 69.40-71.64 (PEG), 127.11, 127.78, 129.30, 129.54, 136.20, 137.97, 161.44 (-C=N-), 166.45, 171.49, 173.01。
化合物21(286.8mg、0.40mmol)を、DCM10mL及びDMF2mLに溶解させ、次いで化合物16(1.0g、0.2mmol)、モレキュラーシーブ(2g)及びDIEA(25.8mg、0.2mmol)を加えた。反応混合物をN2下で室温にて終夜撹拌し、濾過した。溶媒を真空下で除去し、残渣をアセトニトリル-IPAから再結晶化した。非常に微細な固体を遠心分離で単離し、生成物0.6g(52%)を得た: 13C NMR δ 13.94, 22.20, 22.45, 25.42, 25.61, 26.96, 28.96, 29.07, 29.27, 29.51, 31.65, 36.17, 36.46, 38.20, 39.66, 39.82, 52.65, 58.73, 59.92, 69.40-71.64 (PEG), 127.11, 127.78, 129.30, 129.54, 136.20, 137.97, 161.44 (-C=N-), 166.45, 171.49, 173.01。
化合物25の調製
無水DMF中のmPEG-トシレート(MW2000、化合物23、3g、1.39mmol)、2-メトキシ4-ヒドロキシベンズアルデヒド(化合物24、52.9mg、3.48mmol、2.5等量)及び炭酸カリウム(576.6mg、4.18mmol、3等量)を60〜65℃にて終夜撹拌した。反応の完了をHPLCで確認した後、混合物を室温まで冷却し、濾過した。エチルエーテル(300mL)を加え、粗生成物を沈殿させた。粗生成物を濾過し、単離したウェットケーキをDCM(100mL)に溶解させ、0.5%NaHCO3(2×10mL)で洗浄した。有機層を無水MgSO4で乾燥させ、乾燥状態まで濃縮した。残渣をCH3CN/IPA(2mL/80mL)から再結晶化した。沈殿物を濾過により単離し、真空下で35℃にて乾燥させ、生成物1.75gを生成した: 13C NMR δ 55.6, 58.9, 67.7 - 71.8 (PEG), 98.5, 106.0, 118.9, 130.5, 163.3, 165.1, 187.9。
無水DMF中のmPEG-トシレート(MW2000、化合物23、3g、1.39mmol)、2-メトキシ4-ヒドロキシベンズアルデヒド(化合物24、52.9mg、3.48mmol、2.5等量)及び炭酸カリウム(576.6mg、4.18mmol、3等量)を60〜65℃にて終夜撹拌した。反応の完了をHPLCで確認した後、混合物を室温まで冷却し、濾過した。エチルエーテル(300mL)を加え、粗生成物を沈殿させた。粗生成物を濾過し、単離したウェットケーキをDCM(100mL)に溶解させ、0.5%NaHCO3(2×10mL)で洗浄した。有機層を無水MgSO4で乾燥させ、乾燥状態まで濃縮した。残渣をCH3CN/IPA(2mL/80mL)から再結晶化した。沈殿物を濾過により単離し、真空下で35℃にて乾燥させ、生成物1.75gを生成した: 13C NMR δ 55.6, 58.9, 67.7 - 71.8 (PEG), 98.5, 106.0, 118.9, 130.5, 163.3, 165.1, 187.9。
化合物26の調製
化合物25(868mg、0.41mmol)及び化合物13(480mg、0.71mmol、1.75等量)をDCM(15mL)及びDMF(2mL)の混合物に溶解させた。モレキュラーシーブ(2g)を加え、次いでDIEA(52.5mg、0.41mmol、1.0等量)を加えた。混合物を室温で終夜撹拌し、濾過した。濾過液を濃縮して、残渣をエチルエーテルで沈殿させ、遠心分離した。単離した湿潤固体をCH3CN/IPAから再結晶化した。固体を遠心分離により単離し、真空下で35℃にて乾燥させ、生成物570mgを生成した: 13C NMR δ 14.1, 22.7, 25.4, 25.7, 27.2, 29.2, 29.3, 29.5, 29.7, 31.9, 36.4, 36.5, 40.4, 42.1, 55.2, 55.4, 59.0, 60.2, 67.4 - 76.6 (PEG), 98.6, 105.8, 117.6, 128.3, 129.5, 129.8, 158.0 159.9, 162.2, 170.0, 174.1, 175.2。
化合物25(868mg、0.41mmol)及び化合物13(480mg、0.71mmol、1.75等量)をDCM(15mL)及びDMF(2mL)の混合物に溶解させた。モレキュラーシーブ(2g)を加え、次いでDIEA(52.5mg、0.41mmol、1.0等量)を加えた。混合物を室温で終夜撹拌し、濾過した。濾過液を濃縮して、残渣をエチルエーテルで沈殿させ、遠心分離した。単離した湿潤固体をCH3CN/IPAから再結晶化した。固体を遠心分離により単離し、真空下で35℃にて乾燥させ、生成物570mgを生成した: 13C NMR δ 14.1, 22.7, 25.4, 25.7, 27.2, 29.2, 29.3, 29.5, 29.7, 31.9, 36.4, 36.5, 40.4, 42.1, 55.2, 55.4, 59.0, 60.2, 67.4 - 76.6 (PEG), 98.6, 105.8, 117.6, 128.3, 129.5, 129.8, 158.0 159.9, 162.2, 170.0, 174.1, 175.2。
化合物29の調製
Boc-NHCH2CH2NH2(11、4g、25.0mmol、1.2等量)を4-メトキシベンゾイルクロリド(27、3.6g、20.81mmol、1等量)と無水THF35mL中のTEA(4.27g、5.9mL、42.2mmol、2等量)の存在下で室温にて30分間反応させた。反応の完了をTLCで確認した。反応混合物をDCM350mLで希釈し、1N HCl300mL及び水300mLで洗浄し、無水硫酸マグネシウムで乾燥させ、真空下で濃縮し、生成物7.2g、98%を生成した: 13C NMR δ 28.38, 40.10, 41.81, 55.33, 79.70, 113.49, 126.37, 128.71, 157.26, 161.90, 167.27。
Boc-NHCH2CH2NH2(11、4g、25.0mmol、1.2等量)を4-メトキシベンゾイルクロリド(27、3.6g、20.81mmol、1等量)と無水THF35mL中のTEA(4.27g、5.9mL、42.2mmol、2等量)の存在下で室温にて30分間反応させた。反応の完了をTLCで確認した。反応混合物をDCM350mLで希釈し、1N HCl300mL及び水300mLで洗浄し、無水硫酸マグネシウムで乾燥させ、真空下で濃縮し、生成物7.2g、98%を生成した: 13C NMR δ 28.38, 40.10, 41.81, 55.33, 79.70, 113.49, 126.37, 128.71, 157.26, 161.90, 167.27。
化合物30の調製
Boc-NHCH2CH2NHCO-4-メトキシベンゼン(化合物29、7.1g、24.1mmol)をDCM:TFA(4:1、v/v)23mLに溶解させ、室温で30分間撹拌した。反応の完了をTLCで確認した。溶媒を真空下で室温にて除去し、残渣をDCM40mLに溶解させ、1N NaOH40mLで1回洗浄し、有機層を無水硫酸マグネシウムで乾燥させた。溶媒を真空下で除去し、生成物2.65g、57%を生成した: 13C NMR (DMSO-d6) δ 41.32, 42.54, 55.10, 113.23, 126.57, 128.48, 161.58, 167.08。
Boc-NHCH2CH2NHCO-4-メトキシベンゼン(化合物29、7.1g、24.1mmol)をDCM:TFA(4:1、v/v)23mLに溶解させ、室温で30分間撹拌した。反応の完了をTLCで確認した。溶媒を真空下で室温にて除去し、残渣をDCM40mLに溶解させ、1N NaOH40mLで1回洗浄し、有機層を無水硫酸マグネシウムで乾燥させた。溶媒を真空下で除去し、生成物2.65g、57%を生成した: 13C NMR (DMSO-d6) δ 41.32, 42.54, 55.10, 113.23, 126.57, 128.48, 161.58, 167.08。
化合物31の調製
化合物3(3.88mL)を無水DMF75mL及び無水DCM200mLに溶解させ、溶液を0〜5℃まで冷却し、DMAP(2.84g、23.29mmol)、化合物7(7.76mmol)及びEDC(2.98g、15.53mmol)を加えた。反応混合物を窒素下で0℃〜室温にて終夜撹拌した。反応混合物をDCM250mLで希釈し、0.2N HCl(3×250mL)及び水(3×200mL)で洗浄した。有機層を、無水硫酸マグネシウムで乾燥させ、溶媒を除去して、生成物を生成した。
化合物3(3.88mL)を無水DMF75mL及び無水DCM200mLに溶解させ、溶液を0〜5℃まで冷却し、DMAP(2.84g、23.29mmol)、化合物7(7.76mmol)及びEDC(2.98g、15.53mmol)を加えた。反応混合物を窒素下で0℃〜室温にて終夜撹拌した。反応混合物をDCM250mLで希釈し、0.2N HCl(3×250mL)及び水(3×200mL)で洗浄した。有機層を、無水硫酸マグネシウムで乾燥させ、溶媒を除去して、生成物を生成した。
化合物32の調製
化合物31(0.102mmol)を室温にてCH3OH/H2O中のK2CO3(42mg、0.305mmol)で処理した。反応を、HPLCで追跡した。反応が完了した後、溶媒を除去し、残渣をDCMに再溶解させ、0.45μmの膜により濾過した。溶媒を除去し、残渣をIPAから再結晶化して、生成物を生成した。
化合物31(0.102mmol)を室温にてCH3OH/H2O中のK2CO3(42mg、0.305mmol)で処理した。反応を、HPLCで追跡した。反応が完了した後、溶媒を除去し、残渣をDCMに再溶解させ、0.45μmの膜により濾過した。溶媒を除去し、残渣をIPAから再結晶化して、生成物を生成した。
化合物34の調製
HO-2KPEG-COOH(33、7g、3.5mmol、1等量)を無水MeOH(56g、70.8mL、1750mmol、500等量)及び無水DCM70mLに溶解させた。混合物を0℃まで冷却し、次いでEDC(3.36g、17.5mmol、5等量)及びDMAP(2.1g、17.5mmol、5等量)を0℃にて加えた。反応混合物を室温で終夜撹拌し、真空下で濃縮した。残渣を0.1N HCl(pH約2)40mLに再溶解させ、DCMで3回抽出した。有機層を合わせ、無水硫酸マグネシウムで乾燥させて、溶媒を真空下で除去した。残渣をIPA100mLから再結晶化し、回収し、遠心分離によりエーテルで洗浄し、真空下で40℃にて乾燥させ、生成物6.5g(92%)を生成した: 13C NMR δ 51.77, 61.70, 68.57, 70.36, 70.50, 70.85, 72.42, 170.65。
HO-2KPEG-COOH(33、7g、3.5mmol、1等量)を無水MeOH(56g、70.8mL、1750mmol、500等量)及び無水DCM70mLに溶解させた。混合物を0℃まで冷却し、次いでEDC(3.36g、17.5mmol、5等量)及びDMAP(2.1g、17.5mmol、5等量)を0℃にて加えた。反応混合物を室温で終夜撹拌し、真空下で濃縮した。残渣を0.1N HCl(pH約2)40mLに再溶解させ、DCMで3回抽出した。有機層を合わせ、無水硫酸マグネシウムで乾燥させて、溶媒を真空下で除去した。残渣をIPA100mLから再結晶化し、回収し、遠心分離によりエーテルで洗浄し、真空下で40℃にて乾燥させ、生成物6.5g(92%)を生成した: 13C NMR δ 51.77, 61.70, 68.57, 70.36, 70.50, 70.85, 72.42, 170.65。
化合物35の調製
HO-2KPEG-COOMe(34、6.3g、3.15mmol、1等量)及びDMAP(1.92g、15.75mmol、5等量)を無水DCM38mLに溶解させ、0℃まで冷却した。無水DCM63mL中のトシルクロリド(3.00g、15.75mmol、5等量)を、0℃にて3時間かけて滴下した。混合物を0℃〜室温にて終夜撹拌した。溶媒を除去し、残渣をIPAで沈殿させ、生成物5.85gを生成した: 13C NMR δ 21.73, 51.80, 68.61, 69.22, 70.53, 70.88, 76.21, 77.21, 127.86, 129.69, 132.82, 144.62, 170.69。
HO-2KPEG-COOMe(34、6.3g、3.15mmol、1等量)及びDMAP(1.92g、15.75mmol、5等量)を無水DCM38mLに溶解させ、0℃まで冷却した。無水DCM63mL中のトシルクロリド(3.00g、15.75mmol、5等量)を、0℃にて3時間かけて滴下した。混合物を0℃〜室温にて終夜撹拌した。溶媒を除去し、残渣をIPAで沈殿させ、生成物5.85gを生成した: 13C NMR δ 21.73, 51.80, 68.61, 69.22, 70.53, 70.88, 76.21, 77.21, 127.86, 129.69, 132.82, 144.62, 170.69。
化合物36の調製
NaOH(0.066g、1.65mmol、1.1等量)を水15mL中のTsO-PEG-COOMe(化合物35、3.00g、1.5mmol、1等量)の溶液に加えた。HPLC-ELSDでモニターした反応は3時間後に完了した。溶液を1 HClを0℃にて滴下してpH2まで酸性にし、DCM150mLで3回抽出した。有機層を合わせ、無水硫酸マグネシウムで乾燥させ、真空下で30℃にて濃縮した。残渣をIPA 20mLから再結晶化し、遠心分離で単離した。最終生成物を真空下で40℃にて乾燥させ、生成物2.6gを生成した: 13C NMR δ 21.67, 68.59, 68.79, 69.17, 70.30, 70.45, 71.22, 127.80, 128.65, 132.81, 144.58, 171.29。
NaOH(0.066g、1.65mmol、1.1等量)を水15mL中のTsO-PEG-COOMe(化合物35、3.00g、1.5mmol、1等量)の溶液に加えた。HPLC-ELSDでモニターした反応は3時間後に完了した。溶液を1 HClを0℃にて滴下してpH2まで酸性にし、DCM150mLで3回抽出した。有機層を合わせ、無水硫酸マグネシウムで乾燥させ、真空下で30℃にて濃縮した。残渣をIPA 20mLから再結晶化し、遠心分離で単離した。最終生成物を真空下で40℃にて乾燥させ、生成物2.6gを生成した: 13C NMR δ 21.67, 68.59, 68.79, 69.17, 70.30, 70.45, 71.22, 127.80, 128.65, 132.81, 144.58, 171.29。
化合物37の調製
EDC(2.84mmol)及びDMAP(5.68mmol)を、無水DCM20mL及びDMF4mL中のTsO-PEG-COOH(36、2.0g、1.00mmol、1等量)及び化合物32(2.42mmol)の溶液に0℃で加えた。反応混合物を0℃〜室温で終夜撹拌した。溶液を真空下で室温にて濃縮し、残渣をエーテルで沈殿させ、遠心分離で単離した。物質を、DCM中0〜2%MeOH(v/v)を用いるアルミナ(脱活性、3%水)カラムクロマトグラフィーにより精製し、生成物1.16gを生成した: 13C NMR δ 14.10, 22.61, 24.74, 25.51, 25.64, 27.13, 29.10, 29.22, 29.45, 29.68, 31.82, 36.43, 38.86, 39.45, 40.17, 41.71, 54.55, 59.22, 59.34, 68.53, 69.11, 70.42, 99.77, 127.74, 129.46, 129.57, 129.72, 169.99, 174.11, 174.86。
EDC(2.84mmol)及びDMAP(5.68mmol)を、無水DCM20mL及びDMF4mL中のTsO-PEG-COOH(36、2.0g、1.00mmol、1等量)及び化合物32(2.42mmol)の溶液に0℃で加えた。反応混合物を0℃〜室温で終夜撹拌した。溶液を真空下で室温にて濃縮し、残渣をエーテルで沈殿させ、遠心分離で単離した。物質を、DCM中0〜2%MeOH(v/v)を用いるアルミナ(脱活性、3%水)カラムクロマトグラフィーにより精製し、生成物1.16gを生成した: 13C NMR δ 14.10, 22.61, 24.74, 25.51, 25.64, 27.13, 29.10, 29.22, 29.45, 29.68, 31.82, 36.43, 38.86, 39.45, 40.17, 41.71, 54.55, 59.22, 59.34, 68.53, 69.11, 70.42, 99.77, 127.74, 129.46, 129.57, 129.72, 169.99, 174.11, 174.86。
化合物38の調製
化合物30(5等量)及びEt3N(5等量)をDMSO(2容量)中のTsO-PEG-COO-Dap脂質(37、1.0等量)の溶液に室温で加えた。反応物を90℃にて2.5時間加熱した。物質を-78℃にてIPAから再結晶化し、Et2Oで2回洗浄し、真空下で40℃にて乾燥させ、中性アルミナカラムクロマトグラフィーにより精製し、生成物60%を得た: 13C NMR δ 14.13, 22.66, 24.78, 25.54, 25.68, 27.16, 28.41, 29.15, 29.48, 29.71, 31.86, 38.49, 38.89, 39.25, 39.48, 41.80, 48.24, 28.55, 54.58, 55.29, 59.26, 59.39, 70.25, 70.39, 70.42, 70.88, 99.82, 113.42, 126.76, 128.49, 129.49, 129.78, 161.76, 166.77, 170.02, 174.16, 174.94。
化合物30(5等量)及びEt3N(5等量)をDMSO(2容量)中のTsO-PEG-COO-Dap脂質(37、1.0等量)の溶液に室温で加えた。反応物を90℃にて2.5時間加熱した。物質を-78℃にてIPAから再結晶化し、Et2Oで2回洗浄し、真空下で40℃にて乾燥させ、中性アルミナカラムクロマトグラフィーにより精製し、生成物60%を得た: 13C NMR δ 14.13, 22.66, 24.78, 25.54, 25.68, 27.16, 28.41, 29.15, 29.48, 29.71, 31.86, 38.49, 38.89, 39.25, 39.48, 41.80, 48.24, 28.55, 54.58, 55.29, 59.26, 59.39, 70.25, 70.39, 70.42, 70.88, 99.82, 113.42, 126.76, 128.49, 129.49, 129.78, 161.76, 166.77, 170.02, 174.16, 174.94。
化合物39の調製
化合物30(1g、5.15mmol)、Boc-NHCH2CH2Br(35、1.38g、6.18mmol)及びDIPEA(1.33g、10.3mmol)の溶液をTHF(20mL)中で還流した。反応をTLCでモニターした。反応が完了した後、溶媒を除去し、残渣をシリカゲルカラムにより精製して、生成物0.78g、28%を生成した: 13C NMR δ 28.25, 39.25, 39.98, 48.27, 48.62, 55.15, 78.92, 113.31, 126.37, 128.63, 156.00, 161.70, 167.11。
化合物30(1g、5.15mmol)、Boc-NHCH2CH2Br(35、1.38g、6.18mmol)及びDIPEA(1.33g、10.3mmol)の溶液をTHF(20mL)中で還流した。反応をTLCでモニターした。反応が完了した後、溶媒を除去し、残渣をシリカゲルカラムにより精製して、生成物0.78g、28%を生成した: 13C NMR δ 28.25, 39.25, 39.98, 48.27, 48.62, 55.15, 78.92, 113.31, 126.37, 128.63, 156.00, 161.70, 167.11。
化合物40の調製
エチルトリフルオロエタノエート(0.42g、2mmol)をTHF(20mL)中のtert-ブチル2-(2-(4-メトキシベンズアミド)エチルアミノ)エチルカルバメート(39、0.45g、1.33mmol)及びDIEA(0.52g、4mmol)の混合物に徐々に加え、混合物を-10〜-15℃で15分間撹拌した。塩水50mLを加えて反応物を失活させ、溶液をエチルアセテートで数回抽出した。有機層を合わせ、無水MgSO4で乾燥させた。溶媒を除去し、残渣をシリカゲルカラムクロマトグラフィーにより精製し、生成物0.52g、90%を生成した: 13C NMR δ 27.171, 28.02, 30.10, 37.54, 38.01, 38.42, 44.52, 45.27, 45.59, 46.76, 47.59, 48.12, 55.06, 55.41, 55.46, 60.15, 79.32, 113.27, 113.37, 113.90, 114.33, 114.42, 117.13, 117.71, 118.00, 122.58, 122.67, 125.15, 125.88, 125.95, 128.55, 128.77, 131.97, 132.12, 155.63, 155.23, 157.04, 159.58, 160.10, 161.88, 164.52, 164.81, 167.27, 170.24, 170.53, 170.82。
エチルトリフルオロエタノエート(0.42g、2mmol)をTHF(20mL)中のtert-ブチル2-(2-(4-メトキシベンズアミド)エチルアミノ)エチルカルバメート(39、0.45g、1.33mmol)及びDIEA(0.52g、4mmol)の混合物に徐々に加え、混合物を-10〜-15℃で15分間撹拌した。塩水50mLを加えて反応物を失活させ、溶液をエチルアセテートで数回抽出した。有機層を合わせ、無水MgSO4で乾燥させた。溶媒を除去し、残渣をシリカゲルカラムクロマトグラフィーにより精製し、生成物0.52g、90%を生成した: 13C NMR δ 27.171, 28.02, 30.10, 37.54, 38.01, 38.42, 44.52, 45.27, 45.59, 46.76, 47.59, 48.12, 55.06, 55.41, 55.46, 60.15, 79.32, 113.27, 113.37, 113.90, 114.33, 114.42, 117.13, 117.71, 118.00, 122.58, 122.67, 125.15, 125.88, 125.95, 128.55, 128.77, 131.97, 132.12, 155.63, 155.23, 157.04, 159.58, 160.10, 161.88, 164.52, 164.81, 167.27, 170.24, 170.53, 170.82。
化合物41の調製
TFA(2mL)を、DCM(8mL)中のtert-ブチル2-(2,2,2-トリフルオロ-N-(2-(4-メトキシベンズアミド)エチル)アセトアミド)エチルカルバメート(40、0.2g)の溶液に加えた。混合物を室温で撹拌し、反応をTLCでモニターした。反応が完了した後、溶媒を真空下で除去し、生成物100%を生成した: 13C NMR (CD3OD) δ 37.37, 37.78, 37.92, 38.45, 38.85, 46.15, 46.50, 47.78, 47.89, 48.15, 55.86, 11466, 115.11, 118.94, 119.43, 126.86, 127.04, 12/9.02, 129.75, 130.00, 130.29, 159.24, 159.71, 160.83, 161.33, 163.83, 163.989, 164.04, 170.05, 170.17, 170.86。
TFA(2mL)を、DCM(8mL)中のtert-ブチル2-(2,2,2-トリフルオロ-N-(2-(4-メトキシベンズアミド)エチル)アセトアミド)エチルカルバメート(40、0.2g)の溶液に加えた。混合物を室温で撹拌し、反応をTLCでモニターした。反応が完了した後、溶媒を真空下で除去し、生成物100%を生成した: 13C NMR (CD3OD) δ 37.37, 37.78, 37.92, 38.45, 38.85, 46.15, 46.50, 47.78, 47.89, 48.15, 55.86, 11466, 115.11, 118.94, 119.43, 126.86, 127.04, 12/9.02, 129.75, 130.00, 130.29, 159.24, 159.71, 160.83, 161.33, 163.83, 163.989, 164.04, 170.05, 170.17, 170.86。
化合物42の調製
DCM(10mL)中のN-(2-(N-(2-アミノエチル)-2,2,2-トリフルオロアセトアミド)エチル-4-メトキシベンズアミド(41、255g、0.593mmol)、無水コハク酸(59mg、0.593mmol)及びTEA(59mg、0.593mmol)のTFA塩の混合物を室温で撹拌した。反応進行をTLCで追跡した。反応が完了した後、溶媒を除去し、残渣をシリカゲルカルムクロマトグラフィーにより精製し、生成物170mg、66%を生成した: 13C NMR (CD3OD) δ 28.84, 30.09, 30.31, 38.75, 38.89, 39.10, 46.07, 46.70, 48.15, 55.91, 114.63, 116.07, 119.12, 119.96, 127.05, 127.28, 129.97, 130.00, 158.52, 159.01, 162.28, 162.73, 163.57, 163.66, 169.58, 174.53, 174.61, 175.92, 176.11。
DCM(10mL)中のN-(2-(N-(2-アミノエチル)-2,2,2-トリフルオロアセトアミド)エチル-4-メトキシベンズアミド(41、255g、0.593mmol)、無水コハク酸(59mg、0.593mmol)及びTEA(59mg、0.593mmol)のTFA塩の混合物を室温で撹拌した。反応進行をTLCで追跡した。反応が完了した後、溶媒を除去し、残渣をシリカゲルカルムクロマトグラフィーにより精製し、生成物170mg、66%を生成した: 13C NMR (CD3OD) δ 28.84, 30.09, 30.31, 38.75, 38.89, 39.10, 46.07, 46.70, 48.15, 55.91, 114.63, 116.07, 119.12, 119.96, 127.05, 127.28, 129.97, 130.00, 158.52, 159.01, 162.28, 162.73, 163.57, 163.66, 169.58, 174.53, 174.61, 175.92, 176.11。
化合物43の調製
EDC(151mg、0.786mmol)を、氷浴中でDCM中の4-オキソ-4-(2-(2,2,2-トリフルオロ-N-(2-(4-メトキシベンズアミド)エチル)アセトアミド)エチルアミノ)ブタン酸(42、170mg、0.393mmol)、NHS(91mg、0.786mmol)及びDMAP(144mg、1.18mmol)の混合物に加え、混合物を0℃〜室温で3時間撹拌した。反応混合物を0.5N HClで洗浄し、無水Na2SO4で乾燥させた。溶媒を真空下で除去し、生成物0.2gを生成し、それを更なる精製なしに使用した。
EDC(151mg、0.786mmol)を、氷浴中でDCM中の4-オキソ-4-(2-(2,2,2-トリフルオロ-N-(2-(4-メトキシベンズアミド)エチル)アセトアミド)エチルアミノ)ブタン酸(42、170mg、0.393mmol)、NHS(91mg、0.786mmol)及びDMAP(144mg、1.18mmol)の混合物に加え、混合物を0℃〜室温で3時間撹拌した。反応混合物を0.5N HClで洗浄し、無水Na2SO4で乾燥させた。溶媒を真空下で除去し、生成物0.2gを生成し、それを更なる精製なしに使用した。
化合物44の調製
DCM(10mL)中の活性化エステル(43、0.2g、0.37mmol)、NH2-PEG(2000)-COOH(0.4g、0.2mmol)及びDIEA(0.35mL、2mmol)の混合物を室温で終夜撹拌し、次いで1N HClで洗浄した。反応混合物を無水Na2SO4で乾燥させた。溶媒を真空下で除去し、残渣をIPAから再結晶化し、生成物0.3g、62%を生成した: 13C NMR δ 25.16, 27.45, 27.58, 29.31, 30.92, 38.24, 38.38, 38.56, 39.00, 39.08, 45.62, 46.06, 48.01, 55.01, 68.14-70.52 (PEG), 77.20, 113.15, 113.54, 125.61, 125.75, 128.51, 128.64, 156.76, 157.25, 161.61, 161.72, 166.84, 167.07, 169.42, 171.25, 171.81, 171.95, 173.44, 174.02。
DCM(10mL)中の活性化エステル(43、0.2g、0.37mmol)、NH2-PEG(2000)-COOH(0.4g、0.2mmol)及びDIEA(0.35mL、2mmol)の混合物を室温で終夜撹拌し、次いで1N HClで洗浄した。反応混合物を無水Na2SO4で乾燥させた。溶媒を真空下で除去し、残渣をIPAから再結晶化し、生成物0.3g、62%を生成した: 13C NMR δ 25.16, 27.45, 27.58, 29.31, 30.92, 38.24, 38.38, 38.56, 39.00, 39.08, 45.62, 46.06, 48.01, 55.01, 68.14-70.52 (PEG), 77.20, 113.15, 113.54, 125.61, 125.75, 128.51, 128.64, 156.76, 157.25, 161.61, 161.72, 166.84, 167.07, 169.42, 171.25, 171.81, 171.95, 173.44, 174.02。
化合物45の調製
EDCをDCM(20mL)中のアニサミド-PEG酸(44、0.3g、0.123mmol)、ケタール脂質(32、0.185g、0.247mmol)及びDMAP(90mg、0.74mmol)の混合物に0〜5℃で加え、反応混合物を0℃〜室温で終夜撹拌した。溶媒を真空下で除去し、残渣をIPAから再結晶化し、生成物0.32g、82%を生成した: 13C NMR δ 13.83, 22.32, 24.49, 25.10, 25.29, 25.37, 26.85, 27.46, 27.60, 28.80, 28.94, 29.15, 29.31, 30.98, 31.53, 36.08, 36.11, 38.27, 38.38, 38.58, 38.94, 39.03, 39.16, 41.23, 45.62, 46.09, 47.44, 48.03, 54.21, 54.97, 58.95, 59.07, 63.48, 69.22-70.58 (PEG), 99.49, 113.09, 125.72, 125.85, 128.48, 128.63, 129.16, 129.42, 161.55, 161.66, 166.67, 166.98, 169.71, 169.80, 171.46, 171.80, 173.37, 173.75, 173.91, 174.56。
EDCをDCM(20mL)中のアニサミド-PEG酸(44、0.3g、0.123mmol)、ケタール脂質(32、0.185g、0.247mmol)及びDMAP(90mg、0.74mmol)の混合物に0〜5℃で加え、反応混合物を0℃〜室温で終夜撹拌した。溶媒を真空下で除去し、残渣をIPAから再結晶化し、生成物0.32g、82%を生成した: 13C NMR δ 13.83, 22.32, 24.49, 25.10, 25.29, 25.37, 26.85, 27.46, 27.60, 28.80, 28.94, 29.15, 29.31, 30.98, 31.53, 36.08, 36.11, 38.27, 38.38, 38.58, 38.94, 39.03, 39.16, 41.23, 45.62, 46.09, 47.44, 48.03, 54.21, 54.97, 58.95, 59.07, 63.48, 69.22-70.58 (PEG), 99.49, 113.09, 125.72, 125.85, 128.48, 128.63, 129.16, 129.42, 161.55, 161.66, 166.67, 166.98, 169.71, 169.80, 171.46, 171.80, 173.37, 173.75, 173.91, 174.56。
化合物46の調製
CH3OH/H2O中の保護されたアニサミド-PEG-ケタール脂質(45、0.32g、0.102mmol)及びK2CO3(42mg、0.305mmol)の混合物を、反応が完了するまで室温で撹拌し、HPLCでモニターした。溶媒を除去し、残渣をDCMに再溶解させて、0.45μmの膜により濾過した。溶媒を除去し、残渣をIPAから再結晶化し、生成物0.28gを生成した: 13C NMR δ 14.15, 22.69, 24.81, 24.84, 25.59, 25.72, 27.20, 27.23, 28.39, 29.17, 29.31, 29.52, 29.69, 29.76, 31.38, 31.90, 36.53, 38.93, 39.31, 39.54, 39.82, 40.54, 41.85, 45.04, 46.05, 48.43, 51.57, 54.63, 55.32, 59.30, 59.44, 69.71-70.92 (PEG), 77.20, 99.87, 113.46, 126.43, 128.75, 128.95, 129.54, 161.79, 166.81, 167.13, 170.06, 170.15, 171.86, 172.01, 173.88, 174.20, 174.97。
CH3OH/H2O中の保護されたアニサミド-PEG-ケタール脂質(45、0.32g、0.102mmol)及びK2CO3(42mg、0.305mmol)の混合物を、反応が完了するまで室温で撹拌し、HPLCでモニターした。溶媒を除去し、残渣をDCMに再溶解させて、0.45μmの膜により濾過した。溶媒を除去し、残渣をIPAから再結晶化し、生成物0.28gを生成した: 13C NMR δ 14.15, 22.69, 24.81, 24.84, 25.59, 25.72, 27.20, 27.23, 28.39, 29.17, 29.31, 29.52, 29.69, 29.76, 31.38, 31.90, 36.53, 38.93, 39.31, 39.54, 39.82, 40.54, 41.85, 45.04, 46.05, 48.43, 51.57, 54.63, 55.32, 59.30, 59.44, 69.71-70.92 (PEG), 77.20, 99.87, 113.46, 126.43, 128.75, 128.95, 129.54, 161.79, 166.81, 167.13, 170.06, 170.15, 171.86, 172.01, 173.88, 174.20, 174.97。
化合物47の調製
ベンズオキシジエチルアミン(30、5等量)及びTEA(5等量)を、DMSO(2容量)中のTsO-PEG-COOMe(35、1.0等量)の溶液に室温にて加え、反応混合物を80℃にて1.5時間撹拌した。反応進行をモニターした。DCMを反応混合物に加え、反応混合物を水及び0.1N HClで洗浄した。有機層を乾燥させ、濾過し、濃縮した。残渣をIPAから再結晶化し、Et2Oで2回洗浄し、真空下で40℃にて乾燥させ、収率88%で標的化合物(870mg)を得た。それはNMRで確認された: 13C NMR δ 46.60, 47.57, 48.30, 51.75, 55.31, 65.80, 68.56, 70.83, 113.39, 125.63, 128.75, 129.48, 162.05, 167.40, 170.65。
ベンズオキシジエチルアミン(30、5等量)及びTEA(5等量)を、DMSO(2容量)中のTsO-PEG-COOMe(35、1.0等量)の溶液に室温にて加え、反応混合物を80℃にて1.5時間撹拌した。反応進行をモニターした。DCMを反応混合物に加え、反応混合物を水及び0.1N HClで洗浄した。有機層を乾燥させ、濾過し、濃縮した。残渣をIPAから再結晶化し、Et2Oで2回洗浄し、真空下で40℃にて乾燥させ、収率88%で標的化合物(870mg)を得た。それはNMRで確認された: 13C NMR δ 46.60, 47.57, 48.30, 51.75, 55.31, 65.80, 68.56, 70.83, 113.39, 125.63, 128.75, 129.48, 162.05, 167.40, 170.65。
化合物48の調製
アニサミド-PEG-COOMe(48、1.0等量)、水(5容量)及びNaOH(1.1等量)の混合物を室温で終夜撹拌した。反応をHPLCでモニターした。DCMを反応混合物に加えた。反応混合物を水及び0.1N HClで洗浄した。有機層を乾燥させ、濾過し、濃縮した。残渣をIPAから再結晶化し、Et2Oで2回洗浄し、真空下で40℃にて乾燥させ、収率95%で生成物(80mg)を得た: 13C NMR δ 36.63, 47.56, 48.27, 55.31, 65.83, 68.83, 70.01, 70.42, 71.17, 109.67, 113.41, 125.62, 128.59, 129.46, 162.05, 167.44, 171.39。
アニサミド-PEG-COOMe(48、1.0等量)、水(5容量)及びNaOH(1.1等量)の混合物を室温で終夜撹拌した。反応をHPLCでモニターした。DCMを反応混合物に加えた。反応混合物を水及び0.1N HClで洗浄した。有機層を乾燥させ、濾過し、濃縮した。残渣をIPAから再結晶化し、Et2Oで2回洗浄し、真空下で40℃にて乾燥させ、収率95%で生成物(80mg)を得た: 13C NMR δ 36.63, 47.56, 48.27, 55.31, 65.83, 68.83, 70.01, 70.42, 71.17, 109.67, 113.41, 125.62, 128.59, 129.46, 162.05, 167.44, 171.39。
化合物49の調製
Boc2O(69mg、1.4等量)及びTEA(0.044ml、1.4等量)を、DCM中のアニサミド-PEG-COOH(48、450mg、1.0等量)の溶液に加え、反応混合物を室温で1時間撹拌した。溶液を0.1N HClで洗浄し、乾燥させ、濾過し、濃縮した。残渣をIPAから再結晶化し、Et2Oで2回洗浄し、真空下で40℃にて乾燥させ、収率93%で生成物(420mg)を得た: 13C NMR δ 28.30, 42.60, 47.80, 55.21, 68.55, 69.85, 70.20, 70.26, 70.40, 71.18, 77.43, 113.58, 161.66, 166.69, 171.22。
Boc2O(69mg、1.4等量)及びTEA(0.044ml、1.4等量)を、DCM中のアニサミド-PEG-COOH(48、450mg、1.0等量)の溶液に加え、反応混合物を室温で1時間撹拌した。溶液を0.1N HClで洗浄し、乾燥させ、濾過し、濃縮した。残渣をIPAから再結晶化し、Et2Oで2回洗浄し、真空下で40℃にて乾燥させ、収率93%で生成物(420mg)を得た: 13C NMR δ 28.30, 42.60, 47.80, 55.21, 68.55, 69.85, 70.20, 70.26, 70.40, 71.18, 77.43, 113.58, 161.66, 166.69, 171.22。
化合物51の調製
DMAP(98mg、4等量)及びEDC(115mg、3等量)を、DCM中の化合物49(400mg、1.0等量)及びDSPE-アミン(449mg、3等量)の溶液に0℃で加えた。混合物を室温で終夜撹拌した。溶液を0.1N HClで洗浄し、乾燥させ、濾過し、濃縮した。残渣をIPAから再結晶化し、Et2Oで2回洗浄し、真空下で40℃にて乾燥させ、収率75%で生成物(357mg)を得た: 13C NMR δ 13.95, 14.74, 22.47, 24.62, 24.69, 24.75, 28.18, 28.94, 29.31, 29.43, 29.47, 31.20, 31.68, 33.77, 33.88, 34.08, 36.24, 40.38, 42.49, 46.98, 47.71, 48.06, 50.06, 55.09, 62.58, 63.13, 63.31, 63.48, 68.22, 69.24, 69.41, 69.51, 69.64, 69.67, 69.82, 69.97, 70.03, 70.26, 70.75, 71.05, 77.20, 78.96, 113.14, 128.46, 161.52, 162.07, 166.49, 169.52, 172.53, 172.91。
DMAP(98mg、4等量)及びEDC(115mg、3等量)を、DCM中の化合物49(400mg、1.0等量)及びDSPE-アミン(449mg、3等量)の溶液に0℃で加えた。混合物を室温で終夜撹拌した。溶液を0.1N HClで洗浄し、乾燥させ、濾過し、濃縮した。残渣をIPAから再結晶化し、Et2Oで2回洗浄し、真空下で40℃にて乾燥させ、収率75%で生成物(357mg)を得た: 13C NMR δ 13.95, 14.74, 22.47, 24.62, 24.69, 24.75, 28.18, 28.94, 29.31, 29.43, 29.47, 31.20, 31.68, 33.77, 33.88, 34.08, 36.24, 40.38, 42.49, 46.98, 47.71, 48.06, 50.06, 55.09, 62.58, 63.13, 63.31, 63.48, 68.22, 69.24, 69.41, 69.51, 69.64, 69.67, 69.82, 69.97, 70.03, 70.26, 70.75, 71.05, 77.20, 78.96, 113.14, 128.46, 161.52, 162.07, 166.49, 169.52, 172.53, 172.91。
化合物52の調製
DCM(2.4ml)中の化合物51(300mg)及びTFA(0.6ml)の混合物を室温で3時間撹拌した。反応溶液を飽和NaHCO3水溶液で洗浄し、乾燥させ、真空下で濃縮した。残渣を調製HPLCで精製し、生成物160mgを生成した: 13C NMR δ 14.13, 22.67, 24.85, 24.91, 29.14, 29.32, 29.50, 29.69, 31.88, 34.05, 34.23, 36.90, 36.89, 39.89, 39.95, 45.45, 47.51, 47.82, 55.27, 62.55, 63.51, 63.58, 64.10, 64.18, 66.08, 70.14, 70.23, 70.41, 70.49, 70.76, 71.27, 77.21, 113.34, 125.87, 129.28, 161.98, 167.34, 169.94, 172.74, 173.11。
DCM(2.4ml)中の化合物51(300mg)及びTFA(0.6ml)の混合物を室温で3時間撹拌した。反応溶液を飽和NaHCO3水溶液で洗浄し、乾燥させ、真空下で濃縮した。残渣を調製HPLCで精製し、生成物160mgを生成した: 13C NMR δ 14.13, 22.67, 24.85, 24.91, 29.14, 29.32, 29.50, 29.69, 31.88, 34.05, 34.23, 36.90, 36.89, 39.89, 39.95, 45.45, 47.51, 47.82, 55.27, 62.55, 63.51, 63.58, 64.10, 64.18, 66.08, 70.14, 70.23, 70.41, 70.49, 70.76, 71.27, 77.21, 113.34, 125.87, 129.28, 161.98, 167.34, 169.94, 172.74, 173.11。
核酸ナノ粒子組成物の調製
本実施例において、LNAを含むオリゴヌクレオチドを有するナノ粒子組成物を調製した。例えば、カチオン性脂質:DOPE:Chol:化合物10を、90%エタノール10mL中で18:60:20:2のモル比で混合した(総脂質30μmol)。オリゴヌクレオチド(アンチ-BCl siRNA:配列番号2及び3、0.4μmol)を等量の20mMトリス緩衝液(pH7.4〜7.6)に溶解させた。37℃まで加熱した後、二つの溶液をデュアルシリンジポンプにより混合し、次いで混合溶液を20mMトリス緩衝液(300mM NaCl、pH7.4〜7.6)20mLで希釈した。混合物を37℃で30分間インキュベートし、10mM PBS緩衝液(138mM NaCl、2.7mM KCl、pH7.4)で透析した。透析により混合物からエタノールを除去した後、安定な粒子が得られた。ナノ粒子溶液を遠心分離により濃縮した。ナノ粒子溶液を15mLの遠心分離濾過装置(Amicon Ultra-15、Millipore、USA)に移した。遠心分離速度は4℃で3000rpmであった。濃縮懸濁液を収集し、0.22μmのシリンジフィルター(Millex-GV、Millipore、USA)による濾過により滅菌した。均質なナノ粒子懸濁液が得られた。
本実施例において、LNAを含むオリゴヌクレオチドを有するナノ粒子組成物を調製した。例えば、カチオン性脂質:DOPE:Chol:化合物10を、90%エタノール10mL中で18:60:20:2のモル比で混合した(総脂質30μmol)。オリゴヌクレオチド(アンチ-BCl siRNA:配列番号2及び3、0.4μmol)を等量の20mMトリス緩衝液(pH7.4〜7.6)に溶解させた。37℃まで加熱した後、二つの溶液をデュアルシリンジポンプにより混合し、次いで混合溶液を20mMトリス緩衝液(300mM NaCl、pH7.4〜7.6)20mLで希釈した。混合物を37℃で30分間インキュベートし、10mM PBS緩衝液(138mM NaCl、2.7mM KCl、pH7.4)で透析した。透析により混合物からエタノールを除去した後、安定な粒子が得られた。ナノ粒子溶液を遠心分離により濃縮した。ナノ粒子溶液を15mLの遠心分離濾過装置(Amicon Ultra-15、Millipore、USA)に移した。遠心分離速度は4℃で3000rpmであった。濃縮懸濁液を収集し、0.22μmのシリンジフィルター(Millex-GV、Millipore、USA)による濾過により滅菌した。均質なナノ粒子懸濁液が得られた。
ナノ粒子の直径及び多分散性を、Plus 90 Particle Size Analyzer Dynamic Light Scattering Instrument(Brookhaven、New York)で培地として水(Sigma)中で25°で測定した。
核酸封入効率をUV-VIS(Agilent8453)で決定した。バックグラウンド紫外線-visスペクトルは、PBS緩衝生理食塩水(250μL)、メタノール(625μL)及びクロロホルム(250μL)からなる混合溶液である溶液を走査することにより得られた。封入された核酸の濃度を決定するために、メタノール(625μL)及びクロロホルム(250μL)をPBS緩衝生理食塩水ナノ粒子懸濁液(250μL)に加えた。混合後、透明な溶液が得られ、この溶液を260nmでの吸光度を測定する前に2分間超音波処理した。封入された核酸の濃度及び充填効率を、方程式(1)及び(2)に従って計算した:
Cen(μg/ml)=A260×OD260単位(μg/mL)×希釈係数(μL/μL) (1)
希釈係数は、アッセイ体積(μL)を試料貯蔵体積(μL)で割ることにより得られる。
Cen(μg/ml)=A260×OD260単位(μg/mL)×希釈係数(μL/μL) (1)
希釈係数は、アッセイ体積(μL)を試料貯蔵体積(μL)で割ることにより得られる。
封入効率(%)=[Cen/Cinitial]×100 (2)
Cenは、精製後にナノ粒子懸濁液に封入された核酸(即ち、LNAオリゴヌクレオチド)の濃度であり、Cinitialは、ナノ粒子懸濁液の形成前の最初の核酸(LNAオリゴヌクレオチド)の濃度である。
Cenは、精製後にナノ粒子懸濁液に封入された核酸(即ち、LNAオリゴヌクレオチド)の濃度であり、Cinitialは、ナノ粒子懸濁液の形成前の最初の核酸(LNAオリゴヌクレオチド)の濃度である。
pH7.4及び37℃でのナノ粒子の安定性
本発明に従って調製したナノ粒子の安定性をpH7.4で評価した。ナノ粒子の安定性は、構造的完全性をPBS緩衝液中で37℃にて経時的に保持するその能力として定義された。ナノ粒子のコロイド安定性を、平均径の変化を経時的にモニターすることにより評価した。2〜10%の放出可能ポリマー脂質(化合物10)を含有するナノ粒子を、10mM PBS緩衝液(138 mM NaCl、2.7 mM KCl、pH 7.4)中に分散させ、37℃にて貯蔵した。所与の時間で、懸濁液約20〜50μLを取り出し、純水で最大2mLまで希釈した。ナノ粒子の大きさを25℃にてDLSで測定した。結果は、2〜10%で化合物10を含有するナノ粒子が、貯蔵、配合及び正常な体液の条件に匹敵するpH7.4で安定であることを示している。結果を図12に示す。
本発明に従って調製したナノ粒子の安定性をpH7.4で評価した。ナノ粒子の安定性は、構造的完全性をPBS緩衝液中で37℃にて経時的に保持するその能力として定義された。ナノ粒子のコロイド安定性を、平均径の変化を経時的にモニターすることにより評価した。2〜10%の放出可能ポリマー脂質(化合物10)を含有するナノ粒子を、10mM PBS緩衝液(138 mM NaCl、2.7 mM KCl、pH 7.4)中に分散させ、37℃にて貯蔵した。所与の時間で、懸濁液約20〜50μLを取り出し、純水で最大2mLまで希釈した。ナノ粒子の大きさを25℃にてDLSで測定した。結果は、2〜10%で化合物10を含有するナノ粒子が、貯蔵、配合及び正常な体液の条件に匹敵するpH7.4で安定であることを示している。結果を図12に示す。
酸性pHでのナノ粒子安定性
ナノ粒子の安定性を酸性環境で評価した。2%若しくは5%の放出可能ポリマー脂質(化合物10)又は2%の永久結合したポリマー脂質(化合物52)を含有するナノ粒子の大きさの変化をpH6.5及び5.5で測定した。2%又は5%の放出可能ポリマー脂質(化合物10)を含有するナノ粒子は、永久結合したポリマー脂質(化合物52)を含有するナノ粒子と比較して、酸性pH5.5で有意に分解された。永久結合したポリマー脂質を含有するナノ粒子は、pH5.5で非常に安定であった。結果を図13に示した。結果は、本発明の放出可能ポリマー脂質を含有するナノ粒子が、腫瘍及びエンドソーム等の酸性環境において封入された活性薬剤の放出を促進することを示している。ナノ粒子は、エンドソームを破壊/破裂させ、封入された核酸の細胞質中への放出を促進することができる。本発明に従って調製したナノ粒子と比較したとき、永久結合したポリマー脂質を含有するナノ粒子中に封入された核酸は補足され、利用できなかった。結果は、本発明に従って調製したナノ粒子により、標的領域で治療薬のバイオアベイラビリティーを増加させる手段がもたらされることを示している。
ナノ粒子の安定性を酸性環境で評価した。2%若しくは5%の放出可能ポリマー脂質(化合物10)又は2%の永久結合したポリマー脂質(化合物52)を含有するナノ粒子の大きさの変化をpH6.5及び5.5で測定した。2%又は5%の放出可能ポリマー脂質(化合物10)を含有するナノ粒子は、永久結合したポリマー脂質(化合物52)を含有するナノ粒子と比較して、酸性pH5.5で有意に分解された。永久結合したポリマー脂質を含有するナノ粒子は、pH5.5で非常に安定であった。結果を図13に示した。結果は、本発明の放出可能ポリマー脂質を含有するナノ粒子が、腫瘍及びエンドソーム等の酸性環境において封入された活性薬剤の放出を促進することを示している。ナノ粒子は、エンドソームを破壊/破裂させ、封入された核酸の細胞質中への放出を促進することができる。本発明に従って調製したナノ粒子と比較したとき、永久結合したポリマー脂質を含有するナノ粒子中に封入された核酸は補足され、利用できなかった。結果は、本発明に従って調製したナノ粒子により、標的領域で治療薬のバイオアベイラビリティーを増加させる手段がもたらされることを示している。
マウス血漿中のナノ粒子の安定性
放出可能ポリマー脂質(化合物10)を含有するナノ粒子の安定性をマウス血漿中で評価した。結果は、37℃でのマウス血漿中のナノ粒子の半減期が約17.95時間であったことを示している。pH7.4及び5.5の緩衝液中のナノ粒子の半減期は各々31.05時間及び0.59時間であった。結果を図14に示す。結果は、本発明によるナノ粒子が、体内で循環し、標的領域に核酸を送達するのに十分に生理的条件下で安定であることを示している。pH5.5の緩衝液中の非常に短い半減期は、生理的pHにおいて安定なナノ粒子が、癌細胞及びエンドソーム等の酸性環境において急速に分解し、封入された核酸の放出が標的領域において促進されることを示している。
放出可能ポリマー脂質(化合物10)を含有するナノ粒子の安定性をマウス血漿中で評価した。結果は、37℃でのマウス血漿中のナノ粒子の半減期が約17.95時間であったことを示している。pH7.4及び5.5の緩衝液中のナノ粒子の半減期は各々31.05時間及び0.59時間であった。結果を図14に示す。結果は、本発明によるナノ粒子が、体内で循環し、標的領域に核酸を送達するのに十分に生理的条件下で安定であることを示している。pH5.5の緩衝液中の非常に短い半減期は、生理的pHにおいて安定なナノ粒子が、癌細胞及びエンドソーム等の酸性環境において急速に分解し、封入された核酸の放出が標的領域において促進されることを示している。
核酸の細胞取込み及び細胞質内局在に対する効果
核酸の細胞取込み及び細胞質内局在に対する本明細書に記載の化合物の効果を、細胞で評価した。癌細胞を2%の放出可能ポリマー脂質(化合物10)又は2%の永久結合したポリマー脂質(化合物52)を含有するナノ粒子で処理した。細胞を洗浄し、染色し、固定させた。試料を蛍光顕微鏡下で検査した。処理した細胞試料の蛍光画像を図15に示す。画像において、オリゴヌクレオチドは、放出可能ポリマー脂質を含有するナノ粒子で処理した細胞のサイトゾル及び核中に示されている。オリゴヌクレオチドは、エンドソームから放出され、細胞質内に分散された。画像は、永久結合したポリマー脂質を含有するナノ粒子が、核酸を核に送達する証拠を示さなかったことを示している。結果は、放出可能ポリマー脂質を含有するナノ粒子が、治療用核酸を細胞に送達し、それを細胞内の細胞コンパートメント、細胞質領域及び核に局在するための効果的な手段であることを示している。
核酸の細胞取込み及び細胞質内局在に対する本明細書に記載の化合物の効果を、細胞で評価した。癌細胞を2%の放出可能ポリマー脂質(化合物10)又は2%の永久結合したポリマー脂質(化合物52)を含有するナノ粒子で処理した。細胞を洗浄し、染色し、固定させた。試料を蛍光顕微鏡下で検査した。処理した細胞試料の蛍光画像を図15に示す。画像において、オリゴヌクレオチドは、放出可能ポリマー脂質を含有するナノ粒子で処理した細胞のサイトゾル及び核中に示されている。オリゴヌクレオチドは、エンドソームから放出され、細胞質内に分散された。画像は、永久結合したポリマー脂質を含有するナノ粒子が、核酸を核に送達する証拠を示さなかったことを示している。結果は、放出可能ポリマー脂質を含有するナノ粒子が、治療用核酸を細胞に送達し、それを細胞内の細胞コンパートメント、細胞質領域及び核に局在するための効果的な手段であることを示している。
インビトロでの標的遺伝子発現の調節に対する放出可能ポリマー脂質の量の増加の効果
標的遺伝子の調節に対する放出可能ポリマー脂質の量の効果を、ヒト前立腺癌細胞(15PC3)を用いて評価した。様々な量の放出可能ポリマー脂質(化合物10)を有するナノ粒子組成物を表6に要約する。アンチセンスErbB3オリゴヌクレオチド(配列番号6)をナノ粒子中に封入した。
標的遺伝子の調節に対する放出可能ポリマー脂質の量の効果を、ヒト前立腺癌細胞(15PC3)を用いて評価した。様々な量の放出可能ポリマー脂質(化合物10)を有するナノ粒子組成物を表6に要約する。アンチセンスErbB3オリゴヌクレオチド(配列番号6)をナノ粒子中に封入した。
結果は、最大10%の放出可能ポリマー脂質を含むナノ粒子がErbB3 mRNAの発現を抑制したことを示した。結果を図16に示す。永久結合したポリマー脂質の量が、2%から5%に増加したとき、永久結合したポリマー脂質を含有するナノ粒子は、標的遺伝子発現の調節に対する有効性を失った。(データは図示せず)。ナノ粒子が多量のポリマー脂質を含有していた場合、封入された核酸は、永久結合したポリマー脂質を含有するナノ粒子から放出されなかった。結果は、本発明により、ナノ粒子は、永久結合したポリマー脂質を含むナノ粒子と比較して、所望される場合、多量のポリマー脂質を含むことができることを示している。ポリマー脂質は、輸送系の循環を延長し、身体からの早期排泄を低減するため有利である。
ヒト前立腺癌細胞におけるインビトロでのBCL2 mRNAのダウンレギュレーション
標的遺伝子発現の調節に対する本明細書に記載の化合物の効果を、ヒト前立腺癌細胞(15PC3)で評価する。細胞を実施例51の表5に記載されているようにNP1、NP2及びNP3組成物を用いて調製したナノ粒子で処理した。ナノ粒子はアンチセンスBCL2 siRNAオリゴマー(配列番号2及び3)を含有していた。細胞を、スクランブルオリゴヌクレオチドを有するナノ粒子、オリゴヌクレオチドなしの空ナノ粒子又は裸のsiRNAでも処理した。結果は、2%、5%及び8%の放出可能ポリマー脂質を含有するナノ粒子中に封入されたアンチセンスsiRNAオリゴマーがBCL2遺伝子の発現を抑制したことを示している。抑制は濃度依存的であった。結果を図17に示す。
標的遺伝子発現の調節に対する本明細書に記載の化合物の効果を、ヒト前立腺癌細胞(15PC3)で評価する。細胞を実施例51の表5に記載されているようにNP1、NP2及びNP3組成物を用いて調製したナノ粒子で処理した。ナノ粒子はアンチセンスBCL2 siRNAオリゴマー(配列番号2及び3)を含有していた。細胞を、スクランブルオリゴヌクレオチドを有するナノ粒子、オリゴヌクレオチドなしの空ナノ粒子又は裸のsiRNAでも処理した。結果は、2%、5%及び8%の放出可能ポリマー脂質を含有するナノ粒子中に封入されたアンチセンスsiRNAオリゴマーがBCL2遺伝子の発現を抑制したことを示している。抑制は濃度依存的であった。結果を図17に示す。
ヒト肺癌細胞におけるインビトロでのBCL2 mRNAのダウンレギュレーション
標的遺伝子発現の調節に対する本明細書に記載の化合物の効果を、ヒト肺癌細胞(A549)で評価する。細胞を、アンチセンスBCL2 siRNAオリゴマー(配列番号2及び3)を含有するナノ粒子で処理した。ナノ粒子は2%、5%又は8%の放出可能ポリマー脂質(化合物10)を含有していた。細胞を、スクランブルオリゴヌクレオチドを有するナノ粒子又は裸のsiRNAでも処理した。結果は、放出可能ポリマー脂質を含有するナノ粒子中に封入されたアンチセンスBCL2 siRNAオリゴマーがBCL2遺伝子の発現を抑制したことを示した。抑制は、標的配列特異的及び用量依存的であった。結果を図18に示す。
標的遺伝子発現の調節に対する本明細書に記載の化合物の効果を、ヒト肺癌細胞(A549)で評価する。細胞を、アンチセンスBCL2 siRNAオリゴマー(配列番号2及び3)を含有するナノ粒子で処理した。ナノ粒子は2%、5%又は8%の放出可能ポリマー脂質(化合物10)を含有していた。細胞を、スクランブルオリゴヌクレオチドを有するナノ粒子又は裸のsiRNAでも処理した。結果は、放出可能ポリマー脂質を含有するナノ粒子中に封入されたアンチセンスBCL2 siRNAオリゴマーがBCL2遺伝子の発現を抑制したことを示した。抑制は、標的配列特異的及び用量依存的であった。結果を図18に示す。
ヒト前立腺癌細胞におけるインビトロでのErbB3 mRNAのダウンレギュレーション
標的遺伝子発現の調節に対する本明細書に記載の化合物の効果を、ヒト前立腺癌細胞(DU149)で評価する。細胞を、アンチセンスErbB2オリゴマー(配列番号6)を含有するナノ粒子で処理した。アンチセンスオリゴマーは、LNA及びホスホロジエステル結合等の修飾核酸を含む。ナノ粒子は、標的基であるアニサミドで修飾した放出可能ポリマー脂質(化合物38)を含有していた。細胞を、アニサミドを含む5%若しくは10%の放出可能ポリマー脂質(化合物38)又はアニサミドを含まない5%若しくは10%の放出可能ポリマー脂質(化合物10):18%カチオン性脂質1:20%コレステロール:57%DOPE:5%化合物10若しくは38の混合物、又は18%カチオン性脂質1:20%コレステロール:52%DOPE:10%化合物10若しくは38の混合物を含むナノ粒子で処理した。結果は、放出可能ポリマー脂質を含有するナノ粒子中に封入されたアンチセンスErbB3オリゴマーが標的遺伝子の発現を抑制したことを示した。抑制は標的配列特異的であり、用量依存的であった。結果を図19に示す。
標的遺伝子発現の調節に対する本明細書に記載の化合物の効果を、ヒト前立腺癌細胞(DU149)で評価する。細胞を、アンチセンスErbB2オリゴマー(配列番号6)を含有するナノ粒子で処理した。アンチセンスオリゴマーは、LNA及びホスホロジエステル結合等の修飾核酸を含む。ナノ粒子は、標的基であるアニサミドで修飾した放出可能ポリマー脂質(化合物38)を含有していた。細胞を、アニサミドを含む5%若しくは10%の放出可能ポリマー脂質(化合物38)又はアニサミドを含まない5%若しくは10%の放出可能ポリマー脂質(化合物10):18%カチオン性脂質1:20%コレステロール:57%DOPE:5%化合物10若しくは38の混合物、又は18%カチオン性脂質1:20%コレステロール:52%DOPE:10%化合物10若しくは38の混合物を含むナノ粒子で処理した。結果は、放出可能ポリマー脂質を含有するナノ粒子中に封入されたアンチセンスErbB3オリゴマーが標的遺伝子の発現を抑制したことを示した。抑制は標的配列特異的であり、用量依存的であった。結果を図19に示す。
インビトロでの標的遺伝子発現の調節に対する効果
標的遺伝子発現の調節に対する本明細書に記載のナノ粒子の効果を、表皮癌細胞(A431)、前立腺癌細胞(15PC3、LNCaP、PC3、CWR22)、肺癌細胞(A549、HCC827又はH1581)、乳癌細胞(SKBR3)、結腸癌細胞(SW480)、膵臓癌細胞(BxPC3)、胃癌細胞(N87)及び黒色腫(518A2)を含む、幾つかの異なる癌細胞で評価する。細胞は、化合物10(オリゴ2又はスクランブル配列のオリゴ3)を含有するナノ粒子で処理される。処理後、ヒトErbB3等の標的遺伝子及びGAPDH等のハウスキーピング遺伝子の細胞内mRNA量をRT-qPCRで定量する。GAPDHの発現レベルまで正規化したmRNAの発現レベルを比較する。また、mRNAのダウンレギュレーションデータを確認するために、細胞からのタンパク質レベルをWestern Blot法によりオリゴ-2とオリゴ-3の両方の複合体を用いて分析した。
標的遺伝子発現の調節に対する本明細書に記載のナノ粒子の効果を、表皮癌細胞(A431)、前立腺癌細胞(15PC3、LNCaP、PC3、CWR22)、肺癌細胞(A549、HCC827又はH1581)、乳癌細胞(SKBR3)、結腸癌細胞(SW480)、膵臓癌細胞(BxPC3)、胃癌細胞(N87)及び黒色腫(518A2)を含む、幾つかの異なる癌細胞で評価する。細胞は、化合物10(オリゴ2又はスクランブル配列のオリゴ3)を含有するナノ粒子で処理される。処理後、ヒトErbB3等の標的遺伝子及びGAPDH等のハウスキーピング遺伝子の細胞内mRNA量をRT-qPCRで定量する。GAPDHの発現レベルまで正規化したmRNAの発現レベルを比較する。また、mRNAのダウンレギュレーションデータを確認するために、細胞からのタンパク質レベルをWestern Blot法によりオリゴ-2とオリゴ-3の両方の複合体を用いて分析した。
インビボでの標的遺伝子のダウンレギュレーションに対する効果
標的遺伝子発現のダウンレギュレーションに対する本明細書に記載のナノ粒子の効果を、ヒト癌細胞を異種移植したマウスで評価する。異種移植腫瘍を、ヒト癌細胞を注射することによりマウスに定着させる。15PC3ヒト前立腺腫瘍を、5×106細胞/マウスを右脇腹に皮下注射することによりヌードマウスに定着させる。腫瘍が約100mm3に達したとき、マウスを、静脈内(i.v.)(或いは、腹腔内)に化合物10又は38(オリゴ2を含む)を含有するナノ粒子で、又は60mg/kg/用量、45mg/kg/用量、30mg/kg/用量、25mg/kg/用量、15mg/kg/用量若しくは5mg/kg/用量(等量のオリゴ2)でq3d×4以上にて処理する。投与量は、ナノ粒子に含有されるオリゴヌクレオチドの量に基づくものである。マウスを最終投与の24時間後に屠殺する。血漿試料をマウスから採取し、-20℃で貯蔵する。腫瘍試料及び肝臓試料もマウスから採取する。mRNAのKDについて試料を分析する。
標的遺伝子発現のダウンレギュレーションに対する本明細書に記載のナノ粒子の効果を、ヒト癌細胞を異種移植したマウスで評価する。異種移植腫瘍を、ヒト癌細胞を注射することによりマウスに定着させる。15PC3ヒト前立腺腫瘍を、5×106細胞/マウスを右脇腹に皮下注射することによりヌードマウスに定着させる。腫瘍が約100mm3に達したとき、マウスを、静脈内(i.v.)(或いは、腹腔内)に化合物10又は38(オリゴ2を含む)を含有するナノ粒子で、又は60mg/kg/用量、45mg/kg/用量、30mg/kg/用量、25mg/kg/用量、15mg/kg/用量若しくは5mg/kg/用量(等量のオリゴ2)でq3d×4以上にて処理する。投与量は、ナノ粒子に含有されるオリゴヌクレオチドの量に基づくものである。マウスを最終投与の24時間後に屠殺する。血漿試料をマウスから採取し、-20℃で貯蔵する。腫瘍試料及び肝臓試料もマウスから採取する。mRNAのKDについて試料を分析する。
Claims (57)
- Mがケタール含有部分若しくはアセタール含有部分又はイミン含有部分である、請求項1に記載の化合物。
- Mが、-CR3R4-O-CR1R2-O-CR5R6-
[式中、
R1〜2は水素、C1〜6アルキル、C2〜6アルケニル、C2〜6アルキニル、C3〜19分岐アルキル、C3〜8シクロアルキル、C1〜6置換アルキル、C2〜6置換アルケニル、C2〜6置換アルキニル、C3〜8置換シクロアルキル、アリール、置換アリール、ヘテロアリール、置換ヘテロアリール、C1〜6ヘテロアルキル、置換C1〜6ヘテロアルキル、C1〜6アルコキシ、アリールオキシ、C1〜6ヘテロアルコキシ、ヘテロアリールオキシ、C2〜6アルカノイル、アリールカルボニル、C2〜6アルコキシカルボニル、アリールオキシカルボニル、C2〜6アルカノイルオキシ、アリールカルボニルオキシ、C2〜6置換アルカノイル、置換アリールカルボニル、C2〜6置換アルカノイルオキシ、置換アリールオキシカルボニル及び置換アリールカルボニルオキシからなる群から独立に選択され、
R3〜6は水素、アミン、置換アミン、アジド、カルボキシ、シアノ、ハロ、ヒドロキシル、ニトロ、シリルエーテル、スルホニル、メルカプト、C1〜6アルキルメルカプト、アリールメルカプト、置換アリールメルカプト、置換C1〜6アルキルチオ、C1〜6アルキル、C2〜6アルケニル、C2〜6アルキニル、C3〜19分岐アルキル、C3〜8シクロアルキル、C1〜6置換アルキル、C2〜6置換アルケニル、C2〜6置換アルキニル、C3〜8置換シクロアルキル、アリール、置換アリール、ヘテロアリール、置換ヘテロアリール、C1〜6ヘテロアルキル、置換C1〜6ヘテロアルキル、C1〜6アルコキシ、アリールオキシ、C1〜6ヘテロアルコキシ、ヘテロアリールオキシ、C2〜6アルカノイル、アリールカルボニル、C2〜6アルコキシカルボニル、アリールオキシカルボニル、C2〜6アルカノイルオキシ、アリールカルボニルオキシ、C2〜6置換アルカノイル、置換アリールカルボニル、C2〜6置換アルカノイルオキシ、置換アリールオキシカルボニル及び置換アリールカルボニルオキシからなる群から独立に選択される]
である、請求項1に記載の化合物。 - R1及びR2が水素、C1〜6アルキル、C3〜8分岐アルキル、C3〜8シクロアルキル、C1〜6置換アルキル、C3〜8置換シクロアルキル、アリール、置換アリール及びアラルキルからなる群から独立に選択される、請求項3に記載の化合物。
- Mが-N=CR10-又は-CR10=N-(式中、R10は水素、C1〜6アルキル、C3〜8分岐アルキル、C3〜8シクロアルキル、C1〜6置換アルキル、C3〜8置換シクロアルキル、アリール及び置換アリールである)である、請求項1に記載の化合物。
- Rがポリアルキレンオキシドである、請求項1に記載の化合物。
- Rがポリエチレングリコールである、請求項1に記載の化合物。
- Qが式(Ia)の構造:
Y1及びY'1は独立にO、S又はNR31であり、
(c)は0又は1であり、
(d)は0又は正の整数であり、
(e)は0又は1であり、
XはC、N又はPであり、
Q1はH、C1〜3アルキル、NR32、OH又は
Q2はH、C1〜3アルキル、NR33、OH又は
Q3は孤立電子対、(=O)、H、C1〜3アルキル、NR34、OH又は
但し、
(i)XがCであるとき、Q3は孤立電子対又は(=O)ではなく、
(ii)XがNであるとき、Q3は孤立電子対であり、
(iii)XがPであるとき、Q3は(=O)であり、(e)は0であり、
L11、L12及びL13は独立に選択される二官能性スペーサーであり、
Y11、Y'11、Y12、Y'12、Y13及びY'13は独立にO、S又はNR35であり、
R11、R12及びR13は独立に飽和又は不飽和のC4〜30であり、
(f1)、(f2)及び(f3)は独立に0又は1であり、
(g1)、(g2)及び(g3)は独立に0又は1であり、
(h1)、(h2)及び(h3)は独立に又は1であり、
R7〜8は水素、ヒドロキシル、アミン、置換アミン、C1〜6アルキル、C2〜6アルケニル、C2〜6アルキニル、C3〜19分岐アルキル、C3〜8シクロアルキル、C1〜6置換アルキル、C2〜6置換アルケニル、C2〜6置換アルキニル、C3〜8置換シクロアルキル、アリール、置換アリール、ヘテロアリール、置換ヘテロアリール、C1〜6ヘテロアルキル及び置換C1〜6ヘテロアルキルから独立に選択され、
R31〜35は水素、C1〜6アルキル、C2〜6アルケニル、C2〜6アルキニル、C3〜19分岐アルキル、C3〜8シクロアルキル、C1〜6置換アルキル、C2〜6置換アルケニル、C2〜6置換アルキニル、C3〜8置換シクロアルキル、アリール、置換アリール、ヘテロアリール、置換ヘテロアリール、C1〜6ヘテロアルキル及び置換C1〜6ヘテロアルキルから独立に選択されるが、
但し、QはR11、R12及びR13の少なくとも一つ又は二つを含む]
を有する、請求項1に記載の化合物。 - Q1〜3が独立にC12〜22アルキル、C12〜22アルケニル、C12〜22アルキルオキシ、ラウロイル(C12)、ミリストイル(C14)、パルミトイル(C16)、ステアロイル(C18)、オレオイル(C18)及びエルコイル(C22);飽和又は不飽和のC12アルキルオキシ、C14アルキルオキシ、C16アルキルオキシ、C18アルキルオキシ、C20アルキルオキシ及びC22アルキルオキシ;並びに飽和又は不飽和のC12アルキル、C14アルキル、C16アルキル、C18アルキル、C20アルキル及びC22アルキルから選択される基を含む、請求項8に記載の化合物。
- L11、L12及びL13が、
-(CR31R32)q1-;及び
-Y26(CR31R32)q1-
[式中、
Y26はO、NR33又はSであり、
R31〜32は水素、ヒドロキシル、C1〜6アルキル、C3〜12分岐アルキル、C3〜8シクロアルキル、C1〜6置換アルキル、C3〜8置換シクロアルキル、C1〜6ヘテロアルキル、置換C1〜6ヘテロアルキル、C1〜6アルコキシ、フェノキシ及びC1〜6ヘテロアルコキシからなる群から独立に選択され、
R33は水素、C1〜6アルキル、C3〜12分岐アルキル、C3〜8シクロアルキル、C1〜6置換アルキル、C3〜8置換シクロアルキル、C1〜6ヘテロアルキル、置換C1〜6ヘテロアルキル、C1〜6アルコキシ、フェノキシ及びC1〜6ヘテロアルコキシからなる群から選択され、
(q1)は0又は正の整数である]
からなる群から独立に選択される、請求項8に記載の化合物。 - L11、L12及びL13が-CH2-、-(CH2)2-、-(CH2)3-、-(CH2)4-、-(CH2)5-、-(CH2)6-、-O(CH2)2-、-O(CH2)3-、-O(CH2)4-、-O(CH2)5-、-O(CH2)6-及びCH(OH)-からなる群から独立に選択される、請求項8に記載の化合物。
- L1が、
-(CR21R22)t1-[C(=Y16)]a3-、
-(CR21R22)t1Y17-(CR23R24)t2-(Y18)a2-[C(=Y16)]a3-、
-(CR21R22CR23R24Y17)t1-[C(=Y16)]a3-、
-(CR21R22CR23R24Y17)t1(CR25R26)t4-(Y18)a2-[C(=Y16)]a3-、
-[(CR21R22CR23R24)t2Y17]t3(CR25R26)t4-(Y18)a2-[C(=Y16)]a3-、
-(CR21R22)t1-[(CR23R24)t2Y17]t3(CR25R26)t4-(Y18)a2-[C(=Y16)]a3-、
-(CR21R22)t1(Y17)a2[C(=Y16)]a3(CR23R24)t2-、
-(CR21R22)t1(Y17)a2[C(=Y16)]a3Y14(CR23R24)t2-、
-(CR21R22)t1(Y17)a2[C(=Y16)]a3(CR23R24)t2-Y15-(CR23R24)t3-、
-(CR21R22)t1(Y17)a2[C(=Y16)]a3Y14(CR23R24)t2-Y15-(CR23R24)t3-、
-(CR21R22)t1(Y17)a2[C(=Y16)]a3(CR23R24CR25R26Y19)t2(CR27CR28)t3-、
-(CR21R22)t1(Y17)a2[C(=Y16)]a3Y14(CR23R24CR25R26Y19)t2(CR27CR28)t3-、及び
Y16はO、NR28又はSであり、
Y14〜15及びY17〜19は独立にO、NR29又はSであり、
R21〜27は水素、ヒドロキシル、アミン、C1〜6アルキル、C3〜12分岐アルキル、C3〜8シクロアルキル、C1〜6置換アルキル、C3〜8置換シクロアルキル、アリール、置換アリール、アラルキル、C1〜6ヘテロアルキル、置換C1〜6ヘテロアルキル、C1〜6アルコキシ、フェノキシ及びC1〜6ヘテロアルコキシからなる群から独立に選択され、
R28〜29は水素、C1〜6アルキル、C3〜12分岐アルキル、C3〜8シクロアルキル、C1〜6置換アルキル、C3〜8置換シクロアルキル、アリール、置換アリール、アラルキル、C1〜6ヘテロアルキル、置換C1〜6ヘテロアルキル、C1〜6アルコキシ、フェノキシ及びC1〜6ヘテロアルコキシからなる群から独立に選択され、
(t1)、(t2)、(t3)及び(t4)は独立に0又は正の整数であり、
(a2)及び(a3)は独立に0又は1である]
からなる群から選択される、請求項1に記載の化合物。 - L1が、
-CH2-、-(CH2)2-、-(CH2)3-、-(CH2)4-、-(CH2)5-、-(CH2)6-、-NH(CH2)-、
-CH(NH2)CH2-、
-(CH2)4-C(=O)-、-(CH2)5-C(=O)-、-(CH2)6-C(=O)-、-NH(CH2)-
-CH2CH2O-CH2O-C(=O)-、
-(CH2CH2O)2-CH2O-C(=O)-、
-(CH2CH2O)3-CH2O-C(=O)-、
-(CH2CH2O)2-C(=O)-、
-CH2CH2O-CH2CH2NH-C(=O)-、
-(CH2CH2O)2-CH2CH2NH-C(=O)-、
-CH2-O-CH2CH2O-CH2CH2NH-C(=O)-、
-CH2-O-(CH2CH2O)2-CH2CH2NH-C(=O)-、
-CH2-O-CH2CH2O-CH2C(=O)-、
-CH2-O-(CH2CH2O)2-CH2C(=O)-、
-(CH2)4-C(=O)NH-、-(CH2)5-C(=O)NH-、
-(CH2)6-C(=O)NH-、
-CH2CH2O-CH2O-C(=O)-NH-、
-(CH2CH2O)2-CH2O-C(=O)-NH-、
-(CH2CH2O)3-CH2O-C(=O)-NH-、
-(CH2CH2O)2-C(=O)-NH-、
-CH2CH2O-CH2CH2NH-C(=O)-NH-、
-(CH2CH2O)2-CH2CH2NH-C(=O)-NH-、
-CH2-O-CH2CH2O-CH2CH2NH-C(=O)-NH-、
-CH2-O-(CH2CH2O)2-CH2CH2NH-C(=O)-NH-、
-CH2-O-CH2CH2O-CH2C(=O)-NH-、
-CH2-O-(CH2CH2O)2-CH2C(=O)-NH-、
-(CH2CH2O)2-、-CH2CH2O-CH2O-、
-(CH2CH2O)2-CH2CH2NH-、
-(CH2CH2O)3-CH2CH2NH-、
-CH2CH2O-CH2CH2NH-、
-(CH2CH2O)2-CH2CH2NH-、
-CH2-O-CH2CH2O-CH2CH2NH-、
-CH2-O-(CH2CH2O)2-CH2CH2NH-、
-CH2-O-CH2CH2O-、
-CH2-O-(CH2CH2O)2-、
-C(=O)NH(CH2)3-、-CH2C(=O)NH(CH2)3-、
-C(=O)NH(CH2)4-、-CH2C(=O)NH(CH2)4-、
-C(=O)NH(CH2)5-、-CH2C(=O)NH(CH2)5-、
-C(=O)NH(CH2)6-、-CH2C(=O)NH(CH2)6-、
-C(=O)O(CH2)2-、-CH2C(=O)O(CH2)2-、
-C(=O)O(CH2)3-、-CH2C(=O)O(CH2)3-、
-C(=O)O(CH2)4-、-CH2C(=O)O(CH2)4-、
-C(=O)O(CH2)5-、-CH2C(=O)O(CH2)5-、
-C(=O)O(CH2)6-、-CH2C(=O)O(CH2)6-、
-(CH2CH2)2NHC(=O)NH(CH2)2-、
-(CH2CH2)2NHC(=O)NH(CH2)3-、
-(CH2CH2)2NHC(=O)NH(CH2)4-、
-(CH2CH2)2NHC(=O)NH(CH2)5-、
-(CH2CH2)2NHC(=O)NH(CH2)6-、
-(CH2CH2)2NHC(=O)O(CH2)2-、
-(CH2CH2)2NHC(=O)O(CH2)3-、
-(CH2CH2)2NHC(=O)O(CH2)4-、
-(CH2CH2)2NHC(=O)O(CH2)5-、
-(CH2CH2)2NHC(=O)O(CH2)6-、
-(CH2CH2)2NHC(=O)(CH2)2-、
-(CH2CH2)2NHC(=O)(CH2)3-、
-(CH2CH2)2NHC(=O)(CH2)4-、
-(CH2CH2)2NHC(=O)(CH2)5-、及び
-(CH2CH2)2NHC(=O)(CH2)6-
からなる群から選択される、請求項1に記載の化合物。 - L2が、
-(CR'21R'22)t'1-[C(=Y'16)]a'3(CR'27CR'28)t'2-、
-(CR'21R'22)t'1Y'14-(CR'23R'24)t'2-(Y'15)a'2-[C(=Y'16)]a'3(CR'27CR'28)t'3-、
-(CR'21R'22CR'23R'24Y'14)t'1-[C(=Y'16)]a'3(CR'27CR'28)t'2-、
-(CR'21R'22CR'23R'24Y'14)t'1(CR'25R'26)t'2-(Y'15)a'2-[C(=Y'16)]a'3(CR'27CR'28)t'3-、
-[(CR'21R'22CR'23R'24)t'2Y'14]t'1(CR'25R'26)t'2-(Y'15)a'2-[C(=Y'16)]a'3(CR'27CR'28)t'3-、
-(CR'21R'22)t'1-[(CR'23R'24)t'2Y'14]t'2(CR'25R'26)t'3-(Y'15)a'2-[C(=Y'16)]a'3(CR'27CR'28)t'4-
-(CR'21R'22)t'1(Y'14)a'2[C(=Y'16)]a'3(CR'23R'24)t'2-、
-(CR'21R'22)t'1(Y'14)a'2[C(=Y'16)]a'3Y'15(CR'23R'24)t'2-、
-(CR'21R'22)t'1(Y'14)a'2[C(=Y'16)]a'3(CR'23R'24)t'2-Y'15-(CR'23R'24)t'3-、
-(CR'21R'22)t'1(Y'14)a'2[C(=Y'16)]a'3Y'14(CR'23R'24)t'2-Y'15-(CR'23R'24)t'3-、
-(CR'21R'22)t'1(Y'14)a'2[C(=Y'16)]a'3(CR'23R'24CR'25R'26Y'15)t'2(CR'27CR'28)t'3-、
-(CR'21R'22)t'1(Y'14)a'2[C(=Y'16)]a'3Y'17(CR'23R'24CR'25R'26Y'15)t'2(CR'27CR'28)t'3-、及び
Y'16はO、NR'28又はSであり、
Y'14〜15及びY'17は独立にO、NR'29又はSであり、
R'21〜27は水素、ヒドロキシル、アミン、C1〜6アルキル、C3〜12分岐アルキル、C3〜8シクロアルキル、C1〜6置換アルキル、C3〜8置換シクロアルキル、アリール、置換アリール、アラルキル、C1〜6ヘテロアルキル、置換C1〜6ヘテロアルキル、C1〜6アルコキシ、フェノキシ及びC1〜6ヘテロアルコキシからなる群から独立に選択され、
R'28〜29は水素、C1〜6アルキル、C3〜12分岐アルキル、C3〜8シクロアルキル、C1〜6置換アルキル、C3〜8置換シクロアルキル、アリール、置換アリール、アラルキル、C1〜6ヘテロアルキル、置換C1〜6ヘテロアルキル、C1〜6アルコキシ、フェノキシ及びC1〜6ヘテロアルコキシからなる群から独立に選択され、
(t'1)、(t'2)、(t'3)及び(t'4)は独立に0又は正の整数であり、
(a'2)及び(a'3)は独立に0又は1である]
からなる群から選択される、請求項1に記載の化合物。 - L2が、
-CH2-、-(CH2)2-、-(CH2)3-、-(CH2)4-、-(CH2)5-、-(CH2)6-、-NH(CH2)-
-CH(NH2)CH2-、
-O(CH2)2-、-C(=O)O(CH2)3-、-C(=O)NH(CH2)3-、
-C(=O)(CH2)2-、-C(=O)(CH2)3-、
-CH2-C(=O)-O(CH2)3-、
-CH2-C(=O)-NH(CH2)3-、
-CH2-OC(=O)-O(CH2)3-、
-CH2-OC(=O)-NH(CH2)3-、
-(CH2)2-C(=O)-O(CH2)3-、
-(CH2)2-C(=O)-NH(CH2)3-、
-CH2C(=O)O(CH2)2-O-(CH2)2-、
-CH2C(=O)NH(CH2)2-O-(CH2)2-、
-(CH2)2C(=O)O(CH2)2-O-(CH2)2-、
-(CH2)2C(=O)NH(CH2)2-O-(CH2)2-、
-CH2C(=O)O(CH2CH2O)2CH2CH2-、
-(CH2)2C(=O)O(CH2CH2O)2CH2CH2-、
-(CH2CH2O)2-、-CH2CH2O-CH2O-.
-(CH2CH2O)2-CH2CH2NH-、-(CH2CH2O)3-CH2CH2NH-、
-CH2CH2O-CH2CH2NH-、
-CH2-O-CH2CH2O-CH2CH2NH-、
-CH2-O-(CH2CH2O)2-CH2CH2NH-、
-CH2-O-CH2CH2O-、-CH2-O-(CH2CH2O)2-、
-C(=O)NH(CH2)2-、-CH2C(=O)NH(CH2)2-、
-C(=O)NH(CH2)3-、-CH2C(=O)NH(CH2)3-、
-C(=O)NH(CH2)4-、-CH2C(=O)NH(CH2)4-、
-C(=O)NH(CH2)5-、-CH2C(=O)NH(CH2)5-、
-C(=O)NH(CH2)6-、-CH2C(=O)NH(CH2)6-、
-C(=O)O(CH2)2-、-CH2C(=O)O(CH2)2-、
-C(=O)O(CH2)3-、-CH2C(=O)O(CH2)3-、
-C(=O)O(CH2)4-、-CH2C(=O)O(CH2)4-、
-C(=O)O(CH2)5-、-CH2C(=O)O(CH2)5-、
-C(=O)O(CH2)6-、-CH2C(=O)O(CH2)6-、
-(CH2CH2)2NHC(=O)NH(CH2)2-、
-(CH2CH2)2NHC(=O)NH(CH2)3-、
-(CH2CH2)2NHC(=O)NH(CH2)4-、
-(CH2CH2)2NHC(=O)NH(CH2)5-、
-(CH2CH2)2NHC(=O)NH(CH2)6-、
-(CH2CH2)2NHC(=O)O(CH2)2-、
-(CH2CH2)2NHC(=O)O(CH2)3-、
-(CH2CH2)2NHC(=O)O(CH2)4-、
-(CH2CH2)2NHC(=O)O(CH2)5-、
-(CH2CH2)2NHC(=O)O(CH2)6-、
-(CH2CH2)2NHC(=O)(CH2)2-、
-(CH2CH2)2NHC(=O)(CH2)3-、
-(CH2CH2)2NHC(=O)(CH2)4-、
-(CH2CH2)2NHC(=O)(CH2)5-、及び
-(CH2CH2)2NHC(=O)(CH2)6-
からなる群から選択される、請求項1に記載の化合物。 - 前記標的基が細胞表面標的基である、請求項21に記載の化合物。
- 前記標的基が、RGDペプチド、葉酸塩、アニサミド、血管内皮細胞増殖因子、FGF2、ソマトスタチン及びソマトスタチン類似体、トランスフェリン、メラノトロピン、ApoE及びApoEペプチド、フォンウィルブランド因子及びフォンウィルブランド因子ペプチド、アデノウイルスファイバータンパク質及びアデノウイルスファイバータンパク質ペプチド、PD1及びPD1ペプチド、EGF及びEGFペプチドからなる群から選択される、請求項21に記載の化合物。
- 請求項1に記載の式(I)の化合物を含む、ナノ粒子組成物。
- カチオン性脂質及び融合性脂質を更に含む、請求項28に記載のナノ粒子組成物。
- 前記融合性脂質が、DOPE、DOGP、POPC、DSPC、EPC及びそれらの組合せからなる群から選択される、請求項28に記載のナノ粒子組成物。
- コレステロールを更に含む、請求項28に記載のナノ粒子組成物。
- カチオン性脂質が、ナノ粒子組成物中に存在する総脂質の約10%〜約99.9%の範囲のモル比を有する、請求項28に記載のナノ粒子組成物。
- 前記カチオン性脂質が、ナノ粒子組成物中に存在する総脂質の約15%〜約25%の範囲のモル比を有する、請求項34に記載のナノ粒子組成物。
- カチオン性脂質と、非コレステロール系融合性脂質と、式(I)の化合物と、コレステロールとのモル比が、ナノ粒子組成物中に存在する総脂質の約15〜25%:20〜78%:0〜50%:2〜10%である、請求項33に記載のナノ粒子組成物。
- カチオン性脂質、ジアシルホスファチジルエタノールアミン、式(I)の化合物及びコレステロールの混合物、
カチオン性脂質、ジアシルホスファチジルコリン、式(I)の化合物及びコレステロールの混合物、
カチオン性脂質、ジアシルホスファチジルエタノールアミン、ジアシルホスファチジルコリン、式(I)の化合物及びコレステロールの混合物、並びに
カチオン性脂質、ジアシルホスファチジルエタノールアミン、式(I)の化合物、セラミドに結合したPEG(PEG-Cer)及びコレステロールの混合物
からなる群から選択される、請求項33に記載のナノ粒子組成物。 - 請求項28に記載のナノ粒子組成物中に封入された核酸を含むナノ粒子。
- 前記核酸が一本鎖又は二本鎖のオリゴヌクレオチドである、請求項39に記載のナノ粒子。
- 前記核酸がデオキシヌクレオチド、リボヌクレオチド、ロック核酸(LNA)、低分子干渉RNA(siRNA)、マイクロRNA(miRNA)、アプタマー、ペプチド核酸(PNA)、ホスホロジアミデートモルホリノオリゴヌクレオチド(PMO)、トリシクロ-DNA、二本鎖オリゴヌクレオチド(デコイODN)、触媒RNA(RNAi)、アプタマー、シュピーゲルマー、CpGオリゴマー及びそれらの組合せからなる群から選択される、請求項39に記載のナノ粒子。
- 前記オリゴヌクレオチドがアンチセンスオリゴヌクレオチドである、請求項40に記載のナノ粒子。
- 前記オリゴヌクレオチドが、ホスホジエステルホスホロチオエート結合、及びそれらの組合せを有する、請求項40に記載のナノ粒子。
- 前記オリゴヌクレオチドがLNAを含む、請求項40に記載のナノ粒子。
- 前記オリゴヌクレオチドが約8個〜50個のヌクレオチドを有する、請求項40に記載のナノ粒子。
- 前記オリゴヌクレオチドが、癌遺伝子、プロ血管新生経路遺伝子、プロ細胞増殖経路遺伝子、ウイルス感染因子遺伝子及びプロ炎症経路遺伝子の発現を抑制する、請求項40に記載のナノ粒子。
- 前記オリゴヌクレオチドが、アンチセンスbcl-2オリゴヌクレオチド、アンチセンスHIF-1αオリゴヌクレオチド、アンチセンススルビビンオリゴヌクレオチド、アンチセンスErbB3オリゴヌクレオチド、アンチセンスPIK3CAオリゴヌクレオチド、アンチセンスHSP27オリゴヌクレオチド、アンチセンスアンドロゲン受容体オリゴヌクレオチド、アンチセンスGli2オリゴヌクレオチド及びアンチセンスβカテニンオリゴヌクレオチドからなる群から選択される、請求項40に記載のナノ粒子。
- 前記オリゴヌクレオチドが、配列番号1、配列番号2及び3、配列番号3、配列番号4、配列番号5、配列番号6、配列番号7、配列番号7、配列番号8、配列番号9、配列番号10、配列番号11、配列番号12、配列番号13、配列番号14、配列番号15、配列番号16並びに配列番号17に示される8個以上の連続ヌクレオチドを含み、各核酸が、天然核酸又は修飾核酸である、請求項40に記載のナノ粒子。
- 前記核酸とカチオン性脂質との電荷比が約1:20〜約20:1の範囲である、請求項40に記載のナノ粒子。
- 前記ナノ粒子が、約50nm〜約150nmの範囲のサイズを有する、請求項40に記載のナノ粒子。
- 請求項39に記載のナノ粒子をそれを必要とする哺乳動物に投与することを含む、哺乳動物における疾患を治療する方法。
- 細胞と請求項39に記載のナノ粒子とを接触させることを含む、細胞にオリゴヌクレオチドを導入する方法。
- ヒト細胞又はヒト組織と請求項38に記載のナノ粒子とを接触させることを含む、ヒト細胞又はヒト組織における遺伝子発現を抑制する方法。
- 前記細胞又は組織が癌細胞又は癌組織である、請求項53に記載の方法。
- 有効量の請求項39に記載のナノ粒子をそれを必要とする哺乳動物に投与することを含む、哺乳動物における遺伝子発現をダウンレギュレートする方法。
- 癌細胞と請求項39に記載のナノ粒子とを接触させることを含む、癌細胞の増殖又は成長を抑制する方法。
- 抗癌剤を投与することを更に含む、請求項55に記載の方法。
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US11537908P | 2008-11-17 | 2008-11-17 | |
| US11537108P | 2008-11-17 | 2008-11-17 | |
| US61/115,371 | 2008-11-17 | ||
| US61/115,379 | 2008-11-17 | ||
| PCT/US2009/064701 WO2010057150A1 (en) | 2008-11-17 | 2009-11-17 | Releasable polymeric lipids for nucleic acids delivery systems |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2012509366A true JP2012509366A (ja) | 2012-04-19 |
| JP2012509366A5 JP2012509366A5 (ja) | 2013-01-10 |
Family
ID=42170403
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2011536581A Withdrawn JP2012509366A (ja) | 2008-11-17 | 2009-11-17 | 核酸送達系のための放出可能ポリマー脂質 |
Country Status (7)
| Country | Link |
|---|---|
| US (1) | US20110305770A1 (ja) |
| EP (1) | EP2362728A1 (ja) |
| JP (1) | JP2012509366A (ja) |
| CN (1) | CN102231950A (ja) |
| CA (1) | CA2742838A1 (ja) |
| TW (1) | TW201023914A (ja) |
| WO (1) | WO2010057150A1 (ja) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2012509258A (ja) * | 2008-11-17 | 2012-04-19 | エンゾン ファーマシューティカルズ,インコーポレーテッド | 核酸送達系のための分岐カチオン性脂質 |
Families Citing this family (28)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US8450290B2 (en) * | 2007-11-26 | 2013-05-28 | Enzon Pharmaceuticals, Inc. | Methods for treating androgen receptor dependent disorders including cancers |
| CA2843503C (en) * | 2011-08-12 | 2020-12-22 | Ulrich Hersel | Polymeric hyperbranched carrier-linked prodrugs |
| ES2535654T3 (es) * | 2011-10-13 | 2015-05-13 | Association Institut De Myologie | ADN triciclo-fosforotioato |
| WO2013086354A1 (en) | 2011-12-07 | 2013-06-13 | Alnylam Pharmaceuticals, Inc. | Biodegradable lipids for the delivery of active agents |
| PL3766916T3 (pl) | 2014-06-25 | 2023-02-27 | Acuitas Therapeutics Inc. | Nowe lipidy i formulacje nanocząstek lipidowych do dostarczania kwasów nukleinowych |
| PT3313829T (pt) | 2015-06-29 | 2024-07-08 | Acuitas Therapeutics Inc | Formulações de lípidos e de nanopartículas lipídicas para a administração de ácidos nucleicos |
| RU2730871C1 (ru) * | 2015-09-30 | 2020-08-26 | Сионоги Энд Ко., Лтд. | Производное нуклеиновой кислоты, обладающее иммуностимулирующей активностью |
| WO2017057612A1 (ja) | 2015-09-30 | 2017-04-06 | 日油株式会社 | 環状ベンジリデンアセタールリンカーを介して親水性ポリマーが結合した脂質誘導体 |
| US10940201B2 (en) | 2015-09-30 | 2021-03-09 | Shionogi & Co., Ltd. | Nucleic acid derivative having immunostimulatory activity |
| WO2017075531A1 (en) | 2015-10-28 | 2017-05-04 | Acuitas Therapeutics, Inc. | Novel lipids and lipid nanoparticle formulations for delivery of nucleic acids |
| WO2018191657A1 (en) | 2017-04-13 | 2018-10-18 | Acuitas Therapeutics, Inc. | Lipids for delivery of active agents |
| CA3061612A1 (en) | 2017-04-28 | 2018-11-01 | Acuitas Therapeutics, Inc. | Novel carbonyl lipids and lipid nanoparticle formulations for delivery of nucleic acids |
| US11639329B2 (en) | 2017-08-16 | 2023-05-02 | Acuitas Therapeutics, Inc. | Lipids for use in lipid nanoparticle formulations |
| US11542225B2 (en) | 2017-08-17 | 2023-01-03 | Acuitas Therapeutics, Inc. | Lipids for use in lipid nanoparticle formulations |
| WO2019036000A1 (en) | 2017-08-17 | 2019-02-21 | Acuitas Therapeutics, Inc. | LIPIDS FOR USE IN LIPID NANOPARTICLE FORMULATIONS |
| WO2019036030A1 (en) | 2017-08-17 | 2019-02-21 | Acuitas Therapeutics, Inc. | LIPIDS FOR USE IN LIPID NANOPARTICLE FORMULATIONS |
| TWI724578B (zh) * | 2018-10-15 | 2021-04-11 | 國立陽明大學 | 酸鹼敏感型脂質奈米粒子用於包覆抗癌藥物和微小核糖核酸及其用途 |
| CN109251150B (zh) * | 2018-11-02 | 2021-07-30 | 宁夏医科大学 | 一种2,3-二氨基丙酸甲酯的制备方法 |
| KR20210138569A (ko) | 2019-01-11 | 2021-11-19 | 아퀴타스 테라퓨틱스 인크. | 활성제의 지질 나노입자 전달을 위한 지질 |
| AU2021308681A1 (en) | 2020-07-16 | 2023-03-09 | Acuitas Therapeutics, Inc. | Cationic lipids for use in lipid nanoparticles |
| KR102433981B1 (ko) * | 2020-12-15 | 2022-08-19 | 대구가톨릭대학교산학협력단 | HIF-1α 및 STAT5 전사인자를 억제하는 합성 디코이 올리고핵산 및 이를 유효성분으로 함유하는 아토피 피부염의 예방 또는 치료용 약학적 조성물 |
| CN114904003B (zh) * | 2021-02-09 | 2023-09-29 | 广州立得生物医药科技有限公司 | 可电离的阳离子脂质类似物材料在作为核酸药物递送载体或转染试剂中的应用 |
| CA3211623A1 (en) | 2021-05-24 | 2022-12-01 | Bo YING | Lipid compounds and lipid nanoparticle compositions |
| EP4408436A1 (en) * | 2021-09-28 | 2024-08-07 | The Trustees of The University of Pennsylvania | Compositions and methods for t cell targeted delivery of therapeutic agents |
| WO2023056418A1 (en) * | 2021-10-01 | 2023-04-06 | The Trustees Of The University Of Pennsylvania | Lipid nanoparticle (lnp) compositions and methods of use thereof |
| WO2023107920A1 (en) * | 2021-12-07 | 2023-06-15 | The Trustees Of The University Of Pennsylvania | Anisamide-containing lipids and compositions and methods of use thereof |
| CN116549659A (zh) * | 2022-01-27 | 2023-08-08 | 中山大学 | 阳离子脂质类似物在基因编辑核糖核蛋白复合物胞内递送中的应用 |
| CN114699997B (zh) * | 2022-03-28 | 2022-11-25 | 山东大学 | 一种具有高抗盐性的碱基@囊泡复合体及其制备方法 |
Family Cites Families (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2009114154A (ru) * | 2006-09-15 | 2010-10-20 | Энзон Фармасьютикалз, Инк. (Us) | Полимерные пролекарства с направленной доставкой, содержащие полифункциональные линкеры |
| LT2494993T (lt) * | 2007-05-04 | 2018-12-27 | Marina Biotech, Inc. | Aminorūgščių lipidai ir jų panaudojimas |
-
2009
- 2009-11-17 WO PCT/US2009/064701 patent/WO2010057150A1/en active Application Filing
- 2009-11-17 US US13/129,628 patent/US20110305770A1/en not_active Abandoned
- 2009-11-17 CN CN2009801458902A patent/CN102231950A/zh active Pending
- 2009-11-17 JP JP2011536581A patent/JP2012509366A/ja not_active Withdrawn
- 2009-11-17 EP EP09826946A patent/EP2362728A1/en not_active Withdrawn
- 2009-11-17 CA CA2742838A patent/CA2742838A1/en not_active Abandoned
- 2009-11-17 TW TW098138947A patent/TW201023914A/zh unknown
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2012509258A (ja) * | 2008-11-17 | 2012-04-19 | エンゾン ファーマシューティカルズ,インコーポレーテッド | 核酸送達系のための分岐カチオン性脂質 |
Also Published As
| Publication number | Publication date |
|---|---|
| TW201023914A (en) | 2010-07-01 |
| WO2010057150A1 (en) | 2010-05-20 |
| WO2010057150A8 (en) | 2011-01-06 |
| EP2362728A1 (en) | 2011-09-07 |
| US20110305770A1 (en) | 2011-12-15 |
| CA2742838A1 (en) | 2010-05-20 |
| CN102231950A (zh) | 2011-11-02 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2012509366A (ja) | 核酸送達系のための放出可能ポリマー脂質 | |
| JP2012509272A (ja) | 核酸送達系のための放出性カチオン脂質 | |
| JP2012509273A (ja) | 核酸送達系のための放出可能融合性脂質 | |
| JP2012509258A (ja) | 核酸送達系のための分岐カチオン性脂質 | |
| JP5977394B2 (ja) | 脂質に封入された干渉rna | |
| JP2011529912A (ja) | 核酸送達システム用のナノ粒子組成物 | |
| KR101762466B1 (ko) | 지질, 지질 조성물 및 이의 사용 방법 | |
| JP4796062B2 (ja) | 脂質封入干渉rna | |
| US20210369862A1 (en) | Therapeutic nanoparticles and methods of use thereof | |
| WO2018225871A1 (ja) | カチオン性脂質としての化合物 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20121113 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20121113 |
|
| A761 | Written withdrawal of application |
Free format text: JAPANESE INTERMEDIATE CODE: A761 Effective date: 20131211 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20131219 |