発明の詳細な記載
材料、組成物および成分を開示し、それらは、そのために用いることができ、併用して用いることができ、そのための調製において用いることができ、または開示された方法および組成物の生産物である。これらおよび他の材料は、本明細書に開示し、そしてこれらの材料の組合せ、サブセット(部分集合)、相互作用、群、その他が開示されるとき、これらの化合物の各々の種々の個々のもの、および集合的組合せ(collective combination)および順列(permutation)の特定の言及は明示的に開示されないかもしれないが、各々は特に本明細書において予期され、および記載されることが理解される。たとえば、ポリペプチドが開示され、および議論され、およびポリペプチドを含む多数の分子に行われる多数の修飾が議論される場合、各々およびすべての組合せおよび順列のポリペプチドおよび可能な修飾は、とりわけそれと反対に示されない限り、特に予期される。それゆえ、分子A、B、およびCのクラス(部類)が分子D、E、およびFの分子のクラスと同様に開示され、および組合せの分子の例、A-Dが開示される場合、次いで各々が個々に規定されない場合でさえ、各々は個々におよび集合的に予期される。それゆえ、この例は、各々の組合せA-E、A-F、B-D、B-E、B-F、C-D、C-E、およびC-Fであり、それらは特に予期され、そしてA、B、およびC;D、E、およびF;そして、例の組合せA-Dの開示から開示されたと考慮されなければならない。同様に、これらの任意のサブセットまたは組合せはまた、特に予期され、および開示される。このように、たとえば、A-E、B-F、およびC-Eのサブ(下位)群は、特に予期され、およびA、B、およびC;D、E、およびF;そして、例の組合せA-Dの開示から開示されるものと考慮されなければならない。この概念は、この出願のすべての局面に適用され、それには、制限されないが、開示された組成物を作成し、および用いる方法における工程が含まれる。このように、実行することができる多種多様の追加的な工程がある場合、これらの追加的な工程の各々が、開示された方法の任意の特定の具体例、または具体例の組合せを用いて実行することができ、および各々のそのような組合せは特に予期され、および開示されたと考えなければならないと理解される。
開示された方法および組成物が記載された特定の方法論、プロトコル(手順)、および試薬に限られず、これらが変動しうるものと理解される。また、本明細書に用いる述語が特定の具体例だけを記述する目的であり、添付の特許請求の範囲によってだけ制限されるものである本発明の範囲が制限されることは意図されないと理解される。
他に定められない限り、本明細書で用いるすべての専門的および科学的な用語は本明細書の前後関係においてこの技術における技量の者によって普通に理解される意味を持つ。
本明細書において、および添付の特許請求の範囲において用いるように、単数形の“a”、“an”、および“the”には、前後関係で指図されない限り、複数の言及が含まれることに留意しなければならない。それゆえ、たとえば、“a polypeptide”への言及には、複数のそのようなポリペプチドが含まれ、“the polypeptide”への言及には、当業者、その他に知られるその1種またはそれよりも多くのポリペプチドおよび等価物(均等)への言及である。
“オプション(随意)の”または“オプション(随意)により”は、その後に記載された事象(発症)、状況、または材料が、起こりうるか、または存在しうるか、またはその可能性がないかを意味し、記載が、事象、事情、または材料が、起こるか、または存在するかの場合、およびそれが起こらないか、または存在しないかの場合が含まれることを意味する。
範囲は、本明細書において、“約”の1種の特定の値から、および/または“約”の別の特定の値にまでとして表現することができる。そのような範囲が表現されるとき、別の具体例には、1種の特定の値から、および/または他に特定の値までを含む。同様に、値が近似のものとして表されるとき、前例の“約”の使用によって、特定の値が別の具体例を形成することが理解される。範囲の各々の終点(エンドポイント)が他の終点に関して、および他の終点に無関係に、双方とも重要であることがさらに理解される。本明細書に開示する多数の値が存在し、そして各値が、その特定の値でそれ自身の値に加えて“約”としてまた開示されることもまた理解される。たとえば、その値“10”が開示されるならば、“約10”もまた開示される。また、値が開示されるとき、その値と“それより低いか、またはそれに等しい”、“その値よりも高いか、またはそれに等しい”および値の間の可能な範囲もまた、熟練者によって適切に理解されるように開示される。たとえば、値“10”が開示される場合、“10より低いか、またはそれに等しい”ならびに“10より高いか、またはそれに等しい”もまた開示される。また、本明細書全体で(the throughout the application)、データを多数の異なる形式(フォーマット)において提供し、およびこのデータが、終点および開始点を表し、およびデータ点の任意の組合せのために変動することは理解される。たとえば、特定のデータ点“10”および特定のデータ点15が開示されるならば、それは、10および15より高い、それより高いか、または等しい、それより低い、それより低いか、または等しい、およびそれに等しく、ならびに10および15の間が開示されると考えられることが理解される。また、2つの特定の単位の間の各単位もまた開示されるとも理解される。たとえば、10および15が開示されるならば、11、12、13、および14もまた明らかである。
本明細書で用いるように、用語“対象体(サブジェクト)”は、動物またはヒトに、好ましくは所定の病気、状態、事象または損傷のための処置が必要な対象体に言及するこのように、対象体はヒトであることができる。用語は、特定の齢または性を表示しない。成体および新生仔の対象体、ならびに胎仔、雄性であるか、または雌性であるかは、範囲に入る(カバーされる)と意図される。受動体(患者)は病気または障害を患う対象体に言及する。用語“受動体”には、人間および獣医学の対象体が含まれる。
“抑制する”、“抑制性”、および“抑制”は、活性、反応、状態(条件)、病気、または他の生物学的パラメータを減少させることを意味する。これには、制限されないが、活性、反応、条件、または病気の完全なアブレーション(消失)が含まれる。これにはまた、たとえば、自然またはコントロールのレベルと比較して、活性、反応、条件、または病気における10%の減少が含まれうる。このように、減少は、自然またはコントロールのレベルと比較して、10、20、30、40、50、60、70、80、90、100%、または特別に規定されたパーセンテージの間における任意の量の減少であることができる。
“促進する(プロモート)”、“促進”、および“促進性”は、活性、反応、条件、病気、または他の生物学的パラメータにおける増加に言及する。これには、制限されないが、活性、反応、条件、または病気の惹起が含まれる。これにはまた、たとえば、自然またはコントロールのレベルと比較して、活性、反応、条件、または病気における10%の増加が含まれうる。このように、活性、反応、条件、病気または他の生物学的パラメータにおける増加は、自然またはコントロールのレベルと比較して、10、20、30、40、50、60、70、80、90、100%、またはそれよりも高いことができ、特別に規定されたパーセンテージの間での増加の任意の量が含まれる。
用語“治療上効果的な”は、用いる組成物の量が、病気または障害の1種またはそれよりも多くの原因または徴候を寛解するために十分な量のものであることを意味する。そのような寛解は、減少または変質(alteration)を、必ずしも排除ではなく、必要とするだけである。
用語“担体(キャリヤー)”は、化合物、組成物、物質、または構造で、それは、化合物または組成物との組合せにおいてのとき、その意図された使用または目的のために、調製、保管、管理、配送、有効性、選択性、または化合物または組成物の他の任意の特長も助け、または促すものを意味する。たとえば、担体は活性原材料の任意の分解をも最小にし、および対象体における任意の有害な副作用でも最小にするために選ぶことができる。
“アルキル”は、随意に置換された、単一の炭素-炭素結合によってつながれ、そして互いに接合された1から8個までの炭素原子をもつ炭化水素基に言及する。アルキル炭化水素基は、直鎖であるか、または1種またはそれよりも多くの分枝を含むことがある。これらの基には、メチル、エチル、プロピル、イソプロピル、ブチル、イソブチル、第三ブチル、ペンチル、ヘキシル、などが含まれる。“低級アルキル”は、1から4個までの炭素をもつ随意に置換された分枝の、または直鎖のアルキルに言及する。
“アルケニル”は、炭素原子の間で少なくとも1種の炭素-炭素二重結合を含み、そして互いに接合される2-8の炭素原子を含む随意に置換された炭化水素基に言及する。アルケニル炭化水素基は分枝か、または直鎖であってよい。
“シクロアルキル”は、随意に置換された環式アルキルまたは随意に置換され、そして単環式および二環式および三環式のような多重の融合した環構造を含む非芳香族の環式アルケニルに言及する。シクロアルキルは、たとえば、3から15までの炭素原子をもちうる。1種の具体例において、シクロアルキルは5から12までの炭素原子をもつ。適切なシクロアルキル基の例には、シクロプロピル、シクロブチル、シクロペンチル、シクロヘキシルなどが含まれる。
“複素環”は、少なくとも1種の非炭素原子を含む、随意に置換された、飽和または部分的に飽和した非-芳香族の環状の部分に言及する。複素環部分は、典型的に単一の環、または二環式および三環式のような多重の融合した環構造を含む。1種の具体例において、環(群)は5から6-員環であり、そして典型的に、1から3までの非-炭素原子を含む。複素環のための非炭素原子は、無関係に窒素、酸素およびイオウから選ばれうる。
“アリール”は共役(結合)パイ電子環システムをもつ少なくとも1種の環を有する随意に置換された芳香族基に言及し、および単環式および二環式および三環式のような多重の融合した環構造を含む。アリールには、随意に置換された炭素環式アリールが含まれる。適切なアリール基の例には、フェニル、ナフチル、アントラセニル、フェナントレニルなどが含まれる。
“複素環アリール”は、少なくとも1種の非炭素原子を含む共役パイ電子環システムをもつ少なくとも1種の環を有する随意に置換された芳香族基に言及する。複素環アリール部分は、典型的に1種の環または二環式および三環式のような多重の融合した環構造を含む。適切な複素環アリール基の例には、フラニル、チエニル、ピロールイル、イミダゾリル、ピリジニル、などが含まれる。
“アルコキシ”は、アルキル基に接合される酸素に言及する。“低級アルコキシ”は低級アルキル基に接合させる酸素に言及する。1種の具体例において、酸素は長さにおいって非置換アルキル1から4までの炭素に接合される。たとえば、アルコキシは、メトキシ、エトキシなどでありうる。
“アルキレン”は、炭素原子の間で炭素-炭素単結合だけを含む随意に置換された炭化水素鎖に言及する。アルキレン鎖は1から6までの炭素をもち、および他の官能基または構造的部分に対する2つの場所で付着される。適切なアルキレン基の例には、メチレン、エチレンなどが含まれる。
活性な薬剤の“生物学的に活発な”および“望ましい生物学的活性”を参照するとき、標的とされた分子の活性または活性化を調節する能力に言及する。特に、具体例では、本明細書に記載する生物学的に活性な薬剤と組合せて用いるとき、“生物学的に活性な”および“望ましい生物学的活性”は、直接または間接的に標的とされた分子の活性または活性化を抑制するか、またはブロックする能力に言及する。
本明細書に用いるように、“小分子”は低分子量の化合物に言及する。特定の具体例において、たとえば、そのような小分子化合物は、50ダルトンおよび800ダルトンの間での分子量が見れる化合物である。代わりの具体例において、本明細書に記載するような小分子は、分子量が100ダルトンおよび500ダルトンの間、および250ダルトンから475ダルトンまでの間の範囲から選ばれる分子量を見せる。
本明細書に用いるように、用語“処置する”、“処置すること”、および“処置”は、治療上の利益に言及し、それによって、特定の病気、状態、事象または創傷の有害な効果(群)または発達が防止され、減らされ、止められ、または遅くされる。
“治療上有効な量”は、治療上の利益で、病気をもつ対象体において病気を遅らせるか、または病期の発症を予防上遅らせるようなものを達成する化合物の量である。治療上有効な量は、対象体において病気または疾患の1種またはそれよりも多くの徴候を若干の範囲までに取り除く量であり、部分的に、または完全に、病気または障害に関係するか、または原因となる1種またはそれよりも多くの生理的または生化学的パラメータのいずれかを正常にまで戻し、および/またはその障害の病気の発症の見込みを減らす。
用語“病理学的”または“病理学的状況”は、病気、状態、事象または損傷の結果でありうる、健康な、正常な、または能率的な状態からの何らかの逸脱に言及する。
用語“調節配列”は、遺伝子座のコード領域の通常100-1000キロベース(kb)内のそれらの配列に言及するが、それらはまた、コード領域からより一層遠く離れていてよく、それは遺伝子の発現に影響を及ぼす。発現のそのような調節には、遺伝子の転写、および翻訳、スプライシング、およびメッセンジャー(伝令)RNAの安定性が包含される。
用語“操作可能に連結される”は、近位(juxtaposition、並置)に言及し、そこでは、そのように記載する構成要素が、それらに対し、それらの意図された様式において機能するのを許している関係にある。例として、プロモーターはコード配列に操作可能に連結され、それは、そのプロモーターがその転写または発現に影響を及ぼす場合である。用語“操作可能に連結される”は、核酸発現コントロール配列(例は、転写因子結合部位のプロモーター、エンハンサー、またはアレイ)および第2の核酸配列の間の機能的な連結に言及しうるもので、そこでは、発現コントロール配列は第2の配列に対応する核酸の転写を指向する。
“分離(単離)された”は、本明細書において開示する生体分子を記載するのに用いるとき、例は、その自然環境の構成要素(コンポーネント)から識別され、および分離され、および/または回収されたペプチド、タンパク質、または核酸を意味する。その自然環境の汚染物質の構成要素は、典型的に分離された分子(群)のための診断または治療上の用途に干渉する物質であり、そして酵素、ホルモン類、および他のタンパク質性または非タンパク質性(non-proteinaceous)の物質を含みうる。本明細書に記載する生体分子の分離および精製のための方法は、この技術において既知であり、そして利用可能であり、分離または精製する物質に照らして適した分離および精製の方法を定めることができる。分離された生体分子は、それが本明細書において用いられるように、典型的に少なくとも1種の精製工程(ステップ)を用いて調製されるが、“分離される”は追加的に、たとえば、ペプチド、タンパク質、抗体、または核酸の物質の、インサイツで、組換え型細胞内でのものに言及し、それは、同種細胞のタイプにおいて発現する場合でさえである。
さらに、用語“分離される”、“実質純粋”、および“実質同種”は、モノマー(単量体の)タンパク質を記載するのに用いられ、それら互換的に本明細書において用いられる。試料の少なくとも約60から75%までが1種のポリペプチド配列を見せるとき、モノマータンパク質は実質純粋である。実質純粋なタンパク質は、典型的にタンパク質試料の約60から90%までのW/Wを構成することができ、そしてそこでは、望ましい、実質純粋なタンパク質は、約90%、約95%、または約99%を超えて純粋であることができる。タンパク質の純度または均質性(均一性)はこの技術においてよく知られた多数の手段で、タンパク質試料のポリアクリルアミドゲル電気泳動のようなもので、次いでゲルを染色して単一のポリペプチドバンドを視覚化することによって指し示すことができる。一定の目的のために、より一層高い分解能を、精製のために利用されるこの技術においてよく知られるHPLCまたは他の手段を用いて提供することができる。
この明細書の説明および特許請求の範囲の全体から、言葉“備える(comprise)”およびその言葉の変形で、“備えている(comprising)”および“備える(comprises)”のようなものは、“制限されないが含まれている”を意味し、そして、たとえば、他の添加物、構成要素、整数(integers、完全なもの)または工程を除外することを意図しない。
タンパク質およびペプチド
これらの用語が本明細書で用いられるように、“タンパク質”および“ペプチド”は単純には、ポリペプチド分子に概して言及し、そして任意の特定のサイズ(大きさ)、長さまたは分子量のポリペプチド分子に言及するためには用いられない。タンパク質の変種および誘導体は、この技術における技量の者によく理解され、そしてアミノ酸配列の修飾を包含することができる。たとえば、アミノ酸配列の修飾は典型的に、3つの部類の1種またはそれよりも多くのものに該当し、すなわち、置換の、挿入の、または欠失の変種である。挿入には、アミノおよび/またはカルボキシルの末端融合ならびに単一または多重のアミノ酸残基の配列内(intrasequence)挿入が含まれる。挿入は普通に、アミノまたはカルボキシルの末端融合の挿入よりも小さい挿入であり、たとえば、1種から4つの桁の残基の上でのものである。免疫原性融合タンパク質誘導体で、例において記載するもののようなものは、インビトロでの架橋結合(cross-linking)によって、または融合をコード化するDNAで形質転換された組換え型細胞培養によって、標的配列に免疫原性を付与するために十分に大きなポリペプチドを融合させることで作成される。欠失は、タンパク質配列から1種またはそれよりも多くのアミノ酸残基を除去することによって特徴づけられる。典型的に、約2から6までを超えない残基を、タンパク質分子の範囲内の任意の1種の部位で削除する。これらの変種は普通に、タンパク質をコード化するDNAのヌクレオチドの部位特異的変異によって調製され、それによって変種をコード化するDNAが生産され、およびその後、組換え型細胞培養においてDNAが発現される。既知の配列を持つDNAにおいて予め定められた部位での置換変異をもたらすための技術は、よく知られており、たとえば、M 13プライマー変異誘発(primer mutagenesis)およびPCR変異誘発である。アミノ酸置換は典型的に単一の残基のものであるが、同時に多数の異なる位置で起こすことができ;挿入は通常、約1から10個までのアミノ酸残基の桁でのものであり;および欠失は約1から30までの残基に及ぶ。欠失または挿入は、好ましくは、隣接した組、すなわち2つの残基の削除または2つの残基の挿入においてなされる。置換、欠失、挿入またはそれらの任意の組合せは、最終的な構築物に到達するために組合せうる。変異は、配列を読み枠(リーディングフレーム)の外に置いてはならず、そして好ましくは、二次的mRNA構造を生産することができる相補的な領域を創作しない。置換型の変種は、少なくとも1種の残基が除去され、そして異なる残基がその場所(place)において挿入されたものである。そのような置換は概して、以下の表1に従ってなされ、そして保存的な置換と称される。
表1:アミノ酸置換の元の残基の模範的保存置換、他はこの技術において既知である。
機能における実質的変化または免疫学的同一性(アイデンティティ)は表1のものよりもあまり保存的でない置換を選ぶことによって作成され、すなわち、(a)置換の領域においてのポリペプチドの骨格の構造、たとえば、シートまたはらせん形のコンフォメーション(立体構造)として、(b)標的部位での分子の変化または疎水性、または(c)側鎖のかさ高さ(バルク)の維持に及ぼすそれらの効果におけるより一層有意に異なる残基を選定する。概して、タンパク質特性における最も大きな変化を生成するために予期される置換は、次のものであり、(a)親水性残基、例は、セリルまたはスレオニルで、疎水性残基のために(またはそれによって)置換され、例は、ロイシル、イソロイシル、フェニルアラニル、バリルまたはアラニルであり;(b)システインまたはプロリンは、任意の他の残基のために(またはそれによって)置換され;(c)陽性(electropositive)側鎖、例は、リジル、アルギニル、またはヒスチジルを持つ残基は、陰性残基のために(またはそれによって)置換され、例は、グルタミルまたはアスパルチルであり;または、(d)かさ高な側鎖を持つ残基、例は、フェニルアラニンは、側鎖を持たないもののために(またはそれによって)置換され、例は、グリシンであり、この場合、(e)硫酸化および/またはグリコシル化のための部位の数を増やすことによっている。
たとえば、生物学上および/または化学的に似た別のものによる1種のアミノ酸残基の置き換えは、保存的な置換として当業者に知られている。たとえば、保存的な置換は、1種の疎水性残基を別のものに置き換え、または1種の極性残基を別のものに置き換えることである。置換には、組合せが含まれ、たとえば、Gly、Ala;Val、Ile、Leu;Asp、Glu;Asn、Gln;Ser、Thr;Lys、Arg;および、Phe、Tyrのようなものである。各々の明示的に開示される配列のそのような保存的に置換された変形物は、本明細書に提供するポリペプチドの範囲内に含まれる。
置換による、または欠失による変異誘発は、N-グリコシル化(Asn-X-Thr/Ser)またはO-グリコシル化(SerまたはThr)のための部位を挿入するために採用することができる。システインまたは他の不安定な(変化しやすい)残基の削除はまた、望ましいことがある。潜在的タンパク質分解の部位、例は、Argの欠失または置換は、たとえば、塩基性残基の1種の削除またはグルタミニルまたはヒスチジル残基による1種の置換によって成し遂げられる。
一定の翻訳後の誘導体化は、発現されたポリペプチド上での組換え型宿主細胞の作用の結果である。グルタミニルおよびアスパラギニルの残基は、しばしば対応するグルタミルおよびアスパルチル(asparyl)の残基に、翻訳後に脱アミド化される。代わりに、これらの残基は、弱酸性条件の下で脱アミド化される。他の翻訳後修飾には、プロリンおよびリジンのヒドロキシル化、セリルまたはスレオニルの残基のヒドロキシル基のリン酸化、リジン、アルギニンおよびヒスチジンの側鎖のo-アミノ基のメチル化(T.E. Creighton(クレイトン), Proteins: Structure and Molecular Properties(タンパク質:構造および分子的な特性), W. H. Freeman & Co.(フリーマン社), San Francisco (サンフランシスコ)、pp 79-86(1983年))、N-末端のアミンのアセチル化および、若干の例において、C-末端カルボキシルのアミド化が含まれる。
本明細書に開示するタンパク質およびペプチドの変種および誘導体を定義する1種のやり方は、変種および誘導体を、特定の既知の配列に対する相同性/同一性に関して定義することを通してのものであることが理解される。本明細書において開示するこれらの、および他のタンパク質の変種を特に開示するが、それらは、規定された(stated)配列に対し、少なくとも70%または75%または80%または85%または90%または95%の相同性を持つ。当業者は、簡単に、2つのタンパク質の相同性を定める方法を理解する。たとえば、相同性は、相同性がその最高レベルにあるように、2つの配列を整列させ(配列比較し)た後に算出することができる。
相同性を算出する別のやり方では、刊行されたアルゴリズムによって実行することができる。比較のための配列の最適な配列比較は、Smith(スミス)およびWaterman(ウォーターマン)のローカル相同性アルゴリズムAdv. Appl. Math.(アドバンシーズ・イン・アプライド・マセマティックス) 2: 482 (1981年)によって、Needlemann(ニードルマン)およびWunsch(ブンシュ)の相同性配列比較アルゴリズムJ. MoL Biol.(ジャーナル・オブ・モレキュラー・バイオロジー) 48: 443 (1970年)によって、Pearson(ピアソン)およびLipman(リップマン)の類似性の方法のための検索、Proc. Natl. Acad. Sci. U.S.A.(プロシーディングス・オブ・ザ・ナショナル・アカデミー・オブ・サイエンシーズ・オブ・U.S.A.) 85: 2444 (1988年)、これらのアルゴリズムのコンピューター化された履行(Wisconsin Genetics Software Package(ウィスコンシン・ジェネティック・ソフトウェア・パッケージ)、Genetics Computer Group(ジェネティック・コンピューター・グループ)、575のScience Dr.(科学博士)、Madison(マディソン)、WI(ウィスコンシン州)、米国におけるGAP、BESTFIT、FASTA、およびTFASTA)によって、または、点検(inspection)によって行いうる。
相同性の同じ種類(タイプ)を、たとえばZuker(ズーカー)M. Science(サイエンス) 244: 48-52, 1989年、Jaeger(イエガー)ら、Proc. Natl. Acad. Sci. USA 86:7706-7710, 1989年、Jaeger et al. Methods Enzymol.(メソッヅ・イン・エンザイモロジー)183:281-306, 1989に開示されるアルゴリズムによって核酸のために得ることができ、それは、少なくとも核酸アラインメントに関連した材料のために参照することにより本明細書に組み込む。
保存的な変異および相同性の記載が一緒に、任意の組合せで、変種が保存的な変異である特定の配列に少なくとも70%の相同性を持つ具体例のようなものにおいて組み込むことができると理解されます。
この明細書が種々のタンパク質およびタンパク質配列を議論するように、それらのタンパク質配列をコード化することができる核酸も明らかにされるものと理解される。これには、特定のタンパク質配列、すなわち、すべての核酸で、1種の特定のタンパク質をコード化する配列を持つもの、ならびにすべての核酸で、変性核酸が含まれ、タンパク質配列の開示された変種および誘導体をコード化するものに関連したすべての変性配列が含まれる。このように、各々の特定の核酸配列が本明細書に全部書き出されないかもしれない一方で、各々のあらゆる配列も実際に明らかにされ、そして開示されたタンパク質配列を通して本明細書に記載されたものと理解される。
開示された組成物中に組み込むことができる非常に多くのアミノ酸およびペプチドの類似体が存在すると理解される。たとえば、非常に多くのDアミノ酸および異なる機能的な置換基を持つアミノ酸が存在し、それからそれらのアミノ酸を表1で示した。ペプチドの類似体の立体異性体と同様に、天然に存在するペプチドの逆の立体異性体を明らかにする。これらのアミノ酸は、一般に好まれるアミノ酸を有するtRNA分子を負荷することおよび、たとえば、類似体(アナログ)のアミノ酸をペプチド鎖に部位特異的なやり方で挿入するためにアンバーコドンを利用する遺伝子構築物を操作すること(エンジニアリング)によって、ポリペプチド鎖に簡単に組み込むことができる(Thorson(ソーソン)ら、Methods in Molec. Biol.(メソッヅ・イン・モレキュラー・アンド・セルラー・バイオロジー)77: 43-73 (1991年)、Zoller(ゾラー)、Current Opinion in Biotechnology(カレント・オピニオン・イン・バイオテクノロジー)、3:348-354(1992年); Ibba(イッバ)、Biotechnology & Genetic Enginerring Reviews(バイオテクノロジー・アンド・ジェネティック・エンジニアリング・レビューズ)13: 197-216 (1995年)、Cahill(ケイヒル)ら、TIBS、14(10); 400-403 (1989年); Benner(ベナー)、TIB Tech(テク)、12: 158-163 (1994年); IbbaおよびHennecke(ヘンネック)、Bio/Technology(バイオ/テクノロジー)、12: 678-682 (1994年)、それらのすべてを少なくともアミノ酸の類似体に関連した材料のために参照によって本明細書に組み込む)。
Dアミノ酸はより一層安定なペプチドを生成するのに用いることができ、それはDアミノ酸がペプチダーゼ等々によって認められないからである。同じ種類(例は、L-リジンの代わりにD-リジン)のDアミノ酸を有する共通配列の1種またはそれよりも多くのアミノ酸の系統的な置換は、より一層安定なペプチドを生成するのに用いることができる。システイン残基は、環化または、一緒に2つまたはそれよりも多くのペプチドを付着するために用いることができる。これは、ペプチドを特定のコンフォメーション中に束縛するために有益であることができる(Rizo(リゾウ)およびGierasch(ギエラシュ)、Ann. Rev. Biochem. 61: 387 (1992年)、参照することにより本明細書に組み込む)。
脈管透過性
本明細書に用いるように、“脈管透過性”は、小分子(例は、イオン、水、栄養分)、大きな分子(例は、タンパク質および核酸)または細胞全体(炎症の部位へ行く途中のリンパ球)でさえも、血管壁を通過する能力に言及する。
望ましくない脈管透過性によって特徴づけられる病気および障害には、たとえば、脳腫瘍と関係する浮腫、悪性病変に関係する腹水症、メイグスの症候群、肺炎症、ネフローゼ症候群、心膜液貯留(pericardial effusion)および胸水(pleural effusion)が含まれる。このように、脈管透過性または浮腫の増加と関連したこれらまたは任意の他の病気も処置、または予防する方法を提供する。たとえば、2、3の例を挙げれば、浮腫形成を抑制することは、全体的な患者予後に対し、以下の状況で、すなわち、炎症、アレルギー疾患、ガン、脳卒中、心筋梗塞、肺および心臓での機能不全、腎不全、および網膜症のようなもので、有益でなければならない。さらに、浮腫は、組織低酸素の一般的な成り行き(consequence)であるので、脈管漏出の抑制が組織低酸素の処置への潜在的アプローチを表示すると結論することができる。たとえば、病的条件(血栓形成のようなもの)または医療行為(medical intervention)(心筋保護、臓器移植、および血管形成術)による血流の中断は、脈管漏出の抑制物質を使って、急性的に、そして予防的にの双方で処置することができた。
虚血/再灌流傷害に次ぐ脳卒中および心筋梗塞はまた、脈管透過性および浮腫によって特徴づけられる。組織灌流における欠乏(deficit)は、持続性の虚血後の血管原性浮腫に導かれ、それは増加した脈管透過性の結果として発達する。組織灌流は、動脈の開存性および動脈での血の流れにより、所定の組織に達する酸素を負荷したある程度の血である。組織血管新生は、妨害物(blockage)のために破壊されうるか、あるいは代わりに、それは影響を受けた部位の上流で血管漏出または出血から招かれる血流の欠乏から生じうる。急性心筋梗塞、脳卒中、外科的血行再建手法、および他の条件で、そこでは組織血管新生が崩壊したものの間の組織灌流における欠乏は、患者の条件の予後における重要な因子である。浮腫は、管崩壊(collapse)および障害のある電気的機能、特に心臓を含む、種々の種類の損害(damage)を引き起こすことができる。以降の再灌流はまた、しかし、若干の患者において似た損害を引き起こすことができ、処置パラドックス(逆説)を導く。それが必要な間、閉鎖された(occluded)血管から障害物を取り除く(アンブロックする)ため、または損害を受けた血管を修復または取り替えるために、次の(ensuing)再灌流は、場合によっては、更なる損害を引き起こすことがある。同様に、バイパス手術の間に、心臓が打つのを止められ、そして患者を心臓のポンプにつなぐことが必要である。たとえば、バイパス手術を受ける若干の患者は、条件が悪化することを経験するかもしれず(“ポストポンプ症候群”)、それは、手術の間の心機能の停止の間の虚血の結果であるかもしれない。動脈の妨害物は、血の流れの減少を引き起こしうるもので、しかし、妨害物が取り除かれ、そして動脈が切開された後でさえ、組織の再灌流が起こることができないなら、更なる組織の損傷は招かれうる。たとえば、血餅(clot)の破壊は、組織灌流の損失を、灌流の獲得よりもむしろ導く事象の連鎖の引き金を引きうる。
望ましくない脈管透過性によって特徴づけられる更なる病気および障害には、たとえば、サイトカインストーム(サイトカイン急増)を招きうる、感染性および非感染性の病気が含まれる。サイトカインストームは、多数の感染性および非感染性の病気で、たとえば、移植片対宿主病(GVHD)、成人呼吸窮迫症候群(ARDS)、敗血症、トリインフルエンザ、天然痘、および全身性(systemmic)炎症性反応症候群(SIRS)を含むものによって誘起される(増悪する)ことがある。
病的血管形成
血管形成および血管形成関連の病気は、細胞増殖によって密接に影響を受ける。ここに使うように、用語“血管形成”は組織または器官中への新しい血管の生成を意味する。通常の生理的条件の下で、人間または動物は、非常に特定の制限された状況だけで血管形成を経る。たとえば、血管形成は通常、創傷治癒、胎児性および胚性の発達および黄体、子宮内膜および胎盤の形成において観察される。用語“内皮”は、扁平細胞の薄層としてここに規定され、それは、漿膜腔(serous cavities)、リンパ管、および血管を裏打ちする。これらの細胞は、“内皮細胞”としてここに定義されます。用語“内皮抑制活性”は、概して血管形成を抑制する分子の能力を意味する。内皮細胞増殖(繁殖)の抑制はまた、血管形成の抑制を招く。
制御された、および抑制されてない血管形成は双方とも、同様の様式において進行することが考えられる。内皮細胞およびペリサイト(周皮細胞)は、基底膜によって囲まれ、および毛管の血管を形成する。血管形成は、内皮細胞および白血球によって放出される酵素により基底膜の浸食から始める。内皮細胞は、それは血管のルーメン(管腔)を裏打ちし、ついで基底膜を通して突き出る。血管形成の刺激物質には、侵食された基底膜を通して移動するために、内皮細胞を誘導する。移動性の細胞は、親のような血管からはなれて“出芽”を形成し、そこで内皮細胞は有糸分裂を経、そして増殖する。内皮出芽は毛管のループ(輪)を形成するために互いで合併し、新しい血管が創作される。
新しい血管はまた、脈管形成によっても部分的には形成されうる。脈管形成は、内皮細胞の供給源によって血管形成から区別される。脈管形成は、血管芽細胞(アンジオブラスト)として知られる内皮前駆(祖先)細胞の漸増を含む。これらの血管芽細胞は、循環から、または組織からくることができる。脈管形成は、血管形成として似たシグナリング経路によって規制される。このように、用語“血管形成”は、血管形成をモジュレートする方法が脈管形成(vasculogenesis)をモジュレートすることもできるように、ここで脈管形成と互換的に使われる。
病的血管形成は、それは持続的であるか、または調節不全にされた(dysregulated)か、または未規制の血管形成として特徴づけられうるもので、多重度の病気の状態、腫瘍転移および内皮細胞によっての異常な増殖において起こり、これらの条件において見られる病理学的損害を支える。病的血管形成が存在する多様な病気の状態は、血管形成に依存し、血管形成に関係し、または血管形成に関連した病気として一緒にグループ化された。これらの病気は、異常であるか、または望ましくない細胞増殖、特に内皮細胞増殖の結果である。
病気およびプロセスは、異常または望ましくない内皮細胞増殖で、制限されないが、血管腫、固形腫瘍、白血病、転移、毛細管拡張症乾癬強皮症(telangiectasia psoriasis scleroderma)、化膿性肉芽腫、心筋血管形成、プラーク(班)新血管新生、冠状管の側枝(coronary collaterals)(coronary collaterals)、虚血性肢血管形成(ischemic limb angiogenesis)、角膜疾患、ルベオーシス(rubeosis)、血管新生緑内障、糖尿病性網膜症(DR)、後水晶体線維増殖症、非増殖性糖尿病性黄斑浮腫(DME)、関節炎、糖尿病性新血管新生、加齢黄斑変性(AMD)、未熟児網膜症(ROP)、虚血性網膜静脈閉塞症(IRVO)、傷治癒、消化性潰瘍、骨折、ケロイド、脈管形成、造血発生(hematopoiesis)、排卵、月経、および胎盤形成が含まれものによって媒介された。
ROBO4シグナリング経路
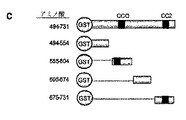
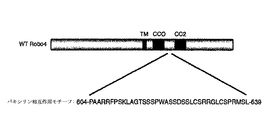
タンパク質のRoboファミリーは、神経系における軸索誘導(axonal pathfinding)をガイドするためにSlitタンパク質と相互作用することが既知の貫膜タンパク質のファミリーである。Robosは脊椎動物において識別され、そしてRobo 1-3は神経系において主に発現された(Marillat(マリラント)et al., 2002)。対照的に、Robo4は、マジックラウンドアバウト(Magic Roundabout)としても知られ、排他的に、または主に、脈管構造において発現される(Park(パーク)et al., 2003、Huminiecki(ヒュームイニエキ)et al., 2002、およびHuminiecki et al., 2002、Seth(セス)et al., 2005)。Robo4はさらに、その多岐にわたる(divergent)配列によってRobo1-3から区別され、すなわち、神経のRobosの外部ドメインは5つの免疫グロブリン(Ig)ドメインおよび3つのフィブロネクチンのタイプIII(FNIII)の繰返しを含み、その一方、Robo4は2つのIg領域および2つのFNIIIの繰返しを含む(Huminiecki et al., 2002; Park et al., 2003)。そのうえ、Robo 1-3は4つの保存された細胞質の(CC)モチーフ、CC0、CC1、CC2およびCC3を所有し(Kidd(キッド)et al., 1998; Zallen(ザーレン)et al., 1998)、そのCC0およびCC2だけが、Robo4において存在する(Huminiecki et al., 2002; Park et al., 2003)。
出版された報告はRobosが、双方のSlit依存およびSlit非依存のやり方において血管形成を促すことができると提案した。たとえば、Robo1のSlit2刺激がインビトロでの移動および管形成を誘発し、そしてインビボで腫瘍血管形成を促すと報告された(Feng(フォン)et al., 2004)。さらに、ある2004年に行われた調査は可溶性Robo4外部ドメインでのRobo4活性の抑制がインビトロでの移動および管形成を抑制し、血管形成の間、Robo4のためにポジティブな(積極的な)役割と一致することを示した。さらに、この調査は、Slitタンパク質がRobo4と結合せず、それによって、受容体のための未知のリガンドが関係すると報告した(Suchting(サッチング)et al., 2004)。Robo4が血管新生促進性(proangiogenic)であるという概念はまた、Robo4の過剰発現が内皮細胞接着および移動を無関係に増大させることを示している最近のデータも出現させた(Kaur(カウル)et al., 2006)。
Robo4シグナリングが突出事象を抑制するところのシグナル伝達経路は細胞移動に関与し、内皮の細胞-細胞間結合を安定化し、そして本明細書に記載する病理学的血管形成をブロックすることを本明細書に記載する。本明細書に記載するシグナル伝達経路は、図35において例示され、そしてたとえば、細胞運動性、脈管透過性、および新血管新生に影響を及ぼすやり方においてモジュレート(調節)されうる多重の標的を提供する。“調節(モジュレーション)”には、本明細書で用いるように標的の活性の変化が含まれ、および“操作(マニピュレーション)”には、ここで用いるように細胞の状態における変化が含まれる。ここに明らかにされるように、Robo4のリガンドによるRobo4のシグナル伝達の開始で、ここに明らかにされるSlit-2タンパク質のようなものは、否定的に細胞運動性を規制し、そして脈管透過性を抑制する。特に、Slit2はRobo4の活性化を介して内皮において反発性のキューを引き出し、そのような活性に対して原因となる新しいシグナル伝達カスケードが定められる。ここに記載するように、Robo4のSlit2活性化は、なかでも、Rac活性化を抑制し、そしてそれゆえに、Racは細胞運動性および細胞伝播を惹起し、または媒介した。
ここに提供する教示は、Robo4およびアダプタータンパク質パキシリンの間のSlit2に依存する関係を確立し、そこでは、実験データをここに詳述して、生化学の、および細胞生物学的な証拠を提供し、それは、この相互作用が、細胞移動、伝播およびRac活性化のRobo4に依存する抑制を促進する。とりわけ、Robo4活性化は、GIT1のパキシリンの活性化、および次に、ARF(アルフ、ADPリボシル化因子)6のGIT1抑制を惹起する。Robo4活性化は、内皮バリア機能を保ち、VEGF受容体の下流のVEGFシグナリングを阻止し、そして、細胞突出活性、血液漏出、内皮透過性、および/または病的血管形成を抑制する。Robo4活性化はVEGFシグナリングを阻止するだけでなく、トロンビンおよびbFGFを含む、多重の血管形成、透過性および炎症性因子からのシグナリングを抑制する。
ここにさらに明らかにされるように、ARF-GAP活性のモジュレーションは細胞の突出活性、脈管リーク、内皮透過性、および/または病的血管形成を抑制するために標的とすることができる。特に、ARF-GAPsの活性化は、ARF6の活性を抑制することができ、そしてARF6活性の抑制は、細胞の突出活性、脈管リーク、内皮透過性、および病的血管形成を抑制することが示される。加えて、ここに記載する例が、ARF-GAPsで、ARF-GAP GIT1のようなものの不活化が内皮完全性上でRobo4シグナリングの安定した効果を逆にすることができることを例示する。ARF-GAP GIT1の活性化はARF6の活性化を抑制し、VEGF誘導内皮細胞反応の抑制が招かれる。そのように、ARF 6活性の直接的または間接的なモジュレーションは、脈管透過性および血管形成を制御するための標的を表す。
ARF-GAPsに加え、1種またはそれよりも多くのARF-GEFsで、1種またはそれよりも多くのサイトヘシンのようなもので、サイトヘシンのARNOファミリーを含むもののモジュレーションは、細胞の突出活性、脈管リーク、内皮透過性および/または病的血管形成を抑制するために標的とすることができる。特定の理論に束縛されることなく、Slit2-Robo4シグナリングの効果は1種またはそれよりも多くのARFsのGTP負荷(ローディング)の抑制または防止であると信じられる。特に、また、特定の理論に束縛されることなく、Slit2-Robo4シグナリングの効果がARF6および/またはARF1のGTP負荷の抑制または防止であると信じられる。ARF-GEFsで、ここに明らかにされるものを含み、それはARF6のGTP負荷を容易にし、そしてARF-GEF活性の抑制はARF活性化または活性を抑制する。ここに記述されるように、ARF-GEFsの抑制剤(インヒビター)で、サイトヘシンの抑制剤のようなもので、ARNOおよびサイトヘシンのARNOファミリーを含むもの、ARNOは、ARF活動の抑制、ならびに細胞の突出活性、脈管リーク、内皮透過性、および/または病的血管形成の抑制を招く。
組成物
脈管透過性および病的血管形成を抑制するための組成物が、ここに提供される。
ARFsの活性を調節するための組成物をここに提供する。1種の具体例で、組成物は、直接または間接的にARF6およびARF1の一方または双方から選ばれるARFの活性または活性化のいずれかを抑制する。そのような1種の具体例において、組成物は直接、AFR6およびARF1の一方または両方から選ばれるARFを抑制する1種またはそれよりも多くの活性薬剤を含む。そのような具体例において、1種またはそれよりも多くの活性薬剤は、ARF6および/またはARF1の1種またはそれよりも多くのリガンドを含みうる。別のそのような具体例において、1種またはそれよりも多くの活性な薬剤は、直接ARF6および/またはARF1の活性または活性化を抑制する1種またはそれよりも多くの小分子、タンパク質、ペプチドまたは核酸から選ばれる。別の具体例において、組成物は間接的に、AFR6およびARF1の一方または双方から選ばれるARFを抑制する1種またはそれよりも多くの活性な薬剤を含む。そのような具体例において、1種またはそれよりも多くの活性薬剤は、ARF6またはARF1活性または活性化の上流のモジュレーターを含むことができ、そこでは、そのような上流のモジュレーターが1種またはそれよりも多くの小分子、タンパク質、ペプチド、核酸から選ばれ、それは直接、ARF6またはARF1活性の上流モジュレーターで、例えば、Robo4レセプター、ARF-GAPで、GIT1のようなもの、またはARF-GEFで、ARNOまたは他のサイトヘシンのようなものの活性または活性化を抑制する。別の具体例で、組成物はここに記載するように、RacのARF6活性化を抑制する1種またはそれよりも多くの活性な薬剤を含む。そのような1種の具体例において、1種またはそれよりも多くの活性薬剤は、VEGFによってRac活性化を抑制するするために、ここに記載するように、ARF6上で、またはそれを通して直接または間接的に振舞う1種またはそれよりも多くの小分子、タンパク質、ペプチドまたは核酸から選ばれうる。
1種の具体例において、1種またはそれよりも多くのARFsの活性を調節するための組成物は、ARF6活性または活性化を抑制するために必要とされるアクセサリータンパク質の活性化、活性または利用能を調節することによって間接的にARF6の活性または活性化を抑制する活性薬剤を含みうる。そのような1種の具体例において、ここに記述するような組成物は、1種またはそれよりも多くのARFファミリータンパク質で、ARF6および/またはARF1のようなものの活性または活性化が減らされるように、直接または間接的1種またはそれよりも多くのARF-GEFsで、サイトヘシンまたはサイトヘシンのARNOファミリーの一員のようなものを抑制する1種またはそれよりも多くの活性薬剤を含みうる。そのような1種の具体例において、ここに記載するような組成物はARNOを結びつけ、より一層少ないARF6および/またはARF1タンパク質が、およびGTP結合状態にあるように、個々のARNOタンパク質の活性を減少させ、それによって活性ARF6タンパク質のプールを減らす、1種またはそれよりも多くの活性薬剤を含みうる。直接または間接的に1種またはそれよりも多くのARF-GEFsを抑制する1種またはそれよりも多くの活性薬剤を含む組成物の1種の具体例において、1種またはそれよりも多くの活性薬剤は、標的とされたARF-GEFのリガンドである場合がある。直接または間接的に1種またはそれよりも多くのARF-GEFsを抑制する1種またはそれよりも多くの活性薬剤を含む組成物の別のそのような具体例では、1種またはそれよりも多くの活性薬剤は、標的とされたARF-GEFの活性、活性化または利用能を直接的に抑制する1種またはそれよりも多くの小分子、タンパク質、ペプチドまたは核酸から選ばれうる。直接または間接的に1種またはそれよりも多くのARF-GEFsを抑制する1種またはそれよりも多くの活性薬剤を含む組成物の別の具体例では、1種またはそれよりも多くの活性薬剤は、1種またはそれよりも多くのARF-GEFsの利用能、活性化または活性化を抑制するために任意の機構によって操作される任意の薬剤であってよい。
別の具体例において、1種またはそれよりも多くのARFsの活性を調節するための組成物は、1種またはそれよりも多くのARFタンパク質で、ARF6および/またはARF1のようなものの活性または活性化が減らされるように、1種またはそれよりも多くのARF-GAPsの活性、活性化、または利用能を増やす1種またはそれよりも多くの活性薬剤を含みうる。たとえば、ここに記載する組成物は、より一層少ないARFタンパク質、たとえばARF6および/またはARF1が活性化され、それによってARF6を通したシグナルカスケードが減らされ、またはそれによって伝播されるように、直接または間接的にGIT1の活性、活性化、または利用能を増やす1種またはそれよりも多くの活性薬剤を含みうる。そのような1種の具体例において、1種またはそれよりも多くの活性薬剤は、1種またはそれよりも多くのARFタンパク質で、ARF6および/またはARF1のようなものの活性または活性化が減らされるように、直接GIT1と結合し、そしてGIT1の活性化または活性を増やすGIT1のリガンドを含みうる。組成物が、直接1種またはそれよりも多くのARF-GAPsの活性、活性化または利用能を増やす1種またはそれよりも多くの活性薬剤を含む場合、1種またはそれよりも多くの活性薬剤は、直接または間接的に標的とされたARF-GAPの活性、活性化または利用能を増やす1種またはそれよりも多くの小分子、タンパク質、ペプチドまたは核酸を含みうる。あるいはまた、1種またはそれよりも多くのARF-GAPsの活性、活性化または利用能を増やす1種またはそれよりも多くの活性薬剤を含む組成物の別の具体例において、1種またはそれよりも多くの活性薬剤は、1種またはそれよりも多くのARF-GAPsの利用能、活性化または活性を促進するために、任意のメカニズムによって操作される任意の薬剤でありうる。
1種の具体例において、ここに提供される組成物は、Robo4受容体のリガンドを備える。1種のそのような具体例において、Robo4のリガンドは、否定的に細胞運動性を規制するために、Robo4を通して働くことができる任意の組成物または分子であることができる。別のそのような具体例において、Robo4のリガンドは、脈管透過性を抑制するために、Robo4を通して働くことができる任意の組成物または分子であることができる。また別のそのような具体例において、Robo4のリガンドは、VEGFによってRac活性化を抑制するためにRobo4を通して働くことができる任意の組成物または分子であることができる。また更なる具体例において、組成物は、ここに記載するように、Robo4受容体のリガンドを含み、そこでは、リガンドがGIT1のパキシリン活性化を惹起するために、Robo4を通して働くことができる。別の具体例では、組成物は、ここに記述するように、Robo4受容体のリガンドを含み、そこではリガンドはARF6のGit1抑制を活性化するために、Robo4を通して働くことができる。更なる具体例で、組成物はここに記述するように、Robo4受容体のリガンドを含み、そこでは、リガンドは、次のもの、内皮バリア機能、VEGF受容体の下流のVEGFシグナリングのブロッキング、血液漏出の抑制、病的血管形成の抑制、多重血管形成の信号抑制、透過性および炎症性因子の予防の1種またはそれよりも多くを招く様式においてRobo4を通して働くことができる。
本発明の組成物がRobo4のリガンドを含む場合、リガンドはRobo4の細胞外ドメインを結合する任意の組成物または分子である。あるいは、Robo4のリガンドは、VEGFによってRac活性化を抑制するために、Robo4レセプターを通して働く任意の組成または分子であることができる。さらにまた、Robo4のリガンドは、ARF6のGit1抑制を活性化するために、Robo4レセプターを通して働く任意の組成または分子であることができる。またさらに、Robo4のリガンドは、Git1のパキシリン活性化を活性化するために、Robo4レセプターを通して働く任意の組成または分子であることができる。別の局面では、Robo4のリガンドは、Git1のパキシリン活性化を活性化するために、Robo4レセプターを擬態する任意の組成または分子であることができる。1種の具体例において、本明細書に従う組成において含まれるRobo4のリガンドは、約5、10、15、20、25、30、40、50、60、70、80、90、100、200、300、400のアミノ酸の長さの分離したポリペプチドを備える。
ここに記載するような組成にはRobo4のリガンドが含まれ、そのようなリガンドはSlitリガンドで、Slit2リガンドのようなもの、またはRobo4を結合し、および活性化するその断片または変種であることができる。特定の具体例において、Slitリガンドまたはその断片または変種は、以下の1種またはそれよりも多くのものを招く様式においてRobo4を結合し、および活性化させ、すなわち、Racの抑制;ARF6の抑制;内皮バリア機能の保存;VEGFレセプターの下流のVEGFシグナリングのブロッキング;血液漏出の抑制;病的血管形成の抑制;および多重な血管形成、透過性および炎症の因子の抑制である。たとえば、Robo4のリガンドは、Slit1(配列番号1)、Slit2(配列番号2)、Slit3(配列番号3)、Slit1の断片で、配列番号4によって表される断片のようなもの、Slit2の断片で、配列番号5によって表される断片のようなもの、およびSlit3の断片で、配列番号6によって表されるようなものを含むことができる。他の具体例において、Robo4のリガンドは配列番号7から配列番号15までによって表されるSlit2リガンドから選ぶことができる。特に、本明細書の記載に従うRobo4リガンドは、Slit2N(配列番号7)、配列番号8によって表されるSlit2、Slit2ΔP(配列番号9)、Slit2 D1(配列番号10)、Slit2 D1-D2(配列番号11)、Slit2 D1-D3(配列番号12)、Slit2 D1-D4(配列番号13)、Slit2 D1-DE5(配列番号14)、およびSlit2 D1-E6(配列番号15)、またはRobo4に結合するその断片から選ぶことができる。たとえば、若干の具体例において、そのようなアミノ酸配列の断片は、少なくとも約5、10、15、20、25、30、40、50、60、70、80、90、または100のアミノ酸の長さであることができる。Robo4のリガンドは、少なくとも約70%、少なくとも約75%、少なくとも約80%、少なくとも約85%、少なくとも約90%、少なくとも約95%、または少なくとも約100%の配列同一性を、配列番号1、配列番号2、配列番号3、および配列番号4から配列番号15を通しての任意のもの、またはRobo4と、以下の1種またはそれよりも多く
のものを招く様式において相互作用をするその断片から選ばれるアミノ酸配列から選ばれるアミノ酸配列に対してもつアミノ酸配列を備えることができ、すなわち、Racの抑制、ARF6の抑制、内皮バリア機能の保存、VEGFレセプターの下流のVEGFシグナリングのブロック、血管漏出の抑制、病的血管形成の抑制、および多重の血管形成、透過性および炎症性因子のシグナル抑制である。
若干の具体例において、本明細書に記載するようなRobo4リガンドとして適するSlit断片は、SlitのN末端領域を備えることができる。たとえば、Robo4のリガンドは、Slit1のアミノ酸1-1132(配列番号4)、Slit2のアミノ酸1-1119(配列番号5)、Slit3のアミノ酸1-1118(配列番号6)、または図23において例示され、および配列番号7から配列番号15を通して詳細に示されるn-末端断片の任意のものを備えることができる。特定の具体例において、Robo4のリガンドは、基本的に、配列番号4から配列番号15を通しての任意のアミノ酸配列から選ばれるものから構成されるポリペプチドを備えることができる。若干の具体例において、アミノ酸配列の配列番号7から配列番号15を通して反映されているように、本発明の組成において含まれるSlit断片は、ほとんどN末端のほとんどのアミノ酸(N-teminal most amino acides)を備えない。たとえば、若干の具体例において、アミノ酸配列は、自然なSlitの約5、10、15、20、25、30、40、50、60、70、80、90、または100のN末端アミノ酸を欠きうる。他の具体例において、Slit断片は、自然なSlitの約5、10、15、20、25、30、40、50、60、70、80、90、または100のアミノ酸のほとんどC末端を備えないでよい。
たとえば、Robo4のリガンドは、基本的に、Slit1のアミノ酸281-511(配列番号16)、またはSlit2のアミノ酸271-504(配列番号:17)から構成されるポリペプチドを備えることができる。このように、Robo4のリガンドは、配列番号15または配列番号16またはRobo4と結合するその断片を備えることができる。Robo4のリガンドは、配列番号16または配列番号17またはRobo4と結合するその断片に対し、少なくとも約70%、少なくとも約75%、少なくとも約80%、少なくとも約85%、少なくとも約90%、少なくとも約95%、または少なくとも約100%の配列同一性を持つアミノ酸配列を、1種またはそれよりも多くの次のものを招く様式で備えることができ、すなわち、Racの抑制、ARF6の抑制、内皮バリア機能の保存、VEGFレセプターの下流のVEGFシグナリングのブロック、血液漏出の抑制、病的血管形成の抑制、および多重の血管形成、透過性および炎症性因子のシグナル抑制である。
1種の具体例において、本明細書の記載による1種またはそれよりも多くのARFsの活性を調節するための組成は、1種またはそれよりも多くのARFsの上流のアクチベーター(活性剤)の活性を調節することができる小分子の活性薬剤を含む。そのような1種の具体例において、ここに記載するように、小分子活性薬剤は1種またはそれよりも多くのARF-GAPsの利用能、活性化または活性を促進する。別のそのような具体例において、ここに記載するように、小分子活性薬剤は、ARF-GEFの利用能、活性化または活性を抑制する。別のそのような具体例において、小分子活性薬剤は、以下の1種またはそれよりも多くのものを招く様式で、サイトヘシンの活性を抑制し、すなわち、Racの抑制、ARF6の抑制、内皮バリア機能の保存、VEGFレセプターの下流のVEGFシグナリングのブロック、血管漏出の抑制、病的血管形成の抑制、および多重の血管形成、透過性および炎症性因子のシグナル抑制である。
また別のそのような具体例において、小分子活性薬剤は、以下の1種またはそれよりも多くのものを招く様式で、サイトヘシンのARNOファミリーから選ばれるサイトヘシンの活性を抑制し、すなわち、Racの抑制、ARF6の抑制、内皮バリア機能の保存、VEGFレセプターの下流のVEGFシグナリングのブロック、血管漏出の抑制、病的血管形成の抑制、および多重の血管形成、透過性および炎症性因子のシグナル抑制である。別の具体例において、小分子活性薬剤は、以下の1種またはそれよりも多くのものを招く様式で、ARNOの活性を抑制し、すなわち、Racの抑制、ARF6の抑制、内皮バリア機能の保存、VEGFレセプターの下流のVEGFシグナリングのブロック、血管漏出の抑制、病的血管形成の抑制、および多重の血管形成、透過性および炎症性因子のシグナル抑制である。小分子活性薬剤を含む各々の具体例において、ここに記載するような1種またはそれよりも多くの活性薬剤を組成において含ませることができる。
特定の具体例において、脈管透過性および/または病的血管形成を抑制するための組成はセシン(Secin)H3を含み、その構造は図29に提供される。セシンH3はサイトヘシンの既知の抑制剤である(Hafner(ハーフナー)ら、Inhibition of cytohesins by SecinH3 leads to hepatic insulin resistance (セシンH3によるサイトヘシンの抑制は肝性インスリン耐性を導く)、Nature(ネイチャー)(2006)、444、941-944、および国際出願公開第WO 2006/053903号参照)。ここに詳述するように、この前後関係で、セシン-H3はARF6活性化、VEGF誘導ARF6-GTP、内皮細胞のVEGF誘導移動、酸素誘導網膜症および脈絡膜新血管形成のモデルでの新血管形成タフト形成、およびVEGFによって起因する網膜過透過性を抑制する。このように、1種の具体例において、組成は、ここに記載するように、例えば、セシンH3を含み、それはサイトヘシン活性で、たとえばARNOの活性のようなものを抑制し、それは以下の1種またはそれよりも多くのものを招く様式でであり、すなわち、Racの抑制、ARF6の抑制、内皮バリア機能の保存、VEGFレセプターの下流のVEGFシグナリングのブロック、血管漏出の抑制、病的血管形成の抑制、および多重の血管形成、透過性および炎症性因子のシグナル抑制である。
別の具体例において、ここに記載する組成は、ARF-GEFで、サイトヘシン、サイトヘシンのARNOファミリーから選ばれるサイトヘシン、またはARNOの利用能、活性化または活性を、以下の1種またはそれよりも多くのものを招く様式で抑制する化合物から選ばれる1種またはそれよりも多くの小分子活性薬剤を含み、すなわち、Racの抑制、ARF6の抑制、内皮バリア機能の保存、VEGFレセプターの下流のVEGFシグナリングのブロック、血管漏出の抑制、病的血管形成の抑制、および多重の血管形成、透過性および炎症性因子のシグナル抑制である。そのような具体例において、ここに記載するような組成は、以下の化学式(式1)をもつ1種またはそれよりも多くの化合物を含むことができ、すなわち
式中、
R
1およびR
3は無関係に、随意に置換されたアリール、随意に置換されたヘテロアリール、随意に置換されたシクロアルキル、または随意に置換された複素環から選ばれ、
R
2は、水素、低級アルコキシ、低級アルキル、ハロゲンまたはヒドロキシから選ばれ、
Zは、O、S、NH、アルキレンまたは単結合から選ばれる
をもつもの、または
製薬上許容可能な塩類、溶媒和化合物またはその水和物である。
1種のそのような具体例において、1種またはそれよりも多くの化合物は、式1によって記載されるような化合物から選ばれ、そこでは、R3は、無関係に、ハロゲン、低級アルキル、低級アルコキシルで、ヘテロ原子低級アルキル、ヒドロキシ、またはメチレンジオキシから選ばれる1から5までの置換基で置換され、そこで、2つの置換基が互いに融合されたシクロアルキルまたは複素環式環構造を形成しうる。別のそのような具体例において、1種またはそれよりも多くの化合物は、式1によって記載されるような化合物から選ばれ、そこでは、R1は、非置換アリールまたは非置換ヘテロアリールから選ばれ、R2は、水素、低級アルコキシ、または低級アルキルから選ばれ、R3は、アリールから選ばれ、随意に、無関係に、ハロゲン、低級アルキル、低級アルコキシ、またはメチレンジオキシから選ばれる1から5までの置換基で置換され、そこで2つの置換基が互いに融合したシクロアルキルまたは複素環式環構造を形成しうるものから選ばれ、およびZは、O、S、または単結合から選ばれる。
別の具体例では、ここに記載する[組成は、ARF-GEFで、サイトヘシン、サイトヘシンのARNOファミリーから選ばれるサイトヘシンまたはARNOのようなものの利用能、活性化または活性を抑制する化合物から選ばれる1種またはそれよりも多くの小分子活性薬剤を含み、それは以下の1種またはそれよりも多くのものが招かれる様式においてであり、すなわち、Racの抑制、ARF6の抑制、内皮バリア機能の保存、VEGFレセプターの下流のVEGFシグナリングのブロック、血管漏出の抑制、病的血管形成の抑制、および多重の血管形成、透過性および炎症性因子のシグナル抑制である。そのような具体例において、ここに記載する組成は、以下の化学式(式2)を持つ1種またはそれよりも多くの化合物を含むことができ、すなわち
式中、
R
1は、随意に置換されたアリール、随意に置換されたヘテロアリール、随意に置換されたシクロアルキル、または随意に置換された複素環から選ばれ、
R
2は、水素、低級アルコキシ、低級アルキル、ハロゲンまたはヒドロキシから選ばれ、
Zは、O、S、NH、アルキレンまたは単結合から選ばれ、
Xは、無関係に、ハロゲン、低級アルキル、低級アルコキシ、ヘテロ原子低級アルキル、ヒドロキシ、またはメチレンジオキシから選ばれ、そこで2つの置換基が互いに融合したシクロアルキルまたはヘテロ環式環構造を形成しうるものであり、
mは、0から5までである
をもつもの、または
製薬上許容可能な塩類、溶媒和化合物またはその水和物である。
1種のそのような具体例において、1種またはそれよりも多くの化合物は、以下の化合物から選ばれ、すなわち
または製薬上許容可能な塩類、溶媒和化合物またはその水和物である。
別の具体例において、本明細書の記載による組成は、ここに記載するように、直接または間接的に標的とされた分子の活性を調節する核酸を含む。ここに記載する組成に含まれうる核酸は、たとえば、アプタマー、アンチセンス分子、siRNA、リボザイム、および三重らせん体分子から選ばれうる。そのような分子の生産および使用のための技術は、ここに、または米国特許第5,800,998号で記載されるように、この技術における熟練者に知られており、それを参照することによってここに組み込む。
アンチセンスRNAおよびDNA分子は、標的とされたmRNAに結合し、およびタンパク質翻訳を防ぐことによって、直接mRNAの翻訳をブロックするために作用する。アンチセンスDNAに関して、オリゴデオキシリボヌクレオチドは、翻訳開始サイト、例として標的配列の-10および+10の間の領域から導き出されたものが好ましい。たとえば、アンチセンスRNAまたはDNA分子は、ここに記載するような組成において、1種またはそれよりも多くのARFタンパク質で、ARF6またはARF1を含むものの翻訳、またはARFタンパク質の上流アクチベーターで、たとえば、サイトヘシン、またはサイトヘシンのARNOファミリーの一員を含むARF-GEFのようなものを減らす様式において含みうる。
1種の具体例において、ここに記載する組成において含む核酸は、低分子干渉(small interfering)RNA(siRNA)化合物またはその修飾した等価物である。別の具体例において、ここに記載する組成において含まれる核酸は、二本鎖低分子干渉RNA(siRNA)化合物またはその修飾した等価物である。たとえば、ここに記載する組成に含まれるsiRNAはARF6またはARF1を含め、1種またはそれよりも多くのARFタンパク質のレベル、またはARFタンパク質の上流の活性剤で、たとえば、サイトヘシンまたはサイトヘシンのARNOファミリーの一員を含め、ARF-GEFのようなものを減らしうる。
一般にこの技術において知られているように、siRNA化合物は、19の塩基対を形成し、2つのヌクレオチドの3’オーバーハングを所有する21のヌクレオチドの2つの相補的一本鎖RNAを含むRNAデュプレックス(二本鎖)である(Elbashir(エルバシャー)ら、Nature 411:494 498(2001)、および、PCT国際公開第WO 00/44895、WO 01/36646、WO 99/32619、WO 00/01846、WO 01/29058、WO 99/07409、およびWO 00/44914参照)。特定のmRNAに対するそのヌクレオチド配列を介して細胞において適切に標的とされるとき、siRNAは特にRNA干渉(RNAi)として既知のプロセスによって遺伝子発現を抑えることができる(Zamore(ザモア)およびAronin(アロニン)、Nature Medicine(ネイチャー・メディシン)、9:266 267(2003)参照)。siRNAsは特異的mRNAの細胞レベルを減らし、そしてそのようなmRNAによってコードされたタンパク質のレベルを低下させることができる。siRNAsは破壊のためにmRNAを標的とするように配列相補性を利用し、そして配列特異的である。このように、それらは極めて標的特異的でありえ、および哺乳類において、同じ遺伝子の異なる対立遺伝子によってコード化されるmRNAを標的とするために示された。この精度のため、伝統的な薬物に典型的に関連した副作用は、減らされ、または排除されうる。加えて、それらは比較的安定で、そしてアンチセンスおよびリボザイム分子の様に、それらは、製薬上の特徴で、増加した安定性、配送可能性(deliverability)および製造の容易さのようなものを達成するために修飾されることもできる。また、siRNA分子は、自然の細胞経路の有利さ、すなわち、RNA干渉をとるので、それらはまた、標的とされたmRNA分子を破壊する際の極めて効率的である。
RNAiによる特定の遺伝子発現のインビボ抑制は、哺乳類を含む種々の生物において達成された。たとえば、Song(ソング)らの、Nature Medicine 9:347 351(2003)は、Fas siRNA化合物の自己免疫肝炎を有する実験マウスへの静脈注入が特異的にマウス肝細胞におけるFas mRNAレベルおよびFasタンパク質の発現を減らしたことを例証する。遺伝子サイレンシング効果は、静脈注入後10日の間、縮小く持続した。注入されたsiRNAは、マウスを肝不全および線維症から保護することにおいて効果的であった。Song et al., Nature Medicine, 9:347 351(2003)。動物へのsiRNAの配送のためのいくつかの他のアプローチは、好首尾であることが証明された(McCaffery(マカフリー)ら、Nature、418:38 39(2002);Lewis(ルイス)ら、Nature Genetics、32:107 108(2002));およびXia(シァ)ら、Nature Biotech.、20:1006 1010(2002)参照)。
本明細書の記載により提供されるsiRNA化合物は、慣習的なRNA合成法を用いて合成することができる。たとえば、それらは適切に保護されたリボヌクレオシドホスホラミダイトおよび慣習的なDNA/RNAシンセサイザーを使って化学的に合成することができる。RNA合成のための種々の適用可能な方法は、例は、Usman(ウスマニ)ら、J. Am. Chem. Soc, 109:7845 7854 (1987)およびScaringe(スカリンジ)ら、Nucleic Acids Res., 18:5433 5441 (1990)において明らかにされる。カスタムの(慣習的な)siRNA合成サービスは、商業上のベンダーで、Ambion(アンビオン)(Austin(オースティン)、Tex.(テキサス州)、USA)、Dharmacon Reserch(Lafayette(ラファイエット)、Colo.(コロラド州)、USA)、Pierce Chemical(ピアスケミカル)(Rockford(ロックフォード)、Ill.(イリノイ州)、USA)、ChemGenes(ケムジーンズ)(Ashland(アシュランド)、Mass(マサチューセッツ州)、USA)、Proligo(プロリゴ)(Hamburg(ハンブルグ)、Germany(ドイツ)、およびCruachem(クルアケム)(Glasgow(グラスゴー)、UK(英国))から入手可能である。
ここに記載するような組成は、製薬上の調剤物として調製しうる。たとえば、1種またはそれよりも多くの小分子、タンパク質、ペプチドまたは核酸に加え、記載したような組成には、治療上の投与に適する調剤物を提供するために、製薬上許容可能なキャリヤ(担体)を含みうる。ここに記載するように、“製薬上許容可能な”は、生物学的に、またはその他で望ましくない物質でないこと言及し、すなわち、その物質は、対象体に、望ましい組成(例は、望ましいリガンド、タンパク質、ペプチド、核酸、治療上の小分子(small molecule therapeutic)、など)とともに、任意の望ましくない生物学的効果を引き起こさず、またはそれが含まれる製薬上の組成物の他の構成要素の任意のものと有害な様式で相互作用することなく投与しうる。キャリヤーは当然、活性原材料の任意の分解も最小にし、および対象体において任意の有害な副作用も最小にするために選ばれ、そのことはこの技術の熟練者によく知られている。
本明細書の記載に従う製薬上の組成物は、投与のために適する任意のもので、錠剤にされた組成物、カプセル封入のための粉体組成物、カプセル化または非経口配送のための溶液組成物、エマルジョン(乳濁液)、または懸濁液で、組み込まれる調剤物がマイクロ粒子、マトリクス物質またはリポソーム中に組み込まれるもののようなものにおいて調製されうる。ここに記載する製薬上の組成物は、抗体、レセプター、またはレセプターリガンドを介する特定の細胞タイプに標的化された成分を含みうる。以下の参照は、腫瘍組織に特異的なタンパク質を標的にする例の調剤技術である(Senter(センター), et al., Bioconjugate Chem., 2:447-451, (1991); Bagshawe(バグスハウェ), K.D., Br. J. Cancer, 60:275-281, (1989); Bagshawe, et al., Br. J. Cancer, 58:700-703, (1988); Senter, et al., Bioconjugate Chem., 4:3-9, (1993); Battelli(バッテリー), et al., Cancer Immunol. Immunother., 35:421-425, (1992); Pietersz(ピエテルツ)およびMcKenzie(マッケンジー), Immunolog. Reviews, 129:57-80, (1992); およびRoffler(ロフラー), et al., Biochem. Pharmacol, 42:2062-2065, (1991))。製薬上のキャリヤーおよびそれらの調剤物は、たとえば、Reminton(レミントン)において記載され、すなわち、The Science and Practice of Pharmacy (ザ・サイエンス・アンド・プラゥティス・オブ・ファーマシー)(19th 版(ed.)) ed. A.R. Gennaro(ゲンナロ), Mack Publishing Company(マック・パブリッシング・カンパニー), Easton(イーストン)、PA 1995年である。典型的に、製薬上許容可能な塩の適切な量が、調剤物を等張性にするために、調剤物において用いられる。製薬上許容可能なキャリヤーの例には、制限されないが、塩水、Ringer’s solution(リンガー溶液)およびブドウ糖溶液が含まれる。溶液のpHは、好ましくは、約5から約8まで、そしてより一層好ましくは約7から約7.5までである。更なるキャリヤーには、抗体を含む固体疎水性ポリマーの半透性のマトリクスのような徐放性調製物が含まれ、そのマトリックスは、形付けられた物品で、例は、フィルム、リポソームまたはマイクロ粒子の形態である。たとえば、一定のキャリヤーが、例として、投与の経路および投与される組成の濃度によってより一層好ましい場合があることは、その技術に熟練する者にとって明らかである。1種またはそれよりも多くのキャリヤーに加え、ここに記載するような製薬上の組成物には、1種またはそれよりも多くの増粘剤、香味料、希釈剤、バッファ、保存剤、抗微生物剤、抗炎症剤、麻酔剤、表面活性剤、などが含まれうる。
ここに明らかにする組成物は、製薬上の組成物を含み、局所または全身的な処置が望まれかどうか、および処置するエリア(面積)に応じ、多数のやり方において管理しうる。たとえば、明らかにされる組成物は、静脈内に、腹腔内に、筋肉内に、皮下に、キャビティ内(腔内)、経皮的に、経口的に、非経口的に(例は、静脈内に)、気管内に、眼科学的に(ophthalmically)、経膣(鞘)的に、直腸性に、鼻腔内に、局所的、または同様のもので投与することができ、局所的な(外用の)鼻腔内投与または吸入剤による投与が含まれる。
使われる場合、組成物の非経口投与は概して、注入(注射)によって特徴づけられます。注射剤(Injectables)は、慣習的な形態において、液体の溶液または懸濁物としてのいずれか、注射に先立つ液体において懸濁物の溶液のために適する固体の形態として、またはエマルジョン類として、調製することができる。恒常的な投薬量が維持されるように、非経口投与のための修正されたアプローチは、遅い放出または徐放システムの使用を包含する。例は、米国特許第3,610,795号を参照し、それをここに参照することによって組み込む。
ここに明らかにされる組成物は、患者または対象体に予防的に施されるかもしれず、その者は、脈管透過性または病的血管形成についての危険がある。このように、方法はさらに投与の前に脈管透過性または病的血管形成の危険がある対象体を確認することを含むことができる。
必要な組成物の正確な量は、対象体に毎に、対象体の種、齢、重さおよび一般的な条件、治療されるアレルギー性障害のひどさ、特定の核酸または使われるベクター、管理のそのモードおよび同様のものに応じて、変動する。このように、すべての組成についての正確な量を指定することは可能ではない。たとえば、組成物を管理するための効果的な投薬量およびスケジュールは、経験的に決定されうるもので、そしてそのような決定をすることは、この技術における技量の範囲内である。組成物の管理のための投薬量の範囲は、徴候の混乱(symptoms disorder)が作用する望ましい影響を生じるのに十分大きなものである。投薬量は、有害な副作用を引き起こすほど大きくてはならず、それらは不必要な交差反応、アナフィラキシー性の反応、および同様のもののようなものである。概して、投薬量は、患者における齢、条件、性および病気の範囲、投与のルート、または他の薬物がレジメン(療法)において含まれるかどうかで変動する。投薬量は、任意の反徴候(counterindications)の場合においてでも個々の医者によって調節することができる。1または数日間、投薬量を変化させることができ、そして毎日、1またはそれよりも多くの用量において投与することができる。ガイダンスは、製薬上の生産物の所定のクラスのための適切な投薬量のための刊行物(literature)において見出すことができる。たとえば、抗体のための適切な用量を選ぶことでのガイダンスが、抗体の治療上の使用についての刊行物において見出すことができ、例は、Handbook of Monoclonal Antibodies, Ferrone(フェローン)et al., eds., Noges Publications, Park Ridge, NJ. , (1985) ch. 22およびpp. 303-357; Smith(スミス)et al., Antibodies in Human Diagnosis and Therapy, Haber(ハーバー)et al., eds., Raven Press, New York (1977) pp. 365-389である。
方法
細胞突出活性、脈管リーク、内皮透過性、および/または病的血管形成を抑制する薬剤のための選別(ふるい分け)、またはその評価のための方法をここに提供する。1種の具体例において、この方法はGIT1、GIT1のRobo4媒介活性化を含むものの活性化または活性に影響を及ぼすための前記薬剤の能力を定めることを具える。たとえば、Git1のRobo4媒介活性化は、次のことを含む工程(ステップ)によって定めることができ、すなわち、Robo4を発現する第1の細胞を候補薬剤と接触すること、基本的に第1の細胞と同じであるが、Robo4を実質欠く第2の細胞を候補薬剤と接触すること、およびGIT1活性化について、第1および第2の細胞においてアッセイすることであり、そこで、第1の細胞において第2の細胞に比べて検出可能な程度により一層高いGit1活性化が前記薬剤によるRobo4媒介Git1活性化を指し示す。
ここに明らかにするように、Robo4媒介Git1活性化はARF6不活化を招く。ARF6は、RacのVEGF媒介活性化に関与し、それはPak(パック、p21活性化)を活性化させ、それはMEK(メック、マイトジェン活性化プロテインキナーゼキナーゼ)を活性化させ、それはERK(エルク、 細胞外シグナル制御キナーゼ)を活性化させ、それは脈管透過性を促す。このように、ここに明らかにするように、GIT1活性化は、活性化され、または不活化されるかのいずれかで、シグナリング経路の構成要素の任意のものを検出することによってアッセイすることができ、そして、Robo4媒介GIT1活性化は、ARF6不活化、Rac不活化、Pak不活化、MEK不活化、またはERK不活化を検出することによってアッセイすることができる。このシグナリング経路を監視する任意の他の既知な、または新しく発見された方法は、この明らかにされた方法において使うことができるものと理解される。
また、薬剤についてスクリーニングし、または評価する方法を提供し、その薬剤は、細胞突出活性、脈管リーク、内皮透過性、および/または病的血管形成を抑制するものであり、ARF6、Rac、Pak、MEK、またはERKを抑制する前記薬剤の能力を定めることを具える。たとえば、1種の具体例において、ARF6、Rac、Pak、MEK、またはErkのRobo4媒介抑制は、次のことを含むステップによって定められ、すなわち、Robo4を発現する第1の細胞を候補薬剤と接触させること、第1の細胞と基本的に同じであるが、Robo4を実質欠く第2の細胞を候補薬剤と接触させること、第1および第2の細胞において、ARF6、Rac、Pak、MEK、ERK、またはそれらの組合せの抑制についてアッセイすることであり、そこで、第2の細胞と比較した第1の細胞の検出可能的な程度により一層低いARF6、Rac、Pak、MEK、またはERK活性化が、前記薬剤によってARF6、Rac、Pak、MEK、またはERK抑制の抑制を指し示す。代わりに、薬剤の、ARF6、Rac、Pac、MEK、またはERKをRobo4の不存在における抑制のための能力も定めることができる。1種のそのような具体例には、次のものが含まれる。すなわち、第1の細胞を候補薬剤と接触すること、第1の細胞と同じ第2の細胞をコントロールを欠く候補薬剤と接触させること、およびARF6、Rac、Pac、MEK、またはERK、またはそれらの組合せの抑制について、第1および第2の細胞においてアッセイすることであり、そこでは、第1細胞におけるARF6、Rac、Pac、MEK、またはERKの活性化が第2細胞のものに比較して検出可能に低く、それが前記薬剤によるARF6、Rac、Pac、MEK、またはERKの抑制の抑制を指示する。
Rac、Pak、MEK、ERKのようなシグナリングタンパク質の活性化は、前記タンパク質のリン酸化を検出することによってアッセイすることができる。タンパク質のリン酸化を検出するための細胞系および無細胞のアッセイはこの技術においてよく知られており、そして抗体の使用が含まれ、たとえば、抗ホスホセリン(Chemicon(R)(ケミコン(商標))1603)(Chemicon(ケミコン社)、Temecula(テミキュラ)、CA(米国カリフォルニア州))、抗ホスホスレオニン(Chemicon(R) 1607)および抗ホスホチロシン(Chemicon(R) 1599)が含まれる。部位特異的な抗体はまた、DDX-3のリン酸化された形態について特異的に発生することができる。前記抗体を生成し、そして使う方法は、この技術でよく知られている。
ここに明らかにしたアッセイ方法は、VEGF、TNF、トロンビン、またはヒスタミンの実質不存在下に実行することができる。あるいは、明らかにしたアッセイ方法は、VEGF、TNF、トロンビン、またはヒスタミンの生物学上活性な量の存在下で実行することができる。
タンパク質またはペプチド分子のような分子の“活性”には、たとえば、転写、翻訳、細胞内転位置(intracellular translocation)、分泌、キナーゼによるリン酸化、プロテアーゼによる開裂、他のタンパク質へのホモフィリック(同種親和性)およびヘテロフィリック(異種親和性)な結合、ユビキチン化が含まれる。
1種の具体例において、ここに記述するスクリーニングの方法は、高処理の(high-throughput)スクリーニングアッセイのような、選別アッセイである。このように、接触ステップは、細胞系の、または無細胞のアッセイにおいて行うことができる。たとえば、脈管内皮細胞は、インビボ、エキソビボ、またはインビトロでのいずれかで、候補薬剤と接触することができる。これらの細胞は、モノレイヤー(単分子層)培養において行うことができるが、好ましくは、上皮を構成する。細胞はインビトロで、またはインサイツ(原位置)でアッセイすることができ、または前記細胞のタンパク質抽出物は、活性化された(例は、リン酸化された)Rac、Pak、MEK、ERKの検出のために試験管内でアッセイすることができる。内皮細胞はまた、リポーター構築物を発現するために操作することもでき、そこでは、細胞を候補薬剤と接触させ、そしてリポーター発現のために評価する。他のそのような細胞系および無細胞の分析法が、ここで使用するために考慮される。
特定の具体例において、たとえば、Hafner(ハーフナー)ら(Displacement of protein-bound aptamers with small molecules screened by fluorescence polarization(蛍光偏光によって選別される小分子を有するタンパク質結合アプタマーの置換), Nat Protoc (2008), 3, 579-587)によって記述されるように、細胞突出活性、血管漏出、内皮透過性、および/または病的血管形成を抑制する薬剤を識別する方法は、アプタマー置換スクリーニングアッセイを含む。特に、そのような方法は、標的とされたARF-GEFで、サイトヘキシン、サイトヘキシンのARNOファミリーに属するサイトヘキシンまたはARNOのようなものの活性を抑制するために、小分子で、ここに記載するそれらのようなものの活性を識別し、そして確かめるのに用いることができる。そのような活性を確かめる際に、細胞突出活性、血管漏出、内皮透過性および/または病的血管形成を抑制することが可能な活性薬剤を識別することができる。そのようなアプタマー-置換スクリーニングアッセイは、蛍光のラベルが付いたアプタマータンパク質抑制剤に似た活性を有する小分子を識別するために、蛍光のラベルが付いたアプタマータンパク質抑制剤の置換を利用する。その標的を有するアプタマーは、蛍光偏光によって検出される。蛍光のラベルが付いたアプタマーは、非結合状態において偏光を見せる。標的タンパク質に結合するとき、蛍光のラベルが付いたアプタマーの蛍光偏光が増える。小分子が、アプタマーをタンパク質から置き換える場合、蛍光のラベルが付いたアプタマーの蛍光偏光は減少し、それによって蛍光のラベルが付いたアプタマーに似た活性を示す小分子候補の識別を許す。
概して、候補薬剤は、この技術で知られる方法に従い自然な、または合成の(または半合成の)抽出物または化学的ライブラリーのライブラリーから識別することができる。薬物発見および発達の分野において熟練した人々は、試験抽出物または化合物の正確な供給源が本発明のスクリーニング手法(群)にあまり重大でないことを理解する。したがって、事実上、任意の多くの化学的抽出物または化合物は、ここに記述する模範的な方法を使用して選別することができる。そのような抽出物の例または化合物には、制限されないが、以下が含まれ、植物-、菌類(fungal)-、原核生物-または動物-ベースの抽出物、発酵ブロス、および合成化合物、ならびに既存の化合物の修飾である。非常に多くの方法もまた、任意の多くの化学的合成物のランダムまたは定方向の合成の生成のために(例は、半合成または全合成)利用可能であり、制限されないが、糖類-、脂質-、ペプチド-、ポリペプチド-および核酸-ベースの化合物が含まれる。合成化合物のライブラリーは商業上利用可能であり、例は、Brandon Associates(ブランドン・アソシエーツ)(Merrimack(メリマック), NH(ニューハンプシャー州))およびAldrich Chemical(アルドリッチ・ケミカル)(Milwaukee(ミルウォーキー), WI(ウィスコンシン州))である。あるいは、細菌、菌類、植物、および動物の抽出物の形態においての自然な化合物のライブラリーは、多数の供給源から商業上入手可能であり、以下のものが含まれ、Biotics(バイオティクス)(Sussex, UK), Xenova(ゼノバ)(Slough, UK), Harbor Branch Oceangraphics Institute(ハーバー・ブランチ・オセアングラフィックス・インスティチュート)(Ft. Pierce, FIa.),およびPharmaMar(ファルマメア), U.S.A. (Cambridge, Mass.)である。そのうえ、自然な、および合成的に生産されたライブラリーは、必要により、この技術で知られる方法に従って、例は、標準的な抽出および分画の方法によって生産される。さらにまた、必要により、任意のライブラリーまたは化合物でも、標準的な化学的、物理的、または生化学的な方法を用いて、容易に修飾される。そのうえ、薬物の発見および発達の技術における熟練者は、可能な場合はいつでも、デレプリケーション(dereplication)(例は、分類学のデレプリケーション、生物学的デレプリケーション、および化学的デレプリケーション、または任意のそれらの組合せ)またはそれらの効果について既に知られた物質の複製または繰り返しの排除のための方法が採用されなければならないことを容易に理解する。
粗抽出物が望ましい活性を持つことが見出されるとき、ポジティブな(正の)リード抽出物の更なる画分は、観察された効果の原因である化学成分を分離することが必要である。このように、抽出、分画、および精製のプロセスのゴールは、脈管透過性を刺激または抑制する活性を持つ粗抽出物の範囲内の化学的実体の慎重な特徴づけおよび識別である。化合物の混合物における活性の検出のためにここに記述する同じアッセイは、活性な構成要素を精製し、そしてその誘導体を試験するのに用いられることができる。分画とそのような不均一な抽出物の精製の方法は、この技術において知られている。必要に応じ、処置のための役に立つ薬剤であることが示される化合物は、この技術で知られている方法によって、化学的に修飾される。治療上の価値があると確認される化合物は、それが脈管透過性を規制するのを望まれる病気または条件のための動物モデルを使ってその後分析しうる。
対象体において、細胞突出活性、血管漏出、内皮透過性、および/または病的血管形成を抑制する方法もここに提供する。ここに詳述するように、Robo4の活性化は、ARF6の活性化を抑制し、または減らし、そしてそれによって脈管透過性を抑制する。ここに記載するように、Robo4シグナリングの活性化はGIT1のパキシリンの活性化の惹起を通してそのような効果を達成し、それは、次に、ARF6のGIT1抑制を導く。したがって、1種の具体例において、ここに記載するように、細胞突出活性、血液漏出、内皮透過性、および/または病的血管形成を抑制するための方法は、ここに記載するような組成物の治療上効果的な量を、それが必要な対象体に投与することを具える。1種のそのような具体例において、Racの抑制、VEGFによるRac活性化の抑制、内皮細胞バリア機能の保存、VEGFレセプターの下流のVEGFシグナリングの抑制、血液漏出の抑制、および多重の血管形成、透過性および炎症性因子の抑制の1種またはそれよりも多くのものから選ばれる効果を達成するために、その方法は、本明細書の記載に従いRobo4リガンドの治療上効果的な量を投与することを含む。
しかし、ここにさらに記載するように、脈管透過性の抑制またはRobo4シグナリングから生じる病的血管形成はRobo4の活性化なしで達成することができ、特に、ここに記述されるようなRobo4シグナル経路での1種またはそれよりも多くの下流の工程の調節が、細胞突出活性、血液漏出、内皮透過性および/または病的血管形成を抑制することもできる。1種のそのような具体例では、ここに記載する方法は、そのようにして、Racの抑制、VEGFによるRac活性化の抑制、内皮細胞バリア機能の保存、VEGFレセプターの下流のVEGFシグナリングの抑制、血液漏出の抑制および多重の血管形成、透過性および炎症性の因子の抑制の1種またはそれよりも多くのものから選ばれる効果を達成するために、Robo4シグナリング経路において1種またはそれよりも多くの工程を調節することを含む。
1種のそのような具体例では、ここに記載するような方法は、ARF6の活性化を、直接または間接的に抑制することを含む。たとえば、1種の具体例において、細胞突出活性、血液漏出、内皮透過性、および/または病的血管形成を抑制するための方法は、ARF6の上流のアクチベーターを抑制することを含む。1種のそのような具体例において、タンパク質のARFファミリーの1種またはそれよりも多くのタンパク質の活性が減らされるように、その方法には、1種またはそれよりも多くのARF-GEFまたは他のサイトヘシンファミリーのGEFsの活性を抑制することを含む。たとえば、その方法は、より一層少ないARF6タンパク質がGTP結合状態にあるように、サイトヘシンで、ARNOまたはサイトヘシンのARNOファミリーに属するサイトヘシンのようなものの活性、活性化または利用能を減少させる1種またはそれよりも多くの分子を含む組成を提供することを含むことができ、それによって活性ARFタンパク質のプールが減らされる。別のそのような具体例において、その方法はARF6の上流の抑制剤の活性を促進することを含む。1種のそのような具体例において、タンパク質のARFファミリーからの1種またはそれよりも多くのタンパク質の活性または活性化が減らされるように、その方法は1種またはそれよりも多くのARF-GAPの活性を増やすことを含む。たとえば、その方法は、より一層少ないARFタンパク質が活性化されるように、個々のGit1タンパク質の活性または利用能を増やし、それで、ARFタンパク質を介して作用するか、またはそれによって伝播される(propogated)シグナルカスケードを減らす1種またはそれよりも多くの分子を含む組成を提供することを含みうる。そのような具体例において、タンパク質のARFファミリーの活性が標的とされる場合に、影響を受けるARFタンパク質(群)は、たとえば、ARF6およびARF1から選ばれうる。
細胞突出活性、血液漏出、内皮透過性および/または病的血管形成を抑制するための方法の各々には、ここに記載するような組成は、直接ARF6活性を抑制し、ARF6の上流のアクチベーターを抑制するか、またはARF6の上流のアクチベーターを促進するのに用いることができる。特定の具体化において、細胞突出活性、血液漏出、内皮透過性および/または病的血管形成を抑制する方法には、ここに記載するように、小分子、タンパク質、ペプチドまたは核酸の投与によるARF6活性を抑制することが含まれる。別の具体例において、脈管透過性または病的血管形成を抑制する方法には、ARF-GAPで、Git1のようなもののアクチベーターの投与によってARF6活性を抑制することが含まれる。さらに別の具体例において、細胞突出活性、血液漏出、内皮透過性および/または病的血管形成を抑制する方法には、RacのARF6活性化の抑制剤を投与することを含む。
特定の具体例において、ここに記載されるような血液漏出または内皮透過性のための方法には、細胞突出活性、血液漏出、内皮透過性、および/または病的血管形成を抑制することが含まれ、それらは、対象体によって経験され、対象体は、サイトカインストーム、移植片対宿主病(GVHD)、成人呼吸窮迫症候群(ARDS)、敗血症、トリインフルエンザ、天然痘、および全身性(systemmic)炎症性反応症候群(SIRS)、虚血/再灌流傷害に次ぐ脳卒中または心筋梗塞、脳腫瘍と関係する浮腫、悪性病変と関係する腹水症、メイグスの症候群、肺炎症、ネフローゼ症候群、心嚢貯留液および胸水、炎症、アレルギー疾患、ガン、脳卒中発作(cerebral stroke)、心筋梗塞、肺でのおよび心臓での機能不全、腎不全、および網膜症を招きうる感染性および非感染性の病気から選ばれる病気の状態と関係する。
追加的に、特定の具体例において、ここに記載するような病的血管形成を抑制するための方法には、対象体によって経験され、次のものから選ばれる病気状態と関係する病的血管形成を抑制することが含まれ、それらは、血管腫、固形腫瘍、白血病、転移、毛細管拡張症乾癬強皮症、化膿性肉芽腫、心筋血管形成、プラーク新血管新生、冠血管側枝、虚血性肢血管形成、角膜病気、ルベオーシス、血管新生緑内障、糖尿病性網膜症(DR)、後水晶体線維増殖症、非増殖性糖尿病性黄斑浮腫(DME)、関節炎、糖尿病性新血管新生、加齢黄斑変性(AMD)、未熟児網膜症(ROP)、虚血性網膜静脈閉塞症(IRVO)、傷治癒、消化性潰瘍、骨折、ケロイド、脈管形成、造血発生、排卵、月経、および胎盤形成からである。
別の具体例において、トリインフルエンザを処置または予防する方法が提供され、そこでは、その方法は、前記トリインフルエンザを持つ、または持つ危険がある対象体を識別すること、および対象体にここに記載する組成物の治療上効果的な量を施すことを具える。
別の具体例で、成人呼吸促迫症候群(ARDS)を処置または予防する方法が提供され、そこで、方法は前記ARDSを持つ、または持つ危険がある対象体を確認し、および対象体にここに記載する組成物の治療上効果的な量を施すことを具える。
別の具体例では、全身性炎症反応症候群(SIRS)を処置または防止する方法が提供され、そこで、その方法は前記SIRSを持つ、または持つ危険がある対象体を確認し、およし対象体にここに記載する組成物の治療上効果的な量を施すことを具える。
別の具体例で、移植片対宿主病(GVHD)を処置または予防する方法が提供され、そこで、その方法は前記RDSを持つ、または持つ危険がある対象体を確認し、および対象体にここに記載する組成物の治療上効果的な量を施すことを具える。
別の具体例で、腫瘍形成または増殖を処置または防ぐ方法が提供され、そこで、その方法は前記腫瘍形成または増殖を持つ、または持つ危険がある対象体を確認し、および対象体にここに記載する組成物の治療上効果的な量を施すことを具える。
別の具体例において、呼吸促迫症候群(RDS)を処置または予防する方法が提供され、そこで、その方法は前記RDSを持つ、または持つ危険がある対象体を確認し、および対象体にここに記載する組成物の治療上効果的な量を施すことを具える。
別の具体例で、対象体において虚血性網膜静脈閉塞(IRVO)を処置または予防する(preventin)方法が提供され、そこで、その方法は前記IRVOを持つ、または持つ危険がある対象体を確認すること、そして対象体にここに記載する組成物の治療上効果的な量を施すことを具える。
別の具体例において、対象体で非増殖性糖尿病性黄斑浮腫(DME)を処置または予防する方法が提供され、そこで、その方法は前記DMEを持つ、または持つ危険がある対象体を確認し、そして対象体にここに記載する組成物の治療上効果的な量を施すことを具える。
別の具体例において、未熟児網膜症(ROP)を処置または予防する方法が提供され、そこで、その方法は前記ROPを持つ、または持つ危険がある対象体を確認し、そして対象体にここに記載する組成物の治療上効果的な量を施すことを具える。
別の具体例において、対象体で糖尿病性網膜症(DR)を処置または予防する方法が提供され、そこで、その方法は前記DRを持つ、または持つ危険がある対象体を確認し、そして対象体にここに記載する組成物の治療上効果的な量を施すことを具える。
別の具体例において、対象体で湿性(wet)黄斑変性症(AMD)を処置または防ぐ方法が提供され、そこで、その方法は前記AMDを持つ、または持つ危険がある対象体を確認し、対象体にここに記載する組成物の治療上効果的な量を施すことを具える。
別の具体例化において、対象体で虚血を処置または防ぐ方法が提供され、そこで、その方法は前記虚血を持つ、または持つ危険がある対象体を確認し、そして対象体にここに記載する組成物の治療上効果的な量を施すことを具える。
別の具体例で、対象体で出血性卒中を処置または予防する方法が提供され、そこでその方法は、前記出血性卒中を持つ、または持つ危険がある対象体を確認し、そして対象体にここに記載する組成物の治療上効果的な量を施すことを具える。
別の具体例では、対象体において、再灌流傷害で、心筋梗塞および脳卒中において観察されるようなものを処置または防ぐ方法が提供され、そこでその方法は、前記再灌流傷害を持つ、または持つ危険がある対象体を確認し、そして対象体にここに記載する組成物の治療上効果的な量を施すことを具える。
別の具体例において、対象体で真皮脈管傷(ブレミッシュ)または形成異常を処置または予防する方法が提供され、そこで、その方法は前記傷を持つ、または持つ危険がある対象体を確認し、そして対象体の皮膚にここに記載する組成物の治療上効果的な量を施すことを具える。
若干の局面では、対象体は医学的診断によって確認される。たとえば、糖尿病性網膜症および黄斑変性症を有する対象体は、眼において過剰な血管の視覚化によって確認することができる。急性肺傷害は、うっ血性心不全(congetive heart failure)の不存在において肺水腫によって診断することができる。虚血性発作(脳卒中)は、神経性の症状およびイメージング(MRIおよびCT)によって診断することができる。他の既知または新しく発見される医学上の決定は、明らかにされた方法における使用のために対象体を確認するのに用いることができる。
そのうえ、対象体は遺伝的素因(genetic predisposition)によって確認することができる。たとえば、患者の加齢黄斑変性の素因になる遺伝子は特定された(Klein(クライン)RJ, et al, 2005; Yang(ヤン)Z, et al. 2006; Dewan(デューアン)A, et al. 2006)。同様に、脳において患者の脈管形成異常の素因になる遺伝子変異は確認された(Plummer(プラマー)NW, et al., 2005)。他の既知または新しく発見される遺伝子の決定は、明らかにされた方法における使用のために対象体を確認するのに用いることができる。
例
あとに続く例は、例証(実例)の目的だけに対して供され、そしてどんな形であれ、ここに記述する組成物および方法の範囲を制限することを意図しない。それぞれの例では、特に明記しない限り、標準的な材料および方法が、提供される例において記述される仕事を実行する際に用いられた。本明細書におけるすべての特許および引用する刊行物の参照は、その全体において参照することによってここに組み込む。
本発明の実践は、特に明記しない限り、化学、分子生物学、細菌学、組換えDNA、遺伝学、免疫学、細胞生物学、細胞培養およびトランスジェニック生物学の慣習的な技術を採用するもので、それはこの技術の技量の範囲内である(例は、Maniatis, T., et al. (1982) Molecular Cloning: A Laboratory Manual (Cold Spring Harbor Laboratory, Cold Spring Harbor, N.Y.); Sambrook, J., et al. (1989) Molecular Cloning: A Laboratory Manual, 2nd Ed. (Cold Spring Harbor Laboratory, Cold Spring Harbor, N. Y.); Ausubel, F. M., et al. (1992) Current Protocols in Molecular Biology, (J. Wiley and Sons, NY); Glover, D. (1985) DNA Cloning, I and II (Oxford Press); Anand, R. (1992) Techniques for the Analysis of Complex Genomes, (Academic Press); Guthrie, G. and Fink, G. R. (1991) Guide to Yeast Genetics and Molecular Biology (Academic Press); Harlow and Lane (1988) Antibodies: A Laboratory Manual (Cold Spring Harbor Laboratory, Cold Spring Harbor, N. Y.); Jakoby, W. B. and Pastan, I. H. (eds.) (1979) Cell Culture. Methods in Enzymology, Vol. 58 (Academic Press, Inc., Harcourt Brace Jovanovich (NY); Nucleic Acid Hybridization (B. D. Hames & S. J. Higgins eds. 1984); Transcription And Translation (B. D. Hames & S. J. Higgins eds. 1984); Culture Of Animal Cells (R. I. Freshney, Alan R. Liss, Inc., 1987); Immobilized Cells And Enzymes (IRL Press, 1986); B. Perbal, A Practical Guide To Molecular Cloning (1984); the treatise, Methods In Enzymology (Academic Press, Inc., N.Y.); Gene Transfer Vectors For Mammalian Cells (J. H. Miller and M. P. Calos eds., 1987, Cold Spring Harbor Laboratory); Methods In Enzymology, VoIs. 154 and 155 (Wu et al. eds.), Immunochemical Methods In Cell And Molecular Biology (Mayer and Walker, eds., Academic Press, London, 1987); Handbook Of Experimental Immunology, Volumes I-IV (D. M. Weir and C. C. Blackwell, eds., 1986); Hogan et al. (eds) (1994) Manipulating the Mouse Embryo. A Laboratory Manual, 2n Edition, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N. Y. A general discussion of techniques and materials for human gene mapping, including mapping of human chromosome 1, is provided, e.g., in White and Lalouel (1988) Ann. Rev. Genet. 22:259 279参照。本発明の実践は、特に明記しない限り、化学、分子生物学、細菌学、組換えDNA、遺伝学、および免疫学の慣習的な技術を採用する。(例は、Maniatis et al., 1982; Sambrook et al., 1989; Ausubel et al., 1992; Glover, 1985; Anand, 1992; Guthrie and Fink, 1991参照)。
ここでは何も、本発明が先の発明によってそのような開示に先だつ権利がないというアドミッション(認識)として解釈されることはない。いかなる参照も先行技術を構成するというアドミッションは行われない。参照文献の議論は、それらの著者が断言するものを述べ、そして出願人は引用された文書の正確さ、および適切さに疑問を呈する権利を保有する。多数の出版物がここに参照されるが、そのような参照がこの技術における共通の技術常識の1部分を形成するというアドミッションを構成しないということは明らかに理解される。
例1
Robo4がインビボで血管のガイダンスのために必要である:過去の10年間に、ゼブラフィッシュは脈管の発達の分析のための魅力的なモデルになって(Weinstein(ウェインスタイン), 2002)、そしてインビボでRobo4の生物学的重要性を研究するために選ばれた。Robo4遺伝子発現を抑えるために、Robo4プレmRNAのエキソン10-イントロン10バウンダリ(境界線)を標的とする以前に述べたスプライス-ブロッキングモルフォリノ(Bedell(ベデル)et al., 2005)が、使われた。Robo4モルフォリノの有効性を確かめるために、RNAを、注入されない(un-injected)、およびモルフォリノ注入された胚から分離し、および標的化されたエクソン(図8A)の側面に位置するプライマーを用いて、RT-PCRによって分析した。注入されないコントロールと比較するとき、Robo4モルフォリノの注入は野生型のRNAの完全な損失を招き、モルファントのゼブラフィッシュがRobo4のために機能的にヌル(無効)なことを示した(図8B)。
TG(fli1:egfp)y1ゼブラフィッシュ胚は、内皮特異的な(endothelialspecific)flilのプロモーターの制御下の緑色蛍光タンパク質を発言し、および生体内で発達する内皮の詳細な視覚化が許容され、それは脈管の発達に関してRobo4のモルフォリノ-媒介ノックダウンのコンセンサス(成り行き)を評価するために利用した(図1A;Lawson(ローソン)およびWeinstein(ウェインスタイン), 2002)。48hpfで、Robo4 MO-注射の胚は、主軸の血管の野生型の形成(背部大動脈および後主静脈)、ならびに背側縦方向吻合血管(dorsal longitudinal anastomotic vessel)およびパラコルダル(parachordal、パラ腱の)血管を見せ、脈管形成および血管形成が、それぞれ、Robo4レベルの減少により影響を受けないことが指し示された(図1B、右側パネル)。しかし、異常性の著明な程度は、Robo4モルフォラントにおいてセグメント(体節)間血管のアーキテクチャー(建築物)で観察された。野生型の胚において、体節間血管は背部大動脈から起こり、そして胚の背面の方へ増殖し、体節の境界線にきつく並べて置かれる。それは、体節間血管の特徴的な山形形状を定める体節の間のこの正確な軌道である(図1A、右側パネル)。このステレオタイプの(常同的)パターンの適合よりはむしろ、Robo4のモルファントの胚の体節間血管は間違った方向を成長させた(図1B、右側パネル:白色矢は、異常な血管を指し示す)。48hpfで、野生型の胚の5%と比較して、Robo MOを注射される60%の胚は、この欠陥を見せた。重要なことに、Robo4モルファントは位相差顕微鏡法によってコントロール胚から見分けがつかず、観察された脈管パターニング障害は著しい形態的な混乱の結果ではなかったことを指し示した。一緒に、これらのデータはゼブラフィッシュの脈管の発達の間、Robo4のための要件を実証し、そしてレセプターからの機能的な出力がリパルシブなガイダンスキューを引き出すことを示唆する。
例2
Robo4の細胞質テイル(Tail)は、生体内で脈管ガイダンスのために要求される:Robo4モルファントにおいて観察された脈管欠陥がrobo4の再構成によって抑制されうるかどうかが次に定められた。robo4 MOおよび野生型のネズミRobo4 RNAは、モルフォリノに不応性であり、それらはTG(flil:egfp)yl胚に注射され、そして脈管パターニングが48hpfで分析された。Robo4 RNAは、トランク(躯幹)血管の常同的なパターニングを、約60%のモルファントな胚において回復させ、遺伝子ノックダウン特異性が確かめられた(図1BおよびC、右側パネル)。
脈管の発達を規制するためのrobo4の能力は、たぶん細胞質の信号を送るその能力の成り行きである。この概念を立証するために、Robo4 MOおよび細胞質の構成要素(robo4Δテイル)と相互作用するレセプターの部分を欠くネズミRobo4の変種形態を、コインジェクト(同時注入)し、そして管の建築物の評価を48hpfでした。野生型のRobo4 RNAとは異なり、robo4Δテイルはモルファントな胚におけるパターニング欠陥を救うことができなかった(図1BおよびD、右側パネル)。これらのデータは、Robo4の細胞質のテイル(尾部)に含まれる情報がゼブラフィッシュの胚形成の間、脈管ガイダンスのために重要であることを実証する。全体で、これらの生体内分析は、Robo4活性が、脊椎動物の脈管の発達の間に体節間血管の軌跡を正確に定めるために必要であることを指し示す(図1E)。
例3
Robo4の細胞質テイルは走触性の抑制のために要求される:Slit2-Robo4シグナリングは、VEGFの勾配の方への一次内皮細胞(primary endothelial cell)の、および血清の方へのRobo4を異所性に発現するHEK 293細胞の移動を抑制する(Park et al., 2003; Seth et al., 2005)。可溶性増殖因子に加え、フィブロネクチンのような固定化細胞外基質タンパク質は、細胞の運動性において重要な役割を演じ(Ridley(リドリー)et al., 2003)、そしてフィブロネクチンの勾配は走触性(haptotaxis)と呼ばれるプロセスにおいて移動を指示することができる。実際に、フィブロネクチンがゼブラフィッシュの初期胚において移動性の内皮細胞に隣接して沈澱することが示されている(Jin(ジン)et al., 2005)。Robo4が生体内でふさわしい内皮細胞移動のために必要であるという観察結果(図1)は、フィブロネクチン誘発走触性を調整するためのSlit2-Robo4シグナリングの能力を指し示した。HEK293セルはRobo4またはRobo4ΔTailでトランスフェクションされ(図2A)、そしてフィブロネクチンおよびSlit2(Slit2N(配列番号7))の混合物を用いてコートされた膜上で走触性の移動アッセイを受けた。Slit2は、Robo4ΔTailでなく、Robo4を発現する細胞のフィブロネクチン誘発移動を抑制し、Robo4細胞質テイルがレセプターのリパルシブな活性のために重要であることを実証した(図2B)。
細胞移動の抑制のために必要であるRobo4細胞質テイルの領域が次に定められた。HEK293細胞は、Robo4欠失構築物でトランスフェクションし(図2A)、そして走触性の移動アッセイを受けた。Robo4-NH2を発現する細胞のフィブロネクチン依存移動はRobo4-COOH以外で、Slit2によって抑制され(図2C)、そしてRobo4細胞質テイルのN末端半分が細胞運動性の調節(modulation)に必要であり、そして十分なことが実証された。
Slit2-Robo4シグナリングが伝播するのを抑制するかどうかを評価するために、本発明者れはRobo4、Robo4 ED-TMまたは空のベクター(pcDNA3)でHEK293細胞をトランスフェクションし、フィブロネクチン上でそれらを付着させ、および伝播アッセイを受けさせた。Robo4を発現する細胞が正常にフィブロネクチンおよびSlit2で被覆したカバーグラスに付着したが(データは示さない)、それらがRobo4 ED-TMまたはpcDNA3でトランスフェクションした細胞よりも有意に少なく伝播し(図26B)、Slit2-Robo4シグナリングが細胞伝播を制御する細胞内経路を調節することを示した。
伝播を抑制するRobo4 ED-TMの不能は、Robo4細胞質ドメインがこの活性のために必要とされることを示し、それが伝播の抑制のために十分かどうか試験するために、本発明者らがαllbインテグリン-Robo4のキメラのタンパク質を生じさせ、そこでRobo4の細胞質ドメインがインテグリンαllbサブユニットのC末端テイルに融合し(αIIb-Robo4)、このようにして、本発明者らが、フィブリノゲン、αllbβ3インテグリンのためのリガンドを有するRobo4シグナリングを惹起することができるようにした。我々は、αllbおよびβ3サブユニット(αllb:β3)またはフィブロネクチン単独またはフィブロネクチン/フィブリノゲンの混合物上でのαIIb-Robo4およびβ3サブユニット(αIIb-Robo4:β3)を発現するチャイニーズハムスター卵巣(CHO-K1)細胞を平板培養した。αllb:β3発現細胞はどちらのマトリックスででも同じ範囲に伝播し、その一方αIIb-Robo4:β3発現細胞は、フィブリノゲンの存在において有意に抑制された(図26C)。
我々は、次に、細胞移動の抑制のために必要とされるRobo4細胞質テイルの領域を定めた。HEK293細胞をRobo4欠失構築物(図26A)でトランスフェクションし、そして走触性移動アッセイを受けさせた。Robo4-NH2を発現する細胞のフィブロネクチン依存的な移動は、Robo4-COOH以外で、Slit2によって抑制されなず(Slit2N(配列番号7))(図2C)、Robo4細胞質テイルのN末端半分が細胞運動性の調節に必要であり、そしてそれに十分であることが例証された。
例4
パキシリンファミリーのメンバーは、Robo4相互作用性タンパク質である:機能的な活性を与えるRobo4細胞質テイルの領域の識別は、Robo4のシグナル伝達を規制するかもしれない細胞質の構成要素のための検索を許した。ベイト(餌)としてRobo4テイルのN末端半分を用いて、ヒト大動脈cDNAライブラリーの酵母(イースト)2-ハイブリッドスクリーニング法を実行し、それはアダプタータンパク質、Hic-5のパキシリンファミリーのメンバーを、潜在的なRobo4相互作用性タンパク質として確認した(図8)。この相互作用を確かめるために、Hic-5プラスミドを分離し、そして酵母中に、Robo4またはエンプティ(空)のベクターを再形質移入した。Robo4およびHic-5を同時発現する株だけは、栄養分欠損媒体上で増殖し、そして頑強なベータガラクトシダーゼ活性を誘発する資格があった(図8B)。さらにこの相互作用を確かめるために、免疫共沈降実験を、Hic-5およびRobo4細胞質テイルで同時トランスフェクションさせた哺乳類の細胞を使って実行した。Hic-5は、Hic-5だけでなく、Robo4およびHic-5を発現するHEK293細胞の抗Robo4免疫沈降において見出された(図3A)。まとめると、これらのデータは、Hic-5が特に、酵母および哺乳類の細胞においてRobo4細胞質テイルと相互作用することを実証する。
Hic-5およびそのパラログ(paralog)、パラキシリンは、細胞タイプ特異的発現を見せることができる(Turner(ターナー), 2000; Yuminamochi(ユミナモチ)et al., 2003)。この理由から、これらのタンパク質のものがHEK293細胞において発現したことが定められ、細胞系が走触性移動アッセイにおいて使われた。CHO-K1、HEK 293およびHic-5またはパキシリンに対する抗体を有するNIH3T3細胞からの細胞溶解物のウエスタンブロット分析は、すべての細胞系でパキシリンを見出し、ところが、Hic-5はCHO-K1およびNIH3T3細胞で見出されるだけだった(図3B)。これはHic-5およびパキシリンが細胞移動を規制するためにRobo4と相互作用することができることだけでなく、パキシリンが、HEK293細胞の有望な結合パートナー(相手)であることを示唆した。この後者の考えを考慮して、免疫共沈降実験は、パキシリンおよびRobo4細胞質テイルを発現する哺乳類の細胞を使って実行した。Hic-5で観察されたように、パキシリンは、パキシリンだけでなく、パキシリンおよびRobo4を発現するHEK293細胞の抗Robo4免疫沈降において確認された(図3C)。
Slit2がRobo4の生理的リガンドであるので(Park et al., 2003; Hohenester(ホーエンエスター)et al., 2006)、Slit2刺激がRobo4およびパキシリンの間の相互作用を規制したかどうかは決定した。Robo4を発現するHEK 293細胞を、Slit2の有無においてインキュベーションした(Slit2N(配列番号7))。Slit2の存在下、内因性パキシリンは、Robo4免疫沈降において検出された。著しく対照的に、Slit2が不存在である場合、パキシリンは免疫沈降において何も検出されなかった(図3E)。このように、Slit2によるRobo4の関わりは、パキシリンとのその関連を刺激した。
例5
Robo4のパキシリン相互作用モチーフの識別:パキシリンとの相互作用に必要であるRobo4の領域を正確に規定するために、細胞質テイルのすべての長さにわたる一連のGST-Robo4融合タンパク質を創作した(図4A)。精製した組換え型パキシリンでの試験管内の結合アッセイは、Robo4テイル(494-731)のアミノ末端半分がパキシリンとの直接的な相互作用に必要であり、および十分であることを実証した(図4B)。細胞質テイルのアミノ末端半分の約70個のアミノ酸断片を包含する4つの付加的なGST-Robo4融合タンパク質は、それから生成した(図4C)。試験管内での結合アッセイは、パキシリンが選択的に、CC0およびCC2のモチーフの間で備わるRobo4テイルの断片と相互作用することを明らかにした(604-674;図4D)。Robo4のこの領域がパキシリンと相互作用するために必要であったかどうか決定するために、アミノ酸604-674を、細胞質テイルから削除し、そしてこの変種GST-Robo4融合タンパク質を試験管内での結合アッセイにかけた。パキシリンとの相互作用が弱められる間、それは、既知のRobo4-結合タンパク質、メナ(Mena)と相互作用し、アミノ酸604-674の排除がRobo4テイルのコンフォメーション(立体構造)に影響を及ぼすことが指し示された。この問題を回避するために、より一層小さな欠失を、この70個のアミノ酸ストレッチ(伸展)の範囲内で創作され、そして追加的な試験管内での結合アッセイが実行された。このアプローチを用いて、変種GST-Robo4融合タンパク質は、36個のアミノ酸を欠くとして識別され(604-639;図9)、それはパキシリンへの結合を失うが、メナへの結合は保持された(図4E)。Robo4のこの領域は、パキシリン相互作用のモチーフ(PIM)としてこれまでに呼ばれる。
例6
パキシリン相互作用のモチーフは走触性のRobo4依存抑制のために必要である:Robo4のパキシリン相互作用のモチーフがレセプターの機能的な活性にとって重要かどうかが次に決定された。アミノ酸604-639(Robo4ΔPIM)を欠く全長Robo4の変種の形態を、部位特異的変異誘発によって生成し、走触性の移動のアッセイにおいて使った。Robo4ΔPIMはフィブロネクチンの勾配の方への移動のSlit2誘導抑制を媒介しないで(図4F)、パキシリン結合のために必要なRobo4テイルの領域が同様に細胞移動のRobo4依存抑制のために必要であることが実証された。
例7
Slit2-Robo4シグナリングは、細胞拡散およびRacおよびARF6を抑制する:フィブロネクチン上でRobo4を発現する細胞の移動を抑制する固定されたSlit2の能力は、このECMタンパク質上での付着および/または拡散の否定的な規制から潜在的に生じることがありえた。Slit2-Robo4シグナリングがこれらのプロセスに影響するかどうか決定するために、HEK 293細胞を、Robo4または空ベクター(pcDNA3)でトランスフェクションし、そしてフィブロネクチン上で付着および拡散のアッセイを受けさせた。Robo4を発現する細胞は通常、フィブロネクチンおよびSlit2(Slit2N(配列番号7))でコートしたカバーグラスに付着したが、それらはpcDNA3でトランスフェクションする細胞よりあまり拡散しなかった(図5A)。これらのデータは、Slit2-Robo4シグナリングが拡散する細胞を制御する細胞内経路を調整することを指し示す。
ECMタンパク質で、フィブロネクチンのようなものの上に拡がる細胞の能力は、小さなGTPasesのRhoファミリーの活性化によって規制され、それにはRho、Cdc42およびRacの移動が含まれる(Nobes(ノウブズ)およびHall(ホール), 1995; NobesおよびHall, 1998)。これらのタンパク質のうち、Racは、細胞を拡散および移動に導くアクチン重合を促すことで重要な役割を演じる((NobesおよびHall, 1995; NobesおよびHall, 1998)。Racおよび細胞拡散の間のこの確立した関係は、Slit2-Robo4シグナリングがRacの付着依存活性化を抑制するかもしれないことを指し示した。この可能性を評価するために、HEK 293細胞を、Robo4またはpcDNA3でトランスフェクションし、フィブロネクチンおよびSlit2(Slit2N(配列番号7))でコートされるディッシュ上へ板状培養し、そしてRac-GTPのレベルをGST-PBDのプルダウン(引き下ろし)アッセイを使ってアッセイした。追加的に、αIIb:β3またはαIIb-robo4:β3を発現する細胞をフィブロネクチンおよびフィブリノーゲン上で板状培養し、そしてRac-GTPレベルを分析した。Robo4またはαIIb-Robo4:β3を発現する細胞は、著しく少ない付着刺激されたRac活性化をみせ、それはpcDNA3またはαIIb:β3でトランスフェクトした細胞と比較したときである(図5B、5Cおよび図27)。
我々はRobo4ΔPIMを用いるこれらの実験を繰り返し、そしてこの変異受容体を発現する細胞がSlit2に効果がなかったことを見出した。
Cdc42活性化はまた、Robo4を発現する細胞において検討した。我々は、Robo4を発現する細胞においてCdc42活性化がSlit2への曝露によって変化しなかったことを見出した(図11A)。この結果は、Robo4がRobo1結合タンパク質srGAP1、Cdc42のための既知のGTPase活性化タンパク質と相互作用しないという観察によって支持される(図11B)。全体として、これらのデータは、Slit2-Robo4シグナリングが特異的にRacの付着誘導活性化を抑制することを実証する。
細胞伝播のRobo4依存的な抑制が主にRac活性化の抑制によっていたことを確認するために、我々はRobo4およびRac、Rac(G12V)の支配的な活性型を用い、HEK293細胞を、同時トランスフェクションし、それらに伝播アッセイを受けさせた。Rac(G 12V)を発現する細胞は、細胞伝播のRobo4依存的な抑制に効果がなく(図5G)、Slit2-Robo4シグナリングがRacを抑制することによって突出活性がブロックされることが例証された。
Robo4がパキシリンと相互作用し、そして突出活性を抑制するという我々の知見は、我々にRobo4シグナリングがARF6経路に影響を与えるかどうか定めることを促した。αIIb-Robo4:β3を発現する細胞を、フィブロネクチン単独で、またはフィブロネクチンおよびフィブリノーゲン上で板状培養し、そしてARF6-GTPレベルをGST-GGA3親和性沈降技術を使用することで分析した。フィブロネクチンがARF6の活性化を刺激する一方、フィブリノゲンはαIIb-Robo4:β3を発現する細胞においてArf6-GTPレベルを減らした(図16A)。この結果は、Robo4シグナリングがARF6活性化を抑制することを証明し、Rac活性をブロックするRobo4の能力がARF6のその規制から生じることを示唆した。
例8
パキシリン相互作用モチーフは細胞拡散およびRac活性化のRobo4依存抑制のために必要である:Robo4ΔPIMが、フィブロネクチン誘発細胞拡散およびRac活性化を抑制するのに有能であったかどうかが次に評価された。HEK 293細胞を、Robo4ΔPIMでトランスフェクションし、フィブロネクチンおよびSlit2をコートした表面上に板状培養し、そして拡散またはRacのアッセイを受けさせた。レセプターのこの変種の形態は、細胞拡散および付着依存Rac活性化を抑制することが不可能であり(図5D、EおよびF)、パキシリン相互作用のモチーフは、試験管内でRobo4の機能的な活性にとって不可欠なことが実証された。
細胞拡散のRobo4依存抑制が主にRac活性化の抑制によることを確認するために、HEK 293細胞を、Robo4およびRacの支配的な活性型、Rac(G12V)で同時トランスフェクションし、そして拡散アッセイを受けさせた。Rac(G12V)を発現する細胞は、細胞拡散のRobo4依存抑制に抵抗性であり(図5G)、Slit2-Robo4 シグナリングは、Rac活性を抑制することによって拡散をブロックすることが実証された。
例9
Slit2は、一次ヒト内皮細胞においてVEGF誘発Rac活性化を抑制する:Slit2はいくつかの一次ヒト内皮細胞系のVEGF刺激された移動を抑制し(Park et al., 2003)、およびRacはVEGF誘発細胞運動性におけるそののための重要な役割を演じる(Soga(ソガ)et al., 2001a; Soga et al., 2001b)。したがって、Slit2-Robo4シグナリングが内因性セッティングにおいてRac活性化を抑制することができたかどうかを決定した。ヒトの臍帯静脈内皮細胞(Umbilcal Vein Endothelial Cells)(HUVEC)はSlit2(Slit2N(配列番号7))の存在および不存在でVEGFで刺激され、そしてGTP-RacレベルがGST-PBDプルダウンアッセイを使ってアッセイされた。Slit2処置は完全にVEGF刺激されたRac活性化を抑圧し(図5HおよびI)、内因性Slit2-Robo4シグナリングはRac活性化を調整することが実証された。
例10
パキシリンのLim4は、Robo4との相互作用および細胞拡散のRobo4依存抑制のために必要である:Robo4ΔPIMがMenaとのその相互作用を維持するが(図4E)、この変異がパキシリン以外のタンパク質とのRobo4の相互作用を撹乱させたかもしれない。決定的にこの問題に対処するために、パキシリンの変種が生成され、それはRobo4との関連を崩壊させた。パキシリンは、N末端ロイシン/アスパラギン酸(LD)の繰返し、およびC末端Limドメインから構成されるモジュラータンパク質(調節タンパク質)である(図6A)。イースト2-ハイブリッドスクリーニング法から回収されるクローンの分析(図9A参照)は、Limドメイン、特にLim3およびLim4がRobo4との相互作用のために重要であることを指し示した。この概念を検証(バリデート)するために、免疫共沈降実験を、Robo4テイルおよびパキシリン-LDまたはパキシリン-Limのいずれかでもで同時トランスフェクションさせたHEK 293細胞を用いて実行した。パキシリン-Limは、パキシリン-LDではなく、Robo4免疫沈降において見出された(図6B)、パキシリンのLimドメインがRobo4との相互作用のために必要で、そして十分であることが実証された。どのLimドメインが、Robo4への結合のために必要かを明らかにするために、連続的削除をパキシリンのカルボキシ末端から行い、HEK 293細胞中にRobo4テイルで同時トランスフェクションし、そして免疫共沈降実験を実行した。パキシリンのLim4ドメインの削除はRobo4への結合を完全に無効にし(図6C)、パキシリンのこの領域がRobo4と相互作用するその能力のために重要であることが実証された。
パキシリン上のRobo4結合部位の描写は、細胞拡散のRobo4依存抑制において、パキシリンの役割の直接的な評価を許した。内因性パキシリンは、HEK 293細胞において、siRNAを使ってノックダウンされ、そして野生型チキンのパキシリン(Ch-パキシリン)またはCh-パキシリンΔLim4で再構成された(図6D)。これらの細胞は次いで、フィブロネクチンおよびSlit2(Slit2N(配列番号7))でコートされたカバーグラス上で拡散アッセイを受けさせられた。Ch-パキシリンΔLim4を発現する細胞は、細胞拡散のRobo4依存抑制に抵抗性であり、一方、Ch-パキシリンを発現する細胞は細胞エリアの特徴のある減少をしめした(図6E)。これらのデータは、Robo4とのパキシリンの相互作用はSlit2-Robo4シグナリングが細胞拡散を抑圧するのを可能にすることを確認する。
例11
パキシリン相互作用モチーフは、生体内で脈管ガイダンスのために必要である:ゼブラフィッシュの脈管発達の間のRobo4のパキシリン相互作用のモチーフの要件をアッセイした。以前に記述するように、TG(fli1:egfp)y1胚へのrobo4 MOの注入は、体節間管の混乱を引き起こした(図1B参照)。robo4ΔPIM RNAの同時注入はrobo4 MOによって起因する欠陥を増悪させ、一方、野生型robo4 RNAがこれらの欠陥を抑圧した(7A図)。モルファントな胚の脈管パターニングの欠陥を救うためのrobo4Δテイルおよびrobo4ΔPlM RNAの双方の無能力は、36個のアミノ酸のパキシリン相互作用のモチーフがRobo4細胞質テイルにおける重要なシグナル伝達モジュールであることを実証する。さらに、これらのデータは、パキシリンおよびRobo4の間の相互作用がゼブラフィッシュの脈管構造のふさわしいパターニングにとって不可欠であることを指し示す。
例12
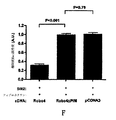
Robo4はRac-依存突出活性をARF6の抑制を通してブロックする:Robo4がパキシリンと相互作用し、そして突き出た活性を抑制するという本発明者らの決定は、本発明者らをRobo4がARF6経路を侵害するかどうか決定するように促した。αIIb-Robo4を発現する細胞:β3はフィブロネクチン単独、またはフィブロネクチンおよびフィブリノゲン上で板状培養し、そしてARF6-GTPレベルを、GST-GGA3アフィニティ(親和性)沈降技術を使用して分析した。フィブロネクチンがARF6の活性化を刺激する一方、フィブリノゲンはαIIb-Robo4:β3を発現する細胞においてARF6-GTPレベルを減らした(図16A)。この結果はRobo4シグナリングがARF6活性化を抑制することを実証し、そしてRac活性をブロックするRobo4の能力がARF6のその規制から発せられることを示唆した。
次に、本発明者らは突き出た活性のRobo4依存抑制において、パキシリン-GIT1複合体の要件を分析した。GIT1上のパキシリン結合性配列(PBS)は、タンパク質のカルボキシ末端で見出され、GIT1およびパキシリンの相互作用を防ぐことが示された(Uemura(ウエムラ)et al., 2006)。細胞は、αIIb-Robo4:β3および空のベクトルまたはGIT1-PBSのどちらかでトランスフェクションし、そしてフィブロネクチンまたはフィブロネクチンおよびフィブリノーゲン上で拡散アッセイを受けさせた。以前に解説するように、αIIb-Robo4:β3を発現する細胞は、フィブリノゲン上で板状培養するとき、細胞エリア(面積)の減少を表示し、しかし、これはGIT1-PBSとともにトランスフェクションする細胞において失われた(図16B)。本発明者らは、フィブロネクチンまたはフィブロネクチンおよびSlit2(Slit2N(配列番号7))の上で板状培養された全長Robo4を発現する細胞においてこの実験を繰り返し、そしてキメラのレセプターの実験と類似して、GIT1-PBSは、細胞エリアでのSlit2依存減少を防いだ(図16C)。これらのデータは、機能的なパキシリン-GIT1複合体がSlit2-Robo4シグナリングのために必要なことを実証する。
Slit2-Robo4シグナリングがARF6を不活性化することによって突き出た活性を抑制するかどうか決定するために、本発明者らはRobo4でARF6グアニンヌクレオチド交換因子ARNOを同時発現させ、そして拡散アッセイを実行した。ARNOの過剰発現は細胞エリアを減らすSlit2の能力をブロックし、Slit2-Robo4シグナリングの主要な影響がARF6のGTP-負荷を防ぐことであることが指し示された(図16C)。Robo4を発現する細胞のSlit2上に拡がる能力をARNOが元に戻すならば、本発明者らはそれが同様にフィブロネクチンに反応してRac活性化を再確立しなければならないと判断した。実際に、ARNOの過剰発現は、フィブロネクチンおよびSlit2上で板状培養される細胞において、GTP-Racの正常なレベルを導いた(図16D)。全体として、これらの実験はSlit2-Robo4シグナリングがARF6を不活性化することを実証し、それは細胞の拡散および移動のために、Rac活性化のローカル(局所的)遮断(local blockade)および必要な膜突起のその後の抑制を導く。
例13
免疫沈降は、SlitリガンドおよびRobo4レセプターの間の相互作用を実証する:トランスフェクションされないヒト胚腎臓細胞(HEK)、Slitにmycエピトープをタグ付けしてトランスフェクションしたHEK細胞(Slit-myc)、Robo4にHAエピトープをタグ付けしてトランスフェクションしたHEK細胞(Robo4-HA)およびコントロールベクターでトランスフェクションしたHEK細胞(コントロール-HEK)からの細胞溶解物を、免疫沈降させた(immunopreciptated)。Slit-mycタンパク質は、Slit-mycおよびRobo4-HA細胞溶解物を組み合せ、そして抗HA抗体とともに免疫沈降させた後、抗myc抗体でウエスタンブロットによって検出した(図17A、レーン6)。この相互作用の特異性は、溶解物の他の全ての組合せで検出可能なSlitタンパク質の不存在によって確かめた(図17A、レーン2-5)。溶解物の同じ量を、各々の実験で使った。Slit-myc細胞溶解物のウエスタンブロット分析は、コントロールとして役立ち、そしてSlitタンパク質が以前の報告に従っておよそ210kDの質量を持つことを実証した(図17 A、レーン1)。図17Aのレーン2-6で示される下側バンドは、免疫グロブリン重鎖に対応する。
トレンスフェクションされてないHEK細胞(HEK CM)、Slitにmycエピトープをタグ付けしてトランスフェクションしたHEK細胞(Slit-myc CM)、Robo4のN末端可溶性外部ドメイン にHAエピトープをタグ付けしてトランスフェクションしたHEK細胞(NRobo4-HA CM)およびコントロールベクターでトランスフェクションしたHEK細胞(コントロールHEK CM)からの条件培地もまた、免疫沈降させた。全長のSlit-mycタンパク質(210KD)およびそのC末端タンパク質分解断片(70KD)を、抗myc抗体によって、Slit-myc CMにおいて検出した(図17B、レーン1)。Slit-mycタンパク質はまた、Slit-mycおよびRobo4-HA条件培地を組み合せ、そして抗HA抗体とともに免疫沈降した後、ウエスタンブロットによって検出した(図17B、レーン6)。この相互作用の特異性は、条件培地の他の全ての組合せで、Slitタンパク質の不存在によって確かめられた。
図17Cから図17Fを通して示されるように、Slitタンパク質はRobo4を発現する細胞の原形質膜と結合する。Slit-mycタンパク質の結合は、抗myc抗体を使って検出され、そしてAlexa(アレクサ)594は抗マウス抗体を接合した。図17Dおよび図17Fにおいて分かるように、結合はコントロールHEK細胞(図17D)ではなく、Robo4-HEK細胞(図17F)の表面上で検出された。
例14
Robo4ノックアウトマウス:生体内でRobo4の機能的な重要性を解明するために、ノックアウトマウスを、標準的な技術を使用して生産した。ノックアウトマウスを生産するために、Robo4を発現する遺伝子のうちの5つを通しての1つのエクソンを、相同組換えを使ってアルカリホスファターゼ(AP)リポーター遺伝子と入れ替えた。この対立遺伝子、Robo4APは、Robo4外部ドメインの免疫グロブリン(IgG)繰返しをコード化するエクソンを欠き、それはSlitタンパク質との相互作用のために必要であると予測される。Robo4+ AP動物は、標的にされた対立遺伝子のためにホモ接合性だったマウスを生成するために交雑受精させた。マウスのゲノム構造の例証は、図25に提供する。Robo4AP/AP動物は生存可能で、そして繁殖性で、および脈管系の正常なパターニングを見せた。これらのデータはRobo4が発育中のマウスにおいて血管形成を出芽させるために必要でないことを指し示し、哺乳類の内皮においてRobo4シグナリングのために、代わりの機能を指摘する。アルカリホスファターゼ活性は発育中の胚のすべての脈管床の内皮を通してこれらの動物において、そして成体マウスにおいて検出され、それはRobo4AP対立遺伝子がRobo4発現の有効なマーカーであることを確認した。
例15
Robo4活性化は成熟した管を安定化させる:ネズミ網膜脈管叢の中央領域(central region)は、特に柄細胞(stalk cell)から構成され、成熟した、ルーメナイズされた(lumenized)脈管チューブに特有の分化型/標準化された表現型の例である。したがって、本発明者らは柄におけるRobo4発現が、血管新生促進の因子で、VEGF-Aのようなものによって刺激されるプロセスを抑制することによってこの表現型を維持するかもしれないと判断した。VEGF-Aによって刺激されるプロセス上でRobo4シグナリングの影響は、VEGF-A内皮細胞移動アッセイおよびVEGF-A管形成アッセイを使って評価された。双方のそのようなアッセイは、試験管内での血管形成を研究するのに日常的に用いられる。
内皮細胞移動およびチューブ(管)形成のアッセイを行うために、Robo4+/+およびRobo4AP/APマウスの肺からの内皮細胞は分離し、そしてそれらの同一性は免疫細胞化学およびフローサイトメトリーを使うことで確かめた。これらの細胞は次いで、VEGF-A依存内皮細胞移動およびチューブ形成のアッセイにおいて利用した。これらのアッセイにおいて使うSlit2分子は、Slit2Nであった(配列番号7)。図19Aおよび図19Bに示すように、Slit2はRobo4+/+内皮細胞の移動およびチューブ形成を抑制した。しかし、Slit2の抑制活性は、Robo4AP/AP内皮細胞において失われた。これらの結果はSlit2がRobo4依存様式において内皮細胞移動およびチューブ形成を抑制することを実証し、およびSlit2によるRobo4の活性化が成熟した管の脈管内皮を安定化させるのに役立つことを指し示す。
例16
Robo4活性化は内皮バリア機能を保つ:成熟した脈管床において、内皮細胞は互いに独立してふるまわず;むしろ、それらは周囲の組織中に、内皮ルーメンからのタンパク質、流体および細胞の動きを妨げるモノレイヤー(単分子層)を形成する。このバリア機能は、西洋ワサビ(ホースラディッシュ)ペルオキシダーゼ(HRP)の輸送を分析するためのTranswell(トランスウェル)アッセイを使って、Robo4+/+とRobo4AP/APマウスの肺から採取した内皮細胞の集密的な細胞モノレイヤーを横切って、試験管内でモデル化された。Robo4+/+およびRobo4AP/AP内皮細胞のVEGF-A、既知の透過性誘発因子での刺激は、Transwellの下側チャンバー(室)において、HRPの蓄積を高めた。図19Cに示すように、しかし、Slit2タンパク質による細胞モノレイヤーの前処理は(Slit2N(配列番号7))、Robo4AP/AP内皮細胞ではなく、Robo4+/+でのこの影響を防いだ。
次に、生体内での内皮バリア機能のSlit2の影響を評価した。マイルスアッセイは、Robo4+/+およびRobo4AP/APマウスの尾部静脈中にエバンスブルーを注入することによって実行した。Slit2タンパク質の不存在および存在におけるVEGF-A(Slit2N(配列番号7))は、真皮中にその後注入された。試験管内のアッセイに類似して、真皮へのエバンスブルーのVEGF-Aを刺激された漏出は、Robo4AP/APマウスにおいてではなく、Robo4+/+でのSlit2タンパク質の付随する投与によって防ぐことができた(図19Dに示される)。これらの観察結果は、網膜内皮のVEGF-A誘発された透過性亢進を抑圧するSlit2の能力を評価することによって延長された。とりわけ、Robo4+/+マウスでの硝子体内注射VEGF-Aが網膜血管からエバンスブルーの漏出を誘発することが見出された。しかし、網膜血管からのエバンスブルーのそのようなVEGF-A誘発された漏出は、Slit2タンパク質Slit2Nの同時注射によって、Robo4+/+マウスにおいて抑圧された(配列番号39)(図19E)。この実験はRobo4AP/APマウスの網膜で繰り返され、そしてRobo4AP/APがSlit2Nで処置に抵抗性であることが見出された(配列番号39)。これらのデータは、Robo4が試験管内で、および生体内でVEGF-A誘発された内皮透過性亢進のSlit2依存抑制を媒介することを実証する。
例17
Robo4 はVEGFレセプターの下流のVEGFシグナリングをブロックする:血管形成および透過性を促すVEGF-Aの能力はVEGFR2の活性化に依存し、それは自己リン酸化次いでリガンド結合によって起こる。その後、多数の非受容体チロシンキナーゼ、セリン/スレオニンキナーゼおよび小さなGTPasesは、空間的に、および時間的に特定の様式においてVEGF-Aシグナリングを遂行するために活性化される。Slit2-Robo4シグナリングがどこでVEGF-A-VEGFR2経路と交差する(intersects)かについて決定するために、VEGFR2リン酸化それに次いでVEGF-AおよびSlit2による刺激を、Slit2Nを使って分析した(配列番号7)。Slit2N(配列番号7)はVEGF-A誘発VEGFR2リン酸化に対する影響を持たず(図19F)、Slit2-Robo4経路がレセプターの下流のVEGF-Aシグナリングと交差しなければならないことが指し示された。注意はそれから、VEGF-A誘発血管形成および透過性を媒介することにおいてのそれらの文書で十分に裏付けられた役割のため、非受容体チロシンキナーゼ、Fyn(フューン)YesおよびSrcのSrcファミリー上に集中した(Eliceiri(エリセイリ)et al., 2002; Eliceiri et al., 1999)。Slit2Nによる内皮細胞の処置(配列番号7)は、c-SrcのVEGF-A-刺激されたリン酸化を減らした(図19G)。近年は、いくつかの報告は、Rhoファミリーの小さなGTPase、Rac1のSrc依存活性化がVEGF-A-誘発内皮細胞移動および透過性にとって不可欠であることを示した(Gavard(ガバルド)et al., 2006; Garrett(ギャレット)et al., 2007)。Slit2Nによる内皮細胞モノレイヤーの処置(配列番号7)は、VEGF-A-依存Rac1活性化を防いだ(図19H)。これらの生化学実験は、Slit2-Robo4経路がSrc-Rac1シグナリング軸の抑制を介するVEGF-A誘発内皮移動および透過性亢進を抑圧することを指し示す。
例18
Robo4の活性化は、CNVおよびOIRのモデルにおいて脈管漏出および病的血管形成を減少させる:酸素誘発された網膜症(OIR)のネズミモデルは、糖尿病性網膜症および未熟児網膜症の双方において観察される虚血誘発された血管形成を擬態し、網膜血管病に関してRobo4シグナリングの影響を研究するのに用いた。このモデルにおいて、P7マウスは、5日間の75%の酸素環境で維持され、そして次いで追加の5日間25%の酸素に戻した。気付かれた酸素欠乏(oxygen deficit)は網膜でのVEGF-A発現の急速な増加を惹起し、病理学的血管形成を導く(Ozaki(オザキ)et al., 2000; Werdich(ウェルディヒ)et al., 2004。Robo4+/+マウスおよびRobo4AP/APマウスは、このモデルを使って評価した。Slit2Nの硝子体内投与(配列番号7)は。Robo4AP/APマウスのでなく、Robo4+/+マウスにおいて血管形成を著しく減らした(図20A-図20E、そこでは矢印は病理学的血管形成のエリアを指し示す)。さらにまた、Robo4AP/APマウスは、Robo4+/+マウスそれに次いで過酸素条件への曝露よりより積極的な血管形成を指し示した(例は、図20Aおよび図20C参照)。
記述されたOIRモデルに加え、レーザーによって誘発された脈絡叢の新血管新生は、加齢関連黄斑変性症を擬態し、マウスにおいて病理学的血管形成を調査するために普通に用いられる(Lima(リマ)et al., 2005)。このモデルにおいて、レーザーを、Bruch's membrane(ブルッフ膜)を崩壊させるのに用い、それは下にある脈絡叢の脈管構造が網膜下の色素上皮中に透過するのを許す。この病理学的プロセスでのRobo4シグナリングの影響を見分けるために、8-12週齢のRobo4+/+およびRobo4AP/APマウスがSlit2Nの硝子体内注射が続くレーザー誘発脈絡叢新血管新生を受けた(配列番号7)。類似する結果が、Robo4AP/APマウスではなく、Robo4+/+マウスでの酸素誘発網膜症、Slit2Nを減らした血管形成の硝子体内投与のマウスモデルにおいて達成された(図20F-図20J参照)。全体として、酸素誘発網膜症および脈絡叢の新血管新生モデルは、区別できる特徴を有する2つの脈管床、きつい血液脳関門(tight blood-brain barrier)の1種および他は有窓内皮(fenestrated endothelium)が、Slit2-Robo4シグナリングの活性化による病理学的損傷(pathological insult)から保護されることを指し示す。
例19
Robo4は、成熟した管を不安定にする多重因子からのシグナリングを抑制する:bFGF、および血管形成因子、およびトロンビン、内皮透過性因子の活性上のSlit2分子によって、Robo4活性化の影響を評価した。図21で示すように、Slit2N(配列番号7)は、bFGF誘発内皮チューブ形成およびトロンビン誘発透過性をブロックした。これらの調査はSlit-Robo4シグナリングが、多重の血管形成および透過性の因子によって誘発されるシグナリングを妨げることができることを実証し、そしてSlit-Robo4経路が、成熟した脈管床を、多重血管形成、透過性およびサイトカインの因子から保護する概念を支持する。
Robo4シグナリングが脈管構造を、多重血管形成、透過性およびサイトカインの要因から保護することを強化するために、Slit2Nによる(配列番号7)Robo4活性化の影響を、急性肺傷害のマウスモデルにおいて評価した。このモデルにおいて、細菌のエンドトキシンLPSは、気管内投与を介してマウスに投薬された。細菌のエンドトキシンへの曝露は、肺脈管床の破滅的な不安定化を引き起こすサイトカインストームを導き、非心原性肺水腫を招く(Matthay(マッテイ)et al., 2005)。LPSの気管内投与の後、マウスをSlit2N(配列番号7)またはMock(モック)調製物で処置し、モックは見せかけのタンパク質抽出物で、コントロールとして役立つ。図22で示すように、Slit2Nで処置した(配列番号7)マウスからの気管支肺胞洗浄(BAL)の炎症性細胞およびタンパク質の濃度は、モック調製物で処置されるマウスのものよりも十分に低かった。これらの結果は、これらの状況の下でのRobo4の活性化が、有力な脈管安定化を提供することを実証し、そしてSlit2-Robo4が成熟した内皮の健全性を保存し、そしてサイトカインストームの極端な形態に対して脈管ホメオスタシスを維持するために作動する有力な脈管安定化経路であることを示唆する。
例20
Slit2タンパク質の投与は、トリインフルエンザ(Avian Flu)のマウスモデルにおいて、死亡率を減少させる:次の例では、トリインフルエンザウイルス(Avian Flu Virus)に感染したマウスの生存に関するSlitタンパク質の影響を分析した。合計での120匹の雌性のBALB/cマウスを、鼻腔内にトリインフルエンザウイルス、株H5N1/Duck(アヒル)/Mn/1525/81)の1:400希釈の50μlを接種した。この例で用いるマウスは、Charles River(チャールズ・リバー)から得られ、そして18-20グラムから変動する平均体重を持った。表2に関して、マウスは各々20匹のマウスの6つのケージにランダムに分け、そして各々のグループを5日の間毎日の処置を受けさせた。生存率(生存者権)(死)および体重を、処置の間およびその後に観察した。
手短には、表2に示すように、グループ1を生理的塩類溶液(PSS)の陰性コントロールで処置した。グループ2および3を、モック調製物で処置した。グループ4および5を、Slitタンパク質の異なる濃度で処置した(Slit2N(配列番号7))。陽性コントロールとして、グループ6の20匹のマウスを、0.1mLのPSSの総容量において提示する(brought up)75mg/kg/日のリバビリンでの腹腔内で処置した。
分析の結果は、図24に例証し、そして表3で詳述する。23日後に、グループ4および5でSlitタンパク質により処置したマウスは、グループ1、2および3でSlitタンパク質を受け取らなかったそれらのマウスよりも低い死亡率を持った。グループ4のマウスは、用量につきSlitの12.5μgで処置し、それは、25%の生存性の率を持った。グループ5のマウスは、用量につきSlitの1.25μgで処置し、それは、50%の生存性の率を持った。グループ4および5の生存率と対照的に、グループ1、PSSで処置されるものの陰性コントロールのマウスのわずか5%(1/20)が過去23日を生き残った。
表3は、接種後14日に、グループ4および5においてSlit処置されたサーバイバー(生存物)よりも、グループ1、2、および3の生存物の平均体重がかなり低かったことを示す。さらに、グループ5での10/20マウスは、それはSlit処置濃度がより一層低いものであったが、21日に、17.7グラムの開始される平均体重とほとんど同じくらい高い平均17.6グラムの体重を有して生き残った。したがって、Slitタンパク質で処置されるそれらの感染したマウスは、それらの体重を未処置のマウスより良好に保つことができた。
例21
Slitタンパク質の断片は、Robo4を活性化するために作動する:図23は、Slit2タンパク質の種々の構築物を例証する。ここにすでに解説したように、150kDのタンパク質Slit2N(配列番号7)は、試験管内で、および生体内でのモデルにおいて、Miles assays(マイルスアッセイ)、網膜透過性、チューブ形成および内皮細胞移動のためのアッセイを含めて、そしてOIRおよび眼疾患のCNVのモデルにおいて効果的であることが見出された。そのうえ、図23に示されるように、(40kD)タンパク質SlitD1(配列番号42)およびSlit2N(配列番号39)構築物は、VEGF誘発内皮細胞移動のアッセイにおいて、全長Slit2(配列番号40)に似た活性を見せる。
例22
Slit2は、ARF-GAPsを介して内皮細胞における細胞突出を抑制する:我々の実験は、Robo4の下流のシグナル伝達カスケードを解読するために、モデル細胞システムを利用した。この分子機構が一次細胞においてRobo4機能にとって重要かどうか定めるために、我々は、フィブロネクチンおよびSlit2の混合物を用いて下側上を被覆したトランスウェル上でヒトの微小血管内皮細胞に走触性移動アッセイを受けさせた(Slit2N(配列番号7))。HEK細胞に類似して、Slit2はフィブロネクチン導出(driven)細胞移動をブロックした(図28A)。次に、我々は伝播アッセイをフィブロネクチン(アルフ5ベータ1インテグリンのためのリガンド)の9-11の断片およびSlit2(Slit2N(配列番号7))で被覆されるカバーグラス上で実行し、そしてSlit2がインテグリン連結反応によって刺激された細胞突出活性を抑えたことを再び知見した(図28B)。細胞突起のSlit2依存的な抑制においてGIT1の役割を分析するために、我々はArf-GAPs、Qs11の小分子抑制剤で内皮細胞を前処理し、それからそれらに9-11およびSlit2(Slit2N(配列番号7))上の伝播アッセイを受けさせた。Arf-GAP抑制は、Arf-GAP活性が細胞突出のSlit2依存的な抑制にとって本質的であることを証明するSlit2(図28B)によって引き出される細胞エリアにおける縮小を防止した。
例23
Slit2は、フィブロネクチンおよびVEGF-165への反応におけるARF6活性化をブロックする:これらの細胞生物学的データは、内皮細胞におけるSlit2-Robo4シグナリングがインテグリン連結反応に応じてARF6活性化をブロックするべきであることを示唆した。この考えを確かめるために、我々はフィブロネクチンとSlit2で被覆された皿上で内皮細胞を板状に培養し、そしてARF6-GTPレベルを、GST-GGA3親和性沈殿技術を用いて分析した。CHO細胞からの結果(図16A)と一致して、Slit2(Slit2N(配列番号7))は、ARF6-GTPにおいてフィブロネクチンによって誘導された増加をブロックした(図28C)。フィブロネクチンに加え、血管形成および透過性誘導因子VEGF-165は、それがインビボで細胞外基質拘束形態として存在し、ARF6を活性化させるために提案された。VEGF-165およびSlit2(Slit2N(配列番号7))のARF6活性上での効果を明らかにするために、我々は、双方のタンパク質で被覆した皿上で内皮細胞を板状培養し、およびARF6-GTPレベルをGST-GGA3親和性沈殿技術を使用して分析した。VEGF-165はARF6を活性化させ、そしてSlit2は、この活性化を防止し(図28D)、Slit2が双方の細胞外基質タンパク質-および増殖因子-誘導のARF6活性化を抑制することを例証する。
例24
ARF6の抑制は、病的血管形成および血液漏出を防止する:Robo4は、新血管形成のタフト形成および内皮過透過性(REF)のSlit2依存的な抑制、フィブロネクチンのような細胞外基質タンパク質、およびVEGF(REFs)のような増殖因子によって惹起され、永続されるプロセスを媒介する。インテグリンおよびVEGF受容体シグナリングにおけるARF6、およびフィブロネクチンとVEGF-165に応じてARF6活性化をブロックするSlit2の能力の関係は、我々をARF6が病的血管形成および血液漏出を規制するシグナリング経路における重大なネクサスであるかもしれないとの推測に導いた。この仮説を試験するために、我々は野生型マウスの眼にサイトヘシンArf-GEFs、セシンH3(図29))の小分子抑制剤を注入し、そしてこれらの動物に酸素誘導網膜症(OIR)、レーザー誘導脈絡膜新血管形成(CNV)およびVEGF-165誘導網膜透過性のアッセイを受けさせた。セシンH3は、DMSOコントロール以外で、OIR(図30Aおよび図30B)およびCNV(図30Cおよび図30D)の新血管形成のタフト形成を抑制し、そしてVEGF-165(図30E)に起因する網膜過透過性を抑制し、このようにして、これらの病理学的プロセスにおいてArf-GTPasesの中心関係を例証すること、およびArf活性化の封鎖を例証することは、病的血管形成および血液リークによって特徴づけられる病気の潜在的療法である。
例25
セシン-H3は、VEGFによって誘導されたARF6-GTPを抑制する:セシン-H3がARF6-GTPの蓄積を弱めたかどうか試験するために、ヒトのミクロ血管内皮細胞(HMVEC)を、いずれも処置しない(図31最も左側のレーン)、20ng/mlのVEGF\DMSOでの処置し(図31 中央レーン)、または20ng/mlのVEGF\50μMのセシン-H3での処置した(図31最も右側のレーン)。細胞可溶化物は、ARF6-GTP抗体またはARF6抗体で探索し、これらのARF6種の相対的な量を、ウエスタンブロッティングを介して比較した。細胞を次いで、氷冷PBS二回洗い、そして、50mMトリスpH 7.0、500mMのNaCl、1mM のMgCl2、1mMのEGTA、1mMのDTT、0.5%のNP-40、1Xプロテアーゼ抑制剤、1Xホスファターゼ抑制剤、そして50μg/mlのGST-GGA3-VHS-GATで溶解した。溶解物は14,000rpmで5分間遠心分離し、そして上澄みを4℃で30分間グルタチオンアガロースの50μlでインキュベートした。次いで、3回溶解バッファで洗い、結合タンパク質を2×試料バッファで溶出させた。Arf6を、Arf6-特異抗体を用いてウエスタンブロッティングによって検出した。これらの実験の結果は、小有機分子セシン-H3が、ARF6-GTPの蓄積をブロックすることを例証する(図31と比較、頂部パネル中央レーンおよび頂部パネル右レーン)。
例26
セシン-H3は、HMVECsのVEGF誘導移動を抑制する:細胞移動アッセイは、セシン-H3(図29)が試験管内アッセイにおいてVEGF誘導HMVEC移動を抑制することができるかどうか試験するために修飾されたBoyden chamber Transwel(ボイデンチャンバートランスウェル)アッセイを使って実行した。ここに記載するように、細胞を板状に培養し、そしてコントロール的処置または実験的処置のいずれかを受けさせた。コントロール的処置は、0.2%のBSA、そしてDMSOを含み、そして実験的な処置は0.2%のBSA+15ng/mlのVEGF-165およびDMSO+15μMセシン-H3を含んだ。50μlの0.2%のBSA、0.2%のBSA\15ng/mlのVEGF-165、0.2%のBSA\15ng/mlのVEGF-165\DMSO、および0.2%のBSA\15ng/mlのVEGF-165\15μMのセシン-H3を含む実験的処置を、板状に48ウェルのBoydenチャンバー器具(NeuroProbe(ニューロプローブ)、Cabin John(キャビンジョン)、MD(メリーランド州))中に培養し、そしてウェルは8μm孔のポリカーボネート膜(NeuroProbe)でオーバーレイし、それは前もって50μg/mlのヒトフィブロネクチンで被覆した(Biomedical Technologies(バイオメディカル・テクノロジー社)、Stoughton(ストートン)、MA(マサチューセッツ州))。それから、3.75×104細胞のヒトの微小血管内皮細胞(HMVEC)を上部チャンバーに加え、そして移動を37℃(5%のCO2)で3時間進行させておいた。膜をその後、取り出し、メタノールにおいて固定して、Hema(ヘマ)3ステインセットで染色し(Fisher Scientific(フィッシャー・サイエンティフィク社)、Pittsburgh(ピッツバーグ)、PA(ペンシルベニア州))、50×75mmのスライドガラス上に置いた(移動-サイドダウン)。膜の移動した側上に存在する細胞を、手動で計数し(ウェルにつき3回のランダムな200×フィールド)、そして、各実験のためのデータポイントは6つの別々のウェルから移動した細胞の平均数を表す(ウェルにつき計数された3つの200×フィールド)。
図32で描かれる結果はVEGF-165で処理される細胞が細胞移動反応を例証することを示し、それはDMSOでの更なる処置によって弱められない。セシン-H3による処置は、VEGF-165誘導細胞移動反応を弱めた。
例27
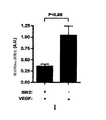
GIT1 RNAiは、VEGF誘導HMVEC透過性を増やす:図34は、問題がRNAiを介するGIT1の発現における縮小がVEGF誘導透過性を高めることができるかどうかに関して試験したHMVEC透過性アッセイからの結果を例示する。細胞を、ここに記載されるように板状に培養し、そしてコントロールsiRNAまたはGIT1 siRNAのいずれかでトランスフェクションした。各々のsiRNA群は分裂し、そして細胞の半分をVEGF-165で処置した。図34で描かれるように、VEGF誘導透過性は他の細胞と比較したGIT1 siRNA細胞において高めた。
例28
セシン-H3は、Arf6活性化、内皮細胞のVEGF誘導移動、OIRおよびCNVのモデルでの新血管新生のタフト形成、およびVEGF-165に起因する網膜過透過性を抑制する:我々は、内皮細胞を抑制剤またはビークルコントロールで前処置し、およびArf6活性化および細胞移動アッセイを実行することによって、セシンH3のVEGFに対する効果を定めた。セシンH3は、VEGF誘導Arf6活性化およびVEGF誘導細胞移動の双方を防止した(図36 A、B)。次に、我々は野生型マウスの眼にセシンH3を注入し、そしてこれらの動物に酸素誘導網膜症(OIR)、レーザー誘導脈絡膜新血管形成(CNV)、およびVEGF-165誘導網膜透過性のアッセイを受けさせた。セシンH3は、DMSOのビークルコントロール以外ではOIR(図36 C、D)およびCNV(図36 E、F)、およびVEGF-165に起因した網膜過透過性(図36 G)における新脈管形成タフト形成を抑制し、そのようにして、これらの病理学的プロセスにおいてArf-GTPasesの中心関係が例証された。
酸素誘導網膜症:手短には、P7パップを育てる母体(nursing mother)と一緒に、80%の酸素において置き、それをプロ-OX酸素コントローラ(BioSpherix(バイオスフェリックス))によって維持した。パップはP12上で取り出され、そしてセシンH3の眼内注射を終濃度21.6μMで与えられた。マウスを、P17上で犠牲にし、眼を摘出し、4%のパラホルムアルデヒド中に2時間固定した。そして網膜を切開し、およびAlexa Fluor 488共役イソレクチン1:50(Invitrogen(インビトロゲン社))を用いて一昼夜染色した。網膜フィアトマウント(fiatmounts)を生成させ、画像を、Axiovert(アキシオベルト)200蛍光顕微鏡法(Carl Zeiss(カール・ツァィス社))を使用して撮影した。新血管新生はAxioVision(アキシオビジョン)ソフトウェア(Carl Zeiss)を使用して定量化した。データを、14匹の野生型マウスの平均±s. e.として提示する。
レーザー誘導脈絡叢新血管真性:2-3月齢のマウスを、アベルチンで麻酔した(2-2-2トリブロモエタノール、0.4mg/g;Acros Organics(アクロス・オルガニクス))、そしてピューピル(ひとみ)を、1%のトロピカミド(Alcon(アルコン))により広げた。Slitランプ配送システムを有するIridex OcuLight(イリデックス・オクライト)GL532nmのレーザー光凝固装置(Iridex)を、以下のパラメータを有する3、6、および9時での視神経円板から3つのバーンズ(火傷)3ディスク直径を作り出すために用い、すなわち、150mW出力、75umスポットサイズ、および0.1秒の期間である。ブルッフの(Bruch's)膜のレーザーを指示する断裂の時点での泡の生産は、CNVを得ることにおいて重要な因子であり、したがって、泡が生産されるバーンズだけがこの調査において含まれた。レーザー処置の直後および3日後、マウスに、21.6μMの終濃度でセシンH3の硝子体内注射を与えた。レーザー処置の1週間後、マウスを犠牲にし、そして脈絡叢のフラットマウントを生成させた。Alexa 488の共役イソレクチン(Sigma(シグマ社))を、CNVを染色するために用いた。フラットマウントを、Zeiss LSM 510の共焦点顕微鏡(Carl Zeiss)を用いて検査し、およびCNVをImageJソフトウェア(NIH)を使用して定量化した。データは、少なくとも15匹の野生型マウスについて、平均±s.e.として提示する。
網膜透過性:網膜透過性を、以前記述24のとおり評定した。手短には、8-10週齢のマウスを、アベルチンで麻酔した(2-2-2トリブロモエタノール、0.4mg/g;Acros Organics)。マウスに、1.5μLの35.7μg/mLのVEGF-165(R&D Systems Inc.)および2%のDMSO中の21.6μMのセシンH3(我々は終濃度が21.6μMであり、およびDMSOは0.2%であると推定した)または2%DMSO単独のいずれかのものの眼内注入を与えた。6時間後、50μLの60mg/mLのEvans Blue(エバンスブルー)溶液を、尾静脈を介して投与した。2時間後、マウスを犠牲にし、そして静脈内エバンスブルーを除去するために、クエン酸塩緩衝化ホルムアルデヒドをかん流した。眼を摘出し、そして網膜を解剖した。エバンスブルー色素を、70℃で18時間0.4mLのホルムアミドにおいて溶出した。抽出物を、2時間、5kDフィルターによって超遠心分離機にかけた。吸光度を620nmで測定した。バックグラウンド吸光度を740nmで測定し、そして外へ引いた。データを、5匹の野生型マウスについて平均±s. e.として提示する。
例29
Slit2は、接着斑へのパキシリンの補充をブロックする:パキシリンの亜細胞性の分布に関して、Robo4のSlit連結反応の効果を評定するために、細胞について、Slit2の有無においてフィブロネクチンで被覆したカバーガラスに付着するのを許し、そして内因性パキシリンのために染色した。Slit2(モック)の不存在において、全長Robo4を発現するHEK細胞は、正常に伝播して、パキシリンについて染色された細胞周辺の近くで、大量の接着斑を形成した(図37 A.、頂部パネル)。対照的に、Slit2(Slit2N(配列番号7))およびフィブロネクチン上に板状に培養された細胞は、減少した伝播、F-アクチンのために著しく少ない染色をみせ、非常により一層少ない、そしてより一層小さなパキシリンで染色された接着斑を形成した(図37A、下部パネル)。フィブロネクチンおよびSlit2上で接着したコントロールのHEK細胞(Robo4を発現しない)は、フィブロネクチンだけの上に付着したもの(データは示さない)と比較されるとき、形態学における違いを示さず、Slitの効果がRobo4に依存していることが示された。
我々はウシ大動脈内皮(BAE)細胞でのアッセイを繰り返し、それは内因的にRobo4を発現する。フィブロネクチンおよびSlit2(Slit2N(配列番号7))で被覆した基層上で、BAE細胞は、フィブロネクチンだけ付着した細胞(モック)と比較して減らされた伝播をみせ、Slit2-Robo4シグナリングの類似した抑制性効果が示された(図37B)。フィブロネクチンおよびSlit2に付着したBAE細胞は、より一層大きく、そして伸びたフィブロネクチン-接着細胞の成熟した接着斑とは異なる小さなパキシリン染色された構造を形成した(図37B)。細胞がより一層長い期間の間付着したので、Slit2の細胞伝播上での抑制性効果は一時的であるように見え、それはSlit2の有無にかかわらず、同程度の伝播および接着斑形成が示された(データは示さない)。Slit2がRobo4にパキシリンの補充を誘導するという観察と共に、我々はRobo4の連結作用が接着性構造への補充のためにパキシリンの利用能を減らすことを提唱し、それによって減少した細胞の伝播および移動の一因となる。
例30
Slit2は、パキシリンを細胞表面に補充する:我々のデータは、Robo4を発現する細胞において、Slit2処置が、パキシリンを、接着斑から細胞表面まで(それがレセプターとで共局在化する)再配布することを示唆する。この概念の真実性を定めるために、我々は、Slit2タンパク質(Slit2N(配列番号である7))の存在および不存在下でインキュベートされる細胞においてパキシリンおよびRobo4の亜細胞性の分布を分析した。Slit2が細胞伝播をブロックするので、そしてこのようにして原形質膜のはっきりした視覚化を妨げるので、我々はフィブロネクチン上で予備的(プレ)伝播される(pre-spread)内皮細胞におけるこれらの実験を行った。モックで処理される細胞では、Robo4が細胞表面(図37C、頂部のパネル)に局所化される一方、パキシリンはほとんど排他的に接着斑において見出された。Slit2で処置される細胞では、しかし、パキシリンのかなりの部分は、細胞表面に現れ、Robo4と共に共局在化し、局地化でのこの変化は、接着斑におけるパキシリンの減少と一致した(図37C、下部パネル)。これらのデータは、パキシリンをRobo4のSlit2刺激が、接着斑から細胞表面まで、それがRobo4にアクセスできるまで再分布させることを明らかにする。
例31
パキシリン相互作用のモチーフ(PIM)は、内皮細胞においてSlit2シグナリングのために要求される:次に、我々は細胞伝播のSlit2依存的な抑制のためにRobo4と結合するパキシリンの条件を定めた。Slit2タンパク質(Slit2N(配列番号7))の不存在および存在で、我々は、内皮細胞においてRobo4ΔPIMまたはLacZを発現させ、そして伝播アッセイをフィブロネクチン上で実行した。内因性Robo4(GFP-)を発現する非トランスフェクション細胞がSlit2の上で著しく抑制されるが、モックではそうでない一方(図38 CおよびD)、Robo4ΔPIM(GFP+)を発現する細胞はモックおよびSlit2の双方上で同等に伝播した。これらのデータは、Robo4と結合するパキシリンが細胞突出活性を調節するためにSlit2にとって必要なことを示す。
例32
Slit2は、内皮細胞でのRacおよびArf6の活性化をブロックする:これらの細胞生物学的データは、内皮細胞におけるSlit2-Robo4シグナリングがインテグリン連結作用に応じてRacおよびArf6の活性化をブロックすべきであることを示唆した。この考えを確かめるために、我々はフィブロネクチンおよびSlit2タンパク質(Slit2N(配列番号7))で被覆された皿上へ内皮細胞を板状に培養し、そしてRac-GTPおよびArf6-GTPを分析した。HEKおよびCHO細胞からの結果と一致して、Slit2は効率的にRac-GTP(図38 E)およびArf6-GTPレベル(図38 F)におけるフィブロネクチン誘導増加をブロックした。フィブロネクチンに加え、血管形成性および透過性誘導因子VEGF-165は、インビボで細胞外基質の構成要素として存在する。VEGF-165およびSlit2のArf6活性に対する効果を確かめるために、我々は双方のタンパク質で被覆された皿上に内皮細胞を板状に培養し、そしてArf6-GTPレベルを分析した。VEGF-165だけがArf6を活性化させる一方、Slit2の追加はこの活性化を防止し(図37 D)、Slit2が双方の細胞外基質タンパク質および増殖因子によって誘導されたArf6の活性化を抑制することを例証した。
Slit2によってRhoおよびCdc42の規制に対する洞察を得るために、我々はSlit2(Slit2N(配列番号7))の不存在および存在でフィブロネクチン上で内皮細胞を板状に培養し、そしてRho-GTPとCdc42-GTPレベルを分析した。Rho活性化がSlit2によって変えられない間、Cdc42活性化はかなり減らされた(図39)。Robo4がRobo1結合タンパク質srGAPl Cdc42のための既知のGTPase活性化タンパク質と相互作用しないとすると(図39)、Slit2のCdc42に対する効果はいくぶん驚くべきことであった。
材料および方法
試薬:HEK 293およびCOS-7細胞、およびすべてのIMAGE(イメージ)クローンは、ATCCからのものであった。SP6およびT7のMessage Machine(メッセージ・マシーン)キットは、Ambion(アンビオン)からであった。HUVEC(ヒト臍帯静脈内皮細胞)、EBM-2およびブレット(弾丸)キットは、Cambrex(カンブレックス)からであった。イースト2-ハイブリッドプラスミドおよび試薬は、Clontech(クローンテック)からであった。FBSは、Hyclone(ハイクローン)からであった。抗HAアフィニティマトリックス、Fugene(フュージーン)6およびプロテアーゼインヒビターカクテルは、Roche(ロシュ)からであった。Goat Anti-Mouse(ヤギ抗マウス)HRPおよびGoat Anti-Rabbit(ラビット)-HRP二次抗体は、Jackson immunoResearch(ジャクソン・イムノリサーチ)からであった。抗V5抗体、DAPI、DMEM、リポフェクタミン(Lipofectamine)2000、ペニシリン-ストレプトマイシン、Superscript(スーパースクリプト)IIIキット、Trizol(トリゾール、商品名)およびTrypLE Express(トリプレ・エクスプレス)は、Invitrogenからであった。抗Flag(フラグ)M2、ホスファターゼインヒビターカクテルズ(Phosphatase Inhibitor Cocktails)、ソイビーントリプシンインヒビター(Soybean Trypsin Inhibitor)および脂肪酸フリーのウシ血清アルブミン(Bovine Serum Albumin)(BSA)は、Sigma(シグマ)からであった。ヒトフィブロネクチンは、Biomedical Technologies(バイオケミカル・テクノロジー)およびInvitorogenからであった。Coster Transwells(コスター・トランスウェルズ)およびAmicon Ultra(アミコン・ウルトラ)-15 Concentrator Columns(コンセントレータ・カラム)は、Fisher(フィッシャー)からであった。Rosetta(ロゼッタ)2のE. coli(大腸菌)は、Novagen(ノバゲン)からであった。Glutathion-Sepharose(グルタチオンセファロース)4B、パレンタル(親の)pGEX-4T1およびECL PLUSは、Amersham-Pharmacia(アマシャム-ファルマシア)からであった。Coomassie Blue(クーマシーブルー)およびPVDFは、BioRad(バイオラド)からであった。Quick change site-directed mutagenesis kit(クイック・チェンジ・サイト-ディレクテッド・ミュータジェネシス・キット)は、Stratagene(ストラタジーン)からであった。通常のRat IgGagarose接合体は、Santa Cruz(サンタクルス)からであった。Robo4モルフォリノは、Gene Tools(ジーン・ツールズ)からであった。PCRのためのオリゴヌクレオチドは、University of Utah Core Facility(ユタ大学コアファシリティー)からであった。Alexa564-ファロイジン、抗GFPおよびヤギ抗ウサギAlex488は、Molecular Probes(モレキュラー・プローブ)からであった。低融点アガロースは、NuSieve(ヌシーブ)からであった。T7試験管内転写/翻訳キットは、form Promega(プロメガから)であった。
分子生物学:Robo4-HA、Slit2-Myc-Hisおよびチキンパキシリンプラスミドは、以前に述べた(Park et al., 2003; Nishiya(ニシヤ)et al., 2005)。Robo4-NH2はRobo4-HAから増幅され、pcDNA3-HAのEcoRV/Not1中にクローン化された。Robo4-COOHはオーパーラップ(重複)-エクステンション(伸張)PCRによってRobo4-HAから増幅され、そしてpcDNA3-HAのEcoRV/Not1中にクローン化された。ヒトのRobo4細胞質テイル(AA 465-723)のアミノ末端半分は、PCRによって増幅され、そしてpGBKT7の(EcoRI/BamHI)中にクローン化された。ネズミRobo4断片はPCRによって増幅され、そしてpGEX-4T1のBamHI/EcoRI中にクローン化された。ネズミHic-5、メナおよびパキシリン(欠失を含む)は、PCRによってIMAGEクローンから増幅され、そしてpcDNA3-V5のEcoRV/NotI中にクローン化された。GST-Robo4ΔPIMおよび全長Robo4ΔPIMは、Quick Changeを使って関連した野生型の構築物の部位特異的変異誘発によって生成された。すべての構築物の完全性は、ユタ大学Core Facilityで配列決定によって確かめた。
胚培養およびゼブラフィッシュ保存株:ゼブラフィッシュ、Danio rerio(ダニオ・レリオ)は、標準的な方法によって維持した(Westerfield(ウェスターフィールド), 2000)。発達段階(Developmental staging)は、28.5℃で生じる胚の標準的な形態学上の特長を用いて遂行した(Kimmel(キンメル)et al., 1995)。Tg(fli:EGFP)y1トランスジェニックゼブラフィッシュ系は、この調査に用い、Lawson(ローソン)およびWeinstein(ウェインスタイン), 2002に記述された。撮像された胚は、色素形成を防ぐために、24hpfの後、0.2mMの1-フェニル-2-チオ尿素(PTU)で処置された。
robo4のアンチセンス欠乏:アンチセンスのモルフォリノオリゴヌクレオチド(MO)は、robo4のエクソン10/イントロン10のスプライス部位に指向し(5'-tttttagcgtacctatgagcagtt-3、配列番号28)、それぞれ、5ng/nlの濃度で、IX Danieau’s Buffer(ダニエウバッファー)において溶解した。注入の前に、モルフォリノは注射効率を監視するために、色素の無視できる小量を混ぜ合わせられ、5分間、短く冷やされ、65℃で加熱され、そしておよそ1nlを1-2の細胞期のストリーミングヨーク(流動卵黄)に注入した。
逆転写(RT)PCR:RNAを、注入してない20匹から、およびトリゾール、および試薬を使ってrobo4 MOを注入した20匹の胚から抽出し、その後、cDNAを、ランダムな六量体およびオリゴdTプライマーの双方の混合物によってプライムされたSuperscript IIIを使って実行した。robo4は、エクソン8(5'-caacaccagacacttacgagtgcc-3’)、配列番号29)での前方のプライマー、およびエクソン12(5'-ttcgaaggccagaattctcctggc-3’)、配列番号30)での逆行のプライマーとともに、以下のパラメータを使うことで、PCRによってcDNAから増幅し、すなわち、(4’のための94℃、30”のための94℃、30”のための58℃、45”のための68℃、1’のための68℃)である。PCR反応の線形範囲を確認するために、cDNAを23、25、27および30サイクル増幅し、β-アクチンを、cDNA入力について制御するために、すべての試料からの前方のプライマー(5'-cccaaggccaacagggaaaa、配列番号31)および逆行のプライマー(5'-ggtgcccatctcctgctcaa-3’、配列番号32)を用いて増幅した。
ホールマウントの間接的な免疫蛍光法:手短には、同齢の24および48hpfの胚は、デクロリオネートされ(dechorionated)、そして4℃で4%のPFA/4%のショ糖/PBSにおいて一昼夜固定した。胚を次いで、PBS/0.1%のTween(ツイーン)-20において洗浄し、無水メタノールに対して脱水し、PBS-Tween 20へ再水和させ、さらにPBS/1%のTriton(トリトン)-Xにおいて透過処理し、PBS/1%のTriton-X/2%のBSAですすぎ、室温でPBS/1%のTriton-X/2%のBSA/10%のシープ血清(Sheep Serum)/1%のDMSOでブロックし、それからIgG精製された抗GFP(1:400)、4℃で一昼夜ブロッキング溶液においてインキュベートした。以下の日数の胚を、活発にPBS/1%のTriton-X/2%のBSAにおいて洗浄し、次いでヤギ-抗-ラビットAlexa 488の接合した二次抗体(1:200)において4℃で一昼夜ブロッキング溶液にてインキュベートした。次の日数で、胚を広範囲にPBS/1%のTriton-X/2%のBSAで洗浄し、それからPBS中1%の低融点アガロースに埋め、そしてLeica(ライカ)共焦点顕微鏡上で写真を撮り、そしてAdobe Photoshop(アドビ・フォトショップ)ソフトウェアを使用して処理した。
細胞培養:HEK 293およびCOS-7細胞を、10%のFBSおよび1%のペニシリン/ストレプトマイシンで補われるDMEMにおいて培養した。ヒトの微小血管の内皮細胞(HMVEC)をEGM-2 MVにおいて培養し、そしてヒトの臍帯静脈内皮細胞(HUVEC)を、10%のFBSで補われるEGM-2において培養した。ECsを継代2および5の間で日常的に用いた。
形質移入(トランスフェクション):HEK293およびCOS-7細胞を、製造者のプロトコルに従ってFugene6またはLipofectamine 2000でトランスフェクションした。
濃縮Slit2タンパク質の調製:COS-7細胞は、空のpSECTAG2またはpSECTAG2::hSlit2で一過性にトランスフェクションした。48時間後に、細胞をPBSで二回洗浄し、そして6mlの塩抽出緩衝剤(10mM HEPES、pH7.5、1M NaClおよびIXプロテアーゼインヒビター)で15分間25℃でインキュベートした。塩抽出を繰り返し、そして試料を、細胞片がペレット化するように、10,000rpmで20分の間遠心分離した。上澄みをAmicon Ultra(アミコン・ウルトラ)-15コンセントレータカラム/100kDaのカットオフ上に負荷し、そして12mlの塩抽出がおよそ500μlに減るまで、遠心分離した。濃縮されたタンパク質調製物をクーマシーブルー染色によって分析し、そして最高で1週間4℃で保存した。このプロトコルを使って、20-50μg/mlのSlit2濃縮物を日常的に入手した。Slit2プラスミドでトランスフェクションされた細胞からの濃縮されたタンパク質を調製することに加え、同じプロトコルを、空のベクター(pSECTAG2)でトランスフェクションされた細胞上で実行した。この結果として生じる調製物は、“モック”の調製物と称し、そしてそれがSlit2の影響を分析するすべての実験においてコントロールとして用いた。
走触性移動アッセイ:細胞を、TrypLE Expressとともに組織培養ディッシュから取り除き、0.1%のトリプシンインヒビター、DMEMまたはEBM-2での0.2%の脂肪酸フリーのBSAで1回、および0.2%のBSAが関連した媒体中にあるもので二回洗浄した。洗った細胞を計数し、そして0.3×105細胞/mlで再懸濁した。1.5×105を、5μg/mlのフィブロネクチンで下側表面をプレコートされた12μmのCostar トランスウェルの上側チャンバー中に負荷した。走触性上のSlit2の影響を、0.5μg/mlのSlit2またはモック調製物の等量での同時コーティングによって分析した。細胞移動は、6時間進行するのを許され、そしてその後、トランスウェルの上側表面上の細胞を、コットンスワブで除去した。下側表面上の細胞を、5分間4%のホルムアルデヒドで固定し、PBSを用いて3回洗浄した。HEK 293細胞のために、下側表面上のGFP陽性細胞(HEK 293)の数を、インバーター蛍光顕微鏡上で6つの10×視野を計数することによって数え上げた。フィブロンエクチン/モック-コート膜上の遊走された(migrated)細胞の数は、データプレゼンテーションおよび以降の統計分析のために100%考慮した。
イースト2ハイブリッドアッセイ:pGBKT7::hRobo4 465-723を、イースト株PJ694A中に形質転換させ、PJ694A-Robo4を創作した。ヒト大動脈cDNAライブラリーを、プレイ(犠牲)プラスミドpACT2中にクローン化し、そして次いでPJ694A-Robo4中に形質転換された。同時形質転換イースト株は、形質転換効率を分析するために、SD-Leu-Trp(-LT)上に、推定上の相互作用性タンパク質を識別するために、SD-Leu-Trp-His-Ade(-LTHA)上に板状培養した。SD-LTHA上で育つ能力がある酵母株は、それからフィルターリフトアッセイによってβ-ガラクトシダーゼの発現用に試験した。犠牲プラスミドはSD-LTHA上で増殖し、β-ガラクトシダーゼを発現することができる酵母株から分離され、そしてユタ大学のコアファシリティで配列決定した。
免疫沈降:細胞溶解物を、50mMのトリス-Cl、pH7.4、50mMのNaCl、1mMのDTT、0.5%のTriton X-100、ホスファターゼおよびプロテアーゼインヒビターにおいて調製し、不溶性物質をペレット化するために、20分間14Kで遠心分離し、60分間正常なIgGをアガロースビーズに接合させたものを用いてきれいにし、そしてアガロースビーズに接合した関連した抗体をとともに、4℃で2時間インキュベートした。沈殿物を広範囲に、溶解緩衝剤において洗浄し、そして2×試料緩衝剤(125mMのトリス-Cl、pH6.8、4%のSDS、20%のグリセロール、0.04%のブロモフェノールブルーおよび1.4Mの2-メルカプトエタノール)において再懸濁させた。
GSTプルダウンアッセイ:pGEX-4Tlを抱えるRosetta2 E. coli::mRobo4を、0.6のOD600にまで増殖させ、そして0.3mMのIPTGで誘発した。30℃、220rpmでの3-4時間後に、細胞を20mMトリス-ClのpH7.4、1%のTriton X-100、1μg/mlリゾチーム、1mMのDTTおよびプロテアーゼインヒビターにおいて超音波処理によって溶解した。GST-融合タンパク質はグルタチオンセファロース4B上で捕獲され、リゾチームを伴わない溶解緩衝剤で1回洗浄し、および次いで結合/洗浄緩衝剤(50mMトリス-Cl、pH7.4、150mMのNaCl、1mMのDTT、1%のTriton X-100、0.1%のBSAおよびプロテアーゼインヒビター)を用いて2回洗浄した。GST-融合タンパク質は、4℃で一昼夜60nMの精製された組換え型パキシリンとともにインキュベートし、広範囲に結合/洗浄緩衝剤において洗浄し、そして2×試料緩衝剤において再懸濁した。
ウェスタンブロット法:免疫沈降およびGST-融合タンパク質を、100℃で2分間インキュベートし、SDSポリアクリルアミドゲル電気泳動(SDS-PAGE)によって分離し、ポリビニルジフルオライド(PVDF)膜に移した。PVDF膜は、25℃で60分、PBS中に5%の脱脂粉乳を有する+ 0.1%のTween20(PBST)(PBST-M)を用いてインキュベートした。ブロックされた膜は、一次抗体とともに(抗Flag M2の1:2000;抗HAの1:10,000;抗Hic-5の1:500;抗パキシリンの1:10,000;抗Racの1:1,000および抗Cdc42の1:500)、PBST-Mにおいて、60分間、25℃で、または一昼夜4℃でインキュベートした。膜は3×10分、PBSTで洗浄し、次いで二次抗体とともに(ヤギ抗マウスまたはヤギ抗ラビット西洋ワサビペルオキシダーゼで、1:10,000)、60分間、25℃でインキュベートした。膜は3×10分、PBSTにおいて洗浄し、そしてECL PLUSで視覚化した。
試験管内での転写/翻訳:メナ-V5は、製造者のプロトコルに従ってT7クイックカップルド(Quick Coupled)インビトロ転写/翻訳システムを用いて合成された。
拡散アッセイ:細胞を、5μg/mlのフィブロネクチン、または若干の場合、指示されるように、フィブロネクチンの9-11フラグメントの30μg/mlでコートされるカバーグラス上へ板状培養した。5%のCO2および37℃の30分のインキュベーションの後、細胞を氷冷のPBSで3回洗浄し、室温で10分間3.7%のホルムアルデヒドで固定した。細胞を、それから3分間0.2%のトリトンX-100で透過性にし(peremabilized)、PBS+0.1%のTween20(PBST)で3回洗浄し、そして室温で1時間10μg/mlのローダミン-ファロイジンでインキュベーションした。PBS-Tでの3回の洗浄の後、カバーグラスをプロ-ロング・ゴールドに装着し、そして共焦点顕微鏡法によって分析された。3つの独立した実験において少なくとも150の細胞の総面積は、イメージJを使って測定した。
パキシリンのsiRNA媒介ノックダウン:HEK 293細胞を、100nMのsiRNA二本鎖、(5'-CCCUGACGAAAGAGAAGCCUAUU-3’、配列番号19および5'-UAGGCUUCUCUUUCGUCAGGGUU-3’)を用い、リポフェクタミン(LipofectAMINE)2000を使って、製造者の指示に従い、トランスフェクションした。トランスフェクションの48h後、細胞を生化学的分析または細胞拡散アッセイのために加工した。パキシリンの再構成はチキンのパキシリンをコード化する発現ベクターでのトランスフェクションによって達成し、それはヌクレオチド配列5'-CCCCTACAAAAGAAAAACCAA-3’をsiRNAの標的部位内に持つ。ノックダウンおよび再構成は、パキシリン抗体でウェスタンブロッティングによって視覚化され、デンシトメトリーによって定量化した。
RacおよびCdc42活性化アッセイ:細胞を、細胞培養ディッシュから剥離し、DMEM+0.2%のBSAにおいて1時間の懸濁において保ち、そして5分間5μg/mlのフィブロネクチンでコートされた細菌のペトリディッシュ上へ板状培養した。細胞をそれから、氷冷のPBSで2回洗浄し、そして50mMのトリスpH7.0、500mMのNaCl、1mMのMgCl2、1mMのEGTA、1mMのDTT、0.5%のNP-40、1Xプロテアーゼインヒビター、1Xホスファターゼインヒビターおよび20μg/mlのGST-PBDにおいて溶解した。溶解物を、14,000rpmで5分間遠心分離し、そして上澄みを4℃30分間グルタチオンアガロースの30μlとともにインキュベーションした。次いで3回の溶解緩衝剤で洗浄し、結合したタンパク質を2×試料緩衝剤で抽出した。RacおよびCdc42は、各々のタンパク質に特異的抗体でのウェスタンブロッティングによって検出した。Rac活性化レベルを合計のRacに対し正常化し、そして各々の実験において最も高い値を1の値を割り当てた。
Robo4 AP/APマウスおよび遺伝子型同定:Robo4ターゲティングベクターを、胚性幹(ES)細胞に電気穿孔した。標的とされた対立遺伝子のためのヘテロ接合性のES細胞は、胚盤胞に注入され、そしてそれから偽妊娠の雌性に移された。キメラの雄性はアグーチカラーの存在によって識別され、そしてそれからES細胞誘導子孫を生産するために、C57BL/6雌性に交配された。遺伝子型は、テイルDNAのサザンブロット分析によって確かめられた。耳パンチまたは尾部の試料からのゲノムDNAを、以下の条件の下でPCR遺伝子型同定のために使われ、30秒間の94℃の変性、30秒間の60℃のアニーリング、および60秒の40サイクル間の72℃の伸張である。以下の2つのプライマーが、Robo4の遺伝子型同定のために使われ、すなわち、5’cccttcacagacagactctcgtatttcc3’(前方)および5'cccagacctacattaccttttgccg3’(逆行)、およびAPのための、すなわち5'ggcaacttccagaccattggcttg3’(前方)および5’ggttaccactcccactgacttccctg3’(逆行)である。
胚および発現分析:胚の病期診断、インサイツ(原位置)ハイブリダイゼーション、パラフィン切片化(paraffin sectioning)および全載PECAM-1免疫組織化学を実行した。ノーザンブロット分析のために、合計のRNAの20μgを、TRIZOL(トリゾール)を用いて分離した後、レーンにつき負荷した。32Pのラベル化したプローブを、プライムIt II Random-Primer(ランダム-プライマー)ラベリング(標識化)キット(Stratagene(ストラタジーン))を使用して生成させた。肺溶解物を、溶解緩衝剤[1%のNP-40、150mMのNaCl、50mMのトリス-Cl(pH7.5)、1mMのEDTAおよびプロテアーゼインヒビターカクテル(Roche(ロシュ))]で調製した。肺溶解物からのRobo4タンパク質を、前述のとおり、多クローン性抗Robo4抗体を使うウェスタンブロット分析によって検出した。
アルカリホスファターゼ(AP)染色:胚または組織を、4%のパラホルムアルデヒドおよび2mMのMgCl2のPBS中、一昼夜4℃で振盪しながら固定した。試料を、15分間3回、PBST(PBS、0.5%のTween 20)で洗浄した。内在性アルカリホスファターゼを、2mMのMgCl2を有するPBSにおいて90分間65℃で不活性化し、それからAP緩衝剤(100mMトリス-Cl、pH9.5、100mM NaCl、50mMのMgCl2、0.1%のTween 20、2mMのレバミソール)で、15分間2回洗浄した。染色は、胚のため(Boehringer Mannheim)BMパープルサブストレート(基材)(Boehringer Mannheim(ベーリンガーマンハイム))または成体の組織のためにNBT/BCIPにおいてのために実行した。5mMのEDTAで、染色をPBSにおいて止めた。
AP染色の後の全載免疫組織化学:固定され、および解剖した網膜のアルカリホスファターゼ(AP)染色は、上述のように実行した。染色は、PBS-5mMのEDTAにおいて止めた。網膜は2回PBSで洗浄し、5分、4%のパラホルムアルデヒド、リン酸塩緩衝化塩類溶液においてRTでポスト(後)固定し、そして2回PBSにおいて洗浄した。PBlec(PBS、pH6.8、1%トリトン-X100、0.1mMのCaCl、0.1mMのMgCl、0.1mMのMnCl)において2hの時間のインキュベーションの後、網膜を一昼夜、4℃で抗体とともにインキュベーションした。周皮細胞(ペリサイト)に、ラビット抗NG2抗体を使ってラベルをつけ(1:200;Chemicon(ケミコン))、そして内皮細胞をラット抗エンドムシン(endomucin)を使ってラベルをつけた(クローンV.7C7はDietmar Vestweber(ディートマー・ベストウェバー)によって快く提供された; 1 :20希釈)。PBS-T(PBS、pH7.4、1%トリトン-X100)で3回洗浄した後、試料を適切な蛍光色素を接合させた二次抗体とともに-アレクサ(Alexa)フルーア(Fluor)488または568(Molecular Probes(モレキュラー・プローブ); Invitrogen(インビトロゲン))のPBSでインキュベーションした。洗浄および4%のPFAでの短いポスト固定(postfixation)の後、網膜をフラットマウントし、そしてMowiol(モウイオル)/DABCO(Sigma-Aldrich(シグマ-オールドリッチ))を用いカバーガラス上に置いた(coversliped)。試料は、Zeiss(ツァイス)Axiocam(アキシオカム)HRcデジタルカメラを備えるZeiss Stereomicroscope Stemi(ステレオミクロスコープ・ステミ)SV 11 Bioquad(バイオクアド)を用いる観衆的な光学式および蛍光顕微鏡により、そしてZeiss LSM Meta(メタ)510を用いる共焦点レーザー走査顕微鏡によって分析した。AP染色は、633nmのHeNeレーザーおよび反射セッティングを使って視覚化した。デジタル画像をボロシティー(Volocity)(4.0 Improvision(インプロビジョン))を用いて処理し、そしてAdobe Photoshop(アドビ・フォトショップ)CS2において編集した。
免疫組織化学:全載トリプル免疫蛍光共焦点顕微鏡法を実行した。手短には、PECAM、NP1、CX40、2H3、BFABPおよびαSMAに対する抗体を、Robo4 +/+またはRobo4-/-の胚の肢の皮膚にE 15.5にてラベルをつけるために用いた。
299
Robo4発現HEK細胞上のRobo4アアゴニスト(作用薬)の結合および活性:Robo4-HA(Robo4-HEK)またはpcDNA3ベクター(コントロールHEK)だけを発現する安定した細胞系を、100μg/mlのポリL-リジンでプレコートされた6ウェルの培養ディッシュにおいて播種した。細胞を、HEK CMまたはSlit-myc CM、37℃でインキュベーションした。 1時間条件培地とともにインキュベーションした後、PBSにおいて3回の洗浄が続き、細胞を20分間4%のパラホルムアルデヒドにおいて固定した。細胞を、次いでPBSで3回洗浄し、そしてマウス抗myc抗体(Santa Cruz Biotech(サンタクルス・バイオテク))および抗マウスアレクサ(Alexa)594接合二次抗体(Molecular Probes)とともにインキュベーションとした。それらの作用薬の能力は、移動を抑制するためにRobo4と結合し、それはPark(パーク)KW, Morrison(モリソン)CM, Sorensen(ソレンセン)LK, et al., "Robo4 is a vascular-specific receptor that inhibits endothelial migration(Robo4は内皮の移動を抑制する脈管特異受容体である)," Dev Biol 2003;261(l):251-67に従って実行された。
ネズミ肺内皮細胞の分離:ヒツジ抗ラットIgGのDynal(ダイナル)ビーズ(Dynal Biotech(ダイナル・バイオテク))は、ビーズの100μLにつき、抗体の5μgで、抗-PECAM-1または抗-ICAM-2のモノクローナル抗体(BD Pharmingen(ファルミンゲン))のいずれかと接合された。ビーズは、プレコートされ、2週間まで、4℃で保存された(0.1%のBSAを有するPBSの4×108ビーズ/mL)。3匹の成体マウスからの肺を収集した。肺葉は、可視的な気管支および縦隔結合組織から解剖された。肺は赤血球を除去するために50mL冷えた分離培地(20%のFBS-DMEM)において洗浄し、はさみで細かく切り刻み、そして穏やかな動揺とともに45分間37℃で25mLの予め暖められた(pre-warmed)コラゲナーゼ(2mg/mL、Worthington(ワージントン))において消化した。消化された組織を、14ゲージ金属カニューレに付着させた60ccのシリンジ(注射筒)を通して12時間粉砕すること(triturating)によって解離させ、そしてそれから無菌の70μm使い捨ての細胞ストレーナー(Falcon(ファルコン))を介してろ過した。懸濁物を4℃で10分間400×gで遠心分離した。細胞ペレットを2mlの冷えたPBSで再懸濁し、そしてそれから、10分間室温でPECAMIコートしたビーズとともにインキュベーションした(15μL/mL細胞)。磁気セパレーターを、ビーズに結合した細胞を回収するのに用い、それを分離培地において洗い、そしてそれから、完全培地(EGM-2 MV、Lonza(ロンザ))において再懸濁した。細胞を単一のフィブロネクチンコートした75-cm2の組織培養フラスコにおいて板状培養し、そして非接着性細胞を一昼夜でのインキュベーションの後、除去した。接着細胞を、PBSで洗い、そして15mlの完全培地を加えた。培養細胞に、完全培地を交互の日に供給した。培養物が70〜80%の集密度に達したとき、それらをトリプシン-EDTAで分離し、2mlのPBSにおいて再懸濁させ、そしてICAM-2(アイカム2、細胞接着分子)接合ビーズを用い(15μL/mL細胞)、第2の時間について分類した。細胞を、上記のように洗い、板状培養した。継代2〜5を、機能的なアッセイのため
に使った。
細胞培養:ヒト真皮微小血管内皮細胞(HMVEC、Cambrex)を、EGM-2 MVにおいて増殖させ、および継代3および6の間で使った。
免疫細胞化学:8つのウェルのチャンバースライド(Lab-Tek(ラブ-テク))を、細胞の板状培養に先立ち、2時間 1.5μg/cm2のフィブロネクチンでコートした。ネズミ肺内皮細胞を、完全培地、EGM-2MVにおいて、37℃で一昼夜板状培養した(100,000の細胞/ウェル)。細胞を次いで、3回PBSにおいて洗浄し、そして室温で10分間4%のパラホルムアルデヒドで固定した。さらに3回PBSにおいて洗ったあと、細胞を室温で15分間PBSにおける1%のトリトンX-100で洗い、次いでPBST(PBSにおいて0.1%のトリトンX-100)で3回の洗浄が続いた。細胞を、それから室温で20分間PBSにおいて2%のBSAでブロックし、そして2%のBSAにおいて一次抗体:ラット抗-PECAM1(Pharmigen(ファルミゲン))、ウサギ抗-Von Willebrand Factor(フォン・ウィルブランド・ファクター)(vWF)(DAKO(ダコー))とともに室温で1時間インキュベーションした。一次抗体でのインキュベーションの後、細胞をPBSTで洗い、そして2%のBSAにおいて二次抗体:Alexa Fluor(フルーア)488ロバ抗ラットIgGおよびAlexa Fluor 594ロバ抗ウサギIgG(Molecular Probe)とともに室温で1時間インキュベーションした。細胞を1回PBSTで、1回PBSで洗い、Vectashield mounting media(ベクタシールド・マウンティング・メディア)(Vector Laboratories(ベクター・ラボラトリーズ))においてマウントし、そして共焦点顕微鏡法によって写真を撮影した。
蛍光活性化細胞ソート(FACS):ネズミ肺内皮細胞を、培養ディッシュから、37℃で、短いトリプシン処理(2分以下)によって剥離した。タンパク質分解を、EBM-2+0.1%のBSAにおいて、トリプシンインヒビターの添加によって抑止した。細胞を2回FACS緩衝剤(Ca2+およびMg2+を伴わない+0.1%BSAのPBS)で洗い、そしてそれから1mLのFACS緩衝剤で再懸濁した。細胞表面マーカーの発現の分析を、ツーステップ免疫蛍光染色で実行した。細胞を、精製したモノクローナル抗体:ラット抗PECAM-1、ウサギ抗vWFとともに4℃で30分間インキュベーションした。細胞を、それから2回FACS緩衝剤で洗い、1mLのFACS緩衝剤において再懸濁した。細胞を、それから蛍光二次抗体:Alexa Fluor488ロバ抗ラットIgGおよびAlexa Fluor 594ロバ抗ウサギIgG(Molecular Probe)とともに4℃で30分間インキュベーションした。細胞を、再び2回洗い、1mLのFACS緩衝剤において再懸濁し、そしてFACSで分析した。
細胞移動アッセイ:細胞を1時間、CellTracker Green CMFDA(セルトラッカー・グリーンCMFDA)(Molecular Probe)でラベルを付け、洗浄し、そしてそれから、0.1%のBSAで補われたEBM-2において、一昼夜飢餓させた。細胞を、トリプシン処理し、洗い、300,000細胞/mLまで再懸濁した。細胞懸濁物の100μL(30,000の細胞)を、予め5μg/mLのヒトフィブロネクチンで双方の側をコートされた8μm HTS FluoroBlock(フルオロブロック)フィルタ(BD Falcon)上に負荷した。試験因子を、EBM2/0.1%のBSAにおいて希釈し、そして下側チャンバーに置いた。3時間の37℃でのインキュベーションの後、各々のウェルからの2つの5×視野を、倒立蛍光顕微鏡(Axiovert(アキシオバート)200)上で、写真を撮った。移動した細胞の数を、蛍光細胞を計数することによって数え上げた。Robo4+/+細胞の基礎の移動は1に設定した。データを、三組の3つの独立した実験の平均±S. E.として提示する。
チューブ形成アッセイ:以前に記載5のように、チューブ形成を実行した。手短には、Robo4+/+およびRobo4AP/APマウスから分離される肺内皮細胞を、48ウェルディッシュのマトリゲルコートしたウェルの上へ板状培養し、そして0.5%の血清において一昼夜飢餓させた。細胞を、それから3.5時間、Slit2の不存在または存在下に0.48nMのVEGF-Aで刺激し、そしてそれから、写真を撮った。平均チューブ長を、イメージJソフトウェアを使用して測定した。データは、二つ組の3つの独立した実験の平均±S.E.として提示する。
試験管内の透過性アッセイ:Robo4+/+およびRobo4AP/APマウスから分離される肺内皮細胞(ECs)を、1.5μg/cm2のヒトフィブロネクチンでプレコートした3.0μm Costar transwells上に板状培養し、そして集密度に増殖させた。細胞を一昼夜飢餓させ、30-60分間0.3nMのSlit2で予め処理し、そしてそれから3.5時間2.4nMのVEGF-Aで刺激した。西洋ワサビペルオキシダーゼ(HRP)を、100μg/mlの最終濃度で一番上のチャンバーに加え、そして30分後に、培地を下側チャンバーから除去した。アリコート(分割量)を0.5mMのグアヤコール、50mMのNa2HPO4と0.6mMのH2O2とともにインキュベーションし、そしてO-フェニレンジアミンの形成を、470nmでの吸光度の測定によって定めた。モノレイヤーの基礎の透過性は、100%で設定した。データは、三つ組の3つの独立した実験の平均±S.E.として提示する。
VEGFは網膜透過性を誘発した:手短には、8-10週齢のマウスを、アバーティン(Avertin)で麻酔した(2-2-2トリブロムエタノイール、0.4mg/g;Acros Organics(アクロス・オルガニクス)、Morris Plains(モリスプレーンズ)、NJ(米国ニュージャージー州))。マウスに、50ngのSlit2N(配列番号39)を有する1.4uLの35.7ug/mLのVEGF-A(R&D Systems(R&Dシステムズ)Inc. Minneapolis(ミネアポリス)、MN(ミネソタ州))の眼内注入を与えた。モック調製物の等量による注射は、反対側の目で与えられた。指示するように、1.4uLの塩類溶液、モックの調製物、またはslitを投与した。6時間後、マウスに、60mg/mL 50uLのEvans Blue(エバンスブルー)の尾部静脈を介してのLV.注射を与えた。2時間後、マウスを犠牲にし、そして静脈内エバンスブルーを除去するために、クエン酸塩-緩衝化パラホルムアルデヒドをかん流させた。眼を摘出し、そして網膜を解剖した。エバンスブルー色素を、70℃で、18時間0.3mLのホルムアミドにおいて溶出した。抽出物を2時間、5kDフィルターを通して超遠心分離機にかけた。吸光度を、620nmで測定した。バックグラウンド吸光度を740nmで測定し、そして外へ引いた。
Robo4のアデノウイルス発現:Robo4を、以前に記述のとおり、アデノウイルスを介して発現した。
マイルアッセイ:エバンスブルーを、6-8週齢のマウスの尾部静脈中に注射し、そして30分後に、塩類溶液、またはVEGF-Aの10ngを、100ngのSlit2の不存在および存在において真皮中に注射した。さらに30分後に、パンチ生検をプリフォーム(予め形成)し、そしてエバンスブルーを60℃で18時間ホルムアミドにおいて真皮組織から溶出させた。遠心分離に次いで、吸光度を620nmで測定した。塩類溶液を注射された動物で観察される真皮透過性の量を1で設定した。データを、二つ組で各々の処置を有する5匹の個々のマウスの平均±S. E.として提示する(動物につき6つの合計の注射)。
生化学的アッセイ:HMVECを、フィブロネクチンコートされたディッシュ上に集密度にまで増殖させ、そしてEBM-2+0.2%のBSAにおいて一昼夜飢餓させた。その翌日、細胞を5分間50ng/mLのVEGF-Aで刺激し、そして氷冷のPBSで2回洗い、50mMのトリスpH7.4、150mMのNaCl、10mMのMgCl2、1mMのDTT、10%のグリセロール、1%のNP-40、0.5%のデオキシコール酸ナトリウム、0.1%のSDS、1Xプロテアーゼインヒビター、1Xホスファターゼインヒビターでにおいて溶解した。溶解物を2X試料緩衝剤と組み合わせ、SDS-PAGEによって分け、そしてホスホVEGFR2、ホスホ-p42/44およびホスホSrc(Cell Signaling(セル・シグナリング))に対する抗体で1:1000で精査した(probed with)。Rac活性化アッセイのため、粗製の膜プレップ(preps)を生成し9、そしてGTP-Racを20μg/mlのGST-PBDにより沈殿させた。溶解緩衝剤による3回の洗浄後、結合したタンパク質を、2X試料緩衝剤で溶出させた。Rac1を、モノクローナル抗体(BD Biosciences)でのウェスタンブロッティングによって検出した。
ARF活性化アッセイ:細胞を細胞培養皿から引き離し、1時間DMEM+0.2%BSAにおいて懸濁状態に保ち、そして5μg/mlのフィブロネクチンで5分間被覆したバクテリアのペトリ皿上に板状に培養した。細胞を次に2回氷冷PBSで洗浄し、そして50mMトリスpH 7.0、500mMのNaCl、1mM のMgCl2、1mMのEGTA、1mMのDTT、0.5%のNP-40、1Xプロテアーゼ抑制剤、1Xホスファターゼ抑制剤、そして50μg/mlのGST-GGA3-VHS-GATで溶解した。溶解物は14,000rpmで5分間遠心分離し、そして上澄みを4℃で30分間グルタチオンアガロースの50μlと共にインキュベートした。次いで、3回溶解バッファで洗い、結合タンパク質を2×試料バッファで溶出させた。Arf6を、Arf6-特異抗体を用いてウエスタンブロッティングによって検出した。
統計的分析:統計的有意性を、スチューデントt-検定またはANOVA(分散分析)を用いて、適切なように定めた。
参照
(1) Afzal A, Shaw LC, Ljubimov AV, Boulton ME, Segal MS, Grant MB. Retinal and choroidal microangiopathies: Therapeutic opportunities. Microvasc Res 2007.
(2) Armour KL, Clark MR, Hadley AG, Williamson LM. Recombinant human IgG molecules lacking Fcgamma receptor I binding and monocyte triggering activities. Eur J Immunol 1999; 29(8):2613-24.
(3) Balasubramanian, N., Scott, D. W., Castle, J. D., Casanova, J.E. & Schwartz, M.A. Arfo and microtubules in adhesion-dependent trafficking of lipid rafts. Nature cell biology 9, 1381-1391 (2007).
(4) Bashaw, G.J., Kidd, T., Murray, D., Pawson, T., and Goodman, CS. (2000). Repulsive axon guidance: Abelson and Enabled play opposing roles downstream of the roundabout receptor. Cell 101, 703-715.
(5) Battye, R., Stevens, A., and Jacobs, J.R. (1999). Axon repulsion from the midline of the Drosophila CNS requires slit function. Development 126, 2475-2481.
(6) Battye R, Stevens A, Perry RL, Jacobs JR. Repellent signaling by Slit requires the leucine-rich repeats. J Neurosci 2001; 21(12):4290-8.
(7) Bedell, V.M., Yeo, S.Y., Park, K. W., Chung. J., Seth, P., Shivalingappa, V., Zhao, J., Obara, T., Sukhatme, V.P., Drummond, I.A., Li, D.Y., and Ramchandran, R. (2005). roundabout4 is essential for angiogenesis in vivo. Proc. Natl. Acad. Sci. U.S.A. 102, 6373-6378.
(8) Brooks, P. C, Clark, R. A., and Cheresh, D. A. (1994). Requirement of vascular integrin alpha v beta 3 for angiogenesis. Science 264, 569-571.
(9) Brooks, P.C., Montgomery, A.M., Rosenfeld, M., Reisfeld, R.A., Hu, T., Klier, G., and Cheresh, D. A. (1994). Integrin alpha v beta 3 antagonists promote tumor regression by inducing apoptosis of angiogenic blood vessels. Cell 30, 1157-1164.
(10) Brose, K., Bland, K.S., Wang, K.H., ARNOtt, D., Henzel, W., Goodman, C.S., Tessier-Lavigne, M., and Kidd, T. (1999). Slit proteins bind Robo receptors and have an evolutionarily conserved role in repulsive axon guidance. Cell 19, 795-806.
(11) Brown DM, Kaiser PK, Michels M, Soubrane G, Heier JS, Kim RY, Sy JP, Schneider S; ANCHOR Study Group. Ranibizumab versus verteporfin for neovascular age- related macular degeneration. N Engl J Med. 2006 355(14): 1432-44.
(12) Brown, M.C., and Turner, CE. (2004). Paxillin: adapting to change. Physiol. Rev. 84, 1315-1339.
(13) Byzova, T.V., Goldman, C.K., Pampori, N., Thomas, K.A., Bett, A., Shattil, S.J., and Plow, E. F. (2000). A mechanism for modulation of cellular responses to VEGF: activation of the integrins. Mol. Cell 6, 851-860.
(14) Carmeliet P, Tessier-Lavigne M. Common mechanisms of nerve and blood vessel wiring. Nature 2005; 436(7048): 193-200.
(15) Cheng HJ, Nakamoto M, Bergemann AD, Flanagan JG. Complementary gradients in expression and binding of ELF-1 and Mek4 in development of the topographic retinotectal projection map. Cell 1995; 82(3):371-81.
(16) Chun DW, Heier JS, Topping TM, Duker JS, Bankert JM. A pilot study of multiple intravitreal injections of ranibizumab in patients with center-involving clinically significant diabetic macular edema. Ophthalmology 2006; 113(10):1706-12.
(17) Cross MJ, Dixelius J, Matsumoto T, Claesson-Welsh L. VEGF-receptor signal transduction. Trends in biochemical sciences 2003; 28(9):488-94.
(18) Culotti JG, Merz DC. DCC and netrins. Curr Opin Cell Biol 1998; 10(5):609-13.
(19) Diabetic Retinopathy Clinical Research Network, Scott IU, Edwards AR, Beck RW, Bressler NM, Chan CK, Elman MJ, Friedman SM, Greven CM, Maturi RK, Pieramici DJ, Shami M, Singerman LJ, Stockdale CR. A phase II randomized clinical trial of intravitreal bevacizumab for diabetic macular edema. Ophthalmology. 2007 114(10): 1860-7.
(20) Dickson BJ. Molecular mechanisms of axon guidance. Science 2002; 298(5600): 1959-64.
(21) Dong QG, Bernasconi S, Lostaglio S, et al. A general strategy for isolation of endothelial cells from murine tissues. Characterization of two endothelial cell lines from the murine lung and subcutaneous sponge implants. Arterioscler Thromb Vase Biol 1997; 17(8): 1599-604.
(22) Dorrell M, Uusitalo-Jarvinen H, Aguilar E, Friedlander M. Ocular neovascularization: basic mechanisms and therapeutic advances. Surv Ophthalmol. 2007 52 Suppl 1:S3-19.
(23) Drescher U, Kremoser C, Handwerker C, Loschinger J, Noda M, Bonhoeffer F. In vitro guidance of retinal ganglion cell axons by RAGS, a 25 kD tectal protein related to ligands for Eph receptor tyrosine kinases. Cell 1995; 82(3):359-70.
(24) D'Souza-Schorey, C, and Chavrier, P. (2006). ARF proteins: roles in membrane traffic and beyond. Nat. Rev. Mol. Cell. Biol. 7, 347-358.
(25) Eliceiri BP, Cheresh DA. (2000). Role of alpha v integrins during angiogenesis. Cancer J. 6, S245-249.
(26) Eliceiri BP, Paul R, Schwartzberg PL, Hood JD, Leng J, Cheresh DA. Selective requirement for Src kinases during VEGF-induced angiogenesis and vascular permeability. Molecular cell 1999; 4(6):915-24.
(27) Eliceiri BP, Puente XS, Hood JD, et al. Src-mediated coupling of focal adhesion kinase to integrin alpha(v)beta5 in vascular endothelial growth factor signaling. The Journal of cell biology 2002; 157(1): 149-60.
(28) Francis, S.E., Goh, K.L., Hodivala-Dilke, K., Bader, B.L., Stark, M., Davidson, D., and Hynes, R.O. (2002). Central roles of alpha5betal integrin and fibronectin in vascular development in mouse embryos and embryoid bodies. Arterioscler. Thromb. Vase. Biol. 22, 927-933.
(29) Garrett TA, Van Buul JD, Burridge K. VEGF-induced Racl activation in endothelial cells is regulated by the guanine nucleotide exchange factor Vav2. Experimental cell research 2007; 313(15):3285-97.
(30) Gavard J, Gutkind JS. VEGF controls endothelial-cell permeability by promoting the beta-arrestin-dependent endocytosis of VE-cadherin. Nature cell biology 2006; 8(11):1223-34.
(31) Gerhardt H, Golding M, Fruttiger M, et al. VEGF guides angiogenic sprouting utilizing endothelial tip cell filopodia. The Journal of cell biology 2003; 161(6): 1163-77.
(32) Goldfinger, L.E., Han, J., Kiosses, W.B., Howe, A.K., and Ginsberg, M.H. (2003). Spatial restriction of alpha4 integrin phosphorylation regulates lamellipodial stability and alpha4betal -dependent cell migration. J. Cell Biol. 162, 731-741.
(33) Markus Hafner, Anton Schmitz, Imke Gru 'ne, Seergazhi G. Srivatsan, Bianca Paul, Waldemar Kolanus, Thomas Quast, Elisabeth Kremmer, Inga Bauer & Michael Famulok (2006). Inhibition of cytohesins by SecinH3 leads to hepatic insulin resistance. Nature. 444, 941-944.
(34) Hagel, M., George, E. L., Kim, A., Tamimi, R., Opitz, S. L., Turner, C.E. , Imamoto, A., and Thomas, S.M. (2002). The adaptor protein paxillin is essential for normal development in the mouse and is a critical transducer of fibronectin signaling. Mol. Cell. Biol. 22, 901-915.
(35) Han, J., Liu, S., Rose, D.M., Schlaepfer, D.D., McDonald, H., and Ginsberg, M.H. (2001). Phosphorylation of the integrin alpha 4 cytoplasmic domain regulates paxillin binding. J. Biol. Chem. 276, 40903-40909.
(36) Hohenester E, Hussain S, Howitt JA. Interaction of the guidance molecule Slit with cellular receptors. Biochem Soc Trans 2006; 34(Pt 3):418-21.
(37) Hohenester, E., Hussain, S., and Howitt, J.A. (2006). Interaction of the guidance molecule Slit with cellular receptors. Biochem. Soc. Trans. 34, 418-421.
(38) Hong K, Hinck L, Nishiyama M, Poo MM, Tessier-Lavigne M, Stein E. A ligand- gated association between cytoplasmic domains of UNC5 and DCC family receptors converts netrin-induced growth cone attraction to repulsion. Cell 1999; 97(7):927-41.
(39) Howitt JA, Clout NJ, Hohenester E. Binding site for Robo receptors revealed by dissection of the leucine-rich repeat region of Slit. Embo J 2004; 23(22):4406-12.
(40) Hu, H., Li, M., Labrador, J. P., McEwen, J., Lai, E.C., Goodman, C. S., and Bashaw, G.J. (2005). Cross GTPase-activating protein (CrossGAP)/Vilse links the Roundabout receptor to Rac to regulate midline repulsion. Proc. Natl. Acad. Sci. U.S.A. 102, 4613-4618.
(41) Huminiecki, L., and Bicknell, R. (2000). In silico cloning of novel endothelialspecific genes. Genome Res. 10, 1796-1806.
(42) Huminiecki L, Gorn M, Suchting S, Poulsom R, Bicknell R. Magic roundabout is a new member of the roundabout receptor family that is endothelial specific and expressed at sites of active angiogenesis. Genomics 2002; 79(4):547-52.
(43) Huminiecki, L., Gorn, M., Suchting, S., Poulsom, R., and Bicknell, R. (2002). Magic roundabout is a new member of the roundabout receptor family that is endothelial specific and expressed at sites of active angiogenesis. Genomics 79, 547-552.
(44) Ikeda, S. et al. Novel role of ARF6 in vascular endothelial growth factor-induced signaling and angiogenesis. Circulation research 96, 467-475 (2005).
(45) Jain RK. Molecular regulation of vessel maturation. Nat Med 2003; 9(6):685-93.
(46) Jin, S.W., Beis, D., Mitchell, T., Chen, J.N., and Stainier, D.Y. (2005). Cellular and molecular analyses of vascular tube and lumen formation in zebrafish. Development 132, 5199-5209.
(47) Jones CA, Li DY. Common cues regulate neural and vascular patterning. Curr Opin Genet Dev. 2007 Aug; 17(4):332-6.
(48) Kanellis, J., Garcia, G.E., Li, P., Parra, G., Wilson, C.B., Rao, Y., Han, S., Smith, C.W., Johnson, R.J., Wu, J. Y., and Feng, L. (2004). Modulation of inflammation by slit protein in vivo in experimental crescentic glomerulonephritis. Am. J. Pathol. 165, 341-352.
(49) Katoh Y, Katoh M. Comparative genomics on SLIT1, SLIT2, and SLIT3 orthologs. Oncol Rep 2005; 14(5):1351-5.
(50) Kaur, S., Castellone, M.D., Bedell, V.M., Konar, M., Gutkind, J.S., and Ramchandran, R. (2006). Robo4 signaling in endothelial cells implies attraction guidance mechanisms. J. Biol. Chem. 281, 11347-11356.
(51) Kidd, T., Bland, K.S., and Goodman, CS. (1999). Slit is the midline repellent for the robo receptor in Drosophila. Cell 96, 785-794.
(52) Kidd, T., Brose, K., Mitchell, K.J., Fetter, R.D., Tessier-Lavigne, M., Goodman, C. S., and Tear, G. (1998). Roundabout controls axon crossing of the CNS midline and defines a novel subfamily of evolutionarily conserved guidance receptors. Cell 92, 205-215.
(53) Kidd, T., et al. Roundabout controls axon crossing of the CNS midline and defines a novel subfamily of evolutionarily conserved guidance receptors. Cell 92, 205-215 (1998).
(54) Kimmel, C.B., Ballard, W. W., Kimmel, S.R., Ullmann, B., and Schilling, T.F. (1995). Stages of embryonic development of the zebrafish. Dev. Dyn. 203, 253-310.
(55) Lantry LE. Ranibizumab, a mAb against VEGF-A for the potential treatment of age- related macular degeneration and other ocular complications. Curr Opin Mol Ther. 2007 9(6):592-602.
(56) Lauffenburger, D. A., and Horwitz, A.F. (1996). Cell migration: a physically integrated molecular process. Cell 84, 359-369.
(57) Lawson, N.D., and Weinstein, B.M. (2002). In vivo imaging of embryonic vascular development using transgenic zebrafish. Dev. Biol. 248, 307-318.
(58) Li, H.S., Chen, J.H., Wu, W., Fagaly, T., Zhou, L., Yuan, W., Dupuis, S., Jiang, Z.H., Nash, W., Gick, C, Ornitz, D.M., Wu, J. Y., and Rao, Y. (1999). Vertebrate slit, a secreted ligand for the transmembrane protein roundabout, is a repellent for olfactory bulb axons. Cell 19, 807-818.
(59) Li Q, Olsen BR. Increased angiogenic response in aortic explants of collagen XVIII/endostatin-null mice. Am J Pathol 2004; 165(2):415-24.
(60) Lim YC, Garcia-Cardena G, Allport JR, et al. Heterogeneity of endothelial cells from different organ sites in T-cell subset recruitment. Am J Pathol 2003; 162(5):1591-601.
(61) Lima e Silva R, Saishin Y, Saishin Y, et al. Suppression and regression of choroidal neovascularization by polyamine analogues. Investigative ophthalmology & visual science 2005; 46(9):3323-30.
(62) Little M, Rumballe B, Georgas K, Yamada T, Teasdale RD. Conserved modularity and potential for alternate splicing in mouse and human Slit genes. Int J Dev Biol 2002; 46(4):385-91.
(63) Liu, S., and Ginsberg, M. H. (2000). Paxillin binding to a conserved sequence motif in the alpha 4 integrin cytoplasmic domain. J. Biol. Chem. 275, 22736-22742.
(64) Liu, S., Kiosses, W.B., Rose, D.M., Slepak, M., Salgia, R., Griffin, J.D., Turner, C.E., Schwartz, M.A., and Ginsberg, M.H. (2002). A fragment of paxillin binds the alpha 4 integrin cytoplasmic domain (tail) and selectively inhibits alpha 4-mediated cell migration. J. Biol. Chem. 277, 20887-20894.
(65) Liu, S., Thomas, S.M., Woodside, D.G., Rose, D.M., Kiosses, W.B., Pfaff, M., and Ginsberg, M.H. (1999). Binding of paxillin to alpha4 integrins modifies integrin-dependent biological responses. Nature 402, 676-681.
(66) Long, H., et al. Conserved roles for Slit and Robo proteins in midline commissural axon guidance. Neuron 42, 213-223 (2004).
(67) Lundstrom, A., Gallio, M., Englund, C, Steneberg, P., Hemphala, J., Aspenstrom, P., Keleman, K., Falileeva, L., Dickson, B.J., and Samakovlis, C. (2004). Vilse, a conserved Rac/Cdc42 GAP mediating Robo repulsion in tracheal cells and axons. Genes Dev. 18, 2161-2171.
(68) Mahabeleshwar, G.H., Feng, W., Reddy, K., Plow, E. F. & Byzova, T.V. Mechanisms of integrin-vascular endothelial growth factor receptor cross-activation in angiogenesis. Circulation research 101, 570-580 (2007).
(69) Marillat, V., Cases, O., Nguyen-Ba-Charvet, K.T., Tessier-Lavigne, M., Sotelo, C, and Chedotal, A. (2002). Spatiotemporal expression patterns of slit and robo genes in the rat brain. J. Comp. Neurol. 442, 130-155.
(70) Matthay MA, Zimmerman GA. (2005). Acute lung injury and the acute respiratory distress syndrome: four decades of inquiry into pathogenesis and rational management. Am J Respir Cell Mol Biol.; 33(4):319-27.
(71) Nakamura, K., Yano, H., Uchida, H., Hashimoto, S., Schaefer, E., and Sabe, H. (2000). Tyrosine phosphorylation of paxillin alpha is involved in temporospatial regulation of paxillin-containing focal adhesion formation and F-actin organization in motile cells. J. Biol. Chem. 275, 27155-27164.
(72) Navankasattusas, S., K.J. Whitehead, A. SuIi, L.K. Sorensen, A.H. Lim, J. Zhao, K.R. Thomas, CB. Chien, and D. Y. Li. The netrin receptor, Unc5b, promotes angiogenesis in specific vascular beds. Development (in press).
(73) Nishiya, N., Kiosses, W.B., Han, J., and Ginsberg, M.H. (2005). An alpha4 integrin- paxillin-Arf-GAP complex restricts Rac activation to the leading edge of migrating cells. Nat. Cell Biol. 7, 343-352.
(74) Nobes, CD., and Hall, A. (1995). Rho, rac, and cdc42 GTPases regulate the assembly of multimolecular focal complexes associated with actin stress fibers, lamellipodia, and filopodia. Cell 81, 53-62.
(75) Nobes, CD. & Hall, A. Rho GTPases control polarity, protrusion, and adhesion during cell movement. The Journal of cell biology 144, 1235-1244 (1999).
(76) Ojima T, Takagi H, Suzuma K, Oh H, Suzuma I, Ohashi H, Watanabe D, Suganami E, Murakami T, Kurimoto M, Honda Y, Yoshimura N. EphrinA1 inhibits vascular endothelial growth factor-induced intracellular signaling and suppresses retinal neovascularization and blood-retinal barrier breakdown. Am J Pathol. 2006 Jan; 168(l):331-9.
(77) Ozaki H, Seo MS, Ozaki K, et al. Blockade of vascular endothelial cell growth factor receptor signaling is sufficient to completely prevent retinal neovascularization. Am J Pathol 2000; 156(2):697-707.
(78) Park KW, Crouse D, Lee M, et al. The axonal attractant Netrin- 1 is an angiogenic factor. Proc Natl Acad Sci U S A 2004; 101(46): 16210-5.
(79) Park KW, Morrison CM, Sorensen LK, et al. Robo4 is a vascular-specific receptor that inhibits endothelial migration. Dev Biol 2003; 261(1):251-67.
(80) Park, K. W., Morrison, CM., Sorensen, L.K., Jones, C.A., Rao, Y., Chien, C. B., Wu, J. Y., Urness, L.D., and Li, D. Y. (2003). Robo4 is a vascular-specific receptor that inhibits endothelial migration. Dev. Biol. 261, 251-267.
(81) Raper JA. Semaphorins and their receptors in vertebrates and invertebrates. Curr Opin Neurobiol 2000; 10(1):88-94.
(82) Reutershan J, Morris MA, Burcin TL, Smith DF, Chang D, Saprito MS, Ley K. Critical role of endothelial CXCR2 in LPS-induced neutrophil migration into the lung. J Clin Invest. 2006 116(3):695-702.
(83) Ridley, A.J., Schwartz, M.A., Burridge, K., Firtel, R.A., Ginsberg, M.H., Borisy, G., Parsons, J.T., and Horwitz, A.R. (2003). Cell migration: integrating signals from front to back. Science. 302, 1704-1709.
(84) Rosenfeld PJ, Brown DM, Heier JS, et al. Ranibizumab for neovascular age-related macular degeneration. N Engl J Med 2006; 355(14): 1419-31.
(85) Ruhrberg C, Gerhardt H, Golding M, et al. Spatially restricted patterning cues provided by heparin-binding VEGF-A control blood vessel branching morphogenesis. Genes & development 2002; 16(20):2684-98.
(86) Salgia, R., Li, J.L., Ewaniuk, D.S., Wang, Y.B., Sattler, M., Chen, W.C., Richards, W., Pisick, E., Shapiro, G.I., Rollins, B.J., Chen, L.B., Griffin, J.D., and Sugarbaker, DJ. (1999). Expression of the focal adhesion protein paxillin in lung cancer and its relation to cell motility. Oncogene. 18, 67-77.
(87) Seeger, M., Tear, G., Ferres-Marco, D., and Goodman, CS. (1993). Mutations affecting growth cone guidance in Drosophila: genes necessary for guidance toward or away from the midline. Neuron 10, 409-426.
(88) Senger, D.R., Claffey, K.P., Benes, J.E., Perruzzi, CA., Sergiou, A.P., and Detmar, M. (1997). Angiogenesis promoted by vascular endothelial growth factor: regulation through alphalbetal and alpha2betal integrins. Proc. Natl. Acad. Sci. U.S.A. 94, 13612-13617.
(89) Seth, P., Lin, Y., Hanai, J., Shivalingappa, V., Duyao, M.P., and Sukhatme, V.P. Magic roundabout, a tumor endothelial marker: expression and signaling. Biochem. Biophys. Res. Commun. 332, 533-541.
(90) Seth P, Lin Y, Hanai J, Shivalingappa V, Duyao MP, Sukhatme VP. Magic roundabout, a tumor endothelial marker: expression and signaling. Biochem Biophys Res Commun 2005; 332(2):533-41.
(91) Shields RL, Namenuk AK, Hong K, et al. High resolution mapping of the binding site on human IgGl for Fc gamma RI, Fc gamma RII, Fc gamma RIII, and FcRn and design of IgGl variants with improved binding to the Fc gamma R. J Biol Chem 2001; 276(9):6591-604.
(92) Smith LE, Wesolowski E, McLellan A, et al. Oxygen-induced retinopathy in the mouse. Investigative ophthalmology & visual science 1994; 35(1):101-11.
(93) Soga, N., Connolly, J.O., Chellaiah, M., Kawamura, J., and Hruska, K. A. (2001). Rac regulates vascular endothelial growth factor stimulated motility. Cell Commun. Adhes. 8, 1-13.
(94) Soga, N., Namba, N., McAllister, S., Cornelius, L., Teitelbaum, S.L., Dowdy, S. F., Kawamura, J., and Hruska, K.A. (2001). Rho family GTPases regulate VEGF stimulated endothelial cell motility. Exp. Cell Res. 269, 73-87.
(95) Soldi, R., Mitola, S., Strasly, M., Defilippi, P., Tarone, G., and Bussolino, F. (1999). Role of alphavbeta3 integrin in the activation of vascular endothelial growth factor receptor-2. EMBO J. 18, 882-892.
(96) Stein E, Tessier-Lavigne M. Hierarchical organization of guidance receptors: silencing of netrin attraction by slit through a Robo/DCC receptor complex. Science 2001; 291(5510):1928-38.
(97) Suchting, S., Heal, P., Tahtis, K., Stewart, L.M., and Bicknell, R. (2005). Soluble Robo4 receptor inhibits in vivo angiogenesis and endothelial cell migration. FASEB J. 19, 121-138.
(98) Turner, C.E. (2000). Paxillin interactions. J. Cell Sci. 113, 139-140. Wang, K.H., Brose, K., ARNOtt, D., Kidd, T., Goodman, C.S., Henzel, W., and Tessier-Lavigne, M. (1999). Biochemical purification of a mammalian slit protein as a positive regulator of sensory axon elongation and branching. Cell 96, 771-784.
(99) Turner, C.E. Paxillin and focal adhesion signalling. Nature cell biology 2, E231-236 (2000).
(100) Uemura A, Kusuhara S, Katsuta H, Nishikawa S. Angiogenesis in the mouse retina: a model system for experimental manipulation. Experimental cell research 2006; 312(5):676-83.
(101) Urness LD, Li DY. Wiring the vascular circuitry: from growth factors to guidance cues. Curr Top Dev Biol 2004; 62:87-126.
(102) Wang, B., Xiao, Y., Ding, B.B., Zhang, N., Yuan, X., Gui, L., Qian, K.X., Duan, S., Chen, Z., Rao, Y., and Geng, J. G. (2003). Induction of tumor angiogenesis by Slit-Robo signaling and inhibition of cancer growth by blocking Robo activity. Cancer Cell 4, 19-29.
(103) Wang, K.H. et al. Biochemical purification of a mammalian slit protein as a positive regulator of sensory axon elongation and branching. Cell 96, 771-784 (1999).
(104) Watanabe D, Suzuma K, Matsui S, Kurimoto M, Kiryu J, Kita M, Suzuma I, Ohashi H, Ojima T, Murakami T, Kobayashi T, Masuda S, Nagao M, Yoshimura N, Takagi H. Erythropoietin as a retinal angiogenic factor in proliferative diabetic retinopathy. N Engl J Med. 2005 353(8):782-92.
(105) Weinstein, B.M. (2002). Plumbing the mysteries of vascular development using the zebrafish. Semin. Cell Dev. Biol. 13, 515-522.
(106) Werdich XQ, McCollum GW, Rajaratnam VS, Penn JS. Variable oxygen and retinal VEGF levels: correlation with incidence and severity of pathology in a rat model of oxygen- induced retinopathy. Exp Eye Res 2004; 79(5):623-30.
(107) West, K.A., Zhang, H., Brown, M.C., Nikolopoulos, S.N., Riedy, M.C., Horwitz, A.F., and Turner, C.E. (2001). The LD4 motif of paxillin regulates cell spreading and motility through an interaction with paxillin kinase linker (PKL). J. Cell Biol. 154, 161-176.
(108) Westerfield, M. (2000). The zebrafish book. A guide for the laboratory use of zebrafish (Danio rerio). 4th ed. (Univ. of Oregon Press, Eugene).
(109) Wilkinson DG, Bhatt S, Herrmann BG. Expression pattern of the mouse T gene and its role in mesoderm formation. Nature 1990; 343(6259):657-9.
(110) Wilson BD, Ii M, Park KW, et al. Netrins promote developmental and therapeutic angiogenesis. Science 2006; 313(5787):640-4.
(111) Wojciak-Stothard, B., Potempa, S., Eichholtz, T., and Ridley, AJ. (2001). Rho and Rac but not Cdc42 regulate endothelial cell permeability. J. Cell Sci. 114, 1343-1355.
(112) Wong, K., Ren, X.R., Huang, Y.Z., Xie, Y., Liu, G., Saito, H., Tang, H., Wen, L., Brady-Kalnay, S.M., Mei, L., Wu, J. Y., Xiong, W.C., and Rao, Y. (2001). Signal transduction in neuronal migration: roles of GTPase activating proteins and the small GTPase Cdc42 in the Slit-Robo pathway. Cell 107, 209-221.
(113) Wu, J.Y., Feng, L., Park, H.T., Havlioglu, N., Wen, L., Tang, H., Bacon, K.B., Jiang, Z., Zhang, X., and Rao, Y. (2001). The neuronal repellent Slit inhibits leukocyte chemotaxis induced by chemotactic factors. Nature 410, 948-952.
(114) Wu, W., Wong, K., Chen, J., Jiang, Z., Dupuis, S., Wu, J. Y., and Rao, Y. (1999). Directional guidance of neuronal migration in the olfactory system by the protein Slit. Nature 400, 331-336.
(115) Xu Q, Qaum T, Adamis AP. Sensitive blood-retinal barrier breakdown Quantitation using evans blue. Invest Ophthalmol Vis Sci. 2001; 42(3):789-94.
(116) Yano, H., Mazaki, Y., Kurokawa, K., Hanks, S.K., Matsuda, M., and Sabe, H. (2004). Roles played by a subset of integrin signaling molecules in cadherinbased cell-cell adhesion. J. Cell Biol. 166, 283-295.
(117) Yano, H., Uchida, H., Iwasaki, T., Mukai, M., Akedo, H., Nakamura, K., Hashimoto, S., and Sabe, H. (2000). Paxillin alpha and Crk-associated substrate exert opposing effects on cell migration and contact inhibition of growth through tyrosine phosphorylation. Proc. Natl. Acad. Sci. U.S.A. 97, 9076-9081.
(118) Yu, T.W., Hao, J.C., Lim, W., Tessier-Lavigne, M., and Bargmann, C.I. (2002). Shared receptors in axon guidance: SAX-3/Robo signals via UNC-34/Enabled and a Netrin- independent UNC-40/DCC function. Nat. Neurosci. 5, 1147-1154.
(119) Yuan, W., Zhou, L., Chen, J.H., Wu, J. Y., Rao, Y., and Ornitz, D.M. (1999). The mouse SLIT family: secreted ligands for ROBO expressed in patterns that suggest a role in morphogenesis and axon guidance. Dev. Biol. 212, 290-306.
(120) Yuminamochi, T., Yatomi, Y., Osada, M., Ohmori, T., Ishii, Y., Nakazawa, K., Hosogaya, S., and Ozaki, Y. (2003). Expression of the LIM proteins paxillin and Hic-5 in human tissues. J. Histochem. Cytochem. 51, 513-521.
(121) Zallen, J.A., Yi, B.A., and Bargmann, C.I. (1998). The conserved immunoglobulin superfamily member SAX-3/Robo directs multiple aspects of axon guidance in C. elegans. Cell 92, 217-227.
(122) Zhang, Q. et al. Small-molecule synergist of the Wnt/beta-catenin signaling pathway. Proceedings of the National Academy of Sciences of the United States of America 104, 7444- 7448 (2007).
(123) Zhu, Y., Li, H., Zhou, L., Wu, J. Y., and Rao, Y. (1999). Cellular and molecular guidance of GABAergic neuronal migration from an extracortical origin to the neocortex. Neuron 23, 473-485.