発明の詳細な説明
I. 概要
CD4+Tヘルパー細胞のサブセットは、広範なヒト炎症性疾患に影響し、それらを調節し得る分子および経路を解明するために相当な努力が費やされている。TIM-3は、最終分化を遂げたIFN-γ分泌CD4+Th1細胞上で特異的に発現され、それらの機能を制限する分子として最初に同定された。TIM-3は、完全に分化したTh1細胞上で選択的に発現されるがTh2細胞上では発現されず(Monney, Nature. 2002 415(6871):536-41)、Th1細胞の機能および寛容を誘導する能力の両方を調節することがマウスにおいて示されている(Sabatos, Nat Immunol. 2003 Nov;4(11):1102-10; Sanchez-Fueyo, Nat Immunol. 2003 Nov;4(11):1093-101)。ガレクチン-9は、TIM-3のリガンドであり、参照により組み入れられる米国特許出願公開第2005/0191721号に開示されている。ガレクチン-9は、ガレクチンファミリーのメンバーであり、様々な細胞型で遍在的に発現され、β-ガラクトシドに結合する。
ガレクチン-9:TIM-3の相互作用は、エフェクターTh1細胞において細胞死を特異的に誘導することによってTh1免疫を負に調節する。発明者らは最近、ヒトにおいて、多発性硬化症(MS)患者の脳脊髄液から単離した潜在的に病原性のTh1 T細胞クローンが、対照対象から得られたものよりも低レベルのTIM-3を発現し、CNSにおけるT細胞寛容の低下と一致していることを実証した。したがって、TIM-3は、ヒト自己免疫疾患における自己反応性T細胞と関連して、Th1細胞および寛容の維持を決定的に調節し得る。
樹状細胞およびマクロファージを含む抗原提示細胞は、免疫応答の結果を指令する際に決定的に重要な役割を果たし、それらが刺激される様式に応じて、T細胞活性化を刺激または抑制することができる。ミクログリアは、CNSの抗原提示細胞であり、浸潤T細胞を活性化することができる。実際、ミクログリア活性化は、CNSの様々な神経変性疾患および炎症性疾患に関連している。
発明者らは、ナイーブな状態で、TIM-3は、マウスおよびヒトの両方において先天性免疫系の細胞上で高レベルで構成的に発現されること、ならびにこれらの細胞上でのTIM-3発現は、Th1分化を逆説的に促進することを発見した。さらに、TIM-3とTLR(Toll様受容体)シグナル伝達の相乗作用が本明細書において実証される。これらの結果の有意性は、2種の異なるCNS疾患において検査される。活性なMS病変から単離したAPC、特にCD11b+ミクログリアにおいて、切除した膠芽腫組織から単離したものと比べて有意に高いTIM-3発現が判明した。多発性硬化症のマウスモデルにおいて、TIM-3を対象とするアゴニスト抗体の存在下では疾患が悪化した。まとめると、本開示は、先天性免疫系において、TIM-3の存在は、最初はTh1免疫の発生を増大させるが、分化したTh1細胞上でその発現が優勢である場合、その後、適応免疫を終結させ得ることを実証する。これらの知見は、本明細書において開示する広範な末梢性および器官特異的な炎症性ヒト疾患に関連性がある。
本発明の1つの局面は、一般に、神経系障害、特に、炎症を伴うかまたは炎症を特徴とする障害の治療のための新規な方法および作用物質を提供する。好ましい神経系障害には、多発性硬化症および神経膠の腫瘍が含まれる。本発明の方法は、対象においてTIM-3活性を調整して、障害を治療する。TIM-3活性を低下させるための本発明の方法は、神経変性障害のような神経系障害を有する対象にとって有用であり得るのに対し、対象においてTIM-3活性を上昇させる方法は、神経膠の腫瘍または他の神経系腫瘍を有する対象にとって有用であり得る。
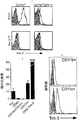
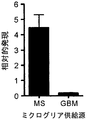
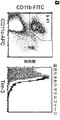
本発明の局面は、樹状細胞、ヒト単球、およびCD11b+ミクログリアを含むAPC上にTIM-3が存在し、かつガレクチン-9のようなTIM-3リガンドによる刺激がTFNα分泌をもたらすという予想外の知見に部分的に基づいている。さらに、TIM-3発現は、MS病変の活性な境界領域において増加しているが、TIM-3発現は、CNS腫瘍、多形性神経膠芽細胞腫から得た組織において減少している。
本発明の1つのさらなる局面は、TIM-3発現が、対照組織と比べて、多形性神経膠芽細胞腫脳腫瘍組織から単離したミクログリアにおいて有意に低いという予想外の知見に部分的に基づいている。本発明は、対象において腫瘍を治療する方法であって、対象においてTIM-3活性を上昇させる治療的有効量の作用物質を対象に投与する段階を含む方法を提供する。1つの態様において、腫瘍は、中枢神経系腫瘍である。中枢神経系腫瘍には、髄膜腫、下垂体腺腫、神経腫、ならびに星細胞腫、乏突起膠腫、上衣細胞腫、混合膠腫、乏突起星細胞腫、神経節膠腫、および多形性神経膠芽細胞腫などの神経膠腫が含まれるがそれらに限定されるわけではない。1つの態様において、腫瘍は、神経膠の腫瘍である。
本発明の1つのさらなる局面は、抗原提示細胞またはAPCにおけるTIM-3活性化が、TNF-α分泌を誘導するという予想外の知見に部分的に基づいている。したがって、本発明は、TIM-3活性を上昇させる作用物質をアジュバントとして含むワクチン組成物を提供する。これらは、ウイルスワクチン、細菌ワクチン、または癌ワクチンのために有用であり得る。
II. 定義
便宜上、本明細書、実施例、および添付の特許請求の範囲において使用するいくつかの用語を以下に集める。他に規定されない限り、本明細書で使用される技術用語および科学用語はすべて、本発明が属する技術分野の当業者によって一般に理解されるのと同じ意味を有する。
冠詞「a」および「an」は、本明細書において、冠詞の1つまたは複数(すなわち、少なくとも1つ)の文法上の対象物を指すために使用される。例えば、「要素(an element)」とは、1つの要素または複数の要素を意味する。
「抗原」という用語は、適応免疫系によって認識され得る物質すべてを含む。これは、例えば、ウイルス、細菌、腫瘍特異的抗原、トキソイド、多糖類のコンジュゲート、RNA、およびDNAを含む。
「含む(including)」という用語は、「含まれるがそれらに限定されるわけではない」という語句を意味するために本明細書において使用され、かつこれと同義的に使用される。
「または」という用語は、文脈において特に指示がない限り、「および/または」という用語を意味するために本明細書において使用され、かつこれと同義的に使用される。
「など(such as)」という用語は、「などであるがそれらに限定されるわけではない(such as but not limited to)」という語句を意味するために本明細書において使用され、かつこれと同義的に使用される。
「核酸」という用語は、デオキシリボ核酸(DNA)、および必要に応じてリボ核酸(RNA)などのポリヌクレオチドを意味する。この用語はまた、ヌクレオチド類似体から作製されたRNAまたはDNAいずれかの類似体、ならびに説明される態様に適用可能な場合は、一本鎖ポリヌクレオチド(センスまたはアンチセンス)および二本鎖ポリヌクレオチドを、等価物として含むと理解されるべきである。
「予防する」という用語は、当技術分野において認識されており、局所的再発(例えば疼痛)、癌のような疾患、心不全のような複合症候群、または他の任意の医学的状態などの状態に関して使用される場合、当技術分野において良く理解されており、組成物を与えられない対象と比べて、対象において医学的状態の頻度を低下させるか、重症度を低下させるか、または症状の発症を遅延させる組成物を、状態が発生する前に投与する段階を含む。したがって、癌の予防は、例えば、未治療の対照集団と比べて、予防的治療を受けている患者集団における検出可能な癌成長の数を減少させる段階、ならびに/または、未治療の対照集団と比べて、治療集団における検出可能な癌成長の出現を、例えば、統計学的および/もしくは臨床的に有意な期間(amount)遅延させる段階を含む。感染症の予防は、例えば、未治療の対照集団と比べて、治療集団における感染症の診断数を減少させる段階、および/または未治療の対照集団と比べて、治療集団における感染症の症状の発症を遅延させる段階を含む。疼痛の予防は、例えば、未治療の対照集団と比べて、治療集団の対象が経験する痛覚の頻度を低下させるか、重症度を低下させるか、あるいは遅延させる段階を含む。
本明細書において使用される「有効量」という用語は、所望の結果を実現するために必要な投薬量および期間で有効な量と定義される。本発明の化合物の有効量は、動物の疾患の状態、年齢、性別、および体重などの因子によって変動し得る。投与計画を調整して、最適な治療応答を提供することができる。例えば、いくつかに分割した用量を毎日投与してよいか、または、治療状況の緊急性によって必要に応じて用量を比例的に減少させてよい。
本明細書において使用される「対象」とは、任意の脊椎動物、好ましくは哺乳動物、およびより好ましくはヒトを意味する。対象の例には、ヒト、非ヒト霊長類、げっ歯動物、モルモット、ウサギ、ヒツジ、ブタ、ヤギ、雌ウシ、ウマ、イヌ、ネコ、トリ、および魚が含まれる。
関心対象のポリペプチドの「変種」とは、本明細書において使用される場合、1つまたは複数のアミノ酸によって変更されているアミノ酸配列を意味する。変種は、置換されるアミノ酸が、類似した構造的特性または化学的特性を有する「保存的」変更を有してよい(例えば、イソロイシンによるロイシンの置換)。よりまれではあるが、変種は、「非保存的」変更を有してよい(例えば、トリプトファンによるグリシンの置換)。また、同様の軽微な変化には、アミノ酸欠失もしくは挿入、または両方も含まれ得る。生物学的活性も免疫学的活性も消滅させずに、どのアミノ酸残基を置換するか、挿入するか、または欠失させ得るかを決定する際の手引きは、当技術分野において周知のコンピュータプログラム、例えば、DNA-STARソフトウェアを用いて見出すことができる。
「変種」は、この用語が本明細書において使用される場合、親ポリペプチドの少なくとも1つの生物活性を保持している。この文脈で使用される場合、「生物活性」は、親ポリペプチドまたは変種ポリペプチドに対する抗体を生成する免疫応答を単に生じさせることを除外する。
本明細書において使用される場合、「中枢神経系の炎症性障害」という用語は、病理が炎症性構成要素を含むか、またはそれを特徴とする、CNSの疾患または障害を意味する。炎症および炎症経路の活性化の顕著な特徴は、当業者によって認識される。
「アジュバント」という用語は、ワクチン抗原に対する宿主の免疫応答を増強、増大、または強化する物質を意味する。
本明細書において使用される場合、「免疫応答を増強する」という用語は、作用物質の投与または治療の際の、そのような作用物質も治療も無い場合の免疫応答と比べた免疫応答の改善を意味する。当業者は、免疫応答を容易に測定することができ、「増強された」免疫応答は、例えば、抗原特異的な抗体の生成、細胞死滅によって測定しようと、免疫応答の別の指標によって測定しようと、統計学的に有意な量だけ増加していると考えられる。不確かさを避けるために、「増強された」応答は、一般に、作用物質の不在下で観察される応答より少なくとも10%大きい。
本明細書において使用される場合、「ワクチン」とは、無害な形態で抗原を含む生物または材料を意味する。ワクチンは、免疫保護的応答を誘発するように設計される。ワクチンは、組換え型または非組換え型でよい。非免疫宿主に接種された場合、ワクチンは、生物または材料に対する能動免疫を誘発するが、疾患は引き起こさない。ワクチンは、例えば、トキソイド(無毒化されているが、その主要な免疫原決定基を引き続き保持している毒素と定義される);もしくは、腸チフス、コレラ、およびポリオなど死滅させた生物;もしくは弱毒化した生物(生きているがビルレントではない形態の病原体である)の形態をとってよく、または、それはそのような生物によってコードされた抗原でよいか、または、それは生きた腫瘍細胞もしくは腫瘍細胞上に存在する抗原でよい。
本明細書において使用される場合、「Toll様受容体アゴニスト」または「TLRアゴニスト」という用語は、Toll様受容体のシグナル伝達活性を活性化する作用物質を意味する。
範囲が本明細書において説明される場合、これらの範囲は、その間の整数値すべて、ならびにすべての部分範囲を、まるでそれらが本明細書において具体的に列挙されるかのように含み、かつ説明することに留意すべきである。したがって、例えば、範囲0〜50%は、1%、2%、3%、4%・・・50%だけでなく、非限定的な例として、0〜40%、0〜30%、5〜45%、5〜40%、5〜10%、10〜30%、および40〜45%も含む。
III. TIM-3およびガレクチン-9の配列
A. 参照配列
特定の局面において、本開示は、利用可能な単離および/または精製した形態のTIM-3ポリペプチドおよびそれらの断片を作製し、これらは、通常はそのタンパク質またはそのタンパク質を含む特定の複合体に付随している場合がある他のタンパク質から単離されるか、または別の方法でそれらを実質的に含まない。
特定の態様において、TIM-3ポリペプチドは、SEQ ID NO:1と少なくとも90%、少なくとも95%、少なくとも97%、少なくとも99%、または100%同一であるアミノ酸配列を有し、SEQ ID NO:1のTIM-3ポリペプチドの1つまたは複数のシグナル伝達活性を保持しているポリペプチドである。TIM-3ポリペプチドという用語はまた、SEQ ID NO:1のポリペプチドの1つまたは複数のシグナル伝達活性を保持しているこのようなポリペプチドの一部分、ならびにSEQ ID NO:1のポリペプチドの1つまたは複数のシグナル伝達活性を保持しているTIM-3ポリペプチドの保存的置換変種を包含する。最低でも、TIM-3ポリペプチドは、CD11b+ミクログリアの活性化を媒介するか、もしくはガレクチン-9に結合するか、または両方をすることができる。1つの態様において、一部分は、TIM-3のIgVドメインを含む。いくつかの態様において、TIM-3ポリペプチドは、SEQ ID: 1のアミノ酸22〜131を含む。いくつかの態様において、可溶性TIM-3ポリペプチドは、SEQ ID NO:1に対して1つまたは複数の保存的アミノ酸置換を含む。
特定の態様において、TIM-3ポリペプチドは、SEQ ID NO:1のアミノ酸22〜131と少なくとも90%、少なくとも95%、少なくとも97%、少なくとも99%、または100%同一であるポリペプチドである。2つのポリペプチドのアミノ酸同一性は、PAM250マトリックスに基づいたもののようなアライメントアルゴリズムを用いて2つのポリペプチド配列を最初に整列させることによって決定することができる。
本明細書において説明する方法の1つの態様において、TIM-3活性を上昇させる作用物質はTIM-3リガンドである。本明細書において使用される場合、「TIM-3リガンド」という用語は、TIM-3の細胞外ドメインに結合し、TIM-3の1つまたは複数のシグナル伝達活性を活性化または阻害する分子を意味する。このようなリガンドの例は、ガレクチン-9である。代替の態様において、TIM-3リガンドは、ガレクチン-9ポリペプチドの結合を得るために競合し得る。ヒトガレクチン-9のポリペプチド配列は、Genbankアクセッション番号NP_033665として見出すことができ、また、SEQ ID NO:5としても示す。したがって、いくつかの態様において、前記作用物質は、ガレクチン-9ポリペプチドを含む。ガレクチン-9は、存在する炭水化物またはTIM-3 IgVドメインを介してTIM-3に結合することが公知である。相互作用は、ガレクチン-9の炭水化物認識ドメインを使用する。別の態様において、前記作用物質は、ガレクチン-9の2つの炭水化物認識ドメイン(CRD)のうち少なくとも1つ、すなわち、少なくともN末端もしくはC末端、または両方を含むポリペプチドを含む。
本明細書において使用される場合、「ガレクチン-9ポリペプチド」という用語は、本明細書においてこの用語が定義されるように、SEQ ID NO:5のポリペプチドと少なくとも90%、少なくとも95%、少なくとも97%、少なくとも99%、または100%同一であるアミノ酸配列を有し、TIM-3ポリペプチドに結合する能力を保持しているポリペプチドを意味する。「ガレクチン-9ポリペプチド」という用語はまた、TIM-3ポリペプチドに結合する能力を保持しているガレクチン-9ポリペプチドの断片または保存的置換変種も包含する。この用語は、SEQ ID NO:5のガレクチン-9ポリペプチドの1つまたは両方の炭水化物認識ドメインを含むポリペプチド、およびTIM-3ポリペプチドに結合する能力を保持しているそれらの保存的置換変種も具体的に包含する。TIM-3およびガレクチン-9(および特にガレクチン-9のCRD)の両方の結晶構造は公知である。この知識は、TIM-3結合のために決定的に重要であるガレクチンの構造に関する手引きとなる。特定の態様において、ポリペプチドは、ヒトガレクチン-9の少なくとも1つのCRDのアミノ酸配列と少なくとも80%、90%、または95%同一であるアミノ酸配列を含む。
B. 参照配列に対してアミノ酸同一性を有するポリペプチド
本発明は、あるポリペプチドに対して指定された程度の配列同一性または類似性を共有するポリペプチドを用いた方法を提供する。2つのアミノ酸配列の同一性パーセントを決定するために、最適に比較することを目的としてこれらの配列を整列させる(例えば、最適なアライメントのために第1および第2のアミノ酸配列または核酸配列の1つまたは両方にギャップを導入することができ、かつ、比較のために、非相同配列を無視することができる)。好ましい態様において、少なくとも30%、少なくとも40%、少なくとも50%、少なくとも60%、少なくとも70%、少なくとも80%、少なくとも90%、少なくとも95%またはそれ以上の長さの参照配列が、比較のために整列される。次いで、対応するアミノ酸位置のアミノ酸残基を比較する。第1の配列中のある位置が、第2の配列中の対応する位置と同じアミノ酸残基によって占有されている場合、これらの分子はその位置で同一である。2つの配列間の同一性パーセントは、2つの配列の最適なアライメントのために導入される必要があるギャップ数および各ギャップの長さを考慮に入れた、これらの配列に共通である同一な位置の数の関数である。
配列の比較ならびに2つの配列間の同一性パーセントおよび類似性パーセントの決定は、数学アルゴリズムを用いて遂行することができる。(Computational Molecular Biology, Lesk, A. M.編、Oxford University Press, New York, 1988; Biocomputing: Informatics and Genome Projects, Smith, D. W.編、Academic Press, New York, 1993; Computer Analysis of Sequence Data, Part 1, Griffin, A. M.およびGriffin, H. G.編、Humana Press, New Jersey, 1994; Sequence Analysis in Molecular Biology, von Heinje, G., Academic Press, 1987;ならびに Sequence Analysis Primer, Gribskov, M.およびDevereux, J.編、M Stockton Press, New York, 1991)。
1つの態様において、2つのアミノ酸配列間の同一性パーセントは、GCGソフトウェアパッケージのGAPプログラム(http://www.gcg.comから入手可能)に組み入れられているNeedlemanおよびWunsch(J Mol. Biol. (48):444-453 (1970))のアルゴリズムを用いて決定する。特定の態様において、GAPプログラムにおいて次のパラメーターを使用する:Blossom 62マトリックスまたはPAM250マトリックスのいずれか、ならびにギャップウェイト16、14、12、10、8、6、または4、および長さウェイト1、2、3、4、5、または6。さらに別の態様において、2つのヌクレオチド配列間の同一性パーセントは、GCGソフトウェアパッケージのGAPプログラム(Devereux, J., et al., Nucleic Acids Res. 12(1):387 (1984))(http://www.gcg.comから入手可能)を用いて決定する。例示的なパラメーターには、NWSgapdna.CMPマトリックスならびに40、50、60、70、または80のギャップウェイトおよび1、2、3、4、5、または6の長さウェイトの使用も含まれる。
別の態様において、2つのアミノ酸配列間の同一性パーセントは、ALIGNプログラム(バージョン2.0)に組み入れられたE. MyersおよびW.Millerのアルゴリズム(CABIOS, 4:11-17 (1989))を用い、PAM120ウェイト残基テーブル、ギャップ長ペナルティー12、およびギャップペナルティー4を使用して、決定する。
2つのアミノ酸配列間の全体的な最良のアライメントを決定するための別の態様は、Brutlag et al.のアルゴリズムに基づいたFASTDBコンピュータプログラム(Comp. App. Biosci., 6:237-245 (1990))を用いて決定することができる。配列アラインメントにおいて、クエリー配列および対象配列は、両方ともアミノ酸配列である。前記グローバル配列アライメントの結果は、同一性パーセントの見地から提示される。1つの態様において、アミノ酸配列同一性は、Brutlag et al.のアルゴリズムに基づいたFASTDBコンピュータプログラム(Comp. App. Biosci., 6:237-245 (1990))を用いて実施される。特定の態様において、アミノ酸アライメントの同一性パーセントおよび類似性パーセントを算出するために使用するパラメーターは、次のものを含む:マトリックス=PAM150、k-タプル=2、ミスマッチペナルティー=1、結合ペナルティー=20、ランダム化グループ長=0、カットオフスコア=1、ギャップペナルティー=5、およびギャップサイズペナルティー=0.05。
本発明のいくつかの局面は、ポリペプチドを提供するか、または、これらのポリペプチドを使用するための治療方法を提供し、該ポリペプチドは、少なくとも部分的に、参照配列と対比して定義される。したがって、このようなポリペプチドは、参照配列と同一ではないアミノ酸残基を一定の比率有してよい。1つの好ましい態様において、同一ではない残基は、それらが同一ではない残基と同様の化学的特性を有する。同様の特性を有するグループには、以下のアミノ酸が含まれる:E、D、N、Q;H、K、R;Y、F、およびW;I、L、V、M、C、A;ならびにS、T、C、P、A。
別の態様において、同一ではない残基は、参照配列と少なくとも1種の進化的に関係している種における、例えば、同じ目内の種におけるオルソロガスな配列との間で進化的に保存されていないものである。哺乳動物の参照配列の場合、好ましい態様において変異していてよいアミノ酸は、参照配列と別の哺乳動物種のオルソロガスな配列との間で保存されていないものである。例えば、本発明の方法において使用されるポリペプチドが、ヒトTIM-3のIgVドメインと少なくとも90%同一であるアミノ酸配列を含むと述べられる場合、該ポリペプチドは、TIM-3のIgVドメインならびにマウス、ウシ、および/またはオランウータンのそれが異なる位置に、同一ではない残基を有してよい。別の態様において、本発明の方法において使用されるポリペプチドは、ヒトTIM-3のIgVドメインと少なくとも90%同一であり、以下の位置に1つまたは複数の置換を含む:32、35、39、41〜47、51、57、60〜62、64〜67、72、74、76〜79、83、85〜86、88〜89、94、96、98、103、105、107、114、117、121、123〜124、126、および128番目。
図8は、TIM-3ホモログのIgVドメインのアミノ酸配列アラインメントを示し、これらは、ヒト(SEQ ID NO:1)、オランウータン(SEQ ID NO:2、Genbankアクセッション番号CAH92001)、ハツカネズミ(SEQ ID NO:3、Genbankアクセッション番号NP_599011)、およびウシ(SEQ ID NO:4、Genbankアクセッション番号NP_001070573)である。図8から明らかであるように、哺乳動物のTIM-3ポリペプチドの間で保存されていない多数の残基がTIM-3のIgVドメインに沿ってあり、SEQ ID NO:1に基づいて番号を付けた22〜25、27〜29、32、35、39、41〜47、51、57、60〜62、64〜67、72、74、76〜79、83、85〜86、88〜89、94、96、98、103、105、107、114、117、121、123〜124、126、128、および131番目の位置が含まれる。TIM-3のIgVドメインと少なくとも90%の同一性を共有するポリペプチドには、これらの多様な領域に保存的置換を有するポリペプチドが含まれる。保存的置換として典型的に見られるのは、脂肪族アミノ酸Ala、Val、Leu、およびIleのうち1つが別のものと変わる置換、ヒドロキシル残基SerおよびThrの交換、酸性残基AspおよびGluの交換、アミド残基AsnおよびGln間の置換、塩基性残基LysおよびArgの交換、ならびに芳香族残基PheおよびTyr間の置換である。どのアミノ酸変更が表現型的にサイレントである可能性が高いかに関するさらなる手引きは、Bowie et al., Science 247:1306-1310 (1990)において見出される。
SEQ ID NO:1のアミノ酸30〜128と少なくとも90%、少なくとも95%、少なくとも97%、少なくとも99%、または100%同一であるポリペプチドは、好ましくは、TIM-3 IgVドメインの機能を保持している。いくつかの態様において、SEQ ID NO:1のアミノ酸30〜128と少なくとも90%、少なくとも95%、少なくとも97%、少なくとも99%、または100%同一であるポリペプチドは、TIM-3リガンドに結合し、かつ/またはAPCの活性化を調整する。いくつかの態様において、TIM-3リガンドは、ガレクチン-9である。いくつかの態様において、SEQ ID NO:1のアミノ酸30〜128と少なくとも90%同一であるポリペプチドは、APC、特にCD11b+ミクログリア細胞によるTNF-αの放出を阻害する。
SEQ ID NO:5と少なくとも90%同一であるポリペプチドは、好ましくは、TIM-3に結合する能力および/またはAPCの活性化を調整する能力を保持している。いくつかの態様において、SEQ ID NO:5と少なくとも90%同一であるポリペプチドは、APCによるTNF-αの放出を促進する。
C. 参照配列に対してアミノ酸同一性を有する改変ポリペプチド
本発明は、TIM-3またはガレクチン-9ポリペプチドもしくはそれらの断片、および異種ポリペプチドを含む融合ポリペプチドをさらに含む。1つの態様において、可溶性TIM-3ポリペプチドは、IgVドメインを含むが、ムチンドメインの少なくとも一部分を欠き、かつ膜貫通ドメインおよび任意で細胞内ドメインを欠く。特定の態様において、可溶性TIM-3またはガレクチン9ポリペプチドおよび免疫グロブリン要素を含む融合ポリペプチドが提供される。例示的な免疫グロブリン要素は、ヒトIgG1重鎖のFcドメインのような定常領域である(Browning et al., J. Immunol., 154, pp. 33-46 (1995))。可溶性受容体-IgG融合ポリペプチドは、一般的な免疫学的反応物であり、その構築方法は当技術分野において公知である(例えば、米国特許第5,225,538号、同第5,766,883号、および同第5,876,969号を参照されたい。これらはすべて、参照により本明細書に組み入れられる)。いくつかの態様において、本発明の可溶性ペプチドは、Fc変種に融合される。
関連する態様において、本発明の改変ポリペプチドは、免疫グロブリンのFc領域とのTIM-3融合ポリペプチドまたはガレクチン9融合ポリペプチドを含む。公知のように、各免疫グロブリン重鎖定常領域は、4つまたは5つのドメインを含む。これらのドメインは、順を追って以下のように命名される:CH1-ヒンジ-CH2-CH3(-CH4)。重鎖ドメインのDNA配列は、免疫グロブリンクラス間で交差相同性を有し、例えば、IgGのCH2ドメインは、IgAおよびIgDのCH2ドメインと相同であり、IgMおよびIgEのCH3ドメインと相同である。本明細書において使用される場合、「免疫グロブリンFc領域」という用語は、免疫グロブリン鎖の定常領域、好ましくは免疫グロブリン重鎖定常領域のカルボキシル末端部分またはその一部分を意味すると理解される。例えば、免疫グロブリンFc領域は、1)CH1ドメイン、CH2ドメイン、およびCH3ドメイン、2)CH1ドメインおよびCH2ドメイン、3)CH1ドメインおよびCH3ドメイン、4)CH2ドメインおよびCH3ドメイン、または5)2つもしくはそれ以上のドメインの組合せならびに免疫グロブリンヒンジ領域を含み得る。好ましい態様において、免疫グロブリンFc領域は、少なくとも免疫グロブリンヒンジ領域、CH2ドメイン、およびCH3ドメインを含み、好ましくはCH1ドメインを欠く。
1つの態様において、重鎖定常領域が由来する免疫グロブリンのクラスは、IgG(Igγ)(γサブクラス1、2、3、または4)である。他のクラスの免疫グロブリンであるIgA(Igα)、IgD(Igδ)、IgE(Igε)、およびIgM(Igμ)を使用してもよい。適切な免疫グロブリン重鎖定常領域の選択は、米国特許第5,541,087号および同第5,726,044号で詳細に考察されている。特定の結果を得るために、いくつかの免疫グロブリンクラスおよびサブクラスから特定の免疫グロブリン重鎖定常領域配列を選択することは、当業者のレベルの範囲内であるとみなされる。免疫グロブリンFc領域をコードするDNA構築物の一部分は、好ましくは、ヒンジドメインの少なくとも一部分、および好ましくはFcγのCH3ドメインまたはIgA、IgD、IgE、もしくはIgMのいずれかの相同ドメインの少なくとも一部分を含む。
さらに、免疫グロブリン重鎖定常領域内のアミノ酸の置換または欠失は、本発明の実施に際して有用であり得ることが予想される。1つの例は、Fc受容体に対する親和性が減少したFc変種を作製するために上部のCH2領域にアミノ酸置換を導入することであろう(Cole et al. (1997) J. IMMUNOL. 159:3613)。当業者は、周知の分子生物学技術を用いてこのような構築物を調製することができる。
さらなる態様において、融合ポリペプチドは、融合ポリペプチドのインビボ安定性を増大させるため、またはその生物活性もしくは局在化を調整するため、または融合ポリペプチドの精製を容易にするために、可溶性のTIM-3またはガレクチン9ポリペプチドおよび第2の異種ポリペプチドを含む。TIM-3またはガレクチン9の可溶性融合ポリペプチドを作製するために使用するできる他の例示的な異種ポリペプチドには、アフィニティークロマトグラフィーによる融合ポリペプチドの単離に特に有用である、ポリヒスチジン、Glu-Glu、グルタチオンSトランスフェラーゼ(GST)、チオレドキシン、ポリペプチドA、ポリペプチドG、および免疫グロブリン重鎖定常領域(Fc)、マルトース結合ポリペプチド(MBP)が含まれるがそれらに限定されるわけではない。アフィニティー精製のために、アフィニティークロマトグラフィー用の適切なマトリックス、例えば、グルタチオン、アミラーゼ、およびニッケル、またはコバルトを結合させた樹脂を使用する。当技術分野において周知の別の融合ドメインは、緑色蛍光ポリペプチド(GFP)である。融合ドメインには、通常は短いペプチド配列であり、特異的な抗体がそれに対して利用可能である「エピトープタグ」も含まれる。特異的なモノクローナル抗体が容易に利用可能である周知のエピトープタグには、FLAGタグ、インフルエンザウイルス赤血球凝集素(HA)タグ、およびc-mycタグが含まれる。場合によっては、融合ドメインは、第Xa因子またはトロンビンなどに対するプロテアーゼ切断部位を有し、これにより、関連するプロテアーゼが融合ポリペプチドを部分的に消化し、それによって組換えポリペプチドをそれから遊離させることが可能になる。次いで、それに続くクロマトグラフィー分離により、遊離させたポリペプチドを融合ドメインから単離することができる。
好ましくは、典型的には血液循環中での半減期が20時間より長い安定な血漿ポリペプチドが、TIM-3との融合ポリペプチドを構築するために使用される。このような血漿ポリペプチドには、免疫グロブリン、血清アルブミン、リポポリペプチド、アポリポポリペプチド、およびトランスフェリンが含まれるがそれらに限定されるわけではない。また、可溶性のTIM-3分子またはガレクチン9分子を特定の細胞または組織型にターゲティングすることができる配列を可溶性のTIM-3またはガレクチン9に結合して、特異的に局在する可溶性のTIM-3またはガレクチン9の融合ポリペプチドを作製してもよい。
1つの好ましい態様において、本発明は、アルブミンへのTIM-3またはガレクチン-9の融合物を提供する。本明細書において使用される場合、「アルブミン」とは、アルブミンポリペプチドもしくはアミノ酸配列、またはアルブミンの1つもしくは複数の機能活性(例えば生物活性)を有するアルブミン断片もしくは変種をまとめて指す。特に、「アルブミン」は、ヒト血清アルブミンもしくはその断片(EP201239、EP322094、WO97/24445、WO95/23857を参照されたい)、特に、ヒトアルブミンの成熟型または他の脊椎動物由来のアルブミンを意味する。特に、本発明のアルブミン融合ポリペプチドには、ヒトアルブミンの天然に存在する多形性変種およびヒトアルブミンの断片(WO95/23857を参照されたい)、例えばEP322094で開示されている断片(すなわちHA(Pn)、nは369〜419である)が含まれ得る。アルブミンは、任意の脊椎動物、特に、任意の哺乳動物、例えば、ヒト、雌ウシ、ヒツジ、またはブタに由来してよい。非哺乳動物アルブミンには、雌鳥およびサケが含まれるがそれらに限定されるわけではない。アルブミン融合ポリペプチドのアルブミン部分は、TIM-3ポリペプチドまたはガレクチン-9ポリペプチドとは異なる動物に由来してよい。
いくつかの態様において、アルブミン融合ポリペプチドのアルブミンポリペプチド部分は、血清アルブミンの断片に相当する。血清アルブミンポリペプチドの断片には、アミノ末端またはC末端から1つまたは複数の残基が欠失したポリペプチドが含まれる。一般的に言って、HA断片またはHA変種は、少なくとも100アミノ酸長、好ましくは少なくとも150アミノ酸長である。HA変種は、HAの少なくとも1つの完全なドメインからなるか、あるいはこれを含んでよい。ヒトアルブミンのドメインは、米国特許公報第2004/0171123号に記載されている。
また、治療的有効性もしくは予防的有効性または安定性(例えば、エクスビボでの貯蔵寿命およびインビボでのタンパク分解耐性)の強化のような目的のために本TIM-3ポリペプチドまたはガレクチン9ポリペプチドの構造を改変することも可能である。このような改変ポリペプチドは、天然に存在する形態のポリペプチドの少なくとも1つの活性を保持するように設計された場合、本明細書においてより詳細に説明するTIM-3ポリペプチドまたはガレクチン9ポリペプチドの機能的等価物とみなされる。このような改変ポリペプチドは、例えば、アミノ酸の置換、欠失、または付加によって作製することができる。
例として、例えば、ロイシンからイソロイシンもしくはバリン、アスパラギン酸からグルタミン酸、トレオニンからセリンへの単発的な(isolated)置換、またはあるアミノ酸から構造的に関連したアミノ酸への同様の置換(すなわち保存的変異)は、結果として生じる分子の生物活性に大きな影響を与えないと予想することが妥当である。保存的置換は、側鎖が関連しているアミノ酸ファミリー内で起こるものである。遺伝的にコードされたアミノ酸は、次の4つのファミリーに分類することができる:(1)酸性=アスパラギン酸、グルタミン酸、(2)塩基性=リジン、アルギニン、ヒスチジン、(3)非極性=アラニン、バリン、ロイシン、イソロイシン、プロリン、フェニルアラニン、メチオニン、トリプトファン、および(4)非荷電性で極性=グリシン、アスパラギン、グルタミン、システイン、セリン、トレオニン、チロシン。フェニルアラニン、トリプトファン、およびチロシンは、芳香族アミノ酸に一緒に分類されることがある。同様の様式で、アミノ酸レパートリーは、次のようにグループ分けすることができる:(1)酸性=アスパラギン酸、グルタミン酸、(2)塩基性=リジン、アルギニン、ヒスチジン、(3)脂肪族=グリシン、アラニン、バリン、ロイシン、イソロイシン、セリン、トレオニン(セリンおよびトレオニンは、任意で、脂肪族ヒドロキシルとして別にグループ分けされる)、(4)芳香族=フェニルアラニン、チロシン、トリプトファン、(5)アミド=アスパラギン、グルタミン、ならびに(6)硫黄含有=システインおよびメチオニン。(例えば、Biochemistry、第2版、L.Stryer編、W.H.Freeman and Co., 1981を参照されたい)。ポリペプチドのアミノ酸配列の変化が機能的ホモログをもたらすかどうかは、変種ポリペプチドが野生型ポリペプチドと同様の様式で細胞における応答を生じる能力を評価することによって容易に決定することができる。例えば、TIM-3ポリペプチドまたはガレクチン9ポリペプチドのこのような変種型を、例えば、CD11b+ミクログリア細胞によるTNF-α分泌を調整する能力について評価することができる。複数の置換が起こったポリペプチドを、同じ様式で容易に試験することができる
本発明によって提供されるか、または本発明の方法において使用されるTIM-3ポリペプチドまたはガレクチン9 ポリペプチドの一部は、翻訳後修飾をさらに含んでよい。例示的な翻訳後ポリペプチド修飾には、リン酸化、アセチル化、メチル化、ADP-リボシル化、ユビキチン化、グリコシル化、カルボニル化、SUMO化、ビオチン化、またはポリペプチド側鎖もしくは疎水基の付加が含まれる。結果として、改変された可溶性ポリペプチドは、脂質、多糖もしくは単糖、およびリン酸などの非アミノ酸要素を含み得る。
本発明において使用するためのキメラまたは融合ポリペプチドは、標準的な組換えDNA技術によって作製することができる。例えば、異なるポリペプチド配列をコードしているDNA断片を、従来の技術に従って、例えば、ライゲーションのための平滑末端または付着末端の使用、適切な末端を提供するための制限酵素消化、必要に応じた付着末端の平滑化(filling-in)、望ましくない連結を回避するためのアルカリホスファターゼ処理、および酵素的ライゲーションにより、インフレームで相互に連結させる。別の態様において、自動DNA合成機を含む従来の技術によって融合遺伝子を合成することができる。あるいは、続いてアニールおよび再増幅させてキメラ遺伝子配列を生じさせることができる2つの連続した遺伝子断片の間に相補的なオーバーハングを生じさせるアンカープライマーを用いて、遺伝子断片のPCR増幅を実施することもできる(例えば、Ausubel et al. (編) CURRENT PROTOCOLS IN MOLECULAR BIOLOGY, John Wiley & Sons, 1992を参照されたい)。さらに、融合部分(例えば、免疫グロブリン重鎖のFc領域)をコードしている多くの発現ベクターが市販されている。融合部分が免疫グロブリンポリペプチドにインフレームで連結されるように、TIM-3またはガレクチン-9をコードしている核酸をこのような発現ベクター中にクローニングすることができる。
本発明の1つの特定の態様において、本TIM-3ポリペプチドまたはガレクチン9ポリペプチドの改変型は、本可溶性ポリペプチドの非ポリペプチドポリマーへの連結を含む。1つの特定の態様において、ポリマーは、米国特許第4,640,835号;同第4,496,689号;同第4,301,144号;同第4,670,417号;同第4,791,192号、または同第4,179,337号に記載されている様式のポリエチレングリコール(「PEG」)、ポリプロピレングリコール、またはポリオキシアルキレンである。PEGは、市販されているか、または当技術分野において周知の方法によるエチレングリコールの開環重合によって調製することができる周知の水溶性ポリマーである(SandlerおよびKaro、Polymer Synthesis, Academic Press, New York、第3巻、138〜161頁)。「PEG」という用語は広範に使用されて、PEGのサイズも末端修飾も問わず、任意のポリエチレングリコール分子を包含し、式:X-O(CH2CH2O)n-1CH2CH2OH(1)(式中、nは20〜2300であり、XはHまたは末端修飾基(例えばC1〜4アルキル)である)によって表すことができる。1つの態様において、本発明のPEGは、一方の端がヒドロキシ基またはメトキシ基で終結している(すなわち、XはHまたはCH3(「メトキシPEG」)である)。PEGは、結合反応に必要であるか、分子の化学合成に起因するか、または分子の一部分を最適な距離にするためのスペーサーであるさらなる化学基を含んでよい。さらに、このようなPEGは、相互に連結した1つまたは複数のPEG側鎖からなってもよい。複数のPEG鎖を有するPEGは、多分岐PEGまたは分枝PEGと呼ばれる。分枝PEGは、例えば、グリセロール、ペンタエリトリトール、およびソルビトールを含む様々なポリオールへのポリエチレンオキシドの付加によって調製することができる。例えば、4つに分岐したPEGを、ペンタエリトリトールおよびエチレンオキシドから調製することができる。分枝PEGは、例えば、EP-0473084および米国特許第5,932,462号に記載されている。PEGの1つの形態は、リジンの第一級アミノ基を介して連結された2つのPEG側鎖(PEG2)を含む(Monfardini, C., et al., Bioconjugate Chem. 6 (1995) 62- 69)。
ペプチドまたはポリペプチドへのPEG結合は、一般に、PEGの活性化、および活性化PEG-中間体の標的ポリペプチド/ペプチドへの直接結合またはリンカーへの結合(続いてリンカーを活性化し、標的ポリペプチド/ペプチドに結合させる)を含む(Abuchowski, A. et al, J. Biol. Chem., 252, 3571 (1977)およびJ. Biol. Chem., 252, 3582 (1977), Zalipsky, et al.,およびHarris et. al.、Poly(ethylene glycol) Chemistry: Biotechnical and Biomedical Applications; (J.M.Harris 編) Plenum Press: New York, 1992; 21章および22章を参照されたい)。
当業者は、例えば、ペグ化したTIM-3ポリペプチドまたはガレクチン9ポリペプチドをどのように治療的に使用するか、所望の投薬量、循環時間、タンパク分解耐性、免疫原性、および他の考慮すべき事柄に基づいて、PEGの適切な分子量を選択することができる。ポリペプチドの特性を増強するためのPEGおよびその使用に関する考察については、N. V. Katre, Advanced Drug Delivery Reviews 10: 91-114 (1993)を参照されたい。
本発明の1つの態様において、PEG分子を活性化して、TIM-3ポリペプチドまたはガレクチン9ポリペプチド上のアミノ基と、例えばリジンと反応させることができる(Bencham C. O. et al., Anal. Biochem., 131, 25 (1983); Veronese, F. M. et al., Appl. Biochem., 11, 141 (1985)。; Zalipsky, S. et al., Polymeric Drugs and Drug Delivery Systems, adrs 9-110 ACS Symposium Series 469 (1999); Zalipsky, S. et al., Europ.Polym.J., 19, 1177-1183 (1983); Delgado, C. et al., Biotechnology and Applied Biochemistry, 12, 119-128 (1990))。別の態様において、PEG分子は、tim-4またはtim-1上のスルフヒドリル基に結合させることができる(Sartore, L., et al., Appl. Biochem. Biotechnol., 27, 45 (1991); Morpurgo et al., Biocon. Chem., 7, 363-368 (1996); Goodson et al., Bio/Technology (1990) 8, 343; 米国特許第5,766,897号)。米国特許第6,610,281号および同第5,766,897号では、スルフヒドリル基に結合させることができる例示的な反応性PEG種を説明している。いくつかの態様において、ペグ化したTIM-3ポリペプチドまたはガレクチン9ポリペプチドは、N末端アミノ酸のαアミノ基に共有結合したPEG分子を含む。部位特異的なN末端還元的アミノ化は、Pepinsky et al., (2001) JPET, 297,1059および米国特許第5,824,784号に記載されている。他の利用可能な求核アミノ基を用いたポリペプチドの還元的アミノ化のためのPEG-アルデヒドの使用は、米国特許第4,002,531号、Wieder et al., (1979) J. Biol. Chem. 254,12579、およびChamow et al., (1994) Bioconjugate Chem. 5, 133に記載されている。
IV. TIM-3活性を調整する作用物質
本明細書において使用される場合、「TIM-3活性」とは、TIM-3によって媒介されるシグナル伝達活性を意味し、TIM-3の下流エフェクターの活性化ならびにT細胞による炎症性サイトカイン発現の調節および/またはTIM-3依存性のAPC活性化を含む。したがって、TIM-3の下流エフェクターのTIM-3依存性の変化を測定することによって、TIM-3活性を測定することができる。
1つの態様において、TIM-3活性を低下させる作用物質は、TIM-3へのガレクチン-9の結合を阻害する。1つの態様において、ガレクチン-9への完全長TIM-3の結合を阻害する作用物質は、ラクトースまたはペクチン/改変ペクチンなどの炭水化物を含む。改変ペクチンは、米国特許公報第2003/0004132号および同第2002/0187959号に記載されている。
他の態様において、TIM-3活性を上昇させる作用物質は、TIM-3受容体を活性化する際に機能的にガレクチン-9の代わりとなることができるペプチド模倣体または低分子である。このペプチドまたは低分子は、TIM-3に結合するガレクチン-9の表面に構造的に類似することができ、その結果、ペプチドまたは低分子は、TIM-3に結合した際にそれを活性化して、TIM-3活性を上昇させることができる。特定の態様において、TIM-3活性を上昇させる作用物質は、TIM-3の細胞内ドメインのチロシンリン酸化を促進する。
本明細書において使用される場合、1つもしくは複数のシグナル伝達活性またはTIM-3活性の下流の読み出しが、そのような作用物質も刺激も無い場合と比べて作用物質または刺激がある場合に、統計学的に有意な量、および好ましくは少なくとも10%減少している場合、TIM-3活性は「低下して」いる。
本明細書において使用される場合、1つもしくは複数のシグナル伝達活性またはTIM-3活性の下流の読み出しが、そのような作用物質も刺激も無い場合と比べて作用物質または刺激がある場合に、統計学的に有意な量、および好ましくは少なくとも10%増加している場合、TIM-3活性は「上昇して」いる。
A. アンチセンスオリゴヌクレオチド
いくつかの態様において、TIM-3活性は、TIM-3アンタゴニストまたはガレクチン-9アンタゴニストを用いて調整される。いくつかの態様において、これらのアンタゴニストは、二本鎖RNA分子または二本鎖RNAを生成できるDNA構築物などのRNAi/アンチセンスオリゴヌクレオチドを含む。さらに別の態様において、TIM-3活性を上昇させる作用物質は、可溶性TIM-3の発現または機能を低下させるが、完全長TIM-3のそれらには直接的に影響を及ぼさない。1つの態様において、作用物質は、SEQ ID NO:6のヌクレオチド配列を含むもののような、可溶性TIM-3の発現を特異的に阻害する二本鎖RNA種である。二本鎖RNAには、ヘアピンRNAおよび2つの相補的な一本鎖RNA分子によって形成されたRNAが含まれるがそれらに限定されるわけではない。アンチセンスオリゴヌクレオチドは、ある特定のポリペプチドをコードするmRNAのコード鎖(センス鎖)に相補的(またはアンチセンス)である比較的短い核酸である。アンチセンスオリゴヌクレオチドは典型的にはRNAベースであるが、DNAベースでもよい。さらに、アンチセンスオリゴヌクレオチドは、安定性を高めるためにしばしば改変される。
理論に拘泥するものではないが、これらの比較的短いオリゴヌクレオチドのmRNAへの結合は、内因性のRNアーゼによるメッセージの分解の引き金となる二本鎖RNAのストレッチを誘導すると考えられている。さらに、時折、オリゴヌクレオチドは、メッセージのプロモーター付近に結合するように特異的に設計され、これらの状況下では、アンチセンスオリゴヌクレオチドはさらに、メッセージの翻訳にも干渉し得る。アンチセンスオリゴヌクレオチドが機能する具体的なメカニズムに関わらず、細胞、組織、または生物にそれらを投与することにより、ある特定のポリペプチドをコードするmRNAを分解することが可能になる。したがって、アンチセンスオリゴヌクレオチドは、特定のポリペプチドの発現および/または活性を低下させる。この場合、それらはTIM-3および/またはガレクチン-9を標的とするのに特に望ましい。
オリゴヌクレオチドは、DNAもしくはRNAまたはキメラ混合物またはそれらの誘導体もしくは改変型でよく、一本鎖または二本鎖でよい。例えば、分子の安定性、ハイブリダイゼーションなどを改善するために、オリゴヌクレオチドの塩基部分、糖部分、またはリン酸骨格を改変することができる。オリゴヌクレオチドは、(例えば、宿主細胞受容体を標的とするための)ペプチドのような他の付加的な(appended)基、または細胞膜(例えば、Letsinger et al., 1989, Proc. Natl. Acad. Sci. USA. 86:6553-6556; Lemaitre et al., 1987, Proc. Natl. Acad. Sci. 84:648-652;1988年12月15日に公開されたPCT公報WO88/09810を参照されたい)もしくは血液脳関門(例えば、1988年4月25日に公開されたPCT公報WO89/10134を参照されたい)を通過する輸送を促進する化合物、ハイブリダイゼーションが引き金となる切断剤(例えば、Krol et al., 1988, BioTechniques 6:958- 976を参照されたい)、または挿入剤(例えば、Zon, 1988, Pharm.Res. 5:539-549を参照されたい)を含んでよい。このために、オリゴヌクレオチドを別の分子と結合させてよい。
アンチセンスオリゴヌクレオチドは、非限定的に5-フルオロウラシル、5-ブロモウラシル、5-クロロウラシル、5-ヨードウラシル、ヒポキサンチン、キサンチン、4-アセチルシトシン、5-(カルボキシヒドロキシトリエチル)ウラシル、5-カルボキシメチルアミノメチル-2-チオウリジン、5-カルボキシメチルアミノメチルウラシル、ジヒドロウラシル、β-D-ガラクトシルキュェオシン、イノシン、N6-イソペンテニルアデニン、1-メチルグアニン、1-メチルイノシン、2,2-ジメチルグアニン、2-メチルアデニン、2-メチルグアニン、3-メチルシトシン、5-メチルシトシン、N6-アデニン、7-メチルグアニン、5-メチルアミノメチルウラシル、5-メトキシアミノメチル-2-チオウラシル、β-D-マンノシルキュェオシン、5'-メトキシカルボキシメチルウラシル、5-メトキシウラシル、2-メチルチオ-N6-イソペンテニルアデニン、ウラシル-5-オキシ酢酸(v)、ワイブトキソシン、シュードウラシル、キュェオシン、2-チオシトシン、5-メチル-2-チオウラシル、2-チオウラシル、4-チオウラシル、5-メチルウラシル、ウラシル-5-オキシ酢酸メチルエステル、ウラシル-5-オキシ酢酸(v)、5-メチル-2-チオウラシル、3-(3-アミノ-3-N-2-カルボキシプロピル)ウラシル、(acp3)w、および2,6-ジアミノプリンを含む群より選択される、少なくとも1つの修飾塩基部分を含んでよい。
アンチセンスオリゴヌクレオチドはまた、非限定的にアラビノース、2-フルオロアラビノース、キシルロース、およびヘキソースを含む群より選択される少なくとも1つの修飾糖部分を含んでよい。アンチセンスオリゴヌクレオチドは、中性のペプチド様骨格も含んでよい。このような分子は、ペプチド核酸(PNA)オリゴマーと呼ばれ、例えば、Perry- O'Keefe et al. (1996) Proc. Natl. Acad. Sci. USA. 93:14670およびEglom et al. (1993) Nature 365:566に記載されている。PNAオリゴマーの1つの利点は、DNAの中性骨格の寄与による、媒体のイオン強度から本質的に独立して相補的DNAに結合する能力である。さらに別の態様において、アンチセンスオリゴヌクレオチドは、ホスホロチオアート、ホスホロジチオアート、ホスホルアミドチオアート、ホスホルアミダート、ホスホルジアミダート、メチルホスホナート、アルキルホスホトリエステル、およびホルムアセタールまたはその類似体からなる群より選択される少なくとも1つの修飾リン酸骨格を含む。
さらに別の態様において、アンチセンスオリゴヌクレオチドは、α-アノマーオリゴヌクレオチドである。α-アノマーオリゴヌクレオチドは、相補的なRNAと特異的な二本鎖ハイブリッドを形成し、その中でこれらの鎖は、通常のα-ユニットとは異なり、互いに平行に伸びる(Gautier et al., 1987, Nucl. Acids Res. 15:6625-6641)。オリゴヌクレオチドは、2'-O-メチルリボヌクレオチド(Inoue et al., 1987, Nucl.Acids Res. 15:6131-6148)、またはキメラRNA-DNA類似体(Inoue et al., 1987, FEBS Lett. 215:327-330)でよい。
本発明で使用するためのオリゴヌクレオチドは、当技術分野において公知の標準的な方法によって、例えば、自動DNA合成機(例えば、Biosearch、Applied Biosystemsなどから市販されているもの)を用いて合成することができる。例として、ホスホロチオアートオリゴヌクレオチドは、Stein et al. (1988, Nucl. Acids Res. 16:3209)の方法によって合成することができ、メチルホスホナートオリゴヌクレオチドは、制御された細孔をもつ多孔質ガラスポリマー支持体(Sarin et al., 1988, Proc. Natl. Acad. Sci. USA. 85:7448-7451)などを用いて調製することができる。
適切なオリゴヌクレオチドの選択は、当業者によって容易に実施され得る。ある特定のポリペプチドをコードする核酸配列を考慮すれば、当業者は、該配列に結合するアンチセンスオリゴヌクレオチドを設計し、かつこれらのオリゴヌクレオチドをインビトロまたはインビボの系で試験して、その特定のポリペプチドをコードするmRNAにそれらが結合し、その分解を媒介することを確認することができる。特定のmRNAに特異的に結合し、その分解を媒介するアンチセンスオリゴヌクレオチドを設計するためには、そのオリゴヌクレオチドによって認識される配列がその特定のmRNAに対して特有または実質的に特有であることが重要である。例えば、mRNAの全体に渡って頻繁に繰り返されている配列は、ある特定のメッセージを特異的に認識し、分解するオリゴヌクレオチを設計するためには理想的な選択ではない場合がある。当業者は、オリゴヌクレオチドを設計し、かつ、そのオリゴヌクレオチドの配列を、公的に入手可能なデータベースに寄託されている核酸配列と比較して、ある特定のポリペプチドに対してその配列が特異的または実質的に特異的であることを確認することができる。
別の実施例において、複数のメッセージに結合し、その分解を媒介するアンチセンスオリゴヌクレオチドを設計することが望ましい場合がある。1つの実施例において、これらのメッセージは、アイソフォームまたは機能的に重複しているポリペプチドなど関連したポリペプチドをコードし得る。このような場合、当業者は、これらの関連したポリペプチドをコードする核酸配列を整列させ、かつ両方のメッセージを認識するオリゴヌクレオチドを設計することができる。
アンチセンスDNAまたはRNAを細胞に送達するための多数の方法が開発されている。例えば、アンチセンス分子を組織部位に直接注射することができ、または所望の細胞を標的とするように設計した改変アンチセンス分子(例えば、標的細胞表面で発現される受容体もしくは抗原に特異的に結合するペプチドもしくは抗体と連結させたアンチセンス)を系統的に(systematically)投与することができる。
しかしながら、いくつかの場合では、内因性のTIM-3 mRNAまたはガレクチン-9 mRNAにおける翻訳を抑制するのに十分なアンチセンスの細胞内濃度を実現することが困難な場合がある。したがって、別のアプローチは、アンチセンスオリゴヌクレオチドが強力なpol IIIプロモーターまたはpol IIプロモーターの制御下に置かれている組換えDNA構築物を利用する。例えば、ベクターが細胞によって取り込まれ、アンチセンスRNAの転写を指示するように、インビボにベクターを導入することができる。このようなベクターは、それが転写されて所望のアンチセンスRNAを生じ得る限り、エピソームのままでよいか、または染色体に統合されてよい。このようなベクターは、当技術分野において標準的な組換えDNA技術方法によって構築することができる。ベクターは、プラスミド、ウイルス、または哺乳動物細胞における複製および発現のために使用される当技術分野において公知の他のものでよい。アンチセンスRNAをコードする配列の発現は、哺乳動物細胞、好ましくはヒト細胞において作用することが当技術分野において公知の任意のプロモーターによってよい。このようなプロモーターは誘導性または構成的でよい。このようなプロモーターには、SV40初期プロモーター領域(BernoistおよびChambon, 1981, Nature 290:304-310)、ラウス肉腫ウイルスの3'の長い末端反復配列に含まれるプロモーター(Yamamoto et al., 1980, Cell 22:787-797)、ヘルペスチミジンキナーゼプロモーター(Wagner et al., 1981, Proc. Natl. Acad. Sci. USA. 78:1441-1445)、メタロチオネイン遺伝子の調節配列(Brinster et al, 1982, Nature 296:39-42)などが含まれるがそれらに限定されるわけではない。任意のタイプのプラスミド、コスミド、YAC、またはウイルスベクターを使用して、組織部位中に直接導入できる組換えDNA構築物を調製することができる。あるいは、所望の組織に選択的に感染するウイルスベクターを使用することができ、この場合、投与は別の経路によって(例えば、系統的に)遂行することができる。
RNAi構築物は、標的遺伝子の発現を特異的に妨害することができる二本鎖RNAを含む。「RNA干渉」または「RNAi」は、二本鎖RNA(dsRNA)が特異的かつ転写後に遺伝子発現を妨害する、植物およびぜん虫で観察された現象に最初に適用された用語である。理論に拘泥するものではないが、RNAiは、特定のセットのヌクレアーゼの活性化を介したmRNA分解を含むと思われ、しかしながら、生化学的メカニズムは現在、研究の活発な分野である。作用メカニズムに関していくらか不明なことがあるものの、RNAiは、インビトロまたはインビボで遺伝子発現を阻害する有用な方法を提供する。本明細書において使用される場合、「dsRNA」という用語は、siRNA分子、または二本鎖の特徴を含み、かつ細胞中でプロセシングされてsiRNAになることができる他のRNA分子、例えばヘアピンRNA部分を意味する。「機能損失」という用語は、本RNAi方法によって阻害される遺伝子に関する場合、RNAi構築物の不在下でのレベルと比べた場合の遺伝子の発現レベルの低下を意味する。
本明細書において使用される場合、「RNAiを媒介する」という語句は、どのRNAがRNAiプロセスによって分解されるべきかを区別する能力を意味し(示し)、例えば、分解は、配列に依存しないdsRNA応答、例えば、PKR 応答によってではなく、配列特異的に起こる。
本明細書において使用される場合、「RNAi構築物」という用語は、本明細書の全体を通して使用される一般的な用語であり、低分子干渉RNA(siRNA)、ヘアピンRNA、およびインビボで切断されてsiRNAを形成し得る他のRNA種を含む。また、本明細書において、RNAi構築物には、細胞中でdsRNAもしくはヘアピンRNAを形成する転写物、および/またはインビボでsiRNAを生成し得る転写物を生じることができる発現ベクター(RNAi発現ベクターとも呼ばれる)も含まれる。
「RNAi発現ベクター」(本明細書において「dsRNAをコードするプラスミド」とも呼ばれる)とは、構築物が発現される細胞中でsiRNA部分を生成するRNAを発現させる(転写する)ために使用される複製可能な核酸構築物を意味する。このようなベクターは、(1)(2)に機能的に連結されている、遺伝子発現において調節役割を有する遺伝子エレメント、例えば、プロモーター、オペレーター、またはエンハンサー、(2)転写されて二本鎖RNAを生成する「コード」配列(細胞中でアニールしてsiRNAを形成する2つのRNA部分もしくはプロセシングされてsiRNAになり得る一本鎖ヘアピンRNA)、および(3)適切な転写開始配列および転写終結配列のアセンブリを含む転写単位を含む。プロモーターおよび他の調節エレメントの選択は、一般に、意図される宿主細胞によって異なる。一般に、組換えDNA技術において有用な発現ベクターは、しばしば、「プラスミド」の形態であり、これは、環状の二本鎖DNAループを意味し、ベクター形態では染色体に結合していない。プラスミドはベクターの最も一般に使用される形態であるため、本明細書において、「プラスミド」および「ベクター」は同義的に使用される。しかしながら、本発明は、等価な機能を果たすこのような他の形態の発現ベクター、例えばウイルスベクターなど、および本明細書の後に当技術分野において公知になるベクターも含むと意図される。
RNAi構築物は、細胞の生理的条件下で、阻害しようとする遺伝子(すなわち「標的」遺伝子、例えばTIM-3)に対するmRNA転写物の少なくとも一部分のヌクレオチド配列にハイブリダイズするヌクレオチド配列を含む。二本鎖RNAは、RNAiを媒介する能力を有するのに十分なだけ天然RNAに類似している必要があるにすぎない。したがって、本発明は、遺伝子変異、株多型性、または進化的分岐が原因で予想され得る配列変異を許容することができるという利点を有する。標的配列とRNAi構築物配列間で許容されるヌクレオチドミスマッチの数は、5塩基対中1個以下、または10塩基対中1個以下、または20塩基対中1個以下、または50塩基対中1個以下である。siRNA二重鎖の中心のミスマッチが最も重大な意味を持ち、標的RNAの切断を本質的に無効にする場合がある。一方、標的RNAに相補的であるsiRNA鎖の3'末端のヌクレオチドは、標的認識の特異性に有意に寄与しない。
配列同一性は、当技術分野において公知の配列比較およびアライメントアルゴリズム(GribskovおよびDevereux、Sequence Analysis Primer, Stockton Press, 1991、ならびにその中で引用されている参考文献を参照されたい)ならびに、例えば、初期設定パラメーターを用いるBESTFITソフトウェアプログラム(例えばUniversity of Wisconsin Genetic Computing Group)中で実行されるSmith-Watermanアルゴリズムによる、ヌクレオチド配列間の差異パーセントの算出によって最適化することができる。阻害性RNAと標的遺伝子の一部分との配列同一性が90%を上回ること、またはさらに配列同一性が100%であることが好ましい。あるいは、RNAの二重鎖領域は、標的遺伝子転写物の一部分とハイブリダイズすることができる(例えば、400mM NaCl、40mM PIPES、pH6.4、1mM EDTA、50℃または70℃、12〜16時間のハイブリダイゼーション、続いて洗浄)ヌクレオチド配列と機能的に定義することもできる。
RNAi構築物の作製は、化学的合成方法によって、または組換え核酸技術によって実施することができる。処理された細胞の内因性RNAポリメラーゼがインビボで転写を媒介することができるか、またはクローン化したRNAポリメラーゼをインビトロでの転写のために使用することができる。RNAi構築物は、例えば、細胞ヌクレアーゼに対する感受性を減少させるため、生物学的利用能を向上させるため、製剤特徴を改善するため、かつ/または他の薬物動態学的特性を変更するために、リン酸-糖骨格またはヌクレオシドのいずれかに対する改変を含んでよい。例えば、天然RNAのリン酸ジエステル結合を、少なくとも1つの窒素へテロ原子または硫黄へテロ原子を含むように改変してよい。RNA構造の改変は、dsRNAに対する一般的な応答を回避しつつ、特異的な遺伝的阻害を可能にするように仕立てることができる。同様に、アデノシンデアミナーゼの活性を妨害するために塩基を改変してもよい。RNAi構築物は、酵素的に、または、部分的/全体的な有機合成によって作製することができる。インビトロでの酵素的合成または有機合成によって任意の改変リボヌクレオチドを導入することができる。
RNA分子を化学的に改変する方法を、RNAi構築物の改変用に適応させることができる(例えば、Heidenreich et al. (1997) Nucleic Acids Res, 25:776-780; Wilson et al. (1994) J Mol Recog 7:89-98; Chen et al. (1995) Nucleic Acids Res 23:2661-2668; Hirschbein et al. (1997) Antisense Nucleic Acid Drug Dev 7:55-61を参照されたい)。例示に過ぎないが、RNAi構築物の骨格は、ホスホロチオアート、ホスホルアミダート、ホスホジチオアート、キメラのメチルホスホナート-ホスホジエステル、ペプチド核酸、5-プロピル−ピリミジンを含むオリゴマー、または糖改変(例えば、2’-置換リボヌクレオシド、a-立体配置)を用いて改変することができる。
二本鎖構造は、単一の自己相補的RNA鎖または2つの相補的RNA鎖によって形成され得る。RNA二重鎖形成は、細胞の内側または外側のいずれかで開始することができる。RNAは、細胞1つ当たり少なくとも1個のコピーの送達を可能にする量で導入することができる。高用量(例えば、細胞1つ当たり少なくとも5個、10個、100個、500個、または1000個のコピー)の二本鎖材料の方がより効果的な阻害をもたらし得るが、低用量もまた、特定の用途に有用な場合がある。RNAの二重鎖領域に対応するヌクレオチド配列が遺伝的阻害の標的とされているという点で、阻害は配列特異的である。
特定の態様において、本RNAi構築物は、「低分子干渉RNA」または「siRNA」である。これらの核酸は、約19〜30ヌクレオチド長であり、およびさらにより好ましくは、21〜23ヌクレオチド長であり、例えば、より長い二本鎖RNAのヌクレアーゼ「切断(dicing)」によって生成する断片に対応する長さである。siRNAは、ヌクレアーゼ複合体を動員し、かつ、特異的配列と対合することにより、それらの複合体を標的mRNAに導くと理解されている。結果として、標的mRNAは、ポリペプチド複合体中のヌクレアーゼによって分解される。特定の態様において、21〜23ヌクレオチドのsiRNA分子は、3'ヒドロキシル基を含む。
本発明のsiRNA分子は、当業者に公知である多くの技術を用いて得ることができる。例えば、siRNAは、当技術分野において公知の方法を用いて、化学合成するか、または組換えによって作製することができる。例えば、短いセンスRNAオリゴマーおよびアンチセンスRNAオリゴマーを合成し、かつアニールして、各末端に2-ヌクレオチドオーバーハングを有する二本鎖RNA構造物を形成させることができる(Caplen, et al. (2001) Proc Natl Acad Sci USA, 98:9742-9747; Elbashir, et al. (2001) EMBO J, 20:6877-88)。次いで、後述するもののように、受動的取込みまたは最適な送達系のいずれかによって、これらの二本鎖siRNA構造物を細胞中に直接導入することができる。
特定の態様において、siRNA構築物は、例えば酵素ダイサーの存在下で、より長い二本鎖RNAをプロセシングすることによって作製することができる。1つの態様において、ショウジョウバエ(Drosophila)のインビトロの系が使用される。この態様において、dsRNAをショウジョウバエ胚由来の可溶性抽出物と組み合わせ、それによって、組合せを作製する。この組合せは、dsRNAがプロセシングされて約21〜約23ヌクレオチドのRNA分子になる条件下で維持される。
siRNA分子は、当業者に公知であるいくつかの技術を用いて精製することができる。例えば、ゲル電気泳動を用いてsiRNAを精製することができる。あるいは、非変性カラムクロマトグラフィーのような非変性的方法を用いてsiRNAを精製することができる。さらに、クロマトグラフィー(例えば、サイズ排除クロマトグラフィー)、グリセロール勾配遠心分離、抗体を用いたアフィニティー精製を使用して、siRNAを精製することもできる。
特定の好ましい態様において、siRNA分子の少なくとも1つの鎖は、約1〜約6ヌクレオチド長(2〜4ヌクレオチド長でもよい)の3'オーバーハングを有する。より好ましくは、3'オーバーハングは、1〜3ヌクレオチド長である。特定の態様において、一方の鎖は3'オーバーハングを有し、もう一方の鎖は平滑末端であるか、または同様にオーバーハングを有する。オーバーハングの長さは、同じまたは各鎖によって異なってよい。siRNAの安定性をさらに高めるために、3'オーバーハングを分解しないように安定化することができる。1つの態様において、RNAは、アデノシンヌクレオチドまたはグアノシンヌクレオチドなどのプリンヌクレオチドを含むことによって安定化される。あるいは、改変した類似体によるピリミジンヌクレオチドの置換、例えば、2'-デオキシチミジンによるウリジンヌクレオチド3'オーバーハングの置換も許容され、RNAiの効率に影響を及ぼさない。2'ヒドロキシル基を欠くことにより、組織培養培地中でのオーバーハングのヌクレアーゼ耐性が有意に高まり、インビボで有益な場合がある。
他の態様において、RNAi構築物は、長い二本鎖RNAの形態である。特定の態様において、RNAi構築物は、少なくとも25塩基、50塩基、100塩基、200塩基、300塩基、または400塩基である。特定の態様において、RNAi構築物は、400〜800塩基長である。二本鎖RNAは細胞内で消化されて、例えば、細胞中でsiRNA配列を生成する。しかしながら、配列非依存性のdsRNA応答によって引き起こされ得る有害作用がおそらくは原因で、長い二本鎖RNAのインビボでの使用は必ずしも実用的ではない。このような態様において、局所送達系および/またはインターフェロンもしくはPKRの影響を減らす作用物質の使用が好ましい。
特定の態様において、RNAi構築物は、ヘアピン構造物(ヘアピンRNAと名付けられる)の形態である。ヘアピンRNAは、外因的に合成することができるか、またはインビボでRNAポリメラーゼIIIプロモーターから転写することによって形成させることができる。哺乳動物細胞における遺伝子サイレンシングのためにこのようなヘアピンRNAを作製し、かつ使用する例は、例えば、Paddison et al., Genes Dev, 2002, 16:948-58; McCaffrey et al., Nature, 2002, 418:38-9; McManus et al., RNA, 2002, 8:842-50; Yu et al., Proc Natl Acad Sci USA, 2002, 99:6047-52に記載されている。好ましくは、このようなヘアピンRNAは、所望の遺伝子の連続的かつ安定な抑制を確実にするために、細胞中または動物中で人工的に設計される。細胞中でヘアピンRNAをプロセシングすることによってsiRNAが産生され得ることは当技術分野において公知である。
さらに他の態様において、プラスミドは、例えば転写産物として二本鎖RNAを送達するのに使用される。このような態様において、プラスミドは、RNAi構築物のセンス鎖およびアンチセンス鎖それぞれに対する「コード配列」を含むように設計される。コード配列は、例えば逆方向プロモーターが隣接した同じ配列でよいか、またはそれぞれが別々のプロモーターの転写制御下にある2つの別々の配列でよい。コード配列が転写された後、相補的RNA転写物は塩基対合して、二本鎖RNAを形成する。
PCT出願WO01/77350では、導入遺伝子を双方向的に転写し、真核細胞中で同じ導入遺伝子のセンスRNA転写物およびアンチセンスRNA転写物の両方を得るための例示的なベクターを説明している。したがって、特定の態様において、本発明は、次の独特な特徴を有する組み換えベクターを提供する:これは、反対の向きに並べられ、かつ関心対象のRNAi構築物の導入遺伝子に隣接する2つの重複転写単位を有するウイルスレプリコンを含み、これら2つの重複転写単位は、宿主細胞において、同じ導入遺伝子断片からセンスRNA転写物およびアンチセンスRNA転写物の両方を生じる。
RNAi構築物は、標的核酸配列と同一もしくは実質的に同一である二本鎖RNAの長いストレッチ、または標的核酸配列のある領域にのみ同一もしくは実質的に同一である二本鎖RNAの短いストレッチのいずれかを含んでよい。長いRNAi構築物または短いRNAi構築物のいずれかを作製および送達する例示的な方法は、例えば、WO01/68836およびWO01/75164において見出すことができる。
B. リボザイム分子
別の態様において、TIM-3アンタゴニストまたはガレクチン-9アンタゴニストは、TIM-3またはガレクチン-9の発現レベルを低下させるリボザイム分子である。mRNA転写物を触媒的に切断するように設計されたリボザイム分子を用いて、TIM-3 mRNAまたはガレクチン-9 mRNAの翻訳を妨げることができる(例えば、1990年10月4日に公開されたPCT国際公開WO90/11364; Sarver et al., 1990, Science 247:1222-1225、および米国特許第5,093,246号を参照されたい)。mRNAを部位特異的な認識配列の位置で切断するリボザイムを用いて特定のmRNAを破壊することができ、ハンマーヘッド型リボザイムの使用が好ましい。ハンマーヘッド型リボザイムは、標的mRNAと相補的塩基対を形成する隣接領域によって規定される位置でmRNAを切断する。標的mRNAが2つの塩基からなる以下の配列、すなわち5'-UG-3'を有することが唯一の要件である。ハンマーヘッド型リボザイムの構築および作製は、当技術分野において周知であり、HaseloffおよびGerlach、1988, Nature, 334:585-591において、より完全に説明されている。
C. 抗体
本明細書において説明するこれらの方法の別の態様において、TIM-3活性を低下または上昇させる作用物質は、抗TIM-3抗体を含む。モノクローナル抗体のようなTIM-3細胞外ドメインに結合する抗体は、当業者が作製することができ、本発明によって提供される方法を用いて、これらの抗体がTIM-3およびTIM-3リガンドの結合を妨害する能力をさらに試験することができる。アンタゴニスト抗体は、TIM-3とTIM-3リガンド(例えばガレクチン-9)の結合相互作用を妨害し、それら自体はTIM-3活性の活性化因子として作用しない。1つの態様において、抗体は、TIM-3のIgVドメイン(SEQ ID NO:1のアミノ酸30〜128)に結合し、完全長TIM-3へのTIM-3リガンドの結合を妨害する。当業者は、Th1応答の減少またはTh2応答の増大をモニターするアッセイ法を用いることによって、候補抗体がTIM-3活性のアンタゴニストであるかを判定することができる。例えば、このような試験は、免疫化したマウスに抗体を投与し、かつマウスの脾臓から単離したT細胞のインビトロでの増殖およびサイトカイン産生を試験することによって実施することができる。
他の態様において、TIM-3に対するアゴニスト抗体が使用される。TIM-3に結合し、リガンドの結合を模倣する抗体を作製して、細胞内シグナル伝達を生じさせることができる。TIM-3の細胞外ドメインに結合する抗体を作製する際、当業者は、その抗体がTIM-3を活性化するかどうか(Th1細胞増殖の抑制、サイトカイン放出の減少、および寛容の増大をもたらすと思われる)を試験することができる。実験手順で説明する方法を用いて、抗体結合が完全長TIM-3を活性化するかを判定することができる。TIM-3の活性化は、例えば、TIM-3の細胞内チロシンリン酸化のモニタリングによってモニターすることができる。特定の態様において、TIM-3活性を上昇させる抗体は、TIM-3およびガレクチン-9に特異的な二重特異性抗体である。
本明細書において使用される「抗体」という用語は、免疫グロブリン分子および免疫グロブリン(Ig)分子の免疫学的に活性な部分、すなわち抗原に特異的に結合する(免疫反応する)抗原結合部位を含む分子を意味する。このような抗体には、例えば、ポリクローナル断片、モノクローナル断片、キメラ断片、単鎖断片、Fab断片、Fab'断片およびF(ab')2断片、ならびにFab発現ライブラリーが含まれる。一般に、ヒトから得られる抗体分子は、クラスIgG、IgM、IgA、IgE、およびIgDのいずれかに関し、これらは分子中に存在する重鎖の性質が互いに異なる。いくつかのクラスは、同様にIgG1およびIgG2などのサブクラスも有する。さらに、ヒトでは、軽鎖はκ鎖またはλ鎖でよい。本明細書における抗体への言及は、このようなすべてのクラス、サブクラス、およびタイプのヒト抗体種への言及を含む。また、TIM-3ポリペプチドに対する抗体には、TIM-3ポリペプチドを含む融合ポリペプチドまたはTIM-3ポリペプチドの断片に対する抗体も含まれる。
TIM-3ポリペプチドは、抗原またはその一部分もしくは断片として使用することができ、さらに、ポリクローナル抗体およびモノクローナル抗体を調製するための標準的技術を用いて、抗原に免疫特異的に結合する抗体を作製するための免疫原として使用することもできる。免疫原として使用するための抗原の抗原ペプチド断片は、例えば、SEQ ID NO:1に示すアミノ酸配列のようなアミノ末端領域のアミノ酸配列の少なくとも7個のアミノ酸残基を含み、かつ、ペプチドに対して産生される抗体が、完全長ポリペプチドまたはエピトープを含む任意の断片と特異的な免疫複合体を形成するように、そのエピトープを含む。好ましくは、抗原ペプチドは、少なくとも10個のアミノ酸残基、または少なくとも15個のアミノ酸残基、または少なくとも20個のアミノ酸残基、または少なくとも30個のアミノ酸残基を含む。抗原ペプチドに含まれる好ましいエピトープは、その表面に位置しているポリペプチドの領域である。一般にこれらは親水性領域である。好ましい態様において、抗原ペプチドは、TIM-3のセグメント、または全体、IgVドメイン、および/もしくはムチンドメインを含む。
いくつかの態様において、抗原ペプチドに含まれる少なくとも1つのエピトープは、ポリペプチドの表面に位置しているTIM-3ポリペプチドのある領域、例えば親水性領域である。TIM-3ポリペプチドの疎水性解析により、TIM-3ポリペプチドのどの領域が特に親水性であり、したがって、ターゲティング抗体作製のために有用な表面残基をコードする可能性が高いかが示される。ターゲティング抗体作製のための手段として、親水性領域および疎水性領域を示すヒドロパシープロットを、例えば、Kyte Doolittleの方法またはHopp Woodsの方法を含む当技術分野において周知の任意の方法により、フーリエ変換を使用または使用せずに、作製することができる。例えば、HoppおよびWoods (1981) Proc. Nat. Acad. Sci. USA 78: 3824-3828; KyteおよびDoolittle (1982) J. Mol. Biol. 157: 105-142を参照されたい。ある抗原ポリペプチド内の1つまたは複数のドメインに特異的である抗体、またはそれらの誘導体、断片、類似体、もしくはホモログもまた、本明細書において提供される。いくつかの態様において、TIM-3の誘導体、断片、類似体、ホモログ、またはオルソログが、これらのポリペプチド成分に免疫特異的に結合する抗体を作製する際に免疫原として利用され得る。
当技術分野において公知のさまざまな手順が、本発明のポリペプチドに対する、またはその誘導体、断片、類似体、ホモログ、もしくはオルソログに対するポリクローナル抗体またはモノクローナル抗体を作製するために使用され得る。例えば、ANTIBODIES: A LABORATORY MANUAL, HarlowおよびLane (1988) Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Yを参照されたい。これらの抗体のうちいくつかを下記に考察する。
「モノクローナル抗体」(MAb)または「モノクローナル抗体組成物」という用語は、本明細書において使用される場合、独特な軽鎖遺伝子産物および独特な重鎖遺伝子産物からなる抗体分子のただ1つの分子種のみを含む抗体分子集団を意味する。特に、モノクローナル抗体の相補性決定領域(CDR)は、この集団の全分子において同一である。したがって、MAbは、抗原の特定のエピトープと免疫反応することができる抗原結合部位を含み、これは、それに対する独特な結合親和性を特徴とする。
モノクローナル抗体は、KohlerおよびMilstein (1975) Nature, 256:495によって説明されているもののようなハイブリドーマ方法を用いて調製することができる。ハイブリドーマ方法において、典型的にはマウス、ハムスター、または他の適切な宿主動物を免疫化物質で免疫化して、その免疫化物質に特異的に結合する抗体を産生するか、または産生することができるリンパ球を誘発する。あるいは、インビトロでリンパ球を免疫化してもよい。
本発明のポリペプチド抗原を対象とする抗体は、ヒト化抗体またはヒト抗体をさらに含んでよい。これらの抗体は、投与された免疫グロブリンに対抗するヒトによる免疫応答を引き起こさずにヒトに投与するのに適している。ヒト化型の抗体は、主としてヒト免疫グロブリンの配列からなり、かつ非ヒト免疫グロブリンに由来する最小限の配列を含む、キメラの免疫グロブリン、免疫グロブリン鎖、またはそれらの断片(Fv、Fab、Fab'、F(ab')2、もしくは抗体の他の抗原結合部分配列など)である。ヒト化は、Winterおよび共同研究者の方法(Jones et al. (1986) Nature, 321 :522-525;Riechmann et al. (1988) Nature, 332:323-327; Verhoeyen et al. (1988) Science, 239:1534-1536)に従って、げっ歯動物のCDRまたはCDR配列でヒト抗体の対応する配列を置換することによって実施することができる(米国特許第5,225,539号も参照されたい)。
TIM-3に対するイディオタイプを含む抗体断片は、当技術分野において公知の技術によって作製することができ、(i)抗体分子のペプシン消化によって作製されるF(ab')2断片;(ii)F(ab')2断片のジスルフィド架橋を還元することによって作製されるFab断片;(iii)パパインおよび還元剤で抗体分子を処理することによって作製されるFab断片;ならびに(iv)Fv断片が含まれるがそれらに限定されるわけではない。
D. TIM-3活性に対する影響を決定するための方法
いくつかの態様において、TIM-3活性を低下させる作用物質は、TIM-3リガンドへのTIM-3の結合を減少させる。1つの態様において、作用物質はTIM-3の細胞外ドメインに結合し、TIM-3リガンドが結合するのを妨げる。1つの態様において、作用物質は、抗TIM-3アンタゴニスト抗体である。1つの態様において、作用物質はガレクチン-9に結合する。1つの態様において、作用物質は、SEQ ID NO:1のアミノ酸30〜128、またはSEQ ID NO:1のアミノ酸30〜128と少なくとも90%同一であるアミノ酸配列を含むポリペプチドを含む。1つの態様において、作用物質は、APCにおいてTNF-αの放出を阻害する。1つの態様において、作用物質は、抗CD3抗体で刺激されたCD4+ 細胞によるIFN-γ分泌を促進する。
いくつかの態様において、作用物質はTIM-3活性を上昇させる。いくつかの態様において、作用物質はTIM-3に結合し、シグナル伝達を活性化する。いくつかの態様において、作用物質はTIM-3リガンドである。いくつかの態様において、作用物質は、SEQ ID NO:5のアミノ酸配列と少なくとも90%同一であるアミノ酸配列を含むポリペプチドである。いくつかの態様において、作用物質は、抗TIM-3アゴニスト抗体である。いくつかの態様において、作用物質は、APCによるTNF-α放出を刺激する。1つの態様において、作用物質は、抗CD3抗体で刺激されたCD4+細胞によるIFN-γ分泌を阻害する。1つの態様において、作用物質は、CD4+細胞における増殖を阻害する。
単純な結合アッセイ法を用いて、TIM-3もしくはガレクチン-9に結合するか、またはTIM-3ポリペプチドとガレクチン-9ポリペプチドの相互作用を混乱させる作用物質を検出することができる。TIM-3およびガレクチン-9は膜貫通型タンパク質であるため、完全長タンパク質ではなくこれらのタンパク質の可溶型を使用するアッセイ法を使用することができる。可溶型には、膜貫通ドメインを欠いているもの、および/もしくはIgVドメインを含むもの、または同系の結合相手に結合する能力を保持しているそれらの断片が含まれる。
例えば、TIM-3タンパク質は、そのタンパク質を含む溶液をプレート中に導入し、タンパク質をプラスチックに結合させることによって、マルチウェルプレート(例えば96ウェルプレート)中のウェルの底に結合させることができる。次いで、過剰なタンパク質を含む溶液を洗い流し、(例えば、ウシ血清アルブミン(BSA)を含む)ブロッキング溶液を導入して、非特異的な結合部位をブロックする。次いで、プレートをさらに数回洗浄し、ガレクチン-9タンパク質、および(対照に対する)実験ウェルの場合は、TIM-3活性に影響する作用物質を含む溶液を添加する。あるいは、マルチウェルプレートのウェルを、TIM-3タンパク質ではなくガレクチン-9タンパク質を含むポリペプチドでコーティングし、遊離のTIM-3タンパク質を添加した際の結合相互作用を分析してもよい。また、固定化しようとするタンパク質の結合を促進し、かつ/または非特異的結合のレベルを低下させる化合物でウェルを予めコーティングしてもよい。例えば、ウェルを誘導体化してグルタチオンを含ませ、かつBSAで予めコーティングして、結合部位が露出した公知の向きでの固定化タンパク質の結合を促進することができる。
本明細書において使用される場合、「TIM-3へのガレクチン-9の結合を減少させる」という用語は、本明細書において説明するTIM-3/ガレクチン-9結合アッセイ法で測定した場合に、結合が少なくとも10%減少していることを意味する(前述の2つの段落を参照されたい)。
一般に、「結合を阻害する」または「結合を減少させる」という用語は、統計学的に有意な結合の減少または阻害を意味する。しかしながら、不確かさを避けるために、この用語は少なくとも10%の結合の阻害または減少を一般に意味する。
このようなアッセイ法において有用な検出方法には、抗体ベースの方法(すなわち、「遊離」タンパク質を対象とする抗体)、「遊離」タンパク質中に組み入れられたレポーター部分(例えば蛍光標識)の直接検出、および接近エネルギー転移法(例えば、固定化されたタンパク質または固体支持体中に組み入れられた分子の蛍光またはシンチレーションをもたらす、放射性「遊離」タンパク質)が含まれる。
ガレクチン-9タンパク質へのTIM-3タンパク質の結合を決定するためのアッセイ法のさらに別の変形法は、アフィニティーバイオセンサー法の使用を介する。このような方法は、圧電効果、電気化学、または偏光解析法、光波誘導、および表面プラズモン共鳴(SPR)などの光学的方法に基づいてよい。
TIM-3の活性を決定するためのアッセイ法は、米国特許出願公開第2005/0191721号において開示されている。本明細書において開示する実施例6〜9および17もまた、TIM-3活性をモニターするためのアッセイ法を説明する。エクスビボアッセイ法の例では、磁性ビーズ(Miltenyi Biotech)を用いて、健常な対象の末梢血からネガティブ選択によってヒト単球を単離する。段階的な用量のガレクチン-9ポリペプチドで単球(2×105個/ウェル)を刺激し、48時間後にサイトカイン産生をELISAによって測定し、SEQ ID NO:5で刺激した単球におけるサイトカイン産生と比較した。あるいは、活性化が影響を受けるかを判定するために、TIM-3ポリペプチドの存在下で、単球をSEQ ID NO:5で刺激する。
V. CNSの炎症性疾患または炎症性障害を治療する方法
本発明は、TIM-3およびそのリガンドであるガレクチン-9の両方が、炎症を起こした白質組織中のグリア細胞(それぞれミクログリアおよび星状細胞)において上方調節されているという驚くべき発見に部分的に基づいている。末梢の骨髄由来単球はミクログリアを生じ、末梢単球は、多数の炎症性CNS疾患においてCNSに浸潤する。したがって、内在するミクログリアおよびそれらの発生元である浸潤単球の両方が、CNS炎症の一因となり得る。理論に拘束されることを望むものではないが、ミクログリアにおけるTIM-3発現/活性を調節することによって、CNS に対する先天性免疫の炎症への寄与を調整することができる。
本発明の1つの局面は、神経系障害を治療するための方法であって、対象においてTIM-3活性を低下させる治療的有効量の作用物質を対象に投与する段階を含む方法を提供する。神経系障害には、中枢神経系における炎症、脱髄性の中枢神経系疾患、脳炎、髄膜炎、エイズ認知症、大脳マラリア、アルツハイマー病、パーキンソン病、多発性硬化症(MS)、およびハンチントン病が含まれるがそれらに限定されるわけではない。これらの各障害は、TIM-3活性の阻害によって利益を受けると予想される炎症性構成要素を有する。本発明の1つの局面は、対象において多発性硬化症を治療する方法であって、対象においてTIM-3活性を低下させる治療的有効量の作用物質を対象に投与する段階を含む方法を提供する。
1つの態様において、この方法は、APCにおいてTIM-3活性を低下させる。1つの態様において、APCは、単球またはCD11b+ミクログリア細胞である。1つの態様において、APCはDCである。別の態様において、APCは、中枢神経系中にある。
1つの態様において、治療されるMSは、二次性進行型MSに分類される。特定のカテゴリーのMSに罹患した対象を診断することは、当業者にとってルーチンである。一般に、症状は一定であり、二次性進行型MSでは改善せず、次第に悪化する可能性が高い。メトトレキサート、アザチオプリン、シクロホスファミド、またはクラドリビンを用いた治療のような免疫抑制療法は、MSの初期、例えば再発寛解型MSにおいて影響を及ぼすことが示されているが、二次性進行期の対象は一般に免疫療法に対して反応しない。
本発明の1つの局面は、多発性硬化症、および特に二次性進行型多発性硬化症に罹患している対象において平均余命を延長する方法であって、対象においてTIM-3活性を低下させる治療的有効量の作用物質を対象に投与する段階を含む方法を提供する。1つの態様において、TIM-3活性を低下させる作用物質は、対象の平均余命を少なくとも1日、少なくとも1週、少なくとも2週、少なくとも3週、少なくとも1ヶ月、少なくとも2ヶ月、少なくとも3ヶ月、少なくとも6ヶ月、または少なくとも1年延長する。本発明の1つの局面は、多発性硬化症、および特に二次性進行型多発性硬化症に罹患している対象において健康調整平均余命を延長する方法であって、対象においてTIM-3活性を低下させる治療的有効量の作用物質を対象に投与する段階を含む方法を提供する。1つの態様において、TIM-3活性を低下させる作用物質は、対象の健康調整平均余命を少なくとも1日、少なくとも1週、少なくとも2週、少なくとも3週、少なくとも1ヶ月、少なくとも2ヶ月、少なくとも3ヶ月、少なくとも6ヶ月、または少なくとも1年延長する。
平均余命は、同様の個体、例えば同じ障害を患っている個体の群の平均寿命と定義することができる(Naimark D., et. al., J Gen Intern Med 9:702-707 (1994))。平均余命に影響を及ぼす因子には、性別、遺伝的障害、遺伝的背景、肥満、健康管理、食生活、年齢、および薬物、アルコール、またはタバコ使用などの危険な習性が含まれる。平均余命の延長は、寿命を延ばすことを目的とする医学的介入を測定および評価するための手段として使用することができる(Wright JCおよびWeinstein MC、N Engl J Med, 339:380-386 (1998))。
健康調整平均余命は、死亡率の変化ならびに罹患率および能力障害の変化の両方を説明する測定値であり、生活の質の指標である。生活の質および生活の質に対する医学的介入の効果を評価するための様々な測定値が存在し、例えば、損失生存可能年数、無障害平均余命、健康調整生存年、質調整生存年、等価な健康年数(healthy years equivalents)、得られる健康日数(healthy days gained)、エピソードの無い日、Q-TWiST、健康効用指標(Health Utilities Index)、および健康生存年数などである。
1つの例において、健康調整平均余命は、Wilkins, R.およびAdams, OB.、Am J Public Health, 73:1073-1080 (1983)において説明されている健康調整平均余命(HALE)指標によって測定される。健康調整平均余命は、所与の集団の質調整生存年(QALY)の平均であり、医学的介入の治療的価値を評価するために使用することができる。質調整生存年は、1〜0までの尺度で各生存年を評価する健康指標である(Weinstein MCおよびStason WB、N Engl J Med, 296:716-721 (1977))。完全な健康は1と採点され、死亡は0と採点され、能力障害および疼痛は重症度に基づいて採点される。QALYは、各健康状態にある年数をかけることによって決定される。
QALYは、個々の対象を彼らの変更状態に関して調査することによって決定される。健康効用指標(マークI、マークII、およびマークIII)、簡易健康状態調査(Short Form Health Status Survey)(SF-36)、ノッティンガム健康プロファイル(Nottingham Health Profile)、疾病影響プロファイル(Sickness Impact Profile)、EuroQoL (EQ-5D)、および健康の質の尺度(Quality of Well-Being Scale)を含むいくつかの調査が臨床医によって使用される。一般に、これらの調査はすべて、対象の身体的健康および感情的健康を測定することを企図する。
1つの態様において、疾患の重症度を低減させるか、または疾患の症状発現を遅らせる、多発性硬化症を治療する方法が提供される。MSの一般的な症状には、視神経炎、複視(diplopis)、および眼ディスメトリアなどの視覚的症状;不全麻痺、麻痺、痙攣、および機能障害性の反射を含む運動性の症状;知覚異常、神経痛、および固有受容性の機能障害など感覚性の症状;運動失調、めまい、測定障害、およびジストニーなどの協調症状;うつ病、認知機能障害、および痴呆を含む認知性の症状、ならびに疲労、睡眠障害、および勃起不全を含む他の症状が含まれる。MSの重症度および進行を測定するために臨床医が使用するいくつかの方法があり、スクリップスの神経症状評価尺度(Scripps Neurologic Rating Scale)(SNRS)、クルップの疲労重症度尺度(Krupp Fatigue Severity Scale)(FSS)、不能状態尺度(Incapacity Status Scale)(ISS)、機能的自立度評価法(Functional Independence Measure)(FIM)、歩行運動指標(Ambulation Index)(AI)、ケンブリッジ多発性硬化症基礎スコア(Cambridge Multiple Sclerosis Basic Score)(CAMBS)、多発性硬化症の機能評価(Functional Assessment of Multiple Sclerosis)(FAMS)、気分状態プロファイル(Profile of Mood States)(POMS)、疾病影響プロファイル(Sickness Impact Profile)(SIP)、クルツケの拡大身体障害状態尺度(Kurtzke Expanded Disability Status Scale)(EDSS)、ならびにMS病変を観察するためのMRIスキャンが含まれる。これらのうち1つもしくは複数または他の臨床的に認められている疾患重症度の標準のスコアが治療後に統計学的に有意に変化する場合、効果的な治療であることを示す。
1つの態様において、治療方法において使用する作用物質は、TIM-3活性を低下させる。1つの態様において、作用物質は、TIM-3シグナル伝達を減少させる。1つの態様において、使用される作用物質は、APC、特にCD11b+ミクログリアによるTNF-α分泌を減少させる。1つの態様において、使用される作用物質は、DCによるTNF-α分泌を減少させる。
1つの態様において、TIM-3活性は、例えば、TIM-3 RNAiまたはTIM-3リガンドに対するRNAiによる処理の結果として、TIM-3発現の減少を経て低下する。1つの態様において、TIM-3活性は、TIM-3と1つまたは複数のTIM-3リガンドの相互作用の妨害によって低下する。1つの態様において、TIM-3と1つまたは複数のTIM-3リガンドの相互作用を妨害する作用物質は、本明細書において開示するアンタゴニスト抗体またはポリペプチドである。1つの態様において、TIM-3リガンドはガレクチン-9ではない。1つの態様において、作用物質は、炭水化物またはペクチンである。1つの態様において、炭水化物は、ラクトースまたはβ-ガラクトシドである。
TIM-3を阻害する作用物質は、当業者が認識する任意の数の手段によって、多発性硬化症を治療する能力に関して試験することができる。実験的アレルギー性脳脊髄炎(EAE)は、ヒトMSのマウスモデルである(old et al., Mol. Med. Today, 6:88-91, 2000; Anderton et al., Immunol. Rev., 169:123-137, 1999)。MSは、ミエリンタンパク質MOG(ミエリン乏突起膠細胞糖タンパク質)のペプチドでマウスを免疫化することによって誘導する。このタンパク質は、ミエリン鞘の外側に存在し、ミエリンの保護層の役割を果たす。RIBIアジュバント中で乳化させたMOGペプチド(MOG35-55)を0日目にマウスに皮下注射して免疫化する。次いで、2日目に百日咳毒素(PT)をマウスに静脈内注射する。マウスは、だらりとした尾部、よろよろした動きで始まる麻痺とそれに続く後肢および前肢の麻痺の症状を示し始めるので、疾患のタイミング、程度、および重症度を測定するいくつかの異なるパラメーターに従ってスコア化する。疾患の発症の遅延により、その作用物質がマウスの疾患プロセスを改変していることが示唆される。発病率の低下により、その作用物質が疾患に罹患しているマウスの数に影響を与えることが示唆される。臨床スコアの減少により、その作用物質が疾患の重症度に影響を与えることが示唆される。
ヒト対象における作用物質の影響は、めまい、視覚的機能障害、疲労、および認知速度低下など多発性硬化症の一般的症状の発生率および重症度の観察によってモニターすることができる。クルツケの拡大身体障害状態尺度(EDSS)およびMS機能複合(MS Functional composite)(MSFC)スコアの両方が、能力障害をモニタリングするために使用され得る。上記のように、これらのスコアのいずれかが統計学的に有意に改善する場合、効果的な療法であることが示唆される。
本発明の化合物の好ましい量は、医学的にも許容されるその治療的有効量である。本発明の薬学的組成物中の実際の投薬量レベルは、個々の患者、薬学的組成物、および投与様式に対して所望の治療応答を実現するのに効果的である量を得るために、患者にとって毒性にならないように変更してよい。選択される投薬量レベルおよび投与頻度は、投与経路、投与時間、治療期間、本発明の化合物と組み合わせて使用される他の薬物、化合物、および/または材料、治療される患者の年齢、性別、体重、状態、全体的健康状態、および以前の病歴、ならびに医薬分野において周知である同様の因子を含む様々な因子に依存すると考えられる。当技術分野において通常の技能を有する医師は、必要とされる薬学的組成物の治療的有効量を容易に決定し、処方することができる。
適切な場合には、例えば、免疫応答の増大を測定することにより、例えば、高力価の抗体の存在、高親和性抗体の存在、特定の抗原に対する記憶細胞のような免疫細胞の所望の集団の存在、または特定の抗原特異的細胞障害性T細胞の存在に基づいて、ワクチンの有効量を決定することができる。また、感染症の場合には微生物負荷の減少または癌の場合には腫瘍の大きさもしくは進行の低減に基づいて、有効量を測定することもできる。また、有効量は、治療される個々の対象が経験する症状の減少にも反映され得る。
CNSの炎症性障害の治療の場合、投薬量を適切に調整して、所望の薬物レベルを局所的または全身的に達成することができる。一般に、化合物の用量は、約0.001mg/kg/用量〜約1000mg/kg/用量である。これらのレベルの投与は、投与される製剤に応じて、例えば、毎日、1日当たり数回まで、またはより長い間隔で実施してよい。安定化した製剤または徐放製剤を投与する場合、投薬量は、例えば、毎日、1日おき、2日毎、3日毎など、毎週、隔週、またはさらに毎月、与えることができる。約0.1〜50mg/kg/日の範囲の用量が効果的であると一般に予想される。対象における応答がこのような用量で不十分である事象では、患者の耐性が許容する程度まで、さらなる高用量(または、より局所的な異なる送達経路による効果的な高用量)を使用してよい。
様々な投与経路が利用可能である。選択される個々の様式は、当然、選択される個々の薬物、治療される疾患状態の重症度、および治療的有効性のために必要とされる投薬量に依存すると考えられる。一般的に言って、本発明の方法は、医学的に許容される任意の投与様式、すなわち臨床的に許容できない有害作用を引き起こさずに効果的なレベルの活性化合物をもたらす任意の様式を用いて実施することができる。このような投与様式には、経口経路、直腸経路、舌下経路、局所経路、鼻経路、経皮経路、または非経口経路が含まれる。「非経口」という用語は、皮下、静脈内、筋肉内、または輸注を含む。経口経路および静脈内経路が好ましい。
VI. 腫瘍を治療する方法
本発明はさらに、腫瘍を治療する新規な方法、腫瘍/癌の成長を阻害する新規な方法、腫瘍に罹患している対象の生命を延長する新規な方法、または腫瘍に関連した1つもしくは複数の症状を軽減する新規な方法を提供する。本発明の1つの局面は、そのような治療を必要とする対象において腫瘍/癌を治療する方法であって、対象においてTIM-3活性を上昇させる治療的有効量の作用物質を対象に投与する段階を含む方法を提供する。
本発明の1つの局面は、腫瘍に罹患している対象において平均余命を延長する方法であって、対象においてTIM-3活性を上昇させる治療的有効量の作用物質を対象に投与する段階を含む方法を提供する。1つの態様において、TIM-3活性を上昇させる作用物質は、対象の平均余命を少なくとも1日、少なくとも1週、少なくとも2週、少なくとも3週、少なくとも1ヶ月、少なくとも2ヶ月、少なくとも3ヶ月、少なくとも6ヶ月、または少なくとも1年延長する。
本発明の1つの局面は、腫瘍に罹患している対象において健康調整平均余命を延長する方法であって、対象においてTIM-3活性を低下させる治療的有効量の作用物質を対象に投与する段階を含む方法を提供する。1つの態様において、TIM-3活性を上昇させる作用物質は、対象の健康調整平均余命を少なくとも1日、少なくとも1週、少なくとも2週、少なくとも3週、少なくとも1ヶ月、少なくとも2ヶ月、少なくとも3ヶ月、少なくとも6ヶ月、または少なくとも1年延長する。
本発明の1つの局面は、癌を発症するリスクがある対象を治療するための方法を提供する。癌を発症するリスクがある対象は、例えば、一般母集団と比べて、または年齢、性別、人種、および家族歴など1つもしくは複数のリスク因子を一致させた集団と比べて、癌を発症する確率が通常よりも高い者である。これらの対象には、例えば、より高い癌発症可能性に関連していることが実証されている遺伝的異常を有する対象、癌に対する家族性素因を有する対象、タバコ、アスベスト、または他の化学的毒など癌の原因となる作用物質(すなわち発癌物質) に曝露されている対象、および以前に癌を治療され、見かけ上寛解している対象が含まれる。本発明の1つの局面は、癌を発症するリスクがある対象を治療する方法であって、対象においてTIM-3活性を上昇させる治療的有効量の作用物質を対象に投与する段階を含む方法を提供する。
腫瘍を治療する方法は、多形性神経膠芽細胞腫(GBM)から得られたミクログリアが対照組織と比べて低いレベルでTIM-3を発現するという驚くべき発見に部分的に基づいている。神経膠の腫瘍の全体かつ周囲に分布しているミクログリアは機能的に障害されていることが報告されている。特に、CpGオリゴデオキシヌクレオチド、インターフェロン-γ、およびIFN-γ/LPSなどの活性化因子に応答したMHC-II誘導は、脳腫瘍から得られたミクログリアにおいて有意に減少している(Schartner, J. M. et al. Glia 51, 279-85 (2005))。本発明のこの局面は、TIM-3活性を上昇させることに基づいた、腫瘍に対する治療を提供する。
「腫瘍」とは、本明細書において使用される場合、悪性であるか良性であるかを問わず、すべての新生細胞の成長および増殖、ならびにすべての前癌性および癌性の細胞および組織を意味する。1つの態様において、腫瘍は、中枢神経系の腫瘍である。
2つのタイプの癌、すなわち良性および悪性がある。ほぼすべての良性癌は被包化されており、かつ非浸潤性である;一方、悪性癌は被包化されることはほとんどなく、浸潤性の破壊的な成長によって隣接組織に侵入する。この浸潤性の成長に続いて、元の癌と連続しない部位に癌細胞が移植する場合がある。本発明の作用物質を用いて、非限定的に、肉腫、癌腫、線維腫、白血病、リンパ腫、黒色腫、骨髄腫、神経芽細胞腫、横紋筋肉腫、網膜芽細胞腫、および神経膠腫、ならびに本明細書において説明する他の各癌を含む癌をヒトにおいて治療することができる。
元の位置から移動し、重要器官に播種する(それによって転移性の病変を生じる)癌は、最終的に、罹患器官の機能悪化によって対象の死亡を招き得る。転移は、原発性癌に由来する癌細胞による身体の他の部分への播種に起因する、原発性癌の位置とは異なる癌細胞領域である。したがって、転移性癌を有する対象もまた、本発明に従って治療することができる。いくつかの態様において、転移性癌は、上皮起源のものである。癌腫は、乳癌で観察されているように骨に、および結腸癌でときどきあるように肝臓に、転移し得る。本発明の方法は、転移部位および/または原発性癌の部位に関わらず転移性癌を治療することを意図する。
1つの態様において、本出願は、髄膜腫を含む脳腫瘍;上衣細胞腫、乏突起膠腫、およびすべてのタイプの星細胞腫(低グレード、未分化、および多形性神経膠芽細胞腫または単に膠芽腫)を含む神経膠腫;髄芽腫、神経節膠腫、神経鞘腫、脊索腫;ならびに未分化神経外胚葉性腫瘍を含む主に小児の脳腫瘍を治療する方法を提供する。原発性脳腫瘍(すなわち脳で発生するもの)および続発性脳腫瘍または転移性脳腫瘍の両方を、本発明の方法によって治療することができる。
1つの態様において、腫瘍は、星細胞腫、乏突起膠腫、上衣細胞腫、混合膠腫、乏突起星細胞腫、神経節膠腫、もしくは多形性神経膠芽細胞腫、または神経線維腫症より選択される。
1つの態様において、腫瘍は星細胞腫である。星細胞腫は、星状細胞と呼ばれる脳細胞またはそれらの前駆体から発生する神経膠腫腫瘍である。星状細胞は、神経機能を支える中枢神経系中の細胞である。悪性度の上昇を表す組織学的特徴によって、星細胞腫を星細胞腫、未分化星細胞腫、または多形性神経膠芽細胞腫に類別することができる。未分化星細胞腫および多形性神経膠芽細胞腫は、高グレードの神経膠腫とみなされているのに対し、星細胞腫は低グレードの神経膠腫であるとみなされている。高グレードの腫瘍は急速に成長し、容易に浸潤し得、かつ脳全体に拡大し得る。低グレードの星細胞腫もまた脳に浸潤し得るが、通常は、より限局性であり、長い期間に渡って緩徐に成長する。高グレードの腫瘍の方がはるかに攻撃的であり、極めて熱心な療法を必要とする。小児の星細胞腫瘍の大多数は低グレードであるのに対し、成人での大多数は高グレードである。星細胞腫は脳および脊髄中のどこでも発生し得るが、大半は大脳半球中に位置している。
1つの態様において、腫瘍は、異型性グリオーマである。異型性グリオーマは、低グレードのもの(限局性、緩徐に成長)と多形性神経膠芽細胞腫(急速に成長し、著しく浸潤性)の間に分類される中グレードの浸潤性神経膠腫である。未分化星細胞腫(AA)は、星状細胞と呼ばれる脳細胞および/またはそれらの前駆体から発生する腫瘍である。
1つの態様において、腫瘍は、多形性神経膠芽細胞腫である。多形性神経膠芽細胞腫としても公知の膠芽腫は、最高グレードの悪性度であるWHOグレードIVの神経膠腫である(KleihuesおよびCavenee、2000)。これは、頭蓋内腫瘍の15%〜23%および星細胞腫の約50%〜60%に相当する。細胞の細胞質中でグリア線維性酸性タンパク質を同定することができるため、一般に、大半の例は星状細胞から発生するとみなされている。しかしながら、いくつかの例は、乏突起膠細胞のような他の膠細胞系列から発生するように見受けられる。膠芽腫は、最も頻繁に発生する星細胞腫である。剖検研究および連続的な生検研究により、いくつかの星細胞腫は、いくつかのグレードの悪性度を経て進行し、低グレードから未分化星細胞腫へ、膠芽腫へと転換することが示された(Muller et al., 1977)。しかし、膠芽腫のいくつかの例は、他の点では正常な患者において急速に発生するらしく、かつそれらが小さい時点で認識されるため、この種類の膠芽腫はまた、より低グレードの悪性度を経ずに、星状細胞前駆細胞の悪性転換から直接発生し得ると考えられている(KleihuesおよびOhgaki、1997; 1999)。本明細書において考案するTIM-3増強作用物質は、腫瘍治療のその他の方法と組み合わせて使用してよい。
米国特許公報第2007-0032453号および同第2006-0281720号は、本明細書において説明するTIM-3増強作用物質と組み合わせて使用され得る、神経膠の腫瘍を治療するその他の方法を開示している。
癌には、基底細胞癌、胆道癌;膀胱癌;骨癌;脳およびCNSの癌;乳癌;子宮頸癌;絨毛癌;結腸直腸癌;結合組織癌;消化器系の癌;子宮内膜癌;食道癌;眼癌;頭頸部癌;胃癌;胚細胞腫瘍;上皮内新生物;カポジ肉腫;腎臓癌;喉頭癌;白血病(例えば、急性骨髄性白血病、急性リンパ性白血病、慢性骨髄性白血病および慢性リンパ性白血病);肝臓癌;肺癌(例えば、小細胞および非小細胞);ホジキンリンパ腫および非ホジキンリンパ腫を含むリンパ腫;黒色腫;骨髄腫;神経芽細胞腫;口腔癌(例えば、唇、舌、口、および咽頭);卵巣癌;膵臓癌;前立腺癌;腎細胞癌;網膜芽細胞腫;横紋筋肉腫;直腸癌;腎臓癌;呼吸器系の癌;肉腫;皮膚癌;胃癌;間質腫瘍;精巣癌;甲状腺癌;子宮癌;泌尿器系の癌、ならびに他の癌腫および肉腫が含まれるがそれらに限定されるわけではない。
治療する癌は、難治性の癌であってよい。本明細書において使用される難治性の癌とは、処方される通常の標準治療に対して抵抗性の癌である。これらの癌は、最初は治療に応答性と思われる場合があるか(次いで再発する)、またはそれらは治療に完全に非応答性である場合がある。通常の標準治療は、癌のタイプおよび対象における進行の程度に応じて異なってよい。これは、化学療法、手術、もしくは放射線照射、またはそれらの組合せでよい。当業者は、このような標準治療を承知している。したがって、本発明に従って難治性癌を治療される対象は、癌に対する別の治療に既に曝露されている場合がある。あるいは、(例えば、癌細胞の解析または対象の病歴を考慮して)癌が難治性である可能性が高い場合、対象は、別の治療にまだ曝露されていない場合がある。難治性癌の例には白血病、黒色腫、腎細胞癌、結腸癌、肝臓癌、膵臓癌、および肺癌が含まれるがそれらに限定されるわけではない。
いくつかの場合における本発明の組成物および方法は、既存の外科的処置または薬物療法と取って代わるために有用な場合があるが、大半の場合、本発明は、そのような状態を治療するための既存の療法の有効性を改善するのに有用である。したがって、併用療法を用いて、とりわけて感染症または癌の治療を受けているか、または受けるであろう対象を治療することができる。例えば、本発明の作用物質は、抗微生物剤または抗増殖剤と併用して投与することができる。また、本発明の作用物質は、抗原、アジュバント、免疫賦活剤などを用いた他の免疫療法、または抗体を用いた受動免疫療法と併用して投与することもできる。また、本発明の作用物質は、外科手術、放射線療法、または化学療法などの非薬物治療と併用して投与することもできる。他の療法は、本発明の作用物質を用いた治療の前、同時、または後に実施してよい。また、本発明の作用物質が他の治療の前または後に投与され得るように、異なる治療の実施には、数時間、数日、およびいくつかの場合には数週間の遅れがあってもよい。
1つの態様において、癌対象に作用物質を投与すると、APCにおいてTIM-3活性が上昇する。1つの態様において、APCは、単球またはCD11b+ミクログリア細胞である。別の態様において、これらの細胞は、中枢神経系中にある。
1つの態様において、TIM-3シグナル伝達を増大させる作用物質が対象に投与される。1つの態様において、使用される作用物質は、APCによるTNF-α分泌を増加させる。1つの態様において、APCは、単球、DC、またはCD11b+ミクログリア細胞である。1つの態様において、作用物質は、TIM-3の細胞内ドメインのリン酸化を増加させる。1つの態様において、作用物質がガレクチン-9ではないことを条件として、TIM-3シグナル伝達を増大させる作用物質が対象に投与される。
1つの態様において、作用物質は抗体または抗体断片であり、抗体はTIM-3アゴニストとして作用する。1つの態様において、作用物質は、TIM-3リガンドまたはTIM-3リガンドの効果を模倣する化合物である。1つの態様において、TIM-3リガンドは、ガレクチン-9ポリペプチドを含むか、またはガレクチン-9ポリペプチドと少なくとも90%、少なくとも95%、もしくは少なくとも99%同一である。別の態様において、作用物質は、リガンドがガレクチン-9および/または抗ガレクチン-9抗体ではないことを条件として、TIM-3リガンドである。
インビボで腫瘍を治療する能力に関して本発明の作用物質を試験するために、腫瘍をヌードマウス(すなわち無胸腺マウス)中に外植することができる。様々な異種移植モデルが当技術分野において公知である。腫瘍がマウス中で定着した後、TIM-3活性を上昇させる作用物質をマウスに投与して、作用物質が腫瘍を減少させ得るか、または動物の生存期間中央値を延長し得るかを試験する。
1つの態様において、TIM-3活性を上昇させる作用物質は、他の抗癌療法と組み合わせて(すなわち、前、実施中、または後)、一緒に投与される。例えば、作用物質は、腫瘍学の当業者に公知である任意の1種または複数種の化学療法薬、例えば、カルムスチン、クロラムブシル、シスプラチン、カルボプラチン、オキシプラチン(oxiplatin)、プロカルバジン、およびシクロホスファミドなどのアルキル化剤;フルオロウラシル、フロクスウリジン、フルダラビン、ゲムシタビン、メトトレキサート、およびヒドロキシ尿素などの代謝拮抗剤;植物アルカロイドおよび抗生物質を含む天然産物、例えば、ブレオマイシン、ドキソルビシン、ダウノルビシン、イダルビシン、エトポシド、マイトマイシン、ミトキサントロン、ビンブラスチン、ビンクリスチン、およびTaxol(パクリタキセル)、または関連化合物、例えば、脳腫瘍用に具体的に承認されており、テモゾロミドを含むTaxotere(商標)剤およびカルムスチンを含むGliadel(商標)wafer;ならびにイリノテカンおよびGleevec(商標)を含む他の薬物、ならびにWO2005/017107A2(参照により本明細書に組み入れられる)に列挙されている承認されている抗癌剤および実験的抗癌剤すべてと共に投与されてよい。作用物質は、例えば、標準的な化学療法治療プログラムにおいて、1種、2種、3種またはそれ以上のこれらの作用物質と組み合わせて投与することができる。TIM-3活性を上昇させる作用物質と共に投与できる他の作用物質には、HER2抗原に対するHerceptin(商標)、VEGFに対するAvastin(商標)、Erbitux(商標)のようなEGF受容体に対する抗体、または抗FGF mAbを含むモノクローナル抗体のような生物製剤、ならびに低分子抗血管新生薬物またはIressa(商標)およびTarceva(商標)などのEGF受容体アンタゴニスト薬物が含まれる。さらに、作用物質は、外部ビーム放射線照射、強度変調放射線療法(IMRT)を含む任意の形態の放射線療法、およびガンマナイフ(Gamma Knife)、サイバーナイフ(Cyberknife)、ライナック(Linac)、および組織内照射(例えば、埋め込み型の放射性シーズ、GliaSiteバルーン)を含む任意の形態の放射線外科療法と共に投与することができる。1つの態様において、作用物質は、例えば、腫瘍切除または腫瘍生検の進行中のような外科的処置の進行中に投与される。
本発明の作用物質はまた、癌腫瘤を除去するための外科的処置、化学療法、または放射線療法など癌の非薬物治療と共に使用される。非薬物療法は、本発明の作用物質を用いた治療の前、同時、または後に実施してよい。また、本発明の作用物質が他の治療の前または後に投与され得るように、異なる治療の実施には、数時間、数日、およびいくつかの場合には数週間の遅れがあってもよい。
癌を治療するための外科的方法には、右半結腸切除または左半結腸切除、S字結腸、部分的、または全体的な結腸切除および胃切除、根治的乳房切除または乳腺部分切除、前立腺切除、ならびに子宮摘出などの腹腔内外科手術が含まれる。1つの態様において、TIM-3活性を上昇させる作用物質は、腫瘍の外科的除去の後または実施中に癌性腫瘤の部分に局所的に投与される。
本発明は、1つの態様において、癌抗原に対する免疫記憶細胞を作製するために、外科手術、放射線照射、または化学療法の前に癌対象において本発明の作用物質を使用することを企図する。この方法では、免疫系の記憶細胞を癌抗原でプライミングし、それによって長期に渡る免疫監視を提供することができる。このようにしてプライミングされた免疫細胞は腫瘍部位に侵入し、他の治療後に残存している任意の腫瘍破片を効果的に取り除くことができる。
本発明の作用物質は、癌抗原と共に使用され得る。本明細書において使用される癌抗原は、好ましくは癌細胞の細胞表面に(またはさらには新生血管系の表面に)あり、免疫応答を引き起こすことができる、癌に差次的に関連した化合物である。抗原は、MHC分子によって抗原提示細胞の表面に(消化された形態で)提示された場合に免疫応答を引き起こす。癌抗原は、例えば、Cohen, et al., 1994, Cancer Research, 54:1055に記載されているように、癌細胞の粗抽出物を調製することにより癌細胞から、抗原を部分的に精製することにより、組換え技術により、または公知の抗原の新規合成により、調製することができる。癌抗原には、組換えによって発現させた抗原、その免疫原性部分、または腫瘍全体もしくは癌全体が含まれるがそれらに限定されるわけではない。このような抗原は、組換えによってまたは当技術分野において公知の他の任意の手段によって、単離または調製することができる。
癌抗原は、癌細胞と正常細胞では差次的に発現される抗原を含む。この差次的な発現のおかげで、これらの抗原は抗腫瘍療法で標的とすることができる。癌抗原は、正常細胞において調節された様式で発現され得る。例えば、それらは、分化の特定の段階または生物もしくは細胞の発生における特定の時点でのみ発現され得る。一部は、胚性抗原および胎児性抗原として時間的に(temporally)発現される。さらに他のものは正常細胞において決して発現されないか、またはそのような細胞におけるそれらの発現は非常に少ないため検出不可能である。
他の癌抗原は、変異細胞遺伝子、例えば癌遺伝子(例えば、活性化されたras癌遺伝子)、サプレッサー遺伝子(例えば変異p53)にコードされ、内部の欠失または染色体転座に起因する融合タンパク質である。さらに他の癌抗原は、RNA腫瘍ウイルスおよびDNA腫瘍ウイルス上にあるもののようなウイルス遺伝子にコードされてよい。
癌抗原の例には、HER-2(p185)、CD20、CD33、GD3ガングリオシド、GD2ガングリオシド、癌胎児性抗原(CEA)、CD22、ミルクムチンコアタンパク質、TAG-72、ルイス(Lewis)A抗原、OV-TL3およびMOv18などの卵巣関連抗原、ならびに抗体9.2.27、HMFG-2、SM-3、B72.3、PR5C5、PR4D2によって認識される高分子量(high Mr)の黒色腫抗原などが含まれる。他の癌抗原は、米国特許第5,776,427号に記載されている。
その他の例には、MAGE、MART-1/Melan-A、gp100、ジペプチジルペプチダーゼIV(DPPIV)、アデノシンデアミナーゼ結合タンパク質(ADAbp)、FAP、シクロフィリンb、結腸直腸関連抗原(CRC)--C017-1A/GA733、癌胎児性抗原(CEA)ならびにその免疫原性エピトープCAP-1およびCAP-2、etv6、am11、前立腺特異抗原(PSA)ならびにその免疫原性エピトープPSA-1、PSA-2、およびPSA-3、前立腺特異的膜抗原(PSMA)、T細胞受容体/CD3-ζ鎖、MAGE-ファミリーの腫瘍抗原(例えば、MAGE-A1、MAGE-A2、MAGE-A3、MAGE-A4、MAGE-A5、MAGE-A6、MAGE-A7、MAGE-A8、MAGE-A9、MAGE-A10、MAGE-A11、MAGE-A12、MAGE-Xp2(MAGE-B2)、MAGE-Xp3(MAGE-B3)、MAGE-Xp4(MAGE-B4)、MAGE-C1、MAGE-C2、MAGE-C3、MAGE-C4、MAGE-C5)、GAGE-ファミリーの腫瘍抗原(例えば、GAGE-1、GAGE-2、GAGE-3、GAGE-4、GAGE-5、GAGE-6、GAGE-7、GAGE-8、GAGE-9)、BAGE、RAGE、LAGE-1、NAG、GnT-V、MUM-1、CDK4、チロシナーゼ、p53、MUCファミリー、HER2/neu、p21ras、RCAS1、α-フェトプロテイン、E-カドヘリン、α-カテニン、β-カテニン、およびγ-カテニン、p120ctn、gp100Pmel117、PRAME、NY-ESO-1、cdc27、大腸腺腫性ポリポーシスタンパク質(APC)、ホドリン、コネキシン(Connexin)37、Ig-イディオタイプ、p15、gp75、GM2ガングリオシドおよびGD2ガングリオシド、ヒトパピローマウイルスタンパク質のようなウイルス産物、Smadファミリーの腫瘍抗原、lmp-1、P1A、EBVにコードされた核抗原(EBNA)-1、脳グリコーゲンホスホリラーゼ、SSX-1、SSX-2(HOM-MEL-40)、SSX-1、SSX-4、SSX-5、SCP-1およびCT-7、CD20、ならびにc-erbB-2が含まれる。
また、癌抗原または腫瘍抗原は、それらが関連している(すなわちそれらが発現される)癌または腫瘍に基づいて分類することもできる。腫瘍抗原に関連している癌または腫瘍には、急性リンパ芽球性白血病(etv6;aml1;シクロフィリンb)、B細胞リンパ腫(Ig-イディオタイプ);バーキット(非ホジキン)リンパ腫(CD20);神経膠腫(E-カドヘリン;α-カテニン;β-カテニン;γ-カテニン;p120ctn)、膀胱癌(p21ras)、胆道癌(p21ras)、乳癌(MUCファミリー;HER2/neu;c-erbB-2)、子宮頸癌(p53;p21ras)、結腸癌(p21ras;HER2/neu;c-erbB-2;MUCファミリー)、結腸直腸癌(結腸直腸関連抗原(CRC)-C017-1A/GA733;APC)、絨毛癌(CEA)、上皮細胞癌(シクロフィリンb)、胃癌(HER2/neu;c-erbB-2;ga733糖タンパク質)、肝細胞癌(α-フェトプロテイン)、ホジキンリンパ腫(lmp-1;EBNA-1)、肺癌(CEA;MAGE-3;NY-ESO-1)、リンパ系細胞に由来する白血病(シクロフィリンb)、黒色腫(p15タンパク質、gp75、癌胎児性抗原、GM2ガングリオシドおよびGD2ガングリオシド)、骨髄腫(MUCファミリー;p21ras)、非小細胞肺癌(HER2/neu;c-erbB-2)、鼻咽頭癌(lmp-1;EBNA-1)、卵巣癌(MUCファミリー;HER2/neu;c-erbB-2)、前立腺癌(前立腺特異抗原(PSA)ならびにその免疫原性エピトープPSA-1、PSA-2、およびPSA-3;PSMA;HER2/neu;c-erbB-2)、膵臓癌(p21ras;MUCファミリー;HER2/neu;c-erbB-2;ga733糖タンパク質)、腎臓(HER2/neu;c-erbB-2)、子宮頸および食道の扁平上皮癌(ヒトパピローマウイルスタンパク質および非感染性粒子などのウイルス産物)、精巣癌(NY-ESO-1)、T細胞白血病(HTLV-1エピトープ)、ならびに黒色腫(Melan-A/MART-1;cdc27;MAGE-3;p21ras;gp100Pmel117)が含まれる。
いくつかの好ましい態様において、癌抗原は、VEGF、抗イディオタイプmAb(GD3ガングリオシド模倣体)、CD20、CD52、抗イディオタイプmAb(CEA模倣体)、ERBB2、EGFR、CD22、ERBB2 X CD65(fcγRI)、EpCam、PEM、およびCD33である。
VII. 免疫応答の刺激
また、抗原およびアジュバントとしてTIM-3活性を上昇させる作用物質を含むワクチン組成物も本明細書において開示される。開示される組成物はまた、ウイルス感染症を治療するため、腫瘍免疫性を増強するため、ワクチン接種の有効性を高めるため、または免疫抑制を改善する際に有用な場合がある。TIM-3活性を上昇させる作用物質は、例えば感染病原体を処理するため、かつ/または癌を治療するためのワクチンの有効性を高めるために有用であり得る。
1つの態様において、TIM-3活性を上昇させる作用物質は、APCによるTNF-α分泌を増加させる。1つの態様において、作用物質は、TIM-3の細胞内ドメインのリン酸化を増加させる。
1つの態様において、作用物質は抗体または抗体断片であり、抗体はTIM-3アゴニストとして作用する。1つの態様において、作用物質は、TIM-3リガンドまたはTIM-3リガンドの効果を模倣する化合物である。1つの態様において、TIM-3リガンドは、ガレクチン-9ポリペプチドを含むか、またはガレクチン-9ポリペプチドと少なくとも90%、少なくとも95%、もしくは少なくとも99%同一である。別の態様において、作用物質は、リガンドがガレクチン-9ではないことを条件として、TIM-3リガンドである。
免疫応答を増強するための方法は、樹状細胞におけるTIM-3発現が、インビボで炎症性Th1応答を促進するために使用され得るという驚くべき発見に部分的に基づいている。アゴニスト抗TIM-3抗体を含むIFA (不完全フロイントアジュバント)で免疫化したマウスの方が、IFAおよび対照抗体で免疫化したマウスよりも重度の疾患を発症することが観察された(例えば、図7を参照されたい)。
1つの態様において、ワクチン組成物は、抗原およびアジュバントとしてTIM-3活性を上昇させる作用物質を含み、かつTLRリガンドをさらに含む。少なくとも10種のヒトTLRおよび12種のマウスTLR(Toll様受容体)が説明されている(例えば、Takeda et. al., Annu. Rev. Immunol. 21 :335, 2003を参照されたい;下記も参照されたい)。特定のTLRと相互作用し、続いてそれらを活性化する1種または複数種のリガンドが同定されている。1つの態様において、リガンドは、TLR1、TLR2、TLR3、TLR4、TLR5、TLR6、TLR7、またはTLR9のうち1種または複数種に結合する。髄膜炎菌(Neisseria meningitidis)のある種の外膜タンパク質、例えばOMP2(PorBとも呼ばれる)は、TLR2と相互作用するのに対し、すべてではないが大半のグラム陰性菌のLPSはTLR4と相互作用する。他のTLRリガンドの例には、可溶性因子(例えば、髄膜炎菌)、トリ-アシルリポペプチド(細菌、マイコバクテリア)、リポタンパク質およびリポペプチド、ポーリン(ナイセリア(Neisseria))、非定型LPS(例えば、レプトスピラ・インテロガンス(Leptospira interrogans)、P.ジンジバリス(gingivalis))、ペプチドグリカン(グラム陽性菌)、リポテイコ酸(グラム陽性菌)、HSP70(宿主)、糖脂質(例えば、トレポネーマ・マルトフィラム(Treponema maltophilum)、二本鎖RNA(例えばウイルス性)、LPS(グラム陰性菌)、タキソール(植物)、HSP60(宿主)、HSP70(宿主)、HSP60(クラミジア・ニューモニエ(Chlamydia pneumoniae))、フィブリノーゲン(宿主)、フラゲリン(細菌)、ジ-アシルリポペプチド(マイコプラズマ)、イミダゾキノリン(合成化合物)、ロキソリビン(合成化合物)、ブロピリミン(合成化合物)、およびCpG DNA(細菌)が含まれる。1つの態様において、作用物質は、米国特許出願公開第2005/0013812号に説明されているようなTLRリガンド:リポソーム複合体に製剤化してよい。広範なTLRリガンドが、例えばInvivogen (San Diego, CA)から市販されている。
TLRは、細胞外のロイシンに富むドメインおよび「Toll/IL-1受容体」(TIR)ドメインと呼ばれる保存領域を含む細胞質尾部をそれぞれ特徴とするI型膜貫通型タンパク質である。TLRは、一般に、免疫機能に関与している組織、例えば、脾臓および末梢血白血球、ならびに外環境に曝露されているもの、例えば胃腸管および肺において発現される。TLRの発現パターンは、組織および細胞型によって異なる。細胞内であるTLR3、TLR7、およびTLR9を除いて、TLRは形質膜上に位置している。
少なくとも10種のヒトTLRおよび12種のマウスTLRが特徴付けられており、ヒトではTLR1〜TLR10、マウスではTLR1〜TLR9、TLR11、TLR12(別名TLR11)およびTLR13であり、TLR10のホモログは偽遺伝子である。TLR2は、細菌のリポタンパク質、リポマンナン、およびリポテイコ酸を含む、グラム陽性菌由来の様々な病原体関連分子パターンの認識のために極めて重要である。TLR3は、ウイルスに由来する二本鎖RNAの認識に関係があるとされている。TLR4は、主にリポ多糖によって活性化される。TLR5は細菌のフラゲリンを検出し、TLR9は、非メチル化CpG DNAに対する応答に必要とされる。TLR7およびTLR8は、小型の合成抗ウイルス分子を認識することが報告されており(Jurk et al., 2002, Nat. Immunol., 3:499)、最近、一本鎖RNAがそれらの天然リガンドであることが報告された(Heil et al., 2004, Science, 303:1526-9)。TLR11は、尿路病原性大腸菌(E.coli)およびトキソプラズマ・ゴンディ(Toxoplasma gondii)由来のプロフィリン様タンパク質を認識することが報告されている。
TLRは、互いにヘテロ二量体化することができ、結果として特異性の範囲が広くなる。例えば、TLR2およびTLR6の二量体は、ジアシル化リポタンパク質に対する応答に必要とされ、TLR2およびTLR1は相互作用してトリアシル化リポタンパク質を認識する。また、TLRの特異性は、LPSに応答してTLR4との複合体を形成するMD-2およびCD14など様々なアダプター分子およびアクセサリー分子の影響も受ける。
本明細書において使用される場合、「TLRシグナル伝達活性」という用語は、受容体によってリガンド結合の際に誘導されるTLRの1つまたは複数のシグナル伝達活性を意味する。TLRシグナル伝達は、少なくとも2つの異なる経路を介して発生する:炎症性サイトカインの産生をもたらすMyD88依存性経路、ならびにIFN-βの刺激および樹状細胞の成熟に関連しているMyD88非依存性経路。MyD88依存性経路は、すべてのTLRに共通である。微生物抗原によって活性化されると、TLRは、リン酸化によってIRAK-1を活性化するそのTIRドメインを介してMyD88動員を誘導する。次いで、IRAK-1はMyD88-TLR複合体を離れ、一時的にTRAF6と結合する。この結合により、下流のシグナル伝達が誘発されて、NF-κBの活性化がもたらされ、その結果として、TNF-α、IL-1、およびIL-12などの炎症誘発性サイトカインの産生が誘導される。したがって、TLRの活性は、経路中の媒介物の活性に感受性の受容体、または、例えば、TLRシグナル伝達によって活性化されるNF-kBもしくはAP-1に応答性の受容体を非限定的に含む、任意のこのような下流のシグナル伝達活性の測定によって測定することができる。
1つの態様において、ワクチン組成物は、抗原およびアジュバントとしてTIM-3活性を上昇させる作用物質を含み、かつ、例えば、非核酸アジュバント、核酸アジュバント、非核酸粘膜アジュバント、または免疫刺激アジュバントを含む1種または複数種の付加的なアジュバントをさらに含む。
「核酸アジュバント」とは、核酸またはその類似体であるアジュバントである。例には、2001年2月27日に発行された米国特許第6,194,388号、2001年3月27日に発行された米国特許第6,207,646号、および2001年5月29日に発行された米国特許第6,239,116号で説明されているように、CpGジヌクレオチドを含むもののような免疫賦活性核酸分子が含まれる。
「非核酸アジュバント」とは、体液性免疫応答および/または細胞性免疫応答を刺激できる、免疫賦活性核酸以外の任意の分子または化合物である。非核酸アジュバントには、例えば、持続効果をもたらすアジュバント、免疫刺激アジュバント、持続効果をもたらし、かつ免疫系を刺激するアジュバント、および粘膜アジュバントが含まれる。
免疫刺激アジュバントとは、免疫系の細胞の活性化を引き起こすアジュバントである。例えば、これは、免疫細胞にサイトカインを産生および分泌させ得る。このクラスのアジュバントには、Q.サポナリア(saponaria)樹木の樹皮から精製したサポニン、例えばQS21(HPLC分画によって21番目のピークで溶出する糖脂質;Antigenics, Inc., Waltham, MA);ポリ[ジ(カルボキシラトフェノキシ)ホスファゼン(PCPPポリマー、Virus Research Institute, USA);リポ多糖の誘導体、例えば、モノホスホリルリピドA(MPL; Ribi ImmunoChem Research, Inc., Hamilton, MT)、ムラミルジペプチド(MDP;Ribi)、およびスレオニル-ムラミルジペプチド(t-MDP;Ribi);OM-174(リピドAに関連したグルコサミン二糖類;OM Pharma SA, Meyrin, Switzerland);ならびにリーシュマニア(Leishmania)伸長因子(精製したリーシュマニアタンパク質;Corixa Corporation, Seattle, WA)が含まれるがそれらに限定されるわけではない。
非核酸粘膜アジュバントとは、抗原と共に粘膜表面に投与された場合に対象において粘膜免疫応答を誘導することができる、免疫賦活性核酸以外のアジュバントである。粘膜アジュバントには、細菌毒素:例えば、コレラ毒素(CT)、非限定的にCT Bサブユニット(CTB)(Wu et al., 1998, Tochikubo et al., 1998);CTD53(Val〜Asp)(Fontana et al., 1995);CTK97(Val〜Lys)(Fontana et al., 1995);CTK104(Tyr〜Lys)(Fontana et al., 1995);CTD53/K63(Val〜Asp、Ser〜Lys)(Fontana et al., 1995);CTH54(Arg〜His)(Fontana et al., 1995);CTN107(His〜Asn)(Fontana et al., 1995);CTE114(Ser〜Glu)(Fontana et al., 1995);CTE112K(Glu〜Lys)(Yamamoto et al., 1997a);CTS61F(Ser〜Phe)(Yamamoto et al., 1997a, 1997b);CTS106(Pro〜Lys)(Douce et al., 1997, Fontana et al., 1995);およびCTK63(Ser〜Lys)(Douce et al., 1997, Fontana et al., 1995)を含むCT誘導体、閉鎖帯毒素、zot、大腸菌(Escherichia coli)易熱性エンテロトキシン、不安定毒素(LT)、非限定的にLT Bサブユニット(LTB)(Verweij et al., 1998);LT7K (Arg〜Lys)(Komase et al., 1998, Douce et al., 1995);LT61F(Ser〜Phe)(Komase et al., 1998);LT112K(Glu〜Lys)(Komase et al., 1998);LT118E(Gly〜Glu)(Komase et al., 1998);LT146E(Arg〜Glu)(Komase et al., 1998);LT192G(Arg〜Gly)(Komase et al., 1998);LTK63(Ser〜Lys)(Marchetti et al., 1998, Douce et al., 1997, 1998, Di Tommaso et al., 1996);およびLTR72(Ala〜Arg)(Giuliani et al., 1998)を含むLT誘導体、PT-9K/129G(Roberts et al., 1995, Cropley et al., 1995)を含む百日咳毒素、PT.(Lycke et al., 1992, Spangler BD, 1992, FreytagおよびClemments, 1999, Roberts et al., 1995, Wilson et al., 1995);毒素誘導体(下記を参照されたい)(Holmgren et al., 1993, Verweij et al., 1998, Rappuoli et al., 1995, FreytagおよびClements、1999);リピドA誘導体(例えば、モノホスホリルリピドA、MPL)(Sasaki et al., 1998, Vancott et al., 1998;ムラミルジペプチド(MDP)誘導体(Fukushima et al., 1996, Ogawa et al., 1989, Michalek et al., 1983, Morisaki et al., 1983);細菌の外膜タンパク質(例えば、ボレリア・ブルグドルフェリ(Borrelia burgdorferi)の細胞表層タンパク質A(OspA)リポタンパク質、髄膜炎菌の外膜タンパク質)(Marinaro et al., 1999, Van de Verg et al., 1996);水中油型エマルジョン(例えば、MF59)(Barchfield et al., 1999, Verschoor et al., 1999, O'Hagan, 1998);アルミニウム塩(Isaka et al., 1998, 1999);およびサポニン(例えばQS21)、Aquila Biopharmaceuticals, Inc., Worcester, MA)(Sasaki et al., 1998, MacNeal et al., 1998)、ISCOMS、MF-59(Span85およびTween80で安定化させた水中スクアレンエマルジョン;Chiron Corporation、Emeryville、CA);モンタニド(Montanide)アジュバントのSeppic ISAシリーズ(例えば、Montanide ISA 720; AirLiquide, Paris, France);PROVAX(安定化界面活性剤およびミセル形成剤を含む水中油型エマルジョン;IDEC Pharmaceuticals Corporation, San Diego, CA);Syntextアジュバント製剤(SAF; Syntex Chemicals, Inc., Boulder, CO);ポリ[ジ(カルボキシラトフェノキシ)ホスファゼン(PCPPポリマー;Virus Research Institute, USA)、ならびにリーシュマニア(Leishmania)伸長因子(Corixa Corporation, Seattle, WA)が含まれるがそれらに限定されるわけではない。
本発明の1つの局面は、TIM-3活性を上昇させる作用物質を用いて、疾患に罹患しているか、もしくは罹患するリスクがある対象および/または免疫抑制の状態にある対象を治療するための方法に関する。例えば、対象は、感染症に罹患しているか、または発症するリスクがあってよい。別の実施例において、対象は、癌に罹患しているか、または発症するリスクがあってよい。別の実施例において、対象は、遺伝的状態、放射線治療、化学療法、または慢性感染症のような感染症などに起因する免疫系抑制の状態にあってよいか、または免疫系抑制を示すリスクがあってよい。CD4細胞数が異常に低い対象は、免疫が抑制された対象の一例である。一般に、正常な範囲内にある機能的CD4+-T細胞の数は、様々な哺乳動物種に関して公知である。ヒト血液において、例えば、正常な範囲にあるとみなされる機能的CD4+-T細胞の数は、約600個〜約1500個のCD4+-T細胞/mm3(血液)である。CD4+-T細胞の数が正常範囲より下、例えば約600個/mm3未満である個体は、「CD4+欠損」とみなしてよい。
シクロスポリンのような免疫抑制薬物または分裂中の造血細胞に影響を及ぼす高用量の化学療法化合物のいずれかを用いて、骨髄系、リンパ系、または全身の免疫抑制状態に対象を曝露させることができる。また、免疫抑制は、全身照射または骨髄移植前の移植前処置などの治療様式の結果としても生じ得る。特にヒト免疫不全ウイルス (HIV)による感染の場合のようなウイルス感染もまた、個体の免疫を抑制し得る。いくつかの態様において、対象は、前述の条件に曝露されていない者、および曝露されると予想されていない者である。他の態様において、本発明は、(例えば、1つまたは複数の前述の条件への曝露によって)骨髄抑制されるか、または免疫抑制された可能性がある対象を治療することを目標とする。
したがって、本発明は、いくつかの態様において、免疫無防備状態である個体の、および他の態様において、免疫無防備状態ではない個体の治療を含む。免疫無防備状態ではない対象は、正常な範囲の血液細胞数を有する者である。免疫無防備状態である対象は、正常な範囲未満の血液細胞数を有する者である。血球数の正常範囲は、医療担当者に公知であり、そのような計数値に関する標準的な血液学教科書を参照することができる。さらに、公開されているPCT出願PCT/US00/14505を参照することもできる。
前述したように、対象は、感染症に罹患しているか、または発症するリスクがあってよい。したがって、本発明の作用物質を用いて、細菌感染症、ウイルス感染症、真菌感染症、寄生虫感染症、およびマイコバクテリア(myobacterial)感染症などの感染症を予防または治療することができる。また、開示するワクチン組成物を予防的に用いて、例えば、インフルエンザの季節、流行病、および病原体曝露のリスクが高い場所への旅行を含むリスクが増大した期間中の感染症の発生を予防するか、または発生率を減少させることができる。ワクチン組成物はまた、対象に病原体への受動的曝露の準備をさせることができる。また、ワクチン組成物は、1種または複数種の従来の薬物療法に対して耐性であるか、または耐性になった感染症に罹患している対象を治療するためにも使用され得る。
本発明の方法において使用され得る、感染症に関連した抗原には、細菌全体、ウイルス全体、真菌全体、寄生虫全体、それらの断片、それらの溶解物、それらを死滅させた種類などが含まれる。TIM-3活性化作用物質は、ヒト対象用であるか非ヒト対象用であるかを問わず、現在使用されているか、または開発中の様々なワクチンと組み合わせて使用することができる。ヒト対象用であり、かつ感染症を対象とするワクチンの例には、ジフテリアトキソイドと破傷風トキソイドを組み合わせたワクチン;百日咳全菌体ワクチン;不活化インフルエンザワクチン;23価肺炎球菌ワクチン;麻疹生ワクチン;おたふくかぜ生ワクチン;風疹生ワクチン;カルメット・ゲラン杆菌(Bacille Calmette-Guerin)(BCG)結核ワクチン;A型肝炎ワクチン;B型肝炎ワクチン;C型肝炎ワクチン;狂犬病ワクチン(例えば、ヒト二倍体細胞ワクチン);不活化ポリオワクチン;髄膜炎菌多糖体ワクチン;四価髄膜炎菌ワクチン;黄熱病ウイルス生ワクチン;腸チフス死滅化全菌体ワクチン;コレラワクチン;B型日本脳炎死滅化ウイルスワクチン;アデノウイルスワクチン;サイトメガロウイルスワクチン;ロタウイルスワクチン;水痘ワクチン;炭疽ワクチン;天然痘ワクチンが含まれる。
細菌感染症の例には、大腸菌、連鎖球菌(Streptococcal)感染症、ブドウ球菌(Staphylococcal)感染症、シュードモナス(Pseudomonas)感染症、クロストリジウム・ジフィシル(Clostridium difficile)、レジオネラ(Legionella)感染症、肺炎球菌感染症、ヘモフィルス(Haemophilus)感染症(例えば、インフルエンザ菌(Haemophilus influenzae)感染症)、クレブシエラ(Klebsiella)感染症、エンテロバクター(Enterobacter)感染症、シトロバクター(Citrobacter)感染症、ナイセリア感染症(例えば、髄膜炎菌(N. meningitidis)感染症、淋菌(N. gonorrhoeae)感染症)、赤痢菌(Shigella)感染症、サルモネラ(Salmonella)感染症、リステリア(Listeria)感染症(例えば、L.モノサイトゲネス(monocytogenes)感染症)、パスツレラ(Pasteurella)感染症(例えば、パスツレラ・マルトシダ(Pasteurella multocida)感染症)、ストレプトバチルス(Streptobacillus)感染症、スピリルム(Spirillum)感染症、トレポネーマ(Treponema)感染症(例えば、梅毒トレポネーマ(Treponema pallidum)感染症)、アクチノマイセス(Actinomyces)感染症(例えば、アクチノマイセス・イスラエリイ(Actinomyces israelli)感染症)、ボレリア(Borrelia)感染症、コリネバクテリウム(Corynebacterium)感染症、ノカルジア(Nocardia)感染症、ガードネレラ(Gardnerella)感染症(例えば、ガードネレラ・バギナリス(Gardnerella vaginalis)感染症)、カンピロバクター(Campylobacter)感染症(例えば、カンピロバクター・フィタス(Campylobacter fetus)感染症)、スピロヘータ(Spirochaeta)感染症、プロテウス(Proteus)感染症、バクテロイデス感染症、H.ピロリ(pylori)、および炭疽菌が含まれる。
ウイルス感染症の例には、HIV感染症、単純ヘルペス(Herpes simplex)ウイルス1型および2型感染症(脳炎型、新生児型、および性器型を含む)、ヒトパピローマウイルス感染症、サイトメガロウイルス感染症、エプスタイン・バー(Epstein Barr)ウイルス感染症、A型、B型、およびC型肝炎ウイルス感染症、ロタウイルス感染症、アデノウイルス感染症、A型インフルエンザウイルス感染症、呼吸器合胞体ウイルス感染症、水痘帯状疱疹ウイルス感染症、天然痘感染症、サル痘感染症、ならびにSARS感染症が含まれる。いくつかの態様において、これらの方法は、HIV感染症を治療または予防すること意図していない。
真菌感染症の例には、カンジダ症感染症、白癬、ヒストプラスマ症感染症、ブラストミセス症感染症、パラコクシジオイデス症感染症、クリプトコックス症(crytococcosis)感染症、アスペルギルス症感染症、黒色真菌症感染症、菌腫感染症、シュードアレシェリア症感染症、およびでん風感染症が含まれる。
寄生虫感染症の例には、原虫感染症と線虫感染症の両方が含まれる。これらには、アメーバ症、クルーズ・トリパノソーマ(Trypanosoma cruzi)感染症(すなわちシャガス病)、肝てつ症(例えば、肝てつ(Facioloa hepatica)感染症)、リーシュマニア症、プラスモディウム(Plasmodium)感染症(例えば、マラリアを引き起こすプラスモディウム種による感染症、例えば、熱帯熱マラリア原虫(P. falciparum)、二日熱マラリア原虫(P. knowlesi)、四日熱マラリア原虫(P. malariae))、オンコセルカ症、肺吸虫症、トリパノソーマ・ブルセイ(Trypanosoma brucei)感染症(すなわち睡眠病)、ニューモシスチス感染症(例えば、ニューモシスチス・カリニ(Pneumocystis carinii)感染症)、膣トリコモナス(Trichomonas vaginalis)感染症、条虫(Taenia)感染症、膜様条虫(Hymenolepsis)感染症(例えば、小型条虫(Hymenolepsis nana)感染症)、エキノコックス(Echinococcus)感染症、住血吸虫症(例えば、マンソン住血吸虫(Schistosoma mansoni)感染症)、神経嚢虫症、アメリカ鉤虫(Necator americanus)感染症、およびヒト鞭虫(Trichuris trichuria)感染症が含まれる。
本発明の方法に従って治療できる他の感染症には、クラミジア(Chlamydia)感染症、結核およびハンセン病などのマイコバクテリア感染症、ならびにリケッチア(Rickettsiae)が含まれる。感染症の前述のリストは、包括的であることを意図せず、もっと正確に言えば例示的である。当業者は、本発明の方法を用いた予防および治療が適用できる他の感染症を特定すると考えられる。
感染症に罹患している対象は、感染症の症状(例えば、急速な発症、発熱、悪寒、筋肉痛、羞明、咽頭炎、急性リンパ節症、脾腫、胃腸の不調、白血球増加、または白血球減少)を提示し、かつ、感染性病原体またはそれらの副産物が体内で検出され得る者である。感染症を診断するための試験は当技術分野において公知であり、通常の医療担当者は、これらの実験室試験に精通していると考えられ、これらには、顕微鏡的解析、培養に依存する試験(例えば、培養物)、および核酸検出試験が含まれるがそれらに限定されるわけではない。これらには、湿式マウント、染色で改善した顕微鏡観察、免疫顕微鏡観察(例えばFISH)、ハイブリダイゼーション顕微鏡観察、粒子凝集、酵素結合免疫吸着剤アッセイ法、尿スクリーニング試験、DNAプローブハイブリダイゼーション、血清学的試験などが含まれる。医療担当者はまた、一般に、上記に挙げた実験室試験を実行する他に、全病歴を取得し、完全な理学的検査も実施する。
感染症を発症するリスクがある対象は、感染性病原体に曝露されるリスクがある者である。このような対象には、そのような病原体が存在することが公知であり、そのような感染症が一般的である地域で生活している者が含まれる。また、これらの対象には、針の共有、保護されていない性的行為への関与、対象の感染試料との定期的接触(例えば医療担当者)など高リスクの活動に関与する者、非限定的に腹部手術を含む外科手術を受けた人なども含まれる。
本発明の作用物質はまた、ヒトパピローマウイルス(HPV)感染症の治療に必要とされる。HPVの現行の療法は、病変へのIFN注射および/または外科的アブレーションである。本発明の作用物質に対して構想されるもののような全身的治療は、現行の臨床的療法と比べて望ましいと思われる。本発明の作用物質は、HPVウイルス様粒子(VLP)ベースのワクチン(例えば、Virology 2000 Jan 20;266(2):237-45を参照されたい)のような現在開発中のHPVワクチンと組み合わせても同様に有用である。
したがって、感染症の治療に関する態様において、本明細書において提供されるこれらの治療およびワクチン組成物は、抗微生物剤をさらに含んでよい。抗微生物物質の例には、抗細菌物質、抗マイコバクテリア物質、抗ウイルス物質、抗真菌物質、および抗寄生虫物質が含まれる。
抗細菌物質の例には、β-ラクタム抗生物質、ペニシリン(天然ペニシリン、アミノペニシリン、ペニシリナーゼ耐性ペニシリン、カルボキシペニシリン、ウレイドペニシリンなど)、セファロスポリン(第1世代、第2世代、および第3世代セファロスポリン)、および他のβ-ラクタム(イミペネム、モノバクタムなど)、β-ラクタマーゼ阻害物質、バンコマイシン、アミノグリコシド、およびスペクチノマイシン、テトラサイクリン、クロラムフェニコール、エリスロマイシン、リンコマイシン、クリンダマイシン、リファンピン、メトロニダゾール、ポリミキシン、スルホンアミドおよびトリメトプリム、ならびにキノリンが含まれる。
抗マイコバクテリア物質には、ミヤンブトール(Myambutol)(塩酸エタンブトール)、ダプソン(Dapsone)(4,4'-ジアミノジフェニルスルホン)、ペイサー(Paser)顆粒剤(アミノサリチル酸顆粒)、プリフチン(Priftin)(リファペンチン)、ピラジナミド、イソニアジド、リファディン(Rifadin)(リファンピン(Rifampin))、リファディン(Rifadin) IV、リファメート(Rifamate)(リファンピンおよびイソニアジド)、リファター(Rifater)(リファンピン、イソニアジド、およびピラジナミド)、硫酸ストレプトマイシン、ならびにトレカーター-SC(Trecator-SC)(エチオナミド)が含まれる。
抗ウイルス物質には、アマンチジンおよびリマンタジン、リバビリン、アシクロビル、ビダラビン、トリフルオロチミジン、ガンシクロビル、ジドブジン、レチノビル(retinovir)、ならびにインターフェロンが含まれる。抗ウイルス物質には、以下のものがさらに含まれる:アセマンナン;アシクロビル;アシクロビルナトリウム;アデホビル;アロブジン;アルビルセプトスドトックス(Alvircept sudotox);塩酸アマンタジン;アラノチン;アリルドン;メシル酸アテビルジン;アブリジン;シドフォビル;シパムフィリン;塩酸シタラビン;メシル酸デラビルジン;デスシクロビル;ジダノシン;ジソキサリル;エドクスジン;エンビラデン;エンビロキシム;ファムシクロビル;塩酸ファモチン;フィアシタビン(Fiacitabine);フィアルリジン(Fialuridine);ホサリラート(Fosarilate);ホスカルネットナトリウム;ホスホネットナトリウム;ガンシクロビル;ガンシクロビルナトリウム;イドクスウリジン;ケトキサール;ラミブジン;ロブカビル(Lobucavir);塩酸メモチン;メチサゾン;ネビラピン;ペンシクロビル;ピロダビル;リバビリン;塩酸リマンタジン;メシル酸サキナビル;塩酸ソマンタジン;ソリブジン;スタトロン(Statolon);スタブジン;塩酸チロロン;トリフルリジン;塩酸バラシクロビル;ビダラビン;ビダラビンリン酸;ビダラビンリン酸ナトリウム;ビロキシム;ザルシタビン;ジドブジン;ジンビロキシム、ならびにインテグラーゼ阻害物質。
抗真菌物質には、イミダゾールおよびトリアゾール、ポリエンマクロライド抗生物質、グリセオフルビン、アムホテリシンB、ならびにフルシトシンが含まれる。抗寄生虫物質には、重金属、抗マラリアキノリン、葉酸アンタゴニスト、ニトロイミダゾール、ベンゾイミダゾール、アベルメクチン、プラジカンテル、オルニチンデカルボキシラーゼ阻害物質、フェノール(例えば、ビチオノール、ニクロサミド);合成アルカロイド(例えば、デヒドロエメチン);ピペラジン(例えば、ジエチルカルバマジン);アセトアニリド(例えば、ジロキサニドフロナート(furonate));ハロゲン化キノリン(例えば、ヨードキノール(ジヨードヒドロキシキン));ニトロフラン(例えば、ニフルチモクス);ジアミジン(例えば、ペンタミジン);テトラヒドロピリミジン(例えば、パモ酸ピランテル);硫酸化ナフチルアミン(例えば、スラミン)が含まれる。
他の抗感染物質には、塩酸ジフロキサシン;ラウリルイソキノリニウムブロミド;モキサラクタム二ナトリウム;オルニダゾール;ペンチソマイシン(Pentisomicin);塩酸サラフロキサシン;HIVおよび他のレトロウイルスのプロテアーゼ阻害物質;HIVおよび他のレトロウイルスのインテグラーゼ阻害物質;セファクロル(Ceclor);アシクロビル(Zovirax);ノルフロキサシン(Noroxin);セフォキシチン(Mefoxin);セフロキシムアキセチル(Ceftin);シプロフロキサシン(Cipro);塩酸アミナクリン;塩化ベンゼトニウム:ビチオノラートナトリウム;ブロムクロレノン;過酸化カルバミド;塩化セタルコニウム;塩化セチルピリジニウム:塩酸クロルヘキシジン;クリオキノール;臭化ドミフェン;フェンチクロル;塩化フルダゾニウム;フクシン、塩基性;フラゾリドン;ゲンチアナバイオレット;ハルキノール;ヘキサクロロフェン:過酸化水素;イクタモール;イミデシル(Imidecyl)ヨウ素;ヨウ素;イソプロピルアルコール;酢酸マフェニド;メラレインナトリウム;メルクフェノールクロリド;水銀、アンモニア化;メチル塩化ベンゼトニウム;ニトロフラゾン;ニトロメルソール;塩酸オクテニジン;オキシクロロセン;オキシクロロセンナトリウム;パラクロロフェノール、ショウノウで処理;過マンガン酸カリウム;ポビドン-ヨウ素;塩化セパゾニウム;硝酸銀;スルファジアジン、銀;シムクロセン;チメルホナートナトリウム;チメロサール:トロクロセンカリウムが含まれる。
ワクチン組成物はまた、癌に罹患しているか、または癌を発症するリスクがある対象を治療するために使用される。本発明は、免疫原性である癌を治療するために使用される。免疫原性である癌は、それらの表面に、または細胞死の際に免疫原を発現することが公知である(または発現する可能性が高い)癌である。これらの免疫原は、癌抗原のインビボの内因性供給源であり、それらの放出は、癌を治療するために本発明の方法によって活用され得る。いくつかの態様において、ワクチン組成物は、本明細書において先に開示した癌抗原を含む。癌の治療に関係する態様において、本明細書において提供されるこれらの方法およびワクチン組成物は、本明細書において先に開示したものを含む抗癌剤をさらに含んでよい。
本発明はまた、樹状細胞ワクチンを含む他の形態の免疫療法を増強しようとする。これらのワクチンは、一般に、腫瘍関連抗原のような抗原をエクスビボで負荷された樹状細胞を含む。樹状細胞を抗原と共にインキュベートし、それによって、抗原プロセシングおよび細胞表面での発現を可能にさせてよいか、またはこれらの細胞を単純に抗原と組み合わせ、その後にインビボに注射してもよい。あるいは、樹状細胞をインビトロで活性化し、次いで、活性化した状態で対象中に再注入してもよい。
本出願は、これらの態様すべてにおいて樹状細胞と組み合わせることができるワクチン組成物をさらに提供する。樹状細胞ベースのワクチンの例には、自己腫瘍抗原をパルスした樹状細胞(進行した婦人科の悪性腫瘍);前立腺癌抗原をエクスビボで負荷した血液由来樹状細胞(Provenge; Dendreon Corporation);多発性骨髄腫および他のB細胞悪性腫瘍の抗原をエクスビボで負荷した血液由来樹状細胞(Mylovenge; Dendreon Corporation);ならびにHER-2/neu癌原遺伝子を発現する癌の抗原をエクスビボで負荷した血液由来樹状細胞(APC8024; Dendreon Corporation);ならびに異種抗原(例えばPAP)を負荷した樹状細胞などが含まれる。
TIM-3活性を上昇させる作用物質を、1種または複数種の付加的な作用物質を用いた併用療法において使用して、腫瘍抗原、ウイルス抗原、または細菌抗原に対する免疫応答を増強することができる。例えば、樹状細胞が抗原をプロセシングし、エフェクターT細胞に対して抗原を提示する能力を増強するCD40結合タンパク質を、TIM-3活性を上昇させる作用物質と組み合わせて投与して、免疫応答を劇的に増強することができる。このような免疫応答には、感染症の原因であるウイルス抗原または細菌抗原に対する応答、および腫瘍抗原に対する免疫応答が含まれ得る。TIM-3活性を上昇させる作用物質との併用療法において有用である代表的なCD40結合タンパク質には、PCT公報WO93/08207およびWO96/40918に記載されているCD40-LおよびCD40と免疫反応性である抗体が含まれる。
さらに、4-1BB-Lおよび4-1BBと反応性の抗体(両方とも、T細胞同時活性化因子である)を、TIM-3活性を上昇させる作用物質と組み合わせて投与して、免疫応答を劇的に増強することができる。4-1BB-Lおよび4-1BBと反応性の抗体を併用療法で使用して、感染症の原因であるウイルス抗原および細菌抗原に対する免疫応答を増強すること、ならびに腫瘍抗原に対する免疫応答を増強することができる。4-1BB-Lおよび4-1BBと反応性の抗体は、米国特許第5,674,704号に記載されている。
さらに、インターフェロンα、RANKL、またはCD30リガンドアンタゴニストを、TIM-3活性を上昇させる作用物質と組み合わせて投与して、免疫応答を劇的に増強することもできる。
免疫応答は、サイトカインもしくはケモカイン(BuelerおよびMulligan、1996; Chow et al.,1997; Geissler et al.,1997; Iwasaki et al.,1997; Kim et al.,1997)またはB-7共刺激分子(Iwasaki et al.,1997; Tsuji et al.,1997)によって誘導するか、または増大させることができる。サイトカインおよび/もしくはケモカインは、直接投与することができるか、またはサイトカインがインビボで発現され得るように、サイトカインをコードする核酸ベクターの形態で投与することができる。1つの態様において、サイトカインまたはケモカインは、プラスミド発現ベクターの形態で投与される。「サイトカイン」という用語は、ナノモル〜ピコモル濃度で体液性調節因子として作用し、かつ、正常な条件または病理学的条件下のいずれかで、個々の細胞および組織の機能的活性を調整する可溶性タンパク質およびペプチドの様々なグループに対する一般的名称として使用されている。これらのタンパク質はまた、細胞間の相互作用を直接媒介し、かつ細胞外環境で起こるプロセスを調節する。サイトカインはまた、T細胞応答を指示する際に中心となる。
サイトカインの例には、IL-1、IL-2、IL-4、IL-5、IL-6、IL-7、IL-10、IL-12、IL-15、IL-18、顆粒球マクロファージコロニー刺激因子(GM-CSF)、顆粒球コロニー刺激因子(G-CSF)、インターフェロン-γ(IFN-γ)、IFN-α、腫瘍壊死因子(TNF)、TGF-β、FLT-3リガンド、およびCD40リガンドが含まれるがそれらに限定されるわけではない。いくつかの態様において、サイトカインはTh1サイトカインである。さらに別の態様において、サイトカインはTh2サイトカインである。
「ケモカイン」という用語は、先天性免疫および適応免疫の両方の走化性(chemoattract)エフェクター細胞に主として作用するペプチドまたはポリペプチドに対する一般的名称として使用されている。ケモカインは、腫瘍または感染病原体が存在する解剖学的部位で好中球、マクロファージ、好酸球、ならびにTリンパ球およびBリンパ球を濃縮することによって、腫瘍および感染病原体に対抗する免疫学的防御を調整すると考えられている。さらに、多くのケモカインが、エフェクター細胞を活性化することが公知であり、その結果、それらの免疫機能(例えば、腫瘍細胞の細胞溶解)が細胞当たりベースで増強される。これらのポリペプチドのアミノ末端部分で保存されている最初の2つのシステイン残基の位置によって、2つのグループのケモカインが区別されている。これらの残基は隣接しているか、または1つのアミノ酸で隔てられていてよく、それによって、それぞれCCサイトカインおよびCXC サイトカインと定義される。各ケモカインの活性は、特定のエフェクター細胞に限られており、この特異性は、ケモカインとエフェクター細胞によって発現される特異的な細胞膜受容体とのコグネイト相互作用に起因する。例えば、CXCケモカインであるIL-8、Groα/β、およびENA78は、好中球上で特異的に作用するのに対し、CCケモカインであるRANTES、MIP-1α、およびMCP-3は、単球および活性化T細胞上で作用する。さらに、CXC ケモカインのIP-10は、活性化T細胞に対する化学誘引物質であるだけでなく、腫瘍に対する抗血管新生活性も有すると思われる。MIP-1αはまた、報告によれば、造血性前駆体に対する作用も有する。
本発明による有用な増殖因子には、エリスロポエチン(米国特許第4,703,008号)およびその類似体、ジペプチジルペプチダーゼ阻害物質、血小板由来増殖因子(PDGF)(米国特許第4,766,073号)、血小板由来内皮細胞増殖因子(PD-ECGF)(米国特許第5,227,302号)、ヒト脳下垂体成長ホルモン(HGH)(米国特許第3,853,833号)、形質転換増殖因子β(TGFβ)(米国特許第5,168,051号)、形質転換増殖因子α(TGFα)(米国特許第5,633,147号)、ケラチノサイト増殖因子(KGF)(米国特許第5,731,170号)、インスリン様増殖因子I(IGF-I)(米国特許第4,963,665号)、上皮増殖因子(EGF)(米国特許第5,096,825号)、エリスロポエチン(EPO)、顆粒球マクロファージコロニー刺激因子(GM-CSF)(米国特許第5,200,327号)、M-CSF(米国特許第5,171,675号)、コロニー刺激因子-1(CSF-1)(米国特許第4,847,201号)、スチール因子(Steel factor)、カルシトニン、AP-1タンパク質(米国特許第5,238,839号)、脳由来神経栄養因子(BDNF)(米国特許第5,229,500号)が含まれる。上記に引用した参照文献はすべて、その全体が参照により本明細書に組み入れられる。
本発明によるTIM-3活性を上昇させる作用物質と組み合わせて使用され得る他の分子には、IL-2、IL-12、IL-15、TRAIL、Fasリガンド、VEGFアンタゴニスト、Tekアンタゴニスト、樹状細胞の機能、生存、または増殖を促進する分子、T細胞の活性化または分化を促進する分子、様々なケモカインを含む樹状細胞遊走を促進する分子、アポトーシス因子のような標的細胞抗原の有効性を高める分子、ならびに様々なインターフェロンを含むMHCクラスI提示を促進する分子、血管新生阻害物質、IL-10、VEGF、およびTGF-βを含む腫瘍によって放出される免疫抑制分子の阻害物質、ならびに毒素標識抗体または放射性標識抗体を含む腫瘍特異的抗体が含まれる。
患者内に既に存在する抗原に対する免疫応答を刺激することに加えて、免疫化するために患者に抗原を投与する前、同時、または後に、TIM-3活性を上昇させる作用物質を投与してよい。さらに、免疫化するために患者に抗原を投与する前、同時、または後に、TIM-3活性を上昇させる作用物質を、付加的な活性化合物と組み合わせてワクチンアジュバントとして投与して、腫瘍抗原、ウイルス抗原、または細菌抗原に対する免疫応答を増強することができる。例えば、樹状細胞がT細胞に対して抗原を提示する能力を増強するCD40結合タンパク質、例えばCD40-LおよびCD40に対する抗体を、TIM-3活性を上昇させる作用物質と組み合わせて投与して、免疫応答を劇的に増強することができる。同様に、4-1BB-L、4-1BBと反応性の抗体、インターフェロンα、RANKL、またはCD30リガンドアンタゴニストを、TIM-3活性を上昇させる作用物質と組み合わせて投与して、免疫応答を増強し、かつ抗原に対するより効果的な免疫化を提供することができる。
ヒトにインビボ投与する場合、TIM-3活性を上昇させる作用物質は、薬学的に有用な組成物を調製するために使用される公知の方法に従って製剤化することができる。TIM-3活性を上昇させる作用物質は、薬学的に適切な希釈剤(例えば、Tris-HCl、酢酸、リン酸)、保存剤(例えば、チメロサール、ベンジルアルコール、パラベン)、乳化剤、可溶化剤、アジュバントおよび/もしくは担体と共に、唯一の活性材料として、または他の公知の活性材料(例えば、CD40-LもしくはCD40と反応性の抗体などのCD40結合タンパク質、4-1BB-Lもしくは4-1BBと反応性の抗体、インターフェロンα、RANKL、CD30リガンドアンタゴニスト)と混合して組み合わせることができる。適切な担体およびそれらの製剤は、Remington's Pharmaceutical Sciences、第16版、1980, Mack Publishing Coに記載されている。さらに、このような組成物は、ポリエチレングリコール(PEG)、金属イオンと複合体を形成させるか、もしくはポリ酢酸、ポリグリコール酸、ヒドロゲルなどのポリマー化合物中に組み入れるか、またはリポソーム、マイクロエマルジョン、ミセル、単層膜もしくは多重膜の小胞、赤血球影、もしくはスフェロブラスト(spheroblast)中に組み入れた、TIM-3活性を上昇させる作用物質を含んでよい。このような組成物は、TIM-3活性を上昇させる作用物質の物理的状態、溶解度、安定性、インビボでの放出速度、およびインビボでのクリアランス速度に影響すると考えられる。
TIM-3活性を上昇させる作用物質は、局所的に、非経口的に、または吸入によって投与することができる。「非経口」という用語は、皮下注射、静脈内注射、筋肉内注射、槽内注射、または輸注技術を含む。典型的には、これらの組成物は、単独で、または有効量の他の任意の活性材料、例えば前述のものと組み合わせて、TIM-3活性を上昇させる有効量の作用物質を含む。組成物中に含まれるTIM-3活性を上昇させる作用物質および活性な化合物(例えば、CD40-Lおよび/または4-1BB-L、4-1BBと反応性の抗体、インターフェロンα、RANKL、CD30リガンドアンタゴニスト)の有効量、または投薬量、および所望の濃度は、意図される用途、患者の体重および年齢、ならびに投与経路を含む多くの因子に応じて変動し得る。予備用量は、動物試験によって決定することができ、かつヒト投与のための投薬量の調整は、技術分野で容認されている通例に従って実施することができる。上記の説明に留意すると、TIM-3活性を上昇させる作用物質の典型的な投薬量は、平方メートル当たり約10μg〜平方メートル当たり約1000μgの範囲でよい。好ましい用量範囲は、平方メートル当たり約100μg〜平方メートル当たり約300μg程度である。
VIII. 製剤
本明細書において説明する治療物質は、薬学的組成物に製剤化することができる。本発明に従って使用するための薬学的組成物は、1種または複数種の生理学的に許容される担体または賦形剤を用いて従来の様式で製剤化することができる。したがって、これらの化合物ならびにそれらの生理学的に許容される塩および溶媒和物は、例えば、エアロゾル、静脈内経路、経口経路、または局所経路によって投与するために製剤化することができる。投与は、病巣内注射、腹腔内注射、皮下注射、筋肉内注射、または静脈注射;輸注;リポソームを介した送達; 局所的送達、くも膜下腔内送達、歯肉ポケット送達、経直腸的送達、気管支内送達、鼻送達、経粘膜送達、腸送達、経口送達、眼送達、または耳送達を含んでよい。
本発明の例示的な組成物は、許容される賦形剤を任意で含むリポソーム系のような送達系と混合されたRNAiを含む。好ましい態様において、組成物は、注射用に製剤化される。
技術および製剤は、一般に、Remmington's Pharmaceutical Sciences, Meade Publishing Co., Easton, PAにおいて確認することができる。全身投与の場合、筋肉内、静脈内、腹腔内、および皮下を含む注射が好ましい。注射の場合、本発明の作用物質は、液状溶液、好ましくはハンクス溶液またはリンガー溶液などの生理学的に適合する緩衝液中で製剤化され得る。さらに、作用物質は、固形形態で製剤化し、かつ、使用直前に再溶解または懸濁させてもよい。凍結乾燥させた形態もまた、含まれる。
経口投与の場合、薬学的組成物は、結合剤(例えば、アルファ化トウモロコシデンプン、ポリビニルピロリドン、もしくはヒドロキシプロピルメチルセルロース);増量剤(例えば、ラクトース、微結晶性セルロース、もしくはリン酸水素カルシウム);滑沢剤(例えば、ステアリン酸マグネシウム、タルク、もしくはシリカ);崩壊剤(例えば、バレイショデンプンもしくはグリコール酸デンプンナトリウム);または湿潤剤(例えばラウリル硫酸ナトリウム)などの薬学的に許容される賦形剤を用いて従来手段によって調製された、例えば、錠剤またはカプセル剤の形態をとってよい。錠剤は、当技術分野において周知の方法によって、コーティングされてもよい。経口投与用の液体製剤は、例えば、液剤、シロップ剤、もしくは懸濁剤の形態をとってよく、または、それらは、使用前に水もしくは他の適切なビヒクルを用いて構成するための乾燥製品として提供されてもよい。このような液体製剤は、薬学的に許容される添加剤、例えば、懸濁化剤(例えば、ソルビトールシロップ、セルロース誘導体、または食用硬化脂);乳化剤(例えば、レシチンまたはアラビアゴム);非水系ビヒクル(例えば、アーモンド油、油状エステル、エチルアルコール、または分別された植物油);および保存剤(例えば、メチル-p-ヒドロキシベンゾアートもしくはプロピル-p-ヒドロキシベンゾアートまたはソルビン酸)を用いて従来手段によって調製することができる。また、製剤は、緩衝塩、矯味剤、着色剤、および甘味剤も適宜含んでよい。
経口投与用の製剤は、活性化合物の制御放出を与えるように適切に製剤化することができる。口腔内投与の場合、組成物は、従来の様式で製剤化された錠剤またはロゼンジの形態をとってよい。吸入によって投与する場合、本発明に従って使用するための作用物質は、適切な噴射剤、例えば、ジクロロジフルオロメタン、トリクロロフルオロメタン、ジクロロテトラフルオルエタン、二酸化炭素、または他の適切な気体を用いて、加圧パックまたはネブライザーから、エアロゾルスプレー授与の形態で便宜的に送達される。加圧したエアロゾルの場合、投薬単位は、計量された量を送達するバルブを提供することによって決定することができる。化合物の粉末混合物およびラクトースまたはデンプンなどの適切な粉末基剤を含む、吸入器または吹入器において使用するための、例えばゼラチンからなるカプセル剤およびカートリッジが製剤化され得る。
化合物は、注射、例えば、ボーラス注射または持続輸注による非経口投与用に製剤化することができる。注射用の製剤は、単位剤形で、例えば、アンプル中または多回投与用容器中で、保存剤を加えて提供することができる。組成物は、油性または水性のビヒクル中の懸濁剤、液剤、または乳剤などの形態をとってよく、かつ、製剤化剤(formulatory agent)、例えば、懸濁化剤、安定化剤、および/または分散剤を含んでよい。あるいは、活性成分は、使用前に適切なビヒクル、例えば、滅菌済みパイロジェンフリー水を用いて構成するための粉末形態でもよい。
化合物は、例えば、ココアバターまたは他のグリセリドなど従来の坐剤基剤を含む、坐剤または停留浣腸などの直腸用組成物に製剤化することもできる。
先に説明した製剤に加えて、これらの化合物はまた、デポ製剤として製剤化することもできる。このような長時間作用性の製剤は、埋め込みによって(例えば、皮下もしくは筋肉内)、または、筋肉内注射によって投与することができる。したがって、例えば、化合物は、適切なポリマー材料もしくは疎水性材料(例えば、許容される油中の乳剤として)またはイオン交換樹脂と共に、または、難溶性誘導体、例えば、難溶性塩として、製剤化することができる。
全身投与はまた、経粘膜手段または経皮手段によることもできる。経粘膜投与または経皮投与の場合、浸透すべきバリアに対して適切な浸透剤が製剤中で使用される。このような浸透剤は一般に当技術分野において公知であり、例えば、経粘膜投与の場合は胆汁酸塩およびフシジン酸誘導体が含まれ、さらに、浸透を促進するために界面活性剤を使用してもよい。経粘膜投与は、点鼻用スプレー剤によるか、または坐剤を用いてよい。局所投与の場合、当技術分野において一般に公知である軟膏剤、膏薬、ゲル剤、またはクリーム剤に本発明のオリゴマーを製剤化する。洗浄液剤を局所的に用いて、損傷または炎症を治療して、治癒を速めることができる。
組成物は、所望の場合は、活性成分を含む1つまたは複数の単位剤形を含むことができる容器またはディスペンサー器具中で提供することができる。この容器は、例えば、ブリスターパックのような金属ホイルまたはプラスチックホイルを含んでよい。容器またはディスペンサー器具には、投与用の取扱い説明書を添付してよい。
核酸の投与を含む療法の場合、全身投与および局所投与または局所的投与を含む様々な投与様式用に本発明のオリゴマーを製剤化することができる。技術および製剤は、一般に、Remmington's Pharmaceutical Sciences, Meade Publishing Co., Easton, PAにおいて確認することができる。全身投与の場合、筋肉内注射、静脈内注射、腹腔内注射、結節内注射、および皮下注射を含む注射が好ましい。本発明のオリゴマーは、液状溶液、好ましくはハンクス溶液またはリンガー溶液などの生理学的に適合する緩衝液中で製剤化され得る。さらに、オリゴマーは、固形形態で製剤化し、かつ、使用直前に再溶解または懸濁させてもよい。凍結乾燥させた形態もまた、含まれる。
全身投与はまた、経粘膜手段もしくは経皮手段によることができ、または化合物を経口投与することもできる。経粘膜投与または経皮投与の場合、浸透すべきバリアに対して適切な浸透剤が製剤中で使用される。このような浸透剤は一般に当技術分野において公知であり、例えば、経粘膜投与の場合は胆汁酸塩およびフシジン酸誘導体が含まれる。さらに、界面活性剤を使用して浸透を促進してもよい。経粘膜投与は、点鼻用スプレー剤によるか、または坐剤を用いてよい。経口投与の場合、カプセル剤、錠剤、およびトニック剤(tonic)など従来の経口投与形態にオリゴマーを製剤化する。局所投与の場合、当技術分野において一般に公知である軟膏剤、膏薬、ゲル剤、またはクリーム剤に本発明のオリゴマーを製剤化する。
本発明の作用物質および組成物の毒性および治療的有効性は、例えば、LD50(集団の50%に対して致死的な用量)およびED50(集団の50%において治療的に有効な用量)を決定するための、細胞培養物または実験動物における標準的な薬学的手順によって決定することができる。毒性作用と治療的効果の用量比が治療指数であり、比LD50/ED50として表すことができる。高い治療指数を示す化合物が好ましい。毒性の副作用を示す化合物を使用してもよいが、感染していない細胞に対する潜在的なダメージを最小限に抑え、それによって、副作用を軽減するために、このような化合物を患部組織の部位に標的化する送達系を設計するように配慮すべきである。
ヒトにおいて使用するための投薬量範囲を公式化する際に、細胞培養アッセイ法および動物試験から得られたデータを使用することができる。このような化合物の投薬量は、ED50を含み、毒性がほとんどまたは全く無い、循環濃度の範囲内にあることが好ましい。投薬量は、使用される剤形および利用される投与経路に応じて、この範囲内で変動してよい。本発明の方法において使用される任意の化合物の場合、治療的有効量は、細胞培養アッセイ法から最初に概算することができる。用量は、細胞培養において決定されるIC50(すなわち、症状の最大半減抑制を達成する試験化合物の濃度)を含む循環血漿中濃度範囲を実現するように、動物モデルにおいて公式化することができる。このような情報を用いて、ヒトにおいて有用な用量をより正確に決定することができる。血漿中のレベルは、例えば、高速液体クロマトグラフィーによって測定することができる。
本発明の特定の局面に関する投薬量範囲は、上記に別に考察する。ある特定の用途に関して何らかの疑問がある場合は、その用途に関して挙げた投薬量範囲が当然優先される。しかしながら、他の用途または適用の場合、投薬量は、一般に、約0.001〜100,000μg/kg(対象の体重)の範囲であると考えられる。
本明細書において説明する方法の1つの態様において、作用物質は、少なくとも1日に1回投与される。1つの態様において、作用物質は毎日投与される。1つの態様において、作用物質は1日おきに投与される。1つの態様において、作用物質は、6〜8日毎に投与される。1つの態様において、作用物質は毎週投与される。
対象に投与するための化合物および/または作用物質の量に関しては、当業者は適切な量の決定の仕方を知っているはずである。本明細書において使用される場合、用量または量は、障害を抑制するか、障害を治療するか、対象を治療するか、または対象が障害に罹患するのを防ぐのに十分な量のものである。この量は、有効量とみなすことができる。一般に、1つまたは複数の症状または疾患もしくは障害のマーカーが、統計学的に有意な量だけ減少する場合、治療は「有効」である。疾患または障害のマーカーには、例えば、治療される個体から採取された生物試料中で分析することができるマーカーが含まれ、例えば、タンパク質、核酸、代謝産物、抗原、サイトカイン、炭水化物、脂質、または疾患もしくは障害の状況の指標として測定できる他の任意の実体を包含する。また、いくつかの場合において、マーカーの増加が治療的有効性を示し得ることも企図される。このような場合、そのようなマーカーの統計学的に有意な増加は、有効な治療の証拠である。当業者は、単純な滴定実験を実施して、対象を治療するのにどれだけの量が必要とされるかを決定することができる。本発明の組成物の用量は、対象および使用される個々の投与経路に応じて変動する。組成物に基づいて、例えば連続的ポンプによって連続的に、または定期的な間隔で、用量を送達することができる。例えば、1回または複数回の別々の機会に送達する。特定の組成物を複数回投与する望ましい時間間隔は、当業者が過度に実験をすることなく決定することができる。
有効量は、とりわけ、化合物のサイズ、化合物の生分解性、化合物の生物活性、および化合物の生物学的利用能に基づくか、またはそれらの影響を受け得る。化合物が迅速に分解せず、生物が利用可能であり、かつ高度に活性である場合、有効となるために必要とされる量はより少量である。有効量は当業者に公知であり、これはまた、化合物の形態、化合物のサイズ、および化合物の生物活性にも依存すると考えられる。当業者は、実験に基づいた活性試験を化合物に対してルーチン的に実施して、バイオアッセイ法における生物活性を決定し、したがって、有効量を決定することができる。上記の方法の1つの態様において、化合物の有効量は、約1.0ng/kg〜約100mg/kg(対象の体重)を含む。上記の方法の別の態様において、化合物の有効量は、約100ng/kg〜約50mg/kg(対象の体重)を含む。上記の方法の別の態様において、化合物の有効量は、約1μg/kg〜約10mg/kg(対象の体重)を含む。上記の方法の別の態様において、化合物の有効量は、約100μg/kg〜約1mg/kg(対象の体重)を含む。
化合物、組成物、および/または作用物質をいつ投与すべきかに関して、当業者は、そのような化合物および/または作用物質をいつ投与すべきか決定することができる。投与は、特定の期間、常時でもよく、または定期的かつ特定の間隔でもよい。化合物は、(例えば、持続放出形態で)毎時、毎日、毎週、毎月、毎年、または一回限りの送達として送達してよい。送達は、一定期間に渡る連続的送達、例えば静脈内送達でよい。本明細書において説明する方法の1つの態様において、作用物質は、少なくとも1日に1回投与される。本明細書において説明する方法の1つの態様において、作用物質は、毎日投与される。本明細書において説明する方法の1つの態様において、作用物質は、1日おきに投与される。本明細書において説明する方法の1つの態様において、作用物質は、6〜8日毎に投与される。本明細書において説明する方法の1つの態様において、作用物質は、毎週投与される。
ポリペプチドを含む作用物質を対象に投与する本明細書において説明する方法のいくつかの態様において、ポリペプチドは、そのようなポリペプチドをコードする遺伝子を投与することによって対象に投与される。治療的ポリペプチド(例えば、野生型または変異体のTIM-3 IgVドメインを含むポリペプチド)の発現構築物は、任意の生物学的に有効な担体、例えば、組換え融合遺伝子によってインビボで細胞を効果的にトランスフェクトすることができる任意の製剤または組成物中で投与することができる。アプローチは、組換えレトロウイルス、アデノウイルス、アデノ随伴ウイルス、および単純ヘルペスウイルス-1を含むウイルスベクター、または組換え細菌プラスミドもしくは組換え真核生物プラスミド中への本融合遺伝子の挿入を含む。ウイルスベクターは、細胞を直接トランスフェクトするために使用することができる。プラスミドDNAは、遺伝子構築物の直接注射またはインビボで実施されるCaPO4沈殿に加えて、例えば、カチオン性リポソーム(リポフェクチン)もしくは誘導体化した(例えば、抗体を結合させた)ポリリジン結合体、グラミシジンS、人工ウイルスエンベロープ、または他のこのような細胞内運搬体の助けを借りて送達することができる。適切な標的細胞の形質導入は、遺伝子療法において決定的に重要な最初の段階に相当するため、個々の遺伝子送達系の選択は、意図される標的の表現型および投与経路、例えば局所的または全身的などの因子に依存する。さらに、例えば、ウイルスベクター中に含まれるcDNAによってウイルスベクター内でコードされる分子は、ウイルスベクター核酸を取り込んだ細胞において効率的に発現される。
レトロウイルスベクターおよびアデノ随伴ウイルスベクターは、一般に、特にヒト中にインビボで外来性遺伝子を移入するために最適な組換え遺伝子送達系であると理解されている。これらのベクターは、細胞中への遺伝子の効率的な送達を提供し、移入された核酸は、宿主の染色体DNA中に安定に組み込まれる。レトロウイルスを使用するための主な必要条件は、特に、細胞集団中に野生型ウイルスが伝播する可能性に関して、それらの使用の安全性を確保することである。複製欠損レトロウイルスのみを産生する特殊化した細胞株(「パッケージング細胞」と呼ばれる)の開発により、遺伝子療法に対するレトロウイルスの有用性が増した。欠損レトロウイルスは、遺伝子療法を目的とする遺伝子移入において使用するために十分に特徴付けられている(総説については、Miller, A.D. (1990) Blood 76:271を参照されたい)。したがって、レトロウイルスコード配列の一部分(gag、pol、env)がCKIポリペプチドをコードする核酸によって置換されて、レトロウイルス複製が欠損した状態になった組換えレトロウイルスを構築することができる。次いで、標準技術によりヘルパーウイルスを用いて、標的細胞を感染させるために使用できるビリオン中に、複製欠損レトロウイルスをパッケージングする。組換えレトロウイルスを作製し、インビトロまたはインビボでそのようなウイルスに細胞を感染させるためのプロトコールは、Current Protocols in Molecular Biology, Ausubel, F.M. et al. (編) Greene Publishing Associates, (1989), Sections 9.10-9.14および他の標準的な実験室マニュアルにおいて見出すことができる。適切なレトロウイルスの例には、当業者には周知であるpLJ、pZIP、pWE、およびpEMが含まれる。エコトロピックなレトロウイルス系およびアンホトロピックなレトロウイルス系の両方を調製するのに適したパッケージングウイルス株の例には、ΨCrip、ΨCre、Ψ2、およびΨAmが含まれる。レトロウイルスは、インビトロおよび/またはインビボで、神経細胞、上皮細胞、内皮細胞、リンパ球、筋芽細胞、肝細胞、骨髄細胞を含む多くの異なる細胞型中に様々な遺伝子を導入するために使用されている(例えば、Eglitis, et al. (1985) Science 230:1395-1; DanosおよびMulligan (1988) Proc.Natl. Acad. Sci. USA 85:6460- 6464; Wilson et al. (1988) Proc.Natl. Acad. Sci. USA 85:3014-3018; Armentano et al. (1990) Proc. Natl. Acad. Sci. USA 87:6141-6145; Huber et al. (1991) Proc. Natl. Acad. Sci. USA 88:8039-8043; Ferry et al. (1991) Proc. Natl. Acad. Sci. USA 88:8377-8381; Chowdhury et al. (1991) Science 254:1802-1805; van Beusechem et al. (1992) Proc. Natl. Acad. Sci. USA 89:7640-7644; Kay et al. (1992) Human Gene Therapy 3:641-647; Dai et al. (1992) Proc. Natl. Acad. Sci. USA 89:10892-10895; Hwu et al. (1993) J.Immunol. 150:4104-4115;米国特許第4,868,116号;米国特許第4,980,286号;PCT出願WO89/07136;PCT出願WO89/02468;PCT出願WO89/05345;およびPCT出願WO92/07573を参照されたい)。
さらに、ウイルス粒子表面のウイルスパッケージングポリペプチドを改変することによって、レトロウイルス、およびその結果としてレトロウイルスベースのベクターの感染範囲を制限することが可能であることも示されている(例えば、PCT公報WO93/25234、WO94/06920、およびWO94/11524を参照されたい)。例えば、レトロウイルスベクターの感染範囲を改変するための戦略には次のものが含まれる:ウイルスのenvポリペプチドへの細胞表面抗原に特異的な抗体の結合(Roux et al. (1989) PNAS 86:9079-9083; Julan et al. (1992) J.Gen Virol 73:3251-3255;およびGoud et al. (1983) Virology 163:251-254);またはウイルスのenvポリペプチドへの細胞表面リガンドの結合(Neda et al. (1991) J Biol Chem 266:14143- 14146)。結合は、融合ポリペプチド(例えば、単鎖抗体/env融合ポリペプチド)の作製によるものだけでなく、ポリペプチドまたは他の種類(例えば、envポリペプチドをアシアロ糖ポリペプチドに変換するためのラクトース)との化学的架橋の形態でもよい。この技術は、特定の組織型に感染を限定するか、または別の方法で方向付けるのに有用であり、また、エコトロピックベクターをアンホトロピックベクターに変換するのにも使用され得る。
上記に例示したもののようなウイルス移入法の他に、ウイルスを用いない方法もまた、動物の組織中で本ポリペプチドの発現を引き起こすために使用することができる。遺伝子移入の大半の非ウイルス方法は、哺乳動物細胞が巨大分子の取込みおよび細胞内輸送のために使用する正常なメカニズムに依拠する。好ましい態様において、本発明の非ウイルス遺伝子送達系は、標的とされる細胞による遺伝子取込みのためのエンドサイトーシス経路に依拠する。このタイプの例示的な遺伝子送達系には、リポソームに由来する系、ポリリジン結合体、および人工ウイルスエンベロープが含まれる。
代表的な態様において、本ポリペプチドのうち1種をコードする遺伝子を、表面に正電荷を有し(例えば、リポフェクチン)、かつ(任意で)標的組織の細胞表面抗原に対する抗体でタグ化されているリポソーム中に閉じ込めることができる(Mizuno et al. (1992) No Shinkei Geka 20:547-551;PCT公報WO91/06309;日本特許出願第1047381号;および欧州特許広報EP-A-43075)。例えば、神経膠腫細胞のリポフェクションは、神経膠腫関連抗原に対するモノクローナル抗体でタグ化したリポソームを用いて実施することができる(Mizuno et al. (1992) Neurol. Med. Chir. 32:873- 876)。
臨床現場において、いくつかの方法のいずれか(各方法は当技術分野においてよく知られている)によって、患者に遺伝子送達系を導入することができる。例えば、遺伝子送達系の医薬製剤は、例えば静脈注射によって全身に導入することができ、標的細胞の特異的な形質導入は、遺伝子送達媒介物(vehicle)、その遺伝子の発現を制御する転写調節配列に起因する細胞型もしくは組織型の発現、またはその組合せによって提供されるトランスフェクションの特異性から主に生じる。他の態様において、組換え遺伝子の初期の送達はより制限されており、動物中への導入は非常に局所的である。例えば、遺伝子送達媒介物は、カテーテルにより(米国特許第5,328,470号を参照されたい)、または定位的注入(例えば、Chen et al. (1994) PNAS 91 : 3054-3057)により導入することができる。
本明細書において含まれる核酸配列およびアミノ酸配列の説明:
SEQ ID NO:1は、TIM-3ヒトポリペプチド(Genbankアクセッション番号NP_116171)である。
SEQ ID NO:2は、オランウータン由来の予測されるTIM-3ホモログ(Genbankアクセッション番号CAH92001)である。
SEQ ID NO:3は、ハツカネズミ由来の予測されるTIM-3ホモログ(Genbankアクセッション番号NP_599011)である。
SEQ ID NO:4は、ウシ由来の予測されるTIM-3ホモログ(Genbankアクセッション番号NP_001070573)である。
SEQ ID NO:5は、ガレクチン-9ヒトポリペプチド(Genbankアクセッション番号NP_033665)である。
SEQ ID NO:6は、TIM-3に対するアンチセンスオリゴヌクレオチドである。
本出願の任意の箇所で参照される任意の特許、特許出願、特許公報、または科学論文の内容は、その全体が参照により本明細書に組み入れられる。
本発明を以下に一般的に説明するが、以下の実施例を参照することによって、より容易に理解されるであろう。これらの実施例は、本発明の特定の局面および態様の例証のために含まれるにすぎず、本発明を限定することを意図せず、当業者が本明細書の上記の教示および以下の実施例から認識するように、例えば、他の細胞型、作用物質、構築物、またはデータ解析方法を、すべて非限定的に、特許請求の範囲に記載されている発明の範囲から逸脱することなく使用することができる。
実施例
方法
フローサイトメトリー
コラゲナーゼで処理した脾臓に由来する単細胞懸濁液を以下の抗体で染色した:抗CD11b、抗CD11c、抗TIM-3(EBioscience)およびラットIgG1アイソタイプ対照(BD Biosciences)。データはすべてFACSCalibur (BD Biosciences)を用いて集め、FlowJoソフトウェア(Tree Star)を用いて解析した。
リアルタイム定量的PCR
Trizol(Invitrogen)とそれに続くRNAクリーンアップおよびDNaseI消化(Qiagen)によって、選別した細胞集団から全RNAを調製した。次いで、RNAを逆転写してcDNAを得、Taqmanシステム(Applied Biosystems)を用いた定量的RT-PCRにおいて鋳型として使用した。完全長マウスTIM-3を検出するためのプライマーおよびプローブをムチンドメイン中に設計した。配列は次のとおりであった:プローブ、
、フォワードプライマー、
、リバースプライマー、
。GAPDHプライマーおよびGAPDHプローブはApplied Biosystems社から購入した。試料は、デュプリケートで実施した;内部のGAPDH対照と比べた発現として、データを表す。
インビトロでのT細胞分化
BD FACSAriaにおける細胞選別によって、野生型マウスまたはTIM3-/-DO11.10TCRトランスジェニックマウスのいずれかから、ナイーブな(CD4+CD62Lの高い)T細胞を単離した。ナイーブT細胞(1×106個)を、5×106個の放射線照射した脾臓APCおよびOVA323-339ペプチド(50μg/ml)と共に培養した。10日目に細胞を回収し、製造業者のプロトコール(BD Biosciences)に従った細胞質内サイトカイン染色によってサイトカイン産生を解析した。
樹状細胞刺激
CD11c磁性ビーズ(Miltenyi Biotech)を用いて、コラゲナーゼで消化した脾臓から樹状細胞を単離した。DC(3×105個/ウェル)およびD2SC1細胞(2.5×105個/ウェル)を、2μg/mlの組換えヒトガレクチン-9または1ng/mlのLPS(Sigma)で刺激した。抗TIM-3またはマウスIgG1で刺激するために、組織培養ウェルを25μg/mlのヤギ抗マウスIgG FC断片特異的抗体(Jackson Immunoresearch)で予めコーティングした。次いで、コーティングしたウェルに10μg/mlの抗TIM-3またはマウスIgG1を添加し、インキュベートした。未結合の抗体を洗い流した後、D2SC1細胞を添加した。18時間目に上清を採取し、細胞数測定ビーズアレイ(CBA)(BD Biosciences)によって、サイトカイン産生を評価した。NF-kBレポーターアッセイ法の場合、D2SC1樹状細胞株を6ウェルプレート中に3×105個の細胞/ウェルで播種し、Fugene 6 (Roche Applied Science)を製造業者の取扱い説明書に従って用いて、1μgのNF-κB-ルシフェラーゼレポータープラスミド構築物をトランスフェクトした。トランスフェクション後36時間目に、細胞を採取し、抗マウスIgG(Fcγ特異的、25μg/ml、Jackson Immunolaboratories)およびマウスIgG1(eBioscience)または抗TIM-3モノクローナル抗体5D12(10μg/ml)でコーティングしたプレート上に再び播種した。6時間後および24時間後に、細胞を溶解し、かつ、Luciferase Assay System (Promega)を製造業者の取扱い説明書に従って用いてルシフェラーゼ活性を分析した。ルシフェラーゼ活性を相対的単位で表示する。
免疫組織化学および免疫蛍光法
凍結した組織切片を5μmの厚さに切り、アセトン中で2分間固定した。HLA-DR、CD80、CD86、PD-L1に対する抗体(Dako社から入手可能)ならびにTIM-3およびガレクチン-9に対する抗体(GalPharma、Japan)を、様々な年齢の正常な脳の白質組織切片および灰白質組織切片と共に、最適濃度でインキュベートした。西洋ワサビペルオキシダーゼ(IHCの場合)または蛍光色素(IFの場合)と結合させた二次抗体を用いて、CD11b+ミクログリア上でのこれらの分子の発現を可視化した。
LCMおよび定量的RT-PCR
遺伝子発現の差を定量するために、正常な脳の白質領域および灰白質領域に由来するミクログリアまたは炎症を起こしたCNS組織試料に由来するミクログリアを、レーザー捕獲顕微解剖(LCM)によって単離した。凍結した組織試料に由来する切片(5μm)を抗CD11b mAbで染色して、ミクログリアを同定した。Pixcellシステム(Arcturus)を用いたレーザー捕獲によって、個々のミクログリア細胞を選択した(試料当たり約200個の細胞)。Absolutely RNA Nanoprep Kit (Stratagene)を用いて、LCMキャップからRNAを抽出した。逆転写によって相補的DNAを作製し、予備増幅段階に続いて、TIM-3およびガレクチン-9に対するプライマー/プローブを用いてTaqMan PCRを実施した。各遺伝子発現反応はデュプリケートで実施した。ハウスキーピング遺伝子であるβ-2ミクログロブリンおよびGAPDHと比較することによって、これらの遺伝子の相対的発現を算出した。TaqMan RT-PCRのために有効なプライマーおよびプローブは、ヒトTIM-3の解析を除いてApplied Biosystems Gene Expression Assaysから入手し (Khademi et al., 2004)、反応条件は、RNA UltraSense One-Step Quantitative RT-PCRキット(Invitrogen)のユーザー用マニュアルに従って最適化した。
TIM-3のTaqman解析のためのエクスビボでのヒトミクログリアのFACS単離
MS斑または腫瘍標本の単細胞懸濁液を1%ヒト血清を含むPBS(FACS緩衝液)中で洗浄し、遮光し、4℃で30分間、透析した(アジドを含まない)最適希釈率の抗体で染色した。CD11bおよびCD11cに対する抗体(BD Pharmingen) を用いて、CNS内のミクログリア/マクロファージ集団および樹状細胞集団をそれぞれ同定し、かつ区別した。次いで、細胞を洗浄し、緩衝液300μl中に再懸濁し、BD FACSAria (BD Biosciences)を用いて選別した。
エクスビボでのヒト単球の機能
磁性ビーズ(Miltenyi Biotech)を用いて、健常な対象の末梢血からネガティブ選択によってヒト単球を単離した。ブロッキングTIM-3抗体またはアイソタイプ対照の存在下、LPSを含まない段階的な用量の組換えヒトガレクチン-9で単球(2×105個/ウェル)を刺激して、特異性を実証した。48時間後にサイトカイン産生をELISAによって測定した。
EAEの誘導
結核菌(4mg/ml)を添加した完全フロイントアジュバント(CFA)、100μgの抗TIM-3(クローン5D12)、マウスIgG1(Ebioscience)いずれかを含む不完全フロイントアジュバント(IFA)、またはIFA単独中に乳化した100μgのPLP 139-151でSJLマウスを免疫化した。また、0日目および2日目に、百日咳毒素(List)100ngをマウスに静脈内投与した。インビボで使用した抗体はすべてLPSを含まなかった。マウスの疾患の発症を毎日モニターし、以下の尺度に従ってスコア化した:0、臨床徴候無し;1、尾部の緊張の低下;2、後肢衰弱;3、後肢麻痺;4、前肢麻痺;および5、瀕死または死亡。
マウスのミクログリアの解析
完全フロイントアジュバント(Difco)中に乳化した100μgのPLP139-151を用いた免疫化によって、SJL/JマウスにおいてEAEを誘導した。また、0日目および2日目に、百日咳毒素100ngを各マウスに静脈内投与した。疾患の異なる病期で、マウスを屠殺し、コラゲナーゼで消化したCNS組織(脳および脊髄)のパーコール勾配遠心分離によって、CNS単核細胞を得た。次いで、CD11b、CD45、TIM-3に対する抗体、またはRatIgG1アイソタイプ対照で細胞を染色し、BD FACSCaliburを用いて解析した。
実験シリーズ:樹状細胞におけるTIM-3発現
実施例1
マクロファージおよび骨髄系樹状細胞(DC)におけるTIM-3 mRNAおよびタンパク質の発現を検査した。マウスのマクロファージ(CD11b+CD11c-)はTIM-3を発現しなかったのに対し、ほぼすべてのCD11c+DCは、高レベルのTIM-3をエクスビボで直接発現した(図1A)。TIM-3-/-マウスに由来するCD11c+細胞において染色は観察されなかったため、DCにおけるTIM-3の染色は特異的であった。リンパ系DC(CD8+)、骨髄系DC(CD11b+)、および形質細胞様DC(B220+)におけるTIM-3発現もまた、検査した。すべてのサブセットにおいてTIM-3は同等に発現された。TIM-3は、未成熟な骨髄由来DCおよび成熟した骨髄由来DCにおいて同様のレベルで発現された。
実施例2
マクロファージおよび樹状細胞の両方の純粋な集団を細胞選別によって単離し、定量的RT-PCRによってTIM-3 mRNAを検査した。エクスビボで選別したCD4+T細胞、活性化したTh1 T細胞クローン、およびCHOのTIM-3トランスフェクタントに由来するmRNAを対照として使用した。フローサイトメトリーのデータと一致して、TIM-3 mRNAは、樹状細胞中では高レベルで存在し、マクロファージ中には不在であった(図1B)。
実施例3
健常な対象の末梢血から単離されたエクスビボのCD11b+単球およびCD11c+骨髄系DCにおけるヒトTIM-3の発現を同様に評価した(図1C)。マウスの場合のように、ヒトDCは、高レベルのTIM-3を発現した。興味深いことに、マウスのマクロファージとは違って、ヒト単球は、低レベルのTIM-3を構成的に発現した。したがって、TIM-3は、マウスとヒトの両方において、DCで構成的に高発現された。
実験シリーズ:APC上のTIM-3はTh1分化を促進する
実施例4
ナイーブなDO11.10 TCRトランスジェニックT細胞を、ペプチド抗原および野生型APCまたはTIM-3-/-APCのいずれかを用いて中性条件下で分化させた。驚くべきことに、DO11.10 TCRトランスジェニックT細胞は、TIM-3-/-APCによる刺激後、より少量のIFN-γならびにより多量のIL-4およびIL-10を産生した(図2A)。同様のTh表現型が、DO11.10 TCRトランスジェニックTIM-3-/-T細胞の並行(parallel)培養物において観察された(図2A)。TIM-3-/-APCを用いた場合のみ明らかであり、かつ野生型T細胞またはTIM-3-/-T細胞を用いた場合は同等であったため、Th2表現型への分化は、T細胞ではなくAPCにおけるTIM-3発現によって後押しされた(図2B)。
実験シリーズ:樹状細胞におけるTIM-3機能
実施例5
ガレクチン-9、LPS、またはガレクチン-9およびLPSに応答した野生型DCおよびTIM-3-/-DCからのサイトカイン産生を検査した。ガレクチン-9刺激単独に応答していくらかのTNF-α産生が観察されたが、産生は少なく、すべての実験で存在したわけではなかった。しかしながら、ガレクチン-9は一貫してLPSと相乗作用して、野生型DCにおいてLPS単独の場合よりもはるかに多いTNF-α産生を誘導し、この相乗効果は、Tim-3-/-DCにおいては弱かった(図3A)。TIM-3-/-DCは、同様にLPSに対しても弱い応答を一貫して示した(図3A)。実際、LPS、ならびにLPSおよびガレクチン-9に応答したTNF-α産生は、野生型DCにおけるTNF-α産生と比べて、TIM-3-/-DCにおいて約30〜40%弱まっていた。IL-6レベルおよびIL-10レベルもまた、測定した。IL-10の特異的な産生は観察されず、野生型DCとTIM-3-/-DCの間でIL-6産生の差はほとんど観察されなかった(データ不掲載)。
実施例6
TIM-3-/-マウスを免疫化し、TIM-3に特異的に結合し、かつTIM-3+ Th1 T細胞の増殖とIFN-γ分泌の両方を阻害した抗体をスクリーニングすることによって、アゴニスト抗TIM-3抗体を作製した。T細胞においてアゴニスト活性を示すものとして、1種の抗TIM-3抗体(クローン5D12)を同定した(データ不掲載)。
実施例7
DCにおけるTIM-3シグナル伝達と関連した分子事象のいくつかを検査するために、TIM-3を発現する樹状細胞株を使用した。D2SC1細胞株は、天然にTIM-3を発現する(データ不掲載)。エクスビボで単離したDCは、TIM-3連結に応答してTNF-αを産生した。NF-κBの誘導を検査した。これを実施するために、D2SC1細胞にNFκBレポーター構築物をトランスフェクトした。トランスフェクトした細胞をアゴニスト抗TIM-3抗体で刺激し、次いで、ルシフェラーゼ活性について分析した。アゴニスト抗TIM-3抗体によるこの細胞株の刺激がTNF2も誘導した(図3B)サイトカインデータと一致して、TIM-3が関与すると、NFκBが特異的に誘導される(図3B)。
実施例8
ヒト単球上に存在するTIM-3によってこの効果が媒介されるかどうかを検査した。実際、抗TIM-3抗体は、ヒト単球からのガレクチン-9を介したTNF-α分泌を75%阻害し得(図3C)、このことは、ガレクチン-9によってTIM-3を作働させることにより、DCからのTNF-α分泌が誘導されるという、マウスにおいて得られた観察結果をさらに裏付ける。
実験シリーズ:CNS中のヒトミクログリアにおけるTIM-3発現
実施例9
公知の炎症性疾患に罹患していない対象の剖検から得た15個の脳のCNSにおけるTIM-3発現を検査した。驚くべきことに、強いTIM-3染色が白質において観察されたが、組織学的にミクログリアであると思われた場所の灰白質実質では観察されなかった(図4A)。白質領域と灰白質領域におけるTIM-3発現のこの著しい差は、検査した対象15名すべてのCNS組織において観察された。TIM-3およびCD11bに対する抗体を用いた二重免疫蛍光染色により、CNS白質中のミクログリア上でのTIM-3発現が確認された(図4B)。炎症を起こしていないマウスCNS組織の免疫組織化学的染色により、灰白質組織ではなく白質組織におけるTIM-3の選択的発現が確認された(データ不掲載)。
実施例10
いくつかの骨髄細胞マーカーの染色は、白質組織と灰白質組織とで異なる。したがって、正常な白質組織および灰白質組織に由来するCD11b+ミクログリアのレーザー捕獲顕微解剖(LCM)および定量的RT-PCR解析を用いて、白質ミクログリアにおけるTIM-3の特異的かつ選択的発現を確認した。TIM-3抗体を用いた免疫組織化学的染色と一致して、灰白質組織から得たミクログリアにおいてTIM-3 mRNAはほとんどまたは全く検出されなかったのに対し、白質組織から得たミクログリアではTIM-3 mRNAが観察された(図4C)。
実施例11
他の細胞表面決定基がCNSミクログリアにおいて差次的に発現されるかどうかを判定するために、免疫組織化学的染色を用いて、HLAクラスIIならびに共刺激分子CD80、CD86、およびPDL1の発現を解析した。HLA-DRの免疫組織化学的染色により、白質および灰白質両方のミクログリアにおいて同程度の発現が明らかになったが(図4D)、白質ミクログリアにおいても灰白質ミクログリアにおいても、CD80、CD86、およびPDL1の発現はほとんどないか、または全くなかった(データ不掲載)。
実験シリーズ:ミクログリアにおけるTIM-3発現は、CNS炎症の性質によって異なる
実施例12
TIM-3発現が、増大した免疫応答に関連する自己免疫白質組織のCNSから単離したミクログリアにおいて増加するのに対し、弱まった応答に関連するCNS腫瘍から単離したミクログリアにおいて減少するかを検査した。すなわち、TIM-3発現を、MS組織標本および多形性神経膠芽細胞腫(GBM)脳腫瘍組織標本から捕獲したミクログリアにおいて比較した。リンパ球およびミクログリアは、両方のタイプの炎症を起こした組織に浸潤するが、サイトカインのプロファインはかなり異なり、Th1サイトカインIFN-γおよびTNF-αはMS組織浸潤物に付随するが、GBM組織浸潤物には付随しない。MS病変の活性な境界領域から捕獲したミクログリアは、MS病変の静止性の中心、正常に見える隣接した白質から捕獲したもの、または炎症を起こしていない対照の白質組織から得たものよりも高いレベルのTIM-3を発現した(図5A)。
実施例13
TIM-3発現は、対照組織またはMS組織から得たものと比べて、多形性神経膠芽細胞腫(GBM)組織から得たミクログリアにおいて有意に低かった。生存能力がある組織調製物から蛍光活性化細胞選別(FACS)によって単離したミクログリアの定量的RT-PCR解析によって、MS組織試料およびGBM組織試料から得たミクログリアにおけるTIM-3発現の差を確認した(図5B)。これらのデータから、ミクログリアにおけるTIM-3発現とTh1型CNS炎症の関連が実証される。
実施例14
ガレクチン-9が、MS病変中に存在する星状細胞において上方調節されるかどうかを検査した。実際、ガレクチン-9レベルは、正常なヒトCNS組織と比べて、MS病変中に存在する星状細胞において有意に上昇していた(図5C)。まとめると、これらのデータから、TIM-3とそのリガンドであるガレクチン-9の両方が、グリア細胞(それぞれミクログリアおよび星状細胞)において上方調節され、TNF-α分泌を誘導し得ることが実証される。さらに、これらから、白質ミクログリアにおけるTIM-3発現が、CNS内の先天性免疫が組織の炎症を感知する重要な手段であり得ることが示唆される。
ヒトおよびマウスの神経膠の腫瘍の解析では、腫瘍の全体および周囲に広く分布している多数の腫瘍浸潤ミクログリアが一貫して実証され(Badie et al., 2002, J. Neuroimmunol. 133: 39-45; Badie et al., 2000, Neurosurgery 46: 957-961; Deininger et al., 2001, J.Neuro-Oncology 55: 141-147; Morantz et al., 1979, J. Neurosurg. 50: 298-304; Roggendorf et al., 1996, Acta Neuropathol. 92: 288-293; Tran et al., 1998 J. Immunol. 161 : 3767-3775)、実際、多くの場合、ミクログリアは、腫瘍腫瘤の3分の1超を含む (Morimura et al., 1990; Badie et al., 2000、前記; Morantz, 1979、前記)。明らかになりつつあるデータから、腫瘍微環境に存在するミクログリアが機能的に障害されていることが示唆される(Flugel et al., 1999, Int. J. Dev. Neurosci. 17: 547-556; Schartner et al., 2005 Glia 51: 279-285; Tran et al., 1998、前記)。理論に拘束されることを望むものではないが、本発明の実験から、TIM-3/ガレクチン-9経路の抑制が、神経膠芽腫に浸潤するミクログリアの刺激能力および殺腫瘍能力を阻害するメカニズムであり得ることが示される。他のCNS疾患における炎症の中心的役割を考慮すれば、TIM-3/ガレクチン-9経路が、とりわけ、MSの炎症によりよく似ているもの、例えば、HIV関連認知症またはウイルス性脳炎を含む、他の疾患において重要であることが予想される。
実験シリーズ:マウスの単球/マクロファージおよびミクログリア上のTIM-3の解析
実施例15
炎症を起こしていないCNSにおいて灰白質ミクログリアではなく白質ミクログリアにおいてTIM-3が選択的に発現されることに関していくつかの有望な説明があり、血液からCNSの白質領域中へのTIM-3+単球の選択的遊走、またはミクログリアにおいてTIM-3発現をそれぞれ誘導もしくは抑制する、白質領域もしくは灰白質領域中に存在する因子が含まれる。これらの可能性を調査するために、本発明者らは、ナイーブな野生型マウスおよびTim-3欠損マウスの脾臓から単離したCD11b+マクロファージにおけるTim-3発現を検査した。ミクログリアと対照的に、末梢マクロファージは、Tim-3に関して一様に陰性であった。
ミエリンプロテオリピドタンパク質、PLP 139-151でマウスを免疫化して、実験的自己免疫性脳脊髄炎(EAE)、すなわちMSのマウスモデルを誘導し、疾患誘導後5日目に、末梢マクロファージにおけるTIM-3発現を解析した。活性化されたCD11b+細胞は、TIM-3発現を上方調節しなかった(図6A)。しかしながら、驚くべきことに、末梢からCNSに浸潤したCD11b+単球は、内在するミクログリアと異なりCD45をより高レベルで発現し(Ford, A. L. et. al., J Immunol 154, 4309-21 (1995)およびWilliams, K. et al., J Neuropathol Exp Neurol 51, 538-49 (1992))、TIM-3を発現した(図6B)。さらに、ミクログリアおよび浸潤単球の両方におけるTIM-3レベルは同程度であり、疾患の重症度と共に上昇し、臨床的疾患のピークの直前にピークに達した(図6C)。
末梢マクロファージはTim-3に関して一様に陰性であるが、CNS中に侵入するとTim-3に関して一様に陽性であるため、これらのデータから、CNS中に存在する因子が、内在する単球および浸潤単球においてTim-3発現を誘導し得ることが強く示唆される。実際、CNSの全体に渡るミクログリアの形態の異質性の原因は、微環境中の領域の差に対するこれらの細胞の感受性であり(Lawson et al., 1990)、これらのデータから、TIM-3発現が領域の差によって同様に調節されることが実証される。
灰白質は少し関与するものの、MSは主に、CNS白質における炎症の疾患である。抗原特異的な細胞は、主にCNS 白質内部の抗原を認識するため、MSは白質の疾患であると一般に想定されている。本発明者らは基本的にはこれが正しいと考えているが、本明細書において説明するデータは、さらなる選択肢を与える。理論に拘束されることを望むものではないが、ミエリン反応性Th1細胞はCNSの白質領域に侵入し、ミエリン抗原を認識することができ、そこで、それらはIFN-γを分泌して、星状細胞において高レベルのガレクチン-9を誘導する。次いで、反応性星状細胞におけるガレクチン-9の発現は、白質中のミクログリアおよび/または浸潤単球の表面のTIM-3と連動し、TNF-α分泌を誘導して、炎症および脱髄を促進するように働き得る。これは、この分野の主要な治療的観察と一致している。初期の再発/寛解型患者は免疫抑制に応答するが、二次性進行型疾患の患者は、T細胞によって媒介されない変性期にある場合があり、免疫療法に対して反応しない。この段階の疾患は、TIM-3:ガレクチン-9軸(axis)による、浸潤単球/ミクログリアの長期的活性化によって媒介され得る。実際、最近の証拠から、二次性進行型MSの初期の事象がCNSミクログリアの活性化であることが実際に示されている(Trapp et al., 2004)。さらに、最近のEAE研究により、疾患の発症におけるミクログリアの重要性が実証された(Heppner et al., 2005; Ponomarev et al., 2005)。
この調子で、多発性硬化症の再発/寛解期が主としてT細胞によって駆動されるプロセスであることに留意されたい。すなわち、再発/寛解型MSにおいて、不適切なT細胞活性化は、付随する炎症と共に、組織損傷の主な原因である。しかしながら、その後の疾患の二次性進行期では、病理はT細胞に主として起因するのではなく、むしろ、抗原提示細胞の不適切な活性に起因する。理論に拘束されることを望むものではないが、TIM-3はT細胞活性化の負の調節因子として働くが、APC活性化の正の調節因子として働くことに留意されたい。したがって、再発/寛解型 MSでは、TIM-3活性の阻害が治療的に役立つとは予想されず、むしろ、TIM-3の天然の阻害活性を抑制すると、過剰な炎症から保護する因子の除去によって疾患が悪化すると予想し得る。しかしながら、APC活性化が主な役割を果たし、TIM-3がAPC活性化を正の方向に調節する二次性進行型MSでは、TIM-3活性の阻害は、疾患の進行を阻害するために有効であると思われる。したがって、TIM-3が発現され、APC活性化を正の方向に調節することの発見により、TIM-3調節に基づいた治療が、MSの二次性進行期の者にのみ実施されるべきであることが示される。したがって、TIM-3阻害因子の投与を含む治療は、そのような投与の前に、治療される個体が疾患の二次性進行期にあるか判定することを含むべきである。通常の熟練した臨床医は、MSが再発/寛解期にあるか、または二次性進行期にあるかを判定することができる。患者の症状の履歴、寛解、および増悪の他に、病期を示す臨床マーカーおよびパラメーターは当業者に公知である。臨床マーカーから病期を決定できる方法の1つの例は、Jongen et al., 1997, J. Neurol. Neurosurg. Psychiatry 63: 446- 451によって説明されており、これは、例えば、アルブミンCSF:末梢血比率、単核細胞数、CD4+サブセット、CD8+サブセット、およびB1+サブセット、CD4+:CD8+比率、IgG、IgG指数、IgM、IgM指数、補体成分C3およびC4、ならびにC3指数およびC4指数、ミエリン塩基性タンパク質、神経細胞特異的エノラーゼ、S100および乳酸を含む、マーカーのパネルに関する脳脊髄液の評価を説明する。これらのパラメーターおよびマーカーの測定により、参照により本明細書に組み入れられるこの研究の著者らによって説明されているように、信頼性の高いMS病期診断が可能になる。
実験シリーズ:,アゴニスト抗TIM-3抗体のインビボでの影響
実施例16
マウスを免疫化して、実験的自己免疫性脳脊髄炎(EAE)を発症させた。これは、Th1細胞とTNF-αの両方が疾患の病因において非常に重要な役割を果たす中枢神経系(CNS)自己免疫の動物モデルである。アゴニスト抗TIM-3抗体またはアイソタイプ対照のいずれかを含む不完全フロイントアジュバント(IFA)中に乳化したPLP139-151を用いてマウスを免疫化した。アゴニスト抗TIM-3を含むIFAで免疫化したマウスの方が、IFAおよび対照抗体で免疫化したマウスよりも重度の疾患を発症した(図7A)。この観察結果は、先天性免疫系において、TIM-3はTh1免疫の発生を増強するが、その後、分化したTh1細胞において発現されると適応免疫に影響し得るという仮説が裏付ける。回帰曲線解析により、アゴニスト抗TIM-3モノクローナル抗体の存在下および対照抗体の存在下では、誘導される疾患の経過に著しく有意な差があることが示された(図7B)。
実施例17
量を漸増させたガレクチン-9の不在下および存在下で、エクスビボの単球を1μg/ml LPSで刺激した。単球は、量を漸増させたガレクチン-9の存在下で、より多量のTNF-αを分泌することが見出された(図9)。ブロッキング抗TIM-3抗体を添加すると、ガレクチン-9によって増えていたTNF-α分泌が抑制された(図9)。LPS刺激が無い場合、TNF-αは分泌されなかった。これらのデータから、APC(ヒトCD11b+単球、組換えガレクチン-9を使用)におけるTIM-3シグナル伝達の活性化とTLR4活性化(LPSを使用)の間の相乗作用が実証される。したがって、TLRアゴニストは、TIM-3活性化を伴う免疫応答を増強し得る。
他の態様
本明細書において引用する特許、特許出願、および公表された参考文献はすべて、その全体が参照により本明細書に組み入れられる。本発明は、その好ましい態様を参照して特に示し、説明したが、添付の特許請求の範囲によって包含される本発明の範囲から逸脱することなく、本発明において形態および詳細を様々に変更してよいことが、当業者には理解されるであろう。