発明の簡単な概要
一つの局面において、本発明は、患者試料中に存在がインフルエンザウイルスA型に感染していることを示すインフルエンザウイルスA型のNS1タンパク質が存在するかどうかを判定することによって、患者がインフルエンザウイルスA型に感染しているかどうかを識別するための方法を提供する。この判定する工程は、患者試料をインフルエンザウイルスA型タンパク質であるNS1に特異的に結合する作用物質と接触させる工程;およびこの作用物質とNS1タンパク質の特異的結合を検出する工程であって特異的結合がインフルエンザウイルスA型の存在を示す工程を含むことができる。または、あるいはさらに、判定する工程はNS1タンパク質のPDZリガンドモチーフ(PL)をコードするmRNAの存在を判定する工程、およびmRNAの存在からNS1タンパク質の存在を推測する工程を含み得る。好ましくは、PLは、Sがセリンであり、Tがスレオニンであり、Vがバリンであり、Iがイソロイシンであり、Lがロイシンであり、Xが任意のアミノ酸であるS/T-X-V/I/Lのモチーフを有する。好ましくは、この作用物質は少なくとも一つのPDZポリペプチドである。または、この作用物質は少なくとも一つの抗体であることができる。汎特異的抗体に関して、この抗体はNS1タンパク質の保存領域に特異的であり得る。好ましくは、接触させる工程は、患者試料をインフルエンザウイルスA型タンパク質であるNS1の異なるエピトープに特異的に結合する第1および第2の作用物質と接触させる工程であって、第1の作用物質が支持体上に固定される工程、ならびにウイルスの存在を示すために第1および第2の作用物質がNS1タンパク質に特異的に結合するサンドイッチを検出する検出工程を伴う。第1および第2の作用物質は第1および第2の抗体であり得るが、好ましくは第1の作用物質は一つまたは複数のPDZポリペプチドであり、第2の作用物質は一つまたは複数の抗体である。第1の作用物質は、一つまたは複数のPDZポリペプチドと一つまたは複数の抗体との混合物であってもよい。抗体はインフルエンザウイルスA型のNS1のすべての亜型に特異的な抗体であり得る。
一つまたは複数のPDZポリペプチドは次の一つまたは複数であり得る:外膜、PSD95(PDZ#2)、PSD95(PDZ#1、2、3)、DLG1(PDZ#1)、DLG1(PDZ#1、2)、DLG1(PDZ#2)、DLG2(PDZ#1)、DLG2(PDZ#2)、Magi3(PDZ#1)、PTN3(PDZ#1)、MAST2(PDZ#1)、NeDLG(PDZ#1、2)、Shank1 d1、Shank2 d1、Shank3 d1、シントロフィン1α、シントロフィンγ1、Magi1(PDZ#1)、Magi1(PDZ#4)、Tip1;PTPL1(PDZ#1)、Mint3(PDZ#1)、Lym Mystique(PDZ#1)、DLG2(PDZ#3)、MUPP1(PDZ#8)、NeDLG(PDZ#1)、DLG5(PDZ#1)、PSD95(PDZ#1)、NumBP(PDZ#3)、LIMK1(PDZ#1)、KIAA0313、DLG1(PDZ#2)、シンテニン(PDZ#2)、Pickl、MAST2、PTN3(PDZ#1)、NOS1(PDZ#1、2、3)、MINT1(PDZ#2)、ZO-1(PDZ#2)、NSP、およびRIM212。
患者試料は次のいずれかであってよい:血液、組織、鼻分泌物、肺浸出物、総排出腔試料、糞試料、咽頭スワブ、および唾液。好ましくは、患者はヒト、トリ、ブタ、ウマ、または哺乳動物である。PDZポリペプチドは、好ましくは、例えば配列番号:1に示されるPSD95 d2のPL結合領域などのPL結合領域(80〜100アミノ酸の領域)を含む。亜型特異的アッセイについて、PDZポリペプチドは好ましくはPSD95 d1、PSD95 d2、PSD95 d3、INADL8d1、Magi1 d1、DLG1d2、DLG1d3、NeDLG1d1、またはNeDLG1d2である。
さらなる局面において、本発明は、亜型特異的インフルエンザA型ウイルスタンパク質であるNS1 PDZリガンドモチーフ(PL)領域の存在を識別することによって、インフルエンザA型感染の診断および分類のための方法を提供する。好ましくは、PL領域は、Sがセリンであり、Tがスレオニンであり、Vがバリンであり、Iがイソロイシンであり、Lがロイシンであり、Xが任意のアミノ酸であるS/T-X-V/I/Lのモチーフを有する。
一つの局面において、本発明は、試験試料のアリコートを結合に適した条件下において少なくとも一つのPDZペプチドおよび少なくとも一つのPDZリガンド(PL)検出試薬と混合することによって試験試料中のPL領域を含むインフルエンザウイルスA型タンパク質の存在および量を検出するための方法;ならびにPDZペプチドおよびPL検出試薬の結合を測定するための方法であって結合の減少が試験試料中のインフルエンザウイルスA型タンパク質の存在を示す方法を提供する。好ましくは、インフルエンザウイルスA型タンパク質は、NP、HA、M1、またはNS1である。好ましくは、PL検出試薬は、NP、HA、M1、およびNS1からなる群より選択されるインフルエンザウイルスA型タンパク質のC末端からのPLモチーフを含む。好ましくは、PLモチーフは、Sがセリンであり、Tがスレオニンであり、Vがバリンであり、Iがイソロイシンであり、Lがロイシンであり、Xが任意のアミノ酸であるS/T-X-V/I/Lである。
一つのさらなる局面において、本発明は、患者に由来する鼻分泌物、痰試料、または咽頭スワブにインフルエンザウイルスA型のNS1タンパク質が存在するかどうかを判定する工程であって、存在が患者がインフルエンザウイルスA型に感染していることを示す工程によって、患者がインフルエンザウイルスA型に感染しているかどうかを識別するための方法を提供する。
一つの局面において、本発明は、試験試料のアリコートを少なくとも一つのPDZペプチドと混合することによって試験試料中のPL領域を含むインフルエンザウイルスA型タンパク質の存在および量を検出するための方法;ならびにPDZペプチドおよびPLインフルエンザウイルスA型タンパク質の結合を測定するための方法であって結合が試験試料中のインフルエンザウイルスA型タンパク質の存在を示す方法を提供する。
一つのさらなる局面において、本発明は、患者がインフルエンザAに感染しているかどうかを判定することによって患者がインフルエンザAの病原性株に感染しているかどうかを判定する方法;患者が感染している場合はさらに、患者試料におけるPLモチーフを有する非構造タンパク質の存在を判定する方法であって存在が患者がインフルエンザウイルスA型の病原性株に感染していることを示す方法を提供する。
一つの局面において、本発明は、患者試料を少なくとも一つのPDZポリペプチドまたはインフルエンザウイルスAの亜型に特異的なNS1タンパク質のPLモチーフと特異的に結合する少なくとも一つの捕捉抗体と接触させることによって患者試料におけるインフルエンザA型ウイルスの特異的亜型の存在を識別するための方法;およびPDZポリペプチドまたは捕捉抗体が試料中のPLモチーフに特異的に結合するかどうかを検出する方法であって特異的結合が亜型の存在を示す方法を提供する。好ましくは、接触させる工程は、患者試料をインフルエンザウイルスAの複数の亜型に特異的な複数のNS1タンパク質における複数のPLモチーフと特異的に結合する複数のPDZポリペプチドと接触させる工程を伴い、検出する工程はどのPDZポリペプチドがそのPLモチーフに特異的に結合するかを判定する工程であってそれによって一つまたは複数のPDZポリペプチドでの結合が亜型の存在を示す工程を伴う。好ましくは、捕捉抗体はNS1のカルボキシ末端を認識する。好ましくは、捕捉抗体またはPDZポリペプチドはPDZリガンドモチーフ(PL)の一つまたは複数を認識する:ESEV(配列番号:2)、ESEI(配列番号:3)、ESKV(配列番号:4)、TSEV(配列番号:5)、GSEV(配列番号:6)、RSEV(配列番号:7)、RSKV(配列番号:8)、GSEI(配列番号:9)、GSKV(配列番号:10)、NICI(配列番号:l 1)、TICI(配列番号:12)、RICI(配列番号:13)、DMAL(配列番号:14)、DMTL(配列番号:15)、DIAL(配列番号:16)、DLDY(配列番号:17)、SICL(配列番号:18)、SEV、SEI、SKV、および SKI。好ましくは、PDZポリペプチドは以下の少なくとも1つである:外膜、PSD95(PDZ#2)、PSD95(PDZ#1、2、3)、DLG1(PDZ#1)、DLG1(PDZ#1、2)、DLG1(PDZ#2)、DLG2(PDZ#1)、DLG2(PDZ#2)、Magi3(PDZ#1)、PTN3(PDZ#1)、MAST2(PDZ#1)、NeDLG(PDZ#1、2)、Shank1 d1、Shank2 d1、Shank3 d1、シントロフィン1α、シントロフィンγ1、Magi1(PDZ#1)、Magi1(PDZ#4)、Tip1;PTPL1(PDZ#1)、Mint3(PDZ#1)、Lym Mystique(PDZ#1)、DLG2(PDZ#3)、MUPP1(PDZ#8)、NeDLG(PDZ#1)、DLG5(PDZ#1)、PSD95(PDZ#1)、NumBP(PDZ#3)、LIMK1(PDZ#1)、KIAA0313、DLG1(PDZ#2)、シンテニン(PDZ#2)、Pickl、MAST2、PTN3(PDZ#1)、NOS1(PDZ#1、2、3)、MINT1(PDZ#2)、ZO-1(PDZ#2)、NSP、およびRIM2。患者試料は、鼻分泌物、痰試料、咽頭スワブ、総排出腔試料、糞試料、肺浸出物、または唾液であり得る。該方法が亜型を識別するために用いられる場合、亜型は好ましくはトリインフルエンザAであり、PLはPLモチーフESEV/I/A(配列番号:19)である。または、亜型はH3N2であり、PLはPLモチーフRSKV(配列番号:8)である。または、PLはPLモチーフESKV(配列番号:4)である。または、亜型はH1N1であり、PLはPLモチーフRSEV(配列番号:7)である。該方法は、試料を検出抗体と接触させる工程を含んでもよい。好ましくは、検出抗体はシグナル発生化合物を含み、PLのPDZへの結合または捕捉抗体のNS1への結合を阻害しない。
PDZポリペプチドまたは抗体は固体支持体上に固定化されてよい。固体支持体がキャピラリーフローアッセイ装置である場合、接触の工程はスティックを患者試料中に浸漬する工程を伴う。好ましくは、キャピラリーフローアッセイは免疫アッセイである。好ましくは、固体支持体はラテラルフローアッセイである。
一つの局面において、本発明は、患者試料中におけるインフルエンザウイルスAウイルスの識別および亜型分類のためのキットであって、固体支持体上の固定されたインフルエンザAウイルスNS1に特異的に結合する作用物質を持つキットを提供する。好ましくは、作用物質は抗体、PDZポリペプチド、オリゴヌクレオチドアプタマー、または混合物である。
さらなる局面において、本発明は、インフルエンザAウイルスによってコードされるタンパク質に特異的に結合する作用物質およびNS1タンパク質に特異的に結合する作用物質を含み、患者試料におけるインフルエンザAウイルスを識別または亜型分類するためのキットを提供する。好ましくは、NS1タンパク質に特異的に結合する作用物質はタンパク質上のPL領域に結合する。好ましくは、この作用物質は抗体、PDZポリペプチド、オリゴヌクレオチドアプタマー、または混合物である。好ましくは、インフルエンザAウイルスによってコードされるタンパク質はNS1である。
一つの局面において、本発明は、PLモチーフ部分以外でNS1に特異的に結合する作用物質およびPLモチーフにおいてNS1に特異的に結合する作用物質を含み、患者試料におけるインフルエンザAウイルスを識別または亜型分類するためのキットを提供する。
一つの局面において、本発明は、複数のインフルエンザAウイルスの複数のNS1タンパク質における複数のPLモチーフに特異的な複数のPDZポリペプチドを持つキットを提供する。
一つの局面において、本発明は、インフルエンザウイルスの非構造タンパク質であるPLを結合に適した条件下でPDZドメインを持つ候補ポリペプチドと接触させることによって、インフルエンザウイルスPDZリガンド(PL)に特異的に結合することができるPDZポリペプチドを識別するための方法;候補ポリペプチドに対するPLの特異的結合を検出するための方法;およびPLがPDZ結合部位に結合していることを確認するための方法を提供する。
一つの局面において、本発明は、インフルエンザウイルスA型のNS1タンパク質におけるカルボキシ末端モチーフに特異的に結合する単離された抗体を提供する。好ましくは、PLモチーフを持つカルボキシ末端モチーフは、ESEV(配列番号:2)、ESEI(配列番号:3)、ESKV(配列番号:4)、TSEV(配列番号:5)、GSEV(配列番号:6)、RSEV(配列番号:7)、RSKV(配列番号:8)、GSEI(配列番号:9)、GSKV(配列番号:10)、NICI(配列番号:11)、TICI(配列番号:12)、RICI(配列番号:13)、DMAL(配列番号:14)、DMTL(配列番号:15)、DIAL(配列番号:16)、DLDY(配列番号:17)、SICL(配列番号:18)、SEV、SEI、SKV、またはSKIである。好ましくは、抗体はモノクローナル抗体または抗体フラグメントである。好ましくは、PLモチーフはESEV/I/A(配列番号:19)である。
一つの局面において、本発明は、患者にウイルスのNS1タンパク質と細胞のPDZタンパク質の相互作用を阻害する作用物質の有効な投与計画を投与して、それによって感染の治療または予防を達成することによって、インフルエンザウイルスA型に感染しているまたは感染のリスクを有する患者の治療または予防のための方法を提供する。好ましくは、作用物質はインフルエンザウイルスA型のNS1タンパク質のPLモチーフに特異的に結合する抗体である。好ましくは、作用物質はアンチセンスオリゴヌクレオチド、小分子、siRNA、または亜鉛フィンガータンパク質であり、この作用物質はインフルエンザAのNS1タンパク質またはPDZタンパク質の発現を阻害する。好ましくはNS1のPLモチーフはESEV(配列番号:2)、ESEI(配列番号:3)、ESKV(配列番号:4)、TSEV(配列番号:5)、GSEV(配列番号:6)、RSEV(配列番号:7)、RSKV(配列番号:8)、GSEI(配列番号:9)、GSKV(配列番号:10)、NICI(配列番号:11)、TICI(配列番号:12)、RICI(配列番号:13)、DMAL(配列番号:14)、DMTL(配列番号:15)、DIAL(配列番号:16)、DLDY(配列番号:17)、SICL(配列番号:18)、SEV、SEI、SKV、またはSKIである。好ましくは、この作用物質はPDZポリペプチドであり、少なくとも配列番号:1のPLと相互作用する結合部位を含む。好ましくは、PDZポリペプチドは、外膜、PSD95(PDZ#2)、PSD95(PDZ#1、2、3)、DLG1(PDZ#1)、DLG1(PDZ#1、2)、DLG1(PDZ#2)、DLG2(PDZ#1)、DLG2(PDZ#2)、Magi3(PDZ#1)、PTN3(PDZ#1)、MAST2(PDZ#1)、NeDLG(PDZ#1、2)、Shank1 d1、Shank2 d1、Shank3 d1、シントロフィン1α、シントロフィンγ1、Magi1(PDZ#1)、Magi1(PDZ#4)、Tip1;PTPL1(PDZ#1)、Mint3(PDZ#1)、Lym Mystique(PDZ#1)、DLG2(PDZ#3)、MUPP1(PDZ#8)、NeDLG(PDZ#1)、DLG5(PDZ#1)、PSD95(PDZ#1)、NumBP(PDZ#3)、LIMK1(PDZ#1)、KIAA0313、DLG1(PDZ#2)、シンテニン(PDZ#2)、Pickl、MAST2、PTN3(PDZ#1)、NOS1(PDZ#1、2、3)、MINT1(PDZ#2)、ZO-1(PDZ#2)、NSP、およびRIM2の少なくとも一つである。
さらなる局面において、本発明は、試験化合物の存在下および非存在下においてPDZポリペプチドとインフルエンザウイルスPDZリガンド(PL)とを接触させて、試験化合物の存在下でのPDZ/PL結合の量を非存在下と比較することによって、抗ウイルス物質のスクリーニングのための方法を提供する。好ましくは、抗ウイルス物質はPDZ/PL結合を抑制し、該方法は、インターフェロン産生に干渉するかどうかを識別するためにインビボまたは細胞内においてこの作用物質を検査する工程を含んでもよい。
一つの局面において、本発明は、PLが哺乳動物のPDZポリペプチドに結合することができるようなインフルエンザAタンパク質のC末端アミノ酸配列内から選択される直線アレイ(linear array)のアミノ酸を有する非天然型PDZリガンド(PL)ペプチド診断試薬を提供する。好ましくは、PLは、Sがセリンであり、Tがスレオニンであり、Vがバリンであり、Iがイソロイシンであり、Lがロイシンであり、Xが任意のアミノ酸であるS/T-X-V/I/Lのモチーフを有する。好ましくは、インフルエンザA NS1タンパク質のアレイは、ESEV(配列番号:2)、ESEI(配列番号:3)、ESKV(配列番号:4)、TSEV(配列番号:5)、GSEV(配列番号:6)、RSEV(配列番号:7)、RSKV(配列番号:8)、GSEI(配列番号:9)、GSKV(配列番号:10)、NICI(配列番号:11)、TICI(配列番号:12)、RICI(配列番号:13)、DMAL(配列番号:14)、DMTL(配列番号:15)、DIAL(配列番号:16)、DLDY(配列番号:17)、SICL(配列番号:18)、SEV、SEI、SKV、またはSKIの少なくとも一つを含む。陽性対照、陰性対照、アッセイ標準物質、アッセイキャリブレーター、競合アッセイリガンド、標識ペプチド検出試薬、または固相捕捉物質などの診断試薬も含むことができる。合成ペプチド、組換え型ポリペプチド、実質的に精製された天然型PLポリペプチド、天然型PLポリペプチドの実質的に精製されたフラグメント、ペプチド模倣PL、オリゴヌクレオチドアプタマーPL、またはポリペプチドアプタマーPLも含めることができる。好ましくは、PLペプチドはインフルエンザA NS1タンパク質由来である。
一つの局面において、本発明は、インフルエンザA NS1タンパク質に結合することができる非天然PDZポリペプチドを有する、生物試料中のインフルエンザA PLを検出するための非天然PDZポリペプチド診断試薬を提供し、好ましくは、このPDZドメインタンパク質診断試薬は陽性対照、陰性対照、アッセイ標準物質、アッセイキャリブレーター、競合リガンド、標識タンパク質検出結合パートナー、および捕捉物質からなる診断試薬の群より選択されて、好ましくは外膜、PSD95(PDZ#2)、PSD95(PDZ#1、2、3)、DLG1(PDZ#1)、DLG1(PDZ#1、2)、DLG1(PDZ#2)、DLG2(PDZ#1)、DLG2(PDZ#2)、Magi3(PDZ#1)、PTN3(PDZ#1)、MAST2(PDZ#1)、NeDLG(PDZ#1、2)、Shank1 d1、Shank2 d1、Shank3 d1、シントロフィン1α、シントロフィンγ1、Magi1(PDZ#1)、Magi1(PDZ#4)、Tip1;PTPL1(PDZ#1)、Mint3(PDZ#1)、Lym Mystique(PDZ#1)、DLG2(PDZ#3)、MUPP1(PDZ#8)、NeDLG(PDZ#1)、DLG5(PDZ#1)、PSD95(PDZ#1)、NumBP(PDZ#3)、LIMK1(PDZ#1)、KIAA0313、DLG1(PDZ#2)、シンテニン(PDZ#2)、Pickl、MAST2、PTN3(PDZ#1)、NOS1(PDZ#1、2、3)、MINT1(PDZ#2)、ZO-1(PDZ#2)、NSP、またはRIM2である。
さらなる局面において、本発明は、非天然型PLまたは非天然PDZを有し、そのPLまたはPDZのいずれかがシグナル発生化合物に共有結合的に結合するペプチドまたはポリペプチドである、試験試料中のインフルエンザAタンパク質を検出するためのシグナル発生抱合体物質を提供する。
一つの局面において、本発明は、患者試料中にインフルエンザウイルスA型のNS2タンパク質が存在するかどうかを判定することによって、患者が病原性インフルエンザAに感染しているかどうかを識別するための方法であって、該タンパク質が70位にセリンを有し、その存在が患者がインフルエンザAの病原性株に感染していることを示す方法を提供する。好ましくは、この判定する工程は、患者試料をセリン70を有する配列に特異的に結合する作用物質と接触させる工程である。好ましくは、この作用物質は抗体または核酸である。
一つの局面において、患者が病原性トリインフルエンザウイルスA型に感染しているかどうかを識別するための方法であって、患者試料をPSD-95 PDZタンパク質と接触させる工程、およびPSD-95 PDZタンパク質および試料の特異的結合を検出する工程であって特異的結合がインフルエンザウイルスA型の存在を示し、存在が患者が病原性トリインフルエンザウイルスA型に感染していることを示す工程を伴う方法が提供される。好ましくは、病原性インフルエンザウイルスA型はH5N1である。好ましくは、PSD-95 PDZタンパク質はPSD-95のドメイン2である。好ましくは、インフルエンザNS1タンパク質PLはESKV、ESEI(配列番号:3)、またはESEV(配列番号:2)のモチーフを有する。一つの局面において、接触させる工程は、患者試料をPSD-95 PDZタンパク質、およびPSD-95 PDZタンパク質以外のインフルエンザウイルスA型タンパク質NS1の異なるエピトープに特異的に結合する抗体と接触させる工程を伴い、このPSD-95は支持体上に固定化されて、検出する工程は抗体に特異的に結合するNS1タンパク質を検出する。さらなる局面において、該方法は、患者試料を対照として第2のPDZタンパク質であるINADL d8と接触させて特異的結合を測定するもう一つの工程を含み、第2のPDZタンパク質に比して第1のPDZ-95タンパク質の特異的結合が大きいことは患者が病原性トリインフルエンザウイルスA型に感染していることを示す。
定義
別途定義される場合を除いて、本明細書で用いられるすべての技術的および科学的用語は、本発明が属する技術分野の当業者によって一般的に理解されるものと同一の意味を持つ。次の参照は、当業者に、本発明で用いられている用語の多くの一般的定義を提供する:Singleton et al., DICTIONARY OF MICROBIOLOGY AND MOLECULAR BIOLOGY(2d ed. 1994);THE CAMBRIDGE DICTIONARY OF SCIENCE AND TECHNOLOGY(Walker ed., 1988);およびHale & Marham, THE HARPER COLLINS DICTIONARY OF BIOLOGY(1991)。本明細書に述べられるものと類似または同等の任意の方法および材料が本発明の実践または試験において用いることができるが、現時点で好ましい方法および材料について記載する。定義は、本発明の実践において読者を補助するために(アルファベット順ではなく)理論的な順序で、つまり次のように示される:
「作用物質」は、例えば、タンパク質、ポリペプチド、小分子有機分子、多糖類-ペプチドキメラ分子、ヌクレオチド-ペプチドキメラ分子などを含むがこれらに限定されない任意の物質、分子、要素、化合物、実体、またはそれらの組み合わせを含む。作用物質の典型的な例は、非天然型の状態の天然産物、合成ペプチド化合物、化学的化合物、および2つまたはそれよりも多い天然または非天然化合物の組み合わせを含む。特記する場合を除いて、「作用物質」、「物質」、および「化合物」という用語は互換的に用いられる。
「トリインフルエンザA」とは、トリ対象に感染し、トリ対象間で伝播可能であるインフルエンザA亜型を意味する。トリインフルエンザ血球凝集素亜型の典型的な例はH5、H6、H7、H9、およびH10を含み、典型的な株にはH5N1、H6N2、H7N3、H7N7、H9N2、H10N4、およびH10N5が含まれる。
「トリ対象」とは、野生のトリ(野禽など)および家畜化された種(家禽など)を含めて、すべてのトリの種を含む検査または治療に適した対象を意味する。好ましくは、検査または治療されるべきトリ対象は、ニワトリ、七面鳥、アヒル、ガチョウ、ウズラ、ダチョウ、エミュー、ならびにオウム(parrot)、バタン(cockatoo)、およびオカメインコ(cockatiel)などのエキゾチックバードからなる群より選択される。より好ましくは、検査されるべきトリ対象はニワトリ、七面鳥、ガチョウ、またはウズラである。
「非天然」は、自然に発生しない組成物を意味するために用いられる。非天然組成物の典型的な例には、実質的に精製された組成物、ならびに、例えば、化学的および遺伝的に修飾されたタンパク質、核酸、および同様のもののような、天然では同一の化学的な形が出現しない化合物を含む組成物が含まれる。
本明細書で用いられる「調節」は、例えば作用によるアップレギュレーション(即ち、活性化または刺激)、および例えば結合活性の拮抗によるダウンレギュレーション(即ち、阻害または抑制)の双方を指す。本明細書で用いられるように、「PDZリガンド結合調節物質」という用語は、PDZドメイン含有ポリペプチドのPDZリガンド(即ち、「PL」)への結合を変化させることができる作用物質を指す。調節物質には、例えばアゴニストのような活性化物質および例えばアンタゴニストのような阻害物質の両方が含まれるが、これらに限定されるものではない。阻害物質は結合の部分的または完全な阻害を引き起こし得る。
インフルエンザウイルスの異なる株を区別する状況において用いられる場合、「インフルエンザAの病原性株」は、例えばOIEの「Manual of Diagnostic Tests and Vaccines for Terrestrial Animals, 5th edition, 2004 (
www.oie.int)」において公示されるような、OIE世界動物保健機構、世界保健機関、またはそれらの指定代理機関によって公示されるガイドラインに基づく「届出トリインフルエンザ」(NAI)ウイルスを意味する。さらに、対象の病原性株は、毒性ウイルスにおいて認められている、即ち、OIEまたは代表的な同様の国内のもしくは国際的な機関または業界団体によって定められる任意の配列と同様のインフルエンザA血球凝集素(HA)前駆タンパク質HAO開裂部位のアミノ酸配列を用いた毒性またはH5もしくはH7ウイルスに関する典型的検査において「高病原性」を有する。インフルエンザAの毒性H5およびH7株におけるHAO開裂部位アミノ酸配列の典型的な例は、例えば、H7ウイルスの低毒株が-PEIPKGR
*GLF-(配列番号:20)または-PENPKGR
*GLF-(配列番号:21)を有する場合、高病原性株は
を有するなど、ウイルス性前駆血球凝集素タンパク質の開裂部位に複数の塩基性アミノ酸(アルギニンまたはリジン)を含む。病原性に関する最新の典型的検査には、10日以内に75%よりも高い死亡率が惹起される場合に株が高病原性と判断されるところの、4〜8週齢のニワトリへの感染性ウイルスの接種;および/または静脈内接種されたトリを24時間間隔で10日間にわたって検査し、「0」正常;「1」病気;「2」重度の病気;「3」死亡についてスコア化して平均スコアをIVPIとして算出して、1.2よりも高い血管内病原性指数(IVPI)を有する任意のウイルスの接種を含む。後者の高病原性株は、OIEにより「高病原性NAIウイルス」(HPNIA)として記載される。NAIの最新の典型的な例は、インフルエンザAのH5およびH7株を含む。HPNIAの最新の典型的な例はH5N1を含む。
「インフルエンザAの低病原性株」は、届出義務のあるトリインフルエンザA、即ち、NAI単離物(前記)であるが、ニワトリに関して病原性でなく、毒性ウイルスで認められている任意の配列と同様のHAO開裂部位アミノ酸配列を持たない、即ち、OIEにより「低病原性トリインフルエンザ(LPAI)」と呼ばれる株である。
「PDZドメイン」は、約90の連続したアミノ酸、好ましくは約80〜90、より好ましくは約70〜80、さらに好ましくは約50〜70のアミノ酸を通して相同であるアミノ酸配列、ならびに脳シナプスタンパク質PSD-95、ショウジョウバエ中隔結合タンパク質Discs-Large(DLG)、および/または上皮密着結合タンパク質ZO1(ZO1)を有する。PDZドメインの典型的な例は、当技術分野では、Discs-Large相同反復(「DHR」)および「GLGF」反復(配列番号:26)としても公知である。PDZドメインの例は、グアニル酸キナーゼ同族体のMAGUKファミリーのメンバー、複数のタンパク質ホスファターゼおよびキナーゼ、神経型一酸化窒素合成酵素、腫瘍抑制タンパク質、および総称してシントロフィンとして公知である複数のジストロフィン関連タンパク質を含む様々な膜関連タンパク質に見られる。このPDZドメインは天然および非天然のアミノ酸配列を含む。PDZドメインの典型的な例には、PDZタンパク質の多型変異型、ならびに2種類の異なるPDZタンパク質などの部分を含むキメラPDZドメインを含む。好ましくは、このPDZドメインは、参照によりそれらの全体が本明細書に組み込まれる米国特許出願第10/485,788号(2004年2月3日出願)、国際特許出願PCT/US03/285/28508(2003年9月9日出願)、国際特許出願PCT/US01/44138(2001年11月9日出願)に開示されているものと実質的に同一のアミノ酸配列を含む。典型的な非天然PDZドメインは、例えば、PLへの結合または結合特異性が変化する(強化または減弱化)アミノ酸変化を生じるように内部のアミノ酸配列に関する対応する遺伝コードが突然変異しているドメインを含む。任意で、PDZドメインまたはその変異型は脳シナプスタンパク質PSD-95、ショウジョウバエ中隔結合タンパク質Discs-Large(DLG)および/または上皮密接結合タンパク質Z01(Z01)、および動物の同族体の少なくとも一つに由来するPDZドメインと少なくとも50、60、70、80、または90%配列同一性を持つ。任意で、天然PDZドメインの変異型は天然PDZドメインと少なくとも90%の配列同一性を持つ。PDZドメインの配列同一性は、PDZドメイン内の少なくとも70のアミノ酸、好ましくは80のアミノ酸、およびより好ましくは80〜90または80〜100のアミノ酸を通して求められる。類似体のアミノ酸には、類似体およびヒト配列を最大限に整列させて、天然ヒト配列における対応するアミノ酸と同一の番号が割り付けられる。類似体は、一般的には、時に保存的置換によって1カ所、2カ所、または数カ所の位置において天然型ペプチドと異なる。「対立遺伝子変異型」という用語は、同一動物種の異なる個体の遺伝子間およびその遺伝子によってコードされるタンパク質における対応する変異型の間の変異を指すために用いられる。PSD-95 d2の例示的PDZドメインは配列番号:1として示される。
「PDZドメインを含むポリペプチド」および「PDZポリペプチド」と互換的に用いられる「PDZタンパク質」とは、PDZドメインを有する天然型または非天然型タンパク質(前記)を意味する。PDZタンパク質の典型的な例については既に開示されており(前記)、CASK、MPP1、DLG1、DLG2、PSD95、NeDLG、TIP-33、TIP-43、LDP、LIM、LIMK1、LIMK2、MPP2、AF6、GORASP1、INADL、KIAA0316、KIAA1284、MAGI1、MAST2、MINT1、NSP、NOS1、PAR3、PAR3L、PAR6β、PICK1、Shank1、Shank2、Shank3、SITAC-18、TIP1、およびZO-1が含まれる。スクリーニングアッセイにおいて有用なこの非天然PDZドメインポリペプチドは、例えば、天然PDZドメインよりも小さなPDZドメインを含み得る。例えば、非天然PDZドメインは、「GLGF」モチーフ、即ち、例えばN末端の約10〜20アミノ酸以内など一般にPDZドメインの近位に位置するGLGFアミノ酸配列(配列番号:26)を有するモチーフを含んでもよい。後者のGLGFモチーフ(配列番号:26)およびGLGFモチーフ(配列番号:26)までのN末端の直近の3個のアミノ酸はしばしばPDZ結合活性に必要とされる。同様に、PDZドメインのC末端においてβシートを欠く非天然PDZドメインが構築され得て、つまり、この領域はしばしばPLの結合に影響を及ぼすことなく天然PDZドメインから欠失する可能性がある。いくつかの例示的PDZタンパク質が提供され、括弧内にGIまたはアクセッション番号を示す:PSMD9(9184389)、af6(430993)、AIPC(12751451)、ALP(2773059)、APXL-1(13651263)、MAGI2(2947231)、CARDI1(1282772)、CARDI4(13129123)、CASK(3087815)、CNK1(3930780)、CBP(3192908)、Densin 180(16755892)、DLG1(475816)、DLG2(12736552)、DLG5(3650451)、DLG6スプライスvar 1(14647140)、DLG6スプライスvar 2(AB053303)、DVL1(2291005)、DVL2(2291007)、DVL3(6806886)、ELFIN 1(2957144)、ENIGMA(561636)、ERBIN(8923908)、EZRIN結合タンパク質50(3220018)、FLJ00011(10440342)、FLJ11215(11436365)、FLJ12428(BC012040)、FLJ12615(10434209)、FLJ20075 Semcap2(7019938)、FLJ21687(10437836)、FLJ31349(AK055911)、FLJ32798(AK057360)、GoRASPl(NM031899)、GoRASP2(13994253)、GRIP1(4539083)、GTPアーゼ活性化酵素(2389008)、グアニン交換因子(6650765)、HEMBA 1000505(10436367)、HEMBA 1003117(7022001)、HSPC227(7106843)、HTRA3(AY040094)、HTRA4(AL576444)、INADL(2370148)、KIAA0147 Vartul(1469875)、KIAA0303 MAST4(2224546)、KIAA0313(7657260)、KIAA0316(6683123)、KIAA0340(2224620)、KIAA0380(2224700)、KIAA0382(7662087)、KIAA0440(2662160)、KIAA0545(14762850)、KIAA0559(3043641)、KIAA0561 MAST3(3043645)、KIAA0613(3327039)、KIAA0751 RIM2(12734165)、KIAA0807 MAST2(3882334)、KIAA0858(4240204)、KIAA0902(4240292)、KIAA0967(4589577)、KIAA0973 SEMCAP3(5889526)、KIAA1202(6330421)、KIAA1222(6330610)、KIAA1284(6331369)、KIAA1389(7243158)、KIAA1415(7243210)、KIAA1526(5817166)、KIAA1620(10047316)、KIAA1634 MAGI3(10047344)、KIAA1719(1267982)、LIM Mystique(12734250)、LIM(3108092)、LIMK1(4587498)、LIMK2(1805593)、LIM-RIL(1085021)、LU-1(U52111)、MAGI1(3370997)、MGC5395(BC012477)、MINT1(2625024)、MINT3(3169808) MPP1(189785)、MPP2(939884)、MPP3(1022812)、MUPP1(2104784)、NeDLG(10853920)、ノイラビンII(AJ401189)、NOS1(642525)、新規PDZ遺伝子(7228177)、新規セリンプロテアーゼ(1621243)、Numb結合タンパク質(AK056823)、外膜タンパク質(7023825)、p55T(12733367)、PAR3(8037914)、PAR3様(AF428250)、PAR6(2613011)、PAR6β(13537116)、PAR6γ(13537118)、PDZ-73(5031978)、PDZK1(2944188)、PICK1(4678411)、PIST(98394330)、prIL16(1478492)、PSAP(6409315)、PSD95(3318652)、PTN-3(179912)、PTN-4(190747)、PTPL1(515030)、RGS12(3290015)、RGS3(18644735)、Rho-GAP10(NM020824)、ローフィリン様(14279408)、セリンプロテアーゼ(2738914)、Shank 2(6049185)、Shank 3(AC000036)、Shroom(18652858)、GRASP65類似型(14286261)、Numb px2リガンド類似型(BC036755)、PTP同族体(21595065)、SIP1(2047327)、SITAC-18(8886071)、SNPCIIA(20809633)、Shank 1(7025450)、シンテニン(2795862)、シントロフィン1α(1145727)、シントロフィンβ2(476700)、シントロフィンγ1(9507162)、シントロフィンγ2(9507164)、TAX2様タンパク質(3253116)、TIAM 1(4507500)、TIAM 2(6912703)、TIP1(2613001)、TIP2(2613003)、TIP33(2613007)、TIP43(2613011)、X-11β(3005559)、ZO-1(292937)、ZO-2(12734763)、ZO-3(10092690)。
「PL]と略される「PDZリガンド」は、PDZドメインを持つ分子相互作用複合体に結合するおよびこれを形成するアミノ酸配列を持つ天然のタンパク質を意味する。PLの典型的な例は、先行のUSおよび国際特許出願(前記)に既に示されている。インフルエンザA PLのさらなる例は以下の実施例に示される。
「PDZ物質」は、PDZ物質を含まない対照に比して、試験アッセイにおいて、少なくとも20%、例えば、少なくとも30%、少なくとも40%、少なくとも50%、少なくとも60%、少なくとも70%、少なくとも80%、少なくとも90%、少なくとも95%、約99%または100%まで、PDZリガンドポリペプチドおよびPDZドメイン含有ポリペプチドの間に生じる結合相互作用に干渉する化合物を意味するために用いられる。任意の特定の作用機序に限定されることを望まないと同時に、このPDZ物質は、例えばそれ以外の場合にはインフルエンザNS1リガンドに結合するであろうPDZドメインに結合することによって干渉し得て、または、PDZタンパク質への結合を阻止するためにNS1リガンドに直接結合する可能性もある。一般に、後者のPDZ物質は約1mMまたはそれよりも低い範囲において特定のアッセイでIC50を示す作用物質である。低いIC50を示す化合物は、例えば、一般的には約100μM、10μM、1μM、100nM、10nM、1nM、またはさらに低いIC50を持つ。後者のPDZ物質は、インフルエンザAウイルスの感染に起因する疾患の一つまたは複数の症状の緩和、治療または防止のために投与される治療的および予防的な薬用組成物において有用である。「PL調節物質」は、PDZ物質(前記)の関連において、インフルエンザA NS1タンパク質に結合してPDZドメインへのその結合を調節する化合物を意味するために用いられる。
「PDZ調節物質」は、PDZ物質(前記)の関連において、PDZドメインに結合して対象のPDZドメイン部位におけるインフルエンザNS1タンパク質の結合を調節する化合物を意味するために用いられる。
このPDZ調節物質およびPL調節物質は、それぞれ、PDZドメインまたはPLを結合するために設計されたペプチド、ペプチド模倣物、または小分子模倣物であり得る。PDZ調節物質がPDZドメインに結合するかどうかを判定するためのアッセイについては、以下の実施例の項に詳細に記載される。同様に、例えば、組換え型NS1融合タンパク質に結合する組換え型PDZドメイン融合タンパク質などPL調節物質がPDZドメインに結合するかどうかを判定するためのアッセイも記載される。
「PDZ介在性疾患」とは、インフルエンザAに感染した対象における、宿主細胞PDZドメインでのインフルエンザAウイルスタンパク質PLの結合に起因する一つまたは複数の症状を意味する。ウイルス感染によって惹起される後者の症状には、発熱、咳嗽、咽喉痛、筋痛、結膜炎、呼吸障害、気道における過度の粘液産生、二次的細菌感染に対する感受性強化、肺炎、神経感染などが含まれるが、これらに限定されるものではない。
本明細書においてトリ対象を指すために用いられる場合、「病気」は、疾患の明らかな徴候をほとんど伴わない突然死から、呼吸器症状、過度の流涙、副鼻腔炎、頭部の浮腫、羽毛のない皮膚のチアノーゼ、および下痢を伴うより特徴的な疾患まで様々であり得る。OIEによってそれらの健康ガイドラインである「Manual of Diagnostic Tests and Vaccines for Terrestrial Animals, 5th edition, 2004, World Organization for Animal Health」に開示された「病気」に関する典型的な診断症状、標本、および検査は、参照によりそれらの全体が本明細書に組み入れられる。
「類似体」は、本明細書では、関心対象の天然型PDZまたはPL分子に構造的に類似するが、例えば1つまたは複数の特定のアミノ酸置換基の置き換えまたは化学的修飾によって修飾されている分子を指すために用いられる。最初の分子に比して、類似体は同一、同様、または改善された有用性を示し得る。改善された特色を有する公知の化合物の変異型を識別するための類似体の合成およびスクリーニングは、例えば、結合親和性の向上、標的に対する結合選択性の変化、標的外の分子に対する結合の低下、インビトロおよびインビボにおける安定性の向上、ならびに薬学的特性の改善など、医学の技術分野では周知である。
「接触」は、その通常の意味を持ち、例えば試験試料中のPLがPDZと結びつくなど、それによって構成物が結びつくように2つまたはそれよりも多い作用物質を組み合わせることを指す。接触は、例えばPDZタンパク質が試験管またはその他の容器中で細胞溶解物と結びつくなど、インビトロにおいて、または例えば天然の宿主細胞PDZタンパク質および天然のウイルスPLが細胞の固有の生合成活性によってインフルエンザに感染した細胞内で結びつくなどインサイチューにおいて、起こり得る。または、組換え型PDZは、例えばインフルエンザAに感染した細胞内にPDZドメインをコードする配列をトランスフェクトすることによってウイルス性PLと結びつく。
「ポリマー」は、供給源に関わらず、1つまたは複数のタイプの反復単位の連続的アレイを指すために用いられる。ポリマーは生物学的な系において見出すことができ、特に、ポリペプチドおよびポリヌクレオチド、ならびにアミノ酸、ヌクレオチド、またはそれらの類似体を含む化合物を含む。「ポリヌクレオチド」という用語は、10〜100ヌクレオチドの長さの範囲のオリゴヌクレオチドおよび100よりも多いヌクレオチドの長さのポリヌクレオチドを含む任意の長さのヌクレオチドまたはその類似型を指す。「ポリペプチド」という用語は、任意の長さのアミノ酸の連続的アレイ、好ましくは約12〜約50の範囲の連続的アレイのアミノ酸、および最も好ましくは約50よりも多いアミノ酸を持つポリマーを指す。
「ポリペプチド」および「タンパク質」は互換的に用いられ、内部の天然のペプチド結合したバックボーンが非天然の合成バックボーンで置き換えられているアミノ酸、および内部の1つまたは複数の天然アミノ酸が1つまたは複数の非天然のまたは合成の模倣アミノ酸で置き換えられている、ポリマー性の、アミノ酸の連続的アレイを含むために用いられる。
「融合タンパク質」は、2つまたはそれよりも多い天然型タンパク質から派生して単一の組換え型タンパク質として発現する、即ち、固有の状態では接続しないが、組換え型タンパク質においては、例えばペプチド結合を介してそれらのそれぞれのアミノ末端およびカルボキシル末端によって連続して単一の連続するアミノ酸配列を形成する2つまたはそれよりも多いアミノ酸配列から構成されるポリペプチドを意味する。融合タンパク質は、2つ、3つ、または実に4つもしくはそれよりも多い異なる天然または非天然タンパク質の組み合わせであり得る。典型的な融合タンパク質は2つまたはそれよりも多い異種の、即ち、無関係なアミノ酸配列を持つタンパク質;異種および同種の、即ち、関連性のある配列を持つタンパク質を含む。融合タンパク質は、また、時にN末端メチオニン残基を持つアミノ酸配列、抗原性エピトープを用いて識別のためにタグ付けされたアミノ酸配列、ならびに例えば、蛍光パートナーを持つ融合タンパク質などの融合パートナー、β-ガラクトシダーゼのような酵素パートナー、ルシフェラーゼのような化学発光パートナーとしてシグナル発生化合物を持つアミノ酸配列からなる。
診断用アッセイの試薬または方法の関連で用いられる場合、「捕捉物質」は、結合相互作用において、例えば結合親和性として測定される十分な強度で、かつ異なるウイルス分析物の混合物からのウイルス分析物の濃縮を可能とする特異性で、ならびに診断用アッセイ様式での使用に適した期間、即ち、一般的には約5分から約90分、好ましくは約5分から約60分、および最も好ましくは約5分から約30分の期間、インフルエンザウイルス分析物に結合することができる作用物質を指す。本発明の代替の態様に従って、この捕捉物質はPDZドメインまたはPLのいずれかを含む。典型的な捕捉物質を以下の実施例において例証する。捕捉物質は、通常、例えば、PLを含まないタンパク質などのその他の分析物を除外して、例えばPL含有タンパク質などの一つまたは複数のウイルス分析物に「特異的に結合」する。好ましくは、この捕捉物質は対象のウイルス分析物に約10-6Mよりも低い、好ましくは約10-7Mよりも低い、さらに最も好ましくは約10-8Mよりも低い解離定数(KD)で結合する。
この天然および非天然PDZドメインおよびPL試薬の結合相互作用に関して用いられる場合、「特異的結合」は、捕捉物質または検出物質が、異なるウイルス分析物の混合物中に存在する特定のウイルス分析物に優先的に結合する能力を指すために用いられる。一部の態様において、対象の特異的結合相互作用はPLを持つまたは持たないタンパク質を区別することができ、つまり、いくつかの態様において、この識別能力は約10倍から約100倍よりも高く、好ましくは約1000倍から約10,000倍よりも高い。
「実質的に同一」という用語は、2つのペプチドの配列が、初期設定のギャップ重量を用いてGAPまたはBESTFITのプログラムなどによって最適に整列させた際に、少なくとも65%の配列同一性、好ましくは少なくとも80または90%の配列同一性、より好ましくは少なくとも95%またはそれよりも多い配列同一性(例えば、99%配列同一性またはそれよりも高い)同一性を共有することを意味する。好ましくは、同一でない残基の位置は保存的アミノ酸置換基により異なる。
「結合干渉」は、診断用アッセイ様式において複合体を形成するためのPDZドメインとPLの第一の結合相互作用に関連して用いられ、対象の複合体はその後、必要な第2の結合相互作用として、即ち、第1の結合相互作用が第2の結合相互作用を阻害し、その結果、シグナル発生化合物によって産生されるシグナルの強度が低下する干渉結果として、実質的に検出される。本発明の方法においてこの組成物によって発生されるシグナルは、15%よりも低い、好ましくは10%よりも低い、最も好ましくは約5%よりも低い結合干渉に供される。
「捕捉物質/分析物複合体」は、例えばPDZドメイン融合タンパク質などの捕捉物質と、例えばPLを有するインフルエンザウイルスタンパク質などの分解物との特異的結合から生じる複合体である。捕捉物質および分析物は「特異的結合に適した条件」下において特異的に、即ち、一方が他方に結合し、このような物理化学的条件は、例えば塩濃度、pH、界面活性剤濃度、タンパク質濃度、温度、および時間に関して簡便に表される。対象の条件は、例えば、溶液中で、または結合メンバーの一つが固相に固定化された場合に生じるような結合に適している。そのように適切な典型的条件は診断の技術分野において周知であり、例えば、Harlow and Lane, 「Antibodies: A Laboratory Manual」, Cold Spring Harbor Laboratory, Cold Spring Harbor, N.Y. (1989)を参照されたい。好ましくは、適切な条件は、約10-6Mよりも少ない、好ましくは約10-7Mよりも少ない、最も好ましくは約10-8Mよりも少ない解離定数(KD)を持つ結合相互作用を生じる。
「表面結合捕捉物質」は、「固相捕捉物質」と互換的に用いられ、例えば、シート、ビーズ、または以下により詳細に示すようにウェルを有するプレートのようなその他の構造物などの固体基質の表面に固定化されたPDZドメインまたはPL捕捉物質を指すために用いられる。一部の態様において、本明細書で用いられる捕捉物質の集積は、例えば表面上の特定の位置が特定の表面結合捕捉物質の存在に対応するアレイの形で、同一支持体の表面に存在する。
「分離」または「精製」は、一般に、物質がそれが属する試料の顕著な割合(例えば、2%よりも多い、5%よりも多い、10%よりも多い、20%よりも多い、50%よりも多い、またはそれよりも多い、通常は約90%〜100%まで)を含むような物質(化合物、ポリヌクレオチド、タンパク質、ポリペプチド、ポリペプチド組成物)の単離を指す。一部の態様において、実質的に精製された成分が試料の少なくとも50%、80%〜85%、または90〜95%を構成する。関心対象のポリヌクレオチドおよびポリペプチドを精製するための技術は当技術分野において周知であり、例えば、イオン交換クロマトグラフィー、アフィニティークロマトグラフィー、および密度に基づく沈降が含まれる。一般に、物質は、試料のその他の成分に比して、それが試料中に自然の状態では認められない量で存在する場合に精製される。
このアッセイの関連で用いられる場合、「評価(assessing)」は、検査結果を査定する工程、および/またはインフルエンザAウイルス分析物が試験試料中に存在するかどうかを判定するために検査測定を実施する工程を指す。典型的な査定には、「判定(determining)」、「測定(measuring)」、「査定(evaluating)」、「評価(assessing)」、および「アッセイ(assaying)」が含まれ、これらは互換的に用いられ、定量的および/または定性的な測定を含めるために用いられ得る。評価は相対的または絶対的であり得る。「結合の評価」には、結合相互作用の量または程度の判定、さらに特定の相互作用が起こっているかどうか、即ち、結合が存在するかまたは存在しないかの判定が含まれる。
「治療(treatment)」、「治療(treating)」、「治療する(treat)」、および同様の語は、所望の薬学的および/または生理学的影響、例えば、疾患(前記)の一つまたは複数の症状の防止または軽減を達成するためにそれらを必要とする対象に対して本発明に従って化合物を投与する工程を指す。治療は、疾患の一つまたは複数の症状の発現を防止するために予防的に投与されてもよく、および/または疾患の症状を抑制もしくは排除するために治療的に投与されてもよい。それらを必要とする対象にはヒトおよび家畜が含まれる。
本明細書において、「対象」は、ヒト、および例えば、哺乳動物、魚、鳥類、爬虫類、両生類などの家畜動物を指すために用いられる。
「シグナル発生化合物」、略して「SGC」は、(例えば、以下に詳細に開示される化学的結合方法を用いて)PLまたはPDZに結合することができ、本開示のアッセイで検出可能な化学的または物理的実体(即ち、反応産物)を形成するために反応することができる分子を意味する。反応産物の典型的な例には、沈殿物、蛍光シグナル、色を持つ化合物などが含まれる。典型的なSGCには、例えば、生物発光化合物(例えば、ルシフェラーゼ)、フルオロフォア(例えば、以下)、生物発光および化学発光化合物、放射性同位体(例えば、131I、125I、14C、3H、35S、32Pなど)、酵素(例えば、以下)、結合タンパク質(例えば、ビオチン、アビジン、ストレプトアビジンなど)、磁気粒子、化学的反応性化合物(例えば、有色色素)、標識オリゴヌクレオチド、分子プローブ(例えば、CY3、Research Organics, Inc.)などが含まれる。典型的なフルオロフォアには、フルオレセインイソチオシアネート、サクシニルフルオレセイン、ローダミンB、リサミン、9,10,-ジフェニルアントラセン、ペリレン、ルブレン、ピレン、およびイソシアネート、イソチオシアネート、塩酸または塩化スルホニル、ウンベリフェロン、ユーロピウム(Eu)のようなランタニドの希土類キレートなどの蛍光誘導体が含まれる。シグナル発生抱合体において有用な典型的SGCには次の酵素が含まれる:IUBクラス1、特に1.1.1および1.6(例えば、アルコールデヒドロゲナーゼ、グリセロールデヒドロゲナーゼ、乳酸デヒドロゲナーゼ、リンゴ酸デヒドロゲナーゼ、グルコース-6-リン酸デヒドロゲナーゼ、グリセルアルデヒド-3-リン酸デヒドロゲナーゼなど);IUBクラス1.11.1(例えば、カタラーゼ、ペルオキシダーゼ、アミノ酸オキシダーゼ、ガラクトースオキシダーゼ、グルコースオキシダーゼ、アスコルビン酸オキシダーゼ、ジアフォラーゼ、ウレアーゼなど);IUBクラス2、特に2.7および2.7.1(例えば、ヘキソキナーゼなど);IUBクラス3、特に3.2.1および3.1.3(例えば、アルファアミラーゼ、セルラーゼ、(β-ガラクツロニダーゼ、アミログルコシダーゼ、β-グルクロニダーゼ、アルカリホスファターゼ、酸性ホスファターゼなど);IUBクラス4(例えば、リアーゼ);IUBクラス5、特に5.3および5.4(例えば、ホスホグルコースイソメラーゼ、トリオースホスファターゼイソメラーゼ、ホスホグルコースムターゼなど)。シグナル発生化合物には、その産物が例えば、ルシフェラーゼ、152Euのような蛍光金属またはその他のランタン系列など;ルミノール、イソルミノール、アクリジニウム塩などのような化合物;ルシフェリンのような生物発光化合物;蛍光タンパク質など、蛍光および化学発光波長によって検出可能なSGCも含まれる。蛍光タンパク質には次が含まれるが、これらに限定されるものではない:つまり、(i)緑色蛍光タンパク質(GFP)、つまり天然型ヌクレオチド配列のコドンが交換されてヒトコドンバイアスにより密接に適合するGFPの「ヒト化」型を含むがこれらに限定される訳ではない;(ii)発光オワンクラゲ(Aequoria victoria)に由来するGFP、および例えばClontech, Inc.から市販されている高感度GFPのような「ヒト化」誘導体などのその誘導体;(iii)例えばWO 99/49019およびPeelleら、(2001) J. Protein Chem. 20:507-519に記載されるようなウミシイタケ(Renilla reniformis)、レニラムレリ(Renilla mulleri)、またはオレンジシーペン(Ptilosarcus guernyi)のようなその他の種由来のGFP;(iv)「ヒト化」組換え型GFP(hrGFP)(Stratagene);ならびに(v)Matz et al. (1999) Nature Biotechnol. 17:969- 973に記載されるような花虫類に由来するその他の蛍光および有色タンパク質など。対象のシグナル発生化合物はPLまたはPDZドメインポリペプチドに共役され得る。一部のSGCのタンパク質への接続は、EDTAなどの金属キレート官能基を介して達成することができる。対象のSGCは、試験試料中のインフルエンザPL分析物の検出および/または定量を可能とする一般的特性を共有する。対象のSGCは視覚的な方法、好ましくは分光光度法、蛍光法、化学発光法、例えばコンダクタンス、インピーダンス、抵抗などの変化に関与する電気的ナノメーター法、および磁場法のような自動化に適した方法を用いて検出可能である。
本明細書で用いられるように、「固相」は、1つまたは複数の反応物が静電気的、疎水的、または共有結合的に接続され得る表面を意味する。典型的な固相には、例えば、ナイロン6、ナイロン66、ポリスチレン、ラテックスビーズ、磁気ビーズ、ガラスビーズ、ポリエチレン、ポリプロピレン、ポリブチレン、ブタジエン-スチレンコポリマー、サイラスティックゴム、ポリエステル、ポリアミド、セルロースおよび誘導体、アクリレート、メタクリル酸、ポリビニル、塩化ビニル、ポリ塩化ビニル、ポリフッ化ビニル、ポリスチレンのコポリマー、シリカゲル、シリカウェハーガラス、アガロース、デキストラン、リポソーム、不溶性タンパク質金属、ならびにニトロセルロースが含まれる。典型的な固相は、ビーズ、チューブ、条片、ディスク、濾紙、プレートなどとして形成される相を含む。濾紙は、分析物を例えば濾液として捕捉するために用いることができ、あるいはエントラップメントによって機能する、またはフィルター上でPLまたはPDZを共有結合することによって機能することができる(例えば、以下の実施例の項を参照されたい)。本発明の一部の態様に従って、ユーザーへの流通のための固相捕捉試薬は、「捕捉試薬」(下記)でコーティングされて、生物学的試料中のインフルエンザPL分析物への捕捉試薬の結合を保持および/または最大化するために(例えば、窒素大気下で)包装される固相(前記)からなってもよい。
「捕捉物質」は、インフルエンザPLを結合することができる固定化されたPDZポリペプチド(またはペプチド)を意味する。対象の捕捉試薬は、PDZ、もしくは固相への結合を促進するために修飾されたPDZの溶液、または例えば(以下に詳細に開示される通り)静電力、ファンデルワールス力、疎水力、共有化学結合などを介して固相(前記)にPDZを接続させることによる固定化など、既に固相の表面に固定化されたPDZからなり得る。PDZ捕捉試薬の典型的な例は以下の実施例の項に開示され、例えば、ラテックスビーズディップスティックアッセイにおける可動性ラテックスビーズに固定化されたPDZのような可動性固相PDZ捕捉試薬が含まれる。
「検出試薬」は、PLまたはPDZポリペプチドもしくはペプチドに連結されたSGC;またはPLもしくはPDZに特異的に結合することができる抗体に連結されたSGCを含む抱合体を意味する。この検出試薬の典型的な例には、1つまたは複数のSGC化合物を持つ1つまたは複数のPLまたはPDZの複合体、つまり高分子複合体が含まれる。対象の検出試薬には、ラテックスビーズディップスティックアッセイにおける可動性ラテックスビーズのような可動性固相検出試薬が含まれる。
「生物学的試料」は、例えば、哺乳動物、魚、鳥類、爬虫類、有袋類など、生きている(または死んだ)生物体から得られた試料を意味する。生物学的試料には、組織液、組織切片、例えば、生物テロの脅威などを評価するために、空中または水中に運搬されてそこから例えば濾過、遠心分離などによって採集された生物学的材料が含まれる。別の生物学的試料は、胎児または卵、卵黄、および羊膜液から採取され得る。典型的な生物学的液体には、例えば、尿、血液、血漿、血清、脳脊髄液、精液、肺洗浄液、糞便、痰、粘液、生物学的材料を運搬する水などが含まれる。または、生物学的試料には、鼻咽頭または口喉頭のスワブ、鼻腔洗浄液、ならびに気管、肺、気嚢、腸、脾臓、腎臓、脳、肝臓、および心臓に由来する組織、痰、粘液、生物学的材料を運搬する水、総排出腔のスワブ、痰、鼻腔および口腔の粘液などが含まれる。典型的な生物学的試料には、例えば、肉、加工食品、家禽、ブタなどの試料などの食品も含まれる。生物学的試料には、汚染された溶液(例えば、食品加工液など)、外来部門、病院、医院、食品調理施設(例えば、レストラン、屠殺場、低温貯蔵施設、スーパーマーケット包装部門など)から得られるスワブ試料も含まれる。生物学的試料はインサイチューの組織および体液(即ち、検査のために採取されない試料)も含むことができ、例えば、この方法は、例えば点眼薬、結膜に直接適用される検査紙を用いるなど眼におけるウイルス感染の存在もしくは程度を検出する際に;または、例えば検査対象の口または鼻咽頭に指示薬カプセルを挿入することによって肺感染の存在もしくは程度を検出する際に有用であり得る。または、スワブまたは検査紙は口に適用されてもよい。生物学的試料は、対象の任意の組織、臓器または細胞群から由来し得る。いくつかの態様において、対象から切屑、生検標本、または洗浄液が得られる。生物学的試料は、血液、尿、痰、および口腔液のような体液;ならびに鼻腔の洗浄液、スワブまたは吸引液、気管吸引液、下疳スワブ、および糞便試料などの試料を含み得る。例えば、鼻腔のスワブ、洗浄咳もしくは吸引液、または呼吸器疾患に関連する高リスクインフルエンザAウイルスの場合における気管吸引液、口腔スワブのような鼻咽頭標本など、関心対象の個々の病原体の検出に適した生物学的標本の採取のための方法は当業者に公知である。従って、本発明の態様は、インフルエンザAの汚染または感染の有無または量に関して異なる様々な種類の生物学的試料の検査において有用な方法を提供する。任意で、生物学的試料は、ペニシリン、ストレプトマイシン、ゲンタマイシン、およびミコスタチンのような抗生物質を含む等張液に懸濁されてもよい。
本明細書で用いられるように、「リガンド」は、PDZ結合部位に結合することができるPL化合物を指す。リガンドの典型的な例には、インフルエンザAの様々な異なる株に見出されるように、PL含有複合体ウイルス粒子(前記)が含まれる。対象のリガンドは、静電斥力を最小限として、静電引力を最大限とし、さらに疎水力および水素結合力を最大限とするようにPDZドメイン結合部位の結合部位において三次元の空隙を埋めることができる。特異的および飽和性の方法でのPDZポリペプチドへのリガンド結合、ならびに結合親和性は、例えば、以下に詳細に開示されるような、当業者に公知のリガンド結合アッセイに従って測定することができる。
本発明の態様に基づくアッセイの関連において用いられる場合、「特異性」とは、本発明の工程に従って実施される対象のアッセイが一群の生物学的試料(例えば、100試料によるパネル)において試料の「指示された」割合を適切に識別することができることを意味する。対象の試料パネルはすべて、1つまたは複数のムレイン分析物(例えば、細菌または真菌で汚染された陽性対照試料)を含む。好ましくは、対象の「指示された」特異性は85%よりも高く(例えば、アッセイは、100のうち85よりも多くの試料で1つまたは複数のムレイン分析物を含むことを示すことができる)、最も好ましくは、対象のアッセイは90%よりも高い指示された特異性を有する。任意で、対象のアッセイは「真のインフルエンザA以外の症例」を識別する、即ち、一群の生物学的試料(例えば、100試料のパネル)において「指示された」割合の陰性試料を検出することができる。好ましくは、本発明のこの工程は「真のトリインフルエンザA以外の症例」を適切に識別することができて、最も好ましくは、本発明のこの工程は「真の低病原性トリインフルエンザAの症例」を適切に識別することができる。異なる態様において、対象の試料の陰性対照群はインフルエンザA PL分析物を含まない、またはトリ以外のインフルエンザA以外のPL分析物を含む、もしくは非病原性インフルエンザA PLを含む。好ましくは、対象の特異性は85%よりも高く(例えば、アッセイは、100のうち85よりも多くの試料を示すことができる)、最も好ましくは、対象のアッセイは90%よりも高い特異性を有する。
本発明の態様に基づくアッセイの関連において用いられる場合、「感度」とは、本発明の工程に従って実施される対象のアッセイが陽性対照(前記)および陰性対照(即ち、PL分析物を欠く)の双方を含む一群の試料においてインフルエンザPL分析物を含む試料の「指示された」割合を識別することができることを意味する。好ましくは、対象の「指示された」感度は85%よりも高く、最も好ましくは90%よりも高い。任意で、対象のアッセイは、一群の試料においてインフルエンザPL分析物を含む試料の「指示された」割合において「真のインフルエンザAの症例」を識別することができる。好ましくは、本発明のこの工程は「真のトリインフルエンザAの症例」を適切に識別することができて、最も好ましくは、本発明のこの工程は「真の病原性トリインフルエンザAの症例」を適切に識別することができる。異なる態様において、対象の試料の陽性対照群は、インフルエンザA PL分析物を含む、またはトリインフルエンザA PL分析物を含む、もしくは高病原性インフルエンザA PLを含む。好ましくは、対象の「指示された」感度は約70%よりも高く、より好ましくは約80%よりも高い。さらにより好ましくは、感度は約85%よりも高く、最も好ましくは対照の感度の約90%よりも高い。または、感度は、同一タンパク質を識別するPCR反応の感度を基準として測定することもできる。
特異性および感受性に関して、任意で次の定義を適用してもよい。
「陽性予測値」、略してPPVは、試料のその割合がこの方法において検査陽性であり、真のトリインフルエンザAの症例であることを意味する。好ましくは、この方法は約65%よりも高い、最も好ましくは約80%よりも高いPPVを持つ。
「陰性予測値」、略してNPVは、検査陰性であり、かつ、真のインフルエンザA 陰性の症例である試料の割合を意味する。好ましくは、この方法は約85%よりも高い、最も好ましくは約90%よりも高いNPVを持つ。
生物学的試料に関連して用いられる「真のインフルエンザA陽性」は、例えば、孵化鶏卵での分離および培養、HAおよび/もしくはNA亜型の識別ための市販の免疫アッセイ検査、免疫拡散法、血球凝集試験および/もしくは血球凝集阻害試験でのウイルス抗原の識別、RT-PCRによるウイルスRNAの検出、または免疫蛍光法による呼吸器試料中の細胞におけるインフルエンザA抗原の検出など、2つまたはそれよりも多い独立した検査において確認されるようにインフルエンザAビリオン粒子を含む試料を意味する。
生物学的試料に関連して用いられる「真のトリインフルエンザA陽性」は、例えば、孵化鶏卵での分離および培養、HAおよび/もしくはNA亜型の識別のための市販の免疫アッセイ検査、免疫拡散法、血球凝集試験および/もしくは血球凝集阻害試験でのウイルス抗原の識別、RT-PCRによるウイルスRNAの検出、または免疫蛍光法による呼吸器試料中の細胞におけるインフルエンザA抗原の検出など、2つまたはそれよりも多い独立した検査において確認されるようにトリインフルエンザAビリオン粒子を含む試料を意味する。
生物学的試料に関連して用いられる「真の高病原性トリインフルエンザA陽性」は、前記に定義される通り、また、例えば、孵化鶏卵での分離および培養、HAおよび/もしくはNA亜型の識別のための市販の免疫アッセイ検査、免疫拡散法、血球凝集試験および/もしくは血球凝集阻害試験でのウイルス抗原の識別、RT-PCRによるウイルスRNAの検出、または免疫蛍光法による呼吸器試料中の細胞におけるインフルエンザA抗原の検出など、2つまたはそれよりも多い独立した検査において確認されるように高病原性トリインフルエンザAビリオン粒子を含む試料を意味する。
生物学的試料に関連して用いられる「真のインフルエンザA陰性」は、例えば、孵化鶏卵での分離および培養、HAおよび/もしくはNA亜型の識別のための市販の免疫アッセイ検査、免疫拡散法、血球凝集試験および/もしくは血球凝集阻害試験でのウイルス抗原の識別、RT-PCRによるウイルスRNAの検出、または免疫蛍光法による呼吸器試料中の細胞におけるインフルエンザA抗原の検出など、2つまたはそれよりも多い独立した検査において確認されるようにインフルエンザAビリオン粒子を含まない試料を意味する。
生物学的試料に関連して用いられる「真のトリインフルエンザA陰性」は、例えば、孵化鶏卵での分離および培養、HAおよび/もしくはNA亜型の識別のための市販の免疫アッセイ検査、免疫拡散法、血球凝集試験および/もしくは血球凝集阻害試験でのウイルス抗原の識別、RT-PCRによるウイルスRNAの検出、または免疫蛍光法による呼吸器試料中の細胞におけるインフルエンザA抗原の検出など、2つまたはそれよりも多い独立した検査において確認されるようにトリインフルエンザAビリオン粒子を含まない試料を意味する。この場合、生物学的試料は、前記に定義されるようなトリインフルエンザAビリオン粒子以外のインフルエンザAビリオン粒子を含み得る。
生物学的試料に関連して用いられる「真の高病原性トリインフルエンザA陰性」は、前記に定義される通り、また、例えば、孵化鶏卵での分離および培養、HAおよび/もしくはNA亜型の識別のための市販の免疫アッセイ検査、免疫拡散法、血球凝集試験および/もしくは血球凝集阻害試験でのウイルス抗原の識別、RT-PCRによるウイルスRNAの検出、または免疫蛍光法による呼吸器試料中の細胞におけるインフルエンザA抗原の検出など、2つまたはそれよりも多い独立した検査において確認されるように高病原性トリインフルエンザAビリオン粒子を含まない試料を意味する。但し、対象試料は、前記のインフルエンザAビリオン粒子または比較的病原性の低いトリインフルエンザAビリオン粒子を含んでもよい。
本発明の態様に基づくアッセイの関連において用いられる場合、「バックグラウンド」とは、それらがアッセイ中に存在した場合にアッセイの適切な性能に干渉する可能性のある物質によって引き起こされる、検査結果の不確定度を意味する(偽陽性もしくは偽陰性の検査結果の割合として、または検査結果の信頼度の値によって表されることもある)。干渉し得る物質、即ち、干渉物質、混乱物質などの典型的な例には、内因性PDZ結合ポリペプチド、例えば酵素阻害物質、フリーラジカル反応性化合物、内因性ペルオキシダーゼなどのシグナル発生化合物の阻害物質または基質が含まれる。
「実質的に精製された」とは、本明細書では、天然のPDZまたはPLポリペプチドもしくはペプチドを例えば自然の状態よりも高純度といった非天然の状態で含む調製物を指すために用いられる。天然試料において記録されるよりも高い典型的な純度は、自然の供給源材料に含まれる量に対して、約10倍〜約25倍高く、好ましくは約26倍〜約50倍高く、最も好ましくは約100倍高く濃縮されるPDZおよびPLポリペプチドならびにそれらのフラグメントを含む。対象の調製物は、好ましくは、例えばSDS-PAGEまたは逆相HPLCによって検出可能である約10%よりも低い不純物、最も好ましくは約5%よりも低い不純物を含む。
これまでに調べられてNCBIのGenbankデータベースに電子的に寄託されている核酸およびタンパク質の配列は、本明細書ではGenbankアクセッション番号(GI)によって示される。これらのGenbank登録項目に示された配列は、すべての目的のために参照によりそれらの全体が本明細書に組み入れられる。本出願者らは、明らかに、これらの配列の1つもしくは複数、またはそれらの記載される任意の一部を具体的に列挙する本明細書を後で補正する権利を有する。
本明細書において記載される様々な生化学的および分子生物学的方法は当技術分野では周知であり、例えば、Sambrook et al., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Press, N.Y. Second Edition (1989)およびThird Edition (2000)、ならびにCurrent Protocols in Molecular Biology, (Ausubel, F. M. et al., eds.) John Wiley & Sons, Inc., New York (1987-1999)において記載されている。
核酸は、DNAまたはRNAであってよく、一本鎖または二本鎖であってよい。オリゴヌクレオチドは天然または合成のものであってよいが、一般的には合成手段によって調製される。本発明の好ましい核酸は、表12に示されるSer 70を含むNS2配列の任意の1つを含むDNAのセグメントまたはそれらの相補型を含む。セグメントは、通常、5〜100の連続した塩基であり、時に5、10、12、15、20、または25のヌクレオチドから10、15、30、25、20、50、または100のヌクレオチドの範囲である。5〜10、5〜20、10〜20、12〜30、15〜30、10〜50、20〜50、または20〜100塩基の核酸が一般的である。多型部位はセグメントの任意の位置において発生し得る。セグメントは表12に示すNS2の任意の対立形質由来であり得る。表では簡潔にするため、Tの記号はDNAにおけるチミジンおよびRNAにおけるウラシルの双方を示すために用いられる。従って、RNAオリゴヌクレオチドの場合、Tの記号はウラシル残基を示すと解釈されなければならない。
ハイブリダイゼーションプローブは、塩基特異的な方法で核酸の相補鎖に結合することができる。このようなプローブには、Nielsen et al., Science 254,1497-1500 (1991)に示される通り、核酸、ペプチド核酸が含まれる。
プライマーという用語は、適切な条件下(即ち、4つの異なるヌクレオシド三リン酸、およびDNAポリメラーゼもしくはRNAポリメラーゼまたは逆転写酵素などの重合のための作用物質の存在下)において適切な緩衝液および適した温度にて鋳型に誘導されるDNA合成の開始点として作用することができる一本鎖オリゴヌクレオチドを指す。プライマーの適切な長さはプライマーの意図される用途に依存するが、一般的には15〜40ヌクレオチドの範囲である。短いプライマー分子は、一般に、鋳型と共に十分に安定したハイブリッド複合体を形成するために比較的低い温度を必要とする。プライマーは鋳型の正確な配列を反映する必要はないが、鋳型とハイブリダイズするために十分に相補的でなければならない。プライマー部位という用語は、プライマーがハイブリダイズする標的DNAの領域を指す。プライマーペアという用語は、増幅対象であるDNA配列の5'末端とハイブリダイズする5'上流プライマーおよび増幅対象である配列の3'末端の相補型とハイブリダイズする3'下流プライマーを含むプライマーのセットを意味する。
多型は、ウイルス集団内における2種類またはそれよりも多い遺伝学的に調べられた代替配列または対立遺伝子の出現を指す。最初に識別された対立形質は恣意的に基準型と命名されて、その他の対立形質は代替または変異型対立遺伝子と命名される。この場合、多型はグリシンがセリンで置換される70位を含む。
一塩基多型は1個のヌクレオチドによって占められる多型部位に生じる多型であり、これは対立遺伝子配列の間の変異部位である。この部位は、通常、前後に対立遺伝子の保存配列(例えば、集団の1/100または1/1000未満のメンバーにおいて変異する配列)を持つ。
一塩基多型は、通常、多型部位において1個のヌクレオチドがもう1つのヌクレオチドと置換することによって生じる。トランジションは、1個のプリンのもう1個のプリンによる、または1個のピリミジンのもう1個のピリミジンによる置換である。トランスバーションは、プリンのピリミジンによる、またはその逆の置換である。一塩基多型は、基準対立遺伝子からのヌクレオチドの欠失またはヌクレオチドの挿入によっても生じ得る。
多型のセットは、表12もしくは13および/または表3a〜eに示される少なくとも2つ、時には5つまたはそれよりも多い多型を意味する。
ハイブリダイゼーションは、通常、オリゴヌクレオチドと表12もしくは13および/または表3a〜eに示される多型部位の1つを含む標的DNAの特異的な結合を可能とするストリンジェントな条件下にて実施される。ストリンジェントな条件は、表12または13に示される多型部位の少なくとも1カ所に位置する高度に相同な配列に対するオリゴヌクレオチドの特異的ハイブリダイゼーションを可能とする任意の適切な緩衝液の濃度および温度、ならびにオリゴヌクレオチドの非特異的結合を除去する洗浄条件として定義される。例えば、5×SSPE(750mM NaCl、50mMリン酸ナトリウム、5mM EDTA、pH 7.4)および温度 25〜30℃の条件は、対立遺伝子特異的プローブのハイブリダイゼーションに適している。
洗浄条件は、通常、室温から60℃までの範囲である。
「プライマー」という用語は、適切な条件下(即ち、4つの異なるヌクレオシド三リン酸、およびDNAポリメラーゼもしくはRNAポリメラーゼまたは逆転写酵素などの重合のための作用物質の存在下)において適切な緩衝液および適した温度にて鋳型に誘導されるDNA合成の開始点として作用することができる一本鎖オリゴヌクレオチドを指す。プライマーの適切な長さはプライマーの意図される用途に依存するが、一般的には15〜30ヌクレオチドの範囲であるが、より短いまたはより長いプライマーも使用することができる。短いプライマー分子は、一般に、鋳型と十分に安定したハイブリッド複合体を形成するために比較的低い温度を必要とする。プライマーは鋳型の正確な配列を反映する必要はないが、鋳型とハイブリダイズするために十分に相補的でなければならない。「プライマー部位」という用語は、プライマーがハイブリダイズする標的DNAの領域を指す。「プライマーペア」という用語は、増幅対象であるDNA配列の5'末端とハイブリダイズする5'上流プライマーおよび増幅対象である配列の3'末端の相補型とハイブリダイズする3'下流プライマーを含むプライマーのセットを意味する。
アミノ酸置換基を保存的または非保存的として分類するため、アミノ酸は次のようにグループ分けされる:I群(疎水性側鎖):ノルロイシン、met、ala、val、leu、ile;II群(中性親水性側鎖):cys、ser、thr;III群(酸性側鎖):asp、glu;IV群(塩基性側鎖):asn、gln、his、lys、arg;V群(鎖の配向に影響を及ぼす残基):gly、pro;およびVI群(芳香族側鎖):trp、tyr、phe。保存的置換基は同一クラス内のアミノ酸同士の置換を伴う。非保存的置換基は、これらの一つのクラスのメンバーともう一つのメンバーとの交換を構成する。
本明細書に記載される方法は、このような順序が理論的に可能である限り、記載される事象の任意の順序で実施してよい。さらに、値の範囲が示される場合は、記載される範囲の上限値および下限値の間のすべての介在値、ならびに対象範囲内に収まる任意のその他の記載値または介在値が本発明に含まれる。また、本発明の変異型に関するあらゆる任意の特徴は、独立して、または本明細書に記載される任意の1つもしくは複数の特徴と組み合わせて、記載または特許請求され得る。
単数の項目への言及は、複数の同一項目が存在する可能性を含む。より具体的には、本明細書および添付の特許請求の範囲で用いられる通り、単数形である「一つの(a)」、「一つの(an)」、「該(said)」および「その(the)」は、文脈によってそうでないことが明確に示される場合を除いて複数への言及を含む。特許請求の範囲はあらゆる任意の要素を排除するように記載され得ることがさらに示される。このように、この記載は、特許請求の要素に関する記載に関連して「専ら(solely)」、「のみ(only)」などのような排他的用語の使用、または「負」の制限の使用に関する前提の根拠として用いられることを意図するものである。
発明の詳細な説明
本発明は、一部分において、インフルエンザNS1タンパク質が哺乳動物PDZタンパク質と相互作用するPL領域を持ち、異なるPLモチーフが異なるPDZタンパク質と特異的に相互作用するという洞察を前提とする。本発明は、一部分において、NS1 PLタンパク質の検出可能な量が鼻分泌物などの身体分泌物中に見出され得るという結果をさらなる前提とする。インフルエンザAは正常な宿主細胞機能を侵害して病原性に至る変化を引き起こす。インフルエンザの一部の病原性株は、哺乳動物PDZタンパク質に結合するリガンドモチーフを持つ非構造NS1タンパク質を有することが発見されている。緊急毒性因子として、NS1タンパク質は宿主細胞高分子タンパク質複合体のPDZタンパク質構築に干渉する、またはそれをそらす(divert)可能性が高い。PDZタンパク質は正常な状態でシャペロン、エンドサイトーシスおよび分泌の過程にも関与することから、本明細書に開示される証拠は毒性インフルエンザ株が細胞のPDZをベースとする調節メカニズムを混乱させるという見解を強く支持する。本発明は、新規の診断用組成物および方法、ならびに治療用抗ウイルス標的および候補化合物を提供する。
この結果は、特定のPDZタンパク質がインフルエンザNS1に高い親和性および特異性で結合することを示す。PDZタンパク質は、インフルエンザAの毒性株のC末端トリ-およびテトラ-ペプチドNS1モチーフには結合するが、非毒性株では結合しない。方法の例証の通り、組換え型PDZタンパク質および交差反応性抗NS1モノクローナル抗体を用いて、インフルエンザAの病原性株および非病原性株(毒性および非毒性とも呼ばれる)を識別するためにキメラアッセイが構築された。このアッセイ方法は、対象由来の試験試料をPDZドメイン含有ポリペプチドと接触させる工程、および試料中の病原性インフルエンザA NS1 PDZリガンドがPDZリガンドポリペプチドに結合したかどうかを検出する工程を含んだ。PDZ含有ポリペプチドおよびウイルスPDZリガンドの結合により、NS1がインフルエンザAの毒性株由来であることが示された。患者試料に関してこのアッセイを用いた場合、この結果は対象がインフルエンザAウイルスの病原性株に感染していることを示す。このアッセイは、病原性株であるH5および/またはH7の識別に特に適している。より好ましくは、このアッセイはH5N1、H7N2、H7N7、H10N7を含む少なくとも1つの病原性株を識別し、最も好ましくはこのアッセイはH5N1の株を識別する。より好ましくは、このアッセイは、トリインフルエンザの現在の原因でありNS1 PLモチーフESEV(配列番号:2)を持つH5N1などのトリ株である病原性株を識別する。
インフルエンザAの様々な株が、異なるPDZリガンド(PL)を持つタンパク質をコードする。従って、インフルエンザAの様々な株がそれらのPLに基づいて識別可能である。そこで、本発明は、特異的なNS1 PLクラスとの関連性によってインフルエンザウイルスの亜型を決定するための方法も提供する。ヒト対象がインフルエンザウイルスのトリH5N1株に感染しているかどうかを判定するための方法も提供する。抗ウイルス物質を特定するためのアッセイも提供する。この方法は感染細胞内のみで産生されるウイルスNS1抗原を検出することから、この方法は現在感染してる対象を検出するためのスクリーニングにおいて有用である。この方法は、他の方法と異なり、ワクチン接種した対象と感染した対象とを識別できることから、特に有利である。感染した対象はウイルスNS1抗原を持つが、ワクチン接種した対象は持たない。最も好ましくは、この方法は、生物学的試料中に存在する場合、陽性検査結果を用いて、トリインフルエンザAの1つまたは複数の高病原性株を識別するためにトリインフルエンザAウイルスの異なる亜型を識別することができる。好ましくは、この検査方法は、例えば、商業的屠殺施設、農場または繁殖施設において、H5N1またはH7のようなトリインフルエンザAの高病原性株への感染に関してトリ対象をモニターする工程を含む。その他の態様において、本発明は、感染した動物を識別して、他の対象への伝染を阻止するためにそれらを除去および/もしくは駆除、ならびに/または治療することによって複数の対象におけるインフルエンザAウイルス流行の拡大を阻止するための方法を提供する。好ましくは、この方法は、低病原性株に感染した対象から例えばH5N1などのトリ亜型などの高病原性インフルエンザA株に感染したトリ対象およびヒト対象を識別する工程を含む。
本発明は、さらに、対象がインフルエンザウイルスに感染しているかどうか、および/またはその対象がインフルエンザAウイルスの高リスクのトリ株に感染しているかどうかを判定するための方法を提供する。この方法は、対象に由来する試験試料をPDZドメインポリペプチド、抗体、および/もしくはアプタマーならびに/またはNS1 PLを特異的に認識するその他の作用物質に接触させる工程、ならびに結合相互作用が試験試料中の分析物ならびにPDZドメインポリペプチド、抗体、および/またはアプタマーの間で生じているかどうかを判定する工程を伴う。対象の結合相互作用を評価および検出する工程は、試験試料がインフルエンザウイルスPLを含むことを調べるために用いられ、これによって対象が感染していることが識別される。この方法は、例えば、対象がH5N1などのトリインフルエンザウイルスの高リスク株(病原性)、または低リスクのH1N1株(非病原性)に感染しているかどうかを評価するなど、インフルエンザAウイルスの株間を区別することができる。例えば、医薬の開発において、薬用抗ウイルス性化合物を識別するために有用なスクリーニングアッセイも提供される。このように、本発明は様々な診断的および治療的応用において用途が見出される。
I.インフルエンザウイルス
インフルエンザウイルスはオルトミクソウイルス(Orthomyxoviridae)科に属し、それらの核タンパク質(NP)およびマトリックスタンパク質(M1)の抗原の違いに基づいてA、B、およびCのグループに分類される。株へのさらなる亜型分類は、一般に、2つのビリオン糖タンパク質、つまり血球凝集素(HA;H)およびノイラミニダーゼ(NA;N)に存在する抗原の種類の評価に基づく。HAおよびNPは、宿主細胞の表面へのビリオンの接続を介在する毒性因子である。M1タンパク質はウイルスの構築および排出において機能し、NPはRNAの複製および転写において機能すると考えられる。これらのビリオンタンパク質に加えて、ウイルス感染した細胞内ではその他の2つの非構造タンパク質(すなわち、ビリオン以外のタンパク質)が発現し、非構造タンパク質1および2(NS1;NS2)と呼ばれる。非構造ウイルスタンパク質NS1は、細胞mRNAのスプライシングおよび核外輸送の調節ならびに翻訳の刺激、さらに宿主インターフェロン能力の相殺を含む複数の機能を有する。インフルエンザウイルスのNS1タンパク質は、識別およびシーケンシングされており、その配列はNCBIデータベースで閲覧することができる。その他のインフルエンザウイルスのNS1タンパク質は、例えば、Genbankアクセッション番号CY003340、CY003324、DQ266101などの配列を用いて、公知のインフルエンザ亜型においてNS1タンパク質として識別されるタンパク質の1つと最も高い配列同一性を持つタンパク質を意味する。
トリインフルエンザウイルスはすべてA型に分類される。A型ウイルスはヒト、ブタ、ウマ、および海洋哺乳類、ならびに家禽および野禽から分離されている。1957年のアジア風邪および1968年の香港風邪はいずれもトリ供給源から派生したと考えられるウイルスによって引き起こされたことから、トリインフルエンザウイルスはヒトインフルエンザ感染爆発の発生に対する重要な要因である。近年、香港およびオランダにおいて、H5N1およびH7N7の亜型の純粋なトリインフルエンザウイルスが致命的なヒトの疾患を直接引き起こしている(Horimoto, T. and Kawaoka, Y. (2001) Clin. Microbiol. Rev. 14: 129-149;Guan, Y. et al. (2004) Proc. Natl. Acad. Sci. USA 101: 8156-8161)。
II.PL領域
以下の実施例は、インフルエンザウイルス病原体がPDZタンパク質に結合するPDZリガンドのモチーフを持つウイルスタンパク質を含むことを示す。PLモチーフを持つウイルスタンパク質には、血球凝集素(HA)、核タンパク質(NP)、マトリックス1(M1)、および非構造タンパク質1(NS1)のタンパク質が含まれる。しかし、(NS1タンパク質を除くすべてにおける)クラスIIのPLモチーフはPDZタンパク質に関して弱い結合を示す。PLモチーフは、一般に、タンパク質の最後の3つまたは4つのC末端アミノ酸に見出され得る。インフルエンザNS1タンパク質の大部分に見出される識別可能なモチーフはS/T-X-V/I/Lのモチーフであり、Sはセリンであり、Tはスレオニンであり、Vはバリンであり、Iはイソロイシンであり、Lはロイシンであり、Xは任意のアミノ酸である。各々の具体的モチーフの頻度は実施例1および表3a〜eに示す。EPEV(配列番号:27)およびKMAD(配列番号:28)は代表的なPLモチーフには対応しないが、それらはいくつかのレベルにおいてPDZに結合し、識別のために使用することもできる。表3a〜eおよび図1〜3の結果は、HおよびN抗原によって識別される亜型と対応するNS1 PLモチーフの非ランダムの相関性を示す。具体的なNS1 PLモチーフは、本明細書ではNS1 PLクラスとして記載される。
III.PDZタンパク質
PDZドメインは、形質膜でのタンパク質複合体の中央形成体(central organizer)として最近明らかとなってきた。PDZドメインは、元々、シナプス後肥厚部タンパク質PSD95/SAP90、ショウジョウバエ腫瘍抑制因子d1g-A、および密着結合タンパク質ZO-1における保存配列エレメントとして識別された。元々、GLGF(配列番号:26)またはDHRモチーフとして示されたが、現在ではそれらはこれらの最初の3つのPDZ含有タンパク質を示す頭字語(PDZ:PSD95/DLG/ZO-1)により公知である。現在、75を優に超えるタンパク質においてこれらの80〜90のアミノ酸配列が同定されており、単一のタンパク質において複数のコピーが特徴的に発現する。PDZドメインは、例えばPfamでは、米国立生物工学情報センター(www.ncbi.gov)によりファミリーとして認識されている。それらは、系統発生学を通じて、後生動物、植物、および細菌などの多様な有機体において見出されている。このような幅広い種への分布はこのドメインに特有と思われるが、PDZドメインの最も特徴的な特性は、恐らく、それらを含む圧倒的多数のタンパク質が形質膜に関連するという知見である。PDZドメインは多くの異なる構造物に見られるが、各PDZタンパク質は一般に、シナプス;細胞-細胞接触;または先端部、基底部、もしくは側面の細胞表面など、特定の細胞内ドメインに限定されている。このことから、PDZドメインは形質膜ドメインの構築において中心的役割を示すように早い段階で進化したことが推測される。PDZドメインの最も一般的な機能は、それらのリガンドを適切な形質膜ドメインに局在させることである可能性がある。極性化した上皮細胞の場合、PDZタンパク質は異なる先端部、基底-側面部、および接合部の膜ドメインに明らかに局在し、大半の場合ではそれらの膜貫通型およびサイトゾルの結合パートナーと共存する。PDZタンパク質は、また、明らかに特定の細胞内ドメイン内で膜貫通型タンパク質の空間的なクラスター形成およびアンカリングの基本的役割を持つ。
PDZドメインは、5〜6のβストランドおよび2つのαらせんのβサンドイッチを持つ構造物にたたみ込まれた約80〜90の残基を含む。ペプチドリガンドは、βストランド(bB)、αらせん、およびペプチドカルボキシレート基を結合するループから構成される疎水性間隙内で結合する。ペプチドはbBストランドに対して逆平行に結合し、C末端残基が疎水性ポケットを占有する。PDZヘテロダイマーは、パートナータンパク質の一つにおいて内部の認識に関与する直線性の頭-尾配列を形成する。PDZドメインタンパク質は当技術分野において公知であり、新しいタンパク質はタンパク質のシーケンシングおよびPDZドメインの存在を識別することによってPDZドメインを持つと識別することができる。PDZタンパク質については詳細に説明されており、2004年8月2日に出願された米国特許出願10/485,788に多くの実施例が示されている。または、PDZタンパク質であることが推測されるタンパク質は、様々なPLタンパク質またはNS1 PLクラスへの結合に関して検査することができる。
IV.PDZ/PL相互作用
NS1タンパク質は、実施例に示される通り、PDZタンパク質に結合したPLモチーフを含むインフルエンザに由来する。結合を識別するために用いられた方法を実施例2に示す。PDZドメインポリペプチドおよびPDZリガンドポリペプチド候補の結合を検出するための2つの相補的アッセイ(AおよびGアッセイ)については、2004年8月2日に出願された米国特許出願10/485,788および2003年11月14日に出願された10/714,537に詳細に示されている。2つの異なる各アッセイでは、1つまたは複数のPDZドメインへの結合に関与するタンパク質のC末端に対応する配列を持つペプチド(即ち、候補PLペプチド)およびPDZドメインポリペプチド(典型的にはPDZドメインを含む融合タンパク質)の結合が検出される。
A.PDZドメインポリペプチドおよびNMDAレセプターPLタンパク質の相互作用検出のためのアッセイ
「A」および「G」とされる2つの相補的アッセイは、PDZドメインポリペプチドおよび候補PDZリガンドの結合を検出するために開発された。2つの異なる各アッセイでは、1つまたは複数のPDZドメインへの結合に関与するタンパク質のC末端に対応する配列を持つペプチド(即ち、候補PLペプチド)およびPDZドメインポリペプチド(典型的にはPDZドメインを含む融合タンパク質)の結合が検出される。「A」のアッセイでは、候補PLペプチドを固定化して、この固定化したペプチドに対する可溶性PDZドメインポリペプチドの結合を検出する(「A」アッセイは、一つの態様においてペプチドの固定化にアビジン(avidin)表面が用いられることから命名される)。「G」アッセイでは、PDZドメインポリペプチドを固定化して、可溶性PLペプチドの結合を検出する(「G」アッセイは、PDZドメインポリペプチドを固定化するためにGST結合表面が用いられることからそのように命名される)。例示的アッセイを以下に説明する。
I.「Aアッセイ」−固定化したPLペプチドを用いたPDZリガンド結合の検出
このアッセイは以下を伴う。
(1)ビオチン化した候補PLペプチドをアビジンでコーティングした表面に固定化する。続いて、この表面へのPDZドメイン融合タンパク質の結合を測定する。
(2)アビジンは、例えば、タンパク質結合表面などの表面に結合する。アビジンは、カルシウムおよびマグネシウムを含まないpH 7.4のリン酸緩衝生理食塩液(「PBS」、GibcoBRL)中、4℃にて12時間、20μg/mLのアビジン(Pierce)をウェル当たり100μL加えることによって、ポリスチレン96穴プレート(例えば、Nunc Polysorb(カタログ番号475094)に結合させてもよい。続いて、非特異的な相互作用を遮断するために、100mL当たり2gのプロテアーゼフリーウシ血清アルブミンを含むPBS(「PBS/BSA」)を4℃にて2時間、ウェル当たり200μL加えることによってプレートを処理する。次に、プレートの各ウェルにPBSをウェル当たり200μLずつ繰り返し加えることによってプレートをPBSで3回洗浄した後、プレートの内容を廃棄用容器に空けて、プレートを乾燥した表面上で静かに叩く。
(3)ビオチン化PLペプチド(または候補PLペプチド)は、PBS/BSA中0.4μMペプチドを4℃にて30分間、ウェル当たり50μL加えて、プレートのウェルの表面に固定化する。通常、それぞれの異なるペプチドは、多数の測定(例えば、二反復、ならびに異なるGST/PDZドメイン融合タンパク質およびGST単独の陰性対照を用いた測定)が実施できるように少なくとも8つの異なるウェルに加えられ、またペプチドが固定化されていない追加の陰性対照のウェルも調製される。表面にPLペプチドを固定化した後、プレートをPBSで3回洗浄する。
(4)GST/PDZドメイン融合タンパク質は、PBS/BSA中5μg/mLのGST/PDZドメイン融合タンパク質を含む溶液を4℃にて2時間、ウェル当たり50μL加えることによって、表面と反応させる。陰性対照として、GST単独(即ち、融合タンパク質を含まない)を特定のウェル、一般的には固定化した各ペプチドにつき少なくとも2つのウェル(即ち、二反復測定)に加える。2時間の反応の後、未結合の融合タンパク質を除去するために、プレートをPBSで3回洗浄する。
(5)アビジン-ビオチン化したペプチド表面へのGST/PDZドメイン融合タンパク質の結合は、様々な方法および当技術分野において公知の検出物質を用いて検出され得る。一つの態様において、PBS/BSA中の抗GST抗体(例えば、ポリクローナルヤギ抗GST抗体 2.5μg/mL、Pierce)をウェル当たり50μL、プレートに加えて、4℃にて20分間、反応させる。プレートをPBSで3回洗浄して、第2の検出可能に標識した抗体を加える。一つの態様において、2.5μg/mLのセイヨウワサビペルオキシダーゼ(HRP)-抱合ポリクローナルウサギ抗ヤギ免疫グロブリン抗体をウェル当たり50μL、プレートに加えて、4℃にて20分間、反応させる。プレートを0.2% Tween 20を含む50mM Tris pH 8.0で5回洗浄して、HRP基質溶液(TMB、Dako)をウェル当たり100μL加えて室温(RT)で20分間、発色させる。1M硫酸をウェル当たり100μLで加えることによってHRPおよびその基質の反応を停止させて、プレートの各ウェルの吸光度(O.D.)を450nmで読み取る。
(6)PLペプチドおよびPDZドメインポリペプチドの特異的結合は、PLペプチドおよびPDZドメインポリペプチドが結合されているウェルからのシグナルをバックグラウンドのシグナルと比較することによって検出される。バックグラウンドのシグナルは陰性対照に見られるシグナルである。一般的には、特異的または選択的反応はバックグラウンドシグナルの少なくとも2倍であり、より典型的にはバックグラウンドの5倍よりも高く、最も典型的にはバックグラウンドシグナルの10倍もしくはそれよりも高い。さらに、統計学的に有意な反応は反応の複数回の測定を伴い、該シグナルおよびバックグラウンドは少なくとも2標準誤差、より典型的には4標準誤差、最も典型的には6またはそれよりも多い標準誤差だけ異なる。これに対応して、該シグナルの反復測定値をバックグラウンドの反復測定値と比較する統計学的検定(例えば、T検定)では、p値は<0.05となり、より典型的にはp値<0.01、最も典型的にはp値<0.001またはそれよりも低くなる。記載する通り、「A」アッセイの態様において、PLペプチドに曝されていない(即ち、コーティングされていない)アビジン表面へのGST/PDZドメイン融合タンパク質の結合に由来するシグナルは1つの適切な陰性対照である(時に、「B」と呼ばれる)。PLペプチドに露出されている(即ち、覆われている)アビジンコーティング表面へのGSTポリペプチド単独(即ち、融合タンパク質でない)の結合に起因するシグナルは、第2の適切な陰性対照である(時に「B2」と呼ばれる)。測定はすべて複数反復(即ち、少なくとも二反復)にて実施されるので、結合の判定にはいくつかの測定値の算術平均(または、同等の平均値)が用いられて、結合の測定における確率誤差の判定には平均の標準誤差が用いられる。N個の測定値の平均の標準誤差は次の平方根に等しい:各測定値および平均値の差の二乗の合計を(N)および(N-1)の積で割った値。従って、一つの態様において、プレート結合型PLペプチドに対するPDZタンパク質の特異的結合は、特定のPL-PDZの組み合わせにおける平均シグナル(「平均S」)およびシグナルの標準誤差(「SE」)を平均値B1および/または平均値B2と比較することによって求められる。
II.「Gアッセイ」−固定化したPDZドメイン融合ポリペプチドを用いたPDZリガンド結合の検出
一つの局面において、本発明はGST/PDZ融合タンパク質が表面に固定化されるアッセイを提供する(「G」アッセイ)。続いて、この表面に対する標識PLペプチド(例えば、図3a〜eに示されるものの1つ)の結合が測定される。好ましい態様において、アッセイは次の通り実施される。
(1)PDZドメインポリペプチドは、例えば、タンパク質結合表面などの表面に結合する。好ましい態様において、1つまたは複数のPDZドメインを含むGST/PDZ融合タンパク質はポリスチレン96穴プレートに結合される。GST/PDZ融合タンパク質は任意の様々な標準的方法によってプレートに結合されることができるが、プレートへの融合タンパク質の結合の過程がPDZドメインのリガンド結合特性を変化させないように一定程度の注意が必要である。一つの態様において、GST/PDZ融合タンパク質は96穴プレート上にコーティングした抗GST抗体を介して結合する。プレートへの十分な結合は次の場合に達成され得る:
a.ポリスチレン96穴プレート(例えば、Nunc Polysorb)に、PBS中5μg/mLヤギ抗GSTポリクローナル抗体(Pierce)を、4℃で2時間、ウェル当たり100μL加える。
b.PBS/BSAを、4℃で2時間、ウェル当たり200μL加えることによって、プレートを遮断する。
c.プレートをPBSで3回洗う。
d.プレートに、PBS/BSA中5μg/mLのGST/PDZ融合タンパク質)、または陰性対照としてGSTポリペプチド単独(即ち、融合タンパク質でない)を、4℃で2時間、ウェル当たり50μL加える。
e.プレートを再度、PBSで3回洗う。
(2)ビオチン化PLペプチドは、PBS/BSA中のビオチン化ペプチド溶液20μMを、4℃で10分間、ウェル当たり50μL加えた後、25℃でさらに20分間インキュベートして、表面と反応させる。プレートを氷冷PBSで3回洗う。
(3)ビオチン化ペプチドのGST/PDZ融合タンパク質表面への結合は、当業者に公知の様々な方法および検出物質を用いて検出され得る。例示的手順において、BSA/PBSに溶解した0.5μg/mLストレプトアビジン-セイヨウワサビペルオキシダーゼ(HRP)抱合体をウェル当たり100μL加えて、4℃にて20分間、反応させる。続いて、プレートを0.2% Tween 20を含む50mM Tris pH 8.0で5回洗浄して、HRP基質溶液(TMB、Dako)を、室温(RT)で20分間、ウェル当たり100μL加えて発色させる。1M硫酸をウェル当たり100μL加えることによってHRPおよびその基質の反応を停止させて、プレートの各ウェルの吸光度(O.D.)を450umで読み取る。
(4)PLペプチドおよびPDZドメインポリペプチドの特異的結合は、PLペプチドおよびPDZドメインポリペプチドが結合されているウェルからのシグナルをバックグラウンドのシグナルと比較することによって測定される。バックグラウンドのシグナルは陰性対照に見られるシグナルである。一般的には、特異的または選択的反応はバックグラウンドシグナルの少なくとも2倍であり、より典型的にはバックグラウンドの5倍よりも高く、最も典型的にはバックグラウンドシグナルの10倍またはそれよりも高い。さらに、統計学的に有意な反応は反応の複数回の測定を伴い、該シグナルおよびバックグラウンドは少なくとも2標準誤差、より典型的には4標準誤差、最も典型的には6またはそれよりも多い標準誤差だけ異なる。これに対応して、該シグナルの反復測定値をバックグラウンドの反復測定値と比較する統計学的検定(例えば、T検定)では、p値は<0.05となり、より典型的にはp値<0.01、最も典型的にはp値<0.001またはそれよりも低くなる。記載の通り、「G」アッセイの態様において、所与のPLペプチドの固定化した(表面結合型)GSTポリペプチド単独への結合によるシグナルは、1つの適切な陰性対照である(時に、「B1」と記載される)。測定はすべて複数反復(即ち、少なくとも二反復)にて実施されるので、結合の判定にはいくつかの測定値の算術平均(または、同等の平均値)が用いられて、結合の測定における確率誤差の判定には平均の標準誤差が用いられる。N個の測定値の平均の標準誤差は次の平方根に等しい:各測定値および平均値の差の二乗の合計を(N)および(N-1)の積で割った値。従って、一つの態様において、プレート結合型ペプチドに対するPDZタンパク質の特異的結合は、特定のPL-PDZの組み合わせにおける平均シグナル(「平均S」)およびシグナルの標準誤差(「SE」)を平均値B1と比較することによって求められる。
(i)「G'アッセイ」および「G"アッセイ」
「Gアッセイ」に関する前記の特定の条件の2つの特定の変更は特に有用である。変更されたアッセイはより少ない量の標識PLペプチドを使用し、前記の特定のアッセイ条件に比してPDZリガンド結合の検出に関して生化学的要件が若干異なる。
便宜上、この章に記載されるアッセイ条件は「G'アッセイ」および「G"アッセイ」に関して記載され、前章においてGアッセイについて記載された特異的条件は「G0アッセイ」に関して記載されたものである。「G'アッセイ」は、工程(2)のペプチド濃度が20μMではなく10μMである点を除いて、「G0アッセイ」と同一である。この結果、親和性が低く、かつ/または解離速度の速い相互作用の検出の感度が若干低下する。これに対応して、検出される相互作用は生物学的な重要性および有用な治療上の標的であるのに十分な親和性および半減期であるという確実性が若干高まる。
「G"アッセイ」は、工程(2)においてペプチド濃度が20μMではなく1μMであり、インキュベートが(例えば4℃にて10分間、続いて25℃にて20分間ではなく)25℃において60分間実施されることを除いて、「G0アッセイ」と同一である。この結果、親和性が低く、解離速度が速く、かつ/または25℃での親和性が4℃での場合よりも低い相互作用に関する感度が低下する。(本発明者らが、PDZリガンド結合においては概ね真実であることを見出しているように)反応エントロピーが負である(即ち、産物のエントロピーが反応物質のエントロピーよりも低い)場合、相互作用は4℃の場合よりも25℃において低い親和性を有すると考えられる。一方、PDZ-PL結合シグナルは、PDZ-PL複合体が「G"アッセイ」の比較的長いインキュベート期間中に蓄積することから、会合および解離速度の遅い相互作用に関しては「G"アッセイ」および「G0アッセイ」において類似である可能性がある。従って、「G"アッセイ」および「G0アッセイ」の結果の比較は、異なるPDZ-PL相互作用の相対的なエントロピー、エンタルピー、およびキネティクスを求めるために用いることができる。(エントロピーおよびエンタルピーは、ΔG=RT ln(Kd)=ΔH−TΔSの等式により結合親和性に関連し、ここでΔG、HおよびSは、それぞれ、反応フリーエネルギー、エンタルピー、およびエントロピーであり、TはKelvinを単位とする温度であり、Rは気体定数、Kdは平衡解離定数である)。特に、「G0アッセイ」においてのみ、または「G0アッセイ」において極めて強く検出される相互作用は一般に25℃において早い解離速度(t1/2<10分)および負の反応エントロピーを有するが、「G"アッセイ」において同様に強く検出される相互作用は一般に25℃において遅い解離速度(t1/2>10分)を有する。(前記に概述する通り「G"アッセイ」に対する「G0アッセイ」の結果の比較により達成され得る)PDZ-PL相互作用の熱力学およびキネティクスに関する大雑把な推定は、相互作用の効率的阻害剤の設計に使用することができる。例えば、(「G"アッセイ」において「G0アッセイ」と類似の結合によって示される)所与のPDZドメインから緩徐に解離するPLの化学的構造に基づく小分子阻害剤はそれ自体、緩徐に解離し、従って、高親和性であり得る。
この方法で、PDZリガンド結合反応のキネティクスおよび熱力学ならびに反応阻害剤の設計に関する洞察を得るために、「Gアッセイ」の工程(2)の温度および期間のバリエーションを用いることができる。
本発明の検出可能な標識は、(上記のような)分子と直接または間接的に抱合する任意の検出可能な化合物または組成物であってよい。標識は単独で検出可能であってもよく(例えば、放射性同位体標識または蛍光標識)、または酵素的標識の場合は検出可能な基質の化合物または組成物の化学的変化を触媒してもよい。好ましい標識は、非放射性発色試薬の色の変化を触媒する酵素的な標識である。
時に、標識は抗体と間接的に抱合される。当業者は、間接的抱合体形成に関して様々な技術を認識している。例えば、抗体はビオチンと抱合することができ、上記の任意のカテゴリーの標識はアビジンと抱合することができ、またはその逆も可能である(上記の「A」および「G」アッセイも参照されたい)。ビオチンは選択的にアビジンに結合し、従って、この標識はこの間接的な方法で抗体と抱合することができる。ビオチン-アビジン抱合および同様のアッセイに関する技術の総説については、前記のAusubelを参照のこと。または、標識と抗体との間接的抱合を達成するために、抗体は小さなハプテン(例えば、ジゴキシン)と抱合し、上記の異なる種類の標識の一つが抗ハプテン抗体(例えば、抗ジゴキシン抗体)と抱合する。このように、標識と抗体との間接的抱合が達成され得る。
アッセイのバリエーションは異なる洗浄工程を含み得る。「洗浄」とは、固相を水相溶液(通常は緩衝液または細胞培養培地)に曝露する工程を意味し、このようにして未結合の材料(例えば、非付着性細胞、非付着性捕捉物質、非結合リガンド、レセプター、レセプター構築物、細胞溶解液、またはHRP抗体)がそれらから除去される。バックグラウンドのノイズを減らすために、洗浄液に界面活性剤(例えば、トリトンX)を含めることが利便性がよい。通常、水性洗浄液を洗浄後にアッセイプレートのウェルからデカントする。好都合なことには、洗浄は自動洗浄装置を用いて達成してもよい。時には、いくつかの洗浄工程(例えば、約1回〜10回の間の洗浄工程)が必要となり得る。
PDZ-PL検出アッセイでは、様々な緩衝液も使用できる。例えば、アッセイのバックグラウンドを抑制するために、様々なブロッキング緩衝液も使用できる。「ブロッキング緩衝液」という用語は、PLまたはPDZ含有タンパク質でコーティングされていない基質の露出表面に結合することができる少なくとも1つのブロッキング化合物を含む水性のpH緩衝液を指す。ブロッキング化合物は、通常、ウシ血清アルブミン(BSA)、ゼラチン、カゼイン、または粉ミルクなどのタンパク質であり、アッセイではいずれの試薬にも交差反応(cross reat)しない。ブロック緩衝液は、一般に、約7〜7.5のpHを示し、適切なブロッキング物質にはホスフェートおよびTRISが含まれる。
また、PDZ-PL相互作用の検出には、様々な酵素-基質の組み合わせが利用できる。酵素-基質の組み合わせの例には、例えば次が含まれる。
(i)セイヨウワサビペルオキシダーゼ(HRPO)、および基質として、色素前駆物質(例えば、オルトフェニレンジアミン[OPD]または3,3',5,5'-塩酸テトラメチルベンジジン[TMB])(上記の通り)を酸化する水素ペルオキシダーゼ。
(ii)アルカリホスファターゼ(AP)、および色素産生性基質としてパラ-ニトロフェニルホスフェート。
(iii)β-D-ガラクトシダーゼ(βD-Gal)および色素産生性基質(例えば、p-ニトロフェニル-β-D-ガラクトシダーゼ)または蛍光発生性基質である4-メチルウンベリフェリル-β-D-ガラクトシダーゼ。その他の多くの酵素-基質組み合わせが利用可能である。これらの全般的な総説として、いずれも参照により本明細書に組み入れられる米国特許第4,275,149号および第4,318,980号を参照されたい。
次頁の表1および2は、本明細書において相互の結合が識別されているPDZドメイン含有タンパク質(「PDZタンパク質」)およびPDZリガンド(「PL」)を列記する。それぞれのPLタンパク質は少なくとも1つのPDZタンパク質に関して結合親和性を持つ。表1の2列目は、PLタンパク質の派生元であるインフルエンザAタンパク質のリストである(例えば、血球凝集素(HA)、核タンパク質(NP)、マトリックス(M1)、および非構造タンパク質1(NS1);3列目はPLモチーフアミノ酸配列のリストである;さらに4列目はPLに結合するPDZドメインタンパク質のGenBank識別番号(GI番号)を示す(このデータベースの登録項目は、そこに記載される注釈を含めて、参照により本明細書に組み入れられる)。
(表1)PDZ-PL相互作用
*
* 実験的に確認された相互作用。
PDZタンパク質は、それらが活性PDZドメインを含む限り、融合タンパク質として産生することができる。例えば、GST-PDZ融合タンパク質産生のためにベクター(PGEX-3Xベクター)にクローニングされたPDZドメイン(Pharmacia)が作成されて、例えば、参照により全体が本明細書に組み入れられる米国特許出願第10/485,788号 (2004年2月3日出願)、国際特許出願PCT/US03/285/28508(2003年9月9日出願)、国際特許出願PCT/US01/44138(2001年11月9日出願)などの先行の米国および国際特許出願において教示されている。
V.PDZタンパク質のスクリーニング
スクリーニングの方法は、配列解析および/またはドメイン解析の使用のために公知である任意のコンピュータプログラムを用いた、PDZドメインを識別するための配列解析の使用を含むことができる。一旦、PDZタンパク質が識別されると、それはインフルエンザPLタンパク質との相互作用の可能性についてスクリーニングすることができる。
PDZタンパク質またはPDZドメインポリペプチドはPDZドメインを含む任意のタンパク質である。天然型、組み合え型、キメラ型、またはフラグメントにかかわらず、PDZドメインを含む任意のタンパク質を、インフルエンザPLドメインへの結合能力についてスクリーニングすることができる。PDZドメインの識別方法は、参照によりそれらの全体が本明細書に組み入れられる米国特許出願第10/485,788号(2004年2月3日出願)、国際特許出願PCT/US03/285/28508(2003年9月9日出願)、国際特許出願PCT/US01/44138(2001年11月9日出願)に示されている。
VI.その他のPL結合物質のスクリーニング
診断用アッセイでの使用に適したPL結合物質は、1つまたは複数のPLモチーフに特異的に結合する任意の作用物質を含む。このような作用物質は、抗ウイルス物質に関するスクリーニングの方法において開示された同一の方法を用いて識別することができる。例えば、作用物質はPLモチーフを含むタンパク質を用いて識別することができる。試験化合物は、例えば発現ライブラリおよび低分子ライブラリを含む任意の種類のライブラリを用いて識別することができる。治療薬または治療用リード(therapeutic lead)に関するスクリーニングにおいて用いるための試験化合物の好ましいソースはファージディスプレイライブラリである。例えば、Devlin, WO 91/18980; Key, B.K., et al., eds., Phage Display of Peptides and Proteins, A Laboratory Manual, Academic Press, San Diego,CA, 1996を参照されたい。ファージディスプレイは、108〜109の異なる配列を含むライブラリから所望の特徴のペプチドまたはタンパク質を選択し、かつ増幅するためにファージの遺伝学的性質を使用することを可能とする強力な技術である。ライブラリは、所望の特徴に対するライブラリの偏りを考慮して、所望の位置におけるアミノ酸配列の特定の多様性のために設計され得る。ライブラリは、ペプチドがバクテリオファージの表面に発現したタンパク質に融合して発現するように設計される。所望の特徴のファージ発現ペプチドが選択されて、増殖のために再成長させることができる。ペプチドはファージの増殖によって増幅されることから、特定のファージに由来するDNAは容易にシーケンシングされ得て、特定のペプチドの迅速な解析が促進される。
ペプチド阻害物質をコードするファージは、PDZドメインタンパク質および/またはNS1 PLに特異的に結合するファージについて選択することによって選択され得る。ライブラリは、ファージの表面に発現する遺伝子IIなどのタンパク質に融合して作成される。ライブラリは様々な長さのペプチドから構成され得て、直線性または2つのCysアミノ酸の包含によって拘束され、ファージタンパク質に融合され得て、または足場としての別のタンパク質に融合されてもよい。本明細書に開示されるPL領域の方向に偏っている、または追加の試験阻害物質化合物を提供する最初のライブラリからの結合ファージの選択から得られるペプチド配列の方向に偏っているライブラリを設計することもできる。
VII.診断用および治療用用途のための抗体
本発明のNS1、NS1 PL、PDZ、およびPDZ PL結合ドメインポリペプチドは、診断および治療における使用のための抗体を作成するために有用である。抗体は、ポリクローナル抗体、別のモノクローナル抗体、または異なるエピトープ特異性を持つプールされたモノクローナル抗体であり得る。モノクローナル抗体は、抗体の種類に基づく標準的手順によりタンパク質の抗原含有フラグメントから作成される(例えば、Kohler, et al., Nature, 256:495, (1975);およびHarlow & Lane, Antibodies, A Laboratory Manual (C.S.H.P., NY, 1988) Queen et al., Proc. Natl. Acad. Sci. USA 86:10029-10033 (1989)、ならびにWO 90/07861;Dower et al., WO 91/17271 およびMcCafferty et al., WO 92/01047(それぞれ、すべての目的のために参照により組み入れられる)を参照されたい)。ファージディスプレイ技術は、本発明のペプチドに対して親和性を持つことが予め示された抗体のCDR領域を突然変異誘発するためにも用いることができる。一部の抗体は、NS1またはPDZタンパク質の1つの型に存在するエピトープに結合するが、その他には結合しない。例えば、いくつかの抗体はNS1のC末端PL位置においてエピトープに結合する。特異的NS1 PLモチーフに結合する抗体はNS1 PLクラス特異的抗体として分類され得る。さらに、いくつかの抗体はPDZタンパク質のPDZドメイン内のエピトープに結合する。いくつかの抗体は、表1に示すようなPDZポリペプチドに特異的に結合して、その他には結合しない。抗体は、例えば、抗体が生じたポリペプチドまたはペプチドが結合する支持体に結合する、およびそれらから溶出することによって、精製することができる。
「抗体」または「免疫グロブリン」という用語は、完全な抗体およびその結合フラグメントを含めるために用いられる。一般的には、フラグメントは、異なる重鎖、軽鎖であるFab、Fab'、F(ab')2、Fabc、およびFvを含む抗原フラグメントへの特異的結合に関して、派生元となった完全な抗体と競合する。フラグメントは、組換えDNA技術によって、または完全免疫グロブリンの酵素的もしくは化学的分離によって作出される。「抗体」という用語は、その他のタンパク質と共に融合タンパク質に化学的に抱合する、または融合タンパク質として発現する1つまたは複数の免疫グロブリン鎖も含む。「抗体」という用語は二重特異性抗体も含む。二重特異性抗体または二機能性抗体は、2つの異なる重鎖/軽鎖ペアおよび2つの異なる結合部位を持つ人工的ハイブリッド抗体である。二重特異性抗体は、ハイブリドーマの融合またはFab'フラグメントの連結を含む様々な方法によって作出され得る。例えば、Songsivilai & Lachmann, Clin. Exp. Immunol. 79:315-321 (1990);Kostelny et al., J. Immunol. 148, 1547-1553(1992)を参照されたい。
抗体は、インフルエンザA感染およびその亜型、特にトリインフルエンザA感染の予測および診断のための試薬として(例えば、包装済みキットの状態で)利用することができる。インフルエンザA感染を予測および診断するために、様々な方法を用いることができる。
A.汎反応性抗体
汎反応性(pan-reactive)または汎特異的(pan-specific)抗体は、任意のすべてのインフルエンザAウイルスNS1タンパク質に結合する、または3つよりも多くの、もしくはより好ましくは5つよりも多くのインフルエンザNS1タンパク質に結合するモノクローナルまたはポリクローナル抗体である。好ましくは、汎反応性または汎特異的抗体は少なくとも次の3つのインフルエンザA株を認識する:H5N1、H3N2、およびH1N1。汎反応性抗体は、それがどの亜型であるかを識別することなくインフルエンザAウイルスの存在を識別するために用いることができる。 従って、汎反応性モノクローナル抗体はNS1タンパク質の保存領域を特異的に認識することができ、またはNS1タンパク質の2つもしくはそれよりも多いPL領域または特異的なNS1 PLクラスを認識することができる。NS1タンパク質の好ましい保存領域は、例えば、RNA結合ドメインに見出され得て、米国立生物工学情報センターのウェブサイトではNCBI IVNS1ABPとして示されている。一方、PL領域はウイルス亜型間で異なることが示されていて、NS1領域の1つよりも多いPLに結合するモノクローナル抗体を識別することが可能である。
しかし、汎反応性抗体のその他の態様には、全体的に見て、すべてまたは多くのインフルエンザAウイルスを識別するポリクローナル抗体および/またはモノクローナル抗体の混合物が含まれる。これらの抗体はNS1タンパク質の保存領域または非保存領域を認識することができる。抗体がNS1 PL領域を認識する場合、抗体の混合物は好ましくはPL領域をさらに含むNS1を認識する:ESEV(配列番号:2)、ESEI(配列番号:3)、ESKV(配列番号:4)、TSEV(配列番号:5)、GSEV(配列番号:6)、RSEV(配列番号:7)、RSKV(配列番号:8)、GSEI(配列番号:9)、GSKV(配列番号:10)、NICI(配列番号:11)、TICI(配列番号:12)、RICI(配列番号:13)、DMAL(配列番号:14)、DMTL(配列番号:15)、DIAL(配列番号:16)、DLDY(配列番号:17)、SICL(配列番号:18)、SEV、SEI、SKV、およびSKI。1つよりも多い抗体および/またはPDZタンパク質が用いられる場合、PDZタンパク質は好ましくは表1または2から選択される少なくとも1つであり、抗体は好ましくはPDZタンパク質の少なくとも1つを模倣する。
B.PDZタンパク質のモノクローナル抗体の代用物
上記および実施例に示す通り、NS1タンパク質のPLモチーフを認識して結合するPDZタンパク質は多様である。同一モチーフを認識する抗体をこれらのPDZタンパク質の代用として用いることができる。好ましくは、PDZタンパク質は次の1つである:外膜タンパク質、PSD95(PDZ#2)、PSD95(PDZ#1、2、3)、DLG1(PDZ#1)、DLG1(PDZ#1、2)、DLG1(PDZ#2)、DLG2(PDZ#1)、DLG2(PDZ#2)、Magi3(PDZ#1)、PTN3(PDZ#1)、MAST2(PDZ#1)、NeDLG(PDZ#1、2)、Shank1 d1、Shank2 d1、Shank3 d1、シントロフィン1α、シントロフィンγ1、Magi1(PDZ#1)、Magi1(PDZ#4)、Tip1;PTPL1(PDZ#1)、Mint3(PDZ#1)、Lym Mystique(PDZ#1)、DLG2(PDZ#3)、MUPP1(PDZ#8)、NeDLG(PDZ#1)、DLG5(PDZ#1)、PSD95(PDZ#1)、NumBP(PDZ#3)、LIMK1(PDZ#1)、KIAA0313、DLG1(PDZ#2)、シンテニン(PDZ#2)、Pickl、または類似体もしくはフラグメント。より好ましくは、抗体はPL ESEV(配列番号:2)を特異的に認識する任意のPDZタンパク質を模倣する。特異的NS1 PLモチーフを認識する抗体代用物は、NS1 PLクラス特異的と命名することができる。
C.抗体およびその他の結合物質の混合物
抗体およびPDZタンパク質(ならびに/またはアプタマー)の混合物は任意のアッセイで使用することができる。PDZタンパク質および抗体は、異なる亜型のNS1の識別、インフルエンザAウイルスの識別、および低病原性型と比較した病原性型の識別に使用することができる。いくつかのアッセイにおいて、抗体およびPDZタンパク質は混合して一緒に試料に投与される。その他のアッセイにおいて、抗体およびPDZタンパク質は分離して、2つの異なる亜型の識別のため、または亜型の識別を確認するために、異なる試料に結合させる。
VIII.アプタマー
アプタマーは、膨大な集団の無作為配列からインビトロにおいて選択され、結合ポケットを形成することによって特異的リガンドを認識するRNA分子またはDNA分子である。アロステリックリボザイムは、活性部位から離れて位置するアプタマードメインへのエフェクター分子の結合によって活性が調節されるRNA酵素である。これらのRNAは、特異的なエフェクターの存在または不在によって制御される精密な分子スイッチとして作用する。アプタマーは核酸、タンパク質、さらには生物体全体に結合することができる。アプタマーは抗体とは異なるものの、様々な診断様式において抗体の特性を模倣する。従って、アプタマーは、一般的および特異的なNS1 PL領域の存在を識別するために、抗体および/もしくはPDZタンパク質の代わりに、またはそれらと組み合わせて使用することができる。
IX.NS2配列および病原性の相関性
インフルエンザAの非構造タンパク質であるNS1およびNS2はいずれも、同一の遺伝子から異なるスプライシングを用いて産生される。起こるスプライシングのタイプによってNS1およびNS2タンパク質のカルボキシ末端に差が生じる。NS1の場合にはこれによってカルボキシ末端は特徴的なPLとなり、NS2の場合はC末端にPLを持たない。NS1におけるPL領域の特異的配列は病原性と相関し得ることから、NS2タンパク質の変化についてあらゆる種類の相関性を分析した。病原性株のスプライシングの結果生じるNS2配列を非病原性株に比較して解析した。配列は、表12および13に示すタンパク質レベルおよびヌクレオチドレベルの双方にて解析した。表から、70位のグリシンからセリンへの置換は、1918のH1N1株を基準とすると特に、病原性および/またはウイルスの毒性と高度に相関することが示される。例示的NS2配列は、例えばAF144307のように米国立生物工学情報センター(www.ncbi.gov)に記載されるH5N1株により記載されて、配列を最大限に整列させた場合、他のNS2タンパク質のアミノ酸およびアミノ酸をコードするコドンはそれに応じて番号付けされる。この相関性により、所与のインフルエンザA株が病原性であるかどうかを分析するために、Ser 70におけるNS2多型を使用する方法は、別の試験として識別される。方法は特異的インフルエンザ株を識別するためにも使用することができる。または、NS2多型は、病原性を識別するために、または異なる方法で識別される病原性を確認するために、本明細書に開示されるNS1試験と組み合わせて用いることができる。
NS2タンパク質におけるSer 70配列変化に関するスクリーニング方法には、タンパク質レベルまたはヌクレオチドレベルでの変化を同定する方法が含まれる。
1. タンパク質をベースとする診断的検査
本発明は、インフルエンザAウイルス、インフルエンザAウイルス株、および病原性インフルエンザAウイルス株を識別するために、Ser 70を含むNS2タンパク質の存在を識別するための、タンパク質をベースとする診断的検査を提供する。NS2におけるSer 70多型配列を用いた診断的検査は、NS1解析における使用と同一の様式で用いることができる(第VIII節およびその他の関連する項を参照されたい)。このアッセイは70位におけるセリンの存在を識別し、セリンが存在する場合はインフルエンザ株を病原性と識別する。セリンが存在しない場合は、インフルエンザ株は非病原性と識別される。
NS2タンパク質におけるセリン70の変化を認識するモノクローナルまたはポリクローナル抗体は、インフルエンザ株をインフルエンザAと同定するために使用することができ、特定のインフルエンザA株を同定することができ、さらにウイルスが病原性であるかどうかを識別することができる。NS2抗体はセリン70の存在を認識するように作出することができ、病原性株を識別するために使用することができる。例えば、NS2領域が70位にセリンを持つように、表12または13に示されるペプチドを用いて抗体を作出することができる。続いて、Ser-70抗体は、70位にグリシンまたはその他のアミノ酸を持つペプチドと交差反応するかどうかを確認するためにスクリーニングすることができる。または、各株についてセリン 70を含む特異的配列を認識する抗体を作出することが可能であり、株特異的抗体が作出される(NS1抗体に適用される第VIII節も参照されたい)。いくつかのアッセイにおいて、抗体は株を病原性と識別するために使用される。いくつかのアッセイにおいて、NS2抗体はNS1抗体の代替として用いられる。いくつかのアッセイにおいて、NS2抗体は、NS1タンパク質を用いる任意のアッセイにおいてNS1抗体と組み合わせて用いられる。NS2抗体は、特定のインフルエンザAウイルスを識別するため、ウイルスをインフルエンザAウイルスとして識別するため、またはウイルスを病原性として識別するために使用することができる。
または、ファージディスプレイライブラリ技術によって選択されるペプチドのようなその他の結合物質を抗体の代用として使用することができる。
2.核酸診断的検査
本発明は、Ser 70を含むタンパク質をコードするNS2核酸の存在を識別するための核酸をベースとする診断的検査も提供する。これらはインフルエンザAウイルス、インフルエンザAウイルス株、および病原性インフルエンザAウイルス株を識別するために使用することができる。診断的検査は、様々な様式で、NS2におけるSer 70をコードするコドンを含む配列を使用する。例えば、診断的検査はSer 70をコードする配列と相補的なプローブまたはプライマーを使用することができる。好ましくは、表12に示されるペプチドをコードする配列が用いられる。Ser 70が存在すると識別されると、インフルエンザウイルスは病原性と識別される。
NS2における多型の検出の方法。NS2核酸に関する表12に示されるSer 70を含む配列を占有する塩基の識別は、順次記載されるいくつかの方法によって試料中で調べることができる。
A.一塩基伸長法
一塩基伸長法は、例えば、US 5,846,710、US 6,004,744、US 5,888,819、およびUS 5,856,092に記載されている。要約すると、これらの方法は、プライマーの3'末端が標的配列の潜在的変異部位に直接的に隣接はするがこれにまたがらないように標的配列に相補的なプライマーをハイブリダイズすることによって機能する。つまり、プライマーは多型部位に直接的に隣接する塩基および5'の塩基において終了する標的ポリヌクレオチドの相補配列に由来する部分配列を含む。ハイブリダイゼーションは、潜在的変異部位を占める可能性のある塩基に相補的な1つまたは複数の標識ヌクレオチドの存在下で実施される。例えば、NS2 Ser 70多型をコードする配列の場合、1つまたは複数の標識ヌクレオチドプライマーが使用され得る。各多型のためのプライマーは、多型を差別化するために異なる標識を含むことができる。好ましくは、プライマーはスプライシング部位と重複するまたはスプライシング部位を一部コードする。このことは、スプライシング部位または多型領域のいくつかの部分はプライマーに、好ましくはSer 70の位置に含まれることを意味する。いくつかの方法、特に複数の差次的に標識されたヌクレオチドを用いる方法の場合、ヌクレオチドはジデオキシヌクレオチドである。ハイブリダイゼーションは、標的配列において変異部位を占める塩基に対して相補的なヌクレオチドが存在する場合、プライマーの伸長を可能とする条件下で実施される。伸長では標識ヌクレオチドが取り込まれ、これによって標識伸長プライマーが生成する。複数の差次的標識ヌクレオチドが使用され、かつ、標的がヘテロ接合型である場合は、多数の差次的に標識された伸長プライマーが得られ得る。伸長プライマーは、どの塩基が標的ポリヌクレオチドの変異部位を占めるかが示されれば、検出される。
B.対立遺伝子特異的プローブ
多型の分析のためのプローブの設計および使用については、例えば、Saikiら、Nature 324,163-166 (1986);Dattagupta, EP 235,726、Saiki, WO 89/11548に記載されている。この開示を用いて、1つの種類のウイルスまたはウイルス株由来の標的DNAのセグメントに対してはハイブリダイズするが、2つのウイルスに由来するそれぞれのセグメントでは異なる多型の型が存在するために、もう1つの種類のウイルスまたはウイルス株に由来する対応するセグメントにはハイブリダイズしないSer 70多型を含む特異的配列を認識するプローブを設計することができる。ハイブリダイゼーションの条件は、Ser 70領域の対立遺伝子間のハイブリダイゼーション強度には顕著な差があるほど十分にストリンジェントでなければならず、好ましくは本質的にバイナリーな反応であり、これによってプローブは対立遺伝子の一方にのみハイブリダイズする。いくつかのプローブは、Ser 70の多型部位がプローブの中央の位置(例えば、15塩基長の場合は7の位置;16塩基長の場合は8または9の位置)に整列するように標的DNAのセグメントにハイブリダイズするように設計される。プローブのこの設計は、異なるウイルスおよび/または株に由来するNS2タンパク質をコードする異なる核酸間のハイブリダイゼーションにおいて優れた識別を行う。
これらのプローブはしばしば対で用いられて、対の一方のプローブは標的配列の1つの基準型に対して完全な対応を示し、他方のプローブは変異型または異なる基準型に対して完全な対応を示す。続いて、同一標的配列内の複数の多型の同時分析のために、プローブのいくつかのペアを同一の支持体上に固定化してもよい。多型は核酸列へのハイブリダイゼーションによっても識別することができて、このいくつかの例についてはWO 95/11995(すべての目的のために参照によりその全体が組み入れられる)に示されている。
C.対立遺伝子特異的増幅方法
対立遺伝子特異的プライマーは多型に重複する標的DNAの位置にハイブリダイズして、プライマーが完全な相補性を示す対立遺伝子の型の増幅のみを刺激する。Gibbs, Nucleic Acid Res. 17,2427-2448 (1989)を参照されたい。このプライマーは遠位部位にハイブリダイズする第2のプライマーと組み合わせて用いられる。増幅は2つのプライマーから進行して、特定の対立遺伝子型が存在することを示す検出可能産物が産生される。制御は通常、第2のプライマーペアを用いて行われ、その一方は多型部位において単一塩基のミスマッチを示し、他方は遠位部位に対する完全な相補性を示す。単一塩基のミスマッチによって増幅が阻止されて、検出可能な産物は形成されない。いくつかの方法では、ミスマッチは多型と共に整列したオリゴヌクレオチドの最も3'寄りの位置に含まれるが、これはこの位置がプライマーからの伸長に対して最も不安定化しているためである。例えば、WO 93/22456を参照されたい。この場合は、対立遺伝子特異的プライマーはSer 70の位置を含むNS2のスプライス位置に重複するように設計され得る。
D.直接的シーケンシング
本発明のNS2多型の配列の直接解析は、ジデオキシ鎖終結法またはマクサム-ギルバート法を用いて行うことができる(Sambrook et al., Molecular Cloning, A Laboratory Manual (2nd Ed., CSHP, New York 1989);Zyskind et al., Recombinant DNA Laboratory Manual, (Acad. Press, 1988)を参照されたい)。
E.変性勾配ゲル電気泳動法
ポリメラーゼ連鎖反応を用いて作成された増幅産物は、変性勾配ゲル電気泳動法を用いることによって解析することができる。NS2 Ser 70多型の異なる対立遺伝子は、配列依存性融解特性および溶液中でのDNAの電気泳動移動の違いに基づいて識別することができる。Erlich, ed., PCR Technology, Principles and Applications for DNA Amplification, (W.H. Freeman and Co, New York, 1992), Chapter 7。
F.一本鎖構造多型解析
標的配列の対立遺伝子は、Orita et al., Proc. Nat. Acad. Sci. 86, 2766-2770 (1989)が示した通り、一本鎖PCR産物の電気泳動移動における変化によって塩基の違いを識別する一本鎖構造多型解析を用いて差別化することができる。増幅PCR産物は上記の通り産生され得て、一本鎖増幅産物を形成するために加熱または別の方法で変性させることができる。一本鎖核酸は再び折り畳んで、または、塩基配列に一部依存する二次構造を形成し得る。一本鎖増幅産物の電気泳動移動の違いは、標的配列の対立遺伝子間の塩基配列の違いに関連し得る。
3.NS2治療薬− NS1およびPDZタンパク質に関して本明細書に開示される抗ウイルス治療薬および抗ウイルス治療薬スクリーニングのための方法は、同様に、NS2の結合パートナーを識別するため、NS2および結合パートナーの相互作用を遮断する治療物質を識別するため、さらに毒性インフルエンザA感染の患者を治療するために使用することができる。(第XI節の薬学的組成物を参照されたい)。NS2に関する治療薬の識別のための標的には、重複領域における結合パートナーおよびNS2の相互作用を遮断する作用物質(Ser 70を含む)、NS2 PL(内部の位置)およびPDZ結合パートナーの相互作用を遮断する作用物質、Ser 70をリン酸化することで、相互作用を阻害するセリンキナーゼが含まれる。
X.診断的検査
本発明の態様は、様々な異なる種類の生物学的試料におけるインフルエンザAウイルスおよびそれらの産物を識別するためのアッセイ方法において有用な診断用捕捉および検出物質を提供する。インフルエンザウイルスの検出に有用な典型的アッセイ様式には、酵素結合固相吸着アッセイ、放射標識結合アッセイ、蛍光PDZ-およびPL-結合アッセイ、時間分解PDZおよびPL蛍光アッセイ、ならびにサンドイッチ-および酵素-カスケードアッセイの様式が含まれる。対象アッセイにおける使用のために免疫アッセイの技術分野から適応可能であり得る例示的方法には、同種性および異種アッセイ様式、競合的および非競合的アッセイ様式、酵素結合固相アッセイ様式、蛍光アッセイ様式、時間分解蛍光アッセイ様式、生物発光アッセイ様式、カスケード酵素アッセイなどが含まれる。
本発明の一部の態様において、1つまたは複数のPDZタンパク質は、生物学的試料から1つまたは複数のPL分解物を単離するための捕捉物質として使用される。その他の代替的な態様において、1つまたは複数のPDZタンパク質は、1つまたは複数のシグナル発生化合物と抱合して、生物学的試料における1つまたは複数のPL分析物の存在または量を識別するための検出試薬として使用される。さらにその他の態様において、PLタンパク質およびPLペプチドは、シグナル発生化合物と抱合して(PL-SGC)、ウイルス性PLの存在が1つまたは複数のPL-SGCのPDZへの結合を競合する競合的リガンド阻害アッセイにおいて用いられる。好ましくは、PDZタンパク質は次の少なくとも1つである:外膜タンパク質、PSD95(PDZ#2)、PSD95(PDZ#1、2、3)、DLG1(PDZ#1)、DLG1(PDZ#1、2)、DLG1(PDZ#2)、DLG2(PDZ#1)、DLG2(PDZ#2)、Magi3(PDZ#1)、PTN3(PDZ#1)、MAST2(PDZ#1)、NeDLG(PDZ#1、2)、Shank1 d1、Shank2 d1、Shank3 d1、シントロフィン1α、シントロフィンγ1、Magi1(PDZ#1)、Magi1(PDZ#4)、Tip1;PTPL1(PDZ#1)、Mint3(PDZ#1)、Lym Mystique(PDZ#1)、DLG2(PDZ#3)、MUPP1(PDZ#8)、NeDLG(PDZ#1)、DLG5(PDZ#1)、PSD95(PDZ#1)、NumBP(PDZ#3)、LIMK1(PDZ#1)、KIAA0313、DLG1(PDZ#2)、シンテニン(PDZ#2)、Pick 1、または類似体もしくはフラグメント。一般にインフルエンザAを識別する検査では、PDZタンパク質および抗体の混合物が使用され得る。これらの検査では、PDZタンパク質は、その他の病原体特異的またはインフルエンザA特異的PLモチーフを認識するその他のものとの混合物に上記の1つを含んでもよい。
本発明は試料中の病原体PLタンパク質を検出する方法を提供し、対象のウイルス感染の診断における有用性を見出す。多くの態様において、生物学的試料を対象から得て、該試料中の病原体PLの存在を判定する。試料中に検出可能量の病原体PLタンパク質が存在することは、個体が特定のウイルスに感染していることを示す。その他の態様において、生物学的試料中の病原体PLタンパク質の量を測定して、試料における対照の量と比較する。試料中の病原体PLタンパク質の相対的な量は、病原体による感染の程度を示す。
前記方法は、一般に、インフルエンザA PLタンパク質に特異的な2つの結合パートナーに関連し、その内の一つは上記の通りPDZドメインポリペプチドである。前記方法は、一般に、(a)一方の結合パートナーを用いて試料から病原体PLを単離する工程、および(b)他方の結合パートナーを用いて病原体PLタンパク質を検出する工程を伴う。
亜型特異的検査またはNS1 PLクラス特異的検査では、識別されるべきPLは好ましくは次の1つである:ESEV(配列番号:2)、ESEI(配列番号:3)、ESKV(配列番号:4)、TSEV(配列番号:5)、GSEV(配列番号:6)、RSEV(配列番号:7)、RSKV(配列番号:8)、GSEI(配列番号:9)、GSKV(配列番号:10)、NICI(配列番号:11)、TICI(配列番号:12)、RICI(配列番号:13)、DMAL(配列番号:14)、DMTL(配列番号:15)、DIAL(配列番号:16)、DLDY(配列番号:17)、SICL(配列番号:18)、SEV、SEI、SKV、およびSKI。亜型特異的検査では、用いられるPDZタンパク質は好ましくは次の少なくとも1つである:PSD95(PDZ#2)、PSD95(PDZ#1、2、3)、DLG1(PDZ#1)、DLG1(PDZ#1、2)、DLG1(PDZ#2)、DLG2(PDZ#1)、DLG2(PDZ#2)、Magi3(PDZ#1)、PTN3(PDZ#1)、MAST2(PDZ#1)、NeDLG(PDZ#1、2)、Shank1 d1、Shank2 d1、Shank3 d1、シントロフィン1α、シントロフィンγ1、Magi1(PDZ#1)、Magi1(PDZ#4)、Tip1;PTPL1(PDZ#1)、Mint3(PDZ#1)、Lym Mystique(PDZ#1)、DLG2(PDZ#3)、MUPP1(PDZ#8)、NeDLG(PDZ#1)、DLG5(PDZ#1)、PSD95(PDZ#1)、NumBP(PDZ#3)、LIMK1(PDZ#1)、KIAA0313、DLG1(PDZ#2)、シンテニン(PDZ#2)、Pick 1、または類似体もしくはフラグメント。NS1 PLは、ウイルスのHおよびA抗原ならびに亜型を強力に予示し得る。
病原体特異的検査では、識別されるべきNS1 PLは好ましくは次の少なくとも1つである:ESEV(配列番号:2)、ESEI(配列番号:3)、ESKV(配列番号:4)、TSEV(配列番号:5)、GSEV(配列番号:6)、RSEV(配列番号:7)、RSKV(配列番号:8)、GSEI(配列番号:9)、GSKV(配列番号:10)、NICI(配列番号:11)、TICI(配列番号:12)、RICI(配列番号:13)、DMAL(配列番号:14)、DMTL(配列番号:15)、DIAL(配列番号:16)、DLDY(配列番号:17)、SICL(配列番号:18)、SEV、SEI、SKV、およびSKI。病原体特異的検査において、用いられるPDZタンパク質は好ましくは表1もしくは2から選択される少なくとも1つ、または類似体もしくはフラグメントである。
インフルエンザA特異的検査では、識別されるべきNS1 PLは好ましくは次の少なくとも1つである:ESEV(配列番号:2)、ESEI(配列番号:3)、ESKV(配列番号:4)、TSEV(配列番号:5)、GSEV(配列番号:6)、RSEV(配列番号:7)、RSKV(配列番号:8)、GSEI(配列番号:9)、GSKV(配列番号:10)、NICI(配列番号:11)、TICI(配列番号:12)、RICI(配列番号:13)、DMAL(配列番号:14)、DMTL(配列番号:15)、DIAL(配列番号:16)、DLDY(配列番号:17)、SICL(配列番号:18)、SEV、SEI、SKV、およびSKI。病原体特異的検査において、用いられるPDZタンパク質は好ましくは表1もしくは2から選択される少なくとも1つ、または類似体もしくはフラグメントである。
A.ELISAサンドイッチ異種アッセイ様式
以下の実施例の項に例示される通り、このPDZ捕捉およびモノクローナル抗NS1を用いて、生物学的試料中の高リスクインフルエンザA株を検出するためにサンドイッチアッセイ様式が構築された。このアッセイは、生物学的試料中のインフルエンザAウイルスの種類または量の検出において、商業的に使用するために十分に感受性である1〜1,000ng/mlの範囲の感度を持つ:つまり、
(a)免疫アッセイはインフルエンザAのH5N1、H1N1、およびH3N2株のNS1タンパク質を区別することができる;
(b)異なるアッセイ様式の交差反応特性は様々であり、また検出される特定のインフルエンザA株、および細胞溶解物を含む生物学的試料中の絶対的感度に依存する;さらに
(c)異なるアッセイ様式について検出限界を調べることは、今日、診断用装置の技術分野において、比較的定型的である。
この方法での想定される使用において様々な競合的および非競合的アッセイ様式が識別可能であるが、これらのアッセイは性能の特徴および十分に確立された様々なシグナル増幅手段が証明されていることから、現在ではサンドイッチアッセイ様式が好ましい。現在の好ましいサンドイッチ免疫アッセイの態様において、特異的高親和性非天然PDZタンパク質は生物学的試料中の天然ウイルスNS1抗原を捕捉するために用いられる;抗NS1マウスモノクローナル抗体は結合型NS1抗原を検出するために用いられる;さらに結合型抗NS1抗体の存在は、シグナル発生化合物を例えば第2の酵素抱合型抗体(例えば、セイヨウワサビペルオキシダーゼ抱合抗体;HRP)またはビオチン化された第2の抗体およびストレプトアビジン-酵素抱合体(例えば、HRP)のいずれかと用いて検出される。
一般に、本発明の方法は、(i)第1の結合物質、即ち、捕捉物質を用いて複合生物学的試料から固有のウイルスPLタンパク質分析物を分離する工程(即ち、単離する工程)、および(ii)第2の結合物質、即ち、検出物質を用いて単離されたPL分析物を検出する工程を伴う。分離および検出する工程は、PL分析物に関して異なるレベルの特異性を有する結合パートナーを用いて実施され得て、例えば、捕捉物質が高度に特異的である場合は、続いて検出試薬中には低い特異性が要求され得て、逆も同様である。一部の態様において、捕捉物質は好ましくはPDZドメインポリペプチドである。より好ましくは、捕捉物質は表1および/または表2に列記するものの1つである。代替となる態様において、これらの態様では検出試薬の少なくとも1つの成分が、例えば、捕捉/単離されたPL分析物に結合するPDZタンパク質検出物質などのPDZポリペプチドであり、シグナル発生化合物と抱合した抗PDZ抗体を用いて複合体中でのその存在が検出されるという条件で、第1の結合パートナーは抗病原体PLタンパク質抗体または抗体混合物である。一部の現在の好ましい態様において、PDZ捕捉物質は固相に直接またはリンカーを介して結合する。例えば、1つの非限定的な例において、PDZドメインポリペプチドは磁気ビーズに結合する。後者の例において、生物学的試料と接触すると、磁気ビーズに固定化されたPDZ捕捉物質は試料中のインフルエンザウイルスPLタンパク質とのPDZ-PL相互作用複合体の形成において有効である。次に、磁場が適用されて、試料から結合型インフルエンザウイルスPLとの相互作用複合体が単離される。もう一つの非限定的な例において、PDZドメインポリペプチド捕捉物質はマイクロタイタープレートの表面に固定化される;インフルエンザPLを含む生物学的試料が固定化された捕捉試薬と接触すると、その結果、PLがプレート表面に結合する;プレートを緩衝液で洗浄してプレートから非PLウイルス分析物を除去する;このようにして、固定化されたPL分析物が生物学的試料から単離される。例えば、磁場の適用、洗浄などの異なる分離/単離手段が公知である。用いられる特定の手段は、特定のアッセイ様式に依存する。例えば、分離は、洗浄;磁気的手段;遠心分離;濾過;分子ふるい、イオン交換およびアフィニティーを含むクロマトグラフィー;電場内での分離;例えば、ラテラルフロー検査紙を用いた毛管現象;免疫沈降法;ならびに以下にさらに開示されるものなどを含むがこれらに限定されない多くの異なる方法によって達成され得る。
一部の態様において、インフルエンザPLタンパク質は、生物学的試料のアリコートを検査紙の一方の端に接触させて、続いて、例えば、ラテラルフローのような毛管現象によってタンパク質を検査紙上で移動させることによって、生物学的試料中のその他のウイルス性および細胞性タンパク質と分離される。この方法は、アッセイに対してウイルスの高リスクインフルエンザA株の存在または量を特異的に識別する能力を付与する、アッセイ内における、例えば捕捉試薬および/または検出試薬としての1つまたは複数のPDZポリペプチド物質、抗体、および/またはアプタマーの存在によって先行の免疫アッセイ法とは区別される。この方法は、それらが抗体ではなく患者試料中に存在するウイルスタンパク質を識別するという事実によって、先行の免疫アッセイ法とは区別される。ラテラルフローによる分離、検出、および定量のための方法および装置は、例えば、参照によりそれらの全体が本明細書に組み入れられる米国特許第6,942,981号、第5,569,608号、第6,297,020号、および第6,403,383号など、当技術分野において公知である。一つの非限定的な例において、検査紙は試料をロードするための基部領域(試料ローディング領域)、ならびにPDZポリペプチド捕捉物質および緩衝試薬、ならびにPDZポリペプチドおよび移動する生物学的試料中の任意のインフルエンザPLタンパク質の結合相互作用を確立するために適した添加物質を含む遠位検査領域を含む。代替的な態様において、検査紙は、それぞれ、異なるインフルエンザPLタンパク質分析物と特異的に相互作用することができる異なるPDZドメインポリペプチドを含む2つの検査領域を含む。
上記に開示される方法に従って、試料中の分析物が検出および/または定量に適切であるような方法で、インフルエンザPLタンパク質分析物は生物学的試料中のその他のタンパク質から分離される。本発明の態様は、PDZポリペプチド、シグナル発生化合物と抱合したPDZポリペプチド、抗体、アプタマーなどを用いて単離されたインフルエンザPLタンパク質の検出のための新しい方法を提供する。代替的な態様に従って、PDZ捕捉物質、抗体および/またはアプタマーに結合したインフルエンザPL分析物は、例えば、シグナル発生化合物と抱合した抗体など、病原体PLタンパク質に特異的な抗体(antibody)または抗体(antibodies)を用いて検出される。勿論、診断の技術分野では様々な検出方法が公知であり、すべての代替的な周知の方法を記載することはこの(非限定的な)開示の意図ではない。むしろ、この開示は本発明の実践の最も適した方法を記載するための要件を満たして、代替的な方法に対する一般的な基準となる指標としての役割を果たすことを意図する。
一部の態様において、SGC(シグナル発生化合物)と抱合したPDZドメインは、分離の工程を必要としない同種アッセイ様式において試料中の病原体PLタンパク質分析物の存在を検出するために用いられる。このアッセイ方法において、PLのPDZドメインへの結合は、例えば、蛍光異方性の変化など、SGCによって引き起こされるシグナルの変化を誘発する。
その他の態様において、(前記に開示される)異種固相アッセイ様式は生物学的試料中のインフルエンザPL分析物の検出に有用である。上記の「背景技術」の項に記載した通り、PDZタンパク質はPLを含む細胞性タンパク質に結合する。同様に、感染細胞ではPLを含むインフルエンザウイルスタンパク質が宿主細胞のPDZタンパク質に結合する。これらの相互作用は通常、診断用アッセイ様式において結合と競合することが期待され、この結果、予想外に、これらの後者の自然相互作用の親和性および物質収支は十分に弱く、または界面活性剤で抽出された細胞溶解物中では十分に破壊されていて、インフルエンザPL分解物はこの診断的アッセイ様式において検出可能であるというさらなる目安が示される。従って、溶解物を、Tween 20またはTriton X100などの約0.5%よりも少ない、好ましくは約0.2%よりも少ない、最も好ましくは約0.1%よりも少ない界面活性剤の存在下において調製してアッセイを実施してもよい。
一部の態様において、試料中のウイルスPLタンパク質の量は定量されかつ/または対照と比較され得る。適切な陰性対照試料は、例えば、例えばインフルエンザウイルス感染を持たないことが公知である個体など、健常であることが公知である個体から得られたものである。特異性対照は、公知のインフルエンザB感染を持つ個体、または例えばH1N1、H3N2など毒性の低いインフルエンザ株に感染した患者から採取され得る。対照試料は検査される対象と遺伝的に関連する個体由来であって良いが、遺伝的に無関係の個体由来であってもよい。適切な陰性対照試料は感染の早期段階、即ち、試験試料が採取される段階よりも早い時期の個体から採取された試料であっても良い。本発明の態様には、非感染性の陽性対照、即ち、高リスクインフルエンザAウイルスPLのアミノ酸配列を持つ組換え型タンパク質が含まれる。
最初のウェスタンブロット(以下の実施例の項を参照されたい)は、生物学的試料中のNS1量が十分であり様々な異なる可能な免疫アッセイ様式においてこれらの抗原の検出が可能であることを示している。しかしながら、特定の生物学的試料中のNS1の量が特定の免疫アッセイ様式での検出に限定的であることが証明されても、他の一つの代替の態様として、生物学的試料中の生存ウイルスはインビトロでの細胞感染によって増幅され得て、ウイルス増幅試料中のNS1タンパク質が約6時間〜約12時間以内に検出可能となるはずである。その他の代替の態様において、生物学的試料およびウイルス増幅試料中でのNS1抗原の収量を改善するための方法には、プロテアーゼ阻害剤および例えばMG132などのプロテアソーム阻害剤の使用が含まれる。
B.試薬の調製
PLペプチド、PDZドメインポリペプチド、およびアプタマーは、合成により(即ち、機械を用いて)、または当技術分野において公知である組換え手段を用いて作成することができる。例えば、組換えタンパク質の発現のための方法および条件は当技術分野において周知であり、例えば、前記のSambrookおよび前記のAusubelを参照されたい。ポリペプチドを発現させるための哺乳動物組織細胞培養の使用については、Winnacker, 「From Genes to Clones」, VCH Publishers, N.Y., N.Y., 1987および前記のAusubelで大まかに考察されている。
また、結合アッセイの詳細については、2003年7月29日に出願されてUS 20040018487として公開された米国特許出願第10/630,590号および米国特許第6,942,981号において開示されている。
細胞をベースとするアッセイは、一般に、組換え型発現系を用いて対象であるPDZドメインポリペプチドおよびインフルエンザPLを共-産生(co-produce)する工程(即ち、それらが産生される時期に関わらず、同一の細胞内で産生する工程)を伴う。真核細胞での対象のポリペプチドの産生に適した細胞については、以下の実施例の項で開示される。対象であるPDZドメインポリペプチドおよびインフルエンザPLの発現に潜在的に適切な細胞タイプには次が含まれる:例えば、サル腎細胞(COS細胞)、SV40で形質転換したサル腎CVI細胞(COS-7、ATCC CRL 165 1); ヒト胚性腎細胞(HEK-293、Graham et al. J. Gen Virol. 36:59(1977));HEK-293T細胞;ベビーハムスター腎細胞(BHK、ATCC CCL 10); チャイニーズハムスター卵巣細胞(CHO、Urlaub and Chasin、Proc. Natl. Acad. Sci.(USA) 77:4216、(1980);マウスセルトリ細胞(TM4、Mather、Biol. Reprod. 23:243-251(1980));サル腎細胞(CVI ATCC CCL 70); アフリカミドリザル腎細胞(VERO-76、ATCC CRL-1587);ヒト子宮頚癌細胞(HELA、ATCC CCL 2);イヌ腎細胞(MDCK、ATCC CCL 34);Buffaloラット肝細胞(BRL 3A、ATCC CRL 1442);ヒト肺細胞(W138、ATCC CCL 75);ヒト肝細胞(hep G2、HB 8065);マウス乳癌(MMT 060562、ATCC CCL 51);TRI細胞(Mather et al., Annals N. Y. Acad. Sci 383:44-68 (1982));NIH/3T3細胞(ATCC CRL-1658);およびマウスL細胞(ATCC CCL-1)。さらなる細胞株も明らかであると考えられる。様々な細胞株がAmerican Type Culture Collection, 10801 University Boulevard, Manassas, Va. 20110-2209から入手可能である。
C.試料の調製
検出可能な濃度のインフルエンザタンパク質および好ましくはNS1を含む任意の試料が用いられ得る。用いることのできる試料の例は、例えば、肺浸出物、細胞抽出液(呼吸系、鼻腔を裏打ちする上皮)、血液、粘液、および鼻腔スワブである。本明細書では、極めて高濃度のNS1がブタおよびヒトの鼻腔スワブにおいて見出され得ることが示された。NS1が細胞内タンパク質であると考えられ、これは驚くべきことである。従って、NS1の識別のための好ましい試料は鼻分泌物である。
PLタンパク質のPDZタンパク質および/または抗体への結合は、実施例において、0.03%および0.01%を含めて、0.05%SDSまでの存在下で起こることが示された。従って、鼻またはその他の身体分泌物がラテラルフロー様式において容易に用いられる可能性が低い場合は、SDSで処理してもよい。好ましくは、加えられるSDSの量は0.01%の最終濃度までであり、より好ましくは0.03%、さらにより好ましくは0.05%までである。PDZタンパク質、抗体、またはアプタマーもしくはその他の作用物質のPLタンパク質への結合に干渉しないその他の界面活性剤などを用いてもよい。緩衝液または水での希釈を含む、タンパク質/タンパク質相互作用に干渉しない試料処理のその他の方法を使用することができる。
D.単独または併用による一般的インフルエンザA検査
この検査は試料中のインフルエンザAの存在を識別する。従って、検査は、抗体またはアプタマーなどを用いてNS1保存領域の存在を識別する方法を使用することができる。好ましくは、単一のモノクローナル抗体または単一のアプタマーがNS1のすべての変異型を識別する。これは、NS1タンパク質の保存領域を認識する抗体を使用する場合に最も可能性が高い。または、1つよりも多い抗体および/もしくはアプタマー、ならびに/またはPDZタンパク質もしくはその他の結合物質がすべてのインフルエンザAの亜型を識別するために使用することができる。この方法は、NS1タンパク質の存在によってすべてのインフルエンザAを識別するために抗体およびPDZタンパク質の混合物も使用できる。一般的インフルエンザA検査はウイルスの亜型を調べるためにより特異的な検査と組み合わせて使用され得て、検査は連続的にまたは同時に実施してもよい。検査において用いられる場合の好ましいPL領域およびPDZタンパク質に関する上記の汎特異的抗体の説明も参照されたい。
E.病原性インフルエンザA検査
この検査はNS1タンパク質PLモチーフを持つウイルスのすべての型を識別する。本明細書では、インフルエンザAの非病原性株がトリPLモチーフを欠くNS1タンパク質を持つことが指摘された。従って、病原性インフルエンザAウイルスの存在を特異的に識別するための方法はトリPL領域を含むNS1の存在を識別することができる。1つまたは複数のPDZタンパク質および/または抗体がPL領域のすべての変異型を識別するために使用され得る。例えば、PDZタンパク質のみが使用される場合、すべてのNS1 PLタンパク質を識別するためには少なくとも2つのPDZタンパク質が必要であると考えられる。または、PL領域を有するNS1タンパク質を認識することができる単一の抗体が用いられる。好ましくは、識別されるべきNS1のPL領域は次の少なくとも1つである:ESEV(配列番号:2)、ESEI(配列番号:3)、ESKV(配列番号:4)、TSEV(配列番号:5)、GSEV(配列番号:6)、RSEV(配列番号:7)、RSKV(配列番号:8)、GSEI(配列番号:9)、GSKV(配列番号:10)、NICI(配列番号:11)、TICI(配列番号:12)、RICI(配列番号:13)、DMAL(配列番号:14)、DMTL(配列番号:15)、DIAL(配列番号:16)、DLDY(配列番号:17)、SICL(配列番号:18)、SEV、SEI、SKV、およびSKI。好ましくは、識別されるべきPL領域はトリPL領域を有するものである。好ましくは、1つまたは複数のPDZタンパク質は表1もしくは2から選択される少なくとも1つ、または類似体もしくは活性フラグメントである。
F.病原性トリインフルエンザウイルスA型検査
H5N1トリインフルエンザ由来のNS1タンパク質は、様々なPDZドメインに結合してH3N2などの一般的ヒトインフルエンザ由来のNS1には結合できないC末端の配列を有する。トリインフルエンザH5N1単離物の77%に由来するNS1タンパク質はESEV(配列番号:2)で終結し、さらに、ESEV(配列番号:2)後の最も一般的な2つのC末端NS1配列であり、トリインフルエンザ単離物の別の17%を占める、ESKV(配列番号:4)およびESEI(配列番号:3)は、PSD-95にも高い親和性で結合する(即ち、それぞれ、45nMおよび200nM)。H3N2 NS1はPSD-95と、仮に結合するとしても極めて低い親和性で結合するRSKV(配列番号:8)において終結する。従って、PSD-95は、トリインフルエンザの検出試薬として用いることができ、トリインフルエンザをH3N2などのその他の株と識別することができる。
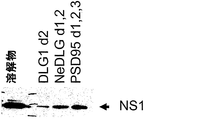
PDZドメインを含む限り、PSD-95タンパク質の任意の部分が使用され得るが、PSD-95ドメイン-1、-2、および-3は異なる結合特異性および親和性を有する。どのPDZタンパク質がトリインフルエンザH5N1 PLに極めて高い親和性で結合するかを識別する一環として(実施例2および表4a〜eを参照のこと)、PSD-95ドメイン2のPDZが極めて高い親和性で結合することが見出された。従って、アッセイで用いられるPSD-95 PDZタンパク質はそのタンパク質に由来する1つのPDZドメインを含むことが必要であり、好ましくは、少なくとも、特異的結合に十分なドメイン2由来のPDZまたはそのフラグメントを含む。PSD-95 PDZタンパク質を試料と接触させる。試料が病原性インフルエンザウイルスAを含む場合、PSD-95 PDZは病原性インフルエンザウイルスのNS1タンパク質のPLに特異的に結合する。
図8および11ならびに実施例6に記載されるようなラテラルフロー様式は、PDZ捕捉およびモノクローナル抗体による検出を順次用いて、トリNS1 PLタンパク質の検出のために使用することができる。または、ラテラルフロー様式はモノクローナル抗体捕捉およびPDZ検出を使用してもよい。ラテラルフローは、膜に沿った特異的な部位にて膜上に沈着させた捕捉物質としての1つまたは複数の組換え型PDZタンパク質を使用して発生され得る(実施例6も参照されたい)。ラテラルフローの結果の解析は、定性的または定量的であり得る。好ましくは、鼻分泌物由来の患者試料が用いられる。試料は、ラテラルフロー様式において用いられたように膜上をより簡単に流れるように前処理してもよい。患者試料は、先ず、単一分子と抱合した汎反応性抗NS1モノクローナル抗体と接触させてよい。検出に用いられるモノクローナル抗体は、好ましくは、用いられるPDZタンパク質と同一のエピトープには結合しないが、代わりにすべてのNS1タンパク質に広く見られる別のエピトープに結合する。試料中のNS1タンパク質が捕捉物質(膜上に沈着したPDZタンパク質)に結合する場合、膜上のPDZタンパク質が沈着した部位にバンドが見られる。トリインフルエンザ株に特異的なC末端NS1モチーフはこのラテラルフロー様式を用いて検出され得る。これらには、ESEV(配列番号:2)、ESEI(配列番号:3)、およびESKV(配列番号:4)が含まれる。いくつかの場合には、EPEV(配列番号:27)が用いられ得る。NS1タンパク質上の1つのPLモチーフのみに特異的に結合する抗体を含む、代替の捕捉物質を使用することができる。
定性的または定量的解析のため、および品質管理のため、次の対照の任意の1つまたはすべてを含めることができる:ヤギ抗マウス抗体(GAM)から構成された対照バンド;膜上のNS1タンパク質のすべての型に結合する抗体を沈着させることによって、任意のインフルエンザAが存在するかどうかを識別するレーン;PDZドメインを除くすべてのドメインを有するPSD-95タンパク質を含む陰性対照。その他の対照は、膜上の捕捉物質に対し、弱く、中等度に、もしくは強く結合する、または全く結合しないことが公知であるPLタンパク質の精製型などのシグナルを定量するための対照を含んでもよく、好ましくは捕捉物質はPDZタンパク質または1つもしくは複数のPLに特異的な抗体のいずれかである。
シグナルを定量するための対照は、PSD-95に対し、弱くまたは中等度に結合するPLを差別化するために結合の強度を解析するために加えることができる。例えば、実施例6は結合強度が次の記号を用いて定量されることを示している:(-)結合なし、(+)弱い結合、(++)中等度の結合、および(+++)強い結合。特異的PDZタンパク質に対する結合の強度は、PSD-95を中等度の親和性で結合するRSEVで終結するNS1を持つH1N1を差別化するために使用することができる。強い結合のための陽性対照はH5N1由来の精製NS1であり得て、弱い結合のための対照はH3N2由来の精製NS1であり得て、中等度の結合のための対照はH1N1由来の精製NS1であり得る。
または、PSD-95に結合する株同士をさらに差別化するために、その他のPDZタンパク質を使用することができる。例えば、実施例6に示す通り、H5N1およびH1N1はいずれもPSD-95に結合する。従って、INADL D8は、H1N1のみが結合することから、株がH1N1またはH5N1であるかどうかを識別するために使用される。INADL D8への結合は、PSD-95に結合するPLをH5N1として明確に識別することを可能とする。H1N1に結合してH5N1には結合しないその他のPDZタンパク質は、表4a〜eおよび実施例2に示す。
G.特異的NS1 PL検査
この検査は、特異的NS1 PLによってNS1 PLクラスの特異的クラスを識別させる。特異的NS1 PLクラスによる亜型も識別させる。一般的にはHAおよびNP抗原の型はNS1 PL領域と相関するが、これは必ずしも常に当てはまるとは限らない。例えば、再集合またはウイルスが受け得るその他の遺伝的過程のために、例えばH1N1ウイルスに由来するNS1 PL領域がH2N1ウイルスに伝達され得る可能性がある。しかし、具体的な理論に結びつけられるものではないが、NS1 PL領域の存在は患者試料中のウイルスの病原性を示すより強い指標である可能性が高い。これは、NS1が感染に関与するという生物学的役割によるものである可能性がある。好ましい検査は、ヒトPL ESEV(配列番号:2)を識別する。好ましい検査は、ESEV(配列番号:2)、ESEI(配列番号:3)、およびESKV(配列番号:4)のモチーフを持つトリインフルエンザA NS1 PLを識別する。これはウイルスの極めて高い病原性の株を識別し、疾患を治療および阻止するために適切な対策が講じられ得る。その他の好ましい検査には、例えば、NS1 PL亜型の特異的な識別を可能とするアレイが含まれる。この種類のアレイはインフルエンザAに関する一般的検査も含み得る。この種類の検査は、HAおよびNPタンパク質の種類を調べるための検査も含み得る。好ましくは、識別されるべきPLは次の1つである:ESEV(配列番号:2)、ESEI(配列番号:3)、ESKV(配列番号:4)、TSEV(配列番号:5)、GSEV(配列番号:6)、RSEV(配列番号:7)、RSKV(配列番号:8)、GSEI(配列番号:9)、GSKV(配列番号:10)、NICI(配列番号:11)、TICI(配列番号:12)、RICI(配列番号:13)、DMAL(配列番号:14)、DMTL(配列番号:15)、DIAL(配列番号:16)、DLDY(配列番号:17)、SICL(配列番号:18)、SEV、SEI、SKV、およびSKI。より好ましくは、識別されるべきNS1 PLはESEV(配列番号:2)である。好ましくは、用いられる少なくとも1つのPDZタンパク質は表1または表2から選択される少なくとも1つ、フラグメントまたは類似体である。より好ましくは、少なくとも1つのPDZタンパク質は次の少なくとも1つである:外膜タンパク質、PSD95(PDZ#2)、PSD95(PDZ#1、2、3)、DLG1(PDZ#1)、DLG1(PDZ#1、2)、DLG1(PDZ#2)、DLG2(PDZ#1)、DLG2(PDZ#2)、Magi3(PDZ#1)、PTN3(PDZ#1)、MAST2(PDZ#1)、NeDLG(PDZ#1、2)、Shank1 d1、Shank2 d1、Shank3 d1、シントロフィン1α、シントロフィンγ1、Magi1(PDZ#1)、Magi1(PDZ#4)、Tip1;PTPL1(PDZ#1)、Mint3(PDZ#1)、Lym Mystique(PDZ#1)、DLG2(PDZ#3)、MUPP1(PDZ#8)、NeDLG(PDZ#1)、DLG5(PDZ#1)、PSD95(PDZ#1)、NumBP(PDZ#3)、LIMK1(PDZ#1)、KIAA0313、DLG1(PDZ#2)、シンテニン(PDZ#2)、Pick1、または類似体もしくはフラグメント、および/または任意のPDZタンパク質を模倣する抗体。
H.血清中抗体の検査
特異的なNS1 PLモチーフおよび/または70位にセリンを持つNS2タンパク質に結合する血清中抗体の存在を識別するための検査は様式に関して任意の診断方法で用いることができる。NS1 PLペプチドおよび/またはSer 70を含む重複領域を含むペプチドは、ラテラルフローまたはその他の様式において捕捉試薬として用いられ得る。
I.流行状況下でのアッセイの使用
生物学的試料中のインフルエンザA NS1の異なる絶対的検出レベルを達成するために、例えば、競合アッセイ様式における競合リガンドのレベルを下げることによって、サンドイッチアッセイなどにおいて捕捉試薬および検出試薬の量を変化させることによって、アッセイの感度および特異性を変化させることができる。従って、この検査方法は、以下の実施例の項に例示されるように異なる用途において生じる異なる要求を満たすための異なる性能特性を持つ様々なアッセイを包含する。例えば、トリ流行状況下では最も高いPPVが一般に記録されて、陽性検査結果は真実である可能性が極めて高い、すなわちNPVおよび偽陰性の結果は最も低い値である可能性がより高い傾向がある。トリ対象におけるインフルエンザAの流行のモニタリングにおいても、検査のためにすべての試料を基準検査機関に提出することは、現在、一般的な慣行である。例えば、現場において、または治療の時点で、このスクリーニングアッセイで真の陽性試料を識別することによって、この検査アッセイは、検査のために最終的に基準検査機関に提出しなければならない試料の数、即ち、流行期間中、検査の負担が大きい際の特定の値を抑制するのに有用である。現在の所、それらが感染しているかどうかに関わらず、全動物を屠殺することが慣例であるため、相対的に高い偽陽性率が受け入れられ得るが、同時に偽陰性率は相対的に低くなければならない。一部の態様において、本発明は、本明細書において「流行病検査方法」として記載される流行時の使用のための異なる特異性、感度、PPV、およびNPVを持つ検査キットを提供する。好ましくは現在の要求に合わせるために、この流行病検査方法は次のようなアッセイ性能を有する:つまり、約65%よりも高い特異性;約90%よりも高い感度;約85%よりも高いPPV;約65%よりも高いNPV;約25%よりも低い偽陽性値;および約5%よりも低い偽陰性値。
これに対して、トリ対象におけるインフルエンザA発生率が低い場合には、最も低いPPVは一般に偽陽性の検査結果を伴って記録される可能性がより高く、最も高いNPVおよび陰性検査結果はさらに可能性が高く真実である傾向がある。これらの発生率が低い場合は、スクリーニングの目的は潜在的に感染した動物を迅速に識別して、例えば、基準検査機関において確認検査が完了するまでそれらを隔離することである場合がある。従って、一部の態様において、本発明は、モニタリングが不可欠である、即ち、本明細書において「モニタリング検査方法」として記載されるインフルエンザA発生率が低い時期における使用のために高い感度およびNPVを持つ検査方法を提供する。好ましくは、このモニタリング検査方法は次のアッセイ性能を持つ:つまり、約65%よりも高い特異性;約90%よりも高い感度;約85%よりも高いPPV;約65%よりも高いNPV;約20%よりも低い偽陽性値;および約5%よりも低い偽陰性値。このモニタリング検査方法が群のうちの100よりも多い個体をスクリーニングするために用いられる場合、群の全体としてのPPVは任意の1つの特定のアッセイで得られる予測値よりも著しく高い。従って、モニタリング検査方法において陽性検査結果が得られる場合、前記の流行病検査アッセイを用いて群の個体を再検査することが有益であることを示す可能性がある。
トリではなくヒトの場合、検査の目的は当然異なる。インフルエンザA感染の時宜を得た証拠は、例えば、小児または高齢の対象における抗ウイルス物質の早期投与の促進など、重要なケースマネジメントの意味合いを持ち得る。一般に、ヒト診断用製剤には、例えば90%よりも高い特異性および90%PPVよりも高い感度など、高い特異性および感度が必要である。しかし、例えば大型客船における感染などPPVが高い限定された流行状況では、偽陽性の可能性は低く、偽陰性の可能性が高い;また試料が確認検査に提出される場合は、偽陰性の検査結果の数字を、例えば約5%よりも低い値など、さらに低下させるために、65%などのより低い特異性を持つことが望ましいことが示され得る。
J.診断用および治療用キット
この方法を実施するためのキットが提供される。このキットは、少なくとも次の1つまたは複数の存在によって、免疫アッセイキットとは区別される:(i)PDZドメインポリペプチド、および(ii)PDZドメインポリペプチドを用いて生物学的試料中の高リスクインフルエンザAトリウイルス株を識別するためのアッセイを実施するための印刷された説明書。キットは、抗体ではなく、患者試料中のウイルスタンパク質を識別するものであり、感染した個体に対する特異性がより高くなる。キットは、試薬、緩衝液、または前記で開示された付加組成物もしくは試薬の1つまたは複数を含んでも良い;また、一部の態様において、キットはインフルエンザAウイルスのPL、好ましくはNS1に特異的な抗体を含むこともできる。その他の態様において、キットは、生物学的試料中のその他の潜在的干渉物質からインフルエンザウイルスPLを除去するための、装置または系などの手段をさらに含んでもよい。キットは、所望ならば、例えば、1つもしくは複数のアッセイ容器;1つもしくは複数の対照もしくは検量試薬;アッセイを実施するための1つもしくは複数の固相表面;または1つもしくは複数の緩衝液、添加物、または検出試薬もしくは抗体;例えば、アッセイの実施において用いられるべきそれぞれの成分の量、およびアッセイの結果の評価に関する目安を明示するための、添付文書ならびに/または容器のラベルなどの1つもしくは複数の印刷された説明書など、アッセイの実施に有用な1つまたは複数の異なる要素を含んでも良い。このキットは、例えば、検査紙、サンドイッチELISA、ウェスタンブロットアッセイ、ラテックス凝集などを含む、様々な異なるタイプのアッセイ様式を実施するために有用な要素を含んでよい。キット内の、参照対象、対照、および検量物質は、例えば、1つもしくは複数の天然および非天然インフルエンザPLタンパク質、組換え型PLポリペプチド、合成PLペプチド、PDZドメインポリペプチド、PDZドメインペプチド、ならびに/またはこの方法の性能および精度を評価するための適切な比色分析標準物質および酵素標準物質などを含んでよい。
対象の方法を実践するための説明書は、一般に適切な記録媒体に記録されて、例えば、添付文書としてキットと共に含められる。例えば、説明書は、紙またはプラスチックのような基質に印刷され得る。その他の態様において、説明書は、例えば、CD-ROM、ディスケットなどのコンピュータで判読可能な電子保存媒体にデジタルで記録してもよい。さらにその他の態様において、この方法を実施するための説明書は、例えば、インターネットのウェブサイトにおいてダウンロード可能な文書ファイルの形で、リモートのデジタルソースからユーザーによって入手されてもよい。
任意で、キットは、特異的検査と同様に、インフルエンザAの一般的検査を実施するための試薬を含んでも良い。例えば、ラテラルフロー検査は、一般的なインフルエンザAウイルスの存在を識別するためのレーン、およびウイルスがトリインフルエンザAであるかどうかを識別するためのレーンを有してもよい。一般的な検査は、NS1の存在に関する検査を含めて、インフルエンザAウイルスの存在を識別する任意の検査であり得る。含められ得る一般的なインフルエンザAのその他のタイプは、任意のインフルエンザAタンパク質を識別することができる。または、インフルエンザAの存在は、患者の血液中の抗体の存在によって識別され得る。最後に、PCR検査はインフルエンザAの存在を一般的に識別するために用いることができる。
K.アレイ
さらなるその他の態様において、本発明は、固相上の識別可能な特定の位置に固定化された異なるPDZポリペプチド、抗体、および/またはアプタマーもしくは匹敵する結合物質からなる、PDZ、抗体、および/またはアプタマーのアレイを提供する。アレイ内の固定化されたPDZポリペプチド、抗体および/またはアプタマーの各々は、インフルエンザウイルスタンパク質のPLと識別された結合相互作用を含めて、PLリガンドに関して所定の結合親和性および特異性を有する。アレイの区別活性(discriminatory activity)は、(i)それぞれの異なるPDZポリペプチド、抗体、および/またはアプタマーの結合親和性;(ii)PLに関するそれぞれの異なるPDZポリペプチド、抗体、および/またはアプタマーの結合特異性;ならびに(iii)イオン強度、時間、pHなどのアッセイ条件よって付与される。PDZドメインは、例えば、MAST205のPDZドメインがTDVおよびSDVを含むC末端のPL配列同士を識別できるなど、高度に特異的である。同様に、同一のPDZタンパク質内において、異なるそれぞれのドメインは異なる結合特異性および親和性を持ち得て、即ち、PSD-95ドメイン-1、-2、および-3は異なる結合特異性および親和性を持つ。本発明者らは、ヒトゲノムにおける全PDZドメインの90%より多くを含む255よりも多い異なるヒトPDZドメインの配列をクローン化して発現し、先行の米国特許出願において開示している。PDZドメイン融合タンパク質の異なるPLペプチドとのマッピングした相互作用は、このインフルエンザアレイの特定のメンバーの選択のための根拠を構成する。予想外なことに、アレイの選択性は次の知見に基づく:(i)下記の実施例の項に例示されるように、インフルエンザAの異なる株における特徴的に異なるNS-1 PLアミノ酸配列モチーフ;および(ii)異なるインフルエンザウイルスタンパク質、即ち、HA、NP、MA1、NS1などにおける異なるPL配列モチーフとの併用。
本発明の態様は、例えば、HA、NP、MA-1、NS1などのインフルエンザウイルスタンパク質におけるPLの構成的結合特性に基づいて、試験試料中のインフルエンザAウイルスまたはインフルエンザBの異なる株間を区別するための方法であって、インフルエンザAおよびBの異なる株および/または亜型がアレイにおいて特徴的な結合パターンを生じる方法を提供する。該方法は次の工程を伴う:(a)アレイ内の予め定められた異なる位置に試験試料のアリコートを接触させる工程;(b)アレイの特定の位置における結合の有無を検出する工程;(c)アレイにおける結合パターンから(i)試験試料中にインフルエンザPLが存在すること、および(ii)アレイにおけるPL結合のパターンがインフルエンザAまたはBウイルスの特定の株における特徴的な特性を構成することを調べる工程。アレイに基づいて区別可能なインフルエンザAウイルスの典型的な例には、例えば、H1N1、H2N2、H2N3、H2N5、H3N2、H3N8、H4N6、H5N1、H6N1、H6N2、H7N2、H7N3、およびH7N7などが含まれる。好ましくは、アレイは少なくとも一部はNS1 PLへの結合に基づく。より好ましくは、PDZ、抗体、および/またはアプタマーのアレイは、次を含む少なくとも1つのNS1 PLの存在を特異的に識別する:ESEV(配列番号:2)、ESEI(配列番号:3)、ESKV(配列番号:4)、TSEV(配列番号:5)、GSEV(配列番号:6)、RSEV(配列番号:7)、RSKV(配列番号:8)、GSEI(配列番号:9)、GSKV(配列番号:10)、NICI(配列番号:11)、TICI(配列番号:12)、RICI(配列番号:13)、DMAL(配列番号:14)、DMTL(配列番号:15)、DIAL(配列番号:16)、DLDY(配列番号:17)、SICL(配列番号:18)、SEV、SEI、SKV、およびSKI。より好ましくは、NS1 PLはESEV(配列番号:2)である。好ましくは、PDZタンパク質は表1または表2から選択される少なくとも1つ、フラグメントまたは類似体である。より好ましくは、アレイは、表1および2に列記される少なくとも1つのPDZタンパク質、抗体または任意のPDZタンパク質のアプタマー模倣物、類似体および活性フラグメントを含む。より好ましくは、アレイは、外膜タンパク質、PSD95(PDZ#2)、PSD95(PDZ#1、2、3)、DLG1(PDZ#1)、DLG1(PDZ#1、2)、DLG1(PDZ#2)、DLG2(PDZ#1)、DLG2(PDZ#2)、Magi3(PDZ#1)、PTN3(PDZ#1)、MAST2(PDZ#1)、NeDLG(PDZ#1、2)、Shank1 d1、Shank2 d1、Shank3 d1、シントロフィン1α、シントロフィンγ1、Magi1(PDZ#1)、Magi1(PDZ#4)、Tip1;PTPL1(PDZ#1)、Mint3(PDZ#1)、Lym Mystique(PDZ#1)、DLG2(PDZ#3)、MUPP1(PDZ#8)、NeDLG(PDZ#1)、DLG5(PDZ#1)、PSD95(PDZ#1)、NumBP(PDZ#3)、LIMK1(PDZ#1)、KIAA0313、DLG1(PDZ#2)、シンテニン(PDZ#2)、Pick1、または類似体もしくはフラグメント、および/または任意のPDZタンパク質を模倣する抗体(もしくはアプタマー)を含む、PDZタンパク質、抗体模倣物、および/またはアプタマーを含む。
L.ラテラルフロー設計
家庭用妊娠検査と同様に、ラテラルフロー装置は、特殊な生物学的薬剤で処理しておいた検査紙に液体を適用することによって機能する。液体試料によって運搬されることで、それぞれの生物学的薬剤で標識されたリンが検査紙を移動して、それらが特定のゾーン内に達すると捕捉される。検査紙上に見られるリンシグナルの量は標的分析物の量に比例する。
インフルエンザAを含むことが疑われる試料を何らかの手段によってラテラルフロー装置に加えて、拡散によって試料を移動させ、線または着色ゾーンによってインフルエンザAの存在を示す。ラテラルフローは一般的には3つの特異的区画を含む固体支持体(例えば、ニトロセルロース膜)を含む:試料添加区画、固定化した1つまたは複数のPDZタンパク質および抗体を含む捕捉区画、ならびに1つまたは複数のゾーンを含み、各ゾーンが1つまたは複数の標識を含む読み取り区画。ラテラルフローは陽性対照および陰性対照も含み得る。従って、例えば一部の態様におけるラテラルフロー装置は次の通り機能する:インフルエンザPLタンパク質を、生物学的試料のアリコートを検査紙の一方の端に接触させて、続いて、例えば、ラテラルフローのような毛管現象により、タンパク質を検査紙上で移動させることによって、生物学的試料中のその他のウイルス性および細胞性タンパク質と分離する。PDZポリペプチド物質、抗体、および/またはアプタマーのような1つまたは複数のPL結合物質が捕捉試薬および/または検出試薬として含まれる。ラテラルフローによる分離、検出、および定量のための方法および装置は、例えば、参照によりそれらの全体が本明細書に組み入れられる米国特許第5,569,608号、第6,297,020号、および第6,403,383号など、当技術分野において公知である。一つの非限定的な例において、検査紙は試料をロードするための基部領域(試料ローディング領域)、ならびにPDZポリペプチド捕捉物質および緩衝試薬、ならびにPDZポリペプチドおよび移動する生物学的試料中の任意のインフルエンザPLタンパク質の結合相互作用を確立するために適した添加物質を含む遠位検査領域を含む。代替的な態様において、検査紙は、それぞれ、異なるインフルエンザPLタンパク質分析物と特異的に相互作用することができる異なるPDZドメインポリペプチドを含む2つの検査領域を含む。
XI.薬学的組成物
上記のスクリーニング過程は、薬学的組成物に組み入れられ得る1つまたは複数の種類の化合物を識別することができる。これらの化合物には、少なくとも1つのNS1タンパク質、少なくとも1つのPDZタンパク質のいずれかの、転写、翻訳、および翻訳後の過程の阻害剤である作用物質が含まれる。この作用物質は、さらに、NS1およびPDZタンパク質、またはそれらの混合物の結合を阻害または遮断し得る。これらの化合物は、1つもしくは複数のNS1タンパク質、1つもしくは複数のPDZタンパク質、またはNS1およびPDZタンパク質の相互作用の阻害物質であって、固有の呼吸器細胞特異的活性および/または消化器細胞特異的活性もしくは上皮細胞特異的活性または造影活性を持つ作用物質も含む。化合物は、薬学的物質または造影成分がNS1、PDZタンパク質、またはNS1タンパク質およびPDZタンパク質の相互作用のいずれかの阻害物質に連結する抱合体も含む。望ましくない副作用をもたらすであろう作用物質の非感染細胞への輸送を抑制するために、薬学的活性を持つ作用物質、および作用物質単独に比してPDZタンパク質に対する基質能力の低い抱合体分子を含む抱合体も提供される。好ましくは、化合物または作用物質はPDZタンパク質に対する次のPLの少なくとも1つの結合を阻害または遮断する:ESEV(配列番号:2)、ESEI(配列番号:3)、ESKV(配列番号:4)、TSEV(配列番号:5)、GSEV(配列番号:6)、RSEV(配列番号:7)、RSKV(配列番号:8)、GSEI(配列番号:9)、GSKV(配列番号:10)、NICI(配列番号:11)、TICI(配列番号:12)、RICI(配列番号:13)、DMAL(配列番号:14)、DMTL(配列番号:15)、DIAL(配列番号:16)、DLDY(配列番号:17)、SICL(配列番号:18)、SEV、SEI、SKV、およびSKI。より好ましくは、遮断または阻害されるNS1 PLはESEVである。好ましくは、化合物または作用物質は表1または2のPDZタンパク質の少なくとも1つへの結合を阻害する。より好ましくは、阻害されるPDZタンパク質または相互作用は次の少なくとも1つである:PSD95(PDZ#2)、PSD95(PDZ#1、2、3)、DLG1(PDZ#1)、DLG1(PDZ#1、2)、DLG1(PDZ#2)、DLG2(PDZ#1)、DLG2(PDZ#2)、Magi3(PDZ#1)、PTN3(PDZ#1)、MAST2(PDZ#1)、NeDLG(PDZ#1、2)、Shank1 d1、Shank2 d1、Shank3 d1、シントロフィン1α、シントロフィンγ1、Magi1(PDZ#1)、Magi1(PDZ#4)、Tip1;PTPL1(PDZ#1)、Mint3(PDZ#1)、Lym Mystique(PDZ#1)、DLG2(PDZ#3)、MUPP1(PDZ#8)、NeDLG(PDZ#1)、DLG5(PDZ#1)、PSD95(PDZ#1)、NumBP(PDZ#3)、LIMK1(PDZ#1)、KIAA0313、DLG1(PDZ#2)、シンテニン(PDZ#2)、Pick1、または類似体もしくはフラグメント、および/または任意のPDZタンパク質を模倣する抗体(またはアプタマー)。
1つまたは複数の上記の実体は、動物またはヒトへの投与のための薬学的組成物を製剤化するために広く用いられる溶媒として定義される、薬学的に許容可能な無毒性の担体または希釈剤と組み合わせてよい。希釈剤は、組み合わせたものの生物活性に影響しないように選択される。このような希釈剤の例は、蒸留水、緩衝液、生理食塩液、リン酸緩衝生理食塩液(PBS)、リンガー液、デキストロース液、およびハンクス液である。さらに、薬学的組成物または製剤は、その他の担体、アジュバント、または無毒性、非治療的、非免疫原性の安定剤、賦形剤なども含んでよい。組成物は、適切な生理学的条件まで、pH調整剤および緩衝剤、毒性調整剤、湿潤剤、界面活性剤などのような付加的物質をさらに含むことができる(例えば、Remington's Pharmaceutical Sciences, Mace Publishing Company, Philadelphia, PA, 17th ed. (1985)を参照されたい;薬剤送達法の簡潔な総論についてはLanger, Science 249:1527-1533 (1990)を参照されたい;これらの各参照は、参照によりその全体が組み入れられる)。
経口投与のための薬学的組成物は、例えば、錠剤、丸剤、粉剤、ロゼンジ剤、カシェ剤、エリキシル剤、懸濁剤、乳剤、液剤、またはシロップ剤などの剤形であってよい。適切な賦形剤のいくつかの例には、ラクトース、デキストロース、ショ糖、ソルビトール、マンニトール、デンプン、アラビアゴム、リン酸カルシウム、アルギネート、トラガカント、ゼラチン、ケイ酸カルシウム、微結晶性セルロース、ポリビニルピロリドン、セルロース、滅菌水、シロップ、およびメチルセルロースが含まれる。メチル-およびプロピルヒドロキシ-安息香酸のような保存物質;甘味料;ならびに香料も含まれ得る。製剤に応じて、組成物は患者への投与後に活性成分の急速、持続、または遅延放出を提供することができる。高分子の材料は経口持続放出送達に使用することができる(「Medical Applications of Controlled Release」、Langer and Wise (eds.), CRC Pres., Boca Raton, Florida (1974);「Controlled Drug Bioavailability」、Drug Product Design and Performance, Smolen and Ball (eds.), Wiley, New York (1984);Ranger and Peppas, 1983, J Macromol. Sci. Rev. Macromol Chem. 23:61を参照されたい; Levy et al., 1985, Science 228: 190;During et al., 1989, Ann. Neurol. 25:351;Howard et al., 1989, J. Neurosurg. 71:105も参照されたい)。持続放出は、抱合体をカプセルまたは緩徐に溶解するポリマーに封入することによって達成することができる。好ましいポリマーには、カルボキシメチルセルロースナトリウム、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、およびヒドロキシエチルセルロース(最も好ましくはヒドロキシプロピルメチルセルロース)が含まれる。その他の好ましいセルロースエーテルが記載されている(Alderman, Int. J. Pharm. Tech. & Prod. Mfr., 1984, 5(3) 1-9)。薬剤放出に影響する要因については、当技術分野において記載されている(Bamba et al., Int. J. Pharm., 1979, 2, 307)。吸入による投与の場合、本明細書の開示に基づく使用のための化合物は、例えばジクロロジフルオロメタン、トリクロロフルオロメタン、ジクロロテトラフルオロエタン、二酸化炭素、もしくはその他の適切なガスなどの適切な噴霧剤を用いて加圧パックまたはネブライザーから、または噴霧剤を含まない乾燥粉末吸入器からエアロゾル噴霧調製物の形で簡便に送達される。加圧エアロゾルの場合、投与単位は計量した量を送達するためのバルブを提供することによって決定することができる。化合物およびラクトースまたは澱粉などの適切な粉末基剤の粉末混合物を含む吸入器またはインサフレーターで使用するための例えばゼラチンのカプセルおよびカートリッジが製剤化され得る。
薬学的組成物の有効な投与量および投与計画(投与の量および頻度)は、十分に確立された複数のプロトコルの任意の1つに従って容易に決定される。例えば、体重kg当たりの生物活性物質の最大耐用量を求めるために、動物試験(例えば、マウス、ラット)が広く用いられる。一般に、試験される動物種の少なくとも1つは哺乳動物である。動物試験の結果は、例えばヒトなどのその他の動物種における用量を決定するために外挿することができる。
化合物は、予防的および/または治療的投与として患者に投与することができる。治療的用量は、疾患の状態もしくは症状を治療するために、またはそうでない場合は、いかなる方法であれ、疾患もしくはその他の任意の望ましくない症状の進行を防止し、妨害し、遅延させ、もしくは後戻りさせるために十分な量である。予防的適用では、化合物は、特定の疾患または感染症の疑いがある、またはそうでない場合は特定の疾患または感染症のリスクがある患者に対して投与される。従って、「予防上有効な」量は疾患の状態またはその症状を防ぎ、妨害し、または遅延させるために十分な量である。いずれの場合も、組成物に含まれる化合物の正確な量は患者の健康状態および体重に依存する。
体重kg当たりの生物活性物質の最大耐用量を求めるために、例えば、動物試験(例えば、マウス、ラット)が広く用いられて薬学的組成物の適切な投与量が決定される。一般に、試験される動物種の少なくとも1つは哺乳動物である。動物試験の結果を基に推定して、例えばヒトなどのその他の動物種における用量を決定することができる。
薬学的組成物の成分は好ましくは高純度であり、実質的に潜在的に有害な混入物を含まない(例えば、少なくともNational Food (NF)のグレードにおいて、一般に少なくとも分析グレード、より一般的には少なくとも医薬品グレード)。
所与の化合物が使用前に合成されなければならない場合、得られる産物は一般的に任意の潜在的有毒物質、特に合成または精製の過程に存在し得る任意の内毒素を実質的に含まない。組成物は、通常、GMP条件下にて作成される。非経口投与のための組成物は、通常、無菌であり、実質的に等張である。
A.抗ウイルス物質
本発明の用途に適した薬学的組成物は、有効投与量の活性物質が含まれる組成物を含む。抗ウイルス物質は、好ましくは、NS1またはPDZ mRNAもしくはタンパク質の少なくとも30、50、75、95または99%阻害を示すNS1、PDZ、および/またはNS1/PDZ相互作用の阻害物質を含む。タンパク質の発現は、タンパク質に特異的に結合する抗体を用いた免疫学的解析を形成して、続いて抗体およびタンパク質の間に形成される複合体を検出することによって定量され得る。mRNAの量は、例えば、ドットブロット分析、インサイチューハイブリダイゼーション、RT-PCR、定量的逆転写PCR(即ち、いわゆる「TaqMan」法)、ノーザンブロット、および核酸プローブアレイ法によって定量することができる。好ましくは、阻害物質を識別するために用いられるNS1 PLは次のうちの1つである:ESEV(配列番号:2)、ESEI(配列番号:3)、ESKV(配列番号:4)、TSEV(配列番号:5)、GSEV(配列番号:6)、RSEV(配列番号:7)、RSKV(配列番号:8)、GSEI(配列番号:9)、GSKV(配列番号:10)、NICI(配列番号:11)、TICI(配列番号:12)、RICI(配列番号:13)、DMAL(配列番号:14)、DMTL(配列番号:15)、DIAL(配列番号:16)、DLDY(配列番号:17)、SICL(配列番号:18)、SEV、SEI、SKV、およびSKI。より好ましくは、阻害物質を識別するために用いられるNS1 PLはESEV(配列番号:2)である。好ましくは、阻害物質を識別するために用いられるPDZタンパク質は表1または表2から選択される少なくとも1つ、フラグメントまたは類似体である。より好ましくは、阻害物質を識別するために用いられるPDZタンパク質は次の少なくとも1つである:外膜タンパク質、PSD95(PDZ#2)、PSD95(PDZ#1、2、3)、DLG1(PDZ#1)、DLG1(PDZ#1、2)、DLG1(PDZ#2)、DLG2(PDZ#1)、DLG2(PDZ#2)、Magi3(PDZ#1)、PTN3(PDZ#1)、MAST2(PDZ#1)、NeDLG(PDZ#1、2)、Shank1 d1、Shank2 d1、Shank3 d1、シントロフィン1α、シントロフィンγ1、Magi1(PDZ#1)、Magi1(PDZ#4)、Tip1;PTPL1(PDZ#1)、Mint3(PDZ#1)、Lym Mystique(PDZ#1)、DLG2(PDZ#3)、MUPP1(PDZ#8)、NeDLG(PDZ#1)、DLG5(PDZ#1)、PSD95(PDZ#1)、NumBP(PDZ#3)、LIMK1(PDZ#1)、KIAA0313、DLG1(PDZ#2)、シンテニン(PDZ#2)、Pick1、または類似体もしくはフラグメント、および/または任意のPDZタンパク質を模倣する抗体(またはアプタマー)。
抗ウイルス物質は、インフルエンザNS1またはその他のPLタンパク質と相互作用するPDZタンパク質への結合として識別されるPLペプチド治療薬を含み得る。抗ウイルス物質は、ベースとするPLモチーフまたはPDZドメインを含むペプチドを含む。インフルエンザウイルスPLおよびPLに結合するPDZドメインの相互作用を阻害するためのいくつかの例示的ペプチドを表11(配列番号:89〜987)に示す。その他の有用なペプチドは、実施例に記載される通り、配列番号:2、48、53、996、および997である。本発明の治療用物質は、ペプチド自身、C末端から始まる少なくとも5、10、15、または20の隣接する残基を含むその切断、ならびにこれらのすべてのペプチドの保存的に置換された変異型および模倣物を含み、薬学的組成物に組み込まれてもよい。もしある場合は、保存的置換は、好ましくはペプチドのC末端3〜4個のアミノ酸の外側に生じる。病原性インフルエンザPLのPDZへの結合を遮断するペプチドは病原性インフルエンザの治療に有用である。好ましくは、表11に示すペプチド、切断、保存的に置換された変異型またはそれらの模倣物は、ペプチド配列のN末端においてトランスポーターペプチド(タンパク質形質導入ドメイン)に連結する。Tatおよびアンテナペディアを含む複数のトランスポーターペプチド配列が使用され得る(実施例7も参照されたい)。抗ウイルス治療薬は、ウイルスPLとPDZとの相互作用を阻害する小分子、ならびにCox2阻害剤(本明細書において表8に示される)をさらに含む。いくつかの小分子阻害剤は、本明細書の表9および10に記載されている。
B.抗ウイルス物質のスクリーニングの方法
NS1 PLタンパク質および/またはPDZタンパク質に結合する作用物質に関するスクリーニングの方法が本明細書において開示される。作用物質は、先ず、NS1 PLまたはPDZタンパク質のPDZドメインへの結合に関してスクリーニングされる。続いて、それらについてPDZ/PL相互作用の阻害能に関して検査される。これらの方法は、下記の「B.抗ウイルス物質のアッセイ」にも示される。結合アッセイは、天然または合成PLタンパク質を用いてインビトロにて実施することができる。または、タンパク質を含む天然または合成PDZドメインは、特定のPDZタンパク質に結合できる作用物質を識別するために用いられ得る。
本明細書に開示される抗ウイルス物質のスクリーニングの方法は、ウイルスPLとそれが相互作用するPDZタンパク質との間の相互作用を遮断または阻害する作用物質を識別する。阻害剤およびそれらをコードするDNAについて、NS1および/またはPDZの発現の阻害能に関してスクリーニングする。最初のスクリーニングは、PDZ/PL相互作用を阻害または停止できる作用物質のサブセットを選択するために実施することができる。このようなアッセイは、単離されたPDZタンパク質およびPLタンパク質、または互いに結合できるそれらのフラグメントを用いて、インビトロにおいて実施してよい。このようなスクリーニングによって識別された作用物質は、続いて、機能的にアッセイされ得る。作用物質は、PLタンパク質を発現している細胞、およびPDZタンパク質を自然に発現している細胞、またはPDZタンパク質を発現するように形質転換された細胞においてもスクリーニングされ得る。
上記に開示および例証される診断的アッセイに加えて、態様はインフルエンザA感染細胞におけるインフルエンザウイルスPLおよび宿主細胞PDZポリペプチドの間に生じる1つまたは複数の結合相互作用を調節することができる抗ウイルス候補物質を識別するためのアッセイを提供する この方法は、抗ウイルス試験物質の存在下において、例えば合成PLペプチドなどの対照PLの、例えば組換え型PDZ融合タンパク質などのPDZドメインポリペプチドへの結合を検査する工程を伴う。抗ウイルス候補物質は、対照PLおよびPDZドメインポリペプチドの結合を調節する。本発明者は、既に、例えば、参照によりそれらの全体が本明細書に組み入れられる国際特許出願5,569,608、6,297,020、および6,403,383などのUSおよび国際特許出願において、対照PLおよびPDZドメインポリペプチドの間の結合相互作用を測定するためのアッセイを開示している。
特に有用なスクリーニングアッセイは、1つまたは複数のインフルエンザNS1 PLおよび1つまたは複数のPDZドメインタンパク質の双方を発現する細胞を使用する。このような細胞はタンパク質をコードするポリヌクレオチドを用いた細胞の同時形質移入によって組換え技術により作出され得て、またはタンパク質の1つを天然で持つ細胞に第2のタンパク質を形質移入することによって作出され得る。特定の態様において、このような細胞はマルチウェル培養プレートで増殖し、経験的に定められ得る予め決められた期間、試験する化合物(compound)または化合物(compounds)の様々な濃度に曝露される。細胞全体の溶解物、培養培地または細胞膜を、PL/PDZ相互作用の阻害についてアッセイする。(以下に考察する通り)対照に比して活性を著しく阻害する試験化合物を治療薬候補と見なす。
単離されたPDZドメインタンパク質またはそのPL結合フラグメントは、任意の様々な薬剤スクリーニング技術における治療用化合物のスクリーニングにおいて使用され得る。または、単離されたNS1 PLタンパク質またはPLモチーフを含むフラグメントが使用され得る。このような検査で用いられるタンパク質は、膜に結合し、溶液中で遊離し、固体支持体に固定され、細胞表面に位置し、または細胞内に分布し得る。PDZドメインまたはNS1 PLと試験しようとする作用物質との結合複合体の形成が測定され得る。より具体的には、相互作用が試験化合物の不在下で測定される相互作用よりも著しく低下する場合、試験化合物はPDZ/PL相互作用の阻害物質と見なされる。この関連において、「著しく低下する」という用語は、試験化合物の存在下において、PDZ/PL相互作用が試験化合物の非存在下で測定される場合に比して、アッセイ方法の信頼限界内で測定可能に低下することを意味する。
ペプチドまたはその他の化合物のランダムライブラリを、PDZ/PL結合の阻害物質としての適合性に関して、または単にPDZドメインタンパク質もしくはNS1 PLタンパク質のいずれかへの結合に関してさらにスクリーニングしてもよい。段階的方法で合成され得る多くの種類の化合物について組み合わせライブラリを作成することができる。このような化合物には、ポリペプチド、βターン模倣物、多糖類、リン脂質、ホルモン、プロスタグランジン、ステロイド、芳香族化合物、複素環式化合物、ベンゾジアゼピン、オリゴマーN置換グリシン、およびオリゴカルバメートが含まれる。化合物の大きな組み合わせライブラリは、Affymax、WO 95/12608、Affymax、WO 93/06121、Columbia University、WO 94/08051、Pharmacopeia、WO 95/35503およびScripps、WO 95/30642(それぞれ、参照によりすべての目的のために組み入れられる)に説明されるコード化合成ライブラリ(ESL:encoded synthetic libraries)法によって構築され得る。
治療薬または治療用リードに関するスクリーニングで用いるための試験化合物の好ましいソースはファージディスプレイライブラリである。例えば、Devlin、WO 91/18980; Key, B.K., et al., eds., Phage Display of Peptides and Proteins, A Laboratory Manual, Academic Press, San Diego, CA, 1996を参照されたい。ファージディスプレイは、108〜109の異なる配列を含むライブラリから所望の特徴のペプチドまたはタンパク質を選択および増幅するためにファージの遺伝学的性質を使用することを可能とする強力な技術である。ライブラリは、所望の特徴に対するライブラリの偏りを考慮して、所望の位置におけるアミノ酸配列の特定の多様性のために設計され得る。ライブラリは、ペプチドがバクテリオファージの表面に発現したタンパク質に融合して発現するように設計される。所望の特徴のファージ発現ペプチドが選択されて、増殖のために再成長させることができる。ペプチドはファージの増殖によって増幅されることから、特定のファージに由来するDNAは容易にシーケンシングされ得て、特定のペプチドの迅速な解析が促進される。
ペプチド阻害物質をコードするファージは、PDZドメインタンパク質および/またはNS1 PLに特異的に結合するファージについて選択することによって選択され得る。ライブラリは、ファージの表面に発現する遺伝子IIなどのタンパク質に融合して作成される。ライブラリは様々な長さのペプチドから構成され得て、直線性または2つのCysアミノ酸の包含によって拘束され、ファージタンパク質に融合され得て、または足場としてのさらなるタンパク質に融合されてもよい。本明細書に開示されるPL領域の方向に偏った、またはさらなる試験阻害物質化合物を提供する最初のライブラリからの結合ファージの選択から得られるペプチド配列の方向に偏ったライブラリを設計することもできる。
C.抗ウイルス物質の種類
スクリーニング方法において識別されたものと同様に、以下に示す任意の作用物質が医薬として用いられ得る。阻害物質は、RNA発現ライブラリ、バクテリオファージ発現ライブラリ、小分子ライブラリ、ペプチドライブラリを含む任意の種類のライブラリから識別され得る。阻害物質は、核酸および/またはポリペプチドの公知の配列を用いて作成することもできる。化合物は、亜鉛フィンガータンパク質、リボザイム、siRNA、およびアンチセンスRNAなどの遺伝子発現を調節することが公知である複数のカテゴリーの分子をさらに含む。
(a)siRNA阻害物質
siRNAは相対的に短く、少なくとも一部は二本鎖の、相補的mRNA転写物の発現阻害に役立つRNA分子である。本発明の実践にはメカニズムの理解は要求されないが、siRNAは相補的mRNA転写物の分解を誘発することによって作用すると考えられている。siRNAの設計および使用の原理は、一般に、WO 99/32619、Elbashir, EMBO J. 20, 6877-6888 (2001)およびNykanen et al., Cell 107, 309-321 (2001);WO 01/29058に記載されている。
本発明のsiRNAは少なくとも部分的に相補性のRNAの2本の鎖から形成されて、各鎖は好ましくは10〜30、15〜25、または17〜23もしくは19〜21ヌクレオチドの長さである。鎖はそれらの長さ全体を通して互いに完全に相補的であり得て、またはそれ以外の場合には二本鎖分子の一端または両端において一本鎖の3'-オーバーハングを有し得る。一本鎖オーバーハングが存在する場合は、通常、1〜6塩基であり、1または2塩基が好ましい。siRNAのアンチセンス鎖は、NS1またはPDZ転写物のセグメントに実質的に相補的(例えば、少なくとも80、90、95%、および好ましくは100%)であるように選択される。任意の不適正塩基は、好ましくは、siRNAの鎖の末端または末端近くに生じる。末端での不適正塩基はデオキシリボヌクレオチドであり得る。siRNAのセンス鎖は、NS1またはPDZ転写物のセグメントの相補物と類似の関連性を示す。それぞれが完全相補性の19の塩基を持ち、かつセンス鎖の3'末端に2つおよびアンチセンス鎖の3'末端に1つの非対応塩基を持つ2本の鎖を持つsiRNAは特に適している。
siRNAがこのように投与されるべき場合、siRNAをコードするDNAの形とは異なるので、siRNAの鎖は1つまたは複数のヌクレオチド類似体を含み得る。ヌクレオチド類似体は、例えば、5'末端および/または3'末端の領域、特に一本鎖オーバーハング領域内など、阻害物質活性が実質的に影響を受けない位置に位置する。好ましいヌクレオチド類似体は糖またはバックボーンが修飾されたリボヌクレオチドである。核酸塩基修飾リボヌクレオチド、即ち、例えば5-(2-アミノ)プロピルウリジン、5-ブロモウリジンなどの5位が修飾されたウリジンまたはシチジン;例えば8-ブロモグアノシンなどの8位が修飾されたアデノシンおよびグアノシン;例えば7-デアザ-アデノシンなどのデアザヌクレオチド;例えばN6-メチルアデノシンなどのO-およびN-アルキル化ヌクレオチドなど、天然の核酸塩基の代わりに非天然の核酸塩基を含むリボヌクレオチドも適切である。好ましい糖修飾リボヌクレオチドにおいて、2'OH基はH、OR、R、ハロ、SH、SR、NH2、NHR、NR2、またはCNより選択される基によって置換され、ここでRはC1-C6アルキル、アルケニル、またはアルキニルであり、ハロはF、CI、Br、またはIである。好ましいバックボーン修飾リボヌクレオチドにおいて、隣接するリボヌクレオチドに接続するリン酸エステル基は例えばホスホチオエート基などの修飾基によって置換される。さらなる好ましい修飾は、siRNAの5'水酸基にリン酸基を導入することである。このような基はATPおよびT4キナーゼを用いたsiRNAの処理によって導入することができる。天然RNAのホスホジエステル結合は、少なくとも1つの窒素または硫黄のヘテロ原子を含むようにさらに修飾され得る。RNA構造の修飾は、dsRNAによって生じるいくつかの生物体における一般的なパニック反応を避ける一方で特異的な遺伝子阻害を可能とするように調整することができる。同様に、塩基はアデノシンデアミナーゼの活性を遮断するように修飾することができる。
NS1またはPDZ転写物内の多くのセグメントがsiRNAの設計において適切な標的である。NS1 PLの特定のセグメントが亜型を選択的に標的とするために用いられる場合、セグメントは好ましくは転写物のその他のNS1 PL領域と完全な配列同一性の欠除を示す。好ましくは、NS1またはPDZタンパク質の特定のセグメントは、NS1 PLの対応するセグメント(もしある場合)から少なくとも1、2、3、4またはそれよりも多いヌクレオチドの相違を示す。標的部位は、NS1またはPDZのコード領域である5'UTRおよび3'UTRから選択され得て、いくつかの場合には、NS1のPL位置が好ましい。好ましい標的位置はNS1 PLと呼ばれるsiRNAの位置である(実施例を参照されたい)。この位置はC末端であり、インフルエンザAウイルスの亜型に特異的である。その他の好ましい位置には、PDZタンパク質のPL結合位置が含まれる。
siRNAは、挿入されたセグメントの転写を逆向きに行うように方向付けられた一対のプロモーターの間に、siRNAをコードするDNAのセグメントを挿入することによって、組換え技術により合成することができる。このようなプロモーターからの転写によって2つの相補的RNA鎖が産生されて、その後、アニールして所望のdsRNAを形成することができる。このような系での使用のための例示的プラスミドはプラスミド(PCR 4.0 TOPO)(Invitrogenより入手可能)を含む。もう一つの例はベクターのpGEM-T(Promega, Madison, WI)であり、この場合、逆向きに方向付けられたプロモーターはT7およびSP6である;T3プロモーターも使用できる。または、siRNAの鎖をコードするDNAセグメントは単一プロモーターの下流に挿入される。この系では、自己相補的であり、従ってdsRNAを形成できる単一のRNA鎖を生成するためにsiRNAのセンスおよびアンチセンス鎖が同時転写される。siRNAをコードするベクターはインビトロにおいてもしくは細胞培養内で転写され得て、またはインサイチューでの発現のためにトランスジェニック動物もしくは患者に導入されてもよい。適切なベクターを下記に示す。組換え発現のためのプロモーターの選択、または任意でその他の調節配列の選択は、発現の組織特異性を決定し得る。例えば、PDGF、プリオン、神経エノラーゼ、またはthy-1プロモーターは、中枢神経系での発現に適している。
siRNAの鎖は、有機化学合成によって合成されてインビトロにおいてアニールされてもよい。化学的またはインビトロでの酵素的合成によって合成される場合、RNAは細胞への導入前に精製することができる。例えば、RNAは溶媒を用いた抽出、もしくは樹脂による沈降、電気泳動、クロマトグラフィー、またはそれらの組み合わせによって混合物から精製され得る。RNAは保存のために乾燥してもよく、または水溶液に溶解してもよい。溶液はアニーリングおよび/または二本鎖の安定化を促進するために緩衝液または塩を含み得る。siRNAは、以下に示す通り、様々なアプローチにより、RNAとして、またはRNAをコードするDNAの形で、細胞または生物体に導入することができる。
(b)アンチセンスポリヌクレオチド
アンチセンスポリヌクレオチドは、センスmRNAに結合および翻訳に干渉することによって、転写に干渉し、RNA前駆物質の加工もしくは局在化に干渉し、mRNAの転写を抑制し、またはいくつかのその他のメカニズムを介して作用することによって、抑制を惹起し得る。アンチセンス分子が発現を抑制する特定のメカニズムは重要でない。
一般的に、アンチセンスポリヌクレオチドは、遺伝子のmRNAに由来する配列に特異的にハイブリダイズする少なくとも7〜10ないし一般的には20またはそれよりも多いヌクレオチドの一本鎖アンチセンス配列を含む。いくつかのアンチセンスポリヌクレオチドは約10〜約50ヌクレオチドの長さであり、または約14〜約35ヌクレオチドの長さである。いくつかのアンチセンスポリヌクレオチドは、約100ヌクレオチドよりも少ない、または約200ヌクレオチドよりも少ないポリヌクレオチドである。一般に、アンチセンスポリヌクレオチドは、安定な二本鎖を形成するために十分な長さでなければならないが、必要に応じて、インビボにおいて投与されるために送達方式に応じて十分に短くなけらばならない。標的配列への特異的ハイブリダイゼーションに必要なポリヌクレオチドの最小の長さは、その他の要因の中でも、G/C含量、不適正塩基の位置(もしある場合)、標的ポリヌクレオチドの集団に比較した場合の配列の固有度、およびポリヌクレオチドの化学的性状(例えば、メチルホスホネートバックボーン、ペプチド核酸、ホスホロチオエート)のような複数の要因に依存する。
特異的ハイブリダイゼーションを確保するため、アンチセンス配列は標的mRNAのセグメントまたは標的mRNAをコードする遺伝子のセグメントに対して少なくとも実質的に相補的である。いくつかのアンチセンス配列は、それらの目的とする標的配列に対して厳密に相補的である。しかし、アンチセンスポリヌクレオチドは、RNAまたはその遺伝子に対応する関連する標的配列への特異的結合がポリヌクレオチドの機能特性として保持される限り、ヌクレオチドの置換、付加、欠失、移行、転移、もしくは修飾、またはその他の核酸配列もしくは核酸以外の分子も含み得る。NS1またはPDZタンパク質の発現を阻害するよう意図されるアンチセンスポリヌクレオチドは、特異的なNS1またはPDZ遺伝子もしくは転写物に対して完全または実質的な程度の配列同一性、ならびに異なるPDZ遺伝子に対して不完全および低い程度の配列同一性を示すように設計される。
いくつかのアンチセンス配列はmRNAの比較的アクセス可能な配列に対して相補的である(例えば、二次構造を比較的欠くなど)。これは、例えばMFOLDプログラム(Genetics Computer Group, Madison WI)および当技術分野において公知のインビトロまたはインビボにおける検査を用いて予想されるRNA二次構造を解析することによって調べることができる。有効なアンチセンス組成物を識別するためのもう一つの有用な方法は、オリゴヌクレオチドの組み合わせアレイ(例えば、Milner et al., 1997, Nature Biotechnology 15:537を参照されたい)を使用する。
アンチセンス核酸(DNA、RNA、修飾、類似体など)は、本明細書で開示される化学的合成および組換え法のような核酸を作成するための任意の適切な方法を用いて作出することができる。アンチセンスRNAは、そのままで、またはアンチセンスRNAをコードするDNAの形で送達され得る。アンチセンスRNAをコードするDNAは、ベクターの構成要素として、または以下に示すような複製不能な形で送達され得る。
(c)亜鉛フィンガータンパク質
亜鉛フィンガータンパク質は、NS1もしくはPDZタンパク質、または核酸もしくは特異的NS1亜型の発現を抑制するためにも用いられ得る。亜鉛フィンガータンパク質は、標的遺伝子内の任意の所望の標的部位に結合するように遺伝子操作され得る、または選択され得る。いくつかの方法において、標的部位はプロモーターまたはエンハンサー内である。その他の方法において、標的部位は構造遺伝子内である。いくつかの方法において、亜鉛フィンガータンパク質は、ヒトKOX-1タンパク質由来のKRAB抑制ドメインのような、転写リプレッサーに連結する(Thiesen et al., New Biologist 2, 363-374 (1990);Margolin et al., Proc. Natl. Acad. Sci. USA 91, 4509-4513 (1994);Pengue et al., Nucl. Acids Res. 22:2908-2914 (1994);Witzgall et al., Proc. Natl. Acad. Sci. USA 91, 4514-4518 (1994)。亜鉛フィンガータンパク質によるターゲティングに適した標的部位を選択するための方法、および選択された標的部位に結合する亜鉛フィンガータンパク質を設計するための方法は、WO 00/00388に記載されている。ファージディスプレイを用いた標的に結合する亜鉛フィンガータンパク質を選択するための方法は、EP.95908614.1に記載されている。亜鉛フィンガータンパク質の設計に用いられる標的部位は、一般的にはほぼ9〜19ヌクレオチドである。NS1もしくはPDZタンパク質またはポリヌクレオチドの阻害のため、標的部位は上記のように異なるPDZ遺伝子または転写物に対して不完全な配列同一性を示すまたは実質的な配列同一性を欠くNS1もしくはPDZタンパク質またはポリペプチド内にて選択される。内因性遺伝子を調節するために亜鉛フィンガータンパク質を使用するための方法は、WO 00/00409に記載されている。亜鉛フィンガータンパク質は、タンパク質として、または亜鉛フィンガーをコードする核酸の形で投与することが可能である。後者の場合、核酸はベクターを用いて、または以下に示すような複製不能な形で、送達され得る。
(d)リボザイム
リボザイムは酵素として機能するRNA分子であり、その他のRNA分子を特定の部位で開裂するように遺伝子操作することができる。リボザイム自身はこの過程で消費されず、mRNA標的分子の複数のコピーを開裂するために触媒的に機能することができる。トランス(trans)における標的RNAを開裂するリボザイム設計のための一般的な規準は、Haseloff & Gerlach, (1988) Nature 334:585-591およびUhlenbeck, (1987) Nature 328:596-603ならびにUS 5,496,698に記載されている。
リボザイムは、一般的には、フランキングセグメント間の転写物(標的サブサイト)および触媒領域の2つの部位に相補性を示して結合する2つのフランキングセグメントを含む。フランキングセグメントは、一般的には5〜9ヌクレオチドの長さであり、任意で6〜8ヌクレオチドの長さである。リボザイムの触媒領域は、一般に、約22ヌクレオチドの長さである。mRNA標的は、一般式NUN、好ましくはGUCを持つ標的サブサイト間に共通開裂部位を含む。(Kashani-Sabet and Scanlon, (1995) Cancer Gene Therapy 2:213-223;Perriman, et al., (1992) Gene (Amst.) 113:157-163;Ruffner, et al., (1990) Biochemistry 29: 10695-10702);Birikh, et al., (1997) Eur. J.Biochem. 245:1-16;Perrealt, et al., (1991) Biochemistry 30:4020-4025)。
リボザイムの特異性は、標的サブサイト、従ってこのようなサブサイトに相補的であるリボザイムのフランキングセグメントの選択によって制御され得る。NS1またはPDZタンパク質の阻害物質として、標的サブサイトは、好ましくはその他のPDZタンパク質に厳密に対応するサブサイトがないように、かつ好ましくは実質的に配列同一性を持つ対応するサブサイトがないように選択される。リボザイムは、RNA分子として、または複製可能なベクターの構成要素としてもしくは下記に示すような複製不能な形でリボザイムをコードするDNAの形で、送達され得る。
(e)抗体
化合物は、本発明の遺伝子によってコードされるタンパク質に特異的に結合するFabs、Fvsなどのような、完全抗体およびそれらの結合フラグメントの双方の抗体を含む。通常、抗体はモノクローナル抗体であるが、ポリクローナル抗体も組換え技術によって発現させることができる(例えば、US 6,555,310を参照されたい)。発現させることのできる抗体の例には、マウス抗体、キメラ抗体、ヒト化抗体、ベニア化(veneered)抗体、およびヒト抗体が含まれる。キメラ抗体は、その軽鎖および重鎖遺伝子が異なる動物種に属する免疫グロブリン遺伝子セグメントから一般的には遺伝子工学によって作出されている抗体である(例えば、Boyce et al., Annals of Oncology 14:520-535 (2003)を参照されたい)。例えば、マウスモノクローナル抗体由来の遺伝子の可変性(V)セグメントはヒト定常(C)セグメントに結合され得る。従って、一般的なキメラ抗体は、マウス抗体由来のVすなわち抗原結合ドメインと、ヒト抗体由来のCすなわちエフェクタードメインからなるハイブリッドタンパク質である。ヒト化抗体は、実質的にヒト抗体に由来する可変性領域フレームワーク残基(アクセプター抗体と呼ばれる)および実質的にマウス抗体に由来する相補性決定領域(ドナー免疫グロブリンとして記載される)を持つ。Queen et al., Proc. Natl. Acad. Sci. USA 86:10029-10033 (1989)、ならびにWO 90/07861、US 5,693,762、US 5,693,761、US 5,585,089、US 5,530,101およびWinter, US 5,225,539を参照されたい。定常領域は、存在する場合は、同じく、実質的にまたは完全にヒト免疫グロブリン由来である。抗体は、従来のハイブリドーマアプローチであるファージディスプレイ(例えば、Dower et al., WO 91/17271、およびMcCafferty et al., WO 92/01047を参照されたい)、その他の供給源の中でもヒト免疫系を用いたトランスジェニックマウスの使用(Lonberg et al., W093/12227 (1993))によって得ることができる。免疫グロブリン鎖をコードする核酸は抗体を産生するハイブリドーマもしくは細胞株から、または既刊文献における免疫グロブリンの核酸もしくはアミノ酸配列に基づいて、得ることができる。
(f)模倣化合物
特定の態様において、このスクリーニング方法化合物において識別される対象の抗ウイルス化合物候補は対象のPDZドメインポリペプチドまたはPLのペプチド模倣物、即ち、対象のPDZドメインまたはPLと実質的に同一の構造および/または機能特性を持つ合成化学的化合物である。対象模倣物は、すべてアミノ酸の合成非天然類似体から構成されるか、または一部が天然ペプチドのアミノ酸で一部が非天然のアミノ酸類似体のキメラ分子であるかのいずれかであり得る。模倣物は、このような置換基が同じく模倣物の構造および/または阻害もしくは結合活性を実質的に変化させない限り、天然アミノ酸保存的置換基の任意の量をさらに組み入れることができる。保存的変異型である本発明のポリペプチドと同様に、模倣物が本発明の範囲内であるかどうか、即ち、その構造および/または機能が実質的に変化していないことは、定型の実験により判定される。このように、模倣組成物は、それが対象ポリペプチド間の結合を阻害し得るならば、本発明の範囲内である。
模倣物は、一般的に3つの構造群に由来する非天然構造的構成要素の任意の組み合わせを含み得る:(a)天然アミド結合(「ペプチド結合」)の連結以外の残基連結基;(b)天然のアミノ酸残基の代わりの非天然残基;または(c)二次構造模倣を誘発する、即ち、例えばβターン、γターン、βシート、αらせん構造などの二次構造を誘発するまたは安定させる残基。
ポリペプチドは、残基のすべてまたはいくつかが天然のペプチド結合以外の化学的手段によって結合する模倣物として特徴付けられ得る。個々のペプチド模倣残基は、ペプチド結合、その他の化学結合、または例えば、グルタルアルデヒド、N-ヒドロキシスクシニミドエステル、二機能性マレイミド、N,N=ジシクロヘキシルカルボジイミド(DCC)またはN,N=ジイソプロピルカルボジイミド(DIC)のようなカップリング手段によって連結され得る。通常のアミド結合(「ペプチド結合」)連結の代替となり得る連結基には、例えば、ケトメチレン(例えば、-C(=O)-NH-の-C(=O)-CH2-)、アミノメチレン(CH2-NH)、エチレン、オレフィン(CH=CH)、エーテル(CH2-O)、チオエーテル(CH2-S)、テトラゾール(CN4-)、チアゾール、レトロアミド、チオアミド、またはエステルが含まれる(例えば、Spatola (1983)、Chemistry and Biochemistry of Amino Acids, Peptides and Proteins, Vol. 7, pp 267-357, A Peptide Backbone Modifications, Marcell Dekker, NYを参照されたい)。
ポリペプチドは、天然のアミノ酸残基の代わりにすべてまたはいくつかの非天然残基を含むことによる模倣物としてさらに特徴付けられ得る。非天然残基については科学文献および特許文献中で十分に説明されている;天然アミノ酸残基の模倣物として有用な少数の例示的非天然組成物およびガイドラインについて以下に説明する。
芳香族アミノ酸の模倣物は、例えば、D-またはL-ナフィルアラニン;D-またはL-フェニルグリシン;D-またはL-2チエネイルアラニン;D-またはL-1、-2、3-もしくは4-ピレネイルアラニン;D-またはL-3チエネイルアラニン;D-またはL-(2-ピリジニル)-アラニン;D-またはL-(3-ピリジニル)-アラニン;D-またはL-(2-ピラジニル)-アラニン;D-またはL-(4-イソプロピル)-フェニルグリシン;D-(トリフルオロメチル)-フェニルグリシン;D-(トリフルオロメチル)-フェニルアラニン;D-p-フルオロフェニルアラニン;D-またはL-p-ビフェニルフェニルアラニン;K-またはL-p-メトキシビフェニルフェニルアラニン;D-またはL-2-インドール(アルキル)アラニン;およびD-またはL-アルキルアミン(ここで、アルキルは置換型または非置換型メチル、エチル、プロピル、へキシル、ブチル、ペンチル、イソプロピル、イソ-ブチル、sec-イソチル、イソ-ペンチル、または非酸性アミノ酸であってよい)によって置き換えられることによって産生され得る。非天然型アミノ酸の芳香環は、例えば、チアゾリル、チオフェニル、プラゾリル、ベンズイミダゾリル、ナフチル、フラニル、ピロリル、およびピリジル芳香環を含む。
酸性アミノ酸の模倣物は、例えば、負の電荷を維持したカルボキシレート以外のアミノ酸、(ホスホノ)アラニン、硫酸化スレオニンなどによる置換によって産生され得る。カルボキシル側鎖(例えば、アスパルチルまたはグルタミル)は、例えば、1-シクロヘキシル-3(2-モルフォリニル-(4-エチル)カルボジイミドまたは1-エチル-3(4-アゾニア-4,4-ジメトルペンチル)カルボジイミドなどのようなカルボジイミド(R=-N-C-N-R=)との反応によって選択的にさらに修飾され得る。アスパチルまたはグルタミルは、アンモニウムイオンとの反応によってアスパラギニル残基およびグルタミニル残基にさらに転換され得る。
塩基性アミノ酸の模倣物は、例えば、(リジンおよびアルギニンに加えて)アミノ酸であるオルニチン、シトルリン、または(グアニジノ)酢酸もしくは(グアニジノ)アルキル酢酸(ここでアルキルは上記に定義される)などを用いた置換によって産生され得る。ニトリル誘導体(例えば、COOHの代わりにCN分子を含む)はアスパラギンまたはグルタミンの代用となり得る。アスパラギニル残基およびグルタミニル残基は、対応するアスパルチル残基またはグルタミル残基へと脱アミノ化され得る。
アルギニン残基模倣物は、アルギニルを、例えばフェニルグリオキサール、2,3-ブタンジオン、1,2-シクロヘキサンジオン、またはニンヒドリンを含む例えば1つまたは複数の通常の試薬と、好ましくはアルカリ条件下で反応させることによって産生され得る。
チロシン残基模倣物は、例えば芳香族ジアゾニウム化合物またはテトラニトロメタンと反応させることによって産生され得る。N-アセチルイミダゾールおよびテトラニトロメタンは、それぞれ、O-アセチルチロシル種および3-ニトロ誘導体を形成するために用いられ得る。
システイン残基模倣物は、システイニル残基を、例えば2-クロロ酢酸またはクロロアセトアミドのようなα-ハロアセテートおよび対応するアミンと反応させてカルボキシメチルまたはカルボキシアミドメチル誘導体を得ることによって産生され得る。システイン残基模倣物は、システイニル残基を、例えば、ブロモ-トリフルオロアセトン、α-ブロモ-β-(5-イミドゾイル)プロピオン酸;クロロアセチルリン酸、N-アルキルマレイミド、3-ニトロ-2-ピリジルジスルフィド;メチル2-ピリジルジスルフィド;p-クロロ水銀安息香酸;2-クロロ水銀-4ニトロフェノール;またはクロロ-7-ニトロベンゾ-オキサ-l,3-ジアゾールアゾールと反応させることによっても産生され得る。
リジン模倣物は、リジニルを例えばコハク酸またはその他のカルボン酸無水物と反応させることによって産生され得る(またアミノ末端残基が変化され得る)。リジンおよびその他のα-アミノ含有残基模倣物は、メチルピコリンイミデートのようなイミドエステル、ピリドキサールホスフェート、ピリドキサール、クロロブロモヒドリド、トリニトロベンゼンスルホン酸、O-メチルイソウレア、2,4,ペンタンジオンとの反応、およびグリオキシレートとのトランスアミダーゼ触媒反応によっても産生され得る。
メチオニン模倣物は、例えばメチオニンスルホキシドとの反応によって産生され得る。プロリンの模倣物には、例えば、ピペコリン酸、カルボン酸チアゾリジン、3-もしくは4-ヒドロキシプロリン、デヒドロプロリン、3-もしくは4-メチルプロリン、または3,3,-ジメチルプロリンが含まれる。ヒスチジン残基模倣物は、ヒスチジルを例えばジエチルプロカルボネートまたはパラ-ブロモフェナシルブロミドと反応させることによって産生され得る。
その他の模倣物には、例えば、プロリンおよびリジンのヒドロキシル化;セリル残基もしくはスレオニル残基のヒドロキシル基のリン酸化;リジン、アルギニン、およびヒスチジンのα-アミノ基のメチル化;N末端アミンのアセチル化;主鎖アミド残基のメチル化もしくはN-メチルアミノ酸での置換;またはC末端カルボキシル基のアミド化によって産生されるものが含まれる。
対象ポリペプチドのアミノ酸は反対のキラリティーのアミノ酸(またはペプチド模倣残基)によってさらに置き換えられ得る。このように、L立体配座(化学的実体の構造に応じて、RまたはSとも呼ばれ得る)における天然の任意のアミノ酸は、一般にD-アミノ酸と呼ばれる反対のキラリティーのアミノ酸ではなく同一の化学構造タイプのアミノ酸またはペプチド模倣物によって置き換えられ得るが、これはR-またはS-型とも呼ばれ得る。
本発明の模倣物は、構造的模倣残基、特に、βターン、βシート、αらせん構造、γターンなどの二次構造を誘導または模倣する残基を含む組成物も含み得る。例えば、天然アミノ酸残基のD-アミノ酸;N-α-メチルアミノ酸;C-α-メチルアミノ酸;またはペプチド内のデヒドロアミノ酸での置換はβターン、γターン、βシート、またはαらせん立体構造を誘発または安定化させ得る。βターン模倣物構造は、例えば、Nagai (1985) Tet. Lett. 26:647-650;Feigl (1986) J. Amer. Chem. Soc. 108:181-182;Kahn (1988) J. Amer. Chem. Soc. 110:1638-1639;Kemp (1988) Tet. Lett. 29:5057-5060;Kahn (1988) J. Molec. Recognition 1:75-79によって説明されている。βシート模倣物構造は、例えば、Smith (1992) J. Amer. Chem. Soc. 114:10672-10674によって説明されている。例えば、シスアミド代用物である1,5-二置換型テトラゾールによって誘発されるタイプVIのβターンはBeusen (1995) Biopolymers 36:181-200によって説明されている。 アミド結合の置換としてポリメチレン単位を産生するためのアキラルωアミノ酸残基の組み入れについてはBanerjee (1996) Biopolymers 39:769-777によって説明されている。ポリペプチドの二次構造は、例えば、強磁場1H NMRまたは2D NMR分光法によって分析され得て、例えば、Higgins (1997) J. Pept. Res. 50:421-435を参照されたい。Hruby (1997) Biopolymers 43:219-266、 Balaji, et al., 米国特許第5,612,895号も参照されたい。
D.抗ウイルス物質の改善
選択細胞への抗ウイルス物質の許容性および導入を改善するためにha
、多くの公知の方法がある。例えば、タンパク質のPEG化は,
それらの免疫系に対する抵抗性を高めるために用いられ得る。または、より容易に選択細胞に侵入できるようにするために、細胞内シグナルまたは分子をタンパク質およびベクターに付加することができる。タンパク質またはベクターを感染細胞による取り込みにおいて特に受け入れられるようにする分子を加えることができ、この場合、レセプターに特異的なリガンドが呼吸器細胞によって発現される。この分子はインフルエンザレセプターまたは細胞タイプ特異的レセプターに特異的であり得る。
この治療用化合物は、化合物をより可溶性とするため、または細胞への侵入を容易にするために、さらに修飾され得る。例えば、化合物は任意の位置でPEG化され得て、または化合物はtatのような膜転移ペプチド(membrane translocating peptide)、アンテナペディア、または参照によりその全体が本明細書に組み入れられるU. Langel, "Cell Penetrating Peptides", CRC Press, Boca Rotan, 2002によって説明されるようなシグナル配列膜転移ペプチドに抱合され得る。
当技術分野では、多くのペプチド配列がこれらの配列に連結するペプチドの形質膜を介しての細胞への侵入を促進し得るものとして説明されている(Derossi et al., 1998, Trends in Cell Biol. 8:84)。本発明の目的のため、このようなペプチドは集合的に「膜貫通トランスポーターペプチド」と呼ばれ、「細胞貫通ペプチド」と互換的に用いられる。後者の細胞貫通ペプチドの例には、次が含まれるが、これらに限定されるものではない:つまり、HIVから派生するtat(Vives et al., 1997, J. Biol. Chem. 272:16010;Nagahara et al., 1998, Nat. Med. 4:1449)、ショウジョウバエ由来のアンテナペディア(Derossi et al., 1994, J. Biol. Chem. 261:10444)、単純ヘルペスウイルス由来のVP22(Elliot and D'Hare, 1997, Cell 88:223-233)、抗DNA抗体の相補性決定領域(CDR)2および3(Avrameas et al., 1998, Proc. Natl Acad. Sci. U.S.A., 95:5601-5606)、70KDa熱ショックタンパク質(Fujihara, 1999, EMBO J. 18:411-419)、およびトランスポータン(transportan)(Pooga et al., 1998, FASEB J. 12:67-77)。一部の態様において、切断されたHIV tatペプチドが用いられ得る。
E.インターフェロンの産生
インターフェロン-αおよび-β(IFN-α/β)は、例えば、ウイルス配列の転写および翻訳を阻害するなど、抗ウイルス抵抗の固有の細胞メカニズムにおいて重要な役割を果たす。IFN-α/βレセプターシグナリング複合体の組み立ては、例えば、NF-κB、STATおよびINF誘発転写因子-3などの転写因子;ならびにタンパク質キナーゼを含む因子のレセプター複合体への動員を必要とする。RACK1は、恐らくヘミデスマゾーム形成体であるプレクチンとの関連において、PKCおよびSTATを複合体に動員および/または結合させる足場タンパク質として機能し得る。他の研究機関からの最新のデータでは、流行性耳下腺炎および麻疹ウイルスはINF-α/βシグナリング複合体を破壊し得て、即ち、報告によると、流行性耳下腺炎Vタンパク質はRACK1と結合してレセプター複合体からのSTATの解離を誘発し、また、麻疹ウイルスに感染した細胞ではウイルス性Cおよび/またはVタンパク質がINF-α/βレセプター複合体との結合および「凍結」によってシグナリングキナーゼのリン酸化を阻害することが報告されている。
インターフェロン-α/βシグナリングは、STATおよびNFκB14の核移動を介して細胞の生存を促すアポトーシス促進反応を阻害する。インターフェロンレセプターシグナリングはPKC-δ15の活性化を引き起こして、次いで、これはカスパーゼ316、さらにSTAT17を介して、また気道ではNFκB18,19を介して炎症促進性シグナリングをダウンレギュレートすることができる。またPKC-δの活性化は、報告では、TNFα誘発アポトーシスを抑制する20,21。この点において、トリインフルエンザNS1によるIFN-α/βシグナリングの阻害は、細胞死を促進して疾患の程度を決定するように運命付けられていると思われる。従って、薬物開発のための薬用剤候補および新規の分子標的は、IFN-α/βシグナリングに対するNS1の影響に干渉するおよび/または影響を妨害する作用物質である。これらの作用物質は、インフルエンザAに感染した対象における疾患の1つまたは複数の症状を緩解させる所望の治療的効果を促進する。
インフルエンザAの高リスク(病原性も参照されたい)トリ株はヒトにおいて劇症性の感染を起こし、即ち、粘膜肺組織のみでなく循環およびCNSへと急速に拡大する。特定の理論に束縛されるものではないが、後者の影響の一部は非構造インフルエンザAウイルスタンパク質に介在されるINF-α/βシグナリングの阻害に起因する。さらに、NS1およびNS2のようなウイルスタンパク質は、有効なIFN-α/βシグナリングおよび細胞性抗ウイルス抵抗メカニズムの誘発に必須の細胞内PDZドメイン-PL相互作用を阻害する可能性が極めて高い。
想定されるPDZリガンド(PL)配列は、本明細書では、INF-α/βレセプター-1(アクセッション番号16166194)、C末端配列である「QDFV」(配列番号:31)、即ち、想定されるクラス-1 PL配列において同定された。同様に、INF-α/β-レセプター-1シグナリング複合体のその他の潜在的メンバーも次の通り推定C末端PL配列モチーフを含む:つまり、MAP-1A(アクセッション番号2119250)は「KSRV」(配列番号:32)を含む;MAP-1B(アクセッション番号14165456/5174525)は「KIEL」(配列番号:33)を含む;MAP-1A/1B軽鎖-3(アクセッション番号12383056/18551443)はC末端「KLSV」(配列番号:34)を含む;プレクチン-1(アクセッション番号4505877)はC末端PL配列モチーフ「SAVA」(配列番号:35)を含む;PKC-δ(アクセッション番号509050)は「KVLL」(配列番号:36)を含む;INF誘導可能タンパク質キナーゼ(アクセッション番号13637584および4506103−elf2α)はC末端配列モチーフ「RHTC」(配列番号:37)を含む; インターフェロンα反応性転写因子-3(アクセッション番号5174475)はC末端モチーフ「LSLV」(配列番号:38)を持つ;さらに、インターフェロン調節因子-2(アクセッション番号20141499/4504723)は「VKSC」(配列番号:39)を含む。
このように、PDZドメイン-PL相互作用はウイルス病原性において重要な役割を果たし、従って、医用化合物の開発のための標的を構成する。
NS1とIFN-α/βレセプター複合体の細胞内PDZドメインの相互作用を阻害することができる医用化合物には、PLペプチドおよびその模倣物、NS1 PL/IFN相互作用のペプチド阻害物質、NS1発現の阻害物質、細胞浸透性非天然PDZドメインポリペプチドおよびそれらの模倣物、ならびにNS1 PLのIFN-α/β応答に関与するヒト特異的PDZドメインへの結合を阻害することができる小分子阻害物質が含まれる。
F.治療の方法
本明細書に開示される薬学的組成物はインフルエンザA疾患の予防または治療の方法において用いられる。
上記の開示から認識され得る通り、本発明は幅広い応用を持つ。例えば、NS1タンパク質、PDZタンパク質、またはNS1およびPDZタンパク質の相互作用のいずれかの阻害物質は、トランスポーターと相互作用して感染細胞に侵入し得る作用物質または抱合体を識別するために用いられ得る。NS1タンパク質、PDZタンパク質、またはNS1タンパク質およびPDZタンパク質の相互作用のいずれかの阻害物質は、感染細胞に結合する抱合体分子を識別して抱合分子を作用物質に連結させることによって、作用物質の感染細胞への結合能を増大させるために用いることができる。
予防的適用では、薬学的組成物または薬剤はインフルエンザA感染に対して感受性の患者またはそうでない場合は発現のリスクのある患者に対して、インフルエンザA感染の発現を防止、抑制、または抑止するために十分な量で投与される。治療的適用では、組成物または薬剤はインフルエンザの発現が疑われる、または既に罹患している患者に対して、インフルエンザA感染の症状を逆行、抑止、または少なくとも部分的に抑止させるために十分な量で投与される。予防的および治療的投与計画のいずれにおいても、NS1、PDZ、および/またはNS1-PDZ相互作用の阻害物質の形の本発明の活性物質は、通常、十分な反応が達成されるまで複数回投与される。但し、予防的および治療的投与計画のいずれにおいても、活性物質は十分な反応が達成されるまで単回投与において投与される可能性がある。一般的には、投与はモニターされて反復投与が行われ得る。さらに、治療計画は、インフルエンザA感染またはインフルエンザA感染の進行の治療において用いられる計画とほぼ等しい投与量、投与経路、および投与頻度を採用してよい。
単回投与剤形を作成するために担体材料と混合することができるNS1タンパク質、PDZタンパク質、および/またはNS1/PDZ相互作用の阻害物質およびその他の活性物質の量は、治療される疾患、哺乳動物種、および特定の投与モードに依存して異なる。任意の特定の患者における「有効投与量」、「薬学的に許容される用量」または「薬学的に許容される量」は、用いられる特定の化合物の活性、治療しようとする患者の動物種、年齢、体重、全般的な健康、性別、および食餌;投与の時期および経路;代謝または排出の速度;同時に投与するまたは予め投与されているその他の薬剤;疾患の種類および程度;副作用の程度;患者が動物であるかヒトであるかなどを含む様々な要因に依存し得る。通常、患者はヒトであるが、トランスジェニックの哺乳動物を含むヒト以外の哺乳動物も治療され得る。活性物質の完全長または活性フラグメントを有効投与量にて投与してもよい。
NS1タンパク質、PDZタンパク質、および/またはNS1/PDZ相互作用の任意の阻害物質、ならびに本発明の方法で用いられるその他の活性物質について、ヒトにおける有効量は先ず、ヒト以外の動物モデルから推定され得る。有効量は、当技術分野において公知のパラメータを用いて臨床医によって定められる可能性もある。一般に、投与は至適有効量よりも若干少ない量で開始される。続いて、投与は、その後、有効投与量が達成されるまで少しずつ増量される。(参照により本明細書に組み入れられるThe Merck Manual of Diagnosis and Therapy, 16th Edition, セクション22, 1992, Berkow, Merck Research Laboratories, Rahway, New Jerseyを参照されたい)。
投与量は、安全性および効果を至適とするために用量設定される必要がある。本明細書に開示される化合物の毒性および治療効果は、例えば、LD50(試験集団の50%に対する致死用量)およびED50(検査集団の50%における治療上有効な用量)を求めるなど、実験動物における標準的な薬学的手順によって求めることができる。毒性および治療的作用の用量比は治療係数であり、LD50およびED50の比として表すことができる。高い治療係数を示す化合物が好ましい。これらのヒト以外の動物試験から得られたデータは、ヒトでの使用において毒性でない用量範囲の製剤化に用いられ得る。このような化合物の投与量は、好ましくは、毒性のほとんどないまたは全くないED50を含む循環濃度の範囲内にある。正確な製剤、投与経路、および投与量は、患者の状態に照らして個々の医師によって選択されてよい(例えば、参照により本明細書に組み入れられるFingl et al. (1975) In: The Pharmacological Basis of Therapeutics, Chapter 1を参照されたい)。
G.投与方法
NS1タンパク質、PDZタンパク質、および/またはNS1/PDZ相互作用の阻害物質、ならびにその他の活性物質は、例えば、ヒトの患者もしくは対象などの哺乳動物に単独で、薬学的に許容される塩もしくはそれらの加水分解可能な前駆物質の形で、または適切な担体もしくは賦形剤と混合される薬学的組成物の形で、有効投与量にて送達または投与され得る。有効な投与計画は、薬剤または薬剤の組み合わせが、インフルエンザA感染の少なくとも1つの症状の発現を検出可能に防止、遅延、阻害、または逆戻りさせるために十分な量および頻度で適切な経路により投与されることを意味する。「有効投与量」、「薬学的に許容される用量」、「薬学的に許容される量」は、例えば、適切な投与計画で投与された際にインフルエンザA感染の症状またはインフルエンザA感染の進行を防止、遅延、阻害、または逆戻りさせるなどの所望の結果を達成するための、NS1タンパク質もしくは発現、PDZタンパク質もしくは発現、および/またはNS1/PDZタンパク質相互作用の阻害物質、その他の活性物質との組み合わせにおける活性物質またはNS1、PDZタンパク質および/もしくはNS1/PDZタンパク質相互作用の阻害物質の十分な量が存在することを意味する。
インフルエンザA由来NS1、1つもしくは複数のPDZタンパク質、および/またはNS1/PDZタンパク質相互作用の阻害物質、ならびに本発明の方法で用いられるその他の活性物質は、その他の様々な薬学的に許容される成分と共にNS1、PDZタンパク質、および/またはNS1/PDZタンパク質相互作用の阻害物質または活性物質を含む薬学的組成物として投与され得る。薬学的組成物は、固体(粉末、顆粒、ドラジェ、錠剤、もしくは丸剤など)、半固体(ゲル、スラリー、もしくは軟膏など)、液体、または気体(エアロゾルもしくは吸入剤)の形であってよい。
本発明での使用のための適切な製剤は、参照により本明細書に組み入れられるRemington's Pharmaceutical Sciences (Mack Publishing Company 1985) Philadelphia, PA, 17th edition) およびLanger, Science (1990) 249:1527-1533に記載されている。本明細書に記載される薬学的組成物は、混合、溶解、顆粒化、ドラジェ作成、微粒子化、乳化、カプセル化、封入、または凍結乾燥の過程の通常の方法で製造され得る。
NS1、PDZタンパク質、および/またはNS1/PDZタンパク質相互作用の阻害物質、ならびにその他の活性物質は一般的な賦形剤、希釈剤、または担体と共に製剤化されて、錠剤に圧縮される、または簡便な経口投与用にエリキシル剤もしくは液剤として製剤化され得る。NS1、PDZタンパク質、および/またはNS1/PDZタンパク質相互作用の阻害物質、ならびにその他の活性物質は、持続放出投与剤形などとしても製剤化され得る。
化合物の投与は、経口、口腔内、直腸、非経口、腹腔内、皮内、経皮、気管内、静脈内、および筋肉内投与を含む様々な方法で達成され得る。化合物は、デポー製剤または持続性放出製剤として全身性ではなく局所性の様式で投与することもできる。加えて、化合物はリポソームに入れて投与することもできる。さらに、化合物は遺伝子療法により投与することもできる。
口腔内投与の場合、組成物は従来の方法で製剤化される錠剤またはロゼンジの形で服用され得る。
吸入による投与の場合、本発明に基づく使用のための化合物は、例えば、ジクロロジフルオロメタン、トリクロロフルオロメタン、ジクロロテトラフルオロエタン、二酸化炭素、またはその他の適切なガスなどの適切な噴霧剤を使用して加圧パック、ネブライザー、もしくはシリンジ噴霧器から、または噴霧剤を含まない乾燥粉末吸入器から、エアロゾル噴霧調製物の形で簡便に送達される。加圧エアロゾルの場合、投与単位は計量した量を送達するためのバルブを提供することによって決定することができる。化合物およびラクトースまたは澱粉などの適切な粉末基剤の粉末混合物を含む吸入器またはインサフレーターで使用するための例えばゼラチンのカプセルおよびカートリッジが製剤化され得る。
化合物は、例えば、ボーラス注入または連続注入による注射による非経口投与のために製剤化され得る。注射用製剤は、例えば、添加保存料と共にアンプルまたは多数回使用容器に入った単位投与剤形で提供され得る。組成物は、懸濁液、油ベースもしくは水性溶媒中の溶液または乳濁液のような剤形をとり得て、懸濁物質、安定剤、および/または分散剤のような製剤化物質を含んでも良い。組成物は、無菌かつ、実質的に等張であり、米国食品医薬品局のGood Manufacturing Practice(GMP)基準に完全準拠して製剤化される。
NS1、PDZタンパク質、および/またはNS1/PDZタンパク質相互作用の阻害物質、ならびにその他の活性物質は、例えば、体温ではすべて融解するが室温では固体のままである、ココアバター、カーボワックス、ポリエチレングリコール、またはその他のグリセリドのような通常の坐剤基剤を含む坐剤または停留浣腸のような直腸用組成物に製剤化されてもよい。
これまでに述べられた製剤化に加えて、組成物はデポー調製物としても製剤化され得る。このような長時間作用型の製剤は埋め込み(例えば、皮下または筋肉内)、または筋肉内注射によって投与してもよい。従って、例えば、化合物は、適切な高分子のもしくは疎水性の材料(例えば、許容される油中の乳濁液として)またはイオン交換樹脂を用いて、または僅かに可溶性の誘導体、例えば僅かに可溶性の塩として製剤化されてもよい。(例えば、参照により本明細書に組み入れられるUrquhart et al., (l984), Ann Rev. Pharmacol. Toxicol. 24:199;Lewis, ed., 1981, Controlled Release of Pesticides and Pharmaceuticals, Plenum Press, New York, N.Y.、米国特許第3,773,919号および第3,270,960号を参照されたい)。
または、疎水性の薬学的化合物のためのその他の送達系を用いてもよい。リポソームおよび乳濁液は、疎水性薬剤の送達用溶媒または担体の周知の例である。いくつかの方法において、長時間循環性、即ち、ステルスリポソームが用いられ得る。このようなリポソームについては、一般に、参照によりその内容が本明細書に組み入れられるWoodleらの米国特許第5,013,556号に開示されている。本発明の化合物は、参照によりその開示が本明細書に組み入れられる米国特許第3,845,770号、第3,916,899号、第3,536,809号、第3,598,123号、および第4,008,719号に開示されるような制御放出手段および/または送達装置によって投与することもできる。
遺伝子療法による投与では、関心対象の遺伝物質(例えば、DNAまたはRNA)がインフルエンザA感染を治療または防止するために宿主に移植される。本発明において、関心対象の遺伝物質は、NS1、PDZ、および/またはNS1/PDZ相互作用の阻害物質、活性物質またはそのフラグメントをコードする。本発明の一つの局面に従って、遺伝物質は治療的に有効でなければならない。このような多くのタンパク質、ベクター、DNAは、それ自体公知である。(参照によりその全体が本明細書に組み入れられるCulver, K. W., "Gene Therapy", 1994, p. xii, Mary Ann Liebert, Inc., Publishers, New York, N.Y.を参照されたい)。例示目的のためのみにおいて、ベクターは、モロニーマウス白血病ウイルスベクター、組織特異的プロモーターを持つアデノウイルスベクター、単純ヘルペスベクター、ワクシニアベクター、人工染色体、レセプター介在遺伝子送達、および上記のベクターの混合物からなる群より選択され得る。遺伝子療法ベクターは、Chiron, Inc., Emeryville, Calif.;Genetic Therapy, Inc., Gaithersburg, Md.;Genzyme, Cambridge, Mass.;Somtax, Alameda, Calif.;Targeted Genetics, Seattle, Wash.;Viagene and Vical, San Diego, Calif.のような異なる研究機関から購入することができる。
アデノウイルスは、NS1、PDZ、および/またはNS1/PDZ相互作用の阻害物質、活性物質またはそのフラグメントをコードする遺伝物質のための有望な遺伝子療法ベクターである。アデノウイルスは、所望の遺伝子産物(例えば、NS1、PDZ、および/もしくはNS1/PDZ相互作用の阻害物質、またはそのフラグメント)をコードおよび発現して、同時に正常な溶菌性ウイルスライフサイクルにおいてその複製能の面で不活性化されるように操作することができる。アデノウイルスの発現はウイルスDNAが宿主細胞の染色体に組み込まれることなく達成されて、これにより挿入突然変異に関する懸念が軽減される。さらに、アデノウイルスは優れた安全性特性を有し、長年にわたって腸溶性生ワクチンとして用いられている(Schwartz, A. R. et al. (1974) Am. Rev. Respir. Dis. 109:233-238)。最後に、アデノウイルスに介在される遺伝子導入は、コットンラットの肺へのα-1-アンチトリプシンおよびCFTRの導入を含む多くの例において実証されている(Rosenfeld, M. A. et al. (1991) Science 252:431-434;Rosenfeld et al., (1992) Cell 68:143-155)。さらに、アデノウイルスをヒトの癌における原因物質として証明しようとする広範な試験は一様に陰性であった(Green, M. et al. (1979) PNAS USA 76:6606)。
薬学的組成物は適切な固体またはゲル状の担体または賦形剤も含んでよい。このような担体または賦形剤の例には、炭酸カルシウム、リン酸カルシウム、様々な糖、澱粉、セルロース誘導体、ゼラチン、およびポリエチレングリコールのようなポリマーが含まれるが、これらに限定されるものではない。
実施例
実施例1:インフルエンザA NS1タンパク質はPDZドメインリガンド(PL)モチーフを持つ
NCBIのインフルエンザリソースデータベースを調べた結果、NS1タンパク質の配列はPDZドメインへの結合能と一致する特性を持つことが明らかとなった。このような配列はPDZドメインリガンドまたはPLと呼ばれる。これらのインフルエンザNS1タンパク質のPLモチーフはS/T-X-V/I/Lと同定され、Sはセリンであり、Tはスレオニンであり、Vはバリンであり、Iはイソロイシンであり、Lはロイシンであり、Xは任意のアミノ酸である。NCBIデータベースにおける747の完全長ヒトNS1配列の内、572がこのモチーフを持つ。NCBIデータベースにおける345の完全長ニワトリNS1配列の内、237がこのモチーフを持つ。このデータを表3a〜3eおよび図1〜3にまとめる。このデータは、異なる動物およびヒトにおける具体的なNS1 PLモチーフの出現に関する統計学的表示を示す。各動物にどのPLモチーフが見られるのか、それらはどのようにして動物種間を移動してきた可能性があるのか、さらに、いくつかのケースでは、通常はどのPLが具体的なHまたはNタンパク質と共に見られるのかを分析するために統計学的解析が用いられ得る。
ヒトPLは5つの配列グループに属する(表3aを参照されたい):RSKI(配列番号:40)、ESEV(配列番号:2)、KSEV(配列番号:41)、RSEV(配列番号:7)、およびRSKV(配列番号:8)。亜型と特定のPLモチーフには強い関連性がある;RSKI(配列番号:40)とH3N2(93%)、ESEV(配列番号:2)とH5N1(100%)、KSEV(配列番号:41)とH1N1(100%、但し、数は少ない)、RSEV(配列番号:7)とH3N2(98%)、およびRSKV(配列番号:8)とH3N2(95%)
ニワトリPLは5つの配列グループに属する(表3bを参照されたい):ESEI(配列番号:3)、ESEV(配列番号:2)、GSEV(配列番号:6)、ESKV(配列番号:4)およびGSKV(配列番号:10)。亜型または亜型のグループと特定のPLモチーフには強い関連性がある;ESEI(配列番号:3)とH7N2 (90%)、ESEV(配列番号:2)とH5N1(64%)、ESKV(配列番号:4)とH5N2(84%)、およびGSKV(配列番号:10)とH5N2(100%、但し、数は若干少ない)。注目すべきトリインフルエンザ、つまりH5およびH7を一括りにすると、ESEI(配列番号:3)はNAIと100%関連し、ESEV(配列番号:2)はNAIと83%関連した。
アヒルPLは3つの配列グループに属する(表3cを参照されたい)。ブタPLは7つの配列グループに属する(表3dを参照されたい)。ウマPLは1つの配列グループに属する(表3eを参照されたい)。
NS1 PL配列のHN亜型分類を用いた非ランダム類別は、NS1 PL分類によるHN亜型分類の方法を示唆する。PDZ結合特性は異なるPL配列間の区別に用いることができて、インフルエンザ亜型分類の根拠として機能し得る。
(表3a)ヒトNS1 PL 572 PL/747分離物
(表3b)ニワトリNS1 PL 237 PL/345分離物
(表3c)アヒルNS1 PL 72 PL/110分離物
(表3d)ブタNS1 PL 31 PL/109分離物
3つの典型的なPL配列グループであるESEV(配列番号:2)、EPEV(配列番号:27)およびRSKV(配列番号:8)を調べた結果、PLの想定される起源が明らかとなった。ESEV(配列番号:2)はトリ単離物に最初に出現して、2003年まではヒトおよび哺乳動物宿主には侵入しなかった(図1を参照)。EPEV(配列番号:27)はウマ単離物において最初に出現して、1997年にヒト、トリおよびその他の哺乳動物宿主に侵入した(図2を参照)。RSKV(配列番号:8)はヒト単離物において最初に出現して、1997年までその他の動物種、特にブタには侵入しなかった(図3を参照)。このタイプの分析は、流行性インフルエンザの種の起源を推定する際に重要であり得る。
上記の分析は、インフルエンザAおよび特定の亜型に特異的なPLモチーフを用いてインフルエンザウイルスNS1ポリペプチドの存在について検査するための新しい方法を実証した。特異的PLの識別は、インフルエンザウイルスのどの株が試料中に存在するかを識別するための方法である。
実施例2:PDZの分析
この実施例は、様々なインフルエンザA PLモチーフに対するPDZタンパク質の結合について説明する。PDZタンパク質は、変法ELISAを用いて評価された。簡潔に言うと、PDZタンパク質の全PDZドメインを含むGST-PDZ融合物が作成された。さらに、様々なインフルエンザA株のNS1タンパク質におけるC末端の20個のアミノ酸に対応するビオチン化されたペプチドが合成されて、HPLCにより精製された。これらの実体間の結合は、ビオチンおよびペルオキシダーゼ基質を結合させるためにアビジン-HRPを用いて比色分析である「G」アッセイにより検出された。特定のインフルエンザ株に由来するNS1タンパク質の配列を配列番号:42〜47に示す。
NS1 PL(または、H5N1Aの場合はC末端)のヒトPDZタンパク質への結合は、(i)インフルエンザAのH5N1、H1N1、およびH3N2株におけるNS1 PL(またはC末端)配列の一部を模倣するために選択されたビオチン化された合成20-merペプチド;および(ii)組換えの系において合成遺伝子、即ち、発現系で合成されて免疫化学的タグであるMBPをコードする配列に融合されたNS1 DNA(マルトース結合タンパク質;NEB;製造業者の説明書に従って作成)によってコードされた組換え型NS1タンパク質の双方を用いて調べられた。
マトリックスグラフペプチドおよびタンパク質は、ヒトゲノムのすべての異なるPDZドメインのほぼ完全なセット(255)を構成するアレイ様式で検査した。各PDZドメインポリペプチドは、市販のグルタチオンS-トランスフェラーゼタグ化発現系において組換え型GST-PDZポリペプチドとして発現した。ビオチン化PLペプチドのPDZドメインポリペプチドへの特異的結合は、ストレプトアビジン-HRPおよびTMB基質を用いて検出された。同様に、PDZドメインポリペプチドへのNS1-MBP融合タンパク質の特異的結合は、ビオチン化抗MBP、ストレプトアビジン-HRPおよびTMB基質を用いて可視化された。結合の相対的強度を分析して、各々のPLについて強いおよび弱い結合剤が示される。PLタンパク質を捕捉または識別するために使用する場合には、より強力に結合するPDZタンパク質が好ましい。しかし、様々なPLタンパク質へのPDZタンパク質の異なる結合を用いる検査では、弱い結合のPDZタンパク質が有用なこともある。結果は次の通りであった:A/Taiwan/1996 Ac.# AAC14269株由来MBP.NS1 H1N1 (RSEV) PL(配列番号:42)は様々なPDZタンパク質への結合に関して検査された。次のPDZタンパク質は強い結合であることが明らかとなった:Rho-Gap 10、シントロフィン1α、外膜、Magi2 d3、Magi1 d4、Tip43 d1、Magi1 d1,Tip 1、PSD95 d1,2,3、PTPL1 d2、PSD95 d2、INADL d8、DLG1 d1,2、Vartul d2、PSD95 d1、magi13 d1、DLG1 d2、Mast2 d1、NeDLG d1,2、SNPC lla、DLG2 d2。次のPDZタンパク質は弱い結合であることが明らかとなった:Magi3 d2、PTN3 d1、DLG2 d1。直接結合サンドイッチアッセイを用いた滴定試験において、PSD95 d1,2,3はEC50 1.29μg/mlで結合することが見出され、外膜タンパク質はEC50 1.25μg/mlで結合することが見出された。その他の測定は表4aに示す。
(表4a)滴定EC50:MBP.NS1 H1N1 (RSEV−配列番号:7)
A/New York/31/2004Ac.# AAX56415株由来MBP.NS1 H3N2 (RSKV) PL(配列番号:43)は様々なPDZタンパク質への結合について検査された。次のPDZタンパク質は強い結合であることが明らかとなった:外膜、PSD95 d1,2,3、INADL d8、DLG1 d1,2、Grip 1 d4、Shank 1、GoRaspl d1、Sim GoRasp65、シンテニンd2、NeDLG d3、FLJ12615、KIAA0967、PTN3 d1、DLG2 d1、NeD1Gl、d1,2、D1G2 d2、mastl d1、Kiaa1719d4、Kiaa1415 d1、およびPICK1 FL。次は弱い結合であることが明らかとなった:Shank 2、NumbBP d3、psd95 d1,2,3、およびMast2d1。直接結合サンドイッチアッセイを用いた滴定試験において、PSD95 d1,2,3はEC50 25.3μg/mlで結合することが見出され、INADL d8はEC50 0.869μg/mlで結合することが見出された。その他の測定値は表4bに示す。
(表4b)滴定EC50:MBP.NS1 H3N2 (RSKV−配列番号:8)
A/Hong Kong/97/1998 Ac.# AAK49317株由来MBP.NS1 H5N1A (EPEV) PL(配列番号:44)は、様々なPDZタンパク質への結合について検査された。次のPDZタンパク質は強く結合することが明らかとなった:ALP、PSD95 d1、およびPICK FL。次は弱く結合することが明らかとなった:INADL d8、NeDLG d1,2、およびKIAA1719 d4。直接結合サンドイッチアッセイを用いた滴定試験において、外膜タンパク質はEC50 12.55μg/mlで結合することが見出され、PSD95 d1,2,3はEC50 15.76μg/mlで結合することが見出された。その他の測定値を表4cに示す。
(表4c)滴定EC50:MBP.NS1 H5N1A(EPEV−配列番号:27)
A/Viet nam/1194/2004 Ac.# AAT73394株由来MBP.NS1 H5N1B (ESEV) PL(配列番号:45)は、様々なPDZタンパク質への結合について検査された。次のPDZタンパク質は強く結合することが明らかとなった:DLG1 d1,2、LIM mystique d1、DLG2 d3、Vartul d2、PSD95 d1、Magi3 d1、DLG1 d2、PTN-3 d1、DLG2 d1、NeDLGl d1,2、Magi2 d5、DLG2 d2、およびPSD95 d3 CS結合型、Magi2 d1、DLG1 d1、RhoGap1O、外膜、Magi1 d4、Tip 43、Tip1 d1、PSD95 d1,2,3、Tip33 d1、PSD95 d2。次は弱く結合することが明らかとなった:SIP1 d2、Lim RiL、mint3 d2、ALP1、PSD95 d3、SEMCAP 3 d1、LIMK 1、Kiaa0613、シントロフィンγ1、Magi2 d6、Mast2d1、Magil d5、INADL d3、Magi3 d2、シントロフィン1α、magi2 d3、par3L d2、Magil d1、Kiaal719 d5、Vartul d1、およびPTPL1 d1。直接結合サンドイッチアッセイを用いた滴定試験において、PSD95 d1,2,3はEC50 0.29μg/mlで結合することが見出され、外膜タンパク質はEC50 0.18μg/mlで結合することが見出された。その他の測定値は表4dに示す(NDは測定なしを意味する)。
(表4d)滴定EC50:MBP.NS1 H5N1B(ESEV −配列番号:2)
A/duck/ST/4003/2003 Ac.# AAF02349/6048830株由来ペプチド1958 H5N1A (EPEV) PL(配列番号:46)は、様々なPDZタンパク質への結合について検査された。次のPDZタンパク質は弱く結合することが明らかとなった:MAST2 d1, PSD95 d1,2,3およびPSD95 d2。直接結合サンドイッチアッセイを用いた滴定試験において、PSD95 d2はEC50 3.8μg/mlで結合することが見出され、PSD95 d1,2,3はEC50 4.1μg/mlで結合することが見出された。その他の測定値を表4eに示す。
(表4e)滴定EC50:ペプチド1958 H5N1A(EPEV−配列番号:27)
A/chicken/Hong Kong/915/1997 Ac.# AAT73457/50296374株由来ペプチド1959 H5N1B (ESEV) PL(配列番号:47)は、様々なPDZタンパク質への結合について検査された。
hit分類に関する特別な基準を満たすPDZをマトリックスhitリストである表4a〜eに総括して、相互作用の相対的な強さを示す。hitとして分類されるためには、NS1-PDZ相互作用のODはバックグラウンド平均の2倍よりも大きくなければならず、少なくとも2検体の試料においてhitとして認定されなければならなかった。「弱い」として分類されるhitは0.5よりも小さいODを持ち、「強い」として分類されるhitは0.5よりも大きいODを持った。
ペプチドおよび融合タンパク質の滴定は、マトリックスアッセイについての上記と同一の検出系を用いて実施された。マトリックスhitリストは、相互作用の強度を測定するためにどのPDZがNS1を用いて滴定されるかを調べるために用いられた。滴定結果は、検査した各々の特異的PLに関して上記に示す。滴定したNS1-PDZ相互作用について算出したEC50をリストに示す。用いられた特異的アッセイおよび方法を以下に示す。
A.ペプチドの精製
様々なインフルエンザA NS1タンパク質のC末端20アミノ酸を示すペプチドは標準的なFMOC化学によって合成して、未標識競合物質として使用されない場合はビオチン化した。ペプチドは、10*25mm、5μmの大きさを持つVydac 218TP CI8逆相カラムを用いて逆相高速液体クロマトグラフィー(HPLC)により精製した。ペプチドの約40mgを49.9%アセトニトリルおよび0.1%トリフルオロ酢酸(TFA)の水溶液2.0mlに溶解した。続いて、この溶液を25ミクロンシリンジフィルター(Millipore)を介してHPLC装置に注入した。良好な分離を得るために使用した緩衝液は、(A)0.1%TFA加蒸留水および(B)アセトニトリル加0.1%TFAであった。分離はペプチドの性状に基づいて行われた。全体的に疎水性のペプチドは、親水性のペプチドよりも遅れて溶出した。「純粋」なペプチドを含む分画を回収して、質量分析計(MS)により確認した。精製したペプチドは安定性および後続の使用に備えて凍結乾燥した。
B.ペプチドおよび融合タンパク質間の相互作用の識別のための「G」アッセイ
試薬および材料:
・Nunc Polysorp 96穴イムノプレート(Nunc cat#62409-005)
(Maxisorpプレートは高いバックグラウンドシグナルを有することが示されている)
・PBS pH 7.4(Gibco BRL cat#16777-148)または(AVCリン酸緩衝生理食塩液、8gm NaCl、0.29 gm KCl、1.44 gm Na2HPO4, 0.24gm KH2PO4、H2Oを1 Lまで加える、pH 7.4;0.2μmフィルター
・2% BSA/PBS(10gmウシ血清アルブミン、分画V(ICN Biomedicals cat#ICl5142983)を500ml PBSに加える
・ヤギ抗GST mAb原液5mg/ml、4℃にて保存(Amersham Pharmacia cat#27-4577-01)、PBSで1:1000に希釈、最終濃度 5μg/ml
・HRP-ストレプトアビジン、2.5mg/2mlの原液を4℃で保存(Zymed cat#43-4323)、2% BSAに加えて1:2000に希釈、最終濃度 0.5μg/ml
・洗浄緩衝液、50mM Tris pH8.0中0.2% Tween 20
・使用準備済みTMB(Dako cat#S1600)
・1M H2SO4
・12w マルチチャンネルピペッター
・50ml 試薬保存容器
・15ml ポリプロピレンコニカルチューブ
プロトコール
1)プレートを5μg/mlヤギ抗GST 100μlで4℃にて一晩、コーティングする
2)コーティング抗体を捨てて水気を拭き取る
3)ブロッキング−2% BSAをウェル当たり200μl加えて、4℃にて2時間
4)タンパク質を2% BSA中に調製する
(1列当たりまたは2カラム当たり2ml)
5)冷PBSで3回洗浄する(全実験を通して冷たくなければならない)
(最終の洗浄時には、直ちに次の工程を加えるまでPBSをウェルに残す)
6)氷冷しながら、タンパク質をウェル当たり50μl加える(4℃にて1〜2時間)
7)ペプチドを2%BSA中に調製する(列当たりまたはカラム当たり2ml)
8)冷PBSで3回洗浄
9)氷冷しながら、ペプチドをウェル当たり50μl加える(タイムオン/タイムオフ)
a.最終のペプチドを加えた後、正確に10分間、氷冷する
b.正確に20分間、室温に置く
10)12ml/プレートのHRP-ストレプトアビジンを調製する(2% BSA中1:2000の希釈)
11)冷PBSで3回洗浄
12)氷冷しながら、HRP-ストレプトアビジンをウェル当たり100μl加えて、4℃にて20分
13)プレートリーダーのスイッチを入れて、ファイルを作成する
14)5回洗浄する、気泡は避ける
15)手袋を使用して、TMB基質をウェル当たり100μl加える
a.室温、暗所にてインキュベートする
b.プレートを定期的に確認する(5、10および20分)
c.必要ならば早めに判定する650nm(青)
d.20分の時点で1M H2SO4 100μlを加えて反応を停止させる
e.450nm(黄)にて最終の判定を行う
実施例3:NS1タンパク質はヒト臨床標本において発現させる
ヒト鼻分泌物について、インフルエンザA由来NS1の存在および量を調べた。ヒト鼻腔吸引液を回収して、M4ウイルス輸送培地(Remel, Inc, Lenexa, KS)に入れて-80℃で保存した。保存した材料を融解して、10% SDS-PAGEにかけた。NS1に対するモノクローナル抗体である3H3および1A10(Arbor Vita Corporation, Sunnyvale, CA)を用いてウェスタンブロット解析を実施した。6検体の試料の結果を表4に示す。結果は、NS1が鼻分泌物中に大量に存在することを示す。
インフルエンザAウイルスが感染した細胞によってNS1が産生および分泌される時系列を調べるために、MDCK細胞にヒトインフルエンザA/PR/8を0.1のMOIにて感染させた。上清および細胞を回収して1% Triton X-100で溶解し、SDS-PAGEおよびNS1に対して汎反王制のモノクローナル抗体3H3を用いたウェスタン解析に供した。NS1は感染後24時間以内に感染細胞中に検出されて、感染細胞の上清中には48時間以内に検出された(図5を参照)。これは、NS1に基づく診断がインフルエンザAによる感染を48時間以内に、場合によっては24時間以内に検出可能であり得ることを示唆する。
実施例4:NS1は細胞のPDZと相互に反応する
NS1が細胞内のPDZタンパク質と相互作用することを確認するために、一連のPDZプルダウン実験を実施した。293 HEK細胞を、HA-NS1-H5N1Bを含むプラスミドまたはHA-NS1-H3N2でトランスフェクトした。溶解物は本明細書に記載する通りに調製した。グルタチオン-セファロース-PDZビーズを調製して(DLG1d1,2 10μg、NeDLGd1,2 10μg、およびPSD95d1,2,3 10μg)、図6および7に示す通り、トランスフェクトした293ET細胞の溶解物150μgをプルダウンするために使用した。4℃にて一晩インキュベートしてHNTG緩衝液で繰り返し洗浄した後、プルダウンにて膜を調製した。F63-3G1上清(1:5)を用いて膜をプローブした。検査した3つのすべてのPDZがHA-H5N1Bを発現している細胞からNS1をうまくプルダウンした(図6を参照)。
同様に、グルタチオン-セファロース-PDZビーズを調製して(INADL d8 40μg)、H3N2をトランスフェクトした293ET細胞由来の溶解物150μgのプルダウンに使用した。4℃にて一晩インキュベートしてPBSで繰り返し洗浄した後、ウェスタンブロットを調製して、a-HA(1:500)(Roche)をプローブした。INADLd8は細胞溶解物からHA-H3N2 NS1をうまくプルダウンした(図7)。
以上より、NS1 PLは細胞内で機能性であり、MATRIXアッセイによって調べられた通り、PDZドメインと相互作用することができる。
実施例5:NS1に対するモノクローナル抗体
NS1タンパク質サブタイプ、NS1 PLクラスに特異的に結合するように、また汎特異性にモノクローナル抗体を調製した。NS1に対するモノクローナル抗体の作出方法は以下の通りであり、結果を表5、6および7に示す:
1.表5にまとめるサブタイプについて、NS1のGSTおよびMBP融合タンパク質を作成した。クローニングベクターはPharmacia(GST)またはNew England Biolabs(MBP)から入手した。NS1コード領域は、DNA 2.0(Menlo Park, CA)より重複オリゴヌクレオチドを用いて合成した。
2.CFA、IFAおよびPBSを順次用いて、マウスをMBP-NS1融合タンパク質で投与1回当たり10〜100μgの範囲の用量で免疫した。
3.Kohler and Milstein(Nature 1975)に従って、対応するGST-NS1融合タンパク質の最終の追加免疫の3日後にスペノサイトおよびリンパ球を回収してFOX-NY骨髄腫細胞と融合させた。
4.ハイブリドーマを、先ず、ELISAにおいてMBP-NS1を用いてスクリーニングした(表5〜7の直接ELISAを参照)。陽性の細胞をクローン化して、MBPおよびGST NS1の群を用いて再度スクリーニングし、汎反応性または亜型反応性に分類した。
5.NS1と一致する標的タンパク質の分子量を確認するために、ウェスタンブロットを用いてさらなるスクリーニングを実施した。
6.PDZ捕捉との適合性に関して、S2アッセイ様式(実施例4を参照)を用いて追加のスクリーニングを実施した(表5〜7のS2 ELISAを参照)。
7.細胞溶解物の形の真核生物に発現させたNS1を用いて工程5および6を反復実施した。
8.抗体について、実施例6に記載されるラテラルフロー様式との適合性を確認する。
9.最後に、抗体について臨床標本中のNS1検出能を確認する。
このワークフローは、ヒト臨床標本を認識する抗体を得るために重要である。
実施例6:ラテラルフロー
NS1の検出のためのラテラルフロー様式の例を図8、9および11に示す。図8は、PDZ捕捉を用いたラテラルフローおよびその後のモノクローナル抗体検出を示す。すべての場合において、ストライパーを用いてRF120 Milliporeメンブランに組換え型PDZドメインタンパク質または抗体を沈着させた。図8では、PDZタンパク質であるPSD95D1-3、およびINADL D8を0.5mg/mlの濃度で沈着させた。ヤギ抗マウス抗体(GAM)から構成される対照のバンドも同じく0.5mg/mlで沈着させた。NS1タンパク質は、TBS-T緩衝液中100μlの液量にて、4B2のような金結合モノクローナル抗NS1と混合した。用いられたNS1タンパク質はH1N1、H3N2、H5N197、H5N1由来であり、対照レーンはNS1を含まなかった。すべての場合について、ヒト鼻腔吸引液を希釈して、記載通り、生理食塩液またはM4で保存した。試料は金結合抗体と以下に記載する量にて直接混合した。
PDZで縞を付けた膜をNS1/抗NS1タンパク質の溶液に挿入して、毛管現象および這い上がり用パッドによりフローを開始した。NS1はPDZ反応のパターンに基づいて亜型を分類した;H1N1はPSD95およびINADL d8の双方に結合する;H3N2はINADL d8にのみ結合する;H5N1はPSD95のみに結合する。インフルエンザAの亜型分類は、PDZに対する反応性および金結合汎反応性抗NS1モノクローナル抗体を用いた検出によりNS1ラテラルフローの結果に基づいて行った。
図9では、13種類の異なるモノクローナル抗体をラテラルフロー装置に沈着させた。用いられた13種類の抗体は、F64-1A0、F64-3H3、F64-6G12、F64-7A8、F64-7D1、F68-1D10、F68-4B2、F68-4H9、F68-6A12、F68-6B7、F68-6D6、F68-7B10である。亜型特異的金結合型汎NS1抗体をH1N1インフルエンザウイルスを含む試料に加えた。試料をラテラルフロー装置に適用して、結果を図9に示す。結果は、検査には汎特異的抗体が用いられ得て、アッセイではどの抗体がH1N1への結合に最も適しているかが特定されたことを示す。結合強度は次の記号を用いて定量される:(-)結合なし、(+)弱い結合、(+++)強い結合、および(++)中等度の結合。
患者試料中の病原性インフルエンザAを識別するためのラテラルフローアッセイは、膜上に沈着された汎特異的抗体を用いて産生される。患者試料はすべてのNS1 PLを認識する金標識抗体の混合物と混合する。試料をラテラルフロー検査紙に適用して、インフルエンザAの病原性株が存在する場合は、ラインがストライプを形成する。
条片検査は次のプロトコールおよび材料を用いて実施された:用いられた材料には次が含まれる:予めヤギ抗マウス/PSD95 d1,2,3/INADL d8で縞を付けた条片;TBST/2% BSA/0.25% Tween 20緩衝液;NS1タンパク質であるMBP-H1N1、MBP-H3N2、MBP-H5N1AおよびMBP-H5N1Bの「古い」(Jon's)早い金結合F68-4B2抗体のストック;およびMaxisorp ELISAプレート。手順は次の通り実施した:
1.)NS1タンパク質のストックをTBST/2% BSA/0.25% Tween 20で100ng/μLに希釈した(希釈の実施には5μLを下回らないタンパク質を使用)
2.)このタンパク質10μLをTBST/2% BSA/0.25% Tween 20の10μLに加えることによって、
100ng/μLの希釈液を50ng/μLに希釈した。
3.)TBST/2% BSA/0.25% Tween 20緩衝液中金結合抗体の原液を調製した。抗体の4μLを緩衝液の各100μLに加えて、6検体の100μL反応に備えて十分な緩衝液を調製した(余分なデッドボリュームを与える)。
4.)抗体/緩衝液混合物の98μLをELISAプレートの別々のウェルに加えた。
5.)緩衝液入りのウェルにNS1希釈液の2μLを加えた(ウェル当たり1つのNS1)。
6.)1つのウェルは、「NS1なし」の陰性対照とするために抗体および緩衝液のみのまま残した。
7.)ウェルの内容物を混合するため、ELISAプレートを複数回、軽く叩いた。
8.)前もって縞を付けた条片をウェルに入れて、展開中、観察を行った。
(すべての液体が吸収されたが、条片はまだ乾燥してない)約15分後、条片をウェルから取り出して、コンピュータでスキャンした。
図10aおよび10bに示される検査は次の通り調製された:トリ検査に備えてGST-PSD95 d1,2,3タンパク質を用いて3mg/mLで膜上に縞を作り、または全インフルエンザA検査に備えて2種類のモノクローナル抗体の混合物を用いてもよい(1.1mg/mL F64-3H3および0.075mg/mL F68-4H9)。2本目のラインである1mg/mLポリクローナルヤギ抗マウス抗体を検査捕捉ラインとして使用した。工程を以下に示す。
1.試料膜および吸い込み用パッドを伴うカードを調製
2.PDZタンパク質および/または抗体を用いて膜に縞を作る(濃度については上記を参照)
3.膜を56℃で一晩乾燥させた後、カードを幅4.26mmの条片にカットする
4.条片の底部のガラス繊維の試料パッドをセットして、条片全体を検査用カセットに入れる
5.検査すべき試料を融解して、試料の80μlを緩衝液20μlに加える。混合するため、ピペットで複数回、吸引および排出を行う
6.金結合(Au-)検出物質混合液の8μlを試料/緩衝液に加える。この検出物質混合液はAu-F68-3D5の4μlを含むAu-F68-4B2の4μlである。混合するために、ピペットで複数回、吸引および排出を行う
7.調製した試料の100μlをカセットの試料ウェルに加える
8.試料添加の15分後にカセットの検査および対照ラインを判定する。任意の検査結果が信頼性を持って判定されるためには、対照ラインは透明に見える。インフルエンザA陽性試料は(+)で示される。インフルエンザA陰性試料は(−)で示される。一番上の矢印は対照を示し、一番下の矢印は検査試料を示す。いずれも、最上部のラインは対照ライン(ヤギ抗マウスmAb)であり、下の二番目のラインが検査ラインである(全インフルエンザA検査では、F64-3H3およびF68-4H9 mAbの混合物、トリ検査ではPSD95 d1,2,3)。トリ検査では、H5N1タンパク質の2ngを検査した。底部の丸いスポットは試料のウェルである。図10aでは、両検査が陽性である。
図10cは、図10aおよび10bに示す様式で検査した20検体の内の3検体のヒト試料を示す。試料は様々な結果を示したが、例えば、試料1はインフルエンザA陽性であったが、トリインフルエンザAは陰性であり、試料14は両方とも陰性であった。図10dは、H1N1、H3N2およびH5N1の組換えタンパク質に関する同一検査を示す。全インフルエンザA検査は全3件について陽性であった。トリインフルエンザ検査はH5N1についてのみ陽性であった。図10eでは、金結合PDZを検出物質として使用して、単一または複数のmAbを捕捉のために使用した。図10eは、液体の金をAu-PSD95 d1,2,3の形でF68-4B2 mAb捕捉と共に加えた。NS1 H5N1タンパク質の1.7ngは検査陽性であった。これは、トリインフルエンザ特異的検査であった。
図10fでは、乾燥金法を用いた。カードの調製は液体金のプロトコールと同一に処理した。但し、試料パッドは、ストライピングを行う前にカードに固定した。捕捉物質を縞状としたら、金結合検出物質混合物(ここでは抱合体希釈液も含む)をカード底部の試料パッドに噴霧した。カードを乾燥させてカットし、液体検査と同様にカセットにセットした。ヒト試料が調製されたら、それらは緩衝液のみで処理した後、100μlをカセットに適用した(追加の金結合検出物質混合物は加えなかった)。インフルエンザA陽性試料は(+)で示し、インフルエンザA陰性試料は(-)で示す。これらのカセットは、液体金カセットと同一の方法で設計および判定された。図10fでは、試料7および9はインフルエンザAおよびトリインフルエンザの双方について陽性であり、試料12はインフルエンザAおよびトリインフルエンザの双方について陰性であった。
実施例7:PDZ/PDZリガンド相互作用の阻害物質
この実施例において、化合物はPDZ/PDZリガンド相互作用の阻害物質として分析のために選択された。次の23種類の薬剤が特定のPDZ/PLペアに対してスクリーニングされた(番号1〜17はCOX阻害物質である)。1.ニフルミン酸、2.イブプロフェン、3.ナプロキセンナトリウム、4.ジクロフェナクナトリウム塩、5.アセチルサリチル酸、6.サリチル酸、7.フルルビプロフェン、8.硫化スリンダク、9.スリンダク、10.エトドラク、11.インドメタシン、12.ケトロラックトリス塩、13.ケトプロフェン、14.メフェナム酸、15.カルプロフェン、16.バクロフェン、17.フェノプロフェン、18.メタンスルホン酸べンズトロピン、19.塩酸アミトリプチリン、20.クロモリンナトリウム、21.塩酸デシプラミン、22.塩酸クロミプラミン、および23.塩酸ノルトリプチリン。以下の説明において、セクションAはCOX阻害物質を用いて実施された実験を示し、セクションBは小分子阻害物質を用いて実施された実験を示し、セクションCはペプチド阻害物質を用いて実施された実験を示す。表8は、セクションA〜Cにおいて阻害物質を識別するために用いられたPDZ/PL相互作用を示す。用いたPL配列は配列番号:54〜59であった。結果を表11〜13に示す。
(表8)薬剤スクリーニングで用いられたPDZ/PL相互作用
A.COX阻害物質は2つの規準に基づいて選択された:1. PDZの0位において好都合に相互作用し得るカルボキシル基の存在、および2.PDZの0位に位置し得るカルボキシル基の近くの疎水性または芳香族の基。疎水性または芳香族の基は絶対的に必要ではなかったが、好ましいとされた。
COX分子はマトリックス/アレイ競合アッセイ様式において250μMの薬剤濃度においてスクリーニングに供され、即ち、このアッセイでは、リガンドの融合タンパク質の固相PDZドメインへのドッキングが既述の通り小分子競合物質の存在下および非存在下において評価された。結果は次の通りである。MAGI1 d1/AVC1857は硫化スリンダクによって阻害された。PSD95 d1/AVC1912相互作用はフェノプロフェンによって阻害された。PSD95 d2/AVCAA345相互作用は、アッセイのいかなる薬剤によっても顕著な阻害は受けなかった。PSD95 d2/AVCAA348相互作用はフェノプロフェンによって阻害された。PSD95 d3/AVC1916相互作用はフェノプロフェンによって阻害された。SHANK1/AVC1965相互作用はフェノプロフェンによって阻害された。TIP1/AVCAA56相互作用は硫化スリンダクによって阻害された。その他の薬剤は、このアッセイでは顕著な阻害を示さなかった。2つの主な小分子hitは硫化スリンダクおよびフェノプロフェンであった。
結果は、COX阻害物質がPDZ/PDZリガンド相互作用の阻害物質として用いられ得て、これらの誘導体はPDZをベースとする標的の有用な治療薬であり得ること、および検査したものの内、硫化スリンダクおよびフェノプロフェンが最も強力な阻害を示したことを示している。
B.PDZ/PDZリガンド相互作用の小分子阻害物質は、分子モデリングから予測された。Accelrysソフトウェア(Accelrys, San Diego, CA)を用いたインシリコのスクリーニングは、650,000分子のライブラリ(ChemDiv, San Diego, CA;Blanca Pharmaceuticals, Mountain View, CA)および4つの異なるPDZドメイン模倣物のモデリングおよびドッキングに用いられた。分子モデリングは、静電気的、水素結合および疎水的相互作用を介してPDZと相互作用する能力を持つ化合物の見出に基づいた。
インシリコにおけるスクリーニングからの最も適したhitは、マトリックス/アレイ競合アッセイ様式においてスクリーニングに供され、即ち、このアッセイでは、融合タンパク質の固相PDZドメインへのリガンドのドッキングが別に記載される通り小分子競合物質の存在下および非存在下において評価された。小分子は、表9に列記されるPDZ/PDZリガンド相互作用の阻害に関してスクリーニングされた。検査された小分子阻害物質の化学構造および化学式は、当業者に公知である小分子に関する任意の公的データベースを参照して見出すことができる。小分子阻害物質のその他の例は、参照によりその全体が本明細書に組み入れられた に出願された題名「Small Molecule Inhibitors of PDZ Interactions」の米国仮出願ARBV:002USP1に見出すことができる。スクリーニングで用いられた小分子の濃度は約250μMであった。これらのスクリーニングの結果を表10に示す。
(表9)250μMの小分子濃度での薬剤スクリーニングにおけるhitに関するhitの相対的強度
結果を総括する表10および11について、小分子は、弱い、中等度の、または強いアッセイのOD(450)判定値に基づく、hitと見なされた:弱いhit:対照に比してODの>40%の減少、中等度のHit:対照に比してODの約40〜60%の減少、強いHit:ODの>40%の減少。
続いて、この後者の分析における最も優れたhitを滴定結合試験、即ち、推定およびIC50値のための同一の競合アッセイにおける小分子の滴定に供して、結果を表10にまとめる。
インシリコにおけるスクリーニングに基づいて、PDZ/PL相互作用の様々な小分子阻害物質が識別された。これらの分子は、インフルエンザA NS1/PDZ相互作用を含めて治療効果のPDZ/PL相互作用を遮断するために用いられ得る。
C.ペプチド治療用阻害物質が識別されて検査された(表11を参照)。PL(H5N1、H3M2およびH1N1)を含む各インフルエンザA NS1タンパク質の型は複数のPDZと相互作用する可能性を持つ。これらの各PDZは本来、関連するインフルエンザA株に対して潜在的な治療標的であり得て、それ自体、ペプチドを用いてPDZを遮断することは治療上の有用性を持つ可能性がある。潜在的治療用ペプチドを識別するために、AVC占有データベースを各PDZのPDZリガンドについて検索した。AVCデータベースには、先に記載した通り、それ自体、ELISAをベースとする占有アッセイ(Gアッセイ)に基づいて識別されたPL/PDZ相互作用が含まれた。有望なPLを識別するために用いられた基準は次の3つの基準に基づいた:(1)OD(450nm)>=0.5、(2)測定値の相対的標準偏差<0.25、(3)ペプチド濃度=<20マイクロモル。
PDZ/PL結合相互作用のデータベース、構造および結合データに基づいて、C末端配列はPSD95 d2構造および結合データからPSD95 d2構造(例えば、配列番号:1)に結合する可能性が極めて高いとして識別された。従って、トリインフルエンザA(H5N1)における好ましいペプチド治療用阻害物質はPSD95 d2に結合するペプチドをベースとして、PSD95 d2に結合する最適および好ましいペプチド配列は共通配列:E/D/N/Q-S/T-D/E/Q/N-V/L(配列番号:48)に一致した。
この共通配列を用いて、以下はPSD95 d2ドメインに結合するペプチド阻害物質における好ましいC末端配列の例である:
1)ESDV(配列番号:49)
2)ESEV(配列番号:2)
3)ETDV(配列番号:50)
4)ETEV(配列番号:51)
5)DTDV(配列番号:52)
6)DTEV(配列番号:53)
7)DSDV(配列番号:996)
8)DSEV(配列番号:997)
各PDZにおける潜在的PDZリガンド治療用ペプチドを表11にまとめる。表11の最初の列はPLペプチド識別名(AVC ID)を示し、2列目はPLペプチド名(その派生元であるタンパク質から派生)を示し、3列目はペプチドの配列を、最後の列は配列識別番号を示す。表の各部分は、PLが結合するPDZタンパク質を識別する表題を含む。表11に示すペプチド、またはC末端PLを残すその切断はインフルエンザの治療に適した作用物質である。病原性インフルエンザPLのPDZへの結合を遮断するPLペプチド治療薬は病原性インフルエンザの治療に有用である。例えば、これらの各ペプチド(配列番号:89〜987)のC末端配列(3〜20アミノ酸長)は、ペプチド配列のN末端にトランスポーターペプチド(タンパク質形質導入ドメイン)を接続させることによって治療薬に転換される。C末端の3個のアミノ酸が保存された少なくとも5アミノ酸長、好ましくは少なくとも6アミノ酸長、7アミノ酸長、8アミノ酸長、9アミノ酸長および10アミノ酸長のこれらのペプチドのサブフラグメントは、表11に示される各PDZにおけるウイルスPL/PDZ相互作用の治療的阻害物質として用いられる。好ましくは少なくともC末端の4個のアミノ酸が保存され、より好ましくはC末端の5個のアミノ酸が保存され、C末端の6個のアミノ酸、またはC末端の7個のアミノ酸が保存される。ペプチド治療薬は、ペプチド模倣物におけるアミノ酸の保存的置換を含むペプチドをさらに含む。しかし、好ましくは保存的置換は最後の3または4個のアミノ酸以外の領域内である。Tatおよびアンテナペディアを含む複数のトランスポーターペプチド配列が用いられる。ペプチドは、実施例2に記載されるAまたはG PDZアッセイを用いて、PDZ/PL相互作用を阻害するペプチドを識別することによってさらに分析に供される。阻害物質であることが示されるペプチドは、インビトロおよびインフルエンザの動物モデルにおいてさらなる試験に供される。
実施例8:毒性に関連するNS2モチーフ
先のセクションにおいて、NS1 PLモチーフであるESEV(配列番号:2)は、H5N1のようなトリ亜型に見られる高毒性/致死性の表現型に関連した。NS1のPL部分はNS2と重複することから、重複領域のNS2配列に対するトリPL保存の影響について分析した。NS1およびNS2は重複領域を通して異なるリーディングフレームを使用しており、これは用いられ得るコドンの選択に制限を付ける。分析では、この領域の配列の変化はNS1のタンパク質配列を変化させるがNS2は変化させないことが指摘された(表12および13を参照−表12のSTYPEはウイルスの亜型を指す)。具体的には、H5N1の場合、PL配列であるESEV(配列番号:2)、EPEV(配列番号:27)およびESKV(配列番号:4)はNS2のタンパク質配列を変化させずにNS2の70位におけるセリン(SまたはSer)が維持される。これに対して、H3N2のような良性の亜型は70位がグリシンとなったヌクレオチド配列を含んだ。この唯一の例外は、1918の致死的感染爆発の原因である1918株H1N1であり、H5N1株のように70位にセリンを持つKSEV(配列番号:41)のPLを発現した。表12に示すNS1 PL配列は、ESEV(配列番号:2)、EPEV(配列番号:27)、ESKV(配列番号:4)、RSKV(配列番号:8)、KSEV(配列番号:41)、およびRSEV(配列番号:7)であり、NS1 C末端のコード領域の配列番号はNS2領域の配列番号と同じく表に記載される(表12および13を参照)。従って、インフルエンザAウイルスNS2タンパク質の70位のセリンはウイルスの毒性と相関する。結果として、70位のセリンは高毒性のマーカーとして用いられ得て、NS2の70位のグリシンはより良性の臨床経過のマーカーとして用いられ得る。NS2の70位の変異は、次の診断マーカーおよび治療用標的として用いられる。セリン置換はこの配列のリン酸化を可能としてキナーゼによって調節される可能性がある。
診断マーカーとしての使用
粘液試料はインフルエンザAの症状を示している患者から採取する。試料は、ラテラルフロー様式での使用に備えてより液体となるように処理する。ラテラルフロー様式は実施例6で示したプロトコールを用いて産生される。但し、重複を含む配列と相補的であり表12のNS2タンパク質のセリン70を含む核酸は、試料中の70位に存在するセリンを含む任意のNS2を捕捉するための捕捉物質を識別するために用いられる。捕捉物質は、すべての公知の毒性インフルエンザA株の相補的核酸を含む。陽性の結果は、患者がインフルエンザAウイルスの高毒性型に関して治療されなければならないことを示す。
モノクローナル抗体をベースとする試験は、表12のセリン70を含むNS2重複領域を特異的に認識する一連の抗体が捕捉物質として用いられる点を除いて、同一である。
治療設計のための使用
NS2および標的の相互作用を遮断する治療用物質が用いられる。具体的には、治療用物質はNS2タンパク質の70位のセリンにおける結合を遮断する。ペプチドまたは小分子の治療用物質は、インフルエンザAに感染しているまたは感染前の患者に対してNS2およびその標的の相互作用を遮断するために十分な量で投与される。投与は吸入を介して行われ、治療は患者の症状が消えるまで、および/または患者にもはや疾患にかかる危険がなくなるまで継続される。
個々のそれぞれの刊行物または特許が具体的かつ個別に参照により組み入れられるべきであることが示されるならば、本明細書に記載されるすべての刊行物および特許は参照により本明細書に組み入れられる。GIDまたはアクセッション番号により参照されるGenbank記録、特に任意のポリペプチド配列、ポリヌクレオチド配列またはそれらの注解は参照により本明細書に組み入れられる。任意の刊行物の引用は出願日前のその開示のためであり、本発明が先行発明という理由でこのような刊行物に先行する権利が与えられないということの容認として解釈されるべきではない。
本発明はその具体的態様の参照を用いて説明されているが、当業者は様々な変更が可能であり、本発明の真の精神および範囲を逸脱することなく同等物と置き換えてよいことを理解すべきである。さらに、特定の状況、材料、重要な組成物、プロセス、プロセスの工程(step)または工程(steps)を本発明の目的、精神および範囲に適応させるために、多くの修正が行われてよい。このようなすべての修正は、本資料に添付される特許請求の範囲の範囲内であることが意図される。本明細書において言及されるすべての刊行物および特許出願は、個々の各刊行物または特許出願が参照により組み入れられることが具体的かつ個別に明記される場合と同様に、参照により本明細書に組み入れられる。
(表11)DLG2 d1を結合するPL配列
(表11)続き:GORASP d1を結合するPL配列
(表11)続き:GRIP1 d4を結合するPL配列
(表11)続き:INADL d8を結合するPL配列
(表11)続き:INADL d8を結合するPL配列(続き)
(表11)続き:KIAA1284 d1を結合するPL配列
(表11)続き:KIAA1284 d1を結合するPL配列
(表11)続き:KIAA1415 d1を結合するPL配列
(表11)続き:KIAA1719 d4を結合するPL配列
(表11)続き:Lim Mystique d1を結合するPL配列
(表11)続き:Lim Mystique d1を結合するPL配列(続き)
(表11)続き:MAGI1 d1を結合するPL配列
(表11)続き:MAGI1 d1を結合するPL配列(続き)
(表11)続き:MAGI2 d5を結合するPL配列(続き)
(表11)続き:MAGI2 d5を結合するPL配列(続き)
(表11)続き:MAGI3 d1を結合するPL配列
(表11)続き:MAGI3 d1を結合するPL配列(続き)
(表11)続き:MAGI3 d2を結合するPL配列
(表11)続き:MAGI3 d2を結合するPL配列(続き)
(表11)続き:NeDLG d1を結合するPL配列
(表11)続き:NeDLG d2を結合するPL配列
(表11)続き:NeDLG d2を結合するPL配列
(表11)続き:外膜タンパク質を結合するPL配列
(表11)続き:外膜タンパク質を結合するPL配列
(表11)続き:PICK1 d1を結合するPL配列
(表11)続き:PSD95 d1を結合するPL配列
(表11)続き:PSD95 d1を結合するPL配列
(表11)続き:PSD95 d1,2を結合するPL配列
(表11)続き:PSD95 d1,2を結合するPL配列(続き)
(表11)続き:PSD95 d2を結合するPL配列
(表11)続き:PSD95 d2を結合するPL配列(続き)
(表11)続き:PTN-3を結合するPL配列
(表11)続き:SHANK 1を結合するPL配列
(表11)続き:SHANK 1を結合するPL配列
(表11)続き:TIP43 d1を結合するPL配列
(表11)続き:Vartul d2を結合するPL配列