JP2008535549A - 埋め込み型デバイス用コーティング及びその形成方法 - Google Patents
埋め込み型デバイス用コーティング及びその形成方法 Download PDFInfo
- Publication number
- JP2008535549A JP2008535549A JP2008503229A JP2008503229A JP2008535549A JP 2008535549 A JP2008535549 A JP 2008535549A JP 2008503229 A JP2008503229 A JP 2008503229A JP 2008503229 A JP2008503229 A JP 2008503229A JP 2008535549 A JP2008535549 A JP 2008535549A
- Authority
- JP
- Japan
- Prior art keywords
- region
- implantable device
- active ingredient
- polymer
- primer
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2/00—Filters implantable into blood vessels; Prostheses, i.e. artificial substitutes or replacements for parts of the body; Appliances for connecting them with the body; Devices providing patency to, or preventing collapsing of, tubular structures of the body, e.g. stents
- A61F2/82—Devices providing patency to, or preventing collapsing of, tubular structures of the body, e.g. stents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L31/00—Materials for other surgical articles, e.g. stents, stent-grafts, shunts, surgical drapes, guide wires, materials for adhesion prevention, occluding devices, surgical gloves, tissue fixation devices
- A61L31/08—Materials for coatings
- A61L31/10—Macromolecular materials
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L31/00—Materials for other surgical articles, e.g. stents, stent-grafts, shunts, surgical drapes, guide wires, materials for adhesion prevention, occluding devices, surgical gloves, tissue fixation devices
- A61L31/14—Materials characterised by their function or physical properties, e.g. injectable or lubricating compositions, shape-memory materials, surface modified materials
- A61L31/16—Biologically active materials, e.g. therapeutic substances
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2250/00—Special features of prostheses classified in groups A61F2/00 - A61F2/26 or A61F2/82 or A61F9/00 or A61F11/00 or subgroups thereof
- A61F2250/0058—Additional features; Implant or prostheses properties not otherwise provided for
- A61F2250/0067—Means for introducing or releasing pharmaceutical products into the body
- A61F2250/0068—Means for introducing or releasing pharmaceutical products into the body the pharmaceutical product being in a reservoir
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2300/00—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices
- A61L2300/60—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices characterised by a special physical form
- A61L2300/606—Coatings
Abstract
【選択図】 図1A
Description
[0001]本発明は、ステントなどの埋め込み型デバイス又は管腔内プロテーゼのコーティング及びコーティングの形成方法に関する。
[0002]経皮経管冠動脈形成術(PTCA)は、心疾患を治療するための処置である。バルーン部分を有するカテーテルアセンブリを、上腕又は大腿動脈を介して患者の心血管系に経皮的に導入する。バルーン部分が閉塞性病変を横切って位置するまで、冠状血管系を介してカテーテルアセンブリを進める。病変を横切って位置すると、血管壁を再建するためにバルーンを所定のサイズに拡張させて、病変のアテローム斑に放射状に押しつける。次いで、患者の血管系からカテーテルを引き出せるように、バルーンを小さい形状に収縮する。
[0006]本発明の一態様によれば、埋め込み型デバイスのコーティングの形成方法が提供される。その方法は、埋め込み型デバイスの表面の少なくとも一部分上にポリマーを含む、重量測定値Xを有するプライマー層を形成するステップと、プライマー層の選択された少なくとも一部分上にポリマー及び有効成分を含む、重量測定値Yを有するリザーバー層を形成するステップとを含み、X/Yは、0.25以上である。一実施形態では、コーティングは、30%以上の薬剤搭載量を有する。別の実施形態では、その方法はさらに、リザーバー層の形成の前に、プライマー層の表面に凹凸を形成するステップを含む。さらに別の実施形態では、プライマー層は、ある程度の細孔を有する少なくとも一領域を含む。
[0012]本文書は、2002年12月16日に出願の認可済み米国特許出願第10/320,935号、2000年12月28日出願の米国特許出願第09/750,595号及び1999年12月23日出願の米国特許出願第09/470,559号の全文を参照により完全に組み込む。
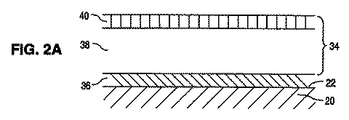
[0014]図1Aを参照すると、表面22、例えばステンレス鋼などの金属製表面を有するステント20の本体が示されている。コーティング24は、表面22上に配置される。コーティング24は、有効成分を含有するリザーバー領域26を含む。実質的にいかなる有効成分も含まないプライマー領域28は、リザーバー領域26の少なくとも一部分の下に配置される。図1Bに示されるように、コーティング24は、実質的にいかなる有効成分も含まないバリア領域30を含むこともできる。各図は、尺度通りに描かれておらず、各種領域及び層の深度及び厚さは、例示目的のために拡大又は縮小強調されている。
式中、Vは体積である。
[0031]プライマー層の組成物の実施形態は、全ての構成要素を組み合わせ、次いでブレンドする通常の方法によって調製される。より詳細には、所定の量のポリマー又はプレポリマーを、所定の量の溶媒又は溶媒の組合せに添加する。その混合物は、大気圧、無水雰囲気下で調製することができる。必要ならば、プレポリマーの硬化又は架橋の開始のために、フリーラジカル又はUV開始剤を組成物に添加することができる。ポリマーを溶媒に溶解するために、加熱及び撹拌及び/又は混合することができる。
[0048]有効成分含有又はリザーバー層の組成物の実施形態は、全ての構成要素を組み合わせ、次いでブレンドする通常の方法によって調製される。より詳細には、所定の量のポリマー化合物を、所定の量の互いに相溶性のある溶媒又は溶媒の組合せに添加する。ポリマー化合物は、大気圧、無水雰囲気下で添加することができる。必要ならば、ポリマーを溶媒に溶解するために、弱い加熱及び撹拌及び/又は混合することができ、例えば約60℃の水槽中で12時間である。
[0087]減速膜又は拡散バリア層の組成物の実施形態は、全ての構成要素を組み合わせる通常の方法によって調製される。粒子を使用する実施形態において、凝集塊又は粒子フロック(particle flocs)の形成を回避するために、分散技術も使用されるべきである。
[0101]プライマー層を塗布する前に、デバイス又はプロテーゼの表面は清浄にされるべきであり、製造中に導入されることがある汚染物質を含むべきではない。しかしながらプロテーゼの表面は、塗布されるコーティングを保持するための特別な表面処理を必要としない。ステントの金属製表面は、例えば当業者に周知のアルゴンプラズマプロセスによって清浄にすることができる。組成物の塗布は、組成物をプロテーゼ上に噴霧する、又は組成物中にプロテーゼを浸漬するなど、通常の任意の方法によることができる。より均一なコーティングを得るために、拭取り、遠心、ブローイング又は他のウェブクリーニング法などの操作を行うこともできる。簡潔には、拭取りとは、ステントの表面から過剰なコーティングを物理的に除去することを指し、遠心とは、回転軸周囲でのステントの急速な回転を指し、ブローイングとは、堆積したコーティングに選択された圧力で空気を当てることを指す。過剰なコーティングは、デバイスの表面から吸引除去することもできる。湿潤性流体の添加は、組成物のばらつきのない塗布をもたらし、それにより、やはりコーティングをプロテーゼの表面に均一に堆積させる。
[0114]上述の方法に従って、有効成分を医療デバイス、例えばステントに塗布し、ステントの送達及び拡張中、ステント上に保持し、埋め込み部位において所望の制御速度で所定の期間放出することができる。上述のコーティング層を有するステントは、一例として、胆管、食道、気管/気管支及び他の生体通路における腫瘍によって生じる閉塞の治療を含めた様々な医療処置に有用である。上述のコーティング層を有するステントは、平滑筋細胞の異常又は不適切な移動及び増殖、血栓症並びに再狭窄による血管の閉塞部位の治療に特に有用である。ステントは、動脈及び静脈両方の多様な血管に置くことができる。部位の代表的な例には、腸骨、腎臓及び冠状動脈が含まれる。しかし本発明の適用は、ステントに限定されるべきではなく、したがって、コーティングの実施形態は、様々な医療基板と共に用いることができる。
Claims (56)
- 有効成分の送達のためのコーティングを備える埋め込み型デバイスであって、前記コーティングが、
埋め込み型デバイスの表面の少なくとも一部分上にポリマーを含み、厚さXを有するプライマー領域と、
前記プライマー領域の少なくとも選択された一部分上にポリマー及び有効成分を含み、厚さYを有するリザーバー領域と
を含み、前記有効成分が前記リザーバー領域から前記プライマー領域まで移動する前に、前記プライマー領域の外表面から前記埋め込み型デバイスの表面までの厚さXが測定され、
(a)前記厚さXが、約0.1ミクロンから約10ミクロンであり、前記厚さYが、約0.5ミクロンから約10ミクロンであり、
(b)X/Yが、以下の範囲、0.01から0.2、0.05から0.2、0.01から20、0.05から20、0.01から1、0.05から1又は0.01から0.05から選択され、
或いは
(a)及び(b)の両方であるデバイス。 - 前記厚さXが、約0.1ミクロンから約10ミクロンであり、前記厚さYが約0.5ミクロンから約10ミクロンである、請求項1に記載の埋め込み型デバイス。
- X/Yが、0.01以上及び20以下である、請求項1に記載の埋め込み型デバイス。
- X/Yが、0.01以上及び0.2以下である、請求項1に記載の埋め込み型デバイス。
- X/Yが、0.05以上及び20以下である、請求項1に記載の埋め込み型デバイス。
- X/Yが、0.05以上及び0.2以下である、請求項1に記載の埋め込み型デバイス。
- 前記プライマー領域又は前記リザーバー領域が、エチレンビニルアルコールコポリマー又はポリ(ブチルメタクリレート)を含む、請求項1に記載の埋め込み型デバイス。
- 前記デバイスが患者の体内に挿入された後、前記有効成分が前記リザーバー領域から放出される速度を低減するために、前記リザーバー領域の少なくとも選択された一部分上へのバリア領域の形成をさらに含む、請求項1に記載の埋め込み型デバイス。
- 前記デバイスがステントである、請求項1に記載の埋め込み型デバイス。
- 前記デバイスがステントである、請求項3に記載の埋め込み型デバイス。
- 前記デバイスがステントである、請求項5に記載の埋め込み型デバイス。
- 前記デバイスがステントである、請求項7に記載の埋め込み型デバイス。
- 埋め込み型デバイス用のコーティングの製造方法であって、
埋め込み型デバイスの表面の少なくとも一部分上にポリマーを含み、厚さXを有するプライマー領域を形成するステップと、
前記プライマー領域の少なくとも選択された一部分上にポリマー及び有効成分を含み、厚さYを有するリザーバー領域を形成するステップとを含み、
(a)前記厚さXが、約0.1ミクロンから約10ミクロンであり、前記厚さYが、約0.5ミクロンから約10ミクロンであり、
(b)X/Yが、以下の範囲、0.01から0.2、0.05から0.2、0.01から20、0.05から20、0.01から1、0.05から1又は0.01から0.05から選択され、
或いは
(a)及び(b)の両方である製造方法。 - 前記厚さXが、約0.1ミクロンから約10ミクロンであり、前記厚さYが約0.5ミクロンから約10ミクロンである、請求項13に記載の製造方法。
- X/Yが、0.01以上及び20以下である、請求項13に記載の製造方法。
- X/Yが、0.01以上及び0.2以下である、請求項13に記載の製造方法。
- X/Yが、0.05以上及び20以下である、請求項13に記載の製造方法。
- X/Yが、0.05以上及び0.2以下である、請求項13に記載の製造方法。
- 前記デバイスが患者の体内に挿入された後、前記有効成分が前記リザーバー領域から放出される速度を低減するために、前記リザーバー領域の少なくとも選択された一部分上にバリア領域を形成するステップをさらに含む、請求項13に記載の製造方法。
- 前記プライマー領域又は前記リザーバー領域が、エチレンビニルアルコールコポリマー又はポリ(ブチルメタクリレート)を含む、請求項13に記載の製造方法。
- 有効成分の送達のためのコーティングを備える埋め込み型デバイスであって、前記コーティングが、
埋め込み型デバイスの表面の少なくとも一部分上にポリマーを含み、質量Xを有するプライマー領域と、
前記プライマー領域の少なくとも選択された一部分上にポリマー及び有効成分を含み、質量Yを有するリザーバー領域とを含み、
X/Yが、以下の範囲、0.01から0.2、0.05から0.2、0.01から20、0.05から20、0.01から1、0.05から1又は0.01から0.05から選択されるデバイス。 - X/Yが、0.01以上及び20以下である、請求項21に記載の埋め込み型デバイス。
- X/Yが、0.01以上及び0.2以下である、請求項21に記載の埋め込み型デバイス。
- X/Yが、0.05以上及び20以下である、請求項21に記載の埋め込み型デバイス。
- X/Yが、0.05以上及び0.2以下である、請求項21に記載の埋め込み型デバイス。
- 前記プライマー領域又は前記リザーバー領域が、エチレンビニルアルコールコポリマー又はポリ(ブチルメタクリレート)を含む、請求項21に記載の埋め込み型デバイス。
- 前記デバイスが患者の体内に挿入された後、前記有効成分が前記リザーバー領域から放出される速度を低減するために、前記リザーバー領域の少なくとも選択された一部分上へのバリア領域の形成をさらに含む、請求項21に記載の埋め込み型デバイス。
- 前記デバイスがステントである、請求項21に記載の埋め込み型デバイス。
- 前記デバイスがステントである、請求項22に記載の埋め込み型デバイス。
- 前記デバイスがステントである、請求項26に記載の埋め込み型デバイス。
- 前記デバイスがステントである、請求項24に記載の埋め込み型デバイス。
- 埋め込み型デバイス用のコーティングの製造方法であって、
埋め込み型デバイスの表面の少なくとも一部分上にポリマーを含み、質量Xを有するプライマー領域を形成するステップと、
前記プライマー領域の少なくとも選択された一部分上にポリマー及び有効成分を含み、質量Yを有するリザーバー領域を形成するステップとを含み、
X/Yが、以下の範囲、0.01から0.2、0.05から0.2、0.01から20、0.05から20、0.01から1、0.05から1又は0.01から0.05から選択される製造方法。 - X/Yが、0.01以上及び20以下である、請求項32に記載の製造方法。
- X/Yが、0.01以上及び0.2以下である、請求項32に記載の製造方法。
- X/Yが、0.05以上及び20以下である、請求項32に記載の製造方法。
- X/Yが、0.05以上及び0.2以下である、請求項32に記載の製造方法。
- 前記デバイスが患者の体内に挿入された後、前記有効成分が前記リザーバー領域から放出される速度を低減するために、前記リザーバー領域の少なくとも選択された一部分上にバリア領域を形成するステップをさらに含む、請求項32に記載の製造方法。
- 前記プライマー領域又は前記リザーバー領域が、エチレンビニルアルコールコポリマー又はポリ(ブチルメタクリレート)を含む、請求項32に記載の製造方法。
- 有効成分の送達のためのコーティングを備える埋め込み型デバイスであって、前記コーティングが、
埋め込み型デバイスの表面の少なくとも一部分上にポリマーを含む、質量Xを有するプライマー領域と、
前記プライマー領域の少なくとも選択された一部分上にポリマー及び有効成分を含む、前記有効成分を除いた質量Yを有するリザーバー領域とを含み、
X/Yが、以下の範囲、0.01から0.2、0.05から0.2、0.01から20、0.05から20、0.01から1、0.05から1又は0.01から0.05から選択されるデバイス。 - X/Yが、0.01以上及び20以下である、請求項39に記載の埋め込み型デバイス。
- X/Yが、0.01以上及び0.2以下である、請求項39に記載の埋め込み型デバイス。
- X/Yが、0.05以上及び20以下である、請求項39に記載の埋め込み型デバイス。
- X/Yが、0.05以上及び0.2以下である、請求項39に記載の埋め込み型デバイス。
- 前記プライマー領域又は前記リザーバー領域が、エチレンビニルアルコールコポリマー又はポリ(ブチルメタクリレート)を含む、請求項39に記載の埋め込み型デバイス。
- 前記デバイスが患者の体内に挿入された後、前記有効成分が前記リザーバー領域から放出される速度を低減するために、前記リザーバー領域の少なくとも選択された一部分上へのバリア領域の形成をさらに含む、請求項39に記載の埋め込み型デバイス。
- 前記デバイスがステントである、請求項39に記載の埋め込み型デバイス。
- 前記デバイスがステントである、請求項41に記載の埋め込み型デバイス。
- 前記デバイスがステントである、請求項42に記載の埋め込み型デバイス。
- 前記デバイスがステントである、請求項44に記載の埋め込み型デバイス。
- 埋め込み型デバイス用のコーティングの製造方法であって、
埋め込み型デバイスの表面の少なくとも一部分上にポリマーを含み、質量Xを有するプライマー領域を形成するステップと、
前記プライマー領域の少なくとも選択された一部分上にポリマー及び有効成分を含み、前記有効成分を除いた質量Yを有するリザーバー領域を形成するステップとを含み、
(i)X/Yが、以下の範囲、0.01から0.2、0.05から0.2、0.01から20、0.05から20、0.01から1、0.05から1又は0.01から0.05から選択される製造方法。 - X/Yが、0.01以上及び20以下である、請求項50に記載の製造方法。
- X/Yが、0.01以上及び0.2以下である、請求項50に記載の製造方法。
- X/Yが、0.05以上及び20以下である、請求項50に記載の製造方法。
- X/Yが、0.05以上及び0.2以下である、請求項50に記載の製造方法。
- 前記デバイスが患者の体内に挿入された後、前記有効成分が前記リザーバー領域から放出される速度を低減するために、前記リザーバー領域の少なくとも選択された一部分上にバリア領域を形成するステップをさらに含む、請求項50に記載の製造方法。
- 前記プライマー領域又は前記リザーバー領域が、エチレンビニルアルコールコポリマー又はポリ(ブチルメタクリレート)を含む、請求項50に記載の製造方法。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US11/089,763 US20050238686A1 (en) | 1999-12-23 | 2005-03-25 | Coating for implantable devices and a method of forming the same |
| PCT/US2006/010810 WO2006104894A2 (en) | 2005-03-25 | 2006-03-23 | Coating for implantable devices and a method of forming the same |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2008535549A true JP2008535549A (ja) | 2008-09-04 |
| JP2008535549A5 JP2008535549A5 (ja) | 2009-05-07 |
Family
ID=36939187
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2008503229A Pending JP2008535549A (ja) | 2005-03-25 | 2006-03-23 | 埋め込み型デバイス用コーティング及びその形成方法 |
Country Status (4)
| Country | Link |
|---|---|
| US (1) | US20050238686A1 (ja) |
| EP (1) | EP1868667A2 (ja) |
| JP (1) | JP2008535549A (ja) |
| WO (1) | WO2006104894A2 (ja) |
Families Citing this family (31)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6790228B2 (en) | 1999-12-23 | 2004-09-14 | Advanced Cardiovascular Systems, Inc. | Coating for implantable devices and a method of forming the same |
| US7807211B2 (en) * | 1999-09-03 | 2010-10-05 | Advanced Cardiovascular Systems, Inc. | Thermal treatment of an implantable medical device |
| US20050238686A1 (en) * | 1999-12-23 | 2005-10-27 | Advanced Cardiovascular Systems, Inc. | Coating for implantable devices and a method of forming the same |
| GB0100761D0 (en) | 2001-01-11 | 2001-02-21 | Biocompatibles Ltd | Drug delivery from stents |
| US20040073294A1 (en) | 2002-09-20 | 2004-04-15 | Conor Medsystems, Inc. | Method and apparatus for loading a beneficial agent into an expandable medical device |
| US7919075B1 (en) * | 2002-03-20 | 2011-04-05 | Advanced Cardiovascular Systems, Inc. | Coatings for implantable medical devices |
| US8435550B2 (en) | 2002-12-16 | 2013-05-07 | Abbot Cardiovascular Systems Inc. | Anti-proliferative and anti-inflammatory agent combination for treatment of vascular disorders with an implantable medical device |
| US20090093875A1 (en) | 2007-05-01 | 2009-04-09 | Abbott Laboratories | Drug eluting stents with prolonged local elution profiles with high local concentrations and low systemic concentrations |
| US6926919B1 (en) * | 2003-02-26 | 2005-08-09 | Advanced Cardiovascular Systems, Inc. | Method for fabricating a coating for a medical device |
| US20050118344A1 (en) | 2003-12-01 | 2005-06-02 | Pacetti Stephen D. | Temperature controlled crimping |
| US8709469B2 (en) * | 2004-06-30 | 2014-04-29 | Abbott Cardiovascular Systems Inc. | Anti-proliferative and anti-inflammatory agent combination for treatment of vascular disorders with an implantable medical device |
| US8155754B2 (en) * | 2005-01-25 | 2012-04-10 | Medtronic, Inc. | Method for fabrication of low-polarization implantable stimulation electrode |
| US20070048350A1 (en) * | 2005-08-31 | 2007-03-01 | Robert Falotico | Antithrombotic coating for drug eluting medical devices |
| US8784860B2 (en) * | 2005-10-27 | 2014-07-22 | Cordis Corporation | Local administration of a combination of rapamycin and cilostazol for the treatment of vascular disease |
| US20070128246A1 (en) * | 2005-12-06 | 2007-06-07 | Hossainy Syed F A | Solventless method for forming a coating |
| US20090053391A1 (en) * | 2005-12-06 | 2009-02-26 | Ludwig Florian N | Method Of Coating A Drug-Releasing Layer Onto A Substrate |
| US20080033522A1 (en) | 2006-08-03 | 2008-02-07 | Med Institute, Inc. | Implantable Medical Device with Particulate Coating |
| US7713541B1 (en) | 2006-11-21 | 2010-05-11 | Abbott Cardiovascular Systems Inc. | Zwitterionic terpolymers, method of making and use on medical devices |
| EP2153803B1 (en) * | 2006-12-07 | 2011-10-26 | Mallinckrodt Inc. | Medical devices for localized drug delivery |
| US7753962B2 (en) * | 2007-01-30 | 2010-07-13 | Medtronic Vascular, Inc. | Textured medical devices |
| US8996129B2 (en) * | 2007-01-31 | 2015-03-31 | Medtronic, Inc. | Medical electrode including an iridium oxide surface and methods of fabrication |
| US20080286332A1 (en) | 2007-05-14 | 2008-11-20 | Pacetti Stephen D | Implantable medical devices with a topcoat layer of phosphoryl choline acrylate polymer for reduced thrombosis, and improved mechanical properties |
| US20090016935A1 (en) * | 2007-07-09 | 2009-01-15 | Andrianov Alexander K | Coating formulations including polyphosphazene polyelectrolytes and biologically active agents and asperities coated with such formulations |
| WO2009020550A2 (en) * | 2007-08-03 | 2009-02-12 | University Of Massachusetts Medical School | Composites for biomedical applications |
| US20090111787A1 (en) * | 2007-10-31 | 2009-04-30 | Florencia Lim | Polymer blends for drug delivery stent matrix with improved thermal stability |
| WO2009112851A1 (en) * | 2008-03-13 | 2009-09-17 | Enbio Limited | Surface modification of nitinol |
| US8092822B2 (en) | 2008-09-29 | 2012-01-10 | Abbott Cardiovascular Systems Inc. | Coatings including dexamethasone derivatives and analogs and olimus drugs |
| US8183337B1 (en) | 2009-04-29 | 2012-05-22 | Abbott Cardiovascular Systems Inc. | Method of purifying ethylene vinyl alcohol copolymers for use with implantable medical devices |
| EP2266638A3 (de) * | 2009-06-25 | 2014-08-13 | Biotronik VI Patent AG | Biokorrodierbares Implantat mit einer aktiven Beschichtung |
| WO2013025572A1 (en) * | 2011-08-12 | 2013-02-21 | Rutgers, The State University Of New Jersey | An interpolymer network delivery system |
| AU2016361380B2 (en) * | 2015-11-26 | 2021-04-08 | Japan Medical Device Technology Co., Ltd. | Bioabsorbable stent |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2003090818A2 (en) * | 2002-04-24 | 2003-11-06 | Sun Biomedical, Ltd. | Drug-delivery endovascular stent and method for treating restenosis |
| US20040086542A1 (en) * | 1999-12-23 | 2004-05-06 | Hossainy Syed F.A. | Coating for implantable devices and a method of forming the same |
Family Cites Families (96)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| FR732895A (fr) * | 1932-10-18 | 1932-09-25 | Consortium Elektrochem Ind | Objets filés en alcool polyvinylique |
| US4656242A (en) * | 1985-06-07 | 1987-04-07 | Henkel Corporation | Poly(ester-amide) compositions |
| US4733665C2 (en) * | 1985-11-07 | 2002-01-29 | Expandable Grafts Partnership | Expandable intraluminal graft and method and apparatus for implanting an expandable intraluminal graft |
| US5721131A (en) * | 1987-03-06 | 1998-02-24 | United States Of America As Represented By The Secretary Of The Navy | Surface modification of polymers with self-assembled monolayers that promote adhesion, outgrowth and differentiation of biological cells |
| US4800882A (en) * | 1987-03-13 | 1989-01-31 | Cook Incorporated | Endovascular stent and delivery system |
| IL90193A (en) * | 1989-05-04 | 1993-02-21 | Biomedical Polymers Int | Polurethane-based polymeric materials and biomedical articles and pharmaceutical compositions utilizing the same |
| US5292516A (en) * | 1990-05-01 | 1994-03-08 | Mediventures, Inc. | Body cavity drug delivery with thermoreversible gels containing polyoxyalkylene copolymers |
| US5298260A (en) * | 1990-05-01 | 1994-03-29 | Mediventures, Inc. | Topical drug delivery with polyoxyalkylene polymer thermoreversible gels adjustable for pH and osmolality |
| US5306501A (en) * | 1990-05-01 | 1994-04-26 | Mediventures, Inc. | Drug delivery by injection with thermoreversible gels containing polyoxyalkylene copolymers |
| US5300295A (en) * | 1990-05-01 | 1994-04-05 | Mediventures, Inc. | Ophthalmic drug delivery with thermoreversible polyoxyalkylene gels adjustable for pH |
| US5258020A (en) * | 1990-09-14 | 1993-11-02 | Michael Froix | Method of using expandable polymeric stent with memory |
| GB9027793D0 (en) * | 1990-12-21 | 1991-02-13 | Ucb Sa | Polyester-amides containing terminal carboxyl groups |
| US5500013A (en) * | 1991-10-04 | 1996-03-19 | Scimed Life Systems, Inc. | Biodegradable drug delivery vascular stent |
| US5573934A (en) * | 1992-04-20 | 1996-11-12 | Board Of Regents, The University Of Texas System | Gels for encapsulation of biological materials |
| US5464650A (en) * | 1993-04-26 | 1995-11-07 | Medtronic, Inc. | Intravascular stent and method |
| US5994341A (en) * | 1993-07-19 | 1999-11-30 | Angiogenesis Technologies, Inc. | Anti-angiogenic Compositions and methods for the treatment of arthritis |
| US5380299A (en) * | 1993-08-30 | 1995-01-10 | Med Institute, Inc. | Thrombolytic treated intravascular medical device |
| WO1995010989A1 (en) * | 1993-10-19 | 1995-04-27 | Scimed Life Systems, Inc. | Intravascular stent pump |
| US6051576A (en) * | 1994-01-28 | 2000-04-18 | University Of Kentucky Research Foundation | Means to achieve sustained release of synergistic drugs by conjugation |
| US5857998A (en) * | 1994-06-30 | 1999-01-12 | Boston Scientific Corporation | Stent and therapeutic delivery system |
| US5485496A (en) * | 1994-09-22 | 1996-01-16 | Cornell Research Foundation, Inc. | Gamma irradiation sterilizing of biomaterial medical devices or products, with improved degradation and mechanical properties |
| WO1996011671A1 (en) * | 1994-10-12 | 1996-04-25 | Focal, Inc. | Targeted delivery via biodegradable polymers |
| US5869127A (en) * | 1995-02-22 | 1999-02-09 | Boston Scientific Corporation | Method of providing a substrate with a bio-active/biocompatible coating |
| US5605696A (en) * | 1995-03-30 | 1997-02-25 | Advanced Cardiovascular Systems, Inc. | Drug loaded polymeric material and method of manufacture |
| US5837313A (en) * | 1995-04-19 | 1998-11-17 | Schneider (Usa) Inc | Drug release stent coating process |
| US6774278B1 (en) * | 1995-06-07 | 2004-08-10 | Cook Incorporated | Coated implantable medical device |
| US5609629A (en) * | 1995-06-07 | 1997-03-11 | Med Institute, Inc. | Coated implantable medical device |
| US5820917A (en) * | 1995-06-07 | 1998-10-13 | Medtronic, Inc. | Blood-contacting medical device and method |
| AU716005B2 (en) * | 1995-06-07 | 2000-02-17 | Cook Medical Technologies Llc | Implantable medical device |
| US6010530A (en) * | 1995-06-07 | 2000-01-04 | Boston Scientific Technology, Inc. | Self-expanding endoluminal prosthesis |
| US7611533B2 (en) * | 1995-06-07 | 2009-11-03 | Cook Incorporated | Coated implantable medical device |
| US7550005B2 (en) * | 1995-06-07 | 2009-06-23 | Cook Incorporated | Coated implantable medical device |
| US5877224A (en) * | 1995-07-28 | 1999-03-02 | Rutgers, The State University Of New Jersey | Polymeric drug formulations |
| US5874500A (en) * | 1995-12-18 | 1999-02-23 | Cohesion Technologies, Inc. | Crosslinked polymer compositions and methods for their use |
| US5723219A (en) * | 1995-12-19 | 1998-03-03 | Talison Research | Plasma deposited film networks |
| US6033582A (en) * | 1996-01-22 | 2000-03-07 | Etex Corporation | Surface modification of medical implants |
| US6054553A (en) * | 1996-01-29 | 2000-04-25 | Bayer Ag | Process for the preparation of polymers having recurring agents |
| US5876433A (en) * | 1996-05-29 | 1999-03-02 | Ethicon, Inc. | Stent and method of varying amounts of heparin coated thereon to control treatment |
| NL1003459C2 (nl) * | 1996-06-28 | 1998-01-07 | Univ Twente | Copoly(ester-amides) en copoly(ester-urethanen). |
| US5711958A (en) * | 1996-07-11 | 1998-01-27 | Life Medical Sciences, Inc. | Methods for reducing or eliminating post-surgical adhesion formation |
| US6530951B1 (en) * | 1996-10-24 | 2003-03-11 | Cook Incorporated | Silver implantable medical device |
| US5954724A (en) * | 1997-03-27 | 1999-09-21 | Davidson; James A. | Titanium molybdenum hafnium alloys for medical implants and devices |
| US5879697A (en) * | 1997-04-30 | 1999-03-09 | Schneider Usa Inc | Drug-releasing coatings for medical devices |
| US6180632B1 (en) * | 1997-05-28 | 2001-01-30 | Aventis Pharmaceuticals Products Inc. | Quinoline and quinoxaline compounds which inhibit platelet-derived growth factor and/or p56lck tyrosine kinases |
| US6159978A (en) * | 1997-05-28 | 2000-12-12 | Aventis Pharmaceuticals Product, Inc. | Quinoline and quinoxaline compounds which inhibit platelet-derived growth factor and/or p56lck tyrosine kinases |
| US6211249B1 (en) * | 1997-07-11 | 2001-04-03 | Life Medical Sciences, Inc. | Polyester polyether block copolymers |
| CA2298580A1 (en) * | 1997-08-08 | 1999-02-18 | The Procter & Gamble Company | Laundry detergent compositions with amino acid based polymers to provide appearance and integrity benefits to fabrics laundered therewith |
| US6015541A (en) * | 1997-11-03 | 2000-01-18 | Micro Therapeutics, Inc. | Radioactive embolizing compositions |
| US20030040790A1 (en) * | 1998-04-15 | 2003-02-27 | Furst Joseph G. | Stent coating |
| EP1019111B1 (en) * | 1998-04-27 | 2002-06-26 | Surmodics Inc. | Bioactive agent release coating |
| EP1105169A1 (en) * | 1998-08-20 | 2001-06-13 | Cook Incorporated | Coated implantable medical device |
| US6335029B1 (en) * | 1998-08-28 | 2002-01-01 | Scimed Life Systems, Inc. | Polymeric coatings for controlled delivery of active agents |
| US6011125A (en) * | 1998-09-25 | 2000-01-04 | General Electric Company | Amide modified polyesters |
| US6358276B1 (en) * | 1998-09-30 | 2002-03-19 | Impra, Inc. | Fluid containing endoluminal stent |
| US6530950B1 (en) * | 1999-01-12 | 2003-03-11 | Quanam Medical Corporation | Intraluminal stent having coaxial polymer member |
| US6494862B1 (en) * | 1999-07-13 | 2002-12-17 | Advanced Cardiovascular Systems, Inc. | Substance delivery apparatus and a method of delivering a therapeutic substance to an anatomical passageway |
| US6283947B1 (en) * | 1999-07-13 | 2001-09-04 | Advanced Cardiovascular Systems, Inc. | Local drug delivery injection catheter |
| US6177523B1 (en) * | 1999-07-14 | 2001-01-23 | Cardiotech International, Inc. | Functionalized polyurethanes |
| US6503954B1 (en) * | 2000-03-31 | 2003-01-07 | Advanced Cardiovascular Systems, Inc. | Biocompatible carrier containing actinomycin D and a method of forming the same |
| US6503556B2 (en) * | 2000-12-28 | 2003-01-07 | Advanced Cardiovascular Systems, Inc. | Methods of forming a coating for a prosthesis |
| US6713119B2 (en) * | 1999-09-03 | 2004-03-30 | Advanced Cardiovascular Systems, Inc. | Biocompatible coating for a prosthesis and a method of forming the same |
| US20040029952A1 (en) * | 1999-09-03 | 2004-02-12 | Yung-Ming Chen | Ethylene vinyl alcohol composition and coating |
| US6379381B1 (en) * | 1999-09-03 | 2002-04-30 | Advanced Cardiovascular Systems, Inc. | Porous prosthesis and a method of depositing substances into the pores |
| US6203551B1 (en) * | 1999-10-04 | 2001-03-20 | Advanced Cardiovascular Systems, Inc. | Chamber for applying therapeutic substances to an implant device |
| US6508832B1 (en) * | 1999-12-09 | 2003-01-21 | Advanced Cardiovascular Systems, Inc. | Implantable nickel-free stainless steel stents and method of making the same |
| US6613432B2 (en) * | 1999-12-22 | 2003-09-02 | Biosurface Engineering Technologies, Inc. | Plasma-deposited coatings, devices and methods |
| US20050238686A1 (en) * | 1999-12-23 | 2005-10-27 | Advanced Cardiovascular Systems, Inc. | Coating for implantable devices and a method of forming the same |
| US6506954B1 (en) * | 2000-04-11 | 2003-01-14 | Exxon Mobil Chemical Patents, Inc. | Process for producing chemicals from oxygenate |
| US6527801B1 (en) * | 2000-04-13 | 2003-03-04 | Advanced Cardiovascular Systems, Inc. | Biodegradable drug delivery material for stent |
| US6776796B2 (en) * | 2000-05-12 | 2004-08-17 | Cordis Corportation | Antiinflammatory drug and delivery device |
| US20020007213A1 (en) * | 2000-05-19 | 2002-01-17 | Robert Falotico | Drug/drug delivery systems for the prevention and treatment of vascular disease |
| US20020007214A1 (en) * | 2000-05-19 | 2002-01-17 | Robert Falotico | Drug/drug delivery systems for the prevention and treatment of vascular disease |
| US20020005206A1 (en) * | 2000-05-19 | 2002-01-17 | Robert Falotico | Antiproliferative drug and delivery device |
| US20020007215A1 (en) * | 2000-05-19 | 2002-01-17 | Robert Falotico | Drug/drug delivery systems for the prevention and treatment of vascular disease |
| US6395326B1 (en) * | 2000-05-31 | 2002-05-28 | Advanced Cardiovascular Systems, Inc. | Apparatus and method for depositing a coating onto a surface of a prosthesis |
| US6673385B1 (en) * | 2000-05-31 | 2004-01-06 | Advanced Cardiovascular Systems, Inc. | Methods for polymeric coatings stents |
| US6451373B1 (en) * | 2000-08-04 | 2002-09-17 | Advanced Cardiovascular Systems, Inc. | Method of forming a therapeutic coating onto a surface of an implantable prosthesis |
| US6503538B1 (en) * | 2000-08-30 | 2003-01-07 | Cornell Research Foundation, Inc. | Elastomeric functional biodegradable copolyester amides and copolyester urethanes |
| KR100741903B1 (ko) * | 2000-10-23 | 2007-07-24 | 엘지.필립스 엘시디 주식회사 | 액정 적하 방식의 lcd 패널 및 그 제조방법 |
| AU2002254158A1 (en) * | 2001-03-08 | 2002-09-24 | Volcano Therapeutics, Inc. | Medical devices, compositions and methods for treating vulnerable plaque |
| US6712845B2 (en) * | 2001-04-24 | 2004-03-30 | Advanced Cardiovascular Systems, Inc. | Coating for a stent and a method of forming the same |
| EP2033648A3 (en) * | 2001-04-26 | 2009-06-03 | pSivida Inc | Sustained release drug delivery system containing prodrugs |
| US6656506B1 (en) * | 2001-05-09 | 2003-12-02 | Advanced Cardiovascular Systems, Inc. | Microparticle coated medical device |
| US6527938B2 (en) * | 2001-06-21 | 2003-03-04 | Syntheon, Llc | Method for microporous surface modification of implantable metallic medical articles |
| US6695920B1 (en) * | 2001-06-27 | 2004-02-24 | Advanced Cardiovascular Systems, Inc. | Mandrel for supporting a stent and a method of using the mandrel to coat a stent |
| US6673154B1 (en) * | 2001-06-28 | 2004-01-06 | Advanced Cardiovascular Systems, Inc. | Stent mounting device to coat a stent |
| US6527863B1 (en) * | 2001-06-29 | 2003-03-04 | Advanced Cardiovascular Systems, Inc. | Support device for a stent and a method of using the same to coat a stent |
| US6706013B1 (en) * | 2001-06-29 | 2004-03-16 | Advanced Cardiovascular Systems, Inc. | Variable length drug delivery catheter |
| US7195640B2 (en) * | 2001-09-25 | 2007-03-27 | Cordis Corporation | Coated medical devices for the treatment of vulnerable plaque |
| US20030059520A1 (en) * | 2001-09-27 | 2003-03-27 | Yung-Ming Chen | Apparatus for regulating temperature of a composition and a method of coating implantable devices |
| US6708514B1 (en) * | 2002-01-16 | 2004-03-23 | William F. Miller | Air conditioner cover |
| US6743463B2 (en) * | 2002-03-28 | 2004-06-01 | Scimed Life Systems, Inc. | Method for spray-coating a medical device having a tubular wall such as a stent |
| US6865810B2 (en) * | 2002-06-27 | 2005-03-15 | Scimed Life Systems, Inc. | Methods of making medical devices |
| US20040054104A1 (en) * | 2002-09-05 | 2004-03-18 | Pacetti Stephen D. | Coatings for drug delivery devices comprising modified poly(ethylene-co-vinyl alcohol) |
| US20040147999A1 (en) | 2003-01-24 | 2004-07-29 | Kishore Udipi | Stent with epoxy primer coating |
| US20040230298A1 (en) | 2003-04-25 | 2004-11-18 | Medtronic Vascular, Inc. | Drug-polymer coated stent with polysulfone and styrenic block copolymer |
-
2005
- 2005-03-25 US US11/089,763 patent/US20050238686A1/en not_active Abandoned
-
2006
- 2006-03-23 EP EP06739536A patent/EP1868667A2/en not_active Withdrawn
- 2006-03-23 WO PCT/US2006/010810 patent/WO2006104894A2/en active Application Filing
- 2006-03-23 JP JP2008503229A patent/JP2008535549A/ja active Pending
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20040086542A1 (en) * | 1999-12-23 | 2004-05-06 | Hossainy Syed F.A. | Coating for implantable devices and a method of forming the same |
| WO2003090818A2 (en) * | 2002-04-24 | 2003-11-06 | Sun Biomedical, Ltd. | Drug-delivery endovascular stent and method for treating restenosis |
Also Published As
| Publication number | Publication date |
|---|---|
| US20050238686A1 (en) | 2005-10-27 |
| EP1868667A2 (en) | 2007-12-26 |
| WO2006104894A2 (en) | 2006-10-05 |
| WO2006104894A3 (en) | 2007-03-22 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2008535549A (ja) | 埋め込み型デバイス用コーティング及びその形成方法 | |
| JP5031989B2 (ja) | 植え込み可能な器具用の被覆及びその形成方法 | |
| JP5463003B2 (ja) | 医療用生体分解性組成物 | |
| US9028859B2 (en) | Phase-separated block copolymer coatings for implantable medical devices | |
| US9821091B2 (en) | Methods of treatment of polymeric coatings for control of agent release rates | |
| US9180227B2 (en) | Coating layers for medical devices and method of making the same | |
| JP5106415B2 (ja) | ナノ粒子放出型医療デバイス | |
| JP5493230B2 (ja) | 速吸収性又は溶解性のコーティング | |
| US20020123801A1 (en) | Diffusion barrier layer for implantable devices | |
| US20050025799A1 (en) | Biologically absorbable coatings for implantable devices and methods for fabricating the same | |
| JP2007512103A (ja) | 生体腐食性のポリエステルを含む、埋め込み型用具のためのコーティング及びその製造方法 | |
| US20050196422A1 (en) | Methods for fabricating a coating for implantable medical devices | |
| JP2008523901A (ja) | 薬物送達ステントのための反管腔側の多層被覆構築物 | |
| CA2633032A1 (en) | Anti-adhesion agents for drug coatings | |
| JP2009540931A (ja) | ステントコーティングを改変するための凍結−融解法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20090319 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20090319 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20120228 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20120528 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20120604 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20120918 |