JP2007514460A - 増大した生物適合性を示すセンサー - Google Patents
増大した生物適合性を示すセンサー Download PDFInfo
- Publication number
- JP2007514460A JP2007514460A JP2006534128A JP2006534128A JP2007514460A JP 2007514460 A JP2007514460 A JP 2007514460A JP 2006534128 A JP2006534128 A JP 2006534128A JP 2006534128 A JP2006534128 A JP 2006534128A JP 2007514460 A JP2007514460 A JP 2007514460A
- Authority
- JP
- Japan
- Prior art keywords
- sensor
- membrane
- cavity
- biosensor
- electrochemical
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 239000003153 chemical reaction reagent Substances 0.000 claims abstract description 73
- 239000000463 material Substances 0.000 claims abstract description 46
- 239000011159 matrix material Substances 0.000 claims abstract description 35
- 239000012530 fluid Substances 0.000 claims abstract description 33
- 238000000034 method Methods 0.000 claims abstract description 20
- 102000004190 Enzymes Human genes 0.000 claims abstract description 18
- 108090000790 Enzymes Proteins 0.000 claims abstract description 18
- 239000003054 catalyst Substances 0.000 claims abstract description 14
- 239000011230 binding agent Substances 0.000 claims abstract description 7
- 239000012528 membrane Substances 0.000 claims description 136
- 239000012491 analyte Substances 0.000 claims description 62
- 239000004020 conductor Substances 0.000 claims description 31
- 239000000758 substrate Substances 0.000 claims description 31
- 238000007920 subcutaneous administration Methods 0.000 claims description 29
- 238000009792 diffusion process Methods 0.000 claims description 24
- 238000001514 detection method Methods 0.000 claims description 23
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 claims description 19
- 239000008103 glucose Substances 0.000 claims description 19
- 238000001727 in vivo Methods 0.000 claims description 19
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 claims description 17
- 229940088598 enzyme Drugs 0.000 claims description 17
- 229910052760 oxygen Inorganic materials 0.000 claims description 17
- 239000001301 oxygen Substances 0.000 claims description 17
- 210000001124 body fluid Anatomy 0.000 claims description 14
- NUJOXMJBOLGQSY-UHFFFAOYSA-N manganese dioxide Chemical compound O=[Mn]=O NUJOXMJBOLGQSY-UHFFFAOYSA-N 0.000 claims description 14
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 claims description 12
- 229910052799 carbon Inorganic materials 0.000 claims description 12
- 238000005259 measurement Methods 0.000 claims description 12
- 239000010839 body fluid Substances 0.000 claims description 11
- 239000012510 hollow fiber Substances 0.000 claims description 8
- 239000002245 particle Substances 0.000 claims description 7
- 238000012360 testing method Methods 0.000 claims description 7
- 108010015776 Glucose oxidase Proteins 0.000 claims description 6
- 239000004366 Glucose oxidase Substances 0.000 claims description 6
- 239000004952 Polyamide Substances 0.000 claims description 6
- 239000004642 Polyimide Substances 0.000 claims description 6
- 229940116332 glucose oxidase Drugs 0.000 claims description 6
- 235000019420 glucose oxidase Nutrition 0.000 claims description 6
- 229920002647 polyamide Polymers 0.000 claims description 6
- 229920001721 polyimide Polymers 0.000 claims description 6
- 229920000642 polymer Polymers 0.000 claims description 6
- 230000004044 response Effects 0.000 claims description 6
- 239000013060 biological fluid Substances 0.000 claims description 5
- 239000007788 liquid Substances 0.000 claims description 3
- 239000012811 non-conductive material Substances 0.000 claims description 3
- 239000000376 reactant Substances 0.000 claims description 3
- 239000012891 Ringer solution Substances 0.000 claims description 2
- 229920000249 biocompatible polymer Polymers 0.000 claims description 2
- 238000000502 dialysis Methods 0.000 claims description 2
- 238000011049 filling Methods 0.000 claims description 2
- 125000002791 glucosyl group Chemical group C1([C@H](O)[C@@H](O)[C@H](O)[C@H](O1)CO)* 0.000 claims description 2
- 206010033675 panniculitis Diseases 0.000 claims description 2
- 229920002492 poly(sulfone) Polymers 0.000 claims description 2
- 210000004304 subcutaneous tissue Anatomy 0.000 claims description 2
- 238000004070 electrodeposition Methods 0.000 claims 3
- 239000000853 adhesive Substances 0.000 claims 1
- 230000001070 adhesive effect Effects 0.000 claims 1
- 238000006243 chemical reaction Methods 0.000 abstract description 17
- 238000004519 manufacturing process Methods 0.000 abstract description 10
- 239000000126 substance Substances 0.000 abstract description 4
- 230000008021 deposition Effects 0.000 abstract 2
- 239000010410 layer Substances 0.000 description 30
- 238000000576 coating method Methods 0.000 description 12
- 239000000203 mixture Substances 0.000 description 11
- 210000001519 tissue Anatomy 0.000 description 11
- 239000011248 coating agent Substances 0.000 description 9
- 238000005538 encapsulation Methods 0.000 description 8
- 208000005422 Foreign-Body reaction Diseases 0.000 description 7
- 102000004169 proteins and genes Human genes 0.000 description 7
- 108090000623 proteins and genes Proteins 0.000 description 7
- MHAJPDPJQMAIIY-UHFFFAOYSA-N Hydrogen peroxide Chemical compound OO MHAJPDPJQMAIIY-UHFFFAOYSA-N 0.000 description 6
- 238000001179 sorption measurement Methods 0.000 description 6
- 238000013459 approach Methods 0.000 description 5
- 230000008901 benefit Effects 0.000 description 5
- 150000001875 compounds Chemical class 0.000 description 5
- 238000013461 design Methods 0.000 description 5
- 238000001690 micro-dialysis Methods 0.000 description 5
- 229920005596 polymer binder Polymers 0.000 description 5
- 239000002491 polymer binding agent Substances 0.000 description 5
- 230000035945 sensitivity Effects 0.000 description 5
- 239000002904 solvent Substances 0.000 description 5
- 230000033115 angiogenesis Effects 0.000 description 4
- 238000004891 communication Methods 0.000 description 4
- 230000000694 effects Effects 0.000 description 4
- 230000006870 function Effects 0.000 description 4
- 230000035699 permeability Effects 0.000 description 4
- 230000008569 process Effects 0.000 description 4
- 102000008186 Collagen Human genes 0.000 description 3
- 108010035532 Collagen Proteins 0.000 description 3
- 230000001413 cellular effect Effects 0.000 description 3
- 230000008859 change Effects 0.000 description 3
- 229920001436 collagen Polymers 0.000 description 3
- 231100000135 cytotoxicity Toxicity 0.000 description 3
- 230000003013 cytotoxicity Effects 0.000 description 3
- 238000000835 electrochemical detection Methods 0.000 description 3
- PCHJSUWPFVWCPO-UHFFFAOYSA-N gold Chemical compound [Au] PCHJSUWPFVWCPO-UHFFFAOYSA-N 0.000 description 3
- 229910052737 gold Inorganic materials 0.000 description 3
- 239000010931 gold Substances 0.000 description 3
- 238000002513 implantation Methods 0.000 description 3
- 238000012986 modification Methods 0.000 description 3
- 230000004048 modification Effects 0.000 description 3
- 238000007254 oxidation reaction Methods 0.000 description 3
- 239000000243 solution Substances 0.000 description 3
- 231100000167 toxic agent Toxicity 0.000 description 3
- RZVAJINKPMORJF-UHFFFAOYSA-N Acetaminophen Chemical compound CC(=O)NC1=CC=C(O)C=C1 RZVAJINKPMORJF-UHFFFAOYSA-N 0.000 description 2
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 2
- 229920000557 Nafion® Polymers 0.000 description 2
- 108090000854 Oxidoreductases Proteins 0.000 description 2
- 102000004316 Oxidoreductases Human genes 0.000 description 2
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 2
- 229910021607 Silver chloride Inorganic materials 0.000 description 2
- 238000009825 accumulation Methods 0.000 description 2
- 230000009471 action Effects 0.000 description 2
- 239000000654 additive Substances 0.000 description 2
- 238000004458 analytical method Methods 0.000 description 2
- 239000008280 blood Substances 0.000 description 2
- 210000004369 blood Anatomy 0.000 description 2
- 210000004027 cell Anatomy 0.000 description 2
- 230000002708 enhancing effect Effects 0.000 description 2
- 229920002313 fluoropolymer Polymers 0.000 description 2
- 230000035876 healing Effects 0.000 description 2
- 238000012623 in vivo measurement Methods 0.000 description 2
- 208000014674 injury Diseases 0.000 description 2
- 229910052751 metal Inorganic materials 0.000 description 2
- 239000002184 metal Substances 0.000 description 2
- 230000003647 oxidation Effects 0.000 description 2
- 238000000059 patterning Methods 0.000 description 2
- 239000012071 phase Substances 0.000 description 2
- 150000003904 phospholipids Chemical class 0.000 description 2
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical compound [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 2
- 229920001296 polysiloxane Polymers 0.000 description 2
- 239000011527 polyurethane coating Substances 0.000 description 2
- 239000011148 porous material Substances 0.000 description 2
- 230000001737 promoting effect Effects 0.000 description 2
- 238000007650 screen-printing Methods 0.000 description 2
- HKZLPVFGJNLROG-UHFFFAOYSA-M silver monochloride Chemical compound [Cl-].[Ag+] HKZLPVFGJNLROG-UHFFFAOYSA-M 0.000 description 2
- 231100000331 toxic Toxicity 0.000 description 2
- 230000002588 toxic effect Effects 0.000 description 2
- 230000008733 trauma Effects 0.000 description 2
- 238000003466 welding Methods 0.000 description 2
- 102000016938 Catalase Human genes 0.000 description 1
- 108010053835 Catalase Proteins 0.000 description 1
- 102000004127 Cytokines Human genes 0.000 description 1
- 108090000695 Cytokines Proteins 0.000 description 1
- XTHFKEDIFFGKHM-UHFFFAOYSA-N Dimethoxyethane Chemical compound COCCOC XTHFKEDIFFGKHM-UHFFFAOYSA-N 0.000 description 1
- RYECOJGRJDOGPP-UHFFFAOYSA-N Ethylurea Chemical compound CCNC(N)=O RYECOJGRJDOGPP-UHFFFAOYSA-N 0.000 description 1
- 206010061218 Inflammation Diseases 0.000 description 1
- OFOBLEOULBTSOW-UHFFFAOYSA-L Malonate Chemical compound [O-]C(=O)CC([O-])=O OFOBLEOULBTSOW-UHFFFAOYSA-L 0.000 description 1
- 206010067584 Type 1 diabetes mellitus Diseases 0.000 description 1
- LEHOTFFKMJEONL-UHFFFAOYSA-N Uric Acid Chemical compound N1C(=O)NC(=O)C2=C1NC(=O)N2 LEHOTFFKMJEONL-UHFFFAOYSA-N 0.000 description 1
- TVWHNULVHGKJHS-UHFFFAOYSA-N Uric acid Natural products N1C(=O)NC(=O)C2NC(=O)NC21 TVWHNULVHGKJHS-UHFFFAOYSA-N 0.000 description 1
- 239000013543 active substance Substances 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- 235000010323 ascorbic acid Nutrition 0.000 description 1
- 229960005070 ascorbic acid Drugs 0.000 description 1
- 239000011668 ascorbic acid Substances 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- 239000012620 biological material Substances 0.000 description 1
- 239000006227 byproduct Substances 0.000 description 1
- 239000002775 capsule Substances 0.000 description 1
- 230000021164 cell adhesion Effects 0.000 description 1
- 230000005779 cell damage Effects 0.000 description 1
- 230000010261 cell growth Effects 0.000 description 1
- 229910010293 ceramic material Inorganic materials 0.000 description 1
- 238000003486 chemical etching Methods 0.000 description 1
- 239000003795 chemical substances by application Substances 0.000 description 1
- GTKRFUAGOKINCA-UHFFFAOYSA-M chlorosilver;silver Chemical compound [Ag].[Ag]Cl GTKRFUAGOKINCA-UHFFFAOYSA-M 0.000 description 1
- 239000012459 cleaning agent Substances 0.000 description 1
- 238000004132 cross linking Methods 0.000 description 1
- 230000003111 delayed effect Effects 0.000 description 1
- 230000000779 depleting effect Effects 0.000 description 1
- 238000003745 diagnosis Methods 0.000 description 1
- 230000004069 differentiation Effects 0.000 description 1
- 238000005553 drilling Methods 0.000 description 1
- 238000003487 electrochemical reaction Methods 0.000 description 1
- 239000007772 electrode material Substances 0.000 description 1
- -1 electrode structures Substances 0.000 description 1
- 239000008393 encapsulating agent Substances 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 230000002255 enzymatic effect Effects 0.000 description 1
- 238000000605 extraction Methods 0.000 description 1
- 239000000835 fiber Substances 0.000 description 1
- 210000002950 fibroblast Anatomy 0.000 description 1
- 239000011888 foil Substances 0.000 description 1
- 238000009472 formulation Methods 0.000 description 1
- 150000002303 glucose derivatives Chemical class 0.000 description 1
- 239000003292 glue Substances 0.000 description 1
- 238000010438 heat treatment Methods 0.000 description 1
- 229920001477 hydrophilic polymer Polymers 0.000 description 1
- 230000002209 hydrophobic effect Effects 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 230000008595 infiltration Effects 0.000 description 1
- 238000001764 infiltration Methods 0.000 description 1
- 210000004969 inflammatory cell Anatomy 0.000 description 1
- 230000004054 inflammatory process Effects 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- 230000003834 intracellular effect Effects 0.000 description 1
- 238000010030 laminating Methods 0.000 description 1
- 150000002605 large molecules Chemical class 0.000 description 1
- 238000000608 laser ablation Methods 0.000 description 1
- 229920002521 macromolecule Polymers 0.000 description 1
- 210000002540 macrophage Anatomy 0.000 description 1
- 238000010002 mechanical finishing Methods 0.000 description 1
- 238000010297 mechanical methods and process Methods 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 230000005012 migration Effects 0.000 description 1
- 238000013508 migration Methods 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 230000037125 natural defense Effects 0.000 description 1
- 230000017095 negative regulation of cell growth Effects 0.000 description 1
- 229910000510 noble metal Inorganic materials 0.000 description 1
- 239000003960 organic solvent Substances 0.000 description 1
- 229910052763 palladium Inorganic materials 0.000 description 1
- 229960005489 paracetamol Drugs 0.000 description 1
- 230000002093 peripheral effect Effects 0.000 description 1
- 239000004033 plastic Substances 0.000 description 1
- 229920003023 plastic Polymers 0.000 description 1
- 229910052697 platinum Inorganic materials 0.000 description 1
- 229920000728 polyester Polymers 0.000 description 1
- 238000012545 processing Methods 0.000 description 1
- 239000000047 product Substances 0.000 description 1
- 238000011084 recovery Methods 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 229920005573 silicon-containing polymer Polymers 0.000 description 1
- 229920006268 silicone film Polymers 0.000 description 1
- 150000003384 small molecules Chemical class 0.000 description 1
- 239000007787 solid Substances 0.000 description 1
- 239000007790 solid phase Substances 0.000 description 1
- 125000006850 spacer group Chemical group 0.000 description 1
- 238000013222 sprague-dawley male rat Methods 0.000 description 1
- 238000004544 sputter deposition Methods 0.000 description 1
- 230000006641 stabilisation Effects 0.000 description 1
- 238000011105 stabilization Methods 0.000 description 1
- 238000003860 storage Methods 0.000 description 1
- 239000002344 surface layer Substances 0.000 description 1
- 230000000451 tissue damage Effects 0.000 description 1
- 231100000827 tissue damage Toxicity 0.000 description 1
- 229940116269 uric acid Drugs 0.000 description 1
- 238000007740 vapor deposition Methods 0.000 description 1
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 1
- 238000001039 wet etching Methods 0.000 description 1
- 238000009736 wetting Methods 0.000 description 1
- 230000029663 wound healing Effects 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/145—Measuring characteristics of blood in vivo, e.g. gas concentration, pH value; Measuring characteristics of body fluids or tissues, e.g. interstitial fluid, cerebral tissue
- A61B5/1486—Measuring characteristics of blood in vivo, e.g. gas concentration, pH value; Measuring characteristics of body fluids or tissues, e.g. interstitial fluid, cerebral tissue using enzyme electrodes, e.g. with immobilised oxidase
- A61B5/14865—Measuring characteristics of blood in vivo, e.g. gas concentration, pH value; Measuring characteristics of body fluids or tissues, e.g. interstitial fluid, cerebral tissue using enzyme electrodes, e.g. with immobilised oxidase invasive, e.g. introduced into the body by a catheter or needle or using implanted sensors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/145—Measuring characteristics of blood in vivo, e.g. gas concentration, pH value; Measuring characteristics of body fluids or tissues, e.g. interstitial fluid, cerebral tissue
- A61B5/14532—Measuring characteristics of blood in vivo, e.g. gas concentration, pH value; Measuring characteristics of body fluids or tissues, e.g. interstitial fluid, cerebral tissue for measuring glucose, e.g. by tissue impedance measurement
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/001—Enzyme electrodes
- C12Q1/005—Enzyme electrodes involving specific analytes or enzymes
- C12Q1/006—Enzyme electrodes involving specific analytes or enzymes for glucose
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B2562/00—Details of sensors; Constructional details of sensor housings or probes; Accessories for sensors
- A61B2562/02—Details of sensors specially adapted for in-vivo measurements
Abstract
Description
Claims (67)
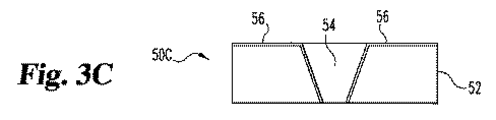
- 少なくとも頂部表面、底部表面、および第一末端を有する第一層、
第一層の底部表面に実質的に隣接する頂部表面を有する第二層、
計器との電気的接続に適合し、第一層の第一末端に隣接する第一接点、
第一層および第二層が第一層の頂部表面を通る開口部を有する空洞を定義し、該開口部が、第一層の第一末端からから離間されており、および
空洞の少なくとも20%を満たす試薬を包含するインビボで使用するための電気化学的バイオセンサーであって、該試薬が、電気的導電性マトリックスおよび酵素を包含し、
該マトリックスが、第一接点と電気的に接続している電気化学的バイオセンサー。 - 第一層が、非導電性材料から製造される請求項1記載の電気化学的バイオセンサー。
- 第二層が、非導電性材料から製造される請求項1記載の電気化学的バイオセンサー。
- 第一層が、ポリイミドから製造される請求項1記載の電気化学的バイオセンサー。
- 第一層が、約10μmと約130μmのあいだの平均厚さを有する請求項1記載の電気化学的バイオセンサー。
- 第一層が、約20μmと約50μmのあいだの平均厚さを有する請求項5記載の電気化学的バイオセンサー。
- 開口部が、面積Aを有し、および
試薬を横断しない開口部に平行に取られた空洞の各断面が、少なくともAの面積を有する請求項1記載の電気化学的バイオセンサー。 - 開口部に平行に取られた空洞の各断面が、少なくともAの面積を有する請求項1記載の電気化学的バイオセンサー。
- 開口部に平行に取られた空洞の断面が、それらが、開口部から遠くに取られるにしたがって単調に増大する面積を有する請求項8記載の電気化学的バイオセンサー。
- 空洞の体積対開口部の面積の比が、頂部表面と底部表面とのあいだの少なくともおよその距離である請求項1記載の電気化学的バイオセンサー。
- 請求項1による電気化学的センサーストリップ、および
センサー電極に電気信号を印加し、電気応答を測定するように適合された計器を包含する電気化学的バイオセンサーシステム。 - 試薬が体液中の分析物と反応するために選択され、および
計器が、体液中の分析物の濃度に対応する測定信号を生成するようにさらに適応される請求項11記載のシステム。 - 頂部表面と底部表面、
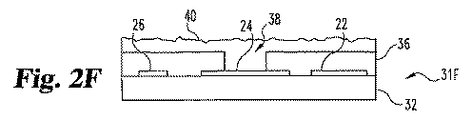
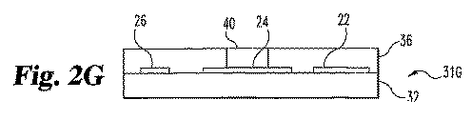
接点末端と検出末端、
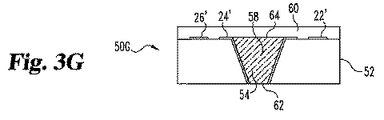
接点末端のまたはその近くの第一接点および第二接点、
検出末端のまたはその近くの第一電極位置を有する第一層、
該第一電極位置の近くの第二電極位置、
第一電極位置の第一層内および第一電極位置の第一層によって定義された空洞であって、該空洞が頂部表面を通る開口部を有し、
空洞および第一接点を電気的に接続する第一導電体、および
第二電極位置と第二接点を電気的に接続する第二導電体を含む第一層上の少なくとも2つの導電体、
空洞の体積の少なくとも約20%を満たす導電性マトリックスであって、該マトリックスが試薬を包含し、および
第二電極位置に対照電極を包含する分析物の濃度または存在を試験するためのストリップ。 - 空洞が、開口部を除いて、分析物によって非透過性である1つまたは複数の材料により実質的に囲まれている請求項13記載のストリップ。
- 1つまたは複数の材料の少なくとも1つが、酸素透過性である請求項14記載のストリップ。
- 少なくとも1つの酸素透過性材料の1つまたは複数が、第一層の底部表面に隣接した配置される側面を有する請求項15記載のストリップ。
- 1つまたは複数の材料の少なくとも1つが、試薬に対する共反応体に透過可能である請求項14記載のストリップ。
- 空洞の少なくとも一部が、酸素透過可能である材料によって定義される請求項13記載のストリップ。
- 酸素透過可能である材料が、第一層の底部表面に隣接する請求項18記載のストリップ。
- 溶着が、空洞の体積の少なくとも約80%を満たす請求項13記載のストリップ。
- 第一導電体が、その空洞を少なくとも部分的に定義する空洞に拡張する請求項13記載のストリップ。
- 第一導電体が、第一層の頂部表面に沿って配置される請求項13記載のストリップ。
- 第一導電体が、第一層の底部表面に沿って配置される請求項13記載のストリップ。
- 導電性マトリックスが、空洞の体積の少なくとも約80%を満たす請求項13記載のストリップ。
- 導電性マトリックスが、空洞を実質的に満たす請求項13記載のストリップ。
- 基板、
参照電極、および
基板によって少なくとも部分的に定義される空洞を実質的に満たす作用電極を包含する電気化学的センサーであって、該作用電極が多孔性導電性マトリックスおよび酵素を包含し、
該参照電極が、液体試料を通して作用電極に電気的に接続可能である
電気化学的センサー。 - 導電性マトリックスが、炭素粒子を包含する請求項26記載の電気化学的センサー。
- 酵素が、グルコースオキシダーゼである請求項26記載の電気化学的センサー。
- 作用電極が、さらに触媒を包含する請求項26記載の電気化学的センサー。
- 触媒が、二酸化マンガンを包含する請求項29記載の電気化学的センサー。
- 作用電極が、さらに結合剤を包含する請求項26記載の電気化学的センサー。
- 結合剤が、重合体である請求項31記載の電気化学的センサー。
- 作用電極が、さらに触媒を包含する請求項31記載の電気化学的センサー。
- 触媒が、二酸化マンガンである請求項33記載の電気化学的センサー。
- 結合剤が、重合体である請求項33記載の電気化学的センサー。
- 空洞が、実質的に円筒形状を示す請求項26記載の電気化学的センサー。
- 空洞が、実質的にピラミッド円錐台の形状を有する請求項26記載の電気化学的センサー。
- 空洞が、実質的に円錐台の形状を有する請求項26記載の電気化学的センサー。
- 空洞が、小型表面および
小型表面と少なくとも同じくらい大きな表面積を有する大型表面を有し、および、
小型表面は、分析物が空洞を通過するのに十分に開放している請求項26記載の電気化学的センサー。 - 大型表面が、酸素透過可能な材料に隣接している請求項39記載の電気化学的センサー。
- 小型表面が、円形である請求項39記載の電気化学的センサー。
- 大型表面が、円形である請求項39記載の電気化学的センサー。
- 小型表面が、円形である請求項42記載の電気化学的センサー。
- 作用電極の第一表面が開放されており、これによって、試料が分析物の拡散を制限する層を通過することなく、電極に入ることができるように請求項26記載の電気化学的センサー。
- 生物学上の流体中の分析物に応答する活性領域を有するバイオセンサー、および
活性領域上に配置された中間面の膜を含むインビボで使用するためのバイオセンサー・システムであって、これによって分析物が、膜の少なくとも一部を通過して測定のためのバイオセンサーに達し、
該膜が活性領域から離間され、および
膜の一部が、活性領域の少なくとも2倍の表面領域を有する
バイオセンサー・システム。 - 膜の一部が、活性領域の膜の少なくとも4倍の表面積を有する請求項45記載のバイオセンサー・システム。
- 膜の一部が、活性領域の膜の少なくとも10倍の表面積を有する請求項45記載のバイオセンサー・システム。
- 膜の一部が、活性領域の膜の少なくとも100倍の表面積を有する請求項45記載のバイオセンサー・システム。
- 膜が、活性領域に接触しない請求項45記載のバイオセンサー・システム。
- 生物学上の流体中の分析物に応答する活性領域を有するバイオセンサー、および
活性領域上に配置された中間面の膜を含むインビボで使用するためのバイオセンサー・システムであって、これによって分析物が、膜の少なくとも一部を通って、流動体の外部体積から、バイオセンサーおよび膜によって定義された内部体積に入り、
内部体積のサイズが、少なくとも約s3/2/10であり、sが、センサーの活性領域の領域であり、および
内部体積が、バイオセンサーの活性領域と接触しているバイオセンサー・システム。 - 膜内の流動体中の分析物の拡散係数が、膜内の分析物の拡散係数と少なくともほぼ同じくらい高い、配置された請求項50記載のバイオセンサー・システム。
- 内部体積のサイズが、少なくとも約s3/2である請求項50記載のバイオセンサー・システム。
- 内部体積のサイズが、少なくとも約10s3/2である請求項50記載のバイオセンサー・システム。
- 生物学上の流動体中で分析物に応答する活性領域を有するバイオセンサー、および
活性領域上に配置された中間面の膜を含むインビボで使用するためのバイオセンサー・システムであって、これによって分析物が、膜の少なくとも一部を通って、流動体の外部体積から、バイオセンサーおよび膜によって定義された内部体積に入り、
中間面の膜が、それの最接近点で活性領域から約10μmと約100μmのあいだ離間されたバイオセンサー・システム。 - 分析物に敏感であるセンサー活性表面、および
活性表面の少なくとも一部を封入する膜を有する皮下空間に移植され得るセンサーヘッドを包含する
分析物の濃度または存在をインビボで試験するための皮下センサーであって、
該膜が、センサーが皮下組織に移植される際、活性表面から離間され、活性表面と膜とのあいだに内部体積を供する皮下センサー。 - 化学的試薬を包含する、請求項55記載の皮下センサー。
- 膜が、生物適合性接着剤によってセンサーヘッドに接続される請求項55記載の皮下センサー。
- 膜が、センサーヘッドに加熱封印される請求項55記載の皮下センサー。
- センサーが、測定のために電気化学的システムを使用する請求項55記載の皮下センサー。
- センサーが、分析物に透過可能である生物適合性重合体で被覆する請求項55記載の皮下センサー。
- センサーヘッドが、MPCで被覆される請求項60記載の皮下センサー。
- 膜が、半透過性透析中空繊維である請求項55記載の皮下センサー。
- 膜が、ポリアミドおよびポリスルホンからなる群から選択される材料から製造される請求項55記載の皮下センサー。
- センサーが、グルコース・センサーであり、および
膜が、約10kDと約100kDのあいだのカットオフを有する材料から製造される請求項55記載の皮下センサー。 - 内部体積が、リンガー溶液で満たされる請求項55記載の皮下センサー。
- 請求項55〜65いずれかに記載のセンサーを包含する皮下センサー。
- 請求項55によるセンサーを包含する皮下センサーの生物適合性を増大させる方法。
Applications Claiming Priority (4)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US50739903P | 2003-09-30 | 2003-09-30 | |
| US50742603P | 2003-09-30 | 2003-09-30 | |
| US54295304P | 2004-02-09 | 2004-02-09 | |
| PCT/US2004/032293 WO2005032362A2 (en) | 2003-09-30 | 2004-09-30 | Sensor with increaseed biocompatibility |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2007514460A true JP2007514460A (ja) | 2007-06-07 |
| JP2007514460A5 JP2007514460A5 (ja) | 2007-10-04 |
Family
ID=34426882
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2006534128A Pending JP2007514460A (ja) | 2003-09-30 | 2004-09-30 | 増大した生物適合性を示すセンサー |
Country Status (8)
| Country | Link |
|---|---|
| US (2) | US8180423B2 (ja) |
| EP (1) | EP1681992B2 (ja) |
| JP (1) | JP2007514460A (ja) |
| AT (1) | ATE464834T1 (ja) |
| CA (1) | CA2541616A1 (ja) |
| DE (1) | DE602004026763D1 (ja) |
| ES (1) | ES2341963T3 (ja) |
| WO (1) | WO2005032362A2 (ja) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2007130482A (ja) * | 2005-11-12 | 2007-05-31 | F Hoffmann-La Roche Ag | 人体内または動物の体内の検体の濃度を測定するための植え込み電極系、方法、および装置 |
Families Citing this family (143)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US8527026B2 (en) | 1997-03-04 | 2013-09-03 | Dexcom, Inc. | Device and method for determining analyte levels |
| US6001067A (en) | 1997-03-04 | 1999-12-14 | Shults; Mark C. | Device and method for determining analyte levels |
| US20030032874A1 (en) * | 2001-07-27 | 2003-02-13 | Dexcom, Inc. | Sensor head for use with implantable devices |
| US7828728B2 (en) * | 2003-07-25 | 2010-11-09 | Dexcom, Inc. | Analyte sensor |
| US8364229B2 (en) * | 2003-07-25 | 2013-01-29 | Dexcom, Inc. | Analyte sensors having a signal-to-noise ratio substantially unaffected by non-constant noise |
| US7613491B2 (en) | 2002-05-22 | 2009-11-03 | Dexcom, Inc. | Silicone based membranes for use in implantable glucose sensors |
| US7226978B2 (en) | 2002-05-22 | 2007-06-05 | Dexcom, Inc. | Techniques to improve polyurethane membranes for implantable glucose sensors |
| US7811231B2 (en) | 2002-12-31 | 2010-10-12 | Abbott Diabetes Care Inc. | Continuous glucose monitoring system and methods of use |
| US7587287B2 (en) | 2003-04-04 | 2009-09-08 | Abbott Diabetes Care Inc. | Method and system for transferring analyte test data |
| US7679407B2 (en) | 2003-04-28 | 2010-03-16 | Abbott Diabetes Care Inc. | Method and apparatus for providing peak detection circuitry for data communication systems |
| US8066639B2 (en) | 2003-06-10 | 2011-11-29 | Abbott Diabetes Care Inc. | Glucose measuring device for use in personal area network |
| US7722536B2 (en) * | 2003-07-15 | 2010-05-25 | Abbott Diabetes Care Inc. | Glucose measuring device integrated into a holster for a personal area network device |
| US7761130B2 (en) | 2003-07-25 | 2010-07-20 | Dexcom, Inc. | Dual electrode system for a continuous analyte sensor |
| US9763609B2 (en) | 2003-07-25 | 2017-09-19 | Dexcom, Inc. | Analyte sensors having a signal-to-noise ratio substantially unaffected by non-constant noise |
| EP1648298A4 (en) | 2003-07-25 | 2010-01-13 | Dexcom Inc | OXYGEN-IMPROVED MEMBRANE SYSTEMS FOR IMPLANTABLE DEVICES |
| US7074307B2 (en) | 2003-07-25 | 2006-07-11 | Dexcom, Inc. | Electrode systems for electrochemical sensors |
| US7591801B2 (en) | 2004-02-26 | 2009-09-22 | Dexcom, Inc. | Integrated delivery device for continuous glucose sensor |
| US7920906B2 (en) | 2005-03-10 | 2011-04-05 | Dexcom, Inc. | System and methods for processing analyte sensor data for sensor calibration |
| US20050090607A1 (en) * | 2003-10-28 | 2005-04-28 | Dexcom, Inc. | Silicone composition for biocompatible membrane |
| US9247900B2 (en) | 2004-07-13 | 2016-02-02 | Dexcom, Inc. | Analyte sensor |
| WO2005057168A2 (en) | 2003-12-05 | 2005-06-23 | Dexcom, Inc. | Calibration techniques for a continuous analyte sensor |
| US8423114B2 (en) | 2006-10-04 | 2013-04-16 | Dexcom, Inc. | Dual electrode system for a continuous analyte sensor |
| US11633133B2 (en) | 2003-12-05 | 2023-04-25 | Dexcom, Inc. | Dual electrode system for a continuous analyte sensor |
| WO2005089103A2 (en) | 2004-02-17 | 2005-09-29 | Therasense, Inc. | Method and system for providing data communication in continuous glucose monitoring and management system |
| US8808228B2 (en) | 2004-02-26 | 2014-08-19 | Dexcom, Inc. | Integrated medicament delivery device for use with continuous analyte sensor |
| US8277713B2 (en) | 2004-05-03 | 2012-10-02 | Dexcom, Inc. | Implantable analyte sensor |
| US20060010098A1 (en) | 2004-06-04 | 2006-01-12 | Goodnow Timothy T | Diabetes care host-client architecture and data management system |
| US20060020192A1 (en) | 2004-07-13 | 2006-01-26 | Dexcom, Inc. | Transcutaneous analyte sensor |
| US20060270922A1 (en) | 2004-07-13 | 2006-11-30 | Brauker James H | Analyte sensor |
| US8029441B2 (en) | 2006-02-28 | 2011-10-04 | Abbott Diabetes Care Inc. | Analyte sensor transmitter unit configuration for a data monitoring and management system |
| US9636450B2 (en) * | 2007-02-19 | 2017-05-02 | Udo Hoss | Pump system modular components for delivering medication and analyte sensing at seperate insertion sites |
| US7697967B2 (en) | 2005-12-28 | 2010-04-13 | Abbott Diabetes Care Inc. | Method and apparatus for providing analyte sensor insertion |
| US9351669B2 (en) | 2009-09-30 | 2016-05-31 | Abbott Diabetes Care Inc. | Interconnect for on-body analyte monitoring device |
| US7545272B2 (en) | 2005-02-08 | 2009-06-09 | Therasense, Inc. | RF tag on test strips, test strip vials and boxes |
| US8744546B2 (en) | 2005-05-05 | 2014-06-03 | Dexcom, Inc. | Cellulosic-based resistance domain for an analyte sensor |
| JP2006308463A (ja) * | 2005-04-28 | 2006-11-09 | National Institute Of Advanced Industrial & Technology | ナノカーボンセンサー |
| US7768408B2 (en) | 2005-05-17 | 2010-08-03 | Abbott Diabetes Care Inc. | Method and system for providing data management in data monitoring system |
| US8880138B2 (en) * | 2005-09-30 | 2014-11-04 | Abbott Diabetes Care Inc. | Device for channeling fluid and methods of use |
| US7756561B2 (en) * | 2005-09-30 | 2010-07-13 | Abbott Diabetes Care Inc. | Method and apparatus for providing rechargeable power in data monitoring and management systems |
| US7583190B2 (en) | 2005-10-31 | 2009-09-01 | Abbott Diabetes Care Inc. | Method and apparatus for providing data communication in data monitoring and management systems |
| US7766829B2 (en) | 2005-11-04 | 2010-08-03 | Abbott Diabetes Care Inc. | Method and system for providing basal profile modification in analyte monitoring and management systems |
| US11298058B2 (en) | 2005-12-28 | 2022-04-12 | Abbott Diabetes Care Inc. | Method and apparatus for providing analyte sensor insertion |
| US7826879B2 (en) | 2006-02-28 | 2010-11-02 | Abbott Diabetes Care Inc. | Analyte sensors and methods of use |
| US8478557B2 (en) | 2009-07-31 | 2013-07-02 | Abbott Diabetes Care Inc. | Method and apparatus for providing analyte monitoring system calibration accuracy |
| US7618369B2 (en) | 2006-10-02 | 2009-11-17 | Abbott Diabetes Care Inc. | Method and system for dynamically updating calibration parameters for an analyte sensor |
| US8473022B2 (en) | 2008-01-31 | 2013-06-25 | Abbott Diabetes Care Inc. | Analyte sensor with time lag compensation |
| US9392969B2 (en) | 2008-08-31 | 2016-07-19 | Abbott Diabetes Care Inc. | Closed loop control and signal attenuation detection |
| US7653425B2 (en) | 2006-08-09 | 2010-01-26 | Abbott Diabetes Care Inc. | Method and system for providing calibration of an analyte sensor in an analyte monitoring system |
| US8374668B1 (en) | 2007-10-23 | 2013-02-12 | Abbott Diabetes Care Inc. | Analyte sensor with lag compensation |
| US8140312B2 (en) | 2007-05-14 | 2012-03-20 | Abbott Diabetes Care Inc. | Method and system for determining analyte levels |
| US7620438B2 (en) | 2006-03-31 | 2009-11-17 | Abbott Diabetes Care Inc. | Method and system for powering an electronic device |
| WO2007147475A1 (en) * | 2006-06-19 | 2007-12-27 | Roche Diagnostics Gmbh | Amperometric sensor and method for its manufacturing |
| US9700252B2 (en) | 2006-06-19 | 2017-07-11 | Roche Diabetes Care, Inc. | Amperometric sensor and method for its manufacturing |
| EP1892877B1 (en) * | 2006-08-25 | 2008-12-03 | Alcatel Lucent | Digital signal receiver with Q-monitor |
| WO2008045877A2 (en) * | 2006-10-10 | 2008-04-17 | St. Jude Medical, Atrial Fibrillation Division, Inc. | Electrode tip and ablation system |
| US8579853B2 (en) | 2006-10-31 | 2013-11-12 | Abbott Diabetes Care Inc. | Infusion devices and methods |
| US20080199894A1 (en) | 2007-02-15 | 2008-08-21 | Abbott Diabetes Care, Inc. | Device and method for automatic data acquisition and/or detection |
| US8123686B2 (en) | 2007-03-01 | 2012-02-28 | Abbott Diabetes Care Inc. | Method and apparatus for providing rolling data in communication systems |
| US7751864B2 (en) | 2007-03-01 | 2010-07-06 | Roche Diagnostics Operations, Inc. | System and method for operating an electrochemical analyte sensor |
| EP2146624B1 (en) | 2007-04-14 | 2020-03-25 | Abbott Diabetes Care Inc. | Method and apparatus for providing data processing and control in medical communication system |
| WO2009096992A1 (en) | 2007-04-14 | 2009-08-06 | Abbott Diabetes Care, Inc. | Method and apparatus for providing data processing and control in medical communication system |
| CA2683721C (en) | 2007-04-14 | 2017-05-23 | Abbott Diabetes Care Inc. | Method and apparatus for providing dynamic multi-stage signal amplification in a medical device |
| WO2008128210A1 (en) | 2007-04-14 | 2008-10-23 | Abbott Diabetes Care, Inc. | Method and apparatus for providing data processing and control in medical communication system |
| CA2683953C (en) | 2007-04-14 | 2016-08-02 | Abbott Diabetes Care Inc. | Method and apparatus for providing data processing and control in medical communication system |
| CA2683962C (en) | 2007-04-14 | 2017-06-06 | Abbott Diabetes Care Inc. | Method and apparatus for providing data processing and control in medical communication system |
| US7928850B2 (en) | 2007-05-08 | 2011-04-19 | Abbott Diabetes Care Inc. | Analyte monitoring system and methods |
| US8665091B2 (en) | 2007-05-08 | 2014-03-04 | Abbott Diabetes Care Inc. | Method and device for determining elapsed sensor life |
| US8461985B2 (en) | 2007-05-08 | 2013-06-11 | Abbott Diabetes Care Inc. | Analyte monitoring system and methods |
| US8456301B2 (en) | 2007-05-08 | 2013-06-04 | Abbott Diabetes Care Inc. | Analyte monitoring system and methods |
| US10002233B2 (en) | 2007-05-14 | 2018-06-19 | Abbott Diabetes Care Inc. | Method and apparatus for providing data processing and control in a medical communication system |
| US8444560B2 (en) | 2007-05-14 | 2013-05-21 | Abbott Diabetes Care Inc. | Method and apparatus for providing data processing and control in a medical communication system |
| US8103471B2 (en) | 2007-05-14 | 2012-01-24 | Abbott Diabetes Care Inc. | Method and apparatus for providing data processing and control in a medical communication system |
| US8260558B2 (en) | 2007-05-14 | 2012-09-04 | Abbott Diabetes Care Inc. | Method and apparatus for providing data processing and control in a medical communication system |
| US8600681B2 (en) | 2007-05-14 | 2013-12-03 | Abbott Diabetes Care Inc. | Method and apparatus for providing data processing and control in a medical communication system |
| US8560038B2 (en) | 2007-05-14 | 2013-10-15 | Abbott Diabetes Care Inc. | Method and apparatus for providing data processing and control in a medical communication system |
| US9125548B2 (en) | 2007-05-14 | 2015-09-08 | Abbott Diabetes Care Inc. | Method and apparatus for providing data processing and control in a medical communication system |
| US8239166B2 (en) | 2007-05-14 | 2012-08-07 | Abbott Diabetes Care Inc. | Method and apparatus for providing data processing and control in a medical communication system |
| US20200037874A1 (en) | 2007-05-18 | 2020-02-06 | Dexcom, Inc. | Analyte sensors having a signal-to-noise ratio substantially unaffected by non-constant noise |
| US20080306444A1 (en) | 2007-06-08 | 2008-12-11 | Dexcom, Inc. | Integrated medicament delivery device for use with continuous analyte sensor |
| AU2008265541B2 (en) | 2007-06-21 | 2014-07-17 | Abbott Diabetes Care, Inc. | Health management devices and methods |
| CN101686804B (zh) | 2007-06-21 | 2013-05-08 | 雅培糖尿病护理公司 | 健康监控器 |
| EP2017350A1 (de) * | 2007-07-19 | 2009-01-21 | F. Hoffmann-La Roche AG | Elektrochemischer Sensor mit kovalent gebundenem Enzym |
| US8834366B2 (en) | 2007-07-31 | 2014-09-16 | Abbott Diabetes Care Inc. | Method and apparatus for providing analyte sensor calibration |
| EP2227132B1 (en) | 2007-10-09 | 2023-03-08 | DexCom, Inc. | Integrated insulin delivery system with continuous glucose sensor |
| US8377031B2 (en) | 2007-10-23 | 2013-02-19 | Abbott Diabetes Care Inc. | Closed loop control system with safety parameters and methods |
| US8409093B2 (en) | 2007-10-23 | 2013-04-02 | Abbott Diabetes Care Inc. | Assessing measures of glycemic variability |
| US20090164190A1 (en) * | 2007-12-19 | 2009-06-25 | Abbott Diabetes Care, Inc. | Physiological condition simulation device and method |
| US20090164239A1 (en) | 2007-12-19 | 2009-06-25 | Abbott Diabetes Care, Inc. | Dynamic Display Of Glucose Information |
| US8682408B2 (en) * | 2008-03-28 | 2014-03-25 | Dexcom, Inc. | Polymer membranes for continuous analyte sensors |
| US8583204B2 (en) | 2008-03-28 | 2013-11-12 | Dexcom, Inc. | Polymer membranes for continuous analyte sensors |
| EP3387993A3 (en) * | 2008-03-28 | 2018-11-14 | Dexcom, Inc. | Polymer membranes for continuous analyte sensors |
| US11730407B2 (en) | 2008-03-28 | 2023-08-22 | Dexcom, Inc. | Polymer membranes for continuous analyte sensors |
| US7826382B2 (en) | 2008-05-30 | 2010-11-02 | Abbott Diabetes Care Inc. | Close proximity communication device and methods |
| US8876755B2 (en) | 2008-07-14 | 2014-11-04 | Abbott Diabetes Care Inc. | Closed loop control system interface and methods |
| US20100057040A1 (en) | 2008-08-31 | 2010-03-04 | Abbott Diabetes Care, Inc. | Robust Closed Loop Control And Methods |
| US9943644B2 (en) * | 2008-08-31 | 2018-04-17 | Abbott Diabetes Care Inc. | Closed loop control with reference measurement and methods thereof |
| US8622988B2 (en) * | 2008-08-31 | 2014-01-07 | Abbott Diabetes Care Inc. | Variable rate closed loop control and methods |
| US8734422B2 (en) | 2008-08-31 | 2014-05-27 | Abbott Diabetes Care Inc. | Closed loop control with improved alarm functions |
| US8560039B2 (en) | 2008-09-19 | 2013-10-15 | Dexcom, Inc. | Particle-containing membrane and particulate electrode for analyte sensors |
| US8986208B2 (en) * | 2008-09-30 | 2015-03-24 | Abbott Diabetes Care Inc. | Analyte sensor sensitivity attenuation mitigation |
| US9402544B2 (en) | 2009-02-03 | 2016-08-02 | Abbott Diabetes Care Inc. | Analyte sensor and apparatus for insertion of the sensor |
| DK3912551T3 (da) | 2009-02-26 | 2023-10-30 | Abbott Diabetes Care Inc | Fremgangsmåde til kalibrering af en analytsensor |
| WO2010127050A1 (en) | 2009-04-28 | 2010-11-04 | Abbott Diabetes Care Inc. | Error detection in critical repeating data in a wireless sensor system |
| US20100274515A1 (en) * | 2009-04-28 | 2010-10-28 | Abbott Diabetes Care Inc. | Dynamic Analyte Sensor Calibration Based On Sensor Stability Profile |
| WO2010138856A1 (en) | 2009-05-29 | 2010-12-02 | Abbott Diabetes Care Inc. | Medical device antenna systems having external antenna configurations |
| WO2011011739A2 (en) | 2009-07-23 | 2011-01-27 | Abbott Diabetes Care Inc. | Real time management of data relating to physiological control of glucose levels |
| LT3689237T (lt) * | 2009-07-23 | 2021-09-27 | Abbott Diabetes Care, Inc. | Nuolatinio analitės matavimo sistema ir gamybos būdas |
| US9314195B2 (en) * | 2009-08-31 | 2016-04-19 | Abbott Diabetes Care Inc. | Analyte signal processing device and methods |
| JP5795584B2 (ja) | 2009-08-31 | 2015-10-14 | アボット ダイアベティス ケア インコーポレイテッドAbbott Diabetes Care Inc. | 医療用装置 |
| EP2473099A4 (en) | 2009-08-31 | 2015-01-14 | Abbott Diabetes Care Inc | ANALYTICAL SUBSTANCE MONITORING SYSTEM AND METHODS OF MANAGING ENERGY AND NOISE |
| US20130123594A1 (en) * | 2010-03-09 | 2013-05-16 | Arkray, Inc. | Electrochemical Sensor |
| CN102781308B (zh) * | 2010-03-11 | 2015-11-25 | 霍夫曼-拉罗奇有限公司 | 用于体内分析物浓度的电化学测量的方法以及用于该方法的燃料电池 |
| US11213226B2 (en) | 2010-10-07 | 2022-01-04 | Abbott Diabetes Care Inc. | Analyte monitoring devices and methods |
| US8560086B2 (en) | 2010-12-02 | 2013-10-15 | St. Jude Medical, Atrial Fibrillation Division, Inc. | Catheter electrode assemblies and methods of construction therefor |
| KR102022106B1 (ko) | 2011-02-16 | 2019-09-17 | 더 제너럴 하스피탈 코포레이션 | 내시경용 광 결합기 |
| US10136845B2 (en) | 2011-02-28 | 2018-11-27 | Abbott Diabetes Care Inc. | Devices, systems, and methods associated with analyte monitoring devices and devices incorporating the same |
| EP2680754B1 (en) | 2011-02-28 | 2019-04-24 | Abbott Diabetes Care, Inc. | Devices, systems, and methods associated with analyte monitoring devices and devices incorporating the same |
| JP2014512839A (ja) * | 2011-05-05 | 2014-05-29 | アンパック バイオ−メディカル サイエンス カンパニー リミテッド | 腫瘍細胞を検出するための装置 |
| WO2013010106A2 (en) * | 2011-07-13 | 2013-01-17 | Lockheed Martin Corporation | Three dimensional microfluidic multiplexed diagnostic system |
| US9069536B2 (en) | 2011-10-31 | 2015-06-30 | Abbott Diabetes Care Inc. | Electronic devices having integrated reset systems and methods thereof |
| US9317656B2 (en) | 2011-11-23 | 2016-04-19 | Abbott Diabetes Care Inc. | Compatibility mechanisms for devices in a continuous analyte monitoring system and methods thereof |
| US8710993B2 (en) | 2011-11-23 | 2014-04-29 | Abbott Diabetes Care Inc. | Mitigating single point failure of devices in an analyte monitoring system and methods thereof |
| KR101892540B1 (ko) * | 2012-05-10 | 2018-08-28 | 삼성전자주식회사 | 바이오 물질의 알에프 특성 측정 방법 및 장치 |
| EP2890297B1 (en) | 2012-08-30 | 2018-04-11 | Abbott Diabetes Care, Inc. | Dropout detection in continuous analyte monitoring data during data excursions |
| US9968306B2 (en) | 2012-09-17 | 2018-05-15 | Abbott Diabetes Care Inc. | Methods and apparatuses for providing adverse condition notification with enhanced wireless communication range in analyte monitoring systems |
| US8896032B2 (en) * | 2013-01-23 | 2014-11-25 | International Business Machines Corporation | Self-aligned biosensors with enhanced sensitivity |
| ES2922701T3 (es) * | 2013-03-06 | 2022-09-19 | Hoffmann La Roche | Procedimiento para detectar un analito usando un sensor con catalizador de Mn2O3 |
| EP2972268B1 (en) | 2013-03-15 | 2017-05-24 | Roche Diabetes Care GmbH | Methods of failsafing electrochemical measurements of an analyte as well as devices, apparatuses and systems incorporating the same |
| WO2014140177A2 (en) | 2013-03-15 | 2014-09-18 | Roche Diagnostics Gmbh | Methods of detecting high antioxidant levels during electrochemical measurements and failsafing an analyte concentration therefrom as well as devices, apparatuses and systems incorporting the same |
| WO2014140164A1 (en) | 2013-03-15 | 2014-09-18 | Roche Diagnostics Gmbh | Methods of using information from recovery pulses in electrochemical analyte measurements as well as devices, apparatuses and systems incorporating the same |
| CN105164523B (zh) | 2013-03-15 | 2017-09-12 | 豪夫迈·罗氏有限公司 | 缩放用于构造生物传感器算法的数据的方法以及合并所述方法的设备、装置和系统 |
| US9459442B2 (en) | 2014-09-23 | 2016-10-04 | Scott Miller | Optical coupler for optical imaging visualization device |
| WO2016127105A1 (en) * | 2015-02-05 | 2016-08-11 | The Regents Of The University Of California | Multiple-use renewable electrochemical sensors based on direct drawing of enzymatic inks |
| US10548467B2 (en) | 2015-06-02 | 2020-02-04 | GI Scientific, LLC | Conductive optical element |
| CN113349766A (zh) | 2015-07-10 | 2021-09-07 | 雅培糖尿病护理公司 | 对于生理参数进行动态葡萄糖曲线响应的系统、装置和方法 |
| CN108289595B (zh) | 2015-07-21 | 2021-03-16 | 图像科学有限责任公司 | 具有可角度调节的出射口的内窥镜附件 |
| US11298059B2 (en) * | 2016-05-13 | 2022-04-12 | PercuSense, Inc. | Analyte sensor |
| CN109804240A (zh) | 2016-10-05 | 2019-05-24 | 豪夫迈·罗氏有限公司 | 用于多分析物诊断测试元件的检测试剂和电极布置以及其使用方法 |
| EP3600014A4 (en) | 2017-03-21 | 2020-10-21 | Abbott Diabetes Care Inc. | METHODS, DEVICES AND SYSTEM FOR PROVIDING DIAGNOSIS AND THERAPY FOR DIABETIC CONDITION |
| EP3457121A1 (en) * | 2017-09-18 | 2019-03-20 | Roche Diabetes Care GmbH | Electrochemical sensor and sensor system for detecting at least one analyte |
| AU2018354120A1 (en) | 2017-10-24 | 2020-04-23 | Dexcom, Inc. | Pre-connected analyte sensors |
| US11331022B2 (en) | 2017-10-24 | 2022-05-17 | Dexcom, Inc. | Pre-connected analyte sensors |
| CN111351934B (zh) * | 2020-03-11 | 2020-10-20 | 青岛大学附属医院 | 一种用于诊断早期肺癌肿瘤标志物免疫传感器及其制备方法与应用 |
Citations (13)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS57137847A (en) * | 1981-02-19 | 1982-08-25 | Olympus Optical Co Ltd | Chemically sensitive element and its preparation |
| JPS625171A (ja) * | 1985-06-28 | 1987-01-12 | マイルス・インコーポレーテッド | 電気化学的センサ−用電極 |
| JPH04231858A (ja) * | 1990-11-15 | 1992-08-20 | Ngk Spark Plug Co Ltd | バイオセンサ |
| JPH0694670A (ja) * | 1992-09-09 | 1994-04-08 | Agency Of Ind Science & Technol | 炭素センサー電極およびその製造方法 |
| JPH06281614A (ja) * | 1992-12-15 | 1994-10-07 | Avl Medical Instr Ag | 電流測定酵素電極 |
| JPH06288963A (ja) * | 1993-03-30 | 1994-10-18 | Taiyo Yuden Co Ltd | 酵素センサプレート |
| JPH09127041A (ja) * | 1995-10-30 | 1997-05-16 | Nippon Chibagaigii Kk | 酵素電極 |
| JPH10332624A (ja) * | 1997-06-05 | 1998-12-18 | Daikin Ind Ltd | バイオセンサの製造方法およびバイオセンサ |
| JP2001021523A (ja) * | 1999-07-02 | 2001-01-26 | Akebono Brake Res & Dev Center Ltd | 生体触媒の固定化方法 |
| JP2003503090A (ja) * | 1999-06-18 | 2003-01-28 | セラセンス、インク. | 物質移動が制限された生体内分析物センサー |
| JP2003503134A (ja) * | 1999-07-01 | 2003-01-28 | メドトロニック ミニメド インコーポレイテッド | 再使用可能な分析物センササイト |
| WO2003011354A2 (en) * | 2001-07-27 | 2003-02-13 | Dexcom, Inc. | Membrane for use with implantable devices |
| JP2003513230A (ja) * | 1999-09-14 | 2003-04-08 | イムプランテッド・バイオシステムズ・インコーポレイテッド | 体内埋め込み可能なグルコースセンサ |
Family Cites Families (19)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4650547A (en) * | 1983-05-19 | 1987-03-17 | The Regents Of The University Of California | Method and membrane applicable to implantable sensor |
| US5063081A (en) * | 1988-11-14 | 1991-11-05 | I-Stat Corporation | Method of manufacturing a plurality of uniform microfabricated sensing devices having an immobilized ligand receptor |
| US5322063A (en) † | 1991-10-04 | 1994-06-21 | Eli Lilly And Company | Hydrophilic polyurethane membranes for electrochemical glucose sensors |
| US5385846A (en) * | 1993-06-03 | 1995-01-31 | Boehringer Mannheim Corporation | Biosensor and method for hematocrit determination |
| US5403462A (en) * | 1993-06-24 | 1995-04-04 | Yissum Research Development Company Of The Hebrew Univeristy Of Jerusalem | Electrochemical electrodes and methods for the preparation thereof |
| US5497772A (en) * | 1993-11-19 | 1996-03-12 | Alfred E. Mann Foundation For Scientific Research | Glucose monitoring system |
| US5494562A (en) † | 1994-06-27 | 1996-02-27 | Ciba Corning Diagnostics Corp. | Electrochemical sensors |
| DE19605583A1 (de) * | 1996-02-15 | 1997-08-21 | Bayer Ag | Elektrochemische Sensoren mit verbesserter Selektivität und erhöhter Empfindlichkeit |
| JP2943700B2 (ja) * | 1996-07-10 | 1999-08-30 | 日本電気株式会社 | バイオセンサ |
| US5696314A (en) * | 1996-07-12 | 1997-12-09 | Chiron Diagnostics Corporation | Multilayer enzyme electrode membranes and methods of making same |
| US5707502A (en) † | 1996-07-12 | 1998-01-13 | Chiron Diagnostics Corporation | Sensors for measuring analyte concentrations and methods of making same |
| US6119028A (en) * | 1997-10-20 | 2000-09-12 | Alfred E. Mann Foundation | Implantable enzyme-based monitoring systems having improved longevity due to improved exterior surfaces |
| US6030827A (en) * | 1998-01-23 | 2000-02-29 | I-Stat Corporation | Microfabricated aperture-based sensor |
| US6175752B1 (en) * | 1998-04-30 | 2001-01-16 | Therasense, Inc. | Analyte monitoring device and methods of use |
| PT1077634E (pt) * | 1998-05-13 | 2003-12-31 | Cygnus Therapeutic Systems | Monitorizacao de substancias fisiologicas a analisar |
| US6627057B1 (en) * | 1999-12-23 | 2003-09-30 | Roche Diagnostic Corporation | Microsphere containing sensor |
| US6405066B1 (en) † | 2000-03-17 | 2002-06-11 | The Regents Of The University Of California | Implantable analyte sensor |
| CA2406814A1 (en) * | 2000-03-17 | 2001-09-20 | F. Hoffmann-La Roche Ag | Implantable analyte sensor |
| US20030032874A1 (en) * | 2001-07-27 | 2003-02-13 | Dexcom, Inc. | Sensor head for use with implantable devices |
-
2004
- 2004-09-30 AT AT04789425T patent/ATE464834T1/de not_active IP Right Cessation
- 2004-09-30 WO PCT/US2004/032293 patent/WO2005032362A2/en active Application Filing
- 2004-09-30 DE DE602004026763T patent/DE602004026763D1/de active Active
- 2004-09-30 ES ES04789425T patent/ES2341963T3/es active Active
- 2004-09-30 JP JP2006534128A patent/JP2007514460A/ja active Pending
- 2004-09-30 EP EP04789425.8A patent/EP1681992B2/en not_active Not-in-force
- 2004-09-30 CA CA002541616A patent/CA2541616A1/en not_active Abandoned
-
2006
- 2006-03-29 US US11/392,134 patent/US8180423B2/en not_active Expired - Fee Related
-
2012
- 2012-04-26 US US13/456,730 patent/US20120209097A1/en not_active Abandoned
Patent Citations (13)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS57137847A (en) * | 1981-02-19 | 1982-08-25 | Olympus Optical Co Ltd | Chemically sensitive element and its preparation |
| JPS625171A (ja) * | 1985-06-28 | 1987-01-12 | マイルス・インコーポレーテッド | 電気化学的センサ−用電極 |
| JPH04231858A (ja) * | 1990-11-15 | 1992-08-20 | Ngk Spark Plug Co Ltd | バイオセンサ |
| JPH0694670A (ja) * | 1992-09-09 | 1994-04-08 | Agency Of Ind Science & Technol | 炭素センサー電極およびその製造方法 |
| JPH06281614A (ja) * | 1992-12-15 | 1994-10-07 | Avl Medical Instr Ag | 電流測定酵素電極 |
| JPH06288963A (ja) * | 1993-03-30 | 1994-10-18 | Taiyo Yuden Co Ltd | 酵素センサプレート |
| JPH09127041A (ja) * | 1995-10-30 | 1997-05-16 | Nippon Chibagaigii Kk | 酵素電極 |
| JPH10332624A (ja) * | 1997-06-05 | 1998-12-18 | Daikin Ind Ltd | バイオセンサの製造方法およびバイオセンサ |
| JP2003503090A (ja) * | 1999-06-18 | 2003-01-28 | セラセンス、インク. | 物質移動が制限された生体内分析物センサー |
| JP2003503134A (ja) * | 1999-07-01 | 2003-01-28 | メドトロニック ミニメド インコーポレイテッド | 再使用可能な分析物センササイト |
| JP2001021523A (ja) * | 1999-07-02 | 2001-01-26 | Akebono Brake Res & Dev Center Ltd | 生体触媒の固定化方法 |
| JP2003513230A (ja) * | 1999-09-14 | 2003-04-08 | イムプランテッド・バイオシステムズ・インコーポレイテッド | 体内埋め込み可能なグルコースセンサ |
| WO2003011354A2 (en) * | 2001-07-27 | 2003-02-13 | Dexcom, Inc. | Membrane for use with implantable devices |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2007130482A (ja) * | 2005-11-12 | 2007-05-31 | F Hoffmann-La Roche Ag | 人体内または動物の体内の検体の濃度を測定するための植え込み電極系、方法、および装置 |
Also Published As
| Publication number | Publication date |
|---|---|
| US8180423B2 (en) | 2012-05-15 |
| WO2005032362A2 (en) | 2005-04-14 |
| DE602004026763D1 (de) | 2010-06-02 |
| EP1681992B1 (en) | 2010-04-21 |
| EP1681992B2 (en) | 2015-03-04 |
| EP1681992A2 (en) | 2006-07-26 |
| ES2341963T3 (es) | 2010-06-30 |
| CA2541616A1 (en) | 2005-04-14 |
| US20120209097A1 (en) | 2012-08-16 |
| US20070007133A1 (en) | 2007-01-11 |
| WO2005032362A3 (en) | 2005-06-09 |
| ATE464834T1 (de) | 2010-05-15 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US8180423B2 (en) | Sensor with increased biocompatibility | |
| US10060877B2 (en) | Electrochemical sensor for determining an analyte concentration | |
| US8326393B2 (en) | Layered sensor for determining an analyte concentration | |
| KR100894975B1 (ko) | 생물학적 유체 성분 샘플링 및 측정 장치 | |
| EP1841363B1 (en) | Catheter-free implantable needle biosensor | |
| RU2305279C2 (ru) | Устройство и способ для определения концентрации восстановленной формы или окисленной формы окислительно-восстановительного вещества в жидкой пробе | |
| US20080190783A1 (en) | Electrode For Electrochemical Sensor | |
| EP0320109A1 (en) | Improved sensing system | |
| JP5021678B2 (ja) | 少なくとも一つの電極を有する基板を用いる電気化学センサーシステム及び同システムの形成方法 | |
| JP2004512914A (ja) | グルコースセンサーシステム | |
| US20210361204A1 (en) | Electrochemical sensors and methods for making electrochemical sensors using advanced printing technology | |
| JP2023530781A (ja) | 微小針アレイベースの持続的分析物監視デバイスのための障害検出 | |
| EP3749199A1 (en) | Multilayer electrochemical analyte sensors and methods for making and using them | |
| US20060008581A1 (en) | Method of manufacturing an electrochemical sensor | |
| CA2347378A1 (en) | Minimally invasive sensor system | |
| EP0103031B1 (en) | Electro-chemical cell for determining a particular property or component of a fluid | |
| KR20230027013A (ko) | 분석물 센서 및 분석물 센서를 생성하기 위한 방법 | |
| CN116242896A (zh) | 用于检测至少一种分析物的电化学传感器和传感器系统 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20070808 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20070808 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20100909 |
|
| RD03 | Notification of appointment of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7423 Effective date: 20100913 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20101019 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20110329 |