JP2007504222A - オメプラゾール及びエソメプラゾールiの新規な塩 - Google Patents
オメプラゾール及びエソメプラゾールiの新規な塩 Download PDFInfo
- Publication number
- JP2007504222A JP2007504222A JP2006525304A JP2006525304A JP2007504222A JP 2007504222 A JP2007504222 A JP 2007504222A JP 2006525304 A JP2006525304 A JP 2006525304A JP 2006525304 A JP2006525304 A JP 2006525304A JP 2007504222 A JP2007504222 A JP 2007504222A
- Authority
- JP
- Japan
- Prior art keywords
- omeprazole
- esomeprazole
- ammonium salt
- salt
- adamantane
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- SUBDBMMJDZJVOS-UHFFFAOYSA-N 5-methoxy-2-{[(4-methoxy-3,5-dimethylpyridin-2-yl)methyl]sulfinyl}-1H-benzimidazole Chemical class N=1C2=CC(OC)=CC=C2NC=1S(=O)CC1=NC=C(C)C(OC)=C1C SUBDBMMJDZJVOS-UHFFFAOYSA-N 0.000 title claims abstract description 50
- SUBDBMMJDZJVOS-DEOSSOPVSA-N esomeprazole Chemical class C([S@](=O)C1=NC2=CC=C(C=C2N1)OC)C1=NC=C(C)C(OC)=C1C SUBDBMMJDZJVOS-DEOSSOPVSA-N 0.000 title claims abstract description 45
- 229960000381 omeprazole Drugs 0.000 title claims abstract description 42
- 229960004770 esomeprazole Drugs 0.000 title claims abstract description 41
- 150000003839 salts Chemical class 0.000 title claims abstract description 36
- 150000001875 compounds Chemical class 0.000 claims abstract description 34
- QHKGZGABGGEUOC-UHFFFAOYSA-N adamantane;azane Chemical compound N.C1C(C2)CC3CC1CC2C3 QHKGZGABGGEUOC-UHFFFAOYSA-N 0.000 claims abstract description 26
- 238000000034 method Methods 0.000 claims abstract description 14
- 210000004211 gastric acid Anatomy 0.000 claims abstract description 10
- DKNWSYNQZKUICI-UHFFFAOYSA-N amantadine Chemical compound C1C(C2)CC3CC2CC1(N)C3 DKNWSYNQZKUICI-UHFFFAOYSA-N 0.000 claims abstract description 8
- 239000008194 pharmaceutical composition Substances 0.000 claims abstract description 6
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical group CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 claims description 27
- 239000000203 mixture Substances 0.000 claims description 14
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 claims description 12
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 claims description 12
- -1 methoxy-3,5-dimethyl-2-pyridinyl Chemical group 0.000 claims description 12
- 238000004519 manufacturing process Methods 0.000 claims description 10
- 238000011282 treatment Methods 0.000 claims description 9
- 239000004480 active ingredient Substances 0.000 claims description 7
- 208000024891 symptom Diseases 0.000 claims description 7
- 230000001225 therapeutic effect Effects 0.000 claims description 6
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims description 4
- 239000002244 precipitate Substances 0.000 claims description 4
- 125000000475 sulfinyl group Chemical group [*:2]S([*:1])=O 0.000 claims description 4
- 239000004615 ingredient Substances 0.000 claims description 3
- BZLVMXJERCGZMT-UHFFFAOYSA-N Methyl tert-butyl ether Chemical compound COC(C)(C)C BZLVMXJERCGZMT-UHFFFAOYSA-N 0.000 claims description 2
- 239000003814 drug Substances 0.000 claims description 2
- 239000000546 pharmaceutical excipient Substances 0.000 claims description 2
- 239000003960 organic solvent Substances 0.000 claims 3
- XKMRRTOUMJRJIA-UHFFFAOYSA-N ammonia nh3 Chemical compound N.N XKMRRTOUMJRJIA-UHFFFAOYSA-N 0.000 claims 1
- 238000001035 drying Methods 0.000 claims 1
- 238000000634 powder X-ray diffraction Methods 0.000 description 13
- 239000000126 substance Substances 0.000 description 10
- 239000008186 active pharmaceutical agent Substances 0.000 description 7
- 239000000243 solution Substances 0.000 description 7
- 230000015572 biosynthetic process Effects 0.000 description 6
- 238000002360 preparation method Methods 0.000 description 6
- 239000000047 product Substances 0.000 description 6
- 238000002425 crystallisation Methods 0.000 description 5
- 230000008025 crystallization Effects 0.000 description 5
- 239000002552 dosage form Substances 0.000 description 5
- 238000005160 1H NMR spectroscopy Methods 0.000 description 4
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 4
- RTAQQCXQSZGOHL-UHFFFAOYSA-N Titanium Chemical compound [Ti] RTAQQCXQSZGOHL-UHFFFAOYSA-N 0.000 description 4
- 201000010099 disease Diseases 0.000 description 4
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 4
- 208000002551 irritable bowel syndrome Diseases 0.000 description 4
- 159000000003 magnesium salts Chemical class 0.000 description 4
- 230000002265 prevention Effects 0.000 description 4
- 239000011734 sodium Substances 0.000 description 4
- 229910052708 sodium Inorganic materials 0.000 description 4
- 239000007787 solid Substances 0.000 description 4
- 229910052719 titanium Inorganic materials 0.000 description 4
- 239000010936 titanium Substances 0.000 description 4
- 241000124008 Mammalia Species 0.000 description 3
- 239000003054 catalyst Substances 0.000 description 3
- 238000002050 diffraction method Methods 0.000 description 3
- KWORUUGOSLYAGD-YPPDDXJESA-N esomeprazole magnesium Chemical class [Mg+2].C([S@](=O)C=1[N-]C2=CC=C(C=C2N=1)OC)C1=NC=C(C)C(OC)=C1C.C([S@](=O)C=1[N-]C2=CC=C(C=C2N=1)OC)C1=NC=C(C)C(OC)=C1C KWORUUGOSLYAGD-YPPDDXJESA-N 0.000 description 3
- 238000001914 filtration Methods 0.000 description 3
- 239000000041 non-steroidal anti-inflammatory agent Substances 0.000 description 3
- 229940021182 non-steroidal anti-inflammatory drug Drugs 0.000 description 3
- 239000002904 solvent Substances 0.000 description 3
- 238000003786 synthesis reaction Methods 0.000 description 3
- HBAQYPYDRFILMT-UHFFFAOYSA-N 8-[3-(1-cyclopropylpyrazol-4-yl)-1H-pyrazolo[4,3-d]pyrimidin-5-yl]-3-methyl-3,8-diazabicyclo[3.2.1]octan-2-one Chemical class C1(CC1)N1N=CC(=C1)C1=NNC2=C1N=C(N=C2)N1C2C(N(CC1CC2)C)=O HBAQYPYDRFILMT-UHFFFAOYSA-N 0.000 description 2
- BSYNRYMUTXBXSQ-UHFFFAOYSA-N Aspirin Chemical compound CC(=O)OC1=CC=CC=C1C(O)=O BSYNRYMUTXBXSQ-UHFFFAOYSA-N 0.000 description 2
- 206010019375 Helicobacter infections Diseases 0.000 description 2
- NTYJJOPFIAHURM-UHFFFAOYSA-N Histamine Chemical compound NCCC1=CN=CN1 NTYJJOPFIAHURM-UHFFFAOYSA-N 0.000 description 2
- 208000022559 Inflammatory bowel disease Diseases 0.000 description 2
- 238000002441 X-ray diffraction Methods 0.000 description 2
- 229960001138 acetylsalicylic acid Drugs 0.000 description 2
- 239000002585 base Substances 0.000 description 2
- 239000013078 crystal Substances 0.000 description 2
- 239000003937 drug carrier Substances 0.000 description 2
- 208000000718 duodenal ulcer Diseases 0.000 description 2
- 201000000052 gastrinoma Diseases 0.000 description 2
- 208000021302 gastroesophageal reflux disease Diseases 0.000 description 2
- 230000002401 inhibitory effect Effects 0.000 description 2
- 239000000543 intermediate Substances 0.000 description 2
- 229940112641 nexium Drugs 0.000 description 2
- 239000011591 potassium Substances 0.000 description 2
- 229910052700 potassium Inorganic materials 0.000 description 2
- 150000003141 primary amines Chemical class 0.000 description 2
- 239000012066 reaction slurry Substances 0.000 description 2
- 239000002002 slurry Substances 0.000 description 2
- 150000003608 titanium Chemical class 0.000 description 2
- SUBDBMMJDZJVOS-XMMPIXPASA-N (R)-omeprazole Chemical compound C([S@@](=O)C=1NC2=CC=C(C=C2N=1)OC)C1=NC=C(C)C(OC)=C1C SUBDBMMJDZJVOS-XMMPIXPASA-N 0.000 description 1
- HYZJCKYKOHLVJF-UHFFFAOYSA-N 1H-benzimidazole Chemical compound C1=CC=C2NC=NC2=C1 HYZJCKYKOHLVJF-UHFFFAOYSA-N 0.000 description 1
- KPYSYYIEGFHWSV-UHFFFAOYSA-N Baclofen Chemical compound OC(=O)CC(CN)C1=CC=C(Cl)C=C1 KPYSYYIEGFHWSV-UHFFFAOYSA-N 0.000 description 1
- 208000023514 Barrett esophagus Diseases 0.000 description 1
- 229940122361 Bisphosphonate Drugs 0.000 description 1
- 206010009900 Colitis ulcerative Diseases 0.000 description 1
- 208000011231 Crohn disease Diseases 0.000 description 1
- MHZGKXUYDGKKIU-UHFFFAOYSA-N Decylamine Chemical compound CCCCCCCCCCN MHZGKXUYDGKKIU-UHFFFAOYSA-N 0.000 description 1
- 238000005033 Fourier transform infrared spectroscopy Methods 0.000 description 1
- 208000007882 Gastritis Diseases 0.000 description 1
- 208000018522 Gastrointestinal disease Diseases 0.000 description 1
- 238000004566 IR spectroscopy Methods 0.000 description 1
- 206010061218 Inflammation Diseases 0.000 description 1
- 201000008197 Laryngitis Diseases 0.000 description 1
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 1
- 201000004681 Psoriasis Diseases 0.000 description 1
- 238000001069 Raman spectroscopy Methods 0.000 description 1
- 208000007107 Stomach Ulcer Diseases 0.000 description 1
- 206010042220 Stress ulcer Diseases 0.000 description 1
- GWEVSGVZZGPLCZ-UHFFFAOYSA-N Titan oxide Chemical compound O=[Ti]=O GWEVSGVZZGPLCZ-UHFFFAOYSA-N 0.000 description 1
- 201000006704 Ulcerative Colitis Diseases 0.000 description 1
- 206010046274 Upper gastrointestinal haemorrhage Diseases 0.000 description 1
- 201000008629 Zollinger-Ellison syndrome Diseases 0.000 description 1
- 239000002253 acid Substances 0.000 description 1
- 239000013543 active substance Substances 0.000 description 1
- 230000001154 acute effect Effects 0.000 description 1
- QZWNXXINFABALM-UHFFFAOYSA-N adamantan-2-amine Chemical compound C1C(C2)CC3CC1C(N)C2C3 QZWNXXINFABALM-UHFFFAOYSA-N 0.000 description 1
- ORILYTVJVMAKLC-UHFFFAOYSA-N adamantane Chemical group C1C(C2)CC3CC1CC2C3 ORILYTVJVMAKLC-UHFFFAOYSA-N 0.000 description 1
- 239000000556 agonist Substances 0.000 description 1
- 229920000615 alginic acid Polymers 0.000 description 1
- 235000010443 alginic acid Nutrition 0.000 description 1
- 150000004703 alkoxides Chemical class 0.000 description 1
- 229960003805 amantadine Drugs 0.000 description 1
- 150000003863 ammonium salts Chemical class 0.000 description 1
- 238000004458 analytical method Methods 0.000 description 1
- 150000008064 anhydrides Chemical class 0.000 description 1
- 229940069428 antacid Drugs 0.000 description 1
- 239000003159 antacid agent Substances 0.000 description 1
- 239000005557 antagonist Substances 0.000 description 1
- 230000000844 anti-bacterial effect Effects 0.000 description 1
- 239000012296 anti-solvent Substances 0.000 description 1
- 239000003699 antiulcer agent Substances 0.000 description 1
- 208000006673 asthma Diseases 0.000 description 1
- 229960000794 baclofen Drugs 0.000 description 1
- 239000003637 basic solution Substances 0.000 description 1
- 125000003785 benzimidazolyl group Chemical group N1=C(NC2=C1C=CC=C2)* 0.000 description 1
- 150000004663 bisphosphonates Chemical class 0.000 description 1
- 239000002775 capsule Substances 0.000 description 1
- 239000003795 chemical substances by application Substances 0.000 description 1
- 238000000975 co-precipitation Methods 0.000 description 1
- MQANMCFSNPBYCQ-UHFFFAOYSA-N decan-2-amine Chemical compound CCCCCCCCC(C)N MQANMCFSNPBYCQ-UHFFFAOYSA-N 0.000 description 1
- 239000003085 diluting agent Substances 0.000 description 1
- 239000006185 dispersion Substances 0.000 description 1
- 230000002183 duodenal effect Effects 0.000 description 1
- 201000006549 dyspepsia Diseases 0.000 description 1
- 238000001704 evaporation Methods 0.000 description 1
- 230000008020 evaporation Effects 0.000 description 1
- 230000001747 exhibiting effect Effects 0.000 description 1
- 238000009472 formulation Methods 0.000 description 1
- 230000027119 gastric acid secretion Effects 0.000 description 1
- 208000015419 gastrin-producing neuroendocrine tumor Diseases 0.000 description 1
- 238000000227 grinding Methods 0.000 description 1
- 159000000011 group IA salts Chemical class 0.000 description 1
- 150000002357 guanidines Chemical class 0.000 description 1
- 229960001340 histamine Drugs 0.000 description 1
- 150000004677 hydrates Chemical class 0.000 description 1
- XLYOFNOQVPJJNP-UHFFFAOYSA-M hydroxide Chemical compound [OH-] XLYOFNOQVPJJNP-UHFFFAOYSA-M 0.000 description 1
- 238000011065 in-situ storage Methods 0.000 description 1
- 230000004054 inflammatory process Effects 0.000 description 1
- 239000011872 intimate mixture Substances 0.000 description 1
- 238000001990 intravenous administration Methods 0.000 description 1
- 208000019423 liver disease Diseases 0.000 description 1
- 238000011866 long-term treatment Methods 0.000 description 1
- 230000002503 metabolic effect Effects 0.000 description 1
- 125000000956 methoxy group Chemical group [H]C([H])([H])O* 0.000 description 1
- 229960003117 omeprazole magnesium Drugs 0.000 description 1
- 239000006186 oral dosage form Substances 0.000 description 1
- 239000008203 oral pharmaceutical composition Substances 0.000 description 1
- 230000003647 oxidation Effects 0.000 description 1
- 238000007254 oxidation reaction Methods 0.000 description 1
- 238000007911 parenteral administration Methods 0.000 description 1
- 208000000689 peptic esophagitis Diseases 0.000 description 1
- 239000000825 pharmaceutical preparation Substances 0.000 description 1
- 230000036470 plasma concentration Effects 0.000 description 1
- XAEFZNCEHLXOMS-UHFFFAOYSA-M potassium benzoate Chemical compound [K+].[O-]C(=O)C1=CC=CC=C1 XAEFZNCEHLXOMS-UHFFFAOYSA-M 0.000 description 1
- 159000000001 potassium salts Chemical class 0.000 description 1
- 239000002325 prokinetic agent Substances 0.000 description 1
- 229940126409 proton pump inhibitor Drugs 0.000 description 1
- 239000000612 proton pump inhibitor Substances 0.000 description 1
- 125000001453 quaternary ammonium group Chemical group 0.000 description 1
- 150000003242 quaternary ammonium salts Chemical class 0.000 description 1
- 238000001953 recrystallisation Methods 0.000 description 1
- 230000004044 response Effects 0.000 description 1
- 150000003335 secondary amines Chemical class 0.000 description 1
- 201000002859 sleep apnea Diseases 0.000 description 1
- 208000019116 sleep disease Diseases 0.000 description 1
- 208000020685 sleep-wake disease Diseases 0.000 description 1
- 239000012453 solvate Substances 0.000 description 1
- 238000010561 standard procedure Methods 0.000 description 1
- 238000003756 stirring Methods 0.000 description 1
- 150000003462 sulfoxides Chemical class 0.000 description 1
- 229910052717 sulfur Inorganic materials 0.000 description 1
- 125000004434 sulfur atom Chemical group 0.000 description 1
- 238000001356 surgical procedure Methods 0.000 description 1
- 239000000725 suspension Substances 0.000 description 1
- 239000003826 tablet Substances 0.000 description 1
- 150000003512 tertiary amines Chemical class 0.000 description 1
- 238000002560 therapeutic procedure Methods 0.000 description 1
- OGIDPMRJRNCKJF-UHFFFAOYSA-N titanium oxide Inorganic materials [Ti]=O OGIDPMRJRNCKJF-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C04—CEMENTS; CONCRETE; ARTIFICIAL STONE; CERAMICS; REFRACTORIES
- C04B—LIME, MAGNESIA; SLAG; CEMENTS; COMPOSITIONS THEREOF, e.g. MORTARS, CONCRETE OR LIKE BUILDING MATERIALS; ARTIFICIAL STONE; CERAMICS; REFRACTORIES; TREATMENT OF NATURAL STONE
- C04B35/00—Shaped ceramic products characterised by their composition; Ceramics compositions; Processing powders of inorganic compounds preparatory to the manufacturing of ceramic products
- C04B35/622—Forming processes; Processing powders of inorganic compounds preparatory to the manufacturing of ceramic products
- C04B35/626—Preparing or treating the powders individually or as batches ; preparing or treating macroscopic reinforcing agents for ceramic products, e.g. fibres; mechanical aspects section B
- C04B35/63—Preparing or treating the powders individually or as batches ; preparing or treating macroscopic reinforcing agents for ceramic products, e.g. fibres; mechanical aspects section B using additives specially adapted for forming the products, e.g.. binder binders
- C04B35/632—Organic additives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/06—Antiasthmatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/06—Antipsoriatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/20—Hypnotics; Sedatives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/16—Otologicals
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C211/00—Compounds containing amino groups bound to a carbon skeleton
- C07C211/33—Compounds containing amino groups bound to a carbon skeleton having amino groups bound to carbon atoms of rings other than six-membered aromatic rings
- C07C211/34—Compounds containing amino groups bound to a carbon skeleton having amino groups bound to carbon atoms of rings other than six-membered aromatic rings of a saturated carbon skeleton
- C07C211/38—Compounds containing amino groups bound to a carbon skeleton having amino groups bound to carbon atoms of rings other than six-membered aromatic rings of a saturated carbon skeleton containing condensed ring systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/12—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C2603/00—Systems containing at least three condensed rings
- C07C2603/56—Ring systems containing bridged rings
- C07C2603/58—Ring systems containing bridged rings containing three rings
- C07C2603/70—Ring systems containing bridged rings containing three rings containing only six-membered rings
- C07C2603/74—Adamantanes
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Veterinary Medicine (AREA)
- General Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Ceramic Engineering (AREA)
- Manufacturing & Machinery (AREA)
- Inorganic Chemistry (AREA)
- Pulmonology (AREA)
- Materials Engineering (AREA)
- Structural Engineering (AREA)
- Neurosurgery (AREA)
- Neurology (AREA)
- Biomedical Technology (AREA)
- Anesthesiology (AREA)
- Dermatology (AREA)
- Plural Heterocyclic Compounds (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Abstract
本発明は、オメプラゾール及びエソメプラゾールのそれぞれの新規な塩、すなわち5−メトキシ−2−[[(4−メトキシ−3,5−ジメチル−2−ピリジニル)メチル]スルフィニル]−1H−ベンゾイミダゾール及びその(S)−エナンチオマーの塩に関する。より具体的には、本発明は、オメプラゾール及びエソメプラゾールのそれぞれとアダマンタンアミンとの反応により形成された上記化合物のアダマンタンアンモニウム塩に関する。本発明はまた、本発明の化合物の製造方法、医薬組成物、及び本発明の化合物の投与による胃酸関連障害の治療方法に関する。
Description
本発明は、5−メトキシ−2−[[(4−メトキシ−3,5−ジメチル−2−ピリジニル)メチル]スルフィニル]−1H−ベンゾイミダゾールの新規な塩、又は純粋かつ単離された形態にあるその単独エナンチオマーの塩に関する。具体的には、本発明は、これらの化合物のアダマンタンアンモニウム塩に関する。本発明はまた、純粋かつ単離された形態にあるオメプラゾール及びエソメプラゾールのアダマンタンアンモニウム塩の製造方法、並びにそれらを含有する医薬組成物に関する。
オメプラゾールの一般名を有する5−メトキシ−2−[[(4−メトキシ−3,5−ジメチル−2−ピリジニル)メチル]スルフィニル]−1H−ベンゾイミダゾール、及びその治療上許容される塩は、EP 0 005 129に記載されている。
オメプラゾールはスルホキシドであり、そしてキラル化合物であり、その硫黄原子は立体中心である。このように、オメプラゾールはその二つの単独エナンチオマー、すなわちオメプラゾールの(R)−及び(S)−エナンチオマーのラセミ混合物であり、これらは本明細書において(R)−オメプラゾール及び(S)−オメプラゾールと呼ばれ、後者はエソメプラゾールの一般名を有する。オメプラゾールのエナンチオマーの絶対配置は、(R)−エナンチオマーのN−アルキル化誘導体のX線研究により決定されている。
オメプラゾール及びエソメプラゾールはプロトンポンプ阻害剤であり、そして抗潰瘍剤として有用である。より一般的な意味では、オメプラゾール及びエソメプラゾールは、哺乳類及び特にヒトにおける胃酸関連疾患の予防及び治療に使用することができる。
オメプラゾールの特定のアルカリ性塩は、EP 0 124 495に開示されている。そこにはオメプラゾールの第四級アンモニウム塩及びグアニジン塩が開示されている。文献WO 97/41114は、オメプラゾールのマグネシウム塩を包含するベンゾイミダゾールのマグネシウム塩の製造方法を開示している。しかしながら、第一級アミンから製造されたオメプラゾールの塩は、これらの文献では言及されていない。
オメプラゾールの単独エナンチオマーのある種の塩及びそれらの製造は、WO 94/27988に開示されており、例えば、エソメプラゾールの第四級アンモニウム塩が言及されている。しかしながら、第一級、第二級又は第三級アミンを用いた塩は、開示も示唆もされていない。記載されたエソメプラゾールの塩は、改善された薬物動態及び代謝特性を有し、これらは改善された治療プロフィール、例えばより低い程度の個人間変動を与えるだろう。WO 96/02535及びWO 98/54171は、エソメプラゾール及びその塩の好ましい製造方法を開示している。さらに、第一級アミン塩は、WO 03/074514に開示されている。
薬剤組成物の製剤において、活性医薬成分は、それを都合よく取り扱い及び加工できる形態にあることが重要である。これは、商業的に実現可能な製造方法を得る観点からだけでなく、活性医薬成分を含む医薬製剤(例えば錠剤のような投与形態)をその後に製造する観点からも重要である。
さらに、経口医薬組成物の製造において、患者への投与後に活性医薬成分の確実な、再現可能な及び一定の血漿濃度プロフィールが与えられることが重要である。
活性医薬成分の化学的安定性、固体状態安定性及び「貯蔵寿命」は、医薬活性化合物にとって重要な特性である。活性医薬成分及びそれを含有する組成物は、活性医薬成分の物理化学的特性、例えばその化学的組成、密度、吸湿性及び溶解性の著しい変化を示すことなく、かなりの期間にわたって貯蔵できるべきである。このように、商業的に実現可能でありそして製薬上許容される薬剤組成物の製造において、可能な限り、結晶性でありかつ安定な形態にある活性医薬成分を提供することが重要である。
本発明は、化合物Ia、Ib及びIcを包含する下記式Iを有する新規なアダマンタンアンモニウム塩に関する:
式Ia:ラセミオメプラゾールのアダマンタンアンモニウム塩
式Ib:オメプラゾールの(S)−エナンチオマーのアダマンタンアンモニウム塩
式Ic:オメプラゾールの(R)−エナンチオマーのアダマンタンアンモニウム塩
式中、Rはアダマンタン基と定義される。アダマンタンアミン、H2N−Rは、トリシクロ[3.3.1.13,7]デカン−1−アミン及びトリシクロ[3.3.1.13,7]デカン−2−アミンから選択される。
式Ib:オメプラゾールの(S)−エナンチオマーのアダマンタンアンモニウム塩
式Ic:オメプラゾールの(R)−エナンチオマーのアダマンタンアンモニウム塩
式中、Rはアダマンタン基と定義される。アダマンタンアミン、H2N−Rは、トリシクロ[3.3.1.13,7]デカン−1−アミン及びトリシクロ[3.3.1.13,7]デカン−2−アミンから選択される。
本発明の化合物は、溶媒和物、水和物及び無水物の形態で製造することができる。
化学名5−メトキシ−2−[[(4−メトキシ−3,5−ジメチル−2−ピリジニル)メチル]スルフィニル]−1H−ベンゾイミダゾールアダマンタンアンモニウム塩及び化学名(S)−5−メトキシ−2−[[(4−メトキシ−3,5−ジメチル−2−ピリジニル)メチル]スルフィニル]−1H−ベンゾイミダゾールアダマンタンアンモニウム塩;化学名5−メトキシ−2−[[(4−メトキシ−3,5−ジメチル−2−ピリジニル)メチル]スルフィニル]−1H−ベンゾイミダゾール1−アダマンタンアンモニウム塩及び化学名(S)−5−メトキシ−2−[[(4−メトキシ−3,5−ジメチル−2−ピリジニル)メチル]スルフィニル]−1H−ベンゾイミダゾール1−アダマンタンアンモニウム;並びに化学名5−メトキシ−2−[[(4−メトキシ−3,5−ジメチル−2−ピリジニル)メチル]スルフィニル]−1H−ベンゾイミダゾール2−アダマンタンアンモニウム塩及び化学名(S)−5−メトキシ−2−[[(4−メトキシ−3,5−ジメチル−2−ピリジニル)メチル]スルフィニル]−1H−ベンゾイミダゾール2−アダマンタンアンモニウム塩は、ベンゾイミダゾール部分のメトキシ基が5位にあることを必ずしも意味するのではなく、6位にあってもよく、又はそれらの混合物であってもよい。
もう一つの態様において、本発明は、オメプラゾール及びエソメプラゾールのアダマンタンアンモニウム塩の製造方法を提供する。驚くべきことに、オメプラゾールのアダマンタンアンモニウム塩並びにそれらの(R)−及び(S)−エナンチオマーのアダマンタンアンモニウム塩を、明確な結晶状態で得ることができることを見出した。より具体的には、本発明に係る化合物オメプラゾールのアダマンタンアンモニウム塩及びエソメプラゾールのア
ダマンタンアンモニウム塩は、明確な構造を有する結晶であることを特徴としている。
ダマンタンアンモニウム塩は、明確な構造を有する結晶であることを特徴としている。
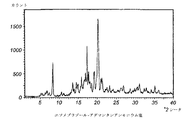
Braggの式から計算したd値及び強度で確認されるピークは、オメプラゾールの1−アダマンタンアンモニウム塩の回折像から抽出した。
相対強度は信頼性が低いので、数値の代わりに、ピークに相当する相対強度は強い(s)、中位(m)又は弱い(w)と表示される。
表に示したピークに加えて、回折像は多くの極めて弱いピークを含有する。
相対強度は信頼性が低いので、数値の代わりに、ピークに相当する相対強度は強い(s)、中位(m)又は弱い(w)と表示される。
表に示したピークに加えて、回折像は多くの極めて弱いピークを含有する。
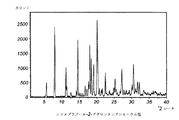
Braggの式から計算したd値及び強度で確認されるピークは、エソメプラゾールの1−アダマンタンアンモニウム塩の回折像から抽出した。
相対強度は信頼性が低いので、数値の代わりに、ピークに相当する相対強度は強い(s)、中位(m)又は弱い(w)と表示される。
表に示したピークに加えて、回折像は多くの極めて弱いピークを含有する。
相対強度は信頼性が低いので、数値の代わりに、ピークに相当する相対強度は強い(s)、中位(m)又は弱い(w)と表示される。
表に示したピークに加えて、回折像は多くの極めて弱いピークを含有する。
Braggの式から計算したd値及び強度で確認されるピークは、エソメプラゾールの2−アダマンタンアンモニウム塩の回折像から抽出した。
相対強度は信頼性が低いので、数値の代わりに、ピークに相当する相対強度は強い(s)、中位(m)又は弱い(w)と表示される。
相対強度は信頼性が低いので、数値の代わりに、ピークに相当する相対強度は強い(s)、中位(m)又は弱い(w)と表示される。
表に示したピークに加えて、回折像は多くの極めて弱いピークを含有する。
相対強度は可変スリットを用いて測定した回折像から得られた。XRPD間隔値は、最後の小数位において±2の範囲で変動することがある。
相対強度は可変スリットを用いて測定した回折像から得られた。XRPD間隔値は、最後の小数位において±2の範囲で変動することがある。
X線粉末回折(XRPD)分析は、オメプラゾールの1−アダマンタンアンモニウム塩、エソメプラゾールの1−アダマンタンアンモニウム塩、及びエソメプラゾールの2−アダマンタンアンモニウム塩のサンプルについて、標準的方法、例えば、Giacovazzo, C. et al. (1995), Fundamentals of Crystallography, Oxford University Press; Jenkins, R. and Snyder, R. L. (1996), Introduction to X-Ray Powder Diffractometry, John Wiley & Sons, New York; Bunn, C. W. (1948), Chemical Crystallography, Clarendon Press, London;又はKlug, H. P.& Alexander, L. E. (1974), X-ray Diffraction Procedures, John Wiley and Sons, New Yorkに記載された方法により行った。X線分析はSiemens D5000回折計を用いて行った。
本発明の化合物は、X線粉末回折像におけるピークの位置及び強度を特徴としている。さらに、本発明の化合物は、1H−NMR、IR、FTIR及びラマン分光法により特性決定することができる。
もう一つの態様において、本発明は、オメプラゾール及びエソメプラゾールのそれぞれのアダマンタンアンモニウム塩の製造方法を提供する。塩形成の好適な方法は、温度誘発結晶化、高められた温度での急速結晶化、室温での緩徐結晶化、熱再結晶化、アンチソル
ベント(antisolvent)誘発結晶化及び蒸発による結晶化である。
ベント(antisolvent)誘発結晶化及び蒸発による結晶化である。
もう一つの態様において、本発明は、次の段階:オメプラゾール又はエソメプラゾールを好適な溶剤、例えばアセトニトリル、酢酸エチル、tert−ブチルメチルエーテル及びメタノール、又はそれらの混合物に溶解するか又は該溶剤中、その場で形成することを含む、オメプラゾール又はエソメプラゾールのアダマンタンアンモニウム塩の製造方法を提供する。アダマンタンアミンを攪拌中に加える。塩化合物の沈殿が生成し、そして沈殿を濾過により分離する。得られた化合物を溶剤で洗浄し、そして得られた結晶を乾燥する。
本発明のさらにもう一つの態様は、新規化合物が他の化合物、例えばオメプラゾール及びエソメプラゾールのマグネシウム塩(これらは商品名Losec(登録商標)、MUPS(登録商標)及びNexium(登録商標)を有する製品の医薬活性成分である)の合成における中間体として重要でありうることである。Nexium(登録商標)の活性成分、すなわちエソメプラゾールのマグネシウム塩の合成中に、塩形成段階に先立つ酸化段階にチタン触媒を用いることができる。合成は、1価水酸化物又はアルコキシドの添加によるエソメプラゾールの1価塩の形成を伴って通常進行する。エソメプラゾールのこの1価塩、例えばナトリウム又はカリウム塩は、その後にマグネシウム塩に変換される。不溶性の無機チタン塩、例えば酸化チタンは、チタン触媒の溶液にナトリウム又はカリウムアルコキシドのような強塩基を加える場合に生成する。塩形成剤として、ナトリウム又はカリウム含有塩基を用いるよりはむしろ、アダマンタンアミンを用いることは、無機チタン塩が所望の塩と共沈殿するのを回避する。たとえチタン触媒がアダマンタンアミンと反応したとしても、アダマンタンアミン及びチタンの可溶性錯体が生成し、これはベンゾイミダゾール化合物の所望のアダマンタンアンモニウム塩を濾別する間に溶液中に留まることができる。
溶解しかつイオン化した、オメプラゾールのアルキルアンモニウム塩又はエソメプラゾールのアルキルアンモニウム塩を含有する溶液は、オメプラゾール及びエソメプラゾールの既知のナトリウム及びカリウム塩で作った相当する溶液よりも低いpHを有する。より塩基性が低い溶液は、静脈内投与にとって有利である。
例証したオメプラゾール及びエソメプラゾールのアダマンタンアンモニウム塩は、それぞれ結晶性形態にある。それらは有利な特性、例えば都合よい取り扱い並びに化学的及び固体状態安定性を示す。本発明により得られた生成物は明確な結晶性生成物である。このような結晶性生成物は、好適な投与形態の製造中に容易に加工可能である。結晶性生成物は、粉砕、濾過及び製錠中の取り扱いが容易である。これらの操作は再現性が高い。また、安定性は、化合物の明確な結晶形態が得られる場合に改善される。これらの特性は、例えば錠剤のような投与形態を考慮すると、大きな価値を有する。
これらの活性物質は、哺乳類及びヒトにおける胃酸分泌の抑制に有用である。より一般的な意味では、それらは哺乳類及びヒトにおける、例えば逆流性食道炎、胃炎、十二指腸炎、胃潰瘍及び十二指腸潰瘍を包含する胃酸関連疾患の予防及び治療に使用することができる。さらに、それらは、例えばNSAID(非ステロイド性抗炎症剤)療法を受けている患者、非潰瘍性消化不良の患者、症候性及び非症候性の胃−食道逆流性疾患の患者、並びにガストリノーマの患者において胃酸抑制効果が望ましい他の胃腸障害の治療に使用することができる。それらはまた、集中治療状況の患者、急性上部消化管出血の患者において、術前及び術後に胃酸の酸吸引を予防するため、そしてストレス性潰瘍を予防及び治療するために使用することができる。さらに、それらは、過敏性腸症候群(IBS)、炎症性腸疾患(IBS)、潰瘍性大腸炎(IBD)、クローン病、喘息、喉頭炎、バレット症候群、睡眠時無呼吸症、睡眠障害、乾癬の予防及び治療に有用なことがあり、並びにヘリコバクター感染及び上記の症状に関連する疾患の予防及び治療に有用である。
疑念を回避するために、「治療」とは、症状の治療的処置及び予防を包含することを意味する。
本発明に係るオメプラゾール又はエソメプラゾールのアダマンタンアンモニウム塩の有効量を患者に与えるために、任意の好適な投与経路を用いることができる。例えば、経口又は非経口製剤などを用いることができる。投与形態は、カプセル、錠剤、分散液、懸濁液などを包含する。
さらに、活性成分として本発明に係る化合物を、製薬上許容される担体、希釈剤又は賦形剤及び場合により他の治療成分と共に含む医薬組成物が提供される。他の治療成分を含む組成物は、ヘリコバクター感染の治療において特に興味深いものである。本発明はまた、胃酸関連症状の治療に使用するための医薬の製造における化合物の使用、及び胃酸関連症状を患う被験者に本発明に係る化合物の治療有効量を投与することを含む胃酸関連症状の治療方法を提供する。
本発明の組成物は、経口又は非経口投与に適する組成物を包含する。最も好ましい経路は経口経路である。組成物は、好都合には単位用量形態で存在することができ、そして製薬学の技術分野で公知の任意の方法により製造することができる。
本発明の実施において、本発明に係る化合物の最も好適な投与経路及び治療量の大きさは、いずれにせよ治療すべき疾患の性質及び重症度に依存するだろう。投与量及び投与頻度は、個々の患者の年齢、体重及び応答により変動することができる。ゾリンジャー−エリソン症候群を有する患者に対しては、特別な要件が必要なことがあり、例えば平均的患者よりも高い投与量を必要とすることがある。小児及び肝臓疾患の患者は、平均よりも幾分低い投与量の恩恵を受けるだろう。このように、ある条件において、以下に述べる範囲外の投与量の使用が必要なことがあり、例えば長期治療はより低い投与量を必要とすることがある。このようなより高い投与量及びより低い投与量は、本発明の範囲内にある。このような1日量は、5mg〜300mgで変動することができる。
一般的に、本発明の化合物の好適な経口投与形態は、5mg〜300mgの全1日量の投
与量範囲に及ぶことができ、1回の単一投与量又は一様の分割投与量で投与される。好ましい投与量範囲は10mg〜80mgである。
与量範囲に及ぶことができ、1回の単一投与量又は一様の分割投与量で投与される。好ましい投与量範囲は10mg〜80mgである。
本発明の化合物は活性成分として、従来技術により製薬用担体との密接な混合物に、例えばWO 96/01623及びEP 0 247 983(これらの開示は全体として参照により本明細書に組み込まれる)に記載された経口製剤に組み合わせることができる。
本発明の化合物及び他の活性成分を含む組み合わせ調製物も使用できる。このような活性成分の例は、抗菌化合物、非ステロイド性抗炎症剤(アセチルサリチル酸(ASA)を包含する)、制酸剤、アルギネート、消化管運動促進剤(prokinetic agent)、ヒスタミンH2−受容体拮抗剤、ビスホスホネート、及びGABAb作用剤、例えばバクロフェン並びにWO 01/42252及びWO 01/41743に開示されたものを包含するが、これらに限定されるものではない。
以下の実施例は、異なる処理経路による本発明の化合物(新規な中間体を包含する)の製造をさらに説明する。これらの実施例は、上記で定義した通りの又は特許請求した通りの本発明の範囲を限定しようとするものではない。
〔実施例1〕
5−メトキシ−2−[[(4−メトキシ−3,5−ジメチル−2−ピリジニル)メチル]スルフィニル]−1H−ベンゾイミダゾール1−アダマンタンアンモニウム塩
オメプラゾール(1.0g、2.9mmol)をアセトニトリル(10ml)及びメタノール(2ml)に40〜50℃で溶解した。1−アダマンタンアミン(0.86g、5.7mmol)を加え、次いでこの混合物を室温に冷却した。これらの条件で、スラリーを得た。このスラリーをさらに2時間攪拌するとすぐに沈殿を濾別し、アセトニトリルで洗浄し、乾燥した。表題の化合物1g(73%)を得た。
1H-NMR (400 MHz, CD2Cl2): 1.5 (bs, 18H), 2.12 (s, 3H), 2.17 (s, 3H), 3.63 (s, 3H), 3.77 (s, 3H), 4.49 (d, 1H), 4.65 (d, 1H), 6.84-6.91 (dd, 1H), 6.99 (bs, 1H), 7.47 (m, 1H), 8.14 (s, 1H)。
製造した化合物をXRPDにより分析して、図1に示す回折像を得た。
5−メトキシ−2−[[(4−メトキシ−3,5−ジメチル−2−ピリジニル)メチル]スルフィニル]−1H−ベンゾイミダゾール1−アダマンタンアンモニウム塩
オメプラゾール(1.0g、2.9mmol)をアセトニトリル(10ml)及びメタノール(2ml)に40〜50℃で溶解した。1−アダマンタンアミン(0.86g、5.7mmol)を加え、次いでこの混合物を室温に冷却した。これらの条件で、スラリーを得た。このスラリーをさらに2時間攪拌するとすぐに沈殿を濾別し、アセトニトリルで洗浄し、乾燥した。表題の化合物1g(73%)を得た。
1H-NMR (400 MHz, CD2Cl2): 1.5 (bs, 18H), 2.12 (s, 3H), 2.17 (s, 3H), 3.63 (s, 3H), 3.77 (s, 3H), 4.49 (d, 1H), 4.65 (d, 1H), 6.84-6.91 (dd, 1H), 6.99 (bs, 1H), 7.47 (m, 1H), 8.14 (s, 1H)。
製造した化合物をXRPDにより分析して、図1に示す回折像を得た。
〔実施例2〕
(S)−5−メトキシ−2−[[(4−メトキシ−3,5−ジメチル−2−ピリジニル)メチル]スルフィニル]−1H−ベンゾイミダゾール1−アダマンタンアンモニウム塩
エソメプラゾール(1.0g、2.9mmol)をアセトニトリル(20ml)に室温で溶解した。この溶液に1−アダマンタンアミン(0.86g、5.7mmol)を加えるとすぐに白色固体が沈殿した。反応スラリーを室温でさらに2時間攪拌した。生成した沈殿を濾別し、アセトニトリル(10ml)で洗浄し、乾燥した。表題の化合物1.13g(83%)を得た。
1H-NMR (400 MHz, CD2Cl2): 1.48 (bs, 18H), 2.14 (s, 3H), 2.18 (s, 3H), 3.66 (s, 3H), 3.78 (s, 3H), 4.46 (d, 1H), 4.66 (d, 1H), 6.88 (d, 1H), 6.95 (m, 1H), 7.52 (d, 1H), 8.15 (s, 1H)。
製造した化合物をXRPDにより分析して、図2に示す回折像を得た。
(S)−5−メトキシ−2−[[(4−メトキシ−3,5−ジメチル−2−ピリジニル)メチル]スルフィニル]−1H−ベンゾイミダゾール1−アダマンタンアンモニウム塩
エソメプラゾール(1.0g、2.9mmol)をアセトニトリル(20ml)に室温で溶解した。この溶液に1−アダマンタンアミン(0.86g、5.7mmol)を加えるとすぐに白色固体が沈殿した。反応スラリーを室温でさらに2時間攪拌した。生成した沈殿を濾別し、アセトニトリル(10ml)で洗浄し、乾燥した。表題の化合物1.13g(83%)を得た。
1H-NMR (400 MHz, CD2Cl2): 1.48 (bs, 18H), 2.14 (s, 3H), 2.18 (s, 3H), 3.66 (s, 3H), 3.78 (s, 3H), 4.46 (d, 1H), 4.66 (d, 1H), 6.88 (d, 1H), 6.95 (m, 1H), 7.52 (d, 1H), 8.15 (s, 1H)。
製造した化合物をXRPDにより分析して、図2に示す回折像を得た。
〔実施例3〕
(S)−5−メトキシ−2−[[(4−メトキシ−3,5−ジメチル−2−ピリジニル)メチル]スルフィニル]−1H−ベンゾイミダゾール2−アダマンタンアンモニウム塩
エソメプラゾール(0.5g、1.4mmol)を、酢酸エチル(10ml)及び2−アダマンタンアミン(0.44g、2.9mmol)の溶液に溶解した。得られた溶液を約4mlに濃縮し、アセトニトリル(10ml)を加えた。得られた混合物を再び約半量に濃縮するとすぐに白色固体が沈殿し始めた。反応スラリーを室温で一夜攪拌した。沈殿した生成物を濾別し、アセトニトリルで洗浄した。表題の化合物0.1gを得た。
1H-NMR (400 MHz, CD3OD): 1.64 (d, 2H), 1.77-1.88 (m, 8H), 1.93 (d, 2H), 2.02 (d,
2H), 2.16 (s, 3H), 2.25 (s, 3H), 3.10 (bs, 1H), 3.70 (s, 3H), 3.86 (s, 3H), 4.69 (d, 1H), 4.84 (d, 1H), 6.92 (dd, 1H), 7.11 (d, 1H), 7.52 (d, 1H), 8.15 (s, 1H)。
製造した化合物をXRPDにより分析して、図3に示す回折像を得た。
(S)−5−メトキシ−2−[[(4−メトキシ−3,5−ジメチル−2−ピリジニル)メチル]スルフィニル]−1H−ベンゾイミダゾール2−アダマンタンアンモニウム塩
エソメプラゾール(0.5g、1.4mmol)を、酢酸エチル(10ml)及び2−アダマンタンアミン(0.44g、2.9mmol)の溶液に溶解した。得られた溶液を約4mlに濃縮し、アセトニトリル(10ml)を加えた。得られた混合物を再び約半量に濃縮するとすぐに白色固体が沈殿し始めた。反応スラリーを室温で一夜攪拌した。沈殿した生成物を濾別し、アセトニトリルで洗浄した。表題の化合物0.1gを得た。
1H-NMR (400 MHz, CD3OD): 1.64 (d, 2H), 1.77-1.88 (m, 8H), 1.93 (d, 2H), 2.02 (d,
2H), 2.16 (s, 3H), 2.25 (s, 3H), 3.10 (bs, 1H), 3.70 (s, 3H), 3.86 (s, 3H), 4.69 (d, 1H), 4.84 (d, 1H), 6.92 (dd, 1H), 7.11 (d, 1H), 7.52 (d, 1H), 8.15 (s, 1H)。
製造した化合物をXRPDにより分析して、図3に示す回折像を得た。
Claims (14)
- 5−メトキシ−2−[[(4−メトキシ−3,5−ジメチル−2−ピリジニル)メチル]スルフィニル]−1H−ベンゾイミダゾール(オメプラゾール)及び(S)−5−メトキシ−2−[[(4−メトキシ−3,5−ジメチル−2−ピリジニル)メチル]スルフィニル]−1H−ベンゾイミダゾール(エソメプラゾール)のアダマンタンアンモニウム塩。
- 塩がオメプラゾールの1−アダマンタンアンモニウム塩である請求項1に記載のアダマンタンアンモニウム塩。
- 塩がエソメプラゾールの1−アダマンタンアンモニウム塩である請求項1に記載のアダマンタンアンモニウム塩。
- 塩がオメプラゾールの2−アダマンタンアンモニウム塩である請求項1に記載のアダマンタンアンモニウム塩。
- 塩がエソメプラゾールの2−アダマンタンアンモニウム塩である請求項1に記載のアダマンタンアンモニウム塩。
- 化合物が結晶性であることを特徴とする、請求項1〜5の何れかに記載のアダマンタンアンモニウム塩。
- 下記の段階:
a)オメプラゾール又はエソメプラゾールを有機溶剤に溶解し;
b)アダマンタンアミンを加え、そして所望の塩を沈殿させ;
c)得られたオメプラゾール又はエソメプラゾールの塩を単離し、そして乾燥する
ことを含む、請求項1〜6の何れかに記載のオメプラゾール及びエソメプラゾールのアダマンタンアンモニウム塩の製造方法。 - 有機溶剤がアセトニトリル、酢酸エチル、tert−ブチルメチルエーテル及びメタノール、又はそれらの混合物から選択される、請求項7に記載の方法。
- 有機溶剤がアセトニトリル、酢酸エチル及びメタノール、又はそれらの混合物から選択される、請求項7に記載の方法。
- オメプラゾールのアダマンタンアンモニウム塩が得られる、請求項7〜9の何れかに記載の方法。
- エソメプラゾールのアダマンタンアンモニウム塩が得られる、請求項7〜9の何れかに記載の方法。
- 活性成分として請求項1〜6の何れかに記載のオメプラゾール又はエソメプラゾールのアダマンタンアンモニウム塩を、製薬上許容される賦形剤及び場合により他の治療成分と共に含む医薬組成物。
- 胃酸関連症状の治療に用いられる医薬を製造するための、請求項1〜6の何れかに記載のオメプラゾール又はエソメプラゾールのアダマンタンアンモニウム塩の使用。
- 胃酸関連症状を患う患者に請求項1〜6の何れかに記載のオメプラゾール又はエソメプラゾールのアダマンタンアンモニウム塩の治療有効量を投与することを含む、胃酸関連
症状の治療方法。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| SE0302381A SE0302381D0 (sv) | 2003-09-04 | 2003-09-04 | New salts I |
| PCT/SE2004/001258 WO2005023796A1 (en) | 2003-09-04 | 2004-09-01 | New salts of omeprazole and esomeprazole i |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2007504222A true JP2007504222A (ja) | 2007-03-01 |
| JP2007504222A5 JP2007504222A5 (ja) | 2007-09-27 |
Family
ID=28787270
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2006525304A Pending JP2007504222A (ja) | 2003-09-04 | 2004-09-01 | オメプラゾール及びエソメプラゾールiの新規な塩 |
Country Status (6)
| Country | Link |
|---|---|
| US (1) | US7326724B2 (ja) |
| EP (1) | EP1664019A1 (ja) |
| JP (1) | JP2007504222A (ja) |
| CA (1) | CA2549465A1 (ja) |
| SE (1) | SE0302381D0 (ja) |
| WO (1) | WO2005023796A1 (ja) |
Families Citing this family (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| SE0302382D0 (sv) | 2003-09-04 | 2003-09-04 | Astrazeneca Ab | New salts II |
| US7576219B2 (en) | 2005-10-26 | 2009-08-18 | Hanmi Pharm. Co., Ltd | Crystalline S-omeprazole strontium hydrate, method for preparing same, and pharmaceutical composition containing same |
| EP1801110A1 (en) | 2005-12-22 | 2007-06-27 | KRKA, tovarna zdravil, d.d., Novo mesto | Esomeprazole arginine salt |
| DE602007010926D1 (de) * | 2006-06-07 | 2011-01-13 | Astrazeneca Ab | Neues verfahren zur herstellung von ammoniumsalzen von esomeprazol |
| EP2114919A2 (en) | 2007-01-31 | 2009-11-11 | Krka Tovarna Zdravil, D.D., Novo Mesto | Process for the preparation of optically pure omeprazole via salt formation with a chiral amine or treatment with an entiomer converting enzyme and chromatographic seperation |
| US8748619B2 (en) | 2009-11-12 | 2014-06-10 | Hetero Research Foundation | Process for the resolution of omeprazole |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS5745155A (en) * | 1980-07-01 | 1982-03-13 | Squibb & Sons Inc | Mercaptoacyl derivatives of variety of 4-substituted prolines |
| JPS59167587A (ja) * | 1983-03-04 | 1984-09-21 | アクチエボラゲツト・ヘツスレ | オメプラゾ−ル化合物 |
Family Cites Families (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| SE7804231L (sv) | 1978-04-14 | 1979-10-15 | Haessle Ab | Magsyrasekretionsmedel |
| SE9301830D0 (sv) | 1993-05-28 | 1993-05-28 | Ab Astra | New compounds |
| SE504459C2 (sv) | 1994-07-15 | 1997-02-17 | Astra Ab | Förfarande för framställning av substituerade sulfoxider |
| SE508669C2 (sv) | 1996-04-26 | 1998-10-26 | Astra Ab | Nytt förfarande |
| SE510650C2 (sv) | 1997-05-30 | 1999-06-14 | Astra Ab | Ny förening |
| CA2474246C (en) | 2002-03-05 | 2010-06-29 | Astrazeneca Ab | Alkylammonium salts of omeprazole and esomeprazole |
| SE0302382D0 (sv) | 2003-09-04 | 2003-09-04 | Astrazeneca Ab | New salts II |
-
2003
- 2003-09-04 SE SE0302381A patent/SE0302381D0/xx unknown
-
2004
- 2004-09-01 JP JP2006525304A patent/JP2007504222A/ja active Pending
- 2004-09-01 CA CA002549465A patent/CA2549465A1/en not_active Abandoned
- 2004-09-01 US US10/569,819 patent/US7326724B2/en not_active Expired - Fee Related
- 2004-09-01 EP EP04775364A patent/EP1664019A1/en not_active Ceased
- 2004-09-01 WO PCT/SE2004/001258 patent/WO2005023796A1/en active Application Filing
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS5745155A (en) * | 1980-07-01 | 1982-03-13 | Squibb & Sons Inc | Mercaptoacyl derivatives of variety of 4-substituted prolines |
| JPS59167587A (ja) * | 1983-03-04 | 1984-09-21 | アクチエボラゲツト・ヘツスレ | オメプラゾ−ル化合物 |
Also Published As
| Publication number | Publication date |
|---|---|
| CA2549465A1 (en) | 2005-03-17 |
| WO2005023796A8 (en) | 2006-04-06 |
| US20070004778A1 (en) | 2007-01-04 |
| WO2005023796A1 (en) | 2005-03-17 |
| SE0302381D0 (sv) | 2003-09-04 |
| US7326724B2 (en) | 2008-02-05 |
| EP1664019A1 (en) | 2006-06-07 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP4002303B2 (ja) | S−オメプラゾールの新規な形態 | |
| RU2237666C2 (ru) | Калиевая соль (s)-омепразола, способ ее получения и фармацевтический препарат на ее основе | |
| JP2001522780A (ja) | オメプラゾールの新規な結晶形 | |
| JP2001508805A (ja) | オメプラゾールナトリウム塩 | |
| KR20040093187A (ko) | 란소프라졸 다형 및 그것의 제조 방법 | |
| JP4495465B2 (ja) | オメプラゾール及びエソメプラゾールのアルキルアンモニウム塩 | |
| JP5457632B2 (ja) | エソメプラゾールのナトリウム塩の製造に使用するための結晶の改変型の作成方法 | |
| US20120122933A1 (en) | Compounds | |
| JP2007504223A (ja) | オメプラゾール及びエソメプラゾールiiの新規な塩 | |
| JP2007504222A (ja) | オメプラゾール及びエソメプラゾールiの新規な塩 | |
| MXPA01007516A (en) | Potassium salt of (s | |
| KR20130063762A (ko) | 신규 에스라베프라졸, 이의 알칼리금속 및 알칼리토금속염 및 이의 제조방법 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20070807 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20070807 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20101116 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20110419 |