JP2006519852A - 弱塩基の塩 - Google Patents
弱塩基の塩 Download PDFInfo
- Publication number
- JP2006519852A JP2006519852A JP2006507175A JP2006507175A JP2006519852A JP 2006519852 A JP2006519852 A JP 2006519852A JP 2006507175 A JP2006507175 A JP 2006507175A JP 2006507175 A JP2006507175 A JP 2006507175A JP 2006519852 A JP2006519852 A JP 2006519852A
- Authority
- JP
- Japan
- Prior art keywords
- salt
- pharmaceutical composition
- carbon atoms
- composition according
- hydrogen
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 0 *c1nc(C=C)c(C=C)[n]1 Chemical compound *c1nc(C=C)c(C=C)[n]1 0.000 description 2
- MCTWTZJPVLRJOU-UHFFFAOYSA-N C[n]1cncc1 Chemical compound C[n]1cncc1 MCTWTZJPVLRJOU-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D235/00—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, condensed with other rings
- C07D235/02—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, condensed with other rings condensed with carbocyclic rings or ring systems
- C07D235/04—Benzimidazoles; Hydrogenated benzimidazoles
- C07D235/24—Benzimidazoles; Hydrogenated benzimidazoles with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached in position 2
- C07D235/30—Nitrogen atoms not forming part of a nitro radical
- C07D235/32—Benzimidazole-2-carbamic acids, unsubstituted or substituted; Esters thereof; Thio-analogues thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/4353—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom ortho- or peri-condensed with heterocyclic ring systems
- A61K31/437—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom ortho- or peri-condensed with heterocyclic ring systems the heterocyclic ring system containing a five-membered ring having nitrogen as a ring hetero atom, e.g. indolizine, beta-carboline
Abstract
薬学的組成物であって、以下の式:
【化1】
の弱塩基化合物の塩であって、Xは、水素、ハロゲン、7個未満の炭素原子のアルキルもしくは7個未満の炭素原子のアルコキシであり;nは、4未満の正の整数であり;Yは、水素、塩素、ニトロ、メチル、エチルまたはオキシクロロであり;Rは、水素、アルキル基が3〜6個の炭素原子を有するアルキルアミノカルボニルまたは1〜8個の炭素原子を有するアルキル基であり、R2は、4−チアゾリル、Rが7個未満の炭素原子の脂肪族炭化水素であるNHCOOR1、または7個未満の炭素原子のアルキル基である、弱塩基化合物の塩;1つ以上の遊離の酸;ならびに任意の薬学的添加物を含む、薬学的組成物が提供される。
【化1】
の弱塩基化合物の塩であって、Xは、水素、ハロゲン、7個未満の炭素原子のアルキルもしくは7個未満の炭素原子のアルコキシであり;nは、4未満の正の整数であり;Yは、水素、塩素、ニトロ、メチル、エチルまたはオキシクロロであり;Rは、水素、アルキル基が3〜6個の炭素原子を有するアルキルアミノカルボニルまたは1〜8個の炭素原子を有するアルキル基であり、R2は、4−チアゾリル、Rが7個未満の炭素原子の脂肪族炭化水素であるNHCOOR1、または7個未満の炭素原子のアルキル基である、弱塩基化合物の塩;1つ以上の遊離の酸;ならびに任意の薬学的添加物を含む、薬学的組成物が提供される。
Description
本発明は、ベンゾイミダゾール誘導体および他の弱塩基の水溶性を改善する分野ならびにベンゾイミダゾール誘導体および他の弱塩基の薬学的処方物を提供する分野に属する。
(連邦政府の研究支援への謝辞)
本発明は、少なくとも一部分は、国立衛生研究所からの基金を受けて実施された。従って、合衆国政府は、本発明に対して特定の権利を所有し得る。
本発明は、少なくとも一部分は、国立衛生研究所からの基金を受けて実施された。従って、合衆国政府は、本発明に対して特定の権利を所有し得る。
(発明の背景)
多くの薬学的活性成分は、水によく溶けず、それゆえに、治療的に実行可能な処方物を開発することにおいて、処方者に課題を提供する。溶質または溶媒のいずれかの改変を関与させる多くの可溶化技術が、この課題を克服するために記載されている。化合物がイオン化中心を有する場合には、塩を形成する可能性が存在する。塩形成は、薬物の物理化学的特性およびその結果生じる生物学的特性を、その化学構造を改変することなく変える手段を提供する。塩形成によって変更され得る因子としては、溶解度、溶解、吸湿性、風味、物理的安定性および化学的安定性または多形性が挙げられる。水溶性の塩は、注射可能な無菌水溶液の調製を可能にし、固体投薬形態に含まれる活性成分の迅速な溶解を可能にする。
多くの薬学的活性成分は、水によく溶けず、それゆえに、治療的に実行可能な処方物を開発することにおいて、処方者に課題を提供する。溶質または溶媒のいずれかの改変を関与させる多くの可溶化技術が、この課題を克服するために記載されている。化合物がイオン化中心を有する場合には、塩を形成する可能性が存在する。塩形成は、薬物の物理化学的特性およびその結果生じる生物学的特性を、その化学構造を改変することなく変える手段を提供する。塩形成によって変更され得る因子としては、溶解度、溶解、吸湿性、風味、物理的安定性および化学的安定性または多形性が挙げられる。水溶性の塩は、注射可能な無菌水溶液の調製を可能にし、固体投薬形態に含まれる活性成分の迅速な溶解を可能にする。
ベンゾイミダゾール誘導体は、哺乳動物、特にヒトおよび温血動物における、癌、腫瘍およびウイルスの増殖の阻害のために有用である(米国特許第6,479,526号;同第5,880,144号;同第6,245,789号、同第5,767,138号;同第6,265,437号)。他の化合物と組み合わせて使用される特定のベンゾイミダゾール誘導体は、殺真菌剤として有用であることが報告されている(米国特許第3,954,993号;同第4,593,040号;同第5,756,500号、同第4,835,169号;同第4,980,346号)。しかしながら、ベンゾイミダゾール誘導体は、カルベンダジム(carbendazim)を含めて、あまり水に溶解しない。癌の処置のためのカルベンダジムの推定経口用量は、1日あたり数100mgまでに及び、それはその水溶解度よりもはるかに大きい。他の弱塩基は、同じ小さい水溶解度の問題を有している。
ベンゾイミダゾール誘導体および他の弱塩基の改善された処方物に対する要求が存在する。
(発明の要旨)
式:
式:
また、式:
疾患を処置する方法もまた提供され、その方法は、患者に、薬学的に有効な量の式:
ここでXは、水素、ハロゲン、7個未満の炭素原子のアルキルもしくは7個未満の炭素原子のアルコキシであり;nは、4未満の正の整数であり;Yは、水素、塩素、ニトロ、メチル、エチルまたはオキシクロロであり;Rは、水素、アルキル基が3〜6個の炭素原子を有するアルキルアミノカルボニルまたは1〜8個の炭素原子を有するアルキル基であり、R2は、4−チアゾリル、R1が7個未満の炭素原子の脂肪族炭化水素であるNHCOOR1、または7個未満の炭素原子のアルキル基である。特定の薬学的組成物では、上記塩と遊離の酸は、上記組成物中で約1:0.5〜約1:3の重量比で存在する。本明細書中で記載されるような他の比もまた含まれる。
本明細書中で使用される場合、「遊離の酸」とは、水中でイオン化し水素イオンおよびアニオンを生成する組成物を意味する。本発明の特定の組成物では、その遊離の酸は、その塩と同一のアニオンを含む。本発明の特定の組成物では、その遊離の酸は、1つ以上のアニオンを含み、そのアニオンのうちの1つは上記塩におけるアニオンと同一のアニオンであり得る。本明細書中で使用される場合、「塩」とは、水中でイオン化しアニオンおよびカチオンを生成する組成物を意味する。本発明の塩では、上記弱塩基はその塩中のカチオンを提供する。
本明細書中で使用される場合、「弱塩基」または「弱塩基(複数)」は、約7より小さいpKaを有する化合物である。弱塩基は、弱塩基のプロドラッグを含む。好ましい弱塩基は、約5より小さいpKaを有する。他の好ましい弱塩基は、約4より小さいpKaを有する。約7より小さいpKa値を有する弱塩基および7より小さいすべてのpKa範囲にある化合物は、本発明に含まれる。いくつかのクラスの弱塩基としては、約7より下のpKaを有するイミダゾール誘導体、約7より下のpKaを有するピリジン誘導体、約7より下のpKaを有するアニリン誘導体、および約7より下のpKaを有するこれらの組み合わせを含有する化合物が挙げられる。イミダゾール誘導体は、構造:
いくつかの好ましいイミダゾールとしては以下が挙げられる。
いくつかの好ましいピリジン誘導体としては以下が挙げられる。
いくつかの好ましいアニリン誘導体としては以下が挙げられる。
別のクラスのイミダゾール誘導体としては、ベンゾイミダゾールおよびベンゾイミダゾール誘導体が挙げられる。本明細書中で使用される場合、ベンゾイミダゾールは、式:
本明細書中で使用される場合、「ベンゾイミダゾール誘導体」としては、上に定義されたようなベンゾイミダゾールおよびベンゾイミダゾールのプロドラッグが挙げられる。「プロドラッグ」は、任意の共有結合したキャリアと考えられ、プロドラッグは、そのようなプロドラッグが哺乳動物の被験体に投与された場合に、上記の親薬物の式に従う活性な親薬物(弱塩基)をインビボで放出する。上記弱塩基のプロドラッグは、改変が、慣用的な操作またはインビボのいずれかで親化合物に切断されるように、その化合物内に存在する官能基を改変することにより調製される。プロドラッグとしては、ヒドロキシ基、アミン基またはスルフヒドリル基が、哺乳動物の被験体に投与された場合に、開裂して、それぞれ、遊離のヒドロキシル基、アミン基またはスルフヒドリル基を生成する任意の基に結合されている化合物が挙げられる。プロドラッグの例としては、上記弱塩基中のアルコール官能基およびアミン官能基の酢酸誘導体、ギ酸誘導体、または安息香酸誘導体;上記弱塩基中のアルコール官能基およびフェノール官能基のリン酸エステル、ジメチルグリシンエステル、アミノアルキルベンジルエステル、アミノアルキルエステルおよびカルボキシアルキルエステル;などが挙げられるが、これらに限定されない。
本発明の組成物は、動物、好ましくは哺乳動物、そして好ましくはヒトへの投与のために有用である。本発明の組成物は、当該分野で公知のように、任意の投与形態、および動物中、好ましくは哺乳動物中へ薬学的に活性な用量を提供する任意の適切な調剤を使用して、投与される。
本発明の組成物は、当該分野で公知のように、経口投与、緩速静脈内注射投与または点滴投与のために使用される。上記組成物は酸性であるので、他の投与形態は、不適切であり得る。上記組成物が注入される場合には、当該分野で公知のように、注入速度は局所的な刺激を避けるためにゆっくりであるべきである。
本発明の組成物は、当該分野で公知のように、そして例えば、WO01/12169、米国特許第3,903,297号および同第6,423,734号(これらのすべてが、本明細書中に、本明細書と矛盾がない程度まで、特に処方の詳細について、参考として援用される)に記載されるように、処方され得る。
本発明の組成物は、単位投薬形態で投与され得、そして過度の実験なしに当該分野で周知の任意の方法によって調製され得る。そのような方法としては、本発明の組成物を過度の実験なしに当該分野で公知のように、1つ以上の薬学的に受容可能な添加剤を構成するキャリアまたは希釈剤と組み合わせる工程を包含する。本発明の組成物の投薬および投与の頻度は、過度の実験なしに当該分野で公知の手段により容易に決定される。
本発明の実施における使用のために適した経口処方物としては、カプセル剤、ゼリー、カシェ剤、錠剤、発泡性の散剤もしくは錠剤、または非発泡性の散剤もしくは散剤、散剤あるいは顆粒剤;水性液体中の溶液もしくは懸濁液または非水性液体中の溶液もしくは懸濁液として;あるいは水中油型液体乳剤または油中水型乳剤が挙げられる。本発明の組成物はまた、ボーラス、舐剤またはペーストとして提示され得る。カプセル剤または錠剤は、当該分野で公知のように、所望の特性を提供する適切当該分野で公知のような添加剤(例えば、結合剤、滑沢剤、希釈剤、崩壊剤、着色剤、矯味矯臭剤、流動促進剤および融解剤)を含み得る。
本発明において有用な投薬形態を製造するための技術および組成物は、以下の参考文献に記載されている:7 Modern Pharmaceutics,Chapter 9および10(Banker & Rhodes編,1979);Liebermanら、Pharmaceutical Dosage Forms:Tablets(1981);およびAnsel,Introduction to Pharmaceutical Dosage Forms 第2版(1976)。適切な薬学的キャリアは、この分野の標準的な参考文献であるRemington’s Pharmaceutical Sciences,Mack Publishing Companyに記載されている。
疾患を処置することにおいて有用なキットもまた、提供され、そのキットは1つ以上の本発明の組成物を含み、投与のための指示書を含み得る。
「薬学的に受容可能」および「無毒の」とは、合理的な利益/危険比に見合って、過度の不利な副作用(例えば、毒性、刺激およびアレルギー性反応)なしにヒトおよび/または動物についての使用に適することを意味する。「薬学的に活性」とは、動物、好ましくは哺乳動物において、意図された生理学的変化をもたらし得ることを意味する。
「薬学的に受容可能な添加剤」としては、共溶媒、界面活性剤、錯化剤、ヒドロトロープ、および当該分野で公知のように、薬学的な使用のために望まれる他の成分(例えば、薬学的に受容可能なキャリア、保存剤、乳化剤、希釈剤、甘味剤、矯味矯臭剤、増粘剤、濃化剤、着色剤、および融解剤が挙げられる。任意のレベルの薬学的に受容可能な添加剤および任意の個々の薬学的に受容可能な添加剤または添加剤の組み合わせは、これらの添加剤が望ましいレベルより下に溶解度を低下させないか、または上で定義されたように、上記組成物を毒性にしない限り、使用され得る。用語「薬学的に受容可能なキャリア」は、当該分野で公知であり、例えば、米国特許第6,479,526号を参照のこと。
本明細書中で使用される場合には、「約」は、実験上の不確実性によりもたらされる範囲を示すことが意図されている。塩と酸との比に関連して使用される場合には、「約」は、±5%を意味する。
本明細書中で使用される場合には、「患者」とは、動物、哺乳動物またはヒトを意味する。1つのクラスの患者は、哺乳動物である。1つのクラスの患者はヒトである。
(発明の詳細な説明)
本発明は、以下の非限定的な例の参照によりさらに理解され得る。当業者は、特に例示された弱塩基および酸以外のすべての弱塩基および酸が、過度の実験なしに使用され得ることを理解する。出願人は、本明細書中で提示されるいずれの理論によっても拘束されることを望まない。
本発明は、以下の非限定的な例の参照によりさらに理解され得る。当業者は、特に例示された弱塩基および酸以外のすべての弱塩基および酸が、過度の実験なしに使用され得ることを理解する。出願人は、本明細書中で提示されるいずれの理論によっても拘束されることを望まない。
(合成)
ベンゾイミダゾール誘導体を含めて弱塩基は、市販されているか、または過度の実験なしに、有機合成の当業者に周知の多くの方法で調製され得る。上記ベンゾイミダゾール誘導体は、有機合成化学の分野で公知の合成方法または過度の実験なしに当業者により理解されるようなそれらのバリエーションとともに、以下に記載される方法を用いて合成される。
ベンゾイミダゾール誘導体を含めて弱塩基は、市販されているか、または過度の実験なしに、有機合成の当業者に周知の多くの方法で調製され得る。上記ベンゾイミダゾール誘導体は、有機合成化学の分野で公知の合成方法または過度の実験なしに当業者により理解されるようなそれらのバリエーションとともに、以下に記載される方法を用いて合成される。
ベンゾイミダゾール誘導体は、Adamsらに対し1973年6月12日に発行された米国特許第3,738,995号に記載される方法により調製され得る。チアゾリル誘導体は、Brownら、J.Am.Chem.Soc.,83 1764(1961)およびGrendaら、J.Org.Chem.,30,259(1965)に記載される方法により調製され得る。
(物質)
カルベンダジムは、Procter & Gamble Company(Cincinnati,Ohio)により提供され、入手したまま使用した。すべての他の化学物質は、試薬等級であり、Sigma(St.Louis,MO)またはAldrich(St.Louis,MO)から購入し、さらなる精製なしに使用した。
カルベンダジムは、Procter & Gamble Company(Cincinnati,Ohio)により提供され、入手したまま使用した。すべての他の化学物質は、試薬等級であり、Sigma(St.Louis,MO)またはAldrich(St.Louis,MO)から購入し、さらなる精製なしに使用した。
(塩の調製)
イオン化可能薬物の塩選択のための主要な問題は、その薬物の相対的塩基性度(または酸性度)および共役酸(共役塩基)の相対的強度の考慮である。塩を形成するために、その共役酸のpKaは、上記薬物の塩基性中心のpKaよりも少なくとも2単位小さくなければならない。好ましくは、選択された対イオンは、最小の毒性効果を有するべきである。カルベンダジムは、4.5という塩基性pKaを有する。以下のアニオン性対イオンが塩の調製のために使用された。
イオン化可能薬物の塩選択のための主要な問題は、その薬物の相対的塩基性度(または酸性度)および共役酸(共役塩基)の相対的強度の考慮である。塩を形成するために、その共役酸のpKaは、上記薬物の塩基性中心のpKaよりも少なくとも2単位小さくなければならない。好ましくは、選択された対イオンは、最小の毒性効果を有するべきである。カルベンダジムは、4.5という塩基性pKaを有する。以下のアニオン性対イオンが塩の調製のために使用された。
同様に、等モル量の酸および遊離塩基を添加することにより、他の塩(塩酸塩、硫酸塩、トシラート、およびベシラート)を調製した。メシラート塩を合成するためには、遊離塩基のメタンスルホン酸への高い溶解度に起因して、上記手順を改変しなければならない。2mlの2M メタンスルホン酸溶液へ、600mgのカルベンダジムを数回に分けて添加し、ボルテックスにかけた。その懸濁液を、次いで、エンドツーエンド回転器(end−to−end rotator)で一晩回転させた。次いで、それを濾過し、室温で放置し、ゆっくりと2日間蒸発させ、そして針状の微結晶を得た。その結晶を、濾過によりその溶液から分離し、イソプロピルアルコールで洗浄し、過剰のメタンスルホン酸を取り除いた。その結晶を次いで風乾し、イソプロピルアルコールの蒸発を確実にした。
(熱分析)
使用した熱分析法は、示差走査熱量測定(DSC)、熱重量分析(TGA)、および熱時顕微鏡観察(hot stage microscopy)(HSM)を含んだ。DSC線は、TA Instruments DSC Q1000(TA Instruments,New Castle,DE)を用いて記録した。1〜3mgの重量のサンプルを、圧着したアルミパン中で、毎分40mlの窒素流量の下で、毎分5℃の速度で加熱した。TGA分析を、溶媒和物または水和物であるかも知れないとDSCにより示されたすべてのサンプルについて実施した。TGA線を、TA Instruments TGA Q−50(TA Instruments,New Castle,DE)を用いて記録した。サンプル重量は、約2〜4mgであり、毎分60mlの窒素ガス流量の下で、毎分2〜15℃の加熱速度を使用した。
使用した熱分析法は、示差走査熱量測定(DSC)、熱重量分析(TGA)、および熱時顕微鏡観察(hot stage microscopy)(HSM)を含んだ。DSC線は、TA Instruments DSC Q1000(TA Instruments,New Castle,DE)を用いて記録した。1〜3mgの重量のサンプルを、圧着したアルミパン中で、毎分40mlの窒素流量の下で、毎分5℃の速度で加熱した。TGA分析を、溶媒和物または水和物であるかも知れないとDSCにより示されたすべてのサンプルについて実施した。TGA線を、TA Instruments TGA Q−50(TA Instruments,New Castle,DE)を用いて記録した。サンプル重量は、約2〜4mgであり、毎分60mlの窒素ガス流量の下で、毎分2〜15℃の加熱速度を使用した。
HSM分析を、Mettler FP80中央処理装置を備えたMettler FP82 hot stage(Mettler,Columbus,OH)を用い、Leica DM LP顕微鏡(E.Licht Co.,Denver,CO)で焦点を合わせて、少量のサンプルについて実施した。サンプルの結晶挙動に対する温度上昇の効果を、少量の各サンプルをスライドガラス上に置き、それをカバーガラスで覆い、そして約300℃まで、毎分10℃の加熱速度で、温度を徐々に上昇させることにより研究した。鉱油中に浸漬したサンプルについて、脱水が観察された。写真を、Diagnostics Instruments 1X−HRDデジタルカメラカプラー(Diagnostics Instruments Inc.,Sterling Heights,MI)を備えたNikon 100 Nicデジタルカメラで撮影し、コンピューターに転送した。
(粉末X線回折(PXRD))
カルベンダジムの様々な塩のPXRDパターンを、周囲温度および周囲圧力で、Philips PM990/100回折計(Philips,The Netherland)を用いて決定した。X線発生装置(PW3373/00 Cu LFF DK119706)は、50kVの電圧および40mAの電流を発生する銅放射線源を有する。計数を、リアルタイム多重ストリップ(real time multiple strip)(RTMS)技術に基づいたX’Celerator検出器を用いて測定した。サンプルをゼロバックグラウンドのシリコンサンプルホルダーに充填し、その微結晶の好ましい配向を導入することを回避するために予防措置を使用した。そのサンプルを、4秒の回転時間を有する回転運動部分に供した。そのサンプルを、回折角2θを3°から63°まで0.0167°のステップサイズで増加させ、15.24秒の計数時間を用いて走査した。サンプル(吸湿または安定性に供した塩)のXRDパターンの痕跡を、ピーク位置および相対強度、ピーク移動、ならびに特定の角度領域におけるピークの存在または欠如に関して比較した。
カルベンダジムの様々な塩のPXRDパターンを、周囲温度および周囲圧力で、Philips PM990/100回折計(Philips,The Netherland)を用いて決定した。X線発生装置(PW3373/00 Cu LFF DK119706)は、50kVの電圧および40mAの電流を発生する銅放射線源を有する。計数を、リアルタイム多重ストリップ(real time multiple strip)(RTMS)技術に基づいたX’Celerator検出器を用いて測定した。サンプルをゼロバックグラウンドのシリコンサンプルホルダーに充填し、その微結晶の好ましい配向を導入することを回避するために予防措置を使用した。そのサンプルを、4秒の回転時間を有する回転運動部分に供した。そのサンプルを、回折角2θを3°から63°まで0.0167°のステップサイズで増加させ、15.24秒の計数時間を用いて走査した。サンプル(吸湿または安定性に供した塩)のXRDパターンの痕跡を、ピーク位置および相対強度、ピーク移動、ならびに特定の角度領域におけるピークの存在または欠如に関して比較した。
(吸湿研究)
種々の塩の吸湿を、重量測定された量(約2〜3mg)の塩を4mlガラスバイアル中に曝露し、そのガラスバイアルを飽和塩溶液を含む封止したデシケーター中に置くことにより決定した。規定された相対湿度(温度の関数として)を与える飽和塩溶液は、物理学的データおよび化学的データを含む種々のハンドブックに報告されている。
種々の塩の吸湿を、重量測定された量(約2〜3mg)の塩を4mlガラスバイアル中に曝露し、そのガラスバイアルを飽和塩溶液を含む封止したデシケーター中に置くことにより決定した。規定された相対湿度(温度の関数として)を与える飽和塩溶液は、物理学的データおよび化学的データを含む種々のハンドブックに報告されている。
今回の研究を、25℃で、43%(炭酸カリウムの飽和溶液)および81%(臭化カリウムの飽和溶液)の相対湿度値で実施した。上記サンプルを既知の相対湿度のデシケーター中に8日間保存し、それに続いてそれらを再度重量測定し%重量変化を計算した。その固相を、次いでPXRDを用いて分析し、水分含量の効果を確認した。
(溶解度測定)
上記結晶性カルベンダジム塩に関して飽和溶液を与えるのに必要とされる量を超えた一定量の各結晶性カルベンダジム塩(溶解度が1Mを超えない限り)を、4〜7日間、室温で、1〜2mlのMillipore waterを含む4mlのガラスバイアル中で回転させた。水中、37℃および45℃での塩の溶解度を、上記バイアルを、その運転の温度の0.05℃以内に保持された校正された定温水浴(Jouan Inc.,Winchester,VA)に置くことにより決定した。これらは端から端への回転により混合した。各サンプルを、次いで0.45μmPVDFフィルターを通して濾過した。濾液を2つ以上の分画に収集し、それらを別々にHPLCにより分析し、そのフィルタ上での吸着から生じる誤解を招く溶解度測定がないことを確認した。連続する分画の濃度が±5%以内で一致する場合には、フィルターの吸着は無視できると考えられた。固体残渣の組成を検査し、上記溶液と平衡にある少なくともいくつかの固相が実際に塩であることを確実にした。上記異なる塩の溶解度をも、0.01Mおよび0.1Mのその対応する酸中で測定した。
上記結晶性カルベンダジム塩に関して飽和溶液を与えるのに必要とされる量を超えた一定量の各結晶性カルベンダジム塩(溶解度が1Mを超えない限り)を、4〜7日間、室温で、1〜2mlのMillipore waterを含む4mlのガラスバイアル中で回転させた。水中、37℃および45℃での塩の溶解度を、上記バイアルを、その運転の温度の0.05℃以内に保持された校正された定温水浴(Jouan Inc.,Winchester,VA)に置くことにより決定した。これらは端から端への回転により混合した。各サンプルを、次いで0.45μmPVDFフィルターを通して濾過した。濾液を2つ以上の分画に収集し、それらを別々にHPLCにより分析し、そのフィルタ上での吸着から生じる誤解を招く溶解度測定がないことを確認した。連続する分画の濃度が±5%以内で一致する場合には、フィルターの吸着は無視できると考えられた。固体残渣の組成を検査し、上記溶液と平衡にある少なくともいくつかの固相が実際に塩であることを確実にした。上記異なる塩の溶解度をも、0.01Mおよび0.1Mのその対応する酸中で測定した。
ひとたびその残渣の固相が過剰の塩を含有することが立証されると、たいていの場合に、Ksp測定を、観察されたカルベンダジム濃度から直接に計算した。遊離酸の沈殿は等量の対イオンのその遊離塩基形態への中和を生じるので、同一の手順を使用して、所与の塩での系の飽和の前に遊離の酸の沈殿が発生する系においてKspを計算し得た。
(溶解研究)
室温におけるカルベンダジムおよびその塩の溶解を、Millipore waterと0.1N塩酸(HCl)との中、pH1.09で研究した。薬物およびリン酸の、1:1および1:2のモル比の物理的混合物の溶解をも、研究した。重量測定された量の塩(50mgのカルベンダジムを有するように)を粉砕して均一な粒径を提供し、その塩を溶解媒体に懸濁させた。懸濁媒体の体積は、250mlであり、攪拌速度は250rpmに維持した。0.45μmMillipore濾紙を通して濾過した1mlのアリコートサンプルをそれぞれ1分、5分、10分、15分、20分、30分、45分、および60分の時点で抜き取った。1mlのその溶解媒体を、各サンプリング期間の後、溶解容器に添加し、一定の体積を維持した。そのサンプルを、次いでHPLCで分析した。
室温におけるカルベンダジムおよびその塩の溶解を、Millipore waterと0.1N塩酸(HCl)との中、pH1.09で研究した。薬物およびリン酸の、1:1および1:2のモル比の物理的混合物の溶解をも、研究した。重量測定された量の塩(50mgのカルベンダジムを有するように)を粉砕して均一な粒径を提供し、その塩を溶解媒体に懸濁させた。懸濁媒体の体積は、250mlであり、攪拌速度は250rpmに維持した。0.45μmMillipore濾紙を通して濾過した1mlのアリコートサンプルをそれぞれ1分、5分、10分、15分、20分、30分、45分、および60分の時点で抜き取った。1mlのその溶解媒体を、各サンプリング期間の後、溶解容器に添加し、一定の体積を維持した。そのサンプルを、次いでHPLCで分析した。
(高性能液体クロマトグラフィー)
モデル番号168検出器(280nmでの)を備えたBeckman Gold HPLCシステムをすべてのアッセイに対して使用した。Pinnacle ODSアミンカラム(250×4.6mm、Restek,Bellefonte,PA)を、pH3の40%の20mMリン酸塩緩衝剤および60%のアセトニトリルから構成される移動相とともに使用した。流速を毎分0.8mlに制御し、カルベンダジムの保持時間は3.5分であった。注入体積は20μlであった。上記アッセイの評価を、0.1μg/mlから100μg/mlの範囲にわたる濃度のカルベンダジム標準溶液を用いることにより、実施した。どの可溶化剤も上記アッセイを妨害しなかった。すべての実験データは、3%未満の平均誤差を有する2連の値の平均である。
モデル番号168検出器(280nmでの)を備えたBeckman Gold HPLCシステムをすべてのアッセイに対して使用した。Pinnacle ODSアミンカラム(250×4.6mm、Restek,Bellefonte,PA)を、pH3の40%の20mMリン酸塩緩衝剤および60%のアセトニトリルから構成される移動相とともに使用した。流速を毎分0.8mlに制御し、カルベンダジムの保持時間は3.5分であった。注入体積は20μlであった。上記アッセイの評価を、0.1μg/mlから100μg/mlの範囲にわたる濃度のカルベンダジム標準溶液を用いることにより、実施した。どの可溶化剤も上記アッセイを妨害しなかった。すべての実験データは、3%未満の平均誤差を有する2連の値の平均である。
(単結晶X線構造解析)
約0.07×0.22×0.37mmの寸法を有するカルベンダジムリン酸塩の無色の塊をガラス繊維の上にランダムな配向で据え付けた。443(2)Kおよび50kV、40mAの電力設定で、Bruker SMART 1000 CCD検出器X線回折計でのその結晶の調査は、θが少なくとも24.4565°までの測定可能な回折を示した。データをSMART 1000システムで、グラファイト単色光化Mo K放射線(=0.71073Å)を用いて収集した。
約0.07×0.22×0.37mmの寸法を有するカルベンダジムリン酸塩の無色の塊をガラス繊維の上にランダムな配向で据え付けた。443(2)Kおよび50kV、40mAの電力設定で、Bruker SMART 1000 CCD検出器X線回折計でのその結晶の調査は、θが少なくとも24.4565°までの測定可能な回折を示した。データをSMART 1000システムで、グラファイト単色光化Mo K放射線(=0.71073Å)を用いて収集した。
最初の格子定数および積算のための配向マトリクスを、逆格子空間の3つの直交する5°ウェッジにおいて得られた反射から決定した。0<2θ<60°を有効範囲に含み、0.3のωスキャン幅および10秒の暴露時間を有する1検出器設定での全体のXフレームを収集した。そのフレームを、Bruker SAINTソフトウェアパッケージのナローフレームアルゴリズム(narrow frame algorithm)を使用して積算した。積算され保存された7239の全反射から、2676は独立であった(冗長度=2.7、Rint=2.8%、Rsig=3.2%)。それらの独立な反射から、2287(85.5%)が、I>2σ(I)を満足して観測された。a=7.7610(9)Å、b=9.0368(11)Å、c=9.9799(11)Å、α=115.098(2)、β=104.913(2)、γ=98.536(2)、体積=585.36(12)Å3という最終の三斜晶系格子パラメーターは、I>3σ(I)を満足し、2.4125<θ<24.4565の範囲に及ぶ3034個の反射のXYZ中心の精密化に基づいている。経験的な吸収補正および減衰補正を、SADABSプログラムを使用して適用した。吸収係数は0.265mm−1、Tmin=0.9084、およびTmax=0.9817である。Z=2および式量(FW)=289.19に対して、密度計算値は1.641g/cm3である。系統的な不在および強度統計は、空間群が、精密化と矛盾しない
構造は、Bruker SHELXTL(バージョン5.0)ソフトウェアパッケージ中のSHELXSを用いて解析した。精密化を、SHELXLを用いて実施し、図示をXPを使用して実施した。解析を、直接法を利用し、続いてFourier合成を行うことにより達成した。水素原子を、それらが結合する原子に乗るよう拘束し、かつその結合した原子の1.2倍のUisoまたは1.5倍のUisoに等しい熱的パラメーターを有する理想化された位置に追加した。すべての反射のF2に基づく、最終の異方性フルマトリクス最小二乗精密化(full−matrix least squares refinement)は、R1=0.0421、wR2=0.0987、および適合度=1.060で収斂した(最大シフト/esd=0.000)た。F>4σ(F)を満足する2287個の反射を用いた「従来の」精密化指標は、R1=0.0349、wR2=0.0941である。そのモデルは、220個の可変パラメーター、0個の拘束(constraint)および0個の拘束(restraint)から構成された。対角線外の熱パラメーターを関与させる鈍角に起因して、0.555と0.633との間に24個の相関係数が存在した。最終の差地図(difference map)での最高ピークは、0.468eA−3であり、C(8)から0.66に存在した。最低のピークは、−0.303eA−3で生じ、P(1)から0.59に存在した。散乱因子および異常分散を、International Tables Vol C、表4.2.6.8および表6.1.1.4から採用した。
すべての他の塩に対する単結晶X線構造解析を上で議論した様式と類似の様式で実施した。そのデータを表2にまとめる。
(結果および考察)
(カルベンダジム塩のモルホロジー)
結晶形態の調製および回収後、目視および顕微鏡評価(図1)は、調製した塩のモルホロジーの、もとの化合物との差異を明らかに示した。顕微鏡を用いてすべての塩を分析した結果、単結晶系または斜方晶系いずれかであることがわかった。
(カルベンダジム塩のモルホロジー)
結晶形態の調製および回収後、目視および顕微鏡評価(図1)は、調製した塩のモルホロジーの、もとの化合物との差異を明らかに示した。顕微鏡を用いてすべての塩を分析した結果、単結晶系または斜方晶系いずれかであることがわかった。
(X線回折分析)
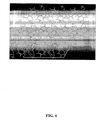
合成した塩のすべては図2に示すような、明確で特徴的なPXRDパターンを有していた。これらのPXRDパターンを水分吸着実験あるいは安定性実験を受けたそれぞれのサンプルと比較した。
合成した塩のすべては図2に示すような、明確で特徴的なPXRDパターンを有していた。これらのPXRDパターンを水分吸着実験あるいは安定性実験を受けたそれぞれのサンプルと比較した。
DSCデータの概要を表3に示す。この表は、すべての熱的事象(すなわち、脱水および融解)およびそれらに対応する必要熱量を含んでいる。塩酸塩および硫酸塩を除いた各塩のDSC線(図3)は単一の融解吸熱を示した。このことは、それらが無水塩として合成されたことを指し示している。一方、硫酸塩および塩酸塩のDSC線は1より多い吸熱を示した。このことは溶媒分子および/または多形体の存在を示唆している。すべての塩調製において用いられている唯一の溶媒は水であるから、上の二つの塩は水和物だと考えられた。
サンプルがさらに加熱されると、化合物の第2形態が融解物から再結晶する。しかしながら、この事象はDSC分析では検知されなかった。この形態の融解は、DSCサーモグラム中の2番目のより小さい吸熱(B)に対応しており、約175℃で起こっている。塩の第2形態に関する仮定を立証するため、硫酸塩を140℃に維持されたオーブンで加熱した後、カルベンダジムの存在を調べるために、そのサンプルを以前述べた手順を用いたHPLCにかけた。3.5分の溶離液は、もとの化合物と同様の紫外スペクトルを有しており、このことは、仮定が正しいことを示している。第2融解の後、再び再結晶が起こり、樹状結晶が生成する。この樹状結晶は、DSC線の第3の吸熱で示されるように融解するまで成長を続け、分解生成物になる。最初の吸熱の温度は、水の沸点を35℃超えており、これは安定なイオン性水和物を形成していることを示している。このことは充填の配列の詳細な研究によって確認され、この充填の配列においては水分子の存在が多数の水素結合の形成に寄与している。硫酸塩中のゲストの水分子はb軸の長さに沿って孤立した空洞内に位置し、硫酸塩、カルベンダジム、および他の水分子と水素結合を形成している。従って、結晶の脱水は、図6に示すような結晶構造の完全な破壊を伴わなければならず、強いホスト−ゲスト水素結合および孤立した空洞内のゲスト分子の位置に起因して、比較的高い温度で起こるはずである。
TGAおよびHSMと一緒に、硫酸塩のDSCサーモグラムから、硫酸塩に二形態あることを確認した。合成した塩はひとつの形態のみを含んでいるが、Aの融解の後にのみ、この融解物からもう一方の形態が成長する。硫酸塩のDSCサーモグラムから、モノトロピーとエナンチオトロピーの間の違いを識別することは困難である。DSCカーブの解釈は、バーガーの融解エンタルピーの法則によって容易化されている。すなわち、より高い融解形態がより低い融解エンタルピーを有する場合には、両形態はエナンチオトロピー的に関連している。表4は種々の形態の硫酸塩および塩酸塩の融点および融解エンタルピーを列挙している。より高い融解形態であるBの融解エンタルピーはAの融解エンタルピーより低い。従って、これらの2つの形態はエナンチオトロピー的に関連している。しかしながら、変態温度以下ではA形態のみが安定である。同様に、塩酸塩は66℃で脱水し、引き続いて120℃で融解吸熱が起こることがわかった。45−86℃の温度範囲にわたる13.1%の重量損失(図5)は理論値13.6%と一致している。ここで、この理論値は、塩酸塩1分子につき2分子の水を含んだ溶媒和物について計算されたものである。塩酸塩は3つの形態を有しているいることがわかった。これらの形態もまたエナンチオトロピー的に関連している。
(種々のカルベンダジム塩の構造の比較)
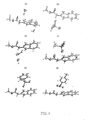
種々のカルベンダジム塩のX線結晶構造により、これらの結晶形態の物理的性質を決定し得るコンフォメーション的優位性、水素結合相互作用、および結晶充填力についての詳細な分析が可能となった。原子の番号付けとともにこれらの塩の図示を図9(a−f)に示す。最終的な適切な原子の位置、結合長、結合角、ねじれ角、異方性熱的置換、および水素の位置はこの図では示していない。
種々のカルベンダジム塩のX線結晶構造により、これらの結晶形態の物理的性質を決定し得るコンフォメーション的優位性、水素結合相互作用、および結晶充填力についての詳細な分析が可能となった。原子の番号付けとともにこれらの塩の図示を図9(a−f)に示す。最終的な適切な原子の位置、結合長、結合角、ねじれ角、異方性熱的置換、および水素の位置はこの図では示していない。
カルベンダジム分子中には、C(3)原子とO(4)原子の間に二重結合がある(1.192(3)Å)。一方、C(3)原子とO(2)原子の間は単結合されている(1.335(3)Å)。C(3)とO(2)の間の結合距離は単結合の共有結合の値である1.41Åよりも短い。このことはO(2)原子が部分的なsp2性を有しており、従ってメチル基のC(1)がより柔軟性がなくなっていることを示している。
イミダゾール窒素N(14)はプロトン化されており、従って、C(6)−N(14)結合は伸びている(1.332(3)Å)。このプロトンは、分子間水素結合を通して対イオンと結合している。例えば、対イオンとしては塩酸塩中の塩化物イオンCl(17)(N(14)...Cl(17)=3.143Å)が挙げられる。プロトン(H(14))がカルバメート基の酸素O(4)と分子内水素結合を有することは可能であるが、結合角は直線からかけ離れている(∠N(14)H(14A)O(4)=116.12)。
カルベンダジム分子の正電荷は、対イオンにより包接された酸性部位から中和されている。形成されたカチオンは共鳴安定化されており、正電荷は3つの窒素N(5)、N(7)およびN(14)の間で変動している。このことは、C(6)−N(5)(1.346(3)Å)、C(6)−N(7)(1.338(3)Å)およびC(6)−N(14)(1.332(3)Å)の結合長により確認された。これらの長さは、C−N単結合の長さの値(0.143Å)とC=N二重結合の長さの値(0.127Å)との間である。カルベンダジムの構造に関する上記情報は、すべての形成された塩について正しい。
研究したすべての塩のカルベンダジム部分は、結晶系/空間群、および/または結晶格子内に存在する対イオンに関わりなく平面構造であることがわかった。これは驚くべきことではない。なぜなら、一端にあるベンゾイミダゾール環の存在が分子全体を平面にするからである。興味深いことに、メトキシ基の酸素の隣にあるカルボニル基が、この酸素にわずかなsp2性を与えており、これによって、このメトキシ基の自由回転が制限されている。このことは、この酸素が利用可能なすべてのHドナーと水素結合を形成できないことからも確認される。硫酸塩を除いて、どの塩も、分子内またはカルベンダジム分子間で水素結合を示さなかった。硫酸塩においては、弱いC−H...O分子間水素結合が存在した。
通常の共有結合を除いては、有機塩の充填配列は、主に分子間および分子内水素結合をする能力、ならびに水素結合ほどではないが、ファンデルワールス相互作用によって決定される。従って、水素結合数(HBN)とともに水素結合力の知識を融点との相関についての定性的な手法において使用し得る。化合物の融点は、対称性、離心率、充填、柔軟性、および水素結合などのいくつかのパラメーターの関数であることを思い出すべきである。
水素結合の強さは、ドナー(D)およびアクセプター(A)原子の電気陰性度の関数である。結晶中のD原子とA原子との近さは水素が相互に引きつけるものとしてどれだけ有効に機能しているかの尺度であるから、結晶学的A−B距離を、水素結合の強さの尺度として使用し得る。HBNは、繰り返し格子中に存在し得る水素結合の最大数として定義される。HBNは、結合できる水素の数または分子中の水素結合アクセプター部位の数のいずれかの最小値の2倍に等しい。
すべての塩は複数の水素結合を形成しているが、顕著なもののみ(強さに基づいて)を表5に列挙している。すべてのスルホン酸塩は強い水素結合を形成しており、これらの水素結合により、カルベンダジムの3つのNHは、スルフォナートの3つのOと結合している。従って、これらすべてのスルホン酸塩は他のすべての塩より比較的高い融点を有している。しかしながら、スルホン酸塩は、水素結合を形成するように配列するため、理論上、水素結合をしない分子より非効率な充填配列を呈する。このことはスルホン酸塩の充填効率の値が低いことから確認される。
リン酸塩もまた、リン酸部位同士で強い水素結合を形成しているが、カルベンダジム分子はリン酸と緩く結合しているのみである。従って、リン酸塩はスルホン酸塩より低い融点を有するが、塩酸塩および硫酸塩より高い融点を有する。一方、塩酸塩および硫酸塩はいくつかのH結合(少なくとも6)を形成し、これらは互いに競合し、すべての結合の形成を制限し得る。いくつかのH結合によって引き起こされる位置的制限は、新たな結合を厳しく制限し、結果的に融点が低くなり得る可能性が非常に高い。低ストリンジェントの要件に起因して、硫酸塩と塩酸塩との両方は緊密に充填している。
興味深いことに、溶媒分子を結晶格子に組み入れることが、積極的にあるいは消極的に最大水素結合数を達成することに関連しているようである。塩酸塩および硫酸塩はアクセプター原子およびドナー原子が不足している。これらの格子において溶媒として水を使用することは、電子を共有することに類似しており、これにより、塩酸塩および硫酸塩は安定した結晶構造を達成することができる。
カルベンダジムの塩酸塩は斜方晶系の空間群P212121で結晶化する。この空間群はキラルであり、反転または鏡映と関連するいかなる対称操作も有しない。従って、この空間群は対称中心を欠いており、まさに非中心対称と定義できる。この空間群についての対称操作は、螺旋軸と呼ばれる与えられた軸に沿った回転および並進の双方を含んでいる。この空間群においては、3つの二回螺旋軸が、a、bおよびc方向に沿って存在している。従って、212121は、その軸の周りで1/2回転するごとに非対称ユニットが、これら3つの軸に沿って繰り返し単位の1/2移動するということを意味している。これらの対称操作のため、4等点(equipoint)変換が現れる(x,y,z;1/2+x,1/2−y,−z;−x,1/2+y,1/2−z;1/2−x,−y,1/2+z)。これにより、単位格子中に4の一般位置多重度を有する。カルベンダジム塩酸塩の非対称ユニットは、水分子2つとともに塩酸およびカルベンダジムそれぞれ1分子を含んでいる。ユニットパターン内の2つの水分子の存在は、結晶化プロセスにおける水の重要性を物語っている。
塩酸塩の熱的楕円ダイアグラム(図9(a))は原子に番号付けを行っている。また、その単位胞のステレオ充填ダイアグラムは図10に示されている。水分子とともに、塩化物アニオンは、カルベンダジム集合体のための架橋剤としてはたらく。カルベンダジム分子(カチオン種として存在している)の自己集合パターンは、二回螺旋軸のまわりの無限の螺旋配列であって、イミダゾール環およびフェニル環を介したπ−πスタッキングを通して結合している(図10(a))。このような集合により空間ができ、そこには塩化物イオンおよび水分子が含まれている(図10(b))。塩化物イオンは、囲んでいるカルベンダジムイオンおよび水分子と複数の水素結合により相互作用している。ここで、水素結合の一つはカルベンダジムとの結合であり(N(14)−H(14A)...Cl(17))、別の水素結合は、2つの水分子のそれぞれとの結合である(O(15)−H(15B)...Cl(17)およびO(16)−H(16A)...Cl(17))。これらの水分子はカルベンダジムイオンの窒素(N(5)およびN(7))ならびに酸素(O(4))とも水素結合を形成している。これら2つの水分子はまた、分子間水素結合を通して互いに結合している。
カルベンダジム塩酸塩集合体の顕著な特徴は、カルベンダジムのメチル基のC1(H1A)と塩化物イオンとの間に形成されたC−H...Cl結合の存在である。3.693ÅというC(1)−H(1A)...Cl(17)距離は、ファンデルワールス距離である4.08Åより短いだけでなく、顕著な直線性を維持しており、C−H...Cl角は157.82°である。塩酸塩の水素結合パラメーターを表6に列挙している。上で議論した塩酸塩の充填配列においては、水のOは、水素結合アクセプターとしてもドナーとしても機能しており、一方、NおよびCの両方は水素ドナーとして、Clはアクセプターとして機能している。
(カルベンダジムリン酸塩)
カルベンダジムのリン酸塩は、三斜晶系で結晶化し、中心対称の空間群
カルベンダジムのリン酸塩は、三斜晶系で結晶化し、中心対称の空間群
この塩は、特定の分子コンフォメーションを採用しており、分子間水素結合を促進している。塩酸塩と同様に、この薬物分子はモノプロトン化されており、薬物分子とリン酸アニオンの分子比は1:1である。この構造においては、薬物分子の3つのN−Hドナー(N(4)、N(7)、およびN(14))およびリン酸アニオンの酸素アクセプターが、水素結合に寄与している。酸素O(12)およびO(14)は、アクセプターとして振る舞い、それぞれの酸素は2つのH結合相互作用を形成している。ここで、1つはプロトン化された薬物との相互作用であり、もう一方はリン酸アニオンとの相互作用である。O(13)は、アクセプター(N(7)−H(10A)...O(13))としてもドナー(O(13)−H(13B)...O(12))としても振る舞い、H結合相互作用を形成する。O(11)は、ドナーとして振る舞い、リン酸アニオンのO(14)と分子間H結合を形成する。カチオン性の薬物部分のNHとアニオン性のリン酸の酸素との間の強い分子間N−H...O結合は、隣接するカルベンダジム分子を鎖に結合させている。リン酸分子間のO−H...O水素結合は、アニオン分子を、b軸と平行な直線に配列させることを可能にしている(図11)。
(カルベンダジム硫酸塩)
カルベンダジム硫酸塩は、単斜晶系で結晶化し、中心対称の空間群C2/cを有している。単斜晶系には、“特有の”軸が存在する。すなわち、その軸は残りの2つの軸と垂直になっている。この特有の軸は、通常、b軸として選択され、従って、β≧90°である。硫酸塩の結晶パターンは、原始的なパターンを有する塩酸塩あるいはリン酸塩と異なり、中心に位置している。中心に位置したパターンにおいては、長方形の格子の中心でのモチーフの群は、コーナーでのそれと同一である。記号‘C’は、格子が面心、すなわち、先端中心であって、第二の格子点がC面(a軸およびb軸によって定義される)の中心に位置することを示している。このような系においては、格子体積は、原始格子の2倍である。C2/cにおいては、対称操作はb軸と平行な二回回転軸であり、映進面はb軸と垂直である。記号‘c’は、映進方向がc軸と平行であることを示している。映進面は、反射操作を並進操作と結合させ、従って、長いアレイにおいてのみ起こる。
カルベンダジム硫酸塩は、単斜晶系で結晶化し、中心対称の空間群C2/cを有している。単斜晶系には、“特有の”軸が存在する。すなわち、その軸は残りの2つの軸と垂直になっている。この特有の軸は、通常、b軸として選択され、従って、β≧90°である。硫酸塩の結晶パターンは、原始的なパターンを有する塩酸塩あるいはリン酸塩と異なり、中心に位置している。中心に位置したパターンにおいては、長方形の格子の中心でのモチーフの群は、コーナーでのそれと同一である。記号‘C’は、格子が面心、すなわち、先端中心であって、第二の格子点がC面(a軸およびb軸によって定義される)の中心に位置することを示している。このような系においては、格子体積は、原始格子の2倍である。C2/cにおいては、対称操作はb軸と平行な二回回転軸であり、映進面はb軸と垂直である。記号‘c’は、映進方向がc軸と平行であることを示している。映進面は、反射操作を並進操作と結合させ、従って、長いアレイにおいてのみ起こる。
この空間群においては、点対称によって2つの等点(equipoint)変換が現れ、この点対称は中心対称によって2倍される(4まで)。この結晶系は一つの面心であるため、その数はさらに8まで倍化され、従って、単位格子中に8の一般位置多重度をもたらす。これらの一般位置は、(x,y,z)、(−x,−y,−z)、(1/2+x,1/2+y,z)、(1/2−x,1/2−y,−z)、(−x,y,1/2−z)、(x,−y,1/2+z)、(1/2−x,1/2+y,1/2−z)、および(1/2+x,1/2−y,1/2+z)である。
最小の分子ユニットにおいては、SO4 2−は、その半分のみが特有となるように、二回軸上に存在している。薬物分子とアニオンの分子比は2:1である。従って、非対称ユニットは、単一のプロトン化されたカルベンダジム分子、一つの水分子、および1/2の硫酸アニオンから成っている。
硫酸塩は、分子間水素結合を促進する分子コンフォメーションを採用している。この構造においては、水分子とともに、薬物分子の3つのN−Hドナーおよびアニオンの硫酸酸素アクセプターが水素結合に寄与している。NH(イミダゾールおよびカルバメート双方)と硫酸塩あるいは水の酸素との間の強い分子間水素結合は、プロトン化されたカルベンダジム、硫酸アニオン、および水分子を鎖に結合させており、この鎖は、b軸に沿って広がっている(図12)。従って、この塩の充填ダイアグラムは、リン酸塩のものと著しく類似しており、b軸と平行に延びるアニオン(この場合はSO4 2−)のカラムを有している。このb軸においては、硫酸分子は水分子と水素結合している(O(20)−H(21)...O(10)およびO(20)−H(20)...O(11))。薬物分子は、リン酸塩中で行われているのと同様に、再度、分子の両側でアニオンとH結合している(N(7)−H(7A)...O(10)、N(5)−H(5A)...O(11)、N(5)−H(5A)...S(1)およびN(7)−H(7A)...S(1))。また、薬物分子は、水分子と水素結合を形成している(N(14)−H(14A)...O(20))。
さらに、硫酸塩の充填配列は、一方のカルベンダジムのメチル基ともう一方のカルベンダジムのベンゼン環との間のC−H...π相互作用の存在によって安定化されている。これらの相互作用は、C(11)...H(1C)(2.797Å)およびC(10)...H(1C)(2.676Å)である。
(カルベンダジムメシラート)
カルベンダジムメシラート塩は、硫酸塩と同様、単斜晶系で結晶化するが、メシラート塩は異なる空間群、Ccを有する。また、他のカルベンダジムスルホン酸塩と異なり、メシラート塩についてのブラヴェ格子は、中心に位置している。この空間群と関連する唯一の対称操作は、c軸と平行の方向での映進面である。この空間群はキラルであり、z値4を有している。一般位置は(x,y,z)、(1/2+x,1/2−y,z)、(x,−y,1/2+z)、および(1/2+x,1/2−y,1/2+z)で与えられる。
カルベンダジムメシラート塩は、硫酸塩と同様、単斜晶系で結晶化するが、メシラート塩は異なる空間群、Ccを有する。また、他のカルベンダジムスルホン酸塩と異なり、メシラート塩についてのブラヴェ格子は、中心に位置している。この空間群と関連する唯一の対称操作は、c軸と平行の方向での映進面である。この空間群はキラルであり、z値4を有している。一般位置は(x,y,z)、(1/2+x,1/2−y,z)、(x,−y,1/2+z)、および(1/2+x,1/2−y,1/2+z)で与えられる。
非対称ユニットは、プロトン化されたカルベンダジムおよびアニオン性のメタンスルホン酸それぞれ1分子から成っている。その塩の原子配列のb軸に沿った投影を図13に示している。充填は、プロトン化されたカルベンダジムとメシラートアニオンの交互の平行なスタックから成っている。これらのスタックはa軸と平行であり(図13)、各スタック内では、すべての分子は、同じ方向に配向している。これらのカルベンダジムおよびメタンスルホン酸のスタックは、分子間水素結合およびC−H...π相互作用によって一緒に保持されている。カルベンダジム分子のすべてのNHは、水素ドナーとして振る舞い、一方、メシラートアニオンのOおよびSは、水素アクセプターとして振舞っている。各メシラートアニオンは、3つのN−H...O結合を形成しており、このうち2つは右側のカルベンダジム分子と、残りの1つは左側のもうひとつのカルベンダジム分子と結合している(図13)。N(5)−H(5A)...O(17)結合は、N(5)−H(5A)...S(18)より、より直線的であるにもかかわらず、カルベンダジムのN(5)はまた、メシラートアニオンのS(18)とH結合を形成し得る。水素結合パラメーターを表9に列挙する。
強力で、非常に制限された位置関係をもった1点相互作用であるH結合に加えて、他のより弱い、制限の少ない相互作用が存在し、この相互作用もまた、分子を一緒に保持する役割を担っている。そのような1つの相互作用は、C−H...πであり、この結合においては、分極したC−H基が芳香環と相互作用している。電子吸引性のスルホナート基の存在は、メシラートのメチル基を分極して、電子を不足させる。この結果、C−H...π相互作用を形成することによって、電子が豊富なカルベンダジムのベンゼン環と相互作用する。C(10)−H(19C)間の距離、2.759Åは、それらのファデルワールス半径(2.9Å)の和より小さく、このことは、そのような相互作用の存在を裏付ける。従って、水素結合およびファンデルワールス接触は、構造の三次元構築をもたらし、安定性を付加する。
その塩の充填配列は、プロトン化されたカルベンダジムとベンゼンスルホン酸アニオンとの間の分子間水素結合の存在を示している(図14)。しかしながら、2つのカルベンダジム分子あるいは2つのベンゼンスルホン酸分子の間には分子内水素結合あるいは分子間水素結合のいずれも観測されなかった。他の塩と同様に、すべての水素供与性原子(N)は水素アクセプター原子(OおよびS)と水素結合を形成する。しかしながら、塩酸塩および硫酸塩とは異なり、ベシラート塩の充填モチーフは、ドナーとしての炭素を含んだ2つの分子間水素結合の形成を許容している。ベンゼンスルホン酸アニオンのフェニル炭素(C(22)およびC(23))は、カルベンダジム分子のメトキシ酸素(O(2))と水素結合を形成する。両C−H...O結合の結合長(C...O)は、3.4Åより短く、結合角は、130°より大きい。カルベンダジムとベンゼンスルホン酸アニオンとの間の分子間水素結合のため、カルベンダジム分子は、b軸に沿って配列している。
(カルベンダジムトシラート)
カルベンダジムトシラート塩は、空間群P212121を有する斜方晶系で結晶化する。この空間群はキラルである。この空間群は、反転または鏡映に関するいかなる対称操作も有しない。従って、対称中心を欠いており、非中心対称と適切に定義される。この空間群についての対称操作は、螺旋軸に沿った回転および並進の双方を含んでいる。この空間群においては、3つの二回螺旋軸が、a、b、およびcの方向に沿って存在している。従って、212121は、その軸の周りで1/2の回転するごとに、非対称ユニットが、これら3つの軸に沿って、繰り返しユニットの1/2移動することを意味している。これらの対称操作のため、4つの等点(equipoint)変換が発生し(x,y,z;1/2+x,1/2−y,−z;−x,1/2+y,1/2−z;1/2−x,−y,1/2+z)、従って、単位格子中に4の一般位置多重度を有する。
カルベンダジムトシラート塩は、空間群P212121を有する斜方晶系で結晶化する。この空間群はキラルである。この空間群は、反転または鏡映に関するいかなる対称操作も有しない。従って、対称中心を欠いており、非中心対称と適切に定義される。この空間群についての対称操作は、螺旋軸に沿った回転および並進の双方を含んでいる。この空間群においては、3つの二回螺旋軸が、a、b、およびcの方向に沿って存在している。従って、212121は、その軸の周りで1/2の回転するごとに、非対称ユニットが、これら3つの軸に沿って、繰り返しユニットの1/2移動することを意味している。これらの対称操作のため、4つの等点(equipoint)変換が発生し(x,y,z;1/2+x,1/2−y,−z;−x,1/2+y,1/2−z;1/2−x,−y,1/2+z)、従って、単位格子中に4の一般位置多重度を有する。
非対称ユニットは、カルベンダジムおよびトルエンスルホン酸の各一分子から成っている。図9(f)に見られるように、カルベンダジム分子とトルエンスルホン酸は、互いに垂直に位置している。単位格子は、カルベンダジムおよびトルエンスルホン酸の各四分子を含んでいる。これらの分子は、カルベンダジムおよびトシラート塩の交互の層に配列されており、全3方向に渡っている(図15)。トシラート塩中のカルベンダジムおよびトシラート分子は、二回螺旋軸のまわりの無限螺旋内に配列されている。結晶学的c軸を見下ろすと、スタック内のカルベンダジム分子は、180°ひっくり返っており、一方、トシラート分子は、同じ方向に配向している。カルベンダジムの隣接スタックの分子は、スタック軸(この場合においてはa軸)に対して、±41.11°の傾斜角を示している。
予測されるように、トシラートの充填配列(図15)は、カルベンダジムのNHとトシラートのOおよびSとの間の分子間水素結合(表11)を示している。ベシラートと同様、トシラートの充填配列は、いくつかのエッジ−トゥー−フェイス相互作用およびCH−π相互作用を示している。これらの相互作用は、カルベンダジムのフェニル環とp−トルエンスルホン酸のフェニル環との間だけではなく、カルベンダジムのメチル基とp−トルエンスルホン酸のフェニル環との間にも起こっている。いくつかの注目される相互作用は、H(9A)...C(23)(2.769Å)、H(9A)...C(24)(2.786Å)およびH(1A)...C(23)(2.779Å)である。
充填力および結晶の対称性は、結晶性物質の化学的および物理的性質を決定する。Kitraigorodskiiの最密充填の原則と呼ばれる、分子結晶の充填の基本法則によれば、密度を最大化し、自由体積を最小化すべきである。結晶間の空隙は望ましくないが、通常、避けることはできない。結晶の密度が高くなる、すなわち、より近密に充填されるほど、自由エネルギーは小さくなり、より高い安定性を生じる。
充填効率は、与えられた結晶の充填係数、κを測定することによって判断し得る。充填係数は、格子中の、分子によって満たされた空間の量を表し、
K=NVvdw/Vcell
で計算される。ここで、Nは単位格子中の分子の数であり、Vvdwは非対称ユニット中の分子のファンデルワールス体積であり、Vcellは単位格子の体積である。ここで現れたファンデルワールス体積は、DS ViewerProプログラムのConolly表面特徴およびそのソフトウェアに含まれている標準ファンデルワールス半径を用いて計算された。様々なカルベンダジム塩の充填係数を表12に列挙している。すべての塩の充填係数は、0.65と0.73との間であり、安定結晶の
K=NVvdw/Vcell
で計算される。ここで、Nは単位格子中の分子の数であり、Vvdwは非対称ユニット中の分子のファンデルワールス体積であり、Vcellは単位格子の体積である。ここで現れたファンデルワールス体積は、DS ViewerProプログラムのConolly表面特徴およびそのソフトウェアに含まれている標準ファンデルワールス半径を用いて計算された。様々なカルベンダジム塩の充填係数を表12に列挙している。すべての塩の充填係数は、0.65と0.73との間であり、安定結晶の
医薬製造工場ではよくあると思われる湿度条件である、30〜50%RHでの塩による高度の水分吸着あるいは脱着は、薬効および実質密度の変動、流れ性、溶解速度および生体利用効率の変動ならびに化学的不安定性が挙げられる、多くの操作上および製造上の困難をもたらし得る。塩の水和物を形成する性質と対イオンの半径および電荷のような様々な構造的特徴との間の一般的傾向は認められていたが、与えられた塩は、結晶化条件に依存して、複数の化学量論的水和物を形成し得る。従って、化合物の水分を吸収する能力の評価は、発展可能かどうかの重要な判断基準となる。
図16は、43%および81%の相対湿度値の下でのカルベンダジム塩の水分吸収カーブを示している。見られ得るように、塩酸塩および硫酸塩は、吸湿性が最も低く、43%および81%の両方のRHの下で水分吸収は1%よりも低い。ちなみに、これらの塩は両方とも水和物として合成された。これとは対照的に、リン酸塩およびメシラート塩は、吸湿性が高く、43%RHで1〜2%の水分を吸収するのに対し、81%RHではそれぞれ7.5%および10.1%の水分を吸収することがわかった。ベシラート塩およびトシラート塩は、43%RHでは水分吸収は1%より低く、81%RHでは約4.3%の水分を吸収した。
塩酸塩、硫酸塩、ベシラート塩、およびトシラート塩の粉末X線回折パターンは43%の湿度値と81%の湿度値とで変化しないままであった。しかしながら、メシラート塩およびリン酸塩の両方では、81%RHの下で保存したサンプルのPXRDパターンに変化を示した。これは、結晶形態における変化に起因し得る(図17(a)および(b))。81%RHの下で保存されたメシラートのサンプルは、11.7°の2θおよび20.3°の2θでの主要な反射とともに、より高いアングルピークにおいて、強度が下がり、18.8°の2θに新たなピークが現れた。一方、43%RHの下で保存されたサンプルは、合成された塩と同様のPXRDパターンを有している。43%RHの下で保存されたリン酸塩サンプルは28°の2θ反射において強度が下がり、81%RHパターンは26°の2θで新たな反射を有し、22°の2θで強度が下がっている。
これらの結果は、43%のRH値においては、すべての塩は大気から2%未満の水分を吸収することを示している。このことは、リン酸塩に形態を変化させたが、他の塩はそれらの固相状態において変化しないままであった。
(溶解度実験)
カルベンダジムの塩酸塩、リン酸塩、硫酸塩、ベシラート塩およびトシラート塩の25℃での水への溶解度を表13に列挙している。メシラート塩は非常に溶けやすいことがわかり(>200mg/ml)、従って、その飽和溶解度を決定することができなかった。硫酸塩の溶解度は、pH1.58より下の領域では約1.2×10−2Mで一定となった。このことは、このpHより下ではその溶液が、硫酸塩に関して飽和していることを示している。一方、ベシラート塩およびトシラート塩の両方の溶解度は、それぞれ、pH値1.65および1.82より下では、低下した。また、様々な塩の溶解度積を表13にまとめている。
カルベンダジムの塩酸塩、リン酸塩、硫酸塩、ベシラート塩およびトシラート塩の25℃での水への溶解度を表13に列挙している。メシラート塩は非常に溶けやすいことがわかり(>200mg/ml)、従って、その飽和溶解度を決定することができなかった。硫酸塩の溶解度は、pH1.58より下の領域では約1.2×10−2Mで一定となった。このことは、このpHより下ではその溶液が、硫酸塩に関して飽和していることを示している。一方、ベシラート塩およびトシラート塩の両方の溶解度は、それぞれ、pH値1.65および1.82より下では、低下した。また、様々な塩の溶解度積を表13にまとめている。
(溶解研究)
遊離塩基ならびに塩酸塩、リン酸塩、硫酸塩、メシラート、ベシラート、およびトシラートの溶解挙動を、Millipore水およびpH1.1の0.1N塩酸溶液中で比較した。pH1.1の溶液は、胃液をシミュレートしている(胃のpHは1〜3である)。これは、この溶液中での挙動が、経口投与後の生体利用効率に関連しているからである。図18aおよびbは、水中および0.1N HCl中の溶解プロファイルを示している。図18(a)にみられるように、塩酸塩、硫酸塩、ベシラート、トシラート、およびリン酸塩ならびに遊離塩基形態は、完全には水に溶解しなかった。これらの5つの塩はいずれも、60分後に、最初の投入量の40%より多くが溶解した。極端な例として、遊離塩基は60分後、1%未満溶解したが、メシラート塩は、ちょうど30分で水に完全に溶解した。
遊離塩基ならびに塩酸塩、リン酸塩、硫酸塩、メシラート、ベシラート、およびトシラートの溶解挙動を、Millipore水およびpH1.1の0.1N塩酸溶液中で比較した。pH1.1の溶液は、胃液をシミュレートしている(胃のpHは1〜3である)。これは、この溶液中での挙動が、経口投与後の生体利用効率に関連しているからである。図18aおよびbは、水中および0.1N HCl中の溶解プロファイルを示している。図18(a)にみられるように、塩酸塩、硫酸塩、ベシラート、トシラート、およびリン酸塩ならびに遊離塩基形態は、完全には水に溶解しなかった。これらの5つの塩はいずれも、60分後に、最初の投入量の40%より多くが溶解した。極端な例として、遊離塩基は60分後、1%未満溶解したが、メシラート塩は、ちょうど30分で水に完全に溶解した。
0.1N HCl中の各塩の溶解性を図18(b)に示している。6つの塩および遊離塩基はすべて、この溶解液中で完全に溶解する。サンプル結晶の100%が溶解する時間に相違があった。メシラート塩は、即座に溶解し、一方、硫酸塩およびリン酸塩は、完全に混和するのに5〜10分を要した。塩酸塩、ベシラート、およびトシラートと同様、遊離塩基は15〜20分で完全に溶解した。
調製した塩の溶解性と、遊離塩基と酸との物理的混合物の溶解性を比較するために、カルベンダジム:リン酸混合物を、1:1および1:2のモル比で調製した。図19は、2つの物理的混合物およびリン酸塩の、Millipore水中における溶解プロファイルを示している。リン酸塩(1:1であることがわかっている)は、1:1物理的混合物より高い溶解性を示す。一方、1:2物理的混合物は、リン酸塩より高い溶解性を示す。過剰な酸のため、1:2物理的混合物は、1:1リン酸塩と比較して、粒子の微環境における拡散層のpHを下げており、従って、溶解し易くなると考えられる。
塩は、同じ平衡溶解度を有しているのにもかかわらず、いずれの与えられたpHにおいても、その塩基より高い溶解速度を示す。塩は、効果的に、それ自身が“バッファー”として振る舞い、拡散境界層のpHを変化させ、これによって、その層への親薬物のみかけの溶解度を増加させると考えられる。従って、塩の形態で塩基性薬物を投与すると、インビボでの溶解よりむしろ、胃が空になることが、その吸収の律速要因となるのは確実である。溶解性の研究から、形成された塩は、遊離塩基より高い溶解性を有していることは明らかである。水中では、メシラート塩が、最も速く溶解した。0.1N塩酸中では、与えられた量の6つの塩のすべて(50mgのカルベンダジムに相当する)および遊離塩基(50mg)は、20分以内に完全に溶解した。リン酸塩(1:1)は、カルベンダジムおよびリン酸の1:1物理的混合物より高い溶解性を有していた。一方、1:2物理的混合物は、過剰量のリン酸に起因して、これらの3つの中で最も高い溶解性を有していた。
みかけの溶解性を上げるため、いくつかの弱両電解質性のカルベンダジムの酸性塩を合成した。すべての合成塩について、予備処方研究を行った。表14は、遊離塩基とともに、研究された塩の物理的性質を列挙している。すべての塩は、遊離塩基より高い溶解速度プロファイルを示し、メシラートが、最も良好な溶解時間を有していた。塩酸塩および硫酸塩を、水和物として合成し、これらが1より多い形態で存在していることがわかった。
本明細書中に記述されている弱塩基化合物の塩を含有する処方物中の遊離酸は、その弱塩基化合物の溶解性を改善した。例えば、さらなる酸を含んでいない処方物より、溶解性は速く、あるいはより完全になり得る。弱塩基の塩の遊離酸に対する比は、いかなる比にもなり得るが、約1:0.5から約1:3は、特に有用な比であり、この中には、すべての中間値および中間比を含んでいる。組成物の特定の例として、上述の比でリン酸遊離酸と合わせられた弱塩基のリン酸塩が挙げられる。本発明の組成物の他の特定の例として、上述の比で塩酸遊離酸と合わせられた弱塩基の塩化物塩が挙げられる。本発明の組成物の他の特定の例として、上述の比で硫酸遊離酸と合わせられた弱塩基の硫酸塩が挙げられる。本発明の組成物の他の特定の例として、上述の比でメタンスルホン酸遊離酸と合わせられた弱塩基のメシラート塩が挙げられる。本発明の組成物の他の特定の例として、上述の比でベンゼンスルホン酸遊離酸と合わせられた弱塩基のベシラート塩が挙げられる。本発明の組成物の他の特定の例として、上述の比でトルエンスルホン酸遊離酸と合わせられた弱塩基のトシラート塩が挙げられる。遊離酸は、塩を調製するのに使用される酸と同じであり得るか、あるいは異なり得る。また、遊離酸は、塩を調製するのに使用される酸と塩を調製するのに使用されない1またはそれ以上の酸との混合物であり得る。処方物に有用な1つのそのような弱塩基は、カルベンダジムである。
処方物中の遊離酸の重要性を評価するため、カルベンダジムトシラート塩の溶解プロファイルとカルベンダジムトシラート塩−p−トルエンスルホン酸の物理的等モル混合物の溶解プロファイルを比較した。溶解研究を、Millipore処理した水で行った。計量した塩あるいは物理的混合物(50mgの遊離カルベンダジムに相当する)を、均一な粒子サイズとなるように粉砕し、250mlのMillipore処理水に懸濁させた。攪拌速度を、250rpmに維持し、研究を室温で行った。0.45μmのMilliporeフィルターを通した1mlのアリコートサンプルを、それぞれ1分、5分、10分、15分、20分、30分、45分、および60分経過したところで抜き取った。各サンプリング時間の後、一定の体積を維持するため、1mlの溶解媒体を溶解用容器に加えた。そのサンプルをHPLC手順により分析した。
カルベンダジムトシラート塩およびカルベンダジムトシラート塩−p−トルエンスルホン酸の物理的混合物の溶解性を図20に示している。物理的混合物が、塩単独より高い溶解性を示すことは明らかである。
本明細書中での記載は、多くの特異性を含んでいるが、発明の範囲を制限するものと解釈すべきではなく、単に、発明のいくつかの具体例を提供するものと解釈すべきである。例えば、本明細書中で具体的に述べられれているもの以外の弱塩基の塩は、本明細書中で提供されている記述を用いて作製され得る。従って、本明細書中で引用されるすべての参考文献は、本明細書に開示されているものと矛盾しない程度まで、本明細書によって参考として援用される。
Claims (21)
- 式:
1つ以上の遊離の酸;ならびに
任意の薬学的添加剤を含む薬学的組成物であって、ここでXは、水素、ハロゲン、7個未満の炭素原子のアルキルもしくは7個未満の炭素原子のアルコキシであり;nは、4未満の正の整数であり;Yは、水素、塩素、ニトロ、メチル、エチルまたはオキシクロロであり;Rは、水素、アルキル基が3〜6個の炭素原子を有するアルキルアミノカルボニルまたは1〜8個の炭素原子を有するアルキル基であり、R2は、4−チアゾリル、R1が7個未満の炭素原子の脂肪族炭化水素であるNHCOOR1、または7個未満の炭素原子のアルキル基であり、該塩と1つ以上の遊離の酸は、該組成物中で1:0.5〜1:3の重量比で存在する、薬学的組成物。 - 前記塩が、塩化物、臭化物、リン酸塩、硫酸塩、トシラート、ベンゾイル化物、硝酸塩、スルホン酸塩、ギ酸塩、酒石酸塩、マレイン酸塩、リンゴ酸塩、クエン酸塩、安息香酸塩、サリチル酸塩、アスコルビン酸塩およびメシラートからなる群から選択される1つ以上のものである、請求項1に記載の薬学的組成物。
- 前記塩が、塩化物、リン酸塩、硫酸塩、トシラート、ベンゾイル化物およびメシラートからなる群から選択される1つ以上のものである、請求項2に記載の薬学的組成物。
- 前記塩および前記遊離の酸が、前記組成物中で1:1の重量比で存在する、請求項1に記載の薬学的組成物。
- 前記塩および前記遊離の酸が、前記組成物中で1:2の重量比で存在する、請求項1に記載の薬学的組成物。
- 前記塩が結晶性である、請求項1に記載の薬学的組成物。
- 前記組成物の水溶液または懸濁液のpHが、2以下である、請求項1に記載の薬学的組成物。
- 前記弱塩基化合物が、イミダゾール誘導体である、請求項1に記載の薬学的組成物。
- 前記弱塩基化合物がベンゾイミダゾール誘導体である、請求項1に記載の薬学的組成物。
- 前記弱塩基化合物が、カルベンダジムである、請求項10に記載の薬学的組成物。
- 前記弱塩基化合物が、ピリジン誘導体である、請求項1に記載の薬学的組成物。
- 前記弱塩基化合物が、アニリン誘導体である、請求項1に記載の薬学的組成物。
- 前記組成物が、経口投与、静脈内投与または点滴投与のために使用される、請求項1に記載の薬学的組成物。
- 前記遊離の酸が、前記塩と同一のアニオンを有する、請求項1に記載の薬学的組成物。
- 前記塩とは異なるアニオンを有する遊離の酸をさらに含む、請求項15に記載の薬学的組成物。
- 前記遊離の酸が、前記塩と異なるアニオンを有する、請求項1に記載の薬学的組成物。
- 請求項1に記載の薬学的組成物の溶液または懸濁液。
- 1つ以上の遊離の酸をさらに含む、請求項19に記載の結晶性塩。
- 疾患を処置する方法であって、患者に、薬学的に活性な量の請求項1に記載の薬学的組成物を投与する工程を包含する、方法。
Applications Claiming Priority (4)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US45403503P | 2003-03-12 | 2003-03-12 | |
| US45451403P | 2003-03-13 | 2003-03-13 | |
| US10/402,347 US7022712B2 (en) | 2002-03-26 | 2003-03-26 | Solubilization of weak bases |
| PCT/US2004/007786 WO2004081006A1 (en) | 2003-03-12 | 2004-03-12 | Weak base salts |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2006519852A true JP2006519852A (ja) | 2006-08-31 |
| JP2006519852A5 JP2006519852A5 (ja) | 2007-04-19 |
Family
ID=32995897
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2006507175A Pending JP2006519852A (ja) | 2003-03-12 | 2004-03-12 | 弱塩基の塩 |
Country Status (6)
| Country | Link |
|---|---|
| EP (1) | EP1606290A1 (ja) |
| JP (1) | JP2006519852A (ja) |
| AU (1) | AU2004220053A1 (ja) |
| CA (1) | CA2515289A1 (ja) |
| MX (1) | MXPA05009564A (ja) |
| WO (1) | WO2004081006A1 (ja) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2015231990A (ja) * | 2008-11-19 | 2015-12-24 | セファロン、インク. | インダゾロ[5,4−a]ピロロ[3,4−c]カルバゾール化合物の新しい形態 |
Families Citing this family (24)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7407955B2 (en) | 2002-08-21 | 2008-08-05 | Boehringer Ingelheim Pharma Gmbh & Co., Kg | 8-[3-amino-piperidin-1-yl]-xanthines, the preparation thereof and their use as pharmaceutical compositions |
| US7501426B2 (en) | 2004-02-18 | 2009-03-10 | Boehringer Ingelheim International Gmbh | 8-[3-amino-piperidin-1-yl]-xanthines, their preparation and their use as pharmaceutical compositions |
| DE102004054054A1 (de) | 2004-11-05 | 2006-05-11 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | Verfahren zur Herstellung chiraler 8-(3-Amino-piperidin-1-yl)-xanthine |
| DE102005035891A1 (de) | 2005-07-30 | 2007-02-08 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | 8-(3-Amino-piperidin-1-yl)-xanthine, deren Herstellung und deren Verwendung als Arzneimittel |
| CA2810839A1 (en) | 2006-05-04 | 2007-11-15 | Boehringer Ingelheim International Gmbh | A polymorphic form of 1-[(4-methyl-quinazolin-2-yl)methyl]-3-methyl-7-(2-butyn-1-yl)-8-(3-(r)-amino-piperidin-1-yl)-xanthine |
| PE20110235A1 (es) | 2006-05-04 | 2011-04-14 | Boehringer Ingelheim Int | Combinaciones farmaceuticas que comprenden linagliptina y metmorfina |
| EP1852108A1 (en) | 2006-05-04 | 2007-11-07 | Boehringer Ingelheim Pharma GmbH & Co.KG | DPP IV inhibitor formulations |
| PE20140960A1 (es) | 2008-04-03 | 2014-08-15 | Boehringer Ingelheim Int | Formulaciones que comprenden un inhibidor de dpp4 |
| KR20200118243A (ko) | 2008-08-06 | 2020-10-14 | 베링거 인겔하임 인터내셔날 게엠베하 | 메트포르민 요법이 부적합한 환자에서의 당뇨병 치료 |
| UY32030A (es) | 2008-08-06 | 2010-03-26 | Boehringer Ingelheim Int | "tratamiento para diabetes en pacientes inapropiados para terapia con metformina" |
| US8513264B2 (en) | 2008-09-10 | 2013-08-20 | Boehringer Ingelheim International Gmbh | Combination therapy for the treatment of diabetes and related conditions |
| US20200155558A1 (en) | 2018-11-20 | 2020-05-21 | Boehringer Ingelheim International Gmbh | Treatment for diabetes in patients with insufficient glycemic control despite therapy with an oral antidiabetic drug |
| MX2011006713A (es) | 2008-12-23 | 2011-07-13 | Boehringer Ingelheim Int | Formas salinas de compuesto organico. |
| TW201036975A (en) | 2009-01-07 | 2010-10-16 | Boehringer Ingelheim Int | Treatment for diabetes in patients with inadequate glycemic control despite metformin therapy |
| KR20120107080A (ko) | 2009-11-27 | 2012-09-28 | 베링거 인겔하임 인터내셔날 게엠베하 | 리나글립틴과 같은 dpp-iv 억제제를 사용한 유전자형 검사된 당뇨병 환자의 치료 |
| JP6034781B2 (ja) | 2010-05-05 | 2016-11-30 | ベーリンガー インゲルハイム インターナショナル ゲゼルシャフト ミット ベシュレンクテル ハフツング | 併用療法 |
| AU2011268940B2 (en) | 2010-06-24 | 2015-05-21 | Boehringer Ingelheim International Gmbh | Diabetes therapy |
| US9034883B2 (en) | 2010-11-15 | 2015-05-19 | Boehringer Ingelheim International Gmbh | Vasoprotective and cardioprotective antidiabetic therapy |
| NZ618698A (en) | 2011-07-15 | 2015-08-28 | Boehringer Ingelheim Int | Substituted quinazolines, the preparation thereof and the use thereof in pharmaceutical compositions |
| US9555001B2 (en) | 2012-03-07 | 2017-01-31 | Boehringer Ingelheim International Gmbh | Pharmaceutical composition and uses thereof |
| WO2013171167A1 (en) | 2012-05-14 | 2013-11-21 | Boehringer Ingelheim International Gmbh | A xanthine derivative as dpp -4 inhibitor for use in the treatment of podocytes related disorders and/or nephrotic syndrome |
| WO2013174767A1 (en) | 2012-05-24 | 2013-11-28 | Boehringer Ingelheim International Gmbh | A xanthine derivative as dpp -4 inhibitor for use in modifying food intake and regulating food preference |
| US9526728B2 (en) | 2014-02-28 | 2016-12-27 | Boehringer Ingelheim International Gmbh | Medical use of a DPP-4 inhibitor |
| MX2018015089A (es) | 2016-06-10 | 2019-05-13 | Boehringer Ingelheim Int | Combinacion de linagliptina y metformina. |
Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB1195180A (en) * | 1967-05-05 | 1970-06-17 | Du Pont | Use of Alkyl 2-Benzimidazole-Carbamate Salts a Fungicides |
| GB1391873A (en) * | 1972-05-17 | 1975-04-23 | Canadian Patents Dev | Method for the treatment of trees subject to dutch elm disease and other fungus diseases |
| JPS5459338A (en) * | 1977-10-20 | 1979-05-12 | Takeda Chem Ind Ltd | Remedy for dermatomycosis |
| DE3602881A1 (de) * | 1985-02-04 | 1986-08-07 | Chinoin Gyógyszer és Vegyészeti Termékek Gyára RT., Budapest | Neue fungizid wirkende salze, verfahren zu deren herstellung und diese verbindungen enthaltende agrochemische praeparate |
| JP2003506482A (ja) * | 1999-08-13 | 2003-02-18 | ザ プロクター アンド ギャンブル カンパニー | 癌の治療法 |
-
2004
- 2004-03-12 AU AU2004220053A patent/AU2004220053A1/en not_active Abandoned
- 2004-03-12 EP EP04720454A patent/EP1606290A1/en not_active Withdrawn
- 2004-03-12 WO PCT/US2004/007786 patent/WO2004081006A1/en active Application Filing
- 2004-03-12 CA CA002515289A patent/CA2515289A1/en not_active Abandoned
- 2004-03-12 JP JP2006507175A patent/JP2006519852A/ja active Pending
- 2004-03-12 MX MXPA05009564A patent/MXPA05009564A/es not_active Application Discontinuation
Patent Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB1195180A (en) * | 1967-05-05 | 1970-06-17 | Du Pont | Use of Alkyl 2-Benzimidazole-Carbamate Salts a Fungicides |
| GB1391873A (en) * | 1972-05-17 | 1975-04-23 | Canadian Patents Dev | Method for the treatment of trees subject to dutch elm disease and other fungus diseases |
| JPS5459338A (en) * | 1977-10-20 | 1979-05-12 | Takeda Chem Ind Ltd | Remedy for dermatomycosis |
| DE3602881A1 (de) * | 1985-02-04 | 1986-08-07 | Chinoin Gyógyszer és Vegyészeti Termékek Gyára RT., Budapest | Neue fungizid wirkende salze, verfahren zu deren herstellung und diese verbindungen enthaltende agrochemische praeparate |
| JP2003506482A (ja) * | 1999-08-13 | 2003-02-18 | ザ プロクター アンド ギャンブル カンパニー | 癌の治療法 |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2015231990A (ja) * | 2008-11-19 | 2015-12-24 | セファロン、インク. | インダゾロ[5,4−a]ピロロ[3,4−c]カルバゾール化合物の新しい形態 |
| JP2018008977A (ja) * | 2008-11-19 | 2018-01-18 | セファロン、インク. | インダゾロ[5,4−a]ピロロ[3,4−c]カルバゾール化合物の新しい形態 |
Also Published As
| Publication number | Publication date |
|---|---|
| EP1606290A1 (en) | 2005-12-21 |
| AU2004220053A1 (en) | 2004-09-23 |
| WO2004081006A1 (en) | 2004-09-23 |
| MXPA05009564A (es) | 2005-11-17 |
| CA2515289A1 (en) | 2004-09-23 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2006519852A (ja) | 弱塩基の塩 | |
| US10519176B2 (en) | Crystalline forms | |
| JP2020100624A (ja) | L−オルニチンフェニルアセテートおよびその製造方法 | |
| US6242460B1 (en) | Zolpidem salt forms | |
| BRPI0818464B1 (pt) | método para preparar maleato de (e)-n-{4-[3-cloro-4-(2-piridinilmetóxi)anilina]-3-ciano-7-etóxi-6-quinolinil}-4-(dimetilamino)-2-butenamida sob a forma de um monoidrato cristalino | |
| AU1252692A (en) | Novel salts/ion pairs of non-steroidal anti-inflammatory drugs in various dosage forms | |
| Li et al. | Solubility and dissolution rate enhancement of triamterene by a cocrystallization method | |
| JP2018531280A (ja) | 改善された特性を有するβ−グアニジノプロピオン酸の薬学的に許容される塩及びその使用 | |
| JP2018531280A6 (ja) | 改善された特性を有するβ−グアニジノプロピオン酸の薬学的に許容される塩及びその使用 | |
| Devarapalli et al. | Investigation of poor solubility of a salt-cocrystal hydrate: A case study of the common-ion effect in Betrixaban, an anticoagulant drug | |
| US20070043070A1 (en) | Weak base salts | |
| KR20210008829A (ko) | 디히드로피리미딘 화합물의 고체 형태 및 이의 제조 방법 및 이의 용도 | |
| TW201217366A (en) | Aprepitant L-proline composition and cocrystal | |
| Chi et al. | Sodium salts and solvate of rebamipide: Synthesis, structure, and pharmacokinetic study | |
| EP2323984A1 (en) | Two phase bioactive formulations | |
| JPWO2002083633A1 (ja) | トシル酸スプラタスト結晶 | |
| Reis et al. | Crystallization of isoniazid in choline-based ionic liquids: Physicochemical properties and anti-tuberculosis activity | |
| Ma et al. | Molecular structures of eight hydrogen bond-mediated minoxidil adducts from different aryl acids | |
| JP5651271B2 (ja) | デニブリン二塩酸塩 | |
| EP3430018B1 (en) | Crystal form comprising lithium ions, pharmaceutical compositions thereof, methods for preparation and their uses for the treatment of depressive disease | |
| An et al. | Exploring the differences in crystal structure landscapes and physicochemical properties of enrofloxacin through the number of-OH in coformers: a case study | |
| EP4198016A1 (en) | Nimesulide salts and method of obtaining nimesulide salt crystals | |
| WO2024083183A1 (zh) | 一种膦酰衍生物的盐及晶型和在医药上的用途 | |
| US11414427B2 (en) | Solid forms of stemospironine and its salts | |
| BR102021009918A2 (pt) | Dispersão sólida do antibiótico rifampicina |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20070227 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20070227 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20100817 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20110131 |