JP2005539067A - ポリエチレングリコールリンカーを用いる二重特異性分子の産生 - Google Patents
ポリエチレングリコールリンカーを用いる二重特異性分子の産生 Download PDFInfo
- Publication number
- JP2005539067A JP2005539067A JP2004536556A JP2004536556A JP2005539067A JP 2005539067 A JP2005539067 A JP 2005539067A JP 2004536556 A JP2004536556 A JP 2004536556A JP 2004536556 A JP2004536556 A JP 2004536556A JP 2005539067 A JP2005539067 A JP 2005539067A
- Authority
- JP
- Japan
- Prior art keywords
- peg
- antibody
- molecule
- recognition binding
- binding moiety
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Withdrawn
Links
- 0 *C(N*CCC(ON(C(CC1)=O)C1=O)=O)=O Chemical compound *C(N*CCC(ON(C(CC1)=O)C1=O)=O)=O 0.000 description 2
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/12—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from bacteria
- C07K16/1267—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from bacteria from Gram-positive bacteria
- C07K16/1278—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from bacteria from Gram-positive bacteria from Bacillus (G)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
- A61P31/16—Antivirals for RNA viruses for influenza or rhinoviruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
- A61P31/18—Antivirals for RNA viruses for HIV
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/20—Antivirals for DNA viruses
- A61P31/22—Antivirals for DNA viruses for herpes viruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P33/00—Antiparasitic agents
- A61P33/02—Antiprotozoals, e.g. for leishmaniasis, trichomoniasis, toxoplasmosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P33/00—Antiparasitic agents
- A61P33/02—Antiprotozoals, e.g. for leishmaniasis, trichomoniasis, toxoplasmosis
- A61P33/06—Antimalarials
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2896—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against molecules with a "CD"-designation, not provided for elsewhere
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/24—Immunoglobulins specific features characterized by taxonomic origin containing regions, domains or residues from different species, e.g. chimeric, humanized or veneered
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/31—Immunoglobulins specific features characterized by aspects of specificity or valency multispecific
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/55—Fab or Fab'
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/60—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments
- C07K2317/62—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments comprising only variable region components
- C07K2317/622—Single chain antibody (scFv)
Abstract
本発明は、特定の分子に結合する1以上の第二認識結合部分にポリ-(エチレングリコール)(「PEG」)リンカーを用いて架橋している、Cab様受容体に結合する第一認識結合部分を含んでいる二重特異性分子に関する。本発明は、さらに、そのような二重特異性分子を産生する方法、及び、そのような二重特異性分子の治療における使用に関する。
Description
1.発明の分野
本発明は、ポリ-(エチレングリコール)(「PEG」)リンカーを用いて1以上の第二認識結合部分(これは、特定の分子に結合する)に架橋している第一認識結合部分(これは、C3b様受容体に結合する)を含んでいる二重特異性分子に関する。本発明は、さらに、そのような二重特異性分子を産生する方法、及び、治療におけるそのような二重特異性分子の使用に関する。
本発明は、ポリ-(エチレングリコール)(「PEG」)リンカーを用いて1以上の第二認識結合部分(これは、特定の分子に結合する)に架橋している第一認識結合部分(これは、C3b様受容体に結合する)を含んでいる二重特異性分子に関する。本発明は、さらに、そのような二重特異性分子を産生する方法、及び、治療におけるそのような二重特異性分子の使用に関する。
2.発明の背景
霊長類の赤血球(RBC)は、循環系から抗原を排除する上で重要な役割を果たす。循環系において免疫複合体が形成されると、霊長類における補体因子C3bが活性化され、その結果、C3bが該免疫複合体に結合する。このC3b/免疫複合体は、次に、該免疫複合体に結合したC3b分子を介して、赤血球の表面上で発現された1型補体受容体(CR1)であるC3b受容体に結合する。次いで、この免疫複合体は、肝臓及び脾臓内の細網内皮系(RES)まで赤血球により付き添われて、中和される。RES細胞、とりわけ、クッパー細胞と称される肝臓内の固定化組織マクロファージ(fixed-tissue macrophage)は、C3b/免疫複合体を認識し、C3b受容体-RBCの結合を切断することにより該複合体をRBCから分離し、遊離化された赤血球及びC3b/免疫複合体を生じさせる。これは、次いで、クッパー細胞に取り込まれ、クッパー細胞内の細胞下小器官内で完全に破壊される。しかしながら、この病原体排除プロセスは、補体依存性であり、即ち、C3b受容体により認識される免疫複合体に限定されており、C3b受容体により認識されない免疫複合体は除去することができない。
霊長類の赤血球(RBC)は、循環系から抗原を排除する上で重要な役割を果たす。循環系において免疫複合体が形成されると、霊長類における補体因子C3bが活性化され、その結果、C3bが該免疫複合体に結合する。このC3b/免疫複合体は、次に、該免疫複合体に結合したC3b分子を介して、赤血球の表面上で発現された1型補体受容体(CR1)であるC3b受容体に結合する。次いで、この免疫複合体は、肝臓及び脾臓内の細網内皮系(RES)まで赤血球により付き添われて、中和される。RES細胞、とりわけ、クッパー細胞と称される肝臓内の固定化組織マクロファージ(fixed-tissue macrophage)は、C3b/免疫複合体を認識し、C3b受容体-RBCの結合を切断することにより該複合体をRBCから分離し、遊離化された赤血球及びC3b/免疫複合体を生じさせる。これは、次いで、クッパー細胞に取り込まれ、クッパー細胞内の細胞下小器官内で完全に破壊される。しかしながら、この病原体排除プロセスは、補体依存性であり、即ち、C3b受容体により認識される免疫複合体に限定されており、C3b受容体により認識されない免疫複合体は除去することができない。
Taylorらは、補体に依存しないで循環系から病原体を除去する方法を見いだした。Taylorらは、霊長類C3b受容体に特異的な第一のモノクローナル抗体(mAb)と病原性抗原分子に特異的な第二のモノクローナル抗体を化学的に架橋させることにより、補体を活性化することなく病原性抗原分子を霊長類のC3b受容体に結合させるメカニズムを提供する二重特異性ヘテロ重合体抗体が得られることを示した。(米国特許第5,487,890号;米国特許第5,470,570号;及び、米国特許第5,879,679号)。抗C3b受容体に特異的なmAbのFc部分が、赤血球-免疫複合体の受容細胞(acceptor cell)への移動とその後の赤血球-免疫複合体のタンパク質分解において重要な役割を果たすことが分かっている(Nardinら, 1999, Molecular Immunology 36:827-835)。Taylorらは、通常の補体依存性プロセスでは病原体の約10〜15%が循環から除去されるのに比較して、この複合体に依存しないプロセスでは、99%を超える病原体を循環から除去することが可能であることを示した。さらに、Taylorにより、循環から病原性抗原に特異的な自己抗体を除去するために使用可能なHPについての報告が成された。そのようなHPは、「抗原ベースヘテロポリマー(antigen-based heteropolymer)(AHP)」とも称されるが、それは、抗原に架橋したCR1特異的モノクローナル抗体を含んでいる(例えば, 以下の文献を参照されたい:米国特許第5,879,679号; Lindorferら, 2001, Immunol Rev. 183: 10-24; Lindorferら, 2001, J Immunol Methods 248: 125-138; Fergusonら, 1995, Arthritis Rheum 38: 190-200)。
しかしながら、Taylorの方法には、ある種の欠点がある。第一に、架橋反応の化学があまり効率的でない。典型的には、そのような化学的架橋反応の収率は、約10%〜20%にすぎない。その結果、製造プロセスにおける化学的架橋ステップに際して、かなりな量の精製されたmAb又は病原体結合部分が失われる。例えば、標準的な化学的架橋剤(例えば, PierceのSATA, 及び,スルホ-SMCCなど)を使用した場合、1mgの純粋なmAb2に架橋した1mgの純粋なmAb1を使用して、本発明者らが生成させることができた純粋な生成物mAbl×mAb2は、0.2〜0.4mgにすぎない。第二に、化学的架橋により産生された二重特異性分子は化学的架橋剤のフラグメントを含んでおり、その架橋剤のフラグメントは免疫原性であり得る。架橋剤が有する免疫原性は、Taylorの二重特異性分子を同一の個体に再投与した場合に不利であり得る。それは、その個体が該架橋剤部分に対して免疫応答を起こす場合があり、同じ個体が該二重特異性分子の次の投与を受けたときに、その二重特異性分子に対して強い免疫応答を起こす可能性があるからである。その場合、そのような免疫応答がなかった場合に該二重特異性分子によりもたらされる治療上の利益が低減される。第三に、Taylorの特許に記載されている架橋プロセスは部位特異的ではなく、従って、mAb又は病原体認識領域の機能性がある程度低下する場合がある。従って、二重特異性分子を産生するためのさらに効率のよい方法が求められている。
本明細書における参考文献の議論又は引用例は、そのような参考文献を本発明の先行技術として位置づけるものであると見なされるべきではない。
3.発明の概要
本発明は、C3b様受容体又はその機能的等価物(霊長類において、補体受容体1(CR1)又はCD35として知られている)に結合する第一認識結合部分と、C3b様受容体以外の分子である特定の分子に結合する1以上の第二認識結合部分を含み、該第一認識結合部分が該第二認識結合部分にポリエチレングリコールリンカーを用いて架橋している二重特異性分子に関する。本発明は、さらに、そのような二重特異性分子を産生する方法、並びに、治療及び予防におけるその使用にも関し、また、そのような二重特異性分子含んでいるキットにも関する。
本発明は、C3b様受容体又はその機能的等価物(霊長類において、補体受容体1(CR1)又はCD35として知られている)に結合する第一認識結合部分と、C3b様受容体以外の分子である特定の分子に結合する1以上の第二認識結合部分を含み、該第一認識結合部分が該第二認識結合部分にポリエチレングリコールリンカーを用いて架橋している二重特異性分子に関する。本発明は、さらに、そのような二重特異性分子を産生する方法、並びに、治療及び予防におけるその使用にも関し、また、そのような二重特異性分子含んでいるキットにも関する。
好ましくは、本発明の二重特異性分子は、哺乳動物(好ましくは、ヒト)の循環から排除されるのが望ましい分子に結合する。好ましい実施形態では、哺乳動物(好ましくは、ヒト)の循環中において該分子の量が低減されるのが望ましい。一実施形態では、該分子は、病原体の抗原、即ち、細菌若しくはウイルスの抗原であるか、又は、毒素である。特定の実施形態では、第二認識結合部分が結合する前記分子は、病原性抗原分子である。別の特定の実施形態では、該分子は、自己免疫抗原である。さらに別の特定の実施形態では、該分子は、感染性疾患因子の抗原である。特定の実施形態では、第一認識結合部分は、CR1に結合する。
本発明の方法及び組成物においては、当技術分野で知られている任意のポリエチレングリコールリンカーを使用することが可能である。特定の実施形態では、本発明の二重特異性分子の産生において使用されるPEGリンカーは、式X-PEG-Y(式中、X及びYは、官能基を意味する)で表される二官能性PEGリンカーである。幾つかの実施形態では、X官能基とY官能基は同一であり、従って、該PEGリンカーは、ホモ-二官能性架橋剤である。別の実施形態では、X官能基とY官能基は異なっている。本発明は、本発明の二重特異性分子を産生する目的における、PEGリンカーを用いた第一認識結合部分又は第二認識結合部分の誘導体化を包含する。本発明は、第一認識結合部分又は第二認識結合部分がタンパク質を含有し、該第一認識結合部分又は該第二認識結合部分に含まれている1以上のアミノ酸が該二官能性PEGリンカーにより誘導体化されている二重特異性分子を包含する。本発明の方法を用いて、第一認識結合部分又は該第二認識結合部分に含まれている任意のアミノ酸を誘導体化することが可能である。好ましくは、誘導体化されるアミノ酸は、第一認識結合部分又は第二認識結合部分の表面上に存在している。好ましい実施形態では、本発明の架橋された二重特異性分子は、PEGリンカーを用いて架橋する前の第一認識結合部分又は第二認識結合部分と同一の結合活性を有している。
本発明の方法及び組成物で使用可能なPEGリンカーは、直鎖分子又は非直鎖分子であることが可能である。非直鎖PEG分子の例には、限定するものではないが、分枝鎖PEG、直鎖フォーク状PEG又は分枝鎖フォーク状PEGなどがある。
本発明は、PEGリンカーの使用を包含し、その際、該PEGリンカーの分子量は、5〜500ダルトンである。別の実施形態では、本発明の方法及び組成物で使用可能なPEGリンカーの分子量は、200〜20,000ダルトンである。別の実施形態では、本発明の方法及び組成物で使用可能なPEGリンカーの分子量は、500〜1000ダルトンである。さらに別の実施形態では、本発明の方法及び組成物で使用可能なPEGリンカーの分子量は、1000〜8000ダルトンである。
本発明の二重特異性分子の第一認識結合部分は、C3b様受容体(例えば, CR1)に結合する任意の分子を含有し得る。一実施形態では、C3b様受容体に結合する第一認識結合部分は、CR1に結合する抗体である。好ましい実施形態では、第一認識結合部分は、抗CR1モノクローナル抗体を含有する。一実施形態では、C3b様受容体に結合する抗体は、モノクローナル抗体、例えば、マウスモノクローナル抗体、例えば、マウス抗CR1抗体7G9、ヒト化モノクローナル抗体又はヒトモノクローナル抗体などである。さらに特定の実施形態では、C3b様受容体に結合する抗体は、非免疫化モノクローナル抗体である。非免疫化抗体(deimmunized antibody)は、非ヒト起源の抗体ではあるが1以上のアミノ酸が置換されることにより修飾されていて、そのような修飾を受ける前の最初の非ヒト抗体と比較した場合に、ヒトに対して免疫原性が低いか又は非免疫原性である抗体を意味する。本発明の方法で使用するための非免疫化抗体は、2003年3月28日に出願された米国特許出願番号第60/458,869号に記載されている方法のいずれかを用いて産生することができる(この特許出願は, 参照によりその全体を本明細書に組み入れる)。特定の実施形態では、CR1に結合する非免疫化モノクローナル抗体は、モノクローナル抗体H9であり、これは、以下の突然変異〔重鎖可変領域における, 17位:Ser → Thr; 25位:Thr → Ser; 29位:Ile → Met; 44位:Asn → Lys; 45位:Lys → Gly; 49位:Met → Ile; 71位:Thr → Ser; 83位:Leu → Met;及び、114位:Ala → Gln;軽鎖可変領域における, 15位:Leu → Val; 53位:Lys → Tyr; 80位:His → ser; 104位:Gly → Pro; 107位:Thr → Lys; 108位:Leu → Val;及び、 111位:Arg → Lys〕を含んでいるモノクローナル抗体E11(マウスハイブリドーマE11, カタログ番号; 184-020, Ancell Immunology Research Products, MN)に由来する。
別の実施形態では、第一認識結合部分は、Fc領域に結合した単鎖Fvフラグメントであるか、又は、C3b様受容体結合領域とFcを有するキメラ抗体である。
本発明の二重特異性分子の第二認識結合部分は、特定の分子に結合する任意の分子又はそのフラグメントであることが可能である。特に、該分子は、哺乳動物の循環から排除されるのが望ましい。好ましい実施形態では、該分子は、哺乳動物の循環において、その量が低減されるのが望ましい。一実施形態では、第二認識結合部分は、抗原分子、例えば、病原体の天然抗原に結合する。該抗原分子は、哺乳動物の循環中に存在する哺乳動物にとって潜在的に有害であるか又は哺乳動物の体内において潜在的に望ましくない任意の物質であることが可能であり、そのようなものには、限定するものではないが、タンパク質若しくは薬物若しくは毒素、自己抗体若しくは自己抗原、又は、任意の感染因子の分子若しくはその産物などがある。哺乳動物の循環から排除される前記分子は、哺乳動物において疾患若しくは障害又は別の任意の望ましくない状態の原因となる物質(例えば、病原体)であるか又はそのような物質の一部分である抗原決定基(又は、抗原決定基以外で結合領域が結合可能であるもの)であることが可能である。本発明の第二認識結合部分は、任意の種類の分子であることが可能であり、そのようなものとしては、限定するものではないが、ペプチド、ポリペプチド、核酸、オリゴ糖又は有機小分子などがある。
好ましい実施形態では、第二認識結合部分は、バシルス・アンスラシス(Bacillus anthracis)の防御抗原(PA)タンパク質に結合する。さらに別の好ましい実施形態では、第二認識結合部分は、バシルス・アンスラシス(Bacillus anthracis)の防御抗原(PA)タンパク質に結合するマウスモノクローナル抗体14B7であるか、又は、バシルス・アンスラシス(Bacillus anthracis)の防御抗原(PA)タンパク質に結合するその抗原結合性フラグメントである。
別の実施形態では、第二認識結合部分は、哺乳動物の循環から排除される抗原分子に結合する抗体であるか、又は、哺乳動物の循環から排除される抗原分子に結合するその抗原結合性抗体フラグメントである。本発明の二重特異性分子の産生において使用可能な抗原結合性抗体フラグメントには、限定するものではないが、Fabフラグメント、Fab'フラグメント、(Fab)'2フラグメント、Fvフラグメント、又は、sFvフラグメントなどがある。
一実施形態では、本発明の二重特異性分子は、PEGリンカーを用いて第一認識結合部分に架橋している単一の第二認識結合部分を含んでいる。代替的な実施形態では、本発明の二重特異性分子は、PEGリンカーを用いて第一認識結合部分の異なった領域に架橋している2つ以上の第二認識結合部分を含んでいる。第一認識結合部分が抗体(即ち、抗CR1抗体)を含み且つ本発明の二重特異性分子が2つの第二認識結合部分を含んでいる特定の実施形態では、該2つの第二認識結合部分は、PEGリンカーを用いて、第一認識結合部分の重鎖のそれぞれに架橋させることができる。本発明の二重特異性分子に2つ以上の第二認識結合部分が含まれている場合、そのような第二認識結合部分は、同一の認識結合部分又は異なった認識結合部分であることが可能である。本発明の好ましい実施形態では、第一認識結合部分及び第二認識結合部分は、協力して排除される分子を標的にする。 別の実施形態では、第一認識結合部分及び第二認識結合部分は、異なった分子を標的にする異なった認識結合部分である。
本発明は、二重特異性分子の集団を産生する方法を包含し、該方法は、C3b様受容体に結合する抗体を1以上の認識結合部分と接触させることを含んでなり、ここで、該抗体は二官能性ポリ-(エチレン)グリコール(PEG)リンカーとコンジュゲートさせ、該1以上の認識結合部分は該二官能性ポリ-(エチレン)グリコール(PEG)リンカーと反応するように誘導体化し、該1以上の認識結合部分が特定の分子と結合するが、ここで、前記接触は、該誘導体化された認識結合部分が該PEGリンカーと反応して共有結合を形成するような条件下で行わせ、それにより、二重特異性分子の集団を生成させる。特定の実施形態では、前記分子は、哺乳動物の循環から排除されるのが望ましい。さらに別の特定の実施形態では、前記分子は、哺乳動物の循環中においてその量が低減されるのが望ましい。特定の実施形態では、1以上の認識結合部分の誘導体化は、チオール特異的誘導体化剤、ヒドラジン若しくはアルデヒド修飾剤を用いて前記1以上の認識結合部分をチオール化することを含む。
本発明は、さらに、二重特異性分子の集団を産生する方法を包含し、該方法は、抗CR1抗体をNHS-ポリ-(エチレン)グリコール(PEG)-マレイミドと接触させて、該抗CR1抗体の1以上の部位を該NHS-PEG-マレイミドのNHS官能基で誘導体化すること; 認識結合部分をN-スクシンイミジル-S-アセチル-チオアセテート(SATA)と接触させて、1以上の遊離チオールを含むように該認識結合部分を誘導体化すること(ここで、該認識結合部分は特定の分子に結合する); ポリ-(エチレン)グリコール(PEG)で誘導体化された前記抗CR1抗体をチオールで誘導体化された前記認識結合部分と結合させることを含み、それにより、二重特異性分子の集団を産生する。特定の実施形態では、認識結合部分は、バシルス・アンスラシス(Bacillus anthracis)(炭疽菌)の防御抗原(PA)タンパク質に結合する。一実施形態では、認識結合部分に結合する前記分子は、自己免疫抗原であるか、又は、感染性疾患因子の抗原である。
特定の実施形態では、本発明は、二重特異性分子の集団を産生する方法を包含し、該方法は、抗CR1抗体をNHS-ポリ-(エチレン)グリコール(PEG)-ベンズアルデヒド(PBA)と接触させて、該抗CR1抗体の1以上の部位を誘導体化すること; 認識結合部分をC6 4-ヒドラジノ-ニコチンアミドアセトンヒドラゾン(Hz)と接触させて、該認識結合部分を誘導体化すること(ここで、該認識結合部分は特定の分子に結合する); ポリ-(エチレン)グリコール(PEG)で誘導体化された前記抗CR1抗体をヒドラゾンで誘導体化された前記認識結合部分と結合させることを含み、それにより、二重特異性分子の集団を産生する。本発明は、本明細書中で開示され例示されているPEGリンカーのようなヒドラジン/カルボニル官能基対を含む任意のPEGリンカー(例えば、NHS-ポリ-(エチレン)グリコール(PEG)-ベンズアルデヒド(PBA)、N-ヒドロキシ-スクシンイミジル-PEG-ヒドラジノニコチネートなど)を用いて二重特異性分子を産生することを包含する。
特定の実施形態では、認識結合部分は、バシルス・アンスラシス(Bacillus anthracis)(炭疽菌)の防御抗原(PA)タンパク質に結合する。一実施形態では、認識結合部分に結合する分子は、自己免疫抗原であるか、又は、感染性疾患因子の抗原である。幾つかの実施形態では、本発明は、NHS-ポリ-(エチレン)グリコール(PEG)-ベンズアルデヒドで誘導体化された抗CR1抗体とヒドラゾンで誘導体化された認識結合部分を結合させ、それにより二重特異性分子の集団を産生することを包含する。
本発明は、ポリエチレングリコールリンカーを含んでいるC3b様受容体に結合する抗体の集団を産生する方法を包含し、該方法は、該抗体をポリエチレングリコールリンカーと接触させて、該抗体の1以上の部位を該ポリエチレングリコールリンカーで誘導体化することを含み、それにより、PEGで誘導体化された抗体の集団を産生する。
本発明は、さらに、哺乳動物の循環中における前記分子の存在に関連した望ましくない状態にある哺乳動物を治療するのに有効な量の本発明の二重特異性分子及び製薬上許容される担体を含む医薬組成物も包含する。
本発明は、ポリエチレングリコールで誘導体化された抗CR1抗体を含んでいる第一の容器;抗CR1抗体以外の認識結合部分を含んでいる第二の容器;及び、1以上の前記認識結合部分を誘導体化するのに適した誘導体化剤を含んでいる第三の容器を含むキットを包含する。
本発明は、哺乳動物の循環中の前記分子の存在に関連する該哺乳動物の障害を治療する方法を提供し、該方法は、治療有効量の本発明の二重特異性分子を投与することを含んでなる。
4.図面の簡単な説明
図1. 14B7IgG-PEG-7G9IgGを産生する架橋方法についての例示的なプロセスを要約しているフローチャート
二重特異性分子14B7IgG-PEG-7G9IgGの産生に含まれているステップを図式的に例示している。
図1. 14B7IgG-PEG-7G9IgGを産生する架橋方法についての例示的なプロセスを要約しているフローチャート
二重特異性分子14B7IgG-PEG-7G9IgGの産生に含まれているステップを図式的に例示している。
図2. 粗14B7IgG-PEG-7G9IgGのクロマトグラフプロフィール
14B7IgG-PEG-7G9IgGの粗調製物の溶出プロフィールが示されている。使用したカラムは、Hi Prep 26/60 Sephacryl S300である。ランニングバッファーは、PBSE(50mM KP04+150mM NaCl+1mM EDTA(pH7.8)である。
14B7IgG-PEG-7G9IgGの粗調製物の溶出プロフィールが示されている。使用したカラムは、Hi Prep 26/60 Sephacryl S300である。ランニングバッファーは、PBSE(50mM KP04+150mM NaCl+1mM EDTA(pH7.8)である。
A. この溶出プロフィールは、8:1のモル比(8×NHS-PEG-マレイミド:1×7G9IgG)を用いて調製した14B7IgG-PEG-7G9IgGの粗調製物のプロフィールを表している。
B. この溶出プロフィールは、16:1のモル比(16×NHS-PEG-マレイミド:1×7G9IgG)を用いて調製した14B7IgG-PEG-7G9IgGの粗調製物のプロフィールを表している。
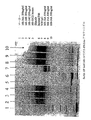
図3. 14B7IgG-PEG-7G9IgGのSDS-PAGE分析
14B7IgG-PEG-7G9IgGの集団をSDS-PAGEで分析して、存在している各分子種のSEC300分別後の移動性を確認した。HMW画分、LMW画分及び単量体画分からの画分について分析した。
14B7IgG-PEG-7G9IgGの集団をSDS-PAGEで分析して、存在している各分子種のSEC300分別後の移動性を確認した。HMW画分、LMW画分及び単量体画分からの画分について分析した。
A. レーン1:IgM標準; レーン2:IgA標準; レーン3:IgG標準; レーン4:1:8のモル比で調製した粗14B7IgG-PEG-7G9IgG; レーン5及び6:1:4のモル比での調製におけるLMW画分及び単量体画分; レーン7〜9:1:8のモル比での調製におけるHMW画分、LMW画分及び単量体画分; レーン10〜12:1:16のモル比での調製におけるHMW画分、LMW画分及び単量体画分; レーン13:Mav 7G9標準。
B. レーン1:MW標準; レーン2〜4:1:4のモル比での調製におけるHMW画分、LMW画分及び単量体画分; レーン5〜7:1:8のモル比での調製におけるHMW画分、LMW画分及び単量体画分; レーン8〜10:1:16のモル比での調製におけるHMW画分、LMW画分及び単量体画分。
図4. 14B7-PEG-7G9調製物の分子量分布
1:4、1:8、及び、1:16のモル比で14B7-PEG-7G9を産生したときに生成された分子種の分子量分布を表す棒グラフ
図5A. 14B7scAb-PEG-7G9を産生する架橋方法についての例示的なプロセスを要約しているフローチャート
2:1のコンジュゲートを使用し、SATA及びNHS-PEG-MALを用いて、14B7scAbと7G9を架橋するための例示的なプロセスを示している。
1:4、1:8、及び、1:16のモル比で14B7-PEG-7G9を産生したときに生成された分子種の分子量分布を表す棒グラフ
図5A. 14B7scAb-PEG-7G9を産生する架橋方法についての例示的なプロセスを要約しているフローチャート
2:1のコンジュゲートを使用し、SATA及びNHS-PEG-MALを用いて、14B7scAbと7G9を架橋するための例示的なプロセスを示している。
図5B. 14B7scAb-PEG-7G9のSDS-PAGE分析
産生された二重特異性分子14B7scAb-PEG-7G9Aを含んでいるトリス-グリシン SDS PAGE(第2レーン及び第8レーン)
図6A. 14B7Fab-PEG-7G9を産生する架橋方法についての例示的なプロセスを要約しているフローチャート
2:1のコンジュゲートを使用し、SATA及びNHS-PEG-MALを用いて、14B7Fabと7G9を架橋するための例示的なプロセスを示している。
産生された二重特異性分子14B7scAb-PEG-7G9Aを含んでいるトリス-グリシン SDS PAGE(第2レーン及び第8レーン)
図6A. 14B7Fab-PEG-7G9を産生する架橋方法についての例示的なプロセスを要約しているフローチャート
2:1のコンジュゲートを使用し、SATA及びNHS-PEG-MALを用いて、14B7Fabと7G9を架橋するための例示的なプロセスを示している。
図6B. 14B7Fab-PEG-7G9のSDS-PAGE分析
産生された二重特異性分子14B7Fab-PEG-7G9を含んでいるトリス-グリシン SDS PAGE(第7レーン)。
産生された二重特異性分子14B7Fab-PEG-7G9を含んでいるトリス-グリシン SDS PAGE(第7レーン)。
図7. 14B7-HZ-PEG-H9の溶出プロフィール
Suprose6カラム(Amersham)をPBSG(PBS, 5%グリセロール)で平衡化した。流速は0.8mL/分であった。0.5mLのサンプルを注入し、画分を収集した。
Suprose6カラム(Amersham)をPBSG(PBS, 5%グリセロール)で平衡化した。流速は0.8mL/分であった。0.5mLのサンプルを注入し、画分を収集した。
図8. 14B7-HZ-PEG-H9のSDS-PAGE分析
サイズ排除カラムからの画分を、3−8%トリスアセテート勾配ゲルで分析した。
サイズ排除カラムからの画分を、3−8%トリスアセテート勾配ゲルで分析した。
5.発明の詳細な説明
本発明は、C3b様受容体又はその機能的等価物(霊長類において、補体受容体1(CR1)又はCD35として知られている)に結合する第一認識結合部分と、C3b様受容体以外の分子である特定の分子に結合する1以上の第二認識結合部分を含み、該第一認識結合部分が該第二認識結合部分にポリエチレングリコールリンカーを用いて架橋している二重特異性分子に関する。本発明は、さらに、そのような二重特異性分子を産生する方法、並びに、治療及び予防におけるその使用にも関し、また、そのような二重特異性分子含んでいるキットにも関する。
本発明は、C3b様受容体又はその機能的等価物(霊長類において、補体受容体1(CR1)又はCD35として知られている)に結合する第一認識結合部分と、C3b様受容体以外の分子である特定の分子に結合する1以上の第二認識結合部分を含み、該第一認識結合部分が該第二認識結合部分にポリエチレングリコールリンカーを用いて架橋している二重特異性分子に関する。本発明は、さらに、そのような二重特異性分子を産生する方法、並びに、治療及び予防におけるその使用にも関し、また、そのような二重特異性分子含んでいるキットにも関する。
5.1 二重特異性分子
本発明は、2つ以上の異なった認識特異性を有する二重特異性分子を包含する。本発明の二重特異性分子は、C3b様受容体に結合する第一認識結合部分及びC3b様受容体以外の特定の分子に結合する1以上の第二認識結合部分を含んでいる分子を意味する。本明細書で使用される場合、第一認識結合部分は、C3b様受容体のための結合部位を含有する化学物質を含んでおり、第二認識結合部分は、C3b様受容体以外の特定の分子(例えば、哺乳動物の循環から排除される分子)のための結合部位を含有する化学物質を含んでいる。
本発明は、2つ以上の異なった認識特異性を有する二重特異性分子を包含する。本発明の二重特異性分子は、C3b様受容体に結合する第一認識結合部分及びC3b様受容体以外の特定の分子に結合する1以上の第二認識結合部分を含んでいる分子を意味する。本明細書で使用される場合、第一認識結合部分は、C3b様受容体のための結合部位を含有する化学物質を含んでおり、第二認識結合部分は、C3b様受容体以外の特定の分子(例えば、哺乳動物の循環から排除される分子)のための結合部位を含有する化学物質を含んでいる。
特定の実施形態では、本発明の二重特異性分子は、哺乳動物の循環から排除されるのが望ましい分子に結合する。別の特定の実施形態では、本発明の二重特異性分子は、哺乳動物の循環中においてその量が低減されるのが望ましい分子に結合する。哺乳動物の循環から排除される分子は、哺乳動物の循環中に存在する哺乳動物にとって潜在的に有害であるか又は哺乳動物の体内において潜在的に望ましくない任意の物質であることが可能であり、そのようなものには、限定するものではないが、タンパク質若しくは薬物若しくは毒素、自己抗体若しくは自己抗原、又は、任意の感染因子の分子若しくはその産物などがある。さらにまた、哺乳動物の循環から排除される前記分子は、病原性抗原分子であることが可能であり、これは、哺乳動物において疾患若しくは障害又は別の任意の望ましくない状態の原因となる物質(例えば、病原体)であるか又はそのような物質の一部分である抗原決定基(又は、抗原決定基以外で結合領域が結合可能であるもの)を含んでいる任意の分子である。本発明の二重特異性分子は、第一認識結合部分又は第二認識結合部分の機能を損なわないポリ-エチレングリコール(PEG)リンカーを介して第一認識結合部分と1以上の第二認識結合部分を架橋させることにより産生する。
本明細書で使用される場合、用語「C3b様受容体」は、免疫複合体に会合した分子に結合し、次いで例えば食細胞まで血液細胞に付き添われて排除されるという点で霊長類C3b受容体(CR1)に似た機能を有する、哺乳動物血液細胞の表面上に発現される任意の哺乳動物循環分子を意味する。本明細書で使用される場合、「エピトープ」は、抗原決定基、即ち、宿主内で免疫学的応答を惹起するか又は抗体に結合された分子の領域を意味する。この領域は、連続したアミノ酸を含んでいてもよいが、必ずしも含んでいる必要ではない。エピトープという用語は、当技術分野において「抗原決定基」としても知られている。エピトープは、空間的コンホメーション中に少なくて3つのアミノ酸を含むことができ、これは、宿主の免疫系に固有のものである。一般的に、エピトープは、少なくとも5つのそのようなアミノ酸からなり、より一般的には、少なくとも8〜10のそのようなアミノ酸からなる。そのようなアミノ酸の空間的コンホメーションを決定する方法は、当技術分野では知られている。本明細書で使用される場合、抗原結合抗体フラグメント(抗原結合性抗体フラグメント)は、完全抗体よりは小さく、抗原が結合する抗体の領域を含んでいる抗体フラグメントを意味する。
本発明において、本発明の二重特異性分子の第一認識結合部分は、C3b様受容体(例えば, CR1)に結合する任意の分子であり得る。特定の実施形態では、第一認識結合部分は、Fc領域及びCR1のための結合領域を含んでいる抗体である。好ましい実施形態では、第一認識結合部分は、抗CR1抗体である。さらに別の好ましい実施形態では、第一認識結合部分は、抗CR1モノクローナル抗体である。別の好ましい実施形態では、抗CR1モノクローナル抗体は、7G9、HB8592、3D9、57F、又は、1B4である(例えば, 以下の特許を参照されたい:Talyorら, 米国特許第5,487,890号(前記特許は, 参照によりその全体を本明細書内に組み入れる))。さらに特定の実施形態では、C3b様受容体に結合する抗体は、非免疫化モノクローナル抗体である。非免疫化抗体は、非ヒト起源の抗体ではあるが、例えば1以上のアミノ酸が置換されることにより修飾されていて、そのような修飾を受ける前の最初の非ヒト抗体と比較した場合に、ヒトに対して免疫原性が低いか又は非免疫原性である抗体を意味する。本発明の方法で使用するための非免疫化抗体は、2003年3月28日に出願された米国特許出願番号第60/458,869号に記載されている方法のいずれかを用いて産生することができる。この特許出願は、参照によりその全体を本明細書に組み入れる。特定の実施形態では、CR1に結合する非免疫化モノクローナル抗体は、モノクローナル抗体H9であり、これは、以下の突然変異〔重鎖可変領域における, 17位:Ser → Thr; 25位:Thr → Ser; 29位:Ile → Met; 44位:Asn → Lys; 45位:Lys → Gly; 49位:Met → Ile; 71位:Thr → Ser; 83位:Leu → Met;及び、114位:Ala → Gln;軽鎖可変領域における, 15位:Leu → Val; 53位:Lys → Tyr; 80位:His → Ser; 104位:Gly → Pro; 107位:Thr → Lys; 108位:Leu → Val;及び、 111位:Arg → Lys〕を含んでいるモノクローナル抗体E11(マウスハイブリドーマE11, カタログ番号 184-020, Ancell Immunology Research Products, MN)に由来する。
別の実施形態では、第一認識結合部分は抗CR1抗体であり、それには、限定するものではないが、免疫グロブリンFc領域のN-末端に融合したC3b様受容体に対する特異性を有する単鎖可変領域フラグメント(scFv)などが包含される。
第一認識結合部分は、さらにまた、キメラ抗体であることも可能である。そのようなキメラ抗体は、例えば、限定するものではないが、相補性決定領域がマウスであり且つフレームワーク領域がヒトであって、それにより、該抗体で処置されたヒト患者における免疫応答が生起する可能性が低減されているヒト化モノクローナル抗体などである(米国特許第4,816,567号;米国特許第4,816,397号;米国特許第5,693,762号;米国特許第5,585,089号;米国特許第5,565,332号及び米国特許第5,821,337号(これらの特許は, 参照によりその全体を本明細書に組み入れる))。好ましくは、キメラ抗体のFc領域は、食細胞上のFc受容体により認識されることができ、それにより、RBC-免疫複合体の移動及びそれに続くタンパク質分解が促進される。簡単にするために、本明細書における開示は、しばしば、抗CR1認識結合部分又は抗CR1抗体に言及しているが、そのような抗原認識結合部分又は抗体が当技術分野で知られている任意のC3b様受容体に結合する任意の認識結合部分又は抗体を意味することは理解される。
本発明において、本発明の二重特異性分子の第二認識結合部分は、限定するものではないが、哺乳動物の循環から排除される分子(例えば、病原性抗原分子)を認識してそれに結合する抗体又はその抗原結合性フラグメントなどの、任意の分子部分であることが可能である。例えば、第二認識結合部分は、循環系から排除される抗体(例えば、自己免疫疾患を引き起こす抗体など)が結合する抗原決定基又はエピトープであることが可能である。本発明の二重特異性分子の第二認識結合部分には、非タンパク質性部分も包含される。一実施形態では、第二認識結合部分は、核酸である。別の実施形態では、第二認識結合部分は、有機小分子である。さらに別の実施形態では、第二認識結合部分は、オリゴ糖である。
本発明において、第二認識結合部分は、抗原分子に結合する抗体の抗原結合性抗体フラグメントであることが可能である。抗原結合性抗体フラグメントを含んでいる二重特異性分子を産生する方法は、2002年9月16日に出願された米国仮特許出願第(未指定)(代理人事件整理番号9635-041-888)に開示されている。この特許は、参照によりその全体を本明細書に組み入れる。本発明の二重特異性分子の抗原結合性抗体フラグメントは、哺乳動物の循環から排除される分子(限定するものではないが、例えば、病原性抗原分子など)を認識してそれに結合する抗体の任意の抗原結合性フラグメントであることができる。好ましくは、そのような抗原結合性抗体フラグメントは、Fc領域を含まない。好ましい実施形態では、抗原結合性抗体フラグメントは、免疫グロブリン分子の、Fabフラグメント、Fab'フラグメント、(Fab')2フラグメント又はFvフラグメントである。そのようなFabフラグメント、Fab'フラグメント又はFvフラグメントは、例えば、完全抗体から酵素的プロセシングにより得ることができるか、又は、ファージディスプレイライブラリーからアフィニティースクリーニングとそれに続く組換え発現により得ることができる(例えば, 以下の文献を参照されたい:Watkinsら, Vox Sanguinis 78:72-79;米国特許第5,223,409号及び米国特許第5,514,548号;PCT公開第WO92/18619号;PCT公開第WO91/17271号;PCT公開第WO92/20791号;PCT公開第WO92/15679号;PCT公開第WO93/01288号;PCT公開第WO92/01047号;PCT公開第WO92/09690号;PCT公開第WO90/02809号;Fuchsら, 1991, Bio/Technology 9:1370-1372;Hayら, 1992, Hum. Antibod. Hybridomas 3:81-85;Huseら, 1989, Science 246:1275-1281;Griffithsら, 1993, EMBO J. 12:725-734;及び, McCaffertyら, 1990, Nature 348:552-554(前記文献の各々は, 参照によりその全体を本明細書に組み入れる))。別の好ましい実施形態では、抗原結合性抗体フラグメントは単鎖Fv(scFv)フラグメントであり、これは、例えば、ファージディスプレイ抗体フラグメントのライブラリーからアフィニティースクリーニングとそれに続く組換え発現により得ることができる。別の実施形態では、抗原結合性抗体フラグメントは、選択されたアミノ酸配列を含んでいる所望の鎖長のリンカーペプチドと融合したFabフラグメント、Fab'フラグメント、(Fab')2フラグメント、Fvフラグメント又はscFvフラグメントである。好ましい実施形態では、該リンカーペプチドは、1つのアミノ酸、2つのアミノ酸、5つのアミノ酸、10のアミノ酸、又は、20のアミノ酸からなる。
本発明の一実施形態では、本発明の二重特異性分子は、ポリ-エチレングリコールリンカーを用いて2つ以上の第二認識結合部分に架橋している第一認識結合部分(例えば、抗CR1モノクローナル抗体)を含んでいる。幾つかの実施形態では、該2つの第二認識結合部分は、同一の認識結合部分である。別の実施形態では、該2つの第二認識結合部分は、異なった認識結合部分である。該2つの第二認識結合部分は、同一の分子を標的とする異なった認識結合部分であることが可能である。
本発明の好ましい実施形態では、該2つの第二認識結合部分は、哺乳動物の循環から協力して排除される抗原分子を標的にする。非限定的な例として、第二認識結合部分のうちの一方は、他方の第二認識結合部分の結合親和性を高めるように該抗原分子のコンフォメーションを改変し、それにより、哺乳動物の循環からの該抗原分子の排除を促進する(Thaliら, J. Acquired Immune Deficiency Syndromes 5:591-599)。該2つの第二認識結合部分は、哺乳動物の循環から排除される異なった抗原を標的とする異なった認識結合部分であることも可能である。そのような第二認識結合部分には、限定するものではないが、ポリペプチド、ペプチド、抗原結合領域、エピトープ、核酸又は有機小分子などがある。
好ましい実施形態では、本発明の二重特異性分子は、ポリエチレングリコールリンカーを用いて1つ以上の第二認識結合部分に架橋している抗CR1抗体(即ち、抗CR1モノクローナル抗体)を含有する。特定の実施形態では、本発明の二重特異性分子は、ポリエチレングリコールリンカーを用いて、少なくとも1、2、3、4、5又は6の第二認識結合部分に架橋している抗CR1抗体(即ち、抗CR1モノクローナル抗体)を含有する。好ましくは、架橋されている該二重特異性分子は、それらが誘導された元の分子が有する抗原特異性を保持している。第一認識結合部分が抗体を含んでいる一実施形態では、第二認識結合部分は、ポリエチレングリコールリンカーを用いて該抗体の所定の部位(即ち、抗CR1抗体のFc領域)に架橋させる。好ましくは、そのような所定の部位は、第一認識結合部分又は第二認識結合部分がそれらのそれぞれの抗原に結合するのに対して悪影響を与えない。第一認識結合部分又は第二認識結合部分がタンパク質を含み且つ第一認識結合部分と第二認識結合部分がPEGリンカーを用いて所定の部位で架橋されている最も好ましい実施形態では、そのような所定の部位は、第一認識結合部分又は第二認識結合部分の表面に存在する。
第一認識結合部分が抗体を含んでいる本発明の好ましい実施形態では、1以上の第二認識結合部分は、ポリエチレングリコールリンカーを用いて、第一認識結合部分(即ち、抗CR1抗体)の重鎖又は軽鎖のいずれかに架橋している。第一認識結合部分が抗体を含んでいるさらに別の好ましい実施形態では、1以上の第二認識結合部分は、ポリエチレングリコールリンカーを用いて、第一認識結合部分(即ち、抗CR1抗体)の重鎖又は軽鎖のいずれかに架橋しているが、但し、該架橋は、カルボキシ末端を介したモノではない。本発明には別の立体配置も包含されることは、当業者には理解される。非限定的な例には、限定するものではないが、第二認識結合部分の一方がポリエチレングリコールリンカーを用いて重鎖に架橋し且つ他方の第二認識結合部分がポリエチレングリコールリンカーを用いて軽鎖に架橋している立体配置などがある。
本発明は、当技術分野で知られている任意のポリエチレングリコールリンカーを本発明の二重特異性分子を産生するために使用することを包含する。本発明は、当技術分野で知られている任意のポリエチレングリコールリンカーを用いて本発明の二重特異性分子の第一認識結合部分又は第二認識結合部分を誘導体化することを包含する。好ましい実施形態では、該ポリエチレングリコールリンカーは、二官能性ポリエチレングリコールである。本発明の方法及び組成物において使用するために、当業者に知られている任意の方法を用いて、ポリエチレングリコールリンカーを使用して第一認識結合部分又は第二認識結合部分を誘導体化することができる。ポリエチレングリコールリンカーを使用して第一認識結合部分又は第二認識結合部分を誘導体化した後、架橋しようとする他方の認識領域を、それがポリエチレングリコールで誘導体化された分子と反応して本発明の架橋された二重特異性分子を生成できるように、当業者に知られている任意の誘導体化試薬を用いて誘導体化又は活性化する。簡単にするために、本明細書における開示は、しばしば、ポリエチレングリコールリンカーで誘導体化された第一認識結合部分について言及しているが、本発明の二重特異性分子を産生するために、第一認識結合部分又は第二認識結合部分をポリエチレングリコールリンカーで誘導体化することができ、他方の部分は、それがポリエチレングリコールで誘導体化された部分と反応するように特定の試薬を用いて誘導体化することは、当業者には明らかである。
本発明は、さらに、ポリエチレングリコールリンカーを用いて1つ以上の第二認識結合部分(これは、特定の分子に結合する)に架橋された第一認識結合部分(これは、C3b様受容体(例えば、抗CR1抗体)に結合する)をそれぞれが含んでいる二重特異性分子のポリクローナル集団も提供する。特定の実施形態では、該分子は、哺乳動物の循環から排除されるのが望ましい。本発明の二重特異性分子のポリクローナル集団は、概して、C3b様受容体に結合する抗CR1抗体とそれにPEGリンカーを介して架橋している1つ以上の別の認識結合部分(これは、特定の分子に結合する)をそれぞれが含有する複数の異なった二重特異性分子を含んでいる任意の集団を意味する。従って、そのような集団は、異なった認識結合部分を介して複数の異なった結合特異性を示す複数の異なった二重特異性分子を含んでいる。そのような複数の異なった認識結合部分は、病原体の同一のエピトープを認識してそれに結合することができる。複数の異なった認識結合特異性は、病原体の複数の異なったエピトープを標的とすることも可能である。複数の異なった認識結合特異性は、1種類の病原体の複数の異なった変異株を標的とすることも可能である。複数の異なった認識結合特異性は、さらに、複数の異なった病原体を標的とすることも可能である。複数の異なった認識結合特異性は、さらに、複数の異なった病原体上の複数の異なったエピトープを標的とすることも可能である。ポリクローナル集団中の複数の二重特異性分子内の各二重特異性分子の特性及び機能は、知ることが可能であるか又は不可能である。ポリクローナル集団中の複数の二重特異性分子内の各二重特異性分子の正確な割合も、知ることが可能であるか又は不可能である。最適の治療効果及び/又は予防効果を得るために、必要に応じて、ポリクローナル集団中の複数の二重特異性分子内の二重特異性分子の正確な割合を調節することが可能となるように、ポリクローナル集団中の複数の二重特異性分子内の少なくとも幾つかの二重特異性分子の特性及び割合は、知られているのが好ましい。二重特異性分子のポリクローナル集団は、標的となる1以上の病原性抗原分子に結合しない二重特異性分子を含んでいることも可能である。例えば、二重特異性分子の集団は、標的病原体上に存在するもの以外の抗原分子に結合する抗体を含んでいる高度免疫血清から調製することができる。好ましくは、ポリクローナル集団中の複数の二重特異性分子は、該集団の、少なくとも、1%、5%、10%、20%、50%、又は、80%を構成する。さらに好ましくは、ポリクローナル集団中の複数の二重特異性分子は、該集団の少なくとも90%を構成する。二重特異性分子のポリクローナル集団中の複数の二重特異性分子は、好ましくは、複数の二重特異性分子のうちの95%、80%又は60%を超える割合を有する単一の二重特異性分子を全く含まない。さらに好ましくは、二重特異性分子のポリクローナル集団中の複数の二重特異性分子は、複数の二重特異性分子のうちの50%を超える割合を有する単一の二重特異性分子を全く含まない。ポリクローナル集団中の複数の二重特異性分子は、異なった抗原結合特異性を有する少なくとも2つの異なった二重特異性分子を含んでいる。好ましくは、ポリクローナル集団中の複数の二重特異性分子は、異なった抗原結合特異性を有する少なくとも10の異なった二重特異性分子を含んでいる。さらに好ましくは、ポリクローナル集団中の複数の二重特異性分子は、異なった抗原結合特異性を有する少なくとも100の異なった二重特異性分子を含んでいる。ポリクローナル集団は、例えば限定するものではないがポリクローナル免疫グロブリン調製物のような抗原認識部分の適切なポリクローナル集団から生成されるポリクローナル集団であることができる。
5.2 認識結合部分の産生
5.2.1 抗CR1抗体の産生
本発明の二重特異性分子は、特定の分子に結合する1以上の第二認識結合部分にポリエチレングリコールリンカーを用いて架橋している第一認識結合部分(これは、C3b様受容体に結合する)を含んでいる。好ましくは、該分子は、哺乳動物の循環から排除されるのが望ましい。本発明は、本発明の方法及び組成物で使用するためのPEGで誘導体化されている分子の集団を産生するために、当技術分野で知られている任意のPEGリンカーで第一認識結合部分を誘導体化することを包含する。好ましい実施形態では、第一認識結合部分は、C3b様受容体(即ち、抗CR1抗体)に結合する抗体である。C3b様受容体に結合する抗体は、当技術分野で知られている任意の方法を用いて、その1以上の部位をPEGリンカーで誘導体化することができる。好ましい実施形態では、PEGリンカーで誘導体化される、C3b様受容体に結合する抗体は、誘導体化されていない該抗体と同一の活性(即ち、C3b様受容体に対する結合親和性)を有する。さらに別の好ましい実施形態では、PEGリンカーで誘導体化される、C3b様受容体に結合する抗体は、誘導体化されていない該抗体と比較して、少なくとも、50%、60%、70%、80%、90%又は99%の活性を有する。本発明は、PEGリンカーを含んでいる、C3b様受容体に結合する抗体の集団を調製する方法を包含し、該方法は、該抗体をPEGリンカーと接触させて、抗体の1以上の部位をPEGリンカーで誘導体化することを含み、それにより、PEGで誘導体化された抗体の集団を産生する。
5.2.1 抗CR1抗体の産生
本発明の二重特異性分子は、特定の分子に結合する1以上の第二認識結合部分にポリエチレングリコールリンカーを用いて架橋している第一認識結合部分(これは、C3b様受容体に結合する)を含んでいる。好ましくは、該分子は、哺乳動物の循環から排除されるのが望ましい。本発明は、本発明の方法及び組成物で使用するためのPEGで誘導体化されている分子の集団を産生するために、当技術分野で知られている任意のPEGリンカーで第一認識結合部分を誘導体化することを包含する。好ましい実施形態では、第一認識結合部分は、C3b様受容体(即ち、抗CR1抗体)に結合する抗体である。C3b様受容体に結合する抗体は、当技術分野で知られている任意の方法を用いて、その1以上の部位をPEGリンカーで誘導体化することができる。好ましい実施形態では、PEGリンカーで誘導体化される、C3b様受容体に結合する抗体は、誘導体化されていない該抗体と同一の活性(即ち、C3b様受容体に対する結合親和性)を有する。さらに別の好ましい実施形態では、PEGリンカーで誘導体化される、C3b様受容体に結合する抗体は、誘導体化されていない該抗体と比較して、少なくとも、50%、60%、70%、80%、90%又は99%の活性を有する。本発明は、PEGリンカーを含んでいる、C3b様受容体に結合する抗体の集団を調製する方法を包含し、該方法は、該抗体をPEGリンカーと接触させて、抗体の1以上の部位をPEGリンカーで誘導体化することを含み、それにより、PEGで誘導体化された抗体の集団を産生する。
好ましい実施形態では、第一認識結合部分は、C3b様受容体に結合する抗体である。本発明において使用するのに適切な抗体は、天然源から得ることができるか、又は、遺伝子工学技術による定常領域の機能の修飾(米国特許第5,624,821号)などの、ハイブリドーマ、組換え若しくは化学的合成法により産生することが可能である。本発明の抗体は、任意のイソタイプであることが可能であるが、好ましくは、ヒトIgG1である。
幾つかの実施形態では、二重特異性分子の抗CR1認識結合部分は、抗CR1抗体を含んでいる。好ましい実施形態では、二重特異性分子の抗CR1認識結合部分は、抗CR1mAbを含んでいる。ヒトC3b受容体に結合する抗CR1mAbは、当技術分野で知られている任意の方法により産生することが可能である。一実施形態では、抗CR1mAb、好ましくは、抗CR1IgGは、当技術分野で知られている標準的なハイブリドーマ法を用いて調製することができる(例えば, 以下の文献を参照されたい:Kohler及びMilstein, 1975, Nature 256:495-497;Hoggら, 1984, Eur. J. Immunol. 14:236-243;O'Sheaら, 1985, J. Immunol. 134:2580-2587;Schreiber, 米国特許第4,672,044号)。適切なマウスを、ヒト赤血球から精製することが可能なヒトCR1で免疫化する。免疫化マウスから得た脾臓細胞を、不死化マウス骨髄腫細胞系と融合させることにより、ハイブリドーマ細胞の集団(抗CR1抗体を産生するハイブリドーマを含む)を得る。次いで、抗CR1抗体を産生するハイブリドーマを、酵素結合免疫吸着アッセイ(ELISA)などの慣習的な技術を用いて、ハイブリドーマの集団から選択(すなわち「クローン化」)する。さらに、抗CR1mAbを発現するハイブリドーマ細胞系は、様々な供給元から得ることも可能であり、例えば、米国特許第4,672,044号に記載されているヒトCR1に結合するマウス抗CR1mAbは、American Type Culture Collection(ATCC)からハイブリドーマ細胞系ATCC HB 8592として入手可能である。本発明においては、別の抗CR1mAbを使用することもできる。例えば、以下の文献を参照されたい:Nickellsら, 1998, Clin. Exp. Immunol. 112:27-33。得られたハイブリドーマ細胞を、当技術分野で公知の標準的な方法を用いて培養し、洗浄する。次いで、上清から抗CR1抗体を回収する。
別の実施形態では、抗CR1mAb(好ましくは、抗CR1IgG)の重鎖及び軽鎖をコードする核酸を、当技術分野で公知の標準的な方法によりハイブリドーマ細胞系から調製する。非限定的な例として、適切なプライマーを用いてmRNAをプライミングした後、適切な順方向及び逆方向プライマーを用いるPCR増幅に付すことにより、抗CR1IgGの重鎖及び軽鎖をコードするcDNAを調製する。cDNA合成用の任意の市販キットを使用可能である。核酸は、発現ベクターの構築に使用する。発現ベクターを適切な宿主にトランスフェクトする。非限定的な例としては、大腸菌(E.coli)、酵母、昆虫細胞及び哺乳動物系(例えば、チャイニーズハムスター卵巣細胞系など)などを挙げることができる。抗体の産生は、当技術分野で公知の標準的な方法により惹起することができる。
抗CR1抗体は、ヒト赤血球から精製することが可能なヒトCR1を用いて適切な被検体を免疫化することにより調製することができる。免疫化した被検体における抗体力価は、固定化ポリペプチドを用いる酵素結合免疫吸着アッセイ(ELISA)などの標準的な技術により経時的にモニタリングすることができる。必要に応じて、抗体分子を哺乳動物から(例えば、血液から)単離し、プロテインAクロマトグラフィーなどの周知の技術によりさらに精製して、IgG画分を得ることができる。
免疫化後の適切な時点において(例えば、特定の抗原力価が最大であるとき)、被検体から抗体産生細胞を得ることが可能であり、また、その抗体産生細胞を用いて、Kohler及びMilsteinにより最初に記述されたハイブリドーマ技術(1975, Nature 256:495-497)、KozborらによるヒトB細胞ハイブリドーマ技術(1983, Immunol. Today 4:72)、ColeらによるEBV-ハイブリドーマ技術(1985, Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, Inc., pp. 77-96)又はトリオーマ技術などの標準的な技術により、モノクローナル抗体を調製することができる。ハイブリドーマを産生するための技術は周知である(概して、以下の文献を参照されたい:Current Protocols in Immunology, 1994, John Wiley and Sons, Inc., New York, NY)。本発明のモノクローナル抗体を産生するハイブリドーマ細胞は、ハイブリドーマ培養上清を目的のポリペプチドに結合する抗体について、例えば標準的なELISAアッセイを用いて、スクリーニングすることにより検出される。
モノクローナル抗体は、実質的に同種である抗体の集団(即ち、少量に存在する場合がある自然発生的に起こり得る突然変異以外は、集団を構成する個々の抗体が同一である)から得られる。従って、「モノクローナル」という修飾語は、別個の抗体の混合物でないという抗体の特徴を示す。例えば、モノクローナル抗体は、Kohlerらにより最初に記述されたハイブリドーマ方法(1975, Nature, 256:495)を用いて産生し得るか、又は、組換えDNA方法(米国特許第4,816,567号)によって産生し得る。本明細書で使用される場合、用語「モノクローナル抗体」は、抗体が免疫グロブリンであることも示している。
モノクローナル抗体を生成するハイブリドーマ方法では、マウス又は別の適切な宿主動物(例えば、ハムスターなど)を上記に準じて免疫化して、免疫化に使用するタンパク質に特異的に結合する抗体を産生するリンパ球又は産生することが可能なリンパ球を引き出す(例えば, 米国特許第5,914,112号を参照されたい(この特許は、参照によりその全体を本明細書に組み入れる))。
あるいは、リンパ球をインビトロで免疫化してもよい。次に、ポリエチレングリコールなどの適切な融合剤(fusing agent)を用いてリンパ球を骨髄腫細胞に融合させて、ハイブリドーマ細胞を形成させる(Goding, Monoclonal Antibodies:Principles and Practice, pp. 59-103 (Academic Press, 1986))。このようにして調製したハイブリドーマ細胞を、融合されていない親骨髄腫細胞の増殖又は生存を阻害する1種以上の物質を好ましくは含有している適切な培養培地に播種し、増殖させる。例えば、親骨髄腫細胞が酵素ヒポキサンチングアニンホスホリボシルトランスフェラーゼ(HGPRT又はHPRT)を欠く場合、典型的には、ハイブリドーマ用の培養培地に、HGPRT欠損細胞の増殖を妨げる物質であるヒポキサンチン、アミノプテリン及びチミジン(HAT培地)を含ませる。
好ましい骨髄腫細胞は、効率的に融合し、選択された抗体産生細胞による抗体の安定した高レベルの産生を支持し、HAT培地などの培地に対して感受性を有するものである。このれら中で、好ましい骨髄腫細胞系は、マウス骨髄腫系、例えば、Salk Institute Cell Distribution Center, San Diego, Calif. USAから入手可能なMOPC-21及びMPC-11マウス腫瘍から誘導されたもの、及び、American Type Culture Collection, Rockville, Md. USAから入手可能なSP-2細胞である。
ヒト骨髄腫細胞系及びマウス-ヒトへテロ骨髄腫細胞系も、ヒトモノクローナル抗体の産生に関して記述されている(Kozbor, 1984, J. Immunol., 133:3001;Brodeurら, Monoclonal Antibody Production Techniques and Applications, pp. 51-63 (Marcel Dekker, Inc., New York, 1987))。ハイブリドーマ細胞を増殖させる培養培地を、抗原に対するモノクローナル抗体の産生についてアッセイする。好ましくは、ハイブリドーマ細胞により産生されたモノクローナル抗体の結合特異性は、免疫沈降により決定するか、又は、インビトロ結合アッセイ、例えば、ラジオイムノアッセイ(RIA)若しくは酵素結合免疫吸着アッセイ(ELISA)などにより決定する。モノクローナル抗体の結合親和性は、例えば、Munsonら(1980, Anal. Biochem., 107:220)のスキャッチャード分析により決定することができる。
所望の特異性、親和性及び/又は活性を有する抗体を産生するハイブリドーマ細胞を同定した後、希釈手順を限定することによりクローンをサブクローニングし、標準的な方法で増殖させることができる(Goding, Monoclonal Antibodies: Principles and Practice, pp. 59-103 (Academic Press, 1986))。この目的に適する培養培地としては、例えば、D-MEM又はRPMI-1640培地などを挙げることができる。さらに、ハイブリドーマ細胞は、動物体内の腹水腫瘍としてインビボで増殖させることもできる。サブクローンにより分泌されたモノクローナル抗体は、適切には、慣習的な免疫グロブリン精製手順(例えば、プロテインA-セファロース、ヒドロキシルアパタイトクロマトグラフィー、ゲル電気泳動、透析又はアフィニティークロマトグラフィーなど)により、培養培地、腹水液又は血清から分離する。
モノクローナル抗体を分泌するハイブリドーマを調製する代わりに、ヒトCR1を用いて組換えコンビナトリアル免疫グロブリンライブラリー(例えば、抗体ファージディスプレイライブラリーなど)をスクリーニングすることにより、ヒトCR1に対するモノクローナル抗体を同定及び単離することができる。ファージディスプレイライブラリーを生成及びスクリーニングするためのキットは、市販されている(例えば、Pharmacia Recombinant Phage Antibody System, カタログNo.27-9400-01;及び, Stratagene antigen SurfZAPTM Phage Display Kit, カタログNo.240612)。さらに、抗体ディスプレイライブラリーの生成及びスクリーニングにおいて使用するのに特に適している方法及び試薬の例は、例えば、以下の文献に記載されている:米国特許第5,223,409号及び米国特許第5,514,548号;PCT公開第WO92/18619号;PCT公開第WO91/17271号;PCT公開第WO92/20791号;PCT公開第WO92/15679号;PCT公開第WO93/01288号;PCT公開第WO92/01047号;PCT公開第WO92/09690号;PCT公開第WO90/02809号;Fuchsら, 1991, Bio/Technology 9:1370-1372;Hayら, 1992, Hum. Antibod. Hybridomas 3:81-85;Huseら, 1989, Science 246:1275-1281;Griffithsら, 1993, EMBO J. 12:725-734。
さらにまた、抗体は、重鎖の可変領域にポリペプチドリンカーを介して融合している軽鎖の可変領域からなる融合ポリペプチドを一般に含んでいる単鎖抗体(scFv)であることも可能である。一実施形態では、抗CR1scFvは、当技術分野で知られている標準的な方法に従って調製する。
別の実施形態では、抗CR1キメラ抗体及びそのような抗CR1キメラ抗体をコードする核酸は、当技術分野で公知の標準的方法に従って調製する(米国特許第4,816,567号、米国特許第4,816,397号、米国特許第5,693,762号;米国特許第5,585,089号;米国特許第5,565,332号及び米国特許第5,821,337号(これらは, 参照によりその全体を本明細書に組み入れる))。
さらに、適切な抗原特異性を有するマウス抗体分子由来の遺伝子を適切な生物学的活性を有するヒト抗体分子由来の遺伝子と一緒にスプライシングすることによる、「キメラ抗体」の産生のために開発された技術(Morrisonら, 1984, Proc. Natl. Acad. Sci., 81, 6851-6855;Neubergerら, 1984, Nature 312, 604-608;Takedaら, 1985, Nature 314, 452-454)が使用可能である。キメラ抗体は、マウスmAbから誘導された可変領域とヒト免疫グロブリン定常領域を有する分子のような、分子内の異なる部分が異なる動物種から誘導された分子である。(例えば、以下の特許を参照されたい:Cabillyら, 米国特許第4,816,567号;及び, Bossら, 米国特許第4,816,397号(これら特許各々は、参照によりその全体を本明細書に組み入れる))。
抗CR1抗原認識結合部分は、標準的なファージディスプレイ技術によっても産生することができる。ファージディスプレイライブラリーを生成及びスクリーニングするためのキットは市販されている(例えば, Pharmacia Recombinant Phage Antibody System, カタログNo.27-9400-01;及び, the Stratagene antigen SurfZAPTM Phage Display Kit, カタログNo.240612)。さらに、抗体ディスプレイライブラリーの生成及びスクリーニングにおいて使用するのに特に適している方法及び試薬の例は、例えば、以下の文献に記載されている:米国特許第5,223,409号及び米国特許第5,514,548号;PCT公開第WO92/18619号;PCT公開第WO91/17271号;PCT公開第WO92/20791号;PCT公開第WO92/15679号;PCT公開第WO93/01288号;PCT公開第WO92/01047号;PCT公開第WO92/09690号;PCT公開第WO90/02809号;Fuchsら, 1991, Bio/Technology 9:1370-1372;Hayら, 1992, Hum. Antibod. Hybridomas 3:81-85;Huseら, 1989, Science 246:1275-1281;Griffithsら, 1993, EMBO J. 12:725-734。
ヒト化抗体は、非ヒト種由来の1つ以上の相補性決定領域(CDR)及びヒト免疫グロブリン分子由来のフレームワーク領域を有する非ヒト種由来の抗体分子である。(例えば、米国特許第5,585,089号を参照されたい(この特許は、参照によりその全体を本明細書に組み入れる))。完全ヒト抗体は、ヒト患者の治療的処置のために特に望ましい。そのような抗体は、内因性免疫グロブリン重鎖及び軽鎖遺伝子は発現できないが、ヒト重鎖及び軽鎖遺伝子は発現可能なトランスジェニックマウスを用いて産生することができる。トランスジェニックマウスは、通常の方法で、ヒトCR1を用いて免疫化する。さらに、キメラ及びヒト化モノクローナル抗体は、例えば以下の文献に記載される方法を使用して、当技術分野で公知の組換えDNA技術により産生することができる:PCT公開第WO87/02671号;欧州特許出願第184,187号;欧州特許出願第171,496号;欧州特許出願第173,494号;PCT公開第WO86/01533号;米国特許第4,816,567号及び米国特許第5,225,539号;欧州特許出願第125,023号;Betterら, 1988, Science 240:1041-1043;Liuら, 1987, Proc. Natl. Acad. Sci. USA 84:3439-3443;Liuら, 1987, J. Immunol. 139:3521-3526;Sunら, 1987, Proc. Natl. Acad. Sci. USA 84:214-218;Nishimuraら, 1987, Canc. Res. 47:999-1005;Woodら, 1985, Nature 314:446-449;Shawら, 1988, J. Natl. Cancer Inst. 80:1553-1559;Morrison 1985, Science 229:1202-1207;Oiら, 1986, Bio/Techniques 4:214;Jonesら, 1986, Nature 321:552-525;Verhoeyanら, 1988, Science 239:1534;及び, Beidlerら, 1988, J. Immunol. 141:4053-4060。
相補性決定領域(CDR)移植は、抗体をヒト化するための別の方法である。この方法には、完全抗原特異性及び結合親和性をヒトフレームワークに移すためにマウス抗体を再形成することが含まれている(Winterら, 米国特許第5,225,539号)。CDR移植抗体は、様々な抗原に対して上手く構築されてきた。例えば、Queenら(1989, Proc. Natl. Acad. Sci. USA 86:10029)に記載されたIL-2受容体に対する抗体;Riechmannら(1988, Nature, 332:323)に記載された細胞表面受容体-CAMPATHに対する抗体;Coleら(1991, Proc. Natl. Acad. Sci. USA 88:2869)に記載されたB型肝炎に対する抗体;及び、Tempestら(1991, Bio-Technology 9:267)に記載れたウイルス抗原-呼吸器合胞体ウイルスに対する抗体などがある。マウスモノクローナル抗体のCDRがヒト抗体に移植されたCDR移植抗体を生成する。移植後、ほとんどの抗体は、親和性を維持するためのフレームワーク領域における付加的なアミノ酸変化による恩恵を受ける。これは、おそらく、フレームワーク残基がCDRコンホメーションを維持するために必要であることによる。また、一部のフレームワーク残基は、抗原結合部位の一部であることが実証された。しかしながら、抗原性部位を全く導入しないようにフレームワーク領域を保持するために、配列を、確立された生殖系列の配列と比較した後に、コンピュータモデリングを行う。
完全ヒト抗体は、ヒト患者の治療的処置のために特に望ましい。そのような抗体は、内因性免疫グロブリン重鎖及び軽鎖遺伝子は発現できないが、ヒト重鎖及び軽鎖遺伝子は発現可能なトランスジェニックマウスを用いて産生することができる。トランスジェニックマウスは、通常の方法で、ヒトCR1を用いて免疫化する。
選択されたエピトープを認識してそれに結合する完全ヒト抗体は、「誘導型選択(guided selection)」と称される技術を用いて生成することができる。このアプローチにおいては、選択された非ヒトモノクローナル抗体(例えば、マウス抗体)を使用して、同じエピトープを認識する完全ヒト抗体の選択を導く(Jespersら, 1994, Bio/technology 12:899-903)。
本発明の方法及び組成物では、以前から存在している抗CR1抗体も使用可能であり、そのようなものとしては、限定するものではないが、7G9、HB8592、3D9、57F、及び、1B4などを挙げることができる(例えば、以下の特許を参照されたい:Talyorら, 米国特許第5,487, 890号(この特許は、参照によりその全体を本明細書に組み入れる))。好ましい実施形態では、高親和性抗CR1モノクローナル抗体(例えば、7G9(マウスIgG2a, kappa))を分泌するハイブリドーマ細胞系を使用して、マスターセルバンク(MCB)を生成する。好ましくは、マスターセルバンクを、マウス抗体産生、マイコプラズマ及び無菌性について試験する。次いで、腹水液から抗CR1抗体を産生及び精製する。別の好ましい実施形態では、本発明の二重特異性分子を産生するのに使用する抗CR1モノクローナル抗体は、インビトロ(ホローファイバーバイオリアクター)で産生し、cGMPの存在下で精製する。
5.2.2 認識結合部分の産生
本発明は、C3b様受容体に結合する第一認識結合部分を、ポリエチレングリコールリンカーを用いて、特定の分子に結合する1以上の第二認識結合部分に架橋させることを包含する。好ましくは、該分子は、哺乳動物の循環から排除されるのが望ましい。本発明の二重特異性分子の認識結合部分は、抗原分子を認識し、それに結合する任意の分子部分であることが可能である。そのような分子部分には、限定するものではないが、抗体若しくはその抗原結合性フラグメント、又は、排除される分子により認識及び結合される任意の分子部分、例えば、限定するものではないが、エピトープ若しくは抗原決定基、ポリペプチド、ペプチド、核酸及び有機小分子などがある。そのような認識結合部分は、当技術分野で知られている種々の方法で産生することができる。
本発明は、C3b様受容体に結合する第一認識結合部分を、ポリエチレングリコールリンカーを用いて、特定の分子に結合する1以上の第二認識結合部分に架橋させることを包含する。好ましくは、該分子は、哺乳動物の循環から排除されるのが望ましい。本発明の二重特異性分子の認識結合部分は、抗原分子を認識し、それに結合する任意の分子部分であることが可能である。そのような分子部分には、限定するものではないが、抗体若しくはその抗原結合性フラグメント、又は、排除される分子により認識及び結合される任意の分子部分、例えば、限定するものではないが、エピトープ若しくは抗原決定基、ポリペプチド、ペプチド、核酸及び有機小分子などがある。そのような認識結合部分は、当技術分野で知られている種々の方法で産生することができる。
本発明の方法及び組成物で使用する抗体は、免疫原として抗原を用いて適切な被検体を免疫化することにより調製することができる。免疫化した被検体における抗体力価は、固定化ポリペプチドを用いる酵素結合免疫吸着アッセイ(ELISA)などの標準的な技術により経時的にモニタリングすることができる。必要に応じて、抗体分子を哺乳動物から(例えば、血液から)単離し、プロテインAクロマトグラフィーなどの周知の技術によりさらに精製して、IgG画分を得ることができる。免疫化後の適切な時点において(例えば、特定の抗原力価が最大であるとき)、被検体から抗体産生細胞を得ることが可能であり、また、その抗体産生細胞を用いて、Kohler及びMilsteinにより最初に記述されたハイブリドーマ技術(1975, Nature 256:495-497)、KozborらによるヒトB細胞ハイブリドーマ技術(1983, Immunol. Today 4:72)、ColeらによるEBV-ハイブリドーマ技術(1985, Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, Inc., pp. 77-96)又はトリオーマ技術などの標準的な技術により、モノクローナル抗体を調製することができる。ハイブリドーマを産生するための技術は周知である(概して、以下の文献を参照されたい:Current Protocols in Immunology, 1994, John Wiley and Sons, Inc., New York, NY)。本発明のモノクローナル抗体を産生するハイブリドーマ細胞は、ハイブリドーマ培養上清を目的のポリペプチドに結合する抗体について、例えば標準的なELISAアッセイを用いて、スクリーニングすることにより検出される。
モノクローナル抗体は、実質的に同種である抗体の集団(即ち、少量に存在する場合がある自然発生的に起こり得る突然変異以外は、集団を構成する個々の抗体が同一である)から得られる。例えば、モノクローナル抗体は、Kohlerらにより最初に記述されたハイブリドーマ方法(1975, Nature, 256:495)を用いて産生し得るか、又は、組換えDNA方法(米国特許第4,816,567号)によって産生し得る。
モノクローナル抗体を生成するハイブリドーマ方法では、マウス又は別の適切な宿主動物(例えば、ハムスターなど)を上記に準じて免疫化して、免疫化に使用するタンパク質に特異的に結合する抗体を産生するリンパ球又は産生することが可能なリンパ球を引き出す(例えば, 米国特許第5,914,112号を参照されたい(この特許は、参照によりその全体を本明細書に組み入れる))。
あるいは、リンパ球をインビトロで免疫化してもよい。ポリエチレングリコールなどの適切な融合剤(fusing agent)を用いてリンパ球を骨髄腫細胞に融合させて、ハイブリドーマ細胞を形成させる(Goding, Monoclonal Antibodies:Principles and Practice, pp. 59-103 (Academic Press, 1986))。このようにして調製したハイブリドーマ細胞を、融合されていない親骨髄腫細胞の増殖又は生存を阻害する1種以上の物質を好ましくは含有している適切な培養培地に播種し、増殖させる。例えば、親骨髄腫細胞が酵素ヒポキサンチングアニンホスホリボシルトランスフェラーゼ(HGPRT又はHPRT)を欠く場合、典型的には、ハイブリドーマ用の培養培地に、HGPRT欠損細胞の増殖を妨げる物質であるヒポキサンチン、アミノプテリン及びチミジン(HAT培地)を含ませる。
好ましい骨髄腫細胞は、効率的に融合し、選択された抗体産生細胞による抗体の安定した高レベルの産生を支持し、HAT培地などの培地に対して感受性を有するものである。このれら中で、好ましい骨髄腫細胞系は、マウス骨髄腫系、例えば、Salk Institute Cell Distribution Center, San Diego, Calif. USAから入手可能なMOPC-21及びMPC-11マウス腫瘍から誘導されたもの、及び、American Type Culture Collection, Rockville, Md. USAから入手可能なSP-2細胞である。
ヒト骨髄腫細胞系及びマウス-ヒトへテロ骨髄腫細胞系も、ヒトモノクローナル抗体の産生に関して記述されている(Kozbor, 1984, J. Immunol., 133:3001;Brodeurら, Monoclonal Antibody Production Techniques and Applications, pp. 51-63 (Marcel Dekker, Inc., New York, 1987))。ハイブリドーマ細胞を増殖させる培養培地を、抗原に対するモノクローナル抗体の産生についてアッセイする。好ましくは、ハイブリドーマ細胞により産生されたモノクローナル抗体の結合特異性は、免疫沈降により決定するか、又は、インビトロ結合アッセイ、例えば、ラジオイムノアッセイ(RIA)若しくは酵素結合免疫吸着アッセイ(ELISA)などにより決定する。モノクローナル抗体の結合親和性は、例えば、Munsonら(1980, Anal. Biochem., 107:220)のスキャッチャード分析により決定することができる。
所望の特異性、親和性及び/又は活性を有する抗体を産生するハイブリドーマ細胞を同定した後、希釈手順を限定することによりクローンをサブクローニングし、標準的な方法で増殖させることができる(Goding, Monoclonal Antibodies: Principles and Practice, pp. 59-103 (Academic Press, 1986))。この目的に適する培養培地としては、例えば、D-MEM又はRPMI-1640培地などを挙げることができる。さらに、ハイブリドーマ細胞は、動物体内の腹水腫瘍としてインビボで増殖させることもできる。サブクローンにより分泌されたモノクローナル抗体は、適切には、慣習的な免疫グロブリン精製手順(例えば、プロテインA-セファロース、ヒドロキシルアパタイトクロマトグラフィー、ゲル電気泳動、透析又はアフィニティークロマトグラフィーなど)により、培養培地、腹水液又は血清から分離する。
モノクローナル抗体を分泌するハイブリドーマを調製する代わりに、目的の抗原を用いて組換えコンビナトリアル免疫グロブリンライブラリー(例えば、抗体ファージディスプレイライブラリーなど)をスクリーニングすることにより、病原体又は病原性抗原分子ポリペプチドに対する本発明のモノクローナル抗体を同定及び単離することができる。ファージディスプレイライブラリーを生成及びスクリーニングするためのキットは、市販されている(例えば、Pharmacia Recombinant Phage Antibody System, カタログNo.27-9400-01;及び, Stratagene antigen SurfZAPTM Phage Display Kit, カタログNo.240612)。さらに、抗体ディスプレイライブラリーの生成及びスクリーニングにおいて使用するのに特に適している方法及び試薬の例は、例えば、以下の文献に記載されている:米国特許第5,223,409号及び米国特許第5,514,548号;PCT公開第WO92/18619号;PCT公開第WO91/17271号;PCT公開第WO92/20791号;PCT公開第WO92/15679号;PCT公開第WO93/01288号;PCT公開第WO92/01047号;PCT公開第WO92/09690号;PCT公開第WO90/02809号;Fuchsら, 1991, Bio/Technology 9:1370-1372;Hayら, 1992, Hum. Antibod. Hybridomas 3:81-85;Huseら, 1989, Science 246:1275-1281;Griffithsら, 1993, EMBO J. 12:725-734。ファージディスプレイライブラリーにより、非常に大きな特異性の範囲から1以上の所望の抗体を選択することが可能となる。ファージディスプレイライブラリーの付加的な利点は、選択された抗体をコードする核酸が都合良く得られることで、その後の発現ベクターの構築が容易になることである。
さらに、適切な抗原特異性を有するマウス抗体分子由来の遺伝子を適切な生物学的活性を有するヒト抗体分子由来の遺伝子と一緒にスプライシングすることによる、「キメラ抗体」の産生のために開発された技術(Morrisonら, 1984, Proc. Natl. Acad. Sci., 81, 6851-6855;Neubergerら, 1984, Nature 312, 604-608;Takedaら, 1985, Nature 314, 452-454)が使用可能である。キメラ抗体は、マウスmAbから誘導された可変領域とヒト免疫グロブリン定常領域を有する分子のような、分子内の異なる部分が異なる動物種から誘導された分子である。(例えば、以下の特許を参照されたい:Cabillyら, 米国特許第4,816,567号;及び, Bossら, 米国特許第4,816,397号(これら特許の各々は、参照によりその全体を本明細書に組み入れる))。
ヒト化抗体は、非ヒト種由来の1つ以上の相補性決定領域(CDR)及びヒト免疫グロブリン分子由来のフレームワーク領域を有する非ヒト種由来の抗体分子である。(例えば、米国特許第5,585,089号を参照されたい(この特許は、参照によりその全体を本明細書に組み入れる)。そのようなキメラ及びヒト化モノクローナル抗体は、例えば以下の文献に記載されている方法を使用して、当技術分野で公知の組換えDNA技術により産生することができる:PCT公開第WO87/02671号;欧州特許出願第184,187号;欧州特許出願第171,496号;欧州特許出願第173,494号;PCT公開第WO86/01533号;米国特許第4,816,567号及び米国特許第5,225,539号;欧州特許出願第125,023号;Betterら, 1988, Science 240:1041-1043;Liuら, 1987, Proc. Natl. Acad. Sci. USA 84:3439-3443;Liuら, 1987, J. Immunol. 139:3521-3526;Sunら, 1987, Proc. Natl. Acad. Sci. USA 84:214-218;Nishimuraら, 1987, Canc. Res. 47:999-1005;Woodら, 1985, Nature 314:446-449;Shawら, 1988, J. Natl. Cancer Inst. 80:1553-1559;Morrison 1985, Science 229:1202-1207;Oiら, 1986, Bio/Techniques 4:214;Jonesら, 1986, Nature 321:552-525;Verhoeyanら, 1988, Science 239:1534;及び, Beidlerら, 1988, J. Immunol. 141:4053-4060。
相補性決定領域(CDR)移植は、抗体をヒト化するための別の方法である。この方法には、完全抗原特異性及び結合親和性をヒトフレームワークに移すためにマウス抗体を再形成することが含まれている(Winterら, 米国特許第5,225,539号)。CDR移植抗体は、様々な抗原に対して上手く構築されてきた。例えば、Queenら(1989, Proc. Natl. Acad. Sci. USA 86:10029)に記載されたIL-2受容体に対する抗体;Riechmannら(1988, Nature, 332:323)に記載された細胞表面受容体-CAMPATHに対する抗体;Coleら(1991, Proc. Natl. Acad. Sci. USA 88:2869)に記載されたB型肝炎に対する抗体;及び、Tempestら(1991, Bio-Technology 9:267)に記載れたウイルス抗原-呼吸器合胞体ウイルスに対する抗体などがある。マウスモノクローナル抗体のCDRがヒト抗体に移植されたCDR移植抗体を生成する。移植後、ほとんどの抗体は、親和性を維持するためのフレームワーク領域における付加的なアミノ酸変化による恩恵を受ける。これは、おそらく、フレームワーク残基がCDRコンホメーションを維持するために必要であることによる。また、一部のフレームワーク残基は、抗原結合部位の一部であることが実証された。しかしながら、抗原性部位を全く導入しないようにフレームワーク領域を保持するために、配列を、確立された生殖系列の配列と比較した後に、コンピュータモデリングを行う。
上記抗原に対するモノクローナル抗体は、慣習的なハイブリドーマ技術を用いて得ることができる。トランスジェニックマウスにより含まれているヒト免疫グロブリン導入遺伝子は、B細胞が分化する間に再配列し、その後、クラス切換え及び体細胞変異を経る。従って、このような技術を使用して、治療的に有用なIgG抗体、IgA抗体及びIgE抗体を産生することが可能である。ヒト抗体を産生するためのこの技術の概要については、Lonberg及びHuszar(1995, Int. Rev. Immunol. 13:65-93)を参照されたい。ヒト抗体及びヒトモノクローナル抗体を産生するためのこの技術の詳細な議論、並びに、このような抗体を産生するためのプロトコルについては、例えば、以下の特許を参照されたい:米国特許第5,625,126号;米国特許第5,633,425号;米国特許第5,569,825号;米国特許第5,661,016号;及び、米国特許第5,545,806号。さらに、Abgenix Inc.(Freemont, CA (例えば、米国特許第5,985,615号を参照されたい))、及び、Medarex, Inc.(Princeton, NJ)などの企業に、上記技術と同様の技術を用いて選択された抗原に対するヒト抗体を提供させることができる。
選択されたエピトープを認識してそれに結合する完全ヒト抗体は、「誘導型選択(guided selection)」と称される技術を用いて生成することができる。このアプローチにおいては、選択された非ヒトモノクローナル抗体(例えば、マウス抗体)を使用して、同じエピトープを認識する完全ヒト抗体の選択を導く(Jespersら, (1994) Bio/technology 12:899-903)。
病原体に対して以前から存在している抗体を用いて、アフィニティークロマトグラフィー又は免疫沈降などの標準的な技術により、免疫原として使用するための病原体の追加の抗原を単離することができる。さらに、病原体の存在量及び発現のパターンを評価するために、このような抗体を使用して、タンパク質(例えば、細胞溶解物又は細胞上清中のタンパク質)を検出することができる。さらにまた、臨床テスト手順の一部として組織中の病原体レベルをモニターリングするために該抗体を診断的に使用することもできる(例えば、所与の治療計画の効力を決定する)。
本発明の方法及び組成物での使用に適する抗原性フラグメントは、例えば、8アミノ酸、より好ましくは10アミノ酸、さらにより好ましくは15アミノ酸の長さである抗原の少なくとも一部を含んでいる抗原性認識結合部分である。抗原性認識結合部分として使用される抗原及び抗原性フラグメントは、組換え的に発現させることができるか、又は、化学的に合成することが可能である。
本発明は、さらに、抗原認識結合部分として使用するためのキメラ抗原又は融合抗原も提供する。本明細書で使用される場合、「キメラ抗原」又は「融合抗原」は、機能し得る形で異種ポリペプチドに連結された本発明で使用するための抗原の全体又は一部を含む。融合抗原内では、「機能し得る形で連結」という用語は、抗原と異種ポリペプチドが、互いにインフレームで融合していることを示すことが意図されている。異種ポリペプチドは、抗原のN末端又はC末端に融合させることができる。
キメラ及び融合タンパク質は、標準的な組換えDNA技術により産生できる。一実施形態では、融合遺伝子は、自動DNAシンセサイザーを包含する慣習的な技術により合成することができる。あるいは、2つの連続した遺伝子断片の間の相補的なオーバーハングを生じる(これは、その後アニーリング及び再増幅を行って、キメラ遺伝子配列を生成できる)アンカープライマーを使用して、遺伝子断片のPCR増幅を行うことができる(例えば、Ausubelら、上掲)。さらに、融合ドメイン(例えば、GSTポリペプチド)を既にコードしている多くの発現ベクターが市販されている。免疫原をコードする核酸を、融合ドメインがポリペプチドにインフレームで連結されるように、このような発現ベクターにクローニングすることができる。
本発明の別の抗原認識結合部分は、当技術分野で知られている適切な方法を用いて産生することが可能である。例えば、核酸は、DNAを合成するための任意の公知方法により産生可能である。有機小分子は、有機合成に関して当業者に公知の任意の方法により産生可能である。
本発明の二重特異性分子の抗原結合性抗体フラグメントは、当技術分野で知られている種々の方法により産生することが可能である。
一実施形態では、抗原結合性抗体フラグメントは、哺乳動物の循環から排除される分子(例えば、病原性抗原分子)に特異的に結合する結合領域を含む免疫グロブリン分子のフラグメントである。免疫グロブリン分子の免疫学的に活性なフラグメントの例としては、限定するものではないが、Fabフラグメント、Fab'フラグメント及び(Fab')2フラグメントなどがあり、これらは、ペプシン又はパパインなどの酵素で抗体を処理することにより生成することができる。
好ましい実施形態では、抗原結合性抗体フラグメントは、所望の抗原結合特異性を有するモノクローナル抗体から産生される。そのようなモノクローナル抗体は、当技術分野で知られている標準的な方法のいずれかにより標的の抗原を使用して生じさせることができる。例えば、抗原分子に対するモノクローナル抗体は、上記で挙げた方法のいずれかを用いて、CR1の代わりに抗原分子を使用して生じさせることができる(第5.2.1節も参照されたい)。次いで、その抗体をペプシン又はパパインで処理する。抗原が、ヒンジ領域内のジスルフィド結合の下流でペプシンにより消化されることにより、ジスルフィド結合でVH-CH1に結合している軽鎖から構成されるFabの二量体である抗体の(Fab')2フラグメントが生成される。穏やかな条件下で(Fab')2フラグメントを還元して、ヒンジ領域内のジスルフィド結合を還元することができ、それにより、(Fab')2二量体がFab'単量体に変換される。Fab'単量体は、本質的に、ヒンジ領域の一部を含んでいるFabである。エピトープ、抗体及び抗体フラグメントについての詳細な説明に関しては、以下の文献を参照されたい:Paul, ed., 1993, Fundamental Immunology, Third Edition(New York:Raven Press)。当業者は、そのようなFab'フラグメントが、化学的に、又は、組換えDNA技術を用いて、新たに合成可能であること理解するであろう。従って、本明細書で使用される場合、用語「抗体フラグメント」には、完全抗体を修飾することにより産生された抗体フラグメント又は新たに合成された抗体フラグメントが包含される。
別の実施形態では、米国特許第5,648,237号(この特許は、参照によりその全体を本明細書に組み入れる)に記載されている抗体の免疫学的に活性なフラグメントの生成及び発現方法を使用する。
抗原結合性抗体フラグメントを含んでいる二重特異性分子の産生方法は、2002年9月16日に出願された米国仮特許出願第(未指定)(代理人事件整理番号9635-041-888)に開示されている。この特許は、参照によりその全体を本明細書に組み入れる。
さらに別の実施形態では、抗原結合性抗体フラグメント、例えば、Fv、Fab、Fab'、又は、(Fab')2などは、ファージディスプレイライブラリーのアフィニティースクリーニングを含んでいる方法により産生する(例えば, 以下の文献を参照されたい:Watkinsら, Vox Sanguinis 78:72-79;米国特許第5,223,409号及び米国特許第5,514,548号;PCT公開第WO92/18619号;PCT公開第WO91/17271号;PCT公開第WO92/20791号;PCT公開第WO92/15679号;PCT公開第WO93/01288号;PCT公開第WO92/01047号;PCT公開第WO92/09690号;PCT公開第WO90/02809号;Fuchsら, 1991, Bio/Technology 9:1370-1372;Hayら, 1992, Hum. Antibod. Hybridomas 3:81-85;Huseら, 1989, Science 246:1275-1281;Griffithsら, 1993, EMBO J. 12:725-734;及び, McCaffertyら, 1990, Nature 348:552-554 (これら文献の各々は、参照によりその全体を本明細書に組み入れる))。発現ベクターを構築するために、次いで、ファージディスプレイライブラリーから選択された1以上の抗体フラグメントをコードする核酸を得る。1以上の該抗体フラグメントは、適切な宿主系(例えば、細菌宿主系、酵母宿主系又は哺乳動物宿主系)内で産生させることができる(例えば, 以下の文献を参照されたい:Pluckthunら、Immunotechnology 3:83-105;Adair, Immunological Reviews 130:5-40;Cabillyら, 米国特許第4,816,567号;及び, Carter, 米国特許第5,648,237号 (これら文献の各々は、参照によりその全体を本明細書に組み入れる))。
さらに別の実施形態では、単鎖抗体を産生するための既に記述されている技術(米国特許第4,946,778号;Bird, 1988, Science 242:423-426;Hustonら, 1988, Proc. Natl. Acad. Sci. USA 85:5879-5883;及び, Wardら, 1989, Nature 334:544-546 (これら文献の各々は、参照によりその全体を本明細書に組み入れる))を適合させて、抗原分子に対する単鎖抗体を産生することができる。単鎖抗体は、アミノ酸架橋を介して、Fv領域の重鎖フラグメント及び軽鎖フラグメントを連結して単鎖ポリペプチドを生じさせることにより形成させる。
本発明は、特定の分子に結合する認識結合部分(即ち、抗原結合性抗体フラグメント)を、誘導体化された該認識結合部分が上記で述べたように既にPEGリンカーとコンジュゲートしている別の認識結合部分(即ち、抗CR1抗体)と反応するように、当技術分野で知られている任意の誘導体化剤で誘導体化することを包含する。一実施形態では、認識結合部分の誘導体化には、該認識結合部分をチオール特異的誘導体化剤でチオール化することが含まれる。本発明の方法及び組成物において使用可能なチオール特異的誘導体化剤としては、限定するものではないが、スクシンイミジル-3-(2-ピリジルチオ-プロピオネート)(SPDP)、又は、スクシンイミジルアセチルチオアセテート(SATA)などを挙げることができる。別の実施形態では、認識結合部分の誘導体化には、該認識結合部分をヒドラジン修飾試薬又はアルデヒド修飾試薬で修飾することが含まれる。本発明の方法及び組成物において使用可能なヒドラジン修飾試薬又はアルデヒド修飾試薬は、スクシンイミジル 6-ヒドラジノニコチネートアセトンヒドラゾン(SANH)、又は、スクシンイミジル 4-ホルミルベンゾエート(SFB)、又は、スクシンイミジル C6 4-ヒドラジノ-ニコチンアミドアセトンヒドラゾン(Hz)である。
認識結合部分がタンパク質を含んでいる特定の実施形態では、本発明の認識結合部分は、それらが所定の部位で誘導体化されるように、修飾することができる。好ましくは、そのような所定の部位は、誘導体化された後又は本発明の抗CR1抗体に架橋された後において該認識結合部分の結合活性が損なわれないように選択する。本発明の方法及び組成物において使用するために、認識結合部分の任意のアミノ酸を、認識結合部分の結合が誘導体化により損なわれないように(例えば、認識結合部分の結合対象である抗体に対する該認識結合部分の結合親和性が損なわれないように)、誘導体化することができる。好ましくは、修飾される該アミノ酸は、システイン、リシン又はアルギニンである。一実施形態では、認識結合部分は、1以上の部位において誘導体化する。好ましい実施形態では、認識結合部分は、1つの部位のみで誘導体化する。一実施形態では、認識結合部分は、標準的な組換えDNA技術を用いて、誘導体化しようとする所定の部位に特定のアミノ酸(即ち, システイン)を含むように作る。別の好ましい実施形態では、誘導体化の対象のアミノ酸は認識結合部分の表面に存在する。別の実施形態では、誘導体化された認識結合部分は、誘導体化されていない該認識結合部分の活性の少なくとも、50%、60%、70%、80%、90%、95%又は99%の活性を有する。
5.3 ポリエチレングリコールリンカーを含んでいる二重特異性分子の産生
「ポリエチレングリコール」又は「PEG」は、カップリング部分又は活性化部分による誘導体化(例えば、チオール、トリフラート、トレシラート、アジリジン(aziridune)若しくはオキシランによる誘導体化、又は、好ましくは、マレイミドによる誘導体化)を含むか又は含まないポリエチレングリコール化合物を意味する。マレイミドモノメトキシPEGのような化合物を、本発明の活性化されたPEG化合物の例として挙げることができる。
「ポリエチレングリコール」又は「PEG」は、カップリング部分又は活性化部分による誘導体化(例えば、チオール、トリフラート、トレシラート、アジリジン(aziridune)若しくはオキシランによる誘導体化、又は、好ましくは、マレイミドによる誘導体化)を含むか又は含まないポリエチレングリコール化合物を意味する。マレイミドモノメトキシPEGのような化合物を、本発明の活性化されたPEG化合物の例として挙げることができる。
本発明は、ポリエチレングリコール(「PEG」)リンカーを用いて、本発明の二重特異性分子の第一認識結合部分と第二認識結合部分を架橋させることを包含し、ここで、そのような架橋は、第一認識結合部分又は第二認識結合部分の結合活性を損なわないようなものである。第一認識結合部分が抗体である特定の実施形態では、1以上の第二認識結合部分は、好ましくは、PEGリンカーを介して第一認識結合部分の軽鎖又は重鎖に架橋させる。さらに別の特定の実施形態では、1以上の第二認識結合部分をPEGリンカーを介して第一認識結合部分に架橋させるが、但し、該第二認識結合部分は、第一認識結合部分のC-末端には架橋しない。
特定の実施形態では、本発明は、PEGリンカーを用いて、抗CR1抗体(例えば、米国特許第5,879,679号に記載されている7G9モノクローナル抗体)を1以上の認識結合部分に架橋させる方法を包含する。一実施形態では、本発明は、抗CR1抗体を1以上の認識結合部分に架橋させる方法を包含し、該方法は、PEGリンカーを抗CR1抗体にコンジュゲートさせるのに適する条件下で抗CR1抗体をPEGリンカーに接触させること、抗CR1抗体にコンジュゲートしているPEGリンカーと第二認識結合部分が反応するように1以上の第二認識結合部分を誘導体化剤で活性化又は誘導体化すること、及び、抗CR1抗体が1以上の第二認識結合部分に架橋するのに適する条件下で抗CR1抗体と活性化されている第二認識結合部分を混合することを含んでなる。別の特定の実施形態では、PEGリンカーを1以上の第二認識結合部分にコンジュゲートさせ、及び、1以上の第二認識結合部分にコンジュゲートしているPEGリンカーと抗CR1抗体が反応するように抗CR1抗体を誘導体化剤で活性化又は誘導体化する。
PEGリンカーを第一認識結合部分又は第二認識結合部分(即ち、抗体、タンパク質)にコンジュゲートさせる方法は、当技術分野では周知である。PEGリンカーをコンジュゲートさせるために当技術分野で知られている任意の方法を用いて、本発明の二重特異性分子を産生することができる。当業者は、PEGリンカーを抗CR1抗体又は本発明の別の認識結合部分にコンジュゲートさせるために、当技術分野で知られている任意の方法を用いることができる。
本発明の二重特異性分子がタンパク質を含んでいる特定の実施形態では、例えば1979年12月18日に発行された米国特許18,1979号(この特許は、参照によりその全体を本明細書に組み入れる)に開示されている、PEGリンカーをタンパク質に結合させる一般的な方法を用いることができる。さらに、PEGリンカーを本発明の第一認識結合部分又は第二認識結合部分(ここで、第一認識結合部分又は第二認識結合部分は、タンパク質を含んでいる)に結合させる別の方法は、米国特許第5,122,614号(この特許も同様に、参照によりその全体を本明細書に組み入れる)に開示されている方法を適合させることができる(以下の文献も参照されたい:Veroneseら, 1985, Applied Biochem, and Biotech, 11:141-152;Katreら, 米国特許第4,766,106号及び米国特許第4,917,888号;Roberts M.J.ら, 2002 Advanced Drug Delivery Reviews, 54:459-476;米国特許第5,766,897号;米国特許第6,433,158B1号;米国特許第5,849,860号;これら文献は全て、参照によりその全体を本明細書に組み入れる)。
特定の実施形態では、本発明の二重特異性分子は、最大数以下で、1以上の部位、好ましくは2以上の部位、より好ましくは3以上の部位、最も好ましくは4以上の部位に結合しているPEGリンカーを含んでいるが、このPEGリンカーの結合は、本発明の親第一認識を損なわないようなものである。PEGリンカーと本発明の第一認識結合部分又は第二認識結合部分のいずれかの割合は、好ましくは、1:1、より好ましくは、2:1、さらに好ましくは、4:1、6:1、8:1、最大で10:1又は40:1の、本発明の第一認識結合部分又は第二認識結合部分に対するPEGリンカーである。本発明の第一認識結合部分又は第二認識結合部分に結合しているPEGリンカーの分子量は、200〜20,000ダルトンの範囲である。好ましくは、該PEGリンカーは、5〜500ダルトン、500〜1000ダルトン、又は、1000〜8000ダルトンであり、さらに好ましくは、3250〜5000ダルトンであるか、又は、約5000ダルトンである。
本発明の二重特異性分子がタンパク質を含んでいる特定の実施形態では、該タンパク質の表面上で及び/又は活性部位から離れたところに存在しているアミノ酸残基に、PEGリンカーを共有結合により結合させる。
PEG及びモノメトキシポリエチレングリコールの活性化形態は市販されており、また、本発明の方法及び組成物で使用することができる。特に、アルバマ州ハンツヴィルの Shearwater Polymers, Inc. は、多くのPEGポリマー及びPEG誘導体を提供している。Shearwater Polymers Inc Catalog(Shearwaters Polymers, Inc. Catalog Functionalized Biocompatible Polymers for Research, 2001 は、参照により本明細書に組み入れ、さらに、オンライン(www. shearwatercorp. com)でも利用可能である)には、幅広い条件下でタンパク質にカップリングさせるのに適した広範な種類の活性化されたPEGが記載されており、また、入手可能である。このカタログには、さらに、誘導体化されたPEG試薬のための好ましい反応条件も記載されている。タンパク質をPEGとコンジュゲートさせるのに適する多くの試薬についての知識を有している当業者は、選択したタンパク質の性質、タンパク質上の反応性アミノ基又はスルフヒドリル基の性質及びコンジュゲートさせたタンパク質の最終用途を考慮して、さまざまな試薬の選択を正しく認識するであろう。スルフヒドリル基よりも優先的にアミノ基と反応する活性化PEG、又は、アミノ基よりも優先的にスルフヒドリル基と反応する活性化PEGを入手可能である。一般的に選択される活性化PEGには、スクシンイミジルカルボネート活性化PEG、スクシンイミジルスクシネートPEG、及び、スクシンイミジルプロピオン酸PEGなどがある。本発明の代替的な実施形態では、対象のPEGは、ヒドロキシル官能性と反応して目的のタンパク質上の部位と反応性の部位を形成する試薬を用いて活性化することができる。幾つかの実施形態では、タンパク質反応性部位は、アミノ基又はスルフヒドリル基であり、PEGは、活性エステル又はイミダゾールである(同書の第274〜185頁を参照されたい)。好ましい実施形態では、当技術分野で知られている技術を用いて、PEGの1つのヒドロキシル官能性のみを活性化する。
最も好ましい実施形態では、本発明は、当技術分野で知られている技術を用いて両方のヒドロキシル基が活性化又は誘導体化されているヘテロ官能性PEGリンカーを包含する。ヘテロ官能性PEGリンカーは、一般式X-PEG-Y (式中、X及びYは、誘導体化基又は官能基(例えば、活性化された官能基)である)で表される。本明細書で使用される場合、「官能基」は、共有結合的に結合している原子からなり、求電子的又は求核的に活性化され、共有結合を介して別の分子を誘導体化することが可能な基を意味する。官能基の具体的な例としては、限定するものではないが、以下のものを挙げることができる:-COOH、-COOR[ここで、Rは、低級アルキル又はフェニルである](カルボン酸エステル)、-COZ[ここで、Zはハライドである]、-CHO(アルデヒド)、-C(O)R(ケトン)、-SO2Z[ここで、Zは、ハライド又はCF3である]、-SO2NHZ[ここで、Zはハライドである]、-SO2NH2、-マレイミド、-アミノ、-ハロゲン化アルキル、-アルキル-Z[ここで、Zは、メシラート、トリフラート又はトシラートである]、-アルキルイソシアネート、-アルキルイソチオシアネート、-アルキルアミン、-アルキル-OH、-アルキル-SH、-アルキルスルホン、-アルキルスルホンアミド、-アルキルアルデヒド、-アルキルケトン、-アルキル-COOH、-アルキル-COOR、-アルキル-COZ[ここで、Zはハライドである]、-アルキルスルホンアミド、-アルキルスルホン、-アルキルスルホニルハライド。上記で挙げた官能基は全て、アルキル部分ではなくアリール部分を含むことも可能である。
本発明の二重特異性分子がタンパク質を含んでおり且つヘテロ官能性PEGリンカーのX活性化官能基及びY活性化官能基が同一である一実施形態では、X活性化官能基及びY活性化官能基は、本発明の第一認識結合部分又は第二認識結合部分(例えば、抗CR1抗体又は認識結合部分)の同じタイプのアミノ酸を修飾する。別の実施形態では、X活性化官能基とY活性化官能基は同一ではなく、本発明の第一認識結合部分又は第二認識結合部分(例えば、抗CR1抗体又は認識結合部分)の異なったタイプのアミノ酸を修飾する。
本発明の二重特異性分子がタンパク質を含んでいる特定の実施形態では、本発明の二重特異性分子の、本発明の方法によりPEGリンカーで修飾されることが可能なアミノ酸は、当技術分野で知られており、そのようなアミノ酸としては、限定するものではないが、以下のものを挙げることができる:リシン残基(リシン残基は、e-NH2を介してPEGと反応する)、ヒスチジン、トリプトファン、システイン(これは、スルフヒドリルSHを介してPEGと反応する;例えば、以下の文献を参照されたい:Goodsonら, 1990 Biotechnology 8:343)、アスパラギン酸(これは、そのカルボキシル官能性を介してPEGと反応する)、アルギニン、セリン(これは、ヒドロキシルOHを介してPEGと反応する)、トレオニン(これは、ヒドロキシルOHを介してPEGと反応する)、又は、グルタミン酸(これは、そのカルボキシル官能性を介してPEGと反応する)。
本発明の二重特異性分子がタンパク質を含んでいる好ましい実施形態では、PEGリンカーで修飾される本発明の第一認識結合部分又は第二認識結合部分のアミノ酸は、第一認識結合部分又は第二認識結合部分の表面に存在する。さらに別の実施形態では、第一認識結合部分又は第二認識結合部分のN-末端アミノ基(例えば、以下の文献を参照されたい:Kinstlerら, Pharm. Res. 13:1996)又はC-末端カルボン酸を、PEGリンカーを用いて誘導体化する。PEGリンカーと第一認識結合部分又は第二認識結合部分に含まれているアミノ酸残基の間の反応に適する条件は、当業者には知られている。典型的には、これらの手順には、第一に、PEGリンカー上の1つ又は両方のヒドロキシル基が活性化されている活性化PEGリンカーを提供すること、及び、該活性化PEGリンカーを、PEGとコンジュゲートさせるために選択されたタンパク質の残基と反応させることが含まれている。PEGをタンパク質とコンジュゲートさせるための一般的な方法及び一般的な活性化試薬は、以下の文献に記載されている:Delgadoら, 1992 in "The Uses and Properties of PEG-linked Proteins" from CriticalReviews illTlzerapeutic Drug Carrier Syrathesis, 9(3,4):249-304, 及び, the ACS Symposium Series 680 ed. Harriesら, Poly(ethylene glycol) Chemistry and Biological Applications 1997 (これらの文献は、いずれも、参照により本明細書に組み入れる)。
本発明の二重特異性分子がタンパク質を含んでいる幾つかの実施形態では、本発明の第一認識結合部分と第二認識結合部分を架橋させるのに使用されるヘテロ官能性PEGリンカーのX活性化官能基又はY活性化官能基は、当技術分野で知られている方法により、求電子的に活性化する。PEGリンカー上のヒドロキシル基の少なくとも1つは、本発明の第一認識結合部分又は第二認識結合部分上のアミノ基の窒素による求核攻撃に対して感受性を有する官能基(X又はY)で活性化する。本発明の一実施形態では、求電子的に活性化されたPEGリンカーを用いて、本発明の第一認識結合部分又は第二認識結合部分のアミン残基を修飾する。PEGリンカーのアミンコンジュゲートは、当技術分野で周知であり、該アミンコンジュゲートにおいては、求電子的に活性化されたPEGリンカーが求核的なアミン基を標的にする。本発明の二重特異性分子に含まれているアミン残基を修飾するのに使用することが可能なPEGリンカーの例としては、限定するものではないが、PEGジクロロトリアゼン、PEGトレシラート、PEGスクシンイミジルカルボネート、PEGベンゾトリアゾールカルボネート、PEG p-ニトロフェニルカルボネート、PEGトリクロロフェニルカルボネート、PEGカルボニルイミダゾール又はPEGスクシンイミジルスクシネートなどを挙げることができる。好ましい実施形態では、本発明に従って使用される求電子的に活性化されたPEGは、PEGスクシンイミジルスクシネート(mPEG-SS)、PEGプロピオン酸のスクシンイミド(mPEG-SPA)、又は、PEGブタン酸のスクシンイミド(mPEG-SBA)である。本発明の二重特異性分子に含まれているアミン残基を修飾するのに使用することが可能なPEGリンカーの別の例としては、限定するものではないが、mPEG2-H-ヒドロキシスクシンイミド(mPEG2-NHS)、mPEG-ベンゾトリアゾールカルボネート(mPEG-BTC)、mPEG-プロピオンアルデヒド(mPEG-ALD)、mPEG-アセトアルデヒドジエチルアセタール(mPEG-ACET)、又は、mPEG2-アルデヒド(mPEG2-ALD)などを挙げることができる。
本発明の二重特異性分子がタンパク質を含んでいる好ましい実施形態では、本発明の二重特異性分子を産生するのに使用されるヘテロ官能性PEGリンカーのX活性化基又はY活性化基は、リシン-活性PEGである。リシン修飾のための最も好ましいPEG誘導体は、PEGスクシンイミジルスクシネート(mPEG-SS)及びスクシンイミジルプロピオネート(mPEG-SPA)などのN-ヒドロキシルスクシンイミド(「NHS」)活性エステルである。一実施形態では、非限定的な例として、以下に示されているプロトコルを使用する。等質量のリシン-活性PEG(MW, 5000)と、誘導体化の対象の本発明の第一認識結合部分又は第二認識結合部分(即ち、抗CR1抗体)を、pH8〜9.5、室温で、30分間又は誘導体化を生起させるのに充分な時間、混合する。幾つかの実施形態において、タンパク質アミノ酸組成が知られている場合は、1〜5:1のタンパク質アミノ基に対するPEG(MW 5000)のモル比を使用する。
本発明の二重特異性分子がタンパク質を含んでいる別の実施形態では、本発明の二重特異性分子を産生するのに使用されるヘテロ官能性PEGリンカーのX活性化基又はY活性化基を使用して、本発明の二重特異性分子に含まれているシステイン残基を修飾する。本発明の二重特異性分子に含まれているシステイン残基を修飾するのに使用することが可能なPEGリンカーの例としては、限定するものではないが、mPEG2-フォーク状マレイミド、mPEG-フォーク状マレイミド、mPEG-マレイミド、又は、mPEG2マレイミドなどを挙げることができる。PEGリンカーをシステイン残基に結合させる方法は、米国特許第5,766,897号(この特許は、参照によりその全体を本明細書に組み入れる)に開示されている。一実施形態では、PEGリンカーを用いるシステイン残基の部位特異的誘導体化は、当技術分野で知られている部位特異的突然変異誘発で特異的システイン突然変異体を作ることにより、本発明の方法及び組成物を用いて達成することができる(Kunkelら, 1988, Nucleic Acids and Molecular Biology, Eckstein, F. Lilley, eds., Springer-Verlag, Berling and Heidelberg, vol. 2, p.124)。さらに別の好ましい実施形態では、本発明の二重特異性分子は、スルフヒドリル-選択的PEGを用いて架橋させる。スルフヒドリル修飾のための最も好ましいPEGリンカーは、ビニルスルホン、ヨードアセトアミド、及び、マレイミドである。一実施形態では、非限定的な例として、以下に示されているプロトコルを使用する。誘導体化の対象のタンパク質を、pH7〜8、室温で、僅かにモル過剰量のPEGと、0.5〜2時間混合する。
本発明の組成物及び方法に従って使用することが可能な別のヘテロ官能性PEGリンカーの例としては、限定するものではないが、NHS-ビニルスルホン及びNHS-マレイミド(それぞれ, NHS-PEG-VS, 及び, NHS-PEG-マレイミド)、ビス-ヒドラジド-PEG、ビス-ヒドラジン-PEG、及び、アルデヒド-PEG-NHSなどを挙げることができる。
[式中、Rは、フェニル、ナフチル又は芳香族ヘテロ環であり、これらはいずれも、少なくとも1つの-C(O)H基又は-NH-NH2基で置換されている]
で表される化合物又はその製薬上許容される塩である。
で表される化合物又はその製薬上許容される塩である。
「芳香族ヘテロ環」は、1〜4の環炭素原子が独立してN原子、O原子又はS原子で置き換えられている5員〜10員の単環式又は二環式の芳香環を意味する。芳香族ヘテロ環基の代表的な例としては、限定するものではないが、ピロリル、イミダゾリル、ベンゾイミダゾリル、テトラゾリル、インドリル、イソキノリニル、キノリニル、キナゾリニル、プリニル、イソオキサゾリル、ベンゾイソオキサゾリル、フラニル、フラザニル、ピリジル、オキサゾリル、ベンゾオキサゾリル、チアゾリル、ベンゾチアゾリル及びチオフェニルなどを挙げることができる。
一実施形態では、Rはフェニルである。
特定の実施形態では、C3b様受容体(即ち、抗CR1抗体、例えば、抗CR1モノクローナル抗体)に結合する第一認識結合部分は、NHS-PEG-マレイミドで誘導体化する。非限定的な例として、NHS-PEG-マレイミドについてのプロトコルは、以下のとおりであり得る:抗CR1抗体を、6:1のモル比(6×NHS-PEG-マレイミド:1×抗CR抗体)でNHS-PEG-マレイミドを用いて誘導体化し、反応は、15〜30分毎に穏やかに反転させながら室温で2時間行わせる。その際、抗CR1抗体は1以上の部位においてNHS-PEG-マレイミドで誘導体化される。該誘導体化により得られた生成物を、次いで、当技術分野で公知の標準的な手順を用いて、クロマトグラフィーにより脱塩する(例えば、Amersham Hi-Prep 26/10 脱塩カラムをMESバッファー中で使用して行う)。
さらに別の特定の実施形態では、C3b様受容体(即ち、抗CR1抗体、例えば、抗CR1モノクローナル抗体)に結合する第一認識結合部分は、NHS-PEG-ベンズアルデヒドで誘導体化する。NHS-PEG-ベンズアルデヒドによる修飾は、マレイミド化学を伴う方法のような別の修飾方法と比較して、幾つかの利点を有し得る。特定の作用機構に拘束されるものではないが、NHS-PEG-ベンズアルデヒドで修飾された分子(例えば、抗体)は、長期間(例えば、少なくとも1ヶ月間)にわたり安定である傾向を有する。これは、抗体を典型的に保存するpH範囲においてヒドラゾン部分又はアルデヒド部分が安定であるからである。従って、抗体の誘導体化反応は、コンジュゲート反応を行うよりかなり前に行うことができる。従って、NHS-PEG-ベンズアルデヒドを用いた修飾は、商業的生産にとって好ましい修飾であり得る。それは、生産スケジュールをより柔軟性に富んだものとすることが可能であり、また、コンジュゲートされなかった単量体画分をリサイクルすることができるからである。抗体をNHS-PEG-ベンズアルデヒドで修飾することの別の利点は、ヒドラジン又はアルデヒドの化学では、抗体内の別の官能基との間で結合が形成されないこと;及び、アミノ基とアルデヒド基の間で弱い結合が形成される可能性はあるが、たとえ形成されたとしても、それは、生理学的な条件下、水性バッファー中で加水分解されることである。しかしながら、マレイミドの化学を用いて抗体を修飾した場合は、誘導体化された抗体は、抗体上の遊離スルフヒドリル基と反応する可能性があり、その場合、望ましくない修飾となる。本発明のNHS-PEG-ベンズアルデヒドリンカーが有するさらに別の特定の利点は、抗体が安定な形態で典型的に維持されるpHの範囲にわたって、安定な結合を形成するのに還元剤を必要としないことである。スルフヒドリルで修飾されたタンパク質はホモ二量体を形成する場合があるが、ヒドラゾンリンカーを用いた抗体はホモ二量体を形成しない。ヒドラジンの化学を用いることのさらに別の利点は、ヒドラジン/カルボイニル結合の反応速度が速く、また、抗体を活性形態に維持することが可能な条件で反応を行わせることができることである。
本発明は、当業者に公知の任意のプロトコルを使用し、PEGリンカーを用いて本発明の第一認識結合部分又は第二認識結合部分を誘導体化することを包含する。本発明の第一認識結合部分又は第二認識結合部分を誘導体化するのに使用するPEGリンカーのモル比が、使用するPEGリンカーの分子量と、誘導体化される分子の分子量に依存すると言うことは、当業者には明らかである。当業者は、慣例的な実験を行うことにより、第一認識結合部分又は第二認識結合部分を誘導体化するのに使用するPEGリンカーのモル比を決定することができる。特定の実施形態では、NHS-PEG-マレイミドにより本発明の第一認識結合部分又は第二認識結合部分を誘導体化するための、第一認識結合部分又は第二認識結合部分に対するNHS-PEG-マレイミドのモル比は、3:1、4:1、5:1、6:1、又は、8:1である。
直鎖PEGリンカーは、本発明において、最も好ましい架橋試薬である。幾つかの実施形態では、別の架橋試薬が本発明に包含される。さらに別の架橋試薬の例としては、限定するものではないが、修飾されたPEGリンカー、分枝鎖PEGリンカー(例えば、PEG2)、直鎖フォーク状PEGリンカー、分枝鎖フォーク状PEGリンカー、又は、架橋されているPEGリンカーなどを挙げることができる。
幾つかの実施形態では、PEGリンカーを用いる本発明の二重特異性分子の第一認識結合部分と第二認識結合部分の架橋は、部位特異的な方法で行う。本発明の第一認識結合部分又は第二認識結合部分が抗体を含んでいる特定の実施形態では、PEGリンカーは、第一認識結合部分又は第二認識結合部分のFc領域内に含まれている酸化された糖質残基に部位特異的にコンジュゲートさせる。糖質を酸化する方法は、当技術分野では周知であり、そのような方法としては、限定するものではないが、酵素的酸化(例えば、グルコースオキシダーゼ)又は化学的酸化(例えば、過ヨウ素酸)などがある。糖質残基を酸化すると、多数の反応性アルデヒド基が生成され、これらに、PEGリンカー(例えば、アミン官能基又はヒドラジド官能基を有しているPEGリンカー)をコンジュゲートさせることができる。
本発明は、式X-PEG-Yで表されるヘテロ官能性PEGリンカーを用いて第一認識結合部分と第二認識結合部分を架橋させる方法を包含する。第一認識結合部分をヘテロ官能性PEGリンカーで(例えば、X-官能基を使用して)誘導体化した後は、得られたPEGで誘導体化された認識結合部分を活性化又は誘導体化されている第二認識結合部分と所望のモル比で混合して、活性化又は誘導体化されている第二認識結合部分を、PEGで誘導体化された第一認識結合部分の上で自由に反応できるPEGリンカーの官能性と反応させる。当業者は、PEGで誘導体化された第一認識結合部分と誘導体化された第二認識結合部分のモル比を決定することができる。特定の実施形態では、第一認識結合部分は抗CR1抗体である。
第一認識結合部分又は第二認識結合部分を活性化又は誘導体化する技術は、当技術分野で周知されており、当技術分野で知られている任意の方法を本発明で使用することができる。例えば、認識結合部分は、スルフヒドリル基に指向されたPEG誘導体と反応させるために、当技術分野で知られている試薬及び方法を用いてチオール化することができる。例えば、本発明の認識結合部分のアミンは、スクシンイミジル3-(2-ピリジルジチオ)プロピオネート(「SPDP」)と反応させた後、DTT又はトリス-(2-カルボキシエチル)ホスフィン(「TCEP」)を用いて還元することにより、間接的にチオール化することができる。さらにまた、アミンも、スクシンイミジルアセチルチオアセテート(「SATA」)と反応させた後、中性のpH又は中性に近いpHで、50mMのヒドロキシルアミン又はヒドラジンを用いてアセチル基を除去することにより、チオール化することができる。さらに、EDACが介在するシスタミンとの反応を行った後、DTT又はTCEPを用いてジスルフィドを還元することにより、カルボン酸基にチオールを組み入れることができる。第一認識結合部分又は第二認識結合部分をチオール化するための別の技術は、当技術分野で周知されており、本発明の方法で使用することができる。
特定の実施形態では、本発明は、バシルス・アンスラシス(Bacillus anthracis)(炭疽菌)の防御抗原(PA)タンパク質に結合する第二認識結合部分に、PEGリンカーを用いて第一認識結合部分を架橋させることを包含する。さらに別の特定の実施形態では、バシルス・アンスラシス(Bacillus anthracis)(炭疽菌)の防御抗原(PA)タンパク質に結合する第二認識結合部分は、マウスモノクローナル抗体14B7である。特定の実施形態では、本発明の方法に従って既に誘導体化してあるPEGで誘導体化された第一認識結合部分と反応させるために、14B7の1つ以上の部位をSATAで誘導体化する。非限定的な例として、以下に示してあるプロトコルを使用して、14B7をSATAで誘導体化する:PBSEバッファー中で、4℃で、14B7を一晩透析し;SATAを透析された14B7と6:1のモル比(6×SATA:1×14B7)で、15〜30分毎に穏やかに反転させながら室温で2時間反応させる。次いで、ヒドロキシルアミン塩酸塩を2000:1のモル比(2000×ヒドロキシルアミン塩酸塩:1×SATAで誘導体化された14B7)で反応混合物に添加し、得られた混合物を、アルゴンガス下、室温で2時間反応させる。次に、この混合物を、当業者に公知の標準的な方法(即ち、MESバッファー中のAmersham Hi-Prep 脱塩カラム(26/10))を用いて脱塩する。
本発明の認識結合部分は、ヒドラジン又はアルデヒドアミン修飾試薬を用いて、例えば、「SANH」(スクシンイミジル6-ヒドラジノニコチネートアセトンヒドラゾン)又は「SFB」(スクシンイミジル4-ホルミルベンゾエート)で修飾することができる。
場合により、当技術分野で知られている種々の方法を用いて、本発明の第一認識結合部分又は第二認識結合部分とPEGリンカーの誘導体化を評価することができる。当業者は、アッセイを用いて、本発明の第一認識結合部分又は第二認識結合部分に結合しているPEGリンカーの数を確認することができるし、また、本発明の第一認識結合部分又は第二認識結合部分に対するPEGリンカーによる誘導体化の結果として形成された異なったPEGで誘導体化された部分を確認することができる。
本発明の二重特異性分子がタンパク質を含んでいる特定の実施形態では、PEGリンカーで修飾されている特定のアミノ酸を確認することができる。本発明の第一認識結合部分又は第二認識結合部分のリシン残基がPEGリンカーで誘導体化されている特定の一実施形態では、修飾されていないリシン基は、「Habeeb法」(この方法では、修飾されていないリシン基をトリニトロベンゼンスルホン酸と反応させた後、UV測定に付す)(Habeeb, 1966, Anal Biochem. 14:328;Karrら, 1986, J. Chrom. 354:269;Abuchowskiら, 1977 J. Biol. Chem. 252:3578)を用いて確認することができる。修飾されていないリシン基を確認するための別の方法は、Stocksのフルオレサミン法(この方法では、フルオレサミンを修飾されていないリシン基と反応させて、蛍光誘導体を生成させる)(Karrら, 1994, Methods in Enzymology, 228:377)である。本発明の第一認識結合部分又は第二認識結合部分のシステイン残基がPEGリンカーで誘導体化されている別の実施形態では、利用可能なシステイン基は、2-チオピリドン(2-チオピリドンは、pH7.2、e=7060で、343nmの光を吸収する)を形成する2,2'-ジピリジルジスルフィドとの反応に基づく分光光度アッセイにより確認することができる。別のアプローチは、エルマン試薬(5,5'-ジチオビス(2-ニトロ安息香酸)と反応させることである(以下の文献を参照されたい:Grassettiら, 1967 Biochem. Biophys., 119:41;Riddlesら, 1979, Anal. Bioch, 94:75)。
5.3.1 二重特異性分子の精製及び特性付け
上記で説明した方法のような本発明の方法により産生された二重特異性分子の集団は、精製するのが好ましい。二重特異性分子は、二重特異性分子の集団の分子サイズ排除又は二重特異性分子の集団の特異的結合親和性又はそれらの組合せを含む精製技術を用いて、当業者に公知の任意の方法により精製することができる。
上記で説明した方法のような本発明の方法により産生された二重特異性分子の集団は、精製するのが好ましい。二重特異性分子は、二重特異性分子の集団の分子サイズ排除又は二重特異性分子の集団の特異的結合親和性又はそれらの組合せを含む精製技術を用いて、当業者に公知の任意の方法により精製することができる。
本発明は、本発明の方法により産生された二重特異性分子の集団を、DEAE、ヒドロキシルアパタイト、リン酸カルシウムなどの本発明の二重特異性分子の単離に適したカラムを用いるイオン交換クロマトグラフィーにより精製することを包含する(概して、以下の文献を参照されたい:Current Protocols in Immunology, 1994, John Wiley & Sons, Inc., New York、NY)。
別の実施形態では、本発明の方法により産生された二重特異性分子の集団を、三段階連続アフィニティークロマトグラフィーにより精製する(Corvalan及びSmith, 1987, Cancer Immunol. Immunother., 24:127-132):第1のカラムは固体マトリックスに結合したプロテインAからなり、ここで抗体のFc部分はプロテインAに結合し、抗体はカラムに結合する;次に、二重特異性分子の抗CR1mAb部分を介して結合するC3b様受容体についてアッセイする、固体マトリックスに結合したC3b様受容体を利用した第2のカラム;及び、次に、二重特異性分子の抗原認識結合部分に結合する、目的の抗原分子の特異的結合を利用した第3のカラム。
本発明は、さらにまた、本発明の方法により産生された二重特異性分子の集団を、サイズ排除クロマトグラフィー、高性能液体クロマトグラフィー(HPLC)及びアフィニティークロマトグラフィーを組み合わせて行うことにより精製することを包含する。一実施形態では、サイズ排除クロマトグラフィー、高性能クロマトグラフィー(HPLC)から溶出した適切な画分を、二重特異性分子の抗原認識結合部分に特異的な抗原分子を含んでいるカラムを用いて、さらに精製する。
さらに、本発明は、好ましくは、当技術分野で知られている任意の方法を用いて本発明の二重特異性分子の特性付けを行うことを包含する。本発明の二重特異性分子の収率は、タンパク質濃度に基づいて特性付けることができる。一実施形態では、タンパク質の濃度は、Lowryアッセイを用いて決定する。好ましくは、本発明の方法により産生された二重特異性分子は、少なくとも、0.100mg/mL、より好ましくは、少なくとも、0.5mg/mL、さらに好ましくは、少なくとも、2.0mg/mL、最も好ましくは、少なくとも、10mg/mLのタンパク質濃度を有する。別の実施形態では、本発明の二重特異性分子の濃度は、紫外吸収分光法で測定することにより決定する。該濃度は、280nmでの二重特異性分子の吸光度を測定することにより決定する。好ましくは、本発明の方法により産生された二重特異性分子は、少なくとも0.14の、280nmにおける吸光度を有する。
本発明の二重特異性分子は、さらにまた、当技術分野で知られている任意の別の標準的な方法を用いて特性付けを行うこともできる。一実施形態では、高性能サイズ排除クロマトグラフィー(HPLC-SEC)アッセイを用いて、遊離IgGタンパク質の混入量を決定する。好ましい実施形態では、本発明の方法により産生された二重特異性分子組成物に混入しているIgGの濃度は、50%未満であり、より好ましくは30%未満、最も好ましくは10%未満である。
一実施形態では、本発明の二重特異性分子は、SDS-PAGEを用いて、本発明の方法により産生された二重特異性分子の集団の分子種の分子量を測定することにより特性付けすることができる。
好ましい実施形態では、本発明は、当技術分野における標準的な方法(即ち、SDS-PAGEにおける移動性;サイズ排除クロマトグラフィーにおける溶出プロフィール)で測定したときに、集団内の二重特異性分子の分子種の少なくとも90%が架橋されている二量体種である、本発明の方法により産生された二重特異性分子の均質な集団を包含する。別の実施形態では、本発明は、当技術分野における標準的な方法(即ち、SDS-PAGE上における移動性;サイズ排除クロマトグラフィーにおける溶出プロフィール)で測定したときに、集団内の二重特異性分子の分子種の少なくとも50%、60%、70%又は80%が架橋されている二量体種である、本発明の方法により産生された二重特異性分子の均質な集団を包含する。
本発明は、さらに、二重特異性分子の機能的活性に基づいて、本発明の二重特異性分子を特性付けることを包含する。一実施形態では、固定化CR1受容体分子(例えばマイクロタイタープレートなどの固相に結合させたCR1受容体分子)を使用するELISAを用いて、抗CR1結合活性を決定する(以下の文献を参照されたい:Porterら, 米国仮特許出願第60/380,211号(この特許は、参照によりその全体を本明細書に組み入れる))。このアッセイは、CR1/抗体アッセイ又はCAAとも称され、このアッセイを一般的に用いて、任意の抗CR1抗体、又は、抗CR1抗体を含んでいるHP若しくはAHPを測定することができる。好ましい実施形態では、ELISAプレート、例えば、高結合平底ELISAプレート(high binding flat bottom ELISA plates)(Costar IA/RIA ストリッププレート 2592)を、適切な量のCR1受容体重炭酸塩溶液と一緒にインキュベーションすることにより、ELISA/CR1プレートを調製する。好ましくは、CR1受容体の重炭酸塩溶液の濃度は、0.2μg/mLであり、これは、5mg/mLのsCR1受容体原液(Avant Technology Inc.)と炭酸塩-重炭酸塩バッファー(pH9.6, Sigma C-3041)から調製する。好ましい実施形態では、100μLのCR1-重炭酸塩溶液をELISAプレートの各ウェルに供給し、そのプレートを4℃で一晩インキュベーションする。次いで、そのプレートを、好ましくは、例えば洗浄バッファー(PBS, 0.1% Tween-20, 0.05% 2-クロロアセトアミド)を用いて、洗浄する。別の好ましい実施形態では、洗浄後、該プレートに、室温で、約30〜60分間、PBS中のSuperBlockブロッキングバッファー(Pierce)を添加する。次いで、そのプレートを乾燥させ、4℃で保存することができる。抗CR1Abs又は二重特異性分子の力価測定は、校正物質としてCR1結合タンパク質(例えば、ヒト抗CR1IgG)を使用して実施することができる。好ましい実施形態では、校正物質は、300mg/mL又は600mg/mLの濃度を有するヒト抗CR1IgGである。一実施形態では、本発明の二重特異性分子の精製した組成物の力価は、希釈バッファーとしての、PBS、0.25% BSA、0.1% Tween-20、洗浄バッファーとしての、PBS、0.1% Tween-20、0.05% 2-クロロアセトアミド、ELISAのための、TMB-Liquid Substrate System(3,3',5,5'-テトラメチル-ベンジジン)、及び、停止液としての、2N H2SO4を使用して測定する。好ましくは、本発明の方法により産生された二重特異性分子は、少なくとも0.03mg/mL、より好ましくは、少なくとも2.0mg/mL、最も好ましくは、少なくとも6.0mg/mLのCAA力価を有する。幾つかの実施形態では、特異的抗CR1活性を測定する。特異的抗CR1活性は、CAAとLowryの比率である。
本発明の二重特異性分子の抗原結合活性は、固定化抗原分子を使用するELISAを用いて測定することができる。
別の実施形態では、炭疽菌の防御抗原(PA)タンパク質に結合する抗原結合性抗体フラグメントと架橋しているC3b様受容体に結合する抗体を含んでいる二重特異性分子を、ELISAアッセイを用いて、そのPA抗原の結合に関して特性付ける。このアッセイは、HPCAアッセイとも称される。このHPCAアッセイを用いて、二重特異性分子のCR-1及びPAに対する結合特異性の点から、架橋されている本発明の二重特異性分子の機能性を分析する。
非限定的な例として、以下に示されているプロトコルを使用することができる。プレート(Corning Costar アッセイプレート, v-底非処理ポリスチレン)を、0.2μg/mLの濃度のCR-1でコーティングする。抗-PAヘテロポリマーを内部標準として使用する(464.0μg/mLの濃度の14B7×7G9)。対照として種々の濃度のものを使用した。高濃度対照(「HC」)1.0μg/mL、中濃度対照(「MC」)0.5μg/mL、低濃度対照(「LC」)0.25μg/mL。ビオチンをコンジュゲートさせたPAを、0.81mg/mLの濃度で使用する。ELISA希釈バッファーは、1×PBXバッファー、0.25% BSA、0.1% Tween-20、0.05% 2-クロロアセトアミドを含んでいる。ELISA洗浄バッファーは、1×PBS、0.1% Tween-20、0.05% 2-クロロアセトアミドを含んでいる。3,3',5.5'-テトラメチル-ベンジジン(「TMB」)は、Sigmaから得る(カタログ番号 T-0440, LOT番号;21K1392)。停止液は、2N H2SO4を含んでいる。西洋ワサビペルオキシダーゼをコンジュゲートさせたストレプトアビジン(SA-HRP)を、0.5mg/mLで供する。
最初に、PA(即ち、14B7)に結合する抗体又はその抗原結合性フラグメントにPEGで架橋されているC3b様受容体(即ち、抗CR1抗体(7G9))に結合する抗体を、以下の手順を用いて、CR-1プレートに結合させる。PEGで架橋されている二重特異性抗体を、ELISA希釈バッファー中で、5μg/mLに希釈する。希釈プレート内で、サンプルを5μg/mLで列A〜列Hにロードし、1:3倍で連続的に希釈する。
希釈した100μLのサンプルを、希釈プレートからCR-1でコーティングしてあるプレートの対応するウェルに移す。100μLのHC、MC及びLCを、それぞれ、列A11及びA12、列B11及びB12、列C11及びC12に、2反復で添加する。100μLの希釈液をブランクとして5つのウェルに2反復で添加する。次いで、そのプレートを接着プレートシーラーで密封し、37℃で1時間インキュベーションする。溶液を廃棄し、そのプレートを自動プレート洗浄機で5サイクルプログラムで洗浄する。
次に、以下の手順を用いて、ビオチニル化PA(「b-PA」)を、PEGで架橋されている二重特異性抗体に結合させる。b-PAを、ELISA希釈バッファー中で、2.5ng/mLに希釈する。希釈した100μLのb-PAを、全てのウェル(ブランクウェルも含む)に移す。次いで、そのプレートを接着プレートシーラーで密封し、37℃で1時間インキュベーションする。溶液を廃棄し、そのプレートを自動プレート洗浄機で5サイクルプログラムで洗浄する。
最後に、以下の方法を用いて、ストレプトアビジンをコンジュゲートさせてある西洋ワサビペルオキシダーゼ(「SA-HRP」)をb-PAに結合させる。SA-HRPを、ELISA希釈バッファー中で、1:10,000に希釈する。
希釈した100μLのSA-HRPを、全てのウェル(ブランクウェルも含む)に移す。次いで、そのプレートを接着プレートシーラーで密封し、37℃で1時間インキュベーションする。溶液を廃棄し、そのプレートを自動プレート洗浄機で5サイクルプログラムで洗浄する。
シグナルを発生させるために、予め加温しておいた100μLのTMBを全てのウェルに添加する。そのプレートを、室温で15分間(光から保護した状態で)インキュベーションする。100μLの停止液(2N H2SO4)を添加し、そのプレートを室温でさらに10分間インキュベーションする。プレートリーダーを用いて、450nmで、プレートを読み取る。
得られた最大吸光度の値(「Max OD」と称する)を、二重特異性分子の総活性の尺度として使用することができる。好ましい実施形態では、「Max OD」は、光学密度データの4-パラメータシグモイドフィットから得る。別の実施形態では、さらに、C50のレベルも決定する。C50は、「Max OD」の50%を生じるサンプルの濃度である。
5.4 二重特異性分子の用途
本発明の二重特異性分子は、病原性抗原分子の存在に関連する疾患又は障害を治療又は予防するのに有用である。病原性抗原分子は、治療対象の被検体において潜在的に有害であるか又は望ましくない、循環中に存在する任意の物質であることが可能であり、そのような物質としては、限定するものではないが、タンパク質若しくは薬物若しくは毒素、自己抗体若しくは自己抗原、又は、任意の感染因子の分子若しくはその産物などを挙げることができる。病原性抗原分子は、疾患若しくは障害又は別の任意の望ましくない状態の原因となる物質(例えば、病原体)であるか又はそのような物質の一部分である抗原決定基(又は、抗原決定基以外で結合領域が結合可能であるもの)を含んでいる任意の分子である。
本発明の二重特異性分子は、病原性抗原分子の存在に関連する疾患又は障害を治療又は予防するのに有用である。病原性抗原分子は、治療対象の被検体において潜在的に有害であるか又は望ましくない、循環中に存在する任意の物質であることが可能であり、そのような物質としては、限定するものではないが、タンパク質若しくは薬物若しくは毒素、自己抗体若しくは自己抗原、又は、任意の感染因子の分子若しくはその産物などを挙げることができる。病原性抗原分子は、疾患若しくは障害又は別の任意の望ましくない状態の原因となる物質(例えば、病原体)であるか又はそのような物質の一部分である抗原決定基(又は、抗原決定基以外で結合領域が結合可能であるもの)を含んでいる任意の分子である。
治療又は予防を目的として、本発明の二重特異性抗体を投与する好ましい被検体は、哺乳動物であり、そのような哺乳動物としては、限定するものではないが、非ヒト動物(例えば、ウマ、ウシ、ブタ、イヌ、ネコ、ヒツジ、ヤギ、マウス、ラットなど)を挙げることができ、また、好ましい実施形態では、該被検体は、ヒト又は非ヒト霊長類である。
固定された組織食細胞により排除される循環性病原性抗原分子としては、被検体に対して有害な任意の抗原部分などがある。有害な病原性抗原分子の例には、寄生生物、菌類、原生動物、細菌又はウイルスに関連する任意の病原性抗原分子などがある。さらに、循環性病原性抗原分子としては、毒素、免疫複合体、自己抗体、薬物、過剰用量物質(例えば、バルビツレート)なども挙げることができ、又は、循環中に存在し且つ宿主哺乳動物の健康に対して望ましくないか又は有害な全てのものを挙げることもできる。病原性抗原分子を哺乳動物の循環中から効果的に除去する免疫系に欠陥があると、外傷性ショック及び血液量減少性ショックが生じ得る(Altura及びHershey, 1968, Am. J. Physiol. 215:1414-9)。
さらに、非病原性抗原(例えば、移植抗原)は、宿主に対して有害であると誤って認識され、病原性抗原分子であるかのように宿主免疫系により攻撃される。本発明は、さらに、移植拒絶を処置する実施形態を提供し、該実施形態は、移植拒絶に関与する免疫細胞又は免疫因子(例えば、移植抗原特異的抗体)に結合してそれを除去する有効量の本発明の二重特異性抗体を被検体に投与することを含んでなる。
5.4.1 自己免疫抗原
一実施形態では、循環から排除される病原性抗原分子に自己免疫抗原が包含される。そのような抗原としては、限定するものではないが、自己抗体、又は、自己免疫疾患に関連する天然分子などを挙げることができる。
一実施形態では、循環から排除される病原性抗原分子に自己免疫抗原が包含される。そのような抗原としては、限定するものではないが、自己抗体、又は、自己免疫疾患に関連する天然分子などを挙げることができる。
1つの例として、血友病を患っている特定のヒトはVIII因子が不足していることが示されている。この血友病は、組換えVIII因子置換により治療される。しかしながら、最終的には、一部の患者ではVIII因子に対する抗体が発達し、それにより、この治療が妨げられる。抗-抗-VIII因子抗体を用いて調製した本発明の二重特異性抗体は、この問題に対する治療的解決をもたらす。特に、C3b様受容体に対する第一認識結合部分の特異性と抗VIII因子自己抗体に対する第二認識結合部分の特異性を有する二重特異性抗体は、循環から自己抗体を排除して疾患を緩和するのに治療上有用であろう。
本発明の二重特異性抗体により排除することが可能な自己抗体のさらなる例としては、限定するものではないが、以下に示されている抗原に対する自己抗体などを挙げることができる:筋肉アセチルコリン受容体(この抗体は、重症筋無力症に関連している);カルジオリピン(狼瘡に関連している);血小板関連タンパク質(特発性血小板減少性紫斑病に関連している);シェーグレン症候群に関連する複数の抗原;組織移植自己免疫反応のケースに関与する抗原;心筋上に見られる抗原(自己免疫性心筋炎に関連している);免疫複合体介在性腎臓疾患に関連する抗原;dsDNA及びssDNA抗原(ループス腎炎に関連している);デスモグレイン及びデスモプラキン(天疱瘡及び類天疱瘡に関連している);又は、特性付けされていて且つ疾患病因に関連する任意の別の抗原。
上記二重特異性抗体をヒト又は非ヒト霊長類の循環中に注入した場合、該二重特異性抗体は、高い割合でヒト又は霊長類のC3b受容体領域認識部位を介して、また、赤血球上のC3b様受容体部位の数に従って、赤血球に結合する。二重特異性抗体は、該モノクローナル抗体に結合した抗原を介して自己抗体に間接的に同時に会合する。次いで、表面上に二重特異性抗体/自己抗体複合体を有する赤血球細胞は、結合した病原性自己抗体の中和及び循環中からの排除を促進する。
本発明においては、二重特異性抗体は、表面上にC3b様受容体を発現している造血細胞に病原性抗原又は自己抗体が結合するのを促進し、その後、造血細胞は排除することなく、該病原性抗原又は自己抗体を循環中から排除する。
5.4.2 感染性疾患
特定の実施形態では、感染性疾患因子の抗原とC3b様受容体の両方に結合する本発明の二重特異性分子を投与することにより、感染性疾患を治療又は予防する。従って、このような実施形態では、病原性抗原分子は、感染性疾患因子の抗原である。
特定の実施形態では、感染性疾患因子の抗原とC3b様受容体の両方に結合する本発明の二重特異性分子を投与することにより、感染性疾患を治療又は予防する。従って、このような実施形態では、病原性抗原分子は、感染性疾患因子の抗原である。
そのような抗原としては、限定するものではないが、以下のものを挙げることができる:インフルエンザウイルス赤血球凝集素(Genbank受託番号JO2132;Air, 1981, Proc. Natl. Acad. Sci. USA 78:7639-7643;Newtonら, 1983, Virology 128:495-501)、ヒト呼吸器合胞体ウイルスG糖タンパク質(Genbank受託番号Z33429;Garciaら, 1994, J. Virol.;Collinsら, 1984, Proc. Natl. Acad. Sci. USA 81:7683)、デングウイルスのコアタンパク質、マトリックスタンパク質又は他のタンパク質(Genbank受託番号M19197;Hannら, 1988, Virology 162:167-180)、麻疹ウイルス赤血球凝集素(Genbank受託番号M81899;Rotaら, 1992, Virology 188:135-142)、単純ヘルペスウイルス2型糖タンパク質gB(Genbank受託番号M14923;Bzikら, 1986, Virology 155:322-333)、ポリオウイルスI VP1(Eminiら, 1983, Nature 304:699)、HIV Iのエンベロープ糖タンパク質(Putneyら, 1986, Science 234:1392-1395)、B型肝炎表面抗原(Itohら, 1986, Nature 308:19;Neurathら, 1986, Vaccine 4:34)、ジフテリア毒素(Audibertら, 1981, Nature 289:543)、ストレプトコッカス24Mエピトープ(Beachey, 1985, Adv. Exp. Med. Biol. 185:193)、ゴノコッカル・ピリン(gonococcal pilin)(Rothbard及びSchoolnik, 1985, Adv. Exp. Med. Biol. 185:247)、仮性狂犬病ウイルスg50(gpD)、仮性狂犬病ウイルスII(gpB)、仮性狂犬病ウイルスgIII(gpC)、仮性狂犬病ウイルス糖タンパク質H、仮性狂犬病ウイルス糖タンパク質E、伝染性胃腸炎糖タンパク質195、伝染性胃腸炎マトリックスタンパク質、ブタロタウイルス糖タンパク質38、ブタパルボウイルスキャプシドタンパク質、セルプリナ・ヒドジセンテリエ(Serpulina hydodysenteriae)保護抗原、ウシウイルス性下痢糖タンパク質55、ニューカッスル病ウイルス赤血球凝集素-ノイラミニダーゼ、ブタインフルエンザ赤血球凝集素、ブタインフルエンザノイラミニダーゼ、口蹄疫ウイルス、ブタコレラウイルス、ブタインフルエンザウイルス、アフリカ豚コレラウイルス、マイコプラズマ・ヒオニューモニエ(Mycoplasma hyopneumoniae)、ウシ感染性鼻気管炎ウイルス(例えば、ウシ感染性鼻気管炎ウイルス糖タンパク質E又は糖タンパク質G)、感染性喉頭気管炎ウイルス(例えば、感染性喉頭気管炎ウイルス糖タンパク質G又は糖タンパク質I)、ラクロスウイルスの糖タンパク質(Gonzales-Scaranoら, 1982, Virology 120:42)、新生子ウシ下痢ウイルス(Matsuno及びInouye, 1983, Infection and Immunity 39:155)、ベネズエラウマ脳脊髄炎ウイルス(Mathews及びRoehrig, 1982, J. Immunol. 129:2763)、プンタトロウイルス(Dalrympleら, 1981, Replication of Negative Strand Viruses, Bishop及びCompans(eds.), Elsevier, NY, p. 167)、マウス白血病ウイルス(Steevesら, 1974, J. Virol. 14:187)、マウス乳腺癌ウイルス(Massey及びSchochetman, 1981, Virology 115:20)、B型肝炎ウイルスコアタンパク質及び/若しくはB型肝炎ウイルス表面抗原又はその断片若しくは誘導体(例えば、以下の文献を参照されたい:1980年6月4日に公開された英国特許出願公開第GB 2034323A号;Ganem及びVarmus, 1987, Ann. Rev. Biochem. 56:651-693;Tiollaisら, 1985, Nature 317:489-495を参照)、ウマインフルエンザウイルス又はウマヘルペスウイルス(例えば、ウマインフルエンザウイルスA型/アラスカ91ノイラミニダーゼ、ウマインフルエンザウイルスA型/マイアミ63ノイラミニダーゼ、ウマインフルエンザウイルスA型/ケンタッキー81ノイラミニダーゼ、ウマヘルペスウイルス1型糖タンパク質B、及び、ウマヘルペスウイルス1型糖タンパク質D)、ウシ呼吸器合胞体ウイルス又はウシパラインフルエンザウイルスの抗原(例えば、ウシ呼吸器合胞体ウイルス付着タンパク質(BRSV G)、ウシ呼吸器合胞体ウイルス融合タンパク質(BRSV F)、ウシ呼吸器合胞体ウイルスヌクレオキャプシドタンパク質(BRSV N)、ウシパラインフルエンザウイルス3型融合タンパク質、及び、ウシパラインフルエンザウイルス3型赤血球凝集素ノイラミニダーゼ)、ウシウイルス性下痢ウイルス糖タンパク質48又は糖タンパク質53。
本発明の二重特異性分子を使用することにより治療又は予防が可能なさらなる疾患又は障害としては、限定するものではないが、以下のものによって引き起こされる疾患又は障害などを挙げることができる:A型肝炎、B型肝炎、C型肝炎、インフルエンザ、水痘、アデノウイルス、単純ヘルペスウイルスI型(HSV-I)、単純ヘルペスウイルスII型(HSV-II)、牛疫、ライノウイルス、エコーウイルス、ロタウイルス、呼吸器合胞体ウイルス、パピローマウイルス、パポバウイルス、サイトメガロウイルス、エキノウイルス(echinovirus)、アルボウイルス、ハンタウイルス、コクサッキーウイルス、流行性耳下腺炎ウイルス、麻疹ウイルス、風疹ウイルス、ポリオウイルス、ヒト免疫不全ウィルスI型(HIV-I)、ヒト免疫不全ウィルスII型(HIV-II)、任意のピコルナウイルス、エンテロウイルス、カリシウイルス科ウイルス、Norwalk群のウイルスのいずれか、トガウイルス(例えば、デングウイルス)、アルファウイルス、フラビウイルス、コロナウイルス、狂犬病ウイルス、マルブルグウイルス、エボラウイルス、パラインフルエンザウイルス、オルトミクソウイルス、ブンヤウイルス、アレナウイルス、レオウイルス、ロタウイルス、オルビウイルス、ヒトT細胞白血病ウイルスI型、ヒトT細胞白血病ウイルスII型、サル免疫不全ウイルス、レンチウイルス、ポリオーマウイルス、パルボウイルス、エプスタイン-バーウイルス、ヒトヘルペスウイルス-6、オナガザルヘルペスウイルス1(Bウイルス)、及び、ポックスウイルス。
本発明の二重特異性分子を使用することにより治療又は予防が可能な細菌性の疾患又は障害としては、限定するものではないが、以下のものを挙げることができる:マイコバクテリア・リケッチア(Mycobacteria rickettsia)、マイコプラズマ、ナイセリア属(例えば、髄膜炎菌及び淋菌)、レジオネラ、コレラ菌、連鎖球菌(例えば、肺炎連鎖球菌)、ジフテリア菌、破傷風菌、百日咳菌、ヘモフィルス属(例えば、インフルエンザ菌)、クラミジア属、腸毒性大腸菌、及び、炭疽菌(炭疽病)。
本発明の二重特異性分子を使用することにより治療又は予防が可能な原生動物性の疾患又は障害としては、限定するものではないが、マラリア原虫(plasmodia)、アイメリア(eimeria)、リーシュマニア(Leishmania)及びトリパノソーマ(trypanosoma)などを挙げることができる。
特定の実施形態では、本発明は、炭疽菌感染症を治療するための方法及び組成物を提供する。該方法は、バシルス・アンスラシス(Bacillus anthracis)(炭疽菌)の防御抗原(PA)タンパク質に結合する全長抗体(即ち、14B7マウスモノクローナル抗体)又はその抗原結合性フラグメントにPEGリンカーを用いて架橋されているC3b様受容体に結合する抗体を含んでいる二重特異性分子の治療有効量を患者に投与することを含んでなる。ここで、該防御抗原(PA)タンパク質は、炭疽菌の致死性及び浮腫性の毒素の共通成分である(例えば、以下の文献を参照されたい:Littleら, 1991, Biochem Biophys Res Commun.180:531-7;Littleら, 1988, Infect Immun. 56:1807-13)。炭疽菌の防御抗原タンパク質は、毒性を示すのに必要であることが示された(Littleら, 1988, Infect Immun. 56:1807-13)。本発明の二重特異性分子を用いて、循環中からPAを除去することが可能であり、それにより、炭疽菌の毒性作用を和らげることができる。PAタンパク質に結合する抗体の抗原結合性抗体フラグメントを含む二重特異性分子を産生する方法は、2002年9月16日に出願された米国仮特許出願第(未指定)(代理人事件整理番号9635-041-888)に開示されている。この特許は、参照によりその全体を本明細書に組み入れる。
一実施形態では、抗体フラグメントは、PAに結合する抗体14B7のFabフラグメントである(例えば、以下の文献を参照されたい:Littleら, 1991, Biochem Biophys Res Commun.180:531-7;Littleら, 1988, Infect Immun. 56:1807-13)。別の実施形態では、抗体フラグメントは、14B7(14B7scAb)から誘導された単鎖抗体である。14B7scAbは、ヒト定常k領域と融合させた14B7の単鎖Fvからなる(例えば、以下の文献を参照されたい:Maynardら, Nature Biotechnology 20:597-601)。好ましい実施形態では、C3b様受容体に結合する抗体は、マウス抗CR1IgG7G9である。好ましい実施形態では、本発明の二重特異性分子は、架橋剤として、N-スクシンイミジル-S-アセチル-チオアセテート(SATA)及びスルホスクシンイミジル4-(N-マレイミドメチル)シクロヘキサン-1-カルボキシレート(sSMCC)を使用して、抗CR1mAb(例えば、7G9)と抗-PA Fabフラグメント(例えば、14B7Fab)を架橋させることにより産生する。別の好ましい実施形態では、該二重特異性分子は、架橋剤として、N-スクシンイミジル-S-アセチル-チオアセテート(SATA)及びNHS-ポリ(エチレングリコール)-マレイミド(PEG-MAL)を使用して、抗CR1mAb(例えば、7G9)と抗-PA単鎖抗体(例えば、14B7scAb)を架橋させることにより産生する。さらに別の好ましい実施形態では、該二重特異性分子は、架橋剤として、N-スクシンイミジル-S-アセチル-チオアセテート(SATA)及びNHS-ポリ(エチレングリコール)-マレイミド(PEG-MAL)を使用して、抗CR1mAb(例えば、7G9)と抗-PA単鎖抗体(例えば、14B7Fab)を架橋させることにより産生する。
5.4.3 さらなる病原性抗原
一実施形態では、本発明の方法及び組成物により循環から排除される病原性抗原分子は、血清剤(serum drug)を包含する。そのような血清剤としては、限定するものではないが、バルビツール薬、三環系抗鬱薬及びジギタリス薬などを挙げることができる。
一実施形態では、本発明の方法及び組成物により循環から排除される病原性抗原分子は、血清剤(serum drug)を包含する。そのような血清剤としては、限定するものではないが、バルビツール薬、三環系抗鬱薬及びジギタリス薬などを挙げることができる。
別の実施形態では、排除される病原性抗原分子は、過剰用量で存在して被検体に対して一時的又は恒久的な害を与え得る血清抗原を包含する。この実施形態は、特に、薬物の過剰投与に関連する。
別の実施形態では、循環から排除される病原性抗原分子は、天然産生物質を包含する。本発明の方法及び組成物により排除し得る天然の病原性抗原分子の例としては、限定するものではないが、低密度リポタンパク質、インターロイキン又は別の免疫調節剤、及び、ホルモンである。
5.4.4 二重特異性分子のカクテル
精製した本発明の種々の二重特異性分子を組み合わせて、二重特異性分子の「カクテル」とすることが可能である。そのような二重特異性分子のカクテルには、抗CR1mAbを第一認識結合部分として有し且つ数種類の望ましい認識結合部分のいずれか1つを第二認識結合部分として有する二重特異性分子を含ませることができる。例えば、二重特異性分子のカクテルは、複数の異なった二重特異性分子を含有し、その際、複数の二重特異性分子のうちの異なる各二重特異性分子は、異なる病原体を標的とする異なる第二認識結合部分を含む。第二認識結合部分は、タンパク性部分及び/又は非タンパク性部分であり得る。そのような二重特異性分子のカクテルは、個々の患者の必要性に合わせた個人用の特別の医薬として有用である。
精製した本発明の種々の二重特異性分子を組み合わせて、二重特異性分子の「カクテル」とすることが可能である。そのような二重特異性分子のカクテルには、抗CR1mAbを第一認識結合部分として有し且つ数種類の望ましい認識結合部分のいずれか1つを第二認識結合部分として有する二重特異性分子を含ませることができる。例えば、二重特異性分子のカクテルは、複数の異なった二重特異性分子を含有し、その際、複数の二重特異性分子のうちの異なる各二重特異性分子は、異なる病原体を標的とする異なる第二認識結合部分を含む。第二認識結合部分は、タンパク性部分及び/又は非タンパク性部分であり得る。そのような二重特異性分子のカクテルは、個々の患者の必要性に合わせた個人用の特別の医薬として有用である。
5.5 医薬組成物及び投与
本発明の二重特異性分子は、哺乳動物(好ましくは、ヒト)への投与に適した医薬組成物に組み入れることができる。そのような組成物は、典型的には、二重特異性分子と製薬上許容される担体を含んでいる。本明細書で使用される場合、用語「製薬上許容される担体」は、製薬の投与に適合する、任意の全ての溶媒、分散媒、コーティング剤、抗菌剤及び抗真菌剤、等張化剤及び吸収遅延剤などを包含することが意図されている。医薬として活性な物質のためのそのような媒質及び薬剤の使用は、当技術分野で周知である。慣習的な任意の媒質又は薬剤は、それらが二重特異性抗体と適合しない範囲を除き、該組成物中での使用が予期される。さらに、補足的な二重特異性抗体も該組成物中に組み入れることができる。
本発明の二重特異性分子は、哺乳動物(好ましくは、ヒト)への投与に適した医薬組成物に組み入れることができる。そのような組成物は、典型的には、二重特異性分子と製薬上許容される担体を含んでいる。本明細書で使用される場合、用語「製薬上許容される担体」は、製薬の投与に適合する、任意の全ての溶媒、分散媒、コーティング剤、抗菌剤及び抗真菌剤、等張化剤及び吸収遅延剤などを包含することが意図されている。医薬として活性な物質のためのそのような媒質及び薬剤の使用は、当技術分野で周知である。慣習的な任意の媒質又は薬剤は、それらが二重特異性抗体と適合しない範囲を除き、該組成物中での使用が予期される。さらに、補足的な二重特異性抗体も該組成物中に組み入れることができる。
本発明の医薬組成物は、意図される投与経路に適合するように製剤する。好ましい投与経路は、静脈内である。投与経路の他の例には、非経口、皮内、皮下、経皮(局所)及び経粘膜などがある。非経口、皮内又は皮下適用のために使用する溶液又は懸濁液は、以下の成分を含み得る:無菌希釈液、例えば、注射用蒸留水、食塩水、固定油、ポリエチレングリコール、グリセリン、プロピレングリコール又は別の合成溶媒;抗菌剤、例えば、ベンジルアルコール又はメチルパラベン;抗酸化剤、例えば、アスコルビン酸又は亜硫酸水素ナトリウム;キレート化剤、例えば、エチレンジアミン四酢酸;緩衝剤、例えば、酢酸塩、クエン酸塩又はリン酸塩;及び、張性を調節するための物質、例えば、塩化ナトリウム又はデキストロース。pHは、塩酸又は水酸化ナトリウムなどの酸又は塩基を用いて調節することが可能である。非経口投与用の調製物は、ガラス製又はプラスチック製の、アンプル、使い捨て注射器又は複数用量バイアルの中に封入し得る。
注射可能な使用に適した医薬組成物には、無菌の水溶液(水溶性の場合)又は分散液、及び、無菌の注射可能な溶液又は分散液を必要に応じて調製するための無菌の粉末などがある。静脈内投与に適する担体には、生理的塩類溶液、静菌性水、Cremophor ELTM(BASF;Parsippany, NJ)又はリン酸緩衝食塩水(PBS)などがある。いずれの場合も、該組成物は、無菌であることが必要であり、また、粘度が低く該二重特異性抗体が注射可能な程度に流動性でなければならない。該組成物は、製造及び保存の条件下で安定であることが必要であり、細菌及び菌類などの微生物による汚染作用に対して保護されなければならない。
担体は、例えば、水、エタノール、ポリオール(例えば、グリセロール、プロピレングリコール、及び、液体ポリエチレングリコールなど)及びそれらの適切な混合物を含んでいる溶媒又は分散媒であり得る。例えば、レシチンなどのコーティングを用いることにより、及び、分散液の場合には必要とされる粒径を維持することにより、及び、界面活性剤を使用することにより、適切な流動性を維持することが可能である。微生物の作用は、種々の抗菌剤及び抗真菌剤、例えば、パラベン類、クロロブタノール、フェノール、アスコルビン酸、チメロサールなどにより防止することができる。多くの場合、該組成物中に、等張化剤、例えば、糖類、多価アルコール類、例えば、マンニトール、ソルビトール、塩化ナトリウムなどを含有させるのが好ましい。注射可能な組成物中に、吸収を遅延させる作用物質(例えば、モノステアリン酸アルミニウム及びゼラチン)を含ませることにより、そのような組成物の吸収を延長することができる。
無菌の注射可能な溶液は、上記で列挙した成分の1つ又はそれらの組合わせを含んでいる適切な溶媒中に必要量の二重特異性分子(例えば、1種以上の二重特異性抗体)を加えた後、必要に応じて、濾過滅菌を行うことにより調製することができる。一般に、分散液は、基剤としての分散媒と上記で列挙した成分の中から選択される必要な別の成分を含んでいる無菌ビヒクルに該二重特異性分子を加えることにより調製することができる。無菌の注射可能な溶液を調製するための無菌粉末の場合、好ましい調製方法は、活性成分と任意の所望の追加成分の予め滅菌濾過してある溶液からそれら成分の粉末を生じる真空乾燥及び凍結乾燥である。
一実施形態では、インプラント及びマイクロカプセル化送達系を包含する制御放出製剤のような身体からの急速な排泄に対して化合物を保護する担体を用いて、二重特異性分子を調合する。エチレン酢酸ビニル、ポリ無水物、ポリグリコール酸、コラーゲン、ポリオルトエステル及びポリ乳酸などの、生物分解性で生体適合性のポリマーを使用することができる。このような製剤の調製方法は、当業者には明らかである。さらに、材料は、Alza Corporation及びNova Pharmaceuticals, Inc.から商業的に入手することもできる。リポソーム懸濁液(ウイルス抗原に対するモノクローナル抗体を用いて感染細胞を標的にするリポソームを包含する)も、製薬上許容される担体として使用することができる。これらは、例えば、米国特許第4,522,811号(この特許は、参照によりその全体を本明細書に組み入れる)の記載に準じて、当業者に公知の方法により調製することができる。
投与を容易にし且つ投与量を均一にするために、非経口投与用組成物を投与単位形態に製剤するのが有利である。本明細書で使用される場合、「投与単位形態」は、治療対象の被検体についての単位投与量に適する物理的に分離されている単位を意味する。各単位は、必要とされる製薬用担体と協力して所望の治療効果を得るように計算された所定量の二重特異性抗体を含む。本発明の投与単位形態の仕様は、二重特異性抗体の独特の特徴及び達成しようとする特定の治療効果、並びに、個体の治療用に該二重特異性抗体を調合する技術に特有の限定に従い、また、それらに直接的に依存する。
該医薬組成物は、投与用の使用説明書と一緒に、キット、容器、パック又はディスペンサーに含ませることができる。
5.5.1 二重特異性抗体の用量
本発明の二重特異性分子の用量は、通常の実験を行うことにより医師により決定され得る。その効力は、ヒトに投与する前に動物モデルにおいて示されることが好ましい。当技術分野で公知の循環器疾患用の任意の動物モデルを使用することができる。
本発明の二重特異性分子の用量は、通常の実験を行うことにより医師により決定され得る。その効力は、ヒトに投与する前に動物モデルにおいて示されることが好ましい。当技術分野で公知の循環器疾患用の任意の動物モデルを使用することができる。
より詳細には、二重特異性抗体の用量は、造血細胞の濃度、及び、造血細胞当たりの、抗C3b様受容体モノクローナル抗体が結合しているC3b様受容体エピトープ部位の数に基づいて決定することができる。二重特異性抗体が過剰に添加されると、二重特異性抗体の一部は造血細胞に結合せず、病原性抗原が造血細胞に結合するのを阻害する。それは、溶液中に遊離状態の二重特異性抗体が存在する場合、その遊離状態の二重特異性抗体が、結合可能な病原性抗原について、造血細胞に結合した二重特異性抗体と競合するからである。従って、二重特異性抗体が介在する病原性抗原の造血細胞への結合は、投入された二重特異性抗体の濃度の関数として結合を試験した場合、それは、鐘型曲線に従う。
一般に、抗体についてはの好ましい投与量は、体重1kg当たり0.1mg〜100mg(一般に、体重1kg当たり10mg〜20mg)である。抗体が脳内で作用する場合、体重1kg当たり50mg〜100mgの投与量が通常適切である。一般に、部分的ヒト抗体及び完全ヒト抗体は、他の抗体よりも、ヒト体内における半減期が長い。従って、多くの場合、投与量及び投与頻度を少なくすることが可能である。脂質化(lipidation)などの修飾を用いて、抗体を安定させることも可能であるし、また、取り込み及び組織への浸透(例えば、脳への浸透)を向上させることもできる。抗体を脂質化する方法は、Cruikshankら((1997) J. Acquired Immune Deficiency Syndromes and Human Retrovirology 14:193)によって記述されている。
本明細書において定義されているように、二重特異性抗体の治療有効量(即ち、有効投与量)は、体重1kg当たり約0.001〜30mgの範囲、好ましくは、体重1kg当たり約0.01〜25mgの範囲、より好ましくは、体重1kg当たり約0.1〜20mgの範囲であり、そして、さらに好ましくは、体重1kg当たり約1〜10mg、2〜9mg、3〜8mg、4〜7mg、又は、5〜6mgの範囲である。
当業者は、被検体を効果的に治療するのに必要な投与量に特定の要因が影響を及ぼし得るということを理解するであろう。そのような要因としては、限定するものではないが、疾患又は障害の重症度、以前行われた治療、被検体の全般的な健康及び/又は年齢、並びに、現存する別の疾患などを挙げることができる。さらに、治療有効量の二重特異性抗体を用いた被検体の治療には、単回治療も包含され得るし、又は、好ましくは、一連の治療を包含され得る。好ましい例では、被検体は、体重1kg当たり約0.1〜20mgの範囲の二重特異性抗体を用いて、週に1度で、約1〜10週間、好ましくは、2〜8週間、より好ましくは約3〜7週間、さらに好ましくは、約4、5又は6週間の間治療する。さらにまた、治療に使用される二重特異性抗体の有効投与量は、特定の治療の過程において増加又は減少され得るということも明らかであろう。投与量の変更は、本明細書に記載されている診断アッセイの結果から得られ、また、明らかになり得る。
二重特異性抗体剤の適切な用量が、通常の熟練した医師、獣医又は研究者の知識の範囲内にある多数の要因に依存するということは、理解されるであろう。二重特異性抗体の用量は、例えば、治療対象の被検体又はサンプルのアイデンティティー、大きさ及び状態に依存して変わり、さらに、適切な場合には、該組成物を投与する経路に依存して変わり、また、開業医が求める二重特異性抗体の病原性抗原分子又は自己抗体に対する効果に依存して変わる。
さらにまた、二重特異性抗体の適切な用量が、排除する抗原に対する二重特異性抗体の効能に依存することも理解されよう。そのような適切な用量は、本明細書に記述されているアッセイを用いて決定し得る。このような二重特異性抗体の1つ以上を、抗原を排除するために動物(例えば、ヒト)に投与する場合、医師、獣医又は研究者は、例えば、最初は比較的低い用量で処方し、その後、適切な応答が得られるまで用量を増加させることもできる。さらに、任意の特定の動物被検体に対する具体的な用量レベルが、用いる二重特異性抗体の活性、被検体の年齢、体重、全般的な健康、性別及び食事、投与の時間、投与の経路、排泄速度、薬物の併用、並びに、排除する抗原の濃度などを含む様々な要因に依存することは理解されよう。
5.6 キット
本発明は、さらに、本発明の二重特異性分子を含んでいるキットも提供する。本発明の医薬組成物を含んでいるキットも提供する。
本発明は、さらに、本発明の二重特異性分子を含んでいるキットも提供する。本発明の医薬組成物を含んでいるキットも提供する。
6. 実施例
以下の実施例により、抗CR1mAbとバシルス・アンスラシス(Bacillus anthracis)(炭疽菌)の防御抗原(PA)タンパク質に結合する抗体を含んでいる二重特異性分子の産生について記述する。ここで、該防御抗原(PA)タンパク質は、炭疽菌の致死性及び浮腫性の毒素の共通成分である(例えば、以下の文献を参照されたい:Littleら, 1991, Biochem Biophys Res Commun. 180:531-7;Littleら, 1988, Infect Immun. 56:1807-13)。PAが細胞の受容体に結合することが毒性を示すのに必要であることが示された(例えば、以下の文献を参照されたい:Littleら, 1988, Infect Immun. 56:1807-13)。14B7抗体は、PAに結合する(例えば、以下の文献を参照されたい:Littleら, 1991, Biochem Biophys Res Commun. 180:531-7;Littleら, 1988, InfectImmun. 56:1807-13)。従って、下記実施例において産生された二重特異性分子は、循環からPAを排除することにより、炭疽菌感染症を治療するのに使用することができる。
以下の実施例により、抗CR1mAbとバシルス・アンスラシス(Bacillus anthracis)(炭疽菌)の防御抗原(PA)タンパク質に結合する抗体を含んでいる二重特異性分子の産生について記述する。ここで、該防御抗原(PA)タンパク質は、炭疽菌の致死性及び浮腫性の毒素の共通成分である(例えば、以下の文献を参照されたい:Littleら, 1991, Biochem Biophys Res Commun. 180:531-7;Littleら, 1988, Infect Immun. 56:1807-13)。PAが細胞の受容体に結合することが毒性を示すのに必要であることが示された(例えば、以下の文献を参照されたい:Littleら, 1988, Infect Immun. 56:1807-13)。14B7抗体は、PAに結合する(例えば、以下の文献を参照されたい:Littleら, 1991, Biochem Biophys Res Commun. 180:531-7;Littleら, 1988, InfectImmun. 56:1807-13)。従って、下記実施例において産生された二重特異性分子は、循環からPAを排除することにより、炭疽菌感染症を治療するのに使用することができる。
特に、実施例6.1では、架橋剤としてN-スクシンイミジル-S-アセチル-チオアセテート(SATA)とN-ヒドロキシスクシンイミド-ポリ(エチレングリコール)-マレイミド(NHS-PEG-MAL)を使用して行う、抗CR1mAb(7G9)と抗PA抗体(14B7IgG)を含有する二重特異性分子の産生について記述する。実施例6.2では、架橋剤としてN-スクシンイミジル-S-アセチル-チオアセテート(SATA)とNHS-ポリ(エチレングリコール)-マレイミド(PEG-MAL)を使用して行う、7G9と抗PA単鎖抗体(14B7scAb)を含有する二重特異性分子の産生について記述する。実施例6.3では、架橋剤としてN-スクシンイミジル-S-アセチル-チオアセテート(SATA)とNHS-ポリ(エチレングリコール)-マレイミド(PEG-MAL)を使用して行う、7G9と14B7Fabを含有する二重特異性分子の産生について記述する。また、実施例6.4〜6.6では、架橋剤としてC6 4-ヒドラジノ-ニコチンアミドアセトンヒドラゾン(Hz)(Solulink)とNHS-PEG-ベンズアルデヒドを使用して行う、ヒト化モノクローナル抗体H9とモノクローナル抗体14B7を含有する二重特異性分子の産生及び特性付けについて記述する。
実施例6.1
二重特異性分子S:14B7IgG-PEG-7G9IgG
抗CR1モノクローナル抗体(7G9)と抗PA抗体(14B7IgG)を含有する二重特異性分子を産生した。簡単にするために、ここでは、該二重特異性分子を「14B7IgG-PEG-7G9IgG」と称する。
二重特異性分子S:14B7IgG-PEG-7G9IgG
抗CR1モノクローナル抗体(7G9)と抗PA抗体(14B7IgG)を含有する二重特異性分子を産生した。簡単にするために、ここでは、該二重特異性分子を「14B7IgG-PEG-7G9IgG」と称する。
抗CR1モノクローナル抗体, 7G9
高親和性抗CR1モノクローナル抗体を分泌するハイブリドーマ細胞系を使用して、7G9(マウスIgG2a, kappa)抗CR1mAbを産生した。上記細胞系からマスターセルバンク(MCB)を生成し、マウス抗体産生、マイコプラズマ及び無菌性について試験した(Charles River Tektagen)。該二重特異性分子の産生に用いた7G9抗体は、腹水液から産生し、精製した。
高親和性抗CR1モノクローナル抗体を分泌するハイブリドーマ細胞系を使用して、7G9(マウスIgG2a, kappa)抗CR1mAbを産生した。上記細胞系からマスターセルバンク(MCB)を生成し、マウス抗体産生、マイコプラズマ及び無菌性について試験した(Charles River Tektagen)。該二重特異性分子の産生に用いた7G9抗体は、腹水液から産生し、精製した。
誘導体化/架橋
以下に示してあるプロトコルを用いて、抗PA-抗体(ここでは「l4B7IgG抗体」と称する)をSATAで誘導体化した。PBSEバッファー中、4℃で、l4B7IgG抗体を一晩透析した。透析終了後、14B7IgGの容積は1.8mLであり、A280測定により求めたタンパク質濃度は4.3mg/mLであった。SATA(MW 231.2g/mol)原液を、DMSO中の3.5mg/mLとして調製した。7.2μLのSATA原液(0.025mg, 108nmol)を18nmol(2.7mg;容積=0.628mL)の透析された14B7IgGに添加し(モル比 6×:1×;6×SATA:1×14B7IgG)、15〜30分毎に穏やかに反転させながら室温で2時間反応させた。0.76gのヒドロキシルアミンHC1と1.0mLの0.5M EDTAを25mLのMES(pH7.5;38.8mg/mL)に添加することにより、ヒドロキシルアミンHC1(「HA-HC1」;MW 69.49g/mol)原液を調製した。72μLのHA-HC1溶液(2.79mg, 36μmol)を、SATA誘導体化14B7IgGの反応混合物に添加し(モル比 2000×:1×;2000×HA-HC1:1×14B7IgG-SATA誘導体化)、アルゴンガス下、室温で2時間反応させた。次いで、この混合物を、MESバッファー中のAmersham Hi-Prep 脱塩カラム(26/10)でのクロマトグラフィーにより脱塩した(プール容積=3.8mL, A280で測定したタンパク質濃度=0.57mg/mL, 回収率=67%〜80%)。
以下に示してあるプロトコルを用いて、抗PA-抗体(ここでは「l4B7IgG抗体」と称する)をSATAで誘導体化した。PBSEバッファー中、4℃で、l4B7IgG抗体を一晩透析した。透析終了後、14B7IgGの容積は1.8mLであり、A280測定により求めたタンパク質濃度は4.3mg/mLであった。SATA(MW 231.2g/mol)原液を、DMSO中の3.5mg/mLとして調製した。7.2μLのSATA原液(0.025mg, 108nmol)を18nmol(2.7mg;容積=0.628mL)の透析された14B7IgGに添加し(モル比 6×:1×;6×SATA:1×14B7IgG)、15〜30分毎に穏やかに反転させながら室温で2時間反応させた。0.76gのヒドロキシルアミンHC1と1.0mLの0.5M EDTAを25mLのMES(pH7.5;38.8mg/mL)に添加することにより、ヒドロキシルアミンHC1(「HA-HC1」;MW 69.49g/mol)原液を調製した。72μLのHA-HC1溶液(2.79mg, 36μmol)を、SATA誘導体化14B7IgGの反応混合物に添加し(モル比 2000×:1×;2000×HA-HC1:1×14B7IgG-SATA誘導体化)、アルゴンガス下、室温で2時間反応させた。次いで、この混合物を、MESバッファー中のAmersham Hi-Prep 脱塩カラム(26/10)でのクロマトグラフィーにより脱塩した(プール容積=3.8mL, A280で測定したタンパク質濃度=0.57mg/mL, 回収率=67%〜80%)。
抗CR1モノクローナル抗体(7G9抗体)を、NHS-PEG-マレイミドで誘導体化した。7G9抗体のNHS-PEG-マレイミド誘導体化による7G9IgG-PEGの回収率は、68%であった(NHS-PEG-マレイミドはShearwater Corporationから入手した;Shearwater PEGのカタログ番号:2D2ZOF021)。NHS-PEGマレイミド(MW 3400g/mol)原液を、MESバッファー(14.7nmol/μL)中の50mg/mLとして調製した。7.34μLのNHS-PEGマレイミド原液を7G9抗体に8:1(8×NHS-PEGマレイミド:1×7G9抗体)のモル比で添加し、15〜30分毎に穏やかに反転させながら室温で2時間反応させた。次いで、この混合物を、MESバッファー中のAmersham Hi-Prep 脱塩カラム(26/10)でのクロマトグラフィーにより脱塩した。誘導体化プロトコルのための最適のモル比を決定するために、NHS-PEG-マレイミド誘導体化に関して種々のモル比を使用した。
誘導体化した抗体を、架橋反応混合物中で等質量で混合した。最終反応混合物中の総タンパク質の、Lowry又はA280測定による測定は行わなかった。総タンパク質は、投入した抗体の合計量(3.8mg)であると推定した。反応混合物の最終容積は7.4mLであった。14B7IgG-PEG-7G9IgGの産生に関連する架橋プロセスと誘導体化プロセスを示すフローチャートは、図1に示してある。
Sephacryl 300 サイズ排除クロマトグラフィー(「SEC」)分別
最終反応混合物の一部(5mL, 2.6mg, 68%)を、さらに、Sephacryl 300による分別の処理に付した。反応混合物についての溶出プロフィールは3つ面積に分解した。それらを図2に示してあるように画分として収集した。溶出プロフィールのピークに従い、カラム画分を合してプールとした。分離したボイド容量ピーク(画分14〜19;総容積12mL)は、高分子量;「HMW」画分と名付けた。二番目の幅の広い主要なピーク(画分20〜37;総容積35mL)は、低分子量;「LMW」画分と名付けた。三番目のショルダーピーク(画分38〜56;総容積22.5mL)は、単量体画分と名付けた。プールした3種類のピーク画分を、A280を測定することによりタンパク質濃度について分析した。総反応混合物(7.4mL)は、3800μgの投入された抗体を含んでいた。S300により分別された5mL部分は、2568μgのタンパク質を含んでいた。3種類の画分全てにおけるSECの後で回収された総タンパク質は、1818μg(71%)であった。各S300ピーク画分をさらに濃縮した後、A280により分析した(表1)。溶出プロフィールは図2Aに示してある。図2Bは、誘導体化のためのモル比が16:1(16×NHS-PEGマレイミド:1×7G9 抗体)であったときの溶出プロフィールを表している。
最終反応混合物の一部(5mL, 2.6mg, 68%)を、さらに、Sephacryl 300による分別の処理に付した。反応混合物についての溶出プロフィールは3つ面積に分解した。それらを図2に示してあるように画分として収集した。溶出プロフィールのピークに従い、カラム画分を合してプールとした。分離したボイド容量ピーク(画分14〜19;総容積12mL)は、高分子量;「HMW」画分と名付けた。二番目の幅の広い主要なピーク(画分20〜37;総容積35mL)は、低分子量;「LMW」画分と名付けた。三番目のショルダーピーク(画分38〜56;総容積22.5mL)は、単量体画分と名付けた。プールした3種類のピーク画分を、A280を測定することによりタンパク質濃度について分析した。総反応混合物(7.4mL)は、3800μgの投入された抗体を含んでいた。S300により分別された5mL部分は、2568μgのタンパク質を含んでいた。3種類の画分全てにおけるSECの後で回収された総タンパク質は、1818μg(71%)であった。各S300ピーク画分をさらに濃縮した後、A280により分析した(表1)。溶出プロフィールは図2Aに示してある。図2Bは、誘導体化のためのモル比が16:1(16×NHS-PEGマレイミド:1×7G9 抗体)であったときの溶出プロフィールを表している。
各種類のSDS-PAGEによる分子量分布(%)について、表3に記載され、また、図3においても示されているように、S300画分の各々から視覚的に評価した。図3は、NHS-PEG-マレイミドの7G9への異なったコンジュゲートにより産生された14B7IgG-PEG-7G9IgGの、それらのSDS-PAGEにおける移動性に基づく分子量種の分布を示している。
PEGをコンジュゲートさせる手順により、多様な分子量種を含む14B7IgG-PEG-7G9IgG分子の集団が産生された。反応混合物をSEC及びSDS-PAGEで分析することにより、以下の分美分布が示された:37%の生成物(二量体, 三量体, 四量体)、及び、12%の単量体。
表5及び表6は、さらに、Lowryアッセイ、A280測定アッセイ及びCAAアッセイにより特性付けを行った場合の、14B7IgG-PEG-7G9IgGの産生において生成された各分子種の特性について要約している。示されている結果が、14B7IgG-PEG-7G9IgGを産生するための種々のNHS-PEG-マレイミドコンジュゲートの結果を示していることは留意されるべきである。特に、14B7IgG-PEG-7G9IgG は、1:4、1:8、及び、1:16のモル比を用いて産生したが、それらの各々について特性付けを行った(「1:4」は「1×NHS-PEG-マレイミド:4×7G9IgG」を意味し;「1:8」は「1×NHS-PEG-マレイミド:8×7G9IgG」を意味し;「1:16」は「1×NHS-PEG-マレイミド:16×7G9IgG」を意味する)。さらに、図4は、NHS-PEG-マレイミドの7G9IgGへの異なったコンジュゲートにより産生された14B7IgG-PEG-7G9IgGの分子量種の分布を要約している。
CR1抗体アッセイ(「CAA」)及びヘテロポリマーコンジュゲートアッセイ(「HPCA」)
CAAアッセイ又はHPCAアッセイを記述されているように用いて、14B7IgG-PEG-7G9IgG二重特異性分子の機能性について確認した。
CAAアッセイ又はHPCAアッセイを記述されているように用いて、14B7IgG-PEG-7G9IgG二重特異性分子の機能性について確認した。
CAAアッセイ
このアッセイを用いて、一般に、任意の抗CR1抗体、又は、抗CR1抗体を含んでいる任意の分子を評価することができる。ELISAプレート、高結合平底ELISAプレート(high binding flat bottom ELISA plates)(Costar EIA/RIA ストリッププレート 2592)を、適切な量のCR1受容体重炭酸塩溶液と一緒にインキュベーションすることにより、ELISA/CR1プレートを調製した。CR1受容体の重炭酸塩溶液の濃度は、0.2μg/mLであり、これは、炭酸塩-重炭酸塩バッファー(pH9.6, Sigma C-3041)中で、5mg/mLのCR1受容体原液(Avant Technology Inc.)から調製した。100μLのCR1-重炭酸塩溶液をELISAプレートの各ウェルに供給し、そのプレートを4℃で一晩インキュベーションした。次いで、そのプレートを、PBS、0.1%のTween-20及び0.05%の2-クロロアセトアミドを含んでいる洗浄バッファーを用いて洗浄した。洗浄後、該プレートに、室温で、約30〜60分間、PBS中のSuperBlockブロッキングバッファー(Pierce)を添加した。そのプレートを乾燥させ、4℃で保存した。対照又は「校正物質」として、300mg/mL又は600mg/mLの濃度を有するヒト抗CR1IgGを使用した。希釈バッファーとしての、PBS、0.25% BSA、0.1% Tween-20、洗浄バッファーとしての、PBS、0.1% Tween-20、0.05% 2-クロロアセトアミド、ELISAのための、TMB-Liquid Substrate System(3,3',5,5'-テトラメチル-ベンジジン)、及び、停止液としての、2N H2SO4を使用して、14B7IgG-PEG-7G9の組成物の力価を測定した。
このアッセイを用いて、一般に、任意の抗CR1抗体、又は、抗CR1抗体を含んでいる任意の分子を評価することができる。ELISAプレート、高結合平底ELISAプレート(high binding flat bottom ELISA plates)(Costar EIA/RIA ストリッププレート 2592)を、適切な量のCR1受容体重炭酸塩溶液と一緒にインキュベーションすることにより、ELISA/CR1プレートを調製した。CR1受容体の重炭酸塩溶液の濃度は、0.2μg/mLであり、これは、炭酸塩-重炭酸塩バッファー(pH9.6, Sigma C-3041)中で、5mg/mLのCR1受容体原液(Avant Technology Inc.)から調製した。100μLのCR1-重炭酸塩溶液をELISAプレートの各ウェルに供給し、そのプレートを4℃で一晩インキュベーションした。次いで、そのプレートを、PBS、0.1%のTween-20及び0.05%の2-クロロアセトアミドを含んでいる洗浄バッファーを用いて洗浄した。洗浄後、該プレートに、室温で、約30〜60分間、PBS中のSuperBlockブロッキングバッファー(Pierce)を添加した。そのプレートを乾燥させ、4℃で保存した。対照又は「校正物質」として、300mg/mL又は600mg/mLの濃度を有するヒト抗CR1IgGを使用した。希釈バッファーとしての、PBS、0.25% BSA、0.1% Tween-20、洗浄バッファーとしての、PBS、0.1% Tween-20、0.05% 2-クロロアセトアミド、ELISAのための、TMB-Liquid Substrate System(3,3',5,5'-テトラメチル-ベンジジン)、及び、停止液としての、2N H2SO4を使用して、14B7IgG-PEG-7G9の組成物の力価を測定した。
HPCAアッセイ
HPCAアッセイを用いて、14B7IgG-PEG-7G9のCR-1及びPAに対する結合特異性の点から、架橋されている抗-PA二重特異性分子14B7IgG-PEG-7G9の機能性を分析した。
HPCAアッセイを用いて、14B7IgG-PEG-7G9のCR-1及びPAに対する結合特異性の点から、架橋されている抗-PA二重特異性分子14B7IgG-PEG-7G9の機能性を分析した。
材料及び方法
プレート(Corning Costar アッセイプレート, v-底非処理ポリスチレン)を、0.2μg/mLの濃度のCR-1でコーティングした。抗-PAヘテロポリマーを内部標準として使用した(464.0μg/mLの濃度の14B7×7G9)。
プレート(Corning Costar アッセイプレート, v-底非処理ポリスチレン)を、0.2μg/mLの濃度のCR-1でコーティングした。抗-PAヘテロポリマーを内部標準として使用した(464.0μg/mLの濃度の14B7×7G9)。
HC=1.0μg/mL、MC=0.5μg/mL、LC=0.25μg/mL ビオチンをコンジュゲートさせたPAを、0.81mg/mLの濃度で使用した。ELISA希釈バッファーは、1×PBXバッファー、0.25% BSA、0.1% Tween-20、0.05% 2-クロロアセトアミドを含んでいた。ELISA洗浄バッファーは、1×PBS、0.1% Tween-20、0.05% 2-クロロアセトアミドを含んでいた。TMBは、Sigmaから入手した(カタログ番号 T-0440, LOT番号;21K1392)。停止液は、2N H2SO4を含んでいた。西洋ワサビペルオキシダーゼをコンジュゲートさせたストレプトアビジン(SA-HRP)を、0.5mg/mLで供した。
最初に、架橋させたヘテロポリマーを、以下の手順を用いて、CR-1プレートに結合させた。ヘテロポリマーを、ELISA希釈バッファー中で、5μg/mLに希釈した。希釈プレート内で、サンプルを5μg/mLで列A〜列Hにロードし、1:3倍で連続的に希釈した。校正物質も含めて、全てのサンプルについて2反復で行った。
希釈した100μLのサンプルを、希釈プレートからCR-1でコーティングしてあるプレートの対応するウェルに移した。100μLのHC、MC及びLCを、それぞれ、列A11及びA12、列B11及びB12、列C11及びC12に、2反復で添加した。100μLの希釈液をブランクとして5つのウェルに2反復で添加した。次いで、そのプレートを接着プレートシーラーで密封し、37℃で1時間インキュベーションした。溶液を廃棄し、そのプレートを自動プレート洗浄機で5サイクルプログラムで洗浄した。
次に、以下の手順を用いて、ビオチニル化PA(「b-PA」)を、ヘテロポリマーに結合させた。b-PAを、ELISA希釈バッファー中で、2.5ng/mLに希釈した。希釈した100μLのb-PAを、全てのウェル(ブランクウェルも含む)に移した。次いで、そのプレートを接着プレートシーラーで密封し、37℃で1時間インキュベーションした。溶液を廃棄し、そのプレートを自動プレート洗浄機で5サイクルプログラムで洗浄した。
最後に、以下の方法を用いて、ストレプトアビジンをコンジュゲートさせてある西洋ワサビペルオキシダーゼ(「SA-HRP」)をb-PAに結合させた。SA-HRPを、ELISA希釈バッファー中で、1:10,000に希釈した。
希釈した100μLのSA-HRPを、全てのウェル(ブランクウェルも含む)に移した。次いで、そのプレートを接着プレートシーラーで密封し、37℃で1時間インキュベーションした。溶液を廃棄し、そのプレートを自動プレート洗浄機で5サイクルプログラムで洗浄した。
シグナルを発生させるために、予め加温しておいた100μLのTMBを全てのウェルに添加した。そのプレートを、室温で15分間(光から保護した状態で)インキュベーションした。100μLの停止液(2N H2SO4)を添加し、そのプレートを室温でさらに10分間インキュベーションした。プレートリーダーを用いて、450nmで、プレートを読み取った。
実施例6.2
二重特異性分子S:7G9-PEG-14B7scAb
この実施例では、炭疽菌PAが結合する抗体フラグメントは、ヒト定常k領域と融合させたマウスモノクローナル抗体14B7の単鎖Fvからなる単鎖抗体フラグメントであった。scAbフラグメントは、Maynardら(Nature Biotechnology 20:597-601)に記述されている手順に従って調製した。産生プロセスを示すフローチャートは、図5Aに示してある。
二重特異性分子S:7G9-PEG-14B7scAb
この実施例では、炭疽菌PAが結合する抗体フラグメントは、ヒト定常k領域と融合させたマウスモノクローナル抗体14B7の単鎖Fvからなる単鎖抗体フラグメントであった。scAbフラグメントは、Maynardら(Nature Biotechnology 20:597-601)に記述されている手順に従って調製した。産生プロセスを示すフローチャートは、図5Aに示してある。
14B7scAb抗原結合性抗体フラグメントは、実施例6.1の記述に準じて、SATAで誘導体化した。14B7scAbは、1:3のモル比(14B7scAb:SATA)を用いて誘導体化した。
7G9抗体を、以下のようにして、NHS-PEG-MAL(Shearwater Polymers, カタログ番号;2D2ZOF021)で誘導体化した。NHS-PEG-MAL(14.7nmol/μL)の、50mg/mL MES溶液を調製した。7.34μLのNHS-PEG-MAL溶液を、1.5mLの7G9(36nmol)に添加した(モル比約3:1 PEG:抗体)。反応物を、15〜30分毎に穏やかに反転させながら室温で2時間インキュベーションした。次いで、反応混合物を、MESバッファー中のAmersham Hi-Prep 脱塩カラムを用いるクロマトグラフィーにより脱塩する。次いで、反応混合物を、MESバッファー中のAmersham Hi-Prep 脱塩カラム(26/10)を用いるクロマトグラフィーにより脱塩した。3.3mLのプールしたサンプルを回収した。回収したサンプルは1.5mgであり、0.45mg/mL(A280)のタンパク質濃度を有していた。これは、3.3%の回収率を意味する。PEG-MALで修飾した抗体7G9-PEG-MALは、PBSEバッファーを用いて、ボイド容量で溶出させた。
14B7scAb-SHと7G9-PEG-MALのモル比2:1(14B7Fab-SH:7G9-PEG-MAL)の反応混合物を調製した。この反応混合物を、18時間インキュベーションした。この混合物を、NEM中でクエンチし、翌日、S300 SECクロマトグラフィーを用いて分別した。
サンプルET168-14Aは、S300カラムのランから得られた画分のプールであった。S300カラムのラン(ET168-26)(5mLの濃縮した反応混合物をロードした)により、120の2mLの画分が生じた。画分19〜画分51から得た65mLのプールを、「ET168-14A」と名付けた。プーリングプロセスはET168-26で記録した。サンプルET168-14Aを、さらに、限外瀘過による処理に付すことにより、生成物の混合物を濃縮して、2.9mLの最終容積とした。SDS-PAGE分析により、サンプルET168-14Aが、10%の遊離scAbと45%の単量体(PEG-7G9)と45%高MW二重特異性分子を含んでいることが示された。図5Bは、サンプルET168-14Aを含んでいるTris-Glycine SDS PAGEの写真を示している。
サンプルET168-14Aについての、SDS-PAGEデータ、機能的CR1結合(CAA)データ、機能的PA結合(PAA)データ、二価結合(HPCA)データ及びタンパク質含有量(Lowry)データが、表8に要約してある。
Lowryデータは、最終的な二重特異性分子混合物(168-14A)中に、9.3mgのタンパク質が回収されたことを示している。これは、最初に投入された総抗体(28mg)の32%に相当する。SDS-PAGE分析は、サンプル168-14Aが、多様なコンジュゲート種を含んでいることを示しており、また、約45%の架橋されていない抗体を含んでいることを示している。SDS-ゲルは、コンジュゲートのサイズが約200kDであることを示している。200kDであることにより、モル比は、1:1(ScAb:7G9)であると推測される。
サンプルET168-14Aは、CR1結合活性を有することがCAAアッセイにより示された。特異的活性は、0.58であると計算された。
サンプルET168-14Aは、炭疽菌PA結合活性を有することがPAAアッセイにより示された。特異的活性は、0.18であると計算された。また、対照の14B7抗体との比較により、約25%(0.18/0.71)の未修飾抗体の活性が示された。未修飾ScAbの特異的活性は記録されていない。
実施例6.3
二重特異性分子:7G9-PEG-14B7Fab
この実施例では、二重特異性分子7G9-PEG-14B7Fabの産生について記述する。産生プロセスを示すフローチャートは、図6Aに示してある。
二重特異性分子:7G9-PEG-14B7Fab
この実施例では、二重特異性分子7G9-PEG-14B7Fabの産生について記述する。産生プロセスを示すフローチャートは、図6Aに示してある。
14B7Fab抗原結合性抗体フラグメントは、実施例6.1の記述に準じて、SATAで誘導体化した。7G9抗体は、実施例6.2の記述に準じて、NHS-PEG-MALで誘導体化した。
14B7scAb-SHと7G9-PEG-MALのモル比2:1(14B7Fab-SH:7G9-PEG-MAL)の反応混合物を調製した。この反応混合物を、4時間インキュベーションした。この混合物を、NEM中でクエンチし、2日後、S300 SECクロマトグラフィーを用いて分別した。
サンプルET140-47Iは、反応混合物についてのS300カラムのランから得られたプールした画分であった。S300カラムのラン(4.5mLの反応混合物をロードした)により、140の2mLの画分が生じた。画分24〜画分57から得た68mLのプールを、「ET140-54D」と名付けた。画分42〜画分64から得た68mLのプールを、「ET140-47I」と名付けた。サンプルET140-47Iを、さらに、限外瀘過による処理に付すことにより、調製物を濃縮して、0.5mLの最終容積とした。SDS-PAGE分析により、サンプルDが、遊離抗体と高MW二重特異性分子を含んでいることが示された。図6Bは、サンプルET140-47Iを含んでいるTris-Glycine SDS PAGEの写真を示している。
サンプルET140-47Iについての、SDS-PAGEデータ、機能的CR1結合(CAA)データ、機能的PA結合(PAA)データ、二価結合(HPCA)データ及びタンパク質含有量(Lowry)データが、表9に要約してある。
Lowryデータは、二重特異性分子の画分(140-47I)中に、0.070mgのタンパク質が回収されたことを示している。これは、最初に投入された総抗体(2.4mg)の3%に相当する。SDS-PAGE分析は、サンプルDが、多様なコンジュゲート種を含んでいることを示しており、また、約50%の未反応抗体を含んでいることを示している。
サンプルET140-47Iは、CR1結合活性を有することがCAAアッセイにより示された。特異的活性は、0.33であると計算された。また、対照の7G9抗体との比較により、約39%(0.33/0.85)の未修飾抗体の活性が示された。
サンプルET140-47Iは、炭疽菌PA結合活性を示すことがPAAアッセイにより示された。特異的活性は、0.07であると計算された。未修飾14B7の特異的活性は記録しなかった。
25mL容の丸底フラスコ内で、500mgのカルボキシル-ポリエチレングリコール-アミン(0.147mmole)(Shearwater)を25mLの10mM リン酸バッファー(pH7.5)で希釈した。得られた溶液に、ジメチルスルホキシドに溶解させた49.42mgのN-ヒドロキシスクシンイミジル-ホルミルベンゾエート(Solulink)を添加した。得られた反応物を、暗所で、アルゴン下、室温で撹拌した。4時間経過した後、水相をジクロロメタン(DCM)で抽出した。DCM相をMgSO4で脱水し、減圧下に濃縮した。残留した液体をエーテル(3×50mL)で抽出した。エーテル相を合し、それに、冷イソプロピルアルコール(IPA)を添加したことにより、カルボキシ-PEG-ベンズアルデヒド(CPB)が沈澱した。次いで、沈澱物を冷IPAで洗浄した後、8mLのDCMに溶解させた。得られた溶液に、0.8mLの10%リン酸ナトリウムバッファー(pH5.0)を添加した後、150mgの(1-エチル-3-(3-ジメチルアミノプロピル)カルボジイミド(EDC)及び102mgのN-ヒドロキシスクシンイミド(NHS)を添加した。得られた反応物を、アルゴン下で、2時間撹拌した。DCM相を集めてMgSO4で脱水し、減圧下に濃縮して、油性の残渣を得た。これを、IPAを用いて洗浄し、減圧下に乾燥させて、化合物(1)を得た(収量=238mg)。PEGの分子量は3400Daである。
EDC及びNHSとのさらに別の反応に付すことにより、中間体生成物の残留しているカルボキル基を最終生成物に完全に変換した。例えば、50mgの中間体生成物を2.5mLの酢酸エチルに溶解させた。16.11mgのNHSと28.475mgのEDCを添加した。得られた反応混合物をアルゴン下で1.5時間撹拌し、濃縮して無色のゴム状物質とした。2mLのエーテルを添加して、沈澱物を形成させた。エーテルをデカントし、残渣をエーテルで2回以上洗浄した。固体物質(23mg)を最終生成物として収集した。この化合物を薄層クロマトグラフィープレート上で分析し、明瞭なスポットとして観察された。最終生成物の紫外スペクトルは、NHS-ベンズアルデヒドに一致した。この化合物(N-ヒドロキシ-スクシンイミジル-ポリエチレングリコール-ベンズアルデヒド)は、以後、「PBA」と称する。また、この化合物は、式(I)で表される。
N-ヒドロキシ-スクシンイミジル-ポリエチレングリコール-ベンズアルデヒド)(PBA)(1)
1
実施例6.5
二重特異性分子:H9-PEG-ベンズヒドラゾン-ニコチネート-カプリル-14B7(HZ-HP)
ヒト化モノクローナル抗体H9を、二官能性高分子NHS-PEG-ベンズアルデヒド(PBA)で誘導体化した。モノクローナル抗体14B7を、二官能性化合物スクシンイミジルC6 4-ヒドラジノ-ニコチンアミドアセトンヒドラゾン(Hz)(Solulink)で誘導体化した。0.15M NaCl及び50mM リン酸カリウムを含有するサンプルバッファー(pH7.4)中で、500nmolのHzを用いて、31.25nmolの14B7を誘導体化した。反応物を室温で1時間撹拌した。コンジュゲートバッファー(0.1M クエン酸, pH5)で平衡化させた10mLのPD 10-カラム(Amersham)内で、反応混合物から小分子を除去した。別の反応として、上記で規定したサンプルバッファー中で、500nmolのPBAを用いて、31.25nmolのH9を誘導体化した。反応混合物を25℃で1時間撹拌した後、PD10 カラム内で、小分子を除去した。
1
実施例6.5
二重特異性分子:H9-PEG-ベンズヒドラゾン-ニコチネート-カプリル-14B7(HZ-HP)
ヒト化モノクローナル抗体H9を、二官能性高分子NHS-PEG-ベンズアルデヒド(PBA)で誘導体化した。モノクローナル抗体14B7を、二官能性化合物スクシンイミジルC6 4-ヒドラジノ-ニコチンアミドアセトンヒドラゾン(Hz)(Solulink)で誘導体化した。0.15M NaCl及び50mM リン酸カリウムを含有するサンプルバッファー(pH7.4)中で、500nmolのHzを用いて、31.25nmolの14B7を誘導体化した。反応物を室温で1時間撹拌した。コンジュゲートバッファー(0.1M クエン酸, pH5)で平衡化させた10mLのPD 10-カラム(Amersham)内で、反応混合物から小分子を除去した。別の反応として、上記で規定したサンプルバッファー中で、500nmolのPBAを用いて、31.25nmolのH9を誘導体化した。反応混合物を25℃で1時間撹拌した後、PD10 カラム内で、小分子を除去した。
1〜3mg/mLの総タンパク質濃度で2種類のモノクローナル抗体を混合することにより、コンジュゲート反応を開始させた。反応は、室温で16時間行わせた。コンジュゲートに際して、2種類の誘導体化モノクローナル抗体のモル比は、1:1であった。架橋させた二重特異性のサンプルを、次いで、PBSG(10mM リン酸塩, 0.15M NaCl, 5% グリセロール, pH7.4)で平衡化させたSuprose6 カラム(Amersham)で精製した。反応生成物を、その溶出に応じて、種々の分子の大きさの画分に分離させた。生成した総ヘテロポリマータンパク質は、出発物質の46.7%であった。サイズ排除プロフィールは、図7に示してある。SDS-PAGEで分析した、対応タンパク質のプロフィールは、図8に示してある。
溶離時間に応じて、該分子種の明らかなオリゴマー状態が推定された。13.5分より前に溶出した画分は、高度に架橋している分子種に対応する。13.5分〜14.5分に溶出した画分は、四量体及び五量体に対応する。14.5分〜15.5分に溶出した画分は、三量体及び四量体に対応する。15.5分〜16.5分に溶出した画分は、三量体に対応する。16.5分〜17.5分に溶出した画分は、二量体及び三量体に対応する。17.5分〜18.5分に溶出した画分は、二量体に対応する。個々の分子種の分子量分布は、41.2%の二量体、32.5%の三量体、13%の四量体及び3.5%の五量体であった。
実施例6.6
二重特異性分子14B7-HZ-PEG-H9の活性アッセイ
6.25nmolのH9を31.25nmolのNHS-PEG-ベンズアルデヒド(PBA)で修飾した以外は、実施例6.5において記述した方法と同じ方法を用いて、二重特異性分子を産生した。6.25nmolの14B7を62.5nmolのHzで誘導体化した。得られたヘテロポリマー混合物を、サイズ排除 Suprose6 カラムで分別した。種々の形態の架橋分子に対応する5つの画分を収集し、それらの結合活性を確認するために、上記活性アッセイ、ELISAアッセイ、例えば、CAA、PAA及びHPCAなどで分析した。活性アッセイの結果は、下記表で要約している。
二重特異性分子14B7-HZ-PEG-H9の活性アッセイ
6.25nmolのH9を31.25nmolのNHS-PEG-ベンズアルデヒド(PBA)で修飾した以外は、実施例6.5において記述した方法と同じ方法を用いて、二重特異性分子を産生した。6.25nmolの14B7を62.5nmolのHzで誘導体化した。得られたヘテロポリマー混合物を、サイズ排除 Suprose6 カラムで分別した。種々の形態の架橋分子に対応する5つの画分を収集し、それらの結合活性を確認するために、上記活性アッセイ、ELISAアッセイ、例えば、CAA、PAA及びHPCAなどで分析した。活性アッセイの結果は、下記表で要約している。
上記アッセイのそれぞれにおける二重特異性分子の活性は、該二重特異性分子のオリゴマー状態に依存する。即ち、より高度にオリゴマー化した状態は、アッセイを行った特定の抗原に対する結合活性は低いものとなる。この結果は、抗原に対するヘテロポリマーの結合特性及びステレオアベイラビリティーを反映したものであり得る。該二重特異性分子が二価結合活性を示したので、HPCAの結果により、該二重特異性分子が実際にCR1及びPA抗原の両方に対して特異性を有していることが明らかに示された。
25mL容の丸底フラスコ内で、50mgのカルボキシル-ポリエチレングリコール-アミン(0.0147mmol)(Shearwater)を2.5mLの10mM リン酸バッファー(pH7.5)で希釈する。得られた溶液に、テトラヒドロフラン(THF)中の15.5mgのN-ヒドロキシスクシンイミジル-6-BOC-ヒドラジノニコチネート(Solulink)を添加する。得られた反応物を、暗所で、アルゴン下、室温で撹拌する。4時間経過した後、水相をジクロロメタン(DCM)で抽出する。DCM相をMgSO4で脱水し、減圧下に濃縮して、液体残渣を得る。これを、次いで、エーテルを用いて沈澱させる。沈澱したPEG-ポリマーを濾過により収集し、10mLの冷(-20℃)イソプロピルアルコール(IPA)で洗浄して、カルボキシ-PEG-6-BOC-ヒドラジノニコチネート(CPN-Boc)を得る。これを、次いで、1mLのTHFで希釈する。得られた溶液に、15mgのN,N'-ジシクロヘキシルカルボジイミド(DCC)及び10.2mgのN-ヒドロキシスクシンイミド(NHS)を添加する。この反応混合物を、アルゴン下で3時間撹拌する。得られた溶液に乾燥シリカゲル(1mg)を添加して沈澱させる。上清を固体沈澱物から分離した後、減圧下に溶媒を除去して残渣を得る。これを、0.5mLの酢酸エチルに再懸濁させ、0.5mLの3M HC1で10分間(3回)抽出する。有機相をMgSO4で脱水し、減圧下に濃縮し、エーテルで抽出する。次いで、得られたエーテル溶液に冷IPAを添加して、化合物2を沈澱物として得る。
7.引用文献
本明細書中で引用した全ての参考文献は、個々の刊行物、特許又は特許出願が、それぞれ具体的に且つ個々に、あらゆる目的のために参照によりその全体を組み込れると示されているのと同程度に、あらゆる目的のために参照によりその全体を本明細書に組み入れる。
本明細書中で引用した全ての参考文献は、個々の刊行物、特許又は特許出願が、それぞれ具体的に且つ個々に、あらゆる目的のために参照によりその全体を組み込れると示されているのと同程度に、あらゆる目的のために参照によりその全体を本明細書に組み入れる。
当業者には明らかなように、本発明の精神及び範囲から逸脱することなく、本発明の多くの改変及び変更を行うことができる。本明細書に記載した具体的な実施形態は、例示のためにのみ提供されるものであり、本発明は、請求の範囲が権利を与える等価物の全範囲と共に、添付の請求の範囲によってのみ限定される。
Claims (77)
- (a) C3b様受容体に結合する第一認識結合部分;
及び、
(b) C3b様受容体以外の特定の分子に結合する1以上の第二認識結合部分;
を含む二重特異性分子であって、該第一認識結合部分がポリ-(エチレン)グリコール(PEG)リンカーを介して該第二認識結合部分に架橋している、前記二重特異性分子。 - 哺乳動物の循環中において前記分子の量が低減するのが望ましい、請求項1に記載の二重特異性分子。
- 前記分子が病原性抗原分子である、請求項1に記載の二重特異性分子。
- 前記病原性抗原分子が自己免疫抗原である、請求項3に記載の二重特異性分子。
- 前記分子が感染性疾患因子の抗原である、請求項1に記載の二重特異性分子。
- 前記第二認識結合部分が、抗原分子に結合する抗体であるか又はその抗原結合性抗体フラグメントである、請求項1に記載の二重特異性分子。
- 前記抗原結合性抗体フラグメントが、Fabフラグメント、Fab'フラグメント、(Fab)'2フラグメント、Fvフラグメント、又は、sFvフラグメントからなる群から選択される、請求項6に記載の二重特異性分子。
- 前記第二認識結合部分が、ポリペプチド、ペプチド、エピトープ、抗原決定基、核酸分子又は小分子である、請求項1に記載の二重特異性分子。
- 第二認識結合部分が、バシルス・アンスラシス(Bacillus anthracis)(炭疽菌)の防御抗原(PA)タンパク質に結合する、請求項1に記載の二重特異性分子。
- 前記ポリ-(エチレン)グリコール(PEG)リンカーが、式X-PEG-Y(式中、X及びYは、官能基である)で表される二官能性ポリ-(エチレン)グリコール(PEG)分子である、請求項1に記載の二重特異性分子。
- 前記ポリ-(エチレン)グリコール(PEG)リンカーが直鎖PEG分子を含んでいる、請求項1又は10に記載の二重特異性分子。
- 前記ポリ-(エチレン)グリコール(PEG)リンカーが非直鎖PEG分子を含んでいる、請求項1又は10に記載の二重特異性分子。
- 前記非直鎖ポリ-(エチレン)グリコール(PEG)リンカーが、分枝鎖ポリ-(エチレン)グリコール(PEG)分子、直鎖フォーク状ポリ-(エチレン)グリコール(PEG)分子、又は、分枝鎖フォーク状ポリ-(エチレン)グリコール(PEG)分子を含んでいる、請求項12に記載の二重特異性分子。
- 前記X官能基と前記Y官能基が同一である、請求項10に記載の二重特異性分子。
- 前記X官能基と前記Y官能基が異なっている、請求項10に記載の二重特異性分子。
- 前記第一及び第二認識結合部分がタンパク質を含有し、該第一認識結合部分又は該第二認識結合部分に含まれている1以上のアミノ酸が前記二官能性PEGリンカーにより誘導体化されている、請求項1に記載の二重特異性分子。
- 前記アミノ酸が前記第一又は第二認識結合部分の表面に存在している、請求項16に記載の二重特異性分子。
- 前記アミノ酸が、リシン、システイン、ヒスチジン、セリン、トレオニン、グルタミン酸又はアルギニンである、請求項17に記載の二重特異性分子。
- 前記第一及び第二認識結合部分がタンパク質を含有し、該第一認識結合部分又は該第二認識結合部分のN-末端アミノ基が前記二官能性PEGリンカーにより誘導体化されている、請求項1に記載の二重特異性分子。
- 前記第一及び第二認識結合部分がタンパク質を含有し、該第一認識結合部分又は該第二認識結合部分のC-末端カルボン酸が前記二官能性PEGリンカーにより誘導体化されている、請求項1に記載の二重特異性分子。
- C3b様受容体に結合する前記第一認識結合部分がCR1に結合するモノクローナル抗体である、請求項1に記載の二重特異性分子。
- 前記第二認識結合部分が前記第一認識結合部分の重鎖又は軽鎖に架橋しているが、但し、該架橋はカルボキシ末端を介していない、請求項21に記載の二重特異性分子。
- 前記モノクローナル抗体がマウスモノクローナル抗体である、請求項21に記載の二重特異性分子。
- 前記モノクローナル抗体がヒト化モノクローナル抗体である、請求項21に記載の二重特異性分子。
- 前記ポリ-(エチレン)グリコール(PEG)分子の分子量が5〜500ダルトンである、請求項1又は10に記載の二重特異性分子。
- 前記ポリ-(エチレン)グリコール(PEG)分子の分子量が200〜20,000ダルトンである、請求項1又は10に記載の二重特異性分子。
- 前記ポリ-(エチレン)グリコール(PEG)分子の分子量が500〜1000ダルトンである、請求項1又は10に記載の二重特異性分子。
- 前記ポリ-(エチレン)グリコール(PEG)分子の分子量が1000〜8000ダルトンである、請求項1又は10に記載の二重特異性分子。
- 二重特異性分子の集団を産生する方法であって、C3b様受容体に結合する抗体を1以上の認識結合部分と接触させることを含んでなり、ここで、該抗体は二官能性ポリ-(エチレン)グリコール(PEG)リンカーとコンジュゲートさせ、該1以上の認識結合部分は該二官能性ポリ-(エチレン)グリコール(PEG)リンカーと反応するように誘導体化し、該1以上の認識結合部分は特定の分子と結合するものであり、前記接触を、該誘導体化された認識結合部分が該PEGリンカーと反応して共有結合を形成するような条件下で行い、それにより、二重特異性分子の集団を生成させる、前記方法。
- 哺乳動物の循環中において前記分子の量が低減するのが望ましい、請求項29に記載の方法。
- チオール特異的誘導体化剤を用いて前記1以上の認識結合部分をチオール化することを含む方法により該1以上の認識結合部分を誘導体化する、請求項29に記載の方法。
- 前記チオール特異的誘導体化剤が、スクシンイミジル-3-(2-ピリジルチオ-プロピオネート)(SPDP)、又は、スクシンイミジルアセチルチオアセテート(SATA)からなる群から選択される、請求項31に記載の方法。
- ヒドラジン修飾試薬又はアルデヒド修飾試薬を用いて前記1以上の認識結合部分を修飾することを含む方法により該1以上の認識結合部分を誘導体化する、請求項29に記載の方法。
- 前記ヒドラジン修飾試薬が、スクシンイミジル6-ヒドラジノニコチネートアセトンヒドラゾン(SANH)又はスクシンイミジル4-ホルミルベンゾエート(SFB)である、請求項33に記載の方法。
- 前記二官能性ポリ-(エチレン)グリコール(PEG)分子が、式X-PEG-Y で表されるヘテロ二官能性ポリ-(エチレン)グリコール(PEG)である、請求項29に記載の方法。
- 前記ヘテロ二官能性ポリ-(エチレン)グリコール(PEG)が、NHS-PEG-マレイミド、NHS-PEG-ビニルスルホン、ビス-ヒドラジド-PEG、アルデヒド-PEG-NHS、及び、ビス-ヒドラジン-PEGからなる群から選択される、請求項35に記載の方法。
- 二重特異性分子の集団を産生する方法であって:
(a) 抗CR1抗体をNHS-ポリ-(エチレン)グリコール(PEG)-マレイミドと接触させて、該抗CR1抗体の1以上の部位を該NHS-PEG-マレイミドのNHS官能基で誘導体化すること;
(b) 認識結合部分をN-スクシンイミジル-S-アセチル-チオアセテート(SATA)と接触させて、1以上の遊離チオールを含むように該抗原認識結合部分を誘導体化すること、ここで、該認識結合部分は特定の分子に結合する;
(c) ステップ(a)で産生したポリ-(エチレン)グリコール(PEG)で誘導体化された抗CR1抗体をステップ(b)で産生したチオールで誘導体化された認識結合部分と結合させること;
を含み、それにより、二重特異性分子の集団を産生する、前記方法。 - 前記認識結合部分がバシルス・アンスラシス(Bacillus anthracis)(炭疽菌)の防御抗原(PA)タンパク質に結合する、請求項37に記載の方法。
- 前記分子が、自己免疫抗原であるか、又は、感染性疾患因子の抗原である、請求項37に記載の方法。
- 前記分子がバシルス・アンスラシス(Bacillus anthracis)(炭疽菌)の防御抗原(PA)タンパク質である、請求項37に記載の方法。
- 前記ステップ(c)を、前記PEGで誘導体化された抗CR1抗体と前記SATAで誘導体化された認識結合部分とを1:1のモル比で混合することを含む方法により行う、請求項37に記載の方法。
- 前記ステップ(c)を、前記PEGで誘導体化された抗CR1抗体と前記SATAで誘導体化された認識結合部分とを2:1のモル比で混合することを含む方法により行う、請求項37に記載の方法。
- 前記二重特異性分子の集団を単離すること及び精製することをさらに含む、請求項37又は29に記載の方法。
- 前記二重特異性分子の集団を単離及び精製する方法がサイズ排除クロマトグラフィーを含んでいる、請求項43に記載の方法。
- NHS-PEG-マレイミドを1:4のモル比(抗CR1抗体:NHS-PEG-マレイミド)で用いて、前記抗CR1抗体を誘導体化する、請求項37に記載の方法。
- NHS-PEG-マレイミドを1:8のモル比(抗CR1抗体:NHS-PEG-マレイミド)で用いて、前記抗CR1抗体を誘導体化する、請求項37に記載の方法。
- NHS-PEG-マレイミドを1:16のモル比(抗CR1抗体:NHS-PEG-マレイミド)で用いて、前記抗CR1抗体を誘導体化する、請求項37に記載の方法。
- N-スクシンイミジル-S-アセチル-チオアセテート(SATA)を1:4のモル比(認識結合部分:SATA)で用いて、前記認識結合部分を誘導体化する、請求項37に記載の方法。
- N-スクシンイミジル-S-アセチル-チオアセテート(SATA)を1:8のモル比(認識結合部分:SATA)で用いて、前記認識結合部分を誘導体化する、請求項37に記載の方法。
- N-スクシンイミジル-S-アセチル-チオアセテート(SATA)を1:16のモル比(認識結合部分:SATA)で用いて、前記認識結合部分を誘導体化する、請求項37に記載の方法。
- 請求項29又は37に記載の方法により産生された二重特異性分子の集団。
- ポリエチレングリコールリンカーを含んでいるC3b様受容体に結合する抗体の集団を産生する方法であって、該抗体をポリエチレングリコールリンカーと接触させて、該抗体の1以上の部位を該ポリエチレングリコールリンカーで誘導体化することを含み、それにより、PEGで誘導体化された抗体の集団を産生する前記方法。
- 前記PEGで誘導体化された抗体が、PEG誘導体を含まない抗体が示した活性の少なくとも50%の活性でC3b様受容体に結合する、請求項52に記載の方法。
- 請求項52に記載の方法により産生されたPEGで誘導体化されている抗体の集団。
- 治療上有効な量の請求項1〜28のいずれか1項に記載の二重特異性分子及び製薬上許容される担体を含んでなり、前記量が哺乳動物の循環中における前記分子の存在に関連した望ましくない状態にある哺乳動物を治療するのに有効な量である、医薬組成物。
- (a) ポリエチレングリコールで誘導体化された抗CR1抗体を含んでいる第一の容器;
(b) 抗CR1抗体以外の認識結合部分を含んでいる第二の容器;
及び、
(c) 1以上の前記認識結合部分を誘導体化するのに適した誘導体化剤を含んでいる第三の容器;
を含むキット。 - 前記1以上の第二認識結合部分が抗体であり、且つ、前記二重特異性分子が前記第一又は第二認識結合部分のFc領域内の1以上の糖質部分において酸化されており、且つ、酸化されている該糖質がPEGリンカーが誘導体化されている部位である、請求項21に記載の二重特異性分子。
- 前記第一又は第二認識結合部分が抗体であり、且つ、該第一又は第二認識結合部分のFc領域内の1以上の酸化されている糖質部分が前記PEGリンカーにより誘導体化されている、請求項10に記載の二重特異性分子。
- 前記酸化されている糖質部分が、化学的に酸化されているか、又は、酵素的に酸化されている、請求項57又は58に記載の二重特異性分子。
- 前記第一認識結合部分がCR1に結合する、請求項1〜13のいずれか1項に記載の二重特異性分子。
- 哺乳動物の循環中の前記分子の存在に関連する該哺乳動物の障害を治療する方法であって、治療有効量の請求項1〜28のいずれか1項に記載の二重特異性分子を投与することを含んでなる、前記方法。
- 二重特異性分子の集団を産生する方法であって:
(a) 抗CR1抗体をNHS-ポリ-(エチレン)グリコール(PEG)-ベンズアルデヒドと接触させて、該抗CR1抗体の1以上の部位をNHS官能基で誘導体化すること;
(b) 認識結合部分をC6 4-ヒドラジノ-ニコチンアミドアセトンヒドラゾンと接触させて、該抗原認識結合部分を誘導体化すること、ここで、該認識結合部分は特定の分子に結合する;
及び、
(c) ステップ(a)で産生したポリ-(エチレン)グリコール(PEG)で誘導体化された抗CR1抗体をステップ(b)で産生したヒドラゾンで誘導体化された認識結合部分と結合させること;
を含み、それにより、二重特異性分子の集団を産生する、前記方法。 - 前記PEGリンカーがNHS-ポリ-(エチレン)グリコール(PEG)-ベンズアルデヒドである、請求項1に記載の二重特異性分子。
- 請求項62に記載の方法により産生された二重特異性分子の集団。
- (a) C3b様受容体に結合する第一認識結合部分;
及び、
(b) C3b様受容体以外の特定の分子に結合する1以上の第二認識結合部分;
を含む二重特異性分子であって、該第一認識結合部分がNHS-ポリ-(エチレン)グリコール(PEG)-ベンズアルデヒドリンカーを介して該第二認識結合部分に架橋している、前記二重特異性分子。 - 前記第一認識結合部分が非免疫化抗CR1モノクローナル抗体である、請求項65に記載の二重特異性分子。
- 前記非免疫化抗CR1モノクローナル抗体がH9である、請求項66に記載の二重特異性分子。
- 前記認識結合部分がバシルス・アンスラシス(Bacillus anthracis)(炭疽菌)の防御抗原(PA)タンパク質に結合する、請求項62に記載の方法。
- 前記分子が、自己免疫抗原であるか、又は、感染性疾患因子の抗原である、請求項62に記載の方法。
- 前記分子がバシルス・アンスラシス(Bacillus anthracis)(炭疽菌)の防御抗原(PA)タンパク質である、請求項62に記載の方法。
- 哺乳動物の循環中における前記分子の存在に関連した望ましくない状態にある哺乳動物を治療するのに有効な量の請求項65〜67のいずれか1項に記載の二重特異性分子及び製薬上許容される担体を含む医薬組成物。
- 哺乳動物における障害を治療する方法であって、治療有効量の請求項65〜67のいずれか1項に記載の二重特異性分子を投与することを含んでなり、ここで、該障害が、該哺乳動物の循環中における前記分子の存在に関連している、前記方法。
- 請求項73〜75のいずれか1項に記載の化合物で誘導体化されている抗体。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US41173102P | 2002-09-16 | 2002-09-16 | |
| PCT/US2003/029059 WO2004024889A2 (en) | 2002-09-16 | 2003-09-16 | Production of bispecific molecules using polyethylene glycol linkers |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2005539067A true JP2005539067A (ja) | 2005-12-22 |
| JP2005539067A5 JP2005539067A5 (ja) | 2006-11-02 |
Family
ID=31994266
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2004536556A Withdrawn JP2005539067A (ja) | 2002-09-16 | 2003-09-16 | ポリエチレングリコールリンカーを用いる二重特異性分子の産生 |
Country Status (6)
| Country | Link |
|---|---|
| US (1) | US20060153839A1 (ja) |
| EP (1) | EP1539811A4 (ja) |
| JP (1) | JP2005539067A (ja) |
| AU (1) | AU2003270686A1 (ja) |
| CA (1) | CA2499075A1 (ja) |
| WO (1) | WO2004024889A2 (ja) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2014516991A (ja) * | 2011-06-03 | 2014-07-17 | スリーエム イノベイティブ プロパティズ カンパニー | ポリエチレングリコールセグメントを有するヘテロ2官能性リンカー及び該リンカーから調製された免疫反応調節複合体 |
| JP2017160220A (ja) * | 2011-06-03 | 2017-09-14 | スリーエム イノベイティブ プロパティズ カンパニー | ポリエチレングリコールセグメントを有するヘテロ2官能性リンカー及び該リンカーから調製された免疫反応調節複合体 |
Families Citing this family (53)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20040234521A1 (en) * | 2001-03-15 | 2004-11-25 | Elusys Therapeutics, Inc | Polyclonal populations of bispecific molecules and methods of production and uses thereof |
| US20030232045A1 (en) * | 2002-02-15 | 2003-12-18 | Ramberg Elliot R. | Methods and compositions for in vivo clearance of pathogens |
| US20040132101A1 (en) | 2002-09-27 | 2004-07-08 | Xencor | Optimized Fc variants and methods for their generation |
| US7317091B2 (en) | 2002-03-01 | 2008-01-08 | Xencor, Inc. | Optimized Fc variants |
| US8188231B2 (en) | 2002-09-27 | 2012-05-29 | Xencor, Inc. | Optimized FC variants |
| US8093357B2 (en) | 2002-03-01 | 2012-01-10 | Xencor, Inc. | Optimized Fc variants and methods for their generation |
| JP2006501816A (ja) * | 2002-05-13 | 2006-01-19 | エリューシス セラピューティクス,インコーポレーテッド | 二重特異性分子の精製組成物および生産方法 |
| US8084582B2 (en) | 2003-03-03 | 2011-12-27 | Xencor, Inc. | Optimized anti-CD20 monoclonal antibodies having Fc variants |
| US8388955B2 (en) | 2003-03-03 | 2013-03-05 | Xencor, Inc. | Fc variants |
| US20090010920A1 (en) | 2003-03-03 | 2009-01-08 | Xencor, Inc. | Fc Variants Having Decreased Affinity for FcyRIIb |
| US20040180054A1 (en) * | 2003-03-13 | 2004-09-16 | Hanmi Pharm. Co., Ltd. | Physiologically active polypeptide conjugate having prolonged in vivo half-life |
| US20050176108A1 (en) * | 2003-03-13 | 2005-08-11 | Young-Min Kim | Physiologically active polypeptide conjugate having prolonged in vivo half-life |
| WO2004087759A2 (en) * | 2003-03-28 | 2004-10-14 | Elusys Therapeutics, Inc. | Method and compositions for conversion of antibody activity |
| US9051373B2 (en) | 2003-05-02 | 2015-06-09 | Xencor, Inc. | Optimized Fc variants |
| US20090036327A1 (en) * | 2003-07-08 | 2009-02-05 | Trex Enterprises Corp. | Method for chemical treatment of porous silicon surface |
| US9714282B2 (en) | 2003-09-26 | 2017-07-25 | Xencor, Inc. | Optimized Fc variants and methods for their generation |
| US8101720B2 (en) | 2004-10-21 | 2012-01-24 | Xencor, Inc. | Immunoglobulin insertions, deletions and substitutions |
| EP2256134B1 (en) * | 2003-11-13 | 2014-01-08 | Hanmi Science Co., Ltd. | IgG Fc fragment for a drug carrier and method for the preparation thereof |
| US20150010550A1 (en) | 2004-07-15 | 2015-01-08 | Xencor, Inc. | OPTIMIZED Fc VARIANTS |
| WO2006050291A1 (en) * | 2004-10-29 | 2006-05-11 | Elusys Therapeutics, Inc. | Use of cr1-binding molecules in clearance and induction of immune responses |
| US8367805B2 (en) | 2004-11-12 | 2013-02-05 | Xencor, Inc. | Fc variants with altered binding to FcRn |
| US8802820B2 (en) | 2004-11-12 | 2014-08-12 | Xencor, Inc. | Fc variants with altered binding to FcRn |
| WO2006053301A2 (en) | 2004-11-12 | 2006-05-18 | Xencor, Inc. | Fc variants with altered binding to fcrn |
| US8546543B2 (en) | 2004-11-12 | 2013-10-01 | Xencor, Inc. | Fc variants that extend antibody half-life |
| US20060134694A1 (en) * | 2004-12-22 | 2006-06-22 | Intel Corporation | Methods of protein profiling by thiolation |
| AU2006239154A1 (en) * | 2005-04-28 | 2006-11-02 | Ventana Medical Systems, Inc | Nanoparticle conjugates |
| CA2609702C (en) | 2005-04-28 | 2013-05-28 | Ventana Medical Systems, Inc. | Antibody conjugates via heterobifunctional peg linkers |
| DK1931709T3 (en) | 2005-10-03 | 2017-03-13 | Xencor Inc | FC VARIETIES WITH OPTIMIZED FC RECEPTOR BINDING PROPERTIES |
| AU2006302254B2 (en) | 2005-10-06 | 2011-05-26 | Xencor, Inc. | Optimized anti-CD30 antibodies |
| WO2007062177A2 (en) | 2005-11-23 | 2007-05-31 | Ventana Medical Systems, Inc. | Molecular conjugate |
| AU2006325030B2 (en) * | 2005-12-16 | 2012-07-26 | Cellectis | Cell penetrating peptide conjugates for delivering nucleic acids into cells |
| WO2007097934A2 (en) * | 2006-02-17 | 2007-08-30 | Elusys Therapeutics, Inc. | Methods and compositions for using erythrocytes as carriers for delivery of drugs |
| DE102006011507A1 (de) | 2006-03-14 | 2007-09-20 | Lts Lohmann Therapie-Systeme Ag | Wirkstoffbeladene Nanopartikel auf Basis hydrophiler Proteine |
| RS53263B (en) | 2006-08-14 | 2014-08-29 | Xencor Inc. | CD19 OPTIMIZED ANTIBODY |
| AU2007299843B2 (en) | 2006-09-18 | 2012-03-08 | Xencor, Inc | Optimized antibodies that target HM1.24 |
| US7935345B2 (en) | 2007-05-21 | 2011-05-03 | Children's Hospital & Research Center At Oakland | Monoclonal antibodies that specifically bind to and neutralize bacillus anthracis toxin, compositions, and methods of use |
| EP2185480A4 (en) * | 2007-07-30 | 2010-09-08 | Trex Entpr Corp | PROCESS FOR THE CHEMICAL TREATMENT OF POROUS SILICON SURFACES |
| SI2808343T1 (sl) | 2007-12-26 | 2019-10-30 | Xencor Inc | Fc-variante s spremenjeno vezavo na FcRn |
| US20100136584A1 (en) * | 2008-09-22 | 2010-06-03 | Icb International, Inc. | Methods for using antibodies and analogs thereof |
| US20100092470A1 (en) * | 2008-09-22 | 2010-04-15 | Icb International, Inc. | Antibodies, analogs and uses thereof |
| WO2011028952A1 (en) | 2009-09-02 | 2011-03-10 | Xencor, Inc. | Compositions and methods for simultaneous bivalent and monovalent co-engagement of antigens |
| WO2011091078A2 (en) | 2010-01-19 | 2011-07-28 | Xencor, Inc. | Antibody fc variants with enhanced complement activity |
| KR20220051197A (ko) * | 2012-05-17 | 2022-04-26 | 익스텐드 바이오사이언시즈, 인크. | 개선된 약물 전달용 캐리어 |
| CA2883707A1 (en) * | 2012-08-28 | 2014-03-06 | The Governors Of The University Of Alberta | Parathyroid hormone, insulin, and related peptides conjugated to bone targeting moieties and methods of making and using thereof |
| US9585934B2 (en) | 2014-10-22 | 2017-03-07 | Extend Biosciences, Inc. | Therapeutic vitamin D conjugates |
| WO2016065052A1 (en) | 2014-10-22 | 2016-04-28 | Extend Biosciences, Inc. | Insulin vitamin d conjugates |
| US9789197B2 (en) | 2014-10-22 | 2017-10-17 | Extend Biosciences, Inc. | RNAi vitamin D conjugates |
| WO2016149404A1 (en) | 2015-03-16 | 2016-09-22 | California Institute Of Technology | Botulinum neurotoxin-specific capture agents, compositions, and methods of using and making |
| CN115112898A (zh) | 2015-07-15 | 2022-09-27 | 加州理工学院 | Il-17f-特异性捕获剂、组合物以及使用和制造的方法 |
| US11884707B2 (en) | 2016-09-29 | 2024-01-30 | Regeneron Pharmaceuticals, Inc. | Compositions for detection, inhibition and imaging of indoleamine 2, 3-dioxygenase 1 (IDO1) and methods of making and using same |
| EP3638687A1 (en) | 2017-06-15 | 2020-04-22 | Indi Molecular, Inc. | Il-17f and il-17a-specific capture agents, compositions, and methods of using and making |
| CN111557902A (zh) * | 2020-07-03 | 2020-08-21 | 中国人民解放军总医院 | 一种负载阿仑膦酸钠的可注射聚乙二醇水凝胶的制备方法与应用 |
| WO2022098743A1 (en) | 2020-11-03 | 2022-05-12 | Indi Molecular, Inc. | Compositions, imaging, and therapeutic methods targeting folate receptor 1 (folr1) |
Family Cites Families (15)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4179337A (en) * | 1973-07-20 | 1979-12-18 | Davis Frank F | Non-immunogenic polypeptides |
| US4672044A (en) * | 1984-08-24 | 1987-06-09 | Scripps Clinic & Research Foundation | Murine monoclonal antibody combining site to human C3b receptor (CR1) |
| US5122614A (en) * | 1989-04-19 | 1992-06-16 | Enzon, Inc. | Active carbonates of polyalkylene oxides for modification of polypeptides |
| US6552170B1 (en) * | 1990-04-06 | 2003-04-22 | Amgen Inc. | PEGylation reagents and compounds formed therewith |
| AU8869291A (en) * | 1990-10-04 | 1992-04-28 | University Of Virginia Alumni Patents Foundation, The | Primate erythrocyte bound monoclonal antibody heteropolymers |
| ATE240740T1 (de) * | 1991-03-15 | 2003-06-15 | Amgen Inc | Pegylation von polypeptiden |
| US5679546A (en) * | 1993-09-24 | 1997-10-21 | Cytomed, Inc. | Chimeric proteins which block complement activation |
| US5914112A (en) * | 1996-01-23 | 1999-06-22 | Genentech, Inc. | Anti-CD18 antibodies in stroke |
| WO1999064603A2 (en) * | 1998-06-12 | 1999-12-16 | Henry M. Jackson Foundation For The Advancement Of Military Medicine | ENHANCEMENT OF B CELL ACTIVATION AND IMMUNOGLOBULIN SECRETION BY CO-STIMULATION OF RECEPTORS FOR ANTIGEN AND EBV Gp350/220 |
| US6572856B1 (en) * | 1998-09-10 | 2003-06-03 | The University Of Virginia Patent Foundation | Methods for the prevention and treatment of cancer using anti-C3b(i) antibodies |
| EP1284752A4 (en) * | 2000-04-26 | 2004-08-18 | Elusys Therapeutics Inc | BISPECIFIC MOLECULES AND USES THEREOF |
| EP1339427A4 (en) * | 2000-11-01 | 2004-09-15 | Elusys Therapeutics Inc | PROCESS FOR PRODUCING BISPECIFIC MOLECULES BY TRANSEPISSANCE OF PROTEINS |
| US6436386B1 (en) * | 2000-11-14 | 2002-08-20 | Shearwater Corporation | Hydroxyapatite-targeting poly (ethylene glycol) and related polymers |
| US20040018203A1 (en) * | 2001-06-08 | 2004-01-29 | Ira Pastan | Pegylation of linkers improves antitumor activity and reduces toxicity of immunoconjugates |
| AU2002357072A1 (en) * | 2001-12-07 | 2003-06-23 | Centocor, Inc. | Pseudo-antibody constructs |
-
2003
- 2003-09-16 US US10/527,936 patent/US20060153839A1/en not_active Abandoned
- 2003-09-16 CA CA002499075A patent/CA2499075A1/en not_active Abandoned
- 2003-09-16 WO PCT/US2003/029059 patent/WO2004024889A2/en active Application Filing
- 2003-09-16 JP JP2004536556A patent/JP2005539067A/ja not_active Withdrawn
- 2003-09-16 AU AU2003270686A patent/AU2003270686A1/en not_active Abandoned
- 2003-09-16 EP EP03752394A patent/EP1539811A4/en not_active Withdrawn
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2014516991A (ja) * | 2011-06-03 | 2014-07-17 | スリーエム イノベイティブ プロパティズ カンパニー | ポリエチレングリコールセグメントを有するヘテロ2官能性リンカー及び該リンカーから調製された免疫反応調節複合体 |
| JP2017160220A (ja) * | 2011-06-03 | 2017-09-14 | スリーエム イノベイティブ プロパティズ カンパニー | ポリエチレングリコールセグメントを有するヘテロ2官能性リンカー及び該リンカーから調製された免疫反応調節複合体 |
| JP2017160219A (ja) * | 2011-06-03 | 2017-09-14 | スリーエム イノベイティブ プロパティズ カンパニー | ヒドラジノ1h−イミダゾキノリン−4−アミン及びこれから調製された複合体 |
Also Published As
| Publication number | Publication date |
|---|---|
| AU2003270686A1 (en) | 2004-04-30 |
| WO2004024889A3 (en) | 2004-07-29 |
| US20060153839A1 (en) | 2006-07-13 |
| EP1539811A2 (en) | 2005-06-15 |
| CA2499075A1 (en) | 2004-03-25 |
| WO2004024889A2 (en) | 2004-03-25 |
| EP1539811A4 (en) | 2006-05-24 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2005539067A (ja) | ポリエチレングリコールリンカーを用いる二重特異性分子の産生 | |
| US20210040177A1 (en) | Multi-Specific Molecules | |
| JP3803790B2 (ja) | 新規なダイアボディ型二重特異性抗体 | |
| JP2024050548A (ja) | Cd47に対するヒト化及びキメラモノクローナル抗体 | |
| JP3280376B2 (ja) | 多価抗原結合性蛋白質 | |
| US5877305A (en) | DNA encoding biosynthetic binding protein for cancer marker | |
| AU2008201062B2 (en) | High Affinity Antibody Having a TCR-like Specificity and Use in Detection and Treatment | |
| US7368110B2 (en) | Antibodies, including Fv molecules, and immunoconjugates having high binding affinity for mesothelin and methods for their use | |
| CN110913904A (zh) | 用于改善的储存和施用的包含双特异性抗体构建体的药物组合物 | |
| CN114716557A (zh) | Psma和cd3双特异性t细胞接合抗体构建体 | |
| JP2018524296A (ja) | Cd123抗体及びその複合体 | |
| MX2015003616A (es) | Anticuerpos sin fc que comprenden dos fragmentos fab y metodos de uso. | |
| WO2019024911A1 (zh) | B7h3抗体-药物偶联物及其医药用途 | |
| CN110582297A (zh) | 包含T细胞接合抗体构建体的低pH药物组合物 | |
| RU2322260C2 (ru) | Пассивная иммунизационная терапия на основе пептидов для лечения атеросклероза | |
| TW202241519A (zh) | 腫瘤特異性密連蛋白18﹒2抗體藥物結合物 | |
| JP2005333993A (ja) | 新規なダイアボディ型二重特異性抗体 | |
| JP2005538738A (ja) | 抗原結合性抗体フラグメントに架橋された抗cr1抗体を含む二重特異性分子 | |
| JP2021525786A (ja) | 抗cd99ダイアボディ又はigg抗体及びそれらの使用 | |
| Kelly et al. | Short FcRn-binding peptides enable salvage and transcytosis of scFv antibody fragments | |
| CN114853890A (zh) | 一种prlr抗原结合蛋白及其制备方法和应用 | |
| CN114763383A (zh) | 靶向人bcma的单克隆抗体及其应用 | |
| Trakas et al. | Conjugation of acetylcholine receptor-protecting Fab fragments with polyethylene glycol results in a prolonged half-life in the circulation and reduced immunogenicity | |
| JP2004532626A (ja) | 二重特異性分子のポリクローナル集団、ならびにそれらの産生方法および使用 | |
| JP2018511306A (ja) | 治療 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20060915 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20060915 |
|
| A761 | Written withdrawal of application |
Free format text: JAPANESE INTERMEDIATE CODE: A761 Effective date: 20081219 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20081219 |