JP2005298468A - 高沸点化合物 - Google Patents
高沸点化合物 Download PDFInfo
- Publication number
- JP2005298468A JP2005298468A JP2004145682A JP2004145682A JP2005298468A JP 2005298468 A JP2005298468 A JP 2005298468A JP 2004145682 A JP2004145682 A JP 2004145682A JP 2004145682 A JP2004145682 A JP 2004145682A JP 2005298468 A JP2005298468 A JP 2005298468A
- Authority
- JP
- Japan
- Prior art keywords
- compound
- farnesene
- boiling point
- terpinene
- acrylate
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 150000001875 compounds Chemical class 0.000 title claims abstract description 50
- 238000009835 boiling Methods 0.000 title claims abstract description 34
- 239000000126 substance Substances 0.000 claims abstract description 56
- YHQGMYUVUMAZJR-UHFFFAOYSA-N α-terpinene Chemical compound CC(C)C1=CC=C(C)CC1 YHQGMYUVUMAZJR-UHFFFAOYSA-N 0.000 claims abstract description 30
- JSNRRGGBADWTMC-UHFFFAOYSA-N alpha-farnesene Natural products CC(C)=CCCC(C)=CCCC(=C)C=C JSNRRGGBADWTMC-UHFFFAOYSA-N 0.000 claims abstract description 26
- UAHWPYUMFXYFJY-UHFFFAOYSA-N beta-myrcene Chemical compound CC(C)=CCCC(=C)C=C UAHWPYUMFXYFJY-UHFFFAOYSA-N 0.000 claims abstract description 20
- CXENHBSYCFFKJS-UHFFFAOYSA-N α-farnesene Chemical compound CC(C)=CCCC(C)=CCC=C(C)C=C CXENHBSYCFFKJS-UHFFFAOYSA-N 0.000 claims abstract description 17
- WSTYNZDAOAEEKG-UHFFFAOYSA-N Mayol Natural products CC1=C(O)C(=O)C=C2C(CCC3(C4CC(C(CC4(CCC33C)C)=O)C)C)(C)C3=CC=C21 WSTYNZDAOAEEKG-UHFFFAOYSA-N 0.000 claims abstract description 15
- 125000002887 hydroxy group Chemical group [H]O* 0.000 claims abstract description 11
- GQVMHMFBVWSSPF-SOYUKNQTSA-N (4E,6E)-2,6-dimethylocta-2,4,6-triene Chemical compound C\C=C(/C)\C=C\C=C(C)C GQVMHMFBVWSSPF-SOYUKNQTSA-N 0.000 claims abstract description 10
- VYBREYKSZAROCT-UHFFFAOYSA-N alpha-myrcene Natural products CC(=C)CCCC(=C)C=C VYBREYKSZAROCT-UHFFFAOYSA-N 0.000 claims abstract description 10
- JSNRRGGBADWTMC-QINSGFPZSA-N (E)-beta-Farnesene Natural products CC(C)=CCC\C(C)=C/CCC(=C)C=C JSNRRGGBADWTMC-QINSGFPZSA-N 0.000 claims abstract description 8
- JXBSHSBNOVLGHF-UHFFFAOYSA-N 10-cis-Dihydrofarnesen Natural products CC=C(C)CCC=C(C)CCC=C(C)C JXBSHSBNOVLGHF-UHFFFAOYSA-N 0.000 claims abstract description 8
- YSNRTFFURISHOU-UHFFFAOYSA-N beta-farnesene Natural products C=CC(C)CCC=C(C)CCC=C(C)C YSNRTFFURISHOU-UHFFFAOYSA-N 0.000 claims abstract description 8
- 238000005698 Diels-Alder reaction Methods 0.000 claims abstract description 7
- GQVMHMFBVWSSPF-UHFFFAOYSA-N cis-alloocimene Natural products CC=C(C)C=CC=C(C)C GQVMHMFBVWSSPF-UHFFFAOYSA-N 0.000 claims abstract description 7
- IHPKGUQCSIINRJ-UHFFFAOYSA-N β-ocimene Natural products CC(C)=CCC=C(C)C=C IHPKGUQCSIINRJ-UHFFFAOYSA-N 0.000 claims abstract description 7
- 150000007823 ocimene derivatives Chemical class 0.000 claims abstract description 5
- XJPBRODHZKDRCB-UHFFFAOYSA-N trans-alpha-ocimene Natural products CC(=C)CCC=C(C)C=C XJPBRODHZKDRCB-UHFFFAOYSA-N 0.000 claims abstract description 5
- -1 oscene Chemical compound 0.000 claims description 19
- 238000005984 hydrogenation reaction Methods 0.000 claims description 9
- OMIGHNLMNHATMP-UHFFFAOYSA-N 2-hydroxyethyl prop-2-enoate Chemical compound OCCOC(=O)C=C OMIGHNLMNHATMP-UHFFFAOYSA-N 0.000 claims description 8
- 239000002904 solvent Substances 0.000 abstract description 22
- 239000000463 material Substances 0.000 abstract description 16
- 239000000203 mixture Substances 0.000 abstract description 9
- 239000002994 raw material Substances 0.000 abstract description 7
- 239000004014 plasticizer Substances 0.000 abstract description 6
- NIXOWILDQLNWCW-UHFFFAOYSA-M Acrylate Chemical compound [O-]C(=O)C=C NIXOWILDQLNWCW-UHFFFAOYSA-M 0.000 abstract description 5
- 239000003085 diluting agent Substances 0.000 abstract description 5
- 229920000642 polymer Polymers 0.000 abstract description 5
- 229920002803 thermoplastic polyurethane Polymers 0.000 abstract description 5
- 229920000704 biodegradable plastic Polymers 0.000 abstract description 3
- 229920000747 poly(lactic acid) Polymers 0.000 abstract description 3
- 239000004626 polylactic acid Substances 0.000 abstract description 3
- 239000011248 coating agent Substances 0.000 abstract description 2
- 238000000576 coating method Methods 0.000 abstract description 2
- 238000010438 heat treatment Methods 0.000 abstract description 2
- OGLDWXZKYODSOB-UHFFFAOYSA-N α-phellandrene Chemical compound CC(C)C1CC=C(C)C=C1 OGLDWXZKYODSOB-UHFFFAOYSA-N 0.000 abstract 2
- OGLDWXZKYODSOB-SNVBAGLBSA-N alpha-phellandrene Natural products CC(C)[C@H]1CC=C(C)C=C1 OGLDWXZKYODSOB-SNVBAGLBSA-N 0.000 abstract 1
- 238000009413 insulation Methods 0.000 abstract 1
- 238000010521 absorption reaction Methods 0.000 description 19
- 239000000047 product Substances 0.000 description 18
- 238000002290 gas chromatography-mass spectrometry Methods 0.000 description 14
- 239000000779 smoke Substances 0.000 description 14
- 238000006243 chemical reaction Methods 0.000 description 10
- 238000001225 nuclear magnetic resonance method Methods 0.000 description 9
- 239000003054 catalyst Substances 0.000 description 8
- 238000000655 nuclear magnetic resonance spectrum Methods 0.000 description 6
- 235000007586 terpenes Nutrition 0.000 description 6
- 229940095095 2-hydroxyethyl acrylate Drugs 0.000 description 5
- 238000004566 IR spectroscopy Methods 0.000 description 5
- 239000000853 adhesive Substances 0.000 description 5
- 230000001070 adhesive effect Effects 0.000 description 5
- 239000010735 electrical insulating oil Substances 0.000 description 4
- 125000004185 ester group Chemical group 0.000 description 4
- 238000001228 spectrum Methods 0.000 description 4
- 238000003756 stirring Methods 0.000 description 4
- 0 CC(CC(C(C)(*)C1C2*1)C(O*O)=O)*2N(*)** Chemical compound CC(CC(C(C)(*)C1C2*1)C(O*O)=O)*2N(*)** 0.000 description 3
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 3
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 3
- 239000003849 aromatic solvent Substances 0.000 description 3
- 238000001460 carbon-13 nuclear magnetic resonance spectrum Methods 0.000 description 3
- 238000004817 gas chromatography Methods 0.000 description 3
- 239000001257 hydrogen Substances 0.000 description 3
- 229910052739 hydrogen Inorganic materials 0.000 description 3
- 238000000034 method Methods 0.000 description 3
- 229920001200 poly(ethylene-vinyl acetate) Polymers 0.000 description 3
- 238000000425 proton nuclear magnetic resonance spectrum Methods 0.000 description 3
- 229920002725 thermoplastic elastomer Polymers 0.000 description 3
- NDWUBGAGUCISDV-UHFFFAOYSA-N 4-hydroxybutyl prop-2-enoate Chemical compound OCCCCOC(=O)C=C NDWUBGAGUCISDV-UHFFFAOYSA-N 0.000 description 2
- 241000196324 Embryophyta Species 0.000 description 2
- WOBHKFSMXKNTIM-UHFFFAOYSA-N Hydroxyethyl methacrylate Chemical compound CC(=C)C(=O)OCCO WOBHKFSMXKNTIM-UHFFFAOYSA-N 0.000 description 2
- RRHGJUQNOFWUDK-UHFFFAOYSA-N Isoprene Chemical compound CC(=C)C=C RRHGJUQNOFWUDK-UHFFFAOYSA-N 0.000 description 2
- CERQOIWHTDAKMF-UHFFFAOYSA-M Methacrylate Chemical compound CC(=C)C([O-])=O CERQOIWHTDAKMF-UHFFFAOYSA-M 0.000 description 2
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 2
- 239000002202 Polyethylene glycol Substances 0.000 description 2
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 2
- 229910052782 aluminium Inorganic materials 0.000 description 2
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 2
- PNEYBMLMFCGWSK-UHFFFAOYSA-N aluminium oxide Inorganic materials [O-2].[O-2].[O-2].[Al+3].[Al+3] PNEYBMLMFCGWSK-UHFFFAOYSA-N 0.000 description 2
- 238000004821 distillation Methods 0.000 description 2
- 238000005516 engineering process Methods 0.000 description 2
- 230000007613 environmental effect Effects 0.000 description 2
- 239000005038 ethylene vinyl acetate Substances 0.000 description 2
- 239000011888 foil Substances 0.000 description 2
- 125000000524 functional group Chemical group 0.000 description 2
- 125000004435 hydrogen atom Chemical group [H]* 0.000 description 2
- 238000002329 infrared spectrum Methods 0.000 description 2
- 239000007788 liquid Substances 0.000 description 2
- 238000004519 manufacturing process Methods 0.000 description 2
- 239000003973 paint Substances 0.000 description 2
- 229920002120 photoresistant polymer Polymers 0.000 description 2
- 230000000704 physical effect Effects 0.000 description 2
- 229920001223 polyethylene glycol Polymers 0.000 description 2
- 229920001451 polypropylene glycol Polymers 0.000 description 2
- 238000012916 structural analysis Methods 0.000 description 2
- 150000003505 terpenes Chemical class 0.000 description 2
- LLVWLCAZSOLOTF-UHFFFAOYSA-N 1-methyl-4-[1,4,4-tris(4-methylphenyl)buta-1,3-dienyl]benzene Chemical compound C1=CC(C)=CC=C1C(C=1C=CC(C)=CC=1)=CC=C(C=1C=CC(C)=CC=1)C1=CC=C(C)C=C1 LLVWLCAZSOLOTF-UHFFFAOYSA-N 0.000 description 1
- QOXOZONBQWIKDA-UHFFFAOYSA-N 3-hydroxypropyl Chemical group [CH2]CCO QOXOZONBQWIKDA-UHFFFAOYSA-N 0.000 description 1
- QZPSOSOOLFHYRR-UHFFFAOYSA-N 3-hydroxypropyl prop-2-enoate Chemical compound OCCCOC(=O)C=C QZPSOSOOLFHYRR-UHFFFAOYSA-N 0.000 description 1
- YKXAYLPDMSGWEV-UHFFFAOYSA-N 4-hydroxybutyl 2-methylprop-2-enoate Chemical compound CC(=C)C(=O)OCCCCO YKXAYLPDMSGWEV-UHFFFAOYSA-N 0.000 description 1
- YGTVWCBFJAVSMS-UHFFFAOYSA-N 5-hydroxypentyl 2-methylprop-2-enoate Chemical compound CC(=C)C(=O)OCCCCCO YGTVWCBFJAVSMS-UHFFFAOYSA-N 0.000 description 1
- INRQKLGGIVSJRR-UHFFFAOYSA-N 5-hydroxypentyl prop-2-enoate Chemical compound OCCCCCOC(=O)C=C INRQKLGGIVSJRR-UHFFFAOYSA-N 0.000 description 1
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 1
- 241000219495 Betulaceae Species 0.000 description 1
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical class [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 1
- XDTMQSROBMDMFD-UHFFFAOYSA-N Cyclohexane Chemical compound C1CCCCC1 XDTMQSROBMDMFD-UHFFFAOYSA-N 0.000 description 1
- MQIUGAXCHLFZKX-UHFFFAOYSA-N Di-n-octyl phthalate Natural products CCCCCCCCOC(=O)C1=CC=CC=C1C(=O)OCCCCCCCC MQIUGAXCHLFZKX-UHFFFAOYSA-N 0.000 description 1
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 1
- BRLQWZUYTZBJKN-UHFFFAOYSA-N Epichlorohydrin Chemical compound ClCC1CO1 BRLQWZUYTZBJKN-UHFFFAOYSA-N 0.000 description 1
- 239000005909 Kieselgur Substances 0.000 description 1
- CERQOIWHTDAKMF-UHFFFAOYSA-N Methacrylic acid Chemical compound CC(=C)C(O)=O CERQOIWHTDAKMF-UHFFFAOYSA-N 0.000 description 1
- KJTLSVCANCCWHF-UHFFFAOYSA-N Ruthenium Chemical compound [Ru] KJTLSVCANCCWHF-UHFFFAOYSA-N 0.000 description 1
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 1
- 150000001252 acrylic acid derivatives Chemical class 0.000 description 1
- 150000001298 alcohols Chemical class 0.000 description 1
- 150000001336 alkenes Chemical class 0.000 description 1
- 125000004429 atom Chemical group 0.000 description 1
- BJQHLKABXJIVAM-UHFFFAOYSA-N bis(2-ethylhexyl) phthalate Chemical compound CCCCC(CC)COC(=O)C1=CC=CC=C1C(=O)OCC(CC)CCCC BJQHLKABXJIVAM-UHFFFAOYSA-N 0.000 description 1
- 238000007664 blowing Methods 0.000 description 1
- 125000004432 carbon atom Chemical group C* 0.000 description 1
- 230000003197 catalytic effect Effects 0.000 description 1
- 238000012663 cationic photopolymerization Methods 0.000 description 1
- 239000007795 chemical reaction product Substances 0.000 description 1
- 239000007810 chemical reaction solvent Substances 0.000 description 1
- 238000013329 compounding Methods 0.000 description 1
- 125000000596 cyclohexenyl group Chemical group C1(=CCCCC1)* 0.000 description 1
- 229960001760 dimethyl sulfoxide Drugs 0.000 description 1
- 229910001873 dinitrogen Inorganic materials 0.000 description 1
- 229930004069 diterpene Natural products 0.000 description 1
- 125000000567 diterpene group Chemical group 0.000 description 1
- 230000000694 effects Effects 0.000 description 1
- 150000002148 esters Chemical class 0.000 description 1
- 150000002170 ethers Chemical class 0.000 description 1
- UAIZDWNSWGTKFZ-UHFFFAOYSA-L ethylaluminum(2+);dichloride Chemical compound CC[Al](Cl)Cl UAIZDWNSWGTKFZ-UHFFFAOYSA-L 0.000 description 1
- 229930009668 farnesene Natural products 0.000 description 1
- 239000007789 gas Substances 0.000 description 1
- 238000012844 infrared spectroscopy analysis Methods 0.000 description 1
- 239000003999 initiator Substances 0.000 description 1
- 239000000976 ink Substances 0.000 description 1
- 239000011968 lewis acid catalyst Substances 0.000 description 1
- 239000000178 monomer Substances 0.000 description 1
- 229930003658 monoterpene Natural products 0.000 description 1
- 150000002773 monoterpene derivatives Chemical class 0.000 description 1
- 235000002577 monoterpenes Nutrition 0.000 description 1
- 229910000510 noble metal Inorganic materials 0.000 description 1
- JRZJOMJEPLMPRA-UHFFFAOYSA-N olefin Natural products CCCCCCCC=C JRZJOMJEPLMPRA-UHFFFAOYSA-N 0.000 description 1
- 230000001590 oxidative effect Effects 0.000 description 1
- 229910052763 palladium Inorganic materials 0.000 description 1
- 239000003208 petroleum Substances 0.000 description 1
- 150000002989 phenols Chemical class 0.000 description 1
- 229920000515 polycarbonate Polymers 0.000 description 1
- 239000004417 polycarbonate Substances 0.000 description 1
- 239000000843 powder Substances 0.000 description 1
- 238000010992 reflux Methods 0.000 description 1
- 229910052703 rhodium Inorganic materials 0.000 description 1
- 239000010948 rhodium Substances 0.000 description 1
- MHOVAHRLVXNVSD-UHFFFAOYSA-N rhodium atom Chemical compound [Rh] MHOVAHRLVXNVSD-UHFFFAOYSA-N 0.000 description 1
- 229910052707 ruthenium Inorganic materials 0.000 description 1
- 229930195734 saturated hydrocarbon Natural products 0.000 description 1
- 229930004725 sesquiterpene Natural products 0.000 description 1
- 150000004354 sesquiterpene derivatives Chemical class 0.000 description 1
- 229910000029 sodium carbonate Inorganic materials 0.000 description 1
- 235000011121 sodium hydroxide Nutrition 0.000 description 1
- 239000002195 soluble material Substances 0.000 description 1
- 230000001502 supplementing effect Effects 0.000 description 1
- 229930006978 terpinene Natural products 0.000 description 1
- 150000003507 terpinene derivatives Chemical class 0.000 description 1
- 229920006305 unsaturated polyester Polymers 0.000 description 1
- 239000000341 volatile oil Substances 0.000 description 1
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 1
Images
Landscapes
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
Abstract
【課題】インク組成物のビヒクル成分や電気絶縁油、ウレタン樹脂用希釈剤、熱媒体、塗料用溶剤、ペースト用溶剤、ポリマー原料、ブレーキ用溶剤、感光性材料、ポリ乳酸等生分解性プラスチックの可塑剤等々に有用な、高沸点化合物を提供する。
【解決手段】α−テルピネン、アロオシメン、ミルセン、オシメン、α−ファルネセン、β−ファルネセン、α−フェランドレンの中から選ばれる少なくとも1種の化合物と末端に水酸基を有する(メタ)アクリレート系化合物をディールス−アルダー反応して得られる化学構造式、ならびにその水添物の化学構造式を有する高沸点化合物に関するものである。
【選択図】 なし
【解決手段】α−テルピネン、アロオシメン、ミルセン、オシメン、α−ファルネセン、β−ファルネセン、α−フェランドレンの中から選ばれる少なくとも1種の化合物と末端に水酸基を有する(メタ)アクリレート系化合物をディールス−アルダー反応して得られる化学構造式、ならびにその水添物の化学構造式を有する高沸点化合物に関するものである。
【選択図】 なし
Description
本発明は、新規な高沸点化合物に関するものである。
本発明で使用する(メタ)アクリレート系化合物とは、アクリレート系化合物及びメタクリレート系化合物の意味である。
本発明で使用する(メタ)アクリレート系化合物とは、アクリレート系化合物及びメタクリレート系化合物の意味である。
高沸点溶剤は、ビヒクル成分としてのインキ組成物や電気絶縁油、感圧複写材料の染料溶解材料、ウレタン樹脂用希釈剤、エチレン−酢酸ビニル共重合体や熱可塑性エラストマー用の可塑剤、熱媒体、塗料用溶剤、ペースト用溶剤、ブレーキ用溶剤等に使用されている。
それら、高沸点溶剤には、溶解力に優れ、安価であることから、石油系溶剤を主成分とする芳香族系溶剤が広く使用されている。
しかしながら、それら高沸点溶剤も、多くは沸点200〜250℃程度の性状のものであり、250℃を越える性状を示すものはあまり見られない。
また、上記のように、高沸点溶剤として、芳香族系溶剤が広く使用されており、環境問題が社会問題になっている今日、それら、芳香族溶剤は好ましいものではない。
特開平9−157189号公報
それら、高沸点溶剤には、溶解力に優れ、安価であることから、石油系溶剤を主成分とする芳香族系溶剤が広く使用されている。
しかしながら、それら高沸点溶剤も、多くは沸点200〜250℃程度の性状のものであり、250℃を越える性状を示すものはあまり見られない。
また、上記のように、高沸点溶剤として、芳香族系溶剤が広く使用されており、環境問題が社会問題になっている今日、それら、芳香族溶剤は好ましいものではない。
本発明の目的は、インク組成物のビヒクル成分や電気絶縁油、感圧複写材料の染料溶解材料、ウレタン樹脂用希釈剤、エチレン−酢酸ビニル共重合体や熱可塑性エラストマー用、熱媒体、塗料用溶剤、ペースト用溶剤、ポリマー原料、ブレーキ用溶剤、感光性材料、ポリ乳酸等生分解性プラスチックの可塑剤等々に有用な、新規な高沸点化合物を提供することである。
本発明は、α−テルピネン、アロオシメン、ミルセン、オシメン、α−ファルネセン、β−ファルネセン、α−フェランドレンの中から選ばれる少なくとも1種の化合物と末端に水酸基を有する(メタ)アクリレート系化合物をディールス−アルダー反応して得られる化学構造式を有する高沸点化合物、ならびに、その水添物の化学構造式を有する高沸点化合物である。
本発明の高沸点化合物は、沸点が200℃を十分越えるもので、300℃付近の性状を有するものもあり、環境問題でも影響の少ない安全な新規な、高沸点化合物である。
本発明の高沸点化合物は、より高沸点性が要求される、インク組成物のビヒクル成分や電気絶縁油、感圧複写材料の染料溶解材料、ウレタン樹脂用希釈剤、エチレン−酢酸ビニル共重合体や熱可塑性エラストマー用の可塑剤(粘・接着剤組成物)、熱媒体、塗料用溶剤、ペースト用溶剤、ポリマー原料、(メタ)アクリレート化合物等化学品の中間原料等、様々な用途に展開が可能となる。
粘・接着剤組成物として使用した場合、配合量は、市販の可塑剤(例:フタル酸ジオクチル等)を使用した場合に比べて耐熱性が向上する。
不飽和ポリエステルやポリカーボネートの原料の一部として使用した場合、使用しない場合に比べて、耐熱性向上の効果がより向上することになる。
また、本発明の高沸点化合物のうち、水添しない二重結合を有する化合物においては、さらに二重結合部分を酸化して、エポキシ化することにより、ホトレジストなどの感光性材料としても利用できるものである。
また、ポリ乳酸等の生分解性プラスチックとの相溶性にも優れており、今後この分野のフィルム化への展開も期待できるものである。
本発明の高沸点化合物は、より高沸点性が要求される、インク組成物のビヒクル成分や電気絶縁油、感圧複写材料の染料溶解材料、ウレタン樹脂用希釈剤、エチレン−酢酸ビニル共重合体や熱可塑性エラストマー用の可塑剤(粘・接着剤組成物)、熱媒体、塗料用溶剤、ペースト用溶剤、ポリマー原料、(メタ)アクリレート化合物等化学品の中間原料等、様々な用途に展開が可能となる。
粘・接着剤組成物として使用した場合、配合量は、市販の可塑剤(例:フタル酸ジオクチル等)を使用した場合に比べて耐熱性が向上する。
不飽和ポリエステルやポリカーボネートの原料の一部として使用した場合、使用しない場合に比べて、耐熱性向上の効果がより向上することになる。
また、本発明の高沸点化合物のうち、水添しない二重結合を有する化合物においては、さらに二重結合部分を酸化して、エポキシ化することにより、ホトレジストなどの感光性材料としても利用できるものである。
また、ポリ乳酸等の生分解性プラスチックとの相溶性にも優れており、今後この分野のフィルム化への展開も期待できるものである。
本発明の、α−テルピネン、アロオシメン、ミルセン、オシメン、α−ファルネセン、β−ファルネセン、α−フェランドレンの中から選ばれる1種の化合物(共役二重結合を有するテルペン化合物)と末端に水酸基を有する(メタ)アクリレート系化合物をディールス−アルダー反応して得られる化学構造式を有する高沸点化合物、ならびに、その水添物について説明する。
一般に、テルペン化合物は、一般に植物の葉、樹、根などから得られる植物精油に含まれる化合物である。
ここでテルペンについて説明する。テルペンとは一般的に、イソプレン(C5H8)の重合体で、モノテルペン(C10H16)、セスキテルペン(C15H24)、ジテルペン(C20H32)等に分類される。テルペン化合物とは、これらを基本骨格とする化合物であり、分子中に二重結合を有している。
本発明で使用される共役二重結合を有するテルペン化合物としては、α−テルピネン(化5)、アロオシメン(化6)、ミルセン(化7)、オシメン(化8)、α−ファルネセン(化9)、β−ファルネセン(化10)、α−フェランドレン(化11)が挙げられる。
これらの中で、容易に入手可能なα−テルピネン、アロオシメン、ミルセンが好ましい。
一般に、テルペン化合物は、一般に植物の葉、樹、根などから得られる植物精油に含まれる化合物である。
ここでテルペンについて説明する。テルペンとは一般的に、イソプレン(C5H8)の重合体で、モノテルペン(C10H16)、セスキテルペン(C15H24)、ジテルペン(C20H32)等に分類される。テルペン化合物とは、これらを基本骨格とする化合物であり、分子中に二重結合を有している。
本発明で使用される共役二重結合を有するテルペン化合物としては、α−テルピネン(化5)、アロオシメン(化6)、ミルセン(化7)、オシメン(化8)、α−ファルネセン(化9)、β−ファルネセン(化10)、α−フェランドレン(化11)が挙げられる。
これらの中で、容易に入手可能なα−テルピネン、アロオシメン、ミルセンが好ましい。
本発明の末端に水酸基を有する(メタ)アクリレート系化合物について説明する。
本発明の上記(メタ)アクリレート系化合物としては、具体的には、2−ヒドロキシエチルアクリレート(CAS No.818−61−1)、2−ヒドロキシエチルメタクリレート、3−ヒドロキシプロピルアクリレート、3−ヒドロキシプロピルメタクリレート、4−ヒドロキシブチルアクリレート(CAS No.2478−10−6)、4−ヒドロキシブチルメタクリレート、5−ヒドロキシペンチルアクリレート、5−ヒドロキシペンチルメタクリレート、ポリエチレングリコールアクリレート、ポリエチレングリコールメタクリレート、ポリプロピレングリコールアクリレート、ポリプロピレングリコールメタクリレート等が挙げられる。
本発明の上記(メタ)アクリレート系化合物としては、具体的には、2−ヒドロキシエチルアクリレート(CAS No.818−61−1)、2−ヒドロキシエチルメタクリレート、3−ヒドロキシプロピルアクリレート、3−ヒドロキシプロピルメタクリレート、4−ヒドロキシブチルアクリレート(CAS No.2478−10−6)、4−ヒドロキシブチルメタクリレート、5−ヒドロキシペンチルアクリレート、5−ヒドロキシペンチルメタクリレート、ポリエチレングリコールアクリレート、ポリエチレングリコールメタクリレート、ポリプロピレングリコールアクリレート、ポリプロピレングリコールメタクリレート等が挙げられる。
本発明で使用されるディールス−アルダー反応は、一般的な化学書等に記載されている公知の技術である。
ディールス−アルダー反応は、共役二重結合(1,3−ジエン)を有する化合物が、オレフィン類と環状付加して、シクロヘキセン骨格を生成する反応である。
ディールス−アルダー反応は、共役二重結合(1,3−ジエン)を有する化合物が、オレフィン類と環状付加して、シクロヘキセン骨格を生成する反応である。
本発明をさらに具体的に説明する。
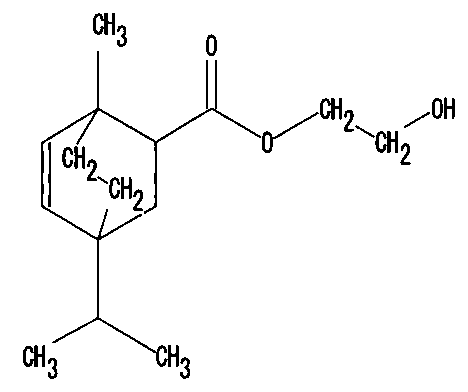
下記化12、化13の混合物である本発明の高沸点化合物は、例えば、α−テルピネン(化1)1.0モルと2−ヒドロキシエチルアクリレート1.0〜4.0モル、好ましくはα−テルピネン1.0モルと2−ヒドロキシエチルアクリレート1.0〜1.5モルを、ルイス酸触媒下、あるいは無触媒下、100℃〜170℃の温度で、0.5〜24時間反応させることにより得られる。溶媒は使用しなくてもよいが、パラメンタン等の高沸点の二重結合や官能基を有しない溶媒を使用してもよい。触媒は使用しなくてもよいが、エチルアルミニウムジクロライドなどの触媒を0.1〜100ミリモル程度で使用してもよい。
原料のα−テルピネンや2−ヒドロキシエチルアクリレートの純度は、純度がより高いほど好ましいが、反応開始時、少なくとも、60重量%以上であることが望ましい。
下記化12、化13の混合物である本発明の高沸点化合物は、例えば、α−テルピネン(化1)1.0モルと2−ヒドロキシエチルアクリレート1.0〜4.0モル、好ましくはα−テルピネン1.0モルと2−ヒドロキシエチルアクリレート1.0〜1.5モルを、ルイス酸触媒下、あるいは無触媒下、100℃〜170℃の温度で、0.5〜24時間反応させることにより得られる。溶媒は使用しなくてもよいが、パラメンタン等の高沸点の二重結合や官能基を有しない溶媒を使用してもよい。触媒は使用しなくてもよいが、エチルアルミニウムジクロライドなどの触媒を0.1〜100ミリモル程度で使用してもよい。
原料のα−テルピネンや2−ヒドロキシエチルアクリレートの純度は、純度がより高いほど好ましいが、反応開始時、少なくとも、60重量%以上であることが望ましい。
本発明のα−テルピネン、アロオシメン、オシメン、ミルセン、ファルネセン、α−フェランドレンの中から選ばれる少なくとも1種の化合物と末端に水酸基を有する(メタ)アクリレート系化合物をディールス−アルダー反応し、さらに水添して得られる高沸点化合物における水添反応について説明する。
水添する方法としては、特に限定されるものではなく、例えば、パラジウム、ルテニウム、ロジウムなどの貴金属またはそれらを活性炭素、活性アルミナ、珪藻土などの坦体上に担持したものを触媒として使用して行う方法が挙げられる。
この時、粉末状の触媒を懸濁攪拌しながら反応を行うバッチ方式にすることも、成形した触媒を充填した反応塔を用いた連続方式にすることも可能であり、反応形式に特に制限はない。
この時、粉末状の触媒を懸濁攪拌しながら反応を行うバッチ方式にすることも、成形した触媒を充填した反応塔を用いた連続方式にすることも可能であり、反応形式に特に制限はない。
触媒の使用量は、反応がバッチ方式の場合、原料であるフェノール類に対し0.1〜50重量%、好ましくは0.2〜20重量%である。触媒量が0.1重量%未満では、水素化反応速度が遅くなり、一方、50重量%を超えても触媒効果が上がらないので好ましくない。
水添の際、反応溶媒は用いなくてもよいが、通常、アルコール類、エーテル類、エステル類、飽和炭化水素類が使用される。
水添の際の反応温度は、特に限定されないが、通常20〜250℃、好ましくは、50〜200℃である。反応温度が20℃未満であると、水素化速度が遅くなり、一方、250℃を超えると、水添物の分解が多くなる恐れがある。
水添の際の水素圧は、通常10〜200kgf/cm2(9.8×104〜196.0×104Pa)である。好ましくは、20〜50kgf/cm2(19.6×104〜49.0×104Pa)である。
水添することにより、水添する前の化合物に比べて、色相が改善される。
水添することにより、水添する前の化合物に比べて、色相が改善される。
上記の化12、化13の高沸点化合物を水添(水素添加)することにより、下記、化14、化15とすることができる。
上記、化12、化13、化14、化15等の本発明の高沸点化合物は、5〜7mmHg/160℃〜180℃の減圧蒸留等により、より高純度の化合物を得ることが出来る。
本発明の高沸点化合物の構造は、NMR(核磁気共鳴法)、GC−MS(ガスクロマトグラフィー質量分析法)、IR(赤外分光分析)などにより解析することが出来る。
具体的には、NMRにおいて、水素原子の数や種類は、1H−NMRスペクトルにより、炭素原子の数や種類は、13C−NMRスペクトルにより確認することが出来る。
また、GC−MS(ガスクロマトグラフィー質量分析法)においては、分子量や原子団を確認することが出来る。さらに、IRにおいては、官能基の種類や原子間の結合の種類を確認することが出来る。
具体的には、NMRにおいて、水素原子の数や種類は、1H−NMRスペクトルにより、炭素原子の数や種類は、13C−NMRスペクトルにより確認することが出来る。
また、GC−MS(ガスクロマトグラフィー質量分析法)においては、分子量や原子団を確認することが出来る。さらに、IRにおいては、官能基の種類や原子間の結合の種類を確認することが出来る。
以下、本発明を実施例により説明する。ただし本発明は実施例により限定されるものではない。
実施例1
(化12、化13の化合物の製造)
温度計、撹拌装置、滴下ロートおよび冷却管を備えた内容積2リットルの4つ口フラスコに、ヤスハラケミカル(株)製α−テルピネン(純度76%)40.0g(2.94モル相当)を仕込んだのち、160℃の温度に保持しながら、2−ヒドロキシ−エチルアクリレート(和光純薬製、純度98%)350.0g(3.02モル相当)を1時間かけて滴下した。その後、160℃で4時間加熱し、攪拌した。この生成物を、5mmHgの減圧蒸留下、178〜190℃で、留去させ、化12、化13の混合物からなる、淡黄色の液体である化合物248.48g(蒸留品A)を得た(色相:APHA94)。
この蒸留品AをAgilent Technologies社製6890N型ガスグロマトグラフィーにより分析した結果、2本のピークの合計純度は94.31%であった。
なお、この蒸留品Aの物性値は下記の通りであった。
粘度:214cps/25℃、屈折率(20℃):1.4934、沸点:285〜292℃、引火点:174℃。
実施例1
(化12、化13の化合物の製造)
温度計、撹拌装置、滴下ロートおよび冷却管を備えた内容積2リットルの4つ口フラスコに、ヤスハラケミカル(株)製α−テルピネン(純度76%)40.0g(2.94モル相当)を仕込んだのち、160℃の温度に保持しながら、2−ヒドロキシ−エチルアクリレート(和光純薬製、純度98%)350.0g(3.02モル相当)を1時間かけて滴下した。その後、160℃で4時間加熱し、攪拌した。この生成物を、5mmHgの減圧蒸留下、178〜190℃で、留去させ、化12、化13の混合物からなる、淡黄色の液体である化合物248.48g(蒸留品A)を得た(色相:APHA94)。
この蒸留品AをAgilent Technologies社製6890N型ガスグロマトグラフィーにより分析した結果、2本のピークの合計純度は94.31%であった。
なお、この蒸留品Aの物性値は下記の通りであった。
粘度:214cps/25℃、屈折率(20℃):1.4934、沸点:285〜292℃、引火点:174℃。
さらに、この蒸留品Aについて、NMRおよびGC−MS(Hewlett Packard社製6890型)、IR(パーキンエルマー社製Spectrum One システムB型)により、以下の構造解析を行った。
NMRデータ(1Hと13Cのチャート)、GC−MSデータ、IRデータをそれぞれ図1、図2、図3、図4、5に掲載した。
NMRデータ(1Hと13Cのチャート)、GC−MSデータ、IRデータをそれぞれ図1、図2、図3、図4、5に掲載した。
ここで、蒸留品Aの1H(図1)、13C(図2)のNMRスペクトルについて説明する。ただし、化12および化13の化合物の各分子の位置関係は、化12A、化13Aのとおりとした。
蒸留品Aの1HのNMRスペクトルにおけるケミカルシフトを表1に、蒸留品Aの13CのNMRスペクトルにおけるケミカルシフトを表2に示す。
図3に蒸留品AのGC−MSのデータを掲載した。分子量252が確認された。
図4、5の蒸留品AのIRデータを説明する。3456cm−1の幅広い吸収ピークは、O−Hの伸縮振動によるものである。1064cm−1の吸収ピークは、C−Oの伸縮振動によるものである。1733cm−1の吸収ピークは、エステル基におけるC=O伸縮振動であり、1100〜1300cm−1の吸収帯は、エステル基の吸収帯である。
2800〜3000cm−1付近の吸収ピークは、C−Hの伸縮振動、1350〜1456cm−1付近の吸収ピークは、CH2基やCH3基の吸収である。
3038cm−1の吸収帯は、C=CのC−H伸縮振動、1618cm−1の吸収帯は、C=Cの伸縮振動である。
以上のNMRおよびGC−MS、IRデータより、蒸留品Aは、化12、化13の化合物であることを確認した。
2800〜3000cm−1付近の吸収ピークは、C−Hの伸縮振動、1350〜1456cm−1付近の吸収ピークは、CH2基やCH3基の吸収である。
3038cm−1の吸収帯は、C=CのC−H伸縮振動、1618cm−1の吸収帯は、C=Cの伸縮振動である。
以上のNMRおよびGC−MS、IRデータより、蒸留品Aは、化12、化13の化合物であることを確認した。
参考例1
(蒸留品Aの溶剤としての性状)
沸点:285〜292℃、引火点:174℃、粘度:214cps/25℃。
(蒸留品Aの発煙性試験結果)
○ 発煙が見られない。
発煙性試験:180℃に加熱されたホットプレートにアルミニウム箔の皿に試料0.1gを取り、試料をトールビーカーで覆い機密性を保ち、30秒後の内部の発煙状態を観察した。発煙が多く見られるものを×、やや発煙が見られるものを△、発煙が見られないものを○とした。
。
(蒸留品Aの溶剤としての性状)
沸点:285〜292℃、引火点:174℃、粘度:214cps/25℃。
(蒸留品Aの発煙性試験結果)
○ 発煙が見られない。
発煙性試験:180℃に加熱されたホットプレートにアルミニウム箔の皿に試料0.1gを取り、試料をトールビーカーで覆い機密性を保ち、30秒後の内部の発煙状態を観察した。発煙が多く見られるものを×、やや発煙が見られるものを△、発煙が見られないものを○とした。
。
参考例2
(感光性モノマーとしての利用)
温度計、空気吹き込み管、還流冷却管、攪拌機を備えた、500ml、四つ口フラスコに、実施例1で得られた蒸留品Aを85.7g(約0.34モル)と炭酸ナトリウムの粉末を1g仕込み、100℃で攪拌しながら、空気を100ml/分のスピードで吹き込み24時間反応を行った。その後、150℃に温度を上げ1時間攪拌した。反応物は減圧蒸留し、未反応留分を留去した後、留分69.8gを得た。ガスクロマトグラフィーによる純度は95%であった。得られた留分の化学構造式は、下記化16、17と推定される。
この化16、17のエポキシ化したオキサイド化合物は、光カチオン重合開始剤と併用して使用することにより、耐熱性を有するフォトレジスト等の感光性材料として使用できる。
また、化16、17のエポキシ化したオキサイド化合物は、水酸基部分を(メタ)アクリル酸等とエステル化反応させた後、感光性材料として使用することもできる。
また、化16、17のエポキシ化したオキサイド化合物は、水酸基部分を、例えば、メチルスルホキシドの存在下に苛性ソーダなどを添加して反応させることによりエピクロルヒドリンなどを反応させることにより、ジオキサイド化合物とし、感光性材料として使用することもできる。
(感光性モノマーとしての利用)
温度計、空気吹き込み管、還流冷却管、攪拌機を備えた、500ml、四つ口フラスコに、実施例1で得られた蒸留品Aを85.7g(約0.34モル)と炭酸ナトリウムの粉末を1g仕込み、100℃で攪拌しながら、空気を100ml/分のスピードで吹き込み24時間反応を行った。その後、150℃に温度を上げ1時間攪拌した。反応物は減圧蒸留し、未反応留分を留去した後、留分69.8gを得た。ガスクロマトグラフィーによる純度は95%であった。得られた留分の化学構造式は、下記化16、17と推定される。
この化16、17のエポキシ化したオキサイド化合物は、光カチオン重合開始剤と併用して使用することにより、耐熱性を有するフォトレジスト等の感光性材料として使用できる。
また、化16、17のエポキシ化したオキサイド化合物は、水酸基部分を(メタ)アクリル酸等とエステル化反応させた後、感光性材料として使用することもできる。
また、化16、17のエポキシ化したオキサイド化合物は、水酸基部分を、例えば、メチルスルホキシドの存在下に苛性ソーダなどを添加して反応させることによりエピクロルヒドリンなどを反応させることにより、ジオキサイド化合物とし、感光性材料として使用することもできる。
実施例2
(化14、化15の化合物の製造)
実施例1で得られた蒸留物(ガスクロマトグラフィー純度94.31%)を150.0g、シクロヘキサンを200ml、および粉末状の5%ルテニウム担持アルミナ触媒1.0gを仕込み、次いで、これを密閉し、雰囲気を窒素ガスで置換した後、水素ガス3kg/cm2の圧力をかけながら導入した。そして攪拌しながら加熱し50℃となったところで、水素の圧力を5kg/cm2とし、吸収された水素を補うことで圧力を5kg/cm2に保ちながら2時間反応させ、無色の液体である化合物(蒸留品B)142gを得た(色相:APHA41)。
この蒸留品BをAgilent Technologies社製6890N型ガスグロマトグラフィーにより分析した結果、2本のピークの合計純度は94.91%であった。
なお、この蒸留品Bの物性値は下記の通りであった。
粘度:240cps/25℃、屈折率(20℃):1.4869、沸点:315〜322℃、引火点:173℃。
(化14、化15の化合物の製造)
実施例1で得られた蒸留物(ガスクロマトグラフィー純度94.31%)を150.0g、シクロヘキサンを200ml、および粉末状の5%ルテニウム担持アルミナ触媒1.0gを仕込み、次いで、これを密閉し、雰囲気を窒素ガスで置換した後、水素ガス3kg/cm2の圧力をかけながら導入した。そして攪拌しながら加熱し50℃となったところで、水素の圧力を5kg/cm2とし、吸収された水素を補うことで圧力を5kg/cm2に保ちながら2時間反応させ、無色の液体である化合物(蒸留品B)142gを得た(色相:APHA41)。
この蒸留品BをAgilent Technologies社製6890N型ガスグロマトグラフィーにより分析した結果、2本のピークの合計純度は94.91%であった。
なお、この蒸留品Bの物性値は下記の通りであった。
粘度:240cps/25℃、屈折率(20℃):1.4869、沸点:315〜322℃、引火点:173℃。
さらに、この蒸留品Bについて、NMRおよびGC−MS(Hewlett Packard社製6890型)、IR(パーキンエルマー社製Spectrum One システムB型)により、構造解析を行った。
NMRデータ(1Hと13Cのチャート)、GC−MSデータ、IRデータをそれぞれ図6、図7、図8、図4、5に掲載した。
NMRデータ(1Hと13Cのチャート)、GC−MSデータ、IRデータをそれぞれ図6、図7、図8、図4、5に掲載した。
ここで、蒸留品Bの1H(図6)、13C(図7)のNMRスペクトルについて説明する。ただし、化14および化15の化合物の各分子の位置関係は、化14B、化15Bのとおりとした。
蒸留品Bの1HのNMRスペクトルにおけるケミカルシフトを表3に、蒸留品Bの13CのNMRスペクトルにおけるケミカルシフトを表4に示す。
図8に蒸留品BのGC−MSのデータを掲載した。分子量254が確認された。
図4、5のIRの蒸留品Bのデータを解析する。3447cm−1の幅広い吸収ピークは、O−Hの伸縮振動によるものである。1082cm−1の吸収ピークは、C−Oの伸縮振動によるものである。1733cm−1の吸収ピークは、エステル基におけるC=O伸縮振動であり、1100〜1300cm−1の吸収帯は、エステル基の吸収帯である。
2800〜3000cm−1付近の吸収ピークは、C−Hの伸縮振動、1350〜1456cm−1付近の吸収ピークは、CH2基やCH3基の吸収である。
蒸留品Bにおいては、蒸留品Aで見られた3038cm−1や1618cm−1のC=C由来の吸収ピークが無くなっているのが特徴である。
以上のNMRおよびGC−MS、IRデータより、蒸留品Bは、化14、化15の化合物であることを確認した。
2800〜3000cm−1付近の吸収ピークは、C−Hの伸縮振動、1350〜1456cm−1付近の吸収ピークは、CH2基やCH3基の吸収である。
蒸留品Bにおいては、蒸留品Aで見られた3038cm−1や1618cm−1のC=C由来の吸収ピークが無くなっているのが特徴である。
以上のNMRおよびGC−MS、IRデータより、蒸留品Bは、化14、化15の化合物であることを確認した。
参考例3
(蒸留品Bの溶剤としての性状)
沸点:315〜322℃、引火点:173℃、粘度:240cps/25℃。
(蒸留品Bの発煙性試験結果)
○ 発煙が見られない。
発煙性試験:180℃に加熱されたホットプレートにアルミニウム箔の皿に試料0.1gを取り、試料をトールビーカーで覆い機密性を保ち、30秒後の内部の発煙状態を観察した。発煙が多く見られるものを×、やや発煙が見られるものを△、発煙が見られないものを○とした。
(蒸留品Bの溶剤としての性状)
沸点:315〜322℃、引火点:173℃、粘度:240cps/25℃。
(蒸留品Bの発煙性試験結果)
○ 発煙が見られない。
発煙性試験:180℃に加熱されたホットプレートにアルミニウム箔の皿に試料0.1gを取り、試料をトールビーカーで覆い機密性を保ち、30秒後の内部の発煙状態を観察した。発煙が多く見られるものを×、やや発煙が見られるものを△、発煙が見られないものを○とした。
本発明の新規高沸点化合物は、ポリマー、粘接着剤の原料、可塑剤、溶剤、インク組成物のビヒクル成分や電気絶縁油、感圧複写材料の染料溶解材料、ウレタン樹脂用希釈剤、熱媒体、ペースト用溶剤等などに使用することが出来る。
Claims (4)
- α−テルピネン、アロオシメン、ミルセン、オシメン、α−ファルネセン、β−ファルネセン、α−フェランドレンの中から選ばれる少なくとも1種の化合物と末端に水酸基を有する(メタ)アクリレート系化合物をディールス−アルダー反応して得られる化学構造式を有する高沸点化合物。
- α−テルピネン、アロオシメン、ミルセン、オシメン、α−ファルネセン、β−ファルネセン、α−フェランドレンの中から選ばれる少なくとも1種の化合物と末端に水酸基を有する(メタ)アクリレート系化合物をディールス−アルダー反応し、さらに水添して得られる化学構造式を有する高沸点化合物。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2004145682A JP2005298468A (ja) | 2004-04-13 | 2004-04-13 | 高沸点化合物 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2004145682A JP2005298468A (ja) | 2004-04-13 | 2004-04-13 | 高沸点化合物 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| JP2005298468A true JP2005298468A (ja) | 2005-10-27 |
Family
ID=35330444
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2004145682A Pending JP2005298468A (ja) | 2004-04-13 | 2004-04-13 | 高沸点化合物 |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP2005298468A (ja) |
Cited By (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2008540784A (ja) * | 2005-05-18 | 2008-11-20 | チバ ホールディング インコーポレーテッド | ディールス−アルダー保湿剤を含む顔料着色濃厚物 |
| WO2012158250A1 (en) * | 2011-05-13 | 2012-11-22 | Amyris, Inc. | Plasticizers |
| WO2013148842A1 (en) * | 2012-03-27 | 2013-10-03 | Stepan Company | Surfactants and solvents containing diels-alder adducts |
| CN103923525A (zh) * | 2014-04-30 | 2014-07-16 | 苏州安洁科技股份有限公司 | 丝网印刷用亮黑色油墨的制备方法 |
| KR20240053749A (ko) * | 2022-10-18 | 2024-04-25 | 경상국립대학교산학협력단 | 바이오 소재 기반의 액상 고무 중합체의 제조방법 및 이에 따라 제조된 액상 고무 중합체 |
-
2004
- 2004-04-13 JP JP2004145682A patent/JP2005298468A/ja active Pending
Cited By (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2008540784A (ja) * | 2005-05-18 | 2008-11-20 | チバ ホールディング インコーポレーテッド | ディールス−アルダー保湿剤を含む顔料着色濃厚物 |
| WO2012158250A1 (en) * | 2011-05-13 | 2012-11-22 | Amyris, Inc. | Plasticizers |
| WO2013148842A1 (en) * | 2012-03-27 | 2013-10-03 | Stepan Company | Surfactants and solvents containing diels-alder adducts |
| CN103923525A (zh) * | 2014-04-30 | 2014-07-16 | 苏州安洁科技股份有限公司 | 丝网印刷用亮黑色油墨的制备方法 |
| KR20240053749A (ko) * | 2022-10-18 | 2024-04-25 | 경상국립대학교산학협력단 | 바이오 소재 기반의 액상 고무 중합체의 제조방법 및 이에 따라 제조된 액상 고무 중합체 |
| KR102817613B1 (ko) | 2022-10-18 | 2025-06-10 | 경상국립대학교산학협력단 | 바이오 소재 기반의 액상 고무 중합체의 제조방법 및 이에 따라 제조된 액상 고무 중합체 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| Firdaus et al. | Renewable co-polymers derived from vanillin and fatty acid derivatives | |
| Fache et al. | New vanillin-derived diepoxy monomers for the synthesis of biobased thermosets | |
| Thomas et al. | Limonene | |
| Yang et al. | Novel renewable resource-based UV-curable copolymers derived from myrcene and tung oil: Preparation, characterization and properties | |
| US4841017A (en) | Polyether compounds, epoxy resins and processes for production thereof | |
| CN103443057A (zh) | 通过催化转移氢解来还原c-o键 | |
| Evans et al. | Pyrolysis–gas-chromatographic study of a series of polyester thermosets | |
| JP2005298468A (ja) | 高沸点化合物 | |
| JP2009149577A (ja) | シクロヘキシルアルカノール | |
| Higgins et al. | Evaluation of thermal and oxidative stability of three generations of phenolic based novel dendritic fuel and lubricant additives | |
| CN106866331A (zh) | 一种由糠醇制备环戊二烯或双环戊二烯的方法 | |
| US20170044282A1 (en) | Terpene and terpenoid derivatives containing vinyl groups for the preparation of polymers | |
| Alonso et al. | Conjugate reduction of α, β-unsaturated carbonyl compounds promoted by nickel nanoparticles | |
| CN102408500A (zh) | 一种新型含硅大分子光引发剂及其制备方法 | |
| Khan et al. | Synthesis and structure design of new bio-based elastomers via Thiol-ene-Click Reactions | |
| CA2520913A1 (en) | Reactive diluents in coating formulation | |
| JP5294259B2 (ja) | テルペン系アルコール化合物、テルペン系(メタ)アクリレート化合物、およびこれらの製造方法 | |
| Jena et al. | Ruthenium‐Catalyzed Addition of Carboxylic Acids to Propargylic Alcohols: An Easy Route to O‐Dienyl Esters and Their Tandem Atom‐Transfer Radical Polymerization | |
| JP4452037B2 (ja) | 新規な脂環式ビニルエーテル | |
| Shabtai et al. | Base-Catalyzed Reactions of α, β-Unsaturated Esters and Nitriles. I. Potassium-Catalyzed Dimerization of Ethyl Crotonate1a | |
| JP7708122B2 (ja) | ジエポキシ化合物、硬化性組成物、硬化物及び光学部材 | |
| CN112707883B (zh) | 一种ε-己内酯的制备方法 | |
| CN111233641A (zh) | 二甘醇单甲醚的制备方法 | |
| Venuto et al. | The Preparation of Allylic Alcohols from Citral a and Citral b. A Study of Their Dehydration Reactions1 | |
| JPH06104641B2 (ja) | α−(アルキルシクロヘキシルオキシ)−β−アルカノールの製造法 |