JP2005298344A - フェノール誘導体及びその製法 - Google Patents
フェノール誘導体及びその製法 Download PDFInfo
- Publication number
- JP2005298344A JP2005298344A JP2002112865A JP2002112865A JP2005298344A JP 2005298344 A JP2005298344 A JP 2005298344A JP 2002112865 A JP2002112865 A JP 2002112865A JP 2002112865 A JP2002112865 A JP 2002112865A JP 2005298344 A JP2005298344 A JP 2005298344A
- Authority
- JP
- Japan
- Prior art keywords
- group
- formula
- lower alkyl
- alkyl group
- hydroxyl group
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 0 Cc(cc(cc1N)OCC=*N2CCOCC2)c1O* Chemical compound Cc(cc(cc1N)OCC=*N2CCOCC2)c1O* 0.000 description 1
Classifications
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02P—CLIMATE CHANGE MITIGATION TECHNOLOGIES IN THE PRODUCTION OR PROCESSING OF GOODS
- Y02P20/00—Technologies relating to chemical industry
- Y02P20/50—Improvements relating to the production of bulk chemicals
- Y02P20/55—Design of synthesis routes, e.g. reducing the use of auxiliary or protecting groups
Landscapes
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Abstract
Description
【0001】
【発明の属する技術分野】
本発明は、優れた抗酸化作用を有する新規フェノール誘導体に関する。
【0002】
【従来の技術】
虚血性疾患の発症における細胞膜傷害(細胞死を含む)の発生機序は必ずしも解明されているわけではないが、かかる細胞傷害過程においては、活性酸素の産生亢進が重要な役割を担っているものと考えられている。また、活性酸素は脂質の過酸化のみならず、酵素や蛋白質の変性、及び核酸の傷害等を引き起こし、これらが種々の臓器障害の原因となることも知られている。例えば、冠動脈閉塞による心筋梗塞発作を発症した場合、これが心原性ショックや致死性不整脈等の重篤な症状を惹起しやすいため、初期治療として、梗塞部位の血流再開を目的とした再灌流療法(血栓溶解療法、経皮的冠形成術(PTCA)、冠動脈バイパス手術(CABG)等)がしばしば施行される。しかしながら、この場合、血行再開によって心筋組織障害が悪化すること(虚血/再灌流障害)も少なくない。この虚血/再灌流障害の発症機序の一つとして、活性酸素の関与が報告されており、再灌流時に発生した酸素ラジカルが再灌流不整脈を惹起し、ATP産生障害に伴う細胞障害や酵素蛋白活性増加に伴う細胞膜破壊によって心筋障害をきたすと考えられている。
【0003】
一方、ラジカル消去作用や抗酸化作用を有する化合物としては、例えば、特開平10−195037に、2−[4−(4−アミノフェニル)ピペラジン−1−イル]アミド−4−メトキシ−6−tert−ブチルフェノール等のフェノール誘導体が開示されている。しかしながら、虚血性疾患の薬物治療に際しては、特に、注射剤として有効かつ安全に投与できる薬剤が望まれるが、前記既知フェノール誘導体は、溶解度その他の面で、注射剤として好適な特性を具備するものとはいい難い。このため、優れた抗酸化作用のみならず、注射用薬としても好適な特性を具有する薬物を見出す必要があった。
【0004】
【発明が解決しようとする課題】
本発明は、優れた抗酸化作用を有するとともに、注射剤としても好適な特性を具備し、心筋梗塞や虚血/再灌流時の細胞傷害及び不整脈等の予防・治療に有用な新規フェノール誘導体を提供するものである。また、本発明は、このような新規フェノール誘導体の製法をも提供するものである。
【0005】
【課題を解決するための手段】
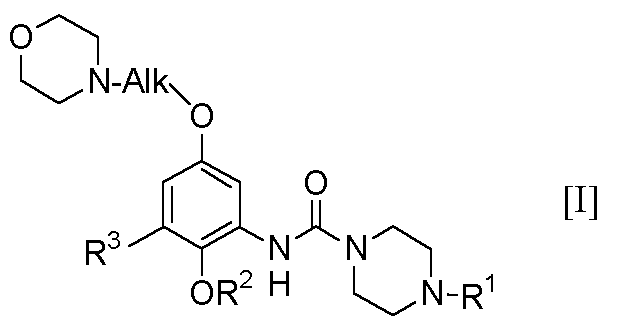
本発明は、一般式[I]:
【0006】
【化5】
【0007】
(式中、R1は低級アルキル基、OR2は保護されていてもよい水酸基、R3 は低級アルキル基、Alkは低級アルキレン基を表す。)
で示されるフェノール誘導体またはその薬理的に許容し得る塩に関する。
【0008】
【発明の実施の形態】
本発明のフェノール誘導体[I]としては、R1 がメチル基、エチル基の如き炭素数1〜6個の低級アルキル基、OR2 が水酸基またはメトキシメチル基等の如き炭素数1〜6個の低級アルコキシ低級アルキル基で保護された水酸基、R3 がメチル基、エチル基、tert-ブチル基の如き炭素数1〜6個の直鎖または分枝鎖の低級アルキル基、Alkがメチレン基、エチレン基の如き炭素数1〜6個の低級アルキレン基である化合物があげられる。
【0009】
本発明のフェノール誘導体[I]のうち、好ましい化合物としては、R1 がメチル基、OR2 が水酸基またはメトキシメトキシ基、R3 がtert−ブチル基、Alkがメチレン基またはエチレン基である化合物があげられる。このうち、とりわけ好ましい化合物としては、R1 がメチル基、OR2 が水酸基、R3 がtert−ブチル基、Alkがエチレン基である化合物があげられる。
【0010】
本発明のフェノール誘導体[I]は、遊離の形でも、また薬理的に許容し得る塩の形のいずれでも医薬用途に用いることができる。かかる薬理的に許容し得る塩としては、例えば塩酸塩、硫酸塩、臭化水素酸塩等の如き無機酸塩、酢酸塩、フマル酸塩、シュウ酸塩、マレイン酸塩、メタンスルホン酸塩の如き有機酸塩等が挙げられる。また、本発明のフェノール誘導体[I]またはその薬理的に許容し得る塩には、その水和物もしくは溶媒和物をも含む。
【0011】
本発明のフェノール誘導体[I]又はその薬理的に許容し得る塩は、優れた脂質過酸化抑制作用、酸化LDL生成抑制作用、イン・ビボ(マウス)抗酸化作用、スーパーオキシドアニオン消去作用、ヒドロキシラジカル消去作用等を有し、虚血性疾患(心筋梗塞、脳梗塞、虚血再灌流時の細胞傷害、不整脈等)、動脈硬化、炎症等の各種疾患の予防・治療薬として有用である。
【0012】
本発明のフェノール誘導体[I]またはその薬理的に許容し得る塩は、経口的にも非経口的にも投与することができるが、とりわけ注射剤として非経口的(例えば、静脈内)に投与するのが好ましい。特に、本発明の化合物であるN−[3−(tert−ブチル)−2−ヒドロキシー5−(2−モルホリン−4−イルエトキシ)フェニル](4−メチルピペラジニル)カルボキサミド・2塩酸塩・1/5エタノールは、水に対する溶解度が高く(>100mg/mL,pH7.4)、また、局所刺激性(細胞毒性)も低いため、注射剤等の形態での非経口投与に好適な化合物である。
【0013】
更に、本発明のフェノール誘導体[I]またはその薬理的に許容し得る塩は、薬物代謝酵素に対する非特異的阻害活性が低いため、薬物動態面でも好ましい特性を有する。
本発明のフェノール誘導体[I]またはその薬理的に許容し得る塩の投与量は、投与方法、患者の年齢、体重、状態等によっても異なるが、経口的に投与する場合、通常、1日当たり0.1〜1000mg/kg、とりわけ1〜100mg/kgとするのが好ましく、非経口的に(例えば注射剤として)投与する場合、通常、1日当たり0.01〜100mg/kg、とりわけ0.1〜10mg/kgとするのが好ましい。
【0014】
本発明のフェノール誘導体[I]は、例えば、式[II]:
【0015】
【化6】
【0016】
(式中、R21 は低級アルキル基、OR2 は保護されていてもよい水酸基、Alkは低級アルキレン基を表す。)
で示されるアニリン化合物またはその塩とホスゲン等価体とを反応させ、次いで、当該反応生成物と式[III]:
【0017】
【化7】
【0018】
(式中、R1 は低級アルキル基を表す。)
で示されるピペラジン化合物またはその塩とを反応させた後、OR2 が保護された水酸基である場合には、所望により生成物から当該水酸基の保護基を除去することにより製することができる。
【0019】
上記アニリン化合物[II]またはピペラジン化合物[III]の塩としては、例えば、塩酸塩、硫酸塩等の無機酸との塩、ナトリウム塩等のアルカリ金属塩またはカルシウム塩等のアルカリ土類金属塩の如き無機塩基との塩が挙げられる。
【0020】
アニリン化合物[II]又はその塩とホスゲン等価体(例えば、ホスゲン、トリホスゲン等)との反応、当該反応生成物とピペラジン化合物[III]又はその塩との反応は、塩基の存在下、適当な溶媒中、または無溶媒で実施することができる。塩基としては、トリエチルアミン、ピリジン、ジメチルアミノピリジン、1,8−ジアザビシクロ[5,4,0]−7−ウンデセン、ジイソプロピルエチルアミン等があげられる。溶媒としては、例えば、ジクロロメタン、ジメチルスルホキシド、クロロホルム、ジエチルエーテル、テトラヒドロフラン、トルエン、ベンゼン、ジオキサン、ジメチルホルムアミド、エチレングリコールジメチルエーテル、1,2−ジクロロエタン等が挙げられる。
本反応は、−78℃〜100℃で実施することができ、とりわけ−78℃〜30℃で好適に進行する。
【0021】
上記方法において、OR2 が保護された水酸基である場合、当該保護基の除去は、保護基の種類に応じて、公知の方法(加水分解、酸処理、還元等)によって実施することができる。
【0022】
本発明にかかる原料化合物のうち、アニリン化合物[II]は、例えば下記反応スキームに従い、一般式[IV]で示されるフェノール化合物とp−アニシジンとを反応(ジアゾカップリング)させ、生成物を還元することにより製することができる。
【0023】
【化8】
【0024】
(式中、記号は前記と同一意味を有する。)
なお、本発明において、低級アルキル基としては、例えばメチル基、エチル基、n−プロピル基、tert−ブチル基の如き炭素数1〜6個の直鎖または分枝鎖アルキル基があげられ、低級アルコキシ基としては、メトキシ基、エトキシ基、プピルオキシ基等の如き炭素数1〜6個のアルコキシ基があげられる。低級アルキレン基としては、例えばメチレン基、エチレン基等の如き炭素数1〜6個のアルキレン基があげられる。
【0025】
以下、本発明の目的化合物[I]の具体例を示すが、これにより本発明が限定されるものではない。
【0026】
【実施例】
実施例
(1)2−tert−ブチルヒドロキノン(96.1g)のアセトン(1L)溶液に4−(2−クロロエチル)モルホリン塩酸塩(112g)、炭酸カリウム(207g)を加え、55〜65℃で3日間攪拌する。不溶物を濾去し、濾液を濃縮後、残渣を塩酸に溶解し、酢酸エチルで洗浄する。水層に炭酸カリウムを注意深く加えて中和後、酢酸エチルで抽出し、有機層を硫酸マグネシウムで乾燥後、溶媒を留去する。これをシリカゲルカラムクロマトグラフィー(クロロホルム:酢酸エチル=1:1→1:2)にて精製し、2−(tert−ブチル)−4−(2−モルホリンー4−イルエトキシ)フェノール(橙色油状物、89.6g、収率53%)を得る。
IR(film): 3370、2956、1210 cm-1
MS(APCI): 280 (M+1)
(2) p−アニシジン(49.3g)の塩酸(2N,500ml)水溶液に5〜10℃で亜硝酸ナトリウム(30g)の水溶液(70ml)を滴下し、1時間攪拌する。この溶液を、前記(1)で得られた化合物(89.5g)の2N水酸化ナトリウム水溶液/1,4−ジオキサン混液の溶液に激しく撹拌しながら0℃で徐々に加え、その後2時間攪拌する。反応液から1,4−ジオキサンを留去し、残渣に塩酸を徐々に加えて中和した後、酢酸エチルで3回抽出する。有機層を合わせて硫酸マグネシウムで乾燥後、溶媒を留去する。残渣をシリカゲルカラムクロマトグラフィー(ヘキサン:酢酸エチル=1:1→1:2)にて精製することにより、2−(tert−ブチル)−6−[(4−メトキシフェニル)ジアゼニル]−4−(2−モルホリンー4−イルエトキシ)フェノール(暗橙色カラメル、90.9g、収率69%)を得る。
IR(film): 3437、2958、1602、1253 cm-1
MS(APCI): 414 (M+1)
(3) 前記(2)で得られた化合物(90.0g)のジメチルホルムアミド(250ml)溶液に氷冷下で水素化ナトリウム(9.6g)を注意深く加え、30分攪拌する。該溶液にクロロメチルメチルエーテル(19.3g)のジメチルホルムアミド(50ml)溶液を徐々に加え、該混合物を2時間攪拌する。反応液に水を加えてクエンチした後、濃縮し、残渣にジエチルエーテルを加えて水洗する。有機層を硫酸マグネシウムで乾燥後、溶媒を留去する。残渣をシリカゲルカラムクロマトグラフィー(ヘキサン:酢酸エチル=2:1→1:1→2:3)にて精製後、冷メタノールを加えて固化する。固形物を少量の冷メタノールで洗浄後、乾燥することにより、 [3−(tert−ブチル)−2−(メトキシメトキシ)−5−(2−モルホリン−4−イルエトキシ)フェニル](4−メトキシフェニル)ジアゼン(黄色粉末、63.4g、収率64%)を得る。
m.p.92−93 ℃
IR(film): 3437、2953、1599 cm-1
MS(APCI): 458 (M+1)
(4)前記(3)で得られた化合物(60.5g)にメタノール(250ml)を加え、窒素気流下で10%パラジウム炭素を加える。該混合物をParr接触還元装置を用いて、水素(5気圧)充填下で1日振とうする。反応液中の不溶物をセライトを用いて濾去し、濾液から溶媒を留去する。残渣をシリカゲルカラムクロマトグラフィー(クロロホルム:酢酸エチル=4:1→クロロホルム:アセトン=5:1→2:1→1:1)で精製することにより、3−(tert−ブチル)−2−(メトキシメトキシ)−5−(2−モルホリン−4−イルエトキシ)フェニルアミン(橙色油状物、36.9g、収率82.6%)を得る。
IR(film): 3460、3370、2957、1595、1445、976 cm-1
MS(APCI): 339 (M+1)
(5)トリホスゲン(17.8g)の塩化メチレン(300ml)溶液に−78℃、窒素置換下で 前記(4)で得られた化合物(27.1g)とトリエチルアミン(42ml)の塩化メチレン(100ml)溶液を3時間かけて滴下する。−78℃下で1時間攪拌後、反応液の温度を攪拌下徐々に室温まで昇温した後、濃縮する。残渣にトルエンを加えて濃縮する。残渣に塩化メチレン(300ml)を加え、0℃下で1−メチルピペラジン(15g)の塩化メチレン(100ml)溶液を20分かけて滴下し、該混合物を室温で2時間攪拌する。反応液に塩化メチレンを加え、炭酸カリウム水溶液で洗浄後、硫酸マグネシウムで乾燥し溶媒を留去する。残渣をNH−シリカゲルカラムクロマトグラフィー(ヘキサン:酢酸エチル=5:1→3:1→1:1→酢酸エチル:アセトン=1:1→4:1)、シリカゲルカラムクロマト(アセトン:メタノール=1:0→10:1→5:1→2:1→1:1→0:1)で精製することにより、N−[3−(tert−ブチル)−2−(メトキシメトキシ)−5−(2−モルホリンー4−イルエトキシ)フェニル](4−メチルピペラジニル)カルボキサミド(淡黄色カラメル、30.3g、収率82%)を得る。
IR(film): 3392、2954、1668、1537、1436、1230、1058 cm-1)
MS(APCI): 465 (M+1)
(6)前記(5)で得られた化合物(29.9g)のメタノール(150ml)溶液に0℃下で4N塩酸/酢酸エチル(150ml)をゆっくり滴下し、さらに1時間攪拌した後に反応液を濃縮する。残渣に熱エタノール(300ml)を加えて溶解し、0℃まで徐々に冷却して結晶を析出させる。結晶を濾取し、冷エタノールで洗浄後、乾燥することにより、N−[3−(tert−ブチル)−2−ヒドロキシー5−(2−モルホリン−4−イルエトキシ)フェニル](4−メチルピペラジニル)カルボキサミド・2塩酸塩・1/5エタノール(無色結晶、30.5g、収率94%)を得る。
m.p.147−150 ℃
IR(film): 3402、2957、2690、1632、1447、1272 cm-1
MS(APCI): 421 (M+1)
【発明の属する技術分野】
本発明は、優れた抗酸化作用を有する新規フェノール誘導体に関する。
【0002】
【従来の技術】
虚血性疾患の発症における細胞膜傷害(細胞死を含む)の発生機序は必ずしも解明されているわけではないが、かかる細胞傷害過程においては、活性酸素の産生亢進が重要な役割を担っているものと考えられている。また、活性酸素は脂質の過酸化のみならず、酵素や蛋白質の変性、及び核酸の傷害等を引き起こし、これらが種々の臓器障害の原因となることも知られている。例えば、冠動脈閉塞による心筋梗塞発作を発症した場合、これが心原性ショックや致死性不整脈等の重篤な症状を惹起しやすいため、初期治療として、梗塞部位の血流再開を目的とした再灌流療法(血栓溶解療法、経皮的冠形成術(PTCA)、冠動脈バイパス手術(CABG)等)がしばしば施行される。しかしながら、この場合、血行再開によって心筋組織障害が悪化すること(虚血/再灌流障害)も少なくない。この虚血/再灌流障害の発症機序の一つとして、活性酸素の関与が報告されており、再灌流時に発生した酸素ラジカルが再灌流不整脈を惹起し、ATP産生障害に伴う細胞障害や酵素蛋白活性増加に伴う細胞膜破壊によって心筋障害をきたすと考えられている。
【0003】
一方、ラジカル消去作用や抗酸化作用を有する化合物としては、例えば、特開平10−195037に、2−[4−(4−アミノフェニル)ピペラジン−1−イル]アミド−4−メトキシ−6−tert−ブチルフェノール等のフェノール誘導体が開示されている。しかしながら、虚血性疾患の薬物治療に際しては、特に、注射剤として有効かつ安全に投与できる薬剤が望まれるが、前記既知フェノール誘導体は、溶解度その他の面で、注射剤として好適な特性を具備するものとはいい難い。このため、優れた抗酸化作用のみならず、注射用薬としても好適な特性を具有する薬物を見出す必要があった。
【0004】
【発明が解決しようとする課題】
本発明は、優れた抗酸化作用を有するとともに、注射剤としても好適な特性を具備し、心筋梗塞や虚血/再灌流時の細胞傷害及び不整脈等の予防・治療に有用な新規フェノール誘導体を提供するものである。また、本発明は、このような新規フェノール誘導体の製法をも提供するものである。
【0005】
【課題を解決するための手段】
本発明は、一般式[I]:
【0006】
【化5】
【0007】
(式中、R1は低級アルキル基、OR2は保護されていてもよい水酸基、R3 は低級アルキル基、Alkは低級アルキレン基を表す。)
で示されるフェノール誘導体またはその薬理的に許容し得る塩に関する。
【0008】
【発明の実施の形態】
本発明のフェノール誘導体[I]としては、R1 がメチル基、エチル基の如き炭素数1〜6個の低級アルキル基、OR2 が水酸基またはメトキシメチル基等の如き炭素数1〜6個の低級アルコキシ低級アルキル基で保護された水酸基、R3 がメチル基、エチル基、tert-ブチル基の如き炭素数1〜6個の直鎖または分枝鎖の低級アルキル基、Alkがメチレン基、エチレン基の如き炭素数1〜6個の低級アルキレン基である化合物があげられる。
【0009】
本発明のフェノール誘導体[I]のうち、好ましい化合物としては、R1 がメチル基、OR2 が水酸基またはメトキシメトキシ基、R3 がtert−ブチル基、Alkがメチレン基またはエチレン基である化合物があげられる。このうち、とりわけ好ましい化合物としては、R1 がメチル基、OR2 が水酸基、R3 がtert−ブチル基、Alkがエチレン基である化合物があげられる。
【0010】
本発明のフェノール誘導体[I]は、遊離の形でも、また薬理的に許容し得る塩の形のいずれでも医薬用途に用いることができる。かかる薬理的に許容し得る塩としては、例えば塩酸塩、硫酸塩、臭化水素酸塩等の如き無機酸塩、酢酸塩、フマル酸塩、シュウ酸塩、マレイン酸塩、メタンスルホン酸塩の如き有機酸塩等が挙げられる。また、本発明のフェノール誘導体[I]またはその薬理的に許容し得る塩には、その水和物もしくは溶媒和物をも含む。
【0011】
本発明のフェノール誘導体[I]又はその薬理的に許容し得る塩は、優れた脂質過酸化抑制作用、酸化LDL生成抑制作用、イン・ビボ(マウス)抗酸化作用、スーパーオキシドアニオン消去作用、ヒドロキシラジカル消去作用等を有し、虚血性疾患(心筋梗塞、脳梗塞、虚血再灌流時の細胞傷害、不整脈等)、動脈硬化、炎症等の各種疾患の予防・治療薬として有用である。
【0012】
本発明のフェノール誘導体[I]またはその薬理的に許容し得る塩は、経口的にも非経口的にも投与することができるが、とりわけ注射剤として非経口的(例えば、静脈内)に投与するのが好ましい。特に、本発明の化合物であるN−[3−(tert−ブチル)−2−ヒドロキシー5−(2−モルホリン−4−イルエトキシ)フェニル](4−メチルピペラジニル)カルボキサミド・2塩酸塩・1/5エタノールは、水に対する溶解度が高く(>100mg/mL,pH7.4)、また、局所刺激性(細胞毒性)も低いため、注射剤等の形態での非経口投与に好適な化合物である。
【0013】
更に、本発明のフェノール誘導体[I]またはその薬理的に許容し得る塩は、薬物代謝酵素に対する非特異的阻害活性が低いため、薬物動態面でも好ましい特性を有する。
本発明のフェノール誘導体[I]またはその薬理的に許容し得る塩の投与量は、投与方法、患者の年齢、体重、状態等によっても異なるが、経口的に投与する場合、通常、1日当たり0.1〜1000mg/kg、とりわけ1〜100mg/kgとするのが好ましく、非経口的に(例えば注射剤として)投与する場合、通常、1日当たり0.01〜100mg/kg、とりわけ0.1〜10mg/kgとするのが好ましい。
【0014】
本発明のフェノール誘導体[I]は、例えば、式[II]:
【0015】
【化6】
【0016】
(式中、R21 は低級アルキル基、OR2 は保護されていてもよい水酸基、Alkは低級アルキレン基を表す。)
で示されるアニリン化合物またはその塩とホスゲン等価体とを反応させ、次いで、当該反応生成物と式[III]:
【0017】
【化7】
【0018】
(式中、R1 は低級アルキル基を表す。)
で示されるピペラジン化合物またはその塩とを反応させた後、OR2 が保護された水酸基である場合には、所望により生成物から当該水酸基の保護基を除去することにより製することができる。
【0019】
上記アニリン化合物[II]またはピペラジン化合物[III]の塩としては、例えば、塩酸塩、硫酸塩等の無機酸との塩、ナトリウム塩等のアルカリ金属塩またはカルシウム塩等のアルカリ土類金属塩の如き無機塩基との塩が挙げられる。
【0020】
アニリン化合物[II]又はその塩とホスゲン等価体(例えば、ホスゲン、トリホスゲン等)との反応、当該反応生成物とピペラジン化合物[III]又はその塩との反応は、塩基の存在下、適当な溶媒中、または無溶媒で実施することができる。塩基としては、トリエチルアミン、ピリジン、ジメチルアミノピリジン、1,8−ジアザビシクロ[5,4,0]−7−ウンデセン、ジイソプロピルエチルアミン等があげられる。溶媒としては、例えば、ジクロロメタン、ジメチルスルホキシド、クロロホルム、ジエチルエーテル、テトラヒドロフラン、トルエン、ベンゼン、ジオキサン、ジメチルホルムアミド、エチレングリコールジメチルエーテル、1,2−ジクロロエタン等が挙げられる。
本反応は、−78℃〜100℃で実施することができ、とりわけ−78℃〜30℃で好適に進行する。
【0021】
上記方法において、OR2 が保護された水酸基である場合、当該保護基の除去は、保護基の種類に応じて、公知の方法(加水分解、酸処理、還元等)によって実施することができる。
【0022】
本発明にかかる原料化合物のうち、アニリン化合物[II]は、例えば下記反応スキームに従い、一般式[IV]で示されるフェノール化合物とp−アニシジンとを反応(ジアゾカップリング)させ、生成物を還元することにより製することができる。
【0023】
【化8】
【0024】
(式中、記号は前記と同一意味を有する。)
なお、本発明において、低級アルキル基としては、例えばメチル基、エチル基、n−プロピル基、tert−ブチル基の如き炭素数1〜6個の直鎖または分枝鎖アルキル基があげられ、低級アルコキシ基としては、メトキシ基、エトキシ基、プピルオキシ基等の如き炭素数1〜6個のアルコキシ基があげられる。低級アルキレン基としては、例えばメチレン基、エチレン基等の如き炭素数1〜6個のアルキレン基があげられる。
【0025】
以下、本発明の目的化合物[I]の具体例を示すが、これにより本発明が限定されるものではない。
【0026】
【実施例】
実施例
(1)2−tert−ブチルヒドロキノン(96.1g)のアセトン(1L)溶液に4−(2−クロロエチル)モルホリン塩酸塩(112g)、炭酸カリウム(207g)を加え、55〜65℃で3日間攪拌する。不溶物を濾去し、濾液を濃縮後、残渣を塩酸に溶解し、酢酸エチルで洗浄する。水層に炭酸カリウムを注意深く加えて中和後、酢酸エチルで抽出し、有機層を硫酸マグネシウムで乾燥後、溶媒を留去する。これをシリカゲルカラムクロマトグラフィー(クロロホルム:酢酸エチル=1:1→1:2)にて精製し、2−(tert−ブチル)−4−(2−モルホリンー4−イルエトキシ)フェノール(橙色油状物、89.6g、収率53%)を得る。
IR(film): 3370、2956、1210 cm-1
MS(APCI): 280 (M+1)
(2) p−アニシジン(49.3g)の塩酸(2N,500ml)水溶液に5〜10℃で亜硝酸ナトリウム(30g)の水溶液(70ml)を滴下し、1時間攪拌する。この溶液を、前記(1)で得られた化合物(89.5g)の2N水酸化ナトリウム水溶液/1,4−ジオキサン混液の溶液に激しく撹拌しながら0℃で徐々に加え、その後2時間攪拌する。反応液から1,4−ジオキサンを留去し、残渣に塩酸を徐々に加えて中和した後、酢酸エチルで3回抽出する。有機層を合わせて硫酸マグネシウムで乾燥後、溶媒を留去する。残渣をシリカゲルカラムクロマトグラフィー(ヘキサン:酢酸エチル=1:1→1:2)にて精製することにより、2−(tert−ブチル)−6−[(4−メトキシフェニル)ジアゼニル]−4−(2−モルホリンー4−イルエトキシ)フェノール(暗橙色カラメル、90.9g、収率69%)を得る。
IR(film): 3437、2958、1602、1253 cm-1
MS(APCI): 414 (M+1)
(3) 前記(2)で得られた化合物(90.0g)のジメチルホルムアミド(250ml)溶液に氷冷下で水素化ナトリウム(9.6g)を注意深く加え、30分攪拌する。該溶液にクロロメチルメチルエーテル(19.3g)のジメチルホルムアミド(50ml)溶液を徐々に加え、該混合物を2時間攪拌する。反応液に水を加えてクエンチした後、濃縮し、残渣にジエチルエーテルを加えて水洗する。有機層を硫酸マグネシウムで乾燥後、溶媒を留去する。残渣をシリカゲルカラムクロマトグラフィー(ヘキサン:酢酸エチル=2:1→1:1→2:3)にて精製後、冷メタノールを加えて固化する。固形物を少量の冷メタノールで洗浄後、乾燥することにより、 [3−(tert−ブチル)−2−(メトキシメトキシ)−5−(2−モルホリン−4−イルエトキシ)フェニル](4−メトキシフェニル)ジアゼン(黄色粉末、63.4g、収率64%)を得る。
m.p.92−93 ℃
IR(film): 3437、2953、1599 cm-1
MS(APCI): 458 (M+1)
(4)前記(3)で得られた化合物(60.5g)にメタノール(250ml)を加え、窒素気流下で10%パラジウム炭素を加える。該混合物をParr接触還元装置を用いて、水素(5気圧)充填下で1日振とうする。反応液中の不溶物をセライトを用いて濾去し、濾液から溶媒を留去する。残渣をシリカゲルカラムクロマトグラフィー(クロロホルム:酢酸エチル=4:1→クロロホルム:アセトン=5:1→2:1→1:1)で精製することにより、3−(tert−ブチル)−2−(メトキシメトキシ)−5−(2−モルホリン−4−イルエトキシ)フェニルアミン(橙色油状物、36.9g、収率82.6%)を得る。
IR(film): 3460、3370、2957、1595、1445、976 cm-1
MS(APCI): 339 (M+1)
(5)トリホスゲン(17.8g)の塩化メチレン(300ml)溶液に−78℃、窒素置換下で 前記(4)で得られた化合物(27.1g)とトリエチルアミン(42ml)の塩化メチレン(100ml)溶液を3時間かけて滴下する。−78℃下で1時間攪拌後、反応液の温度を攪拌下徐々に室温まで昇温した後、濃縮する。残渣にトルエンを加えて濃縮する。残渣に塩化メチレン(300ml)を加え、0℃下で1−メチルピペラジン(15g)の塩化メチレン(100ml)溶液を20分かけて滴下し、該混合物を室温で2時間攪拌する。反応液に塩化メチレンを加え、炭酸カリウム水溶液で洗浄後、硫酸マグネシウムで乾燥し溶媒を留去する。残渣をNH−シリカゲルカラムクロマトグラフィー(ヘキサン:酢酸エチル=5:1→3:1→1:1→酢酸エチル:アセトン=1:1→4:1)、シリカゲルカラムクロマト(アセトン:メタノール=1:0→10:1→5:1→2:1→1:1→0:1)で精製することにより、N−[3−(tert−ブチル)−2−(メトキシメトキシ)−5−(2−モルホリンー4−イルエトキシ)フェニル](4−メチルピペラジニル)カルボキサミド(淡黄色カラメル、30.3g、収率82%)を得る。
IR(film): 3392、2954、1668、1537、1436、1230、1058 cm-1)
MS(APCI): 465 (M+1)
(6)前記(5)で得られた化合物(29.9g)のメタノール(150ml)溶液に0℃下で4N塩酸/酢酸エチル(150ml)をゆっくり滴下し、さらに1時間攪拌した後に反応液を濃縮する。残渣に熱エタノール(300ml)を加えて溶解し、0℃まで徐々に冷却して結晶を析出させる。結晶を濾取し、冷エタノールで洗浄後、乾燥することにより、N−[3−(tert−ブチル)−2−ヒドロキシー5−(2−モルホリン−4−イルエトキシ)フェニル](4−メチルピペラジニル)カルボキサミド・2塩酸塩・1/5エタノール(無色結晶、30.5g、収率94%)を得る。
m.p.147−150 ℃
IR(film): 3402、2957、2690、1632、1447、1272 cm-1
MS(APCI): 421 (M+1)
Claims (5)
- R1がメチル基、OR2が水酸基、R3がtert−ブチル基、Alkがメチレン基又はエチレン基である請求項1記載の化合物。
- OR2が水酸基、Alkがエチレン基である請求項2記載の化合物。
- N−[3−(tert−ブチル)−2−ヒドロキシー5−(2−モルホリン−4−イルエトキシ)フェニル](4−メチルピペラジニル)カルボキサミドまたはその薬理的的に許容し得る塩。
Priority Applications (4)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2002112865A JP2005298344A (ja) | 2002-04-16 | 2002-04-16 | フェノール誘導体及びその製法 |
| TW092108617A TW200307551A (en) | 2002-04-16 | 2003-04-15 | Phenol compound, process for preparing the same and synthetic intermediate thereof |
| AU2003235169A AU2003235169A1 (en) | 2002-04-16 | 2003-04-16 | Phenol compound, process for producing the same, and intermediate therefor |
| PCT/JP2003/004798 WO2003087074A1 (en) | 2002-04-16 | 2003-04-16 | Phenol compound, process for producing the same, and intermediate therefor |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2002112865A JP2005298344A (ja) | 2002-04-16 | 2002-04-16 | フェノール誘導体及びその製法 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| JP2005298344A true JP2005298344A (ja) | 2005-10-27 |
Family
ID=35330328
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2002112865A Pending JP2005298344A (ja) | 2002-04-16 | 2002-04-16 | フェノール誘導体及びその製法 |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP2005298344A (ja) |
-
2002
- 2002-04-16 JP JP2002112865A patent/JP2005298344A/ja active Pending
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR100345942B1 (ko) | 1-페닐피라졸 화합물 또는 그 광학 이성질체 및 이를 유효 성분으로 함유하는 과요산혈증 및 통풍 치료용 약학 조성물 | |
| EP2639229B9 (en) | Thiazole Derivative and use thereof as VAP-1 Inhibitor | |
| JPH0912560A (ja) | 改良された抗ウイルス化合物 | |
| JPH01502661A (ja) | チモロール誘導体 | |
| JPWO1998018765A1 (ja) | 1−フェニルピラゾール化合物およびその医薬用途 | |
| JPH10510536A (ja) | 2−置換された1,2,5−チアジアゾリジン−3−オン1,1−ジオキシド及びそれらの組成物 | |
| WO2008071421A1 (en) | Nitrate esters of carbonic anhydrase inhibitors | |
| HUE031506T2 (en) | Aldose reductase inhibitors and their use | |
| IE920046A1 (en) | N-hydroxyurea derivatives as antiallergy and¹antiinflammatory agents | |
| JP2007527904A (ja) | グリコーゲンホスホリラーゼ阻害剤としてのピロロピリジン−2−カルボン酸ヒドラジド化合物 | |
| US12215090B2 (en) | Agents and methods for treating dysproliferative diseases | |
| JP2002538117A (ja) | 肥満の予防または治療のための医薬の製造のための多環2−アミノチアゾール系の使用 | |
| KR910009980B1 (ko) | 구아니디노벤조 에스테르유도체 및 그의 제조방법 | |
| JP2005232179A (ja) | 3−フェニルスルホニル−3,7−ジアザビシクロ[3,3,1]ノナン−化合物を含有する抗不整脈剤 | |
| PL193438B1 (pl) | Pochodna 5-podstawionego-1,2,4-tiadiazolilu, jej zastosowanie i sposób wytwarzania, kompozycja farmaceutyczna, karbotioaminowa pochodna piperazyny i sposób jej wytwarzania | |
| HUT65660A (en) | Process for preparing quinolyl-methoxy-phenyl-acetamide derivatives substituted with heterocycles and pharmaceutical compositions containing them | |
| JP2526084B2 (ja) | 新規なチアゾリジン誘導体 | |
| JP2005281309A (ja) | 新規な融合ピラゾリル化合物 | |
| JPH0327382A (ja) | ジヒドロイミダゾキノリノンオキシムスルホン酸誘導体 | |
| JP2005298344A (ja) | フェノール誘導体及びその製法 | |
| JPH09278737A (ja) | フェノール誘導体及びその製法 | |
| JP2005298345A (ja) | フェノール化合物及びその製法 | |
| SK62293A3 (en) | Substituted (benzothiazolyl and quinaxalyl-methoxy) phenyl-acetic acid derivatives | |
| CN111138422B (zh) | 一种用于防治红斑狼疮的药物及其制备方法 | |
| CN109280028B (zh) | 喹啉类化合物及其在dpp-4酶抑制剂的应用 |