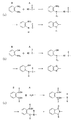JP2005290192A - 有機高分子膜形成用の前駆体溶液及び有機高分子膜の形成方法 - Google Patents
有機高分子膜形成用の前駆体溶液及び有機高分子膜の形成方法 Download PDFInfo
- Publication number
- JP2005290192A JP2005290192A JP2004106879A JP2004106879A JP2005290192A JP 2005290192 A JP2005290192 A JP 2005290192A JP 2004106879 A JP2004106879 A JP 2004106879A JP 2004106879 A JP2004106879 A JP 2004106879A JP 2005290192 A JP2005290192 A JP 2005290192A
- Authority
- JP
- Japan
- Prior art keywords
- monomer
- precursor solution
- polymer film
- derivative
- organic polymer
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Granted
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G83/00—Macromolecular compounds not provided for in groups C08G2/00 - C08G81/00
- C08G83/002—Dendritic macromolecules
- C08G83/003—Dendrimers
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G73/00—Macromolecular compounds obtained by reactions forming a linkage containing nitrogen with or without oxygen or carbon in the main chain of the macromolecule, not provided for in groups C08G12/00 - C08G71/00
- C08G73/06—Polycondensates having nitrogen-containing heterocyclic rings in the main chain of the macromolecule
- C08G73/10—Polyimides; Polyester-imides; Polyamide-imides; Polyamide acids or similar polyimide precursors
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G73/00—Macromolecular compounds obtained by reactions forming a linkage containing nitrogen with or without oxygen or carbon in the main chain of the macromolecule, not provided for in groups C08G12/00 - C08G71/00
- C08G73/06—Polycondensates having nitrogen-containing heterocyclic rings in the main chain of the macromolecule
- C08G73/10—Polyimides; Polyester-imides; Polyamide-imides; Polyamide acids or similar polyimide precursors
- C08G73/1003—Preparatory processes
- C08G73/1007—Preparatory processes from tetracarboxylic acids or derivatives and diamines
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08L—COMPOSITIONS OF MACROMOLECULAR COMPOUNDS
- C08L79/00—Compositions of macromolecular compounds obtained by reactions forming in the main chain of the macromolecule a linkage containing nitrogen with or without oxygen or carbon only, not provided for in groups C08L61/00 - C08L77/00
- C08L79/04—Polycondensates having nitrogen-containing heterocyclic rings in the main chain; Polyhydrazides; Polyamide acids or similar polyimide precursors
- C08L79/08—Polyimides; Polyester-imides; Polyamide-imides; Polyamide acids or similar polyimide precursors
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01B—CABLES; CONDUCTORS; INSULATORS; SELECTION OF MATERIALS FOR THEIR CONDUCTIVE, INSULATING OR DIELECTRIC PROPERTIES
- H01B3/00—Insulators or insulating bodies characterised by the insulating materials; Selection of materials for their insulating or dielectric properties
- H01B3/18—Insulators or insulating bodies characterised by the insulating materials; Selection of materials for their insulating or dielectric properties mainly consisting of organic substances
- H01B3/30—Insulators or insulating bodies characterised by the insulating materials; Selection of materials for their insulating or dielectric properties mainly consisting of organic substances plastics; resins; waxes
Landscapes
- Chemical & Material Sciences (AREA)
- Health & Medical Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Medicinal Chemistry (AREA)
- Polymers & Plastics (AREA)
- Organic Chemistry (AREA)
- Physics & Mathematics (AREA)
- Spectroscopy & Molecular Physics (AREA)
- Formation Of Insulating Films (AREA)
- Other Resins Obtained By Reactions Not Involving Carbon-To-Carbon Unsaturated Bonds (AREA)
- Organic Insulating Materials (AREA)
- Manufacture Of Macromolecular Shaped Articles (AREA)
Abstract
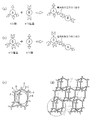
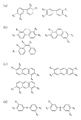
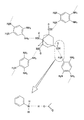
【解決手段】 本発明の有機高分子膜の前駆体溶液は、ルイス酸である第1のモノマーAと、第1のモノマーとルイス酸塩基反応するルイス塩基である第2のモノマーBと、極性基を有する犠牲有機分子Cとを含む。該前駆体溶液を用いて有機高分子膜を形成するには、基板上に塗布した前駆体溶液の内部において、第1のモノマーAと第2のモノマーBとに犠牲有機分子Cを内包する超分子構造を形成させる。次に、第1のモノマーAと第2のモノマーBとを共重合させた後に、犠牲有機分子Cを除去して空孔を形成する。
【選択図】 図1
Description
このようにすると、第1の有機高分子膜形成膜の形成方法と同様の効果に加え、前駆体溶液中に第1のモノマーと第2のモノマーとから形成され且つ犠牲有機分子を内包するオリゴマーを形成することによって、確実に超分子構造を形成することができる。この結果、均一且つ微細な空孔を有すると共に高架橋密度且つ低誘電率の有機高分子膜をより確実に形成できる。
B 第2のモノマー
C 犠牲有機分子
d 第1のモノマーと第2のモノマーとの電気的相互作用による結合部位
Claims (14)
- ルイス酸である第1のモノマーと、
前記第1のモノマーとルイス酸塩基反応を生じるルイス塩基である第2のモノマーと、
極性基を有する犠牲有機分子とを含むことを特徴とする有機高分子膜形成用の前駆体溶液。 - 前記第1のモノマー及び前記第2のモノマーのうち、いずれか一方が3次元架橋分子であると共に他方が2次元架橋分子であることを特徴とする請求項1に記載の前駆体溶液。
- 前記第1のモノマーと前記第2のモノマーとは、前記犠牲有機分子を内包するモノマー付加体をルイス酸塩基相互作用によって形成することを特徴とする請求項1又は2に記載の前駆体溶液。
- 前記モノマー付加体は、ダイヤモンド構造を取ると共に、該ダイヤモンド構造の空孔に前記犠牲有機分子を内包することを特徴とする請求項3に記載の前駆体溶液。
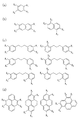
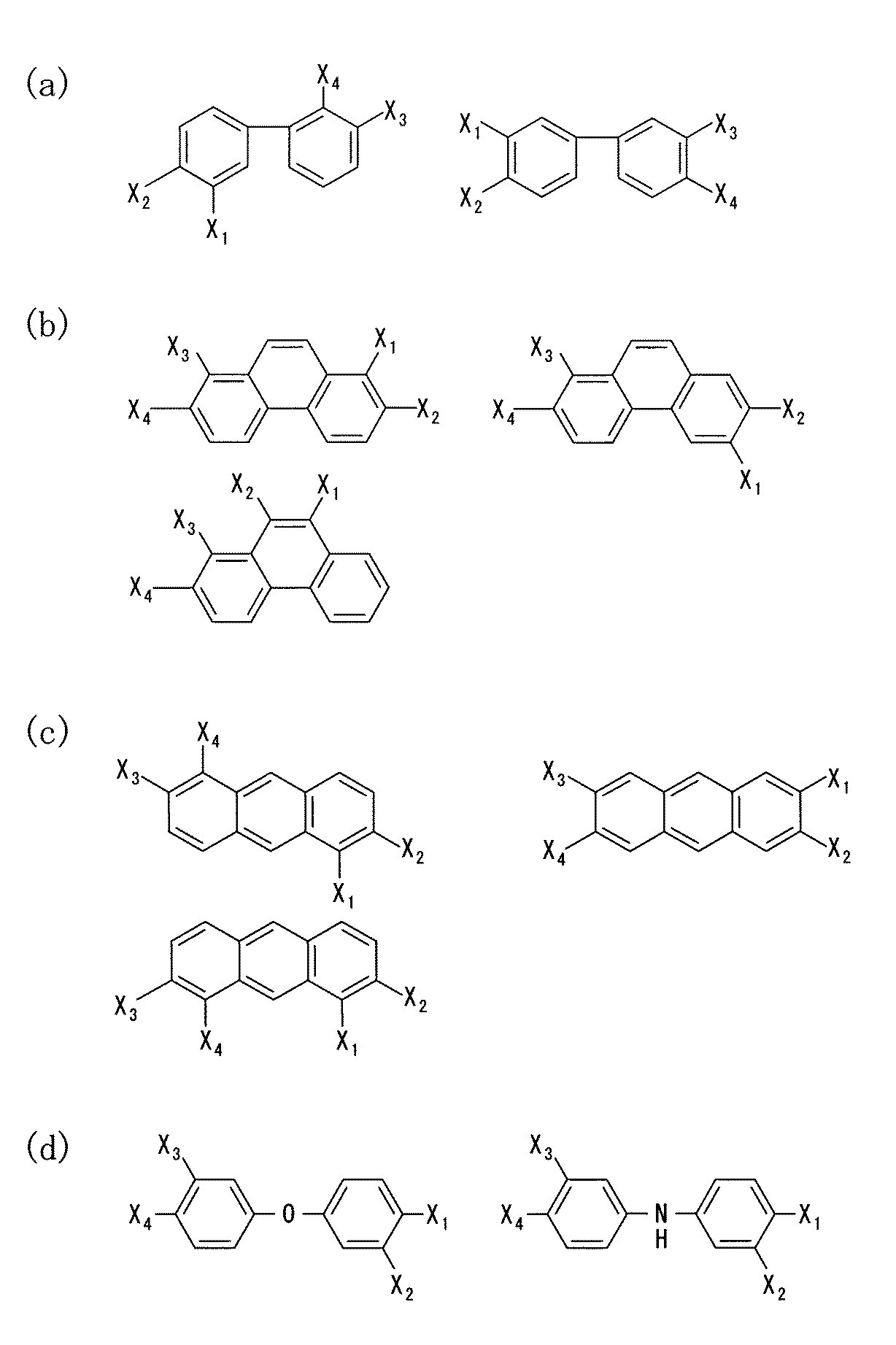
- 前記第1のモノマーは、カルボン酸誘導体、アルコール誘導体、ケトン誘導体、アルデヒド誘導体又は酸無水物誘導体のうちのいずれかの物質であると共に、
前記第2のモノマーはアミン誘導体であることを特徴とする請求項1〜4のいずれか1つに記載の前駆体溶液。 - 前記第1のモノマーは、少なくとも1つ以上のカルボキシル基を有するアダマンタン誘導体であり、
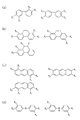
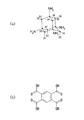
前記第2のモノマーは、少なくとも1つ以上のアミノ基を有する芳香族炭化水素誘導体であることを特徴とする請求項1〜4のいずれか1つに記載の前駆体溶液。 - 前記第1のモノマーは、少なくとも1つ以上のカルボキシル基を有するアダマンタン誘導体であり、
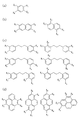
前記第2のモノマーは、少なくとも1つ以上のアミノ基及び少なくとも1つ以上のヒドロキシル基を有する芳香族炭化水素誘導体であることを特徴とする請求項1〜4のいずれか1つに記載の前駆体溶液。 - 前記第1のモノマーは、少なくとも1つ以上のカルボキシル基を有する芳香族炭化水素誘導体であり、
前記第2のモノマーは、少なくとも1つ以上のアミノ基を有するアダマンタン誘導体であることを特徴とする請求項1〜4のいずれか1つに記載の前駆体溶液。 - 前記犠牲有機分子は、シクロデキストリン誘導体又はデンドリマー誘導体であることを特徴とする請求項1〜8のいずれか1つに記載の前駆体溶液。
- 前記第1のモノマーの一部と前記第2のモノマーの一部とが、前記犠牲有機分子の一部を内包するオリゴマーを形成していることを特徴とする請求項1〜9のいずれか1つに記載の前駆体溶液。
- 請求項1〜10のいずれか1つに記載の前駆体溶液を基板上に塗布する工程と、
前記基板に塗布された前記前駆体溶液中の前記第1のモノマーと前記第2のモノマーとを共重合させて共重合体を得る工程と、
前記共重合体から前記犠牲有機分子を除去することによって有機高分子膜を形成する工程とを備えていることを特徴とする有機高分子膜の形成方法。 - 前記共重合体を得る工程及び前記有機高分子膜を形成する工程において、熱処理を行うことを特徴とする請求項11に記載の有機高分子膜の形成方法。
- 請求項1〜9のいずれか1つに記載の前駆体溶液に対して加熱処理を行なうことによって、前記前駆体溶液中に、前記第1のモノマーの一部と前記第2のモノマーの一部とから形成され且つ前記犠牲有機分子の一部を内包するオリゴマーを形成する工程と、
前記オリゴマーを含む前記前駆体溶液を基板上に塗布する工程と、
前記基板に塗布された前記オリゴマーを含む前記前駆体溶液中の前記第1のモノマーと前記第2のモノマーと前記オリゴマーとを共重合させて共重合体を得る工程と、
前記共重合体から前記犠牲有機分子を除去することによって有機高分子膜を形成する工程とを備えていることを特徴とする有機高分子膜の形成方法。 - 前記共重合体を得る工程及び前記有機高分子膜を形成する工程において、熱処理を行うことを特徴とする請求項13に記載の有機高分子膜の形成方法。
Priority Applications (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2004106879A JP4084772B2 (ja) | 2004-03-31 | 2004-03-31 | 有機高分子膜の形成方法 |
| EP05005896A EP1593704A3 (en) | 2004-03-31 | 2005-03-17 | Precursor solution for organic polymer film formation and method for forming organic polymer film |
| US11/081,621 US20050234157A1 (en) | 2004-03-31 | 2005-03-17 | Precursor solution for organic polymer film formation and method for forming organic polymer film |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2004106879A JP4084772B2 (ja) | 2004-03-31 | 2004-03-31 | 有機高分子膜の形成方法 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2005290192A true JP2005290192A (ja) | 2005-10-20 |
| JP4084772B2 JP4084772B2 (ja) | 2008-04-30 |
Family
ID=34934342
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2004106879A Expired - Fee Related JP4084772B2 (ja) | 2004-03-31 | 2004-03-31 | 有機高分子膜の形成方法 |
Country Status (3)
| Country | Link |
|---|---|
| US (1) | US20050234157A1 (ja) |
| EP (1) | EP1593704A3 (ja) |
| JP (1) | JP4084772B2 (ja) |
Cited By (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2007217376A (ja) * | 2006-02-17 | 2007-08-30 | Nagoya Institute Of Technology | 自己組織化ペプチド組成物 |
| JP2007217455A (ja) * | 2006-02-14 | 2007-08-30 | Daicel Chem Ind Ltd | 絶縁膜形成材料及び絶縁膜 |
| JP2007217297A (ja) * | 2006-02-14 | 2007-08-30 | Daicel Chem Ind Ltd | アミノ基含有アダマンタン誘導体とその製造方法、絶縁膜形成材料、ポリマー及び絶縁膜 |
| JP2008038004A (ja) * | 2006-08-04 | 2008-02-21 | Chiba Univ | メソ細孔性ポリマーの製造方法及びその製造装置 |
| WO2008105551A1 (ja) * | 2007-02-28 | 2008-09-04 | Sumitomo Bakelite Co., Ltd. | 有機絶縁材料、それを用いた有機絶縁膜用ワニス、有機絶縁膜及び半導体装置 |
| JP2008201982A (ja) * | 2007-02-22 | 2008-09-04 | Idemitsu Kosan Co Ltd | 多環脂環式化合物を前駆体物質とする薄膜、及びその製造方法 |
Families Citing this family (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP2000510B1 (en) * | 2006-03-29 | 2012-05-02 | Sumitomo Bakelite Company, Ltd. | Resin composition, varnish, resin film, and semiconductor device using the resin film |
| JP2010021401A (ja) * | 2008-07-11 | 2010-01-28 | Fujitsu Microelectronics Ltd | 半導体装置及びその製造方法 |
Family Cites Families (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| FR2189454B1 (ja) * | 1972-06-21 | 1974-12-27 | France Etat | |
| US6107357A (en) * | 1999-11-16 | 2000-08-22 | International Business Machines Corporatrion | Dielectric compositions and method for their manufacture |
| US6903006B2 (en) * | 2000-03-17 | 2005-06-07 | Matsushita Electric Industrial Co., Ltd. | Interlayer dielectric film, and method for forming the same and interconnection |
| JP3578722B2 (ja) * | 2000-03-17 | 2004-10-20 | 松下電器産業株式会社 | 層間絶縁膜、その形成方法及び配線の形成方法 |
| DE60135540D1 (de) * | 2001-03-27 | 2008-10-09 | Samsung Electronics Co Ltd | noporen |
| JP4499391B2 (ja) * | 2003-03-26 | 2010-07-07 | ダイセル化学工業株式会社 | 絶縁膜形成材料及び絶縁膜 |
| KR20050040275A (ko) * | 2003-10-28 | 2005-05-03 | 삼성전자주식회사 | 절연막 형성용 조성물 및 이를 이용한 절연막 또는 절연막패턴의 형성방법 |
-
2004
- 2004-03-31 JP JP2004106879A patent/JP4084772B2/ja not_active Expired - Fee Related
-
2005
- 2005-03-17 EP EP05005896A patent/EP1593704A3/en not_active Withdrawn
- 2005-03-17 US US11/081,621 patent/US20050234157A1/en not_active Abandoned
Cited By (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2007217455A (ja) * | 2006-02-14 | 2007-08-30 | Daicel Chem Ind Ltd | 絶縁膜形成材料及び絶縁膜 |
| JP2007217297A (ja) * | 2006-02-14 | 2007-08-30 | Daicel Chem Ind Ltd | アミノ基含有アダマンタン誘導体とその製造方法、絶縁膜形成材料、ポリマー及び絶縁膜 |
| JP2007217376A (ja) * | 2006-02-17 | 2007-08-30 | Nagoya Institute Of Technology | 自己組織化ペプチド組成物 |
| JP2008038004A (ja) * | 2006-08-04 | 2008-02-21 | Chiba Univ | メソ細孔性ポリマーの製造方法及びその製造装置 |
| JP2008201982A (ja) * | 2007-02-22 | 2008-09-04 | Idemitsu Kosan Co Ltd | 多環脂環式化合物を前駆体物質とする薄膜、及びその製造方法 |
| WO2008105551A1 (ja) * | 2007-02-28 | 2008-09-04 | Sumitomo Bakelite Co., Ltd. | 有機絶縁材料、それを用いた有機絶縁膜用ワニス、有機絶縁膜及び半導体装置 |
| JP5299266B2 (ja) * | 2007-02-28 | 2013-09-25 | 住友ベークライト株式会社 | 有機絶縁材料、それを用いた有機絶縁膜用ワニス、有機絶縁膜及び半導体装置 |
Also Published As
| Publication number | Publication date |
|---|---|
| US20050234157A1 (en) | 2005-10-20 |
| EP1593704A3 (en) | 2006-10-18 |
| EP1593704A2 (en) | 2005-11-09 |
| JP4084772B2 (ja) | 2008-04-30 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US7087982B2 (en) | Nitrogen-containing polymers as porogens in the preparation of highly porous, low dielectric constant materials | |
| JP4308176B2 (ja) | 多孔質誘電材料とその製造方法 | |
| JP4084772B2 (ja) | 有機高分子膜の形成方法 | |
| TW553967B (en) | Low dielectric constant materials with polymeric networks | |
| US10767084B2 (en) | Enhanced adhesive materials and processes for 3D applications | |
| CN101663348B (zh) | 聚酰亚胺前体和聚酰亚胺以及形成图像的下层膜涂布液 | |
| US20020132496A1 (en) | Ultra low-k dielectric materials | |
| US6812551B2 (en) | Defect-free dielectric coatings and preparation thereof using polymeric nitrogenous porogens | |
| TWI254057B (en) | Covalently bonded polyhedral oligomeric silsesquioxane/polyimide nanocomposites and process for synthesizing the same | |
| US20190378781A1 (en) | Enhanced adhesive materials and processes for 3d applications | |
| TW574104B (en) | Etch-stop resins | |
| JP3775375B2 (ja) | 多層配線間の空洞形成方法 | |
| KR101425374B1 (ko) | 다공성 탄소 박막재료 및 이의 제조방법 | |
| US6764718B2 (en) | Method for forming thin film from electrically insulating resin composition | |
| KR101086073B1 (ko) | 폴리우레아 다공질체-폴리이미드 복합체막 및 그 제조방법 | |
| JP3706369B2 (ja) | 高分子材料の合成方法、高分子薄膜の形成方法及び層間絶縁膜の形成方法 | |
| JP3571522B2 (ja) | 多孔質膜の形成方法及び多孔質膜の形成材料 | |
| TW200402800A (en) | Method of synthesizing polymeric material, method of forming thin polymer film, and method of forming interlayer dielectric | |
| JP2007513514A (ja) | 銅配線用超低誘電絶縁膜 | |
| US6861479B2 (en) | Composition and process for the production of a porous layer using the composition | |
| KR102247980B1 (ko) | 고분자 수지 및 동일반응계 분산제를 포함하는 질화붕소 복합체 및 그 제조방법 | |
| CN120289991B (zh) | 一种低热膨胀系数的聚酰亚胺薄膜及其制备方法 | |
| JP2007234871A (ja) | 層間絶縁膜の形成方法及び層間絶縁膜形成用の前駆体溶液 | |
| JP2001283638A (ja) | 絶縁材用樹脂組成物及びこれを用いた絶縁材 | |
| JPS60262826A (ja) | 高分子量ポリジフエニルシロキサン及びその製造方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20070509 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20070515 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20070713 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20080122 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20080215 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20110222 Year of fee payment: 3 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20120222 Year of fee payment: 4 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20130222 Year of fee payment: 5 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20130222 Year of fee payment: 5 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20140222 Year of fee payment: 6 |
|
| LAPS | Cancellation because of no payment of annual fees |