JP2004525359A - 試料中のアンフェタミンおよびメタンフェタミンの新規トレーサーの組成物および合成方法 - Google Patents
試料中のアンフェタミンおよびメタンフェタミンの新規トレーサーの組成物および合成方法 Download PDFInfo
- Publication number
- JP2004525359A JP2004525359A JP2002557773A JP2002557773A JP2004525359A JP 2004525359 A JP2004525359 A JP 2004525359A JP 2002557773 A JP2002557773 A JP 2002557773A JP 2002557773 A JP2002557773 A JP 2002557773A JP 2004525359 A JP2004525359 A JP 2004525359A
- Authority
- JP
- Japan
- Prior art keywords
- group
- amphetamine
- tracer
- sample
- antibody
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Withdrawn
Links
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/94—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving narcotics or drugs or pharmaceuticals, neurotransmitters or associated receptors
- G01N33/946—CNS-stimulants, e.g. cocaine, amphetamines
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C331/00—Derivatives of thiocyanic acid or of isothiocyanic acid
- C07C331/16—Isothiocyanates
- C07C331/28—Isothiocyanates having isothiocyanate groups bound to carbon atoms of six-membered aromatic rings
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10S—TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10S436/00—Chemistry: analytical and immunological testing
- Y10S436/815—Test for named compound or class of compounds
- Y10S436/816—Alkaloids, amphetamines, and barbiturates
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Life Sciences & Earth Sciences (AREA)
- Organic Chemistry (AREA)
- Molecular Biology (AREA)
- Urology & Nephrology (AREA)
- Immunology (AREA)
- Biomedical Technology (AREA)
- Hematology (AREA)
- Medicinal Chemistry (AREA)
- Analytical Chemistry (AREA)
- Cell Biology (AREA)
- Pharmacology & Pharmacy (AREA)
- Food Science & Technology (AREA)
- Biotechnology (AREA)
- Physics & Mathematics (AREA)
- Microbiology (AREA)
- Biochemistry (AREA)
- General Health & Medical Sciences (AREA)
- General Physics & Mathematics (AREA)
- Pathology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
Abstract
【化1】
本発明は生物学的または水性試料中のアンフェタミン(APM)、メタンフェタミン(MAPM)およびそれらの誘導体などの規制薬物の検出のための免疫測定における新規トレーサーおよびそれらの合成および使用に関する。具体的には、本発明は、非規制薬物がトレーサー合成の出発物質および抗体に関して得られた新規トレーサー上の結合部位の両方であり、それによって、出発物質として規制薬物の使用の必要性を排除することができる新規トレーサーの合成方法を提供する。さらに、本発明の新規トレーサーは連続流動置換免疫測定法などの免疫測定法における分析物類似体として用いることができる。意外にも、本発明の新規トレーサーが、従来設計されたトレーサーと比較して、連続流動置換免疫測定法の性能を実質的に改善することが判明した。
本発明は生物学的または水性試料中のアンフェタミン(APM)、メタンフェタミン(MAPM)およびそれらの誘導体などの規制薬物の検出のための免疫測定における新規トレーサーおよびそれらの合成および使用に関する。具体的には、本発明は、非規制薬物がトレーサー合成の出発物質および抗体に関して得られた新規トレーサー上の結合部位の両方であり、それによって、出発物質として規制薬物の使用の必要性を排除することができる新規トレーサーの合成方法を提供する。さらに、本発明の新規トレーサーは連続流動置換免疫測定法などの免疫測定法における分析物類似体として用いることができる。意外にも、本発明の新規トレーサーが、従来設計されたトレーサーと比較して、連続流動置換免疫測定法の性能を実質的に改善することが判明した。
Description
【技術分野】
【0001】
本発明は生物学的または水性試料中のアンフェタミン(APM)、メタンフェタミン(MAPM)およびそれらの誘導体などの規制薬物の検出のための免疫測定における新規トレーサーおよびそれらの合成および使用に関する。具体的には、非規制薬物がトレーサー合成の出発物質および抗体に関して得られた新規トレーサー上の結合部位の両方であり、それによって、出発物質として規制薬物の使用の必要性を排除することができる新規トレーサーの合成方法を提供する。さらに、本発明の新規トレーサーは連続流動置換免疫測定法(continuous flow displacement immunoassay)などの免疫測定法における分析物類似体として用いることができる。連続流動置換免疫測定法は、最初に固定抗体が標識分析物類似体で飽和され、標識分析物類似体が試験試料中の分析物によって置換され、ついで置換された標識分析物類似体を測定するという原理によって行われる。意外にも、本発明の新規トレーサーが、従来設計されたトレーサーと比較して、連続流動置換免疫測定法の性能を実質的に改善することがわかった。
【背景技術】
【0002】
アンフェタミンおよびメタンフェタミンはフェニルエチルアミンとして知られている化合物の誘導体である。アンフェタミンおよびメタンフェタミンは両方とも中枢神経および末梢神経系の交感神経部位の刺激剤である。他の刺激剤と同様に、アンフェタミンまたはメタンフェタミン摂取の短期効果は心拍数の増加、血圧上昇、食欲減退、瞳孔散大、幸福および能力感、疲労感の減少を含む。それらの刺激作用がこれらの化合物が濫用され違法に販売される理由である。
【0003】
よくあるアンフェタミンおよびメタンフェタミンの濫用のために、生物学的標本中のこれらの薬物の存在を検出する非−侵襲的で迅速な試験法の必要性が増大している。過去において、生物学的試料中のアンフェタミンは、薄層クロマトグラフィー(TLC)、高速液体クロマトグラフィー(HPLC)およびガスクロマトグラフィー/質量分析(GC/MS)などの多数の技法のよって検出されてきた。これらの試験方法は一般に、時間がかかり、検出感度が低い(Vapatalo, H. K. S,およびSenius, K. E., Comparison of Saliva and Urine Samples in Thin-Layer Chromatographic Detection of Central Nervous System Stimulants, Intl. J. Clin. Pharmacol. Res., 4: 5-8 (1984), Cook, C. E.ら, Pharmacokinetics of Metannphetamine Self-administered to Human Subjects by Smoking s-(+)- Metannphetamine hydrochloride, Drug Metab. Dispos., 21: 717-723 (1993), Suzuki, S.ら、Analysis of Metannphetamine in Hair, Nail, Sweat, and Saliva by Mass Fragmentography, J. Anal. Toxicol., 13: 176-178 (1989)参照、これらをここに引用してこの明細書の記載とする)。さらに、TLC、HPLCおよびGC/MSには高度の熟練者を必要とするので行うのが困難である。免疫測定法は、アンフェタミンおよびメタンフェタミンの検出および定量のために、TLC、HPLCおよびGC/MSの使用に代わる好ましい方法を提供してきた。具体的には、免疫測定法は感度、効率を改善し、より労働集約的でない。尿中のアンフェタミンおよびメタンフェタミンの検出のための多数の検出免疫測定法技術が開発されてきた(Brynesら、 EPO # 279,213 B1, Huら、EPO # 371,422 A2,およびHelmanら、EPO # 371,253 A2参照、これらのすべての記述をここに引用してこの明細書の記載とする)。さらに、連続流動置換免疫測定法(continuous flow displacement immunoassay)は唾液および尿における濫用薬物の有用かつ迅速な検出方法であることが示されている(Hao Yu ら, Use of the USDT Flow Immunosensor for Quantitation of Benzolecgonine in Urine, Biosensors and Bioelectronics, 725-734 (1996); Nam, D.ら, Programme and Abstracts of TIAFT 2000 at Helsinki, 2000; Liang, G.ら、Proc. of ICADTS 2000, Jun. 22-26, 2000参照、これらのすべての記述をここに引用してこの明細書の記載とする)。
【0004】
本発明に用いられるトレーサーは免疫測定法に用いられる標識抗体またはヘプタンであり、抗体の抗原結合部位について当該特定の物質(分析物)と競合する。トレーサーは標識された被検出分析物と同じ抗原またはヘプタンであってもよいし、または、構造的に分析物と関連し、選択された抗体に対して望ましい交差反応をするように修飾されていてもよい。連続流動置換免疫測定法において、例えば、結合親和性を減少させる標識抗原またはヘプタンに対する修飾は事実置換反応を促進し、その結果、系の感度を上げる。禁制薬物の検出のために、多くの免疫測定法は一般に禁制薬物自体を、すなわち、標識アンフェタミンおよびメタンフェタミンを、試料中のこれらの物質の存在および含有量の検出のためのトレーサーとして用いる。これら薬物は規制されているから、研究室でのそれらの使用には、一連の操作手順および事務処理が伴う。最近、アンフェタミンおよびメタンフェタミントレーサー合成における出発物質として非−規制薬物の使用が報告されている(Heiman, D.ら, EP 0 371 233 A2)が、合成された最終トレーサーは、やはりアンフェタミン抗体の結合部位としてアンフェタミン分子自体を含んでいる。
【0005】
Fig.1に示すように、トレーサーの合成には種々の方法がある。トレーサー合成の通常の方法の1つは、出発物質として、アンフェタミンおよびメタンフェタミンなどの禁制薬物の使用を含む(Salamamone, S.ら, EP 0 386 644 A2)。これらの出発物質は複数の合成工程を経て、薬物ベースのトレーサーを得る(Fig.1、方法A参照)。トレーサー合成の別法は非−規制薬物を出発物質として使用し、薬物ベースのトレーサーを得るものである(Heiman, D. F. ら, EP 0 371 233 A2)(Fig.1、方法B参照)。これら2つの方法において、合成経路は出発物質、中間体または最終製造トレーサーとして禁制薬物を含む。
【0006】
本発明は、非−規制薬物から製造され、トレーサーとして標識非−規制薬物を生成する新規な1組のトレーサーの合成方法を提供する(Fig.1、方法C参照)。これらの非−規制薬物ベースのトレーサーの合成は、合成過程のいずれの段階でも禁制薬物の製造を含まない。本発明者らはこれらの新規トレーサーが生物学的または水性試料中のアンフェタミンおよびメタンフェタミンの存在および/または含有量を検出する免疫測定法での使用に理想的であるとの知見を得た。本発明者らは、免疫測定法系において抗体が生物学的試料中の分析物より低い親和性のトレーサーに結合する限り、特定の標識分析物自体(すなわち、アンフェタミン)をトレーサーにする必要がないことを知った。本発明の新規トレーサーは特に連続流動置換免疫測定法に有効である。
【発明の開示】
【0007】
発明の要約
本発明は、生物学的または水性試料中のアンフェタミン(APM)、メタンフェタミン(MAPM)およびそれらの誘導体の検出のための免疫測定法における使用に適した新規組成物に関する。本発明で開発されたトレーサー合成方法は、トレーサー合成の出発物質または生成物として禁制薬物、すなわち、アンフェタミンおよびメタンフェタミンを排除する。これらの非−薬物ベースのトレーサーは特に連続流動置換免疫測定法に有用である。本発明は新規トレーサーの合成方法および生物学的試料におけるフェニルエチルアミン誘導体の検出および定量のための蛍光免疫測定法におけるこれらのトレーサーの使用に関する。
【0008】
Fig.2はアンフェタミンおよびメタンフェタミンの基本構造を示す。アンフェタミンおよびメタンフェタミンは本発明の免疫測定法において検出され得る分析物の例である。アンフェタミンはn値が1である。本発明のトレーサーはn値が1より大である。好ましいトレーサーはn値が2またはそれより大である。Fig.3および4は本発明のトレーサー合成に用いられ得る通常の蛍光標識を示す。
【0009】
本発明の具体例において、合成新規トレーサーは、標識された1−メチル−3−フェニルアルキルアミンであり、Fig.5に示される化合物である。
【0010】
本発明の別の具体例において、合成新規トレーサーはN−標識−1−メチル−3−フェニルアルキルアミンであり、Fig.6に示される化合物である。
【0011】
本発明の別の具体例において、合成新規トレーサーは標識N−メチル−1−メチル−3−フェニルアルキルアミンであり、Fig.7に示される化合物である。
【0012】
本発明の別の具体例において、合成新規トレーサーはN−標識N−メチル−1−メチル−3−フェニルアルキルアミンであり、Fig.8に示される化合物である。
【0013】
本発明の好ましい具体例において、合成新規トレーサーは、パラ−ヘミスクシニト−1−メチル−3−フェニルアルキルアミン−N−トリフルオロアセトアミドのスクシニジル活性エステルとCy5EDAとの反応生成物であり、Fig.9および10に示される化合物である。この好ましいトレーサーは実施例IIに記載の方法によって合成される。
【0014】
好ましい具体例の詳細な記載
本発明は生物学的試料中のアンフェタミン、メタンフェタミンおよびそれらの誘導体の存在および/または含有量を検出するための蛍光免疫測定法における使用のための組成物および化合物の合成方法を提供する。生物学的試料中のアンフェタミンおよびメタンフェタミンの検出のための組成物またはトレーサーは特に連続流動置換免疫測定法に適している。
【0015】
連続流動置換免疫測定法において、分析物および抗体の動態学的性質は重要な役割を果たす。分析物は免疫測定法で試験される物質である。例えば、本発明においては、分析物はアンフェタミンまたはメタンフェタミンであってもよい。抗体は分析物を認識し、分析物に特異的に結合し得る。トレーサーは抗体に対する結合について分析物と競合し得る標識された化合物である。本発明は、3つの部分を有するトレーサーを用いる。すなわち、抗体に結合する部位、結合基および標識である。抗体に結合する分析物上の部位は通常抗体に結合するトレーサー上の部位と類似している。言いかえれば、もし、分析物がアンフェタミンのとき、アンフェタミンに対する抗体は分析物上で認識するのと同じトレーサー上の結合部位を認識する。
【0016】
典型的な連続流動置換免疫測定法は、アンフェタミンまたはメタンフェタミンに対する固−相固定抗体を含む。抗体の抗原結合部位は合成標識トレーサーに暴露され、標識合成トレーサー−抗体複合体を形成する。抗体は抗体の抗原結合部位が標識合成トレーサーで飽和されるようにトレーサーに暴露される。ついで、分析物であるアンフェタミンまたは メタンフェタミンを含有する疑いのある生物学的試料が連続して固−相固定抗体−標識合成トレーサー複合体を通過して行く。もし、試料中に分析物が存在すると、分析物は抗体に結合し、標識合成トレーサーと置換される。従って、結合点より下流での標識トレーサーの検出は、生物学的試料中の分析物の存在および含有量を示す(Liglerら、U.S. Pat. No. 5,183,740、記載のすべてをここに引用してこの明細書の記載とする)。
【0017】
連続流動置換免疫測定法ベースの生成物の開発の成功は、抗体からの結合トレーサーのすばやい解離速度を達成し、それによって分析物の迅速な結合を可能にする抗体およびトレーサーの選択による。一般に、理想的な連続流動置換免疫測定法は、抗体が分析物に対して高い親和性を有し、トレーサーに対してはより低い親和性を有する系を用いる。抗体が分析物に対して高い親和性を有し、トレーサーに対してはより低い親和性を有するというこの組合せはより迅速な置換を促進する。本発明において、トレーサーは下記の性質を有する:抗体に対するトレーサーの親和性は、20−100%の範囲のいずれでもよい。好ましいトレーサーは、抗体に対して約40−80%交差−反応性を有する。本発明の目的のために、トレーサーが構造的に分析物であるアンフェタミンまたはメタンフェタミンに関連することは重要ではない。トレーサーのリガンド−結合部位が抗体と20−100%の交差−反応性を有する限り、免疫測定法、具体的には、連続流動置換免疫測定法における使用に適している。アンフェタミンおよびメタンフェタミンに対する抗体の多くはフェニルエチルアミン誘導体を認識する。本発明のトレーサーは、抗体がフェニルエチルアミン類似体を認識し得るかぎり有用である。分析物に対する構造的類似性は問題ではない。この特徴、トレーサーと分析物との間の構造的非類似性は、本発明のトレーサーと先行技術のトレーサーを差別化するものである。
【0018】
トレーサーの標識は、当分野に公知の従来の方法によって行うことができる。標識そのものは、適切には、フルオロフォア、発色団、放射性標識、金属性コロイド、酵素または化学発光もしくは生物発光分子であってもよい。適切なフルオロフォアsおよび発色団は、R. P. Haugland, Molecular Probes, Handbook of Fluorescent Probes and Research Chemicals, 5thEd., Molecular Probes, Inc., Eugene, Oreg., 1992に記載されており、ここに引用して明細書の記載とする。好ましいフルオロフォアの例には、フルオレセイン、ローダミンおよびスルフォインドシアニン染料、Cy5(Mujumdar, R. B.ら、Bioconjugate Chemistry, vol. 4, p. 105 (1992))が含まれる。
【0019】
本発明の使用に用い得る広範囲の抗体は市販されている(例えば、Omega Biologicals, Inc., 910 Technology Blvd., Bozeman, Mont.から)かまたは、文献から入手できる製造方法の記載から製造することができる。モノクローナルまたはポリクローナル抗体などの抗体は、市販されているか、文献に記載されており、広範囲の標的物質の同定のために本発明の方法に採用または適合し得る。
【0020】
この方法は、これらに限定されないが、水、血液、血漿、血清または尿を含む生物学的または水性試料の特定の成分を検出するために用いることができる。唾液は、濫用薬物の検出および測定のための有効な試験材料であることが示されている("Saliva as a Diagnostic Fluid", Ed by D. Malamud and L. Tabak, Annals of the New York Academy of Sciences, 1993, V. 694.)。例えば、唾液試料中のメタンフェタミンは、最終投与2日後までGC/MASSによって検出することができる(S. Suzuki, T. Inoue and S. Inayama, Analysis of methanphetamine in hair, nail, sweat, and saliva by mass fragmentography, J. Anal. Toxicol. 1989, 13, 176-178.)。
【0021】
下記の実施例は本発明の実施に用い得る具体的な技術を含む本発明の具体的な適用を詳述するために記載されている。これらの具体的な実施例は適用に記載されたものに本発明の範囲を限定するものではない。
【実施例】
【0022】
実施例1
標識トレーサーの一般的製造方法
p'、o'およびm'−置換トレーサー合成のフローチャートがFig.12に記載されている。製造工程の詳細な記述は以下の通りである。
【0023】
A.パラ、メタおよびオルト−ニトロアンフェタミン−N−トリフルオロアセトアミドの製造および分離
トリフルオロ無水酢酸0.7 mLをアセトニトリル 1mL中パラ−、メタ−およびオルト−ニトロアンフェタミンの混合物0.4 gの溶液に0℃にてゆっくりと添加した。得られた混合物を0℃にて1時間攪拌し、冷蔵庫中で4℃にて一夜維持した。揮発物質を除去し、粗生成物をシリカゲルカラムにかけ、1:2 酢酸エチル/ヘキサンで溶出させて精製した。この方法で、純粋なパラ−ニトロアンフェタミン−N−トリフルオロアセトアミド0.15 g、純粋なメタ−ニトロアンフェタミン−N−トリフルオロアセトアミド0.03 および純粋なオルト−ニトロアンフェタミン−N−トリフルオロアセトアミド0.04 gを得た。
【0024】
B.パラ−アミノアンフェタミン−N−トリフルオロアセトアミドの製造
製造したパラ−ニトロアンフェタミン−N−トリフルオロアセトアミド0.15 gをエタノール8 mlに溶解した。10%Pd/C 0.4 mgをこの溶液に添加した。混合物をH2下室温にて一夜水素添加した。触媒および溶媒を除去すると、暗緑色の残渣が得られた。得られた混合物を分取シリカ薄層クロマトグラフィーで、展開剤として1/1の酢酸エチル/ヘキサン混合物を用いて精製した。かくして、対応アミン生成物0.75 mgを得た。
【0025】
C.パラ−イソチオシアナトアンフェタミン−N−トリフルオロアセトアミドの製造
ジクロロメタン0.5 ml中パラ−アミノアンフェタミン−N−トリフルオロアセトアミド25 mg の混合物を攪拌し、NaHCO3 15 μlおよびチオホスゲンを混合物に添加した。得られた混合物を室温にて30分攪拌した。ついで反応混合物をシリカプレートで精製し、パラ−イソチオシアナトアンフェタミン−N−トリフルオロアセトアミド21 mgを得た。
【0026】
D.パラ−イソチオシアナトアンフェタミン−N−フルオロアセトアミドとCy5EDAのカップリング
ホウ酸緩衝液(pH8)0.5 ml中パラ−イソチオシアナトアンフェタミン−N−トリフルオロアセトアミド2 mgおよびCy5EDAの混合物を室温にて4時間攪拌した。得られた溶液を直接C18プレートにスポットし、70/30(v/v)メタノール/水で展開した。生成物のバンドを切り取り、メタノールで抽出した。
【0027】
実施例II
好ましいアンフェタミン免疫測定トレーサーの製造
好ましいトレーサー合成のフローチャートがFig.13に記載されている。トレーサーの製造工程の詳細な記述は以下の通りである。
【0028】
工程1:1−メチル−3−フェニルプロピルアミン−N−トリフルオロアセトアミドの製造
アセトニトリル5 ml中1−メチル−3−フェニルプロピルアミン3 gの溶液を室温にて攪拌した。トリフルオロ無水酢酸4 mLおよびピリジン1.3 mLをこの溶液に室温にて添加した。得られた反応混合物を室温にて一夜攪拌し、ついで、混合物を氷水に入れた。粗生成物を酢酸エチルで抽出し、一緒にした有機層をNa2SO4で乾燥した。有機溶媒を除去し、1−メチル−3−フェニルプロピルアミン−N−トリフルオロアセトアミドを得た。
【0029】
工程2:パラ−ヘミスクシニト−1−メチル−3−フェニルプロピルアミン−N−トリフルオロアセトアミドの製造
AlCl3を、ジクロロメタン5 mL 中無水コハク酸0.24 gおよび1−メチル−3−フェニルプロピルアミン−N−トリフルオロアセトアミド0.4 gの混合物に室温にて添加した。得られた混合物を0℃にて1時間攪拌し、ついで室温にて一夜放置した。3M HCl水溶液5 mlを混合物に添加し、有機層を酢酸エチルで抽出した。一緒にした有機層をNa2SO4で乾燥し、粗生成物0.5 gを得た。粗生成物をさらにシリカゲルカラムで、1:2 エチル/ヘキサンで溶出させて精製を完了した。純粋なパラ−ヘミスクシニト−1−メチル−3−フェニルプロピルアミン−N−トリフルオロアセトアミド0.3 gを得た。
【0030】
工程3:パラ−ヘミスクシニト−1−メチル−3−フェニルプロピルアミン−N−トリフルオロアセトアミドの還元
製造したパラ−ヘミスクシニト−1−メチル−3−フェニルプロピルアミン−N−トリフルオロアセトアミド0.2 gを酢酸3 mlに溶解した。10%Pd/C 0.3 mgをこの溶液に添加した。混合物をH2下室温にて一夜水素添加し、触媒および溶媒を除去すると、油状の残渣が残った。得られた混合物を分取シリカTLCで、展開剤として、1:1比の酢酸エチル/ヘキサンを用いて精製した。純粋な還元パラ−ヘミスクシニト−1−メチル−3−フェニルプロピルアミン−N−トリフルオロアセトアミド83 mgを得た。
【0031】
工程 4:パラ−ヘミスクシニト−1−メチル−3−フェニルプロピルアミン−N−トリフルオロアセトアミドのスクシニミジル活性エステルの製造
N,N'−ジスクシンミジルカーボネート40 mgおよびピリジン60 μlを、アセトニトリル1 mL中パラ−ヘミスクシニト−1−メチル−3−フェニルプロピルアミン−N−トリフルオロアセトアミド40 mgの攪拌混合物に添加した。得られた混合物を室温にて4時間攪拌した。反応混合物をシリカプレートで精製し、パラ−ヘミスクシニト−1−メチル−3−フェニルプロピルアミン−N−トリフルオロアセトアミドのスクシニミジル活性エステル25 mgを得た。
【0032】
工程5:パラ−ヘミスクシニト−1−メチル−3−フェニルプロピルアミン−N−トリフルオロアセトアミドのスクシニミジル活性エステルとCy5EDAのカップリング
ホウ酸緩衝液(pH9)0.5 ml中パラ−ヘミスクシニト−1−メチル−3−フェニルプロピルアミン−N−トリフルオロアセトアミドのスクシニミジル活性エステル2 mgおよびCy5EDA2.5 mgの混合物を室温にて4時間攪拌した。得られた溶液をC18プレートにかけ、70/30(v/v)の割合のメタノール/水で展開した。生成物のバンドを切り取り、メタノールで抽出した。カップリング生成物は好ましいアンフェタミン免疫測定トレーサーである。
【0033】
実施例III
流動免疫測定法の操作
ライフポイント・インコーポレイテッドは、連続流動置換免疫測定法を行うための必要なポンプ、バルブ、配管、交換可能カラムおよび蛍光検出器を含む流動免疫測定法装置を開発した。アンフェタミン標準曲線を、陰性の唾液に種々の濃度のアンフェタミン(Sigma Chemicals, St. Louis, Mo.)を添加して作成した。化学薬品および緩衝液はシグマおよびアルドリッチ・カンパニーから入手した。
【0034】
(a)試薬の製造
唾液中のアンフェタミンの存在の測定のために、特異的抗−アンフェタミンモノクローナル抗体(例えば、Omega Biologicals, Inc., Bozeman, Mont.から入手可能)を、製造業社の標準プロトコルに従ってエンフェース(Emphase)多孔性ビーズに結合または固定した。抗体−結合ビースをついで製造したCy5−標識アンフェタミントレーサーで飽和させた。得られたトレーサー−抗体−樹脂複合体混合物を一夜4℃にて回転混合させながら放置した。複合樹脂を0.1M PBS(10% MeOH)で安定的な基準線が得られるまで洗滌した。洗滌した樹脂を等容量の50 mM PBS(pH 7.4)中150 mMトレハロース緩衝液に添加した。樹脂を凍結−乾燥した。
【0035】
(b)流動測定法
内直径2 mmおよび長さ10 mmのミクロ−ポリスチレンカラムに製造した樹脂4 mgを充填した。充填したカラムをライフポイント免疫測定法装置の5つの流動導管の1つに取り付けた。カラムはラブビューソフト(Labview software, National Instruments, Inc.)で支持された自動システムで制御された適当な緩衝液で予−洗した。唾液試料50 μlを、流速100〜300 μl/分で導管を通過させた。蛍光シグナルの平均強度を試料中のアンフェタミン濃度の測定のために用いた。
【0036】
実施例IV:好ましいメタンフェタミン免疫測定トレーサーの製造
工程1:N−メチル−1−メチル−3−フェニルプロピルアミン−N−トリフルオロアセトアミドの製造
アセトニトリル1 ml中N−メチル−1−メチル−3−フェニルプロピルアミン0.4 gの溶液を攪拌した。トリフルオロ無水酢酸1 mlおよびピリジン0.6 mlをこの溶液に室温にて添加し、得られた混合物を一夜室温にて攪拌した。次に、混合物を氷水に入れた。粗生成物を酢酸エチルで抽出し、有機層を一緒にし、Na2SO4で乾燥した。有機溶媒を除去して所望の生成物を得た。TLC分析でこの生成物が次の合成工程に十分純粋であることを確認した。
【0037】
工程2:p'−ヘミスクシニト−N−メチル−1−メチル−3−フェニルプロピルアミン−N−トリフルオロアセトアミドの製造
AlCl3 0.2 gを、ジクロロメタン5 mL 中無水コハク酸0.1 gおよびN−メチル−1−メチル−3−フェニルプロピルアミン−N−トリフルオロアセトアミド0.2 gの混合物に室温にて添加した。得られた混合物を2℃〜8℃にて1時間攪拌し、ついで室温にて一夜放置した。3M HCl水溶液2 mlを混合物に添加し、生成物を酢酸エチルで抽出した。有機層を一緒にし、Na2SO4で乾燥し、粗生成物0.2 gを得た。粗生成物をさらにシリカゲルカラムで、エチル/ヘキサン(1:2)で溶出させて精製を完了し、純粋な生成物0.12 gを得た。
【0038】
工程3:パラ−ヘミスクシニト−N−メチル−1−メチル−3−フェニルプロピルアミン−N−トリフルオロアセトアミドの還元
製造したパラ−ヘミスクシニト−1−メチル−3−フェニルプロピルアミン−N−トリフルオロアセトアミド0.2 gを酢酸3 mlに溶解した。10%Pd/C 0.3 mgをこの溶液に添加した。混合物をH2下室温にて一夜水素添加した。触媒および溶媒を除去し、油状の残渣を得た。得られた混合物をシリカTLCで、展開剤として、(1:1)酢酸エチル/ヘキサンを用いて精製した。工程終了後に純粋な生成物62 mgを得た。
【0039】
工程4:パラ−ヘミスクシニト−1−メチル−3−フェニルプロピルアミン−N−トリフルオロアセトアミドのスクシニミジル活性エステルの製造
アセトニトリル1 mL中にパラ−ヘミスクシニト−1−メチル−3−フェニルプロピルアミン−N−トリフルオロアセトアミド40 mgを攪拌しながら入れた。N,N'−ジスクシニミジルカーボネート40 mgおよびピリジン60 μlをこの溶液に添加した。得られた混合物を室温にて4時間攪拌した。反応混合物をシリカプレートで精製し、パラ−ヘミスクシニト−1−メチル−3−フェニルプロピルアミン−N−トリフルオロアセトアミドのスクシニミジル活性エステル25 mgを得た。
【0040】
工程5:パラ−ヘミスクシニト−1−メチル−3−フェニルプロピルアミン−N−フルオロアセトアミドのスクシニミジル活性エステルとCy5EDAのカップリング
パラ−ヘミスクシニト−1−メチル−3−フェニルプロピルアミン−N−トリフルオロアセトアミドのスクシニミジル活性エステル2 mgを、ホウ酸緩衝液(pH9)0.5 ml中およびCy5EDA2.5 mgと混合した。この溶液を室温にて4時間攪拌し、得られた溶液を直接C18プレートにスポットし、70/30−メタノール/水で展開した。生成物のバンドを切り取り、パラ−ヘミスクシニト−1−メチル−3−フェニルプロピルアミン−N−フルオロアセトアミドのスクシニミジル活性エステルとCy5EDAのカップリング生成物をメタノールで抽出した。
【0041】
実施例V
唾液中のアンフェタミンの流動免疫測定法
(a)試薬の製造
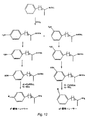
選択された抗−アンフェタミンモノクローナル抗体(例えば、Omega Biologicals, Inc., Bozeman, Mont.から入手可能)を、製造業社の標準プロトコルに従ってエンフェース多孔性ビーズに結合または固定し、GW3−38、本発明の新規トレーサー(Fig.9)などの製造されたトレーサーおよびGW5−12、従来のトレーサー(Fig.11)で飽和させた。得られた複合体混合物を一夜4℃にて回転混合させながら放置した。複合体樹脂を0.1M PBS(10% MeOH)で安定的な基準線が得られるまで洗滌した。洗滌した樹脂を等容量の50 mM PBS(pH 7.4)中150 mMトレハロース緩衝液に添加した。樹脂を凍結−乾燥した。
【0042】
a)流動測定法の操作
内直径2 mmおよび長さ10 mmのミクロ−ポリスチレンカラムに製造した樹脂4 mgを充填した。充填したカラムをライフポイント免疫測定法装置の5つの流動導管の1つに取り付けた。カラムはラブビューソフト(Labview software, National Instruments, Inc.)で支持された自動システムで制御された適当な緩衝液で予−洗した。その後、試験試料50 μlを、流速100 μl/分、ついで0.2%BSA/PBS緩衝液350 μlを導管を通過させた。
【0043】
b)結果
蛍光シグナルの平均強度を試料中の薬物濃度の測定のために用いた。トレーサーGW3−38およびGW5−12を用いるアンフェタミンの流動免疫測定法の比較をFig.14およびFig.15に示した。本発明の好ましいトレーサーは従来のトレーサーのほぼ10倍(10X)のシグナル強度を示している。
【図面の簡単な説明】
【0044】
【図1】Fig.1はトレーサーの製造方法を示す。方法Aは、出発物質として禁制薬物の使用を含み、薬物ベースのトレーサーを生成する。方法Bは、非−規制物質の使用を含み、薬物ベースのトレーサーを生成する。方法Cは、出発物質として非−規制物質を用い、非−規制物質ベースのトレーサーを生成する本発明のトレーサー合成方法を開示する。
【図2】Fig.2はアンフェタミンおよびメタンフェタミンの基本構造を示す。
【図3】Fig.3は本発明のトレーサー製造に用い得る通常の蛍光標識を示す。
【図4】Fig.4は本発明のトレーサー製造に用い得る通常の蛍光標識を示す。
【図5】Fig.5は合成新規トレーサー化合物、N−標識1−メチル−3−フェニルアルキルアミンを示す。
【図6】Fig.6は合成新規トレーサー化合物、標識1−メチル−3−フェニルアルキルアミンを示す。
【図7】Fig.7は合成新規トレーサー化合物、標識N−メチル−1−メチル−3−フェニルアルキルアミンを示す。
【図8】Fig.8は合成新規トレーサー化合物、N−標識N−メチル−1−メチル−3−フェニルアルキルアミンを示す。
【図9】Fig.9は好ましい合成新規トレーサー化合物である、標識されたパラ−ヘミスクシニト−1−メチル−3−フェニルプロピルアミン−N−トリフルオロアセトアミドのスクシニミジル活性エステルとCy5EDAとの反応生成物を示す。
【図10】Fig.10は好ましい合成新規トレーサー化合物である、標識されたパラ−ヘミスクシニト−N−メチル−1−メチル−3−フェニルプロピルアミン−N−トリフルオロアセトアミドのスクシニミジル活性エステルとCy5EDAとの反応生成物を示す。
【図11】Fig.11は従来の(薬物ベース)トレーサー、GW5−12を示す。
【図12】Fig.12はp', m'およびo'−置換アンフェタミントレーサーの一般的な製造工程を記載したフローチャートを示す。
【図13】Fig.13は本発明の好ましいトレーサーの1種の合成工程を記載したフローチャートを示す。
【図14】Fig.14は、Fig.9に記載の好ましい非−薬物ベースのトレーサーによるアンフェタミンの流動免疫測定の結果を示す。Fig.14と15は流動免疫測定法による好ましいトレーサーのGW3−38と従来のトレーサーのGW5−12を用いるアンフェタミンの測定の比較を示す。
【図15】Fig.15は、Fig.11に記載の従来の薬物ベースのトレーサーを用いるアンフェタミンの流動免疫測定の結果を示す。Fig.14と15は流動免疫測定法による好ましいトレーサーのGW3−38と従来のトレーサーのGW5−12を用いるアンフェタミンの測定の比較を示す。
【0001】
本発明は生物学的または水性試料中のアンフェタミン(APM)、メタンフェタミン(MAPM)およびそれらの誘導体などの規制薬物の検出のための免疫測定における新規トレーサーおよびそれらの合成および使用に関する。具体的には、非規制薬物がトレーサー合成の出発物質および抗体に関して得られた新規トレーサー上の結合部位の両方であり、それによって、出発物質として規制薬物の使用の必要性を排除することができる新規トレーサーの合成方法を提供する。さらに、本発明の新規トレーサーは連続流動置換免疫測定法(continuous flow displacement immunoassay)などの免疫測定法における分析物類似体として用いることができる。連続流動置換免疫測定法は、最初に固定抗体が標識分析物類似体で飽和され、標識分析物類似体が試験試料中の分析物によって置換され、ついで置換された標識分析物類似体を測定するという原理によって行われる。意外にも、本発明の新規トレーサーが、従来設計されたトレーサーと比較して、連続流動置換免疫測定法の性能を実質的に改善することがわかった。
【背景技術】
【0002】
アンフェタミンおよびメタンフェタミンはフェニルエチルアミンとして知られている化合物の誘導体である。アンフェタミンおよびメタンフェタミンは両方とも中枢神経および末梢神経系の交感神経部位の刺激剤である。他の刺激剤と同様に、アンフェタミンまたはメタンフェタミン摂取の短期効果は心拍数の増加、血圧上昇、食欲減退、瞳孔散大、幸福および能力感、疲労感の減少を含む。それらの刺激作用がこれらの化合物が濫用され違法に販売される理由である。
【0003】
よくあるアンフェタミンおよびメタンフェタミンの濫用のために、生物学的標本中のこれらの薬物の存在を検出する非−侵襲的で迅速な試験法の必要性が増大している。過去において、生物学的試料中のアンフェタミンは、薄層クロマトグラフィー(TLC)、高速液体クロマトグラフィー(HPLC)およびガスクロマトグラフィー/質量分析(GC/MS)などの多数の技法のよって検出されてきた。これらの試験方法は一般に、時間がかかり、検出感度が低い(Vapatalo, H. K. S,およびSenius, K. E., Comparison of Saliva and Urine Samples in Thin-Layer Chromatographic Detection of Central Nervous System Stimulants, Intl. J. Clin. Pharmacol. Res., 4: 5-8 (1984), Cook, C. E.ら, Pharmacokinetics of Metannphetamine Self-administered to Human Subjects by Smoking s-(+)- Metannphetamine hydrochloride, Drug Metab. Dispos., 21: 717-723 (1993), Suzuki, S.ら、Analysis of Metannphetamine in Hair, Nail, Sweat, and Saliva by Mass Fragmentography, J. Anal. Toxicol., 13: 176-178 (1989)参照、これらをここに引用してこの明細書の記載とする)。さらに、TLC、HPLCおよびGC/MSには高度の熟練者を必要とするので行うのが困難である。免疫測定法は、アンフェタミンおよびメタンフェタミンの検出および定量のために、TLC、HPLCおよびGC/MSの使用に代わる好ましい方法を提供してきた。具体的には、免疫測定法は感度、効率を改善し、より労働集約的でない。尿中のアンフェタミンおよびメタンフェタミンの検出のための多数の検出免疫測定法技術が開発されてきた(Brynesら、 EPO # 279,213 B1, Huら、EPO # 371,422 A2,およびHelmanら、EPO # 371,253 A2参照、これらのすべての記述をここに引用してこの明細書の記載とする)。さらに、連続流動置換免疫測定法(continuous flow displacement immunoassay)は唾液および尿における濫用薬物の有用かつ迅速な検出方法であることが示されている(Hao Yu ら, Use of the USDT Flow Immunosensor for Quantitation of Benzolecgonine in Urine, Biosensors and Bioelectronics, 725-734 (1996); Nam, D.ら, Programme and Abstracts of TIAFT 2000 at Helsinki, 2000; Liang, G.ら、Proc. of ICADTS 2000, Jun. 22-26, 2000参照、これらのすべての記述をここに引用してこの明細書の記載とする)。
【0004】
本発明に用いられるトレーサーは免疫測定法に用いられる標識抗体またはヘプタンであり、抗体の抗原結合部位について当該特定の物質(分析物)と競合する。トレーサーは標識された被検出分析物と同じ抗原またはヘプタンであってもよいし、または、構造的に分析物と関連し、選択された抗体に対して望ましい交差反応をするように修飾されていてもよい。連続流動置換免疫測定法において、例えば、結合親和性を減少させる標識抗原またはヘプタンに対する修飾は事実置換反応を促進し、その結果、系の感度を上げる。禁制薬物の検出のために、多くの免疫測定法は一般に禁制薬物自体を、すなわち、標識アンフェタミンおよびメタンフェタミンを、試料中のこれらの物質の存在および含有量の検出のためのトレーサーとして用いる。これら薬物は規制されているから、研究室でのそれらの使用には、一連の操作手順および事務処理が伴う。最近、アンフェタミンおよびメタンフェタミントレーサー合成における出発物質として非−規制薬物の使用が報告されている(Heiman, D.ら, EP 0 371 233 A2)が、合成された最終トレーサーは、やはりアンフェタミン抗体の結合部位としてアンフェタミン分子自体を含んでいる。
【0005】
Fig.1に示すように、トレーサーの合成には種々の方法がある。トレーサー合成の通常の方法の1つは、出発物質として、アンフェタミンおよびメタンフェタミンなどの禁制薬物の使用を含む(Salamamone, S.ら, EP 0 386 644 A2)。これらの出発物質は複数の合成工程を経て、薬物ベースのトレーサーを得る(Fig.1、方法A参照)。トレーサー合成の別法は非−規制薬物を出発物質として使用し、薬物ベースのトレーサーを得るものである(Heiman, D. F. ら, EP 0 371 233 A2)(Fig.1、方法B参照)。これら2つの方法において、合成経路は出発物質、中間体または最終製造トレーサーとして禁制薬物を含む。
【0006】
本発明は、非−規制薬物から製造され、トレーサーとして標識非−規制薬物を生成する新規な1組のトレーサーの合成方法を提供する(Fig.1、方法C参照)。これらの非−規制薬物ベースのトレーサーの合成は、合成過程のいずれの段階でも禁制薬物の製造を含まない。本発明者らはこれらの新規トレーサーが生物学的または水性試料中のアンフェタミンおよびメタンフェタミンの存在および/または含有量を検出する免疫測定法での使用に理想的であるとの知見を得た。本発明者らは、免疫測定法系において抗体が生物学的試料中の分析物より低い親和性のトレーサーに結合する限り、特定の標識分析物自体(すなわち、アンフェタミン)をトレーサーにする必要がないことを知った。本発明の新規トレーサーは特に連続流動置換免疫測定法に有効である。
【発明の開示】
【0007】
発明の要約
本発明は、生物学的または水性試料中のアンフェタミン(APM)、メタンフェタミン(MAPM)およびそれらの誘導体の検出のための免疫測定法における使用に適した新規組成物に関する。本発明で開発されたトレーサー合成方法は、トレーサー合成の出発物質または生成物として禁制薬物、すなわち、アンフェタミンおよびメタンフェタミンを排除する。これらの非−薬物ベースのトレーサーは特に連続流動置換免疫測定法に有用である。本発明は新規トレーサーの合成方法および生物学的試料におけるフェニルエチルアミン誘導体の検出および定量のための蛍光免疫測定法におけるこれらのトレーサーの使用に関する。
【0008】
Fig.2はアンフェタミンおよびメタンフェタミンの基本構造を示す。アンフェタミンおよびメタンフェタミンは本発明の免疫測定法において検出され得る分析物の例である。アンフェタミンはn値が1である。本発明のトレーサーはn値が1より大である。好ましいトレーサーはn値が2またはそれより大である。Fig.3および4は本発明のトレーサー合成に用いられ得る通常の蛍光標識を示す。
【0009】
本発明の具体例において、合成新規トレーサーは、標識された1−メチル−3−フェニルアルキルアミンであり、Fig.5に示される化合物である。
【0010】
本発明の別の具体例において、合成新規トレーサーはN−標識−1−メチル−3−フェニルアルキルアミンであり、Fig.6に示される化合物である。
【0011】
本発明の別の具体例において、合成新規トレーサーは標識N−メチル−1−メチル−3−フェニルアルキルアミンであり、Fig.7に示される化合物である。
【0012】
本発明の別の具体例において、合成新規トレーサーはN−標識N−メチル−1−メチル−3−フェニルアルキルアミンであり、Fig.8に示される化合物である。
【0013】
本発明の好ましい具体例において、合成新規トレーサーは、パラ−ヘミスクシニト−1−メチル−3−フェニルアルキルアミン−N−トリフルオロアセトアミドのスクシニジル活性エステルとCy5EDAとの反応生成物であり、Fig.9および10に示される化合物である。この好ましいトレーサーは実施例IIに記載の方法によって合成される。
【0014】
好ましい具体例の詳細な記載
本発明は生物学的試料中のアンフェタミン、メタンフェタミンおよびそれらの誘導体の存在および/または含有量を検出するための蛍光免疫測定法における使用のための組成物および化合物の合成方法を提供する。生物学的試料中のアンフェタミンおよびメタンフェタミンの検出のための組成物またはトレーサーは特に連続流動置換免疫測定法に適している。
【0015】
連続流動置換免疫測定法において、分析物および抗体の動態学的性質は重要な役割を果たす。分析物は免疫測定法で試験される物質である。例えば、本発明においては、分析物はアンフェタミンまたはメタンフェタミンであってもよい。抗体は分析物を認識し、分析物に特異的に結合し得る。トレーサーは抗体に対する結合について分析物と競合し得る標識された化合物である。本発明は、3つの部分を有するトレーサーを用いる。すなわち、抗体に結合する部位、結合基および標識である。抗体に結合する分析物上の部位は通常抗体に結合するトレーサー上の部位と類似している。言いかえれば、もし、分析物がアンフェタミンのとき、アンフェタミンに対する抗体は分析物上で認識するのと同じトレーサー上の結合部位を認識する。
【0016】
典型的な連続流動置換免疫測定法は、アンフェタミンまたはメタンフェタミンに対する固−相固定抗体を含む。抗体の抗原結合部位は合成標識トレーサーに暴露され、標識合成トレーサー−抗体複合体を形成する。抗体は抗体の抗原結合部位が標識合成トレーサーで飽和されるようにトレーサーに暴露される。ついで、分析物であるアンフェタミンまたは メタンフェタミンを含有する疑いのある生物学的試料が連続して固−相固定抗体−標識合成トレーサー複合体を通過して行く。もし、試料中に分析物が存在すると、分析物は抗体に結合し、標識合成トレーサーと置換される。従って、結合点より下流での標識トレーサーの検出は、生物学的試料中の分析物の存在および含有量を示す(Liglerら、U.S. Pat. No. 5,183,740、記載のすべてをここに引用してこの明細書の記載とする)。
【0017】
連続流動置換免疫測定法ベースの生成物の開発の成功は、抗体からの結合トレーサーのすばやい解離速度を達成し、それによって分析物の迅速な結合を可能にする抗体およびトレーサーの選択による。一般に、理想的な連続流動置換免疫測定法は、抗体が分析物に対して高い親和性を有し、トレーサーに対してはより低い親和性を有する系を用いる。抗体が分析物に対して高い親和性を有し、トレーサーに対してはより低い親和性を有するというこの組合せはより迅速な置換を促進する。本発明において、トレーサーは下記の性質を有する:抗体に対するトレーサーの親和性は、20−100%の範囲のいずれでもよい。好ましいトレーサーは、抗体に対して約40−80%交差−反応性を有する。本発明の目的のために、トレーサーが構造的に分析物であるアンフェタミンまたはメタンフェタミンに関連することは重要ではない。トレーサーのリガンド−結合部位が抗体と20−100%の交差−反応性を有する限り、免疫測定法、具体的には、連続流動置換免疫測定法における使用に適している。アンフェタミンおよびメタンフェタミンに対する抗体の多くはフェニルエチルアミン誘導体を認識する。本発明のトレーサーは、抗体がフェニルエチルアミン類似体を認識し得るかぎり有用である。分析物に対する構造的類似性は問題ではない。この特徴、トレーサーと分析物との間の構造的非類似性は、本発明のトレーサーと先行技術のトレーサーを差別化するものである。
【0018】
トレーサーの標識は、当分野に公知の従来の方法によって行うことができる。標識そのものは、適切には、フルオロフォア、発色団、放射性標識、金属性コロイド、酵素または化学発光もしくは生物発光分子であってもよい。適切なフルオロフォアsおよび発色団は、R. P. Haugland, Molecular Probes, Handbook of Fluorescent Probes and Research Chemicals, 5thEd., Molecular Probes, Inc., Eugene, Oreg., 1992に記載されており、ここに引用して明細書の記載とする。好ましいフルオロフォアの例には、フルオレセイン、ローダミンおよびスルフォインドシアニン染料、Cy5(Mujumdar, R. B.ら、Bioconjugate Chemistry, vol. 4, p. 105 (1992))が含まれる。
【0019】
本発明の使用に用い得る広範囲の抗体は市販されている(例えば、Omega Biologicals, Inc., 910 Technology Blvd., Bozeman, Mont.から)かまたは、文献から入手できる製造方法の記載から製造することができる。モノクローナルまたはポリクローナル抗体などの抗体は、市販されているか、文献に記載されており、広範囲の標的物質の同定のために本発明の方法に採用または適合し得る。
【0020】
この方法は、これらに限定されないが、水、血液、血漿、血清または尿を含む生物学的または水性試料の特定の成分を検出するために用いることができる。唾液は、濫用薬物の検出および測定のための有効な試験材料であることが示されている("Saliva as a Diagnostic Fluid", Ed by D. Malamud and L. Tabak, Annals of the New York Academy of Sciences, 1993, V. 694.)。例えば、唾液試料中のメタンフェタミンは、最終投与2日後までGC/MASSによって検出することができる(S. Suzuki, T. Inoue and S. Inayama, Analysis of methanphetamine in hair, nail, sweat, and saliva by mass fragmentography, J. Anal. Toxicol. 1989, 13, 176-178.)。
【0021】
下記の実施例は本発明の実施に用い得る具体的な技術を含む本発明の具体的な適用を詳述するために記載されている。これらの具体的な実施例は適用に記載されたものに本発明の範囲を限定するものではない。
【実施例】
【0022】
実施例1
標識トレーサーの一般的製造方法
p'、o'およびm'−置換トレーサー合成のフローチャートがFig.12に記載されている。製造工程の詳細な記述は以下の通りである。
【0023】
A.パラ、メタおよびオルト−ニトロアンフェタミン−N−トリフルオロアセトアミドの製造および分離
トリフルオロ無水酢酸0.7 mLをアセトニトリル 1mL中パラ−、メタ−およびオルト−ニトロアンフェタミンの混合物0.4 gの溶液に0℃にてゆっくりと添加した。得られた混合物を0℃にて1時間攪拌し、冷蔵庫中で4℃にて一夜維持した。揮発物質を除去し、粗生成物をシリカゲルカラムにかけ、1:2 酢酸エチル/ヘキサンで溶出させて精製した。この方法で、純粋なパラ−ニトロアンフェタミン−N−トリフルオロアセトアミド0.15 g、純粋なメタ−ニトロアンフェタミン−N−トリフルオロアセトアミド0.03 および純粋なオルト−ニトロアンフェタミン−N−トリフルオロアセトアミド0.04 gを得た。
【0024】
B.パラ−アミノアンフェタミン−N−トリフルオロアセトアミドの製造
製造したパラ−ニトロアンフェタミン−N−トリフルオロアセトアミド0.15 gをエタノール8 mlに溶解した。10%Pd/C 0.4 mgをこの溶液に添加した。混合物をH2下室温にて一夜水素添加した。触媒および溶媒を除去すると、暗緑色の残渣が得られた。得られた混合物を分取シリカ薄層クロマトグラフィーで、展開剤として1/1の酢酸エチル/ヘキサン混合物を用いて精製した。かくして、対応アミン生成物0.75 mgを得た。
【0025】
C.パラ−イソチオシアナトアンフェタミン−N−トリフルオロアセトアミドの製造
ジクロロメタン0.5 ml中パラ−アミノアンフェタミン−N−トリフルオロアセトアミド25 mg の混合物を攪拌し、NaHCO3 15 μlおよびチオホスゲンを混合物に添加した。得られた混合物を室温にて30分攪拌した。ついで反応混合物をシリカプレートで精製し、パラ−イソチオシアナトアンフェタミン−N−トリフルオロアセトアミド21 mgを得た。
【0026】
D.パラ−イソチオシアナトアンフェタミン−N−フルオロアセトアミドとCy5EDAのカップリング
ホウ酸緩衝液(pH8)0.5 ml中パラ−イソチオシアナトアンフェタミン−N−トリフルオロアセトアミド2 mgおよびCy5EDAの混合物を室温にて4時間攪拌した。得られた溶液を直接C18プレートにスポットし、70/30(v/v)メタノール/水で展開した。生成物のバンドを切り取り、メタノールで抽出した。
【0027】
実施例II
好ましいアンフェタミン免疫測定トレーサーの製造
好ましいトレーサー合成のフローチャートがFig.13に記載されている。トレーサーの製造工程の詳細な記述は以下の通りである。
【0028】
工程1:1−メチル−3−フェニルプロピルアミン−N−トリフルオロアセトアミドの製造
アセトニトリル5 ml中1−メチル−3−フェニルプロピルアミン3 gの溶液を室温にて攪拌した。トリフルオロ無水酢酸4 mLおよびピリジン1.3 mLをこの溶液に室温にて添加した。得られた反応混合物を室温にて一夜攪拌し、ついで、混合物を氷水に入れた。粗生成物を酢酸エチルで抽出し、一緒にした有機層をNa2SO4で乾燥した。有機溶媒を除去し、1−メチル−3−フェニルプロピルアミン−N−トリフルオロアセトアミドを得た。
【0029】
工程2:パラ−ヘミスクシニト−1−メチル−3−フェニルプロピルアミン−N−トリフルオロアセトアミドの製造
AlCl3を、ジクロロメタン5 mL 中無水コハク酸0.24 gおよび1−メチル−3−フェニルプロピルアミン−N−トリフルオロアセトアミド0.4 gの混合物に室温にて添加した。得られた混合物を0℃にて1時間攪拌し、ついで室温にて一夜放置した。3M HCl水溶液5 mlを混合物に添加し、有機層を酢酸エチルで抽出した。一緒にした有機層をNa2SO4で乾燥し、粗生成物0.5 gを得た。粗生成物をさらにシリカゲルカラムで、1:2 エチル/ヘキサンで溶出させて精製を完了した。純粋なパラ−ヘミスクシニト−1−メチル−3−フェニルプロピルアミン−N−トリフルオロアセトアミド0.3 gを得た。
【0030】
工程3:パラ−ヘミスクシニト−1−メチル−3−フェニルプロピルアミン−N−トリフルオロアセトアミドの還元
製造したパラ−ヘミスクシニト−1−メチル−3−フェニルプロピルアミン−N−トリフルオロアセトアミド0.2 gを酢酸3 mlに溶解した。10%Pd/C 0.3 mgをこの溶液に添加した。混合物をH2下室温にて一夜水素添加し、触媒および溶媒を除去すると、油状の残渣が残った。得られた混合物を分取シリカTLCで、展開剤として、1:1比の酢酸エチル/ヘキサンを用いて精製した。純粋な還元パラ−ヘミスクシニト−1−メチル−3−フェニルプロピルアミン−N−トリフルオロアセトアミド83 mgを得た。
【0031】
工程 4:パラ−ヘミスクシニト−1−メチル−3−フェニルプロピルアミン−N−トリフルオロアセトアミドのスクシニミジル活性エステルの製造
N,N'−ジスクシンミジルカーボネート40 mgおよびピリジン60 μlを、アセトニトリル1 mL中パラ−ヘミスクシニト−1−メチル−3−フェニルプロピルアミン−N−トリフルオロアセトアミド40 mgの攪拌混合物に添加した。得られた混合物を室温にて4時間攪拌した。反応混合物をシリカプレートで精製し、パラ−ヘミスクシニト−1−メチル−3−フェニルプロピルアミン−N−トリフルオロアセトアミドのスクシニミジル活性エステル25 mgを得た。
【0032】
工程5:パラ−ヘミスクシニト−1−メチル−3−フェニルプロピルアミン−N−トリフルオロアセトアミドのスクシニミジル活性エステルとCy5EDAのカップリング
ホウ酸緩衝液(pH9)0.5 ml中パラ−ヘミスクシニト−1−メチル−3−フェニルプロピルアミン−N−トリフルオロアセトアミドのスクシニミジル活性エステル2 mgおよびCy5EDA2.5 mgの混合物を室温にて4時間攪拌した。得られた溶液をC18プレートにかけ、70/30(v/v)の割合のメタノール/水で展開した。生成物のバンドを切り取り、メタノールで抽出した。カップリング生成物は好ましいアンフェタミン免疫測定トレーサーである。
【0033】
実施例III
流動免疫測定法の操作
ライフポイント・インコーポレイテッドは、連続流動置換免疫測定法を行うための必要なポンプ、バルブ、配管、交換可能カラムおよび蛍光検出器を含む流動免疫測定法装置を開発した。アンフェタミン標準曲線を、陰性の唾液に種々の濃度のアンフェタミン(Sigma Chemicals, St. Louis, Mo.)を添加して作成した。化学薬品および緩衝液はシグマおよびアルドリッチ・カンパニーから入手した。
【0034】
(a)試薬の製造
唾液中のアンフェタミンの存在の測定のために、特異的抗−アンフェタミンモノクローナル抗体(例えば、Omega Biologicals, Inc., Bozeman, Mont.から入手可能)を、製造業社の標準プロトコルに従ってエンフェース(Emphase)多孔性ビーズに結合または固定した。抗体−結合ビースをついで製造したCy5−標識アンフェタミントレーサーで飽和させた。得られたトレーサー−抗体−樹脂複合体混合物を一夜4℃にて回転混合させながら放置した。複合樹脂を0.1M PBS(10% MeOH)で安定的な基準線が得られるまで洗滌した。洗滌した樹脂を等容量の50 mM PBS(pH 7.4)中150 mMトレハロース緩衝液に添加した。樹脂を凍結−乾燥した。
【0035】
(b)流動測定法
内直径2 mmおよび長さ10 mmのミクロ−ポリスチレンカラムに製造した樹脂4 mgを充填した。充填したカラムをライフポイント免疫測定法装置の5つの流動導管の1つに取り付けた。カラムはラブビューソフト(Labview software, National Instruments, Inc.)で支持された自動システムで制御された適当な緩衝液で予−洗した。唾液試料50 μlを、流速100〜300 μl/分で導管を通過させた。蛍光シグナルの平均強度を試料中のアンフェタミン濃度の測定のために用いた。
【0036】
実施例IV:好ましいメタンフェタミン免疫測定トレーサーの製造
工程1:N−メチル−1−メチル−3−フェニルプロピルアミン−N−トリフルオロアセトアミドの製造
アセトニトリル1 ml中N−メチル−1−メチル−3−フェニルプロピルアミン0.4 gの溶液を攪拌した。トリフルオロ無水酢酸1 mlおよびピリジン0.6 mlをこの溶液に室温にて添加し、得られた混合物を一夜室温にて攪拌した。次に、混合物を氷水に入れた。粗生成物を酢酸エチルで抽出し、有機層を一緒にし、Na2SO4で乾燥した。有機溶媒を除去して所望の生成物を得た。TLC分析でこの生成物が次の合成工程に十分純粋であることを確認した。
【0037】
工程2:p'−ヘミスクシニト−N−メチル−1−メチル−3−フェニルプロピルアミン−N−トリフルオロアセトアミドの製造
AlCl3 0.2 gを、ジクロロメタン5 mL 中無水コハク酸0.1 gおよびN−メチル−1−メチル−3−フェニルプロピルアミン−N−トリフルオロアセトアミド0.2 gの混合物に室温にて添加した。得られた混合物を2℃〜8℃にて1時間攪拌し、ついで室温にて一夜放置した。3M HCl水溶液2 mlを混合物に添加し、生成物を酢酸エチルで抽出した。有機層を一緒にし、Na2SO4で乾燥し、粗生成物0.2 gを得た。粗生成物をさらにシリカゲルカラムで、エチル/ヘキサン(1:2)で溶出させて精製を完了し、純粋な生成物0.12 gを得た。
【0038】
工程3:パラ−ヘミスクシニト−N−メチル−1−メチル−3−フェニルプロピルアミン−N−トリフルオロアセトアミドの還元
製造したパラ−ヘミスクシニト−1−メチル−3−フェニルプロピルアミン−N−トリフルオロアセトアミド0.2 gを酢酸3 mlに溶解した。10%Pd/C 0.3 mgをこの溶液に添加した。混合物をH2下室温にて一夜水素添加した。触媒および溶媒を除去し、油状の残渣を得た。得られた混合物をシリカTLCで、展開剤として、(1:1)酢酸エチル/ヘキサンを用いて精製した。工程終了後に純粋な生成物62 mgを得た。
【0039】
工程4:パラ−ヘミスクシニト−1−メチル−3−フェニルプロピルアミン−N−トリフルオロアセトアミドのスクシニミジル活性エステルの製造
アセトニトリル1 mL中にパラ−ヘミスクシニト−1−メチル−3−フェニルプロピルアミン−N−トリフルオロアセトアミド40 mgを攪拌しながら入れた。N,N'−ジスクシニミジルカーボネート40 mgおよびピリジン60 μlをこの溶液に添加した。得られた混合物を室温にて4時間攪拌した。反応混合物をシリカプレートで精製し、パラ−ヘミスクシニト−1−メチル−3−フェニルプロピルアミン−N−トリフルオロアセトアミドのスクシニミジル活性エステル25 mgを得た。
【0040】
工程5:パラ−ヘミスクシニト−1−メチル−3−フェニルプロピルアミン−N−フルオロアセトアミドのスクシニミジル活性エステルとCy5EDAのカップリング
パラ−ヘミスクシニト−1−メチル−3−フェニルプロピルアミン−N−トリフルオロアセトアミドのスクシニミジル活性エステル2 mgを、ホウ酸緩衝液(pH9)0.5 ml中およびCy5EDA2.5 mgと混合した。この溶液を室温にて4時間攪拌し、得られた溶液を直接C18プレートにスポットし、70/30−メタノール/水で展開した。生成物のバンドを切り取り、パラ−ヘミスクシニト−1−メチル−3−フェニルプロピルアミン−N−フルオロアセトアミドのスクシニミジル活性エステルとCy5EDAのカップリング生成物をメタノールで抽出した。
【0041】
実施例V
唾液中のアンフェタミンの流動免疫測定法
(a)試薬の製造
選択された抗−アンフェタミンモノクローナル抗体(例えば、Omega Biologicals, Inc., Bozeman, Mont.から入手可能)を、製造業社の標準プロトコルに従ってエンフェース多孔性ビーズに結合または固定し、GW3−38、本発明の新規トレーサー(Fig.9)などの製造されたトレーサーおよびGW5−12、従来のトレーサー(Fig.11)で飽和させた。得られた複合体混合物を一夜4℃にて回転混合させながら放置した。複合体樹脂を0.1M PBS(10% MeOH)で安定的な基準線が得られるまで洗滌した。洗滌した樹脂を等容量の50 mM PBS(pH 7.4)中150 mMトレハロース緩衝液に添加した。樹脂を凍結−乾燥した。
【0042】
a)流動測定法の操作
内直径2 mmおよび長さ10 mmのミクロ−ポリスチレンカラムに製造した樹脂4 mgを充填した。充填したカラムをライフポイント免疫測定法装置の5つの流動導管の1つに取り付けた。カラムはラブビューソフト(Labview software, National Instruments, Inc.)で支持された自動システムで制御された適当な緩衝液で予−洗した。その後、試験試料50 μlを、流速100 μl/分、ついで0.2%BSA/PBS緩衝液350 μlを導管を通過させた。
【0043】
b)結果
蛍光シグナルの平均強度を試料中の薬物濃度の測定のために用いた。トレーサーGW3−38およびGW5−12を用いるアンフェタミンの流動免疫測定法の比較をFig.14およびFig.15に示した。本発明の好ましいトレーサーは従来のトレーサーのほぼ10倍(10X)のシグナル強度を示している。
【図面の簡単な説明】
【0044】
【図1】Fig.1はトレーサーの製造方法を示す。方法Aは、出発物質として禁制薬物の使用を含み、薬物ベースのトレーサーを生成する。方法Bは、非−規制物質の使用を含み、薬物ベースのトレーサーを生成する。方法Cは、出発物質として非−規制物質を用い、非−規制物質ベースのトレーサーを生成する本発明のトレーサー合成方法を開示する。
【図2】Fig.2はアンフェタミンおよびメタンフェタミンの基本構造を示す。
【図3】Fig.3は本発明のトレーサー製造に用い得る通常の蛍光標識を示す。
【図4】Fig.4は本発明のトレーサー製造に用い得る通常の蛍光標識を示す。
【図5】Fig.5は合成新規トレーサー化合物、N−標識1−メチル−3−フェニルアルキルアミンを示す。
【図6】Fig.6は合成新規トレーサー化合物、標識1−メチル−3−フェニルアルキルアミンを示す。
【図7】Fig.7は合成新規トレーサー化合物、標識N−メチル−1−メチル−3−フェニルアルキルアミンを示す。
【図8】Fig.8は合成新規トレーサー化合物、N−標識N−メチル−1−メチル−3−フェニルアルキルアミンを示す。
【図9】Fig.9は好ましい合成新規トレーサー化合物である、標識されたパラ−ヘミスクシニト−1−メチル−3−フェニルプロピルアミン−N−トリフルオロアセトアミドのスクシニミジル活性エステルとCy5EDAとの反応生成物を示す。
【図10】Fig.10は好ましい合成新規トレーサー化合物である、標識されたパラ−ヘミスクシニト−N−メチル−1−メチル−3−フェニルプロピルアミン−N−トリフルオロアセトアミドのスクシニミジル活性エステルとCy5EDAとの反応生成物を示す。
【図11】Fig.11は従来の(薬物ベース)トレーサー、GW5−12を示す。
【図12】Fig.12はp', m'およびo'−置換アンフェタミントレーサーの一般的な製造工程を記載したフローチャートを示す。
【図13】Fig.13は本発明の好ましいトレーサーの1種の合成工程を記載したフローチャートを示す。
【図14】Fig.14は、Fig.9に記載の好ましい非−薬物ベースのトレーサーによるアンフェタミンの流動免疫測定の結果を示す。Fig.14と15は流動免疫測定法による好ましいトレーサーのGW3−38と従来のトレーサーのGW5−12を用いるアンフェタミンの測定の比較を示す。
【図15】Fig.15は、Fig.11に記載の従来の薬物ベースのトレーサーを用いるアンフェタミンの流動免疫測定の結果を示す。Fig.14と15は流動免疫測定法による好ましいトレーサーのGW3−38と従来のトレーサーのGW5−12を用いるアンフェタミンの測定の比較を示す。
Claims (13)
- 標識が、フルオロフォア、発色団、放射性標識、金属性コロイド、酵素または化学発光もしくは生物発光分子からなる群から選ばれる、請求項1〜4のいずれか1項記載の合成トレーサー。
- 標識が、Fig.3および4に記載の蛍光染料であり、式中:
(a)mが、0、1、2、3および4からなる群から選ばれ数であり;および
(b)Xが、OSuおよびEDAからなる群から選ばれる基である、
請求項1〜4のいずれか1項記載の合成トレーサー。 - 試料中のアンフェタミンおよびその誘導体の存在および含有量の測定方法であって、工程:
(a)アンフェタミンの固相−固定抗体を準備し、
(b)抗体の抗原結合部位を、請求項1〜4のいずれか1項に記載の合成トレーサーに暴露させ、固相−固定・標識合成トレーサー−抗体複合体(ここで、抗体の抗原結合部位が標識合成トレーサーで飽和されている)を形成させ、
(c)アンフェタミンを含む疑いのある試料を、固相−固定・標識抗原−抗体複合体を通過して非平衡条件下連続して流し、および
(d)置換された請求項1〜4のいずれか1項に記載の標識合成トレーサーを検出し、上記置換された標識合成トレーサーの量が、試料中の上記アンフェタミンの濃度に直接比例している
を含むことを特徴とする方法。 - 試料が、唾液、全血、血清、血漿または尿などの生物学的試料である、請求項7記載の方法。
- 試料が、水性試料である、請求項7記載の方法。
- 特異的抗体が、アンフェタミンおよびそれらの誘導体に特異的なモノクローナル抗体またはポリクローナル抗体である、請求項7記載の方法。
- Fig.9に記載の化合物を含むことを特徴とする、試料中のアンフェタミンおよびその誘導体の存在または含有量の検出のための免疫測定法に使用するための合成トレーサー。
- Fig.10に記載の化合物を含むことを特徴とする、試料中のアンフェタミンおよびその誘導体の存在または含有量の検出のための免疫測定法に使用するための合成トレーサー。
- トレーサーがFig.2に記載のフェニルアルキルアミン(ここで、n>1)を含むことを特徴とする、試料中にアンフェタミンおよびその誘導体の存在または含有量の検出のための免疫測定法に使用するための合成トレーサー。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US09/730,095 US6472228B2 (en) | 2000-12-04 | 2000-12-04 | Composition and methods for synthesis of novel tracers for detecting amphetamine and methamphetamine in samples |
| PCT/US2001/045024 WO2002057739A2 (en) | 2000-12-04 | 2001-11-29 | Composition and methods for synthesis of novel tracers for detecting amphetamine and methamphetamine in samples |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2004525359A true JP2004525359A (ja) | 2004-08-19 |
| JP2004525359A5 JP2004525359A5 (ja) | 2005-06-30 |
Family
ID=24933880
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2002557773A Withdrawn JP2004525359A (ja) | 2000-12-04 | 2001-11-29 | 試料中のアンフェタミンおよびメタンフェタミンの新規トレーサーの組成物および合成方法 |
Country Status (5)
| Country | Link |
|---|---|
| US (1) | US6472228B2 (ja) |
| EP (1) | EP1340081A4 (ja) |
| JP (1) | JP2004525359A (ja) |
| CA (1) | CA2433195A1 (ja) |
| WO (1) | WO2002057739A2 (ja) |
Families Citing this family (16)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7314569B2 (en) * | 2003-04-04 | 2008-01-01 | Arrowhead Center, Inc. | Treatment of arsenic-contaminated water using akaganeite adsorption |
| BRPI0410792B8 (pt) * | 2003-05-29 | 2021-05-25 | New River Pharmaceuticals Inc | compostos de anfetamina resistentes à dependencia |
| US7341841B2 (en) * | 2003-07-12 | 2008-03-11 | Accelr8 Technology Corporation | Rapid microbial detection and antimicrobial susceptibility testing |
| US20120077206A1 (en) | 2003-07-12 | 2012-03-29 | Accelr8 Technology Corporation | Rapid Microbial Detection and Antimicrobial Susceptibility Testing |
| CA2532414C (en) | 2003-07-12 | 2017-03-14 | Accelr8 Technology Corporation | Sensitive and rapid biodetection |
| US20050136405A1 (en) * | 2003-12-17 | 2005-06-23 | James Linder | Novel method for the detection of cancer biomarkers in cervical specimens |
| US7037669B2 (en) * | 2004-03-22 | 2006-05-02 | Dade Behring Inc. | Assays for amphetamine and methamphetamine using stereospecific reagents |
| GB2404022B (en) | 2004-06-14 | 2005-08-10 | Cozart Bioscience Ltd | Competitive assays for the detection of methamphetamine group drugs |
| GB2404023B (en) | 2004-07-02 | 2005-07-06 | Cozart Bioscience Ltd | Delta-9-tetrahydrocannabinol detection method |
| JP2008533167A (ja) | 2005-03-15 | 2008-08-21 | アプレラ コーポレイション | 分析物の検出のための、抗体の代替抗原系の使用 |
| US10254204B2 (en) | 2011-03-07 | 2019-04-09 | Accelerate Diagnostics, Inc. | Membrane-assisted purification |
| EP2683831B1 (en) | 2011-03-07 | 2015-09-23 | Accelerate Diagnostics, Inc. | Rapid cell purification systems |
| US9677109B2 (en) | 2013-03-15 | 2017-06-13 | Accelerate Diagnostics, Inc. | Rapid determination of microbial growth and antimicrobial susceptibility |
| US10023895B2 (en) | 2015-03-30 | 2018-07-17 | Accelerate Diagnostics, Inc. | Instrument and system for rapid microogranism identification and antimicrobial agent susceptibility testing |
| US10253355B2 (en) | 2015-03-30 | 2019-04-09 | Accelerate Diagnostics, Inc. | Instrument and system for rapid microorganism identification and antimicrobial agent susceptibility testing |
| CN114890958B (zh) * | 2022-02-23 | 2023-10-20 | 四川警察学院 | 双光子染料化合物、其制备方法及其应用 |
Family Cites Families (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4868132A (en) | 1987-02-03 | 1989-09-19 | Abbott Laboratories | Fluorescence polarization immunoassay for amphetamine/methamphetamine |
| DE68924243T2 (de) | 1988-10-28 | 1996-03-28 | Abbott Lab | Verfahren und Reagenzien zum Nachweis von Amphetamin und/oder d-Methamphetamin in biologischen Proben. |
| US5135863A (en) | 1988-12-23 | 1992-08-04 | Syntex (U.S.A.) Inc. | Compositions and methods for determining the presence of amphetamines in a sample suspected of containing amphetamine and/or methamphetamine |
| EP0386644B1 (en) | 1989-03-10 | 1997-06-04 | F. HOFFMANN-LA ROCHE & CO. Aktiengesellschaft | Reagents for the determination of drugs |
| US5101015A (en) * | 1989-04-10 | 1992-03-31 | Abbott Laboratories | Reagents for an amphetamine-class fluorescence polarization immunoassay |
| US5183740A (en) | 1990-02-23 | 1993-02-02 | The United States Of America As Represented By The Secretary Of The Navy | Flow immunosensor method and apparatus |
| CA2096495C (en) * | 1992-06-16 | 2002-07-09 | Kathy Palmer Ordonez | Dual analyte immunoassay |
| US6020209A (en) | 1997-04-28 | 2000-02-01 | The United States Of America As Represented By The Secretary Of The Navy | Microcapillary-based flow-through immunosensor and displacement immunoassay using the same |
-
2000
- 2000-12-04 US US09/730,095 patent/US6472228B2/en not_active Expired - Fee Related
-
2001
- 2001-11-29 WO PCT/US2001/045024 patent/WO2002057739A2/en not_active Application Discontinuation
- 2001-11-29 JP JP2002557773A patent/JP2004525359A/ja not_active Withdrawn
- 2001-11-29 CA CA002433195A patent/CA2433195A1/en not_active Abandoned
- 2001-11-29 EP EP01993187A patent/EP1340081A4/en not_active Withdrawn
Also Published As
| Publication number | Publication date |
|---|---|
| EP1340081A2 (en) | 2003-09-03 |
| WO2002057739A3 (en) | 2003-01-23 |
| US6472228B2 (en) | 2002-10-29 |
| WO2002057739A2 (en) | 2002-07-25 |
| CA2433195A1 (en) | 2002-07-25 |
| US20020090661A1 (en) | 2002-07-11 |
| EP1340081A4 (en) | 2005-08-03 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US6472228B2 (en) | Composition and methods for synthesis of novel tracers for detecting amphetamine and methamphetamine in samples | |
| US4476229A (en) | Substituted carboxyfluoresceins | |
| US4510251A (en) | Fluorescent polarization assay for ligands using aminomethylfluorescein derivatives as tracers | |
| GB2111476A (en) | Substituted carboxy- fluoresceins and their use in fluorescence polarization immunoassay | |
| JPH06211867A (ja) | 蛍光化合物 | |
| EP2950104B1 (en) | Immunoassay for compounds of the nbome family | |
| EP0107134A1 (en) | Tricyclic antidepressant drug immunogens, antibodies, labeled conjugates, and related derivatives | |
| JP4570601B2 (ja) | 三環系抗うつ薬誘導体およびイムノアッセイ | |
| JPS6176464A (ja) | 化学ルミネッセンス化合物およびこれを用いる発光計量免疫検定法 | |
| EP0371253B1 (en) | Method and reagents for detecting amphetamine and/or d-methamphetamine in biological samples | |
| US9435817B2 (en) | Detection of synthetic cannabinoids | |
| US6686209B2 (en) | Reagents for detecting cannabinoids | |
| CN111499555A (zh) | 双光子荧光标记探针及其合成方法和新冠病毒诊断的应用 | |
| US10539557B2 (en) | AH-7921 Detection | |
| JP2968910B2 (ja) | 1α,25(OH)2ビタミンD3に対する抗体及びその用途 | |
| JP2758965B2 (ja) | テトリルータンパク質コンジュゲート | |
| AU2002245045A1 (en) | Composition and methods for synthesis of novel tracers for detecting amphetamine and methamphetamine in samples | |
| US10775394B2 (en) | Immunoassay for phenethylamines of the 2C and DO sub-families | |
| EP2698383A1 (en) | Detection of synthetic Cannabinoids | |
| JP3431825B2 (ja) | 抗pahモノクローナル抗体およびそれを産生する細胞株 | |
| AU2002254093A1 (en) | Novel Reagents for Detecting Cannabinoids | |
| EP3366706A1 (en) | U-47700 immunoassay | |
| Class et al. | Patent application title: IMMUNOASSAY FOR COMPOUNDS OF THE NBOMe FAMILY Inventors: Ivan Robert Mcconnell (Ardmore Crumlin, GB) Elouard Benchikh (Crumlin, GB) Elouard Benchikh (Crumlin, GB) Peter Fitzgerald (Crumlin, GB) Peter Fitzgerald (Crumlin, GB) Andrew Philip Lowry (Ardmore Crumlin, GB) | |
| CN117147819A (zh) | 浓度估计试剂盒和浓度估计方法 | |
| JPH07234222A (ja) | 1,5−アンヒドログルシトールの定量方法及び抗体 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20041118 |
|
| A761 | Written withdrawal of application |
Free format text: JAPANESE INTERMEDIATE CODE: A761 Effective date: 20060523 |