JP2004508280A - 活性化プロテインc(apc)の神経保護薬、抗血栓薬および抗炎症薬としての使用 - Google Patents
活性化プロテインc(apc)の神経保護薬、抗血栓薬および抗炎症薬としての使用 Download PDFInfo
- Publication number
- JP2004508280A JP2004508280A JP2001556226A JP2001556226A JP2004508280A JP 2004508280 A JP2004508280 A JP 2004508280A JP 2001556226 A JP2001556226 A JP 2001556226A JP 2001556226 A JP2001556226 A JP 2001556226A JP 2004508280 A JP2004508280 A JP 2004508280A
- Authority
- JP
- Japan
- Prior art keywords
- apc
- subject
- disease
- protein
- inflammatory
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/43—Enzymes; Proenzymes; Derivatives thereof
- A61K38/46—Hydrolases (3)
- A61K38/48—Hydrolases (3) acting on peptide bonds (3.4)
- A61K38/49—Urokinase; Tissue plasminogen activator
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/43—Enzymes; Proenzymes; Derivatives thereof
- A61K38/46—Hydrolases (3)
- A61K38/48—Hydrolases (3) acting on peptide bonds (3.4)
- A61K38/482—Serine endopeptidases (3.4.21)
- A61K38/4866—Protein C (3.4.21.69)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/08—Antiepileptics; Anticonvulsants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
- A61P25/16—Anti-Parkinson drugs
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/02—Non-specific cardiovascular stimulants, e.g. drugs for syncope, antihypotensives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/14—Hydrolases (3)
- C12N9/48—Hydrolases (3) acting on peptide bonds (3.4)
- C12N9/50—Proteinases, e.g. Endopeptidases (3.4.21-3.4.25)
- C12N9/64—Proteinases, e.g. Endopeptidases (3.4.21-3.4.25) derived from animal tissue
- C12N9/6421—Proteinases, e.g. Endopeptidases (3.4.21-3.4.25) derived from animal tissue from mammals
- C12N9/6424—Serine endopeptidases (3.4.21)
- C12N9/6464—Protein C (3.4.21.69)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y304/00—Hydrolases acting on peptide bonds, i.e. peptidases (3.4)
- C12Y304/21—Serine endopeptidases (3.4.21)
- C12Y304/21069—Protein C activated (3.4.21.69)
Landscapes
- Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Organic Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Biomedical Technology (AREA)
- Public Health (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Neurology (AREA)
- Neurosurgery (AREA)
- Zoology (AREA)
- Wood Science & Technology (AREA)
- Genetics & Genomics (AREA)
- Gastroenterology & Hepatology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Epidemiology (AREA)
- Immunology (AREA)
- General Engineering & Computer Science (AREA)
- Biochemistry (AREA)
- Cardiology (AREA)
- Heart & Thoracic Surgery (AREA)
- Biotechnology (AREA)
- Pain & Pain Management (AREA)
- Microbiology (AREA)
- Molecular Biology (AREA)
- Vascular Medicine (AREA)
- Psychology (AREA)
- Urology & Nephrology (AREA)
- Hospice & Palliative Care (AREA)
- Psychiatry (AREA)
- Rheumatology (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Abstract
Description
(技術分野)
本発明は、一般的には、疾病治療のための、抗凝固、抗炎症作用を併せ持つ新規クラスの神経保護薬の使用方法に関し、さらに具体的には、このような疾病の治療を目的とする活性化プロテインC(APC)の使用に関する。
【0002】
(背景技術)
セリンプロテアーゼは、他のタンパク質をタンパク質加水分解により切断するタンパク質の1クラスである。このタンパク質クラスのメンバーは、補体活性化および血液凝固のタンパク質加水分解カスケード反応などの重要な生物学的過程に寄与する。血液凝固因子の切断は凝固カスケードに寄与し、その結果、血液凝固が起こる。様々な医学的状況において、1または別のタンパク質加水分解段階のレベルで凝固カスケードを阻害することが有利な場合がある。さらに、血液製剤操作を必要とする手順は、凝固カスケードのメンバーを活性化する可能性があるため、その特異的阻害が有利である。セリンプロテアーゼの神経保護作用は、これまで認識されていなかった。
【0003】
プロテインC(PC)は、ビタミンK依存性セリンプロテアーゼ凝固因子のクラスのメンバーである。プロコアギュラントである凝固因子(例えば、第VIIa因子、第IXa因子、第Xa因子、第XIIa因子、トロンビン、プラスミンまたは血漿カリクレインの大多数とは違って、プロテインCは、不活性の形態(抗凝固酵素を生成するために、タンパク質加水分解活性を必要とする)で血液中を循環する天然の抗凝固剤として作用することにより、血液凝固を調節する。活性化された形態のプロテインC、すなわちAPCは、凝固カスケードにおける第V因子と第VIII因子のレベルで血液凝固を阻害する。
【0004】
細胞外プロテアーゼの他の大部分のチモーゲン(酵素前駆体)および上述した血液凝固因子と同様に、プロテインCはキモトリプシンファミリーのコア構造をもっており、上記チモーゲンおよび酵素の調節を可能にする挿入部およびN末端延長部を有する(Owen W., Hemostasis and Thrombosis:Basic Principles and Clinical Practice, Colmanら編、pp. 235−241, J.B. Lippincott Co.(フィラデルフィア)、1987参照)。
【0005】
プロテインCは別々の構造および機能を有するドメインから構成される(Fosterら、Proc. Natl. Acad. Sci. USA. 82:4673−4677(1985)およびPlutzkyら、Proc. Natl. Acad. Sci. USA. 83:546−550(1986))。軽鎖は、アミノ末端γカルボキシグルタミン酸(Gla)領域を含み、これに、上皮増殖因子(EGF)前駆体中のドメインと相同である2つのドメインが続く。セリンプロテアーゼ活性は重鎖中に存在する。
【0006】
チモーゲンは、重鎖の位置番号15のアルギニン残基と、位置16のロイシン残基との間の部位で、トロンビンの作用により活性化される(キモトリプシンの番号付け)(Kisiel, J. Clin. Invest., 64:761−769(1976);Marlarら、Blood, 59:1067−1072(1982);Fisherら、Protein Science, 3:588−599(1994)を参照)。因子Xa(Haleyら、J. Biol. Chem. 264:16303−16310(1989))、ラッセルクサリヘビ毒およびトリプシン(Esmonら、J. Biol. Chem., 251:2770−2776(1976))など、他のタンパク質も、不活性プロテインCを酵素的に切断して、その活性化形態に変換することがわかっている。活性化プロテインC(APC)は、重鎖のSer−195、His−57およびAsp−102(キモトリプシンの番号付け)に存在する触媒アミノ酸残基のコアトライアド(core triad)を介して、アルギニンエステルおよび関連基質を加水分解する。該酵素の特異性は少数のタンパク質基質に制限されており、血液凝固補因子、活性化された第VおよびVIII因子、ならびに第VおよびVIII因子が、活性化プロテインCによるタンパク質加水分解不活性化のための既知の巨大分子基質である(Kisielら、Biochem., 16:5824−5831(1977);Veharら、Biochem., 19:401−410(1980);およびWalkerら、Biochim. Biophys. Acta., 571:333−342(1979))。
【0007】
トロンビンは、主要な生理学的プロテインCアクチベーターであると考えられ、生理学的濃度のカルシウムの存在下にあるとき、精製された系、血漿、または血液中で、プロテインCをゆっくりと活性化する。プロテインC活性化を促進する、トロンボモジュリンと呼ばれる膜結合型トロンビン受容体が同定されている。トロンビンは、内皮細胞の内腔表面上のトロンボモジュリンと結合し、プロテインCに対する特異性を増加する。この過程にはカルシウムが必要である。更なる研究によって、プロテインCの膜−脂質結合ドメイン(ビタミンK依存性Glaドメイン)もまた、プロテインCの正常な活性化に必要であることが明らかにされた(Esmonら、”Progress in Vascular Biology, Hemostasis, and Thrombosis”, Ruggeriら編、Annals of The New York Academy of Sciences, Vol. 614:30−43(1991))。内皮プロテインC受容体(EPCR)は、トロンボモジュリンと結合したトロンビンによるプロテインC活性化を増強する。
【0008】
血栓症および血栓塞栓症、すなわち、ヒト患者の血管系における閉塞性血栓の発生は、重大な臨床上の問題を引き起こし、罹病率および死亡率の大きな原因である。動脈血栓は心筋梗塞(MI)および脳虚血(発作)の原因であり、また、静脈血栓は深静脈血栓(DVT)および肺塞栓症(PE)を引き起こす。血栓によって生じる臨床上の課題の大きさは、罹病率および死亡率の統計値に表れている。年齢が50歳以上の男性における主な死亡原因の1つは急性MIであり、発作は依然として衰弱性で予測不可能な疾患である。
【0009】
深静脈血栓症は一般的な疾患である。十分に確証されている危険因子として、最近の外科手術、悪性疾患、妊娠および分娩、長期固定化、ならびに、凝固系統の主要阻害物質うちの1つの欠損が挙げられる。主要阻害物質としては、プロテインC、プロテインSおよびアンチトロンビンが知られている。多くの患者における深静脈血栓症の原因はいまだに不明である。しかし、近年、静脈血栓症の遺伝的傾向を有する多数の家族には、活性化プロテインC(APC)に対する抗凝固応答が乏しいことが確認されている。
【0010】
炎症は、損傷および感染に対する身体の反応である。炎症には、次の3つの主な事象が関与する:(1)損傷または感染部位に対する血液供給の増加;(2)内皮細胞の収縮により可能にされた毛細管透過性の増加;ならびに、(3)毛細管から、周辺組織への白血球の移動(以後、細胞浸潤と呼ぶ)(Roittら、Immunology, Grower Medical Publishing、ニューヨーク、1989)。
【0011】
毛細管透過性の増加により、通常なら通過できないような、大きな分子が内皮を通過することができるため、白血球のような免疫メディエーターが、損傷部位や感染部位に到達することができる。白血球、主として、好中多形核球(多形核白血球、好中球またはPMNとしても知られる)およびマクロファージは、化学走性として知られる過程により、損傷部位に移動する。炎症部位では、組織損傷および補体活性化により、C5aのような化学走性ペプチドの放出が起こる。また、補体活性化産物は、食細胞、マスト細胞および好塩基球の脱顆粒、平滑筋収縮、ならびに、血管透過性の増加が起こる原因となる(Mulliganら、J. Immunol. 148:1479−1485(1991))。
【0012】
外来抗原および生物に対する宿主防御のためには、白血球が、血管壁を通過して血管外組織に到達する必要があるが、白血球−内皮相互作用は、宿主に有害な影響をもたらすことが多い。例えば、接着および内皮貫通移動の過程で、白血球は酸化剤、プロテアーゼおよびサイトカインを放出し、これらは、内皮を直接損傷したり、あるいは、内皮機能障害を引き起こしたりする。いったん血管外部位に到達すると、遊出した白血球は、様々な炎症媒介物質を放出し、これによって組織損傷にさらに寄与する。その上、毛細管内腔に白血球が一度閉塞したり、あるいは、それより大きな血管内で白血球が凝集したりすると、微小血管閉塞や虚血の原因となる。白血球が介在する血管および組織の損傷は、急性および慢性の同種移植拒絶、脈管炎、リウマチ様およびその他の形態の炎症に起因する関節炎、炎症性皮膚病、成人呼吸促進症候群、心筋梗塞、ショック、発作、器官移植、挫傷および下肢再移植のような虚血−再灌流症候群など、非常に多様な臨床疾患の病因に関与してきた。
【0013】
その他の多くの重症の臨床状態は、ヒトでは、根底にある炎症過程を巻き込む。例えば、多発性硬化症(MS)は中枢神経系の炎症性疾患である。MSでは、循環白血球が炎症を起こした脳内皮に浸潤してミエリンを損傷し、その結果、神経伝導を損ない、麻痺を引き起こす(Yednockら、Nature 366:63−66(1992))。全身性エリテマトーデス(SLE)は、自己抗原特異的抗体により引き起こされる組織損傷の存在を特徴とする自己免疫疾患である。様々な器官にある抗原と結合した自己抗体により、補体媒介および炎症細胞媒介の組織損傷が起こる(Theofilopoubs, A.N., Encyclopedia of Immunology, pp. 1414−1417(1992))。
【0014】
再灌流損傷は、炎症系の活性化および白血球−内皮細胞(EC)接着の増加に関連する別の病状である。接着促進分子が、白血球と内皮細胞間の相互作用を促進し、急性炎症性反応および付随する組織損傷に重要な役割を果たすことを示す多くの証拠がある。例えば、IgG免疫複合体の沈着により起こるか、もしくはコブラヘビ毒因子(CVF)の静脈内注射後に起こる急性肺損傷では、好中球活性化および毒性酸素代謝物の発生によって、急性損傷が生じる(Mulliganら、J. Immunol. 150(6):2401−2405(1992))。また、好中球(PMN)は、骨格筋および心筋、腎およびその他の組織における虚血/再灌流を媒介することが知られている(Pembertonら、J. Immunol. 150:5104−5113(1993))。
【0015】
炎症性細胞、特に、好酸球、好中球およびTリンパ球による気道の浸潤は、アトピーまたはアレルギー性喘息に特有の特徴である(Cotranら、Pathological Basis of Disease, W. B. Saunders、フィラデルフィア、1994)。膵島β細胞の破壊を引き起こす膵臓の細胞浸潤は、インスリン依存性糖尿病に関連する根本的病因である(Burklyら、Diabetes 43:529−534(1994))。炎症性細胞(その産物が組織損傷を引き起こす)の活性化は、クローン病や潰瘍性大腸炎のような炎症性腸疾患の病理の根底をなす(Cotranら、1994)。好中球、好酸球、マスト細胞、リンパ球およびマクロファージは炎症性応答に寄与する。真皮の上部上皮層における好中球の微小膿瘍は、特有の表皮過形成/肥厚や、乾癬の落屑を伴なう。
【0016】
根本的な炎症過程を含む病状の治療を目的として使用するのに、様々な抗炎症薬が現在入手可能である。しかし、それらの有効性は非常にばらつきがあり、依然として臨床的に満たされていないニーズが存在する。このことは、特に、利用可能な治療法の有効性が限られているか、あるいは、不要な副作用プロフィールを伴なうかのいずれかである前記疾病に言える。しかも、炎症に関連する組織損傷の主な根本的原因である細胞浸潤を直接阻害する、入手可能な臨床薬はほとんどない。従って、細胞浸潤、ならびに、その結果としての炎症性疾患、損傷および、それによって起こるサイトカインネットワークの灌流に関連する病状を予防および改善する、安全かつ有効な臨床薬が求められる。
【0017】
従って、炎症、血栓症、様々な種類の神経損傷に関連する疾病を治療するために、新規の優れた化合物ならびにその使用方法が当技術分野で必要とされている。
【0018】
(発明の概要)
本発明は、第1の実施形態において、炎症性血管疾患を有するか、またはそのようなリスクがある被験者において炎症を抑制する方法を提供することにより、当分野における上記問題の多くを解決する。上記方法は、抗炎症有効量の活性化プロテインC(APC)を被験者に投与することにより、被験者における炎症を抑制することを含んでなる。
【0019】
別の実施形態では、本発明は、神経病理学的障害を有するか、またはそのようなリスクがある被験者に、神経保護有効量の活性化プロテインC(APC)を投与し、被験者に神経保護をもたらすことによって、該被験者のニューロン細胞を細胞死から保護する方法を提供する。
【0020】
さらに別の実施形態では、本発明は、神経病理学的障害を有するか、またはそのようなリスクがある被験者において炎症を抑制する方法を提供する。上記方法は、抗炎症有効量の活性化プロテインC(APC)を被験者に投与することにより、該被験者において神経性炎症を抑制することを含んでなる。
【0021】
(発明の開示)
本発明は、APCには、虚血事象の前または後のいずれに投与したにかかわらず、脳血管性血栓症を有する一過性巣状脳虚血のマウスモデルにおいて、有意な神経保護、抗血栓症および抗炎症作用があるという独創的な発見に基づくものである。このモデルでは、対照動物における中大脳動脈(MCA)閉塞および再灌流中の脳血流量(CBF)の減少が、以前報告されたマウス発作モデルより顕著である、すなわち、それぞれ約2〜3倍であった。以前のモデルは、大脳梗塞、腫脹、深刻な炎症応答の発生、血栓症、ならびに、再灌流の比較的速い段階での死を引き起こした。発作誘発の前または後のいずれかにAPCで処理すると、進行した発作によるマウスの死を阻止し、MCA再灌流中に、CBFがほぼ完全に回復した。これらの作用には、脳損傷および腫脹の有意な減少と、運動神経機能の改善が伴なった。特定の理論に拘束されるわけではないが、APCの神経保護作用は、虚血性大脳半球に浸潤するPMNの数の著しい減少により示されるように、その抗炎症活性に関連すると同時に、また、発作誘発動物における脳血管フィブリン沈着物の有意な減少により示される通り、その抗血栓症作用によると考えられる。
【0022】
本発明におけるAPCの有利な効果は、虚血後の再循環の顕著な改善、すなわち、対照動物がわずか32%であるのに対して、ベースラインCBFの79%をもたらした。観察されたCBFの改善は、部分的に、APCによる虚血後凝固障害の改善を伴なう可能性がある。これまでの総合的な虚血症の研究から、補体活性化と関連する大量の血管内凝固が明らかにされた。また、巣状虚血モデルでの研究から、CBFにおける重大な閉塞は、多形核(PMN)白血球の血管蓄積と、フィブリン沈着による大量の微小血管閉塞の結果起こる可能性があることがわかった。基本的なフィブリン溶解因子が欠失した動物、例えば、tPA−/−マウスは、CBFが中程度しか減少していない場合でも、実質的虚血性脳血栓症および損傷を発症する恐れがある。脳以外の器官に関するこれまでの研究から、様々な微細動脈血栓症モデルにおいて、in vitroおよびin vivoでのAPCの有意な抗凝固活性が報告されているが、本発明の研究では、APCの抗凝固作用だけではなく、抗炎症および神経保護作用も明らかにする。
【0023】
本明細書に記載する実施例に挙げたデータによれば、APCの抗炎症作用は、虚血後のCBFの回復に寄与すると考えられる。実施例から、APCは、虚血性大脳半球におけるフィブリン沈着を有意に減少させる以外に、血液脳関門を通過する末梢血液細胞、すなわち、PMNの輸送を阻止することにより、脳におけるそれらの蓄積も防ぐことがわかる。APCの抗炎症作用の機構は、まだ完全に理解されているわけではないが、APC処理した虚血動物に、有意な白血球−内皮相互作用がなければ、虚血性脳におけるフィブリン形成が減少するだけではなく、CBFの改善およびニューロン損傷の軽減につながる可能性がある。PMNの血液脳関門貫通を阻止すると、神経学的結果が著しく改善し、ニューロン損傷も制限されることがわかっている。
【0024】
本発明者らは、APCが、脳血管系と脳の両方における損傷を最小限にする作用機構の1つが、炎症反応を低下させることによるものであると考える。本発明の研究から、APCは発作に関連する死亡を予防し、脳梗塞および脳水腫の量をそれぞれ59%および50%減少させると共に、運動神経学的スコアを約2倍改善することが証明された。虚血後の再循環の速度が増加すると、エネルギー生産代謝物の回復、呼吸鎖のレドックス状態の回復、ならびに、イオン交換ポンプの再活性化を伴なう正常組織エネルギー状態の回復が早くなるようである。これらの回復は、正常のニューロン機能および虚血後の水腫の除去には不可欠である。APCが、血管系内の白血球蓄積をほぼ完全に廃し、PMNが脳の実質に浸透するのを防止する能力が、部分的に、その神経保護作用を生み出すと思われる。これは、再循環速度を高めるだけではなく、重要なことには、PMNからの反応性酸素種の虚血後産生を軽減し、これによって、ニューロンの損傷を保護することができる。発作におけるAPCの神経保護作用は、その抗炎症作用および抗血栓症作用により説明することができるが、APC自体が、ニューロンに直接の神経保護作用をもたらす可能性も除外することはできない。
【0025】
本発明の研究から、APCは、止血機能に悪影響を与えたり、脳における出血増加、または脳内出血(ICH)を起こしたりしないことがわかった。これによって、APCのレベルが高まると、出血を引き起こさないことを示す、APCに関するこれまでの実験からの知見が確認される。APCとは対照的に、出血とICHは、プラスミノーゲンアクチベーター(例えば、tPA)による血栓崩壊治療や、ヘパリンによる抗凝固薬治療など、発作に関する他の形態の抗血栓症治療に伴なう、生命を脅かす合併症となり得ることが報告されている。
【0026】
予測的疫学研究では、内在性プロテインCチモーゲンが、ヒトの発作を予防する可能性があることが示されている。低レベルの血漿プロテインCまたはAPC、および/またはAPCの抗凝固作用に対する抵抗は、発作後の思わしくない結果につながる。発作患者に認められるプロテインCの低血漿レベルは、プロテインC生合成のレベル低下および/または過剰なトロンビン産生および急速なAPCクリアランスによるプロテインCの消耗により起こると考えられるのに対し、低循環APCは、プロテインCチモーゲン前駆体の消耗、循環APC阻害物質のレベル増加、あるいは、低レベルの血管内トロンビン、またはトロンボモジュリンおよび/もしくは内皮細胞プロテインC受容体の減少のいずれかによるAPC産生能力の低下によるものと思われる。虚血性組織からのAPCの産生は、例えば、ヒトにおける脳虚血の最中や、心肺バイパス手術後に、保護作用があると推定されている。本明細書に提示した結果から、これまでの臨床研究を見通すことができると共に、神経保護薬としてのAPCの関連可能性が示され、該保護薬は、発作における臨床用途に有利となり得る多数の作用を有する。
【0027】
神経変性疾患は、ニューロン細胞が変性し、認識機能の劣化をもたらす疾病などを含む。様々な疾病および神経欠損が、ニューロン細胞の変性を引き起こすが、そのような疾病として、アルツハイマー病、ハンチントン病または舞踏病、発作により起こる低酸素症またはh1虚血、てんかんにより起こる細胞死、筋萎縮側索硬化症、精神遅滞など、ならびに、老化による神経変性変化が挙げられる。
【0028】
第1の実施形態では、本発明は、炎症性血管疾患を有する、またはそのような恐れがある被験者における炎症を減少させる方法を提供する。上記方法は、例えば、製剤上許容される担体で、抗炎症物質として有効な量の活性化プロテインC(APC)を被験者に投与することを含んでなり、これにより、被験者における炎症を減少させる。
【0029】
本発明は、炎症過程を伴なう様々な病状を治療するのに有用である。例えば、クローン病や潰瘍性腸炎のような炎症性腸疾患は、胃腸管の自発的慢性炎症であり、これは、炎症細胞の活性化を伴ない、その産物が、組織損傷を引き起こす。好中球、好酸球、マスト細胞、リンパ球およびマクロファージは、炎症応答に寄与する。特定の理論に拘束されるわけではないが、APCは、プロテインCおよびAPCの内皮受容体を介して脳内皮細胞(すなわち、血管細胞)に作用し、この受容体が、中心および末梢いずれの内皮に対するその作用を媒介すると推測される。これが、今度は細胞内シグナル伝達系に影響し、この系は、カスケード形式で、血管内皮中の様々な遺伝子をオンおよびオフにし、これが、炎症に対する正常内皮細胞応答を妨害するのではないかと思われる。例えば、接着分子は、白血球と管壁との相互作用を媒介することが知られている。APCが、このような接着分子の発現を阻止するために、炎症応答が阻害されると考えられる。この応答を媒介する接着分子としては、ICAM、VCAMまたはPECAMが挙げられる。
【0030】
本発明はまた、全身性ショック、ならびに、それに関連して起こる多くの病状の治療に関する。全身性ショックは、重症の血液損失、重症の局在化細菌感染および虚血/再灌流傷害の合併症として起こることが多く、集中治療室での死亡の主な原因となっている。敗血症性ショックは、ほとんどの場合、グラム陰性桿菌由来の内毒素(すなわち、細菌細胞壁リポ多糖類(LPS))、またはグラム陽性球菌由来の毒素(すなわち、毒性ショック毒素1)により誘発される。血流へのLPSの放出は、炎症メディエーター(炎症性サイトカイン、血小板活性化因子、補体、ロイコトリエン、酸素代謝物など)の放出を引き起こし、これによって、心筋機能不全、血管拡張、低血圧、内皮損傷、白血球接着および凝集、汎発性血管内凝固症候群、成人呼吸促進症候群(ARDS)、肝、腎および中枢神経系(CNS)不全を招くことになる。血液損失によるショックは、炎症メディエーターの放出も伴なう。いずれの場合にも、炎症応答は、本来の外傷部位で、また、血管系および遠位血管化部位でも誘発される。
【0031】
心筋虚血は、補体系の活性化に関連し、これがさらに、心臓損傷を促進し、一連の炎症事象を悪化させる。生命を脅かす局所および遠位組織損傷は、手術、外傷および発作の際に起こり、そのとき、主要な血管床が酸素付加の間乏しくなり(虚血)、その後正常循環で回復する(再灌流)。再灌流損傷は、水腫や、炎症細胞の浸潤を招く血管透過性を特徴とする。好中球は、酸化物質を産生し、またはプロテアーゼを放出して、微小血管系または隣接組織を損傷させることにより、再灌流損傷に有意に寄与する。補体および炎症細胞機構による細胞死および組織損傷は、臓器不全もしくは臓器の機能低下を招く。また、局所損傷によるメディエーターの活性化は、血管の発達した器官に遠位損傷を引き起こす恐れもある。本発明の化合物および方法は、虚血および再灌流損傷の治療に有用である。
【0032】
炎症応答損傷は、糸球体腎炎および細管疾患でも起こる。炎症細胞の浸潤(特にマクロファージ)は、タンパク尿につながるが、これは、組織学的に、糸球体における過細胞充実性および糸球体半月の形成を伴なう。長期にわたれば、炎症細胞の浸潤は、細胞外マトリックスの蓄積や、腎機能の硬化および慢性的易感染(compromise)を引き起こす。本発明はまた、糸球体腎炎および細管疾患を治療する上でも効能がある。
【0033】
その他にも、本発明の方法から利益を受ける疾病および損傷は多数存在し、例えば、冠状動脈閉塞、心律動異常(不整脈)、うっ血性心不全、心筋症、気管支炎、急性アレルギー反応および過敏症、神経外傷、グラフト/移植片拒絶、心筋炎、インスリン依存性糖尿病、および発作が挙げられる。発作は、非常に強い炎症応答を伴ない、これが白血球を脳へと侵入させて正常な脳細胞およびニューロンを破壊することによって直接、また、微細管を閉塞し、血流を停止させることにより間接的に、ニューロン損傷の原因の1つとなると考えられる。これも、その抗凝固作用とは独立したAPC細胞相互作用の直接または間接的標的となり得る接着分子およびサイトカインを必要とする。
【0034】
心臓発作により起こる外傷に苦しむ患者を治療する以外に、実際の肉体的外傷に苦しむ患者をAPCで治療することによって、身体の一部位が重度の外傷を受けた後、通常起こる炎症や腫脹の量を軽減することもできる。また、出血性ショックを有する患者を治療し、血流の回復に関連する炎症を軽減することも可能である。本発明の調製物を用いて、治療することができるその他の病状として、各種関節炎、皮膚の各種慢性炎症状態、インスリン依存性糖尿病、成人呼吸促進症候群が挙げられる。本明細書を読めば、当業者であれば、本発明のAPC製剤の投与により、治療および/または改善することができるその他の病状および/または症状を認識するであろう。
【0035】
APCが単独で、あるいは、血栓崩壊薬、抗凝固薬、もしくは抗炎症薬と組み合わせて、有用である、動脈血栓症の例として、下記の臨床状況が挙げられる:1)冠状、大脳または末梢動脈を含む急性動脈血栓閉塞;2)血管形成術後の急性血栓閉塞または再狭窄;3)血栓崩壊治療後の再閉塞または再狭窄。t−PAのような血栓崩壊薬は、急性心臓発作または発作の数時間内に用いると、閉塞した動脈中の血流量を回復させることにより、虚血性組織を救う。現在、閉塞した冠状動脈の血栓崩壊性再灌流に成功した患者の4分の1から3分の1が、後に、t−PA注入を中止すると、再閉塞を起こす。この合併症は、全用量ヘパリン治療にもかかわらず起こる。APCは、ヘパリンよりも、再閉塞を予防する上で効力を有するであろう。4)大小の直径を有する血管移植片閉塞。直径が小さい、すなわち、直径3 mm未満の血管移植片は、血栓閉塞の頻度が高い。APCは単独、または血栓崩壊薬と組み合わせて、閉塞を予防するのに有用である。プロテーゼ表面、およびあらゆる血液透析器の流動構造は、血栓形成性である。現在は、透析中に、ヘパリンを注入する。しかし、ヘパリンは、部分的に有効であるため、透析器の再使用を制限する。また、ヘパリンは、多数の厄介な副作用および合併症を伴なう。6)心肺バイパス手術。酸素付加装置およびポンプ装置での血栓形成を予防するために、現在ヘパリンが用いられている。しかし、血小板活性化、ならびに、それによって起こる一過性の血小板不全を阻止することはできず、その結果、手術後出血しやすくなるという問題が生じる。7)左心室補助装置。このプロテーゼポンプは、血栓形成性が高く、生命を脅かす血栓塞栓症事象−合併症を引き起こすが、これらは、従来の抗凝固薬(ヘパリンまたはクマリン薬剤)では部分的にしか軽減されない。8)全人工心臓および左心室補助装置。9)その他の動脈血栓症。APCは、既存の療法では禁忌を示す、あるいは、有効ではないいずれの場合でも、動脈血栓症または血栓塞栓症に有用である。例えば、移植、網膜血栓症、または、感染、腫瘍を併発したあらゆる器官の微小血栓性壊死などの急性毛細血管閉塞前または後の治療、もしくはクマリン治療に有用である。
【0036】
別の実施形態では、本発明は、神経病理学的障害を有する、またはそのような恐れがある被験者におけるニューロン細胞の細胞死を保護する方法を提供する。上記方法は、例えば、製剤上許容される担体で、神経保護するのに有効な量の活性化プロテインC(APC)を被験者に投与することにより、被験者に神経保護をもたらすことを含んでなる。「神経病理学的障害」の例として、限定するものではないが、アルツハイマー病、ハンチントン病、虚血、てんかん、筋萎縮側索硬化症、精神遅滞および老化などが挙げられる。本明細書に記載する、炎症性血管疾患を「有する、またはそのような恐れがある」者とは、そのような疾患の症状を呈示する、あるいは、疾病を発現する恐れがあると診断された被験者を意味する。このような被験者には、以下に記載するように、手術を受けた、もしくは手術に備えている被験者も含まれる。
【0037】
さらに別の実施形態では、本発明は、神経病理学的障害を有する、またはそのような恐れがある被験者における炎症を軽減する方法を提供する。上記方法は、例えば、製剤上許容される担体で、抗炎症物質として有効な量の活性化プロテインC(APC)を被験者に投与することにより、被験者の神経炎症を軽減することを含んでなる。本発明の方法は、前記の神経疾患以外に、多発性硬化症(MS)の治療にも効能がある。MSは、循環白血球による血液脳関門の貫通を特徴とし、脳の様々な部分で脱髄を起こして、神経伝導を損ない、最終的には、麻痺を引き起こす。
【0038】
「治療」または「改善する」という用語は、炎症のような疾病の症状を軽減することを意味する。「治療」または「改善する」という用語は、治療を受ける被験者における炎症または神経疾患の有害な作用の減少を指す。神経疾患に関して、以後用いられる「治療」という用語は、必ずしも神経変性疾患が完全に排除されることを意味するわけではなく、該疾患により損傷された認識機能が改善されることを意味する。本明細書で用いる「治療に有効の」とは、疾病の原因または症状を改善するのに十分な量であるAPCの量を意味する。本発明の被験者は、好ましくは、ヒトであるが、抗炎症または神経保護が必要なあらゆる動物を、本発明の方法で治療することも考えられる。
【0039】
以下に用いる用語「神経変性疾患」とは、認識機能の劣化をもたらす恐れがある脳内の神経細胞の変性を引き起こす病状を意味する。このような神経細胞の変性は、アルツハイマー病(例えば、アルツハイマー病は、シナプスの欠失およびニューロンの欠失を特徴とする)、ハンチントン病または舞踏病;例えば、発作による、脳への血液または酸素供給の一時的欠如により引き起こされる病状;てんかん発作;筋萎縮側索硬化症、精神遅滞のような慢性病状;ならびに、老化による通常の変性によって起こる可能性がある。発作やアルツハイマー病などの疾病は、神経変性および炎症性血管成分の両方を有するため、本発明の方法により治療が可能であることに留意すべきである。
【0040】
本発明の1態様は、APCの「神経保護」活性を含む。用語「ニューロン」には、それぞれ異なる特性を備えた数百種のニューロンが含まれる。各種のニューロンが、様々な組合せの神経伝達物質および神経栄養因子を生産し、かつこれらに応答する。ニューロンは、成体の脳で分裂せず、しかも、in vitroでは長く生存しないと考えられている。本発明の方法は、脳および脊髄の、実質的にあらゆる領域からのニューロンの死または老化から保護する。ニューロンには、海馬、小脳、脊髄、皮質(例えば、運動または体性感覚皮質)、線条体、基底(basal)前脳(コリン作動性ニューロン)、腹側(ventral)中脳(黒質の細胞)、ならびに、青斑(中枢神経系の神経アドレナリン細胞)由来の組織などを含む、胚、胎児または成体の神経組織におけるニューロンが含まれる。
【0041】
脳またはその他の組織にかかわらず、APCは、プロテインCおよびAPCの内皮受容体を介して脳内皮細胞(すなわち、血管細胞)に作用するが、この受容体は、中心または末梢の内皮へのAPCの作用を媒介する。これが今度は、細胞内シグナル伝達系に影響を与え、該シグナル伝達系は、血管内皮における様々な遺伝子を、カスケード形式でオンおよびオフにし、これが、炎症に対する正常の内皮細胞応答を妨害すると思われる。また、ニューロン上のAPCに対する受容体が、APCの神経保護作用を媒介することも考えられる。
【0042】
従って、本発明の1態様では、特定の疾病をより有効に治療するためには、このような受容体の発現をアップレギュレートすることが望ましい。
【0043】
本発明は、炎症過程を伴なう多くの病状を治療するのに有用である。例えば、クローン病や潰瘍性大腸炎などの炎症性腸疾患は、胃腸管の自発的慢性炎症であり、これは、炎症細胞の活性化を伴ない、その産物が、組織損傷を引き起こす。好中球、好酸球、マスト細胞、リンパ球およびマクロファージは、炎症応答に寄与する。
【0044】
本明細書に記載するように、被験者にAPCを投与するのに加えて、1以上の抗炎症剤または別の神経保護剤を共投与することも望ましい。共投与は、APCの前、APCと同時またはAPC投与後のいずれの投与も含む。
【0045】
神経保護剤の非制限的例として、当業者には公知のように、N−メチル−D−アスパラギン酸(NMDA)受容体アンタゴニストおよびカルシウムイオンチャネルアンタゴニストが挙げられる。
【0046】
抗炎症剤の例として下記のものが挙げられるが、これらに限定されるわけではない:エトフェナメート、メクロフェナム酸、メファナム酸、ニフルム酸などのアミノアリールカルボン酸誘導体;アセメタシン、アムフェナック、シンメタシン、クロピラック、ジクロフェナック、フェンクロフェナック、フェンクロラック、フェンクロジック(Fenclozic)酸、フェンチアザック、グルカメタシン、イソキセパック、ロナゾラック、メチアジニン酸、オキサメタシン、プログルメタシン、スリンダク、チアラミド、トルメチンなどのアリール酢酸誘導体;ブチブフェン、フェンブフェンなどのアリール酪酸誘導体;クリダナック、ケトロラック、チノリジンなどのアリールカルボン酸;ブクロキシック酸(Bucloxic)、カルプロフェン、フェノプロフェン、フルノキサプロフェン、イブプロフェン、イブプロキサム、オキサプロジン、ピケトロフェン、ピルプロフェン、プラノプロフェン、プロチジン酸、チアプロフェン酸などのアリールプロピオン酸;メピリゾールなどのピラゾール;クロフェゾン、フェプラゾン、モフェブタゾン、オキシフェンブタゾン、フェニルブタゾン、フェニルピラゾリジニノン、スキシブゾン、チアゾリノブタゾンなどのピラゾロン;ブロモサリゲニン、フェンドサル(Fendosal)、サリチル酸グリコール、メサラミン、サリチル酸1−ナフチル、オルサラジン、スルファサラジンなどのサリチル酸誘導体;ドロキシカム、イソキシカム、ピロキシカムなどのチアジンカルボキシアミド(Thiazinecarboxamide)。その他、イプシロン−アセトアミドカプロン酸、S−アデノシルメチオニン、3−アミノ−4−ヒドロキシ酪酸、アミキセトリン、ベンダザック、ブコロム、カルバゾン、ジフェンピラミド、ジタゾール(Ditazol)、グアヤズレン(Guaiazurene)、マイコフェノール酸の複素環式アミノアルキルエステルおよび誘導体、ナブメトン、ニメスリド、オルゴテイン、オキサセプロール、オキサゾール誘導体、パラニリン、ピフォキシム、2−置換−4,6−ジ−第3−ブチル−s−ヒドロキシ−1,3−ピリミジン、プロカゾン、シアリルルイス.sup.x二量体、またはテニダップ(Tenidap)がある。投与できる別の治療薬として、ステロイド(例えば、プレドニソン、メチルプレドニソンおよびデキサメタソンなどのグルココルチコイド)が挙げられる。
【0047】
本明細書に記載するように、被験者にAPCを投与する以外に、抗凝固薬、抗血小板薬または血栓崩壊薬を共投与するのも望ましい。共投与は、APCの前、APCと同時またはAPC投与後のいずれの投与も含む。血栓崩壊薬の例として、下記のものが挙げられるが、これらに限定されるわけではない:ウロキナーゼ、tPA、Lys−プラスミノーゲン、ストレプトキナーゼ、組織プラスミノーゲンアクチベーター、プロウロキナーゼ、アシル化形態のプラスミノーゲン、アシル化形態のプラスミン、ならびに、アシル化ストレプトキナーゼ−プラスミノーゲン複合体またはそれらの類似体。抗凝固薬の例としてはワルファリンおよびヘパリンが挙げられる。さらに、米国特許第5,679,639号(参照として本明細書に組み込む)に記載されている抗凝固抗体をAPCと一緒に共投与してもよい。抗血小板薬としては、例えば、アスピリン、ジピリダモール、クロピドグレル、アブシキシマブ(abciximab)(レオプロ(Reopuro))または血小板糖タンパク質IIb−IIIaのあらゆる阻害物質が挙げられる。
【0048】
本発明で用いられる組成物、ならびに、調製および投与方法としては、米国特許第5,084,274号、第6,037,322号および第6,156,734号に記載されているものが挙げられ、これらの文献は、参照としてその全文を本明細書に組み込むものとする。「活性化プロテインC」とは、トロンビンによるタンパク質分解により切断されて活性化されたプロテインC(APC)を意味し、これは、第VaおよびVIIIa凝固因子を不活性化し、これにより凝固を阻害する。本明細書に記載するAPCの使用方法は、本明細書に記載されている活性を保持する限り、APCの断片を含む。このような断片、もしくはAPCには、遺伝子組換えにより生産されたもの、ヒト血漿由来のもの、合成により生産されたもの、ならびに、それらの誘導体が含まれる。「合成ペプチド」は、天然に存在するタンパク質やその断片を含まない、ペプチド結合により互いに連結したアミノ酸残基の、化学的に生成された鎖を意味する。「抗凝固薬」とは、凝固を妨害することにより、フィブリン形成を阻害する薬剤を意味する。「凝固」とは、血液の多数の凝固因子が相互作用することにより、フィブリンを形成する連続的過程を意味する。プロテインCは、155アミノ酸残基の軽鎖と、262アミノ酸残基の重鎖とから構成され、また、米国特許第5,679,639号(参照として本明細書に組み込む)に詳しく記載されている。
【0049】
「化学的誘導体」とは、官能側基の反応により化学的に誘導体化された1以上の残基を有する主題のポリペプチドを意味する。このような誘導体化分子として、例えば、遊離アミノ基が誘導体化されて、塩酸アミン、p−トルエンスルホニル基、カルボベンゾキシ基、t−ブチルオキシカルボニル基、クロロアセチル基またはホルミル基を形成した分子が挙げられる。遊離カルボキシル基を誘導体化することにより、塩、メチルおよびエチルエステル、またはその他のタイプのエステル、もしくはヒドラジドを形成することができる。遊離ヒドロキシル基を誘導体化することにより、O−アシルまたはO−アルキル誘導体を形成することができる。ヒスチジンのイミダゾール窒素を誘導体化することにより、N−イム−ベンジルヒスチジンを形成することができる。また、化学的誘導体として、20の標準アミノ酸からなる1以上の天然アミノ酸誘導体を含むペプチドも挙げることができる。例えば、プロリンを4−ヒドロキシプロリンに;リシンを5−ヒドロキシリシンに;ヒスチジンを3−メチルヒスチジンに;セリンをホモセリンに;また、リシンをオルニチンに、それぞれ置換することができる。さらに、本発明のAPCには、必須活性(例えば、抗炎症または神経保護活性)が維持されている限り、ポリペプチドの配列(その配列は、本発明に示した)に対して、1以上の付加および/もしくは欠失または残基を有するあらゆるポリペプチドが含まれる。
【0050】
本発明の治療用組成物は、活性成分としてそこに溶解または分散させた、生理学的に許容可能な担体をAPCと一緒に含む。好ましい実施形態では、治療用組成物は、治療目的で哺乳動物またはヒトに投与したとき、免疫原性ではない。
【0051】
本明細書に用いるように、「製剤上許容される」、「生理学的に許容可能な」という用語、およびそれらの文法上の変形は、組成物、担体、稀釈剤および試薬に関して述べるとき、置換可能に用いられ、吐気、めまい、胃の不調などの望ましくない生理的作用を発生せずに、当該物質を哺乳動物に投与できることを意味する。
【0052】
溶解または分散させた活性成分を含む医薬組成物の調製は、当業者にはよく理解されている。典型的には、このような組成物は、液体溶液または懸濁液のいずれかとして注射可能であるように調製するが、使用前に液体中に溶解または懸濁させるのに適した固体形態を調製することもできる。また、調製物を乳化させてもよい。
【0053】
上記活性成分は、製剤上許容され、かつ該活性成分と適合性を有する賦形剤と一緒に混合することができ、その量は、本明細書に記載した治療方法での使用に適したものとする。好適な賦形剤として、例えば、水、塩水、デキストロース、グリセロール、エタノールなど、およびそれらの組合せが挙げられる。加えて、所望であれば、上記組成物は、活性成分の有効性を高めるような微量の湿潤剤または乳化剤、pH緩衝剤などの補助物質を含んでもよい。
【0054】
本発明の治療用組成物は、その成分の製剤上許容される塩を含有してもよい。製剤上許容される塩として、例えば、塩酸およびリン酸のような無機酸、または酢酸、酒石酸、マンデル酸のような有機酸で形成された酸付加塩(ポリペプチドの遊離アミノ基で形成される)がある。また、遊離カルボキシル基で形成された塩は、例えば、水酸化ナトリウム、水酸化カリウム、水酸化アンモニウム、水酸化カルシウムまたは水酸化第2鉄のような無機塩基、ならびにイソプロピルアミン、トリメチルアミン、2−エチルアミノエタノール、ヒスチジン、プロカインなどの有機塩基から誘導することもできる。
【0055】
生理学的に許容可能な担体は、当業者には公知である。液体担体の例として、活性成分および水以外の物質を一切含まない、あるいは、生理学的pH値のリン酸ナトリウムのようなバッファー、生理食塩水、もしくは、リン酸塩緩衝食塩水のような両方の組合せを含有する、無菌水溶液が挙げられる。さらには、水性担体は、1以上のバッファー塩、ならびに、塩化ナトリウムおよび塩化カリウム、デキストロース、ポリエチレングリコールおよびその他の溶質などの塩を含んでもよい。
【0056】
液体組成物は、水に加えて、または、水を除く、液相を含んでいてもよい。このような別の液相の例として、グリセリン、綿実油のような植物油、および水−油乳濁液がある。
【0057】
APCは非常に種特異的な成分である。ヒト一人に対する、ヒトAPCまたは組換えヒトAPCの用量は、例えば、マウスの適切用量よりもはるかに低い。ヒト一人におけるAPCの通常のベースラインレベルは、典型的に、血液1ml当たり約2.2 ngである。本発明の方法の実施に際し、ベースラインレベルをわずかに超えるまで血中レベルを上げるのに十分なAPCを投与する必要があるが、望ましくない出血を引き起こすほど多くしてはならない。ヒトAPCの治療有効量は、典型的には、APCの血中レベルが、約1.0 ng/mlから約500 ng/ml、好ましくは、約5ng/mlから約200 ng/ml上昇するのに十分な用量で、ヒトに投与する。
【0058】
APCは、製剤上有用な組成物を調製する公知の方法に従って、調製することができる。好ましくは、適切用量を連続注入で約4〜約96時間にわたり注射することにより、有効形態で、APCを確実に血流に送達するように、APCを非経口的に投与する。好ましくは、約4〜約72時間にわたる連続注入により、APCの適切用量を投与する。さらに好ましくは、約4〜約48時間にわたる連続注入により、APCの適切用量を投与する。さらに好ましくは、約12〜約48時間にわたる連続注入により、APCの適切用量を投与する。さらに好ましくは、約12〜約36時間にわたる連続注入により、APCの適切用量を投与する。さらに好ましくは、約4〜約36時間にわたる連続注入により、APCの適切用量を投与する。さらに好ましくは、約12〜約24時間にわたる連続注入により、APCの適切用量を投与する。最も好ましくは、約24時間にわたる連続注入により、APCの適切用量を投与する。APCの投与は、血管閉塞または動脈血栓塞栓症性障害の診断後に出来る限り早く開始する。APCの適切な負荷投与量は、ボーラス注射により与えられるが、その後に、APC注入を実施しても、しなくてもよい。
【0059】
投与するAPCの量は、約0.01 mg/kg/時間〜約0.10 mg/kg/時間でよく、これは、約17 mg/70kg/24時間〜約170 mg/70kg/24時間に相当する。用量レベルは、24時間当たりの特定の量として記載するが、当業者であれば、これは、用量レベルの表示の1つにすぎず、必ずしも24時間注入に限定されるわけではなく、様々な時間、例えば、約4〜約96時間にわたる連続注入も含まれる。さらに好ましくは、投与するAPCの量は、約0.01 mg/kg/時間〜約0.05 mg/kg/時間(約17 mg/70kg/24時間〜約84 mg/70kg/24時間)である。しかし、さらに好ましくは、投与するAPCの量は、約0.01 mg/kg/時間〜約0.03 mg/kg/時間(約17 mg/70kg/24時間〜約50 mg/70kg/24時間)である。さらに、投与するAPCの量は、約0.02 mg/kg/時間〜約0.05 mg/kg/時間であり、これは、約34 mg/70kg/24時間〜約84 mg/70kg/24時間に相当する。さらに好ましくは、投与するAPCの量は、約0.024 mg/kg/時間〜約0.048 mg/kg/時間(約40 mg/70kg/24時間〜約80 mg/70kg/24時間)である。しかし、さらに好ましくは、投与するAPCの量は、約0.027 mg/kg/時間〜約0.045 mg/kg/時間(約45 mg/70kg/24時間〜約75 mg/70kg/24時間)である。しかし、さらに好ましくは、投与するAPCの量は、約0.030 mg/kg/時間〜約0.042 mg/kg/時間(約50 mg/70kg/24時間〜約70 mg/70kg/24時間)である。しかし、さらに好ましくは、投与するAPCの量は、約0.033 mg/kg/時間〜約0.039 mg/kg/時間(約55 mg/70kg/24時間〜約65 mg/70kg/24時間)である。投与するAPCの好ましい量は、約0.024 mg/kg/時間(約40 mg/70kg/24時間)、約0.027 mg/kg/時間(約45 mg/70kg/24時間)または、約0.030 mg/kg/時間〜約0.042 mg/kg/時間(約50 mg/70kg/24時間〜約70 mg/70kg/24時間)である。もちろん、APCの量は、本発明に記載するように、プロテインSのような補因子と一緒に投与する場合、減少することができる。
【0060】
これに代わり、約5〜約120分間にわたりボーラス注射として、毎時適切用量の一部を注射した後、約23時間〜約96時間にわたり適切用量を連続注入することにより、約24〜96時間にわたって適切用量が投与されるように、APCを投与する。
【0061】
本明細書に記載するように、血栓閉塞(例えば、発作)のために投与すべきAPCの最も好ましい用量レベルは、約0.024 mg/kg/時である。
【0062】
本発明の方法と一緒に用いることができる抗凝固抗体の治療有効量は、典型的には、生理学的に許容可能な組成物を用いて投与する場合、1ミリリットル(ml)当たり約0.1マイクログラム(ug)〜約100 ug/mlに、好ましくは、約1 ug/ml〜約5ug/mlに、通常は約5μの血漿濃度を達成するのに十分な量とする。
【0063】
APCを含む治療組成物は、例えば、単位用量の注射により、通常の方法で静脈内投与する。「単位用量」という用語は、本発明の治療組成物について用いる場合、被験者に対する単一用量として好適な物理的に個別の単位を意味し、各々の単位は、予め定めた量の活性物質を含み、この量は、必要な稀釈剤、すなわち、担体またはビヒクルと一緒に、所望の治療効果を達成するよう計算されている。上記組成物は、用量調製物と適合する方法で、治療有効量を投与する。投与すべき量は、治療しようとする被験者、被験者の系が活性成分を利用する能力、および、所望の治療効果の度合いに応じて異なる。投与しなければならない活性成分の正確な量は、医師の判断により決定し、各個体によって異なる。しかし、全身用途について適した用量の範囲は、本明細書に開示する通りであり、これは投与経路によって違ってくる。初回投与および追加注射に適した方法も一定ではないが、典型的には、初回投与の後、1時間以上の間隔で、注射またはその他の投与を繰り返す。あるいは、in vivo治療について指定された範囲に血中濃度を維持するのに十分な連続的静脈内注入も考えられる。
【0064】
該医薬組成物は、単位用量形態をしているのが好都合であり、製薬業の当業者にはよく知られた任意の方法を用いて調製することができる。これらの方法はすべて、化合物を担体と結合させる段階を含むが、この担体は、1以上の補助成分を含んでいてもよい。一般に、丸薬、錠剤、もしくはカプセル(例えば、経口投与用)または粉末用の組成物は、組成物と、微粉化した固体担体を均質かつ入念にブレンドした後、錠剤の場合のように必要であれば、所望の形状およびサイズに製品を成形することにより、調製する。丸薬、錠剤、またはカプセルは、該組成物が、未消化のまま被験者の小腸に到達するのに十分な時間の間、被験者の胃の中で、胃酸や腸内酵素から組成物を保護することが可能な物質でコーティングすることができる。この医薬組成物は、脳室間ポンプにより大脳に直接ターゲッティングすることもできる。
【0065】
これに対し、好都合には、非経口投与(例えば、皮下、静脈内または筋肉内)に適した組成物は、水または生理的食塩水中の化合物の無菌水溶液を含んでなり、これによって、水溶液を生成し、この溶液は無菌となる。上記組成物は、単位または複数用量容器中に含まれていてもよく、これらの容器は、例えば、密封アンプルまたはバイアルでよい。
【0066】
別の態様では、本発明は、治療有効量の本発明の医薬組成物を患者に投与することにより、患者におけるニューロンの死を阻止する方法を提供する。本発明の医薬組成物を用いて、例えば、発作、CNS外傷(例えば、大脳または脊髄手術または損傷)、神経毒素による損傷、ならびに、てんかんなどの急性傷害事象;ハンチントン舞踏病、アルツハイマー病、慢性神経変性疾患、筋萎縮側索硬化症(ALS)、AIDS関連ニューロン変性および脳の老化などの慢性神経変性疾患;あるいは、NMDA受容体の過剰活性化に関連するその他の神経変性障害を治療することができる。
【0067】
特に、APCの補因子であるプロテインSは、本発明の方法に従い投与すると、相乗効果を発揮する。例えば、以下の実施例3から、マウスモデルに、プロテインSとAPCの組合せを投与すると、治療に有効な低量のAPCだけを投与したケースと比較して、たとえ虚血事象後に治療薬を投与した場合でも、マウスの脳梗塞の部位および虚血性脳半球の水腫量を減少させる上で有効であることがわかる。この予想外の結果は、このモデルで発作の治療にAPCだけを使用する際に一般に用いたものより、組合せ治療で投与したAPCの量がはるかに少ない(例えば、0.1 mg/kg)場合でも得られた。従って、APCをプロテインSと一緒に、すなわち、その投与と同時、投与前または後に投与すれば、はるかに少ない量のAPCで有効用量となる。しかし、マウスは内在性プロテインSを含まないが、正常なヒトは内在性プロテインSを含むことに留意すべきである。従って、正常レベルの内在性プロテインSの存在(例えば、ヒトにおける)が、本発明の方法で用いられるAPCの治療用量を実質的に低くする(恐らく、100倍程度も)と考えられる。さらに、このプロテインSとAPCの組合せによる相乗効果は、同じ種由来のAPCおよび補因子に依存する種特異的なものであることも見出された。このため、非ヒトAPCをヒトの治療に用いる場合には、該APCと同じ非ヒト種に由来するプロテインSを共投与するのが好ましい。
【0068】
APC、その類似体または生物活性断片を、投与調製物と適合する様式で、治療に有効となる量投与してもよい。特に、本発明の治療方法は、APCが、発作などの虚血事象の最中、前または後(例えば、発作から3〜6時間以内)に、投与したかにかかわらず、同様に有効であることが発見された。
【0069】
本発明のAPC含有組成物は、医療上許容されるあらゆる様式で投与することができ、その様式は、治療しようとする病状または損傷に応じて異なる。考えられる投与経路として、血管内、静脈内、動脈内、皮下、筋肉内、腫瘍内、腹腔内、心室内、硬膜内などの非経口経路による注射、ならびに、経口、鼻内、眼、直腸、局所、あるいは、吸入によるものがある。上記組成物は、手術中に組織表面に直接塗布することもできる。本発明には、特に、蓄積注射または腐食性移植片(erodible implant)のような手段による持続的放出投与も含まれる。
【0070】
以下の非制限的実施例を参照にしながら、本発明をさらに詳しく説明する。
【0071】
実施例1
動物
動物保護および使用委員会(Institutional Animal Care and Use Committee)により承認された手順を用いて、体重23〜26gの雄C57BL/6マウスで実験を実施した。改変した中大脳動脈(MCA)閉塞技法(E.S. Connollyら、Neurosurgery. 38(3):523−531(1996);H. Haraら、J. Cereb. Blood Flow Metab. 16:605−611(1996);ならびに、P. Tabriziら、Arterioscler. Thromb. Vasc. Biol. 19:2801−2806(1999))にマウスを付すことにより、以下に記載するように、脳血管血栓症を伴なう急性巣状虚血性発作を誘発した。初めにマウスをメタファンで麻酔し、腹腔内に50 mg/kgのペントバルビタールを維持した。硝酸アトロピンメチル(0.18 mg/kg腹腔内)を前投薬として投与することにより、粘液形成による気道閉塞を予防した。動物は自発的に呼吸させた。サーモスタットで調節される加熱パットにより、直腸の温度を37±1℃に維持した。右大腿動脈に、PE−10カテーテルでカニューレ挿入し、血圧および血液分析の連続的なモニタリングを実施した。
【0072】
発作モデルの作製
改変した血管内MCA閉塞技法(Connollyら、1996;Haraら、1996;およびTabriziら、1999)を用いて、虚血性大脳半球におけるMCA領域の大脳血流量(CBF)をほぼ完全に阻止した。非シリコン処理で、かつコーティングされていない、長さ6−0 8 mmのプロレン縫合糸を用いた。この糸は、直径0.20 mmの改変された丸い先端を備えている。縫合糸の先端をこのように改変することにより、体重が23〜26gのマウスに縫合糸を配置した直後に、CBF値が、典型的には、対照ベースライン値の10%近くまで降下した(以下参照)。対照的に、以前の実験では、血栓形成性のないシリコンでコーティングしたナイロンフィラメント(Y. R. Wangら、Nature Med. 4:228−231(1998))を用い、閉塞中に相対CBFに≧50%の減少が認められれば、手順は技術的に成功したとみなしていた。本発明のモデルにおけるCBFの顕著な減少により、主として、小さな微小血管で有意な脳血管血栓症が起こり、大脳動脈からの縫合糸を引き抜くことによりCBFを回復させると、再灌流段階の比較的早期に、大きな梗塞と、発作に関連する死亡が発生した。手短に言えば、作動中の顕微鏡下で、腹部正中切開により、右側共通頚動脈を露出させ、外側頚動脈とその枝を連結させた。動脈の横切開により、縫合糸を外側頚動脈内腔に導入し、内部頚動脈中にゆっくりと前進させることによって、ウイリス輪からMCAをその起点で閉塞した。MCA閉塞を1時間維持した後、24時間の再灌流を実施した。
【0073】
血流量および頭部温度の測定
組織灌流モニター(Transonic BLF21、Ithaca、ニューヨーク州)を用いて、レーザードップラー流量測定法(LDF)によりCBFをモニタリングした。CBF測定は、神経病理学および神経学的分析に付したすべての動物について実施した。CBF測定のために、動物を定位ヘッドフレーム内に配置し、定位マイクロマニピュレーターを用いて、プローブの角度を皮質表面に対し垂直に維持しながら、ブレグマから2mm後ろ(中線の両側から3および6mmの両方)で読取り値を求めた。皮質表面に位置するLDFプローブ(直径0.8 mm)を組織灌流モニター(トランソニックBLF21)に接続した。この手順は、閉塞用縫合糸の配置直後、相対CBFに≧88%の減少が認められたら、技術的に成功したとみなした。この手順は、すべての実験対照動物で成功し、これらの動物は、虚血性大脳半球におけるかなり大きな梗塞量と微小血管血栓症を引き起こすのに十分な虚血レベルを発生した。頭部温度は、デジタル温度計/定温器モデル(モデル9000、Omega、コネティカット州)に接続した側頭筋において、36ゲージ熱電対温度プローブを用いて、モニタリングした。
【0074】
生存時間と神経欠損
再灌流から24時間以内に生存時間をモニタリングし、発作に関連する死亡を記録した。再灌流から24時間後に、また、幾匹かについては再灌流から3時間後にも、神経学的試験を実施した。下記の改変した5点等級に基づきスコアをつけた:神経欠損なし(0);左前足を完全に伸ばすことができない(1);左に向く(2);左に回る(3);自発的に歩くことができない(4);発作に関連する死亡(5)(Heraら、1996およびTabriziら、1999)。
【0075】
血液分析
ABL 30 酸−塩基分析装置(Radiometer、デンマーク、コペンハーゲン)を用いて、動脈血液ガス(pH、PaO2、PaCO2)を測定した。
【0076】
損傷量の測定
リン酸バッファー(pH 7.4)中の2%TTCにおいて、固定していない1mmの冠状脳切片をインキュベートすることにより、損傷の面積を画定した。Jandel Scientific(San Rafael、カリフォルニア州)の画像装置を用いて、デジタル化ビデオスクリーン上に連続的冠状切片を表示した。各冠状切片からの患部面積を合計し、各切片の厚さを掛けることにより、損傷量を算出した。スワンソン補正(Tabriziら、1999)を用いて、脳梗塞および水腫を算出した。
【0077】
組織病理学
免疫染色により、TTCで事前に処理した脳組織切片について、フィブリンの検出を実施した。10%バッファーホルマリン中に固定した組織を処理し、各ブロックから、厚さ4μmのパラフィン冠状切片を切断および染色した。抗フィブリンII抗体(NYB−T2G1、Accurate Chemical Sci. Corp.、ニューヨーク州ウェストベリー)(1:500希釈)を用いて、フィブリンを局在化し、下記の等級に従って等級付けした(P. Tabriziら、1999およびY. Okadaら、Stroke. 25:1847−1853、1994):1、血管内空間に限定されるフィブリン沈着;2、血管内腔および血管周囲空間におけるフィブリン沈着;3、血管外または実質組織のみでのフィブリン格子。抗ヒトフィブリン抗体が、マウスフィブリンと交差反応することはすでに明らかにされている(Tabriziら、1999およびH. Weiler−Guettlerら、J. Clin. Invest. 101:1983−1991(1998))。視覚分析はすべて、被検体源またはタイミングについて知らされていない2人の観察者により実施した。また、パラフィン切片は、白血球接着受容体マクロファージ−1抗原に対して向けられた抗−CD11b抗体(DAKO corporation、カリフォルニア州カーペンテリア)(1:250希釈)を用いて染色した。この抗体は、組織中の多形核白血球(PMN)ならびに活性化マクロファージおよび/または小グリア細胞上のCD11b抗原を検出する。10個のランダムな領域で、独立した予備知識のない2人の観察者によりCD11b陽性細胞の数を計数し、切片1mm2当たりの数として表示した。フィブリンおよび白血球の同時検出を連続的免疫染色により実施した。NYB−T2G1抗体でフィブリンを局在化し、3,3’ジアミノベンジジン(DAB)基質(Vector Labs、カリフォルニア州)を用いて検出した後、CD11b抗体およびベクターSG過酸化物基質(Vector Labs、カリフォルニア州)を用いて白血球の検出を行った。通常の対照切片は、一次抗体の欠失、二次抗体の欠失、ならびに、無関係の一次抗体の使用を含んでなる。また、報告されている(S.G. Sorianoら、Stroke. 30:134−139(1999))ように、エステラーゼ染色キット(Sigma、ミズーリ州)を用いて、ジクロロアセテートエステラーゼ染色により、好中球も脳切片において検出した。切片を脱パラフィン化し、ナフトールAS−Dクロロ酢酸塩と一緒にインキュベートした。好中球上の酵素によるエステル加水分解時に放出された遊離ナフトールを、新しく形成されたジアゾニウム塩で検出した後、Gill No.3ヘマトキシリンで対比染色した。好中球の数を前記のように計数した。
【0078】
定量的ウェスタンブロットによる脳組織切片におけるフィブリンの検出
手順は、すでに記載されている(Tabriziら、1999およびH. Weiler−Guettlerら、J. Clin. Invest. 101:1983−1991(1998))通りである。手短には、TTC染色後、脳組織の1mm切片を対側および同側半球に分けた。10 mMリン酸ナトリウムバッファー、pH 7.5、0.1 mMアミノカプロン酸、5 mMEDTA三ナトリウム、10Uアプロチニン/ml、10 Uヘパリン/ml、および2mM PMSF中で、組織をホモゲナイズした。得られたホモジネートを14時間4℃で攪拌し、10,000gで10分の遠心分離により粒状物質を沈降させ、PMSFを含有しない抽出バッファー中に懸濁させ、再び沈降させた後、最後に、3M尿素中に分散させた。こうして得た懸濁液を37℃で2時間攪拌し、激しく渦を形成した後、14,000gで15分間遠心分離した。上清を吸引し、沈降物を65℃で還元SDSバッファー中に溶解させ、SDS−PAGE(8%)に付した後、エレクトロブロッティングによりPVDF膜(Immobilon−P;Millipore Corp.、マサチューセッツ州)に転移した。フィブリンを抗ヒトフィブリンII抗体(前記)と、増強した化学発光装置(Amercham Corp., IL)で視覚化した。カルシウムの不在下で、過剰のトロンビンを含む既知量のマウスフィブリノーゲン(Sigma Chemical Co.、ミズーリ州)を凝固させることにより、フィブリン標準液を調製した。得られたフィルムをHoefer GS 300走査型デンシトメーターでスキャンした。尚、このデンシトメーターは、DT 2805アナログおよびデジタルシステム(Data Translation、マサチューセッツ州)を備えるIMB PCコンピューターにインターフェース接続されており、データは、組織0.1g当たりのμgフィブリンに変換した。
【0079】
分光測光によるヘモグロビンアッセイ
このアッセイは、脳組織における微小出血を検出するために実施した。手順は、すでに記載されている(T.F. Choudhriら、Stroke. 28(11):2296−2302(1997))通りである。手短には、TTC染色後、厚さ1mmの脳組織切片を対側および同側半球に分けた。蒸留水(200μl)を添加し、組織を30秒間ホモゲナイズし、氷上で1分音波処理し、13,000 rpmで30分遠心分離した。ヘモグロビン含有上清を回収し、80μlのドラブキンの試薬((Sigma Diagnostics、ミズーリ州)を20μlのアリコートに添加して、15分混合させた。この反応は、ヘモグロビンを540 nmで吸光度ピークを有するシアンメトヘモグロビンに変換した。測定された吸光度がヘモグロビンの量を反映していることを確認するために、既知量のウシ赤血球ヘモグロビン(Sigma)と、新しくホモゲナイズした脳組織に添加したマウス血液の増加アリコートを並行して分析した。
【0080】
統計分析
スチューデントt検定およびANOVAを用いて、生理学的変数、梗塞、および水腫量をグループ間で比較した。非パラメーターデータ(神経学的結果のスコア)を、フィッシャー変換を含むカイ二乗検定に付した。生存をクルスカル−ウィリス(Kruskal−Willis)検定により比較した。p<0.05の値を統計的に有意であるとみなした。
【0081】
結果
対照動物と、MCA閉塞前、閉塞中、および再灌流中(データは示していない)にAPCで処理した動物との間に、平均動脈血圧、PaO2、PaCO2、pH、ヘマトクリット、頭部温度および体温、ならびに、血液グルコースに有意な統計的差異はみられなかった。MCA閉塞前15分間のAPC処理による頭部温度および体温に変化は認められず、この間すべての血液パラメーターも正常の範囲内であった。
【0082】
対照およびAPC処理マウスの間で、ベースライン組織灌流単位に有意な差は認められなかったが、これは、閉塞前のCBF値が類似していることを意味する。ベースラインCBF読取り値は、APC投与前に記録したが、閉塞前の値に有意差はなく、APCが基礎条件下ではCBFに影響を与えないことを示している。MCA閉塞中に、虚血性大脳半球(点A)でのCBFの減少が両グループで有意であった;対照グループでは、CBFが、ベースライン値の9〜13%まで落ち込んだ(p<0.001;対照MCAグループ)のに対し、APC処理グループでは、CBFは、ベースライン値の13〜18%に減少した(図1)。以下の表1に示すように、APC処理により、対照グループと比較して、閉塞段階中のCBFに25%(p=0.05)の改善がみられた。
【0083】
【表1】
【0084】
しかし、APCは、対側非虚血性大脳半球(点B)での血流量には影響しなかった。再灌流中、虚血性大脳半球におけるCBFは、ベースライン値の32%以下であった(図1A)。対照的に、APC処理マウスでは、再灌流中のCBFには著しい改善がみられ、値は、ベースライン読取り値の71〜98%の間にあり、対照の虚血前の値にほとんど近かった(図1B)。対照マウスに対するAPC処理マウスにおける再灌流中のCBFの相対的増加は、2.4倍(p<0.0005、表1)であった。ここでも、APCは、非虚血性大脳半球でのCBFに影響しなかった。
【0085】
MCA閉塞/再灌流後の生存時間および神経学的スコアに関して、APCの際立った効果がみられた。以下の表2に示すように、本発明の方法で、発作に関連する死亡(5点)は、6〜13時間の再灌流を受けた7匹の対照動物のうち6匹に認められ、1匹だけが24時間生存した。
【0086】
【表2】
【0087】
対照グループの平均生存時間は、10.2時間であった。これに対し、APC処理マウス6匹のうち5匹が24時間生存し、1匹だけが23時間で死亡した。脳損傷の量を決定するため、APC処理マウスを24時間後に死なせた。APC処理グループの平均生存時間は、23.7時間であった。APC処理マウスにおける運動神経学的スコアは、対照グループより、約2倍低かった。
【0088】
APCで処理したマウスは、対照マウスと比較して、脳損傷の量が有意に減少していた(図2)。灰白質損傷(水腫に補正)の合計量、すなわち、脳梗塞量は、対照マウスと比較して、APC処理マウスでは59%(p<0.02)の有意な減少が認められた(図2A)。病変した虚血性大脳半球における水腫量も、APC処理により50%(p<0.05)減少した。図2Aと同じ脳の5つの冠状切片の各々について、梗塞面積を調べたところ、APC処理マウスにおいて、全ての脳レベルでの損傷の有意な減少が確認された(図2B)。図3から、100%の対照マウスが、損傷を有しており、この損傷は、皮質、皮質下部構造および側線条体などの大脳半球の重要な同側部分に及んでいた;≧50%のマウスが、内側線条体に変化を呈し、<50%が背内側(dorsomedial)および腹内側(ventromedial)皮質に変化を示した。APC処理マウスでは、損傷面積に有意な減少がみられ、マウスはすべて、側皮質の十分に局在化した小さな範囲でしか損傷を起こしていない。
【0089】
TTC 染色後にフィブリン用の免疫染色を実施した
細静脈、細動脈および多数の毛細管など、いくつかの微小血管は、MCAモデルにおけるフィブリン局在化の尺度(P. Tabriziら、1999およびY. Okadaら、1994)によれば等級1に相当する管腔内フィブリン沈着物を含んでいた。対照マウスのいくつかの微小血管周辺には、フィブリン等級2の血管外沈着が認められた。対照マウスでは、実質組織への白血球の移動が頻繁に観察され、PMNを形態学、あるいは、該組織におけるCD11bの陽性染色、および/またはジクロロアセテートエステラーゼの陽性染色のいずれかにより、同定した。単一抗体染色に加えて、ヘマトキシリンで切片を対比染色した。フィブリンおよび白血球の二重染色により、大きな細静脈の完全な血栓が明らかにされた。静脈から毛細血管床へのいわゆる「白色血栓」の膨脹も明らかになった。ヘマトキシリン染色を二重染色と同時に実施しなかったので、好中球の核形態は観察することができなかった。ジクロロアセテートエステラーゼでの染色により、対照マウスで、PMNによる虚血実質組織の浸潤を確認した。対照マウスにおけるフィブリンの沈着は、以前のMCAモデル(Y. Okadaら、Stroke. 25:1847−1853、1994)におけるものより、本発明のモデルではるかに大きかったことに留意すべきである。この差は、以前のモデルに対して今回のモデルは、閉塞中および再灌流中の両方において、CBFの減少が有意に大きいこと(すなわち、それぞれ、63%に対して88%、30%に対して68%)に関連すると考えられる。二重染色により、対照マウスにおける虚血性大脳半球での脳血管中のフィブリンおよび白血球の局在化を確認した。APC処理は、フィブリン沈着、ならびに、血管蓄積およびPMNによる実質浸潤を有意に減少させた。
【0090】
梗塞領域における虚血性大脳半球中のフィブリン陽性微小血管の数は、対照マウスと比較して、APC処理マウスでは、約2.5倍減少した(図4A)。しかし、ここで注意しなければならないのは、対照マウスに比べて、APC処理マウスでは、同時染色した組織切片のフィブリン染色がはるかに弱いため、さらに感度の高い定量的ウェスタンブロット分析で示される(図5)ように、フィブリン陽性微小血管の数が、組織に沈着したフィブリンの量を正確に表しているわけではないことである。CD11−b陽性細胞の数とジクロロアセテートエステラーゼ陽性好中球の数とは、対照マウスにおいて同じであり、ほとんど(全部でなければ)のCD11−b陽性細胞が、実際には、PMNであることを示唆している(図4B)。組織中のPMNの数は、APC処理マウスで11.2倍減少した(図4B)。肉眼検査および組織学的分析から、APC処理マウスでは、脳内出血またはクモ膜下出血がないことがわかった。これらの結果は、APC処理マウスおよび対照マウスの両方で、虚血性大脳半球でのヘモグロビンレベルがかろうじて検出可能であったことにより、確証された。このレベルは、対側非虚血性大脳半球での値より低く(図4C)、虚血性大脳半球での微小出血がないことを証明している。ヘモグロビン値は、対照マウスの虚血性大脳半球で特に低く、これは、脳腫脹および再循環損傷による、赤血球の最小血管閉じ込め (minimal vascular entrapment) を恐らく表している。
【0091】
図5Aおよび5Bは、定量的ウェスタンブロット分析により決定したAPC処理マウスの虚血性大脳半球における沈着フィブリンの量が、対照マウスに対して、8.2倍減少したことを示している。
【0092】
実施例2
MCA閉塞から10分後にAPC(2mg/kg)をマウスに投与する以外は、前記実施例1に記載した方法および材料を用いた個別セットの実験で、閉塞後のAPC投与の効果を調べた。梗塞量は69%(p<0.03)減少し(図6A)、水腫量は61%(p<0.05)減少し(図6B)、脳血流は、基準値に向って回復し(図6C)、好中球の脳蓄積は排除された(図6D)。さらに、虚血性大脳半球でのフィブリン陽性血管の数の減少は25%で、ビヒクルで処理した対照と比較して、有意ではない量であった(図6E)。従って、APCは、用量依存的に脳梗塞および水腫の量を減少させ(図6AおよびB)、再灌流中のCBFに用量依存性回復をもたらした(図6C)。
【0093】
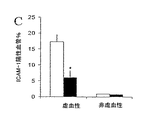
この閉塞後の投与モデルでは、虚血性大脳半球でのICAM−1の免疫染色から、虚血の発作後のAPC投与により、ICAM−1陽性血管の強度が減少し、ICAM−1陽性血管の数も61%減少した(図7)。
【0094】
以下の表3は、閉塞の15分前、または閉塞から10分後にAPC(2mg/kg)で処理したマウスについて実施した実験の累積結果から、対照動物(データは示していない)と比較して、平均動脈血圧、PaO2、PaCO2、pH、ヘマトクリット、頭部温度、ならびに、血液グルコースに有意な統計的差異はみられないことを示している。APC投与は、閉塞/再灌流がない場合には、基礎条件下ではCBFに影響しなかった。
【0095】
【表3】
【0096】
対照グループマウスの平均生存時間は、13.6時間であった。閉塞の15分前または閉鎖から10分後のいずれかに2mg/kg APCで処理した11匹のマウスのうち10匹が24時間生存し、1匹が23時間で死亡した。発作の誘発から10分後に0.5 mg/kg APCで処理した3匹すべてが24時間生存した。脳損傷の量を決定するために、APCで処理したマウスは24時間後に死亡させたため、24時間を超えるデータは得られなかった。
【0097】
MCA閉塞の15分前または閉鎖から10分後に、2mg/kg APCを投与したマウスにおける運動神経学的スコアは、対照グループと比較して、2〜2.7倍改善した。また、MCA閉鎖から10分後に0.5 mg/kg APCを投与すると、神経学上の結果が有意に改善された。しかし、0.1 mg/kg のAPC用量では、生存時間および神経機能(表1)、ならびに、脳損傷の量およびCBFに対する効果(図7)に基づけば、 APCの保護作用は明らかではなかった。
【0098】
実施例3
APCの非酵素補因子であるプロテインSの投与の効果について、実施例1に記載した方法および材料を用いた個別セットの実験で試験した。MCA閉塞から10分後に、ビヒクル、プロテインS(2mg/kg)を単独で、あるいは、低量のAPC(0.1 mg/kg)と共に注射するプロテインS(2mg/kg)のいずれかを注射した。表8Aおよび8Bに示す結果からは、低量のAPC単独では保護作用がないことがわかる。しかし、プロテインS(2mg/kg)とAPC(0.1 mg/kg)の共注射により、相乗効果が生まれ、巣状脳虚血モデルにおいて、脳梗塞および水腫を有意に、それぞれ71%(p<0.008)および51%(p<0.05)減少させた。
【0099】
特定の好ましい実施形態を参照にしながら、本発明を詳しく説明してきたが、改変および変更は、本明細書および特許請求の範囲に記載された精神および範囲に含まれることは理解されるだろう。
【図面の簡単な説明】
【図1】
図1Aおよび1Bは、対照マウス(図1A)およびAPC処理マウス(図1B)におけるMCA閉塞および再灌流中の脳血流量(CBF)の変化を示すグラフである。時間の長さ(I)は、閉塞前に、ビヒクル(図1A)またはAPC(図1B)のいずれかをIV投与した後に記録したCBF値に対応する。値は平均値±SDとして表し、対照グループについてはn=6、APC処理グループについてはn=7である。両グループ間のCBF値の有意差は星印(*)で示す(p<0.02〜<0.005)。
【図2】
図2Aおよび2Bは、1時間の一過性MCA閉塞に付した対照マウスおよびAPC処理マウスで、TTC染色により決定された脳損傷を示すグラフである。図2Aは、脳損傷(左)および水腫(スワンソン補正、右)の量を示す。値は平均値±SEであり、対照マウスはn=6、APC処理マウスはn=7である。スチューデントt検定により*p<0.01および**p<0.05。図2Bは、図2Aと同じ脳の5つの冠状切片の各々についての梗塞面積を示す。値は平均値±SE;*p<0.05。
【図3】
図3Aおよび3Bは、対照マウス(図3A)およびAPC処理マウス(図3B)における一過性MCA閉塞中の視神経交差レベルでの梗塞の発生数および局所解剖学を示す概略図である。対照マウスおよびAPC処理マウスの数は、それぞれ6および7である。局所解剖学(関与領域)の発生率を示す記号は、図3Aに載せる。
【図4】
図4A〜4D は、1時間の一過性MCA閉塞後に決定される対照マウスおよびAPC処理マウスにおける虚血および対側大脳半球中のフィブリン陽性微小血管(図4Aおよび4C)、好中球(図4B)およびヘモグロビンレベル(図4D)を示す一連のグラフである。フィブリン陽性微小血管および白血球は、それぞれ、抗フィブリンII抗体およびCD11b抗体を用いた免疫染色と、ジクロロアセテート染色により検出された。大脳半球切片中のヘモグロビンレベルは、分光測光ヘモグロビンアッセイにより決定した。値は平均値±SEであり、対照マウス(白色棒)はn=6、APC処理マウス(黒色棒)はn=7である。
【図5】
図5Aおよび5Bは、抗フィブリンNYB−T2G1抗体を用いた対照マウスおよびAPC処理マウスの脳切片におけるフィブリンのウェスタンブロット検出を示すグラフである。図5Aは、ウェスタンブロット標準曲線サンプルからのシグナルが、0.05〜3μg/0.1 mlの範囲で線状であることを示す。図5Bは、虚血および対側大脳半球における対照マウスおよびAPC処理マウスの視神経交差のレベルでの10 mg脳組織切片のウェスタンブロット分析を示す。フィブリンレベルは、標準曲線(平均値±SE、n=3)を用いた走査型デンシトメトリーにより決定した。
【図6】
図6A〜6Eは、発作誘発後にビヒクルまたはAPCで処理したマウスにおける脳梗塞面積(図6A)および水腫量(図6B)、再灌流中の脳血流量(CBF)(図6C)、好中球(図6D)およびフィブリン陽性血管(図6E)を示すグラフである。ビヒクル(白棒)、またはAPC(2mg/kg、黒棒)、0.5 mg/kg(薄い灰色の棒)および0.1 mg/kg(濃い灰色の棒)をMCA閉塞から10分後に投与した。平均値±SE、マウス3〜5匹。*p<0.05および**p<0.01。
【図7】
対照マウス(n=4;白棒)とMCA閉塞から10分後に2mg/kgのAPC投与で処理した後のAPC処理マウス(n=4;黒棒)におけるICAM−1陽性血管(平均値±SE)のパーセントを示すグラフである。
【図8】
図8Aおよび8Bは、発作誘発後に、ビヒクルのみ(対照)、低用量(0.1 mg/kg )のAPC、プロテインS(2mg/kg)と共に注射した低用量APC、またはプロテインSのみで処理したマウスの虚血性大脳半球における脳梗塞面積(図8A)および水腫量(図8B)を示すグラフである。平均値±SE、マウス2〜5匹。*p<0.05。また、nsとは、有意でないことを意味する。
Claims (21)
- 神経病理学的障害を有するか、またはそのようなリスクがある被験者において細胞死からニューロン細胞を保護する方法であって、神経保護量の活性化プロテインC(APC)を該被験者に投与することにより、該被験者に神経保護をもたらすことを含んでなる、上記方法。
- 上記APCを静脈内に投与する、請求項1に記載の方法。
- 上記神経病理学的障害が発作、アルツハイマー病、ハンチントン病、パーキンソン病、虚血、てんかん、筋萎縮側索硬化症、髄膜炎、多発性硬化症、精神遅滞および老化からなる群より選択される、請求項1に記載の方法。
- 上記障害が発作であり、発作中または発作の6時間前もしくは後までに上記APCを投与する、請求項3に記載の方法。
- 1種以上の抗血栓因子またはAPC補因子を投与することをさらに含む、請求項1に記載の方法。
- 上記APC補因子がプロテインSである、請求項5に記載の方法。
- 1種以上の別の神経保護薬を投与することをさらに含む、請求項1に記載の方法。
- 上記別の神経保護薬がN−メチル−D−アスパラギン酸(NMDA)受容体アンタゴニストまたはカルシウムイオンチャンネルアンタゴニストである、請求項7に記載の方法。
- 神経病理学的障害を有するか、またはそのようなリスクがある被験者において炎症を抑制する方法であって、抗炎症有効量の活性化プロテインC(APC)を該被験者に投与することにより、該被験者の神経炎症を抑制することを含んでなる、上記方法。
- 上記APCを静脈内に投与する、請求項9に記載の方法。
- 上記神経病理学的障害が発作、アルツハイマー病、ハンチントン病、パーキンソン病、虚血、てんかん、筋萎縮側索硬化症、髄膜炎、多発性硬化症、精神遅滞および老化からなる群より選択される、請求項9に記載の方法。
- 上記障害が発作であり、発作中または発作の6時間前もしくは後までに上記APCを投与する、請求項11に記載の方法。
- 1種以上の抗血栓因子またはAPC補因子を投与することをさらに含む、請求項12に記載の方法。
- 上記APC補因子がプロテインSである、請求項13に記載の方法。
- 炎症性血管疾患を有するか、またはそのようなリスクがある被験者において炎症を抑制する方法であって、抗炎症有効量の活性化プロテインC(APC)を該被験者に投与することにより、該被験者の炎症を抑制することを含んでなる、上記方法。
- 治療上有効な量の1種以上の抗凝固薬、抗血小板薬または血栓崩壊薬を該被験者に投与することをさらに含む、請求項1、9または15のいずれか1項に記載の方法。
- 上記血栓崩壊薬がウロキナーゼ、tPA、Lys−プラスミノーゲンおよびストレプトキナーゼからなる群より選択される、請求項16に記載の方法。
- 上記抗血小板薬がアスピリン、ジピリダモール、チクロピジン、クロピドグレル、アブシキシマブ(レオプロ(Reopro))および血小板糖タンパク質IIb−IIIaの阻害薬からなる群より選択される、請求項16に記載の方法。
- 治療上有効な量の抗血栓因子またはAPC補因子を被験者に投与することをさらに含む、請求項1、9または15のいずれか1項に記載の方法。
- 上記APC補因子がプロテインSである、請求項19に記載の方法。
- 治療上有効な量の1種以上の抗炎症薬を被験者に投与することをさらに含む、請求項19に記載の方法。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US18022700P | 2000-02-04 | 2000-02-04 | |
| PCT/US2001/003758 WO2001056532A2 (en) | 2000-02-04 | 2001-02-05 | Neuroprotective, antithrombotic and anti-inflammatory uses of activated protein c (apc) |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2004508280A true JP2004508280A (ja) | 2004-03-18 |
| JP2004508280A5 JP2004508280A5 (ja) | 2008-03-27 |
Family
ID=22659693
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2001556226A Pending JP2004508280A (ja) | 2000-02-04 | 2001-02-05 | 活性化プロテインc(apc)の神経保護薬、抗血栓薬および抗炎症薬としての使用 |
Country Status (8)
| Country | Link |
|---|---|
| US (1) | US7074402B2 (ja) |
| EP (1) | EP1255556B1 (ja) |
| JP (1) | JP2004508280A (ja) |
| AT (1) | ATE504310T1 (ja) |
| AU (1) | AU2001238034A1 (ja) |
| CA (1) | CA2398929C (ja) |
| DE (1) | DE60144366D1 (ja) |
| WO (1) | WO2001056532A2 (ja) |
Families Citing this family (21)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20040096443A1 (en) * | 2002-03-08 | 2004-05-20 | Traynelis Stephen Francis | Treatment of neurodegenerative diseases and conditions using par1 antagonists |
| AU2002302192B2 (en) | 2001-06-13 | 2007-08-16 | Zz Biotech Llc | Treatment and composition for wound healing |
| US20030073636A1 (en) * | 2001-09-19 | 2003-04-17 | Oklahoma Medical Research Foundation | Method of treating diabetes |
| AU2003277034A1 (en) * | 2002-09-30 | 2004-04-23 | Socratech L.L.C. | Protein s protects the nervous system from injury |
| EP1567199B1 (en) * | 2002-12-05 | 2014-07-23 | Zz Biotech L.L.C. | Neuroprotective activity of activated protein c is independent of its anticoagulant activity |
| WO2004056309A2 (en) * | 2002-12-05 | 2004-07-08 | Socratech L.L.C. | Neuroprotective activity of activated protein c is independent of its anticoagulant activity |
| US20070142272A1 (en) * | 2003-01-24 | 2007-06-21 | Zlokovic Berislav V | Neuroprotective activity of activated protein c independent of its anticoagulant activity |
| US9192657B2 (en) * | 2003-07-08 | 2015-11-24 | The Scripps Research Institute | Activated protein C variants with normal cytoprotective activity but reduced anticoagulant activity |
| JP2008507561A (ja) * | 2004-07-23 | 2008-03-13 | ザ ユニバーシティ オブ ロチェスター | 活性化プロテインcによる、脳内のプラスミノゲン活性化因子の不都合な作用の阻害 |
| EP1841442A4 (en) * | 2005-01-07 | 2009-12-09 | Northern Sydney And Central Co | TREATMENT OF AUTOIMMUNE DISEASES AND INFLAMMATORY DISEASES |
| US7785857B2 (en) * | 2006-08-31 | 2010-08-31 | Saint Louis University | Protein C variant |
| AU2008280782B2 (en) | 2007-07-20 | 2014-01-23 | Diamedica Inc. | Tissue kallikrein for the treatment of diseases associated with amyloid protein |
| US8257700B2 (en) * | 2008-02-05 | 2012-09-04 | The Board Of Trustees Of The Leland Stanford Junior University | Proteomic analysis of active multiple sclerosis lesions |
| EP2421554A4 (en) * | 2009-04-22 | 2012-11-28 | Sanomune Inc | TISSUE KALLICREIN FOR THE TREATMENT OF HUNTINGTON'S DISEASE |
| ES2676422T3 (es) | 2012-07-04 | 2018-07-19 | Zz Biotech Llc | Proteína C activada para su uso en el tratamiento de trastornos inflamatorios de la piel |
| CN104122396A (zh) * | 2013-04-23 | 2014-10-29 | 中国科学院上海生命科学研究院 | 维生素k依赖性蛋白s作为糖尿病标志物的应用 |
| CN106573040B (zh) | 2014-04-16 | 2021-07-06 | Zz生物技术有限责任公司 | 治疗异常皮肤瘢痕形成 |
| CN105806818B (zh) * | 2016-04-01 | 2019-11-22 | 南京医科大学 | 检测血小板nmda受体活性的方法及其应用 |
| EP3464322B1 (en) | 2016-06-05 | 2023-04-05 | Tel HaShomer Medical Research Infrastructure and Services Ltd. | Novel molecules for the treatment of inflammation |
| CN110446501A (zh) | 2017-03-09 | 2019-11-12 | 代阿麦迪卡股份有限公司 | 组织激肽释放酶1的剂型 |
| WO2021190563A1 (zh) * | 2020-03-24 | 2021-09-30 | 泰伦基国际有限公司 | 一种治疗亨廷顿病的方法和药物 |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH01238536A (ja) * | 1987-11-17 | 1989-09-22 | Scripps Clinic Res Found | 動脈の血栓症的閉塞または塞栓症を阻止するための医薬組成物 |
| JPH0338528A (ja) * | 1989-06-26 | 1991-02-19 | Immuno Ag Chem Med Prod | 血栓症および血栓寒栓併発症を処置および予防するための調整物 |
| WO1998042358A1 (en) * | 1997-03-24 | 1998-10-01 | Eli Lilly And Company | Methods for treating vascular disorders |
Family Cites Families (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5009889A (en) * | 1987-12-31 | 1991-04-23 | Oklahoma Medical Research Foundation | Treatment of dysfunctional vascular endothelium using activated protein C |
| US5254532A (en) * | 1989-06-26 | 1993-10-19 | Immuno Aktiengesellschaft Fur Chemisch-Medizinische Produkte | Preparation for treating and preventing thromboses and thromboembolic complications, use of such a preparation and a method of producing the same |
| WO1998055142A1 (en) * | 1997-06-05 | 1998-12-10 | Eli Lilly And Company | Methods for treating thrombotic disorders |
| HUP0001237A3 (en) * | 1997-10-20 | 2002-01-28 | Lilly Co Eli | Methods for treating vascular disorders |
-
2001
- 2001-02-05 CA CA2398929A patent/CA2398929C/en not_active Expired - Fee Related
- 2001-02-05 US US09/777,484 patent/US7074402B2/en not_active Expired - Fee Related
- 2001-02-05 JP JP2001556226A patent/JP2004508280A/ja active Pending
- 2001-02-05 AU AU2001238034A patent/AU2001238034A1/en not_active Abandoned
- 2001-02-05 WO PCT/US2001/003758 patent/WO2001056532A2/en active Application Filing
- 2001-02-05 EP EP01910427A patent/EP1255556B1/en not_active Expired - Lifetime
- 2001-02-05 AT AT01910427T patent/ATE504310T1/de not_active IP Right Cessation
- 2001-02-05 DE DE60144366T patent/DE60144366D1/de not_active Expired - Lifetime
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH01238536A (ja) * | 1987-11-17 | 1989-09-22 | Scripps Clinic Res Found | 動脈の血栓症的閉塞または塞栓症を阻止するための医薬組成物 |
| JPH0338528A (ja) * | 1989-06-26 | 1991-02-19 | Immuno Ag Chem Med Prod | 血栓症および血栓寒栓併発症を処置および予防するための調整物 |
| WO1998042358A1 (en) * | 1997-03-24 | 1998-10-01 | Eli Lilly And Company | Methods for treating vascular disorders |
Also Published As
| Publication number | Publication date |
|---|---|
| WO2001056532A3 (en) | 2001-12-06 |
| WO2001056532A2 (en) | 2001-08-09 |
| CA2398929C (en) | 2011-05-31 |
| US7074402B2 (en) | 2006-07-11 |
| DE60144366D1 (de) | 2011-05-19 |
| EP1255556B1 (en) | 2011-04-06 |
| EP1255556A2 (en) | 2002-11-13 |
| ATE504310T1 (de) | 2011-04-15 |
| WO2001056532A9 (en) | 2003-01-09 |
| AU2001238034A1 (en) | 2001-08-14 |
| CA2398929A1 (en) | 2001-08-09 |
| US20020028199A1 (en) | 2002-03-07 |
| EP1255556A4 (en) | 2003-07-02 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2004508280A (ja) | 活性化プロテインc(apc)の神経保護薬、抗血栓薬および抗炎症薬としての使用 | |
| US6315995B1 (en) | Methods for treating an ischemic disorder and improving stroke outcome | |
| FI104790B (fi) | Menetelmä aktivoidun proteiini C:n valmistamiseksi | |
| AU735012B2 (en) | Modified factor VII | |
| US6183743B1 (en) | Modified factor VII | |
| DE69828462T2 (de) | Verwendung von APC, in Kombination mit Blutplättchenaggregationshemmer, zur Behandlung thrombothischer Störungen | |
| US20170051268A1 (en) | Non-neurotoxic plasminogen activating factors for treating of stroke | |
| JPH11500408A (ja) | 改良型▲vii▼因子 | |
| JP4986618B2 (ja) | 通常の細胞保護活性を有するが抗凝固活性が低下した活性化プロテインc変異体 | |
| JP2010508031A (ja) | 通常の細胞保護活性を有するが抗凝固活性が低下した活性化プロテインc変異体 | |
| JP2006525270A (ja) | 脳梗塞の処置のための非神経毒性プラスミノーゲン活性剤の静脈内注射 | |
| JP2006525270A5 (ja) | ||
| US20050250688A1 (en) | Methods for treating an ischemic disorder and improving stroke outcome | |
| JP2012077090A (ja) | 脳梗塞の処置のための非神経毒性プラスミノーゲン活性剤の静脈内注射 | |
| US20060135425A1 (en) | Intravenous injection of plasminogen non-neurotoxic activators for treating cerebral stroke | |
| US20080057050A1 (en) | Intravenous injection of plasminogen non-neurotoxic activators for treating cerebral stroke | |
| US20040087498A1 (en) | Modified factor VII | |
| WO2005074979A1 (fr) | Utilisation de la prourokinase pour le traitement du syndrome pulmonaire thrombo-embolique ou de l'occlusion de l'artere centrale de la retine | |
| JP2008507561A (ja) | 活性化プロテインcによる、脳内のプラスミノゲン活性化因子の不都合な作用の阻害 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20080131 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20080131 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20101109 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20110209 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20110510 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20110804 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20110811 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20111109 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20120327 |