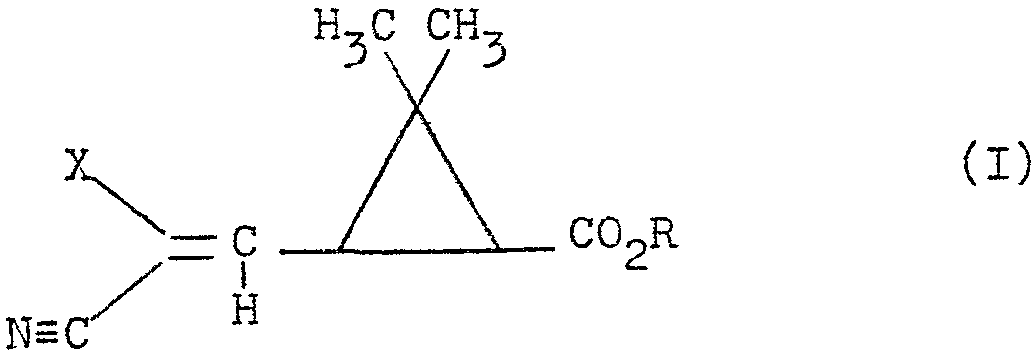FR2550191A1 - Nouveaux derives de l'acide cyclopropane carboxylique, leur procede de preparation et leur application a la lutte contre les parasites - Google Patents
Nouveaux derives de l'acide cyclopropane carboxylique, leur procede de preparation et leur application a la lutte contre les parasites Download PDFInfo
- Publication number
- FR2550191A1 FR2550191A1 FR8312858A FR8312858A FR2550191A1 FR 2550191 A1 FR2550191 A1 FR 2550191A1 FR 8312858 A FR8312858 A FR 8312858A FR 8312858 A FR8312858 A FR 8312858A FR 2550191 A1 FR2550191 A1 FR 2550191A1
- Authority
- FR
- France
- Prior art keywords
- formula
- compounds
- sep
- alcohol
- esters
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Granted
Links
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D213/00—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members
- C07D213/02—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members
- C07D213/04—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D213/60—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D213/62—Oxygen or sulfur atoms
- C07D213/63—One oxygen atom
- C07D213/64—One oxygen atom attached in position 2 or 6
- C07D213/647—One oxygen atom attached in position 2 or 6 and having in the molecule an acyl radical containing a saturated three-membered ring, e.g. chrysanthemumic acid esters
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N53/00—Biocides, pest repellants or attractants, or plant growth regulators containing cyclopropane carboxylic acids or derivatives thereof
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C255/00—Carboxylic acid nitriles
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D233/00—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings
- C07D233/54—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having two double bonds between ring members or between ring members and non-ring members
- C07D233/66—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having two double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D233/72—Two oxygen atoms, e.g. hydantoin
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F3/00—Compounds containing elements of Groups 2 or 12 of the Periodic System
- C07F3/10—Mercury compounds
Abstract
L'INVENTION A POUR OBJET SOUS TOUTES LES FORMES ISOMERES POSSIBLES AINSI QUE LES MELANGES DE CES ISOMERES LES COMPOSES DE FORMULE I : (CF DESSIN DANS BOPI) DANS LAQUELLE LA COPULE ACIDE CYCLOPROPANIQUE EST DE STRUCTURE 1R CIS OU 1R TRANS, X REPRESENTE UN ATOME D'HALOGENE ET R REPRESENTE UN ATOME D'HYDROGENE, UN RADICAL ALCOYLE LINEAIRE, RAMIFIE OU CYCLISE, SATURE OU INSATURE, RENFERMANT JUSQU'A 12 ATOMES DE CARBONE OU LE RESTE D'UN ALCOOL R-OH UTILISE DANS LA SYNTHESE DES PYRETHRINOIDES, LA GEOMETRIE DE LA DOUBLE LIAISON PORTEE PAR LE CARBONE EN 3 POUVANT ETRE DE STRUCTURE E OU Z. L'INVENTION A EGALEMENT POUR OBJET UN PROCEDE DE PREPARATION DES COMPOSES DE FORMULE I. L'INVENTION A AUSSI POUR OBJET L'APPLICATION DES COMPOSES DE FORMULE I A LA LUTTE CONTRE LES PARASITES.
Description
La présente invention concerne de nouveaux dérivés de l'acide cyclopropane carboxylique, leur procédé de préparation et leur application a la lutte contre les parasites.
L'invention a pour objet sous toutes leurs formes isomères possibles ainsi que les mélanges de ces isomères les composés de formule (I)
dans laquelle la copule acide cyclopropanique est de structure 1R cis ou 1R trans, X représente un atome d'halogene et R représente un atome d'hydrogéne, un radical alcoyle linéaire, ramifié ou cyclisé, saturé ou insaturé, renfermant jusqu'a 12 atomes de carbone ou le reste d'un alcool
R-OH utilisé dans la synthèse des pyréthrinoides, la géométrie de la double liaison portée par le carbone en 3 pouvant être de structure E ou Z.
dans laquelle la copule acide cyclopropanique est de structure 1R cis ou 1R trans, X représente un atome d'halogene et R représente un atome d'hydrogéne, un radical alcoyle linéaire, ramifié ou cyclisé, saturé ou insaturé, renfermant jusqu'a 12 atomes de carbone ou le reste d'un alcool
R-OH utilisé dans la synthèse des pyréthrinoides, la géométrie de la double liaison portée par le carbone en 3 pouvant être de structure E ou Z.
Lorsque R représente un radical alcoyle linéaire, ramifié ou cyclisé, saturé ou insaturé, il s'agit de préférence du radical méthyle, éthyle, propyle linéaire ou ramifié, butyle linéaire ou ramifié, pentyle linéaire ou ramifié, hexyle linéaire ou ramifié, cyclopropyle, cyclobutyle, cyclopentyle, cyclohexyle, 1-propényle, 1-butynyle, 1,3-butédiényle, 1pentényle, l-cyclobutynyle, 1-cyclopentadiényle, 1-cyclohexényle.
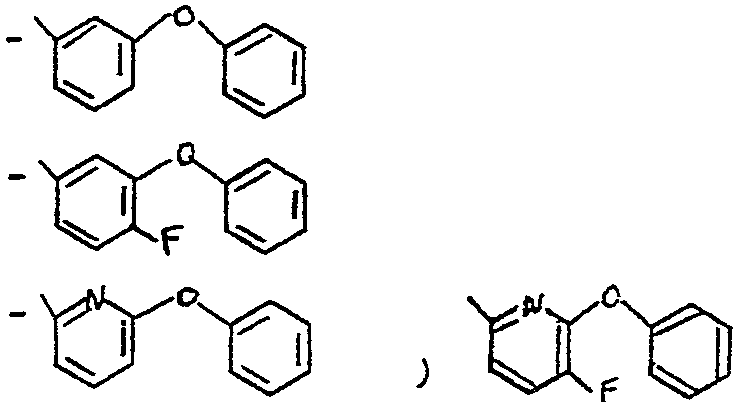
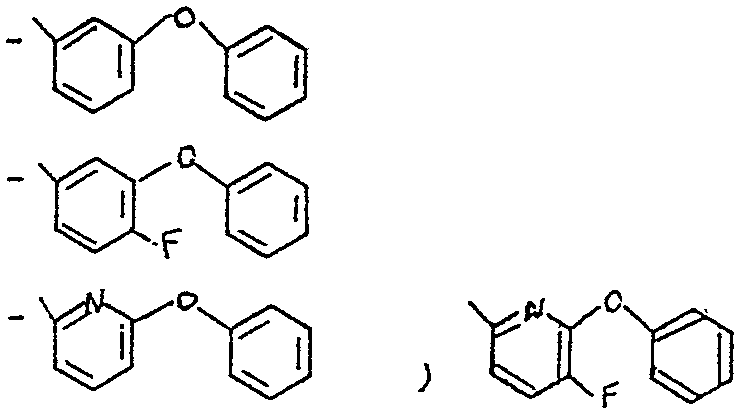
Lorsque R représente le reste d'un alcool utilisé dans la synthese des pyréthrinoîdes, il s'agit de préférence du radical choisi dans le groupe des radicaux suivants
A - les radicaux -CH-Ardans lesquels Z représente un atome
z d'hydrogène, un radical éthynyle, méthyle, ou cyano et Ar représente un radical
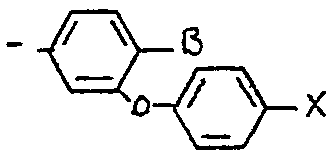
dans lequel 5 représente un atome d'hydrogène ou de fluor et x représente
un atome de fluor, de chlore ou de broine
A - les radicaux -CH-Ardans lesquels Z représente un atome
z d'hydrogène, un radical éthynyle, méthyle, ou cyano et Ar représente un radical
dans lequel 5 représente un atome d'hydrogène ou de fluor et x représente
un atome de fluor, de chlore ou de broine
D - et les radicaux
formule dans laquelle Y2 représente un atome d'hydrogène, un atome de fluor, de chlore ou de brome, un groupement -C-N ou un groupement -Cr CH, Y3, Y4, Y5 identiques ou différents, représentent un atome d'hydrogène, un atome de fluor, de chlore ou de brome, un radical alcoyle linéaire, ramifié ou cyclique, renfermant de 1 a 8 atomes de carbone, éventuellement substitué par un ou plusieurs groupements fonctionnels, identiques ou différents, un radical alcényle comportant de 2 à 8 atomes de carbone ou un radical alcynyle comportant de 2 a 8 atomes de carbone, les radicaux Y3, Y4 et Y5 peuvent former les cycles entre eux deux a deux.
formule dans laquelle Y2 représente un atome d'hydrogène, un atome de fluor, de chlore ou de brome, un groupement -C-N ou un groupement -Cr CH, Y3, Y4, Y5 identiques ou différents, représentent un atome d'hydrogène, un atome de fluor, de chlore ou de brome, un radical alcoyle linéaire, ramifié ou cyclique, renfermant de 1 a 8 atomes de carbone, éventuellement substitué par un ou plusieurs groupements fonctionnels, identiques ou différents, un radical alcényle comportant de 2 à 8 atomes de carbone ou un radical alcynyle comportant de 2 a 8 atomes de carbone, les radicaux Y3, Y4 et Y5 peuvent former les cycles entre eux deux a deux.
Par atome d'halogène, on entend les atomes de fluor, de chlore ou de brome, mais l'invention a tout particulièrement pour objet les composés de formule (I) dans laquelle X représente un atome de fluor.
L'invention a tout spécialement pour objet les composés de formule (I) pour lesquels la géométrie de la double liaison portée par le carbone en 3 du cyclopropane est de structure Z.
Parmi les composés de l'invention, on peut citer tout particulièrement les composés pour lesquels R représente un radical -CH-Ar, dans lequel Z Z représente un atome d'hydrogène, un radical-C -CH,CH3 ou un radical -C--N
et Ar représente un radical choisi dans le groupe des radicaux - C5H5 - C6F5
et Ar représente un radical choisi dans le groupe des radicaux - C5H5 - C6F5
<tb> avec <SEP> B=H <SEP> ou <SEP> F
<tb> <SEP> X=F, <SEP> Cl, <SEP> Br
<tb> dans lequel B représente un atome d'hydrogène ou de fluor et X représente un atome de fluor, de chlore ou de brome et notamment les composés pour lesquels Ar représente un radical X -cyano métaphênoxy benzyle comme le 1R cis 2,2-diméthyl 3/z E 2-fluoro 2-cyano éthényl/ cyclopropane carboxylate de (S) < -cyano métaphénoxybenzyle ou l'isomereD Z correspondant.
<tb> <SEP> X=F, <SEP> Cl, <SEP> Br
<tb> dans lequel B représente un atome d'hydrogène ou de fluor et X représente un atome de fluor, de chlore ou de brome et notamment les composés pour lesquels Ar représente un radical X -cyano métaphênoxy benzyle comme le 1R cis 2,2-diméthyl 3/z E 2-fluoro 2-cyano éthényl/ cyclopropane carboxylate de (S) < -cyano métaphénoxybenzyle ou l'isomereD Z correspondant.
Les composés de formule (Ij présentent d'intéressantes propriétés qui permettent leur utilisation dans la lutte contre les parasites. Il peut s'agir par exemple de la lutte contre les parasites des végétaux, les parasites des locaux et les parasites des animaux a sang chaud. C'est ainsi que l'on peut utiliser les produits de l'invention pour lutter contre les inspectes, les nématodes et les acariens parasites des végétaux et des animaux.
L'invention a donc aussi pour objet l'application des composés de formule (I) tels que définis précédemment a la lutte contre les parasites des végétaux, les parasites des locaux et les parasites des animaux à sang chaud.
Les produits de formule (I) peuvent être utilises notamment pour lutter contre les insectes dans le domaine agricole, pour lutter par exemple contre les pucerons, les larves de lépidoptères et les coléoptères. Ils sont utilisés a des doses comprises entre 10 g et 300 g de matière active a l'hectare.
Les produits de formule (I) peuvent également être utilisés pour lutter contre les insectes dans les locaux, pour lutter notamment contre les mouches, les moustiques et les blattes
Les produits de formule (I) peuvent aussi être utilisés pour lutter contre les acariens et les nématodes parasites des végétaux.
Les produits de formule (I) peuvent aussi être utilisés pour lutter contre les acariens et les nématodes parasites des végétaux.
Les composés de formule (I) peuvent encore être utilisés pour lutter contre les acariens parasites des animaux, pour lutter par exemple contre les tiques et notamment les tiques de l'espèce Boophilus, ceux de l'espèce Hyalomnia, ceux de l'espèce Amblyomnia et ceux de l'espèce Rhipicephalus ou pour lutter contre toutes sortes de gales et notamment la gale sarcoptique, la gale psoroptique et la gale chorioptique. Ils peuvent aussi être utilisés contre les poux et les helminthes.
L'invention a donc également pour objet les compositions destinées a la lutte contre les parasites des végétaux, les parasites des locaux et les parasites des animaux à sang chaud, caractérisées en ce qu'elles renferment comme principe actif au moins un des produits de formule générale (I).
L'invention a notamment pour objet les compositions insecticides renfermant comme principe actif au moins l'un des produits de formule générale (I).
Parmi les compositions notamment insecticides proférées de l'invention, on peut citer tout spécialement les compositions renfermant les composés
décrits dans les exemples et notamment le (1R cis) 2,2-diméthyl 3/(S E) 2fluoro 2-cyano éthényl/ cyclopropane carboxylate de (S)d-cyano métaphénoxy
benzyle.
décrits dans les exemples et notamment le (1R cis) 2,2-diméthyl 3/(S E) 2fluoro 2-cyano éthényl/ cyclopropane carboxylate de (S)d-cyano métaphénoxy
benzyle.
Ces compositions sont préparées selon les procédés usuels de l'industrie agrochimique. Elles peuvent être additionnées éventuellement d'un ou plusieurs autres agents pesticides. Ces compositions peuvent se presenter sous forme de poudres, granulés, suspensions, émulsions, solutions, solutions pour aérosols, bandes combustibles, appâts ou autres préparations employés classiquement pour l'utilisation de ce genre de composés.
Outre le principe actif, ces compositions contiennent, en général un véhicule et/ou un agent tensio-actif, non ionique, assurant, en outre, une dispersion uniforme des substances constitutives du mélange. Le véhicule utilisé peut etre un liquide, tel que liteau, l'alcool, les hydrocarbures ou autres solvants organiques, une huile minérale, animale ou végétale, une poudre telle que le talc, les argiles, les silicates, le kieselguhr ou un solide combustible.
Les compositions insecticides selon l'invention contiennent de préférence 0,005 à à 10 % en poids de matière active.
Selon un mode opératoire avantageux, pour un usage dans les locaux, les compositions selon l'invention sont utilisées sous forme de compositions fumigantes.
Les compositions selon l'invention peuvent alors être avantageusement constituees, pour la partie non active, d'un serpentin combustible,.ou ou encore d'un susbtrat fibreux incombustible. Dans ce dernier cas, le fumigant obtenu après incorporation de la matière active est place sur un appareil chauffant.
Dans le cas ou -l'on utilise un serpentin insecticide, le support inerte peut être. par exemple, composé de marc de pyrèthre, poudre de Tabu (ou poudre de feuilles Machilus Thumbergii, poudre de tige de pyrethre, poudre de feuille de cèdre, poudre de bois (telle que de la sciure de pin) amidon et poudre de coque de noix de coco.
La dose de matière active peut alors être, par exemple,de 0,03 à 1 en poids.
Dans le cas ou l'on utilise un support fibreux incombustible, la dose de matière active peut alors être, par exemple, de 0,03 a 25 en poids.
Les compositions selon l'invention pour un usage dans les locaux peuvent aussi être obtenues en préparant une huile pulvérisable a base de principe actif, cette huile imbibant Ta mèche d'une lampe et étant alors soumise à la combustion.
La concentration du principe actif incorporé à l'huile est, de préférence, de 0,03 a 25 % en poids.
Les compositions acaricides et nématicides peuvent se présenter notamment sous forme de poudre, granulés, suspensions, émulsions, solutions.
Les compositions acaricides et nématicides peuvent être additionnées éventuellement d'un ou plusieurs autres agents pesticides.
Pour l'usage acaricide, on utilise de préférence des poudres mouillables, pour pulvérisation foliaire, contenant de 1 à 80 % de principe actif ou des liquides pour pulvérisation foliaire contenant de 1 a 500 g/l de principe actif. On peut également employer des poudres pour poudrage foliaires contenant de 0,05 à 3 % de matiere active.
Pour l'usage nématicide, on utilise de préférence des liquides pour traitement des sols contenant de 300 a 500 g/l de principe actif.
Les composés acaricides et nématicides selon l'invention sont utilisées, de préférence, à des doses comprises entre I et 100 g de matière active a l'hectare.
L'invention a donc -aussi pour objet les compositions acaricides renfermant comme principe actif au moins l'un des produits de formule générale (i) ainsi que les compositions nématicides renfermant comme principe actif au moins l'un des produits définis de formule générale (I).
L'invention a également pour objet les compositions acaricides renfermant comme principe actif l'un au moins des composés de formule générale (I), caractérisées en ce qu'elles sont utilisées dans la lutte contre les parasites des animaux a sang chaud, notamment contre les tiques et les gales.
Lorsqu'il s'agit de lutter contre les parasites des animaux, les compositions peuvent être utilisées sous forme de spray, de bain, ou encore selon la méthode "pour-on".
Lorsqu'on utilise la méthode pour-on, on utilise due préférence des solutions renfermant de 0,5 a 4 g de principe actif pour 100 cm3 de solution.
Lorsqu'il s'agit de lutter contre les acariens parasites des animaux, on peut incorporer les produits de l'invention dans des compositions alimentaires en association avec un mélange nutritif adapté a l'alimentation animale. Le mélange nutritiel peut varier selon l'espèce animale ; il peut renfermer des céréales, des sucres et des grains des tourteaux de soja, d'arachide et de tournesol, des farines d'origine animale, par exemple des farines de poissons, des acides aminés de
synthese, des sels minéraux, des vitamines et des antioxydants.
synthese, des sels minéraux, des vitamines et des antioxydants.
L'invention a donc ainsi également pour objet les compositions
destinées a l'alimentation animale renfermant comme principe actif au moins l'un des produits de formule générale (t).
destinées a l'alimentation animale renfermant comme principe actif au moins l'un des produits de formule générale (t).
L'invention a également pour objet les associations douées d'activité insecticide, acaricide ou némati ci de, caractérisés en ce qu'elles contiennent comme matière active, d'une part un au moins des composés de formule générale (I) et d'autre part, un au moins des esters pyrethrinoldes choisis dans le groupe constitué par les esters d'alléthrolones, d'alcool 3,4,5,6-tétrahydrophtalimido - méthyl ique, d'alcool 5-benzyl 3-furyl méthylique, d'alcool 3-phénoxy benzylique et d'alcools -cyano 3-phênoxy benzyliques des acides chrysanthémiques, par les esters d'alcool 5-benzyl 3-furyl méthylique des acides 2,2-diméthyl 3-(2-oxo 3-tétrahydrothiophénylidène méthyl) cyclopropane l-carboxyliques, par les esters d'alcool 3phénoxy benzylique et d'alcools -cyano 3-phénoxy benzyliques des acides 2,2-diméthyl 3-(2,2-dichlorovinyl) cyclopropane 1-carboxyliques, par les esters d'alcools o(-cyano 3-phénoxy benzyliques d'acides 2,2-diméthyl 3 (2,2-dibromovinyl) cyclopropane carboxyliques, par les esters d'alcool 3phénoxy benzylique des acides 2-parachlorophényl 2-isopropyl acétiques-, par les esters d'allêthrolones, d'alcool 3,4,5,6-tétrahydrophtalimido méthylique, d'alcool 5-benzyl 3-furyl méthylique, d'alcool 3-phénoxy benzylique et d'alcools o(-cyano 3-phénoxy benzyliques des acides 2,2diméthyl 3-(1,2-2,2-tétrahaloéthyl) cyclopropane 1-carboxyliques dans lesquels "halo" représente un atome de fluor, de chlore ou de brome, étant entendu que les copules acides et alcools des esters pyréthrinoides cidessus peuvent exister sous toutes leurs formes stéréoisomères possibles.
L'inventio a pour objet les compositions insecticides définies précédemment, caractérisées en ce qu'elles renferment en outre un synergiste des pyréthrinoides
Comme synergistes classiques utilisés en pareil cas, on peut citer le 1-(2,5,8-trioxadodécyl) 9-propyl 4,5-méthylène dioxy benzène (ou butoxyde de pipéronyle) ou le N-(2-éthyl heptyl) bicyclo /2,2-1/5-heptène 2,3 di carboximi de, ou le pipéronyl-bis-2-(2n-butoxy éthoxy) éthyl acétal (ou tropital).
Comme synergistes classiques utilisés en pareil cas, on peut citer le 1-(2,5,8-trioxadodécyl) 9-propyl 4,5-méthylène dioxy benzène (ou butoxyde de pipéronyle) ou le N-(2-éthyl heptyl) bicyclo /2,2-1/5-heptène 2,3 di carboximi de, ou le pipéronyl-bis-2-(2n-butoxy éthoxy) éthyl acétal (ou tropital).
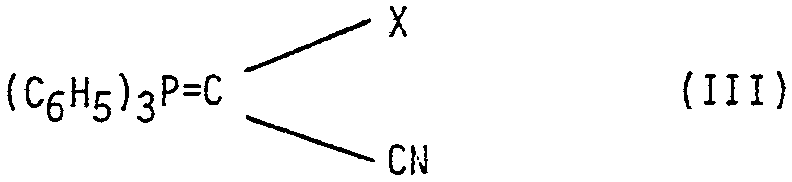
L'invention a également pour objet un procédé de préparation des composés de formule (I) tels que définis précédemment, caractérisé en ce que l'on soumet selon la réaction de Wittig un composé de formule (II)
dans laquelle R conserve la même signification que précédemment å l'action d'un composé de formule (III)
dans laquelle X conserve la même signification que précédemment pour obtenir un composé de formule (I) correspondant que l'on soumet, si désiré, à l'action d'un agent d'estérification si R représente un atome d'hydrogène, ou que l'on soumet, si désiré, à l'action d'un agent de clivage de la fonction ester, puis, si désiré, à l'action d'un agent d'estérification.
dans laquelle R conserve la même signification que précédemment å l'action d'un composé de formule (III)
dans laquelle X conserve la même signification que précédemment pour obtenir un composé de formule (I) correspondant que l'on soumet, si désiré, à l'action d'un agent d'estérification si R représente un atome d'hydrogène, ou que l'on soumet, si désiré, à l'action d'un agent de clivage de la fonction ester, puis, si désiré, à l'action d'un agent d'estérification.
Les composés de formule (II) et de formule (III) sont des produits connus.
Les produits de formule (III) peuvent etre préparés selon le procédé décrit dans Helv. Chem. Acta. Vol .60 (1977) p. 585.
La réaction de Wittig utilisée généralement pour préparer les produits de formule (I) fournit des composés de formule (I) dont la géométrie est
E + Z.
E + Z.
Les isomères au niveau de la double liaison peuvent être séparés, si désiré, par des méthodes physiques telles que la chromatographie, soit au niveau des acides, soit au niveau des esters d'alcoyle, soit au niveau des esters finaux.
L'agent de clivage du groupement CO2P est de préférence la chaleur utilisée avec un agent d'hydrolyse acide. Comme agent d'hydrolyse acide, on peut utiliser l'acide p-toluène sulfonique.
L'estérification peut être effectuée en présence d'une base tertiaire, telle que la pyridine. Cette estérification peut être effectuée avantageusement en présence d'un mélange de pyri di ne, de dicyclohexyl carbodiimide et,de de 4-diméthylaminopyridine ou de pyridine.
Il va de soi que la réaction de Wittig, les clivages des fonctions esters, l'estérification sont des réactions bien connues de l'homme de métier et n'ont pas à être detaillées ici.
Les exemples suivants illustrent l'invention sans toutefois la limiter.
EXEMPLE i : Acide 1R cis 2,2-diméthyl 3/(E+Z) 2-bromo 2-cyano éthényl/- cyclopropans carboxylique.
On mélange sous atmosphère inerte 3,5 g de bromo cyano méthylène triphényl phosphorane, 30cm3 de tétrahydrofuranne et 4cm3 de diméthyl formamide. On ajoute à la solution obtenue 1,3 9 de la lactone de l'acide 1R cis 2,2-diméthyl dihydroxy méthyl cyclopropane carboxylique et lOcm3 de tétrahydrofuranne. On maintient 16 heures à la température ambiante, amène à sec, on obtient 5,8 g d'un résidu huileux que l'on chromatographie sur silice en éluant par le mélange hexane, acétate d'éthyle,(7.3) à 1% d'a -cide acétique . On obtient le mélange des isomères #E etaZ (F=132 C).
EXEMPLE 2: 1R cis 2,2-diméthyl 3-/( E) 2-bromo 2-cyano éthényll cyclopropane carboxylate de (S)α(-cyano 3-phenoxybenzyle et isomères correspondant.
On ajoute 30 mg de diméthylaminopyridine a Oe*5 C dans 10cm3 d' une solution renfermant 1,4 g d'acide 1R cis 2,2-diméthyl 3/(E+Z) 2-bromo 2cyano éthényl cyclopropane carboxylique et 1,4 g d'alcool (S)-cyano
3-phénoxybenzylique. On ajoute ensuite ,29 de dicyclohexyicarbodiimide et 5cm3 de chlorure de méthylène. On laisse le mélange réactionnel revenir à 20 C et agite pendant 3 heures. On filtre l'urée formée, rince et amène à sec le filtrat obtient 3,7 g de produit que l'on chromatographie sur silice en éluant par le benzène.On obtient d'une part 1,3 g d'isomère# E (F=600C) et d'autre part, 750 mg d'isomère Z#(F=64 C).
3-phénoxybenzylique. On ajoute ensuite ,29 de dicyclohexyicarbodiimide et 5cm3 de chlorure de méthylène. On laisse le mélange réactionnel revenir à 20 C et agite pendant 3 heures. On filtre l'urée formée, rince et amène à sec le filtrat obtient 3,7 g de produit que l'on chromatographie sur silice en éluant par le benzène.On obtient d'une part 1,3 g d'isomère# E (F=600C) et d'autre part, 750 mg d'isomère Z#(F=64 C).
EXEMPLE 3 : 1R cis 2,2-diméthyl 3/( Z! Z) 2-fluoro 2-cyano éthényl/ cyclopropane carboxylate de terbutyle et isomère bE correspondant.
On porte au reflux sous agitation pendant 1 heure un mélange renfermant 15 g de phényl bromo fluoro cyano méthyl mercure, 180cm3 de xylène,
8 g de triphénylphosphine et 5,25 g
1R, cis 2,2-diméthyl 3-formyl cyclopropane 1carboxylate de terbutyle.
8 g de triphénylphosphine et 5,25 g
1R, cis 2,2-diméthyl 3-formyl cyclopropane 1carboxylate de terbutyle.
On glace, filtre et amène a sec le filtrat. On obtient 20 g d'un produit que l'on chromatographie sur silice en éluant par du benzène pur.
On obtient - 3 g d'isomère #E (rf=0,4 - 1,3 g d'isomère #z (rf=0,33).
Préparation du phényl bromo fluoro cyano methyl mercure utilisé au début de l'exemple.
a) Bromo fluoro acétamide
On ajoute à +5"C 86cm3 d'ammoniaque concentré dans 79 g de bromofluoro acétate d'éthyle en agitant fortement. On maintient encore 30 minutes l'agitation et la température, évapore à sec, distille le résidu et obtient 53,6 g de produit attendu eb/0,1=82-84 C.
On ajoute à +5"C 86cm3 d'ammoniaque concentré dans 79 g de bromofluoro acétate d'éthyle en agitant fortement. On maintient encore 30 minutes l'agitation et la température, évapore à sec, distille le résidu et obtient 53,6 g de produit attendu eb/0,1=82-84 C.
b) Bromo fluoro acétonitrile
On ajoute 92 g d'anhydride phosphorique dans 183 g de bromofluoro acétamide obtenu comme précédemment chauffé suffisamment pour mélanger, puis on chauffe progressivement le mélange jusqu'à 200 C (extérieur) et distille entre 55 à 80 C 87 g de produit brut attendu.
On ajoute 92 g d'anhydride phosphorique dans 183 g de bromofluoro acétamide obtenu comme précédemment chauffé suffisamment pour mélanger, puis on chauffe progressivement le mélange jusqu'à 200 C (extérieur) et distille entre 55 à 80 C 87 g de produit brut attendu.
c) Phényl bromo fluoro cyano méthyl mercure
On refroidit à -50 C 15,65 g de chlorure de phényle mercurique dans 100 cm3 de tétrahydrofuranne, ajoute 10,6 g de fluoro bromo acétonitrile obtenu comme ci-dessus, puis, toujours à -50 C et sous agitation, une suspension contenant 7,85 g de terbutylate de potassium, 50 cm3 de tétrahydrofuranne et 6,6 cm3 d'alcool terbutylique.
On refroidit à -50 C 15,65 g de chlorure de phényle mercurique dans 100 cm3 de tétrahydrofuranne, ajoute 10,6 g de fluoro bromo acétonitrile obtenu comme ci-dessus, puis, toujours à -50 C et sous agitation, une suspension contenant 7,85 g de terbutylate de potassium, 50 cm3 de tétrahydrofuranne et 6,6 cm3 d'alcool terbutylique.
Après 30 minutes, on verse le mélange réactionnel sur de l'eau glacée renfermant 6 cm3 d'acide chlorhydrique concentré et extrait au chloroforme.
On sèche la phase organique et concentre à sec. On reprend le résidu par un mélange chloroforme hexane (1/1), filtre l'insoluble, glace, essore et obtient 9,3 g de produit attendu (F=130-132"C).
EXEMPLE 4 : Acide 1R cis 2,2-diméthyl 3/( Z) 2-cyano 2-fluoro éthényl/ cyclopropane carboxylique.
On porte a 120-130"C 1,3 g de 1R cis 2,2-diméthyl 3-/ < Z) 2-fluoro 2cyano éthényl/ cyclopropane carboxylate de terbutyle, 13cm3 de méthylbenzene et 130 mg d'acide paratoluènesulfonique. On maintient le mélange réactionnel 15 minutes sous agitation après le début du reflux. On ramène le mélange réactionnel a 20 C, lave à l'eau, sèche sur sulfate de
soude la solution toluénique, la filtre et l'amène a sec sous pression
réduite. On obtient 1 g de produit recherché.
soude la solution toluénique, la filtre et l'amène a sec sous pression
réduite. On obtient 1 g de produit recherché.
EXEMPLE 5 : Acide 1R cis 2,2-diméthyl 3-/(6 E) 2-cyano 2-fluoro éthényl/ cyclopropane carboxylique.
En opérant comme a l'exemple 4, à partir du 1R cis 2,2-diméthyl 3/(# E) 2-fluoro 2-cyano éthényl/ cyclopropane carboxylate de terbutyle, on obtient le produit recherché.
EXEMPLE 6 : 1R cis 2,2-diméthyl 3/( Z) 2-fluoro 2-cyano éthényl/ cyclopropane carboxylate de (S) α-cyano 3-phénoxybentyle.
On ajoute a 5 C 30 mg de diméthylaminopyridine dans une solution renfermant 1 g d'acide 1R cis 2,2-diméthyl 3/(fl Z) 2-fluoro 2-cyano éthényl/ cyclopropane carboxylique, 6cm3 de chlorure de méthylène et 1,2 g d'alcool (S) α-cyano 3-phénoxybenzylique. On ajoute ensuite 1,1 g de dicyclohexylcarbodiimide et 8cm3 de chlorure de méthylène. On laisse le mélange réactionnel revenir a 20 C et l'on maintient sous agitation pendant 2 heures. On ajoute ensuite 0,5cm3 d'acide acétique et 0,5cm3 d'éthanol. On filtre ensuite l'urée formée, la rince avec un peu de chlorure de méthylène et amène le filtrat a sec.On obtient 2,8 g de produit que l'on chromatographie sur silice en éluant par le mélange chlorure de méthylène, hexane (8-2). On obtient 1,5 g du produit recherché brut. Après recristallisation dans l'isopropanol au reflux, on obtient 1,3 g du produit recherché fondant a 90 C.
EXEMPLE 7 : Acide 1R cis 2,2-diméthyl 3/(E+Z) 2-chloro 2-cyano éthényl/ cyclopropane carboxylique.
En opérant comme a l'exemple 1, à partir du chloro cyanométhyl triphényl phosphorane, on obtient le produit recherché (F < 50 C).
EXEMPLE 8 : 1R cis 2,2-diméthyl 3/( j E) 2-chloro 2-cyano éthényl/ cyclopropane carboxylate de (S) -cyano 3-phénoxybenzyle et isomère #z correspondant.
En opérant comme a l'exemple 2, à partir de l'acidepréparé à l'exemple 7, on a obtenu - d'une part, l'isomère #E (F=66 C) - d'autre part, l'isomère #z (F=630C).
EXEMPLE - 9 : 1R trans 2,2-diméthyl 3/(X E) 2-cyano 2-fluoro éthényl/ cyclopropane carboxylate de (S)4 -cyano métaphénoxybenzyle et isomère #z correspondant.
On porte au reflux sous agitation pendant 2 heures un mélange renfermant 10 g d'acide 1R trans 2,2-diméthyl 3-formyl cyclopropane carboxylique, 8 g de triphénylphosphine, 180 cm3 de xylène et 15 g-de phényl bromo cyano fluoro méthyl mercure. On glace, essore et amène à sec le filtrat. On obtient 24 g d'une huile que l'on chromatographie sur silice en éluant par le toluène. On sépare après plusieurs"HPLC",835 mg d'isomèreJZ (α D=17 + 1 5 -c=1 % dans CHCl3) et 1,8 g d'isomère #E (D=-21 + 205 c=0,5 % dans CHCi3).
EXEMPLES 10 à 22
En opérant comme précédemment, on a obtenu les produits répondant à la formule (I) suivants
En opérant comme précédemment, on a obtenu les produits répondant à la formule (I) suivants
<tb> 'Exemples <SEP> X <SEP> d <SEP> Géométrie <SEP> R
<tb> <SEP> CDI)
<tb> <SEP> 10 <SEP> F <SEP> E <SEP> 1Rcis <SEP> a <SEP> "(0-7)
<tb> <SEP> 11 <SEP> Br <SEP> E <SEP> 1Rcis
<tb> <SEP> 12 <SEP> Br <SEP> E <SEP> 3 <SEP> lacis
<tb> <SEP> Z <SEP> Br
<tb> <SEP> 13 <SEP> ' <SEP> E
<tb> <SEP> ci'
<tb> <SEP> 14 <SEP> El <SEP> El <SEP> El <SEP> M
<tb> <SEP> 15 <SEP> -çD/,10
<tb> <SEP> 16 <SEP> C1 <SEP> 11 <SEP> 1 <SEP> lRtrans
<tb> <SEP> Ct.
<tb>
<tb> <SEP> CDI)
<tb> <SEP> 10 <SEP> F <SEP> E <SEP> 1Rcis <SEP> a <SEP> "(0-7)
<tb> <SEP> 11 <SEP> Br <SEP> E <SEP> 1Rcis
<tb> <SEP> 12 <SEP> Br <SEP> E <SEP> 3 <SEP> lacis
<tb> <SEP> Z <SEP> Br
<tb> <SEP> 13 <SEP> ' <SEP> E
<tb> <SEP> ci'
<tb> <SEP> 14 <SEP> El <SEP> El <SEP> El <SEP> M
<tb> <SEP> 15 <SEP> -çD/,10
<tb> <SEP> 16 <SEP> C1 <SEP> 11 <SEP> 1 <SEP> lRtrans
<tb> <SEP> Ct.
<tb>
<SEP> 4
<tb> <SEP> Exemples <SEP> X <SEP> 4 <SEP> Géométrie <SEP> R
<tb> <SEP> o
<tb> <SEP> 18 <SEP> C1 <SEP> E <SEP> îRcis
<tb> <SEP> 'E <SEP> Z <SEP> "
<tb> <SEP> 19 <SEP> Cl <SEP> 3
<tb> <SEP> 'E <SEP> E, <SEP> -r <SEP>
<tb> <SEP> L
<tb> <SEP> 20 <SEP> ., <SEP> E+Z <SEP> "
<tb> 'a'
<tb> <SEP> 21 <SEP> lE <SEP> Il <SEP> ll <SEP> M
<tb> <SEP> 22 <SEP> F <SEP> Z <SEP> 1Rtrans
<tb>
EXEMPLE 23 : Préparation d'un concentré soluble.
<tb> <SEP> Exemples <SEP> X <SEP> 4 <SEP> Géométrie <SEP> R
<tb> <SEP> o
<tb> <SEP> 18 <SEP> C1 <SEP> E <SEP> îRcis
<tb> <SEP> 'E <SEP> Z <SEP> "
<tb> <SEP> 19 <SEP> Cl <SEP> 3
<tb> <SEP> 'E <SEP> E, <SEP> -r <SEP>
<tb> <SEP> L
<tb> <SEP> 20 <SEP> ., <SEP> E+Z <SEP> "
<tb> 'a'
<tb> <SEP> 21 <SEP> lE <SEP> Il <SEP> ll <SEP> M
<tb> <SEP> 22 <SEP> F <SEP> Z <SEP> 1Rtrans
<tb>
EXEMPLE 23 : Préparation d'un concentré soluble.
On a effectué un mélange homogène de - produit de l'exemple 6 ....................... 0,25 g - butoxyde de pipéronyle ....................... 1,00 g - tween 80...................................... 0,25 g - topanol A..................................... 0,1 g - eau........................................... 98,4 g
EXEMPLE 24 : Préparation d'un concentré émulsifiable.
EXEMPLE 24 : Préparation d'un concentré émulsifiable.
- produit de l'exemple 10............................. 0,015 g - butoxyde de pipéronyle ............................. 0,5 g - topanol A.......................................... 0,1 g - tween 80............................................ 3,5 g - xylène............................................. 95,885 g
Etude de l'effet létal sur larves de Spodoptera Littoralis.
Etude de l'effet létal sur larves de Spodoptera Littoralis.
Les essais sont effectués par application topique d'une solution acétonique toxique a l'aide du micro manipulateur d'Arnold sur le thorax dorsal des chenilles.Qn détermine la DL50 du produit en utilisant
15 larves par dose de produit tester Les chenilles utilisées sont des larves du quatrième stade larvaire, c' est-â-dire âgées d'environ 10 jours en élevage sur milieu artificiel (milieu de Poitout) â 24 C et 55 d'humidité relative. Apres traitement, les individus sont mis en observation sur milieu nutritif artificiel.
15 larves par dose de produit tester Les chenilles utilisées sont des larves du quatrième stade larvaire, c' est-â-dire âgées d'environ 10 jours en élevage sur milieu artificiel (milieu de Poitout) â 24 C et 55 d'humidité relative. Apres traitement, les individus sont mis en observation sur milieu nutritif artificiel.
On effectue le contrôle des mortalités 48 heures après traitement.
Les résultats expérimentaux obtenus pour les produits des exemples 2, 6 et 8 sont compris entre 0,48 et 4,8 ng par insecte.
Etude de l'effet d'abattage sur mouche domestique.
Les insectes tests sont des mouches domestiques femelles âgées-de 4 a 5 jours. On opère par pulvérisation directe à la concentration de 0,25 g/l en chambre de Kearns et March en utilisant comme solvant un mélange d'acétone (5 %) et d'Isopar L (solvant pétrolier) (quantité de solvant utilisée 2 ml en une seconde). On utilise 50 insectes par traitement. On effectue les contrôles d'abattage toutes les minutes jusqu" 10 minutes, puis à 15 minutes et l'on détermine le KT 50 par les méthodes habituelles.
tes résultats expérimentaux obtenus pour les produits des exemples 2, 6, et 8 exprimés en KT 50 en minutes sont compris entre 1,8 et 3,6 minutes.
Claims (14)
1) Sous toutes leurs formes isomères possibles ainsi que les mélanges de ces isomères les composés de formule (I)
dans laquelle la copule acide cyclopropanique est de structure 1R cis ou 1R
trans, X représente un atome d'halogène et R représente un atome
d'hydrogène, un radical alcoyle linéaire, ramifié ou cyclisé, saturé ou
insaturé, renfermant jusqu'à 12 atomes de carbone ou le reste d'un alcool
R-OH utilisé dans la synthèse des pyréthrinoldes, la géométrie de la double
liaison portée par le carbone en 3 pouvant être de structure E ou Z.
2) Les composés de formule (I) telle que définie à la revendication 1
dans laquelle X représente un atome de fluor.
3) Les composés de formule (I) tels que définis à l'une quelconque des
revendications 1 ou 2 pour lesquels la géométrie de la double liaison
portée par le carbone en 3 du cyclopropane est de structure Z.
4) Les composés de formule (I) tels que définis à l'une quelconque des
revendications 1 ou 3 pour lesquels R représente un radical -CH-Ardans 2
lequel Z représente un atome d'hydrogène, un radical CECH,CH3,Un radical -CEM et Ar représente un radical choisi dans le groupe des radicaux
- C6H5 C6F5
avec fn=H ou F
X=F, C1, Br dans lequel B représente un atome d'hydrogène ou de fluor et X représente un atome de fluor, de chlore ou de brome.
5) Les composés de formule (I) tels que définis à la revendication 4
dans lesquels Ar représente un radical -cyano métaphénoxybenzyle.
6) Les composés de formule (I)tels que définis à la revendication 1
dont les noms suivent
- le 1R cis 2,2-diméthyl 3/(S E) 2-fluoro 2-cyano éthényl/ cyclopropane
carboxylate de (S) o( -cyano métaphénoxybenzyle ainsi que 1 'isomère nZ
correspondant.
7) Application des composés de formule (I) tels que définis à l'une
quelconque des revendications 1 à 6 à la lutte contre les parasites des
végétaux, les parasites des locaux et les parasites des animaux à sang
chaud.
b) Les compositions destinées à la lutte contre les parasites des
végétaux, les parasites des locaux et les parasites des animaux à sang chaud, caractérisées en ce qu'elles renferment comme principe actif au moins un des produits définis à l'une quelconque des revendications 1 à 6.
9) Les compositions insecticides renfermant comme principe actif au moins l'un des produits définis à l'une quelconque des revendications 1 à 6
10) Les compositions acaricides renfermant comme principe actif au moins l'un des produits définis à l'une quelconque des revendications 1 à
6
11) Les compositions nématicides renfermant commue principe actif au
moins l'un des produits définis à l'une quelconque des revendications 1 à 6.
12) Les compositions acaricides renfermant comme principe actif l'un au moins des produits définis à l'une quelconque des revendications 1 à 6, caractérisées en ce qu'elles sont utilisées dans la lutte contre les
parasites des animaux à sang chaud, notamment contre les tiques et les
gales.
13) Les compositions destinées à l'alimentation animale renfermant
comme principe actif au moins l'un des produits définis à l'une quelconque
des revendications 1 à 6.
14) Associations douées d'activité insecticide, acaricide ou
nematicide, caractérisées en ce qu'elles contiennent comme matière active,
d'une part un au moins des composés de formule générale () et d'autre
part, un au moins des esters pyréthrinoldes choisis dans le groupe
constitué par les esters d'allêthrolones, d'alcool 3,4,5,6-tétrahydro-
phtalimido méthylique, d'alcool 5-benzyl 3-furyl méthylique, d'alcool 3
phénoxy benzylique et d'alcools -cyano 3-phénoxy benzyliques des acides
chrysanthémiques, par les esters d'alcool 5-benzyl 3-furyl méthylique des acides 2,2-diméthyl 3-(2-oxo 3-tétrahydrothiophénylidene méthyl) cyclopropane 1-carboxyliques, par les esters d'alcool 3-phénoxy benzylique et d'alcools < -cyano 3-phénoxy benzyliques des acides 2,2-diméthyl 3-(2,2dichlorovinyl) cyclopropane 1-carboxyliques, par les esters d'alcoolsC(- cyano 3-phénoxy benzyliques d'acides 2,2-diméthyl 3-(2,2-dibroniovinyl) cyclopropane 1-carboxyliques, par les esters d'alcool 3-phénoxy benzylique parachlorophényl 2-isopropyl acétiques, par les esters d'alléthrolones, d'alcool 3,4,5 ,6-tétrahydrophtal imi do méthylique, d'alcool- 5-benzyl 3-furyl méthylique, d'alcool 3-phénoxy benzylique et d'alcools (-cyano 3-phénoxy benzyliques des acides 2,2-diméthyl 3-(1,2-2,2-tétrahaloéthyl) cyclopropane 1-carboxyliques dans lesquels "halo" représente un atome de fluor, de chlore ou de brome, étant entendu que les copules acides et alcools des esters pyréthrinoldes ci-dessus peuvent exister sous toutes leurs formes stéréoisomères possibles.
15) Les compositions selon l'une quelconque des revendications 8 à 14 caractérisées en ce qu'elles renferment en outre un synergiste des pyréthri noides.
16) Procédé de préparation des composés de formule (I) tels que définis à l'une quelconque des revendications 1 à 6 caractérisé en ce que lton soumet selon la réaction de Wittig un composé de formule (II)
dans laquelle R conserve la même signification que dans la revendication 1 à l'action d'un composé de formule (III)
dans laquelle X conserve la même signification que dans la revendication 1 pour obtenir un composé de formule (I) correspondant que l'on soumet, si désiré, à l'action d'un agent d'estérification si P. représente un atome d'hydrogène ou que l'on soumet, si désiré, à l'action d'un agent de clivage de la fonction ester, puis, si désiré, à l'action d'un agent d'estérification.
Priority Applications (13)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| FR8312858A FR2550191B1 (fr) | 1983-08-04 | 1983-08-04 | Nouveaux derives de l'acide cyclopropane carboxylique, leur procede de preparation et leur application a la lutte contre les parasites |
| ZA845790A ZA845790B (en) | 1983-08-04 | 1984-07-26 | Derivatives of cyclopropane carboxylic acid,their preparation,their use in combatting parasites and the compositions containing them |
| US06/637,106 US4565822A (en) | 1983-08-04 | 1984-08-02 | 2-Fluoro-2-cyanoethenyl cyclopropane carboxylates as pesticides |
| EP84401616A EP0133406B1 (fr) | 1983-08-04 | 1984-08-02 | Nouveaux dérivés de l'acide cyclopropane carboxylique, leur préparation, leur application à la lutte contre les parasites et les compositions les renfermant |
| DE8484401616T DE3463263D1 (en) | 1983-08-04 | 1984-08-02 | Cyclopropanecarboxylic-acid derivatives, their preparation, their use as parasiticides and compositions containing them |
| AU31474/84A AU576775B2 (en) | 1983-08-04 | 1984-08-03 | Derivatives of cyclopropane carboxylic acid |
| HU842964A HU196951B (en) | 1983-08-04 | 1984-08-03 | Process for production of 2,2-dimethil-3-/2-fluor-2-cyane-ethenil/-cycloprophane carbonic acid esthers |
| BR8403898A BR8403898A (pt) | 1983-08-04 | 1984-08-03 | Processo para preparar sob todas as formas isomericas possiveis ou sob forma de misturas desses isomeros-derivados de acido ciclopropano carboxilico,bem como composicoes destinadas ao combate de parasitas de vegetais,parasitas de recintos e parasitas de animais de sangue quente a base de tais compostos |
| JP16300984A JPH0723350B2 (ja) | 1983-08-04 | 1984-08-03 | シクロプロパンカルボン酸の新誘導体、それらの製造法及びそれらを含有する寄生虫駆除用組成物 |
| ES534871A ES534871A0 (es) | 1983-08-04 | 1984-08-03 | Procedimiento para preparar nuevos derivados de acido ciclopropanocarboxilico |
| SU843785252A SU1468410A3 (ru) | 1983-08-04 | 1984-08-03 | Способ получени производных циклопропанкарбоновых кислот |
| CA000460347A CA1222250A (fr) | 1983-08-04 | 1984-08-03 | Derives de l'acide cyclopropane carboxylique, leur preparation, leur application a la lutte contre les parasites et les compositions les renfermant |
| SU884356226A SU1591807A3 (ru) | 1983-08-04 | 1988-08-05 | Способ получения производных циклопропанкарбоновой кислоты |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| FR8312858A FR2550191B1 (fr) | 1983-08-04 | 1983-08-04 | Nouveaux derives de l'acide cyclopropane carboxylique, leur procede de preparation et leur application a la lutte contre les parasites |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| FR2550191A1 true FR2550191A1 (fr) | 1985-02-08 |
| FR2550191B1 FR2550191B1 (fr) | 1986-09-26 |
Family
ID=9291393
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| FR8312858A Expired FR2550191B1 (fr) | 1983-08-04 | 1983-08-04 | Nouveaux derives de l'acide cyclopropane carboxylique, leur procede de preparation et leur application a la lutte contre les parasites |
Country Status (3)
| Country | Link |
|---|---|
| FR (1) | FR2550191B1 (fr) |
| SU (2) | SU1468410A3 (fr) |
| ZA (1) | ZA845790B (fr) |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB2099810A (en) * | 1981-06-09 | 1982-12-15 | Shell Int Research | Cyclopropanecarboxylate esters and their use as pesticides |
-
1983
- 1983-08-04 FR FR8312858A patent/FR2550191B1/fr not_active Expired
-
1984
- 1984-07-26 ZA ZA845790A patent/ZA845790B/xx unknown
- 1984-08-03 SU SU843785252A patent/SU1468410A3/ru active
-
1988
- 1988-08-05 SU SU884356226A patent/SU1591807A3/ru active
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB2099810A (en) * | 1981-06-09 | 1982-12-15 | Shell Int Research | Cyclopropanecarboxylate esters and their use as pesticides |
Also Published As
| Publication number | Publication date |
|---|---|
| SU1591807A3 (ru) | 1990-09-07 |
| FR2550191B1 (fr) | 1986-09-26 |
| SU1468410A3 (ru) | 1989-03-23 |
| ZA845790B (en) | 1985-08-28 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP0050534B1 (fr) | Esters d'acides cyclopropane carboxyliques apparentés à l'acide pyréthrique, leur procédé de préparation et leur application à la lutte contre les parasites | |
| FR2539956A2 (fr) | Nouveaux derives de l'acide cyclopropane carboxylique, leur procede de preparation et leur application a la lutte contre les parasites | |
| FR2610624A1 (fr) | Nouveaux esters d'acides cyclopropanecarboxyliques apparentes a l'acide pyrethrique, leur procede de preparation et leur application a la lutte contre les parasites | |
| EP0448427B1 (fr) | Nouveaux esters dérivés d'acide 3-[2-cyano 2-halogéno éthényl], 2,2-diméthyl cyclopropanecarboxylique,leur procédé de préparation et leur application comme pesticides | |
| FR2642421A1 (fr) | Nouveaux derives de l'acide 2,2-dimethyl 3-(2-monohaloethenyl) cyclopropane carboxylique, leur procede de preparation et leur application comme medicaments | |
| EP0133406B1 (fr) | Nouveaux dérivés de l'acide cyclopropane carboxylique, leur préparation, leur application à la lutte contre les parasites et les compositions les renfermant | |
| EP0267105B1 (fr) | Nouvelles oximes éthyléniques dérivés d'esters de l'acide cyclopropane carboxylique, leur procédé et les intermédiaires de préparation et leur application à la lutte contre les parasites | |
| FR2534252A1 (fr) | Nouveaux derives de l'acide cyclopropane carboxylique substitues en 3 par une chaine vinylique elle-meme substituee, leur procede de preparation et leur application comme pesticides | |
| EP0557192B1 (fr) | Esters pyréthrinoides, dérivés de l'alcool 6-(trifluorométhyl)benzylique, leur procédé de préparation et leur application comme pesticides | |
| EP0110769B1 (fr) | Nouveaux esters dérivés d'acides 2,2-diméthyl cyclopropane carboxyliques et d'alcools biaryliques, leur procédé de préparation, leur application à la lutte contre les parasites et les compositions les renfermant | |
| EP0114012B1 (fr) | Esters d'acides cyclopropane carboxyliques et d'alcools aliphatiques insaturés, procédé et intermédiaires de préparation et compositions pesticides les renfermant | |
| EP0335801A2 (fr) | Nouveau procédé de préparation de dérivés trifluorométhylvinyliques à partir de dérivés halogénovinyliques correspondants | |
| EP0638543A1 (fr) | Nouveaux esters dérivés de l'acide 2,2-diméthyl 3-(3,3,3-trifluoro-1-propényl) cyclopropane carboxylique, leur procédé de préparation et leur application comme pesticides | |
| EP0228942A1 (fr) | Nouveaux dérivés de l'acide cyclopropane carboxylique à substituant iodé, leur préparation, leur application à la lutte contre les parasites des végétaux et des animaux et les compositions les renfermant | |
| EP0261035A1 (fr) | Dérivés de l'indole, leur procédé de préparation, leur application à la lutte contre les parasites et les compositions les renfermant | |
| FR2550191A1 (fr) | Nouveaux derives de l'acide cyclopropane carboxylique, leur procede de preparation et leur application a la lutte contre les parasites | |
| FR2537973A1 (fr) | Esters d'acides cyclopropane carboxyliques et d'alcools aliphatiques insatures, leur procede de preparation et les compositions pesticides les renfermant | |
| EP0194919B1 (fr) | Nouveaux esters dérivés de l'acide 2,2-diméthyl 3-éthényl cyclopropane carboxylique, leur préparation, leur application à la lutte contre les parasites et les compositions les renfermant | |
| EP0215701B1 (fr) | Nouveaux esters d'acides cyclopropane carboxyliques et de 2,3-dihydro 4-phényl 1H-inden-2-ol, leur préparation, leur application à la lutte contre les parasites et les compositions les renfermant | |
| EP0364326B1 (fr) | Nouveax dérivés de l'acide 2,2-diméthyl 3-(1-hydroxy 2-sulfinoéthyl) cyclopropane carboxylique, leur procédé de préparation et leur application comme pesticides | |
| EP0093664B1 (fr) | Ester d'acide cyclopropane carboxylique et d'alcool(S)cyano(4-fluoro-3-phénoxyphényl) méthylique, sa préparation, son application à la lutte contre les parasites et les compositions le renfermant | |
| FR2686602A1 (fr) | Nouveaux derives de l'acide 2,2-dimethyl 3-[(2,2-difluorocyclopropylidene methyl] cyclopropane carboxylique, leur procede de preparation et leur application comme pesticides. | |
| FR2558466A2 (fr) | Nouveau derive de l'acide cyclopropane carboxylique, leur procede de preparation et leur application a la lutte contre les parasites | |
| FR2536392A2 (fr) | Nouveaux derives de l'acide cyclopropane carboxylique, leur procede de preparation et leur application a la lutte contre les parasites | |
| FR2601360A2 (fr) | Nouveaux derives de l'acide cyclopropane carboxylique a substituant iode, leur preparation, leur application a la lutte contre les parasites des vegetaux et des animaux. |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| ST | Notification of lapse |