EP0235079A1 - Process for the after-treatment of celluloric materials or materials containing cellulose, printed with reactive dyes - Google Patents
Process for the after-treatment of celluloric materials or materials containing cellulose, printed with reactive dyes Download PDFInfo
- Publication number
- EP0235079A1 EP0235079A1 EP87810038A EP87810038A EP0235079A1 EP 0235079 A1 EP0235079 A1 EP 0235079A1 EP 87810038 A EP87810038 A EP 87810038A EP 87810038 A EP87810038 A EP 87810038A EP 0235079 A1 EP0235079 A1 EP 0235079A1
- Authority
- EP
- European Patent Office
- Prior art keywords
- cationic
- oder
- alkyl
- optical brightener
- amphoteric
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Ceased
Links
- 0 C*1=****=*1O Chemical compound C*1=****=*1O 0.000 description 2
Classifications
-
- D—TEXTILES; PAPER
- D06—TREATMENT OF TEXTILES OR THE LIKE; LAUNDERING; FLEXIBLE MATERIALS NOT OTHERWISE PROVIDED FOR
- D06P—DYEING OR PRINTING TEXTILES; DYEING LEATHER, FURS OR SOLID MACROMOLECULAR SUBSTANCES IN ANY FORM
- D06P5/00—Other features in dyeing or printing textiles, or dyeing leather, furs, or solid macromolecular substances in any form
- D06P5/02—After-treatment
- D06P5/04—After-treatment with organic compounds
- D06P5/06—After-treatment with organic compounds containing nitrogen
-
- C—CHEMISTRY; METALLURGY
- C11—ANIMAL OR VEGETABLE OILS, FATS, FATTY SUBSTANCES OR WAXES; FATTY ACIDS THEREFROM; DETERGENTS; CANDLES
- C11D—DETERGENT COMPOSITIONS; USE OF SINGLE SUBSTANCES AS DETERGENTS; SOAP OR SOAP-MAKING; RESIN SOAPS; RECOVERY OF GLYCEROL
- C11D3/00—Other compounding ingredients of detergent compositions covered in group C11D1/00
- C11D3/40—Dyes ; Pigments
- C11D3/42—Brightening agents ; Blueing agents
-
- D—TEXTILES; PAPER
- D06—TREATMENT OF TEXTILES OR THE LIKE; LAUNDERING; FLEXIBLE MATERIALS NOT OTHERWISE PROVIDED FOR
- D06L—DRY-CLEANING, WASHING OR BLEACHING FIBRES, FILAMENTS, THREADS, YARNS, FABRICS, FEATHERS OR MADE-UP FIBROUS GOODS; BLEACHING LEATHER OR FURS
- D06L4/00—Bleaching fibres, filaments, threads, yarns, fabrics, feathers or made-up fibrous goods; Bleaching leather or furs
- D06L4/60—Optical bleaching or brightening
- D06L4/671—Optical brightening assistants, e.g. enhancers or boosters
-
- D—TEXTILES; PAPER
- D06—TREATMENT OF TEXTILES OR THE LIKE; LAUNDERING; FLEXIBLE MATERIALS NOT OTHERWISE PROVIDED FOR
- D06P—DYEING OR PRINTING TEXTILES; DYEING LEATHER, FURS OR SOLID MACROMOLECULAR SUBSTANCES IN ANY FORM
- D06P5/00—Other features in dyeing or printing textiles, or dyeing leather, furs, or solid macromolecular substances in any form
- D06P5/02—After-treatment
- D06P5/04—After-treatment with organic compounds
- D06P5/08—After-treatment with organic compounds macromolecular
Definitions
- This aftertreatment is carried out primarily with cationic auxiliaries, either directly after the washout process or after the washed and dried goods.
- reactive prints are also optically lightened together with the equipment of the material.
- the conventional anion-active optical brighteners are not compatible with the cation-active auxiliaries, since uncontrolled precipitations result, so that these processes have hitherto not been technically feasible.
- the invention accordingly relates to a process for the aftertreatment of cellulose or cellulose-containing materials printed with reactive dyes by using an aqueous aftertreatment liquor is, which contains at least one cationic auxiliary and at least one amphoteric optical brightener and / or at least one cationic optical brightener.
- This process allows prints to be produced which on the one hand have a high level of fastness, above all a very good wet fastness and on the other hand have the required degree of whiteness.
- the cationic auxiliaries to be used according to the invention are, above all, those which improve wet fastness, such as water, sweat, wet iron and sea water fastness.
- Suitable cationic auxiliaries of this type are derivatives of ammonia and / or imidazoline with 2 long-chain aliphatic saturated or unsaturated radicals, such as, for example, 1-methyl-1-oleylamidoethyl-2-oleyl-imidazolinium.
- X e 1-methyl-l-tallowamidoethyl-2-tallow-imidazolinium.
- X ⁇ di-tallow dimethyl ammonium.
- X or a compound of the formula wherein QC is 14-16 alkyl and X is chloride, bromide, methyl sulfate, ethyl sulfate, methane, ethane or toluenesulfonate anion.
- Amine-formaldehyde condensation products are also suitable, such as a condensation product of ethylenediamine dihydrochloride, dicyandiamide and formaldehyde.
- the cationic auxiliary is used in amounts of 1 to 10 g / 1 aftertreatment liquor.
- amphoteric optical brightener of the formula is particularly preferred from this class
- optical brightener of the formula is particularly preferred
- amphoteric and cationic optical brighteners are known (for example EP-A-0 059 684, DE-A-2 159 469, EP-A-0 019 078 and EP-A-0 019 702)) and can be prepared by known methods will.
- amphoteric and cationic optical brighteners which can be used according to the invention are used in amounts of totally 0.1 to 3 g / 1, preferably 1 to 2 g / 1, of aftertreatment liquor.
- synthetic resins can also be added to the aftertreatment liquor.
- synthetic non-crystalline resinous compounds that soften on heating, are capable of film formation and are insoluble in water. They are usually macromolecules that are obtained by polymerization or polycondensation, e.g. Phenol-formaldehyde resins, polyesters, polyamides, epoxy resins (condensation products from epichlorohydrin and diphenylolpropane, crosslinked e.g. with urea-formaldehyde).
- particularly interesting synthetic resins are etherified glycol resins.
- the process is preferably carried out at room temperature, it being possible for the aftertreatment liquor to be applied expediently by padding using a wide variety of methods.
- the material After the cellulose or cellulose-containing material printed with reactive dyes has been treated with the aftertreatment liquor, the material is dried, then heated to 100 ° to 200 ° C. for 10 seconds to 10 minutes and finished.
- Another object of the invention relates to the aqueous liquor for carrying out the method, which is characterized in that it contains at least one cationic auxiliary and at least one amphoteric optical brightener and / or at least one cationic optical brightener and optionally a synthetic resin.
- the cationic additives, amphoteric and cationic optical brighteners and synthetic resins that can be used are those mentioned at the beginning.
- a refined cotton fabric is obtained which is very wash-resistant and has a good degree of whiteness.
- EXAMPLE 2 The procedure is as in Example 1, but 1 g / l of the cationic optical brightener of the formula is used instead of the amphoteric optical brightener you get a refined cotton fabric that is very wash-resistant and has a good degree of whiteness.
Abstract
Beschrieben wird ein Verfahren zum Nachbehandeln von mit Reaktivfarbstoffen bedruckten Cellulose- oder cellulosehaltigen Materialien, indem das bedruckte Material mit einer wässrigen Flotte behandelt wird, die mindestens ein kationaktives Hilfsmittel und mindestens einen amphoteren und/oder mindestens einen kationischen optischen Aufheller enthält. Es werden dabei Drucke erhalten, die einerseits ein hohes Echtheitsniveau, vor allem eine sehr gute Nassechtheit und andererseits den geforderten Weissgrad aufweisen.A process is described for the aftertreatment of cellulose or cellulose-containing materials printed with reactive dyes by treating the printed material with an aqueous liquor which contains at least one cationic auxiliary and at least one amphoteric and / or at least one cationic optical brightener. Prints are obtained which on the one hand have a high level of fastness, above all a very good wet fastness and on the other hand have the required degree of whiteness.
Description
Hohe Echtheitsanforderungen einerseits und formaldehydarme Ausrüstung andererseits machen es notwendig, dass mit Reaktivfarbstoffen bedruckte Cellulose- oder cellulosehaltige Materialien oft einer Nachbehandlung, vor allem einer nassechtheitsverbesserten Nachbehandlung bedürfen.High authenticity requirements on the one hand and low-formaldehyde finishing on the other hand make it necessary that cellulose or cellulose-containing materials printed with reactive dyes often require post-treatment, especially post-treatment that improves wet fastness.
Diese Nachbehandlung erfolgt vor allem mit kationaktiven Hilfsmitteln, entweder im direkten Anschluss an den Auswaschvorgang oder im Anschluss an die gewaschene und getrocknete Ware. In den weitaus meisten Fällen werden jedoch Reaktivdrucke gleichzeitig zusammen mit der Ausrüstung des Materials auch optisch aufgehellt. Die herkömmlichen anionaktiven optischen Aufheller sind jedoch mit den kationaktiven Hilfsmitteln nicht verträglich, da unkontrollierte Ausfällungen resultieren, so dass diese Verfahren bislang technisch nicht gut durchführbar sind.This aftertreatment is carried out primarily with cationic auxiliaries, either directly after the washout process or after the washed and dried goods. In the vast majority of cases, however, reactive prints are also optically lightened together with the equipment of the material. However, the conventional anion-active optical brighteners are not compatible with the cation-active auxiliaries, since uncontrolled precipitations result, so that these processes have hitherto not been technically feasible.
Es wurde nun überraschenderweise gefunden, dass eine Nassechtheitsverbesserung und gleichzeitige optische Aufhellung von mit Reaktivfarbstoffen bedruckten Cellulose- und cellulosehaltigen Materialien möglich ist, wenn zusammen mit dem kationaktiven Hilfsmittel amphotere und/oder kationische optische Aufheller verwendet werden.It has now surprisingly been found that an improvement in wet fastness and simultaneous optical brightening of cellulose and cellulose-containing materials printed with reactive dyes is possible if amphoteric and / or cationic optical brighteners are used together with the cationic auxiliary.
Die Erfindung betrifft demnach ein Verfahren zum Nachbehandeln von mit Reaktivfarbstoffen bedruckten Cellulose- oder cellulosehaltigen Materialien, indem eine wässrige Nachbehandlungsflotte verwendet wird, die mindestens ein kationaktives Hilfsmittel und mindestens einen amphoteren optischen Aufheller und/oder mindestens einen kationischen optischen Aufheller enthält.The invention accordingly relates to a process for the aftertreatment of cellulose or cellulose-containing materials printed with reactive dyes by using an aqueous aftertreatment liquor is, which contains at least one cationic auxiliary and at least one amphoteric optical brightener and / or at least one cationic optical brightener.
Dieses Verfahren erlaubt Drucke herzustellen, die einerseits ein hohes Echtheitsniveau, vor allem eine sehr gute Nassechtheit und andererseits den geforderten Weissgrad aufweisen.This process allows prints to be produced which on the one hand have a high level of fastness, above all a very good wet fastness and on the other hand have the required degree of whiteness.
Bei den erfindungsgemäss zu verwendeten kationaktiven Hilfsmitteln handelt es sich vor allem um solche, welche die Nassechtheit wie die Wasser-, Schweiss-, Nassbügel- und Seewasserechtheit verbessern.The cationic auxiliaries to be used according to the invention are, above all, those which improve wet fastness, such as water, sweat, wet iron and sea water fastness.
Als derartige kationaktive Hilfsmittel eignen sich beispielsweise Derivate des Ammoniaks und/oder des Imidazolins mit 2 langkettigen aliphatischen gesättigten oder ungesättigten Resten, wie z.B. 1-Methyl-1-oleylamidoäthyl-2-oleyl-imidazolinium. Xe, 1-Methyl-l-talgamidoäthyl-2-talg-imidazolinium. X⊖, Di-talg-dimethylammonium. X oder einer Verbindung der Formel
Das kationaktive Hilfsmittel wird in Mengen von 1 bis 10 g/1 Nachbehandlungsflotte eingesetzt.The cationic auxiliary is used in amounts of 1 to 10 g / 1 aftertreatment liquor.
Amphotere optische Aufheller können den verschiedensten chemischen Klassen angehören. Als besonders interessant haben sich in diesem Zusammenhang optische Aufheller der Formel
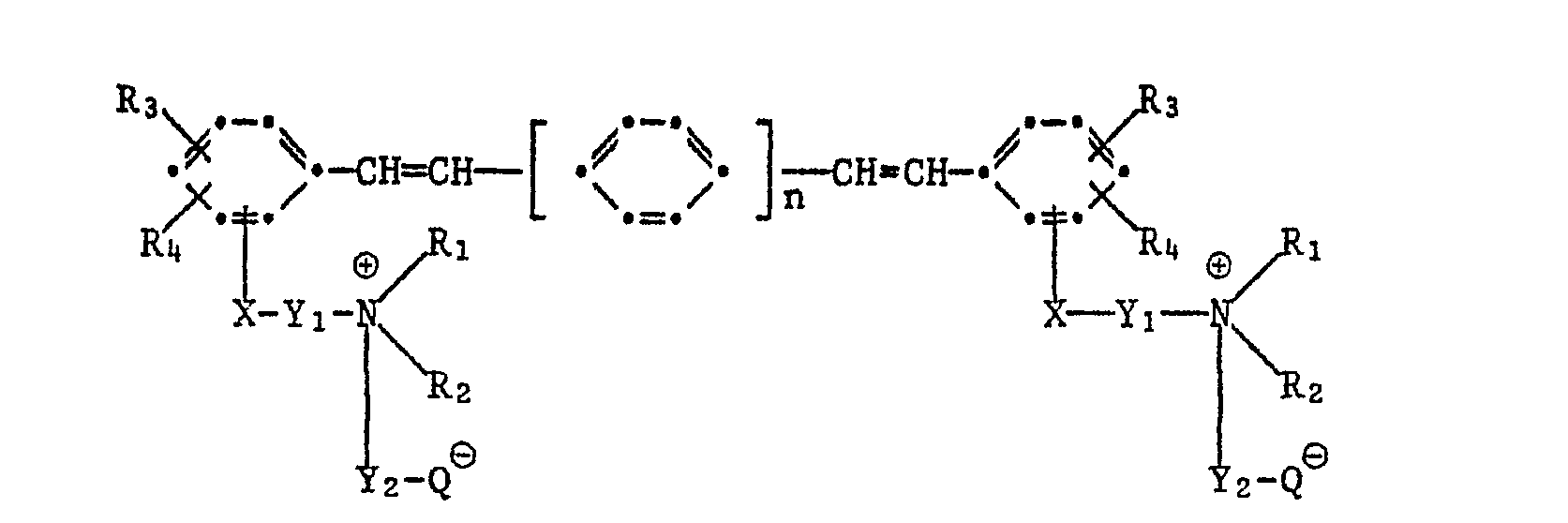
- X Sauerstoff, Schwefel, die direkte Bindung, -SO2N(R5)-, -CON(R5)- oder -COO-,
- Y1 und Y2 unabhängig voneinander C1-C4-Alkylen oder Hydroxypropylen, R1 und R2 unabhängig voneinander C1-C4-Alkyl oder zusammen mit dem N-Atom einen Pyrrolidin-, Piperidin-, Hexamethylenimin- oder Morpholinring und R1 zusammen mit R5 auch einen Piperazinring,
- R3 und R4 Wasserstoff-, Ci-4-Alkyl, Chlor, C1-4-Alkoxy, C3-4-Alkenyl oder in o-Stellung zueinander zusammen eine Trimethylen- oder Tetramethylengruppe,
- R5 Wasserstoff, C1-4-Alkyl, Cyanoäthyl oder zusammen mit R1 einen Piperazinring,
- Q -COO oder -S03 und
- n die Zahl 1 oder 2
bedeuten.Amphoteric optical brighteners can belong to a wide variety of chemical classes. Optical brighteners of the formula have proven to be particularly interesting in this context
- X oxygen, sulfur, the direct bond, -SO 2 N (R 5 ) -, -CON (R 5 ) - or -COO-,
- Y 1 and Y 2 independently of one another C 1 -C 4 alkylene or hydroxypropylene, R 1 and R 2 independently of one another C 1 -C 4 alkyl or together with the N atom a pyrrolidine, piperidine, hexamethyleneimine or morpholine ring and R 1 together with R 5 also a piperazine ring,
- R 3 and R 4 are hydrogen, Ci-4-alkyl, chlorine, C 1-4 alkoxy, C 3 - 4 alkenyl or together in the o-position to one another a trimethylene or tetramethylene group,
- R 5 is hydrogen, C 1-4 alkyl, cyanoethyl or together with R 1 is a piperazine ring,
- Q -COO or -S0 3 and
- n is the number 1 or 2
mean.
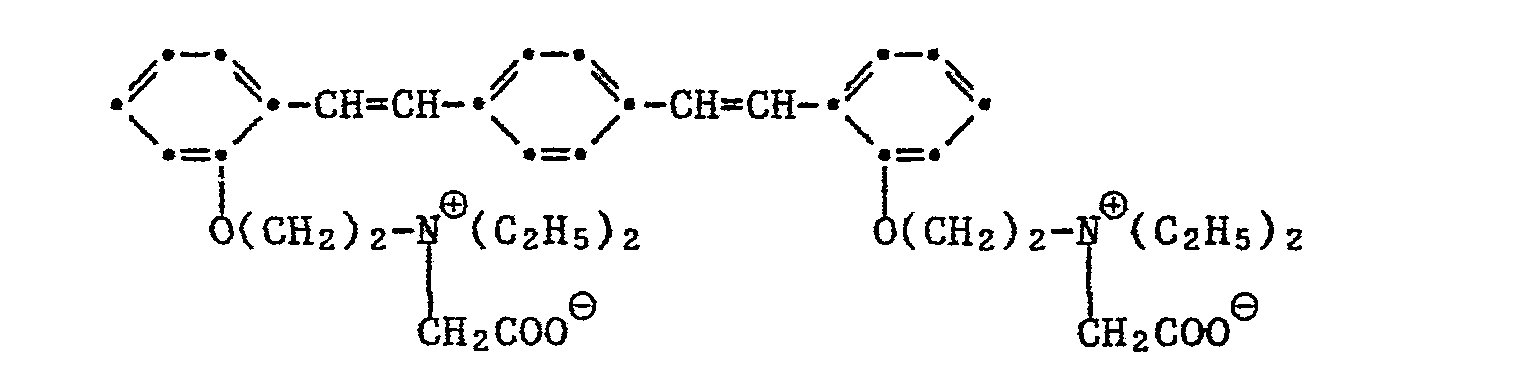
Besonders bevorzugt aus dieser Klasse ist der amphotere optische Aufheller der Formel
Kationische optische Aufheller können ebenfalls den verschiedensten chemischen Strukturen angehören. Aus der grossen Vielzahl dieser kationischen optischen Aufheller sind beispielsweise Benzofurane der Formel
- R1 Wasserstoff, Halogen, eine niedere Alkyl- oder Alkoxygruppe oder zusammen mit Rz einen annellierten Benzolrest,
- R2 Wasserstoff, eine niedere Alkyl- oder Alkoxygruppe, Halogen, eine Carboxy-, Carbalkoxy-, Aminocarbonyl-, Mono- oder Dialkylaminocarbonyl-, Sulfonsäure-, Alkylsulfonyl-, Alkyloxysulfonyl-, Aminosulfonyl- oder Mono- oder Dialkylaminosulfonylgruppe oder zusammen mit Ri oder R3 einen annellierten Benzolrest,
- R3 Wasserstoff, Halogen oder eine niedere Alkyl- oder Alkoxygruppe oder zusammen mit R2 oder R4 einen annellierten Benzolrest,
- R4 Wasserstoff, eine niedere Alkyl- oder Alkoxygruppe oder Halogen oder zusammen mit R3 einen annellierten Benzolrest,
- R5 Wasserstoff, eine niedere Alkylgruppe oder eine gegebenenfalls mit Methyl und/oder Methoxy substituierte Phenylgruppe,
- R6 Wasserstoff, eine niedere Alkyl- oder Alkoxygruppe, Halogen, einen Phenylrest, einen Alkylsulfonyl- oder einen Phenylsulfonylrest,
- R7 Wasserstoff, eine niedere Alkyl- oder Alkoxygruppe oder Halogen, R8 eine niedere Alkylgruppe, eine mindestens zwei Kohlenstoffatome aufweisende Hydroxyalkylgruppe, die Cyanäthylgruppe, einen gegebenenfalls durch Halogen, niedere Alkyl- oder Alkoxygruppe substituierten Phenylrest, einen Cycloalkylrest oder einen Aralkylrest,
- R9 eine niedere Alkylgruppe, eine Hydroxyalkylgruppe, eine Alkoxyalkylgruppe, einen gegebenenfalls substituierten Aralkylrest oder den -CHzCN, -CH2CONHz, -CHz-COOR Rest, wobei R eine Alkylgruppe mit 1 bis 4 Kohlenstoffatomen darstellt und
- X Halogen, einen Alkylsulfonsäurerest oder einen gegebenenfalls durch niederes Alkyl substituierten Phenylsulfonsäurerest bedeuten.
- R 1 is hydrogen, halogen, a lower alkyl or alkoxy group or together with Rz a fused benzene radical,
- R 2 is hydrogen, a lower alkyl or alkoxy group, halogen, a carboxy, carbalkoxy, aminocarbonyl, mono- or dialkylaminocarbonyl, sulfonic acid, alkylsulfonyl, alkyloxysulfonyl, aminosulfonyl or mono- or dialkylaminosulfonyl group or together with Ri or R 3 is a fused benzene residue,
- R 3 is hydrogen, halogen or a lower alkyl or alkoxy group or together with R 2 or R 4 a fused benzene radical,
- R 4 is hydrogen, a lower alkyl or alkoxy group or halogen or together with R 3 is a fused benzene radical,
- R 5 is hydrogen, a lower alkyl group or a phenyl group which is optionally substituted by methyl and / or methoxy,
- R 6 is hydrogen, a lower alkyl or alkoxy group, halogen, a phenyl radical, an alkylsulfonyl or a phenylsulfonyl radical,
- R 7 is hydrogen, a lower alkyl or alkoxy group or halogen, R 8 is a lower alkyl group, a hydroxyalkyl group which has at least two carbon atoms, the cyanoethyl group, a phenyl radical which is optionally substituted by halogen, lower alkyl or alkoxy group, a cycloalkyl radical or an aralkyl radical,
- R 9 is a lower alkyl group, a hydroxyalkyl group, an alkoxyalkyl group, an optionally substituted aralkyl radical or the -CHzCN, -CH 2 CONHz, -CH z -COOR radical, where R represents an alkyl group having 1 to 4 carbon atoms and
- X is halogen, an alkyl sulfonic acid residue or a phenyl sulfonic acid residue optionally substituted by lower alkyl.
Desweiteren kommen als kationische optische Aufheller Distyrylbenzole der Formel
- X und X' unabhängig voneinander -COO- oder -CON(R4)- in o-Stellung, die direkte Bindung, Sauerstoff, Schwefel, -O-C1-3-Alkylen-CON(R4)-, -SO2N(R4)-, -O-C1-3-Alkylen-COO- oder -OCO-,
- Y und Y' unabhängig voneinander C1-20-Alkylen,
- R1 und R1 unabhängig voneinander unsubstituiertes oder substituiertes C1-18-Alkyl, C3-4-Alkenyl oder zusammen mit R2 bzw. R2 einen aeterocyclischen Ring,
- R2 und R2 unabhängig voneinander unsubstituiertes oder substituiertes C1-4-Alkyl, C3-4-Alkenyl oder zusammen mit R1 bzw. R1 einen heterocyclischen Ring oder R1 und R2 bzw. R1 und R2 zusammen mit R3 einen Pyridin- oder Picolinring,
- R3 Wasserstoff, unsubstituiertes oder substituiertes Cl-4-Alkyl, C3-4-Alkenyl, oder zusammen mit R1 und Rz bzw. Ri und R2 einen Pyridin- :der Picolinring,
- R4 Wasserstoff oder unsubstituiertes oder substituiertes CI-6-Alkyl, A ein farbloses Anion und
- n und n' urabhängig voneinander die Zahl 0 oder 1 bedeuten, wobei die lenzolkerne B und C auch nicht-chromophor substituiert sein können. Besonders voteilhaft haben sich optische Aufheller der Formel
- X and X 'independently of one another -COO- or -CON (R 4 ) - in the o-position, the direct bond, oxygen, sulfur, -OC 1-3 -alkylene-CON (R 4 ) -, -SO 2 N ( R 4 ) -, -OC 1-3 -alkylene-COO- or -OCO-,
- Y and Y 'independently of one another are C 1-20 alkylene,
- R 1 and R 1 independently of one another are unsubstituted or substituted C 1-18 alkyl, C 3 - 4 alkenyl or together with R 2 or R 2 an aeterocyclic ring,
- R 2 and R 2 independently of one another are unsubstituted or substituted C 1-4 alkyl, C 3 - 4 alkenyl or together with R 1 or R 1 a heterocyclic ring or R 1 and R 2 or R 1 and R 2 together with R 3 is a pyridine or picoline ring,
- R 3 is hydrogen, unsubstituted or substituted C l - 4 alkyl, C 3-4 alkenyl, or together with R 1 and R z or R i and R 2 a pyridine: The picoline,
- R 4 is hydrogen or unsubstituted or substituted C I - 6 alkyl, A is a colorless anion and
- n and n ', independently of one another, denote the number 0 or 1, it being possible for the benzene nuclei B and C to be non-chromophore-substituted. Optical brighteners of the formula have been particularly advantageous
Aus dieser Klasse bevorzugt ist vorallem der optische Aufheller der Formel
All diese amphoteren und kationischen optischen Aufheller sind bekannt (z.B. EP-A-0 059 684, DE-A-2 159 469, EP-A-0 019 078 sowie EP-A-0 019 702)) und können nach bekannten Methoden hergestellt werden.All of these amphoteric and cationic optical brighteners are known (for example EP-A-0 059 684, DE-A-2 159 469, EP-A-0 019 078 and EP-A-0 019 702)) and can be prepared by known methods will.
Die erfindungsgemäss verwendbaren amphoteren und kationischen optischen Aufheller werden in Mengen von total 0,1 bis 3 g/1 vorzugsweise 1 bis 2 g/1 Nachbehandlungsflotte eingesetzt.The amphoteric and cationic optical brighteners which can be used according to the invention are used in amounts of totally 0.1 to 3 g / 1, preferably 1 to 2 g / 1, of aftertreatment liquor.
Desweiteren können der Nachbehandlungsflotte noch Kunstharze zugesetzt werden. Dies sind synthetische nichtkristalline harzartige Verbindungen, die beim Erwärmen erweichen, zur Filmbildung befähigt und unlöslich in Wasser sind. Es handelt sich meist um Makromoleküle, die durch Polymerisation oder Polykondensation gewonnen werden, z.B. Phenol-Formaldehyd-Harze, Polyester, Polyamide, Epoxydharze (Kondensationsprodukte aus Epichlorhydrin und Diphenylolpropan, vernetzt z.B. mit Harnstoff-Formaldehyd). In diesem Zusammenhang besonders interessante Kunstharze sind verätherte Glykolharze.Furthermore, synthetic resins can also be added to the aftertreatment liquor. These are synthetic non-crystalline resinous compounds that soften on heating, are capable of film formation and are insoluble in water. They are usually macromolecules that are obtained by polymerization or polycondensation, e.g. Phenol-formaldehyde resins, polyesters, polyamides, epoxy resins (condensation products from epichlorohydrin and diphenylolpropane, crosslinked e.g. with urea-formaldehyde). In this context, particularly interesting synthetic resins are etherified glycol resins.
Die Durchführung des Verfahrens erfolgt vorzugsweise bei Raumtemperatur, wobei die Nachbehandlungsflotte mittels der verschiedensten Methoden, zweckmässig durch Foulardieren aufgebracht werden kann.The process is preferably carried out at room temperature, it being possible for the aftertreatment liquor to be applied expediently by padding using a wide variety of methods.
Nachdem das, mit Reaktivfarbstoffen bedruckte Cellulose- oder cellulosehaltige Material mit der Nachbehandlungsflotte behandelt wurde, wird das Material getrocknet, anschliessend auf 100° bis 200°C während 10 Sekunden bis 10 Minuten erhitzt und fertiggestellt.After the cellulose or cellulose-containing material printed with reactive dyes has been treated with the aftertreatment liquor, the material is dried, then heated to 100 ° to 200 ° C. for 10 seconds to 10 minutes and finished.
Einen weiteren Erfindungsgegenstand betrifft die wässrige Flotte zur Durchführung des Verfahrens, die dadurch gekennzeichnet ist, dass diese mindestens ein kationaktives Hilfsmittel und mindestens einen amphoteren optischen Aufheller und/oder mindestens einen kationischen optischen Aufheller sowie gegebenenfalls ein Kunstharz enthält.Another object of the invention relates to the aqueous liquor for carrying out the method, which is characterized in that it contains at least one cationic auxiliary and at least one amphoteric optical brightener and / or at least one cationic optical brightener and optionally a synthetic resin.
Als kationaktive Hilfsmittel, amphotere und kationische optische Aufheller und Kunstharze kommen die eingangs genannten in Frage.The cationic additives, amphoteric and cationic optical brighteners and synthetic resins that can be used are those mentioned at the beginning.
Die folgenden Beispiele erläutern das erfindungsgemässe Verfahren; Temperaturen sind in Grad Celsius angegeben.The following examples illustrate the process according to the invention; Temperatures are given in degrees Celsius.
Beispiel 1: Ein mit dem Reaktivfarbstoff der Formel
- 40 g/l des Kunstharzes der Formel
- 3,3 g/l eines Kondensationsproduktes aus Ethylendiamindihydrochlorid, Dicyandiamid und Formaldehyd,
- 1,2 g/l des amphoteren optischen Aufhellers der Formel
- 16 g/1 eines Katalysators der Verbindung der Formel MgCl2·6H2O bei Raumtemperatur imprägniert. Die Flüssigkeitsaufnahme beträgt 60 %. Anschliessend wird das Baumwoll-Gewebe bei 60° getrocknet und während 5 Minuten mit Heissluft von 150° behandelt.
- 40 g / l of the synthetic resin of the formula
- 3.3 g / l of a condensation product of ethylenediamine dihydrochloride, dicyandiamide and formaldehyde,
- 1.2 g / l of the amphoteric optical brightener of the formula
- 16 g / 1 of a catalyst of the compound of the formula MgCl 2 .6H 2 O impregnated at room temperature. The fluid intake is 60%. The cotton fabric is then dried at 60 ° and treated with hot air at 150 ° for 5 minutes.
Man erhält ein veredeltes Baumwoll-Gewebe, das sehr waschbeständig ist und einen guten Weissgrad aufweist.A refined cotton fabric is obtained which is very wash-resistant and has a good degree of whiteness.
Verwendet man anstelle des Katalysators der Formel MgCl2·6H2O gleiche Mengen des Katalysators der Formel MgC12 + A1C13 oder MgCl2·6H2O + 0,2-0,5 g/1 NaBF4, so erhält man bei im übrigen gleicher Arbeitsweise ein gleich gut veredeltes Baumwoll-Gewebe.If, instead of the catalyst of the formula MgCl 2 · 6H 2 O equal amounts of the catalyst of the formula MGC1 2 + A1C1 3 or MgCl 2 · 6H 2 O + 0.2-0.5 g / 1 NaBF 4, is obtained at the the same way of working an equally well finished cotton fabric.
Beispiel 2: Verfährt man wie im Beispiel 1, verwendet aber anstelle des amphoteren optischen Aufhellers 1 g/l des kationischen optischen Aufhellers der Formel
Claims (12)
bedeuten.6. The method according to claim 1, characterized in that the amphoteric optical brightener is one of the formula
mean.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CH327/86 | 1986-01-29 | ||
| CH32786 | 1986-01-29 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| EP0235079A1 true EP0235079A1 (en) | 1987-09-02 |
Family
ID=4184493
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| EP87810038A Ceased EP0235079A1 (en) | 1986-01-29 | 1987-01-23 | Process for the after-treatment of celluloric materials or materials containing cellulose, printed with reactive dyes |
Country Status (3)
| Country | Link |
|---|---|
| US (1) | US4880433A (en) |
| EP (1) | EP0235079A1 (en) |
| JP (1) | JPS62184186A (en) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP0334372A1 (en) * | 1988-03-25 | 1989-09-27 | Ciba-Geigy Ag | Liquid, anionic storage-stable detergents containing amphoteric distyryl derivatives |
Families Citing this family (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN106049025B (en) * | 2016-07-15 | 2018-12-04 | 东华大学 | A kind of formaldehydeless wash-and-wear fabrics whitening fluid of polycarboxylic acid and its application |
Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB877948A (en) * | 1958-03-04 | 1961-09-20 | Ciba Ltd | Process for improving textile dyeings |
| GB952680A (en) * | 1961-05-10 | 1964-03-18 | Ici Ltd | New colouration process |
| DE2841445A1 (en) * | 1977-09-28 | 1979-04-05 | Ciba Geigy Ag | DETERGENTS AND DETERGENTS |
| EP0029003A2 (en) * | 1979-11-01 | 1981-05-20 | Ciba-Geigy Ag | Salts of cationic brighteners, their preparation and their use on organic materials as well as their concentrated aqueous solutions |
| EP0059684A1 (en) * | 1981-02-26 | 1982-09-08 | Ciba-Geigy Ag | Amphoteric styrene derivatives |
| EP0151370A2 (en) * | 1984-01-03 | 1985-08-14 | Sandoz Ag | Dyeing and printing fibres |
-
1987
- 1987-01-23 EP EP87810038A patent/EP0235079A1/en not_active Ceased
- 1987-01-27 US US07/007,835 patent/US4880433A/en not_active Expired - Fee Related
- 1987-01-29 JP JP62017410A patent/JPS62184186A/en active Pending
Patent Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB877948A (en) * | 1958-03-04 | 1961-09-20 | Ciba Ltd | Process for improving textile dyeings |
| GB952680A (en) * | 1961-05-10 | 1964-03-18 | Ici Ltd | New colouration process |
| DE2841445A1 (en) * | 1977-09-28 | 1979-04-05 | Ciba Geigy Ag | DETERGENTS AND DETERGENTS |
| EP0029003A2 (en) * | 1979-11-01 | 1981-05-20 | Ciba-Geigy Ag | Salts of cationic brighteners, their preparation and their use on organic materials as well as their concentrated aqueous solutions |
| EP0059684A1 (en) * | 1981-02-26 | 1982-09-08 | Ciba-Geigy Ag | Amphoteric styrene derivatives |
| EP0151370A2 (en) * | 1984-01-03 | 1985-08-14 | Sandoz Ag | Dyeing and printing fibres |
Non-Patent Citations (1)
| Title |
|---|
| BOOK OF PAPERS, 1983 NATIONAL TECHNICAL CONFERNCE - AATCC, 1983 Intersectional Technical Paper Competition Piedmont Section, Seiten 31-44, Triangle Park, US; D.H. ALLEN et al.: "Effect of softeners on the colorfastness of polyester/cotton knit fabric" * |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP0334372A1 (en) * | 1988-03-25 | 1989-09-27 | Ciba-Geigy Ag | Liquid, anionic storage-stable detergents containing amphoteric distyryl derivatives |
Also Published As
| Publication number | Publication date |
|---|---|
| JPS62184186A (en) | 1987-08-12 |
| US4880433A (en) | 1989-11-14 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP0225281B1 (en) | Auxiliary agent combination and its use as a textile-finishing agent | |
| DE2210087A1 (en) | TEXTILE SOFTENERS | |
| DE2500428A1 (en) | METALLIC ION SEPARATION METHOD | |
| EP0235079A1 (en) | Process for the after-treatment of celluloric materials or materials containing cellulose, printed with reactive dyes | |
| EP0221855B1 (en) | Diquaternary ammonium salts, their preparation and their use as textile finishing agents | |
| EP0038299B1 (en) | Cationic compounds | |
| DE3041580C2 (en) | Water-soluble, oligomeric condensation product of glyoxal and cyclic urea and its use for the production of crease-resistant textiles | |
| DE2433233B2 (en) | Process for spin-dyeing polymers or copolymers of acrylonitrile | |
| DE1469868A1 (en) | Process for coloring organic products with pigment dyes | |
| EP0145656A2 (en) | Cationic compounds | |
| DE1901710A1 (en) | New organic fluorine compounds and their use as oil repellants | |
| DE2148014A1 (en) | Stilbene derivatives | |
| DE2104731A1 (en) | Perfluoroalkylalkylmonocarboxylic acid esters, process for the preparation of these compounds and their use | |
| DE2335674A1 (en) | METHOD AND MEANS OF ANTISTATIC FIBER EQUIPMENT | |
| DE2921641A1 (en) | CATIONIC BRIGHTENERS | |
| DE1419364C (en) | ||
| DE2062559C2 (en) | Process for flame retardant finishing | |
| DE1419367C (en) | Preparations for making fiber materials water-repellent | |
| DE2436138A1 (en) | COLORING PROCESS | |
| DE1938101A1 (en) | Process for the flame retardancy of cellulose-containing fabrics | |
| DE1469280C (en) | Use of aqueous preparations of salts of N, N disubstituted acid amides of di or tricarboxylic acids for softening textiles | |
| DE1444077A1 (en) | Organosilicon compounds for making natural and synthetic fiber material water repellent | |
| DE1619318A1 (en) | New dyes and processes for dyeing modified polypropylene | |
| DE1619071A1 (en) | Process for finishing and whitening textiles | |
| DE2148512A1 (en) | New triazole derivatives |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PUAI | Public reference made under article 153(3) epc to a published international application that has entered the european phase |
Free format text: ORIGINAL CODE: 0009012 |
|
| 17P | Request for examination filed |
Effective date: 19870126 |
|
| AK | Designated contracting states |
Kind code of ref document: A1 Designated state(s): AT CH DE ES FR GB IT LI NL |
|
| 17Q | First examination report despatched |
Effective date: 19890727 |
|
| STAA | Information on the status of an ep patent application or granted ep patent |
Free format text: STATUS: THE APPLICATION HAS BEEN REFUSED |
|
| 18R | Application refused |
Effective date: 19900812 |
|
| RIN1 | Information on inventor provided before grant (corrected) |
Inventor name: DEFAGO, RAYMOND Inventor name: SUETTERLIN, WOLFGANG |