EP0166331A2 - Substituierte Phenoxyalkylaminopropanole, Verfahren zu ihrer Herstellung und ihre Verwendung sowie diese Verbindungen enthaltende Zubereitungen - Google Patents
Substituierte Phenoxyalkylaminopropanole, Verfahren zu ihrer Herstellung und ihre Verwendung sowie diese Verbindungen enthaltende Zubereitungen Download PDFInfo
- Publication number
- EP0166331A2 EP0166331A2 EP85107405A EP85107405A EP0166331A2 EP 0166331 A2 EP0166331 A2 EP 0166331A2 EP 85107405 A EP85107405 A EP 85107405A EP 85107405 A EP85107405 A EP 85107405A EP 0166331 A2 EP0166331 A2 EP 0166331A2
- Authority
- EP
- European Patent Office
- Prior art keywords
- group
- eine
- oder
- compounds
- substituted
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Withdrawn
Links
- -1 phenoxyalkyl aminopropanols Chemical class 0.000 title claims abstract description 14
- 150000001875 compounds Chemical class 0.000 title claims description 25
- 238000002360 preparation method Methods 0.000 title claims description 14
- 238000000034 method Methods 0.000 title claims description 13
- 239000000203 mixture Substances 0.000 title claims description 5
- 150000003839 salts Chemical class 0.000 claims abstract description 20
- 125000005843 halogen group Chemical group 0.000 claims abstract description 18
- 239000002253 acid Substances 0.000 claims abstract description 13
- 125000004432 carbon atom Chemical group C* 0.000 claims abstract description 11
- 125000000217 alkyl group Chemical group 0.000 claims abstract description 10
- 125000003545 alkoxy group Chemical group 0.000 claims abstract description 7
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims abstract description 7
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims abstract description 7
- 206010020772 Hypertension Diseases 0.000 claims abstract description 6
- 125000004442 acylamino group Chemical group 0.000 claims abstract description 5
- MYONAGGJKCJOBT-UHFFFAOYSA-N benzimidazol-2-one Chemical compound C1=CC=CC2=NC(=O)N=C21 MYONAGGJKCJOBT-UHFFFAOYSA-N 0.000 claims abstract description 5
- 208000035475 disorder Diseases 0.000 claims abstract description 5
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 claims abstract description 4
- 239000001257 hydrogen Substances 0.000 claims abstract description 4
- 229910052739 hydrogen Inorganic materials 0.000 claims abstract description 4
- 206010002383 Angina Pectoris Diseases 0.000 claims abstract description 3
- 206010052895 Coronary artery insufficiency Diseases 0.000 claims abstract description 3
- 125000003277 amino group Chemical group 0.000 claims abstract description 3
- BNBQRQQYDMDJAH-UHFFFAOYSA-N benzodioxan Chemical compound C1=CC=C2OCCOC2=C1 BNBQRQQYDMDJAH-UHFFFAOYSA-N 0.000 claims abstract description 3
- 125000004435 hydrogen atom Chemical group [H]* 0.000 claims abstract description 3
- 125000002887 hydroxy group Chemical group [H]O* 0.000 claims abstract description 3
- 125000001041 indolyl group Chemical group 0.000 claims abstract description 3
- 125000004430 oxygen atom Chemical group O* 0.000 claims abstract description 3
- 125000004076 pyridyl group Chemical group 0.000 claims abstract description 3
- 125000004603 benzisoxazolyl group Chemical group O1N=C(C2=C1C=CC=C2)* 0.000 claims abstract 2
- 239000003085 diluting agent Substances 0.000 claims description 4
- 150000001412 amines Chemical class 0.000 claims description 3
- 239000003814 drug Substances 0.000 claims description 2
- 230000002093 peripheral effect Effects 0.000 claims description 2
- 239000000825 pharmaceutical preparation Substances 0.000 claims description 2
- 239000012050 conventional carrier Substances 0.000 claims 1
- 229940124597 therapeutic agent Drugs 0.000 claims 1
- 102000012740 beta Adrenergic Receptors Human genes 0.000 abstract description 5
- 108010079452 beta Adrenergic Receptors Proteins 0.000 abstract description 5
- 230000001800 adrenalinergic effect Effects 0.000 abstract description 2
- HBEDSQVIWPRPAY-UHFFFAOYSA-N 2,3-dihydrobenzofuran Chemical group C1=CC=C2OCCC2=C1 HBEDSQVIWPRPAY-UHFFFAOYSA-N 0.000 abstract 1
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 8
- 239000004480 active ingredient Substances 0.000 description 8
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 6
- VTYYLEPIZMXCLO-UHFFFAOYSA-L Calcium carbonate Chemical compound [Ca+2].[O-]C([O-])=O VTYYLEPIZMXCLO-UHFFFAOYSA-L 0.000 description 4
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 4
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 4
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 4
- 239000000460 chlorine Substances 0.000 description 4
- 229910052801 chlorine Inorganic materials 0.000 description 4
- 235000019441 ethanol Nutrition 0.000 description 4
- 238000004519 manufacturing process Methods 0.000 description 4
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 3
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric acid Natural products [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 description 3
- 150000007513 acids Chemical class 0.000 description 3
- 230000000903 blocking effect Effects 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 3
- 150000002367 halogens Chemical class 0.000 description 3
- 102000005962 receptors Human genes 0.000 description 3
- 108020003175 receptors Proteins 0.000 description 3
- 239000002904 solvent Substances 0.000 description 3
- 239000000126 substance Substances 0.000 description 3
- 239000000725 suspension Substances 0.000 description 3
- 235000002906 tartaric acid Nutrition 0.000 description 3
- 239000011975 tartaric acid Substances 0.000 description 3
- FKASFBLJDCHBNZ-UHFFFAOYSA-N 1,3,4-oxadiazole Chemical compound C1=NN=CO1 FKASFBLJDCHBNZ-UHFFFAOYSA-N 0.000 description 2
- HBAQYPYDRFILMT-UHFFFAOYSA-N 8-[3-(1-cyclopropylpyrazol-4-yl)-1H-pyrazolo[4,3-d]pyrimidin-5-yl]-3-methyl-3,8-diazabicyclo[3.2.1]octan-2-one Chemical class C1(CC1)N1N=CC(=C1)C1=NNC2=C1N=C(N=C2)N1C2C(N(CC1CC2)C)=O HBAQYPYDRFILMT-UHFFFAOYSA-N 0.000 description 2
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 2
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 2
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 2
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 description 2
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 2
- 108010010803 Gelatin Proteins 0.000 description 2
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 2
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 2
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 2
- 229920002472 Starch Polymers 0.000 description 2
- 235000021355 Stearic acid Nutrition 0.000 description 2
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 2
- DKGAVHZHDRPRBM-UHFFFAOYSA-N Tert-Butanol Chemical compound CC(C)(C)O DKGAVHZHDRPRBM-UHFFFAOYSA-N 0.000 description 2
- 239000000654 additive Substances 0.000 description 2
- 230000001476 alcoholic effect Effects 0.000 description 2
- 125000004448 alkyl carbonyl group Chemical group 0.000 description 2
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 2
- 229910052794 bromium Inorganic materials 0.000 description 2
- 229910000019 calcium carbonate Inorganic materials 0.000 description 2
- 239000002775 capsule Substances 0.000 description 2
- 229910052799 carbon Inorganic materials 0.000 description 2
- 239000000969 carrier Substances 0.000 description 2
- 238000006243 chemical reaction Methods 0.000 description 2
- 201000010099 disease Diseases 0.000 description 2
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 2
- NUVBSKCKDOMJSU-UHFFFAOYSA-N ethylparaben Chemical compound CCOC(=O)C1=CC=C(O)C=C1 NUVBSKCKDOMJSU-UHFFFAOYSA-N 0.000 description 2
- 229910052731 fluorine Inorganic materials 0.000 description 2
- 239000011737 fluorine Substances 0.000 description 2
- 239000008273 gelatin Substances 0.000 description 2
- 229920000159 gelatin Polymers 0.000 description 2
- 235000019322 gelatine Nutrition 0.000 description 2
- 235000011852 gelatine desserts Nutrition 0.000 description 2
- 229910052736 halogen Inorganic materials 0.000 description 2
- 239000008101 lactose Substances 0.000 description 2
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 2
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 2
- 150000007522 mineralic acids Chemical class 0.000 description 2
- QIQXTHQIDYTFRH-UHFFFAOYSA-N octadecanoic acid Chemical compound CCCCCCCCCCCCCCCCCC(O)=O QIQXTHQIDYTFRH-UHFFFAOYSA-N 0.000 description 2
- OQCDKBAXFALNLD-UHFFFAOYSA-N octadecanoic acid Natural products CCCCCCCC(C)CCCCCCCCC(O)=O OQCDKBAXFALNLD-UHFFFAOYSA-N 0.000 description 2
- 230000003287 optical effect Effects 0.000 description 2
- 150000007524 organic acids Chemical class 0.000 description 2
- 235000005985 organic acids Nutrition 0.000 description 2
- 239000003755 preservative agent Substances 0.000 description 2
- 230000036454 renin-angiotensin system Effects 0.000 description 2
- 239000007787 solid Substances 0.000 description 2
- 239000008107 starch Substances 0.000 description 2
- 235000019698 starch Nutrition 0.000 description 2
- 239000008117 stearic acid Substances 0.000 description 2
- 239000000454 talc Substances 0.000 description 2
- 235000012222 talc Nutrition 0.000 description 2
- 229910052623 talc Inorganic materials 0.000 description 2
- 230000001225 therapeutic effect Effects 0.000 description 2
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 2
- 230000024883 vasodilation Effects 0.000 description 2
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 2
- JWZZKOKVBUJMES-UHFFFAOYSA-N (+-)-Isoprenaline Chemical compound CC(C)NCC(O)C1=CC=C(O)C(O)=C1 JWZZKOKVBUJMES-UHFFFAOYSA-N 0.000 description 1
- QBYIENPQHBMVBV-HFEGYEGKSA-N (2R)-2-hydroxy-2-phenylacetic acid Chemical compound O[C@@H](C(O)=O)c1ccccc1.O[C@@H](C(O)=O)c1ccccc1 QBYIENPQHBMVBV-HFEGYEGKSA-N 0.000 description 1
- AAWZDTNXLSGCEK-LNVDRNJUSA-N (3r,5r)-1,3,4,5-tetrahydroxycyclohexane-1-carboxylic acid Chemical compound O[C@@H]1CC(O)(C(O)=O)C[C@@H](O)C1O AAWZDTNXLSGCEK-LNVDRNJUSA-N 0.000 description 1
- MIOPJNTWMNEORI-GMSGAONNSA-N (S)-camphorsulfonic acid Chemical compound C1C[C@@]2(CS(O)(=O)=O)C(=O)C[C@@H]1C2(C)C MIOPJNTWMNEORI-GMSGAONNSA-N 0.000 description 1
- BJEPYKJPYRNKOW-REOHCLBHSA-N (S)-malic acid Chemical compound OC(=O)[C@@H](O)CC(O)=O BJEPYKJPYRNKOW-REOHCLBHSA-N 0.000 description 1
- KTZQTRPPVKQPFO-UHFFFAOYSA-N 1,2-benzoxazole Chemical group C1=CC=C2C=NOC2=C1 KTZQTRPPVKQPFO-UHFFFAOYSA-N 0.000 description 1
- IXPNQXFRVYWDDI-UHFFFAOYSA-N 1-methyl-2,4-dioxo-1,3-diazinane-5-carboximidamide Chemical compound CN1CC(C(N)=N)C(=O)NC1=O IXPNQXFRVYWDDI-UHFFFAOYSA-N 0.000 description 1
- IIZPXYDJLKNOIY-JXPKJXOSSA-N 1-palmitoyl-2-arachidonoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCC\C=C/C\C=C/C\C=C/C\C=C/CCCCC IIZPXYDJLKNOIY-JXPKJXOSSA-N 0.000 description 1
- 125000004203 4-hydroxyphenyl group Chemical group [H]OC1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 1
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 1
- 239000005995 Aluminium silicate Substances 0.000 description 1
- 241000416162 Astragalus gummifer Species 0.000 description 1
- AAWZDTNXLSGCEK-UHFFFAOYSA-N Cordycepinsaeure Natural products OC1CC(O)(C(O)=O)CC(O)C1O AAWZDTNXLSGCEK-UHFFFAOYSA-N 0.000 description 1
- 229920002261 Corn starch Polymers 0.000 description 1
- 241000283973 Oryctolagus cuniculus Species 0.000 description 1
- OFOBLEOULBTSOW-UHFFFAOYSA-N Propanedioic acid Natural products OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 1
- AAWZDTNXLSGCEK-ZHQZDSKASA-N Quinic acid Natural products O[C@H]1CC(O)(C(O)=O)C[C@H](O)C1O AAWZDTNXLSGCEK-ZHQZDSKASA-N 0.000 description 1
- IWYDHOAUDWTVEP-UHFFFAOYSA-N R-2-phenyl-2-hydroxyacetic acid Natural products OC(=O)C(O)C1=CC=CC=C1 IWYDHOAUDWTVEP-UHFFFAOYSA-N 0.000 description 1
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 1
- 208000001871 Tachycardia Diseases 0.000 description 1
- 229920001615 Tragacanth Polymers 0.000 description 1
- 206010047141 Vasodilatation Diseases 0.000 description 1
- 239000001089 [(2R)-oxolan-2-yl]methanol Substances 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- 125000002777 acetyl group Chemical group [H]C([H])([H])C(*)=O 0.000 description 1
- 230000004913 activation Effects 0.000 description 1
- 125000002252 acyl group Chemical group 0.000 description 1
- 230000000996 additive effect Effects 0.000 description 1
- 235000010443 alginic acid Nutrition 0.000 description 1
- 239000000783 alginic acid Substances 0.000 description 1
- 229920000615 alginic acid Polymers 0.000 description 1
- 229960001126 alginic acid Drugs 0.000 description 1
- 150000004781 alginic acids Chemical class 0.000 description 1
- BJEPYKJPYRNKOW-UHFFFAOYSA-N alpha-hydroxysuccinic acid Natural products OC(=O)C(O)CC(O)=O BJEPYKJPYRNKOW-UHFFFAOYSA-N 0.000 description 1
- 235000012211 aluminium silicate Nutrition 0.000 description 1
- 238000011914 asymmetric synthesis Methods 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- 239000008280 blood Substances 0.000 description 1
- 210000004369 blood Anatomy 0.000 description 1
- 230000036772 blood pressure Effects 0.000 description 1
- 235000010216 calcium carbonate Nutrition 0.000 description 1
- 239000001506 calcium phosphate Substances 0.000 description 1
- 229910000389 calcium phosphate Inorganic materials 0.000 description 1
- 235000011010 calcium phosphates Nutrition 0.000 description 1
- 230000000747 cardiac effect Effects 0.000 description 1
- 239000003795 chemical substances by application Substances 0.000 description 1
- 238000004587 chromatography analysis Methods 0.000 description 1
- 239000003086 colorant Substances 0.000 description 1
- 239000012230 colorless oil Substances 0.000 description 1
- 238000001816 cooling Methods 0.000 description 1
- 239000008120 corn starch Substances 0.000 description 1
- 239000008298 dragée Substances 0.000 description 1
- 230000000694 effects Effects 0.000 description 1
- 239000004403 ethyl p-hydroxybenzoate Substances 0.000 description 1
- 235000010228 ethyl p-hydroxybenzoate Nutrition 0.000 description 1
- 239000000796 flavoring agent Substances 0.000 description 1
- 235000013355 food flavoring agent Nutrition 0.000 description 1
- 235000003599 food sweetener Nutrition 0.000 description 1
- 125000002485 formyl group Chemical group [H]C(*)=O 0.000 description 1
- 238000001640 fractional crystallisation Methods 0.000 description 1
- 238000005194 fractionation Methods 0.000 description 1
- 239000001530 fumaric acid Substances 0.000 description 1
- 210000001035 gastrointestinal tract Anatomy 0.000 description 1
- 239000011521 glass Substances 0.000 description 1
- 239000003979 granulating agent Substances 0.000 description 1
- 125000000268 heptanoyl group Chemical group O=C([*])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 239000003701 inert diluent Substances 0.000 description 1
- 239000004615 ingredient Substances 0.000 description 1
- PNDPGZBMCMUPRI-UHFFFAOYSA-N iodine Chemical compound II PNDPGZBMCMUPRI-UHFFFAOYSA-N 0.000 description 1
- 238000005342 ion exchange Methods 0.000 description 1
- 229960001317 isoprenaline Drugs 0.000 description 1
- NLYAJNPCOHFWQQ-UHFFFAOYSA-N kaolin Chemical compound O.O.O=[Al]O[Si](=O)O[Si](=O)O[Al]=O NLYAJNPCOHFWQQ-UHFFFAOYSA-N 0.000 description 1
- 239000000787 lecithin Substances 0.000 description 1
- 235000010445 lecithin Nutrition 0.000 description 1
- 229940067606 lecithin Drugs 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 239000000314 lubricant Substances 0.000 description 1
- 235000019359 magnesium stearate Nutrition 0.000 description 1
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 1
- 239000011976 maleic acid Substances 0.000 description 1
- 239000001630 malic acid Substances 0.000 description 1
- 235000011090 malic acid Nutrition 0.000 description 1
- 229960002510 mandelic acid Drugs 0.000 description 1
- 230000001404 mediated effect Effects 0.000 description 1
- 229920000609 methyl cellulose Polymers 0.000 description 1
- 239000001923 methylcellulose Substances 0.000 description 1
- 235000010981 methylcellulose Nutrition 0.000 description 1
- 229960002900 methylcellulose Drugs 0.000 description 1
- 244000005700 microbiome Species 0.000 description 1
- 229910052757 nitrogen Inorganic materials 0.000 description 1
- 235000006408 oxalic acid Nutrition 0.000 description 1
- 230000036513 peripheral conductance Effects 0.000 description 1
- 239000008194 pharmaceutical composition Substances 0.000 description 1
- 230000000144 pharmacologic effect Effects 0.000 description 1
- SONNWYBIRXJNDC-VIFPVBQESA-N phenylephrine Chemical compound CNC[C@H](O)C1=CC=CC(O)=C1 SONNWYBIRXJNDC-VIFPVBQESA-N 0.000 description 1
- 229960001802 phenylephrine Drugs 0.000 description 1
- 239000000244 polyoxyethylene sorbitan monooleate Substances 0.000 description 1
- 235000010482 polyoxyethylene sorbitan monooleate Nutrition 0.000 description 1
- 229920000053 polysorbate 80 Polymers 0.000 description 1
- 239000002244 precipitate Substances 0.000 description 1
- 125000001501 propionyl group Chemical group O=C([*])C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000002572 propoxy group Chemical group [*]OC([H])([H])C(C([H])([H])[H])([H])[H] 0.000 description 1
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 235000013772 propylene glycol Nutrition 0.000 description 1
- 238000000746 purification Methods 0.000 description 1
- 239000011541 reaction mixture Substances 0.000 description 1
- 238000001953 recrystallisation Methods 0.000 description 1
- 230000011514 reflex Effects 0.000 description 1
- 230000035945 sensitivity Effects 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 239000000741 silica gel Substances 0.000 description 1
- 229910002027 silica gel Inorganic materials 0.000 description 1
- 235000010413 sodium alginate Nutrition 0.000 description 1
- 239000000661 sodium alginate Substances 0.000 description 1
- 229940005550 sodium alginate Drugs 0.000 description 1
- 229910000029 sodium carbonate Inorganic materials 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- 239000007858 starting material Substances 0.000 description 1
- 239000000375 suspending agent Substances 0.000 description 1
- 239000003765 sweetening agent Substances 0.000 description 1
- 230000002889 sympathetic effect Effects 0.000 description 1
- 235000020357 syrup Nutrition 0.000 description 1
- 239000006188 syrup Substances 0.000 description 1
- 239000003826 tablet Substances 0.000 description 1
- 230000006794 tachycardia Effects 0.000 description 1
- BSYVTEYKTMYBMK-UHFFFAOYSA-N tetrahydrofurfuryl alcohol Chemical compound OCC1CCCO1 BSYVTEYKTMYBMK-UHFFFAOYSA-N 0.000 description 1
- 235000010487 tragacanth Nutrition 0.000 description 1
- 239000000196 tragacanth Substances 0.000 description 1
- 229940116362 tragacanth Drugs 0.000 description 1
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 1
- 239000000080 wetting agent Substances 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D271/00—Heterocyclic compounds containing five-membered rings having two nitrogen atoms and one oxygen atom as the only ring hetero atoms
- C07D271/02—Heterocyclic compounds containing five-membered rings having two nitrogen atoms and one oxygen atom as the only ring hetero atoms not condensed with other rings
- C07D271/10—1,3,4-Oxadiazoles; Hydrogenated 1,3,4-oxadiazoles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/08—Vasodilators for multiple indications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/12—Antihypertensives
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings
- C07D413/12—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings linked by a chain containing hetero atoms as chain links
Definitions
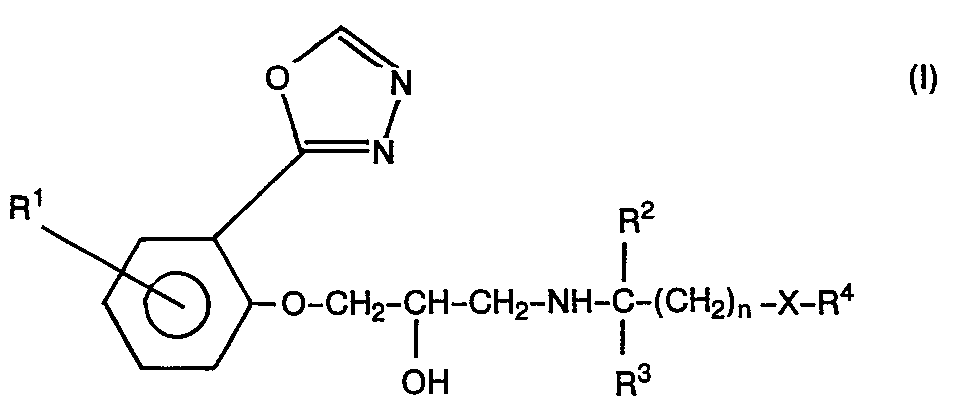
- the new compounds of general formula I contain one or two asymmetric carbon atoms.
- the various optical isomers and the diastereoisomers are therefore also a subject of the invention, as are the addition salts of these compounds with acids. Racemates can be separated into their optical antipodes by methods known per se.
- alkyl groups according to the invention and the alkyl parts of the alkoxy groups can be straight-chain or branched and are preferably methyl, ethyl and propyl groups.
- Halogen is fluorine, chlorine, bromine or iodine, preferably fluorine, chlorine or bromine, but especially chlorine.
- Preferred acyl groups are alkylcarbonyl groups with straight-chain or branched alkyl groups and preferably 1 to 10 carbon atoms, in particular straight-chain alkylcarbonyl groups with 1 to 7 carbon atoms.
- the formyl, acetyl, propionyl and heptanoyl group is particularly preferred.
- R 1 is preferably halogen, especially chlorine, or the acylamino group.
- Halogen substituents R are preferably in the 4-position and the acylamino group is preferably in the 5-position of the phenyl ring with respect to the oxadiazole radical.
- radicals R 2 and R 3 are preferably hydrogen or straight-chain alkyl groups, in particular methyl and ethyl.
- R 4 is bonded to the - (CH 2 ) n group or to the carbon atom carrying the R 2 and R radicals.
- n O - (CH 2 ) - also means a single bond, the radicals X or R 4 are then connected to the carbon atom carrying the radicals R 2 and R 3 .
- 1,2-Benzisoxazole groups R 4 can carry a halogen atom or be unsubstituted.
- the compounds of the formula I according to the invention and their physiologically tolerated acid addition salts are therapeutic active ingredients, have high pharmacological activity and are valuable medicaments. They block both the alpha receptors and the beta receptors of the adrenergic system and are therefore preferably suitable for the treatment of hypertension, circulatory disorders, in particular peripheral circulatory disorders, angina pectoris and coronary insufficiency.
- the compounds mentioned in the present invention lower rabbits in a dose of 10-100 mg / kg. po the isoprenaline-related tachycardia by 50% (ß 1 blockade) and the phenylephrine-related blood pressure increase by 50% ( ⁇ 1 blockade).
- the compounds of the present invention can be used orally or parenterally.
- the single dose in humans is 1 mg to 500 mg, preferably 10 mg to 100 mg, in particular 30 mg to 50 mg. These dosages are advantageous for the treatment of the abovementioned diseases, in particular for the treatment of hypertension.
- the daily dose must be adjusted individually because it depends on the receptor sensitivity and the sympathetic tone of the patient.
- the treatment is expediently started with low doses and then increased.
- compositions which contain a compound of formula I or its pharmaceutically acceptable salts, together with a pharmaceutically acceptable diluent or carrier.
- the compounds according to the invention can be mixed with customary pharmaceutically acceptable diluents or carriers and, if appropriate, with other auxiliaries and administered, for example, orally or parenterally. They can be administered orally in the form of tablets, dragees, syrups, suspensions and liquids or parenterally in the form of solutions or suspensions. Preparations to be administered orally can contain one or more additives, such as sweeteners, flavoring agents, colorants and preservatives.
- Tablets can contain the active ingredient mixed with customary, pharmaceutically compatible auxiliaries, for example inert diluents such as calcium carbonate, sodium carbonate, lactose and talc, granulating agents and agents which promote the disintegration of the tablets when administered orally, such as starch or alginic acid, binders such as starch or gelatin , Lubricants such as magnesium stearate, stearic acid and talc.
- auxiliaries for example inert diluents such as calcium carbonate, sodium carbonate, lactose and talc, granulating agents and agents which promote the disintegration of the tablets when administered orally, such as starch or alginic acid, binders such as starch or gelatin , Lubricants such as magnesium stearate, stearic acid and talc.
- Suitable carriers are, for example, milk sugar (lactose), gelatin, corn starch, stearic acid, ethanol, propylene glycol, ether of tetrahydrofurfuryl alcohol and water.
- the tablets can be coated according to known procedures to delay disintegration and absorption in the gastrointestinal tract, whereby the activity of the active ingredient can extend over a longer period of time.
- the active ingredient in the suspensions can be mixed with auxiliaries which are customary for the preparation of such compositions, for example suspending agents such as methyl cellulose, tragacanth or sodium alginate, wetting agents such as lecithin, polyoxyethylene stearate and polyoxyethylene sorbitan monooleate, and preservatives such as ethyl parahydroxybenzoate.
- suspending agents such as methyl cellulose, tragacanth or sodium alginate
- wetting agents such as lecithin, polyoxyethylene stearate and polyoxyethylene sorbitan monooleate
- preservatives such as ethyl parahydroxybenzoate.
- Capsules can contain the active ingredient as a single component or mixed with a solid diluent such as calcium carbonate, calcium phosphate or kaolin
- the injectable preparations are also formulated in a manner known per se.
- the pharmaceutical preparations can contain the active ingredient in an amount of 0.1 to 90%, in particular 1 to 90%, the rest being a carrier or additive.
- Solid preparations such as tablets and capsules are preferred in view of manufacture and administration.
- the preparations preferably contain the active ingredient in an amount of 10 to 50 mg.
- the reactions are carried out in a solvent, for example an alcohol, at temperatures of 20-80 ° C.
- a solvent for example an alcohol
- the compounds obtained are optionally converted into the acid addition salts using a physiologically tolerated acid.
- the starting compounds of the formulas IIa and IIb are described in European Patent 45 955 and German Offenlegungsschrift 28 11 638 and in the literature or can be obtained analogously to known methods.
- the amines of the formula III are also known compounds described in the literature or can be synthesized by analog processes.
- the compounds of the general formula I can be isolated from the reaction mixtures either as bases or in the form of their salts. They can be converted into the salts as bases with suitable inorganic or organic acids by known processes.
- Physiologically acceptable salts of the compound of formula I are preferred.
- suitable inorganic acids are, for example, hydrohalic acids, for example hydrochloric acid or sulfuric acid
- organic acids are, for example, fumaric acid, maleic acid, citric acid and tartaric acid.
- the hot alcoholic solution of the base is mixed with the alcoholic solution of a suitable acid and the salt is obtained after addition of ether.
- the present compounds of formula I can be present as racemates or as a mixture of two diastereoisomers due to one or two centers of chirality.
- Diastereoisomers can be separated in a known manner due to the physico-chemical differences. Racemates can be separated by known methods, for example by recrystallization in optically active solvents, by microorganisms or reaction with an optically active acid which forms a salt with the racemic compound, separation of the diastereoisomers by fractional crystallization and release of the enantiomers by suitable means.
- optically active acids are, for example, the d- and 1-forms of tartaric acid, diorthotoloyl tartaric acid, malic acid, mandelic acid, camphorsulfonic acid or quinic acid.
- the more active of the antipodes is advantageously isolated. According to the invention, however, it is also possible to obtain the pure enantiomers by asymmetric synthesis.
- oxalate 3.3 g of the base are dissolved in hot ethanol and 0.36 g of oxalic acid are added. After cooling, the crystalline precipitate is filtered off and washed with ethanol and ether. 3.3 g of 2- [2- [2-hydroxy-3- (3- (4-hydroxyphenyl) -1-methylpropylamino) propoxy] -4-chlorophenyl] -1.3.4 are obtained oxadiazole oxalate. Mp 194-196 ° C.
- Tablets containing the ingredients listed below are made according to known procedures. These are suitable for the treatment of the aforementioned diseases, in particular hypertension, in a dosage amount of 40 mg once or twice a day.
- Ampoules containing the components mentioned below can be produced in a known manner. Active ingredient and sodium chloride are dissolved in water and filled into glass ampoules under nitrogen.
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Medicinal Chemistry (AREA)
- Veterinary Medicine (AREA)
- Cardiology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Heart & Thoracic Surgery (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Urology & Nephrology (AREA)
- Vascular Medicine (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Plural Heterocyclic Compounds (AREA)
- Heterocyclic Carbon Compounds Containing A Hetero Ring Having Nitrogen And Oxygen As The Only Ring Hetero Atoms (AREA)
Abstract
- R1 ein Wasserstoff- oder Halogenatom, eine Alkyl- oder Alkoxygruppe mit jeweils 1 bis 4 Kohlenstoffatomen, eine Aminogruppe oder Acylaminogruppe,
- R2 und R3, die gleich oder verschieden sein können, ein Wasserstoffatom oder eine Alkylgruppe mit 1 bis 3 Kohlenstoffatomen,
- R4 eine Phenylgruppe oder eine substituierte Phenylgruppe, die durch ein Halogenatom, eine oder zwei Alkoxygruppen, eine Methylendioxy-Gruppe, eine Hydroxy-Gruppe substituiert sein kann, eine Pyridylgruppe, eine Indolyl-Gruppe, eine gegebenenfalls durch ein Halogenatom substituierte 1,2-Benzisoxazolylgruppe, den Benzimidazol-2-on-, 1,4-Benzodioxan-oder Benzoxolan-Rest,
- X ein Sauerstoffatom oder eine Einfachbindung und
- n die Zahlen 0,1, 2 oder 3 bedeuten,
Description
- Substituierte Phenoxyalkylaminopropanole, Verfahren zu ihrer Herstellung und ihre Verwendung sowie diese Verbindungen enthaltende Zubereitungen
-
- R 1 ein Wasserstoff- oder Halogenatom, eine Alkyl- oder Alkoxygruppe mit jeweils 1 bis 4 Kohlenstoffatomen, eine Aminogruppe oder Acylaminogruppe,
- R 2 und R 3, die gleich oder verschieden sein können, ein Wasserstoffatom oder eine Alkylgruppe mit 1 bis 3 Kohlenstoffatomen,
- R4 eine Phenylgruppe oder eine substituierte Phenylgruppe, die durch ein Halogenatom, eine oder zwei Alkoxygruppen, eine Methylendioxy-Gruppe, eine Hydroxy-Gruppe substituiert sein kann, eine Pyridylgruppe, eine Indolylgruppe, eine gegebenenfalls durch ein Halogenatom substituierte 1,2-Benzisoxazolylgruppe, den Benzimidazol-2-on-, 1,4-Benzodioxan-oder Benzoxolan-Rest,
- X ein Sauerstoffatom oder eine Einfachbindung und
- n die Zahlen 0, 1, 2 oder 3 bedeuten,
- Obgleich pharmazeutisch verträgliche Salze der neuen Verbindungen der Formel I bevorzugt sind, liegen alle Säureadditionssalze innerhalb des Bereichs der Erfindung. Alle Säureadditionssalze sind wertvoll zur Herstellung der Basen, selbst wenn das spezielle Salz nur als Zwischenprodukt gewünscht wird, wie z.B., wenn das Salz nur für Zwecke der Reinigung oder Identifizierung gebildet wird, oder wenn es als ein Zwischenprodukt bei der Herstellung eines pharmazeutisch verträglichen Salzes, wie z.B. durch Ionenaustauschverfahrensweisen, verwendet wird.
- Die neuen Verbindungen der allgemeinen Formel I enthalten ein oder zwei asymetrische Kohlenstoffatome. Daher sind auch die verschiedenen optischen Isomeren sowie die Diastereoisomeren Gegenstand der Erfindung ebenso wie die Additionssalze dieser Verbindungen mit Säuren. Racemate können nach an sich bekannten Methoden in ihre optischen Antipoden aufgetrennt werden.
- Die erfindungsgemäßen Alkylgruppen sowie die Alkylteile der Alkoxygruppen können geradkettig oder verzweigt sein und sind vorzugsweise Methyl-, Ethyl- und Propylgruppen.
- Halogen ist Fluor, Chlor, Brom oder Jod, vorzugsweise Fluor, Chlor oder Brom, insbesondere aber Chlor.
- Bevorzugte Acylgruppen sind Alkylcarbonylgruppen mit geradkettigen oder verzweigten Alkylgruppen und vorzugsweise 1 bis 10 Kohlenstoffatomen, insbesondere geradkettige Alkylcarbonylgruppen mit 1 bis 7 Kohlenstoffatomen. Besonders bevorzugt ist davon die Formyl-, Acetyl-, Propionyl- und Heptanoylgruppe.
- R 1 ist vorzugsweise Halogen, insbesondere Chlor, oder die Acylaminogruppe. Halogensubstituenten R befinden sich vorzugsweise in der 4-Stellung und die Acylaminogruppe vorzugsweise in der 5-Stellung des Phenylrings bezüglich des Oxadiazolrestes.
- Die Reste R 2 und R3 sind vorzugsweise Wasserstoff oder geradkettige Alkylgruppen, insbesondere Methyl und Ethyl.
- Bedeutet X eine Einfachbindung, ist R4 an die -(CH2)n-Gruppe beziehungsweise an das die Reste R 2 und R tragende Kohlenstoffatom gebunden. Für n=O bedeutet -(CH2)- ebenfalls eine Einfachbindung, die Reste X oder R 4 sind dann mit dem die Reste R2 und R3 tragenden Kohlenstoffatom verbunden.
- 1,2-Benzisoxazolgruppen R4 können ein Halogenatom tragen oder unsubstituiert sein.
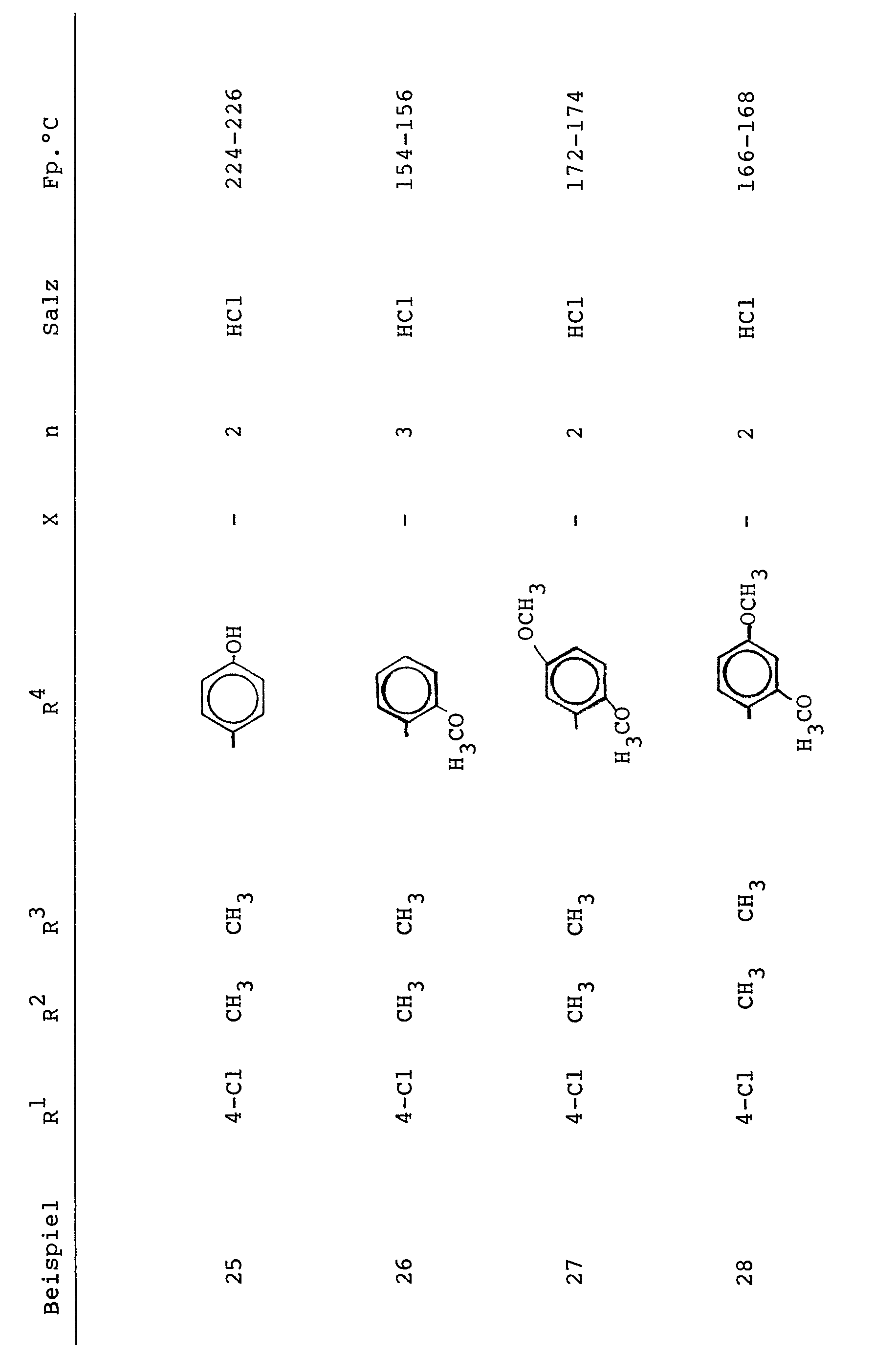
- Die folgenden Verbindungen der Formel I und deren Salze mit hohem therapeutischem Effekt werden besonders bevorzugt und zwar in der Form der Racemate sowie in der Form optisch aktiver Isomerer (Beispiel 4, 10, 6 u. 12): 2-[2-[2-Hydroxy-3-(3-phenyl-1,1-dimethyl-propylamino)-propoxy7-4-chlor-phenyl7-1,3,4-oxadiazol 2- [2-[2-Hydroxy-3-(2-(2-methoxy-phenoxy)-äthylamino)-propoxy7-4-chlor-phenyl7-1,3,4-oxadiazol 2-[2-[2-Hydroxy-3-(3-(2-methoxy-phenyl)-1,1-dimethyl- propylamino)-propxy]-4-chlor-phenyl]1,3,4-oxadiazol 2-[2- [2-(Hydroxy-3-(2-(2-methoxy-phenoxy)-äthylamino)-propoxy7-5-heptano ylamino-pheny]1,3,4-oxadiazol
- Die erfindungsgemäßen Verbindungen der Formel I und ihre physiologisch verträglichen Säureadditionssalze sind therapeutische Wirkstoffe, besitzen hohe pharmakologische Wirkung und sind wertvolle Arzneimittel. Sie blockieren sowohl die Alpharezeptoren als auch die Betarezeptoren des adrenergen Systems und sind daher vorzugsweise zur Behandlung von Hypertonie, Durchblutungsstörungen, insbesondere peripheren Durchblutungsstörungen, Angina pectoris und Coronarinsuffizienz geeignet.
- Die Kombination einer alpharezeptorenblockierenden Eigenschaft mit einer betarezeptorenblockierenden ist aus zwei Gründen sinnvoll:
- 1. Im Gegensatz zu einer Betablockade allein wird der erhöhte Blutdruck vorwiegend durch die über Alpharezeptoren vermittelte Reduktion des peripheren Gefäßwiderstandes gesenkt; ein reflektorischer Anstieg des Herzzeitvolumens wird durch die betarezeptorenblockierende Eigenschaft der Substanzen verhindert.
- 2. Die Aktivierung des Renin-Angiotensinsystems, die nach Vasodilatation durch Alphablockade beobachtet wird und einen blutdrucksteigernden Einfluß ausübt, wird durch Betablockade unterdrückt.
- Die in vorliegender Erfindung genannten Verbindungen senken bei Kaninchen in einer Dosis von 10-100mg/kg. p.o. die Isoprenalin-bedingte Tachycardie um 50% (ß1-Blockade) und den Phenylephrin-bedingten Blutdruckanstieg um 50% (α1-Blockade).
- Die Verbindungen der vorliegenden Erfindung können oral oder parenteral angewendet werden. Die Einzeldosis beträgt beim Menschen 1 mg bis 500 mg, vorzugsweise 10 mg bis 100 mg, insbesondere 30 mg bis 50 mg. Diese Dosierungen sind vorteilhaft zur Behandlung der vorstehend genannten Krankheiten, insbesondere zur Behandlung von Hypertonie.
- Die Tagesdosis ist, wie für Alpha- und Betarezeptoren üblich, individuell abzustimmen, weil sie von der Rezeptorenempfindlichkeit und dem Sympathikotonus des Patienten abhängt. Zweckmäßigerweise wird die Behandlung mit niederen Dosen begonnen und dann gesteigert.
- Gemäß der Erfindung werden pharmazeutische Zusammensetzungen geschaffen, die eine Verbindung der Formel I oder deren pharmazeutisch verträgliche Salze, zusammen mit einem pharmazeutisch verträglichen Verdünnungsmittel oder Träger enthalten.
- Die Verbindungen gemäß der Erfindung können mit üblichen pharmazeutisch verträglichen Verdünnungsmitteln oder Trägern und gegebenenfalls mit anderen Hilfsmitteln vermischt und beispielsweise oral oder parenteral verabreicht werden. Sie können oral in Form von Tabletten, Dragees, Sirups, Suspensionen und Flüssigkeiten oder parenteral in Form von Lösungen oder Suspensionen verabreicht werden. Oral zu verabreichende Präparate können ein oder mehrere Zusätze, wie Süßungsmittel, Aromatisierungsmittel, Farbstoffe und Konservierungsmittel, enthalten. Tabletten können den Wirkstoff mit üblichen, pharmazeutisch verträglichen Hilfsmitteln vermischt enthalten, zum Beispiel inerten Verdünnungsmitteln wie Calciumcarbonat, Natriumcarbonat, Lactose und Talk, Granulierungsmitteln und Mitteln, die den Zerfall der Tabletten bei oraler Verabreichung fördern, wie Stärke oder Alginsäure, Bindemitteln wie Stärke oder Gelatine, Gleitmitteln wie Magnesiumstearat, Stearinsäure und Talk.
- Geeignete Trägerstoffe sind beispielsweise Milchzucker (Lactose), Gelatine, Maisstärke, Stearinsäure, Äthanol, Propylenglycol, Äther des Tetrahydrofurfuryl alkohols und Wasser.
- Die Tabletten können nach bekannten Arbeitsweisen überzogen werden, um den Zerfall und die Resorption im Magen-Darmtrakt zu verzögern, wodurch die Aktivität des Wirkstoffs sich über eine längere Zeitspanne erstrecken kann. Ebenso kann in den Suspensionen der Wirkstoff mit Hilfsmitteln vermischt sein, die für die Herstellung solcher Zusammensetzungen üblich sind, zum Beispiel Suspendiermitteln wie Methylcellulose, Tragacanth oder Natriumalginat, Netzmitteln wie Lecithin, Polyoxyäthylen stearat und Polyoxyäthylensorbitanmonooleat, und Konservierungsmitteln wie Äthylparahydroxybenzoat. Kapseln können den Wirkstoff als einzigen Bestandteil oder vermischt mit einem festen Verdünnungsmittel wie Calciumcarbonat, Calciumphosphat oder Kaolin enthalten. Die injizierbaren Präparate werden ebenfalls in an sich bekannter Weise formuliert. Die pharmazeutischen Präparate können den Wirkstoff in einer Menge von 0,1 bis 90%, insbesondere 1 bis 90%, enthalten, wobei der Rest ein Trägerstoff oder Zusatzstoff ist. Im Hinblick auf die Herstellung und Verabreichung werden feste Präparate, wie Tabletten und Kapseln, bevorzugt. Vorzugsweise enthalten die Präparate den Wirkstoff in einer Menge von 10 bis 50 mg.
- Das Verfahren zur Herstellung der Verbindungen der Formel I ist dadurch gekennzeichnet, daß man Verbindungen der allgemeinen Formel IIa oder IIb oder deren Gemische,
wobei Y für ein Halogenatom steht, mit einem Amin der allgemeinen Formel III
in der R 2, R3, R 4, X und n die oben angegebene Bedeutung haben, umsetzt. - Die Reaktionen werden in einem Lösungsmittel, beispielsweise einem Alkohol, bei Temperaturen von 20 - 80°C durchgeführt. Die erhaltenen Verbindungen werden gegebenenfalls mit einer physiologisch verträglichen Säure in die Säureadditionssalze überführt.
- Die Ausgangsverbindungen der Formeln IIa und IIb sind in der europäischen Patentschrift 45 955 und der deutschen Offenlegungsschrift 28 11 638 und in der Literatur beschrieben oder können analog zu bekannten Methoden erhalten werden. Auch die Amine der Formel III sind bekannte, in der Literatur beschriebene Verbindungen oder können nach Analogverfahren synthetisiert werden.
- Die Verbindungen der allgemeinen Formel I können entweder als Basen oder in Form ihrer Salze aus den Reaktionsgemischen isoliert werden. Sie lassen sich als Basen mit geeigneten anorganischen oder organischen Säuren nach bekannten Verfahren in die Salze überführen.
- Bevorzugt werden physiologisch verträgliche Salze der Verbindung der Formel I. Hierfür sind als anorganische Säuren beispielsweise Halogenwasserstoffsäuren, zum Beispiel Salzsäure oder Schwefelsäure und als organische Säuren zum Beispiel Fumarsäure, Maleinsäure, Zitronensäure und Weinsäure geeignet. Zur Herstellung wird die heiße alkoholische Lösung der Base mit der alkoholischen Lösung einer geeigneten Säure versetzt und man erhält nach Etherzusatz das Salz.
- Die vorliegenden Verbindungen der Formel I können aufgrund eines oder zweier Chiralitätszentren als Racemate oder als Gemisch von zwei Diastereoisomeren vorliegen. Diastereoisomere können in bekannter Weise aufgrund der physikalisch-chemischen Unterschiede getrennt werden. Racemate können nach bekannten Methoden getrennt werden, beispielsweise durch Umkristallisieren in optisch aktiven Lösungsmitteln, durch Mikroorganismen oder Reaktion mit einer optisch aktiven Säure, die mit der racemischen Verbindung ein Salz bildet, Trennung der Diastereoisomere durch fraktionierte Kristallisation und Freisetzung der Enantiomeren durch geeignete Mittel. Besonders geeignete optisch aktive Säuren sind beispielsweise die d- und 1-Formen der Weinsäure, Diorthotoloylweinsäure, Äpfelsäure, Mandelsäure, Kamphersulfonsäure oder Chininsäure. Vorteilhafterweise wird der aktivere der Antipoden isoliert. Gemäß der Erfindung ist es jedoch auch möglich, die reinen Enantiomeren durch asymmetrische Synthese zu erhalten.
- Die folgenden Beispiele dienen zur Erläuterung der Erfindung:
- 5,1 g (0.02 Mol) 2-[2-(2,3-Epoxypropoxy)-4-chlor- phenylJ-1,3,4-oxadiazol und 3,3 g (0,02 Mol) 4-(4-Hydroxyphenyl)―butylamin-2 werden in 100 ml t-Butanol 4 Stunden bei 80°C gerührt. Nach Entfernen des Lösungsmittels wird der Rückstand durch Chromatografie an Kieselgel gereinigt (CH2C12/CH30H=3/2). Man erhält nach Fraktionierung 4 g eines farblosen Öls, dessen Struktur 2-[2-[2-Hydroxy-3-(3-(4-hydroxyphenyl)-1-methyl-propylamino)-propox]-4-chlor-phenyl]-1,3,4-oxadiazol entspricht.
- Zur Herstellung des Oxalats löst man 3,3 g der Base in heißem Ethanol und versetzt mit 0,36 g Oxalsäure. Nach Erkalten wird der kristalline Niederschlag abgesaugt und mit Ethanol und Äther gewaschen. Man erhält 3,3 g des 2-[2-[2-Hydroxy-3-(3-(4-hydroxyphenyl)-1-methyl-propylamino)-propoxy]-4-chlor-phenyl]-1,3,4-oxadiazol-oxalats. Fp. 194 - 196°C.
-
-
-
sowie ihre Säureadditionssalze, Verfahren zu ihrer Herstellung und ihre Verwendung und Zubereitungen, die diese Verbindungen enthalten.
Claims (4)
in der
sowie ihre Säureadditionssalze.
wobei Y für ein Halogenatom steht, mit einem Amin der allgemeinen Formel III
in der R 2, R 3, R 4, X und n die oben angegebene Bedeutung haben, umsetzt.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DE3423429 | 1984-06-26 | ||
| DE19843423429 DE3423429A1 (de) | 1984-06-26 | 1984-06-26 | Substituierte phenoxyalkylaminopropanole, verfahren zu ihrer herstellung und ihre verwendung sowie diese verbindungen enthaltende zubereitungen |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| EP0166331A2 true EP0166331A2 (de) | 1986-01-02 |
| EP0166331A3 EP0166331A3 (de) | 1986-11-12 |
Family
ID=6239117
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| EP85107405A Withdrawn EP0166331A3 (de) | 1984-06-26 | 1985-06-15 | Substituierte Phenoxyalkylaminopropanole, Verfahren zu ihrer Herstellung und ihre Verwendung sowie diese Verbindungen enthaltende Zubereitungen |
Country Status (5)
| Country | Link |
|---|---|
| EP (1) | EP0166331A3 (de) |
| JP (1) | JPS6124579A (de) |
| AU (1) | AU4399985A (de) |
| DE (1) | DE3423429A1 (de) |
| ES (1) | ES8608498A1 (de) |
Cited By (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2003016307A1 (en) * | 2001-08-14 | 2003-02-27 | Eli Lilly And Company | β3 ADRENERGIC AGONISTS |
| US6825220B2 (en) | 2000-11-10 | 2004-11-30 | Eli Lilly And Company | 3-Substituted oxindole β 3 agonists |
| US6911463B2 (en) | 2001-08-14 | 2005-06-28 | Eli Lilly And Company | 3-substituted oxindole β-3 agonists |
| US7009060B2 (en) | 2002-01-11 | 2006-03-07 | Eli Lilly And Company | 2-oxo-benzimidazolyl substituted ethanolamine derivatives and their use as β3 agonists |
| US7071208B2 (en) | 2001-11-20 | 2006-07-04 | Eli Lilly And Company | β3 Adrenergic agonists |
| US7205407B2 (en) | 2001-11-20 | 2007-04-17 | Eli Lilly And Company | 3-Substituted oxindole β3 agonists |
Families Citing this family (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO1993009106A1 (fr) * | 1991-10-28 | 1993-05-13 | Tsentr Po Khimii Lekarstvennykh Sredstv | Derives de 5-phenoxymethyle-1,2,4-oxadiazole, leur sels, procede d'obtention et preparation pharmaceutique a base de ceux-ci presentant des proprietes antihypertensives, antiangineuses, antiarrhythmiques et antiglaucomatomeuses |
| CA2415331A1 (en) * | 2000-07-13 | 2002-01-24 | Eli Lilly And Company | Beta3 adrenergic agonists |
Family Cites Families (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS5231858B1 (de) * | 1969-12-17 | 1977-08-17 | ||
| DE2811638A1 (de) * | 1978-03-17 | 1979-09-20 | Beiersdorf Ag | Substituierte aryloxy-aminopropanole und verfahren zu deren herstellung |
| WO1980000152A1 (fr) * | 1978-07-03 | 1980-02-07 | Sandoz Ag | Derives d'un 3-aminopropoxy-aryle, leur preparation et utilisation |
| DE2926517A1 (de) * | 1979-06-30 | 1981-01-15 | Beiersdorf Ag | Substituierte 3-aryl-pyrazole und 5-aryl-isoxazole und verfahren zu ihrer herstellung |
| DE3005287A1 (de) * | 1980-02-13 | 1981-08-20 | Basf Ag, 6700 Ludwigshafen | Phenylpiperazinderivate von 1,3,4-oxadiazolylphenolen, ihre herstellung und diese enthaltende therapeutische mittel |
| DE3006351A1 (de) * | 1980-02-20 | 1981-09-17 | Basf Ag, 6700 Ludwigshafen | 2- ((3-amino-2- hydroxy-propoxy)-styryl )-verbindungen |
| DE3006809A1 (de) * | 1980-02-23 | 1981-09-24 | Basf Ag, 6700 Ludwigshafen | 2-((3-amino-2-hydroxy-propoxy)-styryl)-isoxazole, verfahren zu ihrer herstellung und diese enthaltende pharmazeutische zubereitungen |
| DE3030573A1 (de) * | 1980-08-13 | 1982-03-11 | Beiersdorf Ag, 2000 Hamburg | 2-(2-(2-hydroxy-3-tert.-butylamino-propoxy)-5-acetamidophenyl) -1,3,4-oxadiazol, verfahren zu dessen herstellung und diese verbindung enthaltende pharmazeutische zubereitung |
| DE3030561A1 (de) * | 1980-08-13 | 1982-03-25 | Beiersdorf Ag, 2000 Hamburg | 2-(2-hydroxy-3-tert-butylamino-propoxy)-5-acylamino-phenyl)-1,3,4-oxadiazole, verfahren zu ihrer herstellung und diese verbindungen enthaltende pharmazeutische zubereitungen |
| DE3030530A1 (de) * | 1980-08-13 | 1982-03-18 | Beiersdorf Ag, 2000 Hamburg | Alkyl- und cycloalkylsubstituierte 2-(2-(-hydroxy-3-tert-butylamino-propoxy)-5-acylaminophenyl)-1,3,4-oxadiazole, verfahren zu ihrer herstellung und diese verbindungen enthaltende pharmazeutische zubereitungen |
| DE3200304A1 (de) * | 1981-01-16 | 1982-08-26 | Sandoz-Patent-GmbH, 7850 Lörrach | 3-aminopropoxyaryl-derivate, ihre herstellung und sie enthaltende arzneimittel |
-
1984
- 1984-06-26 DE DE19843423429 patent/DE3423429A1/de not_active Withdrawn
-
1985
- 1985-06-15 EP EP85107405A patent/EP0166331A3/de not_active Withdrawn
- 1985-06-24 AU AU43999/85A patent/AU4399985A/en not_active Abandoned
- 1985-06-25 ES ES544511A patent/ES8608498A1/es not_active Expired
- 1985-06-25 JP JP13708485A patent/JPS6124579A/ja active Pending
Cited By (13)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6825220B2 (en) | 2000-11-10 | 2004-11-30 | Eli Lilly And Company | 3-Substituted oxindole β 3 agonists |
| US7122680B2 (en) | 2000-11-10 | 2006-10-17 | Eli Lilly And Company | 3-Substituted oxindole β3 agonsists |
| US6911463B2 (en) | 2001-08-14 | 2005-06-28 | Eli Lilly And Company | 3-substituted oxindole β-3 agonists |
| WO2003016307A1 (en) * | 2001-08-14 | 2003-02-27 | Eli Lilly And Company | β3 ADRENERGIC AGONISTS |
| US7087635B2 (en) | 2001-08-14 | 2006-08-08 | Eli Lilly And Company | 3-substituted oxindole β3 agonists |
| US7208505B2 (en) | 2001-08-14 | 2007-04-24 | Eli Lilly And Company | β3 adrenergic agonists |
| US7253181B2 (en) | 2001-11-20 | 2007-08-07 | Eli Lilly And Company | β3 adrenergic agonists |
| US7071208B2 (en) | 2001-11-20 | 2006-07-04 | Eli Lilly And Company | β3 Adrenergic agonists |
| US7205407B2 (en) | 2001-11-20 | 2007-04-17 | Eli Lilly And Company | 3-Substituted oxindole β3 agonists |
| US7265127B2 (en) | 2001-11-20 | 2007-09-04 | Eli Lilly And Company | β3 adrenergic agonists |
| US7241772B2 (en) | 2001-11-20 | 2007-07-10 | Eli Lilly And Company | β3 adrenergic agonists |
| US7009060B2 (en) | 2002-01-11 | 2006-03-07 | Eli Lilly And Company | 2-oxo-benzimidazolyl substituted ethanolamine derivatives and their use as β3 agonists |
| US7214697B2 (en) | 2002-01-11 | 2007-05-08 | Eli Lilly And Company | 2-Oxo-benzimidazolyl substituted ethanolamine derivatives and their use as β3 agonists |
Also Published As
| Publication number | Publication date |
|---|---|
| AU4399985A (en) | 1986-01-02 |
| ES8608498A1 (es) | 1986-07-16 |
| DE3423429A1 (de) | 1986-01-02 |
| ES544511A0 (es) | 1986-07-16 |
| EP0166331A3 (de) | 1986-11-12 |
| JPS6124579A (ja) | 1986-02-03 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP0026317B1 (de) | Optisch aktive 1,4-Dihydropyridine, Verfahren zu ihrer Herstellung und ihre Verwendung als Arzneimittel | |
| WO1980000152A1 (fr) | Derives d'un 3-aminopropoxy-aryle, leur preparation et utilisation | |
| EP0353557A1 (de) | Tetrahydro-1-benz-[c,d]-indol-propionsäure-sulfonamide | |
| CH641159A5 (de) | Verfahren zur herstellung von neuen guanidinderivaten. | |
| EP0167121B1 (de) | Neue substituierte Phenylpiperazinyl-propanole, Verfahren zu ihrer Herstellung und ihre Vewendung sowei diese Verbindungen enthaltende Zubereitungen | |
| DE3309596A1 (de) | 2-substituierte 1-(3'-aminoalkyl)-1,2,3,4-tetrahydro-ss-carboline, ihre herstellung und verwendung als arzneimittel | |
| EP0297380B1 (de) | Indolylpropanole, Verfahren zu ihrer Herstellung und ihre Verwendung sowie die Verbindungen enthaltende Zubereitungen | |
| EP0166331A2 (de) | Substituierte Phenoxyalkylaminopropanole, Verfahren zu ihrer Herstellung und ihre Verwendung sowie diese Verbindungen enthaltende Zubereitungen | |
| DE68920913T2 (de) | Serotonin-Antagonisten. | |
| EP0179386B1 (de) | 1,4-Dihydropyridin-hydroxyamine, Verfahren zu ihrer Herstellung sowie ihre Verwendung in Arzneimitteln | |
| EP0171689B1 (de) | Neue Aminoalkohole, Verfahren zu deren Herstellung sowie diese Verbindungen enthaltende Arzneimittel und Zwischenprodukte | |
| EP0665228A1 (de) | Neue 3-Phenylsulfonyl-3,7-diazabicyclo(3,3,1)nonan-Verbindungen enthaltende Arzneimittel | |
| EP0158956B1 (de) | 4-(Nitrophenyl)-tetrahydropyridine, Verfahren zu ihrer Herstellung und ihre Verwendung als Arzneimittel | |
| EP0303920A1 (de) | Neue Benzofuranderivate und diese enthaltende therapeutische Mittel | |
| EP0308785B1 (de) | Dihydropyridinether, Verfahren zu ihrer Herstellung und ihre Verwendung | |
| EP0045911B1 (de) | Neue Aminopropanol-Derivate, Verfahren zu ihrer Herstellung und diese Verbindungen enthaltende Arzneimittel | |
| DE3526044A1 (de) | Dihydrochinolinon-derivate, verfahren zu ihrer herstellung, sie enthaltende arzneimittel und deren verwendung, sowie zwischenprodukte zu ihrer herstellung | |
| EP0175293A1 (de) | Bicyclische Lactame, Verfahren zu ihrer Herstellung und ihre Verwendung sowie diese Verbindungen enthaltende Zubereitungen | |
| EP0185988B1 (de) | 10,11-Dihydro-5H-dibenzo[a,d]cycloheptadien-Derivate, ihre Herstellung und Verwendung | |
| DE1593782A1 (de) | Neue nitrilsubstituierte 1-Phenoxy-2-hydroxy-3-tert.-butylaminopropane und Verfahren zu ihrer Herstellung | |
| DE4002391A1 (de) | Indolylpropanole, verfahren zu ihrer herstellung und ihre verwendung sowie die verbindungen enthaltende zubereitungen | |
| DE3545206A1 (de) | Substituierte 4-fluor-isoindoline, verfahren zu ihrer herstellung und ihre verwendung sowie diese verbindungen enthaltende zubereitungen | |
| EP0126933A1 (de) | Tetrahydro-1H-pyrazolo(5,1-a)isoindole, Verfahren zu deren Herstellung, diese Verbindungen enthaltende Zubereitungen und Zwischenprodukte | |
| EP0091057B1 (de) | 5,6-Dihydro-11-alkylen-morphantridin-6-one, ihre Herstellung und diese enthaltende Arzneimittel | |
| DE3620632A1 (de) | 1,4-dihydropyridinsulfon-derivate, verfahren zu ihrer herstellung und sie enthaltende pharmazeutische mittel |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PUAI | Public reference made under article 153(3) epc to a published international application that has entered the european phase |
Free format text: ORIGINAL CODE: 0009012 |
|
| 17P | Request for examination filed |
Effective date: 19850615 |
|
| AK | Designated contracting states |
Designated state(s): AT BE CH DE FR GB IT LI NL SE |
|
| PUAL | Search report despatched |
Free format text: ORIGINAL CODE: 0009013 |
|
| AK | Designated contracting states |
Kind code of ref document: A3 Designated state(s): AT BE CH DE FR GB IT LI NL SE |
|
| STAA | Information on the status of an ep patent application or granted ep patent |
Free format text: STATUS: THE APPLICATION HAS BEEN WITHDRAWN |
|
| 18W | Application withdrawn |
Withdrawal date: 19870113 |
|
| RIN1 | Information on inventor provided before grant (corrected) |
Inventor name: COHNEN, ERICH, DR. Inventor name: JACOBITZ, PETRA, DR. |