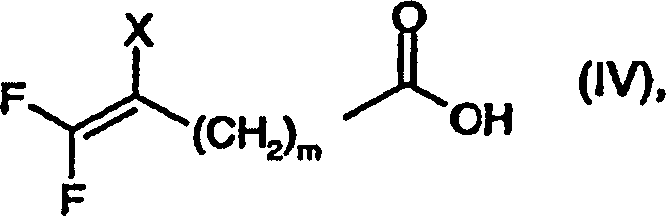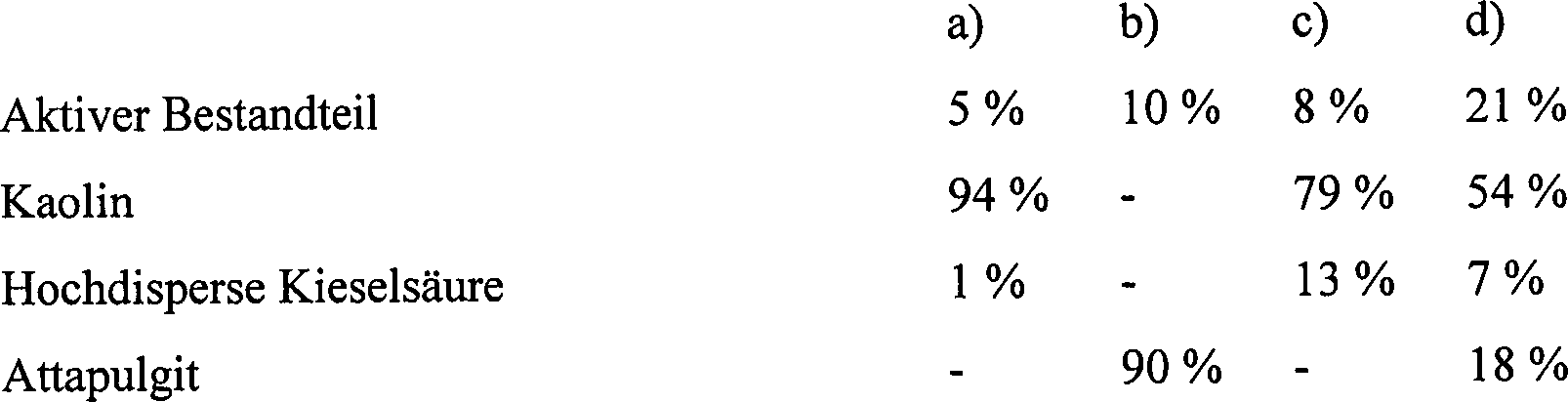-
Die
vorliegende Erfindung betrifft Verbindungen der Formel
worin
R
1 Halo-C
1-C
6-alkyl; Halo-C
2-C
6-alkenyl; oder
Halo-C
3-C
6-alkinyl
bedeutet;
R
2 Halogen, Nitro, Cyano,
C
1-C
10-Alkyl, C
2-C
6-Alkenyl, C
2-C
6-Alkinyl, C
3-C
8-Cycloalkyl, C
1-C
6-Alkoxy, C
3-C
6-Alkenyloxy,
Halo-C
1-C
10-alkyl,
Halo-C
2-C
6-alkenyl,
Halo-C
1-C
6-alkoxy,
C
3-C
6-Alkinyloxy,
C
1-C
4-Alkylthio, Di-(C
1-C
4-alkyl)-amin
bedeutet, worin die zwei Alkylgruppen unabhängig voneinander sind; Aryl,
Aryloxy, Arylthio oder substituiertes Aryl, Aryloxy oder Arylthio;
R
3 Wasserstoff oder unsubstituiertes oder
substituiertes C
1-C
10-Alkyl;
oder Benzyl, worin der Phenylring unsubstituiert oder monosubstituiert
ist durch einen Substituenten, ausgewählt unter Nitro, Halogen, -CF
3, -CN und C
1-C
4-Alkyl, bedeutet;
m für 3, 5,
7 oder 9 steht;
n für
0, 1, 2, 3 oder 4 steht; und
X Wasserstoff bedeutet;
in
freier Form oder in Salzform;
ein Verfahren zur Herstellung
derartiger Verbindungen und die Verwendung derartiger Verbindungen,
pestizide Zusammensetzungen, worin der aktive Bestandteil unter
solchen Verbindungen in freier Form oder in einer agrochemisch geeigneten
Salzform ausgewählt
ist, ein Verfahren zur Herstellung derartiger Zusammensetzungen
und die Verwendung derartiger Zusammensetzungen, Pflanzenvermehrungsgut,
das mit solchen Zusammensetzungen behandelt ist, und ein Verfahren
zur Kontrolle von Schädlingen.
-
Einige
Halovinylcarbonsäurederivate
werden in der Literatur als wirksame Bestandteile in Pestiziden vorgeschlagen.
Die biologischen Eigenschaften dieser bekannten Verbindungen sind
jedoch im Bereich der Schädlingskontrolle
nicht völlig
zufriedenstellend, weswegen ein Bedarf besteht, weitere Verbindungen
mit schädlingskontrollierenden
Eigenschaften bereitzustellen, insbesondere für die Kontrolle von Insekten
und Vertretern der Ordnung Acarina. Dieses Problem wird erfindungsgemäß durch
die Bereitstellung der vorliegenden Verbindungen der Formel (I)
gelöst.
-
Die
Verbindungen der Formel (I) sind im Stande, mit Basen Salze zu bilden.
Geeignete Salze mit Basen sind zum Beispiel Metallsalze wie Alkalimetall-
oder Erdalkalimetallsalze, z.B. Natrium-, Kalium- oder Magnesiumsalze,
oder Salze mit Ammoniak oder einem organischen Amin wie Morpholin,
Piperidin, Pyrrolidin, einem Mono-, Di- oder Tri-niedrigalkylamin, z.B. Ethyl-, Diethyl-,
Triethyl- oder Dimethylpropylamin, oder einem Mono-, Di- oder Tri-hydroxyniedrigalkylamin,
z.B. Mono-, Di- oder Triethanolamin. Im Bereich der Erfindung sind
Salze bevorzugt, die aus agrochemischer Sicht vorteilhaft sind,
jedoch umfasst die Erfindung auch andere Salze, die zum Beispiel
bei der Isolierung oder Reinigung der freien Verbindungen der Formel
(I) oder der agrochemisch geeigneten Salze hiervon eingesetzt werden.
Die Bezeichnung "Verbindungen
der Formel (I)" ist
vorstehend und nachfolgend so zu verstehen, dass sie freie Verbindungen
der Formel (I) und deren Salze beinhaltet. In jedem Fall ist die
freie Form bevorzugt.
-
Die
vorstehend und nachfolgend verwendeten allgemeinen Bezeichnungen
besitzen die nachstehend angegebenen Bedeutungen, sofern nicht anders
angegeben.
-
Halogen – als Gruppe
per se und als Strukturelement von anderen Gruppen und Verbindungen
wie Haloalkyl, Halocycloalkyl, Haloalkenyl, Haloalkinyl und Haloalkoxy – ist Fluor,
Chlor, Brom oder Iod, insbesondere Fluor, Chlor oder Brom, vor allem
Fluor oder Chlor, insbesondere Chlor.
-
Sofern
nicht anders angegeben enthalten Kohlenstoff-enthaltende Gruppen
und Verbindungen jeweils von 1 bis zu und einschließlich 20,
vorzugsweise von 1 bis zu und einschließ lich 18, insbesondere von
1 bis zu und einschließlich
10, vor allem von 1 bis zu und einschließlich 6, ganz besonders von
1 bis zu und einschließlich
4, insbesondere von 1 bis zu und einschließlich 3, ganz besonders 1 oder
2 Kohlenstoffatome, wobei Methyl besonders bevorzugt ist.
-
Alkyl-
als Gruppe per se und als Strukturelement von anderen Gruppen und
Verbindungen wie zum Beispiel Haloalkyl, Alkoxy, Alkoxyalkyl, Haloalkoxy,
Alkoxycarbonyl, Alkylthio, Haloalkylthio, Alkylsulfonyl und Alkylsulfonyloxy – ist in
jedem Fall unter entsprechender Berücksichtigung der Anzahl der
Kohlenstoffatome, die in der jeweiligen Gruppe oder Verbindung vorhanden
sind, entweder geradkettig, z.B. Methyl, Ethyl, n-Propyl, n-Butyl,
n-Hexyl, n-Octyl, n-Decyl, n-Dodecyl, n-Hexadecyl oder n-Octadecyl,
oder verzweigt, z.B. Isopropyl, Isobutyl, sec-Butyl, tert-Butyl,
Isopentyl, Neopentyl oder Isohexyl.
-
Alkenyl
und Alkinyl – als
Gruppen per se und als Strukturelemente von anderen Gruppen und
Verbindungen wie Haloalkenyl, Haloalkinyl, Alkenyloxy, Haloalkenyloxy,
Alkinyloxy oder Haloalkinyloxy – sind
geradkettig oder verzweigt und enthalten jeweils zwei ungesättigte Kohlenstoff-Kohlenstoff-Bindungen
oder, vorzugsweise, eine ungesättigte
Kohlenstoff-Kohlenstoff-Bindung. Als Beispiele können genannt werden: Vinyl, Prop-2-en-1-yl,
2-Methylprop-2-en-1-yl, But-2-en-1-yl, But-3-en-1-yl, Prop-2-yn-1-yl,
But-2-yn-1-yl und But-3-yn-1-yl.
-
Cycloalkyl – als Gruppe
per se und als Strukturelement von anderen Gruppen und Verbindungen
wie zum Beispiel Alkyl – ist
Cyclopropyl, Cyclobutyl, Cyclopentyl, Cyclohexyl, Cycloheptyl oder
Cyclooctyl. Cyclopropyl, Cyclopentyl und Cyclohexyl sind bevorzugt.
-
Halo-substituierte
Kohlenstoff-enthaltende Gruppen und Verbindungen, wie Haloalkyl
und Haloalkoxy, können
teilweise halogeniert oder perhalogeniert sein, und im Fall der
Polyhalogenierung können
die Halogensubstituenten identisch oder verschieden sein. Beispiele
für Haloalkyl-
als Gruppe per se und als Strukturelement von anderen Gruppen und
Verbindungen wie Haloalkoxy – sind
Methyl, das mono- bis trisubstituiert ist durch Fluor, Chlor und/oder
Brom, wie CHF2, CF3 oder
CH2Cl; Ethyl, das mono- bis pentasubstituiert
ist durch Fluor, Chlor und/oder Brom, wie CH2CF3, CF2CF3,
CF2CCl3, CF2CHCl2, CF2CHF2, CF2CFCl2, CH2CH2Cl, CF2CHBr2, CF2CHClF, CF2CHBrF
oder CClFCHClF; Propyl oder Isopropyl, die mono- bis heptasubstituiert
sind durch Fluor, Chlor und/oder Brom, wie CH2CHBrCH2Br, CF2CHFCF3, CH2CF2CF3, CF2CF2CF3, CH(CF3)2 oder CH2CH2CH2Cl; und Butyl,
das mono- bis nonasubstituiert ist durch Fluor, Chlor und/oder Brom,
oder ein Isomeres hiervon, wie CF(CH3)CHFCF3, CF2(CF2)2CF3 oder
CH2(CF2)2CF3.
-
Aryl
ist Phenyl oder Naphthyl, wobei Phenyl bevorzugt ist.
-
Die
folgenden sind bevorzugte Ausführungsformen
im Bereich der Erfindung:
- a) eine Verbindung
der Formel (I), worin R1 Halo-C1-C3-alkyl oder Halo-C3-C6-alkenyl;
vorzugsweise Halo-C1-C2-alkyl,
insbesondere 2-Chlor-1,1,2-trifluorethyl oder 1,1,2,2-Tetrafluorethyl
bedeutet;
- b) eine Verbindung der Formel (I), worin R2 Halogen
oder C1-C4-Alkyl,
insbesondere Fluor, Chlor, Methyl oder Isopropyl; insbesondere Methyl
oder Isopropyl; vorzugsweise in 2-Position, bedeutet;
- c) eine Verbindung der Formel (I), worin m für 3 steht;
- d) eine Verbindung der Formel (I), worin n für 0, 1, 2 oder 3; vorzugsweise
0, 1 oder 2; vorzugsweise 0 oder 1, insbesondere 1, steht;
- e) eine Verbindung der Formel (I), worin R3 Wasserstoff
oder C1-C4-Alkyl,
insbesondere Wasserstoff, ist;
- f) eine Verbindung der Formel (I), worin -O-R1 sich
in 4-Stellung befindet.
-
Ganz
bevorzugt innerhalb des Bereichs der Erfindung sind die Verbindungen
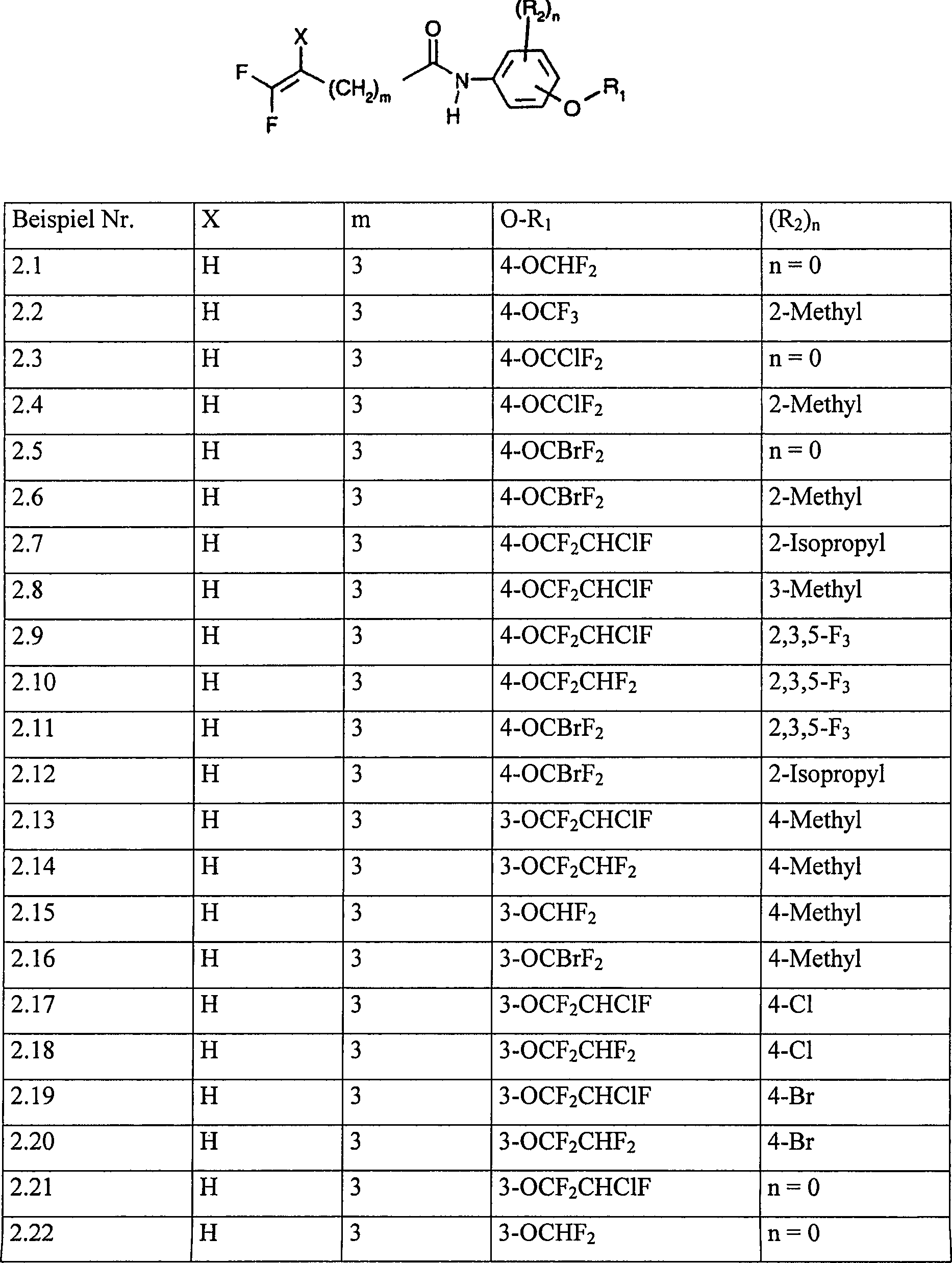
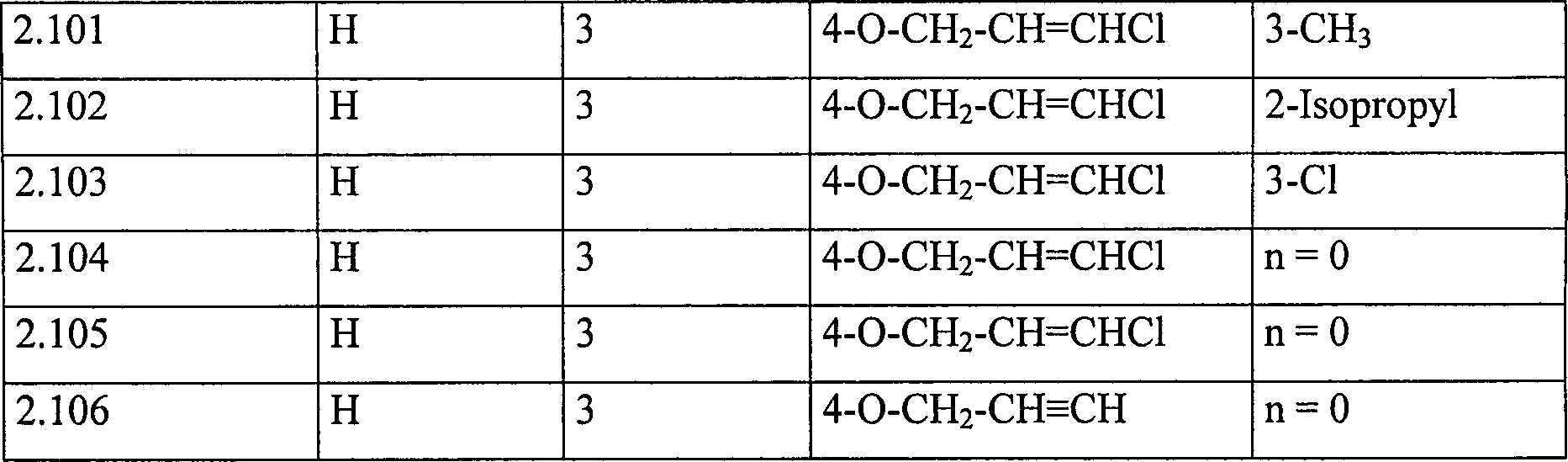
der Formel (I), die in den Tabellen 1 und 2 aufgelistet sind.
-
Die
Erfindung betrifft auch ein Verfahren zur Herstellung der Verbindungen
der Formel (I) in freier Form oder in Salzform, welches umfasst:
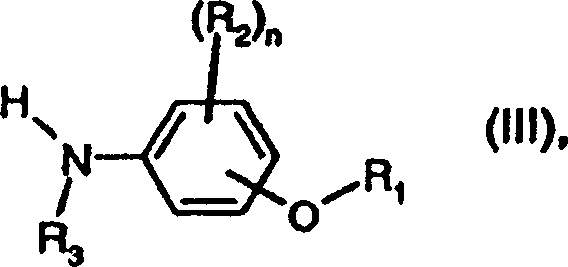
- a) die Umsetzung einer Verbindung der Formel worin X und m wie für Formel
(I) definiert sind und Hal Halogen, vorzugsweise Chlor oder Brom,
bedeutet, geeignetenfalls in einem inerten Lösungsmittel und in Gegenwart
eines Säure-bindenden
Mittels mit einer Verbindung der Formel worin R1,
R2, R3 und n wie
für Formel
(I) definiert sind, oder, gegebenenfalls, mit einem Salz hiervon,
oder
- b) die Umsetzung einer Verbindung der Formel worin X und m wie für Formel
(I) definiert sind, geeignetenfalls in Anwesenheit eines Kondensationsmittels oder
eines Wasser entfernenden Mittels mit einer Verbindung der Formel
(III) oder mit einem Salz hiervon; oder
- c) die Umsetzung einer Verbindung der Formel worin X und m wie für Formel
(I) definier sind, mit einer Verbindung der Formel (III) oder mit
einem Salz hiervon;
und/oder, wenn erwünscht, die Umwandlung einer
Verbindung der Formel (I), die erhältlich ist nach dem Verfahren
oder auf andere Weise, in freier Form oder in Salzform, in eine
andere Verbindung der Formel (I), Trennen einer Mischung der Isomeren,
die nach dem Verfahren erhältlich
ist, und Isolieren des gewünschten
Isomeren und/oder die Umwandlung einer freien Verbindung der Formel
(I), die nach dem Verfahren oder auf andere Weise erhältlich ist,
in ein Salz oder die Umwandlung eines Salzes einer Verbindung der
Formel (I), die nach dem Verfahren oder auf andere Weise erhältlich ist
in die freie Verbindung der Formel (I) oder in ein anderes Salz.
-
Die
Ausgangsmaterialien der Formeln (II), (III), (IV) und (V), die vorstehend
erwähnt
wurden und nachfolgend zur Herstellung der Verbindungen der Formel
(I) in freier Form oder in Salzform eingesetzt werden, sind bekannt
oder können
nach per se bekannten Methoden hergestellt werden.
-
Die
vorstehend und nachfolgend beschriebenen Reaktionen werden in per
se bekannter Weise, zum Beispiel in Abwesenheit oder, sofern geeignet,
in Gegenwart eines geeigneten Lösungsmittels
oder Verdünnungsmittels
oder einer Mischung hiervon durchgeführt, wobei die Umsetzung erforderlichenfalls
unter Kühlung
bei Raumtemperatur oder unter Erhitzen, zum Beispiel in einem Temperaturbereich
von etwa –80°C bis zur
Siedetemperatur der Reaktionsmischung, vorzugsweise von etwa –20°C bis etwa
+150°C,
und, erforderlichenfalls, in einem geschlossenen Gefäß unter
Druck unter Inertgasatmosphäre
und/oder unter wasserfreien Bedingungen erfolgt. Besonders vorteilhafte
Reaktionsbedingungen finden sich in den Beispielen.
-
Die
Reaktion des Verfahrens a) wird vorzugsweise in einem inerten, Hydroxygruppenfreien
Lösungsmittel
in Gegenwart einer organischen Base, wie zum Beispiel Pyridin, 4-Dimethylaminopyridin,
4-Pyrrolidinopyridin, Lutidin, Collidin, Trialkylamin, N,N-Dialkylanilin, oder
in Gegenwart einer bicyclischen, nicht-nucleophilen Base wie 1,4-Diazabicyclo-[2.2.2]-octan
(DABCO), 1,5-Diazabicyclo-[4.3.0]-non-5-en (DBN) oder 1,8-Diazabicyclo-[5.4.0]-undec-7-en
(DBU) durchgeführt.
Im Allgemeinen wird die Reaktion bei Temperaturen von –30°C bis +70°C, vorzugsweise
von –10°C bis +50°C, und vor teilhaft
in Gegenwart von einem inerten Lösungsmittel
oder Lösungsmittelmischung
durchgeführt.
-
Geeignete
Lösungsmittel
sind zum Beispiel aliphatische und aromatische Kohlenwasserstoffe
wie Benzol, Toluol, Xylole, Petrolether, Hexan; halogenierte Kohlenwasserstoffe
wie Chlorbenzol, Methylenchlorid, Ethylenchlorid, Chloroform, Tetrachlorkohlenstoff,
Tetrachlorethylen; Ether und etherische Verbindungen wie Dialkylether
(Diethylether, Diisopropylether, tert-Butylmethylether, usw.), Anisol,
Dioxan, Tetrahydrofuran; Nitrile wie Acetonitril, Propionitril;
Ester wie Ethylacetat, Propylacetat oder Butylacetat; Ketone wie
Aceton, Diethylketon, Methylethylketon oder Methylisobutylketon;
und Mischungen derartiger Lösungsmittel
miteinander. Die Reaktion kann jedoch auch in einem Überschuss
einer der vorstehend erwähnten
Basen, oder anstelle der Base kann ein zweites Äquivalent oder ein relativ
großer Überschuss
der Verbindung der Formel (III) verwendet werden. Die Reaktion erfolgt
unter Umgebungsdruck, obgleich sie bei erhöhtem oder reduziertem Druck durchgeführt werden
kann.
-
Bei
der Verfahrensvariante b) erfolgt die Reaktion vorteilhaft in Gegenwart
eines Kondensationsmittels, wie zum Beispiel Phosphorsäuredichloridphenylester,
Benzolphosphonsäuredichlorid,
2,4,6-Trichlor-s-triazin, Kohlensäurediimidazolid, ein Carbodiimid
wie Dicyclohexylcarbodiimid (DCC), Aluminiumoxid, Titantetrachlorid,
2,2,4,4,6,6-Hexachlor-1,3,5-triazatriphosphorin
oder Chlorameisensäureniedrigalkylester
wie Isobutylchlorformiat. Vorzugsweise erfolgt die Reaktion in Gegenwart
eines inerten Lösungsmittels
oder Lösungsmittelmischung
bei Temperaturen von –30°C bis +70°C, vorzugsweise
von –10 °C bis +50°C. Die Reaktion
wird vorzugsweise ausgeführt
in Gegenwart einer Base, wie zum Beispiel in Gegenwart eines organischen
Amins wie Trialkylamin (Trimethylamin, Triethylamin, Triisopropylamin
oder Diisopropylethylamin), eines Pyridins (Pyridin selbst, 4-Dimethylaminopyridin
oder 4-Pyrrolidinoopyridin), eines Morpholins (N-Methylmorpholin)
oder eines N,N-Dialkylanilins (N,N-Dimethylanilin oder N-Methyl-N-ethylanilin).
Geeignete Lösungsmittel
für die
Reaktion sind zum Beispiel aliphatische und aromatische Kohlenwasserstoffe
wie Benzol, Toluol, Xylole, Petrolether, Hexan; halogenierte Kohlenwasserstoffe
wie Chlorbenzol, Methylenchlorid, Ethylenchlorid, Chloroform, Te trachlorkohlenstoff
Tetrachlorethylen; Ether wie Dialkylether (Diethylether, Diisopropylether,
tert-Butylmethylether, usw.), Anisol, Dioxan, Tetrahydrofuran; Nitrile
wie Acetonitril, Propionitril; Ester wie Ethylacetat, Propylacetat
oder Butylacetat; und Mischungen von derartigen Lösungsmitteln
miteinander.
-
Bei
der Verfahrensvariante c) werden die Reaktionen vorteilhaft in Gegenwart
eines inerten Lösungsmittels
oder Lösungsmittelmischung
bei Temperaturen von 0°C
bis +120°C,
vorzugsweise von 50°C
bis +100°C,
durchgeführt.
Geeignete Lösungsmittel
sind die gleichen wie vorstehend bei Variante a) erwähnt.
-
Die
nach dem Verfahren oder auf andere Weise erhältlichen Verbindungen der Formel
(I) können
in per se bekannter Weise in andere Verbindungen der Formel (I) übergeführt werden
durch Ersetzen eines oder mehrerer Substituenten der Ausgangsverbindung
der Formel (I) durch einen oder mehrere erfindungsgemäße Substituenten
in üblicher
Weise.
-
In
Abhängigkeit
von der Wahl der Reaktionsbedingungen und Ausgangsmaterialien, die
für den
jeweiligen Fall geeignet sind, ist es möglich, dass in einer Reaktionsstufe
lediglich ein Substituent durch andere Substituenten gemäß der Erfindung
ersetzt werden, oder es ist möglich,
dass mehrere Substituenten durch andere Substituenten gemäß der Erfindung
in der gleichen Reaktionsstufe ersetzt werden.
-
Die
Salze der Verbindungen der Formel (I) können in per se bekannter Weise
hergestellt werden. Zum Beispiel werden Salze der Verbindungen der
Formel (I) mit Basen erhalten, indem man die freien Verbindungen
mit einer geeigneten Base oder mit einem geeigneten Ionenaustauschreagens
behandelt.
-
Die
Salze der Verbindungen der Formel (I) können in die freien Verbindungen
der Formel (I) auf übliche Weise,
zum Beispiel durch Behandlung mit einer geeigneten Säure oder
mit einem geeigneten Ionenaustauschreagens, übergeführt werden.
-
Die
Salze der Verbindungen der Formel (I) können in andere Salze einer
Verbindung der Formel (I) auf per se bekannte Weise übergeführt werden.
-
In
Abhängigkeit
von dem Verfahren und den Reaktionsbedingungen können die Verbindungen der Formel
(I) mit salzbildenden Eigenschaften in freier Form oder in Form
der Salze erhalten werden.
-
Die
Verbindungen der Formel (I) in freier Form oder in Salzform können in
Form eines der möglichen Isomeren
oder in Form einer Mischung derselben vorliegen; zum Beispiel können sie
in Abhängigkeit
von der Anzahl der asymmetrischen Kohlenstoffatome, die in dem Molekül vorliegen
und der absoluten und relativen Konfiguration hiervon und/oder in
Abhängigkeit
von der Konfiguration der nicht-aromatischen Doppelbindungen, die
in dem Molekül
vorliegen, in Form der freien Isomeren wie Antipoden und/oder Diastereoisomere,
oder in Form von Mischungen der Isomeren wie Mischungen von Enantiomeren,
zum Beispiel Racematen, Mischungen von Diastereoisomeren oder Mischungen
von Racematen, vorliegen. Die Erfindung betrifft sowohl die reinen
Isomeren wie auch sämtliche
möglichen
Mischungen von Isomeren und ist als solche vorstehend und nachfolgend
zu interpretieren, selbst wenn stereochemische Details nicht in
jedem Fall speziell erwähnt sind.
-
Mischungen
der Diastereoisomeren, Mischungen von Racematen und Mischungen von
Doppelbindungsisomeren der Verbindungen der Formel (I) in freier
Form oder in Salzform, die nach dem Verfahren – in Abhängigkeit von den Ausgangsmaterialien
und den gewählten
Verfahrensweisen – oder
auf andere Weise erhältlich
sind, können
in bekannter Weise in die reinen Diastereoisomeren oder Racemate
auf Basis der physikalisch-chemischen
Unterschiede zwischen ihren Bestandteilen, zum Beispiel durch fraktionierte
Kristallisation, Destillation und/oder Chromatographie, getrennt
werden.
-
Mischungen
von Enantiomeren wie Racemate, die in entsprechender Weise erhältlich sind,
können
in die optischen Antipoden nach bekannten Methoden getrennt werden,
zum Beispiel durch Umkristallisation aus einem optischen aktiven
Lösungsmittel,
durch Chromatographie an chiralen Adsorptionsmitteln, zum Beispiel Hochdruckflüssigkeitschromatogra phie
(HPLC) an Acetylcellulose, mit Hilfe geeigneter Mikroorganismen, durch
Spaltung mit spezifischen, immobilisierten Enzymen, über die
Bildung von Einschlussverbindungen, zum Beispiel unter Verwendung
von chiralen Kronenethern, in welchem Fall lediglich ein Enantiomeres
komplexiert wird, oder durch Umwandlung in diastereomere Salze und
Trennen der Mischung der so erhaltenen Diastereomeren, zum Beispiel
auf Basis ihrer verschiedenen Löslichkeiten
mit Hilfe der fraktionierten Kristallisation, in die Diastereomeren,
aus denen das gewünschte
Enantiomere durch Einwirken geeigneter Mittel freigesetzt werden
kann.
-
Außer ihrer
Erzielung durch Trennen der entsprechenden Mischungen der Isomeren
ist es auch möglich,
dass die reinen Diastereomeren und Enantiomeren erfindungsgemäß erhalten
werden mit Hilfe allgemein bekannter Methoden der diastereo-selektiven
oder enantio-selektiven
Synthese, zum Beispiel indem man das erfindungsgemäße Verfahren
unter Verwendung von Ausgangsmaterialien durchführt, die die entsprechend geeignete
Stereochemie besitzen.
-
Weisen
die individuellen Komponenten unterschiedliche biologische Aktivitäten auf,
ist es in jedem Fall vorteilhaft, das biologisch aktivere Isomere,
z.B. Enantiomere oder Diastereomere, oder eine Mischung der Isomeren,
z.B. eine Mischung der Enantiomeren oder eine Mischung der Diastereomeren,
zu isolieren oder zu synthetisieren.
-
Die
Verbindungen der Formel (I) in freier Form oder in Salzform können auch
erhalten werden in Form ihrer Hydrate und/oder können andere Lösungsmittel
einschließen,
zum Beispiel Lösungsmittel,
die für
die Kristallisation der Verbindungen, die in fester Form vorliegen,
verwendet wurden.
-
Die
Erfindung betrifft auch sämtliche
Ausführungsformen
des Verfahrens, dem gemäß eine Verbindung,
die als Ausgangsmaterial oder Zwischenprodukt in irgendeiner Stufe
des Verfahrens erhältlich
ist, als Ausgangspunkt eingesetzt wird und alle oder einige der
verbliebenen Stufen durchgeführt
werden, oder bei denen ein Ausgangsmaterial in Form eines Derivats
oder Salzes und/oder eines Racemats oder einer Antipode verwendet
wird, oder insbesondere unter den Reaktionsbedingungen gebildet
wird.
-
Bei
dem erfindungsgemäßen Verfahren
sind die Ausgangsmaterialien und Zwischenprodukte, die jeweils in
freier Form oder in Salzform verwendet werden, vorzugsweise solche,
die zu Verbindungen der Formel (I), welche zu Beginn als besonders
wertvoll beschrieben wurden oder zu deren Salzen führen.
-
Die
Erfindung betrifft insbesondere das in Beispiel P1 beschriebene
Herstellungsverfahren.
-
Im
Bereich der Schädlingskontrolle
sind die erfindungsgemäßen Verbindungen
der Formel (I), während
sie von warmblütigen
Tieren, Fischen und Pflanzen gut toleriert werden, selbst bei niedrigen
Konzentrationsraten wertvolle präventive
und/oder heilende aktive Bestandteile mit einem sehr vorteilhaften
bioziden Spektrum. Die erfindungsgemäßen Verbindungen sind auch
gegenüber
sämtlichen
oder individuellen Entwicklungsstadien von normalerweise empfindlichen
tierischen Schädlingen
und auch resistenten tierischen Schädlingen, wie Insekten oder
Vertretern der Ordnung Acarina, wirksam. Die Insektizide oder akarizide
Wirkung der erfindungsgemäßen Verbindungen
kann sich direkt äußern, das
heißt
im Tod der Schädlinge,
der unmittelbar oder lediglich nach einiger Zeit, zum Beispiel während der
Verpuppung, erfolgt, oder indirekt, zum Beispiel bei reduzierter
Eiablage und/oder Ausschlüpfrate,
wobei eine gute Aktivität
einer Mortalitätsrate
von zumindest 50 bis 60 % entspricht.
-
Die
vorstehend genannten tierischen Schädlinge umfassen diejenigen,
die in der europäischen
Patentanmeldung EP-A-736 252 erwähnt
werden. Die dort erwähnten
Schädlinge
sind dem gemäß vom Gegenstand der
vorliegenden Erfindung durch Bezugnahme umfasst. Die erfindungsgemäßen Verbindungen
sind insbesondere geeignet bei der Kontrolle von Boophilus microplus,
Nilaparvata lugens und Tetranychus urticase, und vorzugsweise bei
der Kontrolle derartiger Schädlinge
in Pflanzen, Früchten
und Reiskulturen.
-
Mit
den erfindungsgemäßen Verbindungen
ist es möglich,
Schädlinge
des vorstehend erwähnten
Typs zu kontrollieren, das heißt
zu inhibieren oder zu zerstören,
die insbesondere auf Pflanzen, vor allem auf verwertbaren Pflanzen
und Zierpflanzen, in Landwirtschaft, Gartenbau, Forstwirtschaft,
oder auf Teilen von Pflanzen wie Früchten, Blüten, Blättern, Stengeln, Knollen oder
Wurzeln, auftreten, während
die Pflanzenteile, die später
wachsen, ebenfalls gegen solche Schädlinge in gewissem Ausmaß geschützt werden.
-
Zielkulturen
sind insbesondere Getreide wie Weizen, Gerste, Roggen, Hafer, Reis,
Mais und Hirse; Rüben
wie Zuckerrübe
und Futterrübe;
Früchte
wie Kernobst, Steinobst und Weichobst wie Äpfel, Birnen, Pflaumen, Pfirsiche,
Mandeln, Kirschen oder Beeren, z.B. Erdbeeren, Himbeeren oder Brombeeren;
Leguminosenfrüchte
wie Bohnen, Linsen, Erbsen und Sojabohnen; Ölfrüchte wie Raps, Senf, Mohn,
Oliven, Sonnenblumen, Kokosnuß,
Rizinuspflanzen, Kakaobohnen und Erdnüsse; Cucurbitaceen wie Kürbisse,
Gurken und Melonen; Faserpflanzen wie Baumwolle, Flachs, Hanf und
Jute; Zitrusfrüchte
wie Orangen, Zitronen, Grapefruit und Mandarinen; Gemüse wie Spinat,
Kopfsalat, Spargel, Kohl, Möhren,
Zwiebeln, Tomaten, Kartoffeln und Paprika; Lauraceen wie Avocados,
Zimt und Kampfer; und Tabak, Nüsse,
Kaffee, Auberginen, Zuckerrohr, Tee, Pfeffer, Wein, Hopfen, Bananen
und Naturkautschuk sowie auch Zierpflanzen.
-
Weitere
Anwendungsgebiete der Verbindungen gemäß der Erfindung sind der Schutz
von gelagerten Waren und Vorräten
und Materialien und auch der Schutz auf dem Hygienesektor, insbesondere
der Schutz von Haustieren und produktivem Viehbestand gegen Schädlinge der
erwähnten
Art.
-
Die
Erfindung betrifft auch pestizide Zusammensetzungen wie emulgierbare
Konzentrate, Suspensionskonzentrate, direkt sprühbare oder verdünnbare Lösungen,
auftragbare Pasten, verdünnte
Emulsionen, benetzbare Pulver, lösliche
Pulver, dispergierbare Pulver, benetzbare Pulver, Stäube, Granulate
oder Verkapselungen in polymeren Substanzen, die zumindest eine
der erfindungsgemäßen Verbindungen
umfassen, wobei der Formulierungstyp entsprechend den beabsichtigten
Zwecken und den vorherrschenden Umständen gewählt wird.
-
Der
aktive Bestandteil wird in derartigen Zusammensetzungen in reiner
Form eingesetzt, wobei ein fester aktiver Bestandteil zum Beispiel
in einer speziellen Teilchengröße oder
vorzugsweise zusammen mit zumindest einem der in der Formulierungstechnologie üblichen
Adjuvanzien wie Streckmittel, z.B. Lösungsmittel oder feste Träger, oder
oberflächenaktive
Verbindungen (Surfactants) verwendet wird.
-
Geeignete
Formulierungsadjuvantien sind zum Beispiel feste Träger, Lösungsmittel,
Stabilisatoren, Mittel für
die langsame Abgabe, Farbstoffe und gegebenenfalls oberflächenaktive
Substanzen (Surfactants). Geeignete Träger und Adjuvanzien umfassen
in diesem Fall sämtliche
Substanzen, die normalerweise bei Schutzprodukten für Kulturen
eingesetzt werden, insbesondere in Produkten zur Kontrolle von Schnecken bzw.
schneckenartigen Schädlingen.
Geeignete Adjuvanzien wie Lösungsmittel,
feste Träger,
oberflächenaktive
Verbindungen, nicht-ionische oberflächenaktive Mittel, kationische
oberflächenaktive
Mittel, anionische oberflächenaktive
Mittel und weitere Adjuvanzien in den erfindungsgemäß verwendeten
Zusammensetzungen sind zum Beispiel die in EP-A-736 252 beschriebenen;
sie sind durch Bezugnahme vom Gegenstand der vorliegenden Erfindung
umfasst.
-
Die
Zusammensetzungen enthalten gewöhnlich
0,1 bis 99 %, insbesondere 0,1 bis 95 %, des Wirkstoffs, und 1 bis
99,9 %, insbesondere 5 bis 99,9 %, zumindest eines festen oder flüssigen Adjuvanz,
wobei es im Allgemeinen möglich
ist, dass 0 bis 25 %, insbesondere 0,1 bis 20 %, der Zusammensetzung
oberflächenaktive
Mittel sind (die Prozentangaben sind jeweils auf das Gewicht bezogen).
Während
im Handel erhältliche
Produkte bevorzugt als Konzentrate formuliert werden, wird der Endverbraucher
normalerweise verdünnte
Formulierungen verwenden, die beträchtlich geringere Konzentrationen
an aktivem Bestandteil aufweisen. Bevorzugte Formulierungen besitzen
insbesondere die folgende Zusammensetzung (% = Gewichtsprozent): Emulgierbare
Konzentrate:
| Aktiver
Bestandteil: | 1
bis 95 %, vorzugsweise 5 bis 20 % |
| Oberflächenaktives
Mittel: | 1
bis 30 %, vorzugsweise 10 bis 20 % |
| Lösungsmittel: | 5
bis 98 %, vorzugsweise 70 bis 85 % |
Stäube:
| Aktiver
Bestandteil: | 0,1
bis 10, vorzugsweise 0,1 bis 1 % |
| Fester
Träger: | 99,9
bis 90 %, vorzugsweise 99,9 bis 99 % |
Suspensionskonzentrate:
| Aktiver
Bestandteil: | 5
bis 75 %, vorzugsweise 10 bis 50 % |
| Wasser: | 94
bis 24 $, vorzugsweise 88 bis 30 % |
| Oberflächenaktives
Mittel: | 1
bis 40 %, vorzugsweise 2 bis 30 % |
Benetzbare
Pulver:
| Aktiver
Bestandteil: | 0,5
bis 90 %, vorzugsweise 1 bis 80 % |
| Oberflächenaktives
Mittel: | 0,5
bis 20 %, vorzugsweise 1 bis 15 % |
| Fester
Träger: | 5
bis 99 %, vorzugsweise 15 bis 98 % |
Granulate:
| Aktiver
Bestandteil: | 0,5
bis 30 %, vorzugsweise 3 bis 15 % |
| Fester
Träger: | 99,5
bis 70 %, vorzugsweise 97 bis 85 % |
-
Die
Aktivität
der erfindungsgemäßen Zusammensetzungen
kann durch Zusatz von anderen Insektiziden aktiven Bestandteilen
erheblich erweitert und den vorherrschenden Bedingungen angepasst
werden. Beispiele für
geeignete zusätzliche
aktive Bestandteile umfassen zum Beispiel Vertreter der folgenden
Wirkstoffklassen: Organophosphorverbindungen, Nitrophenole und Derivate,
Formamidine, Acylharnstoffe, Carbamate, Pyrethroide, Nitroenamine
und Derivate, Pyrrole, Thioharnstoffe und Derivate, chlorierte Kohlenwasserstoffe
und Bacillus thuringiensis-Präparate.
Die erfindungsgemäßen Zusammensetzungen
können
auch andere feste oder flüssige
Adjuvanzien wie Stabilisatoren, zum Beispiel pflanzliche Öle oder
epoxidierte pflanzliche Öle
(z.B. epoxidiertes Kokosnussöl,
Rapsöl
oder Sojabohnenöl),
Antischaummittel, z.B. Silikonöl,
Konservierungsmittel, Viskositätsregulatoren,
Bindemittel und/oder Klebemittel ebenso wie Düngemittel oder andere aktive
Be standteile zur Erzielung spezieller Wirkungen, z.B. Akarizide,
Bakterizide, Fungizide, Nematozide, Molluszizide oder selektive
Herbizide, umfassen.
-
Die
erfindungsgemäßen Zusammensetzungen
werden in an sich bekannter Weise hergestellt: In Abwesenheit von
Adjuvanzien, zum Beispiel durch Vermahlen, Sieben und/oder Pressen
eines festen Wirkstoffs oder Wirkstoffmischung, zum Beispiel auf
eine spezifische Teilchengröße, und
in Gegenwart von zumindest einem Adjuvanz, zum Beispiel durch inniges
Mischen und/oder Vermahlen des Wirkstoffs oder Wirkstoffmischung
mit dem oder den Adjuvanzien. Die Erfindung bezieht sich auch auf
solche Verfahren zur Herstellung der erfindungsgemäßen Zusammensetzungen
und auf die Verwendung der Verbindungen I bei der Herstellung von
solchen Zusammensetzungen.
-
Die
Erfindung betrifft auch Verfahren für die Anwendung der Zusammensetzungen,
das heißt
Verfahren zur Kontrolle von Schädlingen
des vorstehend genannten Typs wie Sprühen, Atomisieren, Zerstäuben, Beschichten,
Beizen, Streuen oder Gießen,
die in Abhängigkeit
von den beabsichtigten Zielen und den vorherrschenden Umständen gewählt werden,
und auf die Verwendung der Zusammensetzungen bei der Kontrolle von
Schädlingen
des vorstehend genannten Typs. Typische Konzentrationsraten betragen
von 0,1 bis 1000 ppm, vorzugsweise von 0,1 bis 500 ppm, an Wirkstoff.
Die Aufbringungsraten je Hektar betragen im Allgemeinen von 1 bis
2000 g aktiver Bestandteil je Hektar, insbesondere 10 bis 1000 g/ha,
vorzugsweise 20 bis 600 g/ha.
-
Ein
bevorzugtes Verfahren für
das Aufbringen auf den Bereich des Schutzes von Kulturen ist das
Aufbringen auf die Blätter
der Pflanzen (foliare Anwendung), wobei die Häufigkeit und die Aufbringungsrate
von dem Befallsrisiko durch den jeweiligen Schädling abhängen. Der Wirkstoff kann jedoch
auch in die Pflanzen über
das Wurzelsystem (systemische Wirkung) als Ergebnis der Imprägnierung
des Pflanzenstandorts mit einer flüssigen Formulierung oder durch
Einbringen des Wirkstoffs in fester Form, zum Beispiel in Form von
Granulaten, an den Pflanzenstandort, zum Beispiel in den Boden (Bodenanwendung)
eindringen. Im Fall von Reisfeuchtkulturen können solche Granulate in abgemessenen
Mengen auf das unter Wasser stehende Reisfeld aufgebracht werden.
-
Die
erfindungsgemäßen Zusammensetzungen
sind auch geeignet für
den Schutz von Pflanzenvermehrungsgut einschließlich von genetisch modifiziertem
Vermehrungsgut, z.B. Saatgut wie Früchte, Knollen oder Körner, oder
pflanzliches Schnittmaterial gegen tierische Schädlinge. Das Vermehrungsgut
kann mit der Zusammensetzung vor dem Pflanzen behandelt werden,
zum Beispiel kann das Saatgut vor dem Aussäen gebeizt werden. Die erfindungsgemäßen Verbindungen
können
auch aufgebracht werden auf Saatgutkörner (Beschichten) entweder
durch Imprägnieren
der Körner
mit einer flüssigen
Formulierung oder durch deren Beschichtung mit einer festen Formulierung.
Die Zusammensetzung kann auch auf den Bepflanzungsort aufgebracht
werden, wenn das Vermehrungsmaterial gepflanzt wird, zum Beispiel
kann es auf die Saatfurche während
des Säens
aufgebracht werden. Die Erfindung betrifft auch die Methode der
Behandlung von Pflanzenvermehrungsgut und das so behandelte Pflanzenvermehrungsgut.
-
Die
folgenden Beispiele erläutern
die Erfindung, ohne sie zu beschränken. Die Temperaturen sind
in Grad Celsius angegeben, und die Mischungsverhältnisse der Lösungsmittel
in Volumenteile.
-
Herstellungsbeispiele Beispiel
P1: Herstellung von 6,6-Difluorhex-5-en-säure [4-(2-Chlor-1,1,2-trifluorethoxy)-2-methylphenyl)-amid der
Formel
-
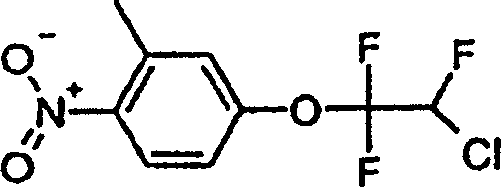
a)
[4-(2-Chlor-1,1,2-trifluorethoxy)-2-methyl-1-nitrobenzol der Formel
-
253,4
g Chlortrifluorethylen werden bei Raumtemperatur in 157,8 g 3-Methyl-4-nitrophenol
und 76,6 g Kaliumhydroxidpulver in 750 ml Dimethylformamid eingebracht,
wobei die Temperatur 60°C
nicht überschreiten
darf. Die Reaktionsmischung wird dann in 4 Liter Eiswasser gegossen
und mit Toluol extrahiert. Nach dem Trocknen der Toluolphase mit
Natriumsulfat wird das Lösungsmittel
durch Verdampfen konzentriert, wobei man 266 g Titelverbindung (Öl) erzielt.
-
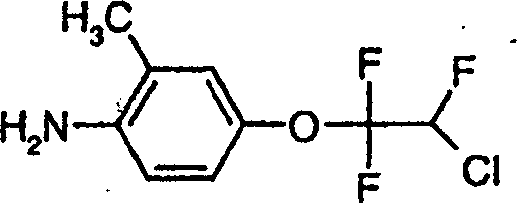
b)
[4-(2-Chlor-1,1,2-trifluorethoxy)-2-methylphenyl]-amin der Formel
-
266,0
g 4-(2-Chlor-1,1,2-trifluorethoxy)-2-methyl-1-nitrobenzol in Dioxan
werden mit Wasserstoff bei Raumtemperatur in Gegenwart von 20 g
Raney-Nickel umgesetzt. Nach Entfernen des Katalysators wird das Lösungsmittel
durch Verdampfen konzentriert und der Rückstand unter Hochvakuum destilliert,
wobei man die Titelverbindung in Form eines Öls erhält.
-
c) 6,6-Difluorhex-5-en-säure [4-(2-Chlor-1,1,2-trifluorethoxy)-2-methylphenyl]-amid:
-
155,4
g 6,6-Difluorhex-5-en-säurechlorid
werden zu 204,5 g [4-(2-Chlor-1,1,2-trifluorethoxy)-2-methylphenyl]-amin,
142,5 ml Triethylamin und 5 g N,N-Dimethylaminopyridin, gerührt bei
Raumtemperatur in 2 Liter Toluol, zugetropft; im Verlauf der Zugabe
wird die Temperatur bei etwa 20°C
durch Kühlen
mit Eis gehalten. Die Reaktionsmischung wird dann über Nacht
bei Raumtemperatur gerührt
und einmal mit Natriumhydrogencarbonatlösung und einmal mit Wasser
gewaschen, und die organische Phase über Natriumsulfat getrocknet. Nach
Einengen des Lösungsmittels
durch Verdampfen wird das Reaktionsprodukt durch Zusatz von Hexan ausgefällt. Nach
Saugfiltration wird der feste braune Filtrationsrückstand
in Ethylacetat aufgenommen und an Silicagel gereinigt (Elutionsmittel:
Ethylacetat/Hexan (1 : 1)). Die Titelverbindung mit einem Schmelzpunkt
von 59–60°C (Verbindung
1.1) wird erhalten.
-
Beispiel
P2: Die weiteren Verbindungen der Tabellen 1 und 2 können analog
zu der vorstehend beschriebenen Weise erhalten werden.
-
Tabelle
1: Verbindungen der Formel
-
Tabelle
2: Verbindungen der Formel
-
-
-
-
Formulierungsbeispiele
(% = Gewichtsprozent) Beispiel
F1: Emulgierbare Konzentrate
-
Das
Vermischen von fein vermahlenem aktiven Bestandteil und Additiven
ergibt ein emulgierbares Konzentrat, welches nach Verdünnen mit
Wasser zu Emulsionen der gewünschten
Konzentration führt.
-
-
-
Das
Vermischen von fein vermahlenem aktiven Bestandteil und Additiven
führt zu
einer Lösung,
die für
die Verwendung in Form von Mikrotröpfchen geeignet ist.
-
-
Der
aktive Bestandteil wird in Methylenchlorid gelöst, die Lösung wird auf die Trägermischung
durch Sprühen
aufgebracht und das Lösungsmittel
wird im Vakuum abgedampft.
-
Biologische
Beispiele
-
Beispiel B1: Ovizide Wirkung
gegenüber
Heliothis virescens
-
Eiablagen
von Heliothis virescens auf Filterpapier werden für kurze
Zeit in eine wässrige
Acetontestlösung
eingetaucht, die 400 ppm der Testverbindung enthält. Nach dem Trocknen der Testlösung werden
die Eier in Petrischalen inkubiert. 6 Tage später wird die Prozentzahl an
Eiern, die zu einem Schlüpfen
geführt
haben, im Vergleich zu unbehandelten Kontrollen bewertet (% Reduktion
der Ausschlüpfrate).
-
Die
Verbindungen der Tabellen zeigen eine gute Aktivität gegenüber Heliothis
virescens in diesem Test. Insbesondere sind die Verbindungen Nr.
1.1, 1.2, 1.3, 1.4, 1.5, 1.6, 1.7, 1.8, 1.9, 1.10, 1.16, 1.17 und
1.18 zu mehr als 80 % wirksam.
-
Beispiel 2: Nilaparvata
lugens
-
Reispflanzen
werden mit einer wässrigen
Emulsionsspraymischung, umfassend 400 ppm der Testverbindung, behandelt.
Nach dem Trocknen des Sprayüberzugs
werden die Reispflanzen mit Nilaparvata lugens-Larven im zweiten
und dritten Stadium besetzt. Die Bewertung erfolgt 21 Tage später. Die
prozentuale Reduktion der Population (% Aktivität) wird durch Vergleich der
Anzahl der überlebenden
Zikaden auf den behandelten Pflanzen mit derjenigen der unbehandelten
Pflanzen ermittelt.
-
Die
Verbindungen der Tabellen zeigen eine gute Wirksamkeit gegenüber Nilaparvata
lugens bei diesem Test. Insbesondere sind die Verbindungen 1.2,
1.4, 1.5, 1.8, 1.9, 1.11, 1.12 und 1.17 zu mehr als 80 % wirksam.
-
Beispiel 3: Wirkung gegenüber Diabrotica
balteata-Larve
-
Maissämlinge werden
mit einer wässrigen
Emulsionsspraymischung, umfassend 400 ppm der Testverbindung, besprüht. Nach
dem Trocknen des Sprayüberzugs
werden die Maissämlinge
mit 10 Diabrotica balteata-Larven im zweiten Stadium besetzt und
hiernach in einen Kunststoffbehälter
gegeben. Die Bewertung erfolgt 6 Tage später. Die prozentuale Reduktion
der Population (% Aktivität)
wird durch Vergleich der Anzahl der toten Larven auf den behandelten
Pflanzen mit derjenigen auf den unbehandelten Pflanzen ermittelt.
-
Die
Verbindungen der Tabellen zeigen eine gute Aktivität gegenüber Diabrotica
balteata in diesem Test. Insbesondere sind die Verbindungen Nr.
1.1 bis 1.18 zu mehr als 80 % wirksam.
-
Beispiel 4: Wirkung gegen
Tetranychus urticae
-
Junge
Bohnenpflanzen werden mit einer Mischpopulation von Tetranychus
urticae besetzt und einen Tag später
mit einer wässrigen
Emulsionsspraymischung, umfassend 400 ppm der Testverbindung, besprüht. Hiernach
werden die Pflanzen 6 Tage bei 25°C
inkubiert und anschließend
bewertet. Die prozentuale Reduktion der Population (% Aktivität) wird
durch Vergleich der Anzahl der getöteten Eier, Larven und ausgewachsenen
Individuen auf den behandelten Pflanzen mit derjenigen auf den unbehandelten
Pflanzen ermittelt.
-
Die
Verbindungen der Tabellen zeigen eine gute Aktivität gegenüber Tetranychus
urticae bei diesem Test. Insbesondere sind die Verbindungen Nr.
1.1 bis 1.13 und 1.17 zu mehr als 80 % wirksam.
-
Beispiel 5: Wirkung gegenüber Spodoptera
littoralis L1
-
Junge
Sojabohnenpflanzen werden mit einer wässrigen Emulsionsspraymischung,
umfassend 400 ppm der Testverbindung, besprüht. Nach dem Trocknen der Spraybeschichtung
werden die Sojabohnenpflanzen mit 10 Raupen von Spodoptera littoralis
im dritten Stadium besetzt und hiernach in einen Kunststoffbehälter gegeben.
Die Bewertung erfolgt 3 Tage später.
Die prozentuale Reduktion der Population und die prozentuale Reduktion
in der Brutschädigung
(% Aktivität)
wird durch Vergleich der Anzahl der toten Raupen und der Fütterungsschädigung an
den behandelten Pflanzen mit derjenigen an den unbehandelten Pflanzen
ermittelt.
-
Die
Verbindungen der Tabellen zeigen eine gute Aktivität gegenüber Spodoptera
littoralis bei diesem Test. Insbesondere sind die Verbindungen 1.1
bis 1.17 zu mehr als 80 % wirksam.
-
Beispiel 6: Wirkung gegenüber Aphis
craccivora
-
Erbsensämlinge werden
einem Befall mit Aphis craccivora unterzogen und anschließend mit
einer Spraymischung, umfassend 400 ppm der Testverbindung, besprüht und bei
20°C inkubiert.
Die Bewertung erfolgt 3 und 6 Tage danach. Die prozentuale Reduktion
in der Population (% Aktivität)
wird durch Vergleich der Anzahl der toten Aphiden auf den behandelten
Pflanzen mit derjenigen auf den unbehandelten Pflanzen ermittelt.
-
Die
Verbindungen der Tabelle 1 zeigen eine gute Aktivität gegenüber Aphis
craccivora in diesem Test. Insbesondere sind die Verbindungen Nr.
1.1, 1.3, 1.4, 1.5, 1.8, 1.9 und 1.17 zu mehr als 80 % wirksam.
-
Beispiel 7: Systemische
Wirkung gegenüber
Myzus persicae
-
Erbsensämlinge werden
einem Befall mit Myzus persicae unterzogen und dann mit ihren Wurzeln
in eine 400 ppm der Testverbindung umfassende Spraymischung gegeben
und bei 20°C
inkubiert. Die Bewertung erfolgt 3 und 6 Tage danach. Die prozentuale
Reduktion der Population (% Aktivität) wird durch Vergleich der
Anzahl der toten Aphiden auf den behandelten Blättern mit derjenigen auf den
unbehandelten Blättern
ermittelt.
-
Die
Verbindungen der Tabellen zeigen eine gute Aktivität gegenüber Myzus
persicae bei diesem Test. Insbesondere ist die Verbindung 1.3 zu
mehr als 80 % wirksam.