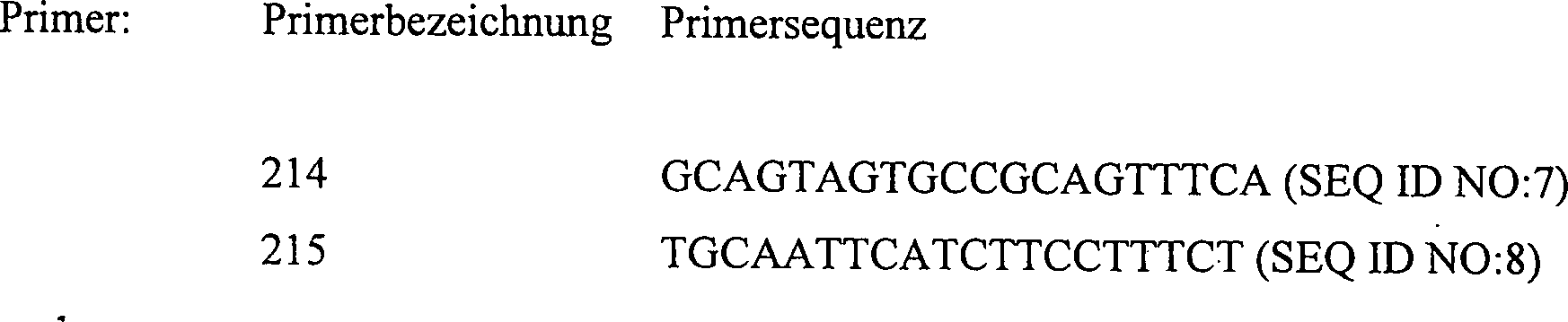
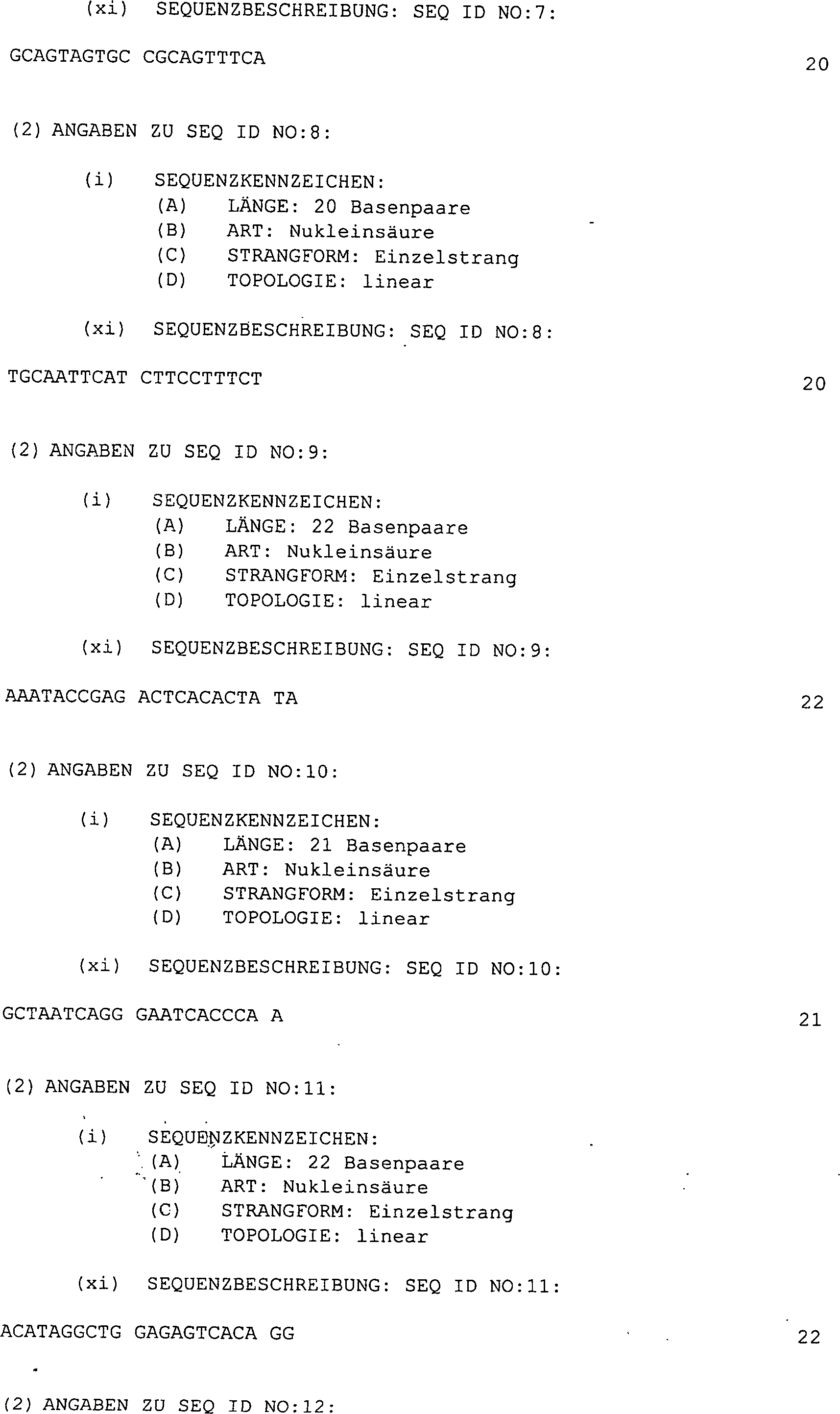
-
GEBIET DER ERFINDUNG
-
Die vorliegende Erfindung betrifft
unsterbliche, maligne, menschliche, adulte epitheliale Prostatazelllinien.
Die Erfindung betrifft auch einzelne Zellklone dieser Linien. Die
Erfindung betrifft weiterhin unsterbliche, maligne, humane, adulte
epitheliale Prostatazelllinien und Klone, die charakterisiert sind
durch Analyse des allelischen Verlusts der Heterozygotie. Im Besonderen
betrifft die Erfindung Paare autologer, normaler und maligner epithelialer
Prostatazelllinien und Klone und ihre Anwendungen in der Forschung.
Die Erfindung betrifft auch die Verwendung der Zellen in der Diagnose
und Behandlung von Prostatakrebs.
-
HINTERGRUND
DER ERFINDUNG
-
Schwierigkeiten in der Etablierung
von humanen Langzeit-Prostatakrebszelllinien in vitro haben Fortschritte
hinsichtlich des Verständnisses
der Tumorentstehung und der Entwicklung neuer Therapien für Prostatakrebs
erschwert. Bislang haben nur vier Prostatakrebszelllinien, die aus
metastatischen Läsionen
initiiert wurden, die Grundlage geschaffen für die Mehrzahl an in vitro-Experimenten,
die die biologischen und molekularen Vorgänge betreffen, die die Entstehung
von Tumoren der Prostata regulieren. Dementsprechend gibt es einen
sehr großen
Bedarf für
die Forschung, die Diagnose und die Therapie für etablierte Langzeit-Prostatakrebszellkulturen.
-
Unter der männlichen Bevölkerung
in den Vereinigten Staaten hat sich Prostatakrebs in den letzten Jahren
als die am häufigsten
diagnostizierte Krebsvariante entwickelt. Allein für dieses Jahr
wird die Zahl der auftretenden Prostatakrebsfälle auf nahezu 300 000, mit über 40 000
Todesfällen,
geschätzt,
was zu einer Krebssterblichkeitsrate führt, die an zweiter Stelle
hinter der Sterblichkeitsrate für
Lungenkrebs liegt (1). Obwohl die durch Prostatakrebs verursachte
Sterblichkeit im Allgemeinen eine Folge der metastatischen Erkrankung
ist, haben nahezu 60% der neu diagnostizierten Patienten örtlich lokalisierbare
Muttergeschwülste.
Chirurgische Maßnahmen
und Strahlentherapie sind oftmals wirkungsvoll in der Behandlung
der örtlich
lokalisierten Erkrankung, aber die ausstrahlende metastatische Erkrankung
ist weitestgehend nicht behandelbar. Trotz erheblicher wissenschaftlicher
Bemühungen
ist immer noch relativ wenig bekannt über die biologischen Vorgänge, die
den Ursprung und den Verlauf von Prostatakrebs verursachen. Die
Entwicklung neuer Strategien für
die Behandlung des Adenokarzinoms der Prostata erfordert ein zunehmendes
Verständnis
der zellulären und
molekularen Vorgänge,
die an der Entstehung von primärem
Prostatakrebs und seiner metastatischen Entwicklung beteiligt sind.
-
Vier humane Prostatakarzinom-Zelllinien
(LNCaP, DU145, PC-3, TSU-Pr1), die auf metastatische Läsionen zurückzuführen sind,
haben die Grundlage geschaffen für
die überwiegende
Anzahl an in vitro-Experimenten betreffend Prostatakrebs. Erhebliche
Fortschritte sind gemacht worden bezüglich der in vitro-Kultivierung
von Kurzzeit-Linien von primären
(nicht metastatischen) Prostatakarzinomen. Diese Fortschritte beinhalteten
die Entwicklung von Kulturmedien und Verbesserungen in der Vorbereitung
frischen Gewebes und epithelialen Prostata-Zellkultur-Techniken
(3, 4). Die Etablierung und das Aufrechterhalten von Langzeithumanen epithelialen
Prostata-Zelllinien von primären
Tumoren konnte in Abwesenheit des Unsterblichmachens von Zellen
in vitro nicht erfolgreich durchgeführt werden. Diesbezüglich gibt
es nur wenige Berichte, die Langzeit-unsterbliche Zelllinien beschreiben
und diese Berichte beschränkten
sich auf normale epitheliale Prostatakulturen (5, 6, 7, 8). Transformation
mit HPV Typ 18-DNA von aus normalem Gewebe und Tumorgewebe gewonnenen
humanen epithelialen Prostatazellen, die infolgedessen unsterblich
wurden, sind von von Weijerman, et al. (Cancer Res., 1994, 54: 5579–5583) beschrieben
worden. Die WO95/29994 betrifft humane Prostatazelllinien, die mit
einem Adenovirus 12-Affenvirus 40 (AD12/SV40)-Hybridvirus unsterblich
gemacht wurden. Die WO95/29990 beschreibt das Unsterblichmachen
von humanen epithelialen Prostatazelllinien mit der DNA des humanen
Papillomavirus (HPV). Folglich war es ein Ziel der vorliegenden
Erfindung, zuverlässige Methoden
zu entwickeln, um fortwährend
proliferierende Prostatakarzinom-Zelllinien aus primären Tumoren zu
generieren.
-
Neben den Schwierigkeiten in der
Etablierung unsterblicher epithelialer Prostata-Zelllinien gibt
es Probleme, kultiviertes Prostatakarzinom von normalen epithelialen
Zellen zu unterscheiden. In der Vergangenheit hat die zytogenetische
Beurteilung von multiplen kurzzeitepithelialen Prostata-Zellkulturen
gezeigt, dass die Mehrzahl aller Linien, die von lokalisierten Prostatakarzinomen
generiert wurden, einen normalen männlichen Karyotyp zeigten (9,
10, 11). Dies, zusammen mit der unauffälligen mikroskopischen Morphologie
von Kurzzeitkulturen, sowie der Mangel an Erfolg mit Xenotransplantation,
hat die genaue Identifizierung und Charakterisierung von humanen
primären
Prostatakarzinom-Zelllinien sehr erschwert.
-
Man nimmt an, dass das Entstehen
von Prostatakrebs das Ergebnis von mehreren genetischen Veränderungen
innerhalb der Zelle darstellt, und auch die Inaktivierung von potentiellen
Tumor-Suppressor-Genen, was sich äußert durch allelische chromosomale
Deletionen, mit einschließt
(Übersicht
in 12). Frühe
Untersuchungen über
chromosomale Deletionen in frischen (nicht in Kultur gehaltenen)
primären
Prostatakarzinom-Proben zeigten allelischen Verlust der Heterozygotie
(LOH) auf Chromosomen 10q und 16q (13, 14, 15). Nachfolgende Studien
zeigten einen bemerkenswert hohen Prozentsatz an allelischem Verlust
auf dem kurzen Arm des Chromosoms 8. Somit wurde Chromosom 8p ein
wahrscheinlicher Kandidat für
die Lokalisierung von mit Prostatakarzinom assoziierte Tumor-Suppressor-Gene
(16, 17, 18). Weiterhin zeigte die kürzlich vorgenommene Untersuchung
von 99 mikro-sezierten Tumoren (19) und 54 mikrosezierten PIN-Läsionen (20)
für LOH
auf dem kurzen Arm des Chromosoms 8p deutliche Hinweise auf die
Inaktivierung von Tumor-Suppressor-Genen (oder eines Tumor-Suppressor-Gens)
auf Chromosom 8p12–21
im Vergleich zu gleichen Normalkontrollen. Dementsprechend repräsentiert
die Untersuchung von LOH innerhalb dieser minimalen Deletionsregion
auf Chromosom 8p12–21
eine potentiell wirksame alternative Methode für die Identifizierung und Charakterisierung
von humanen epithelialen Prostata-Zelllinien, die sich von primären Tumoren
herleiten.
-
Die vorliegende Erfindung betrifft
die erfolgreiche Generierung und einzigartige genetische Charakterisierung
von multiplen unsterblichen humanen Tumorzelllinien, die sich von
primären
Adenokarzinomen der Prostata ableiten.
-
ZUSAMMENFASSUGN
DER ERFINDUNG
-
Die vorliegende Erfindung betrifft
die Isolierung, das Unsterblichmachen und die Charakterisierung von
Langzeit-humanen epithelialen Zelllinien, die sich von kanzerogenem
Prostatagewebe herleiten, sowie die potentiellen Anwendungen dieser
Zelllinien in der Erforschung und zur Therapie von Prostatakrebs.
Insbesondere betrifft die Erfindung die Verwendung epithelialer
Prostata-Zelllinien mit unbeschränktem
Proliferationspotential maligner Proben.
-
Die Zelllinien der vorliegenden Erfindung
sind nützlich
als Modelle in Untersuchungen zur Onkogenese von epithelialen Zellen.
Beispielsweise sind die unsterblich gemachten epithelialen Prostata-Zelllinien
der vorliegenden Erfindung im Besonderen nützlich, um die Tumorentstehung
von Prostatakrebs zu verstehen. Die vorliegende Erfindung betrifft
unsterblich gemachte, gutartige adulte Prostata-Zelllinien für die Verwendung
in Kombination mit unsterblich gemachten, autologen malignen adulten
Prostata-Zelllinien als Reagenzien, um die genetischen Vorgänge zu definieren,
die vom gutartigen zum malignen zellulären Phänotyp führen, und ermöglicht die
Erforschung der Rolle von Heredität in Prostatakrebs.
-
Die vorliegende Erfindung betrifft
eine isolierte, unsterblich gemachte maligne, humane, adulte epitheliale
Prostatazelllinie. Die Erfindung betrifft ferner eine klonierte,
unsterblich gemachte maligne adulte epitheliale Prostata-Zelllinie,
die gekennzeichnet ist durch mindestens einen allelischen Verlust
der Heterozygotie (LOH). Die Erfindung betrifft ferner eine klonierte,
unsterblich gemachte, maligne, humane, adulte, epitheliale Prostata-Zelllinie,
die gekennzeichnet ist durch einen Verlust von einem oder mehreren
Allelen auf Chromosom 8p.
-
Die Zelllinien der Erfindung können verwendet
werden in einer Methode, um ein vorgewähltes Protein herzustellen,
und einer Methode, um Proteine, die epithelialen Zellen entstammen,
herzustellen. Beispielsweise sind die Zelllinien der Erfindung geeignet
zur Isolierung von malignen Prostata-assoziierten Proteinen, die als
Marker für
die Diagnose oder als Ziele für
die Immuntherapie dienen könnten.
In einer Ausführungsform der
Erfindung wird eine Methode für
die Herstellung von Proteinen bereitgestellt, umfassend die Schritte
des In-Kultur-Haltens der epithelialen Zelllinien der vorliegenden
Erfindung und des Sammelns eines oder mehrerer Proteine, die von
den neuen Zellen hergestellt werden. Die Identifizierung der Gene,
die für
diese Proteine kodieren, nach üblichen
Verfahren, gestattet die Konstruktion von rekombinanten Vektoren
zur Herstellung des Proteins oder Teilen davon in großem Maßstab.
-
Die Zelllinien der vorliegenden Erfindung
eignen sich auch zum Testen der Wirkung von Arzneistoffen gegen
Prostatakrebs in vitro, z. B. Chemotherapeutika, biologische „response"
Modifier oder genetische Reagenzien wie Antisense-Oligonukleotide.
-
Die Zelllinien der vorliegenden Erfindung
sind auch geeignet als Ganzzell-Impfstoff, um das Wiederauftreten
von Prostatakrebs zu behandeln oder zu verhindern. Der gesamte Zellimpfstoff
kann verabreicht werden in seiner nativen Form, in Kombination mit
Adjuvanzien oder als durch Transgene modifiziert, welche beispielsweise
für verschiedene
Cytokine, Chemokine, Adhäsionsmoleküle oder
MHC-Moleküle
kodieren.
-
Die Zelllinien der vorliegenden Erfindung
sind auch therapeutisch nützlich
als Stimulanzien, um prestatakrebsreaktive Antikörper oder Immunzellen des peripheren
Blutes oder der Lymphknotenzellen für die Verabreichung an Prostatakrebs-Patienten
zu generieren.
-
Die vorliegende Erfindung betrifft
auch unsterbliche Prostata-Zelllinien für die Anwendung in der molekularen
Klonierung von malignen prostataassoziierten Antigenen, die vom
Immunsystem erkannt werden. Diese Antigene werden dann zu rekombinanten
Vakzinen entwickelt, die für
die Prävention
oder Heilung von Prostatakrebs bestimmt sind.
-
Die vorliegende Erfindung betrifft
weiterhin pharmazeutische Zusammensetzungen, umfassend eine oder
mehrere unsterbliche Zelllinien der Erfindung sowie pharmakologische,
therapeutische und diagnostische Anwendungen für die unsterblichen Zelllinien
und pharmakologischen Zusammensetzungen, die Letztere umfassen.
-
Diese und andere Ziele der Erfindung
ergeben sich aus der Beschreibung und den Zeichnungen.
-
KURZE BESCHREIBUNG
DER ZEICHNUNGEN
-
1A und 1B. Morphologische Eigenschaften und Wachstumseigenschaften
einer unsterblichen epithelialen Prostata-Zelllinie. (1A) Das Unsterblichmachen mit dem Retro-Virus
LXSNI6E6E7 war nötig,
um die fortwährende
Proliferation der Kultur 1510-CP, die sich von einer Prostatakarzinom-Probe
herleitet, zu erreichen. Zellen wurden transduziert (1510-CPTX) oder nicht
transduziert (1510-CPNV) bei Kulturpassage 3, und die Proliferation
in Platten mit 24 Näpfchen
wurde entsprechend bei Passagen 10 und 5 überprüft. (1B) Photomikrograph
von 1510-CPTX nach 10 Kulturpassagen (200 x, Phasenkontrast). Das
Aussehen dieser Kultur ist typisch für andere epitheliale Prostata-Zelllinien,
die aus gutartigen oder bösartigen
Proben generiert worden sind.
-
2.
Expression von PSA durch gutartige und maligne epitheliale Prostatazellen
in situ. Ein in Paraffin eingebetteter Gewebeschnitt aus einer radikalen
Prustatektomie-Probe des Patienten 1510 enthält sowohl Bereiche mit invasivem
Prostatakrebs (einzelner Pfeil) als auch mit normalem prostatischem
Epithel (Doppelpfeile). Dunkle Pigmentierung deutet auf die Bindung
eines anti-PSA-monoklonalen Antikörpers hin. Während PSA-Expression
von normalen prostatischen epithelialen Zellen intensiv und homogen
ist, ist die Expression durch Krebszellen schwach und heterogen.
Dazwischenliegende Stromazellen exprimieren PSA nicht (200 x).
-
3.
Die Genkarte des Chromosoms 8p, die die relative Lage des Mikrosatelliten-Markers
identifiziert, der für
die Analyse des Verlustes der Heterozygotie verwendet wird.
-
4.
PCR-Analyse des Mikrosatelliten D8S136 von frischen und kultivierten
Zellen des Patienten 1542. Spur 1, 1542-NPTX, Passage 26. Spur 2,
frischer mikro-sezierter Tumor #11. Spur 3, nicht-kloniertes 1542-CP3TX, Passage 21. Spuren 4–6, Tumorklone 1542-CP3TX.8.1, 1542-CP3TX.8.3
und 1542-CP3TX.8.4 aus der 8. Passage von
1542-CP3TX.
-
5A–5F. IFN-γ induziert
die erhöhte
Oberflächenexpression
von MHC-Klasse-I- und II-Molekülen auf
1542-CP3TX. Nicht behandelte 1542-CP3TX-Zellen exprimierten eine mäßige Anzahl
an Klasse-I-Molekülen
(Färbung
mit mAb W6/32) (5A), exprimierten jedoch
keine nachweisbaren Mengen an Klasse-II-Molekülen (mAb L243) (5B).
Nach Kontakt mit IFN-γ 500
U/ml für
3 Tage erhöhte
sich die Klasse-I-Expression (5C) und Klasse-II-Expres sion
wurde induziert (5D). MHC-Expression
von autologen EBV-transformierten B-Zellen ist als Vergleich gezeigt
(5E und 5F).
-
DETAILLIERTE BESCHRIEBUNG
DER ERFINDUNG
-
Die vorliegende Erfindung betrifft
die Isolierung, das Unsterblichmachen und die Charakterisierung von
humanen, adulten, epithelialen Prostata-Zelllinien und Klone, hergeleitet
aus einer Anzahl von frischen chirurgischen Proben, einschließlich normaler
Prostata- und Prostatakrebszelllinien, sowie ihre mögliche Anwendbarkeit
in Forschung und Therapie.
-
Die vorliegende Erfindung betrifft
ferner unsterbliche Zelllinien und Klone von Zelllinien und pharmazeutische
Zusammensetzungen, umfassend eine oder mehrere der Zelllinien, sowie
ihre Verwendung als pharmazeutisch aktive Wirkstoffe.
-
Im Besonderen betrifft die vorliegende
Erfindung sowohl Zelllinien von unsterblichen, malignen; adulten
epithelialen Prostata-Zelllinien als auch gleiche autologe unsterbliche
maligne und normale adulte epitheliale Prostata-Zelllinien. Die
unsterblich gemachten epithelialen Prostata-Zelllinien werden hier
bezeichnet als 1510-CP (Karzinoma Prostata), 1510-NP (Normal-Prostata),
1512-CP, 1519-CP, 1532-NP (1532-NP, bezeichnet als 1532-NPTX, hinterlegt
am 2. Februar 1996 bei derATCC, Hinterlegungsnummer CRL-12036), 1532-CP1,
1532-CP2 (1532-CP2, bezeichnet als 1532-CP2TX, hinterlegt am 2.
Februar 1996 bei der ATCC, Hinterlegungsnummer CRL-12038), 1535-NP
(1535-NP, bezeichnet als 1535-NPTX,
hinterlegt am 2. Februar 1996 bei der ATCC, Hinterlegungsnummer
CRL-12039), 1535-SV(Samenblase), 1535-CP1 (1535-CP1, bezeichnet
als 1535-CP1TX, hinterlegt am 2. Februar 1996 bei der ATCC, Hinterlegungsnummer
CRL-12041), 1535-CP2, 1542-NP (1542-NP, bezeichnet als 1542-NPTX, hinterlegt
am 2. Febraur 1996 bei der ATCC, Hinterlegungsnummer CRLK-12040),
1542-SV, 1542-CP1, 1542-CP2 und 1542-CP3 (1542-CP3, bezeichnet als 1542-CP3TX, hinterlegt
am 2. Februar ,1996 bei der ATCC, Hinterlegungsnummer CRL-12037).
-
Die vorliegende Erfindung betrifft
ferner klonierte, unsterblich gemachte maligne epitheliale Prostata-Zelllinien.
Im Weiteren betrifft die Erfindung diese Klone, die dadurch charakterisiert
sind, dass sie mindestens einen allelischen Verlust der Heterozygotie
(LOH) besitzen.
-
In einer Ausführungsform ist die klonierte,
unsterblich gemachte maligne humane adulte epitheliale Prostata-Zelllinie
dadurch charakterisiert, dass sie einen Verlust der Heterozygotie
an einem oder mehreren Genorten auf Chromosom 8p besitzt. In einer
weiteren Ausführungsform
besitzt die klonierte unsterblich gemachte maligne epitheliale Prostata-Zelllinie einen oder
mehrere allelische Verluste der Heterozygotie am Genort 12 bis 21
auf Chromosom 8p.
-
In einer besonderen Ausführungsform
ist die klonierte, unsterblich gemachte maligne humane adulte epitheliale
Prostata-Zelllinie gekennzeichnet durch einen Verlust der unteren
Allele von D8S133, D8S136 und D8S131. Die klonierte, unsterblich
gemachte Zelllinie besitzt die identifizierenden Eigenschaften einer
klonierten unsterblich gemachten malignen humanen adulten epithelialen
Prostata-Zelllinie 1542-CP3TX.8.1, hinterlegt
am 15. Januar 1997 bei der ATCC unter der Hinterlegungsnummer ATCC
CRL-12265 nach den Bestimmung des Budapester Abkommens.
-
In einer weiteren besonderen Ausführungsform
ist die klonierte, unsterblich gemachte maligne humane adulte eptiheliale
Prostata-Zelllinie gekennzeichnet durch einen Verlust der oberen
Allele von D8S133, D8S136 und D8S131. Die klonierte, unsterblich
gemachte Zelllinie hat die identifizierenden Eigenschaften einer
klonierten, unsterblich gemachten malignen humanen adulten epithelialen
Prostata-Zelllinie 1542-CP3TX.8.4, hinterlegt
am 15. Januar 1997 bei der ATCC unter der Hinterlegungsnummer CRL-12264 nach
den Bestimmungen des Budapester Abkommens.
-
In einer weiteren besonderen Ausführungsform
ist die klonierte, unsterblich gemachte maligne humane adulte eptiheliale
Prostata-Zelllinie gekennzeichnet durch einen Verlust der unteren
Allele von SFTP-2, D8S136 und D8S131 und der oberen Allele von D8S133
und NEFL. Die klonierte Zelllinie hat die identifizierenden Eigenschaften
einer klonierten malignen epithelialen Prostata-Zelllinie 1535-CP1TX.14.3,
hinterlegt am 15. Januar 1997 bei der ATCC unter der Hinterlegungsnummer
CRL-12263 nach den Bestimmungen des Budapester Abkommens.
-
Die Zelllinien und klonierten Zellen
der Erfindung sind unsterblich gemacht worden mit dem humanen Papillomavirus-(HPV)-Gen
oder Teilen davon. In einer Ausfühungsform
werden die malignen Zellen unsterblich gemacht mit einem Teil von
HPV, das für
E6 und E7 kodiert und in einem rekombinierten Retrovirus getragen
wird. Kulturen der unsterblich gemachten malignen epithelialen Prostata-Zelllinien
der Erfindung bleiben mit kontinuierlicher Passage für mindestens
1 Jahr stabil und lebensfähig.
-
Die vorliegende Erfindung betrifft
auch ein Verfahren zum Isolieren und Klonieren reiner Zelllinien
von humanen adulten epithelialen Prostata-Zelllinien. Speziell ist
das Verfahren geeignet zur Abtrennung von nicht-epithelialen Zellen
aus den Kulturen, insbesondere zur Abtrennung von Fibroblasten aus
den Kulturen. Das Verfahren umfasst die sorgfältige Dissektion von frischen
primären
Tumoren in Zellen oder Geweben, die morphologisch der normalen Prostata
und der malignen Prostata ähneln.
Um das Wachstum von Fibroblasten zu verhindern, werden Zellen im
Medium mit wenig oder keinem fetalem Rinderserum und/oder Cholera-Toxin kultiviert.
Differenzielle Trypsinierung kann auch dazu verwendet werden, um
Fibroblasten von kultivierten epithelialen Prostatazellen abzutrennen.
Die erhaltenen epithelialen Zelllinien sind > 90%, vorzugsweise 100% rein. Anschließendes Klonieren
der Zelllinie führt
zu 100% reinen epithelialen Zellen.
-
Ein weiterer Aspekt der Erfindung
betrifft ein Verfahren zur Selektion von unsterblich gemachten malignen
epithelialen Prostatazellen. Im Stand der Technik sind Marker, wie
PSA-Expression,
PAP-Expression, PSA-Hochregulation durch Androgen, malignes Wachstum
bei nackten Mäusen
und aneuploiden Karyotypen benutzt worden, um maligne epitheliale
Prostatazellen von normalen epithelialen Prostatazellen zu unterscheiden.
Diese Marker unterscheiden jedoch nicht durchweg maligne epitheliale
Prostatazellen von normalen Zellen. Die Erfindung der Selektion
von unsterblich gemachten malignen epithelialen Prostatazellen auf
der Grundlage des Verlustes der Heterozygotie ermöglicht ein
konstantes, reproduzierbares Selektionsverfahren. Das Verfahren
setzt mindestens einen DNA-Marker ein, der einen spezifischen Allel-Verlust
auf einem bestimmten Chromosom identifiziert. In einer Ausführungsform
des Verfahrens identifiziert der DNA-Marker einen spezifischen Verlust
eines Allels auf Chromosom 8p. Das Verfahren kann verschiedene DNA-Marker
verwenden, um mehr als einen Allel-Verlust auf einem bestimmten
Chromosom oder einen Allel-Verlust auf mehreren Chromosomen zu identifizieren.
-
Bei dem Verfahren zum Nachweis und
zur Identifizierung maligner Zellen werden PCR-Primer spezifisch für einzelne chromosomale Genorte
mit DNA aus einer unsterblich gemachten epithelialen Prostata-Zelllinie
inkubiert und ein PCR-Assay wird durchgeführt. Die amplifizierten Produkte
werden auf LOH an einem oder mehreren Genorten im Vergleich zu einer
DNA-Kontrolle, die aus bekannten normalen Zellen gewonnen wurde,
analysiert. Ein Kriterium für
die Kennzeichnung von LOH ist mindestens 75% Verlust eines Allels
der malignen Zelle im Vergleich zu einer normalen DNA-Kontrolle,
bestimmt durch visuelle Inspektion von Autoradiogrammen. Bekannte
Verfahren, umfassend densitometrische Analyse zum Nachweis von Unterschieden, wobei
die Kriterien für
die Kennzeichnung von LOH mindestens 30% Verlust eines Allels der
malignen Zelle darstellen.
-
Die unsterblich gemachten malignen
epithelialen Prostata-Zelllinien und Klone der Erfindung eignen sich
zur Identifizierung von neuen Genen, die einzigartig für maligne
epitheliale Prostatazellen sind oder die von solchen Zellen überexprimiert
werden und die nicht in normalen epithelialen Prostatazellen gefunden
werden oder in diesen aktiv sind. Die neuen Gene umfassen, sind
aber nicht beschränkt
auf transformierende Gene, Wachstumsfaktor-Gene, Onkogene, Tumor-Suppressor-Gene.
Diese Gene können
identifiziert werden unter Verwendung bekannter Verfahren der RNA
Subtraction Analysis, wie beispielsweise Standard Subtractive Hybridization,
Differential Display oder Representative Differential Analysis (RDA)
(51, 52). Die neuen Gene werden nach bekannten Standardmethoden
der Molekularbiologie kloniert. Die Identifizierung von neuen Genen,
die mit der Entwicklung von Prostatakrebs assoziiert sind, erlaubt
die Entwicklung von Antisense-Oligonukleotiden, die in der Hemmung
oder Prävention
von Prostatakrebs geeignet sind (42), und die Entwicklung von rekombinanten
DNA-Vakzinen.
-
Die Zelllinien der Erfindung sind
nützlich
als Modell zum Studium epithelialer Zellonkogenese. Beispielsweise
sind die epithelialen Prostata-Zelllinien der Erfindung besonders
nützlich,
um die Tumorgenese von Prostatakrebs zu verstehen. Die Erfindung
betrifft eine gutartige Prostata-Zelllinie für die Verwendung in Kombination
mit einer malignen Prostata-Zelllinie, die aus demselben Patienten
stammt, als Reagenzien, um die genetischen Vorgänge zu definieren, die vom
gutartigen zum malignen zellulären
Phänotyp
führen,
und um die Rolle der Heredität
bei Prostatakrebs zu untersuchen.
-
Die Zelllinien der Erfindung eignen
sich für
ein Verfahren, um ein vorgewähltes
Protein oder Teile davon herzustellen, und für ein Verfahren, um Proteine
maligner, prostatischer Zellen epithelialen Ursprungs herzustellen.
Beispielsweise sind die Zelllinien der Erfindung geeignet zum Isolieren
von Prostatakrebs-assoziierten Proteinen, die als Marker zur Diagnose
oder als Ziele für
Immuntherapie dienen können.
In einer Ausführungsform
der Erfindung wird ein Verfahren für die Herstellung von Protein
bereitgestellt, umfassend die Schritte des Kultivierens der epithelialen
Zelllinien der Erfindung und des Isolierens eines oder mehrerer
Proteine, die von diesen Zellen gebildet werden. Die übliche Identifizierung
der für
diese Proteine kodierenden Gene ermöglicht die Konstruktion von
rekombinanten Vektoren und Wirtszellen zur wirksamen Herstellung
des Proteins oder Teilen davon in großem Maßstab.
-
Die vorliegende Erfindung umfasst
ein neues rekombinantes Virus, das ein Prostatakrebsassoziiertes Protein
oder einen Teil davon exprimiert. Das rekombinante Virus kann auch
ein oder mehrere ko-stimulatorische Moleküle exprimieren, Cytokine, MHC-Moleküle, Chemokine
und dergleichen, um die Immunantwort auf das Prostatakrebs-assoziierte
Protein oder Teile davon zu erhöhen.
Verfahren zur Konstruktion und zur Expression exogener Genprodukte
von rekombinanten Virusvektoren sind bekannt (43–50).
-
Die vorliegende Erfindung umfasst
DNA oder RNA, isoliert aus unsterblich gemachten humanen malignen
adulten epithelialen Prostatazellen, die LOH aufweisen, wie in den
Ansprüchen
1–15 definiert.
Die isolierte DNA oder RNA kann zum Nachweis und zur Diagnose von
Prostatakrebs oder seiner Vorform in einem Patienten verwendet werden.
Die DNA oder RNA kann als Sondenmoleküle und/oder Primer in üblichen
Verfahren der Molekularbiologie wie Southern-Blot-Analyse, Northern-Blot-Analyse,
PCR, RT-PCR und dergleichen zum Nachweis und zur Diagnose von Prostatakrebs
oder seiner Vorform verwendet werden.
-
Nackte DNA, die für Prostatakrebs-Antigen oder
Epitope davon kodiert, kann zur aktiven Immuntherapie bei Prostatakrebs
verwendet werden. Bekannte Methoden zur intramuskulären oder
subkutanen Injektion von nackter DNA oder an Lipide verknüpfter nackter
DNA können
benutzt werden, um sowohl eine zelluläre als auch eine humorale Immunantwort
auf das kodierte Prostatakrebs-Antigen oder seiner Epitope hervorzurufen
(33–41).
-
Die Zelllinien der Erfindung eignen
sich auch zum Nachweis der Wirkungen von Therapeutika gegen Prostatakrebs
in vivo oder in vitro. Beispielsweise können chemotherapeutische Medikamente,
biologische Response Modifier oder genetische Reagenzien wie Antisense-Oligonukleotide
auf ihre Wirksamkeit hin gescreent werden. Der Wirkstoff wird in
Gegenwart der Zellen in vivo oder in vitro getestet. Nach einer
geeigneten Anwendungsdauer wird die Wirkung der Chemikalie oder
des Agens auf die Zelle durch bekannte Verfahren wie Cytotoxizitäts-Analyse,
Proteininhibitions-Analysen, Inhibition von Tumorwachstum und Ähnlichem
geprüft.
Der Wirkstoff, der eine vitale Stoffwechselfunktion inhibiert oder
die Zellen tötet,
wird als wirksames Mittel angesehen.
-
Die Zelllinien und Klone der Erfindung
sind auch geeignet als Ganzzell-Vakzin zur Behandlung oder zum Verhindern
des Wiederauftretens von Prostatakrebs. Dieses Vakzin kann in seiner
nativen Form verabreicht werden, in Kombination mit Adjuvantien,
oder modifiziert durch Transgene, die beispielsweise verschiedene
Cytokine, Chemokine, ko-stimulatorische Moleküle, Adhäsionsmoleküle, MHC-Moleküle und dergleichen kodieren.
Solche Modifikationen können
zur Steigerung des immuntherapeutischen Effekts des Immunogens und
des Vakzins der Erfindung verwendet werden.
-
Die Gene können nach bekannten Verfahren
wie Elektroporation, Polybren-induzierte DNA-Transfektion, über Plasmide, über rekombinante
Viren und dergleichen in die unsterblich gemachten humanen malignen
epithelialen Prostata-Zelllinien und Klone eingebracht werden. Ein
rekombinantes Virus, das ein oder mehrere interessierende Gene enthält, kann
gemäß der WO94/16716,
WO96/11279 und WO96/10419 konstruiert werden.
-
Ko-stimulatorische Moleküle, die
in der Erfindung eingesetzt werden können, beinhalten, sind aber nicht
beschränkt
auf B7-1, B7-2, B7-3, ICAM-1, LFA-1, LFA-3, CD72 und dergleichen.
-
Cytokine, die in der Erfindung benutzt
werden können,
beinhalten, sind aber nicht beschränkt auf IL-2; GM-CSF, TNFα, IFN-γ, IL-12,
IL-4, IL-7 und dergleichen.
-
MHC-Moleküle beinhalten, sind aber nicht
beschränkt
auf Klasse-I- oder Klasse-II-Moleküle und dergleichen. Nichtklassische
MHC-Moleküle
oder MHC-ähnliche
Moleküle
wie CD1 können
ebenfalls verwendet werden.
-
Chemokine beinhalten, sind aber nicht
beschränkt
auf RANTES, IL-8, MIP1-alpha, MIP1-beta und dergleichen.
-
Die Zelllinien der Erfindung sind
auch therapeutisch geeignet als Stimulanzien zur Generierung von Prostatakrebs-reaktiven
Antikörpern
oder Immunzellen des peripheren Blutes oder Lymphknotenzellen für die Verabreichung
an Prostatakrebs-Patienten.
-
Die Erfindung betrifft ferner unsterbliche
Prostata-Zelllinien für
die Verwendung in der molekularen Klonierung von Prostatakrebs-assoziierten
Antigenen, die vom Immunsystem erkannt werden. Diese Antigene werden
dann zu rekombinanten Vakzinen entwickelt, welche auf die Prävention
oder Heilung von Prostatakrebs gerichtet sind.
-
Die Erfindung betrifft ferner pharmazeutische
Zusammensetzungen, die die unsterblichen Zelllinien der Erfindung
enthalten, sowie die Verwendung dieser Zelllinien und pharmakologischen
Zusammensetzungen, die diese Zelllinien umfassen, für pharmakologische,
therapeutische und diagnostische Anwendungen.
-
Pharmazeutische Zusammensetzungen,
Vakzine und Immunogene können
nach üblichen
Methoden hergestellt werden. Solche Zusammensetzungen können einem
Patienten in an sich bekannter Weise unter Berücksichtigung des Alters, des
Körpergewichts
und des Zustand des einzelnen Patienten und unter Berücksichtigung
des Verabreichungsweges verabreicht werden.
-
Das Immunisierungsprotokoll für die Zusammensetzungen,
Vakzine und Immunogene kann parenteral (intravenös, intraperitoneal, intradermal,
intramuskulär
oder subkutan) sein. Die Zusammensetzung, das Vakzin und das Immunogen
können
auch direkt in eine Tumormasse appliziert werden. Überdies
können
die Zusammensetzungen in vitro verwendet werden; um Antigen-spezifische
cytotoxische T-Lymphozyten zu stimulieren, welche anschließend dem
Patienten wieder zugeführt
werden.
-
Die Zusammensetzungen, Vakzine und
Immunogene können
ko-appliziert werden oder nacheinander appliziert werden mit Adjuvantien
wie Alaun, inkomplettem Freund'schem Adjuvans und dergleichen, Cytokinen,
Ko-Stimulanzien, Chemokinen, Adhäsionsmolekülen, MHC-Molekülen und
dergleichen. Zusätzlich
können
die Zusammensetzungen, Vakzine und Immunogene ko-appliziert oder
nacheinander appliziert werden mit anti-neoplastischen, Anti-Tumor-, Anti-Krebs-Agenzien
und/oder mit Agenzien, die die Nebenwirkungen von antineoplastischen,
Anti-Tumor- oder Anti-Krebs-Agenzien reduzieren oder mildern.
-
Beispiele von Vakzinen oder Zusammensetzungen
der Erfindung beinhalten flüssige
Präparate
wie Suspension, Sirupe, Elixiere und Präparate für die parenterale, subkutane,
intradermale, intramuskuläre
oder intravenöse
Gabe. Die pharmazeutischen Zusammensetzungen können im Gemisch mit einem geeigneten Träger, Verdünnungsmittel
oder Hilfsstoff wie steriles Wasser, physiologische Kochsalzlösung, Glukose
und dergleichen vorliegen.
-
Die Wirksamkeit der Behandlung lässt sich
durch Bildung von Antikörpern
oder Immunzellen feststellen, die die maligne Zelle oder das Prostatakrebs-Peptid
oder einen Teil davon erkennen, ferner durch Bestimmung der Antigen-spezifischen
Cytotoxizität,
der spezifischen Cytokin-Produktion oder der Tumorregression.
-
Die unsterblich gemachten humanen
adulten epithelialen Prostatazellen können in Form eines Kits bereit
gestellt werden. Der Kit kann eine oder mehrere unsterblich gemachte
humane adulte epitheliale Prostatazelle oder Teile davon enthalten.
Teile enthalten lysierte Zellen, Zellfragmente, intrazellulare Bestandteile,
extrazellulare Komponenten, Protein, DNA, RNA, Glykolipide und dergleichen.
Kits können
auch autologe unsterblich gemachte humane adulte maligne epitheliale
Prostatazellen oder Teile davon in Kombination mit autologen unsterblich
gemachten humanen adulten normalen epithelialen Prostatazellen oder
Teile davon enthalten. In einer Ausführungsform umfasst der Kit
die unsterblich gemachte humane adulte normale epitheliale Zelllinie
1532-NP in Kombination mit der autologen unsterblich gemachten humanen
adulten malignen Zelllinie 1532-CP1 und/oder 1532-CP2. In einer
Ausfürungsform
umfasst der Kit die unsterblich gemachte humane adulte normale epitheliale
Zelllinie 1535-NP
in Kombination mit der autologen unsterblich gemachten humanen adulten
malignen Zelllinie 1535-CP1, 1535-CP2 und/oder 1535-CP1TX.14.3.
In einer weiteren Ausführungsform
umfasst der Kit die unsterblich gemachte humane adulte normale epitheliale
Zelllinie 1542-NP in Kombination mit einer oder mehreren der autologen
unsterblich gemachten humanen adulten malignen Zelllinien 1542-CP1,
1542-CP2, 1542-CP3,
1542-CP3TX.8.1 und 1542-CP3TX.8.4.
Der Kit kann auch einen gesonderten Behälter umfassen, der einen geeigneten
Träger,
ein Verdünnungsmittel
oder einen Hilfsstoff enthält.
Der Kit kann auch ein Adjuvans, ein Cytogen, ein ko-stimulatorisches
Molekül,
ein Chemokin, ein Adhäsionsmolekül, ein MHC-Molekül, ein anti-neoplastisches
Mittel, ein Anti-Tumor-Mittel, Immunoassay-Reagenzien, PCR-Reagenzien,
radioaktive Marker und dergleichen enthalten. Zusätzlich kann
der Kit Anweisungen für
das Mischen oder das Kombinieren der Bestandteile und/oder für die Verabreichung
enthalten.
-
Der Ausdruck „unsterblich gemacht" bedeutet
hier, dass die Zelllinie fortwährend
wächst
ohne zu altern, wenn sie in vitro in einem geeigneten Wachstumsmedium
kultiviert wird.
-
Die Zelllinien der Erfindung eignen
sich für
eine Vielzahl von therapeutischen und diagnostischen Zwecken. Diese
werden nachstehend weiter beschrieben.
-
Beispiel I
-
(1) Charakteristische
Merkmale von Patienten, von denen in Kultur gehaltene Zelllinien
erhalten wurden.
-
Epitheliale Prostata-Zelllinien wurden
aus Radikal-Prostatektomieproben entnommen, die von 6 Patienten
mit mittel- bis hochgradigen Tumoren stammten (Gleason Grad 6–8) (siehe
Tabelle 1). Zellkulturen wurden generiert durch mechanisches Zertrümmern oder
enzymatische Verdauung von primären
Tumorknötchen, die
aus frischen Radikal-Prostatektomieproben herausgeschnitten wurden;
vgl. Beispiel II für
eine detaillierte Beschreibung der Verfahren der Kultivierung.
-
Tabelle
1: Prostatakrebs-Patienten: Klinische Informationen
-
(2) Pathologische Analyse
von Gewebeproben
-
Pathologische Analyse von frischen
Gewebeproben, die verwendet wurden, um Prostata-Zelllinien zu erzeugen, zeigten, dass
einige Karzinomproben reines Tumorgewebe waren, während andere
aus einer Mischung von gutartigen und malignen Zellen bestanden.
Siehe Tabelle 2: Eine vorbereitende Identifizierung der Proben wurde
mittels „gross
examination" von einem erfahrenen Pathologen durchgeführt. Mikroskopische Identifizierung
wurde von einem erfahrenen Pathologen durchgeführt. BPH = gutartige prostatische
Hypertrophie. PIN = prostatische intraepitheliale Neoplasie. a = ein Gemisch von Zelltypen. b =
80% der Proben bestanden aus gutartigem fibromuskulärem Stroma. c = ein mikroskopischer Fokus des festgestellten
Krebses.
-
Tabelle
2: Pathologische Analyse von frischen Prostataproben
-
(3) Bestätigung des
epithelialen Ursprungs von Prostata-abgeleiteten Zelllinien
-
Der epitheliale Ursprung von Prostata-abgeleiteteten
Zelllinien wurde bestätigt
mittels Cytokeratinfärbung.
Cytokeratine sowohl mit hohem als auch niedrigem Molekulargewicht
wurden in allen 16 Zelllinien exprimiert, die aus 6 Radikalprostatektomieproben
(normale Prostata, Prostatakrebs, normale Samenblase) generiert
wurden. Mit Ausnahme einer frühen
Passage von 1519-CP exprimierten keine der Prostata-abgeleiteten
Zelllinien PSA oder PAP. Siehe Tabelle 3: F = Fibroblasten, NP =
normale Prostata, SV = Samenblase, CP = Prostatakarzinom. a = enthält
sowohl hoch- als auch niedermolekulare Keratine. n =
PSA- und PAP-Expression wurde bei Kulturpassage Nr. 5 festgestellt,
trat aber im weiteren Verlauf der Passage in vitro nicht mehr auf. c = die beobachtete Färbung wurde als möglicher
Hintergrund festgestellt.
-
Tabelle
3: Immunzytochemische Analyse von unsterblich gemachten epithelialen
Prostata-Zelllinien
-
(4) Zelloberflächenphenotypisierung
-
Zelloberflächenphenotypisierung wird beschrieben
in Beispiel II, Tabelle 6.
-
(5) Genetische Analyse
von epithelialen Prostata-Zelllinien
-
Allelischer Verlust auf Chromosom
8 ist in Zusammenhang gebracht worden mit PIN und invasivem Prostatakrebs
und repräsentiert
somit ein alternatives Verfahren, um epitheliale Zelllinien, die
von Prostatakrebsproben abgeleitet sind, zu charakterisieren. Die
Untersuchung des allelischen Verlustes an 10 verschiedenen Genorten
auf Chromosom 8p unter Verwendung der PCR (Polymerase-Kettenreaktion)
zeigte einen Verlust der Heterozygotie (LOH) an einem Genort in
1 von 9 untersuchten nicht-klonierten Krebs-abgeleiteten Zelllinien,
was vermuten lasst, dass dies eine etablierte Langzeit-primäre Prostata-Zelllinie
ist. Obwohl äußerst genau
darauf geachtet wurde, nur die reinst möglichen Tumorfragmente für die in
vitro-Kultivierung zu sezieren, zeigte die nachfolgende mikroskopische
Auswertung der ursprünglichen
Tumorproben eine veränderliche Mischung
von gutartigem Epithel BPH, PIN und/oder invasivem Tumor (siehe
Tabelle 2), das LOH maskieren könnte,
was die Epithelzellklonierung für
eine genaue Charakterisierung erfordert. Eine definitive genetische Charakterisierung
der epithelialen Prostatazellkulturen, die hier beschrieben sind,
sowie die Einzelzellklonierung der Zelllinien werden nachstehend
beschrieben.
-
Beispiel II
-
Einzelzellklonierung und
Charakterisierung von unsterblich gemachten malignen epithelialen
Prostatazellen
-
Material und Methoden
-
Erzeugung von primären Zellkulturen.
Gewebeproben für
die Erzeugung von Zelllinien wurden aus sechs Patienten entnommen,
die Radikalprostatektomie am NCI zur Behandlung von mittel- bis
hochgradig lokalisiertem Prostatakrebs (Gleason-Grad 6–8, Tumorphasen
T2C bis T3C) unterzogen wurden. Frische Prostatektomieproben, die
direkt aus dem Operationssaal erhalten wurden, wurden unter sterilen
Bedingungen von einem Pathologen seziert.
-
Gewebe, das bei "gross inspection"
als normale Prostata, Prostatakrebs oder normale Samenblasengewebe
bezeichnet wurde, wurde gesondert zur Erzeugung von Zellkulturen
jeweils zerkleinert. Kulturen wurden angelegt durch mechanisches
Zertrümmern
(Fragmente mit einem Durchmesser < 1
cm) oder durch enzymatischen Verdau (Fragmente mit einem Durchmesser > 1 cm) (21). Proben
von den Patienten 1510 und 1512 wurden durch enzymatischen Verdau
vorbereitet, während
nachfolgende Kulturen durch mechanisches Zertrümmern erzeugt wurden. Für den enzymatischen
Verdau wurde das zerkleinerte Gewebe in 100 ml Verdaumedium suspendiert
und auf einem Rührtisch über Nacht
bei Raumtemperatur stehen gelassen. Die erhaltene Einzelzellsuspension
wurde dann mit sterilem PBS gewaschen, in Wachstumsmedium resuspendiert
(siehe unten) und in Platten mit 6 Näpfchen gegeben, die mit Typ-I-Rattenschwanz-Collagen
(Collaborative Biomedical Products, Bedford, MA) beschichtet waren.
Für die
mechanische Zertrümmerung
der Proben wurden Gewebefragmente in einem kleinen Volumen von Wachstumsmedium
vorsichtig in 2–2
mm große
quadratische Stücke
zerwürfelt.
Die erhaltene Gewebe- und Zellaufschwämmung wurde in Platten mit
6 Näpfchen
gegeben. Alle Kulturen wurden in einem Volumen von 1 ml pro Näpfchen angesetzt
und bei 37°C
und 5% CO2 inkubiert. Sie wurden für 2–3 Tage
in Ruhe stehen gelassen, um es den lebenden Zellen und den Gewebestücken zu
ermöglichen,
sich niederzusetzen und sich an den Napfwandungen anzuheften. Anschließend wurden nicht
angeheftete Zelltrümmer
vorsichtig abgesaugt und die Näpfchen
mit 3–5
ml frischem Wachstumsmedium gespült.
Kulturmedium wurde routinemäßig alle
2–4 Tage
ausgetauscht und proliferierende adhärente Zellen wurden passagiert
nach Ablösung
mit Trypsin. Etablierte wachsende Kulturen wurden in Gewebekulturflaschen
(Falcon, Becton Dickinson, Lincoln Park, NJ) gehalten. Wachstumsmedium
für Prostata-
und Samenblasen-Epithelial-Zelllinien bestanden aus keratinocytenserumfreiem
Medium (Keratinocyte-SFM, GIBCO-BRL, Grand Island, NY), das 25 μg/ml Rinderhypophysenextrakt,
5 ng/ml epidermalen Wachstumsfaktor, 2 mM L-Glutamin, 10 mM HEPES-Puffer,
Antibiotika und 5% Hitze-inaktiviertes fetales Rinderserum (FBS)
(Biofluids, Rockville, MD) enthielt. Für das Anlegen von epithelialen
Kulturen aus frischen Gewebeproben wurde die Konzentration an fetalem
Rinderserum auf 1– 2%
reduziert und/oder Choleratoxin (Sigma, St. Louis, MO) in einer
Menge von 10–20
ng/ml wurde als Schutz gegen das Überwachsen von Fibroblast-Verunreinigungen hinzugefügt. In dem
seltenen Fall, dass Fibroblasten in epithelialen Zellkulturen weiterbestehen,
war die differentielle Trypsinierung (Inkubation für 1–2 min bei
37°C, gefolgt
vom Auswaschen losgelöster
Fibroblasten, um die adhärenteren
epithelialen Zellen zu behalten) äußerst erfolgreich in der Erzeugung
reiner epithelialer Zellkulturen.
-
Autologe Fibroblast-Zelllinien wurden
aus mechanisch zerkleinerten gutartigem stromalem Prostatagewebe
erzeugt und in RPMI 1640-Medium kultiviert, das 10% Hitze-inaktiviertes
FBS enthielt. Die mit autologem Epstein-Barr-Virus transformierten
B-Zelllinien wurden unter Verwendung von StandardMethoden erzeugt und
in RPMI 1640 mit 10% fetalem Rinderserum kultiviert.
-
Metastatische Prostatakrebs-Zellkulturen.
Die adhärenten
Zelllinien LNCaP, DU145, PC-3
(ATCC, CRL1740, HTB 81 bzw. CRL1435) und TSU-Prl (erhalten von Dr.
William Isaacs, John Hopkins University, Baltimore, MD; wie beschrieben
in Iizumi et al., J. Urol. 137: 1304– 1306, 1987) wurden in RPMI
1640-Medium, supplementiert mit 10% fetalem Rinderserum, gehalten.
-
Das Unsterblichmachen von primären Zellkulturen.
Das Unsterblichmachen von Zellkulturen wurde erreicht durch Transduktion
von aktiv proliferierenden Zellen mit einem rekombinanten Retrovirus,
das für
die transformierenden Proteine E6 und E7 des humanen Papillomavirus
Serotyp 16 (HPV 16) und den eukaryotischen Selektionsmarker Neomycin
Phosphotransferase, bezeichnet als LXSN16E6E7 (erhalten von Dr.
Denise Galloway, Fred Hutchinson Cancer ResearchCenter, Seattle,
WA) (22), kodiert. Als Vorbereitung für das Unsterblichmachen wurden
kurzeit-epitheliale Zellkulturen (Kulturpassagen 1–3) 1 :
2 geteilt und für
mindestens 48 Std. am Boden der Platten mit 6 Näpfchen anheften gelassen, wobei
50–60%
konfluente Kulturen erhalten wurden. Zur Transduktion mit dem LXSN16E6E7
Retrovirus wurde das Kulturmedium ersetzt durch den von der Retrovirus-Produktionslinie
PA317 gesammelten Kulturüberstand
(22) in Anwesenheit von 10 μg/ml DEAE-Dextran
(Sigma) für
eine Zeitdauer von 24 Std.
-
Einzelzellklonierung der unsterblich
gemachten Zellkulturen. Klonale Populationen von unsterblichen epithelialen
Zellkulturen wurden regeneriert für die Verwendung in Studien
zur Charakterisierung von LOH. Kurz gesagt wurden konfluente Zellkulturen
mit Trypsin geerntet, gewaschen und gezählt. Zellen wurden in Keratinocyt-Wachstumsmedium
(siehe oben) seriell verdünnt
auf eine Konzentration von 2–5
Zellen pro ml und in 8–10
einzelne Flachboden-Mikrokulturplatten mit 96 Näpfchen in einer Menge von 200 μl/Näpfchen (≤ 1 Zelle/Näpfchen)
verteilt. Näpfchen
mit konfluentem Inhalt, die von Verdünnungen < 1 Zelle/Näpfchen herrührten, wurden auf Platten mit
24 Näpfchen
expandiert, um zu gewährleisten,
dass genug Zellen für
DNA-Extraktion und Cryo-Konservierung zur Verfügung standen.
-
Immunzytochemische Analyse. Für die immunzytochemische
Untersuchungen von unsterblich gemachten kultivierten Zellen wurden
Zellen mit Trypsin geerntet, gewaschen und pellettiert. Zellpellets
wurden anschließend
in 10% gepuffertem Formalin fixiert und in Paraffin eingebettet.
Frische Gewebeschnitte von Prostataproben wurden ebenfalls in Formalin
fixiert und in Paraffin eingebettet. Fünf Mikronschnitte wurden auf frischen
Tumorproben und kultivierten Zellblöcken und auf geladenen Objektträgern angebracht
(Fisher Scientific, Pittsburgh, PA) (23). Immunzytochemie wurde
durchgeführt
unter Verwendung der Avidin-Biotin-Peroxidase-Komplexmethode
und der folgenden primären
Antikörper:
Monoklonales anti-humanes prostataspezifisches Antigen (PSA) (Dako
Corp. Carpenteria, CA); polyklonale anti-humane prostatische saure
Phosphatase (PAP) (Dako Corp., Carpenteria, CA); antihumanes Cytokeratin
CAM 5.2 (Becton-Dickinson, San Jose, CA); und anti-humanes Cytokeratin
AE1/AE3 (Boehringer-Manheim, Indianapolis, IN). Zelllinien und Tumorgewebeschnitte
wurden beurteilt auf der Grundlage des Prozentsatzes an eingefärbten Zellen
(< 25%, 25–50%, 50–75% oder > 75%) sowie der Intensität der Färbung (1+
bis 4+).
-
Fließzytometrie. Für zukünftige Studien
und weitere Charakterisierung war es von Interesse, das Ausmaß der Expression
von Oberflächenmolekülen zu ermitteln,
die immunologische Bedeutung für
die Langzeit-epithelialen Prostata-Zelllinien besitzen. Unsterblich
gemachte Zellkulturen wurden geerntet und mit den folgenden monoklonalen
Antikörpern
gefärbt:
CD54 (Anti-ICAM-1), CD80 (Anti-B7.1), CD86 (Anti-B7.2) (Becton-Dickinson),
W6/32 (Anti-HLA-A, B, C) und L243 (Anti-HLA-DR) (ATCC, Rockville,
MD) (21). Um die Oberflächenexpression
von MHC-Molekülen
zu erhöhen,
wurden Zellen in Anwesenheit von IFN-γ 500
U/ml für
72 Std. vor der fließzytrometrischen
Analyse kultiviert.
-
Mikrodissektion und DNA-Extraktion.
Mikrodissektion ausgewählter
Foci normaler epithelialer Prostatazellen oder invasiver Tumorzellen
aus formalinfixierten, in Paraffin eingebetteten Gewebeproben, wurden
unter unmittelbaren lichtmikroskopischen Bedingungen, wie vorher
beschreiben (24, 25, 26) durchgeführt. Kurz gesagt wurden nicht
gefärbte
formalinfixierte, in Paraffin eingebettete 5 Mikron dicke, histologische
Gewebeschnitte auf Glasobjektträgern
vorbereitet und zweimal mit Xylol deparaffiniert, zweimal mit 95%igem
Ethanol gewaschen, mit Eosin gefärbt
und luftgetrocknet. Die Nachbarsektion wurde mit Hematoxylin und
Eosin gefärbt.
Bestimmte interessierende Zellen wurden von den mit Eosin gefärbten Objektträgern ausgewählt und mittels
einer modifizierten Wegwerf-Injektionsspritze
mit einer Nadelgröße von 30
Gauge mikroseziert. DNA wurde aus 1 – 5 × 103 Zellen
extrahiert, die durch Mikrodissektion erhalten wurden. In einigen
Fällen
wurden Zellen mehrerer benachbarter sezierter Tubuli des Krebs-
oder normalen Epithelgewebes kombiniert. DNA wurde ebenfalls aus
1 – 5 × 104 Zellen extrahiert, die aus schnell wachsenden
unsterblichen Kulturen erhalten wurden. Die Zellen wurden sofort
in einer Lösung
(20 μl für mikrosezierte
oder 200 μl
für kultivierte
Zellen) resuspendiert, die 0,01 M TRIS-HCL, pH 8,0, 1 mM EDTA, 1%
Tween 20 und 0,1 mg/ml Proteinase K enthielt, und über Nacht
bei 37°C
inkubiert. Nach der Inkubation wurde die Mischung für 5–10 min
gekocht, um die Proteinase K zu inaktivieren, und bei 4°C für die nachfolgende
Polymerase-Kettenreaktion (PCR)-Analyse aufbewahrt.
-
Ermittlung des Verlustes der Heterozygotie.
Die polymorphen DNA-Marker, die für den Nachweis von LOH auf
Chromosom 8p12–21
untersucht wurden, enthielten: SFTP-2, D8S133, D8S136, NEFL, D8S137, D8S131,
D8S139 und ANK. Die PCR-Primer-Paare, die zur Amplifizierung der
DNA-Mikrosatellitenmarker verwendet wurden, sind Folgende:
-
1)
SFTP-2
Nukleinsäuresequenzen:
L16861
-
Amplifizierte Seq. Min Länge: 0,111
Amplifizierte
Seq. Max Länge:
0,157
Vgl. Wood, S., Genomics 24: 597–600, 1994. SFTP2-kartiert
in der Region zwischen 8p11– 8p22.
-
2)
D8S133
Nukleinsäuresequenzen:
M73471
-
Amplifizierte Seq. Min. Länge: 0,094
Amplifizierte
Seq. Max. Länge:
0,112
Vgl. Wood, S. Cytogenet Cell Genet 58: 1932, 1991; Wood,
S., Genomics 13: 232, 1992.
-
-
Amplifizierte Seq. Min. Länge: 0,071
Amplifizierte
Seq. Max. Länge:
0,089
Vgl. Wood, S., Cytogenet Cell Genet 58: 1932, 1991.
-
4)
NEFL
Nukleinsäuresequenzen:
L04147
-
Amplifizierte Seq. Min. Länge: 0,137
Amplifizierte
Seq. Max. Länge:
0,147
Vgl. Rogaev, E., Hum. Mol. Genet. 1: 781, 1992.
-
5)
D8S137
Nukleinsäuresequenzen:
X61694
-
Amplifizierte Seq. Min. Länge: 0,152
Amplifizierte
Seq. Max. Länge:
0,161
Vgl. Wood, S., Cytogenet Cell Genet 58: 1932, 1991; Wood,
S., Nucleic Acids Res. 19: 6664, 1991.
-
-
Amplifizierte Seq. Min. Länge: 0,132
Amplifizierte
Seq. Max. Länge:
0,144
Vgl. Yu, CE., Hum. Mol. Genet. 3: 211, 1994.
-
-
Amplifizierte Seq. Min. Länge: 0,162
Amplifizierte
Seq. Max. Länge:
0,176
Vgl. Thomas, W., Hum. Mol. Genet. 2: 828, 1993.
-
8)
ANK
Nukleinsäuresequenzen:
D16990
-
Vgl. Polymeropoulos et al., Nucleic
Acids Res. 19: 969, 1991.
-
PCR wurde durchgeführt wie
vorher beschrieben (19). Kurz gesagt enthielten 12,5 ml PCR-Reaktionslösung 200
mM dATP, dGTP und dTTP; 40 μM
dCTP; 0,8 mM Primer (Research Genetics, Huntsville, Ala., oder synthetisiert
mittels eines Applied Biosystems DNA-Synthesizers); 2 μCi [α32P]
dCTP; 16 μM
Tetramethylammoniumchlorid (27); 1 × PCR-Reaktionspuffer (enthaltend 1,25 mM
MgCl2) und eine Einheit Taq-Poylmerase (Boehringer-Mannheim). Fünf Prozent
DMSO wurde zu den Reaktionen für
die Marker D8S133 und D8S137 hinzugefügt, um die Auflösung und
Amplifikation der Produkte zu verbessern. Reaktionen mit allen Markern wurden
wie folgt durchgeführt:
2 min bei 95°C,
gefolgt von 28–40
Zyklen (je nach Marker) des Annealing und der Extension (95°C für 30 s,
Annealing-Temperatur
für 30
s und 72°C
für 30
s) und eine zweiminütige
Inkubation bei 72°C.
Annea ling-Temperaturen für
jeden einzelnen Marker wurde nach einer anfänglichen Schätzung, bezogen
auf Primer-Länge
und Zusammensetzung, empirisch bestimmt.
-
Die markierten amplifizierten DNA-Proben
wurden für
5–10 min
bei 90°C
denaturiert und auf ein Gel geladen, das aus 7% Acrylamid (30 :
0,8 Acrylamid : Bisacryamid), 5,6 M Harnstoff, 32% Formamid und
1 × TBE
(0,089 M Tris pH 8,3, 0,089 M Borat, 0,002 M EDTA) bestand (28).
Proben wurden bei 95°C
für 2–4 Std. elektrophoriert.
Gele wurden dann auf Sequenziergel-Filterpapier (Bio-Rad) transferiert
und Audioradiographie wurde mit Kodak X-OMAT-Film durchgeführt. Das Kriterium für LOH war
mindestens 75% Verlust eines Allels im Vergleich zu einer autologen
frischen. PBL-Kontrolle, bestimmt durch direktes Untersuchen von
drei unabhängigen
Prüfern.
Wenn ausreichend DNA verfügbar
war, wurde LOH durch mindestens zwei unabhängige Experimente verifiziert.
-
Ergebnisse
-
Gewebe für die Zellkultur. Angesichts
der bekannten Schwierigkeiten, die mit der Erzeugung von unsterblichen
Prostata-Zelllinien von primären
(nicht metastatischen) Proben einhergehen, wurden die größten, grob
sichtbaren Tumorknötchen
(1–3 cm
im Durchmesser) zunächst
ausgesucht als Quelle für
frisches Gewebe für
die Generierung von Kulturen. Nachfolgende mikroskopische Analyse
der angrenzenden Gewebesektionen der ersten drei Vesuche (Patienten
1510, 1512 und 1519) zeigten, dass "Tumor"-Proben tatsächlich eine variable
Mischung von gutartigem prostatischen Epithel, gutartiger prostatischer
Hypertrophie (BPH), prostatischer intraepithelialer Neoplasie (PIN)
und invasiven Tumorzellen enthielten. Jedoch bestanden "normale" Proben
von Patienten 1512 und 1519 aus gutartigem prostatischem Epithel
(Tabelle 2).
-
Um die Wahrscheinlichkeit zu erhöhen, reines
Tumorgewebe für
das Anlegen von Tumorzelllinien von nachfolgenden Patienten zu erhalten,
wurden kleinere Gewebefragmente (< 1
cm) mit angrenzenden Sektionen beschafft, die für Gewebekultur, Gefrier- und
Paraffinsektionen bestimmt waren. Zusätzlich wurden, wann immer es
möglich
war, verschiedene ausgeprägte
Tumorgewebsfragmente aus einzelnen Proben selektiert für das Anlegen
der Kultur. Durch den Einsatz dieser strengeren Bedingungen war
es möglich,
Gewebesektionen zu erhalten, die mindestens 95% neoplastische Zellen
(PIN plus invasivem Krebs) in 6 von 7 Versuchen an drei Radikalprostatektomieproben
(Patienten 1532, 1535 und 1542) enthalten. Zusätzlich wurden Gewebefragmente,
die für
das Anlegen von drei gutartigen epithelialen Prostata-Zelllinien
und zwei benignen epithelialen Zelllinien der Samenblase geeignet
waren, erfolgreich aus diesen Radikalprostatektomieproben seziert (Tabelle
2).
-
Das Unsterblichmachen und die immunzytochemische
Charakterisierung von Prostataabgeleiteten Zelllinien. Alle bis
auf eine von den 17 Gewebeproben, die in Tabelle 2 (normale Prostata
aus Patient 1519) aufgelistet sind, wurden ohne Weiteres in Kurzzeit-Kultur
etabliert. Jedoch war die Zellproliferation relativ langsam und
die in vitro-Immortalisierung der epithelialen Zellkulturen war
nötig,
um schnell wachsende Kulturen zu etablieren, die im Stande waren, über 5–6 Wochen
hinaus zu überleben.
Adhärente
Mono-Layer-Kulturen wurden bei der zweiten oder dritten Passage
mit einem rekombinanten Retrovirus, der für die E6- und E7-transformierenden
Proteine von HPV 16 kodierte, transduziert. Dies ergab die Etablierung
von 16 Langzeit-epithelialen Zelllinien: 4 abgeleitet aus normaler
Prostata, 2 aus der Samenblase und 10 aus primären Tumorproben. Zusätzlich wurden
unsterbliche fibroblastische Linien, die aus prostatischem Stroma
angesetzt worden waren, in vier Patienten etabliert. Erfolgreiche
Transduktion wurde bestätigt
durch Zellüberlebensfähigkeit
in G418 bei einer Konzentration von 1 mg/ml und erweiterte Zelllebensfähigkeit
und rasche Proliferation jenseits von 50 Kulturpassagen im Vergleich
zu nicht unsterblich gemachten Zellen, die parallel dazu kultiviert wurden
(1A). Unter dem Mikroskop zeigten
die unsterblich gemachten epithelialen Prostatazelllinien alle eine
vergleichbare Morphologie, unabhängig
davon, ob sie von benignem oder malignem Gewebe stammten. Somit
war die Morphologie der Kulturen kein brauchbares Kriterium, um
benigne von malignen Zellen zu unterscheiden (1B).
-
Um die epithelialen und prostatischen
Ursprünge
der Prostata-abgeleiteten Zelllinien zu bestätigen, wurde Immunzytochemie
an Zellblöcken
aus aktiv wachsenden unsterblichen Kulturen durchgeführt (Tabelle 3).
Cytokeratine mit sowohl hohem als auch niedrigem Molekulargewicht
wurden von allen epithelialen Zelllinien, die in unserem Labor angelegt
wurden, einschließlich
solchen, die von normaler Prostata, normalen Samenblasen und Prostatakrebsproben
abgeleitet waren, exprimiert. Mehr als 75% der Zellen färbten mit
4 + Intensität, ähnlich der
Färbung
wie sie mit etablierten metastatischen Prostatakrebszelllinien LNCaP, DU145, PC-3 und TSAU-PR1 beobachtet werden
konnten. Somit war der epitheliale Ursprung dieser Kulturen bestätigt. Keine
nennenswerte Cytokeratinexpression wurde für Kontrollfibroblastenlinien
oder Melanomzellen beobachtet.
-
Obwohl positive Cytokeratinexpression
darauf hindeutete, dass Zelllinien, die aus primären Prostatakrebsproben generiert
wurden, eigentlich epithelialen Ursprungs waren, war es auch von
Interesse, die Expression der Prostata-assoziierten Proteine, PSA
und PAP, von diesen Kulturen zu bewerten. Nur die unsterbliche Prostatatumor-abgeleitete
Zelllinie, die aus Patient 1519 (1519-CPTX) generiert wurde, exprimierte
nachweisbare Mengen dieser Proteine (> 75% der Zellen, färbend mit 2 – 3 + Intensität, und > 75% mit 4 + Intensität) nach
5 Kulturpassagen. Nach 30 Kulturpassagen war die Expression von
PSA und PAP in 1519-CPTX
jedoch nicht mehr nachweisbar. Im Weiteren war die Expression in
den späten
Passagen dieser Zelllinie nicht durch IFN-5-aza-2'-Deoxicytidine
oder Dihydroxytestosteron induzierbar. Immunhistochemische Untersuchung
von fixierten Prostatakrebsgewebeschnitten zur Expression von PSA
und PAP zeigten oftmals schwache und heterogene Färbung von
Tumor-"Coals", wobei einige Tumorherde keine nachweisbare Expression
dieser Proteine zeigten. Im Gegensatz dazu färbten alle normalen Drüsen in demselben
mikroskopischen Schnitt kräftig und
gleichmäßig für PSA und
PAP (2). Die schwache
heterogene Expression von PSA und PAP von Prostatakrebszellen in
situ könnte
die Abwesenheit der Expression der unsterblichen Prostatatumor-abgeleiteten Zelllinien
erklären.
Jedoch korreliert der Mangel an Expression in den gutartigen epithelialen
Prostatazelllinien nicht mit der starken Expression, die in den
entsprechenden Gewebeschnitten beobachtet worden sind. Dies deutet
darauf hin, dass der Verlust der PSA- und PAP-Expression auch als
Folge der in vitro-Zellkultur
auftreten kann.
-
Untersuchung von Chromosom 8p auf
LOH in mikrosezierten Geweben. Wie vorstehend bemerkt, wurden unsere
"Prostatakrebs"-Zelllinien in den meisten Fällen tatsächlich von Gewebeproben abgeleitet,
die eine Mischung aus benignen und malignen Zelltypen enthielten
(Tabelle 2). Da alle Kulturen retrovirale Transformation benötigten,
um Langzeitproliferation induzieren zu können, und da transformierte
benigne und maligne epitheliale Prostatazellen morphologisch und
histochemisch nicht unterscheidbar waren, wurde die Verwendung der
LOH-Analyse als alternatives Mittel zur Charakterisierung der neu
etablierten Kulturen untersucht. LOH auf Chromosom 8p12–21 wurde
zuerst in mikrosezierten Herden von Tumor- oder normalen epithelialen
Zellen der entsprechenden frischen Gewebesektionen bewertet. Ein
Satz von 8 Mikrosatellitenmarkern, von welchen vorher gezeigt werden
konnte, dass sie einen hohen Prozentsatz an LOH in mikrosezierten Prostatakrebsproben
detektieren können
(19), wurde ausgewählt,
um Deletionen auf Chromosom 8p zu identifizieren. Der Satz der 8
Mikrosatellitenmarker ist im Stande, Deletionen an den Genorten
11 bis 21 des Chromosoms 8 zu identifizieren, wie in 3 gezeigt. Unter der Annahme,
dass Zellen, die im Mikroskop normal erscheinen, LOH als Vorläufer für die maligne
Transformation enthalten könnten,
wurden frische autologe PBL als normale Kontrolle für die LOH-Analyse
verwendet. Es stellte sich heraus, dass alle 6 Patienten heterozygot (informativ)
an 4 oder weiteren Genorten der 8 Genorte waren, die bei der Analyse
der DNA von frischem PBL untersucht wurden. Jedoch lieferten für 2 Patienten
(1519 und 1532) mikrosezierte Tumorproben keinen Hinweis auf LOH.
Dies zeigt, dass die LOH-Analyse möglicherweise für die Charakterisierung
von Zellkulturen, die von solchen Proben hergeleitet sind, nicht
geeignet ist (Tabelle 4).
-
Tabelle
4: LOH auf Chromosom 8p in mikrasezierten Foci von Prastatakrebs
oder benignem Epithel
-
-
Im Gegensatz dazu zeigten mikrosezierte
Tumore der Patienten 1510 und 1512 LOH an allen untersuchten informativen
Genorten. Für
Patient 1535 wurden 6 einzelne mikrosezierte Tumor-Foci untersucht
und alle zeigten ähnliche
LOH-Muster. Von Bedeutung ist, dass die LOH-Analyse von 12 einzelnen
mikrosezierten Tumoren des Patienten 1542 verschiedene LOH-Muster
zeigte, wobei 4/12 das Beibehalten aller untersuchten 16 informative
Allele zeigte (Tabelle 5). Mikroseziertes Normalepithel zeigte kein
Anzeichen von LOH auf Chromosom 8p mit der Ausnahme von Proben,
die von Patient 1510 stammten. Alle 3 "normalen" mikrosezierten Foci
des Patienten 1510 zeigten extensives LOH im Einklang mit dem LOH-Muster,
das in autologem Tumor beobachtet wurde. Dies verdeutlicht die Bedeutung
der Verwendung von PBL als Normalkontrolle für diese Art von Untersuchung.
-
Tabelle
5: LOH auf Chromosom 8p in mikrosezierten Prostatageweben und unsterblich
gemachte Zelllinien des Patienten 1542
-
LOH-Analyse von unsterblich gemachten
Zelllinien des Patienten 1542. Verlust von Heterozygotie in Zellkulturen,
die von Patient 1542 erzeugt wurden, war von besonderem Interesse
hinsichtlich der verschiedenen Muster von LOH, die sich in 12 charakteristischen
mikrosezierten Tumor-Foci zeigten. Dieser Patient lieferte aufschlussreiche
Informationen bezüglich
der Genorte D8S133, D8S136, D8S137, D8S131, D8S339 und ANK. Vier
von diesen Genorten wurden auf Verlust von Allelen in Kulturen näher untersucht,
die sich aus Tumoren normaler Prostata, normaler Samenblase und
normalen Fibroblasten ableiteten (Tabelle 5). Wiederholte Analyse
von „Bulk"-Kulturen
früher
Passagen (Passage 3, 6, 13) die aus Tumorgewebe gewonnen wurden und
als 1542-CP3TX bezeichnet wurden, zeigten
keinen LOH für
jeden der vier untersuchten Satellitenmarker. Jedoch zeigte 1542-CP3TX nach 21 seriellen Kulturpassagen (ungefähr 6 Monate)
einen Verlust des oberen Allels an allen vier untersuchten Genorten.
Dieses Muster des Allelenverlustes war identisch mit dem Muster, das
in dem mikrosezierten Tumorherd Nr. 7 gefunden wurde. Dreißig Einzelzellklone
wurden aus Passage 23 von 1542-CP3TX erzeugt.
Alle Klone zeigten ein Muster an LOH, welches identisch mit dem
der nicht klonierten späten
Kulturpassage und des mikrosezierten Tumors Nr. 7 war. Dies deutete
auf die klonale oder annähernd klonale
Zusammensetzung der "Bulk-Late"-Passage-Zelllinie
hin. Diese Befunde legten außerdem
nahe, dass die Unfähigkeit,
LOH in frühen
Passagen von 1542-CP3TX nachzuweisen, die
Anwesenheit von multiplen Tumorklonen in der "Bulk"-Kultur, die
verschiedene Muster an LOH besitzt, zeigen könnte, was den Nachweis von
LOH mit einer PCR-basierten Technik ausschließen würde. Um dies zu untersuchen,
wurden Einzelzellklone aus einer frühen Passage (Passage 8) von
1542-CP3TX
erzeugt und auf LOH untersucht (4).
Sieben der neun Klone offenbarten kein LOH bei D8S136 oder D8S131, ähnlich der
3/12 mikrosezierten Tumore des Patienten 1542. Jedoch zeigte ein
einzelner Klon (Klon 4) (1542-CP3TX.8.4)
ein Muster an LOH, was ähnlich zu
dem des mikrosezierten Tumors Nr. 7, der späten Passage von 1542-CP3TX und ihrer abgeleiteten Klone ist. Dies
zeigt, dass der (die) Tumor-Klon(e), der (die) in der "Bulk"-Kultur der späten Passage
vorherrschte(n), offensichtlich in sehr frühen Kulturpassagen vorherrschte(n).
Interessanterweise zeigte Klon 1 (1542-CP3TX.8.1)
der frühen
Passage 1542-CP3TX ein anderes Muster an LOH als das, was
bei den anderen 8 Klonen aus frühen
Passagen mit Verlust der unteren Allelen von D8S133, D8S136 und
D8S131 beobachtet wurde. Dies war wiederum im Einklang mit dem Muster
an LOH, welches in zwei mikrosezierten Tumoren (Nr. 1 und Nr. 3)
nachgewiesen wurde. Bemerkenswert ist, dass LOH nicht nachgewiesen
werden konnte in wiederholten Experimenten mit frühen und
späten
Passagen von unsterblich gemachten Kulturen von normalem prostatischem
Epithel der Samenblase oder von Fibroblasten des Patienten 1542.
Dies spricht gegen die Wahrscheinlichkeit, dass der Verlust an Heterozygotie,
der in Tumor-abgeleiteten Zellen beobachtet wurde, ein Artefakt
der Kultur darstellte.
-
Untersuchung des Verlustes der Heterozygotie
auf Chromosom 8p12–21
in Zellkulturen, die aus den fünf
verbleibenden Patienten gewonnen wurden. In den Patienten 1510 und
1512 wurde LOH an verschiedenen Genorten in mikrosezierten Tumorproben
nachgewiesen (Tabelle 4). Jedoch konnten unsterblich gemachte epitheliale
Kulturen, die aus entsprechenden krebsenthaltenden Gewebeproben
erzeugt worden waren, keinen Verlust der Heterozygotie zeigen, wenn
sie auf dem "Bulk"-Niveau bei frühen
oder späten
Kulturpassagen untersucht wurden. In ähnlicher Weise konnten auch
Klone, die aus späten
Kulturpassagen (Passage 23 für 1510-CPTX,
Passage 31 für
1512-CPTX) kein Vorhandensein an LOH anzeigen. Dies könnte das
Vorhandensein bedeutender Mengen an normalem prostatischem Epithel
in den Gewebeproben, aus denen diese Kulturen generiert wurden,
widerspiegeln (Tabelle 2), verbunden mit einem übermäßigen Wachstum von normalen
Zellen in vitro. Das Klonieren dieser Zellkulturen bei sehr frühen Kulturpassagen
könnte
vielversprechendere Resultate ergeben.
-
Die Untersuchung von mikrosezierten
Tumor-Foci von den Patienten 1519 (ein Focus) und 1532 (8 Foci)
zeigte keinen Verlust der Heterozygotie (Tabelle 4). Dennoch wurden
Kulturen, die aus diesen Tumoren etabliert wurden, auf LOH geprüft. Im Falle
des Patienten 1519 zeigte die Untersuchung der "Bulk"-Kultur 1519-CPTX
die Beibehaltung der Heterozygotie bei 6 informativen Genorten,
die untersucht wurden. Jedoch zeigte ein Zellklon aus 11 Einzelzellklonen,
die aus Kulturpassage 24 gewonnen wurden, Verlust der Heterozygotie
an einem einzigen Genort, D8S 133. Im Falle des Patienten 1532 zeigte
die "Bulk"-kultivierte Linie 1532-CP2TX,
die aus einer von zwei Tumorzellproben (Tabelle 2) erzeugt wurde,
einen Verlust der Heterozygotie bei D8S 133, D8S 136 und NEFL, dies
allerdings nur nach anhaltender Kultivierung (Passage 24). Alle 10
Klone, die aus der späten
Kulturpassage erzeugt wurden, zeigten ebenfalls das gleiche Verlustmuster.
Jedoch zeigte eine unsterblich gemachte Kultur, die aus normalem
Prostatagewebe des Patienten 1532 gewonnen wurde, kein Anzeichen
von LOH, auch nicht nach 20 Kulturpassagen. In ähnlicher Weise behielt eine
autologe, unsterblich gemachte Fibroblastenlinie Heterozygotie an
den gleichen 3 Allelen bei, die bei 1532-CP2TX
verloren waren. Somit deutet der Verlust der Heterozygotie, der
bei einem einzigen 1519-CPTX-Klon und bei 1532-CP2TX
beobachtet wurde, darauf hin, dass diese Befunde den Verlust der
Heterozygotie widerspiegeln, der in einem In situ-Tumor-Focus vorhanden
ist, der nicht für
die Analyse seziert wurde.
-
Interessante Ergebnisse wurden mit
Kulturen erhalten, die von Patient 1535 gewonnen wurden. In diesem
Fall wurde ein umfassender Verlust der Heterozygotie in 6 verschiedenen
mikrosezierten Tumor-Foci dokumentiert, wobei alle das gleiche Verlustmuster
zeigten (Tabelle 4). Kulturen aus frühen und späten Passagen, die aus Prostatakrebs
erzeugt wurden, sowie aus normaler Prostata und normaler Samenblase,
zeigten keinen Verlust der Heterozygotie. In ähnlicher Weise zeigten 11 Tumorklone,
die bei Kulturpassage 27 generiert wurden, keinen Verlust. Jedoch
zeigte die Klonierung einer Tumorkultur einer frühen Passage (Passage 12) einen
Klon mit einem Muster an LOH, welcher den 6 mikrosezierten Tumor-Foci
glich (Klon 1535-CP1TX.14.3). Diese Ergebnisse
stimmen mit den Ergebnissen des Patienten 1542 überein und sprechen dafür, dass
die frühe
Klonierung von unsterblich gemachten Kulturen, die aus histologisch
heterogenen Prostatakrebsproben erzeugt wurden, notwendig sein könnte, um
reine Tumorkulturen zu erhalten.
-
Expression von MHC-Molekülen durch
unsterblich gemachte Zelllinien, die von Prostatakrebs abgeleitet
sind. Die Untersuchung der Oberflächen-MHC-Expression auf unsterblich
gemachten Tumor-abgeleiteten Zellenlinien war von Bedeutung bei
der Betrachtung der potentiellen Nützlichkeit dieser Linien für immunologische
Studien. Kulturen, die von allen 6 Patienten gewonnen wurden, exprimierten
signifikante Oberflächenmengen
an MHC-Klasse I und dem Adhäsionsmolekül ICAM-1,
wie durch Fließzytometrie
ermittelt wurde (Tabelle 6).
-
Tabelle
6: Zelloberflächenexpression
von MHC- und Adäsionsmolekülen durch
unsterblich gemachte epitheliale Prostatazelllinien
-
Keine der unsterblich gemachten Linien
exprimierten nachweisbare Mengen an MHC-Klasse-II-Molekülen oder an der B7-Familie
ko-stimulatorischer Moleküle
(B7.1, B7.2). Jedoch war es von Interesse zu ermitteln, ob die Expression
von MHC-Molekülen
in Anwesenheit von IFN-γ hochreguliert
werden könnte,
wie vorher für
Melanomzelllinen berichtet worden ist (29). Unsterblich gemachte
Tumor-abgeleitete Zelllinien 1532-CP2TX,
1535CP1TX und 1542-CP3TX
wurden in Anwesenheit von 500 U/ml IFN-γ für 72 Std. kultiviert und anschließend auf
MHC-Expression geprüft.
Alle Zelllinien wurden zur Expression signifikanter Mengen an MHC-Klasse-II-Molekülen veranlasst.
Zusätzlich
wurde die Expression von MHC-Klasse-I-Molekülen erhöht im Vergleich zu unbehandelten
Kontrollen (5C gegenüber 5A). Angesichts dessen repräsentieren
diese unsterblichen tumorabgeleiteten Zelllinien potentiell wertvolle
Reagenzien, um die CD4+ und CD8+-zellvermittelte Immunantwort
in Patienten mit primären
Adenokarzinom der Prostata zu studieren oder zu stimulieren.
-
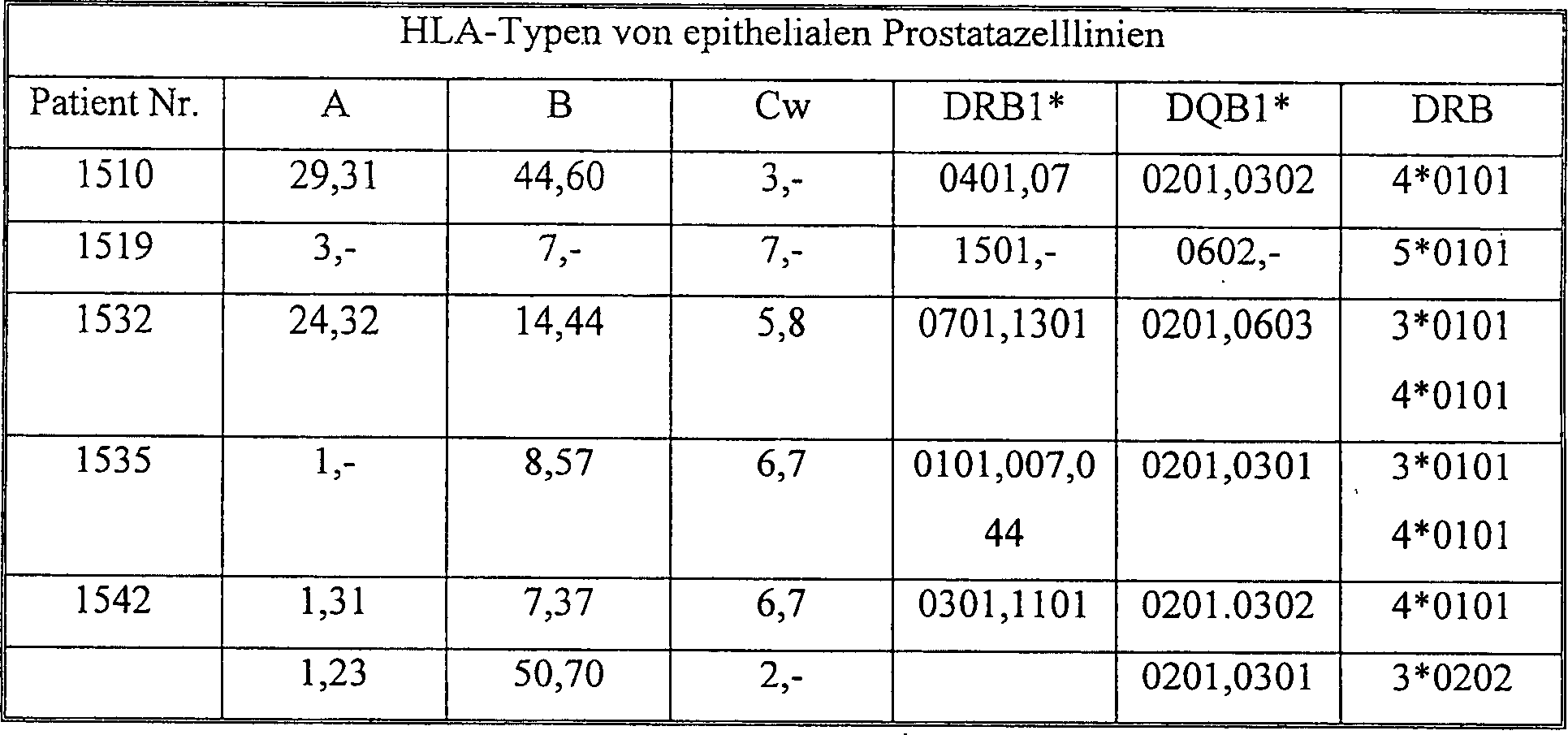
HLA-Typisierung von epithelialen
Prostatazelllinien. HLA-Typisierung wurde für jeden Patienten durchgeführt, von
dem epitheliale Prostatazelllinien stammten. Typen A, B und C wurden
durch Serotypisierung von Lymphozyten unter Verwendung von üblichen
Methoden bestimmt. Die Typen DR und DQ wurden durch Genotypisierung
von Lymphozyten nach üblichen
Methoden bestimmt. Die Ergebnisse der HLA-Typisierung sind in Tabelle
7 dargestellt.
-
-
Literaturstellen
-
- 1. Parker, S. L., Tong, T., Bolden, S. and Wingo, P. A.,
Cancer Statistics, 1996. CA Cancer J. Clin. 65: 5–27, 1996.
- 2. Isaacs, J. T., Isaacs, W. B. and Schalken, J. Comparative
aspects of multistep prostatic carcinogenesis in humans and rodents.
Prog. Clin. Biol. Res. 376: 261–288,
1992.
- 3. Webber, M. M., Chaproniere-Rickenberg, D. M. and Donohue,
R. E. Isolation and growth of adult human prostatic epithelium in
serum-free, defined medium. In: Methods for serum-free culture of
cells of the endocrine system, Seiten 47–61. New York: Alan R. Liss,
1984.
- 4. Peehl, D. M. Culture of human prostatic epithelial cells.
In: Culture of epithelial cells, Seiten 159–180. New York: Wiley-Liss,
1992.
- 5. Rhim, J. S., Webber, M. M., Bello, D., Lee, M. S., Arnstein,
P., Chen, L. and Jay, G. Stepwise immortalization and transformation
of adult human prostate epithelial cells by combination of HPV-18
and v-Ki-ras. Proc. Natl. Acad. Sci. USA 91: 11874–11878,
1994.
- 6. Bondou, P., Cussenot, O., Soliman, H., Villette, J. M., Teillac,
P., LeDuc, A. and Fiet, J. Distinct androgen 5 alpha-reduction pathways
in cultured fibroblasts and immortalized epithelial cells from normal
human adult prostate. J. Urol. 152: 226–231, 1994.
- 7. Lee, M., Garkovenko, E., Yun, J. S., Weijerman, P. C., Peehl,
D. M., Chen, L. and Rhim, J. S. Characterization of adult human
prostatic epithelial cells immortalized by polybrene-induced DNA
transfection with a plasmid containing an origin-defective SV40
genome: Int. J. Oncol. 4: 821–830,
1994.
- 8. Weijerman, P. C., König,
J. J., Wong, S. T., Niesters, G. M. and Peehl, D. M. Lipofection-mediated
immortalization of human prostatic epithelial cells of normal and
malignant origin using human papillomavirus type 18 DNA. Cancer
Res. 54: 5579–5583,
1994.
- 9. Brothman, A. R., Peehl, D. M., Patel, A. M. und McNeal, J.
E. Frequency and pattern of karyotypic abnormalities in human prostate
cancer. Cancer Res. 50: 3795–3803,
1990.
- 10. Brothman, A. R., Peehl, D. M., Patel, A. M., McDonald, G.
R., McNeal, J. E., Ladaga, L. E. und Schellhammer, P. F. Cytogenetic
evaluation of 20 cultures primary prostatic tumors. Cancer Genet.
Cytogenet. 55: 79–84, 1991.
- 11. Brothman, A. R., Patel, A. M., Peehl, D. M. und Schellhammer,
P. F. Analysis of prostatic tumor cultures using fluorescence in-situ
hybridization (FISH). Cancer Genet. Cytogenet. 62: 180–185, 1992.
- 12. Isaacs, W. B., Bova, G. S., Morton, R. A., Bussemakers,
J. D. und Ewing, C. M. of prostate cancer. Seminars in Molecular
biology Oncology 21: 514–521,
1994.
- 13. Carter, B. S., Ewing, C. M., Ward, ALS., Treiger, B. F.,
Aalders, T. W., Schalker, J. A., Epstein, J. I. und Isaacs, W. B.
Allelic loss of chromosomes 16q and lOq in human prostate cancer.
Proc. Natl. Acad. Sci. USA 87: 8751–8755, 1990.
- 14. Bergenheim, U. S. R., Kunimi, K., Collies, V. P. und Ekman,
P. Deletion mapping of chromosomes 8, 10, and 16 in human prostatic
carcinoma. Genes, Chromosomes and Cancer 3: 215–220, 1991.
- 15. Sakar, W. A., Macoska, J. A., Benson, P., Grignon, D. J.,
Wolman, S. R., Pontes, J. E. und Crissman, J. D. Allelic loss in
locally metastatic; multisampled prostate cancer. Cancer Res. 54:
3273–3277,
1994.
- 16. Bova, G. S., Carter, B. S., Bussemakers, M. J. G., Emi,
M., Fujiwara, Y., Kyprianou, N., Jacobs, S. C., Robinson, J. C.,
Epstein, J. I., Walsh, P. C. und Isaacs, W. B. Homozygous deletion
and frequent allelic loss of chromosome 8p22 loci in human prostate
cancer. Cancer Res. 53: 3869–3873,
1993.
- 17. Trapman, J., Sleddens, H. F. B. M., van der Weiden, M. M.,
Dinjens, W. N. M., Konig, J. J., Schroder, F. H., Faber, P. W. und
Bosman, F. T. Loss of heterozygosity of chromosome 8 microsatellite
loci implicates a candidate tumor suppressor gene between the loci
D8S87 and D8S133 in human prostate cancer. Cancer Res. 54: 6061–6064, 1994.
- 18. Macoska, J. A., Trybus, T. M., Benson, P. D., Sakr, W. A.,
Grignon, D. J., Wojno, K. D., Pietruk, T. und Powell, I. J. Evidence
for three tumor suppressor gene loci on chromosome 8p in human prostate
cancer. Cancer Res. 55: 5390–5395,
1995.
- 19. Vocke, C. D., Pozzatti, R. O., Bostwick, D. G., Florence,
C. D., Jennings, S. B., Sirup, S. E., Duray, P. H., Liotta, L. A.,
Emmert-Buck, M. R. und Linehand, W. M. Analysis of 99 microdissected
prostate carcinomas reveals a high frequency of allelic loss on
chromosome 8p12-21. Cancer Res. 56: 2411–2416, 1996.
- 20. Emmert-Buck, M. R., Vocke, C. D., Pozzatti, R. O., Duray,
P. H., Jennings, S. B., Florence, C. D., Zhuang, Z., Bostwick, D.
G., Liotta, L. A. und Linehan, W. M. Allelic loss on chromosome
8p12-21 in microdissected prostatic intraepithelial neoplasia. Cancer
Res. 55: 2959–2962,
1995.
- 21. Topalian, S. L., Muul, L. M., Solomon, D. und Rosenberg,
S. A. Expansion of human infiltrating lymphocytes for use in immunotherapy
trials. J. Immunol. Meth. 102: 127–141, 1987.
- 22. Halbert, C. L., Demers, G. W. und Galloway, D. A. The E7
gene of human papillomavirus type 16 is sufficient for immortalization
of human epithelial cells. J. Virol. 65: 473–478, 1991.
- 23. Topalian, S. L., Solomon, D., Avis, F. P., Chang, A. E.,
Freerksen, D. L., Linehan, W. M., Lothe, M. T., Robertson, C. N.,
Seipp, C. A., Simon, P., Simpson, C. G. und Rosenberg, S. A. Immunotherapy
of patients with advanced cancer using tumor-infiltrating lymphocytes
and recombinant interleukin-2: A pilot study. J. Clin. Onol. 6:
839–853,
1988.
- 24. Emmert-Buck, M. R., Roth, M. J., Zhuang, Z., Campo, E.,
Rozhin, J., Sloane, B. F., Liotta, L. A., Stetler-Stevenson, W.
G. Increased gelatinase A and cathepsin B activity in invasive tumor
regions of human colon cancer samples. Am. J. Pathol. 154: 1285–1290, 1994.
- 25. Zhuang, Z., Berttheau, P., Emmert-Buck, M. R., Liotta, L.
A., Gnarra, J., Linehan, W. M., Lubensky, I. A. A new microdissection
technique for archival DNA analysis of specific cell populations
in lesions less than one millimeter. Am. J. Pathol. 146: 620–625, 1995.
- 26. Zhuang, Z., Merino, M. J., Chuaqui, R., Liotta, L. A. and
Emmert-Buck, M. R. Identical allelic loss on chromosome 11q13 in
microdissected in situ and invasive human breast cancer. Cancer
Res. 55: 467–471,
1995.
- 27. Hung, T., Mak, K. and Fong, K. A. A Specificity enhancer
for polymerase chain reaction. Nuleic Acid Res. 18: 4953, 1990.
- 28. Litt, M., Hauge, X. and Sharma, V. Shadow bands seen when
typing polymorphic dinucleotide repeats: some causes and cures.
Biotechniques 15: 280–284,
1993.
- 29. Markus, N. R., Rosenberg, S. A. and Topalian, S. L. Analysis
of cytokine secretion by melanoma-specific CD+ T lymphocytes. J.
Interferon Cytokine Res. 15: 739–746, 1995.
- 30. Burrows, M. T., Burns, J. E. and Suzuki, Y. Studies on the
growth of cells. The cultivation of bladder and prostatic tumors
outside the body. J. Urol. 1: 3, 1917.
- 31. Horoszewicz, J. S., Leong, S. S:, Kawinski, E., Karr, J.
P., Rosentbal, H., Chu, T. M, Mirand, E. A. and Murphy, G. P. LNCaP
model of prostatic carcinoma. Cancer Res. 43: 1809– 1818,
1983.
- 32. Henttu, P., Liao, S. and Vihko, P. Androgens up-regulate
the human prostate specific antigen messenger ribonucleic acid (mRNA),
but down-regulate the prostatic acid phosphatase mRNA in the LNCaP
cell line. Endocrinology 130: 766–772, 1992.
- 33. Cooney, E. L. et al., 1991, Lancet 337: 567.
- 34. Wolff, J. A. et al., 1990, Science 247: 1465.
- 35. Davis, H. L. et al., 1993, Hum. Gene Ther. 4: 151.
- 36. Yang, N. S. et al., 1990, Proc. Natl. Acad. Sci. USA 87:
9568.
- 37. Williams, R. S. et al., 1991, Proc. Natl. Acad. Sci. USA
88: 2726.
- 38. Fynan, E. R. et al.; 1995, Proc. Natl. Acad. Sci. USA 90:
11478.
- 39. Eisenbraum, M. D. et al., 1993, DNA and Cell Biol. 12: 791.
- 40. Fuller, D. H. et al., 1994, AIDS Res. Hum. Retrovir. 10(11):
1433.
- 41. Acsadi, G. et al., 1991, Nature 352: 815.
- 42. Matteucci, M. D. et al., 1996, Nature 384: 20–22.
- 43. Perkus et al., 1985, Science 229: 981–984.
- 44. Kaufman et al., 1991, Int. J. Cancer 48: 900–907.
- 45. Moss, 1991, Science 252: 1662.
- 46. Smith und Moss, BioTechniques, Nov./Dez. 1984, Seiten 306–312.
- 47. US-PS 4,738,846 .
- 48. Sutter und Moss, 1992, Proc. Natl. Acad. Sci. USA 89: 10847–10851.
- 49. Baxby und Paoletti, 1992, Vaccine 10: 8–9.
- 50. PCT-Veröffentlichungsnr.
WO 94/16716, veröffentlicht
am 4. August 1994.
- 51. Short Protocols in Molecular Biology, 3. Auflage, F. Ausubel
et al., Hrsg. John Wiley & Son,
Inc., 1995.
- 52. Basic Methods in Molecular Biology, 2. Auflage, L. Davis
et al., Hrsg. Appleton & Lange,
1994.
-
-
-
-
-