-
Die vorliegende Erfindung liegt auf dem Gebiet der pflanzlichen Molekularbiologie und stellt Verfahren für die Herstellung von konstitutiven Promotern mit hoher Expression und für die Herstellung von Pflanzen mit einer verstärkten konstitutiven Expression von Nukleinsäuren bereit, wobei die Nukleinsäureexpression verstärkende Nukleinsäuren (NEENAs) funktionell mit den Promotern verbunden und/oder in Pflanzen eingeführt werden.
-
Die Expression von Transgenen in Pflanzen wird stark von verschiedenen äußerlichen und innerlichen Faktoren beeinflusst, was zu einem variablen und unvorhersehbaren Niveau der Transgenexpression führt. Häufig müssen zahlreiche Transformanten erzeugt und analysiert werden, um Linien mit einer gewünschten Expressionsstärke zu identifizieren. Da die Transformation und das Screening von Linien mit einer erwünschten Expressionsstärke kosten- und laborintensiv sind, besteht ein Bedarf an einer hohen Expression von einem oder mehreren Transgenen in einer Pflanze. Dieses Problem ist besonders dann schwerwiegend, wenn mehrere Gene koordiniert in einer transgenen Pflanze exprimiert werden müssen, um einen bestimmten Effekt zu erzielen, da eine Pflanze identifiziert werden muss, in der jedes einzelne Gen stark exprimiert wird.
-
So zum Beispiel kann die Expression eines Transgens in Abhängigkeit von dem Aufbau des Konstrukts und Positionseffekten des T-DNA-Insertionslocus in einzelnen Transformations-Events äußerst unterschiedlich sein. Mit starken Promotern können diese Herausforderungen teilweise überwunden werden. Die Verfügbarkeit von geeigneten Promotern, die eine starke Expression mit der gewünschten Spezifität aufweisen, ist jedoch häufig beschränkt. Um die Verfügbarkeit von genügend Promotern mit der gewünschten Expressionsspezifität zu gewährleisten, kann die Identifikation und Charakterisierung von zusätzlichen Promotern beim Schließen dieser Lücke hilfreich sein. Die natürliche Verfügbarkeit von Promotern mit der jeweiligen Spezifität und Stärke sowie die zeitaufwändige Charakterisierung von möglichen Promotern behindert jedoch die Identifikation von geeigneten neuen Promotern.
-
Um diese Herausforderungen zu überwinden wurde von unterschiedlichen genetischen Elementen und/oder Motiven gezeigt, dass sie die Genexpression positiv beeinflussen. Unter diesen Elementen und/oder Motiven wurden manche Introns als genetische Elemente erkannt, die für die Verbesserung der Genexpression vielversprechend sind. Obwohl der Mechanismus größtenteils unbekannt ist, wurde gezeigt, dass manche Introns die Steady-State-Menge an reifer mRNA positiv beeinflussen, möglicherweise durch eine verstärkte Transkriptionsaktivität, eine verbesserte mRNA-Reifung, einen verstärkten mRNA-Export aus dem Zellkern und/oder eine verbesserte Translationsinitiation (z. B. Huang und Gorman, 1990; Le Hir et al., 2003; Nott et al., 2004). Da nur von ausgewählten Introns gezeigt wurde, dass sie die Expression erhöhen, ist es wahrscheinlich, dass das Spleißen als solches nicht für die beobachteten Auswirkungen verantwortlich ist.
-
Die Erhöhung der Genexpression, die beim funktionellen Verknüpfen von Introns und mit Promotern beobachtet wird, wird „intronvermittelte Verstärkung (intron-medlated enhancement, IME) der Genexpression” genannt und ist in verschiedenen monokotylen Pflanzen (z. B. Callis et al., 1987; Vasil et al., 1989; Bruce et al., 1990; Lu et al., 2008) und dikotylen Pflanzen (z. B. Chung et al., 2006; Kim et al., 2006; Rose et al., 2008) nachgewiesen worden. Diesbezüglich wurde gezeigt, dass die Lage von Intron gegenüber dem Translationsstartpunkt (ATG) für die intronvermittelte Verstärkung der Genexpression von höchster Bedeutung ist (Rose et al., 2004).
-
Neben ihrer Fähigkeit, die Genexpression zu verstärken, wurde von einigen Introns auch gezeigt, dass sie die Gewebespezifität in ihrer nativen Nukleotidumwelt in Pflanzen beeinflussen. Es wurde gefunden, dass die Expression von Reportergenen vom Vorhandensein von Genomregionen, die bis zu zwei Introns enthalten, abhängig ist (
Sieburth et al., 1997;
Wang et al., 2004). Es wurde auch gefunden, dass 5'UTR-Introns für das richtige Funktionieren von Promoterelementen wichtig sind, vermutlich aufgrund von gewebespezifischen Genkontrollelementen, die in diesen Introns vorliegen (
Fu et al., 1995a;
Fu et al., 1995b;
Vitale et al., 2003;
Kim et al., 2006). Diese Studien zeigen jedoch auch, dass die Kombination von Introns mit heterologen Promotern starke negative Auswirkungen auf die Stärke und/oder Spezifität der Genexpression haben kann (Vitale et al., 2003; Kim et al., 2006,
WO2006/003186 ,
WO2007/098042 ). So zum Beispiel wird der starke konstitutive Promoter des Blumenkohlmosaikvirus CaMV35S durch Kombination mit dem Sesam-SeFAD2-5'UTR-Intron negativ beeinflusst (Kim et al., 2006). Im Gegensatz zu diesen Beobachtungen zeigen manche Druckschriften eine verstärkte Expression einer Nukleinsäure durch IME, ohne die Gewebespezifität des jeweiligen Promoters zu beeinflussen (
Schünmann et al., 2004).
-
In der vorliegenden Anmeldung werden weitere Nukleinsäuremoleküle, die bei funktioneller Verknüpfung mit konstitutiven Promotern die Expression von diesen Promotern verstärken, ohne ihre Spezifität zu beeinflussen, beschrieben. Diese Nukleinsäuremoleküle werden in der vorliegenden Anmeldung als „die Nukleinsäureexpression verstärkende Nukleinsäuren” (NEENA) beschrieben. Ein intrinsisches Merkmal von Introns ist es, aus der entsprechenden pre-mRNA herausgespleißt zu werden. Im Gegensatz dazu müssen die in der vorliegenden Anmeldung vorgestellten Nukleinsäuren nicht unbedingt in der mRNA eingeschlossen sein, oder, falls sie in der mRNA vorliegen, müssen sie nicht unbedingt aus der mRNA herausgespleißt werden, um die von dem Promoter, mit dem die NEENAs funktionell verknüpft sind, stammende Expression zu verstärken.
-
Detaillierte Beschreibung der Erfindung
-
Eine erste Ausführungsform der Erfindung umfasst ein Verfahren zur Herstellung eines konstitutiven Pflanzenpromoters mit hoher Expression, umfassend das funktionelle Verknüpfen eines Promoters mit einem oder mehreren die Expression von Nukleinsäure verstärkenden Nukleinsäure(NEENA)-Molekül(en), umfassend
- i) das Nukleinsäuremolekül mit einer Sequenz gemäß SEQ ID NO: 1 bis 19, vorzugsweise SEQ ID NO: 1 bis 9, oder
- ii) ein Nukleinsäuremolekül mit einer Sequenz mit mindestens 80% Identität zu SEQ ID NO: 1 bis 19, vorzugsweise SEQ ID NO: 1 bis 9, vorzugsweise beträgt die Identität 85% oder mehr, stärker bevorzugt beträgt die Identität 90% oder mehr, noch stärker bevorzugt beträgt die Identität 95% oder mehr, 96% oder mehr, 97% oder mehr, 98% oder mehr oder 99% oder mehr, in der am stärksten bevorzugten Ausführungsform beträgt die Identität 100% zu einer der Sequenzen gemäß SEQ ID NO: 1 bis 19, vorzugsweise SEQ ID NO: 1 bis 9, oder
- iii) ein Fragment von mindestens 100 aufeinanderfolgenden Basen, vorzugweise 150 oder mehr aufeinanderfolgenden Basen, stärker bevorzugt 200 aufeinanderfolgenden Basen oder mehr, noch stärker bevorzugt 250 oder mehr aufeinanderfolgenden Basen eines Nukleinsäuremoleküls gemäß i) oder ii), das eine expressionsverstärkende Aktivität aufweist, zum Beispiel 65% oder mehr, vorzugsweise 70% oder mehr, stärker bevorzugt 75% oder mehr, noch stärker bevorzugt 80% oder mehr, 85% oder mehr oder 90% oder mehr, in einer am stärksten bevorzugten Ausführungsform weist es 95% oder mehr der expressionsverstärkenden Aktivität wie das entsprechende Nukleinsäuremolekül mit der Sequenz einer der Sequenzen gemäß von SEQ ID NO: 1 bis 19 aufweist, vorzugsweise SEQ ID NO: 1 bis 9, oder
- iv) ein Nukleinsäuremolekül, bei dem es sich um das Komplement oder umgekehrte Komplement von einer der zuvor unter i) bis iii) erwähnten Nukleinsäuremoleküle handelt, oder
- v) ein Nukleinsäuremolekül, das mittels PCR unter Verwendung von Oligonukleotid-Primern gemäß SEQ ID NO: 20 bis 57, vorzugsweise SEQ ID NO: 20/21; 26/27; 30/31; 38/39; 42/43; 44/45; 46/47; 50/51 und 56/57, wie in Tabelle 2 dargestellt, erhältlich ist, oder
- vi) ein Nukleinsäuremolekül mit einer Größe von 100 Nukleotiden oder mehr, 150 Nukleotiden oder mehr, 200 Nukleotiden oder mehr oder 250 Nukleotiden oder mehr, das unter Bedingungen entsprechend Hybridisierung in 7% Natriumdodecylsulfat (SDS), 0,5 M NaPO4, 1 mM EDTA bei 50°C mit Waschen in 2 × SSC, 0,1% SDS bei 50°C oder 65°C, vorzugsweise 65°C, mit einem Nukleinsäuremolekül umfassend mindestens 50, vorzugsweise mindestens 100, stärker bevorzugt mindestens 150, noch stärker bevorzugt mindestens 200, am stärksten bevorzugt mindestens 250 aufeinanderfolgende Nukleotide einer transkriptionsverstärkenden Nukleotidsequenz gemäß SEQ ID NO: 1 bis 19, vorzusweise SEQ ID NO: 1 bis 9, oder dem Komplement davon hybridisiert. Vorzugsweise hybridisiert das Nukleinsäuremolekül unter Bedingungen entsprechend einer Hybridisierung in 7% Natriumdodecylsulfat (SDS), 0,5 M NaPO4, 1 mM EDTA bei 50°C mit Waschen in 1 × SSC, 0,1% SDS bei 50°C oder 65°C, vorzugsweise 65°C, mit einem Nukleinsäuremolekül umfassend mindestens 50, vorzugsweise mindestens 100, starker bevorzugt mindestens 150, noch stärker bevorzugt mindestens 200, am stärksten bevorzugt mindestens 250 aufeinanderfolgende Nukleotide einer transkriptionsverstärkenden Nukleotidsequenz gemäß SEQ ID NO: 1 bis 19, vorzugsweise SEQ ID NO: 1 bis 9, oder dem Komplement davon; stärker bevorzugt hybridisiert das Nukleinsäuremolekül unter Bedingungen entsprechend einer Hybridisierung in 7% Natiumdodecylsulfat (SDS), 0,5 M NaPO4, 1 mM EDTA bei 50°C mit Waschen in 0,1 × SSC, 0,1% SDS bei 50°C oder 65°C, vorzugsweise 65°C, mit einem Nukleinsäuremolekül umfassend mindestens 50, vorzugsweise mindestens 100, stärker bevorzugt mindestens 150, noch stärker bevorzugt mindestens 200, am stärksten bevorzugt mindestens 250 aufeinanderfolgende Nukleotide einer transkriptionsverstärkenden Nukleotidsequenz gemäß einer der Sequenzen gemäß SEQ ID NO: 1 bis 19, vorzugsweise SEQ ID NO: 1 bis 9, oder dem Komplement davon.
-
In einer Ausführungsform ist die eine oder die mehreren NEENA zu dem Promoter, mit dem sie funktionell verbunden ist/sind, heterolog.
-
Wie oben unter v) beschrieben, ist das Nukleinsäuremolekül, das mittels PCR unter Verwendung von Oligonukleotiden gemäß SEQ ID 20 bis 57, vorzugsweise SEQ ID NO: 20/21; 26/27; 30/31; 38/39; 42/43; 44/45; 46/47; 50/51 und 56/57, wie in Tabelle 2 dargestellt erhältlich ist, zum Beispiel aus genomischer DNA aus Arabidopsis-Pflanzen, wie A. thaliana, erhältlich, und zwar unter den in Beispiel 1 unten beschriebenen Bedingungen.
-
Der Fachmann ist mit Variationen bezüglich des Temperaturprofils, der Zyklusanzahl und/oder der Pufferzusammensetzung oder -konzentration für das Erhalten des entsprechenden NEENA-Moleküls vertraut. Die spezifische Kombination von Oligonukleotiden, die in der jeweiligen PCR-Reaktion einzusetzen sind, um ein entsprechendes NEENA-Molekül zu erhalten, ist in Tabelle 2 beschrieben.
-
Der Fachmann ist mit Methoden, mit denen man aus einem unidirektionellen Promoter einen bidirektionellen Promoter machen kann, und mit Verfahren für die Verwendung des Komplements oder reversen Komplements einer Promotersequenz zur Schaffung eines Promoters mit derselben Promoterspezifität wie die ursprüngliche Sequenz vertraut. Solche Verfahren sind zum Beispiel für konstitutive Promoter sowie für induzierbare Promoter beschrieben von
Xie et al. (2001) "Bidirectionalization of polar promoters in plants" Nature Biotechnology 19, Seiten 677–679. Die Autoren beschreiben, dass es ausreicht, an das 5'-Prime-Ende eines beliebigen Promoters einen Minimalpromoter anzufügen, um zu einem Promoter zu gelangen, der die Expression in beide Richtungen mit derselben Promoterspezifität kontrolliert. Ein Promoter mit hoher Expression in funktioneller Verknüpfung mit einer NEENA wie oben beschrieben ist daher in einem Komplement oder reversen Komplement funktionsfähig, und die NEENA ist daher ebenfalls in einem Komplement oder reversen Komplement funktionsfähig.
-
Ein konstitutiver Promoter bedeutet im vorliegenden Text einen Promoter, der in im Wesentlichen allen Pflanzengeweben über im Wesentlichen die gesamte Lebensdauer einer Pflanze oder eines Teils davon exprimiert wird. Ein Promoter, der in im Wesentlichen allen Pflanzengeweben exprimiert wird, kann auch Promoter umfassen, die in mindestens zwei der wichtigsten Pflanzengewebe, wie dem Blatt, dem Stängel und/oder der Wurzel, exprimiert werden und die in manchen oder allen unbedeutenderen Geweben oder Zellen wie Epidermis, Stomata, Trichom, Blüte, Samen oder Meristemgewebe exprimiert oder auch nicht exprimiert werden. In einer bevorzugten Ausführung versteht man unter einem konstitutiven Promoter im vorliegenden Text, dass dieser mindestens in grünen Geweben wie Blatt und Stängel exprimiert wird. Ein Promoter, der über im Wesentlichen die gesamte Lebensdauer einer Pflanze oder eines Teils davon exprimiert wird, kann auch Promoter umfassen, die in jungem und entwickeltem Gewebe exprimiert werden, bei denen jedoch eine Expression zu bestimmten Zeitpunkten in der Lebensdauer einer Pflanze oder unter spezifischen Bedingungen wie während der Keimung und/oder der Alterung oder unter biotischen und/oder abiotischen Stressbedingungen wie Pilz- oder Bakterienbefall, Dürre, Hitze oder Kälte keine Expression stattfindet. In einer bevorzugten Ausführungsform wird ein konstitutiver Promoter, der im Wesentlichen über die gesamte Lebensdauer einer Pflanze exprimiert wird, zumindest in vollständig entfaltetem Gewebe bis zum Beginn der Alterung exprimiert.
-
Im Prinzip kann die NEENA mit einem beliebigen Promoter, wie gewebespezifischen, induzierbaren, entwicklungsspezifischen oder konstitutiven Promotern, funktionell verbunden werden. Die entsprechende NEENA wird zu einer Expression der heterologen Nukleinsäure unter der Kontrolle des entsprechenden Promoters, mit dem die mindestens eine NEENA funktionell verknüpft ist, führen. Die Verstärkung der Expression von Promotern, bei denen es sich nicht um konstitutive Promoter handelt, zum Beispiel von gewebespezifischen Promotern, wird die Spezifität von diesen Promotern machen. Die Expression der Nukleinsäure unter der Kontrolle des entsprechenden Promoters wird nachweisbar sein in zusätzlichem Gewebe oder Entwicklungsstadien das Transkript der Nukleinsäure war ohne die NEENA nicht nachgewiesen worden. Hier kann ein gewebe- oder entwicklungsspezifischer oder ein sonstiger Promoter zu einem konstitutiven Promoter gemacht werden, und zwar dadurch, dass man mindestens eines der NEENA-Moleküle wie oben beschrieben mit diesem Promoter funktionell verknüpft. Eine weitere Ausführungsform der Erfindung besteht daher darin, ein Verfahren bereitzustellen, mit dem man die Spezifität von einem beliebigen Promoter, der in Pflanzen funktionsfähig ist, zu einem konstitutiven Promoter macht, und zwar dadurch, dass man den entsprechenden Promoter mit einem NEENA-Molekül, umfassend eine Sequenz wie oben unter i) bis vi) beschrieben, verknüpft. Vorzugsweise ist/sind die eine oder die mehreren NEENA funktionell mit einem beliebigen konstitutiven Promoter verbunden und wird/werden die Expression des Nukleinsäuremoleküls unter der Kontrolle dieses Promoters verstärken. Konstitutive Promoter, die in einem beliebigen Verfahren der Erfindung einzusetzen sind, können von Pflanzen, zum Beispiel von monokotylen oder dikotylen Pflanzen, von Bakterien und/oder von Viren abstammen, oder es kann sich um synthetische Promoter handeln. Konstitutive Promoter, die einzusetzen sind, sind zum Beispiel der PcUbi-Promoter aus P. crispum (
WO 2003102198 ), der ZmUbi-Promoter aus Zea maize, AtNit-Promoter aus dem A. thaliana-Gen At3g44310, das für die Nitrilase 1 codiert, der 34S-Promoter aus dem Braunwurz-Mosaikvirus, der 35S-Promoter des Tabakmosaikvirus, der nos- und ocs-Promoter, der aus Agrobakterien stammt, der ScBv-Promoter (
US 5 994 123 ), der SUPER-Promoter (
Lee at al. 2007, Plant, Phys.), der AtFNR-Promoter aus dem A. thaliana-Gen At5g66190, das für die Ferredoxin-NADH-Reductase codiert, der ptxA-Promoter aus Pisum sativum (
WO2005085450 ), der AtTPT-Promoter aus dem A. thaliana-Gen At5g46110, das für den Triosephosphattranslocator codiert, der bidirektionale AtOASTL-Promoter aus den A. thaliana-Genen At4g14880 und At4g14890, der PRO0194-Promoter aus dem A. thalian-Gen At1g13440, das für die Glyceraldehyd-3-phosphatdehydrogenase codiert, der PRO0162-Promoter aus dem A. thaliana-Gen At3g52930, der für die Fructose-bisphosphataldolase codiert, der AHAS-Promoter (
WO2008124495 ) oder der CaffeoylCoA-MT-Promoter und OsCP12 aus Reis (
WO2006084868 ).
-
Die erfindungsgemäßen konstitutiven Promoter mit hoher Expression, die funktionell mit einer NEENA verbunden sind, können in jeglicher Pflanze eingesetzt werden, zum Beispiel einer Moos-, Farn-, Gymnospermen- oder Angiospermen-pflanze, zum Beispiel einer monokotylen oder einer dikotylen Pflanze. In einer bevorzugten Ausführungsform kann der erfindungsgemaße Promoter, der funktionell mit einer NEENA verbunden ist, in monokotylen oder dikotylen Pflanzen, vorzugsweise Kulturpflanzen wie Mais, Soja, Canola, Baumwolle, Kartoffel, Zuckerrübe, Reis, Weizen, Sorghum, Gerste, Musa, Zuckerrohr, Miscanthus und dergleichen, eingesetzt werden. In einer bevorzugten Ausführungsform der Erfindung kann der Promoter, der funktionell mit einer NEENA verbunden ist, in monokotylen Kulturpflanzen wie Mais, Reis, Weizen, Sorghum, Musa, Miscanthus, Zuckerrohr oder Gerste eingesetzt werden. In einer besonders bevorzugten Ausführungsform kann der Promoter, der funktionell mit einer NEENA verbunden ist, in dikotylen Kulturpflanzen wie Soja, Canola, Baumwolle, Zuckerrübe oder Kartoffel, eingesetzt werden.
-
Ein konstitutiver Promoter mit hoher Expression bedeutet im Zusammenhang mit der Anmeldung zum Beispiel einen Promoter, der funktionell mit einer NEENA verbunden ist, die eine verstärkte Expression des konstitutiven Promoters in einer Pflanze oder einem Teil davon führt, wobei die Akkumulation der RNA bzw. die RNA-Syntheserate, die von dem Nukleinsäuremolekül unter der Kontrolle des entsprechenden Promoters in funktioneller Verknüpfung mit einer NEENA abstammen, höher, vorzugsweise signifikant höher, ist als die Expression, die von demselben Promoter, dem eine erfindungsgemäße NEENA fehlt, verursacht wird. Vorzugsweise ist die RNA-Menge der entsprechenden Nukleinsäure und/oder die RNA-Syntheserate und/oder RNA-Stabilität in einer Pflanze 50% oder mehr, zum Beispiel 100% oder mehr, vorzugsweise 200% oder mehr, stärker bevorzugt 5fach oder mehr, noch stärker bevorzugt 10fach oder mehr, am stärksten bevorzugt 20fach oder mehr, zum Beispiel 50fach, im Vergleich zu einer Kontrollpflanze desselben Alters, die unter denselben Bedingungen herangezogen wird und denselben konstitutiven Promoter umfasst, wobei dieser Promoter nicht mit einer erfindungsgemäßen NEENA funktionell verknüpft ist, erhöht.
-
Im vorliegenden Text bedeutet ”signifikant höher” statistische Signifikanz, die der Fachmann zu bestimmen weiß, zum Beispiel durch Anwenden von statistischen Tests, wie dem t-Test, auf die entsprechenden Datensätze.
-
Verfahren zum Nachweisen der Expression, die von einem Promoter vermittelt wird, sind fachbekannt. So zum Beispiel kann der Promoter funktionell mit einem Markergen, wie GUS, GFP oder Luciferase verknüpft werden und die Aktivität des jeweiligen Proteins, das von dem jeweiligen Markergen codiert wird, kann in der Pflanze oder einem Teil davon bestimmt werden. Als repräsentatives Beispiel wird das Verfahren zum Nachweisen von Luciferase unten genau beschrieben. Weitere Methoden sind zum Beispiel das Messen des Steady-State-Niveaus oder der RNA-Syntheserate des Nukleinsäuremoleküls unter der Kontrolle des Promoters nach fachbekannten Verfahren, zum Beispiel mittels Northern-Blot-Analyse, qPCR, Run-On-Assays oder anderen fachbekannten Verfahren.
-
Der Fachmann ist mit verschiedenen Verfahren für die funktionelle Verknüpfung von zwei oder mehr Nukleinsäuremolekülen vertraut. Solche Verfahren können Restriktion/Ligation, ligaseunabhängiges Klonieren, Rekombinieren, Rekombination oder Synthese umfassen. Für das funktionelle Verknüpfen von zwei oder mehr Nukleinsäuremolekülen können andere Verfahren eingesetzt werden.
-
Eine weitere Ausführungsform der vorliegenden Erfindung ist ein Verfahren zur Herstellung einer Pflanze oder eines Teils davon mit verstärkter konstitutiver Expression von einem oder mehreren Nukleinsäuremolekül(en) im Vergleich zu einer entsprechenden Kontrollpflanze oder einem Teil davon, umfassend die folgenden Schritte: Einführen der einen oder der mehreren NEENA, umfassend ein Nukleinsäuremolekül gemäß oben unter i) bis vi) in die Pflanze oder den Teil davon und funktionelles Verknüpfen der einen oder der mehreren NEENA mit einem Promoter, insbesondere einem konstitutiven Promoter und mit einem Nukleinsäuremolekül unter der Kontrolle des Promoters, vorzugsweise des konstitutiven Promoters, wobei die NEENA zu dem Nukleinsäuremolekül heterolog ist.
-
Die NEENA kann zu dem Nukleinsäuremolekül, das unter der Kontrolle des Promoters, mit dem die NEENA funktionell verknüpft ist, ist, heterolog sein oder sowohl zu dem Promoter als auch dem Nukleinsäuremolekül unter der Kontrolle dieses Promoters heterolog sein.
-
Der Begriff „heterolog” bedeutet in Bezug auf ein Nukleinsäuremolekül oder eine DNA ein Nukleinsäuremolekül, das mit einem zweiten Nukleinsäuremolekül, mit dem es in der Natur nicht operativ verknüpft ist oder mit dem es in der Natur an einer unterschiedlichen Stelle operativ verknüpft ist, operativ verknüpft ist oder so manipuliert wird, dass es hiermit operativ verknüpft wird. So zum Beispiel ist eine erfindungsgemäße NEENA in ihrer natürlichen Umwelt funktionell mit ihrem nativen Promoter verknüpft, während sie in der vorliegenden Erfindung mit einem anderen Promoter verknüpft ist, der von demselben Organismus oder einem unterschiedlichen Organismus abstammen kann oder ein synthetischer Promoter, wie der SUPER-Promoter, sein kann. Es kann auch bedeuten, dass die NEENA der vorliegenden Erfindung mit ihrem nativen Promoter verknüpft ist, dass das Nukleinsäuremolekül unter der Kontrolle dieses Promoters jedoch heterolog zu dem Promoter umfassend die native NEENA ist. Zusätzlich soll es bedeuten, dass der Promoter und/oder das Nukleinsäuremolekül unter der Kontrolle des Promoters in funktioneller Verknüpfung mit einer erfindungsgemäßen NEENA heterolog zu dieser NEENA ist/sind, da ihre Sequenz so manipuliert worden ist, zum Beispiel durch Mutation, wie Insertionen, Deletionen usw., dass die natürliche Sequenz des Promoters und/oder des Nukleinsäuremoleküls unter der Kontrolle des Promoters modifiziert wurde und so heterolog zu einer NEENA der Erfindung geworden ist. Es kann auch bedeuten, dass die NEENA zu der Nukleinsäure, mit der sie funktionell verknüpft ist, wenn die NEENA funktionell mit ihrem nativen Promoter verknüpft ist, heterolog ist, wobei die Lage der NEENA in Bezug auf den Promoter verändert ist, so dass der Promoter nach solch einer Manipulation eine stärkere Expression aufweist.
-
Eine Pflanze mit einer verstärkten konstitutiven Expression eines Nukleinsäuremoleküls bedeutet im vorliegenden Zusammenhang eine Pflanze mit einer höheren, vorzugsweise einer statistisch signifikant höheren, konstitutiven Expression von einem Nukleinsäuremolekül im Vergleich zu einer Kontrollpflanze ohne die jeweilige NEENA in funktioneller Verknüpfung mit dem jeweiligen Nukleinsäuremolekül, wobei diese Kontrollpflanze unter denselben Bedingungen herangezogen worden ist. Bei solch einer Kontrollpflanze kann es sich um eine Wildtyppflanze oder eine transgene Pflanze handeln, die denselben Promoter, der dasselbe Gen kontrolliert, umfasst wie in der erfindungsgemäßen Pflanze, in der der Promoter nicht mit einer NEENA der Erfindung verknüpft ist.
-
Das Herstellen einer Pflanze, wie sie im vorliegenden Zusammenhang verwendet wird, umfasst Verfahren zur stabilen Transformation, wie Einführen eines rekombinanten DNA-Konstrukts in einer Pflanze oder einem Teil davon mittels Agrobacterium-vermittelter Transformation, Protoplastentransformation, Beschuss mit der Genkanone oder dergleichen und gegebenenfalls anschließendes Regenerieren einer transgenen Pflanze. Es umfasst auch Verfahren für die vorübergehende Transformation einer Pflanze oder eines Teils davon, wie Virusinfektion oder Infiltration mit Agrobacterium. Dem Fachmann sind weitere Verfahren für die stabile und/oder vorübergehende Transformation einer Pflanze oder eines Teils davon vertraut. Ansätze wie Züchtungsmethoden oder Protoplastenfusion können ebenfalls eingesetzt werden, um eine erfindungsgemäße Pflanze herzustellen, und sind hiermit abgedeckt.
-
Das erfindungsgemäße Verfahren kann auf eine beliebige Pflanze angewandt werden, zum Beispiel auf Gymnospermen oder Angiospermen, vorzugsweise Angiospermen, zum Beispiel dikotyle oder monokotyle Pflanzen, vorzugsweise dikotyle Pflanzen. Bevorzugte monokotyle Pflanzen sind zum Beispiel Mais, Weizen, Reis, Gerste, Sorghum, Musa, Zuckerrohr, Miscanthus, und Brachypodium, besonders bevorzugte monokotyle Pflanzen sind Mais, Weizen und Reis. Bevorzugte dikotyle Pflanzen sind zum Beispiel Soja, Raps, Canola, Lein, Baumwolle, Kartoffel, Zuckerrübe, Tagetes und Arabidopsis, besonders bevorzugte dikotyle Pflanzen sind Soja, Raps, Canola und Kartoffel.
-
In einer Ausführungsform der Erfindung umfassen die wie oben definierten Verfahren die folgenden Schritte:
- a) Einführen einer oder mehrerer NEENA, umfassend ein Nukleinsäuremolekül gemäß oben i) bis vi) in eine Pflanze oder einen Teil davon und
- b) Integrieren der einen oder mehreren NEENA in das Genom der Pflanze oder des Teils davon, wobei die eine oder die mehreren NEENA funktionell mit einer endogenen, vorzugsweise konstitutiv exprimierten, Nukleinsäure, die zu der einen oder den mehreren NEENA heterolog ist, verknüpft ist und gegebenenfalls
- c) Regenerieren einer Pflanze oder eines Teils davon, die bzw. der die eine oder die mehreren NEENA aus der transformierten Zelle umfasst.
-
Die NEENA kann in Bezug auf das Nukleinsäuremolekül, das unter der Kontrolle des Promoters, mit dem die NEENA funktionell verknüpft ist, steht, heterolog sein oder sowohl zu dem Promoter als auch zu dem Nukleinsäuremolekül unter der Kontrolle des Promoters heterolog sein.
-
Das eine oder die mehreren NEENA-Moleküle) kann/können in die Pflanze oder den Teil davon mittels Beschuss mit der Genkanone, Protoplastenelektroporation, Virusinfektion, Agrobacterium-vermittelte Transformation oder nach einem beliebigen anderen fachbekannten Ansatz eingeführt werden. Das NEENA-Molekül kann zum Beispiel in in ein Plasmid oder in Virus-DNA oder Virus-RNA integrierter Form eingeführt werden. Das NEENA-Molekül kann vor der Einführung in die Pflanze oder den Teil der Pflanze auch auf einem BAC, YAC oder künstlichen Chromosom umfasst sein. Es kann auch als lineares Nukleinsäuremolekül umfassend die NEENA-Sequenz eingeführt werden, wobei zusätzliche Sequenzen neben der NEENA-Sequenz auf dem Nukleinsäuremolekül vorhanden sein können. Diese Sequenzen, die der NEENA-Sequenz benachbart sind, können von ungefähr 20 Bp, zum Beispiel 20 Bp bis mehreren 100 Basenpaaren, zum Beispiel 100 Bp oder mehr, groß sein und können die Integration in das Genom, zum Beispiel durch homologe Rekombination, erleichtern. Es kann jegliche sonstige Methode für die Integration in ein Genom eingesetzt werden, egal, ob es sich dabei um Ansätze für die gezielte Integration, wie homologe Rekombination, oder um Ansätze mit zufälliger Integration, wie illegitime Rekombination, handelt.
-
Die endogene, vorzugsweise konstitutiv exprimierte Nukleinsäure, mit der das NEENA-Molekül funktionell verknüpft sein kann, kann jede beliebige Nukleinsäure sein, vorzugsweise jedes Nukleinsäuremolekül, das konstitutiv exprimiert wird. Bei dem Nukleinsäuremolekül kann es sich um ein für ein Protein codierendes Nukleinsäuremolekül oder um ein nichtcodierendes Molekül, wie Antisense- RNA, rRNA, tRNA, miRNA, ta-siRNA, siRNA, dsRNA, snRNA, snoRNA oder eine beliebige andere nichtcodierende fachbekannte RNA handeln.
-
Der Fachmann ist mit Verfahren zum Identifizieren von Nukleinsäuremolekülen, die konstitutiv exprimiert werden und auf die das erfindungsgemäße Verfahren vorzugsweise angewandt werden kann, zum Beispiel durch Microarray-Chip-Hybridisierung, qPCR, Northern-Blot-Analyse, Sequenzierung der nächsten Generation usw. vertraut.
-
Ein weiterer Weg des Durchführens der erfindungsgemäßen Verfahren kann Folgendes sein:
- a) Bereitstellen eines Expressionskonstrukts, umfassend eine oder mehrere NEENA, umfassend ein Nukleinsäuremolekül gemäß oben i) bis vi) in funktioneller Verknüpfung mit einem vorzugsweise konstitutiven Promoter gemäß obiger Definition und mit einem oder mehreren Nukleinsäuremolekül(en), wobei Letztere(s) zu der einen oder den mehreren NEENA heterolog ist/sind und das/die unter der Kontrolle des vorzugsweise konstitutiven Promoters steht/stehen, und
- b) Integrieren des Expressionskonstrukts, umfassend die eine oder die mehreren NEENA in das Genom der Pflanze oder des Teils davon und gegebenenfalls
- c) Regenerieren einer Pflanze oder eines Teils davon, umfassend das eine oder die mehreren Expressionskonstrukt(e) aus der transformierten Pflanze oder dem Teil davon. Die NEENA kann zu dem Nukleinsäuremolekül, das unter der Kontrolle des Promoters, mit dem die NEENA funktionell verknüpft ist, steht, heterolog sein oder sowohl zu dem Promoter als auch dem Nukleinsäuremolekül unter der Kontrolle dieses Promoters heterolog sein.
-
Das Expressionskonstrukt kann in das Genom der entsprechenden Pflanze nach einem beliebigen fachbekannten Verfahren integriert werden. Die Integration kann zufällig erfolgen, und zwar unter Verwendung von Verfahren wie Beschuss mit der Genkanone oder Agrobakteriumvermittelte Transformation. In einer bevorzugten Ausführungsform erfolgt die Integration über die gezielte Integration, zum Beispiel durch homologe Rekombination. Das letztgenannte Verfahren würde es gestatten, das Expressionskonstrukt umfassend einen Promoter mit hoher Expression, der funktionell mit einer NEENA verknüpft ist, in eine günstige Region des Genoms zu integrieren. Günstige Regionen des Genoms sind zum Beispiel Genomregionen, von denen bekannt ist, dass sie Gene umfassen, die stark exprimiert werden, zum Beispiel in Samen, und die daher die von dem Expressionskonstrukt stammende Expression im Vergleich zu einer Genomregion, die keine Transkriptionsaktivität aufweist, erhöhen.
-
In einer weiteren bevorzugten Ausführungsform ist/sind die eine oder die mehreren NEENA Funktionell mit einem Promoter, vorzugsweise einem konstitutiven Promoter, nahe der Transkriptionsstartstelle des heterologen Nukleinsäuremoleküls verknüpft.
-
Nahe der Transkriptionsstartstelle bedeutet im vorliegenden Zusammenhang das funktionelle Verknüpfen von einer oder der mehreren NEENA mit einem Promoter, vorzugsweise einem konstitutiven Promoter, 2500 Bp oder weniger, vorzugsweise 2000 Bp oder weniger, stärker bevorzugt 1500 Bp oder weniger, noch stärker bevorzugt 1000 Bp oder weniger und am stärksten bevorzugt 500 Bp oder weniger von der Transkriptionsstartstelle des heterologen Nukleinsäuremoleküls. Es ist deutlich, dass die NEENA stromaufwärts oder stromabwärts in dem jeweiligen Abstand von der Transkriptionsstartstelle des entsprechenden Promoters integriert werden kann. Die eine oder die mehreren NEENA braucht/brauchen daher nicht unbedingt in dem Transkript der entsprechenden heterologen Nukleinsäure unter der Kontrolle des vorzugsweise konstitutiven Promoters, mit dem die eine oder die mehreren NEENA funktionell verknüpft ist/sind, beinhaltet sein. Vorzugsweise wird die eine oder werden die mehreren NEENA stromabwärts von der Transkriptionsstartstelle des entsprechenden Promoters, vorzugsweise eines konstitutiven Promoters, integriert. Die Integrationsstelle stromabwärts der Transkriptionsstartstelle kann im 5' UTR, im 3' UTR, in einem Exon oder Intron liegen, oder sie kann ein Intron oder teilweise oder vollständig die 5' UTR oder die 3' UTR der heterologen Nukleinsäure unter der Kontrolle des vorzugsweise konstitutiven Promoters ersetzen. Vorzugsweise wird die eine oder werden die mehreren NEENA in die 5' UTR oder ein Intron integriert, oder die NEENA ersetzt ein Intron oder einen Teil oder die vollständige 5' UTR, am stärksten bevorzugt wird sie in die 5' UTR der entsprechenden heterologen Nukleinsäure integriert.
-
Eine weitere Ausführungsform der Erfindung umfasst ein rekombinantes Expressionskonstrukt, das eine oder mehrere NEENA umfassend ein Nukleinsäuremolekül gemäß oben in i) bis vi) umfasst.
-
Das rekombinante Expressionskonstrukt kann weiterhin einen oder mehrere Promoter, vorzugsweise konstitutive(n) Promoter, mit dem/denen die eine oder die mehreren NEENA funktionell verknüpft ist/sind, und gegebenenfalls ein oder mehrere exprimierte(s) Molekül(e), wobei Letztere(s) zu der einen oder den mehreren NEENA heterolog ist/sind, umfassen.
-
Die NEENA kann zu dem Nukleinsäuremolekül, das unter der Kontrolle des Promoters, mit dem die NEENA funktionell verknüpft ist, steht, heterolog sein, oder sie kann sowohl zu dem Promoter als auch zu dem Nukleinsäuremolekül unter der Kontrolle des Promoters heterolog sein. Das Expressionskonstrukt kann eine oder mehrere, zum Beispiel zwei oder mehr, zum Beispiel 5 oder mehr, wie 10 oder mehr, Kombinationen von Promotern, vorzugsweise konstitutiven Promotern, in funktioneller Verknüpfung mit einer NEENA und ein Nukleinsäuremolekül, des heterolog zu der entsprechenden NEENA zu exprimieren ist, umfassen. Das Expressionskonstrukt kann auch weitere Promoter umfassen, die keine mit dem zu exprimierenden Nukleinsäuremolekül funktionell verknüpfte NEENA umfassen und die homolog oder heterolog zu dem entsprechenden Promoter sind.
-
Ein rekombinanter Expressionsvektor, der eines oder mehrere rekombinante Expressionskonstrukte wie oben definiert umfasst, ist eine weitere Ausführungsform der Erfindung. Der Fachmann ist mit einer Vielzahl von Expressionsvektoren, die in der vorliegenden Erfindung verwendet werden können, vertraut. Verfahren zum Einführen solch eines Vektors, der solch ein Expressionskonstrukt, umfassend zum Beispiel einen Promoter in funktioneller Verknüpfung mit einer NEENA und gegebenenfalls weitere Elemente wie einen Terminator, in das Genom einer Pflanze sowie Verfahren zum Gewinnen von transgenen Pflanzen aus einer transformierten Zelle sind ebenso in der Fachwelt gut bekannt. Je nach dem für die Transformation einer Pflanze oder eines Teils davon verwendeten Verfahren kann der gesamte Vektor in das Genom der Pflanze oder des Teils davon integriert werden, oder es können bestimmte Bestandteile des Vektors in das Genom integriert werden, wie zum Beispiel eine T-DNA.
-
Die vorliegende Erfindung umfasst auch eine transgene Pflanze oder amen Teil davon, umfassend eine oder mehrere heterologe NEENA gemäß oben in i) bis vi). Eine NEENA ist als heterolog zu der Pflanze anzusehen, wenn sie synthetisch ist, von einem anderen Organismus oder demselben Organismus abgeleitet ist, ihre natürliche Lage in dem Genom jedoch im Vergleich zu einer Kontrollpflanze, wie zum Beispiel einer Wildtyppflanze, abgegeben wird. Eine abgegebene Lage im Genom bedeutet, dass die NEENA auf einem anderen Chromosom liegt oder dass sie auf demselben Chromosom liegt, jedoch 10 kB oder mehr, zum Beispiel 10 kB, vorzugsweise 5 kB oder mehr, zum Beispiel 5 kB, stärker bevorzugt 1000 Bp oder mehr, zum Beispiel 1000 Bp, noch stärker bevorzugt 500 Bp oder mehr, zum Beispiel 500 Bp, besonders bevorzugt 100 Bp oder mehr, zum Beispiel 100 Bp, am meisten bevorzugt 10 Bp oder mehr, zum Beispiel 10 Bp, vom Locus ihrer natürlichen Lage in dem Genom, zum Beispiel in einer Wildtyppflanze, entfernt liegt.
-
Eine transgene Zelle oder transgene Pflanze oder ein Teil davon umfassend einen rekombinanten Expressionsvektor wie oben definiert oder ein rekombinantes Expressionskonstrukt wie oben definiert ist eine weitere Ausführungsform der Erfindung. Die transgene Zelle, transgene Pflanze oder der Teil davon kann aus der Gruppe bestehend aus Bakterien, Pilzen, Hefen oder Pflanzen-, Insekten- oder Säugetierzellen oder Pflanzen ausgewählt werden. Bevorzugt sind die transgenen Zellen Bakterien, Pilze, Hefen oder Pflanzenzellen. Bevorzugte Bakterien sind Enterobacteria wie E. coli und Bakterien der Gattung Agrobacteria, zum Beispiel Agrobacterium tumefaciens und Agrobacterium rhizogenes. Bevorzugte Pflanzen sind monokotyle oder dikotyle Pflanzen, zum Beispiel monokotyle oder dikotyle Kulturpflanzen wie Mais, Soja, Canola, Baumwolle, Kartoffel, Zuckerrübe, Reis, Weizen, Sorghum, Gerste, Miscanthus, Musa, Zuckerrohr oder dergleichen. Bevorzugte Kulturpflanzen sind Mais, Reis, Weizen, Soja, Canola, Baumwolle oder Kartoffel. Besonders bevorzugte dikotyle Kulturpflanzen sind Soja, Canola, Baumwolle oder Kartoffel. Besonders bevorzugte monokotyle Kulturpflanzen sind Mais, Weizen und Reis.
-
Eine transgene Zellkultur, transgene Samen, Teile oder Vermehrungsmaterial abstammend von einer transgenen Zelle oder Pflanze oder einem Teil davon wie oben definiert, umfassend die heterologe NEENA gemäß oben in i) bis vi) oder das rekombinante Expressionskonstrukt oder den rekombinanten Vektor wie oben definiert sind weitere Ausführungsformen der Erfindung. Transgene Teile oder transgenes Vermehrungsmaterial soll im vorliegenden Zusammenhang alle Gewebe und Organe umfassen, zum Beispiel Blatt, Stängel und Frucht sowie Material, das sich für die Vermehrung und/oder Regeneration von Pflanzen eignet, wie Ableger, Edelreiser, Absenker, Zweige oder Sprosse umfassend die entsprechende NEENA, das entsprechende rekombinante Expressionskonstrukt oder den entsprechenden rekombinanten Vektor.
-
Eine weitere Ausführungsform der Erfindung ist die Verwendung der NEENA gemäß oben in i) bis vi) oder des rekombinanten Konstrukts oder des rekombinanten Vektors wie oben definiert zum Verstärken der Expression in Pflanzen oder Teilen davon.
-
Die vorliegende Anmeldung stellt also Nukleinsäuremoleküle bereit, die die Genexpression mit Spezifität bzw. Bevorzugung für den Samen verstärken und die einen oder mehrere Promoter, vorzugsweise samenspezifischen und/oder samenprferentiellen Promoter, in funktioneller Verknüpfung mit einer oder mehreren NEENA umfassen. Zusätzlich bereitgestellt werden die Verwendung von solchen Nukleinsäuremolekülen, die die Genexpression verstärken, sowie Expressionskonstrukte, Expressionsvektoren, transgene Pflanzen oder Teile davon und transgene Zellen, umfassend solche Nukleinsäuremoleküle, die die Genexpression verstärken.
-
Eine Verwendung einer transgenen Zellkultur, eines transgenen Samens, von Teilen oder von Vermehrungsmaterial abgeleitet von einer transgenen Zelle oder Pflanze oder einem Teil davon wie oben definiert für die Herstellung von Nahrungsmitteln, Tierfuttermitteln, Samen, Pharmazeutika oder Feinchemikalien wird ebenso von der vorliegenden Erfindung umfasst.
-
DEFINITIONEN
-
- Abkürzungen: NEENA – die Nukleinsäureexpression verstärkende Nukleinsäure, GFP – „green fluorescent protein”, GUS – beta-Glucuronidase, BAP – 6-Benzylaminopurin; 2,4-D – 2,4-Dichlorphenoxyessigsäure; MS – Murashige-Skoog-Medium; NAA – 1-Naphthalinessigsäure; MES, 2-(N-Morpholino)ethansulfonsäure, IAA – Indolessigsäure; Kan – Kanamycinsulfat; GA3 – Gibberellinsäure; TimentinTM – Ticarcillin-Dinatrium/Kaliumclavulanat; μl: Mikroliter.
-
Es ist klar, dass die vorliegende Erfindung nicht auf die als solche beschriebenen jeweiligen Methoden oder Protokolle beschränkt ist. Es ist ebenfalls klar, dass die im vorliegenden Text verwendete Terminologie lediglich der Beschreibung von bestimmten Ausführungsformen dient und den Umfang der vorliegenden Erfindung, der nur durch die beigelegten Ansprüche eingeschränkt wird, nicht einschränken soll. Es ist anzumerken, dass im vorliegenden Text und in den beigefügten Ansprüchen die Singularformen „ein/e/s” und „der/die/das” auch den Plural beinhalten, außer wenn dies aus dem Zusammenhang anders hervorgeht. So bedeutet zum Beispiel die Erwähnung von „einem Vektor” die Erwähnung von einer oder mehreren Vektoren und beinhaltet Äquivalente davon, mit denen der Fachmann vertraut ist, usw. Der Begriff „ungefähr” soll im vorliegenden Zusammenhang „circa”, „grob gesagt”, „ungefähr” oder „im Bereich von” bedeuten. Wird der Begriff „ungefähr” im Zusammenhang mit einem Zahlenbereich verwendet, so modifiziert er diesen Bereich dadurch, dass er die oberen und unteren Grenzen der angeführten Zahlenwerte erweitert. Im Allgemeinen wird der Begriff „ungefähr' im vorliegenden Zusammenhang dazu verwendet, um einen Zahlenwert über und unter dem angegebenen Wert zu modifizieren, und zwar um eine Varianz von 20%, vorzugsweise 10%, hinauf oder hinunter (höher oder niedriger). Im vorliegenden Zusammenhang bedeutet das Wort „oder” ein beliebiges Mitglied einer bestimmten Aufzählung und beinhaltet auch beliebige Kombinationen von Mitgliedern dieser Aufzählung. Die Wörter „umfassen”, „umfassend”, „beinhalten”, „beinhaltend” und „beinhaltet” sollen in dieser Beschreibung und in den folgenden Ansprüchen das Vorhandensein von einer/einem oder mehreren angegebenen Merkmalen, ganzen Zahlen, Komponenten oder Schritten angegeben, schließen jedoch das Vorhandensein oder die Hinzufügung von einer/einem oder mehreren anderen Merkmalen, ganzen Zahlen, Komponenten, Schritten oder Gruppen davon nicht aus. Aus Klarheitsgründen werden gewisse Ausdrücke, die in der Beschreibung verwendet werden, folgendermaßen definiert und verwendet:
Antiparallel: „Antiparallel” bezieht sich im vorliegenden Zusammenhang auf zwei Nukleotidsequenzen, die über Wasserstoffbrückenbindungen zwischen komplementären Basenresten gebunden sind, wobei die Phosphodiesterbindungen in einer Nukleotidsequenz in 5'-3'-Richtung laufen und in der anderen Nukleotidsequenz in 3'-5'-Richtung.
-
Antisense: Der Begriff „antisense” bezieht sich auf eine Nukleotidsequenz, die in Bezug auf ihre normale Orientierung für die Transkription oder Funktion invertiert ist und so ein RNA-Transkript exprimiert, das zu einem innerhalb der Wirtszelle exprimierten Target-Gen-mRNA-Molekül komplementär ist, (z. B. die mit dem Target-Gen-mRNA-Molekül oder der einzelsträngigen genomischen DNA über Watson-Crick-Basenpaarung hybridisieren kann) oder die zu einem Ziel-DNA-Molekül, wie zum Beispiel genomischer DNA, die in der Wirtszelle vorliegt, komplementär ist.
-
Codierregion: Im vorliegenden Zusammenhang bezieht sich der Begriff „Codierregion”, wenn er in Bezug auf ein Strukturgen verwendet wird, auf die Nukleotidsequenzen, die für die in dem naszierenden Polypeptid als Ergebnis der Translation eines mRNA-Moleküls auftretenden Aminosäuren codieren. Die Codierregion wird in Eukaryonten an der 5'-Seite von dem Nukleotid-Triplett „ATG”, das für das Initiator-Methionin codiert, und an der 3'-Seite von einem der drei Tripletts, die Stopp-Codons spezifizieren (d. h. TAA, TAG, TGA), begrenzt. Zusätzlich dazu, dass die genomischen Formen eines Gens Introns enthalten, können sie auch Sequenzen beinhalten, die am 5'- und am 3'-Ende der Sequenzen, die am RNA-Transkript vorhanden sind, liegen. Diese Sequenzen werden als flankierende” Sequenzen oder Regionen bezeichnet (diese flankierenden Sequenzen befinden sich in 5'- oder 3'-Richtung von den nichttranslatierten Sequenzen, die auf dem mRNA-Transkript vorliegen). Die 5'-flankierende Region kann Regulationssequenzen wie Promoter und Enhancer enthalten, welche die Transkription des Gens kontrollieren oder beeinflussen. Die 3'-flankierende Region kann Sequenzen enthalten, die Transkriptionstermination, posttranskriptionelle Spaltung und Polyadenylierung dirigieren.
-
Komplementär: „komplementär” oder „Komplementarität” bezieht sich auf zwei Nukleotidsequenzen, die antiparallele Nukleotidsequenzen umfassen, welche fähig sind, sich bei Bildung von Wasserstoffbrückenbindungen zwischen den komplementären Basenresten in den antiparallelen Nukleotidsequenzen miteinander zu paaren (gemäß den Basenpaarungsregeln). Zum Beispiel ist die Sequenz 5'-AGT-3' zu der Sequenz 5'-ACT-3' komplementär. Die Komplementarität kann „teilweise” oder „vollständig” sein. Eine „teilweise” Komplementarität besteht dann, wenn eine oder mehrere Nukleinsäurebasen nicht gemäß den Basenpaarungsregeln gepaart sind. Eine „vollständige” oder „komplette” Komplementarität zwischen den Nukleinsäuremolekülen besteht dann, wenn jede einzelne Nukleinsäurebase mit einer anderen Base gemäß den Basenpaarungsregeln gepaart ist. Das Ausmaß der Komplementarität zwischen den Nukleinsäuremolekülsträngen hat signifikante Auswirkungen auf die Wirksamkeit und Stärke der Hybridisierung zwischen den Nukleinsäuremolekülsträngen. Ein „Komplement” einer Nukleinsäuresequenz bedeutet im vorliegenden Zusammenhang eine Nukleotidsequenz, deren Nukleinsäuremoleküle eine vollständige Komplementarität zu den Nukleinsäuremolekülen der Nukleinsäuresequenz aufweisen.
-
Doppelstrang-RNA: ein „Doppelstrang-RNA”-Molekül oder „dsRNA”-Molekül umfasst ein sense-RNA-Fragment einer Nukleotidsequenz und ein antisense-RNA-Fragment der Nukleotidsequenz, die beide Nukleotidsequenzen, die zueinander komplementär sind, umfassen und es so dem sense- und dem antisense-RNA-Fragment gestatten, sich miteinander zu paaren und ein Doppelstrang-RNA-Molekül zu bilden.
-
Endogen: Eine „endogene” Nukleotidsequenz bezieht sich auf eine Nukleotidsequenz, die in dem Genom der untransformierten Pflanzenzelle vorhanden ist.
-
Verstärkte Expression: die Begriffe „verstärken” oder „erhöhen” der Expression eines Nukleinsäuremoleküls in einer Pflanzenzelle werden im vorliegenden Text gleichwertig eingesetzt und bedeuten, dass das Expressionsniveau des Nukleinsäuremoleküls in einer Pflanze, einem Teil einer Pflanze oder einer Pflanzenzelle nach Anwendung eines Verfahrens der vorliegenden Erfindung höher ist als die Expression in der Pflanze, dem Teil der Pflanze oder der Pflanzenzelle vor dem Anwenden des Verfahrens oder im Vergleich zu einer Referenzpflanze, der ein rekombinantes erfindungsgemäßes Nukleinsäuremolekül fehlt. So zum Beispiel umfasst die Referenzpflanze dasselbe Konstrukt, dem lediglich die entsprechende NEENA fehlt. Die Begriffe „verstärkt” oder „erhöht” sind im vorliegenden Zusammenhang synonym und bedeuten eine höhere, vorzugsweise signifikant höhere, Expression des zu exprimierenden Nukleinsäuremoleküls. Im vorliegenden Zusammenhang bedeutet eine Verstärkung” oder „Erhöhung” der Menge eines Agens wie eines Proteins, mRNA oder RNA, dass die Menge im Vergleich zu einer im Wesentlichen identischen Pflanze, einem im Wesentlichen identischen Teil einer Pflanze oder einer im Wesentlichen identischen Pflanzenzelle, die/der unter im Wesentlichen identischen Bedingungen herangezogen wurde und der/dem ein erfindungsgemäßes rekombinantes Nukleinsäure fehlt, der/dem zum Beispiel das erfindungsgemäße NEENA-Mokekül, des erfindungsgemäße rekombinante Konstrukt oder der erfindungsgemäße rekombinante Vektor fehlt, erhöht ist. Im vorliegenden Zusammenhang bedeutet „Verstärkung” oder „Erhöhung” der Menge eines Agens wie zum Beispiel einer preRNA, mRNA, rRNA, tRNA, snoRNA, snRNA, die von dem Zielgen exprimiert wird, und/oder des von dem Zielgen codierten Proteinprodukts, dass der Gehalt mindestens 50% oder mehr, zum Beispiel 100% oder mehr, vorzugsweise 200% oder mehr, stärker bevorzugt 5fach oder mehr, noch stärker bevorzugt 10fach oder mehr, am stärksten bevorzugt 20fach oder mehr, zum Beispiel 50fach, in Bezug auf eine Zelle oder einen Organismus, der/dem ein erfindungsgemäßes rekombinantes Nukleinsäuremolekül fehlt, erhöht ist. Die Erhöhung oder Verstärkung kann nach Verfahren, mit denen der Fachmann vertraut ist, bestimmt werden. So kann die Erhöhung oder Verstärkung der Nukleinsäure- oder Proteinmenge zum Beispiel durch einen immunologischen Nachweis des Proteins bestimmt werden. Weiterhin können Techniken wie Protein-Assay, Fluoreszenz, Northern-Hybridisierung, Nukleaseschutz-Assay, reverse Transkription (quantitative RT-PCR), ELISA (enzyme-linked immunosorbent assay), Western-Blotting, Radioimmun-Assay (RIA) oder andere Immun-Assays und die fluoreszenzaktivierte Zellanalyse (FACS) verwendet werden, um ein bestimmtes Protein oder eine bestimmte RNA in einer Pflanze oder Pflanzenzelle zu messen. Je nach der Art des induzierten Proteinprodukts, kann auch seine Aktivität oder die Auswirkung auf den Phänotyp des Organismus oder der Zelle bestimmt werden. Der Fachmann ist mit Methoden zur Bestimmung der Proteinmenge vertraut. Es sind zum Beispiel die folgenden zu erwähnen: die Mikro-Biuret Methode (Goa J. (1953) Scand. J. Clin. Lab. Invest. 5: 218–222), die Methode von Folin-Ciocalteau (Lowry O. H. et al. (1951) J. Biol. Chem. 193: 265–275) oder die Absorptionsmessung von CBB G-250 (Bradford M. M. (1976) Analyt. Biochem. 72: 248–254). Als ein Beispiel für die quantitative Bestimmung der Aktivität eines Proteins wird der Nachweis der Luciferaseaktivitat in den Beispielen unten beschrieben.
-
Expression: „Expression” bezieht sich auf die Biosynthese eines Genprodukts, vorzugsweise die Transkription und/oder Translation einer Nukleotidsequenz, zum Beispiel eines endogenen Gens oder eines heterologen Gens in einer Zelle. Bei einem Strukturgen zum Beispiel involviert Expression die Transkription des Strukturgens in mRNA und – gegebenenfalls – die anschließende Translation der mRNA in ein oder mehrere Polypeptide. In anderen Fällen kann sich Expression nur auf die Transkription der DNA, die ein RNA-Molekül birgt, beziehen.
-
Expressionskonstrukt: „Expressionskonstrukt” im vorliegenden Zusammenhang bedeutet eine DNA-Sequenz, die fähig ist, die Expression einer bestimmten Nukleotidsequenz in einem entsprechenden Teil einer Pflanze oder einer entsprechenden Pflanzenzelle zu dirigieren, der/die einen Promoter, der im Teil einer Pflanze oder einer Pflanzenzelle, in dem/die sie eingeführt werden wird, funktionell ist, umfasst, und der operativ mit der Nukleotidsequenz von Interesse verbunden ist, die – gegebenenfalls – operativ mit Terminationssignalen verbunden ist. Ist eine Translation erforderlich, so umfasst es typischerweise auch Sequenzen, die für die korrekte Translation der Nukleotidsequenz erforderlich sind. Die Codierregion kann für elf interessierendes Protein codieren, kann jedoch auch für eine interessierende funktionelle RNA, zum Beispiel RNAa, siRNA, snoRNA, snRNA, microRNA, ta-siRNA oder für eine beliebige sonstige nichtcodierende regulierende RNA codieren, und zwar in sense- oder antisense-Richtung. Das Expressionskonstrukt, das die interessierende Nukleotidsequenz umfasst, kann eine Chimäre sein, das bedeutet, dass mindestens eine seiner Komponenten in Bezug auf mindestens eine seiner sonstigen Komponenten heterolog ist. Das Expressionskonstrukt kann auch ein natürlich vorkommendes Expressionskonstrukt sein, das jedoch in rekombinanter Form erhalten wurde, so dass es sich für die heterologe Expression eignet. Typischerweise jedoch ist das Expressionskonstrukt in Bezug auf den Wirt heterolog, d. h. die bestimmte DNA-Sequenz des Expressionskonstrukts kommt nicht auf natürliche Weise in der Wirtszelle vor und muss in die Wirtszelle oder einen Vorläufer der Wirtszelle durch ein Transformations-Event eingeführt worden sein. Die Expression der Nukleotidsequenz in dem Expressionskonstrukt kann unter Kontrolle eines konstitutiven Promoters oder eines induzierbaren Promoters, der die Transkription nur dann initiiert, wenn die Wirtszelle einem bestimmten äußeren Reiz ausgesetzt wird, stehen. Bei einer Pflanze kann der Promoter auch für ein bestimmtes Gewebe oder Organ oder Entwicklungsstadium spezifisch sein.
-
Fremd: Der Begriff „fremd” bezieht sich auf jedes Nukleinsäuremolekül (z. B. eine Gensequenz), das in das Genom einer Zelle durch versuchsmäßge Manipulationen eingeführt wird und kann Sequenzen beinhalten, die in dieser Zelle auftreten, solange die eingeführte Sequenz irgendeine Modifikation enthält (z. B. eine Punktmutation, das Vorhandensein eines Selektionsmarkergens usw.) und sich daher von der natürlich vorkommenden Sequenz unterscheidet.
-
Funktionelle Verknüpfung: der Begriff „funktionelle Verknüpfung” oder „funktionell verknüpft” soll zum Beispiel die aufeinanderfolgende Anordnung eines Regulationselements (z. B. eines Promoters) mit einer zu exprimierenden Nukleinsäuresequenz sowie gegebenenfalls weiteren Regulationselementen (wie z. B. einem Terminator oder einer NEENA) so, dass jedes der Regulationselemente seine gewünschte Funktion, nämlich die Expression der Nukleinsäuresequenz zu gestatten, zu modifizieren, zu erleichtern oder sonst wie zu beeinflussen, ausüben kann, bedeuten. Als Synonym kann der Begriff „operative Verknüpfung” oder „operativ verknüpft” verwendet werden. Je nach der Anordnung der Nukleinsäuresequenzen in Bezug auf sense- oder antisense-RNA kann Expression erfolgen. Zu diesem Zweck ist eine direkte Bindung im chemischen Sinn nicht unbedingt erforderlich. Genetische Kontrollsequenzen wie zum Beispiel Enhancer-Sequenzen, können ihre Funktion auch auf die Zielsequenz von Positionen ausüben, die weiter entfernt sind, ja sogar von anderen DNA-Molekülen aus. Bevorzugte Anordnungen sind solche, in denen die rekombinant zu exprimierende Nukleinsäuresequenz hinter die als Promoter agierende Sequenz gestellt wird, so dass die zwei Sequenzen kovalent miteinander verbunden sind. Die Distanz zwischen der Promotersequenz und der rekombinant zu exprimierenden Nukleinsäuresequenz beträgt vorzugsweise weniger als 200 Basenpaare, insbesondere vorzugsweise weniger als 100 Basenpaare, ganz besonders bevorzugt weniger als 50 Basenpaare. In einer bevorzugten Ausführungsform befindet sich die zu transkribierende Nukleinsäuresequenz hinter dem Promoter, so dass der Transkriptionsstart mit dem gewünschten Anfang der chimären RNA der Erfindung identisch ist. Eine funktionelle Verknüpfung und ein Expressionskonstrukt können wie beschrieben mit Hilfe von üblichen Rekombinations- und Klonierungstechniken erzeugt werden (z. B. in Maniatis T., Fritsch E. F. und Sambrook J. (1989) Molecular Cloning: A Laboratory Manual, 2. Ausg., Cold Spring Harbor Laboratory, Cold Spring Harbor (NY); Silhavy et al. (1984) Experiments with Gene Fusions, Cold Spring Harbor Laboratory, Cold Spring Harbor (NY); Ausubel et al. (1987) Current Protocols in Molecular Biology, Greene Publishing Assoc. und Wiley lnterscience; Gelvin et al. (Hrsg.) (1990) Plant Molecular Biology Manual; Kluwer Academic Publisher, Dordrecht, Niederlande). Weitere Sequenzen, die beispielsweise als Linker mit spezifischen Restriktionsenzymspaltstellen oder als Signalpeptid agieren, können jedoch ebenfalls zwischen die zwei Sequenzen gestellt werden. Die Insertion von Sequenzen kann auch zur Expression von Fusionsproteinen führen. Vorzugsweise kann das Expressionskonstrukt, das aus einer Verknüpfung einer Regulationsregion, zum Beispiel einem Promoter und der zu exprimierenden Nukleinsäuresequenz besteht, in vektorintegrierter Form vorliegen und in ein Pflanzengenom zum Beispiel mittels Transformation insertiert werden.
-
Gen: Der begriff „Gen” bezieht sich auf eine Region, die mit entsprechenden Regulationssequenzen, die fähig sind, die Expression des Genprodukts (z. B. ein Polypeptid oder eine funktionelle RNA) auf irgendeine Art und Weise zu regulieren, operativ verknüpft ist. Ein Gen beinhaltet untranslatierte Regulationsregionen der DNA (z. B. Promoter, Enhancer, Repressoren usw.), die vor (stromaufwärts) und nach (stromabwärts) der Codierregion (offenes Leseraster, ORF) stehen, sowie, wo zutreffend, dazwischenliegende Sequenzen (z. B. Introns) zwischen einzelnen Codierregionen (d. h. Exons). Der Begriff „Strukturgen” soll im vorliegenden Zusammenhang eine DNA-Sequenz bedeuten, die in mRNA transkribiert wird, welche dann in eine Aminosäuresequenz, die für ein bestimmtes Polypeptid spezifisch ist, translatiert wird.
-
Genom und genomische DNA: Die Begriffe „Genom” oder „genomische DNA” beziehen sich auf die vererbbaren genetischen Informationen eines Wirtsorganismus. Diese genomische DNA umfasst die DNA des Zellkerns (auch als chromosomale DNA bezeichnet), jedoch auch die DNA der Plastiden (z. B. Chloroplasten) und von anderen Zellorganellen (z. B. der Mitochondrien). Vorzugsweise beziehen sich die Ausdrücke Genom oder genomische DNA auf die chromosomale DNA des Zellkerns.
-
Heterolog: Der Begriff „heterolog” bedeutet in Bezug auf ein Nukleinsäuremolekül oder eine DNA ein Nukleinsäuremolekül, das mit einem zweiten Nukleinsäuremolekül, mit dem es in der Natur nicht operativ verknüpft ist oder mit dem es in der Natur in einer unterschiedlichen Lage operativ verknüpft ist, operativ verknüpft ist bzw. dahingehend manipuliert wird, dass es damit operativ verknüpft wird. Ein heterologes Expressionskonstrukt, umfassend ein Nukleinsäuremolekül und mindestens ein Regulationsnukleinsäuremolekül (wie einen Promoter oder ein Transkriptionsterminationssignal), das damit verknüpft ist, ist zum Beispiel ein Konstrukt, das durch versuchsmäßige Manipulationen entsteht, wobei entweder a) das Nukleinsäuremolekül oder b) das Regulationsnukleinsäuremolekül oder c) beide (d. h. a) und b)) nicht in ihrer natürlichen (nativen) genetischen Umwelt vorliegt/vorliegen, oder durch versuchsmäßige Manipulationen modifiziert wurde, wobei ein Beispiel für eine Modifikation eine Substitution, Addition, Deletion, Inversion oder Insertion von einem oder mehr Nukleotidresten ist. Die natürliche genetische Umwelt bezieht sich auf den natürlichen chromosomalen Locus in dem Ausgangsorganismus oder auf das Vorhandensein in einer genomischen Bibliothek. Bei einer genomischen Bibliothek bleibt die natürliche genetische Umwelt der Nukleinsäuremolekülsequenz vorzugsweise erhalten, zumindest teilweise. Die Umwelt flankiert die Nukleinsäuresequenz zumindest einseitig und weist eine Sequenz mit einer Länge von mindestens 50 bp, vorzugsweise mindestens 500 bp, besonders bevorzugt mindestens 1,000 bp, ganz besonders bevorzugt mindestens 5,000 bp, auf. Ein natürlich vorkommendes Expressionskonstrukt – zum Beispiel die natürlich vorkommende Kombination eines Promoters mit dem entsprechenden Gen – wird zu einem transgenen Expressionskonstrukt, wenn es durch nichtnatürliche, synthetische, „künstliche” Verfahren wie zu Beispiel Mutagenisierung modifiziert wird. Solche Verfahren sind beschrieben worden (
US 5,565,350 ;
WO 00/15815 ). So zum Beispiel wird ein Proteincodiernukleinsäuremolekül in operativer Verknüpfung mit einem Promoter, bei dem es sich nicht um den nativen Promoter dieses Moleküls handelt, als heterolog in Bezug auf den Promoter betrachtet. Vorzugsweise ist die heterologe DNA nicht endogen mit bzw. nicht natürlich assoziiert mit der Zelle, in die sie eingeführt wird, sondern wurde aus einer anderen Zelle gewonnen oder wurde synthetisch hergestellt. Heterologe DNA beinhaltet auch eine endogene DNA-Sequenz, die eine gewisse Modifikation, nicht natürlich vorkommende, multiple Kopien einer endogenen DNA-Sequenz, oder eine DNA-Sequenz, die mit einer anderen DNA-Sequenz, mit der sie physikalisch verknüpft ist, nicht natürlich assoziiert ist, enthält. Im Allgemeinen, jedoch nicht unbedingt, codiert heterologe DNA für RNA und Proteine, die von der Zelle, in die sie exprimiert wurde, normalerweise nicht produziert werden.
-
Konstitutiver Promoter mit hoher Expression: Ein „konstitutiver Promoter mit hoher Expression” bedeutet im vorliegenden Zusammenhang einen Promoter, der konstitutive Expression in einer Pflanze oder einem Teil davon verursacht, wobei die Akkumulation oder Syntheserate der RNA oder die Stabilität der RNA, die von dem Nukleinsäuremolekül unter der Kontrolle des entsprechenden Promoters stammt, höher, vorzugsweise signifikant höher, ist als die Expression, die von dem Promoter verursacht wird, dem die NEENA der Erfindung fehlt. Vorzugsweise ist die RNA-Menge und/oder die RNA-Syntheserate und/oder RNA-Stabilität um 50% oder mehr, zum Beispiel 100% oder mehr, vorzugsweise 200% oder mehr, stärker bevorzugt 5fach oder mehr, noch stärker bevorzugt 10fach oder mehr, am stärksten bevorzugt 20fach oder mehr, zum Beispiel 50fach, in Bezug auf einen konstitutiven Promoter, dem eine NEENA der Erfindung fehlt, erhöht.
-
Hybridisierung: Der Begriff „Hybridisierung” beinhaltet im vorliegenden Zusammenhang „jeglichen Vorgang, durch den sich ein Strang von Nukleinsäuremolekülen durch Basenpaarung mit einem Komplementärstrang verbindet” (J. Coombs (1994) Dictionary of Biotechnology, Stockton Press, New York). Die Hybridisierung und Stärke der Hybridisierung, (d. h. die Stärke der Assoziation zwischen den Nukleinsäuremolekülen) wird von Faktoren wie dem Ausmaß der Komplementarität zwischen den Nukleinsäuremolekülen, der Stringenz der vorherrschenden Bedingungen, der Tm des gebildeten Hybrids und dem G:C-Verhältnis innerhalb der Nukleinsäuremoleküle beeinflusst. im vorliegenden Zusammenhang wird der Begriff „Tm” in Bezug auf die „Schmelztemperatur” verwendet. Die Schmelztemperatur ist diejenige Temperatur, bei der eine Population von Doppelstrangnukleinsäuremolekülen halb in Einzelstränge dissoziiert. Die Gleichung für die Berechnung der Tm von Nukleinsäuremolekülen ist in der Fachwelt bekannt. Aus Standardreferenzen ergibt sich, dass ein einfacher Schätzwert des Tm-Werts mit Hilfe der folgenden Gleichung berechnet werden kann: Tm = 81,5 + 0,41 (% G + C), wenn ein Nukleinsäuremolekül in einer wässrigen Lösung mit 1 M NaCl vorliegt [siehe z. B. Anderson und Young, Quantitative Filter Hybridization, in Nucleic Acid Hybridization (1985)]. In anderen Referenzen finden sich kompliziertere Berechnungen, die Strukturcharakteristika wie auch Sequenzcharakteristika für die Berechnung der Tm mit einbeziehen. Stringente Bedingungen sind dem Fachmann bekannt und finden sich in Current Protocols in Molecular Biology, John Wiley & Sons, N.Y. (1989), 6.3.1–6.3.6.
-
„Identität”: „Identität” bedeutet in Bezug auf den Vergleich von zwei oder mehr Nukleinsäure- oder Aminosäuremolekülen, dass den Sequenzen dieser Moleküle ein gewisses Ausmaß an Sequenzähnlichkeit gemeinsam ist, wobei die Sequenzen teilweise identisch sind. Um den Prozentsatz der Identität (Homologie wird im vorliegenden Zusammenhang austauschbar verwendet) von zwei Aminosäuresequenzen oder von zwei Nukleinsäuremolekülen zu bestimmen, werden die Sequenzen für einen optimalen Vergleich untereinander geschrieben (man kann zum Beispiel Lücken in die Sequenz eines Proteins oder einer Nukleinsäure einfügen, um eine optimale Ausrichtung mit einem anderen Protein bzw. der anderen Nukleinsäure zu erzielen).
-
Dann werden die Aminosäurereste oder Nukleinsäuremoleküle an den entsprechenden Aminosäurepositionen bzw. Nukleotidpositionen verglichen. Ist eine Position in einer Sequenz durch den gleichen Aminosäurerest bzw. das gleiche Nukleinsäuremolekül wie die entsprechende Position in der anderen Sequenz belegt, so sind die Moleküle in dieser Position homolog (d. h. Aminosäure- oder Nukleinsäure„homologie” wie im vorliegenden Zusammenhang verwendet entspricht einer Aminosäure- oder Nukleinsäure„identität”). Die prozentuale Identität zwischen den beiden Sequenzen ist eine Funktion der Anzahl an identischen Positionen, die von den Sequenzen geteilt werden (d. h. % Homologie = Anzahl an identischen Positionen/Gesamtzahl an Positionen × 100). Die Ausdrücke „Homologie” und „Identität” sind somit als Synonyme anzusehen.
-
Zur Bestimmung der prozentualen Identität von zwei oder mehr Aminosäuren oder von zwei oder mehr Nukleotidsequenzen wurden mehrere Computersoftware-Programme entwickelt. Die Identität von zwei oder mehr Sequenzen lässt sich zum Beispiel mit der fasta-Software berechnen, die in der vorliegenden Erfindung in Version fasta 3 verwendet wurde (W. R. Pearson und D. J. Lipman, PNAS 85, 2444 (1988); W. R. Pearson, Methods in Enzymology 183, 63 (1990); W. R. Pearson und D. J. Lipman, PNAS 85, 2444 (1988); W. R. Pearson, Enzymology 183, 63 (1990)). Ein anderes nützliches Programm für die Berechnung von Identitäten unterschiedlicher Sequenzen ist das standardmäßige blast-Programm, welches in der Biomax-Pedant-Software (Biomax, München, Bundesrepublik Deutschland) enthalten ist. Dieses führt unglücklicherweise manchmal zu suboptimalen Ergebnissen, da blast nicht immer vollständige Sequenzen der Datenbanksequenz (subject) und der Suchsequenz (query) beinhaltet Da dieses Programm nichts desto weniger sehr effizient ist, kann es für den Vergleich einer gewaltigen Anzahl von Sequenzen verwendet werden. Die folgenden Einstellungen werden typischerweise für einen derartigen Vergleich von Sequenzen verwendet:
-p Program Name [String]; -d Database [String]; default = nr; -i Query File [File In]; default = stdin; -e Expectation value (E) [Real]; default = 10.0; -m alignment view options: 0 = pairwise; 1 = query-anchored showing identities; 2 = query-anchored no identities; 3 = flat queryanchored, show identities; 4 = flat query-anchored, no identities; 5 = query-anchored no identities and blunt ends; 6 = flat query-anchored, no identities and blunt ends; 7 = XML Blast output; 8 = tabular; 9 tabular with comment lines [Integer]; default = 0; -o BLAST report Output File [File Out] Optional; default = stdout; -F Filter query sequence (DUST with blastn, SEG with others) [String]; default = T; -G Cost to open a gap (zero invokes default behavior) [Integer]; default = 0; -E Cost to extend a gap (zero invokes default behavior) [Integer]; default = 0; -X X dropoff value for gapped alignment (in bits) (zero invokes default behavior); blastn 30, megablast 20, tblastx 0, all others 15 [Integer]; default = 0; -I Show GI's in deflines [T/F]; default = F; -q Penalty for a nucleotide mismatch (blastn only) [Integer]; default = -3; -r Reward for a nucleotide match (blastn only) [Integer]; default = 1; -v Number of database sequences to show oneline descriptions for (V) [Integer]; default = 500; -b Number of database sequence to show alignments for (B) [Integer]; default = 250; -f Threshold for extending hits, default if zero; blastp 11, blastn 0, blastx 12, tblastn 13; tblastx 13, megablast 0 [Integer]; default = 0; -g Perfom gapped alignment (not available with tblastx) [T/F]; default = T; -Q Query Genetic code to use [Integer]; default = 1; -D DB Genetic code (for tblast[nx] only) [Integer]; default = 1; -a Number of processors to use [Integer]; default = 1; -O SeqAlign file [File Out] Optional; -J Believe the query defline [T/F]; default = F; -M Matrix [String]; default = BLOSUM62; -W Word size, default if zero (blastn 11, megablast 28, all others 3) [Integer]; default = 0; -z Effective length of the database (use zero for the real size) [Real]; default = 0; -K Number of best hits from a region to keep (off by default, if used a value of 100 is recommended) [Integer]; default = 0; -P 0 for multiple hit, 1 for single hit [Integer]; default = 0; -Y Effective length of the search space (use zero for the real size) [Real]; default = 0; -S Query strands to search against database (for blast[nx], and tblastx); 3 is both, 1 is top, 2 is bottom [Integer]; default = 3; -T Produce HTML Output [T/F]; default = F; -I Restrict search of database to list of GI's [String] Optional; -U Use lower case filtering of FASTA sequence [T/F] Optional; default = F; -y X dropoff value for ungapped extensions in bits (0.0 invokes default behavior); blastn 20, megablast 10, all others 7 [Real]; default = 0.0; -Z X dropoff value for final gapped alignment in bits (0.0 invokes default behavior); blastn/megablast 50, tblastx 0, all others 25 [Integer]; default = 0; -R PSI-TBLASTN checkpoint file [File In] Optional; -n MegaBlast search [T/F]; default = F; -L Location an query sequence [String] Optional; -A Multiple Hits window size, default if zero (blastn/megablast 0, all others 40 [Integer]; default = 0; -w Frame shift penalty (OOF algorithm for blastx) [Integer]; default = 0; -t Length of the largest intron allowed in tblastn for linking HSPs (0 disables linking) [Integer]; default = 0.
-
Ergebnisse mit hoher Qualität werden durch Einsatz des Algorithmus von Needleman und Wunsch oder Smith und Waterman erzielt. Deshalb werden Programme, die auf den genannten Algorithmen basieren, bevorzugt. Vorzugsweise können die Vergleiche von Sequenzen mit dem Programm PileUp (J. Mol. Evolution., 25, 351 (1987), Higgins et al., CABIOS 5, 151 (1989)) oder vorzugsweise mit den Programmen „Gap” und „Needle”, die beide auf den Algorithmen von Needleman und Wunsch basieren (J. Mol. Biol. 48; 443 (1970)), und „BestFit”, das auf dem Algorithmus von Smith und Waterman basiert (Adv. Appl. Math. 2; 482 (1981)), durchgeführt werden. „Gap” und „BestFit” sind Bestandteil des GCG-Software-Pakets (Genetics Computer Group, 575 Science Drive, Madison, Wisconsin, USA 53711 (1991); Altschul et al., (Nucleic Acids Res. 25, 3389 (1997)), „Needle” ist Bestandteil der The European Molecular Biology Open Software Suite (EMBOSS) (Trends in Genetics 16 (6), 276 (2000)). Deshalb werden die Berechnungen zur Bestimmung der Prozentsätze der Sequenzidentität vorzugsweise mit den Programmen „Gap” oder „Needle” über den gesamten Bereich der Sequenzen hinweg durchgeführt. Die folgenden Standardeinstellungen für den Vergleich von Nukleinsäuresequenzen wurden für „Needle” verwendet: matrix: EDNAFULL, Gap_penalty: 10,0, Extend_penalty: 0,5. Die folgenden Standardeinstellungen wurden für den Vergleich von Nukleinsäuresequenzen für „Gap” verwendet: gap weight: 50, length weight: 3, average match: 10,000, average mismatch: 0,000.
-
So versteht man zum Beispiel unter einer Sequenz, von der gesagt wird, dass sie 80% Identität mit der Sequenz SEQ ID NO: 1 auf Nukleinsäureebene aufweist, eine Sequenz, die bei Vergleich mit der Sequenz gemäß SEQ ID NO: 1 mittels des oben genannten Programms „Needle” mit dem obengenannten Parametersatz 80% Identität aufweist. Vorzugsweise wird die Identität über die vollständige Länge der Suchsequenz, zum Beispiel SEQ ID NO: 1, berechnet.
-
Intron: Dies bezieht sich auf Abschnitte von DNA (dazwischen liegenden Sequenzen) innerhalb eines Gens, die nicht für einen Teil des Proteins, das das Gen produziert, codieren und das aus der mRNA, die von dem Gen transkribiert wird, herausgespleißt wird, bevor es aus dem Zellkern exportiert wird. Der Begriff Intronsequenz bezieht sich auf die Nukleinsäuresequenz eines Introns. Introns sind daher diejenigen Regionen von DNA-Sequenzen, die gemeinsam mit der Codiersequenz (Exons) transkribiert werden, die jedoch während der Bildung der reifen mRNA entfernt werden. Introns können innerhalb der tatsächlichen Codierregion oder in einem der 5'-seitig oder 3'-seitig untranslatierten Leitsequenzen der pre-mRNA (ungespleißte mRNA) liegen. Die Introns in dem Primärtranskript werden herausgeschnitten, und die Codiersequenzen werden gleichzeitig und präzise ligiert, um die reife mRNA zu bilden. Die Stellen, an denen die Introns und Exons aneinandergefügt werden, bilden die Spleißstelle. Die Sequenz eines Introns beginnt mit GU und endet mit AG. Weiterhin wurden in Pflanzen zwei Beispiele von AU-AC-Introns beschrieben: das vierzehnte Intron des RecA-like Proteingens und das siebte Intron des G5-Gens aus Arabidopsis thaliana sind AT-AC-Introns. Pre-mRNAs, die Introns enthalten, weisen drei kurze Sequenzen auf, die – neben anderen Sequenzen – essentiell sind, damit das Intron korrekt gespleißt wird. Diese Sequenzen sind die 5'-Spleißstelle, die 3'-Spleißstelle und der Verzweigungspunkt. Das Spleißen der mRNA ist das Entfernen von dazwischen liegenden Sequenzen (Introns), die in Primär-mRNA-Iranskripten vorliegen, und das Aneinanderfügen oder Ligieren von Exon-Sequenzen. Dies ist auch unter der Bezeichnung cis-Spleißen bekannt, bei dem zwei Exons an derselben RNA unter Entfernung der dazwischen liegenden Sequenz (Intron) aneinander gefügt werden. Die funktionellen Elements eines Introns umfasst Sequenzen, die von den spezifischen Proteinkomponenten des Spleißosoms erkannt und gebunden werden (z. B. Spleiß-Konsensussequenzen an den Enden von Introns). Die Wechselwirkung der funktionellen Elemente mit dem Spleißosom führt zu der Entfernung der Intronsequenz aus der vor-reifen mRNA und dem Aneinanderfügen der Exon-Sequenzen. Introns weisen drei kurze Sequenzen auf, die essentiell – jedoch nicht ausreichend – sind, damit das Intron korrekt gespleißt wird. Diese Sequenzen sind die 5'-Spleißstelle, die 3'-Spleißstelle und der Verzweigungspunkt. Die Verzweigungspunktsequenz ist für das Spleißen und für die Auswahl der Spleißstelle in Pflanzen von Wichtigkeit. Die Verzweigungspunktsequenz liegt üblicherweise 10–60 Nukleotide stromaufwärts von der 3'-Spleißstelle.
-
Isogen: Organismen (z. B. Pflanzen), die genetisch identisch sind, mit der Ausnahme, dass sie sich durch das Vorliegen oder Fehlen einer heterologen DNA-Sequenz unterscheiden können.
-
Isoliert: Der Begriff „isoliert” bedeutet im vorliegenden Zusammenhang, dass ein Material durch den Menschen entfernt worden ist und außerhalb seiner ursprünglichen, nativen Umwelt vorliegt und daher nicht ein Naturprodukt ist. Ein isoliertes Material oder Molekül (wie ein DNA-Molekül oder ein Enzym) kann in aufgereinigter Form vorliegen oder kann in einer nichtnativen Umwelt vorliegen, wie zum Beispiel in einer transgenen Wirtszelle. So zum Beispiel ist ein natürlich vorkommendes Polynukleotid oder Polypeptid, das in einer lebenden Pflanze vorhanden ist, nicht isoliert, jedoch dasselbe Polynukleotid bzw. Polypeptid, das von einem Teil oder allen koexisitierenden Materialien in dem natürlichen System getrennt ist, ist isoliert. Solche Polynukleotide können Teil eines Vektors sein, und/oder solche Polynukleotide oder Polypeptide könnten Teil einer Zusammensetzung sein, und wären insofern isoliert, als solch ein Vektor oder eine Zusammensetzung nicht Teil der ursprünglichen Umwelt ist. Vorzugsweise bezieht sich der Begriff „isoliert”, wenn er in Bezug auf ein Nukleinsäuremolekül verwendet wird, wie zum Beispiel in „eine isolierte Nukleinsäuresequenz”, auf eine Nukleinsäuresequenz, die identifiziert und von mindestens einem kontaminierenden Nukleinsäuremolekül, mit dem es üblicherweise in seiner natürlichen Quelle assoziiert ist, getrennt ist. Ein isoliertes Nukleinsäuremolekül ist ein Nukleinsäuremolekül, das in einer Form oder einem Milieu vorliegt, die/das sich von der/dem in der Natur auftretenden Form bzw. Milieu unterscheidet. Im Gegensatz dazu sind nichtisolierte Nukleinsäuremoleküle Nukleinsäuremoleküle wie DNA und RNA, die in dem Zustand auftreten, in dem sie in der Natur vorliegen. So zum Beispiel tritt eine gegebene DNA-Sequenz (z. B. ein Gen) auf dem Wirtszellenchromosom neben benachbarten Genen auf; RNA-Sequenzen, wie eine spezifische mRNA-Sequenz, die für ein spezifisches Protein codiert, treten in der Zelle als Mischung mit zahlreichen anderen mRNAs, die für eine Vielzahl von Proteinen codieren, auf. Eine isolierte Nukleinsäuresequenz, die zum Beispiel SEQ ID NO: 1 umfasst, beinhaltet jedoch zum Beispiel solche Nukleinsäuresequenzen in Zellen, die üblicherweise SEQ ID NO: 1 enthalten, wobei die Nukleinsäuresequenz in einer chromosomalen oder extrachromosomalen Lage vorkommt, die sich von derjenigen der natürlichen Zellen unterscheidet, oder auf andere Weise von einer unterschiedlichen Nukleinsäuresequenz wie derjenigen, die in der Natur auftritt, flankiert wird. Die isolierte Nukleinsäuresequenz kann in Einzelstrangform oder Doppelstrangform vorliegen. Soll eine isolierte Nukleinsäuresequenz zum Exprimieren eines Proteins verwendet werden, so enthält die Nukleinsäuresequenz als Minimum zumindest einen Abschnitt des sense-Strangs bzw. Codierstrangs (d. h. die Nukleinsäuresequenz kann einzelsträngig sein). Alternativ dazu kann sie sowohl den sense- als auch den antisense-Strang enthalten (d. h. die Nukleinsäuresequenz kann doppelsträngig sein).
-
Minimalpromoter: Promoterelemente, insbesondere ein TATA-Element, die inaktiv sind oder die bei Fehlen einer Aktivierung stromaufwärts eine stark reduzierte Promoteraktivität aufweisen. In Gegenwart eines geeigneten Transkriptionsfaktors ermöglicht das Funktionieren des Minimalpromoters eine Transkription.
-
NEENA: siehe „Die Nukleinsäureexpression verstärkende Nukleinsäure”.
-
Nichtcodierend: Der Begriff „nichtcodierend” bezieht sich auf Sequenzen von Nukleinsäuremolekülen, die nicht für einen Teil eines exprimierten Proteins oder das gesamte exprimierte Protein codieren. Zu nichtcodierenden Sequenzen zählen, jedoch ohne Einschränkung, Introns, Enhancer, Promoterregionen, 3'-untranslatierte Regionen sowie 5'-untranslatierte Regionen.
-
Die Nukleinsäureexpression verstärkende Nukleinsäure (NEENA): Der Begriff „die Nukleinsäureexpression verstärkende Nukleinsäure” bezieht sich auf eine Sequenz und/oder ein Nukleinsäuremolekül einer spezifischen Sequenz mit der intrinsischen Eigenschaft, die Expression einer Nukleinsäure unter der Kontrolle eines Promoters, mit dem die NEENA funktionell verknüpft ist, zu verstärken. Im Gegensatz zu Promotersequenzen ist die NEENA als solche nicht fähig, die Expression voranzutreiben. Um die Funktion des Verstärkens der Expression eines Nukleinsäuremoleküls, das funktionell mit der NEENA verknüpft ist, zu erfüllen, muss die NEENA selbst funktionell mit einem Promoter verknüpft sein. Zum Unterschied von fachbekannten Enhancer-Sequenzen agiert die NEENA in cis, jedoch nicht in trans, und muss nahe der Transkriptionsstartstelle der zu exprimierenden Nukleinsäure liegen.
-
Nukleinsäuren und Nukleotide: Die Begriffe „Nukleinsäuren” und „Nukleotide” beziehen sich auf natürlich vorkommende oder synthetische oder künstliche Nukleinsäuren oder Nukleotide. Die Begriffe „Nukleinsäuren” und „Nukleotide” umfassen Desoxyribonukleotide oder Ribonukleotide oder beliebige Nukleotidanaloga und Polymere oder Hybride davon, und zwar entweder in Einzelstrang- oder Doppelstrangform, sense-Form oder antisense-Form. Falls nicht anders erwähnt umfasst eine bestimmte Nukleinsäuresequenz nicht nur die explizit angegebene Sequenz, sondern implizit auch konservativ modifizierte Varianten davon (z. B. degenerierte Godonsubstitutionen) sowie komplementäre Sequenzen. Der Begriff Nukleinsäure” wird im vorliegenden Text austauschbar mit „Gen”, „cDNA”, „mRNA”, „Oligonukleotid” und „Polynukleotid” verwendet. Zu den Nukleotidanaloga zählen Nukleotide mit Modifikationen in der chemischen Struktur der Base, des Zuckers und/oder des Phosphats, darunter, jedoch nicht ausschließlich, Modifikationen der Pyrimidine in 5-Position, Modifikationen der Purine in 8-Position, Modifikationen von exocyclischen Cytosinaminen, Substitution von 5-Bromuracil und dergleichen; und Modifikationen von Zuckern in 2'-Position, darunter, jedoch nicht ausschließlich, zuckermodifizierte Ribonukleotide, in denen das 2'-OH durch eine Gruppe aus der Reihe H, OR, R, Halogen, SH, SR, NH2, NHR, NR2 oder CN ersetzt ist. Kurze Hairpin-RNAs (shRNAs) können auch nichtnatürliche Elemente umfassen, wie nichtnatürliche Basen, z. B. Ionosin und Kanthin, nichtnatürliche Zucker, z. B. 2'-Methoxyribose oder nichtnatürliche Phosphodiesterbindungen, z. B. Methylphosphonate, Phosphorothioate und Peptide.
-
Nukleinsäuresequenz: Der Begriff „Nukleinsäuresequenz” bezieht sich auf ein einzelsträngiges oder doppelsträngiges Polymer von Desoxyribonukleotid- oder Ribonukleotidbasen, das vom 5'- zum 3'-Ende gelesen wird. Er beinhaltet chromosomale DNA, selbstreplizierende Plasmide, infektiöse Polymere von DNA oder RNA und DNA oder RNA mit primär strukturellem Zweck. „Nukleinsäuresequenz” bezieht sich auch auf eine aufeinanderfolgende Aufzählung von Abkürzungen, Buchstaben, Symbolen oder Wörtern, die Nukleotide darstellen. In einer Ausführungsform kann eine Nukleinsäure eine „Sonde” sein, wobei es sich um eine relativ kurze Nukleinsäure mit einer Länge von üblicherweise weniger als 100 Nukleotiden handelt. Häufig weist eine Nukleinsäuresonde eine Länge von ungefähr 50 Nukleotiden bis ungefähr 10 Nukleotiden auf. Eine „Zielregion” einer Nukleinsäure ist ein Abschnitt einer Nukleinsäure, der als interessant identifiziert wird. Eine „Codierregion” einer Nukleinsäure ist derjenige Abschnitt der Nukleinsäure, der, wenn er unter die Kontrolle von entsprechenden Regulationssequenzen gestellt wird, auf sequenzspezifische Art und Weise transkribiert und translatiert wird, wodurch man zu einem bestimmten Polypeptid oder Protein gelangt. Man sagt, dass die Codierregion für solch ein Polypeptid oder Protein codiert.
-
Oligonukleotid: Der Begriff „Oligonukleotid” bezieht sich auf ein Oligomer oder Polymer von Ribonukleinsäure (RNA) oder Desoxyribonukleinsäure (DNA) oder ihren Mimetika, sowie auf Oligonukleotide mit nichtnatürlich vorkommenden Abschnitten mit einer ähnlichen Funktion. Solche modifizierten oder substituierten Oligonukleotide werden häufig gegenüber nativen Formen bevorzugt, da sie wünschenswerte Eigenschaften aufweisen, wie zum Beispiel eine gesteigerte Aufnahme durch die Zelle, eine gesteigerte Affinität als Target für Nukleinsäuren sowie eine erhöhte Stabilität in Gegenwart von Nukleasen. Ein Oligonukleotid beinhaltet vorzugsweise zwei oder mehr Nukleomonomere, die miteinander kovalent durch Bindungen (z. B. Phosphodiester) oder Ersatzbindungen gekoppelt sind.
-
Überhang: Überhang ist eine relativ kurze einzelsträngige Nukleotidsequenz am 5'- oder 3'-Hydroxylende eines doppelsträngigen Oligonukleotidmoleküls (auch als „Extension”, „hervorstehendes Ende” oder „kohäsives Ende” bezeichnet).
-
Pflanze: Hierunter versteht man im Allgemeinen jeden eukaryontischen einzelligen oder mehrzelligen Organismus oder eine Zelle, ein Gewebe, ein Organ, einen Teil oder Vermehrungsmaterial (wie Samen oder Frucht) davon, das zur Photosynthese befähigt ist. Im Zusammenhang mit der vorliegenden Erfindung sind alle Gattungen und Arten der höheren und niederen Pflanzen des Königreichs Pflanzen umfasst. Bevorzugt sind einjährige, ausdauernde, monokotyle und dikotyple Pflanzen. Der Begriff beinhaltet reife Pflanzen, Samen, Sprosse und Keimpflanzen und ihre abgeleiteten Teile, Vermehrungsmaterial (wie Samen oder Mikrosporen), Pflanzenorgane, Gewebe, Protoplasten, Kallus und andere Kulturen, zum Beispiel Zellkulturen, sowie jegliche sonstige Art von Pflanzenzellgruppierung, die funktionelle Einheiten oder Struktureinheiten ergibt. „Reife Pflanze” bezieht sich auf Pflanzen in einem beliebigen Entwicklungsstadium nach dem Keimpflanzenstadium. Keimpflanze bedeutet eine junge unreife Pflanze in einem frühen Entwicklungsstadium. Einjährige, zweijährige, monokotyle und dikotyle Pflanzen sind bevorzugte Wirtsorganismen für die Erzeugung von transgenen Pflanzen. Die Expression von Genen ist weiterhin in allen Zierpflanzen, Nutzbäumen oder Zierbäumen, Blumen, Schnittblumen, Sträuchern oder Rasen vorteilhaft. Pflanzen, die beispielsweise, jedoch nicht einschränkend, zu erwähnen sind, sind Angiospermen, Bryophyten wie zum Beispiel Hepaticae (Lebermoose) und Musci (Laubmoose); Pteridophyten wie Farne, Schachtelhalm und Bärlapp; Gymnospermen wie Koniferen, Cycaden, Ginkgo sowie Gnetatae; Algen wie Chlorophyceae, Phaeophpyceae, Rhodophyceae, Myxophyceae, Xanthophyceae, Bacillariophyceae (Diatomeen) und Euglenophyceae. Bevorzugt sind Pflanzen, die für Nahrungsmittel- oder Futtermittelzwecke verwendet werden, wie die Familie der Leguminosae wie Erbse, Luzerne und Soja; Gramineae wie Reis, Mais, Weizen, Gerste, Sorghum, Hirse, Roggen, Triticale oder Hafer; die Familie Umbelliferae, insbesondere der Gattung Daucus, ganz besonders der Species carota (Karotte) und Apium, ganz besonders der Art graveolens dulce (Sellerie) und viele andere; die Familie Solanaceae, insbesondere der Gattung Lycopersicon, ganz besonders der Art esculentum (Tomate) und der Gattung Solanum, ganz besonders der Art tuberosum (Kartoffel) und melongena (Aubergine), und viele andere (wie Tabak); und der Gattung Capsicum, ganz besonders der Art annuum (Paprika) und viele andere; die Familie Leguminosae, insbesondere der Gattung Glycine, ganz besonders der Art max (Sojabohne), Luzerne, Erbse, Alfalfa, Bohnen oder Erdnuß und viele andere; und die Familie Cruciferae (Brassicacae), insbesondere der Gattung Brassica, ganz besonders der Art napus (Raps), campestris (Rübe), oleracea cv. Tastie (Kraut), oleracea cv. Snowball Y (Blumenkohl) und oleracea cv. Emperor (Brokkoli); sowie der Gattung Arabidopsis, ganz besonders der Art thaliana und viele andere; die Familie Compositae, insbesondere der Gattung Lactuca, ganz besonders der Art sativa (Salat) und viele andere; die Familie Asteraceae wie Sonnenblume, Tagetes, Salat oder Calendula und viele andere; die Familie Cucurbitaceae wie Melone, Kürbis oder Zucchini, sowie Lein. Weiterhin bevorzugt sind Baumwolle, Zuckerrohr, Hanf, Flachs, Cayennepfeffer und die verschiedenen Baum-, Nuß- und Weinarten.
-
Polypeptid: Die Begriffe „Polypeptid”, „Peptid”, „Oligopeptid”, „Polypeptid”, „Genprodukt”, „Expressionsprodukt” und Protein” werden im vorliegenden Zusammenhang als gleichwertig verwendet, um ein Polymer oder Oligomer von aufeinanderfolgenden Aminosäureresten zu bezeichnen.
-
Präprotein: Protein, bei dem normalerweise ein Targeting an ein Zellorganell, wie einen Chloroplasten, erfolgt und das noch sein Transitpeptid umfasst.
-
Primärtranskript: Der Begriff „Primärtranskript” bezieht sich im vorliegenden Zusammenhang auf ein unreifes RNA-Transkript eines Gens. Ein „Primärtranskript” umfasst zum Beispiel noch Introns und/oder umfasst noch nicht einen polyA-Schwanz oder eine Cap-Struktur und/oder es fehlen ihm andere Modifikationen, die für sein korrektes Funktionieren als Transkript erforderlich sind, wie zum Beispiel Trimming oder Editieren.
-
Promoter: Die Begriffe „Promoter” oder „Promotersequenz” sind Äquivalente; im vorliegenden Zusammenhang bedeuten sie eine DNA-Sequenz, die, wenn sie mit einer interessierenden Nukleotidsequenz ligiert wird, fähig ist, die Transkription der interessierenden Nukleotidsequenz in RNA zu kontrollieren. Solche Promoter finden sich zum Beispiel in den folgenden öffentlichen Datenbanken: http://www.grassius.org/grasspromdb.html, http://mendel.cs.rhul.ac.uk/mendel.php?topic=plantprom, http://ppdb.gene.nagoya-u.ac.jp/cgibin/index.cgi. Die darin angeführten Promoter können mit den Verfahren der Erfindung zielgesteuert werden und werden in dem vorliegenden Text durch Bezugnahme aufgenommen. Ein Promoter befindet sich in 5'-Richtung (d. h. stromaufwärts) in der Nähe des Transkriptionsstartpunkts einer interessierenden Nukleotidsequenz, deren Transkription in mRNA er kontrolliert, und stellt eine Stelle für die spezifische Bindung durch die RNA-Polymerase und andere Transkriptionsfaktoren zwecks Initiation der Transkription bereit. Der Promoter umfasst zum Beispiel die mindestens 10 kB, zum Beispiel 5 kB oder 2 kB, die der Transkriptionsstartstelle benachbart sind. Er kann auch die mindestens 1500 Bp, vorzugsweise die mindestens 1000 Bp, stärker bevorzugt die mindestens 500 Bp, noch stärker bevorzugt die mindestens 400 Bp, die mindestens 300 Bp, die mindestens 200 Bp oder die mindestens 100 Bp, die der Transkriptionsstartstelle benachbart sind, umfassen. In einer weiteren bevorzugten Ausführungsform umfasst der Promoter die mindestens 50 Bp, zum Beispiel mindestens 25 Bp, die der Transkriptionsstartstelle benachbart sind. Der Promoter umfasst nicht Exon- und/oder Intronregionen oder 5'-untranslatierte Regionen. Der Promoter kann zum Beispiel heterolog oder homolog in Bezug auf die entsprechende Pflanze sein. Eine Polynukleotidsequenz ist „heterolog” in Bezug auf einen Organismus oder eine zweite Polynukleotidsequenz, wenn sie von einer fremden Art stammt oder, wenn sie von derselben Art ist, in Bezug auf ihre ursprüngliche Form modifiziert ist. So zum Beispiel bedeutet Promoter in operativer Verknüpfung zu einer heterologen Codiersequenz eine Codiersequenz von einer Art, die sich von derjenigen, von der der Promoter erhalten wurde, unterscheidet, oder, wenn er von derselben Art ist, eine Codiersequenz, die mit dem Promoter nicht natürlich assoziiert ist (z. B. eine gentechnisch veränderte Codiersequenz oder ein Allel von einem unterschiedlichen Ökotyp oder einer unterschiedlichen Varietät). Geeignete Promoter können von Genen von Wirtszellen stammen, wo die Expression stattfinden soll, oder von Pathogenen von diesen Wirtszellen (zum Beispiel Pflanzen oder Pflanzenpathogenen wie Pflanzenviren). Ein pflanzenspezifischer Promoter ist ein Promoter, der sich für die Regulation der Expression in einer Pflanze eignet. Er kann von einer Pflanze stammen, jedoch auch von Pflanzenpathogenen, oder es kann sich um einen vom Menschen entwickelten synthetischen Promoter handeln. Handelt es sich bei einem Promoter um einen induzierbaren Promoter, dann erhöht sich die Transkriptionsrate als Reaktion auf ein Induktionsmittel. Der Promoter kann auch auf gewebespezifische oder gewebebevorzugte Weise reguliert werden, so dass er beim Transkribieren der assoziierten Codierregion nur, oder in erster Linie, in einem spezifischen Gewebetyp(en) wie Blättern, Wurzeln oder im Meristem aktiv ist. Der Begriff „gewebespezifisch” bezieht sich in Bezug auf einen Promoter auf einen Promoter, der fähig ist, eine selektive Expression einer interessierenden Nukleotidsequenz in einem bestimmten Gewebetyp (zum Beispiel Blütenkronenblättern) bei relativem Fehlen der Expression derselben interessierenden Nukleotidsequenz in einem unterschiedlichen Gewebetyp (zum Beispiel den Wurzeln) zu dirigieren. Die Gewebespezifität eines Promoters kann zum Beispiel dadurch ausgewertet werden, dass man ein Reportergen operativ mit der Promotersequenz verknüpft, um ein Reporterkonstrukt zu erzeugen, dann das Reporterkonstrukt in das Genom einer Pflanze einführt, so dass das Reporterkonstrukt in jedes Gewebe der erhaltenen transgenen Pflanze integriert ist, und die Expression des Reportergens (zum Beispiel Nachweisen von mRNA, Protein, oder der von dem Reportergen codierten Aktivität eines Proteins) in unterschiedlichen Geweben der transgenen Pflanze nachweist. Der Nachweis eines höheren Expressionsniveaus des Reportergens in einem oder mehreren Geweben in Bezug auf das Expressionsniveau des Reportergens in anderen Geweben zeigt, dass der Promoter für die Gewebe spezifisch ist, in denen höhere Expressionsniveaus nachgewiesen werden. Der Begriff „zelltypspezifisch” bezieht sich im Zusammenhang mit einem Promoter auf einen Promoter, der fähig ist, die selektive Expression einer interessierenden Nukleotidsequenz in einem spezifischen Zelltyp bei relativem Fehlen von Expression derselben interessierenden Nukleotidsequenz in einem unterschiedlichen Zelltyp innerhalb desselben Gewebes zu dirigieren. Der Begriff „zelltypspezifisch” bedeutet in Bezug auf einen Promoter auch einen Promoter, der fähig ist, die selektive Expression einer interessierenden Nukleotidsequenz in einer Region innerhalb eines einzelnen Gewebes voranzutreiben. Die Zelltypspezifität eines Promoters kann mit gut fachbekannten Verfahren beurteilt werden, zum Bespiel GUS-Aktivitätsfärbung, GFP-Protein-Färbung oder immunhistochemische Färbung. Der Begriff „konstitutiv” bedeutet im Zusammenhang mit einem Promoter oder der von einem Promoter abgeleiteten Expression, dass der Promoter fähig ist, die Transkription einer operativ verknüpften Nukleinsäuresequenz bei Fehlen eines Reizes (zum Beispiel Hitzeschock, Chemikalien, Licht usw.) in einem Großteil der Pflanzengewebe und -zellen während im Wesentlichen der gesamten Lebensdauer einer Pflanze oder des Teils einer Pflanze zu dirigieren. Typischerweise sind konstitutive Promoter fähig, die Expression eines Transgens in im Wesentlichen jeglicher Zelle und jeglichem Gewebe zu dirigieren.
-
Promoterspezifität: Der Begriff „Spezifität” bedeutet in Bezug auf einen Promoter das Expressionsmuster, das von dem jeweiligen Promoter vermittelt wird. Die Spezifität beschreibt die Gewebe und/oder den Entwicklungszustand einer Pflanze oder eines Teils davon, in der/dem der Promoter die Expression des Nukleinsäuremoleküls unter der Kontrolle des jeweiligen Promoters vermittelt. Der Begriff Spezifität eines Promoters kann auch die Umweltbedingungen umfassen, unter denen der Promoter aktiviert oder herunterreguliert werden kann, wie Induktion oder Repression durch biologischen Stress oder Umweltstress, wie Kälte, Dürre, Verwundung oder Infektion.
-
Aufgereinigt: Im vorliegenden Zusammenhang betrifft der Begriff „aufgereinigt” Moleküle, entweder Nukleinsäure- oder Aminosäuresequenzen, die aus ihrer natürlichen Umwelt entfernt, isoliert oder getrennt sind. „Weitgehend aufgereinigte” Moleküle sind zumindest 60% frei, vorzugsweise mindestens 75% frei und stärker bevorzugt mindestens 90% frei von anderen Bestandteilen, mit denen sie auf natürliche Weise assoziiert sind. Eine gereinigte Nukleinsäuresequenz kann eine isolierte Nukleinsäuresequenz sein.
-
Rekombinant: Der Begriff „rekombinant” bedeutet in Bezug auf Nukleinsäuremoleküle Nukleinsäuremoleküle, die mittels DNA-Rekombinationstechniken erzeugt worden sind. Rekombinante Nukleinsäuremoleküle können auch Moleküle umfassen, die als solche in der Natur nicht vorkommen, sondern die von Menschen modifiziert, verändert, mutiert oder sonstwie manipuliert sind. Vorzugsweise ist ein „rekombinantes Nukleinsäuremolekül” ein nicht natürlich vorkommendes Nukleinsäuremolekül, das sich in Bezug auf die Sequenz um mindestens eine Nukleinsäure von einem natürlich vorkommenden Nukleinsäuremolekül unterscheidet. Ein „rekombinantes Nukleinsäuremolekül” kann auch ein „rekombinantes Konstrukt” umfassen, das, vorzugsweise in operativer Verknüpfung, eine Sequenz von Nukleinsäuremolekülen, die in der Natur in dieser Reihenfolge nicht vorkommen, umfasst. Bevorzugte Verfahren zur Herstellung dieses rekombinanten Nukleinsäuremoleküls können Klonierungstechniken, gerichtete oder ungerichtete Mutagenese-, Synthese- oder Rekombinationstechniken umfassen.
-
Sense: Der Begriff „sense” soll ein Nukleinsäuremolekül mit einer Sequenz, die zu einer Zielsequenz komplementär ist oder damit identisch ist, bedeuten, zum Beispiel einer Sequenz, die an einen Proteintranskriptionsfaktor bindet und die an der Expression eines bestimmten Gens beteiligt ist. Gemäß einer bevorzugten Ausführungsform umfasst das Nukleinsäuremolekül ein interessierendes Gen sowie Elemente, die die Expression des interessierenden Gens gestatten.
-
Nennenswerte Erhöhung oder Erniedrigung: Eine Erhöhung oder Erniedrigung, zum Beispiel bei der Enzymaktivität oder der Genexpression, die größer ist als die messtechnisch bedingte Fehlermarge, vorzugsweise eine Erhöhung oder Erniedrigung um das ungefähr Zweifache oder mehr als die Aktivität des Kontrollenzyms oder der Expression in der Kontrollzelle, stärker bevorzugt eine Erhöhung oder Erniedrigung um ungefähr das Fünffache oder mehr, und am stärksten bevorzugt eine Erhöhung oder Erniedrigung um ungefähr das Zehnfache oder mehr.
-
Kleine Nukleinsäuremoleküle: „Kleine Nukleinsäuremoleküle” bedeuten Moleküle, die aus Nukleinsäuren oder Derivaten davon bestehen, wie RNA oder DNA. Sie können doppelsträngig oder einzelsträngig sein und weisen eine Größe zwischen ungefähr 15 und ungefähr 30 Bp, zum Beispiel zwischen 15 und 30 Bp, stärker bevorzugt zwischen ungefähr 19 und ungefähr 26 Bp, zum Beispiel zwischen 19 und 26 Bp, noch stärker bevorzugt zwischen ungefähr 20 und ungefähr 25 Bp, zum Beispiel zwischen 20 und 25 Bp, auf. In einer besonders bevorzugten Ausführungsform weisen die Oligonukleotide eine Größe zwischen ungefähr 21 und ungefähr 24 Bp, zum Beispiel zwischen 21 und 24 Bp, auf. In einer am stärksten bevorzugten Ausführungsform weisen die kleinen Nukleinsäuremoleküle eine Größe von ungefähr 21 Bp und ungefähr 24 Bp, zum Beispiel 21 Bp und 24 Bp auf.
-
Weitgehend komplementär: Im weitesten Sinn bedeutet der Begriff weitgehend komplementär”, wenn er für eine Nukleotidsequenz in Bezug auf eine Referenz- oder Zielnukleotidsequenz verwendet wird, eine Nukleotidsequenz mit einem Identitätsprozentsatz zwischen der weitgehend komplementären Nukleotidsequenz und der exakt komplementären Sequenz dieser Referenz- oder Zielnukleotidsequenz von mindestens 60%, stärker erwünscht mindestens 70%, stärker erwünscht mindestens 80% oder 85%, vorzugsweise mindestens 90%, stärker bevorzugt mindestens 93%, noch stärker bevorzugt mindestens 95% oder 96%, noch stärker bevorzugt mindestens 97% oder 98%, noch stärker bevorzugt mindestens 99% oder am stärksten bevorzugt 100% (wobei Letzteres in diesem Zusammenhang dem Begriff „identisch” äquivalent ist). Vorzugsweise wird die Identität über eine Länge von mindestens 19 Nukleotiden, vorzugsweise mindestens 50 Nukleotiden, stärker bevorzugt über die gesamte Länge der Nukleinsäuresequenz gegenüber der Referenzsequenz beurteilt (falls unten nicht anders angegeben). Sequenzvergleiche werden unter Verwendung der Default-GAP-Analyse mit der University of Wisconsin GCG, SEQWEB-Applikation von GAP, durchgeführt, die auf dem Algorithmus von Needleman und Wunsch (Needleman und Wunsch (1970) J Mol. Biol. 48: 443–453; wie oben definiert) beruht. Eine Nukleotidsequenz, die gegenüber einer Referenznukleotidsequenz „weitgehend komplementär” ist, hybridisiert mit der Referenznukleotidsequenz unter Niederstringenzbedingungen, vorzugsweise Mittelstringenzbedingungen, am stärksten bevorzugt Hochstringenzbedingungen (wie oben definiert).
-
Transgen: Der Begriff „Transgen” bezieht sich im vorliegenden Zusammenhang auf eine beliebige Nukleinsäuresequenz, die in das Genom einer Zelle durch experimentelle Manipulationen eingeführt wird. Bei einem Transgen kann es sich um eine „endogene DNA-Sequenz” oder eine „heterologe DNA-Sequenz” (d. h. „Fremd-DNA”) handeln. Der Begriff „endogene DNA-Sequenz” bezieht sich auf eine Nukleotidsequenz, die in der Zelle, in die sie eingeführt wird, auf natürliche Weise auftritt, solange sie nicht irgendeine Modifikation (z. B. eine Punktmutation, das Vorliegen eines Selektionsmarkergens usw.) in Bezug auf die natürlich vorkommende Sequenz enthält.
-
Transgen: Der Begriff „transgen” bedeutet in Bezug auf einen Organismus, dass dieser mit einem rekombinanten DNA-Molekül, das vorzugsweise einen geeigneten Promoter in operativer Verknüpfung mit einer interessierenden DNA-Sequenz umfasst, transformiert, vorzugsweise stabil transformiert, ist.
-
Vektor: Im vorliegenden Zusammenhang bezieht sich der Begriff „Vektor” auf ein Nukleinsäuremolekül, das fähig ist, ein anderes Nukleinsäuremolekül, mit dem es verknüpft worden ist, zu transportieren. Eine Art von Vektor ist ein genomisch integrierter Vektor, oder „integrierter Vektor”, der in die chromosomale DNA der Wirtszelle integriert werden kann. Ein weiterer Typ eines Vektors ist ein episomaler Vektor, d. h. ein Nukleinsäuremolekül, das zur extrachromosomalen Replikation befähigt ist. Vektoren, die fähig sind, die Expression von Genen, mit denen sie operativ verknüpft sind, zu dirigieren, werden im vorliegenden Text als „Expressionsvektoren” bezeichnet. In der vorliegenden Beschreibung werden „Plasmid” und „Vektor” austauschbar verwendet, falls dies nicht aus dem Zusammenhang anders hervorgeht. Expressionsvektoren, die dahingehend entwickelt wurden, dass sie in vitro oder in vivo wie hierin beschriebene RNAs produzieren, können Sequenzen enthalten, die von irgendeiner RNA-Polymerase erkannt werden, darunter mitrochondrieller RNA-Polymerase, RNA pol I, RNA pol II und RNA pol III. Mit diesen Vektoren kann das gewünschte RNA-Molekül in der erfindungsgemäßen Zelle transkribiert werden. Unter einem Pflanzentransformationsvektor versteht man einen Vektor, der sich für das Verfahren der Pflanzentransformation eignet.
-
Wildtyp: Der Begriff „Wildtyp”, „natürlich” oder „natürlicher Ursprung” bedeutet in Bezug auf einen Organismus, ein Polypeptid oder eine Nukleinsäuresequenz, dass dieser Organismus natürlich vorkommt oder zumindest in einem natürlich vorkommenden Organismus, der vom Menschen nicht verändert, mutiert oder anderweitig manipuliert ist, auftritt.
-
BEISPIELE
-
Chemikalien und übliche Verfahren
-
Falls nicht anders erwähnt werden die Klonierungsvorgänge, die für den Zweck der vorliegenden Erfindung durchgeführt werden, einschließlich Restriktionsverdau, Agarose-Gelelektrophorese, Aufreinigung von Nukleinsäuren, Ligation von Nukleinsäuren, Transformation, Selektion und Kultivieren von Bakterienzellen, wie beschrieben (Sambrook et al., 1989) durchgeführt. Die Sequenzanalysen von rekombinanter DNA wurden mit einem Laser-Fluoreszenz-DNA-Sequenziergerät (Applied Biosystems, Foster City, CA, USA) unter Verwendung der Sanger-Technik (Sanger et al., 1977) durchgeführt. Falls nicht anders beschrieben wurden die Chemikalien und Reagentien von Sigma Aldrich (Sigma Aldrich, St. Louis, USA), von Promega (Madison, WI, USA), Duchefa (Haarlem, Niederlande) oder Invitrogen (Carlsbad, CA, USA) bezogen. Die Restriktionsendonukleasen stammten von New England Biolabs (Ipswich, MA, USA) oder Roche Diagnostics GmbH (Penzberg, Deutschland). Die Oligonukleotide wurden von Eurofins MWG Operon (Ebersberg, Deutschland) synthetisiert.
-
Beispiel 1: Identifizieren von die Nukleinsäureexpression verstärkenden Nukleinsäuren-(NEENA) aus Genen mit konstitutiver Expression
-
1.1 Identifzierung von NEENA-Molekülen aus A. thaliana-Genen
-
Unter Verwendung von öffentlich zugänglichen genomischen DNA-Sequenzen (z. B.
http://www.ncbi.nlm.nih.gov/genomes/PLANTS/PlantList.html) und Transkriptionsexpressionsdaten (z. B.
http://www.weigelworld.org/resources/microarray/AtGenExpress/) wurde ein Satz von 18 potentiellen NEENA-Kandidaten, die von Arabidopsis thaliana – Transkripten aus hochexprimierenden konstitutiven Genen abstammen, für detaillierte Analysen ausgewählt. Zusätzlich wurde ein aus Petersilie stammendes mutmaßliches NEENA-Molekül in der Analyse mitgeführt. Die Kandidaten wurden folgendermaßen bezeichnet: Tabelle 1: Konstitutive NEENA-Kandidaten (NEENAc).
| NEENA-Bezeichnung | Locus | Annotierung | SEQ ID NO |
| NEENAc24 | | Petroselinum-crispum-Gen Pcubi4-2 für Polyubiquitin | 1 |
| NEENAc17 | At2g47170 | ADP-Ribosylierungsfaktor 1 (ARF 1) | 2 |
| NEENAc5 | At1g56070 | Elongationsfaktor 2, mutmaßlich/EF-2, mutmaßlich | 3 |
| NEENAc18 | At5g54760 | eukaryontischer Translationsinitiationsfaktor SUI1, mutmaßlich | 4 |
| NEENAc7 | At4g02890 | Polyubiquitin (UBQ14) | 5 |
| NEENAc13 | At3g03780 | AtMS2 (Arabidopsis-thaliana-Methioninsynthase 2) | 6 |
| NEENAc1 | At5g60390 | Elongationsfaktor 1-alpha/EF-1-alpha | 7 |
| NEENAc21 | At1g14400 | ubiquitinkonjugierendes Enzym 1 (UBC1) | 8 |
| NEENAc16 | At4g14880 | Cysteinsyrithase/O-Acetylserin(thiol)lyase/O-Acetylserinsulfhydrylase (OAS1) | 9 |
| NEENAc2 | At4g27960 | ubiquitinkonjugierendes Enzym E2-17 kDa 9 (UBC9) | 10 |
| NEENAc14 | At1g64230 | ubiquitinkonjugierendes Enzym, mutmaßlich | 11 |
| NEENAc4 | At2g37270 | 40S ribosomales Protein S5 (RPS5A) | 12 |
| NEENAc6 | At4g05050 | Polyubiquitin (UBQ11) | 13 |
| NEENAc8 | At1g43170 | 60S ribosomales Protein L3 (RPL3A) | 14 |
| NEENAc11 | At1g01100 | 60S saures ribosomales Protein P1 (RPP1A) | 15 |
| NEENAc12 | At5g04800 | 40S ribosomales Protein S17 (RPS17D) | 16 |
| NEENAc19 | At4g34110 | polyadenylatbindendes Protein 2 (PABP2) | 17 |
| NEENAc22 | At2g34770 | Fettsäurehydroxylase (FAH1) (erwartete IME-Wirkung) | 18 |
| NEENAc23 | At5g17920 | cobalaminunabhängige Methioninsynthase (CIMS) | 19 |
-
1.2 Isolieren der NEENA-Kandidaten
-
Aus grünem Gewebe von A. thaliana wurde mit Hilfe des Qiagen DNeasy Plant Mini Kits (Qiagen, Hilden, Deutschland) genomische DNA extrahiert. Für das mutmaßliche NEENA-Molekül mit der SEQ ID NO: 1 wurde DNA des Vektorkonstrukts 1bxPcUbi4-2GUS (
WO 2003102198 ) verwendet. Genomische DNA-Fragmente, die mutmaßliche NEENA-Moleküle enthielten, wurden durch konventionelle Polymerasekettenreaktion (PCR) isoliert. Die Polymerasekettenreaktion umfasste 19 Primer Sätze (Tabelle 2). Die Primer wurden auf Grundlage der A. thaliana-Genomsequez mit einer Vielzahl von NEENA-Kandidaten entwickelt. Für die Entwicklung von Primer (SEQ ID NO: 56 und 57) für die Amplifikation des NEENA-Kandidaten gemäß SEQ ID NO: 1 (Tabelle 2) wurde die Nukleotidsequenz des Vektorkonstrukts 1bxPcUbi4-2GUS (
WO 2003102198 ) verwendet. Die Polymerasekettenreaktion folgte dem Protokoll gemäß Phusion High Fidelity DNA Polymerase (Katalog Nr. F-540L, New England Biolabs, Ipswich, MA, USA). Die isolierte DNA wurde als Matrizen-DNA in einer PCR-Amplifikation verwendet, und zwar unter Einsatz der folgenden Primer: Tabelle 2: Primer-Sequenzen
-
Die Amplifikation während der PCR wurde mit der folgenden Zusammensetzung (50 μl) durchgeführt:
3,00 μl A. thaliana genomische DNA (50 ng/μl genomische DNA, 5 ng/μl Vektorkonstrukt)
10,00 μl 5 × Phusion HF-Puffer
4,00 μl dNTP (2,5 mM)
2,50 μl for Primer (10 μM)
2,50 μl rev Primer (10 μM)
0,50 μl Phusion HF DNA-Polymerase (2 U/μl)
-
Für die PCR wurde ein Touch-Down-Ansatz mit den folgenden Parametern eingesetzt: 98,0°C 30 sec (1 Zyklus), 98,0°C 30 sec, 56,0°C 30 sec und 72,0°C 60 sec (4 Zyklen), 4 zusätzliche Zyklen mit jeweils 54,0°C, 51,0°C und 49,0°C Reassoziationstemperatur, gefolgt von 20 Zyklen von 98,0°C 30 sec, 46,0°C 30 sec und 72,0°C 60 sec (4 Zyklen) und 72,0°C 5 min. Die Amplifikationsprodukte wurden auf 2%iges (w/v) Agarose-Gel aufgetragen und bei 80 V getrennt. Die PCR-Produkte wurden aus dem Gel herausgeschnitten und mit dem Qiagen Gel Extraction Kit (Qiagen, Hilden, Deutschland) herausgeschnitten. Nach DNA-Restriktionsverdau mit der Restriktionsendonuklease KpnI (10 U/μl) und NcoI (10 U/μl) oder EcoRV (10 U/μl) wurden die Verdauungsprodukte nochmals mit dem Qiagen Gel Extraction Kit (Qiagen, Hilden, Deutschland) aufgereinigt.
-
1.3 Vektorkonstruktion
-
1.3.1 Erzeugung von Vektorkonstrukten mit potentiellen NEENA-Molekülen
-
Unter Verwendung des Multisite-Gateway-Systems (Invitrogen, Carlsbad, CA, USA) wurden die Promoter:: NEENA::Reportergenkassetten in binäre Konstrukte für die Transformation von Pflanzen assembliert. In dem Reportergenkonstrukt wurde der Promoter A. thaliana p-AtNit1 (At3g44310, GenBank X86454;
WO03008596 ; mit dem Präfix p-, was Promoter bedeutet) verwendet und die Leuchtkäfer-Luciferase (Promega, Madison, WI, USA) wurde als Reporterprotein für die quantitative Bestimmung der expressionsverstärkenden Wirkungen der mutmaßlichen zu analysierenden NEENA-Moleküle verwendet.
-
Der pENTR/A-Vektor, der den Promoter p-AtNit1 birgt, wurde über ortsspezifische Rekombination (BP-Reaktion) zwischen den pDONR/A-Vektor und die p-AtNit1-Amplifikationsprodukte mit den Primern p-AtNit1-for und p-AtNit1-rev (Tabelle 3) auf genomischer DNA (siehe oben) gemäß dem Handbuch des Herstellers (Invitrogen, Carlsbad, CA, USA) kloniert, wobei ortsspezifische Rekombinationsstellen an jedem Ende lagen. Mit den positiven pENTR/A-Klonen wurde eine Sequenzanalyse durchgeführt, um zu gewährleisten, dass der Promoter p-AtNit1 korrekt war. Tabelle 3: Primer-Sequenzen (p-AtNit1)
-
Es wurde ein ENTR/B-Vektor, der die Leuchtkäfer-Luciferase-Kodiersequenz (Promega, Madison, WI, USA) gefolgt von dem t-nos-Nopalinsynthasetranskriptionsterminator (Genbank V00087) enthielt, erzeugt. PCR-Fragmente (siehe oben) von NEENA-Kandidaten wurden separat stromaufwärts der Leuchtkäfer-Luciferase-Kodiersequenz kloniert, und zwar unter Verwendung der Restriktionsenzyme KpnI und NcoI oder EcoRV. Die erhaltenen pENTR/B-Vektoren sind in Tabelle 4 zusammengefasst, wobei Promotermoleküle das Präfix p- aufweisen, Kodiersequenzen das Präfix c- aufweisen und Terminatormoleküle das Präfix t- aufweisen. Tabelle 4: alle pENTR/B-Vektoren plus und minus NEENA-Kandidaten
| pENTR/B-Vektor | Zusammensetzung der partiellen Expressionskassette SEQ ID NO:: Reportergen::Terminator |
| LJK1 | MCS::c-LUC::t-nos |
| LJK4 | SEQ ID NO1::c-LUC::t-nos |
| LJK40 | SEQ ID NO7::c-LUC::t-nos |
| LJK41 | SEQ ID NO10::c-LUC::t-nos |
| LJK43 | SEQ ID NO12::c-LUC::t-nos |
| LJK44 | SEQ ID NO3::c-LUC::t-nos |
| LJK46 | SEQ ID NO13::c-LUC::t-nos |
| LJK47 | SEQ ID NO5::c-LUC:t-nos |
| LJK48 | SEQ ID NO14::c-LUC::t-nos |
| LJK51 | SEQ ID NO15::c-LUC::t-nos |
| LJK52 | SEQ ID NO16::c-LUC::t-nos |
| LJK53 | SEQ ID NO6::c-LUC::t-nos |
| LJK54 | SEQ ID NO11::c-LUC::t-nos |
| LJK56 | SEQ ID NO9::c-LUC::t-nos |
| LJK57 | SEQ ID NO2::c-LUC::t-nos |
| LJK58 | SEQ ID NO4::c-LUC::t-nos |
| LJK59 | SEQ ID NO17::c-LUC::t-nos |
| LJK61 | SEQ ID NO8::c-LUC::t-nos |
| LJK62 | SEQ ID NO18::c-LUC::t-nos |
| LJK63 | SEQ ID NO19::c-LUC::t-nos |
-
Der pENTR/C-Vektor wurde dadurch konstruiert, dass man eine multiple Klonierungsstelle (SEQ ID NO60) über KpnI- und HindIII–Restriktionsstellen einführte. Durch Durchführen einer ortsspezifischen Rekombination (LR-Reaktion) wurden die erzeugten pENTR/A, pENTR/B und pENTR/C mit dem pSUN-Destinationsvektor (pSUN-Derivativ) kombiniert, und zwar gemäß dem Multisite-Gateway-Handbuch des Herstellers (Invitrogen, Carlsbad, CA, USA). Die Reaktionen ergaben 1 binären Vektor mit p-AtNit1-Promoter, der Leuchtkäfer-Luciferase-Kodiersequenz c-LUC und dem t-nos-Terminator und 19 Vektoren, die SEQ ID NO1, NO2, NO3, NO4, NO5, NO6, NO7, NO8, NO9, NO10, NO11, NO12, NO13, NO14, NO15, NO16, NO17, NO18 und NO19 unmittelbar stromaufwärts der Leuchtkäfer-Luciferase-Kodiersequenz bargen (Tabelle 5), für die die Kombination mit SEQ ID NO1 als Beispiel angeführt ist (SEQ ID NO61). Außer für die verschiedenen SEQ ID NO2 bis NO19 ist die Nukleotidsequenz in allen Vektoren identisch (Tabelle 5). Die erhaltenen Pflanzentransformationsvektoren sind in Tabelle 5 zusammengefasst: Tabelle 5: Pflanzenexpressionsvektoren für die Transformation von A. thaliana
| Pflanzenexpressionsvektor | Zusammensetzung der Expressionskassette Promoter::SEQ ID NO::Reportergen::Terminator | SEQ ID NO |
| LJK132 | p-AtNit1::-::c-LUC::t-nos | |
| LJK133 | p-AtNit1::SEQ ID NO1::c-LUC::t-nos | 61 |
| LJK91 | p-AtNit1::SEQ ID NO7::c-LUC::t-nos | |
| LJK92 | p-AtNit1::SEQ ID NO10::c-LUC::t-nos | |
| LJK94 | p-AtNit1::SEQ ID NO12::c-LUC::t-nos | |
| LJK95 | p-AtNit1::SEQ ID NO3::c-LUC::t-nos | |
| LJK97 | p-AtNit1::SEQ ID NO13::c-LUC::t-nos | |
| LJK98 | p-AtNit1::SEQ ID NO5::c-LUC::t-nos | |
| LJK99 | p-AtNit1::SEQ ID NO14::c-LUC::t-nos | |
| LJK102 | p-AtNit1::SEQ ID NO15::c-LUC::t-nos | |
| LJK103 | p-AtNit1::SEQ ID NO16::c-LUC:t-nos | |
| LJK104 | p-AtNit1::SEQ ID NO6::c-LUC:t-nos | |
| LJK105 | p-AtNit1::SEQ ID NO11::c-LUC::t-nos | |
| LJK107 | p-AtNit1::SEQ ID NO9::c-LUC:t-nos | |
| LJK108 | p-AtNit1::SEQ ID NO2::c-LUC::t-nos | |
| LJK109 | p-AtNit1::SEQ ID NO4::c-LUC::t-nos | |
| LJK110 | p-AtNit1::SEQ ID NO17::c-LUC::t-nos | |
| LJK112 | p-AtNit1::SEQ ID NO8::c-LUC::t-nos | |
| LJK113 | p-AtNit1::SEQ ID NO18::c-LUC::t-nos | |
| LJK114 | p-AtNit1::SEQ ID NO19::c-LUC::t-nos | |
-
Mit den erhaltenen Vektoren wurden anschließend A. thaliana-Blattprotoplasten transient transformiert.
-
1.3.2 Renilla-luciferase-Kontrollkonstrukt
-
Renilla-luciferase-cDNA wurde unter Verwendung von 10 ng des Plasmids pRL-null von Promega (Madison, WI, USA) als DNA-Matrize und den Primern R-LUC_for und R-LUC_rev (Tabelle 6) unter Verwendung der oben beschriebenen PCR-Parameter amplifiziert. Tabelle 6: Primer-Sequenzen (c-RLUC)
-
Im Anschluss an einen DNA-Restriktionsverdau mit der Restriktionsendonuklease KpnI (10 U/μl) und SacI (10 U/μl) wurden die verdauten Produkte nochmals mit dem Qiagen Gel Extraction Kit (Qiagen, Hilden, Deutschland) aufgereinigt.
-
Das Fragment wurde in einen ENTR/B-Vektor, der den konstitutiven Nopalinsynthasepromoter p-nos (Genbank V00087) und im Anschluss daran den t-nos-Nopalinsynthasetranskriptionsterminator (Genbank V00087) enthielt, über KpnI und Sack Restriktionsstellen cloniert, wodurch man zu einem pENTR/B-Clon gelangte, mit dem eine Sequenzanalyse durchgeführt wurde, um zu gewährleisten, dass die Expressionskassette, die die Renilla-luciferase enthielt, korrekt war.
-
Beispiel 2: Screening auf NEENA-Molekülkandidaten, die die Genexpression in transient transformierten A. thaliana-Blattprotoplasten verstärken
-
Dieses Beispiel erläutert, dass nur ausgewählte NEENA-Moleküle fähig sind, die Genexpression zu verstärken.
-
2.1 Isolation und transiente Transformation von A. thaliana-Blattprotoplasten
-
Die Isolation und transiente Transformation von A. thaliana-Blattprotoplasten wurde entsprechend von etablierten Protokollen modifiziert (Damm und Willmitzer, 1988; Damm et al., 1989). Die Blätter von 4 Wochen alten A. thaliana-Pflanzen wurden mit einer Rasierklinge in kleine Stücke geschnitten und diese wurden in eine Lösung mit 1,5% Cellulse R10 (Duchefa, Haarlem, Niederlande), 0,3% Mazerozyme R10 (Duchefa, Haarlem, Niederlande), 400 mM Mannit, 20 mM KCl, 20 mM MES, 10 mM CaCl2, pH 5,7 gegeben und über Nacht bei Raumtemperatur inkubiert. Aufgrund einer Variabilität der transienten A. thaliana-Blattprotoplastentransformation wurde die Renilla-luciferase (Dual-Luciferase® Reporter Assay System, Promega, Madison, WI, USA) dazu verwendet, um die Fähigkeit der Leuchtkäfer-Luciferase-Expression der oben genannten Konstrukte zu normalisieren. Die transiente Transformation des NEENA-freien (LJK132) und jedes NEENA-haltigen Vektorkonstrukts (LJK66–LJK114) erfolgte in dreifacher Wiederholung mit 6 μg Plasmid-DNA, die vor der Transformation mit 25 μg des die Renilla-luciferase enthaltenden Konstrukts vermischt worden war, unter Verwendung von PEG (Polyethylenglykol) und 1 × 104 Protoplasten.
-
2.2 Dualer Luciferase-Reportergen-Assay
-
Transfizierte A. thaliana-Protoplasten wurden durch Zentrifugieren bei 100 g gewonnen und nach Entfernen des Überstands in flüssigem Stickstoff eingefroren. Der Assay für den Nachweis der Leuchtkäfer- und Renilla-Luciferaseaktivität in den transfizierten Zellen erfolgte gemäß dem Handbuch des Herstellers (Promega, Madison, WI, USA) Dual-Luciferase Reporter Assay System. Die Lumineszenzmessungen erfolgten in einem Gerät des Typs MicroLumat Plus LB96V (Berthold Technologies, Bad Wildbad, Deutschland) nach Zugabe der Luciferase-Substrate. Die Messwerte von beiden Luciferase-Aufnahmen wurden dadurch normalisiert, dass man ein Verhältnis zwischen der Leuchtkäfer-luciferase und der Renilla-luciferase berechnete. Aus den Daten aus drei Versuchen wurden für jedes Konstrukt Durchschnitte errechnet und auf der Grundlage von diesen durchschnittlichen Expressionswerten wurden Fold-Change-Werte berechnet, um die Auswirkung des Vorhandenseins einer mutmaßlichen NEENA gegenüber Reportergenkonstrukten, denen die jeweilige mutmaßliche NEENA fehlt, zu beurteilen. Im Vergleich zu Reportergenkonstrukten ohne NEENA und nur mit p-AtNit1-Promoter mit Spezifität für den Samen zeigten die 19 geprüften NEENA-Kandidaten enthaltenden Konstrukte sowohl negative als auch positive Auswirkung, die von einer 0,1-fachen bis 18,1-fachen Induktion der Leuchtkäfer-Luciferaseaktivität reichten (1). Insgesamt vermittelten 9 mutmaßliche NEENA-Moleküle umfassend Sequenzen mit SEQ ID NO1, NO2, NO3, NO4, NO5, NO6, NO7, NO8 und NO9 eine Erhöhung der Genexpression basierend auf der Aktivität des Luciferasereportergens von 2-fach oder mehr im Vergleich zu dem Reportergenkonstrukt ohne NEENA und nur mit Promoter (1) und sind daher funktionelle NEENA-Moleküle. Da mehrere der getesteten NEENA-Kandidatenmoleküle nur geringe oder sogar negative Auswirkung auf die Verstärkung der Genexpression ausüben, vermitteln nicht alle mutmaßlichen NEENA-Moleküle eine gemeinsame stimulierende Auswirkung; vielmehr vermitteln die ausgewählten NEENA-Sequenzen eine signifikante Verstärkung der Genexpression (SEQ ID NO 1 bis 9).
-
Beispiel 3: Prüfen von NEENA-Molekülen auf die Verstärkung der Genexpression in Rapspflanzen
-
Dieses Beispiel zeigt, dass NEENA-Moleküle über verschiedene Arten hinweg eingesetzt werden können, um die Genexpression eines Promoters in allen geprüften Geweben im Vergleich zu einem Ansatz ohne NEENA und nur mit Promoter zu verstärken.
-
Die NEENA-Moleküle, die im Vor-Screening die stärkste Verstärkung der Genexpression vermittelten (vgl. Beispiel 2, SEQ ID NO1, NO2, NO3, NO4 und NO5) wurden ausgewählt, um die Verstärkung der Genexpressionsniveaus in transgenen Rapspflanzen zu bestimmen.
-
3.1 Vektorkonstruktion für die Pflanzentransformation von B. napus
-
Für die Transformation von Rapspflanzen wurden Reportergenexpressionskassetten mit und ohne Genexpressionskontrollmoleküle (SEQ IDs NO1–NO5) mit einer Genexpressionskassette, die ein Selektionsmarkergen für den Nachweis von transgenen Pflanzenlinien trägt, innerhalb eines pENTR/C-Vektors kombiniert. Durch Durchführen einer ortsspezifischen Rekombination (LR-Reaktion) wie zuvor beschrieben (siehe oben, 1.4) wurden pENTR/A, pENTR/B und pENTR/C mit der Selektionsmarkerkassette, gemäß dem Multisite-Gateway-Handbuch des Herstellers (Invitrogen, Carlsbad, CA, USA) mit dem pSUN-Destinationsvektor kombiniert. Die Reaktionen ergaben einen binären Vektor mit p-AtNit1-Promoter, der Leuchtkäfer-Luciferase-Kodiersequenz c-LUC, dem t-nos-Terminator und der Selektionsmarkerkassette, sowie 5 Vektoren, die SEQ ID NO1, NO2, NO3, NO4 und NO5 unmittelbar stromaufwärts der Leuchtkäfer-Luciferase-Kodiersequenz bargen (Tabelle 7), für die die Kombination mit SEQ ID NO1 als Beispiel angeführt ist (SEQ ID NO 64). Außer für die verschiedenen SEQ ID NO2 bis NO5 ist die Nukleotidsequenz in allen Vektoren identisch (Tabelle 7). Die erhaltenen Pflanzentransformationsvektoren sind in Tabelle 7 zusammengefasst: Tabelle 7: Pflanzenexpressionsvektoren für die Transformation von B. napus
| Pflanzenexpressionsvektor | Zusammensetzung der Expressionskassette Promoter::SEQ ID NO::Reportergen::Terminator | SEQ ID NO |
| LJK138 | p-AtNit1::-::c-LUC::t-nos | |
| LJK139 | p-AtNit1::SEQ ID NO1::c-LUC::t-nos | 64 |
| LJK141 | p-AtNit1::SEQ ID NO3::c-LUC::t-nos | |
| LJK142 | p-AtNit1::SEQ ID NO5::c-LUC::t-nos | |
| LJK143 | p-AtNit1::SEQ ID NO2::c-LUC::t-nos | |
| LJK144 | p-AtNit1::SEQ ID NO4::c-LUC::t-nos | |
-
3.2 Herstellung von transgenen Rapspflanzen (geändertes Protokoll gemäß Maloney et al., 1992, Plant Cell Reports, 8: 238–242).
-
Als Vorbereitung für die Herstellung von transgenen Rapspflanzen wurden die binären Vektoren in Agrobacterium tumefaciens C58C1:pGV2260 hineintransformiert (Deblaere et al., 1985, Nucl. Acids. Res. 13: 4777–4788). Eine 1:50-Verdünnung einer Übernachtkultur von Agrobakterien, die das jeweilige binäre Konstrukt bergen, wurde in Murashige-Skoog-Medium (Murashige und Skoog, 1962, Physiol. Plant 15, 473) mit einem Zusatz von 3% Saccharose (3MS-Medium) herangezogen. Für die Transformation von Rapspflanzen wurden Petiolen oder Hypokotyle von sterilen Pflanzen 5–10 Minuten lang in einer 1:50 Agrobacterium-Lösung inkubiert, gefolgt von einer drei Tage langen Coinkubation auf 3 MS-Medium mit einem Zusatz von 0,8% Bacto-Agar im Dunkeln bei 25°C. Nach drei Tagen wurden die Explantate auf MS-Medium, das 500 mg/l Claforan (Cefotaxime-Natrium), 100 nM Imazetapyr, 20 μM Benzylaminopurin (BAP) und 1,6 g/l Glukose mit einer Fotoperiode von 16 h Licht/8 h Dunkelheit umgesetzt, was wöchentlich wiederholt wurde. Die wachsenden Sprosse wurden auf MS-Medium mit 2% Saccharose, 250 mg/l Claforan und 0,8% Bacto-Agar umgesetzt. Nach 3 Wochen wurde das Medium mit dem Wachstumshormon 2-Indolbutylsäure versetzt, um die Wurzelbildung zu fördern. Die Sprosse wurden nach der Wurzelentwicklung auf Erde umgesetzt, 2 Wochen lang in einer Wachstumskammer herangezogen und unter Gewächshausbedingungen bis zur Reife herangezogen.
-
3.3 Pflanzenanalyse
-
Aus den erzeugten transgenen Pflanzen wurden von Blättern, Blüten und Schoten Gewebeproben entnommen, in einem Gefrierschrank bei –80°C aufbewahrt, einem Luciferase-Reportergen-Assay unterzogen (geänderte Vorschrift nach Ow et al, 1986). Nach dem Mahlen wurden die gefrorenen Gewebeproben wieder in 800 μl Puffer I (0,1 M Phosphatpuffer pH 7,8, 1 mM DTT (Sigma Aldrich, St. Louis, MO, USA)), 0,05% Tween 20 (Sigma Aldrich, St. Louis, MO, USA) suspendiert und anschließend 10 min bei 10 000 g zentrifugiert. Von dem wässrigen Überstand wurden 75 μl in 96-Well-Platten überführt. Nach Versetzen mit 25 μl Puffer II (80 mM Gycinglycyl (Carl Roth, Karlsruhe, Deutschland), 40 mM MgSO4 (Duchefa, Haarlem, Niederlande), 60 mM ATP (Sigma Aldrich, St. Louis, MO, USA), pH 7,8) und D-Luciferin auf eine Endkonzentration von 0,5 mM (Kat Nr: L-8220, BioSynth, Staad, Schweiz) wurde die Lumineszenz in einem Gerät des Typs MicroLumat Plus LB96V (Berthold Technologies, Bad Wildbad, Deutschland) aufgezeichnet, wodurch man die Einheit relative Lichteinheit RLU pro Minute (RLU/min) erhält. Zum Normalisieren der Luciferaseaktivität zwischen den Proben wurde die Proteinkonzentration in dem wässrigen Überstand parallel zu der Luciferaseaktivität (Adaptation nach Bradford, 1976, Anal. Biochem. 72, 248) bestimmt. 5 μl des wässrigen Zellextrakts in Puffer I wurden mit 250 μl Bradford-Reagens (Sigma Aldrich, St. Louis, MO, USA) vermischt, und der Ansatz wurde 10 min bei Raumtemperatur inkubiert. Die Absorption wurde bei 595 nm in einem Plattenlesegerät (Thermo Electron Corporation, Multiskan Ascent 354) bestimmt. Die Gesamtproteinmengen in den Proben wurden mit einer zuvor erstellten Standard-Konzentrationskurve berechnet. Mit den Werten, die aus einem Verhältnis von RLU/min und mg Protein/ml Probe erzielt wurden, wurden Durchschnitte für transgene Pflanzen, die identische Konstrukte bargen, berechnet, und die Fold-Change-Werte wurden berechnet, um die Auswirkung des Vorhandenseins des NEENA-Moleküls im Vergleich zu Reportergenkonstrukten ohne NEENA zu beurteilen.
-
3.4 NEENA-Sequenzen vermitteln eine starke Verstärkung der Genexpression in Rapspflanzen Zum Beurteilen des Potentials der Verstärkung der Genexpression von ausgewählten NEENA-Molekülen (SEQ ID NO: 1, 2, 3, 4 und 5) in Rapspflanzen, wurden Blätter, Blüten und samenhaltige Schoten von Pflanzen in identischen Entwicklungsstadien, die unter den gleichen Wachstumsbedingungen herangezogen wurden, gewonnen. Die Proben wurden von einzelnen transgenen Rapspflanzenlinien, die entweder ein Reportergenkonstrukt mit nur dem Promoter oder Luciferase-Reportergenkonstrukte enthaltend eine NEENA (SEQ ID NO1, 2, 3, 4 und 5) bargen, entnommen. Von jedem transgenen Event wurden 10 Samen entnommen, verarbeitet und wie oben beschrieben auf Luciferaseaktivitat analysiert (Beispiel 3.3).
-
Im Vergleich zu den Reportergenkonstrukten mit nur dem konstitutiven p-AtNit1-Promoter und ohne NEENA vermittelten alle fünf geprüften NEENA-Moleküle starke Verstärkung der Genexpression in Blattgewebe (2, a). Eine vergleichbare Verstärkung der Expression wurde in Rapsblüten und -schoten einschließlich Samen nachgewiesen (2, b und c).
-
Beispiel 4: Analyse der konstitutiven Verstärkung der Genexpression in Sojabohnenpflanzen
-
Dieses Beispiel zeigt, dass NEENA-Moleküle in verschiedensten Pflanzenarten und über die Artenbarriere von unterschiedlichen Pflanzenfamilien hinweg eingesetzt werden können, um im Vergleich zu einem Ansatz ohne NEENA mit nur einem Promoter die Genexpression in allen Geweben zu verstärken.
-
Die NEENA-Sequenzmoleküle, die im Vor-Screening die stärkste Verstärkung der Genexpression vermittelten (vgl. Beispiel 2, SEQ ID NO1, 2, 3, 4 und 5), wurden ausgewählt, um die Verstärkung der Genexpressionsniveaus in transgenen Sojabohnenpflanzen zu bestimmen. Für die stabile Transformation von Sojabohnen wurden die Expressionsvektoren LJK138, LJK139, LJK141, LJK142, LJK143 und LJK144 (vgl. Beispiel 3.1) benutzt.
-
4.1 Erzeugung von transgenen Sojabohnenpflanzen (geänderte Vorschrift gemäß WO2005/121345; Olhoft et al., 2007).
-
Das Keimen von Sojabohnensamen, die Vermehrung, die Präparation von A. rhizogenes und Axelmeristemexplantaten sowie das Inokulieren erfolgten wie zuvor beschrieben (
WO2005/121345 ;
Olhoft et al., 2007), nur dass die Konstrukte LJK138, LJK139, LJK141, LJK142, LJK143 und LJK144 (vgl. Beispiel 3.1) jeweils ein mutiertes AHAS-Gen enthielten, das von dem Petersilien-Ubiquitin-Promoter PcUbi4-2 vorangetrieben wurde, was Toleranz für Imidazolinonherbizide für Selektionszwecke vermittelt.
-
4.2 NEENA-Sequenzen vermitteln eine starke Verstärkung der Genexpression in Sojabohnenpflanzen
-
Aus den erzeugten transgenen Pflanzen wurden Gewebeproben aus Blättern, Blüten und Samen entnommen. Die Gewebeproben wurden wie oben beschrieben verarbeitet und analysiert (vgl. Beispiel 3.3)
-
Im Gegensatz zu dem Genkonstrukt mit nur dem konstitutiven p-AtNit1-Promoter und ohne das NEENA-Reportgen vermittelten alle fünf getesteten NEENA-Moleküle eine starke Verstärkung der Expression in Blättern (3a). Eine vergleichbare Verstärkung der Genexpression, die durch NEENAs (SEQ ID NO1 bis NO5) vermittelt wurde, wurde in Blüten und Schoten nachgewiesen (3, b und c).
-
Beispiel 5: Analyse der NEENA-Aktivität in monokotylen Pflanzen
-
Dieses Beispiel beschreibt die Analyse der NEENA-Sequenzen mit SEQ ID NO 1, 2, 3, 4 und 5 in monokotylen Pflanzen.
-
5.1 Vektorkonstruktion
-
Für die Analyse von NEENA-Sequenzen mit SEQ ID NO 1, 2, 3, 4 und 5 in monokotylen Pflanzen wird ein auf pUC basierender Expressionsvektor, der eine Expressionskassette birgt, die aus dem NEENA-freien konstitutiven monokotylen Promoter p-Ubi aus Z. mais besteht, mit einer Kodiersequenz des beta-Glucuronidase(GUS)-Gens, gefolgt von dem Nopalinsynthase(NOS)-Transkriptionsterminator, kombiniert. Genomische DNA wird aus grünem Gewebe von A. thaliana unter Verwendung des Qiagen DNeasy Plant Mini Kits (Qiagen, Hilden, Deutschland) extrahiert. Genomische DNA-Fragmente enthaltend NEENA-Moleküle werden mittels traditioneller Polymerase-Kettenreaktion (PCR) isoliert. Die Primer werden auf Grundlage der A. thaliana-Genomsequenz mit einer Vielzahl von NEENA-Kandidaten entwickelt. Die Reaktion umfasst 5 Primer-Sätze (Tabelle 8) und folgt der von Phusion High Fidelity DNA Polymerase (Cat No F-540L, New England Biolabs, Ipswich, MA, USA) umrissenen Vorschrift, wobei die folgenden Primer eingesetzt werden: Tabelle 8: Primer-Sequenzen

-
Die Amplifikation während der PCR und die Aufreinigung der Amplifikationsprodukte erfolgt wie oben angeführt (Beispiel 1.2). Nach DNA-Restriktionsverdau mit AscI (10 U/μl)-Restriktionsendonuklease werden die verdauten Produkte mit dem Qiagen Gel Extraction Kit (Qiagen, Hilden, Deutschland) aufgereinigt.
-
Die NEENA-PCR-Fragmente (siehe oben) werden unter Verwendung von AscI Restriktionsstellen stromaufwärts von der beta-Glucuronidase-Kodiersequenz separat kloniert. Die Reaktion ergibt einen binären Vektor mit dem p-Ubi-Promoter, der beta-Glucuronidase-Kodiersequenz c-GUS und dem t-nos-Terminator sowie fünf Vektoren, die SEQ ID NO1, NO2, NO3, NO4 und NO5 unmittelbar stromaufwärts von der beta-Glucuronidase-Kodiersequenz bergen (Tabelle 9), für die die Kombination mit SEQ ID NO1 als Beispiel angeführt wird (SEQ ID NO75). Mit Ausnahme für die verschiedenen SEQ ID NO2 bis NO5 ist die Nukleotidsequenz in allen Vektoren identisch (Tabelle 9). Die erhaltenen Vektoren sind in Tabelle 9 zusammengefasst, wobei Promotermoleküle das Präfix p-, Kodiersequenzen das Präfix c- und Terminatormoleküle das Präfix t- aufweisen. Tabelle 9: Pflanzenexpressionsvektoren
| Pflanzenexpressionsvektor | Zusammensetzung der Expressionskassette Promoter::SEQ ID NO::Reportergen::Terminator | SEQ ID NO |
| RTP2940 | p-Ubi::-::c-GUS::t-nos | |
| LJK361 | p-Ubi::SEQ ID NO1::c-GUS::t-nos | 75 |
| LJK362 | p-Ubi::SEQ ID NO2::c-GUS::t-nos | |
| LJK363 | p-Ubi::SEQ ID NO3::c-GUS::t-nos | |
| LJK364 | p-Ubi::SEQ ID NO4::c-GUS::t-nos | |
| LJK365 | p-Ubi::SEQ ID NO5::c-GUS::t-nos | |
-
Mit den erhaltenen Vektoren werden NEENA-Moleküle in unten umrissenen Versuchen analysiert (Beispiel 5.2).
-
5.2 Analyse von NEENA-Molekülen, die die Genexpression in monokotylen Pflanzengeweben verstärken
-
Diese Versuche werden dadurch durchgeführt, dass man monokotyle Pflanzengewebe oder Zellkulturen beschießt (Beispiel 6.2.1), durch PEG-vermittelte (oder methodisch ähnliche) Einführung von DNA in Pflanzenprotoplasten (Beispiel 6.2.2) oder durch Agrobacterium-vermittelte Transformation (Beispiel 6.3.3). Das Zielgewebe für diese Versuche können Pflanzengewebe (z. B. Blattgewebe), pflanzliche Zellkulturen (z. B. der Mais Block Mexican Sweetcorn (BMS)) oder Pflanzenembryonen für Agrobacterium-Protokolle sein.
-
5.2.1 Transienter Assay mit Beschuss mit Mikroprojektilen
-
Die Plasmidkonstrukte werden mit dem Qiagen-Plasmidkit (Kat. Nr. 12143) isoliert. Die DNA wird gemäß dem Protokoll von Sanford et al. (1993) (Optimizing the biolistic process for different biological applications. Methods in Enzymology, 217: 483–509) auf 0,6 μM Goldpartikel (Bio-Rad Kat. Nr. 165–2262) gefällt und mit einem Gerät des PDS-1000/He-Systems (Bio-Rad) auf Zielgewebe (z. B., zwei Wochen alte Maisblätter, BMS-Zellkulturen usw.) beschleunigt. Alle DNA-Fallungs- und -Beschussschritte werden unter sterilen Bedingungen bei Raumtemperatur durchgeführt. Suspensionskulturen von Mais „Block Mexican Sweet” (BMS) werden in flüssigem BMS-Zellkulturmedium [Murashige und Skoog(MS)-Salze (4,3 g/l), 3% (w/v) Saccharose, myo-Inosit (100 mg/l), 3 mg/l 2,4-Dichlorphenoxyessigsäure (2,4-D), Caseinhydrolysat (1 g/l), Thiamin (10 mg/l) und L-Prolin (1,15 g/l), pH 5,8] vermehrt. Jede Woche werden 10 ml einer Kultur von stationären Zellen in 40 ml frisches Medium umgesetzt und in einem 250-ml-Kolben auf einem Rundschüttler bei 110 U/m bei 27°C kultiviert.
-
60 mg Goldpartikel in einem silikonbeschichteten Eppendorf-Röhrchen werden in 100% Ethanol suspendiert und anschließend 30 Sekunden zentrifugiert. Das Pellet wird ein Mal mit 100% Ethanol und zwei Mal mit sterilem Wasser gewaschen, wobei nach jedem Waschschritt zentrifugiert wird. Schließlich wird das Pellet in 1 ml sterilem 50%igem Glyzerin suspendiert. Die Goldsuspension wird dann in aliquote Teile zu je 50 μl aufgeteilt und bei 4°C aufbewahrt. Jeder aliquote Teil wird mit den folgenden Reagentien versetzt: 5 μl 1 μg/μl Gesamt-DNA, 50 μl 2,5 M CaCl2, 20 μl 0,1 M Spermidin, freie Base. Die DNA-Lösung wird 1 Minute lang im Vortex-Mischer gemischt und 3 min bei –80°C stehengelassen, wonach 10 Sekunden lang zentrifugiert wird. Der Überstand wird abgenommen. Das Pellet wird durch Anschnippen des Röhrchens mit dem Finger vorsichtig wiederum in 1 ml 100%igem Ethanol suspendiert, wonach 10 Sekunden lang zentrifugiert wird. Der Überstand wird abgenommen und das Pellet wird vorsichtig in 50 μl 100%igem Ethanol suspendiert und bis zur Verwendung bei –80°C aufbewahrt (30 min bis 4 h vor dem Beschießen). Wenn Goldaggregate in der Lösung sichtbar sind, werden die Röhrchen unmittelbar vor der Verwendung eine Sekunde lang in einem Wasserbad-Ultraschallgerät mit Ultraschall behandelt.
-
Für das Beschießen werden zwei Wochen alte Maisblätter in Stücke mit einer Länge von ungefähr 1 cm geschnitten und mit der Oberfläche nach oben auf ein osmotisches Induktionsmedium M-N6-702 [N6 Salze (3,96 g/l), 3% (w/v) Saccharose, 1,5 mg/l 2,4-Dichlorphenoxyessigsäure (2,4-D), Caseinhydrolysat (100 mg/l) und L-Prolin (2,9 g/l), MS-Vitaminvorratslösung (1 ml/l), 0,2 M Mannit, 0,2 M Sorbit, pH 5,8] gelegt. Die Stücke werden 1–2 Stunden lang inkubiert. Bei den BMS-Zellkulturen werden eine Woche alte Suspensionszellen bei 1000 g in einer Zentrifuge des Typs Avanti J25 von Beckman/Coulter pelletiert und der Überstand wird verworfen. Die Zellen werden mit einer Spatel als 1/16-Inch-dicke Lage auf aschefreie Whatman-Rundfilter ausplattiert Das Filterpapier zusammen mit dem Pflanzenmaterial werden 1–2 Stunden vor dem Beschießen bei 27°C im Dunkeln auf osmotisches Induktionsmedium gegeben. Kurz vor dem Beschießen werden die Filter von dem Medium entfernt und auf einen Stoß von sterilem Filterpapier gelegt, um die Kallusoberfläche teilweise trocknen zu lassen.
-
Jede Platte wird zwei Mal mit 6 μl Gold-DNA-Lösung beschossen, und zwar bei 1,800 psi für das Blattmaterial und bei 1,100 psi für die BMS-Zellkulturen. Um die Position des Pflanzenmaterials beizubehalten, wird ein sterilisiertes Drahtnetz auf die Probe gelegt. Nach dem Beschießen werden die Filter mit den Proben auf M-N6-702 ohne Mannit und Sorbit umgesetzt und vor den transienten Assays 2 Tage im Dunkeln bei 27°C inkubiert.
-
Die transiente Transformation durch Beschießen von anderen monokotylen Pflanzen mit Mikroprojektilen erfolgt zum Beispiel mit einer bei Wang et al., 1988 (Transient expression of foreign genes in rice, wheat and soybean cells following particle bombardment. Plant Molecular Biologe, 11 (4), 433–439), Christou, 1997 (Rice transformation: bombardment. Plant Mol Biol. 35 (1–2)) beschriebenen Technik.
-
Die Expressionsniveaus der exprimierten Gene in den oben beschriebenen Konstrukten (Beispiel 5.1) werden mittels GUS-Färbung, quantitativer Bestimmung der Lumineszenz/Fluoreszenz, RT-PCR und Proteinabundanz (Nachweis durch spezifische Antikörper) mit fachbekannten Vorschriften bestimmt. Die GUS-Färbung erfolgt durch 16–24stündiges Inkubieren des Pflanzenmaterials in GUS-Lösung [100 mM NaHPO4, 10 mM EDTA, 0,05% Triton X100, 0.025% X-Gluc-Lösung (5-Brom-4-chlor-3-indolyl-beta-D-glucuronsäure, gelöst in DMSO), 10% Methanol, pH 7,0] bei 37°C. Mit den Pflanzengeweben wird zwei Mal 15 Minuten lang eine Vakuuminfiltration durchgeführt, damit die Färbung gleichmäßig erfolgt. Die Analysen der Luciferaseaktivitäten werden wie oben beschrieben durchgeführt (Beispiel 2 und 13). Im Vergleich zu den Reportergenkonstrukten mit nur dem konstitutiven p-Ubi-Promoter und ohne NEENA vermitteln alle NEENA-Moleküle in diesen Assays eine starke Verstärkung der Genexpression.
-
5.2.2 Transienter Assay mit Protoplasten
-
Die Protoplasten werden nach dem von Sheen (1990) (Metabolic Repression of Transcription in Higher Plasts. The Plant Cell 2 (10), 1027–1038) entwickelten Protokoll isoliert. Maiskeimpflanzen wurden 10 Tage lang bei 25°C im Dunkeln und 20 Stunden vor der Protoplastenpräparation bei Licht gehalten. Der Mittelteil der Blätter wird in 0,5-mm-Streifen (ungefähr 6 cm lang) geschnitten und in einer Enzymlösung inkubiert, die 1% (w/v) Cellulose RS, 0,1% (w/v) Macerozyme R10 (beide von Yakult Honsha, Nishinomiya, Japan), 0,6 M Mannit, 10 mM Mes (pH 5,7), 1 mM CaCl2, 1 mM MgCl2, 10 mM beta-Mercaptoethanol und 0,1% BSA (w/v) enthielt, 3 Stunden bei 23°C inkubiert, wonach 10 Minuten lang bei 80 U/min vorsichtig geschüttelt wurde, um die Protoplasten freizusetzen. Die Protoplasten werden durch 2-minütiges Zentrifugieren bei 100 × g gewonnen, einmal mit kalter 0,6 M Mannitlösung gewaschen, zentrifugiert und wiederum in kaltem 0,6 M Mannit (2 × 106/ml) suspendiert.
-
Insgesamt werden 0,5 ml einer Maisprotoplastensuspension (1 × 106 Zellen/ml) mit insgesamt 50 μg Plasmid-DNA in einem Gesamtvolumen von 100 μl sterilem Wasser versetzt und vorsichtig vermischt. Dann wird mit 0,5 ml PEG-Lösung (40% PEG 4.000, 100 mM CaNO3, 0,5 Mannit) versetzt und auf 70°C unter vorsichtigem Schütteln vorgewärmt, wonach mit 4,5 ml MM-Lösung (0,6 M Mannit, 15 mM MgCl2 und 0,1% MES) versetzt wird. Die Mischung wird 15 Minuten lang bei Raumtemperatur inkubiert. Die Protoplasten werden zweimal durch 5-minütiges Pelletieren bei 600 U/min gewaschen und in 1,0 ml MMB-Lösung [0,6 M Mannit, 4 mM Mes (pH 5,7) und Brommosaikvirus(BMV)-Salzen (optional)] resuspendiert und 48 Stunden lang im Dunkeln bei 25°C inkubiert. Nach dem letzten Waschschritt werden die Protoplasten in 3 ml MMB-Medium aufgenommen und 48 Stunden lang im Dunkeln bei 25°C inkubiert.
-
Die transiente Transformation von Protoplasten von anderen monokotylen Pflanzen wird zum Beispiel mit einer bei Hodges et al., 1991 (Transformation and regeneration of rice protoplasts, Biotechnology in agriculture, No. 6, Rice Biotechnology. International Rice Research Institute, ISBN: 0-85198-712-5) oder Lee et al., 1990 (Transient gene expression in wheat (Triticum aestivum) protoplasts. Biotechnology in agriculture and forestry 13 – Wheat. Springer Verlag, ISBN-10: 3540518096) beschriebenen Technik durchgeführt.
-
Die Expressionsniveaus der exprimierten Gene in den oben beschriebenen Konstrukten (Beispiel 5.1) werden durch GUS-Färbung, quantitative Bestimmung der Lumineszenz/Fluoreszenz, RT-PCR oder Proteinabundanz (Nachweis durch spezifische Antikörper) unter Verwendung der fachbekannten Protokolle bestimmt. Die GUS-Färbung erfolgt durch Inkubieren des Pflanzenmaterials in GUS-Lösung [100 mM NaHPO4, 10 mM EDTA, 0,05% Triton X100, 0,025% X-Gluc-Lösung (5-Brom-4-chlor-3-indolyl-beta-D-glucuronsäure, gelost in DSMO), 10% Methanol, pH 7,0] bei 37°C über 16–24 Stunden. Die Analysen der Luciferaseaktivitäten werden wie oben beschrieben (Beispiel 2 und 3.3) durchgeführt.
-
Im Vergleich zu dem Reportergenkonstrukt mit nur dem konstitutivem p-Ubi-Promoter und ohne NEENA vermitteln die NEENA-Moleküle in diesen Assays eine starke Verstärkung der Genexpression.
-
5.2.3 Transformation und Regeneration von monokotylen Kulturpflanzen
-
Die Agrobacterium-vermittelte Pflanzentransformation mit Hilfe von standardmäßigen Transformations- und Regenerationstechniken kann auch erfolgen, um Kulturpflanzen zu transformieren (
Gelvin und Schilperoort, 1995, Plant Molecular Biology Manual, 2. Ausgabe, Dordrecht: Kluwer Academic Publ. ISBN 0-7923-2731-4;
Glick und Thompson (1993) Methods in Plant Molecular Biology and Biotechnology, Boca Raton: CRC Press, ISBN 0-8493-5164-2). Die Transformation von Mais oder anderen monokotylen Pflanzen kann zum Beispiel mit Hilfe einer in
US 5,591,616 beschriebenen Technik erfolgen. Die Transformation von Pflanzen durch Beschießen mit der Genkanone, die polyethylenglykolvermittelte DNA-Aufnahme oder die Siliziumcarbonatfasertechnik ist zum Beispiel beschrieben in
Freeling & Walbot (1993) "The maize handbook" ISBN 3-540-97826-7, Springer Verlag New York).
-
Die Expressionsniveaus der exprimierten Gene in den oben beschriebenen Konstrukten (Beispiel 5.1) werden unter Verwendung von fachbekannten Vorschriften mittels GUS-Färbung, quantitativer Bestimmung der Lumineszenz oder Fluoreszenz, RT-PCR, Proteinabundanz (Nachweis durch spezifische Antikörper) bestimmt. Die GUS-Färbung erfolgt durch 16–24stündiges Inkubieren des Pflanzenmaterials in GUS-Lösung [100 mM NaHPO4, 10 mM EDTA, 0,05% Triton X100, 0,025% X-Gluc-Lösung (5-Brom-4-chlor-3-indolyl-beta-D-glucuronsäure, gelöst in DMSO), 10% Methanol, pH 7,0] bei 37°C. Mit den Pflanzengeweben wird zwei Mal 15 Minuten lang eine Vakuuminfiltration durchgeführt, damit die Färbung gleichmäßig erfolgt. Die Analysen der Luciferaseaktivitäten werden wie oben beschrieben durchgeführt (siehe Beispiel 2 und 3.3).
-
Im Vergleich zu den Reportergenkonstrukten mit nur dem konstitutiven p-Ubi-Promoter und ohne NEENA vermitteln die NEENA-Moleküle eine starke Verstärkung der Genexpression in Pflanzen.
-
Beispiel 6: Quantitative Analyse der NEENA-Aktivität in Maispflanzen
-
Dieses Beispiel beschreibt die Analyse der NEENA-Sequenzen mit SEQ ID NO 1 und 2 in Maispflanzen
-
6.1 Vektorkonstruktion
-
Für die quantitative Analyse der NEENA-Sequenzen mit SEQ ID NO 1 und 2 in monokotylen Pflanzen wurde ein auf pUC-basierender Expressionsvektor, der eine Expressionskassette birgt, die aus dem konstitutiven monokotylen Promoter ohne NEENA p-Ubi aus Z. mais besteht, mit einer Kodiersequenz des Leuchtkäfer-Luciferase(LUC)-Gens (Promega, Madison, WI, USA) kombiniert, gefolgt von einem Nopalinsynthase(NOS)-Transkriptionsterminator. Genomische DNA wurde aus grünem Gewebe von A. thaliana unter Verwendung des Qiagen DNeasy Plant Mini Kits (Qiagen, Hilden, Deutschland) extrahiert. Genomische DNA-Fragmente enthaltend NEENA-Moleküle wurden mittels traditioneller Polymerase-Kettenreaktion (PCR) isoliert. Die Primer wurden auf Grundlage der A. thaliana-Genomsequenz mit einer Vielzahl von NEENA-Kandidaten entwickelt. Die Reaktion umfasste 2 Primer-Sätze (Tabelle 10) und folgt der von Phusion High Fidelity DNA Polymerase (Cat No F-540L, New England Biolabs, Ipswich, MA, USA) umrissenen Vorschrift, wobei die folgenden Primer eingesetzt werden: Tabelle 10: Primer-Sequenzen
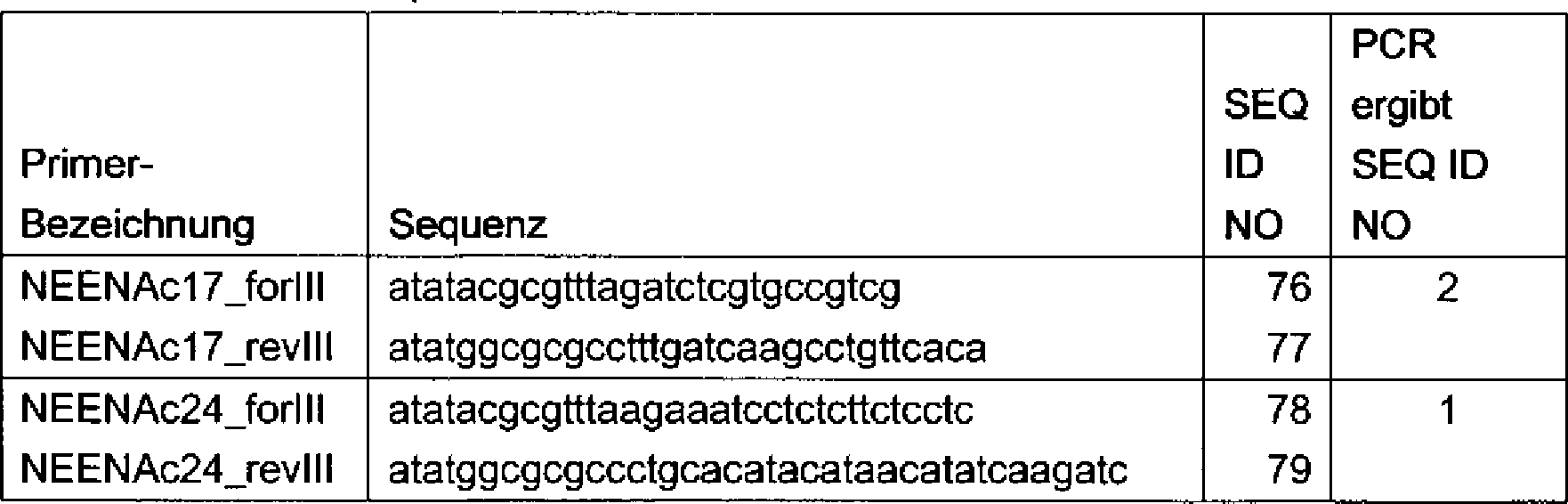
-
Die Amplifikation während der PCR und die Aufreinigung der Amplifkationsprodukte erfolgte wie oben angeführt (Beispiel 12). Nach DNA-Restriktionsverdau mit MluI (10 U/μl) und AscI (10 U/μl) Restriktionsendonukleasen wurden die verdauten Produkte mit dem Qiagen Gel Extraction Kit (Qiagen, Hilden, Deutschland) aufgereinigt.
-
Die NEENA-PCR-Fragmente (siehe oben) wurden unter Verwendung von AscI-Restriktionsstellen separat stromaufwärts von der Leuchtkäfer-Luciferase-Kodiersequenz kloniert. Die Reaktion ergab einen binären Vektor mit dem p-Ubi-Promoter, der Leuchtkäfer-Luciferase-Kodiersequenz c-LUC und dem t-nos-Terminator, sowie zwei Vektoren, die SEQ ID NO1 und NO2 unmittelbar stromaufwärts von der Leuchtkäfer-Luciferase-Kodiersequenz (Tabelle 11) bergen, für die die Kombination mit SEQ ID NO1 beispielhaft angeführt ist (SEQ ID NO80). Mit Ausnahme für die verschiedenen SEQ ID NO2 ist die Nukleotidsequenz in allen Vektoren identisch (Tabelle 11). Die erhaltenen Vektoren sind in Tabelle 11 zusammengefasst, wobei Promotermoleküle das Präfix p-, Kodiersequenzen das Präfix c- und Terminatarmoleküle das Präfix t- aufweisen. Tabelle 11: Pflanzenexpressionsvektoren
| Pflanzenexpressionsvektor | Zusammensetzung der Expressionskassette Promoter::SEQ ID NO::Reportergen::Terminator | SEQ ID NO |
| LJK309 | p-Ubi::-::c-LUC::t-nos | |
| LJK327 | p-Ubi::SEQ ID NO1::c-LUC::t-nos | 80 |
| LJK326 | p-Ubi::SEQ ID NO2::c-LUC::t-nos | |
-
Mit den erhaltenen Vektoren werden NEENA-Moleküle in unten umrissenen Versuchen analysiert (Beispiel 6.2).
-
6.2 Herstellung von transgenen Maispflanzen
-
Das Keimen von Mais, die Vermehrung, die Präparation von A. tumefaciens und die Inokulationen erfolgten wie zuvor beschrieben (
WO2006136596 ,
US20090249514 ), nur dass die Konstrukte LJK309, LJK326 und LJK327 (siehe Beispiel 6.1) jeweils ein mutiertes AHAS-Gen, das von dem Mais-Ubiquitin-Promoter p-Ubi vorangetrieben wird, enthielten, wodurch Toleranz gegenüber Imidazolinonherbiziden für die Selektion vermittelt wurde.
-
6.3 NEENA-Sequenzen vermitteln eine starke und gewebespezifische Verstärkung der Genexpression in Maispflanzen
-
Aus den hergestellten transgenen Pflanzen wurden Gewebeproben aus Blättern und Körnern entnommen. Die Gewebeproben wurden wie oben beschrieben verarbeitet und analysiert (vgl. Beispiel 3.3)
-
Im Vergleich zu dem Repartergenkonstrukt mit nur dem konstitutiven p-Ubi-Promoter und ohne NEENA vermittelten die zwei getesteten NEENA-Moleküle starke Verstärkung bei der Genexpression in Blättern (4a). Eine vergleichbare Verstärkung der von NEENAs (SEQ ID NO1 bis NO2) vermittelten Genexpression wurde in Maiskörnern nachgewiesen (4b).
-
Beispiel 7: Quantitative Analyse der NEENA-Aktivität in Reispflanzen
-
Dieses Beispiel beschreibt die Analyse der NEENA-Sequenzen mit SEQ ID NO 1 in Reispflanzen
-
7.1 Vektorkonstruktion
-
Für die quantitative Analyse der NEENA-Sequenzen mit SEQ ID NO 1 in Reispflanzen wurden die pENTR/B-Vektoren LJK1 und LJK4 (vgl. Beispiel 1.3) gemäß dem Gateway-Handbuch des Herstellers (Invitrogen, Carlsbad, CA, USA) mit einem Destinationsvektor, der den konstitutiven Reispromoter PRO0239 stromaufwärts von der Rekombinationsstelle birgt, mittels ortsspezifischer Rekombination (LR-Reaktion) kombiniert. Die Reaktionen ergaben einen binären Vektor mit dem PRO0239-Promoter, der Leuchtkäfer-Luciferase-Kodiersequenz c-LUC und dem t-nos-Terminator sowie 1 Vektor, der SEQ ID NO1 unmittelbar stromaufwärts von der Leuchtkäfer-Luciferase-Kodiersequenz birgt (Tabelle 12). Die erhaltenen Vektoren sind in Tabelle 12 zusammengefasst, wobei Promotermoleküle das Präfix p-, Kodiersequenzen das Präfix c- und Terminatormoleküle das Präfix t- aufweisen. Tabelle 12: Pflanzenexpressionsvektoren
| Pflanzenexpressionsvektor | Zusammensetzung der Expressionskassette Promoter::SEQ ID NO::Reportergen::Terminator | SEQ ID NO |
| CD30963 | p-PRO0239 ::-::c-LUC::t-nos | |
| CD30964 | p-PRO0239 ::SEQ ID NO1::c-LUC::t-nos | - |
-
Mit den erhaltenen Vektoren werden NEENA-Moleküle in unten umrissenen Versuchen analysiert (Beispiel 7.2).
-
7.2 Herstellung von transgenen Reispflanzen
-
Mit dem Agrobacterium, das den entsprechenden Expressionsvektor enthielt, wurden Oryzasativa-Pflanzen transformiert. Reife trockene Samen der japonica-Reissorte Nipponbare wurden entspelst. Das Sterilisieren erfolgte durch einminütiges Inkubieren in 70%igem Ethanol, anschließend 30 Minuten in 0,2% HgCl2, anschließend 6 Mal 15minütiges Waschen mit sterilem destilliertem Wasser. Die sterilen Samen wurden dann auf einem 2,4-D-haltigen Medium (Kallusinduktionsmedium) keimen gelassen. Nach 4wöchigem Inkubieren im Dunkeln wurden embryogene vom Schildchen abgeleitete Kalli herauspräpariert und auf demselben Medium vermehrt. Nach zwei Wochen wurden die Kalli durch 2wöchiges Subkultivieren auf demselben Medium vermehrt bzw. propagiert. Embryogene Kallusstücke wurden 3 Tage vor der Cokultivierung auf frischem Medium subkultiviert (um die Zellteilungsaktivität zu fördern).
-
Für die Cokultivierung wurde der Aprobacterium-Stamm LBA4404, der den entsprechenden Expressionsvektor enthält, verwendet. Agrobacterium wurde auf AB-Medium mit den jeweiligen Antibiotika inokuliert und 3 Tage lang bei 28°C kultiviert. Dann wurden die Bakterien entnommen und in flüssigem Cokulturmedium in einer Dichte (OD600) von ungefähr 1 suspendiert. Dann wurde die Suspension in eine Petrischale überführt und die Kalli wurden 15 Minuten lang in die Suspension eingetaucht. Die Kallusgewebe wurden dann auf einem Filterpapier trockengetupft, auf verfestigtes Cokulturmedium umgesetzt und 3 Tage lang im Dunkeln bei 25°C inkubiert. Die cokultivierten Kalli wurden in Gegenwart eines Selektionsmittels 4 Wochen lang im Dunkeln bei 28°C auf 2,4-D-haltigem Medium herangezogen. Während dieses Zeitraums entwickelten sich rasch wachsende resistente Kallusinseln. Nach dem Umsetzen dieses Materials auf ein Regenerationsmedium und Inkubieren im Licht wurde das embryogene Potential freigesetzt, und in den nächsten vier bis fünf Wochen entwickelten sich Sprosse. Die Sprosse wurden aus dem Kalli herauspräpariert und 2 bis 3 Wochen lang auf einem auxinhaltigen Medium inkubiert, von dem aus sie in Erde umgesetzt wurden. Die abgehärteten Sprosse wurden in einem Gewächshaus bei hoher Feuchtigkeit im Kurztag herangezogen.
-
Pro Konstrukt wurden ungefähr 35 unabhängige TO-Reistransformanten hergestellt. Die Primärtransformanten wurden von einer Gewebekulturkammer in ein Gewächshaus umgesetzt. Nach Durchführung einer quantitativen PCR-Analyse, um die Kopienzahl desT-DNA-Inserts zu überprüfen, wurden nur transgene Ein-Kopien-Pflanzen, die eine Toleranz für das Selektionsmittel aufwiesen, für das Ernten von T1-Samen behalten. Die Samen wurden dann drei bis fünf Monate nach dem Umpflanzen geerntet. Das Verfahren ergab Ein-Locus-Transformanten mit einer Rate von über 50% (Aldemita und Hodges 1996, Chan et al. 1993, Hiei et al. 1994).
-
7.3 NEENA-Sequenzen vermitteln eine starke und gewebespezifische Verstärkung der Genexpression in Reispflanzen
-
Aus den hergestellten transgenen Pflanzen wurden Gewebeproben aus Blättern und Körnern entnommen. Die Gewebeproben wurden wie oben beschrieben verarbeitet und analysiert (vgl. Beispiel 3.3)
-
Im Vergleich zu dem Reportergenkonstrukt mit nur konstitutivem p-PRO239-Promoter und ohne NEENA vermittelten die getesteten NEENA-Moleküle (SEQ ID NO 1) eine starke Verstärkung der Genexpression in Blättern (5a). Starke Verstärkung der Genaktivität, die von der NEENA (SEQ ID NO1) vermittelt wurde, wurde in Reissamen nachgewiesen (5b).
-
Legenden zu den Figuren:
-
1: Analyse der Luciferase-Reportergenexpression in transient transformierten A. thaliana-Blattprotoplasten von Konstrukten ohne NEENA (LJK132) bzw. mit NEENA (LJK91–LJK133), die aus Genen mit konstitutiver Expression stammende, mutmaßliche NEENA-Moleküle unter der Kontrolle des p-AtNit1-Promoters darstellen. Normalisierung wurde durch Kotransformation und Analyse der Renilla-Luciferase durchgeführt, und die Expressionswerte sind relativ zu dem Kontrollkonstrukt ohne NEENA dargestellt (LJK132 = 1). Die Expressionswerte sind relativ zu dem Kontrollkonstrukt ohne NEENA dargestellt (LJK134 = 1).
-
2: Balkendiagramm der Luciferase-Reportergenaktivität, die als relative Lichteinheiten (RLE) von unabhängigen transgenen Rapspflanzenlinien dargestellt ist, welche Reportergenkonstrukte ohne NEENA (LJK138) oder mit NEENA enthalten, die NEENA-Moleküle aus Genen mit konstitutiver Expression (LJK139–LJK144) unter der Kontrolle des p-AtNit1-Promoters darstellen, und zwar nach Normalisieren in Bezug auf den Proteingehalt jeder Probe (durchschnittliche Werte, es wurden Gewebe von 20 unabhängigen transgenen Pflanzen analysiert). A) Blattgewebe, B) Blüten, C) Schoten
-
3: Balkendiagramm der Luciferase-Reportergenaktivität, die als relative Lichteinheiten (RLE) von unabhängigen transgenen Sojapflanzenlinien dargestellt ist, welche Reportergenkonstrukte ohne NEENA (LJK138) oder mit NEENA enthalten, die NEENA-Moleküle aus Genen mit konstitutiver Expression (LJK139–LJK144) unter der Kontrolle des p-AtNit1-Promoters darstellen, und zwar nach Normalisieren in Bezug auf den Proteingehalt jeder Probe (durchschnittliche Werte, es wurden Gewebe von 10 unabhängigen transgenen Pflanzen analysiert). A) Blattgewebe, B) Blüten, C) Samen
-
4: Balkendiagramm der Luciferase-Reportergenaktivitat, die als relative Lichteinheiten (RLE) logarithmische Skala von unabhängigen transgenen Maispflanzenlinien dargestellt ist, welche Reportergenkonstrukte ohne NEENA (LJK309) oder mit NEENA enthalten, die NEENA-Moleküle aus Genen mit konstitutiver Expression (LJK326–LJK327) unter der Kontrolle des p-ZmUbi-Promoters darstellen, und zwar nach Normalisieren in Bezug auf den Proteingehalt jeder Probe (durchschnittliche Werte, es wurden Gewebe von 15 unabhängigen transgenen Pflanzen analysiert). A) Blattgewebe, B) Körner
-
5: Balkendiagramm der Luciferase-Reportergenaktivität, die als relative Lichteinheiten (RLE) von unabhängigen transgenen Reispflanzenlinien dargestellt ist, welche Reportergenkonstrukte ohne NEENA (CD30963) oder mit NEENA enthalten, die NEENA-Moleküle aus Genen mit konstitutiver Expression (CD30964) unter der Kontrolle des konstitutiven Reis-p-PRO239-Promoters darstellen, und zwar nach Normalisieren in Bezug auf den Proteingehalt jeder Probe (durchschnittliche Werte, es wurden Gewebe von 15 unabhängigen transgenen Pflanzen analysiert). A) Blattgewebe, B) Samen
-
ZITATE ENTHALTEN IN DER BESCHREIBUNG
-
Diese Liste der vom Anmelder aufgeführten Dokumente wurde automatisiert erzeugt und ist ausschließlich zur besseren Information des Lesers aufgenommen. Die Liste ist nicht Bestandteil der deutschen Patent- bzw. Gebrauchsmusteranmeldung. Das DPMA übernimmt keinerlei Haftung für etwaige Fehler oder Auslassungen.
-
Zitierte Patentliteratur
-
- WO 2006/003186 [0006]
- WO 2007/098042 [0006]
- WO 2003102198 [0014, 0095, 0095]
- US 5994123 [0014]
- WO 2005085450 [0014]
- WO 2008124495 [0014]
- WO 2006084868 [0014]
- US 5565350 [0058]
- WO 00/15815 [0058]
- WO 03008596 [0098]
- WO 2005/121345 [0118]
- US 5591616 [0138]
- WO 2006136596 [0146]
- US 20090249514 [0146]
-
Zitierte Nicht-Patentliteratur
-
- Huang und Gorman, 1990 [0004]
- Le Hir et al., 2003 [0004]
- Nott et al., 2004 [0004]
- Callis et al., 1987 [0005]
- Vasil et al., 1989 [0005]
- Bruce et al., 1990 [0005]
- Lu et al., 2008 [0005]
- Chung et al., 2006 [0005]
- Kim et al., 2006 [0005]
- Rose et al., 2008 [0005]
- Rose et al., 2004 [0005]
- Sieburth et al., 1997 [0006]
- Wang et al., 2004 [0006]
- Fu et al., 1995a [0006]
- Fu et al., 1995b [0006]
- Vitale et al., 2003 [0006]
- Kim et al., 2006 [0006]
- Schünmann et al., 2004 [0006]
- Xie et al. (2001) ”Bidirectionalization of polar promoters in plants” Nature Biotechnology 19, Seiten 677–679 [0012]
- Lee at al. 2007, Plant, Phys. [0014]
- Goa J. (1953) Scand. J. Clin. Lab. Invest. 5: 218–222 [0051]
- Lowry O. H. et al. (1951) J. Biol. Chem. 193: 265–275 [0051]
- Bradford M. M. (1976) Analyt. Biochem. 72: 248–254 [0051]
- Maniatis T., Fritsch E. F. und Sambrook J. (1989) Molecular Cloning: A Laboratory Manual, 2. Ausg., Cold Spring Harbor Laboratory, Cold Spring Harbor (NY) [0055]
- Silhavy et al. (1984) Experiments with Gene Fusions, Cold Spring Harbor Laboratory, Cold Spring Harbor (NY) [0055]
- Ausubel et al. (1987) Current Protocols in Molecular Biology, Greene Publishing Assoc. und Wiley lnterscience [0055]
- Gelvin et al. (Hrsg.) (1990) Plant Molecular Biology Manual; Kluwer Academic Publisher, Dordrecht, Niederlande [0055]
- J. Coombs (1994) Dictionary of Biotechnology, Stockton Press, New York [0060]
- Anderson und Young, Quantitative Filter Hybridization, in Nucleic Acid Hybridization (1985) [0060]
- Current Protocols in Molecular Biology, John Wiley & Sons, N.Y. (1989), 6.3.1–6.3.6 [0060]
- W. R. Pearson und D. J. Lipman, PNAS 85, 2444 (1988) [0063]
- W. R. Pearson, Methods in Enzymology 183, 63 (1990) [0063]
- W. R. Pearson und D. J. Lipman, PNAS 85, 2444 (1988) [0063]
- W. R. Pearson, Enzymology 183, 63 (1990) [0063]
- J. Mol. Evolution., 25, 351 (1987), Higgins et al., CABIOS 5, 151 (1989) [0064]
- J. Mol. Biol. 48; 443 (1970) [0064]
- Adv. Appl. Math. 2; 482 (1981) [0064]
- Genetics Computer Group, 575 Science Drive, Madison, Wisconsin, USA 53711 (1991) [0064]
- Altschul et al., (Nucleic Acids Res. 25, 3389 (1997) [0064]
- Trends in Genetics 16 (6), 276 (2000) [0064]
- http://www.grassius.org/grasspromdb.html [0081]
- http://mendel.cs.rhul.ac.uk/mendel.php?topic=plantprom [0081]
- http://ppdb.gene.nagoya-u.ac.jp/cgibin/index.cgi [0081]
- Needleman und Wunsch (1970) J Mol. Biol. 48: 443–453 [0088]
- Sambrook et al., 1989 [0093]
- Sanger et al., 1977 [0093]
- http://www.ncbi.nlm.nih.gov/genomes/PLANTS/PlantList.html [0094]
- http://www.weigelworld.org/resources/microarray/AtGenExpress/ [0094]
- Damm und Willmitzer, 1988 [0107]
- Damm et al., 1989 [0107]
- Deblaere et al., 1985, Nucl. Acids. Res. 13: 4777–4788 [0112]
- Olhoft et al., 2007 [0118]
- Sanford et al. (1993) (Optimizing the biolistic process for different biological applications. Methods in Enzymology, 217: 483–509) [0127]
- Wang et al., 1988 (Transient expression of foreign genes in rice, wheat and soybean cells following particle bombardment. Plant Molecular Biologe, 11 (4), 433–439) [0131]
- Christou, 1997 (Rice transformation: bombardment. Plant Mol Biol. 35 (1–2)) [0131]
- Sheen (1990) (Metabolic Repression of Transcription in Higher Plasts. The Plant Cell 2 (10), 1027–1038) [0133]
- Hodges et al., 1991 (Transformation and regeneration of rice protoplasts, Biotechnology in agriculture, No. 6, Rice Biotechnology. International Rice Research Institute, ISBN: 0-85198-712-5) [0135]
- Lee et al., 1990 (Transient gene expression in wheat (Triticum aestivum) protoplasts. Biotechnology in agriculture and forestry 13 – Wheat. Springer Verlag, ISBN-10: 3540518096) [0135]
- Gelvin und Schilperoort, 1995, Plant Molecular Biology Manual, 2. Ausgabe, Dordrecht: Kluwer Academic Publ. ISBN 0-7923-2731-4 [0138]
- Glick und Thompson (1993) Methods in Plant Molecular Biology and Biotechnology, Boca Raton: CRC Press, ISBN 0-8493-5164-2 [0138]
- Freeling & Walbot (1993) ”The maize handbook” ISBN 3-540-97826-7, Springer Verlag New York [0138]
- Aldemita und Hodges 1996, Chan et al. 1993, Hiei et al. 1994 [0154]










