CN1188520C - 在植物中生产聚酮化合物 - Google Patents
在植物中生产聚酮化合物 Download PDFInfo
- Publication number
- CN1188520C CN1188520C CNB988070812A CN98807081A CN1188520C CN 1188520 C CN1188520 C CN 1188520C CN B988070812 A CNB988070812 A CN B988070812A CN 98807081 A CN98807081 A CN 98807081A CN 1188520 C CN1188520 C CN 1188520C
- Authority
- CN
- China
- Prior art keywords
- pks
- polyketide
- plant
- gene
- vegetable cell
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/10—Transferases (2.)
- C12N9/12—Transferases (2.) transferring phosphorus containing groups, e.g. kinases (2.7)
- C12N9/1241—Nucleotidyltransferases (2.7.7)
- C12N9/1258—Polyribonucleotide nucleotidyltransferase (2.7.7.8), i.e. polynucleotide phosphorylase
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/52—Genes encoding for enzymes or proenzymes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/79—Vectors or expression systems specially adapted for eukaryotic hosts
- C12N15/82—Vectors or expression systems specially adapted for eukaryotic hosts for plant cells, e.g. plant artificial chromosomes (PACs)
- C12N15/8241—Phenotypically and genetically modified plants via recombinant DNA technology
- C12N15/8242—Phenotypically and genetically modified plants via recombinant DNA technology with non-agronomic quality (output) traits, e.g. for industrial processing; Value added, non-agronomic traits
- C12N15/8243—Phenotypically and genetically modified plants via recombinant DNA technology with non-agronomic quality (output) traits, e.g. for industrial processing; Value added, non-agronomic traits involving biosynthetic or metabolic pathways, i.e. metabolic engineering, e.g. nicotine, caffeine
Landscapes
- Health & Medical Sciences (AREA)
- Genetics & Genomics (AREA)
- Life Sciences & Earth Sciences (AREA)
- Engineering & Computer Science (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Wood Science & Technology (AREA)
- Biotechnology (AREA)
- Zoology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Biomedical Technology (AREA)
- General Engineering & Computer Science (AREA)
- Molecular Biology (AREA)
- Microbiology (AREA)
- Biochemistry (AREA)
- General Health & Medical Sciences (AREA)
- Plant Pathology (AREA)
- Biophysics (AREA)
- Physics & Mathematics (AREA)
- Cell Biology (AREA)
- Nutrition Science (AREA)
- Medicinal Chemistry (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Enzymes And Modification Thereof (AREA)
- Breeding Of Plants And Reproduction By Means Of Culturing (AREA)
- Compounds Of Unknown Constitution (AREA)
- Polyesters Or Polycarbonates (AREA)
Abstract
本发明提供被遗传改变的植物和植物细胞,它们被修饰成包含能够表达功能性聚酮化合物合成酶(PKS)的表达系统。本发明还提供用这些植物和细胞产生PKS和聚酮化合物的方法。
Description
技术领域
本发明属于聚酮化合物(polyketide)合成和转基因植物生产领域。具体地说,本发明提供了制备表达一种或多种功能性聚酮化合物合成酶(PKS)和聚酮化合物的植物细胞和植物的方法。
背景技术
聚酮化合物是由不同结构天然产物组成的一个大族。聚酮化合物具有许多生物活性,其中包括抗生素特性和药理特性。例如,代表聚酮化合物的有:诸如四环素和红霉素等抗生素;包括道诺霉素在内的抗癌药物,例如FK506和雷帕霉素;例如莫能菌素和阿佛菌素等兽用产品;和诸如spinocyn(杀虫剂)和soraphen(抗真菌剂)等农用化合物。聚酮化合物在一类丝状菌,放线菌中尤其丰富。
聚酮化合物合成酶是多功能酶,与脂肪酸合成酶(FAS)有关联。PKS催化酰基硫酯之间通过重复的(脱羧)Claisen缩合反应生物合成聚酮化合物,所述酰基通常是乙酰基、丙酰基、丙二酰基或甲基丙二酰基。随着每次缩合,通过催化、部分催化或不催化正在合成中的聚酮化合物链β酮基团上的还原循环(包括酮还原、脱水和烯酰基还原),PKS在产物中引入了结构可变性。当碳链达到特定化合物的特有长度后,它通过硫解或酰基转移从合成酶上释放。所以,PKS是由许多族酶构成的,它们共同协作生成给定的聚酮化合物。造成天然聚酮化合物之间差异的是由各PKS基因决定的链长的有调变化,成链单元的选择和还原循环。为了具有抗生素活性,PKS催化反应生成的聚酮化合物通常需要进一步的修饰,例如糖基化。
有三类主要的PKS。其中之一称I型,“复合”或“模块化”PKS,代表性的是合成大环内酯(例如红霉素)的PKS。“模块化”PKS是一组多功能大蛋白,各自带有针对碳链组装和修饰作用各步骤的分开的活性位点(Cortes,J.等,Nature(1990)348:176;Donadio,S.等,Science(1991)252:675;MacNeil,D.J.等,Gene(1992)115:119)。这一类中的结构差异来自PKS中活性位点数量和类型的不同。这一类PKS表现出PKS基本序列活性位点数量和簇化与聚酮化合物骨架之间一对一的关联性(见图1)。
第二类PKS称II型或“芳香族”PKS,代表性的是芳香族化合物的合成酶。“芳香族”PKS一般由至少3个分开的开放读码框编码,具有一组反复使用的活性位点(Bibb,M.J.等,EMBO J.(1989)8:2727;Sherman,D.H.等,EMBOJ.(1989)8:2717;Fernandez-Moreno,M.A.等,J.Biol.Chem.(1992)267:19278)(见图2)。
第三类PKS通常称“真菌”PKS,是一种多功能蛋白,由一个读码框编码。典型的“真菌”PKS是6-甲基水杨酸合成酶(MSAS),一般来自展青霉菌。还从构巢曲霉(Aspergillus nidulan)和葫芦科炭疽病毛盘孢(Colletotrichum lagenarium)分离到了该基因,还分离到一种催化构巢曲霉产生norsolorinic酸的PKS。Fujii,I.等,Mole Gen Genet(1996)253:1-10。所以,真菌PKS不完全符合区别于模块化PKS的芳香族PKS的分类,所以构成第三类(见图3)。
链霉菌属是一种芳香族聚酮化合物高产放线菌。在迄今研究过的各种链霉菌芳香族PKS中,碳链的组装需要3个开放读码框(ORF)的产物。ORF1编码酮基合成酶(KS)和一个酰基转移酶(AT)活性位点;ORF2编码与ORF1产物类似但没有KS和AT基序的蛋白质;ORF3编码一个独立的酰基运载蛋白(ACP)。
例如,天蓝色链霉菌(Streptomyces coelicolor)产生兰色染料聚酮化合物,放线紫素。目前已经克隆了放线紫素基因簇(act)。该基因簇编码上述PKS酶,环化酶和一系列通过后继修饰反应合成放线紫素的专用酶,以及参与抗生素输出的蛋白质和至少一种转移激活基因簇转录的蛋白质。全面调节抗生素生物合成以及提供聚酮化合物生物合成引发剂(乙酰CoA)和延伸剂(丙二酰基CoA)单元所需的其它基因位于基因组的其他位置。天蓝色链霉菌的act基因簇已经被用于在小链霉菌(S.parvulus)中产生放线紫素。Malpartida,F.等,Nature(1984)309:462。
Bartel等,J.Bacteriol(1990)172:4816-4826,用actI,actIII,actIV和actVII四个基因座构成的天蓝色链霉菌的act基因簇转化S.galilaeus,以重组法生产芦荟皂草苷(aloesaponarin)II。已经设计出了能够表达功能性合成酶的杂交PKS,它包括基本的act基因组和来自榴菌素,氧合四环素,tetracenomycin和富伦菌素PKS的ACP基因。Khosla,C.等,J.Bacteriol(1993)175:2197-2204,Hopwood,D.A.等,Nature(1985)314:642-644,说明了用重组技术生产杂交聚酮化合物。Sherman,D.H.等,J.Bacteriol.(1992)174:6184-6190,报道用对应的紫红链霉菌(S.violaceoruber)的榴菌素(gra)基因反式转化各种缺失了不同act PKS基因簇。
已经在链霉菌中实现了重组法生产异源功能性PKS—即能够产生聚酮化合物的PKS,而且已经在这些宿主中产生了杂交形式的芳香族PKS。参见,例如Khosla,C.等,J.Bacteriol(1993)175:2194-2204;Hopwood,D.A.等,Nature(1985)314:642-644;Sherman,D.H.等,J.Bacteriol(1992)174:6184-6190。此外,如PCT申请WO95/08548所述,已经在链霉菌中实现了重组法产生模块化PKS酶。但是,Robert,G.A.,Eur J Biochem(1993)214:305-311曾将带有编码PKS催化位点的基因的一个载体转化到大肠杆菌内,但是PKS没有功能,可能是因为酰基运载蛋白没有被磷酸泛酸巯基乙胺基化(phosphopantetheinylation)。
于1998年1月15日公开的PCT申请WO98/01546和WO98/01571中也说明在链霉菌中重组法生产功能性聚酮化合物合成酶。
已经克隆了大量聚酮化合物合成酶,包括生产阿佛菌素(美国专利5,252,474);螺旋霉素(美国专利5,098,837)和泰乐霉素(1997年2月19日公开的欧洲专利申请791,655)的PKS。
美国专利5,716,849回收了编码PKS簇的核苷酸序列并进行了测序,以用于生产soraphen。本发明全面参考其中内容。该专利预言了编码soraphenPKS的核苷酸在细菌、酵母和植物中的表达。其中指出,所得的PKS能够合成聚酮化合物。但是,它并没有实际证明表达和功能。
已知,要使PKS簇具有功能,翻译产生的脱辅酶PKS必需经酶作用磷酸泛酸巯基乙胺基化得到全ACP合成酶组成。Carreras,C.W.等,Biochemistry(1997)36:11757-11761。脱辅酶PKS转化为全ACP组成需要合适的磷酸泛酸巯基乙胺基转移酶(PPT)。已知PPT酶都属于同一超家族,但是它们彼此之间不能互换。例如,能够将脱辅酶脂肪酸合成酶簇转化为全酶形式(holo-form)的PPT酶不能转化典型的PKS脱辅酶酶。Lambalot,R.H.等,Chem andBiol.(1996)3:923-936。Cox,R.J.等在FEBS LETT(1997)405:267-272中提出,要在大肠杆菌内重组产生功能性PKS必需提供PPT活性。此外,本发明全面参考的WO98/27203用包含展青霉菌6-MSAS和枯草杆菌PPT酶(全-ACP合成酶)的融合蛋白,即表面活性全ACP合成酶(Sfp.),在酵母中用重组法生产功能性6-MSAS。已经在特定条件下,在经修饰而具有6-MSAS表达系统和Sfp基因表达系统的大肠杆菌中生产出6-MSAS。
本发明提供了经转化含有产生PKS的单载体或多载体系统的植物,和所得的聚酮化合物。用植物来表达和产生功能性PKS提供了大规模生产PKS和聚酮化合物的合适来源;此外,产生的聚酮化合物可能赋予其生产植物所需的特性,例如抗虫害特性。
本发明内容
本发明提供用重组技术有效生产新的和已知的PKS和聚酮化合物的方法,以及植物宿主/载体系统。具体地说,本发明用植物宿主/载体系统生产PKS,PKS再催化产生多种聚酮化合物。所述的聚酮化合物可以用作:抗生素;抗肿瘤药;免疫抑制剂;用于多种其它药理用途;和以制剂形式或原位保留在其生产植物中用于农业用途(例如作为抗真菌剂和杀虫剂)。
在一种实施方式中,本发明提供为了生产重组聚酮化合物合成酶(PKS)基因簇而经基因工程修饰的植物细胞,植物和植物组成部分。具体地说,本发明提供包含以下组分的植物细胞,植物组成部分和植物:
(a)PKS基因簇,编码能够催化聚酮化合物合成的PKS;和
(b)与PKS基因簇操作性连接的一个或多个调控序列,使得基因簇内的基因能够在基因工程植物细胞,植物组成部分和植物中被转录和翻译,产生功能性PKS。
在优选实施例中,植物细胞,植物组成部分或植物经进一步修饰而含有PPT酶,该酶将酰基运载蛋白(ACP)脱辅酶酶活性转化为全ACP。如后文所述,这类PPT酶可自多种微生物来源获得。
本发明还提供如下生产功能性重组PKS和聚酮化合物的方法:在使PKS基因簇得以表达并具有功能活性的条件下培养植物,植物细胞等;还可以在使PKS具有功能活性并产生聚酮化合物的条件下培养所述植物,植物细胞等。
在另一实施例中,本发明提供了一种制备重组聚酮化合物文库的方法,它包括:
(a)提供一载体群,所述载体具有随机组合的聚酮化合物合成酶(PKS)基因,模块,活性位点或它们的某些部分,还有与所述基因操作性连接的一个或多个调控序列;
(b)用所述的载体群转化宿主植物细胞或植物群;
(c)在所述基因簇内基因能够被转录和翻译的条件下培养所述的宿主植物细胞群或植物群,由此产生重组PKS和所得的聚酮化合物的文库。
本发明还提供了用于在植物宿主中产生PKS酶的重组材料,和在植物宿主中生产出的聚酮化合物。
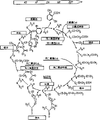
附图简述
图1显示作为典型的模块化PKS之一的红霉素PKS的组织结构。
图2显示几种典型芳香族PKS的组成。
图3显示真菌6-MSAS的组织结构。
本发明的实施方式
本发明参考的美国专利5,712,146说明了模块化和芳香族PKS的各种重组表达系统。此外,前文提到的本发明所参考的PCT/US97/23014说明了各种用于在大肠杆菌和酵母中生产功能性PKS的多载体系统以及合适的PPT酶活性表达系统,所述的PPT酶活性能够通过提供全ACP将产生的脱辅酶PKS转化为其功能形式。现在发现,这些重组生产系统可以用在植物宿主内。
本发明能够以组成性方式,或在植物宿主细胞或植物生长周期的适当阶段大量生产PKS和聚酮化合物。如此生产出的聚酮化合物可以根据其特定类型作为治疗药物治疗许多疾病。例如,本发明方法生产的几种聚酮化合物可以用作免疫抑制剂,抗肿瘤药物,用于治疗病毒、细菌和寄生虫感染,还可以用在农业上,例如作为杀虫剂或抗真菌剂。能够在植物细胞中重组产生聚酮化合物还为分析PKS及其作用机制,以及为植物提供有用的性征提供了有效的工具。
一般PKS表达系统
美国专利5,712,146详细说明了多种已知PKS表达系统以及如何用重组DNA技术进行这些系统的基因操作。这些内容可以如后文所述加以改动后在本发明中用于产生表达一种或多种PKS的重组植物细胞和植物。图1、2、3和后文简要概括(并非限定)了芳香族、模块化和真菌PKS系统。
芳香族PKS系统的特征在于产生的酶上催化位点间的反复使用(iteractiveuse)。在芳香族PKS系统中,构成基本PKS的酶由3个开放读码框(ORF)编码。图2显示,放线紫素PKS由6个ORF编码。就基本PKS而言,一个ORF含有酮合成酶(KS)和酰基转移酶(AT);第二个ORF含有链长因子(CLF);第三个读码框编码酰基运载蛋白(ACP)。其它ORF编码芳香酶(aromatase)(ARO),环化酶(CYC)和酮还原酶(KR)。KS/AT,ACP和CLF组合,构成基本PKS,因为这些元件是两个碳单元一次缩合所必需的。另一方面,grsPKS具有5个分开的ORF,其中,KS/AT,ACP和CLF处于3个ORF上,KR在第四个上,ARO在第五个上。
另一方面,在模块化PKS系统中,每个催化位点只用一次,整个PKS由一系列“模块”编码。基本模块包括至少一个KS,一个AT和一个ACP。如图1所示,可选的其它活性包括KR,DH,烯酰基还原酶(ER)和硫酯酶(TE)活性。
如图3所示,编码6-甲基水杨酸合成酶(6-MSAS)的“真菌”PKS在某种意义上类似于芳香族PKS,但是它只有一个编码其全部活性(KS/AT,脱水酶(DH),KR和ACP)的读码框,因为这些位点被反复使用。
本发明可用于产生植物细胞,植物组成部分和整株植物内芳香族,模块化和真菌PKS系统催化活性的表达系统。
例如,可以用重组法从表达PKS的生物体获得感兴趣的该PKS亚基,例如通过筛选来自表达该基因的细胞的cDNA或基因组文库,或通过从已知含有该基因的载体中获得该基因。然后,可用标准技术分离该基因并与其它所需的PKS亚基组合。如果目的基因已经存在于合适的表达载体中,它可以根据需要在原位与其他PKS亚基组合。也可以通过合成而不是克隆来产生感兴趣的基因。可以根据所需的特定氨基酸序列设计出具有合适密码子的核苷酸序列。一般选用为表达序列所用植物宿主所优选的密码子。用标准法制得的重叠寡核苷酸组装完整序列,并组装成完整的编码序列用于转移到植物宿主细胞内。参见,Edge(1981)Nature 292:756;Nambair等,(1984)Science 223:1299;Jay等,(1984)J.Biol.Chem.259:6311。
另外,产生的PKS蛋白可能含有这些蛋白质天然形式或改变形式的氨基酸序列,这样,只要保持有所需的催化活性,就可以使用它们的底物特异性和活性。如美国专利5,712,146所述,可以在天然PKS亚基序列内制造突变,只要这些突变能够与PKS亚基一起发挥作用共同催化某种特定聚酮化合物的合成。可以用常规技术对天然序列造成这样的突变,例如合成包含所需突变的寡核苷酸,用限制性酶消化将突变序列插入编码PKS亚基的基因内。(参见,Kunkel,T.A,Proc.Natl.Acad.Sci.USA(1985)82:448;Geisslsoder等,BioTechniques(1987)5:786)
或者,可以在错配双链熔点以下某温度,用与天然核苷酸序列(一般是对应RNA序列的cDNA序列)杂交的错配引物(一般长10-20个核苷酸)造成突变。通过保持引物长度和碱基组成限于一较窄范围内和保持突变碱基居中(Zoller等,Methods Enzymol(1983)100:468),可使得引物具有特异性。用DNA聚合酶进行引物的延伸,克隆产物,挑选出由分离引物延伸链得到的含突变DNA的克隆。可以用突变引物作为杂交探针进行挑选。该技术也可用于产生多点突变。参见,Dalbadie-McFarland等,Proc.Natl.Acad.Sci USA(1982)79:6409。也可以用PCR诱变产生所需的突变。
美国专利5,712,146还构建了用于在丝状真菌内表达的单载体和多载体杂交芳香族或模块化PKS系统,例如放线紫素的开放读码框被包含在含来自其它芳香族系统的开放读码框的表达载体中。本发明参考的1998年5月6日的美国专利申请09/073,538说明了进一步的全突变,尤其是在模块化PKS簇内,由此可以在重组宿主细胞内产生多种已知和新的聚酮化合物。本发明和本发明的实施例表明植物细胞宿主和植物可以作为PKS表达宿主用于产生功能性PKS和得到聚酮化合物,由此扩展了现有的发明。
要获得功能性PKS,除PKS簇内的活性之外,翻译后修饰也是必需的。尤其重要的是用磷酸泛酸巯基乙胺基集团提供ACP功能。前述全ACP合成酶是这一活化作用所必需的。在本发明的优选实施例中,仍用重组表达系统使植物细胞,植物组成部分和整株植物具有全ACP合成酶。
所以,本发明的优选实施方式是同时表达异源全ACP合成酶和PKS酶,从而将脱辅酶PKS转化为在体内具有活性的全PKS。如本发明参考的Kealey等,Proc.Natl.Acad.Sci USA(1998)95:505-509所述,展青霉菌的6-MSAS在酵母中产生很少或不产生聚酮化合物产物,除非具有异源的全ACP合成酶。这一功能可以通过引入表达全ACP合成酶的另一载体,引入同时表达全ACP合成酶和PKS的一个载体,或编码全ACP合成酶与PKS形成的融合酶的一个基因来提供。
实施本发明的优选方式之一是用枯草杆菌的Sfp酶,这是生产surfactin所必需的一种磷酸泛酸巯基乙胺基转移酶(PPTase)。引入重组Sfp基因可以用不同于包含PKS基因的载体的另一载体,也可以与PKS基因在同一载体内。而且,Sfp蛋白的编码序列可以与PKS编码序列融合,使这两者各自成为一种嵌合蛋白的一部分。
本发明使用的其它PPT酶是肠杆菌素合成所必需的大肠杆菌的EntD(Gehring等,Biochem(1997)36:8495-8503)和短杆菌素合成所必需的枯草杆菌的Gsp(Borchert等,J.Bacteriol(1994)176:2458-2462)。一种PPTase可能就足以翻译后修饰多种PKS,其它PPTase可能具有有限的底物特异性,所以,产生一种PKS可能必需特定的PPTase。entD编码的PPTase对肠杆菌素合成酶具有特异性,而ACP则对脂肪酸合成酶具有特异性(Larmbalot等,同上)。
本发明所用的PKS表达系统可以存在于单个载体上,也可以在多个载体上。在使用多个载体时,这些载体可以组合在一个经改变的细胞内形成功能性PKS的表达系统,或者单独表达PKS系统的每个元件从而提供聚酮化合物合成所需要的每一种酶活性。以上两种方法记载在美国专利5,712,146和PCT申请US97/23014中。在单载体系统中,一个载体包含PKS的全部酶元件。在多载体系统中,PKS表达系统的催化活性分散在不同的载体上,它们可以在引入植物宿主细胞后重组成一个PKS表达系统或用彼此独立的表达调控元件来表达,从而形成PKS。单载体方法产生功能性PKS更有效,而多载体方法的优点则在于能够用于产生各自具有不同酶活性的PKS的文库。如果使用多载体,有时能够在不同植株中提供用于蛋白簇不同部分的载体,它们可以经交叉选育而成为完全的所需表达系统。而且,蛋白簇的组分,实际上即翻译后酶,可以编码在一个读码框内,从而获得融合蛋白。提供模块化PKS簇以及全ACP合成酶的融合蛋白参见前文提到的PCT申请。
在构建用于产生芳香族PKS系统的载体时,如图2所示的独立读码框可以结合在同一载体内,或者,如果构建得好,各读码框可以分散在多个载体上,各自具有用于调控其在植物宿主细胞内表达或读码框重组的合适序列。对于模块化系统来说,一个模块或多个模块可以是单个载体上一个表达系统的一部分,或者可以用多个载体修饰植物细胞,使其包含完整的所需PKS系统。
为了实现磷酸泛酸巯基乙胺基化,除PKS编码序列之外,还宜在植物宿主内引入其它蛋白的表达系统。如前所述,如果带有PKS簇表达系统或PPT酶的载体可以产生包括部分或全部PKS的融合蛋白,产生合适PPT酶的表达系统可以在同一载体上,也可以在不同的载体上。
特别的是,为了在植物内表达,可以修饰PKS和翻译后加工酶表达系统,使它们采用植物优选密码子,从而消除隐蔽剪接位点和改变GC/AT含量等。不改变所编码的氨基酸序列的对核苷酸序列的适当修饰是本领域的已知技术。
还可以通过合适的重组表达系统将使得翻译后修饰聚酮化合物的其它酶,例如糖基化酶,被引入植物宿主内。
在实施例之一中,用了3种载体来产生模块化PKS。各载体允许用两种延伸剂AT(一种来自甲基丙二酰基CoA,另一种来自丙二酰基CoA)构建64个不同的开放读码框,和包括KR,DH和ER在内的4种前述组合。这样,1号模块可以用丙二酰基CoA作为延伸剂;2号模块用甲基丙二酰基CoA;可以用相反的序列,或者,两种延伸剂都用丙二酰基CoA,或两种都用甲基丙二酰基CoA。这就产生了4种不同的延伸剂组合,每一种都被4种KR/DH/ER变体所倍增。各质粒提供相同的一组可能性;质粒之一必需包含加载(loading)功能,另一种必需包含硫酯酶功能。这样,通过构建192种质粒,能合成的新聚酮化合物的上限是64×64×64或262,144个分子,由此提供了一种获得大量新聚酮化合物的有效方法。
在植物内表达外源DNA的表达单元
本发明用表达单元(或表达载体,系统或模块)在植物细胞或由其再生而成的植株内表达编码PKS的外源DNA。用在植物中用于产生表达单元/系统/载体的方法是本领域众所周知的,经过简单的修改就可以用于表达PKS编码序列。通常,如前所述,这样的单元使用一个PKS编码模块和一个或多个表达调控元件。调控元件的选用以欲改变的植物,对表达的调控水平和所用的转化系统为基础。根据已知方法和本文的说明,一般技术人员可方便地将任何合适的植物/载体/表达系统用于本发明方法。在实施例中说明了几种合适的植物表达载体的构建。
用来调控PKS编码序列表达的表达调控元件通常是异源表达调控元件,即正常情况下不与PKS编码序列结合的元件。但是,如果所述的元件在所选的植物内具有活性,也可以使用同源的调控元件,即正常情况下与PKS编码序列结合的元件。本领域已知许多异源表达调控元件,它们可方便地用来制备用于本发明的表达单元。例如,转录起始区可包含多种冠瘿碱起始区中的任何一种,例如章鱼碱,甘露碱和胭脂氨碱等的起始区,它们存在于致瘤农杆菌的Ti质粒中。或者,也可以使用植物病毒的启动子调控植物内基因的表达,例如烟草花叶病毒35S启动子。最后,也可以使用例如繁殖(prolifera)启动子,果实特异性启动子,Ap3启动子,热休克启动子,种子特异性启动子等植物启动子。最好的启动子应该在植物细胞生长或发育阶段具有活性,使得PKS的产生具有例如在叶组织内,种子内或成果体内的植物组织或器官特异性。
通常,用本领域已知的标准技术将组成型启动子(例如CaMV或Nos启动子),器官特异性启动子(例如西红柿的E8启动子)或诱导型启动子与PKS编码区连接。还可以用例如转录终止子和/或增强子优化表达单元。
这样,为了在植物中表达,除PKS编码序列之外,表达单元还包含植物启动区、转录起始位点和转录终止序列。如实施例所述,表达单元的5’和3’末端通常包括独特的限制性酶位点以便于插入现有载体。
在构建受异源启动子调控的表达系统时,启动子与异源转录起始位点的距离宜等于天然情况下它与转录起始位点的距离。但是,正如本领域所知道的,上述距离可容许一定的不同而不至于损失启动子功能。
除启动子序列之外,表达系统/单元还可在结构基因的下游包含转录终止区从而有效终止转录。终止区可与启动子来自同一基因,也可来自不同的基因。要有效加工PKS编码序列所编码的mRNA,一般还在载体结构中加入指导RNA聚腺苷酸化的DNA序列。聚腺苷酸化序列包括但不限于农杆菌章鱼碱合成酶信号(Gielen等,EMBO J3:835-846(1984)或胭脂氨碱合成信号(Depicker等,Mol andAppl Gene 1:561-573(1982))。
将所得的表达单元通过连接或其它方式构建到适于转化高等植物的载体内。载体通常还包含可选标记基因,从而能在培养物中鉴定出被转化的植物。标记基因通常编码抗生素抗性。这类标记包括对G418,潮霉素,博莱霉素,卡那霉素和庆大霉素的抗性。在转化植物细胞后,根据在含有特定抗生素的培养基中的生长能力鉴定出含有载体的细胞。为将载体克隆到细菌或噬菌体宿主中,一般还包括细菌或病毒的复制起点序列,最好是适合广泛宿主的原核复制起点。要挑选出带有所需结构的细菌细胞还应该包含细菌的可选标记。合适的原核可选标记也包括对卡那霉素或四环素之类抗生素的抗性。
如本领域所知,载体中还可包含编码其它功能的DNA序列。例如,在转化农杆菌时,为了更好地转移到植物染色体中,还应包含T-DNA序列。
在本发明的优选实施例中,通过将聚酮化合物应答性受体引入产该聚酮化合物的细胞内或展示在其表面,可使植物细胞或植物具有自筛选性。这一“自分泌”系统使得集落能够自身挑选出可激活受体的细胞。这类系统可参见Braoch,J.R.等,Nature(1996)384:Supp.7:14-16。
但是自分泌系统不必限于受体,还包括在转化植物细胞内表达且可以评价其与所产聚酮化合物有关的相互作用的蛋白质,所用的方式类似于Field在美国专利5,283,173中所述的酵母2杂交系统。
所以,可以修饰植物细胞以创建“基于植物细胞的聚酮化合物功能检测系统”。聚酮化合物功能包括对表达在细胞表面或胞内的某受体的激活或拮抗,或者,聚酮化合物可以是双杂交筛选的活化剂或拮抗剂,从而能够挑选出类似雷帕霉素和FK506的蛋白-蛋白相互作用抑制剂或交联因子。
酶活性的区室化
聚酮化合物可使用许多酰基CoA前体合成聚酮化合物产物。其中包括许多生物合成途径常用的乙酰基CoA,丙二酰基CoA,丙酰基CoA和甲基丙二酰基CoA。此外,还可以使用具有更高特异性的酰基CoA,作为合成循环中的合成起始前体,或作为后期的延伸前体。植物内常用前体的丰度尚不十分清楚。但是,预计所述前体的水平在不同细胞区室间是不同的。所以,预计特异性PKS催化的聚酮化合物合成在不同区室间也是不同的。任何作为分解代谢和合成代谢功能典型位置的亚细胞区室都可用作聚酮化合物合成位置,包括胞质溶胶,质体,过氧化物酶体,线粒体等。
虽然PKS可根据与其一起表达的其它功能使用任何区室,但是对用特定的前体进行合成来说,有些区室可能更好。例如,对于由PKS催化仅需要乙酰基CoA和丙二酰基CoA作为前体(例如真菌PKS)的反应来说,优选的区室是胞质溶胶和质体,最好的是质体。质体是脂肪酸合成的位置,因此预计在各种细胞区室中,此处所含乙酰基CoA和丙二酰基CoA的水平最高。Nawrath等,Proc.Natl.Acad.Sci.USA(1994)91:12760-12764报道,用针对质体而非胞质溶胶的酶活性多羟基丁酸酯在植物细胞内的异源合成增加了5至10倍。异源合成多羟基丁酸酯唯一所需的前体是乙酰基CoA。
植物细胞内不同区室中丙酰基CoA和甲基丙二酰基CoA的存在情况尚不清楚。有一则报道称,根据甲基丙二酰基CoA在美国五针松(Pinus strobus)中合成C-甲基化查耳酮的要求,它存在于某些植物细胞中(Schr der,J.等,Biochemistry(1998)37:8417-8425,在此作为参考)。丙酰基CoA产生于奇数链长脂肪酸和某些氨基酸的分解代谢过程中,所以可能存在于例如线粒体或过氧化物酶体等氧化性区室中。在植物发育的某些阶段,预计这些区室在脂肪酸分解代谢全程中含有高水平的乙酰基CoA。因为这些区室并不参与生物合成,所以估计丙二酰基CoA的水平不很高。
已经对将基因产物导向真核细胞(特别是植物细胞)特定的亚细胞区室进行了广泛的研究。例如,美国专利5,728,925和5,717,084(本发明参考其中内容)说明了将蛋白质导向叶绿体的方法。普遍的叶绿体导向性可以通过在胞质溶胶蛋白N末端增加一段转运肽而实现。可以作为质体的转运肽的不同序列范围及其普遍特征是本领域众所周知的。
将蛋白导向过氧化物酶体也是本领域已知的,也同样使用胞质溶胶中合成的蛋白质的特定序列。导向过氧化物酶体基质的蛋白可用两种不同的导向信号(1型或2型PTS)导入过氧化物酶体。PTS1是一种位于C末端的非切割三肽基序,例如SKL(以单氨基酸命名表示),其它三肽则使用碱性疏水性氨基酸小基序(参见Gietl,C.Physiol.Plant(1996)97:599-608;Olsen等,Ann Rev Plant Physiol and PlantMol Biol(1995)46:123-46)。PTS2是一种R-L/I/Q-X5-H/Q-L形式的九肽位于某些导向过氧化物酶体基质的N末端区域。
将蛋白质导向线粒体的方法是本领域众所周知的。合成的导向线粒体的蛋白质是带有N末端前导序列的胞质溶胶前体。前导序列与受体蛋白反应引发如下过程:蛋白质被护送穿过细胞外膜,可能还穿过内膜,进入线粒体的各种亚区室。将前体多肽导向线粒体和叶绿体的的序列也是本领域众所周知的(例如WO95/08633)。为了进入线粒体或其它亚区室,大蛋白需要增强其它功能(例如伴侣蛋白)的表达来解折叠。例如mhsp70在线粒体内协助蛋白穿越线粒体外膜(Matouschek等,EMBO J(1997)16:6727-6736)。已知例如线粒体促输入因子(MSF)等功能参与了胞质溶胶中的蛋白解折叠过程,蛋白质然后才与线粒体蛋白输入受体结合(Komiya等,EMBO J(1997)16:4267-4275)。
前体的产生
前体可能限制特定聚酮化合物的合成。为了提高特定聚酮化合物的生产水平,可能需要提供编码提高特定产物合成所必需的酶的基因结构。例如,要提高丙二酰CoA的量,可以在合适的区室内表达催化乙酰CoA直接转化为丙二酰CoA的乙酰CoA羧化酶(ACCase)。已知植物的ACCase催化丙酰CoA转化为甲基丙二酰CoA。ACCase的利用度取决于对应底物,乙酰CoA和丙酰CoA的多少。当以适当水平在产乙酰CoA的区室内表达时,ACCase可平衡作为底物的乙酰CoA与丙二酰CoA之间的量,得到合适的聚酮化合物。或者,当乙酰CoA与丙二酰CoA都存在时,适当表达ACCase可合成适量的乙酰CoA,丙酰CoA,丙二酰CoA和甲基丙二酰CoA。
为了特异性地加强甲基丙二酰CoA的合成,可以在所需的区室内表达丙酰CoA羧化酶活性。已经在天蓝色链霉菌A3(2)中鉴定到了具有丙酰CoA特异性羧化酶活性的酶(Bramwell等,Microbiology(1996)142(Pt3):649-655),并已经克隆了该异源二聚酶的单体之一。用两种不同羧化酶的适当表达水平,可以在不同区室内形成适合许多不同聚酮化合物生物合成路径的前体水平。
因为植物一般不以氨基酸作为能源,可能需要加强丙酰CoA的水平来合成某些聚酮化合物。因为丙酰CoA来自某些氨基酸的分解代谢,提高特定氨基酸的合成从而提高该氨基酸的胞内浓度可提高氨基酸代谢路径的通量。由于生物合成路径一般受反馈调节,干扰生物合成蛋白的反馈调节位点就足以提高氨基酸的胞内浓度。已经通过诱变乙酰乳酸酯(acetolactate)合成酶来缓解反馈抑制,从而提高了氨基酸在植物细胞内的浓度。
Schroder等,Biochemistry(1998)37:8417-8425说明了一种需要甲基丙二酰CoA作为底物且显然发生于胞质溶胶区室内的生物合成反应。该反应是C-甲基黄酮生物合成的一部分。已知少量其他植物也产生C-甲基黄酮,这是一种由与细菌和真菌PKS无关的PKS产生的查耳酮的衍生物。根据结构分析推断,甲基丙二酰CoA是这些不同C-甲基黄酮合成中的底物。显然,某些植物能够合成甲基丙二酰CoA。根据本领域已知的方法,可以鉴定出负责生物合成甲基丙二酰CoA的基因,并将它们引入植物宿主,实现甲基丙二酰CoA的生物合成。也可以从生产C-甲基黄酮的生物体中获得负责合成丙酰CoA的基因。
组织类型和发育阶段
在特定类型组织的某些发育阶段,植物使用特化的代谢功能。在某些情况下,需提高底物浓度来获得代谢原料。例如,在油菜籽的发育和成熟过程中,表现出很高的脂肪酸合成速度,伴随着乙酰CoA和丙二酰CoA通量的提高。当以纯化药用或农用聚酮化合物为目的时,油菜籽可以作为聚酮化合物合成要导向的位置。PKS,翻译后修饰所必需的酶,和聚酮化合物合成所需的其它酶可以按程序用合适的启动子表达,所述的启动子在所需的组织内具有特别高的活性。这类组织或发育节段特异性启动子是本领域所熟知的。
辅助功能
在具有适当水平生物合成底物的植物亚细胞区室内的功能性PKS可以合成聚酮化合物。大多数原初聚酮化合物产物不具有生物活性。通常需要其它生物合成酶将原初聚酮化合物转化成生物活性分子。
已经说明了许多将原初聚酮化合物转化成生物活性分子所必需的辅助功能。其中包括环化反应,氧化反应,还原反应,甲基化反应(在氧原子或碳原子上),脱羧反应,脱水反应,脱氢酶反应和连接反应。所需的步骤数有很大不同;例如,要将原初聚酮化合物转化为强毒性真菌毒素黄曲霉素需要至少10步反应(Brown等,Proc.Natl.Acad.Sci USA(1996)93:1418-1422)。
作为实施例之一,milbemycin和avermectin是具有杀螨和杀线虫活性的聚酮化合物。这些化合物是由avermitilis链霉菌和hygroscopicus subsp.aureolacrimosus链霉菌模块化PKS产生的。milbemycin和avermectin的原初聚酮化合物需要12个模块,位于4种不同的蛋白质上,预计分子量为450,700,610和540KD(Ikeda,H.等,Chem Rev(1997)97(7):2591-2609)。这些模块的差异仅在于起始物酰基CoA的特异性,以及avermectin的C22-C23存在着一个双键。这类聚酮化合物间的主要差异在于milbemycin合成开始时的酰基CoA比avermectin的更常见,以及,milbemycin没有结合在avermectin苷元C13羟基上的二糖。合成milbemycin需要环化呋喃环和还原C5酮基的附加功能。合成avermectin需要合成二糖和将其与核心聚酮化合物结合的附加功能。合成milbemycin必需的全部基因都可以从生产它的生物体分离得到,并经基因工程改造而适合在植物细胞内异源表达。
作为第二个实施例,strobilurin A是一种真菌聚酮化合物,是由某些担子菌(例如Strobilurus tenacellus)产生的。虽然尚不清楚其完整的生物合成路径,但已知除核心的PKS之外还需要几种附加酶:一至二种将肉桂酰CoA转化为起始物苯甲酰CoA的酶,将C1上的COOH重排到C3上的酶,C-甲基转移酶和两种O-甲基转移酶。
合成细菌和真菌聚酮化合物所需的生物合成酶通常成簇存在于生产它们的生物体基因组内。许多文献记载了链霉菌产生的聚酮化合物(Chater,K等,EMBOJ(1985)4:1893)和丝状真菌产生的聚酮化合物(例如黄曲霉素,Brown等)。目前用异源PKS探针来鉴定包含任何未明来源的PKS的基因组克隆。因为各PKS基因簇的核苷酸序列很不相同,常用针对PKS基因保守区的简并引物通过聚合酶链反应制备同源PKS探针。除通过杂交直接测得的PKS之外,大基因组克隆(用λ噬菌体,粘粒,BAC或本领域已知的其他载体)还包含辅助基因。
植物细胞的转化
获得了合适的载体,例如前文所述的载体,就可以制备包含所需表达单元的转基因植物。如实施例所述,转化方法之一是利用真空渗透将编码PKS的DNA引入构成种子形成器官的植物细胞内(Bechtold,N.,Ellis,J. & Pelletier,G(1993)C.R.Acad.Sci.,Paris/Life Sciences 316:1194-1199)。在真空渗透法中,整株植物在真空下与含有农杆菌转化体的溶液接触。然后,任植物继续生长和发育形成种子。然后收集种子,筛选出含有引入载体的种子。该方法的优点是不需要体细胞成胚胎作用从培养的植物细胞再生植株。
在另一种转化方法中,用微量移液管将载体直接微注射到植物细胞内,从而将重组DNA机械转移到植物细胞内(Crossway,Mol Gen Genetics(1986)202:179-185)。在另一方法中,将遗传物质转移到植物细胞内是用聚乙二醇(Krens等,Nature(1982)296:72-74),或用核酸在微珠或颗粒内部或表面的小颗粒进行高速轰击渗透(Klein等,Nature(1987)327:70-73)。在另一种方法中,原生质体与含有需要导入的DNA的其它个体融合。这些个体是小细胞,细胞,溶酶体或其它可融合的以脂质体为表面的实体(Fraley等,Proc.Natl.Acad.Sci.USA(1982)79:1859-1863)。
还可以用电穿孔法将DNA引入植物细胞(Fromm等,Proc.Natl.Acad.Sci.USA(1985)82:5824)。在该技术中,在含有表达载体的质粒存在下进行植物原生质体的电穿孔。高强度电脉冲可逆性地提高生物膜的通透性,以允许质粒的导入。电穿孔后的植物原生质体重新形成细胞壁,分化和再生。
就细菌感染介导的转化而言,用已经用欲引入DNA转化了的根癌农杆菌或毛根农杆菌感染植物细胞。农杆菌是革蓝氏阴性根瘤菌科的代表属。所属各种造成冠瘿病(根癌农杆菌)和毛根病(毛根农杆菌)。诱导冠瘿碱和毛根中的植物细胞产生氨基酸衍生物冠瘿碱,它只由细菌分解代谢。表达冠瘿碱的细菌基因是嵌合表达盒所需调控元件的良好来源。除了分析是否存在冠瘿碱之外,还可以用来鉴定被转化组织。
可以用根癌农杆菌的Ti质粒或毛根农杆菌的Ri质粒将编码PKS的基因序列引入合适的植物细胞。Ti质粒或Ri质粒在用农杆菌感染后转移给植物细胞(St.Schell J.,Science(1987)237:1176-1183)。Ti和Ri质粒包含两个产生转化细胞所必需的区域。其一称为转移DNA(T-DNA),被转移到植物细胞核内,诱导根癌或毛根的形成。另一个称为致病(vir)区,是T-DNA转移所必需的,但本身并不转移。即使vir区在另一质粒上,T-DNA也能被转移到植物细胞内(Hoekema等,Nature(1983)303:179-180)。可以通过插入异源DNA来增加被转移DNA的大小而不影响它被转移的能力。这样,可以将修饰即删除了致病基因的Ti或Ri质粒作为载体将本发明的基因结构转移到合适的植物细胞内。
重组Ti和Ri质粒的构建是本领域众所周知的,一般使用典型方法,使用常用细菌载体,例如pBR322(Konez,C.和Schell,J.(1986),Molecular and GeneralGenetics 204:383-396)。还可以利用辅助遗传元件,这些元件有时存在于天然质粒中,有时由外源序列构建而成。其中包括但不限于“穿梭载体”(Ruvkum & Ausubel,Nature(1981)298:85-88),启动子(Lawton等,Plant Mol.Biol.(1987)9:315-324)和作为选择因子的抗生素抗性的结构基因(Fraley等,Proc.Natl Acad Sci.USA(1983)80:4803-4807)。
目前使用的有两类重组Ti和Ri质粒。在称为“共整合体”的一类中,含有感兴趣基因的穿梭载体通过基因重组插入非致癌Ti质粒,该质粒含有植物转化所需的顺式作用和反式作用元件,例如pMLJ1穿梭载体(DeBlock等,EMBOJ(1984)3:1681-1689)与非致癌Ti质粒pGV3850(Zambryski等,EMBO J(1983)2:2143-2150)。在第二类或称“双质粒”的系统中,感兴趣的基因插入含有植物转化所需的顺式作用元件的穿梭载体中。其它必需功能由非致癌Ti质粒以反式提供,例如pBIN19穿梭载体(Bevan,Nucleic Acids Reseach(1984)12:8711-8721)与非致癌Ti质粒PAL4404(Hoekma等,Nature(1983)303:179-180)。这类载体中有些可以购得。
有两种用农杆菌转化植物细胞的方法:将农杆菌与培养的分离的原生质体一起培养,或用农杆菌转化完整细胞或组织。第一种方法需要建立允许培养原生质体和由培养的原生质体再生成植物的培养系统。第二种方法要求(a)完整植物组织例如子叶能够被农杆菌转化,和(b)转化后的细胞或组织能够经诱导而再生成完整的植物。
大多数双子叶植物能够被农杆菌转化,和所有农杆菌的天然植物宿主一样,它们能够被体外转化。单子叶植物,特别是谷类,不是农杆菌的天然宿主。用农杆菌转化它们的努力直到目前方才获得成功(Hooykas-Van Slogtern等,Nature(1984)311:763-764)。但是,现在越来越多的证据表明,某些单子叶植物能够被农杆菌转化。现在,用新的实验方法,可以转化例如黑麦(de la Peza等,Nature(1987)325:274-276),玉米(Rhodes等,Science(1988)240:204-207)和水稻(Shimamoto等,Nature(1989)338:274-276)等谷类植物。
如前所述,鉴定转化细胞或植物一般通过在转化用载体内包含可选标记或通过获得细菌感染成功的证据来实现。
转化植物的再生
可用已知技术再生经转化而含有PKS编码序列的植物细胞。例如,以下文献记述从培养的原生质体再生成植株:Evans等,Handbook of Plant Cell Culture,Vol.1:(MacMillan Publishing Co.New York,1983);和Vasil I.R.(编),Cell Cultureand Somatic Cell Genetics of Plants,Acad.Press,Orlando,Vol.I,1984和Vol.II,1986)。已知,实际上所有植物都可以从培养细胞或组织再生而成,包括但不限于甘蔗、甜菜、棉花、果树和豆类。
再生的方法因植物种类而异,但通常首先需要提供转化原生质体悬浮液或包含转化培养块的培养皿。愈伤组织形成,由愈伤诱导产生苗,然后生根。或者,可在愈伤组织中诱导形成体细胞胚。这些体细胞胚萌发成天然胚,再形成植株。培养基一般包含各种氨基酸和植物激素,例如植物生长素和细胞激动素。还宜在培养基中加入谷氨酸和脯氨酸,这特别适合如玉米和苜蓿等植物。有效的再生倚赖于培养基,基因型和培养历程。如果这三个变量得到控制,则再生通常可以再现和重复。
用以上方法可以转化和再生许多植物。以下说明的拟南芥菜属(arabidopsis)和烟草。其它有用的种类是豌豆,胡椒,矮牵牛花,玉米,小麦和棉花。以上所列并不是仅限于此,所需的任何高等植物都可以用作宿主。
以下实施例是为了说明而不是限定本发明。
实施例1
构建6-MSAS的表达载体
设计一个合成多接头,方便聚酮化合物合成酶基因克隆到表达载体pBI121中。该多接头包含SacI,BamHI,NdeI,XbaI,EcoRI,AvrII,SpeI,SnaBI和Asp718限制性位点:
5′-CGGATCCATATGAACCTCTAGAGAATTCATAGACTAGTCCTAGGTACGTAG-3′
3′-
TCGAGCCTAGGTATACTTGGAGATCTCTTAAGTATCTGATCAGGATCCATGCATCCATG-5′
将该多接头克隆到pBlueScript(Stratagene)的Sacl/Asp718位点,生成克隆载体131a。
设计一段具有BamHI,AvrIIk,SpeI和SanBI限制性位点的合成多接头:
5′-GATCCATCCACTAGTCCTAGGTAC-3′
3′-GTAGGTGATCAGGATCCATG-5′
将该多接头克隆到pBI121(Clontech)的BamHI/SanBI限制性位点,产生表达载体131b。
从pDB102(分离自大肠杆菌SCS110)分离得到含有展青霉菌6-甲基水杨酸合成酶基因的一段5.5kbp的NdeI/XbaI片段,将它克隆到131a的NdeI/XbaI位点。将来自该中间质粒的BamHI/SpeI片段克隆到131b的BamHI/SpeI位点中,得到含有6-MSAS表达系统的载体131c。
实施例2
构建eryA-1的表达载体
从pCJT75中分离与DEBS硫酯酶融合的含有Saccharopolyspora erythraea的eryAI基因的一段11.2kbp NdeI/EcoRI片段(Kao,C.M.等,J Am ChemSoc(1995)117:9105-06),将它克隆到载体131a的NdeI/EcoRI位点中。将来自该中间质粒的BamHI/AvrII片段克隆到131b的BamHI/AvrII位点,得到eryA-1的表达载体131d。
实施例3
构建grsA的表达载体
从pQE60-PheAT分离含有短芽孢杆菌grsA基因的NcoI/HindIII片段,将它克隆到131a的NcoI/HindIII位点中。将来自该中间质粒的XbaI/SpeI片段克隆到131b的XbaI/SpeI位点中,得到grsA的表达载体131e。
实施例4
用真空渗透转化拟南芥菜属
1.
将具有合活基因型的植物培养到刚好出现苔的阶段
较好的是,将12至15株植物培养在一个3.5英寸花盆中。在种植后,可用尼龙窗纱覆盖花盆。植物将透过窗纱生长,这样,在倒转花盆进行渗透时,落出的泥土较少。
2.
摘除苔促进大量次级苔的生长
为了促进大量次级苔的生长,摘除(例如用剪刀)出现的苔。
真空渗透
3.带有合适PKS表达载体,例如131c,131d和131e的农杆菌液体培养物培养通宵。例如,在进行真空渗透前的2至3天开始通宵培养25ml培养物(LB+抗生素),并用作起始培养物。然后,在渗透的前一天,将培养物加入400mlLB+抗生素中。
4.培养约24小时后,离心(例如,在GSA离心机中5Krpm离心10分钟,以室温为宜)收获细胞,重悬在3体积渗透介质中(OD600约0.8)。(较好的是,先将细胞重悬成小体积,再稀释到OD600约0.8。要装满用来转一层化拟南芥菜属的真空罐约需2L细菌。
5.将农杆菌(处于渗透介质中:1/2X Murashige & Skoog盐,或MS盐+有机物;1X维生素B5;5.0%蔗糖;0.44μM苄基氨基嘌呤(每升加10μl的1mg/ml溶于DMSO中的储备液)加入培养皿或烧杯,倒转植物(花盆,土壤和全部)浸在溶液中(将苔和整个叶丛浸在渗透介质中)。
6.将烧杯置于钟形罩内。抽真空,直到叶面和茎表面上形成气泡而且溶液开始微微起泡,然后迅速释放真空。
所需的时间和真空度每次实验均不同。被水浸透的组织颜色均匀变深,则清楚地表明渗透良好。
7.从烧杯中取出植物,覆以树脂膜包裹或加盖以保持湿度。第二天,让植物暴露。
给植物加保湿罩直到天黑,以防植物在渗透后立刻接触直接光照。尽可能早地去除保湿罩,以尽可能减少腐生植物的生长。
8.生长约4周,保持各盆的苔在一起,与邻盆的分开。
筛选转化体
9.当植株上的长角果很干时,收获种子(来自同一盆的种子收集在一起)。卡那霉素筛选
10.铺制选择培养板(1/2X Murashige & Skoog盐;0.8%琼脂);高压蒸汽灭菌,冷却,然后加入1X维生素B5和抗生素(例如Km50μg/ml);常用的是150×15mm的树脂培养皿(Murashige等,(1962)Physiologia Plantarum 15:473-497)。
11.将种子灭菌。很多灭菌方法都可以使用。例如:乙醇或异丙醇处理1分钟,然后用50%漂白粉液/50%水/0.05%Tween处理5分钟,再用无菌水洗涤3次。
12.将种子重悬在无菌,室温,0.1%琼脂糖中,铺在选择培养板上进行平板培养。在通风橱中干燥培养板,直到即使倾倒培养板,种子也不再流动。每500-1000粒种子用1ml琼脂糖。
每个150×15mm的培养板上培养2000-4000棵种子。密度再高会降低抗生素的选择效率。
13.对培养板在冷室内进行2个通宵的春化处理。将培养板转移到培养室中。
14.约7天后,可清楚的鉴定出转化体:植株呈深绿色,次生子叶呈健康的绿色,根扩展开来并深入选择培养基内。
15.将小植株移植到土壤中,令其生长,采集种子。要提高移植成功率,可在拔出植株前打碎根周围的琼脂,在种植前清除黏附在根上的所有琼脂,在种植后浇足水,在第一或前2天让植株在罩子中生长(保证高湿度)。如果根被折断,将小植株转移到新鲜选择培养板上培养数天,然后再种植。
实施例5
构建附加表达载体
从pKOS018-88A分离含有枯草杆菌Sfp编码序列的700bp NcoI/XbaI片段。将该片段与一段4.1kbp的NcoI/XbaI片段连接,后者含有一个pUC复制子,氨苄青霉素抗性基因,e35S启动子(Kay,R.等,Science(1987)236:1299-1302)和到NcoI位点为止的Cab22L前导序列,和从XbaI位点开始的胭脂氨碱合成酶3’片段。所得的表达载体pBH1000包含嵌合的e35S-Sfp-nos3’基因。
从pBH 1000分离含e35S-Sfp-nos3’嵌合基因的一段1.7kbp BamHI/BglII片段。将该片段插入pAR4741的BamHI位点,pAR4741含有pACYC184复制子(Chang,A.C.Y.等,J.Bacteriol.(1978)134:1141-1156),pVS1复制子(Itoh,Y.等,Plasmid(1984)11:206-220),Tn1721的tetA基因(Waters,S.H.等,Nucleic AcidReseach(1983)11:6089-6105),和烟草乙酰乳酸酯合成酶突变体(surB,Lee,K.等,EMBO J.(1988)7:1241-1248)周围的T-DNA边界片段(van den Elzen,P.等,PlantMol.Biol(1985)5:149-154),克隆位点和lacZalpha基因片段。所得的双质粒载体(binary vector)pBH1001包含e35S-Sfp-nos3’嵌合基因,并保留了供以后插入DNA片段的一个BamHI位点。
从pKOS018-97分离出包含DEBS1+TE(即eryAI编码序列与DEBS硫酯酶的编码序列融合,(Kao,C.M.等,(1995),同上))完整编码序列的一段11.2kbpNdeI/AvrII片段。将该片段与一段4.2kbp的NdeI/XbaI片段连接,后者含有pUC复制子,氨苄青霉素抗性基因,e35S启动子和至NdeI位点的Cab22L前导序列和始于XbaI位点的章鱼碱合成酶3’片段(DeGreve,H等,J.Mol.Appl.Genet(1983)1:499-511)。所得的质粒pBH 1006包含e35S-DEBS1+TE-ocs3’嵌合基因。
从pBH 1006中分离出含e35S-DEBS1+TE-ocs3’嵌合基因的一段12.6kbpBamHI/BglII片段。将该片段插入pBH1001的BamHI位点,pBH1001已经含有位于T-DNA边界之间的35S-Sfp-nos3’嵌合基因。所得的双重载体pBH 1008即含35S-Sfp-nos3’嵌合基因又含e35S-DEBS1-ocs3’嵌合基因。
从pBH 1006中分离出一段14.2kbp的NdeI(钝端)/BglIII片段,它包含pUC复制子,至BglIII位点为止的氨苄青霉素抗性基因,与始于NdeI位点的ocs3’末端连接的DEBS1+TE编码序列。将该片段与分离自pER5526的含e35S-Cab22L前导序列-叶绿体转运肽(ctp)的1kbp SphI(钝端)/BglII片段连接。所得的质粒pBH1009含有e35S-ctp-DEBS1+TE-ocs3’嵌合基因。
从pBH1009中分离出含e35S-ctp-DEBS1+TE-ocs3’嵌合基因的一段12.9kbp的BamHI/BglII片段。将该片段插入pAR4741的BamHI位点。所得的双重载体pBH 1011包含e35S-ctp-DEBS1+TE-ocs3’嵌合基因,并保留一个供以后插入片段的BglII位点。
从pBH 1000中分离出一段3.9kbp的NcoI(钝端)/BglII片段,它包含pUC复制子,氨苄青霉素抗性基因,与始于NcoI位点的nos3’末端连接的Sfp编码序列。将该片段与分离自pER5526的含e35S-Cab22L前导序列-ctp的1kbp SphI(钝端)/BglII片段连接。所得的质粒pBH1010含有e35S-ctp-Sfp-ocs3’嵌合基因。
从pBH1010中分离出含e35S-ctp-Sfp-ocs3’嵌合基因的一段2.0kbp的BamHI/BglII片段。将该片段插入pAR4741的BamHI位点。所得的双重载体pSG5578包含e35S-ctp-Sfp-ocs3’嵌合基因,并保留一个供以后插入片段的BamHI位点。
从pBH1010中分离出含e35S-ctp-Sfp-ocs3’嵌合基因的一段2.0kbp的BamHI/BglII片段。将该片段插入pBH1011的BamHI位点。所得的双重载体pBH1012包含e35S-ctp-DEBS1+TE-ocs3’嵌合基因和e35S-ctp-Sfp-nos3’嵌合基因,并保留一个供以后插入片段的BamHI位点。
从pKOS12-71d中分离出包含展青霉菌MSAS编码序列的一段5.5kbp的NdeI/XbaI片段。将该片段与以下一段NdeI/XbaI片段连接,所述片段包含pUC复制子和氨苄青霉素抗性基因,至NdeI位点为止的e35S-Cab22L前导序列和始于XbaI位点的ocs3’末端。所得的质粒pSG5540包含e35S-MSAS-ocs3’嵌合基因。
从pKOS14-69中分离出包含展青霉菌MSAS蛋白与枯草杆菌Sfp蛋白所成融合蛋白的编码序列的一段6kbp的NdeI/XbaI片段。将该片段与以下一段NdeI/XbaI片段连接,所述片段包含pUC复制子和氨苄青霉素抗性基因,至NdeI位点为止的e35S-Cab22L前导序列和始于XbaI位点的ocs3’末端。所得的质粒pSG5541包含e35S-MSASSfp-ocs3’嵌合基因。
将e35S-MSAS-ocs3’嵌合基因插入双重载体pWTT2144的HIndIII和KpnI位点之间。从pSG5540中分离出两段片段;其一是5.1kbp的HindIII/AatII片段,另一段是1.95kbp的AatII/KpnI片段。将两片段与HindIII/KpnI消化的pWTT2144连接。所得的双重载pSG5574包含e35S-MSAS-ocs3’嵌合基因。
将e35S-MSASSfp-ocs3’嵌合基因插入双重载体pWTT2144的HIndIII和KpnI位点之间。从pSG5441中分离出两段片段;其一是5.1kbp的HindIII/AatII片段,另一段是2.5kbp的AatII/KpnI片段。将两片段与HindIII/KpnI消化的pWTT2144连接。所得的双重载pSG5575包含e35S-MSASSfp-ocs3’嵌合基因。
从pSG5540中分离出含MSAS编码序列的一段5.5kbp的NdeI(钝端)/XbaI片段。将该片段与以下SphI(钝端)/XbaI片段连接,后者包含pUC复制子,氨苄青霉素抗性基因,至SphI位点为止的e35S-Cab22L前导序列,和始于XbaI位点的ocs3’末端。所得的质粒pSG5581含有e35S-ctp-MSAS-ocs3’嵌合基因。
从pSG5541中分离出含MSASSfp编码序列的一段6.0kbp的NdeI(钝端)/XbaI片段。将该片段与以下SphI(钝端)/XbaI片段连接,后者包含pUC复制子,氨苄青霉素抗性基因,至SphI位点为止的e35S-Cab22L前导-ctp序列,和始于XbaI位点的ocs3’末端。所得的表达载体pSG5582含有e35S-ctp-MSASSfp-ocs3’嵌合基因。
将e35S-ctp-MSAS-ocs3’嵌合基因插入双重载体pWTT2144的HIndIII和KpnI位点之间。从pSG5581中分离出两段片段;其一是5.1kbp的HindIII/AatII片段,另一段是1.90kbp的AatII/KpnI片段。将两片段与HindIII/KpnI消化的pWTT2144连接。所得的双重载pSG5583包含e35S-ctp-MSAS-ocs3’嵌合基因。
将e35S-ctp-MSASSfp-ocs3’嵌合基因插入双重载体pWTT2144的HIndIII和KpnI位点之间。从pSG5582中分离出两段片段;其一是5.1kbp的HindIII/AatII片段,另一段是2.5kbp的AatII/KpnI片段。将两片段与HindIII/KpnI消化的pWTT2144连接。所得的双重载体pSG5584包含e35S-ctp-MSASSfp-ocs3’嵌合基因。
实施例6
转化烟草悬浮培养物
培养物的形成
将无菌烟草(Petite Havan)茎尖培养在无激素Murashige & Skoog(MS)培养基上。切取圆叶片,接种到补充了2mg/L吲哚乙酸(IAA)和0.5 mg/L苄基氨基嘌呤(BA)的固化MS培养基(1%琼脂)上。种有叶片的培养皿在28℃,16小时光周期,培养3周,期间,在剪切边缘形成非分化细胞(愈伤组织)。将愈伤组织从叶片上转移到含0.2mg/L 2,4-D作为唯一植物激素的液体MS培养基中。
将上述细胞悬浮液培养在叶片培养条件下,但是加以130rpm的振荡。在此条件下,培养物以2天为倍增时间成长为单细胞和小细胞簇(一般不超过100个细胞),每周将2ml沉淀细胞体积(SCV)的细胞转移入50ml液体培养基。也可以在含2mg/L IAA和0.5mg/L BA的条件下培养,但是悬浮液在此条件下的生长慢得多,而且主要由大细胞聚合体组成。
转化悬浮培养物
悬浮培养物是添加化学前体和了解酶在植物中如何转化前体的理想系统。
用与带双重质粒的致癌农杆菌的共培养来转化悬浮液,所述的双重质粒包含PKS的表达系统基因(例如编码DEBS1-硫酯酶的基因),最好同时包含全ACP合成酶的表达系统,和可选标记基因(例如提供对除草剂chlorsufuron抗性的ALS基因)。
转化的进行是在液体培养基中将农杆菌细胞与悬浮细胞混合。培养和选择可以在液体培养基中进行,即继续如前但在24℃暗环境中振荡农杆菌/烟草细胞混合物,或在固体培养基上进行,即将混合物采集到滤纸上,将带有共培养烟草细胞的滤纸转移到组成与烟草叶片所用相同的固体培养基上。在两种情况中,都在共培养培养基中加100μM乙酰丁香酮。
在组成与培养所用相同的液体或固体培养基中加50μg/L chlorsufuron和500mg/L羧苄青霉素,如此挑选出被转化的细胞和反选去除农杆菌培养物。在液体转化中,先用新鲜培养基洗去大部分细菌,然后重悬在含除草剂和抗生素的培养基中。在固体转化中,将转化后的愈伤组织转移到液体培养基中,进行或不进行选择和反选择,重新形成悬浮培养物。
在4-5周的选择和反选择后,含感兴趣基因的转化(除草剂抗性)细胞悬浮液即可用于分析和/或培养研究。据假设,转化悬浮液由多种转化混合体组成,其中,T-DNA可整合在多个随机基因座。可用这些转化悬浮液生产聚酮化合物。
用上述方法可获得被修饰成包含实施例5的表达系统pBH1008的植物细胞。pBH1008包含各自独立的DEBS1+TE表达系统和Sfp表达系统,都受35S启动子调控。
同样,使用相同的方法,但用pBH1012代替pBH1008,可将植物细胞转化成包含导向叶绿体的DEBS1+TE和Sfp的表达系统。
实施例7
将多酮混合物合成酶基因引入烟草的转化方法
叶培养块的来源是体外培养(27℃,16小时光周期)在TCMA培养基(1/2MS盐,维生素B5,100mg/L m-肌醇,600mg/L MES,20g/L蔗糖,pH5.6,并用7g/LTC琼脂固化)上的烟草(Petite Havana)。去除叶上的中脉,然后切成2×2mm的培养块。将培养块漂浮在含稀释至5×107个细胞/ml的LBA4404细胞通宵培养物和合适的双重载体的minAsuc培养基上。几分钟后,将培养块转移到含TCMA基本培养基(补充了0.5mg/L BAP,2mg/L IAA和100μM乙酰丁香酮)的培养板中。培养块在盖有滤纸片的该培养基上于24℃/暗环境共培养2天。然后将培养块转移到补充了0.5mg/L BAP,2mg/L IAA,25μg/L chlorsulfuron(或25mg/L庆大霉素)和250mg/L羧苄青霉素的TCMA基本培养基上。在与体外培养茎相同的条件下培养培养块,3周后,大多数培养块上都已经形成了转基因茎。
用以上方法可以获得被修饰成包含实施例5中的表达系统pSG5574,pSG5575和pBH1008的植物。pSG5574包含受35S启动子调控的MSAS的表达系统。pSG5575包含受35S启动子调控的MSAS与Sfp所成融合蛋白的表达系统。
用相同的方法,但用包含受35S启动子调控的MSAS-Sfp融合蛋白的表达系统和一段ctp序列的pSG5584代替上述质粒,可获得产生导向叶绿体的融合蛋白的植物。同样,pSG5578(含Sfp的表达系统)与pSG5583(含MSAS的表达系统)共转化提供叶绿体中含有这些蛋白的植物,因此能够生产聚酮化合物。
Claims (11)
1.一种植物细胞,它被修饰成包含至少一个能够产生至少一种基本真菌聚酮化合物合成酶的表达系统,所述的基本真菌聚酮化合物合成酶包含酮合成酶/酰基转移酶催化区和酰基运载蛋白活性。
2.根据权利要求1所述的植物细胞,它被进一步修饰成包含至少一个能够产生全酰基运载蛋白合成酶的表达系统。
3.根据权利要求2所述的植物细胞,所述的真菌聚酮化合物合成酶表达系统和全酰基运载蛋白合成酶表达系统位于不同的载体上。
4.根据权利要求2所述的植物细胞,所述的真菌聚酮化合物合成酶表达系统和全酰基运载蛋白合成酶表达系统位于同一载体上。
5.根据权利要求2所述的植物细胞,所述的真菌聚酮化合物合成酶表达系统和全酰基运载蛋白合成酶表达系统构成包含所述聚酮化合物合成酶与所述全酰基运载蛋白合成酶的融合蛋白的表达系统。
6.根据权利要求1所述的植物细胞,编码所述酮合成酶/酰基转移酶的核苷酸序列与编码所述酰基运载蛋白的核苷酸序列来自相同的真菌聚酮化合物合成酶。
7.根据权利要求1所述的植物细胞,编码所述酮合成酶/酰基转移酶的核苷酸序列与编码所述酰基运载蛋白的核苷酸序列来自不同的真菌聚酮化合物合成酶。
8.根据权利要求1所述的植物细胞,还包含基于细胞的聚酮化合物检测系统的表达系统。
9.根据权利要求2所述的植物细胞,还包含基于细胞的聚酮化合物检测系统的表达系统。
10.一种产生聚酮化合物合成酶的方法,该方法包括在所述聚酮化合物合成酶的产生条件下培养权利要求2所述的植物细胞。
11.权利要求2所述的植物细胞用于制备聚酮化合物的用途。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US5221197P | 1997-07-10 | 1997-07-10 | |
| US60/052,211 | 1997-07-10 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN1263557A CN1263557A (zh) | 2000-08-16 |
| CN1188520C true CN1188520C (zh) | 2005-02-09 |
Family
ID=21976131
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CNB988070812A Expired - Fee Related CN1188520C (zh) | 1997-07-10 | 1998-07-10 | 在植物中生产聚酮化合物 |
Country Status (10)
| Country | Link |
|---|---|
| US (2) | US6262340B1 (zh) |
| EP (1) | EP1007689A2 (zh) |
| JP (1) | JP2001509379A (zh) |
| KR (1) | KR100540287B1 (zh) |
| CN (1) | CN1188520C (zh) |
| AU (1) | AU744751C (zh) |
| CA (1) | CA2294616A1 (zh) |
| IL (1) | IL133716A0 (zh) |
| NZ (1) | NZ501998A (zh) |
| WO (1) | WO1999002669A2 (zh) |
Families Citing this family (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6033883A (en) | 1996-12-18 | 2000-03-07 | Kosan Biosciences, Inc. | Production of polyketides in bacteria and yeast |
| US6410301B1 (en) | 1998-11-20 | 2002-06-25 | Kosan Biosciences, Inc. | Myxococcus host cells for the production of epothilones |
| JP4662635B2 (ja) | 1998-11-20 | 2011-03-30 | コーサン バイオサイエンシーズ, インコーポレイテッド | エポチロンおよびエポチロン誘導体を生成するための組換え方法および材料 |
| US6358712B1 (en) | 1999-01-05 | 2002-03-19 | Trustee Of Boston University | Ordered gene assembly |
| AU3604100A (en) * | 1999-03-15 | 2000-10-04 | Pioneer Hi-Bred International, Inc. | Methods for enhancing the disease resistance of plants |
| US7011959B1 (en) * | 1999-10-27 | 2006-03-14 | Kosan Biosciences, Inc. | Heterologous production of polyketides |
| AU1231701A (en) * | 1999-10-25 | 2001-05-08 | Kosan Biosciences, Inc. | Production of polyketides |
| US7256888B2 (en) * | 2003-11-07 | 2007-08-14 | Cardial Health 303, Inc. | Fluid verification system and method for infusions |
| US8852902B2 (en) | 2010-11-22 | 2014-10-07 | The Regents Of The University Of California | Producing a trimethylpentanoic acid using hybrid polyketide synthases |
| MX349840B (es) * | 2011-06-23 | 2017-08-16 | Rho Renewables Inc | Sistemas de produccion recombinante para moleculas aromaticas. |
| US10233431B2 (en) | 2014-02-26 | 2019-03-19 | The Regents Of The University Of California | Producing 3-hydroxycarboxylic acid and ketone using polyketide synthases |
| CN106916834B (zh) * | 2015-12-24 | 2022-08-05 | 武汉合生科技有限公司 | 化合物的生物合成基因簇及其应用 |
Family Cites Families (16)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE3587548T2 (de) | 1984-12-28 | 1993-12-23 | Plant Genetic Systems Nv | Rekombinante DNA, die in pflanzliche Zellen eingebracht werden kann. |
| US5098837A (en) | 1988-06-07 | 1992-03-24 | Eli Lilly And Company | Macrolide biosynthetic genes for use in streptomyces and other organisms |
| US5252474A (en) | 1989-03-31 | 1993-10-12 | Merck & Co., Inc. | Cloning genes from Streptomyces avermitilis for avermectin biosynthesis and the methods for their use |
| US5283173A (en) | 1990-01-24 | 1994-02-01 | The Research Foundation Of State University Of New York | System to detect protein-protein interactions |
| US5639949A (en) | 1990-08-20 | 1997-06-17 | Ciba-Geigy Corporation | Genes for the synthesis of antipathogenic substances |
| US5712146A (en) | 1993-09-20 | 1998-01-27 | The Leland Stanford Junior University | Recombinant combinatorial genetic library for the production of novel polyketides |
| US5672491A (en) | 1993-09-20 | 1997-09-30 | The Leland Stanford Junior University | Recombinant production of novel polyketides |
| EP0725778B1 (en) | 1993-09-20 | 2001-09-26 | The Leland Stanford Junior University | Recombinant production of novel polyketides |
| GB9319722D0 (en) | 1993-09-24 | 1993-11-10 | John Innes Foundation | Plant genetic manipulation |
| US5716849A (en) | 1994-06-08 | 1998-02-10 | Novartis Finance Corporation | Genes for the biosynthesis of soraphen |
| JP4709333B2 (ja) * | 1995-10-13 | 2011-06-22 | プレジデント・アンド・フエローズ・オブ・ハーバード・カレツジ | ホスホパンテテイニルトランスフェラーゼおよびその使用 |
| CA2197524A1 (en) | 1996-02-22 | 1997-08-22 | Bradley Stuart Dehoff | Polyketide synthase genes |
| NZ333861A (en) | 1996-07-05 | 2000-08-25 | Pfizer | Erythromycins and preparation from unnatural starter units in microorganisms |
| WO1998010546A2 (en) | 1996-09-02 | 1998-03-12 | Telia Ab (Publ) | Improvements in, or relating to, multi-carrier transmission systems |
| US6033883A (en) | 1996-12-18 | 2000-03-07 | Kosan Biosciences, Inc. | Production of polyketides in bacteria and yeast |
| US6140486A (en) | 1997-06-04 | 2000-10-31 | Calgene Llc | Production of polyunsaturated fatty acids by expression of polyketide-like synthesis genes in plants |
-
1998
- 1998-07-10 CA CA002294616A patent/CA2294616A1/en not_active Abandoned
- 1998-07-10 NZ NZ501998A patent/NZ501998A/en unknown
- 1998-07-10 IL IL13371698A patent/IL133716A0/xx unknown
- 1998-07-10 US US09/114,083 patent/US6262340B1/en not_active Expired - Lifetime
- 1998-07-10 EP EP98934536A patent/EP1007689A2/en not_active Withdrawn
- 1998-07-10 KR KR1020007000041A patent/KR100540287B1/ko not_active IP Right Cessation
- 1998-07-10 AU AU84033/98A patent/AU744751C/en not_active Ceased
- 1998-07-10 CN CNB988070812A patent/CN1188520C/zh not_active Expired - Fee Related
- 1998-07-10 WO PCT/US1998/014570 patent/WO1999002669A2/en not_active Application Discontinuation
- 1998-07-10 JP JP2000502167A patent/JP2001509379A/ja active Pending
-
2001
- 2001-05-01 US US09/847,089 patent/US20020002712A1/en not_active Abandoned
Also Published As
| Publication number | Publication date |
|---|---|
| KR100540287B1 (ko) | 2006-01-10 |
| EP1007689A2 (en) | 2000-06-14 |
| JP2001509379A (ja) | 2001-07-24 |
| AU744751B2 (en) | 2002-02-28 |
| AU744751C (en) | 2005-11-24 |
| NZ501998A (en) | 2001-04-27 |
| KR20010021509A (ko) | 2001-03-15 |
| US6262340B1 (en) | 2001-07-17 |
| CN1263557A (zh) | 2000-08-16 |
| CA2294616A1 (en) | 1999-01-21 |
| AU8403398A (en) | 1999-02-08 |
| WO1999002669A3 (en) | 1999-04-01 |
| WO1999002669A2 (en) | 1999-01-21 |
| US20020002712A1 (en) | 2002-01-03 |
| IL133716A0 (en) | 2001-04-30 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US9752130B2 (en) | Chalcone synthase dihyrdoflavonol 4-reductase and leucoanthocyanidine reductase from clover, medic ryegrass or fescue | |
| AU741197B2 (en) | Plant cellulose synthase and promoter sequences | |
| US8569064B2 (en) | Manipulation of flavonoid biosynthesis in plants | |
| JP4755109B2 (ja) | 飽和脂肪酸のレベルが低減されたトランスジェニック植物およびその製造方法 | |
| CN1188520C (zh) | 在植物中生产聚酮化合物 | |
| JPH09505739A (ja) | 脂肪アシル−CoA代謝に関与する植物細胞質タンパク質をコードする核酸配列 | |
| AU2002333038A1 (en) | Manipulation of flavonoid biosynthesis in plants | |
| CN1117867C (zh) | Dna序列及其用途 | |
| WO2011010485A1 (ja) | エイコサノイド生産方法、並びにゼニゴケ由来のエイコサノイド生合成系遺伝子及びその利用 | |
| AU2013202734B2 (en) | Manipulation of flavonoid biosynthesis in plants (4) | |
| AU2008201994B2 (en) | Manipulation of flavonoid biosynthesis in plants (2) | |
| MXPA00000404A (en) | Production of polyketides in plants | |
| AU2012227243A1 (en) | Manipulation of flavonoid biosynthesis in plants (3) |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| C14 | Grant of patent or utility model | ||
| GR01 | Patent grant | ||
| C19 | Lapse of patent right due to non-payment of the annual fee | ||
| CF01 | Termination of patent right due to non-payment of annual fee |