CN116082457A - 蛋白化合物及其用途 - Google Patents
蛋白化合物及其用途 Download PDFInfo
- Publication number
- CN116082457A CN116082457A CN202211550292.7A CN202211550292A CN116082457A CN 116082457 A CN116082457 A CN 116082457A CN 202211550292 A CN202211550292 A CN 202211550292A CN 116082457 A CN116082457 A CN 116082457A
- Authority
- CN
- China
- Prior art keywords
- amino acid
- protein molecule
- pkc
- absent
- acid residues
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K7/00—Peptides having 5 to 20 amino acids in a fully defined sequence; Derivatives thereof
- C07K7/04—Linear peptides containing only normal peptide links
- C07K7/08—Linear peptides containing only normal peptide links having 12 to 20 amino acids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/43—Enzymes; Proenzymes; Derivatives thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/10—Transferases (2.)
- C12N9/12—Transferases (2.) transferring phosphorus containing groups, e.g. kinases (2.7)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y207/00—Transferases transferring phosphorus-containing groups (2.7)
- C12Y207/11—Protein-serine/threonine kinases (2.7.11)
- C12Y207/11013—Protein kinase C (2.7.11.13)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
Abstract
本申请涉及蛋白化合物及其用途。本发明公开了蛋白分子及其在涉及PKC‑θ过表达的状况中的用途,例如癌症。更具体地,本发明公开了蛋白分子及其用于改变PKC‑θ过表达细胞的(i)形成、(ii)增殖、(iii)维持、(iv)上皮细胞向间充质细胞转化或者(v)间充质细胞向上皮细胞转化中的至少一种。
Description
本申请是申请日为2017年02月01日,申请号为201780021694.9,发明名称为“蛋白化合物及其用途”的申请的分案申请。
本申请要求2016年2月1日提交的名称为“蛋白化合物及其用途”
(Proteinaceous Compounds and Uses Therefor)的澳大利亚临时申请号2016900314的优先权,其内容通过引用整体并入本文。
发明领域
本发明涉及蛋白分子及其在涉及PKC-θ过表达的状况,例如癌症中的用途。更具体地,本发明涉及蛋白分子及其用于改变PKC-θ过表达细胞的(i)形成、(ii)增殖、(iii)维持、(iv)上皮细胞向间充质细胞转化或者(v)间充质细胞向上皮细胞转化中的至少一种。
发明背景
本说明书中对任何现有出版物(或从其获得的信息)或任何已知的事物的引用,不是且也不应被视为认可或承认或任何形式的这样的暗示:该先前出版物(或从其获得的信息)或已知事物形成本说明书涉及领域中的公知常识的一部分。
蛋白激酶C(PKCs)是一类激酶家族,其使许多蛋白质上丝氨酸残基和苏氨酸残基发生磷酸化,从而调控很多细胞反应。存在11种亚型,它们可以细分为:经典亚型,包括二酰基甘油依赖性和钙依赖性的PKC-α、PKC-βI、PKC-βII和PKC-γ;新型亚型,包括二酰基甘油依赖性的PKC-δ、PKC-ε、PKC-η和PKC-θ;和非经典型亚型,包括二酰基甘油非依赖性和钙非依赖性的PKC-λ、PKC-ι和PKC-ζ。
近年来,PKC-θ亚型越来越被认为是各种状况的有希望的治疗靶标。PKC-θ通过控制T细胞功能而在免疫系统的功能中起主要作用。PKC-θ从细胞质易位到细胞核,在细胞核影响在T细胞中有效免疫应答所必需的诱导型免疫应答基因转录和微小RNA。已证实PKC-θ的失调参与炎性状况、肿瘤进展和转移。PKC-θ活性也已证实参与各种神经、血管和呼吸道紊乱。最近,PKC-θ失调与侵袭性乳腺癌有关,且PKC-θ已证实在诱导上皮细胞向间充质细胞转化(EMT)和乳腺癌干细胞(CSC)的形成中起作用(Zafar等人(2014)Mol Cell Biol,34(36):2961-2980;Lim等人(2015)Immunology,146:508-522)。
由于PKC-θ参与炎性状况和肿瘤形成和进展,PKC-θ是有希望的治疗靶标。虽然有几种PKC-θ抑制剂正在开发中,特别是目前正在进行银屑病和器官移植试验的sotrastaurin,但相对于其他PKC酶,这些抑制剂通常缺乏对PKC-θ的选择性。由于PKC酶介导的大量细胞反应,非常需要选择性PKC-θ抑制(Lim等人(2015)Immunology,146:508-522;Manicassamy(2009)Curr Opin Investig Drugs,10(11):1225-1235)。
因此,需要抑制PKC-θ的新型治疗剂,其可以用于与PKC-θ过表达相关的状况,例如癌症。
发明内容
本发明部分基于以下发现:基于PKC-θ多肽的子序列和结构相关分子的蛋白分子抑制PKC-θ活性,包括PKC-θ易位入细胞核中。这些分子还被证实在抑制EMT、抑制CSC和非CSC肿瘤细胞的形成和维持以及诱导间充质细胞向上皮细胞转化(MET)方面具有显著活性,因此这使它们用于治疗一系列与PKC-θ过度表达相关的状况,例如癌症。
在本发明的一个方面,提供一种改变PKC-θ过表达细胞的(i)形成、(ii)增殖、(iii)维持、(iv)上皮细胞向间充质细胞转化或者(v)间充质细胞向上皮细胞转化中至少一种的方法,所述方法包括使所述PKC-θ过表达细胞与由式I表示的分离或纯化的蛋白分子接触:
Z1X1X2X3X4IDX5PPX6X7X8X9X10X11Z2(I)
其中,
“Z1”和“Z2”独立地不存在,或者独立地选自蛋白部分和保护部分的至少一种,所述蛋白部分包含约1个至约50个氨基酸残基(及其间的所有整数氨基酸残基);
“X1”不存在,或者选自包括R、K及其修饰形式的碱性氨基酸残基;
“X2”和“X3”独立地选自包括R、K及其修饰形式的碱性氨基酸残基;
“X4”选自包括R、K、D、E及其修饰形式的带电荷氨基酸残基;
“X5”不存在,或者是W或其修饰形式;
“X6”选自包括F、Y、W、R、K及其修饰形式的芳香族氨基酸残基或碱性氨基酸残基;
“X7”选自包括R、K及其修饰形式的碱性氨基酸残基;
“X8”不存在,或者是P或其修饰形式;
“X9”选自包括R、K及其修饰形式的碱性氨基酸残基;
“X10”选自包括V、L、I、M及其修饰形式的疏水性残基和P及其修饰形式;
“X11”选自包括R、K及其修饰形式的碱性氨基酸残基。
在本发明的另一个方面,提供一种治疗或预防受试者癌症的方法,其中所述癌症含有至少一种PKC-θ过表达细胞,该方法包括向受试者施用如上述定义并由式I表示的分离或纯化的蛋白分子。
在本发明的再一个方面,提供一种由式I表示的分离或纯化的蛋白分子:
Z1X1X2X3X4IDX5PPX6X7X8X9X10X11Z2(I)
其中,
“Z1”和“Z2”独立地不存在,或者独立地选自蛋白部分和保护部分的至少一种,所述蛋白部分包含约1个至约50个氨基酸残基(及其间的所有整数氨基酸残基);
“X1”不存在,或者选自包括R、K及其修饰形式的碱性氨基酸残基;
“X2”和“X3”独立地选自包括R、K及其修饰形式的碱性氨基酸残基;
“X4”选自包括R、K、D、E及其修饰形式的带电荷氨基酸残基;
“X5”不存在,或者是W或其修饰形式;
“X6”选自包括F、Y、W、R、K及其修饰形式的芳香族氨基酸残基或碱性氨基酸残基;
“X7”选自包括R、K及其修饰形式的碱性氨基酸残基;
“X8”不存在,或者是P或其修饰形式;
“X9”选自包括R、K及其修饰形式的碱性氨基酸残基;
“X10”选自包括V、L、I、M及其修饰形式的疏水性残基和P及其修饰形式;
“X11”选自包括R、K及其修饰形式的碱性氨基酸残基;
其中,所述蛋白分子不是由SEQ ID NO:1的氨基酸序列组成的蛋白分子:
RKEIDPPFRPKVK[SEQ ID NO:1]。
附图简述
图1importinib肽对PKC-θ核易位的影响。(A)表示用importinib肽处理的MCF7细胞的免疫荧光显微照片;(B)人乳腺MCF7-IM模型中,相对于对照ST(受刺激)样品,impotinib肽对PKC-θ抑制的百分比,使用ImageJ软件基于平均密度大于50个细胞进行计算(与ST相比,importinib4759和importinib4759_O1的p值≤0.0001);(C)和(D)表示免疫荧光显微照片(左)和Fn/c(核与细胞质荧光强度的比率;右)的图,显示importinib4759_O1处理对PKC-θ、PKC-β2、PKC-α、Imp 8和Impα2定位的影响。-表示受刺激对照;+表示用importinib4759_O1预处理的受刺激样品。****=p值≤0.0001、ns=p值≥0.05。
图2importinib肽对MCF-IM模型中CD44高CD24低癌症干细胞形成的影响。(A)表示importinib肽处理后的MCF-IM细胞的FACS图,其由前向角散射和侧向角散射进行门控,然后是Hoechst阴性群体(活细胞);(B)相对于对照ST(受刺激)样品,importinib肽对CD44高CD24低(CSC)抑制的百分比(与ST相比,importinib4759和importinib4759_O1的p值为0.0079)。
图3importinib肽对MDA-MB-231模型中CD44高CD24低癌症干细胞形成的影响。(A)表示importinib4759处理后MDA-MB-231细胞的FACS图,其由前向角散射和侧向角散射进行门控,然后是Hoechst阴性群体(活细胞);(B)相对于对照ST(受刺激)样品,importinib肽对CD44高CD24低(CSC)抑制的百分比(与ST相比,importinib4759和importinib4759_O1的p值<0.0001);(C)表示在MCF7或MDA-MB-231细胞中importinib4759_O1处理后的活细胞群。
图4importinib4759_O1对转录因子NF-κB p65和p53的核转位以及肿瘤抑制蛋白如Rb的影响。(A)表示用importinib4759_O1处理的MCF7细胞的免疫荧光显微照片和Fn/c的图。-表示受刺激对照;+表示用importinib4759_O1预处理的受刺激样品。与对照相比,Importinib4759_O1与p65相关的p值为0.0033,与Rb相关的p值为0.0007,以及与p53相关的p值为0.0009。****=p值≤0.0001、***=p值≤0.001、**=p值≤0.01、*=p值≤0.05、ns=p值≥0.05。
图5靶向其他PKC亚型的肽抑制剂靶对PKC-θ核易位的影响。(A)表示用靶向PKC-β1、PKC-δ和PKC-ε的肽抑制剂处理细胞的免疫荧光显微照片和Fn/c的图,其中ST表示受刺激样品。
图6是随时间推移的线形图,显示了importinib4759和多烯紫杉醇(Docetaxel)对Balb/c裸鼠MDA-MB-231异种移植乳腺癌模型中肿瘤体积的影响(数据以平均值±±SE表示)。Importinib4759的总体p值为0.003。
图7是柱状图,显示了importinib4759和多烯紫杉醇对Balb/c裸鼠MDA-MB-231异种移植乳腺癌模型中癌症干细胞(CD44高CD24低)比例的影响(数据以平均值±SE表示)。Importinib4759的总体p值为0.0317。
图8是随时间推移的线形图,显示了importinib4759_O1和多烯紫杉醇对Balb/c裸鼠MDA-MB-231异种移植乳腺癌模型中肿瘤体积的影响(数据以平均值±SE表示)。Importinib4759_O1的总体p值为0.0079。
图9是柱状图,显示了importinib4759_O1和多烯紫杉醇对Balb/c裸鼠MDA-MB-231异种移植乳腺癌模型中癌症干细胞(CD44高CD24低)比例的影响(数据以平均值±SE表示)。Importinib4759_O1的总体p值为0.0286。
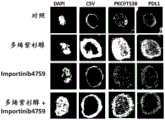
图10表示共聚焦显微照片,显示了在来源于Balb/c裸鼠MDA-MB-231异种移植乳腺癌模型的细胞中,importinib4759和多烯紫杉醇对癌症干细胞标志物(CSV、LSD1p和PDL1)表达的影响。
图11显示了在来源于Balb/c裸鼠MDA-MB-231异种移植乳腺癌模型的细胞中,importinib4759和多烯紫杉醇对癌症干细胞标志物(CSV、LSD1p和PDL1)的核(TNFI)和细胞质(TCFI)表达的影响(n≥20个单个细胞;数据以平均值±SE表示)。****=p值≤0.0001、***=p值≤0.001、**=p值≤0.01、*=p值≤0.05、ns=p值≥0.05。
图12表示共聚焦显微照片,显示了在来源于Balb/c裸鼠MDA-MB-231异种移植乳腺癌模型的细胞中,importinib4759和多烯紫杉醇对癌症干细胞标志物(CSV、PKC-θ和PDL1)表达的影响。
图13显示了在来源于Balb/c裸鼠MDA-MB-231异种移植乳腺癌模型的细胞中,importinib4759和多烯紫杉醇对癌症干细胞标志物(CSV、PKC-θ和PDL1)的核(TNFI)和细胞质(TCFI)表达的影响(n≥20个单个细胞;数据以平均值±SE表示)。****=p值≤0.0001、***=p值≤0.001、**=p值≤0.01、*=p值≤0.05、ns=p值≥0.05。
图14表示共聚焦显微照片,显示了在来源于Balb/c裸鼠MDA-MB-231异种移植乳腺癌模型的细胞中,importinib4759和多烯紫杉醇对CAF标志物(FAP、LSD1和CCL2)表达的影响。
图15显示了在来源于Balb/c裸鼠MDA-MB-231异种移植乳腺癌模型的细胞中,importinib4759和多烯紫杉醇对CAF标志物(FAP、L SD1和CCL2)的核(TNFI)和细胞质(TCFI)表达的影响(n≥20个单个细胞;数据以平均值±SE表示)。****=p值≤0.0001、***=p值≤0.001、**=p值≤0.01、*=p值≤0.05、ns=p值≥0.05。
图16表示共聚焦显微照片,显示了在来源于Balb/c裸鼠MDA-MB-231异种移植乳腺癌模型的细胞中,importinib4759和多烯紫杉醇对M1巨噬细胞标志物(LSD1p、CCR7和CD38)表达的影响。
图17显示了在来源于Balb/c裸鼠MDA-MB-231异种移植乳腺癌模型的细胞中,importinib4759和多烯紫杉醇对M1巨噬细胞标志物(LSD1p、CCR7和CD38)的核(TNFI)和细胞质(TCFI)表达的影响(n≥20个单个细胞;数据以平均值±SE表示)。****=p值≤0.0001、***=p值≤0.001、**=p值≤0.01、*=p值≤0.05、ns=p值≥0.05。
发明详细说明
1.定义
除非另有定义,否则本文所使用的全部技术和科学术语具有与本发明所属领域普通技术人员通常所理解的相同的含义。虽然类似于或等效于本文中所述方法和材料的任何方法和材料可以用于实践或测试本发明,但是仅描述了优选的方法和材料。出于本发明的目的,以下术语定义如下。
本文使用的冠词“一(‘a’和‘an’)”是指一个/种或多于一个/种(即至少一个/种)的所述冠词的语法对象。举例来说,“要素”是指一个/种或多于一个/种要素。
“约”意味着数量、水平、数值、数目、频率、百分比、尺寸、大小,用量、重量或长度相对于参考数量、水平、数值、数目、频率、百分比、尺寸、大小,用量、重量或长度,以15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2%或1%程度变化。
术语“同时施用(administration concurrently)”,“同时施用(administeringconcurrently)”或“同时施用了((administered concurrently))”等是指施用含有两种或更多种活性成分的单一组合物,或者将每种活性成分作为单独的组合物施用和/或通过单独途径递送每种活性成分,其为同步或同时或在足够短的时间段内连续施用,该足够短的时间段使得有效结果等同于当所有这些活性成分作为单一组合物施用时所获得的有效结果。“同时”意味着在实质上相同的时间施用活性剂,并且理想地在同一制剂中一起施用。“同步”意味着在紧接的时间施用活性剂,例如在施用一种活性剂之前或之后约一分钟至约一天内施用另一种活性剂。任何同步的时间均可以使用。然而,通常情况是,当不同时施用时,所述活性剂会在约1分钟内至约8小时内施用,优地在少于约1小时至约4小时内施用。当同步施用时,所述活性剂适合在受试者的相同部位施用。术语“相同部位”包括准确的位置,但也可以是在约0.5cm至约15cm内,优选在约0.5cm至约5cm内。
本文所用的术语“和/或”是指并包括了任何以及所有可能的一种或更多种相关所列项目的组合,并且当在可选情况下解释(“或”)时缺少组合。
术语“癌症干细胞”(CSC)是指具有肿瘤起始和肿瘤维持能力的细胞,所述能力包括广泛增殖能力、形成新肿瘤和维持癌症发展的能力,即具有推动肿瘤的形成和生长的无限增殖潜能的细胞。CSC在生物学上与大多数肿瘤细胞不同,其具有与干细胞相关的特征,特别是在特定癌症样品中发现具有自我更新和繁殖以及产生所有细胞类型的能力。术语“癌症干细胞”(CSC)包括干细胞(SC)中基因改变和成为CSC的细胞中的基因改变。在具体的实施方案中,CSC是乳腺CSC,其符合CD24+CD44+,示例性例子包括CD44高CD24低。
在整个说明书和权利要求中,除非上下文另有要求,否则词语“包括/包含(comprise)”及变形如“包括/包含(comprises)”和“包括/包含(comprising)”将被理解为暗示包括所述整数或步骤或者整数或步骤的组,但不排除任何其他整数或步骤或者整数或步骤的组。因此,使用术语“包括/包含(comprising)”等表示所列整数是必需或强制的,而其他整数是任选的且可以存在或不存在。“由…组成”意味着包括且限于短语“由…组成”中所描述的内容。因此,短语“由…组成”表示所列要素是必需或强制的,并且不可以存在其他元素。“基本上由…组成”意味着包括短语中所列任何要素,并且限于对本公开内容中对所列要素指定的活性或作用不干扰或无贡献的其他要素。因此,短语“基本上由…组成”表示所列要素是必需或强制的,但其他要素是任选的且可以存在或不存在,这取决于它们是否影响所列要素的活性或作用。在具体的实施方案中,术语“基本上由…组成”在本文公开的特定氨基酸序列的上下文中,其范围包括特定氨基酸序列上游的约1个至约50个任选氨基酸(及其间所有整数个的任选氨基酸)和/或特定氨基酸序列下游的约1个至约50个任选氨基酸(及其间所有整数个的任选氨基酸)。
本文所用的术语“剂量单位形式”是指适合作为待治疗的受试者的单位剂量的物理上分散的单位,每个单位含有经计算的预定量的活性物质,与所需药学上可接受的媒介物(vehicle)结合以产生所需治疗效果。
本文所用的与PKC-θ相关的术语“酶活性”是指蛋白质上丝氨酸残基和/或苏氨酸残基的磷酸化。
本文所用的术语“上皮向间充质转化”(EMT)是指从上皮细胞向间充质表型的转变,其是胚胎发育的正常过程。EMT也是作为离子和液体转运体转的损伤上皮细胞变为基质重塑性间充质细胞的过程,在癌中,这种转化通常导致细胞形态学上发生改变,间充质蛋白表达和侵袭性增强。在体外定义EMT的标准包括上皮细胞极性消失,分离成单个细胞和随后在获得细胞运动性后分散(参见Vincent-Salomon和Thiery,Breast Cancer Res.2003;5(2):101-6)。在EMT期间表达、分布和/或功能发生变化以及因此被牵涉的分子种类,包括生长因子(例如转化生长因子(TGF)-β、wnts)、转录因子(例如SNAI、SMAD、LEF和核β-catenin)、细胞间粘附轴的分子(钙粘素、连接素(catenins))、细胞骨架调节剂(Rho家族)和细胞外蛋白酶(基质金属蛋白酶、纤溶酶原激活剂)(参见Thompson和Newgreen,CancerRes.2005;65(14):5991-5)。
本文所用的术语“上皮”是指身体的内表面和外表面的覆盖层,包括血管和其他小腔的内衬。其由上皮细胞集合而成,形成比较薄的片或层,这是由于组成细胞在侧面通过细胞间连接而形成相互广泛的粘附。该层是极性的并且具有顶侧和基底侧。尽管上皮细胞组织严密,但上皮确实具有一定的可塑性,切上皮层中的细胞可以改变形状,例如从扁平变为柱状或在一端收缩并在另一端扩张。然而,这些往往发生在细胞群体中而不是个体地发生。(参见Thompson和Newgreen,Cancer Res.2005;65(14):5991-5)。
术语“表达”是指基因产物的生物合成。例如,在编码序列的情况下,表达涉及将编码序列转录成mRNA并将mRNA翻译成一个或更多个多肽。相反,非编码序列的表达仅涉及将非编码序列转录成转录物。术语“表达”在本文中还用于指在特定位置存在蛋白或分子,因此可以与“定位”互换使用。
术语“宿主细胞”包括单个细胞或细胞培养物,其可以是或已经是本发明的任何重组载体或分离的多核苷酸的受体。宿主细胞包括单个宿主细胞的后代,并且由于自然突变、偶然突变或目的性突变和/或改变,后代可能不一定与原代亲本细胞完全相同(在形态学上或在总DNA互补物中)。宿主细胞包括用本发明的重组载体或多核苷酸在体内或体外转染或感染的细胞。包含本发明重组载体的宿主细胞是重组宿主细胞。
本文所用的术语“分离”是指实质上或基本上不含在其天然状态下通常所伴有的组分的物质。例如,“分离的蛋白分子”是指蛋白分子从其天然细胞环境中以及与细胞的其他组分的缔合状态体外分离和/或纯化。“实质上不含”是指蛋白分子制品(preparation)为至少10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%纯。在一个优选的实施方案中,蛋白分子制品具有少于约30%、25%、20%、15%、10%、9%、8%、7%、6%、5%、4%、3%、2%或1%(按干重计)的不是本发明的主题分子(在本文中也称为“污染分子”)。当重组产生蛋白分子时,还希望实质上不含培养基,即培养基占小于约20%、15%、10%、5%、4%、3%、2%或1%的制品体积。本发明包括以其干重计至少0.01mg、0.1mg、1.0mg和10mg的分离或纯化的制品。
本文所用的术语“间充质向上皮转化”(MET)是可逆的生物学过程,其涉及从运动的、多极性的或纺锤形的间充质细胞转化为称为上皮细胞的平面的极化细胞阵列。MET是EMT的逆过程。MET发生在正常发育、癌症转移和诱导多能干细胞重编程中。
本文所用的术语“间充质”是指胚胎中胚层的一部分,由生长于凝胶状基质中松散排列的非特化细胞组成,这些细胞发育成结缔组织、骨、软骨以及循环系统和淋巴系统。间充质形成相对弥散组织网络的细胞的集合。间充质不是完整的细胞层,并且细胞通常仅在其表面上具有与其相邻细胞粘附的粘附点。这些粘附也可能涉及钙粘蛋白结合(参见Thompson和Newgreen,Cancer Res.2005;65(14):5991-5)。
本文所用的术语“过表达(overexpress)”、“过表达(overexpression)”、“过表达(overexpressing)”可互换地指与正常细胞相比通常在癌细胞中以可检测的更高水平转录或翻译的基因(例如PKC-θ基因)。因此,过表达是指蛋白和RNA的过度表达(由于转录、转录后加工、翻译、翻译后加工增加、稳定性改变和蛋白降解改变),以及蛋白运输方式(核定位增加)改变导致的局部过表达和增强的功能活性例如酶水解底物增加。与正常细胞或对比细胞(例如乳腺细胞)相比,过表达也可以是高10%、20%、30%、40%、50%、60%、70%、80%、90%或更多。
本文所用的术语“可操作地连接”是指将结构基因置于包括但不限于启动子的调节元件的调节控制之下,从而控制基因的转录和任选的翻译。在异源启动子/结构基因组合的构建中,通常优选将基因序列或启动子放置在离距基因转录起始位点一定距离处,该距离与在天然环境中该基因序列或启动子与其控制的基因之间的距离大致相同,所述天然环境即为该基因序列或启动子所来源的基因。本领域中已知该距离可允许一些变化而不会使功能丧失。同样地,调节序列元件相对于将置于其控制下的异源基因的优选定位,按照该元件在其天然环境中的定位而定,所述天然环境即为其所来源的基因。
本文所用的术语“PKC-θ抑制剂”及其语法变形是指降低或抑制PKC-θ的至少一种功能或生物活性的分子。例如,PKC-θ抑制剂可以抑制或减少PKC-θ核易位,可以抑制或减少PKC-θ的酶活性和/或可以抑制或减少PKC-θ的表达。在一些实施方案中,术语“PKC-θ抑制剂”是指抑制PKC-θ核易位的分子。
本文所用的术语“PKC-θ过表达细胞”是指比正常细胞以可检测的更高水平表达PKC-θ的脊椎动物细胞,特别是哺乳动物或禽类细胞,尤其是哺乳动物细胞。细胞可以是脊椎动物细胞,如灵长类动物细胞、禽类细胞;家畜动物细胞,如绵羊细胞、牛细胞、马细胞,鹿细胞、驴细胞和猪细胞;实验室试验动物细胞,如兔细胞、小鼠细胞、大鼠细胞、豚鼠细胞和仓鼠细胞;伴侣动物细胞,如猫细胞和狗细胞;以及圈养的野生动物细胞,如狐狸细胞、鹿细胞和野犬细胞。在具体的实施方案中,PKC-θ过表达细胞是人细胞。在具体的实施方案中,PKC-θ过表达细胞是癌症干细胞肿瘤细胞或非癌症干细胞肿瘤细胞;优选癌症干细胞肿瘤细胞。与正常细胞或对比细胞(例如,乳腺细胞)相比,过表达也可以是高10%、20%、30%、40%、50%、60%、70%、80%、90%或更多。
本文所用的术语“多肽”,“蛋白分子”,“肽”和“蛋白”可以互换使用,指氨基酸残基的聚合物及其变体和合成类似物。因此,这些术语适用于其中一个或更多个氨基酸残基是合成的非天然存在氨基酸的氨基酸聚合物如相应天然存在氨基酸的化学类似物,以及天然存在氨基酸聚合物。这些术语不排除修饰,例如糖基化、乙酰化、磷酸化等。目的蛋白分子的可溶形式特别有用。在此定义范围内包括例如含有一个或更多个氨基酸类似物的多肽,所述氨基酸包括例如具有替代连接的非天然氨基酸或多肽。
本文所用的术语“选择性”及其语法变形是指分子抑制PKC-θ但实质上不抑制一种或更多种其他的PKC酶或亚型的功能,如PKC-α、PKC-β、PKC-γ、PKC-δ、PKC-ε、PKC-ζ、PKC-η、PKC-λ、PKC-μ或PKC-ν。通常,相对于抑制一种或更多种其他PKC酶(即除了PKC-θ以外的PKC,如PKC-α、PKC-β、PKC-γ、PKC-δ、PKC-ε、PKC-ζ、PKC-η、PKC-λ、PKC-μ或PKC-ν),对PKC-θ具有选择性的分子表现出高约2倍、5倍、10倍、20倍、50倍或高约100倍的PKC-θ选择性。在其他实施方案中,选择性分子显示出对PKC-θ的抑制比对一种或更多种其他PKC酶的抑制至少高50倍。在进一步的实施方案中,选择性分子显示出对PKC-θ的抑制比对一种或更多种其他PKC酶的抑制至少高100倍。在更进一步的实施方案中,选择性分子显示出对PKC-θ的抑制比对一种或更多种其他PKC酶的抑制至少高500倍。在再进一步的实施方案中,选择性分子显示出对PKC-θ的抑制比对一种或更多种其他PKC酶的抑制至少高100倍。
本文所用的术语“盐”和“前药”包括在施用至接受者时能够(直接或间接)提供本发明的蛋白分子,或其活性代谢物或残余物的任何药学上可接受的盐、酯、水合物或任何其他化合物。合适的药学上可接受的盐包括药学上可接受的无机酸的盐,例如盐酸、硫酸、磷酸、硝酸、碳酸、硼酸、氨基磺酸和氢溴酸,或者药学上可接受的有机酸的盐,例如乙酸、丙酸、丁酸、酒石酸、马来酸、羟基马来酸、富马酸、柠檬酸、乳酸、粘酸、葡萄糖酸、苯甲酸、琥珀酸、草酸、苯乙酸、甲磺酸、甲苯磺酸、苯磺酸、水杨酸、磺胺酸、天冬氨酸、谷氨酸、依地酸、硬脂酸、棕榈酸、油酸、月桂酸、泛酸、鞣酸,抗坏血酸和戊酸。碱式盐包括但不限于与药学上可接受的阳离子形成的碱式盐,例如钠、钾、锂、钙、镁、铵和烷基铵。另外,碱性含氮基团可以使用如下的剂季铵化:低级烷基卤化物如甲基、乙基、丙基和丁基的氯化物、溴化物和碘化物等;硫酸二烃基酯如硫酸二甲酯和硫酸二乙酯;以及其他。然而,应当理解的是,非药学上可接受的盐也属于本发明的范围,因为它们可以用于制备药学上可接受的盐。盐和前药的制备可以通过本领域已知的方法进行。例如,金属盐可以通过本发明化合物与金属氢氧化物的反应来制备。酸式盐可以通过使适当的酸与本发明的蛋白分子反应来制备。
本文所用的术语“严格”是指杂交和洗涤期间的温度和离子强度条件,以及某些有机溶剂的存在或不存在。越是严格,则固定的靶核苷酸序列与洗涤后仍保持与靶杂交的标记探针多核苷酸序列之间的互补程度越高。术语“高严格”是指在只具有高频率互补碱基的核苷酸序列将会杂交的温度和离子条件。所需的严格性是核苷酸序列依赖性的并且取决于杂交期间存在的各种组分。通常,严格条件选择为在特定离子强度和pH下比特定序列的热溶解点(Tm值)低约10℃至20℃。Tm值是50%靶序列与互补探针杂交的温度(在确定的离子强度和pH下)。
本文所用的术语“受试者”是指需要治疗或预防的脊椎动物受试者,具体是哺乳动物或禽类受试者。合适的受试者包括但不限于灵长类动物;禽类;家畜如绵羊、牛、马、鹿、驴和猪;实验室试验动物,如兔、小鼠、大鼠、豚鼠和仓鼠;伴侣动物,如猫和狗;以及圈养的野生动物,如狐狸、鹿和野犬。特别是,受试者是人。但是,应当理解的是,上述术语并不意味着存在症状。
本文所用的术语“肿瘤”是指无论是恶性还是良性的任何赘生性细胞生长和增殖,以及所有的癌前细胞和组织及癌细胞和组织。术语“癌症”和“癌性”是指或描述哺乳动物中典型地以不受调节的细胞生长为部分特征的生理状况。本文所用的术语“癌症”是指非转移性和转移性癌症,包括早期癌症和晚期癌症。术语“癌前的”是指通常在癌症之前或发展成癌症的状况或生长。术语“非转移性”是指良性或保留在原发部位且未侵入除原发部位以外的淋巴或血管系统或组织的癌症。通常,非转移性癌症是0期、I期或II期癌症的任何癌症。“早期癌症”是指非侵袭性或非转移性或被分类为0期、I期或II期癌症的癌症。术语“晚期癌症”通常是指III期或IV期癌症,但也可指II期癌症或II期癌症的亚期。本领域技术人员应当理解的是,将II期癌症分类为早期癌症或晚期癌症取决于癌症的具体类型。癌症的示例性例子包括但不限于:乳腺癌、前列腺癌、卵巢癌、宫颈癌、胰腺癌、结肠直肠癌、肺癌、肝细胞癌、胃癌、肝癌、膀胱癌、尿道癌、甲状腺癌、肾癌、恶性上皮肿瘤、黑素瘤、脑癌、非小细胞肺癌、头颈部鳞状细胞癌、子宫内膜癌、多发性骨髓瘤、间皮瘤、直肠癌和食道癌。在一个示例性实施方案中,癌症是乳腺癌。
本文所用的术语“载体”是指多核苷酸分子,其适当地来自例如质粒,噬菌体、酵母或病毒的DNA分子,多核苷酸可以插入或克隆到其中。载体可以含有一个或更多个单一限制性位点,并且能够在包括靶细胞或其组织或者祖细胞或其组织的限定的宿主细胞中自主复制,或者可以与限定的宿主的基因组整合,使克隆的序列可被复制。因此,载体可以是自主复制的载体,即作为染色体外实体存在的载体,其复制不依赖于染色体的复制,例如线性或闭合环状质粒、染色体外因子、微型染色体或人工染色体。该载体可以包含任何确保自我复制的工具。可选地,载体可以是当被导入宿主细胞时可以整合在基因组中并与其整合进入的染色体一起进行复制的载体。载体系统可以包含单个载体或质粒,两个或多个载体或质粒,它们一起含有待导入宿主细胞基因组的总DNA,或转座子。载体的选择通常取决于载体与载体待导入的宿主细胞的相容性。在本发明中,载体优选是病毒或病毒来源的载体,其在真菌,细菌或动物细胞,优选哺乳动物细胞中可操作地起作用。这种载体可来自痘病毒、腺病毒或酵母。载体还可以包括选择标志物,例如可以用于选择合适转化体的抗生素抗性基因。这种抗性基因的例子是本领域技术人员已知的并且包括赋予抗生素卡那霉素和G418抗性的nptII基因和赋予抗生素潮霉素B抗性的hph基因。
除非另有特别说明,否则本文所述的每个实施方案被加以必要的改变以用于每个实施方案。
2.蛋白性的PKC-θ抑制剂
本发明部分基于确定抑制PKC-θ核转位的蛋白分子。这种蛋白分子抑制CSC和非CSC肿瘤细胞的形成和维持,抑制EMT并诱导CSC肿瘤细胞的MET。因此,本发明人认为本发明的蛋白分子可以用于治疗或预防癌症。
因此,在本发明的一个方面,提供一种由式I表示的分离或纯化的蛋白分子:
Z1X1X2X3X4IDX5PPX6X7X8X9X10X11Z2(I)
其中,
“Z1”和“Z2”独立地不存在,或者独立地选自蛋白部分和保护部分的至少一种,所述蛋白部分包含约1个至约50个氨基酸残基(及其间的所有整数氨基酸残基);
“X1”不存在,或者选自包括R、K及其修饰形式的碱性氨基酸残基;
“X2”和“X3”独立地选自包括R、K及其修饰形式的碱性氨基酸残基;
“X4”选自包括R、K、D、E及其修饰形式的带电荷氨基酸残基;
“X5”不存在,或者是W或其修饰形式;
“X6”选自包括F、Y、W、R、K及其修饰形式的芳香族氨基酸残基或碱性氨基酸残基;
“X7”选自包括R、K及其修饰形式的碱性氨基酸残基;
“X8”不存在,或者是P或其修饰形式;
“X9”选自包括R、K及其修饰形式的碱性氨基酸残基;
“X10”选自包括V、L、I、M及其修饰形式的疏水性残基和P及其修饰形式;
“X11”选自包括R、K及其修饰形式的碱性氨基酸残基。
在一些实施方案中,“X1”至“X11”选自以下一种或更多种的组合:
“X1”不存在,或者是R;
“X2”是R;
“X3”是K;
“X4”是E或R;
“X5”不存在,或者是W;
“X6”是F或R;
“X7”是R;
“X8”不存在,或者是P;
“X9”是K;
“X10”是V或P;以及
“X11”是K。
在一些实施方案中,“Z1”由10个、9个、8个、7个、6个、5个、4个、3个、2个或1个氨基酸残基组成。在一些实施方案中,“Z2”由10个、9个、8个、7个、6个、5个、4个、3个、2个或1个氨基酸残基组成。在一些实施方案中,“Z1”和“Z2”中的氨基酸残基选自任意氨基酸残基。
在一些实施方案中,“Z1”是由式II表示的蛋白分子:
X12X13X14X15X16(II)
其中,
“X12”不存在,或者是保护部分;
“X13”不存在,或者选自P和包括R、K及其修饰形式的碱性氨基酸残基;
“X14”不存在,或者选自P和包括R、K及其修饰形式的碱性氨基酸残基;
“X15”不存在,或者选自P和包括R、K及其修饰形式的碱性氨基酸残基;
“X16”不存在,或者选自P和包括R、K及其修饰形式的碱性氨基酸残基。
在一些实施方案中,“Z2”是由式III表示的蛋白分子:
X17X18X19X20(III)
其中,
“X17”不存在,或者选自任意氨基酸残基;
“X18”不存在,或者选自任意氨基酸残基;
“X19”不存在,或者选自任意氨基酸残基;
“X20”不存在,或者是保护部分。
在一些实施方案中,“Z1”和“Z2”不存在。
在具体的实施方案中,式I的蛋白分子包含SEQ ID NO:1或SEQ IDNO:2所示的氨基酸序列、由该氨基酸序列组成或者基本上由该氨基酸序列组成:
RKEIDPPFRPKVK[SEQ ID NO:1]
或
RRKRIDWPPRRKPK[SEQ ID NO:2]。
SEQ ID NO:1的蛋白分子在本文中也称为“importinib4759”,SEQ IDNO:2的蛋白分子在本文中也称为“importinib4759_O1”。
在一些实施方案中,式I的蛋白分子不是由SEQ ID NO:1的氨基酸序列组成的蛋白分子。
因此,在具体的实施方案中,式I的蛋白分子包含SEQ ID NO:2的氨基酸序列、由该氨基酸序列组成或者基本上由该氨基酸序列组成。
本发明还考虑了作为SEQ ID NO:1和/或2的变体的蛋白分子。这种“变体”蛋白分子包括通过以下方式从天然蛋白得到的蛋白:在天然蛋白的N末端和/或C末端缺失(所谓的截短)或添加一个或更多个氨基酸;在天然蛋白的一个或更多个位点缺失或添加一个或更多个氨基酸;或者在天然蛋白的一个或更多个位点取代一个或更多个氨基酸。
本发明包含的变体蛋白具有生物活性,即它们继续具有天然蛋白的所需生物活性。这些变体可以由例如遗传多态性或人工操作产生。
可以以各种方式改变SEQ ID NO:1和/或SEQ ID NO:2的蛋白分子,包括氨基酸取代、缺失、截短和插入。用于这种操作的方法通常是本领域已知的。例如,SEQ ID NO:1和/或SEQ ID NO:2的氨基酸序列变体可以通过使编码SEQ ID NO:1和/或SEQ ID NO:2氨基酸序列的核酸发生诱变来制备。用于发生诱变和核苷酸序列改变的方法在本领域是众所周知的。例如,参见Kunkel(1985,Proc.Natl.Acad.Sci.USA.82:488-492);Kunkel等人(1987,Methods in Enzymol,154:367-382);美国专利号4,873,192;Watson,J.D.等人(MolecularBiology of the Gene,第四版,Benjamin/Cummings,门洛帕克市,美国加利福尼亚州1987)及其中引用的参考文献。关于不影响所关注蛋白生物活性的适当氨基酸取代的指南可以在以下的模型中找到:Dayhoff等人(1978)Atlas of Protein Sequence and Structure(Natl.Biomed.Res.Found.,美国华盛顿哥伦比亚特区)。筛选通过点突变或截短构建的组合文库的的基因产物方法,以及从cDNA文库中筛选具有所选特性的基因产物的方法是本领域已知的。这些方法适用于快速筛选通过组合诱变SEQ ID NO:1和/或SEQ ID NO:2的蛋白分子产生的基因文库。递归集合诱变(REM)是一种提高文库中功能突变体的频率的技术,可以与筛选测定组合使用以确定活性变体(Arkin和Yourvan(1992)Proc.Natl.Acad.Sci.USA89:7811-7815;Delgrave等人(1993)Protein Engineering,6:327-331)。可能需要保守取代,例如将一种氨基酸与具有相似性质的另一种氨基酸交换,在下文中将更详细地讨论到。
与亲本(例如天然存在的或参考的)氨基酸序列,如SEQ ID NO:1和/或SEQ ID NO:2相比,本发明的变体或多肽可以在其序列的不同位置包含保守氨基酸取代。“保守氨基酸取代”是指氨基酸残基被具有相似侧链的氨基酸残基替换。如下文详细讨论的,本领域已经定义了具有相似侧链的氨基酸残基家族。
本发明蛋白分子的氨基酸序列根据某些特征或子类的氨基酸来定义。氨基酸残基通常被细分为如下的主要子类:
酸性:残基由于在生理pH下失去质子而带负电荷,并且当肽处于生理pH的水性介质中时,残基被水溶液吸引从而寻找包含该残基的肽的构象中的表面位置。具有酸性侧链的氨基酸包括谷氨酸和天冬氨酸。
碱性:残基由于在生理pH或其一个或两个pH单位之内(例如组氨酸)与质子结合而带正电荷,并且当肽处于生理PH的水性介质中时,残基被水溶液吸引从而寻找包含该残基的肽的构象中的表面位置。具有碱性侧链的氨基酸包括精氨酸、赖氨酸和组氨酸
带电荷:残基在生理pH下带电荷,因此包括具有酸性或碱性侧链的氨基酸,如谷氨酸、天冬氨酸、精氨酸、赖氨酸和组氨酸。
疏水性:残基在生理pH下不带电荷,并且当肽处于在生理pH的水性介质中时,残基被水溶液排斥从而寻找包含该残基的肽的构象中的内部位置。具有疏水性侧链的氨基酸包括酪氨酸、缬氨酸、异亮氨酸、亮氨酸、甲硫氨酸、苯丙氨酸和色氨酸。
中性/极性:残基在生理pH下不带电荷,但当肽处于在生理pH的水性介质中时,残基未被水溶液充分排斥从而它将寻找包含该残基的肽的构象中的内部位置。具有中性/极性侧链的氨基酸包括天冬酰胺、谷氨酰胺、半胱氨酸、组氨酸、丝氨酸和苏氨酸。
本说明书还将某些氨基酸描述为“小”,因为即使缺少极性基团,它们的侧链不够大,不能赋予疏水性。除了脯氨酸之外,“小”氨基酸是指当侧链上存在至少一个极性基团时具有四个或更少碳的氨基酸,而当侧链上无极性基团时具有三个或更少碳的氨基酸。具有小侧链的氨基酸包括甘氨酸、丝氨酸、丙氨酸和苏氨酸。基因编码的二级氨基酸脯氨酸是特殊情况,因为已知其对肽链的二级构象有影响。脯氨酸的结构与所有其它天然存在的氨基酸的不同之处在于其侧链与α-氨基的氮以及α-碳结合。但是,几个氨基酸相似性矩阵(例如,如由Dayhoff等人(1978)在A model of evolutionary change in proteins公开的PAM120矩阵和PAM250矩阵;在M.O.Dayhoff(编辑)的Atlas of protein sequence andstructure中的Matrices for determining distance relationships,第5卷,第345-358页,美国国家生物医学研究基金会,美国华盛顿哥伦比亚特区;以及由Gonnet等人(1992),Science,256(5062):1443-1445),将脯氨酸与甘氨酸、丝氨酸、丙氨酸和苏氨酸包括在相同的组中。因此,出于本发明的目的,脯氨酸被分类为“小”氨基酸。
分类为极性或非极性所需的吸引或排斥程度是任意的,因此本发明特别考虑的氨基酸已被分类为一类或另一类。大多数未特别命名的氨基酸可以基于已知的行为进行分类。
氨基酸残基可以进一步细分为环状或非环状及芳香族或非芳香族、根据残基的侧链取代基不言自明的分类,以及小或大。如果残基含有总共四个或更少的碳原子(包括羧基碳),只要存在另外极性取代基,则认为残基是小;如果不存在另外极性取代基则含有三个或更少的碳原子时认为是小。小氨基酸残基当然总是非芳香族的。取决于它们的结构特性,氨基酸残基可以分为两类或更多类。对于天然存在的蛋白氨基酸,根据该方案的子分类示于下表1中。
表:氨基酸子分类
保守性氨基酸取代还包括基于侧链的分组。例如,具有脂肪族侧链的一组氨基酸是甘氨酸、丙氨酸、缬氨酸、亮氨酸和异亮氨酸;具有脂肪族-羟基侧链的一组氨基酸是丝氨酸和苏氨酸;具有含酰胺侧链的一组氨基酸是天冬酰胺和谷氨酰胺;具有芳香族侧链的一组氨基酸是苯丙氨酸、酪氨酸和色氨酸;具有碱性侧链的一组氨基酸是赖氨酸、精氨酸和组氨酸;具有含硫侧链的一组氨基酸是半胱氨酸和甲硫氨酸。例如,可以合理地预期用异亮氨酸或缬氨酸替换亮氨酸,用谷氨酸替换天冬氨酸,用丝氨酸替换苏氨酸,或用结构相关的氨基酸替换氨基酸的类似替换将不会对本发明有用的所得肽变体的性质产生重要影响。氨基酸的变化是否导致抑制PKC-θ的蛋白分子,可以通过测定其活性来容易地确定。保守取代显示在表2中示例性取代和优选取代的标题下。属于本发明范围内的氨基酸取代通常是通过选择对维持(a)取代区域的肽骨架结构,(b)靶位点分子的电荷或疏水性或(c)侧链大小的效应没有显著差异的取代进行的。导入取代基之后,筛选变体的生物学活性。
表2:示例性和优选的氨基酸取代
或者,用于进行保守性取代的类似氨基酸可以基于侧链的一致性分为三类。第一组包括谷氨酸、天冬氨酸、精氨酸、赖氨酸、组氨酸,其均具有带电荷侧链;第二组包括甘氨酸、丝氨酸、苏氨酸、半胱氨酸、酪氨酸、谷氨酰胺、天冬酰胺;第三组包括亮氨酸、异亮氨酸、缬氨酸、丙氨酸、脯氨酸、苯丙氨酸、色氨酸、甲硫氨酸,如Zubay,Biochemistry,第三版,Wm.C.Brown Publishers(1993)。
因此,本发明肽中预测的非必需氨基酸残基通常被来自同一侧链家族的另一个氨基酸残基替换。可选地,可以沿着本发明肽的全部或部分编码序列随机导入突变,例如通过饱和诱变,所得突变体可以被如本文所述筛选亲本多肽的活性,以鉴定保留该活性的突变体。诱变编码序列后,可以重组表达编码肽并测定其活性。“非必需”氨基酸残基是可以从本发明实施方案肽的野生型序列中改变而不消除或不实质上改变其一种或更多种活性的残基。适宜地,这种改变不实质上改变这些活性之一,例如,活性至少是野生型的20%、40%、60%、70%或80%。与此相对,“必需”氨基酸残基是指这样的残基,当与本发明实施方案肽的野生型序列发生改变时,该残基导致亲本分子的活性消失,如存在的活性低于野生型活性的20%。例如,相对于从X1开始的式I编号,这种必需氨基酸残基包括第5位的Ile(或其修饰形式)、第6位的Asp(或其修饰形式)、第8位的Pro(或其修饰形式)和第9位的Pro(或其修饰形式)。
因此,本发明还考虑了本发明的SEQ ID NO:1和/或SEQ ID NO:2蛋白分子的变体,其中所述变体通过添加、缺失或取代一个或更多个氨基酸残基而与亲本序列相区别。一般而言,变体将显示与亲本或参照蛋白分子序列,例如SEQ ID NO:1或SEQ ID NO:2所示的至少约80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%的序列相似性,如由本文其他地方所述的序列比对程序使用默认参数确定的。理想地,变体将与亲本或参考肽序列,例如SEQ ID NO:1或SEQ IDNO:2所示的具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%的序列同一性,如通过本文所述的序列比对程序使用默认参数确定的。属于本发明的肽变体的范围内的importinib4759和importinib4759_O1变体与亲本分子相差通常为至少1个氨基酸残基,但少于5个、4个、3个、2个或1个氨基酸残基。在一些实施方案中,本发明的肽变体与SEQ ID NO:1或SEQ ID NO:2相应的序列相差为至少1个氨基酸残基,但少于5个、4个、3个、2个或1个氨基酸残基。在一些实施方案中,相对于从X1开始的式I的编号,本发明的肽变体的氨基酸序列包含第5位的Ile(或其修饰形式)、第6位的Asp(或其修饰形式)、第8位的Pro(或其修饰形式)和/或第9位的Pro(或其修饰形式)。在一些实施方案中,本发明的肽变体的氨基酸序列包含式I的蛋白分子。在具体的实施方案中,本发明的肽变体抑制PKC-θ核转位。
如果序列比较需要比对,则通常会比对序列以求最大的相似性或同一性。由于缺失或插入或错配的“成环”序列通常被认为是差异。差异合适地是在非必需残基或保守取代上的差异或变化。
在一些实施方案中,序列之间的序列相似性或序列同一性的计算如下进行:
为了确定两个氨基酸序列或两个核酸序列的同一性百分比,将序列进行比对以实现最佳比较目的(例如,可以在第一和第二个氨基酸或核酸序列中的一个或两个中导入空位以进行最佳比对,为了比较的目的,可以忽略非同源序列)。在一些实施方案中,出于比较目的,参考序列比对的长度是参考序列长度的至少40%,更通常至少50%或60%,甚至更通常至少70%、80%、90%或100%。然后,比较相应氨基酸位置或核苷酸位置的氨基酸残基或核苷酸。当第一个序列中的一个位置被第二个序列中相应位置的相同氨基酸残基或核苷酸占据时,则分子在该位置是同一的。对于氨基酸序列比较,当第一个序列中的一个位置被第二个序列中相应位置的相同或相似的氨基酸残基(即保守取代)占据时,则分子在该位置是相似的。
两个序列之间的同一性百分比是考虑到用于两个序列的最佳比对而需要被导入的空位数目和每个空位长度,序列在各个位置共有的相同氨基酸残基数量的函数。相比之下,两个序列之间的相似百分比是考虑到用于两个序列的最佳比对而需要被导入的空位数目和每个空位长度,序列在各个位置共有的相同和相似氨基酸残基数量的函数。
可以使用数学算法完成序列比较和序列之间的同一性百分比或相似性百分比的确定。在某些实施方案中,氨基酸序列之间同一性或相似性百分比使用以下方法来确认:Needleman和Wünsch的(1970,J.Mol。Biol.,48:444-453)算法,其已经整合到GCG软件包中的GAP程序中(Devereaux等人(1984)Nucleic Acids Research,12:387-395),使用Blosum62矩阵或PAM250矩阵,并且空位权重为16、14、12、10、8、6或4且长度权重为1、2、3、4、5或6。在一些实施方案中,氨基酸序列之间同一性或相似性百分比可以使用已经整合到ALIGN程序(2.0版本)的Meyers和Miller(1989,Cabios,4:11-17)算法,使用PAM120权重残基表,空位长度罚分为12和空位罚分为4,来确定。
本发明还考虑了由这样的多核苷酸序列编码的分离、合成或重组肽:该多核苷酸序列在如本文定义的严格条件下,尤其是在中等、高或非常高严格条件下,优选在高或非常高严格条件下,与编码SEQ ID NO:1和/或SEQ ID NO:2肽的多核苷酸序列或其非编码链杂交。本发明还考虑了包含这样的多核苷酸序列的分离的核酸分子:该多核苷酸序列在如本文定义的严格条件下,尤其是在中等、高或非常高严格条件下,优选在高或非常高严格条件下,与编码SEQ ID NO:1和/或SEQ ID NO:2肽的多核苷酸序列或其非编码链杂交。
本文所用的术语“在严格条件下杂交”描述了用于杂交和洗涤的条件,并且可以包括低严格、中等严格、高严格和非常高严格条件。
进行杂交反应的指南可以在Ausubel等人(1998)Current Protocols inMolecular Biology(John Wiley&Sons公司)中,尤其是第6.3.1-6.3.6节中找到。水性和非水性方法均可以使用。本文中提及的低严格条件包括并包含用至少约1%v/v至至少约15%v/v甲酰胺与至少约1M至至少约2M盐在42℃杂交,以及用至少约1M至至少约2M盐在42℃洗涤。低严格条件还可以包括用1%牛血清白蛋白(BSA)、1mM EDTA、0.5M NAHPO4(pH7.2)、7%十二烷基硫酸钠(SDS)在65℃杂交,以及用(i)2×氯化钠/柠檬酸钠(SSC)、0.1%SDS,或者(ii)0.5%BSA、1mM EDTA、40mMNAHPO4(pH 7.2)、5%SDS在室温洗涤。低严格条件的一个实施方案包括在6×SSC中在约45℃下杂交,然后在0.2×SSC、0.1%SDS中至少在50℃洗涤两次(对于低严格条件,洗涤温度可以增加至55℃)。中等严格条件包括并包含用至少约16%v/v至至少约30%v/v甲酰胺与至少约0.5M至至少约0.9M盐在42℃杂交,以及用至少约0.1M至至少约0.2M盐在55℃洗涤。中等严格条件还可以包括用1%牛血清白蛋白(BSA)、1mMEDTA、0.5M NAHPO4(pH 7.2)、7%SDS在65℃杂交,以及用(i)2×SSC、0.1%SDS,或者(ii)0.5%BSA、1mM EDTA、40mM NAHPO4(pH 7.2)、5%SDS在60℃至65℃洗涤。中等严格条件的一个实施方案包括在6×SSC中在约45℃杂交,然后在0.2×SSC、0.1%SDS中在60℃下洗涤一次或更多次。高严格条件包括并包含用至少约31%v/v至至少约50%v/v甲酰胺与约0.01M至约0.15M盐在42℃下杂交,以及用约0.01M至约0.02M盐在约55℃洗涤。高严格条件还可以包括用1%BSA、1mM EDTA、0.5M NAHPO4(pH 7.2)、7%SDS在65℃杂交,以及用(i)0.2×SSC、0.1%SDS,或者(ii)0.5%BSA、1mM EDTA、40mM NAHPO4(pH 7.2)、1%SDS在超过65℃的温度洗涤。高严格条件的一个实施方案包括在6×SSC中在约45℃杂交,然后在0.2×SSC、0.1%SDS中在65℃洗涤一次或更多次。
在本发明的一些方面,提供一种本发明的由这样的多核苷酸序列编码的分离、合成或重组肽:该多核苷酸序列在高严格条件下与编码SEQ IDNO:1和/或SEQ ID NO:2肽的多核苷酸序列或其非编码链杂交。在某些实施方案中,本发明的分离、合成或重组肽由这样的多核苷酸序列编码:该多核苷酸序列在非常高严格条件下与编码SEQ ID NO:1和/或SEQ IDNO:2肽的多核苷酸序列或其非编码链杂交。非常高严格条件的一个实施方案包括用0.5M磷酸钠、7%SDS在65℃杂交,然后在0.2×SSC、1%SDS中在65℃洗涤一次或更多次。在一些实施方案中,相对于从X1开始的式I的编号,本发明的肽变体的氨基酸序列包含第5位的Ile(或其修饰形式)、第6位的Asp(或其修饰形式)、第8位的Pro(或其修饰形式)和/或第9位的Pro(或其修饰形式)。在一些实施方案中,本发明的肽变体的氨基酸序列包含式I的蛋白分子。在具体的实施方案中,本发明的肽变体抑制PKC-θ核易位。
其他严格条件在本领域是众所周知的,并且本领域技术人员会认识到可以操作各种因素来优化杂交的特异性。优化最终洗涤的严格性可以确保杂交程度高。对于详细例子,可以参见Ausubel等人(1998)Current Protocols in Molecular Biology(John Wiley&Sons公司),尤其是2.10.1至2.10.16页,以及Sambrook等人(1989)Molecular Cloning:ALaboratory Manual(冷泉港实验室出版社),尤其是第1.101至1.104节。
虽然严格洗涤通常在约42℃至68℃的温度进行,但是本领域技术人员将认识到其它温度可能适合于严格条件。最大杂交速率通常出现在低于Tm值大约20℃至25℃的温度,以形成DNA-DNA杂交体。本领域众所周知,Tm值是溶解温度,或两个互补多核苷酸序列解离的温度。估计Tm值的方法在本领域是众所周知的(参见Ausubel等人(1998)CurrentProtocols in Molecular Biology(John Wiley&Sons公司)在2.10.8页)通常,完全匹配的DNA双链体的Tm值可以通过下式近似地预测:
Tm值=81.5+16.6(log10 M)+0.41(%G+C)-0.63(甲酰胺%)-(600/长度)
其中:M是Na+的浓度,优选在0.01M至0.4M的范围内;%G+C是鸟苷和胞嘧啶碱基的之和占全部碱基数的百分比,范围在30%至75%G+C之间;甲酰胺%是甲酰胺的体积百分浓度;长度是DNA双链体中碱基对数。双链DNA的Tm值随着随机错配碱基对数的每增加1%而递减约1℃。对于高严格性,洗涤通常在Tm值-15℃进行,或对于中等严格,洗涤通常在Tm值-30℃进行。
在杂交过程的一个例子中,含有固定DNA的膜(例如硝酸纤维素膜或尼龙膜)在含有标记探针的杂交缓冲液(50%去离子甲酰胺、5×SSC、5×Denhardt’s溶液(0.1%ficol、0.1%聚乙烯吡咯烷酮和0.1%BSA)、0.1%SDS和200mg/mL变性鲑鱼精子DNA)中于42℃杂交过夜。然后对膜进行两次连续的中等严格洗涤(即用2×SSC、0.1%SDS在45℃洗涤15分钟,然后用2×SSC、0.1%SDS在50℃洗涤15分钟),随后进行两次连续的更高严格洗涤(即用0.2×SSC、0.1%SDS在55℃洗涤12分钟,然后用0.2×SSC和0.1%SDS溶液在65℃-68℃洗涤12分钟)。
本发明的蛋白分子还包含肽,所述肽包含具有修饰侧链的氨基酸,在肽合成期间掺入非天然氨基酸残基和/或其衍生物,并且使用交联剂和对本发明肽施加构象限制的其他方法。侧链修饰的例子包括氨基基团的修饰,例如用乙酸酐酰化;用琥珀酸酐和四氢邻苯二甲酸酐酰化氨基;用甲基乙酰亚胺酯酰胺化;用氰酸酯的氨甲酰化氨基基团;用5-磷酸吡哆醛的吡哆化(pyridoxylation)赖氨酸,然后用硼氢化钠还原;通过与醛反应进行还原烷基化,然后用硼氢化钠还原;以及用2,4,6-三硝基苯磺酸(TNBS)三硝基苄基化氨基基团。
羧基可以通过碳二亚胺活化,通过O-酰基异脲的形成,随后衍生化,例如成相应的酰胺来修饰。
精氨酸残基的胍基可以通过与试剂如2,3-丁二酮、苯乙二醛和乙二醛形成杂环缩合产物来修饰。
色氨酸残基可以例如用2-羟基-5-硝基苄基溴或磺酰卤烷基化吲哚环,或通过N-溴代琥珀酰亚胺氧化来修饰。
酪氨酸残基可以通过用四硝基甲烷硝化来修饰,形成3-硝基酪氨酸衍生物。
肽合成期间掺入非天然氨基酸和衍生物的例子包括但不限于:使用4-氨基丁酸、6-氨基己酸、4-氨基-3-羟基-5-苯基戊酸、4-氨基-3-羟基-6-甲基庚酸、叔丁基甘氨酸、正亮氨酸、正缬氨酸、苯基甘氨酸、鸟氨酸、肌氨酸、2-噻吩基丙氨酸、硒代半胱氨酸和/或氨基酸的D异构体。表3显示了本发明考虑的非天然氨基酸列表。
表3:示例性非天然氨基酸
尽管本发明的蛋白分子可以固有地穿透膜,但是通过膜穿透部分与蛋白分子的缀合可以进一步增加膜穿透。因此,在一些实施方案中,本发明的蛋白分子包含至少一个膜穿透部分。膜穿透部分可以在蛋白分子的任何点缀合。合适的膜穿透部分包括脂质部分、胆固醇和蛋白,例如细胞穿透肽和多聚阳离子肽;特别是脂质部分。
合适的细胞穿透肽可以包括例如US 20090047272、US 20150266935和US20130136742中描述的肽。因此,合适的细胞穿透肽可以包括但不限于:含有Arg和Lys残基的非天然类似物的碱性聚(Arg)和聚(Lys)以及碱性聚(Arg)和聚(Lys)肽,例如YGRKKRPQRRR(HIV TAT47-57)、RRWRRWWRRWWRRWRR(W/R)、CWK18(AlkCWK18)、K18WCCWK18(Di-CWK18)、WTLNSAGYLLGKINLKALAALAKKIL(Transportan)、GLFEALEELWEAK(DipaLytic)、K16GGCRGDMFGCAK16RGD(K16RGD)、K16GGCMFGCGG(P1)、K16ICRRARGDNPDDRCT(P2)、KKWKMRRNQFWVKVQRbAK (B)bA (P3) 、VAYISRGGVSTYYSDTVKGRFTRQKYNKRA (P3a) 、IGRIDPANGKTKYAPKFQDKATRSNYYGNSPS (P9.3) 、KETWWETWWTEWSQPKKKRKV(Pep-1)、PLAEIDGIELTY(Plae)、K16GGPLAEIDGIELGA(Kplae)、K16GGPLAEIDGIELCA(cKplae)、GALFLGFLGGAAGSTMGAWSQPKSKRKV(MGP)、WEAK(LAKA)2-LAKH(LAKA)2LKAC(HA2)、(LARL)6NHCH3(LARL46)、KLLKLLLKLWLLKLLL(Hel-11-7)、(KKKK)2GGC(KK)、(KWKK)2GCC(KWK)、(RWRR)2GGC(RWR)、PKKKRKV(SV40 NLS7)、PEVKKKRKPEYP(NLS12)、TPPKKKRKVEDP(NLS12a)、GGGGPKKKRKVGG(SV40 NLS13)、GGGFSTSLRARKA(AV NLS13)、CKKKKKKSEDEYPYVPN(AV RMENLS17)、CKKKKKKKSEDEYPYVPNFSTSLRARKA(AV FP NLS28)、LVRKKRKTEEESPLKDKDAKKSKQE(SV40 N1 NLS24)和K9K2K4K8GGK5(Loligomer);HSV-1被膜蛋白VP22;与核输出信号(NES)融合的HSV-1被膜蛋白VP22r;大肠杆菌(Escherichia coli)肠毒素EtxB(H57S)的突变体B亚单位;脱毒外毒素A(ETA);HIV-1Tat蛋白的蛋白质转导结构域,GRKKRRQRRRPPQ;果蝇(Drosophila melanogaster)触角结构域Antp(第43-58位氨基酸)、RQIKIWFQNRRMKWKK;抗菌肽II,TRSSRAGLQFPVGRVHRLLRK;hClock-(第35-47位氨基酸)(人钟蛋白DNA结合肽)、KRVSRNKSEKKRR;MAP(两亲性模型肽)、KLALKLALKALKAALKLA;K-FGF,AAVALLPAVLLALLAP;Ku70衍生肽,其包含选自包含VPMLKE、VPMLK、PMLKE或PMLK的组的肽;朊病毒,小鼠Prpe(第1-28位氨基酸)、MANLGYWLLALFVTMWTDVGLCKKRPKP;pVEC,LLIILRRRIRKQAHAHSK;Pep-I,KETWWETWWTEWSQPKKKRKV;SynBl, RGGRLSYSRRRFSTSTGR; Transportan,GWTLNSAGYLLGKINLKALAALAKKIL; Transportan-10,AGYLLGKINLKALAALAKKIL ; CADY ,Ac-GLWRALWRLLRSLWRLLWRA-半胱胺(cysteamide);Pep-7,SDLWEMMMVSLACQY;HN-1,TSPLNIHNGQKL;VT5,DPKGDPKGVTVTVTVTVTGKGDPKPD;或者pISL,RVIRVWFQNKRCKDKK。
在优选的实施方案中,膜穿透部分是脂质部分,例如C10-C20脂肪酰基基团,特别是十八烷酰基(硬脂酰基,C18)、十六烷酰基(棕榈酰基,C16)或十四烷酰基(肉豆蔻酰基,C14);最特别是十四烷酰基。在优选的实施方案中,膜穿透部分与N末端或C末端氨基酸残基缀合,或者通过蛋白分子的赖氨酸侧链的氨基,特别是通过蛋白分子的N末端氨基酸残基缀合。在具体的实施方案中,膜穿透部分通过蛋白分子的N末端氨基酸残基的氨基缀合。
对于本发明的特定用途和方法,可能需要具有高水平稳定性的蛋白分子以,例如,增加蛋白分子在受试者中的半衰期。因此,在一些实施方案中,本发明的蛋白分子包含稳定部分。稳定部分可以在蛋白分子上的任何点缀合。合适的稳定部分包括聚乙二醇(PEG)或封端部分,包括乙酰基基团、焦谷氨酸或氨基基团。在优选的实施方案中,乙酰基基团和/或焦谷氨酸与蛋白分子的N末端氨基酸残基缀合。在特定实施方案中,蛋白分子的N末端是焦谷酰胺或乙酰胺。在优选的实施方案中,氨基基团与蛋白分子的C末端氨基酸残基缀合。在特定实施方案中,本发明的蛋白分子在C末端具有伯酰胺。在优选的实施方案中,PEG与蛋白分子的N末端或C末端氨基酸残基缀合,或者通过赖氨酸侧链的氨基,特别是通过N末端氨基酸残基或赖氨酸侧链的氨基缀合。
在优选的实施方案中,本发明的蛋白分子在C末端具有伯酰胺或游离羧基,且在N末端具有伯胺。
在一些实施方案中,本发明的蛋白分子是环肽。不希望受理论束缚,认为肽的环化降低了肽对降解的敏感性。在特定实施方案中,蛋白分子使用N至C环化(首尾环化),优选通过酰胺键环化,被环化。这种肽不具有N末端或C末端氨基酸残基。在特定实施方案中,本发明的蛋白分子具有酰胺环化肽骨架。在其它实施方案中,本发明的蛋白分子使用侧链至侧链环化,优选通过二硫键或内酰胺桥环化,被环化。
在一些实施方案中,使用连接部分连接N末端和C末端。连接部分可以是肽接头,使得环化产生酰胺环化的肽骨架。连接部分的肽序列内可能会变化,使得连接部分可以被修饰以改变蛋白分子的物理化学性质,并且潜在地减少本发明蛋白分子的副作用,或者以其他方式提高蛋白分子的治疗用途,例如通过提高稳定性。连接部分具有合适的长度以跨越肽的N末端和C末端之间的距离,而实质上不改变蛋白分子的结构构象,例如,肽连接部分的长度可以在2到10个氨基酸残基之间。在一些实施方案中,可能需要更长或更短的肽连接部分。
本发明的蛋白分子可以是盐或前药的形式。本发明蛋白分子的盐优选是药学上可接受的,但是应当理解的是,非药学上可接受的盐也属于本发明的范围。
本发明的蛋白分子可以是结晶形式和/或溶剂化物形式,例如水合物。可以使用本领域已知的方法进行溶剂化。
在一些实施方案中,本发明的蛋白分子选择性抑制PKC-θ超过至少一种其他PKC酶或亚型,如PKC-α、PKC-β、PKC-γ、PKC-δ、PKC-ε、PKC-ζ、PKC-η、PKC-λ、PKC-μ或PKC-ν。在一些实施方案中,本发明的蛋白分子选择性抑制PKC-θ超过其他10种PKC酶。在一些实施方案中,相对于抑制一种或更多种其他PKC酶(即除了PKC-θ以外的一种或更多种PKC酶,如PKC-α、PKC-β、PKC-γ、PKC-δ、PKC-ε、PKC-ζ、PKC-η、PKC-λ、PKC-μ和/或PKC-ν),本发明的蛋白分子表现出高约2倍、5倍、10倍、20倍、50倍或高约100倍的PKC-θ选择性。在其他实施方案中,选择性分子显示出对PKC-θ的抑制比对一种或更多种其他PKC酶的抑制至少高50倍。在进一步的实施方案中,选择性分子显示出对PKC-θ的抑制比对一种或更多种其他PKC酶的抑制至少高100倍。在更进一步的实施方案中,选择性分子显示出对PKC-θ的抑制比对一种或更多种其他PKC酶的抑制至少高500倍。在再进一步的实施方案中,选择性分子显示出对PKC-θ的抑制比对一种或更多种其他PKC酶的抑制至少高100倍。在一些实施方案中,本发明的蛋白分子是非选择性PKC-θ抑制剂。
本发明还考虑了编码本发明蛋白分子的核酸分子。因此,在本发明的另一方面,提供了一种分离的核酸分子,其包含编码本发明蛋白分子的多核苷酸序列或与编码本发明蛋白分子的多核苷酸序列互补的多核苷酸序列,例如如本文所述的式I、SEQ ID NO:1或SEQID NO:2的蛋白分子或蛋白分子变体。
在一些实施方案中,由多核苷酸序列编码的蛋白分子不是由SEQ IDNO:1的氨基酸序列组成的蛋白分子。
本发明的分离的核酸分子可以是DNA或RNA。当核酸是DNA形式时,它可以是基因组DNA或cDNA。本发明核酸分子的RNA形式通常是mRNA。
尽管核酸分子通常是分离的,但在一些实施方案中,核酸分子可以整合到、连接到或以其他方式融合或缔合到其他遗传分子中,例如表达载体。通常,表达载体包括可操作地连接到多核苷酸序列的转录和翻译调节核酸。因此,在本发明的另一方面,提供了一种表达载体,其包含编码本发明蛋白分子的多核苷酸序列,例如如本文所述的式I、SEQ ID NO:1或SEQ IDNO:2的蛋白分子或蛋白分子变体。
在一些实施方案中,本发明的蛋白分子可以通过导入一种或更多种表达构建体而在细胞内产生,所述表达构建体如表达载体,其包含编码本发明蛋白分子的多核苷酸序列。
本发明考虑了在宿主细胞内重组生产本发明的蛋白分子,所述宿主细胞例如哺乳动物细胞(例如中国仓鼠卵巢(CHO)细胞、小鼠骨髓瘤(NS0)细胞、幼仓鼠肾(BHK)细胞或人胚肾(HEK293)细胞)、酵母细胞(例如巴斯德毕赤酵母(Pichia pastoris)细胞、酿酒酵母(Saccharomyces cerevisiae)细胞、粟酒裂殖酵母(Schizosaccharomyces pombe)细胞、多形汉逊酵母(Hansenula polymorpha)细胞、乳酸克鲁维酵母(Kluyveromyces lactis)细胞、解脂耶罗维亚酵母(Yarrowia lipolytica)细胞或Arxula adeninivorans cell细胞)或细菌细胞(例如大肠杆菌(Escherichia coli)细胞,谷氨酸棒杆菌(Corynebacteriumglutamicum)细胞或荧光假单胞菌(Pseudomonas fluorescens)细胞)。
对于治疗应用,本发明还考虑了在PKC-θ过表达细胞内体内产生本发明的蛋白分子,所述细胞如脊椎动物细胞,特别是哺乳动物或禽类细胞,尤其是哺乳动物细胞。
如上所述,例如在US 5,976,567中,天然或合成核酸的表达通常通过将编码本发明蛋白分子的多核苷酸序列可操作地连接到调节元件(例如启动子,其可以是组成型或诱导型),合适地将构建体整合入表达载体并将载体导入合适的宿主细胞中来实现。典型的载体包含转录和翻译终止子、转录和翻译起始序列以及可以用于调节核酸表达的启动子。载体任选地包括含有至少一个独立终止子序列的通用表达盒、允许盒在真核生物、原核生物或两者中复制的序列(例如穿梭载体)以及原核和真核系统二者的选择标志物。载体可能适用于原核生物、真核生物或两者中的复制和整合。参见Giliman和Smith(1979),Gene,8:81-97;Roberts等人,(1987)Nature,328:731-734;Berger和Kimmel,Guide to MolecularCloning Techniques,Methods in Enzymology,第152卷,Academic出版公司,圣地亚哥市,美国加利福尼亚州(Berger);Sambrook等人(1989),Molecular Cloning:ALaboratoryManual(第二版)第1-3卷,冷泉港实验室,冷泉港实验室出版社,纽约;以及Ausubel等人(1994)Current Protocols in Molecular Biology,EDS,Current Protocols,Greene出版协会公司和John Wiley&Sons公司的合资公司(增刊)。
含有来自真核病毒如逆转录病毒的调节元件的表达载体通常用于真核细胞中核酸序列的表达。SV40载体包括pSVT7和pMT2。来自牛乳头瘤病毒的载体包括pBV-1MTHA,来自EB病毒的载体包括pHEBO和p2O5。其他示例性载体包括pMSG、pAV009/A+、pMTO10/A+、pMAMneo-5、杆状病毒pDSVE,以及允许在SV-40早期启动子、SV-40晚期启动子、金属硫蛋白启动子、小鼠乳腺肿瘤病毒启动子、劳氏肉瘤病毒启动子、多角体蛋白启动子或其他显示在真核细胞中表达有效的启动子的指导下表达蛋白的任何其他载体。
虽然可以使用多种载体,但是应当注意,病毒表达载体可以用于修饰真核细胞,因为病毒载体可高效转染靶细胞并整合到靶细胞基因组中。这种类型的示例性表达载体可来自病毒DNA序列,包括但不限于:腺病毒、腺相关病毒、单纯疱疹病毒和逆转录病毒如B、C和D逆转录病毒,以及泡沫病毒(Spumaviruses)和经修饰的慢病毒。用于转染动物细胞的合适表达载体,例如如下所述:Wu和Ataai(2000)Curr.Opin.Biotechnol.,11(2):205-208;Vigna和Naldini(2000)J.gene Med.,2(5):308-316;Kay等人,(2001)Nat.Med.,7(1):33-40;Athanasopoulos等人,(2000)Int.J.Mol。Med.,6(4):363-375;以及Walther和Stein(2000)Drugs,60(2):249-271。
表达载体的多肽或肽编码部分可以包含天然存在的序列或其变体,其已经使用重组技术进行了工程改造。在变体的一个例子中,编码本发明蛋白分子的多核苷酸的密码子组成被修饰,以允许在哺乳动物宿主中增强表达本发明的蛋白分子,使用利用密码子使用偏倚,或者特定哺乳动物细胞或组织类型中密码子翻译效率的方法,如国际公开WO 99/02694和WO00/42215中所述。简而言之,后一种方法是基于这样的观察:不同细胞或组织之间不同密码子的翻译效率不同,这些差异以及基因的密码子组成可以用来调节特定细胞或组织类型中蛋白的表达。因此,对于密码子优化的多核苷酸的构建,亲本多核苷酸的至少一个现有密码子被同义密码子替换,该同义密码子在靶细胞或组织中的翻译效率高于被其替换的现有密码子。虽然优选用具有更高翻译效率的同义密码子替换亲本核酸分子的所有现有密码子,但这不是必需的,因为即使部分替换也可实现表达的增加。合适地,取代步骤影响亲本多核苷酸的5%、10%、15%、20%、25%、30%、更优选35%、40%、50%、60%、70%或更多的现有密码子。
表达载体与其导入的细胞相容,使得本发明的蛋白分子可被该细胞表达。表达载体可以通过任何合适的方式导入细胞,这取决于所用表达载体和细胞的具体选择。这种导入方式是本领域技术人员所熟知的。例如,导入可以通过使用接触(例如在病毒载体的情况下)、电穿孔、转化、转导、接合或三亲交配、转染、用阳离子脂质体的感染膜融合、用包被有DNA的微粒高速轰击、用磷酸钙-DNA共沉淀孵育、直接显微注射到单细胞中等来实现。其它方法也可以使用,并且是本领域技术人员已知的。可选地,载体是通过阳离子脂质如脂质体导入的。这种脂质体可以商购获得(例如LipofectamineTM等,由LifeTechnologies、Gibco BRL、Gaithersburg、Md提供)。
本发明的蛋白分子可以使用重组DNA技术或通过化学合成来制备。
在一些实施方案中,本发明的蛋白分子使用标准肽合成方法制备,例如液相合成或固相合成。本发明蛋白分子的化学合成可以手动或使用自动合成仪进行。例如,线性肽可以使用Boc或Fmoc化学的固相肽合成来合成,如下所述:Merrifield(1963)J Am Chem Soc,85(14):2149-2154;Schnolzer等人(1992)Int J Pept P rotein Res,40:180-193;Ensenat-Waser等人(2002)IUBMB Life,54:33-36;WO 2002/010193以及Cardosa等人(2015)Mol Pharmacol,88(2):291-303。在从固相载体上脱保护和切割后,使用合适的方法纯化线性肽,如制备色谱法。
在其他实施方案中,本发明的蛋白分子可以是环化的。可以使用几种技术进行环化,例如,如Davies(2003)J Pept Sci,9:471-501中所述。
在一些实施方案中,使用重组DNA技术制备本发明的蛋白分子。例如,本发明的蛋白分子可以通过包括以下步骤的程序制备:(a)制备构建体,所述构建体包含编码本发明蛋白分子并可操作地连接至调节元件的多核苷酸序列;(b)将构建体导入宿主细胞;(c)培养宿主细胞以表达多核苷酸序列,从而产生本发明的编码蛋白分子;以及(d)从宿主细胞中分离本发明的蛋白分子。本发明的蛋白分子可以使用标准方案重组制备,例如如下所述:Klint等人(2013)PLOS One,8(5):e63865;Sambrook等人(1989)Molecular Cloning:ALaboratory Manual(冷泉港实验室出版社),尤其是第16和17节;Ausubel等人(1998)Current Protocols in Molecular Biology(John Wiley&Sons公司),尤其是第10和16章;以及Coligan等人(1997)Current Protocols in Protein Science(John Wiley&Sons公司),尤其是第1、5和6章。
3.药物组合物
根据本发明,蛋白分子可以用于治疗或预防涉及PKC-θ过表达的状况如癌症的组合物和方法中。
因此,在一些实施方案中,本发明的蛋白分子可以是药物组合物的形式,其中所述药物组合物包含本发明的蛋白分子和药学上可接受的载体或稀释剂。
本发明的蛋白分子可以配制成中性或盐形式的药物组合物。
如本领域技术人员所应理解的,药学上可接受的载体或稀释剂的选取取决于施用途径和状况的性质以及待治疗的受试者。本领域技术人员可以容易地确定特定的载体或递送系统和施用途径。载体或递送系统和施用途径应该仔细选择,以确保在制剂制备期间蛋白分子的活性不会耗尽,并且蛋白分子能够完整地到达作用部位。本发明的药物组合物可以通过多种途径施用,包括但不限于:口服、直肠、局部、鼻内、眼内、经粘膜、肠道、肠内、肌肉内、皮下、髓内、鞘内、心室内、脑内、阴道内、膀胱内、静脉内或腹膜内施用。
适于注射使用的药物形式包括无菌注射液或分散液和用于制备无菌注射液的无菌粉末。这种形式在制造和储存条件下应该是稳定的,并且可以被保存而防止受到还原、氧化和微生物污染。
本领域技术人员能够使用常规方法容易地确定本发明蛋白分子的合适制剂。用于配制和施用的技术例如可以在以下书籍最新版中找到:Remington(1980)Remington’sPharmaceutical Sciences),Mack出版公司,伊斯顿镇,美国宾夕法尼亚州。
确定优选的pH范围和合适的赋形剂如抗氧化剂是本领域常规的,例如,如Katdare和Chaubel(2006)在Excipient Development for Pharmaceutical,Biotechnology andDrug Delivery Systems(CRC出版公司)中所述。缓冲系统通常用于提供所需范围的pH值,可以包括但不限于:羧酸缓冲液,如乙酸盐、柠檬酸盐、乳酸盐、酒石酸盐和琥珀酸盐;甘氨酸盐;组氨酸盐;磷酸盐;三(羟甲基)氨基甲烷(Tris);精氨酸盐;氢氧化钠;谷氨酸盐;以及碳酸盐缓冲液。合适的抗氧化剂可以包括但不限于:酚类化合物如丁基化羟基甲苯(BHT)和丁基化羟基苯甲醚;维生素E;抗坏血酸;还原剂如甲硫氨酸或亚硫酸盐;金属螯合剂如乙二胺四乙酸(EDTA);半胱氨酸盐酸盐;亚硫酸氢钠;焦亚硫酸钠;亚硫酸钠;抗坏血酸棕榈酸酯;卵磷脂;没食子酸丙酯;以及α-生育酚。
对于注射,可以将本发明的蛋白分子配制在水溶液中,适合地,配制在生理学上相容的缓冲液中如Hanks溶液、林格氏溶液或生理盐水缓冲液。对于经粘膜施用,在制剂中使用适合于所要透过的屏障的渗透剂。这样的渗透剂在本领域中通常是已知的。
本发明的组合物可被配制用于以下形式的施用:含有可接受的稀释剂(如盐水和无菌水)的液体,或者可以呈含有可接受的稀释剂或载体以赋予所需的质地、稠度、粘度和外观的洗剂、乳膏或凝胶形式。可接受的稀释剂和载体是本领域技术人员所熟知的,包括但不限于:乙氧基化和非乙氧基化表面活性剂、脂肪醇、脂肪酸、烃油(如棕榈油、椰子油和矿物油)、可可脂蜡、硅油、pH平衡剂、纤维素衍生物、乳化剂如非离子有机碱和无机碱、防腐剂、蜡酯、甾醇、甘油三酯、磷脂如卵磷脂和脑磷脂、多元醇酯、脂肪醇酯、亲水性羊毛脂衍生物和亲水性蜂蜡衍生物。
可选地,本发明的蛋白分子可以使用本领域熟知的药学上可接受的载体容易地配制成适于口服施用的剂量,这也是本发明实施所考虑的。这些载体使得本发明的生物活性剂能够配制成如下剂型,如片剂、丸剂、胶囊剂、液体剂、凝胶剂、糖浆剂、浆液剂、悬浮剂等,用于待治疗患者口服摄入。这些载体可以选自糖、淀粉、纤维素及其衍生物、麦芽、明胶、滑石、硫酸钙、植物油、合成油、多元醇、海藻酸、磷酸盐缓冲溶液、乳化剂、等渗盐水和无热原水。
用于肠胃外施用的药物制剂包括水溶形式的本发明蛋白分子的水溶液。另外,本发明蛋白分子的悬浮液可以制备成适当的油性注射悬浮液。合适的亲脂性溶剂或媒介物(vehicle)包括脂肪油如芝麻油,或者合成脂肪酸酯如油酸乙酯或甘油三酯。水性注射悬浮液可以含有提高悬浮液粘度的物质,如羧甲基纤维素钠、山梨糖醇或葡聚糖。任选地,悬浮液还可以含有合适的稳定剂或增加化合物溶解度的试剂,以制备高浓度溶液。
无菌溶液可以通过将以所需量在适当的溶剂中的活性化合物按需要与其它如上所述的赋形剂混合,然后灭菌,例如过滤来制备。通常,通过将各种灭菌的活性化合物掺入无菌媒介物中来制备分散液,所述无菌媒介物含有基础分散介质和如上所述的所需的赋形剂。无菌干粉可以通过真空干燥或冷冻干燥含有活性化合物和如上所述的其他所需赋形剂的无菌溶液来制备。
用于口服使用的药物制剂可以通过以下获得:将本发明的蛋白分子与固体赋形剂混合并加工颗粒混合物,在加入合适的助剂(如果需要)后获得片剂或糖衣丸芯。合适的赋形剂特别是填充剂,如糖,包括乳糖、蔗糖、甘露糖醇或山梨糖醇;纤维素制剂,例如玉米淀粉、小麦淀粉、大米淀粉、马铃薯淀粉、明胶、黄蓍胶、甲基纤维素、羟丙基甲基纤维素、羧甲基纤维素钠和/或聚乙烯吡咯烷酮(PVP)。如果需要,可以加入崩解剂,如交联聚乙烯吡咯烷酮、琼脂,或者海藻酸或其盐如海藻酸钠。此类组合物可以通过任何药学方法制备,但所有方法包括使一种或更多种如上所述的治疗剂与构成一种或更多种必需成分的载体缔合的步骤。通常,本发明的药物组合物可以以本身已知的方式制备,例如,通过常规混合、溶解、制粒、糖包衣、研磨、乳化、包封、包埋或冻干方法。
糖衣丸芯提供有合适的包衣。出于该目的,可以使用浓缩糖溶液,其可以任选地含有阿拉伯树胶、滑石、聚乙烯吡咯烷酮、卡波姆凝胶、聚乙二醇和/或二氧化钛,漆溶液和合适的有机溶剂或溶剂混合物。可以将染料或颜料添加到片剂或糖衣丸包衣中,用于识别或表征颗粒剂量的不同组合。
可口服使用的药物包括由明胶制成的硬胶囊(push-fit capsule),以及由明胶和增塑剂如甘油或山梨糖醇制成的软密封胶囊。硬胶囊可以含有混合了下列物质的活性成分:与填充剂如乳糖、粘合剂如淀粉和/或润滑剂如滑石粉或硬脂酸镁,以及任选的稳定剂。在软胶囊中,活性化合物可以溶解或悬浮在合适的液体中,例如脂肪油、液体石蜡或液体聚乙二醇。此外,可以添加稳定剂。
本发明的蛋白分子可以掺入缓释(modified-release)制品(preparation)和制剂(formulation)中,例如聚合微球制剂以及油基或凝胶基制剂。
在具体的实施方案中,本发明的蛋白分子可以以局部而非全身的方式施用,例如通过将蛋白分子直接注射到组织中,所述组织优选是皮下或网膜组织,通常采取储库(Depot)型制剂或持续释放制剂。
另外,本发明的蛋白分子可以在靶向药物递送系统中施用,例如在适合靶向细胞或组织并被细胞或组织选择性吸收的颗粒中施用。在一些实施方案中,本发明的蛋白分子包含或以其他方式与媒介物缔合,所述媒介物选自脂质体、胶束、树枝状聚合物、可生物降解颗粒、人造DNA纳米结构、基于脂质的纳米颗粒以及碳或金纳米颗粒。在这种类型的示例性例子中,所述媒介物选自聚(乳酸)(PLA)、聚(乙醇酸)(PGA)、聚(乳酸-共-乙醇酸)(PLGA)、聚(乙二醇)(PEG)、PLA-PEG共聚物及其组合。
在局部施用或选择性吸收的情况下,剂的有效局部浓度可能与血浆浓度无关。
以剂量单位形式配制组合物对便于施用和剂量均匀性是有利的。本发明的新型剂量单位形式的确定决定于并直接取决于活性物质的独特特征、要达到的特定治疗效果以及配制活性物质用于治疗活的受试者疾病的领域中固有的局限性,其中该活的受试者具有如本文详述的其中身体健康受损的患病状况。
虽然本发明的蛋白分子可以是施用至受试者的唯一活性成分,但是与所述蛋白分子同时施用其他癌症治疗也在本发明的范围内。例如,可以与一种或更多种癌症治疗同时施用本文所述的式I、SEQ ID NO:1或SEQ IDNO:2的蛋白分子或变体,所述癌症治疗的非限制性例子包括放射治疗、手术、化学治疗、激素消融治疗、促凋亡治疗和免疫治疗,特别是化学治疗。本发明的蛋白分子可以在用癌症治疗治疗之前治疗性使用,可以在癌症治疗之后治疗性使用,或者可以与癌症治疗一起治疗性性使用。
合适的放射治疗包括诱导DNA损伤的辐射及波,例如γ辐射、X射线、UV辐射、微波、电子发射和放射性同位素。通常,可以通过用上述形式的辐射照射局部肿瘤部位来实现治疗。最有可能的是所有这些因素对DNA、DNA前体、DNA的复制和修复以及染色体的组装和维持造成大范围损伤。
X射线的剂量范围从长时间段治疗(如3-4周)的50-200伦琴的每日剂量至2000-6000伦琴的单剂量。放射性同位素的剂量范围改变很大,且取决于同位素的半衰期,发射的辐射的强度和类型,以及肿瘤细胞的吸收。合适的放射治疗可以包括但不限于适形外射束放射治疗(conformal external beam radiotherapy)(分次为50-100戈瑞,持续4-8周)、单次照射或分次高剂量近距离放射治疗、永久性间质短距离放射治疗和全身放射性同位素如锶89。在一些实施方案中,放射治疗可以与放射增敏剂联合施用。合适的放射增敏剂可以包括但不限于:乙丙昔罗(efaproxiral)、依他硝唑(etanidazole)、氟乐舒(Fluosol)、米索硝唑(misonidazole)、尼莫唑(nimorazole)、替莫泊芬(temoporfin)和替拉扎明(tirapazamine)。
合适的化学治疗剂可以包括但不限于:抗增殖药物/抗肿瘤药物及其组合,包括烷化剂类(alkylating agents)(例如顺铂(cisplatin)、卡铂(carboplatin)、环磷酰胺(cyclophosphamide)、氮芥(nitrogen mustard)、美法仑(melphalan)、苯丁酸氮芥(chlorambucil)、白消安(busulphan)和亚硝基脲(nitrosoureas));抗代谢物类(antimetabolites)(例如抗叶酸剂类(antifolates)诸如氟吡啶类(fluoropyridines),如5-氟尿嘧啶(5-fluorouracil)和替加氟(tegafur)、雷替曲塞(raltitrexed)、甲氨蝶呤(methotrexate)、阿糖胞甙(cytosine arabinoside)和羟基脲(hydroxyurea));抗肿瘤抗生素类(例如蒽环类(anthracyclines),如阿霉素(adriamycin)、博来霉素(bleomycin)、多柔比星(doxorubicin)、道诺霉素(daunomycin)、表柔比星(epirubicin)、伊达比星(idarubicin)、丝裂霉素-C(mitomycin-C)、更生霉素(dactinomycin)和光辉霉素(mithramycin));抗有丝分裂剂类(antimitotic agents)(例如长春花生物碱类(Vincaalkaloids),如长春新碱(vincristine)、长春碱(vinblastine)、长春地辛(vindesine)和长春瑞滨(vinorelbin)以及紫杉烷类(taxoids)如紫杉醇(paclitaxel)和多烯紫杉醇(docetaxel));以及拓扑异构酶抑制剂类(topoisomerase inhibitors)(例如表鬼臼毒素类(epipodophyllotoxins),如依托泊甙(etoposide)和替尼泊甙(teniposide)、安吖啶(amsacrine)、托泊替康(topotecan)和喜树碱(camptothecin));细胞抑制剂类(cytostatic agents)如抗雌激素类(antiestrogens)(例如他莫昔芬(tamoxifen)、托瑞米芬(toremifene)、雷洛昔芬(raloxifene)、屈洛昔芬(droloxifene)和艾多昔芬(idoxifene));雌激素受体下调剂类(estrogen receptor down regulators)(例如氟维司群(fulvestrant));抗雄激素类(antiandrogens)(例如比卡鲁胺(bicalutamide)、氟他胺(flutamide)、尼鲁米特(nilutamide)和醋酸环丙孕酮(cyproterone acetate));UH拮抗剂类(UH antagonists)或LHRH激动剂类(LHRH agonists)(例如戈舍瑞林(goserelin)、亮丙瑞林(leuprorelin)和布舍瑞林(buserelin));孕激素类(progestogens)(例如醋酸甲地孕酮(megestrol acetate));芳香酶抑制剂类(aromatase inhibitors)(例如阿那曲唑(anastrozole)、来曲唑(letrozole)、伏氯唑(vorozole)和依西美坦(exemestane))和5α-还原酶抑制剂(inhibitors of 5α-reductase)如非那雄胺(finasteride);抑制癌细胞侵袭的剂(例如金属蛋白酶抑制剂类(metalloproteinase inhibitors),如马马司他(marimastat)和尿激酶纤溶酶原激活物受体功能抑制剂(inhibitors of urokinaseplasminogen activator receptor function));生长因子功能抑制剂,例如此类抑制剂包括生长因子抗体、生长因子受体抗体(例如抗ErbB2抗体曲妥珠单抗(trastuzumab)[HerceptinTM]和抗ErbB1抗体西妥昔单抗(Cetuximab)[C225])、法尼基转移酶抑制剂(farnesyl transferase inhibitors)、MEK抑制剂、酪氨酸激酶抑制剂和丝氨酸/苏氨酸激酶抑制剂;例如,表皮生长因子家族的其他抑制剂(例如其他EGFR家族酪氨酸激酶抑制剂,如N-(3-氯-4-氟苯基)-7-甲氧基-6-(3-吗啉基丙氧基)喹唑啉-4-胺(吉非替尼(Gefitinib)、AZD1839)、N-(3-乙炔基苯基)-6,7-双(2-甲氧基乙氧基)喹唑啉-4-胺(埃罗替尼(Erlotinib)、OSI-774)和6-丙烯酰氨基-N-(3-氯-4-氟苯基)-7-(3-吗啉基丙氧基)喹唑啉-4-胺(CI 1033));例如,血小板衍生生长因子家族的抑制剂和例如肝细胞生长因子家族的抑制剂;抗血管生成剂,如抑制血管内皮生长因子的作用的那些(例如抗血管内皮细胞生长因子抗体贝伐单抗[AvastinTM]、如国际专利申请WO 97/22596、WO 97/30035、WO 97/32856和WO 98/13354中所公开的那些化合物),以及通过其他机制起作用的化合物(例如罗喹美克、整联蛋白αvβ3功能的抑制剂和血管生成抑制素(angiostatin));血管损伤剂类(vascular damaging agents),例如考布他汀A4(Combretastatin A4)和国际专利申请WO99/02166、WO00/40529、WO00/41669、WO01/92224、WO02/04434和WO02/08213中所公开的化合物;反义治疗(antisense therapy),例如,针对以上所列靶的那些反义治疗,如ISIS2503、抗ras反义;以及基因治疗方法,包括例如替代异常基因如异常p53或异常GDEPT(基因导向酶前药治疗)的方法,例如利用胞嘧啶脱氨酶、胸苷激酶或细菌硝基还原酶的那些方法以及提高患者对化学治疗或放射治疗耐受的方法,例如多药物耐药基因治疗(multi-drugresistance gene therapy)。
合适的免疫治疗方法可以包括但不限于提高患者肿瘤细胞的免疫原性的离体和体内方法,例如用细胞因子转染,所述细胞因子包括白细胞介素2、白细胞介素4或粒细胞-巨噬细胞集落刺激因子;降低T细胞无反应性的方法;使用转染的免疫细胞如细胞因子转染的树突细胞的方法;使用细胞因子转染的肿瘤细胞系的方法以及使用抗独特型抗体的方法。这些方法通常依赖于使用免疫效应细胞和分子来靶向和破坏癌细胞。免疫效应物可以是,例如,对恶性细胞表面上某些标记物特异性的抗体。单独的抗体可以作为治疗的效应物,或者它可以募集实际上促进细胞杀伤的其他细胞。抗体也可以与药物或毒素(化疗剂、放射性核素、蓖麻毒素A链、霍乱毒素、百日咳毒素等)缀合,并仅用作靶向剂。可选地,效应物可以是携带表面分子的淋巴细胞,该表面分子直接或间接与恶性细胞靶标相互作用。各种效应细胞包括细胞毒性T细胞和NK细胞。
其他癌症治疗的例子包括植物性治疗、冷冻治疗、毒素治疗或促凋亡治疗。本领域技术人员应当理解的是,该列表并非穷举可以用于癌症和其他增生性病变的治疗方式的类型。
众所周知的是,化学治疗和放射治疗靶向快速分裂的细胞和/或破坏细胞周期或细胞分裂。这些治疗作为治疗数种形式癌症的一部分提供,目的在于通过治愈性治疗来减缓其进展或逆转疾病症状。然而,这些癌症治疗可能导致免疫受损状态和随后的致病性感染,因此,本发明也延伸到联合治疗,其使用本文所述的式I、SEQ ID NO:1或SEQ ID NO:2的蛋白分子或变体、癌症治疗剂和抗感染剂,所述抗感染剂对由癌症治疗引起的免疫受损状态发展的感染或具有增加的由癌症治疗引起的免疫受损状态发展风险的感染有效。抗感染药物适当地选自抗微生物剂,其可以包括但不限于杀死或抑制微生物如病毒、细菌、酵母、真菌、原生动物等生长的化合物,且因此,包括抗生素类(antibiotics)、抗阿米巴药类(amebicides,)、抗真菌药类(antifungals)、抗原生动物药类(antiprotozoals)、抗疟药类(antimalarials)、抗结核药类(antituberculotics)和抗病毒药类(antivirals)。抗感染药物还在其范围内包括驱肠虫药类(anthelmintics)和杀线虫剂类(nematocides)。示例性抗生素类包括喹诺酮类(quinolones)(例如氨氟沙星(amifloxacin)、西诺沙星(cinoxacin)、环丙沙星(ciprofloxacin)、依诺沙星(enoxacin)、氟罗沙星(fleroxacin)、氟甲喹(flumequine)、洛美沙星(lomefloxacin)、萘啶酸(nalidixic acid)、诺氟沙星(norfloxacin)、氧氟沙星(ofloxacin)、左氧氟沙星(levofloxacin)、洛美沙星(lomefloxacin)、奥索利酸(oxolinic acid)、培氟沙星(pefloxacin)、罗索沙星(rosoxacin)、替马沙星(temafloxacin)、托氟沙星(tosufloxacin)、司帕沙星(sparfloxacin)、克林沙星(clinafloxacin)、加替沙星(gatifloxacin)、莫西沙星(moxifloxacin)、吉米沙星(gemifloxacin)和加雷沙星(garenoxacin));四环素类(tetracyclines);甘氨酰四环素类(glycylcycline)和唑烷酮类(oxazolidinones)(例如氯四环素(chlortetracycline)、地美环素(demeclocycline)、多西环素(doxycycline)、赖甲环素(lymecycline)、美他环素(methacycline)、米诺环素(minocycline)、土霉素(oxytetracycline)、四环素(tetracycline)、替加环素(tigecycline)、利奈唑胺(linezolide)、依哌唑胺(eperozolid));糖肽类(glycopeptides);氨基糖苷类(aminoglycosides)(例如阿米卡星(amikacin)、阿贝卡星(arbekacin)、布替罗星(butirosin)、地贝卡星(dibekacin)、福提米星(fortimicins)、庆大霉素(gentamicin)、卡那霉素(kanamycin)、美浓霉素(minomycin)、奈替米星(netilmicin)、核糖霉素(ribostamycin)、西索米星(sisomicin)、大观霉素(spectinomycin)、链霉素(streptomycin)、妥布霉素(tobramycin));β-内酰胺类(β-lactams)(例如亚胺培南(imipenem)、美罗培南(meropenem)、比阿培南(biapenem)、头孢克洛(cefaclor)、头孢羟氨苄(cefadroxil)、头孢孟多(cefamandole)、头孢曲秦(cefatrizine)、头孢吡酮(cefazedone)、头孢唑啉(cefazolin)、头孢克肟(cefixime)、头孢甲肟(cefmenoxime)、头孢地嗪(cefodizime)、头孢尼西(cefonicid)、头孢哌酮(cefoperazone)、头孢雷特(ceforanide)、头孢噻肟(cefotaxime)、头孢替安(cefotiam)、头孢咪唑(cefpimizole)、头孢匹胺(cefpiramide)、头孢泊肟(cefpodoxime)、头孢磺啶(cefsulodin)、头孢他啶(ceftazidime)、头孢特仑(cefteram)、头孢替唑(ceftezole)、头孢布烯(ceftibuten)、头孢唑肟(ceftizoxime)、头孢曲松(ceftriaxone)、头孢呋辛(cefuroxime)、头孢唑喃(cefuzonam)、头孢赛曲(cephacetrile)、头孢氨苄(cephalexin)、头孢来星(cephaloglycin)、头孢噻啶(cephaloridine)、头孢噻吩(cephalothin)、头孢匹林(cephapirin)、头孢拉定(cephradine)、头孢美唑(cefinetazole)、头孢西丁(cefoxitin)、头孢替坦(cefotetan)、氨曲南(azthreonam)、卡芦莫南(carumonam)、氟氧头孢(flomoxef)、拉氧头孢(moxalactam)、美西林(amdinocillin)、阿莫西林(amoxicillin)、氨苄西林(ampicillin)、阿洛西林(azlocillin)、羧苄西林(carbenicillin)、苄青霉素(benzylpenicillin)、卡非西林(carfecillin)、氯唑西林(cloxacillin)、双氯西林(dicloxacillin)、甲氧西林(methicillin)、美洛西林(mezlocillin)、奈夫西林(nafcillin)、苯唑西林(oxacillin)、青霉素G(penicillin G)、哌拉西林(piperacillin)、磺苄西林(sulbenicillin)、替莫西林(temocillin)、替卡西林(ticarcillin)、头孢托仑(cefditoren)、SC004、KY-020、头孢地尼(cefdinir)、头孢布烯(ceftibuten)、FK-312、S-1090、CP-0467、BK-218、FK-037、DQ-2556、FK-518、头孢唑兰(cefozopran)、ME1228、KP-736、CP-6232、Ro 09-1227、OPC-20000、LY206763);利福霉素类(rifamycins);大环内酯类(macrolides)(例如阿奇霉素(azithromycin)、克拉霉素(clarithromycin)、红霉素(erythromycin)、竹桃霉素(oleandomycin)、罗他霉素(rokitamycin)、蔷薇霉素(rosaramicin)、罗红霉素(roxithromycin)、醋竹桃霉素(troleandomycin));酮内酯类(ketolides)(例如泰利霉素(telithromycin)、喹红霉素(cethromycin));香豆霉素类(coumermycins);林可酰胺类(lincosamides)(例如克林霉素(clindamycin)、林可霉素(lincomycin))和氯霉素(chloramphenicol)。
示例性抗病毒药类包括硫酸阿巴卡韦(abacavir sulfate)、阿昔洛韦钠(acyclovir sodium)、盐酸金刚烷胺(amantadine hydrochloride)、安普那韦(amprenavir)、西多福韦(cidofovir)、甲磺酸地拉韦定(delavirdine mesylate)、地达诺新(didanosine)、依非韦伦(efavirenz)、泛昔洛韦(famciclovir)、福米韦生钠(fomivirsen sodium)、膦甲酸钠(foscarnet sodium)、更昔洛韦(ganciclovir)、硫酸茚地那韦(indinavir sulfate)、拉米夫定(lamivudine)、拉米夫定/齐多夫定(lamivudine/zidovudine)、甲磺酸奈非那韦(nelfinavir mesylate)、奈韦拉平(nevirapine)、磷酸奥司他韦(oseltamivir phosphate)、利巴韦林(ribavirin)、盐酸金刚乙胺(rimantadinehydrochloride)、利托那韦(ritonavir)、沙奎那韦(saquinavir)、甲磺酸沙奎那韦(saquinavir mesylate)、司他夫定(stavudine)、盐酸伐昔洛韦(valacyclovirhydrochloride)、扎西他滨(zalcitabine)、扎那米韦(zanamivir)和齐多夫定(zidovudine)。
合适的抗阿米巴药类或抗原生动物药类包括但不限于:阿托伐醌(atovaquone)、盐酸氯喹(chloroquine hydrochloride)、磷酸氯喹(chloroquine phosphate)、甲硝唑(metronidazole)、盐酸甲硝唑(metronidazole hydrochloride)和依西酸喷他脒(pentamidine isethionate)。驱虫药可以是选自甲苯咪唑(mebendazole)、双羟萘酸噻嘧啶(pyrantel pamoate)、阿苯达唑(albendazole)、伊维菌素(ivermectin)和噻苯哒唑(thiabendazole)中的至少一种。示例性抗真菌药类可以选自两性霉素B(amphotericinB)、两性霉素B胆固醇硫酸盐复合物(amphotericin B cholesteryl sulfate complex)、两性霉素B脂质复合物(amphotericin B lipid complex)、两性霉素B脂质体(amphotericinBliposomal)、氟康唑(fluconazole)、氟胞嘧啶(flucytosine)、灰黄霉素微粒(griseofulvin microsize)、灰黄霉素超微粒(griseofulvin ultramicrosize)、伊曲康唑(itraconazole)、酮康唑(ketoconazole)、制霉菌素(nystatin)和盐酸特比萘芬(terbinafine hydrochloride)。合适的抗疟药类包括但不限于:盐酸氯喹(chloroquinehydrochloride)、磷酸氯喹(chloroquine phosphate)、多西环素(doxycycline)、硫酸羟基氯喹(hydroxychloroquine sulfate)、盐酸甲氟喹(mefloquine hydrochloride)、磷酸伯氨喹(primaquine phosphate)、乙胺嘧啶(pyrimethamine)和乙胺嘧啶-磺胺多辛(pyrimethamine with sulfadoxine)。抗结核药类包括但不限于:氯法齐明(clofazimine)、环丝氨酸(cycloserine)、氨苯砜(dapsone)、盐酸乙胺丁醇(ethambutolhydrochloride)、异烟肼(isoniazid)、吡嗪酰胺(pyrazinamide)、利福布汀(rifabutin)、利福平(rifampin)、利福喷丁(rifapentine)和硫酸链霉素(streptomycin sulfate)。
如前所述,为方便有效地施用,可以使用合适的药学上可接受的载体将蛋白分子配制成有效量的剂量单位形式。在一些实施方案中,单位剂型可以包含约0.25μg至约2000mg的范围内的量的本发明的活性肽。本发明的活性肽可以存在于约0.25μg至约2000mg/mL的量的载体上。在药物组合物包含一种或更多种另外的活性成分的实施方案中,剂量通过参考所述成分的常用剂量和施用方式来确定。
4.方法
根据本发明,本发明的蛋白分子可以用于改变PKC-θ过表达细胞的形成、增殖、维持、EMT或MET中的至少一种的方法。本发明的蛋白分子可以用于治疗或预防受试者中涉及PKC-θ过表达的状况,如癌症。
因此,在本发明的另一个方面,提供一种分离或纯化的本发明的蛋白分子,特别是式I、SEQ ID NO:1或SEQ ID NO:2的蛋白分子或者本文所述的肽变体用于治疗的用途。
在本发明的再一个方面,提供一种分离或纯化的本发明的蛋白分子,特别是式I、SEQ ID NO:1或SEQ ID NO:2的蛋白分子或者本文所述的肽变体在制备用于治疗的药物中的用途。
在本发明的又一个方面,提供一种分离或纯化的本发明的蛋白分子,特别是式I、SEQ ID NO:1或SEQ ID NO:2的蛋白分子或者本文所述的肽变体,其用于治疗。
在本发明的再一个方面,提供一种抑制或减少PKC-θ过表达细胞中PKC-θ核易位的方法,该方法包括使PKC-θ过表达细胞与本发明的蛋白分子,特别是式I、SEQ ID NO:1或SEQID NO:2的蛋白分子或者本文所述的肽变体接触。
本发明还提供本发明的蛋白分子,特别是式I、SEQ ID NO:1或SEQ IDNO:2的蛋白分子或者本文所述的肽变体,用于抑制或减少PKC-θ过表达细胞中PKC-θ核易位的用途。
存在许多涉及PKC-θ过表达的状况,在这些状况中本发明的蛋白分子可能是有用的。因此,在本发明的另一方面,提供一种治疗或预防受试者中在PKC-θ抑制与有效治疗相关方面的状况的方法,该方法包括向受试者施用本发明的蛋白分子,特别是式I、SEQ IDNO:1或SEQ ID NO:2的蛋白分子或者本文所述的肽变体。
本发明还考虑了本发明的蛋白分子,特别是式I、SEQ ID NO:1或SEQ ID NO:2的蛋白分子或者本文所述的肽变体在制备药物中的用途,所述药物用于治疗或预防受试者中在PKC-θ抑制与有效治疗相关方面的状况
在本发明的又一个方面,提供一种本发明的蛋白分子,特别是式I、SEQ ID NO:1或SEQ ID NO:2的蛋白分子或者本文所述的肽变体的用于治疗或预防受试者中在PKC-θ抑制与有效治疗相关方面的状况的用途。
在本发明的另一个方面,提供一种本发明的蛋白分子,特别是式I、SEQ ID NO:1或SEQ ID NO:2的蛋白分子或者本文所述的肽变体,其用于治疗或预防受试者中在PKC-θ抑制与有效治疗相关方面的状况。
涉及PKC-θ过表达的状况可以包括但不限于癌症、神经与血管紊乱如唐氏综合症、记忆与认知障碍、痴呆、淀粉样神经病、脑炎、神经与脑创伤、血管淀粉样变性、抑郁症或淀粉样变性脑出血;急性与慢性呼吸道道紊乱,如支气管炎、阻塞性支气管炎、痉挛性支气管炎、过敏性支气管炎、过敏性哮喘、支气管哮喘、肺气肿或慢性阻塞性肺病(COPD);皮肤病,如银屑病、中毒性与过敏性接触性湿疹、特应性湿疹、脂溢性湿疹、单纯性苔藓、晒伤、肛门生殖器瘙痒、斑秃、肥大性瘢痕、盘状红斑狼疮、脓泡性和广泛性脓皮病、内源性和外源性痤疮或酒渣鼻;关节炎状况,如类风湿性关节炎、类风湿性脊椎炎、骨关节炎或其他关节炎状况;获得性免疫缺陷综合症(AIDS);多发性硬化;人类免疫缺陷病毒(HIV)感染;感染性休克;成人呼吸窘迫综合征;移植物抗宿主反应;器官或组织同种异体移植物或异种移植物的急性或慢性排斥;克罗恩病;溃疡性结肠炎;炎症性肠病;过敏性鼻炎或鼻窦炎;过敏性结膜炎;鼻息肉自身免疫性疾病或尿崩症。
在本发明的再一个方面,提供一种改变PKC-θ过表达细胞的(i)形成、(ii)增殖、(iii)维持、(iv)上皮细胞向间充质细胞转化或者(v)间充质细胞向上皮细胞转化中的至少一种的的方法,该方法包括使所述PKC-θ过表达细胞与分离或纯化的本发明的蛋白分子,特别是式I、SEQ ID NO:1或SEQ IDNO:2的蛋白分子或者本文所述的肽变体接触。
在本发明的又一个方面,提供一种分离或纯化的本发明的蛋白分子,特别是由式I表示的蛋白分子或者包含SEQ ID NO:1、SEQ ID NO:2的氨基酸序列、由该氨基酸序列组成或基本上由该氨基酸序列组成的蛋白分子或本文所述的蛋白分子变体在制备药物中的用途,所述药物用于改变PKC-θ过表达细胞的(i)形成、(ii)增殖、(iii)维持、(iv)上皮细胞向间充质细胞转化或者(v)间充质细胞向上皮细胞转化中的至少一种。
在本发明的再一个方面,提供一种分离或纯化的本发明的蛋白分子,特别是式I、SEQ ID NO:1或SEQ ID NO:2的蛋白分子或者本文所述的肽变体,其用于改变PKC-θ过表达细胞的(i)形成、(ii)增殖、(iii)维持、(iv)上皮细胞向间充质细胞转化或者(v)间充质细胞向上皮细胞转化中的至少一种。
在一些实施方案中,本发明的蛋白分子导致减少、损害、下调(abrogation)或预防PKC-θ过表达细胞的(i)形成、(ii)增殖、(iii)维持或者(iv)EMT;以及/或其中增强PKC-θ过表达细胞的(v)MET。
在本发明的另一方面,提供一种分离或纯化的本发明的蛋白分子,特别是由式I表示的蛋白分子或者包含SEQ ID NO:1、SEQ ID NO:2的氨基酸序列、由该氨基酸序列组成或基本上由该氨基酸序列组成的蛋白分子或本文所述的蛋白分子变体在制备药物中的用途,所述药物用于减少、损害、下调或预防PKC-θ过表达细胞的(i)形成、(ii)增殖、(iii)维持或者(iv)EMT;以及/或增强PKC-θ过表达细胞的(v)MET。
合适的PKC-θ过表达细胞可以包括但不限于:乳腺细胞、前列腺细胞、肺细胞、膀胱细胞、胰腺细胞、结肠细胞、黑素瘤细胞、肝细胞或神经胶质细胞,尤其是乳腺细胞。在具体的实施方案中,PKC-θ过表达细胞是乳腺上皮细胞,尤其是乳腺导管上皮细胞。
在具体的实施方案中,PKC-θ过表达细胞是CSC或非CSC肿瘤细胞,优选CSC肿瘤细胞。在一些实施方案中,CSC肿瘤细胞表达CD24和CD44,特别是CD44高,CD24低。
在本发明的再一个方面,提供一种治疗或预防受试者癌症的方法,其中所述癌症含有至少一种PKC-θ过表达细胞,该方法包括向受试者施用分离或纯化的本发明的蛋白分子,特别是由式I表示的蛋白分子或者包含SEQ ID NO:1、SEQ ID NO:2的氨基酸序列、由该氨基酸序列组成或基本上由该氨基酸序列组成的蛋白分子或本文所述的蛋白分子变体。
在一些实施方案中,本发明的蛋白分子用于治疗、预防和/或缓解恶性肿瘤,特别是转移性癌症的症状。在优选的实施方案中,本发明的蛋白分子用于治疗、预防和/或缓解转移性癌症的症状。
在本发明的又一个方面,提供一种分离或纯化的本发明的蛋白分子,特别是由式I表示的蛋白分子或者包含SEQ ID NO:1、SEQ ID NO:2的氨基酸序列、由该氨基酸序列组成或基本上由该氨基酸序列组成的蛋白分子或本文所述的蛋白分子变体在制备药物中的用途,所述药物用于治疗或预防受试者癌症,其中所述癌症含有至少一种PKC-θ过表达细胞。
在本发明的另一个方面,提供一种分离或纯化的本发明的蛋白分子,特别是式I、SEQ ID NO:1或SEQ ID NO:2的蛋白分子或者本文所述的肽变体,其用于治疗或预防受试者癌症,其中所述癌症含有至少一种PKC-θ过表达细胞。
本发明还考虑了分离或纯化的本发明的蛋白分子,特别是本文所述的式I、SEQ IDNO:1或SEQ ID NO:2或者肽变体的蛋白分子用于治疗或预防受试者癌症的用途,其中所述癌症含有至少一种PKC-θ过表达细胞。
本发明的蛋白分子适用于治疗以下个体:已被诊断患有癌症、怀疑患有癌症、已知易患且被认为有可能发展成癌症,或者被认为有可能先前治疗过的癌症复发。癌症可能是激素受体阳性或激素受体阴性。在一些实施方案中,癌症是激素受体阴性的,因此对激素或内分泌治疗具有抗性。在癌症是乳腺癌的一些实施方案中,乳腺癌是激素受体阴性的。在一些实施方案中,乳腺癌是雌激素受体阴性和/或孕酮受体阴性。
在具体的实施方案中,所述方法和用途涉及施用一种或更多种如上文第3节中所述的其他活性剂,如另外的癌症治疗和/或抗感染剂,特别是癌症治疗,尤其是化学治疗剂。一种或更多种其他活性剂和蛋白分子可以单独、同时或顺序施用。
本领域技术人员充分知晓用于评价PKC-θ抑制的适合测定,如抑制核易位,以及确定为PKC-θ抑制剂的蛋白分子,例如如下所述的测定:Sutcliffe等人(2012)FrontImmunol,3:260;Ghildyal等人(2009)J Virol,83(11):5353-5362;在Sittampalam等人Assay Guidance Munal[网页]中的Riss TL等人(2013)细胞活力检测,贝塞斯达(美国马里兰州):礼来公司和美国国家推进转化科学中心,可获得处:http://www.ncbi.nlm.nih.gov/books/NBK144065/;US 2005222186;Li等人(2011)J BiomolScreen,16(2):141-154;以及Zhang等人(2010)FEBS Letters,584(22):4646-4654.
实施例
现在将参考以下实施例描述本发明的某些实施方案,这些实施例仅用于说明目的,并不意图限制上文所述的一般性的范围。
除非另有说明,否则用于合成和测试肽的所有材料和试剂可以商购获得,例如,购自西格玛奥德里奇公司、Novabiochem公司、Abcam公司和美国典型微生物菌种保藏中心(ATCC)。
实施例1合成importinib肽
使用温和的Fmoc化学方法利用自动化现代固相肽合成和纯化技术合成Importinib4759和importinib4759_O1(表4),所述Fmoc化学方法,例如Ensenat-Waser等人(2002)IUBMB Life,54:33-36和WO 2002/010193中所述。使用自动化制备型反相高效液相色谱(RP-HPLC)纯化肽。使用分析型RP-HPLC和质谱分析级分。将98%纯度或更高纯度的级分合并,得到最终产物。
表4:Importinib肽序列
| 名称 | SEQ ID NO | 氨基酸序列 |
| Importinib4759 | 1 | RKEIDPPFRPKVK-OH |
| Importinib4759_O1 | 2 | RRKRIDWPPRRKPK-OH |
在体外测试中测试的所有肽通过N末端氨基酸的N末端氨基被豆蔻酰化。在去保护和纯化肽之前,如上所述,使用标准N,N'-二异丙基碳二亚胺(DIC)/羟基苯并三唑(HOBt)偶联将肉豆蔻酸共价偶联至N末端残基进行肉豆蔻酰化。
使用N-肉豆蔻酰化肽进行以下实施例中描述的所有测试。
实施例2 Importinib肽特异性阻断核PKC-θ易位而不影响其他PKC异构体和输入蛋白(importin)
将MCF7细胞与1mL完全杜尔贝科(Dulbecco's)改良Eagle培养基(DMEM)预先接种于12孔板的无菌盖玻片上过夜,然后与50μMimportinib4759(根据实施例1合成)和importinib4759_O1(根据实施例1合成)孵育24小时。当用0.65ng/mL佛波醇12-肉豆蔻酸酯13-乙酸酯(PMA)刺激MCF7细胞60小时时,未除去测试肽。二乙基焦碳酸酯(DEPC)水用于对照(测试肽溶解在无菌DEPC水中)。用杜尔贝科磷酸盐缓冲盐水(DPBS)洗涤两次后,盖玻片上的样品用4%多聚甲醛固定10分钟,并分别用PKC-θ(Cat.SC-212)、PKC-θ-Phosphor-T538、PKC-β2、PKC-α、Importinα或者Importin 8一抗以及缀合的Alexa-488二抗染色。细胞核用抗褪色2-(4-脒基苯基)-6-吲哚胍(indolecarbamidine)二盐酸盐(DAPI)染色。当样品干燥过夜,使用尼康荧光显微镜拍照。使用ImageJ软件分析密度。Fn/c用下式计算:Fn/c=(核密度-背景密度)/(细胞质密度-背景密度)。
Importinib4759和importinib4759_O1能够阻断核PKC-θ(图1的A图和图1的B图;与对照相比p<0.0001)。然而,与importinib4759相比,importinib4759_O1具有显著更高的阻止PKC-θ易位的能力。Importinib4759_O1不影响其他PKC亚型如PKC-α和PKC-β2(图1的C图)以及输入蛋白如Importinα和Importin 8(图1的D图)的分布(与对照相比p=不显著)。
实施例3 Importinib肽抑制MCF-IM模型中CD44高CD24低癌症干细胞的形成
将5×104MCF7细胞与1mL完全DMEM接种于12孔板中过夜,再用importinib4759(50μM和100μM;根据实施例1合成)或importinib4759_O1(25μM和50μM;根据实施例1合成)处理细胞24小时,然后用PMA刺激60小时。通过胰蛋白酶消化收获样品,接着用含2%热灭活胎牛血清(HI-FBS)的DPBS洗涤。使用抗人CD44-APC、抗人CD24-PE、Hoechst和抗人EpCAM抗体混合物进行FACS染色。由BD FACSLSR-II流式细胞仪收集数据。使用Treestar FlowJo进行数据分析。
importinib4759和importinib4759_O1均抑制癌症干细胞的形成(图2的A图和图2的B图;与对照相比p=0.0079)。
实施例4Importinib肽减少MDA-MB-231模型中CD44高CD24低癌症干细胞的形成
将5×104MDA-MB-231与1mL完全DMEM接种于12孔板中过夜,再用importinib4759(50μM和100μM;根据实施例1合成)或importinib4759_O1(25μM和50μM;根据实施例1合成)处理细胞48小时,然后通过胰蛋白酶消化收获样品,接着用含2%HI-FBS的DPBS洗涤。使用抗人CD44-APC、抗人CD24-PE、Hoechst和抗人EpCAM抗体混合物进行FACS染色。由BDFACSLSR-II流式细胞仪收集数据。使用Treestar FlowJo进行数据分析。
用50μM或100μM importinib4759处理后检测到癌症干细胞显著减少(图3的A图和图3的B图;与对照相比p=<0.0001)。Importinib4759_O1几乎清除了所有MDA-MB-231细胞,而相同浓度的抑制剂对MCF7上皮细胞影响很小(图3的B图和图3的C图;与对照相比p<0.0001)。
实施例5Importinib4759_O1显著阻断转录因子NF-κB p65和p53的核易位并增强肿瘤抑制蛋白如Rb
将MCF7细胞与1mL完全DMEM预先接种于12孔板中的无菌盖玻片上并过夜,然后用50μM importinib4759_O1(根据实施例1合成)抑制24小时。当用0.65ng/mL PMA刺激MCF7细胞60小时时,Importinib4759_O1已去除。使用DEPC水作为对照(将importinib4759_O1溶解在无菌DEPC水)。用DPBS洗涤两次后,盖玻片上的样品用4%多聚甲醛固定10分钟,并用p65、Rb或者p53一抗以及缀合的Alexa-488二抗染色。细胞核用抗褪色DAPI染色。当样品干燥过夜时,使用尼康荧光显微镜拍照。使用ImageJ软件分析密度。Fn/c用下式计算:Fn/c=(核密度-背景密度)/(细胞质密度-背景密度)。
Importinib4759_O1显著抑制了NF-κB转录因子p65和p53的核表达(图4;分别p=0.0033和0.0009)。Importinib4759_O1增强了肿瘤抑制蛋白Rb的表达(图4;p=0.0007)。
实施例6靶向其他PKC亚型的肽抑制剂对PKC-θ核转运无影响
基于PKC-β1、PKC-ε和PKC-δ核定位信号分别设计了nPKC-β1、nPKC-ε和nPKC-δ的肽抑制剂。这些肽的序列如表5所示。使用实施例1的方法合成这些肽并进行N-豆蔻酰化。
表5:肽抑制剂序列
| 肽抑制剂 | 氨基酸序列 |
| nPKC-β1 | RKEIQPPYKPKAR |
| nPKC-ε | KKIKPPFKPRIKTKR |
| nPKC-δ | KRRLEPPFRPKVK |
将MCF7细胞与1mL完全DMEM预先接种于12孔板中的无菌盖玻片上过夜,然后分别用50μM nPKC-β1、nPKC-ε或nPKC-δ肽抑制剂抑制24小时。当用0.65ng/mL PMA刺激MCF7细胞60小时时,未除去抑制剂。DEPC水用于对照(测试肽溶解在无菌DEPC水中)。用DPBS洗涤两次后,盖玻片上的样品用4%多聚甲醛固定10分钟,并用PKC-θ-phosphor-T538一抗以及缀合的Alexa-488二抗染色。细胞核用抗褪色DAPI染色。当样品干燥过夜时,使用尼康荧光显微镜拍照。使用ImageJ软件分析密度。Fn/c用下式计算:Fn/c=(核密度-背景密度)/(细胞质密度-背景密度)。
nPKC-β1、nPKC-δ或nPKC-ε肽抑制剂对PKC-θ的核定位无影响(图5)。
实施例7 importinib肽对Balb/c裸鼠MDA-MB-231异种移植乳腺癌模型的影响
使用Balb/c裸鼠MDA-MB-231异种移植乳腺癌模型来确定单独importinib肽以及与化学治疗剂多烯紫杉醇(Docetaxel)组合与随机肽对照相比较的效果。
向5周龄Balb/c裸鼠(每种测试化合物n=5)注射MDA-MB-231人乳腺癌细胞悬浮液(与25μL BD Matrigel基质混合的25μL PBS中的2×106细胞)皮下注入右乳腺。将在盐水媒介物中[4mg/kg多烯紫杉醇;8mg/kg、40mg/kg和60mg/kg importinib4759或importinib4759_O1(根据实施例1合成);4mg/kg多烯紫杉醇与8mg/kg importinib4759或importinib4759_O1;4mg/kg多烯紫杉醇与40mg/kg importinib4759或importinib4759_O1;4mg/kg多烯紫杉醇与60mg/kg importinib4759或importinib4759_O1;或随机肽对照]中的测试化合物腹膜内注射。在治疗后的五周时间段内,每天使用卡尺评估肿瘤体积。五周时间段后处死动物。用切除术除去肿瘤移植物并处理成单细胞悬浮液。使用FACS分析确定癌症干细胞的百分比。使用抗人CD44-APC、抗人CD24-PE、Hoechst和抗人EpCAM抗体混合物进行FACS染色。由BD FACSLSR-II流式细胞仪收集数据。使用Treestar FlowJo进行数据分析。使用单向ANOVA或Mann-Whitney T检验确定显著性。
随时间推移施用importinib4759显著减少了肿瘤体积(图6;总体p=0.003)。然而,importinib4759和多烯紫杉醇的组合使肿瘤体积明显减少,与对照或单独多烯紫杉醇治疗相比,联合治疗和importinib4759治疗均使肿瘤体积下调。Importinib4759优先选择癌症干细胞(CD44高CD24低),单独importinib4759治疗和与多烯紫杉醇的联合治疗均使癌症干细胞群显著下调(图7;总体p=0.0317)。
同样地,随时间推移施用importinib4759_O1减少了肿瘤体积,与importinib4759_O1和多烯紫杉醇的组合使肿瘤体积明显减少(图8;总体p=0.0079)。与对照或单独多烯紫杉醇治疗相比,联合治疗和importinib4759_O1治疗均使肿瘤体积下调。单独Importinib4759_O1治疗和与多烯紫杉醇的联合治疗均使癌症干细胞群显著下调(图9;总体p=0.0286)。
实施例8Importinib4759抑制剂对MDA-MB-231异种移植乳腺癌细胞中癌症干细胞标志物表达的影响
使用共聚焦激光扫描显微镜评价Importinib4759对来自Balb-c裸小鼠的MDA-MB-231异种移植乳腺癌细胞中癌症干细胞标志物表达的影响。
按照实施例7的方法处理和制备来自Balb-c裸小鼠的MDA-MB-231异种移植乳腺癌细胞。测试化合物包括对照(盐水)、多烯紫杉醇(4mg/kg)、importinib4759(40mg/kg;根据实施例1合成)或者importinib4759(40mg/kg)与多烯紫杉醇(4mg/kg)的组合。单细胞悬浮液用3.7%甲醛固定并用2%Triton-X-100透化,以及再用针对CSV的原代小鼠抗体、针对PDL1的原代山羊抗体和针对磷酸化LSD1的原代兔抗体(LSD1p;赖氨酸特异性组蛋白去甲基化酶1A)或PKC-θ进行检测,接着用与抗小鼠Alexa-Fluor 568、抗山羊Alexa-Fluor 633或抗兔Alexa-Fluor 488缀合的相应二抗。细胞核用抗褪色DAPI染色。每个样品计算至少20个单个细胞的TNFI(总核荧光强度)或TCFI(总细胞质荧光强度)值。显示的数据代表分组到收集时间点的平均值±SE。
单独多烯紫杉醇处理增加了存活的抗性癌细胞中癌症干细胞标志物的表达(图10-13)。单独用importinib4759处理细胞和与多烯紫杉醇的联合处理细胞均使癌症干细胞标志物(侵袭转移性癌症的标志物)的表达显著下调。
实施例9importinib4759对在MDA-MB-231异种移植乳腺癌细胞中癌症相关成纤维细胞(CAF)和巨噬细胞标志物表达的影响
使用共聚焦激光扫描显微镜评价Importinib4759对来自Balb-c裸小鼠的MDA-MB-231异种移植乳腺癌细胞中癌症相关成纤维细胞(CAF)和巨噬细胞表达的影响。
按照实施例7的方法处理和制备来自Balb-c裸小鼠的MDA-MB-231异种移植乳腺癌细胞。测试化合物包括对照(盐水)、多烯紫杉醇(4mg/kg)、importinib4759(40mg/kg;根据实施例1合成)或importinib4759(40mg/kg)与多烯紫杉醇(4mg/kg)的组合。单细胞悬浮液用3.7%甲醛固定并用2%Triton-X-100透化,然后用以下检测:一组CAF特征(signature)抗体[针对FAP(成纤维细胞激活蛋白)的小鼠一抗、针对CCL2(趋化因子(C-C基序)配体2)的山羊一抗和针对LSD1(赖氨酸特异性组蛋白去甲基化酶1A;PKC-θ的靶)的兔一抗]或M1巨噬细胞标志物[针对CCR7(C-C趋化因子受体7)的小鼠一抗、针对CD38(分化簇38)的山羊一抗和针对LSD1p(PKC-θ的靶)的兔一抗],接着用与抗小鼠Alexa-Fluor 568、抗山羊Alexa-Fluor 633或抗兔Alexa-Fluor 488缀合的相应二抗。细胞核用抗褪色DAPI染色。每个样品计算至少20个单个细胞的TNFI或TCFI值。显示的数据代表分组到收集时间点的平均值±SE。
CAF负责产生有助于诱导癌症干细胞特征(signature)并促进肿瘤发生、转移和抗性的肿瘤微环境。
单独用多烯紫杉醇处理显著增加了存活的抗性癌细胞中CAF标志物[FAP、非磷酸化LSD1(LSD1np)和CCL2]的表达(图14和15;所有标志物的p<0.0001)。相反地,单独用importinib4759处理(与对照相比,FAP的p=0.0018、LSD1np的p<0.0001、CCL2的p<0.0001)或与多烯紫杉醇的联合治疗(与对照相比,所有标志物的p<0.0001)使CAF标志物的表达下调。
M1巨噬细胞标志物的表达是肿瘤免疫的指示物。多烯紫杉醇处理后M1巨噬细胞标志物CCR7和CD38的表达未受影响(图16和17;两种标记物的p=不显著)。接着用importinib4759处理(与对照相比,LSD1p的p<0.0001、CCR7的p<0.0001、CD38的p=0.0003)和importinib4759与多烯紫杉醇的组合处理(LSD1p的p<0.0001,CCR7的p<0.0001,CD38的p<0.0001),M1巨噬细胞标志物的表达增强。
本文引用的每个专利,专利申请和出版物的公开内容均通过引用整体并入本文。
本申请提供了以下内容:
项目1.一种改变PKC-θ过表达细胞的(i)形成、(ii)增殖、(iii)维持、(iv)上皮细胞向间充质细胞转化或者(v)间充质细胞向上皮细胞转化中至少一种的方法,所述方法包括使所述PKC-θ过表达细胞与由式I表示的分离或纯化的蛋白分子接触:
Z1X1X2X3X4IDX5PPX6X7X8X9X10X11Z2(I)
其中,
“Z1”和“Z2”独立地不存在,或者独立地选自蛋白部分和保护部分的至少一种,所述蛋白部分包含约1个至约50个氨基酸残基;
“X1”不存在,或者选自包括R、K及其修饰形式的碱性氨基酸残基;
“X2”和“X3”独立地选自包括R、K及其修饰形式的碱性氨基酸残基;
“X4”选自包括R、K、D、E及其修饰形式的带电荷氨基酸残基;
“X5”不存在,或者是W或其修饰形式;
“X6”选自包括F、Y、W、R、K及其修饰形式的芳香族氨基酸残基或碱性氨基酸残基;
“X7”选自包括R、K及其修饰形式的碱性氨基酸残基;
“X8”不存在,或者是P或其修饰形式;
“X9”选自包括R、K及其修饰形式的碱性氨基酸残基;
“X10”选自包括V、L、I、M及其修饰形式的疏水性残基和P及其修饰形式;
“X11”选自包括R、K及其修饰形式的碱性氨基酸残基。
项目2.根据项目1所述的方法,其中,所述PKC-θ过表达细胞是癌症干细胞肿瘤细胞或非癌症干细胞肿瘤细胞。
项目3.根据项目2所述的方法,其中,所述PKC-θ过表达细胞是癌症干细胞肿瘤细胞。
项目4.一种治疗或预防受试者癌症的方法,其中,所述癌症含有至少一种PKC-θ过表达细胞,该方法包括向受试者施用由项目1中定义的式I表示的分离或纯化的蛋白分子。
项目5.根据项目1-4中任一项所述的方法,其中,“X1”不存在,或者是R。
项目6.根据项目1-5中任一项所述的方法,其中,“X2”是R。
项目7.根据项目1-6中任一项所述的方法,其中,“X3”是K。
项目8.根据项目1-7中任一项所述的方法,其中,“X4”是E或R。
项目9.根据项目1-8中任一项所述的方法,其中,“X5”不存在,或者是W。
项目10.根据项目1-9中任一项所述的方法,其中,“X6”是F或R。
项目11.根据项目1-10中任一项所述的方法,其中,“X7”是R。
项目12.根据项目1-11中任一项所述的方法,其中,“X9”是K。
项目13.根据项目1-12中任一项所述的方法,其中,“X10”是V或P。
项目14.根据项目1-13中任一项所述的方法,其中,“X11”是K。
项目15.根据项目1-14中任一项所述的方法,其中,“Z1”是由式II表示的蛋白分子:
X12X13X14X15X16(II)
其中,
“X12”不存在,或者是保护部分;
“X13”不存在,或者选自P和包括R、K及其修饰形式的碱性氨基酸残基;
“X14”不存在,或者选自P和包括R、K及其修饰形式的碱性氨基酸残基;
“X15”不存在,或者选自P和包括R、K及其修饰形式的碱性氨基酸残基;
“X16”不存在,或者选自P和包括R、K及其修饰形式的碱性氨基酸残基。
项目16.根据项目1-15中任一项所述的方法,其中,“Z2”是由式III表示的蛋白分子:
X17X18X19X20(III)
其中,
“X17”不存在,或者选自任意氨基酸残基;
“X18”不存在,或者选自任意氨基酸残基;
“X19”不存在,或者选自任意氨基酸残基;
“X20”不存在,或者是保护部分。
项目17.根据项目1-14中任一项所述的方法,其中,“Z1”和“Z2”不存在。
项目18.根据项目1-17中任一项所述的方法,其中,式I的蛋白分子包含SEQ IDNO:1或SEQ ID NO:2所示的氨基酸序列、由该氨基酸序列组成或者基本上由该氨基酸序列组成:
RKEIDPPFRPKVK[SEQ ID NO:1]
或
RRKRIDWPPRRKPK[SEQ ID NO:2]。
项目19.根据项目1-18中任一项所述的方法,其中,式I的蛋白分子还包含至少一个膜穿透部分。
项目20.根据项目19所述的方法,其中,所述膜穿透部分是脂质部分。
项目21.根据项目20所述的方法,其中,所述膜穿透部分是肉豆蔻酰基基团。
项目22.根据项目19-21中任一项所述的方法,其中所述膜穿透部分与式I的蛋白分子的N末端或C末端氨基酸残基缀合。
项目23.一种由项目1中定义的式I表示的分离或纯化的蛋白分子在制备药物中的用途,所述药物用于改变PKC-θ过表达细胞的(i)形成、(ii)增殖、(iii)维持、(iv)上皮细胞向间充质细胞转化或者(v)间充质细胞向上皮细胞转化中的至少一种。
项目24.一种由项目1中定义的式I表示的分离或纯化的蛋白分子用于改变PKC-θ过表达细胞的(i)形成、(ii)增殖、(iii)维持、(iv)上皮细胞向间充质细胞转化或者(v)间充质细胞向上皮细胞转化中的至少一种的用途。
项目25.一种由项目1中定义的式I表示的分离或纯化的蛋白分子,用于改变PKC-θ过表达细胞的(i)形成、(ii)增殖、(iii)维持、(iv)上皮细胞向间充质细胞转化或者(v)间充质细胞向上皮细胞转化中的至少一种。
项目26.一种由项目1中定义的式I表示的分离或纯化的蛋白分子在制备药物中的用途,所述药物用于治疗或预防受试者癌症,其中所述癌症含有至少一种PKC-θ过表达细胞。
项目27.一种由项目1中定义的式I表示的分离或纯化的蛋白分子用于治疗或预防受试者癌症的用途,其中所述癌症含有至少一种PKC-θ过表达细胞。
项目28.一种由项目1中定义的式I表示的分离或纯化的蛋白分子,用于治疗或预防受试者癌症,其中所述癌症含有至少一种PKC-θ过表达细胞。
项目29.一种由项目1中定义的式I表示的分离或纯化的蛋白分子用于治疗的用途。
项目30.一种由项目1中定义的式I表示的分离或纯化的蛋白分子在制备药物中的用途,所述药物用于治疗。
项目31.一种由式I表示的分离或纯化的蛋白分子:
Z1X1X2X3X4IDX5PPX6X7X8X9X10X11Z2(I)
其中,
“Z1”和“Z2”独立地不存在,或者独立地选自蛋白部分和保护部分的至少一种,所述蛋白部分包含约1个至约50个氨基酸残基;
“X1”不存在,或者选自包括R、K及其修饰形式的碱性氨基酸残基;
“X2”和“X3”独立地选自包括R、K及其修饰形式的碱性氨基酸残基;
“X4”选自包括R、K、D、E及其修饰形式的带电荷氨基酸残基;
“X5”不存在,或者是W或其修饰形式;
“X6”选自包括F、Y、W、R、K及其修饰形式的芳香族氨基酸残基或碱性氨基酸残基;
“X7”选自包括R、K及其修饰形式的碱性氨基酸残基;
“X8”不存在,或者是P或其修饰形式;
“X9”选自包括R、K及其修饰形式的碱性氨基酸残基;
“X10”选自包括V、L、I、M及其修饰形式的疏水性残基和P或其修饰形式;
“X11”选自包括R、K及其修饰形式的碱性氨基酸残基;
其中,所述蛋白分子不是由SEQ ID NO:1的氨基酸序列组成的蛋白分子:
RKEIDPPFRPKVK[SEQ ID NO:1]。
项目32.根据项目31所述的蛋白分子,其中,“X1”不存在,或者是R。
项目33.根据项目31或32所述的蛋白分子,其中,“X2”是R。
项目34.根据项目31-33中任一项所述的蛋白分子,其中,“X3”是K。
项目35.根据项目31-34中任一项所述的蛋白分子,其中,“X4”是E或R。
项目36.根据项目31-35中任一项所述的蛋白分子,其中,“X5”不存在,或者是W。
项目37.根据项目31-36中任一项所述的蛋白分子,其中,“X6”是F或R。
项目38.根据项目31-37中任一项所述的蛋白分子,其中,“X7”是R。
项目39.根据项目31-38中任一项所述的蛋白分子,其中,“X9”是K。
项目40.根据项目31-39中任一项所述的蛋白分子,其中,“X10”是V或P。
项目41.根据项目31-40中任一项所述的蛋白分子,其中,“X11”是K。
项目42.根据项目31-41中任一项所述的蛋白分子,其中,所述蛋白分子包含SEQID NO:2的氨基酸序列、由该氨基酸序列组成或者基本上由该氨基酸序列组成:
RRKRIDWPPRRKPK[SEQ ID NO:2]。
项目43.一种组合物,包含项目31-42中任一项所述的蛋白分子和药学上可接受的载体或稀释剂。
Claims (35)
1.一种由下式I表示的分离或纯化的蛋白分子在制备用于改变PKC-θ过表达细胞的(i)形成、(ii)增殖、(iii)维持、(iv)上皮细胞向间充质细胞转化或者(v)间充质细胞向上皮细胞转化中至少一种的药物中的用途:
Z1X1X2X3X4IDX5PPX6X7X8X9X10X11Z2(I)
其中,
“Z1”和“Z2”独立地不存在,或者独立地选自蛋白部分和保护部分的至少一种,所述蛋白部分由1个至50个氨基酸残基组成;
“X1”不存在,或者选自包括R和K的碱性氨基酸残基;
“X2”和“X3”独立地选自包括R和K的碱性氨基酸残基;
“X4”选自包括R、K、D和E的带电荷氨基酸残基;
“X5”不存在,或者是W;
“X6”选自包括F、Y、W、R和K的芳香族氨基酸残基或碱性氨基酸残基;
“X7”选自包括R和K的碱性氨基酸残基;
“X8”不存在,或者是P;
“X9”选自包括R和K的碱性氨基酸残基;
“X10”选自包括V、L、I和M的疏水性残基和P;
“X11”选自包括R和K的碱性氨基酸残基。
2.根据权利要求1所述的用途,其中,所述PKC-θ过表达细胞是癌症干细胞肿瘤细胞或非癌症干细胞肿瘤细胞。
3.一种由权利要求1中定义的式I表示的分离或纯化的蛋白分子在制备药物中的用途,所述药物用于治疗或预防受试者癌症,其中,所述癌症含有至少一种PKC-θ过表达细胞。
4.一种由权利要求1中定义的式I表示的分离或纯化的蛋白分子在制备药物中的用途,所述药物用于疗法。
5.根据权利要求1-4中任一项所述的用途,其中,“X1”不存在,或者是R。
6.根据权利要求1-5中任一项所述的方法的用途,其中,“X2”是R。
7.根据权利要求1-6中任一项所述的方法的用途,其中,“X3”是K。
8.根据权利要求1-7中任一项所述的用途,其中,“X4”是E或R。
9.根据权利要求1-8中任一项所述的用途,其中,“X5”不存在,或者是W。
10.根据权利要求1-9中任一项所述的用途,其中,“X6”是F或R。
11.根据权利要求1-10中任一项所述的用途,其中,“X7”是R。
12.根据权利要求1-11中任一项所述的用途,其中,“X9”是K。
13.根据权利要求1-12中任一项所述的用途,其中,“X10”是V或P。
14.根据权利要求1-13中任一项所述的用途,其中,“X11”是K。
15.根据权利要求1-14中任一项所述的用途,其中,“Z1”是由式II表示的蛋白分子:
X12X13X14X15X16(II)
其中,
“X12”不存在,或者是保护部分;
“X13”不存在,或者选自P和包括R和K的碱性氨基酸残基;
“X14”不存在,或者选自P和包括R和K的碱性氨基酸残基;
“X15”不存在,或者选自P和包括R和K的碱性氨基酸残基;和
“X16”不存在,或者选自P和包括R和K及的碱性氨基酸残基。
16.根据权利要求1-15中任一项所述的用途,其中,“Z2”是由式III表示的蛋白分子:
X17X18X19X20(III)
其中,
“X17”不存在,或者选自任意氨基酸残基;
“X18”不存在,或者选自任意氨基酸残基;
“X19”不存在,或者选自任意氨基酸残基;
“X20”不存在,或者是保护部分。
17.根据权利要求1-14中任一项所述的用途,其中,“Z1”和“Z2”不存在。
18.根据权利要求1-17中任一项所述的用途,其中,式I的蛋白分子包含SEQ ID NO:1或SEQ ID NO:2所示的氨基酸序列、由该氨基酸序列组成或者基本上由该氨基酸序列组成:
RKEIDPPFRPKVK[SEQ ID NO:1]
或
RRKRIDWPPRRKPK[SEQ ID NO:2]。
19.根据权利要求1-18中任一项所述的用途,其中,式I的蛋白分子还包含至少一个膜穿透部分。
20.根据权利要求19所述的方法,其中,所述膜穿透部分是脂质部分。
21.根据权利要求20所述的方法或用途,其中,所述膜穿透部分是肉豆蔻酰基基团。
22.一种由式I表示的分离或纯化的蛋白分子:
Z1X1X2X3X4IDX5PPX6X7X8X9X10X11Z2(I)
其中,
“Z1”和“Z2”独立地不存在,或者独立地选自蛋白部分和保护部分的至少一种,所述蛋白部分由1个至50个氨基酸残基组成;
“X1”不存在,或者选自包括R和K的碱性氨基酸残基;
“X2”和“X3”独立地选自包括R和K及的碱性氨基酸残基;
“X4”选自包括R、K、D和E的带电荷氨基酸残基;
“X5”不存在,或者是W;
“X6”选自包括F、Y、W、R和K的芳香族氨基酸残基或碱性氨基酸残基;
“X7”选自包括R和K的碱性氨基酸残基;
“X8”不存在,或者是P;
“X9”选自包括R和K的碱性氨基酸残基;
“X10”选自包括V、L、I和M的疏水性残基和P;
“X11”选自包括R和K的碱性氨基酸残基;
其中,所述蛋白分子不是由SEQ ID NO:1的氨基酸序列组成的蛋白分子:
RKEIDPPFRPKVK[SEQ ID NO:1]。
23.根据权利要求22所述的蛋白分子,其中,“X1”不存在,或者是R。
24.根据权利要求22或23所述的蛋白分子,其中,“X2”是R。
25.根据权利要求22-24中任一项所述的蛋白分子,其中,“X3”是K。
26.根据权利要求22-25中任一项所述的蛋白分子,其中,“X4”是E或R。
27.根据权利要求22-26中任一项所述的蛋白分子,其中,“X5”不存在,或者是W。
28.根据权利要求22-27中任一项所述的蛋白分子,其中,“X6”是F或R。
29.根据权利要求22-28中任一项所述的蛋白分子,其中,“X7”是R。
30.根据权利要求22-29中任一项所述的蛋白分子,其中,“X9”是K。
31.根据权利要求22-30中任一项所述的蛋白分子,其中,“X10”是V或P。
32.根据权利要求22-31中任一项所述的蛋白分子,其中,“X11”是K。
33.根据权利要求22-32中任一项所述的蛋白分子,其中,所述蛋白分子包含SEQ IDNO:2的氨基酸序列、由该氨基酸序列组成或者基本上由该氨基酸序列组成:
RRKRIDWPPRRKPK[SEQ ID NO:2]。
34.根据权利要求22-33中任一项所述的蛋白分子,其中式I的蛋白分子还包含至少一个膜穿透部分,其中所述膜穿透部分是脂质部分。
35.一种组合物,包含权利要求22-34中任一项所述的蛋白分子和药学上可接受的载体或稀释剂。
Applications Claiming Priority (4)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| AU2016900314 | 2016-02-01 | ||
| AU2016900314A AU2016900314A0 (en) | 2016-02-01 | Proteinaceous compounds and uses therefor | |
| CN201780021694.9A CN108883155A (zh) | 2016-02-01 | 2017-02-01 | 蛋白化合物及其用途 |
| PCT/AU2017/050083 WO2017132728A1 (en) | 2016-02-01 | 2017-02-01 | Proteinaceous compounds and uses therefor |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201780021694.9A Division CN108883155A (zh) | 2016-02-01 | 2017-02-01 | 蛋白化合物及其用途 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| CN116082457A true CN116082457A (zh) | 2023-05-09 |
Family
ID=59499146
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201780021694.9A Pending CN108883155A (zh) | 2016-02-01 | 2017-02-01 | 蛋白化合物及其用途 |
| CN202211550292.7A Pending CN116082457A (zh) | 2016-02-01 | 2017-02-01 | 蛋白化合物及其用途 |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201780021694.9A Pending CN108883155A (zh) | 2016-02-01 | 2017-02-01 | 蛋白化合物及其用途 |
Country Status (8)
| Country | Link |
|---|---|
| US (1) | US10487115B2 (zh) |
| EP (1) | EP3411061A4 (zh) |
| JP (2) | JP7341451B2 (zh) |
| CN (2) | CN108883155A (zh) |
| AU (1) | AU2017214761B2 (zh) |
| CA (1) | CA3011870A1 (zh) |
| SG (1) | SG11201806122YA (zh) |
| WO (1) | WO2017132728A1 (zh) |
Families Citing this family (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| SG11202004167XA (en) * | 2017-11-08 | 2020-06-29 | Epiaxis Therapeutics Pty Ltd | Immunogenic compositions and uses therefor |
Family Cites Families (25)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4873192A (en) | 1987-02-17 | 1989-10-10 | The United States Of America As Represented By The Department Of Health And Human Services | Process for site specific mutagenesis without phenotypic selection |
| IL122290A0 (en) | 1995-06-07 | 1998-04-05 | Inex Pharmaceuticals Corp | Lipid-nucleic acid complex its preparation and use |
| GB9624482D0 (en) | 1995-12-18 | 1997-01-15 | Zeneca Phaema S A | Chemical compounds |
| IL125686A (en) | 1996-02-13 | 2002-11-10 | Zeneca Ltd | Quinazoline derivatives, processes for their preparation, pharmaceutical preparations containing them and their use in the manufacture of a drug with an anti-angiogenic effect and / or an effect of reducing vascular permeability |
| DE69709319T2 (de) | 1996-03-05 | 2002-08-14 | Astrazeneca Ab | 4-anilinochinazolin derivate |
| GB9718972D0 (en) | 1996-09-25 | 1997-11-12 | Zeneca Ltd | Chemical compounds |
| GB9714249D0 (en) | 1997-07-08 | 1997-09-10 | Angiogene Pharm Ltd | Vascular damaging agents |
| JP4434479B2 (ja) | 1997-07-09 | 2010-03-17 | ザ・ユニバーシティ・オブ・クイーンズランド | 標的の細胞および組織においてタンパク質を選択的に発現するための核酸配列および方法 |
| AUPP807899A0 (en) | 1999-01-08 | 1999-02-04 | University Of Queensland, The | Codon utilization |
| AU2481800A (en) | 1998-12-17 | 2000-07-03 | La Jolla Institute For Allergy And Immunology | Pkc-interacting cousin of trx (picot) polypeptides, polynucleotides, and methodsof making and using them |
| GB9900334D0 (en) | 1999-01-07 | 1999-02-24 | Angiogene Pharm Ltd | Tricylic vascular damaging agents |
| GB9900752D0 (en) | 1999-01-15 | 1999-03-03 | Angiogene Pharm Ltd | Benzimidazole vascular damaging agents |
| CN1431999A (zh) | 2000-05-31 | 2003-07-23 | 阿斯特拉曾尼卡有限公司 | 具有血管损伤活性的吲哚衍生物 |
| CN1255391C (zh) | 2000-07-07 | 2006-05-10 | 安吉奥金尼药品有限公司 | 作为血管破坏剂的colchinol衍生物 |
| MXPA02012903A (es) | 2000-07-07 | 2004-07-30 | Angiogene Pharm Ltd | Derivados de colquinol como inhibidores de angiogenesis. |
| CA2405728A1 (en) * | 2000-07-31 | 2002-02-07 | Dabur Research Foundation | Lipid-peptide conjugates for treatment of cancer |
| EP1515964A1 (en) | 2002-06-14 | 2005-03-23 | ALTANA Pharma AG | Substituted diaminopyrimidines |
| EP1599583A1 (en) * | 2003-02-28 | 2005-11-30 | Novartis AG | Three-dimensional structure of the catalytic domain of protein c theta, methods and use thereof |
| JP2007532666A (ja) | 2004-04-14 | 2007-11-15 | アヴィリッド インコーポレーテッド | ウイルス核酸を対象とした修飾ヌクレアーゼを用いた組成物及びウイルス性疾患の予防並びに治療方法 |
| JP5295785B2 (ja) | 2006-02-20 | 2013-09-18 | エファ・ユニバーシティ・インダストリー・コラボレイション・ファウンデイション | 細胞膜透過性ペプチド |
| AU2011325857A1 (en) * | 2010-11-01 | 2013-05-02 | University Of Technology, Sydney | Immune-modulating agents and uses therefor |
| AU2012228365A1 (en) * | 2011-03-11 | 2013-09-19 | Katholieke Universiteit Leuven, K.U.Leuven R&D | Molecules and methods for inhibition and detection of proteins |
| US10287333B2 (en) | 2012-09-27 | 2019-05-14 | University Of British Columbia | Peptide directed protein knockdown |
| AU2014324092B2 (en) | 2013-09-18 | 2020-02-06 | Epiaxis Therapeutics Pty Ltd | Stem cell modulation II |
| CA2958704A1 (en) * | 2014-08-25 | 2016-03-03 | University Of Canberra | Compositions for modulating cancer stem cells and uses therefor |
-
2017
- 2017-02-01 AU AU2017214761A patent/AU2017214761B2/en active Active
- 2017-02-01 EP EP17746642.2A patent/EP3411061A4/en active Pending
- 2017-02-01 US US16/074,690 patent/US10487115B2/en active Active
- 2017-02-01 SG SG11201806122YA patent/SG11201806122YA/en unknown
- 2017-02-01 CA CA3011870A patent/CA3011870A1/en active Pending
- 2017-02-01 CN CN201780021694.9A patent/CN108883155A/zh active Pending
- 2017-02-01 CN CN202211550292.7A patent/CN116082457A/zh active Pending
- 2017-02-01 WO PCT/AU2017/050083 patent/WO2017132728A1/en active Application Filing
- 2017-02-01 JP JP2018539984A patent/JP7341451B2/ja active Active
-
2021
- 2021-10-29 JP JP2021178010A patent/JP2022023949A/ja active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| CA3011870A1 (en) | 2017-08-10 |
| EP3411061A1 (en) | 2018-12-12 |
| AU2017214761A1 (en) | 2018-08-02 |
| JP7341451B2 (ja) | 2023-09-11 |
| JP2019506167A (ja) | 2019-03-07 |
| US20190040103A1 (en) | 2019-02-07 |
| WO2017132728A1 (en) | 2017-08-10 |
| SG11201806122YA (en) | 2018-08-30 |
| JP2022023949A (ja) | 2022-02-08 |
| AU2017214761B2 (en) | 2024-02-01 |
| EP3411061A4 (en) | 2019-07-10 |
| US10487115B2 (en) | 2019-11-26 |
| CN108883155A (zh) | 2018-11-23 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| TWI678374B (zh) | 穿膜胜肽以及包含該胜肽之共軛物及組成物(三) | |
| US9221886B2 (en) | Supercharged proteins for cell penetration | |
| EP2850097B1 (en) | Anti-inflammatory peptides and composition comprising the same | |
| KR102373603B1 (ko) | 섬유증 억제 활성을 가지는 펩티드 및 이를 포함하는 조성물 | |
| CN113699133A (zh) | 细胞穿透肽、包含其的缀合物、及应用 | |
| AU2019207534B2 (en) | Proteinaceous molecules and uses therefor | |
| JP2006514602A5 (zh) | ||
| US9296787B2 (en) | Antitumor peptide and use thereof | |
| JP2020072716A (ja) | 細胞透過組成物およびそれを用いる方法 | |
| EP2797617B1 (en) | Anti-tumor adjuvant therapy | |
| JP2022023949A (ja) | タンパク質性化合物とその利用 | |
| JP6654899B2 (ja) | カルレティキュリンの発現促進方法および該方法に用いられる合成ペプチド | |
| WO2014022271A1 (en) | Method of treating metastatic cancer | |
| EP3044314B1 (en) | Methods and compositions for interference with dna polymerase and dna synthesis | |
| WO2022232567A2 (en) | Cyclic peptide inhibitors of usp22 | |
| CA3208598A1 (en) | Novel bicyclic peptides | |
| CN114599375A (zh) | 核酸递送促进剂 | |
| US20170066801A1 (en) | Alpha3beta hydrogen bond surrogate macrocycles as modulators of ras |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PB01 | Publication | ||
| PB01 | Publication | ||
| SE01 | Entry into force of request for substantive examination | ||
| SE01 | Entry into force of request for substantive examination |