CN110997667A - 促肾上腺皮质激素释放因子受体拮抗剂 - Google Patents
促肾上腺皮质激素释放因子受体拮抗剂 Download PDFInfo
- Publication number
- CN110997667A CN110997667A CN201880038596.0A CN201880038596A CN110997667A CN 110997667 A CN110997667 A CN 110997667A CN 201880038596 A CN201880038596 A CN 201880038596A CN 110997667 A CN110997667 A CN 110997667A
- Authority
- CN
- China
- Prior art keywords
- pharmaceutical composition
- compound
- pharmaceutically acceptable
- solvate
- acceptable salt
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 229940122402 Corticotropin releasing factor receptor antagonist Drugs 0.000 title description 2
- 239000008194 pharmaceutical composition Substances 0.000 claims abstract description 312
- 229940125904 compound 1 Drugs 0.000 claims description 322
- 150000003839 salts Chemical class 0.000 claims description 230
- 239000012453 solvate Substances 0.000 claims description 227
- 239000002775 capsule Substances 0.000 claims description 119
- 239000000546 pharmaceutical excipient Substances 0.000 claims description 35
- 239000011859 microparticle Substances 0.000 claims description 33
- 239000000463 material Substances 0.000 claims description 15
- 229920000036 polyvinylpyrrolidone Polymers 0.000 claims description 14
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 claims description 14
- 239000001267 polyvinylpyrrolidone Substances 0.000 claims description 10
- 238000007906 compression Methods 0.000 claims description 9
- 230000006835 compression Effects 0.000 claims description 9
- 239000007903 gelatin capsule Substances 0.000 claims description 9
- 108010010803 Gelatin Proteins 0.000 claims description 7
- 239000008273 gelatin Substances 0.000 claims description 7
- 229920000159 gelatin Polymers 0.000 claims description 7
- 235000019322 gelatine Nutrition 0.000 claims description 7
- 235000011852 gelatine desserts Nutrition 0.000 claims description 7
- 239000001913 cellulose Substances 0.000 claims description 6
- 229920000881 Modified starch Polymers 0.000 claims description 5
- 229920002678 cellulose Polymers 0.000 claims description 5
- 238000009474 hot melt extrusion Methods 0.000 claims description 5
- 238000000465 moulding Methods 0.000 claims description 4
- 102000011632 Caseins Human genes 0.000 claims description 3
- 108010076119 Caseins Proteins 0.000 claims description 3
- 102000008186 Collagen Human genes 0.000 claims description 3
- 108010035532 Collagen Proteins 0.000 claims description 3
- 239000004368 Modified starch Substances 0.000 claims description 3
- 229920002125 Sokalan® Polymers 0.000 claims description 3
- 239000005018 casein Substances 0.000 claims description 3
- BECPQYXYKAMYBN-UHFFFAOYSA-N casein, tech. Chemical compound NCCCCC(C(O)=O)N=C(O)C(CC(O)=O)N=C(O)C(CCC(O)=N)N=C(O)C(CC(C)C)N=C(O)C(CCC(O)=O)N=C(O)C(CC(O)=O)N=C(O)C(CCC(O)=O)N=C(O)C(C(C)O)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=O)N=C(O)C(CCC(O)=O)N=C(O)C(COP(O)(O)=O)N=C(O)C(CCC(O)=N)N=C(O)C(N)CC1=CC=CC=C1 BECPQYXYKAMYBN-UHFFFAOYSA-N 0.000 claims description 3
- 235000021240 caseins Nutrition 0.000 claims description 3
- 229920001436 collagen Polymers 0.000 claims description 3
- 238000001125 extrusion Methods 0.000 claims description 3
- 235000019426 modified starch Nutrition 0.000 claims description 3
- 235000010987 pectin Nutrition 0.000 claims description 3
- 239000001814 pectin Substances 0.000 claims description 3
- 229920001277 pectin Polymers 0.000 claims description 3
- 235000018102 proteins Nutrition 0.000 claims description 3
- 102000004169 proteins and genes Human genes 0.000 claims description 3
- 108090000623 proteins and genes Proteins 0.000 claims description 3
- 238000000034 method Methods 0.000 abstract description 56
- 238000011282 treatment Methods 0.000 abstract description 29
- 206010010356 Congenital anomaly Diseases 0.000 abstract description 7
- 230000001919 adrenal effect Effects 0.000 abstract description 7
- 206010020718 hyperplasia Diseases 0.000 abstract description 7
- 230000001054 cortical effect Effects 0.000 abstract description 6
- XVAWSBAQNIXMIO-UHFFFAOYSA-N tildacerfont Chemical compound CC1=NN2C(C(CC)CC)=CC(C)=NC2=C1C(=C(N=1)Cl)SC=1N1CCOCC1 XVAWSBAQNIXMIO-UHFFFAOYSA-N 0.000 abstract description 6
- 235000002639 sodium chloride Nutrition 0.000 description 187
- 239000003826 tablet Substances 0.000 description 152
- 239000000203 mixture Substances 0.000 description 65
- 239000003862 glucocorticoid Substances 0.000 description 61
- 238000009472 formulation Methods 0.000 description 41
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 38
- 102100027467 Pro-opiomelanocortin Human genes 0.000 description 29
- JYGXADMDTFJGBT-VWUMJDOOSA-N hydrocortisone Chemical compound O=C1CC[C@]2(C)[C@H]3[C@@H](O)C[C@](C)([C@@](CC4)(O)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 JYGXADMDTFJGBT-VWUMJDOOSA-N 0.000 description 28
- 101800000414 Corticotropin Proteins 0.000 description 27
- IDLFZVILOHSSID-OVLDLUHVSA-N corticotropin Chemical compound C([C@@H](C(=O)N[C@@H](CO)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC=1NC=NC=1)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)NCC(=O)N[C@@H](CCCCN)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](C(C)C)C(=O)NCC(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CC(N)=O)C(=O)NCC(=O)N[C@@H](C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CO)C(=O)N[C@@H](C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC=1C=CC=CC=1)C(O)=O)NC(=O)[C@@H](N)CO)C1=CC=C(O)C=C1 IDLFZVILOHSSID-OVLDLUHVSA-N 0.000 description 27
- 229960000258 corticotropin Drugs 0.000 description 27
- 239000008187 granular material Substances 0.000 description 26
- 239000012738 dissolution medium Substances 0.000 description 25
- 239000000275 Adrenocorticotropic Hormone Substances 0.000 description 24
- 239000003814 drug Substances 0.000 description 24
- 201000010099 disease Diseases 0.000 description 23
- 238000004090 dissolution Methods 0.000 description 22
- 229940088597 hormone Drugs 0.000 description 20
- 239000005556 hormone Substances 0.000 description 20
- 238000004519 manufacturing process Methods 0.000 description 20
- 229940079593 drug Drugs 0.000 description 19
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 19
- DBPWSSGDRRHUNT-CEGNMAFCSA-N 17α-hydroxyprogesterone Chemical compound C1CC2=CC(=O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@@](C(=O)C)(O)[C@@]1(C)CC2 DBPWSSGDRRHUNT-CEGNMAFCSA-N 0.000 description 17
- 239000011248 coating agent Substances 0.000 description 17
- 238000000576 coating method Methods 0.000 description 17
- 235000019333 sodium laurylsulphate Nutrition 0.000 description 16
- 208000035475 disorder Diseases 0.000 description 15
- MUMGGOZAMZWBJJ-DYKIIFRCSA-N Testostosterone Chemical compound O=C1CC[C@]2(C)[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3CCC2=C1 MUMGGOZAMZWBJJ-DYKIIFRCSA-N 0.000 description 14
- 229960000890 hydrocortisone Drugs 0.000 description 14
- DBMJMQXJHONAFJ-UHFFFAOYSA-M Sodium laurylsulphate Chemical compound [Na+].CCCCCCCCCCCCOS([O-])(=O)=O DBMJMQXJHONAFJ-UHFFFAOYSA-M 0.000 description 13
- 229940088679 drug related substance Drugs 0.000 description 13
- 239000000055 Corticotropin-Releasing Hormone Substances 0.000 description 12
- 239000008186 active pharmaceutical agent Substances 0.000 description 12
- AEMFNILZOJDQLW-QAGGRKNESA-N androst-4-ene-3,17-dione Chemical compound O=C1CC[C@]2(C)[C@H]3CC[C@](C)(C(CC4)=O)[C@@H]4[C@@H]3CCC2=C1 AEMFNILZOJDQLW-QAGGRKNESA-N 0.000 description 12
- 229960005471 androstenedione Drugs 0.000 description 12
- AEMFNILZOJDQLW-UHFFFAOYSA-N androstenedione Natural products O=C1CCC2(C)C3CCC(C)(C(CC4)=O)C4C3CCC2=C1 AEMFNILZOJDQLW-UHFFFAOYSA-N 0.000 description 12
- 239000002245 particle Substances 0.000 description 12
- 230000036470 plasma concentration Effects 0.000 description 12
- 102000012289 Corticotropin-Releasing Hormone Human genes 0.000 description 11
- 108010022152 Corticotropin-Releasing Hormone Proteins 0.000 description 11
- 238000005469 granulation Methods 0.000 description 11
- 230000003179 granulation Effects 0.000 description 11
- 230000009467 reduction Effects 0.000 description 11
- 239000000126 substance Substances 0.000 description 11
- 239000011230 binding agent Substances 0.000 description 9
- 239000007884 disintegrant Substances 0.000 description 9
- 238000009826 distribution Methods 0.000 description 9
- 239000012535 impurity Substances 0.000 description 9
- AICOOMRHRUFYCM-ZRRPKQBOSA-N oxazine, 1 Chemical compound C([C@@H]1[C@H](C(C[C@]2(C)[C@@H]([C@H](C)N(C)C)[C@H](O)C[C@]21C)=O)CC1=CC2)C[C@H]1[C@@]1(C)[C@H]2N=C(C(C)C)OC1 AICOOMRHRUFYCM-ZRRPKQBOSA-N 0.000 description 9
- 238000012360 testing method Methods 0.000 description 9
- 238000005550 wet granulation Methods 0.000 description 9
- WHNWPMSKXPGLAX-UHFFFAOYSA-N N-Vinyl-2-pyrrolidone Chemical compound C=CN1CCCC1=O WHNWPMSKXPGLAX-UHFFFAOYSA-N 0.000 description 8
- 230000015572 biosynthetic process Effects 0.000 description 8
- 230000000694 effects Effects 0.000 description 8
- -1 hexadecyl compounds Chemical class 0.000 description 8
- 238000011068 loading method Methods 0.000 description 8
- 230000001817 pituitary effect Effects 0.000 description 8
- 239000004094 surface-active agent Substances 0.000 description 8
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 7
- 230000008859 change Effects 0.000 description 7
- 239000002552 dosage form Substances 0.000 description 7
- 231100000673 dose–response relationship Toxicity 0.000 description 7
- IXCSERBJSXMMFS-UHFFFAOYSA-N hydrogen chloride Substances Cl.Cl IXCSERBJSXMMFS-UHFFFAOYSA-N 0.000 description 7
- 229960003604 testosterone Drugs 0.000 description 7
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 6
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 6
- 229930195725 Mannitol Natural products 0.000 description 6
- 229920000168 Microcrystalline cellulose Polymers 0.000 description 6
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 6
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 6
- DPXJVFZANSGRMM-UHFFFAOYSA-N acetic acid;2,3,4,5,6-pentahydroxyhexanal;sodium Chemical compound [Na].CC(O)=O.OCC(O)C(O)C(O)C(O)C=O DPXJVFZANSGRMM-UHFFFAOYSA-N 0.000 description 6
- 239000003098 androgen Substances 0.000 description 6
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 6
- 239000012729 immediate-release (IR) formulation Substances 0.000 description 6
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 6
- 239000000594 mannitol Substances 0.000 description 6
- 235000010355 mannitol Nutrition 0.000 description 6
- 239000002609 medium Substances 0.000 description 6
- 235000019813 microcrystalline cellulose Nutrition 0.000 description 6
- 239000002395 mineralocorticoid Substances 0.000 description 6
- 238000002360 preparation method Methods 0.000 description 6
- 239000007916 tablet composition Substances 0.000 description 6
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 5
- 108091005471 CRHR1 Proteins 0.000 description 5
- 102100038018 Corticotropin-releasing factor receptor 1 Human genes 0.000 description 5
- 229920002785 Croscarmellose sodium Polymers 0.000 description 5
- 101000878678 Homo sapiens Corticotropin-releasing factor receptor 1 Proteins 0.000 description 5
- 101000948733 Saccharomyces cerevisiae (strain ATCC 204508 / S288c) Probable phospholipid translocase non-catalytic subunit CRF1 Proteins 0.000 description 5
- 239000003795 chemical substances by application Substances 0.000 description 5
- 150000001875 compounds Chemical class 0.000 description 5
- 229960001681 croscarmellose sodium Drugs 0.000 description 5
- 235000010947 crosslinked sodium carboxy methyl cellulose Nutrition 0.000 description 5
- 239000007888 film coating Substances 0.000 description 5
- 238000009501 film coating Methods 0.000 description 5
- 239000012530 fluid Substances 0.000 description 5
- 229920001903 high density polyethylene Polymers 0.000 description 5
- 239000004700 high-density polyethylene Substances 0.000 description 5
- 230000007170 pathology Effects 0.000 description 5
- 230000002829 reductive effect Effects 0.000 description 5
- 239000008279 sol Substances 0.000 description 5
- 208000024891 symptom Diseases 0.000 description 5
- 229940037128 systemic glucocorticoids Drugs 0.000 description 5
- 229940124597 therapeutic agent Drugs 0.000 description 5
- 238000002560 therapeutic procedure Methods 0.000 description 5
- DBPWSSGDRRHUNT-UHFFFAOYSA-N 17alpha-hydroxy progesterone Natural products C1CC2=CC(=O)CCC2(C)C2C1C1CCC(C(=O)C)(O)C1(C)CC2 DBPWSSGDRRHUNT-UHFFFAOYSA-N 0.000 description 4
- 102100038019 Corticotropin-releasing factor receptor 2 Human genes 0.000 description 4
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 4
- 101000878664 Homo sapiens Corticotropin-releasing factor receptor 2 Proteins 0.000 description 4
- 229920002153 Hydroxypropyl cellulose Polymers 0.000 description 4
- 206010020772 Hypertension Diseases 0.000 description 4
- 241001465754 Metazoa Species 0.000 description 4
- 208000008589 Obesity Diseases 0.000 description 4
- RJKFOVLPORLFTN-LEKSSAKUSA-N Progesterone Chemical compound C1CC2=CC(=O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H](C(=O)C)[C@@]1(C)CC2 RJKFOVLPORLFTN-LEKSSAKUSA-N 0.000 description 4
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 4
- 229920002472 Starch Polymers 0.000 description 4
- 238000010521 absorption reaction Methods 0.000 description 4
- 150000008051 alkyl sulfates Chemical class 0.000 description 4
- 229940024606 amino acid Drugs 0.000 description 4
- 235000001014 amino acid Nutrition 0.000 description 4
- 150000001413 amino acids Chemical class 0.000 description 4
- 230000008901 benefit Effects 0.000 description 4
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 4
- 235000010980 cellulose Nutrition 0.000 description 4
- HVYWMOMLDIMFJA-DPAQBDIFSA-N cholesterol Chemical compound C1C=C2C[C@@H](O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H]([C@H](C)CCCC(C)C)[C@@]1(C)CC2 HVYWMOMLDIMFJA-DPAQBDIFSA-N 0.000 description 4
- 239000003085 diluting agent Substances 0.000 description 4
- 235000010977 hydroxypropyl cellulose Nutrition 0.000 description 4
- 239000001863 hydroxypropyl cellulose Substances 0.000 description 4
- 239000000314 lubricant Substances 0.000 description 4
- 235000020824 obesity Nutrition 0.000 description 4
- 229940068196 placebo Drugs 0.000 description 4
- 239000000902 placebo Substances 0.000 description 4
- 229940037129 plain mineralocorticoids for systemic use Drugs 0.000 description 4
- 229940069328 povidone Drugs 0.000 description 4
- 238000009256 replacement therapy Methods 0.000 description 4
- 239000008107 starch Substances 0.000 description 4
- 235000019698 starch Nutrition 0.000 description 4
- 229940032147 starch Drugs 0.000 description 4
- KWTSXDURSIMDCE-QMMMGPOBSA-N (S)-amphetamine Chemical group C[C@H](N)CC1=CC=CC=C1 KWTSXDURSIMDCE-QMMMGPOBSA-N 0.000 description 3
- 208000007848 Alcoholism Diseases 0.000 description 3
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 3
- 241000124008 Mammalia Species 0.000 description 3
- 229920003081 Povidone K 30 Polymers 0.000 description 3
- 108010069820 Pro-Opiomelanocortin Proteins 0.000 description 3
- 239000000683 Pro-Opiomelanocortin Substances 0.000 description 3
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 3
- 239000004480 active ingredient Substances 0.000 description 3
- 230000002411 adverse Effects 0.000 description 3
- 229960000686 benzalkonium chloride Drugs 0.000 description 3
- CADWTSSKOVRVJC-UHFFFAOYSA-N benzyl(dimethyl)azanium;chloride Chemical compound [Cl-].C[NH+](C)CC1=CC=CC=C1 CADWTSSKOVRVJC-UHFFFAOYSA-N 0.000 description 3
- 239000000090 biomarker Substances 0.000 description 3
- 239000008280 blood Substances 0.000 description 3
- 210000004369 blood Anatomy 0.000 description 3
- 210000004556 brain Anatomy 0.000 description 3
- 239000001506 calcium phosphate Substances 0.000 description 3
- 229910000389 calcium phosphate Inorganic materials 0.000 description 3
- 235000011010 calcium phosphates Nutrition 0.000 description 3
- 229940077731 carbohydrate nutrients Drugs 0.000 description 3
- 150000001720 carbohydrates Chemical class 0.000 description 3
- 235000014633 carbohydrates Nutrition 0.000 description 3
- 230000001186 cumulative effect Effects 0.000 description 3
- 230000007812 deficiency Effects 0.000 description 3
- 229960003957 dexamethasone Drugs 0.000 description 3
- UREBDLICKHMUKA-CXSFZGCWSA-N dexamethasone Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@]2(F)[C@@H]1[C@@H]1C[C@@H](C)[C@@](C(=O)CO)(O)[C@@]1(C)C[C@@H]2O UREBDLICKHMUKA-CXSFZGCWSA-N 0.000 description 3
- 238000002474 experimental method Methods 0.000 description 3
- 239000000945 filler Substances 0.000 description 3
- 238000009478 high shear granulation Methods 0.000 description 3
- 229950000801 hydroxyprogesterone caproate Drugs 0.000 description 3
- 210000003016 hypothalamus Anatomy 0.000 description 3
- 230000006872 improvement Effects 0.000 description 3
- 230000003993 interaction Effects 0.000 description 3
- 230000000968 intestinal effect Effects 0.000 description 3
- 239000008101 lactose Substances 0.000 description 3
- 229960001375 lactose Drugs 0.000 description 3
- 150000002632 lipids Chemical class 0.000 description 3
- 235000019359 magnesium stearate Nutrition 0.000 description 3
- 238000010606 normalization Methods 0.000 description 3
- 239000004800 polyvinyl chloride Substances 0.000 description 3
- 239000000843 powder Substances 0.000 description 3
- 108090000765 processed proteins & peptides Proteins 0.000 description 3
- 238000012545 processing Methods 0.000 description 3
- 230000000069 prophylactic effect Effects 0.000 description 3
- 230000004044 response Effects 0.000 description 3
- 238000012216 screening Methods 0.000 description 3
- 230000028327 secretion Effects 0.000 description 3
- 150000003431 steroids Chemical class 0.000 description 3
- 239000000758 substrate Substances 0.000 description 3
- 230000004083 survival effect Effects 0.000 description 3
- 230000001225 therapeutic effect Effects 0.000 description 3
- 210000001519 tissue Anatomy 0.000 description 3
- 238000011269 treatment regimen Methods 0.000 description 3
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 3
- 230000003442 weekly effect Effects 0.000 description 3
- PQSUYGKTWSAVDQ-ZVIOFETBSA-N Aldosterone Chemical compound C([C@@]1([C@@H](C(=O)CO)CC[C@H]1[C@@H]1CC2)C=O)[C@H](O)[C@@H]1[C@]1(C)C2=CC(=O)CC1 PQSUYGKTWSAVDQ-ZVIOFETBSA-N 0.000 description 2
- PQSUYGKTWSAVDQ-UHFFFAOYSA-N Aldosterone Natural products C1CC2C3CCC(C(=O)CO)C3(C=O)CC(O)C2C2(C)C1=CC(=O)CC2 PQSUYGKTWSAVDQ-UHFFFAOYSA-N 0.000 description 2
- 208000019901 Anxiety disease Diseases 0.000 description 2
- 239000004475 Arginine Substances 0.000 description 2
- 108091005470 CRHR2 Proteins 0.000 description 2
- VTYYLEPIZMXCLO-UHFFFAOYSA-L Calcium carbonate Chemical compound [Ca+2].[O-]C([O-])=O VTYYLEPIZMXCLO-UHFFFAOYSA-L 0.000 description 2
- 208000024172 Cardiovascular disease Diseases 0.000 description 2
- LZZYPRNAOMGNLH-UHFFFAOYSA-M Cetrimonium bromide Chemical compound [Br-].CCCCCCCCCCCCCCCC[N+](C)(C)C LZZYPRNAOMGNLH-UHFFFAOYSA-M 0.000 description 2
- 102400000739 Corticotropin Human genes 0.000 description 2
- 108010056643 Corticotropin-Releasing Hormone Receptors Proteins 0.000 description 2
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 2
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 2
- RFSUNEUAIZKAJO-ARQDHWQXSA-N Fructose Chemical compound OC[C@H]1O[C@](O)(CO)[C@@H](O)[C@@H]1O RFSUNEUAIZKAJO-ARQDHWQXSA-N 0.000 description 2
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 2
- 208000001953 Hypotension Diseases 0.000 description 2
- 206010022489 Insulin Resistance Diseases 0.000 description 2
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 description 2
- YNAVUWVOSKDBBP-UHFFFAOYSA-N Morpholine Chemical compound C1COCCN1 YNAVUWVOSKDBBP-UHFFFAOYSA-N 0.000 description 2
- 229910019142 PO4 Inorganic materials 0.000 description 2
- 229920003171 Poly (ethylene oxide) Polymers 0.000 description 2
- WCUXLLCKKVVCTQ-UHFFFAOYSA-M Potassium chloride Chemical compound [Cl-].[K+] WCUXLLCKKVVCTQ-UHFFFAOYSA-M 0.000 description 2
- ORNBQBCIOKFOEO-YQUGOWONSA-N Pregnenolone Natural products O=C(C)[C@@H]1[C@@]2(C)[C@H]([C@H]3[C@@H]([C@]4(C)C(=CC3)C[C@@H](O)CC4)CC2)CC1 ORNBQBCIOKFOEO-YQUGOWONSA-N 0.000 description 2
- 102100028255 Renin Human genes 0.000 description 2
- 108090000783 Renin Proteins 0.000 description 2
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 2
- 108010011732 Steroid 21-Hydroxylase Proteins 0.000 description 2
- 229930006000 Sucrose Natural products 0.000 description 2
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 2
- AOBORMOPSGHCAX-UHFFFAOYSA-N Tocophersolan Chemical compound OCCOC(=O)CCC(=O)OC1=C(C)C(C)=C2OC(CCCC(C)CCCC(C)CCCC(C)C)(C)CCC2=C1C AOBORMOPSGHCAX-UHFFFAOYSA-N 0.000 description 2
- 206010047486 Virilism Diseases 0.000 description 2
- 230000001133 acceleration Effects 0.000 description 2
- 238000009825 accumulation Methods 0.000 description 2
- 229940081735 acetylcellulose Drugs 0.000 description 2
- 230000004913 activation Effects 0.000 description 2
- 239000000853 adhesive Substances 0.000 description 2
- 210000004100 adrenal gland Anatomy 0.000 description 2
- 201000007930 alcohol dependence Diseases 0.000 description 2
- 229960002478 aldosterone Drugs 0.000 description 2
- 238000004458 analytical method Methods 0.000 description 2
- 229940030486 androgens Drugs 0.000 description 2
- 239000005557 antagonist Substances 0.000 description 2
- 230000000181 anti-adherent effect Effects 0.000 description 2
- 239000012736 aqueous medium Substances 0.000 description 2
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 2
- 229960003121 arginine Drugs 0.000 description 2
- 235000009697 arginine Nutrition 0.000 description 2
- 230000004888 barrier function Effects 0.000 description 2
- 230000003542 behavioural effect Effects 0.000 description 2
- 230000009286 beneficial effect Effects 0.000 description 2
- 230000027455 binding Effects 0.000 description 2
- 230000036772 blood pressure Effects 0.000 description 2
- FUFJGUQYACFECW-UHFFFAOYSA-L calcium hydrogenphosphate Chemical compound [Ca+2].OP([O-])([O-])=O FUFJGUQYACFECW-UHFFFAOYSA-L 0.000 description 2
- 239000003093 cationic surfactant Substances 0.000 description 2
- 229920002301 cellulose acetate Polymers 0.000 description 2
- 229960002798 cetrimide Drugs 0.000 description 2
- 229960001927 cetylpyridinium chloride Drugs 0.000 description 2
- YMKDRGPMQRFJGP-UHFFFAOYSA-M cetylpyridinium chloride Chemical compound [Cl-].CCCCCCCCCCCCCCCC[N+]1=CC=CC=C1 YMKDRGPMQRFJGP-UHFFFAOYSA-M 0.000 description 2
- OSASVXMJTNOKOY-UHFFFAOYSA-N chlorobutanol Chemical compound CC(C)(O)C(Cl)(Cl)Cl OSASVXMJTNOKOY-UHFFFAOYSA-N 0.000 description 2
- 235000012000 cholesterol Nutrition 0.000 description 2
- 230000002060 circadian Effects 0.000 description 2
- 235000015165 citric acid Nutrition 0.000 description 2
- 238000007796 conventional method Methods 0.000 description 2
- 230000003111 delayed effect Effects 0.000 description 2
- 238000012217 deletion Methods 0.000 description 2
- 230000037430 deletion Effects 0.000 description 2
- 238000013461 design Methods 0.000 description 2
- 238000011161 development Methods 0.000 description 2
- 230000018109 developmental process Effects 0.000 description 2
- 239000008121 dextrose Substances 0.000 description 2
- 238000003745 diagnosis Methods 0.000 description 2
- 235000019700 dicalcium phosphate Nutrition 0.000 description 2
- 239000006185 dispersion Substances 0.000 description 2
- 229940000406 drug candidate Drugs 0.000 description 2
- 239000003792 electrolyte Substances 0.000 description 2
- 238000003379 elimination reaction Methods 0.000 description 2
- 238000010828 elution Methods 0.000 description 2
- 150000002148 esters Chemical class 0.000 description 2
- 238000011156 evaluation Methods 0.000 description 2
- 239000000796 flavoring agent Substances 0.000 description 2
- 229960002011 fludrocortisone Drugs 0.000 description 2
- AAXVEMMRQDVLJB-BULBTXNYSA-N fludrocortisone Chemical compound O=C1CC[C@]2(C)[C@@]3(F)[C@@H](O)C[C@](C)([C@@](CC4)(O)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 AAXVEMMRQDVLJB-BULBTXNYSA-N 0.000 description 2
- 230000009246 food effect Effects 0.000 description 2
- 235000021471 food effect Nutrition 0.000 description 2
- 235000013355 food flavoring agent Nutrition 0.000 description 2
- 235000003599 food sweetener Nutrition 0.000 description 2
- 229960002737 fructose Drugs 0.000 description 2
- 239000000499 gel Substances 0.000 description 2
- 239000008103 glucose Substances 0.000 description 2
- 235000011187 glycerol Nutrition 0.000 description 2
- 229940127022 high-dose drug Drugs 0.000 description 2
- 230000002209 hydrophobic effect Effects 0.000 description 2
- 235000010979 hydroxypropyl methyl cellulose Nutrition 0.000 description 2
- 239000001866 hydroxypropyl methyl cellulose Substances 0.000 description 2
- 229920003088 hydroxypropyl methyl cellulose Polymers 0.000 description 2
- UFVKGYZPFZQRLF-UHFFFAOYSA-N hydroxypropyl methyl cellulose Chemical compound OC1C(O)C(OC)OC(CO)C1OC1C(O)C(O)C(OC2C(C(O)C(OC3C(C(O)C(O)C(CO)O3)O)C(CO)O2)O)C(CO)O1 UFVKGYZPFZQRLF-UHFFFAOYSA-N 0.000 description 2
- 230000036543 hypotension Effects 0.000 description 2
- 230000002267 hypothalamic effect Effects 0.000 description 2
- 238000001802 infusion Methods 0.000 description 2
- 230000002401 inhibitory effect Effects 0.000 description 2
- 208000002551 irritable bowel syndrome Diseases 0.000 description 2
- 238000009533 lab test Methods 0.000 description 2
- 230000007774 longterm Effects 0.000 description 2
- 238000005259 measurement Methods 0.000 description 2
- 230000004060 metabolic process Effects 0.000 description 2
- 229920003145 methacrylic acid copolymer Polymers 0.000 description 2
- 229940117841 methacrylic acid copolymer Drugs 0.000 description 2
- 239000008108 microcrystalline cellulose Substances 0.000 description 2
- 229940016286 microcrystalline cellulose Drugs 0.000 description 2
- 229960003793 midazolam Drugs 0.000 description 2
- DDLIGBOFAVUZHB-UHFFFAOYSA-N midazolam Chemical compound C12=CC(Cl)=CC=C2N2C(C)=NC=C2CN=C1C1=CC=CC=C1F DDLIGBOFAVUZHB-UHFFFAOYSA-N 0.000 description 2
- 238000012544 monitoring process Methods 0.000 description 2
- 230000035772 mutation Effects 0.000 description 2
- 239000002547 new drug Substances 0.000 description 2
- 239000006186 oral dosage form Substances 0.000 description 2
- 230000003285 pharmacodynamic effect Effects 0.000 description 2
- 239000010452 phosphate Substances 0.000 description 2
- 235000021317 phosphate Nutrition 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 2
- 239000006187 pill Substances 0.000 description 2
- 229920001223 polyethylene glycol Polymers 0.000 description 2
- 229920005862 polyol Polymers 0.000 description 2
- 229920000915 polyvinyl chloride Polymers 0.000 description 2
- 230000003389 potentiating effect Effects 0.000 description 2
- 229960005205 prednisolone Drugs 0.000 description 2
- OIGNJSKKLXVSLS-VWUMJDOOSA-N prednisolone Chemical compound O=C1C=C[C@]2(C)[C@H]3[C@@H](O)C[C@](C)([C@@](CC4)(O)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 OIGNJSKKLXVSLS-VWUMJDOOSA-N 0.000 description 2
- 229960004618 prednisone Drugs 0.000 description 2
- XOFYZVNMUHMLCC-ZPOLXVRWSA-N prednisone Chemical compound O=C1C=C[C@]2(C)[C@H]3C(=O)C[C@](C)([C@@](CC4)(O)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 XOFYZVNMUHMLCC-ZPOLXVRWSA-N 0.000 description 2
- 229960000249 pregnenolone Drugs 0.000 description 2
- ORNBQBCIOKFOEO-QGVNFLHTSA-N pregnenolone Chemical compound C1C=C2C[C@@H](O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H](C(=O)C)[C@@]1(C)CC2 ORNBQBCIOKFOEO-QGVNFLHTSA-N 0.000 description 2
- 239000003755 preservative agent Substances 0.000 description 2
- 239000000186 progesterone Substances 0.000 description 2
- 229960003387 progesterone Drugs 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- 239000000377 silicon dioxide Substances 0.000 description 2
- 230000007958 sleep Effects 0.000 description 2
- 229910000029 sodium carbonate Inorganic materials 0.000 description 2
- 239000007787 solid Substances 0.000 description 2
- 239000006104 solid solution Substances 0.000 description 2
- 239000000600 sorbitol Substances 0.000 description 2
- 235000010356 sorbitol Nutrition 0.000 description 2
- 238000001694 spray drying Methods 0.000 description 2
- 230000000087 stabilizing effect Effects 0.000 description 2
- 238000003860 storage Methods 0.000 description 2
- 201000009032 substance abuse Diseases 0.000 description 2
- 231100000736 substance abuse Toxicity 0.000 description 2
- 208000011117 substance-related disease Diseases 0.000 description 2
- 238000006467 substitution reaction Methods 0.000 description 2
- 239000005720 sucrose Substances 0.000 description 2
- 238000013268 sustained release Methods 0.000 description 2
- 239000003765 sweetening agent Substances 0.000 description 2
- 238000003786 synthesis reaction Methods 0.000 description 2
- 239000000454 talc Substances 0.000 description 2
- 229910052623 talc Inorganic materials 0.000 description 2
- 235000012222 talc Nutrition 0.000 description 2
- UMGDCJDMYOKAJW-UHFFFAOYSA-N thiourea Chemical compound NC(N)=S UMGDCJDMYOKAJW-UHFFFAOYSA-N 0.000 description 2
- LWIHDJKSTIGBAC-UHFFFAOYSA-K tripotassium phosphate Chemical compound [K+].[K+].[K+].[O-]P([O-])([O-])=O LWIHDJKSTIGBAC-UHFFFAOYSA-K 0.000 description 2
- 208000001072 type 2 diabetes mellitus Diseases 0.000 description 2
- 239000000080 wetting agent Substances 0.000 description 2
- NOOLISFMXDJSKH-UTLUCORTSA-N (+)-Neomenthol Chemical compound CC(C)[C@@H]1CC[C@@H](C)C[C@@H]1O NOOLISFMXDJSKH-UTLUCORTSA-N 0.000 description 1
- DNXHEGUUPJUMQT-UHFFFAOYSA-N (+)-estrone Natural products OC1=CC=C2C3CCC(C)(C(CC4)=O)C4C3CCC2=C1 DNXHEGUUPJUMQT-UHFFFAOYSA-N 0.000 description 1
- PROQIPRRNZUXQM-UHFFFAOYSA-N (16alpha,17betaOH)-Estra-1,3,5(10)-triene-3,16,17-triol Natural products OC1=CC=C2C3CCC(C)(C(C(O)C4)O)C4C3CCC2=C1 PROQIPRRNZUXQM-UHFFFAOYSA-N 0.000 description 1
- MTCFGRXMJLQNBG-REOHCLBHSA-N (2S)-2-Amino-3-hydroxypropansäure Chemical compound OC[C@H](N)C(O)=O MTCFGRXMJLQNBG-REOHCLBHSA-N 0.000 description 1
- JNYAEWCLZODPBN-JGWLITMVSA-N (2r,3r,4s)-2-[(1r)-1,2-dihydroxyethyl]oxolane-3,4-diol Chemical class OC[C@@H](O)[C@H]1OC[C@H](O)[C@H]1O JNYAEWCLZODPBN-JGWLITMVSA-N 0.000 description 1
- LNAZSHAWQACDHT-XIYTZBAFSA-N (2r,3r,4s,5r,6s)-4,5-dimethoxy-2-(methoxymethyl)-3-[(2s,3r,4s,5r,6r)-3,4,5-trimethoxy-6-(methoxymethyl)oxan-2-yl]oxy-6-[(2r,3r,4s,5r,6r)-4,5,6-trimethoxy-2-(methoxymethyl)oxan-3-yl]oxyoxane Chemical compound CO[C@@H]1[C@@H](OC)[C@H](OC)[C@@H](COC)O[C@H]1O[C@H]1[C@H](OC)[C@@H](OC)[C@H](O[C@H]2[C@@H]([C@@H](OC)[C@H](OC)O[C@@H]2COC)OC)O[C@@H]1COC LNAZSHAWQACDHT-XIYTZBAFSA-N 0.000 description 1
- AKHONHCNYRUTLT-NXBFSHDWSA-N (8R,9S,10R,13S,14S,17S)-15,15,17-trihydroxy-10,13-dimethyl-2,6,7,8,9,11,12,14,16,17-decahydro-1H-cyclopenta[a]phenanthren-3-one Chemical compound O=C1CC[C@]2(C)[C@H]3CC[C@](C)([C@H](CC4(O)O)O)[C@@H]4[C@@H]3CCC2=C1 AKHONHCNYRUTLT-NXBFSHDWSA-N 0.000 description 1
- JCIIKRHCWVHVFF-UHFFFAOYSA-N 1,2,4-thiadiazol-5-amine;hydrochloride Chemical compound Cl.NC1=NC=NS1 JCIIKRHCWVHVFF-UHFFFAOYSA-N 0.000 description 1
- IXPNQXFRVYWDDI-UHFFFAOYSA-N 1-methyl-2,4-dioxo-1,3-diazinane-5-carboximidamide Chemical compound CN1CC(C(N)=N)C(=O)NC1=O IXPNQXFRVYWDDI-UHFFFAOYSA-N 0.000 description 1
- FUFLCEKSBBHCMO-UHFFFAOYSA-N 11-dehydrocorticosterone Natural products O=C1CCC2(C)C3C(=O)CC(C)(C(CC4)C(=O)CO)C4C3CCC2=C1 FUFLCEKSBBHCMO-UHFFFAOYSA-N 0.000 description 1
- ZESRJSPZRDMNHY-YFWFAHHUSA-N 11-deoxycorticosterone Chemical compound O=C1CC[C@]2(C)[C@H]3CC[C@](C)([C@H](CC4)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 ZESRJSPZRDMNHY-YFWFAHHUSA-N 0.000 description 1
- NVKAWKQGWWIWPM-ABEVXSGRSA-N 17-β-hydroxy-5-α-Androstan-3-one Chemical compound C1C(=O)CC[C@]2(C)[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3CC[C@H]21 NVKAWKQGWWIWPM-ABEVXSGRSA-N 0.000 description 1
- VOXZDWNPVJITMN-ZBRFXRBCSA-N 17β-estradiol Chemical compound OC1=CC=C2[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3CCC2=C1 VOXZDWNPVJITMN-ZBRFXRBCSA-N 0.000 description 1
- MUZDXNQOSGWMJJ-UHFFFAOYSA-N 2-methylprop-2-enoic acid;prop-2-enoic acid Chemical compound OC(=O)C=C.CC(=C)C(O)=O MUZDXNQOSGWMJJ-UHFFFAOYSA-N 0.000 description 1
- 206010000021 21-hydroxylase deficiency Diseases 0.000 description 1
- RWHRFHQRVDUPIK-UHFFFAOYSA-N 50867-57-7 Chemical compound CC(=C)C(O)=O.CC(=C)C(O)=O RWHRFHQRVDUPIK-UHFFFAOYSA-N 0.000 description 1
- JMHFFDIMOUKDCZ-NTXHZHDSSA-N 61214-51-5 Chemical compound C([C@@H](C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](C)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCCN)C(=O)NCC(=O)N[C@@H](CCC(O)=O)C(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](NC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@H]1N(CCC1)C(=O)[C@@H](NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CO)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](NC(=O)[C@H](CCSC)NC(=O)[C@H](CC=1C=CC=CC=1)NC(=O)CNC(=O)CNC(=O)[C@@H](N)CC=1C=CC(O)=CC=1)[C@@H](C)O)[C@@H](C)O)C(C)C)[C@@H](C)O)C1=CC=CC=C1 JMHFFDIMOUKDCZ-NTXHZHDSSA-N 0.000 description 1
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 1
- 208000026872 Addison Disease Diseases 0.000 description 1
- 206010001367 Adrenal insufficiency Diseases 0.000 description 1
- 208000024827 Alzheimer disease Diseases 0.000 description 1
- QADHLRWLCPCEKT-UHFFFAOYSA-N Androstenediol Natural products C1C(O)CCC2(C)C3CCC(C)(C(CC4)O)C4C3CC=C21 QADHLRWLCPCEKT-UHFFFAOYSA-N 0.000 description 1
- DCXYFEDJOCDNAF-UHFFFAOYSA-N Asparagine Natural products OC(=O)C(N)CC(N)=O DCXYFEDJOCDNAF-UHFFFAOYSA-N 0.000 description 1
- 108010011485 Aspartame Proteins 0.000 description 1
- 101800005049 Beta-endorphin Proteins 0.000 description 1
- VOVIALXJUBGFJZ-KWVAZRHASA-N Budesonide Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@@H]2[C@@H]1[C@@H]1C[C@H]3OC(CCC)O[C@@]3(C(=O)CO)[C@@]1(C)C[C@@H]2O VOVIALXJUBGFJZ-KWVAZRHASA-N 0.000 description 1
- 101150105710 CRF1 gene Proteins 0.000 description 1
- 229920000623 Cellulose acetate phthalate Polymers 0.000 description 1
- CXRFDZFCGOPDTD-UHFFFAOYSA-M Cetrimide Chemical compound [Br-].CCCCCCCCCCCCCC[N+](C)(C)C CXRFDZFCGOPDTD-UHFFFAOYSA-M 0.000 description 1
- 208000017667 Chronic Disease Diseases 0.000 description 1
- 206010008874 Chronic Fatigue Syndrome Diseases 0.000 description 1
- 208000008448 Congenital adrenal hyperplasia Diseases 0.000 description 1
- 229920002261 Corn starch Polymers 0.000 description 1
- OMFXVFTZEKFJBZ-UHFFFAOYSA-N Corticosterone Natural products O=C1CCC2(C)C3C(O)CC(C)(C(CC4)C(=O)CO)C4C3CCC2=C1 OMFXVFTZEKFJBZ-UHFFFAOYSA-N 0.000 description 1
- MFYSYFVPBJMHGN-ZPOLXVRWSA-N Cortisone Chemical compound O=C1CC[C@]2(C)[C@H]3C(=O)C[C@](C)([C@@](CC4)(O)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 MFYSYFVPBJMHGN-ZPOLXVRWSA-N 0.000 description 1
- MFYSYFVPBJMHGN-UHFFFAOYSA-N Cortisone Natural products O=C1CCC2(C)C3C(=O)CC(C)(C(CC4)(O)C(=O)CO)C4C3CCC2=C1 MFYSYFVPBJMHGN-UHFFFAOYSA-N 0.000 description 1
- 102000018832 Cytochromes Human genes 0.000 description 1
- 108010052832 Cytochromes Proteins 0.000 description 1
- NOOLISFMXDJSKH-UHFFFAOYSA-N DL-menthol Natural products CC(C)C1CCC(C)CC1O NOOLISFMXDJSKH-UHFFFAOYSA-N 0.000 description 1
- FMGSKLZLMKYGDP-UHFFFAOYSA-N Dehydroepiandrosterone Natural products C1C(O)CCC2(C)C3CCC(C)(C(CC4)=O)C4C3CC=C21 FMGSKLZLMKYGDP-UHFFFAOYSA-N 0.000 description 1
- 206010012335 Dependence Diseases 0.000 description 1
- 229920002307 Dextran Polymers 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- SNRUBQQJIBEYMU-UHFFFAOYSA-N Dodecane Natural products CCCCCCCCCCCC SNRUBQQJIBEYMU-UHFFFAOYSA-N 0.000 description 1
- 206010013954 Dysphoria Diseases 0.000 description 1
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- DNXHEGUUPJUMQT-CBZIJGRNSA-N Estrone Chemical compound OC1=CC=C2[C@H]3CC[C@](C)(C(CC4)=O)[C@@H]4[C@@H]3CCC2=C1 DNXHEGUUPJUMQT-CBZIJGRNSA-N 0.000 description 1
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 1
- 239000001856 Ethyl cellulose Substances 0.000 description 1
- ZZSNKZQZMQGXPY-UHFFFAOYSA-N Ethyl cellulose Chemical compound CCOCC1OC(OC)C(OCC)C(OCC)C1OC1C(O)C(O)C(OC)C(CO)O1 ZZSNKZQZMQGXPY-UHFFFAOYSA-N 0.000 description 1
- 241001539473 Euphoria Species 0.000 description 1
- 206010015535 Euphoric mood Diseases 0.000 description 1
- 208000001640 Fibromyalgia Diseases 0.000 description 1
- 229930091371 Fructose Natural products 0.000 description 1
- 239000005715 Fructose Substances 0.000 description 1
- 102000027582 GPCRs class B Human genes 0.000 description 1
- 108091008883 GPCRs class B Proteins 0.000 description 1
- 208000002705 Glucose Intolerance Diseases 0.000 description 1
- 206010018429 Glucose tolerance impaired Diseases 0.000 description 1
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 1
- 239000004471 Glycine Substances 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- 208000023105 Huntington disease Diseases 0.000 description 1
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 1
- 206010020751 Hypersensitivity Diseases 0.000 description 1
- 206010020880 Hypertrophy Diseases 0.000 description 1
- 206010021067 Hypopituitarism Diseases 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- ZAGRKAFMISFKIO-UHFFFAOYSA-N Isolysergic acid Natural products C1=CC(C2=CC(CN(C2C2)C)C(O)=O)=C3C2=CNC3=C1 ZAGRKAFMISFKIO-UHFFFAOYSA-N 0.000 description 1
- XUJNEKJLAYXESH-REOHCLBHSA-N L-Cysteine Chemical compound SC[C@H](N)C(O)=O XUJNEKJLAYXESH-REOHCLBHSA-N 0.000 description 1
- ONIBWKKTOPOVIA-BYPYZUCNSA-N L-Proline Chemical compound OC(=O)[C@@H]1CCCN1 ONIBWKKTOPOVIA-BYPYZUCNSA-N 0.000 description 1
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 1
- ODKSFYDXXFIFQN-BYPYZUCNSA-N L-arginine Chemical compound OC(=O)[C@@H](N)CCCN=C(N)N ODKSFYDXXFIFQN-BYPYZUCNSA-N 0.000 description 1
- 229930064664 L-arginine Natural products 0.000 description 1
- 235000014852 L-arginine Nutrition 0.000 description 1
- DCXYFEDJOCDNAF-REOHCLBHSA-N L-asparagine Chemical compound OC(=O)[C@@H](N)CC(N)=O DCXYFEDJOCDNAF-REOHCLBHSA-N 0.000 description 1
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 1
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 1
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 1
- HNDVDQJCIGZPNO-YFKPBYRVSA-N L-histidine Chemical compound OC(=O)[C@@H](N)CC1=CN=CN1 HNDVDQJCIGZPNO-YFKPBYRVSA-N 0.000 description 1
- AGPKZVBTJJNPAG-WHFBIAKZSA-N L-isoleucine Chemical compound CC[C@H](C)[C@H](N)C(O)=O AGPKZVBTJJNPAG-WHFBIAKZSA-N 0.000 description 1
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 1
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 description 1
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 1
- COLNVLDHVKWLRT-QMMMGPOBSA-N L-phenylalanine Chemical compound OC(=O)[C@@H](N)CC1=CC=CC=C1 COLNVLDHVKWLRT-QMMMGPOBSA-N 0.000 description 1
- AYFVYJQAPQTCCC-GBXIJSLDSA-N L-threonine Chemical compound C[C@@H](O)[C@H](N)C(O)=O AYFVYJQAPQTCCC-GBXIJSLDSA-N 0.000 description 1
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 description 1
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 1
- KZSNJWFQEVHDMF-BYPYZUCNSA-N L-valine Chemical compound CC(C)[C@H](N)C(O)=O KZSNJWFQEVHDMF-BYPYZUCNSA-N 0.000 description 1
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 1
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 1
- 239000004472 Lysine Substances 0.000 description 1
- 101000878457 Macrocallista nimbosa FMRFamide Proteins 0.000 description 1
- 108010008364 Melanocortins Proteins 0.000 description 1
- 208000019255 Menstrual disease Diseases 0.000 description 1
- 244000246386 Mentha pulegium Species 0.000 description 1
- 235000016257 Mentha pulegium Nutrition 0.000 description 1
- 235000004357 Mentha x piperita Nutrition 0.000 description 1
- 208000001145 Metabolic Syndrome Diseases 0.000 description 1
- FQISKWAFAHGMGT-SGJOWKDISA-M Methylprednisolone sodium succinate Chemical compound [Na+].C([C@@]12C)=CC(=O)C=C1[C@@H](C)C[C@@H]1[C@@H]2[C@@H](O)C[C@]2(C)[C@@](O)(C(=O)COC(=O)CCC([O-])=O)CC[C@H]21 FQISKWAFAHGMGT-SGJOWKDISA-M 0.000 description 1
- 208000019695 Migraine disease Diseases 0.000 description 1
- 206010028980 Neoplasm Diseases 0.000 description 1
- 208000012902 Nervous system disease Diseases 0.000 description 1
- 208000025966 Neurological disease Diseases 0.000 description 1
- 108090000189 Neuropeptides Proteins 0.000 description 1
- 208000001132 Osteoporosis Diseases 0.000 description 1
- 208000018737 Parkinson disease Diseases 0.000 description 1
- 208000010067 Pituitary ACTH Hypersecretion Diseases 0.000 description 1
- 208000007913 Pituitary Neoplasms Diseases 0.000 description 1
- 208000020627 Pituitary-dependent Cushing syndrome Diseases 0.000 description 1
- 239000002202 Polyethylene glycol Substances 0.000 description 1
- 229920002413 Polyhexanide Polymers 0.000 description 1
- 239000004372 Polyvinyl alcohol Substances 0.000 description 1
- 208000006399 Premature Obstetric Labor Diseases 0.000 description 1
- 206010036600 Premature labour Diseases 0.000 description 1
- 206010036618 Premenstrual syndrome Diseases 0.000 description 1
- ONIBWKKTOPOVIA-UHFFFAOYSA-N Proline Natural products OC(=O)C1CCCN1 ONIBWKKTOPOVIA-UHFFFAOYSA-N 0.000 description 1
- 206010039897 Sedation Diseases 0.000 description 1
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 1
- 201000001880 Sexual dysfunction Diseases 0.000 description 1
- 229920001800 Shellac Polymers 0.000 description 1
- VMHLLURERBWHNL-UHFFFAOYSA-M Sodium acetate Chemical compound [Na+].CC([O-])=O VMHLLURERBWHNL-UHFFFAOYSA-M 0.000 description 1
- DWAQJAXMDSEUJJ-UHFFFAOYSA-M Sodium bisulfite Chemical compound [Na+].OS([O-])=O DWAQJAXMDSEUJJ-UHFFFAOYSA-M 0.000 description 1
- 235000021355 Stearic acid Nutrition 0.000 description 1
- 102000014169 Steroid 21-Hydroxylase Human genes 0.000 description 1
- 208000007107 Stomach Ulcer Diseases 0.000 description 1
- 208000006011 Stroke Diseases 0.000 description 1
- 208000007271 Substance Withdrawal Syndrome Diseases 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-L Sulfate Chemical compound [O-]S([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-L 0.000 description 1
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric acid Natural products [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 description 1
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 description 1
- 239000004473 Threonine Substances 0.000 description 1
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 description 1
- XSQUKJJJFZCRTK-UHFFFAOYSA-N Urea Natural products NC(N)=O XSQUKJJJFZCRTK-UHFFFAOYSA-N 0.000 description 1
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Natural products CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 description 1
- 229920002494 Zein Polymers 0.000 description 1
- 201000000690 abdominal obesity-metabolic syndrome Diseases 0.000 description 1
- 230000002159 abnormal effect Effects 0.000 description 1
- IYKJEILNJZQJPU-UHFFFAOYSA-N acetic acid;butanedioic acid Chemical compound CC(O)=O.OC(=O)CCC(O)=O IYKJEILNJZQJPU-UHFFFAOYSA-N 0.000 description 1
- 229940045942 acetone sodium bisulfite Drugs 0.000 description 1
- 210000004404 adrenal cortex Anatomy 0.000 description 1
- 230000001780 adrenocortical effect Effects 0.000 description 1
- 208000017515 adrenocortical insufficiency Diseases 0.000 description 1
- 230000008484 agonism Effects 0.000 description 1
- 239000000556 agonist Substances 0.000 description 1
- 229960003767 alanine Drugs 0.000 description 1
- 235000004279 alanine Nutrition 0.000 description 1
- 206010001584 alcohol abuse Diseases 0.000 description 1
- 208000025746 alcohol use disease Diseases 0.000 description 1
- 235000010443 alginic acid Nutrition 0.000 description 1
- 229920000615 alginic acid Polymers 0.000 description 1
- 239000000783 alginic acid Substances 0.000 description 1
- 229960001126 alginic acid Drugs 0.000 description 1
- 150000004781 alginic acids Chemical class 0.000 description 1
- 208000026935 allergic disease Diseases 0.000 description 1
- 230000007815 allergy Effects 0.000 description 1
- 206010002026 amyotrophic lateral sclerosis Diseases 0.000 description 1
- QADHLRWLCPCEKT-LOVVWNRFSA-N androst-5-ene-3beta,17beta-diol Chemical compound C1[C@@H](O)CC[C@]2(C)[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3CC=C21 QADHLRWLCPCEKT-LOVVWNRFSA-N 0.000 description 1
- 229960003473 androstanolone Drugs 0.000 description 1
- 229950009148 androstenediol Drugs 0.000 description 1
- 229960004977 anhydrous lactose Drugs 0.000 description 1
- 239000003945 anionic surfactant Substances 0.000 description 1
- 230000003042 antagnostic effect Effects 0.000 description 1
- 230000008485 antagonism Effects 0.000 description 1
- 239000000883 anti-obesity agent Substances 0.000 description 1
- 229940125710 antiobesity agent Drugs 0.000 description 1
- 239000003963 antioxidant agent Substances 0.000 description 1
- 235000006708 antioxidants Nutrition 0.000 description 1
- 230000036506 anxiety Effects 0.000 description 1
- 230000007529 anxiety like behavior Effects 0.000 description 1
- 230000036528 appetite Effects 0.000 description 1
- 235000019789 appetite Nutrition 0.000 description 1
- PYMYPHUHKUWMLA-WDCZJNDASA-N arabinose Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)C=O PYMYPHUHKUWMLA-WDCZJNDASA-N 0.000 description 1
- PYMYPHUHKUWMLA-UHFFFAOYSA-N arabinose Natural products OCC(O)C(O)C(O)C=O PYMYPHUHKUWMLA-UHFFFAOYSA-N 0.000 description 1
- 230000001174 ascending effect Effects 0.000 description 1
- 229960001230 asparagine Drugs 0.000 description 1
- 235000009582 asparagine Nutrition 0.000 description 1
- 239000000605 aspartame Substances 0.000 description 1
- 235000010357 aspartame Nutrition 0.000 description 1
- IAOZJIPTCAWIRG-QWRGUYRKSA-N aspartame Chemical compound OC(=O)C[C@H](N)C(=O)N[C@H](C(=O)OC)CC1=CC=CC=C1 IAOZJIPTCAWIRG-QWRGUYRKSA-N 0.000 description 1
- 229960003438 aspartame Drugs 0.000 description 1
- 229960005261 aspartic acid Drugs 0.000 description 1
- 235000003704 aspartic acid Nutrition 0.000 description 1
- 238000003556 assay Methods 0.000 description 1
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 1
- 230000002238 attenuated effect Effects 0.000 description 1
- 230000002567 autonomic effect Effects 0.000 description 1
- 229940092705 beclomethasone Drugs 0.000 description 1
- NBMKJKDGKREAPL-DVTGEIKXSA-N beclomethasone Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@]2(Cl)[C@@H]1[C@@H]1C[C@H](C)[C@@](C(=O)CO)(O)[C@@]1(C)C[C@@H]2O NBMKJKDGKREAPL-DVTGEIKXSA-N 0.000 description 1
- SRBFZHDQGSBBOR-UHFFFAOYSA-N beta-D-Pyranose-Lyxose Natural products OC1COC(O)C(O)C1O SRBFZHDQGSBBOR-UHFFFAOYSA-N 0.000 description 1
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 1
- 229960002537 betamethasone Drugs 0.000 description 1
- UREBDLICKHMUKA-DVTGEIKXSA-N betamethasone Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@]2(F)[C@@H]1[C@@H]1C[C@H](C)[C@@](C(=O)CO)(O)[C@@]1(C)C[C@@H]2O UREBDLICKHMUKA-DVTGEIKXSA-N 0.000 description 1
- 230000002146 bilateral effect Effects 0.000 description 1
- 230000037396 body weight Effects 0.000 description 1
- 230000037182 bone density Effects 0.000 description 1
- 229960004436 budesonide Drugs 0.000 description 1
- 229910000019 calcium carbonate Inorganic materials 0.000 description 1
- 229960003563 calcium carbonate Drugs 0.000 description 1
- 235000010216 calcium carbonate Nutrition 0.000 description 1
- 229960001714 calcium phosphate Drugs 0.000 description 1
- 238000004364 calculation method Methods 0.000 description 1
- 239000007963 capsule composition Substances 0.000 description 1
- 239000001768 carboxy methyl cellulose Substances 0.000 description 1
- 229940081734 cellulose acetate phthalate Drugs 0.000 description 1
- 210000003169 central nervous system Anatomy 0.000 description 1
- 230000001055 chewing effect Effects 0.000 description 1
- 229960004926 chlorobutanol Drugs 0.000 description 1
- 208000025302 chronic primary adrenal insufficiency Diseases 0.000 description 1
- 208000027845 classic congenital adrenal hyperplasia Diseases 0.000 description 1
- 230000001332 colony forming effect Effects 0.000 description 1
- 239000003086 colorant Substances 0.000 description 1
- 238000004040 coloring Methods 0.000 description 1
- 238000002648 combination therapy Methods 0.000 description 1
- 229940125782 compound 2 Drugs 0.000 description 1
- 239000007891 compressed tablet Substances 0.000 description 1
- 238000013270 controlled release Methods 0.000 description 1
- 239000008120 corn starch Substances 0.000 description 1
- OMFXVFTZEKFJBZ-HJTSIMOOSA-N corticosterone Chemical compound O=C1CC[C@]2(C)[C@H]3[C@@H](O)C[C@](C)([C@H](CC4)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 OMFXVFTZEKFJBZ-HJTSIMOOSA-N 0.000 description 1
- 239000002769 corticotropin releasing factor antagonist Substances 0.000 description 1
- 229960004544 cortisone Drugs 0.000 description 1
- 229960000913 crospovidone Drugs 0.000 description 1
- 239000002577 cryoprotective agent Substances 0.000 description 1
- 229960002433 cysteine Drugs 0.000 description 1
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 1
- 235000018417 cysteine Nutrition 0.000 description 1
- ZESRJSPZRDMNHY-UHFFFAOYSA-N de-oxy corticosterone Natural products O=C1CCC2(C)C3CCC(C)(C(CC4)C(=O)CO)C4C3CCC2=C1 ZESRJSPZRDMNHY-UHFFFAOYSA-N 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- FMGSKLZLMKYGDP-USOAJAOKSA-N dehydroepiandrosterone Chemical compound C1[C@@H](O)CC[C@]2(C)[C@H]3CC[C@](C)(C(CC4)=O)[C@@H]4[C@@H]3CC=C21 FMGSKLZLMKYGDP-USOAJAOKSA-N 0.000 description 1
- 230000002939 deleterious effect Effects 0.000 description 1
- 229940119740 deoxycorticosterone Drugs 0.000 description 1
- 229960000632 dexamfetamine Drugs 0.000 description 1
- 125000003438 dodecyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 239000000890 drug combination Substances 0.000 description 1
- 239000000975 dye Substances 0.000 description 1
- 230000002526 effect on cardiovascular system Effects 0.000 description 1
- 239000003995 emulsifying agent Substances 0.000 description 1
- 230000002124 endocrine Effects 0.000 description 1
- 239000006274 endogenous ligand Substances 0.000 description 1
- 230000002708 enhancing effect Effects 0.000 description 1
- 238000009505 enteric coating Methods 0.000 description 1
- 239000002702 enteric coating Substances 0.000 description 1
- 230000007613 environmental effect Effects 0.000 description 1
- 206010015037 epilepsy Diseases 0.000 description 1
- 229960005309 estradiol Drugs 0.000 description 1
- 229930182833 estradiol Natural products 0.000 description 1
- PROQIPRRNZUXQM-ZXXIGWHRSA-N estriol Chemical compound OC1=CC=C2[C@H]3CC[C@](C)([C@H]([C@H](O)C4)O)[C@@H]4[C@@H]3CCC2=C1 PROQIPRRNZUXQM-ZXXIGWHRSA-N 0.000 description 1
- 229960001348 estriol Drugs 0.000 description 1
- 229960003399 estrone Drugs 0.000 description 1
- MVPICKVDHDWCJQ-UHFFFAOYSA-N ethyl 3-pyrrolidin-1-ylpropanoate Chemical compound CCOC(=O)CCN1CCCC1 MVPICKVDHDWCJQ-UHFFFAOYSA-N 0.000 description 1
- 235000019325 ethyl cellulose Nutrition 0.000 description 1
- 229920001249 ethyl cellulose Polymers 0.000 description 1
- 235000010944 ethyl methyl cellulose Nutrition 0.000 description 1
- 239000001761 ethyl methyl cellulose Substances 0.000 description 1
- 230000007717 exclusion Effects 0.000 description 1
- 230000001747 exhibiting effect Effects 0.000 description 1
- 206010016256 fatigue Diseases 0.000 description 1
- 150000002191 fatty alcohols Chemical class 0.000 description 1
- 238000012395 formulation development Methods 0.000 description 1
- 239000008369 fruit flavor Substances 0.000 description 1
- 229930182830 galactose Natural products 0.000 description 1
- 230000002496 gastric effect Effects 0.000 description 1
- 210000004051 gastric juice Anatomy 0.000 description 1
- 238000012224 gene deletion Methods 0.000 description 1
- 229960002989 glutamic acid Drugs 0.000 description 1
- 235000013922 glutamic acid Nutrition 0.000 description 1
- 239000004220 glutamic acid Substances 0.000 description 1
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 1
- 235000004554 glutamine Nutrition 0.000 description 1
- 229960002743 glutamine Drugs 0.000 description 1
- 125000005456 glyceride group Chemical group 0.000 description 1
- 229960002449 glycine Drugs 0.000 description 1
- 150000002334 glycols Chemical class 0.000 description 1
- 238000004128 high performance liquid chromatography Methods 0.000 description 1
- 229960002885 histidine Drugs 0.000 description 1
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 description 1
- 230000003054 hormonal effect Effects 0.000 description 1
- 235000001050 hortel pimenta Nutrition 0.000 description 1
- 229920003132 hydroxypropyl methylcellulose phthalate Polymers 0.000 description 1
- 229940031704 hydroxypropyl methylcellulose phthalate Drugs 0.000 description 1
- 229920000639 hydroxypropylmethylcellulose acetate succinate Polymers 0.000 description 1
- 239000000960 hypophysis hormone Substances 0.000 description 1
- 230000001900 immune effect Effects 0.000 description 1
- 230000000899 immune system response Effects 0.000 description 1
- 230000002055 immunohistochemical effect Effects 0.000 description 1
- 238000010348 incorporation Methods 0.000 description 1
- 230000006698 induction Effects 0.000 description 1
- 230000004968 inflammatory condition Effects 0.000 description 1
- 239000004615 ingredient Substances 0.000 description 1
- 230000005764 inhibitory process Effects 0.000 description 1
- 230000000977 initiatory effect Effects 0.000 description 1
- 238000002347 injection Methods 0.000 description 1
- 239000007924 injection Substances 0.000 description 1
- 229910010272 inorganic material Inorganic materials 0.000 description 1
- 239000011147 inorganic material Substances 0.000 description 1
- 229960000310 isoleucine Drugs 0.000 description 1
- AGPKZVBTJJNPAG-UHFFFAOYSA-N isoleucine Natural products CCC(C)C(N)C(O)=O AGPKZVBTJJNPAG-UHFFFAOYSA-N 0.000 description 1
- FZWBNHMXJMCXLU-BLAUPYHCSA-N isomaltotriose Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1OC[C@@H]1[C@@H](O)[C@H](O)[C@@H](O)[C@@H](OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C=O)O1 FZWBNHMXJMCXLU-BLAUPYHCSA-N 0.000 description 1
- 229960003136 leucine Drugs 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 230000004807 localization Effects 0.000 description 1
- ZAGRKAFMISFKIO-QMTHXVAHSA-N lysergic acid Chemical compound C1=CC(C2=C[C@H](CN([C@@H]2C2)C)C(O)=O)=C3C2=CNC3=C1 ZAGRKAFMISFKIO-QMTHXVAHSA-N 0.000 description 1
- 229960003646 lysine Drugs 0.000 description 1
- 230000014759 maintenance of location Effects 0.000 description 1
- 238000009115 maintenance therapy Methods 0.000 description 1
- 229960001855 mannitol Drugs 0.000 description 1
- 235000012054 meals Nutrition 0.000 description 1
- 239000002865 melanocortin Substances 0.000 description 1
- 229940041616 menthol Drugs 0.000 description 1
- 230000006371 metabolic abnormality Effects 0.000 description 1
- 229930182817 methionine Natural products 0.000 description 1
- 229960004452 methionine Drugs 0.000 description 1
- 229920000609 methyl cellulose Polymers 0.000 description 1
- 229960004584 methylprednisolone Drugs 0.000 description 1
- 206010027599 migraine Diseases 0.000 description 1
- 239000007932 molded tablet Substances 0.000 description 1
- 150000002772 monosaccharides Chemical class 0.000 description 1
- 230000036651 mood Effects 0.000 description 1
- 201000006417 multiple sclerosis Diseases 0.000 description 1
- 208000029766 myalgic encephalomeyelitis/chronic fatigue syndrome Diseases 0.000 description 1
- 230000003227 neuromodulating effect Effects 0.000 description 1
- 239000002858 neurotransmitter agent Substances 0.000 description 1
- 239000002736 nonionic surfactant Substances 0.000 description 1
- QIQXTHQIDYTFRH-UHFFFAOYSA-N octadecanoic acid Chemical compound CCCCCCCCCCCCCCCCCC(O)=O QIQXTHQIDYTFRH-UHFFFAOYSA-N 0.000 description 1
- OQCDKBAXFALNLD-UHFFFAOYSA-N octadecanoic acid Natural products CCCCCCCC(C)CCCCCCCCC(O)=O OQCDKBAXFALNLD-UHFFFAOYSA-N 0.000 description 1
- 239000011368 organic material Substances 0.000 description 1
- 238000012261 overproduction Methods 0.000 description 1
- 239000001301 oxygen Substances 0.000 description 1
- 229910052760 oxygen Inorganic materials 0.000 description 1
- 238000004806 packaging method and process Methods 0.000 description 1
- 230000036961 partial effect Effects 0.000 description 1
- 230000037361 pathway Effects 0.000 description 1
- 230000035515 penetration Effects 0.000 description 1
- 125000003538 pentan-3-yl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])C([H])([H])[H] 0.000 description 1
- 239000007967 peppermint flavor Substances 0.000 description 1
- 239000008177 pharmaceutical agent Substances 0.000 description 1
- COLNVLDHVKWLRT-UHFFFAOYSA-N phenylalanine Natural products OC(=O)C(N)CC1=CC=CC=C1 COLNVLDHVKWLRT-UHFFFAOYSA-N 0.000 description 1
- 229960005190 phenylalanine Drugs 0.000 description 1
- 229940096826 phenylmercuric acetate Drugs 0.000 description 1
- PDTFCHSETJBPTR-UHFFFAOYSA-N phenylmercuric nitrate Chemical compound [O-][N+](=O)O[Hg]C1=CC=CC=C1 PDTFCHSETJBPTR-UHFFFAOYSA-N 0.000 description 1
- 230000004962 physiological condition Effects 0.000 description 1
- 230000035479 physiological effects, processes and functions Effects 0.000 description 1
- 239000000049 pigment Substances 0.000 description 1
- 239000004014 plasticizer Substances 0.000 description 1
- 229920001983 poloxamer Polymers 0.000 description 1
- 229920000642 polymer Polymers 0.000 description 1
- 150000003077 polyols Chemical class 0.000 description 1
- 229920001451 polypropylene glycol Polymers 0.000 description 1
- 229920000136 polysorbate Polymers 0.000 description 1
- 229940068965 polysorbates Drugs 0.000 description 1
- 229940100467 polyvinyl acetate phthalate Drugs 0.000 description 1
- 229920002451 polyvinyl alcohol Polymers 0.000 description 1
- 229920000523 polyvinylpolypyrrolidone Polymers 0.000 description 1
- 235000013809 polyvinylpolypyrrolidone Nutrition 0.000 description 1
- 239000001103 potassium chloride Substances 0.000 description 1
- 235000011164 potassium chloride Nutrition 0.000 description 1
- 229910000160 potassium phosphate Inorganic materials 0.000 description 1
- 235000011009 potassium phosphates Nutrition 0.000 description 1
- 229920001592 potato starch Polymers 0.000 description 1
- 229920003124 powdered cellulose Polymers 0.000 description 1
- 235000019814 powdered cellulose Nutrition 0.000 description 1
- 229960002847 prasterone Drugs 0.000 description 1
- 239000002243 precursor Substances 0.000 description 1
- 208000026440 premature labor Diseases 0.000 description 1
- 230000002265 prevention Effects 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- 238000004886 process control Methods 0.000 description 1
- 102000004196 processed proteins & peptides Human genes 0.000 description 1
- 201000002212 progressive supranuclear palsy Diseases 0.000 description 1
- 229960002429 proline Drugs 0.000 description 1
- 235000013772 propylene glycol Nutrition 0.000 description 1
- 239000011253 protective coating Substances 0.000 description 1
- 238000012797 qualification Methods 0.000 description 1
- 238000005057 refrigeration Methods 0.000 description 1
- 238000012827 research and development Methods 0.000 description 1
- 238000002271 resection Methods 0.000 description 1
- 230000003938 response to stress Effects 0.000 description 1
- XWGJFPHUCFXLBL-UHFFFAOYSA-M rongalite Chemical compound [Na+].OCS([O-])=O XWGJFPHUCFXLBL-UHFFFAOYSA-M 0.000 description 1
- 235000019204 saccharin Nutrition 0.000 description 1
- CVHZOJJKTDOEJC-UHFFFAOYSA-N saccharin Chemical compound C1=CC=C2C(=O)NS(=O)(=O)C2=C1 CVHZOJJKTDOEJC-UHFFFAOYSA-N 0.000 description 1
- 229940081974 saccharin Drugs 0.000 description 1
- 239000000901 saccharin and its Na,K and Ca salt Substances 0.000 description 1
- 231100000279 safety data Toxicity 0.000 description 1
- 239000000565 sealant Substances 0.000 description 1
- 238000007789 sealing Methods 0.000 description 1
- 230000036280 sedation Effects 0.000 description 1
- 229960001153 serine Drugs 0.000 description 1
- 231100000872 sexual dysfunction Toxicity 0.000 description 1
- 239000004208 shellac Substances 0.000 description 1
- ZLGIYFNHBLSMPS-ATJNOEHPSA-N shellac Chemical compound OCCCCCC(O)C(O)CCCCCCCC(O)=O.C1C23[C@H](C(O)=O)CCC2[C@](C)(CO)[C@@H]1C(C(O)=O)=C[C@@H]3O ZLGIYFNHBLSMPS-ATJNOEHPSA-N 0.000 description 1
- 229940113147 shellac Drugs 0.000 description 1
- 235000013874 shellac Nutrition 0.000 description 1
- 235000012239 silicon dioxide Nutrition 0.000 description 1
- 235000011888 snacks Nutrition 0.000 description 1
- 239000000344 soap Substances 0.000 description 1
- 235000015424 sodium Nutrition 0.000 description 1
- 239000001632 sodium acetate Substances 0.000 description 1
- 235000017281 sodium acetate Nutrition 0.000 description 1
- 235000010413 sodium alginate Nutrition 0.000 description 1
- 239000000661 sodium alginate Substances 0.000 description 1
- 229940005550 sodium alginate Drugs 0.000 description 1
- WXMKPNITSTVMEF-UHFFFAOYSA-M sodium benzoate Chemical compound [Na+].[O-]C(=O)C1=CC=CC=C1 WXMKPNITSTVMEF-UHFFFAOYSA-M 0.000 description 1
- 239000004299 sodium benzoate Substances 0.000 description 1
- 235000010234 sodium benzoate Nutrition 0.000 description 1
- 229940001593 sodium carbonate Drugs 0.000 description 1
- 235000017550 sodium carbonate Nutrition 0.000 description 1
- 235000019812 sodium carboxymethyl cellulose Nutrition 0.000 description 1
- 229920001027 sodium carboxymethylcellulose Polymers 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- 235000010267 sodium hydrogen sulphite Nutrition 0.000 description 1
- 239000001488 sodium phosphate Substances 0.000 description 1
- 229910000162 sodium phosphate Inorganic materials 0.000 description 1
- 229920003109 sodium starch glycolate Polymers 0.000 description 1
- 239000008109 sodium starch glycolate Substances 0.000 description 1
- 229940079832 sodium starch glycolate Drugs 0.000 description 1
- 229940045902 sodium stearyl fumarate Drugs 0.000 description 1
- YNJORDSKPXMABC-UHFFFAOYSA-M sodium;2-hydroxypropane-2-sulfonate Chemical compound [Na+].CC(C)(O)S([O-])(=O)=O YNJORDSKPXMABC-UHFFFAOYSA-M 0.000 description 1
- 235000021058 soft food Nutrition 0.000 description 1
- 239000000243 solution Substances 0.000 description 1
- 230000000392 somatic effect Effects 0.000 description 1
- 241000894007 species Species 0.000 description 1
- 239000007921 spray Substances 0.000 description 1
- 230000006641 stabilisation Effects 0.000 description 1
- 238000011105 stabilization Methods 0.000 description 1
- 238000010561 standard procedure Methods 0.000 description 1
- 238000011272 standard treatment Methods 0.000 description 1
- 235000021193 standardized breakfast Nutrition 0.000 description 1
- 239000008117 stearic acid Substances 0.000 description 1
- 230000010009 steroidogenesis Effects 0.000 description 1
- 230000000638 stimulation Effects 0.000 description 1
- 235000000346 sugar Nutrition 0.000 description 1
- 230000003319 supportive effect Effects 0.000 description 1
- 230000001629 suppression Effects 0.000 description 1
- 230000002459 sustained effect Effects 0.000 description 1
- 239000012730 sustained-release form Substances 0.000 description 1
- 230000009747 swallowing Effects 0.000 description 1
- 208000011580 syndromic disease Diseases 0.000 description 1
- 238000007910 systemic administration Methods 0.000 description 1
- 230000009885 systemic effect Effects 0.000 description 1
- 239000011975 tartaric acid Substances 0.000 description 1
- 235000002906 tartaric acid Nutrition 0.000 description 1
- 230000002123 temporal effect Effects 0.000 description 1
- 238000010998 test method Methods 0.000 description 1
- 125000000437 thiazol-2-yl group Chemical group [H]C1=C([H])N=C(*)S1 0.000 description 1
- RTKIYNMVFMVABJ-UHFFFAOYSA-L thimerosal Chemical compound [Na+].CC[Hg]SC1=CC=CC=C1C([O-])=O RTKIYNMVFMVABJ-UHFFFAOYSA-L 0.000 description 1
- 229940033663 thimerosal Drugs 0.000 description 1
- 229960002898 threonine Drugs 0.000 description 1
- 238000004448 titration Methods 0.000 description 1
- 230000000699 topical effect Effects 0.000 description 1
- 230000001988 toxicity Effects 0.000 description 1
- 231100000419 toxicity Toxicity 0.000 description 1
- 229960005294 triamcinolone Drugs 0.000 description 1
- GFNANZIMVAIWHM-OBYCQNJPSA-N triamcinolone Chemical compound O=C1C=C[C@]2(C)[C@@]3(F)[C@@H](O)C[C@](C)([C@@]([C@H](O)C4)(O)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 GFNANZIMVAIWHM-OBYCQNJPSA-N 0.000 description 1
- 125000005591 trimellitate group Chemical group 0.000 description 1
- 229960004799 tryptophan Drugs 0.000 description 1
- 229960004441 tyrosine Drugs 0.000 description 1
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 1
- 210000002700 urine Anatomy 0.000 description 1
- 229960004295 valine Drugs 0.000 description 1
- 239000004474 valine Substances 0.000 description 1
- 208000009935 visceral pain Diseases 0.000 description 1
- 230000002618 waking effect Effects 0.000 description 1
- 239000003232 water-soluble binding agent Substances 0.000 description 1
- 239000005019 zein Substances 0.000 description 1
- 229940093612 zein Drugs 0.000 description 1
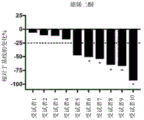
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/535—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with at least one nitrogen and one oxygen as the ring hetero atoms, e.g. 1,2-oxazines
- A61K31/5375—1,4-Oxazines, e.g. morpholine
- A61K31/5377—1,4-Oxazines, e.g. morpholine not condensed and containing further heterocyclic rings, e.g. timolol
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D487/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00
- C07D487/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00 in which the condensed system contains two hetero rings
- C07D487/04—Ortho-condensed systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0053—Mouth and digestive tract, i.e. intraoral and peroral administration
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/16—Agglomerates; Granulates; Microbeadlets ; Microspheres; Pellets; Solid products obtained by spray drying, spray freeze drying, spray congealing,(multiple) emulsion solvent evaporation or extraction
- A61K9/1605—Excipients; Inactive ingredients
- A61K9/1629—Organic macromolecular compounds
- A61K9/1635—Organic macromolecular compounds obtained by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyvinyl pyrrolidone, poly(meth)acrylates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2009—Inorganic compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2022—Organic macromolecular compounds
- A61K9/2027—Organic macromolecular compounds obtained by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyvinyl pyrrolidone, poly(meth)acrylates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2022—Organic macromolecular compounds
- A61K9/205—Polysaccharides, e.g. alginate, gums; Cyclodextrin
- A61K9/2054—Cellulose; Cellulose derivatives, e.g. hydroxypropyl methylcellulose
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2072—Pills, tablets, discs, rods characterised by shape, structure or size; Tablets with holes, special break lines or identification marks; Partially coated tablets; Disintegrating flat shaped forms
- A61K9/2077—Tablets comprising drug-containing microparticles in a substantial amount of supporting matrix; Multiparticulate tablets
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2095—Tabletting processes; Dosage units made by direct compression of powders or specially processed granules, by eliminating solvents, by melt-extrusion, by injection molding, by 3D printing
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/4816—Wall or shell material
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/4816—Wall or shell material
- A61K9/4825—Proteins, e.g. gelatin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P5/00—Drugs for disorders of the endocrine system
- A61P5/38—Drugs for disorders of the endocrine system of the suprarenal hormones
Abstract
本发明提供了包括3‑(4‑氯‑2‑(吗啉‑4‑基)噻唑‑5‑基)‑7‑(1‑乙基丙基)‑2,5‑二甲基吡唑并(l,5‑a)嘧啶的新型药物组合物以及将所述药物组合物用于治疗先天性肾上腺皮质增生症(CAH)的方法。
Description
交叉引用
本申请要求于2017年8月14日提交的美国临时专利申请第62/545,393号的权益,所述美国临时专利申请通过引用整体并入本文。
背景技术
促肾上腺皮质激素释放因子(CRF)是一种41氨基酸肽,所述肽为垂体前叶的阿黑皮素原(POMC)源性肽分泌的主要生理调节剂。除了在垂体处起到内分泌作用外,CRF的免疫组织化学定位已经表明,所述激素在中枢神经系统中广泛分布于下丘脑外,并产生与大脑中的神经递质或神经调质作用一致的各种自主、电生理和行为效应。还有证据表明,CRF在整合免疫系统对生理、心理和免疫应激源的应答方面发挥着重要作用。
发明内容
本发明提供了包括3-(4-氯-2-(吗啉-4-基)噻唑-5-基)-7-(1-乙基丙基)-2,5-二甲基吡唑并(1,5-a)嘧啶的新型药物组合物以及使用此类药物组合物治疗先天性肾上腺皮质增生症(CAH)的方法。
一方面,本公开提供了一种呈胶囊的形式的药物组合物,所述药物组合物包括化合物1:
在一个实施例中,所述药物组合物包括介于约1mg与约500mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一个实施例中,所述药物组合物包括介于约5mg与约500mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一个实施例中,所述药物组合物包括介于约10mg与约500mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一个实施例中,所述药物组合物包括介于约10mg与约300mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一个实施例中,所述药物组合物包括介于约10mg与约100mg之间的化合物1或其药学上可接受的盐或溶剂化物。
在一个实施例中,所述药物组合物包括介于约50mg与约500mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一个实施例中,所述药物组合物包括介于约100mg与约500mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一个实施例中,所述药物组合物包括介于约100mg与约400mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一个实施例中,所述药物组合物包括介于约100mg与约300mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一个实施例中,所述药物组合物包括介于约150mg与约250mg之间的化合物1或其药学上可接受的盐或溶剂化物。
在一个实施例中,所述药物组合物包括约400mg化合物1或其药学上可接受的盐或溶剂化物。在一个实施例中,所述药物组合物包括约300mg化合物1或其药学上可接受的盐或溶剂化物。在一个实施例中,所述药物组合物包括约250mg化合物1或其药学上可接受的盐或溶剂化物。在一个实施例中,所述药物组合物包括约200mg化合物1或其药学上可接受的盐或溶剂化物。在一个实施例中,所述药物组合物包括约150mg化合物1或其药学上可接受的盐或溶剂化物。在一个实施例中,所述药物组合物包括约100mg化合物1或其药学上可接受的盐或溶剂化物。在一个实施例中,所述药物组合物包括约80mg化合物1或其药学上可接受的盐或溶剂化物。在一个实施例中,所述药物组合物包括约60mg化合物1或其药学上可接受的盐或溶剂化物。在一个实施例中,所述药物组合物包括约50mg化合物1或其药学上可接受的盐或溶剂化物。在一个实施例中,所述药物组合物包括约30mg化合物1或其药学上可接受的盐或溶剂化物。
在一个实施例中,化合物1或其药学上可接受的盐或溶剂化物呈微粒的形式。在一个实施例中,所述微粒的平均尺寸介于约1μm与约20μm之间。在一个实施例中,所述微粒的平均尺寸介于约5μm与约15μm之间。在一个实施例中,所述微粒的平均尺寸小于约10μm。
在一个实施例中,所述胶囊为硬明胶胶囊。在一个实施例中,所述胶囊为软明胶胶囊。在一个实施例中,所述胶囊使用选自由以下组成的组的材料形成:天然明胶、合成明胶、果胶、酪蛋白、胶原蛋白、蛋白质、改性淀粉、聚乙烯吡咯烷酮、丙烯酸聚合物、纤维素衍生物和其任何组合。
在一个实施例中,所述药物组合物不含另外的赋形剂。在一个实施例中,所述药物组合物进一步包括一种或多种药学上可接受的赋形剂。
在一方面,本公开提供了一种呈片剂的形式的药物组合物,所述药物组合物包括化合物1:
在一个实施例中,所述药物组合物包括介于约1mg与约500mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一个实施例中,所述药物组合物包括介于约5mg与约500mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一个实施例中,所述药物组合物包括介于约10mg与约500mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一个实施例中,所述药物组合物包括介于约10mg与约300mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一个实施例中,所述药物组合物包括介于约10mg与约100mg之间的化合物1或其药学上可接受的盐或溶剂化物。
在一个实施例中,所述药物组合物包括介于约50mg与约500mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一个实施例中,所述药物组合物包括介于约100mg与约500mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一个实施例中,所述药物组合物包括介于约100mg与约400mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一个实施例中,所述药物组合物包括介于约100mg与约300mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一个实施例中,所述药物组合物包括介于约150mg与约250mg之间的化合物1或其药学上可接受的盐或溶剂化物。
在一个实施例中,所述药物组合物包括约400mg化合物1或其药学上可接受的盐或溶剂化物。在一个实施例中,所述药物组合物包括约300mg化合物1或其药学上可接受的盐或溶剂化物。在一个实施例中,所述药物组合物包括约250mg化合物1或其药学上可接受的盐或溶剂化物。在一个实施例中,所述药物组合物包括约200mg化合物1或其药学上可接受的盐或溶剂化物。在一个实施例中,所述药物组合物包括约150mg化合物1或其药学上可接受的盐或溶剂化物。在一个实施例中,所述药物组合物包括约100mg化合物1或其药学上可接受的盐或溶剂化物。在一个实施例中,所述药物组合物包括约80mg化合物1或其药学上可接受的盐或溶剂化物。在一个实施例中,所述药物组合物包括约60mg化合物1或其药学上可接受的盐或溶剂化物。在一个实施例中,所述药物组合物包括约50mg化合物1或其药学上可接受的盐或溶剂化物。在一个实施例中,所述药物组合物包括约30mg化合物1或其药学上可接受的盐或溶剂化物。
在一个实施例中,化合物1或其药学上可接受的盐或溶剂化物呈微粒的形式。在一个实施例中,所述微粒的平均尺寸介于约1μm与约20μm之间。在一个实施例中,所述微粒的平均尺寸介于约5μm与约15μm之间。在一个实施例中,所述微粒的平均尺寸小于约10μm。
在一个实施例中,所述片剂通过压缩、模制或挤出制备。在一个实施例中,所述片剂通过热熔挤出制备。在一个实施例中,所述药物组合物进一步包括一种或多种药学上可接受的赋形剂。
在一个实施例中,所述药物组合物在25℃下稳定,持续至少1个月。在一个实施例中,所述药物组合物在25℃下稳定,持续至少3个月。在一个实施例中,所述药物组合物在25℃下稳定,持续至少6个月。在一个实施例中,所述药物组合物在25℃下稳定,持续至少9个月。在一个实施例中,所述药物组合物在25℃下稳定,持续至少12个月。
通过引用并入
本说明书中所提及的所有公开、专利以及专利申请通过引用并入本文,其程度如同每个单独的公开、专利或专利申请被专门地且单独地指示通过引用并入。
附图说明
本发明的新颖特征在所附权利要求中具体阐述。通过参考以下对说明性实施例进行阐述的详细说明以及附图,将获得对本发明的特征和优点的更好理解,所述实施例中利用了本发明的原理,在附图中:
图1示出了以每个水平每天给药一次14天后,患有CAH的患者中的化合物1;
图2展示了由于施用化合物1而产生的跨不同受试者的ACTH衰减;
图3展示了由于施用化合物1而产生的17-OHP的减少;
图4展示了由于施用化合物1而产生的雄烯二酮的减少;
图5展示了使用USP-II(桨法)在50rpm下实现的制造配方A-l、A-2和A-3在900mL0.1N HCL+1.0%SDS介质中的释放百分比;
图6展示了使用USP-II(桨法)在50rpm下实现的制造配方B-l、B-2和B-3在900mL0.1N HCL+1.0%SDS介质中的释放百分比;并且
图7展示了使用USP-II(桨法)在50rpm下实现的制造配方C-l、C-2和C-3在900mL0.1N HCL+1.0%SDS介质中的释放百分比。
具体实施方式
CRF已经涉及精神病状和神经疾病(包含抑郁症和焦虑症)以及以下:阿尔茨海默氏病(Alzheimer's disease)、亨廷顿氏病(Huntington's disease)、进行性核上性麻痹、肌萎缩侧索硬化症、帕金森氏病(Parkinson's disease)、癫痫、偏头痛、酒精和物质滥用及相关戒断症状、肥胖症、代谢综合征、先天性肾上腺皮质增生症(CAH)、库兴氏病(Cushing'sdisease)、高血压、中风、肠易激综合征、应激性胃溃疡、经前综合征、性功能障碍、早产、炎症性病状、过敏、多发性硬化症、内脏痛、睡眠病状、垂体肿瘤或异位垂体源性肿瘤、慢性疲劳综合征和纤维肌痛。
已经鉴定出CRF受体亚型CRF1和CRF2,并且所述CRF受体亚型在大脑内非均匀分布,由此表明潜在的功能多样性。例如,广泛分布的大脑CRF1受体在暴露于环境应激源时与情绪密切相关。值得注意的是,CRF1受体而非CRF2受体似乎对选择性的焦虑样行为进行介导。更具离散性的隔膜下丘脑分布和替代性内源性配体的可用性表明CRF2受体具有不同的功能作用。例如,据报道,相对于CRF1受体,对CRF2具有优先亲和力的新型CRF家族神经肽会抑制食欲,而不会产生在选择性CRF1激动的情况下观察到的行为激活情况。在其它情况下,CRF2激动产生的影响与针对CRF1拮抗剂或CRF1基因缺失报告的影响类似。例如,虽然已经提出将CRF2激动剂作为抗肥胖剂,但CRF1拮抗剂对于肥胖症而言也可能是一种重要治疗方法。
对CAH的治疗基于根据婴儿期到成年期的诊断使用各种药物使激素和类固醇水平正常化。糖皮质激素目前是CAH的标准治疗方法,其既用于纠正内源性皮质醇缺乏,也用于降低垂体中升高的ACTH水平,ACTH水平升高是雄激素产量增加的驱动因素。与皮质醇替代疗法足以进行治疗的爱迪生氏病(Addison's disease)(肾上腺功能不全)的治疗不同,CAH的治疗还必须降低ACTH产量,以同样控制随后的雄激素过量。因此,糖皮质激素治疗的目标包含皮质醇替代疗法和ACTH抑制,以防止女性的男性化和月经失调。需要盐皮质激素替代疗法以达到正常的血浆肾素活性,从而维持患有盐消耗形式的CAH的患者的正常血压、电解质平衡和容量状态。
糖皮质激素治疗方案必须支持正常的生理机能,并且还必须确保在可能引发强烈应激反应(例如,并发疾病、运动、低血压)的事件期间可以获得足够的皮质醇。还需要进行仔细监测,以避免因治疗不足而引起阿狄森氏综合征(Addisonian syndrome)。盐皮质激素治疗过度可能导致高血压,而治疗不足可能导致低血压、盐流失、疲劳和对糖皮质激素的需求增加。用于监测治疗功效的典型实验室测试包含测量17-OHP、雄烯二酮、睾酮、肾素活性和电解质的血浆浓度。
在患有CAH的成人患者中,心血管疾病(包含肥胖症、高血压和胰岛素抵抗)的风险因子的普遍率增加。一项针对一大群小儿CAH患者和成人CAH患者的研究(n=244)表明,虽然为患者开具了各种糖皮质激素治疗方案,但患者经常表现出激素控制不良和上述不良后果。CAH的治疗包含用糖皮质激素(儿童通常使用氢化可的松,而成人通常使用治疗指数较窄的更有效的药剂,如地塞米松)和盐皮质激素(通常为氟氢可的松)(对于失盐,如过必要的话)使皮质醇缺乏正常化。然而,实现对过量雄激素的充分抑制所需的糖皮质激素剂量通常远高于患有爱迪生氏病的患者中仅用于皮质醇替代疗法的正常生理剂量。糖皮质激素暴露的这种增加可能导致CAH患者的心血管风险因子增加、葡萄糖耐受不良和骨密度降低。
CRF被认为是促肾上腺皮质激素(“ACTH”)、β-内啡肽和其它促黑皮素原(“POMC”)源性肽从垂体前叶的基底释放和应激诱导释放的主要生理调节剂。CRF的分泌通过与CRF1受体(G蛋白偶联受体B类家族的成员)结合使垂体前叶中的皮质激素释放ACTH。
由于CRF1的生理学意义,具有显著CRF受体结合活性并且能够拮抗CRF1受体的具有生物活性的小分子的形成仍然是期望的目标,并且一直是正在进行的针对焦虑症、抑郁症、肠易激综合征、创伤后应激病状和物质滥用的治疗的研究和开发的主题。
在下丘脑促肾上腺皮质激素释放因子(CRF)的控制下,垂体激素ACTH刺激胆固醇的摄取并驱动孕烯醇酮的合成,从而引发肾上腺中的类固醇生成。肾上腺皮质由三个区域构成,这些区域产生不同种类的激素,其中许多激素通过这一途径被ACTH动员性胆固醇驱动。由于突变或缺失而引起的这些酶的缺乏使底物浓度增加。在通过21-羟化酶基因(CYP21A2)的突变或缺失产生的最常见形式的CAH中,肾上腺由于类固醇前体、孕酮和17-羟孕酮(17-OHP)的积累而产生强效雄激素。在这些情况下,17-OHP的血浆水平可能达到正常浓度的10-1000倍。这些增加导致雄激素,特别是雄烯二酮、睾酮和二羟基睾酮的过量产生,从而导致女性男性化。此外,CAH中的21-羟化酶缺乏导致糖皮质激素和盐皮质激素,特别是皮质醇和醛固酮的生物合成不足。皮质醇是下丘脑CRF分泌和垂体ACTH释放的关键负反馈调节剂。糖皮质激素合成和释放的缺乏会消除对下丘脑和垂体的约束,从而使ACTH水平升高。过度的ACTH刺激导致束状带和网状带的肥大,从而导致肾上腺增生。
在一个实施例中,可用于治疗CAH的CRF受体拮抗剂为3-(4-氯-2-(吗啉-4-基)噻唑-5-基)-7-(1-乙基丙基)-2,5-二甲基吡唑并(1,5-a)嘧啶。
某些定义
除非另外定义,否则本文所用的所有技术术语和科学术语的含义与本领域的普通技术人员通常所理解的含义相同。虽然在本文描述的实施例的实践或测试中可以使用类似于或等同于本文描述的方法和材料的任何方法和材料,但是现在描述某些优选的方法、装置和材料。
如本文和所附权利要求中所使用的,单数形式“一个/一种(a、an)”和“所述”包含复数指代物,除非上下文另外明确指出。因此,例如,提及“一种赋形剂”即提及本领域的技术人员已知的一种或多种赋形剂和其等效物,等等。
贯穿本申请,术语“约”用于表示某个值包含用于测定所述值的装置或方法的标准误差水平。
权利要求中对术语“或”的使用用于意指“和/或”,除非明确指出其仅指代替代方案或替代方案相互排斥,但本公开支持仅指代替代方案以及指代“和/或”的定义。
术语“包括”、“具有”和“包含”为开放式连接动词。这些动词中的一个或多个的任何形式或时态,如“包括(comprises)”、“包括(comprising)”、“具有(has)”、“具有(having)”、“包含(includes)”和“包含(including)”,也是开放式的。例如,任何“包括”、“具有”或“包含”一个或多个步骤的方法不限于仅拥有那些一个或多个步骤,并且还涵盖其它未列出的步骤。
当与治疗剂结合使用时,“施用”是指全身施用治疗剂或局部施用治疗剂,如直接施用到靶组织中或上,或是指对患者施用治疗剂,由此治疗剂积极影响其靶组织。药物组合物的“施用”可以通过注射、局部施用和口服施用或通过仅其它方法或其它方法与其它已知技术的组合来实现。
“药学上可接受的”意味着载体、稀释剂或赋形剂必须与组合物的其它成分相容,并且对其接受者无害。
术语“药物组合物”是指包括至少一种活性成分(如化合物1)的组合物,借此所述组合物适于在哺乳动物(例如但不限于人)中研究指定的功效性结果。本领域的普通技术人员将理解和领会适合于基于技术人员的需要测定活性成分是否具有期望的功效性结果的技术。
术语“超生理量”描述的是与健康个体的平均水平相比升高的激素水平。
术语“生理量”描述的是健康个体的平均激素水平。
本文所用的“治疗有效量”或“有效量”是指研究者、兽医、医生或其它临床医生寻求在组织、系统、动物、个体或人中引起生物或药物反应的活性化合物或药剂的量,所述生物或药物反应包含以下中的一个或多个:(1)预防疾病;例如,预防易患疾病、病症或病状但尚未经历或显示出疾病的病理或症状的个体的所述疾病、病症或病状,(2)抑制疾病;例如,抑制经历或显示出疾病、病症或病状的病理或症状的个体的所述疾病、病症或病状(即,阻止病理和/或症状的进一步发展),和(3)减轻疾病;例如,减轻经历或显示出疾病、病症或病状的病理或症状的个体的所述疾病、病症或病状(即,逆转病理和/或症状)。
本文使用的术语“治疗(treat)”、“治疗(treated)”、“治疗(treatment)”或“治疗(treating)”在一些实施例中是指治疗性治疗,而在其它实施例中是指预防性(prophylactic或preventative)措施,其中目的是预防或减缓(减轻)不期望的生理状况、病状或疾病,或获得有益或期望的临床结果。出于本文所述的目的,有益的或期望的临床结果包含但不限于缓解症状;减轻病症、病状或疾病的程度;稳定病症、病状或疾病的状态(即,使其不恶化);延迟病症、病状或疾病的发作或减缓其进展;改善病症、病状或疾病状态;和缓解(无论是部分地还是全部)(无论是可检测的还是不可检测的)或增强或改善病症、病状或疾病。治疗包含引发临床上显著的反应,而不会产生过度水平的副作用。治疗还包含与未接受治疗的情况下的预期生存期相比延长生存期。治疗的预防性益处包含预防病症、延缓病症进展、稳定病症或降低病症发生的可能性。如本文所用的,“治疗(treat)”、“经治疗(treated)”、“治疗(treatment)”或“治疗(treating)”在一些实施例中包含预防。
尽管本文中已经示出并描述了本发明的优选实施例,但是对于本领域的技术人员来说将明显的是,此类实施例仅通过举例方式提供。在不背离本发明的情况下,本领域的技术人员现在将想到许多变化、改变和替代。应理解的是,在实践本发明时可以采用在本文描述的本发明的实施例的各种替代方案。意图是,以下权利要求限定本发明的范围,并且以下权利要求覆盖处于这些权利要求和其等效物的范围内的方法和结构。
化合物
本文公开了3-(4-氯-2-(吗啉-4-基)噻唑-5-基)-7-(1-乙基丙基)-2,5-二甲基吡唑并(1,5-a)嘧啶(或替代性地,4-(4-氯-5-(2,5-二甲基-7-(戊-3-基)吡唑并[1,5-a]嘧啶-3-基)噻唑-2-基)吗啉)、其药学上可接受的盐和/或溶剂化物:
在一些实施例中,将4-(4-氯-5-(2,5-二甲基-7-(戊-3-基)吡唑并[1,5-a]嘧啶-3-基)噻唑-2-基)吗啉称为化合物1。在一些实施例中,将3-(4-氯-2-(吗啉-4-基)噻唑-5-基)-7-(1-乙基丙基)-2,5-二甲基吡唑并(1,5-a)嘧啶称为化合物1。
药物组合物
难溶性药物可能难以使用如高剪切湿法制粒等技术来配制。难溶性药物的最佳递送可能需要复杂的技术,如固溶体或无定形分散体(例如,热熔挤出或喷雾干燥)、纳米调配物或基于脂质的调配物。根据USP标准可能被视为难溶的疏水性原料药也可能难以用水和其它赋形剂进行制粒,因为用于即释调配物的大多数赋形剂可能是水溶性的或水溶胀性的。
制备难溶的高剂量原料药的小型片剂可能需要高浓度的原料药。然而,当药物浓度增加到超过一定水平时,颗粒形成可能变得更加困难,并且在一定的载药量下,颗粒形成可能变得不可能。
在一个实施例中,本文所述的药物组合物可以用于小儿人群。因此,可能有必要使药物组合物保持尽可能小以利于吞服丸剂并因此增加患者依从性。在一些实施例中,片剂重量小于400mg。在一些实施例中,片剂重量小于300mg。在剂量强度为200mg的一些实施例中,片剂中的载药量高于50%。在剂量强度为200mg的一些实施例中,片剂中的载药量高于66%。在剂量强度为200mg的一些实施例中,载药量尽可能高。
本文公开了一种包含化合物1的药物组合物、其药学上可接受的盐和/或溶剂化物。
剂型
在一些实施例中,本文所述的药物组合物以单位剂型提供。如本文所用的,“单位剂型”是根据良好的医学实践适合于以单个剂量向动物(优选地,哺乳动物)受试者施用的含有一定量化合物1的组合物。然而,制备单个剂型或单位剂型并不意味着所述剂型每天施用一次或每个治疗疗程施用一次。设想的是,此类剂型每天施用一次、两次、三次或更多次,并且可以以输注方式施用经一段时间(例如,约30分钟到约2-6小时),或者可以以连续输注方式施用,并且可以在治疗疗程期间给予一次以上,但是未具体排除单次施用。
药物组合物以适合于待治疗(或预防)疾病的方式施用。合适的剂量以及合适的施用时长和频率将由如患者的状况、患者疾病的类型和严重性、活性成分的具体形式以及施用方法等因素决定。通常,合适的剂量和治疗方案以足以提供治疗和/或预防益处(例如,临床结果改善,如完全或部分缓解更加频繁、或无疾病和/或整体生存期更长或症状严重性减轻)的量提供一种或多种组合物。最佳剂量通常使用实验模型和/或临床试验来测定。最佳剂量取决于患者的身体质量、体重或血容量。
在一些实施例中,本文所述的药物组合物被配制为口服剂型。合适的口服剂型包含例如片剂、丸剂、小袋或胶囊。在一些实施例中,所述药物组合物包括一种或多种另外的药学上可接受的赋形剂。关于药学上可接受的赋形剂的列表,参见例如《雷明顿:药学科学与实践(Remington:The Science and Practice of Pharmacy)》(Gennaro,第21版,麦克出版有限公司(Mack Pub.Co.),伊斯顿,宾夕法尼亚州(2005))。
胶囊
在一些实施例中,所述药物组合物被配制为胶囊。在一些实施例中,所述药物组合物被配制为硬凝胶胶囊。在一些实施例中,所述药物组合物被配制为软凝胶胶囊。
在一些实施例中,所述胶囊使用包含但不限于以下的材料形成:天然或合成明胶、果胶、酪蛋白、胶原蛋白、蛋白质、改性淀粉、聚乙烯吡咯烷酮、丙烯酸聚合物、纤维素衍生物或其任何组合。在一些实施例中,所述胶囊使用以下形成:防腐剂、着色剂和遮光剂、调味剂和甜味剂、糖、耐胃液物质或其任何组合。在一些实施例中,所述胶囊经过包衣。在一些实施例中,覆盖所述胶囊的包衣包含但不限于即释包衣、保护性包衣、肠溶包衣或迟释包衣、缓释包衣、屏障包衣、密封包衣或其组合。在一些实施例中,本文中的胶囊是硬的或软的。在一些实施例中,所述胶囊是无缝的。在一些实施例中,将所述胶囊拆开,使得颗粒洒在软食物上且不经咀嚼吞咽。在一些实施例中,所述胶囊的形状和尺寸也可以有所变化。胶囊形状的实例包含但不限于圆形、椭圆形、管状、长方形、螺旋状或非标准形状。所述胶囊的尺寸可以根据颗粒的体积而变化。在一些实施例中,基于颗粒和粉末的体积调整胶囊的尺寸。硬明胶胶囊或软明胶胶囊可以根据常规方法制造为包括标准胶囊形状的单主体单元。单主体软明胶胶囊通常可以以例如3到22量滴(1量滴等于0.0616ml)的尺寸和椭圆形、长方形或其它形状的形状提供。明胶胶囊还可以根据常规方法制造为例如通常呈标准形状和各种标准尺寸(通常命名为(000)、(00)、(0)、(1)、(2)、(3)、(4)和(5))的密封或未密封的两件式硬明胶胶囊。最大数字对应于最小尺寸。在一些实施例中,本文所述的药物组合物(例如,胶囊)整体吞咽。
在一些实施例中,所述胶囊包括一种或多种药学上可接受的赋形剂。在一些实施例中,所述胶囊不含另外的赋形剂。
在一些实施例中,针对不溶性原料药开发、制造并商业化胶囊。在一些实施例中,如果在水中的溶解度小于0.002mg/mL,则原料药是不溶的。在一些实施例中,所述胶囊的剂量强度高达200mg。在一些实施例中,所述胶囊中的原料药使用USP设备I在溶出介质中立即释放。在一些实施例中,所述胶囊中的原料药使用USP设备II在溶出介质中立即释放。
片剂
不溶性药物可能难以使用高剪切湿法制粒等标准技术来配制。不溶性药物的最佳递送可能需要复杂的技术,如固溶体或无定形分散体(热熔挤出或喷雾干燥)、纳米调配物或基于脂质的调配物。疏水性原料药可能根据USP标准被视为不溶的,并且已知难以用水和其它赋形剂进行制粒。这可能是由于用于即释调配物的大多数已知赋形剂是水溶性的或水溶胀性的。制备不溶的高剂量原料药的片剂可能需要高浓度的原料药。然而,当药物浓度增加到超过一定水平时,颗粒形成可能变得越来越困难。此外,在一定的载药量下,颗粒形成可能变得不可能。
在一些实施例中,所述药物组合物被配制为片剂。
在一些实施例中,所述片剂任选地用一种或多种药学上可接受的赋形剂通过压缩、模制或挤出来制备。在一些实施例中,压缩片剂通过压缩任选地与药学上可接受的赋形剂混合的呈自由流动形式的化合物1制备。在一些实施例中,模制片剂通过模制用惰性液体稀释剂润湿的粉末状化合物1的混合物制备。在一些实施例中,所述片剂通过热熔挤出制备。在一些实施例中,挤出片剂通过在受控条件下迫使包括化合物1的混合物穿过孔口或模具来制备。在一些实施例中,所述片剂经过包衣或刻痕。在一些实施例中,所述片剂被配制成提供化合物1的缓释或控释。在一些实施例中,针对不溶性原料药开发、制造并商业化片剂。在一些实施例中,如果在水中的溶解度小于0.002mg/mL,则原料药是不溶的。在一些实施例中,所述片剂的剂量强度高达200mg。在一些实施例中,所述片剂中的原料药使用USP设备I在溶出介质中立即释放。在一些实施例中,所述片剂中的原料药使用USP设备II在溶出介质中立即释放。
在一些实施例中,片剂尺寸小于约1000mg、小于约800mg、小于约600mg、小于约400mg或小于约200mg。在一些实施例中,所述片剂的剂量强度大于约50mg、大于约100mg、大于约150mg、大于约200mg或大于约250mg。在一些实施例中,对于大于约50mg的剂量强度,所述片剂尺寸小于约1000mg。在一些实施例中,对于大于约100mg的剂量强度,片剂尺寸小于800mg。在一些实施例中,对于大于约150mg的剂量强度,片剂尺寸小于600mg。在一些实施例中,对于大于约200mg的剂量强度,片剂尺寸小于400mg。在一些实施例中,对于200mg的剂量强度,片剂尺寸小于400mg。在一些实施例中,所述片剂的超过约20%溶出在常规溶出介质中。在一些实施例中,所述片剂的超过约40%溶出在常规溶出介质中。在一些实施例中,所述片剂的超过约50%溶出在常规溶出介质中。在一些实施例中,所述片剂的超过约60%溶出在常规溶出介质中。在一些实施例中,所述片剂的超过约70%溶出在常规溶出介质中。在一些实施例中,所述片剂的超过约80%溶出在常规溶出介质中。在一些实施例中,所述片剂的超过约20%在不到24小时内溶出在常规溶出介质中。在一些实施例中,所述片剂的超过约20%在不到12小时内溶出在常规溶出介质中。在一些实施例中,所述片剂的超过约20%在不到6小时内溶出在常规溶出介质中。在一些实施例中,所述片剂的超过约20%在不到3小时内溶出在常规溶出介质中。在一些实施例中,所述片剂的超过约20%在不到2小时内溶出在常规溶出介质中。在一些实施例中,所述片剂的超过约20%在不到60分钟内溶出在常规溶出介质中。在一些实施例中,所述片剂的超过约40%在不到60分钟内溶出在常规溶出介质中。在一些实施例中,所述片剂的超过约50%在不到60分钟内溶出在常规溶出介质中。在一些实施例中,所述片剂的超过约60%在不到60分钟内溶出在常规溶出介质中。在一些实施例中,所述片剂的超过约70%在不到60分钟内溶出在常规溶出介质中。在一些实施例中,所述片剂的超过约80%在不到60分钟内溶出在常规溶出介质中。在一些实施例中,所述片剂的超过70%在60分钟内溶出在常规溶出介质中。
在一些实施例中,所述片剂以商业规模生产。
在一些实施例中,所述片剂包括一种或多种药学上可接受的赋形剂。
在一些实施例中,所述片剂用包衣材料(例如,密封剂)包衣。在一些实施例中,所述包衣材料是水溶性的。在一些实施例中,所述包衣材料包括聚合物、增塑剂、颜料或其任何组合。在一些实施例中,所述包衣材料呈薄膜包衣的形式,例如光泽薄膜、非pH依赖性薄膜包衣、水性薄膜包衣、干粉薄膜包衣(例如,完全干粉薄膜包衣)或其任何组合。在一些实施例中,所述包衣材料是高粘性的。在一些实施例中,所述包衣材料提供低水渗透水平。在一些实施例中,所述包衣材料提供氧气屏障保护。在一些实施例中,所述包衣材料允许立即崩解以实现化合物1的速释。在一些实施例中,所述包衣材料是着色的、透明的或白色的。在一些实施例中,包衣为肠溶包衣。示例性包衣材料包含但不限于:聚乙烯吡咯烷酮、聚乙烯醇、丙烯酸酯-甲基丙烯酸共聚物、甲基丙烯酸酯-甲基丙烯酸共聚物、醋酸邻苯二甲酸纤维素、醋酸琥珀酸纤维素、羟丙基甲基纤维素邻苯二甲酸酯、羟丙基甲基纤维素醋酸琥珀酸酯、聚醋酸乙烯邻苯二甲酸酯、虫胶、醋酸偏苯三酸纤维素、海藻酸钠、玉米蛋白和其任何组合。
药学上可接受的赋形剂
在一些实施例中,所述药物组合物包括药学上可接受的赋形剂。在一些实施例中,所述组合物不含药学上可接受的赋形剂。本文所用的术语“药学上可接受的赋形剂”是指适于向哺乳动物施用的一种或多种相容的固体或包封物质。本文所用的术语“相容的”意味着组合物的组分能够以不存在相互作用的方式与主题化合物混合并且能够彼此混合,所述相互作用在普通使用情况下将大幅降低组合物的药物功效。在一些实施例中,药学上可接受的赋形剂的纯度足够高且毒性足够低,以使其适于优选地向被治疗的动物,优选地哺乳动物施用。
可以充当药学上可接受的赋形剂的物质的一些实例包含:
·氨基酸,如丙氨酸、精氨酸、天冬酰胺、天冬氨酸、半胱氨酸、谷氨酰胺、谷氨酸、甘氨酸、组氨酸、异亮氨酸、亮氨酸、赖氨酸、蛋氨酸、苯丙氨酸、脯氨酸、丝氨酸、苏氨酸、色氨酸、酪氨酸和缬氨酸。在一些实施例中,氨基酸为精氨酸。在一些实施例中,氨基酸为L-精氨酸。
·单糖,如葡萄糖(右旋糖)、阿拉伯糖、甘露醇、果糖(左旋糖)和半乳糖。
·纤维素和其衍生物,如羧甲基纤维素钠、乙基纤维素和甲基纤维素。
·固体润滑剂,如滑石、硬脂酸、硬脂酸镁和硬脂酰富马酸钠。
·多元醇,如丙二醇、甘油、山梨醇、甘露醇和聚乙二醇。
·乳化剂,如聚山梨醇酯。
·阳离子表面活性剂,如西曲溴铵、苯扎氯铵和氯化十六烷基吡啶。
·稀释剂,如碳酸钙、微晶纤维素、磷酸钙、淀粉、预胶化淀粉、碳酸钠、甘露醇和乳糖。
·粘合剂,如淀粉(玉米淀粉和马铃薯淀粉)、明胶、蔗糖羟丙基纤维素(HPC)、聚乙烯吡咯烷酮(PVP)和羟丙基甲基纤维素(HPMC)。
·崩解剂,如淀粉和藻酸。
·超级崩解剂,如ac-di-sol、交联羧甲基纤维素钠、羟基乙酸淀粉钠和交联聚维酮。
·助流剂,如二氧化硅。
·着色剂,如FD&C染料。
·甜味剂和调味剂,如阿斯巴甜、糖精、薄荷醇、薄荷和水果调味剂。
·防腐剂,如苯扎氯铵、PHMB、氯丁醇、硫柳汞、乙酸苯汞、硝酸苯汞、对羟基苯甲酸酯和苯甲酸钠。
·张力调节剂,如氯化钠、氯化钾、甘露醇和甘油。
·抗氧化剂,如亚硫酸氢钠、丙酮亚硫酸氢钠、甲醛次硫酸钠、硫脲和EDTA。
·pH调节剂,如NaOH、碳酸钠、乙酸钠、HCl和柠檬酸。
·冷冻保护剂,如磷酸钠或磷酸钾、柠檬酸、酒石酸、明胶和碳水化合物(如右旋糖、甘露醇和葡聚糖)。
·表面活性剂,如月桂基硫酸钠。例如,阳离子表面活性剂,如西曲溴铵(包含具有十二烷基和十六烷基化合物的十四烷基三甲基溴化铵)、苯扎氯铵和氯化十六烷基吡啶。阴离子表面活性剂的一些实例为烷基硫酸盐、乙氧基化烷基硫酸盐、肥皂、羧酸根离子、硫酸根离子和磺酸根离子。非离子表面活性剂的一些实例为聚氧乙烯衍生物、聚氧丙烯衍生物、多元醇衍生物、多元醇酯、聚氧乙烯酯、泊洛沙姆、乙二醇、甘油酯、山梨糖醇酐衍生物、聚乙二醇(如PEG-40、PEG-50或PEG-55)和脂肪醇的酯。
·有机材料,如碳水化合物、改性碳水化合物、乳糖(包括a-乳糖、一水喷雾干燥乳糖或无水乳糖)、淀粉、预胶化淀粉、蔗糖、甘露醇、山梨醇、纤维素(包含粉状纤维素和微晶纤维素)。
·无机材料,如磷酸钙(包含无水磷酸氢钙、磷酸氢钙或磷酸钙)。
·共加工稀释剂。
·压缩助剂。
·防粘剂,如二氧化硅和滑石。
量
在一些实施例中,所述药物组合物在呈片剂或胶囊形式时包括介于约1mg与约500mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物在呈片剂或胶囊形式时包括介于约1mg与约500mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物在呈片剂或胶囊形式时包括介于约1mg与约400mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物在呈片剂或胶囊形式时包括介于约1mg与约300mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物在呈片剂或胶囊形式时包括介于约1mg与约200mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物在呈片剂或胶囊形式时包括介于约1mg与约100mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物在呈片剂或胶囊形式时包括介于约1mg与约90mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物在呈片剂或胶囊形式时包括介于约1mg与约80mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物在呈片剂或胶囊形式时包括介于约1mg与约70mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物在呈片剂或胶囊形式时包括介于约1mg与约60mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物在呈片剂或胶囊形式时包括介于约1mg与约50mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物在呈片剂或胶囊形式时包括介于约1mg与约40mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物在呈片剂或胶囊形式时包括介于约1mg与约30mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物在呈片剂或胶囊形式时包括介于约1mg与约20mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物在呈片剂或胶囊形式时包括介于约1mg与约10mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物在呈片剂或胶囊形式时包括介于约1mg与约5mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物在呈片剂或胶囊形式时包括约1mg化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物在呈片剂或胶囊形式时包括约5mg化合物1或其药学上可接受的盐或溶剂化物。
在一些实施例中,所述药物组合物在呈片剂或胶囊形式时包括介于约1mg与约500mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物在呈片剂或胶囊形式时包括介于约5mg与约500mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物在呈片剂或胶囊形式时包括介于约10mg与约500mg之间的化合物1或其药学上可接受的盐或溶剂化物。
在一些实施例中,所述药物组合物在呈片剂或胶囊形式时包括介于约10mg与约400mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物在呈片剂或胶囊形式时包括介于约10mg与约300mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物在呈片剂或胶囊形式时包括介于约10mg与约200mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物在呈片剂或胶囊形式时包括介于约10mg与约100mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物在呈片剂或胶囊形式时包括介于约10mg与约90mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物在呈片剂或胶囊形式时包括介于约10mg与约80mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物在呈片剂或胶囊形式时包括介于约10mg与约70mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物在呈片剂或胶囊形式时包括介于约10mg与约60mg之间的化合物1或其药学上可接受的盐或溶剂化物。
在一些实施例中,所述药物组合物在呈片剂或胶囊形式时包括介于约20mg与约500mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物在呈片剂或胶囊形式时包括介于约20mg与约400mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物在呈片剂或胶囊形式时包括介于约20mg与约300mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物在呈片剂或胶囊形式时包括介于约20mg与约200mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物在呈片剂或胶囊形式时包括介于约20mg与约100mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物在呈片剂或胶囊形式时包括介于约20mg与约90mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物在呈片剂或胶囊形式时包括介于约20mg与约80mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物在呈片剂或胶囊形式时包括介于约20mg与约70mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物在呈片剂或胶囊形式时包括介于约20mg与约60mg之间的化合物1或其药学上可接受的盐或溶剂化物。
在一些实施例中,所述药物组合物在呈片剂或胶囊形式时包括介于约30mg与约500mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物在呈片剂或胶囊形式时包括介于约30mg与约400mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物在呈片剂或胶囊形式时包括介于约30mg与约300mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物在呈片剂或胶囊形式时包括介于约30mg与约200mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物在呈片剂或胶囊形式时包括介于约30mg与约100mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物在呈片剂或胶囊形式时包括介于约30mg与约90mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物在呈片剂或胶囊形式时包括介于约30mg与约80mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物在呈片剂或胶囊形式时包括介于约30mg与约70mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物在呈片剂或胶囊形式时包括介于约30mg与约60mg之间的化合物1或其药学上可接受的盐或溶剂化物。
在一些实施例中,所述药物组合物在呈片剂或胶囊形式时包括介于约40mg与约500mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物在呈片剂或胶囊形式时包括介于约40mg与约400mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物在呈片剂或胶囊形式时包括介于约40mg与约300mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物在呈片剂或胶囊形式时包括介于约40mg与约200mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物在呈片剂或胶囊形式时包括介于约40mg与约100mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物在呈片剂或胶囊形式时包括介于约40mg与约90mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物在呈片剂或胶囊形式时包括介于约40mg与约80mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物在呈片剂或胶囊形式时包括介于约40mg与约70mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物在呈片剂或胶囊形式时包括介于约40mg与约60mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物在呈片剂或胶囊形式时包括约50mg化合物1或其药学上可接受的盐或溶剂化物。
在一些实施例中,所述药物组合物在呈片剂或胶囊形式时包括介于约50mg与约500mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物在呈片剂或胶囊形式时包括介于约50mg与约400mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物在呈片剂或胶囊形式时包括介于约50mg与约300mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物在呈片剂或胶囊形式时包括介于约50mg与约200mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物在呈片剂或胶囊形式时包括介于约50mg与约100mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物在呈片剂或胶囊形式时包括介于约50mg与约90mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物在呈片剂或胶囊形式时包括介于约50mg与约80mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物在呈片剂或胶囊形式时包括介于约50mg与约70mg之间的化合物1或其药学上可接受的盐或溶剂化物。
在一些实施例中,所述药物组合物包括介于约100mg与约500mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物包括介于约100mg与约400mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物包括介于约100mg与约300mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物包括介于约150mg与约250mg之间的化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物包括介于约100mg与约200mg之间的化合物1或其药学上可接受的盐或溶剂化物。
在一些实施例中,所述药物组合物包括约500mg化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物包括约400mg化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物包括约300mg化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物包括约250mg化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物包括约200mg化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物包括约150mg化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物包括约100mg化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物包括约90mg化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物包括约80mg化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物包括约70mg化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物包括约60mg化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物包括约50mg化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物包括约40mg化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物包括约30mg化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物包括约20mg化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,所述药物组合物包括约10mg化合物1或其药学上可接受的盐或溶剂化物。
颗粒尺寸
在一些实施例中,所述药物组合物在呈片剂或胶囊形式时包括呈微粒的形式的化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,化合物1的微粒的平均尺寸为约1μm到约100μm。在一些实施例中,化合物1的微粒的平均尺寸为约1μm到约50μm。在一些实施例中,化合物1的微粒的平均尺寸为约1μm到约30μm。在一些实施例中,化合物1的微粒的平均尺寸为约1μm到约20μm。在一些实施例中,化合物1的微粒的平均尺寸为约5μm到约15μm。在一些实施例中,化合物1的微粒的平均尺寸为约1μm到约10μm。在一些实施例中,化合物1的微粒的平均尺寸为约3μm到约10μm。在一些实施例中,化合物1的微粒的平均尺寸为约4μm到约9μm。
在一些实施例中,化合物1的微粒的平均尺寸小于约100μm。在一些实施例中,化合物1的微粒的平均尺寸小于约80μm。在一些实施例中,化合物1的微粒的平均尺寸小于约60μm。在一些实施例中,化合物1的微粒的平均尺寸小于约50μm。在一些实施例中,化合物1的微粒的平均尺寸小于约40μm。在一些实施例中,化合物1的微粒的平均尺寸小于约30μm。在一些实施例中,化合物1的微粒的平均尺寸小于约20μm。在一些实施例中,化合物1的微粒的平均尺寸小于约10μm。
药代动力学
在一些实施例中,化合物1被配制为胶囊或片剂以在受试者中提供约1到约8小时的T最大。在一些实施例中,化合物1被配制为胶囊或片剂以在受试者中提供约2到约7小时的T最大。在一些实施例中,化合物1被配制为胶囊或片剂以在受试者中提供约2到约6小时的T最大。在一些实施例中,化合物1被配制为胶囊或片剂以在受试者中提供约3到约5小时的T最大。
在一些实施例中,化合物1被配制为胶囊或片剂以在受试者中提供约8小时的T最大。在一些实施例中,化合物1被配制为胶囊或片剂以在受试者中提供约7小时的T最大。在一些实施例中,化合物1被配制为胶囊或片剂以在受试者中提供约6小时的T最大。在一些实施例中,化合物1被配制为胶囊或片剂以在受试者中提供约5小时的T最大。在一些实施例中,化合物1被配制为胶囊或片剂以在受试者中提供约4小时的T最大。在一些实施例中,化合物1被配制为胶囊或片剂以在受试者中提供约3小时的T最大。在一些实施例中,化合物1被配制为胶囊或片剂以在受试者中提供约2小时的T最大。在一些实施例中,化合物1被配制为胶囊或片剂以在受试者中提供约1小时的T最大。
稳定性
本文所述的药物组合物在包含冷藏条件、环境条件和加速条件的各种储存条件下稳定。本文所用的稳定是指药物组合物在给定的储存期结束时初始化合物1的量为约95%或更多并且总杂质或相关物质的量为约5%w/w或更少。杂质的百分比是根据杂质相对于化合物1的量计算的。稳定性通过HPLC或任何其它已知的测试方法进行评估。在一些实施例中,稳定的药物组合物具有约5%w/w、约4%w/w、约3%w/w、约2.5%w/w、约2%w/w、约1.5%w/w、约1%w/w或约0.5%w/w的总杂质或相关物质。在其它实施例中,稳定的药物组合物具有约5%w/w的总杂质或相关物质。在又其它实施例中,稳定的药物组合物具有约4%w/w的总杂质或相关物质。在又其它实施例中,稳定的药物组合物具有约3%w/w的总杂质或相关物质。在又其它实施例中,稳定的药物组合物具有约2%w/w的总杂质或相关物质。在又其它实施例中,稳定的药物组合物具有约1%w/w的总杂质或相关物质。
在冷藏条件下,本文所述的药物组合物稳定,持续至少1个月、至少2个月、至少3个月、至少6个月、至少9个月、至少12个月、至少15个月、至少18个月、至少24个月、至少30个月和至少36个月。在一些实施例中,冷藏条件为5±5℃。在一些实施例中,冷藏条件为约0℃、约0.1℃、约0.2℃、约0.3℃、约0.4℃、约0.5℃、约0.6℃、约0.7℃、约0.8℃、约0.9℃、约1℃、约1.1℃、约1.2℃、约1.3℃、约1.4℃、约1.5℃、约1.6℃、约1.7℃、约1.8℃、约1.9℃、约2℃、约2.1℃、约2.2℃、约2.3℃、约2.4℃、约2.5℃、约2.6℃、约2.7℃、约2.8℃、约2.9℃、约3℃、约3.1℃、约3.2℃、约3.3℃、约3.4℃、约3.5℃、约3.6℃、约3.7℃、约3.8℃、约3.9℃、约4℃、约4.1℃、约4.2℃、约4.3℃、约4.4℃、约4.5℃、约4.6℃、约4.7℃、约4.8℃、约4.9℃、约5℃、约5.1℃、约5.2℃、约5.3℃、约5.4℃、约5.5℃、约5.6℃、约5.7℃、约5.8℃、约5.9℃、约6℃、约6.1℃、约6.2℃、约6.3℃、约6.4℃、约6.5℃、约6.6℃、约6.7℃、约6.8℃、约6.9℃、约7℃、约7.1℃、约7.2℃、约7.3℃、约7.4℃、约7.5℃、约7.6℃、约7.7℃、约7.8℃、约7.9℃、约8℃、约8.1℃、约8.2℃、约8.3℃、约8.4℃、约8.5℃、约8.6℃、约8.7℃、约8.8℃、约8.9℃、约9℃、约9.1℃、约9.2℃、约9.3℃、约9.4℃、约9.5℃、约9.6℃、约9.7℃、约9.8℃、约9.9℃或约10℃。在加速条件下,本文所述的药物组合物稳定,持续至少1个月、至少2个月、至少3个月、至少4个月、至少5个月、至少6个月、至少7个月、至少8个月、至少9个月、至少10个月、至少11个月、至少12个月、至少18个月或至少24个月。本文所述药物组合物的加速条件包含处于或高于环境水平的温度(例如,25±5℃)。在一些情况下,加速条件为约40±2℃。在一些情况下,加速条件为约35℃、约40℃、约45℃、约50℃、约55℃或约60℃。本文所述药物组合物的加速条件还包含处于或高于环境水平的相对湿度(RH)(55±10%RH)。在其它情况下,加速条件为高于约65%RH、约70%RH、约75%RH或约80%RH。在另外的情况下,加速条件为环境湿度下约40℃或60℃。在又另外的情况下,加速条件为75±5%RH湿度下约40±2℃。
在一些实施例中,所述药物组合物在约5±5℃到25±5℃下稳定,持续至少12个月。在一个实施例中,所述药物组合物在约5±5℃下稳定,持续至少12个月。在一个实施例中,所述药物组合物在约25±5℃下稳定,持续至少12个月。在一个实施例中,所述药物组合物在约5±5℃下稳定,持续至少24个月。在一个实施例中,所述药物组合物在约25±5℃下稳定,持续至少24个月。
使用方法
本文公开了一种治疗有需要的受试者的先天性肾上腺皮质增生症(CAH)的方法,所述方法包括施用包括化合物1或其药学上可接受的盐或溶剂化物的药物组合物。在一些实施例中,CAH为典型CAH。在一些实施例中,CAH为非典型CAH。在一些实施例中,本文所述的方法使激素水平降低。此类激素包含脱氧皮质酮、11-脱氧皮质醇、皮质醇、皮质酮、醛固酮、孕烯醇酮、17α-羟孕烯醇酮、孕酮、17α-羟孕酮(17-OHP)、脱氢表雄酮、雄烯二醇、雄烯二酮、睾酮、二氢睾酮、雌酮、雌二醇、雌三醇和促肾上腺皮质激素(ACTH)。在一些实施例中,本文所述的方法使17α-羟孕酮(17-OHP)减少。在一些实施例中,本文所述的方法使促肾上腺皮质激素(ACTH)(也称为促肾上腺皮质素)减少。
本文还公开了一种治疗有需要的受试者的先天性肾上腺皮质增生症(CAH)的方法,所述方法包括:
(i)测量所述有需要的受试者的激素水平;
(ii)施用化合物1:
(iii)重复步骤(i)和(ii),直到所述激素水平达到预定范围,然后进行化合物1的每日给药的维持疗法。
在一些实施例中,激素为17α-羟孕酮(17-OHP)、促肾上腺皮质激素(ACTH)、睾酮或雄烯二酮。
在一些实施例中,激素为17-OHP,并且预定范围为约200ng/dL到约400ng/dL。在一些实施例中,激素为17-OHP,并且预定范围为小于约400ng/dL、小于约350ng/dL、小于约300ng/dL、小于约250ng/dL或小于约200ng/dL。
在一些实施例中,激素为ACTH,并且预定范围为低于约100pg/mL。在一些实施例中,激素为ACTH,并且预定范围为低于约100pg/mL、低于约90pg/mL或低于约80pg/mL。
在一些实施例中,激素为睾酮,并且预定范围为约14ng/dL到约76ng/dL。在一些实施例中,激素为睾酮,并且预定范围为小于约76ng/dL、小于约70ng/dL、小于约65ng/dL、小于约60ng/dL、小于约55ng/dL、小于约50ng/dL、小于约45ng/dL、小于约40ng/dL、小于约35ng/dL、小于约30ng/dL、小于约25ng/dL、小于约20ng/dL或小于约15ng/dL。
在一些实施例中,在男性中,激素为雄烯二酮,并且预定范围为约30ng/dL到约200ng/dL。在一些实施例中,在男性中,激素为雄烯二酮,并且预定范围为小于约200ng/dL、小于约150ng/dL、小于约100ng/dL、小于约50ng/dL或小于约30ng/dL。
在一些实施例中,在女性中,激素为雄烯二酮,并且预定范围为约40ng/dL到约150ng/dL。在一些实施例中,在女性中,激素为雄烯二酮,并且预定范围为小于约150ng/dL、小于约100ng/dL、小于约50ng/dL、或小于约40ng/dL。
在一些实施例中,本文所述的方法包含每月一次、每月两次、每月三次、每周一次、每周两次、每周三次、每两天一次、每天一次、每天两次、每天三次或每天四次地施用包括化合物1或其药学上可接受的盐或溶剂化物的药物组合物。在一些实施例中,本文所述的方法每天一次地施用化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,本文所述的方法每天两次地施用化合物1或其药学上可接受的盐或溶剂化物。
在一些实施例中,本文所述的方法包含每天施用约1mg到约2000mg化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,每天施用约100mg到约1600mg化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,每天施用约200mg到约1600mg化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,每天施用约200mg到约1200mg化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,每天施用约200mg到约1000mg化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,每天施用约200mg到约800mg化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,每天施用约100mg到约800mg化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,每天施用约200mg到约800mg化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,每天施用约100mg到约600mg化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,每天施用约200mg到约600mg化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,每天施用约300mg到约600mg化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,每天施用约100mg到约400mg化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,每天施用约200mg到约400mg化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,每天施用约300mg到约400mg化合物1或其药学上可接受的盐或溶剂化物。
在一些实施例中,每天施用少于约2000mg化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,每天施用少于约1800mg化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,每天施用少于约1600mg化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,每天施用少于约1400mg化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,每天施用少于约1200mg化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,每天施用少于约1000mg化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,每天施用少于约800mg化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,每天施用少于约600mg化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,每天施用少于约500mg化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,每天施用少于约400mg化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,每天施用少于约300mg化合物1或其药学上可接受的盐或溶剂化物。在一些实施例中,每天施用少于约200mg化合物1或其药学上可接受的盐或溶剂化物。
在一些实施例中,本文所述的方法包含施用本文所述的药物组合物,其中所述受试者处于进食状态。在一些实施例中,本文所述的方法包含施用本文所述的药物组合物,其中所述受试者处于禁食状态。
在一些实施例中,本文所述的方法包含在临睡前施用本文所述的药物组合物。
在一些实施例中,本文所述的方法包含在睡觉前小于约4小时施用本文所述的药物组合物。在一些实施例中,本文所述的方法包含在睡觉前小于约3小时施用本文所述的药物组合物。在一些实施例中,本文所述的方法包含在睡觉前小于约2小时施用本文所述的药物组合物。在一些实施例中,本文所述的方法包含在睡觉前小于约1小时施用本文所述的药物组合物。在一些实施例中,本文所述的方法包含在睡觉前小于约30分钟施用本文所述的药物组合物。
在一些实施例中,本文所述的方法包含在晚上施用本文所述的药物组合物。
在一些实施例中,本文所述的方法包含在晚上约11点施用本文所述的药物组合物。在一些实施例中,本文所述的方法包含在晚上约10点施用本文所述的药物组合物。在一些实施例中,本文所述的方法包含在晚上约9点施用本文所述的药物组合物。在一些实施例中,本文所述的方法包含在晚上约8点施用本文所述的药物组合物。
在一些实施例中,本文所述的方法包含在促肾上腺皮质激素(ACTH)的预期昼夜节律释放之时或之前施用本文所述的药物组合物。在一些实施例中,本文所述的方法包含在促肾上腺皮质激素(ACTH)的预期昼夜节律释放前约3-4小时施用本文所述的药物组合物。
组合疗法
本文公开了一种治疗有需要的受试者的先天性肾上腺皮质增生症(CAH)的方法,所述方法包括施用化合物1或其药学上可接受的盐或溶剂化物和糖皮质激素的组合。在一些实施例中,与不包括施用化合物1或其药学上可接受的盐或溶剂化物的方法相比,所施用的糖皮质激素的量减少。
在一些实施例中,本文所述的方法将所施用的糖皮质激素的量从超生理量减少到生理量。
在一些实施例中,本文所述的方法减少与高剂量糖皮质激素疗法有关的症状。在一些实施例中,与高剂量糖皮质激素疗法相关的症状为肥胖症、胰岛素抵抗、代谢异常、高血压、心血管疾病或骨质疏松症。
在一些实施例中,与不包括施用化合物1或其药学上可接受的盐或溶剂化物的方法相比,所施用的糖皮质激素的量减少约5%、约10%、约15%、约20%、约25%、约30%、约35%、约40%、约45%、约50%、约55%、约60%、约65%、约70%、约80%或约90%。在一些实施例中,与不包括施用化合物1或其药学上可接受的盐或溶剂化物的方法相比,所施用的糖皮质激素的量减少约5%、约10%、约15%、约20%、约25%、约30%、约35%、约40%、约45%、约50%、约55%或约60%。
在一些实施例中,与不包括施用化合物1或其药学上可接受的盐或溶剂化物的方法相比,所施用的糖皮质激素的量减少约1%到约90%、约1%到约60%、约1%到约30%、约1%到约10%、约10%到约50%、约10%到约40%、约10%到约30%、约15%到约25%、约20%到约30%、约5%到约25%、约20%到约50%、约30%到约60%或约40%到约70%。
在一些实施例中,糖皮质激素以介于约0.1毫克/天与约25毫克/天之间的剂量施用。在一些实施例中,糖皮质激素以介于约1毫克/天与约20毫克/天之间的剂量施用。在一些实施例中,糖皮质激素以介于约1毫克/天与约15毫克/天之间的剂量施用。在一些实施例中,糖皮质激素以介于约1毫克/天与约12毫克/天之间的剂量施用。在一些实施例中,糖皮质激素以介于约1毫克/天与约11毫克/天之间的剂量施用。在一些实施例中,糖皮质激素以介于约1毫克/天与约10毫克/天之间的剂量施用。在一些实施例中,糖皮质激素以介于约1毫克/天与约9毫克/天之间的剂量施用。在一些实施例中,糖皮质激素以介于约1毫克/天与约8毫克/天之间的剂量施用。在一些实施例中,糖皮质激素以介于约1毫克/天与约7毫克/天之间的剂量施用。在一些实施例中,糖皮质激素以介于约1毫克/天与约6毫克/天之间的剂量施用。在一些实施例中,糖皮质激素以介于约1毫克/天与约5毫克/天之间的剂量施用。在一些实施例中,糖皮质激素以介于约1毫克/天与约4毫克/天之间的剂量施用。在一些实施例中,糖皮质激素以介于约1毫克/天与约3毫克/天之间的剂量施用。在一些实施例中,糖皮质激素以介于约1毫克/天与约2毫克/天之间的剂量施用。在一些实施例中,糖皮质激素以介于约3毫克/天与约13毫克/天之间的剂量施用。在一些实施例中,糖皮质激素以介于约5毫克/天与约11毫克/天之间的剂量施用。在一些实施例中,糖皮质激素以介于约8毫克/天与约11毫克/天之间的剂量施用。在一些实施例中,糖皮质激素以介于约9毫克/天与约12毫克/天之间的剂量施用。在一些实施例中,糖皮质激素以介于约9毫克/天与约10毫克/天之间的剂量施用。在一些实施例中,糖皮质激素以介于约5毫克/天与约10毫克/天之间的剂量施用。
在一些实施例中,化合物1或其药学上可接受的盐或溶剂化物和糖皮质激素同时施用。在一些实施例中,化合物1或其药学上可接受的盐或溶剂化物和糖皮质激素在一种药物组合物中施用。在一些实施例中,化合物1或其药学上可接受的盐或溶剂化物和糖皮质激素在单独的药物组合物中同时施用。
在一些实施例中,化合物1或其药学上可接受的盐或溶剂化物和糖皮质激素按顺序施用。在一些实施例中,化合物1或其药学上可接受的盐或溶剂化物和糖皮质激素在24小时之内施用。在一些实施例中,化合物1或其药学上
可接受的盐或溶剂化物和糖皮质激素在12小时之内施用。在一些实施例中,化合物1或其药学上可接受的盐或溶剂化物和糖皮质激素在8小时之内施用。在一些实施例中,化合物1或其药学上可接受的盐或溶剂化物和糖皮质激素在6小时之内施用。在一些实施例中,化合物1或其药学上可接受的盐或溶剂化物和糖皮质激素在4小时之内施用。在一些实施例中,化合物1或其药学上可接受的盐或溶剂化物和糖皮质激素在2小时之内施用。在一些实施例中,化合物1或其药学上可接受的盐或溶剂化物和糖皮质激素在1小时之内施用。在一些实施例中,化合物1或其药学上可接受的盐或溶剂化物和糖皮质激素在30分钟之内施用。在一些实施例中,化合物1或其药学上可接受的盐或溶剂化物和糖皮质激素在10分钟之内施用。
在一些实施例中,糖皮质激素为倍氯米松、倍他米松、布地奈德、可的松、地塞米松、氢化可的松、甲基强的松龙、泼尼松龙、泼尼松或去炎松。在一些实施例中,糖皮质激素为氢化可的松。
在一些实施例中,糖皮质激素为氢化可的松,并且所施用的剂量小于15-25毫克/天的推荐剂量。
在一些实施例中,糖皮质激素为泼尼松,并且所施用的剂量小于5-7.5毫克/天的推荐剂量。
在一些实施例中,糖皮质激素为泼尼松龙,并且所施用的剂量小于4-6毫克/天的推荐剂量。
在一些实施例中,糖皮质激素为地塞米松,并且所施用的剂量小于0.25-0.5毫克/天的推荐剂量。
本文公开了一种治疗有需要的受试者的先天性肾上腺皮质增生症(CAH)的方法,所述方法包括施用化合物1或其药学上可接受的盐或溶剂化物;糖皮质激素;和任选地盐皮质激素的组合。在一些实施例中,盐皮质激素为氟氢可的松,并且剂量小于0.05-0.2毫克/天的推荐剂量。
实例
以下实例进一步说明本发明,但不应被解释为以任何方式限制本发明的范围。具体地,处理条件仅仅是示例性的,并且本领域的普通技术人员可以容易地改变所述处理条件。
除非本文中另外指明或另外明显与上下文矛盾,否则可以按合适的顺序执行本文中描述的所有方法。本文中提供的任何和所有实例或示例性语言(例如,“如”)的使用仅旨在更好地说明本发明,而不对本发明的范围构成限制,除非另外指示。除非另有说明,否则本文中使用的技术术语和科学术语的含义与本发明所属领域的技术人员通常所理解的含义相同。
实例1:药物组合物
将药物组合物制造为含有200mg被微粒化为平均尺寸为10微米或更小的化合物1的1号白色硬明胶胶囊。药物组合物不含另外的赋形剂。
实例2:药物组合物稳定性
稳定性数据汇总
表1中提供了药物组合物稳定性研究的汇总。药物组合物为化合物1,所述化合物以3种强度配置——1mg、5mg和50mg——整齐地填充到未添加赋形剂的0号胶囊中。将胶囊泡罩包装在聚氯乙烯(PVC)基薄膜中。
在长期和加速条件下,在这三个批次中未观察到整个稳定性研究过程中评估的属性中的任何属性的任何显著趋势。
表1.稳定性汇总
CCS=容器封塞系统;CRC=儿童安全封口;DoM=生产日期;HDPE=高密度聚乙烯;PVC=聚氯乙烯
稳定性方案
表2、表3和表4提供了各种药物组合物的稳定性方案。
表2.稳定性方案
RRT=相对保留时间
X-研究开始时执行的测试
A-在25±2℃/60±5%RH的长期条件下储存的样品
B-在40±2℃/75±5%RH的加速条件下储存的样品
表3.稳定性方案(30mL HDPE瓶中200mg胶囊)
LC=标示量;NMT=不超过
X-研究开始时执行的测试
A-在25±2℃/60±5%RH的长期条件下储存的样品
B-在40±2℃/75±5%RH的加速条件下储存的样品
表4.待用于第2阶段临床研究的批次的稳定性方案(30mL HDPE瓶中200mg胶囊)
CFU=菌落形成单位;LC=标示量;n/a=不适用;NMT=不超过
X-研究开始时执行的测试
A-在25±2℃/60±5%RH的长期条件下储存的样品
B-在40±2℃/75±5%RH的加速条件下储存的样品
支持性数据表明,药物组合物稳定,持续至少6个月(研究结束)。在长期条件和加速条件下未观察到不利趋势。在整个研究中测定结果是一致的,并且在稳定性研究期间未观察到新的相关物质种类。储存在泡罩包装配置中的批次的所报告的稳定性结果被视为支持30mL HDPE瓶、感应密封和防儿童开启瓶盖的更新包装配置。任一种配置中都没有赋形剂,并且两种配置都可以避光。
实例3:第1阶段临床研究
已经在健康成年志愿者中在2项第1阶段研究中研究了化合物1。
研究1是一项首次在人体中进行的研究,其研究了口服给予的化合物1的单次递增剂量对健康成人受试者的安全性、耐受性和PK。安全性和耐受性评估是在较大范围的单一口服剂量内进行的,并且直到对先前剂量的安全性数据进行了审查之后才进行剂量递增。来自这项研究的数据用于研究2的剂量选择。
由2个部分组成的多剂量研究(研究2)测定化合物1的重复每日剂量的安全性和耐受性,并研究对酒精依赖治疗的相关性的生物标志物的影响。B部分研究化合物1与咪达唑仑(细胞色素P450 3A4[CYP3A4]底物)的相互作用,从而测定化合物1是否显著抑制由CYP3A4代谢的药物的代谢。
在研究1中,以2mg、10mg、50mg、150mg、400mg或800mg(在进食状态下)和150mg(在禁食状态下)的单个PO剂量向健康成年受试者施用化合物1。在稍晚时间出现吸收,从而实现在进食状态下给药后介于4到6小时的峰值C最大。
表5提供了每种剂量水平下的PK参数的汇总。当在进食状态下给予化合物1时,达到最大血浆浓度的中位时间(T最大)在4与6小时之间出现。当在禁食状态下以150mg给予化合物1时,中位T最大为10.05小时且范围介于6与12小时之间,从而表明在禁食状态下吸收可能延迟。单个PO剂量(进食和禁食状态)后的平均半衰期(t1/2)介于31与44小时之间,范围为11到101小时。表观分布容积(Vz/F)较大且似乎可变性较大,其中在2个最高剂量水平400mg和800mg下观察到最大可变性。
表5.化合物1在以单个口服剂量向健康志愿者(全都为进食状态)施用后的药代动力学参数汇总
AUC=血浆浓度-时间曲线下的面积;CL/F=口服清除率;C最大=最大血浆浓度;CV=变化系数;NC=无法计算;t1/2=消除半衰期;T最大=达到最大血浆浓度的时间;Vss/F=稳态时的分布容积;Vz/F=终末阶段的分布容积
a中位数(范围)
b几何平均值(范围)
作为此单剂量递增研究的一部分,进行食物效应PK研究,以检查在150mg剂量水平下在进食状态和禁食状态两者下化合物1的暴露情况。在这2个给药组中的每个给药组中,总共向6名受试者施用150mg化合物1。在这6名受试者中,4名受试者在进食状态和禁食状态下接受相同剂量的化合物1。与在标准化早餐后5分钟内给予的相同剂量下的平均浓度-时间曲线相比,在禁食状态下施用化合物1产生更平坦的平均浓度-时间曲线(即,具有显著更低的吸收)。150mg剂量在进食状态下产生的平均AUC0-∞值和C最大值分别为禁食状态下的值的约3倍和11倍。表6提供了在进食状态和禁食状态两者下在150mg剂量水平下的PK参数的汇总。
表6.化合物1在以单个口服剂量向健康志愿者施用后的药代动力学参数汇总(进食状态相对于禁食状态)
AUC=血浆浓度-时间曲线下的面积;CL/F=表观总体清除率;C最大=最大血浆浓度;CV=变化系数;N=受试者数量;NC=无法计算;PK=药代动力学;T最大=达到最大血浆浓度的时间;tl/2=消除半衰期;VSSF=血管外施用后的终末阶段期间的稳态时的表观分布容积;Vz/F=血管外施用后的终末阶段期间的表观分布容积。
a中位数(范围)
b几何平均数(范围)
针对在进食状态下施用时的化合物1的从50到800mg的比例化剂量反应关系(doseproportionality)分别对PK参数AUC0-∞和C最大进行分析。分析结果表明,剂量每增加一倍,AUC0-∞可能预期比比例化剂量反应关系下预期的AUC0-∞增加1.74倍。C最大似乎更具比例化剂量反应关系,但正式测试并无定论,因为90%置信区间部分处于0.8-1.25区间内。基于AUC0-∞或C最大无法得出跨进食状态下的所施用剂量具有比例化剂量反应关系。
还在多剂量剂量递增研究(研究2)中对PK进行评估。在研究的A部分中,将受试者分为3个群组,并且受试者接受50mg、150mg或200mg化合物1或安慰剂,持续14天(每个群组中至少有6名受试者接受化合物1,并且2名受试者接受安慰剂)。给药2周后,化合物1的血液浓度接近稳态水平,并且累积比介于2.51到3.65之间。B部分研究化合物1与咪达唑仑(CYP3A4底物)的相互作用,从而测定此化合物是否显著抑制由为了测定在已经施用单个剂量的化合物1后且处于稳定状态下的研究药物的血浆浓度而采集的CYP3A4血液样品代谢的药物的代谢。所有给药都在进食状态下发生。还在给药期之前和给药期期间对日皮质醇水平进行评估并且对在葡萄糖钳夹条件下的日皮质醇水平进行评估。
化合物1的总体浓度时间曲线显示,吸收适度延迟,其中在口服给药后5小时的中值时达到C最大。与单剂量研究(研究1)一致,浓度似乎以双指数方式下降,其特征为在前24小时内迅速下降。每天多次给药2周后,化合物1的t1/2超过100小时;因此,化合物1的累积比介于2.51到3.65之间(参见表7)。T最大似乎跨各个剂量具有一致性。对于150mg和200mg而言,总体半衰期、经过权重归一化的CL/F和V/F一致。然而,后2个参数的值在50mg剂量水平下几乎翻了一番。表观清除率和分布容积的可变性(CV%)较大,并且未随着权重归一化而降低。
表7.在研究的A部分中单次(第1天)和多次(第14天)口服50mg、150mg和200mg化合物1后化合物1的非隔室药代动力学参数汇总
AUC=血浆浓度-时间曲线下的面积;CL/F=表观清除率;C最大=最大血浆浓度;RA=以第14天AUC0-24/第1天AUC0-24的形式计算的累积比;tl/2=终末半衰期;有效tl/2=通过累积比计算的半衰期;T最大=达到最大血浆浓度的时间;Vss/F=稳态时的分布容积;Vz/F=终末阶段的分布容积;WT-归一化=经过权重归一化的
a中位数(范围)。
b几何平均数(范围)。
c n=6,中途退出受试者306未包含在汇总统计数据的计算中。
表8呈现了测试剂量范围内的AUC0-24和C最大的比例化剂量反应关系评估的结果。对于AUC0-24和C最大,第1天和第14天的经过调整的平均斜率全都高于值1,从而表明随剂量增加,AUC0-24值和C最大值的增加略大于比例增加。
表8.通过幂模型对血浆化合物1进行的比例化剂量反应关系评估的汇总
AUC=血浆浓度-时间曲线下的面积;C最大=最大血浆浓度
安全性
在对健康成年志愿者进行的2项第1阶段研究(研究1和研究2)中对化合物1的安全性进行评估。在两项研究中,对不良事件(AE)、临床实验室测试、生命体征(仰卧血压和脉搏率)和心电图(ECG)进行评估。总体而言,在研究1中,化合物1的耐受性良好。当以高达200mg的多个剂量施用时,化合物1在研究的健康受试者群体中总体上具有良好的耐受性。
在研究1中,研究对酒精依赖治疗的相关性的生物标志物的影响。使用成瘾研究中心调查问卷(Research Center Inventory Questionnaire)(ARCI-49)的五个组来比较化合物1相对于安慰剂的影响:分别地,吗啡-苯丙胺组量表测量欣快感;麦角酸二乙酰胺组量表评估烦躁不安和躯体变化;戊巴比妥-氯丙嗪-乙醇组量表测量镇静作用;苯丙胺组(BG)量表测量智力效率和精力;安非他明组量表测量d-安非他明的影响。每个组中均未观察到相对于基线的变化或与安慰剂相比的差异的系统模式或剂量反应。
总之,健康的男性和女性受试者对化合物1的高达800mg的单个口服剂量和高达200mg的多个剂量耐受良好。
实例4:第2阶段多剂量,剂量递增临床研究
第2阶段研究的群组A包含用于治疗患有典型CAH的成人的化合物1的6周多剂量剂量递增研究。在筛选之后,符合条件的患者将被纳入为期6周的治疗期,然后是为期4周的洗脱/安全随访期。
该群组将在大约9名患者中进行,所述患者将每天接受化合物1,持续长达6周。化合物1将以每日口服剂量施用。患者将每隔2周通过三种递增的剂量强度经历化合物1的滴定。患者将在基线下进行过夜PK/PD评估,所述PK/PD评估包含针对PK/PD的给药前过夜评估和施用第一剂后针对PK/PD的给药后过夜评估。在每个为期2周的给药期结束时,患者将返回进行单一过夜访视,以进行稳态PK/PD评估。在患者最后一次给药后30天,将进行门诊随访。初始群组(群组A)完成后,研究将继续针对多达3个连续群组(群组B、C和D)的多次给药剂量渐升法(MAD)设计以进一步评估各种SPR001给药方案的安全性、PK和PD并鉴别最佳剂量方案。每个群组将经历为期2周的导入期(run-in period)、为期2周的治疗期和为期30天的洗脱和安全性随访期。在将在筛选期间发生的导入期期间,受试者将在纸质日记中记录所服用的糖皮质激素药物的每个剂量、每次进餐的时间以及其每天就寝和醒来的时间,以确保对背景糖皮质激素方案的依从性以及其日常生活的稳定性。
群组B中的患者将以200mg BID接受研究药物,其中早上一剂,晚上一剂,所述剂量在就餐时服用或在食用标准化零食时服用。对于群组C和D,剂量水平以及给药频率和定时将基于先前群组的临时数据测定。然而,每个连续群组的剂量水平将被限制为前一群组的每日剂量水平的两倍。
研究设计
·研究类型:干预性
·主要目的:治疗
·研究阶段:第2阶段
·干预性研究模型:顺序分配
·群组数量:多达4
·设盲:未设盲
·分配:非随机
·纳入人数:多达约27人[预期]
药组和干预
结果量度(Outcome Measure)
主要结果量度:
1.评估化合物1在患有CAH的受试者中的安全性。
2.评估通过测量17-OHP相对于基线的百分比变化和绝对变化测量的化合物1在患有典型CAH的受试者中的功效。
次要结果量度:
3.探究引起ACTH、雄烯二酮和睾酮的血浆浓度的药效学变化的一个或多个化合物1剂量,所述药效学变化是通过相对于剂量基线的绝对变化和百分比变化测量的。
4.测定化合物1在患有CAH的受试者中的药代动力学。
5.探究药效学与药代动力学之间的潜在关系。
探究
7.探究引起尿液中药效学生物标志物的变化的一个或多个化合物1剂量,所述变化是通过相对于剂量基线的绝对变化和百分比变化来测量的。
合格标准
·最小年龄:18岁
·最大年龄:
·性别:全部
·基于性别:否
·接受健康志愿者:否
·标准:纳入
标准:
纳入标准:
·18岁或以上的男性和女性患者。
·由于21-羟化酶缺乏而患有典型CAH的书面诊断
·筛选时17-OHP升高
·正接受稳定的糖皮质激素替代方案,持续最少30天
排除标准:
·临床上显著不稳定的医疗病症、疾病或慢性病
·临床上显著的精神病状
·临床上显著的异常实验室发现或评估
·双侧肾上腺切除术或垂体功能减退史
·妊娠女性或哺乳女性
·在30天内使用任何其它研究性药物
·无法理解和遵守研究程序、无法理解风险和/或
不愿提供书面知情同意。
结果:
第2阶段研究表明化合物1整体耐受性良好。在探究了宽范围的剂量(5倍范围)之后,所述研究测定一系列安全剂量(参见图1)。
关于患者对化合物1的反应,80%的患者显示出ACTH减少(参见图2)。总的来说,ACTH的衰减证明了靶标参与和功能性CRF1受体拮抗作用。80%的患者受试者表现出ACTH减少。70%的受试者表现出ACTH减少25%以上。40%的受试者在治疗后处于正常范围内。
17-OHP的减少证明了基于标准指南对疾病的“控制”。这使得类固醇逐渐减少。80%的受试者表现出17-OHP减少(参见图3)。50%的受试者表现出17-OHP减少25%以上。50%的受试者治疗后处于指南范围内(1200ng/dL)。
化合物1减弱了A4的晨间上升,这表明控制过量雄激素产生和相关症状的能力(参见图4)。100%的受试者表现出雄烯二酮减少(在不同剂量下)。60%的受试者表现出雄烯二酮减少25%以上。50%的受试者治疗后处于正常参考范围内。
实例5:调配物开发
此实验的目的是(1)评估不同的调配物以获得化合物1 200mg即释核心片剂;(2)评估
化合物1片剂在湿法制粒工艺中和在用Gelucire 48/16和/或维生素E TPGS制粒时的溶出曲线;以及(3)评估片剂/胶囊在各种生物相关介质和漏槽条件下的溶出度,以比较API在胶囊中的溶出度。
实验结果
化合物1片剂的配制分两个阶段进行。
在第一制造阶段中,制造两种即释试验调配物。第一试验涉及使用Gelucire(10%)将化合物1制粒,并包含填充剂和崩解剂。在此调配物中未使用表面活性剂。最终将颗粒混合并以500mg的片剂重量压缩。在制粒和压缩时未观察到任何问题。第二试验涉及将HPC用作粘合剂,使用填充剂和崩解剂进行湿法制粒。将月桂基硫酸钠以1%的浓度用作表面活性剂。与第一试验相比,颗粒更柔软,并且最终共混物的流动性较差。增加额外颗粒部分中的填充剂以改善压缩期间的流量和重量变化。将片剂以600mg片剂重量压缩。测试第一试验批次产品和第二试验批次产品在不同生物相关介质——SGF(模拟胃液)、SIF(模拟肠液)、FaSSIF(禁食状态模拟肠液)和FeSSIF(进食状态模拟肠液)——中的溶出度。
在第二制造阶段中,制造另外两种具有8%的Gelucire和维生素E TPGS以及高浓度的月桂烷基硫酸钠的调配物。表面活性剂的百分比增加到7%。将片剂以570mg片剂重量压缩。在制造过程中未发现任何问题。进一步的开发包含使用高浓度的Gelucire(25%)进行制造。由于调配物中Gelucire的浓度很高,所以颗粒无法压缩,而是手工装入0号胶囊中。
建议进一步发展湿法制粒工艺,因为流动性差,并且颗粒的粒度不是最佳的。来自湿法制粒调配物的颗粒在压缩期间也显示出重量变化。
对于Gelucire调配物和HPC调配物,在SIF和FaSSIF中的释放非常低,在60分钟时的范围介于0.5%到3%。在60分钟内,在SGF和FeSSIF中的释放较高,并且范围为11-16%。在SGF和FeSSIF中呈现的较高释放可能是由于介质中存在表面活性剂所致。然而,当存在脂质赋形剂或高浓度的表面活性剂时,在生物相关介质中的溶出度没有显示出改善。在60分钟时,在SIF和FeSSIF中的释放低于2%,在SGF中的释放为约15%,在FeSSIR中的释放为约10%。当胶囊调配物中存在高浓度的Gelucire时,溶出度没有显示出改善。对API在胶囊和不同调配物中的溶出度的比较未显示出溶出度有任何改善。还使用湿法制粒调配物和Gelucire调配物进行动物PK研究。溶出度和PK研究表明,目前的配制方法可能不适合于提高化合物1的生物利用度或最小化食物效应。在第2/第3阶段研究中,建议对化合物1采用不同的配制方法。
实例6:初步片剂配制
整个实验的目的是开发、制造和商业化具有不溶性(在水中以及在1.2到7.5的所有生理pH下溶解度小于0.002mg/ml)原料药且剂量强度高达200mg的小型片剂或胶囊。片剂应使用USP设备I或II在溶出介质中立即释放。
成功标准
1.在剂量强度为200mg时,片剂尺寸小于400mg。
2.超过70%在60分钟内溶出在常规溶出介质中。
整体制造程序
将相关的赋形剂手工过筛,然后干混。加入粘合剂溶液,并将混合物进行湿法制粒。然后将颗粒湿磨并干燥。将所得颗粒进行干磨,并添加到其它相关的共同颗粒和赋形剂中。然后按目标片剂重量将混合物压缩成片剂。
开发用最少量和最少数量的赋形剂进行的制粒。制粒由至少90%的化合物1和表面活性剂和粘合剂组成,并且在某些情况下,还包含超级崩解剂。制粒成功后,加入其它赋形剂以实现压缩。这些赋形剂包含压缩助剂、润滑剂、防粘剂和超级崩解剂。
将两种共混物制粒。一种共混物具有95%的化合物1、1%的月桂基硫酸钠和4%的HPC-EXF。第二混合物具有91%的化合物1、1%的月桂基硫酸钠(表面活性剂和润湿剂)、6%的PVP(水溶性粘合剂)和2%的Ac-di-sol(水溶胀性超级崩解剂)。
将由HPC-EXF(粘合剂)组成的制粒进一步与Si02(流动助剂和防粘剂)、ac-di-sol(水溶胀性崩解剂)和硬脂酸镁(润滑剂)混合。将不同水平的MCC添加到片剂中(0%、10%和20%的水平)。三种调配物(90%、81%和71%DL)均迅速溶出,并且在开放培养皿条件下在加速稳定性期间不存在显著变化。将以PVP为粘合剂进行的制粒重复三次。第一制粒由93%的化合物1、6%的PVP和1%的SLS组成。此调配物显示出较差的制造特征(颗粒流动性),但是片剂具有可接受的溶出度。没有进行进一步的稳定性。
第二制粒(与第一种制粒相同)具有可接受的制造特征(良好的流动性和压缩性),但是溶出稍慢,并且在压力非常强的条件下在稳定性期间存在显著变化。
第三制粒由91%的化合物1、6%的PVP、1%的SLS和2%的Ac-di-sol(作为颗粒内超级崩解剂)组成。将制粒进一步与Si02(流动助剂和防粘剂)、ac-di-sol(水溶胀性崩解剂)和硬脂酸镁(润滑剂)混合。将不同水平的MCC添加到片剂中(0%、10%和20%的水平)。所有三种调配物(86%、77%和68%DL)均迅速溶出。
这证明了化合物1的成功片剂,其中水溶解度小于0.002mg/ml,同时保持载药量高于50%,并在常规溶出介质(1%SLS和USP设备II)中产生可接受的溶出度。所述片剂使用传统的高剪切湿法制粒方法制造。
表10.化合物1在不同水性介质中的溶解度汇总(n=2,在室温下24小时)
| 水性介质 | 平衡pH | 溶解度mg/mL | 标准偏差(n=2) | 描述 |
| 水 | 7.78 | 0.0003 | 0.0000 | 不溶 |
| 0.1N HCl | 1.06 | 0.0018 | 0.0000 | 不溶 |
| 0.01N HCl | 2.06 | 0.0004 | 0.0000 | 不溶 |
| 0.001N HCl | 3.36 | 0.0003 | 0.0000 | 不溶 |
| pH 4.5乙酸盐(USP) | 4.65 | 0.0005 | 0.0000 | 不溶 |
| pH 6.0磷酸盐(USP) | 6.08 | 0.0002 | 0.0000 | 不溶 |
| pH 7.5磷酸盐(USP) | 7.57 | 0.0006 | 0.0000 | 不溶 |
| 0.1N NaOH | 11.65 | 0.0002 | 0.0000 | 不溶 |
| SGF | 2.25 | 0.0204 | 0.0001 | 不溶 |
| FaSSIF | 6.73 | 0.0036 | 0.0000 | 不溶 |
| FaSSIF | 5.16 | 0.0104 | 0.0000 | 不溶 |
实例7:片剂配制A
使用利用共同颗粒和PVP K30作为粘合剂的湿法制粒制备三种调配物(参见表11)。用MCC PH102将颗粒稀释,其中载药量分别为95%、85%和75%。
表11.制造配方A
将化合物1、聚维酮和月桂基硫酸钠混合以产生干燥混合物。将水加入干燥混合物中,并以约550-560rpm的叶轮速度对其进行湿法制粒。然后将湿颗粒过筛并干燥。将干燥颗粒干燥过筛,然后将颗粒压缩成片剂。
在工艺控制测试中,每片片剂都符合要求。A-l和A-3的溶出结果显示出相似的曲线,而在前几个点中,A-2比其它两个稍慢(参见表12和图5)。
表12.制造配方A的溶出度
实例8:片剂配制B
使用利用共同颗粒和PVP K30作为粘合剂的湿法制粒制备三种调配物(参见表13)。用MCC PH102将颗粒稀释,其中载药量分别为95%、85%和75%。
表13.制造配方B
将化合物1、聚维酮和月桂基硫酸钠混合以产生干燥混合物。将水加入干燥混合物中,并以约600-610rpm的叶轮速度对其进行湿法制粒。然后将湿颗粒过筛并干燥。将干燥颗粒干燥过筛,然后将颗粒压缩成片剂。
溶出度结果显示溶出比之前的片剂慢,这可能由更多颗粒和更大的硬度引起(见表14和图6)。
表14.制造配方B的溶出度
实例9:片剂配制C
使用利用共同颗粒、PVP K30作为粘合剂和2%的颗粒内交联羧甲基纤维素钠的湿法制粒制备三种调配物(参见表15)。
表15.制造配方C
将化合物1、聚维酮、交联羧甲基纤维素钠和月桂基硫酸钠混合以产生干燥混合物。将水加入干燥混合物中,并以约600-610rpm的叶轮速度对其进行湿法制粒。然后将湿颗粒过筛并干燥。将干燥颗粒干燥过筛,然后将颗粒压缩成片剂。
溶出度结果显示溶出比其它片剂快,这可能由另外的量的交联羧甲基纤维素钠引起(参见表16和图7)。
表16.制造配方C的溶出度
实例10:片剂配制D
使用湿法制粒制备两种调配物(见表17)。
表17.制造配方D
将化合物1、聚维酮、交联羧甲基纤维素钠和月桂基硫酸钠混合以产生干燥混合物。将水加入干燥混合物中,并以约600-610rpm的叶轮速度对其进行湿法制粒。然后将湿颗粒过筛并干燥。将干燥颗粒干燥过筛,然后将颗粒压缩成片剂。
调配物D-1和D2的释放曲线与之前的调配物类似,没有显著变化(参见表18)。
表18.制造配方C的溶出度
两种调配物都在SGF介质中具有较快的释放曲线(参见表19)。
表19.制造配方C在SGF介质中的溶出度
尽管本文中已经示出并描述了本发明的优选实施例,但是对于本领域的技术人员来说将明显的是,此类实施例仅通过举例方式提供。在不背离本发明的情况下,本领域的技术人员现在将想到许多变化、改变和替代。应理解的是,在实践本发明时可以采用在本文描述的本发明的实施例的各种替代方案。意图是,以下权利要求限定本发明的范围,并且以下权利要求覆盖处于这些权利要求和其等效物的范围内的方法和结构。
Claims (62)
2.根据权利要求1所述的药物组合物,其中所述药物组合物包括介于约1mg与约500mg之间的化合物1或其药学上可接受的盐或溶剂化物。
3.根据权利要求1或2所述的药物组合物,其中所述药物组合物包括介于约5mg与约500mg之间的化合物1或其药学上可接受的盐或溶剂化物。
4.根据权利要求1到3中任一项所述的药物组合物,其中所述药物组合物包括介于约10mg与约500mg之间的化合物1或其药学上可接受的盐或溶剂化物。
5.根据权利要求1到4中任一项所述的药物组合物,其中所述药物组合物包括介于约10mg与约300mg之间的化合物1或其药学上可接受的盐或溶剂化物。
6.根据权利要求1到5中任一项所述的药物组合物,其中所述药物组合物包括介于约10mg与约100mg之间的化合物1或其药学上可接受的盐或溶剂化物。
7.根据权利要求1到4中任一项所述的药物组合物,其中所述药物组合物包括介于约50mg与约500mg之间的化合物1或其药学上可接受的盐或溶剂化物。
8.根据权利要求1到4中任一项所述的药物组合物,其中所述药物组合物包括介于约100mg与约500mg之间的化合物1或其药学上可接受的盐或溶剂化物。
9.根据权利要求1到4中任一项所述的药物组合物,其中所述药物组合物包括介于约100mg与约400mg之间的化合物1或其药学上可接受的盐或溶剂化物。
10.根据权利要求1到5中任一项所述的药物组合物,其中所述药物组合物包括介于约100mg与约300mg之间的化合物1或其药学上可接受的盐或溶剂化物。
11.根据权利要求1到5中任一项所述的药物组合物,其中所述药物组合物包括介于约150mg与约250mg之间的化合物1或其药学上可接受的盐或溶剂化物。
12.根据权利要求1到4中任一项所述的药物组合物,其中所述药物组合物包括约400mg化合物1或其药学上可接受的盐或溶剂化物。
13.根据权利要求1到5中任一项所述的药物组合物,其中所述药物组合物包括约300mg化合物1或其药学上可接受的盐或溶剂化物。
14.根据权利要求1到5中任一项所述的药物组合物,其中所述药物组合物包括约250mg化合物1或其药学上可接受的盐或溶剂化物。
15.根据权利要求1到5中任一项所述的药物组合物,其中所述药物组合物包括约200mg化合物1或其药学上可接受的盐或溶剂化物。
16.根据权利要求1到5中任一项所述的药物组合物,其中所述药物组合物包括约150mg化合物1或其药学上可接受的盐或溶剂化物。
17.根据权利要求1到6中任一项所述的药物组合物,其中所述药物组合物包括约100mg化合物1或其药学上可接受的盐或溶剂化物。
18.根据权利要求1到6中任一项所述的药物组合物,其中所述药物组合物包括约80mg化合物1或其药学上可接受的盐或溶剂化物。
19.根据权利要求1到6中任一项所述的药物组合物,其中所述药物组合物包括约60mg化合物1或其药学上可接受的盐或溶剂化物。
20.根据权利要求1到6中任一项所述的药物组合物,其中所述药物组合物包括约50mg化合物1或其药学上可接受的盐或溶剂化物。
21.根据权利要求1到6中任一项所述的药物组合物,其中所述药物组合物包括约30mg化合物1或其药学上可接受的盐或溶剂化物。
22.根据权利要求1到21中任一项所述的药物组合物,其中化合物1或其药学上可接受的盐或溶剂化物呈微粒的形式。
23.根据权利要求22所述的药物组合物,其中所述微粒的平均尺寸介于约1μm与约20μm之间。
24.根据权利要求22或23所述的药物组合物,其中所述微粒的平均尺寸介于约5μm与约15μm之间。
25.根据权利要求22到24中任一项所述的药物组合物,其中所述微粒的平均尺寸小于约10μm。
26.根据权利要求1到25中任一项所述的药物组合物,其中所述胶囊为硬明胶胶囊。
27.根据权利要求1到25中任一项所述的药物组合物,其中所述胶囊为软明胶胶囊。
28.根据权利要求1到27中任一项所述的药物组合物,其中所述胶囊使用选自由以下组成的组的材料形成:天然明胶、合成明胶、果胶、酪蛋白、胶原蛋白、蛋白质、改性淀粉、聚乙烯吡咯烷酮、丙烯酸聚合物、纤维素衍生物和其任何组合。
29.根据权利要求1到28中任一项所述的药物组合物,其中所述药物组合物不含另外的赋形剂。
30.根据权利要求1到28中任一项所述的药物组合物,其中所述药物组合物进一步包括一种或多种药学上可接受的赋形剂。
32.根据权利要求31所述的药物组合物,其中所述药物组合物包括介于约1mg与约500mg之间的化合物1或其药学上可接受的盐或溶剂化物。
33.根据权利要求31或32所述的药物组合物,其中所述药物组合物包括介于约5mg与约500mg之间的化合物1或其药学上可接受的盐或溶剂化物。
34.根据权利要求31到33中任一项所述的药物组合物,其中所述药物组合物包括介于约10mg与约500mg之间的化合物1或其药学上可接受的盐或溶剂化物。
35.根据权利要求31到34中任一项所述的药物组合物,其中所述药物组合物包括介于约10mg与约300mg之间的化合物1或其药学上可接受的盐或溶剂化物。
36.根据权利要求31到35中任一项所述的药物组合物,其中所述药物组合物包括介于约10mg与约100mg之间的化合物1或其药学上可接受的盐或溶剂化物。
37.根据权利要求31到34中任一项所述的药物组合物,其中所述药物组合物包括介于约50mg与约500mg之间的化合物1或其药学上可接受的盐或溶剂化物。
38.根据权利要求31到34中任一项所述的药物组合物,其中所述药物组合物包括介于约100mg与约500mg之间的化合物1或其药学上可接受的盐或溶剂化物。
39.根据权利要求31到34中任一项所述的药物组合物,其中所述药物组合物包括介于约100mg与约400mg之间的化合物1或其药学上可接受的盐或溶剂化物。
40.根据权利要求31到35中任一项所述的药物组合物,其中所述药物组合物包括介于约100mg与约300mg之间的化合物1或其药学上可接受的盐或溶剂化物。
41.根据权利要求31到35中任一项所述的药物组合物,其中所述药物组合物包括介于约150mg与约250mg之间的化合物1或其药学上可接受的盐或溶剂化物。
42.根据权利要求31到34中任一项所述的药物组合物,其中所述药物组合物包括约400mg化合物1或其药学上可接受的盐或溶剂化物。
43.根据权利要求31到35中任一项所述的药物组合物,其中所述药物组合物包括约300mg化合物1或其药学上可接受的盐或溶剂化物。
44.根据权利要求31到35中任一项所述的药物组合物,其中所述药物组合物包括约250mg化合物1或其药学上可接受的盐或溶剂化物。
45.根据权利要求31到35中任一项所述的药物组合物,其中所述药物组合物包括约200mg化合物1或其药学上可接受的盐或溶剂化物。
46.根据权利要求31到35中任一项所述的药物组合物,其中所述药物组合物包括约150mg化合物1或其药学上可接受的盐或溶剂化物。
47.根据权利要求31到36中任一项所述的药物组合物,其中所述药物组合物包括约100mg化合物1或其药学上可接受的盐或溶剂化物。
48.根据权利要求31到36中任一项所述的药物组合物,其中所述药物组合物包括约80mg化合物1或其药学上可接受的盐或溶剂化物。
49.根据权利要求31到36中任一项所述的药物组合物,其中所述药物组合物包括约60mg化合物1或其药学上可接受的盐或溶剂化物。
50.根据权利要求31到36中任一项所述的药物组合物,其中所述药物组合物包括约50mg化合物1或其药学上可接受的盐或溶剂化物。
51.根据权利要求31到36中任一项所述的药物组合物,其中所述药物组合物包括约30mg化合物1或其药学上可接受的盐或溶剂化物。根据权利要求31到50中任一项所述的药物组合物,其中化合物1或其药学上可接受的盐或溶剂化物呈微粒的形式。
52.根据权利要求51所述的药物组合物,其中所述微粒的平均尺寸介于约1μm与约20μm之间。
53.根据权利要求51或52所述的药物组合物,其中所述微粒的平均尺寸介于约5μm与约15μm之间。
54.根据权利要求51到53中任一项所述的药物组合物,其中所述微粒的平均尺寸小于约10μm。
55.根据权利要求31到54中任一项所述的药物组合物,其中所述片剂通过压缩、模制或挤出制备。
56.根据权利要求55所述的药物组合物,其中所述片剂通过热熔挤出制备。
57.根据权利要求31到56中任一项所述的药物组合物,其中所述药物组合物进一步包括一种或多种药学上可接受的赋形剂。
58.根据权利要求1到57中任一项所述的药物组合物,其中所述药物组合物在25℃下稳定,持续至少1个月。
59.根据权利要求1到58中任一项所述的药物组合物,其中所述药物组合物在25℃下稳定,持续至少3个月。
60.根据权利要求1到59中任一项所述的药物组合物,其中所述药物组合物在25℃下稳定,持续至少6个月。
61.根据权利要求1到60中任一项所述的药物组合物,其中所述药物组合物在25℃下稳定,持续至少9个月。
62.根据权利要求1到61中任一项所述的药物组合物,其中所述药物组合物在25℃下稳定,持续至少12个月。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201762545393P | 2017-08-14 | 2017-08-14 | |
| US62/545,393 | 2017-08-14 | ||
| PCT/US2018/046707 WO2019036472A1 (en) | 2017-08-14 | 2018-08-14 | CORTICOTROPIN RELEASE FACTOR RECEPTOR ANTAGONISTS |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| CN110997667A true CN110997667A (zh) | 2020-04-10 |
Family
ID=65362465
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201880038596.0A Pending CN110997667A (zh) | 2017-08-14 | 2018-08-14 | 促肾上腺皮质激素释放因子受体拮抗剂 |
Country Status (13)
| Country | Link |
|---|---|
| US (1) | US20210137935A1 (zh) |
| EP (1) | EP3630763A4 (zh) |
| JP (2) | JP7285222B2 (zh) |
| KR (1) | KR102644781B1 (zh) |
| CN (1) | CN110997667A (zh) |
| AR (1) | AR112471A1 (zh) |
| AU (2) | AU2018318990B2 (zh) |
| BR (1) | BR112020002966A2 (zh) |
| CA (1) | CA3064445A1 (zh) |
| EA (1) | EA202090321A1 (zh) |
| MX (2) | MX2019015318A (zh) |
| TW (2) | TWI803504B (zh) |
| WO (1) | WO2019036472A1 (zh) |
Families Citing this family (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP3096756A1 (en) | 2014-01-21 | 2016-11-30 | Neurocrine Biosciences, Inc. | Crf1 receptor antagonists for the treatment of congenital adrenal hyperplasia |
| JP7427655B2 (ja) | 2018-04-27 | 2024-02-05 | スプルース バイオサイエンシーズ,インク. | 精巣副腎残存腫瘍および卵巣副腎残存腫瘍を処置するための方法 |
| EP3986416A4 (en) * | 2019-07-19 | 2023-06-28 | Spruce Biosciences, Inc. | Methods of treating congenital adrenal hyperplasia |
| CA3188730A1 (en) * | 2020-08-12 | 2022-02-17 | Christopher Barnes | Methods and compositions for treating polycystic ovary syndrome |
| JP2023540223A (ja) * | 2020-08-26 | 2023-09-22 | ニューロクライン バイオサイエンシーズ,インコーポレイテッド | Crf受容体アンタゴニストおよび使用方法 |
| US11708372B2 (en) | 2021-11-19 | 2023-07-25 | Spruce Biosciences, Inc. | Crystalline composition of tildacerfont and methods of use and preparation thereof |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN101142217A (zh) * | 2005-03-21 | 2008-03-12 | 伊莱利利公司 | 咪唑并哒嗪化合物 |
| CN101516887A (zh) * | 2006-09-20 | 2009-08-26 | 伊莱利利公司 | 作为crf1受体拮抗剂的噻唑吡唑并嘧啶类 |
| CN102171212A (zh) * | 2008-10-02 | 2011-08-31 | 伊莱利利公司 | 作为合成中间体的噻唑基吡唑并嘧啶化合物及相关的合成方法 |
Family Cites Families (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO1997029109A1 (en) * | 1996-02-07 | 1997-08-14 | Janssen Pharmaceutica N.V. | Pyrazolopyrimidines as crf receptor antagonists |
| NZ505079A (en) | 1998-01-28 | 2003-08-29 | Du Pont Pharm Co | Pyrazolotriazines and pyrazolopyrimidines useful as corticotropin releasing factor antagonists |
| IL137019A (en) * | 1998-01-28 | 2010-11-30 | Du Pont Pharm Co | 2,7 - dimethyl - 4 - (substituted amino) - 8 - arylpyrazolo [1,5-a] triazine derivatives and pharmaceutical compositions containing them |
| AU1930301A (en) * | 1999-12-08 | 2001-06-18 | Pharmacia Corporation | Valdecoxib compositions |
| US20070129382A1 (en) * | 2004-02-13 | 2007-06-07 | Dimitri Grigoriadis | Crf receptor antagonists, their preparations, their pharmaceutical composition, and their uses |
| CA2662000C (en) | 2006-09-20 | 2013-01-08 | Eli Lilly And Company | Thiophene pyrazolopyrimidine compounds |
-
2018
- 2018-08-14 MX MX2019015318A patent/MX2019015318A/es unknown
- 2018-08-14 AR ARP180102314 patent/AR112471A1/es unknown
- 2018-08-14 CA CA3064445A patent/CA3064445A1/en active Pending
- 2018-08-14 CN CN201880038596.0A patent/CN110997667A/zh active Pending
- 2018-08-14 KR KR1020207005534A patent/KR102644781B1/ko active IP Right Grant
- 2018-08-14 BR BR112020002966-1A patent/BR112020002966A2/pt unknown
- 2018-08-14 US US16/639,540 patent/US20210137935A1/en active Pending
- 2018-08-14 TW TW107128345A patent/TWI803504B/zh active
- 2018-08-14 TW TW112117030A patent/TW202400179A/zh unknown
- 2018-08-14 WO PCT/US2018/046707 patent/WO2019036472A1/en unknown
- 2018-08-14 AU AU2018318990A patent/AU2018318990B2/en active Active
- 2018-08-14 EP EP18846043.0A patent/EP3630763A4/en active Pending
- 2018-08-14 JP JP2019572820A patent/JP7285222B2/ja active Active
- 2018-08-14 EA EA202090321A patent/EA202090321A1/ru unknown
-
2019
- 2019-12-16 MX MX2022015858A patent/MX2022015858A/es unknown
-
2023
- 2023-03-20 AU AU2023201703A patent/AU2023201703A1/en active Pending
- 2023-05-22 JP JP2023084119A patent/JP2023116489A/ja active Pending
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN101142217A (zh) * | 2005-03-21 | 2008-03-12 | 伊莱利利公司 | 咪唑并哒嗪化合物 |
| CN101516887A (zh) * | 2006-09-20 | 2009-08-26 | 伊莱利利公司 | 作为crf1受体拮抗剂的噻唑吡唑并嘧啶类 |
| CN102171212A (zh) * | 2008-10-02 | 2011-08-31 | 伊莱利利公司 | 作为合成中间体的噻唑基吡唑并嘧啶化合物及相关的合成方法 |
Also Published As
| Publication number | Publication date |
|---|---|
| MX2019015318A (es) | 2020-07-20 |
| WO2019036472A1 (en) | 2019-02-21 |
| TWI803504B (zh) | 2023-06-01 |
| KR20200038951A (ko) | 2020-04-14 |
| TW201925197A (zh) | 2019-07-01 |
| AU2018318990B2 (en) | 2023-01-05 |
| CA3064445A1 (en) | 2019-02-21 |
| EA202090321A1 (ru) | 2020-09-24 |
| EP3630763A4 (en) | 2021-03-10 |
| BR112020002966A2 (pt) | 2020-08-11 |
| US20210137935A1 (en) | 2021-05-13 |
| TW202400179A (zh) | 2024-01-01 |
| JP2023116489A (ja) | 2023-08-22 |
| JP2020530832A (ja) | 2020-10-29 |
| EP3630763A1 (en) | 2020-04-08 |
| KR102644781B1 (ko) | 2024-03-06 |
| AU2023201703A1 (en) | 2023-04-13 |
| MX2022015858A (es) | 2023-01-24 |
| AU2018318990A1 (en) | 2019-11-21 |
| AR112471A1 (es) | 2019-10-30 |
| JP7285222B2 (ja) | 2023-06-01 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US11344557B2 (en) | Corticotropin releasing factor receptor antagonists | |
| CN110997667A (zh) | 促肾上腺皮质激素释放因子受体拮抗剂 | |
| US20200255436A1 (en) | Corticotropin releasing factor receptor antagonists | |
| KR20220052927A (ko) | 선천성 부신 증식증의 치료 방법 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PB01 | Publication | ||
| PB01 | Publication | ||
| SE01 | Entry into force of request for substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| RJ01 | Rejection of invention patent application after publication | ||
| RJ01 | Rejection of invention patent application after publication |
Application publication date: 20200410 |