CN107074921B - 重组克氏锥虫jl7抗原变体及其用于检测查加斯病的用途 - Google Patents
重组克氏锥虫jl7抗原变体及其用于检测查加斯病的用途 Download PDFInfo
- Publication number
- CN107074921B CN107074921B CN201580058514.5A CN201580058514A CN107074921B CN 107074921 B CN107074921 B CN 107074921B CN 201580058514 A CN201580058514 A CN 201580058514A CN 107074921 B CN107074921 B CN 107074921B
- Authority
- CN
- China
- Prior art keywords
- trypanosoma cruzi
- polypeptide
- sample
- amino acid
- antibodies
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/569—Immunoassay; Biospecific binding assay; Materials therefor for microorganisms, e.g. protozoa, bacteria, viruses
- G01N33/56905—Protozoa
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/44—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from protozoa
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/564—Immunoassay; Biospecific binding assay; Materials therefor for pre-existing immune complex or autoimmune disease, i.e. systemic lupus erythematosus, rheumatoid arthritis, multiple sclerosis, rheumatoid factors or complement components C1-C9
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/68—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving proteins, peptides or amino acids
- G01N33/6854—Immunoglobulins
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/20—Fusion polypeptide containing a tag with affinity for a non-protein ligand
- C07K2319/21—Fusion polypeptide containing a tag with affinity for a non-protein ligand containing a His-tag
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/40—Fusion polypeptide containing a tag for immunodetection, or an epitope for immunisation
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/70—Fusion polypeptide containing domain for protein-protein interaction
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2333/00—Assays involving biological materials from specific organisms or of a specific nature
- G01N2333/435—Assays involving biological materials from specific organisms or of a specific nature from animals; from humans
- G01N2333/44—Assays involving biological materials from specific organisms or of a specific nature from animals; from humans from protozoa
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2469/00—Immunoassays for the detection of microorganisms
- G01N2469/20—Detection of antibodies in sample from host which are directed against antigens from microorganisms
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2800/00—Detection or diagnosis of diseases
- G01N2800/26—Infectious diseases, e.g. generalised sepsis
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02A—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE
- Y02A50/00—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE in human health protection, e.g. against extreme weather
- Y02A50/30—Against vector-borne diseases, e.g. mosquito-borne, fly-borne, tick-borne or waterborne diseases whose impact is exacerbated by climate change
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Immunology (AREA)
- Engineering & Computer Science (AREA)
- Molecular Biology (AREA)
- Hematology (AREA)
- Biomedical Technology (AREA)
- Urology & Nephrology (AREA)
- General Health & Medical Sciences (AREA)
- Biochemistry (AREA)
- Medicinal Chemistry (AREA)
- Analytical Chemistry (AREA)
- Microbiology (AREA)
- Physics & Mathematics (AREA)
- Cell Biology (AREA)
- Biotechnology (AREA)
- Food Science & Technology (AREA)
- General Physics & Mathematics (AREA)
- Pathology (AREA)
- Organic Chemistry (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Virology (AREA)
- Tropical Medicine & Parasitology (AREA)
- Toxicology (AREA)
- Zoology (AREA)
- Gastroenterology & Hepatology (AREA)
- Biophysics (AREA)
- Genetics & Genomics (AREA)
- Rehabilitation Therapy (AREA)
- Rheumatology (AREA)
- Peptides Or Proteins (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
Abstract
本发明涉及适合于检测分离的生物样品中针对克氏锥虫(引起查加斯病)的抗体的JL7抗原的变体。这些抗原包含JL7特异性氨基酸序列,所述JL7特异性序列由两个拷贝的SEQ ID NO.2组成,其中所述两个拷贝中的每一个与SEQ ID NO.2具有至少90%的氨基酸同一性,并且其中所述多肽中不存在进一步的克氏锥虫特异性氨基酸序列。本发明还涉及可用于检测针对克氏锥虫的抗体的多肽的组合物,其包含上述表征的JL7抗原连同克氏锥虫多肽1F8、Cruzipain、KMP‑11和PAR‑2中的至少一种。此外,其涉及用于产生JL7抗原的方法以及用于使用JL7多肽检测克氏锥虫抗体的诊断方法。此外,本发明涉及包含所述JL7多肽或克氏锥虫多肽的组合物的试剂盒。
Description
技术领域
本发明涉及重组克氏锥虫JL7抗原变体及其用于检测查加斯病的用途。
背景技术
克氏锥虫(Trypanosoma cruzi)是引起被称为查加斯病的热带寄生虫病的鞭毛虫原生动物。在查加斯病过程中,受感染的患者通常通过急性期,随后为慢性期,其具有介于温和和威胁生命之间的不同症状。只有在初期阶段,患者才能对抗寄生虫治疗有响应。一些患者发生导致死亡的心脏或肠道并发症。
克氏锥虫通常通过昆虫载体(即锥猎蝽亚科(subfamily Triatominae)(猎蝽科(family Reduviidae),德文:“Raubwanzen”)的吸血“亲吻虫”)传播给人类和其他哺乳动物。该疾病也可通过输血和器官移植、摄入被寄生虫污染的食物而传播以及从母亲传播到胎儿。为了防止查加斯病的进一步传播,重要的是基于血液中的寄生虫的存在和针对克氏锥虫的抗体筛选献血和医疗产品,特别是在主要感染的区域,如墨西哥、中南美洲和美国南部。
如今,几种血清学诊断方法可用来检测克氏锥虫的感染,例如,通过间接免疫荧光、间接血细胞凝集、补体固定、免疫印迹技术和ELISA检测针对克氏锥虫的抗体。还应用分子生物学方法(例如PCR)和复杂的媒介生物诊断方法。在媒介生物诊断法中,使载体传播的感染物,实验室培育的、无病原体昆虫(此处为:接吻虫)从患者吸取血液。然后检查昆虫的肠内容物中病原体(此处为:克氏锥虫)的存在。
这些方法中的每一种在灵敏度和特异性方面都显示出其自身的弱点和优势,因此目前还没有可用的金标准方法。
在开始开发查加斯测定法用于检测抗体中,应用了且仍正在使用天然抗原裂解物。然而,使用裂解物,在该抗原组合物中仅代表克氏锥虫的三个发育阶段之一,使得存在错过其他两个阶段的感染的特定可能性。更现代的测定法应用代表克氏锥虫感染的所有阶段的重组抗原的混合物。
用于检测针对克氏锥虫抗原的抗体的血清学测定已经在现有技术文献中广泛描述。例如Silveira等人 (Trends in Parasitology 2001, Vol. 17 No. 6, p. 286-291)描述了已经由几个实验室分离了与血清诊断相关的克氏锥虫重组抗原。这些基因中的几个具有串联重复的序列,得到显示重复的氨基酸序列基序的蛋白。
在用于检测针对克氏锥虫的抗体的血清学测定中广泛使用的抗原之一是JL7,UniProt数据库条目号Q4CS87,其也通过同义词FRA、Ag1和H49描述(对于综述,参见例如Cotrim等人 1995, Mol Biochem Parasitol 71, 89-98和Umezawa等人 1999, J ClinMicrobiol, 1554-1560)。Silveira等人(同上)也描述了用于ELISA测定中的各种额外的克氏锥虫抗原的几种混合物中的FRA (JL7)。没有公开特定JL7相关多肽。
Valiente-Gabioud等人(Exp. Parasitol. 2011, 127, p. 672-679)讨论了重复性对克氏锥虫FRA(JL7)蛋白的免疫原性和抗原性的影响。建议使用四个重复的重复以得到令人满意的来自人受感染血清的ELISA信号。没有解决测定特异性的问题,并且没有公开特定JL7多肽。
基于上述JL7序列的所有抗原变体都携带在克氏锥虫的品系和分离株之间高度保守的68个氨基酸的重复。JL7是推定的226个氨基酸的钙蛋白酶半胱氨酸肽酶,其包含所述68个氨基酸的基序的约3.5个重复(参见图1)。然而,携带几个相同或非常相似重复的抗原通常容易受到干扰,所述干扰由存在于待分析抗克氏锥虫抗体的存在的样品中的IgM或IgG分子或风湿因子的非特异性结合引起。
因此,在提供用于检测克氏锥虫感染的重组JL7抗原组合物和诊断方法时可以看到问题,所述重组JL7抗原组合物和诊断方法克服了在干扰敏感性方面的缺点。
该问题通过如权利要求中所指定的本发明来解决。请求保护的抗原和组合物以及诊断方法提供了具有高特异性和灵敏度和可靠再现性的免疫诊断溶液。
发明内容
本发明涉及适合于检测分离的生物样品中针对克氏锥虫JL7抗原的抗体的JL7抗原的变体。这些抗原包含JL7特异性氨基酸序列,所述JL7特异性序列由两个拷贝的SEQ IDNO. 2组成,其中所述两个拷贝中的每一个与SEQ ID NO. 2具有至少90%的氨基酸同一性,并且其中所述多肽中不存在进一步的克氏锥虫特异性氨基酸序列。本发明还涉及可用于检测针对克氏锥虫的抗体的多肽的组合物,其包含上述表征的JL7抗原连同克氏锥虫多肽1F8、Cruzipain、KMP-11和PAR-2中的至少一种。此外,本发明涉及用于产生JL7抗原的方法以及用于使用JL7多肽检测克氏锥虫抗体的诊断方法。此外,本发明涉及包含所述JL7多肽或克氏锥虫多肽的组合物的试剂盒。
公开的氨基酸序列的说明:
SEQ ID NO.1显示了下述的部分序列:克氏锥虫蛋白JL7(UniProt条目Q4CS87),也称为FRA、Ag1、H49;完全描述性名称:钙蛋白酶半胱氨酸肽酶,推定。SEQ ID NO.1显示了上述UniProt数据库条目的氨基酸位置62-287,得到长度为226个氨基酸的多肽。全长蛋白包含氨基酸1至1275。
SEQ ID NO. 2显示了抗原JL7短1,也显示为SEQ ID NO.1的氨基酸位置1-68
SEQ ID NO. 3显示了抗原JL7短2,也显示为SEQ ID NO.1的氨基酸位置69-136
SEQ ID NO. 4显示了对应于SEQ ID NO.2和3的组合的抗原JL7短1+2,也显示为SEQ ID NO.1的氨基酸位置1-136
SEQ ID NO. 5显示了对应于SEQ ID NO.1的氨基酸位置137-226的抗原JL7短3+4
SEQ ID NO. 6显示了对应于SEQ ID NO.1的氨基酸位置137-204的抗原JL7短3
SEQ ID NO.7显示了可以添加至根据本发明的多肽的N-端末端或优选根据本发明的多肽的C端末端的六组氨酸标签。该标签用于促进蛋白纯化。
附图说明
图1完整JL7氨基酸序列中的重复的结构。上部:比对所有四个重复,其显示了氨基酸同一性(粗体字母)和差异(正常加下划线的字母)。下部:JL7变体的示意图及其重复结构域的相对位置。JL7短1+2代表根据本发明的JL7抗原。
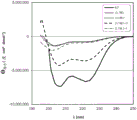
图2:JL7、JL7短1、JL7短2、JL7短1+2和JL7短3+4的远UV CD光谱。在Jasco-720分光偏振计上在恒温槽座中在20℃下记录光谱。在0.1 cm比色杯中,蛋白浓度为0.2 mg/ml。缓冲液为10 mM磷酸钾pH7.5。带宽为1nm,分辨率为1 nm,扫描速度为50 nm/min,响应为2 s。8次记录光谱,并将其平均化,以便改善信噪比。将信号转化为摩尔椭圆率(以度 cm2 dmol-1给出)。JL7和JL7短1+2的光谱指向具有高含量的α-螺旋结构元件(在208nm和222nm的信号带)的蛋白。JL7短1、JL7短2和JL7短3+4的光谱表明具有高度无序结构(200nm附近的信号带)的蛋白。
具体实施方式
克氏锥虫JL7抗原及其氨基酸序列的特性已经在现有技术中广泛描述。然而,由具有多个重复的抗原引起的诊断克氏锥虫测定法的对干扰的敏感性增加的问题尚未得到充分解决。当例如非特异性IgM分子或非特异性IgG与待分析样品中存在的风湿因子一起产生阳性测试结果时,对干扰的高易损性可能导致假阳性结果,假装抗克氏锥虫抗体存在于样品中,而实际上样品应当被检测为阴性。假阳性结果导致测定特异性的不期望的降低。然而,在传染病的诊断方法中,参数监管机构要求高度的特异性。
令人惊讶的是,我们已经鉴定了JL7变体,其一方面的确仍然具有足够的被样品抗体结合的抗原特性,另一方面不会导致假阳性结果。完整的JL7多肽具有68个氨基酸的基序的约3.5个重复。问题是一个重复是否足以提供合适的诊断稀有试剂。当重复1和2(分别命名为JL7短1,SEQ ID NO.2和JL7短2,SEQ ID NO.3)作为分离的抗原表达时,无一缩短的变体能够正确检测所有阳性样品(表2)。对于由约1.5个重复组成的缩短变体(被称为JL7短3+4)(如SEQ ID NO.5中所示)也是如此。然而,当所述68个氨基酸基序的两个重复被相邻地放在一起(诸如SEQ ID NO. 4中)时,已最初使用具有3.5个重复的完整JL7多肽诊断为阳性的样品证明实际上是假阳性样品。另一方面,具有68个氨基酸重复的两个重复的所述JL7多肽(如SEQ ID NO. 2中所示)能够正确地可靠地检测真阳性样品为阳性,即含有针对克氏锥虫的抗体。
因此,本发明涉及适合于检测分离的生物样品中针对克氏锥虫JL7抗原的抗体的多肽,其包含JL7特异性氨基酸序列,所述JL7特异性序列由两个拷贝的SEQ ID NO. 2组成,其中所述两个拷贝中的每一个与SEQ ID NO. 2具有至少90%的氨基酸同一性,并且其中所述多肽中不存在进一步的克氏锥虫特异性氨基酸序列。根据本发明,两个拷贝的SEQ IDNO. 2可以彼此直接相邻,使得在两个拷贝之间不存在另外的氨基酸。作为替代方案,它们可以通过不存在于JL7特异性序列中的接头序列分开。
这两个拷贝的SEQ ID NO. 2不需要完全相同,但两个序列必须显示与SEQ ID NO.2相比至少90%的氨基酸同一性。例如,SEQ ID NO. 4 (JL7短1+2)包含SEQ ID NO. 2 (JL7短1)和SEQ ID NO. 3 (JL7短2)。SEQ ID NO. 2简单地显示与SEQ NO. 2的100%氨基酸同一性,且SEQ ID NO. 3的68个氨基酸中的66个与SEQ ID NO. 2相同,导致97%的氨基酸同一性程度。作为另一个实例,图1中显示的重复3(SEQ ID NO.6)与SEQ ID NO. 2相比具有6个氨基酸位置的差异,导致91%氨基酸同一性(62/68)。根据本发明,JL7多肽因此可以包含其中JL7特异性部分由SEQ ID NO.2和3或SEQ ID NO.2和6或SEQ ID NO 3和6组成的氨基酸序列。在优选的模式中,JL7特异性部分由SEQ ID NO. 4(其为SEQ ID NO 2和3的组合)组成。
为了清楚起见,还有62、63、64、65、66或67个氨基酸的较短长度的JL7特异性氨基酸序列(其中缩短的JL7片段的所有剩余氨基酸残基与SEQ ID NO. 2相同)满足与SEQ IDNO. 2的至少90%氨基酸同一性(例如62/68 = 91%)的要求。在另一个实施方案中,与SEQID NO. 2的氨基酸同一性的要求为至少95%。优选地,所述缩短的JL7片段的缺失涉及N-和C-末端氨基酸残基,使JL7 SEQ ID NO.2序列的核心完整。
重要的是,除了JL7特异性氨基酸序列之外,根据本发明的多肽中不存在进一步的克氏锥虫特异性氨基酸序列。为了清楚起见,在多肽中不存在超出明确描述的那些的还有其它JL7特异性氨基酸序列。因此,本发明中不涵盖如SEQ ID NO. 1中所公开的全长JL7。为了提供本发明的清楚性,例如SEQ ID NO. 4(其已经携带SEQ ID NO. 2中所示的序列基序的两个重复)的还有几个分子不能存在于同一多肽链上。
根据本发明,还考虑JL7抗原的变体,只要满足这样的先决条件:JL7特异性序列由两个拷贝的SEQ ID NO.2组成,每个拷贝与SEQ ID NO. 2具有至少90%的氨基酸同一性。在一个实施方案中,与SEQ ID NO. 2的所述氨基酸同一性为至少95%。只要维持体外诊断免疫测定中的免疫反应性,即变体仍然能够结合并检测样品中存在的抗克氏锥虫抗体,则变体分类为这样。变体也是已经例如通过将接头氨基酸序列、标记物、标签、氨基酸序列或载体部分共价连接至多肽或抗原而修饰的JL7多肽。术语“变体”还涉及翻译后修饰的蛋白,诸如糖基化或磷酸化蛋白,或便于克隆、表达、纯化和折叠的融合蛋白。
术语JL7变体、JL7抗原、JL7多肽或JL7抗原多肽或蛋白在本说明书中同义使用。术语克氏锥虫(Trypanosoma cruzi (=T. cruzi))特异性抗原或克氏锥虫多肽也被理解为同义,并且各自指可以在任何天然存在的克氏锥虫品系中发现的多肽序列,也称为氨基酸序列,其可通过国际蛋白序列数据库(诸如UniProt)获得。
通常为了检测克氏锥虫感染的所有阶段,在用于检测克氏锥虫抗体的测定中应用几种不同的克氏锥虫抗原。因此,本发明的一个进一步方面是适用于检测分离的生物样品中针对克氏锥虫抗原的抗体的多肽的组合物,其包含如上所指定的JL7多肽和至少一种选自1F8、Cruzipain、KMP-11和PAR-2的克氏锥虫多肽。来自这些额外抗原的氨基酸序列是现有技术中已知的,并且可以从公开获得的数据库检索,所述数据库诸如UniProt;例如1F8(UniProt条目Q4D1Q2),也称为FCaBP、Tc24或Tc28;Cruzipain (UniProt条目Q9TW51),也称为Cruzain、gp51/57、Ag 163B6;KMP-11 (UniProt条目Q9U6Z1);PAR2 (UniProt条目Q01530),也称为PFR2。
术语组合物意味着将分离的单独的克氏锥虫多肽组合成混合物。该术语不应包括这样的多肽:其已在一个单个氨基酸链上重组表达或合成、使得所有多肽作为多抗原 - 融合多肽位于仅一个多肽链上。换句话说,排除了天然不出现在单个多肽链上的几个表位的多表位融合抗原。相反,额外克氏锥虫多肽1F8、Cruzipain、KMP-11和PAR2中的每一种在分开的多肽链上表达或作为分开的多肽链化学合成。通过在一个容器或管中混合个别克氏锥虫多肽、导致产生组合物来产生组合物。
所述组合物可以是液体,即将克氏锥虫多肽以水或缓冲液可溶形式添加至混合物。合适的缓冲液成分是本领域技术人员已知的。所述组合物也可以是固体,即其包含冻干或其它干燥形式的克氏锥虫抗原。
此外,本发明涉及产生如上进一步描述的可溶性和免疫反应性克氏锥虫JL7多肽的方法,所述方法包括以下步骤:
a)培养用表达载体转化的宿主细胞,所述表达载体包含可操作连接的编码克氏锥虫JL7多肽的重组DNA分子,
b)表达所述克氏锥虫JL7多肽,和
c)纯化所述克氏锥虫JL7多肽。
本发明的另一个方面是用于检测分离的样品中对于克氏锥虫特异性的抗体的方法,其中如上所公开的克氏锥虫JL7多肽或通过上面定义的方法获得的克氏锥虫JL7多肽或刚刚描述的克氏锥虫多肽的组合物用作所述克氏锥虫抗体的捕获试剂和/或结合配偶体。
又另一个实施方案是用于检测分离的样品中的对于克氏锥虫特异性的抗体的方法,所述方法包括
a)通过将体液样品与根据本发明的克氏锥虫JL7多肽或已经描述的组合物或通过本说明书前述段落中说明的方法获得的克氏锥虫JL7多肽混合而形成免疫反应混合物
b)将所述免疫反应混合物保持足以使体液样品中存在的针对所述多肽样品的组合物的抗体与所述克氏锥虫多肽的组合物免疫反应以形成免疫反应产物的时间段;和
c) 检测所述免疫反应产物中的任一种的存在和/或浓度。
在一个进一步方面,根据本发明的免疫测定方法适用于检测所有可溶性免疫球蛋白亚类的克氏锥虫抗体,包括作为查加斯诊断的最相关亚类的IgG和IgM。
本发明进一步涉及用于以所谓的双抗原夹心形式DAGS检测分离的样品中对于克氏锥虫特异性的抗体的方法。所述用于检测分离的样品中对于克氏锥虫特异性的抗体的方法优选以双抗原夹心(DAGS)形式进行。在此测定中,需要和利用抗体结合至少两个具有其两个(IgG、IgA、IgE)或十个(IgM)互补位的给定抗原的不同分子的能力。在所述DAGS免疫测定中,“固相抗原”和“检测抗原”的基本结构基本上相同,使得样品抗体在两种特异性抗原之间形成桥。因此,两种抗原必须是相同的或免疫交叉反应性的,使得一种抗体能够结合两种抗原。进行此测定的基本要求是一种或多种相关表位存在于两种抗原上。两种抗原之一可以结合固相,而另一抗原携带可检测的标记物。
该方法包括以下步骤:
a)向分离的样品添加可以直接或间接地结合至固相的第一克氏锥虫JL7多肽和第二克氏锥虫JL7多肽,所述第一克氏锥虫多肽携带作为生物亲和(bioaffine)结合对的一部分的效应基团,且所述第二克氏锥虫JL7多肽携带可检测的标记物,其中所述第一和第二克氏锥虫JL7多肽特异性结合所述抗克氏锥虫抗体,
b)形成包含所述第一克氏锥虫JL7多肽、所述样品抗体和所述第二克氏锥虫JL7多肽的免疫反应混合物,其中在形成所述免疫反应混合物之前、期间或之后添加携带所述生物亲和结合对的相应效应基团的固相,
c)将所述免疫反应混合物保持足以使体液样品中针对所述第一和第二克氏锥虫JL7多肽的克氏锥虫抗体与所述第一和第二克氏锥虫多肽免疫反应以形成免疫反应产物的时间段,
d)将液相与固相分离
e)检测所述固相或液相或两者中所述免疫反应产物中的任一种的存在。
在所述夹心方法的优选模式中,第一克氏锥虫JL7多肽携带生物素部分,并且第二克氏锥虫JL7多肽用可以检测其信号的电化学发光钌络合物标记。
本发明还涵盖克氏锥虫JL7多肽或克氏锥虫特异性多肽的组合物或通过上述定义的重组生产方法获得的JL7多肽(全部都在本说明书中上面进一步描述)在用于检测抗克氏锥虫抗体的体外诊断测试中的用途。
本发明的另一个方面是用于检测抗克氏锥虫抗体的试剂盒,其包含根据本发明的克氏锥虫JL7多肽或通过上述进一步描述的生产方法获得的JL7多肽或JL7多肽和至少一种选自1F8、Cruzipain、KMP-11和PAR2的额外克氏锥虫抗原的组合物。
所述试剂盒可用于检测抗克氏锥虫抗体的体外诊断测试,并且可以进一步含有分开小瓶中的对照和标准溶液以及一种或多种溶液中或冻干形式的另外的试剂与通常的添加剂、缓冲液、盐、洗涤剂等,以及本领域技术人员已知的使用说明书。
本发明在实施例部分中进一步举例说明。
实施例1
克氏锥虫JL7抗原变体的克隆和纯化
为了研究适用于免疫诊断测试中的克氏锥虫JL7抗原的最小尺寸,生成了由一个或两个重复单元组成的几种变体。
编码如表1中所列的克氏锥虫抗原的合成基因购自Eurofins MWG Operon(Ebersberg, Germany)。基于Novagen (Madison, WI, USA)的pET24a表达质粒,进行以下克隆步骤。用Nde1和Xho1消化载体,并插入包含各自克氏锥虫抗原的盒。将所得质粒的插入物测序,并发现其编码所需蛋白。所得蛋白的氨基酸序列显示于本发明的序列方案中。所有重组克氏锥虫多肽变体都含有C末端六组氨酸标签(SEQ ID NO.7),以促进Ni-NTA辅助的纯化。SEQ ID NO概述于表1中。
所有克氏锥虫抗原都根据以下方案纯化。使携带表达质粒的大肠杆菌BL21 (DE3)细胞在加有卡那霉素(30 µg/ml)的LB培养基中生长至OD600为1,并通过添加异丙基-β-D-硫代半乳糖苷(IPTG)至1mM的最终浓度而诱导细胞溶质过表达,生长温度为37℃。诱导后4小时,通过离心(5000 x g,20分钟)而收获细胞,冷冻并储存于-20℃。对于细胞裂解,将冷冻的沉淀物重悬浮于每50 ml缓冲液(蛋白酶抑制剂混合物) 25mM磷酸钠pH 8.5、6 mMMgCl2、10 U/ml Benzonase®、1片Complete®和1片Complete® EDTA-free中,并通过高压均质化来裂解所得悬浮液。将粗裂解物补充直至50 mM磷酸钠、10 mM咪唑。离心后,将上清液施加至预先平衡于缓冲液A(50mM磷酸钠pH 8.5、100 mM氯化钠、10 mM咪唑)中的Ni-NTA(镍-次氮基三乙酸酯)柱上。洗脱前,将咪唑浓度提高至40 mM,以除去污染蛋白。然后通过应用250 mM的咪唑浓度来洗脱蛋白。最后,将蛋白进行大小排阻色谱,并将含蛋白级分合并并浓缩。
表 1:克氏锥虫JL7抗原变体SEQ ID No的概述。
| 克氏锥虫抗原 | SEQ ID NO. |
| JL7 | 1 |
| JL7短1 | 2 |
| JL7短2 | 3 |
| JL7短1+2 | 4 |
| JL7短3+4 | 5 |
| JL7短3 | 6 |
实施例2
光谱测量
圆二色光谱(CD)是选择以评价蛋白中的二级结构的方法。酰胺区(190-250nm)中的椭圆率反映了蛋白骨架(即二级结构)中的规则重复元件。
用具有恒温槽座的Jasco-720分光偏振计记录近-UV CD光谱,并将其转化为摩尔椭圆率。缓冲液为10 mM磷酸钾pH7.5。路径长度为0.1cm,蛋白浓度为0.2 mg/ml。带宽为1nm,扫描速度为50 nm/min(分辨率为1 nm),且响应为2 s。为了改善信噪比,八次测量光谱,并将其平均化。
图2显示JL7、JL7短1、JL7短2、JL7短1+2和JL7短3+4的远UV CD光谱。JL7和JL7短1+2的光谱指向具有高含量的α-螺旋结构元件(在208nm和222nm的信号带)的蛋白。JL7短1、JL7短2和JL7短3+4的光谱表明具有高度无序结构(200nm附近的信号带)的蛋白。
因此,结构良好的变体JL7短1+2在免疫测定中显示最佳结果(实施例4和表2)的发现是一致的。我们假设较短的变体JL7短1、JL7短2和JL7短3+4不能维持这样的三维结构,其维持可被样品抗体结合的重要的可识别表位。JL7短1+2以比较短变体JL7短1、JL7短2和JL7短3+4更好可接近的方式将相关表位呈递给样品抗体,所述较短变体JL7短1、JL7短2和JL7短3+4不具有氨基酸序列SEQ ID NO. 2的两个完整重复。
实施例3
生物素和钌部分与克氏锥虫JL7抗原变体的偶联
重组蛋白的赖氨酸ε-氨基分别用N-羟基-琥珀酰亚胺活化的生物素和钌标记物以∼ 10 mg/ml的蛋白浓度进行修饰。对于生物素和钌标记物缀合,将标记物/蛋白摩尔比分别调整至5:1至15:1。反应缓冲液为50 mM磷酸钾(pH 8.5)、150 mM KCl、0.5 mM EDTA。反应在室温下进行30分钟,并通过添加缓冲的L-赖氨酸至10 mM的最终浓度来终止。偶联反应后,通过将粗蛋白缀合物通过凝胶过滤柱(Superdex 200 HI Load)来除去未反应的游离标记物。
实施例4
在免疫诊断测试中评价重组克氏锥虫JL7抗原变体的免疫反应性和对干扰的易损性
在自动化cobas® e601分析仪(Roche Diagnostics GmbH)中评价不同蛋白的免疫反应性。以双抗原夹心形式进行测量。由此,将生物素-缀合物(即捕获抗原)固定在链霉抗生物素蛋白-包被的磁珠的表面上,而检测-抗原携带络合的钌阳离子作为信号传导部分。cobas® e601中的信号检测基于电化学发光。
在特异性免疫球蛋白分析物存在的情况下,显色钌络合物桥接至固相,并在铂电极处激发后发射620 nm的光。信号输出为任意光单位。用抗克氏锥虫阳性和阴性人血清和购自几个来源的血浆样品进行测量。
根据本发明的重组克氏锥虫JL7抗原变体以双抗原夹心(DAGS)免疫测定形式成对评价。例如,JL7-生物素缀合物与含有50 mM MES (pH 6.5)、150 mM NaCl、0.1%聚多卡醇、0.2%牛白蛋白、0.01%N-甲基异噻唑酮、0.1% Oxy-Pyrion的测定缓冲液中各浓度为100ng/ml的JL7-钌络合物缀合物一起进行评价。使用的样品体积为30 µl。抗克氏锥虫阴性人血清用作对照。抗克氏锥虫阳性人血清用于评价各变体的抗原性。
表 2:通过使用重组克氏锥虫JL7抗原变体检测人血清中的抗克氏锥虫抗体
在表2中,显示了表1中所列的所有克氏锥虫JL7抗原变体(除了JL7短3)的免疫活性。
根据制造商的说明书,用商购的Chagas测定法(来自Biokit S.A.的bioelisaChagas)测试了表2的所有样品,所述Chagas测定法使用几种克氏锥虫抗原,但没有JL7。
包含来自巴伐利亚红十字会的献血者(n = 998)的特异性研究揭示,由于巴伐利亚(德国)不是查加斯病的地方性地区的事实,预期4个样品对于抗克氏锥虫抗体是假反应性的,并且批准的bioelisa Chagas (Biokit S.A.)也是无反应性的。
为了决定样品是反应性还是非反应性的,确定平均背景信号(阴性样品的平均值),并且计算了平均背景信号的4.5倍(4.5 x平均值)的截止值。
根据测定条件,个别选择作为用于确定样品是反应性还是非反应性的阈值的截止值。此程序是本领域技术人员已知的。此外,可以通过将信号计数除以预定的截止值(数据未显示)来将绝对信号计数均一化。因此,阳性、即反应性样品将显示为大于1(> 1)的均一化值,而来自非反应性样品的结果将具有0和1之间的值。
参见表2,显然,克氏锥虫JL7抗原变体的反应性强烈取决于完整重复单元的数目。因此,分离的重复单元1或2和与缩短的单元4融合的重复单元3显示显著降低的抗原性。其对干扰的易损性似乎立刻被强烈削弱。与此相反,如在变体JL7短1+2的情况下,两个完整重复单元的融合体维持整个抗原性,如在完整的JL7分子中一样,并且同时正确地鉴定阴性和阳性样品。四个干扰样品中的两个显示测量信号的显著减少。其中JL7特异性部分仅由SEQID NO. 2(和与其具有至少90%氨基酸序列同一性或在一个实施方案中具有至少95%氨基酸序列同一性的变体)的两个重复组成的JL7变体的使用相当地增加了抗克氏锥虫免疫测定的特异性。
序列表
<110> Roche Diagnostics GmbH and Hoffmann-La Roche AG
<120> 重组克氏锥虫JL7抗原变体及其用于检测查加斯病的用途
<130> P32734 WO-IR
<160> 7
<170> PatentIn version 3.5
<210> 1
<211> 226
<212> PRT
<213> 克氏锥虫
<400> 1
Met Glu Gln Glu Arg Arg Gln Leu Leu Glu Lys Asp Pro Arg Arg Asn
1 5 10 15
Ala Arg Glu Ile Ala Ala Leu Glu Glu Ser Met Asn Ala Arg Ala Gln
20 25 30
Glu Leu Ala Arg Glu Lys Lys Leu Ala Asp Arg Ala Phe Leu Asp Gln
35 40 45
Lys Pro Glu Gly Val Pro Leu Arg Glu Leu Pro Leu Asp Asp Asp Ser
50 55 60
Asp Phe Val Ala Met Glu Gln Glu Arg Arg Gln Leu Leu Glu Lys Asp
65 70 75 80
Pro Arg Arg Asn Ala Lys Glu Ile Ala Ala Leu Glu Glu Ser Met Asn
85 90 95
Ala Arg Ala Gln Glu Leu Ala Arg Glu Lys Lys Leu Ala Asp Arg Ala
100 105 110
Phe Leu Asp Gln Lys Pro Glu Gly Val Pro Leu Arg Glu Leu Pro Leu
115 120 125
Asp Asp Asp Ser Asp Phe Val Ser Met Glu Gln Glu Arg Arg Gln Leu
130 135 140
Leu Glu Lys Asp Pro Arg Arg Asn Val Gln Lys Ile Ala Asp Leu Glu
145 150 155 160
Glu Ser Met Asn Ala Arg Ala Gln Glu Leu Ala Arg Glu Lys Lys Leu
165 170 175
Ala Asp Arg Ala Phe Leu Asp Gln Lys Pro Glu Gly Val Ser Leu Arg
180 185 190
Glu Leu Pro Leu Asp Asp Asp Ser Asp Phe Val Ser Met Glu Gln Glu
195 200 205
Arg Arg Gln Leu Leu Glu Lys Asp Pro Arg Lys Asn Val Gln Ile Val
210 215 220
Ala Asp
225
<210> 2
<211> 68
<212> PRT
<213> 克氏锥虫
<400> 2
Met Glu Gln Glu Arg Arg Gln Leu Leu Glu Lys Asp Pro Arg Arg Asn
1 5 10 15
Ala Arg Glu Ile Ala Ala Leu Glu Glu Ser Met Asn Ala Arg Ala Gln
20 25 30
Glu Leu Ala Arg Glu Lys Lys Leu Ala Asp Arg Ala Phe Leu Asp Gln
35 40 45
Lys Pro Glu Gly Val Pro Leu Arg Glu Leu Pro Leu Asp Asp Asp Ser
50 55 60
Asp Phe Val Ala
65
<210> 3
<211> 68
<212> PRT
<213> 克氏锥虫
<400> 3
Met Glu Gln Glu Arg Arg Gln Leu Leu Glu Lys Asp Pro Arg Arg Asn
1 5 10 15
Ala Lys Glu Ile Ala Ala Leu Glu Glu Ser Met Asn Ala Arg Ala Gln
20 25 30
Glu Leu Ala Arg Glu Lys Lys Leu Ala Asp Arg Ala Phe Leu Asp Gln
35 40 45
Lys Pro Glu Gly Val Pro Leu Arg Glu Leu Pro Leu Asp Asp Asp Ser
50 55 60
Asp Phe Val Ser
65
<210> 4
<211> 136
<212> PRT
<213> 克氏锥虫
<400> 4
Met Glu Gln Glu Arg Arg Gln Leu Leu Glu Lys Asp Pro Arg Arg Asn
1 5 10 15
Ala Arg Glu Ile Ala Ala Leu Glu Glu Ser Met Asn Ala Arg Ala Gln
20 25 30
Glu Leu Ala Arg Glu Lys Lys Leu Ala Asp Arg Ala Phe Leu Asp Gln
35 40 45
Lys Pro Glu Gly Val Pro Leu Arg Glu Leu Pro Leu Asp Asp Asp Ser
50 55 60
Asp Phe Val Ala Met Glu Gln Glu Arg Arg Gln Leu Leu Glu Lys Asp
65 70 75 80
Pro Arg Arg Asn Ala Lys Glu Ile Ala Ala Leu Glu Glu Ser Met Asn
85 90 95
Ala Arg Ala Gln Glu Leu Ala Arg Glu Lys Lys Leu Ala Asp Arg Ala
100 105 110
Phe Leu Asp Gln Lys Pro Glu Gly Val Pro Leu Arg Glu Leu Pro Leu
115 120 125
Asp Asp Asp Ser Asp Phe Val Ser
130 135
<210> 5
<211> 90
<212> PRT
<213> 克氏锥虫
<400> 5
Met Glu Gln Glu Arg Arg Gln Leu Leu Glu Lys Asp Pro Arg Arg Asn
1 5 10 15
Val Gln Lys Ile Ala Asp Leu Glu Glu Ser Met Asn Ala Arg Ala Gln
20 25 30
Glu Leu Ala Arg Glu Lys Lys Leu Ala Asp Arg Ala Phe Leu Asp Gln
35 40 45
Lys Pro Glu Gly Val Ser Leu Arg Glu Leu Pro Leu Asp Asp Asp Ser
50 55 60
Asp Phe Val Ser Met Glu Gln Glu Arg Arg Gln Leu Leu Glu Lys Asp
65 70 75 80
Pro Arg Lys Asn Val Gln Ile Val Ala Asp
85 90
<210> 6
<211> 68
<212> PRT
<213> 克氏锥虫
<400> 6
Met Glu Gln Glu Arg Arg Gln Leu Leu Glu Lys Asp Pro Arg Arg Asn
1 5 10 15
Val Gln Lys Ile Ala Asp Leu Glu Glu Ser Met Asn Ala Arg Ala Gln
20 25 30
Glu Leu Ala Arg Glu Lys Lys Leu Ala Asp Arg Ala Phe Leu Asp Gln
35 40 45
Lys Pro Glu Gly Val Ser Leu Arg Glu Leu Pro Leu Asp Asp Asp Ser
50 55 60
Asp Phe Val Ser
65
<210> 7
<211> 15
<212> PRT
<213> 人工序列
<220>
<223> 六组氨酸标签
<400> 7
Gly Gly Gly Ser Gly Gly Gly Leu Glu His His His His His His
1 5 10 15
Claims (9)
1.适用于检测分离的生物样品中的针对克氏锥虫的抗体的多肽,其包含JL7特异性氨基酸序列,其中所述克氏锥虫JL7特异性氨基酸序列由SEQ ID NO. 4组成,并且其中所述多肽中不存在进一步的克氏锥虫特异性氨基酸序列。
2.适用于检测分离的生物样品中的针对克氏锥虫抗原的抗体的多肽的组合物,其包含根据权利要求1所述的多肽和至少一种选自1F8、Cruzipain、KMP-11和PAR-2的克氏锥虫多肽。
3.产生可溶性和免疫反应性克氏锥虫JL7多肽的方法,所述方法包括以下步骤
a)培养用表达载体转化的宿主细胞,所述表达载体包含可操作连接的重组DNA分子,所述重组DNA分子编码根据权利要求1所述的克氏锥虫JL7多肽,
b)表达所述克氏锥虫JL7多肽,和
c)纯化所述克氏锥虫JL7多肽。
4.根据权利要求1所述的克氏锥虫JL7多肽或根据权利要求2所述的克氏锥虫多肽的组合物在制备试剂中的用途,所述试剂用于检测分离的样品中的对于克氏锥虫特异性的抗体,其中根据权利要求1所述的克氏锥虫JL7多肽或根据权利要求2所述的克氏锥虫多肽的组合物用作所述克氏锥虫抗体的捕获试剂和/或结合配偶体。
5.根据权利要求1所述的克氏锥虫JL7多肽或根据权利要求2所述的克氏锥虫多肽的组合物在制备试剂中的用途,所述试剂用于检测分离的样品中的对于克氏锥虫抗原特异性的抗体,所述检测包括
a)通过将体液样品与根据权利要求1所述的克氏锥虫JL7多肽或根据权利要求2所述的组合物混合而形成免疫反应混合物,
b)将所述免疫反应混合物保持足以使体液样品中存在的针对所述多肽样品的组合物的抗体与所述克氏锥虫多肽的组合物免疫反应以形成免疫反应产物的时间段;和
c) 检测所述免疫反应产物中的任一种的存在和/或浓度。
6.根据权利要求5所述的用途,其中以双抗原夹心形式实施所述免疫反应,所述方法包括
a)向所述样品添加可以直接或间接地结合至固相的第一根据权利要求1所述的克氏锥虫JL7多肽和第二根据权利要求1所述的克氏锥虫JL7多肽,所述第一克氏锥虫多肽携带作为生物亲和结合对的一部分的效应基团,且所述第二克氏锥虫JL7多肽携带可检测的标记物,其中所述第一和第二克氏锥虫JL7多肽特异性结合所述抗克氏锥虫抗体,
b)形成包含所述第一克氏锥虫JL7多肽、所述样品抗体和所述第二克氏锥虫JL7多肽的免疫反应混合物,其中在形成所述免疫反应混合物之前、期间或之后添加携带所述生物亲和结合对的相应效应基团的固相,
c)将所述免疫反应混合物保持足以使体液样品中针对所述第一和第二克氏锥虫JL7多肽的克氏锥虫抗体与所述第一和第二克氏锥虫多肽免疫反应以形成免疫反应产物的时间段,
d)将液相与固相分离
e) 检测所述固相或液相或两者中所述免疫反应产物中的任一种的存在。
7.根据权利要求6所述的用途,其中所述第一克氏锥虫JL7多肽携带生物素部分,且所述第二克氏锥虫JL7多肽用电化学发光钌络合物标记。
8.根据权利要求1所述的克氏锥虫JL7多肽或根据权利要求2所述的组合物在制备试剂中的用途,所述试剂用于检测抗克氏锥虫抗体的体外诊断测试。
9.用于检测抗克氏锥虫抗体的试剂盒,其包含根据权利要求1所述的克氏锥虫JL7多肽或根据权利要求2所述的组合物。
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP14192004.1 | 2014-11-06 | ||
| EP14192004.1A EP3018479A1 (en) | 2014-11-06 | 2014-11-06 | Antigen composition for detecting Chagas disease |
| EP15161274.4A EP3072902A1 (en) | 2015-03-27 | 2015-03-27 | Recombinant Trypanosoma cruzi JL7 antigen variants and their use for detecting Chagas disease |
| EP15161274.4 | 2015-03-27 | ||
| PCT/EP2015/075692 WO2016071393A1 (en) | 2014-11-06 | 2015-11-04 | Recombinant trypanosoma cruzi jl7 antigen variants and their use for detecting chagas disease |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN107074921A CN107074921A (zh) | 2017-08-18 |
| CN107074921B true CN107074921B (zh) | 2021-03-16 |
Family
ID=54478742
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201580058514.5A Active CN107074921B (zh) | 2014-11-06 | 2015-11-04 | 重组克氏锥虫jl7抗原变体及其用于检测查加斯病的用途 |
Country Status (7)
| Country | Link |
|---|---|
| US (1) | US10228370B2 (zh) |
| EP (1) | EP3215849B1 (zh) |
| JP (2) | JP7173732B2 (zh) |
| CN (1) | CN107074921B (zh) |
| BR (1) | BR112017007592A2 (zh) |
| MX (1) | MX2017005644A (zh) |
| WO (1) | WO2016071393A1 (zh) |
Families Citing this family (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2023182521A1 (ja) * | 2022-03-25 | 2023-09-28 | 積水メディカル株式会社 | 免疫学的測定用試薬及び免疫学的測定方法 |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2009158729A2 (en) * | 2008-06-27 | 2009-12-30 | The Infectious Disease Research Institute Inc. | Compounds and methods for diagnosis and treatment of chagas disease |
| CN102762588A (zh) * | 2009-11-13 | 2012-10-31 | 波尔多第二大学 | 抗锥虫病的治疗和诊断应用 |
Family Cites Families (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6228372B1 (en) | 1997-04-15 | 2001-05-08 | Corixa Corporation | Compounds and methods for the detection and prevention of T. cruzi infection |
| EP0976763B1 (en) | 1998-07-30 | 2003-11-05 | Innogenetics N.V. | Antigens and immunoassays for diagnosing Chagas' disease |
| PE20050942A1 (es) | 2003-12-04 | 2005-11-10 | Louis V Kirchhoff | Polipeptidos recombinantes para diagnosticar la infeccion con el trypanosoma cruzi |
| EP2182979A4 (en) | 2007-07-30 | 2010-09-08 | Univ Georgia | DIAGNOSTIC TEST OF TRYPANOSOMA CRUZI INFECTION |
| WO2010142829A1 (es) | 2009-06-12 | 2010-12-16 | Consejo Superior De Investigaciones Científicas (Csic) | Método de obtención de datos útiles para el diagnóstico diferencial de la enfermedad de chagas, y para evaluar la respuesta al tratamiento |
-
2015
- 2015-11-04 BR BR112017007592A patent/BR112017007592A2/pt active Search and Examination
- 2015-11-04 MX MX2017005644A patent/MX2017005644A/es active IP Right Grant
- 2015-11-04 JP JP2017523290A patent/JP7173732B2/ja active Active
- 2015-11-04 WO PCT/EP2015/075692 patent/WO2016071393A1/en active Application Filing
- 2015-11-04 CN CN201580058514.5A patent/CN107074921B/zh active Active
- 2015-11-04 EP EP15791571.1A patent/EP3215849B1/en active Active
-
2017
- 2017-05-05 US US15/587,907 patent/US10228370B2/en active Active
-
2021
- 2021-03-16 JP JP2021042064A patent/JP7356467B2/ja active Active
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2009158729A2 (en) * | 2008-06-27 | 2009-12-30 | The Infectious Disease Research Institute Inc. | Compounds and methods for diagnosis and treatment of chagas disease |
| CN102762588A (zh) * | 2009-11-13 | 2012-10-31 | 波尔多第二大学 | 抗锥虫病的治疗和诊断应用 |
Non-Patent Citations (7)
| Title |
|---|
| An improved serodiagnostic test for Chagas’ disease employing a mixture of Trypanosoma cruzi recombinant antigens;Umezawa E S et al;《Transfusion》;20030131;第43卷(第1期);第91页左栏、讨论第2段以及表1 * |
| Ariel A. Valiente-Gabioud et al.Effect of repetitiveness on the immunogenicity and antigenicity of Trypanosoma cruzi FRA protein.《Experimental Parasitology》.2010,第127卷(第3期), * |
| Chagas disease-specific antigens: characterization of epitopes in CRA/FRA by synthetic peptide mapping and evaluation by ELISA-peptide assay;Carolina G Bottino et al;《BMC Infectious Diseases》;20130120;第13卷(第1期);全文 * |
| Comparison of Recombinant Trypanosoma cruzi Peptide Mixtures versus Multiepitope Chimeric Proteins as Sensitizing Antigens for Immunodiagnosis;Cecilia Camussone et al;《Clinical and vaccine immunology》;20090630;第16卷(第6期);全文 * |
| Effect of repetitiveness on the immunogenicity and antigenicity of Trypanosoma cruzi FRA protein;Ariel A. Valiente-Gabioud et al;《Experimental Parasitology》;20101129;第127卷(第3期);第673页左栏第2段,2.材料与方法2.1~2.4,3结果3.4第4段,4.讨论第1段以及图3 * |
| Organization and expression of the gene encoding an immunodominant repetitive antigen associated to the cytoskeleton of Trypanosoma cruzi;Paulo C.Cotrim et al;《Molecular and Biochemical Parasitology》;19950430;第71卷(第1期);全文 * |
| The Repetitive Cytoskeletal Protein H49 of Trypanosoma cruzi Is a Calpain-Like Protein Located at the Flagellum Attachment Zone;Alexandra Galetovic et al;《PLOS ONE》;20111111;第6卷(第11期);全文 * |
Also Published As
| Publication number | Publication date |
|---|---|
| EP3215849A1 (en) | 2017-09-13 |
| JP2017533913A (ja) | 2017-11-16 |
| JP7356467B2 (ja) | 2023-10-04 |
| EP3215849B1 (en) | 2018-12-19 |
| JP2021098746A (ja) | 2021-07-01 |
| JP7173732B2 (ja) | 2022-11-16 |
| MX2017005644A (es) | 2017-06-29 |
| US10228370B2 (en) | 2019-03-12 |
| WO2016071393A1 (en) | 2016-05-12 |
| BR112017007592A2 (pt) | 2018-02-27 |
| CN107074921A (zh) | 2017-08-18 |
| US20170248598A1 (en) | 2017-08-31 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JPH01500053A (ja) | Htlv−3に対する抗体の検出法 | |
| US9316642B2 (en) | Soluble immunoreactive treponema pallidum TpN47 antigens | |
| US10094828B2 (en) | Antigen composition for detecting Chagas disease | |
| JP7356467B2 (ja) | 遺伝子組み換えトリパノソーマ・クルージjl7抗原変異型およびシャーガス病を検出するためのその使用 | |
| JP2005139204A (ja) | Hivウイルスに対して免疫反応性である抗体の検出用の合成抗原 | |
| JP6491228B2 (ja) | HTLVキャプシド抗原p24の可溶性かつ免疫反応性バリアント | |
| US20050244814A1 (en) | Detection of west nile virus | |
| JP6374720B2 (ja) | 抗トレポネーマ属(Treponema)抗体の検出のためのTpN17に基づくイムノアッセイにおける、抗干渉添加剤としてのコレラ菌(Vibriocholerae)リポタンパク質15(Lp15)変異体 | |
| EP3072902A1 (en) | Recombinant Trypanosoma cruzi JL7 antigen variants and their use for detecting Chagas disease | |
| EP1664786B1 (en) | Detection of west nile virus infection and vaccination | |
| BR122024013996A2 (pt) | Composição de polipeptídeos, métodos de produção de polipeptídeo jl7 e de detecção de anticorpos, uso de uma composição de polipeptídeos e kit de reagentes | |
| US20220196672A1 (en) | Rocky Mountain Spotted Fever Detection and Treatment | |
| Mathioudaki | Study of antigenic proteins of the intracellular pathogen Coxiella burnetii, the etiological agent of Q fever | |
| BR122024013968A2 (pt) | Composição de polipeptídeos, método para produzir uma composição, métodos para detectar anticorpos, uso de uma composição e kit | |
| CN112180096A (zh) | 用于诊断线虫感染的新测定法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PB01 | Publication | ||
| PB01 | Publication | ||
| SE01 | Entry into force of request for substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| REG | Reference to a national code |
Ref country code: HK Ref legal event code: DE Ref document number: 1236542 Country of ref document: HK |
|
| GR01 | Patent grant | ||
| GR01 | Patent grant |