CN106008552B - 苯并[e]吡唑并[1,5-c][1,3]噁嗪类化合物及其应用 - Google Patents
苯并[e]吡唑并[1,5-c][1,3]噁嗪类化合物及其应用 Download PDFInfo
- Publication number
- CN106008552B CN106008552B CN201510092377.9A CN201510092377A CN106008552B CN 106008552 B CN106008552 B CN 106008552B CN 201510092377 A CN201510092377 A CN 201510092377A CN 106008552 B CN106008552 B CN 106008552B
- Authority
- CN
- China
- Prior art keywords
- alkyl
- azaspiro
- radical
- octane
- nonane
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- -1 pyrazolo [1,5-c ] [1,3] oxazine compound Chemical class 0.000 title claims abstract description 445
- 125000005605 benzo group Chemical group 0.000 title abstract description 32
- 150000001875 compounds Chemical class 0.000 claims abstract description 228
- 241000711549 Hepacivirus C Species 0.000 claims abstract description 47
- 150000003839 salts Chemical class 0.000 claims abstract description 43
- 239000008194 pharmaceutical composition Substances 0.000 claims abstract description 16
- 239000003814 drug Substances 0.000 claims abstract description 8
- 201000010099 disease Diseases 0.000 claims abstract description 6
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims abstract description 6
- 150000003254 radicals Chemical class 0.000 claims description 129
- TVMXDCGIABBOFY-UHFFFAOYSA-N octane Chemical compound CCCCCCCC TVMXDCGIABBOFY-UHFFFAOYSA-N 0.000 claims description 109
- DIOQZVSQGTUSAI-UHFFFAOYSA-N decane Chemical compound CCCCCCCCCC DIOQZVSQGTUSAI-UHFFFAOYSA-N 0.000 claims description 108
- ZCYXXKJEDCHMGH-UHFFFAOYSA-N nonane Chemical compound CCCC[CH]CCCC ZCYXXKJEDCHMGH-UHFFFAOYSA-N 0.000 claims description 101
- BKIMMITUMNQMOS-UHFFFAOYSA-N normal nonane Natural products CCCCCCCCC BKIMMITUMNQMOS-UHFFFAOYSA-N 0.000 claims description 101
- IMNFDUFMRHMDMM-UHFFFAOYSA-N N-Heptane Chemical compound CCCCCCC IMNFDUFMRHMDMM-UHFFFAOYSA-N 0.000 claims description 90
- 125000003003 spiro group Chemical group 0.000 claims description 74
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 claims description 64
- 229910052736 halogen Inorganic materials 0.000 claims description 57
- 125000004093 cyano group Chemical group *C#N 0.000 claims description 56
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 54
- 125000000217 alkyl group Chemical group 0.000 claims description 53
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims description 51
- 150000002367 halogens Chemical class 0.000 claims description 42
- 125000005843 halogen group Chemical group 0.000 claims description 40
- 125000002887 hydroxy group Chemical group [H]O* 0.000 claims description 39
- 239000001257 hydrogen Substances 0.000 claims description 38
- 229910052739 hydrogen Inorganic materials 0.000 claims description 38
- 125000001624 naphthyl group Chemical group 0.000 claims description 29
- 125000000266 alpha-aminoacyl group Chemical group 0.000 claims description 27
- 125000004432 carbon atom Chemical group C* 0.000 claims description 27
- 125000002971 oxazolyl group Chemical group 0.000 claims description 26
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 claims description 25
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 claims description 25
- 125000000168 pyrrolyl group Chemical group 0.000 claims description 25
- 125000000335 thiazolyl group Chemical group 0.000 claims description 25
- 125000001544 thienyl group Chemical group 0.000 claims description 25
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 claims description 24
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 claims description 24
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 claims description 24
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 claims description 24
- 125000002252 acyl group Chemical group 0.000 claims description 23
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 claims description 23
- 125000001995 cyclobutyl group Chemical group [H]C1([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 claims description 21
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 claims description 21
- 125000002704 decyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 claims description 20
- 125000002883 imidazolyl group Chemical group 0.000 claims description 20
- 125000002541 furyl group Chemical group 0.000 claims description 19
- 125000004076 pyridyl group Chemical group 0.000 claims description 19
- 238000006467 substitution reaction Methods 0.000 claims description 19
- 125000004423 acyloxy group Chemical group 0.000 claims description 18
- 125000001786 isothiazolyl group Chemical group 0.000 claims description 18
- 125000001715 oxadiazolyl group Chemical group 0.000 claims description 18
- 125000003226 pyrazolyl group Chemical group 0.000 claims description 18
- 125000001425 triazolyl group Chemical group 0.000 claims description 18
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 claims description 17
- 125000000842 isoxazolyl group Chemical group 0.000 claims description 17
- 125000004193 piperazinyl group Chemical group 0.000 claims description 16
- 125000003386 piperidinyl group Chemical group 0.000 claims description 16
- 125000002914 sec-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 claims description 16
- 125000002785 azepinyl group Chemical group 0.000 claims description 15
- 125000003718 tetrahydrofuranyl group Chemical group 0.000 claims description 15
- 125000003554 tetrahydropyrrolyl group Chemical group 0.000 claims description 14
- 125000004890 (C1-C6) alkylamino group Chemical group 0.000 claims description 13
- 125000004442 acylamino group Chemical group 0.000 claims description 13
- 125000002393 azetidinyl group Chemical group 0.000 claims description 13
- 125000004069 aziridinyl group Chemical group 0.000 claims description 13
- 125000001188 haloalkyl group Chemical group 0.000 claims description 13
- 125000004043 oxo group Chemical group O=* 0.000 claims description 13
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 claims description 12
- 125000003373 pyrazinyl group Chemical group 0.000 claims description 12
- 125000005958 tetrahydrothienyl group Chemical group 0.000 claims description 12
- 125000006620 amino-(C1-C6) alkyl group Chemical group 0.000 claims description 11
- 125000000582 cycloheptyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 claims description 11
- 125000000714 pyrimidinyl group Chemical group 0.000 claims description 11
- 125000003566 oxetanyl group Chemical group 0.000 claims description 10
- STTPKYFNZHZQBY-UHFFFAOYSA-N 1,2-diazaspiro[2.4]heptane Chemical compound C1CCCC21NN2 STTPKYFNZHZQBY-UHFFFAOYSA-N 0.000 claims description 9
- 125000002347 octyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 claims description 8
- 125000006559 (C1-C3) alkylamino group Chemical group 0.000 claims description 7
- 125000005913 (C3-C6) cycloalkyl group Chemical group 0.000 claims description 7
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 claims description 7
- LVZWSLJZHVFIQJ-UHFFFAOYSA-N Cyclopropane Chemical compound C1CC1 LVZWSLJZHVFIQJ-UHFFFAOYSA-N 0.000 claims description 6
- PMPVIKIVABFJJI-UHFFFAOYSA-N Cyclobutane Chemical compound C1CCC1 PMPVIKIVABFJJI-UHFFFAOYSA-N 0.000 claims description 5
- 239000003937 drug carrier Substances 0.000 claims description 5
- 125000002960 margaryl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 claims description 5
- 125000003725 azepanyl group Chemical group 0.000 claims description 3
- 238000011282 treatment Methods 0.000 claims description 3
- QRDSDKAGXMWBID-UHFFFAOYSA-N 5-azabicyclo[3.1.0]hexane Chemical compound C1CCN2CC21 QRDSDKAGXMWBID-UHFFFAOYSA-N 0.000 claims description 2
- RGSFGYAAUTVSQA-UHFFFAOYSA-N Cyclopentane Chemical compound C1CCCC1 RGSFGYAAUTVSQA-UHFFFAOYSA-N 0.000 claims 6
- 125000004435 hydrogen atom Chemical class [H]* 0.000 claims 5
- XDTMQSROBMDMFD-UHFFFAOYSA-N Cyclohexane Chemical compound C1CCCCC1 XDTMQSROBMDMFD-UHFFFAOYSA-N 0.000 claims 3
- DMEGYFMYUHOHGS-UHFFFAOYSA-N heptamethylene Natural products C1CCCCCC1 DMEGYFMYUHOHGS-UHFFFAOYSA-N 0.000 claims 3
- 238000004519 manufacturing process Methods 0.000 claims 1
- 238000011321 prophylaxis Methods 0.000 claims 1
- 239000012453 solvate Substances 0.000 abstract description 36
- 239000000651 prodrug Substances 0.000 abstract description 35
- 229940002612 prodrug Drugs 0.000 abstract description 35
- 239000013078 crystal Substances 0.000 abstract description 33
- 239000000203 mixture Substances 0.000 abstract description 16
- 208000015181 infectious disease Diseases 0.000 abstract description 12
- 230000002401 inhibitory effect Effects 0.000 abstract description 4
- 231100000053 low toxicity Toxicity 0.000 abstract description 3
- 239000000825 pharmaceutical preparation Substances 0.000 abstract description 2
- 238000002360 preparation method Methods 0.000 description 73
- 238000006243 chemical reaction Methods 0.000 description 57
- 125000001072 heteroaryl group Chemical group 0.000 description 55
- 238000000034 method Methods 0.000 description 53
- 125000003118 aryl group Chemical group 0.000 description 50
- KAESVJOAVNADME-UHFFFAOYSA-N Pyrrole Chemical compound C=1C=CNC=1 KAESVJOAVNADME-UHFFFAOYSA-N 0.000 description 46
- 125000000592 heterocycloalkyl group Chemical group 0.000 description 41
- 125000000753 cycloalkyl group Chemical group 0.000 description 37
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 34
- KXDHJXZQYSOELW-UHFFFAOYSA-M Carbamate Chemical compound NC([O-])=O KXDHJXZQYSOELW-UHFFFAOYSA-M 0.000 description 31
- IAZDPXIOMUYVGZ-WFGJKAKNSA-N Dimethyl sulfoxide Chemical compound [2H]C([2H])([2H])S(=O)C([2H])([2H])[2H] IAZDPXIOMUYVGZ-WFGJKAKNSA-N 0.000 description 25
- 125000001462 1-pyrrolyl group Chemical group [*]N1C([H])=C([H])C([H])=C1[H] 0.000 description 24
- 125000000389 2-pyrrolyl group Chemical group [H]N1C([*])=C([H])C([H])=C1[H] 0.000 description 24
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 24
- 125000003545 alkoxy group Chemical group 0.000 description 24
- 150000002431 hydrogen Chemical class 0.000 description 24
- 238000005160 1H NMR spectroscopy Methods 0.000 description 21
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 21
- 239000000243 solution Substances 0.000 description 17
- HCFOZKOZUAUJDJ-UHFFFAOYSA-N 7H-pyrazolo[1,5-c][1,3]oxazine Chemical group C1OC=CC2=CC=NN12 HCFOZKOZUAUJDJ-UHFFFAOYSA-N 0.000 description 16
- PAYRUJLWNCNPSJ-UHFFFAOYSA-N Aniline Chemical compound NC1=CC=CC=C1 PAYRUJLWNCNPSJ-UHFFFAOYSA-N 0.000 description 16
- 125000004181 carboxyalkyl group Chemical group 0.000 description 16
- 125000004663 dialkyl amino group Chemical group 0.000 description 15
- 125000002768 hydroxyalkyl group Chemical group 0.000 description 15
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 14
- 238000001914 filtration Methods 0.000 description 14
- 125000004429 atom Chemical group 0.000 description 13
- 239000000543 intermediate Substances 0.000 description 13
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 12
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 12
- 125000005251 aryl acyl group Chemical group 0.000 description 11
- 125000002619 bicyclic group Chemical group 0.000 description 11
- 238000004440 column chromatography Methods 0.000 description 11
- 125000005253 heteroarylacyl group Chemical group 0.000 description 11
- 238000005303 weighing Methods 0.000 description 11
- 125000006306 4-iodophenyl group Chemical group [H]C1=C([H])C(*)=C([H])C([H])=C1I 0.000 description 10
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 10
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 10
- 229910052799 carbon Inorganic materials 0.000 description 10
- 238000001035 drying Methods 0.000 description 10
- 230000000694 effects Effects 0.000 description 10
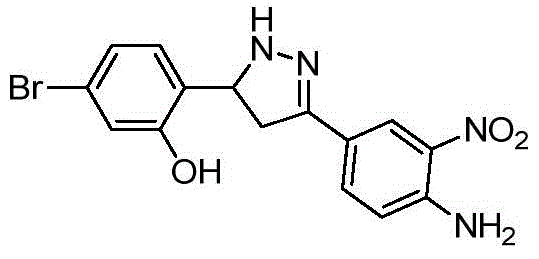
- XZGXMRWLZDHVPO-UHFFFAOYSA-N 2-[3-(4-amino-3-nitrophenyl)-4,5-dihydro-1H-pyrazol-5-yl]-5-bromophenol Chemical compound NC1=C(C=C(C=C1)C1=NNC(C1)C1=C(C=C(C=C1)Br)O)[N+](=O)[O-] XZGXMRWLZDHVPO-UHFFFAOYSA-N 0.000 description 9
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 9
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 9
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 9
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 9
- 125000002723 alicyclic group Chemical group 0.000 description 9
- 125000005842 heteroatom Chemical group 0.000 description 9
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 8
- 125000005256 alkoxyacyl group Chemical group 0.000 description 8
- 125000003037 imidazol-2-yl group Chemical group [H]N1C([*])=NC([H])=C1[H] 0.000 description 8
- 229910052757 nitrogen Inorganic materials 0.000 description 8
- 239000007858 starting material Substances 0.000 description 8
- 108010050904 Interferons Proteins 0.000 description 7
- 102000014150 Interferons Human genes 0.000 description 7
- 229940079322 interferon Drugs 0.000 description 7
- 239000012074 organic phase Substances 0.000 description 7
- 239000004474 valine Substances 0.000 description 7
- 125000006552 (C3-C8) cycloalkyl group Chemical group 0.000 description 6
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 6
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 6
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 6
- 239000012044 organic layer Substances 0.000 description 6
- 108090000623 proteins and genes Proteins 0.000 description 6
- VUEWYZJJYGPJDC-UHFFFAOYSA-N 1-oxaspiro[2.5]octane Chemical compound C1OC11CCCCC1 VUEWYZJJYGPJDC-UHFFFAOYSA-N 0.000 description 5
- 239000006144 Dulbecco’s modified Eagle's medium Substances 0.000 description 5
- JGFZNNIVVJXRND-UHFFFAOYSA-N N,N-Diisopropylethylamine (DIPEA) Chemical compound CCN(C(C)C)C(C)C JGFZNNIVVJXRND-UHFFFAOYSA-N 0.000 description 5
- 125000003785 benzimidazolyl group Chemical group N1=C(NC2=C1C=CC=C2)* 0.000 description 5
- 238000001514 detection method Methods 0.000 description 5
- 125000004857 imidazopyridinyl group Chemical group N1C(=NC2=C1C=CC=N2)* 0.000 description 5
- 208000019423 liver disease Diseases 0.000 description 5
- 239000002609 medium Substances 0.000 description 5
- 239000000546 pharmaceutical excipient Substances 0.000 description 5
- 102000004169 proteins and genes Human genes 0.000 description 5
- 239000002904 solvent Substances 0.000 description 5
- PHICBFWUYUCFKS-UHFFFAOYSA-N spiro[4.4]nonane Chemical compound C1CCCC21CCCC2 PHICBFWUYUCFKS-UHFFFAOYSA-N 0.000 description 5
- GAZHEEFWONCMGH-QMMMGPOBSA-N tert-butyl (2s)-2-(5-bromo-1h-imidazol-2-yl)pyrrolidine-1-carboxylate Chemical compound CC(C)(C)OC(=O)N1CCC[C@H]1C1=NC=C(Br)N1 GAZHEEFWONCMGH-QMMMGPOBSA-N 0.000 description 5
- 238000012360 testing method Methods 0.000 description 5
- YMANQWHUUFJQOW-UHFFFAOYSA-N 1,2-diazaspiro[4.5]decane Chemical compound N1NCCC11CCCCC1 YMANQWHUUFJQOW-UHFFFAOYSA-N 0.000 description 4
- GEYOCULIXLDCMW-UHFFFAOYSA-N 1,2-phenylenediamine Chemical compound NC1=CC=CC=C1N GEYOCULIXLDCMW-UHFFFAOYSA-N 0.000 description 4
- 101710144111 Non-structural protein 3 Proteins 0.000 description 4
- IWUCXVSUMQZMFG-AFCXAGJDSA-N Ribavirin Chemical compound N1=C(C(=O)N)N=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 IWUCXVSUMQZMFG-AFCXAGJDSA-N 0.000 description 4
- 125000004183 alkoxy alkyl group Chemical group 0.000 description 4
- 125000004103 aminoalkyl group Chemical group 0.000 description 4
- 125000003710 aryl alkyl group Chemical group 0.000 description 4
- AXMNGEUJXLXFRY-UHFFFAOYSA-N azaspirodecane Chemical compound C1CCCC21CCNCC2 AXMNGEUJXLXFRY-UHFFFAOYSA-N 0.000 description 4
- HUMNYLRZRPPJDN-UHFFFAOYSA-N benzaldehyde Chemical compound O=CC1=CC=CC=C1 HUMNYLRZRPPJDN-UHFFFAOYSA-N 0.000 description 4
- 239000003153 chemical reaction reagent Substances 0.000 description 4
- 239000000460 chlorine Substances 0.000 description 4
- 125000004966 cyanoalkyl group Chemical group 0.000 description 4
- 125000005879 dioxolanyl group Chemical group 0.000 description 4
- 229940079593 drug Drugs 0.000 description 4
- 235000019441 ethanol Nutrition 0.000 description 4
- 238000002474 experimental method Methods 0.000 description 4
- 238000000605 extraction Methods 0.000 description 4
- 125000004446 heteroarylalkyl group Chemical group 0.000 description 4
- 230000005764 inhibitory process Effects 0.000 description 4
- GTCAXTIRRLKXRU-UHFFFAOYSA-N methyl carbamate Chemical compound COC(N)=O GTCAXTIRRLKXRU-UHFFFAOYSA-N 0.000 description 4
- 125000002757 morpholinyl group Chemical group 0.000 description 4
- 125000004971 nitroalkyl group Chemical group 0.000 description 4
- 125000000160 oxazolidinyl group Chemical group 0.000 description 4
- KDLHZDBZIXYQEI-UHFFFAOYSA-N palladium Substances [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 4
- 125000002294 quinazolinyl group Chemical group N1=C(N=CC2=CC=CC=C12)* 0.000 description 4
- 239000011541 reaction mixture Substances 0.000 description 4
- 238000010992 reflux Methods 0.000 description 4
- 229960000329 ribavirin Drugs 0.000 description 4
- HZCAHMRRMINHDJ-DBRKOABJSA-N ribavirin Natural products O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1N=CN=C1 HZCAHMRRMINHDJ-DBRKOABJSA-N 0.000 description 4
- LBJQKYPPYSCCBH-UHFFFAOYSA-N spiro[3.3]heptane Chemical compound C1CCC21CCC2 LBJQKYPPYSCCBH-UHFFFAOYSA-N 0.000 description 4
- CTDQAGUNKPRERK-UHFFFAOYSA-N spirodecane Chemical compound C1CCCC21CCCCC2 CTDQAGUNKPRERK-UHFFFAOYSA-N 0.000 description 4
- 238000003756 stirring Methods 0.000 description 4
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 3
- WFDIJRYMOXRFFG-UHFFFAOYSA-N Acetic anhydride Chemical compound CC(=O)OC(C)=O WFDIJRYMOXRFFG-UHFFFAOYSA-N 0.000 description 3
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 3
- 108700026244 Open Reading Frames Proteins 0.000 description 3
- OFOBLEOULBTSOW-UHFFFAOYSA-N Propanedioic acid Natural products OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 3
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 3
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical class [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 3
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 3
- 238000001816 cooling Methods 0.000 description 3
- 239000003085 diluting agent Substances 0.000 description 3
- 238000009472 formulation Methods 0.000 description 3
- 150000002430 hydrocarbons Chemical group 0.000 description 3
- 239000005457 ice water Substances 0.000 description 3
- 125000004433 nitrogen atom Chemical group N* 0.000 description 3
- 229910052760 oxygen Inorganic materials 0.000 description 3
- 125000004430 oxygen atom Chemical group O* 0.000 description 3
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 3
- 239000000047 product Substances 0.000 description 3
- 229930195734 saturated hydrocarbon Natural products 0.000 description 3
- 239000007787 solid Substances 0.000 description 3
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 3
- DTQVDTLACAAQTR-UHFFFAOYSA-N trifluoroacetic acid Substances OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 3
- 238000005406 washing Methods 0.000 description 3
- NWZSZGALRFJKBT-KNIFDHDWSA-N (2s)-2,6-diaminohexanoic acid;(2s)-2-hydroxybutanedioic acid Chemical compound OC(=O)[C@@H](O)CC(O)=O.NCCCC[C@H](N)C(O)=O NWZSZGALRFJKBT-KNIFDHDWSA-N 0.000 description 2
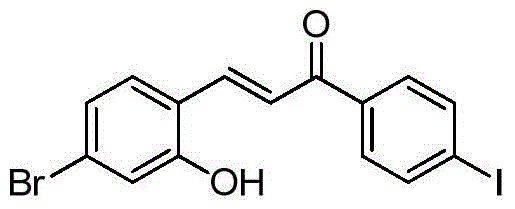
- XFORSOMGYODCKN-XBXARRHUSA-N (E)-3-(4-bromo-2-hydroxyphenyl)-1-(4-iodophenyl)prop-2-en-1-one Chemical compound BrC1=CC(=C(C=C1)/C=C/C(=O)C1=CC=C(C=C1)I)O XFORSOMGYODCKN-XBXARRHUSA-N 0.000 description 2
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 2
- KZPYGQFFRCFCPP-UHFFFAOYSA-N 1,1'-bis(diphenylphosphino)ferrocene Chemical compound [Fe+2].C1=CC=C[C-]1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=C[C-]1P(C=1C=CC=CC=1)C1=CC=CC=C1 KZPYGQFFRCFCPP-UHFFFAOYSA-N 0.000 description 2
- LMDZBCPBFSXMTL-UHFFFAOYSA-N 1-Ethyl-3-(3-dimethylaminopropyl)carbodiimide Substances CCN=C=NCCCN(C)C LMDZBCPBFSXMTL-UHFFFAOYSA-N 0.000 description 2
- HUUPVABNAQUEJW-UHFFFAOYSA-N 1-methylpiperidin-4-one Chemical compound CN1CCC(=O)CC1 HUUPVABNAQUEJW-UHFFFAOYSA-N 0.000 description 2
- VPGLFNOKHAIGEC-UHFFFAOYSA-N 1-phenylpiperidin-4-one Chemical compound C1CC(=O)CCN1C1=CC=CC=C1 VPGLFNOKHAIGEC-UHFFFAOYSA-N 0.000 description 2
- NKPMJJGLSFUOPK-UHFFFAOYSA-N 1-tert-butylpiperidin-4-one Chemical compound CC(C)(C)N1CCC(=O)CC1 NKPMJJGLSFUOPK-UHFFFAOYSA-N 0.000 description 2
- FPQQSJJWHUJYPU-UHFFFAOYSA-N 3-(dimethylamino)propyliminomethylidene-ethylazanium;chloride Chemical compound Cl.CCN=C=NCCCN(C)C FPQQSJJWHUJYPU-UHFFFAOYSA-N 0.000 description 2
- HXTWKHXDFATMSP-UHFFFAOYSA-N 4-bromo-2-hydroxybenzaldehyde Chemical compound OC1=CC(Br)=CC=C1C=O HXTWKHXDFATMSP-UHFFFAOYSA-N 0.000 description 2
- OTXINXDGSUFPNU-UHFFFAOYSA-N 4-tert-butylbenzaldehyde Chemical compound CC(C)(C)C1=CC=C(C=O)C=C1 OTXINXDGSUFPNU-UHFFFAOYSA-N 0.000 description 2
- KYKBJSWUULGMBH-YFKPBYRVSA-N 5-bromo-2-[(2s)-pyrrolidin-2-yl]-1h-imidazole Chemical compound N1C(Br)=CN=C1[C@H]1NCCC1 KYKBJSWUULGMBH-YFKPBYRVSA-N 0.000 description 2
- DKHHEOMXZXYDSB-UHFFFAOYSA-N 5-bromo-2-[3-(4-iodophenyl)-4,5-dihydro-1H-pyrazol-5-yl]phenol Chemical compound BrC=1C=CC(=C(C1)O)C1CC(=NN1)C1=CC=C(C=C1)I DKHHEOMXZXYDSB-UHFFFAOYSA-N 0.000 description 2
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 2
- XJLDYKIEURAVBW-UHFFFAOYSA-N Aethyl-heptyl-keton Natural products CCCCCCCC(=O)CC XJLDYKIEURAVBW-UHFFFAOYSA-N 0.000 description 2
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 2
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 2
- VTYYLEPIZMXCLO-UHFFFAOYSA-L Calcium carbonate Chemical compound [Ca+2].[O-]C([O-])=O VTYYLEPIZMXCLO-UHFFFAOYSA-L 0.000 description 2
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 2
- 102000004190 Enzymes Human genes 0.000 description 2
- 108090000790 Enzymes Proteins 0.000 description 2
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 2
- 108010010803 Gelatin Proteins 0.000 description 2
- 208000005176 Hepatitis C Diseases 0.000 description 2
- 101000600434 Homo sapiens Putative uncharacterized protein encoded by MIR7-3HG Proteins 0.000 description 2
- 108010047761 Interferon-alpha Proteins 0.000 description 2
- 102000006992 Interferon-alpha Human genes 0.000 description 2
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 2
- GRYLNZFGIOXLOG-UHFFFAOYSA-N Nitric acid Chemical compound O[N+]([O-])=O GRYLNZFGIOXLOG-UHFFFAOYSA-N 0.000 description 2
- 101800001019 Non-structural protein 4B Proteins 0.000 description 2
- 101800001014 Non-structural protein 5A Proteins 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 2
- 108010076039 Polyproteins Proteins 0.000 description 2
- 102100037401 Putative uncharacterized protein encoded by MIR7-3HG Human genes 0.000 description 2
- 108010022999 Serine Proteases Proteins 0.000 description 2
- 102000012479 Serine Proteases Human genes 0.000 description 2
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical class [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 2
- 229920002472 Starch Polymers 0.000 description 2
- 101710172711 Structural protein Proteins 0.000 description 2
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 2
- 125000005257 alkyl acyl group Chemical group 0.000 description 2
- 239000007864 aqueous solution Substances 0.000 description 2
- 238000003556 assay Methods 0.000 description 2
- 230000004071 biological effect Effects 0.000 description 2
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 2
- 229910052794 bromium Inorganic materials 0.000 description 2
- 239000000969 carrier Substances 0.000 description 2
- 230000010261 cell growth Effects 0.000 description 2
- 230000003833 cell viability Effects 0.000 description 2
- 239000001913 cellulose Substances 0.000 description 2
- 229920002678 cellulose Polymers 0.000 description 2
- XMPZTFVPEKAKFH-UHFFFAOYSA-P ceric ammonium nitrate Chemical compound [NH4+].[NH4+].[Ce+4].[O-][N+]([O-])=O.[O-][N+]([O-])=O.[O-][N+]([O-])=O.[O-][N+]([O-])=O.[O-][N+]([O-])=O.[O-][N+]([O-])=O XMPZTFVPEKAKFH-UHFFFAOYSA-P 0.000 description 2
- 229910052801 chlorine Inorganic materials 0.000 description 2
- 238000005859 coupling reaction Methods 0.000 description 2
- 238000012258 culturing Methods 0.000 description 2
- 125000001316 cycloalkyl alkyl group Chemical group 0.000 description 2
- JHIVVAPYMSGYDF-UHFFFAOYSA-N cyclohexanone Chemical compound O=C1CCCCC1 JHIVVAPYMSGYDF-UHFFFAOYSA-N 0.000 description 2
- 125000004985 dialkyl amino alkyl group Chemical group 0.000 description 2
- 125000005959 diazepanyl group Chemical group 0.000 description 2
- ZUOUZKKEUPVFJK-UHFFFAOYSA-N diphenyl Chemical compound C1=CC=CC=C1C1=CC=CC=C1 ZUOUZKKEUPVFJK-UHFFFAOYSA-N 0.000 description 2
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 2
- 238000004090 dissolution Methods 0.000 description 2
- 229940088598 enzyme Drugs 0.000 description 2
- 125000006232 ethoxy propyl group Chemical group [H]C([H])([H])C([H])([H])OC([H])([H])C([H])([H])C([H])([H])* 0.000 description 2
- 125000005448 ethoxyethyl group Chemical group [H]C([H])([H])C([H])([H])OC([H])([H])C([H])([H])* 0.000 description 2
- 125000005745 ethoxymethyl group Chemical group [H]C([H])([H])C([H])([H])OC([H])([H])* 0.000 description 2
- 239000012091 fetal bovine serum Substances 0.000 description 2
- 239000000706 filtrate Substances 0.000 description 2
- 125000001153 fluoro group Chemical group F* 0.000 description 2
- 210000004211 gastric acid Anatomy 0.000 description 2
- 229920000159 gelatin Polymers 0.000 description 2
- 239000008273 gelatin Substances 0.000 description 2
- 235000019322 gelatine Nutrition 0.000 description 2
- 235000011852 gelatine desserts Nutrition 0.000 description 2
- LEQAOMBKQFMDFZ-UHFFFAOYSA-N glyoxal Chemical compound O=CC=O LEQAOMBKQFMDFZ-UHFFFAOYSA-N 0.000 description 2
- 208000006454 hepatitis Diseases 0.000 description 2
- 208000010710 hepatitis C virus infection Diseases 0.000 description 2
- 206010073071 hepatocellular carcinoma Diseases 0.000 description 2
- 125000005885 heterocycloalkylalkyl group Chemical group 0.000 description 2
- IKDUDTNKRLTJSI-UHFFFAOYSA-N hydrazine monohydrate Substances O.NN IKDUDTNKRLTJSI-UHFFFAOYSA-N 0.000 description 2
- 238000006460 hydrolysis reaction Methods 0.000 description 2
- NPZTUJOABDZTLV-UHFFFAOYSA-N hydroxybenzotriazole Substances O=C1C=CC=C2NNN=C12 NPZTUJOABDZTLV-UHFFFAOYSA-N 0.000 description 2
- 239000011630 iodine Substances 0.000 description 2
- 229910052740 iodine Inorganic materials 0.000 description 2
- JVTAAEKCZFNVCJ-UHFFFAOYSA-N lactic acid Chemical compound CC(O)C(O)=O JVTAAEKCZFNVCJ-UHFFFAOYSA-N 0.000 description 2
- 239000010410 layer Substances 0.000 description 2
- 239000000463 material Substances 0.000 description 2
- OKKJLVBELUTLKV-VMNATFBRSA-N methanol-d1 Chemical compound [2H]OC OKKJLVBELUTLKV-VMNATFBRSA-N 0.000 description 2
- MPGRFFRFKUIBDJ-LURJTMIESA-N methyl (8s)-1,4-dioxa-7-azaspiro[4.4]nonane-8-carboxylate Chemical compound C1N[C@H](C(=O)OC)CC21OCCO2 MPGRFFRFKUIBDJ-LURJTMIESA-N 0.000 description 2
- YDZXFMFWUBEUSQ-QWRGUYRKSA-N methyl (8s)-7-[(2s)-2-(methoxycarbonylamino)-3-methylbutanoyl]-1,4-dioxa-7-azaspiro[4.4]nonane-8-carboxylate Chemical compound C1[C@@H](C(=O)OC)N(C(=O)[C@H](C(C)C)NC(=O)OC)CC21OCCO2 YDZXFMFWUBEUSQ-QWRGUYRKSA-N 0.000 description 2
- 239000011259 mixed solution Substances 0.000 description 2
- 125000002950 monocyclic group Chemical group 0.000 description 2
- AQEFIRMOFYNFKT-UHFFFAOYSA-N n-(4-acetyl-2-nitrophenyl)acetamide Chemical compound CC(=O)NC1=CC=C(C(C)=O)C=C1[N+]([O-])=O AQEFIRMOFYNFKT-UHFFFAOYSA-N 0.000 description 2
- WECHHDJTILFYQT-UHFFFAOYSA-N n-(4-acetylphenyl)acetamide Chemical compound CC(=O)NC1=CC=C(C(C)=O)C=C1 WECHHDJTILFYQT-UHFFFAOYSA-N 0.000 description 2
- 239000002547 new drug Substances 0.000 description 2
- CTSLXHKWHWQRSH-UHFFFAOYSA-N oxalyl chloride Chemical compound ClC(=O)C(Cl)=O CTSLXHKWHWQRSH-UHFFFAOYSA-N 0.000 description 2
- 125000003551 oxepanyl group Chemical group 0.000 description 2
- QNGNSVIICDLXHT-UHFFFAOYSA-N para-ethylbenzaldehyde Natural products CCC1=CC=C(C=O)C=C1 QNGNSVIICDLXHT-UHFFFAOYSA-N 0.000 description 2
- 239000002953 phosphate buffered saline Substances 0.000 description 2
- 229920001223 polyethylene glycol Polymers 0.000 description 2
- SCVFZCLFOSHCOH-UHFFFAOYSA-M potassium acetate Chemical compound [K+].CC([O-])=O SCVFZCLFOSHCOH-UHFFFAOYSA-M 0.000 description 2
- 238000012545 processing Methods 0.000 description 2
- 238000006722 reduction reaction Methods 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- GEHJYWRUCIMESM-UHFFFAOYSA-L sodium sulfite Chemical compound [Na+].[Na+].[O-]S([O-])=O GEHJYWRUCIMESM-UHFFFAOYSA-L 0.000 description 2
- 235000019698 starch Nutrition 0.000 description 2
- 125000000547 substituted alkyl group Chemical group 0.000 description 2
- 235000000346 sugar Nutrition 0.000 description 2
- 150000008163 sugars Chemical class 0.000 description 2
- 229910052717 sulfur Inorganic materials 0.000 description 2
- GHITWFDHFOLATC-VIFPVBQESA-N tert-butyl (2s)-2-(1h-imidazol-2-yl)pyrrolidine-1-carboxylate Chemical compound CC(C)(C)OC(=O)N1CCC[C@H]1C1=NC=CN1 GHITWFDHFOLATC-VIFPVBQESA-N 0.000 description 2
- OMPRRUIFFXCQAQ-ZETCQYMHSA-N tert-butyl (2s)-2-(4,5-dibromo-1h-imidazol-2-yl)pyrrolidine-1-carboxylate Chemical compound CC(C)(C)OC(=O)N1CCC[C@H]1C1=NC(Br)=C(Br)N1 OMPRRUIFFXCQAQ-ZETCQYMHSA-N 0.000 description 2
- YDBPZCVWPFMBDH-QMMMGPOBSA-N tert-butyl (2s)-2-formylpyrrolidine-1-carboxylate Chemical compound CC(C)(C)OC(=O)N1CCC[C@H]1C=O YDBPZCVWPFMBDH-QMMMGPOBSA-N 0.000 description 2
- YBRBMKDOPFTVDT-UHFFFAOYSA-N tert-butylamine Chemical compound CC(C)(C)N YBRBMKDOPFTVDT-UHFFFAOYSA-N 0.000 description 2
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 2
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 2
- 230000035899 viability Effects 0.000 description 2
- QBYIENPQHBMVBV-HFEGYEGKSA-N (2R)-2-hydroxy-2-phenylacetic acid Chemical compound O[C@@H](C(O)=O)c1ccccc1.O[C@@H](C(O)=O)c1ccccc1 QBYIENPQHBMVBV-HFEGYEGKSA-N 0.000 description 1
- ZQEBQGAAWMOMAI-ZETCQYMHSA-N (2s)-1-[(2-methylpropan-2-yl)oxycarbonyl]pyrrolidine-2-carboxylic acid Chemical compound CC(C)(C)OC(=O)N1CCC[C@H]1C(O)=O ZQEBQGAAWMOMAI-ZETCQYMHSA-N 0.000 description 1
- NWNOWCGAHDFNFJ-RUCXOUQFSA-N (2s)-2,5-bis(azanyl)-5-oxidanylidene-pentanoic acid Chemical compound OC(=O)[C@@H](N)CCC(N)=O.OC(=O)[C@@H](N)CCC(N)=O NWNOWCGAHDFNFJ-RUCXOUQFSA-N 0.000 description 1
- KYXJZFVLUAJUPY-UWVGGRQHSA-N (8s)-7-[(2s)-2-(methoxycarbonylamino)-3-methylbutanoyl]-1,4-dioxa-7-azaspiro[4.4]nonane-8-carboxylic acid Chemical compound C1[C@@H](C(O)=O)N(C(=O)[C@H](C(C)C)NC(=O)OC)CC21OCCO2 KYXJZFVLUAJUPY-UWVGGRQHSA-N 0.000 description 1
- 125000000008 (C1-C10) alkyl group Chemical group 0.000 description 1
- 125000006272 (C3-C7) cycloalkyl group Chemical group 0.000 description 1
- IYWCJUFLHUXACX-ZZXKWVIFSA-N (E)-1-(4-amino-3-nitrophenyl)-3-(4-bromo-2-hydroxyphenyl)prop-2-en-1-one Chemical compound NC1=C(C=C(C=C1)C(\C=C\C1=C(C=C(C=C1)Br)O)=O)[N+](=O)[O-] IYWCJUFLHUXACX-ZZXKWVIFSA-N 0.000 description 1
- IGERFAHWSHDDHX-UHFFFAOYSA-N 1,3-dioxanyl Chemical group [CH]1OCCCO1 IGERFAHWSHDDHX-UHFFFAOYSA-N 0.000 description 1
- JPRPJUMQRZTTED-UHFFFAOYSA-N 1,3-dioxolanyl Chemical group [CH]1OCCO1 JPRPJUMQRZTTED-UHFFFAOYSA-N 0.000 description 1
- UBCHPRBFMUDMNC-UHFFFAOYSA-N 1-(1-adamantyl)ethanamine Chemical compound C1C(C2)CC3CC2CC1(C(N)C)C3 UBCHPRBFMUDMNC-UHFFFAOYSA-N 0.000 description 1
- JZJWCDQGIPQBAO-UHFFFAOYSA-N 1-(4-iodophenyl)ethanone Chemical compound CC(=O)C1=CC=C(I)C=C1 JZJWCDQGIPQBAO-UHFFFAOYSA-N 0.000 description 1
- NZAXGZYPZGEVBD-UHFFFAOYSA-N 1-benzoylpiperidin-4-one Chemical compound C=1C=CC=CC=1C(=O)N1CCC(=O)CC1 NZAXGZYPZGEVBD-UHFFFAOYSA-N 0.000 description 1
- SMZOUWXMTYCWNB-UHFFFAOYSA-N 2-(2-methoxy-5-methylphenyl)ethanamine Chemical compound COC1=CC=C(C)C=C1CCN SMZOUWXMTYCWNB-UHFFFAOYSA-N 0.000 description 1
- NIXOWILDQLNWCW-UHFFFAOYSA-N 2-Propenoic acid Natural products OC(=O)C=C NIXOWILDQLNWCW-UHFFFAOYSA-N 0.000 description 1
- YEDUAINPPJYDJZ-UHFFFAOYSA-N 2-hydroxybenzothiazole Chemical compound C1=CC=C2SC(O)=NC2=C1 YEDUAINPPJYDJZ-UHFFFAOYSA-N 0.000 description 1
- APOYTRAZFJURPB-UHFFFAOYSA-N 2-methoxy-n-(2-methoxyethyl)-n-(trifluoro-$l^{4}-sulfanyl)ethanamine Chemical compound COCCN(S(F)(F)F)CCOC APOYTRAZFJURPB-UHFFFAOYSA-N 0.000 description 1
- TWQRQNJOSFBCJV-UHFFFAOYSA-N 2-tert-butylbenzaldehyde Chemical compound CC(C)(C)C1=CC=CC=C1C=O TWQRQNJOSFBCJV-UHFFFAOYSA-N 0.000 description 1
- IVBNAGGHZWIWCZ-UYJPIKCFSA-N 3-O-benzyl 8-O-methyl (3S)-1,4-dioxa-7-azaspiro[4.4]nonane-3,8-dicarboxylate Chemical compound C(C1=CC=CC=C1)OC(=O)[C@H]1OC2(OC1)CNC(C2)C(=O)OC IVBNAGGHZWIWCZ-UYJPIKCFSA-N 0.000 description 1
- BMYNFMYTOJXKLE-UHFFFAOYSA-N 3-azaniumyl-2-hydroxypropanoate Chemical compound NCC(O)C(O)=O BMYNFMYTOJXKLE-UHFFFAOYSA-N 0.000 description 1
- NYYSPVRERVXMLJ-UHFFFAOYSA-N 4,4-difluorocyclohexan-1-one Chemical compound FC1(F)CCC(=O)CC1 NYYSPVRERVXMLJ-UHFFFAOYSA-N 0.000 description 1
- CLQXZICUPGZTPE-UHFFFAOYSA-N 5-ethylthiophene-2-carbaldehyde Chemical compound CCC1=CC=C(C=O)S1 CLQXZICUPGZTPE-UHFFFAOYSA-N 0.000 description 1
- ZXZDIQFARIPIMF-ZDUSSCGKSA-N 7-o-benzyl 8-o-methyl (8s)-1,4-dioxa-7-azaspiro[4.4]nonane-7,8-dicarboxylate Chemical compound C([C@H](N(C1)C(=O)OCC=2C=CC=CC=2)C(=O)OC)C21OCCO2 ZXZDIQFARIPIMF-ZDUSSCGKSA-N 0.000 description 1
- OYNAEZCDWCRWBO-UHFFFAOYSA-N 8,8-difluorospiro[4.5]decane-1,4-dione Chemical compound C1CC(F)(F)CCC21C(=O)CCC2=O OYNAEZCDWCRWBO-UHFFFAOYSA-N 0.000 description 1
- HBAQYPYDRFILMT-UHFFFAOYSA-N 8-[3-(1-cyclopropylpyrazol-4-yl)-1H-pyrazolo[4,3-d]pyrimidin-5-yl]-3-methyl-3,8-diazabicyclo[3.2.1]octan-2-one Chemical class C1(CC1)N1N=CC(=C1)C1=NNC2=C1N=C(N=C2)N1C2C(N(CC1CC2)C)=O HBAQYPYDRFILMT-UHFFFAOYSA-N 0.000 description 1
- JRLTTZUODKEYDH-UHFFFAOYSA-N 8-methylquinoline Chemical group C1=CN=C2C(C)=CC=CC2=C1 JRLTTZUODKEYDH-UHFFFAOYSA-N 0.000 description 1
- SHWMIZAOLFMOSA-UHFFFAOYSA-N 8-phenyl-1,4-dioxa-8-azaspiro[4.5]decane Chemical compound O1CCOC11CCN(C=2C=CC=CC=2)CC1 SHWMIZAOLFMOSA-UHFFFAOYSA-N 0.000 description 1
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 1
- VHUUQVKOLVNVRT-UHFFFAOYSA-N Ammonium hydroxide Chemical compound [NH4+].[OH-] VHUUQVKOLVNVRT-UHFFFAOYSA-N 0.000 description 1
- 108020005544 Antisense RNA Proteins 0.000 description 1
- GFNHXBIPGKXBOZ-UHFFFAOYSA-N BrC=1C=CC(=C(C1)O)C1CC(=CN1)C1=CC=C(C=C1)I Chemical compound BrC=1C=CC(=C(C1)O)C1CC(=CN1)C1=CC=C(C=C1)I GFNHXBIPGKXBOZ-UHFFFAOYSA-N 0.000 description 1
- 206010008909 Chronic Hepatitis Diseases 0.000 description 1
- 208000035473 Communicable disease Diseases 0.000 description 1
- 229920002261 Corn starch Polymers 0.000 description 1
- 101710118188 DNA-binding protein HU-alpha Proteins 0.000 description 1
- 229940124186 Dehydrogenase inhibitor Drugs 0.000 description 1
- 241000710781 Flaviviridae Species 0.000 description 1
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- 239000004378 Glycyrrhizin Substances 0.000 description 1
- 239000007821 HATU Substances 0.000 description 1
- 229940122604 HCV protease inhibitor Drugs 0.000 description 1
- 241000711557 Hepacivirus Species 0.000 description 1
- HAEJPQIATWHALX-KQYNXXCUSA-N ITP Chemical compound O[C@@H]1[C@H](O)[C@@H](COP(O)(=O)OP(O)(=O)OP(O)(O)=O)O[C@H]1N1C(N=CNC2=O)=C2N=C1 HAEJPQIATWHALX-KQYNXXCUSA-N 0.000 description 1
- 101710200424 Inosine-5'-monophosphate dehydrogenase Proteins 0.000 description 1
- 102100040018 Interferon alpha-2 Human genes 0.000 description 1
- 108010079944 Interferon-alpha2b Proteins 0.000 description 1
- 102000013462 Interleukin-12 Human genes 0.000 description 1
- 108010065805 Interleukin-12 Proteins 0.000 description 1
- 102000000588 Interleukin-2 Human genes 0.000 description 1
- 108010002350 Interleukin-2 Proteins 0.000 description 1
- 102000004889 Interleukin-6 Human genes 0.000 description 1
- 108090001005 Interleukin-6 Proteins 0.000 description 1
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 description 1
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 1
- 108060001084 Luciferase Proteins 0.000 description 1
- 239000005089 Luciferase Substances 0.000 description 1
- 241000124008 Mammalia Species 0.000 description 1
- 102000005741 Metalloproteases Human genes 0.000 description 1
- 108010006035 Metalloproteases Proteins 0.000 description 1
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 1
- 108060004795 Methyltransferase Proteins 0.000 description 1
- GXCLVBGFBYZDAG-UHFFFAOYSA-N N-[2-(1H-indol-3-yl)ethyl]-N-methylprop-2-en-1-amine Chemical compound CN(CCC1=CNC2=C1C=CC=C2)CC=C GXCLVBGFBYZDAG-UHFFFAOYSA-N 0.000 description 1
- PCLIMKBDDGJMGD-UHFFFAOYSA-N N-bromosuccinimide Chemical compound BrN1C(=O)CCC1=O PCLIMKBDDGJMGD-UHFFFAOYSA-N 0.000 description 1
- 101710144128 Non-structural protein 2 Proteins 0.000 description 1
- 101800001020 Non-structural protein 4A Proteins 0.000 description 1
- 101710199667 Nuclear export protein Proteins 0.000 description 1
- 108010019160 Pancreatin Proteins 0.000 description 1
- 108091005804 Peptidases Proteins 0.000 description 1
- 102000035195 Peptidases Human genes 0.000 description 1
- 239000004365 Protease Substances 0.000 description 1
- IWYDHOAUDWTVEP-UHFFFAOYSA-N R-2-phenyl-2-hydroxyacetic acid Natural products OC(=O)C(O)C1=CC=CC=C1 IWYDHOAUDWTVEP-UHFFFAOYSA-N 0.000 description 1
- 101800001554 RNA-directed RNA polymerase Proteins 0.000 description 1
- UIIMBOGNXHQVGW-DEQYMQKBSA-M Sodium bicarbonate-14C Chemical class [Na+].O[14C]([O-])=O UIIMBOGNXHQVGW-DEQYMQKBSA-M 0.000 description 1
- KDYFGRWQOYBRFD-UHFFFAOYSA-N Succinic acid Natural products OC(=O)CCC(O)=O KDYFGRWQOYBRFD-UHFFFAOYSA-N 0.000 description 1
- 229930006000 Sucrose Natural products 0.000 description 1
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 1
- 108090000631 Trypsin Proteins 0.000 description 1
- 102000004142 Trypsin Human genes 0.000 description 1
- 108091023045 Untranslated Region Proteins 0.000 description 1
- 241000700605 Viruses Species 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- 125000004062 acenaphthenyl group Chemical group C1(CC2=CC=CC3=CC=CC1=C23)* 0.000 description 1
- 229960001413 acetanilide Drugs 0.000 description 1
- DPXJVFZANSGRMM-UHFFFAOYSA-N acetic acid;2,3,4,5,6-pentahydroxyhexanal;sodium Chemical compound [Na].CC(O)=O.OCC(O)C(O)C(O)C(O)C=O DPXJVFZANSGRMM-UHFFFAOYSA-N 0.000 description 1
- 239000002253 acid Substances 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 208000038016 acute inflammation Diseases 0.000 description 1
- 230000006022 acute inflammation Effects 0.000 description 1
- 125000003282 alkyl amino group Chemical group 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- DKNWSYNQZKUICI-UHFFFAOYSA-N amantadine Chemical compound C1C(C2)CC3CC2CC1(N)C3 DKNWSYNQZKUICI-UHFFFAOYSA-N 0.000 description 1
- 229960003805 amantadine Drugs 0.000 description 1
- 230000009435 amidation Effects 0.000 description 1
- 238000007112 amidation reaction Methods 0.000 description 1
- 229940024606 amino acid Drugs 0.000 description 1
- 150000001413 amino acids Chemical class 0.000 description 1
- 125000003277 amino group Chemical group 0.000 description 1
- 235000011114 ammonium hydroxide Nutrition 0.000 description 1
- 125000002178 anthracenyl group Chemical group C1(=CC=CC2=CC3=CC=CC=C3C=C12)* 0.000 description 1
- 230000000840 anti-viral effect Effects 0.000 description 1
- YCOXTKKNXUZSKD-UHFFFAOYSA-N as-o-xylenol Natural products CC1=CC=C(O)C=C1C YCOXTKKNXUZSKD-UHFFFAOYSA-N 0.000 description 1
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 1
- 230000008901 benefit Effects 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- 239000004305 biphenyl Substances 0.000 description 1
- 235000010290 biphenyl Nutrition 0.000 description 1
- 125000002529 biphenylenyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3C12)* 0.000 description 1
- UNXISIRQWPTTSN-UHFFFAOYSA-N boron;2,3-dimethylbutane-2,3-diol Chemical compound [B].[B].CC(C)(O)C(C)(C)O UNXISIRQWPTTSN-UHFFFAOYSA-N 0.000 description 1
- KDYFGRWQOYBRFD-NUQCWPJISA-N butanedioic acid Chemical compound O[14C](=O)CC[14C](O)=O KDYFGRWQOYBRFD-NUQCWPJISA-N 0.000 description 1
- FJDQFPXHSGXQBY-UHFFFAOYSA-L caesium carbonate Chemical compound [Cs+].[Cs+].[O-]C([O-])=O FJDQFPXHSGXQBY-UHFFFAOYSA-L 0.000 description 1
- 229910000024 caesium carbonate Inorganic materials 0.000 description 1
- 229910000019 calcium carbonate Inorganic materials 0.000 description 1
- 239000001506 calcium phosphate Substances 0.000 description 1
- 229910000389 calcium phosphate Inorganic materials 0.000 description 1
- 235000011010 calcium phosphates Nutrition 0.000 description 1
- 239000002775 capsule Substances 0.000 description 1
- 239000001768 carboxy methyl cellulose Substances 0.000 description 1
- 238000004113 cell culture Methods 0.000 description 1
- 239000006143 cell culture medium Substances 0.000 description 1
- 239000006285 cell suspension Substances 0.000 description 1
- 229920002301 cellulose acetate Polymers 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 239000012295 chemical reaction liquid Substances 0.000 description 1
- 239000003795 chemical substances by application Substances 0.000 description 1
- 125000001309 chloro group Chemical group Cl* 0.000 description 1
- 208000037976 chronic inflammation Diseases 0.000 description 1
- 230000006020 chronic inflammation Effects 0.000 description 1
- 208000019425 cirrhosis of liver Diseases 0.000 description 1
- 239000003184 complementary RNA Substances 0.000 description 1
- 238000006482 condensation reaction Methods 0.000 description 1
- 239000012050 conventional carrier Substances 0.000 description 1
- 239000008120 corn starch Substances 0.000 description 1
- 125000004122 cyclic group Chemical group 0.000 description 1
- ARUKYTASOALXFG-UHFFFAOYSA-N cycloheptylcycloheptane Chemical group C1CCCCCC1C1CCCCCC1 ARUKYTASOALXFG-UHFFFAOYSA-N 0.000 description 1
- 231100000433 cytotoxic Toxicity 0.000 description 1
- 230000001472 cytotoxic effect Effects 0.000 description 1
- 230000003013 cytotoxicity Effects 0.000 description 1
- 231100000135 cytotoxicity Toxicity 0.000 description 1
- 150000004683 dihydrates Chemical class 0.000 description 1
- 125000000532 dioxanyl group Chemical group 0.000 description 1
- 239000002270 dispersing agent Substances 0.000 description 1
- 239000003995 emulsifying agent Substances 0.000 description 1
- 239000000839 emulsion Substances 0.000 description 1
- FCVNWLZBCKMCKI-UHFFFAOYSA-N ethane-1,2-diol;piperidin-4-one Chemical compound OCCO.O=C1CCNCC1 FCVNWLZBCKMCKI-UHFFFAOYSA-N 0.000 description 1
- 239000012065 filter cake Substances 0.000 description 1
- 125000003983 fluorenyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3CC12)* 0.000 description 1
- 239000011737 fluorine Substances 0.000 description 1
- 229910052731 fluorine Inorganic materials 0.000 description 1
- 239000001530 fumaric acid Substances 0.000 description 1
- 239000008103 glucose Substances 0.000 description 1
- LPLVUJXQOOQHMX-UHFFFAOYSA-N glycyrrhetinic acid glycoside Natural products C1CC(C2C(C3(CCC4(C)CCC(C)(CC4C3=CC2=O)C(O)=O)C)(C)CC2)(C)C2C(C)(C)C1OC1OC(C(O)=O)C(O)C(O)C1OC1OC(C(O)=O)C(O)C(O)C1O LPLVUJXQOOQHMX-UHFFFAOYSA-N 0.000 description 1
- 229960004949 glycyrrhizic acid Drugs 0.000 description 1
- UYRUBYNTXSDKQT-UHFFFAOYSA-N glycyrrhizic acid Natural products CC1(C)C(CCC2(C)C1CCC3(C)C2C(=O)C=C4C5CC(C)(CCC5(C)CCC34C)C(=O)O)OC6OC(C(O)C(O)C6OC7OC(O)C(O)C(O)C7C(=O)O)C(=O)O UYRUBYNTXSDKQT-UHFFFAOYSA-N 0.000 description 1
- 235000019410 glycyrrhizin Nutrition 0.000 description 1
- 229940015043 glyoxal Drugs 0.000 description 1
- 239000008187 granular material Substances 0.000 description 1
- 125000004438 haloalkoxy group Chemical group 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 231100000283 hepatitis Toxicity 0.000 description 1
- 108700008776 hepatitis C virus NS-5 Proteins 0.000 description 1
- 231100000844 hepatocellular carcinoma Toxicity 0.000 description 1
- 125000000623 heterocyclic group Chemical class 0.000 description 1
- 230000007062 hydrolysis Effects 0.000 description 1
- 229960002751 imiquimod Drugs 0.000 description 1
- DOUYETYNHWVLEO-UHFFFAOYSA-N imiquimod Chemical compound C1=CC=CC2=C3N(CC(C)C)C=NC3=C(N)N=C21 DOUYETYNHWVLEO-UHFFFAOYSA-N 0.000 description 1
- 125000003392 indanyl group Chemical group C1(CCC2=CC=CC=C12)* 0.000 description 1
- 238000001802 infusion Methods 0.000 description 1
- 239000003112 inhibitor Substances 0.000 description 1
- 239000007924 injection Substances 0.000 description 1
- 238000002347 injection Methods 0.000 description 1
- 230000002452 interceptive effect Effects 0.000 description 1
- 108700027921 interferon tau Proteins 0.000 description 1
- 229940117681 interleukin-12 Drugs 0.000 description 1
- 229940100601 interleukin-6 Drugs 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 238000007912 intraperitoneal administration Methods 0.000 description 1
- 238000001990 intravenous administration Methods 0.000 description 1
- SNHMUERNLJLMHN-UHFFFAOYSA-N iodobenzene Chemical compound IC1=CC=CC=C1 SNHMUERNLJLMHN-UHFFFAOYSA-N 0.000 description 1
- 230000007794 irritation Effects 0.000 description 1
- 125000001972 isopentyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])C([H])([H])* 0.000 description 1
- 239000004310 lactic acid Substances 0.000 description 1
- 235000014655 lactic acid Nutrition 0.000 description 1
- 239000008101 lactose Substances 0.000 description 1
- 239000008297 liquid dosage form Substances 0.000 description 1
- 210000004185 liver Anatomy 0.000 description 1
- 201000007270 liver cancer Diseases 0.000 description 1
- 208000014018 liver neoplasm Diseases 0.000 description 1
- 239000000314 lubricant Substances 0.000 description 1
- 238000004020 luminiscence type Methods 0.000 description 1
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 1
- 239000011976 maleic acid Substances 0.000 description 1
- 229960002510 mandelic acid Drugs 0.000 description 1
- 125000004184 methoxymethyl group Chemical group [H]C([H])([H])OC([H])([H])* 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 150000004682 monohydrates Chemical class 0.000 description 1
- 210000002200 mouth mucosa Anatomy 0.000 description 1
- 210000004877 mucosa Anatomy 0.000 description 1
- 125000001280 n-hexyl group Chemical group C(CCCCC)* 0.000 description 1
- 125000000740 n-pentyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 229910017604 nitric acid Inorganic materials 0.000 description 1
- 239000002777 nucleoside Substances 0.000 description 1
- 229940127073 nucleoside analogue Drugs 0.000 description 1
- 150000004893 oxazines Chemical class 0.000 description 1
- 230000003647 oxidation Effects 0.000 description 1
- 238000007254 oxidation reaction Methods 0.000 description 1
- 125000005475 oxolanyl group Chemical group 0.000 description 1
- 239000001301 oxygen Substances 0.000 description 1
- 229940055695 pancreatin Drugs 0.000 description 1
- 238000007911 parenteral administration Methods 0.000 description 1
- 239000012071 phase Substances 0.000 description 1
- 108091005981 phosphorylated proteins Proteins 0.000 description 1
- 230000004962 physiological condition Effects 0.000 description 1
- 239000006187 pill Substances 0.000 description 1
- 125000003367 polycyclic group Chemical group 0.000 description 1
- 235000011056 potassium acetate Nutrition 0.000 description 1
- LPNYRYFBWFDTMA-UHFFFAOYSA-N potassium tert-butoxide Chemical compound [K+].CC(C)(C)[O-] LPNYRYFBWFDTMA-UHFFFAOYSA-N 0.000 description 1
- 229920001592 potato starch Polymers 0.000 description 1
- 239000000843 powder Substances 0.000 description 1
- 239000002243 precursor Substances 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 230000002265 prevention Effects 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- 210000000664 rectum Anatomy 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 230000001105 regulatory effect Effects 0.000 description 1
- 230000010076 replication Effects 0.000 description 1
- 229960000888 rimantadine Drugs 0.000 description 1
- 238000006798 ring closing metathesis reaction Methods 0.000 description 1
- 229920006395 saturated elastomer Polymers 0.000 description 1
- 230000035945 sensitivity Effects 0.000 description 1
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 1
- 235000019812 sodium carboxymethyl cellulose Nutrition 0.000 description 1
- 229920001027 sodium carboxymethylcellulose Polymers 0.000 description 1
- 235000010265 sodium sulphite Nutrition 0.000 description 1
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical class O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 1
- 239000007909 solid dosage form Substances 0.000 description 1
- HPRAYQNGLXYUQM-UHFFFAOYSA-N spiro[4.5]decane-1,4,8-trione Chemical compound O=C1CCC(=O)C11CCC(=O)CC1 HPRAYQNGLXYUQM-UHFFFAOYSA-N 0.000 description 1
- 239000008107 starch Substances 0.000 description 1
- 229960005322 streptomycin Drugs 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- 239000000126 substance Substances 0.000 description 1
- 125000001424 substituent group Chemical group 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- 239000005720 sucrose Substances 0.000 description 1
- 239000004094 surface-active agent Substances 0.000 description 1
- 239000000725 suspension Substances 0.000 description 1
- 239000006188 syrup Substances 0.000 description 1
- 235000020357 syrup Nutrition 0.000 description 1
- 230000009885 systemic effect Effects 0.000 description 1
- 239000003826 tablet Substances 0.000 description 1
- YTZKOQUCBOVLHL-UHFFFAOYSA-N tert-butylbenzene Chemical compound CC(C)(C)C1=CC=CC=C1 YTZKOQUCBOVLHL-UHFFFAOYSA-N 0.000 description 1
- 125000005931 tert-butyloxycarbonyl group Chemical group [H]C([H])([H])C(OC(*)=O)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 125000001712 tetrahydronaphthyl group Chemical group C1(CCCC2=CC=CC=C12)* 0.000 description 1
- 230000001225 therapeutic effect Effects 0.000 description 1
- 230000008719 thickening Effects 0.000 description 1
- 239000002562 thickening agent Substances 0.000 description 1
- 238000004448 titration Methods 0.000 description 1
- 238000011277 treatment modality Methods 0.000 description 1
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 1
- ITMCEJHCFYSIIV-UHFFFAOYSA-M triflate Chemical compound [O-]S(=O)(=O)C(F)(F)F ITMCEJHCFYSIIV-UHFFFAOYSA-M 0.000 description 1
- 150000004684 trihydrates Chemical class 0.000 description 1
- 239000012588 trypsin Substances 0.000 description 1
- 108010087967 type I signal peptidase Proteins 0.000 description 1
- 235000015112 vegetable and seed oil Nutrition 0.000 description 1
- 239000008158 vegetable oil Substances 0.000 description 1
- 230000029812 viral genome replication Effects 0.000 description 1
- 230000003612 virological effect Effects 0.000 description 1
Landscapes
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Abstract
本发明属于医药化学领域,涉及一类苯并[e]吡唑并[1,5‑c][1,3]噁嗪类化合物及其应用,具体地,本发明提供通式I的化合物或其药学可接受的盐、异构体、溶剂合物、结晶或前药,以及含有这些化合物的药物组合物和这些化合物或组合物在药物制备中的应用。本发明的化合物对丙肝病毒具有较好的抑制活性,同时对宿主细胞具有低的毒性,有效性高,安全性好,非常有希望成为治疗和/或预防与HCV感染相关的疾病的药物。
Description
技术领域
本发明属于医药化学领域,具体涉及一类具有苯并[e]吡唑并[1,5-c][1,3]噁嗪结构、能够抑制肝炎病毒活性的化合物或其药学可接受的盐、异构体、溶剂合物、结晶或前药,以及含有这些化合物的药物组合物和这些化合物或组合物在药物制备中的应用。
背景技术
丙型病毒性肝炎(Viral hepatitis C)是由丙型肝炎病毒(Hepatitis C virus,HCV)引起的肝脏急、慢性炎症的传染性疾病,HCV感染后极易演变为慢性肝病,如慢性肝炎、肝硬化和肝癌等,严重影响人们身体健康。
HCV属于黄病毒科,目前可分为6个基因型及不同亚型,按照国际通行的方法,以阿拉伯数字表示HCV基因型,以小写的英文字母表示基因亚型,其中基因1型呈现全球性的分布,占所有HCV感染的70%以上,中国人群的主要感染类型是HCV 1b亚型。经研究发现HCV的正链RNA的5’和3’端都含有非编码区(UTR),UTR之间是一个大的多蛋白开放阅读框架(ORF)。ORF编码一个长约3000个氨基酸的多蛋白前体,经宿主编码的信号肽酶及HCV编码的蛋白酶共同作用,裂解为多种HCV成熟蛋白。HCV成熟蛋白包括4个结构蛋白和6个非结构蛋白,其中6个非结构蛋白分别命名为NS2、NS3、NS4A、NS4B、NS5A、NS5B。研究表明,6个非结构蛋白在HCV的复制中起着非常重要的作用,如NS3,调节NS3丝氨酸蛋白酶的活性,NS5A为一种磷酸化蛋白,含有干扰素敏感性决定区域,在干扰素疗效预测、病毒复制、抗病毒抗性、肝细胞癌变等方面具有重要作用,已经成为HCV非结构蛋白研究的重点。
当前,HCV感染的治疗方式一般为重组干扰素α单独或与核苷类似物利巴韦林联合治疗,但是无论是干扰素还是利巴韦林,都存在着多个禁忌症,具有有限的临床益处。因此,对能够有效治疗HCV感染的药物仍然有着很大的需求。
发明内容
第一方面,本发明提供通式I的化合物或其药学可接受的盐、异构体、溶剂合物、结晶或前药,
其中:
Ra、Rb分别独立地选自H、烷基、环烷基、杂环烷基、芳基和杂芳基,或者Ra、Rb与其连接的C原子一起形成环烷基、杂环烷基、螺环烷基或杂螺环烷基,所述的烷基、环烷基、杂环烷基、螺环烷基、杂螺环烷基、芳基和杂芳基可以被一个或多个羟基、氧代、氨基、羧基、卤素、氰基、硝基、烷基、环烷基、杂环烷基、芳基、杂芳基、卤代烷基、烷氧基、羟基烷基、羧基烷基、芳基烷基、杂芳基烷基、单烷基氨基、双烷基氨基、烷基酰基、芳基酰基、杂芳基酰基、烷氧基酰基、烷基酰基氧基、氨基酰基、单烷基氨基酰基、双烷基氨基酰基或烷基酰基氨基取代;
Rc选自氢、羟基、氨基、羧基、卤素、氰基、硝基、烷基、卤代烷基、羟基烷基、氨基烷基、羧基烷基、氰基烷基、硝基烷基、烷氧基、单烷基氨基、双烷基氨基、环烷基和杂环烷基,其中f选自1、2和3;
L1、L2分别独立地选自芳基、杂芳基、-芳基-芳基-、-芳基-杂芳基-和-杂芳基-杂芳基-,所述的芳基、杂芳基、-芳基-芳基-、-芳基-杂芳基-和-杂芳基-杂芳基-可以被一个或多个卤素、羟基、氨基、羧基、氰基、硝基、烷基、环烷基、杂环烷基、烷氧基、卤代烷基、羟基烷基、氨基烷基、羧基烷基、氰基烷基、硝基烷基、环烷基烷基、杂环烷基烷基、烷氧基烷基、单烷基氨基、单烷基氨基烷基、双烷基氨基、双烷基氨基烷基、烷基酰基、烷基酰基烷基、烷氧基酰基、烷氧基酰基烷基、烷基酰基氧基、烷基酰基氧基烷基、氨基酰基、氨基酰基烷基、单烷基氨基酰基、单烷基氨基酰基烷基、双烷基氨基酰基、双烷基氨基酰基烷基、烷基酰基氨基或烷基酰基氨基烷基取代;
p、q分别独立地选自1、2和3;
R1、R2分别独立地选自氢、烷基、环烷基、杂环烷基、芳基和杂芳基,所述的烷基、环烷基、杂环烷基、芳基和杂芳基可以被一个或多个卤素、羟基、氨基、羧基、氰基、硝基、烷基、环烷基、杂环烷基、烷氧基、卤代烷基、羟基烷基、羧基烷基、单烷基氨基、双烷基氨基、烷基酰基、烷氧基酰基、烷基酰基氧基、氨基酰基、单烷基氨基酰基、双烷基氨基酰基或烷基酰基氨基取代;
R3、R4分别独立地选自氢、烷基、环烷基和杂环烷基,所述的烷基、环烷基和杂环烷基可以被一个或多个卤素、羟基、氨基、羧基、氰基、硝基、烷基、环烷基、杂环烷基、烷氧基、芳基或杂芳基取代;和
R5、R6分别独立地选自氢、卤素、羟基、氨基、羧基、氰基、硝基、烷基、环烷基、杂环烷基、烷氧基、烷氧基烷基、芳基和杂芳基,其中,m和n分别独立地选自1、2和3,当m或n为2时,各R5或R6与其连接的C原子可形成环烷基或杂环烷基;所述的羟基、氨基、羧基、烷基、环烷基、杂环烷基、烷氧基、烷氧基烷基、芳基和杂芳基可以被一个或多个卤素、羟基、氨基、羧基、氰基、硝基、烷基、环烷基、杂环烷基、烷氧基、羟基烷基、羧基烷基、单烷基氨基、双烷基氨基、烷基酰基、烷氧基酰基烷基酰基氧基、氨基酰基、单烷基氨基酰基、双烷基氨基酰基或烷基酰基氨基取代。
在一些优选的实施方案中,本发明的化合物为通式I的化合物及其药学可接受的盐、异构体、溶剂合物、结晶或前药,其中:
Ra、Rb分别独立地选自H、C1-10烷基、C3-10环烷基、C3-10杂环烷基、苯基、萘基和含有1-4个杂原子的C5-8杂芳基,或者Ra、Rb与其连接的C原子一起形成C3-10环烷基、C3-10杂环烷基、螺C7-13环烷基、氮杂螺C7-13烷基、二氮杂螺C7-13烷基、氧氮杂螺C7-13烷基、氧杂螺C7-13烷基或二氧杂螺C7-13烷基,所述的烷基、环烷基、杂环烷基、苯基、萘基、杂芳基、螺C7-13环烷基、氮杂螺C7-13烷基、二氮杂螺C7-13烷基、氧氮杂螺C7-13烷基、氧杂螺C7-13烷基和二氧杂螺C7-13烷基可以被一个或多个羟基、氧代、氨基、羧基、卤素、氰基、硝基、烷基、环烷基、杂环烷基、芳基、杂芳基、卤代烷基、烷氧基、羟基烷基、羧基烷基、芳基烷基、杂芳基烷基、单烷基氨基、双烷基氨基、烷基酰基、芳基酰基、杂芳基酰基、烷氧基酰基、烷基酰基氧基、氨基酰基、单烷基氨基酰基、双烷基氨基酰基或烷基酰基氨基取代;
优选地,Ra、Rb分别独立地选自H、C1-8烷基、C3-8环烷基、C3-8杂环烷基、苯基、萘基和含有1-3个杂原子的C5-7杂芳基,或者Ra、Rb与其连接的C原子一起形成C3-8环烷基、C3-8杂环烷基、螺C7-11环烷基、氮杂螺C7-11烷基、二氮杂螺C7-11烷基、氧氮杂螺C7-11烷基、氧杂螺C7-11烷基或二氧杂螺C7-11烷基,所述的烷基、环烷基、杂环烷基、苯基、萘基、杂芳基、螺C7-11环烷基、氮杂螺C7-11烷基、二氮杂螺C7-11烷基、氧氮杂螺C7-11烷基、氧杂螺C7-11烷基和二氧杂螺C7-11烷基可以被一个或多个羟基、氧代、氨基、羧基、卤素、氰基、硝基、C1-6烷基、C3-6环烷基、C3-6杂环烷基、芳基、杂芳基、卤代C1-6烷基、C1-6烷氧基、羟基C1-6烷基、羧基C1-6烷基、芳基C1-6烷基、杂芳基C1-6烷基、单C1-6烷基氨基、双C1-6烷基氨基、C1-6烷基酰基、芳基酰基、杂芳基酰基、C1-6烷氧基酰基、C1-6烷基酰基氧基、氨基酰基、单C1-6烷基氨基酰基、双C1-6烷基氨基酰基或C1-6烷基酰基氨基取代;
进一步优选地,Ra、Rb分别独立地选自H、C1-6烷基、C3-6环烷基、C3-6杂环烷基、苯基、萘基和含有1-3个杂原子的C5-6杂芳基,或者Ra、Rb与其连接的C原子一起形成C3-7环烷基、C3-7杂环烷基、螺庚烷、螺辛烷、螺壬烷、螺癸烷、氮杂螺庚烷、氮杂螺辛烷、氮杂螺壬烷、氮杂螺癸烷、二氮杂螺庚烷、二氮杂螺辛烷、二氮杂螺壬烷、二氮杂螺癸烷、氧氮杂螺庚烷、氧氮杂螺辛烷、氧氮杂螺壬烷、氧氮杂螺癸烷、氧杂螺庚烷、氧杂螺辛烷、氧杂螺壬烷、氧杂螺癸烷、二氧杂螺庚烷、二氧杂螺辛烷、二氧杂螺壬烷、二氧杂螺辛烷,所述的烷基、环烷基、杂环烷基、苯基、萘基、杂芳基、螺庚烷、螺辛烷、螺壬烷、螺癸烷、氮杂螺庚烷、氮杂螺辛烷、氮杂螺壬烷、氮杂螺癸烷、二氮杂螺庚烷、二氮杂螺辛烷、二氮杂螺壬烷、二氮杂螺癸烷、氧氮杂螺庚烷、氧氮杂螺辛烷、氧氮杂螺壬烷、氧氮杂螺癸烷、氧杂螺庚烷、氧杂螺辛烷、氧杂螺壬烷、氧杂螺癸烷、二氧杂螺庚烷、二氧杂螺辛烷、二氧杂螺壬烷和二氧杂螺辛烷可以被一个或多个羟基、氧代、氨基、羧基、卤素、氰基、硝基、C1-3烷基、C3-6环烷基、C3-6杂环烷基、芳基、杂芳基、卤代C1-3烷基、C1-3烷氧基、羟基C1-3烷基、羧基C1-3烷基、芳基C1-3烷基、杂芳基C1-3烷基、单C1-3烷基氨基、双C1-3烷基氨基、C1-3烷基酰基、芳基酰基、杂芳基酰基、C1-3烷氧基酰基、C1-3烷基酰基氧基、氨基酰基、单C1-3烷基氨基酰基、双C1-3烷基氨基酰基或C1-3烷基酰基氨基取代;
更进一步优选地,Ra、Rb分别独立地选自H、甲基、乙基、丙基、异丙基、正丁基、仲丁基、异丁基、叔丁基、环丙基、环丁基、环戊基、环己基、氮杂环丙基、氮杂环丁基、氮杂环戊基、二氮杂环戊基、氧氮杂环戊基、氮杂环己基、二氮杂环己基、氧氮杂环己基、氧杂环丙基、氧杂环丁基、氧杂环戊基、二氧杂环戊基、氧杂环己基、二氧杂环己基、苯基、萘基、噻吩基、吡咯基、呋喃基、咪唑基、噁唑基、噻唑基、吡唑基、异噁唑基、异噻唑基、噁二唑基、三唑基、吡啶基、嘧啶基和吡嗪基,或者Ra、Rb与其连接的C原子一起形成环丙基、环丁基、环戊基、环己基、环庚基、氮杂环丙基、氮杂环丁基、氮杂环戊基、二氮杂环戊基、氧氮杂环戊基、氮杂环己基、二氮杂环己基、氧氮杂环己基、氮杂环庚基、二氮杂环庚基、氧氮杂环庚基、氧杂环丙基、氧杂环丁基、氧杂环戊基、二氧杂环戊基、氧杂环己基、二氧杂环己基、氧杂环庚基、二氧杂环庚基、螺[2.4]庚烷、螺[3.4]辛烷、螺[4.4]壬烷、螺[2.5]辛烷、螺[3.5]壬烷、螺[4.5]癸烷、氮杂螺[2.4]庚烷、氮杂螺[3.4]辛烷、氮杂螺[4.4]壬烷、氮杂螺[2.5]辛烷、氮杂螺[3.5]壬烷、氮杂螺[4.5]癸烷、二氮杂螺[2.4]庚烷、二氮杂螺[3.4]辛烷、二氮杂螺[4.4]壬烷、二氮杂螺[2.5]辛烷、二氮杂螺[3.5]壬烷、二氮杂螺[4.5]癸烷、氧氮杂螺[2.4]庚烷、氧氮杂螺[3.4]辛烷、氧氮杂螺[4.4]壬烷、氧氮杂螺[2.5]辛烷、氧氮杂螺[3.5]壬烷、氧氮杂螺[4.5]癸烷、氧杂螺[2.4]庚烷、氧杂螺[3.4]辛烷、氧杂螺[4.4]壬烷、氧杂螺[2.5]辛烷、氧杂螺[3.5]壬烷、氧杂螺[4.5]癸烷、二氧杂螺[2.4]庚烷、二氧杂螺[3.4]辛烷、二氧杂螺[4.4]壬烷、二氧杂螺[2.5]辛烷、二氧杂螺[3.5]壬烷或二氧杂螺[4.5]癸烷,所述的甲基、乙基、丙基、异丙基、正丁基、仲丁基、异丁基、叔丁基、环丙基、环丁基、环戊基、环己基、环庚基、氮杂环丙基、氮杂环丁基、氮杂环戊基、二氮杂环戊基、氧氮杂环戊基、氮杂环己基、二氮杂环己基、氧氮杂环己基、氮杂环庚基、二氮杂环庚基、氧氮杂环庚基、氧杂环丙基、氧杂环丁基、氧杂环戊基、二氧杂环戊基、氧杂环己基、二氧杂环己基、氧杂环庚基、二氧杂环庚基、苯基、萘基、噻吩基、吡咯基、呋喃基、咪唑基、噁唑基、噻唑基、吡唑基、异噁唑基、异噻唑基、噁二唑基、三唑基、吡啶基、嘧啶基、吡嗪基、螺[2.4]庚烷、螺[3.4]辛烷、螺[4.4]壬烷、螺[2.5]辛烷、螺[3.5]壬烷、螺[4.5]癸烷、氮杂螺[2.4]庚烷、氮杂螺[3.4]辛烷、氮杂螺[4.4]壬烷、氮杂螺[2.5]辛烷、氮杂螺[3.5]壬烷、氮杂螺[4.5]癸烷、二氮杂螺[2.4]庚烷、二氮杂螺[3.4]辛烷、二氮杂螺[4.4]壬烷、二氮杂螺[2.5]辛烷、二氮杂螺[3.5]壬烷、二氮杂螺[4.5]癸烷、氧氮杂螺[2.4]庚烷、氧氮杂螺[3.4]辛烷、氧氮杂螺[4.4]壬烷、氧氮杂螺[2.5]辛烷、氧氮杂螺[3.5]壬烷、氧氮杂螺[4.5]癸烷、氧杂螺[2.4]庚烷、氧杂螺[3.4]辛烷、氧杂螺[4.4]壬烷、氧杂螺[2.5]辛烷、氧杂螺[3.5]壬烷、氧杂螺[4.5]癸烷、二氧杂螺[2.4]庚烷、二氧杂螺[3.4]辛烷、二氧杂螺[4.4]壬烷、二氧杂螺[2.5]辛烷、二氧杂螺[3.5]壬烷和二氧杂螺[4.5]癸烷可以被一个或多个羟基、氧代、氨基、羧基、卤素、氰基、硝基、C1-3烷基、C3-6环烷基、C3-6杂环烷基、芳基、杂芳基、卤代C1-3烷基、C1-3烷氧基、羟基C1-3烷基、羧基C1-3烷基、芳基C1-3烷基、杂芳基C1-3烷基、单C1-3烷基氨基、双C1-3烷基氨基、C1-3烷基酰基、芳基酰基、杂芳基酰基、C1-3烷氧基酰基、C1-3烷基酰基氧基、氨基酰基、单C1-3烷基氨基酰基、双C1-3烷基氨基酰基或C1-3烷基酰基氨基取代。
在一些具体的实施方案中,本发明提供通式I的化合物或其药学可接受的盐、异构体、溶剂合物、结晶或前药,其中Ra、Rb同时选自H、甲基、乙基、丙基、异丙基。
在一些具体的实施方案中,本发明提供通式I的化合物或其药学可接受的盐、异构体、溶剂合物、结晶或前药,其中Ra、Rb中一个选自H,另一个选自甲基、乙基、丙基、异丙基、正丁基、仲丁基、异丁基、叔丁基、环丙基、环丁基、环戊基、环己基、氮杂环丙基、氮杂环丁基、四氢吡咯基、四氢咪唑基、噁唑烷基、哌啶基、哌嗪基、六氢嘧啶基、六氢吡嗪基、吗啉基、噁嗪基、氧杂环丙基、氧杂环丁基、四氢呋喃基、二氧杂环戊基、氧杂环己基、二氧杂环己基、苯基、噻吩基、吡咯基、呋喃基、咪唑基、噁唑基、噻唑基、吡唑基、异噁唑基、异噻唑基、噁二唑基、三唑基、吡啶基、嘧啶基、吡嗪基,其中所述的甲基、乙基、丙基、异丙基、正丁基、仲丁基、异丁基、叔丁基、环丙基、环丁基、环戊基、环己基、氮杂环丙基、氮杂环丁基、四氢吡咯基、四氢咪唑基、噁唑烷基、哌啶基、哌嗪基、六氢嘧啶基、六氢吡嗪基、吗啉基、噁嗪基、氧杂环丙基、氧杂环丁基、四氢呋喃基、二氧杂环戊基、氧杂环己基、二氧杂环己基、苯基、萘基、噻吩基、吡咯基、呋喃基、咪唑基、噁唑基、噻唑基、吡唑基、异噁唑基、异噻唑基、噁二唑基、三唑基、吡啶基、嘧啶基和吡嗪基可以被一个或多个羟基、氧代、氨基、羧基、卤素、氰基、硝基、C1-3烷基、C3-6环烷基、C3-6杂环烷基、芳基、杂芳基、卤代C1-3烷基、C1-3烷氧基、羟基C1-3烷基、羧基C1-3烷基、芳基C1-3烷基、杂芳基C1-3烷基、单C1-3烷基氨基、双C1-3烷基氨基、C1-3烷基酰基、芳基酰基、杂芳基酰基、C1-3烷氧基酰基、C1-3烷基酰基氧基、氨基酰基、单C1-3烷基氨基酰基、双C1-3烷基氨基酰基或C1-3烷基酰基氨基取代。
在一些具体的实施方案中,本发明提供通式I的化合物或其药学可接受的盐、异构体、溶剂合物、结晶或前药,其中Ra、Rb与其连接的C原子一起形成环丙基、环丁基、环戊基、环己基、环庚基、氮杂环丙基、氮杂环丁基、四氢吡咯基、四氢咪唑基、噁唑烷基、哌啶基、哌嗪基、六氢嘧啶基、六氢吡嗪基、吗啉基、噁嗪基、氮杂环庚基、二氮杂环庚基、氧氮杂环庚基、氧杂环丙基、氧杂环丁基、氧杂环戊基、二氧杂环戊基、氧杂环己基、二氧杂环己基、氧杂环庚基、二氧杂环庚基、螺[2.4]庚烷、螺[3.4]辛烷、螺[4.4]壬烷、螺[2.5]辛烷、螺[3.5]壬烷、螺[4.5]癸烷、氮杂螺[2.4]庚烷、氮杂螺[3.4]辛烷、氮杂螺[4.4]壬烷、氮杂螺[2.5]辛烷、氮杂螺[3.5]壬烷、氮杂螺[4.5]癸烷、二氮杂螺[2.4]庚烷、二氮杂螺[3.4]辛烷、二氮杂螺[4.4]壬烷、二氮杂螺[2.5]辛烷、二氮杂螺[3.5]壬烷、二氮杂螺[4.5]癸烷、氧氮杂螺[2.4]庚烷、氧氮杂螺[3.4]辛烷、氧氮杂螺[4.4]壬烷、氧氮杂螺[2.5]辛烷、氧氮杂螺[3.5]壬烷、氧氮杂螺[4.5]癸烷、氧杂螺[2.4]庚烷、氧杂螺[3.4]辛烷、氧杂螺[4.4]壬烷、氧杂螺[2.5]辛烷、氧杂螺[3.5]壬烷、氧杂螺[4.5]癸烷、二氧杂螺[2.4]庚烷、二氧杂螺[3.4]辛烷、二氧杂螺[4.4]壬烷、二氧杂螺[2.5]辛烷、二氧杂螺[3.5]壬烷、二氧杂螺[4.5]癸烷,其中所述的甲基、乙基、丙基、异丙基、正丁基、仲丁基、异丁基、叔丁基、环丙基、环丁基、环戊基、环己基、环庚基、氮杂环丙基、氮杂环丁基、四氢吡咯基、四氢咪唑基、噁唑烷基、哌啶基、哌嗪基、六氢嘧啶基、六氢吡嗪基、吗啉基、噁嗪基、氮杂环庚基、二氮杂环庚基、氧氮杂环庚基、氧杂环丙基、氧杂环丁基、四氢呋喃基、二氧杂环戊基、氧杂环己基、二氧杂环己基、氧杂环庚基、二氧杂环庚基、苯基、萘基、噻吩基、吡咯基、呋喃基、咪唑基、噁唑基、噻唑基、吡唑基、异噁唑基、异噻唑基、噁二唑基、三唑基、吡啶基、嘧啶基、吡嗪基、螺[2.4]庚烷、螺[3.4]辛烷、螺[4.4]壬烷、螺[2.5]辛烷、螺[3.5]壬烷、螺[4.5]癸烷、氮杂螺[2.4]庚烷、氮杂螺[3.4]辛烷、氮杂螺[4.4]壬烷、氮杂螺[2.5]辛烷、氮杂螺[3.5]壬烷、氮杂螺[4.5]癸烷、二氮杂螺[2.4]庚烷、二氮杂螺[3.4]辛烷、二氮杂螺[4.4]壬烷、二氮杂螺[2.5]辛烷、二氮杂螺[3.5]壬烷、二氮杂螺[4.5]癸烷、氧氮杂螺[2.4]庚烷、氧氮杂螺[3.4]辛烷、氧氮杂螺[4.4]壬烷、氧氮杂螺[2.5]辛烷、氧氮杂螺[3.5]壬烷、氧氮杂螺[4.5]癸烷、氧杂螺[2.4]庚烷、氧杂螺[3.4]辛烷、氧杂螺[4.4]壬烷、氧杂螺[2.5]辛烷、氧杂螺[3.5]壬烷、氧杂螺[4.5]癸烷、二氧杂螺[2.4]庚烷、二氧杂螺[3.4]辛烷、二氧杂螺[4.4]壬烷、二氧杂螺[2.5]辛烷、二氧杂螺[3.5]壬烷和二氧杂螺[4.5]癸烷可以被一个或多个羟基、氧代、氨基、羧基、卤素、氰基、硝基、C1-3烷基、C3-6环烷基、C3-6杂环烷基、芳基、杂芳基、卤代C1-3烷基、C1-3烷氧基、羟基C1-3烷基、羧基C1-3烷基、芳基C1-3烷基、杂芳基C1-3烷基、单C1-3烷基氨基、双C1-3烷基氨基、C1-3烷基酰基、芳基酰基、杂芳基酰基、C1-3烷氧基酰基、C1-3烷基酰基氧基、氨基酰基、单C1-3烷基氨基酰基、双C1-3烷基氨基酰基或C1-3烷基酰基氨基取代。
在一些具体的实施方案中,本发明提供通式I的化合物或其药学可接受的盐、异构体、溶剂合物、结晶或前药,其中选自 其中R9选自氢、羟基、氧代、氨基、羧基、卤素、氰基、硝基、烷基、环烷基、杂环烷基、芳基、杂芳基、卤代烷基、烷氧基、羟基烷基、羧基烷基、芳基烷基、杂芳基烷基、单烷基氨基、双烷基氨基、烷基酰基、芳基酰基、杂芳基酰基、烷氧基酰基、烷基酰基氧基、氨基酰基、单烷基氨基酰基、双烷基氨基酰基和烷基酰基氨基,g选自1、2、3和4。
在一些更为具体的实施方案中,本发明提供通式I的化合物或其药学可接受的盐、异构体、溶剂合物、结晶或前药,其中选自 其中R9选自氢、羟基、氧代、氨基、羧基、卤素、氰基、硝基、C1-6烷基、C3-6环烷基、杂C3-6环烷基、苯基、噻吩基、吡咯基、呋喃基、咪唑基、噁唑基、噻唑基、吡唑基、异噁唑基、异噻唑基、噁二唑基、三唑基、吡啶基、嘧啶基、吡嗪基、卤代C1-6烷基、C1-6烷氧基、羟基C1-6烷基、羧基C1-6烷基、苯基C1-6烷基、噻吩基C1-6烷基、吡咯基C1-6烷基、呋喃基C1-6烷基、咪唑基C1-6烷基、噁唑基C1-6烷基、噻唑基C1-6烷基、吡唑基C1-6烷基、异噁唑基C1-6烷基、异噻唑基C1-6烷基、噁二唑基C1-6烷基、三唑基C1-6烷基、吡啶基C1-6烷基、嘧啶基C1-6烷基、吡嗪基C1-6烷基、单C1-6烷基氨基、双C1-6烷基氨基、C1-6烷基酰基、苯基酰基、噻吩基酰基、吡咯基酰基、呋喃基酰基、咪唑基酰基、噁唑基酰基、噻唑基酰基、吡唑基酰基、异噁唑基酰基、异噻唑基酰基、噁二唑基酰基、三唑基酰基、吡啶基酰基、嘧啶基酰基、吡嗪基酰基、C1-6烷氧基酰基、C1-6烷基酰基氧基、氨基酰基、单C1-6烷基氨基酰基、双C1-6烷基氨基酰基和C1-6烷基酰基氨基,g选自1和2。
在一些优选的实施方案中,本发明的化合物为通式I的化合物及其药学可接受的盐、异构体、溶剂合物、结晶或前药,其中:
Rc选自氢、羟基、氨基、羧基、卤素、氰基、硝基、C1-6烷基、卤代C1-6烷基、羟基C1-6烷基、氨基C1-6烷基、羧基C1-6烷基、氰基C1-6烷基、硝基C1-6烷基、C1-6烷氧基、单C1-6烷基氨基、双C1-6烷基氨基、C3-6环烷基和C3-6杂环烷基,其中f选自1、2和3;
优选地,Rc选自氢、羟基、氨基、羧基、卤素、氰基、硝基、C1-6烷基、卤代C1-6烷基、羟基C1-6烷基、氨基C1-6烷基、羧基C1-6烷基、氰基C1-6烷基、硝基C1-6烷基、C1-6烷氧基、单C1-6烷基氨基、双C1-6烷基氨基、C3-6环烷基和C3-6杂环烷基,其中f选自1和2。
在一些优选的实施方案中,本发明的化合物为通式I的化合物及其药学可接受的盐、异构体、溶剂合物、结晶或前药,其中:
L1、L2分别独立地选自苯基、萘基、咪唑基、苯并咪唑基、-苯基-咪唑基-、咪唑并吡啶基、喹唑啉酮基、吡咯基、咪唑酮基、呋喃基、噻吩基、吡唑基、噁唑基、噻唑基、异噁唑基、异噻唑基、噁二唑基和三唑基,所述的苯基、萘基、咪唑基、苯并咪唑基、-苯基-咪唑基-、咪唑并吡啶基、喹唑啉酮基、吡咯基、咪唑酮基、呋喃基、噻吩基、吡唑基、噁唑基、噻唑基、异噁唑基、异噻唑基、噁二唑基和三唑基可以被一个或多个卤素、羟基、氨基、羧基、氰基、硝基、C1-10烷基、C3-10环烷基、C3-10杂环烷基、C1-10烷氧基、卤代C1-10烷基、羟基-C1-10烷基、氨基-C1-10烷基、羧基-C1-10烷基、氰基-C1-10烷基、硝基C1-10烷基、C3-10环烷基-C1-6烷基、C3-10杂环烷基-C1-6烷基、C1-10烷氧基-C1-6烷基、单C1-10烷基氨基、单C1-10烷基氨基-C1-6烷基、双C1-10烷基氨基、双C1-10烷基氨基-C1-6烷基、C1-10烷基酰基、C1-10烷基酰基-C1-6烷基、C1-10烷氧基酰基、C1-10烷氧基酰基-C1-6烷基、C1-10烷基酰基氧基、C1-10烷基酰基氧基-C1-6烷基、氨基酰基、氨基酰基-C1-6烷基、单C1-10烷基氨基酰基、单C1-10烷基氨基酰基-C1-6烷基、双C1-10烷基氨基酰基、双C1-10烷基氨基酰基-C1-6烷基、C1-10烷基酰基氨基或C1-10烷基酰基氨基-C1-6烷基取代;
优选地,L1、L2分别独立地选自苯基、萘基、咪唑基、1H-苯并[d]咪唑基、5-苯基-1H-咪唑基、1H-咪唑并[4,5-b]吡啶基、喹唑啉-4(3H)酮基、吡咯基、咪唑酮基、呋喃基、噻吩基、吡唑基、噁唑基、噻唑基、异噁唑基、异噻唑基、噁二唑基和三唑基,所述的苯基、萘基、咪唑基、1H-苯并[d]咪唑基、5-苯基-1H-咪唑基、1H-咪唑并[4,5-b]吡啶基、喹唑啉-4(3H)酮基、吡咯基、咪唑酮基、呋喃基、噻吩基、吡唑基、噁唑基、噻唑基、异噁唑基、异噻唑基、噁二唑基和三唑基可以被一个或多个卤素、羟基、氨基、羧基、氰基、硝基、C1-6烷基、C3-8环烷基、C3-8杂环烷基、C1-6烷氧基、卤代C1-6烷基、羟基-C1-6烷基、氨基-C1-6烷基、羧基-C1-6烷基、氰基-C1-6烷基、硝基C1-6烷基、C3-8环烷基-C1-6烷基、C3-8杂环烷基-C1-6烷基、C1-6烷氧基-C1-6烷基、单C1-6烷基氨基、单C1-6烷基氨基-C1-6烷基、双C1-6烷基氨基、双C1-6烷基氨基-C1-6烷基、C1-6烷基酰基、C1-6烷基酰基-C1-6烷基、C1-6烷氧基酰基、C1-6烷氧基酰基-C1-6烷基、C1-6烷基酰基氧基、C1-6烷基酰基氧基-C1-6烷基、氨基酰基、氨基酰基-C1-6烷基、单C1-6烷基氨基酰基、单C1-6烷基氨基酰基-C1-6烷基、双C1-6烷基氨基酰基、双C1-6烷基氨基酰基-C1-6烷基、C1-6烷基酰基氨基或C1-6烷基酰基氨基-C1-6烷基取代;
进一步优选地,L1、L2分别独立地选自以下基团:
其中,R7和R8分别独立地选自氢、卤素、羟基、氨基、羧基、氰基、硝基、烷基、环烷基、杂环烷基、烷氧基、卤代烷基、羟基烷基、氨基烷基、羧基烷基、氰基烷基、硝基烷基、环烷基烷基、杂环烷基烷基、烷氧基烷基、单烷基氨基、单烷基氨基烷基、双烷基氨基、双烷基氨基烷基、烷基酰基、烷基酰基烷基、烷氧基酰基、烷氧基酰基烷基、烷基酰基氧基、烷基酰基氧基烷基、氨基酰基、氨基酰基烷基、单烷基氨基酰基、单烷基氨基酰基烷基、双烷基氨基酰基、双烷基氨基酰基烷基、烷基酰基氨基和烷基酰基氨基烷基;优选地,R7和R8分别独立地选自氢、卤素、羟基、氨基、羧基、氰基、硝基、C1-6烷基、C3-8环烷基、C3-8杂环烷基、C1-6烷氧基、卤代C1-6烷基、羟基-C1-6烷基、氨基-C1-6烷基、羧基-C1-6烷基、氰基-C1-6烷基、硝基C1-6烷基、C3-8环烷基-C1-6烷基、C3-8杂环烷基-C1-6烷基、C1-6烷氧基-C1-6烷基、单C1-6烷基氨基、单C1-6烷基氨基-C1-6烷基、双C1-6烷基氨基、双C1-6烷基氨基-C1-6烷基、C1-6烷基酰基、C1-6烷基酰基-C1-6烷基、C1-6烷氧基酰基、C1-6烷氧基酰基-C1-6烷基、C1-6烷基酰基氧基、C1-6烷基酰基氧基-C1-6烷基、氨基酰基、氨基酰基-C1-6烷基、单C1-6烷基氨基酰基、单C1-6烷基氨基酰基-C1-6烷基、双C1-6烷基氨基酰基、双C1-6烷基氨基酰基-C1-6烷基、C1-6烷基酰基氨基和C1-6烷基酰基氨基-C1-6烷基。
在一些优选的实施方案中,本发明的化合物为通式I的化合物及其药学可接受的盐、异构体、溶剂合物、结晶或前药,其中:
R1、R2分别独立地选自氢、C1-10烷基、C3-8环烷基、C3-8杂环烷基、芳基和杂芳基,所述的C1-10烷基、C3-8环烷基、C3-8杂环烷基、芳基和杂芳基可以被一个或多个卤素、羟基、氨基、羧基、氰基、硝基、烷基、环烷基、杂环烷基、烷氧基、羟基烷基、羧基烷基、单烷基氨基、双烷基氨基、烷基酰基、烷氧基酰基、烷基酰基氧基、氨基酰基、单烷基氨基酰基、双烷基氨基酰基或烷基酰基氨基取代;
优选地,R1、R2分别独立地选自氢、C1-6烷基、C3-6环烷基、C3-6杂环烷基、芳基和杂芳基,所述的C1-6烷基、C3-6环烷基、C3-6杂环烷基、芳基和杂芳基可以被一个或多个卤素、羟基、氨基、羧基、氰基、硝基、C1-6烷基、C1-6环烷基、C1-6杂环烷基、C1-6烷氧基,如甲氧基、乙氧基、丙氧基,羟基-C1-6烷基、羧基-C1-6烷基、单C1-6烷基氨基、双C1-6烷基氨基、C1-6烷基酰基、C1-6烷氧基酰基、C1-6烷基酰基氧基、氨基酰基、单C1-6烷基氨基酰基、双C1-6烷基氨基酰基、C1-6烷基酰基氨基取代;
进一步优选地,R1、R2分别独立地选自氢、甲基、乙基、丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、环丙烷基、环丁烷基、环戊烷基、环己烷基、四氢吡咯烷基、四氢呋喃基、四氢噻吩基、四氢噻唑基、四氢噁唑基、哌啶基、哌嗪基、N-烷基哌嗪基、苯基、萘基、吡咯基、噻吩基、噻唑基、噁唑基和吡啶基,所述的甲基、乙基、丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、环丙烷基、环丁烷基、环戊烷基、环己烷基、环庚烷基、四氢吡咯烷基、四氢呋喃基、四氢噻吩基、四氢噻唑基、四氢噁唑基、哌啶基、哌嗪基、N-烷基哌嗪基、苯基、萘基、吡咯基、噻吩基、噻唑基、噁唑基和吡啶基可以被一个或多个卤素、羟基、氨基、羧基、氰基、硝基、C1-6烷基、C1-6烷氧基,如甲氧基、乙氧基、丙氧基,羟基-C1-6烷基、羧基-C1-6烷基、单C1-6烷基氨基或双C1-6烷基氨基取代。
在一些优选的实施方案中,本发明的化合物为通式I的化合物及其药学可接受的盐、异构体、溶剂合物、结晶或前药,其中:
R3、R4分别独立地选自氢、C1-10烷基、C3-8环烷基和C3-8杂环烷基,所述的C1-10烷基、C3-8环烷基和C3-8杂环烷基可以被一个或多个卤素、羟基、氨基、羧基、氰基、硝基、烷基、环烷基、杂环烷基、烷氧基、芳基或杂芳基取代;
进一步优选地,R3、R4分别独立地选自氢、C1-6烷基、C3-7环烷基、C3-7杂环烷基,所述的C1-6烷基、C3-7环烷基和C3-7杂环烷基可以被一个或多个卤素、羟基、氨基、羧基、氰基、硝基、C1-6烷基、C3-7环烷基、C3-7杂环烷基、C1-6烷氧基、芳基或杂芳基取代;
更进一步优选地,R3、R4分别独立地选自氢、甲基、乙基、丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、环丙烷基、环丁烷基、环戊烷基、环己烷基、四氢吡咯烷基、四氢呋喃基、四氢噻吩基、四氢噻唑基、四氢噁唑基、哌啶基、哌嗪基,所述的甲基、乙基、丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、环丙烷基、环丁烷基、环戊烷基、环己烷基、四氢吡咯烷基、四氢呋喃基、四氢噻吩基、四氢噻唑基、四氢噁唑基、哌啶基和哌嗪基可以被一个或多个卤素、羟基、氨基、羧基、氰基、硝基、C1-6烷基、环丙基、环丁基、环戊烷基、环己烷基、四氢吡咯烷基、四氢呋喃基、四氢噻吩基、四氢噻唑基、四氢噁唑基、哌啶基、哌嗪基、N-烷基哌嗪基、C1-6烷氧基、苯基或杂芳基取代。
在一些优选的实施方案中,本发明的化合物为通式I的化合物及其药学可接受的盐、异构体、溶剂合物、结晶或前药,其中:
R5、R6分别独立地选自氢、氰基、羟基、氨基、C1-10烷基、C3-8环烷基、C3-8杂环烷基、卤素、C1-6烷氧基-C1-6烷基、芳基和杂芳基,其中,m和n分别独立地选自1、2和3,当m或n为2时,各R5或R6与其连接的C原子可形成C3-8环烷基或C3-8杂环烷基;所述的羟基、氨基、C1-10烷基、C3-8环烷基、C3-8杂环烷基、卤素、C1-6烷氧基-C1-6烷基、芳基和杂芳基可以被一个或多个卤素、羟基、氨基、羧基、氰基、硝基、烷基、环烷基、杂环烷基、烷氧基、羟基烷基、羧基烷基、单烷基氨基、双烷基氨基、烷基酰基、烷氧基酰基烷基酰基氧基、氨基酰基、单烷基氨基酰基、双烷基氨基酰基或烷基酰基氨基取代;
优选地,R5、R6分别独立地选自氢、氰基、羟基、氨基、C1-6烷基、C3-7环烷基、C3-7杂环烷基、卤素、C1-6烷氧基-C1-6烷基、芳基和杂芳基,其中,m和n分别独立地选自1、2和3,当m或n为2时,各R5或R6与其连接的C原子可形成C3-6环烷基或C3-6杂环烷基;所述的羟基、氨基、C1-6烷基、C3-7环烷基、C3-7杂环烷基、卤素、C1-6烷氧基-C1-6烷基、芳基和杂芳基可以被一个或多个卤素、羟基、氨基、羧基、氰基、硝基、烷基、环烷基、杂环烷基、烷氧基、羟基烷基、羧基烷基、单烷基氨基、双烷基氨基、烷基酰基、烷氧基酰基烷基酰基氧基、氨基酰基、单烷基氨基酰基、双烷基氨基酰基或烷基酰基氨基取代;
更进一步优选地,R5、R6分别独立地选自氢、氰基、羟基、氨基、甲基、乙基、丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、环丙基、环丁基、环戊烷基、环己烷基、四氢吡咯烷基、四氢呋喃基、四氢噻吩基、四氢噻唑基、四氢噁唑基、1,3-二氧戊环基、哌啶基、哌嗪基、N-烷基哌嗪基、1,3-二氧己环基、氟、氯、甲氧基甲基、甲氧基乙基、甲氧基丙基、乙氧基甲基、乙氧基乙基、乙氧基丙基、苯基、萘基、吡咯基、噻吩基、噻唑基、噁唑基和吡啶基,或者当m或n为2时,各自独立地选自氮杂螺烷基(例如氮杂螺[2.4]庚烷基、氮杂螺[3.4]辛烷基、氮杂螺[4.4]壬烷基、氮杂螺[2.5]辛烷基、氮杂螺[3.5]壬烷基、氮杂螺[4.5]癸烷基、氮杂螺[2.6]壬烷基、氮杂螺[3.6]癸烷基)、氧氮杂螺烷基(例如氧杂-氮杂螺[2.4]庚烷基、氧杂-氮杂螺[3.4]辛烷基、氧杂-氮杂螺[4.4]壬烷基、二氧杂-氮杂螺[4.4]壬烷基、氧杂-氮杂螺[4.5]癸烷基、二氧杂-氮杂螺[4.5]癸烷基、三氧杂-氮杂螺[4.5]癸烷基)和氮杂双环烷基(例如氮杂双环[3.1.0]己烷、氮杂双环[3.2.0]庚烷基、八氢环戊并吡咯基、八氢-1H-异吲哚基、八氢-1H-吲哚基、氮杂双环[2.2.1]庚烷基);所述的羟基、氨基、甲基、乙基、丙基、异丙基、正丁基、仲丁基、异丁基、叔丁基、环丙基、环丁基、环戊烷基、环己烷基、四氢吡咯烷基、四氢呋喃基、四氢噻吩基、四氢噻唑基、四氢噁唑基、1,3-二氧戊环基、哌啶基、哌嗪基、N-烷基哌嗪基、1,3-二氧己环基、氟、氯、甲氧基甲基、甲氧基乙基、甲氧基丙基、乙氧基甲基、乙氧基乙基、乙氧基丙基、苯基、萘基、吡咯基、噻吩基、噻唑基、噁唑基和吡啶基,或者当m或n为2时,所述的氮杂螺烷基(氮杂螺[2.4]庚烷基、氮杂螺[3.4]辛烷基、氮杂螺[4.4]壬烷基、氮杂螺[2.5]辛烷基、氮杂螺[3.5]壬烷基、氮杂螺[4.5]癸烷基、氮杂螺[2.6]壬烷基、氮杂螺[3.6]癸烷基)、氧氮杂螺烷基(例如氧杂-氮杂螺[2.4]庚烷基、氧杂-氮杂螺[3.4]辛烷基、氧杂-氮杂螺[4.4]壬烷基、二氧杂-氮杂螺[4.4]壬烷基、氧杂-氮杂螺[4.5]癸烷基、二氧杂-氮杂螺[4.5]癸烷基、三氧杂-氮杂螺[4.5]癸烷基)和氮杂双环烷基(例如氮杂双环[3.1.0]己烷、氮杂双环[3.2.0]庚烷基、八氢环戊并吡咯基、八氢-1H-异吲哚基、八氢-1H-吲哚基、氮杂双环[2.2.1]庚烷基)可以被一个或多个卤素、羟基、氨基、羧基、氰基、硝基、烷基、环烷基、杂环烷基、烷氧基、羟基烷基、羧基烷基、单烷基氨基、双烷基氨基、烷基酰基、烷氧基酰基烷基酰基氧基、氨基酰基、单烷基氨基酰基、双烷基氨基酰基或烷基酰基氨基取代。
在一些具体的实施方案中,本发明提供通式I的化合物或其药学可接受的盐、异构体、溶剂合物、结晶或前药,其中各自独立地选自取代或未取代的所述取代基选自卤素、羟基、氨基、羧基、氰基、硝基、烷基、环烷基、杂环烷基、烷氧基、羟基烷基、羧基烷基、单烷基氨基、双烷基氨基、烷基酰基、烷氧基酰基烷基酰基氧基、氨基酰基、单烷基氨基酰基、双烷基氨基酰基、烷基酰基氨基。
在一些优选的实施方案中,本发明提供通式I的化合物及其药学可接受的盐、异构体、溶剂合物、结晶或前药,其中所述通式I为通式Ia,
其中C*为S构型。
根据本发明,在一些优选的实施方案中,本发明的化合物为通式I或通式Ia的化合物或其药学可接受的盐、异构体、溶剂合物、结晶或前药,其中:
Ra、Rb分别独立地选自H、C1-6烷基、C3-6环烷基、C3-6杂环烷基、苯基、萘基和含有1-3个杂原子的C5-6杂芳基,或者Ra、Rb与其连接的C原子一起形成C3-7环烷基、C3-7杂环烷基、螺庚烷、螺辛烷、螺壬烷、螺癸烷、氮杂螺庚烷、氮杂螺辛烷、氮杂螺壬烷、氮杂螺癸烷、二氮杂螺庚烷、二氮杂螺辛烷、二氮杂螺壬烷、二氮杂螺癸烷、氧氮杂螺庚烷、氧氮杂螺辛烷、氧氮杂螺壬烷、氧氮杂螺癸烷、氧杂螺庚烷、氧杂螺辛烷、氧杂螺壬烷、氧杂螺癸烷、二氧杂螺庚烷、二氧杂螺辛烷、二氧杂螺壬烷或二氧杂螺辛烷,所述的烷基、环烷基、杂环烷基、苯基、萘基、杂芳基、螺庚烷、螺辛烷、螺壬烷、螺癸烷、氮杂螺庚烷、氮杂螺辛烷、氮杂螺壬烷、氮杂螺癸烷、二氮杂螺庚烷、二氮杂螺辛烷、二氮杂螺壬烷、二氮杂螺癸烷、氧氮杂螺庚烷、氧氮杂螺辛烷、氧氮杂螺壬烷、氧氮杂螺癸烷、氧杂螺庚烷、氧杂螺辛烷、氧杂螺壬烷、氧杂螺癸烷、二氧杂螺庚烷、二氧杂螺辛烷、二氧杂螺壬烷和二氧杂螺辛烷可以被一个或多个羟基、氧代、氨基、羧基、卤素、氰基、硝基、C1-3烷基、C3-6环烷基、C3-6杂环烷基、芳基、杂芳基、卤代C1-3烷基、C1-3烷氧基、羟基C1-3烷基、羧基C1-3烷基、芳基C1-3烷基、杂芳基C1-3烷基、单C1-3烷基氨基、双C1-3烷基氨基、C1-3烷基酰基、芳基酰基、杂芳基酰基、C1-3烷氧基酰基、C1-3烷基酰基氧基、氨基酰基、单C1-3烷基氨基酰基、双C1-3烷基氨基酰基或C1-3烷基酰基氨基取代;
Rc选自氢、羟基、氨基、羧基、卤素、氰基、硝基、C1-6烷基、卤代C1-6烷基、羟基C1-6烷基、氨基C1-6烷基、羧基C1-6烷基、氰基C1-6烷基、硝基C1-6烷基、C1-6烷氧基、单C1-6烷基氨基、双C1-6烷基氨基、C3-6环烷基和C3-6杂环烷基,其中f选自1、2和3;
p、q分别独立地选自1、2和3;
L1、L2分别独立地选自苯基、萘基、咪唑基、苯并咪唑基、-苯基-咪唑基-、咪唑并吡啶基、喹唑啉酮基、吡咯基、咪唑酮基、呋喃基、噻吩基、吡唑基、噁唑基、噻唑基、异噁唑基、异噻唑基、噁二唑基和三唑基,所述的苯基、萘基、咪唑基、苯并咪唑基、-苯基-咪唑基-、咪唑并吡啶基、喹唑啉酮基、吡咯基、咪唑酮基、呋喃基、噻吩基、吡唑基、噁唑基、噻唑基、异噁唑基、异噻唑基、噁二唑基和三唑基可以被一个或多个卤素、羟基、氨基、羧基、氰基、硝基、C1-6烷基、C3-8环烷基、C3-8杂环烷基、C1-6烷氧基、卤代C1-6烷基、羟基-C1-6烷基、氨基-C1-6烷基、羧基-C1-6烷基、氰基-C1-6烷基、硝基C1-6烷基、C3-8环烷基-C1-6烷基、C3-8杂环烷基-C1-6烷基、C1-6烷氧基-C1-6烷基、单C1-6烷基氨基、单C1-6烷基氨基-C1-6烷基、双C1-6烷基氨基、双C1-6烷基氨基-C1-6烷基、C1-6烷基酰基、C1-6烷基酰基-C1-6烷基、C1-6烷氧基酰基、C1-6烷氧基酰基-C1-6烷基、C1-6烷基酰基氧基、C1-6烷基酰基氧基-C1-6烷基、氨基酰基、氨基酰基-C1-6烷基、单C1-6烷基氨基酰基、单C1-6烷基氨基酰基-C1-6烷基、双C1-6烷基氨基酰基、双C1-6烷基氨基酰基-C1-6烷基、C1-6烷基酰基氨基或C1-6烷基酰基氨基-C1-6烷基取代;
R1、R2分别独立地选自氢、C1-6烷基、C3-8环烷基、C3-8杂环烷基、芳基和杂芳基,所述的C1-6烷基、C3-8环烷基、C3-8杂环烷基、芳基和杂芳基可以被一个或多个卤素、羟基、氨基、羧基、氰基、硝基、C1-6烷基、C1-8环烷基、C1-8杂环烷基、C1-6烷氧基、羟基-C1-6烷基、羧基-C1-6烷基、单C1-6烷基氨基、双C1-6烷基氨基、C1-6烷基酰基、C1-6烷氧基酰基、C1-6烷基酰基氧基、氨基酰基、单C1-6烷基氨基酰基、双C1-6烷基氨基酰基或C1-6烷基酰基氨基取代;
R3、R4分别独立地选自氢、C1-6烷基、C3-8环烷基和C3-8杂环烷基,所述的C1-6烷基、C3-8环烷基和C3-8杂环烷基可以被一个或多个卤素、羟基、氨基、羧基、氰基、硝基、C1-6烷基、C3-8环烷基、C3-8杂环烷基、C1-6烷氧基、芳基或杂芳基取代;和
R5、R6分别独立地选自氢、氰基、羟基、氨基、C1-6烷基、C3-8环烷基、C3-8杂环烷基、卤素、C1-6烷氧基-C1-6烷基、芳基和杂芳基,其中,m和n分别独立地选自1、2和3,当m或n为2时,各R5或R6与其连接的C原子可形成C3-8环烷基或C3-8杂环烷基;所述的羟基、氨基、C1-6烷基、C3-8环烷基、C3-8杂环烷基、卤素、C1-6烷氧基-C1-6烷基、芳基和杂芳基可以被一个或多个卤素、羟基、氨基、羧基、氰基、硝基、C1-6烷基、C3-8环烷基、C3-8杂环烷基、C1-6烷氧基、羟基C1-6烷基、羧基C1-6烷基、单C1-6烷基氨基、双C1-6烷基氨基、C1-6烷基酰基、C1-6烷氧基酰基C1-6烷基酰基氧基、氨基酰基、单C1-6烷基氨基酰基、双C1-6烷基氨基酰基或C1-6烷基酰基氨基取代。
根据本发明,在另一些优选的实施方案中,本发明提供的化合物为通式I或通式Ia的化合物或其药学可接受的盐、异构体、溶剂合物、结晶或前药,其中:
Ra、Rb分别独立地选自H、甲基、乙基、丙基、异丙基、正丁基、仲丁基、异丁基、叔丁基、环丙基、环丁基、环戊基、环己基、氮杂环丙基、氮杂环丁基、氮杂环戊基、二氮杂环戊基、氧氮杂环戊基、氮杂环己基、二氮杂环己基、氧氮杂环己基、氧杂环丙基、氧杂环丁基、氧杂环戊基、二氧杂环戊基、氧杂环己基、二氧杂环己基、苯基、萘基、噻吩基、吡咯基、呋喃基、咪唑基、噁唑基、噻唑基、吡唑基、异噁唑基、异噻唑基、噁二唑基、三唑基、吡啶基、嘧啶基或吡嗪基,或者Ra、Rb与其连接的C原子一起形成环丙基、环丁基、环戊基、环己基、环庚基、氮杂环丙基、氮杂环丁基、氮杂环戊基、二氮杂环戊基、氧氮杂环戊基、氮杂环己基、二氮杂环己基、氧氮杂环己基、氮杂环庚基、二氮杂环庚基、氧氮杂环庚基、氧杂环丙基、氧杂环丁基、氧杂环戊基、二氧杂环戊基、氧杂环己基、二氧杂环己基、氧杂环庚基、二氧杂环庚基、螺[2.4]庚烷、螺[3.4]辛烷、螺[4.4]壬烷、螺[2.5]辛烷、螺[3.5]壬烷、螺[4.5]癸烷、氮杂螺[2.4]庚烷、氮杂螺[3.4]辛烷、氮杂螺[4.4]壬烷、氮杂螺[2.5]辛烷、氮杂螺[3.5]壬烷、氮杂螺[4.5]癸烷、二氮杂螺[2.4]庚烷、二氮杂螺[3.4]辛烷、二氮杂螺[4.4]壬烷、二氮杂螺[2.5]辛烷、二氮杂螺[3.5]壬烷、二氮杂螺[4.5]癸烷、氧氮杂螺[2.4]庚烷、氧氮杂螺[3.4]辛烷、氧氮杂螺[4.4]壬烷、氧氮杂螺[2.5]辛烷、氧氮杂螺[3.5]壬烷、氧氮杂螺[4.5]癸烷、氧杂螺[2.4]庚烷、氧杂螺[3.4]辛烷、氧杂螺[4.4]壬烷、氧杂螺[2.5]辛烷、氧杂螺[3.5]壬烷、氧杂螺[4.5]癸烷、二氧杂螺[2.4]庚烷、二氧杂螺[3.4]辛烷、二氧杂螺[4.4]壬烷、二氧杂螺[2.5]辛烷、二氧杂螺[3.5]壬烷或二氧杂螺[4.5]癸烷,所述的甲基、乙基、丙基、异丙基、正丁基、仲丁基、异丁基、叔丁基、环丙基、环丁基、环戊基、环己基、环庚基、氮杂环丙基、氮杂环丁基、氮杂环戊基、二氮杂环戊基、氧氮杂环戊基、氮杂环己基、二氮杂环己基、氧氮杂环己基、氮杂环庚基、二氮杂环庚基、氧氮杂环庚基、氧杂环丙基、氧杂环丁基、氧杂环戊基、二氧杂环戊基、氧杂环己基、二氧杂环己基、氧杂环庚基、二氧杂环庚基、苯基、萘基、噻吩基、吡咯基、呋喃基、咪唑基、噁唑基、噻唑基、吡唑基、异噁唑基、异噻唑基、噁二唑基、三唑基、吡啶基、嘧啶基、吡嗪基、螺[2.4]庚烷、螺[3.4]辛烷、螺[4.4]壬烷、螺[2.5]辛烷、螺[3.5]壬烷、螺[4.5]癸烷、氮杂螺[2.4]庚烷、氮杂螺[3.4]辛烷、氮杂螺[4.4]壬烷、氮杂螺[2.5]辛烷、氮杂螺[3.5]壬烷、氮杂螺[4.5]癸烷、二氮杂螺[2.4]庚烷、二氮杂螺[3.4]辛烷、二氮杂螺[4.4]壬烷、二氮杂螺[2.5]辛烷、二氮杂螺[3.5]壬烷、二氮杂螺[4.5]癸烷、氧氮杂螺[2.4]庚烷、氧氮杂螺[3.4]辛烷、氧氮杂螺[4.4]壬烷、氧氮杂螺[2.5]辛烷、氧氮杂螺[3.5]壬烷、氧氮杂螺[4.5]癸烷、氧杂螺[2.4]庚烷、氧杂螺[3.4]辛烷、氧杂螺[4.4]壬烷、氧杂螺[2.5]辛烷、氧杂螺[3.5]壬烷、氧杂螺[4.5]癸烷、二氧杂螺[2.4]庚烷、二氧杂螺[3.4]辛烷、二氧杂螺[4.4]壬烷、二氧杂螺[2.5]辛烷、二氧杂螺[3.5]壬烷和二氧杂螺[4.5]癸烷可以被一个或多个羟基、氧代、氨基、羧基、卤素、氰基、硝基、C1-3烷基、C3-6环烷基、C3-6杂环烷基、芳基、杂芳基、卤代C1-3烷基、C1-3烷氧基、羟基C1-3烷基、羧基C1-3烷基、芳基C1-3烷基、杂芳基C1-3烷基、单C1-3烷基氨基、双C1-3烷基氨基、C1-3烷基酰基、芳基酰基、杂芳基酰基、C1-3烷氧基酰基、C1-3烷基酰基氧基、氨基酰基、单C1-3烷基氨基酰基、双C1-3烷基氨基酰基或C1-3烷基酰基氨基取代;
Rc选自氢、羟基、氨基、羧基、卤素、氰基、硝基、C1-6烷基、卤代C1-6烷基、羟基C1-6烷基、氨基C1-6烷基、羧基C1-6烷基、氰基C1-6烷基、硝基C1-6烷基、C1-6烷氧基、单C1-6烷基氨基、双C1-6烷基氨基、C3-6环烷基和C3-6杂环烷基,其中f选自1和2;
L1、L2分别独立地选自以下基团:
p、q分别独立地选自1和2;
R1、R2分别独立地选自氢、甲基、乙基、丙基、异丙基、丁基、异丁基、叔丁基、环丙烷基、环丁烷基、环戊烷基、环己烷基和苯基,所述的甲基、乙基、丙基、异丙基、丁基、异丁基、叔丁基、环丙烷基、环丁烷基、环戊烷基、环己烷基和苯基可以被一个或多个卤素、羟基、氨基、羧基、氰基、硝基、C1-6烷基、C1-6环烷基、C1-6杂环烷基、C1-6烷氧基、羟基-C1-6烷基、羧基-C1-6烷基、单C1-6烷基氨基、双C1-6烷基氨基、C1-6烷基酰基、C1-6烷氧基酰基、C1-6烷基酰基氧基、氨基酰基、单C1-6烷基氨基酰基、双C1-6烷基氨基酰基或C1-6烷基酰基氨基取代;
R3、R4分别独立地选自氢、C1-6烷基、C3-6环烷基、C3-6环烷基-C1-6烷基-、C3-6杂环烷基和C3-6杂环烷基-C1-6烷基-,所述的C1-6烷基、C3-6环烷基、C3-6环烷基-C1-6烷基-、C3-6杂环烷基和C3-6杂环烷基-C1-6烷基-可以被一个或多个卤素、羟基、氨基、羧基、氰基、硝基、C1-6烷基、C1-6烷氧基、芳基或杂芳基取代;和
R5、R6分别独立地选自氢、卤素、氰基、羟基、氨基、羧基、硝基、C1-6烷基、C3-6环烷基、C3-6杂环烷基、C1-6烷氧基卤代烷基、氰基C1-6烷基、羟基C1-6烷基、氨基C1-6烷基、羧基C1-6烷基、硝基C1-6烷基、C3-6环烷基-C1-6烷基或C3-6杂环烷基-C1-6烷基,或者当m或n为2时,各自独立地选自氮杂螺烷基、氧氮杂螺烷基和氮杂双环烷基,优选地,所述氮杂螺烷基为氮杂螺[2.4]庚烷基、氮杂螺[3.4]辛烷基、氮杂螺[4.4]壬烷基、氮杂螺[2.5]辛烷基、氮杂螺[3.5]壬烷基、氮杂螺[4.5]癸烷基、氮杂螺[2.6]壬烷基或氮杂螺[3.6]癸烷基,所述氧氮杂螺烷基为氧杂-氮杂螺[2.4]庚烷基、氧杂-氮杂螺[3.4]辛烷基、氧杂-氮杂螺[4.4]壬烷基、二氧杂-氮杂螺[4.4]壬烷基、氧杂-氮杂螺[4.5]癸烷基、二氧杂-氮杂螺[4.5]癸烷基或三氧杂-氮杂螺[4.5]癸烷基,以及所述氮杂双环烷基为氮杂双环[3.1.0]己烷、氮杂双环[3.2.0]庚烷基、八氢环戊并吡咯基、八氢-1H-异吲哚基、八氢-1H-吲哚基、氮杂双环[2.2.1]庚烷基。
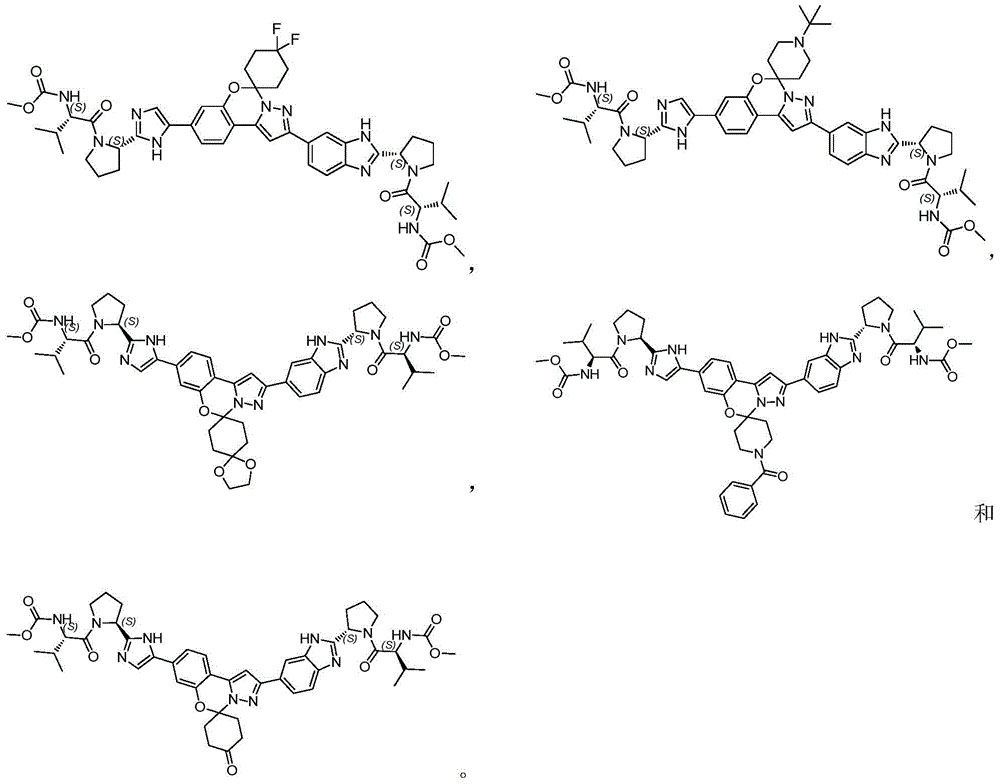
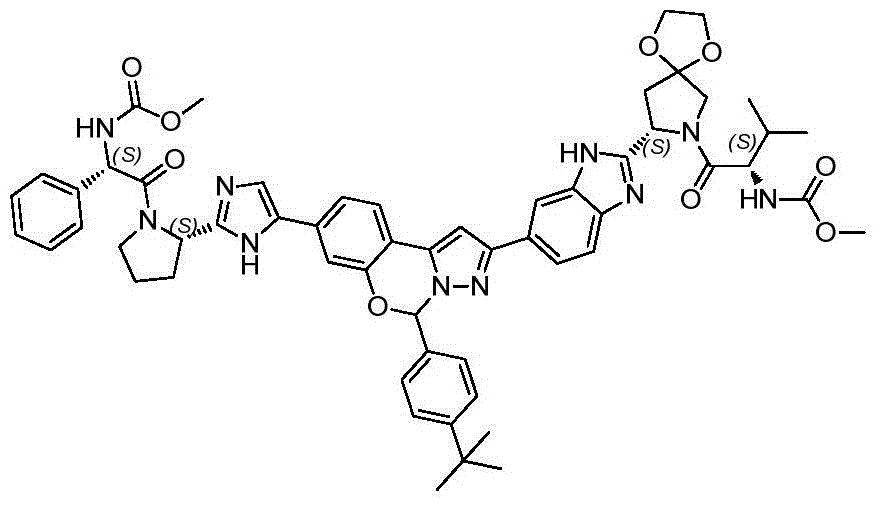
本发明提供了以下具体化合物:
本发明还提供了用于制备本发明化合物或其药学可接受的盐、异构体、溶剂合物、结晶或前药的式(II)的中间体:
其中,
Ra、Rb分别独立地选自H、烷基、环烷基、杂环烷基、芳基和杂芳基,或者Ra、Rb与其连接的C原子一起形成环烷基、杂环烷基、螺环烷基或杂螺环烷基,所述的烷基、环烷基、杂环烷基、螺环烷基、杂螺环烷基、芳基和杂芳基可以被一个或多个羟基、氧代、氨基、羧基、卤素、氰基、硝基、烷基、环烷基、杂环烷基、芳基、杂芳基、卤代烷基、烷氧基、羟基烷基、羧基烷基、芳基烷基、杂芳基烷基、单烷基氨基、双烷基氨基、烷基酰基、芳基酰基、杂芳基酰基、烷氧基酰基、烷基酰基氧基、氨基酰基、单烷基氨基酰基、双烷基氨基酰基或烷基酰基氨基取代;
Rc选自氢、羟基、氨基、羧基、卤素、氰基、硝基、烷基、卤代烷基、羟基烷基、氨基烷基、羧基烷基、氰基烷基、硝基烷基、烷氧基、单烷基氨基、双烷基氨基、环烷基和杂环烷基,其中f选自1、2和3;
R21、R22分别独立地选自三氟甲磺酸酯基、甲磺酸酯基、对甲苯磺酸酯基和R31、R32分别独立地选自氢和C1-6烷基,或R31、R32环合,一起与它们连接的原子构成5至7元任选被一个或多个C1-6烷基、卤素、氨基、羧基、氰基、硝基或C1-6烷氧基取代的杂环;优选地,R21、R22为
另一方面,本发明提供本发明的通式(I)的化合物的制备方法,包括:
a)式(1)的化合物与式(N)的化合物缩合反应得到式(2)的中间体;
b)式(2)的中间体与水合肼反应得到式(3)的中间体;
c)式(3)的中间体与式(M)的化合物反应得到式(4)的中间体;
d)式(4)的中间体经还原反应得到式(5)的中间体;
e)式(5)的中间体经偶联反应得到式(6)的中间体;
f)式(6)的中间体经偶联反应得到式(7)的中间体;
g)式(7)的中间体酰胺化得到通式(I)的化合物。
其中,Ra、Rb、Rc、R1、R2、R3、R4、R5、R6、L1、L2和f具有通式I中的含义,M1表示氢、三甲基硅基乙氧基、叔丁氧羰基,M2表示氢、三甲基硅基乙氧基、叔丁氧羰基,Y表示卤素,优选为氯、溴、碘。
第三方面,本发明提供药物组合物,其包含本发明的化合物或其药学可接受的盐、异构体、溶剂合物、结晶或前药。
在一些实施方案中,本发明提供包含本发明的通式I的化合物或其药学可接受的盐、异构体、溶剂合物、结晶或前药和药学可接受的载体的组合物。在另一些实施方案中,本发明提供包含本发明的通式I的化合物或其药学可接受的盐、异构体、溶剂合物、结晶或前药和另一种或多种HCV抑制剂的组合物。
在一些实施方案中,本发明提供本发明的通式I的化合物或其药学可接受的盐、异构体、溶剂合物、结晶或前药及包含本发明的通式I的化合物或其药学可接受的盐、异构体、溶剂合物、结晶或前药的药物组合物,所述化合物或药物组合物用于治疗和/或预防由丙型肝炎病毒引起的肝脏疾病。
在一些实施方案中,本发明提供药物组合物,其包含本发明的通式I的化合物或其药学可接受的盐、异构体、溶剂合物、结晶或前药,还包含选自下列组成的一种或多种:干扰素、三唑类核苷类药物、甘草甜素复方制剂、HCV蛋白酶抑制剂等。
可以将本发明的化合物或其药学可接受的盐、异构体、溶剂合物、结晶或前药与药学上可接受的载体、稀释剂或赋形剂混合制备成药物制剂,以适合于经口或胃肠外给药。给药方法包括,但不限于皮内、肌内、腹膜内、静脉内、皮下、鼻内和经口途径。所述制剂可以通过任何途径施用,例如通过输注或推注,通过经上皮或皮肤粘膜(例如口腔粘膜或直肠等)吸收的途径施用。给药可以是全身的或局部的。经口施用制剂的实例包括固体或液体剂型,具体而言,包括片剂、丸剂、粒剂、粉剂、胶囊剂、糖浆、乳剂、混悬剂等。所述制剂可通过本领域已知的方法制备,且包含药物制剂领域常规使用的载体、稀释剂或赋形剂。
第四方面,本发明提供本发明的化合物或其药学可接受的盐、异构体、溶剂合物、结晶或前药或本发明的药物组合物治疗和/或预防由丙型肝炎病毒引起的肝脏疾病的方法和在制备预防和/或治疗丙型肝炎病毒引起的肝脏疾病药物中的应用,包括向丙型肝炎病毒引起的肝脏疾病患者施用本发明的化合物或其药学可接受的盐、异构体、溶剂合物、结晶或前药或者包含本发明的化合物或其药学可接受的盐、异构体、溶剂合物、结晶或前药的药物组合物,以有效抑制HCV,阻止病程进展。在一些实施方案中,本发明提供用于治疗和/或预防由丙型肝炎病毒引起的感染的方法,所述方法包括向有此需要的个体给予治疗和/或预防有效量的本发明的化合物或其药学可接受的盐、异构体、溶剂合物、结晶或前药或本发明的药物组合物。可以向有需要的哺乳动物给予本发明的化合物或其药学可接受的盐、异构体、溶剂合物、结晶或前药或本发明的药物组合物以抑制HCV,阻止病程进展。
在另一些实施方案中,所述治疗和/或预防由丙型肝炎病毒引起的感染的方法或用途还包括向所述个体给予本发明的式I的化合物或其药学可接受的盐、异构体、溶剂合物、结晶或前药或含有它们的药物组合物且在给予本发明的式I的化合物或其药学可接受的盐、异构体、溶剂合物、结晶或前药或含有它们的药物组合物之前、之后或同时给予至少一种具有抗HCV活性的其它化合物。在一些实施方案中,所述其它化合物中的至少一种为干扰素或利巴韦林。在一些具体的实施方案中,所述干扰素选自干扰素α2B、PEG化的干扰素α、同感干扰素、干扰素α2A和成淋巴细胞样干扰素τ。在另一些实施方案中,所述其它化合物中的至少一种选自白细胞介素2、白细胞介素6、白细胞介素12、干扰RNA、反义RNA、咪喹莫特、利巴韦林、5’-单磷酸肌苷脱氢酶抑制剂、金刚烷胺和金刚乙胺。在另一些实施方案中,所述其它化合物中的至少一种可有效抑制靶标的功能以治疗HCV感染,所述靶标选自HCV金属蛋白酶、HCV丝氨酸蛋白酶、HCV聚合酶、HCV解旋酶、HCV NS4B蛋白、HCV NS5B蛋白、HCV进入、HCV组装、HCV释出、HCV NS3/4A蛋白和IMPDH。
术语说明
本发明的“烷基”是指直链或支链的饱和烃基。合适的烷基为取代或未取代的C1-10烷基,例如甲基、乙基、正丙基、异丙基、环丙基、正丁基、仲丁基、异丁基、叔丁基、环丁基、正戊基、异戊基、环戊基、环己基、正己基等。
本发明的“环烷基”是指环状的饱和烃基。合适的环烷基可以为取代或未取代的具有3-10个碳原子的单环、二环或三环饱和烃基,例如环丙基、环丁基、环戊基、环己基。
本发明的“烷氧基”是指-O-烷基。根据本发明,合适的烷氧基为C1-10烷氧基,如C1-8烷氧基,C1-7烷氧基,C1-6烷氧基,C1-5烷氧基,C1-4烷氧基,C1-3烷氧基,包括甲氧基、乙氧基、丙氧基、异丙氧基、异丁氧基、仲丁氧基等。
本发明的“杂环烷基”是指含有杂原子的环状的饱和烃基。
本发明的“杂原子”是指N、O或S。
本发明的“卤素”是指氟、氯、溴、碘。
本发明的“卤代烷基”是指至少被一个卤素取代的烷基。
本发明的“卤代烷氧基”是指至少被一个卤素取代的烷氧基。
本发明的“螺环烷基”是指共用一个碳原子的双环脂环烃基,本发明的“螺C7-13环烷基”是指由7-13个原子构成、且共用一个碳原子的双环脂环烃基,本发明的“螺C7-11环烷基”是指由7-11个原子构成、且共用一个碳原子的双环脂环烃基。根据本发明,合适的螺环烷基,如螺[2.4]庚烷、螺[3.4]辛烷、螺[4.4]壬烷、螺[2.5]辛烷、螺[3.5]壬烷、螺[4.5]癸烷等。
本发明的“杂螺环烷基”是指至少含有一个杂原子、且共用一个碳原子的双环脂环烃基,本发明的“氮杂螺C7-13环烷基”是指含有一个氮原子、由7-13个原子构成、且共用一个碳原子的双环脂环烃基,本发明的“二氮杂螺C7-13环烷基”是指含有两个氮原子、由7-13个原子构成、且共用一个碳原子的双环脂环烃基,本发明的“氧氮杂螺C7-13环烷基”是指含有一个氮原子和一个氧原子、由7-13个原子构成、且共用一个碳原子的双环脂环烃基,本发明的“氧杂螺C7-13环烷基”是指含有一个氧原子、由7-13个原子构成、且共用一个碳原子的双环脂环烃基,本发明的“二氧杂螺C7-13环烷基”是指含有两个氧原子、由7-13个原子构成、且共用一个碳原子的双环脂环烃基,根据本发明,合适的杂螺环烷基,如氮杂螺[2.4]庚烷、氮杂螺[3.4]辛烷、氮杂螺[4.4]壬烷、氮杂螺[2.5]辛烷、氮杂螺[3.5]壬烷、氮杂螺[4.5]癸烷、二氮杂螺[2.4]庚烷、二氮杂螺[3.4]辛烷、二氮杂螺[4.4]壬烷、二氮杂螺[2.5]辛烷、二氮杂螺[3.5]壬烷、二氮杂螺[4.5]癸烷、氧氮杂螺[2.4]庚烷、氧氮杂螺[3.4]辛烷、氧氮杂螺[4.4]壬烷、氧氮杂螺[2.5]辛烷、氧氮杂螺[3.5]壬烷、氧氮杂螺[4.5]癸烷、氧杂螺[2.4]庚烷、氧杂螺[3.4]辛烷、氧杂螺[4.4]壬烷、氧杂螺[2.5]辛烷、氧杂螺[3.5]壬烷、氧杂螺[4.5]癸烷、二氧杂螺[2.4]庚烷、二氧杂螺[3.4]辛烷、二氧杂螺[4.4]壬烷、二氧杂螺[2.5]辛烷、二氧杂螺[3.5]壬烷、二氧杂螺[4.5]癸烷等。
本发明的“氨基酰基”是指-C(O)-NH2。
本发明的“单烷基氨基酰基”是指-C(O)-NH-烷基。
本发明的“双烷基氨基酰基”是指-C(O)-N(烷基)(烷基)。
本发明的“芳基”是指可以包含单环或多稠环例如二环或三环的芳香环的芳香系,其中至少稠合的环的一部分形成共轭的芳香系,其含有5至50个碳原子,优选约6至约14个碳原子。合适的芳基包括但不限于苯基、萘基、联苯基、蒽基、四氢萘基、芴基、茚满基、亚联苯基和苊基。
本发明的“杂芳基”是指芳族单环或多稠环如二环或三环的至少有一个碳原子被杂原子替代的芳香性基团,所述的杂原子为O、S、N。合适的杂芳基包括但不限于咪唑基、苯并咪唑基、咪唑并吡啶基、喹唑啉酮基、吡咯基、咪唑酮基、呋喃基、噻吩基、吡唑基、噁唑基、噻唑基、异噁唑基、异噻唑基、噁二唑基、三唑基等。
本发明的“C5-8杂芳基”是指由五个原子、六个原子、七个原子或八个原子构成的单环杂芳基。
本发明的“溶剂合物”在常规意义上是指溶质(如活性化合物、活性化合物的盐)和溶剂(如水)组合形成的复合物。溶剂是指本领域的技术人员所知的或容易确定的溶剂。如果是水,则溶剂合物通常被称作水合物,例如一水合物、二水合物、三水合物等。
本发明的“结晶”是指本发明所述的化合物形成的各种固体形态,包括晶型、无定形。
本发明的“异构体”是指分子中原子在空间上排列方式不同所产生的立体异构体,包括对映异构体和非对映异构体。
本发明的“前药”是指在生物体的生理条件下,由于与酶、胃酸等反应而转化成本发明的化合物的化合物,即通过酶的氧化、还原、水解等转化成本发明的化合物的化合物和/或通过胃酸等的水解反应等转化成本发明的化合物的化合物。
本发明的“药学可接受的盐”是指本发明的化合物与酸形成的药学上可接受的盐,所述的酸包括但不限于磷酸、硫酸、盐酸、氢溴酸、柠檬酸、马来酸、丙二酸、扁桃酸、琥珀酸、富马酸、醋酸、乳酸、硝酸等等。
本发明的“药物组合物”是指包含任何一种本文所述的化合物,包括异构体、前药、溶剂合物、药学上可接受的盐或其化学的保护形式,和一种或多种药学上可接受载体的混合物。
本发明的“药学上可接受的载体”是指对有机体不引起明显刺激性和不干扰所给予化合物的生物活性和性质的载体,包含溶剂、稀释剂或其它赋形剂、分散剂、表面活性剂、等渗剂、增稠剂或乳化剂、防腐剂、固体粘合剂、润滑剂等。除非任何常规载体介质与本发明化合物不相容。可以作为药学上可接受的载体的一些实例包括,但不限于糖类,如乳糖、葡萄糖和蔗糖;淀粉,如玉米淀粉和马铃薯淀粉;纤维素及其衍生物,如羧甲基纤维素钠、以及纤维素和乙酸纤维素;麦芽、明胶等。
本发明的“赋形剂”指加入到药用组合物中以进一步促进给予化合物的惰性物质。赋形剂可以包括碳酸钙、磷酸钙、多种糖类和多种类型的淀粉、纤维素衍生物、明胶、植物油、聚乙二醇。
具体实施方式
下面代表性的实施例是为了更好地说明本发明,而非用于限制本发明的保护范围。
实施例1N-((2S)-1-((S)-2-(5-(2-(4-(2-((2S)-1-((S)-2-甲氧羰基氨基-3-甲基丁酰基)吡咯-2-基)-1H-咪唑-5-基)苯基)-5-苯基-5H-苯并[e]吡唑并[1,5-c][1,3]噁嗪-8-基)-1H-咪唑-2-基)吡咯-1-基)-3-甲基-1-氧代丁烷-2-基)氨基甲酸甲酯
步骤1(E)-3-(4-溴-2-羟基苯基)-1-(4-碘苯基)-2-丙烯-1-酮的制备
称取5g 4-溴-2-羟基苯甲醛和6.4g 4-碘苯乙酮于反应瓶中,加入60mL无水乙醇,0-4℃下加入25mL 10%KOH,室温反应18h,反应结束后,浓缩,加水,浓盐酸调PH至6,过滤,水洗,干燥得标题化合物。
1H NMR:(300MHz,d6-DMSO)δ10.83(s,1H),7.95-7.99(m,3H),7.82-7.90(m,4H),7.06-7.12(m,2H)。
步骤25-溴-2-(3-(4-碘苯基)-4,5-二氢-1H-吡唑-5-基)苯酚的制备
称取5.9g步骤1所得化合物(E)-3-(4-溴-2-羟基苯基)-1-(4-碘苯基)-2-丙烯-1-酮于反应瓶中,加入100mL THF溶解,加入1.3g 80%水合肼,室温反应17h,反应结束后,浓缩至干,加入乙醇,过滤,干燥得标题化合物。
1H NMR:(300MHz,d6-DMSO)δ10.10(s,1H),7.72(d,2H),7.40(d,2H),7.20(d,1H),6.94-6.98(m,2H),4.96(m,1H),3.36-3.45(m,1H),2.64-2.73(m,1H)。
步骤38-溴-2-(4-碘苯基)-5-苯基-5,10b-二氢-1H-苯并[e]吡唑并[1,5-c][1,3]噁嗪的制备
称取1g步骤2制备的化合物5-溴-2-(3-(4-碘苯基)-4,5-二氢-1H-吡唑-5-基)苯酚于反应瓶中,加入5mL THF与20mL甲醇混合溶液溶解,加入360mg苯甲醛,室温反应22h,反应结束后,过滤,干燥得标题化合物。
MS(ESI):[M+H]+=531。
步骤48-溴-2-(4-碘苯基)-5-苯基-5H-苯并[e]吡唑并[1,5-c][1,3]噁嗪的制备
称取1g步骤3制备的化合物8-溴-2-(4-碘苯基)-5-苯基-5,10b-二氢-1H-苯并[e]吡唑并[1,5-c][1,3]噁嗪于反应瓶中,加入40mL乙腈和5mL水悬浮,加入2g硝酸铈铵,室温反应17h,反应结束后,过滤,干燥得标题化合物。
1H NMR(300MHz,d6-DMSO)δ7.81(d,2H),7.70(d,1H),7.63(d,2H),7.47(m,3H),7.41(m,4H),7.24(m,2H)。
步骤55-苯基-8-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2基)-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯基)-5H-苯并[e]吡唑并[1,5-c][1,3]噁嗪的制备
称取350mg步骤4制备的化合物8-溴-2-(4-碘苯基)-5-苯基-5H-苯并[e]吡唑并[1,5-c][1,3]噁嗪、386mg联硼酸频哪醇酯、54mg Pd(dppf)Cl2、260mg醋酸钾于反应瓶中,加入10mL二氧六环,150℃反应2h,浓缩,柱层析提纯得标题化合物。
MS(ESI):[M+H]+=577。
步骤6(2S)-1-叔丁氧羰基-2-甲酰基吡咯烷的制备
在250mL的茄形瓶中,加入16mL草酰氯,125mL无水二氯甲烷,氮气保护且-78℃下,缓慢加入10mL溶有23mL DMSO的二氯甲烷溶液,10mL溶有10g(s)-1-叔丁氧羰基-2-羟甲基吡咯烷的二氯甲烷溶液,加完后,-78℃下继续搅拌30min,然后慢慢滴加46mL三乙胺(TEA),滴毕,0-4℃搅拌30min,反应结束后,把反应液慢慢倒入100g冰块中,加入200mL饱和氯化钠水溶液,二氯甲烷萃取(3×200mL),收集有机相,无水硫酸钠干燥,浓缩,得到标题化合物,直接用于下一步反应。
MS(ESI):[M+H]+=200。
步骤7(2S)-1-叔丁氧羰基-2-(1H-咪唑-2-基)吡咯烷的制备
称取12g步骤6制得的化合物(2S)-1-叔丁氧羰基-2-甲酰基吡咯烷于100mL反应瓶中,加入30mL无水甲醇和30mL氨水溶液溶解,0-4℃下,缓慢滴加14mL乙二醛,室温反应16h,反应结束后,反应液经浓缩去除大部分的乙醇,加入二氯甲烷萃取(3×50mL),合并有机层,无水硫酸钠干燥,过滤,浓缩柱层析纯化得到标题化合物。
MS(ESI):[M+H]+=238。
步骤8(2S)-1-叔丁氧羰基-2-(4,5-二溴-1H-咪唑-2-基)吡咯烷的制备
称取2.4g步骤7制备的化合物(2S)-1-叔丁氧基羰基-2-(1H-咪唑-2-基)吡咯烷于100mL反应中,加入3.6g N-溴代丁二酰亚胺(NBS)和30mL THF,氮气保护条件下室温反应3h,反应结束后,加入20mL水,乙酸乙酯萃取(3×60mL),合并有机相,干燥,过滤,浓缩,柱层析纯化得到标题化合物。
MS(ESI):[M+H]+=394。
步骤9(2S)-1-叔丁氧羰基-2-(5-溴-1H-咪唑-2-基)吡咯烷的制备
称取9.58g步骤8制备的化合物(2S)-1-叔丁氧羰基-2-(4,5-二溴-1H-咪唑-2-基)吡咯烷和3.0g亚硫酸钠于100mL反应瓶中,加入50mL体积比为1:1的乙醇/水混合溶液,90℃反应24h,过滤,浓缩,柱层析得到标题化合物。
MS(ESI):[M+H]+=316。
步骤101-叔丁氧羰基-(S)-2-(5-(2-(4-(2-((2S)-1-叔丁氧羰基吡咯-2-基)-1H-咪唑-5-基)苯基)-5-苯基-5H-苯并[e]吡唑并[1,5-c][1,3]噁嗪-8-基)-1H-咪唑-2-基)吡咯的制备
称取523mg步骤5制得的化合物5-苯基-8-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2基)-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯基)-5H-苯并[e]吡唑并[1,5-c][1,3]噁嗪于干燥的100ml两口烧瓶中,加入631mg步骤9制得的化合物(2S)-1-叔丁氧基羰基-2-(5-溴-1H-咪唑-2-基)吡咯烷,83mgPd(dppf)Cl2,0.39g碳酸铯,3mL水和9mL1,4-二氧六烷,氮气保护条件下100℃反应15h,反应结束后,反应液冷却到室温,加入50mL水,室温搅拌2h,乙酸乙酯萃取(3×60mL),合并有机相,干燥,过滤,浓缩,柱层析纯化得到标题化合物。
MS(ESI):[M+H]+=795。
步骤11(S)-2-(5-(2-(4-(2-((2S)-吡咯-2-基)-1H-咪唑-5-基)苯基)-5-苯基-5H-苯并[e]吡唑并[1,5-c][1,3]噁嗪-8-基)-1H-咪唑-2-基)吡咯的制备
称取565mg步骤10制备的化合物1-叔丁氧羰基-(S)-2-(5-(2-(4-(2-((2S)-1-叔丁氧羰基吡咯-2-基)-1H-咪唑-5-基)苯基)-5-苯基-5H-苯并[e]吡唑并[1,5-c][1,3]噁嗪-8-基)-1H-咪唑-2-基)吡咯,加入5mL DCM溶解,加入1mL TFA,室温反应2h,浓缩干,加水,饱和碳酸氢钠溶液调PH至8,过滤,干燥得标题化合物。
MS(ESI):[M+H]+=595。
步骤12N-((2S)-1-((S)-2-(5-(2-(4-(2-((2S)-1-((S)-2-甲氧羰基氨基-3-甲基丁酰基)吡咯-2-基)-1H-咪唑-5-基)苯基)-5-苯基-5H-苯并[e]吡唑并[1,5-c][1,3]噁嗪-8-基)-1H-咪唑-2-基)吡咯-1-基)-3-甲基-1-氧代丁烷-2-基)氨基甲酸甲酯的制备
称取100mg步骤11制备的化合物(S)-2-(5-(2-(4-(2-((2S)-吡咯-2-基)-1H-咪唑-5-基)苯基)-5-苯基-5H-苯并[e]吡唑并[1,5-c][1,3]噁嗪-8-基)-1H-咪唑-2-基)吡咯和66mg moc-缬氨酸,加入10mL乙腈,冰浴冷却下加入148mg DIPEA,反应0.5h,加入72mgEDCI,12mg HOBT,室温反应18h,浓缩,柱层析提纯得标题化合物。
1H NMR(500MHz,d6-DMSO)δ7.81-7.88(m,4H),7.38-7.71(m,10H),7.21-7.27(m,4H),5.05-5.11(m,2H),4.08-4.09(m,2H),3.81-3.83(m,4H),3.54(s,6H),1.97-2.25(m,10H),0.81-0.89(m,12H)。
MS(ESI):[M+H]+=909。
实施例2N-((2S)-1-((S)-2-(5-(2-(4-(2-((2S)-1-((S)-2-甲氧羰基氨基-3-甲基丁酰基)吡咯-2-基)-1H-咪唑-5-基)苯基)-5-(4-叔丁基苯基)-5H-苯并[e]吡唑并[1,5-c][1,3]噁嗪-8-基)-1H-咪唑-2-基)吡咯-1-基)-3-甲基-1-氧代丁烷-2-基)氨基甲酸甲酯
步骤18-溴-2-(4-碘苯基)-5-(4-叔丁基苯基)-5,10b-二氢-1H-苯并[e]吡唑并[1,5-c][1,3]噁嗪的制备
以实施例1步骤2制备的化合物5-溴-2-(3-(4-碘苯基)-4,5-二氢-1H-吡唑-5-基)苯酚和4-叔丁基苯甲醛为原料,按照实施例1步骤3的方法制得标题化合物。
1H NMR(300MHz,d6-DMSO)δ7.77(d,2H),7.40-7.47(m,6H),7.14(s,1H),7.0-7.08(m,2H),6.86(s,1H),4.82(d,1H),3.51-3.60(m,1H),3.33(m,1H),1.25(s,9H)。
步骤28-溴-2-(4-碘苯基)-5-(4-叔丁基苯基)-5H-苯并[e]吡唑并[1,5-c][1,3]噁嗪的制备
以步骤1制备的化合物8-溴-2-(4-碘苯基)-5-(4-叔丁基苯基)-5,10b-二氢-1H-苯并[e]吡唑并[1,5-c][1,3]噁嗪为原料,按照实施例1步骤4的方法制得标题化合物。
MS(ESI):[M+H]+=585。
步骤35-(4-叔丁基苯基)-8-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2基)-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯基)-5H-苯并[e]吡唑并[1,5-c][1,3]噁嗪的制备
以步骤2制备的化合物8-溴-2-(4-碘苯基)-5-(4-叔丁基苯基)-5H-苯并[e]吡唑并[1,5-c][1,3]噁嗪为原料,按照实施例1步骤5的方法制得标题化合物。
MS(ESI):[M+H]+=633。
步骤4(S)-2-(5-(2-(4-(2-((2S)-吡咯-2-基)-1H-咪唑-5-基)苯基)-5-(4-叔丁基苯基)-5H-苯并[e]吡唑并[1,5-c][1,3]噁嗪-8-基)-1H-咪唑-2-基)吡咯的制备
以步骤3制备的化合物5-(4-叔丁基苯基)-8-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2基)-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯基)-5H-苯并[e]吡唑并[1,5-c][1,3]噁嗪和(2S)-1-叔丁氧基羰基-2-(5-溴-1H-咪唑-2-基)吡咯烷为原料,按照实施例1步骤10和11的方法制得标题化合物。
MS(ESI):[M+H]+=651。
步骤5N-((2S)-1-((S)-2-(5-(2-(4-(2-((2S)-1-((S)-2-甲氧羰基氨基-3-甲基丁酰基)吡咯-2-基)-1H-咪唑-5-基)苯基)-5-(4-叔丁基苯基)-5H-苯并[e]吡唑并[1,5-c][1,3]噁嗪-8-基)-1H-咪唑-2-基)吡咯-1-基)-3-甲基-1-氧代丁烷-2-基)氨基甲酸甲酯的制备
以步骤4制备的化合物(S)-2-(5-(2-(4-(2-((2S)-吡咯-2-基)-1H-咪唑-5-基)苯基)-5-(4-叔丁基苯基)-5H-苯并[e]吡唑并[1,5-c][1,3]噁嗪-8-基)-1H-咪唑-2-基)吡咯和MOC-缬氨酸为原料,按照实施例1步骤12的方法制得标题化合物。
1H NMR(300MHz,d6-DMSO)δ11.84(s,1H),11.75(s,1H),7.79-7.88(m,2H),7.67(m,2H),7.21-7.57(m,10H),7.07-7.12(m,3H),5.06(m,2H),4.07(m,2H),3.80(m,4H),3.54(s,6H),2.13(m,4H),1.96(m,6H),1.24(s,9H),0.84-0.91(m,12H)。
MS(ESI):[M+H]+=965。
实施例3N-((2S)-1-((S)-2-(5-(2-(4-(2-((2S)-1-((S)-2-甲氧羰基氨基-3-甲基丁酰基)吡咯-2-基)-1H-咪唑-5-基)苯基)-5-(5-乙基噻吩-2-基)-5H-苯并[e]吡唑并[1,5-c][1,3]噁嗪-8-基)-1H-咪唑-2-基)吡咯-1-基)-3-甲基-1-氧代丁烷-2-基)氨基甲酸甲酯
步骤18-溴-2-(4-碘苯基)-5-(5-乙基噻吩-2-基)-5,10b-二氢-1H-苯并[e]吡唑并[1,5-c][1,3]噁嗪的制备
以实施例1步骤2制备的化合物5-溴-2-(3-(4-碘苯基)-4,5-二氢-1H-吡咯-5-基)苯酚和5-乙基噻吩-2-甲醛为原料,按照实施例1步骤3的方法制得标题化合物。
1H NMR(300MHz,d6-DMSO)δ7.76(d,2H),7.46(d,2H),7.05-7.12(m,3H),6.93-6.96(m,2H),6.73(d,1H),5.04(d,1H),3.54-3.64(m,1H),3.36(m,1H),2.71-2.79(m,2H),1.20(t,3H)。步骤25-(5-乙基噻吩-2-基)-8-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2基)-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯基)-5H-苯并[e]吡唑并[1,5-c][1,3]噁嗪的制备
以步骤1制备的化合物8-溴-2-(4-碘苯基)-5-(5-乙基噻吩-2-基)-5,10b-二氢-1H-苯并[e]吡唑并[1,5-c][1,3]噁嗪为原料,按照实施例1步骤4和5的方法制得标题化合物。
MS(ESI):[M+H]+=611。
步骤31-叔丁氧羰基-(S)-2-(5-(2-(4-(2-((2S)-1-叔丁氧羰基吡咯-2-基)-1H-咪唑-5-基)苯基)-5-(5-乙基噻吩-2-基)-5H-苯并[e]吡唑并[1,5-c][1,3]噁嗪-8-基)-1H-咪唑-2-基)吡咯的制备
以步骤2制备的化合物5-(5-乙基噻吩-2-基)-8-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯基)-5H-苯并[e]吡唑并[1,5-c][1,3]噁嗪和实施例1步骤9所得物(2S)-1-叔丁氧基羰基-2-(5-溴-1H-咪唑-2-基)吡咯烷为原料,按照实施例1步骤10的方法制得标题化合物。
MS(ESI):[M+H]+=829。
步骤4(S)-2-(5-(2-(4-(2-((2S)-吡咯-2-基)-1H-咪唑-5-基)苯基)-5-(5-乙基噻吩-2-基)-5H-苯并[e]吡唑并[1,5-c][1,3]噁嗪-8-基)-1H-咪唑-2-基)吡咯的制备
以步骤3制备的化合物(2S)-2-(5-(4-(8-(2-((2S)-1-叔丁氧羰基吡咯-2-基)-1H-咪唑-5-基)-5-(5-乙基噻吩-2-基)-5H-苯并[e]吡唑并[1,5-c][1,3]噁嗪-2-基)苯基)-1H-咪唑-2-基)吡咯-1-碳酸叔丁酯为原料,按照实施例1步骤11的方法制得标题化合物。
MS(ESI):[M+H]+=629。
步骤5N-((2S)-1-((S)-2-(5-(2-(4-(2-((2S)-1-((S)-2-甲氧羰基氨基-3-甲基丁酰基)吡咯-2-基)-1H-咪唑-5-基)苯基)-5-(5-乙基噻吩-2-基)-5H-苯并[e]吡唑并[1,5-c][1,3]噁嗪-8-基)-1H-咪唑-2-基)吡咯-1-基)-3-甲基-1-氧代丁烷-2-基)氨基甲酸甲酯的制备
以步骤4制备的化合物(S)-2-(5-(2-(4-(2-((2S)-吡咯-2-基)-1H-咪唑-5-基)苯基)-5-(5-乙基噻吩-2-基)-5H-苯并[e]吡唑并[1,5-c][1,3]噁嗪-8-基)-1H-咪唑-2-基)吡咯和MOC-缬氨酸为原料,按照实施例1步骤12的方法制得标题化合物。
1H NMR(500MHz,d6-DMSO)δ11.86(s,1H),11.76(s,1H),7.79-7.85(m,4H),7.44-7.69(m,6H),7.25-7.28(m,3H),6.82(m,1H),6.69(m,1H),5.07(m,2H),4.02-4.09(m,2H),3.80(m,4H),3.54(s,6H),2.67-2.71(m,2H),2.14(m,4H),1.96(m,6H),1.13(t,3H),0.85-0.93(m,12H)。
MS(ESI):[M+H]+=943。
实施例4N-((2S)-1-((S)-2-(5-(2-(2-((2S)-1-((S)-2-甲氧羰基氨基-3-甲基丁酰基)吡咯-2-基)-1H-苯并[d]咪唑-6-基)-5-苯基-5H-苯并[e]吡唑并[1,5-c][1,3]噁嗪-8-基)-1H-咪唑-2-基)吡咯-1-基)-3-甲基-1-氧代丁烷-2-基)氨基甲酸甲酯
步骤1N-(4-乙酰基苯基)乙酰胺的制备
取50mL醋酐于反应瓶中,分批加入5.4g对乙酰基苯胺,加毕,室温反应1h,反应结束后,将反应液倒入200mL冰水中,过滤,干燥得标题化合物。
MS(ESI):[M+H]+=178。
步骤2N-(4-乙酰基-2-硝基苯基)乙酰胺的制备
取40mL发烟硝酸于反应瓶中,0-5℃下分批加入5.06g步骤1制备的化合物N-(4-乙酰基苯基)乙酰胺,加毕,0-5℃继续反应2h,反应结束后,将反应液倒入冰水中,乙酸乙酯萃取(3×20mL),干燥,过滤,浓缩,柱层析提纯得标题化合物。
MS(ESI):[M+H]+=223。
步骤3(E)-1-(4-氨基-3-硝基苯基)-3-(4-溴-2-羟基苯基)-2-丙烯-1-酮的制备
称取1.33g步骤2制备的化合物N-(4-乙酰基-2-硝基苯基)乙酰胺、1.2g 4-溴-2-羟基苯甲醛于反应瓶中,加入40mL无水乙醇溶解,分批加入6.7g KOH,加完室温反应2h,反应结束后,浓缩,残留物加水,浓盐酸调PH至6,过滤得标题化合物。
MS(ESI):[M+H]+=363。
步骤42-(3-(4-氨基-3-硝基苯基)-4,5-二氢-1H-吡唑-5-基)-5-溴苯酚的制备
以步骤3制备的化合物(E)-1-(4-氨基-3-硝基苯基)-3-(4-溴-2-羟基苯基)-2-烯基-1-丙酮为原料,按照实施例1步骤2的方法制得标题化合物。
MS(ESI):[M+H]+=377。
步骤54-(8-溴-5-苯基-5,10b-二氢-1H-苯并[e]吡唑并[1,5-c][1,3]噁嗪-2-基)-2-硝基苯胺的制备
以步骤4制备的化合物2-(3-(4-氨基-3-硝基苯基)-4,5-二氢-1H-吡唑-5-基)-5-溴苯酚和苯甲醛为原料,按照实施例1步骤3的方法制得标题化合物。
1H NMR(500MHz,d6-DMSO)δ8.07(d,1H),7.75-7.81(m,3H),7.55(d,2H),7.33-7.42(m,3H),7.15(s,1H),7.02-7.05(m,3H),6.87(s,1H),4.74(d,1H),3.49-3.58(m,1H),3.31(m,1H)。
步骤64-(8-溴-5-苯基-5H-苯并[e]吡唑并[1,5-c][1,3]噁嗪-2-基)-2-硝基苯胺的制备
以步骤5制备的化合物4-(8-溴-5-苯基-5,10b-二氢-1H-苯并[e]吡唑并[1,5-c][1,3]噁嗪-2-基)-2-硝基苯胺为原料,按照实施例1步骤4的方法制得标题化合物。
1H NMR(500MHz,d6-DMSO)δ8.39(d,1H),7.86(dd,1H),7.70(d,1H),7.59(s,2H),7.37-7.48(m,7H),7.19-7.22(m,2H),7.11(d,1H)。
步骤74-(8-溴-5-苯基-5H-苯并[e]吡唑并[1,5-c][1,3]噁嗪-2-基)苯-1,2-二胺的制备
称取800mg步骤6制备的化合物4-(8-溴-5-苯基-5H-苯并[e]吡唑并[1,5-c][1,3]噁嗪-2-基)-2-硝基苯胺于反应瓶中,加入80mL异丙醇和20mL水,加入970mg铁粉,回流反应2h,反应结束后,过滤,滤液浓缩,过滤得标题化合物。
MS(ESI):[M+H]+=433。
步骤81-叔丁氧羰基-(S)-2-(6-(8-溴-5-苯基-5H-苯并[e]吡唑并[1,5-c][1,3]噁嗪-2-基)-1H-苯并[d]咪唑-2-基)吡咯的制备
称取600mg步骤7制备的化合物4-(8-溴-5-苯基-5H-苯并[e]吡唑并[1,5-c][1,3]噁嗪-2-基)苯-1,2-二胺和330mg Boc-L-脯氨酸于反应瓶中,加入30mL DCM溶解,0-4℃下加入400mgDIPEA,反应0.5h后加入360mg EDCI,210mg HOBt,室温反应18h,浓缩干,加入10mL醋酸,回流反应1h,浓缩干,加水,饱和碳酸氢钠溶液调PH至8,乙酸乙酯萃取(3×20mL),干燥,过滤,浓缩,柱层析提纯得标题化合物。
MS(ESI):[M+H]+=612。
步骤91-叔丁氧羰基-(S)-2-(6-(8-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)-5-苯基-5H-苯并[e]吡唑并[1,5-c][1,3]噁嗪-2-基)-1H-苯并[d]咪唑-2-基)吡咯的制备
以步骤8制备的化合物1-叔丁氧羰基-(S)-2-(6-(8-溴-5-苯基-5H-苯并[e]吡唑并[1,5-c][1,3]噁嗪-2-基)-1H-苯并[d]咪唑-2-基)吡咯为原料,按照实施例1步骤5的方法制得标题化合物。MS(ESI):[M+H]+=660。
步骤101-叔丁氧羰基-(S)-2-(5-(2-(2-((2S)-1-叔丁氧羰基吡咯-2-基)-1H-苯并[d]咪唑-6-基)-5-苯基-5H-苯并[e]吡唑并[1,5-c][1,3]噁嗪-8-基)-1H-咪唑-2-基)吡咯的制备
以步骤9制备的化合物1-叔丁氧羰基-(S)-2-(6-(8-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)-5-苯基-5H-苯并[e]吡唑并[1,5-c][1,3]噁嗪-2-基)-1H-苯并[d]咪唑-2-基)吡咯和(2S)-1-叔丁氧基羰基-2-(5-溴-1H-咪唑-2-基)吡咯为原料,按照实施例1步骤10的方法制得标题化合物。MS(ESI):[M+H]+=769。
步骤11(S)-2-(5-(2-(2-((2S)-吡咯-2-基)-1H-苯并[d]咪唑-6-基)-5-苯基-5H-苯并[e]吡唑并[1,5-c][1,3]噁嗪-8-基)-1H-咪唑-2-基)吡咯的制备
以步骤10制备的化合物1-叔丁氧羰基-(S)-2-(5-(2-(2-((2S)-1-叔丁氧羰基吡咯-2-基)-1H-苯并[d]咪唑-6-基)-5-苯基-5H-苯并[e]吡唑并[1,5-c][1,3]噁嗪-8-基)-1H-咪唑-2-基)吡咯为原料,按照实施例1步骤11的方法制得标题化合物。
MS(ESI):[M+H]+=569。
步骤12N-((2S)-1-((S)-2-(5-(2-(2-((2S)-1-((S)-2-甲氧羰基氨基-3-甲基丁酰基)吡咯-2-基)-1H-苯并[d]咪唑-6-基)-5-苯基-5H-苯并[e]吡唑并[1,5-c][1,3]噁嗪-8-基)-1H-咪唑-2-基)吡咯-1-基)-3-甲基-1-氧代丁烷-2-基)氨基甲酸甲酯
以步骤11制备的化合物(S)-2-(5-(2-(2-((2S)-吡咯-2-基)-1H-苯并[d]咪唑-6-基)-5-苯基-5H-苯并[e]吡唑并[1,5-c][1,3]噁嗪-8-基)-1H-咪唑-2-基)吡咯和MOC-缬氨酸为原料,按照实施例1步骤12的方法制得标题化合物。
1H NMR(500MHz,d6-DMSO)δ12.25(s,1H),11.88(s,1H),7.87-7.96(m,1H),7.33-7.76(m,13H),7.23(m,2H),5.18(s,1H),5.05(s,1H),4.02-4.07(m,2H),3.79-3.85(m,4H),3.53(s,6H),1.94-2.22(m,10H),0.84-0.92(m,12H)。
MS(ESI):[M+H]+=883。
实施例5N-((1S)-2-((S)-2-(5-(2-(2-((8S)-7-((S)-2-甲氧羰基氨基-3-甲基丁酰基)-1,4-二氧杂-7-氮杂螺[4.4]壬烷-8-基)-1H-苯并[d]咪唑-6-基)-5-(4-叔丁基苯基)-5H-苯并[e]吡唑并[1,5-c][1,3]噁嗪-8-基)-1H-咪唑-2-基)-吡咯-1-基)-2-氧代-1-苯基乙烷-1-基)氨基甲酸甲酯
步骤14-(8-溴-5-(4-叔丁基苯基)-5,10b-二氢-1H-苯并[e]吡唑并[1,5-c][1,3]噁嗪-2-基)-2-硝基苯胺的制备
以实施例4步骤4制备的化合物2-(3-(4-氨基-3-硝基苯基)-4,5-二氢-1H-吡唑-5-基)-5-溴苯酚和4-叔丁基苯甲醛为原料,按照实施例4步骤5的方法制得标题化合物。
MS(ESI):[M+H]+=521。
步骤24-(8-溴-5-(4-叔丁基苯基)-5H-苯并[e]吡唑并[1,5-c][1,3]噁嗪-2-基)-2-硝基苯胺的制备
以步骤1制备的化合物4-(8-溴-5-(4-叔丁基苯基)-5,10b-二氢-1H-苯并[e]吡唑并[1,5-c][1,3]噁嗪-2-基)-2-硝基苯胺为原料,按照实施例1步骤4的方法制得标题化合物。
MS(ESI):[M+H]+=519。
步骤34-(8-溴-5-(4-叔丁基苯基)-5H-苯并[e]吡唑并[1,5-c][1,3]噁嗪-2-基)苯-1,2-二胺的制备
以步骤2制备的化合物4-(8-溴-5-(4-叔丁基苯基)-5H-苯并[e]吡唑并[1,5-c][1,3]噁嗪-2-基)-2-硝基苯胺为原料,按照实施例4步骤7的方法制得标题化合物。
MS(ESI):[M+H]+=489。
步骤47-苄氧羰基-(S)-8-甲氧羰基-1,4-二氧杂-7-氮杂螺[4.4]壬烷的制备
称取10g(S)-1-苄氧基羰基-2-甲氧基羰基-4-氧代吡咯于反应瓶中,加入100mL甲苯和100mL乙二醇溶解,加入620mg对甲苯磺酸,165℃下Dean-Stark回流带水5h,反应结束后,浓缩除去甲苯,加入乙酸乙酯和水萃取,有机层用饱和食盐水洗涤、干燥、浓缩得标题化合物。
步骤5(S)-8-甲氧羰基-1,4-二氧杂-7-氮杂螺[4.4]壬烷的制备
称取218mg步骤4所得物7-苄氧羰基-(S)-8-甲氧羰基-1,4-二氧杂-7-氮杂螺[4.4]壬烷于反应瓶中,加入5mL甲醇溶解,室温搅拌下加入43mg钯碳,氢气条件下室温反应1小时,过滤,浓缩,得标题化合物,直接用于下一步反应。
步骤6(S)-7-((S)-2-甲氧羰基氨基-3-甲基丁酰基)-8-甲氧羰基-1,4-二氧杂-7-氮杂螺[4.4]壬烷的制备
称取187mg步骤5所得物(S)-8-甲氧羰基-1,4-二氧杂-7-氮杂螺[4.4]壬烷、380mgHATU、0.5mL DIEA和175mg MOC-缬氨酸,置于反应瓶中,加入20mL二氯甲烷,室温反应2h,反应结束后,加入二氯甲烷和水萃取,有机层干燥,过滤,柱层析纯化,得标题化合物。
步骤7(S)-7-((S)-2-甲氧羰基氨基-3-甲基丁酰基)-1,4-二氧杂-7-氮杂螺[4.4]壬烷-8-甲酸的制备
称取2g步骤6所得物(S)-7-((S)-2-甲氧羰基氨基-3-甲基丁酰基)-8-甲氧羰基-1,4-二氧杂-7-氮杂螺[4.4]壬烷,置于反应瓶中,加入20mL 1,4-二氧六环溶解,加入1NLiOH水溶液15mL,室温反应1h后,调pH至4-5,二氯甲烷萃取,有机相干燥,浓缩,直接用于下一步反应。
步骤8N-((2S)-1-((S)-8-(6-(8-溴-5-(4-叔丁基苯基)-5H-苯并[e]吡唑并[1,5-c][1,3]噁嗪-2-基)-1H-苯并[d]咪唑-2-基)-1,4-二氧杂-7-氮杂螺[4.4]壬烷-7-基)-3-甲基-1-氧代丁烷-2-基)氨基甲酸甲酯的制备
以步骤3制备的化合物4-(8-溴-5-(4-叔丁基苯基)-5H-苯并[e]吡唑并[1,5-c][1,3]噁嗪-2-基)苯-1,2-二胺和步骤7所得物(S)-7-((S)-2-(甲氧基羰基氨基)-3-甲基丁酰基)-1,4-二氧杂-7-氮杂螺[4.4]壬烷-8-甲酸为原料,按照实施例4步骤8的方法制得标题化合物。
MS(ESI):[M+H]+=783。
步骤9N-((2S)-1-((S)-8-(6-(8-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)-5-(4-叔丁基苯
基)-5H-苯并[e]吡唑并[1,5-c][1,3]噁嗪-2-基)-1H-苯并[d]咪唑-2-基)-1,4-二氧杂-7-氮杂螺[4.4]壬烷-7-基)-3-甲基-1-氧代丁烷-2-基)氨基甲酸甲酯的制备
以步骤8制备的化合物N-((2S)-1-((S)-8-(6-(8-溴-5-(4-叔丁基苯基)-5H-苯并[e]吡唑并[1,5-c][1,3]噁嗪-2-基)-1H-苯并[d]咪唑-2-基)-1,4-二氧杂-7-氮杂螺[4.4]壬烷-7-基)-3-甲基-1-氧代丁烷-2-基)氨基甲酸甲酯为原料,按照实施例1步骤5的方法制得标题化合物。
MS(ESI):[M+H]+=831。
步骤10(S)-2-(4-溴-1H-咪唑-2-基)吡咯烷的制备
以实施例1步骤9制备的化合物(2S)-1-叔丁氧羰基-2-(5-溴-1H-咪唑-2-基)吡咯烷为原料,按照实施例1步骤11的方法制得标题化合物。
步骤11N-((1S)-2-((S)-2-(4-溴-1H-咪唑-2-基)-吡咯-1-基)-2-氧代-1-苯基乙烷-2-基)氨基甲酸甲酯的制备
以步骤10制备的化合物(S)-2-(4-溴-1H-咪唑-2-基)吡咯烷和MOC-苯甘氨酸为原料,按照实施例1步骤12的方法制得标题化合物。
步骤12N-((1S)-2-((S)-2-(5-(2-(2-((8S)-7-((S)-2-甲氧羰基氨基-3-甲基丁酰基)-1,4-二氧杂-7-氮杂螺[4.4]壬烷-8-基)-1H-苯并[d]咪唑-6-基)-5-(4-叔丁基苯基)-5H-苯并[e]吡唑并[1,5-c][1,3]噁嗪-8-基)-1H-咪唑-2-基)-吡咯-1-基)-2-氧代-1-苯基乙烷-1-基)氨基甲酸甲酯的制备
以步骤9制备的化合物N-((2S)-1-((S)-8-(6-(8-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)-5-(4-叔丁基苯基)-5H-苯并[e]吡唑并[1,5-c][1,3]噁嗪-2-基)-1H-苯并[d]咪唑-2-基)-1,4-二氧杂-7-氮杂螺[4.4]壬烷-7-基)-3-甲基-1-氧代丁烷-2-基)氨基甲酸甲酯和步骤11制备的化合物N-((1S)-2-((S)-2-(4-溴-1H-咪唑-2-基)-吡咯-1-基)-2-氧代-1-苯基乙烷-2-基)氨基甲酸甲酯为原料,按照实施例1步骤10的方法制得标题化合物。
1H NMR(300MHz,d6-DMSO)δ12.27(s,1H),11.95(s,1H),7.97-8.05(m,1H),7.25-7.72(m,17H),7.16(m,2H),5.75(s,1H),5.50(m,1H),5.04-5.21(m,2H),3.67-4.12(m,10H),3.55(s,6H),1.94-2.15(m,5H),1.21(s,9H),0.77-0.90(m,6H)。
MS(ESI):[M+H]+=1031。
实施例6N-((2S)-1-((S)-2-(5-(2-(2-((2S)-1-((S)-2-甲氧羰基氨基-3-甲基丁酰基)吡咯-2-基)-1H-苯并[d]咪唑-6-基)-5H-苯并[e]吡唑并[1,5-c][1,3]噁嗪-8-基)-1H-咪唑-2-基)吡咯-1-基)-3-甲基-1-氧代丁烷-2-基)氨基甲酸甲酯
步骤14-(8-溴-5,10b-二氢-1H-苯并[e]吡唑并[1,5-c][1,3]噁嗪-2-基)-2-硝基苯胺的制备
以实施例4步骤4制得的化合物2-(3-(4-氨基-3-硝基苯基)-4,5-二氢-1H-吡唑-5-基)-5-溴苯酚和甲醇为原料,按照实施例1步骤3的方法制得标题化合物。
MS(ESI):[M+H]+=389。
步骤2(S)-2-(5-(2-(2-((2S)-吡咯-2-基)-1H-苯并[d]咪唑-6-基)-5H-苯并[e]吡唑并[1,5-c][1,3]噁嗪-8-基)-1H-咪唑-2-基)吡咯的制备
以步骤1制得的化合物4-(8-溴-5,10b-二氢-1H-苯并[e]吡唑并[1,5-c][1,3]噁嗪-2-基)-2-硝基苯胺为原料,按照实施例4步骤6、7、8、9、10和11的方法制得标题化合物。
MS(ESI):[M+H]+=493。
步骤3N-((2S)-1-((S)-2-(5-(2-(2-((2S)-1-((S)-2-甲氧羰基氨基-3-甲基丁酰基)吡咯-2-基)-1H-苯并[d]咪唑-6-基)-5H-苯并[e]吡唑并[1,5-c][1,3]噁嗪-8-基)-1H-咪唑-2-基)吡咯-1-基)-3-甲基-1-氧代丁烷-2-基)氨基甲酸甲酯的制备
以步骤2制得的化合物(S)-2-(5-(2-(2-((2S)-吡咯-2-基)-1H-苯并[d]咪唑-6-基)-5H-苯并[e]吡唑并[1,5-c][1,3]噁嗪-8-基)-1H-咪唑-2-基)吡咯和moc-缬氨酸为原料,按照实施例1步骤12的方法制得标题化合物。
MS(ESI):[M+H]+=807。
实施例7N-((2S)-1-((S)-2-(5-(1'-苯基-2-(2-((2S)-1-((S)-2-甲氧羰基氨基-3-甲基丁酰基)吡咯-2-基)-1H-苯并[d]咪唑-6-基)螺[苯并[e]吡唑并[1,5-c][1,3]噁嗪-5,4'-哌啶]-8-基)-1H-咪唑-2-基)吡咯-1-基)-3-甲基-1-氧代丁烷-2-基)氨基甲酸甲酯
步骤18-苯基-1,4-二氧杂-8-氮杂螺[4,5]癸烷的制备
在干燥的100ml反应瓶中,加入1.43g 4-哌啶酮缩乙二醇,2.04g碘苯,3.36mg叔丁醇钾,458mg三-(二亚苯-BASE丙酮)二钯,239mg 2-二环己基磷-2,4,6-三异丙基联苯和20mL甲苯,氮气保护及100℃条件下,反应4h,反应结束后,反应液冷却到室温,加入50mL水,室温搅拌2h,乙酸乙酯(3×60mL)萃取。合并有机相,干燥,过滤,浓缩,过柱纯化制得标题化合物。
MS(ESI):[M+H]+=220。
步骤21-苯基哌啶-4-酮的制备
在干燥的250ml单口烧瓶中,加入2.20g步骤1所得物8-苯基-1,4-二氧杂-8-氮杂螺[4,5]癸烷,20mL浓度为6M盐酸水溶液和20mL四氢呋喃,60℃下反应3h,反应结束后,将反应液倒入200mL冰水中,用饱和碳酸氢钠调节pH到7,然后用乙酸乙酯萃取(4×60mL),合并有机相,然后用水洗涤(3×60mL),有机相干燥,过滤,浓缩,过柱纯化制得标题化合物。
MS(ESI):[M+H]+=176。
步骤32-硝基-4-(1'-苯基-8-溴代-1,10b-二氢螺[苯并[e]吡唑并[1,5-c][1,3]噁嗪-5',4-哌啶]-2-基)苯胺的制备
在干燥的100ml两口烧瓶中,加入5g实施例4步骤4制得的化合物2-(3-(4-氨基-3-硝基苯基)-4,5-二氢-1H-吡唑-5-基)-5-溴苯酚、4.65g步骤2制得的化合物1-苯基哌啶-4-酮和120mL四氢呋喃,氮气保护下30℃反应3h,制得标题化合物。
步骤4(S)-2-(5-(1'-苯基-2-(2-((2S)-吡咯-2-基)-1H-苯并[d]咪唑-6-基)螺[苯并[e]吡唑并[1,5-c][1,3]噁嗪-5,4'-哌啶]-8-基)-1H-咪唑-2-基)吡咯的制备
以步骤3制得的化合物2-硝基-4-(1'-苯基-8-溴代-1,10b-二氢螺[苯并[e]吡唑并[1,5-c][1,3]噁嗪-5',4-哌啶]-2-基)苯胺为原料,按照实施例4步骤6、7、8、9、10和11的方法制得标题化合物。
MS(ESI):[M+H]+=638。
步骤5N-((2S)-1-((S)-2-(5-(1'-苯基-2-(2-((2S)-1-((S)-2-甲氧羰基氨基-3-甲基丁酰基)吡咯-2-基)-1H-苯并[d]咪唑-6-基)螺[苯并[e]吡唑并[1,5-c][1,3]噁嗪-5,4'-哌啶]-8-基)-1H-咪唑-2-基)吡咯-1-基)-3-甲基-1-氧代丁烷-2-基)氨基甲酸甲酯的制备
以步骤4制得的化合物(S)-2-(5-(1'-苯基-2-(2-((2S)-吡咯-2-基)-1H-苯并[d]咪唑-6-基)螺[苯并[e]吡唑并[1,5-c][1,3]噁嗪-5,4'-哌啶]-8-基)-1H-咪唑-2-基)吡咯和moc-缬氨酸为原料,按照实施例1步骤12的方法制得标题化合物。
1H NMR:(300MHz,MeOD)δ12.20-12.27(m,1H),11.82-11.93(m,1H),7.48-8.02(m,7H),6.60-7.40(m,8H),4.93-5.23(m,4H),3.50-4.12(m,12H),3.20-3.40(m,4H),1.70-2.12(m,12H),1.15-1.21(m,12H)。
MS(ESI):[M+H]+=952。
实施例8N-((2S)-1-((S)-2-(5-(2-(2-((2S)-1-((S)-2-甲氧羰基氨基-3-甲基丁酰基)吡咯-2-基)-1H-苯并[d]咪唑-6-基)螺[苯并[e]吡唑并[1,5-c][1,3]噁嗪-5,1'-环己烷]-8-基)-1H-咪唑-2-基)吡咯-1-基)-3-甲基-1-氧代丁烷-2-基)氨基甲酸甲酯
步骤12-硝基-4-(8-溴代-1,10b-二氢螺[苯并[e]吡唑并[1,5-c][1,3]噁嗪-5,1'-环己烷]-2-基)苯胺的制备
以实施例4步骤4制得的化合物2-(3-(4-氨基-3-硝基苯基)-4,5-二氢-1H-吡唑-5-基)-5-溴苯酚和环己酮为原料,按照实施例7步骤3的方法制得标题化合物。
步骤2(S)-2-(5-(2-(2-((2S)-吡咯-2-基)-1H-苯并[d]咪唑-6-基)螺[苯并[e]吡唑并[1,5-c][1,3]噁嗪-5,1'-环己烷]-8-基)-1H-咪唑-2-基)吡咯的制备
以步骤1制得的化合物2-硝基-4-(8-溴代-1,10b-二氢螺[苯并[e]吡唑并[1,5-c][1,3]噁嗪-5,1'-环己烷]-2-基)苯胺为原料,按照实施例4步骤6、7、8、9、10和11的方法制得标题化合物。
步骤3N-((2S)-1-((S)-2-(5-(2-(2-((2S)-1-((S)-2-甲氧羰基氨基-3-甲基丁酰基)吡咯-2-基)-1H-苯并[d]咪唑-6-基)螺[苯并[e]吡唑并[1,5-c][1,3]噁嗪-5,1'-环己烷]-8-基)-1H-咪唑-2-基)吡咯-1-基)-3-甲基-1-氧代丁烷-2-基)氨基甲酸甲酯的制备
以步骤2制得的化合物(S)-2-(5-(2-(2-((2S)-吡咯-2-基)-1H-苯并[d]咪唑-6-基)螺[苯并[e]吡唑并[1,5-c][1,3]噁嗪-5,1'-环己烷]-8-基)-1H-咪唑-2-基)吡咯为原料,按照实施例1步骤12的方法制得标题化合物。
1H NMR:(300MHz,MeOD)δ12.20-12.27(m,1H),11.82-11.93(m,1H),7.04-8.02(m,10H),5.08-5.20(m,2H),4.02-4.08(m,2H),3.72-3.89(m,4H),3.54(s,6H),1.22-2.12(m,20H),0.80-1.13(m,12H)。
MS(ESI):[M+H]+=875。
实施例9N-((2S)-1-((S)-2-(5-(2-(2-((2S)-1-((S)-2-甲氧羰基氨基-3-甲基丁酰基)吡咯-2-基)-1H-苯并[d]咪唑-6-基)-4',4'-二氟代螺[苯并[e]吡唑并[1,5-c][1,3]噁嗪-5,1'-环己烷]-8-基)-1H-咪唑-2-基)吡咯-1-基)-3-甲基-1-氧代丁烷-2-基)氨基甲酸甲酯
步骤18,8-二氟代-1,4-二氧代螺[4.5]癸烷的制备
称取6.0g 1,4-二氧螺[4.5]癸烷-8-酮于反应瓶中,加入100mL二氯甲烷溶解,0℃下滴加17.8g双(2-甲氧基乙基)氨基三氟化硫,加完后,室温反应15H,反应结束后,用饱和NaHCO3调pH至7,分液,水相用二氯甲烷萃取(100mL×2),合并有机相,有机相水洗,饱和食盐水洗后用无水硫酸钠干燥,过滤旋干得标题化合物。
MS(ESI):[M+H]+=179。
步骤24,4-二氟环己酮的制备
以步骤1制得的化合物8,8-二氟代-1,4-二氧代螺[4.5]癸烷为原料,按照实施例7步骤2的方法制得标题化合物。
MS(ESI):[M+H]+=135。
步骤32-硝基-4-(4',4'-二氟代-8-溴代-1,10b-二氢螺[苯并[e]吡唑并[1,5-c][1,3]噁嗪-5,1'-环己烷]-2-基)苯胺的制备
以实施例4步骤4制得的化合物2-(3-(4-氨基-3-硝基苯基)-4,5-二氢-1H-吡唑-5-基)-5-溴苯酚和步骤2制得的化合物4,4-二氟环己酮为原料,按照实施例7步骤3的方法制得标题化合物。
步骤4N-((2S)-1-((S)-2-(5-(2-(2-((2S)-1-((S)-2-甲氧羰基氨基-3-甲基丁酰基)吡咯-2-基)-1H-苯并[d]咪唑-6-基)-4',4'-二氟代螺[苯并[e]吡唑并[1,5-c][1,3]噁嗪-5,1'-环己烷]-8-基)-1H-咪唑-2-基)吡咯-1-基)-3-甲基-1-氧代丁烷-2-基)氨基甲酸甲酯的制备
以步骤3制得的化合物为原料,按照实施例4步骤6、7、8、9、10、11和12的方法制得标题化合物。
1H NMR(300MHz,DMSO-d6)δppm:7.94(s,1H),7.45-7.82(m,7H),7.28(s,2H),5.20(s,1H),5.09(s,1H),4.09(t,2H),3.70-3.82(m,4H),3.54(s,6H),1.80-2.40(m,18H),0.73-0.98(m,12H)。MS(ESI):[M+H]+=911。
实施例10N-((2S)-1-((S)-2-(5-(1'-叔丁基-2-(2-((2S)-1-((S)-2-甲氧羰基氨基-3-甲基丁酰基)吡咯-2-基)-1H-苯并[d]咪唑-6-基)螺[苯并[e]吡唑并[1,5-c][1,3]噁嗪-5,4'-哌啶]-8-基)-1H-咪唑-2-基)吡咯-1-基)-3-甲基-1-氧代丁烷-2-基)氨基甲酸甲酯
步骤11-甲基哌啶-4-酮的制备
称取8.0g哌啶-4-酮于反应瓶中,加入100mL乙醇溶解,室温下加入16.3g K2CO3和9.22g MeI,加完后,回流3h,反应结束后,冷却,过滤除去固体,滤液低温下减压除去溶剂标题化合物。
MS(ESI):[M+H]+=114。
步骤21,1-二甲基哌啶-4-酮碘鎓盐的制备
称取3.0g步骤1所得物1-甲基哌啶-4-酮于反应瓶中,加入30mL丙酮溶解,0℃下加入MeI,加完后室温下反应1h,反应结束后,过滤,滤饼用10mL丙酮洗涤,真空干燥后得标题化合物。
MS(ESI):[M-I]+=128。
步骤31-叔丁基哌啶-4-酮的制备
称取4.22g丙烯酸于反应瓶中,加入15mL H2O,室温下滴加5.6mL浓度为10M/L的氢氧化钠溶液,再依次加入3.00g步骤2所得物1,1-二甲基哌啶-4-酮碘鎓盐和24mL叔丁胺。加完后80℃反应3H,反应结束后,冷却,在低于20℃的温度下减压除去叔丁胺,加入乙酸乙酯萃取(50mL×3),合并有机相,干燥浓缩得标题化合物,直接用于下步反应。
1H NMR(300MHz,DMSO-d6)δppm:2.76(t,4H),2.29(t,4H),1.07(s,9H)。
MS(ESI):[M+H]+=156。
步骤42-硝基-4-(1'-叔丁基-8-溴代-1,10b-二氢螺[苯并[e]吡唑并[1,5-c][1,3]噁嗪-5,4'-哌啶]-2-基)苯胺的制备
以实施例4步骤4制得的化合物2-(3-(4-氨基-3-硝基苯基)-4,5-二氢-1H-吡唑-5-基)-5-溴苯酚和步骤3制得的化合物1-叔丁基哌啶-4-酮为原料,按照实施例7步骤3的方法制得标题化合物。
1H NMR(300MHz,DMSO-d6)δppm:7.99(d,1H),7.52(s,2H),7.32(s,1H),7.18(d,1H),7.08(d,1H),7.01(d,1H),6.88(d,1H),5.08(d,1H),3.22-3.43(m,4H),2.23-2.80(m,4H),1.75-1.96(m,2H),1.04(s,9H)。
MS(ESI):[M+H]+=514。
步骤5N-((2S)-1-((S)-2-(5-(1'-叔丁基-2-(2-((2S)-1-((S)-2-甲氧羰基氨基-3-甲基丁酰基)吡咯-2-基)-1H-苯并[d]咪唑-6-基)螺[苯并[e]吡唑并[1,5-c][1,3]噁嗪-5,4'-哌啶]-8-基)-1H-咪唑-2-基)吡咯-1-基)-3-甲基-1-氧代丁烷-2-基)氨基甲酸甲酯的制备
以步骤4制得的化合物2-硝基-4-(1'-叔丁基-8-溴代-1,10b-二氢螺[苯并[e]吡唑并[1,5-c][1,3]噁嗪-5,4'-哌啶]-2-基)苯胺为原料,按照实施例4步骤6、7、8、9、10、11和12的方法制得标题化合物。
1H NMR(300MHz,DMSO-d6)δppm:11.91(s,2H),8.26(s,1H),7.92(s,1H),7.42-7.78(m,6H),7.13-7.30(m,2H),5.19(s,1H),5.08(s,1H),4.07(d,2H),3.70-3.90(m,4H),3.54(s,6H),2.90-3.15(m,4H),1.80-2.30(m,14H),1.10(s,9H),0.87(d,12H)。
MS(ESI):[M+H]+=932。
实施例11N-((2S)-1-((S)-2-(5-(1″,4″-二氧代-2-(2-((2S)-1-((S)-2-甲氧羰基氨基-3-甲基丁酰基)吡咯-2-基)-1H-苯并[d]咪唑-6-基)二螺[苯并[e]吡唑并[1,5-c][1,3]噁嗪-5,1'-环己烷-4',5″-环戊烷]-8-基)-1H-咪唑-2-基)吡咯-1-基)-3-甲基-1-氧代丁烷-2-基)氨基甲酸甲酯
步骤14-(8-溴-1″,4″-二氧代-1,10b-二氢二螺[苯并[e]吡唑并[1,5-c][1,3]噁嗪-5,1'-环己烷-4',5″-环戊烷]-2-基)-2-硝基苯胺的制备
以实施例4步骤4制得的化合物2-(3-(4-氨基-3-硝基苯基)-4,5-二氢-1H-吡唑-5-基)-5-溴苯酚和1,4-二氧代螺[4,5]癸烷-8-酮为原料,按照实施例7步骤3的方法制得标题化合物。
MS(ESI):[M+H]+=515。
步骤2N-((2S)-1-((S)-2-(5-(1″,4″-二氧代-2-(2-((2S)-1-((S)-2-甲氧羰基氨基-3-甲基丁酰基)吡咯-2-基)-1H-苯并[d]咪唑-6-基)二螺[苯并[e]吡唑并[1,5-c][1,3]噁嗪-5,1'-环己烷-4',5″-环戊烷]-8-基)-1H-咪唑-2-基)吡咯-1-基)-3-甲基-1-氧代丁烷-2-基)氨基甲酸甲酯的制备
以步骤1制得的化合物4-(8-溴-1″,4″-二氧代-1,10b-二氢二螺[苯并[e]吡唑并[1,5-c][1,3]噁嗪-5,1'-环己烷-4',5″-环戊烷]-2-基)-2-硝基苯胺为原料,按照实施例4步骤6、7、8、9、10、11和12的方法制得标题化合物。
1H NMR(300MHz,DMSO-d6)δppm:12.15(s,1H),11.87(s,1H),8.22(s,1H),7.91(s,1H),7.63(s,3H),7.53-7.56(m,3H),7.28(s,1H),7.21(s,1H),5.21(s,1H),5.08(s,1H),4.09(s,2H),3.95(s,3H),3.82(s,4H),3.32(s,10H),2.12-2.24(m,7H),1.96(s,6H),1.82(s,2H),0.82-0.96(m,12H)。MS(ESI):[M+H]+=933。
实施例12N-((2S)-1-((S)-2-(5-(1'-苯甲酰基-2-(2-((2S)-1-((S)-2-甲氧羰基氨基-3-甲基丁酰基)吡咯-2-基)-1H-苯并[d]咪唑-6-基)螺[苯并[e]吡唑并[1,5-c][1,3]噁嗪-5,4'-哌啶]-8-基)-1H-咪唑-2-基)吡咯-1-基)-3-甲基-1-氧代丁烷-2-基)氨基甲酸甲酯
步骤12-硝基-4-(1'-苯甲酰基-8-溴代-1,10b-二氢螺[苯并[e]吡唑并[1,5-c][1,3]噁嗪-5,4'-哌啶]-2-基)苯胺的制备
以实施例4步骤4制得的化合物2-(3-(4-氨基-3-硝基苯基)-4,5-二氢-1H-吡唑-5-基)-5-溴苯酚和1-苯甲酰基哌啶-4-酮为原料,按照实施例7步骤3的方法制得标题化合物。
MS(ESI):[M+H]+=562。
步骤2N-((2S)-1-((S)-2-(5-(1'-苯甲酰基-2-(2-((2S)-1-((S)-2-甲氧羰基氨基-3-甲基丁酰基)吡咯-2-基)-1H-苯并[d]咪唑-6-基)螺[苯并[e]吡唑并[1,5-c][1,3]噁嗪-5,4'-哌啶]-8-基)-1H-咪唑-2-基)吡咯-1-基)-3-甲基-1-氧代丁烷-2-基)氨基甲酸甲酯的制备
以步骤1制得的化合物为原料,按照实施例4步骤6、7、8、9、10、11和12的方法制得标题化合物。
1H NMR(500MHz,d6-DMSO)δ12.25(s,1H),11.88(s,1H),7.93(m,1H),7.25-7.68(m,12H),7.23(m,2H),5.20(s,1H),5.08(s,1H),4.08(m,2H),3.83(m,5H),3.33-3.54(m,10H),2.00-2.33(m,13H),0.86(m,12H)。
MS(ESI):[M+H]+=980。
实施例13N-((2S)-1-((S)-2-(5-(4'-氧代-2-(2-((2S)-1-((S)-2-甲氧羰基氨基-3-甲基丁酰基)吡咯-2-基)-1H-苯并[d]咪唑-6-基)螺[苯并[e]吡唑并[1,5-c][1,3]噁嗪-5,1'-环己烷]-8-基)-1H-咪唑-2-基)吡咯-1-基)-3-甲基-1-氧代丁烷-2-基)氨基甲酸甲酯
称取50mg实施例11化合物N-((2S)-1-((S)-2-(5-(1″,4″-二氧代-2-(2-((2S)-1-((S)-2-甲氧羰基氨基-3-甲基丁酰基)吡咯-2-基)-1H-苯并[d]咪唑-6-基)二螺[苯并[e]吡唑并[1,5-c][1,3]噁嗪-5,1'-环己烷-4',5″-环戊烷]-8-基)-1H-咪唑-2-基)吡咯-1-基)-3-甲基-1-氧代丁烷-2-基)氨基甲酸甲酯于10mL圆底烧瓶中,加入0.1%三氟乙酸水溶液1mL和乙腈1mL,室温搅拌1h,柱层析制得标题化合物。
1H NMR(300MHz,DMSO-d6)δppm:12.20(s,1H),11.86(s,1H),7.90-7.97(m,1H),7.69(s,1H),7.49-7.65(m,4H),7.26(s,2H),5.20(s,1H),5.08(s,1H),4.09(s,2H),3.95(s,4H),3.31(s,8H),2.66-2.74(m,4H),2.41(s,4H),2.14-2.23(m,4H),1.96-2.00(m,6H),0.82-0.88(m,12H)。
MS(ESI):[M+H]+=889。
实验例1本发明的化合物的抗HCV-1b复制子活性检测
1实验材料
1.1化合物
以上实施例制备的本发明的化合物,每个化合物用DMSO溶解至10mM后,用DMEM完全培养液稀释至50μM,然后用含0.5%DMSO的完全培养液稀释至20nM后,依次3倍稀释,共10个浓度。
1.2细胞
HCV 1b复制子细胞,即Huh7细胞系稳定转入HCV基因型1b复制子,由药明康德(上海)新药开发有限公司提供。Huh71b复制子细胞系统的具体制备方法参见Lohmann V,Korner F,Koch J,Herian U,Theilmann L,Bartenschlager R.,Replication ofsubgenomic hepatitis C virus RNAs in a hepatoma cell line,Science 285(5424):110-113(1999)。
1.3试剂
DMEM细胞培养液(DMEM medium),购自美国Invitrogen公司;
胎牛血清(Fetal bovine serum,FBS),购自美国Sigma公司;
L-谷氨酰胺(L(+)-Glutamine),购自美国Invitrogen公司;
青霉素-链霉素(Pen-Strep),购自美国Invitrogen公司;
磷酸盐缓冲液(Phosphate buffered saline,PBS),购自美国Hyclone公司;
胰酶(Trypsin),购自美国Invitrogen公司;
二甲基亚砜(Dimethyl sulfoxide,DMSO),购自美国Sigma公司;
Bright-Glo检测试剂,购自美国Promega公司;
细胞生长荧光测定检测试剂(CellTiter-Fluor),购自美国Promega公司。
1.4仪器
自动聚焦荧光多功能酶标仪(PHERAstar Plus),购于德国BMG Labtech公司。
2实验方法
1)化合物准备:用POD810系统将75μl上述浓度梯度的本发明的化合物加入96孔板中,每个化合物每个浓度重复2次;
2)细胞准备:收集对数期的HCV 1b复制子细胞,重悬于DMEM完全培养液中,向上述96孔板每孔中加入75μl细胞悬液(8×103个细胞/孔);同时设立无效作用对照组(Zeropercent effect,ZPE)和100%有效作用对照组(Hundred percent effect,HPE):ZPE组用含0.5%DMSO的完全培养液代替化合物,HPE组孔中只含DMEM培养液;
3)细胞培养:将96孔板置于37℃,5%CO2培养箱中培养3天;
4)细胞活力检测:每孔加入细胞生长荧光滴定检测试剂,37℃,5%CO2培养箱培养细胞1小时后,用多功能酶标仪检测Fluorescence信号值,原始数据(RFU)用于化合物细胞毒性计算;
5)抗HCV病毒复制子活性检测:每孔加荧光素酶发光底物Bright-Glo,5分钟内用多功能酶标仪检测Luminescence信号值,原始数据(RLU)用于化合物抗HCV活性计算;
6)数据处理:使用如下公式将原始数据处理为化合物对HCV复制子的抑制百分比(Inhibition%)和细胞活力百分比(Viability%):
Inhibition%=(RLUZPE-RLUCPD)/(RLUZPE-RLUHPE)×100
Viability%=(RFUCPD-RFUHPE)/(RFUZPE-RFUHPE)×100
其中,CPD:化合物孔的荧光信号值;ZPE(Zeropercenteffect):无效作用对照荧光信号值;HPE(Hundredpercenteffect):100%有效作用对照荧光信号值。
将Inhibition%、Viability%分别导入GRAPHPAD绘图统计软件(GraphPad Software,Inc.)进行数据处理,得出化合物对HCV复制子的半数有效浓度EC50和半数细胞毒性浓度CC50。实验结果显示,本发明的化合物对HCV-1b复制子的EC50均远小于0.1nm,而CC50均远大于10nm。部分化合物的结果见表1。
表1
| 受试化合物 | EC<sub>50</sub>(nm) | CC<sub>50</sub>(nm) | 受试化合物 | EC<sub>50</sub>(nm) | CC<sub>50</sub>(nm) |
| 实施例1 | 0.016 | >10 | 实施例2 | 0.018 | >10 |
| 实施例3 | 0.014 | >10 | 实施例4 | 0.010 | >10 |
| 实施例5 | 0.017 | >10 | 实施例7 | 0.038 | >10 |
| 实施例8 | 0.016 | >10 | 实施例9 | 0.031 | >10 |
| 实施例11 | 0.010 | >10 | 实施例12 | 0.048 | >10 |
从以上实验可以看出,本发明的化合物对丙肝病毒具有较好的抑制活性,同时对宿主细胞具有低的毒性,有效性高,安全性好,非常有希望成为治疗和/或预防与HCV感染相关的疾病的药物。
实验例2本发明的化合物的抗HCV-1a复制子活性检测
用HCV 1a复制子细胞,即稳定转入HCV基因型1a复制子的Huh7细胞系(由药明康德(上海)新药开发有限公司提供)为实验细胞。如以上HCV 1b复制子细胞系统所述,类似地制备HCV基因型1a复制子细胞系统。
按照实验例1测试抗HCV-1b复制子活性的方法,测定本发明化合物抗HCV-1a的活性。结果表明,本发明的化合物对HCV-1a复制子的EC50均小于0.2nm,而CC50均远大于10nm。部分化合物的结果见表2。
表2
| 受试化合物 | EC<sub>50</sub>(nm) | CC<sub>50</sub>(nm) | 受试化合物 | EC<sub>50</sub>(nm) | CC<sub>50</sub>(nm) |
| 实施例1 | 0.143 | >10 | 实施例2 | 0.049 | >10 |
| 实施例3 | 0.054 | >10 | 实施例4 | 0.020 | >10 |
| 实施例5 | 0.028 | >10 | 实施例12 | 0.027 | >10 |
本发明的化合物对丙肝病毒1a亚型也表现出良好的抑制活性,同时对宿主细胞具有低的毒性,有效性高,安全性好,非常有希望成为治疗和/或预防与HCV感染相关的疾病的药物。
尽管以上已经对本发明作了详细描述,但是本领域技术人员理解,在不偏离本发明的精神和范围的前提下可以对本发明进行各种修改和改变。本发明的权利范围并不限于上文所作的详细描述,而应归属于权利要求书。
Claims (6)
1.通式I的化合物或其药学可接受的盐,
其中:
Ra、Rb分别独立地选自H、甲基、乙基、丙基、异丙基、正丁基、仲丁基、异丁基、叔丁基、环丙基、环丁基、环戊基、环己基、氮杂环丙基、氮杂环丁基、氮杂环戊基、二氮杂环戊基、氧氮杂环戊基、氮杂环己基、二氮杂环己基、氧氮杂环己基、氧杂环丙基、氧杂环丁基、氧杂环戊基、二氧杂环戊基、氧杂环己基、二氧杂环己基、苯基、萘基、噻吩基、吡咯基、呋喃基、咪唑基、噁唑基、噻唑基、吡唑基、异噁唑基、异噻唑基、噁二唑基、三唑基、吡啶基、嘧啶基和吡嗪基,或者Ra、Rb与其连接的C原子一起形成环丙基、环丁基、环戊基、环己基、环庚基、氮杂环丙基、氮杂环丁基、氮杂环戊基、二氮杂环戊基、氧氮杂环戊基、氮杂环己基、二氮杂环己基、氧氮杂环己基、氮杂环庚基、二氮杂环庚基、氧氮杂环庚基、氧杂环丙基、氧杂环丁基、氧杂环戊基、二氧杂环戊基、氧杂环己基、二氧杂环己基、氧杂环庚基、二氧杂环庚基、螺[2.4]庚烷、螺[3.4]辛烷、螺[4.4]壬烷、螺[2.5]辛烷、螺[3.5]壬烷、螺[4.5]癸烷、氮杂螺[2.4]庚烷、氮杂螺[3.4]辛烷、氮杂螺[4.4]壬烷、氮杂螺[2.5]辛烷、氮杂螺[3.5]壬烷、氮杂螺[4.5]癸烷、二氮杂螺[2.4]庚烷、二氮杂螺[3.4]辛烷、二氮杂螺[4.4]壬烷、二氮杂螺[2.5]辛烷、二氮杂螺[3.5]壬烷、二氮杂螺[4.5]癸烷、氧氮杂螺[2.4]庚烷、氧氮杂螺[3.4]辛烷、氧氮杂螺[4.4]壬烷、氧氮杂螺[2.5]辛烷、氧氮杂螺[3.5]壬烷、氧氮杂螺[4.5]癸烷、氧杂螺[2.4]庚烷、氧杂螺[3.4]辛烷、氧杂螺[4.4]壬烷、氧杂螺[2.5]辛烷、氧杂螺[3.5]壬烷、氧杂螺[4.5]癸烷、二氧杂螺[2.4]庚烷、二氧杂螺[3.4]辛烷、二氧杂螺[4.4]壬烷、二氧杂螺[2.5]辛烷、二氧杂螺[3.5]壬烷或二氧杂螺[4.5]癸烷,所述的甲基、乙基、丙基、异丙基、正丁基、仲丁基、异丁基、叔丁基、环丙基、环丁基、环戊基、环己基、环庚基、氮杂环丙基、氮杂环丁基、氮杂环戊基、二氮杂环戊基、氧氮杂环戊基、氮杂环己基、二氮杂环己基、氧氮杂环己基、氮杂环庚基、二氮杂环庚基、氧氮杂环庚基、氧杂环丙基、氧杂环丁基、氧杂环戊基、二氧杂环戊基、氧杂环己基、二氧杂环己基、氧杂环庚基、二氧杂环庚基、苯基、萘基、噻吩基、吡咯基、呋喃基、咪唑基、噁唑基、噻唑基、吡唑基、异噁唑基、异噻唑基、噁二唑基、三唑基、吡啶基、嘧啶基、吡嗪基、螺[2.4]庚烷、螺[3.4]辛烷、螺[4.4]壬烷、螺[2.5]辛烷、螺[3.5]壬烷、螺[4.5]癸烷、氮杂螺[2.4]庚烷、氮杂螺[3.4]辛烷、氮杂螺[4.4]壬烷、氮杂螺[2.5]辛烷、氮杂螺[3.5]壬烷、氮杂螺[4.5]癸烷、二氮杂螺[2.4]庚烷、二氮杂螺[3.4]辛烷、二氮杂螺[4.4]壬烷、二氮杂螺[2.5]辛烷、二氮杂螺[3.5]壬烷、二氮杂螺[4.5]癸烷、氧氮杂螺[2.4]庚烷、氧氮杂螺[3.4]辛烷、氧氮杂螺[4.4]壬烷、氧氮杂螺[2.5]辛烷、氧氮杂螺[3.5]壬烷、氧氮杂螺[4.5]癸烷、氧杂螺[2.4]庚烷、氧杂螺[3.4]辛烷、氧杂螺[4.4]壬烷、氧杂螺[2.5]辛烷、氧杂螺[3.5]壬烷、氧杂螺[4.5]癸烷、二氧杂螺[2.4]庚烷、二氧杂螺[3.4]辛烷、二氧杂螺[4.4]壬烷、二氧杂螺[2.5]辛烷、二氧杂螺[3.5]壬烷和二氧杂螺[4.5]癸烷可以被一个或多个羟基、氧代、氨基、羧基、卤素、氰基、硝基、C1-3烷基、C3-6环烷基、C3-6杂环烷基、卤代C1-3烷基、C1-3烷氧基、羟基C1-3烷基、羧基C1-3烷基、单C1-3烷基氨基、双C1-3烷基氨基、C1-3烷基酰基、C1-3烷氧基酰基、C1-3烷基酰基氧基、氨基酰基、单C1-3烷基氨基酰基、双C1-3烷基氨基酰基或C1-3烷基酰基氨基取代;
Rc选自氢、羟基、氨基、羧基、卤素、氰基、硝基、C1-6烷基、卤代C1-6烷基、羟基C1-6烷基、氨基C1-6烷基、羧基C1-6烷基、氰基C1-6烷基、硝基C1-6烷基、C1-6烷氧基、单C1-6烷基氨基、双C1-6烷基氨基、C3-6环烷基和C3-6杂环烷基,其中f选自1、2和3;
L1、L2分别独立地选自
其中,R7和R8分别独立地选自氢、卤素、羟基、氨基、羧基、氰基、硝基、C1-6烷基、C3-8环烷基、C3-8杂环烷基、C1-6烷氧基、卤代C1-6烷基、羟基-C1-6烷基、氨基-C1-6烷基、羧基-C1-6烷基、氰基-C1-6烷基、硝基C1-6烷基、C3-8环烷基-C1-6烷基、C3-8杂环烷基-C1-6烷基、C1-6烷氧基-C1-6烷基、单C1-6烷基氨基、单C1-6烷基氨基-C1-6烷基、双C1-6烷基氨基、双C1-6烷基氨基-C1-6烷基、C1-6烷基酰基、C1-6烷基酰基-C1-6烷基、C1-6烷氧基酰基、C1-6烷氧基酰基-C1-6烷基、C1-6烷基酰基氧基、C1-6烷基酰基氧基-C1-6烷基、氨基酰基、氨基酰基-C1-6烷基、单C1-6烷基氨基酰基、单C1-6烷基氨基酰基-C1-6烷基、双C1-6烷基氨基酰基、双C1-6烷基氨基酰基-C1-6烷基、C1-6烷基酰基氨基和C1-6烷基酰基氨基-C1-6烷基;
p、q分别独立地选自1、2和3;
R1、R2分别独立地选自氢、甲基、乙基、丙基、异丙基、丁基、异丁基、叔丁基、环丙烷基、环丁烷基、环戊烷基、环己烷基、四氢吡咯烷基、四氢呋喃基、四氢噻吩基、四氢噻唑基、四氢噁唑基、哌啶基、哌嗪基、N-烷基哌嗪基、苯基、萘基、吡咯基、噻吩基、噻唑基、噁唑基和吡啶基,所述的甲基、乙基、丙基、异丙基、丁基、异丁基、叔丁基、环丙烷基、环丁烷基、环戊烷基、环己烷基、环庚烷基、四氢吡咯烷基、四氢呋喃基、四氢噻吩基、四氢噻唑基、四氢噁唑基、哌啶基、哌嗪基、N-烷基哌嗪基、苯基、萘基、吡咯基、噻吩基、噻唑基、噁唑基和吡啶基可以被一个或多个卤素、羟基、氨基、羧基、氰基、硝基、C1-6烷基、C1-6烷氧基、羟基-C1-6烷基、羧基-C1-6烷基、单C1-6烷基氨基或双C1-6烷基氨基取代;
R3、R4分别独立地选自氢、甲基、乙基、丙基、异丙基、丁基、异丁基、叔丁基、环丙烷基、环丁烷基、环戊烷基、环己烷基、四氢吡咯烷基、四氢呋喃基、四氢噻吩基、四氢噻唑基、四氢噁唑基、哌啶基和哌嗪基,所述的甲基、乙基、丙基、异丙基、丁基、异丁基、叔丁基、环丙烷基、环丁烷基、环戊烷基、环己烷基、四氢吡咯烷基、四氢呋喃基、四氢噻吩基、四氢噻唑基、四氢噁唑基、哌啶基和哌嗪基可以被一个或多个卤素、羟基、氨基、羧基、氰基、硝基、C1-6烷基、环丙基、环丁基、环戊烷基、环己烷基、四氢吡咯烷基、四氢呋喃基、四氢噻吩基、四氢噻唑基、四氢噁唑基、哌啶基、哌嗪基、N-烷基哌嗪基、C1-6烷氧基或苯基取代;和
R5、R6分别独立地选自氢、卤素、氰基、羟基、氨基、羧基、硝基、C1-6烷基、C3-6环烷基、C3-6杂环烷基、C1-6烷氧基卤代烷基、氰基C1-6烷基、羟基C1-6烷基、氨基C1-6烷基、羧基C1-6烷基、硝基C1-6烷基、C3-6环烷基-C1-6烷基和C3-6杂环烷基-C1-6烷基,m和n分别独立地选自1、2和3,或者当m或n为2时,各自独立地选自氮杂螺烷基、氧氮杂螺烷基和氮杂双环烷基,其中所述氮杂螺烷基为氮杂螺[2.4]庚烷基、氮杂螺[3.4]辛烷基、氮杂螺[4.4]壬烷基、氮杂螺[2.5]辛烷基、氮杂螺[3.5]壬烷基、氮杂螺[4.5]癸烷基、氮杂螺[2.6]壬烷基或氮杂螺[3.6]癸烷基,所述氧氮杂螺烷基为氧杂-氮杂螺[2.4]庚烷基、氧杂-氮杂螺[3.4]辛烷基、氧杂-氮杂螺[4.4]壬烷基、二氧杂-氮杂螺[4.4]壬烷基、氧杂-氮杂螺[4.5]癸烷基、二氧杂-氮杂螺[4.5]癸烷基或三氧杂-氮杂螺[4.5]癸烷基,以及所述氮杂双环烷基为氮杂双环[3.1.0]己烷、氮杂双环[3.2.0]庚烷基、八氢环戊并吡咯基、八氢-1H-异吲哚基、八氢-1H-吲哚基或氮杂双环[2.2.1]庚烷基。
5.一种药物组合物,其包含权利要求1至3之任一项所述的化合物或其药学可接受的盐和可药用载体。
6.权利要求1-3之任一项所述的化合物或其药学可接受的盐或权利要求5所述的药物组合物在制备用于治疗和/或预防由丙型肝炎病毒引起的疾病的药物中的应用。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN201510092377.9A CN106008552B (zh) | 2015-03-01 | 2015-03-01 | 苯并[e]吡唑并[1,5-c][1,3]噁嗪类化合物及其应用 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN201510092377.9A CN106008552B (zh) | 2015-03-01 | 2015-03-01 | 苯并[e]吡唑并[1,5-c][1,3]噁嗪类化合物及其应用 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN106008552A CN106008552A (zh) | 2016-10-12 |
| CN106008552B true CN106008552B (zh) | 2020-08-21 |
Family
ID=57082301
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201510092377.9A Active CN106008552B (zh) | 2015-03-01 | 2015-03-01 | 苯并[e]吡唑并[1,5-c][1,3]噁嗪类化合物及其应用 |
Country Status (1)
| Country | Link |
|---|---|
| CN (1) | CN106008552B (zh) |
Families Citing this family (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN110483376B (zh) * | 2019-09-11 | 2020-11-03 | 山西智创药研科技有限公司 | 一种中间体n-苯基-4-哌啶酮的合成方法 |
| CN113321665B (zh) * | 2021-06-22 | 2022-07-26 | 大连医科大学 | 一种p23小分子抑制剂、制备方法及应用 |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN103328480A (zh) * | 2011-11-16 | 2013-09-25 | 吉利德科学公司 | 作为抗病毒化合物的缩合的咪唑基咪唑 |
| CN104231023A (zh) * | 2013-06-06 | 2014-12-24 | 南京圣和药业有限公司 | 三环稠杂环类核苷氨基磷酸酯化合物、其制备方法及应用 |
-
2015
- 2015-03-01 CN CN201510092377.9A patent/CN106008552B/zh active Active
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN103328480A (zh) * | 2011-11-16 | 2013-09-25 | 吉利德科学公司 | 作为抗病毒化合物的缩合的咪唑基咪唑 |
| CN104231023A (zh) * | 2013-06-06 | 2014-12-24 | 南京圣和药业有限公司 | 三环稠杂环类核苷氨基磷酸酯化合物、其制备方法及应用 |
Also Published As
| Publication number | Publication date |
|---|---|
| CN106008552A (zh) | 2016-10-12 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR101624365B1 (ko) | C형 간염 바이러스 억제제 | |
| US9303061B2 (en) | Spiro compounds as Hepatitis C virus inhibitors | |
| CN104136433B (zh) | 具有杂三环部分的抗病毒化合物 | |
| TW201100401A (en) | Hepatitis C virus inhibitors | |
| KR20120133366A (ko) | C형 간염 바이러스 억제제 | |
| KR20120034603A (ko) | C형 간염 바이러스 억제제 | |
| JP2013518060A (ja) | C型肝炎ウイルス阻害剤 | |
| CA2935089C (en) | 9,9,10,10-tetrafluoro-9,10-dihydrophenanthrene hepatitis c virus inhibitor and application thereof | |
| JP7357146B2 (ja) | アザヘテロアリール化合物及びその使用 | |
| CN104725365B (zh) | 丙型肝炎病毒抑制剂及其应用 | |
| CN103420991A (zh) | 作为丙型肝炎抑制剂的吡咯烷衍生物及其在药物中的应用 | |
| CN103880823B (zh) | 作为丙型肝炎抑制剂的螺环化合物及其在药物中的应用 | |
| CN103848819B (zh) | 作为丙型肝炎抑制剂的螺环化合物、药物组合物及它们在药物中的应用 | |
| CN105884779A (zh) | 作为丙型肝炎抑制剂的化合物及其在药物中的应用 | |
| CN103848820A (zh) | 作为丙型肝炎抑制剂的螺环化合物及其在药物中的应用 | |
| TWI600653B (zh) | 作爲丙型肝炎抑制劑的並環化合物、藥物組合物及它們在藥物中的應用 | |
| CN106008552B (zh) | 苯并[e]吡唑并[1,5-c][1,3]噁嗪类化合物及其应用 | |
| CN105985355B (zh) | 稠合三环类肝炎病毒抑制剂及其应用 | |
| CN107074876A (zh) | 一类抑制丙肝病毒的大环状杂环化合物及其制备和用途 | |
| HK1228391A1 (zh) | 作为丙型肝炎抑制剂的化合物及其在药物中的应用 | |
| HK1222845B (zh) | 9,9,10,10-四氟-9,10二氢菲类丙型肝炎病毒抑制剂及其应用 | |
| TW201038558A (en) | Hepatitis C virus inhibitors |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| SE01 | Entry into force of request for substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| GR01 | Patent grant | ||
| GR01 | Patent grant |