CN102757504A - RORγ-CTAP融合蛋白及RORγ相互作用蛋白的捕获方法 - Google Patents
RORγ-CTAP融合蛋白及RORγ相互作用蛋白的捕获方法 Download PDFInfo
- Publication number
- CN102757504A CN102757504A CN201210215680XA CN201210215680A CN102757504A CN 102757504 A CN102757504 A CN 102757504A CN 201210215680X A CN201210215680X A CN 201210215680XA CN 201210215680 A CN201210215680 A CN 201210215680A CN 102757504 A CN102757504 A CN 102757504A
- Authority
- CN
- China
- Prior art keywords
- ror
- ctap
- rorγ
- protein
- seq
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Landscapes
- Peptides Or Proteins (AREA)
Abstract
本发明涉及RORγ-CTAP融合蛋白,所述RORγ-CTAP融合蛋白从氨基末端到羧基末端依次由RORγ和CTAP融合标签组成,所述RORγ指维甲酸相关孤儿核受体γ,所述CTAP融合标从氨基末端到羧基末端依次由SBP、TEV蛋白酶切位点以及protG组成,RORγ相互作用蛋白的捕获方法为:用RORγ抗体、protG抗体和SBP抗体中任一种或多种对核蛋白进行蛋白印迹检测,并通过显影定影技术获得蛋白条带,所述蛋白条带为RORγ相互作用蛋白;本发明中构建的RORγ-CTAP融合基因序列准确且各组成部分表达正确,能够用于细胞内RORγ蛋白复合物的纯化,适用于大多数实验室在进行RORγ蛋白质复合物研究时采用,具有良好的推广应用价值。
Description
技术领域
本发明属于蛋白质和基因技术,特别涉及RORγ相互作用蛋白的鉴定。
背景技术
在研究蛋白质相互作用时,运用接近生理条件并具有高亲和力的捕获靶蛋白复合物的方法至关重要。已有一些研究相互作用蛋白的方法,如免疫沉淀、酵母双杂交、GST-pull down和单标签亲和纯化等,但这些方法要么存在抗体的交叉反应或抗体泄漏进而会产生显著的背景,要么有很高的假阳性率和假阴性率,或者体外易形成复合体及其与细胞内预装配的复合体竞争致使纯化的蛋白得率较低。鉴于上述各种分离纯化蛋白复合体的方法中存在的问题,最近几年国外发展出一种更好的替代方法。串联亲和纯化方法(TAP)使用2个或2个以上的标签逐步进行纯化,该方法具有高产率、低污染、高特异性等特点,从而大大提高了靶蛋白的真正的伙伴蛋白的得率和大大减少所需要的靶蛋白源细胞数量。但是,关于TAP的维甲酸相关孤儿核受体γ(RORγ)相互作用蛋白的捕获方法至今还未有报道。
发明内容
本发明的目的之一在于提供一种融合蛋白,该融合蛋白含有CTAP融合标签,通过免疫印迹的方法能捕获该融合蛋白。
为实现上述目的,本发明的技术方案为:
捕获RORγ相互作用蛋白的RORγ-CTAP融合蛋白,所述RORγ-CTAP融合蛋白从氨基末端到羧基末端依次由RORγ和CTAP融合标签组成,所述RORγ指维甲酸相关孤儿核受体γ,所述CTAP融合标从氨基末端到羧基末端依次由链亲和素结合肽、TEV蛋白酶切位点以及G蛋白组成。
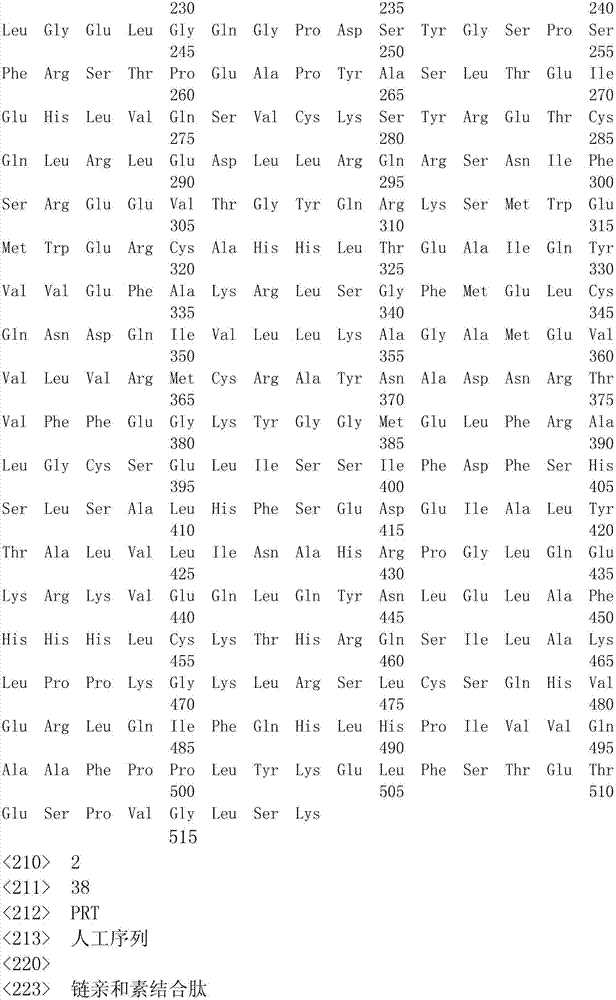
进一步,所述RORγ的氨基酸序列如SEQ ID NO:1所示,所述链亲和素结合肽的氨基酸序列如SEQ ID NO:2所示,所述TEV蛋白酶切位点的氨基酸序列如SEQ ID NO:3所示,所述G蛋白的氨基酸序列如SEQ ID NO:4所示。
本发明的目的之二在于提供一种维甲酸相关孤儿核受体γ相互作用蛋白的捕获方法,该捕获方法为RORγ蛋白复合物的鉴定及纯化工作提供了新的思路。
为实现上述目的,本发明的技术方案为:
RORγ相互作用蛋白的捕获方法,具体包括以下步骤:
A PCR扩增
根据GenBank公布的RORγ基因序列设计扩增引物设,以RORγ基因为模板通过PCR扩增,得如SEQ ID NO:5所示的RORγ基因;
B亚克隆
将步骤A所得的RORγ基因带入所述CTAP融合标签的载体质粒中,得重组载体;
C转染并提取蛋白
将所述重组载体转染入HepG2细胞中,提取转染细胞中核蛋白,其含有蛋白复合物,所述蛋白复合物含有RORγ-CTAP融合蛋白和RORγ相互作用蛋白;
D蛋白印迹检测
用RORγ抗体、protG抗体和SBP抗体中任一种或多种对核蛋白进行蛋白印迹检测,并通过显影定影技术获得蛋白条带,所述蛋白条带为RORγ相互作用蛋白。
进一步,步骤A中,所述RORγ的特异性引物,其上游引物为:
5’-gcgaattcatggacagggccccac-3’(如SEQ ID NO:6所示),其下游引物为:5’-ccgtttaaacttcttggacagccccacag-3’(如SEQ ID NO:7所示),所述引物中分别带有EcoR I和Pme I酶切位点。
进一步,步骤A中,PCR扩增条件为:98℃,15秒;68℃,10秒;72℃,90秒;上述30个循环。
进一步,将如SEQ ID NO:5所示的RORγ基因插入至pCeMM TAP载体中。
进一步,在步骤D中,用未转染HepG细胞来源的核蛋白作为空白对照。
本发明的有益效果在于:构建的RORγ-CTAP融合基因序列准确且各组成部分表达正确,能够用于细胞内RORγ蛋白复合物的纯化,适用于大多数实验室在进行RORγ蛋白质复合物研究时采用,具有良好的推广应用价值。
附图说明
图1为RORγ-CTAP融合蛋白的结构示意图。
图2为RORγ-CTAP融合基因的测序结果。
图3为RORγ-CTAP融合蛋白中各组成部分的免疫印迹表达检测。
具体实施方式
为了使本发明的目的、技术方案和有点更加清楚,下面将结合附图对本发明的优选实施例进行详细的描述。
HepG2细胞由本实验室保持,pCeMM TAP载体由德国法兰克福大学EUROSCARF中心提供,pMSCVpuro载体购自Invitrogen公司,Trizol、各种常规酶、预染蛋白质marker、DNA marker购自TaKaRa总司,各种蛋白质一抗二抗购自Santa Cruz公司。
实施例1带有融合标签CTAP的载体质粒的构建
上海英俊生物公司设计并合成所述RORγ的特异性引物,其上游引物为:5’-gcgaattcatggacagggccccac-3’(如SEQID NO:6所示),其下游引物为:5’-ccgtttaaacttcttggacagccccacag-3’(如SEQID NO:7所示),所述引物中分别带有EcoR I和Pme I酶切位点。以RORγ基因为模板通过PCR方法扩增出RORγCDS序列,PCR扩增条件为:98℃,15秒;68℃,10秒;72℃90秒;上述30个循环;如SEQ ID NO:5所示的RORγ基因。
实施例2细胞转染
将测序鉴定过的融合蛋白ROR γ-CTAP表达载体转染入HepG2细胞中。具体为:HepG2细胞培养于含10%胎牛血清的DMEM完全培养基中。按照试剂说明书方法用LipofectamineTM 2000转染进HepG2细胞中。为获得稳定转染细胞株,细胞转染36小时后在完全培养基中添加1.5μg/ml浓度的嘌呤霉素进行培养,并在随后的每2-3天更换一次含抗生素的完全培养基。
实施例3免疫印迹捕获重组蛋白
1.胞浆蛋白和核蛋白的提取:
①胰酶消化培养的HepG2细胞,计数取4×106个;
②按细胞数加入预冷的CER I(含蛋白酶抑制剂),轻柔混匀,冰浴10分钟;
③往上步反应液中加入11μl预冷的CER II,涡旋5sec,冰浴1分钟;
④涡旋5秒,16000g离心5分钟;
⑤将上清(浆蛋白)迅速转移至干净的预冷的EP管中,冰浴待用或分装-80℃冻存;
⑥用100μl预冷的NER重悬沉淀,涡旋15秒充分重悬沉淀,冰浴40分钟。每10分钟涡旋反应液15秒;
⑦16000g离心10分钟;
⑧上清为核蛋白,转移至预冷的EP管中,冰浴待用或分装-80℃冻存;
⑨蛋白浓度检测为5.2μg/μl,其含有蛋白复合物,所述蛋白复合物含有RORγ-CTAP融合蛋白和RORγ相互作用蛋白;所述RORγ-CTAP融合蛋白从氨基末端到羧基末端依次由RORγ和CTAP融合标签组成,所述RORγ指维甲酸相关孤儿核受体γ,所述CTAP融合标从氨基末端到羧基末端依次由链亲和素结合肽、TEV蛋白酶切位点以及G蛋白组成;所述RORγ的氨基酸序列如SEQID NO:1所示,所述链亲和素结合肽的氨基酸序列如SEQ ID NO:2所示,所述TEV蛋白酶切位点的氨基酸序列如SEQ ID NO:3所示,所述G蛋白的氨基酸序列如SEQ ID NO:4所示。
2.蛋白质凝胶电泳:
②在样品蛋白中加入上样缓冲液,水煮10min;
③12000g离心5min,取上清蛋白;
④在凝胶加样孔中按实验分组要求加上蛋白样品和预染分子量标准蛋白;
⑤电泳。条件为:恒压200V,1hr;
⑥电泳结束,卸下凝胶,用镊子撬开塑料夹板,取出凝胶;
3.电转膜:
①取出的凝胶置于电转缓冲液中平衡15min;
②PVDF膜依次处理:甲醇,浸泡15sec;超纯水,漂洗3min;电转缓冲液中平衡15min;
③电转“三明治”由正极向负极依次叠放顺序为:滤纸→凝胶→PVDF膜→滤纸;
④电转条件:30V,1hr;
⑤电转结束,取出PVDF膜,甲醇短暂漂洗后再在超纯水中漂洗1min去掉电转缓冲液;
4.封闭:PVDF膜放入塑料封闭袋中,加入封闭液(含0.05%Tween 20的Blocking Buffer),室温摇床上缓慢孵育1.5-2hr或4℃过夜;
5.孵一抗:用封闭液按最适比例稀释一抗后,在封闭袋中对PVDF膜进行一抗结合孵育,室温2hr或或4℃过夜;
6.洗一抗:取出PVDF膜,于平皿中用TBST(含0.05%Tween20的TBS)洗涤6min/次×5次;
7.孵二抗:用封闭液按1∶20000比例稀释二抗后,在封闭袋中对PVDF膜进行二抗结合孵育,室温1hr;
8.洗二抗:取出PVDF膜,于平皿中用TBST(含0.05%Tween20的TBS)洗涤6min/次×5次;
9.显色:将结合有一抗二抗的PVDF膜置于显色底物ECL发光液中,避光孵育5min;
10.曝光:挤除发光液,在暗室内用X光片曝光。一般曝光时间点设为8sec,30sec,1min,5min等,具体曝光时间随条带的荧光强度改变;
11.显影定影:曝光过的X光片于首先置于显影液中显影2min,经过自来水充分漂洗,最后置于定影液中定影2min。自来水漂洗后,挂于通风处晾干,扫描胶片结果。
结果显示,RORγ-CTAP转染HepG细胞来源的实验组和未转染HepG细胞来源的对照组,用RORγ抗体均能检测出内源性的RORγ蛋白,此外实验组还检测到RORγ-CTAP融合蛋白;如图3所示,而当用protG抗体或SBP抗体分别进行蛋白印迹检测时,实验组中RORγ-CTAP融合蛋白均能正确表达。
最后说明的是,以上实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的宗旨和范围,其均应涵盖在本发明的权利要求范围当中。
Claims (7)
1.捕获RORγ相互作用蛋白的RORγ-CTAP融合蛋白,其特征在于:所述RORγ-CTAP融合蛋白从氨基末端到羧基末端依次由RORγ和CTAP融合标签组成,所述RORγ指维甲酸相关孤儿核受体γ,所述CTAP融合标从氨基末端到羧基末端依次由链亲和素结合肽、TEV蛋白酶切位点以及G蛋白组成。
2.根据权利要求1所述的RORγ-CTAP融合蛋白,其特征在于:所述RORγ的氨基酸序列如SEQ ID NO:1所示,所述链亲和素结合肽的氨基酸序列如SEQID NO:2所示,所述TEV蛋白酶切位点的氨基酸序列如SEQ ID NO:3所示,所述G蛋白的氨基酸序列如SEQ ID NO:4所示。
3.RORγ相互作用蛋白的捕获方法,其特征在于,具体包括以下步骤:
A PCR扩增
根据GenBank公布的RORγ基因序列设计扩增引物,以RORγ基因为模板通过PCR扩增,得如SEQ ID NO:5所示的RORγ基因;
B亚克隆
将步骤A所得的RORγ基因带入所述CTAP融合标签的载体质粒中,得重组载体;
C转染并提取蛋白
将所述重组载体转染入HepG2细胞中,提取转染细胞中核蛋白,其含有蛋白复合物,所述蛋白复合物含有RORγ-CTAP融合蛋白和RORγ相互作用蛋白;
D蛋白印迹检测
用RORγ抗体、protG抗体和SBP抗体中任一种或多种对核蛋白进行蛋白印迹检测,并通过显影定影技术获得蛋白条带,所述蛋白条带为RORγ相互作用蛋白。
4.根据权利要求3所述的捕获方法,其特征在于,步骤A中,所述ROR γ的特异性引物,其上游引物如SEQ ID NO:6所示,其下游引物为如SEQ ID NO:7所示,所述引物中分别带有EcoR I和Pme I酶切位点。
5.根据权利要求4所述的捕获方法,其特征在于,步骤A中,PCR扩增条件为:98℃,15秒;68℃,10秒;72℃,90秒;上述30个循环。
6.根据权利要求5所述的捕获方法,其特征在于,将如SEQ ID NO:5所示的ROR γ基因插入至pCeMM TAP载体中。
7.根据权利要求3所述的捕获方法,其特征在于,在步骤D中,用未转染HepG细胞来源的核蛋白作为空白对照。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN201210215680XA CN102757504A (zh) | 2012-06-27 | 2012-06-27 | RORγ-CTAP融合蛋白及RORγ相互作用蛋白的捕获方法 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN201210215680XA CN102757504A (zh) | 2012-06-27 | 2012-06-27 | RORγ-CTAP融合蛋白及RORγ相互作用蛋白的捕获方法 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| CN102757504A true CN102757504A (zh) | 2012-10-31 |
Family
ID=47052183
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201210215680XA Pending CN102757504A (zh) | 2012-06-27 | 2012-06-27 | RORγ-CTAP融合蛋白及RORγ相互作用蛋白的捕获方法 |
Country Status (1)
| Country | Link |
|---|---|
| CN (1) | CN102757504A (zh) |
-
2012
- 2012-06-27 CN CN201210215680XA patent/CN102757504A/zh active Pending
Non-Patent Citations (5)
| Title |
|---|
| 《免疫学杂志》 20120530 吴水英等 HepG2 细胞中RORgamma 相互作用蛋白的筛选及鉴定 第28卷, 第5期 * |
| BURCKSTUMMER T ET AL: "Expression vector pCeMM-CTAP(SG), complete sequence", 《GENBANK: EF467048.1》 * |
| CLONTECH LABORATORIES: "pMSCVpuro Vector Information", 《VECTOR INFORMATION》 * |
| SANTARLASCI V ET AL: "nuclear receptor ROR-gamma isoform a [Homo sapiens]", 《NP_005051》 * |
| 吴水英等: "HepG2 细胞中RORγ 相互作用蛋白的筛选及鉴定", 《免疫学杂志》 * |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CA3200150A1 (en) | Antibody against novel coronavirus, and kit for novel coronavirus detection | |
| Wang et al. | Expression of gastrin-releasing peptide receptor gene in developing lung. | |
| CN101988926A (zh) | 一种高尔基蛋白gp73的夹心elisa定量检测方法及其检测试剂盒 | |
| CN103172752A (zh) | 牛肺炎支原体的诊断试剂及应用 | |
| CN108048480A (zh) | 一种split-TEV-Fast系统的构建方法及其在检测蛋白相互作用中的应用 | |
| CN108387723B (zh) | 一种lrp4抗体细胞包被微孔板制备方法 | |
| CN104422763A (zh) | 抗原组在制备诊断疾病的试剂盒中的用途和试剂盒 | |
| CN101235090A (zh) | 一种应用于结核病快速诊断的特异性融合蛋白 | |
| CN113687067A (zh) | 针对AChR单亚基抗体的检测试剂盒及其应用 | |
| CN116068177B (zh) | 检测微小隐孢子虫的直接免疫荧光试剂、试剂盒及其应用 | |
| CN105548539A (zh) | 一种拉沙病毒IgG抗体的间接免疫荧光检测方法 | |
| CN108196061A (zh) | 一种基于单克隆抗体检测人pgrn的双夹心elisa试剂盒 | |
| CN102757504A (zh) | RORγ-CTAP融合蛋白及RORγ相互作用蛋白的捕获方法 | |
| CN112409468B (zh) | 植物光系统i多克隆抗体及其制备方法 | |
| CN105675880A (zh) | 快速检测低丰度蛋白质的无封闭的蛋白质印迹法 | |
| CN105738624B (zh) | 一种裂谷热病毒IgG抗体的间接免疫荧光检测方法 | |
| CN119804863A (zh) | 检测人偏肺病毒抗原的酶联免疫试剂盒及定量检测方法 | |
| CN114438125B (zh) | 增强lgi1免疫荧光的方法、lgi1抗体的免疫荧光检测方法及应用 | |
| CN117624336A (zh) | 一种活性重组hSIRPA蛋白的表达纯化及检测方法 | |
| CN105294849B (zh) | 小鼠精原干细胞特异性抗原4933427d06rik及其抗体和应用 | |
| Dores et al. | Detection of Met-enkephalin and Leu-enkephalin in the posterior pituitary of the holostean fish, Amia calva | |
| TW581812B (en) | Assay for the diagnosis of schizophrenia based on a new peptide | |
| CN109796527A (zh) | 一种红麻线粒体蛋白cox3抗原多肽及制备多克隆抗体的方法和应用 | |
| CN108912225B (zh) | 一种基于双峰驼抗山羊痘病毒vhh-4-1及用途 | |
| CN114002426A (zh) | 猪瘟病毒e0蛋白抗体elisa检测试剂盒 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| C12 | Rejection of a patent application after its publication | ||
| RJ01 | Rejection of invention patent application after publication |
Application publication date: 20121031 |