CAMPO DA INVENÇÃO
[001] A presente invenção pertence ao campo dos procedimentos de fabricação para obtenção de anti-protozoários para o combate a Trypanosoma cruzi, mais especificamente, à obtenção de N-benzil-2-(2-nitro-1H-imidazol-1- ila)acetamida.
FUNDAMENTOS DA INVENÇÃO
[002] A molécula de N-benzil-2-(2-nitro-1H-imidazol-1-ila)acetamida é um anti-parasita, antiprotozoário derivado do 2-nitro-1H-imidazol, com atividade contra Trypanosoma cruzi, e foi preparada e apresentada em 1966 pela Hoffmann-La Roche & Co., patente concedida em 1972 nos USA sob o n° 3.679.698.
[003] O método de síntese apresentado no dito documento norte- americano US 3.679.698 inicialmente usa metóxido de sódio e metanol, adicionando 2-nitroimidazol, em seguida adicionando dimetilformamida, e a mistura é aquecida a 153°C para remover o metanol. A seguir é adicionado o éster 2-cloro-acetato de metila, aquecendo a 122°C e, subsequentemente, a formação de um precipitado ocorre e a mistura formada é aquecida até entre 105°C e 115°C. O solvente é eliminado num banho a 50 ° C, sob pressão reduzida de 0,2 mm Hg. O sólido formado é recristalizado em etanol, obtendo-se o éster 2-[2-nitroimidazol- (1)-ila] acetato de metila.
[004] Posteriormente uma solução do éster 2- [2-nitroimidazol-(1)-ila] acetato de metila com benzilamina em metanol absoluto é deixada repousar durante a noite toda, em seguida, a mistura é arrefecida durante várias horas e os cristais são recolhidos a partir do ponto de fusão 187,5-189,5°C. O filtrado é concentrado sob pressão reduzida e o sólido obtido é recristalizado com acetato de etila, para obter um material adicional de ponto de fusão do 187,5-189°C. A recristalização a partir do etanol produz os cristais de N-benzil-2-(2-nitroimidazol- (1)-ila) acetamida, com ponto de fusão entre 188,5°C-190°C. O produto apresenta Àmáx de 313 mμ em etanol.
[005] A patente US 6.870.057 B1 apresenta a síntese do antifúngico Bifenilimidazoil-(1)-fenilmetano, um dos seus passos é a reação do bifenilfenilcarbinol, na fase sólida, com um excesso de imidazol, sob irradiação com microondas (850-700 W), durante 30 minutos, no nível 4 do forno.
[006] O artigo por Gandolfi Donadío, L et al. Desarrollo de nuevas tecnologías para la producción de benznidazol. En: Tecnointi edición 2013 11° Jornadas Abiertas de Desarrollo, Innovación y Transferencia de Tecnología. 2-4 julio 2013, Buenos Aires. Editado por Instituto Nacional de Tecnología Industrial. Buenos Aires, Outubro, 2013, 1a edição, página 218, ISBN 978-950-532-202-2 apresenta as reações para a síntese do Benznidazol conforme a Rota Azo, a Rota Imidazolona e a Rota 2-metil-tio-imidazol. As duas últimas rotas sugerem como passo final da síntese, a reação de N-benzil-2-cloroacetamida e o 2-nitro-1H- imidazol em presença de NaH utilizando como solvente DMF para obter o benznidazol. Nas rotas descritas por estes autores tanto na Rota imidazolona como na Rota 2-metil-tio-imidazol as três etapas finais de síntese se encontram em vias de estudo.
[007] A publicação por Hernandéz-Núnez, Emanuel et al. Synthesis and in vitro trichomonicidal, giardicidal and amebicidal activity of N- acetamide(sulfonamide)-2-methyl-4-nitro-1H-imidazoles. European Journal of Medicinal Chemistry, 44 (2009) 2975-2984 relata a substituição nucleofílica bimolecular da N-benzil-2-cloroacetamida com o ânion 2-metil-1-H-imidazol em presença de uma base como carbonato de potássio utilizando como solvente a acetonitrila. O proceso é efetuado sob agitação e refluxo durante 8 horas. O presente processo se diferencia daquele apresentado por Hernandéz-Núnez, Emanuel et al., pelo fato de ser efetuado com 2-metil-1-H-imidazol molecular, não aniônico, já que nenhum tipo de base é adicionado e se realiza em ausência de solvente.
SUMÁRIO DA INVENÇÃO
[008] De um modo amplo, o procedimento de fabricação para obtenção da N-benzil-2-(2-nitro-1H-imidazol-1-ila) acetamida (I) conforme a invenção compreende fazer reagir em uma etapa, em estado sólido, uma mistura reacional equimolar de N-benzil-2-hidroxiacetamida (II) e 2-nitro-1-H-imidazol (III) usando radiação de micro-ondas como fonte de ativação a fim de produzir a N-benzil-2-(2- nitro-1H-imidazol-1-ila) acetamida (I). O procedimento da invenção não envolve catalisadores ácidos ou básicos. Além disso, é um procedimento ambientalmente correto.
BREVE DESCRIÇÃO DOS DESENHOS
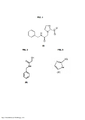
[009] A FIGURA 1 anexa é uma representação esquemática da N-benzil-2- (2-nitro-1H-imidazol-1-ila) acetamida (I), produto da invenção.
[010] A FIGURA 2 anexa é uma representação esquemática do reagente N-benzil-2-hidroxiacetamida (II) utilizado no procedimento da invenção.
[011] A FIGURA 3 anexa é uma representação esquemática do reagente 2-nitro-1-H-imidazol (III) utilizado no procedimento da invenção.
DESCRIÇÃO DETALHADA DA INVENÇÃO
[012] O presente invento está relacionado com a síntese de um derivado de imidazol que possui actividade tripanocida. O processo de síntese realiza-se em uma etapa, em condições secas, é um processo simples, barato e amigável para o meio ambiente. A síntese envolve a preparação da N-benzil-2-(2-nitro-1H- imidazol-1-il) acetamida. O método permite obter N-benzil-2-(2-nitro-1H-imidazol-1- il) acetamida utilizando como materiais de partida a N-benzil-2-hidroxiacetamida e 2-nitro-1-H-imidazol, a adição de cada um dos materiais de partida sendo em razão equimolar.
[013] O processo é limpo, realizado por mistura dos dois materiais de partida e a subsequente irradiação com energia de microondas para formar a N- benzil-2-(2-nitro-1H-imidazol-1-il) acetamida. A síntese é de execução rápida e fácil. A mistura de reação é purificada por passagem em coluna de cromatografia, utilizando como fase estacionária alumina e como fase móvel acetato de etila. O procedimento de manufatura da invenção não requer catalisadores ácidos ou básicos no processo de síntese.
[014] O procedimento apresentado no presente invento pode ser utilizado para a obtenção de outros derivados do imidazol tais como N-benzil-2-(1H- imidazol-1-ila) acetamida utilizando como materiais de partida 1H-imidazol e N- benzil-2-hidroxiacetamida.
[015] Na prática, a reação conforme o procedimento da invenção é levado a cabo como segue:
EXEMPLO 1
[016] Conforme uma primeira modalidade da invenção, a N-benzil-2- hidroxi-acetamida é misturada com 2-nitroimidazol em proporção equimolar. Os materiais de partida são misturados no estado sólido, na ausência de solvente orgânico ou inorgânico, sendo colocados em um recipiente transparente no forno de micro-ondas num banho de sílica e a mistura é então irradiada com microondas em multimodo a 700 W, nível de 4 a 7 do forno durante cerca de 10 minutos. A mistura de reação é purificada através de uma coluna de cromatografia, utilizando como fase estacionária alumina e acetato de etila como fase móvel. Ao produto obtido aplicou-se análise por TLC, espectroscopia de infravermelho e espectrometria de massas.
[017] IR= 1.156 e 1.145 cm-1(N-C, amina terciária), 1.539,3 e 1.367cm-1(C- N, grupo nitro), 1.660,3 cm-1 (CO-NH amida), 3.275,3 cm-1 (NH- amida).
[018] MS= 260 M+
EXEMPLO 2
[019] Conforme uma segunda modalidade da invenção, o mesmo procedimento geral do Exemplo 1 acima é utilizado, somente a irradiação com micro-ondas é em monomodo a 100 W, durante 15 a 20 minutos. As mesmas análises do Exemplo 1 foram efetuadas, com os mesmos resultados.
EXEMPLO 3
[020] Ainda conforme uma terceira modalidade da invenção, o mesmo procedimento geral do Exemplo 1 acima é utilizado, somente a irradiação por micro-ondas é por monomodo a 100 W durante 15 a 20 minutos e por multimodo a 700 W nível 4 a 7 do forno durante 10 minutos.