WO2020071554A1 - がん幹細胞特異的抗体 - Google Patents
がん幹細胞特異的抗体Info
- Publication number
- WO2020071554A1 WO2020071554A1 PCT/JP2019/039400 JP2019039400W WO2020071554A1 WO 2020071554 A1 WO2020071554 A1 WO 2020071554A1 JP 2019039400 W JP2019039400 W JP 2019039400W WO 2020071554 A1 WO2020071554 A1 WO 2020071554A1
- Authority
- WO
- WIPO (PCT)
- Prior art keywords
- antibody
- antigen
- cancer
- present disclosure
- seq
- Prior art date
Links
- 206010028980 Neoplasm Diseases 0.000 title claims abstract description 173
- 201000011510 cancer Diseases 0.000 title claims abstract description 151
- 239000000427 antigen Substances 0.000 claims abstract description 183
- 108091007433 antigens Proteins 0.000 claims abstract description 183
- 102000036639 antigens Human genes 0.000 claims abstract description 183
- 108090000765 processed proteins & peptides Proteins 0.000 claims abstract description 146
- 239000008194 pharmaceutical composition Substances 0.000 claims abstract description 39
- 230000027455 binding Effects 0.000 claims description 93
- 150000001413 amino acids Chemical class 0.000 claims description 63
- 108090000623 proteins and genes Proteins 0.000 claims description 56
- 102100035424 DnaJ homolog subfamily B member 8 Human genes 0.000 claims description 33
- 101000804109 Homo sapiens DnaJ homolog subfamily B member 8 Proteins 0.000 claims description 33
- 102000004169 proteins and genes Human genes 0.000 claims description 32
- 101000877861 Homo sapiens Protein FAM83B Proteins 0.000 claims description 27
- 102100035443 Protein FAM83B Human genes 0.000 claims description 27
- 101000914484 Homo sapiens T-lymphocyte activation antigen CD80 Proteins 0.000 claims description 6
- 102100027222 T-lymphocyte activation antigen CD80 Human genes 0.000 claims description 6
- 230000000890 antigenic effect Effects 0.000 claims description 5
- 125000003275 alpha amino acid group Chemical group 0.000 claims 4
- 210000000130 stem cell Anatomy 0.000 abstract description 83
- 238000000034 method Methods 0.000 abstract description 33
- 230000008685 targeting Effects 0.000 abstract description 8
- 210000004027 cell Anatomy 0.000 description 87
- 108010047041 Complementarity Determining Regions Proteins 0.000 description 38
- 108010013476 HLA-A24 Antigen Proteins 0.000 description 36
- 102100021393 Transcriptional repressor CTCFL Human genes 0.000 description 22
- 101710128101 Transcriptional repressor CTCFL Proteins 0.000 description 22
- 239000003795 chemical substances by application Substances 0.000 description 20
- 102000004196 processed proteins & peptides Human genes 0.000 description 20
- 210000001744 T-lymphocyte Anatomy 0.000 description 19
- 210000001519 tissue Anatomy 0.000 description 18
- 229940024606 amino acid Drugs 0.000 description 17
- 230000000694 effects Effects 0.000 description 17
- 238000011282 treatment Methods 0.000 description 14
- 238000012360 testing method Methods 0.000 description 13
- 102100021969 Nucleotide pyrophosphatase Human genes 0.000 description 12
- 230000002265 prevention Effects 0.000 description 12
- 230000009257 reactivity Effects 0.000 description 12
- 108010019670 Chimeric Antigen Receptors Proteins 0.000 description 11
- 238000001514 detection method Methods 0.000 description 11
- 238000009169 immunotherapy Methods 0.000 description 11
- 230000004540 complement-dependent cytotoxicity Effects 0.000 description 10
- 230000001472 cytotoxic effect Effects 0.000 description 9
- 101000914514 Homo sapiens T-cell-specific surface glycoprotein CD28 Proteins 0.000 description 8
- 102100027213 T-cell-specific surface glycoprotein CD28 Human genes 0.000 description 8
- 239000012472 biological sample Substances 0.000 description 8
- 239000012634 fragment Substances 0.000 description 8
- 108091008874 T cell receptors Proteins 0.000 description 7
- 102000016266 T-Cell Antigen Receptors Human genes 0.000 description 7
- 229940022399 cancer vaccine Drugs 0.000 description 7
- 238000009566 cancer vaccine Methods 0.000 description 7
- FWBHETKCLVMNFS-UHFFFAOYSA-N 4',6-Diamino-2-phenylindol Chemical compound C1=CC(C(=N)N)=CC=C1C1=CC2=CC=C(C(N)=N)C=C2N1 FWBHETKCLVMNFS-UHFFFAOYSA-N 0.000 description 6
- AGPKZVBTJJNPAG-WHFBIAKZSA-N L-isoleucine Chemical compound CC[C@H](C)[C@H](N)C(O)=O AGPKZVBTJJNPAG-WHFBIAKZSA-N 0.000 description 6
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 6
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 6
- 239000003814 drug Substances 0.000 description 6
- 230000014509 gene expression Effects 0.000 description 6
- 210000002865 immune cell Anatomy 0.000 description 6
- 229960000310 isoleucine Drugs 0.000 description 6
- AGPKZVBTJJNPAG-UHFFFAOYSA-N isoleucine Natural products CCC(C)C(N)C(O)=O AGPKZVBTJJNPAG-UHFFFAOYSA-N 0.000 description 6
- 238000002360 preparation method Methods 0.000 description 6
- 238000012413 Fluorescence activated cell sorting analysis Methods 0.000 description 5
- 239000004480 active ingredient Substances 0.000 description 5
- 239000011324 bead Substances 0.000 description 5
- 210000000170 cell membrane Anatomy 0.000 description 5
- 238000006243 chemical reaction Methods 0.000 description 5
- 208000029742 colonic neoplasm Diseases 0.000 description 5
- 239000000203 mixture Substances 0.000 description 5
- 238000002823 phage display Methods 0.000 description 5
- 238000006467 substitution reaction Methods 0.000 description 5
- 206010009944 Colon cancer Diseases 0.000 description 4
- 229940076838 Immune checkpoint inhibitor Drugs 0.000 description 4
- 108060003951 Immunoglobulin Proteins 0.000 description 4
- 102000037984 Inhibitory immune checkpoint proteins Human genes 0.000 description 4
- 108091008026 Inhibitory immune checkpoint proteins Proteins 0.000 description 4
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 4
- COLNVLDHVKWLRT-QMMMGPOBSA-N L-phenylalanine Chemical compound OC(=O)[C@@H](N)CC1=CC=CC=C1 COLNVLDHVKWLRT-QMMMGPOBSA-N 0.000 description 4
- 206010027476 Metastases Diseases 0.000 description 4
- 206010039491 Sarcoma Diseases 0.000 description 4
- 108010090804 Streptavidin Proteins 0.000 description 4
- 230000024932 T cell mediated immunity Effects 0.000 description 4
- 210000004369 blood Anatomy 0.000 description 4
- 239000008280 blood Substances 0.000 description 4
- 238000011161 development Methods 0.000 description 4
- 239000002552 dosage form Substances 0.000 description 4
- 238000001943 fluorescence-activated cell sorting Methods 0.000 description 4
- 238000009472 formulation Methods 0.000 description 4
- 230000004727 humoral immunity Effects 0.000 description 4
- 239000012274 immune-checkpoint protein inhibitor Substances 0.000 description 4
- 230000036039 immunity Effects 0.000 description 4
- 102000018358 immunoglobulin Human genes 0.000 description 4
- 230000009401 metastasis Effects 0.000 description 4
- 229930182817 methionine Natural products 0.000 description 4
- COLNVLDHVKWLRT-UHFFFAOYSA-N phenylalanine Natural products OC(=O)C(N)CC1=CC=CC=C1 COLNVLDHVKWLRT-UHFFFAOYSA-N 0.000 description 4
- XJMOSONTPMZWPB-UHFFFAOYSA-M propidium iodide Chemical compound [I-].[I-].C12=CC(N)=CC=C2C2=CC=C(N)C=C2[N+](CCC[N+](C)(CC)CC)=C1C1=CC=CC=C1 XJMOSONTPMZWPB-UHFFFAOYSA-M 0.000 description 4
- 210000001550 testis Anatomy 0.000 description 4
- 229940124597 therapeutic agent Drugs 0.000 description 4
- 238000002560 therapeutic procedure Methods 0.000 description 4
- 206010006187 Breast cancer Diseases 0.000 description 3
- 208000026310 Breast neoplasm Diseases 0.000 description 3
- 101800001415 Bri23 peptide Proteins 0.000 description 3
- 125000001433 C-terminal amino-acid group Chemical group 0.000 description 3
- 102400000107 C-terminal peptide Human genes 0.000 description 3
- 101800000655 C-terminal peptide Proteins 0.000 description 3
- 101710163595 Chaperone protein DnaK Proteins 0.000 description 3
- 108020004414 DNA Proteins 0.000 description 3
- 102100029721 DnaJ homolog subfamily B member 1 Human genes 0.000 description 3
- 241000588724 Escherichia coli Species 0.000 description 3
- 108010042283 HSP40 Heat-Shock Proteins Proteins 0.000 description 3
- 101710178376 Heat shock 70 kDa protein Proteins 0.000 description 3
- 101710152018 Heat shock cognate 70 kDa protein Proteins 0.000 description 3
- 241000282412 Homo Species 0.000 description 3
- 206010058467 Lung neoplasm malignant Diseases 0.000 description 3
- 102000043129 MHC class I family Human genes 0.000 description 3
- 108091054437 MHC class I family Proteins 0.000 description 3
- 108010029485 Protein Isoforms Proteins 0.000 description 3
- 102000001708 Protein Isoforms Human genes 0.000 description 3
- 241000700159 Rattus Species 0.000 description 3
- 238000004458 analytical method Methods 0.000 description 3
- 239000002246 antineoplastic agent Substances 0.000 description 3
- 230000000295 complement effect Effects 0.000 description 3
- 238000002405 diagnostic procedure Methods 0.000 description 3
- MHMNJMPURVTYEJ-UHFFFAOYSA-N fluorescein-5-isothiocyanate Chemical compound O1C(=O)C2=CC(N=C=S)=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 MHMNJMPURVTYEJ-UHFFFAOYSA-N 0.000 description 3
- 239000003446 ligand Substances 0.000 description 3
- 201000005202 lung cancer Diseases 0.000 description 3
- 208000020816 lung neoplasm Diseases 0.000 description 3
- 229920001184 polypeptide Polymers 0.000 description 3
- 239000000523 sample Substances 0.000 description 3
- 238000012216 screening Methods 0.000 description 3
- 230000009870 specific binding Effects 0.000 description 3
- 208000024891 symptom Diseases 0.000 description 3
- 238000010998 test method Methods 0.000 description 3
- 102100021617 Ankyrin repeat and SOCS box protein 4 Human genes 0.000 description 2
- 241000283690 Bos taurus Species 0.000 description 2
- 241000282472 Canis lupus familiaris Species 0.000 description 2
- 241000283707 Capra Species 0.000 description 2
- 241000699800 Cricetinae Species 0.000 description 2
- 102100035966 DnaJ homolog subfamily A member 2 Human genes 0.000 description 2
- 102000001301 EGF receptor Human genes 0.000 description 2
- 108060006698 EGF receptor Proteins 0.000 description 2
- 241000283086 Equidae Species 0.000 description 2
- 241001524679 Escherichia virus M13 Species 0.000 description 2
- 241000282326 Felis catus Species 0.000 description 2
- 101000754303 Homo sapiens Ankyrin repeat and SOCS box protein 4 Proteins 0.000 description 2
- 101000870166 Homo sapiens DnaJ homolog subfamily C member 14 Proteins 0.000 description 2
- 101000984033 Homo sapiens Protein lin-28 homolog B Proteins 0.000 description 2
- 101000851370 Homo sapiens Tumor necrosis factor receptor superfamily member 9 Proteins 0.000 description 2
- 102000037982 Immune checkpoint proteins Human genes 0.000 description 2
- 108091008036 Immune checkpoint proteins Proteins 0.000 description 2
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 description 2
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 2
- KZSNJWFQEVHDMF-BYPYZUCNSA-N L-valine Chemical compound CC(C)[C@H](N)C(O)=O KZSNJWFQEVHDMF-BYPYZUCNSA-N 0.000 description 2
- 208000003445 Mouth Neoplasms Diseases 0.000 description 2
- 241000699666 Mus <mouse, genus> Species 0.000 description 2
- 241000283973 Oryctolagus cuniculus Species 0.000 description 2
- 108091093018 PVT1 Proteins 0.000 description 2
- 241000282579 Pan Species 0.000 description 2
- 206010061902 Pancreatic neoplasm Diseases 0.000 description 2
- 241001494479 Pecora Species 0.000 description 2
- 206010035226 Plasma cell myeloma Diseases 0.000 description 2
- 241000288906 Primates Species 0.000 description 2
- 206010060862 Prostate cancer Diseases 0.000 description 2
- 208000000236 Prostatic Neoplasms Diseases 0.000 description 2
- 102100025459 Protein lin-28 homolog B Human genes 0.000 description 2
- 241000283984 Rodentia Species 0.000 description 2
- 208000000453 Skin Neoplasms Diseases 0.000 description 2
- 241001493546 Suina Species 0.000 description 2
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 description 2
- 102100036856 Tumor necrosis factor receptor superfamily member 9 Human genes 0.000 description 2
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Natural products CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 description 2
- 229940041181 antineoplastic drug Drugs 0.000 description 2
- 238000003556 assay Methods 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- 238000002659 cell therapy Methods 0.000 description 2
- 201000010897 colon adenocarcinoma Diseases 0.000 description 2
- 230000001419 dependent effect Effects 0.000 description 2
- 238000003745 diagnosis Methods 0.000 description 2
- 238000010586 diagram Methods 0.000 description 2
- 201000010099 disease Diseases 0.000 description 2
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 2
- 229940079593 drug Drugs 0.000 description 2
- 239000000839 emulsion Substances 0.000 description 2
- 108010007811 human immunodeficiency virus p17 gag peptide Proteins 0.000 description 2
- 229940072221 immunoglobulins Drugs 0.000 description 2
- 238000007918 intramuscular administration Methods 0.000 description 2
- 238000001990 intravenous administration Methods 0.000 description 2
- 208000012987 lip and oral cavity carcinoma Diseases 0.000 description 2
- 230000036210 malignancy Effects 0.000 description 2
- 208000015486 malignant pancreatic neoplasm Diseases 0.000 description 2
- 238000005259 measurement Methods 0.000 description 2
- 108020004999 messenger RNA Proteins 0.000 description 2
- 201000000050 myeloid neoplasm Diseases 0.000 description 2
- 210000000822 natural killer cell Anatomy 0.000 description 2
- 239000013642 negative control Substances 0.000 description 2
- 150000007523 nucleic acids Chemical group 0.000 description 2
- 201000002528 pancreatic cancer Diseases 0.000 description 2
- 208000008443 pancreatic carcinoma Diseases 0.000 description 2
- 238000004091 panning Methods 0.000 description 2
- 229920000642 polymer Polymers 0.000 description 2
- 201000000849 skin cancer Diseases 0.000 description 2
- 238000007920 subcutaneous administration Methods 0.000 description 2
- 238000001356 surgical procedure Methods 0.000 description 2
- 230000001225 therapeutic effect Effects 0.000 description 2
- 238000004448 titration Methods 0.000 description 2
- 210000004881 tumor cell Anatomy 0.000 description 2
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 2
- 229960005486 vaccine Drugs 0.000 description 2
- 239000004474 valine Substances 0.000 description 2
- 102100026882 Alpha-synuclein Human genes 0.000 description 1
- 108090000672 Annexin A5 Proteins 0.000 description 1
- 102000004121 Annexin A5 Human genes 0.000 description 1
- 102000017420 CD3 protein, epsilon/gamma/delta subunit Human genes 0.000 description 1
- 108050005493 CD3 protein, epsilon/gamma/delta subunit Proteins 0.000 description 1
- 101150013553 CD40 gene Proteins 0.000 description 1
- 229940045513 CTLA4 antagonist Drugs 0.000 description 1
- 201000009030 Carcinoma Diseases 0.000 description 1
- 241000700198 Cavia Species 0.000 description 1
- 241000700199 Cavia porcellus Species 0.000 description 1
- 102000000844 Cell Surface Receptors Human genes 0.000 description 1
- 108010001857 Cell Surface Receptors Proteins 0.000 description 1
- 206010008342 Cervix carcinoma Diseases 0.000 description 1
- 208000001333 Colorectal Neoplasms Diseases 0.000 description 1
- 101150011616 Ctcf gene Proteins 0.000 description 1
- 102100039498 Cytotoxic T-lymphocyte protein 4 Human genes 0.000 description 1
- 206010059866 Drug resistance Diseases 0.000 description 1
- 101000834898 Homo sapiens Alpha-synuclein Proteins 0.000 description 1
- 101000889276 Homo sapiens Cytotoxic T-lymphocyte protein 4 Proteins 0.000 description 1
- 101000611936 Homo sapiens Programmed cell death protein 1 Proteins 0.000 description 1
- 101000652359 Homo sapiens Spermatogenesis-associated protein 2 Proteins 0.000 description 1
- 101000831007 Homo sapiens T-cell immunoreceptor with Ig and ITIM domains Proteins 0.000 description 1
- 108010054477 Immunoglobulin Fab Fragments Proteins 0.000 description 1
- 102000001706 Immunoglobulin Fab Fragments Human genes 0.000 description 1
- 108010021625 Immunoglobulin Fragments Proteins 0.000 description 1
- 102000008394 Immunoglobulin Fragments Human genes 0.000 description 1
- 108010067060 Immunoglobulin Variable Region Proteins 0.000 description 1
- 102000017727 Immunoglobulin Variable Region Human genes 0.000 description 1
- 102100020870 La-related protein 6 Human genes 0.000 description 1
- 108050008265 La-related protein 6 Proteins 0.000 description 1
- 102000043131 MHC class II family Human genes 0.000 description 1
- 108091054438 MHC class II family Proteins 0.000 description 1
- 108700018351 Major Histocompatibility Complex Proteins 0.000 description 1
- 102000018697 Membrane Proteins Human genes 0.000 description 1
- 108010052285 Membrane Proteins Proteins 0.000 description 1
- 241001465754 Metazoa Species 0.000 description 1
- 241000699670 Mus sp. Species 0.000 description 1
- 108091028043 Nucleic acid sequence Proteins 0.000 description 1
- 108700020796 Oncogene Proteins 0.000 description 1
- 101710160107 Outer membrane protein A Proteins 0.000 description 1
- 206010033128 Ovarian cancer Diseases 0.000 description 1
- 206010061535 Ovarian neoplasm Diseases 0.000 description 1
- 206010070308 Refractory cancer Diseases 0.000 description 1
- 208000006265 Renal cell carcinoma Diseases 0.000 description 1
- 230000006044 T cell activation Effects 0.000 description 1
- 229940126547 T-cell immunoglobulin mucin-3 Drugs 0.000 description 1
- 102100024834 T-cell immunoreceptor with Ig and ITIM domains Human genes 0.000 description 1
- 208000024313 Testicular Neoplasms Diseases 0.000 description 1
- 208000024770 Thyroid neoplasm Diseases 0.000 description 1
- 108091023040 Transcription factor Proteins 0.000 description 1
- 102000040945 Transcription factor Human genes 0.000 description 1
- 102100027671 Transcriptional repressor CTCF Human genes 0.000 description 1
- 101710121478 Transcriptional repressor CTCF Proteins 0.000 description 1
- 102100022153 Tumor necrosis factor receptor superfamily member 4 Human genes 0.000 description 1
- 101710165473 Tumor necrosis factor receptor superfamily member 4 Proteins 0.000 description 1
- 102100040245 Tumor necrosis factor receptor superfamily member 5 Human genes 0.000 description 1
- 208000006105 Uterine Cervical Neoplasms Diseases 0.000 description 1
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical compound [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 description 1
- KYIKRXIYLAGAKQ-UHFFFAOYSA-N abcn Chemical compound C1CCCCC1(C#N)N=NC1(C#N)CCCCC1 KYIKRXIYLAGAKQ-UHFFFAOYSA-N 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- 230000004913 activation Effects 0.000 description 1
- 239000012190 activator Substances 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 230000000259 anti-tumor effect Effects 0.000 description 1
- 230000030741 antigen processing and presentation Effects 0.000 description 1
- 210000000612 antigen-presenting cell Anatomy 0.000 description 1
- 238000001574 biopsy Methods 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- 210000004556 brain Anatomy 0.000 description 1
- 210000004899 c-terminal region Anatomy 0.000 description 1
- 230000005907 cancer growth Effects 0.000 description 1
- 238000002619 cancer immunotherapy Methods 0.000 description 1
- 239000012830 cancer therapeutic Substances 0.000 description 1
- 230000001364 causal effect Effects 0.000 description 1
- 230000010261 cell growth Effects 0.000 description 1
- 201000010881 cervical cancer Diseases 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 239000002299 complementary DNA Substances 0.000 description 1
- 230000009850 completed effect Effects 0.000 description 1
- 238000012790 confirmation Methods 0.000 description 1
- 230000000139 costimulatory effect Effects 0.000 description 1
- 210000004748 cultured cell Anatomy 0.000 description 1
- 210000001151 cytotoxic T lymphocyte Anatomy 0.000 description 1
- 230000010013 cytotoxic mechanism Effects 0.000 description 1
- 230000003013 cytotoxicity Effects 0.000 description 1
- 231100000135 cytotoxicity Toxicity 0.000 description 1
- 230000001934 delay Effects 0.000 description 1
- 210000004443 dendritic cell Anatomy 0.000 description 1
- 230000018109 developmental process Effects 0.000 description 1
- 229940039227 diagnostic agent Drugs 0.000 description 1
- 239000000032 diagnostic agent Substances 0.000 description 1
- 230000037213 diet Effects 0.000 description 1
- 235000005911 diet Nutrition 0.000 description 1
- 239000000539 dimer Substances 0.000 description 1
- 230000000857 drug effect Effects 0.000 description 1
- 238000002651 drug therapy Methods 0.000 description 1
- 230000008030 elimination Effects 0.000 description 1
- 238000003379 elimination reaction Methods 0.000 description 1
- 108020001507 fusion proteins Proteins 0.000 description 1
- 102000037865 fusion proteins Human genes 0.000 description 1
- 238000012239 gene modification Methods 0.000 description 1
- 230000005017 genetic modification Effects 0.000 description 1
- 235000013617 genetically modified food Nutrition 0.000 description 1
- 230000035876 healing Effects 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 201000005787 hematologic cancer Diseases 0.000 description 1
- 208000024200 hematopoietic and lymphoid system neoplasm Diseases 0.000 description 1
- 230000028996 humoral immune response Effects 0.000 description 1
- 230000007062 hydrolysis Effects 0.000 description 1
- 238000006460 hydrolysis reaction Methods 0.000 description 1
- 230000028993 immune response Effects 0.000 description 1
- 210000000987 immune system Anatomy 0.000 description 1
- 238000012744 immunostaining Methods 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 238000000338 in vitro Methods 0.000 description 1
- 230000004941 influx Effects 0.000 description 1
- 210000003734 kidney Anatomy 0.000 description 1
- 210000003292 kidney cell Anatomy 0.000 description 1
- 210000002429 large intestine Anatomy 0.000 description 1
- 210000000265 leukocyte Anatomy 0.000 description 1
- 150000002632 lipids Chemical class 0.000 description 1
- 239000002502 liposome Substances 0.000 description 1
- 210000004185 liver Anatomy 0.000 description 1
- 230000004807 localization Effects 0.000 description 1
- 210000004072 lung Anatomy 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 230000001404 mediated effect Effects 0.000 description 1
- 239000003094 microcapsule Substances 0.000 description 1
- 239000004005 microsphere Substances 0.000 description 1
- 239000002105 nanoparticle Substances 0.000 description 1
- 208000025189 neoplasm of testis Diseases 0.000 description 1
- 230000007935 neutral effect Effects 0.000 description 1
- 210000001672 ovary Anatomy 0.000 description 1
- 210000000496 pancreas Anatomy 0.000 description 1
- 210000005259 peripheral blood Anatomy 0.000 description 1
- 239000011886 peripheral blood Substances 0.000 description 1
- 210000002826 placenta Anatomy 0.000 description 1
- 102000054765 polymorphisms of proteins Human genes 0.000 description 1
- 230000035755 proliferation Effects 0.000 description 1
- 238000011321 prophylaxis Methods 0.000 description 1
- 210000002307 prostate Anatomy 0.000 description 1
- 238000001959 radiotherapy Methods 0.000 description 1
- 239000000376 reactant Substances 0.000 description 1
- 208000016691 refractory malignant neoplasm Diseases 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 210000002966 serum Anatomy 0.000 description 1
- 230000019491 signal transduction Effects 0.000 description 1
- 210000002027 skeletal muscle Anatomy 0.000 description 1
- 210000000813 small intestine Anatomy 0.000 description 1
- 210000000952 spleen Anatomy 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- 230000020382 suppression by virus of host antigen processing and presentation of peptide antigen via MHC class I Effects 0.000 description 1
- 201000003120 testicular cancer Diseases 0.000 description 1
- 210000001541 thymus gland Anatomy 0.000 description 1
- 201000002510 thyroid cancer Diseases 0.000 description 1
- 239000013638 trimer Substances 0.000 description 1
- 239000011701 zinc Substances 0.000 description 1
- 229910052725 zinc Inorganic materials 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/30—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants from tumour cells
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/70503—Immunoglobulin superfamily
- C07K14/70539—MHC-molecules, e.g. HLA-molecules
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/0005—Vertebrate antigens
- A61K39/0011—Cancer antigens
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/70503—Immunoglobulin superfamily
- C07K14/70532—B7 molecules, e.g. CD80, CD86
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
- C07K16/2809—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily against the T-cell receptor (TcR)-CD3 complex
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
- C07K16/2833—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily against MHC-molecules, e.g. HLA-molecules
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/51—Medicinal preparations containing antigens or antibodies comprising whole cells, viruses or DNA/RNA
- A61K2039/515—Animal cells
- A61K2039/5156—Animal cells expressing foreign proteins
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/31—Immunoglobulins specific features characterized by aspects of specificity or valency multispecific
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/52—Constant or Fc region; Isotype
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/60—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments
- C07K2317/62—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments comprising only variable region components
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/60—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments
- C07K2317/62—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments comprising only variable region components
- C07K2317/622—Single chain antibody (scFv)
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/60—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments
- C07K2317/64—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments comprising a combination of variable region and constant region components
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/73—Inducing cell death, e.g. apoptosis, necrosis or inhibition of cell proliferation
- C07K2317/734—Complement-dependent cytotoxicity [CDC]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/01—Fusion polypeptide containing a localisation/targetting motif
- C07K2319/03—Fusion polypeptide containing a localisation/targetting motif containing a transmembrane segment
Definitions
- the present invention relates to an antibody that recognizes an antigen that is specifically presented as an antigen to cancer stem cells, a pharmaceutical composition containing the antibody, particularly a pharmaceutical composition for treating cancer, and uses thereof.
- Cancer stem cells are considered causal cells involved in the development, recurrence, and metastasis of cancer, so targeting cancer stem cells could potentially suppress cancer growth, recurrence, and metastasis Is expected to be high. That is, the detection technology of cancer stem cells and the development of novel therapeutic agents targeting cancer stem cells are important issues for cancer medicine.
- cancer stem cell antigens genes specifically expressed in cancer stem cells (cancer stem cell antigens) (for example, Patent Documents 1 to 3). Partial peptides of the expressed proteins of these genes are presented as antigens on the cell surface. Therefore, development of cancer vaccine immunotherapy targeting cancer stem cells using such peptides has been attempted. In order for cancer vaccine therapy using a peptide derived from a cancer stem cell antigen to be effective, it is necessary to induce many vaccine peptide-specific T cells in a patient. However, it is known that immunity is low in terminal cases and that many T cells are difficult to induce.
- the present invention relates to an antibody that recognizes an antigen that is specifically presented as an antigen on cancer stem cells, a pharmaceutical composition containing the antibody, particularly a pharmaceutical composition for treating cancer and use thereof, and a cancer stem cell. It relates to methods for treating targeted cancer.
- the present inventors have been developing cancer vaccine immunotherapy targeting cancer stem cells, which are responsible for tumorigenicity and drug resistance of cancer, and vaccine peptide-specific T cells are mediated by T cell receptors. Attention was paid to the fact that cancer cells are killed by recognizing peptides presented on HLA-class I molecules on the surface of cancer cells. If there is an antibody that mimics the specificity of this T cell receptor, immunity will increase. We believe that immunotherapy targeting cancer stem cell antigens will be possible even in patients with reduced levels. Thus, while continuing to develop such antibodies, the inventors succeeded in separating an antibody fragment (scFv) that recognizes a complex of a cancer stem cell antigen peptide and HLA class I from human peripheral blood using a phage display antibody library. When these antibodies were converted to human IgG1 type, they found a new finding that they show complement and antibody-dependent cytotoxic activity against cancer cell lines, and as a result of further research, they have completed the present invention. Was.
- scFv antibody fragment
- the present invention relates to the following: [1] A multispecific antibody having an antigen-binding site that recognizes a complex of an antigen peptide derived from a protein selected from the group consisting of DNAJB8 protein, BORIS sf6 protein and FAM83B protein, and an MHC molecule. [2] The multispecific antibody of [1], further comprising an antigen-binding site that recognizes CD3. [3] The multispecific antibody of [1] or [2], wherein the antigen peptide is a peptide having the amino acid sequence of SEQ ID NO: 5, 23 or 6.
- An antigen binding site that recognizes a complex of an antigen peptide derived from a protein selected from the group consisting of DNAJB8 protein, BORIS sf6 protein and FAM83B protein with an MHC molecule has SEQ ID NOs: 7-14 and 24 to 38 Or the amino acid sequence of any one of SEQ ID NOs: 7-14 and SEQ ID NOs: 24-38, wherein one or two amino acids are substituted.
- the multispecific antibody according to [1] to [3].
- a pharmaceutical composition comprising an antibody that recognizes a complex of an antigen peptide derived from a protein selected from the group consisting of DNAJB8 protein, BORIS sf6 protein and FAM83B protein, and an MHC molecule.
- the pharmaceutical composition of [6] which is a pharmaceutical composition for preventing and / or treating cancer.
- the pharmaceutical composition of [6] to [8], wherein the antigenic peptide has the amino acid sequence of SEQ ID NO: 5, 23 or 6.
- ADVANTAGE OF THE INVENTION it becomes possible to perform an immunotherapy targeting cancer stem cells to patients with intractable cancers and sarcomas that are resistant to existing therapies.
- unlike conventional cancer vaccine immunotherapy there is no need to induce cytotoxic T cells, and thus high immunity, which is essential for cancer vaccine therapy, is not required.
- large-scale adjustment (10 10 or more) of cells required for adoptive immunotherapy is unnecessary.
- the antibody of the present invention since the antibody of the present invention has higher affinity than the T cell receptor, a high drug effect can be expected as an anticancer agent.
- FIG. 1 is a schematic diagram showing an outline of screening of scFv antibodies by the phage display method.
- the scFv phage display library is first screened for whether it reacts with the complex of HLA and HIV, and the reactant is removed as a non-specific antibody phage. Thereafter, those that react with the HLA-A24 / natural antigen peptide complex are selected as specific antibody phages, and those that do not react are selected as nonspecific antibody phages, and this is repeated three times. Soluble scFv is obtained from specific antibody phage.
- FIG. 2 shows the results of a peptide titration assay.
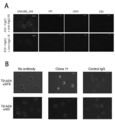
- FIG. 3 is a photographic view showing a state in which the antibody of the present disclosure is reacted with peptide-pulsed T2-A24 cells.
- A is a photograph showing the case where clone A10 and clone B10 are used as antibodies, DNAJB8-143 is used as a natural antigen peptide, and B is a photograph when clone 11 is used as an antibody and SF9 is used as a natural antigen peptide.
- FIG. 4 is a photographic diagram showing a state in which an antibody of the present disclosure is reacted with a cancer cell endogenously presenting a natural antigen peptide.
- A is a photograph when clone A10 and clone B10 are used as antibodies, and B is a photograph when clone 11 is used as an antibody. It is observed that the antibody binds to a part of the cell membrane expressing HLA-A24 and DNAJB8 or FAM83B.
- FIG. 4 is a photographic diagram showing a state in which an antibody of the present disclosure is reacted with a cancer cell endogenously presenting a natural antigen peptide.
- A is a photograph when clone A10 and clone B10 are used as antibodies
- B is a photograph when clone 11 is used as an antibody. It is observed that the antibody binds to a part of the cell membrane expressing HLA-A24 and DNAJB8 or FAM83B.
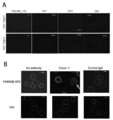
- FIG. 5 is a photograph showing the observed cytotoxic activity when the antibody of the present disclosure was reacted with peptide-pulsed T2-A24 cells.
- A is a photograph showing the case where clone A10 and clone B10 are used as antibodies, DNAJB8-143 is used as a natural antigen peptide, and B is a photograph when clone 11 is used as an antibody and SF9 is used as a natural antigen peptide.
- Complement binds to the periphery of the cells pulsed with the cancer stem cell antigen peptide and is stained red, and it is found that the nucleus is stained blue by DAPI that has broken down the cell membrane and flowed into the cells.
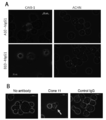
- FIG. 6 is a photograph showing observation of cytotoxic activity when the antibody of the present disclosure is reacted with a cancer cell endogenously presenting a natural antigen peptide.
- A is a photograph when clone A10 and clone B10 are used as antibodies, and B is a photograph when clone 11 is used as an antibody.
- Complement binds around cells expressing HLA-A24 and DNAJB8 or FAM83B and stains red. The nucleus is stained blue by DAPI that has broken down the cell membrane and flowed into the cells.
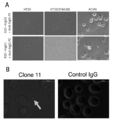
- FIG. 7 is a graph showing the results of FACS analysis of the reactivity of the antibody of the present disclosure in which scFv was converted to hIgG1 type with respect to the HLA-A02 / LV9 peptide complex.
- the antibodies of clone 11, clone 13 and clone 19 were all highly reactive at a concentration of 200 ⁇ g / mL, but clone 19 was the most reactive.
- epitope peptide refers to a major histocompatibility complex (MHC (human leukocyte antigen (HLA) in humans)) molecule, which is presented as an antigen on the cell surface, And a peptide having antigenicity (which can be recognized by T cells).
- MHC human leukocyte antigen
- the epitope peptide is a CTL epitope peptide, which is an epitope peptide that is presented by binding to MHC class I and is recognized by CD8-positive T cells, and is presented by antigen by binding to MHC class II and is recognized by CD4-positive T cells.
- Helper epitope peptide which is the epitope peptide to be used.
- tumor antigen peptides peptides derived from proteins specifically or excessively expressed in tumor cells are particularly referred to as tumor antigen peptides.
- a peptide derived from a protein specifically or excessively expressed in a cancer stem cell is referred to as a cancer stem cell antigen peptide.
- Antigen presentation refers to a phenomenon in which a peptide present in a cell binds to MHC, and this MHC / antigen peptide complex is localized on the cell surface. It is known that antigens presented on the cell surface activate cell-mediated immunity and humoral immunity after being recognized by T cells and the like, and antigens presented on MHC class I activate cell-mediated immunity.
- tumor antigen peptides generally bind to MHC class I. And a peptide to be presented as an antigen.
- binding motif Many peptides that bind to MHC are known to have certain characteristics. In the present disclosure, this feature is referred to as a “binding motif”. It is known in the art which MHC binds to a peptide having what binding motif. For example, in the binding motif of HLA-A24, which is a kind of human MHC, the second amino acid from the N-terminus is tyrosine, phenylalanine, methionine or tryptophan, and the C-terminal amino acid is leucine, isoleucine or phenylalanine.
- the second amino acid from the N-terminus is leucine, isoleucine or methionine, and / or the amino acid at the C-terminus is valine, leucine or isoleucine.
- natural peptide refers to a peptide that is actually presented as an antigen on the cell surface.
- natural antigen peptide refers to a natural peptide whose antigenicity has been confirmed.
- DNAJB8 is a member of the DNAJ / HSP40 family and encodes a 26 KD protein, but its localization and function have not been reported in detail except for its high expression in testis. Many of the DNAJ / HSP40 families have a J domain at the N-terminus, and the J domain binds to HSP70 to promote hydrolysis of ATP, resulting in a structural change in the substrate binding region of HSP70. It is thought to regulate the activity of HSP40 itself also has a peptide binding region, and some have a function of delivering a peptide to HSP70.
- FAM83B family with sequence similarity 83, member B
- EGFR epidermal growth factor receptor
- the BORIS (Brother of the Regulator of Imprinted Sites) gene is a paralog of the CTCF gene, also called 11-zinc finger protein, which contains 11 N-terminal peptide regions and a C-terminal peptide region. It has a zinc finger region.
- BORIS is known to function as a general transcription factor such as a repressor and activator of various gene expressions, and is also known to be expressed in various tumor cells, particularly cancer stem cells. ing. BORIS is classified into six subfamilies (sf1 to 6) according to the sequence of the C-terminal peptide region.
- sequence of the C-terminal peptide region of each subfamily is a sequence unique to each subfamily (for example, the unique sequence of BORIS sf6 is represented by the amino acid sequence of SEQ ID NO: 22), and It is highly conserved among its isoforms. It has been reported that BORIS is not expressed in normal tissues other than testis.
- a gene name such as “DNAJB8”
- it means a gene having a known nucleic acid sequence represented by the gene name, unless otherwise specified, typically, cDNA or Represents the mRNA sequence, but is not limited thereto, as long as one skilled in the art can recognize the sequence as the gene.
- examples of preferred genes and their nucleic acid sequences in the present disclosure include the following genes represented by the following sequences, such as polymorphisms of these genes (for example, SNPs and the like).
- the gene of the present disclosure also includes a sequence that can be recognized as DNAJB8: Gene accession No. NM_153330 (SEQ ID NO: 1)
- FAM83B Gene accession No. NM_001010872 (SEQ ID NO: 3) Therefore, mRNA as a gene expression product of the present disclosure may be represented simply by describing the gene name.
- a gene name such as “DNAJB8 protein” is appended with “protein”, it means the protein encoded by the gene, its isoform, and its homolog.
- the isoform include splicing variants and variants such as SNPs based on individual differences.
- One or more, preferably one to several, more preferably one to ten, one to five, one to three, one or two amino acids are substituted or deleted in the amino acid sequence of the encoded protein.
- an antigen peptide derived from a specific protein such as “an antigen peptide derived from a DNAJB8 protein”, is a partial peptide consisting of a continuous partial sequence in the amino acid sequence constituting the specific protein. And those having the properties of the above antigen peptide.
- Antibodies of the Present Disclosure is an antigen peptide derived from a protein that is an expression product of a gene specifically expressed in cancer stem cells, for example, DNAJB8, FAM83B, BORIS, PVT1, ASB4, LIN28B, and the like. And an antibody that specifically recognizes a complex with an MHC molecule.
- Such an antibody has, in principle, an antigen-binding site that recognizes a complex between the antigen peptide and an MHC molecule.
- antibody refers to a protein having an antigen-binding site and having a property of binding to a molecule recognized by the antigen-binding site, and is typically an immunoglobulin, but is not limited thereto. Not done. Therefore, not only immunoglobulin molecules but also functional fragments (antigen-binding fragments) of antibodies that can be generated from, for example, the antigen-binding site of immunoglobulins are included in the antibodies of the present disclosure.
- Such antigen-binding fragments typically include F (ab ′) 2 fragments, Fab ′ fragments, Fab fragments, Fv fragments, rIgG fragments, etc., as well as scFv, dsFv, diabodies and sc (Fv) 2. Also included.
- these fragments may be linked by a disulfide bond in the constant region or hinge region, or may be single-stranded (scFv) in which each region is linked by a linker.
- the antibodies of the present disclosure are single chain antibodies (scFv).
- the antibodies of the present disclosure are of the IgG1 type.
- the antibodies of the present disclosure also include multimers of immunoglobulins and functional fragments thereof (eg, dimers, trimers, tetramers, and polymers) in the antibodies of the present disclosure.
- the antibody of the present disclosure is not particularly limited as long as it can recognize a complex of a cancer stem cell antigen peptide and an MHC molecule present on the cell surface, and may be a polyclonal antibody or a monoclonal antibody. Good. There is no particular limitation as long as it has an antigen-binding site that recognizes a complex between a cancer stem cell antigen peptide and an MHC molecule. For example, a binding region for binding to another antigen-binding site or another protein may be used. You may have. Thus, in one aspect, the antibodies of the present disclosure may be multispecific antibodies. In one preferred aspect, the antibodies of the present disclosure are bispecific antibodies.
- the antibody of the present disclosure can recognize and bind to a complex between a cancer stem cell antigen peptide and an MHC molecule existing on the surface of a cancer stem cell, and thus can be used for various applications.
- the antibodies of the present disclosure can be used for detecting cancer stem cells.
- the antibodies of the present disclosure can be used for treating cancer stem cells (ie, treating cancer).
- the antibody of the present disclosure is used for treating cancer stem cells, it may be a method utilizing cell-mediated immunity or a method utilizing humoral immunity.
- adoptive immune cell therapy using T cells into which a chimeric antigen receptor (CAR) incorporating the antigen-binding site of the antibody of the present disclosure has been introduced, and the like can be mentioned.
- humoral immunity include, for example, a method utilizing the antibody-dependent cytotoxicity (ADCC) activity and the complement-dependent cytotoxicity (CDCC) activity of an antibody.
- ADCC antibody-dependent cytotoxicity
- CDCC complement-dependent cytotoxicity
- the antibodies of the present disclosure have ADCC activity and / or CDCC activity.
- the antibody of the present disclosure includes a chimeric antigen receptor (CAR) incorporating an antigen-binding site that recognizes a complex of a cancer stem cell antigen peptide and an MHC molecule.
- the antibody of the present disclosure has an antigen-binding site that specifically recognizes a complex of an antigen peptide derived from a protein that is an expression product of a gene specifically expressed in cancer stem cells and an MHC molecule. doing.
- a method for selecting an antigen-binding site that recognizes a specific antigen or an antibody having such an antigen-binding site any method known in the art may be used. Such a method includes, for example, a phage display method.
- any gene known in the art to be specifically expressed in cancer stem cells may be used.
- the gene specifically expressed in cancer stem cells is DNAJB8, FAM83B or BORISBsf6.
- the antigen peptide is not particularly limited as long as it binds to MHC.
- Peptides that bind to MHC have different characteristics depending on the type of MHC.
- HLA which is a human MHC
- a peptide that binds to HLA class I is about 8 to 14 amino acids in length, preferably about 8 to 10 amino acids in length
- HLA class II is 10 or more amino acids in length.
- it binds to a peptide of about 10 to 30 amino acids in length.
- a peptide that binds to HLA-A02 is such that the second amino acid from the N-terminus is leucine, isoleucine or methionine, and / or the C-terminal amino acid is valine, leucine or isoleucine.
- Peptides having a binding motif and binding to HLA-A24 are those wherein the second amino acid from the N-terminus is tyrosine, phenylalanine, methionine or tryptophan and / or the C-terminal amino acid is leucine, isoleucine or phenylalanine. Has a motif.
- the antigen peptide may be determined by predicting an MHC-restricted peptide based on the binding motif from the full-length sequence of the protein, or may be determined by identifying a natural peptide actually presented as an antigen.
- the method for identifying a natural peptide may be a method known in the art or a combination thereof, and includes, for example, the method described in Patent Document 2. Since the antibody of the present disclosure recognizes an antigen peptide presented as an antigen on the cell surface, preferably, the antigen peptide is a natural peptide.
- DNAJB8-143 (AFMEAFSSF (SEQ ID NO: 5)) as a natural peptide of DNAJB8, SF9 (SYQPNENKF (SEQ ID NO: 6)) as a natural peptide of FAM83B, and BORIS sf6 as a natural peptide in human cancer stem cells.
- LV9 LFIGTIKV (SEQ ID NO: 23)
- the antigenic peptide is DNAJB8-143, SF9, or LV9.
- the MHC is HLA. In one more preferred aspect, the MHC is HLA class I. In a further preferred embodiment, the MHC is HLA-A02. In another more preferred aspect, the MHC is HLA-A24.
- the antibody of the present disclosure is not particularly limited as long as it can specifically recognize the complex between the antigen peptide and the MHC molecule, and may be an antibody that recognizes and binds to another molecule. Therefore, in a preferred embodiment, the antibody of the present disclosure may have, in addition to an antigen-binding site that recognizes a complex of a cancer stem cell antigen peptide and an MHC molecule, a binding region for another molecule. Such a binding region is typically, but not limited to, an antigen binding site, and may be, for example, a ligand for a cell surface receptor. In a preferred embodiment, the antibodies of the present disclosure are antibodies that specifically bind to two or more molecules, ie, multispecific antibodies.
- multispecific antibody means an antibody that has at least one antigen-binding site and specifically binds to two or more molecules.
- An antigen-binding site that recognizes a complex between a stem cell antigen peptide and an MHC molecule refers to an antibody that can specifically bind to another molecule.
- Specific binding to another molecule may be achieved by another antigen binding site or by other methods, such as a ligand region for another molecule.
- another antigen recognized by the antibody of the present disclosure is not particularly limited, but is preferably one that contributes to treatment of cancer stem cells.
- antigens include proteins expressed on the cell surface of immune cells, such as CD3, CD28, CD40, PD1, CTLA4, TIGIT, OX40, and CD137.
- another antigen includes a T cell surface protein such as CD3 or CD28.
- the multispecific antibody of the present disclosure has a binding region for CD3 and / or CD28 in addition to an antigen binding site that recognizes a complex between a cancer stem cell antigen peptide and an MHC molecule.
- a binding region may be an antigen binding site, for example, CD80 or the like as a ligand for CD28.
- the present inventors screened the above-mentioned natural antigen peptide DNAs JB8-143, SF9, and LV9 for antibodies having an antigen-binding site that recognizes a complex of these antigen peptides with HLA-A24 or HLA-A02. . Therefore, in one preferred embodiment of the present disclosure, the antigen-binding site that recognizes the complex of the cancer stem cell antigen peptide and the MHC molecule is an amino acid sequence represented by any of SEQ ID NOs: 7-14 and SEQ ID NOs: 24-38, or , GNT, DGT or HDS.
- the antigen-binding site that recognizes a complex of the cancer stem cell antigen peptide and the MHC molecule is an amino acid sequence represented by any one of SEQ ID NOs: 7-14 and SEQ ID NOs: 24-38. It may include an amino acid sequence in which one or two amino acids have been substituted.
- the amino acid substitution is preferably a conservative substitution such as a substitution between acidic amino acids, a substitution between basic amino acids, or a substitution between neutral amino acids.
- Typical examples of the antibody of the present disclosure include a specific antibody having an antigen-binding site that recognizes a complex of a cancer stem cell antigen peptide (DNAJB8-143) having the amino acid sequence of SEQ ID NO: 5 and HLA-A24; A specific antibody having an antigen-binding site that recognizes a complex of a cancer stem cell antigen peptide (SF9) comprising the amino acid sequence of SEQ ID NO: 6 and HLA-A24; a cancer stem cell antigen peptide comprising the amino acid sequence of SEQ ID NO: 5 ( A bispecific antibody having an antigen-binding site that recognizes a complex of DNAJB8-143) and HLA-A24 and an antigen-binding site that recognizes CD3; a cancer stem cell antigen peptide (SF9) comprising the amino acid sequence of SEQ ID NO: 6; ) Having an antigen-binding site that recognizes a complex of HLA-A24 and an antigen-binding site that recognizes CD3 Antibody, an anti
- a trispecific antibody having an antigen-binding site to recognize recognizes an antigen-binding site that recognizes a complex of a cancer stem cell antigen peptide (DNAJB8-143) consisting of the amino acid sequence of SEQ ID NO: 5 and HLA-A24, and recognizes CD3.
- Ranaru cancer stem cell antigen peptide (SF9) and HLA-A24 antigen-binding site recognizes a complex of, such as trispecific antibodies having an antigen binding site and CD80 region recognize CD3 and the like.
- Another typical example of the antibody of the present disclosure includes a specific antibody having an antigen binding site that recognizes a complex of a cancer stem cell antigen peptide (LV9) having the amino acid sequence set forth in SEQ ID NO: 23 and HLA-A02, A bispecific antibody having an antigen-binding site that recognizes a complex of the cancer stem cell antigen peptide (LV9) and HLA-A02 having the amino acid sequence of No.
- the antibody of the present disclosure includes at least one of a complementarity-determining region (CDR) 1, a complementarity-determining region (CDR) 2, and a complementarity-determining region (CDR) 3 at an antigen-binding site; Preferably comprises at least one of a complementarity determining region (CDR) 1, a complementarity determining region (CDR) 2, and a complementarity determining region (CDR) 3.
- the antibodies of the present disclosure in one preferred aspect, comprise the amino acid sequence of SEQ ID NO: 7 and / or SEQ ID NO: 8 at the antigen binding site, particularly as the complementarity determining region (CDR) 3.
- the antigen binding site comprises, in particular as the complementarity determining region (CDR) 3, the amino acid sequence according to SEQ ID NO: 9 and / or SEQ ID NO: 10.
- the antigen binding site comprises the amino acid sequence set forth in SEQ ID NO: 11 and / or 12 as complementarity determining region (CDR) 3.
- the antigen binding site comprises the amino acid sequence set forth in SEQ ID NO: 13 and / or SEQ ID NO: 14, particularly as complementarity determining region (CDR) 3.
- the antibody of the present disclosure has an antigen-binding site comprising an amino acid sequence in which one or two amino acids have been substituted in the amino acid sequence set forth in any one of amino acid sequence numbers 7-14. It may be something.
- the antibody of the present disclosure includes, in a preferred embodiment, an amino acid sequence described in SEQ ID NO: 24 and / or SEQ ID NO: 27 as a complementarity determining region (CDR) 1 at an antigen binding site, and a complementarity determining region (CDR).
- the complementarity determining region (CDR) 3 includes the amino acid sequence of SEQ ID NO: 26 and / or SEQ ID NO: 28.
- the amino acid sequence as set forth in SEQ ID NO: 29 and / or SEQ ID NO: 32, in particular the complementarity determining region (CDR) 2, as the complementarity determining region (CDR) 2, 30 and / or the amino acid sequence represented by DGT, and the complementarity determining region (CDR) 3 include the amino acid sequence of SEQ ID NO: 31 and / or 33.
- the antigen binding site in particular as the complementarity determining region (CDR) 1, the amino acid sequence set forth in SEQ ID NO: 34 and / or SEQ ID NO: 37, the complementarity determining region (CDR) 2 as the sequence
- the amino acid sequence of SEQ ID NO: 35 and / or the amino acid sequence represented by HDS, and the complementarity determining region (CDR) 3 include the amino acid sequence of SEQ ID NO: 36 and / or SEQ ID NO: 38.
- the antibody of the present disclosure has an antigen-binding site comprising an amino acid sequence in which one or two amino acids have been substituted in the amino acid sequence of any of SEQ ID NOs: 24 to 38. It may be.
- CDR3 is particularly important for antigen binding.
- composition of the present disclosure One aspect of the present disclosure relates to a pharmaceutical composition containing the antibody of the present disclosure.
- the antibody of the present disclosure can specifically recognize a cancer stem cell antigen peptide presented as an antigen on the surface of a cancer stem cell, it can be used as an active ingredient of a pharmaceutical composition for various uses. . Therefore, as the antibody of the present disclosure contained as an active ingredient in the pharmaceutical composition of the present disclosure, any of the antibodies described in detail in the above ⁇ 1> can be used.
- the pharmaceutical composition of the present disclosure contains the antibody of the present disclosure as an active ingredient.
- the pharmaceutical composition of the present disclosure can be used not only as a therapeutic agent for treating cancer stem cells (ie, a cancer therapeutic agent), but also, for example, an agent for detecting cancer stem cells, a cancer vaccine immunotherapy for a patient to be treated. Can also be used for applications such as a companion diagnostic agent for diagnosing the efficacy against.
- the antibody of the present disclosure has ADCC activity and / or CDCC activity. That is, the antibody of the present disclosure recognizes a cancer stem cell antigen peptide presented on the surface of a cancer stem cell and binds to the surface of the cancer stem cell, whereby the antibody of the present disclosure exerts its cytotoxic activity on the cancer stem cell. Can be demonstrated. Therefore, in one preferred aspect, the pharmaceutical composition of the present disclosure is a pharmaceutical composition for preventing and / or treating cancer.
- prevention of cancer includes not only prevention of cancer in patients, but also prevention of recurrence in patients whose primary tumor has been removed by surgery, cancer treatment such as surgery, radiation therapy or drug therapy. To prevent metastasis of tumors that could not be completely removed.
- treatment of cancer includes not only cancer healing and improvement of symptoms that reduce the size of the cancer, but also progression that suppresses cancer cell growth, tumor expansion, or metastasis of cancer cells from the primary tumor. Prevention, etc. are included.
- compositions of the present disclosure can be administered to any living individual that can have a tumor, but are preferably human and non-human mammals (eg, rodents such as mice, rats, guinea pigs, hamsters, Primates such as chimpanzees, artiodactyls such as cattle, goats and sheep, equinoids such as horses, rabbits, dogs and cats), and more preferably humans.
- rodents such as mice, rats, guinea pigs, hamsters, Primates such as chimpanzees, artiodactyls such as cattle, goats and sheep, equinoids such as horses, rabbits, dogs and cats
- rodents such as mice, rats, guinea pigs, hamsters, Primates such as chimpanzees, artiodactyls such as cattle, goats and sheep, equinoids such as horses, rabbits, dogs and cats
- primates such as chimpanzees
- the cell population to be detected can be used for a cell population derived from any biological sample obtained from the biological individual, but is preferably used.
- a preferred embodiment of the antibody of the present disclosure has an antigen-binding site that recognizes a complex of a cancer stem cell antigen peptide derived from DNAJB8 protein or FAM83B protein and HLA-A24. Further, another preferred embodiment of the antibody of the present disclosure has an antigen-binding site that recognizes a complex of a cancer stem cell antigen peptide derived from the BORIS ⁇ sf6 protein and HLA-A02. Therefore, the pharmaceutical composition of the present disclosure can be suitably used particularly for subjects suffering from a cancer expressing DNAJB8, a cancer expressing FAM83B, or a cancer expressing BORIS sf6.
- it can be suitably used for a subject having HLA-A24 or HLA-A02 as HLA.
- it can be used for the prevention or treatment of cancer (tumor) such as colon cancer, lung cancer, breast cancer, myeloma, oral cancer, pancreatic cancer, skin cancer, and prostate cancer.
- cancer tumor
- cancer such as colon cancer, lung cancer, breast cancer, myeloma, oral cancer, pancreatic cancer, skin cancer, and prostate cancer.
- the pharmaceutical composition of the present disclosure exerts an antitumor effect by utilizing an immune cell capable of damaging a cancer stem cell to which an antibody serving as an active ingredient is bound. It is considered that a higher therapeutic effect can be exerted by suppressing the function of the above.
- the pharmaceutical compositions of the present disclosure are used with an immune checkpoint inhibitor.
- agent A and another agent B when one agent A and another agent B are "used together” or “used together", it means that the agent B is in a state where the agent B exerts its effect while the agent A is exerting its effect. . Therefore, the agent B may be administered simultaneously with the administration of the agent A, or the agent B may be administered at a certain interval after the administration of the agent A.
- the agent A and the agent B may be in the same dosage form or different dosage forms. Furthermore, as long as the agent A or the agent B does not lose its effect, the agent A and the agent B may be mixed to form one composition.
- immune checkpoint inhibitor in the present embodiment, any agent known as an immune checkpoint inhibitor can be used as long as the antigen recognition ability of the pharmaceutical composition of the present disclosure is not inhibited.
- Known as immune checkpoint inhibitors include, but are not limited to, for example, anti-PD-1, anti-PD-L1, anti-CTLA-4, anti-TIM-3, anti-LAG- 3 antibodies, anti-B7-H3 antibodies, anti-B7-H4 antibodies, anti-B7-H5 antibodies, anti-TIGIT antibodies and the like.
- the dosage form of the pharmaceutical composition of the present disclosure is not particularly limited, but may be an oil emulsion (emulsion formulation), polymer nanoparticles, a liposome formulation, or a particulate formulation bound to beads having a diameter of several ⁇ m. , Lipid-bound preparations, microsphere preparations, microcapsule preparations and the like.
- the administration method includes any known administration method such as intradermal administration, subcutaneous administration, intramuscular administration, and intravenous administration.
- the dose of the pharmaceutical composition of the present disclosure in the formulation can be appropriately adjusted depending on the disease to be treated, the age and weight of the patient, etc., but is usually 0.0001 mg to 1000 mg, preferably 0.001 mg to 1000 mg, It is preferably 0.1 mg to 10 mg, which is preferably administered once every several days to several months.
- chimeric antigen receptor refers to a single-chain antibody (scFv) in which a light chain and a heavy chain of an antibody variable region of an antibody recognizing a molecule present on the cell surface of a cancer cell are linked in series. It is a chimeric protein molecule designed to have a CD3 ⁇ chain on the C-terminal side among molecules constituting the T cell receptor (TCR) / CD3 complex on the terminal side.
- scFv single-chain antibody
- TCR T cell receptor
- CAR can be produced using the antibody of the present disclosure as a scFv.
- CAR which recognizes a complex between a cancer stem cell antigen peptide and MHC, is a cancer antigen that presents a cancer stem cell antigen peptide that can be targeted by CTLs. Since a dendritic cell presenting a peptide can be recognized, a pharmaceutical composition containing the genetically modified T cell (CAR-T) into which the CAR has been introduced is also included in the pharmaceutical composition of the present disclosure. .
- Tumor detection method (test method, diagnostic method)
- test method diagnostic method
- the detection method (diagnosis method) of the present disclosure using the antibody of the present disclosure typically, the blood of a subject is collected, or a part of a test tissue suspected of having a tumor is collected by biopsy or the like, and contained therein.
- colon cancer By detecting and measuring the amount of cells having a complex of a cancer stem cell antigen peptide and an MHC molecule with the antibody of the present disclosure, colon cancer, lung cancer, breast cancer, myeloma, oral cancer, pancreatic cancer, skin cancer, It detects, tests or diagnoses the presence or absence or degree of cancer (tumor) such as prostate cancer.
- Particular embodiments of the detection (test) method of the present disclosure using the antibodies of the present disclosure comprise the following steps (a) and (b), and optionally (c): (A) contacting a biological sample obtained from a subject with a tumor detection agent of the present disclosure; (B) measuring the amount of cells presenting a complex of a cancer stem cell antigen peptide and an HLA antigen in the biological sample using the amount of cells to which the tumor detection agent has been bound as an index; (C) a step of determining the presence of cancer based on the result of (b).
- a specific embodiment of the diagnostic method of the present disclosure using the antibody of the present disclosure includes the steps (a), (b), and (c) described above.
- the biological sample used herein include a sample prepared from a biological tissue of a subject (a tissue suspected of containing cancer cells and its surrounding tissue, blood, or the like). Specific examples include a sample containing tissue cells collected from the tissue.
- Prediction, determination, judgment or diagnosis of the presence or absence of a tumor can be performed, for example, by measuring the amount of cells to which the antibody of the present disclosure is bound in the blood of a subject or a test tissue suspected of having a tumor. At that time, in some cases, the level of cells to which the antibody of the present disclosure is bound in a normal corresponding tissue is used as a reference value, and the reference value is compared with the level in a sample obtained from a subject to determine a difference between the two.
- the comparison between the test tissue of the test subject and the normal corresponding tissue can be performed by performing measurements on the biological sample of the test subject and the biological sample of a normal subject in parallel.
- the antibody of the present disclosure obtained by measuring a plurality of (at least two, preferably three or more, more preferably five or more) normal tissues under uniform measurement conditions binds.
- the average or statistical median value of the amount of cells can be used for comparison as a normal or reference value.
- the determination as to whether or not the subject has cancer is made, for example, by comparing the level of the cells to which the antibody of the present disclosure is bound in the tissue of the subject with, for example, 2 times or more, preferably 3 times, the level of those in a normal person.
- the above can be performed as an index.
- One aspect of the present disclosure is also a method for preventing and / or treating cancer in a subject, comprising the steps of: determining an effective amount of the antibody or CAR-T cell of the present disclosure; It also relates to a method comprising the step of administering to a subject in need thereof.
- the “subject” in the present disclosure may be any biological individual that can suffer from cancer, and is preferably a human or non-human mammal (eg, a mouse, rat, guinea pig, hamster, or other rodent).
- the subject may be healthy or suffer from any disease, but typically suffers from cancer if prevention and / or treatment of cancer is contemplated.
- the subject is HLA-A24 or HLA-A02 positive.
- the subject has or is at risk of having DNAJB8 or FAM83B or BORIS sf6 positive cancer.
- the subject is HLA-A24 positive and has, or is at risk of having, DNAJB8 or FAM83B positive cancer.
- the subject is HLA-A02 positive and has or is at risk of having BORIS sf6 positive cancer.
- Antibodies and CAR-T cells of the present disclosure for use in the prophylaxis / treatment methods of the present disclosure include any of those described herein.
- An effective amount in the present disclosure is, for example, an amount that reduces the symptoms of cancer, or delays or stops the progress thereof, and is preferably an amount that suppresses or cures cancer. Also preferred is an amount that does not cause adverse effects beyond the benefit of administration. Such an amount can be appropriately determined by an in vitro test using cultured cells or the like, or a test using a model animal such as a mouse or rat, and such a test method is well known to those skilled in the art.
- the specific dose of the active ingredient depends on various conditions related to the subject in need thereof, such as the severity of symptoms, general health of the subject, age, weight, sex of the subject, diet, timing and frequency of administration, The determination can be made in consideration of the concomitant drug, reactivity to treatment, dosage form, and compliance with treatment.
- the antibody of the present disclosure As a specific dose, for example, in the case of the antibody of the present disclosure, it is generally 0.0001 mg to 2000 mg, preferably 0.001 mg to 2000 mg, and it is preferable to administer the dose once every one to four weeks.
- the number is usually 1 ⁇ 10 4 to 1 ⁇ 10 8 cells, preferably 1 ⁇ 10 5 to 1 ⁇ 10 7 cells, which is administered once a day to 4 weeks. Is preferred.
- any known appropriate administration method such as intradermal administration, subcutaneous administration, intramuscular administration, or intravenous administration can be used.
- One embodiment of the prevention / treatment method of the present disclosure further includes a step of selecting an HLA-A24 or HLA-A02-positive subject as a prevention / treatment subject before the administering step.
- This aspect of the present disclosure may further include, prior to the selecting step, determining the HLA type of the subject. The determination of the HLA type of a subject can be performed by any known method.
- One embodiment of the prevention / treatment method of the present disclosure further includes, before the administering step, a step of selecting a subject having DNAJB8, FAM83B, or BORIS ⁇ ⁇ sf6-positive cancer as a target of prevention / treatment.
- This aspect of the present disclosure may further include, prior to the selecting step, detecting a DNAJB8 or FAM83B or BORIS sf6-positive cancer in the subject.
- the tumor detection method described in the above ⁇ 3> can be used.
- One embodiment of the prevention / treatment method of the present disclosure is that, prior to the administering step, the subject is HLA-A24-positive and has DNAJB8 or FAM83B-positive cancer, or is HLA-A02-positive, and The method further includes a step of selecting a subject having BORIS sf6-positive cancer as a subject for prevention / treatment.
- This aspect of the disclosure may further comprise, prior to the selecting step, determining the HLA type of the subject and detecting DNAJB8 or FAM83B or BORIS sf6-positive cancer in the subject.
- Example 1 Screening of antibodies specific to HLA-A24 / natural antigen peptide complex (1) Preparation of antibody phage As cancer stem cell antigen peptides, natural antigen peptides DNAJB8-143 (SEQ ID NO: 5) derived from DNAJB8 protein and FAM83B protein are derived. Using the natural antigen peptide SF9 (SEQ ID NO: 6), scFv that recognizes the HLA-A24 / DNAJB8-143 complex and the HLA-A24 / SF9 complex was synthesized by Tsukahara et al., J Biol Chem., 2014, Aug 8 ; 289 (32): 22035-47.
- cancer stem cell antigen peptide means DNAJB8-143 and SF9.
- a phagemid vector incorporating a DNA encoding a peptide in which the heavy chain variable region (VH region) and the light chain variable region (VL region) of an antibody are linked by a linker is prepared from the scFv library, and the resulting phagemid vector is used in E. coli. Infected. This was further infected with a helper phage to prepare an M13 phage (antibody phage) displaying an scFv in which the VH region and the VL region were linked by a linker.
- a phage library was prepared using a biotin-modified complex of HLA-A24 and an HIV peptide (RYLRDQQLGI (SEQ ID NO: 15)) and streptavidin-conjugated magnetic beads. Specific binding phages were removed. Using the biotin-modified HLA-A24 / DNAJB8-143 complex or the biotin-modified HLA-A24 / SF9 complex and streptavidin-bound magnetic beads, antibody phages that bind to the respective complexes are selected from the remaining antibody phages. The (positive panning) step was repeated three times to obtain a candidate antibody phage that specifically binds to the HLA-A24 / natural antigen peptide complex.
- FACS analysis was further performed using an IgG1-type converted antibody (scFv-hIgG1), and clones with particularly high reactivity (DNAJB8-143: clone A10 and clone B10, SF9: clone 4 and clone 11) were selected. .
- Example 2 Peptide titration assay Various concentrations (50 ⁇ g / mL, 5 ⁇ g / mL, 500 ng / mL, 50 ng / mL, 5 ng / mL, 500 ng / mL, 500 pg / mL, 50 pg / mL, respectively) were added to T2 cells (T2-A24 cells) expressing HLA-A24. (mL, 5 pg / mL) and the antibody clone obtained in Example 1 were allowed to react with each other, and the reaction limit concentration of the antibody was calculated.
- HIV SEQ ID NO: 15
- CMV QYDPVAALF
- Example 3 Reactivity with antigen presenting cells
- Reactivity with peptide-pulsed T2-A24 cells Test whether or not the scFv-hIgG1 antibody obtained in Example 2 actually reacts with cells that present antigen on the cell surface did.
- the T2-A24 cells were pulsed with DNAJB8-143, HIV, CMV and EBV adjusted to a final concentration of 50 ⁇ g / mL, and reacted with the A10 antibody and B10 antibody obtained in Example 2 at a final concentration of 10 ⁇ g / mL. Observation was performed by immunostaining with hIgG-PE.
- the clone 11 antibody was similarly observed except that T2-A24 cells were pulsed with SF9 and HIV adjusted to a final concentration of 100 ⁇ g / mL. The results are shown in FIG. It was observed that scFv-IgG1 antibody was bound to the surface of T2-A24 cells pulsed with each cancer stem cell antigen peptide.
- the antibodies of the present disclosure can also recognize endogenously presented natural antigenic peptides.
- Example 4 Confirmation of complement-dependent cytotoxicity (CDCC) activity (1) Cytotoxic activity against peptide-pulsed T2-A24 cells T2-A24 cells pulsed with peptide as in Example 3 (1) were prepared to a final concentration of 10 ⁇ g / mL. Each antibody was reacted and observed using a PE-conjugated anti-C3b antibody and DAPI as fluorescent labels. When CDCC activity is confirmed, C3b binds around the cell and stains red, the cell membrane is destroyed by the CDCC activity, DAPI flows into the cell, and the nucleus stains blue. FIG. 5 shows the results. For all antibodies, CDCC activity against T2-A24 pulsed with a cancer stem cell antigen peptide was observed.
- Example 5 Analysis of Bispecific Antibody BiTE (1) Preparation of BiTE and Binding to Each Cell Using a method similar to that described in Stadler et al., Nature Medicine volume 23, pages 815-817 (2017), The anti-CD3 scFv (SEQ ID NO: 21) was ligated to the scFv of each antibody of clone A10, clone B10, clone 4 and clone 11 to prepare each bispecific antibody BiTE. Using this BiTE, the binding property to T2-A24 cells, T cells and NK cells pulsed with a cancer stem cell antigen peptide was tested. Each BiTE showed binding to T2-A24 cells pulsed with the cancer stem cell antigen peptide. It also showed high binding to T cells, but no binding to NK cells.
- BiTE prepared in (1) was mixed with T cells, and T2-A24 cells were pulsed with a cancer stem cell antigen peptide, in the presence of FITC-labeled annexin V and propidium iodide (PI). Co-cultured. The fluorescence was analyzed by FACS after 2.5 hours and 5 hours, respectively. In the case of the control (untreated and T cells only), cells in which both FITC and PI fluorescence were observed after 2.5 hours and 5 hours were obtained. In contrast, when co-cultured in the presence of BiTE, cells in which both FITC and PI fluorescence were observed showed a marked increase at 5 hours compared to 2.5 hours. It was observed.
- Example 6 Screening of Antibody Specific to HLA-A02 / Natural Antigen Peptide Complex (1) Preparation of Antibody Phage
- a cancer stem cell antigen peptide a natural polypeptide derived from a polypeptide represented by SEQ ID NO: 22 which is a sequence unique to BORIS sf6 ScFv that recognizes the HLA-A02 / LV9 complex using the antigen peptide LV9 (SEQ ID NO: 23) is described in Tsukahara et al., J Biol Chem., 2014, Aug 8; 289 (32): 22035-47. Using the same method as the phage display method.
- “cancer stem cell antigen peptide” means LV9.
- a phagemid vector incorporating a DNA encoding a peptide in which the heavy chain variable region (VH region) and the light chain variable region (VL region) of an antibody are linked by a linker is prepared from the scFv library, and the resulting phagemid vector is used in E. coli. Infected. This was further infected with a helper phage to prepare an M13 phage (antibody phage) displaying an scFv in which the VH region and the VL region were linked by a linker.
- a phage library was prepared using a biotin-modified complex of HLA-A02 and an HIV peptide (SLYNTVATL (SEQ ID NO: 39)) and streptavidin-conjugated magnetic beads. Specific binding phages were removed. From the remaining antibody phages, using a biotin-modified HLA-A02 / LV9 complex and streptavidin-bound magnetic beads, a step of selecting antibody phages that bind to each complex (positive panning) was repeated three times, and HLA- A candidate antibody phage that specifically binds to the A02 / natural antigen peptide complex was obtained.
- sequences of the CDR1 to 3 regions of these clones were as follows. Sequence of clone 11 VH region CDR1 region: GTFFDKYG (SEQ ID NO: 24) Sequence of CDR2 region: ITWNSGKV (SEQ ID NO: 25) Sequence of CDR3 region: CARDLGYYYDSSGYLKPTGSGFDYW (SEQ ID NO: 26) Sequence of clone 11 VL region CDR1 region: SSNIGAGYD (SEQ ID NO: 27) Sequence of CDR2 region: GNT Sequence of CDR3 region: CGTWDSSSLVVLF (SEQ ID NO: 28) Sequence of clone 13 VH region CDR1 region: GYTFTGYY (SEQ ID NO: 29) Sequence of CDR2 region: ISTVFNTP (SEQ ID NO: 30) Sequence of CDR3 region: CARSYSGSLQDAFDIW (SEQ ID NO: 31) Sequence of clone 13 VL region CDR
- the antibodies of the present disclosure can react with endogenously presented natural antigenic peptides and further exhibit cytotoxic activity by humoral immune response. Therefore, it becomes possible to perform immunotherapy targeting cancer stem cells on patients with refractory cancers and sarcomas that are resistant to existing therapies.
- the cytotoxic mechanism is humoral immunity
- cancer vaccine immunotherapy that does not depend on the immunity of the administration target can be performed, and high effects are expected as both anticancer drugs and cancer immunotherapy it can.
Landscapes
- Health & Medical Sciences (AREA)
- Immunology (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Biophysics (AREA)
- Genetics & Genomics (AREA)
- Biochemistry (AREA)
- Molecular Biology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Cell Biology (AREA)
- Zoology (AREA)
- Gastroenterology & Hepatology (AREA)
- Toxicology (AREA)
- Animal Behavior & Ethology (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Oncology (AREA)
- Microbiology (AREA)
- Mycology (AREA)
- Epidemiology (AREA)
- Peptides Or Proteins (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
Abstract
Description
[1]DNAJB8タンパク質、BORIS sf6タンパク質およびFAM83Bタンパク質からなる群から選択されるタンパク質に由来する抗原ペプチドと、MHC分子との複合体を認識する抗原結合部位を有する、多重特異性抗体。
[2]さらにCD3を認識する抗原結合部位を有する、[1]の多重特異性抗体。
[3]抗原ペプチドが、配列番号5、23または6に記載のアミノ酸配列からなるペプチドである、[1]または[2]の多重特異性抗体。
[4]DNAJB8タンパク質、BORIS sf6タンパク質およびFAM83Bタンパク質からなる群から選択されるタンパク質に由来する抗原ペプチドと、MHC分子との複合体を認識する抗原結合部位が、配列番号7~14および24~38のいずれかに記載のアミノ酸配列、または、アミノ酸配列番号7~14および配列番号24~38のいずれかに記載のアミノ酸配列において、1個または2個のアミノ酸が置換されているアミノ酸配列を含む、[1]~[3]の多重特異性抗体。
[5]さらに、CD80領域を含む、[1]~[4]の多重特異性抗体。
[6]DNAJB8タンパク質、BORIS sf6タンパク質およびFAM83Bタンパク質からなる群から選択されるタンパク質に由来する抗原ペプチドと、MHC分子との複合体を認識する抗体を含む、医薬組成物。
[7]がんを予防および/または処置するための医薬組成物である、[6]の医薬組成物。
[8]MHC分子が、HLA分子である、[6]または[7]の医薬組成物。
[9]抗原ペプチドが、配列番号5、23または6に記載のアミノ酸配列からなる、[6]~[8]の医薬組成物。
[10]抗体の抗原結合部位が、配列番号7~14および24~38のいずれかに記載のアミノ酸配列を含む、[6]~[9]の医薬組成物。
[11]抗体が、[1]~[5]の多重特異性抗体である、[6]~[10]の医薬組成物。
本明細書において別様に定義されない限り、本明細書で用いる全ての技術用語および科学用語は、当業者が通常理解しているものと同じ意味を有する。本明細書中で参照する全ての特許、出願および他の出版物や情報は、その全体を参照により本明細書に援用する。また本明細書において参照された出版物と本明細書の記載に矛盾が生じた場合は、本明細書の記載が優先されるものとする。
本開示において、「腫瘍(tumor)」は、良性腫瘍および悪性腫瘍(がん、悪性新生物)を含む。がん(cancer)は、造血器の腫瘍、上皮性の悪性腫瘍(癌、carcinoma)と非上皮性の悪性腫瘍(肉腫、sarcoma)とを含む。
FAM83B(family with sequence similarity 83, member B)は、上皮成長因子受容体(EGFR)シグナル経路において機能すると推定されるタンパク質をコードする遺伝子であるが、その機能の詳細は不明である。乳癌、子宮頚部癌、肺癌、甲状腺癌、大腸癌、精巣腫瘍、卵巣癌等の癌部において、各非癌部と比較して、発現が著しく上昇していることが知られており、がんの発生、形成および増殖に深く関与している癌遺伝子である可能性が指摘されている。
DNAJB8:Gene accession No. NM_153330(配列番号1)
FAM83B:Gene accession No. NM_001010872(配列番号3)
したがって本開示の遺伝子発現産物としてのmRNAを、単に遺伝子名の記載により表す場合がある。
本開示の一側面は、がん幹細胞に特異的に発現する遺伝子、例えばDNAJB8、FAM83B、BORIS、PVT1、ASB4、LIN28Bなど、の発現産物であるタンパク質に由来する抗原ペプチドと、MHC分子との複合体を特異的に認識する抗体に関する。かかる抗体は、原則として、前記抗原ペプチドとMHC分子との複合体を認識する抗原結合部位を有している。
本開示の抗体の別の典型例としては、配列番号23に記載のアミノ酸配列からなるがん幹細胞抗原ペプチド(LV9))とHLA-A02の複合体を認識する抗原結合部位を有する特異抗体、配列番号23に記載のアミノ酸配列からなるがん幹細胞抗原ペプチド(LV9)とHLA-A02の複合体を認識する抗原結合部位およびCD3を認識する抗原結合部位を有する二重特異性抗体、配列番号23に記載のアミノ酸配列からなるがん幹細胞抗原ペプチド(LV9)とHLA-A02の複合体を認識する抗原結合部位、CD3を認識する抗原結合部位およびCD28を認識する抗原結合部位を有する三重特異性抗体、配列番号23に記載のアミノ酸配列からなるがん幹細胞抗原ペプチド(LV9)とHLA-A02の複合体を認識する抗原結合部位、CD3を認識する抗原結合部位およびCD80領域を有する三重特異性抗体などが挙げられる。
本開示の抗体は、好ましい一態様において、抗原結合部位に、特に相補性決定領域(CDR)3として、配列番号7および/または配列番号8に記載のアミノ酸配列を含む。別の好ましい一態様において、抗原結合部位に、特に相補性決定領域(CDR)3として、配列番号9および/または配列番号10に記載のアミノ酸配列を含む。さらに別の好ましい一態様において、抗原結合部位に、特に相補性決定領域(CDR)3として、配列番号11および/または配列番号12に記載のアミノ酸配列を含む。さらに別の好ましい一態様において、抗原結合部位に、特に相補性決定領域(CDR)3として、配列番号13および/または配列番号14に記載のアミノ酸配列を含む。
さらに本開示の抗体は、好ましい一態様において、その抗原結合部位が、アミノ酸配列番号7~14のいずれかに記載のアミノ酸配列において、1個または2個のアミノ酸が置換されているアミノ酸配列を含むものであってもよい。
また本開示の抗体は、好ましい一態様において、抗原結合部位に、特に相補性決定領域(CDR)1として、配列番号24および/または配列番号27に記載のアミノ酸配列、相補性決定領域(CDR)2として、配列番号25に記載のアミノ酸配列および/またはGNTで示されるアミノ酸配列、並びに、相補性決定領域(CDR)3として、配列番号26および/または配列番号28に記載のアミノ酸配列を含む。別の好ましい一態様において、抗原結合部位に、特に相補性決定領域(CDR)1として、配列番号29および/または配列番号32に記載のアミノ酸配列、相補性決定領域(CDR)2として、配列番号30に記載のアミノ酸配列および/またはDGTで示されるアミノ酸配列、並びに、相補性決定領域(CDR)3として、配列番号31および/または配列番号33に記載のアミノ酸配列を含む。さらに別の好ましい一態様において、抗原結合部位に、特に相補性決定領域(CDR)1として、配列番号34および/または配列番号37に記載のアミノ酸配列、相補性決定領域(CDR)2として、配列番号35に記載のアミノ酸配列および/またはHDSで示されるアミノ酸配列、並びに、相補性決定領域(CDR)3として、配列番号36および/または配列番号38に記載のアミノ酸配列を含む。
さらに本開示の抗体は、好ましい一態様において、その抗原結合部位が、配列番号24~38のいずれかに記載のアミノ酸配列において、1個または2個のアミノ酸が置換されているアミノ酸配列を含むものであってもよい。
なお、本開示の抗体において、3つのCDRのなかでも特にCDR3が抗原結合に重要である。
本開示の一側面は、本開示の抗体を含む医薬組成物に関する。上述のとおり本開示の抗体は、がん幹細胞の表面に抗原提示されたがん幹細胞抗原ペプチドを特異的に認識することができるため、種々の用途の医薬組成物の有効成分として用いることができる。したがって本開示の医薬組成物に有効成分として含まれる本開示の抗体としては、上記<1>において詳述した任意の抗体を用いることができる。
投与方法としては、皮内投与、皮下投与、筋肉内投与、静脈内投与などの既知の任意の投与方法が挙げられる。製剤中の本開示の医薬組成物の投与量は、治療目的の疾患、患者の年齢、体重等により適宜調整することができるが、通常0.0001mg~1000mg、好ましくは0.001mg~1000mg、より好ましくは0.1mg~10mgであり、これを数日ないし数月に1回投与するのが好ましい。
本開示の一側面は、本開示の抗体を利用した腫瘍の検出方法(検査方法、診断方法)に関する。
本開示の抗体を用いる本開示の検出方法(診断方法)は、典型的には、被験者の血液を採取するか、もしくは腫瘍が疑われる被験組織の一部をバイオプシ等で採取し、そこに含まれるがん幹細胞抗原ペプチドとMHC分子との複合体を有する細胞の量を、本開示の抗体によって検出・測定することにより、大腸癌、肺癌、乳癌、骨髄腫、口腔癌、膵癌、皮膚癌、前立腺癌等のがん(腫瘍)の罹患の有無またはその程度を検出、検査または診断するものである。
(a)被験者から得られた生体試料と本開示の腫瘍検出剤とを接触させる工程、
(b)該生体試料中のがん幹細胞抗原ペプチドとHLA抗原との複合体を提示する細胞の量を、上記腫瘍検出剤が結合した細胞の量を指標として測定する工程、
(c)(b)の結果をもとに、がんの罹患を判断する工程。
本開示の抗体を用いる本開示の診断方法の特定の態様は、上記(a)、(b)および(c)の工程を含む。
ここで用いられる生体試料としては、被験者の生体組織(がん細胞の存在が疑われる組織およびその周辺組織、または血液など)から調製される試料を挙げることができる。具体的には、該組織から採取された組織細胞を含む試料などを挙げることができる。
ここで被験者の被験組織と正常な対応組織との前記レベルの比較は、被験者の生体試料と正常者の生体試料を対象とした測定を並行して行うことで実施できる。並行して行わない場合は、複数(少なくとも2つ、好ましくは3以上、より好ましくは5以上)の正常な組織を用いて均一な測定条件で測定して得られた本開示の抗体が結合する細胞の量の平均値または統計的中間値を、正常者の値すなわち基準値として、比較に用いることができる。
本開示の一側面はまた、対象におけるがんを予防および/または処置する方法であって、本開示の抗体またはCAR-T細胞の有効量を、それを必要とする対象に投与する工程を含む方法にも関する。
本開示における「対象」は、がんに罹患し得る生物個体であればいかなる生物個体であってもよいが、好ましくはヒトおよび非ヒト哺乳動物(例えば、マウス、ラット、モルモット、ハムスターなどの齧歯類、チンパンジーなどの霊長類、ウシ、ヤギ、ヒツジなどの偶蹄目、ウマなどの奇蹄目、ウサギ、イヌ、ネコなど)の個体であり、より好ましくはヒトの個体である。本開示において、対象は健常であっても、何らかの疾患に罹患していてもよいものとするが、がんの予防および/または処置が企図される場合には、典型的にはがんに罹患しているか、罹患するリスクを有する対象を意味する。本開示の一態様において、対象はHLA-A24またはHLA-A02陽性である。本開示の好ましい一態様において、対象はDNAJB8またはFAM83BまたはBORIS sf6陽性のがんに罹患しているか、罹患するリスクを有する。本開示の一態様において、対象はHLA-A24陽性であり、かつ、DNAJB8またはFAM83B陽性のがんに罹患しているか、罹患するリスクを有する。本開示の別の一態様において、対象はHLA-A02陽性であり、かつ、BORIS sf6陽性のがんに罹患しているか、罹患するリスクを有する。
(1)抗体ファージの作成
がん幹細胞抗原ペプチドとして、DNAJB8タンパク質由来のナチュラル抗原ペプチドDNAJB8-143(配列番号5)およびFAM83Bタンパク質由来のナチュラル抗原ペプチドSF9(配列番号6)を用いて、HLA-A24/DNAJB8-143複合体およびHLA-A24/SF9複合体を認識するscFvを、Tsukahara et al., J Biol Chem., 2014, Aug 8;289(32):22035-47に記載のファージディスプレイ法と同様の方法を用いて同定した。なお、以下の実施例1~5において「がん幹細胞抗原ペプチド」は、DNAJB8-143およびSF9を意味する。
具体的にはまず、scFvライブラリから、抗体の重鎖可変領域(VH領域)および軽鎖可変領域(VL領域)をリンカーで結合したペプチドをコードするDNAを組み込んだファージミドベクターを作製し、大腸菌に感染させた。これにヘルパーファージをさらに感染させて、VH領域およびVL領域がリンカーで結合されたscFvを提示するM13ファージ(抗体ファージ)を作製した。
バイオパニングの前に、ファージライブラリから、HLA-A24とHIVペプチド(RYLRDQQLLGI(配列番号15))との複合体をビオチン修飾したものとストレプトアビジン結合磁気ビーズとを用いて、非特異的結合ファージを除去した。残った抗体ファージから、ビオチン修飾HLA-A24/DNAJB8-143複合体またはビオチン修飾HLA-A24/SF9複合体とストレプトアビジン結合磁気ビーズとを用いて、それぞれの複合体に結合する抗体ファージを選抜する(ポジティブパニング)工程を3回繰り返し、HLA-A24/ナチュラル抗原ペプチド複合体に特異的に結合する候補抗体ファージを得た。
得られた候補抗体ファージからscFv部分を切り離し、VL領域の後ろにFLAGタグを標識し、HLA-A24/DNAJB8-143複合体またはHLA-A24/SF9複合体に対する反応性を、FACSを用いて解析した。解析の結果、反応性の高かったクローンを選抜し、FLAGタグに代えてヒトIgG1の重鎖Fc領域(CH2およびCH3領域、配列番号19)を連結し、scFv抗体をIgG1型に変換した。IgG1型に変換した抗体(scFv-hIgG1)を用いて、さらにFACS解析を行い、特に反応性の高かったクローン(DNAJB8-143:クローンA10およびクローンB10、SF9:クローン4およびクローン11)を選抜した。
クローンA10 VH領域:CARVGWDLLGRAFDIW(配列番号7)
クローンA10 VL領域:CAAWDDSLSGVVF(配列番号8)
クローンB10 VH領域:CARDGEMATVVAGPFDNW(配列番号9)
クローンB10 VL領域:CQVWDSSVVF(配列番号10)
クローン4 VH領域:CAKDIGSGWFSMDVW(配列番号11)
クローン4 VL領域:CAKDIGSGWFSMDVW(配列番号12)
クローン11 VH領域:CAKGKYSGSYYALDYW(配列番号13)
クローン11 VL領域:CQSYDSSLSGSVF(配列番号14)
HLA-A24を発現するT2細胞(T2-A24細胞)に様々な濃度(それぞれ50μg/mL、5μg/mL、500ng/mL、50ng/mL、5ng/mL、500pg/mL、50pg/mL、5pg/mL)でナチュラル抗原ペプチドをパルスしたものと、例1で得られた抗体クローンとを反応させ、抗体の反応限界濃度を算出した。ネガティブコントロールとして、HIV(配列番号15)、EBV(TYGPVFMSL(配列番号16))、CMV(QYDPVAALF(配列番号17))ペプチドをそれぞれ50μg/mLでパルスしたものを用いた。
結果を図2に示す。いずれのクローンも、5ng/mL程度の反応検出限界であった。
(1)ペプチドパルスT2-A24細胞との反応性
例2で得られたscFv-hIgG1抗体が、実際に細胞表面に抗原を提示する細胞と反応するか否かを試験した。T2-A24細胞に終濃度50μg/mLに調製したDNAJB8-143、HIV、CMVおよびEBVをパルスしたものに、例2で得られたA10抗体およびB10抗体を終濃度10μg/mLで反応させ、抗hIgG-PEで免疫染色して観察した。クローン11抗体についても、終濃度100μg/mLに調製したSF9およびHIVでT2-A24細胞をパルスした以外は同様に観察した。
結果を図3に示す。各がん幹細胞抗原ペプチドでパルスしたT2-A24細胞表面にscFv-IgG1抗体が結合していることが観察された。
次に実際のがん細胞に対する反応性を試験した。A10抗体およびB10抗体の試験ではヒト結腸腺癌細胞株HT29(HLA-A24(+)およびDNAJB8(+))、DNAJB8を過剰発現させたHT29およびヒト腎腺癌細胞株ACHN(HLA-A24(-)およびDNAJB8(+))を、クローン11抗体の試験ではヒト大腸癌細胞株SW480のSP画分細胞(HLA-A24(+)およびFAM83B(+))をそれぞれ用いた以外は(1)と同様に試験した。
結果を図4に示す。各癌細胞表面においてもT2-A24細胞と同様に、scFv-hIgG1抗体が細胞表面に結合していることが確認された。したがって、本開示の抗体は、内在的に提示されたナチュラル抗原ペプチドも認識することができることが示された。
(1)ペプチドパルスT2-A24細胞に対する細胞傷害活性
例3(1)と同様にペプチドをパルスしたT2-A24細胞と終濃度10μg/mLに調製した各抗体とを反応させ、蛍光標識としてPE抱合抗C3b抗体およびDAPIを用いて観察した。CDCC活性が確認される場合、細胞周辺にC3bが結合して赤く染色され、CDCC活性により細胞膜が破壊されてDAPIが細胞内に流入し、核が青く染色される。
結果を図5に示す。いずれの抗体でも、がん幹細胞抗原ペプチドをパルスしたT2-A24に対するCDCC活性が観察された。
ヒト結腸腺癌細胞株HT29(HLA-A24(+)およびDNAJB8(+))に代えてヒト腎細胞がCaki-1(HLA-A24(+)およびDNAJB8(+))を用いた以外は例3(2)と同じ細胞を用いて、例4(1)と同様に試験した。
結果を図6に示す。実際の癌細胞もT2-A24細胞と同様に細胞膜の傷害によるDAPIの流入が観察された。したがって内在的にがん幹細胞抗原を提示するがん細胞に対してもCDCC活性が確認された。したがって本開示の抗体は、ナチュラル抗原ペプチドを内在的に提示する細胞を傷害することができることが示された。
(1)BiTEの作製および各細胞との結合性
Stadler et al., Nature Medicine volume 23, pages 815-817 (2017)に記載の方法と同様の方法を用いて、クローンA10、クローンB10、クローン4およびクローン11の各抗体のscFvに、抗CD3のscFv(配列番号21)を連結して、それぞれの二重特異性抗体BiTEを作製した。かかるBiTEを用いて、がん幹細胞抗原ペプチドをパルスしたT2-A24細胞、T細胞およびNK細胞に対する結合性を試験した。各BiTEは、がん幹細胞抗原ペプチドをパルスしたT2-A24細胞との結合性を示した。またT細胞とも高い結合性を示したが、NK細胞とは結合性を示さなかった。
(1)で作製したBiTEとT細胞を混合し、がん幹細胞抗原ペプチドをパルスしたT2-A24細胞と、FITC標識したアネキシンVおよびプロピジウムヨーダイド(PI)の存在下で共培養した。2.5時間および5時間後にそれぞれFACSで蛍光を解析したところ、コントロール(無処理およびT細胞のみ)の場合は2.5時間後および5時間後においてFITCおよびPIの蛍光が両方観察された細胞にほとんど変化がなかったのに対し、BiTEの存在下で共培養した場合は、FITCおよびPIの蛍光が両方観察された細胞は、2.5時間後と比較して5時間後において顕著な増加が見られた。
(1)抗体ファージの作成
がん幹細胞抗原ペプチドとして、BORIS sf6に固有の配列である配列番号22で表されるポリペプチド由来のナチュラル抗原ペプチドLV9(配列番号23)を用いて、HLA-A02/LV9複合体を認識するscFvを、Tsukahara et al., J Biol Chem., 2014, Aug 8;289(32):22035-47に記載のファージディスプレイ法と同様の方法を用いて同定した。なお、実施例6において「がん幹細胞抗原ペプチド」は、LV9を意味する。
具体的にはまず、scFvライブラリから、抗体の重鎖可変領域(VH領域)および軽鎖可変領域(VL領域)をリンカーで結合したペプチドをコードするDNAを組み込んだファージミドベクターを作製し、大腸菌に感染させた。これにヘルパーファージをさらに感染させて、VH領域およびVL領域がリンカーで結合されたscFvを提示するM13ファージ(抗体ファージ)を作製した。
バイオパニングの前に、ファージライブラリから、HLA-A02とHIVペプチド(SLYNTVATL(配列番号39))との複合体をビオチン修飾したものとストレプトアビジン結合磁気ビーズとを用いて、非特異的結合ファージを除去した。残った抗体ファージから、ビオチン修飾HLA-A02/LV9複合体とストレプトアビジン結合磁気ビーズとを用いて、それぞれの複合体に結合する抗体ファージを選抜する(ポジティブパニング)工程を3回繰り返し、HLA-A02/ナチュラル抗原ペプチド複合体に特異的に結合する候補抗体ファージを得た。
得られた候補抗体ファージからscFv部分を切り離し、VL領域の後ろにFLAGタグを標識し、HLA-A02/LV9複合体に対する反応性を、FACSを用いて解析した。解析の結果、候補scFv 23個より反応性の高かったクローンを選抜し、FLAGタグに代えてヒトIgG1の重鎖Fc領域(CH2およびCH3領域、配列番号19)を連結し、scFv抗体をIgG1型に変換した。IgG1型に変換した抗体(scFv-hIgG1)を用いて、さらにFACS解析を行い、特に反応性の高かったクローン(LV9:クローン11、クローン13、およびクローン19)を選抜した。
いずれの抗体も200μg/mLの濃度で反応性が高かったが、クローン19の反応性が最も高かった。ネガティブコントロールとして、HIV(SLYNTVATL(配列番号39))、EBV(YLQQNWWTL(配列番号40))、CMV(NLVPMVATV(配列番号41))ペプチドをそれぞれ200μg/mLでパルスしたものを用いた。結果を図7に示す。
クローン11 VH領域
CDR1領域の配列:GFTFDKYG(配列番号24)
CDR2領域の配列:ITWNSGKV(配列番号25)
CDR3領域の配列:CARDLGYYYDSSGYLKPTGSGFDYW(配列番号26)
クローン11 VL領域
CDR1領域の配列:SSNIGAGYD(配列番号27)
CDR2領域の配列:GNT
CDR3領域の配列:CGTWDSSLSVVLF(配列番号28)
クローン13 VH領域
CDR1領域の配列:GYTFTGYY(配列番号29)
CDR2領域の配列:ISTVFNTP(配列番号30)
CDR3領域の配列:CARSYSGSLQDAFDIW(配列番号31)
クローン13 VL領域
CDR1領域の配列:NLKRKN(配列番号32)
CDR2領域の配列:DGT
CDR3領域の配列:CQVWDIDSEDYVF(配列番号33)
クローン19 VH領域
CDR1領域の配列:TYSFSNYW(配列番号34)
CDR2領域の配列:IYPGDPDT(配列番号35)
CDR3領域の配列:CARRWAARPDDAFDIW(配列番号36)
クローン19 VL領域
CDR1領域の配列:NIESKI(配列番号37)
CDR2領域の配列:HDS
CDR3領域の配列:CQVWDSSSDHVVF(配列番号38)
Claims (11)
- DNAJB8タンパク質、BORIS sf6およびFAM83Bタンパク質からなる群から選択されるタンパク質に由来する抗原ペプチドと、MHC分子との複合体を認識する抗原結合部位を有する、多重特異性抗体。
- さらにCD3を認識する抗原結合部位を有する、請求項1に記載の多重特異性抗体。
- 抗原ペプチドが、配列番号5、23または6に記載のアミノ酸配列からなるペプチドである、請求項1または2に記載の多重特異性抗体。
- DNAJB8タンパク質、BORIS sf6タンパク質およびFAM83Bタンパク質からなる群から選択されるタンパク質に由来する抗原ペプチドと、MHC分子との複合体を認識する抗原結合部位が、配列番号7~14および24~38のいずれかに記載のアミノ酸配列、または、アミノ酸配列番号7~14および配列番号24~38のいずれかに記載のアミノ酸配列において、1個または2個のアミノ酸が置換されているアミノ酸配列を含む、請求項1~3のいずれか一項に記載の多重特異性抗体。
- さらに、CD80領域を含む、請求項1~4のいずれか一項に記載の多重特異性抗体。
- DNAJB8タンパク質、BORIS sf6タンパク質およびFAM83Bタンパク質からなる群から選択されるタンパク質に由来する抗原ペプチドと、MHC分子との複合体を認識する抗体を含む、医薬組成物。
- がんを予防および/または処置するための医薬組成物である、請求項6に記載の医薬組成物。
- MHC分子が、HLA分子である、請求項6または7に記載の医薬組成物。
- 抗原ペプチドが、配列番号5、23または6に記載のアミノ酸配列からなる、請求項6~8のいずれか一項に記載の医薬組成物。
- 抗体の抗原結合部位が、配列番号7~14および24~38のいずれかに記載のアミノ酸配列を含む、請求項6~9のいずれか一項に記載の医薬組成物。
- 抗体が、請求項1~5のいずれか一項に記載の多重特異性抗体である、請求項6~10のいずれか一項に記載の医薬組成物。
Priority Applications (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US17/279,965 US20220033513A1 (en) | 2018-10-05 | 2019-10-04 | Cancer-stem-cell-specific antibody |
| EP19870017.1A EP3862366A4 (en) | 2018-10-05 | 2019-10-04 | Cancer-stem-cell-specific antibody |
| JP2020551131A JPWO2020071554A1 (ja) | 2018-10-05 | 2019-10-04 | がん幹細胞特異的抗体 |
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2018189834 | 2018-10-05 | ||
| JP2018-189834 | 2018-10-05 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| WO2020071554A1 true WO2020071554A1 (ja) | 2020-04-09 |
Family
ID=70055296
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| PCT/JP2019/039400 WO2020071554A1 (ja) | 2018-10-05 | 2019-10-04 | がん幹細胞特異的抗体 |
Country Status (4)
| Country | Link |
|---|---|
| US (1) | US20220033513A1 (ja) |
| EP (1) | EP3862366A4 (ja) |
| JP (1) | JPWO2020071554A1 (ja) |
| WO (1) | WO2020071554A1 (ja) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2023010068A3 (en) * | 2021-07-28 | 2023-03-02 | Cartesian Therapeutics, Inc. | Multiprotein-engineered cells secreting a multispecific antibody |
| WO2023204290A1 (ja) * | 2022-04-21 | 2023-10-26 | 愛知県 | 多重特異性ナノ粒子 |
Citations (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2002521053A (ja) * | 1998-07-28 | 2002-07-16 | マイクロメット アーゲー | ヘテロミニ体 |
| WO2010050190A1 (ja) | 2008-10-27 | 2010-05-06 | 北海道公立大学法人札幌医科大学 | がん幹細胞分子マーカー |
| WO2014153002A1 (en) * | 2013-03-14 | 2014-09-25 | The California Institute For Biomedical Research | Bispecific antibodies and uses thereof |
| JP2014529600A (ja) * | 2011-08-23 | 2014-11-13 | ロシュ グリクアート アーゲー | T細胞活性化抗原に対して特異的な二重特異性抗体及び腫瘍抗原および使用方法 |
| WO2015050259A1 (ja) | 2013-10-03 | 2015-04-09 | 大日本住友製薬株式会社 | 腫瘍抗原ペプチド |
| WO2016047715A1 (ja) | 2014-09-24 | 2016-03-31 | 北海道公立大学法人札幌医科大学 | 腫瘍抗原ペプチド |
| JP2016516049A (ja) * | 2013-03-15 | 2016-06-02 | メモリアル スローン−ケタリング キャンサー センター | 多量体化技術 |
-
2019
- 2019-10-04 EP EP19870017.1A patent/EP3862366A4/en active Pending
- 2019-10-04 JP JP2020551131A patent/JPWO2020071554A1/ja active Pending
- 2019-10-04 US US17/279,965 patent/US20220033513A1/en active Pending
- 2019-10-04 WO PCT/JP2019/039400 patent/WO2020071554A1/ja active Application Filing
Patent Citations (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2002521053A (ja) * | 1998-07-28 | 2002-07-16 | マイクロメット アーゲー | ヘテロミニ体 |
| WO2010050190A1 (ja) | 2008-10-27 | 2010-05-06 | 北海道公立大学法人札幌医科大学 | がん幹細胞分子マーカー |
| JP2014529600A (ja) * | 2011-08-23 | 2014-11-13 | ロシュ グリクアート アーゲー | T細胞活性化抗原に対して特異的な二重特異性抗体及び腫瘍抗原および使用方法 |
| WO2014153002A1 (en) * | 2013-03-14 | 2014-09-25 | The California Institute For Biomedical Research | Bispecific antibodies and uses thereof |
| JP2016516049A (ja) * | 2013-03-15 | 2016-06-02 | メモリアル スローン−ケタリング キャンサー センター | 多量体化技術 |
| WO2015050259A1 (ja) | 2013-10-03 | 2015-04-09 | 大日本住友製薬株式会社 | 腫瘍抗原ペプチド |
| WO2016047715A1 (ja) | 2014-09-24 | 2016-03-31 | 北海道公立大学法人札幌医科大学 | 腫瘍抗原ペプチド |
Non-Patent Citations (8)
| Title |
|---|
| HORIBE R. ET AL.: "Brother of the regulator of the imprinted site (BORIS) variant subfamily 6 is a novel target of lung cancer stem-like cell immunotherapy", PLOS ONE, vol. 12, no. 3, 2017, pages 1 - 14, XP002777592 * |
| SAITO SHIMPEI : "ST-A-6: Development of HLA/peptide complex-specific artificial antibody targeting cancer stem cell antigen FAM83B", PROGRAMS AND ABSTRACTS OF 46TH ANNUAL MEETING OF THE JAPAN SOCIETY FOR CLINICAL IMMUNOLOGY; NOVEMBER 8TH TO 10TH, 2018, vol. 46, 8 November 2018 (2018-11-08), JP, pages 139, XP009528245 * |
| See also references of EP3862366A4 |
| SHIMPEI : "Development of HLA/peptide complex-specific artificial antibody targeting cancer stem cell antigen FAM83B", PROCEEDINGS OF THE JAPANESE SOCIETY OF PATHOLOGY, vol. 107, no. 1, 26 April 2018 (2018-04-26), JP, pages 522, XP009526902, ISSN: 0300-9181 * |
| STADLER ET AL., NATURE MEDICINE, vol. 23, 2017, pages 815 - 817 |
| TADANO HIROKI: "The antibody targeting cancer stem-like cell antigen DNAJB8-drived peptide/HLA-A24 complex", PROCEEDINGS OF THE JAPANESE SOCIETY OF PATHOLOGY, vol. 107, no. 1, 26 April 2018 (2018-04-26), pages 397, XP009526903, ISSN: 0300-9181 * |
| TSUKAHARA ET AL., J BIOL CHEM., vol. 289, no. 32, 8 August 2014 (2014-08-08), pages 22035 - 47 |
| TSUKAHARA TOMOHIDE : "2-8-1 Development of HLA/peptide complex-specific artificial antibody targeting cancer stem cell antigen DNAJB8 against bone and soft tissue sarcoma", THE JOURNAL OF JAPANESE ORTHOPAEDIC SURGICAL SOCIETY, vol. 92, no. 8, 30 August 2018 (2018-08-30), pages S1942, XP009527162, ISSN: 0021-5325 * |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2023010068A3 (en) * | 2021-07-28 | 2023-03-02 | Cartesian Therapeutics, Inc. | Multiprotein-engineered cells secreting a multispecific antibody |
| WO2023204290A1 (ja) * | 2022-04-21 | 2023-10-26 | 愛知県 | 多重特異性ナノ粒子 |
Also Published As
| Publication number | Publication date |
|---|---|
| EP3862366A4 (en) | 2022-06-29 |
| EP3862366A1 (en) | 2021-08-11 |
| US20220033513A1 (en) | 2022-02-03 |
| JPWO2020071554A1 (ja) | 2021-09-09 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| AU2019204921C1 (en) | Chimeric Antigen Receptor (CAR) with Antigen Binding Domains to the T Cell Receptor Beta Constant Region. | |
| US20210038646A1 (en) | Chimeric antigen receptors targeting the tumor microenvironment | |
| US20230190796A1 (en) | Engineered cells expressing prostate-specific membrane antigen (psma) or a modified form thereof and related methods | |
| US20190358262A1 (en) | Methods for modulation of car-t cells | |
| JP7308190B2 (ja) | 抗cd47及び抗pd-l1による卵巣癌の処置 | |
| JP2018525421A (ja) | Cd47遮断及び免疫同時刺激アゴニストを用いた標的細胞の枯渇亢進 | |
| JP2013535963A (ja) | Mhcクラスiiと糖尿病関連自己抗原性ペプチドとの天然型複合体に対するt細胞受容体様特異性を有する単離された高親和性実体 | |
| US11385233B2 (en) | Methods of depleting malignant T-cells | |
| US20180134802A1 (en) | Compositions comprising chimeric antigen receptors, t cells comprising the same, and methods of using the same | |
| WO2020071554A1 (ja) | がん幹細胞特異的抗体 | |
| JP5566374B2 (ja) | 形質細胞の腫瘍性増殖をきたす疾患の治療薬 | |
| US11982673B2 (en) | Methods | |
| TWI805792B (zh) | 抗腫瘤劑及其評估方法 | |
| RU2803148C2 (ru) | Противоопухолевое средство и способ его оценки |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 121 | Ep: the epo has been informed by wipo that ep was designated in this application |
Ref document number: 19870017 Country of ref document: EP Kind code of ref document: A1 |
|
| ENP | Entry into the national phase |
Ref document number: 2020551131 Country of ref document: JP Kind code of ref document: A |
|
| NENP | Non-entry into the national phase |
Ref country code: DE |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 2019870017 Country of ref document: EP |
|
| ENP | Entry into the national phase |
Ref document number: 2019870017 Country of ref document: EP Effective date: 20210506 |