RU2672561C2 - Прогнозирование нежелательных явлений у пациентов с предполагаемым диагнозом хронической сердечной недостаточности - Google Patents
Прогнозирование нежелательных явлений у пациентов с предполагаемым диагнозом хронической сердечной недостаточности Download PDFInfo
- Publication number
- RU2672561C2 RU2672561C2 RU2014145259A RU2014145259A RU2672561C2 RU 2672561 C2 RU2672561 C2 RU 2672561C2 RU 2014145259 A RU2014145259 A RU 2014145259A RU 2014145259 A RU2014145259 A RU 2014145259A RU 2672561 C2 RU2672561 C2 RU 2672561C2
- Authority
- RU
- Russia
- Prior art keywords
- level
- heart failure
- fragments
- procalcitonin
- specified
- Prior art date
Links
- 206010007558 Cardiac failure chronic Diseases 0.000 title claims abstract description 52
- 230000002411 adverse Effects 0.000 title abstract description 12
- 238000004393 prognosis Methods 0.000 title abstract description 8
- 108010048233 Procalcitonin Proteins 0.000 claims abstract description 99
- CWCXERYKLSEGEZ-KDKHKZEGSA-N procalcitonin Chemical compound C([C@@H](C(=O)N1CCC[C@H]1C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@H](C(=O)N[C@@H](C)C(=O)N[C@@H]([C@@H](C)CC)C(=O)NCC(=O)N[C@@H](C(C)C)C(=O)NCC(=O)N[C@@H](C)C(=O)N1[C@@H](CCC1)C(=O)NCC(O)=O)[C@@H](C)O)NC(=O)[C@@H](NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H](CC=1C=CC=CC=1)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC=1C=CC=CC=1)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@@H](NC(=O)CNC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCSC)NC(=O)[C@H]1NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CO)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC(N)=O)NC(=O)CNC(=O)[C@@H](N)CSSC1)[C@@H](C)O)[C@@H](C)O)[C@@H](C)O)C1=CC=CC=C1 CWCXERYKLSEGEZ-KDKHKZEGSA-N 0.000 claims abstract description 99
- 239000012634 fragment Substances 0.000 claims abstract description 41
- 238000000034 method Methods 0.000 claims abstract description 25
- 210000001124 body fluid Anatomy 0.000 claims abstract description 6
- 238000003745 diagnosis Methods 0.000 claims description 47
- 206010019280 Heart failures Diseases 0.000 claims description 33
- 239000003550 marker Substances 0.000 claims description 25
- 238000004458 analytical method Methods 0.000 claims description 24
- 208000024891 symptom Diseases 0.000 claims description 12
- 206010007556 Cardiac failure acute Diseases 0.000 claims description 9
- 210000004369 blood Anatomy 0.000 claims description 8
- 239000008280 blood Substances 0.000 claims description 8
- 210000002381 plasma Anatomy 0.000 claims description 8
- 125000000539 amino acid group Chemical group 0.000 claims description 7
- 230000001154 acute effect Effects 0.000 claims description 6
- 230000034994 death Effects 0.000 claims description 6
- 102100036836 Natriuretic peptides B Human genes 0.000 claims description 5
- 101710187802 Natriuretic peptides B Proteins 0.000 claims description 5
- 239000010839 body fluid Substances 0.000 claims description 5
- 230000007213 cerebrovascular event Effects 0.000 claims description 5
- 210000002966 serum Anatomy 0.000 claims description 5
- 108010074051 C-Reactive Protein Proteins 0.000 claims description 4
- 230000007211 cardiovascular event Effects 0.000 claims description 4
- DDRJAANPRJIHGJ-UHFFFAOYSA-N creatinine Chemical compound CN1CC(=O)NC1=N DDRJAANPRJIHGJ-UHFFFAOYSA-N 0.000 claims description 4
- 206010012601 diabetes mellitus Diseases 0.000 claims description 4
- 239000002243 precursor Substances 0.000 claims description 4
- 102100032752 C-reactive protein Human genes 0.000 claims description 3
- 208000006545 Chronic Obstructive Pulmonary Disease Diseases 0.000 claims description 3
- 208000009982 Ventricular Dysfunction Diseases 0.000 claims description 3
- 108090000765 processed proteins & peptides Proteins 0.000 claims description 3
- 230000035488 systolic blood pressure Effects 0.000 claims description 3
- 230000006815 ventricular dysfunction Effects 0.000 claims description 3
- 102000004379 Adrenomedullin Human genes 0.000 claims description 2
- 101800004616 Adrenomedullin Proteins 0.000 claims description 2
- 102000012192 Cystatin C Human genes 0.000 claims description 2
- 108010061642 Cystatin C Proteins 0.000 claims description 2
- 208000000059 Dyspnea Diseases 0.000 claims description 2
- 206010013975 Dyspnoeas Diseases 0.000 claims description 2
- 102000002045 Endothelin Human genes 0.000 claims description 2
- 108050009340 Endothelin Proteins 0.000 claims description 2
- 108010041834 Growth Differentiation Factor 15 Proteins 0.000 claims description 2
- 102000000597 Growth Differentiation Factor 15 Human genes 0.000 claims description 2
- 102000001554 Hemoglobins Human genes 0.000 claims description 2
- 108010054147 Hemoglobins Proteins 0.000 claims description 2
- 101000852968 Homo sapiens Interleukin-1 receptor-like 1 Proteins 0.000 claims description 2
- 101000585365 Homo sapiens Sulfotransferase 2A1 Proteins 0.000 claims description 2
- 108020001621 Natriuretic Peptide Proteins 0.000 claims description 2
- 102000004571 Natriuretic peptide Human genes 0.000 claims description 2
- 102100029867 Sulfotransferase 2A1 Human genes 0.000 claims description 2
- BMQYVXCPAOLZOK-UHFFFAOYSA-N Trihydroxypropylpterisin Natural products OCC(O)C(O)C1=CN=C2NC(N)=NC(=O)C2=N1 BMQYVXCPAOLZOK-UHFFFAOYSA-N 0.000 claims description 2
- 102000004903 Troponin Human genes 0.000 claims description 2
- 108090001027 Troponin Proteins 0.000 claims description 2
- GXBMIBRIOWHPDT-UHFFFAOYSA-N Vasopressin Natural products N1C(=O)C(CC=2C=C(O)C=CC=2)NC(=O)C(N)CSSCC(C(=O)N2C(CCC2)C(=O)NC(CCCN=C(N)N)C(=O)NCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(CCC(N)=O)NC(=O)C1CC1=CC=CC=C1 GXBMIBRIOWHPDT-UHFFFAOYSA-N 0.000 claims description 2
- 102000002852 Vasopressins Human genes 0.000 claims description 2
- 108010004977 Vasopressins Proteins 0.000 claims description 2
- ULCUCJFASIJEOE-NPECTJMMSA-N adrenomedullin Chemical compound C([C@@H](C(=O)N[C@@H](CCC(N)=O)C(=O)NCC(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)NCC(=O)N[C@@H]1C(N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=2C=CC=CC=2)C(=O)NCC(=O)N[C@H](C(=O)N[C@@H](CSSC1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1NC=NC=1)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](C)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CO)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCC(N)=O)C(=O)NCC(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(N)=O)[C@@H](C)O)=O)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CCSC)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@@H](N)CC=1C=CC(O)=CC=1)C1=CC=CC=C1 ULCUCJFASIJEOE-NPECTJMMSA-N 0.000 claims description 2
- KBZOIRJILGZLEJ-LGYYRGKSSA-N argipressin Chemical compound C([C@H]1C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CSSC[C@@H](C(N[C@@H](CC=2C=CC(O)=CC=2)C(=O)N1)=O)N)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCN=C(N)N)C(=O)NCC(N)=O)C1=CC=CC=C1 KBZOIRJILGZLEJ-LGYYRGKSSA-N 0.000 claims description 2
- 229940109239 creatinine Drugs 0.000 claims description 2
- 230000035487 diastolic blood pressure Effects 0.000 claims description 2
- ZUBDGKVDJUIMQQ-UBFCDGJISA-N endothelin-1 Chemical compound C([C@@H](C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(O)=O)NC(=O)[C@H]1NC(=O)[C@H](CC=2C=CC=CC=2)NC(=O)[C@@H](CC=2C=CC(O)=CC=2)NC(=O)[C@H](C(C)C)NC(=O)[C@H]2CSSC[C@@H](C(N[C@H](CO)C(=O)N[C@@H](CO)C(=O)N[C@H](CC(C)C)C(=O)N[C@@H](CCSC)C(=O)N[C@H](CC(O)=O)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCC(O)=O)C(=O)N2)=O)NC(=O)[C@@H](CO)NC(=O)[C@H](N)CSSC1)C1=CNC=N1 ZUBDGKVDJUIMQQ-UBFCDGJISA-N 0.000 claims description 2
- 239000000692 natriuretic peptide Substances 0.000 claims description 2
- BMQYVXCPAOLZOK-XINAWCOVSA-N neopterin Chemical compound OC[C@@H](O)[C@@H](O)C1=CN=C2NC(N)=NC(=O)C2=N1 BMQYVXCPAOLZOK-XINAWCOVSA-N 0.000 claims description 2
- 102000004196 processed proteins & peptides Human genes 0.000 claims description 2
- 208000013220 shortness of breath Diseases 0.000 claims description 2
- 229960003726 vasopressin Drugs 0.000 claims description 2
- 102400000569 Myeloperoxidase Human genes 0.000 claims 1
- 108090000235 Myeloperoxidases Proteins 0.000 claims 1
- 238000001514 detection method Methods 0.000 claims 1
- 238000012797 qualification Methods 0.000 claims 1
- 239000003814 drug Substances 0.000 abstract description 7
- 230000000694 effects Effects 0.000 abstract description 6
- 150000001413 amino acids Chemical class 0.000 abstract description 4
- 239000000126 substance Substances 0.000 abstract description 3
- 238000003759 clinical diagnosis Methods 0.000 abstract description 2
- 239000000523 sample Substances 0.000 description 24
- 208000024172 Cardiovascular disease Diseases 0.000 description 13
- 201000010099 disease Diseases 0.000 description 12
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 12
- 239000000975 dye Substances 0.000 description 12
- 108010008064 pro-brain natriuretic peptide (1-76) Proteins 0.000 description 11
- 230000004083 survival effect Effects 0.000 description 11
- 238000012360 testing method Methods 0.000 description 11
- 102400001263 NT-proBNP Human genes 0.000 description 10
- 230000035945 sensitivity Effects 0.000 description 10
- 239000011230 binding agent Substances 0.000 description 8
- 239000013256 coordination polymer Substances 0.000 description 7
- 206010003658 Atrial Fibrillation Diseases 0.000 description 5
- 101800000407 Brain natriuretic peptide 32 Proteins 0.000 description 5
- 101800002247 Brain natriuretic peptide 45 Proteins 0.000 description 5
- 206010040047 Sepsis Diseases 0.000 description 5
- 230000005856 abnormality Effects 0.000 description 5
- 210000000748 cardiovascular system Anatomy 0.000 description 5
- 239000013076 target substance Substances 0.000 description 5
- 206010020772 Hypertension Diseases 0.000 description 4
- 239000012491 analyte Substances 0.000 description 4
- 238000003556 assay Methods 0.000 description 4
- 230000001684 chronic effect Effects 0.000 description 4
- 230000004087 circulation Effects 0.000 description 4
- 230000002596 correlated effect Effects 0.000 description 4
- 229940079593 drug Drugs 0.000 description 4
- 239000012530 fluid Substances 0.000 description 4
- 230000006870 function Effects 0.000 description 4
- 208000015181 infectious disease Diseases 0.000 description 4
- 208000010125 myocardial infarction Diseases 0.000 description 4
- 230000033764 rhythmic process Effects 0.000 description 4
- 208000004476 Acute Coronary Syndrome Diseases 0.000 description 3
- 208000035143 Bacterial infection Diseases 0.000 description 3
- 206010007559 Cardiac failure congestive Diseases 0.000 description 3
- 230000002159 abnormal effect Effects 0.000 description 3
- 230000008649 adaptation response Effects 0.000 description 3
- 206010003119 arrhythmia Diseases 0.000 description 3
- 230000006793 arrhythmia Effects 0.000 description 3
- 208000022362 bacterial infectious disease Diseases 0.000 description 3
- 230000003115 biocidal effect Effects 0.000 description 3
- 230000017531 blood circulation Effects 0.000 description 3
- 230000000747 cardiac effect Effects 0.000 description 3
- 208000029078 coronary artery disease Diseases 0.000 description 3
- 230000007423 decrease Effects 0.000 description 3
- 238000003018 immunoassay Methods 0.000 description 3
- 238000000338 in vitro Methods 0.000 description 3
- 230000003993 interaction Effects 0.000 description 3
- 238000002372 labelling Methods 0.000 description 3
- 230000000670 limiting effect Effects 0.000 description 3
- 210000004072 lung Anatomy 0.000 description 3
- -1 myelopyroxidase Proteins 0.000 description 3
- PYWVYCXTNDRMGF-UHFFFAOYSA-N rhodamine B Chemical compound [Cl-].C=12C=CC(=[N+](CC)CC)C=C2OC2=CC(N(CC)CC)=CC=C2C=1C1=CC=CC=C1C(O)=O PYWVYCXTNDRMGF-UHFFFAOYSA-N 0.000 description 3
- 230000035939 shock Effects 0.000 description 3
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 description 2
- UJOBWOGCFQCDNV-UHFFFAOYSA-N 9H-carbazole Chemical compound C1=CC=C2C3=CC=CC=C3NC2=C1 UJOBWOGCFQCDNV-UHFFFAOYSA-N 0.000 description 2
- GJCOSYZMQJWQCA-UHFFFAOYSA-N 9H-xanthene Chemical compound C1=CC=C2CC3=CC=CC=C3OC2=C1 GJCOSYZMQJWQCA-UHFFFAOYSA-N 0.000 description 2
- 206010008190 Cerebrovascular accident Diseases 0.000 description 2
- 208000001953 Hypotension Diseases 0.000 description 2
- 206010049694 Left Ventricular Dysfunction Diseases 0.000 description 2
- 206010030113 Oedema Diseases 0.000 description 2
- 206010035664 Pneumonia Diseases 0.000 description 2
- 208000001647 Renal Insufficiency Diseases 0.000 description 2
- 239000003242 anti bacterial agent Substances 0.000 description 2
- 230000000844 anti-bacterial effect Effects 0.000 description 2
- 239000000090 biomarker Substances 0.000 description 2
- 210000001175 cerebrospinal fluid Anatomy 0.000 description 2
- 208000026106 cerebrovascular disease Diseases 0.000 description 2
- 230000000875 corresponding effect Effects 0.000 description 2
- 235000005911 diet Nutrition 0.000 description 2
- 230000037213 diet Effects 0.000 description 2
- MHMNJMPURVTYEJ-UHFFFAOYSA-N fluorescein-5-isothiocyanate Chemical compound O1C(=O)C2=CC(N=C=S)=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 MHMNJMPURVTYEJ-UHFFFAOYSA-N 0.000 description 2
- 239000008187 granular material Substances 0.000 description 2
- 208000019622 heart disease Diseases 0.000 description 2
- 230000002489 hematologic effect Effects 0.000 description 2
- 230000036543 hypotension Effects 0.000 description 2
- 201000006370 kidney failure Diseases 0.000 description 2
- 238000005259 measurement Methods 0.000 description 2
- 230000036963 noncompetitive effect Effects 0.000 description 2
- 102000004169 proteins and genes Human genes 0.000 description 2
- 108090000623 proteins and genes Proteins 0.000 description 2
- 238000003127 radioimmunoassay Methods 0.000 description 2
- 229910052761 rare earth metal Inorganic materials 0.000 description 2
- 150000002910 rare earth metals Chemical class 0.000 description 2
- 210000003296 saliva Anatomy 0.000 description 2
- 208000011580 syndromic disease Diseases 0.000 description 2
- 230000009897 systematic effect Effects 0.000 description 2
- 230000009885 systemic effect Effects 0.000 description 2
- ANRHNWWPFJCPAZ-UHFFFAOYSA-M thionine Chemical compound [Cl-].C1=CC(N)=CC2=[S+]C3=CC(N)=CC=C3N=C21 ANRHNWWPFJCPAZ-UHFFFAOYSA-M 0.000 description 2
- 210000002700 urine Anatomy 0.000 description 2
- TZMSYXZUNZXBOL-UHFFFAOYSA-N 10H-phenoxazine Chemical compound C1=CC=C2NC3=CC=CC=C3OC2=C1 TZMSYXZUNZXBOL-UHFFFAOYSA-N 0.000 description 1
- VGIRNWJSIRVFRT-UHFFFAOYSA-N 2',7'-difluorofluorescein Chemical compound OC(=O)C1=CC=CC=C1C1=C2C=C(F)C(=O)C=C2OC2=CC(O)=C(F)C=C21 VGIRNWJSIRVFRT-UHFFFAOYSA-N 0.000 description 1
- JNGRENQDBKMCCR-UHFFFAOYSA-N 2-(3-amino-6-iminoxanthen-9-yl)benzoic acid;hydrochloride Chemical compound [Cl-].C=12C=CC(=[NH2+])C=C2OC2=CC(N)=CC=C2C=1C1=CC=CC=C1C(O)=O JNGRENQDBKMCCR-UHFFFAOYSA-N 0.000 description 1
- IDLISIVVYLGCKO-UHFFFAOYSA-N 6-carboxy-4',5'-dichloro-2',7'-dimethoxyfluorescein Chemical compound O1C(=O)C2=CC=C(C(O)=O)C=C2C21C1=CC(OC)=C(O)C(Cl)=C1OC1=C2C=C(OC)C(O)=C1Cl IDLISIVVYLGCKO-UHFFFAOYSA-N 0.000 description 1
- WQZIDRAQTRIQDX-UHFFFAOYSA-N 6-carboxy-x-rhodamine Chemical compound OC(=O)C1=CC=C(C([O-])=O)C=C1C(C1=CC=2CCCN3CCCC(C=23)=C1O1)=C2C1=C(CCC1)C3=[N+]1CCCC3=C2 WQZIDRAQTRIQDX-UHFFFAOYSA-N 0.000 description 1
- BZTDTCNHAFUJOG-UHFFFAOYSA-N 6-carboxyfluorescein Chemical compound C12=CC=C(O)C=C2OC2=CC(O)=CC=C2C11OC(=O)C2=CC=C(C(=O)O)C=C21 BZTDTCNHAFUJOG-UHFFFAOYSA-N 0.000 description 1
- CJIJXIFQYOPWTF-UHFFFAOYSA-N 7-hydroxycoumarin Natural products O1C(=O)C=CC2=CC(O)=CC=C21 CJIJXIFQYOPWTF-UHFFFAOYSA-N 0.000 description 1
- 239000012099 Alexa Fluor family Substances 0.000 description 1
- 101800001288 Atrial natriuretic factor Proteins 0.000 description 1
- 102400001282 Atrial natriuretic peptide Human genes 0.000 description 1
- 101800001890 Atrial natriuretic peptide Proteins 0.000 description 1
- 208000006096 Attention Deficit Disorder with Hyperactivity Diseases 0.000 description 1
- 208000036864 Attention deficit/hyperactivity disease Diseases 0.000 description 1
- 108060006698 EGF receptor Proteins 0.000 description 1
- 238000002965 ELISA Methods 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 206010053172 Fatal outcomes Diseases 0.000 description 1
- 108090000288 Glycoproteins Proteins 0.000 description 1
- 102000003886 Glycoproteins Human genes 0.000 description 1
- 208000010496 Heart Arrest Diseases 0.000 description 1
- 208000016988 Hemorrhagic Stroke Diseases 0.000 description 1
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 1
- 206010020880 Hypertrophy Diseases 0.000 description 1
- 206010020919 Hypervolaemia Diseases 0.000 description 1
- 206010061218 Inflammation Diseases 0.000 description 1
- 208000031773 Insulin resistance syndrome Diseases 0.000 description 1
- 208000032382 Ischaemic stroke Diseases 0.000 description 1
- 239000002841 Lewis acid Substances 0.000 description 1
- 239000002879 Lewis base Substances 0.000 description 1
- 208000032376 Lung infection Diseases 0.000 description 1
- 208000001145 Metabolic Syndrome Diseases 0.000 description 1
- 206010028980 Neoplasm Diseases 0.000 description 1
- 208000031662 Noncommunicable disease Diseases 0.000 description 1
- 108091093037 Peptide nucleic acid Proteins 0.000 description 1
- 206010036790 Productive cough Diseases 0.000 description 1
- 208000010378 Pulmonary Embolism Diseases 0.000 description 1
- 206010062237 Renal impairment Diseases 0.000 description 1
- 206010057190 Respiratory tract infections Diseases 0.000 description 1
- 206010040070 Septic Shock Diseases 0.000 description 1
- 208000032023 Signs and Symptoms Diseases 0.000 description 1
- 206010071436 Systolic dysfunction Diseases 0.000 description 1
- 208000032109 Transient ischaemic attack Diseases 0.000 description 1
- 201000000690 abdominal obesity-metabolic syndrome Diseases 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- 239000000999 acridine dye Substances 0.000 description 1
- 150000001251 acridines Chemical class 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 230000006978 adaptation Effects 0.000 description 1
- 230000003321 amplification Effects 0.000 description 1
- 210000000544 articulatio talocruralis Anatomy 0.000 description 1
- ZYGHJZDHTFUPRJ-UHFFFAOYSA-N benzo-alpha-pyrone Natural products C1=CC=C2OC(=O)C=CC2=C1 ZYGHJZDHTFUPRJ-UHFFFAOYSA-N 0.000 description 1
- 238000004820 blood count Methods 0.000 description 1
- 210000004556 brain Anatomy 0.000 description 1
- 150000001720 carbohydrates Chemical class 0.000 description 1
- NSQLIUXCMFBZME-MPVJKSABSA-N carperitide Chemical compound C([C@H]1C(=O)NCC(=O)NCC(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@H](C(NCC(=O)N[C@@H](C)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CO)C(=O)NCC(=O)N[C@@H](CC(C)C)C(=O)NCC(=O)N[C@@H](CSSC[C@@H](C(=O)N1)NC(=O)[C@H](CO)NC(=O)[C@H](CO)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)CO)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(O)=O)=O)[C@@H](C)CC)C1=CC=CC=C1 NSQLIUXCMFBZME-MPVJKSABSA-N 0.000 description 1
- 230000003197 catalytic effect Effects 0.000 description 1
- 210000004027 cell Anatomy 0.000 description 1
- 230000002490 cerebral effect Effects 0.000 description 1
- 238000010835 comparative analysis Methods 0.000 description 1
- 230000001447 compensatory effect Effects 0.000 description 1
- 230000002860 competitive effect Effects 0.000 description 1
- 238000002967 competitive immunoassay Methods 0.000 description 1
- 150000001875 compounds Chemical class 0.000 description 1
- 235000001671 coumarin Nutrition 0.000 description 1
- 150000004775 coumarins Chemical class 0.000 description 1
- 230000006866 deterioration Effects 0.000 description 1
- 239000006185 dispersion Substances 0.000 description 1
- 230000004064 dysfunction Effects 0.000 description 1
- ZMMJGEGLRURXTF-UHFFFAOYSA-N ethidium bromide Chemical compound [Br-].C12=CC(N)=CC=C2C2=CC=C(N)C=C2[N+](CC)=C1C1=CC=CC=C1 ZMMJGEGLRURXTF-UHFFFAOYSA-N 0.000 description 1
- 229960005542 ethidium bromide Drugs 0.000 description 1
- 210000000416 exudates and transudate Anatomy 0.000 description 1
- 238000001914 filtration Methods 0.000 description 1
- GNBHRKFJIUUOQI-UHFFFAOYSA-N fluorescein Chemical compound O1C(=O)C2=CC=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 GNBHRKFJIUUOQI-UHFFFAOYSA-N 0.000 description 1
- 238000012921 fluorescence analysis Methods 0.000 description 1
- 239000007850 fluorescent dye Substances 0.000 description 1
- 238000005194 fractionation Methods 0.000 description 1
- 230000004217 heart function Effects 0.000 description 1
- 229910052739 hydrogen Inorganic materials 0.000 description 1
- 239000001257 hydrogen Substances 0.000 description 1
- 230000002209 hydrophobic effect Effects 0.000 description 1
- 230000000984 immunochemical effect Effects 0.000 description 1
- 230000004054 inflammatory process Effects 0.000 description 1
- 230000000977 initiatory effect Effects 0.000 description 1
- 208000020658 intracerebral hemorrhage Diseases 0.000 description 1
- 208000028867 ischemia Diseases 0.000 description 1
- 210000005240 left ventricle Anatomy 0.000 description 1
- 231100000518 lethal Toxicity 0.000 description 1
- 230000001665 lethal effect Effects 0.000 description 1
- 210000000265 leukocyte Anatomy 0.000 description 1
- 150000007527 lewis bases Chemical class 0.000 description 1
- 238000012417 linear regression Methods 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 230000007774 longterm Effects 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 230000001404 mediated effect Effects 0.000 description 1
- 238000002493 microarray Methods 0.000 description 1
- 239000000203 mixture Substances 0.000 description 1
- 238000000491 multivariate analysis Methods 0.000 description 1
- 208000031225 myocardial ischemia Diseases 0.000 description 1
- 238000003199 nucleic acid amplification method Methods 0.000 description 1
- 108020004707 nucleic acids Proteins 0.000 description 1
- 102000039446 nucleic acids Human genes 0.000 description 1
- 150000007523 nucleic acids Chemical class 0.000 description 1
- 230000001575 pathological effect Effects 0.000 description 1
- 230000007170 pathology Effects 0.000 description 1
- 239000013610 patient sample Substances 0.000 description 1
- 150000005053 phenanthridines Chemical class 0.000 description 1
- INAAIJLSXJJHOZ-UHFFFAOYSA-N pibenzimol Chemical compound C1CN(C)CCN1C1=CC=C(N=C(N2)C=3C=C4NC(=NC4=CC=3)C=3C=CC(O)=CC=3)C2=C1 INAAIJLSXJJHOZ-UHFFFAOYSA-N 0.000 description 1
- 231100000857 poor renal function Toxicity 0.000 description 1
- 150000004032 porphyrins Chemical class 0.000 description 1
- 208000037920 primary disease Diseases 0.000 description 1
- 208000037821 progressive disease Diseases 0.000 description 1
- 230000002035 prolonged effect Effects 0.000 description 1
- 238000000746 purification Methods 0.000 description 1
- 238000010791 quenching Methods 0.000 description 1
- 230000000171 quenching effect Effects 0.000 description 1
- 239000011541 reaction mixture Substances 0.000 description 1
- 230000000241 respiratory effect Effects 0.000 description 1
- 150000003839 salts Chemical class 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 230000036303 septic shock Effects 0.000 description 1
- 239000007790 solid phase Substances 0.000 description 1
- 210000003802 sputum Anatomy 0.000 description 1
- 208000024794 sputum Diseases 0.000 description 1
- 230000008961 swelling Effects 0.000 description 1
- 208000019270 symptomatic heart failure Diseases 0.000 description 1
- 230000008718 systemic inflammatory response Effects 0.000 description 1
- 238000010998 test method Methods 0.000 description 1
- ABZLKHKQJHEPAX-UHFFFAOYSA-N tetramethylrhodamine Chemical compound C=12C=CC(N(C)C)=CC2=[O+]C2=CC(N(C)C)=CC=C2C=1C1=CC=CC=C1C([O-])=O ABZLKHKQJHEPAX-UHFFFAOYSA-N 0.000 description 1
- MPLHNVLQVRSVEE-UHFFFAOYSA-N texas red Chemical compound [O-]S(=O)(=O)C1=CC(S(Cl)(=O)=O)=CC=C1C(C1=CC=2CCCN3CCCC(C=23)=C1O1)=C2C1=C(CCC1)C3=[N+]1CCCC3=C2 MPLHNVLQVRSVEE-UHFFFAOYSA-N 0.000 description 1
- 238000011426 transformation method Methods 0.000 description 1
- 201000010875 transient cerebral ischemia Diseases 0.000 description 1
- ORHBXUUXSCNDEV-UHFFFAOYSA-N umbelliferone Chemical compound C1=CC(=O)OC2=CC(O)=CC=C21 ORHBXUUXSCNDEV-UHFFFAOYSA-N 0.000 description 1
- HFTAFOQKODTIJY-UHFFFAOYSA-N umbelliferone Natural products Cc1cc2C=CC(=O)Oc2cc1OCC=CC(C)(C)O HFTAFOQKODTIJY-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/68—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving proteins, peptides or amino acids
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/68—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving proteins, peptides or amino acids
- G01N33/6893—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving proteins, peptides or amino acids related to diseases not provided for elsewhere
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2333/00—Assays involving biological materials from specific organisms or of a specific nature
- G01N2333/435—Assays involving biological materials from specific organisms or of a specific nature from animals; from humans
- G01N2333/575—Hormones
- G01N2333/585—Calcitonins
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2800/00—Detection or diagnosis of diseases
- G01N2800/32—Cardiovascular disorders
- G01N2800/325—Heart failure or cardiac arrest, e.g. cardiomyopathy, congestive heart failure
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2800/00—Detection or diagnosis of diseases
- G01N2800/50—Determining the risk of developing a disease
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2800/00—Detection or diagnosis of diseases
- G01N2800/54—Determining the risk of relapse
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2800/00—Detection or diagnosis of diseases
- G01N2800/56—Staging of a disease; Further complications associated with the disease
Landscapes
- Life Sciences & Earth Sciences (AREA)
- Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Molecular Biology (AREA)
- Chemical & Material Sciences (AREA)
- Biomedical Technology (AREA)
- Urology & Nephrology (AREA)
- Hematology (AREA)
- Immunology (AREA)
- Cell Biology (AREA)
- Analytical Chemistry (AREA)
- Biotechnology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Food Science & Technology (AREA)
- Medicinal Chemistry (AREA)
- Physics & Mathematics (AREA)
- Microbiology (AREA)
- Biochemistry (AREA)
- General Health & Medical Sciences (AREA)
- General Physics & Mathematics (AREA)
- Pathology (AREA)
- Investigating Or Analysing Biological Materials (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
- Peptides Or Proteins (AREA)
Abstract
Изобретение относится к области клинической диагностики и касается применения прокальцитонина в способе прогнозирования риска развития нежелательного явления у пациента с диагнозом стабильной хронической сердечной недостаточности или с предполагаемым диагнозом стабильной хронической недостаточности. Способ включает: определение уровня прокальцитонина или его фрагментов с длиной цепи, составляющей по меньшей мере 12 аминокислотных остатков, в образце жидкости организма указанного пациента; корреляцию указанного уровня прокальцитонина или его фрагментов с риском развития нежелательного явления у указанного пациента, причем указанная стадия корреляции включает сравнение указанного уровня прокальцитонина или его фрагментов с пороговым уровнем. Если указанный уровень прокальцитонина или его фрагментов превышает указанный уровень, у указанного пациента существует повышенный риск развития нежелательного явления, при этом значение указанного порогового уровня находится в диапазоне между 0,015 нг/мл и 0,03 нг/мл. 2 н. и 8 з.п. ф-лы, 2 пр., 7 табл., 9 ил.
Description
Область техники, к которой относится настоящее изобретение
Настоящее изобретение относится к области клинической диагностики. Прежде всего, настоящее изобретение относится к прогнозированию нежелательных явлений (например, смертности) у пациентов с диагнозом стабильной хронической сердечной недостаточности или с предполагаемым диагнозом стабильной хронической сердечной недостаточности по результатам определения уровня прокальцитонина (ПКТ).
Предпосылки создания настоящего изобретения
Прокальцитонин (ПКТ) является общепринятым биомаркером для диагностики сепсиса. ПКТ отражает степень тяжести бактериальной инфекции, и его, прежде всего, используют для контроля прогрессирования инфекции в сепсис, острый сепсис или септический шок. ПКТ можно использовать для определения активности системной воспалительной ответной реакции, связанной с сепсисом, для контроля эффективности противобактериального лечения и для оценки прогнозирования (Assicot и др., Lancet, 341, сс. 515-518 (1993), Clec'h С. и др., Crit. Care Med., 32, сс. 1166-1169 (2004), Lee и др., Yonsei Med. J., 45, сс. 29-37 (2004), Meisner и др., Curr. Opin. Crit. Care, 11, сс. 473-480 (2005), Wunder и др., Inflamm. Res., 53, сс. 158-163 (2004)). Повышение уровней ПКТ у пациентов с диагнозом сепсиса коррелирует с уровнем смертности (Oberhoffer и др., Clin. Chem. Lab. Med., 37, сс. 363-368 (1999)).
При бактериальных инфекциях концентрации ПКТ в плазме обычно превышают 0,25 нг/мл. Недавно было установлено, что при некоторых неинфекционных заболеваниях, таких как болезнь коронарных артерий или острые коронарные синдромы, концентрации ПКТ могут превышать диапазон нормальных значений, но оставаться ниже концентраций, которые в настоящее время связывают с бактериальными инфекциями, требующими противобактериальное лечение, и такие концентрации ПКТ связывают с прогнозированием нежелательных явлений у указанных пациентов (Sinnig и др., Circ. J., 75, сс. 1184-1191 (2011), Kelly и др., Biomarkers, 15, сс. 325-331 (2010)).
В заявках на выдачу патента ЕР 07015271.5 и ЕР 09719129.0 описано применение ПКТ для выделения групп риска пациентов, страдающих от стабильной болезни коронарных артерий и острых коронарных синдромов, соответственно.
Сердечная недостаточность (СН), также называемая застойной сердечной недостаточностью (ЗСН), представляет собой состояние сердечно-сосудистой системы, которое возникает, если проблема со структурой или функцией сердца нарушает способность сердца обеспечивать достаточный кровоток, чтобы удовлетворить потребности организма. Такая проблема может вызвать множество симптомов, прежде всего, одышку в состоянии покоя или при выполнении упражнений и/или утомляемость, признаки задержки жидкости, такие как застой крови в легких или припухлость голеностопного сустава, а также объективное доказательство аномальности структуры или функции сердца в состоянии покоя. Однако у некоторых пациентов симптомы могут полностью отсутствовать, при этом бессимптомные аномальности структуры или функции сердца в настоящее время считают предшественниками симптоматической сердечной недостаточности и связывают с высоким уровнем смертности (Wang и др., Circulation, 108, сс. 977-982 (2003)). Сердечная недостаточность является распространенным заболеванием: более 2% населения США, или почти 5 миллионов человек, страдают от сердечной недостаточности, при этом от 30% до 40% пациентов умирают от сердечной недостаточности в течение 1 года после установления диагноза (МсМштау J.J., Pfeffer М.А., Lancet., 365, сс. 1877-1889 (2005)). Сердечная недостаточность часто не диагностируется из-за отсутствия общепринятых критериев установления диагноза и проблем при определении диагноза, прежде всего на ранней стадии. При соответствующем лечении сердечную недостаточность можно контролировать у большинства пациентов, однако сердечная недостаточность является потенциально опасным для жизни состоянием, и прогрессирующее заболевание связывают с 10% общим уровнем ежегодной смертности. Сердечная недостаточность является основной причиной госпитализации людей старше 65 лет (Haldemann G.A. и др., Am. Heart. J., 137, сс. 352-360 (1999)). Как следствие, в европейских странах на лечение сердечной недостаточности расходуется 1-2% всех средств, выделяемых на здравоохранение (Berry и др., Eur. J. Heart Fail., 3, сс. 749-753 (2001)).
Хроническая сердечная недостаточность (хроническая СН) является продолжительным состоянием, развивающимся на протяжении месяцев и лет, обычно характеризующимся стабильной поддающейся лечению симптоматологией. Указанное состояние связано с лежащими в основе деятельности сердечно-сосудистой системы адаптационными ответными реакциями, которые, однако, могут оказывать отрицательное действие в течение продолжительного периода времени и приводить к ухудшению состояния. Острая сердечная недостаточность (ОСН) является термином, используемым для описания обостренной или декомпенсационной сердечной недостаточности, относящейся к эпизодам, при которых у пациента могут наблюдаться изменения признаков и симптомов сердечной недостаточности, требующие неотложное лечение или госпитализацию. ОСН развивается быстро, в течение нескольких часов или дней, и мгновенно может представлять угрозу для жизни, так как для сердца недостаточно времени для компенсационной адаптации. Хроническая СН также может вызвать декомпенсационное состояние, которое в большинстве случаев развивается в результате сопутствующего заболевания (такого как пневмония), инфаркта миокарда, аритмии, неконтролируемой гипертензии, или неспособности пациента соблюдать рекомендации по ограничению приема жидкости, диете или проводить медикаментозное лечение.
В статье Miller и др., J. Cardiovasc. Trans. Res., 2, сс. 526-535 (2009) исследовали применение ПКТ для среднесрочного прогнозирования после-госпитальной смертности (среднее значение на протяжении 10 месяцев после госпитализации) от сердечно-сосудистых заболеваний в когорте пациентов с диагнозом хронической СН, госпитализированных из-за декомпенсации СН. Однако уровни ПКТ у не выживших и выживших пациентов не отличались. Напротив, наблюдалась тенденция увеличения уровней ПКТ у выживших пациентов по сравнению с уровнями ПКТ у не выживших пациентов.
В статье Maisel и др., Eur. J. Heart Fail., 14., сс. 278-286 (2012) сообщается, что уровень ПКТ в значительной степени связан с краткосрочным прогнозированием (90-дневным) общей смертности у пациентов с диагнозом острой сердечной недостаточности.
В заявке ЕР 07817601.3 описан способ диагностики инфекций дыхательных путей и легких, связанных с сердечной недостаточностью.
Однако не известно, можно ли связывать относительно высокие концентрации ПКТ у пациентов с диагнозом стабильной хронической сердечной недостаточности или у пациентов с предполагаемым диагнозом стабильной хронической сердечной недостаточности с прогнозированием нежелательного явления (например, смертности). Возможность предсказания нежелательных явлений при обследовании пациента имеет большое значение, так как раннее выявление риска является необходимым условием для начала проведения мер, чтобы предотвратить развитие нежелательных явлений.
В связи с этим, цель настоящего изобретения заключалась в исследовании взаимосвязи уровней ПКТ у пациентов с диагнозом стабильной хронической сердечной недостаточности или у пациентов с предполагаемым диагнозом стабильной хронической сердечной недостаточности и прогнозирования нежелательных явлений (например, смертности).
Краткое описание сущности изобретения
Настоящее изобретение относится к способу прогнозирования in vitro нежелательных явлений (например, смертности) у пациента с диагнозом стабильной хронической сердечной недостаточности или с предполагаемым диагнозом стабильной хронической сердечной недостаточности, который заключается в определении уровня ПКТ или его фрагментов в образце, полученном от указанного пациента, и в корреляции уровня ПКТ или его фрагментов с риском развития нежелательного явления (например, смертности). Краткое описание фигур
На фиг. 1 показаны кривые выживаемости Каплана-Мейера по квинтилям ПКТ для пациентов с диагнозом стабильной хронической сердечной недостаточности или с предполагаемым диагнозом стабильной хронической сердечной недостаточности (прогнозирование смертности).
На фиг. 2 показаны кривые выживаемости Каплана-Мейера для прогнозирования состояния пациентов с диагнозом систолической дисфункции левого желудочка (СДЛЖ) в соответствии с квартилями ПКТ (общая смертность).
На фиг. 3 показаны кривые выживаемости Каплана-Мейера для прогнозирования состояния пациентов с диагнозом СДЛЖ в соответствии с квартилями ПКТ (смертность от сердечно-сосудистых заболеваний).
На фиг. 4 показаны кривые выживаемости Каплана-Мейера для прогнозирования состояния пациентов с диагнозом обширного структурного заболевания сердца (ОСЗС) в соответствии с квартилями ПКТ (общая смертность).
На фиг. 5 показаны кривые выживаемости Каплана-Мейера для прогнозирования состояния пациентов с диагнозом ОСЗС в соответствии с квартилями ПКТ (смертность от сердечно-сосудистых заболеваний).
На фиг. 6 показаны кривые выживаемости Каплана-Мейера для прогнозирования состояния пациентов без диагноза ОСЗС, но с диагнозом мерцательной аритмии или с уровнем мозгового натрийуретического пептида NT-proBNP>400 нг/л в соответствии с квартилями ПКТ (общая смертность).
На фиг. 7 показаны кривые выживаемости Каплана-Мейера для прогнозирования состояния пациентов без диагноза ОСЗС, но с диагнозом мерцательной аритмии или с уровнем NT-proBNP>400 нг/л в соответствии с квартилями ПКТ (смертность от сердечно-сосудистых заболеваний).
На фиг. 8 показаны кривые выживаемости Каплана-Мейера для прогнозирования состояния пациентов с синусным ритмом и уровнем NT-proBNP<400 нг/л в соответствии с квартилями ПКТ (общая смертность).
На фиг. 9 показаны кривые выживаемости Каплана-Мейера для прогнозирования состояния пациентов с синусным ритмом и уровнем NT-proBNP<400 нг/л в соответствии с квартилями ПКТ (смертность от сердечно-сосудистых заболеваний).
Подробное описание изобретения
Настоящее изобретение относится к способу прогнозирования in vitro нежелательных явлений (например, смертности) у пациента с диагнозом стабильной хронической сердечной недостаточности или с предполагаемым диагнозом стабильной хронической сердечной недостаточности, который заключается в определении уровня ПКТ или его фрагментов в образце, полученном от указанного пациента, и в корреляции уровня ПКТ или его фрагментов с риском развития нежелательного явления (например, смертности).
В предпочтительном варианте осуществления настоящего изобретения определяют уровень ПКТ, содержащего аминокислотные остатки 1-116 или 2-116 или 3-116 последовательности SEQ ID NO: 1.
Другой вариант осуществления настоящего изобретения включает определение уровня одного или более дополнительных прогностических маркеров в образце, полученном от указанного пациента, и комбинирование указанного уровня ПКТ или его фрагментов и указанного уровня одного или более дополнительного прогностического маркера указанной предрасположенности к развитию нежелательного явления, при этом комбинирование указанного уровня ПКТ или его фрагментов с указанным уровнем одного или более дополнительных прогностических маркеров повышает прогностическую значимость указанного уровня ПКТ или его фрагментов для прогнозирования нежелательный явлений.
Другие маркеры, которые можно использовать в качестве дополнительного прогностического маркера(ов), можно выбрать из группы, включающей тропонин, миелопироксидазу, С-реактивный белок, неоптерин, GDF-15, ST2, цистатин-С, а также следующие пептиды в их зрелой форме, в форме их предшественников, прогормонов и ассоциированных фрагментов прогормонов: предсердный натрийуретический пептид, адреномедуллин, эндотелины, вазопрессин.
В другом предпочтительном варианте осуществления настоящего изобретения одним из указанных дополнительных прогностических маркеров(а) является pre-proBNP или его фрагменты (указанные фрагменты могут включать proBNP или его производные, т.е. BNP или NT-proBNP, как описано выше) в образце, полученном от указанного пациента.
В еще одном более предпочтительном варианте осуществления настоящего изобретения указанным фрагментом pre-proBNP является NT pro-BNP (SEQ ID NO: 2).
В другом более предпочтительном варианте осуществления настоящего изобретения указанным фрагментом pre-proBNP является BNP (SEQ ID NO: 3).
В другом варианте способ прогнозирования in vitro развития нежелательного явления у пациента с диагнозом стабильной хронической сердечной недостаточности или с предполагаемым диагнозом стабильной хронической сердечной недостаточности дополнительно включает математическое комбинирование указанного уровня ПКТ или его фрагментов с указанным уровнем одного или более дополнительного прогностического маркера, при этом комбинирование указанного уровня ПКТ или его фрагментов с указанным уровнем дополнительного прогностического маркера(ов) повышает прогностическую значимость указанного уровня ПКТ или его фрагментов или уровня указанного родственного маркера развития нежелательного явления. Математическое комбинирование может представлять собой, например, алгоритм деления пациентов на категории в соответствии с тем, находится ли их уровень ПКТ выше или ниже определенного порогового значения, и в соответствии с тем, находится ли их уровень маркера X (и Y, Z…) выше или ниже определенного порогового значения.
Другим объектом настоящего изобретения является применение сверхчувствительного метода анализа ПКТ, характеризующегося нижним пределом определения <0,045 (+/-0,010) нг/мл, для определения предрасположенности к нежелательному явлению у пациента с диагнозом стабильной хронической сердечной недостаточности или с предполагаемым диагнозом стабильной хронической сердечной недостаточности.
Термин "прогнозирование" относится к предсказанию нежелательного явления (например, смертности) для пациента с диагнозом стабильной хронической сердечной недостаточности или с предполагаемым диагнозом стабильной хронической сердечной недостаточности. Указанное предсказание может включать оценку шанса излечения или шанса летального исхода для указанного пациента.
Нежелательное явление определяют как ухудшающуюся сердечную недостаточность или декомпенсацию сердечной недостаточности, цереброваскулярное явление, сердечно-сосудистое явление и летальный исход.
Цереброваскулярное явление определяют как ишемический инсульт, геморрагический инсульт или преходящую ишемическую атаку.
Сердечно-сосудистое явление определяют как острый коронарный синдром, включая инфаркт миокарда.
Смертность определяют как летальный исход от сердечно-сосудистых заболеваний (связанный, например, с ишемией и инфарктом миокарда, сердечной недостаточностью, остановкой сердца или цереброваскулярным явлением) и смертность, не связанную с сердечно-сосудистыми заболеваниями (включая все другие причины смертности, например, инфекцию, опухолевые заболевания).
Сердечная недостаточность (СН), также называемая застойной сердечной недостаточностью, представляет собой состояние сердечно-сосудистой системы, которое возникает, если проблема со структурой или функцией сердца нарушает способность сердца обеспечивать достаточный кровоток, чтобы удовлетворить потребности организма. Хроническая сердечная недостаточность является продолжительным состоянием (месяцы/годы), обычно характеризующимся стабильной поддающейся лечению симптоматологией, которая связана с лежащими в основе деятельности сердечно-сосудистой системы адаптационными ответными реакциями (например, дилатация, гипертрофия) на провоцирующий фактор. Однако указанные адаптационные ответные реакции могут оказывать отрицательное действие в течение продолжительного времени и приводить к ухудшению состояния.
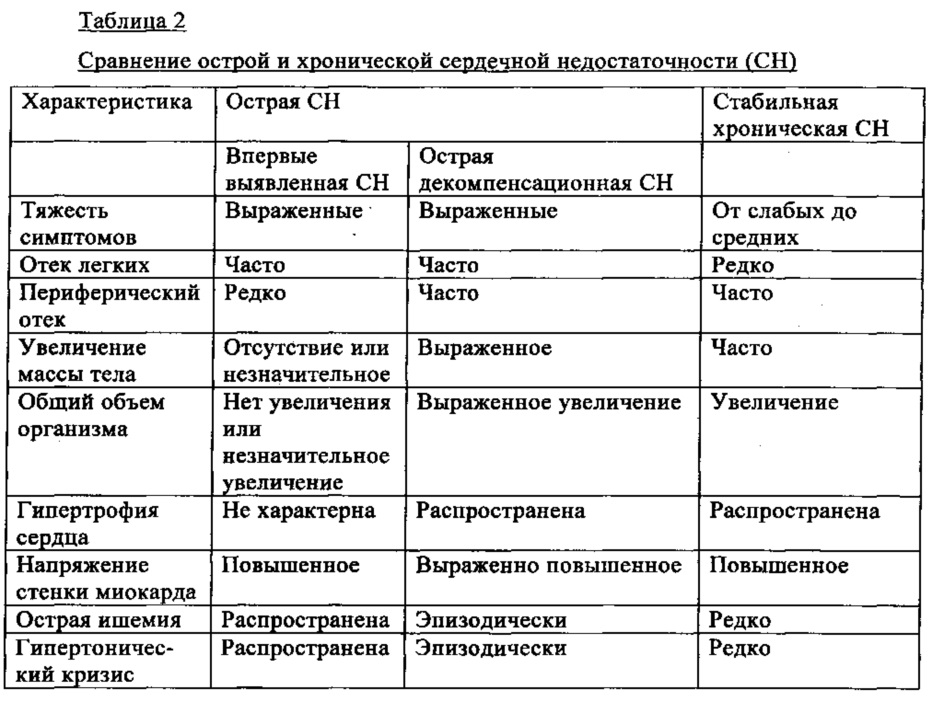
Пациентов с диагнозом хронической СН можно разделить на группы стабильной, ухудшающейся и декомпенсационной хронической СН (см. табл. 1, приведенную согласно руководству европейского общества кардиологов (ESC) (Dickstein и др., Eur. Heart J., 29, сс.2388-2442 (2008))). Острую сердечную недостаточность (ОСЕ) определяют как быстрое развитие вторичных симптомов и признаков аномальной функции сердца. ОСН может развиваться в виде острого первичного заболевания (новый эпизод острой сердечной недостаточности у пациента, у которого ранее дисфункция сердца не была установлена) или в виде острой декомпенсации хронической сердечной недостаточности. Декомпенсация у пациентов с диагнозом хронической СН наиболее часто происходит в результате сопутствующих заболеваний (таких как пневмония), инфаркта миокарда, аритмии, неконтролируемой гипертензии, или неспособности пациента соблюдать рекомендации по ограничению приема жидкости, диете или проводить медикаментозное лечение. Хроническая сердечная недостаточность, которая ухудшается или переходит в декомпенсационное состояние, также как и ОСН, характеризуется изменениями признаков и симптомов СН, приводящими к необходимости неотложного лечения или корректировки лечения, а также к необходимости госпитализации (Jessup и др., Circulation, 119, сс. 1977-2016 (2009)). Указанные пациенты характеризуются тремя клиническими характеристиками: 1) перегрузка сердца объемом, проявляющаяся застоем крови в легких и/или системным застоем, в большинстве случаев провоцируемая резким увеличением объема сердца при хронической гипертензии, 2) выраженное снижение минутного сердечного выброса, проявляющееся гипотензией, почечной недостаточностью и/или шоковым синдромом, и 3) признаки и симптомы гиперволемии и шока (Jessup и др., Circulation, 119, сс. 1977-2016 (2009)). После лечения у пациентов с диагнозом ОСН или острой декомпенсационной хронической СН может восстанавливаться хроническое стабильное компенсационное состояние. Сравнение признаков острой и хронической стабильной сердечной недостаточности приведены в табл.2.
Пациент с диагнозом стабильной хронической сердечной недостаточности или пациент с предполагаемым диагнозом стабильной хронической сердечной недостаточности характеризуется следующими признаками:
- наличие структурной или функциональной недостаточности сердечно-сосудистой системы, которая нарушает способность сердца обеспечивать достаточный кровоток, чтобы удовлетворить потребности организма,
- отсутствие перегрузки сердца объемом (проявляющейся застоем крови в легких и/или системным застоем) и/или выраженного снижения минутного сердечного выброса (проявляющегося гипотензией, почечной недостаточностью и/или шоковым синдромом),
и при этом пациент не нуждается в неотложном лечении или в корректировке лечения, а также в госпитализации.
Распространенными факторами, приводящими к госпитализации из-за сердечной недостаточности, являются, например, острая ишемия миокарда, несоблюдение курса медикаментозного лечения (ограничения приема соли и/или жидкости), нескорректированное высокое кровяное давление, мерцательная аритмия и другие виды аритмии, легочная эмболия или сопутствующие инфекции (Jessup и др., Circulation, 119, сс. 1977-2016 (2009)).
В предпочтительном варианте осуществления настоящего изобретения прогнозируют нежелательное явление в течение 7 лет, предпочтительно в течение 5 лет, более предпочтительно в течение 4 лет, наиболее предпочтительно в течение 2 лет.
В другом предпочтительном варианте осуществления настоящего изобретения уровень ПКТ или его фрагментов коррелирует с одним или более клинических показателей, выбранных из группы, включающей возраст, пол, диабет, хроническое обструктивное заболевание легких (ХОЗЛ), симптомы, качество жизни, функциональную классификацию хронической сердечной недостаточности Нью-Йоркской кардиологической ассоциации (NYHA), индекс массы тела, частоту сердечных сокращений и ритм сердца, систолическое и диастолическое кровяное давление, отек и тяжелую степень дисфункции желудочка.
Использованный в данном контексте термин "пациент" относится к живому организму человека или животного, который проходит или будет проходить курс медикаментозного лечения в связи с заболеванием. Указанный термин включает индивидуумов, у которых заболевание не установлено, и которых обследуют с целью выявления признаков патологии. Таким образом, способы и методы анализов, описанные в данном контексте, можно использовать в медицине и ветеринарии.
Использованный в данном контексте в отношении применения ПКТ в качестве прогностического маркера термин "корреляция" относится к сравнению присутствия или количества маркера у пациента с его присутствием или количеством у индивидуумов, для которых известно, что они страдают от указанного состояния или подвержены риску развития указанного состояния. Уровень маркера в образце пациента можно сравнивать с известным уровнем, который связан с конкретным прогнозированием. Считается, что уровень маркера в образце коррелирует с прогнозированием, т.е. специалист в данной области может использовать уровень маркера для определения наличия у пациента особого риска развития нежелательного явления и для принятия соответствующих мер. В другом варианте уровень маркера в образце можно сравнивать с известным уровнем маркера, который связан с положительным исходом (например, низкий риск развития нежелательного явления).
Использованный в данном контексте термин "образец" обозначает образец жидкости тела, полученный в целях диагностики, прогнозирования или обследования исследуемого субъекта, такого как пациент. Предпочтительные исследуемые образцы включают кровь, сыворотку, плазму, спинномозговую жидкость, мочу, слюну, мокроту и плевральные экссудаты. Кроме того, специалисту в данной области техники представляется очевидным, что некоторые исследуемые образцы можно более эффективно проанализировать после фракционирования или очистки, например, разделения цельной крови на компоненты сыворотки или плазмы.
Таким образом, в предпочтительном варианте осуществления настоящего изобретения образец выбирают из группы, включающей образец крови, образец сыворотки, образец плазмы, образец спинномозговой жидкости, образец слюны и образец мочи или экстракт любого из упомянутых выше образцов. Предпочтительно, образцом является образец крови, наиболее предпочтительно образец сыворотки или образец плазмы.
Согласно способу у пациента с диагнозом стабильной хронической сердечной недостаточности или с предполагаемым диагнозом стабильной хронической сердечной недостаточности существует повышенный риск развития нежелательного явления (например, смертности), если указанный определенный уровень ПКТ составляет величину выше предварительно определенного порогового уровня. Предпочтительно, предварительно определенный пороговый уровень составляет от 0,015 нг/мл до 0,05 нг/мл, более предпочтительно от 0,015 нг/мл до 0,035 нг/мл, еще более предпочтительно от 0,015 нг/мл до 0,03 нг/мл и еще более предпочтительно от 0,015 нг/мл до 0,025 нг/мл, наиболее предпочтительно от 0,02 нг/мл до 0,015 нг/мл (ниже). В предпочтительном варианте у пациента с диагнозом стабильной хронической сердечной недостаточности или с предполагаемым диагнозом стабильной хронической сердечной недостаточности существует повышенный риск развития нежелательного явления (например, смертности), если указанный определенный уровень ПКТ составляет величину выше 0,05 нг/мл, предпочтительно выше 0,035 нг/мл, более предпочтительно выше 0,03 нг/мл, еще более предпочтительно выше 0,025 нг/мл и еще более предпочтительно выше 0,02 нг/мл, наиболее предпочтительно выше 0,015 нг/мл.
Уровни ПКТ по настоящему изобретению определяют в формате анализа ПКТ (ПКТ-чувствительный анализ BRAHMS KRYPTOR), который характеризуется калибровкой в диапазоне количественных измерений, аналогичной калибровке более чувствительного анализа ПКТ (ПКТ LIA-чувствительный анализ BRAHMS), который позволяет количественно определять уровни ПКТ у нормальной популяции, при этом получают средние уровни ПКТ, как описано в заявке ЕР 09011073.5 ("Procalcitonin for the prognosis of adverse events in the asymptomatic population"). Упомянутые выше значения могут отличаться от значений, полученных по результатам других анализов ПКТ, если их калибровка отличается от калибровки ПКТ-чувствительного анализа BRAHMS KRYPTOR. Упомянутые выше значения следует использовать для анализов ПКТ с отличающейся калибровкой соответствующим образом, с учетом этих различий в калибровке. Одна возможность количественного определения различия в калибровке включает способ сравнительного анализа (корреляции) данных используемого анализа ПКТ и ПКТ-чувствительного анализа BRAHMS KRYPTOR при измерении ПКТ в образцах с использованием обоих способов. Другая возможность включает определение используемым методом анализа ПКТ при условии, что указанный анализ характеризуется достаточной аналитической чувствительностью, среднего уровня ПКТ у типичной нормальной популяции, сравнение результатов со средними уровнями ПКТ, как описано в заявке ЕР 09011073.5 ("Procalcitonin for the prognosis of adverse events in the asymptomatic population"), и пересчет калибровки на основе различия, полученного при указанном сравнении.
Чувствительность и специфичность диагностического и/или прогностического теста зависит не только от аналитического "качества" теста, они также зависят от выявления составляющих аномального результата. На практике рабочие характеристические кривые (ROC-кривые), как правило, рассчитывают при построении зависимости значения переменной от ее относительной частоты в "нормальной" (т.е. клинически здоровые субъекты) и "больной" (т.е. пациенты страдают от диабета, резистентности к инсулину и/или метаболического синдрома) популяциях. Для любого конкретного маркера распределение уровней маркера для здоровых и больных субъектов, вероятно, будет перекрываться. В указанных условиях тест не обеспечивает абсолютное различие между здоровыми и больными субъектами со 100% точностью, при этом площадь перекрывания указывает, где результаты теста для здоровых и больных субъектов не различаются. Затем выбирают пороговый уровень, выше которого (или ниже которого, в зависимости от того, как изменяется уровень маркера при заболевании) результаты теста считаются аномальными, а ниже которого результаты теста считаются нормальными. Площадь под ROC-кривой является мерой вероятности, с которой полученный результат измерения обеспечивает корректную идентификацию состояния. ROC-кривые можно использовать, даже если результаты теста необязательно представляют точное число. Если можно оценивать результаты, можно строить ROC-кривую. Например, результаты теста на вероятность "заболевания" в образцах можно оценивать по степени вероятности заболевания (например, 1 обозначает низкую вероятность, 2 обозначает нормальную вероятность, а 3 обозначает высокую вероятность заболевания). Указанную оценку можно коррелировать с результатами оценки для "нормальной" популяции и получить ROC-кривую. Указанные способы широко известны в данной области техники (см., например, статью Hanley и др., Radiology, 143, сс. 29-36 (1982)). Предпочтительно, пороговый уровень выбирают таким образом, чтобы получить площадь под ROC-кривой, равную приблизительно более 0,5, более предпочтительно приблизительно более 0,7, еще более предпочтительно приблизительно более 0,8, и еще более предпочтительно приблизительно более 0,85, а наиболее предпочтительно приблизительно более 0,9. В данном контексте термин "приблизительно" обозначает отклонение+1-5% от данной величины.
Горизонтальная ось ROC-кривой представляет (специфичность 1), которая повышается при увеличении доли ложно-положительных результатов. Вертикальная ось кривой представляет чувствительность, которая повышается при увеличении доли истинно-положительных результатов. Таким образом, для выбранного конкретного уровня отсечения можно определить значение (специфичности 1) и получить соответствующее значение чувствительности. Площадь под ROC-кривой является мерой вероятности, с которой измеренный уровень маркера позволяет корректно идентифицировать заболевание или состояние (например, прогнозирование). Таким образом, площадь под ROC-кривой можно использовать для определения эффективности теста.
В некоторых вариантах маркеры и/или панели маркеров выбирают таким образом, чтобы обеспечить чувствительность, по крайней мере, на уровне приблизительно 70%, более предпочтительно чувствительность, по крайней мере, на уровне приблизительно 80%, еще более предпочтительно чувствительность, по крайней мере, на уровне приблизительно 85% и еще более предпочтительно чувствительность, по крайней мере, на уровне приблизительно 90%, а наиболее предпочтительно чувствительность, по крайней мере, на уровне приблизительно 95% и при этом обеспечить специфичность, по крайней мере, на уровне приблизительно 70%, более предпочтительно специфичность, по крайней мере, на уровне приблизительно 80%, еще более предпочтительно специфичность, по крайней мере, на уровне приблизительно 85% и еще более предпочтительно специфичность, по крайней мере, на уровне приблизительно 90%, а наиболее предпочтительно специфичность, по крайней мере, на уровне приблизительно 95%. Прежде всего, в предпочтительных вариантах оба параметра, чувствительность и специфичность, составляют, по крайней мере, приблизительно 75%, более предпочтительно, по крайней мере, приблизительно 80%, еще более предпочтительно, по крайней мере, приблизительно 85% и еще более предпочтительно, по крайней мере, приблизительно 90%, а наиболее предпочтительно, по крайней мере, приблизительно 95%. В данном контексте термин "приблизительно" обозначает отклонение +/-5% от данной величины.
Пороговые уровни можно определить, например, методом анализа Каплана-Мейера, где наличие заболевания или вероятность нежелательного явления и/или летального исхода коррелируют, например, с квинтилями соответствующего маркера в популяции. Согласно указанному методу анализа, субъекты, у которых уровни маркера превышают 80-ый квинтиль, характеризуются значительно повышенным риском развития нежелательного явления по настоящему изобретению. Указанный результат, кроме того, подтверждают методом анализа с использованием регрессионной модели Кокса с учетом классических факторов риска. Наивысший квартиль по сравнению с другими субъектами в наибольшей степени ассоциирован с повышенным риском развития заболевания или с вероятностью нежелательного явления и/или летального исхода по настоящему изобретению.
Другими предпочтительными значениями отсечения являются, например, 90-ый, 95-ый или 99-ый перцентили эталонной популяции. При использовании перцентиля выше 80-го перцентиля уменьшается число субъектов с ложно-положительными результатами, однако при этом можно не идентифицировать субъектов, которые находятся в группе среднего, хотя все еще повышенного риска. В связи с этим, необходимо подбирать значение отсечения в зависимости от требуемой цели: если требуется идентифицировать большинство субъектов с риском, при этом допуская также возможность получения ложно-положительных результатов, или если требуется идентифицировать главным образом субъектов с высоким риском, допуская, что при этом не будут идентифицированы некоторые субъекты со средним риском.
Другие математические возможности расчета индивидуальных рисков с использованием индивидуальных уровней маркера, а также другие прогностические лабораторные и клинические параметры включают, например, остаточный индекс реклассификации (NRI) или интегрированный индекс дискриминации (IDI). Индексы можно рассчитать, как описано в статье Pencina M.J. и др., «Evaluating the added predictive ability of a new marker: from area under the ROC curve to reclassification and beyond», Stat. Med., 27, cc. 157-172 (2008).
Предпочтительные способы идентификации включают иммунохимические методы анализа в различных форматах, такие как, например, радиоиммуноанализ (РИА), хемилюминесцентный и флуоресцентный иммуноанализы, иммуноферментный анализ (ИФА), анализ с использованием наборов на основе гранул Luminex, анализы с использованием белковых микроматриц, а также форматы экспресс-анализов, такие как, например, иммунохроматографические тест-методики (с использованием индикаторных полосок).
Можно проводить гомогенные или гетерогенные, конкурентные и не конкурентные анализы. Прежде всего, в предпочтительном варианте проводят сэндвич-анализ, который представляет собой не конкурентный иммуноанализ, где молекула, которую необходимо детектировать и/или количественно определить, связывается с первым антителом и со вторым антителом. Первое антитело может быть связано с твердой фазой, например, с гранулой, с поверхностью лунки или другого контейнера, с чипом или полоской, а вторым антителом является антитело, которое содержит метку, например, краситель, радиоизотоп или реакционноспособный или каталитический активный фрагмент. Затем количество меченного антитела, связанного с анализируемым соединением, измеряют соответствующим способом. Основной состав и методики, используемые в "сэндвич-анализах" общепризнаны и известны специалисту в данной области техники ("The Immunoassay Handbook", ред. David Wild, Elsevier LTD, Оксфорд, 3е изд. (май 2005), ISBN-13: 978-0080445267, Hultschig С. и др., Curr. Opin. Chem. Biol., 10, 1, сс. 4-10 (февраль 2006), PMID: 16376134, содержание указанных статей включено в настоящее описание в качестве ссылок).
Прежде всего, в предпочтительном варианте в анализе используют два связывающих вещества, предпочтительно антитела, которые оба присутствуют в виде дисперсий в жидкой реакционной смеси, при этом первый компонент для введения метки присоединен к первому антителу, и указанный первый компонент для введения метки является частью системы для введения метки на основе флуоресцентного или хемилюминесцентного тушения или амплификации, а второй компонент для введения метки указанной системы маркирования присоединен ко второму связывающему веществу, таким образом, при связывании обоих связывающих веществ с анализируемым соединением генерируется измеряемый сигнал, который позволяет регистрировать образовавшиеся сэндвич-комплексы в растворе, содержащем образец.
Еще более предпочтительно указанная система для введения метки включает криптаты редкоземельных металлов или хелаты редкоземельных металлов в комбинации с флуоресцентным красителем или хемилюминесцентным красителем, прежде всего, с красителем цианинового типа.
В контексте настоящего изобретения флуоресцентной анализ включает применение красителей, которые, например, можно выбрать из группы, включающей FAM (5-или 6-карбокстифлуоресцеин), VIC, NED, флуоресцеин, флуоресцеинизотиоционат (FITC), IRD-700/800, цианиновые красители, такие как CY3, CY5, CY3.5, CY5.5, Су7, ксантен (Xanthen), 6-карбокси-2',4',7',4,7-гексахлорфлуоресцеин (HEX), ТЕТ, 6-карбокси-4',5'-дихлор-2',7'-диметоксифлуоресцеин (JOE), N,N,N',N'-тетраметил-6-карбоксиродамин (TAMRA), 6-карбокси-Х-родамин (ROX), 5-карбоксиродамин-6G (R6G5), 6-карбоксиродамин-6G (RG6), родамин, родамин зеленый, родамин красный, родамин 110, красители BODIPY, такие как BODIPY TMR, Орегон зеленый (Oregon Green), кумарины, такие как умбеллиферон, бензимиды, такие как Hoechst 33258, фенантридины, такие как Texas Red, Yakima Yellow, Alexa Fluor, PET, бромид этидич, акридиновые красители, карбазоловые красители, феноксазиновые красители, порфириновые красители, полиметиновые красители и т.п.
В контексте настоящего изобретения хемилюминесцентные анализы включают применение красителей и основаны на физических принципах, описанных для хемилюминесцентных материалов в книге Kirk-Othmer, "Encyclopedia of chemical technology", 4oe изд., вып. ред. Kroschwitz J.I., ред. Howe-Grant M., John Wiley & Sons, т. 15, сс. 518-562 (1993), содержание которой включено в настоящее описание в качестве ссылки, включая цитаты, приведенные на сс.551-562. Предпочтительными хемилюминесцентными красителями являются акридиновые сложные эфиры.
Как указано в данном контексте, термин "анализ" или "диагностический анализ" может относиться к анализу любого типа, используемому в данной области диагностики. Такой анализ может основываться на связывании анализируемого соединения, которое необходимо детектировать, с одним или более связывающих зондов с определенной аффинностью. Что касается взаимодействия между связывающими веществами и веществами-мишенями или анализируемыми веществами, то константа аффинности предпочтительно составляет более 108 М-1.
В контексте настоящего изобретения к "связывающим веществам " относятся вещества, которые можно использовать для связывания веществ-мишеней или анализируемых веществ, т.е. анализируемых соединений (т.е. в контексте настоящего изобретения ПКТ и его фрагменты) в образце. Связывающие вещества должны характеризоваться соответствующей формой, как пространственной формой, так и поверхностными характеристиками, такими как поверхностный заряд, гидрофобность, гидрофильность, присутствие или отсутствие оснований и/или кислот Льюиса, чтобы специфично связываться с веществами-мишенями или анализируемыми веществами. Таким образом, связывание может быть опосредовано, например, ионными, ван-дер-ваальсовыми, π-π, σ-π, гидрофобными или водородными взаимодействиями или комбинацией двух или более упомянутых выше взаимодействий между связывающими веществами и веществами-мишенями или анализируемыми веществами. В контексте настоящего изобретения связывающие вещества можно, например, выбрать из группы, включающей нуклеиновую кислоту, углевод, пептиднуклеиновую кислоту, белок, антитело, пептид или гликопротеин. Предпочтительно, связывающими веществами являются антитела, включая их фрагменты, характеризующиеся достаточной аффинностью к веществу-мишени или к анализируемому веществу, и включая рекомбинантные антитела или фрагменты рекомбинантных антител, а также химически и/или биохимически модифицированные производные указанных антител или их фрагментов, полученные из их вариантов с длиной цепи, составляющей, по крайней мере, 12 аминокислотных остатков.
В предпочтительно варианте осуществления настоящего изобретения ПКТ или его фрагменты с длиной цепи, составляющей, по крайней мере, 12 аминокислотных остатков, используют в качестве показания для лечения антибиотиком пациентам с диагнозом стабильной хронической сердечной недостаточности или пациентам с предполагаемым диагнозом стабильной хронической сердечной недостаточности, включенных в группу повышенного риска развития нежелательного явления.
Еще более предпочтительно антибиотик вводят, когда уровень ПКТ или его фрагментов с длиной цепи, составляющей, по крайней мере, 12 аминокислотных остатков, в образце жидкости организма пациента с диагнозом стабильной хронической сердечной недостаточности или с предполагаемым диагнозом стабильной хронической сердечной недостаточности составляет от 0,015 нг/мл до 0,05 нг/мл, более предпочтительно от 0,015 нг/мл до 0,035 нг/мл, еще более предпочтительно от 0,015 нг/мл до 0,03 нг/мл и еще более предпочтительно от 0,015 нг/мл до 0,025 нг/мл, наиболее предпочтительно от 0,02 нг/мл до 0,015 нг/мл (ниже).
Еще более предпочтительно антибиотик вводят, когда уровень ПКТ или его фрагментов с длиной цепи, составляющей, по крайней мере, 12 аминокислотных остатков, в образце жидкости организма пациента с диагнозом стабильной хронической сердечной недостаточности или с предполагаемым диагнозом стабильной хронической сердечной недостаточности составляет выше 0,05 нг/мл, предпочтительно выше 0,035 нг/мл, более предпочтительно выше 0,03 нг/мл, еще более предпочтительно выше 0,025 нг/мл и еще более предпочтительно выше 0,02 нг/мл, наиболее предпочтительно выше 0,015 нг/мл.
Примеры
Пример 1
Исследования популяции и методики
Пациентами, включенными в исследование, являлись пациенты, отобранные врачами-специалистами для участия в муниципальной программе CHF в городах Kingston-upon-Hull и East Riding в Йоркшире (Великобритания), которую осуществляли при участии популяции численностью 600000 человек в период август 2001 - июнь 2009. Пациентов с предполагаемым диагнозом стабильной хронической сердечной недостаточности направляли из местного учреждения в специализированную клинику для диагностики и лечения предполагаемой стабильной хронической сердечной недостаточности, а также предлагали принять участие в программе. Пациенты, давшие согласие, проходили систематическое обследование, которое включало изучение предшествующей амбулаторной карты пациента, медикаментозного лечения, симптомов, признаков, электро- и эхокардиограмм, стандартных гематологических и биохимических анализов, а также определение уровней ПКТ и N-концевого предшественника натрийуретического пептида головного мозга (NT-proBNP).
Результаты
Средний возраст 1891 пациентов, принимавших участие в исследовании, составлял 72 года (интерквартильный диапазон (ИКД) составлял от 64 до 78), участвовали 669 женщин, у 807 пациентов был поставлен диагноз систолической дисфункции левого желудочка (СДЛЖ), у 400 пациентов не наблюдалось значительных отклонений на эхокардиограмме за исключением СДЛЖ, у 192 пациентов не наблюдалось значительных отклонений на эхокардиограмме, однако уровень NT-proBNP составлял >400 нг/л (среди указанных пациентов у 65 наблюдалась мерцательная аритмия, а у 15 расчетная скорость клубочковой фильтрации (eGFR) составляла <30 мл/мин), при этом у 492 пациентов отсутствовали перечисленные выше патологические отклонения. Средний общий уровень ПКТ (в скобках указан интерквартильный диапазон (ИКД)) составлял 0,022 (0,017-0,047) нг/мл и для каждой из четырех подгрупп составлял 0,023 (0,018-0,032), 0,022 (0,017-0,031), 0,024 (0,019-0,035) и 0,020 (0,016-0,025) нг/мл, соответственно. На протяжении в среднем 5,0 (ИКД: 3,4-7,1) последующих лет 783 (41,8%) пациентов скончались, а 447 пациентов в результате сердечно-сосудистых заболеваний. При проведении инвариантного анализа логарифм концентрации ПКТ (log (ПКТ)) в значительной степени коррелировал с общей смертностью, смертностью от сердечно-сосудистых заболеваний и смертностью по другим причинам (соотношение рисков (CP): 1,91 при 95% доверительном интервале (ДИ): (1,73-2,11), CP: 1,94 (1,71-2,21) и CP: 1,89 (1,61-2,22) соответственно, р<0,001 для всех случаев). Значения CP для общей смертности, полученные по квинтилям ПКТ по данным инвариантного анализа с использованием регрессионной модели Кокса (нескорректированные и скорректированные с учетом возраста и пола), представлены в табл.3. В многовариантной регрессионной модели Кокса уровни ПКТ обеспечивали дополнительную прогностическую информацию для 17 стандартных клинических переменных (возраст, пол, этиология, диабет, хроническое обструктивное заболевание легких (ХОЗЛ), симптомы, качество жизни, классификация NYHA, индекс массы тела, частота сердечных сокращений и ритм сердца, систолическое кровяное давление, отек, степень тяжести дисфункции желудочка, уровни гемоглобина (НЬ) и креатинина, а также NT-proBNP) для общей смертности.
Пример 2
Исследования популяции и методики
Кроме пациентов, включенных в исследование, описанное в примере 1, в исследование включали еще 651 дополнительных пациентов с предполагаемым диагнозом стабильной хронической сердечной недостаточности. В этом случае также указанные пациенты, подписавшие согласие для участия в исследовании, проходили систематическое обследование, включающее изучение предшествующей амбулаторной карты пациента, медикаментозного лечения, симптомов, признаков, электро- и эхокардиограмм, стандартных гематологических и биохимических анализов, а также определение уровней ПКТ и NT-proBN.
Результаты
Из 2542 пациентов, включенных в исследование в целом, у 1100 был поставлен диагноз СДЛЖ. Из общего числа 1442 пациентов без диагноза СДЛЖ у 415 (n=415) пациентов был установлен диагноз обширного структурного заболевания сердца (ОСЗС). Состояние пациентов оценивали с использованием квартилей ПКТ в плазме (табл. 4), а также верхнего и нижнего дециля, чтобы продемонстрировать влияние предельных значений. Переменные представляли в виде процентов или среднего и интерквартильного диапазона (ИКД). Для идентификации независимых переменных, связанных с методом обратного преобразования ПКТ (табл. 5), использовали модели простой и множественной линейной регрессии. Прогностические факторы для общей смертности (включая или не включая ПКТ) представлены в табл. 6. Данные для пациентов, у которых были зарегистрированы явления, т.е. CP для наивысшего и наименьшего квартиля ПКТ и С-статистика приведены в табл. 7. Для сравнения вероятностей выживания в связи с конкретными исходами (общая смертность, смертность от сердечно-сосудистых заболеваний) в соответствии с фенотипами (пациенты с диагнозом СДЛЖ, ОСЗС, без диагноза ОСЗС, но с диагнозом мерцательная аритмия или с уровнем NT-proBNP>400 нг/л, а также пациенты с синусным ритмом и с уровнем NT-proBNP<400 нг/л, соответственно) использовали кривые выживаемости Каплана-Мейера (фиг. 2-9).
В этом случае также уровень ПСК строго коррелировал с общей смертностью и смертностью от сердечно-сосудистых заболеваний (нескорректированные значения CP: 3,46 при 95% ДИ: (2,63-4,56) и CP: 3,72 (2,58-5,35), соответственно, р<0,001 для обоих случаев). По данным многовариантного анализа более высокие концентрации ПКТ в плазме связаны с ухудшением функции почек, более пожилым возрастом, ишемической болезнью сердца, а также с маркерами более тяжелой сердечной недостаточности, но не с другими маркерами инфекции или воспаления, такими как высокочувствительный С-реактивный белок (hsCRP) или число лейкоцитов. Среди пациентов с диагнозом СДЛЖ, уровень ПКТ позволял предсказать общую смертность и смертность от сердечно-сосудистых заболеваний, прежде всего смертность из-за сердечной недостаточности, независимо от других прогностических маркеров, включая NT-proBNP. Уровень ПКТ также позволял предсказать смертность пациентов без диагноза СДЛЖ, включая пациентов, у которых диагноз сердечной недостаточности был отменен, но летальный исход, по-видимому, был главным образом не связан с сердечно-сосудистым заболеванием.
Последовательности
SEQ ID NO: 1 (аминокислотная последовательность ПКТ):
1 APFRSALESS PADPATLSED EARLLLAALV QDYVQMKASE LEQEQEREGS
51 SLDSPRSKRC GNLSTCMLGT YTQDFNKFHT FPQTAIGVGA PGKKRDMSSD
101 LERDHRPHVS MPQNAN
SEQ ID NO: 2 (аминокислотная последовательность NT-pro-BNP):
1 HPLGSPGSAS DLETSGLQEQ RNHLQGKLSE LQVEQTSLEP LQESPRPTGV
51 WKSREVATEG IRGHRKMVLY TLRAPR
SEQ ID NO: 3 (аминокислотная последовательность BNP):
1 SPKMVQGSGC FGRKMDRISS SSGLGCKVLR RH
Claims (14)
1. Способ прогнозирования риска развития нежелательного явления у пациента с диагнозом стабильной хронической сердечной недостаточности или с предполагаемым диагнозом стабильной хронической сердечной недостаточности, где нежелательное явление выбрано из группы, состоящей из ухудшения или декомпенсации сердечной недостаточности, цереброваскулярного явления, кардиоваскулярного явления или смерти, причем указанный способ включает следующие стадии:
- определение уровня прокальцитонина или его фрагментов с длиной цепи, составляющей по меньшей мере 12 аминокислотных остатков, в образце жидкости организма указанного пациента,
- корреляция указанного уровня прокальцитонина или его фрагментов с риском развития нежелательного явления у указанного пациента, причем указанная стадия корреляции включает сравнение указанного уровня прокальцитонина или его фрагментов с пороговым уровнем, при этом, если указанный уровень прокальцитонина или его фрагментов превышает указанный уровень, у указанного пациента существует повышенный риск развития нежелательного явления, при этом значение указанного порогового уровня находится в диапазоне между 0,015 нг/мл и 0,03 нг/мл.
2. Способ по любому из предыдущих пунктов, где у указанного пациента не поставлен диагноз острой или декомпенсационной сердечной недостаточности.
3. Способ по пп. 1 и 2, где прогнозирование относится к прогнозированию развития нежелательного явления в течение 7 лет, более предпочтительно в течение 5 лет, еще более предпочтительно в течение 4 лет, наиболее предпочтительно в течение 2 лет.
4. Способ по любому из предыдущих пунктов, где указанный образец выбирают из группы, включающей образец крови, образец сыворотки и образец плазмы.
5. Способ по любому из предыдущих пунктов, дополнительно включающий корреляцию указанного уровня прокальцитонина или его фрагментов с уровнем одного или более дополнительного прогностического маркера(ов), при этом комбинирование указанного уровня прокальцитонина или его фрагментов с указанным уровнем дополнительного прогностического маркера(ов) повышает прогностическую значимость указанного уровня прокальцитонина или его фрагментов или уровня указанного родственного маркера(ов) при оценке вероятности развития нежелательного явления.
6. Способ по п. 5, где дополнительный прогностический маркер выбирают из группы, включающей тропонин, миелопероксидазу, С-реактивный белок, неоптерин, GDF-15, ST2, цистатин-С, гемоглобин и креатинин, а также следующие пептиды в их зрелой форме, в форме их предшественников, прогормонов и ассоциированных фрагментов прогормонов: натрийуретические пептиды, адреномедуллин, эндотелины, вазопрессин.
7. Способ по п. 5, где одним из указанных прогностических маркеров является pre-proBNP или его фрагменты в образце, полученном от указанного пациента.
8. Способ по любому из предыдущих пунктов, дополнительно включающий корреляцию одной или более клинических переменных, выбранных из группы, включающей возраст, пол, диабет, ХОЗЛ, симптомы, качество жизни, квалификацию NYHA, индекс массы тела, частоту сердечных сокращений и ритм сердца, систолическое и диастолическое кровяное давление, одышку и тяжелую степень дисфункции желудочка.
9. Способ по любому из предыдущих пунктов, где используют анализ прокальцитонина, характеризующийся нижним пределом детектирования менее 0,05 нг/мл.
10. Применение прокальцитонина для прогнозирования риска развития нежелательного явления у пациента с диагнозом стабильной хронической сердечной недостаточности или с предполагаемым диагнозом стабильной хронической сердечной недостаточности, где нежелательное явление выбрано из группы, состоящей из ухудшения или декомпенсации сердечной недостаточности, цереброваскулярного явления, кардиоваскулярного явления или смерти, включающее следующие стадии:
- определение уровня прокальцитонина или его фрагментов с длиной цепи, составляющей по меньшей мере 12 аминокислотных остатков, в образце жидкости организма указанного пациента,
- корреляция указанного уровня прокальцитонина или его фрагментов с риском развития нежелательного явления у указанного пациента, причем указанная стадия корреляции включает сравнение указанного уровня прокальцитонина или его фрагментов с пороговым уровнем, при этом, если указанный уровень прокальцитонина или его фрагментов превышает указанный уровень, у указанного пациента существует повышенный риск развития нежелательного явления, при этом значение указанного порогового уровня находится в диапазоне между 0,015 нг/мл и 0,03 нг/мл.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP12163921 | 2012-04-12 | ||
| EP12163921.5 | 2012-04-12 | ||
| PCT/EP2013/057626 WO2013153177A1 (en) | 2012-04-12 | 2013-04-11 | Prognosis of adverse events in patients with suspected chronic heart failure |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2014145259A RU2014145259A (ru) | 2016-06-10 |
| RU2672561C2 true RU2672561C2 (ru) | 2018-11-16 |
Family
ID=48050768
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2014145259A RU2672561C2 (ru) | 2012-04-12 | 2013-04-11 | Прогнозирование нежелательных явлений у пациентов с предполагаемым диагнозом хронической сердечной недостаточности |
Country Status (9)
| Country | Link |
|---|---|
| US (3) | US9488659B2 (ru) |
| EP (1) | EP2836841B1 (ru) |
| JP (1) | JP5945063B2 (ru) |
| CN (1) | CN104303061B (ru) |
| BR (1) | BR112014025189B1 (ru) |
| HK (1) | HK1203611A1 (ru) |
| IN (1) | IN2014MN02101A (ru) |
| RU (1) | RU2672561C2 (ru) |
| WO (1) | WO2013153177A1 (ru) |
Families Citing this family (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| BR112014025189B1 (pt) * | 2012-04-12 | 2020-04-07 | Brahms Gmbh | métodos de predizer o risco de adquirir um evento adverso e de orientação de tratamento com antibióticos em um paciente com insuficiência cardíaca crônica estável |
| EP2990800A1 (en) * | 2014-08-29 | 2016-03-02 | Fundació Institut d'Investigació en Ciències de la Salut Germans Trias i Pujol | Neprilysin as heartfailure (HF) prognostic marker |
| CA3012985A1 (en) | 2015-01-27 | 2016-08-04 | Kardiatonos, Inc. | Biomarkers of vascular disease |
| US10368774B2 (en) | 2015-07-30 | 2019-08-06 | Medtronic, Inc. | Absolute intrathoracic impedance based scheme to stratify patients for risk of a heart failure event |
| CN105929152B (zh) * | 2016-07-15 | 2018-06-26 | 安徽国科生物科技有限公司 | 一种用于降钙素原检测的智能检测仪 |
| JP7438757B2 (ja) * | 2017-02-06 | 2024-02-27 | バイオテンプト・ベー・フェー | 治療用途のためのヒトcペプチドとヒトエラスチン受容体との相互作用のペプチドモジュレーター |
| CN108931658A (zh) * | 2018-04-16 | 2018-12-04 | 上海交通大学医学院附属瑞金医院 | 用于诊断心力衰竭合并症及预后评估的血清标记物 |
| US12001939B2 (en) | 2018-12-11 | 2024-06-04 | Eko.Ai Pte. Ltd. | Artificial intelligence (AI)-based guidance for an ultrasound device to improve capture of echo image views |
| US11931207B2 (en) | 2018-12-11 | 2024-03-19 | Eko.Ai Pte. Ltd. | Artificial intelligence (AI) recognition of echocardiogram images to enhance a mobile ultrasound device |
| US11446009B2 (en) | 2018-12-11 | 2022-09-20 | Eko.Ai Pte. Ltd. | Clinical workflow to diagnose heart disease based on cardiac biomarker measurements and AI recognition of 2D and doppler modality echocardiogram images |
| RU2766252C1 (ru) * | 2021-04-13 | 2022-02-10 | федеральное государственное бюджетное образовательное учреждение высшего образования "Ульяновский государственный университет" | Способ прогнозирования риска смерти у больных с хронической сердечной недостаточностью с использованием эндогенного эритропоэтина сыворотки крови |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2357250C1 (ru) * | 2007-12-10 | 2009-05-27 | Федеральное государственное учреждение "Федеральный центр сердца, крови и эндокринологии имени В.А. Алмазова Федерального агентства по высокотехнологичной медицинской помощи" | Способ прогнозирования течения хронической сердечной недостаточности |
| WO2009112307A1 (en) * | 2008-03-12 | 2009-09-17 | Brahms Aktiengesellschaft | Use of procalcitonin (pct) in prognosis following acute coronary syndromes |
| WO2010118855A1 (en) * | 2009-04-14 | 2010-10-21 | B.R.A.H.M.S Ag | Risk assessment for antibiotics treatment in patients suffering from primary non-infectious disease by determining the level of procalcitonin |
Family Cites Families (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4281061A (en) * | 1979-07-27 | 1981-07-28 | Syva Company | Double antibody for enhanced sensitivity in immunoassay |
| DE19847690A1 (de) * | 1998-10-15 | 2000-04-20 | Brahms Diagnostica Gmbh | Verfahren und Substanzen für die Diagnose und Therapie von Sepsis und sepsisähnlichen systemischen Infektionen |
| DE102006046996A1 (de) * | 2006-10-01 | 2008-04-03 | Brahms Aktiengesellschaft | Diagnose von Infektionen oder Entzündungserkrankungen der Atemwege und Lunge assoziiert mit Herzinsuffizienz |
| CN101029897A (zh) * | 2007-02-09 | 2007-09-05 | 深圳市新产业生物医学工程有限公司 | 一种降钙素原测试试剂盒及其测试方法 |
| DE102007009751A1 (de) * | 2007-02-28 | 2008-09-04 | B.R.A.H.M.S Aktiengesellschaft | Verfahren zur selektiven Bestimmung von Procalcitonin 1-116 für diagnostische Zwecke sowie Antikörper und Kits zur Durchführung eines solchen Verfahrens |
| EP2293076B1 (en) * | 2007-08-03 | 2012-12-19 | B.R.A.H.M.S GmbH | Use of procalcitonin (PCT) in risk stratification and prognosis of patients with a primary, non-infectious disease |
| EP2284540A1 (en) * | 2009-07-31 | 2011-02-16 | BIOCRATES Life Sciences AG | Method of diagnosing organ failure |
| CN201886025U (zh) * | 2010-12-10 | 2011-06-29 | 四川迈克生物科技股份有限公司 | 一种快速定量检测降钙素原免疫层析试纸条 |
| BR112014025189B1 (pt) * | 2012-04-12 | 2020-04-07 | Brahms Gmbh | métodos de predizer o risco de adquirir um evento adverso e de orientação de tratamento com antibióticos em um paciente com insuficiência cardíaca crônica estável |
-
2013
- 2013-04-11 BR BR112014025189A patent/BR112014025189B1/pt active IP Right Grant
- 2013-04-11 CN CN201380019816.2A patent/CN104303061B/zh active Active
- 2013-04-11 EP EP13714980.3A patent/EP2836841B1/en active Active
- 2013-04-11 US US14/391,953 patent/US9488659B2/en active Active
- 2013-04-11 RU RU2014145259A patent/RU2672561C2/ru active
- 2013-04-11 JP JP2015504958A patent/JP5945063B2/ja active Active
- 2013-04-11 WO PCT/EP2013/057626 patent/WO2013153177A1/en active Application Filing
- 2013-04-11 IN IN2101MUN2014 patent/IN2014MN02101A/en unknown
-
2015
- 2015-04-21 HK HK15103849.0A patent/HK1203611A1/xx unknown
-
2016
- 2016-07-15 US US15/211,802 patent/US9753039B2/en active Active
-
2017
- 2017-09-01 US US15/693,880 patent/US20170370940A1/en not_active Abandoned
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2357250C1 (ru) * | 2007-12-10 | 2009-05-27 | Федеральное государственное учреждение "Федеральный центр сердца, крови и эндокринологии имени В.А. Алмазова Федерального агентства по высокотехнологичной медицинской помощи" | Способ прогнозирования течения хронической сердечной недостаточности |
| WO2009112307A1 (en) * | 2008-03-12 | 2009-09-17 | Brahms Aktiengesellschaft | Use of procalcitonin (pct) in prognosis following acute coronary syndromes |
| WO2010118855A1 (en) * | 2009-04-14 | 2010-10-21 | B.R.A.H.M.S Ag | Risk assessment for antibiotics treatment in patients suffering from primary non-infectious disease by determining the level of procalcitonin |
Also Published As
| Publication number | Publication date |
|---|---|
| US20160320411A1 (en) | 2016-11-03 |
| US20170370940A1 (en) | 2017-12-28 |
| US9488659B2 (en) | 2016-11-08 |
| BR112014025189B1 (pt) | 2020-04-07 |
| US20150079696A1 (en) | 2015-03-19 |
| EP2836841A1 (en) | 2015-02-18 |
| CN104303061A (zh) | 2015-01-21 |
| US9753039B2 (en) | 2017-09-05 |
| IN2014MN02101A (ru) | 2015-08-28 |
| WO2013153177A1 (en) | 2013-10-17 |
| BR112014025189A2 (pt) | 2017-07-11 |
| JP5945063B2 (ja) | 2016-07-05 |
| RU2014145259A (ru) | 2016-06-10 |
| CN104303061B (zh) | 2017-05-31 |
| HK1203611A1 (en) | 2015-10-30 |
| JP2015515630A (ja) | 2015-05-28 |
| EP2836841B1 (en) | 2022-01-05 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2672561C2 (ru) | Прогнозирование нежелательных явлений у пациентов с предполагаемым диагнозом хронической сердечной недостаточности | |
| JP5584695B2 (ja) | Adm及びbnpのレベルを決定することによる心疾患に罹患した患者の予後診断及びリスク評価 | |
| CN108120837B (zh) | 阵发性心房纤颤的基于TnT的诊断 | |
| US20170322225A1 (en) | Biomarkers and methods of prediction | |
| US11686736B2 (en) | Biomarkers to improve prediction of heart failure risk | |
| JP5827229B2 (ja) | 有害事象の予後診断のためのプロカルシトニン | |
| US20230030564A1 (en) | Sepsis management | |
| EP2939028B1 (en) | Use of scd14 or its fragments or derivatives for risk stratisfaction, diagnosis and prognosis | |
| US20150247871A1 (en) | Risk assessment for antibiotics treatment in patients suffering from primary non-infectious disease by determining the level of procalcitonin | |
| KR102112945B1 (ko) | 일반 집단에서 lvh 로의 진행자 확인을 위한 가용성 st2 | |
| US20110207629A1 (en) | Predicting cardiovascular events and renal failure in type 1 diabetics | |
| US20220229075A1 (en) | IGFBP7 RATIO FOR HFpEF | |
| WO2009150253A1 (en) | Assessment of complications of patients with type 1 diabetes | |
| WO2010018123A1 (en) | Retinol binding protein 4 as a marker of peripheral insulin resistance in type 1 diabetes |