RU2625787C2 - Ингибиторы вируса гепатита с, имеющие жесткую вытянутую цепь и содержащие фрагмент { 2-[4-(бифенил-4-ил)-1н-имидазо-2-ил]пирролидин-1-карбонилметил} амина - Google Patents
Ингибиторы вируса гепатита с, имеющие жесткую вытянутую цепь и содержащие фрагмент { 2-[4-(бифенил-4-ил)-1н-имидазо-2-ил]пирролидин-1-карбонилметил} амина Download PDFInfo
- Publication number
- RU2625787C2 RU2625787C2 RU2014122340A RU2014122340A RU2625787C2 RU 2625787 C2 RU2625787 C2 RU 2625787C2 RU 2014122340 A RU2014122340 A RU 2014122340A RU 2014122340 A RU2014122340 A RU 2014122340A RU 2625787 C2 RU2625787 C2 RU 2625787C2
- Authority
- RU
- Russia
- Prior art keywords
- mmol
- alkyl
- compound
- concentrated
- methyl
- Prior art date
Links
- 241000711549 Hepacivirus C Species 0.000 title claims abstract description 55
- 239000003112 inhibitor Substances 0.000 title description 25
- 150000001875 compounds Chemical class 0.000 claims abstract description 290
- 238000000034 method Methods 0.000 claims abstract description 76
- 125000004435 hydrogen atom Chemical group [H]* 0.000 claims abstract description 67
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 claims abstract description 43
- 150000003839 salts Chemical class 0.000 claims abstract description 41
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims abstract description 39
- 239000008194 pharmaceutical composition Substances 0.000 claims abstract description 38
- 238000011282 treatment Methods 0.000 claims abstract description 19
- 125000004429 atom Chemical group 0.000 claims abstract description 14
- 230000029812 viral genome replication Effects 0.000 claims abstract description 12
- 125000002883 imidazolyl group Chemical group 0.000 claims abstract description 11
- 230000002401 inhibitory effect Effects 0.000 claims abstract description 11
- 125000000956 methoxy group Chemical group [H]C([H])([H])O* 0.000 claims abstract description 11
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 claims abstract description 10
- 125000004029 hydroxymethyl group Chemical group [H]OC([H])([H])* 0.000 claims abstract description 9
- DHXVGJBLRPWPCS-UHFFFAOYSA-N Tetrahydropyran Chemical group C1CCOCC1 DHXVGJBLRPWPCS-UHFFFAOYSA-N 0.000 claims abstract description 6
- 208000036142 Viral infection Diseases 0.000 claims abstract 2
- 125000002887 hydroxy group Chemical group [H]O* 0.000 claims abstract 2
- 230000009385 viral infection Effects 0.000 claims abstract 2
- 125000000217 alkyl group Chemical group 0.000 claims description 182
- -1 2,2-dimethylcyclopropyl Chemical group 0.000 claims description 169
- 229910052757 nitrogen Inorganic materials 0.000 claims description 66
- 239000000460 chlorine Substances 0.000 claims description 37
- 125000006239 protecting group Chemical group 0.000 claims description 35
- 241000124008 Mammalia Species 0.000 claims description 33
- 239000007821 HATU Substances 0.000 claims description 30
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 claims description 25
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 claims description 18
- 208000010710 hepatitis C virus infection Diseases 0.000 claims description 17
- 239000003795 chemical substances by application Substances 0.000 claims description 16
- 229910052731 fluorine Inorganic materials 0.000 claims description 14
- 229910052801 chlorine Inorganic materials 0.000 claims description 13
- 239000003814 drug Substances 0.000 claims description 13
- 229910052739 hydrogen Inorganic materials 0.000 claims description 12
- 239000001257 hydrogen Substances 0.000 claims description 12
- 239000011737 fluorine Substances 0.000 claims description 11
- 239000003937 drug carrier Substances 0.000 claims description 10
- 150000001732 carboxylic acid derivatives Chemical class 0.000 claims description 9
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 claims description 8
- LMDZBCPBFSXMTL-UHFFFAOYSA-N 1-ethyl-3-(3-dimethylaminopropyl)carbodiimide Chemical compound CCN=C=NCCCN(C)C LMDZBCPBFSXMTL-UHFFFAOYSA-N 0.000 claims description 7
- FPIRBHDGWMWJEP-UHFFFAOYSA-N 1-hydroxy-7-azabenzotriazole Chemical compound C1=CN=C2N(O)N=NC2=C1 FPIRBHDGWMWJEP-UHFFFAOYSA-N 0.000 claims description 7
- 230000015572 biosynthetic process Effects 0.000 claims description 7
- 238000002360 preparation method Methods 0.000 claims description 7
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 claims description 6
- 229910052763 palladium Inorganic materials 0.000 claims description 4
- QOSSAOTZNIDXMA-UHFFFAOYSA-N Dicylcohexylcarbodiimide Chemical compound C1CCCCC1N=C=NC1CCCCC1 QOSSAOTZNIDXMA-UHFFFAOYSA-N 0.000 claims description 3
- 239000003054 catalyst Substances 0.000 claims description 3
- 125000005500 uronium group Chemical group 0.000 claims description 3
- 230000003993 interaction Effects 0.000 claims 1
- 239000000126 substance Substances 0.000 abstract description 16
- 230000000694 effects Effects 0.000 abstract description 14
- 125000001309 chloro group Chemical group Cl* 0.000 abstract description 4
- 125000001153 fluoro group Chemical group F* 0.000 abstract description 4
- 125000004169 (C1-C6) alkyl group Chemical group 0.000 abstract 2
- 150000002391 heterocyclic compounds Chemical class 0.000 abstract 2
- 125000000876 trifluoromethoxy group Chemical group FC(F)(F)O* 0.000 abstract 1
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 abstract 1
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 434
- 239000011541 reaction mixture Substances 0.000 description 197
- 235000019439 ethyl acetate Nutrition 0.000 description 186
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 175
- 239000000203 mixture Substances 0.000 description 171
- 239000000243 solution Substances 0.000 description 167
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 156
- 239000000543 intermediate Substances 0.000 description 148
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 131
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 120
- JGFZNNIVVJXRND-UHFFFAOYSA-N N,N-Diisopropylethylamine (DIPEA) Chemical compound CCN(C(C)C)C(C)C JGFZNNIVVJXRND-UHFFFAOYSA-N 0.000 description 114
- 239000007787 solid Substances 0.000 description 96
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 93
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 92
- 239000000047 product Substances 0.000 description 90
- KXDHJXZQYSOELW-UHFFFAOYSA-N carbonic acid monoamide Natural products NC(O)=O KXDHJXZQYSOELW-UHFFFAOYSA-N 0.000 description 76
- KJAMZCVTJDTESW-UHFFFAOYSA-N tiracizine Chemical compound C1CC2=CC=CC=C2N(C(=O)CN(C)C)C2=CC(NC(=O)OCC)=CC=C21 KJAMZCVTJDTESW-UHFFFAOYSA-N 0.000 description 73
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 69
- 239000012044 organic layer Substances 0.000 description 67
- 150000004702 methyl esters Chemical class 0.000 description 65
- 238000010898 silica gel chromatography Methods 0.000 description 58
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 55
- RTZKZFJDLAIYFH-UHFFFAOYSA-N ether Substances CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 54
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 50
- 229910052938 sodium sulfate Inorganic materials 0.000 description 50
- 235000011152 sodium sulphate Nutrition 0.000 description 50
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical compound O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 49
- 239000012267 brine Substances 0.000 description 48
- 239000003921 oil Substances 0.000 description 48
- 235000019198 oils Nutrition 0.000 description 47
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 46
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 45
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 45
- 125000000623 heterocyclic group Chemical group 0.000 description 42
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 40
- FXHOOIRPVKKKFG-UHFFFAOYSA-N N,N-Dimethylacetamide Chemical compound CN(C)C(C)=O FXHOOIRPVKKKFG-UHFFFAOYSA-N 0.000 description 36
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 36
- 239000000741 silica gel Substances 0.000 description 31
- 229910002027 silica gel Inorganic materials 0.000 description 31
- 125000005913 (C3-C6) cycloalkyl group Chemical group 0.000 description 30
- 238000004007 reversed phase HPLC Methods 0.000 description 30
- 125000005843 halogen group Chemical group 0.000 description 26
- 125000001072 heteroaryl group Chemical group 0.000 description 26
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 24
- 238000006243 chemical reaction Methods 0.000 description 24
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 24
- 239000011734 sodium Substances 0.000 description 23
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 22
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 21
- 125000003545 alkoxy group Chemical group 0.000 description 21
- 239000003208 petroleum Substances 0.000 description 19
- KZPYGQFFRCFCPP-UHFFFAOYSA-N 1,1'-bis(diphenylphosphino)ferrocene Chemical compound [Fe+2].C1=CC=C[C-]1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=C[C-]1P(C=1C=CC=CC=1)C1=CC=CC=C1 KZPYGQFFRCFCPP-UHFFFAOYSA-N 0.000 description 18
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 18
- IWUCXVSUMQZMFG-AFCXAGJDSA-N Ribavirin Chemical compound N1=C(C(=O)N)N=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 IWUCXVSUMQZMFG-AFCXAGJDSA-N 0.000 description 18
- 239000013543 active substance Substances 0.000 description 18
- 239000010410 layer Substances 0.000 description 18
- 229910000027 potassium carbonate Inorganic materials 0.000 description 18
- 238000000425 proton nuclear magnetic resonance spectrum Methods 0.000 description 18
- 125000001424 substituent group Chemical group 0.000 description 18
- DTQVDTLACAAQTR-UHFFFAOYSA-N trifluoroacetic acid Substances OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 18
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 17
- WMFOQBRAJBCJND-UHFFFAOYSA-M Lithium hydroxide Chemical compound [Li+].[OH-] WMFOQBRAJBCJND-UHFFFAOYSA-M 0.000 description 17
- ZADPBFCGQRWHPN-UHFFFAOYSA-N boronic acid Chemical compound OBO ZADPBFCGQRWHPN-UHFFFAOYSA-N 0.000 description 17
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical class [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 16
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 16
- SCVFZCLFOSHCOH-UHFFFAOYSA-M potassium acetate Chemical compound [K+].CC([O-])=O SCVFZCLFOSHCOH-UHFFFAOYSA-M 0.000 description 16
- 108010050904 Interferons Proteins 0.000 description 15
- 102000014150 Interferons Human genes 0.000 description 15
- 101800001014 Non-structural protein 5A Proteins 0.000 description 15
- 239000000843 powder Substances 0.000 description 15
- CSNNHWWHGAXBCP-UHFFFAOYSA-L Magnesium sulfate Chemical compound [Mg+2].[O-][S+2]([O-])([O-])[O-] CSNNHWWHGAXBCP-UHFFFAOYSA-L 0.000 description 14
- 239000002253 acid Substances 0.000 description 14
- 238000004440 column chromatography Methods 0.000 description 14
- 239000012043 crude product Substances 0.000 description 14
- 229960000329 ribavirin Drugs 0.000 description 14
- HZCAHMRRMINHDJ-DBRKOABJSA-N ribavirin Natural products O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1N=CN=C1 HZCAHMRRMINHDJ-DBRKOABJSA-N 0.000 description 14
- 238000012360 testing method Methods 0.000 description 14
- 238000004128 high performance liquid chromatography Methods 0.000 description 13
- 230000002829 reductive effect Effects 0.000 description 13
- 238000003756 stirring Methods 0.000 description 13
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 12
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Chemical compound BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 12
- 239000012299 nitrogen atmosphere Substances 0.000 description 12
- 239000002777 nucleoside Substances 0.000 description 12
- 150000003833 nucleoside derivatives Chemical class 0.000 description 12
- UKFTXWKNVSVVCJ-UHFFFAOYSA-N 2-[(6-hydrazinylpyridazin-3-yl)-(2-hydroxyethyl)amino]ethanol;hydron;dichloride Chemical class Cl.Cl.NNC1=CC=C(N(CCO)CCO)N=N1 UKFTXWKNVSVVCJ-UHFFFAOYSA-N 0.000 description 11
- 125000004800 4-bromophenyl group Chemical group [H]C1=C([H])C(*)=C([H])C([H])=C1Br 0.000 description 11
- 229910052794 bromium Inorganic materials 0.000 description 11
- 239000003153 chemical reaction reagent Substances 0.000 description 11
- AQEFLFZSWDEAIP-UHFFFAOYSA-N di-tert-butyl ether Chemical compound CC(C)(C)OC(C)(C)C AQEFLFZSWDEAIP-UHFFFAOYSA-N 0.000 description 11
- 239000000706 filtrate Substances 0.000 description 11
- USFZMSVCRYTOJT-UHFFFAOYSA-N Ammonium acetate Chemical compound N.CC(O)=O USFZMSVCRYTOJT-UHFFFAOYSA-N 0.000 description 10
- 239000005695 Ammonium acetate Substances 0.000 description 10
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 10
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 10
- 229940124771 HCV-NS3 protease inhibitor Drugs 0.000 description 10
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 10
- GLUUGHFHXGJENI-UHFFFAOYSA-N Piperazine Chemical compound C1CNCCN1 GLUUGHFHXGJENI-UHFFFAOYSA-N 0.000 description 10
- 235000019257 ammonium acetate Nutrition 0.000 description 10
- 229940043376 ammonium acetate Drugs 0.000 description 10
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 10
- NFHFRUOZVGFOOS-UHFFFAOYSA-N palladium;triphenylphosphane Chemical compound [Pd].C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 NFHFRUOZVGFOOS-UHFFFAOYSA-N 0.000 description 10
- 239000000546 pharmaceutical excipient Substances 0.000 description 10
- PCRRPOJDJXDSHT-ZETCQYMHSA-N (2s)-2-(methoxycarbonylamino)-2-(oxan-4-yl)acetic acid Chemical compound COC(=O)N[C@H](C(O)=O)C1CCOCC1 PCRRPOJDJXDSHT-ZETCQYMHSA-N 0.000 description 9
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 9
- 125000004105 2-pyridyl group Chemical group N1=C([*])C([H])=C([H])C([H])=C1[H] 0.000 description 9
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 9
- 238000004458 analytical method Methods 0.000 description 9
- 239000002775 capsule Substances 0.000 description 9
- 201000010099 disease Diseases 0.000 description 9
- BRZYSWJRSDMWLG-CAXSIQPQSA-N geneticin Natural products O1C[C@@](O)(C)[C@H](NC)[C@@H](O)[C@H]1O[C@@H]1[C@@H](O)[C@H](O[C@@H]2[C@@H]([C@@H](O)[C@H](O)[C@@H](C(C)O)O2)N)[C@@H](N)C[C@H]1N BRZYSWJRSDMWLG-CAXSIQPQSA-N 0.000 description 9
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 9
- 125000004433 nitrogen atom Chemical group N* 0.000 description 9
- 238000005160 1H NMR spectroscopy Methods 0.000 description 8
- FKJSFKCZZIXQIP-UHFFFAOYSA-N 2-bromo-1-(4-bromophenyl)ethanone Chemical compound BrCC(=O)C1=CC=C(Br)C=C1 FKJSFKCZZIXQIP-UHFFFAOYSA-N 0.000 description 8
- JRNVZBWKYDBUCA-UHFFFAOYSA-N N-chlorosuccinimide Chemical compound ClN1C(=O)CCC1=O JRNVZBWKYDBUCA-UHFFFAOYSA-N 0.000 description 8
- DFPAKSUCGFBDDF-UHFFFAOYSA-N Nicotinamide Chemical compound NC(=O)C1=CC=CN=C1 DFPAKSUCGFBDDF-UHFFFAOYSA-N 0.000 description 8
- 239000012298 atmosphere Substances 0.000 description 8
- 125000004432 carbon atom Chemical group C* 0.000 description 8
- 239000003480 eluent Substances 0.000 description 8
- 235000019441 ethanol Nutrition 0.000 description 8
- 108700008776 hepatitis C virus NS-5 Proteins 0.000 description 8
- 229940079322 interferon Drugs 0.000 description 8
- IUYHWZFSGMZEOG-UHFFFAOYSA-M magnesium;propane;chloride Chemical compound [Mg+2].[Cl-].C[CH-]C IUYHWZFSGMZEOG-UHFFFAOYSA-M 0.000 description 8
- 230000014759 maintenance of location Effects 0.000 description 8
- 239000012074 organic phase Substances 0.000 description 8
- 229920001223 polyethylene glycol Polymers 0.000 description 8
- 235000011056 potassium acetate Nutrition 0.000 description 8
- 230000010076 replication Effects 0.000 description 8
- 229920006395 saturated elastomer Polymers 0.000 description 8
- 238000001228 spectrum Methods 0.000 description 8
- 229940124597 therapeutic agent Drugs 0.000 description 8
- CEFVHPDFGLDQKU-YFKPBYRVSA-N (2s)-2-(methoxycarbonylamino)-3-methylbutanoic acid Chemical compound COC(=O)N[C@@H](C(C)C)C(O)=O CEFVHPDFGLDQKU-YFKPBYRVSA-N 0.000 description 7
- PAYRUJLWNCNPSJ-UHFFFAOYSA-N Aniline Chemical compound NC1=CC=CC=C1 PAYRUJLWNCNPSJ-UHFFFAOYSA-N 0.000 description 7
- 238000006069 Suzuki reaction reaction Methods 0.000 description 7
- 239000012230 colorless oil Substances 0.000 description 7
- 208000035475 disorder Diseases 0.000 description 7
- 238000003818 flash chromatography Methods 0.000 description 7
- 229940047124 interferons Drugs 0.000 description 7
- 229910052943 magnesium sulfate Inorganic materials 0.000 description 7
- 235000019341 magnesium sulphate Nutrition 0.000 description 7
- 239000002609 medium Substances 0.000 description 7
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 7
- VHYFNPMBLIVWCW-UHFFFAOYSA-N 4-Dimethylaminopyridine Chemical compound CN(C)C1=CC=NC=C1 VHYFNPMBLIVWCW-UHFFFAOYSA-N 0.000 description 6
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 6
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 6
- 239000002202 Polyethylene glycol Substances 0.000 description 6
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 6
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 6
- 125000000753 cycloalkyl group Chemical group 0.000 description 6
- RAXXELZNTBOGNW-UHFFFAOYSA-N imidazole Natural products C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 description 6
- 208000015181 infectious disease Diseases 0.000 description 6
- 230000035772 mutation Effects 0.000 description 6
- 229960004063 propylene glycol Drugs 0.000 description 6
- 229910000029 sodium carbonate Inorganic materials 0.000 description 6
- 239000000725 suspension Substances 0.000 description 6
- 239000003826 tablet Substances 0.000 description 6
- YIQQCDQMLFPGLN-LLVKDONJSA-N tert-butyl (3r)-4-(5-aminopyridin-2-yl)-3-methylpiperazine-1-carboxylate Chemical compound C[C@@H]1CN(C(=O)OC(C)(C)C)CCN1C1=CC=C(N)C=N1 YIQQCDQMLFPGLN-LLVKDONJSA-N 0.000 description 6
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 6
- JVSFQJZRHXAUGT-UHFFFAOYSA-N 2,2-dimethylpropanoyl chloride Chemical compound CC(C)(C)C(Cl)=O JVSFQJZRHXAUGT-UHFFFAOYSA-N 0.000 description 5
- IPOCOANFUVSCLZ-UHFFFAOYSA-N 6-fluoropyridine-3-carbonyl chloride Chemical compound FC1=CC=C(C(Cl)=O)C=N1 IPOCOANFUVSCLZ-UHFFFAOYSA-N 0.000 description 5
- YCKRFDGAMUMZLT-UHFFFAOYSA-N Fluorine atom Chemical compound [F] YCKRFDGAMUMZLT-UHFFFAOYSA-N 0.000 description 5
- 108010010803 Gelatin Proteins 0.000 description 5
- 238000005481 NMR spectroscopy Methods 0.000 description 5
- 108091005804 Peptidases Proteins 0.000 description 5
- 239000004365 Protease Substances 0.000 description 5
- 102100037486 Reverse transcriptase/ribonuclease H Human genes 0.000 description 5
- 229920002472 Starch Polymers 0.000 description 5
- 241000700605 Viruses Species 0.000 description 5
- DQSCYBZHPGOWIH-CYBMUJFWSA-N [5-chloro-4-[[6-[(2r)-4-(2,2-dimethylpropanoyl)-2-methylpiperazin-1-yl]pyridine-3-carbonyl]amino]-2-(trifluoromethoxy)phenyl]boronic acid Chemical compound C[C@@H]1CN(C(=O)C(C)(C)C)CCN1C1=CC=C(C(=O)NC=2C(=CC(=C(OC(F)(F)F)C=2)B(O)O)Cl)C=N1 DQSCYBZHPGOWIH-CYBMUJFWSA-N 0.000 description 5
- 239000004480 active ingredient Substances 0.000 description 5
- 239000003963 antioxidant agent Substances 0.000 description 5
- 235000006708 antioxidants Nutrition 0.000 description 5
- 239000008346 aqueous phase Substances 0.000 description 5
- 238000003556 assay Methods 0.000 description 5
- 239000002585 base Substances 0.000 description 5
- 229910052799 carbon Inorganic materials 0.000 description 5
- 239000002552 dosage form Substances 0.000 description 5
- 239000008273 gelatin Substances 0.000 description 5
- 229920000159 gelatin Polymers 0.000 description 5
- 235000019322 gelatine Nutrition 0.000 description 5
- 235000011852 gelatine desserts Nutrition 0.000 description 5
- 239000007788 liquid Substances 0.000 description 5
- 230000007246 mechanism Effects 0.000 description 5
- 239000006187 pill Substances 0.000 description 5
- 239000013612 plasmid Substances 0.000 description 5
- 102220082228 rs863224038 Human genes 0.000 description 5
- 239000002904 solvent Substances 0.000 description 5
- 235000019698 starch Nutrition 0.000 description 5
- 238000003786 synthesis reaction Methods 0.000 description 5
- BVJFVSRRBMLMHC-LRDDRELGSA-N tert-butyl (2s,4s)-2-[5-(4-bromophenyl)-1h-imidazol-2-yl]-4-methylpyrrolidine-1-carboxylate Chemical compound CC(C)(C)OC(=O)N1C[C@@H](C)C[C@H]1C1=NC(C=2C=CC(Br)=CC=2)=CN1 BVJFVSRRBMLMHC-LRDDRELGSA-N 0.000 description 5
- CZJGSDMEPZRKKA-CYBMUJFWSA-N tert-butyl (3r)-4-[5-[[4-bromo-2-chloro-5-(trifluoromethoxy)phenyl]carbamoyl]pyridin-2-yl]-3-methylpiperazine-1-carboxylate Chemical compound C[C@@H]1CN(C(=O)OC(C)(C)C)CCN1C1=CC=C(C(=O)NC=2C(=CC(Br)=C(OC(F)(F)F)C=2)Cl)C=N1 CZJGSDMEPZRKKA-CYBMUJFWSA-N 0.000 description 5
- 125000001412 tetrahydropyranyl group Chemical group 0.000 description 5
- BFNMOMYTTGHNGJ-SCSAIBSYSA-N (1s)-2,2-dimethylcyclopropane-1-carboxylic acid Chemical compound CC1(C)C[C@@H]1C(O)=O BFNMOMYTTGHNGJ-SCSAIBSYSA-N 0.000 description 4
- WRIDQFICGBMAFQ-UHFFFAOYSA-N (E)-8-Octadecenoic acid Natural products CCCCCCCCCC=CCCCCCCC(O)=O WRIDQFICGBMAFQ-UHFFFAOYSA-N 0.000 description 4
- NGNBDVOYPDDBFK-UHFFFAOYSA-N 2-[2,4-di(pentan-2-yl)phenoxy]acetyl chloride Chemical compound CCCC(C)C1=CC=C(OCC(Cl)=O)C(C(C)CCC)=C1 NGNBDVOYPDDBFK-UHFFFAOYSA-N 0.000 description 4
- LQJBNNIYVWPHFW-UHFFFAOYSA-N 20:1omega9c fatty acid Natural products CCCCCCCCCCC=CCCCCCCCC(O)=O LQJBNNIYVWPHFW-UHFFFAOYSA-N 0.000 description 4
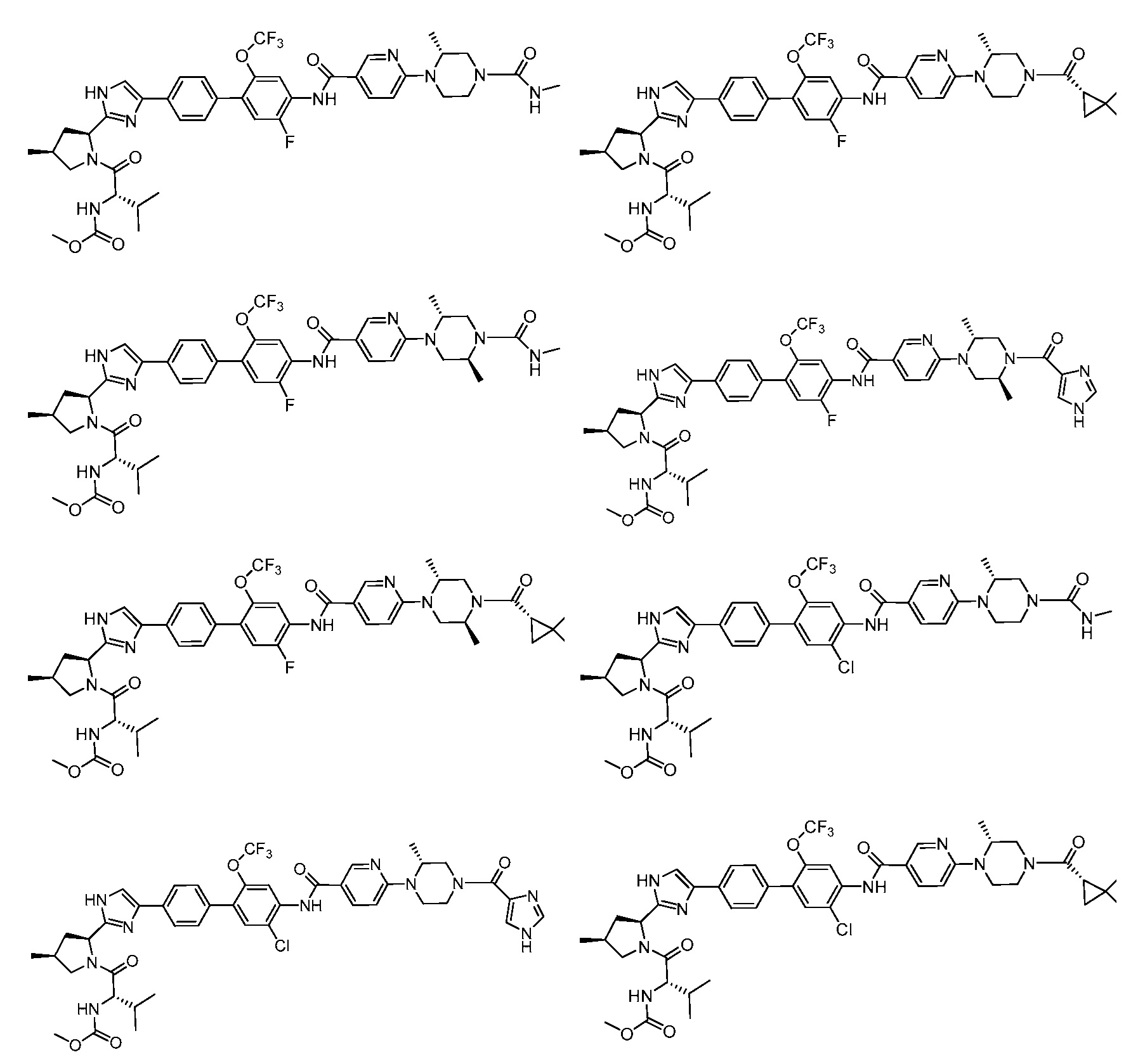
- FMMQLLUKPSSROU-DQLWACAZSA-N 4-[4-[2-[(2s,4s)-1-[(2s)-2-(methoxycarbonylamino)-3-methylbutanoyl]-4-methylpyrrolidin-2-yl]-1h-imidazol-5-yl]phenyl]-3-(trifluoromethoxy)benzoic acid Chemical compound COC(=O)N[C@@H](C(C)C)C(=O)N1C[C@@H](C)C[C@H]1C1=NC(C=2C=CC(=CC=2)C=2C(=CC(=CC=2)C(O)=O)OC(F)(F)F)=CN1 FMMQLLUKPSSROU-DQLWACAZSA-N 0.000 description 4
- DWOZNANUEDYIOF-UHFFFAOYSA-L 4-ditert-butylphosphanyl-n,n-dimethylaniline;dichloropalladium Chemical compound Cl[Pd]Cl.CN(C)C1=CC=C(P(C(C)(C)C)C(C)(C)C)C=C1.CN(C)C1=CC=C(P(C(C)(C)C)C(C)(C)C)C=C1 DWOZNANUEDYIOF-UHFFFAOYSA-L 0.000 description 4
- QSBYPNXLFMSGKH-UHFFFAOYSA-N 9-Heptadecensaeure Natural products CCCCCCCC=CCCCCCCCC(O)=O QSBYPNXLFMSGKH-UHFFFAOYSA-N 0.000 description 4
- BZLVMXJERCGZMT-UHFFFAOYSA-N Methyl tert-butyl ether Chemical compound COC(C)(C)C BZLVMXJERCGZMT-UHFFFAOYSA-N 0.000 description 4
- PCLIMKBDDGJMGD-UHFFFAOYSA-N N-bromosuccinimide Chemical compound BrN1C(=O)CCC1=O PCLIMKBDDGJMGD-UHFFFAOYSA-N 0.000 description 4
- 101710144111 Non-structural protein 3 Proteins 0.000 description 4
- 239000005642 Oleic acid Substances 0.000 description 4
- ZQPPMHVWECSIRJ-UHFFFAOYSA-N Oleic acid Natural products CCCCCCCCC=CCCCCCCCC(O)=O ZQPPMHVWECSIRJ-UHFFFAOYSA-N 0.000 description 4
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 4
- 101710172711 Structural protein Proteins 0.000 description 4
- 125000003277 amino group Chemical group 0.000 description 4
- 238000002648 combination therapy Methods 0.000 description 4
- QTMDXZNDVAMKGV-UHFFFAOYSA-L copper(ii) bromide Chemical compound [Cu+2].[Br-].[Br-] QTMDXZNDVAMKGV-UHFFFAOYSA-L 0.000 description 4
- PQVSTLUFSYVLTO-UHFFFAOYSA-N ethyl n-ethoxycarbonylcarbamate Chemical compound CCOC(=O)NC(=O)OCC PQVSTLUFSYVLTO-UHFFFAOYSA-N 0.000 description 4
- 235000011187 glycerol Nutrition 0.000 description 4
- 150000003840 hydrochlorides Chemical class 0.000 description 4
- 238000000338 in vitro Methods 0.000 description 4
- 230000005764 inhibitory process Effects 0.000 description 4
- QXJSBBXBKPUZAA-UHFFFAOYSA-N isooleic acid Natural products CCCCCCCC=CCCCCCCCCC(O)=O QXJSBBXBKPUZAA-UHFFFAOYSA-N 0.000 description 4
- 239000002960 lipid emulsion Substances 0.000 description 4
- 239000008297 liquid dosage form Substances 0.000 description 4
- 229940040692 lithium hydroxide monohydrate Drugs 0.000 description 4
- GLXDVVHUTZTUQK-UHFFFAOYSA-M lithium hydroxide monohydrate Substances [Li+].O.[OH-] GLXDVVHUTZTUQK-UHFFFAOYSA-M 0.000 description 4
- XIKGXGNARLJTEO-UHFFFAOYSA-N methyl 4-bromo-3-(trifluoromethoxy)benzoate Chemical compound COC(=O)C1=CC=C(Br)C(OC(F)(F)F)=C1 XIKGXGNARLJTEO-UHFFFAOYSA-N 0.000 description 4
- 229960003966 nicotinamide Drugs 0.000 description 4
- 235000005152 nicotinamide Nutrition 0.000 description 4
- 239000011570 nicotinamide Substances 0.000 description 4
- ZQPPMHVWECSIRJ-KTKRTIGZSA-N oleic acid Chemical compound CCCCCCCC\C=C/CCCCCCCC(O)=O ZQPPMHVWECSIRJ-KTKRTIGZSA-N 0.000 description 4
- 239000012071 phase Substances 0.000 description 4
- 229920000728 polyester Polymers 0.000 description 4
- 238000002953 preparative HPLC Methods 0.000 description 4
- 230000008569 process Effects 0.000 description 4
- JUJWROOIHBZHMG-UHFFFAOYSA-N pyridine Substances C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 4
- 238000011160 research Methods 0.000 description 4
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 4
- 235000017557 sodium bicarbonate Nutrition 0.000 description 4
- 238000001308 synthesis method Methods 0.000 description 4
- DYHSDKLCOJIUFX-UHFFFAOYSA-N tert-butoxycarbonyl anhydride Chemical compound CC(C)(C)OC(=O)OC(=O)OC(C)(C)C DYHSDKLCOJIUFX-UHFFFAOYSA-N 0.000 description 4
- FMLPQHJYUZTHQS-MRVPVSSYSA-N tert-butyl (3r)-3-methylpiperazine-1-carboxylate Chemical compound C[C@@H]1CN(C(=O)OC(C)(C)C)CCN1 FMLPQHJYUZTHQS-MRVPVSSYSA-N 0.000 description 4
- 230000001225 therapeutic effect Effects 0.000 description 4
- 125000006645 (C3-C4) cycloalkyl group Chemical group 0.000 description 3
- BAZVFQBTJPBRTJ-UHFFFAOYSA-N 2-chloro-5-nitropyridine Chemical compound [O-][N+](=O)C1=CC=C(Cl)N=C1 BAZVFQBTJPBRTJ-UHFFFAOYSA-N 0.000 description 3
- XTDKZSUYCXHXJM-UHFFFAOYSA-N 2-methoxyoxane Chemical group COC1CCCCO1 XTDKZSUYCXHXJM-UHFFFAOYSA-N 0.000 description 3
- IXFAQDWACWVXRW-UHFFFAOYSA-N 4-bromo-2-fluoro-3-(trifluoromethoxy)benzoic acid Chemical compound OC(=O)C1=CC=C(Br)C(OC(F)(F)F)=C1F IXFAQDWACWVXRW-UHFFFAOYSA-N 0.000 description 3
- QIGASRKTTQHKRR-UHFFFAOYSA-N 4-bromo-3-chloro-5-(trifluoromethoxy)benzoic acid Chemical compound OC(=O)C1=CC(Cl)=C(Br)C(OC(F)(F)F)=C1 QIGASRKTTQHKRR-UHFFFAOYSA-N 0.000 description 3
- FHRDAXACBKRFKI-CYBMUJFWSA-N 4-bromo-3-chloro-n-[6-[(2r)-4-(2,2-dimethylpropanoyl)-2-methylpiperazin-1-yl]pyridin-3-yl]-5-(trifluoromethoxy)benzamide Chemical compound C[C@@H]1CN(C(=O)C(C)(C)C)CCN1C(N=C1)=CC=C1NC(=O)C1=CC(Cl)=C(Br)C(OC(F)(F)F)=C1 FHRDAXACBKRFKI-CYBMUJFWSA-N 0.000 description 3
- ZCOPWHOTJYATSA-CABZTGNLSA-N 5-(4-bromophenyl)-2-[(2s,4s)-4-methylpyrrolidin-2-yl]-1h-imidazole Chemical compound C1[C@H](C)CN[C@@H]1C1=NC(C=2C=CC(Br)=CC=2)=CN1 ZCOPWHOTJYATSA-CABZTGNLSA-N 0.000 description 3
- GQGSNOZHDGXCMO-RYUDHWBXSA-N 5-(4-bromophenyl)-2-[(2s,4s)-4-methylsulfanylpyrrolidin-2-yl]-1h-imidazole Chemical compound C1[C@H](SC)CN[C@@H]1C1=NC(C=2C=CC(Br)=CC=2)=CN1 GQGSNOZHDGXCMO-RYUDHWBXSA-N 0.000 description 3
- FGKRWPJFKNTXLI-LLVKDONJSA-N 6-[(2r)-2-methyl-4-[(2-methylpropan-2-yl)oxycarbonyl]piperazin-1-yl]pyridine-3-carboxylic acid Chemical compound C[C@@H]1CN(C(=O)OC(C)(C)C)CCN1C1=CC=C(C(O)=O)C=N1 FGKRWPJFKNTXLI-LLVKDONJSA-N 0.000 description 3
- 229920001817 Agar Polymers 0.000 description 3
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 3
- AXAYASGEUWOKCS-NDXORKPFSA-N B1(OC(C(O1)(C)C)(C)C)C2=CC=C(C=C2)C3=CN=C(N3)[C@@H]4C[C@@H](CN4C(=O)[C@H](C(C)C)NC(=O)O)C Chemical compound B1(OC(C(O1)(C)C)(C)C)C2=CC=C(C=C2)C3=CN=C(N3)[C@@H]4C[C@@H](CN4C(=O)[C@H](C(C)C)NC(=O)O)C AXAYASGEUWOKCS-NDXORKPFSA-N 0.000 description 3
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 3
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 3
- WSFSSNUMVMOOMR-UHFFFAOYSA-N Formaldehyde Chemical compound O=C WSFSSNUMVMOOMR-UHFFFAOYSA-N 0.000 description 3
- 229940124772 HCV-NS5B polymerase inhibitor Drugs 0.000 description 3
- 102100040018 Interferon alpha-2 Human genes 0.000 description 3
- 108010079944 Interferon-alpha2b Proteins 0.000 description 3
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 3
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 3
- 108060001084 Luciferase Proteins 0.000 description 3
- 239000005089 Luciferase Substances 0.000 description 3
- 229920000168 Microcrystalline cellulose Polymers 0.000 description 3
- RWRDLPDLKQPQOW-UHFFFAOYSA-N Pyrrolidine Chemical compound C1CCNC1 RWRDLPDLKQPQOW-UHFFFAOYSA-N 0.000 description 3
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 3
- 229930006000 Sucrose Natural products 0.000 description 3
- UCXOHFHSFNEAKI-DGCLKSJQSA-N [(3r)-4-(5-aminopyridin-2-yl)-3-methylpiperazin-1-yl]-[(1s)-2,2-dimethylcyclopropyl]methanone Chemical compound C([C@H]1C)N(C(=O)[C@@H]2C(C2)(C)C)CCN1C1=CC=C(N)C=N1 UCXOHFHSFNEAKI-DGCLKSJQSA-N 0.000 description 3
- 230000002378 acidificating effect Effects 0.000 description 3
- 235000010419 agar Nutrition 0.000 description 3
- 235000010443 alginic acid Nutrition 0.000 description 3
- 229920000615 alginic acid Polymers 0.000 description 3
- 239000007864 aqueous solution Substances 0.000 description 3
- LHHCSNFAOIFYRV-DOVBMPENSA-N boceprevir Chemical compound O=C([C@@H]1[C@@H]2[C@@H](C2(C)C)CN1C(=O)[C@@H](NC(=O)NC(C)(C)C)C(C)(C)C)NC(C(=O)C(N)=O)CC1CCC1 LHHCSNFAOIFYRV-DOVBMPENSA-N 0.000 description 3
- 239000006172 buffering agent Substances 0.000 description 3
- 150000001721 carbon Chemical group 0.000 description 3
- 229910002091 carbon monoxide Inorganic materials 0.000 description 3
- 150000001768 cations Chemical class 0.000 description 3
- 239000012141 concentrate Substances 0.000 description 3
- 239000012971 dimethylpiperazine Substances 0.000 description 3
- 238000004090 dissolution Methods 0.000 description 3
- 238000004520 electroporation Methods 0.000 description 3
- 239000003995 emulsifying agent Substances 0.000 description 3
- 239000000284 extract Substances 0.000 description 3
- 238000009472 formulation Methods 0.000 description 3
- 239000012458 free base Substances 0.000 description 3
- 125000004356 hydroxy functional group Chemical group O* 0.000 description 3
- 239000002348 inosinate dehydrogenase inhibitor Substances 0.000 description 3
- 239000008101 lactose Substances 0.000 description 3
- 238000004519 manufacturing process Methods 0.000 description 3
- 238000004949 mass spectrometry Methods 0.000 description 3
- YUJUOERVMDVZNE-UHFFFAOYSA-N methyl 4-bromo-2-chloro-5-(trifluoromethoxy)benzoate Chemical compound COC(=O)C1=CC(OC(F)(F)F)=C(Br)C=C1Cl YUJUOERVMDVZNE-UHFFFAOYSA-N 0.000 description 3
- 239000004530 micro-emulsion Substances 0.000 description 3
- 239000008108 microcrystalline cellulose Substances 0.000 description 3
- 229940016286 microcrystalline cellulose Drugs 0.000 description 3
- 235000019813 microcrystalline cellulose Nutrition 0.000 description 3
- 125000002950 monocyclic group Chemical group 0.000 description 3
- DOYTVHLOWBCSOO-CYBMUJFWSA-N n-[4-bromo-2-chloro-5-(trifluoromethoxy)phenyl]-6-[(2r)-4-(2,2-dimethylpropanoyl)-2-methylpiperazin-1-yl]pyridine-3-carboxamide Chemical compound C[C@@H]1CN(C(=O)C(C)(C)C)CCN1C1=CC=C(C(=O)NC=2C(=CC(Br)=C(OC(F)(F)F)C=2)Cl)C=N1 DOYTVHLOWBCSOO-CYBMUJFWSA-N 0.000 description 3
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 3
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 3
- 229940127073 nucleoside analogue Drugs 0.000 description 3
- 238000007911 parenteral administration Methods 0.000 description 3
- 125000003367 polycyclic group Chemical group 0.000 description 3
- NLKNQRATVPKPDG-UHFFFAOYSA-M potassium iodide Chemical compound [K+].[I-] NLKNQRATVPKPDG-UHFFFAOYSA-M 0.000 description 3
- 238000000634 powder X-ray diffraction Methods 0.000 description 3
- 229940121649 protein inhibitor Drugs 0.000 description 3
- 239000012268 protein inhibitor Substances 0.000 description 3
- 238000000746 purification Methods 0.000 description 3
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 3
- 125000000719 pyrrolidinyl group Chemical group 0.000 description 3
- 238000010992 reflux Methods 0.000 description 3
- 102220227358 rs748198457 Human genes 0.000 description 3
- TTZHDVOVKQGIBA-IQWMDFIBSA-N sofosbuvir Chemical compound N1([C@@H]2O[C@@H]([C@H]([C@]2(F)C)O)CO[P@@](=O)(N[C@@H](C)C(=O)OC(C)C)OC=2C=CC=CC=2)C=CC(=O)NC1=O TTZHDVOVKQGIBA-IQWMDFIBSA-N 0.000 description 3
- 239000007909 solid dosage form Substances 0.000 description 3
- 239000000600 sorbitol Substances 0.000 description 3
- 235000010356 sorbitol Nutrition 0.000 description 3
- 239000008107 starch Substances 0.000 description 3
- 239000000758 substrate Substances 0.000 description 3
- 239000005720 sucrose Substances 0.000 description 3
- 208000024891 symptom Diseases 0.000 description 3
- 239000000080 wetting agent Substances 0.000 description 3
- MRTPHCKZFQIZTP-YUMQZZPRSA-N (2S,4S)-4-morpholin-4-ylpyrrolidine-1,2-dicarboxylic acid Chemical compound OC(=O)[C@@H]1C[C@@H](CN1C(O)=O)N1CCOCC1 MRTPHCKZFQIZTP-YUMQZZPRSA-N 0.000 description 2
- HHDQVBSXYDRQGD-DMTCNVIQSA-N (2s,4r)-4-hydroxypyrrolidine-1,2-dicarboxylic acid Chemical compound O[C@@H]1C[C@@H](C(O)=O)N(C(O)=O)C1 HHDQVBSXYDRQGD-DMTCNVIQSA-N 0.000 description 2
- UVQZQJWQDGQASW-UHNVWZDZSA-N (2s,4r)-4-methylsulfonyloxypyrrolidine-1,2-dicarboxylic acid Chemical compound CS(=O)(=O)O[C@@H]1C[C@@H](C(O)=O)N(C(O)=O)C1 UVQZQJWQDGQASW-UHNVWZDZSA-N 0.000 description 2
- OHPUCEUCBHBIAW-IUCAKERBSA-N (2s,4s)-4-(methoxymethyl)-1-[(2-methylpropan-2-yl)oxycarbonyl]pyrrolidine-2-carboxylic acid Chemical compound COC[C@H]1C[C@@H](C(O)=O)N(C(=O)OC(C)(C)C)C1 OHPUCEUCBHBIAW-IUCAKERBSA-N 0.000 description 2
- MIVXQYMYEMUMKK-SFYZADRCSA-N (2s,4s)-4-cyano-1-[(2-methylpropan-2-yl)oxycarbonyl]pyrrolidine-2-carboxylic acid Chemical compound CC(C)(C)OC(=O)N1C[C@@H](C#N)C[C@H]1C(O)=O MIVXQYMYEMUMKK-SFYZADRCSA-N 0.000 description 2
- JCINQOYGBLWVGB-UHNVWZDZSA-N (2s,4s)-4-cyanopyrrolidine-1,2-dicarboxylic acid Chemical compound OC(=O)[C@@H]1C[C@H](C#N)CN1C(O)=O JCINQOYGBLWVGB-UHNVWZDZSA-N 0.000 description 2
- BSAYEGDCKUEPNE-YUMQZZPRSA-N (2s,5s)-5-methyl-1-[(2-methylpropan-2-yl)oxycarbonyl]pyrrolidine-2-carboxylic acid Chemical compound C[C@H]1CC[C@@H](C(O)=O)N1C(=O)OC(C)(C)C BSAYEGDCKUEPNE-YUMQZZPRSA-N 0.000 description 2
- PDXRPVFVFWBERR-WHFBIAKZSA-N (2s,5s)-5-methylpyrrolidine-1,2-dicarboxylic acid Chemical compound C[C@H]1CC[C@@H](C(O)=O)N1C(O)=O PDXRPVFVFWBERR-WHFBIAKZSA-N 0.000 description 2
- SSEJSSNDPMMWBQ-RXMQYKEDSA-N (3r)-3-methylpiperazine-1-carboxylic acid Chemical compound C[C@@H]1CN(C(O)=O)CCN1 SSEJSSNDPMMWBQ-RXMQYKEDSA-N 0.000 description 2
- JKIFUZPZCBIVQO-SKDRFNHKSA-N (3s,5s)-5-[5-(4-bromophenyl)-1h-imidazol-2-yl]pyrrolidine-3-carbonitrile Chemical compound C1=CC(Br)=CC=C1C1=CNC([C@H]2NC[C@H](C2)C#N)=N1 JKIFUZPZCBIVQO-SKDRFNHKSA-N 0.000 description 2
- VBICKXHEKHSIBG-UHFFFAOYSA-N 1-monostearoylglycerol Chemical compound CCCCCCCCCCCCCCCCCC(=O)OCC(O)CO VBICKXHEKHSIBG-UHFFFAOYSA-N 0.000 description 2
- UPBHYYJZVWZCOZ-QMMMGPOBSA-N 1-o-tert-butyl 2-o-methyl (2s)-4-oxopyrrolidine-1,2-dicarboxylate Chemical compound COC(=O)[C@@H]1CC(=O)CN1C(=O)OC(C)(C)C UPBHYYJZVWZCOZ-QMMMGPOBSA-N 0.000 description 2
- UZQLHSFPEBCFEQ-DDXVTDLHSA-N 1-o-tert-butyl 2-o-methyl (2s,4e)-4-(methoxymethylidene)pyrrolidine-1,2-dicarboxylate Chemical compound CO\C=C1/C[C@@H](C(=O)OC)N(C(=O)OC(C)(C)C)C1 UZQLHSFPEBCFEQ-DDXVTDLHSA-N 0.000 description 2
- MZMNEDXVUJLQAF-SFYZADRCSA-N 1-o-tert-butyl 2-o-methyl (2s,4r)-4-hydroxypyrrolidine-1,2-dicarboxylate Chemical compound COC(=O)[C@@H]1C[C@@H](O)CN1C(=O)OC(C)(C)C MZMNEDXVUJLQAF-SFYZADRCSA-N 0.000 description 2
- HBNJDBHDJUHLHN-UWVGGRQHSA-N 1-o-tert-butyl 2-o-methyl (2s,4s)-4-(methoxymethyl)pyrrolidine-1,2-dicarboxylate Chemical compound COC[C@H]1C[C@@H](C(=O)OC)N(C(=O)OC(C)(C)C)C1 HBNJDBHDJUHLHN-UWVGGRQHSA-N 0.000 description 2
- CEFVHPDFGLDQKU-UHFFFAOYSA-N 2-(methoxycarbonylamino)-3-methylbutanoic acid Chemical compound COC(=O)NC(C(C)C)C(O)=O CEFVHPDFGLDQKU-UHFFFAOYSA-N 0.000 description 2
- XRXMNWGCKISMOH-UHFFFAOYSA-N 2-bromobenzoic acid Chemical compound OC(=O)C1=CC=CC=C1Br XRXMNWGCKISMOH-UHFFFAOYSA-N 0.000 description 2
- GKPPTKDHMYYQCU-BBRMVZONSA-N 2-o-[2-(4-bromophenyl)-2-oxoethyl] 1-o-tert-butyl (2s,4s)-4-(methoxymethyl)pyrrolidine-1,2-dicarboxylate Chemical compound CC(C)(C)OC(=O)N1C[C@@H](COC)C[C@H]1C(=O)OCC(=O)C1=CC=C(Br)C=C1 GKPPTKDHMYYQCU-BBRMVZONSA-N 0.000 description 2
- 125000004485 2-pyrrolidinyl group Chemical group [H]N1C([H])([H])C([H])([H])C([H])([H])C1([H])* 0.000 description 2
- LZPWAYBEOJRFAX-UHFFFAOYSA-N 4,4,5,5-tetramethyl-1,3,2$l^{2}-dioxaborolane Chemical compound CC1(C)O[B]OC1(C)C LZPWAYBEOJRFAX-UHFFFAOYSA-N 0.000 description 2
- FOFHYZYMFVHAHQ-APTRMMRNSA-N 4-[4-[2-[(2s,4s)-1-[(2s)-2-(methoxycarbonylamino)-3-methylbutanoyl]-4-methylsulfanylpyrrolidin-2-yl]-1h-imidazol-5-yl]phenyl]-3-(trifluoromethoxy)benzoic acid Chemical compound COC(=O)N[C@@H](C(C)C)C(=O)N1C[C@@H](SC)C[C@H]1C1=NC(C=2C=CC(=CC=2)C=2C(=CC(=CC=2)C(O)=O)OC(F)(F)F)=CN1 FOFHYZYMFVHAHQ-APTRMMRNSA-N 0.000 description 2
- HIMHSSDLZJNZEX-JBNDGTPBSA-N 4-[4-[2-[(2s,4s)-1-[(2s)-2-(methoxycarbonylamino)-3-methylbutanoyl]-4-methylsulfinylpyrrolidin-2-yl]-1h-imidazol-5-yl]phenyl]-3-(trifluoromethoxy)benzoic acid Chemical compound COC(=O)N[C@@H](C(C)C)C(=O)N1C[C@@H](S(C)=O)C[C@H]1C1=NC(C=2C=CC(=CC=2)C=2C(=CC(=CC=2)C(O)=O)OC(F)(F)F)=CN1 HIMHSSDLZJNZEX-JBNDGTPBSA-N 0.000 description 2
- PELUINKNDGKVJH-LVWPNOBMSA-N 4-[4-[5-chloro-2-[(2s,4s)-1-[(2s)-2-(methoxycarbonylamino)-3-methylbutanoyl]-4-methylpyrrolidin-2-yl]-1h-imidazol-4-yl]phenyl]-3-(trifluoromethoxy)benzoic acid Chemical compound COC(=O)N[C@@H](C(C)C)C(=O)N1C[C@@H](C)C[C@H]1C1=NC(C=2C=CC(=CC=2)C=2C(=CC(=CC=2)C(O)=O)OC(F)(F)F)=C(Cl)N1 PELUINKNDGKVJH-LVWPNOBMSA-N 0.000 description 2
- IXJFWBNYFTWBOR-UHFFFAOYSA-N 4-amino-3-(trifluoromethoxy)benzoic acid Chemical compound NC1=CC=C(C(O)=O)C=C1OC(F)(F)F IXJFWBNYFTWBOR-UHFFFAOYSA-N 0.000 description 2
- KCUDKOAKLVMESG-UHFFFAOYSA-N 4-bromo-2-fluoro-5-(trifluoromethoxy)aniline Chemical compound NC1=CC(OC(F)(F)F)=C(Br)C=C1F KCUDKOAKLVMESG-UHFFFAOYSA-N 0.000 description 2
- ZPVBZJRFMDEULI-CYBMUJFWSA-N 4-bromo-n-[6-[(2r)-4-(2,2-dimethylpropanoyl)-2-methylpiperazin-1-yl]pyridin-3-yl]-2-fluoro-3-(trifluoromethoxy)benzamide Chemical compound C[C@@H]1CN(C(=O)C(C)(C)C)CCN1C(N=C1)=CC=C1NC(=O)C1=CC=C(Br)C(OC(F)(F)F)=C1F ZPVBZJRFMDEULI-CYBMUJFWSA-N 0.000 description 2
- YYROPELSRYBVMQ-UHFFFAOYSA-N 4-toluenesulfonyl chloride Chemical compound CC1=CC=C(S(Cl)(=O)=O)C=C1 YYROPELSRYBVMQ-UHFFFAOYSA-N 0.000 description 2
- AFQLXRZUJAHDND-CABZTGNLSA-N 5-(4-bromophenyl)-2-[(2s,5s)-5-methylpyrrolidin-2-yl]-1h-imidazole Chemical compound N1[C@@H](C)CC[C@H]1C1=NC(C=2C=CC(Br)=CC=2)=CN1 AFQLXRZUJAHDND-CABZTGNLSA-N 0.000 description 2
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 2
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 2
- 241000416162 Astragalus gummifer Species 0.000 description 2
- VTYYLEPIZMXCLO-UHFFFAOYSA-L Calcium carbonate Chemical compound [Ca+2].[O-]C([O-])=O VTYYLEPIZMXCLO-UHFFFAOYSA-L 0.000 description 2
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 2
- CURLTUGMZLYLDI-UHFFFAOYSA-N Carbon dioxide Chemical compound O=C=O CURLTUGMZLYLDI-UHFFFAOYSA-N 0.000 description 2
- 229920002134 Carboxymethyl cellulose Polymers 0.000 description 2
- KZBUYRJDOAKODT-UHFFFAOYSA-N Chlorine Chemical compound ClCl KZBUYRJDOAKODT-UHFFFAOYSA-N 0.000 description 2
- 229910021590 Copper(II) bromide Inorganic materials 0.000 description 2
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 2
- XTHFKEDIFFGKHM-UHFFFAOYSA-N Dimethoxyethane Chemical compound COCCOC XTHFKEDIFFGKHM-UHFFFAOYSA-N 0.000 description 2
- 239000006144 Dulbecco’s modified Eagle's medium Substances 0.000 description 2
- LVGKNOAMLMIIKO-UHFFFAOYSA-N Elaidinsaeure-aethylester Natural products CCCCCCCCC=CCCCCCCCC(=O)OCC LVGKNOAMLMIIKO-UHFFFAOYSA-N 0.000 description 2
- 241000710188 Encephalomyocarditis virus Species 0.000 description 2
- 239000001856 Ethyl cellulose Substances 0.000 description 2
- ZZSNKZQZMQGXPY-UHFFFAOYSA-N Ethyl cellulose Chemical compound CCOCC1OC(OC)C(OCC)C(OCC)C1OC1C(O)C(O)C(OC)C(CO)O1 ZZSNKZQZMQGXPY-UHFFFAOYSA-N 0.000 description 2
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 2
- 241000206672 Gelidium Species 0.000 description 2
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 2
- 239000007818 Grignard reagent Substances 0.000 description 2
- 101000600434 Homo sapiens Putative uncharacterized protein encoded by MIR7-3HG Proteins 0.000 description 2
- 241000725303 Human immunodeficiency virus Species 0.000 description 2
- 108010005716 Interferon beta-1a Proteins 0.000 description 2
- 108010047761 Interferon-alpha Proteins 0.000 description 2
- 102000006992 Interferon-alpha Human genes 0.000 description 2
- ONIBWKKTOPOVIA-BYPYZUCNSA-N L-Proline Chemical compound OC(=O)[C@@H]1CCCN1 ONIBWKKTOPOVIA-BYPYZUCNSA-N 0.000 description 2
- 229930195725 Mannitol Natural products 0.000 description 2
- 239000012359 Methanesulfonyl chloride Substances 0.000 description 2
- YNAVUWVOSKDBBP-UHFFFAOYSA-N Morpholine Chemical compound C1COCCN1 YNAVUWVOSKDBBP-UHFFFAOYSA-N 0.000 description 2
- 229930193140 Neomycin Natural products 0.000 description 2
- 101800001019 Non-structural protein 4B Proteins 0.000 description 2
- 102000007999 Nuclear Proteins Human genes 0.000 description 2
- 108010089610 Nuclear Proteins Proteins 0.000 description 2
- 101150003085 Pdcl gene Proteins 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 2
- NQRYJNQNLNOLGT-UHFFFAOYSA-N Piperidine Chemical compound C1CCNCC1 NQRYJNQNLNOLGT-UHFFFAOYSA-N 0.000 description 2
- ONIBWKKTOPOVIA-UHFFFAOYSA-N Proline Natural products OC(=O)C1CCCN1 ONIBWKKTOPOVIA-UHFFFAOYSA-N 0.000 description 2
- ZTHYODDOHIVTJV-UHFFFAOYSA-N Propyl gallate Chemical class CCCOC(=O)C1=CC(O)=C(O)C(O)=C1 ZTHYODDOHIVTJV-UHFFFAOYSA-N 0.000 description 2
- 102100037401 Putative uncharacterized protein encoded by MIR7-3HG Human genes 0.000 description 2
- KAESVJOAVNADME-UHFFFAOYSA-N Pyrrole Chemical compound C=1C=CNC=1 KAESVJOAVNADME-UHFFFAOYSA-N 0.000 description 2
- PXIPVTKHYLBLMZ-UHFFFAOYSA-N Sodium azide Chemical compound [Na+].[N-]=[N+]=[N-] PXIPVTKHYLBLMZ-UHFFFAOYSA-N 0.000 description 2
- MHFMTUBUVQZIRE-WINRQGAFSA-N Sovaprevir Chemical compound C([C@H](C(=O)N1[C@@H](C[C@H](C1)OC=1C2=CC=C(C=C2N=C(C=1)C=1C=CC=CC=1)OC)C(=O)N[C@]1([C@@H](C1)C=C)C(=O)NS(=O)(=O)C1CC1)C(C)(C)C)C(=O)N1CCCCC1 MHFMTUBUVQZIRE-WINRQGAFSA-N 0.000 description 2
- 108091027544 Subgenomic mRNA Proteins 0.000 description 2
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric Acid Chemical compound [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 description 2
- 229920001615 Tragacanth Polymers 0.000 description 2
- MLESJYFEMSJZLZ-MAAOGQSESA-N [(2r,3r,4r,5r)-5-(4-amino-2-oxopyrimidin-1-yl)-4-fluoro-4-methyl-3-(2-methylpropanoyloxy)oxolan-2-yl]methyl 2-methylpropanoate Chemical compound C[C@@]1(F)[C@H](OC(=O)C(C)C)[C@@H](COC(=O)C(C)C)O[C@H]1N1C(=O)N=C(N)C=C1 MLESJYFEMSJZLZ-MAAOGQSESA-N 0.000 description 2
- RLHLFOJWVMTCMC-UHFFFAOYSA-N [2-chloro-5-(trifluoromethoxy)phenyl]methanol Chemical compound OCC1=CC(OC(F)(F)F)=CC=C1Cl RLHLFOJWVMTCMC-UHFFFAOYSA-N 0.000 description 2
- WGPANXACDVMCJL-UHFFFAOYSA-N [4-bromo-2-chloro-5-(trifluoromethoxy)phenyl]methanol Chemical compound OCC1=CC(OC(F)(F)F)=C(Br)C=C1Cl WGPANXACDVMCJL-UHFFFAOYSA-N 0.000 description 2
- 125000002252 acyl group Chemical group 0.000 description 2
- 239000000783 alginic acid Substances 0.000 description 2
- 229960001126 alginic acid Drugs 0.000 description 2
- 150000004781 alginic acids Chemical class 0.000 description 2
- 238000010976 amide bond formation reaction Methods 0.000 description 2
- 150000001408 amides Chemical class 0.000 description 2
- 230000000840 anti-viral effect Effects 0.000 description 2
- 125000003118 aryl group Chemical group 0.000 description 2
- 229960002118 asunaprevir Drugs 0.000 description 2
- XRWSZZJLZRKHHD-WVWIJVSJSA-N asunaprevir Chemical compound O=C([C@@H]1C[C@H](CN1C(=O)[C@@H](NC(=O)OC(C)(C)C)C(C)(C)C)OC1=NC=C(C2=CC=C(Cl)C=C21)OC)N[C@]1(C(=O)NS(=O)(=O)C2CC2)C[C@H]1C=C XRWSZZJLZRKHHD-WVWIJVSJSA-N 0.000 description 2
- 230000004888 barrier function Effects 0.000 description 2
- ZTTKEBYSXUCBSE-QDFUAKMASA-N beclabuvir Chemical compound C1([C@@H]2C[C@@]2(CN2C3=CC(=CC=C33)C(=O)NS(=O)(=O)N(C)C)C(=O)N4[C@@H]5CC[C@H]4CN(C)C5)=CC(OC)=CC=C1C2=C3C1CCCCC1 ZTTKEBYSXUCBSE-QDFUAKMASA-N 0.000 description 2
- 229950010541 beclabuvir Drugs 0.000 description 2
- 239000000440 bentonite Substances 0.000 description 2
- 229910000278 bentonite Inorganic materials 0.000 description 2
- 235000012216 bentonite Nutrition 0.000 description 2
- SVPXDRXYRYOSEX-UHFFFAOYSA-N bentoquatam Chemical compound O.O=[Si]=O.O=[Al]O[Al]=O SVPXDRXYRYOSEX-UHFFFAOYSA-N 0.000 description 2
- SESFRYSPDFLNCH-UHFFFAOYSA-N benzyl benzoate Chemical compound C=1C=CC=CC=1C(=O)OCC1=CC=CC=C1 SESFRYSPDFLNCH-UHFFFAOYSA-N 0.000 description 2
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 2
- 229960000517 boceprevir Drugs 0.000 description 2
- 125000005621 boronate group Chemical group 0.000 description 2
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 2
- 235000010948 carboxy methyl cellulose Nutrition 0.000 description 2
- 239000001768 carboxy methyl cellulose Substances 0.000 description 2
- 239000008112 carboxymethyl-cellulose Substances 0.000 description 2
- 239000000969 carrier Substances 0.000 description 2
- 229920002301 cellulose acetate Polymers 0.000 description 2
- KXZJHVJKXJLBKO-UHFFFAOYSA-N chembl1408157 Chemical compound N=1C2=CC=CC=C2C(C(=O)O)=CC=1C1=CC=C(O)C=C1 KXZJHVJKXJLBKO-UHFFFAOYSA-N 0.000 description 2
- 239000007795 chemical reaction product Substances 0.000 description 2
- 230000005757 colony formation Effects 0.000 description 2
- 239000003086 colorant Substances 0.000 description 2
- 235000008504 concentrate Nutrition 0.000 description 2
- 238000006482 condensation reaction Methods 0.000 description 2
- 235000005687 corn oil Nutrition 0.000 description 2
- 239000002285 corn oil Substances 0.000 description 2
- 235000012343 cottonseed oil Nutrition 0.000 description 2
- 239000013078 crystal Substances 0.000 description 2
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 2
- SNRCKKQHDUIRIY-UHFFFAOYSA-L cyclopenta-1,4-dien-1-yl(diphenyl)phosphane;dichloromethane;dichloropalladium;iron(2+) Chemical compound [Fe+2].ClCCl.Cl[Pd]Cl.C1=C[CH-]C(P(C=2C=CC=CC=2)C=2C=CC=CC=2)=C1.C1=C[CH-]C(P(C=2C=CC=CC=2)C=2C=CC=CC=2)=C1 SNRCKKQHDUIRIY-UHFFFAOYSA-L 0.000 description 2
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 2
- 239000000134 cyclophilin inhibitor Substances 0.000 description 2
- ZVTDLPBHTSMEJZ-JSZLBQEHSA-N danoprevir Chemical compound O=C([C@@]12C[C@H]1\C=C/CCCCC[C@@H](C(N1C[C@@H](C[C@H]1C(=O)N2)OC(=O)N1CC2=C(F)C=CC=C2C1)=O)NC(=O)OC(C)(C)C)NS(=O)(=O)C1CC1 ZVTDLPBHTSMEJZ-JSZLBQEHSA-N 0.000 description 2
- 238000007405 data analysis Methods 0.000 description 2
- NKLCNNUWBJBICK-UHFFFAOYSA-N dess–martin periodinane Chemical compound C1=CC=C2I(OC(=O)C)(OC(C)=O)(OC(C)=O)OC(=O)C2=C1 NKLCNNUWBJBICK-UHFFFAOYSA-N 0.000 description 2
- 235000014113 dietary fatty acids Nutrition 0.000 description 2
- AJDPNPAGZMZOMN-UHFFFAOYSA-N diethyl (4-oxo-1,2,3-benzotriazin-3-yl) phosphate Chemical compound C1=CC=C2C(=O)N(OP(=O)(OCC)OCC)N=NC2=C1 AJDPNPAGZMZOMN-UHFFFAOYSA-N 0.000 description 2
- 239000012153 distilled water Substances 0.000 description 2
- 231100000673 dose–response relationship Toxicity 0.000 description 2
- 229940079593 drug Drugs 0.000 description 2
- 239000000839 emulsion Substances 0.000 description 2
- 150000002148 esters Chemical class 0.000 description 2
- 235000019325 ethyl cellulose Nutrition 0.000 description 2
- 229920001249 ethyl cellulose Polymers 0.000 description 2
- MMXKVMNBHPAILY-UHFFFAOYSA-N ethyl laurate Chemical compound CCCCCCCCCCCC(=O)OCC MMXKVMNBHPAILY-UHFFFAOYSA-N 0.000 description 2
- LVGKNOAMLMIIKO-QXMHVHEDSA-N ethyl oleate Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OCC LVGKNOAMLMIIKO-QXMHVHEDSA-N 0.000 description 2
- 229940093471 ethyl oleate Drugs 0.000 description 2
- 239000000194 fatty acid Substances 0.000 description 2
- 229930195729 fatty acid Natural products 0.000 description 2
- 238000001914 filtration Methods 0.000 description 2
- 238000007429 general method Methods 0.000 description 2
- 230000002068 genetic effect Effects 0.000 description 2
- 239000008103 glucose Substances 0.000 description 2
- 150000004795 grignard reagents Chemical class 0.000 description 2
- 238000010438 heat treatment Methods 0.000 description 2
- 125000005842 heteroatom Chemical group 0.000 description 2
- 235000010979 hydroxypropyl methyl cellulose Nutrition 0.000 description 2
- 239000001866 hydroxypropyl methyl cellulose Substances 0.000 description 2
- 229920003088 hydroxypropyl methyl cellulose Polymers 0.000 description 2
- UFVKGYZPFZQRLF-UHFFFAOYSA-N hydroxypropyl methyl cellulose Chemical compound OC1C(O)C(OC)OC(CO)C1OC1C(O)C(O)C(OC2C(C(O)C(OC3C(C(O)C(O)C(CO)O3)O)C(CO)O2)O)C(CO)O1 UFVKGYZPFZQRLF-UHFFFAOYSA-N 0.000 description 2
- 239000005457 ice water Substances 0.000 description 2
- 230000002519 immonomodulatory effect Effects 0.000 description 2
- 230000028993 immune response Effects 0.000 description 2
- 238000011534 incubation Methods 0.000 description 2
- 239000004615 ingredient Substances 0.000 description 2
- 239000007924 injection Substances 0.000 description 2
- 238000002347 injection Methods 0.000 description 2
- 238000009434 installation Methods 0.000 description 2
- 108010042414 interferon gamma-1b Proteins 0.000 description 2
- 230000003452 intergenotypic effect Effects 0.000 description 2
- 230000000670 limiting effect Effects 0.000 description 2
- KWGKDLIKAYFUFQ-UHFFFAOYSA-M lithium chloride Chemical compound [Li+].[Cl-] KWGKDLIKAYFUFQ-UHFFFAOYSA-M 0.000 description 2
- 239000006166 lysate Substances 0.000 description 2
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 2
- 235000010355 mannitol Nutrition 0.000 description 2
- 239000000594 mannitol Substances 0.000 description 2
- 239000003550 marker Substances 0.000 description 2
- 230000004060 metabolic process Effects 0.000 description 2
- 229910052751 metal Inorganic materials 0.000 description 2
- 239000002184 metal Substances 0.000 description 2
- QARBMVPHQWIHKH-UHFFFAOYSA-N methanesulfonyl chloride Chemical compound CS(Cl)(=O)=O QARBMVPHQWIHKH-UHFFFAOYSA-N 0.000 description 2
- XMJHPCRAQCTCFT-UHFFFAOYSA-N methyl chloroformate Chemical compound COC(Cl)=O XMJHPCRAQCTCFT-UHFFFAOYSA-N 0.000 description 2
- UKVKDOZVGWGNML-WBAXXEDZSA-N methyl n-[(2s)-3-methyl-1-[(2s,4s)-4-methyl-2-(5-phenyl-1h-imidazol-2-yl)pyrrolidin-1-yl]-1-oxobutan-2-yl]carbamate Chemical compound COC(=O)N[C@@H](C(C)C)C(=O)N1C[C@@H](C)C[C@H]1C1=NC(C=2C=CC=CC=2)=CN1 UKVKDOZVGWGNML-WBAXXEDZSA-N 0.000 description 2
- 125000002757 morpholinyl group Chemical group 0.000 description 2
- OYXYHARRSNVHAS-UHFFFAOYSA-N n-[4-bromo-2-fluoro-5-(trifluoromethoxy)phenyl]-6-fluoropyridine-3-carboxamide Chemical compound C1=NC(F)=CC=C1C(=O)NC1=CC(OC(F)(F)F)=C(Br)C=C1F OYXYHARRSNVHAS-UHFFFAOYSA-N 0.000 description 2
- RICZEKWVNZFTNZ-LFGITCQGSA-N narlaprevir Chemical compound N([C@H](C(=O)N1C[C@H]2[C@H](C2(C)C)[C@H]1C(=O)N[C@@H](CCCC)C(=O)C(=O)NC1CC1)C(C)(C)C)C(=O)NC1(CS(=O)(=O)C(C)(C)C)CCCCC1 RICZEKWVNZFTNZ-LFGITCQGSA-N 0.000 description 2
- 229960004927 neomycin Drugs 0.000 description 2
- YCWSUKQGVSGXJO-NTUHNPAUSA-N nifuroxazide Chemical group C1=CC(O)=CC=C1C(=O)N\N=C\C1=CC=C([N+]([O-])=O)O1 YCWSUKQGVSGXJO-NTUHNPAUSA-N 0.000 description 2
- 239000002773 nucleotide Substances 0.000 description 2
- 125000003729 nucleotide group Chemical group 0.000 description 2
- 239000004006 olive oil Substances 0.000 description 2
- 239000010502 orange oil Substances 0.000 description 2
- 229910052760 oxygen Inorganic materials 0.000 description 2
- 239000001301 oxygen Substances 0.000 description 2
- NXJCBFBQEVOTOW-UHFFFAOYSA-L palladium(2+);dihydroxide Chemical compound O[Pd]O NXJCBFBQEVOTOW-UHFFFAOYSA-L 0.000 description 2
- IVDFJHOHABJVEH-UHFFFAOYSA-N pinacol Chemical compound CC(C)(O)C(C)(C)O IVDFJHOHABJVEH-UHFFFAOYSA-N 0.000 description 2
- 125000003386 piperidinyl group Chemical group 0.000 description 2
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical compound [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 2
- 229920001592 potato starch Polymers 0.000 description 2
- 239000003755 preservative agent Substances 0.000 description 2
- 108090000623 proteins and genes Proteins 0.000 description 2
- 125000003226 pyrazolyl group Chemical group 0.000 description 2
- 230000005855 radiation Effects 0.000 description 2
- 125000006413 ring segment Chemical group 0.000 description 2
- 239000008159 sesame oil Substances 0.000 description 2
- 235000011803 sesame oil Nutrition 0.000 description 2
- 239000000377 silicon dioxide Substances 0.000 description 2
- 229960002091 simeprevir Drugs 0.000 description 2
- JTZZSQYMACOLNN-VDWJNHBNSA-N simeprevir Chemical compound O=C([C@@]12C[C@H]1\C=C/CCCCN(C)C(=O)[C@H]1[C@H](C(N2)=O)C[C@H](C1)OC=1C2=CC=C(C(=C2N=C(C=1)C=1SC=C(N=1)C(C)C)C)OC)NS(=O)(=O)C1CC1 JTZZSQYMACOLNN-VDWJNHBNSA-N 0.000 description 2
- 238000002741 site-directed mutagenesis Methods 0.000 description 2
- 239000011780 sodium chloride Substances 0.000 description 2
- LPXPTNMVRIOKMN-UHFFFAOYSA-M sodium nitrite Chemical compound [Na+].[O-]N=O LPXPTNMVRIOKMN-UHFFFAOYSA-M 0.000 description 2
- GEHJYWRUCIMESM-UHFFFAOYSA-L sodium sulfite Chemical compound [Na+].[Na+].[O-]S([O-])=O GEHJYWRUCIMESM-UHFFFAOYSA-L 0.000 description 2
- 229960002063 sofosbuvir Drugs 0.000 description 2
- 239000007858 starting material Substances 0.000 description 2
- 229910052717 sulfur Inorganic materials 0.000 description 2
- 239000006188 syrup Substances 0.000 description 2
- 235000020357 syrup Nutrition 0.000 description 2
- 239000000454 talc Substances 0.000 description 2
- 229910052623 talc Inorganic materials 0.000 description 2
- 235000012222 talc Nutrition 0.000 description 2
- NHKZSTHOYNWEEZ-AFCXAGJDSA-N taribavirin Chemical compound N1=C(C(=N)N)N=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 NHKZSTHOYNWEEZ-AFCXAGJDSA-N 0.000 description 2
- 229950006081 taribavirin Drugs 0.000 description 2
- BBAWEDCPNXPBQM-GDEBMMAJSA-N telaprevir Chemical compound N([C@H](C(=O)N[C@H](C(=O)N1C[C@@H]2CCC[C@@H]2[C@H]1C(=O)N[C@@H](CCC)C(=O)C(=O)NC1CC1)C(C)(C)C)C1CCCCC1)C(=O)C1=CN=CC=N1 BBAWEDCPNXPBQM-GDEBMMAJSA-N 0.000 description 2
- HMBPBABUQSPBMV-HOCLYGCPSA-N tert-butyl (2s,4s)-2-[5-(4-bromophenyl)-1h-imidazol-2-yl]-4-methoxypyrrolidine-1-carboxylate Chemical compound CC(C)(C)OC(=O)N1C[C@@H](OC)C[C@H]1C1=NC(C=2C=CC(Br)=CC=2)=CN1 HMBPBABUQSPBMV-HOCLYGCPSA-N 0.000 description 2
- STCDLQPMCHTNRN-NEPJUHHUSA-N tert-butyl (2s,5r)-4-(5-aminopyridin-2-yl)-2,5-dimethylpiperazine-1-carboxylate Chemical compound C[C@@H]1CN(C(=O)OC(C)(C)C)[C@@H](C)CN1C1=CC=C(N)C=N1 STCDLQPMCHTNRN-NEPJUHHUSA-N 0.000 description 2
- HHLRPRZVPCFODH-LLVKDONJSA-N tert-butyl (3r)-3-methyl-4-(5-nitropyridin-2-yl)piperazine-1-carboxylate Chemical compound C[C@@H]1CN(C(=O)OC(C)(C)C)CCN1C1=CC=C([N+]([O-])=O)C=N1 HHLRPRZVPCFODH-LLVKDONJSA-N 0.000 description 2
- QATRZAULNXYJGP-CYBMUJFWSA-N tert-butyl (3r)-4-[5-[[4-bromo-2-chloro-5-(trifluoromethoxy)benzoyl]amino]pyridin-2-yl]-3-methylpiperazine-1-carboxylate Chemical compound C[C@@H]1CN(C(=O)OC(C)(C)C)CCN1C(N=C1)=CC=C1NC(=O)C1=CC(OC(F)(F)F)=C(Br)C=C1Cl QATRZAULNXYJGP-CYBMUJFWSA-N 0.000 description 2
- VLHSOIWDWWPXES-CYBMUJFWSA-N tert-butyl (3r)-4-[5-[[4-bromo-2-fluoro-5-(trifluoromethoxy)phenyl]carbamoyl]pyridin-2-yl]-3-methylpiperazine-1-carboxylate Chemical compound C[C@@H]1CN(C(=O)OC(C)(C)C)CCN1C1=CC=C(C(=O)NC=2C(=CC(Br)=C(OC(F)(F)F)C=2)F)C=N1 VLHSOIWDWWPXES-CYBMUJFWSA-N 0.000 description 2
- IOGXOCVLYRDXLW-UHFFFAOYSA-N tert-butyl nitrite Chemical compound CC(C)(C)ON=O IOGXOCVLYRDXLW-UHFFFAOYSA-N 0.000 description 2
- 239000012414 tert-butyl nitrite Substances 0.000 description 2
- 238000002560 therapeutic procedure Methods 0.000 description 2
- 238000004809 thin layer chromatography Methods 0.000 description 2
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 2
- 235000010487 tragacanth Nutrition 0.000 description 2
- 239000000196 tragacanth Substances 0.000 description 2
- 229940116362 tragacanth Drugs 0.000 description 2
- HPAPGONEMPZXMM-CMWVUSIZSA-N vaniprevir Chemical compound O=C([C@H]1C[C@@H]2OC(=O)N3CC=4C=CC=C(C=4C3)CCCCC(C)(C)COC(=O)N[C@@H](C(N1C2)=O)C(C)(C)C)N[C@]1(C(=O)NS(=O)(=O)C2CC2)C[C@H]1C=C HPAPGONEMPZXMM-CMWVUSIZSA-N 0.000 description 2
- 229950000843 vaniprevir Drugs 0.000 description 2
- 239000001993 wax Substances 0.000 description 2
- QIJRTFXNRTXDIP-UHFFFAOYSA-N (1-carboxy-2-sulfanylethyl)azanium;chloride;hydrate Chemical compound O.Cl.SCC(N)C(O)=O QIJRTFXNRTXDIP-UHFFFAOYSA-N 0.000 description 1
- VQJGUUHKSTYEGE-GCYSTPHZSA-N (2S,4R)-4-hydroxypyrrolidine-2-carboxylic acid Chemical compound N1[C@H](C(=O)O)C[C@@H](O)C1.N1[C@H](C(=O)O)C[C@@H](O)C1.N1[C@H](C(=O)O)C[C@@H](O)C1 VQJGUUHKSTYEGE-GCYSTPHZSA-N 0.000 description 1
- ZKWHCGXFTFFFBL-AAEUAGOBSA-N (2S,4S)-2-[5-(4-bromophenyl)-1H-imidazol-2-yl]-4-methoxypyrrolidine-1-carboxylic acid Chemical compound BrC1=CC=C(C=C1)C=1N=C(NC=1)[C@H]1N(C[C@H](C1)OC)C(=O)O ZKWHCGXFTFFFBL-AAEUAGOBSA-N 0.000 description 1
- XFFOVQLJFXBTJC-WHFBIAKZSA-N (2S,4S)-4-methylpyrrolidine-1,2-dicarboxylic acid Chemical compound C[C@H]1C[C@@H](C(O)=O)N(C(O)=O)C1 XFFOVQLJFXBTJC-WHFBIAKZSA-N 0.000 description 1
- HDUCHXGIUDFNEP-MRVPVSSYSA-N (2r)-2-methyl-1-(5-nitropyridin-2-yl)piperazine Chemical compound C[C@@H]1CNCCN1C1=CC=C([N+]([O-])=O)C=N1 HDUCHXGIUDFNEP-MRVPVSSYSA-N 0.000 description 1
- IRZRJANZDIOOIF-GAJNKVMBSA-N (2r,3r,4r,5r)-2-(4-aminopyrrolo[2,3-d]pyrimidin-7-yl)-5-(hydroxymethyl)-3-methyloxolane-3,4-diol Chemical compound C[C@@]1(O)[C@H](O)[C@@H](CO)O[C@H]1N1C2=NC=NC(N)=C2C=C1 IRZRJANZDIOOIF-GAJNKVMBSA-N 0.000 description 1
- JNYAEWCLZODPBN-JGWLITMVSA-N (2r,3r,4s)-2-[(1r)-1,2-dihydroxyethyl]oxolane-3,4-diol Chemical class OC[C@@H](O)[C@H]1OC[C@H](O)[C@H]1O JNYAEWCLZODPBN-JGWLITMVSA-N 0.000 description 1
- MJLQPFJGZTYCMH-LURJTMIESA-N (2s)-1-[(2-methylpropan-2-yl)oxycarbonyl]-5-oxopyrrolidine-2-carboxylic acid Chemical compound CC(C)(C)OC(=O)N1[C@H](C(O)=O)CCC1=O MJLQPFJGZTYCMH-LURJTMIESA-N 0.000 description 1
- QGHRBLCZXFQZBB-QMMMGPOBSA-N (2s)-1-methoxycarbonyl-2-methylpyrrolidine-2-carboxylic acid Chemical compound COC(=O)N1CCC[C@@]1(C)C(O)=O QGHRBLCZXFQZBB-QMMMGPOBSA-N 0.000 description 1
- XLZJPHKIECMDPG-LURJTMIESA-N (2s)-2-azaniumyl-2-(oxan-4-yl)acetate Chemical compound OC(=O)[C@@H](N)C1CCOCC1 XLZJPHKIECMDPG-LURJTMIESA-N 0.000 description 1
- OAWXZFGKDDFTGS-BYPYZUCNSA-N (2s)-pyrrolidine-1,2-dicarboxylic acid Chemical compound OC(=O)[C@@H]1CCCN1C(O)=O OAWXZFGKDDFTGS-BYPYZUCNSA-N 0.000 description 1
- LBEQBTXAQXRZEG-KOLCDFICSA-N (2s,4r)-4-(4-methylphenyl)sulfonyloxypyrrolidine-1,2-dicarboxylic acid Chemical compound C1=CC(C)=CC=C1S(=O)(=O)O[C@H]1CN(C(O)=O)[C@H](C(O)=O)C1 LBEQBTXAQXRZEG-KOLCDFICSA-N 0.000 description 1
- ZCHCMXYJFNBXJJ-YUMQZZPRSA-N (2s,4s)-1-[(2-methylpropan-2-yl)oxycarbonyl]-4-methylsulfanylpyrrolidine-2-carboxylic acid Chemical compound CS[C@H]1C[C@@H](C(O)=O)N(C(=O)OC(C)(C)C)C1 ZCHCMXYJFNBXJJ-YUMQZZPRSA-N 0.000 description 1
- YUJNZTDWBSEPIG-QWRGUYRKSA-N (2s,4s)-1-[(2-methylpropan-2-yl)oxycarbonyl]-4-morpholin-4-ylpyrrolidine-2-carboxylic acid Chemical compound C1[C@@H](C(O)=O)N(C(=O)OC(C)(C)C)C[C@H]1N1CCOCC1 YUJNZTDWBSEPIG-QWRGUYRKSA-N 0.000 description 1
- BFVIGWTWAQLEFO-IUCAKERBSA-N (2s,4s)-4-(dimethylamino)-1-[(2-methylpropan-2-yl)oxycarbonyl]pyrrolidine-2-carboxylic acid Chemical compound CN(C)[C@H]1C[C@@H](C(O)=O)N(C(=O)OC(C)(C)C)C1 BFVIGWTWAQLEFO-IUCAKERBSA-N 0.000 description 1
- QKBOXIBMPVSYAV-WDSKDSINSA-N (2s,4s)-4-(dimethylamino)pyrrolidine-1,2-dicarboxylic acid Chemical compound CN(C)[C@H]1C[C@@H](C(O)=O)N(C(O)=O)C1 QKBOXIBMPVSYAV-WDSKDSINSA-N 0.000 description 1
- SLJSRCNCQDNSEY-IMJSIDKUSA-N (2s,4s)-4-aminopyrrolidine-1,2-dicarboxylic acid Chemical compound N[C@H]1C[C@@H](C(O)=O)N(C(O)=O)C1 SLJSRCNCQDNSEY-IMJSIDKUSA-N 0.000 description 1
- WQBOWGPMMLEVOY-IMJSIDKUSA-N (2s,4s)-4-azidopyrrolidine-1,2-dicarboxylic acid Chemical compound OC(=O)[C@@H]1C[C@H](N=[N+]=[N-])CN1C(O)=O WQBOWGPMMLEVOY-IMJSIDKUSA-N 0.000 description 1
- QLEZWYHCXVFRKO-WHFBIAKZSA-N (2s,4s)-4-methoxypyrrolidine-1,2-dicarboxylic acid Chemical compound CO[C@H]1C[C@@H](C(O)=O)N(C(O)=O)C1 QLEZWYHCXVFRKO-WHFBIAKZSA-N 0.000 description 1
- VAWFVWXTWISVIR-STQMWFEESA-N (3s,5s)-5-[5-(4-bromophenyl)-1h-imidazol-2-yl]-n,n-dimethylpyrrolidin-3-amine Chemical compound C1[C@H](N(C)C)CN[C@@H]1C1=NC(C=2C=CC(Br)=CC=2)=CN1 VAWFVWXTWISVIR-STQMWFEESA-N 0.000 description 1
- AQHMBDAHQGYLIU-XNFHFXFQSA-N (3s,6s,9s,12r,15s,18s,21s,24s,27r,30s,33s)-27-[2-(dimethylamino)ethylsulfanyl]-30-ethyl-33-[(e,1r,2r)-1-hydroxy-2-methylhex-4-enyl]-24-(2-hydroxy-2-methylpropyl)-1,4,7,10,12,15,19,25,28-nonamethyl-6,9,18-tris(2-methylpropyl)-3,21-di(propan-2-yl)-1,4,7,10, Chemical compound CC[C@@H]1NC(=O)[C@H]([C@H](O)[C@H](C)C\C=C\C)N(C)C(=O)[C@H](C(C)C)N(C)C(=O)[C@H](CC(C)C)N(C)C(=O)[C@H](CC(C)C)N(C)C(=O)[C@@H](C)NC(=O)[C@H](C)NC(=O)[C@H](CC(C)C)N(C)C(=O)[C@H](C(C)C)NC(=O)[C@H](CC(C)(C)O)N(C)C(=O)[C@@H](SCCN(C)C)N(C)C1=O AQHMBDAHQGYLIU-XNFHFXFQSA-N 0.000 description 1
- YQUCBFIQSJVCOR-JOCHJYFZSA-N (7r)-14-cyclohexyl-7-{[2-(dimethylamino)ethyl](methyl)amino}-7,8-dihydro-6h-indolo[1,2-e][1,5]benzoxazocine-11-carboxylic acid Chemical compound C([C@@H](CN1C2=CC(=CC=C22)C(O)=O)N(C)CCN(C)C)OC3=CC=CC=C3C1=C2C1CCCCC1 YQUCBFIQSJVCOR-JOCHJYFZSA-N 0.000 description 1
- KYXJZFVLUAJUPY-UWVGGRQHSA-N (8s)-7-[(2s)-2-(methoxycarbonylamino)-3-methylbutanoyl]-1,4-dioxa-7-azaspiro[4.4]nonane-8-carboxylic acid Chemical compound C1[C@@H](C(O)=O)N(C(=O)[C@H](C(C)C)NC(=O)OC)CC21OCCO2 KYXJZFVLUAJUPY-UWVGGRQHSA-N 0.000 description 1
- 125000006704 (C5-C6) cycloalkyl group Chemical group 0.000 description 1
- GVJHHUAWPYXKBD-IEOSBIPESA-N (R)-alpha-Tocopherol Chemical class OC1=C(C)C(C)=C2O[C@@](CCC[C@H](C)CCC[C@H](C)CCCC(C)C)(C)CCC2=C1C GVJHHUAWPYXKBD-IEOSBIPESA-N 0.000 description 1
- SQHSJJGGWYIFCD-UHFFFAOYSA-N (e)-1-diazonio-1-dimethoxyphosphorylprop-1-en-2-olate Chemical compound COP(=O)(OC)C(\[N+]#N)=C(\C)[O-] SQHSJJGGWYIFCD-UHFFFAOYSA-N 0.000 description 1
- 125000003088 (fluoren-9-ylmethoxy)carbonyl group Chemical group 0.000 description 1
- 108010030583 (melle-4)cyclosporin Proteins 0.000 description 1
- DDMOUSALMHHKOS-UHFFFAOYSA-N 1,2-dichloro-1,1,2,2-tetrafluoroethane Chemical compound FC(F)(Cl)C(F)(F)Cl DDMOUSALMHHKOS-UHFFFAOYSA-N 0.000 description 1
- CXUAEBDTJFKMBV-UHFFFAOYSA-N 1-(chloromethyl)-2,3,4,5,6-pentamethylbenzene Chemical compound CC1=C(C)C(C)=C(CCl)C(C)=C1C CXUAEBDTJFKMBV-UHFFFAOYSA-N 0.000 description 1
- SJJCQDRGABAVBB-UHFFFAOYSA-N 1-hydroxy-2-naphthoic acid Chemical compound C1=CC=CC2=C(O)C(C(=O)O)=CC=C21 SJJCQDRGABAVBB-UHFFFAOYSA-N 0.000 description 1
- 125000004066 1-hydroxyethyl group Chemical group [H]OC([H])([*])C([H])([H])[H] 0.000 description 1
- JQCSUVJDBHJKNG-UHFFFAOYSA-N 1-methoxy-ethyl Chemical group C[CH]OC JQCSUVJDBHJKNG-UHFFFAOYSA-N 0.000 description 1
- IIZPXYDJLKNOIY-JXPKJXOSSA-N 1-palmitoyl-2-arachidonoyl-sn-glycero-3-phosphocholine Chemical class CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCC\C=C/C\C=C/C\C=C/C\C=C/CCCCC IIZPXYDJLKNOIY-JXPKJXOSSA-N 0.000 description 1
- 125000004214 1-pyrrolidinyl group Chemical group [H]C1([H])N(*)C([H])([H])C([H])([H])C1([H])[H] 0.000 description 1
- NKWCGTOZTHZDHB-UHFFFAOYSA-N 1h-imidazol-1-ium-4-carboxylate Chemical compound OC(=O)C1=CNC=N1 NKWCGTOZTHZDHB-UHFFFAOYSA-N 0.000 description 1
- BFNMOMYTTGHNGJ-UHFFFAOYSA-N 2,2-dimethylcyclopropane-1-carboxylic acid Chemical compound CC1(C)CC1C(O)=O BFNMOMYTTGHNGJ-UHFFFAOYSA-N 0.000 description 1
- 125000003562 2,2-dimethylpentyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C(C([H])([H])[H])(C([H])([H])[H])C([H])([H])* 0.000 description 1
- YFXGICNMLCGLHJ-RSKRLRQZSA-N 2,2-dimethylpropyl (2s)-2-[[[(2r,3r,4r,5r)-5-(2-amino-6-methoxypurin-9-yl)-3,4-dihydroxy-4-methyloxolan-2-yl]methoxy-naphthalen-1-yloxyphosphoryl]amino]propanoate Chemical compound C1=CC=C2C(OP(=O)(N[C@@H](C)C(=O)OCC(C)(C)C)OC[C@H]3O[C@H]([C@]([C@@H]3O)(C)O)N3C=4N=C(N)N=C(C=4N=C3)OC)=CC=CC2=C1 YFXGICNMLCGLHJ-RSKRLRQZSA-N 0.000 description 1
- 125000003821 2-(trimethylsilyl)ethoxymethyl group Chemical group [H]C([H])([H])[Si](C([H])([H])[H])(C([H])([H])[H])C([H])([H])C(OC([H])([H])[*])([H])[H] 0.000 description 1
- JKMHFZQWWAIEOD-UHFFFAOYSA-N 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid Chemical compound OCC[NH+]1CCN(CCS([O-])(=O)=O)CC1 JKMHFZQWWAIEOD-UHFFFAOYSA-N 0.000 description 1
- ZQFATRVLQKIVTH-UHFFFAOYSA-N 2-amino-1-(4-bromophenyl)ethanone Chemical compound NCC(=O)C1=CC=C(Br)C=C1 ZQFATRVLQKIVTH-UHFFFAOYSA-N 0.000 description 1
- LTBFNTUNLKPFPI-UHFFFAOYSA-N 2-bromo-1-chloro-4-(trifluoromethoxy)benzene Chemical compound FC(F)(F)OC1=CC=C(Cl)C(Br)=C1 LTBFNTUNLKPFPI-UHFFFAOYSA-N 0.000 description 1
- 125000006176 2-ethylbutyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(C([H])([H])*)C([H])([H])C([H])([H])[H] 0.000 description 1
- LSRVHFQASBQSGA-UHFFFAOYSA-N 2-fluoro-3-(trifluoromethoxy)aniline Chemical compound NC1=CC=CC(OC(F)(F)F)=C1F LSRVHFQASBQSGA-UHFFFAOYSA-N 0.000 description 1
- HQUWXEXDIIWBBY-UHFFFAOYSA-N 2-fluoro-5-(trifluoromethoxy)aniline Chemical compound NC1=CC(OC(F)(F)F)=CC=C1F HQUWXEXDIIWBBY-UHFFFAOYSA-N 0.000 description 1
- LLLVHTWJGWNRBD-UHFFFAOYSA-N 2-fluoropyridine-3-carboxylic acid Chemical compound OC(=O)C1=CC=CN=C1F LLLVHTWJGWNRBD-UHFFFAOYSA-N 0.000 description 1
- JNODDICFTDYODH-UHFFFAOYSA-N 2-hydroxytetrahydrofuran Chemical compound OC1CCCO1 JNODDICFTDYODH-UHFFFAOYSA-N 0.000 description 1
- 125000004493 2-methylbut-1-yl group Chemical group CC(C*)CC 0.000 description 1
- JWUJQDFVADABEY-UHFFFAOYSA-N 2-methyltetrahydrofuran Chemical compound CC1CCCO1 JWUJQDFVADABEY-UHFFFAOYSA-N 0.000 description 1
- 125000000175 2-thienyl group Chemical group S1C([*])=C([H])C([H])=C1[H] 0.000 description 1
- FPQQSJJWHUJYPU-UHFFFAOYSA-N 3-(dimethylamino)propyliminomethylidene-ethylazanium;chloride Chemical compound Cl.CCN=C=NCCCN(C)C FPQQSJJWHUJYPU-UHFFFAOYSA-N 0.000 description 1
- RZXQBIKGWSLVEK-UHFFFAOYSA-N 3-[(4-methylcyclohexanecarbonyl)-propan-2-ylamino]-5-phenylthiophene-2-carboxylic acid Chemical compound C1=C(C=2C=CC=CC=2)SC(C(O)=O)=C1N(C(C)C)C(=O)C1CCC(C)CC1 RZXQBIKGWSLVEK-UHFFFAOYSA-N 0.000 description 1
- JBCOHZWNVCQFEA-TYPXCFOJSA-N 3-chloro-n-[6-[(2r)-4-(2,2-dimethylpropanoyl)-2-methylpiperazin-1-yl]pyridin-3-yl]-4-[4-[2-[(2s,4s)-4-methylpyrrolidin-2-yl]-1h-imidazol-5-yl]phenyl]-5-(trifluoromethoxy)benzamide Chemical compound C1[C@H](C)CN[C@@H]1C1=NC(C=2C=CC(=CC=2)C=2C(=CC(=CC=2Cl)C(=O)NC=2C=NC(=CC=2)N2[C@@H](CN(CC2)C(=O)C(C)(C)C)C)OC(F)(F)F)=CN1 JBCOHZWNVCQFEA-TYPXCFOJSA-N 0.000 description 1
- ZANPJXNYBVVNSD-UHFFFAOYSA-N 4-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)aniline Chemical compound O1C(C)(C)C(C)(C)OB1C1=CC=C(N)C=C1 ZANPJXNYBVVNSD-UHFFFAOYSA-N 0.000 description 1
- VNMDHXFSFPKMKJ-UHFFFAOYSA-N 4-(5-aminopyridin-2-yl)-3-methylpiperazine-1-carboxylic acid Chemical compound NC=1C=CC(=NC1)N1C(CN(CC1)C(=O)O)C VNMDHXFSFPKMKJ-UHFFFAOYSA-N 0.000 description 1
- LOIMFVQYRUUXED-APTRMMRNSA-N 4-[4-[2-[(2s,4s)-1-[(2s)-2-(methoxycarbonylamino)-3-methylbutanoyl]-4-methylsulfonylpyrrolidin-2-yl]-1h-imidazol-5-yl]phenyl]-3-(trifluoromethoxy)benzoic acid Chemical compound COC(=O)N[C@@H](C(C)C)C(=O)N1C[C@@H](S(C)(=O)=O)C[C@H]1C1=NC(C=2C=CC(=CC=2)C=2C(=CC(=CC=2)C(O)=O)OC(F)(F)F)=CN1 LOIMFVQYRUUXED-APTRMMRNSA-N 0.000 description 1
- CMIFUXZCAOWQDR-ZEQRLZLVSA-N 4-[4-[2-[(8s)-7-[(2s)-2-(methoxycarbonylamino)-3-methylbutanoyl]-1,4-dioxa-7-azaspiro[4.4]nonan-8-yl]-1h-imidazol-5-yl]phenyl]benzoic acid Chemical compound COC(=O)N[C@@H](C(C)C)C(=O)N([C@@H](C1)C=2NC=C(N=2)C=2C=CC(=CC=2)C=2C=CC(=CC=2)C(O)=O)CC21OCCO2 CMIFUXZCAOWQDR-ZEQRLZLVSA-N 0.000 description 1
- MAQDQJWCSSCURR-UHFFFAOYSA-N 4-[5-(cyclopropanecarbonylamino)-2-(trifluoromethoxy)phenyl]-n-[4-[(4-propylsulfonylpiperazin-1-yl)methyl]phenyl]benzamide Chemical compound C1CN(S(=O)(=O)CCC)CCN1CC(C=C1)=CC=C1NC(=O)C1=CC=C(C=2C(=CC=C(NC(=O)C3CC3)C=2)OC(F)(F)F)C=C1 MAQDQJWCSSCURR-UHFFFAOYSA-N 0.000 description 1
- NUCJNDMRLBQJAH-UHFFFAOYSA-N 4-bromo-2-chloro-5-(trifluoromethoxy)aniline Chemical compound NC1=CC(OC(F)(F)F)=C(Br)C=C1Cl NUCJNDMRLBQJAH-UHFFFAOYSA-N 0.000 description 1
- FXGHMQFEQHOELI-UHFFFAOYSA-N 4-bromo-2-chloro-5-(trifluoromethoxy)benzoic acid Chemical compound OC(=O)C1=CC(OC(F)(F)F)=C(Br)C=C1Cl FXGHMQFEQHOELI-UHFFFAOYSA-N 0.000 description 1
- LPTLQQLBRJFBIN-UHFFFAOYSA-N 4-bromo-2-chloro-5-(trifluoromethyl)aniline Chemical compound NC1=CC(C(F)(F)F)=C(Br)C=C1Cl LPTLQQLBRJFBIN-UHFFFAOYSA-N 0.000 description 1
- GBZLLLBFZOHRHO-UHFFFAOYSA-N 4-bromo-2-fluoro-3-(trifluoromethoxy)aniline Chemical compound NC1=CC=C(Br)C(OC(F)(F)F)=C1F GBZLLLBFZOHRHO-UHFFFAOYSA-N 0.000 description 1
- GRWSAFPBMLDAPS-UHFFFAOYSA-N 4-bromo-2-fluoro-3-(trifluoromethoxy)benzonitrile Chemical compound FC1=C(C#N)C=CC(Br)=C1OC(F)(F)F GRWSAFPBMLDAPS-UHFFFAOYSA-N 0.000 description 1
- LFTJNGSZCSGBFU-UHFFFAOYSA-N 4-bromo-3-(trifluoromethoxy)aniline Chemical compound NC1=CC=C(Br)C(OC(F)(F)F)=C1 LFTJNGSZCSGBFU-UHFFFAOYSA-N 0.000 description 1
- NNFCCFXAODDKRO-ZUCQERFBSA-N 5-(4-bromophenyl)-2-[(2S,4S)-4-methylpyrrolidin-2-yl]-1H-imidazole dihydrochloride Chemical compound Cl.Cl.C[C@@H]1CN[C@@H](C1)c1ncc([nH]1)-c1ccc(Br)cc1 NNFCCFXAODDKRO-ZUCQERFBSA-N 0.000 description 1
- QPKITSLIUXPBRK-RYUDHWBXSA-N 5-(4-bromophenyl)-2-[(2s,4s)-4-methoxypyrrolidin-2-yl]-1h-imidazole Chemical compound C1[C@H](OC)CN[C@@H]1C1=NC(C=2C=CC(Br)=CC=2)=CN1 QPKITSLIUXPBRK-RYUDHWBXSA-N 0.000 description 1
- XBEQSQDCBSKCHJ-UHFFFAOYSA-N 5-[[6-[2,4-bis(trifluoromethyl)phenyl]pyridazin-3-yl]methyl]-2-(2-fluorophenyl)imidazo[4,5-c]pyridine Chemical compound FC1=CC=CC=C1C1=NC2=CN(CC=3N=NC(=CC=3)C=3C(=CC(=CC=3)C(F)(F)F)C(F)(F)F)C=CC2=N1 XBEQSQDCBSKCHJ-UHFFFAOYSA-N 0.000 description 1
- WTDWVLJJJOTABN-UHFFFAOYSA-N 5-cyclopropyl-2-(4-fluorophenyl)-6-[(2-hydroxyethyl)(methylsulfonyl)amino]-n-methyl-1-benzofuran-3-carboxamide Chemical compound C1=C2C(C(=O)NC)=C(C=3C=CC(F)=CC=3)OC2=CC(N(CCO)S(C)(=O)=O)=C1C1CC1 WTDWVLJJJOTABN-UHFFFAOYSA-N 0.000 description 1
- UJDLCTNVHJEBDG-UHFFFAOYSA-N 6-fluoropyridine-3-carboxylic acid Chemical compound OC(=O)C1=CC=C(F)N=C1 UJDLCTNVHJEBDG-UHFFFAOYSA-N 0.000 description 1
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical group [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 1
- HBAQYPYDRFILMT-UHFFFAOYSA-N 8-[3-(1-cyclopropylpyrazol-4-yl)-1H-pyrazolo[4,3-d]pyrimidin-5-yl]-3-methyl-3,8-diazabicyclo[3.2.1]octan-2-one Chemical class C1(CC1)N1N=CC(=C1)C1=NNC2=C1N=C(N=C2)N1C2C(N(CC1CC2)C)=O HBAQYPYDRFILMT-UHFFFAOYSA-N 0.000 description 1
- RFGUWOCFYCYEDM-ZOMNBDOOSA-N 8v42y78hru Chemical compound OP([C@@]12C[C@H]1CCCCCCC[C@@H](C(=O)N1[C@H](C(N2)=O)C[C@H](C1)OC=1C2=CC=C(C(=C2N=C(C=1)C=1N=C(NC(C)C)SC=1)Cl)OC)NC(=O)OC1CCCC1)(=O)CC1=C(F)C=CC=C1F RFGUWOCFYCYEDM-ZOMNBDOOSA-N 0.000 description 1
- PVRFQJIRERYGTQ-DSQUMVBZSA-N 9-[(2s,4ar,6r,7r,7ar)-7-fluoro-7-methyl-2-oxo-2-propan-2-yloxy-4,4a,6,7a-tetrahydrofuro[3,2-d][1,3,2]dioxaphosphinin-6-yl]-6-ethoxypurin-2-amine Chemical compound C([C@H]1O2)O[P@@](=O)(OC(C)C)O[C@H]1[C@](F)(C)[C@@H]2N1C(N=C(N)N=C2OCC)=C2N=C1 PVRFQJIRERYGTQ-DSQUMVBZSA-N 0.000 description 1
- 244000215068 Acacia senegal Species 0.000 description 1
- OLROWHGDTNFZBH-XEMWPYQTSA-N Alisporivir Chemical compound CC[C@@H]1NC(=O)[C@H]([C@H](O)[C@H](C)C\C=C\C)N(C)C(=O)[C@H](C(C)C)N(C)C(=O)[C@H](CC(C)C)N(C)C(=O)[C@H](CC(C)C)N(C)C(=O)[C@@H](C)NC(=O)[C@H](C)NC(=O)[C@H](CC(C)C)N(C)C(=O)[C@H](C(C)C)NC(=O)[C@H](C(C)C)N(CC)C(=O)[C@@H](C)N(C)C1=O OLROWHGDTNFZBH-XEMWPYQTSA-N 0.000 description 1
- 239000005995 Aluminium silicate Substances 0.000 description 1
- 244000144725 Amygdalus communis Species 0.000 description 1
- 235000011437 Amygdalus communis Nutrition 0.000 description 1
- 108020005544 Antisense RNA Proteins 0.000 description 1
- 235000017060 Arachis glabrata Nutrition 0.000 description 1
- 244000105624 Arachis hypogaea Species 0.000 description 1
- 235000010777 Arachis hypogaea Nutrition 0.000 description 1
- 235000018262 Arachis monticola Nutrition 0.000 description 1
- WVDDGKGOMKODPV-UHFFFAOYSA-N Benzyl alcohol Chemical class OCC1=CC=CC=C1 WVDDGKGOMKODPV-UHFFFAOYSA-N 0.000 description 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-M Bicarbonate Chemical compound OC([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-M 0.000 description 1
- COVZYZSDYWQREU-UHFFFAOYSA-N Busulfan Chemical compound CS(=O)(=O)OCCCCOS(C)(=O)=O COVZYZSDYWQREU-UHFFFAOYSA-N 0.000 description 1
- OTXAMWFYPMNDME-FQQWJMKMSA-N CC[C@@H]1C[C@]1(NC(=O)[C@@H]1C[C@H](CN1C(=O)[C@@H](NC(=O)O[C@@H]1C[C@@H]2C[C@@H]2C1)C(C)(C)C)Oc1cc(nc2c(Cl)c(OCCN3CCOCC3)ccc12)-c1csc(NC(C)C)n1)C(O)=O Chemical compound CC[C@@H]1C[C@]1(NC(=O)[C@@H]1C[C@H](CN1C(=O)[C@@H](NC(=O)O[C@@H]1C[C@@H]2C[C@@H]2C1)C(C)(C)C)Oc1cc(nc2c(Cl)c(OCCN3CCOCC3)ccc12)-c1csc(NC(C)C)n1)C(O)=O OTXAMWFYPMNDME-FQQWJMKMSA-N 0.000 description 1
- DCERHCFNWRGHLK-UHFFFAOYSA-N C[Si](C)C Chemical compound C[Si](C)C DCERHCFNWRGHLK-UHFFFAOYSA-N 0.000 description 1
- UGFAIRIUMAVXCW-UHFFFAOYSA-N Carbon monoxide Chemical compound [O+]#[C-] UGFAIRIUMAVXCW-UHFFFAOYSA-N 0.000 description 1
- OKTJSMMVPCPJKN-NJFSPNSNSA-N Carbon-14 Chemical compound [14C] OKTJSMMVPCPJKN-NJFSPNSNSA-N 0.000 description 1
- 229920000623 Cellulose acetate phthalate Polymers 0.000 description 1
- UOPARZXQAUCOJF-UNTHUGQZSA-N ClC1=C(C(=CC(=C1)C(NC=1C=NC(=CC=1)N1[C@@H](CN(CC1)C(C(C)(C)C)=O)C)=O)OC(F)(F)F)C1=CC=C(C=C1)C=1N=C(NC=1)[C@H]1N(C[C@H](C1)C)C(=O)OC(C)(C)C Chemical compound ClC1=C(C(=CC(=C1)C(NC=1C=NC(=CC=1)N1[C@@H](CN(CC1)C(C(C)(C)C)=O)C)=O)OC(F)(F)F)C1=CC=C(C=C1)C=1N=C(NC=1)[C@H]1N(C[C@H](C1)C)C(=O)OC(C)(C)C UOPARZXQAUCOJF-UNTHUGQZSA-N 0.000 description 1
- 208000035473 Communicable disease Diseases 0.000 description 1
- 229920002261 Corn starch Polymers 0.000 description 1
- PMATZTZNYRCHOR-CGLBZJNRSA-N Cyclosporin A Chemical compound CC[C@@H]1NC(=O)[C@H]([C@H](O)[C@H](C)C\C=C\C)N(C)C(=O)[C@H](C(C)C)N(C)C(=O)[C@H](CC(C)C)N(C)C(=O)[C@H](CC(C)C)N(C)C(=O)[C@@H](C)NC(=O)[C@H](C)NC(=O)[C@H](CC(C)C)N(C)C(=O)[C@H](C(C)C)NC(=O)[C@H](CC(C)C)N(C)C(=O)CN(C)C1=O PMATZTZNYRCHOR-CGLBZJNRSA-N 0.000 description 1
- 229930105110 Cyclosporin A Natural products 0.000 description 1
- 108010036949 Cyclosporine Proteins 0.000 description 1
- 101710118188 DNA-binding protein HU-alpha Proteins 0.000 description 1
- 101710088194 Dehydrogenase Proteins 0.000 description 1
- 238000006646 Dess-Martin oxidation reaction Methods 0.000 description 1
- YZCKVEUIGOORGS-OUBTZVSYSA-N Deuterium Chemical compound [2H] YZCKVEUIGOORGS-OUBTZVSYSA-N 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- 235000019739 Dicalciumphosphate Nutrition 0.000 description 1
- 239000004338 Dichlorodifluoromethane Substances 0.000 description 1
- MYMOFIZGZYHOMD-UHFFFAOYSA-N Dioxygen Chemical compound O=O MYMOFIZGZYHOMD-UHFFFAOYSA-N 0.000 description 1
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 1
- 239000004265 EU approved glazing agent Substances 0.000 description 1
- 241000710781 Flaviviridae Species 0.000 description 1
- 229920000084 Gum arabic Polymers 0.000 description 1
- 102000002812 Heat-Shock Proteins Human genes 0.000 description 1
- 108010004889 Heat-Shock Proteins Proteins 0.000 description 1
- 208000005176 Hepatitis C Diseases 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- HAEJPQIATWHALX-KQYNXXCUSA-N ITP Chemical compound O[C@@H]1[C@H](O)[C@@H](COP(O)(=O)OP(O)(=O)OP(O)(O)=O)O[C@H]1N1C(N=CNC2=O)=C2N=C1 HAEJPQIATWHALX-KQYNXXCUSA-N 0.000 description 1
- 206010022004 Influenza like illness Diseases 0.000 description 1
- 108010078049 Interferon alpha-2 Proteins 0.000 description 1
- QAQJMLQRFWZOBN-LAUBAEHRSA-N L-ascorbyl-6-palmitate Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](O)[C@H]1OC(=O)C(O)=C1O QAQJMLQRFWZOBN-LAUBAEHRSA-N 0.000 description 1
- 239000011786 L-ascorbyl-6-palmitate Substances 0.000 description 1
- KZSNJWFQEVHDMF-BYPYZUCNSA-N L-valine Chemical compound CC(C)[C@H](N)C(O)=O KZSNJWFQEVHDMF-BYPYZUCNSA-N 0.000 description 1
- 240000003183 Manihot esculenta Species 0.000 description 1
- 235000016735 Manihot esculenta subsp esculenta Nutrition 0.000 description 1
- 241001465754 Metazoa Species 0.000 description 1
- CERQOIWHTDAKMF-UHFFFAOYSA-N Methacrylic acid Chemical compound CC(=C)C(O)=O CERQOIWHTDAKMF-UHFFFAOYSA-N 0.000 description 1
- 108060004795 Methyltransferase Proteins 0.000 description 1
- 101100059320 Mus musculus Ccdc85b gene Proteins 0.000 description 1
- GXCLVBGFBYZDAG-UHFFFAOYSA-N N-[2-(1H-indol-3-yl)ethyl]-N-methylprop-2-en-1-amine Chemical compound CN(CCC1=CNC2=C1C=CC=C2)CC=C GXCLVBGFBYZDAG-UHFFFAOYSA-N 0.000 description 1
- 101710144128 Non-structural protein 2 Proteins 0.000 description 1
- 101800001020 Non-structural protein 4A Proteins 0.000 description 1
- 101710199667 Nuclear export protein Proteins 0.000 description 1
- YEPBUHWNLNKZBW-UEMKMYPFSA-N O=C([C@]12NC(=O)[C@H]3N(C(N(C)CCCC\C=C/[C@@H]1C2)=O)CC[C@@H](C3)OC=1C2=CC=C(C(=C2N=C(C=1)C=1SC=C(N=1)C(F)(F)F)C)OC)NS(=O)(=O)C1(C)CC1 Chemical compound O=C([C@]12NC(=O)[C@H]3N(C(N(C)CCCC\C=C/[C@@H]1C2)=O)CC[C@@H](C3)OC=1C2=CC=C(C(=C2N=C(C=1)C=1SC=C(N=1)C(F)(F)F)C)OC)NS(=O)(=O)C1(C)CC1 YEPBUHWNLNKZBW-UEMKMYPFSA-N 0.000 description 1
- 239000012425 OXONE® Substances 0.000 description 1
- 240000007817 Olea europaea Species 0.000 description 1
- 235000019502 Orange oil Nutrition 0.000 description 1
- 235000019483 Peanut oil Nutrition 0.000 description 1
- 208000037581 Persistent Infection Diseases 0.000 description 1
- 229920003171 Poly (ethylene oxide) Polymers 0.000 description 1
- 239000004698 Polyethylene Substances 0.000 description 1
- 108010076039 Polyproteins Proteins 0.000 description 1
- 229920001213 Polysorbate 20 Polymers 0.000 description 1
- WTKZEGDFNFYCGP-UHFFFAOYSA-N Pyrazole Chemical compound C=1C=NNC=1 WTKZEGDFNFYCGP-UHFFFAOYSA-N 0.000 description 1
- 101800001554 RNA-directed RNA polymerase Proteins 0.000 description 1
- 108010012770 Rebetron Proteins 0.000 description 1
- 108010052090 Renilla Luciferases Proteins 0.000 description 1
- 235000004443 Ricinus communis Nutrition 0.000 description 1
- 108010090287 SCY-635 Proteins 0.000 description 1
- 235000019485 Safflower oil Nutrition 0.000 description 1
- DBMJMQXJHONAFJ-UHFFFAOYSA-M Sodium laurylsulphate Chemical compound [Na+].CCCCCCCCCCCCOS([O-])(=O)=O DBMJMQXJHONAFJ-UHFFFAOYSA-M 0.000 description 1
- SSZBUIDZHHWXNJ-UHFFFAOYSA-N Stearinsaeure-hexadecylester Natural products CCCCCCCCCCCCCCCCCC(=O)OCCCCCCCCCCCCCCCC SSZBUIDZHHWXNJ-UHFFFAOYSA-N 0.000 description 1
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 1
- 235000019486 Sunflower oil Nutrition 0.000 description 1
- 102000002689 Toll-like receptor Human genes 0.000 description 1
- 108020000411 Toll-like receptor Proteins 0.000 description 1
- YZCKVEUIGOORGS-NJFSPNSNSA-N Tritium Chemical compound [3H] YZCKVEUIGOORGS-NJFSPNSNSA-N 0.000 description 1
- 229920004890 Triton X-100 Polymers 0.000 description 1
- 239000013504 Triton X-100 Substances 0.000 description 1
- HOOMGTNENMZAFP-NYNCVSEMSA-N [(2r,3r,5s)-2-(5-amino-2-oxo-[1,3]thiazolo[4,5-d]pyrimidin-3-yl)-5-(hydroxymethyl)oxolan-3-yl] acetate Chemical compound CC(=O)O[C@@H]1C[C@@H](CO)O[C@H]1N1C(=O)SC2=CN=C(N)N=C21 HOOMGTNENMZAFP-NYNCVSEMSA-N 0.000 description 1
- XJBILYMRFVHPJB-XJQUKVTJSA-N [(2r,3s,4s,5r)-5-(4-amino-2-oxopyrimidin-1-yl)-2-azido-4-methyl-3-(2-methylpropanoyloxy)oxolan-2-yl]methyl 2-methylpropanoate Chemical compound C[C@H]1[C@H](OC(=O)C(C)C)[C@](COC(=O)C(C)C)(N=[N+]=[N-])O[C@H]1N1C(=O)N=C(N)C=C1 XJBILYMRFVHPJB-XJQUKVTJSA-N 0.000 description 1
- SAHIZENKTPRYSN-UHFFFAOYSA-N [2-[3-(phenoxymethyl)phenoxy]-6-(trifluoromethyl)pyridin-4-yl]methanamine Chemical compound O(C1=CC=CC=C1)CC=1C=C(OC2=NC(=CC(=C2)CN)C(F)(F)F)C=CC=1 SAHIZENKTPRYSN-UHFFFAOYSA-N 0.000 description 1
- 239000002250 absorbent Substances 0.000 description 1
- 230000002745 absorbent Effects 0.000 description 1
- 239000003655 absorption accelerator Substances 0.000 description 1
- 235000010489 acacia gum Nutrition 0.000 description 1
- 239000000205 acacia gum Substances 0.000 description 1
- YQNQNVDNTFHQSW-UHFFFAOYSA-N acetic acid [2-[[(5-nitro-2-thiazolyl)amino]-oxomethyl]phenyl] ester Chemical compound CC(=O)OC1=CC=CC=C1C(=O)NC1=NC=C([N+]([O-])=O)S1 YQNQNVDNTFHQSW-UHFFFAOYSA-N 0.000 description 1
- RAFKCLFWELPONH-UHFFFAOYSA-N acetonitrile;dichloromethane Chemical compound CC#N.ClCCl RAFKCLFWELPONH-UHFFFAOYSA-N 0.000 description 1
- 125000002777 acetyl group Chemical group [H]C([H])([H])C(*)=O 0.000 description 1
- 239000012445 acidic reagent Substances 0.000 description 1
- 229940099550 actimmune Drugs 0.000 description 1
- 239000008186 active pharmaceutical agent Substances 0.000 description 1
- 125000005073 adamantyl group Chemical group C12(CC3CC(CC(C1)C3)C2)* 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 239000000443 aerosol Substances 0.000 description 1
- 239000008272 agar Substances 0.000 description 1
- 150000001298 alcohols Chemical class 0.000 description 1
- 229940060516 alferon n Drugs 0.000 description 1
- 125000004453 alkoxycarbonyl group Chemical group 0.000 description 1
- 235000020224 almond Nutrition 0.000 description 1
- 229940087168 alpha tocopherol Drugs 0.000 description 1
- 229910052782 aluminium Inorganic materials 0.000 description 1
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 1
- WNROFYMDJYEPJX-UHFFFAOYSA-K aluminium hydroxide Chemical compound [OH-].[OH-].[OH-].[Al+3] WNROFYMDJYEPJX-UHFFFAOYSA-K 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- 235000012211 aluminium silicate Nutrition 0.000 description 1
- 150000001412 amines Chemical class 0.000 description 1
- 229940024606 amino acid Drugs 0.000 description 1
- 235000001014 amino acid Nutrition 0.000 description 1
- 150000001413 amino acids Chemical class 0.000 description 1
- 150000003927 aminopyridines Chemical class 0.000 description 1
- 230000001028 anti-proliverative effect Effects 0.000 description 1
- 239000003443 antiviral agent Substances 0.000 description 1
- 230000006907 apoptotic process Effects 0.000 description 1
- 150000004982 aromatic amines Chemical class 0.000 description 1
- 125000005101 aryl methoxy carbonyl group Chemical group 0.000 description 1
- 125000005002 aryl methyl group Chemical group 0.000 description 1
- 235000010323 ascorbic acid Nutrition 0.000 description 1
- 229960005070 ascorbic acid Drugs 0.000 description 1
- 239000011668 ascorbic acid Substances 0.000 description 1
- 235000010385 ascorbyl palmitate Nutrition 0.000 description 1
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 1
- 239000012752 auxiliary agent Substances 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- 125000003785 benzimidazolyl group Chemical group N1=C(NC2=C1C=CC=C2)* 0.000 description 1
- 125000000499 benzofuranyl group Chemical group O1C(=CC2=C1C=CC=C2)* 0.000 description 1
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid group Chemical group C(C1=CC=CC=C1)(=O)O WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 1
- 125000001164 benzothiazolyl group Chemical group S1C(=NC2=C1C=CC=C2)* 0.000 description 1
- 125000004196 benzothienyl group Chemical group S1C(=CC2=C1C=CC=C2)* 0.000 description 1
- 229960004217 benzyl alcohol Drugs 0.000 description 1
- 229960002903 benzyl benzoate Drugs 0.000 description 1
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- 230000033228 biological regulation Effects 0.000 description 1
- IPWKHHSGDUIRAH-UHFFFAOYSA-N bis(pinacolato)diboron Chemical compound O1C(C)(C)C(C)(C)OB1B1OC(C)(C)C(C)(C)O1 IPWKHHSGDUIRAH-UHFFFAOYSA-N 0.000 description 1
- 230000037396 body weight Effects 0.000 description 1
- 150000001642 boronic acid derivatives Chemical class 0.000 description 1
- 125000001246 bromo group Chemical group Br* 0.000 description 1
- 239000000872 buffer Substances 0.000 description 1
- FJDQFPXHSGXQBY-UHFFFAOYSA-L caesium carbonate Chemical compound [Cs+].[Cs+].[O-]C([O-])=O FJDQFPXHSGXQBY-UHFFFAOYSA-L 0.000 description 1
- 229910000024 caesium carbonate Inorganic materials 0.000 description 1
- 229910000019 calcium carbonate Inorganic materials 0.000 description 1
- 235000010216 calcium carbonate Nutrition 0.000 description 1
- 239000001506 calcium phosphate Substances 0.000 description 1
- CJZGTCYPCWQAJB-UHFFFAOYSA-L calcium stearate Chemical compound [Ca+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O CJZGTCYPCWQAJB-UHFFFAOYSA-L 0.000 description 1
- 239000008116 calcium stearate Substances 0.000 description 1
- 235000013539 calcium stearate Nutrition 0.000 description 1
- 125000002837 carbocyclic group Chemical group 0.000 description 1
- 239000001569 carbon dioxide Substances 0.000 description 1
- 229910002092 carbon dioxide Inorganic materials 0.000 description 1
- 229960004424 carbon dioxide Drugs 0.000 description 1
- 239000004359 castor oil Substances 0.000 description 1
- 230000010261 cell growth Effects 0.000 description 1
- 235000010980 cellulose Nutrition 0.000 description 1
- 229920002678 cellulose Polymers 0.000 description 1
- 229940081734 cellulose acetate phthalate Drugs 0.000 description 1
- 229960000541 cetyl alcohol Drugs 0.000 description 1
- 239000002738 chelating agent Substances 0.000 description 1
- WPMJNLCLKAKMLA-VVPTUSLJSA-N chembl3039503 Chemical compound C1C[C@@H](C)CC[C@@H]1C(=O)N(C1=C(SC(=C1)C#CC(C)(C)C)C(O)=O)[C@@H]1CC[C@@H](O)CC1 WPMJNLCLKAKMLA-VVPTUSLJSA-N 0.000 description 1
- 238000004587 chromatography analysis Methods 0.000 description 1
- 229960001265 ciclosporin Drugs 0.000 description 1
- 208000019425 cirrhosis of liver Diseases 0.000 description 1
- 239000004927 clay Substances 0.000 description 1
- 239000003245 coal Substances 0.000 description 1
- 229940110456 cocoa butter Drugs 0.000 description 1
- 235000019868 cocoa butter Nutrition 0.000 description 1
- 239000003184 complementary RNA Substances 0.000 description 1
- 239000002131 composite material Substances 0.000 description 1
- 238000013329 compounding Methods 0.000 description 1
- 238000013270 controlled release Methods 0.000 description 1
- 239000012050 conventional carrier Substances 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- 238000001816 cooling Methods 0.000 description 1
- 229940055354 copegus Drugs 0.000 description 1
- DOBRDRYODQBAMW-UHFFFAOYSA-N copper(i) cyanide Chemical compound [Cu+].N#[C-] DOBRDRYODQBAMW-UHFFFAOYSA-N 0.000 description 1
- 239000008120 corn starch Substances 0.000 description 1
- 239000002385 cottonseed oil Substances 0.000 description 1
- 238000002425 crystallisation Methods 0.000 description 1
- 230000008025 crystallization Effects 0.000 description 1
- 125000004122 cyclic group Chemical group 0.000 description 1
- 125000001995 cyclobutyl group Chemical group [H]C1([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 125000000582 cycloheptyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 125000000640 cyclooctyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C([H])([H])C1([H])[H] 0.000 description 1
- USVZFSNDGFNNJT-UHFFFAOYSA-N cyclopenta-1,4-dien-1-yl(diphenyl)phosphane (2,3-dichlorocyclopenta-1,4-dien-1-yl)-diphenylphosphane iron(2+) Chemical compound [Fe++].c1cc[c-](c1)P(c1ccccc1)c1ccccc1.Clc1c(cc[c-]1Cl)P(c1ccccc1)c1ccccc1 USVZFSNDGFNNJT-UHFFFAOYSA-N 0.000 description 1
- NXQGGXCHGDYOHB-UHFFFAOYSA-L cyclopenta-1,4-dien-1-yl(diphenyl)phosphane;dichloropalladium;iron(2+) Chemical compound [Fe+2].Cl[Pd]Cl.[CH-]1C=CC(P(C=2C=CC=CC=2)C=2C=CC=CC=2)=C1.[CH-]1C=CC(P(C=2C=CC=CC=2)C=2C=CC=CC=2)=C1 NXQGGXCHGDYOHB-UHFFFAOYSA-L 0.000 description 1
- ZOOSILUVXHVRJE-UHFFFAOYSA-N cyclopropanecarbonyl chloride Chemical compound ClC(=O)C1CC1 ZOOSILUVXHVRJE-UHFFFAOYSA-N 0.000 description 1
- 229930182912 cyclosporin Natural products 0.000 description 1
- 229960001305 cysteine hydrochloride Drugs 0.000 description 1
- FKRSSPOQAMALKA-CUPIEXAXSA-N daclatasvir Chemical compound COC(=O)N[C@@H](C(C)C)C(=O)N1CCC[C@H]1C1=NC(C=2C=CC(=CC=2)C=2C=CC(=CC=2)C=2N=C(NC=2)[C@H]2N(CCC2)C(=O)[C@@H](NC(=O)OC)C(C)C)=CN1 FKRSSPOQAMALKA-CUPIEXAXSA-N 0.000 description 1
- 229950002891 danoprevir Drugs 0.000 description 1
- UDMJANYPQWEDFT-ZAWFUYGJSA-N deldeprevir Chemical compound C([C@@H]1C(=O)N2[C@H](C(N[C@@]3(C[C@H]3\C=C/CCCCC1)C(=O)NS(=O)(=O)C1CC1)=O)C[C@H](C2)OC=1C2=CC=C(C(=C2N=C(C=1)C=1SC=C(N=1)C(C)C)C)OC)C(=O)N1CCCC(F)(F)C1 UDMJANYPQWEDFT-ZAWFUYGJSA-N 0.000 description 1
- BMAIGAHXAJEULY-UKTHLTGXSA-N deleobuvir Chemical compound C12=CC=C(C(=O)NC3(CCC3)C=3N(C4=CC(\C=C\C(O)=O)=CC=C4N=3)C)C=C2N(C)C(C=2N=CC(Br)=CN=2)=C1C1CCCC1 BMAIGAHXAJEULY-UKTHLTGXSA-N 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 239000011903 deuterated solvents Substances 0.000 description 1
- 229910052805 deuterium Inorganic materials 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- NEFBYIFKOOEVPA-UHFFFAOYSA-K dicalcium phosphate Chemical compound [Ca+2].[Ca+2].[O-]P([O-])([O-])=O NEFBYIFKOOEVPA-UHFFFAOYSA-K 0.000 description 1
- 229940038472 dicalcium phosphate Drugs 0.000 description 1
- 229910000390 dicalcium phosphate Inorganic materials 0.000 description 1
- PXBRQCKWGAHEHS-UHFFFAOYSA-N dichlorodifluoromethane Chemical compound FC(F)(Cl)Cl PXBRQCKWGAHEHS-UHFFFAOYSA-N 0.000 description 1
- 235000019404 dichlorodifluoromethane Nutrition 0.000 description 1
- 229940042935 dichlorodifluoromethane Drugs 0.000 description 1
- 229940087091 dichlorotetrafluoroethane Drugs 0.000 description 1
- 239000003085 diluting agent Substances 0.000 description 1
- 229940042399 direct acting antivirals protease inhibitors Drugs 0.000 description 1
- 239000007884 disintegrant Substances 0.000 description 1
- 239000002270 dispersing agent Substances 0.000 description 1
- 238000009826 distribution Methods 0.000 description 1
- PMMYEEVYMWASQN-UHFFFAOYSA-N dl-hydroxyproline Natural products OC1C[NH2+]C(C([O-])=O)C1 PMMYEEVYMWASQN-UHFFFAOYSA-N 0.000 description 1
- 239000008298 dragée Substances 0.000 description 1
- 238000012377 drug delivery Methods 0.000 description 1
- 229940112141 dry powder inhaler Drugs 0.000 description 1
- BVAZQCUMNICBAQ-PZHYSIFUSA-N elbasvir Chemical compound COC(=O)N[C@@H](C(C)C)C(=O)N1CCC[C@H]1C1=NC(C=2C=C3O[C@H](N4C5=CC=C(C=C5C=C4C3=CC=2)C=2N=C(NC=2)[C@H]2N(CCC2)C(=O)[C@@H](NC(=O)OC)C(C)C)C=2C=CC=CC=2)=CN1 BVAZQCUMNICBAQ-PZHYSIFUSA-N 0.000 description 1
- 238000000132 electrospray ionisation Methods 0.000 description 1
- 238000002330 electrospray ionisation mass spectrometry Methods 0.000 description 1
- 239000003623 enhancer Substances 0.000 description 1
- 230000002708 enhancing effect Effects 0.000 description 1
- 239000002702 enteric coating Substances 0.000 description 1
- 238000009505 enteric coating Methods 0.000 description 1
- XKWHCBFPTFZGLK-JTQLQIEISA-N ethyl (2s)-2-[(2-methylpropan-2-yl)oxycarbonylamino]-5-oxohexanoate Chemical compound CCOC(=O)[C@H](CCC(C)=O)NC(=O)OC(C)(C)C XKWHCBFPTFZGLK-JTQLQIEISA-N 0.000 description 1
- FMTWCIPDRLFSMV-ZETCQYMHSA-N ethyl (2s)-5-methyl-3,4-dihydro-2h-pyrrole-2-carboxylate Chemical compound CCOC(=O)[C@@H]1CCC(C)=N1 FMTWCIPDRLFSMV-ZETCQYMHSA-N 0.000 description 1
- 229940093499 ethyl acetate Drugs 0.000 description 1
- 238000001704 evaporation Methods 0.000 description 1
- 230000008020 evaporation Effects 0.000 description 1
- 230000005284 excitation Effects 0.000 description 1
- 238000000605 extraction Methods 0.000 description 1
- LLGDPTDZOVKFDU-XUHJSTDZSA-N faldaprevir Chemical compound N([C@H](C(=O)N1[C@@H](C[C@H](C1)OC=1C2=CC=C(C(=C2N=C(C=1)C=1N=C(NC(=O)C(C)C)SC=1)Br)OC)C(=O)N[C@]1([C@@H](C1)C=C)C(O)=O)C(C)(C)C)C(=O)OC1CCCC1 LLGDPTDZOVKFDU-XUHJSTDZSA-N 0.000 description 1
- 206010016256 fatigue Diseases 0.000 description 1
- SLVAPEZTBDBAPI-GDLZYMKVSA-N filibuvir Chemical compound CCC1=NC(CC)=CC(CC[C@]2(OC(=O)C(CC3=NN4C(C)=CC(C)=NC4=N3)=C(O)C2)C2CCCC2)=C1 SLVAPEZTBDBAPI-GDLZYMKVSA-N 0.000 description 1
- 229950011045 filibuvir Drugs 0.000 description 1
- 239000000945 filler Substances 0.000 description 1
- 239000012467 final product Substances 0.000 description 1
- 239000000796 flavoring agent Substances 0.000 description 1
- 238000002866 fluorescence resonance energy transfer Methods 0.000 description 1
- 239000006260 foam Substances 0.000 description 1
- 235000013355 food flavoring agent Nutrition 0.000 description 1
- 235000003599 food sweetener Nutrition 0.000 description 1
- 238000005755 formation reaction Methods 0.000 description 1
- 125000002485 formyl group Chemical group [H]C(*)=O 0.000 description 1
- 239000012634 fragment Substances 0.000 description 1
- 238000004108 freeze drying Methods 0.000 description 1
- 125000000524 functional group Chemical group 0.000 description 1
- 125000002541 furyl group Chemical group 0.000 description 1
- 239000007789 gas Substances 0.000 description 1
- 210000001035 gastrointestinal tract Anatomy 0.000 description 1
- 239000003349 gelling agent Substances 0.000 description 1
- YQEMORVAKMFKLG-UHFFFAOYSA-N glycerine monostearate Natural products CCCCCCCCCCCCCCCCCC(=O)OC(CO)CO YQEMORVAKMFKLG-UHFFFAOYSA-N 0.000 description 1
- SVUQHVRAGMNPLW-UHFFFAOYSA-N glycerol monostearate Natural products CCCCCCCCCCCCCCCCC(=O)OCC(O)CO SVUQHVRAGMNPLW-UHFFFAOYSA-N 0.000 description 1
- 150000002334 glycols Chemical class 0.000 description 1
- 239000008187 granular material Substances 0.000 description 1
- OBMNJSNZOWALQB-NCQNOWPTSA-N grazoprevir Chemical compound O=C([C@@H]1C[C@@H]2CN1C(=O)[C@@H](NC(=O)O[C@@H]1C[C@H]1CCCCCC1=NC3=CC=C(C=C3N=C1O2)OC)C(C)(C)C)N[C@]1(C(=O)NS(=O)(=O)C2CC2)C[C@H]1C=C OBMNJSNZOWALQB-NCQNOWPTSA-N 0.000 description 1
- LHGVFZTZFXWLCP-UHFFFAOYSA-N guaiacol Chemical group COC1=CC=CC=C1O LHGVFZTZFXWLCP-UHFFFAOYSA-N 0.000 description 1
- 208000007475 hemolytic anemia Diseases 0.000 description 1
- 206010073071 hepatocellular carcinoma Diseases 0.000 description 1
- 231100000844 hepatocellular carcinoma Toxicity 0.000 description 1
- BXWNKGSJHAJOGX-UHFFFAOYSA-N hexadecan-1-ol Chemical compound CCCCCCCCCCCCCCCCO BXWNKGSJHAJOGX-UHFFFAOYSA-N 0.000 description 1
- 102000011749 human hepatitis C immune globulin Human genes 0.000 description 1
- 108010062138 human hepatitis C immune globulin Proteins 0.000 description 1
- 239000003906 humectant Substances 0.000 description 1
- 150000002430 hydrocarbons Chemical group 0.000 description 1
- 150000002431 hydrogen Chemical class 0.000 description 1
- 230000007062 hydrolysis Effects 0.000 description 1
- 238000006460 hydrolysis reaction Methods 0.000 description 1
- 229920003063 hydroxymethyl cellulose Polymers 0.000 description 1
- 229940031574 hydroxymethyl cellulose Drugs 0.000 description 1
- 229940031704 hydroxypropyl methylcellulose phthalate Drugs 0.000 description 1
- 229920003132 hydroxypropyl methylcellulose phthalate Polymers 0.000 description 1
- 229940072106 hydroxystearate Drugs 0.000 description 1
- 125000002632 imidazolidinyl group Chemical group 0.000 description 1
- 239000012535 impurity Substances 0.000 description 1
- 238000001727 in vivo Methods 0.000 description 1
- 229940084039 incivek Drugs 0.000 description 1
- 125000001041 indolyl group Chemical group 0.000 description 1
- 239000003701 inert diluent Substances 0.000 description 1
- 230000002452 interceptive effect Effects 0.000 description 1
- 108010010648 interferon alfacon-1 Proteins 0.000 description 1
- 229960003358 interferon alfacon-1 Drugs 0.000 description 1
- 229960004461 interferon beta-1a Drugs 0.000 description 1
- 229940028862 interferon gamma-1b Drugs 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 239000007927 intramuscular injection Substances 0.000 description 1
- 239000007928 intraperitoneal injection Substances 0.000 description 1
- 238000001990 intravenous administration Methods 0.000 description 1
- 238000011835 investigation Methods 0.000 description 1
- 229910052740 iodine Inorganic materials 0.000 description 1
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 1
- 125000001972 isopentyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])C([H])([H])* 0.000 description 1
- JMMWKPVZQRWMSS-UHFFFAOYSA-N isopropanol acetate Natural products CC(C)OC(C)=O JMMWKPVZQRWMSS-UHFFFAOYSA-N 0.000 description 1
- 229940011051 isopropyl acetate Drugs 0.000 description 1
- ZLTPDFXIESTBQG-UHFFFAOYSA-N isothiazole Chemical compound C=1C=NSC=1 ZLTPDFXIESTBQG-UHFFFAOYSA-N 0.000 description 1
- 125000001786 isothiazolyl group Chemical group 0.000 description 1
- GWYFCOCPABKNJV-UHFFFAOYSA-N isovaleric acid Chemical compound CC(C)CC(O)=O GWYFCOCPABKNJV-UHFFFAOYSA-N 0.000 description 1
- CTAPFRYPJLPFDF-UHFFFAOYSA-N isoxazole Chemical compound C=1C=NOC=1 CTAPFRYPJLPFDF-UHFFFAOYSA-N 0.000 description 1
- 125000000842 isoxazolyl group Chemical group 0.000 description 1
- NLYAJNPCOHFWQQ-UHFFFAOYSA-N kaolin Chemical compound O.O.O=[Al]O[Si](=O)O[Si](=O)O[Al]=O NLYAJNPCOHFWQQ-UHFFFAOYSA-N 0.000 description 1
- 239000000787 lecithin Chemical class 0.000 description 1
- 235000010445 lecithin Nutrition 0.000 description 1
- 229940067606 lecithin Drugs 0.000 description 1
- VRTWBAAJJOHBQU-KMWAZVGDSA-N ledipasvir Chemical compound COC(=O)N[C@@H](C(C)C)C(=O)N([C@@H](C1)C=2NC(=CN=2)C=2C=C3C(F)(F)C4=CC(=CC=C4C3=CC=2)C=2C=C3NC(=NC3=CC=2)[C@H]2N([C@@H]3CC[C@H]2C3)C(=O)[C@@H](NC(=O)OC)C(C)C)CC21CC2 VRTWBAAJJOHBQU-KMWAZVGDSA-N 0.000 description 1
- 239000002502 liposome Substances 0.000 description 1
- 108010046177 locteron Proteins 0.000 description 1
- 239000007937 lozenge Substances 0.000 description 1
- 239000000314 lubricant Substances 0.000 description 1
- VTHJTEIRLNZDEV-UHFFFAOYSA-L magnesium dihydroxide Chemical compound [OH-].[OH-].[Mg+2] VTHJTEIRLNZDEV-UHFFFAOYSA-L 0.000 description 1
- 239000000347 magnesium hydroxide Substances 0.000 description 1
- 229910001862 magnesium hydroxide Inorganic materials 0.000 description 1
- 239000000395 magnesium oxide Substances 0.000 description 1
- CPLXHLVBOLITMK-UHFFFAOYSA-N magnesium oxide Inorganic materials [Mg]=O CPLXHLVBOLITMK-UHFFFAOYSA-N 0.000 description 1
- 235000019359 magnesium stearate Nutrition 0.000 description 1
- NXPHGHWWQRMDIA-UHFFFAOYSA-M magnesium;carbanide;bromide Chemical compound [CH3-].[Mg+2].[Br-] NXPHGHWWQRMDIA-UHFFFAOYSA-M 0.000 description 1
- AXZKOIWUVFPNLO-UHFFFAOYSA-N magnesium;oxygen(2-) Chemical compound [O-2].[Mg+2] AXZKOIWUVFPNLO-UHFFFAOYSA-N 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 229950010383 mericitabine Drugs 0.000 description 1
- 230000002503 metabolic effect Effects 0.000 description 1
- 229940071648 metered dose inhaler Drugs 0.000 description 1
- 229940063559 methacrylic acid Drugs 0.000 description 1
- 229920003146 methacrylic ester copolymer Polymers 0.000 description 1
- UKVIEHSSVKSQBA-UHFFFAOYSA-N methane;palladium Chemical compound C.[Pd] UKVIEHSSVKSQBA-UHFFFAOYSA-N 0.000 description 1
- OKKJLVBELUTLKV-VMNATFBRSA-N methanol-d1 Chemical compound [2H]OC OKKJLVBELUTLKV-VMNATFBRSA-N 0.000 description 1
- JADZPCGVXVXCLD-UWVGGRQHSA-N methyl (2s)-1-[(2s)-2-(methoxycarbonylamino)-3-methylbutanoyl]-4-oxopyrrolidine-2-carboxylate Chemical compound COC(=O)N[C@@H](C(C)C)C(=O)N1CC(=O)C[C@H]1C(=O)OC JADZPCGVXVXCLD-UWVGGRQHSA-N 0.000 description 1
- WSRMWHNXOYBRSO-UTLUCORTSA-N methyl (2s,4r)-4-hydroxy-1-[(2s)-2-(methoxycarbonylamino)-3-methylbutanoyl]pyrrolidine-2-carboxylate Chemical compound COC(=O)N[C@@H](C(C)C)C(=O)N1C[C@H](O)C[C@H]1C(=O)OC WSRMWHNXOYBRSO-UTLUCORTSA-N 0.000 description 1
- ZORHSASAYVIBLY-UHNVWZDZSA-N methyl (2s,4r)-4-hydroxypyrrolidine-2-carboxylate Chemical compound COC(=O)[C@@H]1C[C@@H](O)CN1 ZORHSASAYVIBLY-UHNVWZDZSA-N 0.000 description 1
- YDZXFMFWUBEUSQ-QWRGUYRKSA-N methyl (8s)-7-[(2s)-2-(methoxycarbonylamino)-3-methylbutanoyl]-1,4-dioxa-7-azaspiro[4.4]nonane-8-carboxylate Chemical compound C1[C@@H](C(=O)OC)N(C(=O)[C@H](C(C)C)NC(=O)OC)CC21OCCO2 YDZXFMFWUBEUSQ-QWRGUYRKSA-N 0.000 description 1
- XICATXXOOIQRRD-UHFFFAOYSA-N methyl 2-chloro-5-(trifluoromethoxy)benzoate Chemical compound COC(=O)C1=CC(OC(F)(F)F)=CC=C1Cl XICATXXOOIQRRD-UHFFFAOYSA-N 0.000 description 1
- VOZICRAZVBGCNM-UHFFFAOYSA-N methyl 4-amino-3-(trifluoromethoxy)benzoate Chemical compound COC(=O)C1=CC=C(N)C(OC(F)(F)F)=C1 VOZICRAZVBGCNM-UHFFFAOYSA-N 0.000 description 1
- RULCORLXURVPRB-UHFFFAOYSA-N methyl 4-amino-3-chloro-5-(trifluoromethoxy)benzoate Chemical compound COC(=O)C1=CC(Cl)=C(N)C(OC(F)(F)F)=C1 RULCORLXURVPRB-UHFFFAOYSA-N 0.000 description 1
- GUPYTJBCAWWSCT-UHFFFAOYSA-N methyl 4-bromo-3-chloro-5-(trifluoromethoxy)benzoate Chemical compound COC(=O)C1=CC(Cl)=C(Br)C(OC(F)(F)F)=C1 GUPYTJBCAWWSCT-UHFFFAOYSA-N 0.000 description 1
- MIIAOCOUBCUZNA-CIHKJSBTSA-N methyl N-[(1S)-2-[(2S,4S)-2-[5-[4-[5-chloro-2-(trifluoromethoxy)phenyl]phenyl]-1H-imidazol-2-yl]-4-methylpyrrolidin-1-yl]-1-(oxan-4-yl)-2-oxoethyl]carbamate Chemical compound ClC=1C=CC(=C(C1)C1=CC=C(C=C1)C=1N=C(NC1)[C@H]1N(C[C@H](C1)C)C([C@H](C1CCOCC1)NC(=O)OC)=O)OC(F)(F)F MIIAOCOUBCUZNA-CIHKJSBTSA-N 0.000 description 1
- XMSZANIMCDLNKA-UHFFFAOYSA-N methyl hypofluorite Chemical compound COF XMSZANIMCDLNKA-UHFFFAOYSA-N 0.000 description 1
- ATOLIHZIXHZSBA-BTSKBWHGSA-N methyl n-[(1r)-2-[(2s)-2-[5-[4-[6-[2-[(2s)-1-[(2s)-2-(methoxycarbonylamino)-3-methylbutanoyl]pyrrolidin-2-yl]-3h-benzimidazol-5-yl]thieno[3,2-b]thiophen-3-yl]phenyl]-1h-imidazol-2-yl]pyrrolidin-1-yl]-2-oxo-1-phenylethyl]carbamate Chemical compound COC(=O)N[C@@H](C(C)C)C(=O)N1CCC[C@H]1C1=NC2=CC(C=3C=4SC=C(C=4SC=3)C=3C=CC(=CC=3)C=3N=C(NC=3)[C@H]3N(CCC3)C(=O)[C@H](NC(=O)OC)C=3C=CC=CC=3)=CC=C2N1 ATOLIHZIXHZSBA-BTSKBWHGSA-N 0.000 description 1
- YMCAVGXTSCNFDE-BBACVFHCSA-N methyl n-[(2s)-1-[(2s)-2-[5-[4-[4-[2-[(8s)-7-[(2s)-2-(methoxycarbonylamino)-3-methylbutanoyl]-1,4-dioxa-7-azaspiro[4.4]nonan-8-yl]-1h-imidazol-5-yl]phenyl]phenyl]-1h-imidazol-2-yl]pyrrolidin-1-yl]-3-methyl-1-oxobutan-2-yl]carbamate Chemical compound COC(=O)N[C@@H](C(C)C)C(=O)N1CCC[C@H]1C1=NC=C(C=2C=CC(=CC=2)C=2C=CC(=CC=2)C=2NC(=NC=2)[C@H]2N(CC3(C2)OCCO3)C(=O)[C@@H](NC(=O)OC)C(C)C)N1 YMCAVGXTSCNFDE-BBACVFHCSA-N 0.000 description 1
- JYLMWUZJMRNMDA-SPRBZRACSA-N methyl n-[(2s)-1-[(2s)-2-[5-[6-[2-[(2s)-1-[(2s)-2-(methoxycarbonylamino)-3-methylbutanoyl]pyrrolidin-2-yl]-3h-benzimidazol-5-yl]naphthalen-2-yl]-1h-imidazol-2-yl]pyrrolidin-1-yl]-3-methyl-1-oxobutan-2-yl]carbamate;dihydrochloride Chemical compound Cl.Cl.COC(=O)N[C@@H](C(C)C)C(=O)N1CCC[C@H]1C1=NC=C(C=2C=C3C=CC(=CC3=CC=2)C=2C=C3NC(=NC3=CC=2)[C@H]2N(CCC2)C(=O)[C@@H](NC(=O)OC)C(C)C)N1 JYLMWUZJMRNMDA-SPRBZRACSA-N 0.000 description 1
- 239000003094 microcapsule Substances 0.000 description 1
- 239000004005 microsphere Substances 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- CQDGTJPVBWZJAZ-UHFFFAOYSA-N monoethyl carbonate Chemical compound CCOC(O)=O CQDGTJPVBWZJAZ-UHFFFAOYSA-N 0.000 description 1
- 210000003097 mucus Anatomy 0.000 description 1
- XMZSTQYSBYEENY-RMKNXTFCSA-N n-[4-[(e)-2-[3-tert-butyl-5-(2,4-dioxopyrimidin-1-yl)-2-methoxyphenyl]ethenyl]phenyl]methanesulfonamide Chemical compound C1=C(N2C(NC(=O)C=C2)=O)C=C(C(C)(C)C)C(OC)=C1\C=C\C1=CC=C(NS(C)(=O)=O)C=C1 XMZSTQYSBYEENY-RMKNXTFCSA-N 0.000 description 1
- CRKACIKUBQYAQK-UHFFFAOYSA-N n-[4-bromo-2-chloro-5-(trifluoromethoxy)phenyl]-6-fluoropyridine-3-carboxamide Chemical compound C1=NC(F)=CC=C1C(=O)NC1=CC(OC(F)(F)F)=C(Br)C=C1Cl CRKACIKUBQYAQK-UHFFFAOYSA-N 0.000 description 1
- BQYIGJVDEKDDIJ-UHFFFAOYSA-N n-[4-bromo-2-chloro-5-(trifluoromethyl)phenyl]-6-fluoropyridine-3-carboxamide Chemical compound C1=NC(F)=CC=C1C(=O)NC1=CC(C(F)(F)F)=C(Br)C=C1Cl BQYIGJVDEKDDIJ-UHFFFAOYSA-N 0.000 description 1
- GPQVZSYTFGRCPI-TYPXCFOJSA-N n-[6-[(2r)-4-(2,2-dimethylpropanoyl)-2-methylpiperazin-1-yl]pyridin-3-yl]-2-fluoro-4-[4-[2-[(2s,4s)-4-methylpyrrolidin-2-yl]-1h-imidazol-5-yl]phenyl]-3-(trifluoromethoxy)benzamide Chemical compound C1[C@H](C)CN[C@@H]1C1=NC(C=2C=CC(=CC=2)C=2C(=C(F)C(C(=O)NC=3C=NC(=CC=3)N3[C@@H](CN(CC3)C(=O)C(C)(C)C)C)=CC=2)OC(F)(F)F)=CN1 GPQVZSYTFGRCPI-TYPXCFOJSA-N 0.000 description 1
- 125000001280 n-hexyl group Chemical group C(CCCCC)* 0.000 description 1
- GRRYSIXDUIAUGY-UHFFFAOYSA-N n-methylcarbamoyl chloride Chemical compound CNC(Cl)=O GRRYSIXDUIAUGY-UHFFFAOYSA-N 0.000 description 1
- 125000000740 n-pentyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 229950003504 narlaprevir Drugs 0.000 description 1
- 239000006199 nebulizer Substances 0.000 description 1
- 125000001971 neopentyl group Chemical group [H]C([*])([H])C(C([H])([H])[H])(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- RPJPZDVUUKWPGT-FOIHOXPVSA-N nim811 Chemical compound CC[C@H](C)[C@@H]1N(C)C(=O)CN(C)C(=O)[C@H](CC)NC(=O)[C@H]([C@H](O)[C@H](C)C\C=C\C)N(C)C(=O)[C@H](C(C)C)N(C)C(=O)[C@H](CC(C)C)N(C)C(=O)[C@H](CC(C)C)N(C)C(=O)[C@@H](C)NC(=O)[C@H](C)NC(=O)[C@H](CC(C)C)N(C)C(=O)[C@H](C(C)C)NC1=O RPJPZDVUUKWPGT-FOIHOXPVSA-N 0.000 description 1
- 229960002480 nitazoxanide Drugs 0.000 description 1
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 description 1
- 231100000252 nontoxic Toxicity 0.000 description 1
- 230000003000 nontoxic effect Effects 0.000 description 1
- 235000008390 olive oil Nutrition 0.000 description 1
- PIDFDZJZLOTZTM-KHVQSSSXSA-N ombitasvir Chemical compound COC(=O)N[C@@H](C(C)C)C(=O)N1CCC[C@H]1C(=O)NC1=CC=C([C@H]2N([C@@H](CC2)C=2C=CC(NC(=O)[C@H]3N(CCC3)C(=O)[C@@H](NC(=O)OC)C(C)C)=CC=2)C=2C=CC(=CC=2)C(C)(C)C)C=C1 PIDFDZJZLOTZTM-KHVQSSSXSA-N 0.000 description 1
- 229960000518 ombitasvir Drugs 0.000 description 1
- 239000008184 oral solid dosage form Substances 0.000 description 1
- 150000002892 organic cations Chemical class 0.000 description 1
- 125000001715 oxadiazolyl group Chemical group 0.000 description 1
- 125000002971 oxazolyl group Chemical group 0.000 description 1
- 125000006299 oxetan-3-yl group Chemical group [H]C1([H])OC([H])([H])C1([H])* 0.000 description 1
- LVSJDHGRKAEGLX-UHFFFAOYSA-N oxolane;2,2,2-trifluoroacetic acid Chemical compound C1CCOC1.OC(=O)C(F)(F)F LVSJDHGRKAEGLX-UHFFFAOYSA-N 0.000 description 1
- 239000012188 paraffin wax Substances 0.000 description 1
- UAUIUKWPKRJZJV-MDJGTQRPSA-N paritaprevir Chemical compound C1=NC(C)=CN=C1C(=O)N[C@@H]1C(=O)N2C[C@H](OC=3C4=CC=CC=C4C4=CC=CC=C4N=3)C[C@H]2C(=O)N[C@]2(C(=O)NS(=O)(=O)C3CC3)C[C@@H]2\C=C/CCCCC1 UAUIUKWPKRJZJV-MDJGTQRPSA-N 0.000 description 1
- 229960002754 paritaprevir Drugs 0.000 description 1
- 230000001575 pathological effect Effects 0.000 description 1
- 235000020232 peanut Nutrition 0.000 description 1
- 239000000312 peanut oil Substances 0.000 description 1
- 229940002988 pegasys Drugs 0.000 description 1
- 108010092853 peginterferon alfa-2a Proteins 0.000 description 1
- 108010092851 peginterferon alfa-2b Proteins 0.000 description 1
- 229940106366 pegintron Drugs 0.000 description 1
- 230000035515 penetration Effects 0.000 description 1
- 239000000137 peptide hydrolase inhibitor Substances 0.000 description 1
- WVDDGKGOMKODPV-ZQBYOMGUSA-N phenyl(114C)methanol Chemical compound O[14CH2]C1=CC=CC=C1 WVDDGKGOMKODPV-ZQBYOMGUSA-N 0.000 description 1
- 239000008363 phosphate buffer Substances 0.000 description 1
- 230000035479 physiological effects, processes and functions Effects 0.000 description 1
- 239000000049 pigment Substances 0.000 description 1
- 125000004193 piperazinyl group Chemical group 0.000 description 1
- 229910052697 platinum Inorganic materials 0.000 description 1
- 229920000573 polyethylene Polymers 0.000 description 1
- 229940068918 polyethylene glycol 400 Drugs 0.000 description 1
- 229920000642 polymer Polymers 0.000 description 1
- 229920005862 polyol Polymers 0.000 description 1
- 150000003077 polyols Chemical class 0.000 description 1
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 1
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 1
- 229940068977 polysorbate 20 Drugs 0.000 description 1
- 229940100467 polyvinyl acetate phthalate Drugs 0.000 description 1
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 1
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 1
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 1
- 238000002600 positron emission tomography Methods 0.000 description 1
- OKBMCNHOEMXPTM-UHFFFAOYSA-M potassium peroxymonosulfate Chemical compound [K+].OOS([O-])(=O)=O OKBMCNHOEMXPTM-UHFFFAOYSA-M 0.000 description 1
- 230000003389 potentiating effect Effects 0.000 description 1
- 239000002244 precipitate Substances 0.000 description 1
- 238000001556 precipitation Methods 0.000 description 1
- 230000002035 prolonged effect Effects 0.000 description 1
- XFJMOMBVBMXWCV-ZSNLZBCWSA-N propan-2-yl (2s)-2-[[[(2r,3r,4r,5r)-5-(2,4-dioxopyrimidin-1-yl)-3,4-dihydroxy-4-methyloxolan-2-yl]methoxy-phenoxyphosphinothioyl]amino]propanoate Chemical compound N1([C@@H]2O[C@@H]([C@H]([C@]2(O)C)O)COP(=S)(N[C@@H](C)C(=O)OC(C)C)OC=2C=CC=CC=2)C=CC(=O)NC1=O XFJMOMBVBMXWCV-ZSNLZBCWSA-N 0.000 description 1
- TTZHDVOVKQGIBA-IAAJYNJHSA-N propan-2-yl (2s)-2-[[[(2r,3r,4r,5r)-5-(2,4-dioxopyrimidin-1-yl)-4-fluoro-3-hydroxy-4-methyloxolan-2-yl]methoxy-phenoxyphosphoryl]amino]propanoate Chemical compound N1([C@@H]2O[C@@H]([C@H]([C@]2(F)C)O)COP(=O)(N[C@@H](C)C(=O)OC(C)C)OC=2C=CC=CC=2)C=CC(=O)NC1=O TTZHDVOVKQGIBA-IAAJYNJHSA-N 0.000 description 1
- 239000003380 propellant Substances 0.000 description 1
- 238000011321 prophylaxis Methods 0.000 description 1
- 239000000473 propyl gallate Chemical class 0.000 description 1
- 235000010388 propyl gallate Nutrition 0.000 description 1
- 229940075579 propyl gallate Drugs 0.000 description 1
- 230000004853 protein function Effects 0.000 description 1
- 235000018102 proteins Nutrition 0.000 description 1
- 102000004169 proteins and genes Human genes 0.000 description 1
- 230000005180 public health Effects 0.000 description 1
- 125000004076 pyridyl group Chemical group 0.000 description 1
- 125000000714 pyrimidinyl group Chemical group 0.000 description 1
- 150000003235 pyrrolidines Chemical class 0.000 description 1
- 125000000168 pyrrolyl group Chemical group 0.000 description 1
- 150000003856 quaternary ammonium compounds Chemical class 0.000 description 1
- 229940053146 rebetol Drugs 0.000 description 1
- 229940038850 rebif Drugs 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 230000001105 regulatory effect Effects 0.000 description 1
- BXNMTOQRYBFHNZ-UHFFFAOYSA-N resiquimod Chemical compound C1=CC=CC2=C(N(C(COCC)=N3)CC(C)(C)O)C3=C(N)N=C21 BXNMTOQRYBFHNZ-UHFFFAOYSA-N 0.000 description 1
- 229950010550 resiquimod Drugs 0.000 description 1
- 230000004044 response Effects 0.000 description 1
- 239000003340 retarding agent Substances 0.000 description 1
- 238000007363 ring formation reaction Methods 0.000 description 1
- 102220100737 rs141577476 Human genes 0.000 description 1
- 102220212648 rs142116829 Human genes 0.000 description 1
- 102220041209 rs142135772 Human genes 0.000 description 1
- 102220059798 rs56203955 Human genes 0.000 description 1
- 102220266584 rs747575706 Human genes 0.000 description 1
- 230000036185 rubor Effects 0.000 description 1
- FGHMGRXAHIXTBM-TWFJNEQDSA-N s-[2-[[(2r,3r,4r,5r)-5-(2-amino-6-oxo-3h-purin-9-yl)-3,4-dihydroxy-4-methyloxolan-2-yl]methoxy-(benzylamino)phosphoryl]oxyethyl] 3-hydroxy-2,2-dimethylpropanethioate Chemical compound C([C@@H]1[C@H]([C@@](C)(O)[C@H](N2C3=C(C(NC(N)=N3)=O)N=C2)O1)O)OP(=O)(OCCSC(=O)C(C)(CO)C)NCC1=CC=CC=C1 FGHMGRXAHIXTBM-TWFJNEQDSA-N 0.000 description 1
- 235000005713 safflower oil Nutrition 0.000 description 1
- 239000003813 safflower oil Substances 0.000 description 1
- 229930195734 saturated hydrocarbon Natural products 0.000 description 1
- 239000012047 saturated solution Substances 0.000 description 1
- 125000002914 sec-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- VPHXUNBMNWOYNQ-XLBCSPGISA-N setrobuvir Chemical compound N1([C@H]2[C@@H]3CC[C@@H](C3)[C@H]2C(=O)/C(C1=O)=C1/NC2=CC=C(C=C2S(=O)(=O)N1)NS(=O)(=O)C)CC1=CC=C(F)C=C1 VPHXUNBMNWOYNQ-XLBCSPGISA-N 0.000 description 1
- DEKOYVOWOVJMPM-RLHIPHHXSA-N setrobuvir Chemical compound N1([C@H]2[C@@H]3CC[C@@H](C3)[C@H]2C(O)=C(C1=O)C=1NC2=CC=C(C=C2S(=O)(=O)N=1)NS(=O)(=O)C)CC1=CC=C(F)C=C1 DEKOYVOWOVJMPM-RLHIPHHXSA-N 0.000 description 1
- 229950004113 setrobuvir Drugs 0.000 description 1
- 230000011664 signaling Effects 0.000 description 1
- 150000004760 silicates Chemical class 0.000 description 1
- RMAQACBXLXPBSY-UHFFFAOYSA-N silicic acid Chemical compound O[Si](O)(O)O RMAQACBXLXPBSY-UHFFFAOYSA-N 0.000 description 1
- 235000012239 silicon dioxide Nutrition 0.000 description 1
- YPNVIBVEFVRZPJ-UHFFFAOYSA-L silver sulfate Chemical compound [Ag+].[Ag+].[O-]S([O-])(=O)=O YPNVIBVEFVRZPJ-UHFFFAOYSA-L 0.000 description 1
- 229910000367 silver sulfate Inorganic materials 0.000 description 1
- 125000003808 silyl group Chemical group [H][Si]([H])([H])[*] 0.000 description 1
- 150000003385 sodium Chemical class 0.000 description 1
- WBHQBSYUUJJSRZ-UHFFFAOYSA-M sodium bisulfate Chemical compound [Na+].OS([O-])(=O)=O WBHQBSYUUJJSRZ-UHFFFAOYSA-M 0.000 description 1
- 229910000342 sodium bisulfate Inorganic materials 0.000 description 1
- 229940100996 sodium bisulfate Drugs 0.000 description 1
- 239000001509 sodium citrate Substances 0.000 description 1
- NLJMYIDDQXHKNR-UHFFFAOYSA-K sodium citrate Chemical compound O.O.[Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O NLJMYIDDQXHKNR-UHFFFAOYSA-K 0.000 description 1
- HRZFUMHJMZEROT-UHFFFAOYSA-L sodium disulfite Chemical compound [Na+].[Na+].[O-]S(=O)S([O-])(=O)=O HRZFUMHJMZEROT-UHFFFAOYSA-L 0.000 description 1
- 235000019333 sodium laurylsulphate Nutrition 0.000 description 1
- 229940001584 sodium metabisulfite Drugs 0.000 description 1
- 235000010262 sodium metabisulphite Nutrition 0.000 description 1
- 235000010288 sodium nitrite Nutrition 0.000 description 1
- 229940001482 sodium sulfite Drugs 0.000 description 1
- 235000010265 sodium sulphite Nutrition 0.000 description 1
- AKHNMLFCWUSKQB-UHFFFAOYSA-L sodium thiosulfate Chemical class [Na+].[Na+].[O-]S([O-])(=O)=S AKHNMLFCWUSKQB-UHFFFAOYSA-L 0.000 description 1
- 239000012321 sodium triacetoxyborohydride Substances 0.000 description 1
- 229950010695 sovaprevir Drugs 0.000 description 1
- 239000003549 soybean oil Substances 0.000 description 1
- 235000012424 soybean oil Nutrition 0.000 description 1
- 239000007921 spray Substances 0.000 description 1
- 238000001694 spray drying Methods 0.000 description 1
- 239000003381 stabilizer Substances 0.000 description 1
- 238000010186 staining Methods 0.000 description 1
- 238000010561 standard procedure Methods 0.000 description 1
- 239000003206 sterilizing agent Substances 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- 239000007929 subcutaneous injection Substances 0.000 description 1
- 235000000346 sugar Nutrition 0.000 description 1
- 150000008163 sugars Chemical class 0.000 description 1
- 239000011593 sulfur Substances 0.000 description 1
- 125000004434 sulfur atom Chemical group 0.000 description 1
- 239000002600 sunflower oil Substances 0.000 description 1
- 239000000829 suppository Substances 0.000 description 1
- 239000000375 suspending agent Substances 0.000 description 1
- 239000003765 sweetening agent Substances 0.000 description 1
- 238000010189 synthetic method Methods 0.000 description 1
- 239000002700 tablet coating Substances 0.000 description 1
- 238000009492 tablet coating Methods 0.000 description 1
- 239000011975 tartaric acid Substances 0.000 description 1
- 235000002906 tartaric acid Nutrition 0.000 description 1
- 229950004886 tegobuvir Drugs 0.000 description 1
- 108010017101 telaprevir Proteins 0.000 description 1
- UPPSEJUGDXOWLJ-WBMJQRKESA-N tert-butyl (2s,4s)-2-[5-(4-bromophenyl)-1h-imidazol-2-yl]-4-cyanopyrrolidine-1-carboxylate Chemical compound CC(C)(C)OC(=O)N1C[C@@H](C#N)C[C@H]1C1=NC=C(C=2C=CC(Br)=CC=2)N1 UPPSEJUGDXOWLJ-WBMJQRKESA-N 0.000 description 1
- IOCZFGUKUJYCDY-HOCLYGCPSA-N tert-butyl (2s,4s)-2-[5-(4-bromophenyl)-1h-imidazol-2-yl]-4-methylsulfanylpyrrolidine-1-carboxylate Chemical compound CC(C)(C)OC(=O)N1C[C@@H](SC)C[C@H]1C1=NC(C=2C=CC(Br)=CC=2)=CN1 IOCZFGUKUJYCDY-HOCLYGCPSA-N 0.000 description 1
- HBRGSRNWJJNDSE-HKUYNNGSSA-N tert-butyl (2s,4s)-2-[5-(4-bromophenyl)-1h-imidazol-2-yl]-4-morpholin-4-ylpyrrolidine-1-carboxylate Chemical compound C=1NC([C@@H]2C[C@@H](CN2C(=O)OC(C)(C)C)N2CCOCC2)=NC=1C1=CC=C(Br)C=C1 HBRGSRNWJJNDSE-HKUYNNGSSA-N 0.000 description 1
- XJZGXQNRXNTVPP-UNTHUGQZSA-N tert-butyl (2s,4s)-2-[5-[4-[4-[[6-[(2r)-4-(2,2-dimethylpropanoyl)-2-methylpiperazin-1-yl]pyridin-3-yl]carbamoyl]-3-fluoro-2-(trifluoromethoxy)phenyl]phenyl]-1h-imidazol-2-yl]-4-methylpyrrolidine-1-carboxylate Chemical compound CC(C)(C)OC(=O)N1C[C@@H](C)C[C@H]1C1=NC(C=2C=CC(=CC=2)C=2C(=C(F)C(C(=O)NC=3C=NC(=CC=3)N3[C@@H](CN(CC3)C(=O)C(C)(C)C)C)=CC=2)OC(F)(F)F)=CN1 XJZGXQNRXNTVPP-UNTHUGQZSA-N 0.000 description 1
- TWGCBXXDPOYFLC-HOTGVXAUSA-N tert-butyl (2s,4s)-2-[[2-(4-bromophenyl)-2-oxoethyl]carbamoyl]-4-(dimethylamino)pyrrolidine-1-carboxylate Chemical compound CC(C)(C)OC(=O)N1C[C@@H](N(C)C)C[C@H]1C(=O)NCC(=O)C1=CC=C(Br)C=C1 TWGCBXXDPOYFLC-HOTGVXAUSA-N 0.000 description 1
- AYLKDKBLYXODJI-NEPJUHHUSA-N tert-butyl (2s,5r)-2,5-dimethyl-4-(5-nitropyridin-2-yl)piperazine-1-carboxylate Chemical compound C[C@@H]1CN(C(=O)OC(C)(C)C)[C@@H](C)CN1C1=CC=C([N+]([O-])=O)C=N1 AYLKDKBLYXODJI-NEPJUHHUSA-N 0.000 description 1
- PGZCVLUQTJRRAA-BDAKNGLRSA-N tert-butyl (2s,5r)-2,5-dimethylpiperazine-1-carboxylate Chemical compound C[C@@H]1CN(C(=O)OC(C)(C)C)[C@@H](C)CN1 PGZCVLUQTJRRAA-BDAKNGLRSA-N 0.000 description 1
- HQLXOZIQFNNHSB-KGLIPLIRSA-N tert-butyl (2s,5r)-4-[5-[[4-bromo-2-chloro-5-(trifluoromethyl)phenyl]carbamoyl]pyridin-2-yl]-2,5-dimethylpiperazine-1-carboxylate Chemical compound C[C@@H]1CN(C(=O)OC(C)(C)C)[C@@H](C)CN1C1=CC=C(C(=O)NC=2C(=CC(Br)=C(C=2)C(F)(F)F)Cl)C=N1 HQLXOZIQFNNHSB-KGLIPLIRSA-N 0.000 description 1
- PBCODPAAOMSJCA-KGLIPLIRSA-N tert-butyl (2s,5r)-4-[5-[[4-bromo-2-fluoro-5-(trifluoromethoxy)phenyl]carbamoyl]pyridin-2-yl]-2,5-dimethylpiperazine-1-carboxylate Chemical compound C[C@@H]1CN(C(=O)OC(C)(C)C)[C@@H](C)CN1C1=CC=C(C(=O)NC=2C(=CC(Br)=C(OC(F)(F)F)C=2)F)C=N1 PBCODPAAOMSJCA-KGLIPLIRSA-N 0.000 description 1
- MPFWQXMMIIJDNP-LRDDRELGSA-N tert-butyl (2s,5s)-2-[5-(4-bromophenyl)-1h-imidazol-2-yl]-5-methylpyrrolidine-1-carboxylate Chemical compound CC(C)(C)OC(=O)N1[C@@H](C)CC[C@H]1C1=NC(C=2C=CC(Br)=CC=2)=CN1 MPFWQXMMIIJDNP-LRDDRELGSA-N 0.000 description 1
- USRSMJQCGIJYLK-CYBMUJFWSA-N tert-butyl (3r)-4-[5-[[4-bromo-2-fluoro-3-(trifluoromethoxy)benzoyl]amino]pyridin-2-yl]-3-methylpiperazine-1-carboxylate Chemical compound C[C@@H]1CN(C(=O)OC(C)(C)C)CCN1C(N=C1)=CC=C1NC(=O)C1=CC=C(Br)C(OC(F)(F)F)=C1F USRSMJQCGIJYLK-CYBMUJFWSA-N 0.000 description 1
- CXWXGVQYOJDVBZ-CYBMUJFWSA-N tert-butyl (3r)-4-[5-[[4-bromo-3-chloro-5-(trifluoromethoxy)benzoyl]amino]pyridin-2-yl]-3-methylpiperazine-1-carboxylate Chemical compound C[C@@H]1CN(C(=O)OC(C)(C)C)CCN1C(N=C1)=CC=C1NC(=O)C1=CC(Cl)=C(Br)C(OC(F)(F)F)=C1 CXWXGVQYOJDVBZ-CYBMUJFWSA-N 0.000 description 1
- IYWRCNFZPNEADN-CXODAYGWSA-N tert-butyl n-[(2s)-1-[(2s,4r)-2-[[(1r,2s)-1-(cyclopropylsulfonylcarbamoyl)-2-ethenylcyclopropyl]carbamoyl]-4-(6-methoxyisoquinolin-1-yl)oxypyrrolidin-1-yl]-3,3-dimethyl-1-oxobutan-2-yl]carbamate Chemical compound O=C([C@@H]1C[C@H](CN1C(=O)[C@@H](NC(=O)OC(C)(C)C)C(C)(C)C)OC=1C2=CC=C(C=C2C=CN=1)OC)N[C@]1(C(=O)NS(=O)(=O)C2CC2)C[C@H]1C=C IYWRCNFZPNEADN-CXODAYGWSA-N 0.000 description 1
- ILMRJRBKQSSXGY-UHFFFAOYSA-N tert-butyl(dimethyl)silicon Chemical compound C[Si](C)C(C)(C)C ILMRJRBKQSSXGY-UHFFFAOYSA-N 0.000 description 1
- 125000001981 tert-butyldimethylsilyl group Chemical group [H]C([H])([H])[Si]([H])(C([H])([H])[H])[*]C(C([H])([H])[H])(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 125000005931 tert-butyloxycarbonyl group Chemical group [H]C([H])([H])C(OC(*)=O)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- CIHOLLKRGTVIJN-UHFFFAOYSA-N tert‐butyl hydroperoxide Chemical compound CC(C)(C)OO CIHOLLKRGTVIJN-UHFFFAOYSA-N 0.000 description 1
- 125000003831 tetrazolyl group Chemical group 0.000 description 1
- 125000001113 thiadiazolyl group Chemical group 0.000 description 1
- 125000000335 thiazolyl group Chemical group 0.000 description 1
- 125000001544 thienyl group Chemical group 0.000 description 1
- 125000004568 thiomorpholinyl group Chemical group 0.000 description 1
- UOBYJVFBFSLCTQ-UHFFFAOYSA-N tmc647055 Chemical compound C12=CC=C(C(NS(=O)(=O)N(C)CCOCCN(C)C3=O)=O)C=C2N2CC3=CC3=CC(OC)=CC=C3C2=C1C1CCCCC1 UOBYJVFBFSLCTQ-UHFFFAOYSA-N 0.000 description 1
- AOBORMOPSGHCAX-DGHZZKTQSA-N tocofersolan Chemical class OCCOC(=O)CCC(=O)OC1=C(C)C(C)=C2O[C@](CCC[C@H](C)CCC[C@H](C)CCCC(C)C)(C)CCC2=C1C AOBORMOPSGHCAX-DGHZZKTQSA-N 0.000 description 1
- 229960000984 tocofersolan Drugs 0.000 description 1
- 239000003970 toll like receptor agonist Substances 0.000 description 1
- 230000000699 topical effect Effects 0.000 description 1
- 238000003146 transient transfection Methods 0.000 description 1
- 125000004306 triazinyl group Chemical group 0.000 description 1
- 125000001425 triazolyl group Chemical group 0.000 description 1
- CYRMSUTZVYGINF-UHFFFAOYSA-N trichlorofluoromethane Chemical compound FC(Cl)(Cl)Cl CYRMSUTZVYGINF-UHFFFAOYSA-N 0.000 description 1
- 229940029284 trichlorofluoromethane Drugs 0.000 description 1
- 125000004044 trifluoroacetyl group Chemical group FC(C(=O)*)(F)F 0.000 description 1
- WRECIMRULFAWHA-UHFFFAOYSA-N trimethyl borate Chemical group COB(OC)OC WRECIMRULFAWHA-UHFFFAOYSA-N 0.000 description 1
- 125000000026 trimethylsilyl group Chemical group [H]C([H])([H])[Si]([*])(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 229910052722 tritium Inorganic materials 0.000 description 1
- 125000002221 trityl group Chemical group [H]C1=C([H])C([H])=C([H])C([H])=C1C([*])(C1=C(C(=C(C(=C1[H])[H])[H])[H])[H])C1=C([H])C([H])=C([H])C([H])=C1[H] 0.000 description 1
- 235000015112 vegetable and seed oil Nutrition 0.000 description 1
- 239000008158 vegetable oil Substances 0.000 description 1
- 229940100050 virazole Drugs 0.000 description 1
- 235000012431 wafers Nutrition 0.000 description 1
- 239000002076 α-tocopherol Chemical class 0.000 description 1
- 235000004835 α-tocopherol Nutrition 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/496—Non-condensed piperazines containing further heterocyclic rings, e.g. rifampin, thiothixene or sparfloxacin
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/14—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing three or more hetero rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/4427—Non condensed pyridines; Hydrogenated derivatives thereof containing further heterocyclic ring systems
- A61K31/4439—Non condensed pyridines; Hydrogenated derivatives thereof containing further heterocyclic ring systems containing a five-membered ring with nitrogen as a ring hetero atom, e.g. omeprazole
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/535—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with at least one nitrogen and one oxygen as the ring hetero atoms, e.g. 1,2-oxazines
- A61K31/5375—1,4-Oxazines, e.g. morpholine
- A61K31/5377—1,4-Oxazines, e.g. morpholine not condensed and containing further heterocyclic rings, e.g. timolol
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/54—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with at least one nitrogen and one sulfur as the ring hetero atoms, e.g. sulthiame
- A61K31/541—Non-condensed thiazines containing further heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/16—Drugs for disorders of the alimentary tract or the digestive system for liver or gallbladder disorders, e.g. hepatoprotective agents, cholagogues, litholytics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/04—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D405/00—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom
- C07D405/14—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D409/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms
- C07D409/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D417/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00
- C07D417/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D491/00—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00
- C07D491/02—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00 in which the condensed system contains two hetero rings
- C07D491/10—Spiro-condensed systems
- C07D491/113—Spiro-condensed systems with two or more oxygen atoms as ring hetero atoms in the oxygen-containing ring
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Epidemiology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Virology (AREA)
- Oncology (AREA)
- Engineering & Computer Science (AREA)
- Communicable Diseases (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Gastroenterology & Hepatology (AREA)
- Molecular Biology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Plural Heterocyclic Compounds (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
- Peptides Or Proteins (AREA)
Abstract
Изобретение относится к области органической химии, а именно к соединению формулы (IV) или к его фармацевтически приемлемой соли, где R1 выбран из C1-6алкила, необязательно замещенного гидрокси или метокси, и тетрагидропирана; R2 обозначает атом водорода; R3 обозначает -С(О)OC1-6алкил; R4 обозначает метил, метокси или -СН2ОСН3; R7 выбран из атома фтора, хлора, -CF3 и -OCF3; R8 независимо обозначает метил или гидроксиметил; R9 выбран из -NHCH3, циклопропила, 2,2-диметилциклопропила, трет-бутила, C1-6алкила, замещенного -ОН, и имидазолила; R10 обозначает атом водорода или гидроксиметил; а принимает значение 1 или 2; и b принимает значение 1 или 2. Также изобретение относится к гетероциклическому соединению формулы (V), конкретному соединению, фармацевтической композиции на основе соединения формул (IV) или (V), способу получения целевого соединения, промежуточному соединению, а также к применению полученных соединений и способу ингибирования репликации вируса гепатита С. Технический результат: получены новые гетероциклические соединения, полезные для лечения вирусной инфекции вируса гепатита С. 8 н. и 7 з.п. ф-лы, 1 ил., 29 табл., 24 пр.
Description
Уровень техники
Область техники, к которой относится изобретение
Изобретение относится к соединениям, пригодным в качестве ингибиторов репликации вируса гепатита С (HCV). Изобретение также относится к фармацевтическим композициям, содержащим подобные соединения, к способам применения подобных соединений для лечения HCV инфекции, а также к способам получения промежуточных соединений и к промежуточным соединениям, пригодным для получения подобных соединений.
Описание предшествующего уровня техники
По недавним оценкам, число людей, инфицированных вирусом гепатита С (HCV) по всему миру, превышает 170 миллионов человек, в том числе 3 миллиона человек в Соединенных Штатах. Уровень распространения данного инфекционного заболевания примерно в 4-5 раз превышает уровень распространения вируса иммунодефицита человека (ВИЧ). Хотя у некоторых людей естественный иммунный ответ способен побороть вирус, в большинстве случаев развивается хроническая инфекция, которая приводит к повышенному риску развития цирроза печени и гепатоклеточной карциномы. Таким образом, заражение гепатитом С представляет серьезную проблему для общественного здравоохранения.
До середины 2011 года, принятый стандарт лечения инфекции HCV предполагал использование пегилированного интерферона, который, как полагают, оказывает свое действие путем усиления иммунного ответа организма, совместно с рибавирином. К сожалению, курс лечения является длительным, как правило, продолжается 48 недель, часто сопровождается серьезными неблагоприятными побочными эффектами, такими как депрессия, гриппоподобные симптомы, усталость и гемолитическая анемия, и оказывается неэффективным для 50% пациентов. В середине 2011 года в США были одобрены два ингибитора протеазы HCV для использования в сочетании с интерфероном и рибавирином. Несмотря на то, что были зарегистрированы лучшие показатели эффективности лечения, курс терапии по-прежнему остается длительным и сопровождается нежелательными побочными эффектами. Таким образом, сохраняется серьезная неудовлетворенная потребность в лечении HCV.
Вирус, ответственный за инфекцию HCV, был идентифицирован как вирус, содержащий плюс-цепь РНК, который принадлежит к семейству Flaviviridae. Геном HCV кодирует полипротеин, который в процессе жизненного цикла вируса расщепляется на десять отдельных белков, включая как структурные, так и неструктурные белки. Было показано, что для репликации РНК требуется шесть неструктурных белков, обозначенных как NS2, NS3, NS4A, NS4B, NS5A и NS5B. В частности, белок NS5A, видимо, играет значительную роль в репликации вируса, а также в регулировании физиологии клетки-хозяина. Было также установлено влияние NS5A на передачу сигнала интерферона, регуляцию клеточного роста и апоптоз. (Macdonald et al., Journal of General Virology (2004), 85, 2485-2502.) Как ожидается, соединения, которые подавляют функцию белка NS5A, предоставляют новые возможности для терапии HCV.
Сущность изобретения
В соответствии с одним аспектом, в настоящем изобретении предлагаются новые соединения, которые ингибируют репликацию вируса HCV.
Таким образом, настоящее изобретение касается соединения формулы (I):
где
R1 выбран из C1-6алкила, C1-6алкокси, фенила, C3-6циклоалкила, гетероцикла и гетероарила, где C1-6алкил необязательно замещен -ORa, амино, -SRe, гетероциклом или гетероарилом, C1-6алкокси необязательно замещен с помощью -ORa, а гетероцикл необязательно замещен -ORa, амино или -C(O)OC1-6алкилом или замещен одним или двумя C1-3алкилами или группой =O;
R2 выбран из атома водорода и C1-6алкила;
R3 выбран из атома водорода, C1-6алкила, -C(O)OC1-6алкила, -C(O)NRmRn, -C(O)C3-6циклоалкила и -S(O)2C1-3алкила;
или R2 и R3 вместе с атомом азота, к которому они присоединены, образуют гетероцикл;
R4 выбран из C1-6алкила, -NRbRc, -ORd, -SRe, -S(O)C1-3алкила, -S(O)2C1-3алкила, -CN, -C(O)NRaRb, гетероцикла, гетероарила и атома галоген, где C1-6алкил необязательно замещен -ORa; а R5 и R6 представляют собой атом водорода;
или R4 и R5 независимо друг от друга обозначают C1-6алкил или атом галогена, а R6 обозначает атом водорода;
или R4 и R5 вместе образуют -(CH2)n-, где n принимает значения 2, 3, 4 или 5, а R6 обозначает атом водорода;
или R4 и R5 вместе образуют -O-(CH2)2-O-, а R6 обозначает атом водорода;
или R4 обозначает атом водорода или C1-3алкил, а R5 и R6 вместе образуют -(CH2)m-, где m принимает значения 1, 2, 3 или 4;
или R4 и R5 каждый обозначает атом водорода, а R6 обозначает C1-6алкил;
R7 выбран из атома галогена, C1-3алкила и C1-3алкокси, где C1-3алкил и C1-3алкокси необязательно замещены одним, двумя, тремя, четырьмя или пятью атомами галогена;
R8 обозначает C1-3алкил, необязательно замещенный -ORh;
R9 выбран из C1-6алкила, C3-6циклоалкила, C1-6алкокси, -NRfRg, гетероарила, гетероцикла и -CH2-гетероарила;
где:
C1-6алкил необязательно замещен одним или двумя заместителями, независимо выбранными из -ORh, -NRjRk, -NHC(O)C1-3алкила, -NHC(O)OC1-3алкила, -NHC(O)C3-6циклоалкила, С3-6циклоалкила, атома галогена, -NHC(O)C1-3алкилC(O)ORh, -NHC(O)C1-3алкилORh, -NHC(O)NHC1-3алкила, -NHS(O)2C1-3алкила и гетероцикла;
C1-6алкокси необязательно замещен -ORh;
любой C3-6циклоалкил необязательно замещен одним, двумя или тремя заместителями, независимо выбранными из C1-3алкила, атома галогена, -NRaRb, -ORh и -CD3, где любой C1-3алкил необязательно замещен одним, двумя или тремя атомами галогена;
любой гетероцикл необязательно замещен одним, двумя или тремя заместителями, независимо выбранными из C1-3алкила, атома галогена, -C(O)OC1-3алкила, -C(O)C1-6алкила, -C(O)C3-6циклоалкила, -C(O)NHC1-6алкила, -C(O)NHC3-6циклоалкила, -S(O)2C1-6алкила и -C(O)NH2;
где любой -C(O)C1-6алкил необязательно замещен -NHC(O)OC1-3алкилом, -ORh, -NRjRk или гетероциклом,
любой -C(O)C3-6циклоалкил необязательно замещен одним или двумя C1-3алкилами, и
любой -C(O)NHC1-6алкил необязательно замещен -ORh или C3-6циклоалкилом;
любой гетероарил необязательно замещен одним или двумя C1-3алкилами;
Ra, Rb, Re, Rh, Rj, Rk, Rm и Rn независимо друг от друга обозначают атом водорода или С1-3алкил;
Rc обозначает атом водорода или C1-6алкил, где C1-6алкил необязательно замещен -ORa или амино;
Rd обозначает атом водорода или C1-6алкил, где C1-6алкил необязательно замещен -ORh или гетероарилом, необязательно замещенным C1-3алкилом;
Rf обозначает атом водорода или C1-6алкил, где C1-6алкил необязательно замещен -ORh;
Rg выбран из атома водорода, C1-6алкила, C1-6алкокси, С3-6циклоалкила, NRaRb и гетероцикла, где C1-6алкил необязательно замещен -ORh, а гетероцикл необязательно замещен одной или двумя группами =O;
R10 выбран из атома водорода, атома галогена и C1-3алкила, где C1-3алкил необязательно замещен одним, двумя или тремя атомами галогена или -ORh;
Аm обозначает -NHC(O)- или -C(O)NH-;
a принимает значение 0, 1 или 2; и
b принимает значение 0, 1 или 2;
или фармацевтически приемлемой соли его стереоизомера.
Далее в настоящем описании выражение "соединение формулы (I)" означает соединение формулы (I) или его фармацевтически приемлемую соль; т.е. если не указано иное, данное выражение означает соединение формулы (I) в форме свободного основания или в форме фармацевтически приемлемой соли.
Изобретение также относится к фармацевтической композиции, содержащей соединение по настоящему изобретению и фармацевтически приемлемый носитель. Кроме того, настоящее изобретение относится к фармацевтической композиции, содержащей соединение по настоящему изобретению, фармацевтически приемлемый носитель и одно или несколько других терапевтических средств, пригодных для лечения инфекции вируса гепатита С.
В настоящем изобретении предлагается также способ лечения инфекции вируса гепатита С у млекопитающего, при этом способ включает введение млекопитающему терапевтически эффективного количества соединения по настоящему изобретению или фармацевтической композиции по настоящему изобретению. Кроме того, в настоящем изобретении предлагается способ лечения инфекции вируса гепатита С у млекопитающего, который включает введение млекопитающему соединения по настоящему изобретению или фармацевтической композиции по настоящему изобретению и одного или нескольких других терапевтических средств, пригодных для лечения инфекции вируса гепатита С. Кроме того, изобретение относится к способу подавления репликации вируса гепатита С у млекопитающего, при этом способ включает введение соединения по настоящему изобретению или фармацевтической композиции по настоящему изобретению.
В соответствии с отдельными и различными аспектами, в настоящем изобретении также предлагаются методики синтеза промежуточных соединения и промежуточные соединения, приведенные в настоящем описании, которые пригодны для получения соединений по настоящему изобретению.
В настоящем изобретение предлагается также приведенное в данном описании соединение по настоящему изобретению для применения при лечении инфекции вируса гепатита С у млекопитающего, а также применение соединения по настоящему изобретению для изготовлении композиции или лекарственного средства, предназначенного для лечения инфекции вируса гепатита С у млекопитающего.
Краткое описание чертежей
На чертеже приведена порошковая рентгеновская дифрактограмма (PXPD) кристаллической (R)-5-хлор-4-(6-(2-метил-4-пивалоилпиперазин-1-ил)никотинамидо)-2-(трифторметокси)-фенилбороновой кислоты.
Подробное описание изобретения
Среди прочих аспектов, настоящее изобретение касается ингибиторов репликации HCV формулы (I), их фармацевтически приемлемых солей, а также промежуточных соединения для их получения. Следующие заместители и значения представлены в качестве иллюстративных примеров различных аспектов настоящего изобретения. Указанные примерные значения предназначены для дальнейшего определения подобных аспектов и не предполагают исключения других значений или ограничения объема настоящего изобретения.
В соответствии с конкретным аспектом, R1 выбран из C1-6алкила, C1-6алкокси, фенила, C3-6циклоалкила, гетероцикла и гетероарила, где C1-6алкил необязательно замещен -ORa, амино, -SRe, гетероциклом или гетероарилом, C1-6алкокси необязательно замещен -ORa, а гетероцикл необязательно замещен -ORa, амино или -C(O)OC1-6алкилом или замещен одним или двумя C1-3алкилами или группой =O.
В соответствии с другим конкретным аспектом, R1 выбран из C1-6алкила, C1-6алкокси, фенила, C3-6циклоалкила, гетероцикла и гетероарила, где C1-6алкил необязательно замещен -ORa, амино, -SRe, гетероциклом или гетероарилом, C1-6алкокси необязательно замещен -ORa, а гетероцикл необязательно замещен-ORa, амино, или -C(O)OC1-6алкилом или одним или двумя C1-3алкилами, где Ra обозначает атом водорода или C1-3алкил.
В соответствии с другим конкретным аспектом, R1 выбран из C1-3алкила, фенила, C5-6циклоалкила и гетероцикла, где C1-3алкил необязательно замещен -ORa, где Ra обозначает атом водорода или C1-3алкил, а любой гетероцикл имеет шесть кольцевых атомов и необязательно замещен одним или двумя C1-3алкилами или группой =O.
В соответствии с другим конкретным аспектом, R1 выбран из C1-6алкила, фенила и гетероцикла, где C1-6алкил необязательно замещен -ORa, а гетероцикл имеет шесть кольцевых атомов и необязательно замещен -ORa, или амино, или одним или двумя метилами. В соответствии с другим конкретным аспектом, R1 выбран из C1-6алкила, фенила и C3-6циклоалкила; где C1-6алкил необязательно замещен -ORa; где Ra обозначает атом водорода или C1-3алкил.
В соответствии с другим конкретным аспектом, R1 выбран из C1-6алкила, фенила и тетрагидропиранила, где C1-6алкил необязательно замещен -ORa; где Ra обозначает атом водорода или C1-3алкил.
В соответствии с другим конкретным аспектом, R1 выбран из C1-6алкила, необязательно замещенного гидрокси или метокси, тетрагидропирана и фенила. В соответствии с другим конкретным аспектом, R1 выбран из C1-6алкила и фенила.
Конкретные значения R1 включают изопропил, фенил, тетрагидропиран-4-ил, 2,6-диметилтетрагидропиран-4-ил, 1,1-диоксогексагидро-1λ6-тиопиран-4-ил, оксэтан-3-ил, 1-гидроксиэтил, 1-метоксиэтил, 2-гидроксипропан-2-ил, циклогексил, циклопентил, тиофен-2-ил и фуран-2-илметил.
В соответствии с одним конкретным аспектом, R1 обозначает С1-3алкил.
В соответствии с другим конкретным аспектом, R1 обозначает изопропил.
В соответствии с еще одним конкретным аспектом, R1 обозначает фенил.
В соответствии с еще одним конкретным аспектом, R1 обозначает тетрагидропиранил.
В соответствии с еще одним конкретным аспектом, R1 обозначает тетрагидропиран-4-ил.
В соответствии с одним конкретным аспектом, R2 обозначает атом водорода или C1-6алкил.
В соответствии с другими конкретными аспектами, R2 обозначает атом водорода или C1-3алкил; или R2 обозначает атом водорода.
В соответствии с одним конкретным аспектом, R3 выбран из атома водорода, C1-6алкила, -C(O)OC1-6алкила, -C(O)NRmRn, -C(O)C3-6циклоалкила и -S(O)2C1-3алкила; или же R2 и R3 вместе с атомом азота, к которому они присоединены, образуют гетероцикл.
В соответствии с другим конкретным аспектом, R3 выбран из атома водорода, C1-6алкила, -C(O)OC1-6алкила, -C(O)NRmRn, -C(O)C3-6циклоалкила и -S(O)2C1-3алкила.
В соответствии с другим конкретным аспектом, R3 выбран из атома водорода, C1-6алкила и -C(O)OC1-6алкила.
В соответствии с еще одним конкретным аспектом, R3 обозначает -C(O)OC1-3алкил.
В соответствии с другим конкретным аспектом, R2 и R3 вместе с атомом азота, к которому они присоединены, образуют гетероцикл.
В соответствии с еще одним конкретным аспектом, R2 и R3 вместе с атомом азота, к которому они присоединены, образуют пиперидинильный цикл.
В соответствии с одним конкретным аспектом, R1 обозначает C1-6алкил, R2 обозначает атом водорода, а R3 обозначает -C(O)OC1-6алкил.
В соответствии с другим конкретным аспектом, R1 обозначает изопропил, R2 обозначает атом водорода, а R3 обозначает -C(O)OCH3.
В соответствии с другими конкретными аспектами, R1 обозначает фенил и R2 и R3 каждый обозначает C1-3алкил; или R1 обозначает фенил, R2 обозначает атом водорода, а R3 обозначает -C(O)OC1-3алкил; или R1 обозначает тетрагидропиранил, R2 обозначает атом водорода, а R3 обозначает -C(O)OC1-3алкил.
В соответствии с конкретным аспектом, R4 выбран из C1-6алкила, -NRbRc, -ORd, -SRe, -S(O)C1-3алкила, -S(O)2C1-3алкила, -CN, -C(O)NRaRb, гетероцикла, гетероарила и атома галогена; и R5 и R6 обозначают атом водорода.
В соответствии с другим конкретным аспектом, R4 выбран из C1-6алкила, -NRbRc, -ORd, -SRe; а R5 и R6 обозначают атом водорода.
В соответствии с другим конкретным аспектом, R4 выбран из С1-6алкила, -ORd и -C(O)NRaRb, а R5 и R6 обозначают атом водорода.
В соответствии с другим конкретным аспектом, R4 выбран из C1-3алкила и -ORd, где C1-3алкил необязательно замещен -ORa, где Ra и Rd независимо обозначают атом водорода или C1-3алкил; а R5 и R6 обозначают атом водорода.
В соответствии с другим конкретным аспектом, R4 выбран из метила, метокси, атома фтора, -CH2OCH3, -C(O)NH2, -CN, -NH2, -NH(CH3)2, -SCH3, -S(O)СН3, -S(O)2CH3, морфолинила и пирролидин-1-ила, а R5 и R6 обозначают атом водорода.
В соответствии с другим конкретным аспектом, R4 выбран из метила, метокси и -C(O)NH2, а R5 и R6 обозначают атом водорода.
В соответствии с еще одним аспектом, R4 обозначает метил или метокси, а R5 и R6 обозначают атом водорода.
В соответствии с еще одним аспектом, R4 обозначает метил, а R5 и R6 обозначают атом водорода.
В соответствии с другим конкретным аспектом, R4 и R5 независимо обозначают C1-6алкил, а R6 обозначает атом водорода.
В соответствии с еще одним конкретным аспектом, R4 и R5 каждый обозначает атом фтора.
В соответствии с еще одним конкретным аспектом, R4 и R5 вместе образуют -O-(CH2)2-O-, а R6 обозначает атом водорода.
В соответствии с еще одним конкретным аспектом, R4 и R5 вместе образуют -(CH2)n-, где n принимает значение 2, 3, 4 или 5.
В соответствии с дополнительными аспектами, R4 обозначает атом водорода, а R5 и R6 вместе образуют -(CH2)n-, где n равно 1 или 4; или R4 обозначает атом водорода, а R5 и R6 вместе образуют -(CH2)4-.
В соответствии с другими аспектами, R4 и R5 каждый обозначает атом водорода, а R6 обозначает C1-6алкил, или R4 и R5 каждый обозначает атом водорода, а R6 обозначает метил.
В соответствии с конкретным аспектом, R7 выбран из атома галогена, C1-3алкила и C1-3алкокси, где C1-6алкил и C1-6алкокси необязательно замещены одним, двумя, тремя, четырьмя или пятью атомами галогена.
В соответствии с другим конкретным аспектом, R7 выбран из атома галогена, C1-3алкила и C1-3алкокси, где C1-6алкил и C1-6алкокси замещены одним, двумя или тремя атомами галогена.
В соответствии с еще одним конкретным аспектом, R7 выбран из атома фтора, хлора, -CF3 и -OCF3.
В соответствии с конкретным аспектом, R8 обозначает C1-3алкил, необязательно замещенный -ORh; где Rh обозначает атом водорода или C1-3алкил.
В соответствии с конкретным аспектом, R8 обозначает C1-3алкил.
В соответствии с другим конкретным аспектом, R8 обозначает метил или гидроксиметил.
В соответствии с другим конкретным аспектом, R8 обозначает метил.
В соответствии с конкретным аспектом, значение R9 определено в формуле (I).
В соответствии с другим конкретным аспектом, R9 выбран из C1-6алкила, C3-6циклоалкила, C1-6алкокси, -NRfRg, гетероарила, гетероцикла и -CH2-гетероарила; где С1-6алкил необязательно замещен одним или двумя заместителями, независимо выбранными из -ORh, -NRjRk, -NHC(O)C1-3алкила, -NHC(O)OC1-3алкила, -NHC(O)C3-6циклоалкила, С3-6циклоалкила и атома галогена; C1-6алкокси необязательно замещен -ORh; любой C3-6циклоалкил необязательно замещен одним, двумя или тремя заместителями, независимо выбранными из C1-3алкила, атома галогена, -NRaRb, -ORh и CD3, где любой C1-3алкил необязательно замещен одним, двумя или тремя атомами галогена; любой гетероцикл необязательно замещен одним, двумя или тремя заместителями, независимо выбранными из C1-3алкила, атома галогена, -C(O)OC1-3алкила, -C(O)C1-6алкила, -C(O)C3-6циклоалкила, -C(O)NHC1-6алкила, -C(O)NHC3-6циклоалкила, -S(O)2C1-6алкила и -C(O)NH2; где любой -C(O)C1-6алкил необязательно замещен -NHC(O)OC1-3алкилом, -ORh, -NRjRk или гетероциклом, любой -C(O)C3-6циклоалкил необязательно замещен одним или двумя C1-3алкилами и любой -C(O)NHC1-6алкил необязательно замещен -ORh или C3-6циклоалкилом; любой гетероарил необязательно замещен одним или двумя C1-3алкилами; значения Ra, Rb, Rh, Rj и Rk определены в формуле (I), а Rg выбран из атома водорода, C1-6алкила, C1-6алкокси, C3-6циклоалкила, NRaRb и гетероцикла, где C1-6алкил необязательно замещенный -ORh, и гетероцикл необязательно замещен группой =O.
В соответствии с другим конкретным аспектом, R9 выбран из C1-6алкила, C3-6циклоалкила, -NRfRg, гетероарила, гетероцикла и -CH2-гетероарила; где любой гетероарил или гетероцикл содержит в цикле 5 или 6 атомов; любой гетероарил необязательно замещен C1-3алкилом; C1-6алкил необязательно замещен одним или двумя заместителями, независимо выбранными из -ORh, -NRjRk, -NHC(O)C1-3алкила и -HC(O)OC1-3алкила; любой C3-6циклоалкил необязательно замещен одним или двумя C1-3алкилами; любой гетероцикл необязательно замещен одним или двумя заместителями, независимо выбранными из C1-3алкила, -C(O)OC1-3алкила, -C(O)C1-6алкила, -C(O)C3-6циклоалкила, -C(O)NHC1-6алкила и -C(O)NHC3-6циклоалкила; где любой -C(O)C1-6алкил необязательно замещен -NHC(O)OC1-3алкилом, -ORh, -NRjRk или гетероциклом; любой -C(O)C3-6циклоалкил необязательно замещен одним или двумя C1-3алкилами; и любой -C(O)NHC1-6алкил необязательно замещен -ORh или C3-6циклоалкилом.
В соответствии с еще одним конкретным аспектом, R9 выбран из С3-4циклоалкила, -CH2NRjRk, -NRfRg, имидазолила, пиразолила, пиримидинила и пирролидинила; где С3-4циклоалкил необязательно замещен одним или двумя C1-3алкилами; пирролидинил необязательно замещен метилом и заместителем, выбранным из -C(O)OC1-3алкила, -C(O)C1-6алкила, -C(O)NHC1-6алкила, где -C(O)C1-6алкил замещен -NHC(O)OC1-3алкилом, -ORh, -NRjRk или гетероциклом.
В соответствии с другим конкретным аспектом, R9 выбран из C1-6алкила, С3-6циклоалкила, NRfRg, где Rf и Rg независимо обозначают атом водорода или C1-3алкил, гетероарила и гетероцикла, где C1-6алкил необязательно замещен -ORh, C3-6циклоалкил необязательно замещен одним или двумя C1-3алкилами или атомами галогена, любой гетероарил имеет пять или шесть атомов в цикле и любой гетероцикл имеет пять атомов в цикле и необязательно замещен одним или двумя заместителями, выбранными из C1-3алкила, -C(O)OC1-3алкила, -C(O)C1-6алкила, -C(O)NHC1-6алкила и -C(O)C1-3алкилNHC(O)OCH3.
Примеры конкретных значений R9, в соответствии с данным аспектом, включают -NHCH3, циклопропил, 2,2-диметилциклопропил, трет-бутил, 3-гидрокси-2,2-диметилпропил, имидазолил, 2,2-дифторциклопропил, 2,2-дихлорциклопропил и 2-метилпирролидин-2-ил, замещенный по атому азота -C(O)NHCH3, -C(O)-t-Bu, -C(O)CH3, -C(O)iPr, C(O)CH2OCH3, C(O)-t-Bu или -C(O)CH(iPr)NHC(O)ОСН3.
В соответствии с еще одним аспектом, R9 выбран из C1-6алкила, необязательно замещенного -ORh, где Rh обозначает атом водорода или C1-3алкил, и C3-4циклоалкила, необязательно замещенного одним или двумя C1-3алкилами.
В соответствии с еще одним аспектом, R9 выбран из -NHCH3, 2,2-диметилциклопропила, трет-бутила и имидазолила.
В соответствии с другим конкретным аспектом, R9 выбран из -NHCH3, циклопропила, 2,2-диметилциклопропила, трет-бутила, 3-гидрокси-2,2-диметилпропила и имидазолила.
В соответствии с еще одним дополнительным аспектом, R9 выбран из циклопропила, 2,2-диметилциклопропила, трет-бутила и 3-гидрокси-2,2-диметилпропила.
В соответствии с конкретным аспектом, R10 обозначает атом водорода, атом галогена, C1-3алкил, где C1-3алкил необязательно замещен одним, двумя или тремя атомами галогена или -ORh.
В соответствии с конкретным аспектом, R10 обозначает атом водорода, атом галогена или C1-3алкил, замещенный одним, двумя или тремя атомами галогена.
В соответствии с другими конкретными аспектами, R10 обозначает атом водорода или атом галогена; или R10 обозначает атом водорода, атом хлора или фтора; или R10 обозначает атом водорода или -CH2OH.
В соответствии с другим конкретным аспектом, R10 обозначает -CF3.
В соответствии с другим конкретным аспектом, R10 обозначает атом хлора.
В соответствии с еще одним конкретным аспектом, R10 обозначает атом водорода.
В соответствии с еще одним дополнительным аспектом, R10 обозначает -CH2OH.
В соответствии с конкретным аспектом, a принимает значение 0, 1 или 2.
В соответствии с другим конкретным аспектом, a принимает значение 1 или 2.
В соответствии с конкретным аспектом, b принимает значение 0, 1 или 2.
В соответствии с другим конкретным аспектом, b принимает значение 1 или 2.
В соответствии с еще одним конкретным аспектом, b равно 1.
В соответствии с другим аспектом, настоящее изобретение касается соединений формулы (II):
где переменные в формуле (II) определены в данном описании.
В соответствии с другим аспектом, настоящее изобретение касается соединений формулы (III):
где переменные в формуле (III) определены в данном описании.
В соответствии с еще одним аспектом, настоящее изобретение касается соединений формулы (IV):
где:
R1 выбран из C1-6алкила, необязательно замещенного гидрокси или метокси, тетрагидропирана и фенила;
R2 обозначает атом водорода;
R3 обозначает -C(O)OC1-6алкил;
R4 обозначает метил или метокси;
R7 выбран из атома фтора, хлора, -CF3 и -OCF3;
R8 независимо обозначает метил или гидроксиметил;
R9 выбран из -NHCH3; циклопропила, 2,2-диметилциклопропила, трет-бутила, 3-гидрокси-2,2-диметилпропила и имидазолила;
R10 обозначает атом водорода или гидроксиметил;
a принимает значение 1 или 2; и
b принимает значение 1 или 2;
или их фармацевтически приемлемой соли.
В соответствии с данным аспектом, соединения по настоящему изобретению являются соединения формулы (IVa) и (IVb):
где R1 обозначает изопропил или тетрагидропиранил, R7d обозначает атом фтора или хлора, а R9 обозначает трет-бутил или 3-гидрокси-2,2-диметилпропил.
В соответствии с еще одним аспектом, настоящее изобретение касается соединений формулы (V):
где:
R1 выбран из C1-6алкила, необязательно замещенного гидрокси или метокси, тетрагидропирана и фенила;
R2 обозначает атом водорода;
R3 обозначает -C(O)OC1-6алкил;
R4 обозначает метил или метокси;
R7 выбран из атома фтора, хлора, -CF3 и -OCF3;
R8 независимо обозначает метил или гидроксиметил;
R9 выбран из -NHCH3, циклопропила, 2,2-диметилциклопропила, трет-бутила, 3-гидрокси-2,2-диметилпропила и имидазолила;
R10 обозначает атом водорода или гидроксиметил;
a принимает значение 1 или 2; и
b принимает значение 1 или 2;
или их фармацевтически приемлемой соли.
В соответствии с одним аспектом, в настоящем изобретении предлагаются соединения, приведенные ниже в примерах 1-24 и в таблицах 1-29.
В соответствии с другим аспектом, в настоящем изобретении предлагается соединение, выбранное из следующих соединений:
и их фармацевтически приемлемых солей.
Химические структуры в данном описании получили название в соответствии с конвенциями IUPAC, которые применены в доступных программных продуктах. Например, соединение примера 1:
обозначено как метиловый эфир ((S)-1-{(2S,4S)-2-[4-(5'-хлор-4'-{[6-((2R,5S)-2,5-диметил-4-метилкарбамоилпиперазин-1-ил)пиперидин-3-карбонил]амино}-2'-трифторметоксибифенил-4-ил)-1H-имидазол-2-ил]-4-метилпирролидин-1-карбонил}-2-метилпропил)карбаминовой кислоты в соответствии с программным продуктом AutoNom (MDL Information Systems GmbH, Франкфурт, Германия). Эквивалентно, соединение может быть названо как метил (S)-1-((2S,4S)-2-(4-(5'-хлор-4'-(6-((2R,5S)-2,5-диметил-4-(метилкарбамоил)пиперазин-1-ил)никотинамидо)-2'-(трифторметокси)бифенил-4-ил)-1H-имидазол-2-ил)-4-метилпирролидин-1-ил)-3-метил-1-оксобутан-2-илкарбамат, в соответствии с программным продуктом ChemDraw (PerkinElmer, Inc., Кембридж, Массачусетс).
Кроме того, имидазольный фрагмент в структуре формулы (I) существует в таутомерных формах, приведенных ниже для фрагмента соединения по примеру 1
В соответствии с конвенцией IUPAC, представленные структуры приводят к различной нумерации атомов имидазольного фрагмента, а именно: метил (S)-3-метил-1-((2S,4S)-4-метил-2-(4-фенил-1H-имидазол-2-ил)пирролидин-1-ил)-1-оксобутан-2-илкарбамат (структура A) в сравнении с метил (S)-3-метил-1-((2S,4S)-4-метил-2-(5-фенил-1H-имидазол-2-ил)пирролидин-1-ил)-1-оксобутан-2-илкарбаматом (структура B). Следует понимать, что хотя структуры изображены или названы в конкретной форме, настоящее изобретение также включает их таутомеры.
Соединения по настоящему изобретению содержат один или несколько хиральных центров и, следовательно, подобные соединения (и их промежуточные соединения) могут существовать в виде рацемических смесей; в виде чистых стереоизомеров (например, энантиомеров или диастереомеров); в виде обогащенных стереоизомером смесей и т.п. Если не указано иное, то предполагается, что хиральные соединения, приведенные или названные в данном описании без указания на определенную стереохимическую конфигурацию при хиральном центре, включают любые или все возможные варианты стереоизомеров для не идентифицированного стереоцентра. Описание или название конкретного стереоизомера означает, что указанный стереоцентр имеет обозначенную стереохимическую конфигурацию, при этом следует понимать, что, если не указано иное, могут также присутствовать небольшие количества других стереоизомеров, при условии, что полезное свойство изображенного или названного соединения не исчезает в присутствии другого стереоизомера.
Соединения формулы (I) также содержат несколько обладающих свойствами основания групп (например, содержат амино группы) и, следовательно, подобные соединения могут существовать в виде свободного основания или в различных солевых формах, таких как монопротонированная солевая форма, дипротонированная солевая форма, трипротонированная солевая форма или их смеси. Если не указано иное, все подобные формы включены в объем настоящего изобретения.
Настоящее изобретение также включает меченные изотопами соединения формулы (I), т.е. соединений формулы (I), где один атом заменен или обогащен атомом, имеющим тот же атомный номер, но атомная масса которого отличается от атомной массы, преобладающей в природе. Примеры изотопов, которые могут быть введены в соединение формулы (I), включают, однако этим не ограничиваясь, 2H, 3H, 11С, 13С, 14С, 13N, 15N, 15O, 17O, 18O, 35S, 36Cl и 18F. Особый интерес представляют соединения формулы (I), обогащенные тритием или углеродом-14, которые могут быть использованы, например, для изучения распределения препаратов в тканях. Кроме того, особый интерес представляют соединения формулы (I), обогащенные дейтерием, в особенности в важных для обмена веществ местах, и как ожидается, указанные соединения обладают большей метаболической стабильностью. Кроме того, особый интерес представляют соединения формулы (I), обогащенные изотопами, излучающими позитроны, такими как 11C, 18F, 15O и 13N, и указанные соединения могут быть использованы, например, для проведения исследований методом позитронно-эмиссионной томографии (PET).
Определения
При описании настоящего изобретения, включая различные его аспекты и варианты, следующие термины, если не указано иное, имеют следующие значения.
Термин "алкил" означает одновалентную насыщенную углеводородную группу, которая может быть линейной или разветвленной или представлять собой их комбинацию. Если не указано иное, подобные алкильные группы обычно содержат от 1 до 10 атомов углерода. Типичные алкильные группы включают, в качестве примера, метил (Me), этил (Et), н-пропил (n-Pr) или (nPr), изопропил (i-Pr) или (iPr), н-бутил (n-Bu) или (nBu), втор-бутил, изобутил, трет-бутил (t-Bu) или (tBU), н-пентил, н-гексил, 2,2-диметилпропил, 2-метилбутил, 3-метилбутил, 2-этилбутил, 2,2-диметилпентил, 2-пропилпентил и т.п.
В том случае, когда для конкретного термина указано число атомов углерода, то число атомов углерода предшествует термину. Например, термин "C1-3алкил" обозначает алкильную группу, имеющую от 1 до 3 атомов углерода, где атомы углерода имеют любую химически приемлемую конфигурацию, в том числе линейную или разветвленную конфигурации.
Термин "алкокси" означает одновалентную группу -O-алкил, где значение алкила определено выше. Типичные алкокси группы включают, в качестве примера, метокси, этокси, пропокси, бутокси и т.п.
Термин "циклоалкил" означает одновалентную насыщенную карбоциклическую группу, которая может быть моноциклической или полициклической. Если не указано иное, подобные циклоалкильные группы обычно содержат от 3 до 10 атомов углерода. Типичные циклоалкильные группы включают, в качестве примера, циклопропил (cPr), циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, адамантил и т.п.
Термин "гетероцикл", "гетероциклический" или "гетероциклическое кольцо" означает одновалентную насыщенную или частично ненасыщенную циклическую неароматическую группу, имеющую в цикле от 3 до 10 атомов, причем цикл содержит от 2 до 9 кольцевых атомов углерода и от 1 до 4 кольцевых гетероатомов, выбранных из атома азота, кислорода и серы. Гетероциклические группы могут быть моноциклическими или полициклическими (например, конденсированными или мостиковыми). Типичные гетероциклические группы включают, в качестве примера, пирролидинил, пиперидинил, пиперазинил, имидазолидинил, морфолинил, тиоморфолинил, индолин-3-ил, 2-имидазолинил, тетрагидропиранил, 1,2,3,4-тетрагидроизохинолин-2-ил, хинуклидинил, 7-азанорборнанил, нортропанил и т.п., где местом присоединения является любой доступный атом углерода или азота цикла. Если из контекста точка присоединения гетероциклической группы очевидна, то подобные группы, в качестве альтернативы, могут быть указаны как невалентные химические соединения, в частности, как пирролидин, пиперидин, пиперазин, имидазол, тетрагидропиран и т.п.
Термин "гетероарил" или "гетероарильный цикл" означает одновалентную ароматическую группу, имеющую от 5 до 10 атомов в цикле, причем цикл содержит от 1 до 9 кольцевых атомов углерода и от 1 до 4 кольцевых гетероатомов, выбранных из атома азота, кислорода и серы. Гетероарильные группы могут быть моноциклическими или полициклическими. Типичные гетероарильные группы включают, в качестве примера, пирролил, изоксазолил, изотиазолил, пиразолил, оксазолил, оксадиазолил, тиадиазолил, тиазолил, имидазолил, триазолил, тетразолил, фуранил, триазинил, тиенил, пиридил (или, эквивалентно, пиридинил), пиримидил, пиридазинил, пиразинил, индолил, бензофуранил, бензотиенил, бензимидазолил, бензтиазолил и т.п., где местом присоединения является любой доступный атом углерода или азота цикла. Если из контекста точка присоединения гетероарильной группы очевидна, то подобные группы могут быть, в качестве альтернативы, указаны в невалентной форме, в частности, как пиррол, изоксазол, изотиазол, пиразол, имидазол и т.д.
Термин "атом галогена" означает атом фтора, хлора, брома или иода.
Термин "терапевтически эффективное количество" означает количество, достаточное для эффективного лечения при введении нуждающемуся в лечении пациенту.
Термин "лечение" в данном описании означает лечение заболевания, расстройства или медицинского состояния у пациента (например, инфекции вируса гепатита С), такого как млекопитающее (в частности, человек), которое включает одно или несколько из следующих действий:
(a) предотвращение возникновения заболевания, расстройства или медицинского состояния, в частности, предотвращение повторного заболевания или медицинского состояния, или профилактическое лечение пациента, который предрасположен к заболеванию или медицинскому состоянию;
(b) снижение интенсивности симптомов заболевания, расстройства или медицинского состояния, в частности, устранение или регрессию заболевания, расстройства или медицинского состояния у пациента, в том числе борьбу с последствиями использования других терапевтических средств;
(c) подавление заболевания, расстройства или медицинского состояния, в частности, замедление или прекращение развития заболевания, расстройства или медицинского состояния у пациента; или
(d) облегчение симптомов заболевания, расстройства или медицинского состояния у пациента.
Термин "фармацевтически приемлемая соль" означает соль, которая является приемлемой для введения пациенту или млекопитающему, такому как человек (например, обозначает соль, имеющую приемлемую безопасность для млекопитающих при заданном режиме дозировки). Примеры фармацевтически приемлемых солей включают соли уксусной, аскорбиновой, бензолсульфоновой, бензойной, камфорсульфоновой, лимонной, этансульфоновой, 1,2-этандисульфоновой, фумаровой, гентизиновой, глюконовой, глюкуроновой, глутаминовой, гиппуровой, бромистоводородной, хлористоводородной, изетионовой, молочной, лактобионовой, малеиновой, яблочной, миндальной, метансульфоновой, слизевой, нафталинсульфоновой, нафталин-1,5-дисульфоновой, нафталин-2,6-дисульфоновой, никотиновой, азотной, оротовой, памовой, пантотеновой, фосфорной, янтарной, серной, винной, п-толуолсульфоновой и ксинафоевой кислоты и т.п.
Термин "его соль" означает соединение, которое образуется, когда атом водорода кислоты заменяется катионом, таким как катион металла или органическим катионом и т.п. Например, катион может представлять собой протонированную форму соединения формулы (I), т.е. форму, в которой одна или несколько аминогрупп протонированы кислотой. Как правило, соль является фармацевтически приемлемой солью, однако это не обязательно для солей промежуточных соединений, которые не предназначены для введения пациенту.
Термин "аминозащитная группа" означает защитную группу, пригодную для предотвращения нежелательных реакций атома азота аминогруппы. Типичные аминозащитные группы включают, однако этим не ограничиваясь, формил; ацильные группы, например, алканоильные группы, такие как ацетил и трифторацетил; алкоксикарбонильные группы, такие как трет-бутоксикарбонил (ВОС); арилметоксикарбонильные группы, такие как бензилоксикарбонил (Cbz) и 9-флуоренилметоксикарбонил (Fmoc); арилметильные группы, такие как бензил (Bn), тритил (Tr) и 1,1-ди-(4'-метоксифенил)метил; силильные группы, такие как триметилсилил (TMS), трет-бутилдиметилсилил (TBDMS), [2-(триметилсилил)этокси]метил (SEM); и т.п. Многочисленные защитные группы, а также их введение и удаление описаны в T.W. Greene and G.M. Wuts, Protecting Groups in Organic Synthesis, Third Edition, Wiley, New York
Общие методики синтеза
Соединения по настоящему изобретению и их промежуточные соединения могут быть получены в соответствии со следующими общими способами и методиками с использованием коммерчески доступных или легко получаемых исходных соединений и реагентов. Заместители и переменные (например, R1, R2, R3, R4 и т.д.), используемые в следующих схемах, если не указано иное, имеют те же значения, что и уже указанные в данном описании. Кроме того, соединения, имеющие кислый или основной атом или функциональную группу, могут быть использованы или могут быть получены в виде соли, если не указано иное (в некоторых случаях, перед проведением реакции использование соли в конкретной реакции потребует превращение соли в несолевую форму, например, в форму свободного основания, с помощью стандартных процедур).
Несмотря на то, что конкретный вариант осуществления настоящего изобретения может быть приведен или описан в следующих методиках, специалистам в данной области техники должно быть понятно, что другие варианты осуществления или аспекты настоящего изобретения также могут быть реализованы с помощью подобных методик или с помощью других методов, реагентов и исходных веществ, известных специалистам. В частности, следует понимать, что соединения по настоящему изобретению могут быть получены различными путями, в которых реагенты объединяют в различном порядке с тем, чтобы синтезировать различные промежуточные соединения, необходимые для получения конечных продуктов.
В одном примерном способе синтеза соединение формулы 1-5, в котором Am обозначает -NHC(O)-, получают, как показано на схеме 1:
Схема 1
где G обозначает группу
а Pg обозначает аминозащитную группу. Промежуточный анилин 1-1 вводят во взаимодействие с карбоновой кислотой 1-2 в типичных условиях образования амидной связи с тем, чтобы защитить промежуточное соединение формулы 1-3. В некоторых случаях карбоновую кислоту 1-2 вначале преобразуют в хлорангидрид, а затем вводят во взаимодействие с промежуточным анилином 1-1 и получают соединение формулы 1-3. Как показано в приведенных ниже примерах, в реакции образования амидной связи можно использовать конденсирующие агенты, такие как гексафторфосфат N,N,N',N'-тетраметил-O-(7-азабензотриазол-1-ил)урония (HATU), или 1,3-дициклогексилкарбодиимид (DCC), 1-(3-диметиламинопропил)-3-этилкарбодиимид (EDC) или гексафторфосфат бензотриазол-1-илокситрипирролидинo-фосфония (РуВор), необязательно в сочетании с 1-гидрокси-7-азабензотриазолом (HOAt). Процесс по схеме 1, предпочтительно, используют для получения соединения формулы 1-3, в котором R7 отсутствует (а равно 0), или R7 представляет собой богатый электронами заместитель, такой как незамещенный алкил или незамещенный алкокси, а реакцию проводят в присутствии конденсирующих агентов EDC и HOAt при температуре приблизительно от 50 до приблизительно 60°С. Из промежуточного соединения 1-3 затем удаляют защитную группу, например, обработкой кислотой, и получают соединение 1-4, которое вводят в реакцию с хлорангидридом в присутствии основания или с карбоновой кислотой в условиях образования амидной связи и получают соединение по настоящему изобретению формулы 1-5.
Должно быть понятно, что конечный продукт 1-5, в качестве альтернативы, можно получить непосредственно по реакции анилина 1-1 с соединением формулы 1-2'
Содержащее защитную группу промежуточное соединение 1-3 удобно также получать по альтернативному процессу, например, как показано на схеме 2:
Схема 2
На первой стадии бифениланилин 1-1 вводят во взаимодействие с фторпиридинкарбонилхлоридом 2-1 в присутствии основания и получают промежуточное фторсодержащее соединение 2-2. Указанное промежуточное фторсодержащее соединение затем подвергают взаимодействию с избытком содержащего защитную группу пиперазина 2-3 и получают содержащее защитную группу промежуточное соединение 1-3. Реакцию обычно проводят в присутствии основания и при нагревании до температуры от приблизительно 80°С до приблизительно 120°С в течение от приблизительно 4 до приблизительно 48 час.
В еще одном альтернативном способе получения промежуточного соединения 1-3 используют реакцию сочетания Сузуки в присутствии палладиевого катализатора (Miyaura and Suzuki, Chem. Rev. 1995, 95, 2457-2483). Как показано ниже на Схеме 3, любое из вступающих в реакцию соединений может включать боронатный фрагмент. В качестве альтернативы, вместо боронатного реагента может быть использован реагент бороновой кислоты, такой как приведенный ниже боронат пинакола.
Схема 3A
Если содержащее защитную группу промежуточное соединение 3-2 заменяют промежуточным соединением 3-2'
то реакция сочетания Сузуки из бороната 3-1 в первом варианте Схемы 3 непосредственно дает конечное соединение по настоящему изобретению.
Аналогично, если содержащее защитную группу промежуточное соединение 3-4 заменяют на промежуточный боронат 3-4' или, что эквивалентно, на промежуточную бороновую кислоту 3-4'',
то реакция сочетания Сузуки промежуточного бромсодержащего соединения, указанного на начальной стадии второго альтернативного варианта Схемы 3, непосредственно дает соединение по настоящему изобретению. Бороновую кислоту 3-4'' можно легко получить в кристаллической форме. См., например, ниже препаративный пример 44.
Еще одна удобная последовательность получения конечных соединений по настоящему изобретению проиллюстрирована на Схеме 3В.
Схема 3B
где защищенные формы реагентов сочетания Сузуки 3-1' или 3-3', в которых атом азота в пролине имеет защитную группу Pg, и промежуточные соединения 3-2', 3-4 или 3-4'', включающие заместитель R9, используются на первой стадии для получения содержащего защитную группу промежуточного соединения 3-5. Содержащее защитную группу промежуточное соединение 3-5 (i) обычным образом освобождают от защитной группы, а затем (ii) вводят во взаимодействие с реагентом HO-G и получают соединение по настоящему изобретению.
Бромсодержащее промежуточное соединение 3-2 на Схеме 3А можно получить, например, по реакции амидной конденсации ариламина 4-1 с фторпиридинкарбонилхлоридом 2-1 с последующим взаимодействием с содержащим защитную группу пиперазином 2-3, как показано на Схеме 4.
Схема 4
В качестве альтернативы, промежуточное соединение 3-2 можно получить по реакции 4-1 с промежуточной карбоновой кислотой 1-2, как показано на Схеме 5.
Схема 5
Как легко должно быть понятно, промежуточные соединения, содержащие заместитель R9, могут быть получены из соответствующих содержащих защитную группу соединений. Например, бромсодержащее промежуточное соединение 3-2' можно получить, удаляя защитную группу из промежуточного соединения 3-2 и затем вводя его во взаимодействие с хлорангидридом кислоты или карбоновой кислоты, как показано на Схеме 1.
Способы получения промежуточных соединений 1-1 и 1-2, которые используют в Схеме синтеза 1, приведены на следующих схемах.
Схема 6
Реакцию фторникотиновой кислоты 6-1 на Схеме 6 с содержащим защитную группу пиперазином 2-3 с получением промежуточного соединения 1-2, как правило, проводят с использованием реактива Гриньяра, такого как изопропилмагнийхлорид, при температуре приблизительно ниже минус 20°С.
Промежуточный биариланилин 1-1 можно получить по реакции сочетания Сузуки по Схеме 7, где, как указано, любое из вступающих в реакцию соединений может содержать боронатный фрагмент.
Схема 7
Промежуточные соединения 3-1 и 3-3, используемые в реакции Сузуки на Схемах 3 и 7, можно получить, например, как показано на Схемах 8 и 9.
Схема 8
Реагент 8-1, где Х обозначает атом брома или хлора, вводят во взаимодействие с содержащей защитную группу карбоновой кислотой пролином 8-2 с получением промежуточного соединения 8-3, которое превращают в промежуточное соединение 8-4 в присутствии избытка ацетата аммония. Реакцию замыкания кольца обычно проводят при температуре в диапазоне от приблизительно 100°С до приблизительно 120°С в течение от приблизительно 4 до приблизительно 24 часов. Для получения соединения 3-3, из промежуточного соединения 8-4 обычно удаляют защитную группу и конденсируют с реагентом HO-G, получая соединение 3-3.
Наконец, промежуточный боронат на Схеме 3 может быть получен из соответствующих бромпроизводных соединений. Например, для получения промежуточного бороната 3-1, промежуточное соединение 3-3 вводят во взаимодействие с бис(пинаколато)дибороном, 9-1, в присутствии палладиевого катализатора, как показано на Схеме 9.
Схема 9
Аналогично, промежуточный боронат 3-4 можно получить по реакции бромсодержащего промежуточного соединения 3-2 с дибороном 9-1 в похожих условиях. Кроме того, партнер бороновой кислоты по реакции сочетания Сузуки также может быть получен из соответствующего бромсодержащего соединения по реакции с боратным сложным эфиром в присутствии реактива Гриньяра, например, в присутствии изопропилмагнийхлорида. См., например, ниже препаративный пример 44.
Соединения формулы 10-5, в которых переменная Am обозначает -C(O)NH-, получают по способам, аналогичным тем, которые описаны выше. Один примерный способ получения соединений формулы 10-5 приведен на Схеме 10.
Схема 10
Кислота 10-1 и аминопиридин 10-2 взаимодействуют в условиях образования амидной связи с получением содержащего защитную группу промежуточного соединения формулы 10-3, из которого затем удаляют защитную группу и который вводят во взаимодействие с хлорангидридом кислоты или карбоновой кислотой, как показано на Схеме 1, получая конечные соединения по настоящему изобретению.
Промежуточные соединения на Схеме 10 могут быть получены с помощью обычных реакций синтеза. Например, диариловую кислоту 10-1 можно получить по реакции сочетания Сузуки с участием боронатного промежуточного соединения 3-1 и бромбензойной кислоты 11-1 с последующим гидролизом (не показан) и превращением в кислоту, при этом получают диариловую кислоту, как показано на Схеме 11.
Схема 11
В качестве альтернативы, соединения формулы 10-3 могут быть получены по реакции, которую поясняет Схема 12:
Схема 12
или, в качестве альтернативы, могут быть по реакции сочетания Сузуки с участием бромсодержащего промежуточного соединения 3-3 и бороната или аналога бороновой кислоты 12-1.
Аналогично, в способе, описанном выше на Схеме 3, если содержащее защитную группу промежуточное соединение 12-1 заменить промежуточным соединением 12-1'
то реакция по Схеме 12 непосредственно дает конечное соединение по настоящему изобретению.
Бромсодержащее промежуточное соединение 12-1 можно получить по реакции амидной конденсации бромбензойной кислоты 13-1 с промежуточным соединением 10-2, как показано на Схеме 13.
Схема 13
а соответствующее промежуточное соединение 12-1' получают из 12-1, удалив защитную группу из 12-1, по реакции с соответствующим хлорангидридом или карбоновой кислотой.
Наконец, промежуточный амин 10-2 удобно получать из нитрозамещенного хлорпиридина, который вводят во взаимодействие с содержащим защитную группу пиперазином 2-3, при этом получают содержащее защитную группу промежуточное соединение 14-2, как показано на Схеме 14.
Схема 14
Восстановление нитрогруппы в аминогруппу дает промежуточное соединение 10-2.
Детали, касающиеся конкретных условий проведения реакций, и другие методики получения отдельных соединений по настоящему изобретению или их промежуточных соединений, описаны в приведенных ниже примерах.
Таким образом, в соответствии с одним из аспектов способа по настоящему изобретению, предлагаются процессы по Схемам 1-14 и их вариации, которые описаны выше, а также процессы, примеры которых приведены ниже.
В соответствии с конкретным аспектом способа по настоящему изобретению, предлагается метод, который иллюстрирует Схема 3В, включающий: (а) взаимодействие содержащего защитную группу бромсодержащего промежуточного соединения 3-3' с промежуточным боронатом 3-4' или бороновой кислотой 3-4'', при этом получают содержащее защитную группу промежуточное соединение 3-5, (b) удаление защитной группы из промежуточного соединения 3-5, и (с) взаимодействие промежуточного соединения, у которого удалена защитная группа, с реагентом HO-G, при этом получают соединение по настоящему изобретению формулы (ΙI') или его фармацевтически приемлемую соль. Указанный аспект включает способ получения соединения формулы (ΙI'), в котором R1 обозначает C1-6алкил или тетрагидропиран, R2 обозначает атом водорода, R3 обозначает -C(O)OC1-6алкил, R4 обозначает метил или метокси, R5 и R6 оба обозначают атом водорода, R7 обозначает атом фтора, хлора или -OCF3, R8 обозначает метил, R9 обозначает трет-бутил или 3-гидрокси-2,2-диметилпропил, a принимает значение 1 или 2, b равен 1. В соответствии с конкретным аспектом, бороновую кислоту 3-4" используют на стадии (а).
Следует также понимать, что настоящее описание охватывает соединения формулы (I), которые получают с помощью описанных выше и ниже методик синтеза или с помощью процессов обмена веществ, включая те, которые происходят в условиях in vivo в организме человека или животного или в условиях in vitro.
Фармацевтические композиции
Соединения по настоящему изобретению и их фармацевтически приемлемые соли обычно используют в виде фармацевтической композиции или лекарственной формы. Подобные фармацевтические композиции могут быть введены пациенту любым приемлемым путем, включая, однако этим не ограничиваясь, пероральный, ректальный, вагинальный, интраназальный, ингаляционный, местный (в том числе трансдермальный) и парентеральный способы введения.
Так, в соответствии с одним из аспектов, касающихся композиций, настоящее изобретение относится к фармацевтической композиции, содержащей фармацевтически приемлемый носитель или наполнитель и соединение формулы (I), где, как указано выше, "соединение формулы (I)" означает соединение формулы (I) или его фармацевтически приемлемую соль. Если необходимо, подобные фармацевтические композиции необязательно могут содержать другие терапевтические и/или вспомогательные средства. При обсуждении композиций и их применения, "соединение по настоящему изобретению" может обозначаться в данном описании как "активный агент". Предполагается, что в данном описании термин "соединение по настоящему изобретению" включает все соединения, охватываемые формулой (I), а также химические соединения, воплощенные в формулах (II), (ΙI'), (III), (IV), (IVa), (IVb) и (V), и их фармацевтически приемлемые соли.
Фармацевтические композиции по настоящему изобретению обычно содержат терапевтически эффективное количество соединения по настоящему изобретению. Тем не менее, специалистам должно быть, понятно, что фармацевтическая композиция может содержать большее, чем терапевтически эффективное, количество, т.е. представлять собой композицию с наполнителем, или меньшее, чем терапевтически эффективное, количество, т.е. представлять собой отдельные единичные дозы, предназначенные для многократного введения, с целью получения терапевтически эффективного количества.
Как правило, подобные фармацевтические композиции содержат от приблизительно 0,1 до приблизительно 95% масс. активного агента; предпочтительно, содержат от приблизительно 5 до приблизительно 70% масс.; и более предпочтительно, содержат от приблизительно 10 до приблизительно 60% масс. активного агента.
В фармацевтических композициях по настоящему изобретению может быть использован любой обычный носитель или наполнитель. Выбор конкретного носителя или наполнителя или комбинации носителей или наполнителей будет зависеть от способа введения, используемого при лечении конкретного пациента, или типа медицинского состояния или патологического состояния. В этой связи приготовление подходящей фармацевтической композиции для конкретного способа введения вполне по силам специалистам в области фармацевтики. Кроме того, носители или наполнители, используемые в фармацевтических композициях по настоящему изобретению, коммерчески доступны. В качестве дополнительной иллюстрации, традиционные методы приготовления составов описаны в Remington: The Science and Practice of Pharmacy, 20th Edition, Lippincott Williams & White, Baltimore, Maryland (2000); и в H.C. Ansel et al., Pharmaceutical Dosage Forms and Drug Delivery Systems, 7th Edition, Lippincott Williams & White, Baltimore, Maryland (1999).
Типичные примеры соединений, которые могут служить в качестве фармацевтически приемлемых носителей, включают, однако этим не ограничиваясь, следующие вещества: сахара, такие как лактоза, глюкоза и сахароза; крахмалы, такие как кукурузный крахмал и картофельный крахмал; целлюлозы, такие как микрокристаллическая целлюлоза и ее производные, такие как натриевое производное карбоксиметилцеллюлозы, этилцеллюлоза и ацетат целлюлозы; порошок трагаканта; солод; желатин; тальк; наполнители, такие как масло какао и воски для суппозиториев; масла, такие как арахисовое масло, хлопковое масло, сафлоровое масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; гликоли, такие как пропиленгликоль; полиолы, такие как глицерин, сорбит, маннит и полиэтиленгликоль; сложные эфиры, такие как этилолеат и этиллаурат; агар; буферные агенты, такие как гидроксид магния и гидроксид алюминия; альгиновая кислота; апирогенная вода; изотонический солевой раствор; раствор Рингера; этиловый спирт; фосфатные буферные растворы; и другие нетоксичные совместимые вещества, используемые в фармацевтических композициях.
Фармацевтические композиции обычно получают путем тщательного и однородного смешивания или компаундирования активного агента с фармацевтически приемлемым носителем и одним или несколькими дополнительными ингредиентами. Из полученной равномерно компаундированной смеси затем можно изготовить таблетки или включить смесь в таблетки, капсулы, пилюли и т.п. с помощью обычных методик и стандартного оборудования.
Фармацевтические композиции по настоящему изобретению предпочтительно готовят в виде стандартной лекарственной формы. Термин "стандартная лекарственная форма" относится к физически дискретной единице, пригодной для дозирования пациенту, т.е. к каждой единице, содержащей заданное количество активного агента, которое рассчитано для получения требуемого терапевтического эффекта, как отдельно, так и в комбинации с одной или несколькими дополнительными единицами. Например, подобные стандартные лекарственные формы могут представлять собой капсулы, таблетки, пилюли и т.п., или отдельные упаковки, пригодные для парентерального введения.
В одном варианте осуществления настоящего изобретения фармацевтические композиции по настоящему изобретению пригодны для перорального введения. Фармацевтические композиции, пригодные для перорального введения, могут быть приготовлены в виде капсул, таблеток, пилюль, лепешек, крахмальных облаток, драже, порошков, гранул; или в виде раствора или суспензии в водной или неводной жидкости; или в виде жидкой эмульсии типа масло-в-воде или вода-в-масле; или в виде эликсира или сиропа; и т.п.; каждая фармацевтическая композиция содержит заранее определенное количество соединения по настоящему изобретению в качестве активного ингредиента.
В том случае, когда фармацевтические композиции по настоящему изобретению предназначены для перорального введения в виде твердой лекарственной формы (например, в виде капсул, таблеток, пилюль и т.п.), они обычно содержат активный агент и один или несколько фармацевтически приемлемых носителей, таких как цитрат натрия или дикальцийфосфат. Необязательно или в качестве альтернативы такие твердые лекарственные формы могут также включать: наполнители или разбавители, такие как крахмалы, микрокристаллическая целлюлоза, лактоза, сахароза, глюкоза, маннит и/или кремневая кислота; связующие, такие как карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахароза и/или аравийская камедь; увлажнители, такие как глицерин; разрыхлители, такие как агар-агар, карбонат кальция, картофельный крахмал или крахмал из тапиоки, альгиновая кислота, некоторые силикаты и/или карбонат натрия; замедляющие растворение агенты, такие как парафин; ускорители абсорбции, такие как четвертичные аммониевые соединения; смачивающие агенты, такие как цетиловый спирт и/или моностеарат глицерина; абсорбенты, такие как каолин и/или бентонитовая глина; лубриканты, такие как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия и/или их смеси; пигменты; и буферные добавки.
В фармацевтических композициях по настоящему изобретению могут также присутствовать облегчающие высвобождение агенты, смачивающие агенты, глазировочные средства, подсластители, вкусовые и ароматизирующие добавки, консерванты и антиоксиданты. Примеры фармацевтически приемлемых антиоксидантов включают: водорастворимые антиоксиданты, такие как аскорбиновая кислота, гидрохлорид цистеина, бисульфат натрия, метабисульфит натрия, сульфит натрия и т.п.; растворимые в масле антиоксиданты, такие как аскорбилпальмитат, бутилзамещенный гидроксианизол, бутилзамещенный гидрокситолуол, лецитин, пропилгаллат, альфа-токоферол и т.п.; и хелатирующие металлы агенты, такие как лимонная кислота, этилендиаминтетрауксусная кислота, сорбит, винная кислота, фосфорная кислота и т.п. Глазировочные средства для таблеток, капсул, пилюль и т.п. включают покрытия для таблеток, которые используются для создания энтеросолюбильных покрытий, такие как ацетат-фталат целлюлозы, поливинил ацетат-фталат, фталат гидроксипропилметилцеллюлозы, сополимеры метакриловой кислоты и кислых сложных эфиров метакриловой кислоты, ацетат-тримеллитат целлюлозы, карбоксиметилэтилцеллюлоза, ацетат-сукцинат гидроксипропилметилцеллюлозы и т.п.
Фармацевтические композиции по настоящему изобретению могут быть также приготовлены таким образом, чтобы они обеспечивали медленное или контролируемое высвобождение активного агента, с использованием, например, гидроксипропилметилцеллюлозы в различных пропорциях; или других полимерных матриц, липосом и/или микросфер. Кроме того, фармацевтические композиции по настоящему изобретению необязательно могут содержать агенты, придающие непрозрачность, и могут быть составлены таким образом, что они высвобождают лишь активный ингредиент или, предпочтительно, высвобождают активный ингредиент в определенной части желудочно-кишечного тракта, необязательно пролонгированным образом. Примеры используемых составных композиций включают полимерные вещества и воски. Активный агент может быть также в форме микрокапсул, если необходимо, вместе с одним или несколькими вышеописанными наполнителями.
Подходящие жидкие лекарственные формы для перорального введения включают, в качестве иллюстрации, фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и эликсиры. Жидкие лекарственные формы, как правило, содержат активное вещество и инертный разбавитель, такой как, например, вода или другие растворители, солюбилизаторы и эмульгаторы, такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, масла (в частности, хлопковое, арахисовое, кукурузное масла, масло из семечек, оливковое, касторовое и кунжутное масла), олеиновую кислоту, глицерин, тетрагидрофуриловый спирт, полиэтиленгликоли и сложные эфиры жирных кислот и сорбитана и их смеси. В качестве альтернативы, некоторые жидкие лекарственные формы могут быть преобразованы, например, путем распылительной сушки, в порошки, которые с помощью обычных процедур используют для получения твердых лекарственных форм.
Помимо активного ингредиента, суспензии, могут содержать суспендирующие средства, такие как, например, этоксилированные изостеариловые спирты, полиоксиэтилен сорбит и сложные эфиры сорбитана, микрокристаллическая целлюлоза, метагидроксид алюминия, бентонит, агар-агар и трагакант и их смеси.
Соединения по настоящему изобретению можно также вводить парентерально (например, путем внутривенной, подкожной, внутримышечной или внутрибрюшинной инъекции). Для парентерального введения активный агент обычно смешивают с носителем, подходящим для парентерального введения, включая, например, стерильные водные растворы, физиологический раствор, низкомолекулярные спирты, такие как пропиленгликоль, полиэтиленгликоль, растительные масла, желатин, эфиры жирных кислот, такие как этилолеат, и т.п. Парентеральные составы могут также содержать один или несколько антиоксидантов, солюбилизаторов, стабилизаторов, консервантов, смачивающих агентов, эмульгаторов, буферных агентов или диспергаторов. Указанные составы можно стерилизовать с использованием стерильной среды для инъекций, стерилизующего средства, с помощью фильтрации, облучения или путем тепловой обработки.
В качестве альтернативы, фармацевтические композиции по настоящему изобретению готовят для введения путем ингаляции. Подходящие фармацевтические композиции для введения путем ингаляции обычно приготавливают в виде аэрозоля или порошка. Подобные композиции обычно вводят с помощью хорошо известных устройств для доставки, таких как дозирующий ингалятор, ингалятор для ингаляции сухого порошка, распылитель или аналогичное устройство для доставки.
При введении путем ингаляции с использованием герметичного контейнера фармацевтические композиции по настоящему изобретению обычно содержат активный ингредиент и подходящий газ-вытеснитель, такой как дихлордифторметан, трихлорфторметан, дихлортетрафторэтан, диоксид углерода или другой подходящий газ. Кроме того, фармацевтическая композиция может быть в форме капсулы или картриджа (изготовленного, например, из желатина), содержащего соединение по настоящему изобретению и порошок, пригодный для использования в порошковом ингаляторе. Подходящие порошковые основы включают, например, лактозу или крахмал.
Соединения по настоящему изобретению также можно назначать трансдермально с использованием известных трансдермальных систем доставки лекарств и наполнителей. Например, активное вещество может быть смешано с усилителями проникновения через кожу, такими как пропиленгликоль, монолаурат полиэтиленгликоля, азациклоалкан-2-оны и т.п., и включено в аппликацию или аналогичную систему доставки. В подобных трансдермальных композициях, если необходимо, могут быть использованы дополнительные наполнители, включая гелеобразующие агенты, эмульгаторы и буферные добавки.
Следующие не ограничивающие настоящее изобретение примеры иллюстрируют типичные фармацевтические композиции по настоящему изобретению.
Пероральная твердая лекарственная форма
Соединение по настоящему изобретению, которое растворяют в полиэтиленгликоле, подкисляют до рН ≤2, дополнительно нагревая, и получают раствор, содержащий 10% масс. или 40% масс. активного агента. Раствор сушат распылением и получают порошок. Полученный порошок помещают в капсулы, например, в капсулы из желатина или гидроксипропилметилцеллюлозы, и получают дозировку, равную 14 мг или 56 мг, соответственно, активного агента на капсулу.
Пероральная жидкая лекарственная форма
Соединение по настоящему изобретению (100 мг) добавляют к смеси этанола (5 мл), пропиленгликоля (10 мл) и полиэтиленгликоля (25 мл). После полного растворения добавляют подкисленную дистиллированную воду (добавляют количество, необходимое для получения объема 100 мл) и получают жидкий состав с концентрацией 1 мг/мл активного агента.
Композиция в виде липидной эмульсии
Композицию в виде липидной эмульсии, содержащую соединение по настоящему изобретению (10%), олеиновую кислоту (78%), полиэтиленгликоль (10%) и полисорбат 20 (2%) масс., получают, добавляя соединение по настоящему изобретению в смеси остальных ингредиентов.
Композиция в виде липидной эмульсии
Композицию в виде липидной эмульсии, содержащую соединение по настоящему изобретению (10%) и олеиновую кислоту (90%) масс., получают, добавляя соединения по настоящему изобретению к олеиновой кислоте.
Состав в виде микроэмульсии
Соединение по настоящему изобретению (1 г) растворяют в смеси этанола (2 мл), пропиленгликоля (2 мл), полиэтиленгликоля 400 (4 мл) и полиэтиленгликоль-15-гидроксистеарата (4 мл). Добавляют подкисленную дистиллированную воду (добавляют количество, необходимое для получения объема 100 мл) и получают состав в виде самоэмульгирующейся микроэмульсии.
Полезность
Было показано, что соединения по настоящему изобретению ингибируют репликацию вируса в исследованиях репликона HCV и, следовательно, как ожидается, будут пригодны при лечении инфекций вируса гепатита С.
Таким образом, в соответствии с одним аспектом, в настоящем изобретении предлагается способ ингибирования репликации вируса гепатита С у млекопитающего (например, у человека), при этом указанный способ включает введение млекопитающему терапевтически эффективного количества соединения по настоящему изобретению или фармацевтической композиции, содержащей фармацевтически приемлемый носитель и соединение по настоящему изобретению.
В настоящем изобретении предлагается также способ лечения инфекции вируса гепатита С у млекопитающего (например, у человека), при этом указанный способ включает введение млекопитающему терапевтически эффективного количества соединения по настоящему изобретению или фармацевтической композиции, содержащей фармацевтически приемлемый носитель и соединение по настоящему изобретению.
Соединения по настоящему изобретению могут ингибировать репликацию вируса путем ингибирования функции белка NS5A, кодируемого геном HCV. Таким образом, в соответствии с одним аспектом, в настоящем изобретении предлагается способ ингибирования белка NS5A в HCV у млекопитающего, при этом указанный способ включает введение млекопитающему соединения или композиции по настоящему изобретению.
При использовании для лечения инфекции HCV соединения по настоящему изобретению обычно назначают перорально в виде одной суточной дозы или в виде нескольких доз в день, хотя могут быть использованы и другие формы введения. Количество активного агента, вводимого в виде одной дозы, или общее количество вводимого активного агента в день, как правило, определяет лечащий врач с учетом соответствующих условий, в том числе подлежащего лечению состояния, выбранного пути введения, конкретного вводимого соединения и его относительной активности, возраста, массы тела и ответной реакции конкретного пациента, тяжести симптомов у пациента и т.п.
Подходящие дозы для лечения инфекции HCV меняются в диапазоне от приблизительно 1 до приблизительно 2000 мг/день активного агента, в том числе от приблизительно 5 до приблизительно 300 мг/день и от приблизительно 10 до приблизительно 200 мг в день активного агента для среднего человека с массой тела 70 кг.
Комбинированные методы лечения
Для эффективного лечения HCV соединения по настоящему изобретению можно также использовать в сочетании с одним или несколькими агентами, которые действуют по тому же самому механизму или по различным механизмам. Пригодные классы агентов для комбинированной терапии включают, однако этим не ограничиваясь, ингибиторы HCV NS3 протеазы, нуклеозидные и ненуклеозидные ингибиторы HCV NS5B полимеразы, ингибиторы геликазы, ингибиторы белка NS4B, ингибиторы попадания вируса HCV в клетку, ингибиторы циклофиллина, агонисты Toll-подобного рецептора, ингибиторы белков теплового шока, интерферирующую РНК, антисмысловую РНК, ингибиторы участка внутренней посадки рибосомы HCV (IRES), тиазолиды, нуклеозидные аналоги, такие как рибавирин и родственные соединения, интерфероны и другие иммуномодулирующие агенты, ингибиторы инозин 5'-монофосфат-дегидрогеназы (IMPDH) и другие ингибиторы белка NS5A. Агенты, которые оказывают свое действие, ингибируя репликацию HCV по любому другому механизму, также могут быть использованы в сочетании с соединениями по настоящему изобретению.
Ингибиторы HCV NS3 протеазы, которые могут быть использованы в комбинированных методах лечения, включают, однако этим не ограничиваясь, Incivek® (телапревир, VX-950), боцепревир (SCH-503034), симепревир (TMC-435), нарлапревир (SCH-900518), ванипревир (МК-7009), данопревир (ITMN-191, Р-7227), BI-201335, ABT-450/r, асунапревир (BMS-650032), GS-9256, GS-9451, совапревир (ACH-1625), ACH-2684, BMS-605339, VX-985, PHX-1766, BMS-791325, IDX-320 и МК-5172.
Примеры нуклеозидных ингибиторов HCV NS5B полимеразы включают, однако этим не ограничиваясь, мерицитабин (RG7128), IDX-184, софосбувир (GS-7977, PSI-7977), PSI-7851, PSI-938, BMS-986094 (IΝΧ-189, IΝΧ-08189), RG7348, МК-0608, TMC-649128, HCV-796 и ALS-2200 (VX-135), а ненуклеозидные ингибиторы HCV NS5B полимеразы включают, однако этим не ограничиваясь, филибувир (PF-8685540), тегобувир (GS-9190), VX-222, VX-759, сетробувир (АNА-598), ABT-072, АВТ-333, BI-207127, BMS-791325, МК-3281, IDX-37, BMS-824393, TMC-647055.
Широкое разнообразие интерферонов и пегилированных интерферонов, включая альфа-, бета-, омега- и гамма-интерфероны, обладающих противовирусным, антипролиферативным и иммуномодулирующим действием, можно объединять с соединениями по настоящему изобретению. Типичные примеры включают, однако этим не ограничиваясь, Intron® А (интерферон-альфа-2b), Actimmune® (интерферон-гамма-1b), Alferon N, Advaferon®, Roferon-A (интерферон-альфа-2а), PegIntron® (пегинтерферон-альфа-2b), Alfaferone, Pegasys® (пегинтерферон-альфа-2а), Alfanative (интерферон-альфа), Zalbin™ (албинтерферон-альфа-2b), Infergon® (интерферон альфакон-1), Omega Duros® (омега-интерферон), Locteron™ (интерферон-альфа), PEG-rIL-29 (пегилированный интерферон-лямбда) и Rebif ® (интерферон-бета-1а).
Нуклеозидные аналоги противовирусных агентов включают, однако этим не ограничиваясь, рибавирин (Copegus®, Rebetol®, Virazole®) и вирамидин (тарибавирин). Интерфероны и рибавирин также готовят в виде наборов, которые включают, например, однако этим не ограничиваясь, Rebetron® (интерферон-альфа-2b/рибавирин) и Pegetron® (пегилированный интерферон-альфа-2b/рибавирин).
Пригодные для использования соединения, действующие по другим механизмам, включают, однако этим не ограничиваясь: ингибиторы циклофилина, такие как DEB-025, SCY-635, NIM-811, и циклоспорина и производные; агонисты Toll-подобного рецептора, например, резиквимод, IMO-2125 и ANA-773, ингибиторы попадания вируса HCV в клетку, такие как цивацир, тиазолиды, такие как нитазоксанид и ингибиторы вирусов широкого спектра, такие как ингибиторы инозин-5'-монофосфат-дегидрогеназы (IMPDH).
Кроме того, соединения по настоящему изобретению можно объединять с ингибиторами NS5, например, даклатасвиром (BMS-790052), AZD-7295, PPI-461, PPI-1301, GS-5885, GSK2336805, ABT-267, ACH-2928, ACH-3102, EDP-239, IDX-719, МК-8742 или PPI-668.
Таким образом, в соответствии с другим аспектом, в настоящем изобретение предлагается терапевтическая комбинация для использования при лечении инфекции вируса гепатита С, при этом указанная комбинация содержит соединение по настоящему изобретению и один или несколько других терапевтических средств, пригодных для лечения HCV. Например, в настоящем изобретении предлагается комбинация, содержащая соединение по настоящему изобретению и одно или несколько средств, выбранных из ингибиторов HCV NS3 протеазы, нуклеозидных ингибиторов HCV NS5B полимеразы и ненуклеозидных ингибиторы HCV NS5B полимеразы, интерфероны и пегилированные интерфероны, ингибиторы циклофилина, ингибиторы HCV NS5A, и рибавирин и родственные нуклеозидные аналоги. Также предлагается фармацевтическая композиция, содержащая соединение по настоящему изобретению и один или нескольких других терапевтических средств, пригодных для лечения HCV.
Кроме того, в соответствии с аспектом способа по настоящему изобретению, предлагается способ лечения инфекции вируса гепатита С у млекопитающего, при этом указанный способ включает введение млекопитающему соединения по настоящему изобретению и одного или нескольких других терапевтических средств, пригодных для лечения HCV.
В соответствии с другим аспектом способа по настоящему изобретению, предлагается способ ингибирования репликации вируса гепатита С у млекопитающего, при этом указанный способ включает введение млекопитающему соединения по настоящему изобретению и одного или нескольких других терапевтических средств, пригодных для ингибирования репликации вируса гепатита С.
Например, в соответствии с одним аспектом способа по настоящему изобретению, предлагается способ лечения инфекции вируса гепатита С у млекопитающего, при этом способ включает введение млекопитающему соединения по настоящему изобретению, интерферона или пегилированного интерферона и рибавирина.
В еще одном примере аспекта способа по настоящему изобретению предлагается способ лечения инфекции вируса гепатита С у млекопитающего, при этом указанный способ включает введение млекопитающему соединения по настоящему изобретению, интерферона или пегилированного интерферона, рибавирина и ингибитора HCV NS3 протеазы.
В соответствии с еще одним аспектом способа по настоящему изобретению, предлагается способ лечения инфекции вируса гепатита С у млекопитающего, при этом указанный способ включает введение млекопитающему соединения по настоящему изобретению, ингибитора HCV NS3 протеазы и рибавирина.
Кроме того, полностью пероральные комбинированные методы лечения, пригодные в соответствии с другими аспектами способа по настоящему изобретению, включают, например, соединение по настоящему изобретению и ингибитор HCV NS3 протеазы; соединение по настоящему изобретению и нуклеозидный ингибитор HCV NS5B полимеразы; соединение по настоящему изобретению, нуклеозидный ингибитор HCV NS5B полимеразы и рибавирин; соединение по настоящему изобретению, ингибитор HCV NS3 протеазы и нуклеозидный ингибитор HCV NS5B полимеразы; соединение по настоящему изобретению, ингибитор HCV NS3 протеазы, нуклеозидный ингибитор HCV NS5B полимеразы и рибавирин; соединение по настоящему изобретению, ингибитор HCV NS3 протеазы и ненуклеозидный ингибитор HCV NS5B полимеразы; и соединение по настоящему изобретению, ингибитор HCV NS3 протеазы, ненуклеозидный ингибитор HCV NS5B полимеразы и рибавирин.
В соответствии с другим аспектом способа по настоящему изобретению, предлагается способ ингибирования репликации вируса гепатита С у млекопитающего с использованием соединения по настоящему изобретению в комбинации с другими средствами, как описано выше.
При использовании в комбинированной терапии, агенты могут быть приготовлены в виде одной фармацевтической композиции, как описано выше в данном описании, или агенты могут быть приготовлены в виде отдельных композиций, которые вводят одновременно или в разное время по тому же самому или по различным путям введения. При раздельном введении агенты вводят достаточно близко по времени друг от друга с тем, чтобы получить желаемый терапевтический эффект. Подобные композиции могут быть упакованы отдельно или могут быть упакованы вместе в виде набора. Два или несколько терапевтических средств в наборе можно назначать по одному и тому же способу введения или разными путями введения.
Наконец, соединения по настоящему изобретению могут также найти применение в качестве исследовательских инструментов, например, для поиска новых ингибиторов белка HCV NS5A или выявления механизмов репликации HCV.
Были показано, что соединения по настоящему изобретению являются действенными ингибиторами репликации HCV в исследованиях репликона HCV, как описано в следующих примерах.
ПРИМЕРЫ
Следующие синтетические и биологические примеры представлены для иллюстрации настоящего изобретения и их ни в коем случае не следует рассматривать как ограничивающие объем настоящее изобретения. В приведенных ниже примерах используемые следующие сокращения имеют следующие значения, если не указано иное. Сокращения, определения которых не приведены ниже, имеют свои общепринятые значения.
| АCN | = ацетонитрил |
| DCM | = дихлорметан |
| DIPEA | = N,N-диизопропилэтиламин |
| DMA | = N,N-диметилацетамид |
| ДМФА | = N,N-диметилформамид |
| DMP | = 1,1,1-триацетокси-1,1-дигидро-1,2-бензиодоксол-3(1H)-он (периодинан Десса-Мартина) |
| ДМСО | = диметилсульфоксид |
| EDC | = N-(3-диметиламинопропил)-N-этилкарбодиимида гидрохлорид |
| EtOAc | = этилацетат |
| час | = часы |
| HATU | = N,N,N',N'-тетраметил-O-(7-азабензотриазол-1-ил)урония гексафторфосфат |
| HCTU | = 2-(6-хлор-1H-бензотриазол-1-ил)-1,1,3,3-тетраметиламиния гексафторфосфат |
| HOAt | = 1-гидрокси-7-азабензотриазол |
| мин | = минуты |
| Pd(dppf)Cl2 | = дихлор (1,1'-бис (дифенилфосфино)-ферроцен)дипалладий (II) |
| MTBE | = метил-трет-бутиловый эфир |
| RT | = комнатная температура |
| TFA | = трифторуксусная кислота |
| ТГФ | = тетрагидрофуран |
| bis(pinacolato)diboron | = 4,4,5,5,4',4',5',5'-октаметил[2,2']би[[1,3,2]диокса-бороланил] |
Реагенты и растворители приобретали из коммерческих источников (Aldrich, Fluka, Sigma и т.д.) и использовали без дальнейшей очистки. Реакции проводили в атмосфере азота, если не указано иное. За ходом реакции следили с помощью тонкослойной хроматографии (ТСХ), аналитической высокоэффективной жидкостной хроматографии (аналитической ВЭЖХ) и масс-спектрометрии. Продукты реакции из реакционных смесей выделяли, как описано конкретно для каждой реакции; обычно продукты очищали путем экстракции и с использованием других методов очистки, таких как кристаллизация и осаждение при различной температуре и в различных растворителях. Кроме того, реакционные смеси очищали обычным образом с помощью препаративной ВЭЖХ, как правило, с использованием предварительно заполненных колонок C18 или BDS и обычных элюентов. Типичные условия проведения препаративной ВЭЖХ описаны ниже.
Исследование свойств продуктов реакции обычно проводили с помощью масс-спектрометрии и 1H-ЯМР спектрометрии. Для проведения анализов методом ЯМР образцы растворяли в дейтерированном растворителе (например, CD3OD, CDCl3, или d6-ДМСО) и 1Н-ЯМР спектры регистрировали на спектрометре Varian Gemini 2000 (400 МГц) в стандартных условиях наблюдения. Масс-спектрометрическую идентификацию соединений проводили методом ионизация при электрораспылении (ESMS) с использованием установки Applied Biosystems (Foster City, CA), модель API 150 EX, или установки Agilent (Palo Alto, CA), модель 1200 LC/MSD.
Общие условия проведения препаративной ВЭЖХ
| Колонка: | С18, 5 мкм, 21,2×150 мм или С18, 5 мкм 21×250 или C14 21×150 |
| Температура колонки: | комнатная температура |
| Скорость подачи: | 20,0 мл/мин |
| Подвижные фазы: | А = вода + 0,05% TFA B = ACN + 0,05% TFA |
| Инжектируемый объем: | 100-1500 мкл |
| Длина волны детектора: | 214 нм |
Неочищенные соединения растворяли в смеси 1:1 вода:уксусная кислота и использовали скорость подачи приблизительно 50 мг/мл. 4-минутный анализ в аналитическом масштабе проводили с использованием колонки 2,1×50 мм C18 с последующим 15- или 20-минутным анализом в препаративном масштабе с использованием объема инъекции 100 мкл в градиенте, при этом данные для этой стадии получали из % удерживания B, полученном на стадии проведения исследования в аналитическом масштабе. Точные градиенты зависят от образца. Образцы с близко идущими примесями, с целью лучшего разделения, проверяли на колонке 21×250 мм С18 и/или колонке 21×150 мм С14. Фракции, содержащие продукт, идентифицировали масс-спектрометрическим анализом.
Аналитическая ВЭЖХ
| Колонка: | Zorbax Bonus-RP 3,5 мкм, 4,6×150 мм |
| Температура колонки: | 35°C |
| Скорость подачи: | 1,0 мл/мин |
| Инжектируемый объем: | 5 мкл |
| Подготовка образца: | растворение в смеси 1:1 ACN:вода |
Метод А
| Подвижные фазы: | А = вода/ACN (98:2)+0,1% TFA B = вода/ACN (10:90)+0,1% TFA |
| Длина волны детектора: | 254 нм |
| Градиент: | в общей сложности 21 мин (время (мин)/% B): 0,5/10, 15/60, 16,5/80, 17/80, 18/10, 21/10 |
Способ B
| Подвижные фазы: | А = вода/ACN (98:2) + 0,1% TFA B = вода/ACN (2:98) + 0,5% TFA |
| Длина волны детектора: | 214 нм |
| Градиент: | в общей сложности 29 мин (время (мин)/% B): 0,5/10, 24/90, 25/90, 26/10, 29/10 |
Препаративный пример 1: трет-бутиловый эфир (R)-4-[5-(4-бром-2-хлор-5-трифторметоксифенилкарбамоил)пиридин-2-ил]-3-метилпиперазин-1-карбоновой кислоты
(a) 4-бром-2-хлор-5-трифторметоксифениламин
К смеси 4-бром-3-трифторметоксифениламина (2,0 г, 7,8 ммоль) в ACN (60 мл) медленно добавляют раствор N-хлорсукцинимида (1,0 г, 7,8 ммоль) в ACN (40 мл). Реакционную смесь нагревают до 60°С в течение ночи и экстрагируют смесью этилацетат/вода. Органический слой сушат над сульфатом натрия и очищают флэш-хроматографией (колонка 40 г, от 100% гексана до 10% EtOAc:гексан), получая требуемый продукт в виде масла, окрашенного в оранжеватый цвет (1,4 г, выход 64%).
(b) N-(4-бром-2-хлор-5-трифторметоксифенил)-6-фторникотинамид
К раствору продукта, полученного на предыдущей стадии (1,2 г, 4,1 ммоль), в DCM (5 мл) медленно добавляют раствор 2-фторпиридин-5-карбонилхлорида (0,66 г, 4,1 ммоль) в DCM (3 мл) и добавляют 20 капель DMA. Реакционную смесь концентрируют и получают желтоватое твердое вещество (2 г). (m/z): [M+H]+ вычислено для C13H6BrClF4N2O2 412,92; 414,92; найдено 413,415.
(c) трет-бутиловый эфир (R)-4-[5-(4-бром-2-хлор-5-трифторметоксифенилкарбамоил)пиридин-2-ил]-3-метилпиперазин-1-карбоновой кислоты
К реакционной смеси продукта, полученного на предыдущей стадии (999 мг, 2,42 ммоль), в смеси N,N-диизопропилэтиламин (0,84 мл, 4,83 ммоль) и ДМСО (0,86 мл, 12,08 ммоль) добавляют трет-бутиловый эфир (R)-3-метилпиперазин-1-карбоновой кислоты (726 мг, 3,62 ммоль) и реакционную смесь нагревают в течение ночи до 120°С, а затем экстрагируют смесью этилацетат/вода. Органический слой сушат над сульфатом натрия и концентрируют в вакууме. Темное масло растворяют в небольшом количестве DCM и очищают хроматографией на силикагеле (колонка 24 г, 0-40% этилацетат:гексан), получая указанное в названии промежуточное соединение в виде твердого вещества белого цвета (916 мг, выход 64%). (m/z): [M+H]+ вычислено для C23H25BrClF3N4O4 593,07; 595,07; найдено 595,4.
Препаративный пример 2: трет-бутиловый эфир (R)-4-[5-(4-бром-2-хлор-5-трифторметоксифенилкарбамоил)пиридин-2-ил]-3-метилпиперазин-1-карбоновой кислоты
По методике, приведенной на стадии (с) препаративного примера 1, заменяя трет-бутиловый эфир (R)-3-метилпиперазин-1-карбоновой кислоты на трет-бутиловый эфир (2S,5R)-2,5-диметилпиперазин-1-карбоновой кислоты (777 мг, 3,62 ммоль), получают указанное в названии промежуточное соединение в виде светло-желтого твердого вещества (1118 мг, выход 76%). (m/z): [M+H]+ вычислено для C24H27BrClF3N4O4 607,09; 609,08; найдено 609,3.
Препаративный пример 3: (S)-2-метоксикарбониламино-3-метилмасляная кислота
Метилхлорформиат (14,5 мл, 0,188 моль) в течение 15 мин добавляют к охлажденной (0-6°С) смеси (S)-2-амино-3-метилмасляной кислоты (20,0 г, 0,171 моль), NaOH (6,80 г, 0,171 моль) и карбоната натрия (18,1 г, 0,171 моль) в воде (200 мл). Охлаждающую баню удаляют, и смесь оставляют на ночь перемешиваться при комнатной температуре. К реакционной смеси добавляют концентрированный водный раствор НСl (30 мл), чтобы довести рН до ~1. Образуется твердое вещество, смесь перемешивают в течение 90 мин. Смесь отфильтровывают и твердое вещество оставляют сушиться на ночь при пониженном давлении при температуре 40°С, получая указанное в названии промежуточное соединение (27,8 г, выход 93%). Спектр 1H ЯМР (CD3OD, 400 МГц) δ (м.д.) 4,87 (уш.с., 4H), 4,05 (д, J=5,49, 1 H), 3,65 (с, 3 H), 2,25-2,05 (м, 1 H), 0,98 (д, J=6,87, 3 H), 0,94 (д, J=6,87, 3 H).
Препаративный пример 4: 4-(4-бромфенил)-2-((2S,4S)-4-метилпирролидин-2-ил)-1H-имидазол
(a) 2-[2-(4-бромфенил)-2-оксоэтиловый] эфир 1-трет-бутиловый эфир (S)-пирролидин-1,2-дикарбоновой кислоты
К смеси п-бромфенацилбромида (242 мг, 0,87 ммоль) в DCM (1,5 мл) и DMA (1,5 мл) в атмосфере азота добавляют 1-трет-бутиловый эфир (2S,4S)-4-метилпирролидин-1,2-дикарбоновой кислоты (200 мг, 0,87 ммоль) и N,N-диизопропилэтиламин (531,8 мкл, 3,05 ммоль) и полученную смесь перемешивают при температуре 35°С в течение 3 час, концентрируют в вакууме, растворяют в DCM (30 мл) и промывают водой (2×5 мл). Органический слой сушат над сульфатом магния, отфильтровывают и концентрируют в вакууме, получая указанное в названии промежуточное соединение.
(b) трет-бутиловый эфир (2S,4S)-2-[4-(4-бромфенил)-1H-имидазол-2-ил]-4-метилпирролидин-1-карбоновой кислоты
Продукт, полученный на предыдущей стадии, растворяют в толуоле (20,0 мл), добавляют ацетат аммония (1,345 г, 17,45 ммоль) и полученную смесь оставляют на ночь перемешиваться при температуре 95°С, концентрируют, очищают хроматографией на силикагеле (24 г, 0-80% EtOAc/гексан)) и получают указанное в названии соединение (265 мг). (m/z): [M+H]+ вычислено для C19H24BrN3O2 406,11; 408,11; найдено 408,5.
(c) 4-(4-бромфенил)-2-((2S,4S)-4-метилпирролидин-2-ил)-1H-имидазол
Продукт, полученный на предыдущей стадии, обрабатывают 4 М раствором HCl в 1,4-диоксане (2,0 мл) в течение 1 чаc и концентрируют на роторном испарителе, получая ди-HCl соль указанного в названии промежуточного соединения (224 мг, выход 68%). (m/z): [M+H]+ вычислено для C14H16BrN3 306,06; 308,06; найдено 306,3.
Препаративный пример 5: метиловый эфир ((S)-1-{(2S,4S)-2-[4-(4-бромфенил)-1H-имидазол-2-ил]-4-метилпирролидин-1-карбонил}-2-метилпропил)карбаминовой кислоты
Смесь (S)-2-метоксикарбониламино-3-метилмасляной кислоты (103 мг, 0,59 ммоль, препаративный пример 3) и HATU (270 мг, 0,71 ммоль) перемешивают в DMA (2 мл) в течение 10 мин, а затем добавляют 4-(4-бромфенил)-2-((2S,4S)-4-метилпирролидин-2-ил)-1H-имидазол 2 НСl (224 мг, 0,59 ммоль, Препаративный пример 4) и N,N-диизопропилэтиламин (0,31 мл, 1,8 ммоль). Полученную смесь перемешивают при комнатной температуре в течение ночи, разбавляют этилацетатом (50 мл) и промывают водой (2×5 мл). Органический слой сушат над сульфатом магния, фильтруют, концентрируют и очищают хроматографией на силикагеле (0-100% EtOAc/гексан)). Фракции с требуемым продуктом объединяют и концентрируют, получая указанное в названии соединение (183 мг, выход 66%). (m/z): [M+H]+ вычислено для C21H27BrN4O3 463,13; 465,12; найдено 465,3.
Препаративный пример 6: метиловый эфир [(S)-2-метил-1-((2S,4S)-4-метил-2-{4-[4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-1H-имидазол-2-ил}пирролидин-1-карбонил)пропил]карбаминовой кислоты
К раствору метилового эфира ((S)-1-{(2S,4S)-2-[4-(4-бромфенил)-1H-имидазол-2-ил]-4-метилпирролидин-1-карбонил}-2-метилпропил)карбаминовой кислоты (183 мг, 0,39 ммоль; препаративный пример 5) и 4,4,5,5,4',4',5',5'-октаметил-[2,2']би[[1,3,2]диоксабороланила] (120 мг, 0,47 ммоль) в 1,4-диоксане (5 мл) добавляют ацетат калия (56 мг, 0,59 ммоль). Через полученную смесь барботируют азот, добавляют Pd(dppf)Cl2·CH2Cl2 (27 мг, 0,033 ммоль), реакционную смесь герметично закрывают и нагревают до 100°С в течение ночи. Реакционную смесь охлаждают до комнатной температуры и распределяют между EtOAc (50 мл) и водой (10 мл). Органический слой промывают водой (5 мл), насыщенным раствором соли (2 мл), сушат над сульфатом магния, отфильтровывают, концентрируют и получают темно-коричневое масло, которое очищают хроматографией на силикагеле (24 г силикагеля, 0-100% EtOAc/гексан). Фракции с требуемым продуктом объединяют, сушат и получают указанное в названии соединение (94 мг, выход 47%) в виде пенообразного вещества белого цвета. (m/z): [M+H]+ вычислено для C27H39BN4O5 511,30; найдено 511,7.
Препаративный пример 7: трет-бутиловый эфир (2S,5R)-4-[5-(4-бром-2-хлор-5-трифторметилфенилкарбамоил)пиридин-2-ил]-2,5-диметилпиперазин-1-карбоновой кислоты
К раствору 5-амино-2-бром-4-хлорбензотрифторида (466 мг, 1,70 ммоль) в DCM (1 мл), медленно добавляют раствор 2-фторпиридин-5-карбонилхлорида (270 мг, 1,70 ммоль) в DCM (1 мл). Добавляют несколько капель DMA и реакционную смесь концентрируют, получая N-(4-бром-2-хлор-5-трифторметилфенил)-6-фторникотинамид в виде твердого вещества темно-розового цвета.
К половине твердого вещества, полученного на предшествующей стадии, добавляют N,N-диизопропилэтиламин (0,5 мл, 3 ммоль), ДМСО (0,5 мл, 7 ммоль) и трет-бутиловый эфир (2S,5R)-2,5-диметилпиперазин-1-карбоновой кислоты (273 мг, 1,27 ммоль) и реакционную смесь оставляют на ночь нагреваться при температуре 120°С, затем концентрируют на роторном испарителе, растворяют в небольшом количестве DCM и очищают хроматографией на силикагеле (0-50% этилацетат:гексан), получая указанное в названии промежуточное соединение (288 мг, выход 29%) в виде твердого вещества желтого цвета. (m/z): [M+H]+ вычислено для C24H27F4N4O4 591,09; 593,09; найдено 593,2.
Препаративный пример 8: метиловый эфир ((S)-1-{(S)-8-[4-(4-бромфенил)-1H-имидазол-2-ил]-1,4-диокса-7-азаспиро[4.4]нонан-7-карбонил}-2-метилпропил)карбаминовой кислоты
(a) метиловый эфир (2S,4R)-4-гидрокси-1-((S)-2-метоксикарбониламино-3-метилбутирил)пирролидин-2-карбоновой кислоты
К раствору метилового эфира (2S,4R)-4-гидроксипирролидин-2-карбоновой кислоты в сухом DCM (200 мл) добавляют (S)-2-метоксикарбониламино-3-метилмасляную кислоту (10 г, 55 ммоль), HATU (24 г, 63,25 ммоль) и триэтиламин (16,7 г, 165 ммоль). Реакционную смесь оставляют перемешиваться на ночь при комнатной температуре. Добавляют DCM (200 мл), полученный раствор промывают насыщенным раствором соли, сушат, концентрируют и очищают колоночной хроматографией на силикагеле (элюируют смесью петролейный эфир: EtOAc от 10:1 до 1:4)), получая указанное в названии промежуточное соединение в виде масла желтого цвета (20 г). (m/z): [M+H]+ вычислено для C13H22N2O6 303,15; найдено 303,1.
(b) метиловый эфир (S)-1-((S)-2-метоксикарбониламино-3-метилбутирил)-4-оксопирролидин-2-карбоновой кислоты
К раствору продукта, полученного на предыдущей стадии (15 г, 50 ммоль), в DCM (500 мл) добавляют DMP (60 г) и реакционную смесь перемешивают в течение ночи при комнатной температуре, промывают насыщенным раствором бикарбоната натрия (3×100 мл), насыщенным раствором соли (100 мл), сушат, концентрируют и очищают колоночной хроматографией на силикагеле (элюируют смесью петролейный эфир: EtOAc 1:2), получая указанное в названии промежуточное соединение в виде масла желтого цвета (7,5 г, выход 50%). (m/z): [M+H]+ вычислено для C13H20N2O6 301,13; найдено 301,1.
(c) метиловый эфир (S)-7-((S)-2-метоксикарбониламино-3-метилбутирил)-1,4-диокса-7-азаспиро[4.4]нонан-8-карбоновой кислоты
К раствору продукта, полученного на предыдущей стадии (7,5 г, 24,9 ммоль), в толуоле (100 мл) добавляют этан-1,2-диол (7,75 г, 125 моль) и 4-метилбензолсульфоновую кислоту (860 мг, 5 ммоль) и полученную смесь перемешивают при кипячении с обратным холодильником в течение ночи. Добавляют этилацетат (300 мл) и раствор промывают насыщенным раствором бикарбоната натрия, сушат, концентрируют и очищают колоночной хроматографией на силикагеле (элюируют смесью петролейный эфир: EtOAc 1:1), получая указанное в названии промежуточное соединение в виде твердого вещества желтого цвета (3,5 г, выход 41%). (m/z): [M+H]+ вычислено для C15H24N2O7 345,16; найдено 345,1.
(d) (S)-7-((S)-2-метоксикарбониламино-3-метилбутирил)-1,4-диокса-7-азаспиро[4.4]нонан-8-карбоновая кислота
Гидроксид лития (730 мг, 30,5 ммоль) добавляют к раствору продукта, полученного на предыдущей стадии (3,0 г, 7,1 ммоль), в ТГФ (40 мл) и воде (30 мл). Реакционную смесь перемешивают при комнатной температуре в течение 3 час и промывают с помощью EtOAc (2×10 мл). Водный слой доводят до рН 1 с помощью 2 М раствора HCl и экстрагируют этилацетатом (4×50 мл); органические порции объединяют, сушат, концентрируют и получают продукт в виде твердого вещества белого цвета (3 г, выход 89%). (m/z): [M+H]+ вычислено для C14H22N2O7 331,14; найдено 331,1.
(e) 2-(4-бромфенил)-2-оксоэтиловый эфир (S)-7-((S)-2-метоксикарбониламино-3-метилбутирил)-1,4-диокса-7-азаспиро[4.4]нонан-8-карбоновой кислоты
К раствору продукта, полученного на предыдущей стадии (2,7 г, 8,17 ммоль), в ДМФА (30 мл) добавляют 2-бром-1-(4-бромфенил)этанон (2,5 г, 8,99 ммоль) и карбонат цезия (5,3 г, 16,34 ммоль) и реакционную смесь перемешивают при комнатной температуре в течение 4 час. Добавляют этилацетат (150 мл), полученный раствор промывают насыщенным раствором соли (3×20 мл), сушат, фильтруют, концентрируют и очищают колоночной хроматографией на силикагеле (элюент: от 0 до 50% EtOAc в петролейном эфире), получая указанное в названии промежуточное соединение в виде твердого вещества желтого цвета (1,6 г, выход 37%). (m/z): [M+H]+ вычислено для C22H27BrN2O8 527,11; 529,10; найдено 527,0; 529,0.
(f) метиловый эфир ((S)-1-{(S)-8-[4-(4-бромфенил)-1H-имидазол-2-ил]-1,4-диокса-7-азаспиро[4.4]нонан-7-карбонил}-2-метилпропил)карбаминовой кислоты
К раствору продукта, полученного на предыдущей стадии (1,5 г, 2,84 ммоль), в толуоле (50 мл) добавляют ацетат аммония (3,3 г, 42,7 ммоль) и полученный раствор перемешивают при кипячении с обратным холодильником в течение ночи. Добавляют этилацетат (100 мл) и полученный раствор промывают насыщенным раствором соли (3×20 мл), сушат, фильтруют, концентрируют и очищают колоночной хроматографией на силикагеле (элюент: от 0 до 50% EtOAc в петролейном эфире), получая указанное в названии промежуточное соединение в виде твердого вещества желтого цвета (1,0 г, выход 69%). (m/z): [M+H]+ вычислено для C22Η27ΒrΝ4O5 507,12; 509,11; найдено 507,0; 509,0. Спектр 1Н-ЯМР (CH3OD, 400) δ (м.д.) 7,58-7,52 (м, 2 H), 7,49-7,42 (м, 2 H), 7,31 (с, 1H), 5,18-5,11 (м, 1 H), 4,17-3,78 (м, 7 H), 3,63 (с, 3 H), 2,52-2,42 (м, 2H), 2,01-1,92 (м, 1H), 0,92-0,82 (м, 6H).
Препаративный пример 9: метиловый эфир ((S)-1-{(S)-8-[4-(4'-амино-2'-трифторметоксибифенил-4-ил)-1H-имидазол-2-ил]-1,4-диокса-7-азаспиро[4.4]нонан-7-карбонил}-2-метилпропил)карбаминовой кислоты
(a) трет-бутиловый эфир (4'-{2-[(S)-7-((S)-2-метоксикарбониламино-3-метилбутирил)-1,4-диокса-7-азаспиро[4.4]нон-8-ил]-1H-имидазол-4-ил}-2-трифторметоксибифенил-4-ил)карбаминовой кислоты
К раствору метилового эфира ((S)-1-{(S)-8-[4-(4-бромфенил)-1H-имидазол-2-ил]-1,4-диокса-7-азаспиро[4.4]нонан-7-карбонил}-2-метилпропил)карбаминовой кислоты (350 мг, 0,69 ммоль) в диоксане (8 мл) и воде (4 мл) добавляют трет-бутиловый эфир [4-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)-3-трифторметоксифенил]карбаминовой кислоты (334 мг, 0,83 ммоль), карбонат натрия (148 мг, 1,4 ммоль) и тетракис(трифенилфосфин)палладий(0) (81 мг, 0,07 ммоль). Реакционную смесь при перемешивании кипятят с обратным холодильником в течение 3 час в атмосфере азота. Добавляют этилацетат (50 мл) и полученный раствор промывают насыщенным раствором соли, сушат над сульфатом натрия, отфильтровывают и концентрируют, получая указанное в названии промежуточное соединение в виде твердого вещества желтого цвета (650 мг), (m/z): [M+H]+ вычислено для C34H40N5O8 704,28; найдено 704,3.
(b) метиловый эфир ((S)-1-{(S)-8-[4-(4'-амино-2'-трифторметоксибифенил-4-ил)-1H-имидазол-2-ил]-1,4-диокса-7-азаспиро[4.4]нонан-7-карбонил}-2-метилпропил)карбаминовой кислоты
К раствору продукта, полученного на предыдущей стадии (610 мг, 0,87 ммоль), в DCM (8 мл) добавляют TFA (1,6 мл) и реакционную смесь перемешивают при комнатной температуре в течение 1 час. Добавляют насыщенный раствор бикарбоната натрия (10 мл) и раствор экстрагируют с помощью DCM (3×20 мл). Органические слои объединяют, сушат над сульфатом натрия, концентрируют и очищают методом ВЭЖХ в кислых условиях (0,075% НСl), получая ди-HCl соль указанного в названии промежуточного соединения в виде твердого вещества белого цвета (92 мг), (m/z): [M+H]+ вычислено для C29H32F3N5O6 604,23; найдено 604,2. Спектр 1Н-ЯМР (CH3OD, 400) δ (м.д.): 7,88 (с, 1H), 7,80 (д, 2H), 7,61 (д, 2H), 7,52-7,49 (м, 1H), 7,21-7,16 (м, 2H), 5,38-5,34 (м, 1 H), 4,18-4,02 (м, 6 H), 3,96-3,90 (м, 1 H), 3,65 (с, 3 H), 2,71-2,63 (м, 1 H), 2,46-2,39 (м, 1H), 2,07-1,94 (м, 1H), 0,93-0,85 (м, 6 H).
Препаративный пример 10: метиловый эфир ((S)-1-{(2S,4S)-2-[4-(4'-аминобифенил-4-ил)-1H-имидазол-2-ил]-4-гидроксипирролидин-1-карбонил}-2-метилпропил)карбаминовой кислоты
К раствору метилового эфира ((S)-1-{(2S,4S)-2-[4-(4-бромфенил)-1H-имидазол-2-ил]-4-гидроксипирролидин-1-карбонил}-2-метилпропил)карбаминовой кислоты (1,8 г, 3,87 ммоль) в диоксане (30 мл) и воде (10 мл) добавляют 4-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)фениламин (848 мг, 3,87 ммоль), карбонат натрия (820 мг, 7,74 ммоль) и Pd(dppf)Cl2 (316 мг, 0,39 ммоль) и реакционную смесь кипятят с обратным холодильником в течение 3 час, охлаждают до комнатной температуры, фильтруют и концентрируют, а затем экстрагируют с помощью EtOAc (50 мл) и промывают водой (50 мл). Органический слой сушат над сульфатом натрия, отфильтровывают, концентрируют и очищают колоночной хроматографией на силикагеле (элюируют смесью от 1% до 3% метанола в DCM), получая указанное в названии промежуточное соединение (1,45 г, выход 65%). Спектр 1H ЯМР (CH3OD, 400) δ (м.д.) 7,70 (м, 2H), 7,67 (м, 2H), 7,45 (м, 2H), 7,29 (с, 1H), 6,80 (д, J=6,8 Гц, 1H), 5,82(д, J=9,2 Гц, 1H), 5,29 (д, J=8,8 Гц, 1H), 4,59 (с, 1H), 4,34 (д, J=8,8 Гц, 1H), 4,16 (д, J=8,0 Гц, 1H), 3,95~4,04 (м, 1H), 3,79~3,83 (м, 1H), 3,76 (с, 3H), 2,55~2,69 (м, 1H), 2,32 (м, 1H), 1,60~2,03 (м, 1H), 1,00 (м, 3H), 0,3~0,85 (м, 3H).
Препаративный пример 11: трет-бутиловый эфир (R)-4-(5-карбоксипиридин-2-ил)-3-метилпиперазин-1-карбоновой кислоты
Смесь 6-фторникотиновой кислоты (150 г, 1,063 моль) и трет-бутилового эфира (R)-3-метилпиперазин-1-карбоновой кислоты (234,2 г, 1,169 моль) в тетрагидрофуране (1,75 л) охлаждают до минус 40°C, а затем медленно добавляют 2 М раствор изопропилмагнийхлорида в тетрагидрофуране (1,196 л, 2,39 моль), поддерживая температуру ниже минус 20°С. Реакционную смесь медленно нагревают до комнатной температуры, перемешивают при комнатной температуре в течение 4 час, а затем добавляют 1N раствор HCl (1,75 л) и воду (1,175 л). Реакционную смесь экстрагируют этилацетатом (4 л). Органическую фазу упаривают и получают сырое твердое вещество (534 г). К сырому продукту добавляют ацетон (2 л) и воду (200 мл). Полученную реакционную смесь нагревают до 50°С и затем медленно добавляют воду (2,8 л). Добавляют затравочные кристаллы вещества, полученные из предыдущего синтеза, который проводят в меньшем масштабе, а затем добавляют ~1 л воды. Реакционную смесь охлаждают до 20°С в течение 3 час, а затем оставляют перемешиваться на ночь при 20°С и фильтруют. Твердое вещество промывают смесью ацетон:вода 2:3 (2×500 мл) и сушат в вакууме, получая указанное в названии соединение (329 г, выход 96%) в виде беловатого твердого вещества, ВЭЖХ Метод А: время удерживания 9,73 мин.
Препаративный пример 12: метиловый эфир ((S)-1-{(2S,4S)-2-[4-(4-бромфенил)-1H-имидазол-2-ил]-4-диметиламинопирролидин-1-карбонил}-2-метилпропил)карбаминовой кислоты
(a) 1-трет-бутиловый эфир 2-метиловый эфир (2S,4R)-4-метансульфонилоксипирролидин-1,2-дикарбоновой кислоты
К раствору 1-трет-бутилового эфира 2-метилового эфира (2S,4R)-4-гидроксипирролидин-1,2-дикарбоновой кислоты (50 г, 0,2 моль), триэтиламина (50,5 г, 0,5 моль) в DCM порциями добавляют метансульфонилхлорид (28 г, 0,25 моль) и реакционную смесь перемешивают при 0°С в течение 20 мин и при комнатной температуре в течение 1,5 час, а затем промывают раствором лимонной кислоты и водой. Органический слой сушат над сульфатом натрия и концентрируют, получая указанное в названии промежуточное соединение (70 г, выход 97%). Спектр 1Н-ЯМР (CDCl3, 400 МГц) δ (м.д.) 5,23 (м, 1H), 4,44 (м, 1H), 3,75 (м, 5H), 3,04 (с, 3H), 2,64 (м, 1H), 2,26 (м, 1H), 1,43 (м, 9H).
(b) 1-трет-бутиловый эфир 2-метиловый эфир (2S,4S)-4-азидопирролидин-1,2-дикарбоновой кислоты
Смесь продукта, полученного на предыдущей стадии (70 г, 0,2 моль), и азида натрия (26 г, 0,4 моль) в ДМФА (800 мл) перемешивают при 80°С в течение ночи. Доводят рН реакционной смеси до 9-10 с помощью бикарбоната натрия и экстрагируют с помощью DCM. Органический слой промывают водой и насыщенным раствором соли, сушат над сульфатом натрия, концентрируют и очищают хроматографией на силикагеле (элюируют смесью петролейный эфир:EtOAc 5:1), получая указанное в названии промежуточное соединение (60 г, выход 97%) в виде прозрачного масла. Спектр 1Н ЯМР (CDCl3, 400 МГц) δ (м.д.) 4,33 (м, 1H), 4,11 (м, 1H), 3,73 (с, 3H), 3,44 (м, 1H), 2,44 (м, 1H), 2,16 (м, 1H), 1,43 (м, 9H).
(c) 1-трет-бутиловый эфир 2-метиловый эфир (2S,4S)-4-аминопирролидин-1,2-дикарбоновой кислоты
Смесь продукта, полученного на предыдущей стадии (60 г, 0,2 моль), и палладия на угле (7 г) в метаноле (700 мл) дегазируют в вакууме, продувают несколько раз водородом, перемешивают в атмосфере водорода (40 фунт на кв.дюйм) при комнатной температуре в течение ночи и фильтруют. Фильтрат концентрируют и получают указанное в названии промежуточное соединение (45 г) в виде коричневого масла. (m/z): [M+H]+ вычислено для C11H20N2O4 245,14; найдено 245,1.
(d) 1-трет-бутиловый эфир 2-метиловый эфир (2S,4S)-4-диметиламинопирролидин-1,2-дикарбоновой кислоты
К раствору продукта, полученного на предыдущей стадии (28 г, 57 ммоль), и формальдегида (20 г, 240 ммоль) в метаноле (500 мл) при комнатной температуре добавляют порциями триацетоксиборгидрид натрия (36 г, 170 ммоль) и реакционную смесь перемешивают при комнатной температуре в течение ночи, а затем концентрируют. Остаток промывают водой и экстрагируют с помощью DCM (2×500 мл). Органический слой промывают водой и насыщенным раствором соли, сушат над сульфатом натрия, концентрируют и очищают хроматографией на силикагеле (элюируют смесью петролейный эфир:EtOAc 1:2, 1% NH4OH), получая указанный в названии продукт (8 г, выход 50%) в виде прозрачного масла. Спектр 1Н-ЯМР (CDCl3, 400 МГц) δ (м.д.) 4,09 (м, 2H), 3,73(с, 3H), 3,53 (м, 1H), 2,58 (м, 2H), 2,26 (с, 6H), 1,88 (м, 1H), 1,42 (м, 9H).
(e) 1-трет-бутиловый эфир (2S,4S)-4-диметиламинопирролидин-1,2-дикарбоновой кислоты
Раствор продукта, полученного на предыдущей стадии (8,0 г, 30 ммоль), и гидроксид натрия (5,8 г, 150 ммоль) в смеси метанол:вода 3:1 (120 мл) перемешивают при комнатной температуре в течение ночи в атмосфере азота и концентрируют. рН водной фазы доводят до 5-6 с помощью 3N раствора НСl и лиофилизируют. Твердое вещество промывают метанолом и отфильтровывают. Фильтрат концентрируют и получают указанное в названии промежуточное соединение (8 г) в виде твердого вещества белого цвета. Спектр 1Н-ЯМР (CDCl3, 400 МГц) δ (м.д.) 4,09 (м, 2H), 3,73 (м, 2H), 3,53 (м, 1H), 2,78 (с, 6H), 2,58 (м, 1H), 2,21 (м, 1H), 1,42 (м, 9H).
(f) трет-бутиловый эфир (2S,4S)-2-[2-(4-бромфенил)-2-оксо-этилкарбамоил]-4-диметиламинопирролидин-1-карбоновой кислоты
Смесь продукта, полученного на предыдущей стадии (5,0 г, 16 ммоль), 2-амино-1-(4-бромфенил)этанона·НСl (4,0 г, 16 ммоль), 3-(диэтоксифосфорилокси)-1,2,3-бензотриазин-4(3Н)-она (DEPBT) (6,0 г, 20 ммоль) и DIPEA (6,0 г, 48 ммоль) в ДМФА (150 мл) перемешивают при комнатной температуре в течение ночи. Реакционную смесь промывают водой и экстрагируют с помощью DCM (2×500 мл). Органический слой промывают водой и насыщенным раствором соли, сушат над сульфатом натрия, концентрируют и очищают хроматографией на силикагеле (элюент: DCM:метанол 10:1), получая указанное в названии промежуточное соединение (2,3 г), которое очищают методом ВЭЖХ и получают указанное в названии промежуточное соединение в виде прозрачного масла (1 г, чистота 97%) и (750 мг, чистота 70%).
(g) {(3S,5S)-5-[4-(4-бромфенил)-1H-имидазол-2-ил]пирролидин-3-ил}диметиламин
Смесь продукта, полученного на предыдущей стадии (1,25 г, 2,75 ммоль), и ацетата аммония (4,2 г, 55 ммоль) в толуоле (50 мл) перемешивают при 100-120°С в течение ночи в атмосфере азота. Реакционную смесь промывают водой и водную фазу экстрагируют с помощью DCM (2×100 мл). Органический слой промывают водой и насыщенным раствором соли, сушат над сульфатом натрия, концентрируют и очищают хроматографией на силикагеле (элюент: DCM:метанол 10:1), получая трет-бутиловый эфир (2S,4S)-2-[4-(4-бромфенил)-1H-имидазол-2-ил]-4-диметиламинопирролидин-1-карбоновой кислоты (1,7 г) в виде твердого вещества коричневого цвета.
Смесь продукта, полученного на предыдущей стадии (1,7 г, 2,3 ммоль), в HCl и метаноле (50 мл) перемешивают при комнатной температуре в течение 1 час и концентрируют, получая указанное в названии промежуточное соединение (1,5 г) в виде твердого вещества коричневого цвета. (m/z): [M+H]+ вычислено для С15H19BrN4 335,08; найдено 334,9.
(h) метиловый эфир ((S)-1-{(2S,4S)-2-[4-(4-бромфенил)-1H-имидазол-2-ил]-4-диметиламинопирролидин-1-карбонил}-2-метилпропил)карбаминовой кислоты
Смесь продукта, полученного на предыдущей стадии (1,5 г, 2,3 ммоль), (S)-2-метоксикарбониламино-3-метилмасляной кислоты (0,6 г, 3,5 ммоль), HATU (1,3 г, 3,5 ммоль) и N,N-диизопропилэтиламина (0,9 г, 6,9 ммоль) в DCM (50 мл) перемешивают при комнатной температуре в течение ночи. Реакционную смесь промывают водой и экстрагируют с помощью DCM (2×100 мл). Органический слой промывают водой и насыщенным раствором соли, сушат над сульфатом натрия, концентрируют и очищают хроматографией на силикагеле (элюент: DCM:метанол 10:1), получая указанное в названии промежуточное соединение (0,8 г, выход 65%) в виде твердого вещества коричневого цвета, (m/z): [M+H]+ вычислено для C22H30BrN5O3 492,15; найдено 492,1.
Препаративный пример 13: трет-бутиловый эфир (R)-3-метил-4-{5-[4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенилкарбамоил]пиридин-2-ил}пиперазин-1-карбоновой кислоты
Раствор трет-бутилового эфира (R)-4-(5-карбоксипиридин-2-ил)-3-метилпиперазин-1-карбоновой кислоты (200 мг, 0,6 ммоль), EDC (140 мг, 0,75 ммоль) и HOAt (100 мг, 0,75 ммоль), растворенного в ДМФА (4,6 мл) перемешивают в течение 30 мин, а затем добавляют 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)анилин (140 мг, 0,62 ммоль) и N,N-диизопропилэтиламин (130 мкл, 0,75 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи и экстрагируют смесью этилацетат/вода. Органический слой сушат над сульфатом натрия, отфильтровывают, концентрируют и очищают хроматографией на силикагеле (элюент: 0-70% этилацетат:гексан), получая указанное в названии промежуточное соединение (250 мг, выход 80%). (m/z): [M+H]+ вычислено для C28H39BN4O5 523,30; найдено 523,5.
Препаративный пример 14: метиловый эфир 4-бром-3-трифторметоксибензойной кислоты
Смесь 4-амино-3-(трифторметокси)бензойной кислоты (504,1 мг, 2,28 ммоль), метанола (7,6 мл) и 4,0 М НСl в 1,4-диоксане (5,7 мл) оставляют на уикенд перемешиваться при комнатной температуре, концентрируют, упаривают с этилацетатом (3×10 мл) и сушат в вакууме, получая твердое вещество коричневатого цвета. Твердое вещество растворяют в смеси ацетонитрила (23 мл) и воды (2,3 мл). К реакционной смеси добавляют бромид меди(II) (595 мг, 2,66 ммоль) и трет-бутилнитрит (0,39 мл, 3,32 ммоль), и реакционную смесь нагревают до 70°С в течение 1,5 час, охлаждают до комнатной температуры и разбавляют с помощью EtOAc (70 мл). Органический слой промывают насыщенным раствором бикарбоната натрия (2×15 мл), насыщенным раствором соли (2×15 мл), сушат над сульфатом натрия, отфильтровывают и концентрируют, получая коричневое масло, которое очищают хроматографией на силикагеле (24 г силикагеля, 0-50% EtOAc/гексан). Требуемые фракции объединяют и концентрируют, получая указанное в названии промежуточное вещество (281 мг, выход 41%) в виде желтоватого масла.
Препаративный пример 15: 4'-{2-[(2S,4S)-1-((S)-2-метоксикарбониламино-3-метилбутирил)-4-метилпирролидин-2-ил]-1H-имидазол-4-ил}-2-трифторметоксибифенил-4-карбоновая кислота
К смеси метилового эфира 4-бром-3-трифторметоксибензойной кислоты (161 мг, 0,54 ммоль; препаративный пример 14), метиловый эфир [(S)-2-метил-1-((2S,4S)-4-метил-2-{4-[4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-1H-имидазол-2-ил}пирролидин-1-карбонил)пропил]карбаминовой кислоты (250 мг, 0,49 ммоль) и карбоната калия (304 мг, 2,20 ммоль) при комнатной температуре добавляют толуол (1,2 мл), а затем воду (0,61 мл). Полученную смесь дегазируют и продувают азотом, добавляют Pd(dppf)Cl2 (24 мг, 0,029 ммоль) в атмосфере азота. Реакционную смесь герметично закрывают и оставляют на ночь при температуре 100°С, охлаждают до комнатной температуры и распределяют между EtOAc (10 мл) и водой (2 мл). Органический слой сушат над сульфатом натрия, отфильтровывают и концентрируют, получая коричневое масло, которое очищают хроматографией на силикагеле (12 г силикагеля, 0-100% EtOAc/гексан). Требуемые фракции объединяют и концентрируют, получая прозрачное масло красноватого цвета.
Маслянистый остаток, полученный на предыдущей стадии, растворяют в смеси метанола (4,9 мл) и воды (2 мл) и в течение 1 час при температуре 65°С обрабатывают моногидратом гидроксида лития (123 мг, 2,94 ммоль). Реакционную смесь концентрируют, растворяют в смеси 1:1 уксусная кислота:вода (1,5 мл), отфильтровывают и очищают методом ВЭЖХ с обращенной фазой. Требуемые фракции объединяют и сушат лиофилизацией, получая соль трифторуксусной кислоты указанного в названии промежуточного соединения (221 мг, выход 64%) в виде твердого вещества белого цвета. (m/z): [M+H]+ вычислено для C29H31F3N4O6 589,22; найдено 589.
Препаративный пример 16: трет-бутиловый эфир (2S,5R)-4-(5-аминопиридин-2-ил)-2,5-диметилпиперазин-1-карбоновой кислоты
(a) трет-бутиловый эфир (2S,5R)-2,5-диметил-4-(5-нитропиридин-2-ил)пиперазин-1-карбоновой кислоты
Смесь 2-хлор-5-нитропиридина (1,0 г, 6,3 ммоль), трет-бутилового эфира (2S,5R)-2,5-диметилпиперазин-1-карбоновой кислоты (1,4 г, 6,3 ммоль) и карбоната калия (1,7 г, 13 ммоль) перемешивают в ДМСО (5,0 мл, 70 ммоль) при 100°С в течение ночи. Реакционную смесь отфильтровывают через слой силикагеля, который промывают с помощью EtOAc (200 мл). Фильтрат промывают водой (2×10 мл), концентрируют и очищают хроматографией на силикагеле (элюент: этилацетат/гексан, от 0 до 80%), получая указанное в названии промежуточное соединение (1,724 г, выход 81%) в виде твердого вещества желтого цвета.
(b) трет-бутиловый эфир (2S,5R)-4-(5-аминопиридин-2-ил)-2,5-диметилпиперазин-1-карбоновой кислоты
Раствор продукта, полученного на предыдущей стадии, в метаноле (250 мл) дегазируют, затем добавляют 20%-ный гидроксид палладия на угле (170 мг, 10% масс.) и реакционную смесь трижды дегазируют и гидрируют в атмосфере водорода в течение ночи. Реакционную смесь отфильтровывают через слой Celite®. Фильтрат концентрируют и очищают хроматографией на силикагеле (элюируют 3%-ным раствором триэтиламина в смеси этилацетат/гексан от 0 до 80%), получая указанное в названии промежуточное соединение (1,3 г, выход 67%) в виде твердого вещества темно-красного цвета. (m/z): [M+H]+ вычислено для C16H26N4O2 307,21; найдено 307,6.
Препаративный пример 17: [(R)-4-(5-аминопиридин-2-ил)-3-метилпиперазин-1-ил]-((S)-2,2-диметилциклопропил)метанон
(a) трет-бутиловый эфир (R)-3-метил-4-(5-нитропиридин-2-ил)пиперазин-1-карбоновой кислоты
В каждой из двух отдельных реакций, смеси 2-хлор-5-нитропиридина (1,0 г, 6,3 ммоль), трет-бутилового эфира (R)-3-метилпиперазин-1-карбоновой кислоты (1,4 г, 6,9 ммоль) и карбоната калия (1,31 г, 9,46 ммоль) в ДМСО (20 мл) нагревают до 100°С в течение ночи. Реакционные смеси охлаждают до комнатной температуры, фильтруют через силикагель и элюируют смесью EtOAc (150 мл). Фильтрат промывают водой (2×20 мл) и насыщенным раствором соли (20 мл), сушат над сульфатом натрия, отфильтровывают и концентрируют, получая коричневатое масло, которое очищают хроматографией на силикагеле (40 г силикагеля, 0-60% EtOAc/гексан). Требуемые фракции объединяют и концентрируют, получая указанное в названии промежуточное соединение (1,39 г каждый) в виде желтоватого твердого вещества. (m/z): [M+H]+ вычислено для C15H22N4O4 323,16; найдено 323,3.
(b) (R)-2-метил-1-(5-нитропиридин-2-ил)пиперазин
Продукт, полученный на предыдущей стадии (2,79 г, 8,65 ммоль), обрабатывают 4 М раствором HCl в 1,4-диоксане (65 мл) и перемешивают при комнатной температуре в течение 1 час, концентрируют, получая твердое вещество желтого цвета, и дважды выпаривают с EtOAc, получая ди-HCl соль указанного в названии промежуточного соединения (2,20 г, выход 86%).
(c) ((S)-2,2-диметилциклопропил)-[(R)-3-метил-4-(5-нитропиридин-2-ил)пиперазин-1-ил]метанон
Продукт, полученный на предыдущей стадии (1,5 г, 6,7 ммоль), растворяют в DMA (65 мл) и добавляют N,N-диизопропилэтиламин (3,5 мл), а затем добавляют (S)-(+)-2,2-диметилциклопропанкарбоновую кислоту (0,93 мл, 8,1 ммоль) и HATU (3,1 г, 8,1 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи, разбавляют с помощью EtOAc и промывают водой и насыщенным раствором соли. Органический слой сушат над сульфатом натрия, отфильтровывают и концентрируют, получая масло желтого цвета, которое очищают хроматографией на силикагеле (0-60% EtOAc:гексан), получая указанное в названии промежуточное соединение (1,29 г, выход 60%) в виде твердого вещества желтого цвета. (m/z): [M+H]+ вычислено для C16H22N4O3 319,17; найдено 319,2.
(d) [(R)-4-(5-аминопиридин-2-ил)-3-метилпиперазин-1-ил]-((S)-2,2-диметилциклопропил)метанон
Раствор продукта, полученного на предыдущей стадии (200 мг, 0,63 ммоль), в метаноле (6 мл) дегазируют азотом в течение 15 мин и затем добавляют 5% платины на влажном угле 65,25% (491 мг, 0,063 ммоль) и через реакционную смесь барботируют водород в течение 15 мин, а затем перемешивают в атмосфере водорода в течение 1,5 час при комнатной температуре. Реакционную смесь дегазируют азотом и фильтруют через целит, промывают этилацетатом и концентрируют, получая темно-красное масло, которое очищают хроматографией на силикагеле (0-100% этилацетат:гексан), получая указанное в названии промежуточное соединение в виде светло-красного твердого вещества (83 мг, выход 46%). (m/z): [M+H]+ вычислено для C16H24N4O 289,20; найдено 289,4.
Препаративный пример 18: 4-(4-бромфенил)-2-((2S,4S)-4-метилсульфанилпирролидин-2-ил)-1H-имидазол
(a) трет-бутиловый эфир (2S,4S)-2-[4-(4-бромфенил)-1H-имидазол-2-ил]-4-метилсульфанилпирролидин-1-карбоновой кислоты
К раствору трет-бутилового эфира (2S,4S)-4-метилсульфанилпирролидин-1,2-дикарбоновой кислоты (250 мг, 0,96 ммоль) и п-бромфенацилбромида (266 мг, 0,96 ммоль) в DCM (10 мл) в атмосфере азота добавляют N,N-диизопропилэтиламин (0,58 мл, 3,35 ммоль) и полученную смесь перемешивают при 35°С в течение 3 час, концентрируют в вакууме, растворяют в DCM (30 мл) и промывают водой (2×5 мл). Органический слой сушат над сульфатом магния, фильтруют и концентрируют в вакууме.
Неочищенное промежуточное соединение, полученное на предыдущей стадии, растворяют в толуоле (75,0 мл), добавляют ацетат аммония (1,475 г, 19,13 ммоль) и полученную смесь перемешивают при 100°С в течение ночи, концентрируют и очищают хроматографией на силикагеле (12 г силикагеля, от 0 до 60% EtOAc/гексан), получая указанное в названии промежуточное соединение (410 мг, выход 98%). (m/z): [M+H]+ вычислено для C19H24BrN3O2S 438,08; 440,08; найдено 440.
(b) 4-(4-бромфенил)-2-((2S,4S)-4-метилсульфанилпирролидин-2-ил)-1H-имидазол
Продукт, полученный на предыдущей стадии, обрабатывают 4 М раствором НСl в 1,4-диоксане (2,0 мл) в течение 1 час и концентрируют на роторном испарителе, получая ди-HCl соль указанного в названии промежуточного соединения (368 мг, выход 93%). (m/z): [M+H]+ вычислено для C14H16BrN3S 338,02; 340,02; найдено 340.
Препаративный пример 19: метиловый эфир ((S)-1-{(2S,4S)-2-[4-(4-бромфенил)-1H-имидазол-2-ил]-4-метилсульфанилпирролидин-1-карбонил}-2-метилпропил)карбаминовой кислоты
Смесь (S)-2-метоксикарбониламино-3-метилмасляной кислоты (156 мг, 0,89 ммоль) и HATU (407 мг, 1,07 ммоль) перемешивают в DMA (3,0 мл) в течение 10 мин, затем добавляют ди-HCl соль 4-(4-бромфенил)-2-((2S,4S)-4-метилсульфанилпирролидин-2-ил)-1H-имидазола (367 мг, 0,89 ммоль; препаративный пример 18) и N,N-диизопропилэтиламин (777,3 мкл, 4,46 ммоль). Полученную смесь перемешивают при комнатной температуре в течение ночи, концентрируют и очищают хроматографией на силикагеле (от 0 до 90% EtOAc/гексан). Фракции с требуемым продуктом объединяют и концентрируют, получая указанное в названии промежуточное соединение (366 мг, выход 82%). (m/z): [M+H]+ вычислено для C21H27BrN4O3S 495,10; 497,10; найдено 495.
Препаративный пример 20: метиловый эфир [(S)-2-метил-1-((2S,4S)-4-метилсульфанил-2-{4-[4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-1H-имидазол-2-ил}пирролидин-1-карбонил)пропил]карбаминовой кислоты
К раствору метилового эфира ((S)-1-{(2S,4S)-2-[4-(4-бромфенил)-1H-имидазол-2-ил]-4-метилсульфанилпирролидин-1-карбонил}-2-метилпропил)карбаминовой кислоты (320 мг, 0,65 ммоль, препаративный пример 19) и 4,4,5,5,4',4',5',5'-октаметил-[2,2']би[[1,3,2]диоксабороланила] (246 мг, 0,97 ммоль) в 1,4-диоксане (5 мл) добавляют ацетат калия (114 мг, 1,16 ммоль). Полученную смесь продувают азотом. Добавляют комплекс дихлорида 1,1'-бис(дифенилфосфино)ферроценопалладия(II) и дихлорметана (47 мг, 0,058 ммоль), реакционную смесь герметично закрывают и оставляют на ночь нагреваться до 100°С. Реакционную смесь охлаждают до комнатной температуры и распределяют между EtOAc (50 мл) и водой (10 мл). Органический слой промывают водой (5 мл) и насыщенным раствором соли (2 мл), сушат над сульфатом магния, отфильтровывают и концентрируют, получая темно-коричневое масло, которое очищают хроматографией на силикагеле (24 г силикагеля, 0-100% EtOAc/гексан). Фракции с требуемым продуктом объединяют и сушат, получая указанное в названии промежуточное соединение (120 мг, выход 34%). (m/z): [M+H]+ вычислено для C27H39BN4O5S 543,27; найдено 543.
Препаративный пример 21: 4'-{2-[(2S,4S)-1-((S)-2-метоксикарбониламино-3-метилбутирил)-4-метилсульфанилпирролидин-2-ил]-1H-имидазол-4-ил}-2-трифторметоксибифенил-4-карбоновая кислота
К смеси метилового эфира 4-бром-3-трифторметоксибензойной кислоты (36 мг, 0,12 ммоль; препаративный пример 14), метилового эфира [(S)-2-метил-1-((2S,4S)-4-метилсульфанил-2-{4-[4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-фенил]-1H-имидазол-2-ил}пирролидин-1-карбонил)пропил]карбаминовой кислоты (60 мг, 0,11 ммоль; препаративный пример 20) и карбоната калия (69 мг, 0,50 ммоль) при комнатной температуре добавляют толуол (0,27 мл) и затем воду (0,14 мл). Полученную смесь дегазируют, продувают азотом и в атмосфере азота добавляют Pd(dppf)Cl2 (5,4 мг, 0,006 ммоль). Реакционную смесь герметично закрывают и выдерживают при 100°С в течение ночи, охлаждают до комнатной температуры и распределяют между EtOAc (10 мл) и водой (2 мл). Органический слой сушат над сульфатом натрия, отфильтровывают, концентрируют и получают масло коричневого цвета, которое очищают хроматографией на силикагеле (12 г силикагеля, 0-100% EtOAc/гексан). Требуемые фракции объединяют и концентрируют, получая прозрачное масло красноватого цвета.
Маслянистый остаток, полученный на предыдущей стадии, растворяют в смеси метанола (1,1 мл) и воды (0,4 мл) и при 65°С в течение 1 час обрабатывают моногидратом гидроксида лития (28 мг, 0,66 ммоль). Реакционную смесь концентрируют, растворяют в смеси 1:1 уксусная кислота:вода (1,5 мл), отфильтровывают и очищают методом ВЭЖХ с обращенной фазой. Требуемые фракции объединяют и сушат вымораживанием, получая соль трифторуксусной кислоты указанного в названии промежуточного соединения (37 мг, выход 46%) в виде твердого вещества белого цвета. (m/z): [M+H]+, вычислено для C29H31F3N4O6S 621,19; найдено 621.
Препаративный пример 22: трет-бутиловый эфир (2S,5R)-4-[5-(4-бром-2-фтор-5-трифторметоксифенилкарбамоил)пиридин-2-ил]-2,5-диметилпиперазин-1-карбоновой кислоты
К раствору 4-бром-2-фтор-5-трифторметоксифениламина (500 мг, 2 ммоль) в DCM (1 мл), медленно добавляют раствор 2-фторпиридин-5-карбонилхлорида (290 мг, 1,8 ммоль) в DCM (1 мл). Добавляют несколько капель DMA и реакционную смесь концентрируют, получая N-(4-бром-2-фтор-5-трифторметоксифенил)-6-фторникотинамид в виде твердого вещества темно-розового цвета.
Твердое вещество, полученное на предыдущей стадии, растворяют в смеси Ν,Ν-диизопропилэтиламина (0,7 мл, 4 ммоль) и ДМСО (0,7 мл, 10 ммоль), добавляют трет-бутиловый эфир (2S,5R)-2,5-диметилпиперазин-1-карбоновой кислоты (590 мг, 2,7 ммоль) и реакционную смесь нагревают до 120°С в течение ночи, концентрируют на роторном испарителе, растворяют в небольшом количестве DCM и очищают хроматографией на силикагеле (0-40% этилацетат:гексан), получая указанное в названии промежуточное соединение (613 мг, выход 57%), в виде твердого вещества белого цвета. (m/z): [M+H]+ вычислено для C24H27F4N4O4 591,12; найдено 591,4.
Препаративный пример 23: 4'-{2-[(S)-7-((S)-2-метоксикарбониламино-3-метилбутирил)-1,4-диокса-7-азаспиро[4.4]нон-8-ил]-1H-имидазол-4-ил}бифенил-4-карбоновая кислота
К раствору метилового эфира ((S)-1-{(S)-8-[4-(4-бромфенил)-1H-имидазол-2-ил]-1,4-диокса-7-азаспиро[4.4]нонан-7-карбонил}-2-метилпропил)карбаминовой кислоты (450 мг, 0,89 ммоль) в диоксане (8 мл) и воде (4 мл) добавляют 4-фенилбороновую кислоту (154 мг, 0,93 ммоль), карбонат натрия (189 мг, 1,78 ммоль) и тетракис(трифенилфосфин)палладий(0) (104 мг, 0,09 ммоль) и реакционную смесь при перемешивании кипятят с обратным холодильником в течение 3 час в атмосфере азота. Доводят рН до 1 с помощью 2 М раствора HCl и реакционную смесь экстрагируют с помощью EtOAc (3×20 мл). Органические слои объединяют, сушат над сульфатом натрия, концентрируют и очищают флэш-хроматографией (элюируют раствором метанола в DCM, 0-7%), получая указанное в названии промежуточное соединение в виде твердого вещества желтого цвета (330 мг, выход 68%). (m/z): [M+H]+ вычислено для C29H32N4O7 549,23; найдено 549,3. Спектр 1Н-ЯМР (CH3OD, 400) δ (м.д.) 8,13-8,11 (м, 2H), 7,90-7,78 (м, 7H), 5,39-5,34 (м, 1 H), 4,19-3,91 (м, 7 H), 3,66 (с, 3 H), 2,72-2,65 (м, 1 H), 2,48-2,41 (м, 1H), 2,12-1,95 (м, 1H), 0,92-0,85 (м, 6 H).
Препаративный пример 24: трет-бутиловый эфир (R)-4-[5-(4-бром-2-фтор-5-трифторметоксифенилкарбамоил)пиридин-2-ил]-3-метилпиперазин-1-карбоновой кислоты
(a) 4-бром-2-фтор-5-трифторметоксифениламин
К смеси 2-фтор-5-(трифторметокси)анилина (2 г, 10 ммоль) в ДМФА (4 мл) медленно добавляют раствор N-бромсукцинимида (2,2 г, 12 ммоль), растворенного в ДМФА (5 мл). Реакционную смесь перемешивают при комнатной температуре в течение 1 час, концентрируют и экстрагируют смесью этилацетат/вода. Органический слой промывают насыщенным раствором соли, перераспределяют, сушат над сульфатом натрия, отфильтровывают, концентрируют и очищают хроматографией на силикагеле (100% гексан), получая указанное в названии промежуточное соединение в виде масла красного цвета (2 г, выход 70%). (m/z): [M+H]+ вычислено для C7H4BrF4NO 273,94; 275,94; найдено 276,2.
(b) N-(4-бром-2-фтор-5-трифторметоксифенил)-6-фторникотинамид
К раствору продукта, полученного на предыдущей стадии (2 г, 7 ммоль), растворенного в DCM (10 мл), медленно добавляют раствор 2-фторпиридин-5-карбонилхлорида (1,2 г, 7,3 ммоль) в DCM (10 мл) и DMA (60 капель). Реакционную смесь концентрируют и получают указанное в названии промежуточное соединение в виде твердого вещества темно-розового цвета (m/z): [M+H]+ вычислено для C13H6BrF5N2O2 396,95; 398,95; найдено 399,0.
(c) трет-бутиловый эфир (R)-4-[5-(4-бром-2-фтор-5-трифторметоксифенилкарбамоил)пиридин-2-ил]-3-метилпиперазин-1-карбоновой кислоты
Твердое вещество, полученное на предыдущей стадии, растворяют в смеси N,N-диизопропилэтиламина (3 мл, 20 ммоль) и ДМСО (3 мл) и добавляют трет-бутиловый эфир (R)-3-метилпиперазин-1-карбоновой кислоты (2,2 г, 11 ммоль). Реакционную смесь нагревают при 120°С в течение ночи, концентрируют на роторном испарителе, растворяют в небольшом количестве DCM и очищают хроматографией на силикагеле (0-40% этилацетат:гексан), получая указанное в названии промежуточное соединение в виде твердого вещества белого цвета (3,6 г, выход 80%). (m/z): [M+H]+ вычислено для C23H25BrF4N4O4 577,10; 579,10; найдено 577,5; 580,3.
Препаративный пример 25: 4'-{5-хлор-2-[(2S,4S)-1-((S)-2-метоксикарбониламино-3-метилбутирил)-4-метилпирролидин-2-ил]-1H-имидазол-4-ил}-2-трифторметоксибифенил-4-карбоновая кислота
Смесь 4'-{2-[(2S,4S)-1-((S)-2-метоксикарбониламино-3-метилбутирил)-4-метилпирролидин-2-ил]-1H-имидазол-4-ил}-2-трифторметоксибифенил-4-карбоновой кислоты (124 мг, 0,21 ммоль) и N-хлорсукцинимида (28 мг, 0,21 ммоль) перемешивают в ацетонитриле (2,0 мл) и N,N-диметилацетамиде (0,2 мл) при 60°С в течение ночи. Реакционную смесь концентрируют на роторном испарителе, растворяют в смеси 1:1 уксусная кислота:вода (8 мл) и очищают методом ВЭЖХ с обращенной фазой, получая TFA-соль указанного в названии соединения (48 мг). (m/z): [M+H]+ вычислено для C29H30ClF3N4O6 623,18; найдено 623,2.
Препаративный пример 26: метиловый эфир ((S)-1-{(2S,4S)-2-[4-(4-бромфенил)-1H-имидазол-2-ил]-4-метоксипирролидин-1-карбонил}-2-метилпропил)карбаминовой кислоты
(a) трет-бутиловый эфир (2S,4S)-2-[4-(4-бромфенил)-1H-имидазол-2-ил]-4-метоксипирролидин-1-карбоновой кислоты
К раствору 1-трет-бутилового эфира (2S,4S)-4-метоксипирролидин-1,2-дикарбоновой кислоты (900 мг, 3,67 ммоль) и п-бромфенацилбромида (1,02 г, 3,67 ммоль) в DCM (20 мл) в атмосфере азота добавляют N,N-диизопропилэтиламин (1,92 мл, 11,01 ммоль). Полученную смесь перемешивают при 35°С в течение 3 час и концентрируют в вакууме. Неочищенное промежуточное соединение растворяют в толуоле (150 мл), добавляют ацетат аммония (5,66 г, 73,39 ммоль) и полученную смесь оставляют перемешиваться на ночь при температуре 95°С, а затем промывают водой (2×10 мл). Органический слой сушат над сульфатом магния, фильтруют, концентрируют и очищают хроматографией на силикагеле (24 г, этилацетат/гексан от 0 до 60%), получая указанное в названии промежуточное соединение (1,49 г, выход 96%).
(b) 4-(4-бромфенил)-2-((2S,4S)-4-метоксипирролидин-2-ил)-1H-имидазол
Продукт, полученный на предыдущей стадии, в течение 1 час обрабатывают 4 М раствором HCl в 1,4-диоксане (2 мл) и концентрируют на роторном испарителе, получая ди-HCl соль указанного в названии промежуточного соединения (1,40 г, выход 97%). (m/z): [M+H]+ вычислено для C14H16BrN3O 322,05; 324,05; найдено 324.
(c) метиловый эфир ((S)-1-{(2S,4S)-2-[4-(4-бромфенил)-1H-имидазол-2-ил]-4-метоксипирролидин-1-карбонил}-2-метилпропил)карбаминовой кислоты
Смесь (S)-2-метоксикарбониламино-3-метилмасляной кислоты (643 мг, 3,67 ммоль) и HATU (1,67 г, 4,40 ммоль) перемешивают в DMA (5 мл) в течение 10 мин, а затем добавляют продукт, полученный на предыдущей стадии (1,40 г, 3,54 ммоль), и N,N-диизопропилэтиламин (1,92 мл, 11,01 ммоль) и полученную смесь перемешивают при комнатной температуре в течение ночи, концентрируют на роторном испарителе, растворяют в этилацетате (100 мл) и промывают водой (2×10 мл). Органический слой сушат над сульфатом магния, фильтруют, концентрируют и очищают хроматографией на силикагеле (этилацетат/гексан от 30 до 80%), получая указанный в названии продукт (1,38 г, выход 79%). (m/z): [М+Н]+ рассчитано для C21H27BrN4O4 479,12; 481,12; найдено 481.
Препаративный пример 27: метиловый эфир [(S)-1-((2S,4S)-4-метокси-2-{4-[4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-1H-имидазол-2-ил}пирролидин-1-карбонил)-2-метилпропил]карбаминовой кислоты
Раствор метилового эфира ((S)-1-{(2S,4S)-2-[4-(4-бромфенил)-1H-имидазол-2-ил]-4-метоксипирролидин-1-карбонил}-2-метилпропил)карбаминовой кислоты (1,05 г, 2,18 ммоль; препаративный пример 26), 4,4,5,5,4',4',5',5'-октаметил-[2,2']би[[1,3,2]диоксабороланила] (0,83 г, 3,27 ммоль) и ацетата калия (0,39 г, 3,93 ммоль) в 1,4-диоксане (5 мл) продувают азотом в течение 5 мин, затем добавляют Pd(dppf)Cl2 (95,80 мг, 0,13 ммоль) и полученную смесь перемешивают при 100°С в течение 3 час, разбавляют этилацетатом (50 мл) и фильтруют через слой целита и силикагеля. Фильтрующий слой промывают этилацетатом (150 мл); фильтрат концентрируют и очищают хроматографией на силикагеле (этилацетат/гексан от 30 до 100%), получая указанное в названии промежуточное соединение (669 мг выход 58%). (m/z): [M+H]+ вычислено для C27H39BN4O6 527,30; найдено 527,2.
Препаративный пример 28: метиловый эфир ((S)-1-{(2S,4S)-2-[4-(5'-хлор-4'-{[6-((R)-2-метилпиперазин-1-ил)пиридин-3-карбонил]амино}-2'-трифторметоксибифенил-4-ил)-1H-имидазол-2-ил]-4-метоксипирролидин-1-карбонил}-2-метилпропил)карбаминовой кислоты
(a) трет-бутиловый эфир (R)-4-[5-(5-хлор-4'-{2-[(2S,4S)-4-метокси-1-((S)-2-метоксикарбониламино-3-метил-бутирил)пирролидин-2-ил]-1H-имидазол-4-ил}-2-трифторметоксибифенил-4-илкарбамоил)пиридин-2-ил]-3-метилпиперазин-1-карбоновой кислоты
К раствору метилового эфира [(S)-1-((2S,4S)-4-метокси-2-{4-[4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-1H-имидазол-2-ил}пирролидин-1-карбонил)-2-метилпропил]карбаминовой кислоты (100 мг, 0,19 ммоль, препаративный пример 27) и трет-бутилового эфира (R)-4-[5-(4-бром-2-хлор-5-трифторметоксифенилкарбамоил)пиридин-2-ил]-3-метилпиперазин-1-карбоновой кислоты (110 мг, 0,19 ммоль) в толуоле (1,18 мл) и воде (0,43 мл) добавляют карбонат калия (127 мг, 0,92 ммоль). Реакционную смесь продувают азотом в течение 15 мин и добавляют Pd(dppf)Cl2·CH2Cl2 (13,55 мг, 0,017 ммоль); реакционную смесь продувают азотом и нагревают до 90°С в течение ночи, охлаждают до комнатной температуры, разбавляют с помощью EtOAc, промывают водой и насыщенным раствором соли и получают темное твердое вещество, которое очищают хроматографией на силикагеле (12 г силикагеля, EtOAc/гексан от 40 до 100%), получая указанное в названии промежуточное соединение (35,3 мг, выход 21%) в виде твердого вещества желтоватого цвета. (m/z): [M+H]+ вычислено для C44H52ClF3N8O8 913,35; найдено 913,3.
(b) метиловый эфир ((S)-1-{(2S,4S)-2-[4-(5'-хлор-4'-{[6-((R)-2-метилпиперазин-1-ил)пиридин-3-карбонил]амино}-2'-трифторметоксибифенил-4-ил)-1Н-имидазол-2-ил]-4-метоксипирролидин-1-карбонил}-2-метилпропил)карбаминовой кислоты
Продукт, полученный на предыдущей стадии, обрабатывают 4 М раствором HCl в 1,4-диоксане (0,92 мл) и НСl (0,28 мл) и реакционную смесь перемешивают при комнатной температуре в течение 1 час, концентрируют и упаривают с этилацетатом (2 х), получая три-HCl соль указанного в названии промежуточного соединения (38,5 мг, выход 23%). (m/z): [M+H]+ вычислено для C39H44ClF3N8O6 813,30; найдено 813,3.
Препаративный пример 29: (S)-метоксикарбониламино-(тетрагидропиран-4-ил)уксусная кислота
Раствор (S)-амино(тетрагидропиран-4-ил)уксусной кислоты (200 мг, 1,26 ммоль) в насыщенном водном растворе бикарбоната натрия (2,46 мл, 25,13 ммоль) перемешивают до тех пор, пока все твердые вещества не растворятся. Добавляют по каплям метилхлорформиат (0,19 мл, 2,51 ммоль) и реакционную смесь перемешивают в течение 30 мин, а затем добавляют НСl, чтобы довести рН до 1. Экстрагируют реакционную смесь этилацетатом (3×5 мл) и органические экстракты сушат над сульфатом натрия, отфильтровывают, концентрируют и оставляют сушиться в вакууме на ночь, получая указанное в названии промежуточное соединение (248 мг, выход 91%) в виде белого липкого твердого вещества. (m/z): [M+H]+ вычислено для C9H15NO5 218,10; найдено 218,1.
Препаративный пример 30: N-(4-бром-2-хлор-5-трифторметоксифенил)-6-[(R)-4-(2,2-диметилпропионил)-2-метилпиперазин-1-ил]никотинамид
(a) N-(4-бром-2-хлор-5-трифторметоксифенил)-6-((R)-2-метилпиперазин-1-ил)никотинамид
Раствор трет-бутилового эфира (R)-4-[5-(4-бром-2-хлор-5-трифторметоксифенилкарбамоил)пиридин-2-ил]-3-метилпиперазин-1-карбоновой кислоты (600 мг, 1,01 ммоль) и 4 М НСl в 1,4-диоксане (5,05 мл) и НСl (1,55 мл) перемешивают при комнатной температуре в течение 1 час, концентрируют и упаривают с этилацетатом (2 х), получая ди-HCl соль указанного в названии промежуточного соединения (625,5 мг). (m/z): [M+H]+ вычислено для C18H17BrClF3N4O2 493,02; 495,02; найдено 494,9.
(b) N-(4-бром-2-хлор-5-трифторметоксифенил)-6-[(R)-4-(2,2-диметилпропионил)-2-метилпиперазин-1-ил]никотинамид
Твердое вещество, полученное на предыдущей стадии, растворяют в DMA (6,58 мл), добавляют DIPEA (0,88 мл, 5,05 ммоль), а затем добавляют 2,2-диметилпропаноилхлорид (130,53 мкл, 1,06 ммоль) и реакционную смесь перемешивают при комнатной температуре в течение 1 час. Реакционную смесь концентрируют на роторном испарителе, получая масло желтого цвета, которое растворяют в небольшом количестве DCM и очищают хроматографией на силикагеле (колонка 24 г, 0-40% этилацетат:гексан), получая указанное в названии промежуточное соединение (552 мг, выход 94%) в виде твердого вещества белого цвета. (m/z): [M+H]+ вычислено для C23H25BrClF3N4O3 577,08; 579,08; найдено 579,0.
Препаративный пример 31: N-{5-хлор-4'-[2-((2S,4S)-4-метилпирролидин-2-ил)-1H-имидазол-4-ил]-2-трифторметоксибифенил-4-ил}-6-[(R)-4-(2,2-диметилпропионил)-2-метилпиперазин-1-ил]никотинамид
(а) трет-бутиловый эфир (2S,4S)-4-метил-2-{4-(4-(4,4,5,5-тетраметил-[1.3.2]диоксаборолан-2-ил)фенил]-1H-имидазол-2-ил}пирролидин-1-карбоновой кислоты
К раствору трет-бутилового эфира (2S,4S)-2-[4-(4-бромфенил)-1H-имидазол-2-ил]-4-метилпирролидин-1-карбоновой кислоты (1,0 г, 2,5 ммоль) и бис(пинаколато)диборона (656 мг, 2,58 ммоль) и ацетата калия (362 мг, 3,69 ммоль) добавляют дегазированный толуол (5,77 мл). Реакционную смесь продувают азотом в течение 15 мин, добавляют комплекс 1,1'-бис(дифенилфосфино)ферроцен-палладия(II) дихлорида и дихлорметана (60,3 мг, 0,074 ммоль) и реакционную смесь перемешивают, продувают азотом и нагревают до 90°C в течение 3 час, получая указанное в названии промежуточное соединение.
(b) трет-бутиловый эфир (2S,4S)-2-{4-[5'-хлор-4'-({6-[(R)-4-(2,2-диметилпропионил)-2-метилпиперазин-1-ил]пиридин-3-карбонил}амино)-2'-трифторметоксибифенил-4-ил]-1H-имидазол-2-ил}-4-метилпирролидин-1-карбоновой кислоты
К реакционной смеси, полученной на предыдущей стадии, добавляют дегазированную воду (2,75 мл) и карбонат калия (1,87 г, 13,54 ммол), а затем добавляют N-(4-бром-2-хлор-5-трифторметоксифенил)-6-[(R)-4-(2,2-диметилпропионил)-2-метилпиперазин-1-ил]никотинамид (1,49 г, 2,58 ммоль; препаративный пример 30). Реакционную смесь продувают азотом, добавляют Pd(dppf)Cl2·CH2Cl2 (30,2 мг, 0,037 ммоль) и смесь вновь продувают, оставляют на ночь нагреваться до 95°С, охлаждают до комнатной температуры, разбавляют с помощью EtOAc, фильтруют через комбинированный слой целита и силикагеля, промывают несколько раз с помощью EtOAc, промывают водой и насыщенным раствором соли, получая твердое вещество темного цвета. Остаток очищают хроматографией на силикагеле (колонка 40 г, от 40% до 100% EtOAc/гексан) и получают указанное в названии промежуточное соединение (890 мг, выход 44%) в виде твердого вещества желтого цвета (m/z): [M+H]+ вычислено для C42H49ClF3N7O5 824,34; найдено 824,3
(c) N-{5-хлор-4'-[2-((2S,4S)-4-метилпирролидин-2-ил)-1H-имидазол-4-ил]-2-трифторметоксибифенил-4-ил}-6-[(R)-4-(2,2-диметилпропионил)-2-метилпиперазин-1-ил]никотинамид
Твердое вещество, полученное на предыдущей стадии, обрабатывают 4 М раствором HCl в 1,4-диоксане (12,3 мл) и НСl (3,8 мл) и реакционную смесь перемешивают при комнатной температуре в течение 1 час, концентрируют и упаривают с этилацетатом (2 х), получая три-HCl соль указанного в названии промежуточного соединения (913 мг, выход 44%). (m/z): [M+H]+ вычислено для C37H41ClF3N7O3 724,29; найдено 724,3.
Препаративный пример 32: N-{5-хлор-4'-[2-((2S,4S)-4-метоксипирролидин-2-ил)-1H-имидазол-4-ил]-2-трифторметоксибифенил-4-ил}-6-[(R)-4-(2,2-диметилпропионил)-2-метилпиперазин-1-ил]никотинамид
По методике, аналогичной приведенной в препаративном примере 31 в масштабе 0,71 ммоль, взяв на стадии (a) трет-бутиловый эфир (2S,4S)-2-[4-(4-бромфенил)-1H-имидазол-2-ил]-4-метоксипирролидин-1-карбоновой кислоты вместо трет-бутилового эфира (2S,4S)-2-[4-(4-бромфенил)-1H-имидазол-2-ил]-4-метилпирролидин-1-карбоновой кислоты, получают три-HCl соль указанного в названии промежуточного соединения (146 мг, выход 24%). (m/z): [M+H]+ вычислено для C37H41ClF3N7O4 740,29; найдено 740,2.
Препаративный пример 33: N-(4-бром-2-хлор-5-трифторметоксифенил)-6-[(R)-4-(3-гидрокси-2,2-диметилпропионил)-2-метилпиперазин-1-ил]никотинамид
(a) N-(4-бром-2-хлор-5-трифторметоксифенил)-6-((R)-2-метилпиперазин-1-ил)никотинамид
Трет-бутиловый эфир (R)-4-[5-(4-бром-2-хлор-5-трифторметоксифенилкарбамоил)пиридин-2-ил]-3-метилпиперазин-1-карбоновой кислоты (500 мг, 0,84 ммоль) обрабатывают 4 М раствором НСl в 1,4-диоксане (4,2 мл) и НСl (1,3 мл) и перемешивают при комнатной температуре в течение 1 час. Реакционную смесь концентрируют, а остаток растворяют в этилацетате и совместно упаривают с этилацетатом (2 х), получая ди-HCl соль указанного в названии промежуточного соединения в виде твердого вещества желтого цвета. (m/z): [M+H]+ вычислено для C18H17BrClF3N4O2 493,02; 495,02; найдено 494,9.
(b) N-(4-бром-2-хлор-5-трифторметоксифенил)-6-[(R)-4-(3-гидрокси-2,2-диметилпропионил)-2-метилпиперазин-1-ил]никотинамид
К раствору 2,2-диметил-3-гидроксипропионовой кислоты (119 мг, 1,01 ммоль) в ДМФА (4,6 мл, 58,9 ммоль) добавляют HATU (384 мг, 1,0 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 15 мин, добавляют продукт, полученный на предыдущей стадии (534 мг), а затем добавляют DIPEA (0,73 мл, 4,2 ммоль) и смесь перемешивают при комнатной температуре в течение 3 час, затем концентрируют на роторном испарителе, получая масло желто-оранжевого цвета, которое растворяют в небольшом количестве DCM и очищают хроматографией на двуокиси кремния (колонка 24 г, 0-80% этилацетат:гексан), получая указанное в названии промежуточное соединение (495 мг) в виде белого твердого вещества (m/z): [M+H]+ вычислено для C23H25BrClF3N4O4 593,07; 595,07; найдено 595,4.
Препаративный пример 34: N-{5-хлор-4'-[2-((2S,4S)-4-метоксипирролидин-2-ил)-1H-имидазол-4-ил]-2-трифторметоксибифенил-4-ил}-6-[(R)-4-(3-гидрокси-2,2-диметилпропионил)-2-метилпиперазин-1-ил]никотинамид
(a) трет-бутиловый эфир (2S,4S)-4-метокси-2-{4-[4-(4,4,5,5-тетраметил-[1.3.2]диоксаборолан-2-ил)фенил]-1H-имидазол-2-ил}пирролидин-1-карбоновой кислоты
К раствору трет-бутилового эфира (2S,4S)-2-[5-(4-бромфенил)-1H-имидазол-2-ил]-4-метоксипирролидин-1-карбоновой кислоты (335 мг, 0,79 ммоль), бис(пинаколато)диборона (212 мг, 0,83 ммоль) и ацетата калия (117 мг, 1,19 ммоль) добавляют дегазированный толуол (1,86 мл). Полученную смесь продувают азотом в течение 15 мин, добавляют Pd(dppf)Cl2·CH2Cl2 (19,4 мг, 0,024 ммоль) и реакционную смесь перемешивают, продувают азотом и нагревают до 90°С в течение 4 час, получая указанное в названии промежуточное соединение. (m/z): [M+H]+ вычислено для C25H36BN3O5 470,27; найдено 470,1.
(b) трет-бутиловый эфир (2S,4S)-2-{4-[5'-хлор-4'-({6-[(R)-4-(3-гидрокси-2,2-диметилпропионил)-2-метилпиперазин-1-ил]пиридин-3-карбонил}амино)-2'-трифторметоксибифенил-4-ил]-1H-имидазол-2-ил}-4-метоксипирролидин-1-карбоновой кислоты
К реакционной смеси, полученной на предыдущей стадии добавляют дегазированную воду (0,89 мл), карбонат калия (603 мг, 4,36 ммоль) и N-(4-бром-2-хлор-5-трифторметоксифенил)-6-[(R)-4-(3-гидрокси-2,2-диметилпропионил)-2-метилпиперазин-1-ил]никотинамид (495 мг, 0,84 ммоль; препаративный пример 33). Реакционную смесь продувают азотом, добавляют Pd(dppf)Cl2·CH2Cl2 (9,72 мг, 0,012 ммоль); смесь вновь продувают азотом и нагревают до 95°С в течение ночи, охлаждают до комнатной температуры, разбавляют этилацетатом, фильтруют через комбинированный слой Celite® и силикагеля, промывают несколько раз с помощью EtOAc, водой и насыщенным раствором соли, получая масло темного цвета. Остаток очищают хроматографией на силикагеле (24 г силикагеля, от 40% до 100% EtOAc/гексан, 5-25 мин, затем 0-10% метанол:EtOAc 10-30 мин), получая указанное в названии промежуточное соединение (211 мг, выход 31%) в виде твердого вещества желтого цвета. (m/z): [M+H]+ вычислено для C42H49ClF3N7O7 856,33; найдено 856,2.
(c) N-{5-хлор-4'-[2-((2S,4S)-4-метоксипирролидин-2-ил)-1H-имидазол-4-ил]-2-трифторметоксибифенил-4-ил}-6-[(R)-4-(3-гидрокси-2,2-диметилпропионил)-2-метилпиперазин-1-ил]никотинамид
Твердое вещество, полученное на предыдущей стадии (211 мг), обрабатывают 4 М раствором HСl в 1,4-диоксане (4,0 мл) и НСl (1,2 мл) и реакционную смесь перемешивают при комнатной температуре в течение 1 час, концентрируют, упаривают с этилацетатом (2 х) и получают три-HCl соль указанного в названии промежуточного соединения (230 мг, выход 33%). (m/z): [M+H]+ вычислено для C37H41ClF3N7O5 756,283; найдено 756,2.
Препаративный пример 35: 4'-{2-[(2S,4S)-4-метансульфинил-1-((S)-2-метоксикарбониламино-3-метилбутирил)пирролидин-2-ил]-1H-имидазол-4-ил}-2-трифторметоксибифенил-4-карбоновая кислота
(a) метиловый эфир 4'-{2-[(2S,4S)-1-((S)-2-метоксикарбониламино-3-метилбутирил)-4-метилсульфанилпирролидин-2-ил]-1H-имидазол-4-ил}-2-трифторметоксибифенил-4-карбоновой кислоты
К смеси метилового эфира 4-бром-3-трифторметоксибензойной кислоты (184 мг, 0,62 ммоль), метилового эфира [(S)-2-метил-1-((2S,4S)-4-метилсульфанил-2-{4-[4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-1H-имидазол-2-ил}пирролидин-1-карбонил)-пропил]карбаминовой кислоты (300 мг, 0,55 ммоль) и карбоната калия (344 мг, 2,49 ммоль) при комнатной температуре добавляют толуол (1,35 мл), а затем воду (0,69 мл). Реакционную смесь продувают азотом и добавляют в атмосфере азота Pd(dppf)Cl2·CΗ2Cl2 (27,4 мг, 0,034 ммоль). Реакционный сосуд герметично закрывают и оставляют нагреваться на ночь при температуре 100°С; охлаждают до комнатной температуры и распределяют между EtOAc (10 мл) и водой (2 мл). Органический слой сушат над сульфатом натрия, фильтруют и концентрируют, получая масло коричневого цвета, которое очищают хроматографией на силикагеле (12 г силикагеля, 0-100% EtOAc/гексан). Требуемые фракции объединяют и концентрируют, получая указанное в названии промежуточное соединение в виде масла оранжевого цвета. (m/z): [M+H]+ вычислено для C30H33F3N4O6S 635,21; найдено 635.
(b) 4'-{2-[(2S,4S)-4-метансульфинил-1-((S)-2-метоксикарбониламино-3-метилбутирил)-пирролидин-2-ил]-1H-имидазол-4-ил}-2-трифторметоксибифенил-4-карбоновая кислота
Маслянистый остаток, полученный на предыдущей стадии, растворяют в смеси ACN (0,29 мл) и DMA (0,03 мл) и обрабатывают N-хлорсукцинимидом (74 мг, 0,55 ммоль) при 65°С в течение 1 час. Реакционную смесь охлаждают до комнатной температуры, обрабатывают насыщенным раствором бикарбоната натрия (3 мл) и экстрагируют с помощью EtOAc (5 мл). Органический слой концентрируют, растворяют в смеси метанола (2 мл) и воды (0,5 мл) и обрабатывают моногидратом гидроксида лития (139 мг, 3,32 ммоль) при 65°С в течение 1 час, охлаждают до комнатной температуры, концентрируют, растворяют в смеси 1:1 уксусная кислота:вода (6 мл) и очищают методом ВЭЖХ с обращенной фазой. Требуемые фракции объединяют и сушат вымораживанием, получая TFA соль указанного в названии промежуточного соединение (117 мг, выход 28%) в виде белого твердого вещества. (m/z): [M+H]+ вычислено для C29H31F3N4O7S 637,19; найдено 637.
Препаративный пример 36: 4'-{2-[(2S,4S)-4-Метансульфонил-1-((S)-2-метоксикарбониламино-3-метилбутирил)пирролидин-2-ил]-1H-имидазол-4-ил}-2-трифторметоксибифенил-4-карбоновая кислота
Пероксимоносульфат калий (66 мг, 0,11 ммоль) добавляют к раствору TFA соли 4'-{2-[(2S,4S)-4-метансульфинил-1-((S)-2-метоксикарбониламино-3-метилбутирил)-пирролидин-2-ил]-1H-имидазол-4-ил}-2-трифторметоксибифенил-4-карбоновой кислоты (67 мг, 0,09 ммоль; препаративный пример 35) в метаноле (5 мл) и воде (1 мл). Реакционную смесь перемешивают при комнатной температуре в течение 2 час, отфильтровывают, концентрируют, растворяют в смеси 1:1 уксусная кислота:вода (5 мл), фильтруют и очищают методом ВЭЖХ с обращенной фазой. Требуемые фракции объединяют и сушат вымораживанием, получая TFA соль указанного в названии промежуточного соединения (55 мг, выход 80%). (m/z): [M+H]+ вычислено для C29H31F3N4O8S 653,18; найдено 653,2.
Препаративный пример 37: метиловый эфир ((S)-1-{(2S,4S)-2-[4-(4-бромфенил)-1H-имидазол-2-ил]-4-морфолин-4-илпирролидин-1-карбонил}-2-метилпропил)карбаминовой кислоты
(a) 1-трет-бутиловый эфир 2-метиловый эфир (2S,4R)-4-(толуол-4-сульфонилокси)пирролидин-1,2-дикарбоновой кислоты
К раствору метил (2S,4R)-N-трет-бутоксикарбонил-4-гидрокси-2-пирролидинкарбоксилата (4,68 г, 19,1 ммоль) в DCM (47 мл) при комнатной температуре добавляют DIPEA (3,66 мл, 21,0 ммоль) и 4-диметиламинопиридин (233 мг, 1,91 ммоль), а затем добавляют п-толуолсульфонилхлорид (3,82 г, 20,1 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи, промывают 1Ν раствором HCl (2 мл), насыщенным раствором бикарбоната натрия (2 мл) и насыщенным раствором соли (2 мл), сушат над сульфатом натрия, отфильтровывают и концентрируют, получая желтоватое масло, которое очищают хроматографией на силикагеле (80 г оксида кремния, 0-100% EtOAc/гексан). Требуемые фракции объединяют и концентрируют, получая указанное в названии промежуточное соединение (1,74 г, выход 23%) в виде бесцветного масла.
(b) 1-трет-бутиловый эфир 2-метиловый эфир (2S,4S)-4-морфолин-4-ил-пирролидин-1,2-дикарбоновой кислоты
Смесь продукта, полученного на предыдущей стадии (908 мг, 2,27 ммоль), и морфолина (3,96 мл, 45,46 ммоль) нагревают до 70°С в течение ночи, концентрируют на роторном испарителе, остаток растворяют в воде (3 мл) и экстрагируют с помощью EtOAc (3×2 мл). Водный слой насыщают солью и добавляют 1Ν водный раствор NaOH (1 мл). Водную фазу экстрагируют с помощью EtOAc (3 мл). Органические слои объединяют, сушат над сульфатом натрия, фильтруют и концентрируют, получая указанное в названии промежуточное соединение в виде бесцветного масла. (m/z): [M+H]+, вычислено для C15H26N2O5 315,18; найдено 315.
(c) 1-трет-бутиловый эфир (2S,4S)-4-морфолин-4-илпирролидин-1,2-дикарбоновой кислоты
Продукт, полученный на предыдущей стадии, растворяют в метаноле (3 мл) и воде (1 мл) при комнатной температуре и обрабатывают моногидратом гидроксида лития (191 мг, 4,55 ммоль) в течение 30 мин. Реакционную смесь концентрируют, добавляют EtOAc (3 мл) и подкисляют до рН~6 с помощью 2N раствора HCl. Водный слой сушат вымораживанием и получают указанное в названии промежуточное соединение в виде пенообразного вещества светло-коричневого цвета. (m/z): [M+H]+ вычислено для С14H24N2O5 301,17; найдено 301.
(d) 2-[2-(4-бромфенил)-2-оксоэтиловый] эфир 1-трет-бутиловый эфир (2S,4S)-4-морфолин-4-илпирролидин-1,2-дикарбоновой кислоты
К пенообразному веществу, полученному на предыдущей стадии, добавляют DCM (11,7 мл, 181,8 ммоль) и DIPEA (0,32 мл, 1,82 ммоль), а затем добавляют п-бромфенацилбромид (505 мг, 1,82 ммоль). Полученную смесь нагревают до 35°С в течение 1 час и концентрируют, получая указанное в названии соединение в виде и желтоватого твердого вещества. (m/z): [M+H]+ вычислено для C22H29BrN2O6 497,12; 499,12; найдено 499.
(e) трет-бутиловый эфир (2S,4S)-2-[4-(4-бромфенил)-1Н-имидазол-2-ил]-4-морфолин-4-илпирролидин-1-карбоновой кислоты
Твердое вещество, полученное на предыдущей стадии, смешивают с ацетатом аммония (2,80 г, 36,36 ммоль) и DIPEA (0,48 мл, 2,73 ммоль) в толуоле (55 мл) и реакционную смесь нагревают до 110°С в течение ночи, охлаждают до комнатной температуры и концентрируют. Полученный остаток очищают хроматографией на силикагеле (12 г силикагеля, 0-100% EtOAc/гексан). Требуемые фракции объединяют и концентрируют, получая указанное в названии промежуточное соединение (133 мг, выход 15% по стадиям с (b) по (e)) в виде пенообразного вещества коричневатого цвета. (m/z): [M+H]+ вычислено для C22H29BrN4O3 477,14; 479,14; найдено 477.
(f) метиловый эфир ((S)-1-{(2S,4S)-2-[4-(4-бромфенил)-1H-имидазол-2-ил]-4-морфолин-4-илпирролидин-1-карбонил}-2-метилпропил)карбаминовой кислоты
Продукт, полученный на предыдущей стадии (133 мг, 0,28 ммоль), обрабатывают 4 М раствором HCl в 1,4-диоксане (2 мл) при комнатной температуре в течение 30 мин. Реакционную смесь концентрируют и упаривают вместе с EtOAc (3×2 мл), получая пенообразное вещество коричневатого цвета. Пенообразное вещество растворяют в ДМФА (2,5 мл) и обрабатывают (S)-2-метоксикарбониламино-3-метилбутановой кислотой (49 мг, 0,28 ммоль) и HATU (106 мг, 0,28 ммоль) при комнатной температуре в течение уикенда. Реакционную смесь разбавляют этилацетатом (5 мл) и промывают водой (2 мл). Органический слой сушат над сульфатом натрия, отфильтровывают и концентрируют, получая коричневого масла, которое очищают хроматографией на силикагеле (4 г силикагеля, 0-100% EtOAc/гексан, затем 10% MeOH/EtOAc (3% Et3N в метаноле)). Требуемые фракции объединяют, концентрируют и получают указанное в названии промежуточное соединение (57 мг, выход 38%) в виде желтоватого масла. (m/z): [M+H]+ вычислено для C24H32BrN5O4 534,16; 536,16; найдено 534.
Препаративный пример 38: 1-трет-бутиловый эфир (2S,4S)-4-цианопирролидин-1,2-дикарбоновой кислоты
(a) 1-трет-бутиловый эфир 2-метиловый эфир (2S,4R)-4-гидроксипирролидин-1,2-дикарбоновой кислоты
К раствору НСl соли метилового эфира (2S,4R)-4-гидроксипирролидин-2-карбоновой кислоты (10 г, 55,1 ммоль) в DCM (100 мл) добавляют триэтиламин (16,73 г, 165,3 ммоль) и ди-трет-бутилдикарбонат (14,41 г, 66,1 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи, концентрируют и очищают колоночной хроматографией (3:1 петролейный эфир:EtOAc), получая указанное в названии промежуточное соединение (12 г, выход 89%). Спектр 1H-ЯМР (400 МГц, CDCl3): δ (м.д.) 4,48 (м, 1H), 4,38 (м, 1H), 3,72 (с, 3H), 3,63 (м, 1 H), 3,45 (м, 1H), 2,29 (м, 1 H), 2,06 (м, 2 H), 1,39 (с, 9H).
(b) 1-трет-бутиловый эфир 2-метиловый эфир (2S,4R)-4-метансульфонилоксипирролидин-1,2-дикарбоновой кислоты
Продукт, полученный на предыдущей стадии (12 г, 48,9 ммоль), растворяют в сухом DCM (100 мл), добавляют триэтиламин (14,87 г, 147 ммоль) на бане со льдом, а затем по каплям добавляют метансульфонилхлорид (6,72 г, 58,7 ммоль). Реакционную смесь перемешивают при 0°С в течение 1 час, выливают в воду со льдом и экстрагируют с помощью DCM (3 ×). Органические слои объединяют, промывают раствором NaHCO3, водой и насыщенным раствором соли, сушат над Na2SO4 и концентрируют, получая указанное в названии промежуточное соединение (15 г). (m/z): [M+H-100]+ вычислено для C12H21NO7S 224,10; найдено 224.
(c) 1-трет-бутиловый эфир 2-метиловый эфир (2S,4S)-4-цианопирролидин-1,2-дикарбоновой кислоты
Смесь продукта, полученного на предыдущей стадии (15 г, 46,4 ммоль), и цианида натрия (22,74 г, 464 ммоль) перемешивают в ДМСО (200 мл), нагревают до 55°С в течение 3 дней в атмосфере азота, охлаждают до комнатной температуры и выливают в воду со льдом. Смесь экстрагируют этилацетатом (3 х), органические экстракты объединяют, промывают три раза водой и насыщенным раствором соли, сушат над Na2SO4 и концентрируют. Остаток очищают колоночной хроматографией (3:1 петролейный эфир:EtOAc) и получают указанное в названии промежуточное соединение (3 г, выход 25%). Спектр 1H-ЯМР (400 МГц, CDCl3): δ (м.д.) 4,38 (м, 1H), 3,93 (м, 1H), 3,73 (с, 3H), 3,65 (м, 1H), 3,08 (м, 1H), 2,24-2,70 (м, 2 H), 1,45 (м, 9H).
(d) 1-трет-бутиловый эфир (2S,4S)-4-цианопирролидин-1,2-дикарбоновой кислоты
К раствору продукта, полученного на предыдущей стадии (3 г, 11,8 ммоль), в метаноле (50 мл) добавляют 4 М водный раствор NaOH (5,9 мл). Смесь перемешивают в атмосфере азота при комнатной температуре в течение ночи и концентрируют. Доводят рН остатка до величины 2 с помощью 1 М раствора НСl, и водный раствор экстрагируют с помощью DCM (3×50 мл). Органические фазы объединяют, промывают насыщенным раствором соли, сушат над Na2SO4, фильтруют и концентрируют, получая указанное в названии промежуточное соединение (2 г). Спектр 1H ЯМР (400 МГц, CDCl3): δ (м.д.) 9,45 (уш., 1H), 4,33-4,52 (м, 1H), 3,59-3,98 (м, 2H), 3,13-3,30 (м, 1H), 2,36-2,74 (м, 2H), 1,49 (м, 9H).
Препаративный пример 39: (3S,5S)-5-[4-(4-бромфенил)-1H-имидазол-2-ил]пирролидин-3-карбонитрил
(a) 2-[2-(4-бромфенил)-2-оксоэтиловый] эфир 1-трет-бутиловый эфир (2S,4S)-4-цианопирролидин-1,2-дикарбоновой кислоты
К раствору соединения из препаративного примера 38 (2 г, 8,3 ммоль) в ацетонитриле (50 мл) добавляют DIPEA (3,22 г, 25,0 ммоль) и 2-бром-1-(4-бромфенил)этанон (2,31 г, 8,3 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи в атмосфере азота. Реакционную смесь концентрируют и остаток растворяют в EtOAc (30 мл) и воде (30 мл). Водный слой экстрагируют с помощью EtOAc (2×30 мл). Объединенные органические слои промывают водой и насыщенным раствором соли, сушат над Na2SO4, отфильтровывают, концентрируют и очищают колоночной хроматографией (10-30% EtOAc в петролейном эфире), получая указанное в названии промежуточное соединение (900 мг, выход 25%). (m/z): [M+H-100]+ вычислено для C19H21BrN2O6 337,06; 339,06; найдено 339.
(b) трет-бутиловый эфир (2S,4S)-2-[4-(4-бромфенил)-1H-имидазол-2-ил]-4-цианопирролидин-1-карбоновой кислоты
К раствору продукта, полученного на предыдущей стадии (900 мг, 2,1 ммоль), в толуоле (30 мл) добавляют ацетат аммония (3,21 г, 41,2 ммоль). Реакционную смесь в атмосфере азота кипятят с обратным холодильником в течение 1,5 час. Смесь концентрируют, а остаток растворяют в EtOAc (50 мл) и воде (50 мл). Водный слой экстрагируют этилацетатом (2×50 мл). Органические слои объединяют, сушат над Na2SO4, фильтруют, концентрируют и очищают колоночной хроматографией (10-50% EtOAc в петролейном эфире), получая указанное в названии промежуточное соединение (400 мг, выход 46%). (m/z): [M+H]+ вычислено для C19H21BrN4O2 417,09; 419,09; найдено 417.
(c) (3S,5S)-5-[4-(4-бромфенил)-1H-имидазол-2-ил]пирролидин-3-карбонитрил
Продукт, полученный на предыдущей стадии (400 мг, 0,96 ммоль), растворяют в смеси HCl/диоксан (10 мл) и перемешивают при комнатной температуре в течение 1 час. Реакционную смесь концентрируют и получают НСl соль указанного в названии промежуточного соединения (340 мг). (m/z): [M+H]+ вычислено для C19H21BrN4O2 317,03; 319,03; найдено 317, 319.
Препаративный пример 40: метиловый эфир [(S)-1-((2S,4S)-4-циано-2-{4-[4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]-1H-имидазол-2-ил}-пирролидин-1-карбонил)-2-метилпропил]карбаминовой кислоты
(a) метиловый эфир ((S)-1-{(2S,4S)-2-[4-(4-бромфенил)-1Н-имидазол-2-ил]-4-цианопирролидин-1-карбонил}-2-метилпропил)карбаминовой кислоты
Продукт из препаративного примера 39 (340 мг, 0,96 ммоль) растворяют в DCM (20 мл) и DIPEA (620 мг, 4,80 ммоль), а затем добавляют 2-метоксикарбониламино-3-метилмасляную кислоту (168 мг, 0,96 ммоль) и HATU (365 мг, 0,96 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 1 час в атмосфере азота, разбавляют с помощью DCM, промывают водным раствором бикарбоната, водой (30 мл) и насыщенным раствором соли (30 мл), сушат над Na2SO4, фильтруют, концентрируют и очищают колоночной хроматографией (30-100% EtOAc в петролейном эфире), получая указанное в названии промежуточное соединение (350 мг, выход 77%). (m/z): [M+H]+ вычислено для C21H24BrN5O3 474,11; 476,11; найдено 474, 476.
(b) метиловый эфир [(S)-1-((2S,4S)-4-циано-2-{4-[4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]-1H-имидазол-2-ил}-пирролидин-1-карбонил)-2-метилпропил]карбаминовой кислоты
К раствору метилового эфира ((S)-1-{(2S,4S)-2-[4-(4-бромфенил)-1H-имидазол-2-ил]-4-цианопирролидин-1-карбонил}-2-метилпропил)карбаминовой кислоты (450 мг, 0,95 ммоль), бис(пинаколато)диборона (362 мг, 1,42 ммоль) и ацетата калия (186 мг, 1,90 ммоль) в диоксане (20 мл) добавляют Pd(dppf)Cl2-CH2Cl2 (78 мг, 0,095 ммоль) и смесь дегазируют азотом и кипятят с обратным холодильником в течение ночи в атмосфере азота. Охлажденную смесь фильтруют через Celite® и промывают с помощью EtOAc. Фильтрат промывают водой и насыщенным раствором соли, сушат над Na2SO4, отфильтровывают, концентрируют и очищают колоночной хроматографией (20-100% EtOAc в петролейном эфире), получая указанное в названии промежуточное соединение (320 мг, выход 65%). (m/z): [M+H]+ вычислено для C27H36BN5O5 522,28; найдено 522. Спектр 1H ЯМР (400 МГц, MeOD): δ (м.д.) 7,72 (м, 2H), 7,64 (м, 2H), 7,36 (с, 1H), 5,14 (м, 1H), 4,60 (м, 1H), 4,11 (м, 1H), 3,99 (м, 1H), 3,63 (с, 3H), 3,45 (м, 1H), 2,85 (м, 1H), 2,52 (м, 1H), 2,00 (м, 1H), 1,34 (с, 12H), 0,84 (м, 6H).
Препаративный пример 41: 1-трет-бутиловый эфир (2S,5S)-5-метилпирролидин-1,2-дикарбоновой кислоты
(a) этиловый эфир (S)-2-трет-бутоксикарбониламино-5-оксогексановой кислоты
Раствор 1-трет-бутилового эфира 2-этилового эфира (S)-5-оксопирролидин-1,2-дикарбоновой кислоты (20 г, 10 ммоль) в сухом ТГФ (150 мл) охлаждают до минус 50°C, а затем в течение 30 мин по каплям добавляют метилмагнийбромид (31 мл, 93,28 ммоль), поддерживая температуру в диапазоне от минус 50 до минус 44°С. Реакционную смесь перемешивают при минус 43°С в течение 2 час и помещают на ночь в морозильную камеру (с температурой приблизительно минус 20°C). Смесь гасят насыщенным раствором NH4Cl и экстрагируют с помощью EtOAc. Объединенные органические слои сушат над Na2SO4, фильтруют, концентрируют при пониженном давлении и получают сырой продукт, который очищают колоночной хроматографией (8:1-3:1 петролейный эфир:EtOAc) и получают указанное в названии промежуточное соединение (38 г) в виде масла светло-желтого цвета. Спектр 1H ЯМР (400 МГц, CDCl3): δ (м.д.) 5,11-5,09 (м, 1H), 4,25-4,24 (м, 1H), 4,19 (кв, J=7,2 Гц, 2H), 2,63-2,52 (м, 2H), 2,15 (с, 3H), 2,12-2,08 (м, 1H), 1,92-1,82 (м, 1H), 1,44 (с, 9H), 1,28 (т, J = 7,2 Гц, 3H).
(b) этиловый эфир (S)-5-метил-3,4-дигидро-2Н-пиррол-2-карбоновой кислоты
К раствору продукта, полученного на предыдущей стадии (5 г, 18,29 ммоль), в сухом DCM (10 мл) добавляют TFA (7,5 мл) и реакционную смесь перемешивают в течение 3 час при комнатной температуре. Смесь концентрируют и получают указанное в названии промежуточное соединение (7 г). Спектр 1H ЯМР (400 МГц, CDCl3): δ (м.д.) 5,14-5,09 (м, 1H), 4,29-4,25 (м, 2H), 3,21-3,17 (м, 2H), 2,77-2,69 (м, 1H), 2,62 (с, 3H), 2,49-2,41 (м, 1H), 1,32-1,29 (м, 3H).
(c) 1-трет-бутиловый эфир 2-этиловый эфир (2S,5S)-5-метилпирролидин-1,2-дикарбоновой кислоты
Продукт, полученный на предыдущей стадии (4 г), растворяют в этаноле (40 мл) и добавляют 10% Pd/C (400 мг). Реакционную смесь оставляют перемешиваться на ночь при температуре 35°С в атмосфере водорода с давлением 55 фунтов на квадратный дюйм. После фильтрования фильтрат концентрируют при пониженном давлении и получают 2,62 г сырого продукта, который добавляют к смеси триэтиламина (4,6 мл) и 4-диметиламинопиридина (DMAP) (102 мг, 0,83 ммоль) в сухом DCM (10 мл). Затем добавляют ди-трет-бутилдикарбонат (4 г, 18,33 ммоль) и реакционную смесь перемешивают при комнатной температуре в течение ночи. Реакционную смесь промывают 1 N раствором НСl и насыщенным раствором соли. Органический слой сушат над Na2SO4, отфильтровывают и концентрируют при пониженном давлении, получая остаток, который очищают колоночной хроматографией (8:1-3:1 петролейный эфир:EtOAc) и получают указанное в названии промежуточное соединение (2 г) в виде бесцветного масла. Спектр 1H ЯМР (400 МГц, CDCl3): δ (м.д.) 4,53-4,50 (м, 1H), 4,30 (кв, J = 7,2 Гц, 1H), 3,93-3,87 (м, 1H), 2,52-2,42 (м, 1H), 2,31-2,19 (м, 2H), 1,71-1,60 (м, 1H), 1,52-1,50 (м, 3H), 1,32 (т, J = 7,2 Гц, 3H).
(d) 1-трет-бутиловый эфир (2S,5S)-5-метилпирролидин-1,2-дикарбоновой кислоты
Смесь продукта, полученного на предыдущей стадии (2 г, 7,77 ммоль), и гидроксида лития (466 мг, 23,3 ммоль) в смеси 3:1 метанол:вода (24 мл) перемешивают при комнатной температуре в течение ночи и концентрируют. Остаток растворяют в воде и экстрагируют с помощью EtOAc (2×20 мл). рН водного слоя доводят до величины 2 с помощью 1N раствора HCl и экстрагируют смесью 3:1 DCM:метанол (3×24 мл), получая указанное в названии промежуточное соединение (1,7 г) в виде белых кристаллов.
Препаративный пример 42: 4-(4-бромфенил)-2-((2S,5S)-5-метилпирролидин-2-ил)-1H-имидазол
(a) 2-[2-(4-бромфенил)-2-оксоэтил]овый эфир 1-трет-бутиловый эфир (2S,5S)-5-метилпирролидин-1,2-дикарбоновой кислоты
Смесь продукта из препаративного примера 41 (1,7 г, 7,41 ммоль), 2-бром-1-(4-бромфенил)этанона (2,08 г, 7,49 ммоль) и DIPEA (2,87 г, 22,23 ммоль) в ACN (50 мл) перемешивают в атмосфере азота при комнатной температуре в течение 2 час. Реакционную смесь концентрируют при пониженном давлении и получают указанное в названии промежуточное соединение (3,16 г).
(b) трет-бутиловый эфир (2S,5S)-2-[4-(4-бромфенил)-1H-имидазол-2-ил]-5-метилпирролидин-1-карбоновой кислоты
Смесь продукта, полученного на предыдущей стадии (3,16 г, 7,41 ммоль), и ацетата аммония (17 г, 222,3 ммоль) в толуоле (50 мл) кипятят с обратным холодильником в атмосфере азота в течение ночи. Реакционную смесь промывают водой и экстрагируют с помощью EtOAc. Органические слои объединяют, сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении, получая остаток, который очищают колоночной хроматографией (10:1-5:1 петролейный эфир:EtOAc), получая указанное в названии промежуточное соединение (3,06 г) в виде твердого вещества.
(c) 4-(4-бромфенил)-2-((2S,5S)-5-метилпирролидин-2-ил)-1H-имидазол
Продукт, полученный на предыдущей стадии (3,06 г, 7,53 ммоль), растворяют в EtOAc (10 мл) и медленно добавляют раствор HCl/диоксан (20 мл). Реакционную смесь перемешивают при комнатной температуре в течение 3 час, концентрируют при пониженном давлении и получают остаток, который распределяют между насыщенным раствором NaHCO3 и DCM. Органические слои объединяют, сушат над Na2SO4, отфильтровывают и концентрируют при пониженном давлении, получая указанное в названии промежуточное соединение (2,5 г) в виде твердого вещества.
Препаративный пример 43: метиловый эфир [(S)-2-метил-1-((2S,5S)-2-метил-5-{4-[4-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)фенил]-1H-имидазол-2-ил}пирролидин-1-карбонил)пропил]карбаминовой кислоты
(a) метиловый эфир ((S)-1-{(2S,5S)-2-[4-(4-бромфенил-1H-имидазол-2-ил]-5-метилпирролидин-1-карбонил}-2-метилпропил)карбаминовой кислоты
Смесь продукта из препаративного примера 42 (2,5 г, 8,16 ммоль), 2-метоксикарбониламино-3-метилмасляной кислоты (1,72 г, 9,79 ммоль), HATU (3,72 г, 9,79 ммоль) и DIPEA (3,16 г, 24,48 ммоль) в DCM (50 мл) перемешивают при комнатной температуре в течение ночи. Реакционную смесь промывают водой и насыщенным раствором соли и экстрагируют с помощью EtOAc. Органические слои объединяют, сушат над Na2SO4, отфильтровывают и концентрируют при пониженном давлении, получая остаток, который очищают колоночной хроматографией (3:1-1:1 петролейный эфир:EtOAc), получая указанное в названии промежуточное соединение (1,5 г, чистота 85%) в виде твердого вещества. Спектр 1H ЯМР (400 МГц, CD3OD): δ (м.д.) 7,73-7,33 (м, 5H), 5,36 (м, 0,5H), 5,10-5,05 (м, 0,5H), 4,75-4,71 (м, 0,5H), 4,23-4,08 (м, 1H), 3,69-3,67 (м, 3H), 2,82-2,80 (м, 0,5H), 2,35-2,33 (м, 0,5H), 2,17-1,91 (м, 4H), 1,5-1,48 (м, 0,5H), 1,27-0,84 (м, 9H).
(b) метиловый эфир [(S)-2-метил-1-((2S,5S)-2-метил-5-{4-[4-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)фенил]-1H-имидазол-2-ил}пирролидин-1-карбонил)пропил]карбаминовой кислоты
Смесь продукта, полученного на предыдущей стадии (1,5 г, 3,24 ммоль), бис(пинаколато)диборона (988 мг, 3,89 ммоль), ацетата калия (954 мг, 9,72 ммоль) и Pd(dppf)Cl2 (150 мг) в диоксане (50 мл) кипятят с обратным холодильником в атмосфере азота в течение 3 час. Реакционную смесь концентрируют при пониженном давлении и получают остаток, который распределяют между водой и EtOAc. Органические слои объединяют, промывают насыщенным раствором соли, сушат над Na2SO4, отфильтровывают и концентрируют при пониженном давлении, получая остаток, который очищают колоночной хроматографией и получают указанное в названии промежуточное соединение (1,1 г). (m/z): [M+H]+ вычислено для C27H39BN4O5 511,3 найдено 511,3. Спектр 1H ЯМР (400 МГц, CDCl3): δ (м.д.) 7,78 (с, 4H), 7,44-7,38 (м, 1H), 5,52-5,45 (м, 1H), 5,3-5,18 (м, 1H), 4,23-4,20 (м, 1H), 3,79-3,68 (м, 3H), 2,39-1,50 (м, 5H), 1,35-1,29 (м, 12H), 1,27-0,78 (м, 9H).
Препаративный пример 44: (R)-5-хлор-4-(6-(2-метил-4-пивалоилпиперазин-1-ил)никотинамидо)-2-(трифторметокси)фенилбороновая кислота
В атмосфере азота смесь N-(4-бром-2-хлор-5-трифторметоксифенил)-6-[(R)-4-(2,2-диметилпропионил)-2-метилпиперазин-1-ил]никотинамида (20,0 г, 34,6 ммоль) и тетрагидрофурана (200 мл) охлаждают до 0°С, а затем добавляют по каплям при 0-10°С 1,3 М раствор комплекса изопропилмагнийхлорида и хлорида лития в тетрагидрофуране (79,9 мл, 104 ммоль). Через 2,5 час добавляют по каплям триметиловый эфир борной кислоты (12,0 мл, 106 ммоль), а затем добавляют 1N раствор НСl (105 мл) и реакционную смесь оставляют перемешиваться на ночь. Реакционную смесь экстрагируют с помощью EtOAc (250 мл); органический слой промывают водой, насыщенным раствором NaHCO3, сушат над MgSO4 и упаривают, получая сырой продукт (22,8 г). К неочищенному продукту добавляют этанол (230 мл), а затем медленно добавляют воду (57,5 мл). Полученную смесь перемешивают в течение 10 дней и отфильтровывают, получая указанное в названии промежуточное соединение в виде кристаллического твердого вещества (10,7 г, выход 57%).
Порошковая рентгеновская дифрактограмма кристаллического образца (R)-5-хлор-4-(6-(2-метил-4-пивалоилпиперазин-1-ил)никотинамидо)-2-(трифторметокси)фенилбороновой кислоты, полученной по описанный выше методике, приведена на фигуре. Дифрактограмму получают на рентгеновском дифрактометре ARL X'Tra, используя линию излучения Cu-Kα (λ=1,54051 Å), с выходным напряжением 45 кВ и величиной тока 40 мА. Образец сканируют в режиме 2θ-2θ от 2° до 40° в 2θ с величиной шага 0,03° и скоростью сканирования 2,0° в минуту. Наблюдаемые положения пиков порошковой рентгеновской дифрактограммы в величинах 2θ и межатомные расстояния приведены в следующей таблице (перечислены лишь пики, имеющие относительную высоту пика (H%) приблизительно 8% или больше).
| 2-тета | d(Å) | Высота | H% |
| 4,77 | 18,51 | 1579 | 100,0 |
| 6,66 | 13,26 | 513 | 32,5 |
| 13,24 | 6,68 | 323 | 20,5 |
| 14,23 | 6,22 | 140 | 8,8 |
| 14,92 | 5,93 | 314 | 19,9 |
| 15,58 | 5,68 | 419 | 26,5 |
| 16,93 | 5,23 | 617 | 39,1 |
| 18,57 | 4,77 | 291 | 18,4 |
| 19,47 | 4,56 | 183 | 11,6 |
| 20,21 | 4,39 | 137 | 8,7 |
| 23,63 | 3,76 | 191 | 12,1 |
| 24,06 | 3,70 | 126 | 8,0 |
| 24,91 | 3,57 | 147 | 9,3 |
| 25,76 | 3,46 | 529 | 33,5 |
| 27,84 | 3,20 | 165 | 10,5 |
| 31,36 | 2,85 | 137 | 8,7 |
Препаративный пример 45: метиловый эфир [(S)-2-{(2S,4S)-2-[4-(4-бромфенил)-1H-имидазол-2-ил]-4-метилпирролидин-1-ил}-2-оксо-1-(тетрагидропиран-4-ил)этил]карбаминовой кислоты
(a) 4-(4-бромфенил)-2-((2S,4S)-4-метилпирролидин-2-ил)-1H-имидазол
Трет-бутиловый эфир (2S,4S)-2-[4-(4-бромфенил)-1H-имидазол-2-ил]-4-метилпирролидин-1-карбоновой кислоты (0,65 г, 1,6 ммоль) обрабатывают 4 М раствором HCl в 1,4-диоксане (4 мл, 20 ммоль) при 50°С в течение 1 час. Реакционную смесь концентрируют и растворяют в этилацетате и упаривают с этилацетатом (2 х), получая HCl соль указанного в названии промежуточного соединения в виде твердого вещества желтого цвета.
(b) метиловый эфир [(S)-2-{(2S,4S)-2-[4-(4-бромфенил)-1H-имидазол-2-ил]-4-метилпирролидин-1-ил}-2-оксо-1-(тетрагидропиран-4-ил)этил]карбаминовой кислоты
Желтое твердое вещество, полученное на предыдущей стадии, растворяют в DMA (3 мл) и добавляют DIPEA (1,4 мл, 8,0 ммоль). Добавляют 0,5 М раствор (S)-метоксикарбониламино(тетрагидропиран-4-ил)уксусной кислоты в DMA (4,0 мл, 2,0 ммоль) и HATU (760 мг, 2,0 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 1 час, растворяют в этилацетате (100 мл) и промывают водой (300 мл). Водный слой экстрагируют этилацетатом (100 мл). Органические слои объединяют, промывают насыщенным раствором соли, сушат над сульфатом натрия, фильтруют, концентрируют и очищают хроматографией на силикагеле (0-100% этилацетат:гексан), получая указанное в названии промежуточное соединение в виде светлого твердого вещества (760 мг, выход 94%). (m/z): [M+H]+ вычислено для C23H29BrN4O4 505,14; 507,14; найдено 506,95.
Препаративный пример 46: метиловый эфир [(S)-2-((2S,4S)-4-метил-2-{4-[4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-1H-имидазол-2-ил}пирролидин-1-ил)-2-оксо-1-(тетрагидропиран-4-ил)этил]-карбаминовой кислоты
Продукт из препаративного примера 45 (760 мг, 1,5 ммоль), бис(пинаколато)диборон (570 мг, 2,2 ммоль) и ацетат калия (220 мг, 2,2 ммоль) смешивают с 1,4-диоксаном (5 мл). Полученную суспензию продувают азотом, а затем добавляют Pd(dppf)Cl2·CH2Cl2 (61 мг, 0,075 ммоль). Реакционную смесь оставляют на ночь нагреваться до 100°С, охлаждают до комнатной температуры и фильтруют через комбинированный слой силикагеля и Celite®. Фильтрующий слой промывают с помощью EtOAc (180 мл). Фильтрат концентрируют и получают масло черного цвета, которое очищают хроматографией на силикагеле (одноразовая колонка с 24 г силикагеля, элюируют смесью 0-100% EtOAc:гексан). Требуемые фракции объединяют и концентрируют, получая указанное в названии промежуточное соединение (544 мг, выход 65%) в виде пенообразного вещества желтого цвета. (m/z): [M+H]+ вычислено для соответствующей бороновой кислоты C23H31BN4O6 471,23; найдено 471,05.
Препаративный пример 47: трет-бутиловый эфир (R)-4-(5-аминопиридин-2-ил)-3-метилпиперазин-1-карбоновой кислоты
(a) трет-бутиловый эфир (R)-3-метил-4-(5-нитропиридин-2-ил)пиперазин-1-карбоновой кислоты
Смесь 2-хлор-5-нитропиридина (1,0 г, 6,3 ммоль), трет-бутилового эфира (R)-3-метилпиперазин-1-карбоновой кислоты (1,26 г, 6,31 ммоль) и карбоната калия (2,18 г, 15,77 ммоль) перемешивают в ДМСО (5 мл) при 120°С в течение ночи. Реакционную смесь концентрируют на роторном испарителе и смешивают с водой (50 мл). Полученный осадок отфильтровывают, промывают водой (3×10 мл) и сушат на воздухе, получая указанное в названии промежуточное соединение.
(b) трет-бутиловый эфир (R)-4-(5-аминопиридин-2-ил)-3-метилпиперазин-1-карбоновой кислоты
Раствор в метаноле (150 мл) продукта, полученного на предыдущей стадии, несколько раз дегазируют, затем добавляют гидроксид палладия на угле (20% масс., 200 мг, 0,29 ммоль) и полученную смесь дегазируют, гидрируют в течение ночи водородом из баллона, вновь дегазируют и фильтруют через Celite®. Фильтрующий слой промывают метанолом (3×5 мл). Фильтрат концентрируют и очищают хроматографией на силикагеле (20-80% EtOAc:гексан), получая указанное в названии промежуточное соединение (1514 мг, выход 82%). (m/z): [M+H]+ вычислено для C15Η24Ν4O2 293,19; найдено 293,1.
Препаративный пример 48: метиловый эфир 4-бром-2-хлор-5-трифторметоксибензойной кислоты
(a) метиловый эфир 2-хлор-5-трифторметоксибензойной кислоты
Смесь 2-бром-1-хлор-4-трифторметоксибензола (5 г, 18,2 ммоль), триэтиламина (5,51 г, 54,5 ммоль) и Pd(dppf)Cl2 (1,33 г, 1,82 ммоль) в метаноле (200 мл) перемешивают при температуре 80°С в атмосфере оксида углерода (50 фунтов на квадратный дюйм) в течение ночи, фильтруют и концентрируют в вакууме. Остаток очищают хроматографией на силикагеле (5% EtOAc в петролейном эфире) и получают указанное в названии промежуточное соединение в виде бесцветной жидкости (3,4 г, выход 74%).
(b) (2-хлор-5-трифторметоксифенил)метанол
К раствору продукта, полученного на предыдущей стадии (2,9 г, 11,4 ммоль) в ТГФ (30 мл) добавляют NaBH4 (2,59 г, 68,3 ммоль). Полученную смесь перемешивают в течение 15 мин при 70°С, затем по каплям в течение 0,5 час добавляют метанол (10 мл) и смесь перемешивают в течение 2 час при температуре 70°С. Реакционную смесь охлаждают до комнатной температуры и прерывают реакцию, добавив насыщенный раствор NH4Cl. Органический слой отделяют, а водный слой экстрагируют с помощью EtOAc.
Органические слои объединяют, сушат над сульфатом натрия, отфильтровывают, концентрируют и получают указанное в названии промежуточное соединение (2,3 г, выход 98%). (m/z): [M-OH]+ вычислено для C8H6ClF3O2 209,0; найдено 209,0.
(c) (4-бром-2-хлор-5-трифторметоксифенил)метанол
К раствору (2-хлор-5-трифторметоксифенил)метанола (16,3 г, 71,94 ммоль) в серной кислоте (200 мл) и воде (60 мл) добавляют бром (12,65 г, 79,13 ммоль), а затем сульфат серебра (12,34 г, 39,57 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 1 час, выливают на лед, а затем экстрагируют с помощью EtOAc (3×100 мл). Органические слои объединяют, сушат над Na2SO4 и концентрируют, получая сырой продукт, который очищают флэш-хроматографией (0-10% EtOAc в петролейном эфире) и получают указанное в названии промежуточное соединение (6,0 г, выход 27%). (m/z): [M-OH]+ вычислено для C8H5BrClF3O2 286,91; 288,91; найдено 289,0.
(d) метиловый эфир 4-бром-2-хлор-5-трифторметоксибензойной кислоты
К раствору (4-бром-2-хлор-5-трифторметоксифенил)метанола (6,6 г, 21,61 ммоль) в метаноле (70 мл) добавляют 2-метил-проп-2-ил-гидропероксид (14,4 мл, 86,42 ммоль) и иодид калия (0,72 г, 4,32 ммоль). Реакционную смесь при перемешивании кипятят с обратным холодильником в течение 48 час и добавляют насыщенный раствор тиосульфата натрия (20 мл). Реакционную смесь концентрируют и экстрагируют с помощью EtOAc (3×100 мл). Органические слои объединяют, промывают насыщенным раствором соли, сушат над сульфатом натрия, концентрируют и очищают методом ВЭЖХ, получая указанное в названии промежуточное соединение (2,86 г, выход 39%). (m/z): [M+H]+ вычислено для C9H5BrClF3O3 332,91; 334,91; найдено 332,9; 334,9. Спектр 1H-ЯМР (400 МГц, CDCl3): δ (м.д.) 7,79 (с, 1H), 7,77 (с, 1H), 3,94 (с, 3H).
Препаративный пример 49: трет-бутиловый эфир (R)-4-[5-(4-бром-2-хлор-5-трифторметоксибензоиламино)пиридин-2-ил]-3-метилпиперазин-1-карбоновой кислоты
(a) 4-бром-2-хлор-5-трифторметоксибензойная кислота
К смеси метилового эфира 4-бром-2-хлор-5-трифторметоксибензойной кислоты (1,0 г, 3,0 ммоль, препаративный пример 48) в метаноле (4 мл) и воде (4 мл) добавляют гидроксид лития (360 мг, 15 ммоль). Реакционную смесь перемешивают при температуре 60°С в течение 1 час и концентрируют. Реакционную смесь доводят до кислого значения рН с помощью 1N раствора НСl, растворяют в EtOAc (60 мл) и промывают водой (60 мл). Водный слой экстрагируют с помощью EtOAc (60 мл). Органические слои объединяют, промывают насыщенным раствором соли, сушат над сульфатом натрия, отфильтровывают и концентрируют, получают указанное в названии промежуточное соединение (966 мг, выход 100%) в виде белого порошка.
(b) трет-бутиловый эфир (R)-4-[5-(4-бром-2-хлор-5-трифторметоксибензоиламино)пиридин-2-ил]-3-метилпиперазин-1-карбоновой кислоты
Белый порошок, полученный на предыдущей стадии (300 мг), растворяют в ДМФА (2,5 мл), добавляют HATU (480 мг, 1,3 ммоль), а затем добавляют DIPEA (550 мкл, 3,2 ммоль) и 0,5 М раствор трет-бутилового эфира (R)-4-(5-аминопиридин-2-ил)-3-метилпиперазин-1-карбоновой кислоты в DMA (2,1 мл, 1,0 ммоль; препаративный пример 47). Реакционную смесь оставляют на ночь перемешиваться при комнатной температуре, растворяют в EtOAc (60 мл) и промывают водой (120 мл). Водный слой экстрагируют с помощью EtOAc (60 мл). Органические слои объединяют, промывают насыщенным раствором соли (60 мл), отделяют и сушат над сульфатом натрия, отфильтровывают, концентрируют и очищают хроматографией на силикагеле (40 г силикагеля, 0-40% этилацетат:гексан), получая указанное в названии промежуточное соединение (491 мг, выход 80%) в виде окрашенного твердого вещества. (m/z): [M+H]+ вычислено для C23H25BrClF3N4O4 593,07; 595,07; найдено 595,0.
Препаративный пример 50: 4-бром-3-хлор-5-(трифторметокси)бензойная кислота
(a) метиловый эфир 4-амино-3-трифторметоксибензойной кислоты
Смесь 4-амино-3-(трифторметокси)бензойной кислоты (5,0 г, 22,61 ммоль), метанола (75 мл) и 4,0 М раствора НСl в 1,4-диоксане (56,53 мл, 226,1 ммоль) перемешивают при комнатной температуре в течение 2 дней. Реакционную смесь концентрируют, а полученный остаток упаривают вместе с EtOAc (3×20 мл) и затем сушат в вакууме, получая НСl соль указанного в названии промежуточного соединения в виде беловатого твердого вещества (6,9 г). Структуру подтверждают методом ЯМР.
(b) метиловый эфир 4-амино-3-хлор-5-трифторметоксибензойной кислоты
Продукт, полученный на предыдущей стадии (200,0 мг, 0,74 ммоль), растворяют в смеси ACN (9,44 мл) и DMA (0,944 мл) при комнатной температуре. К полученному раствору при перемешивании добавляют N-хлорсукцинимид (108,2 мг, 0,81 ммоль). Полученную смесь нагревают до 60°С в течение 1 час, охлаждают до комнатной температуры и распределяют между EtOAc (20 мл) и насыщенным раствором бикарбоната натрия (4 мл). Органический слой промывают насыщенным раствором бикарбоната натрия (4 мл) и насыщенным раствором соли (4 мл), сушат над сульфатом натрия, отфильтровывают и концентрируют, получая желтоватое масло, которое очищают хроматографией на силикагеле (12 г силикагеля, 0-40% EtOAc/гексан) и получают указанное в названии промежуточное соединение в виде твердого вещества белого цвета (173,8 мг, выход 88%). Структуру подтверждают методом ЯМР.
(c) метиловый эфир 4-бром-3-хлор-5-трифторметоксибензойной кислоты
К раствору продукта, полученного на предыдущей стадии (173,8 мг, 0,65 ммоль) в смеси ACN (7,74 мл) и воды (0,80 мл) при комнатной температуре добавляют бромид меди(II) (198,7 мг, 0,89 ммоль), а затем добавляют трет-бутилнитрит (0,13 мл, 1,11 ммоль). Полученную смесь нагревают при 60°С в течение 1 час. Реакционную смесь охлаждают до комнатной температуры и распределяют между EtOAc (10 мл) и водой (2 мл). Органический слой промывают водой (4 мл), насыщенным раствором соли (4 мл), сушат над сульфатом натрия, отфильтровывают и концентрируют, получая коричневое масло, которое очищают хроматографией на силикагеле (12 г силикагеля, 0-30% EtOAc/гексан) и получают указанное в названии промежуточное соединение в виде твердого вещества белого цвета (163,7 мг, выход 76%). Структуру подтверждают методом ЯМР.
(d) 4-бром-3-хлор-5-(трифторметокси)бензойная кислота
Продукт, полученный на предыдущей стадии (75,6 мг, 0,23 ммоль), растворяют в смеси метанола (0,7 мл) и воды (0,2 мл) и в течение 30 минут при температуре 75°С обрабатывают гидроксидом лития (21,7 мг, 0,91 ммоль). Реакционную смесь концентрируют, разбавляют водой (3 мл), затем подкисляют до рН ~1 с помощью 1N раствора НСl и экстрагируют с помощью EtOAc (5 мл). Органический слой промывают водой (2 мл) и насыщенным раствором соли (2 мл), сушат над сульфатом натрия, отфильтровывают и концентрируют, получают твердое вещество белого цвета, которое сразу же используют в препаративном примере 51.
Препаративный пример 51: (R)-4-бром-3-хлор-N-(6-(2-метил-4-пивалоилпиперазин-1-ил)пиридин-3-ил)-5-(трифторметокси)бензамид
(a) (R)-трет-бутил 4-(5-(4-бром-3-хлор-5-(трифторметокси)бензамидо)пиридин-2-ил)-3-метилпиперазин-1-карбоксилат
К смеси (R)-трет-бутил 4-(5-аминопиридин-2-ил)-3-метилпиперазин-1-карбоксилата (59,9 мг, 0,21 ммоль) и 4-бром-3-хлор-5-(трифторметокси)бензойной кислоты (65,5 мг, 0,21 ммоль; препаративный пример 50), в DMA (0,5 мл) при комнатной температуре добавляют HATU (86 мг, 0,23 ммоль), а затем добавляют DIPEA (0,11 мл, 0,62 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 1 час, распределяют между EtOAc (10 мл) и водой (2 мл). Органический слой промывают водой (2 мл), сушат над сульфатом натрия, отфильтровывают и концентрируют, получая указанное в названии промежуточное соединение в виде темного розоватого масла. (m/z): [M+H]+ вычислено для C23H25BrClF3N4O4 593,07; 595,07; найдено 595.
(b) (R)-4-бром-3-хлор-N-(6-(2-метилпиперазин-1-ил)пиридин-3-ил)-5-(трифторметокси)бензамид
К маслянистому остатку, полученному на предыдущей стадии (122 мг, 0,21 ммоль), добавляют 4 N раствор HCl в диоксане (0,51 мл, 2,05 ммоль). Реакционную смесь выдерживают при комнатной температуре в течение ночи, концентрируют, упаривают вместе с EtOAc (3×2,0 мл) и сушат в вакууме, получая ди-HCl соль указанного в названии промежуточного соединения в виде розоватого твердого вещества. (m/z): [M+H]+ вычислено для C18H17BrClF3N4O2 493,02; 495,02; найдено 495.
(c) (R)-4-бром-3-хлор-N-(6-(2-метил-4-пивалоилпиперазин-1-ил)пиридин-3-ил)-5-(трифторметокси)бензамид
Продукт, полученный на предыдущей стадии (116 мг, 0,21 ммоль), растворяют в смеси DCM (2 мл) и DIPEA (0,14 мл, 0,82 ммоль) при комнатной температуре. Добавляют пивалоилхлорид (24,7 мг, 0,21 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 10 мин, а затем очищают хроматографией на силикагеле (12 г силикагель, 0-40% EtOAc/гексан) и получают указанное в названии промежуточное соединение (80,3 мг, выход 68%) в виде твердого вещества светло-желтого цвета. (m/z): [M+H]+, вычислено для C18H17BrClF3N4O2 577,08; 579,07; найдено 579.
Препаративный пример 52: 4-бром-2-фтор-3-(трифторметокси)бензойная кислота
(a) 4-бром-2-фтор-3-(трифторметокси)анилин
К раствору 2-фтор-3-(трифторметокси)анилина (1,0 г, 5,13 ммоль) в ДМФА (2 мл) при 0°С медленно в течение 5 мин добавляют раствор охлажденного N-бромсукцинимид (0,91 г, 5,13 ммоль) в ДМФА (6 мл). Реакционную смесь перемешивают при 0°С в течение 1 час, экстрагируют с помощью EtOAc (125 мл) и промывают водой (3×25 мл). Объединенные водные слои экстрагируют с помощью EtOAc (75 мл). Органические слои объединяют, промывают насыщенным раствором соли (25 мл), сушат над сульфатом натрия, отфильтровывают и концентрируют, получая указанное в названии соединение в виде темно-окрашенной жидкости (1,27 г, выход 90%). (m/z): [M+H]+, вычислено для C7H4BrF4NO 273,94; найдено 273,8.
(b) 4-бром-2-фтор-3-(трифторметокси)бензонитрил
Смесь воды (3 мл) и серной кислоты (0,59 мл) охлаждают до 10°С, добавляют продукт, полученный на предыдущей стадии (1,27 г, 4,62 ммоль), и перемешивают в течение 30 мин, поддерживая температуру ниже 15°С. Смесь охлаждают до температуры ниже 3°С, добавляют раствор нитрита натрия (0,36 г, 5,22 ммоль) в воде (0,75 мл), поддерживая температуру ниже 3°С, и реакционную смесь перемешивают в течение 45 мин. Реакционную смесь добавляют к горячей суспензии (80°C) карбоната натрия (1,35 г, 12,75 ммоль), цианида меди(I) (0,42 г, 4,71 ммоль) и цианида натрия (0,36 г, 7,39 ммоль) в воде (3,27 мл), а затем реакционную смесь нагревают до 65°С в течение 2 час. Добавляют гексан (80 мл) и водную фазу экстрагируют гексаном (2×60 мл). Органические слои объединяют, промывают насыщенным раствором соли, сушат над сульфатом натрия, отфильтровывают, концентрируют и очищают хроматографией на силикагеле (0-5% EtOAc:гексан в течение 40 мин). Фракции 33-39 объединяют и концентрируют, получая указанное в названии соединение (258,6 мг, выход 20%).
(c) 4-бром-2-фтор-3-(трифторметокси)бензойная кислота
К раствору в диоксане (2 мл) продукта, полученного на предыдущей стадии (258,6 мг, 0,91 ммоль), добавляют воду (0,8 мл) и серную кислоту (1,2 мл). Реакционную смесь нагревают до 110°С в течение ночи и экстрагируют с помощью DCM (80 мл) и воды (20 мл). Водный слой экстрагируют с помощью DCM (2×30 мл). Органические слои объединяют, промывают водой (2×30 мл), затем насыщенным раствором соли (30 мл), сушат над сульфатом натрия, отфильтровывают, концентрируют и получают указанное в названии промежуточное соединение (275 мг) в виде окрашенного твердого вещества. (m/z): [M+H]+ вычислено для C8H3BrF4O3 302,92; найдено 302,8.
Препаративный пример 53: (R)-4-бром-2-фтор-N-(6-(2-метил-4-пивалоилпиперазин-1-ил)пиридин-3-ил)-3-(трифторметокси)бензамид
(a) (R)-трет-бутил 4-(5-(4-бром-2-фтор-3-(трифторметокси)бензамидо)пиридин-2-ил)-3-метилпиперазин-1-карбоксилат
К раствору 4-бром-2-фтор-3-(трифторметокси)бензойной кислоты (150 мг, 0,50 ммоль, препаративный пример 52), (R)-трет-бутил 4-(5-аминопиридин-2-ил)-3-метилпиперазин-1-карбоксилата (145 мг, 0,50 ммоль) и HATU (235 мг, 0,62 ммоль) в ДМФА (1 мл) добавляют DIPEA (0,43 мл, 2,48 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 1 час, экстрагируют с помощью EtOAc (80 мл), промывают водой (3×20 мл) и насыщенным раствором соли (20 мл), сушат над сульфатом натрия, отфильтровывают, концентрируют и очищают хроматографией на силикагеле (12 г силикагеля, 0-40% EtOAc:гексан в течение 20 мин), получая указанное в названии промежуточное соединение (203 мг, выход 71%) в виде твердого вещества желтого цвета. (m/z): [M+H]+ вычислено для C23H25BrF4N4O4 577,10; 579,10; найдено 579,0.
(b) (R)-4-бром-2-фтор-N-(6-(2-метилпиперазин-1-ил)пиридин-3-ил)-3-(трифторметокси)бензамид
К продукту, полученному на предыдущей стадии (203 мг, 0,35 ммоль), добавляют 4,0 М раствор НСl в диоксане (3 мл) и реакционную смесь перемешивают при комнатной температуре в течение 1 час, концентрируют и упаривают вместе с EtOAc (2 х), получая ди-HCl соль указанного в названии промежуточного соединения (189,3 мг, выход 98%) в виде твердого вещества желтого цвета. (m/z): [M+H]+ вычислено для C18H17BrF4N4O2 477,05; 479,05; найдено 476,9.
(c) (R)-4-бром-2-фтор-N-(6-(2-метил-4-пивалоилпиперазин-1-ил)пиридин-3-ил)-3-(трифторметокси)бензамид
К раствору продукта, полученного на предыдущей стадии (189,3 мг, 0,34 ммоль), и DIPEA (0,18 мл, 1,03 ммоль) в ДМФА (1 мл) добавляют пивалоилхлорид (0,042 мл 0,34 ммоль) и реакционную смесь перемешивают при комнатной температуре в течение ночи, концентрируют и очищают хроматографией на силикагеле (0-40% EtOAc:гексан в течение 25 мин), получая указанное в названии промежуточное соединение (128,6 мг, выход 67%) в виде белого твердого вещества. (m/z): [M+H]+ вычислено для C23H25BrF4N4O3 561,10; 563,10; найдено 563,0.
Препаративный пример 54: (2S,4S)-трет-бутил 2-(4-(4-бромфенил)-1H-имидазол-2-ил)-4-(метоксиметил)пирролидин-1-карбоксилат
(a) (S)-1-трет-бутил 2-метил 4-оксопирролидин-1,2-дикарбоксилат
К раствору (2S,4R)-1-трет-бутил 2-метил-4-гидроксипирролидин-1,2-дикарбоксилата (40 г, 157 ммоль) в DCM (500 мл) добавляют DMP (80 г, 189 ммоль) при температуре 0°С и реакционную смесь перемешивают при комнатной температуре в течение 4 час; прерывают реакцию, добавив NaHSO3, экстрагируют с помощью DCM и промывают с помощью NaHCO3. Органическую фазу концентрируют и получают указанное в названии промежуточное соединение (33 г, выход 89%) в виде бесцветного масла. Спектр 1H ЯМР (400 МГц, CDCl3): δ (м.д.) 1,51 (с, 9H), 2,550-2,597 (д, 1H, J=18,8 Гц), 2,876-2,944 (т, 1H, J=13,6 Гц), 3,895 (с, 3H), 3,766-3,895 (м,1H), 4,696-4,814 (м, 1H).
(b) (S,E)-1-трет-бутил 2-метил 4-(метоксиметилен)пирролидин-1,2-дикарбоксилат
Карбонат калия (200 г, 2,17 ммоль) добавляют к раствору (S)-1-трет-бутил 2-метил 4-оксопирролидин-1,2-дикарбоксилата (88 г, 362 ммоль) и диметил 1-диазо-2-оксопропилфосфоната (200 г, 1,04 моль) в метаноле (1 л) при температуре 0°С и реакционную смесь перемешивают при комнатной температуре в течение ночи, прерывают реакцию, концентрируют, выливают в воду, экстрагируют с помощью DCM и очищают колоночной хроматографией, получая указанное в названии промежуточное соединение (18 г, выход 17%) в виде масла желтого цвета. Спектр 1H ЯМР (400 МГц, CDCl3): δ (м.д.) 1,406-1,457 (д, 9H, J=20,4 Гц), 2,502-2,520 (м, 1H), 2,601-2,631 (м, 1H), 2,720-2,782 (м, 1H), 3,578 (с, 3H), 3,707 (с, 3H), 3,952-3,983 (м, 1H), 4,302-4,375 (м, 1H), 4,471-4,490(м, 1H), 5,810-5,968 (м, 1H).
(c) (2S,4S)-1-трет-бутил 2-метил 4-(метоксиметил)пирролидин-1,2-дикарбоксилат
Смесь (S,E)-1-трет-бутил 2-метил 4-(метоксиметилен)пирролидин-1,2-дикарбоксилата (9 г, 33,21 ммоль), оксида магния (12 г, 33,21 ммоль) и палладий на угле (3 г) в метаноле (100 мл) выдерживают под непрерывным потоком водорода при комнатной температуре в течение 2 час и фильтруют. Органическую фазу концентрируют и получают указанное в названии промежуточное соединение (9 г, выход 100%) в виде бесцветного масла. Спектр 1H ЯМР (400 МГц, (CD3)2S=O): δ (м.д.) 1,367 (с, 9H), 1,620-1,670 (м, 1H), 1,904-1,953 (м, 1H), 3,110-3,140 (с, 3H, J=12 Гц), 3,255-3,360 (м, 2H), 3,523-3,561 (м, 1H), 3,653 (с, 3H), 4,241-4,283 (м, 1H).
(d) (2S,4S)-1-(трет-бутоксикарбонил)-4-(метоксиметил)пирролидин-2-карбоновая кислота
Раствор (2S,4S)-1-трет-бутил 2-метил 4-(метоксиметил)пирролидин-1,2-дикарбоксилата (18 г, 66,91 ммоль) и гидроксида лития (3,37 г, 80,3 ммоль) в ТГФ (50 мл), метаноле (50 мл) и воде (50 мл) перемешивают при комнатной температуре в течение 2 час. рН реакционной смеси доводят до значения 6 и экстрагируют смесью 10:1 DCM:метанол. Органическую фазу сушат над сульфатом натрия и концентрируют, получая указанное в названии промежуточное соединение (17 г, выход 84%) в виде бесцветного масла. Спектр 1H ЯМР (400 МГц, CDCl3): δ (м.д.) 1,398-1,451 (д, 9H, J=21,2 Гц), 1,625-1,754 (м, 1H), 2,226-2,652 (м, 3H), 3,251-3,458 (м, 1H), 3,316 (с, 3H), 3,316-3,462 (м, 2H), 3,556-3,750 (м, 2H), 4,405-4,445 (м, 1H), 7,652(с, 1H).
(e) (2S,4S)-2-(2-(4-бромфенил)-2-оксоэтил) 1-трет-бутил 4-(метоксиметил)пирролидин-1,2-дикарбоксилат
К раствору (2S,4S)-1-(трет-бутоксикарбонил)-4-(метоксиметил)пирролидин-2-карбоновой кислоты (10 г, 38,61 ммоль) в DCM (100 мл) добавляют (2-бром-1-(4-бромфенил)этанон (11,8 г, 42,47 ммоль) и триэтиламин (7,8 г, 77,22 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 3 час. Добавляют воду и смесь экстрагируют с помощью EtOAc. Органическую фазу сушат над сульфатом натрия, концентрируют и очищают колоночной хроматографией, получая указанное в названии промежуточное соединение (12 г, выход 56%) в виде бесцветного масла. Спектр 1H ЯМР (400 МГц, CDCl3): δ (м.д.) 1,438-1,466 (д, 9H, J=11,2 Гц), 2,024-2,056 (т, 1H, J=12,8 Гц), 2,553 (с, 2H), 3,214-3,776 (м, 6H), 4,410-4,850 (т, 1H, J=15 Гц), 5,155-5,549 (м, 1H), 7,270-7,278 (т, 1H, J=1,6 Гц), 7,636-7,654 (д, 1H, J=7,2 Гц), 7,765-7,774 (д, 1H, J=3,6 Гц).
(f) (2S,4S)-трет-бутил 2-(4-(4-бромфенил)-1H-имидазол-2-ил)-4-(метоксиметил)пирролидин-1-карбоксилат
Ацетат аммония (77 г, 1 моль) добавляют к раствору (2S,4S)-2-(2-(4-бромфенил)-2-оксоэтил) 1-трет-бутил 4-(метоксиметил)пирролидин-1,2-дикарбоксилата (11 г, 25,11 ммоль) в толуоле (150 мл) и реакционную смесь кипятят с обратным холодильником в течение ночи и концентрируют. Добавляют воду (50 мл), рН реакционной смеси доводят до значения 8 и экстрагируют с помощью EtOAc. Органическую фазу сушат над сульфатом натрия, концентрируют и очищают колоночной хроматографией, получая указанное в названии промежуточное соединение (3 г, выход 31%) в виде твердого вещества белого цвета. Спектр 1H ЯМР (400 МГц, CDCl3): δ (м.д.) 1,316-1,535 (м, 9H), 2,457-2,630 (м, 4H), 2,808 (д, 1H), 3,202-3,223 (д, 1H, J=8,4 Гц), 3,404-3,565 (м, 6H), 3,832-3,877 (м, 1H), 5,019-5,054 (т, 1H, J=14 Гц), 7,056-7,592 (м, 6H).
Пример 1: метиловый эфир ((S)-1-{(2S,4S)-2-[4-(5'-хлор-4'-{[6-((2R,5S)-2,5-диметил-4-метилкарбамоилпиперазин-1-ил)пиперидин-3-карбонил]амино}-2'-трифторметоксибифенил-4-ил)-1H-имидазол-2-ил]-4-метилпирролидин-1-карбонил}-2-метилпропил)карбаминовой кислоты
(a) метиловый эфир ((S)-1-{(2S,4S)-2-[4-(5'-хлор-4'-{(6-((2R,5S)-2,5-диметилпиперазин-1-ил)пиридин-3-карбонил]амино}-2'-трифторметоксибифенил-4-ил)-1H-имидазол-2-ил]-4-метилпирролидин-1-карбонил}-2-метилпропил)карбаминовой кислоты
К раствору метилового эфира [(S)-2-метил-1-((2S,4S)-4-метил-2-{4-[4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-1H-имидазол-2-ил}пирролидин-1-карбонил)пропил]карбаминовой кислоты (168 мг, 0,33 ммоль) и трет-бутилового эфира (2S,5R)-4-[5-(4-бром-2-хлор-5-трифторметоксифенилкарбамоил)пиридин-2-ил]-2,5-диметилпиперазин-1-карбоновой кислоты (200 мг, 0,33 ммоль) в толуоле (2,1 мл) и воде (0,36 мл) добавляют карбонат калия (227 мг, 1,65 ммоль). Реакционную смесь продувают азотом в течение 15 мин. Добавляют тетракис(трифенилфосфин)палладий(0) (45,6 мг, 0,039 ммоль) и реакционную смесь продувают азотом и оставляют на ночь нагреваться при температуре 100°С. Реакционную смесь разбавляют этилацетатом и промывают водой и насыщенным раствором соли. Органический слой сушат над сульфатом натрия, отфильтровывают, концентрируют и получают коричневатое твердое вещество.
Твердое вещество, полученное на предыдущей стадии, обрабатывают 4 М раствором НСl в 1,4-диоксане (2,5 мл) и НСl (0,6 мл) и перемешивают при комнатной температуре в течение 1 час. Реакционную смесь концентрируют, растворяют в смеси 1:1 уксусная кислота:вода (6 мл) и очищают методом ВЭЖХ с обращенной фазой. Фракции, содержащие требуемое соединение, объединяют и лиофилизуют, получая три-TFA соль указанного в названии промежуточного соединения (99 мг, выход 26%) в виде белого порошка. (m/z): [M+H]+ вычислено для C40H46ClF3N8O5 811,32; найдено 811,0.
(b) метиловый эфир ((S)-1-{(2S,4S)-2-[4-(5'-хлор-4'-{[6-((2R,5S)-2,5-диметил-4-метилкарбамоилпиперазин-1-ил)пиридин-3-карбонил]амино}-2'-трифторметоксибифенил-4-ил)-1H-имидазол-2-ил]-4-метилпирролидин-1-карбонил}-2-метилпропил)карбаминовой кислоты
Продукт, полученный на предыдущей стадии, растворяют в DMA и добавляют вначале 0,5 М раствор метиламиноформилхлорида в DMA (34,7 мкл, 0,017 ммоль), а затем N,N-диизопропилэтиламин (0,015 мл, 0,087 ммоль) и реакционную смесь оставляют на ночь перемешиваться при комнатной температуре, концентрируют на роторном испарителе, остаток растворяют в смеси 1:1 уксусная кислота:вода (1,5 мл) и очищают методом ВЭЖХ с обращенной фазой, получая ди-TFA соль указанного в названии соединения (15 мг, выход 79%). (m/z): [M+H]+ вычислено для C42H49ClF3N9O6 868,35; найдено 868,6.
Пример 2: метиловый эфир [(S)-1-((2S,4S)-2-{4-[5'-хлор-4'-({6-[(R)-4-((S)-2,2-диметилциклопропанкарбонил)-2-метилпиперазин-1-ил]пиридин-3-карбонил}амино)-2'-трифторметоксибифенил-4-ил]-1H-имидазол-2-ил}-4-метилпирролидин-1-карбонил)-2-метилпропил]карбаминовой кислоты
(a) метиловый эфир ((S)-1-{(2S,4S)-2-[4-[5'-хлор-4'-{(6-((R)-2-метилпиперазин-1-ил)пиридин-3-карбонил]амино}-2'-трифторметоксибифенил-4-ил)-1H-имидазол-2-ил]-4-метилпирролидин-1-карбонил}-2-метилпропил)карбаминовой кислоты
В соответствии с общей методикой примера 1(а) в масштабе 0,30 ммоль, взяв трет-бутиловый эфир (R)-4-[5-(4-бром-2-хлор-5-трифторметоксифенилкарбамоил)пиридин-2-ил]-3-метилпиперазин-1-карбоновой кислоты вместо трет-бутилового эфира (2S,5R)-4-[5-(4-бром-2-хлор-5-трифторметоксифенилкарбамоил)пиридин-2-ил]-2,5-диметилпиперазин-1-карбоновой кислоты и используя альтернативную очистку путем выпаривания с этилацетатом (2 х), получают три-HCl соль указанного в названии промежуточного соединения (101 мг, выход 29%). (m/z): [M+H]+ вычислено для C39H44ClF3N8O5 797,31; найдено 797.
(b) метиловый эфир [(S)-1-((2S,4S)-2-{4-[5'-хлор-4'-({6-[(R)-4-((S)-2,2-диметилциклопропанкарбонил)-2-метилпиперазин-1-ил]пиридин-3-карбонил}амино)-2'-метоксибифенил-4-ил]-1H-имидазол-2-ил}-4-метилпирролидин-1-карбонил)-2-метилпропил]карбаминовой кислоты
К 0,5 М раствору (S)-(+)-2,2-диметилциклопропанкарбоновой кислоты в DMA (41,6 мкл, 0,02 ммоль) добавляют HATU (7,9 мг, 0,02). Реакционную смесь перемешивают в течение 15 мин и добавляют вначале продукт, полученный на предыдущей стадии (20 мг, 0,02 ммоль), а затем N,N-диизопропилэтиламин (0,015 мл, 0,09 ммоль) и реакционную смесь перемешивают при 55°С в течение ночи, концентрируют, растворяют в смеси 1:1 уксусная кислота:вода (1,5 мл) и очищают методом ВЭЖХ с обращенной фазой, получая ди-TFA соль указанного в названии соединения (16 мг, выход 78%). (m/z): [M+H]+ вычислено для C45H52ClF3N8O6 893,37; найдено 893,6.
Пример 3: метиловый эфир [(S)-1-((2S,4S)-2-{4-[5'-хлор-4'-({6-[(2R,5S)-4-(1H-имидазол-4-карбонил)-2,5-диметилпиперазин-1-ил]пиридин-3-карбонил}амино)-2'-трифторметилбифенил-4-ил]-1H-имидазол-2-ил}-4-метилпирролидин-1-карбонил)-2-метилпропил]карбаминовой кислоты
(a) метиловый эфир ((S)-1-{(2S,4S)-2-[4-(5'-хлор-4'-{[6-((2R,5S)-2,5-диметилпиперазин-1-ил)пиридин-3-карбонил]амино}-2'-трифторметилбифенил-4-ил)-1H-имидазол-2-ил]-4-метилпирролидин-1-карбонил}-2-метилпропил)карбаминовой кислоты
В соответствии с методикой, приведенной в примере 1, в масштабе 0,24 ммоль, взяв трет-бутиловый эфир (2S,5R)-4-[5-(4-бром-2-хлор-5-фторметилфенилкарбамоил)пиридин-2-ил]-2,5-диметилпиперазин-1-карбоновой кислоты вместо трет-бутилового эфира (2S,5R)-4-[5-(4-бром-2-хлор-5-трифторметоксифенилкарбамоил)пиридин-2-ил]-2,5-диметилпиперазин-1-карбоновой кислоты, получают три-TFA соль указанного в названии промежуточного соединения (116 мг, выход 54%). (m/z): [M+H]+ вычислено для C40H46ClF3N8O4 795,33; найдено 795,4.
(b) метиловый эфир [(S)-1-((2S,4S)-2-{4-[5'-хлор-4'-({6-[(2R,5S)-4-(1H-имидазол-4-карбонил)-2,5-диметилпиперазин-1-ил]пиперидин-3-карбонил}амино)-2'-трифторметилбифенил-4-ил]-1H-имидазол-2-ил}-4-метилпирролидин-1-карбонил)-2-метилпропил]карбаминовой кислоты
К раствору продукта, полученного на предыдущей стадии (12 мг, 0,013 ммоль), и N,N-диизопропилэтиламина (23 мкл, 0,13 ммоль) в DMA (0,5 мл) добавляют имидазол-4-карбоновую кислоту (1,5 мг, 0,013 ммоль) и HATU (7,6 мг, 0,02 ммоль) и реакционную смесь перемешивают при 50°С в течение 2 час, концентрируют и растворяют в смеси 1:1 уксусная кислота:вода (1,5 мл), очищают методом ВЭЖХ с обращенной фазой и получают три-TFA соль указанного в названии соединения (5 мг). (m/z): [M+H]+ вычислено для C44H48ClF3N10O5 889,35; найдено 889,6.
Пример 4: метил (S)-1-((S)-8-(4-(4'-(6-((R)-4-((S)-2,2-диметилциклопропанкарбонил)-2-метилпиперазин-1-ил)никотинамидо)-2'-(трифторметокси)бифенил-4-ил)-1H-имидазол-2-ил)-1,4-диокса-7-азаспиро[4.4]нонан-7-ил)-3-метил-1-оксобутан-2-илкарбамат
К раствору 2HCl соли метилового эфира ((S)-1-{(S)-8-[4-(4'-амино-2'-трифторметоксибифенил-4-ил)-1H-имидазол-2-ил]-1,4-диокса-7-аза-спиро[4.4]нонан-7-карбонил}-2-метилпропил)карбаминовой кислоты (92,0 мг, 0,136 ммоль, препаративный пример 9) в DCM (1,36 мл) и DMA (0,14 мл) при комнатной температуре добавляют N,N-диизопропилэтиламин (94,7 мкл, 0,54 ммоль) и 2-фторпиридин-5-карбонилхлорид (228 мг, 0,143 ммоль). Реакционную смесь перемешивают в течение 30 мин при комнатной температуре и концентрируют.
Остаток, полученный на предыдущей стадии, растворяют в ДМСО (2,0 мл) и обрабатывают трет-бутиловым эфиром (R)-3-метилпиперазин-1-карбоновой кислоты (136 мг, 0,680 ммоль) и N,N-диизопропилэтиламином (0,237 мл, 1,36 ммоль) при температуре 120°С в течение ночи.
Реакционную смесь концентрируют и обрабатывают 4 М раствором НСl в 1,4-диоксане (1,0 мл, 4,0 ммоль) при комнатной температуре в течение 30 мин. Реакционную смесь концентрируют, растворяют в смеси 1:1 уксусная кислота:вода (6 мл), отфильтровывают и очищают с методом ВЭЖХ с обращенной фазой. Требуемые фракции объединяют и сушат вымораживанием, получая твердое вещество белого цвета (48 мг, выход 30%).
К смеси (S)-(+)-2,2-диметилциклопропанкарбоновой кислоты (1,75 мг, 0,015 ммоль) в DMA (0,5 мл) при комнатной температуре добавляют продукт, полученный на предыдущей стадии (в форме 3-TFA соли) (16 мг, 0,014 ммоль), и N,N-диизопропилэтиламин (12,1 мкл, 0,070 ммоль) и реакционную смесь перемешивают при комнатной температуре в течение ночи, растворяют в смеси 1:1 уксусная кислота:вода (1,5 мл), отфильтровывают и очищают методом ВЭЖХ с обращенной фазой, получая ди-TFA соль указанного в названии соединения (6 мг). (m/z): [M+H]+ вычислено для C46H53F3N8O8 903,39; найдено 904,0.
Пример 5: метиловый эфир (S)-2-{(R)-4-[5-(4'-{2-[(2S,4S)-4-гидрокси-1-((S)-2-метоксикарбониламино-3-метилбутирил)пирролидин-2-ил]-1H-имидазол-4-ил}бифенил-4-илкарбамоил)пиридин-2-ил]-3-метилпиперазин-1-карбонил}-2-метилпирролидин-1-карбоновой кислоты
(a) метиловый эфир (S)-1-{(2S,4S)-4-гидрокси-2-[4-(4'-{[6-((R)-2-метилпиперазин-1-ил)пиридин-3-карбонил]амино}-бифенил-4-ил)-1H-имидазол-2-ил]пирролидин-1-карбонил}-2-метилпропил)карбаминовой кислоты
Раствор трет-бутилового эфира (R)-4-(5-карбоксипиридин-2-ил)-3-метилпиперазин-1-карбоновой кислоты (130 мг, 0,42 ммоль), EDC (120 мг, 0,63 ммоль) и HOAt (86 мг, 0,63 ммоль), растворенный в DMA (3,9 мл) перемешивают при комнатной температуре в течение 30 мин и вначале добавляют метиловый эфир ((S)-1-{(2S,4S)-2-[4-(4'-аминобифенил-4-ил)-1H-имидазол-2-ил]-4-гидроксипирролидин-1-карбонил}-2-метилпропил)карбаминовой кислоты (200 мг, 0,40 ммоль; препаративный пример 10), а затем N,N-диизопропилэтиламин (0,18 мл, 1,0 ммоль). Реакционную смесь оставляют на уикенд перемешиваться при комнатной температуре, а затем экстрагируют этилацетатом и водой. Органический слой сушат над сульфатом натрия, отфильтровывают и упаривают в вакууме.
Коричневое масло, полученное на предыдущей стадии, обрабатывают 4 М раствором HCl в 1,4-диоксане (3,1 мл) и НСl (1,15 мл) и перемешивают при комнатной температуре в течение 1 час. Реакционную смесь концентрируют и упаривают с этилацетатом (2 х), получая коричневое масло. Масло растворяют в смеси 1:1 уксусная кислота:вода (4 мл), отфильтровывают и очищают методом ВЭЖХ с обращенной фазой, получая три-TFA соль требуемого продукта (276 мг). (m/z): [M+H]+ вычислено для C37H44N8O5 681,34; найдено 681,4.
(b) метиловый эфир (S)-2-{(R)-4-[5-(4'-{2-[(2S,4S)-4-гидрокси-1-((S)-2-метоксикарбониламино-3-метилбутирил)пирролидин-2-ил]-1H-имидазол-4-ил}бифенил-4-илкарбамоил)пиридин-2-ил]-3-метилпиперазин-1-карбонил}-2-метилпирролидин-1-карбоновой кислоты
Продукт, полученный на предыдущей стадии (20,0 мг, 0,029 ммоль), растворяют в DMA (1 мл) и добавляют N,N-диизопропилэтиламин (0,015 мл, 0,088 ммоль). К реакционной смеси добавляют 0,5 M раствор 1-метилового эфира (S)-2-метилпирролидин-1,2-дикарбоновой кислоты в DMA (70,5 мкл, 0,035 ммоль), а затем HATU (13 мг, 0,035 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи, концентрируют, растворяют в смеси 1:1 уксусная кислота:вода (1,5 мл) и очищают методом ВЭЖХ с обращенной фазой, получая ди-TFA соль указанного в названии соединения (16,8 мг, выход 56%). (m/z): [M+H]+ вычислено для C45H55N9O8 850,42; найдено 850,4.
Пример 6: метиловый эфир ((S)-1-{(2S,4S)-2-[4-(4'-{[6-((R)-4-циклопропанкарбонил-2-метилпиперазин-1-ил)пиридин-3-карбонил]амино}бифенил-4-ил)-1H-имидазол-2-ил]-4-диметиламинопирролидин-1-карбонил}-2-метилпропил)карбаминовой кислоты
(a) метиловый эфир ((S)-1-{(2S,4S)-4-диметиламино-2-[4-(4'-{[6-((R)-2-метилпиперазин-1-ил)пиридин-3-карбонил]амино}бифенил-4-ил)-1H-имидазол-2-ил]пирролидин-1-карбонил}-2-метилпропил)карбаминовой кислоты
Раствор метилового эфира ((S)-1-{(2S,4S)-2-[4-(4-бромфенил)-1H-имидазол-2-ил]-4-диметиламинопирролидин-1-карбонил}-2-метилпропил)карбаминовой кислоты (135 мг, 0,27 ммоль; препаративный пример 12) и трет-бутилового эфира (R)-3-метил-4-{5-[4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенилкарбамоил]пиридин-2-ил}пиперазин-1-карбоновой кислоты (140 мг, 0,27 ммоль; препаративный пример 13) в 1,2-диметоксиэтане (2,85 мл) и воде (0,99 мл) продувают азотом. Добавляют бикарбонат натрия (86,4 мг, 1,03 ммоль), а затем тетракис(трифенилфосфин)палладий(0) (48 мг, 0,041 ммоль), реакционную смесь герметично закрывают в атмосфере азота и нагревают до 90°С в течение ночи; экстрагируют смесью этилацетат/вода. Органический слой сушат над сульфатом натрия, отфильтровывают, концентрируют и получают масло желтого цвета.
Желтое масло, полученное на предыдущей стадии, обрабатывают 4 М раствором НСl в 1,4-диоксане (3 мл) и перемешивают при комнатной температуре в течение 1 час, концентрируют, растворяют в смеси 1:1 уксусная кислота:вода (4 мл) и очищают методом ВЭЖХ с обращенной фазой и получают три-TFA соль указанного в названии промежуточного соединения (100 мг, выход 30%). (m/z): [M+H]+ вычислено для C39H49N9O4 708,39; найдено 708,9.
(b) метиловый эфир ((S)-1-{(2S,4S)-2-[4-(4'-{[6-((R)-4-циклопропанкарбонил-2-метилпиперазин-1-ил)пиридин-3-карбонил]амино}бифенил-4-ил)-1H-имидазол-2-ил]-4-диметиламинопирролидин-1-карбонил}-2-метилпропил)карбаминовой кислоты
К раствору продукта, полученного на предыдущей стадии (10 мг, 0,01 ммоль), и N,N-диизопропилэтиламина (8,3 мкл, 0,048 ммоль) в DMA (0,3 мл) добавляют циклопропанкарбонилхлорид (0,86 мкл, 0,0095 ммоль) и реакционную смесь перемешивают при комнатной температуре в течение ночи, концентрируют, растворяют в смеси 1:1 уксусная кислота:вода (1,5 мл) и очищают методом ВЭЖХ с обращенной фазой, получая три-TFA соль указанного в названии соединения (6,9 мг). (m/z): [M+H]+ вычислено для C43H53N9O5 776,42; найдено 776,4.
Пример 7: метиловый эфир ((S)-1-{(2S,4S)-2-[4-(4'-{6-[(2R,5S)-4-((S)-2,2-диметилциклопропанкарбонил)-2,5-диметилпиперазин-1-ил]пиридин-3-илкарбамоил}-2'-трифторметоксибифенил-4-ил)-1H-имидазол-2-ил]-4-метилпирролидин-1-карбонил}-2-метилпропил)карбаминовой кислоты
(a) метиловый эфир {(S)-1-[(2S,4S)-2-(4-{4'-[6-((2R,5S)-2,5-диметилпиперазин-1-ил)пиридин-3-илкарбамоил]-2'-трифторметоксибифенил-4-ил}-1H-имидазол-2-ил)-4-метилпирролидин-1-карбонил]-2-метилпропил}карбаминовой кислоты
К смеси TFA соли 4'-{2-[(2S,4S)-1-((S)-2-метоксикарбониламино-3-метилбутирил)-4-метилпирролидин-2-ил]-1H-имидазол-4-ил}-2-трифторметоксибифенил-4-карбоновой кислоты (80 мг, 0,11 ммоль; препаративный пример 15) и трет-бутилового эфира (2S,5R)-4-(5-аминопиридин-2-ил)-2,5-диметилпиперазин-1-карбоновой кислоты (416 мг, 0,14 ммоль; препаративный пример 16) в ДМФА (1 мл) при комнатной температуре добавляют HATU (56,8 мг, 0,15 ммоль), а затем добавляют N,N-диизопропилэтиламин (0,12 мл, 0,68 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи и распределяют между EtOAc (10 мл) и водой (3 мл). Органический слой промывают водой (3 мл), сушат над сульфатом натрия, отфильтровывают и концентрируют, получая коричневато-красное масло.
Маслянистый остаток, полученный на предыдущей стадии, обрабатывают 4 М раствором НСl в 1,4-диоксане (1,0 мл) при комнатной температуре в течение 30 мин. Реакционную смесь концентрируют, упаривают вместе с EtOAc (3×3 мл), растворяют в смеси ACN и воды и сушат вымораживанием, получая три-HCl соль указанного в названии промежуточного соединения (124 мг) в виде твердого вещества красноватого цвета. (m/z): [M+H]+ вычислено для C40H47F3N8O5 777,36; найдено 777.
(b) метиловый эфир ((S)-1-{(2S,4S)-2-[4-(4'-{6-[(2R,5S)-4-((S)-2,2-диметилциклопропанкарбонил)-2,5-диметилпиперазин-1-ил]пиридин-3-илкарбамоил}-2'-трифторметоксибифенил-4-ил)-1H-имидазол-2-ил]-4-метилпирролидин-1-карбонил}-2-метилпропил)карбаминовой кислоты
К смеси (S)-(+)-2,2-диметилциклопропанкарбоновой кислоты (2,6 мг, 0,023 ммоль) и HATU (8,58 мг, 0,023 ммоль) в ДМФА (0,5 мл) при комнатной температуре добавляют продукт, полученный на предыдущей стадии (20,0 мг, 0,023 ммоль), а затем добавляют N,N-диизопропилэтиламин (31,4 мкл, 0,180 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи, концентрируют, растворяют в смеси 1:1 уксусная кислота:вода (1,5 мл) и очищают методом ВЭЖХ с обращенной фазой, получая ди-TFA соль указанного в названии соединения (10 мг). (m/z): [M+H]+ вычислено для C46H55F3N8O6 873,42; найдено 873,8.
Пример 8: метиловый эфир ((S)-1-{(2S,4S)-2-[4-(4'-{6-[(R)-4-((S)-2,2-диметилциклопропанкарбонил)-2-метилпиперазин-1-ил]пиридин-3-илкарбамоил}-2'-трифторметоксибифенил-4-ил)-1H-имидазол-2-ил]-4-метилпирролидин-1-карбонил}-2-метилпропил)карбаминовой кислоты
К смеси TFA соли 4'-{2-[(2S,4S)-1-((S)-2-метоксикарбониламино-3-метилбутирил)-4-метилпирролидин-2-ил]-1H-имидазол-4-ил}-2-трифторметоксибифенил-4-карбоновой кислоты (11,4 мг, 0,016 ммоль) и HATU (6,8 мг, 0,018 ммоль) в ДМФА (0,5 мл) при комнатной температуре добавляют [(R)-4-(5-аминопиридин-2-ил)-3-метилпиперазин-1-ил]-((S)-2,2-диметилциклопропил)метанон (5,1 мг, 0,018 ммоль, препаративный пример 17), а затем N,N-диизопропилэтиламин (14,07 мкл, 0,081 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи, концентрируют, растворяют в смеси 1:1 уксусная кислота:вода (1,5 мл) и очищают методом ВЭЖХ с обращенной фазой, получая ди-TFA соль указанного в названии соединения (9 мг). (m/z): [M+H]+ вычислено для C45H53F3N8O6 859,40; найдено 859,4.
Пример 9: метиловый эфир ((S)-1-{(2S,4S)-2-[4-(4'-{6-[(R)-4-((S)-2,2-диметилциклопропанкарбонил)-2-метилпиперазин-1-ил]пиридин-3-илкарбамоил}-2'-трифторметоксибифенил-4-ил)-1H-имидазол-2-ил]-4-метилсульфанилпирролидин-1-карбонил}-2-метилпропил)карбаминовой кислоты
(a) метиловый эфир {(S)-2-метил-1-[(2S,4S)-2-(4-{4'-[6-((R)-2-метилпиперазин-1-ил)пиридин-3-илкарбамоил]-2'-трифторметоксибифенил-4-ил}-1H-имидазол-2-ил)-4-метилсульфанилпирролидин-1-карбонил]пропил}карбаминовой кислоты
К смеси TFA соли 4'-{2-[(2S,4S)-1-((S)-2-метоксикарбониламино-3-метилбутирил)-4-метилсульфанилпирролидин-2-ил]-1H-имидазол-4-ил}-2-трифторметоксибифенил-4-карбоновой кислоты (37 мг, 0,05 ммоль; препаративный пример 21) и трет-бутилового эфира (R)-4-(5-аминопиридин-2-ил)-3-метилпиперазин-1-карбоновой кислоты (16 мг, 0,06 ммоль) в ДМФА (0,5 мл) при комнатной температуре добавляют HATU (21 мг, 0,06 ммоль), а затем N,N-диизопропилэтиламин (44,3 мкл, 0,25 ммоль). Полученную смесь перемешивают при комнатной температуре в течение ночи. Реакционную смесь распределяют между EtOAc (5 мл) и водой (2 мл). Органический слой промывают водой (2 мл), сушат над сульфатом натрия, отфильтровывают, концентрируют и получают масло коричневато-красного цвета.
Маслянистый остаток, полученный на предыдущей стадии, обрабатывают 4 М раствором HCl в 1,4-диоксане (1,0 мл) при комнатной температуре в течение 30 мин. Реакционную смесь концентрируют, упаривают вместе с EtOAc (3×2 мл), растворяют в смеси ACN и воды и сушат вымораживанием, получая три-HCl соль указанного в названии промежуточного соединения (57 мг) в виде твердого вещества коричневатого цвета. (m/z): [M+H]+ вычислено для C45H53F3N8O6S 891,38; найдено 891.
(b) метиловый эфир ((S)-1-{(2S,4S)-2-[4-(4'-{6-[(R)-4-((S)-2,2-диметилциклопропанкарбонил)-2-метилпиперазин-1-ил]пиридин-3-илкарбамоил}-2'-трифторметоксибифенил-4-ил)-1H-имидазол-2-ил]-4-метилсульфанилпирролидин-1-карбонил}-2-метилпропил)карбаминовой кислоты
К смеси (S)-(+)-2,2-диметилциклопропанкарбоновой кислоты (2,7 мг, 0,023 ммоль) и HATU (8,8 мг, 0,023 ммоль) в ДМФА (0,5 мл) при комнатной температуре добавляют продукт, полученный на предыдущей стадии (19,1 мг, 0,021 ммоль), а затем добавляют N,N-диизопропилэтиламин (18,4 мкл, 0,11 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи, концентрируют, растворяют в смеси 1:1 уксусная кислота:вода (1,5 мл) и очищают методом ВЭЖХ с обращенной фазой, получая ди-TFA соль указанного в названии соединения (11 мг). (m/z): [M+H]+ вычислено для C45H53F3N8O6S 891,38; найдено 891.
Пример 10: метиловый эфир [(S)-1-((2S,4S)-2-{4-[5'-хлор-4'-({6-[(R)-4-(2,2-диметилпропионил)-2-метилпиперазин-1-ил]пиридин-3-карбонил}амино)-2'-трифторметоксибифенил-4-ил]-1H-имидазол-2-ил}-4-метилпирролидин-1-карбонил)-2-метилпропил]карбаминовой кислоты
(a) трет-бутиловый эфир (R)-4-[5-(5-хлор-4'-{2-[(2S,4S)-1-((S)-2-метоксикарбониламино-3-метилбутирил)-4-метилпирролидин-2-ил]-1H-имидазол-4-ил}-2-трифторметоксибифенил-4-илкарбамоил)-пиридин-2-ил]-3-метилпиперазин-1-карбоновой кислоты
К раствору метилового эфира [(S)-2-метил-1-((2S,4S)-4-метил-2-{4-[4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-1H-имидазол-2-ил}пирролидин-1-карбонил)пропил]карбаминовой кислоты (155 мг, 0,30 ммоль) и трет-бутилового эфира (R)-4-[5-(4-бром-2-хлор-5-трифторметоксифенилкарбамоил)пиридин-2-ил]-3-метилпиперазин-1-карбоновой кислоты (180 мг, 0,30 ммоль, препаративный пример 1) в толуоле (1,9 мл) и воде (0,33 мл) добавляют карбонат калия (210 мг, 1,52 ммоль). Реакционную смесь продувают азотом. Добавляют тетракис(трифенилфосфин)палладий(0) (42 мг, 0,036 ммоль), реакционную смесь продувают азотом и нагревают до 100°С в течение ночи. Реакционную смесь разбавляют этилацетатом и промывают водой и насыщенным раствором соли. Органический слой сушат над сульфатом натрия, отфильтровывают, концентрируют и получают указанное в названии промежуточное соединение в виде коричневатого твердого вещества. (m/z): [M+H]+ вычислено для C44H52ClF3N8O7 897,36; найдено 897.
(b) метиловый эфир ((S)-1-{(2S,4S)-2-[4-(5'-хлор-4'-{[6-((R)-2-метилпиперазин-1-ил)пиридин-3-карбонил]амино}-2'-трифторметоксибифенил-4-ил)-1H-имидазол-2-ил]-4-метилпирролидин-1-карбонил}-2-метилпропил)карбаминовой кислоты
Твердое вещество, полученное на предыдущей стадии (431 мг, 0,48 ммоль), обрабатывают 4 М раствором HCl в 1,4-диоксане (2 мл) и реакционную смесь перемешивают при 50°С в течение 30 мин, концентрируют, упаривают с этилацетатом (2 х) и получают три-HCl соль указанного в названии промежуточного соединения в виде твердого вещества желтого цвета (426 мг, 0,47 ммоль). (m/z): [M+H]+ вычислено для C39H44ClF3N8O7 797,31; найдено 797,8.
(c) метиловый эфир [(S)-1-((2S,4S)-2-{4-[5'-хлор-4'-({6-[(R)-4-(2,2-диметилпропионил)-2-метилпиперазин-1-ил]пиридин-3-карбонил}амино)-2'-трифторметоксибифенил-4-ил]-1H-имидазол-2-ил}-4-метилпирролидин-1-карбонил)-2-метилпропил]карбаминовой кислоты
К раствору продукта, полученного на предыдущей стадии (12 мг, 0,014 ммоль), в ДМФА (0,5 мл) добавляют N,N-диизопропилэтиламин (0,024 мл, 0,14 ммоль) с последующим добавлением 2,2-диметилпропаноилхлорида (1,7 мкл, 0,014 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 30 мин, концентрируют, растворяют в смеси 1:1 уксусная кислота:вода (1,5 мл) и очищают методом ВЭЖХ с обращенной фазой, получая ди-TFA соль указанного в названии соединения (7 мг). (m/z): [M+H]+ вычислено для C44H52ClF3N8O6 881,37; найдено 881,8.
Пример 11: метиловый эфир [(S)-1-((2S,4S)-2-{4-[4'-({6-[(R)-4-(2,2-диметилпропионил)-2-метилпиперазин-1-ил]пиридин-3-карбонил}амино)-5'-фтор-2'-трифторметоксибифенил-4-ил]-1H-имидазол-2-ил}-4-метилпирролидин-1-карбонил)-2-метилпропил]карбаминовой кислоты
(a) трет-бутиловый эфир (R)-4-[5-(5-фтор-4'-{2-[(2S,4S)-1-((S)-2-метоксикарбониламино-3-метилбутирил)-4-метилпирролидин-2-ил]-1H-имидазол-4-ил}-2-трифторметоксибифенил-4-илкарбамоил)пиридин-2-ил]-3-метилпиперазин-1-карбоновой кислоты
К раствору метилового эфира [(S)-2-метил-1-((2S,4S)-4-метил-2-{4-[4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-1H-имидазол-2-ил}пирролидин-1-карбонил)пропил]карбаминовой кислоты (170 мг, 0,33 ммоль) и трет-бутилового эфира (R)-4-[5-(4-бром-2-фтор-5-трифторметоксифенилкарбамоил)пиридин-2-ил]-3-метилпиперазин-1-карбоновой кислоты (192 мг, 0,33 ммоль, препаративный пример 24) в толуоле (2,1 мл) и воде (0,8 мл) добавляют карбонат калия (230 мг, 1,67 ммоль). Реакционную смесь продувают азотом, добавляют Pd(dppf)Cl2·CH2Cl2 (25 мг, 0,03 ммоль) и реакционную смесь продувают азотом и нагревают при 90°С в течение ночи. Реакционную смесь охлаждают до комнатной температуры, фильтруют через слой Celite ® и силикагеля и промывают с помощью EtOAc. Фильтрат промывают водой и насыщенным раствором соли, получая масло коричневатого цвета. Остаток очищают хроматографией на силикагеле (24 г, от 40% до 100% EtOAc/гексан) и получают указанное в названии промежуточное соединение в виде желтоватого твердого вещества (227 мг, выход 78%). (m/z): [M+H]+ рассчитано для C44H52F4N8O7 881,39; найдено 881,4.
(b) метиловый эфир ((S)-1-{(2S,4S)-2-[4-(5'-фтор-4'-{[6-((R)-2-метилпиперазин-1-ил)пиридин-3-карбонил]амино}-2'-трифторметоксибифенил-4-ил)-1H-имидазол-2-ил]-4-метилпирролидин-1-карбонил}-2-метилпропил)карбаминовой кислоты
Твердое вещество, полученное на предыдущей стадии (227 мг), обрабатывают 4 М раствором HCl в 1,4-диоксане (1,67 мл) и НСl (0,51 мл) смесь и реакционную смесь перемешивают при комнатной температуре в течение 1 час. Реакционную смесь концентрируют и упаривают с этилацетатом (2 х), получая три-HCl соль указанного в названии промежуточного соединения в виде твердого вещества желтого цвета (237 мг, выход 80%). (m/z): [M+H]+ вычислено для C39H44F4N8O5 781,34; найдено 781,3.
(c) метиловый эфир [(S)-1-((2S,4S)-2-{4-[4'-({6-[(R)-4-(2,2-диметилпропионил)-2-метилпиперазин-1-ил]пиридин-3-карбонил}амино)-5'-фтор-2'-трифторметоксибифенил-4-ил]-1H-имидазол-2-ил}-4-метилпирролидин-1-карбонил)-2-метилпропил]карбаминовой кислоты
К продукту, полученному на предыдущей стадии (15 мг, 0,017 ммоль), растворенному в DMA (1 мл) добавляют N,N-диизопропилэтиламин (14,4 мкл, 0,083 ммоль), а затем 2,2-диметилпропаноилхлорид (24 мг, 0,020 ммоль) и реакционную смесь перемешивают при комнатной температуре в течение ночи, концентрируют, растворяют в смеси 1:1 уксусная кислота:вода (1,5 мл) и очищают методом ВЭЖХ с обращенной фазой, получая ди-TFA соль указанного в названии соединения (15 мг, выход 81%). (m/z): [M+H] + вычислено для C44H52F4N8O6 865,39; найдено 865,8.
Пример 12: метиловый эфир ((S)-1-{(2S,4S)-2-[5-хлор-4-(4'-{6-[(R)-4-(2,2-диметилпропионил)-2-метилпиперазин-1-ил]пиридин-3-илкарбамоил}-2'-трифторметоксибифенил-4-ил)-1H-имидазол-2-ил]-4-метилпирролидин-1-карбонил}-2-метилпропил)карбаминовой кислоты
(a) метиловый эфир {(S)-1-[(2S,4S)-2-(5-хлор-4-{4'-[6-((R)-2-метилпиперазин-1-ил)-пиридин-3-илкарбамоил]-2'-трифторметоксибифенил-4-ил}-1H-имидазол-2-ил)-4-метилпирролидин-1-карбонил]-2метилпропил}карбаминовой кислоты
К смеси TFA соли 4'-{5-хлор-2-[(2S,4S)-1-((S)-2-метоксикарбониламино-3-метилбутирил)-4-метилпирролидин-2-ил]-1H-имидазол-4-ил}-2-трифторметоксибифенил-4-карбоновой кислоты (48 мг, 0,06 ммоль; препаративный пример 25) и HATU (27 мг, 0,07 ммоль) в ДМФА (1 мл) при комнатной температуре добавляют трет-бутиловый эфир 4-(5-аминопиридин-2-ил)-3-метилпиперазин-1-карбоновой кислоты (21 мг, 0,07 ммоль), а затем N,N-диизопропилэтиламин (67,6 мкл, 0,39 ммоль). Реакционную смесь перемешивают в течение 1 час и распределяют между EtOAc (10 мл) и водой (3 мл). Органический слой промывают водой (2 мл), сушат над сульфатом натрия, отфильтровывают, концентрируют и получают темное масло, которое очищают хроматографией на силикагеле (0-100% EtOAc/гексан). Требуемые фракции объединяют и концентрируют, получают желтоватое масла.
Маслянистый остаток, полученный на предыдущей стадии, обрабатывают 4 М раствором НСl в 1,4-диоксане (1,0 мл) при комнатной температуре в течение 30 мин. Реакционную смесь концентрируют, упаривают вместе с EtOAc (2×2 мл) и сушат в вакууме, получая три-HCl соль указанного в названии промежуточного соединения (47 мг) в виде светло-желтого твердого вещества. (m/z): [M+H]+ рассчитано для C39H44ClF3N8O5 797,31; найдено 797.
(b) метиловый эфир ((S)-1-{(2S,4S)-2-[5-хлор-4-(4'-{6-[(R)-4-(2,2-диметилпропионил)-2-метилпиперазин-1-ил]пиридин-3-илкарбамоил}-2'-трифторметоксибифенил-4-ил)-1H-имидазол-2-ил]-4-метилпирролидин-1-карбонил}-2-метилпропил)карбаминовой кислоты
К смеси продукта, полученного на предыдущей стадии (12 мг, 0,013 ммоль), и N,N-диизопропилэтиламина (13,6 мкл, 0,078 ммоль) в ДМФА (0,5 мл) при комнатной температуре добавляют 2,2-диметилпропаноилхлорид (1,92 мкл, 0,016 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 1 час, концентрируют, растворяют в смеси 1:1 уксусная кислота:вода (1,5 мл) и очищают методом ВЭЖХ с обращенной фазой, получая ди-TFA соль указанного в названии соединения (6 мг). (m/z): [M+H]+ вычислено для C44H52ClF3N8O6 881,37; найдено 881,8.
Пример 13: метиловый эфир ((S)-1-{(2S,4S)-2-[4-(4'-{[6-((R)-4-трет-бутил-2-метилпиперазин-1-ил)пиридин-3-карбонил]амино}-5'-хлор-2'-трифторметоксибифенил-4-ил)-1H-имидазол-2-ил]-4-метоксипирролидин-1-карбонил}-2-метилпропил)карбаминовой кислоты
К раствору три-HCl соли метилового эфира ((S)-1-{(2S,4S)-2-[4-(5'-хлор-4'-{[6-((R)-2-метилпиперазин-1-ил)пиридин-3-карбонил]амино}-2'-трифторметоксибифенил-4-ил)-1H-имидазол-2-ил]-4-метоксипирролидин-1-карбонил}-2-метилпропил)карбаминовой кислоты (10 мг, 0,01 ммоль; препаративный пример 28) в DMA (1 мл) добавляют N,N-диизопропилэтиламин (9,44 мкл, 0,05 ммоль), а затем добавляют 2,2-диметилпропаноилхлорид (1,31 мг, 0,01 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи, концентрируют на роторном испарителе, растворяют в смеси 1:1 уксусная кислота:вода (1,5 мл) и очищают методом ВЭЖХ с обращенной фазой, получая ди-TFA соль указанного в названии соединения (7 мг, выход 51%). (m/z): [M+H]+ вычислено для C44H52ClF3N8O7 897,36; найдено 897,8.
Пример 14А: метиловый эфир [(S)-2-((2S,4S)-2-{4-[5'-хлор-4'-({6-[(R)-4-(2,2-диметилпропионил)-2-метилпиперазин-1-ил]пиридин-3-карбонил}амино)-2'-трифторметоксибифенил-4-ил]-1H-имидазол-2-ил}-4-метилпирролидин-1-ил)-2-оксо-1-(тетрагидропиран-4-ил)этил]карбаминовой кислоты
К раствору (S)-метоксикарбониламино-(тетрагидропиран-4-ил)уксусной кислоты (9,4 мг, 0,046 ммоль; препаративный пример 29) в DMA (5 мл) добавляют HATU (45,3 мг, 0,12 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 15 мин и добавляют три-HCl соль N-{5-хлор-4'-[2-((2S,4S)-4-метилпирролидин-2-ил)-1H-имидазол-4-ил]-2-трифторметоксибифенил-4-ил}-6-[(R)-4-(2,2-диметилпропионил)-2-метилпиперазин-1-ил]никотинамида (30,0 мг, 0,036 ммоль; препаративный пример 31), а затем добавляют DIPEA (86,4 мкл, 0,50 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи, концентрируют на роторном испарителе, растворяют в смеси 1:1 уксусная кислота:вода (1,5 мл) и очищают методом ВЭЖХ с обращенной фазой, получая ди-TFA соль указанного в названии соединения (14 мг, выход 37%). (m/z): [M+H]+ вычислено для C46H54ClF3N8O7 923,38; найдено 923,8.
Пример 14B: метиловый эфир [(S)-2-((2S,4S)-2-{4-[5'-хлор-4'-({6-[(R)-4-(2,2-диметилпропионил)-2-метилпиперазин-1-ил]пиридин-3-карбонил}амино)-2'-трифторметоксибифенил-4-ил]-1H-имидазол-2-ил}-4-метоксипирролидин-1-ил)-2-оксо-1-(тетрагидропиран-4-ил)этил]карбаминовой кислоты
(a) (2S,4S)-трет-бутил 2-(4-(5'-хлор-4'-(6-((R)-2-метил-4-пивалоилпиперазин-1-ил)никотинамидо)-2'-(трифторметокси)-[1,1'-бифенил]-4-ил)-1H-имидазол-2-ил)-4-метилпирролидин-1-карбоксилат
В круглодонную колбу помещают (2S,4S)-трет-бутил 2-(4-(4-бромфенил)-1H-имидазол-2-ил)-4-метилпирролидин-1-карбоксилата (10 г, 24,61 ммоль), (R)-(5-хлор-4-(6-(2-метил-4-пивалоилпиперазин-1-ил)никотинамидо)-2-(трифторметокси)фенил)бороновую кислоту (14,16 г, 26,1 ммоль), натрий бикарбонат (7,24 г, 86 ммоль), бис(ди-трет-бутил-(4-диметиламинофенил)фосфин)дихлорпалладий(II) (0,17 г, 0,246 ммоль), 2-метилтетрагидрофуран (120 мл) и воду (44,3 мл) и получают суспензию. Реакционную смесь дегазируют азотом в течение 10 мин, затем оставляют на ночь нагреваться при температуре 70°С. Добавляют воду (60 мл) и слои разделяют. Органический слой промывают насыщенным раствором соли, сушат над Na2SO4, упаривают и получают неочищенный продукт (27,3 г). Сырой продукт очищают флэш-хроматографией (300 г силикагеля, 20-100% EtOAc (50 мин), а затем 100% EtOAc (20 мин)) и получают указанное в названии промежуточное соединение (18,8 г, выход 93%). ВЭЖХ, способ B: время удерживания 14,99 мин.
(b) N-(5-хлор-4'-(2-((2S,4S)-4-метилпирролидин-2-ил)-1H-имидазол-4-ил)-2-(трифторметокси)-[1,1'-бифенил]-4-ил)-6-((R)-2-метил-4-пивалоилпиперазин-1-ил)никотинамид
Раствор продукта, полученного на предыдущей стадии (18,8 г, 22,81 ммоль), в DCM (82 мл) охлаждают до 5°С, а затем добавляют TFA (26,4 мл). Реакционную смесь перемешивают в течение ночи и концентрируют. К реакционной смеси добавляют MTBE (300 мл), 1Ν раствор HCl (200 мл) и воду (100 мл). Органическую фазу экстрагируют 0,5 Ν раствором НСl (100 мл). Водную фазу объединяют, подщелачивают 50% водным раствором NaOH (17 мл) и экстрагируют изопропилацетатом (500 мл). Органический слой сушат над Na2SO4, упаривают и получают указанное в названии промежуточное соединение (13,6 г, выход 82%)). ВЭЖХ Метод B: время удерживания 11,75 мин.
(c) метиловый эфир [(S)-2-((2S,4S)-2-{4-[5'-хлор-4'-({6-[(R)-4-(2,2-диметилпропионил)-2-метилпиперазин-1-ил]пиридин-3-карбонил}амино)-2'-трифторметоксибифенил-4-ил]-1H-имидазол-2-ил}-4-метилпирролидин-1-ил)-2-оксо-1-(тетрагидропиран-4-ил)этил]карбаминовой кислоты
Раствор продукта, полученного на предыдущей стадии (10 г, 13,81 ммоль), (S)-2-((метоксикарбонил)амино)-2-(тетрагидро-2Н-пиран-4-ил)уксусной кислоты (3,15 г, 14,50 ммоль) и ДМФА (120 мл) охлаждают до 0-10°С и затем добавляют HCTU (6,00 г, 14,50 ммоль) с последующим добавлением DIPEA (4,82 мл, 27,6 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Добавляют этилацетат (250 мл) и воду (150 мл); органический слой промывают насыщенным раствором Na2CO3 (100 мл) и насыщенным раствором соли, сушат над Na2SO4 и упаривают, получая первый неочищенный продукт (23,7 г). К первому сырому продукта добавляют метанол (85 мл) и 2N раствор LiOH (7 мл). Через 45 мин реакционную смесь высушивают над Na2SO4, упаривают и получают второй неочищенный продукт, который очищают флэш-хроматографией (300 г силикагеля, 1-8% метанол/DCM в течение 30 мин, затем 8% в течение 20 мин) и получают продукт в виде твердого вещества (7,7 г). К твердому продукту добавляют ТГФ (30 мл) и полученный раствор добавляют по каплям в гексан (165 мл). Полученную смесь фильтруют и оставляют на ночь сушиться в вакууме, получая указанное в названии соединение (6,48 г, выход 49%) в виде твердого вещества. ВЭЖХ Метод B: время удерживания 14,47 мин.
Пример 15А: метиловый эфир [(S)-2-((2S,4S)-2-{4-[5'-хлор-4'-({6-[(R)-4-(2,2-диметилпропионил)-2-метилпиперазин-1-ил]пиридин-3-карбонил}амино)-2'-трифторметоксибифенил-4-ил]-1H-имидазол-2-ил}-4-метоксипирролидин-1-ил)-2-оксо-1-(тетрагидропиран-4-ил)этил]карбаминовой кислоты
К раствору (S)-метоксикарбониламино-(тетрагидропиран-4-ил)уксусной кислоты (9,4 мг, 0,046 ммоль, препаративный пример 29) в DMA (1 мл) добавляют HATU (6,4 мг, 0,017 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 15 мин и добавляют три-HCl соль N-{5-хлор-4'-[2-((2S,4S)-4-метоксипирролидин-2-ил)-1H-имидазол-4-ил]-2-трифторметоксибифенил-4-ил}-6-[(R)-4-(2,2-диметилпропионил)-2-метилпиперазин-1-ил]никотинамида (12,0 мг, 0,014 ммоль; препаративный пример 32), а затем добавляют DIPEA (12,3 мкл, 0,07 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи, концентрируют на роторном испарителе, растворяют в смеси 1:1 уксусная кислота:вода (1,5 мл) и очищают методом ВЭЖХ с обращенной фазой, получая ди-TFA соль указанного в названии соединения (9 мг, 56% выход). (m/z): [M+H]+ вычислено для C46H54ClF3N8O8 939,37; найдено 939,8.
Пример 15B: метиловый эфир [(S)-2-((2S,4S)-2-{4-[5'-хлор-4'-({6-[(R)-4-(2,2-диметилпропионил)-2-метилпиперазин-1-ил]пиридин-3-карбонил}амино)-2'-трифторметоксибифенил-4-ил]-1H-имидазол-2-ил}-4-метокси-пирролидин-1-ил)-2-оксо-1-(тетрагидропиран-4-ил)этил]карбаминовой кислоты
(a) трет-бутиловый эфир (2S,4S)-2-{4-[5'-хлор-4'-({6-[(R)-4-(3-гидрокси-2,2-диметилпропионил)-2-метилпиперазин-1-ил]пиридин-3-карбонил}амино)-2'-трифторметоксибифенил-4-ил]-1H-имидазол-2-ил}-4-метоксипирролидин-1-карбоновой кислоты
В круглодонную колбу помещают трет-бутиловый эфир (2S,4S)-2-[4-(4-бромфенил)-1H-имидазол-2-ил]-4-метоксипирролидин-1-карбоновой кислоты (5,0 г, 11,8 ммоль) и (R)-5-хлор-4-(6-(2-метил-4-пивалоилпиперазин-1-ил)никотинамидо)-2-(трифторметокси)фенилбороновую кислоту (6,75 г, 12,4 ммоль, препаративный пример 44), карбонат калия (5,73 г, 41,4 ммоль) и бис(ди-трет-бутил(4-диметиламинофенил)фосфин)дихлорпалладий(II) (0,092 г, 0,130 ммоль), а затем добавляют дегазированный тетрагидрофуран (50 мл) и воду (1,28 мл). Реакционную смесь дегазируют азотом в течение 5 мин, а затем нагревают до 65°С в течение 4 час и охлаждают до комнатной температуры. Добавляют воду (100 мл) и реакционную смесь экстрагируют с помощью EtOAc (200 мл). Органический слой промывают с помощью NaOH (2×100 мл), водой (2×200 мл) и насыщенным раствором соли, сушат над Na2SO4 и упаривают, получая неочищенный продукт (12,25 г). Сырой продукт очищают флэш-хроматографией (150 г силикагеля, 50-100% EtOAc (10 мин), затем 100% EtOAc (30 мин)) и получают указанное в названии промежуточное соединение (4,2 г, выход 41%). ВЭЖХ, способ B: время удерживания 15,29 мин.
(b) N-{5-хлор-4'-[2-((2S,4S)-4-метоксипирролидин-2-ил)-1H-имидазол-4-ил]-2-трифторметоксибифенил-4-ил}-6-[(R)-4-(2,2-диметилпропионил)-2-метилпиперазин-1-ил]никотинамид
Раствор в DCM (18,01 мл) продукта, полученного на предыдущей стадии (4,2 г, 5,00 ммоль), охлаждают до 5°С, а затем добавляют TFA (5,78 мл). Реакционную смесь перемешивают в течение ночи и концентрируют. Добавляют этилацетат (80 мл); промывают реакционную смесь 1Ν раствором NaOH (2×80 мл), водой и насыщенным раствором соли; сушат над Na2SO4 и упаривают, получая указанное в названии промежуточное соединение (3,56 г, выход 96%)). ВЭЖХ Метод B: время удерживания 12,33 мин.
(c) метиловый эфир [(S)-2-((2S,4S)-2-{4-[5'-хлор-4'-({6-[(R)-4-(2,2-диметилпропионил)-2-метилпиперазин-1-ил]пиридин-3-карбонил}амино)-2'-трифторметоксибифенил-4-ил]-1H-имидазол-2-ил}-4-метоксипирролидин-1-ил)-2-оксо-1-(тетрагидропиран-4-ил)этил]карбаминовой кислоты
Раствор продукта, полученного на предыдущей стадии (3,56 г, 4,81 ммоль), (S)-2-((метоксикарбонил)амино)-2-(тетрагидро-2Н-пиран-4-ил)уксусной кислоты (1,097 г, 5,05 ммоль) и ДМФА (43 мл) охлаждают до 0-10°С, а затем добавляют HCTU (2,089 г, 5,05 ммоль) и DIPEA (1,68 мл, 9,62 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 3 часов. Добавляют этилацетат (150 мл) и воду (100 мл); органический слой промывают насыщенным раствором Na2CO3 (100 мл) и насыщенным раствором соли, сушат над Na2SO4 и упаривают, получая сырой продукт (5,4 г), который очищают флэш-хроматографией (133 г силикагеля, от EtOAc до 10% MeOH/EtOAc (15 мин), затем 10% MeOH/EOAс (15 мин)) и получают указанное в названии соединение (2,8 г, выход 61%), которое сушат в вакууме в течение ночи. ВЭЖХ Метод B: время удерживания 13,70 мин.
Пример 16: метиловый эфир [(S)-2-((2S,4S)-2-{4-[5'-хлор-4'-({6-[(R)-4-(3-гидрокси-2,2-диметилпропионил)-2-метилпиперазин-1-ил]пиридин-3-карбонил}амино)-2'-трифторметоксибифенил-4-ил]-1H-имидазол-2-ил}-4-метоксипирролидин-1-ил)-2-оксо-1-(тетрагидропиран-4-ил)этил]карбаминовой кислоты
К раствору (S)-метоксикарбониламино-(тетрагидропиран-4-ил)уксусной кислоты (37,6 мг, 0,17 ммоль) в DMA (1 мл) добавляют HATU (65,9 мг, 0,17 ммоль). Реакционную смесь перемешивают в течение 15 мин и добавляют 3-HCl соль N-{5-хлор-4'-[2-((2S,4S)-4-метоксипирролидин-2-ил)-1H-имидазол-4-ил]-2-трифторметоксибифенил-4-ил}-6-[(R)-4-(3-гидрокси-2,2-диметилпропионил)-2-метилпиперазин-1-ил]никотинамида (100 мг, 0,12 ммоль; препаративный пример 34), а затем добавляют DIPEA (0,10 мл, 0,58 ммоль) и реакционную смесь перемешивают при комнатной температуре в течение ночи, концентрируют на роторном испарителе, растворяют в смеси 1:1 уксусная кислота:вода (4 мл) и очищают методом ВЭЖХ с обращенной фазой. Фракции, содержащие требуемое соединение, объединяют и лиофилизуют, получая ди-TFA соль указанного в названии соединения (65,2 мг) в виде белого порошка. Неочищенные фракции лиофилизуют, растворяют в смеси 1:1 уксусная кислота:вода (1,5 мл) и очищают методом ВЭЖХ с обращенной фазой, получая дополнительное количество ди-TFA соли указанного в названии соединения (всего 75 мг, выход 55%). (m/z): [M+H]+ вычислено для C46H54ClF3N8O9 955,37; найдено 955,8.
Пример 17: трет-бутиловый эфир (R)-4-[5-(5-хлор-4'-{2-[(2S,4S)-4-циано-1-((S)-2-метоксикарбониламино-3-метилбутирил)пирролидин-2-ил]-1H-имидазол-4-ил}-2-трифторметоксибифенил-4-илкарбамоил)пиридин-2-ил]-3-метилпиперазин-1-карбоновой кислоты
Раствор метилового эфира [(S)-1-((2S,4S)-4-циано-2-{4-[4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]-1H-имидазол-2-ил}пирролидин-1-карбонил)-2-метилпропил]карбаминовой кислоты (0,10 г, 0,19 ммоль), трет-бутилового эфира (R)-4-[5-(4-бром-2-хлор-5-трифторметоксифенилкарбамоил)пиридин-2-ил]-3-метилпиперазин-1-карбоновой кислоты (113,9 мг, 0,19 ммоль) и карбоната калия (119,3 мг, 0,86 ммоль) в толуоле (0,46 мл) и воде (0,24 мл, 13,56 ммоль) дегазируют азотом в течение 20 мин, а затем добавляют Pd(dppf)Cl2·CH2Cl2 (6,27 мг, 0,0076 ммоль) и реакционную смесь дегазируют азотом в течение 15 мин. Реакционную смесь нагревают до 100°С в течение 12 час, концентрируют в вакууме и очищают методом ВЭЖХ с обращенной фазой. Чистые фракции объединяют и концентрируют в вакууме, получая ди-TFA соль указанного в названии соединения (13 мг, выход 6%). (m/z): [M+H]+ вычислено для C44H49ClF3N9O7 908,34; найдено 908,7.
Пример 18: метиловый эфир ([(S)-1-((2S,4S)-4-карбамоил-2-{4-[5'-хлор-4'-({6-[(R)-4-(2,2-диметилпропионил)-2-метилпиперазин-1-ил]пиридин-3-карбонил}амино)-2'-трифторметоксибифенил-4-ил]-1H-имидазол-2-ил}пирролидин-1-карбонил)-2-метилпропил]карбаминовой кислоты
(a) метиловый эфир ((S)-1-{(2S,4S)-4-карбамоил-2-[4-(5'-хлор-4'-{[6-((R)-2-метилпиперазин-1-ил)пиридин-3-карбонил]амино}-2'-трифторметоксибифенил-4-ил)-1H-имидазол-2-ил]пирролидин-1-карбонил}-2-метилпропил)карбаминовой кислоты
Раствор 2-TFA соли трет-бутилового эфира (R)-4-[5-(5-хлор-4'-{2-[(2S,4S)-4-циано-1-((S)-2-метоксикарбониламино-3-метилбутирил)пирролидин-2-ил]-1H-имидазол-4-ил}-2-трифторметоксибифенил-4-илкарбамоил)пиридин-2-ил]-3-метилпиперазин-1-карбоновой кислоты (6,3 мг, 0,0055 ммоль, пример 17) в 4,0 М растворе HCl в 1,4-диоксане (0,14 мл) перемешивают при комнатной температуре в течение 1 час и концентрируют в вакууме, получая указанное в названии промежуточное соединение в виде порошка желтого цвета. (m/z): [M+H]+ вычислено для C39H43ClF3N9O6 826,30; найдено 826,5.
(b) метиловый эфир ([(S)-1-((2S,4S)-4-карбамоил-2-{4-[5'-хлор-4'-({6-[(R)-4-(2,2-диметилпропионил)-2-метилпиперазин-1-ил]пиридин-3-карбонил}амино)-2'-трифторметоксибифенил-4-ил]-1H-имидазол-2-ил}пирролидин-1-карбонил)-2-метилпропил]карбаминовой кислоты
Продукт, полученный на предыдущей стадии, растворяют в DMA (0,28 мл, 2,99 ммоль) и последовательно добавляют 2,2-диметилпропаноилхлорид (0,68 мкл, 0,0055 ммоль) и DIPEA (4,83 мкл, 0,028 ммоль). Раствор перемешивают при комнатной температуре в течение 1 час, концентрируют в вакууме, растворяют в смеси 1:1 уксусная кислота:ACN (1,5 мл) и очищают методом ВЭЖХ с обращенной фазой, получая ди-TFA соль указанного в названии соединения (4 мг, выход 57%). (m/z): [M+H]+ вычислено для C44H51ClF3N9O7 910,36; найдено 910,8.
Пример 19: метил ((S)-2-((2S,4S)-2-(4-(5'-хлор-4'-((6-((R)-2-метил-4-пивалоилпиперазин-1-ил)пиридин-3-ил)карбамоил)-2'-(трифторметокси)-[1,1'-бифенил]-4-ил)-1H-имидазол-2-ил)-4-метилпирролидин-1-ил)-2-оксо-1-(тетрагидро-2Н-пиран-4-ил)этил)карбамат
(a) (R)-трет-бутил 4-(5-(5-хлор-4'-(2-((2S,4S)-1-((S)-2-((метоксикарбонил)амино)-2-(тетрагидро-2Н-пиран-4-ил)ацетил)-4-метилпирролидин-2-ил)-1H-имидазол-4-ил)-2-(трифторметокси)-[1,1'-бифенил]-4-илкарбоксамидо)пиридин-2-ил)-3-метилпиперазин-1-карбоксилат
К смеси толуола (1 мл) и воды (0,4 мл) добавляют метил ((S)-2-((2S,4S)-4-метил-2-(5-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-1H-имидазол-2-ил)пирролидин-1-ил)-2-оксо-1-(тетрагидро-2Н-пиран-4-ил)этил)карбамат (90 мг, 0,16 ммоль; препаративный пример 46), (R)-трет-бутил 4-(5-(4-бром-2-хлор-5-(трифторметокси)бензамидо)пиридин-2-ил)-3-метилпиперазин-1-карбоксилат (97 мг, 0,16 ммоль; препаративный пример 49) и карбонат калия (118 мг, 0,86 ммоль). Реакционную смесь продувают азотом, добавляют Pd(dppf)Cl2 (7,17 мг, 9,77 мкмол) и реакционную смесь продувают азотом, герметично закрывают, нагревают до 90°С в течение ночи, экстрагируют этилацетатом и промывают водой и насыщенным раствором соли. Органический слой сушат над сульфатом натрия, отфильтровывают, концентрируют и очищают хроматографией на силикагеле (колонка 12 г, 0-100% этилацетат:гексан), получая указанное в названии промежуточное соединение (70,3 мг, выход 45,9%) в виде твердого вещества желтого цвета. (m/z): [M+H]+ вычислено для C46H54ClF3N8O8 939,37; найдено 939,30.
(b) метил ((S)-2-((2S,4S)-2-(4-(5'-хлор-4'-((6-((R)-2-метилпиперазин-1-ил)пиридин-3-ил)карбамоил)-2'-(трифторметокси)-[1,1'-бифенил]-4-ил)-1H-имидазол-2-ил)-4-метилпирролидин-1-ил)-2-оксо-1-(тетрагидро-2Н-пиран-4-ил)этил)карбамат
Продукт, полученный на предыдущей стадии (70,3 мг, 0,075 ммоль), обрабатывают 4 М раствором HCl в диоксане (1 мл, 0,075 ммоль) и перемешивают при комнатной температуре в течение 1 час. Реакционную смесь концентрируют и упаривают с этилацетатом (2 х), получая три-HCl соль указанного в названии промежуточного соединения (70,5 мг, выход 99%) в виде твердого вещества желтого цвета. (m/z): [M+H]+ рассчитано для C41H46ClF3N8O6 839,32; найдено 839,20.
(c) метил ((S)-2-((2S,4S)-2-(4-(5'-хлор-4'-((6-((R)-2-метил-4-пивалоилпиперазин-1-ил)пиридин-3-ил)карбамоил-2'-(трифторметокси)-[1,1'-бифенил]-4-ил)-1H-имидазол-2-ил)-4-метилпирролидин-1-ил)-2-оксо-1-(тетрагидро-2Н-пиран-4-ил)этил)карбамат
К раствору продукта, полученного на предыдущей стадии (70,5 мг, 0,074 ммоль), и DIPEA (0,091 мл, 0,52 ммоль) в ДМФА (0,5 мл) добавляют пивалоилхлорид (9,0 мг, 0,075 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 30 мин. Реакционную смесь концентрируют, растворяют в смеси 1:1 уксусная кислота:вода (1,5 мл) и очищают методом ВЭЖХ с обращенной фазой. Фракции, содержащие требуемый продукт, сушат вымораживанием и получают ди-TFA соль указанного в названии соединения в виде белого порошка (32,0 мг, выход 37,2%). (m/z): [M+H]+ вычислено для C46H54ClF3N8O7 923,38; найдено 923,30.
Пример 20: метил ((S)-2-((2S,4S)-2-(4-(2'-хлор-4'-((6-((R)-2-метил-4-пивалоилпиперазин-1-ил)пиридин-3-ил)карбамoил)-6'-(трифторметокси)-[1,1'-бифенил]-4-ил)-1H-имидазол-2-ил)-4-метилпирролидин-1-ил)-2-оксо-1-(тетрагидро-2Н-пиран-4-ил)этил)карбамат
(a) (2S,4S)-трет-бутил 2-(4-(2'-хлор-4'-((6-((R)-2-метил-4-пивалоилпиперазин-1-ил)пиридин-3-ил)карбамоил)-6'-(трифторметокси)-[1,1'-бифенил]-4-ил)-1H-имидазол-2-ил)-4-метилпирролидин-1-карбоксилат
К смеси (R)-4-бром-3-хлор-N-(6-(2-метил-4-пивалоилпиперазин-1-ил)пиридин-3-ил)-5-(трифторметокси)бензамида (80,3 мг, 0,14 ммоль; препаративный пример 51) и (2S,4S)-трет-бутил 4-метил-2-(4-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-1H-имидазол-2-ил)пирролидин-1-карбоксилата (63,0 мг, 0,14 ммоль) в смеси толуола (0,9 мл) и воды (0,3 мл) добавляют карбонат калия (86 мг, 0,63 ммоль). Реакционную смесь продувают азотом, добавляют PdCl2(dppf) (6,1 мг, 8,34 мкмол). Реакционную смесь герметично закрывают, оставляют на ночь нагреваться при 100°С, охлаждают до комнатной температуры и распределяют между EtOAc (5 мл) и водой (2 мл). Органический слой сушат над сульфатом натрия, отфильтровывают и концентрируют, получая коричневое масло, которое очищают хроматографией на силикагеле (12 г силикагеля, 0-100% EtOAc/гексан). Требуемые фракции объединяют и концентрируют, получая указанное в названии промежуточное соединение (58,1 мг, выход 51%) в виде желтоватого масла. (m/z): [M+H]+ вычислено для C42H49ClF3N7O5 824,34; найдено 824.
(b) 2-хлор-N-(6-((R)-2-метил-4-пивалоилпиперазин-1-ил)пиридин-3-ил)-4'-(2-((2S,4S)-4-метилпирролидин-2-ил)-1H-имидазол-4-ил)-6-(трифторметокси)-[1,1'-бифенил]-4-карбоксамид
К продукту, полученному на предыдущей стадии (58,1 мг, 0,07 ммоль), добавляют 4,0 Ν раствор HCl в диоксане (0,18 мл, 0,70 ммоль). Через 30 мин реакционную смесь концентрируют и упаривают вместе с EtOAc (3×3 мл) и получают ди-HCl соль указанного в названии промежуточного соединения в виде желтоватого твердого вещества. (m/z): [M+H]+, вычислено для C37H41ClF3N7O3 724,29; найдено 724.
(c) метил ((S)-2-((2S,4S)-2-(4-(2'-хлор-4'-((6-((R)-2-метил-4-пивалоилпиперазин-1-ил)пиридин-3-ил)карбамoил)-6'-(трифторметокси)-[1,1'-бифенил]-4-ил)-1H-имидазол-2-ил)-4-метилпирролидин-1-ил)-2-оксо-1-(тетрагидро-2Н-пиран-4-ил)карбамат
К смеси продукта, полученного на предыдущей стадии (65,8 мг, 0,083 ммоль), и (S)-2-((метоксикарбонил)амино)-2-(тетрагидро-2Н-пиран-4-ил)уксусной кислоты (19,7 мг, 0,091 ммоль) в DMA (0,5 мл) при комнатной температуре добавляют HATU (34,5 мг, 0,091 ммоль) и DIPEA (0,043 мл, 0,248 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи, концентрируют, растворяют в смеси 1:1 уксусная кислота:вода (1,5 мл), отфильтровывают и очищают методом ВЭЖХ с обращенной фазой. Требуемые фракции объединяют и сушат вымораживанием, получая ди-TFA соль указанного в названии соединения (38,9 мг, выход 37%) в виде твердого вещества белого цвета. (m/z): [M+H]+ вычислено для C46H54ClF3N8O7 923,38; найдено 923,6.
Пример 21: метил ((S)-2-((2S,4S)-2-(4-(3'-фтор-4'-((6-((R)-2-метил-4-пивалоилпиперазин-1-ил)пиридин-3-ил)карбамoил)-2'-(трифторметокси)-[1,1'-бифенил]-4-ил)-1H-имидазол-2-ил)-4-метилпирролидин-1-ил)-2-оксо-1-(тетрагидро-2Н-пиран-4-ил)этил)карбамат
(a) (2S,4S)-трет-бутил 2-(4-(3'-фтор-4'-((6-((R)-2-метил-4-пивалоилпиперазин-1-ил)пиридин-3-ил)карбамоил)-2'-(трифторметокси)-[1,1'-бифенил]-4-ил)-1H-имидазол-2-ил)-4-метилпирролидин-1-карбоксилат
К раствору (2S,4S)-трет-бутил 4-метил-2-(4-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-1H-имидазол-2-ил)пирролидин-1-карбоксилата (68,6 мг, 0,15 ммоль) и (R)-4-бром-2-фтор-N-(6-(2-метил-4-пивалоилпиперазин-1-ил)пиридин-3-ил)-3-(трифторметокси)бензамида (85 мг, 0,15 ммоль, препаративный пример 52) и карбоната калия (110 мг, 0,80 ммоль) в смеси толуола (1,8 мл) и воды (0,6 мл) добавляют PdCl2(dppf) (6,7 мг, 9,08 мкмол). Смесь продувают азотом в течение 2 мин и нагревают до 100°С в течение ночи, а затем экстрагируют этилацетатом и водой. Органический слой сушат над сульфатом натрия, отфильтровывают, концентрируют и очищают хроматографией на силикагеле (12 г силикагеля, 0-100% EtOAc: гексан в течение 20 мин), получая указанное в названии промежуточное соединение (86,9 мг, выход 71%) в виде твердого вещества желтого цвета. (m/z): [M+H]+ вычислено для C42H49F4N7O5 808,37; найдено 808,7.
(b) 3-фтор-N-(6-((R)-2-метил-4-пивалоилпиперазин-1-ил)пиридин-3-ил)-4'-(2-((2S,4S)-4-метилпирролидин-2-ил)-1H-имидазол-4-ил)-2-(трифторметокси)-[1,1'-бифенил]-4-карбоксамид
К продукту, полученному на предыдущей стадии (86,9 мг, 0,11 ммоль), добавляют 4Ν раствор HCl в диоксане (2 мл, 8,00 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 1 час, концентрируют и упаривают вместе с EtOAc (2 х) и получают ди-HCl соль указанного в названии промежуточного соединения (83 мг, выход 99%) в виде твердого вещества желтого цвета. (m/z): [M+H]+ вычислено для C37H41F4N7O3 708,32; найдено 708,3.
(c) метил ((S)-2-((2S,4S)-2-(4-(3'-фтор-4'-((6-((R)-2-метил-4-пивалоилпиперазин-1-ил)пиридин-3-ил)карбамoил)-2'-(трифторметокси)-[1,1'-бифенил]-4-ил)-1H-имидазол-2-ил)-4-метилпирролидин-1-ил)-2-оксо-1-(тетрагидро-2Н-пиран-4-ил)этил)карбамат
К раствору продукта, полученного на предыдущей стадии (83 мг, 0,11 ммоль) и DIPEA (0,094 мл, 0,54 ммоль) в ДМФА (1 мл) добавляют (S)-2-((метоксикарбонил)амино)-2-(тетрагидро-2Н-пиран-4-ил)уксусную кислоту (23 мг, 0,108 ммоль) и HATU (51 мг, 0,14 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 1 час, концентрируют, растворяют в смеси 1:1 уксусная кислота:вода (1,5 мл), очищают методом препаративной ВЭЖХ и получают ди-TFA соль указанного в названии соединения (67,1 мг). (m/z): [M+H]+ вычислено для C46H54F4N8O7 907,41; найдено 907,6.
Используя способы синтеза, аналогичные тем, примеры которых приведены выше, можно получить соединения по примерам 22-24.
Пример 22: метил (S)-2-((2S,4S)-2-(4-(5'-хлор-4'-(6-((R)-2-метил-4-пивалоилпиперазин-1-ил)никотинамидо)-2'-(трифторметокси)бифенил-4-ил)-1H-имидазол-2-ил)-4-метилпирролидин-1-ил)-1-((2S,6S)-2,6-диметилтетрагидро-2H-пиран-4-ил)-2-оксоэтилкарбамат
Пример 23: метил (S)-2-((2S,4S)-2-(4-(5'-хлор-4'-(6-((R)-2-метил-4-пивалоилпиперазин-1-ил)пиридин-3-илкарбамoил)-2'-(трифторметокси)бифенил-4-ил)-1H-имидазол-2-ил)-4-метилпирролидин-1-ил)-1-((2S,6S)-2,6-диметилтетрагидро-2H-пиран-4-ил)-2-оксоэтилкарбамат
Пример 24: метил (S)-2-((2S,5S)-2-(4-(3'-фтор-4'-(6-((R)-2-метил-4-пивалоилпиперазин-1-ил)пиридин-3-илкарбамoил)-2'-(трифторметокси)бифенил-4-ил)-1H-имидазол-2-ил)-5-метилпирролидин-1-ил)-2-оксо-1-(тетрагидро-2H-пиран-4-ил)этилкарбамат
Кроме того, с использованием аналогичных методов синтеза получают соединения, представленные в таблицах 1-29, где пропуск в любом столбце обозначает атом водорода, а символ (R) или (S) в любом столбце обозначает ориентацию соответствующего хирального атома углерода.
(b) Стереоизомеры разделены, но не обозначены
(#) Для всех соединений, где присутствует заместитель R8d, хиральный атом углерода, несущий заместитель R8d, имеет ориентацию (S).
(#) Для всех соединений, где присутствует заместитель R8d, хиральный атом углерода, несущий заместитель R8d, имеет ориентацию (S).
Биологические анализы
Для вируса гепатита C на основе нуклеотидной последовательности были выделены шесть основных различных генотипов, которые дополнительно разделены на подтипы в пределах генотипов.
Соединения по настоящему изобретению демонстрируют ингибирование репликации HCV в одном или нескольких из следующих исследований репликона HCV.
Анализ 1: Исследование репликонов HCV генотипа 1b
Клеточную линию репликона HCV генотипа 1b получали из Apath LLC (Бруклин, Нью-Йорк) (APC144; клеточный субстрат Huh7). В указанном субгеномном репликоне N-конец ядерного белка HCV слит с резистентным к неомицину селектируемым маркером. EMCV IRES располагается в прямом направлении и приводит в действие экспрессию гуманизированной Renilla люциферазы, слитой с неструктурными белками NS3-NS5B. Указанную клеточную линию применяли для определения действенности соединений, используя считывание показаний активности люциферазы как меру ингибирования соединениями уровней репликона.
Клетки выращивали при 37°С в содержащей 5% СО2 атмосфере с использованием увлажненного инкубатора и среды DMEM (Invitrogen), в которую добавляли 10% FBS (HyClone), 1x NEAA (Invitrogen), 1x Pen-Strep (Invitrogen) и 500 мкг/мл G418 (Invitrogen). В 1-й день проведения анализа клетки высевали в количестве 10000 клеток на лунку в белые 96-луночные планшеты для тканевых культур (Costar) в 200 мкл среды без G418. По прошествии четырех часов, как только клетки закреплялись, среду удаляли и заменяли средой (без G418), содержащей определенные количества испытуемых соединений, с целью определения зависимости ответной реакции от дозы. Соединения вначале разбавляли в ДМСО, а затем дополнительно 200х в используемых для анализа средах таким образом, чтобы конечная концентрация ДМСО снизилась до 0,5%. Клетки инкубировали с тестируемыми соединениями в течение 48 час. По окончании инкубационного периода, среды и соединение удаляли из планшетов, и активность люциферазы определяли, используя реагенты Promega Renilla-Glo.
Для анализа данных, строили график зависимости активности люциферазы от концентрации соединения, и значения EC50 определяли с помощью надежной 4-параметрической модели аппроксимации, используя пакет программного обеспечения GraphPad Prism (GraphPad Software, Inc., Сан-Диего, Калифорния). Результаты выражали в виде отрицательного десятичного логарифма величины EC50, pEC50.
Тестируемые соединения, имеющие в данном анализе более высокое значение pEC50, показывали большее ингибирование репликации HCV генотипа 1b. Соединения по настоящему изобретению, протестированные данным методом, обычно показывали величины pEC50 в диапазоне от приблизительно 7 до приблизительно 12.
Анализ 2: Исследование репликонов HCV генотипа 1a
Клеточную линию репликона HCV генотипа 1a получали из Apath LLC (APC89; клеточный субстрат Huh7.5). В указанном субгеномном репликоне N-конец ядерного белка HCV слит с резистентным к неомицину селектируемым маркером. EMCV IRES располагается в прямом направлении и приводит в действие экспрессию неструктурных белков NS3-NS5B. Действенность соединений определяли, используя активность NS3-специфичной протеазы в лизатах как меру ингибирования соединениями уровней репликона.
Клетки выращивали при 37°С в содержащей 5% СО2 атмосфере с использованием увлажненного инкубатора и среды DMEM (Invitrogen), в которую добавляли 10% FBS (HyClone), 1x NEAA (Invitrogen), 1x Pen-Strep (Invitrogen) и 850 мкг/мл G418 (Invitrogen). В 1-й день проведения анализа клетки высевали в количестве 15000 клеток на лунку в черные 96-луночные планшеты для тканевых культур (Costar) в 200 мкл среды без G418. По прошествии четырех часов, как только клетки закреплялись, среду удаляли и заменяли средой (без G418), содержащей определенные количества испытуемых соединений, с целью определения зависимости ответной реакции от дозы. Соединения вначале разбавляли в ДМСО, а затем дополнительно разбавляли 200х в используемых для анализа средах таким образом, чтобы конечная концентрация DMSO снизилась до 0,5%. Клетки инкубировали с тестируемыми соединениями в течение 48 или 72 час. По окончании инкубационного периода, среды и соединение удаляли из планшетов.
Для определения NS3-специфичной активности протеазы в лизатах, клетки подвергали лизису при комнатной температуре в 50 мкл/лунка среды 50 мМ Hepes, рН 7,5, 150 мМ NaCl, 15% глицерина, 0,15% Triton X-100, 10 мМ DTT в течение 20 минут при встряхивании. Затем добавляли в лунки 50 мкл NS3/4а протеаза-специфичного FRET субстрата (Anaspec RET S1 Cat # 22991) с конечной концентрацией 15 мкΜ. Планшеты инкубировали при 37°С в течение 20 минут, что соответствует временной точке, при которой активность протеазы все еще находится в линейной фазе. Активность протеазы определяли, измеряя флуоресценцию (возбуждение: 340 нм; излучение: 509 нм).
Для анализа данных, строили график величины флуоресценции от концентрации соединения, и значения EC50 определяли с помощью надежной 4-параметрической модели аппроксимации, используя пакет программного обеспечения GraphPad Prism. Соединения по настоящему изобретению, протестированные данным методом, обычно показывали величины pEC50 в диапазоне от приблизительно 6 до приблизительно 11,5.
Анализ 3: Исследования репликонов против резистентных мутантов
Для создания клеток репликонов с представляющими интерес резистентными мутациями, вначале вводили мутацию в родительскую плазмиду путем сайт-направленного мутагенеза. Мутации в генотипе 1b включали L31V, Y93H и двойной мутант L31V/Y93H. Мутации в генотипе 1a включали Q30R и L31V. Плазмидный репликон затем линеаризовали и в условиях in vitro транскрибировали в РНК. РНК использовали для того, чтобы стабильно трансфицировать клетки Huh7 путем электропорации, и новые клеточные линии отбирали с помощью 500 мкг/мл G418. Действенность испытуемых соединений против указанных мутантных клеточных линий определяли, как описано выше для анализов репликонов HCV генотипа 1b и генотипа 1a.
Действенность испытуемых соединений против дополнительных представляющих интерес мутаций, определяли, используя анализы транзиторной трансфекции. Указанные мутанты включали генотип 1a Y93C, Y93H, M28T, Q30E, Q30K, L31M и Y93N. Вначале вводили мутацию в родительскую плазмиду путем сайт-направленного мутагенеза. Плазмидный репликон затем линеаризовали и в условиях in vitro транскрибировали в РНК. РНК использовали для того, чтобы транзиторно трансфицировать клетки Huh-LUNЕT (получали из ReBLikon GmbH, Шрисхайм, Германия) путем электропорации, и действенность испытуемых соединений против указанных мутантов определяли, как описано выше.
Анализ 4: Исследование репликонов против NS5A последовательностей других генотипов
Действенность испытуемых соединений против NS5A последовательностей других генотипов определяли путем создания межгенотипных химер. Полный ген NS5A генотипов 2а, 2b, 3а, 4а, 5а и 6а или нуклеотидную последовательность, кодирующую аминокислоты 11-118 в NS5A, субклонировали в генотип репликона 1b. Для генотипа 2а создавали межгенотипные химеры как со штаммом JFH, так и штаммом J6. В общем случае было показано, ингибиторы NS5A демонстрировали значительно более слабую действенность против штамма J6 из-за присутствия встречающегося в природе варианта последовательности L31M. Поскольку большинство последовательностей генотипа 2а в доступных базах данных содержат вариант последовательности L31M, то использование последовательности J6 генотипа 2а может лучше отразить противовирусную активность ингибиторов NS5A.
Указанные химерные плазмидные репликоны затем линеаризовали и в условиях in vitro транскрибировали в РНК. РНК использовали для того, чтобы транзиторно или стабильно трансфицировать клетки Huh-LUNЕT путем электропорации, и действенность испытуемых соединений против указанных химер определяли, как описано выше.
Анализ 5: Исследование образования колоний
Изучение образования колоний использовали для сравнения испытуемых соединений по отношению к их общему генетическому барьеру к сопротивлению. Генотип 1b и генотип 1a клеток репликонов выращивали в присутствии различных концентраций тестируемых соединений и 500 мкг/мл или 850 мкг/мл генетицина для селекции, соответственно. Среды, содержавшие тестируемое соединение, заменяли дважды в неделю. Через 3-4 недели большинство клеток погибало, а резистентные колонии визуализировали окрашиванием с помощью кристаллического фиолетового. Соединения с повышенной действенностью против ключевых устойчивых мутантов показали значительно меньше колоний, что соответствовало улучшенному общему генетическому барьеру к сопротивлению.
Результаты исследований
Все соединения, приведенные в примерах 1-21 и в таблицах 1-29, были протестированы в одном или в нескольких описанных выше исследованиях. Ниже приведены отдельные результаты для соединений по примерам 1-21 для HCV генотипа 1a, 1b, 2а (штамм J6), 3а и анализы резистентных мутантных 1a Y93H репликонов, а также результаты исследований репликонов HCV генотипов 1a и 1b для соединений, представленных в таблицах 1-29. В следующих таблицах A обозначает величину pEC50 в диапазоне от 6 до 8 (ЕС50 в диапазоне от 1 мкΜ до 10 нМ), В обозначает величину pEC50 в диапазоне от 8 до 9 (ЕС50 в диапазоне от 1 до 10 нМ), С обозначает величину pEC50 в диапазоне от приблизительно 9 до приблизительно 10 (ЕС50 в диапазоне от 1 нМ до 0,1 нМ), а D обозначает величину pEC50 > 10 (ЕС50 <0,1 нМ).
| Пример № | Генотип 1a | Генотип 1b | Генотип 1a Y93H | Генотип 2a (J6) | Генотип 3a |
| 1 | D | D | A | A | A |
| 2 | D | D | B | B | |
| 3 | D | D | |||
| 4 | D | D | C | B | B |
| 5 | C | D | |||
| 6 | C | D | |||
| 7 | D | D | A | A | |
| 8 | D | D | A | A | A |
| 9 | D | D | A | A | |
| 10 | D | D | B | B | B |
| 11 | D | D | A | B | B |
| 12 | D | D | B | B | B |
| 13 | D | D | B | C | C |
| 14 | D | D | B | C | C |
| 15 | D | D | B | C | C |
| 16 | D | D | B | B | B |
| 17 | C | A | A | A | |
| 18 | D | D | B | C | B |
| 19 | D | D | A | B | B |
| 20 | D | D | B | B | B |
| 21 | D | D | C | C | C |
| Пример No. | Генотип 1a | Генотип 1b |
| Таблица 1 | ||
| 1-1 | D | D |
| 1-2 | D | |
| 1-3 | D | D |
| 1-4 | D | |
| 1-5 | D | D |
| 1-6 | D | |
| 1-7 | D | D |
| 1-8 | D | D |
| 1-9 | D | D |
| 1-10 | D | D |
| 1-11 | D | D |
| 1-12 | D | D |
| 1-13 | D | D |
| 1-14 | D | D |
| 1-15 | D | D |
| 1-16 | D | D |
| 1-17 | D | D |
| 1-18 | D | D |
| 1-19 | D | D |
| 1-20 | D | D |
| 1-21 | D | |
| 1-22 | D | |
| 1-23 | D | |
| 1-24 | D | |
| 1-25 | D | |
| 1-26 | D | |
| 1-27 | C | |
| 1-28 | D | |
| 1-29 | D | |
| 1-30 | D | D |
| 1-31 | D | |
| 1-32 | D | |
| 1-33 | C | |
| 1-34 | D | D |
| 1-35 | D | D |
| 1-36 | D | D |
| 1-37 | D | |
| 1-38 | D | |
| 1-39 | D | |
| 1-40 | D | D |
| 1-41 | ||
| 1-42 | D | |
| 1-43 | D | D |
| 1-44 | D | |
| 1-45 | D | |
| 1-46 | D | |
| 1-47 | D | |
| 1-48 | D | |
| 1-49 | D | |
| 1-50 | D | |
| 1-51 | D | |
| 1-52 | C | |
| 1-53 | D | D |
| 1-54 | D | |
| 1-55 | D | D |
| 1-56 | D | |
| 1-57 | D | |
| 1-58 | D | |
| 1-59 | D | |
| 1-60 | D | |
| 1-61 | D | D |
| 1-62 | D | D |
| 1-63 | D |
| 1-64 | C | |
| 1-65 | C | |
| 1-66 | C | |
| 1-67 | D | |
| 1-68 | C | |
| 1-69 | D | |
| 1-70 | D | |
| 1-71 | C | |
| 1-72 | D | |
| 1-73 | D | |
| 1-74 | D | |
| 1-75 | D | D |
| 1-76 | D | |
| 1-77 | D | |
| 1-78 | C | D |
| 1-79 | C | |
| 1-80 | C | |
| 1-81 | D | D |
| 1-82 | C | D |
| 1-83 | C | |
| 1-84 | C | |
| 1-85 | B | |
| 1-86 | D | |
| 1-87 | D | |
| 1-88 | D | |
| 1-89 | D | |
| 1-90 | C | |
| 1-91 | D | |
| 1-92 | D | D |
| 1-93 | D | D |
| 1-94 | D | |
| 1-95 | C | |
| 1-96 | D | D |
| 1-97 | C | |
| 1-98 | C | |
| 1-99 | D | |
| 1-100 | D | |
| 1-101 | D | D |
| Таблица 2 | ||
| 2-1 | C | D |
| 2-2 | C | C |
| 2-3 | D | D |
| 2-4 | D |
| 2-5 | C | D |
| 2-6 | D | |
| 2-7 | C | |
| 2-8 | D | |
| Таблица 3 | ||
| 3-1 | D | D |
| 3-2 | D | |
| 3-3 | C | |
| 3-4 | C | |
| Таблица 4 | ||
| 4-1 | D | D |
| 4-2 | D | D |
| 4-3 | D | |
| 4-4 | D | D |
| 4-5 | D | D |
| 4-6 | D | D |
| 4-7 | D | D |
| 4-8 | D | D |
| 4-9 | D | |
| 4-10 | D | D |
| 4-11 | D | D |
| 4-12 | D | D |
| 4-13 | C | |
| 4-14 | C | D |
| 4-15 | D | |
| 4-16 | C | D |
| 4-17 | C | D |
| 4-18 | D | D |
| 4-19 | D | D |
| 4-20 | C | D |
| 4-21 | D | D |
| 4-22 | C | |
| 4-23 | C | |
| 4-24 | C | |
| 4-25 | C | |
| 4-26 | D | |
| 4-27 | C | |
| 4-28 | D | |
| 4-29 | D | |
| 4-30 | C | |
| 4-31 | C | |
| 4-32 | C |
| 4-33 | C | |
| 4-34 | C | |
| 4-35 | C | |
| 4-36 | C | |
| 4-37 | D | D |
| 4-38 | C | |
| 4-39 | C | |
| 4-40 | D | |
| 4-41 | C | |
| 4-42 | D | D |
| 4-43 | C | |
| 4-44 | D | |
| 4-45 | C | |
| 4-46 | D | D |
| 4-47 | C | |
| Таблица 5 | ||
| 5-1 | D | |
| 5-2 | D | |
| 5-3 | D | D |
| 5-4 | D | D |
| 5-5 | D | D |
| 5-6 | C | D |
| 5-7 | D | D |
| 5-8 | D | D |
| 5-9 | D | D |
| 5-10 | A | |
| 5-11 | D | |
| 5-12 | D | |
| 5-13 | D | |
| 5-14 | C | |
| 5-15 | D | |
| 5-16 | D | |
| 5-17 | D | |
| 5-18 | D | D |
| 5-19 | D | |
| 5-20 | D | |
| Таблица 6 | ||
| 6-1 | C | D |
| 6-2 | C | |
| 6-3 | C | |
| 6-4 | A | |
| 6-5 | C | D |
| 6-6 | C | |
| 6-7 | D | |
| 6-8 | C | |
| 6-9 | D | D |
| 6-10 | D | D |
| 6-11 | C | D |
| 6-12 | C | D |
| 6-13 | D | |
| 6-14 | D | |
| 6-15 | C | |
| 6-16 | B | |
| 6-17 | D | |
| 6-18 | C | |
| 6-19 | C | |
| 6-20 | B | |
| 6-21 | C | |
| 6-22 | B | |
| 6-23 | B | |
| 6-24 | B | |
| 6-25 | B | |
| 6-26 | B | |
| 6-27 | C | |
| 6-28 | D | D |
| 6-29 | D | |
| Таблица 7 | ||
| 7-1 | D | |
| 7-2 | A | |
| 7-3 | D | |
| 7-4 | B | |
| 7-5 | B | |
| 7-6 | A | |
| 7-7 | D | |
| 7-8 | B | |
| 7-9 | D | |
| 7-10 | D | |
| 7-11 | D | |
| 7-12 | D | |
| 7-13 | D | |
| 7-14 | D | |
| 7-15 | D | D |
| 7-16 | D | |
| 7-17 | B |
| Таблица 8 | ||
| 8-1 | D | D |
| 8-2 | D | D |
| 8-3 | C | |
| 8-4 | D | D |
| 8-5 | C | |
| 8-6 | C | |
| Таблица 9 | ||
| 9-1 | C | |
| 9-2 | C | |
| 9-3 | C | |
| 9-4 | D | D |
| 9-5 | C | |
| Таблица 10 | ||
| 10-1 | D | D |
| 10-2 | C | |
| 10-3 | D | |
| 10-4 | C | |
| 10-5 | D | |
| Таблица 11 | ||
| 11-1 | C | |
| 11-2 | C | |
| 11-3 | D | |
| 11-4 | D | |
| 11-5 | D | |
| 11-6 | D | |
| 11-7 | D | |
| 11-8 | D | |
| 11-9 | C | |
| 11-10 | D | |
| 11-11 | D | |
| 11-12 | D | |
| Таблица 12 | ||
| 12-1 | D | D |
| 12-2 | C | |
| 12-3 | D | |
| 12-4 | D | |
| 12-5 | D | |
| 12-6 | D |
| 12-7 | C | |
| 12-8 | D | D |
| 12-9 | D | |
| 12-10 | D | |
| 12-11 | D | |
| 12-12 | D | |
| 12-13 | B | |
| 12-14 | D | |
| 12-15 | D | |
| 12-16 | C | |
| 12-17 | D | D |
| 12-18 | D | |
| 12-19 | D | |
| 12-20 | D | |
| 12-21 | D | |
| 12-22 | C | |
| 12-23 | D | |
| 12-24 | D | D |
| 12-25 | D | |
| 12-26 | D | |
| 12-27 | C | |
| 12-28 | D | |
| 12-29 | D | |
| 12-30 | C | |
| 12-31 | D | |
| 12-32 | D | D |
| 12-33 | C | |
| 12-34 | C | |
| 12-35 | D | |
| 12-36 | A | |
| 12-37 | C | |
| 12-38 | C | |
| 12-39 | D | |
| 12-40 | D | |
| 12-41 | C | |
| 12-42 | D | |
| 12-43 | D | |
| 12-44 | D | |
| 12-45 | D | |
| 12-46 | D | |
| 12-47 | D | D |
| 12-48 | D | |
| 12-49 | D | |
| 12-50 | D | D |
| 12-51 | C | |
| 12-52 | C | |
| 12-53 | D | |
| 12-54 | C | |
| 12-55 | D | |
| 12-56 | D | |
| 12-57 | D | |
| 12-58 | C | |
| Таблица 13 | ||
| 13-1 | D | D |
| 13-2 | A | |
| 13-3 | C | |
| 13-4 | C | |
| 13-5 | D | D |
| 13-6 | D | |
| 13-7 | D | |
| 13-8 | D | |
| 13-9 | D | |
| 13-10 | D | |
| 13-11 | D | D |
| 13-12 | D | D |
| 13-13 | D | |
| 13-14 | D | |
| 13-15 | D | |
| 13-16 | D | D |
| 13-17 | D | D |
| 13-18 | D | D |
| 13-19 | D | D |
| 13-20 | D | D |
| 13-21 | D | D |
| 13-22 | D | D |
| 13-23 | D | |
| 13-24 | D | D |
| 13-25 | C | |
| 13-26 | D | |
| 13-27 | D | D |
| 13-28 | D | D |
| 13-29 | D | D |
| 13-30 | D | D |
| 13-31 | D | D |
| 13-32 | D | |
| 13-33 | D | |
| 13-34 | D | D |
| 13-35 | D | D |
| 13-36 | B | |
| 13-37 | B | |
| 13-38 | D | D |
| 13-39 | B | |
| 13-40 | A | |
| 13-41 | D | |
| 13-42 | D | D |
| 13-43 | B | |
| 13-44 | C | |
| 13-45 | C | |
| Таблица 14 | ||
| 14-1 | C | |
| 14-2 | C | |
| 14-3 | C | |
| 14-4 | B | |
| 14-5 | ||
| 14-6 | ||
| Таблица 15 | ||
| 15-1 | C | |
| 15-2 | C | |
| 15-3 | D | D |
| 15-4 | D | |
| 15-5 | D | |
| 15-6 | ||
| 15-7 | D | |
| 15-8 | C | |
| 15-9 | D | |
| 15-10 | B | |
| 15-11 | D | D |
| 15-12 | D | D |
| 15-13 | D | |
| Таблица 16 | ||
| 16-1 | D | D |
| 16-2 | D | D |
| 16-3 | D | D |
| 16-4 | D | D |
| 16-5 | D | D |
| 16-6 | D | |
| 16-7 | D | D |
| 16-8 | D |
| 16-9 | D | |
| 16-10 | C | |
| 16-11 | D | |
| 16-12 | C | |
| 16-13 | D | D |
| 16-14 | D | D |
| 16-15 | C | D |
| 16-16 | D | |
| 16-17 | D | |
| 16-18 | D | |
| Таблица 17 | ||
| 17-1 | D | D |
| 17-2 | D | D |
| 17-3 | D | D |
| 17-4 | D | D |
| Таблица 18 | ||
| 18-1 | C | |
| 18-2 | C | |
| 18-3 | C | |
| 18-4 | C | |
| 18-5 | D | D |
| 18-6 | D | D |
| Таблица 19 | ||
| 19-1 | D | |
| 19-2 | D | D |
| 19-3 | A | |
| 19-4 | D | |
| 19-5 | A | |
| 19-6 | D | D |
| 19-7 | B | |
| 19-8 | B | |
| 19-9 | D | D |
| 19-10 | A | |
| 19-11 | D | |
| 19-12 | D | |
| 19-13 | D | |
| 19-14 | A | |
| 19-15 | D | |
| 19-16 | D | |
| 19-17 | C | |
| 19-18 | C |
| Таблица 20 | ||
| 20-1 | D | D |
| 20-2 | D | D |
| 20-3 | D | D |
| 20-4 | D | D |
| 20-5 | D | D |
| 20-6 | D | D |
| 20-7 | D | D |
| Таблица 21 | ||
| 21-1 | A | |
| 21-2 | A | |
| 21-3 | D | D |
| 21-4 | C | |
| Таблица 22 | ||
| 22-1 | D | D |
| 22-2 | D | |
| 22-3 | D | D |
| 22-4 | D | D |
| 22-5 | D | D |
| 22-6 | D | D |
| 22-7 | D | D |
| 22-8 | D | D |
| 22-9 | D | D |
| 22-10 | D | D |
| 22-11 | D | D |
| 22-12 | D | D |
| 22-13 | D | D |
| 22-14 | D | |
| 22-15 | D | |
| 22-16 | D | D |
| 22-17 | D | |
| Таблица 23 | ||
| 23-1 | A | |
| 23-2 | D | |
| 23-3 | C | |
| Таблица 24 | ||
| 24-1 | C | D |
| 24-2 | C | D |
| 24-3 | C | D |
| 24-4 | C | D |
| 24-5 | C | |
| 24-6 | D | D |
| Таблица 25 | ||
| 25-1 | C | |
| 25-2 | D | D |
| 25-3 | C | |
| 25-4 | C | |
| 25-5 | D | |
| 25-6 | C | |
| 25-7 | B | |
| Таблица 26 | ||
| 26-1 | A | |
| 26-2 | B | |
| 26-3 | B | |
| 26-4 | C | D |
| 26-5 | A | |
| 26-6 | C | |
| 26-7 | C | D |
| 26-8 | C | |
| 26-9 | C | |
| 26-10 | A | |
| 26-11 | A | |
| Таблица 27 | ||
| 27-1 | D | D |
| 27-2 | D | |
| 27-3 | D | D |
| 27-4 | D | |
| 27-5 | D | D |
| 27-6 | D | D |
| 27-7 | D | |
| 27-8 | D | D |
| Таблица 28 | ||
| 28-1 | D | D |
| 28-2 | D | D |
| 28-3 | D | D |
| 28-4 | D | |
| 28-5 | D | |
| 28-6 | D | D |
| 28-7 | D | D |
| 28-8 | D | |
| 28-9 | D | |
| 28-10 | D | |
| 28-11 | D | D |
| 28-12 | D | |
| 28-13 | D | |
| 28-14 | D | |
| 28-15 | D | D |
| 28-16 | D | D |
| 28-17 | D | D |
| 28-18 | D | D |
| 28-19 | C | D |
| 28-20 | D | D |
| 28-21 | D | D |
| 28-22 | D | D |
| 28-23 | C | |
| Таблица 29 | ||
| 29-1 | D | |
| 29-2 | C | |
| 29-3 | C | |
| 29-4 | D |
Хотя настоящее изобретение описано со ссылкой на конкретные аспекты или варианты его осуществления, специалистам в данной области должно быть понятно, что могут быть внесены различные изменения или могут быть сделаны эквивалентные замены, которые не противоречат сущности настоящего изобретения и не выходят за объем настоящего изобретения. Кроме того, в рамках действующего патентного законодательства и разрешенных положений, все публикации, патенты и заявки на патенты, приведенные в данном описании, включены в настоящую заявку посредством ссылки во всей их полноте так, как если бы каждая индивидуальная публикация была указана для включения в настоящую заявку ссылкой.
Claims (85)
1. Соединение формулы (IV):
где:
R1 выбран из C1-6алкила, необязательно замещенного гидрокси или метокси, и тетрагидропирана;
R2 обозначает атом водорода;
R3 обозначает -С(О)OC1-6алкил;
R4 обозначает метил, метокси или -СН2ОСН3;
R7 выбран из атома фтора, хлора, -CF3 и -OCF3;
R8 независимо обозначает метил или гидроксиметил;
R9 выбран из -NHCH3, циклопропила, 2,2-диметилциклопропила, трет-бутила, C1-6алкила, замещенного -ОН, и имидазолила;
R10 обозначает атом водорода или гидроксиметил;
а принимает значение 1 или 2; и
b принимает значение 1 или 2;
или его фармацевтически приемлемая соль.
2. Соединение формулы (V):
где:
R1 выбран из C1-6алкила и тетрагидропирана;
R2 обозначает атом водорода;
R3 обозначает -С(О)OC1-6алкил;
R4 обозначает метил, метокси или -СН2ОСН3;
R7 выбран из атома фтора, хлора и -OCF3;
R8 обозначает метил;
R9 выбран из -NHCH3, циклопропила, 2,2-диметилциклопропила, трет-бутила и C1-6алкила, замещенного -ОН;
R10 обозначает атом водорода;
а принимает значение 1 или 2; и
b принимает значение 1 или 2;
или его фармацевтически приемлемая соль.
3. Соединение по п.1 или 2, где соединение выбрано из следующих соединений:
и их фармацевтически приемлемых солей.
4. Соединение по п.3, где соединение выбрано из:
и их фармацевтически приемлемых солей.
5. Соединение формулы
или его фармацевтически приемлемая соль.
6. Фармацевтическая композиция для лечения вирусной инфекции вируса гепатита С у млекопитающего, содержащая терапевтически эффективное количество соединения по любому из пп.1-5 и фармацевтически приемлемый носитель.
7. Способ получения соединения формулы (II')
где значения R1, R2, R3, R4, R7, R8, R9, а и b определены в п. 1, и каждый из R5 и R6 представляет собой водород, или его фармацевтически приемлемой соли или стереоизомера, при этом указанный способ включает:
(a) взаимодействие соединения формулы 3-3'
где Pg обозначает аминозащитную группу, с соединением формулы 3-4' или 3-4ʺ
в присутствии палладиевого катализатора, с образованием содержащего защитную группу промежуточного соединения 3-5
(b) удаление защитной группы из промежуточного соединения 3-5 общепринятым способом, с образованием промежуточного соединения 3-6, у которого удалена защитная группа:
и
(c) взаимодействие промежуточного соединения 3-6 с карбоновой кислотой:
в условиях образования амидной связи с получением соединения формулы (II') или его фармацевтически приемлемой соли.
8. Способ по п.7, где на стадии (с) используют конденсирующие агенты, выбранные из группы, состоящей из N,N,N',N'-тетраметил-О-(7-азабензотриазол-1-ил)урония (HATU), или 1,3-дициклогексилкарбодиимид (DCC), 1-(3-диметиламинопропил)-3-этилкарбодиимид (EDC) или гексафторфосфат бензотриазол-1-илокситрипирролидино-фосфония (РуВор).
9. Способ по п.8, где конденсирующие агенты используют в сочетании с 1-гидрокси-7-азабензотриазолом (HOAt).
10. Способ по любому из пп.7-9, где R1 обозначает C1-6алкил или тетрагидропиран, R2 обозначает атом водорода, R3 обозначает -С(О)OC1-6алкил, R4 обозначает метил или метокси, каждый из R5 и R6 обозначает атом водорода, R7 обозначает атом фтора, хлора или -OCF3, R8 обозначает метил, R9 обозначает трет-бутил или C1-6алкил, замещенный -ОН, а принимает значение 1 или 2, и b равно 1.
11. Соединение формулы 3-4ʺ:
где R7 обозначает атом фтора, хлора или -OCF3, R8 обозначает метил, R9 обозначает трет-бутил или C1-6алкил, замещенный -ОН, а принимает значение 1 или 2, и b равно 1.
12. Соединение по любому из пп.1-5 для применения при лечении инфекции вируса гепатита С у млекопитающего.
13. Соединение по любому из пп.1-5 для применения при ингибировании репликации вируса гепатита С у млекопитающего.
14. Применение соединения по любому из пп.1-5 для приготовления лекарственного средства, предназначенного для лечения инфекции вируса гепатита С у млекопитающего.
15. Способ ингибирования репликации вируса гепатита С у млекопитающего, который включает введение млекопитающему фармацевтической композиции, содержащей соединение по любому из пп.1-5 и фармацевтически приемлемый носитель.
Applications Claiming Priority (7)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201161555056P | 2011-11-03 | 2011-11-03 | |
| US61/555,056 | 2011-11-03 | ||
| US201261600089P | 2012-02-17 | 2012-02-17 | |
| US61/600,089 | 2012-02-17 | ||
| US201261637961P | 2012-04-25 | 2012-04-25 | |
| US61/637,961 | 2012-04-25 | ||
| PCT/US2012/063181 WO2013067267A1 (en) | 2011-11-03 | 2012-11-02 | Rod -like hepatitis c virus inhibitors containing the fragement {2- [4- (bi phenyl - 4 - yl) - 1h - imidazo - 2 - yl] pyrrolidine - 1 - carbonlymethyl} amine |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2014122340A RU2014122340A (ru) | 2015-12-10 |
| RU2625787C2 true RU2625787C2 (ru) | 2017-07-19 |
Family
ID=47146777
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2014122340A RU2625787C2 (ru) | 2011-11-03 | 2012-11-02 | Ингибиторы вируса гепатита с, имеющие жесткую вытянутую цепь и содержащие фрагмент { 2-[4-(бифенил-4-ил)-1н-имидазо-2-ил]пирролидин-1-карбонилметил} амина |
Country Status (19)
| Country | Link |
|---|---|
| US (2) | US9212168B2 (ru) |
| EP (1) | EP2773634B1 (ru) |
| JP (2) | JP6082747B2 (ru) |
| KR (1) | KR20140091036A (ru) |
| CN (1) | CN103946220B (ru) |
| AR (1) | AR088630A1 (ru) |
| AU (1) | AU2012332358B2 (ru) |
| BR (1) | BR112014010401A8 (ru) |
| CA (1) | CA2852700A1 (ru) |
| CL (1) | CL2014001110A1 (ru) |
| CO (1) | CO6940424A2 (ru) |
| HK (1) | HK1200812A1 (ru) |
| IL (1) | IL232042A (ru) |
| MX (1) | MX347692B (ru) |
| RU (1) | RU2625787C2 (ru) |
| SG (1) | SG11201401891RA (ru) |
| TW (1) | TWI577672B (ru) |
| WO (1) | WO2013067267A1 (ru) |
| ZA (1) | ZA201403198B (ru) |
Families Citing this family (15)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN103189371B (zh) | 2010-11-04 | 2015-04-01 | 施万生物制药研发Ip有限责任公司 | 丙型肝炎病毒抑制剂 |
| JP6069492B2 (ja) * | 2012-04-25 | 2017-02-01 | セラヴァンス バイオファーマ アール&ディー アイピー, エルエルシー | C型肝炎ウイルス阻害剤 |
| CN104302639B (zh) | 2012-04-25 | 2017-03-29 | 施万生物制药研发Ip有限责任公司 | 作为c型肝炎病毒抑制剂的哌嗪‑哌啶化合物 |
| WO2013161913A1 (ja) | 2012-04-25 | 2013-10-31 | 武田薬品工業株式会社 | 含窒素複素環化合物 |
| EP2873669A4 (en) | 2012-07-13 | 2015-11-25 | Takeda Pharmaceutical | HETEROCYCLIC COMPOUND |
| EP2975031A4 (en) | 2013-03-14 | 2017-04-19 | Takeda Pharmaceutical Company Limited | Heterocyclic compound |
| US10053468B2 (en) | 2013-07-03 | 2018-08-21 | Takeda Pharmaceutical Company Limited | Heterocyclic compound |
| WO2015002230A1 (ja) | 2013-07-03 | 2015-01-08 | 武田薬品工業株式会社 | アミド化合物 |
| CN104418784B (zh) * | 2013-09-04 | 2019-02-19 | 浙江九洲药业股份有限公司 | 一种抗病毒药物中间体的拆分方法 |
| WO2016202232A1 (zh) * | 2015-06-19 | 2016-12-22 | 重庆博腾制药科技股份有限公司 | 一种(4S)-N-Boc-4-甲氧基甲基-L-脯氨酸胺盐的合成方法 |
| CN106256819B (zh) * | 2015-06-19 | 2019-07-09 | 重庆博腾制药科技股份有限公司 | 一种(4S)-N-Boc-4-甲氧基甲基-L-脯氨酸胺盐的合成方法 |
| WO2017015439A1 (en) * | 2015-07-21 | 2017-01-26 | Theravance Biopharma R&D Ip, Llc | Crystalline form of a hepatitis c virus inhibitor |
| WO2017062840A1 (en) * | 2015-10-09 | 2017-04-13 | Trek Therapeutics, Pbc | Combination therapy for the treatment of hepatitis c virus |
| CN107501155A (zh) * | 2017-09-19 | 2017-12-22 | 上海泓博智源医药股份有限公司 | 一种抗病毒药物中间体的制备方法 |
| CN112679407B (zh) * | 2021-03-17 | 2021-06-04 | 南京桦冠生物技术有限公司 | 一种手性5-取代脯氨酸类化合物的制备方法 |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2299207C2 (ru) * | 2001-08-30 | 2007-05-20 | Кова Ко., Лтд. | Соединения циклического амина |
| WO2008021927A2 (en) * | 2006-08-11 | 2008-02-21 | Bristol-Myers Squibb Company | Hepatitis c virus inhibitors |
| WO2010094977A1 (en) * | 2009-02-23 | 2010-08-26 | Arrow Therapeutics Limited | Novel biphenyl compounds useful for the treatment of hepatitis c |
Family Cites Families (23)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6867221B2 (en) | 2001-08-30 | 2005-03-15 | Kowa Co., Ltd. | Cyclic amine compounds and pharmaceutical composition containing the same |
| GB0421908D0 (en) | 2004-10-01 | 2004-11-03 | Angeletti P Ist Richerche Bio | New uses |
| CA2621364A1 (en) * | 2005-09-16 | 2007-03-22 | Arrow Therapeutics Limited | Biphenyl derivatives and their use in treating hepatitis c |
| US7659270B2 (en) | 2006-08-11 | 2010-02-09 | Bristol-Myers Squibb Company | Hepatitis C virus inhibitors |
| US8303944B2 (en) | 2006-08-11 | 2012-11-06 | Bristol-Myers Squibb Company | Hepatitis C virus inhibitors |
| CN101558059B (zh) * | 2006-08-11 | 2014-12-03 | 百时美施贵宝公司 | 丙型肝炎病毒抑制剂 |
| DE102009005746A1 (de) * | 2009-01-23 | 2010-07-29 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| US8796466B2 (en) | 2009-03-30 | 2014-08-05 | Bristol-Myers Squibb Company | Hepatitis C virus inhibitors |
| CN109020961A (zh) | 2009-05-13 | 2018-12-18 | 吉利德制药有限责任公司 | 抗病毒化合物 |
| PE20120993A1 (es) | 2009-09-04 | 2012-08-22 | Janssen Pharmaceuticals Inc | Derivados bifenilicos como antivirales |
| US8822700B2 (en) | 2009-09-11 | 2014-09-02 | Enanta Pharmaceuticals, Inc. | Hepatitis C virus inhibitors |
| WO2011031904A1 (en) | 2009-09-11 | 2011-03-17 | Enanta Pharmaceuticals, Inc | Hepatitis c virus inhibitors |
| US20110274648A1 (en) | 2009-11-11 | 2011-11-10 | Bristol-Myers Squibb Company | Hepatitis C Virus Inhibitors |
| US8653070B2 (en) | 2009-12-14 | 2014-02-18 | Enanta Pharmaceuticals, Inc. | Hepatitis C virus inhibitors |
| US8377980B2 (en) | 2009-12-16 | 2013-02-19 | Bristol-Myers Squibb Company | Hepatitis C virus inhibitors |
| AU2010336355A1 (en) | 2009-12-24 | 2012-07-05 | Vertex Pharmaceuticals Incorporated | Analogues for the treatment or prevention of flavivirus infections |
| WO2011091446A1 (en) | 2010-01-22 | 2011-07-28 | Glaxosmithkline Llc | Chemical compounds |
| WO2011153396A1 (en) | 2010-06-04 | 2011-12-08 | Enanta Pharmaceuticals, Inc | Hepatitis c virus inhibitors |
| US20120195857A1 (en) | 2010-08-12 | 2012-08-02 | Bristol-Myers Squibb Company | Hepatitis C Virus Inhibitors |
| BR112013004520A2 (pt) | 2010-08-26 | 2016-06-07 | Univ Emory | inibidores potentes e seletivos do virus da hepatite c |
| WO2012048421A1 (en) | 2010-10-14 | 2012-04-19 | Boehringer Ingelheim International Gmbh | Hepatitis c inhibitor compounds |
| CN103189371B (zh) | 2010-11-04 | 2015-04-01 | 施万生物制药研发Ip有限责任公司 | 丙型肝炎病毒抑制剂 |
| US8552047B2 (en) | 2011-02-07 | 2013-10-08 | Bristol-Myers Squibb Company | Hepatitis C virus inhibitors |
-
2012
- 2012-11-02 JP JP2014540112A patent/JP6082747B2/ja not_active Expired - Fee Related
- 2012-11-02 AR ARP120104114A patent/AR088630A1/es unknown
- 2012-11-02 RU RU2014122340A patent/RU2625787C2/ru not_active IP Right Cessation
- 2012-11-02 TW TW101140863A patent/TWI577672B/zh not_active IP Right Cessation
- 2012-11-02 AU AU2012332358A patent/AU2012332358B2/en not_active Ceased
- 2012-11-02 SG SG11201401891RA patent/SG11201401891RA/en unknown
- 2012-11-02 CN CN201280054361.3A patent/CN103946220B/zh not_active Expired - Fee Related
- 2012-11-02 CA CA2852700A patent/CA2852700A1/en not_active Abandoned
- 2012-11-02 BR BR112014010401A patent/BR112014010401A8/pt not_active IP Right Cessation
- 2012-11-02 MX MX2014005342A patent/MX347692B/es active IP Right Grant
- 2012-11-02 US US13/667,197 patent/US9212168B2/en not_active Expired - Fee Related
- 2012-11-02 KR KR1020147014928A patent/KR20140091036A/ko not_active Application Discontinuation
- 2012-11-02 WO PCT/US2012/063181 patent/WO2013067267A1/en active Application Filing
- 2012-11-02 EP EP12783835.7A patent/EP2773634B1/en active Active
-
2014
- 2014-04-09 IL IL232042A patent/IL232042A/en not_active IP Right Cessation
- 2014-04-28 CO CO14090226A patent/CO6940424A2/es active IP Right Grant
- 2014-04-29 CL CL2014001110A patent/CL2014001110A1/es unknown
- 2014-05-02 ZA ZA2014/03198A patent/ZA201403198B/en unknown
-
2015
- 2015-02-03 HK HK15101128.6A patent/HK1200812A1/xx unknown
- 2015-10-15 US US14/883,856 patent/US9669027B2/en not_active Expired - Fee Related
-
2016
- 2016-12-06 JP JP2016236386A patent/JP2017048248A/ja active Pending
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2299207C2 (ru) * | 2001-08-30 | 2007-05-20 | Кова Ко., Лтд. | Соединения циклического амина |
| WO2008021927A2 (en) * | 2006-08-11 | 2008-02-21 | Bristol-Myers Squibb Company | Hepatitis c virus inhibitors |
| WO2010094977A1 (en) * | 2009-02-23 | 2010-08-26 | Arrow Therapeutics Limited | Novel biphenyl compounds useful for the treatment of hepatitis c |
Also Published As
| Publication number | Publication date |
|---|---|
| JP2014532716A (ja) | 2014-12-08 |
| EP2773634A1 (en) | 2014-09-10 |
| ZA201403198B (en) | 2017-04-26 |
| CO6940424A2 (es) | 2014-05-09 |
| CL2014001110A1 (es) | 2014-08-22 |
| KR20140091036A (ko) | 2014-07-18 |
| US9669027B2 (en) | 2017-06-06 |
| JP6082747B2 (ja) | 2017-02-15 |
| CN103946220A (zh) | 2014-07-23 |
| BR112014010401A8 (pt) | 2017-12-19 |
| NZ623846A (en) | 2016-07-29 |
| CN103946220B (zh) | 2017-12-22 |
| RU2014122340A (ru) | 2015-12-10 |
| BR112014010401A2 (pt) | 2017-04-25 |
| EP2773634B1 (en) | 2018-06-06 |
| JP2017048248A (ja) | 2017-03-09 |
| IL232042A0 (en) | 2014-05-28 |
| SG11201401891RA (en) | 2014-05-29 |
| MX2014005342A (es) | 2014-08-08 |
| AU2012332358A1 (en) | 2014-05-29 |
| AR088630A1 (es) | 2014-06-25 |
| TWI577672B (zh) | 2017-04-11 |
| HK1200812A1 (en) | 2015-08-14 |
| US20130115194A1 (en) | 2013-05-09 |
| IL232042A (en) | 2017-07-31 |
| MX347692B (es) | 2017-05-09 |
| TW201326156A (zh) | 2013-07-01 |
| US20160038483A1 (en) | 2016-02-11 |
| WO2013067267A1 (en) | 2013-05-10 |
| US9212168B2 (en) | 2015-12-15 |
| AU2012332358B2 (en) | 2017-07-13 |
| CA2852700A1 (en) | 2013-05-10 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2625787C2 (ru) | Ингибиторы вируса гепатита с, имеющие жесткую вытянутую цепь и содержащие фрагмент { 2-[4-(бифенил-4-ил)-1н-имидазо-2-ил]пирролидин-1-карбонилметил} амина | |
| JP5891235B2 (ja) | C型肝炎ウイルスの新規阻害剤 | |
| US9365549B2 (en) | Hepatitis C virus inhibitors | |
| JP6069491B2 (ja) | C型肝炎ウイルス阻害剤としてのピペラジン−ピペリジン化合物 | |
| NZ623846B2 (en) | Rod-like hepatitis c virus inhibitors containing the fragment {2-[4-(bi phenyl-4-yl) -1h-imidazo-2-yl] pyrrolidine-1-carbonlymethyl} amine |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| MM4A | The patent is invalid due to non-payment of fees |
Effective date: 20181103 |