RU2599031C1 - Водная композиция рекомбинантного фолликулостимулирующего гормона человека (варианты) - Google Patents
Водная композиция рекомбинантного фолликулостимулирующего гормона человека (варианты) Download PDFInfo
- Publication number
- RU2599031C1 RU2599031C1 RU2015133576/15A RU2015133576A RU2599031C1 RU 2599031 C1 RU2599031 C1 RU 2599031C1 RU 2015133576/15 A RU2015133576/15 A RU 2015133576/15A RU 2015133576 A RU2015133576 A RU 2015133576A RU 2599031 C1 RU2599031 C1 RU 2599031C1
- Authority
- RU
- Russia
- Prior art keywords
- rfsh
- composition
- biological activity
- fsh
- concentration
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/22—Hormones
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/22—Hormones
- A61K38/24—Follicle-stimulating hormone [FSH]; Chorionic gonadotropins, e.g. HCG; Luteinising hormone [LH]; Thyroid-stimulating hormone [TSH]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/16—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite containing nitrogen, e.g. nitro-, nitroso-, azo-compounds, nitriles, cyanates
- A61K47/18—Amines; Amides; Ureas; Quaternary ammonium compounds; Amino acids; Oligopeptides having up to five amino acids
- A61K47/183—Amino acids, e.g. glycine, EDTA or aspartame
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/26—Carbohydrates, e.g. sugar alcohols, amino sugars, nucleic acids, mono-, di- or oligo-saccharides; Derivatives thereof, e.g. polysorbates, sorbitan fatty acid esters or glycyrrhizin
Abstract
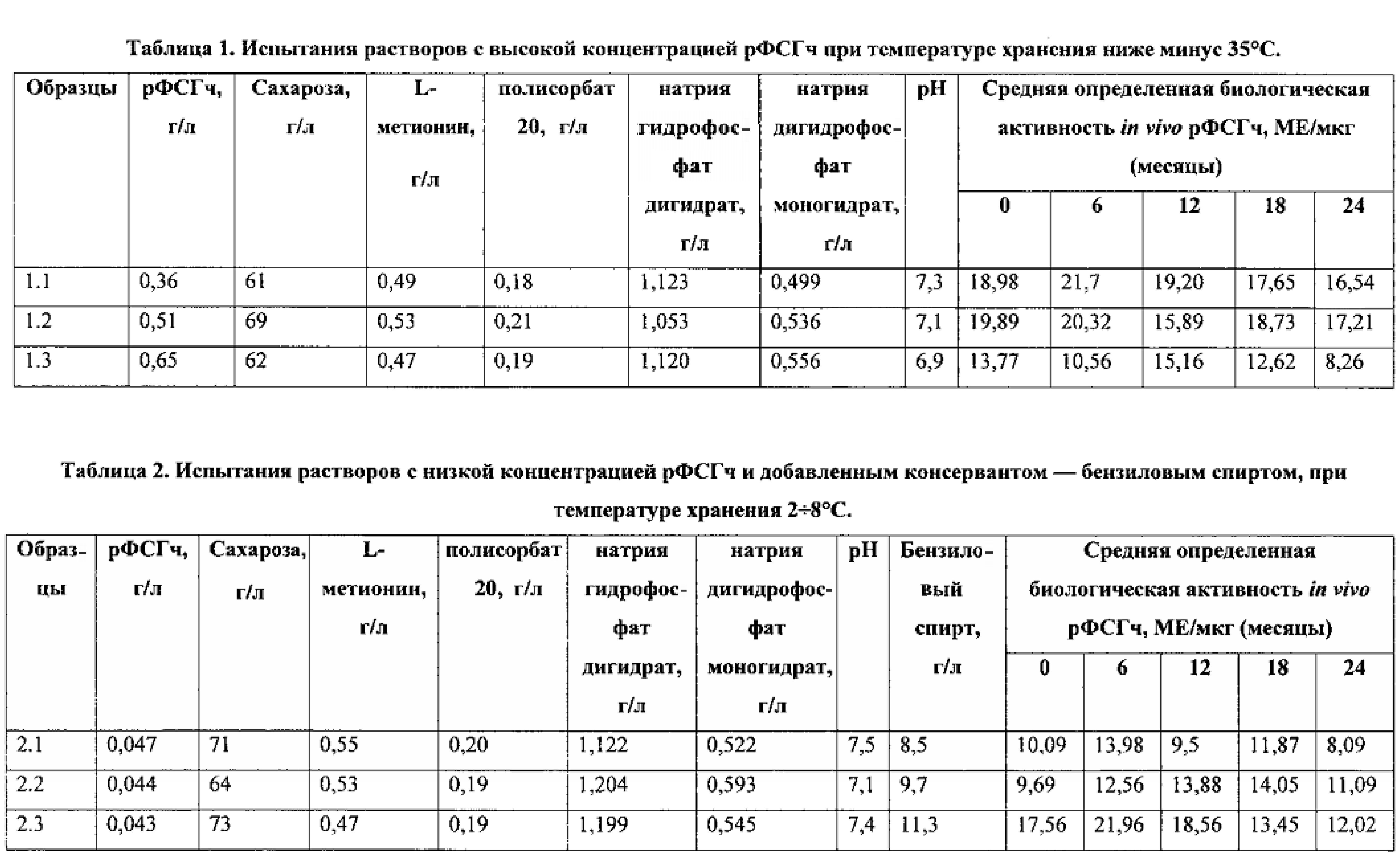
Группа изобретений относится к биотехнологии, фармакологии и представляет собой водные композиции рекомбинантного фолликулостимулирующего гормона человека (рФСГч), содержащие биологически активный рФСГч, сахарозу и полисорбат 20 в качестве стабилизаторов, L-метионин в качестве антиоксиданта, бензиловый спирт в качестве бактериостатического агента в фосфатном буфере. Использование настоящей группы изобретений позволяет сохранить биологическую активность in vivo рФСГч от 8 МЕ/мкг до 22 МЕ/мкг в течение длительного периода времени при температурах хранения ниже -35°C и при 2÷8°C. 2 н. и 5 з.п. ф-лы, 5 ил., 7 табл., 9 пр.
Description
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к биотехнологии и фармакологии, конкретно к составу водной композиции рекомбинантного фолликулостимулирующего гормона человека, который сохраняет свою биологическую активность in vivo в течение длительного времени.
УРОВЕНЬ ТЕХНИКИ
Фолликулостимулирующий гормон (ФСГ) является одним из ключевых гормонов, регулирующих репродуктивные функции у млекопитающих, включая человека. У женщин ФСГ стимулирует развитие фолликулов яичников, содержащих ооциты, у мужчин - активирует сперматогенез. ФСГ связывается с рецепторами ФСГ, расположенными на поверхности гранулезных клеток яичников и плазматических мембран клеток Сертоли в яичках. Связываясь с рецепторами, ФСГ активирует внутриклеточные механизмы регуляции оогенеза и сперматогенеза посредством клеточной репликации и экспрессии специфических белков и ко-факторов, модулирующих гаметогенез.
Рекомбинантные варианты ФСГ человека (рФСГч), полученные с помощью генно-инженерных методов, а также нативные формы ФСГ, получаемые из мочи женщин, широко используются в медицине для стимуляции развития фолликулов для индукции овуляции и контролируемой индукции суперовуляции в программах вспомогательных репродуктивных технологий (см. van Wely М. et al. (2011), «Recombinant versus urinary gonadotrophin for ovarian stimulation in assisted reproductive technology cycles». Cochrane Database of Syst. Rev., 2: CD005354).
ФСГ является гетеродимерным гликопротеиновым гормоном (34 кДа), состоящим из двух нековалентно связанных друг с другом субъединиц, кодирующихся разными генами (см. Pierce J.G., Parsons T.F. (1981), «Glycoproteinhormones: structureandfunction». Annu.Rev. Biochem., 50: 465-495). Альфа-субъединица включает 92 аминокислоты, несущих две углеводных боковых цепи, связанных с Asn-52 и Asn-78. Бета-субъединица состоит из 111 аминокислотных остатков, также несущих две углеводные цепи, связанные с Asn-7 и Asn-24. Вторичные модификации углеводных цепей включают образование разветвленных структур на основе сиаловых кислот, количественный и качественный состав которых определяет как время полужизни ФСГ в кровотоке, так и биологическую активность гормона in vivo и способность к активации рецепторов ФСГ in vitro (см. Ulloa-Aguirre A. etal (1995). «Follicle-stimulating isohormones: characterization and physiological relevance». EndocrRev.; 16(6):765÷87).
В препаратах рФСГч определяются три вида примесей, представляющих собой фрагменты белковой молекулы рФСГч: диссоциированные альфа- и бета-субъединицы, олигомерные формы, а также продукты окисления. Показатели биологической активности, при которой считается, что рФСГч обладает фолликулостимулирующими свойствами, определяются по его способности стимулировать рост фолликулов в тесте, разработанным Steelman S.L. и Pohley F.M., в котором оценивается увеличение массы яичников крыс в линейном диапазоне в зависимости от вводимой дозы препарата рФСГч (см. Steelman S.L., Pohley F.M. (1953) «Assay of the follicle stimulating hormone based on the augmentation with human chorionic gonadotropin». Endocrinology, 53:604÷16).
В программах вспомогательных репродуктивных технологий у человека препараты, содержащие рФСГч, применяются врачами-репродуктологами в протоколах лечения бесплодия в зависимости от его биологической активности, выраженной в Международных Единицах (ME). С учетом анамнеза врачом-специалистом выбирается ежедневная стартовая доза рФСГч в ME, с последующей ее корректировкой, в зависимости от силы ответа яичников пациентки. Таким образом, врачи-репродуктологи используют в своей ежедневной практике в целях назначения стартовой дозы рФСГч и ее последующей корректировки количество препарата рФСГч, выраженного в международных единицах его биологической активности, а не данные об общем количестве белка и содержании белковых примесей в препарате рФСГч.
Состав лекарственного средства, содержащего рФСГч, должен обеспечивать высокую стабильность препарата, в результате чего количество примесей должно практически не меняться в процессе хранения, а главное, должна сохраняется его заявленная биологическая активность in vivo.
На сегодняшний день известны как водные композиции рекомбинантного и мочевого ФСГ, так и лиофилизированные готовые лекарственные формы.
Известна водная композиция человеческого ФСГ, содержащая терапевтически эффективное количество ФСГ, в качестве вспомогательных веществ используется глицин, метионин, неионное поверхностно-активное вещество и фосфатный буфер в качестве стабилизаторов (патент РФ №2407514). В данной композиции содержится глицин в количестве от 0,1 до 10% (вес/об.), метионин в количестве от 0,01 до 2,0% (вес/об.), неионное поверхностно-активное вещество на основе полисорбата, полоксамера или комбинации таковых от 0,001 до 0,02% (вес/об.) и фосфатный буфер с концентрацией соли от 1 до 50 мМ. Также композиция может включать бактериостатический агент бензиловый спирт, крезол или алкилпарабен. В данном случае в качестве стабилизатора используется аминокислота - глицин, а также стабильность композиции доказывается с использованием физико-химических методов анализа, а именно обращенно-фазовой и эксклюзионной ВЭЖХ с анализом окисленных форм и свободных субъединиц, соответственно. Какие-либо сведения о сохранении биологической активности in vivo ФСГ в составе данной водной композиции, выраженной в Международных Единицах (ME) на мкг белка с течением, времени в данном патенте отсутствуют.
Известен способ получения жидкой композиции, содержащей гонадотропин (ФСГ) и стабилизирующие количества поликарбоновой кислоты (лимонная кислота) или ее соли, а также дополнительно неионное поверхностно-активное соединение (патент РФ №2203086). В описании изобретения нет данных по сохранению биологической активности in vivo ФСГ с течением времени, а также нет сведений о влиянии бактериостатических агентов, крезола, бензилового спирта и др. на свойства композиции.
Известна другая жидкая фармацевтическая композиция, содержащая ФСГ или его вариант, а также хлорид бензалкония и бензиловый спирт в качестве консервантов, где ФСГ или его вариант присутствует в концентрации от 10 до 200 мкг/мл и где хлорид бензалкония присутствует в концентрации от 0,005 до 0,05 мг/мл, а бензиловый спирт присутствует в концентрации от 0,5 до 20,0 мг/мл (евразийский патент №019530). Однако в описании этого изобретения нет данных по сохранению биологической активности in vivo ФСГ в составе водной композиции.
Известна жидкая фармацевтическая композиция, содержащая фолликулостимулирующий гормон (ФСГ) или его вариант, поверхностно-активное вещество, которым является Pluronic F68, метионин, а также бактериостатический агент, выбранный из фенола и метакрезола (евразийский патент №012565). В данном изобретении не описано применение полисорбата 20 в качестве стабилизатора, а также бензилового спирта в качестве консерванта, не определено их влияние на стабильность биологической активности ФСГ. К тому же, использование фенола в составе композиции нежелательно, т.к. последний обладает достаточно токсичными свойствами по классификации ЕС 67/548/ЕЕС или 1999/45/ЕС.
В патенте США №6706681 описаны жидкие фармацевтические композиции, включающие ФСГ, и содержащие многоатомный спирт, невосстанавливающий сахар, (предпочтительно маннитол) в качестве стабилизатора, но нет сведений о сохранении биологической активности in vivo ФСГ в составе композиции по патенту с течением времени.
Известна жидкая фармацевтическая композиция, содержащая ФСГ человека или его вариант, а также неорганическую соль из группы, состоящей из хлорида натрия, хлорида кальция и хлорида калия (патент РФ №2553375). В качестве консерванта в данной композиции используется фенол, который, как уже сказано выше, достаточно токсичен.
В патенте США №7563763 описаны жидкие композиции, содержащие ФСГ, для инъекций, содержащие бензиловый спирт, м-крезол или их смесь в качестве консервантов. Биологическая активность ФСГ в данных экспериментах определялась in vitro. Известно, что разные изоформы ФСГ, появляющиеся вследствие гетерогенности содержания сиаловых кислот, разделяются в соответствии с их относительным зарядом, причем изогормоны ФСГ с изоэлектрической точкой (pI) 5,5 имеют в 2÷3 раза более высокую способность к активации рецепторов ФСГ в тестах in vitro, по сравнению с изогормонами с pI 4,3. В то же время, наиболее кислые формы изогормонов ФСГ (с pI 3,5) имеют в 100-200 раз большую биологическую активность в тестах in vivo, по сравнению с изогормонами, имеющими pI 5,5 (см. Mulders J.W. et al. (1999). «Prediction of the in-vivo biological activity of human recombinant follicle-stimulating hormone using quantitative isoelectric focusing. Optimization of the model». Pharm. Pharmacol. Commun., 5:51-55). В связи с различиями данных in vitro исследований от in vivo исследований по определению биологической активности рФСГч в Европейской, Британской, Японской фармакопеях, а также фармакопее США долгое время единственным методом тестирования биологической активности ФСГ остается метод in vivo. Поскольку в упомянутом патенте сохранение биологической активности ФСГ исследовано методом in vitro, а не in vivo, приведенные в нем результаты нельзя признать приемлемыми с точки зрения фармакопеи.
Известна водная композиция, включающая ФСГ, гистидин в качестве стабилизирующего средства и фосфатный или цитратный буфер (патент США №8329649). В этом патенте не приводятся данные о сохранении биологической активности ФСГ в описанной композиции.
Известны белковые композиции, в которых потенциальные проблемы со стабильностью активного вещества решены с помощью лиофилизации - процесса, при котором препарат изначально замораживается, а потом происходит возгонка (или сублимация) растворителя. Лиофильно высушенные белковые препараты в большинстве случаев недостаточно приемлемы для пациентов, так как существует необходимость растворения препарата перед его подкожным или внутримышечным введением, также существует вероятность потери активного вещества в процессе его растворения.
Известен способ получения стабильной изотонической лиофилизированной протеиновой композиции, в которой основной белковый компонент содержится в концентрации не менее 50 мг/мл, а также используется растворитель, который разбавляет композицию, полученную из лиофилизированной смеси протеина и лиопротектора (патент РФ 2497500). В данном изобретении описывается лиофильно высушенная белковая композиция, но данные о сохранении биологической активности рФСГч при растворении и при хранении отсутствуют.
Таким образом, на сегодняшний день все еще существует потребность в разработке новой жидкой композиции рФСГч, которая способна сохранять его биологическую активность in vivo в течение длительного периода времени как при хранении концентрированного раствора рФСГч при температурах хранения ниже -35°C, что приемлемо для хранения активных фармацевтических субстанций данного гормона, так и при температурах хранения 2÷8°C, в случае использования бензилового спирта в качестве бактериостатического агента, например, для получения готовой лекарственной формы препарата рФСГч в виде многодозовых флаконов или картриджей, предзаполненных шприц ручек или шприцев.
Также существует необходимость в уточнении концентраций как вспомогательных, так и основного активного вещества (рФСГч) в композициях, которые бы могли обеспечить стабильность биологической активности in vivo водных растворов рФСГч при хранении.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Задача настоящего изобретения (и его технический результат) состоит в создании фармацевтической композиции с высокой концентрацией рФСГч, которая в течение длительного времени сохраняет биологическую активность, определенную корректным с точки зрения фармакопеи методом (например, тестом in vivo), при ее хранении при температуре ниже -35°C, и в то же самое время, даже после разбавления раствором, содержащим бактериостатический агент - бензиловый спирт, также в течение длительного времени сохраняет активность при хранении при температуре 2÷8°C.
Технический результат достигается благодаря созданию композиции определенного состава с оптимальными количественными значениями содержания сахарозы, полисорбата 20, L-метионина, натрия гидрофосфат дигидрата и натрия дигидрофосфат моногидрата в концентрированной композиции рФСГч и содержания указанных компонентов и бензилового спирта в разбавленной композиции рФСГч.
Таким образом, указанная задача решена посредством создания предлагаемой водной композиции рекомбинантного фолликулостимулирующего гормона человека (рФСГч) следующего состава (грамм/литр):
| рФСГч | 0,35÷0,65 |
| стабилизирующий агент - сахароза | 61÷75 |
| стабилизирующий агент - полисорбат 20 | 0,18÷0,22 |
| антиоксидант - L-метионин | 0,45÷0,55 |
| буферный агент - натрия гидрофосфат дигидрат | 0,999÷1,221 |
| буферный агент - натрия дигидрофосфат моногидрат | 0,486÷0,594 |
Композиция вышеуказанного состава (концентрированая композиция) сохраняет биологическую активность in vivo в интервале от 8 ME до 22 ME из расчета на мкг рФСГч при температурах хранения ниже -35°C в течение не менее 24 месяцев.
Предпочтительно, когда рН композиции по изобретению составляет 6,5÷7,5.
Вышеуказанная задача также решена посредством создания водной композиции рекомбинантного фолликулостимулирующего гормона человека (рФСГч) следующего состава (грамм/литр):
| рФСГч | 0,040÷0,048 |
| стабилизирующий агент - сахароза | 61÷75 |
| стабилизирующий агент - полисорбат 20 | 0,18÷0,22 |
| антиоксидант - L-метионин | 0,45÷0,55 |
| буферный агент - натрия гидрофосфат дигидрат | 0,999÷1,221 |
| буферный агент - натрия дигидрофосфат моногидрат | 0,486÷0,594 |
| бактериостатический агент -- бензиловый спирт | 8,5÷11,5 |
Указанную композицию с концентрацией рФСГч 0,040÷0,048 грамм/литр получают разбавлением вышеописанной (концентрированной) композиции раствором следующего состава (грамм/литр):
| стабилизирующий агент - сахароза | 61÷75 |
| стабилизирующий агент - полисорбат 20 | 0,18÷0,22 |
| антиоксидант - L-метионин | 0,45÷0,55 |
| буферный агент - натрия гидрофосфат дигидрат | 0,999÷1,221 |
| буферный агент - натрия дигидрофосфат моногидрат | 0,486÷0,594 |
| бактериостатический агент - бензиловый спирт | 9,02÷13,08 |
Композиция вышеуказанного состава сохраняет биологическую активность in vivo в интервале от 8 ME до 22 ME из расчета на мкг рФСГч при температурах хранения 2÷8°С в течение не менее 24 месяцев.
Предпочтительно, когда упомянутый раствор, которым разбавляют вышеупомянутую концентрированную композицию имеет pH 6,5÷7,5.
Наиболее предпочтительным вариантом композиции согласно настоящему изобретению является композиция, в которой концентрация рФСГч равна 0,044 г/л, а содержание остальных компонентов составляет (грамм/литр):
| стабилизирующий агент - сахароза | 68,46 |
| стабилизирующий агент - полисорбат 20 | 0,2 |
| антиоксидант - L-метионин | 0,5 |
| буферный агент - натрия гидрофосфат дигидрат | 1,110 |
| буферный агент - натрия дигидрофосфат моногидрат | 0,540 |
| бактериостатический агент - бензиловый спирт | 10 |
Указанные композиции могут быть использованы для получения готовых лекарственных форм препарата рФСГч в виде многодозовых флаконов или картриджей, предзаполненных шприц ручек или шприцев.
КРАТКОЕ ОПИСАНИЕ ФИГУР
На Фиг. 1 представлен профиль рФСГч образца 1.1 (олигомеры, мономер-основной пик и свободные субъединицы) на хроматограмме эксклюзионной-ВЭЖХ.
На Фиг. 2 представлены исходные данные и линейные регрессии для рФСГч и 2го международного стандарта ВОЗ в эксперименте по определению биологической активности in vivo рФСГч через 24 месяца хранения образца 1.1 при температуре ниже -35°C. Определенная по тангенсам угла наклона линий регрессий биологическая активность рФСГч в образце 1.1 составила 16,54 МЕ/мкг.
На Фиг. 3 представлен профиль рФСГч образца 2.1 (олигомеры, мономер -основной пик и свободные субъединицы) на хроматограмме эксклюзионной-ВЭЖХ.
На Фиг. 4 представлена хроматограмма образца бензилового спирта, добавленного к образцам 2.1, 2.2 и 2.3.
На Фиг. 5 представлены исходные данные и линейные регрессии для рФСГч и 2го международного стандарта ВОЗ в эксперименте по определению биологической активности in vivo рФСГч через 24 месяца хранения образца 2.1 при температуре 2÷8°C. Определенная по тангенсам угла наклона линий регрессий биологическая активность рФСГч в образце 2.1 составила 8,09 МЕ/мкг.
ОСУЩЕСТВЛЕНИЕ ИЗОБРЕТЕНИЯ
В качестве источника фолликулостимулирующего гормона человека для водной композиции настоящего изобретения можно применять рФСГч, который экспрессируется, выделяется и очищается из клеток млекопитающих, например, культивируемых в биореакторе генетически модифицированных клеток китайского хомяка или клеток человека.
Водная композиция для поддержания биологической активности in vivo рФСГч с концентрацией от 0,35 г/л до 0,65 г/л, определенной методом эксклюзионной хроматографии (Фиг. 1), включает сахарозу в качестве стабилизатора в концентрации от 61 до 75 г/л. Добавление сахарозы к полипептидным гормонам обеспечивает лучшую гидратацию молекулы белка, включая гидрофобные участки полипептидной цепи (см. Wang W. (1999) «Instability, stabilization, and formulation of liquid protein pharmaceuticals». Int J Pharm. 185(2): 129÷88). L-метионин в концентрации от 0,45 до 0,55 г/л в составе данной композиции препятствует повышенному окислению аминокислотных остатков альфа-субъединицы рФСГч. Композиция согласно настоящему изобретению также включает полисорбат 20 в концентрации от 0,18 до 0,22 г/л для снижения абсорбции рФСГч на поверхности стекла флакона или картриджа при хранении, а также снижения агрегации. Добавление к водной композиции натрия гидрофосфат дигидрата (от 0,999 до 1,221 г/л) и натрия дигидрофосфат моногидрата (от 0,486 г/л до 0,594 г/л) обеспечивает композицию буферными свойствами с параметрами pH от 6,5 до 7,5. Полученные таким образом растворы 1.1, 1.2, 1.3 хранятся при температуре ниже -35°C с последующим анализом биологической активности in vivo каждого образца в течение 24 месяцев с интервалом в 6 месяцев (Таблица 1). Фиг. 2 иллюстрирует анализ биологической активности in vivo образца 1.1 в сравнении со 2-м международным стандартом Всемирной Организации Здравоохранения (ВОЗ) для рекомбинантного ФСГ (Код 08/282, 126 ME (10 мкг в ампуле)) через 24 месяца хранения при температуре ниже -35°C.
Водная композиция для поддержания биологической активности in vivo рФСГч с концентрацией 0,040÷0,048 г/л, определенной методом эксклюзионной хроматографии (Фиг. 3), для хранения при температуре 2÷8°C дополнительно содержит бензиловый спирт в концентрации 8,5÷11,5 г/л (Фиг. 4). Бензиловый спирт представляет собой широко известный бактериостатический агент, используемый для профилактики нежелательного роста микроорганизмов в многодозовых лекарственных формах. Полученные растворы 2.1, 2.2, 2.3 хранятся при температуре 2÷8°C с последующим анализом биологической активности in vivo каждого образца в течение 24 месяцев с интервалом в 6 месяцев (Таблица 2). Фиг. 5 иллюстрирует анализ биологической активности in vivo образца 2.1 в сравнении со 2-м международным стандартом Всемирной Организации Здравоохранения (ВОЗ) для рекомбиантного ФСГ (Код 08/282, 126 ME (10 мкг в ампуле)), через 24 месяца хранения 2÷8°C.
Пример 1. Получение растворов с высокой концентрацией рФСГч
рФСГч переводили в фосфатный буфер, содержащий сахарозу 68,46 г/л, L-метионин 0.5 г/л, полисорбат 20 0.2 г/л, натрия гидрофосфат дигидрат 1,110 г/л, натрия дигидрофосфат моногидрат 0,540 г/л, pH от 6,5 до 7,5, с использованием хроматографической колонки Superdex G75 (GE Healthcare, США).
Подготовленный таким образом раствор рФСГч подвергали стерильной фильтрации и разливали по 1,5 мл во флаконы стеклянные для медицинских препаратов вместимостью 4 мл, герметично укупоривали пробками резиновыми и обкатывали колпачками алюминиевыми. Раствор готовой композиции с концентрацией рФСГч от 0,35 г/л до 0,65 г/л хранят при температуре ниже минус 35°C в защищенном от света месте. Состав подготовленных таким образом растворов приведен в Таблице 1.
Пример 2. Получение растворов с низкой концентрацией рФСГч
Раствор рФСГч с концентрацией 0,5 г/л, измеренной с использованием метода эксклюзионной-ВЭЖХ в сравнении с Европейским фармакопейным стандартом для рФСГч (Follitropin CRS, Код Y0001629) и полученный, как описано в Примере 1, разбавляли в 11,36 раз до концентрации рФСГч, равной 0,044 г/л, буферным раствором, содержащим сахарозу 68,46 г/л, L-метионин 0,5 г/л, полисорбат 20 0,2 г/л, натрия гидрофосфат дигидрат 1,110 г/л, натрия дигидрофосфат моногидрат 0,540 г/л, бензиловый спирт 10,88 г/л, pH от 6,5 до 7,5.
Подготовленный таким образом раствор рФСГч подвергали стерильной фильтрации и разливали по 1,5 мл во флаконы стеклянные для медицинских препаратов вместимостью 4 мл, герметично укупоривали пробками резиновыми и обкатывали колпачками алюминиевыми. Раствор готовой композиции с концентрацией рФСГч от 0,040 до 0,048 г/л хранят при температуре 2-8°C в защищенном от света месте. Состав подготовленных таким образом растворов приведен в Таблице 2.
Пример 3. Определение концентрации рФСГч методом эксклюзионной хроматографии
Определение концентрации рФСГч проводили в следующих хроматографических условиях:
Рассчитывали объемы пиков гетеродимера ФСГ (основной пик), рассчитывали объемы пиков гетеродимера ФСГ для проб стандартного образца (Follitropin CRS, Код Y0001629). Концентрацию гетеродимера ФСГ (С, г/л) в испытуемом растворе определяли по формуле:
Vис - объем пика гетеродимера ФСГ на хроматограмме испытуемого раствора;
Сст - концентрация гетеродимера ФСГ в использованном стандартном образце, г/л;
Vст - объем пика гетеродимера ФСГ на хроматограмме стандартного образца.
Пример 4. Определение биологической активности in vivo рФСГч
Для исследования использовали неполовозрелых самок крыс одной и той же линии (например. Wistar) возрастом в диапазоне 19÷28 дней, различающихся по возрасту не более чем на 3 дня и с различиями по массе не превышающими 10 г. Крыс случайным образом распределяли в семь равных групп, в каждой из которых не менее пяти животных. Животных из одного выводка помечали и равномерно распределяли в каждую из групп.
Подбирали три дозы международного стандартного образца ФСГ (Стандарт ВОЗ, Код 08/282) и три дозы испытуемого образца так, чтобы наименьшая доза обеспечивала стимуляцию яичников у некоторых животных, а наибольшая доза не приводила бы к максимальному ответу у всех крыс. Использовали суточные дозы, увеличивающиеся в геометрической прогрессии, сначала испытывали дозы, равные 0,055 мкг, 0,11 мкг и 0,22 мкг, причем суточная доза зависит от чувствительности используемых животных и может варьировать в широком диапазоне.
Количества испытуемого образца и стандарта, равные используемым суточным дозам, разводили в растворе 1 непосредственно перед экспериментом таким образом, чтобы суточная доза вводилась в объеме около 0,2 мл и содержала не менее 20 ME гонадотропина хорионического человека для обеспечения полной лютеинизации. Все подготовленные растворы хранили при 5±3°С.
Каждой крысе подкожно вводили суточную дозу, предназначенную для каждой группы. В группе контрольных животных вводили эквивалентные объемы раствора стандартного фосфатно-солевого буфера (ФСБ) с pH 7.4 с гонадотропином хорионическим.
Инъекции повторяли через 24 и 48 часов после первой инъекции. Через 24 ч после последней инъекции животных подвергали эвтаназии, удаляли яичники у каждого из животных. Удаляли посторонную жидкость и ткань, не относящуюся к яичнику, после чего яичники немедленно взвешивали, записывали общий вес обоих яичников, полученных от каждого животного в группе.
Статистическую обработку данных проводили в соответствии с принципами расчета биологической активности, изложенными в Евр. Фарм. (глава 5.3), где масса яичников рассматривается в качестве величины ответной реакции.
Пример 5. Определение концентрации сахарозы
Определение концентрации сахарозы проводили в следующих хроматографических условиях:
Концентрацию сахарозы (С, г/л) в испытуемом растворе рассчитывали по следующей формуле:
Аисп - площадь пика сахарозы на хроматограмме испытуемого раствора, мкВ·с;
Астд - площадь пика сахарозы на хроматограмме стандартного раствора, мкВ·с;
Сстд - концентрация стандартного раствора, г/л.
Пример 6. Определение концентрации L-метионина
Определение концентрации L-метионина проводили в следующих хроматографических условиях:
Концентрацию метионина в испытуемом растворе рассчитывали по следующей формуле
Аисп - площадь пика метионина на хроматограмме испытуемого раствора, мкВ·с;
Астд - площадь пика метионина на хроматограмме стандартного раствора, мкВ·с;
Сстд - концентрация стандартного раствора, г/л.
Пример 7. Определение концентрации полисорбата 20
В две полипропиленовые пробирки вместимостью 1,5 мл помещали по 0,5 мл испытуемого раствора, добавляли по 0,5 мл 10 М раствора NaOH, перемешивали и инкубировали 50÷70 мин на кипящей водяной бане. Охлаждали пробирки на воздухе до комнатной температуре и вносили по 0,5 мл 10 М раствора уксусной кислоты. Перемешивали, выдерживали 30 мин при комнатной температуре, центрифугировали 10 мин на максимальной скорости. Переносили по 1 мл надосадочной жидкости в новые полипропиленовые пробирки.
Приготавливали образцы для построения калибровочной кривой объемом по 1,5 мл с концентрацией полисорбата 20 0,4; 0,2; 0,1; 0 г/л, для этого вносили в полипропиленовые пробирки по 500, 250, 125, 0 мкл раствора 0,4 г/л полисорбата 20, 0, 250, 375, 500 мкл воды очищенной. Приготавливали по две порции растворов для каждой концентрации полисорбата 20. Затем вносили во все пробирки по 0,5 мл 10 М раствора NaOH и 0,5 мл 10 М раствора уксусной кислоты. Перемешивали пробирки, переносили по 1 мл полученных растворов в новые полипропиленовые пробирки.
К двум пробам испытуемого раствора и восьми пробам растворов калибровочной кривой добавляли по 3 мл раствора тиоцианат-кобальтового реагента, перемешивали, добавляли по 2 мл метиленхлорида и повторно перемешивали до полного диспергирования жидкостей. Выдерживали пробирки при комнатной температуре до полного разделения фаз, но не менее 30 мин. Измеряли оптические плотности органических фаз из всех пробирок на длине волны 320 нм в кювете с длиной оптического пути 1 см, предварительно установив нулевую оптическую плотность по метиленхлориду. Строили калибровочную кривую линейной зависимости измеренной оптической плотности от концентрации полисорбата 20 методом наименьших квадратов. Вычисляли среднее арифметическое концентрации полисорбата 20 в испытуемом растворе по полученной калибровочной кривой.
Пример 8. Определение концентрации бензилового спирта
Определение концентрации бензилового спирта проводили в следующих хроматографических условиях.
Режим:
Содержание бензилового спирта (X, мг/мл) рассчитывали по следующей формуле:
Sисп - площадь пика бензилового спирта на хроматограмме испытуемого раствора, мкВ·с;
Sстд - площадь пика бензилового спирта на хроматограмме стандартного раствора, мкВ·с;
Cстд - концентрация стандартного раствора, г/л;
Vcont - объем препарата в первичной упаковке, мл.
Пример 9. Определение pH
Использовали pH-метр, откалиброванный по стандартным буферным растворам, приготовленным на воде, свободной от углекислого газа, при той же температуре, при которой проводили измерение pH испытуемого раствора. Чувствительность определения не менее 0,05 ед. pH.
Хотя указанное изобретение описано в деталях со ссылкой на Примеры, для специалиста в указанной области техники очевидно, что могут быть совершены различные изменения и произведены эквивалентные замены, и такие изменения и замены не выходят за рамки настоящего изобретения.
Claims (7)
1. Водная композиция рекомбинантного фолликулостимулирующего гормона человека (рФСГч) следующего состава (г/л):
рФСГч 0,35÷0,65
стабилизирующий агент - сахароза 61÷75
стабилизирующий агент - полисорбат 20 0,18÷0,22
антиоксидант - L-метионин 0,45÷0,55
буферный агент - натрия гидрофосфат дигидрат 0,999÷1,221
буферный агент - натрия дигидрофосфат моногидрат 0,486÷0,594
2. Композиция по п. 1, отличающаяся тем, что она имеет pH 6,5÷7,5.
3. Композиция по любому из пп. 1 или 2, отличающаяся тем, что рФСГч в составе указанной композиции сохраняет биологическую активность in vivo в интервале от 8 ME до 22 ME из расчета на мкг рФСГч при температурах хранения ниже -35°C в течение не менее 24 месяцев.
4. Водная композиция рекомбинантного фолликулостимулирующего гормона человека (рФСГч), следующего состава (г/л):
рФСГч 0,040÷0,048 г/л
стабилизирующий агент - сахароза 61÷75
стабилизирующий агент - полисорбат 20 0,18÷0,22
антиоксидант - L-метионин 0,45÷0,55
буферный агент - натрия гидрофосфат дигидрат 0,999÷1,221
буферный агент - натрия дигидрофосфат моногидрат 0,486÷0,594
бактериостатический агент - бензиловый спирт 8,5÷11,5
5. Композиция по п. 4, отличающаяся тем, что упомянутый раствор имеет pH 6,5÷7,5.
6. Композиция по п. 4, отличающаяся тем, что концентрация рФСГч равна 0,044 г/л, а содержание остальных компонентов составляет (г/л):
стабилизирующий агент - сахароза 68,46
стабилизирующий агент - полисорбат 20 0,2
антиоксидант - L-метионин 0,5
буферный агент - натрия гидрофосфат дигидрат 1,110
буферный агент - натрия дигидрофосфат моногидрат 0,540
бактериостатический агент - бензиловый спирт 10
7. Композиция по любому из пп. 4-6, характеризующаяся тем, что рФСГч в составе указанной композиции сохраняет биологическую активность in vivo в интервале от 8 ME до 22 ME из расчета на мкг рФСГч при температурах хранения 2÷8°C в течение не менее 24 месяцев.
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2015133576/15A RU2599031C1 (ru) | 2015-08-11 | 2015-08-11 | Водная композиция рекомбинантного фолликулостимулирующего гормона человека (варианты) |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2015133576/15A RU2599031C1 (ru) | 2015-08-11 | 2015-08-11 | Водная композиция рекомбинантного фолликулостимулирующего гормона человека (варианты) |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| RU2599031C1 true RU2599031C1 (ru) | 2016-10-10 |
Family
ID=57127422
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2015133576/15A RU2599031C1 (ru) | 2015-08-11 | 2015-08-11 | Водная композиция рекомбинантного фолликулостимулирующего гормона человека (варианты) |
Country Status (1)
| Country | Link |
|---|---|
| RU (1) | RU2599031C1 (ru) |
Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20030104996A1 (en) * | 2001-08-30 | 2003-06-05 | Tiansheng Li | L-methionine as a stabilizer for NESP/EPO in HSA-free formulations |
| WO2011108010A2 (en) * | 2010-03-05 | 2011-09-09 | Intas Biopharmaceuticals Limited | A thermostable liquid formulation of gonadotropins |
| WO2012009254A1 (en) * | 2010-07-14 | 2012-01-19 | Regeneron Pharmaceuticals, Inc | Stabilized formulations containing anti-ngf antibodies |
| WO2015075743A1 (en) * | 2013-11-12 | 2015-05-28 | Cadila Healthcare Limited | Formulation for gonadotropins |
| RU2553375C2 (ru) * | 2010-02-12 | 2015-06-10 | Интас Биофармасьютикалс Лимитед | Жидкий состав фолликулостимулирующего гормона |
-
2015
- 2015-08-11 RU RU2015133576/15A patent/RU2599031C1/ru active
Patent Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20030104996A1 (en) * | 2001-08-30 | 2003-06-05 | Tiansheng Li | L-methionine as a stabilizer for NESP/EPO in HSA-free formulations |
| RU2553375C2 (ru) * | 2010-02-12 | 2015-06-10 | Интас Биофармасьютикалс Лимитед | Жидкий состав фолликулостимулирующего гормона |
| WO2011108010A2 (en) * | 2010-03-05 | 2011-09-09 | Intas Biopharmaceuticals Limited | A thermostable liquid formulation of gonadotropins |
| WO2012009254A1 (en) * | 2010-07-14 | 2012-01-19 | Regeneron Pharmaceuticals, Inc | Stabilized formulations containing anti-ngf antibodies |
| WO2015075743A1 (en) * | 2013-11-12 | 2015-05-28 | Cadila Healthcare Limited | Formulation for gonadotropins |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| ES2345058T3 (es) | Formulacion acuosa de hfsh. | |
| KR101662631B1 (ko) | Fsh의 액체 포뮬레이션 | |
| JP6063877B2 (ja) | ペプチド薬物の非経口注射用の安定な製剤 | |
| RU2203086C2 (ru) | Жидкие композиции, содержащие гонадотропин | |
| JP6522711B2 (ja) | Fshの安定化 | |
| RU2553375C2 (ru) | Жидкий состав фолликулостимулирующего гормона | |
| JP6932710B2 (ja) | 安定な液状ゴナドトロピン製剤 | |
| JP4699991B2 (ja) | 非イオン性界面活性剤を一緒に伴うfsh及びlhの液体医薬組成物 | |
| RU2599031C1 (ru) | Водная композиция рекомбинантного фолликулостимулирующего гормона человека (варианты) | |
| JP2009514777A (ja) | 凍結乾燥fsh/lh製剤 |