RU2560596C2 - Плазмида для экспрессии в клетках сно рекомбинантного фолликулостимулирующего гормона (фсг) человека, плазмида для экспрессии в клетках сно бета-субъединицы рекомбинантного фсг человека, клетка сно - продуцент рекомбинантного фсг человека и способ получения указанного гормона - Google Patents
Плазмида для экспрессии в клетках сно рекомбинантного фолликулостимулирующего гормона (фсг) человека, плазмида для экспрессии в клетках сно бета-субъединицы рекомбинантного фсг человека, клетка сно - продуцент рекомбинантного фсг человека и способ получения указанного гормона Download PDFInfo
- Publication number
- RU2560596C2 RU2560596C2 RU2013143210/10A RU2013143210A RU2560596C2 RU 2560596 C2 RU2560596 C2 RU 2560596C2 RU 2013143210/10 A RU2013143210/10 A RU 2013143210/10A RU 2013143210 A RU2013143210 A RU 2013143210A RU 2560596 C2 RU2560596 C2 RU 2560596C2
- Authority
- RU
- Russia
- Prior art keywords
- fsh
- plasmid
- gene
- human
- beta
- Prior art date
Links
- 102000012673 Follicle Stimulating Hormone Human genes 0.000 title claims abstract description 121
- 108010079345 Follicle Stimulating Hormone Proteins 0.000 title claims abstract description 121
- 229940028334 follicle stimulating hormone Drugs 0.000 title claims abstract description 119
- 238000004519 manufacturing process Methods 0.000 title abstract description 27
- 239000013613 expression plasmid Substances 0.000 title abstract description 18
- 229940088597 hormone Drugs 0.000 title description 40
- 239000005556 hormone Substances 0.000 title description 40
- 210000004027 cell Anatomy 0.000 claims abstract description 151
- 239000013612 plasmid Substances 0.000 claims abstract description 127
- 108090000623 proteins and genes Proteins 0.000 claims abstract description 118
- 102000003864 Human Follicle Stimulating Hormone Human genes 0.000 claims abstract description 48
- 108010082302 Human Follicle Stimulating Hormone Proteins 0.000 claims abstract description 48
- 238000000034 method Methods 0.000 claims abstract description 43
- 108700026244 Open Reading Frames Proteins 0.000 claims abstract description 32
- 241000699802 Cricetulus griseus Species 0.000 claims abstract description 27
- 210000004978 chinese hamster ovary cell Anatomy 0.000 claims abstract description 26
- 241000710188 Encephalomyocarditis virus Species 0.000 claims abstract description 24
- 108010022394 Threonine synthase Proteins 0.000 claims abstract description 19
- 102000004419 dihydrofolate reductase Human genes 0.000 claims abstract description 17
- 108010077524 Peptide Elongation Factor 1 Proteins 0.000 claims abstract description 13
- 241000701044 Human gammaherpesvirus 4 Species 0.000 claims abstract description 11
- 108090000204 Dipeptidase 1 Proteins 0.000 claims abstract description 8
- 102000006635 beta-lactamase Human genes 0.000 claims abstract description 8
- 101150049515 bla gene Proteins 0.000 claims abstract description 8
- 108020004999 messenger RNA Proteins 0.000 claims abstract description 8
- 230000010076 replication Effects 0.000 claims abstract description 8
- 230000014509 gene expression Effects 0.000 claims description 72
- 239000012634 fragment Substances 0.000 claims description 30
- 239000002609 medium Substances 0.000 claims description 28
- 239000001963 growth medium Substances 0.000 claims description 14
- 108020004705 Codon Proteins 0.000 claims description 13
- YQYJSBFKSSDGFO-UHFFFAOYSA-N Epihygromycin Natural products OC1C(O)C(C(=O)C)OC1OC(C(=C1)O)=CC=C1C=C(C)C(=O)NC1C(O)C(O)C2OCOC2C1O YQYJSBFKSSDGFO-UHFFFAOYSA-N 0.000 claims description 12
- 102000010292 Peptide Elongation Factor 1 Human genes 0.000 claims description 11
- 210000001672 ovary Anatomy 0.000 claims description 9
- 239000012531 culture fluid Substances 0.000 claims description 7
- 101000893054 Homo sapiens Follitropin subunit beta Proteins 0.000 claims description 6
- 108091036066 Three prime untranslated region Proteins 0.000 claims description 6
- 108091026898 Leader sequence (mRNA) Proteins 0.000 claims description 5
- 101000966481 Mus musculus Dihydrofolate reductase Proteins 0.000 claims description 5
- 102000007056 Recombinant Fusion Proteins Human genes 0.000 claims description 5
- 108010008281 Recombinant Fusion Proteins Proteins 0.000 claims description 5
- 235000015097 nutrients Nutrition 0.000 claims description 5
- 108091028732 Concatemer Proteins 0.000 claims description 4
- 238000002955 isolation Methods 0.000 claims description 4
- 244000005700 microbiome Species 0.000 claims description 4
- 230000002238 attenuated effect Effects 0.000 claims description 3
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 claims description 2
- 125000003275 alpha amino acid group Chemical group 0.000 claims 2
- 230000000694 effects Effects 0.000 abstract description 18
- 239000003814 drug Substances 0.000 abstract description 7
- 210000003705 ribosome Anatomy 0.000 abstract 1
- 239000000126 substance Substances 0.000 abstract 1
- FBOZXECLQNJBKD-ZDUSSCGKSA-N L-methotrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FBOZXECLQNJBKD-ZDUSSCGKSA-N 0.000 description 32
- 229960000485 methotrexate Drugs 0.000 description 32
- 108020004414 DNA Proteins 0.000 description 28
- 102000004169 proteins and genes Human genes 0.000 description 26
- 239000013598 vector Substances 0.000 description 26
- 238000001890 transfection Methods 0.000 description 23
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 19
- 230000003321 amplification Effects 0.000 description 17
- 238000003199 nucleic acid amplification method Methods 0.000 description 17
- 230000002068 genetic effect Effects 0.000 description 15
- 210000004962 mammalian cell Anatomy 0.000 description 13
- 230000028327 secretion Effects 0.000 description 13
- 238000010367 cloning Methods 0.000 description 12
- 241000588724 Escherichia coli Species 0.000 description 11
- 102000035824 beta Subunit Follicle Stimulating Hormone Human genes 0.000 description 11
- 108010081485 beta Subunit Follicle Stimulating Hormone Proteins 0.000 description 11
- 230000003115 biocidal effect Effects 0.000 description 11
- BRZYSWJRSDMWLG-CAXSIQPQSA-N geneticin Chemical compound O1C[C@@](O)(C)[C@H](NC)[C@@H](O)[C@H]1O[C@@H]1[C@@H](O)[C@H](O[C@@H]2[C@@H]([C@@H](O)[C@H](O)[C@@H](C(C)O)O2)N)[C@@H](N)C[C@H]1N BRZYSWJRSDMWLG-CAXSIQPQSA-N 0.000 description 11
- 238000003752 polymerase chain reaction Methods 0.000 description 11
- 230000014621 translational initiation Effects 0.000 description 11
- IQFYYKKMVGJFEH-XLPZGREQSA-N Thymidine Chemical compound O=C1NC(=O)C(C)=CN1[C@@H]1O[C@H](CO)[C@@H](O)C1 IQFYYKKMVGJFEH-XLPZGREQSA-N 0.000 description 10
- 108010000732 alpha Subunit Glycoprotein Hormones Proteins 0.000 description 10
- 102000002287 alpha Subunit Glycoprotein Hormones Human genes 0.000 description 10
- 230000008488 polyadenylation Effects 0.000 description 10
- 235000018102 proteins Nutrition 0.000 description 10
- 239000011780 sodium chloride Substances 0.000 description 10
- 235000002639 sodium chloride Nutrition 0.000 description 10
- 239000000243 solution Substances 0.000 description 10
- 229960000723 ampicillin Drugs 0.000 description 9
- AVKUERGKIZMTKX-NJBDSQKTSA-N ampicillin Chemical compound C1([C@@H](N)C(=O)N[C@H]2[C@H]3SC([C@@H](N3C2=O)C(O)=O)(C)C)=CC=CC=C1 AVKUERGKIZMTKX-NJBDSQKTSA-N 0.000 description 9
- 210000003527 eukaryotic cell Anatomy 0.000 description 9
- 239000000833 heterodimer Substances 0.000 description 9
- 239000000203 mixture Substances 0.000 description 9
- 108091008146 restriction endonucleases Proteins 0.000 description 9
- 239000000725 suspension Substances 0.000 description 9
- 238000004113 cell culture Methods 0.000 description 8
- 239000003153 chemical reaction reagent Substances 0.000 description 8
- 238000005516 engineering process Methods 0.000 description 8
- FDGQSTZJBFJUBT-UHFFFAOYSA-N hypoxanthine Chemical compound O=C1NC=NC2=C1NC=N2 FDGQSTZJBFJUBT-UHFFFAOYSA-N 0.000 description 8
- 238000002347 injection Methods 0.000 description 8
- 239000007924 injection Substances 0.000 description 8
- 230000010354 integration Effects 0.000 description 8
- 239000002773 nucleotide Substances 0.000 description 8
- 125000003729 nucleotide group Chemical group 0.000 description 8
- 239000000047 product Substances 0.000 description 8
- 230000001105 regulatory effect Effects 0.000 description 8
- 229920001817 Agar Polymers 0.000 description 7
- 239000008272 agar Substances 0.000 description 7
- 230000004071 biological effect Effects 0.000 description 7
- 230000012010 growth Effects 0.000 description 7
- 239000003550 marker Substances 0.000 description 7
- 238000002360 preparation method Methods 0.000 description 7
- 239000012679 serum free medium Substances 0.000 description 7
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 6
- 102000011022 Chorionic Gonadotropin Human genes 0.000 description 6
- 108010062540 Chorionic Gonadotropin Proteins 0.000 description 6
- 241000701022 Cytomegalovirus Species 0.000 description 6
- 238000002965 ELISA Methods 0.000 description 6
- 108091092195 Intron Proteins 0.000 description 6
- 102000009151 Luteinizing Hormone Human genes 0.000 description 6
- 108010073521 Luteinizing Hormone Proteins 0.000 description 6
- 210000004102 animal cell Anatomy 0.000 description 6
- 230000015572 biosynthetic process Effects 0.000 description 6
- 230000001419 dependent effect Effects 0.000 description 6
- 238000001727 in vivo Methods 0.000 description 6
- 229940040129 luteinizing hormone Drugs 0.000 description 6
- 238000012360 testing method Methods 0.000 description 6
- 230000009466 transformation Effects 0.000 description 6
- 238000013519 translation Methods 0.000 description 6
- 230000003612 virological effect Effects 0.000 description 6
- DWRXFEITVBNRMK-UHFFFAOYSA-N Beta-D-1-Arabinofuranosylthymine Natural products O=C1NC(=O)C(C)=CN1C1C(O)C(O)C(CO)O1 DWRXFEITVBNRMK-UHFFFAOYSA-N 0.000 description 5
- 102000004190 Enzymes Human genes 0.000 description 5
- 108090000790 Enzymes Proteins 0.000 description 5
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 5
- 108010068204 Peptide Elongation Factors Proteins 0.000 description 5
- 239000011543 agarose gel Substances 0.000 description 5
- IQFYYKKMVGJFEH-UHFFFAOYSA-N beta-L-thymidine Natural products O=C1NC(=O)C(C)=CN1C1OC(CO)C(O)C1 IQFYYKKMVGJFEH-UHFFFAOYSA-N 0.000 description 5
- 229940041514 candida albicans extract Drugs 0.000 description 5
- 239000003795 chemical substances by application Substances 0.000 description 5
- 239000002299 complementary DNA Substances 0.000 description 5
- 229940079593 drug Drugs 0.000 description 5
- 238000000338 in vitro Methods 0.000 description 5
- 238000003780 insertion Methods 0.000 description 5
- 230000037431 insertion Effects 0.000 description 5
- 239000000178 monomer Substances 0.000 description 5
- 230000035772 mutation Effects 0.000 description 5
- 238000004114 suspension culture Methods 0.000 description 5
- 229940104230 thymidine Drugs 0.000 description 5
- 230000002103 transcriptional effect Effects 0.000 description 5
- 230000035899 viability Effects 0.000 description 5
- 239000012138 yeast extract Substances 0.000 description 5
- 108091026890 Coding region Proteins 0.000 description 4
- 108010042407 Endonucleases Proteins 0.000 description 4
- 102000006771 Gonadotropins Human genes 0.000 description 4
- 108010086677 Gonadotropins Proteins 0.000 description 4
- 101001038874 Homo sapiens Glycoprotein hormones alpha chain Proteins 0.000 description 4
- UGQMRVRMYYASKQ-UHFFFAOYSA-N Hypoxanthine nucleoside Natural products OC1C(O)C(CO)OC1N1C(NC=NC2=O)=C2N=C1 UGQMRVRMYYASKQ-UHFFFAOYSA-N 0.000 description 4
- 241000700159 Rattus Species 0.000 description 4
- 229920002684 Sepharose Polymers 0.000 description 4
- 241000700605 Viruses Species 0.000 description 4
- 150000001413 amino acids Chemical group 0.000 description 4
- 238000001962 electrophoresis Methods 0.000 description 4
- 239000002622 gonadotropin Substances 0.000 description 4
- 229940094892 gonadotropins Drugs 0.000 description 4
- 208000000509 infertility Diseases 0.000 description 4
- 231100000535 infertility Toxicity 0.000 description 4
- 230000036512 infertility Effects 0.000 description 4
- 238000005457 optimization Methods 0.000 description 4
- 239000007787 solid Substances 0.000 description 4
- 238000013518 transcription Methods 0.000 description 4
- 230000035897 transcription Effects 0.000 description 4
- 239000012137 tryptone Substances 0.000 description 4
- 230000002485 urinary effect Effects 0.000 description 4
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 3
- 102000004533 Endonucleases Human genes 0.000 description 3
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 3
- 229930182816 L-glutamine Natural products 0.000 description 3
- 102000003960 Ligases Human genes 0.000 description 3
- 108090000364 Ligases Proteins 0.000 description 3
- 108020004511 Recombinant DNA Proteins 0.000 description 3
- 108700005078 Synthetic Genes Proteins 0.000 description 3
- 235000001014 amino acid Nutrition 0.000 description 3
- 229940024606 amino acid Drugs 0.000 description 3
- 239000003242 anti bacterial agent Substances 0.000 description 3
- 230000002513 anti-ovulatory effect Effects 0.000 description 3
- 229960000074 biopharmaceutical Drugs 0.000 description 3
- 230000003833 cell viability Effects 0.000 description 3
- 229940015047 chorionic gonadotropin Drugs 0.000 description 3
- 239000003636 conditioned culture medium Substances 0.000 description 3
- 238000012239 gene modification Methods 0.000 description 3
- 230000005017 genetic modification Effects 0.000 description 3
- 235000013617 genetically modified food Nutrition 0.000 description 3
- 229940084986 human chorionic gonadotropin Drugs 0.000 description 3
- 229910052757 nitrogen Inorganic materials 0.000 description 3
- 239000013600 plasmid vector Substances 0.000 description 3
- 230000002829 reductive effect Effects 0.000 description 3
- 230000001850 reproductive effect Effects 0.000 description 3
- 230000003248 secreting effect Effects 0.000 description 3
- 239000002594 sorbent Substances 0.000 description 3
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Chemical compound O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 3
- JDKLPDJLXHXHNV-MFVUMRCOSA-N (3s,6s,9r,12s,15s,23s)-15-[[(2s)-2-acetamidohexanoyl]amino]-9-benzyl-6-[3-(diaminomethylideneamino)propyl]-12-(1h-imidazol-5-ylmethyl)-3-(1h-indol-3-ylmethyl)-2,5,8,11,14,17-hexaoxo-1,4,7,10,13,18-hexazacyclotricosane-23-carboxamide Chemical compound C([C@@H]1C(=O)N[C@@H](CCCN=C(N)N)C(=O)N[C@@H](CC=2C3=CC=CC=C3NC=2)C(=O)N[C@@H](CCCCNC(=O)C[C@@H](C(N[C@@H](CC=2NC=NC=2)C(=O)N1)=O)NC(=O)[C@@H](NC(C)=O)CCCC)C(N)=O)C1=CC=CC=C1 JDKLPDJLXHXHNV-MFVUMRCOSA-N 0.000 description 2
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 2
- VOXZDWNPVJITMN-ZBRFXRBCSA-N 17β-estradiol Chemical compound OC1=CC=C2[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3CCC2=C1 VOXZDWNPVJITMN-ZBRFXRBCSA-N 0.000 description 2
- 241000894006 Bacteria Species 0.000 description 2
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 2
- CURLTUGMZLYLDI-UHFFFAOYSA-N Carbon dioxide Chemical compound O=C=O CURLTUGMZLYLDI-UHFFFAOYSA-N 0.000 description 2
- 108091035707 Consensus sequence Proteins 0.000 description 2
- 102000012410 DNA Ligases Human genes 0.000 description 2
- 108010061982 DNA Ligases Proteins 0.000 description 2
- 101710120810 Elongation factor 1-alpha 1 Proteins 0.000 description 2
- 241000206602 Eukaryota Species 0.000 description 2
- 108700024394 Exon Proteins 0.000 description 2
- 102000008175 FSH Receptors Human genes 0.000 description 2
- 108010060374 FSH Receptors Proteins 0.000 description 2
- 108700028146 Genetic Enhancer Elements Proteins 0.000 description 2
- 102000003886 Glycoproteins Human genes 0.000 description 2
- 108090000288 Glycoproteins Proteins 0.000 description 2
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 2
- CSNNHWWHGAXBCP-UHFFFAOYSA-L Magnesium sulfate Chemical compound [Mg+2].[O-][S+2]([O-])([O-])[O-] CSNNHWWHGAXBCP-UHFFFAOYSA-L 0.000 description 2
- 101710201349 Metallothionein B Proteins 0.000 description 2
- 102100031347 Metallothionein-2 Human genes 0.000 description 2
- 101710094505 Metallothionein-2 Proteins 0.000 description 2
- 241001465754 Metazoa Species 0.000 description 2
- 229930193140 Neomycin Natural products 0.000 description 2
- 206010034133 Pathogen resistance Diseases 0.000 description 2
- 108010029485 Protein Isoforms Proteins 0.000 description 2
- 102000001708 Protein Isoforms Human genes 0.000 description 2
- 108010076504 Protein Sorting Signals Proteins 0.000 description 2
- MUMGGOZAMZWBJJ-DYKIIFRCSA-N Testostosterone Chemical compound O=C1CC[C@]2(C)[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3CCC2=C1 MUMGGOZAMZWBJJ-DYKIIFRCSA-N 0.000 description 2
- 102000011923 Thyrotropin Human genes 0.000 description 2
- 108010061174 Thyrotropin Proteins 0.000 description 2
- 108700019146 Transgenes Proteins 0.000 description 2
- 230000009471 action Effects 0.000 description 2
- 229940088710 antibiotic agent Drugs 0.000 description 2
- 230000001580 bacterial effect Effects 0.000 description 2
- 239000000872 buffer Substances 0.000 description 2
- FPPNZSSZRUTDAP-UWFZAAFLSA-N carbenicillin Chemical compound N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)C(C(O)=O)C1=CC=CC=C1 FPPNZSSZRUTDAP-UWFZAAFLSA-N 0.000 description 2
- 229960003669 carbenicillin Drugs 0.000 description 2
- 150000001720 carbohydrates Chemical group 0.000 description 2
- 229910052799 carbon Inorganic materials 0.000 description 2
- 229910002091 carbon monoxide Inorganic materials 0.000 description 2
- 230000032823 cell division Effects 0.000 description 2
- 230000010261 cell growth Effects 0.000 description 2
- 239000006285 cell suspension Substances 0.000 description 2
- 238000005119 centrifugation Methods 0.000 description 2
- 238000012258 culturing Methods 0.000 description 2
- 230000003247 decreasing effect Effects 0.000 description 2
- 238000013461 design Methods 0.000 description 2
- 238000010790 dilution Methods 0.000 description 2
- 239000012895 dilution Substances 0.000 description 2
- 231100000673 dose–response relationship Toxicity 0.000 description 2
- 238000004520 electroporation Methods 0.000 description 2
- 239000013604 expression vector Substances 0.000 description 2
- 230000008217 follicular development Effects 0.000 description 2
- 239000000499 gel Substances 0.000 description 2
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 2
- 230000013595 glycosylation Effects 0.000 description 2
- 238000006206 glycosylation reaction Methods 0.000 description 2
- 210000004368 gonadotroph Anatomy 0.000 description 2
- 238000003119 immunoblot Methods 0.000 description 2
- 238000011534 incubation Methods 0.000 description 2
- 230000006698 induction Effects 0.000 description 2
- 230000000977 initiatory effect Effects 0.000 description 2
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Chemical compound N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 description 2
- 238000001155 isoelectric focusing Methods 0.000 description 2
- 229960000318 kanamycin Drugs 0.000 description 2
- 229930027917 kanamycin Natural products 0.000 description 2
- SBUJHOSQTJFQJX-NOAMYHISSA-N kanamycin Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CN)O[C@@H]1O[C@H]1[C@H](O)[C@@H](O[C@@H]2[C@@H]([C@@H](N)[C@H](O)[C@@H](CO)O2)O)[C@H](N)C[C@@H]1N SBUJHOSQTJFQJX-NOAMYHISSA-N 0.000 description 2
- 229930182823 kanamycin A Natural products 0.000 description 2
- 230000000670 limiting effect Effects 0.000 description 2
- 230000035800 maturation Effects 0.000 description 2
- 238000005259 measurement Methods 0.000 description 2
- 229960004927 neomycin Drugs 0.000 description 2
- 238000010899 nucleation Methods 0.000 description 2
- 230000002611 ovarian Effects 0.000 description 2
- 230000010412 perfusion Effects 0.000 description 2
- 239000000825 pharmaceutical preparation Substances 0.000 description 2
- 238000000746 purification Methods 0.000 description 2
- 238000000926 separation method Methods 0.000 description 2
- 230000003584 silencer Effects 0.000 description 2
- 239000012064 sodium phosphate buffer Substances 0.000 description 2
- 241000894007 species Species 0.000 description 2
- 150000003431 steroids Chemical class 0.000 description 2
- 238000003756 stirring Methods 0.000 description 2
- 238000012546 transfer Methods 0.000 description 2
- LWIHDJKSTIGBAC-UHFFFAOYSA-K tripotassium phosphate Chemical compound [K+].[K+].[K+].[O-]P([O-])([O-])=O LWIHDJKSTIGBAC-UHFFFAOYSA-K 0.000 description 2
- 238000011144 upstream manufacturing Methods 0.000 description 2
- 210000002700 urine Anatomy 0.000 description 2
- QKNYBSVHEMOAJP-UHFFFAOYSA-N 2-amino-2-(hydroxymethyl)propane-1,3-diol;hydron;chloride Chemical compound Cl.OCC(N)(CO)CO QKNYBSVHEMOAJP-UHFFFAOYSA-N 0.000 description 1
- 201000005670 Anovulation Diseases 0.000 description 1
- 206010002659 Anovulatory cycle Diseases 0.000 description 1
- DCXYFEDJOCDNAF-UHFFFAOYSA-N Asparagine Natural products OC(=O)C(N)CC(N)=O DCXYFEDJOCDNAF-UHFFFAOYSA-N 0.000 description 1
- 241000283690 Bos taurus Species 0.000 description 1
- 101100263837 Bovine ephemeral fever virus (strain BB7721) beta gene Proteins 0.000 description 1
- 101800001415 Bri23 peptide Proteins 0.000 description 1
- 101800000655 C-terminal peptide Proteins 0.000 description 1
- 102400000107 C-terminal peptide Human genes 0.000 description 1
- UXVMQQNJUSDDNG-UHFFFAOYSA-L Calcium chloride Chemical compound [Cl-].[Cl-].[Ca+2] UXVMQQNJUSDDNG-UHFFFAOYSA-L 0.000 description 1
- 101800005309 Carboxy-terminal peptide Proteins 0.000 description 1
- 101150074155 DHFR gene Proteins 0.000 description 1
- 108010016626 Dipeptides Proteins 0.000 description 1
- 102100031780 Endonuclease Human genes 0.000 description 1
- 101100316840 Enterobacteria phage P4 Beta gene Proteins 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- 108010043121 Green Fluorescent Proteins Proteins 0.000 description 1
- 102000004144 Green Fluorescent Proteins Human genes 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- 101000940063 Homo sapiens Ubiquitin-conjugating enzyme E2 variant 2 Proteins 0.000 description 1
- GRRNUXAQVGOGFE-UHFFFAOYSA-N Hygromycin-B Natural products OC1C(NC)CC(N)C(O)C1OC1C2OC3(C(C(O)C(O)C(C(N)CO)O3)O)OC2C(O)C(CO)O1 GRRNUXAQVGOGFE-UHFFFAOYSA-N 0.000 description 1
- 206010021067 Hypopituitarism Diseases 0.000 description 1
- 102000004877 Insulin Human genes 0.000 description 1
- 108090001061 Insulin Proteins 0.000 description 1
- DCXYFEDJOCDNAF-REOHCLBHSA-N L-asparagine Chemical compound OC(=O)[C@@H](N)CC(N)=O DCXYFEDJOCDNAF-REOHCLBHSA-N 0.000 description 1
- 241000124008 Mammalia Species 0.000 description 1
- 101001041236 Mus musculus Ornithine decarboxylase Proteins 0.000 description 1
- 101100301239 Myxococcus xanthus recA1 gene Proteins 0.000 description 1
- 230000004988 N-glycosylation Effects 0.000 description 1
- 108091028043 Nucleic acid sequence Proteins 0.000 description 1
- 102000043276 Oncogene Human genes 0.000 description 1
- 108700020796 Oncogene Proteins 0.000 description 1
- 102000052812 Ornithine decarboxylases Human genes 0.000 description 1
- 108700005126 Ornithine decarboxylases Proteins 0.000 description 1
- 239000004695 Polyether sulfone Substances 0.000 description 1
- 108091000054 Prion Proteins 0.000 description 1
- 102000029797 Prion Human genes 0.000 description 1
- 241000700157 Rattus norvegicus Species 0.000 description 1
- 241000283984 Rodentia Species 0.000 description 1
- 101100291452 Saccharomyces cerevisiae (strain ATCC 204508 / S288c) MMS1 gene Proteins 0.000 description 1
- 206010039491 Sarcoma Diseases 0.000 description 1
- 201000001880 Sexual dysfunction Diseases 0.000 description 1
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 1
- 229930006000 Sucrose Natural products 0.000 description 1
- JZRWCGZRTZMZEH-UHFFFAOYSA-N Thiamine Natural products CC1=C(CCO)SC=[N+]1CC1=CN=C(C)N=C1N JZRWCGZRTZMZEH-UHFFFAOYSA-N 0.000 description 1
- GLNADSQYFUSGOU-GPTZEZBUSA-J Trypan blue Chemical compound [Na+].[Na+].[Na+].[Na+].C1=C(S([O-])(=O)=O)C=C2C=C(S([O-])(=O)=O)C(/N=N/C3=CC=C(C=C3C)C=3C=C(C(=CC=3)\N=N\C=3C(=CC4=CC(=CC(N)=C4C=3O)S([O-])(=O)=O)S([O-])(=O)=O)C)=C(O)C2=C1N GLNADSQYFUSGOU-GPTZEZBUSA-J 0.000 description 1
- 102100031122 Ubiquitin-conjugating enzyme E2 variant 2 Human genes 0.000 description 1
- 238000009825 accumulation Methods 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- 239000000654 additive Substances 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 125000000539 amino acid group Chemical group 0.000 description 1
- 231100000552 anovulation Toxicity 0.000 description 1
- 238000013459 approach Methods 0.000 description 1
- 229960001230 asparagine Drugs 0.000 description 1
- 235000009582 asparagine Nutrition 0.000 description 1
- 238000003556 assay Methods 0.000 description 1
- 230000003416 augmentation Effects 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- 239000012888 bovine serum Substances 0.000 description 1
- 238000009395 breeding Methods 0.000 description 1
- 230000001488 breeding effect Effects 0.000 description 1
- 239000001110 calcium chloride Substances 0.000 description 1
- 229910001628 calcium chloride Inorganic materials 0.000 description 1
- 238000004364 calculation method Methods 0.000 description 1
- 235000014633 carbohydrates Nutrition 0.000 description 1
- 239000001569 carbon dioxide Substances 0.000 description 1
- 229910002092 carbon dioxide Inorganic materials 0.000 description 1
- 238000012512 characterization method Methods 0.000 description 1
- 229960001231 choline Drugs 0.000 description 1
- OEYIOHPDSNJKLS-UHFFFAOYSA-N choline Chemical compound C[N+](C)(C)CCO OEYIOHPDSNJKLS-UHFFFAOYSA-N 0.000 description 1
- 238000004587 chromatography analysis Methods 0.000 description 1
- 238000011097 chromatography purification Methods 0.000 description 1
- 238000011109 contamination Methods 0.000 description 1
- 238000005138 cryopreservation Methods 0.000 description 1
- 238000012364 cultivation method Methods 0.000 description 1
- 238000005520 cutting process Methods 0.000 description 1
- 230000002559 cytogenic effect Effects 0.000 description 1
- 238000007405 data analysis Methods 0.000 description 1
- 238000012217 deletion Methods 0.000 description 1
- 230000037430 deletion Effects 0.000 description 1
- 238000000326 densiometry Methods 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 235000015872 dietary supplement Nutrition 0.000 description 1
- 238000007865 diluting Methods 0.000 description 1
- 238000009826 distribution Methods 0.000 description 1
- 230000003828 downregulation Effects 0.000 description 1
- 230000004064 dysfunction Effects 0.000 description 1
- 108010038291 endodeoxyribonuclease PvuI Proteins 0.000 description 1
- 108010027881 endodeoxyribonuclease SpeI Proteins 0.000 description 1
- 210000001163 endosome Anatomy 0.000 description 1
- 239000003623 enhancer Substances 0.000 description 1
- 239000003797 essential amino acid Substances 0.000 description 1
- 235000020776 essential amino acid Nutrition 0.000 description 1
- 229960005309 estradiol Drugs 0.000 description 1
- 229930182833 estradiol Natural products 0.000 description 1
- ZMMJGEGLRURXTF-UHFFFAOYSA-N ethidium bromide Chemical compound [Br-].C12=CC(N)=CC=C2C2=CC=C(N)C=C2[N+](CC)=C1C1=CC=CC=C1 ZMMJGEGLRURXTF-UHFFFAOYSA-N 0.000 description 1
- 229960005542 ethidium bromide Drugs 0.000 description 1
- 230000004720 fertilization Effects 0.000 description 1
- 230000004992 fission Effects 0.000 description 1
- 239000012530 fluid Substances 0.000 description 1
- 230000003325 follicular Effects 0.000 description 1
- 238000007710 freezing Methods 0.000 description 1
- 230000008014 freezing Effects 0.000 description 1
- 239000012737 fresh medium Substances 0.000 description 1
- 230000005714 functional activity Effects 0.000 description 1
- 238000001502 gel electrophoresis Methods 0.000 description 1
- 239000008103 glucose Substances 0.000 description 1
- 239000005090 green fluorescent protein Substances 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 238000010438 heat treatment Methods 0.000 description 1
- 229910001385 heavy metal Inorganic materials 0.000 description 1
- GRRNUXAQVGOGFE-NZSRVPFOSA-N hygromycin B Chemical compound O[C@@H]1[C@@H](NC)C[C@@H](N)[C@H](O)[C@H]1O[C@H]1[C@H]2O[C@@]3([C@@H]([C@@H](O)[C@@H](O)[C@@H](C(N)CO)O3)O)O[C@H]2[C@@H](O)[C@@H](CO)O1 GRRNUXAQVGOGFE-NZSRVPFOSA-N 0.000 description 1
- 229940097277 hygromycin b Drugs 0.000 description 1
- 230000001900 immune effect Effects 0.000 description 1
- 239000003112 inhibitor Substances 0.000 description 1
- 239000002054 inoculum Substances 0.000 description 1
- 229910052500 inorganic mineral Inorganic materials 0.000 description 1
- 229940125396 insulin Drugs 0.000 description 1
- 229910000358 iron sulfate Inorganic materials 0.000 description 1
- BAUYGSIQEAFULO-UHFFFAOYSA-L iron(2+) sulfate (anhydrous) Chemical compound [Fe+2].[O-]S([O-])(=O)=O BAUYGSIQEAFULO-UHFFFAOYSA-L 0.000 description 1
- 208000032839 leukemia Diseases 0.000 description 1
- 150000002632 lipids Chemical class 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 238000011068 loading method Methods 0.000 description 1
- 229910052943 magnesium sulfate Inorganic materials 0.000 description 1
- 235000019341 magnesium sulphate Nutrition 0.000 description 1
- 238000012423 maintenance Methods 0.000 description 1
- 210000001161 mammalian embryo Anatomy 0.000 description 1
- 229940099596 manganese sulfate Drugs 0.000 description 1
- 239000011702 manganese sulphate Substances 0.000 description 1
- 235000007079 manganese sulphate Nutrition 0.000 description 1
- SQQMAOCOWKFBNP-UHFFFAOYSA-L manganese(II) sulfate Chemical compound [Mn+2].[O-]S([O-])(=O)=O SQQMAOCOWKFBNP-UHFFFAOYSA-L 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- 235000010755 mineral Nutrition 0.000 description 1
- 239000011707 mineral Substances 0.000 description 1
- 235000020786 mineral supplement Nutrition 0.000 description 1
- 229940029985 mineral supplement Drugs 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 230000000877 morphologic effect Effects 0.000 description 1
- 231100000252 nontoxic Toxicity 0.000 description 1
- 230000003000 nontoxic effect Effects 0.000 description 1
- 239000002777 nucleoside Substances 0.000 description 1
- 125000003835 nucleoside group Chemical group 0.000 description 1
- 101150012154 nupG gene Proteins 0.000 description 1
- 229920001542 oligosaccharide Polymers 0.000 description 1
- 150000002482 oligosaccharides Chemical class 0.000 description 1
- 150000002894 organic compounds Chemical class 0.000 description 1
- 230000008520 organization Effects 0.000 description 1
- 210000003101 oviduct Anatomy 0.000 description 1
- 230000016087 ovulation Effects 0.000 description 1
- 238000002161 passivation Methods 0.000 description 1
- 230000000737 periodic effect Effects 0.000 description 1
- 239000002504 physiological saline solution Substances 0.000 description 1
- 230000001817 pituitary effect Effects 0.000 description 1
- 210000002826 placenta Anatomy 0.000 description 1
- 210000002381 plasma Anatomy 0.000 description 1
- 238000013492 plasmid preparation Methods 0.000 description 1
- 229920006393 polyether sulfone Polymers 0.000 description 1
- 229920001184 polypeptide Polymers 0.000 description 1
- 230000001323 posttranslational effect Effects 0.000 description 1
- 229910000160 potassium phosphate Inorganic materials 0.000 description 1
- 235000011009 potassium phosphates Nutrition 0.000 description 1
- 239000002244 precipitate Substances 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- 108090000765 processed proteins & peptides Proteins 0.000 description 1
- 102000004196 processed proteins & peptides Human genes 0.000 description 1
- 238000012545 processing Methods 0.000 description 1
- 238000003672 processing method Methods 0.000 description 1
- 238000003753 real-time PCR Methods 0.000 description 1
- 230000033764 rhythmic process Effects 0.000 description 1
- 239000006152 selective media Substances 0.000 description 1
- 238000012163 sequencing technique Methods 0.000 description 1
- 210000002966 serum Anatomy 0.000 description 1
- 239000004017 serum-free culture medium Substances 0.000 description 1
- 231100000872 sexual dysfunction Toxicity 0.000 description 1
- 125000005629 sialic acid group Chemical group 0.000 description 1
- 238000007873 sieving Methods 0.000 description 1
- 238000002741 site-directed mutagenesis Methods 0.000 description 1
- 238000001228 spectrum Methods 0.000 description 1
- 230000021595 spermatogenesis Effects 0.000 description 1
- 230000010473 stable expression Effects 0.000 description 1
- 238000010561 standard procedure Methods 0.000 description 1
- 239000008223 sterile water Substances 0.000 description 1
- 238000004659 sterilization and disinfection Methods 0.000 description 1
- 230000000638 stimulation Effects 0.000 description 1
- 239000007929 subcutaneous injection Substances 0.000 description 1
- 238000010254 subcutaneous injection Methods 0.000 description 1
- 239000005720 sucrose Substances 0.000 description 1
- 239000006228 supernatant Substances 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- 229960003604 testosterone Drugs 0.000 description 1
- 239000011721 thiamine Substances 0.000 description 1
- 235000019157 thiamine Nutrition 0.000 description 1
- KYMBYSLLVAOCFI-UHFFFAOYSA-N thiamine Chemical compound CC1=C(CCO)SCN1CC1=CN=C(C)N=C1N KYMBYSLLVAOCFI-UHFFFAOYSA-N 0.000 description 1
- 229960003495 thiamine Drugs 0.000 description 1
- 210000001519 tissue Anatomy 0.000 description 1
- 238000011426 transformation method Methods 0.000 description 1
- 230000010474 transient expression Effects 0.000 description 1
- 230000030787 translation reinitiation Effects 0.000 description 1
- 230000004614 tumor growth Effects 0.000 description 1
- 238000000108 ultra-filtration Methods 0.000 description 1
- 238000012795 verification Methods 0.000 description 1
- 239000011782 vitamin Substances 0.000 description 1
- 235000013343 vitamin Nutrition 0.000 description 1
- 229940088594 vitamin Drugs 0.000 description 1
- 229930003231 vitamin Natural products 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
- 238000005303 weighing Methods 0.000 description 1
Images
Landscapes
- Preparation Of Compounds By Using Micro-Organisms (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
Abstract
Изобретение относится к области биотехнологии и может быть использовано для рекомбинантного получения фолликулостимулирующего гормона (ФСГ) человека. Конструируют плазмиду для экспрессии в клетках СНО рекомбинантного ФСГ человека, включающую область начала репликации плазмиды pUC, открытую рамку считывания бета-лактамазы (bla) и прокариотический промотор гена bla, участок терминального повтора вируса Эпштейн-Барр человека (EBVTR), функциональные элементы гена фактора элонгации 1 альфа китайского хомячка, последовательность Козак; открытые рамки считывания альфа- и бета-субъединиц ФСГ человека с блоками стоп-кодонов; внутренний сайт связывания рибосом (IRES) вируса EMCV; открытую рамку считывания дигидрофолатредуктазы (DHFR), экспрессирующуюся в составе трицистронной мРНК вместе с геном, кодирующим альфа- и бета-субъединицы ФСГ человека. Полученной плазмидой трансформируют клетку СНО с получением клетки-продуцента ФСГ. Клетка-продуцент может быть дополнительно трансформирована плазмидой, экспрессирующей бета-субъединицу ФСГ человека. Изобретение позволяет существенно повысить эффективность продукции ФСГ человека в клетках СНО. 4 н. и 11 з.п. ф-лы, 7 ил., 3 табл., 10 пр.
Description
Область техники
Изобретение относится к биотехнологии, конкретно к способу получения рекомбинантного фолликулостимулирующего гормона человека, который может быть использован в медицине, методом рекомбинантных ДНК.
Предшествующий уровень техники
Фолликулостимулирующий гормон (ФСГ) является незаменимым для нормального роста и созревания фолликулов и для образования половых стероидов у человека. У женщин уровень ФСГ является критичным для начала и протекания развития фолликулов и, следовательно, для установления определенного ритма созревания и количества достигающих зрелости фолликулов, у мужчин - для индукции и поддержания сперматогенеза. Вследствие этого рекомбинантные и нативные варианты фолликулостимулирующего гормона могут применяться для стимуляции развития фолликулов и образования стероидов во многих случаях нарушения половой функции. Существенная часть производимых лекарственных средств ФСГ используется при применении вспомогательных репродуктивных технологий, проводимых под медицинским контролем, таких как экстракорпоральное оплодотворение и перенос эмбрионов (ЭКО/ПЭ), перенос гамет в маточную трубу (ГИФТ) и интрацитоплазматическая инъекция сперматозоида (ИКСИ) (van Wely M. et al. (2011), "Recombinant versus urinary gonadotrophin for ovarian stimulation in assisted reproductive technology cycles". Cochrane Database of Syst. Rev., 2: CD005354).
В клинической практике препараты, содержащие ФСГ, обычно используют при ановуляторном бесплодии у женщин, а также при применении вспомогательных репродуктивных технологий у пациенток с: (1) первым классом ановуляторного бесплодия (гипоталамо-гипофизарная недостаточность), для которого характерны очень низкие содержания эндогенных ФСГ, лютеинизирующего гормона (ЛГ) и эстрадиола; (2) второго класса ановуляторного бесплодия (гипоталамо-гипофизарная дисфункция), для которого характерны низкий или нормальный уровень эндогенного ФСГ, высокое или нормальное содержание эндогенного ЛГ, высокий или нормальный уровень тестостерона, а также при наличии мужского фактора бесплодия (Dhont M. (2005), "WHO-classification of anovulation: background, evidence, problems. International congress series. 1279:3-9).
На сегодняшний день существует два класса фармацевтических препаратов, содержащих ФСГ: полученные из мочи женщин в постменопаузе и полученные с использованием рекомбинантных ДНК. Препараты ФСГ мочевого происхождения появились на рынке много лет назад (1958 г.) и на сегодняшний день представлены: высокоочищенными мочевыми гонадотропинами с биохимической чистотой ФСГ до 77-95% и содержащими около 2% активности ЛГ; мочевыми гонадотропинами с биохимической чистотой ФСГ до 70%, а также содержащими ЛГ, хорионический гонадотропин (ХГ) и существенные количества посторонних белков, не относящихся к гонадотропинам. Применение технологии рекомбинантной ДНК позволило получить фармацевтические препараты ФСГ, содержащие рекомбинантный ФСГ человека с чистотой более 99% и не содержащих других гонадотропинов. Разработка новых методов и подходов, позволяющих получать большие количества рекомбинантного ФСГ в культивируемых клетках млекопитающих, представляет большой интерес для фармацевтической промышленности вследствие постоянного роста потребления лекарственных препаратов ФСГ и низкой продуктивности разработанных в конце 80-х годов прошлого века систем экспрессии ФСГ, использованных для производства оригинальных препаратов рекомбинантного ФСГ. Оптимизация эукариотической системы экспрессии рекомбинантного ФСГ, проведенная путем многократного увеличения удельной продуктивности получаемой моноклональной клеточной линии лежат в основе настоящего изобретениия.
ФСГ - гетеродимерный гликопротеиновый гормон (34 кДа), продуцирующийся аденогипофизом. Он состоит из двух нековалентно связанных друг с другом субъединиц, кодирующихся разными генами (Pierce J.G., Parsons T.F. (1981), "Glycoproteinhormones: structureandfunction". Annu.Rev. Biochem., 50:465-495). Альфа-субъединица ФСГ человека содержит 92 а.к. и также представлена в лютеинезирующем гормоне, хорионическом гонадотропине и тиреотропном гормоне (ТТГ). Все данные гормоны являются гетеродимерами одинаковой альфа-цепи и различных специфических бета-цепей (или субъединиц). Бета-субъединица ФСГ состоит из 111 а.к. Альфа- и бета-субъединицы ФСГ человека подвергаются N-гликозилированию по остаткам аспарагина альфа-52, альфа-78 и бета-7, бета-24 соответственно, что определяет высокую степень гликозилирования ФСГ до 35% в весовом соотношении, тем самым создавая микрогетерогенность гормона (Mulders J.W. et al. (1997). "Prediction of the in vivo Biological Activity of Human Recombinant Follicle Stimulating Hormone Using Quantitative Isoelectric Focusing". Biologicals, 25(3):269-81). Вторичные модификации карбогидратных цепей включают образование разветвленных структур на основе сиаловых кислот, количественный и качественный состав которых определяет время полужизни ФСГ в кровотоке, биологическую активность гормона in vivo и способность к активации рецепторов ФСГ in vitro (Ulloa-Aguirre A. et al. (1995). "Follicle-stimulating isohormones: characterization and physiological relevance". EndocrRev.; 16(6):765-87). Изогормоны ФСГ с изоэлектрической точкой (pI) 5.5 в 2-3 раза превышают способность к активации рецепторов ФСГ в тестах in vitro изогормонами с pI 4.3, в то же время наиболее кислые формы изогормонов ФСГ (pI 3.5) имеют в 100-200 раз большую биологическую активность в тестах in vivo, по сравнению с изогормонами, имеющими pI 5.5 (Mulders J.W. et al. (1999). "Prediction of the in-vivo biological activity of human recombinant follicle-stimulating hormone using quantitative isoelectric focusing. Optimization of the model". Pharm. Pharmacol. Commun., 5:51-55).
Известен самый первый способ создания векторов, кодирующих альфа- и бета-субъединицы ФСГ человека, и генетическая модификация этими векторами культивируемых клеток мыши линии С127 в целях получения рекомбинантного ФСГ (патенты США 4923805, 5156957). Для экспрессии генов альфа- и бета-субъединиц ФСГ, содержащих все экзоны и интроны, используются две независимые плазмидные конструкции pRF375 и CL28FSH2.8BPV соответственно. Недостатком описанного способа является использование для экспрессии целевых генов металлотеонеинового промотора (МТ) мыши, который не является наиболее сильным для экспрессии белков в эукариотических клетках. Также полученные плазмиды не были использованы для создания стабильной линии клеток-продуцентов полноразмерного ФСГ человека, поэтому неизвестен уровень секреции рекомбинантного ФСГ в культуральную среду при использовании полученных плазмид.
Известен способ получения векторов, кодирующих альфа- и бета-субъединицы ФСГ человека, и генетическая модификация этими векторами культивируемых клеток китайского хомяка линии СНО (Keene J.L. et al. (1989). "Expression of biologically active human follitropin in Chinese hamster ovary cells". J. Biol. Chem., 264:4769-4775). Гены альфа- и бета-субъединицы ФСГ, содержащие интроны и экзоны, клонируют в векторы рМ2/α и рМ2 соответственно, экспрессия субъединиц находится под контролем промотора вируса саркомы мышей Харви (LTR). К недостаткам этого способа относится использование генов субъединиц ФСГ человека, содержащих интроны, которые могут содержать как энхенсерные, так и сайленсерные регуляторные элементы, положительно и отрицательно влияющие на экспрессию кодируемого белка. Обе созданные плазмиды содержат последовательность, обеспечивающую устойчивость трансфицированных клеток к селективному антибиотику - генетицину (G418), тогда как использование двух селективных антибиотиков и последовательности дигидрофолатредуктазы мыши (DHFR) для селективного отбора и амплификации являются более перспективными при создании генетической модификации клеточных культур. При описании данного способа не указывается продуктивность по целевому белку полученной клеточной линии, а также на протяжении скольких пассажей сохраняется продукция ФСГ.
Известен другой способ создания эукариотических продуцентов рекомбинантных гетеродимерных гормонов человека, в том числе ФСГ (патент США 5240832). Способ основан на получении двух независимых плазмидных конструкций. Первая плазмида создана на основе вектора CLH3AXSC2DHFR и содержит полноразмерный ген альфа-субъединицы ФСГ человека, а также открытую рамку считывания DHFR для селективного отбора и амплификации в эукариотических клетках. Вторая плазмида создана на основе вектора CLH3AXSC20DOC и содержит кДНК бета-субъединицы ФСГ человека, ген орнитин декарбоксилазы (ODC) мыши для селективного отбора трансформантов. Экспрессия генов обеих субъединиц ФСГ находится под контролем МТ промотора. С помощью котрансфекции линии клеток DUKX СНО двумя вышеописанными плазмидами с последующей их амплификацией в среде с добавлением 200 мМ метотрексата (МТХ) получают несколько линий клеток-продуцентов ФСГ. Уровень секреции полноразмерного ФСГ в культуральную среду по 9 полученным линиям составляет в среднем 1,25 мкг/106 клеток/день. К недостаткам этого метода относится использование полноразмерного гена альфа-субъединицы ФСГ человека, так как интроны могут содержать сайленсерные регуляторные элементы, отрицательно влияющие на экспрессию кодируемого белка в процессе культивирования. При описании данного способа не указывается конечная концентрация секретируемого ФСГ (т.н. вольюметрическая продуктивность) и число пассажей культуры до падения уровня секреции.
Известен способ создания продуцентов рекомбинантного человеческого ФСГ на основе линии клеток СНО-K1 (Olijve W. et al. (1996). "Molecular biology and biochemistry of human recombinant folliclestimulating hormone" Mol. Hum. Rep., 2(5):371-382). Ген альфа-субъединицы ФСГ, содержащий интроны, и открытую рамку считывания бета-субъединицы ФСГ клонируют в вектор pKMS, созданный на основе вектора pBR327, с получением вектора pKMS.FSHαgβg, в котором экспрессия гена альфа-субъединицы находится под контролем раннего вирусного промотора SV40, с содержанием энхенсерных последовательностей SV40, а бета-субъединицы - под контролем металлотеонеинового промотора (MT-II), с содержанием энхенсерных последовательностей вируса лейкемии мышей (MuLV). Амплификацию плазмиды в геноме эукариотических клеток СНО-K1 обеспечивает открытая рамка считывания дигидрофолатредуктазы мыши, присутствующая в векторе pKMS.FSHαgβg. Клетки СНО-K1 котрансфицируют плазмидами pKMS.FSHαgβg и вспомогательной плазмидой pAG60/MT2, содержащей ген металлотеонеина и ген устойчивости к неомицину, которые обеспечивают резистентность культуры клеток к тяжелым металлам (Cd2+) и селективному антибиотику генетицину (G418) соответственно. Продуктивность линии-продуцента сохраняется при культивировании в биореакторе на микроносителях на протяжении 3-х месяцев и составляет 5-8 МЕ/106 клеток/день, что приблизительно соответствует 0,5-0,8 мкг/106 клеток/день. Данный способ обладает недостатками, а именно: для экспрессии гетерологического белка в эукариотической системе используются неоптимальные промоторы - металлотеонеиновый (МТ-II) и вирусный (SV40), активность последнего может подавляться клетками в процессе культивирования. Также наличие интронов в клонированной последовательности альфа-субъединицы ФСГ может индуцировать отрицательную регуляцию экспрессии этой субъединицы в клетках.
Известен способ получения плазмиды pXM17ss#6 для экспрессии альфа- и бета-субъединиц ФСГ человека в клетках эукариот, которая способна экспрессировать оптимизированные кодирующие синтетические последовательности альфа- и бета-субъединиц ФСГ (патентная заявка США 20120034655 А1). К недостаткам данного метода относится выбор неоптимальных вирусных промоторов (SV40 и CMV), проведение только временной трансфекции полученной плазмидой без проведения амплификации экспрессионной кассеты метотрексатом и дальнейшей селекции антибиотиком, так как известно, что свойства поликлональной культуры клеток после проведения временной трансфекции и стабильно-трансфицированной клеточной культуры могут значительно различаться как по стабильности, так и по продуктивности целевого белка.
Известен способ создания клеток-продуцентов ФСГ с использованием синтетических генов альфа- и бета-субъединиц ФСГ человека (патентная заявка РФ №2012106207). Синтетический ген альфа-субъединицы ФСГ человека клонируют в вектор pcDNA-TOPO (Invitrogen, США) с получением плазмиды pcDNA/FSHальфа, для получения плазмиды pOptiVEC/FSHбета синтетический ген бета-субъединицы клонируют в вектор pOptiVEC-TOPO (Invitrogen, США). В обеих полученных плазмидах экспрессия альфа- и бета-субъединиц ФСГ находится под контролем конститутивного промотора цитомегаловируса (CMV), плазмида pcDNA/FSHальфа содержит ген устойчивости к антибиотику неомицин для селекции стабильных клеточных линий генетицином, плазмида pOptiVEC/FSHбета содержит последовательность дигидрофолатредуктазы. После проведения котрансфекции клеток линии СНО K1 DXB11 полученными плазмидами, получают линию клеток huFSHIK, которая способна секретировать в культуральную среду полноразмерный гормон ФСГ в количестве 1,5 мкг/106 клеток/день в течение 30 пассажей при культивировании с МТХ (в селективных условиях) и, по крайней мере, в течение 15 пассажей без МТХ (в неселективных условиях). Данный метод обладает следующими недостатками. Для экспрессии генов обеих субъединиц ФСГ используется промотор цитомегаловируса (CMV), эффективность которого для экспрессии генов-интереса может изменяться как в течение культивирования модифицированной культуры клеток, так и при криоконсервации клеточной культуры, что может приводить к снижению продуктивности экспрессии каждого из генов двух субъединиц и впоследствии к значительному стехиометрическому дисбалансу в продукции альфа- и бета-субъединиц ФСГ. Также при получении клеток-продуцентов ФСГ клетки культивировали в присутствии 50-100 нМ метотрексата, что недостаточно для получения максимальной амплификации экспрессионных кассет в геноме. Синтетические последовательности открытых рамок считывания альфа- и бета-субъединиц ФСГ были получены путем оптимизации кодонов для экспрессии в млекопитающих, в то же время известно, что оптимизация кодонов и другие манипуляции с кодирующей последовательностью могут приводить к снижению уровней экспрессии целевых генов. Культивирование генетически модифицированных плазмидами клеток проводили в среде с добавлением 10% сыворотки крупного рогатого скота (FBS), что также является недостатком описанного метода ввиду неэкономичности использования FBS при промышленном культивировании клеток, а также наличии риска потери продуктивности клеточной культуры при адаптации к росту в бессывороточной среде культивирования и постоянному риску контаминации промышленной культуры вирусами крупного рогатого скота и прионами.
Известны способ получения вектора, содержащего гены альфа- и бета-субъединицы ФСГ человека, и линия-продуцент рекомбинантного ФСГ, полученная после трансфекции созданным вектором линии клеток DUKX-B11 СНО (Yoon S.K. et al. (2007). "Effect of culture temperature on follicle-stimulating hormone production by Chinese hamster ovary cells in a perfusion bioreactor". Appl. Microbiol. Biotechnol., 76:83-89). Из описания способа неизвестно, какой вектор и структурные элементы были использованы для создания экспрессионной плазмиды. С помощью данного способа получают стабильную клеточную линию, способную при культивировании в биореакторе с перфузией при 28°С продуцировать ФСГ в количестве более 10 мкг/106 клеток/день. К недостаткам данного способа относится возможность получения продуцируемого ФСГ на высоком уровне лишь в течение 8 дней их культивирования (с 15 по 23 день культивирования).
Известен способ получения двух плазмид, кодирующих альфа- и бета-субъединицы ФСГ на основе вектора pLCED, созданного с использованием модифицированного вектора pCDM8 (Invitrogen, США) (Kim D.J. et al. (2010). "Highly expressed recombinant human follicle-stimulating hormone from Chinese hamster ovary cells grown in serum-free medium and its effect on induction of folliculogenesis and ovulation". Fertil. Steril., 93:2652-60). Открытую рамку считывания обеих субъединиц получают с помощью последовательно проведенных полимеразных цепных реакций (ПЦР) и клонируют в отдельный вектор pLCED. Экспрессия субъединиц в клетках СНО начинается независимо по контролем вирусного промотора (CMV), причем обе плазмиды способны экспрессировать также ген DHFR, связанный с генами субъединиц участком, содержащим сайт внутреннего связывания рибосом (IRES). Продуктивность получаемой клональной линии составляет 0,0085 мМЕ/клетку/48 часов, что составляет приблизительно 0,425 мкг/106 клеток/день. К недостаткам данного способа относится использование неоптимальных вирусных промоторов и невысокий уровень продукции ФСГ. Информация о стабильности полученной культуры к продукции ФСГ также отсутствует.
Известен способ создания продуцента ФСГ, в котором последовательность, кодирующую альфа-субъединицу ФСГ, клонируют в вектор рЕ-neo, а последовательность, кодирующую бета-субъединицу, - в вектор pE-hygr (патентная заявка США 2009/0291473 А1). кДНК альфа-субъединицы получают путем ПЦР из библиотеки кДНК человеческой плаценты, а кДНК бета-субъединицы из библиотеки кДНК человеческого гипофиза. Клетки линии СНО котрансфицируют полученными плазмидами и производят селекцию клонов с использованием антибиотиков - гигромицина и генетицина (G418), получают клеточную линию, адаптированную к росту в суспензии в бессывороточной среде, продуктивность которой не превышает 1 мкг ФСГ/106 клеток/день. При данном способе для индукции экспрессии обеих субъединиц используется промотор EF-1 (коровая область промотора фактора элонгации трансляции 1 человека), который является относительно слабым промотором для экспрессии белков в клетках грызунов. Стабильность продукции ФСГ линией-продуцентом в данной заявке не упоминается.
Известны способы повышения биологической активности рекомбинантного ФСГ за счет увеличения его гликозилирования (патентные заявки США 2009/0018070 А1, 2005/0100989 А1) и добавления C-концевого пептида (СТР, carboxyterminalpeptide) бета-субъединицы человеческого хорионического гонадотропина к бета-субъединице ФСГ (патенты США 5338835 и 5585345).
Краткое описание настоящего изобретения
Технической задачей, решаемой авторами, являлось создание высокопродуктивной технологии получения рекомбинантного фолликулостимулирующего гормона человека для биофармацевтического производства.
Технический результат достигался путем создания пары новых совместимых экспрессионный плазмидных ДНК p1.1-FSH-AIB и p1.2-Hygro-B-chain, кодирующих открытые рамки считывания альфа- и бета-цепей гетеродимерного белка фолликулостимулирующего гормона человека и создание на их основе клональной клеточной линии-продуцента.
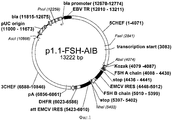
В основе данной технологии лежит разработанная пара совместимых плазмидных ДНК p1.1-FSH-AIB (длина 13222 пар оснований, SEQ ID NO:1, Фиг.1) и p1.2-Hygro-B-chain (длина 12811 пар оснований, SEQ ID NO:4, Фиг.2).
Плазмида p1.1-FSH-AIB состоит из:
- фрагмента ДНК длиной 1324 п.о., в следующей последовательности содержащего:
- последовательность 363 п.о. (SEQ ID NO:1 4079-4441), содержащую синтетическую последовательность Козак (сайт кэп-зависимой инициации трансляции), SEQ ID NO:1 4079-4087), обеспечивающую инициацию трансляции мРНК, и ОРС альфа-субъединицы фолликулостимулирующего гормона человека (SEQ ID NO:1 4088-4438) с блоком стоп-кодонов (SEQ ID NO:1 4436-4441),
- последовательность 955 п.о. (SEQ ID NO:1 4448-5402), содержащую последовательность IRES вируса энцефаломиокардита (EMCV) дикого типа (SEQ ID NO:1 4448-5012), обеспечивающую бицистронную экспрессию в животных клетках, и ОРС бета-субъединицы фолликулостимулирующего гормона человека (SEQ ID NO:1 5010-5399) с блоком стоп-кодонов (SEQ ID NO:1 5397-5402); и
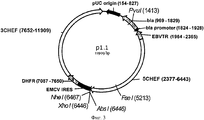
- фрагмента ДНК длиной 11898 п.о. плазмиды p1.1 (SEQ ID NO:1 5403-13222, 1-4074, Фиг.3), в следующей последовательности содержащего регуляторные элементы, обеспечивающие экспрессию целевого белка:
- последовательность IRES вируса энцефаломиокардита (EMCV), обеспечивающая бицистронную экспрессию в животных клетках, (SEQ ID NO:1 5423-6010) и последовательность фактора устойчивости трансфицированных клеток к воздействию метотрексата - дигидрофолатредуктазы (DHFR) (SEQ ID NO:1 6023-6586),
- 3′ нетранслируемую область (3′НТО) гена фактора элонгации 1 альфа китайского хомячка, включающую терминатор и сигнал полиаденилирования этого гена, а также фланкирующие нетранскрибируемые области этого гена, обеспечивающие эухроматинизацию сайтов инсерции и транскрипционную активность генетической кассеты в геноме СНО (SEQ ID NO:1 6588-10846);
- область начала репликации плазмиды pUC, открытую рамку считывания бета-лактамазы (bla) и прокариотический промотор гена bla, обеспечивающей устойчивость бактерий к антибиотику ампициллину, позволяющие проводить препаративную наработку плазмиды в Е.coli (SEQ ID NO:1 11000-10846), и участок терминального повтора вируса Эпштейн-Барр человека (EBVTR) (SEQ ID NO:1 12810-13211);
- 5′ нетранслируемую область (5′НТО) гена фактора элонгации 1 альфа китайского хомячка, включающие фланкирующие нетранскрибируемые области этого гена, обеспечивающие эухроматинизацию сайтов инсерции и транскрипционную активность генетической кассеты в геноме СНО, и его функциональный промотор (SEQ ID NO:1 11-4074).
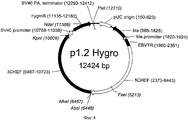
Плазмида p1.2-Hygro-B-chain состоит из:
- фрагмента ДНК, длиной 402 п.о., в следующей последовательности содержащего, последовательность 363 п.о. (SEQ ID NO:4 12409-12810), содержащую синтетическую последовательность Козак (сайт кэп-зависимой инициации трансляции, SEQ ID NO:1 12409-12417), обеспечивающую инициацию трансляции мРНК, и ОРС цепи бета-субъединицы фолликулостимулирующего гормона человека (SEQ ID NO:1 12418-12804) с блоком стоп-кодонов (SEQ ID NO:1 12805-12810),
- фрагмента 12409 п.о. плазмиды р1.2 (SEQ ID NO:4 1-12408, Фиг.4), в следующей последовательности содержащего регуляторные элементы, обеспечивающие экспрессию целевого белка:
- 3′ нетранслируемую область (3′НТО) гена фактора элонгации 1 альфа китайского хомячка, включающую терминатор и сигнал полиаденилирования этого гена, а также фланкирующие нетранскрибируемые области этого гена, обеспечивающие эухроматинизацию сайтов инсерции и транскрипционную активность генетической кассеты в геноме СНО (SEQ ID NO:4 1-4257);
- промотор вируса SV40, последовательность фактора устойчивости трансфицированных клеток к селекционному маркеру - антибиотику гигромицину, сигнал полиаденилирования и терминатор вируса SV40 (SEQ ID NO:4 4292-5946),
- область начала репликации плазмиды pUC, открытую рамку считывания бета-лактамазы (bla) и прокариотический промотор гена bla, обеспечивающей устойчивость бактерий к антибиотику ампициллину, позволяющие проводить препаративную наработку плазмиды в Е.coli (SEQ ID NO:4 6108-6781),
- участок терминального повтора вируса Эпштейн-Барр человека (EBVTR) (SEQ ID NO:4 7918-8319),
- 5′ нетранслируемую область (5′НТО) гена фактора элонгации 1 альфа китайского хомячка, включающую фланкирующие нетранскрибируемые области этого гена, обеспечивающие эухроматинизацию сайтов инсерции и транскрипционную активность генетической кассеты в геноме СНО функциональный промотор этого гена, а также его функциональный промотор (SEQ ID NO:4 8331-12401).
Плазмида p1.1-FSH-AIB имеет размер 13222 п.о. и содержит уникальные сайты узнавания эндонуклеазами рестрикции NheI (1), AgeI (2396), AscI (5464), PvuI (6857), BstBI (11863), AbsI (11894), XbaI (12080).
Плазмида p1.2-Hygro-B-chain имеет размер 12811 п.о. и содержит уникальные сайты узнавания эндонуклеазами рестрикции AgeI (1209), KpnI (4143), NdeI (5120), PsiI (5844), SalI (5962), SwaI (10487), FseI (11171), AbsI (12404).
Плазмиды были последовательно введены методом электротрансфекции (Straus S.E. et al., J. Virol., 1981, Jul; 39(1):290-4) в клетки линии CHO-S (Invitrogen, США; кат. № R800-07), адаптированной к бессывороточной ростовой среде и выделенной в виде отдельного субклона из клеточной линии CHOK1. После введения в клетки линеаризованной плазмиды p1.1-FSH-AIB вели культивацию в безбелковой среде, не содержащей гипоксантин и тимидин, и дополнительно содержащей 1 мкМ ингибитора DHFR метотрексата (МТХ) до восстановления жизнеспособности клеток более 85%. После этого была проведена амплификация целевых генов цепей ФСГ в геноме путем последовательных культивировании в присутствии возрастающих концентраций метотрексата до концентрации МТХ 8 мкМ. Была получена поликлональная популяция клеток, устойчивых к высокой концентрации МТХ и продуцирующих увеличенные количества ФСГ и значительные количества свободной альфа-цепи ФСГ. Клетки данной популяции трансфицировали плазмидой p1.2-Hygro-B-chain, после чего культивировали в присутствии 8 мкМ МТХ и 750 мкг/мл гигромицина до восстановления жизнеспособности клеток более 85%. Была получена популяция клеток, секретирующих большее количество гетеродимера ФСГ. Клетки данной популяции подвергли клонированию методом предельных разведений. Полученные клоны клеток-продуцентов были проанализированы методом иммуноферментного анализа, и были отобраны клоны, дающие максимальный уровень экспрессии гетеродимера ФСГ. Среди них был выбран клон C-P1.3-FSH-G4, при культивировании которого в суспензионной культуре в бессывороточной среде конечная концентрация фолликулостимулирующего гормона человека составляла 36,5 мкг/мл при конечной концентрации клеток 1,55 млн/мл, удельная продуктивность не менее 10 пг/клетка/день. Полученная клеточная линия C-P1.3-FSH-G4 депонирована во Всероссийской Коллекции Промышленных Микроорганизмов (ВКПМ) под регистрационным номером ВКПМ Н-140.
Целью настоящего изобретения является предоставление плазмид для экспрессии рекомбинантного фолликулостимулирующего гормона человека, в частности плазмид p1.1-FSH-AIB и p1.2-Hygro-B-chain. Также целью настоящего изобретения является предоставление моноклональной линии клеток млекопитающего, в частности клеток яичника китайского хомячка, - продуцентов рекомбинантного фолликулостимулирующего гормона человека, содержащей в геноме множественные копии экспрессионных кассет, соответствующих линеаризованным экспрессионным плазмидам, в частности плазмидам p1.1-FSH-AIB и p1.2-Hygro-B-chain. Иллюстративным примером указанной моноклональной линии клеток являются клетки яичника китайского хомячка клона С-P1.3-FSH-G4.
Также целью настоящего изобретения является предоставление способа получения рекомбинантного фолликулостимулирующего гормона человека с использованием указанных клеток.
Подробное описание настоящего изобретения
Для реализации настоящего изобретения главной технической задачей явилось создание технологии высокопродуктивного получения рекомбинантного фолликулостимулирующего гормона человека для биофармацевтического производства с использованием культивируемых клеток яичника китайского хомячка, адаптированных к суспензионному культивированию в безбелковой среде, содержащих в геноме множественные копии генетических кассет, представляющих собой линеаризованные экспрессионные плазмиды, содержащих фрагмент ДНК, кодирующих альфа- и бета-цепи фолликулостимулирующего гормона человека под контролем промотора и регуляторных элементов, функционирующих в эукариотической клетке.
Термин «экспрессионная плазмида» («экспрессионная плазмидная ДНК») означает плазмидную ДНК, содержащую все необходимые генетические элементы для экспрессии внедренного в него гена, например, такие как промотор, терминатор, сигнал полиаденилирования. Конкретным примером генетических элементов, необходимых для экспрессии рекомбинантного фолликулостимулирующего гормона в составе экспрессионной кассеты согласно настоящему изобретению, является, но не ограничивается им, промотор гена фактора элонгации 1 альфа китайского хомячка.
Фрагментами ДНК, кодирующими рекомбинантный фолликулостимулирующий гормон человека согласно настоящему изобретению, являются гены, кодирующие ОРС полипептидов альфа- и бета-цепей ФСГ, которые могут быть получены, например, как указано в Примере 1. Также указанные фрагменты ДНК могут быть получены, например, с использованием технологии клонирования фирмы SloningBioTechnology, описанной в заявке РСТ WO2005071077.
Последовательность искусственного гена, кодирующего ОРС обеих субъединиц рекомбинантного фолликулостимулирующего гормона человека согласно настоящему изобретению, представлена в Перечне последовательностей под номером SEQ ID NO:1 (цепь альфа-субъединицы - нуклеотиды 4088-4438, цепь бета-субъединицы - нуклеотиды 5010-5399). Аминокислотная последовательность секретируемого фолликулостимулирующего гормона человека согласно настоящему изобретению представлена в Перечне последовательностей под номерами SEQ ID NO:2 и 3, и представляет собой продукт трансляции нуклеотидов 4088-4438 и 5010-5399 последовательности ОРС SEQ ID NO:1, включая 24 аминокислоты N-концевого сигнального пептида альфа-цепи и 18 аминокислот N-концевого сигнального пептида бета-цепи, отделяющихся при посттрансляционном процессинге цепей ФСГ и отсутствующих в зрелом секретированном гетеродимерном белке. Часть молекул цепей ФСГ может быть секретирована в свободной форме, для целей настоящего изобретения важно накопление только двуцепочечной формы гетеродимера цепей ФСГ в культуральной среде.
Чтобы обеспечить эффективную трансляцию гена в клетках китайского хомячка, предпочтительно, чтобы ОРС предварялась последовательностью для кэп-зависимой инициации трансляции (последовательность Козак), например, синтетической. Для кэп-независимой инициации трансляции предпочтительно использование вирусных регуляторных элементов класса сайтов внутреннего связывания рибосом (IRES).
Фрагменты ДНК, которые кодируют по существу тот же белок, могут быть получены, например, путем модификации нуклеотидной последовательности фрагмента ДНК SEQ ID NO:1 (цепь альфа-нуклеотиды 4088-4438, цепь бета-нуклеотиды 5010-5399), например, посредством метода сайт-направленного мутагенеза, так, что один или несколько аминокислотных остатков в определенном сайте будут делегированы, заменены, вставлены или добавлены. Фрагменты ДНК, модифицированные, как описано выше, могут быть получены с помощью традиционных методов обработки с целью получения мутации. Фрагменты ДНК, которые кодируют по существу такой же функциональный белок, могут быть выявлены путем экспрессии фрагментов ДНК, имеющих мутацию, описанную выше, в соответствующей клетке и установления активности экспрессируемого продукта.
ФСГ - гетеродимерный гликопротеиновый гормон (34 кДа), продуцирующийся аденогипофизом, и состоит из двух нековалентно связанных друг с другом субъединиц, кодирующихся разными генами (Pierce J.G., Parsons T.F. (1981), "Glycoproteinhormones: structureandfunction". Annu. Rev. Biochem., 50:465-495).
Показатели функциональной активности, при которой считается, что полученный белок обладает свойствами рекомбинантного фолликулостимулирующего гормона человека, определяются по его способности стимулировать рост фолликулов. Так, например, биологическую активность рекомбинантного фолликулостимулирующего гормона человека можно определить с помощью теста Steelman-Pohley, по линейному увеличению веса яичников крыс в зависимости от вводимой дозы препарата ФСГ (Steelman S.L., Pohley F.M. (1953) "Assay of the follicle stimulating hormone based on the augmentation with human chorionic gonadotropin". Endocrinology, 53:604-16). Концентрацию гетеродимерного фолликулостимулирующего гормона человека определяют при помощи иммуноферментного анализа в сравнении со стандартом, в качестве которого можно использовать образцы плазмы крови женщин, калиброванные против первичного международного стандарта ФСГ, изготовляемого Всемирной Организацией Здравоохранения, например стандарта NIBSC code: 08/282. Удельную активность фолликулостимулирующего гормона человека определяют как отношение активности и концентрации ФСГ и выражают в МЕ/мг. Считается, что вариант белка обладает свойствами рекомбинантного фолликулостимулирующего гормона человека при условии, что удельная активность указанного варианта составляет не ниже 1% от удельной активности природного фолликулостимулирующего гормона человека, выделяемого из мочи, то есть не менее 60 МЕ/мг.
Экспрессионная плазмида согласно настоящему изобретению содержит фрагмент ДНК, кодирующий цепи альфа- и бета-субъединиц фолликулостимулирующего гормона человека или индивидуальную цепь бета-субъединицы ФСГ человека под контролем промотора и регуляторных элементов, функционирующих в эукариотической клетке. В качестве рекомбинантной плазмиды согласно настоящему изобретению могут использоваться различные плазмиды, обладающие способностью к экспрессии в клетке-реципиенте, такие как плазмиды pcDNA3.1, pCMV-Myc, pDEF38 и подобные им, но список плазмид не ограничивается ими.
Пара совместимых плазмид согласно настоящему изобретению означает две такие экспрессионные плазмиды, которые могут быть использованы для одновременной или последовательной трансфекции культивируемых клеток млекопитающих и последующей селекции стабильно трансфицированных клеток. Необходимым условием совместимости векторов является наличие в их составе различных генов устойчивости к действию селекционных агентов, сообщающих трансфицированным клеткам устойчивость к действию только одного из нескольких используемых селекционных агентов. Экспрессионые плазмиды из пары совместимых плазмид могут кодировать ген, содержащий ОРС одной или обеих цепей ФСГ.
Конкретным вариантом реализации настоящего изобретения является пара совместимых плазмид p1.1-FSH-AIB (длина 13222 пар оснований, SEQ ID NO:1, Фиг.1) и p1.2-Hygro-B-chain (длина 12811 пар оснований, SEQ ID NO:4, Фиг.2), которые содержат следующие функциональные элементы, перечисленные в порядке их расположения:
Для плазмиды p1.1-FSH-AIB
1. область начала репликации плазмиды pUC (11000-11673), открытую рамку считывания бета-лактамазы (bla) (11815-122675) и прокариотический промотор гена bla (12670-12774), позволяющие проводить препаративную наработку плазмиды в Е.coli;
2. участок терминального повтора вируса Эпштейн-Барр человека (EBVTR), представляющий собой фрагмент конкатемера терминальных повторов вируса Эпштейна-Барр (12810-13211), обеспечивающей увеличение частоты интеграции генетической кассеты в геном клеток СНО и увеличение скорости амплификации кассеты в геноме;
3. фрагмент последовательности, фланкирующей ген фактора элонгации 1 альфа китайского хомячка «выше по течению» (1-4071), включающий нетранскрибируемые области этого гена, промотор этого гена, первый интрон этого гена, обеспечивающий конститутивную экспрессию гена фолликулостимулирующего гормона человека в геноме клеток СНО;
4. синтетическую последовательность Козак (сайт связывания рибосом) (4079-4087), обеспечивающую кэп-зависимую инициацию трансляции мРНК в животных клетках;
5. последовательность, кодирующую открытую рамку считывания альфа-субъединицы фолликулостимулирующего гормона человека (4088-4438) с блоком стоп-кодонов (4436-4441);
6. последовательность внутреннего сайта связывания рибосом вируса энцефаломиокардита EMCV дикого типа (4448-5012), обеспечивающая кэп-независимую инициацию трансляции полицистронных РНК в животных клетках;
7. последовательность, кодирующую открытую рамку считывания бета-субъединицы фолликулостимулирующего гормона человека (5010-5399) с блоком стоп-кодонов (5397-5402);
8. последовательность аттенюированного внутреннего сайта связывания рибосом вируса энцефаломиокардита EMCV (5423-6010), обеспечивающую кэп-независимую инициацию трансляции полицистронных РНК в животных клетках;
9. последовательность, кодирующую открытую рамку считывания дигидрофолатредуктазы (6023-6586) - фактора устойчивости трансфицированных клеток к воздействию метотрексата;
10. фрагмент последовательности, фланкирующей ген фактора элонгации 1 альфа китайского хомячка «ниже по течению» (6588-10846), включающий терминатор и сигнал полиаденилирования, а также нетранскрибируемые области этого гена, обеспечивающий конститутивную экспрессию гена фолликулостимулирующего гормона человека в геноме клеток СНО.
Для плазмиды p1.2-Hygro-B-chain:
1. область начала репликации плазмиды pUC (6108-6781), открытую рамку считывания бета-лактамазы (bla) (6923-7783) и прокариотический промотор гена bla (7778 7882), позволяющие проводить препаративную наработку плазмиды в Е.coli;
2. участок терминального повтора вируса Эпштейн-Барр человека (EBVTR), представляющий собой фрагмент конкатемера терминальных повторов вируса Эпштейна-Барр (7918-8319), обеспечивающей увеличение частоты интеграции генетической кассеты в геном клеток СНО и увеличение скорости амплификации кассеты в геноме;
3. фрагмент последовательности, фланкирующей ген фактора элонгации 1 альфа китайского хомячка «выше по течению» (8331-12401), включающий нетранскрибируемые области этого гена, промотор этого гена, первый интрон этого гена, обеспечивающий конститутивную экспрессию гена бета-цепи фолликулостимулирующего гормона человека в геноме клеток СНО;
4. синтетическую последовательность Козак (сайт связывания рибосом) (12409-12417), обеспечивающую кэп-зависимую инициацию трансляции мРНК в животных клетках;
5. последовательность, кодирующую открытую рамку считывания бета цепи фолликулостимулирующего гормона человека (12418-12804) с блоком стоп-кодонов (12805-12810);
6. фрагмент последовательности, фланкирующей ген фактора элонгации 1 альфа китайского хомячка «ниже по течению» (1-4257), включающий терминатор и сигнал полиаденилирования, а также нетранскрибируемые области этого гена, обеспечивающий конститутивную экспрессию гена бета-субъединицы фолликулостимулирующего гормона человека в геноме клеток СНО.
7. последовательность фактора устойчивости трансфицированных клеток к селекционному маркеру - антибиотику гигромицину (4669-5694) и регуляторные элементы для его экспрессии - промотор (4292-4572), сигнал полиаденилирования и терминатор вируса SV40 (5827-5946).
Плазмида p1.1-FSH-AIB содержит уникальные сайты узнавания эндонуклеазами рестрикции NheI (1), AgeI (2396), AscI (5464), PvuI (6857), BstBI (11863), AbsI (11894), XbaI (12080).
Плазмида р1.2-Hygro-В-chain содержит уникальные сайты узнавания эндонуклеазами рестрикции AgeI (1209), KpnI (4143), NdeI (5120), PsiI (5844), SalI (5962), SwaI (10487), FseI (11171), AbsI (12404).
Структура плазмиды p1.1-FSH-AIB приведена на Фигуре 1.
Структура плазмиды p1.2-Hygro-B-chain приведена на Фигуре 2.
Плазмида p1.1-FSH-AIB сконструирована на базе экспрессионной плазмиды p1.1, подробно описанной в патентной заявке РФ 2011146243, целиком включенной в настоящее описание посредством ссылки. Плазмида p1.1 содержит функциональные промотор и терминатор гена фактора элонгации 1 альфа китайского хомячка, обеспечивающие конститутивную экспрессию целевого гена в клетках СНО, фланкированные 5′ и 3′ НТО этого гена, обеспечивающими эухроматинизацию сайтов интеграции экспрессионной кассеты в геном СНО; участок для клонирования открытых рамок считывания целевых белков; внутренний сайт связывания рибосом вируса энцефаломиокардита (EMCV IRES), обеспечивающий реинициацию трансляции на бицистронной мРНК в клетках млекопитающих и полное генетическое сцепление уровней продукции целевого белка и DHFR; OPC DHFR мыши, экспрессирующуюся в составе бицистронной мРНК вместе с целевым геном (IRES DHFR) и обеспечивающую устойчивость стабильно трансфицированных клеток к отсутствию в среде тимидина и дозозависимую устойчивость к воздействию метотрексата (МТХ), что позволяет вести направленную селекцию высокопродуктивных клонов с множественными копиями экспрессионной кассеты в геноме СНО; участок терминального повтора вируса Эпштейн-Барр человека (EBVTR), обеспечивающий повышенный уровень интеграции кассет в геном клеток СНО и ускорение процесса амплификации целевого гена в геноме под действием МТХ. Использование плазмиды p1.1 позволяет осуществлять высокочастотную интеграцию и ускоренную амплификацию экспрессионной кассеты в клетках млекопитающих, а также получать линии-продуценты с высоким уровнем продукции целевого белка и высокой стабильностью.
Плазмида p1.2-Hygro-B-chain сконструирована на базе экспрессионной плазмиды р1.2 для моноцистронной экспрессии, и подробно описанной в патентной заявке РФ 2013122048, целиком включенной в настоящее описание посредством ссылки. Плазмида р1.2 содержит функциональные промотор и терминатор гена фактора элонгации 1 альфа китайского хомячка, обеспечивающие конститутивную экспрессию целевого гена в клетках СНО, фланкированные 5′ и 3′ НТО этого гена, обеспечивающими эухроматинизацию сайтов интеграции экспрессионной кассеты в геном СНО; участок для клонирования открытых рамок считывания целевых белков; участок терминального повтора вируса Эпштейн-Барр человека (EBVTR), обеспечивающий повышенный уровень интеграции кассет в геном клеток СНО и кассету, обеспечивающую экспрессию селекционного маркера гена устойчивости к антибиотику, под контролем генетических элементов для экспрессии в клетках млекопитающего. Использование плазмиды р1.2 позволяет осуществлять высокочастотную интеграцию экспрессионной кассеты в клетках млекопитающих, а также получать линии-продуценты с высоким уровнем продукции целевого белка при одновременной или последовательной трансфекции культивируемых клеток млекопитающих плазмидами на основе p1.1 и р1.2 и последующей селекции стабильно трансфицированных клеток.
При помощи созданных плазмид согласно настоящему изобретению, в частности плазмид p1.1-FSH-AIB и p1.2-Hygro-B-chain, можно трансформировать эукариотическую клетку, предпочтительно иммортализованную клетку яичника китайского хомячка. Выбор конкретной линии клеток не является критическим, поскольку методология и приемы трансформации хорошо известны специалисту в данной области техники. После проведения одного или нескольких раундов селекции и клонирования популяции трансформированных клеток могут быть получены клональные линии-продуценты рекомбинантного фолликулостимулирующего гормона человека. Методология и приемы селекции и клонирования клеток известны специалисту в данной области техники. И хотя в зависимости от вида клетки и условий культивирования и селекции трансформантов уровень экспрессии фолликулостимулирующего гормона человека может варьироваться, факт транзиентной экспрессии целевого белка будет иметь место при условии успешной трансформации клетки - реципиента, факт стабильной экспрессии целевого белка будет иметь место при успешном проведении раунда селекции популяции клеток-трансформантов.
«Трансформация клетки плазмидой» означает введение плазмиды в клетку с помощью методов, хорошо известных специалисту в данной области техники. Методы трансформации включают любые стандартные методы, известные специалисту в данной области техники, например электропорацию, использование трансфекционных агентов, например метод, описанный в техническом документе компании Invitrogen, Inc. "Lipofectamine® 2000 Reagent" Pub. No. MAN0000995 Rev. Date 20 July 2012.
Согласно настоящему изобретению «клеточная линия - продуцент фолликулостимулирующего гормона человека» означает клональную линию клеток млекопитающих, обладающую способностью к продукции и секреции фолликулостимулирующего гормона человека, когда она согласно настоящему изобретению выращивается в указанной питательной среде. Используемый здесь термин «клеточная линия - продуцент фолликулостимулирующего гормона человека» также означает линию клеток, которые способна секретировать фолликулостимулирующий гормон человека в количестве не менее чем 1 мкг/мл при концентрации клеток 1-2 млн/мл, более предпочтительно не менее чем 10 мкг/мл при концентрации клеток 1-2 млн/мл при культивировании в суспензионной культуре в бессывороточной среде. Указанный фолликулостимулирующий гормон человека секретируется указанными клетками в культуральную жидкость.
Среди клеток млекопитающих предпочтительно использование клеток китайского хомячка (Cricetulus griseus), предпочтительно клеток яичника (СНО). В качестве примера предпочтительных клеток яичника китайского хомячка может быть приведена линия CHO-S (Invitrogen, США; кат. № R800-07) (1. Puck, Т. (1958) J. Exp. Med. 108, 945. 2. Deaven, L.L. and Petersen, D.F. (1973) Chromosoma 41, 129. 3. D′Anna, J.A. (1996) Methods in Cell Science 18, 115. 4. D′Anna, J.A. et al. (1997) Radiation Research 148, 260. 5. Schifferli, K. et al. (1999) Focus 21, 16. 6. Ciccarone, V. et al. (1999) Focus 21, 54). Круг сублиний СНО не ограничен каким-либо образом, например могут быть использованы сублинии СНО CHOZN DHFR, СНО DUKXB11, СНО DG-44 и подобные им.
Конкретным примером линии для получения продуцента фолликулостимулирующего гормона человека согласно настоящему изобретению является линия CHO-S, но спектр линий клеток не ограничивается ей.
Линия CHO-S характеризуется следующими культурально-морфологическими, физиолого-биохимическими и генетическими признаками:
- Данные по видовой принадлежности: китайский хомячок Cricetulus griseus, яичник.
- Контроль видовой идентичности: кариологический, изоферментный (ЛДГ и Г6ФДГ).
- Маркерные признаки и методы их оценки: иммунологические, цитогенетические, биохимические, физиологические:
- Морфология: эпителиоподобная.
- Происхождение, вид клеток: стабильная диплоидная суспензионная клеточная линия CHO-S (Invitrogen, США; кат. № R800-07), адаптированная к бессывороточной ростовой среде, выделена в виде отдельного субклона из клеточной линии СНО K1.
- Признаки опухолевого роста in vivo, in vitro: отсутствуют.
- Онкогены: отсутствуют.
- Морфология клеточной линии: при анализе в световой микроскоп, культура представлена суспензией круглых клеток с овальным ядром, содержащих небольшие эндосомы, время удвоения 16-18 часов.
- Культуральные свойства, маркерные признаки: клетки адаптированы к росту в среде ProCHO 4 (Lonza, Швейцария) без добавления сыворотки, с добавлением L-глутамина 8 мМ.
- Рекомендуемые условия для замораживания: замораживать клетки при плотности ≥2,0×106 живых клеток/мл; ростовая среда, 10% ДМСО.
- Рекомендуемые условия для культивирования: клетки культивируют в колбах Эрленмеера с рабочим объемом 30 мл, 125 мл или 500 мл на орбитальном шейкере при 120-140 об/мин в увлажненной атмосфере при 5% СО2 при температуре 37°С. Пассирование клеток производят каждые 2-3 дня путем разбавления суспензии клеток свежей средой с кратностью 1:4-1:8. Плотность посева 0,2-0,3×106 клеток/мл, максимальная плотность 3,0×106 клеток/мл.
Трансформация клеток линии CHO-S плазмидами p1.1-FSH-AIB (длина 13222 пар оснований, SEQ ID NO:1, Фиг.1) и p1.2-Hygro-B-chain (длина 12811 пар оснований, SEQ ID NO:4, Фиг.2) с последующей селекцией, аплификацией трансгена, кодируемого плазмидой p1.1-FSH-AIB, и клонированием приводит к получению клеточных линий-продуцентов рекомбинантного фолликулостимулирующего гормона человека.
Линия-продуцент C-P1.3-FSH-G4 обеспечивает синтез и секрецию рекомбинантного фолликулостимулирующего гормона человека в количестве 36,5 мкг фолликулостимулирующего гормона на 1 мл среды при концентрации клеток 1,55 млн/мл при культивировании в суспензионной культуре в бессывороточной среде. Линия-продуцент C-P1.3-FSH-G4 депонирована во Всероссийской Коллекции Промышленных Микроорганизмов (ВКПМ) под регистрационным номером ВКПМ Н-140.
Также целью настоящего изобретения является предоставление способа получения рекомбинантного фолликулостимулирующего гормона человека в клетках млекопитающих, включающего культивирование в питательной среде описанных выше клеток млекопитающих - продуцентов рекомбинантного фолликулостимулирующего гормона человека, и выделение полученного целевого рекомбинантного белка из культуральной жидкости.
Выращивание клеток, выделение и очистка целевого белка из культуральной или подобной ей жидкости может быть осуществлена способом, подобным традиционным способам культивирования, в которых рекомбинантный белок продуцируется с использованием клеток млекопитающих.
Питательная среда, используемая для культивирования, может быть как синтетической, так и натуральной при условии, что указанная среда содержит источники углерода, азота, незаменимые аминокислоты, нуклеозиды, незаменимые липиды, минеральные добавки, инсулин и, если необходимо, соответствующее количество питательных добавок, требующихся для роста клеток. В качестве источника углерода могут использоваться различные углеводы, такие как глюкоза или сахароза и другие органические соединения. В качестве источника азота может использоваться аминокислота глутамин или ее дипептиды или природные источники азота, такие как соевый гидролизат. В качестве минеральных добавок могут использоваться фосфат калия, сульфат магния, хлорид натрия, сульфат железа, сульфат марганца, хлорид кальция и подобные им соединения. В качестве витаминов могут использоваться тиамин, дрожжевой экстракт и т.п.
Для получения фармацевтически пригодного фолликулостимулирующего гормона человека предпочтительно использование бессывороточной питательной среды для культивирования.
Выращивание может осуществляться в аэробных условиях, предпочтительно с повышенным содержанием СО2 (8%), таких как перемешивание культуральной жидкости в колбах, при температуре в пределах от 20 до 40°С, предпочтительно в пределах от 34 до 38°С. Обычно выращивание в течение от 24 часов до 20 дней приводит к накоплению целевого рекомбинантного белка в культуральной среде. После выращивания твердые остатки, такие как клетки и их фрагменты, могут быть удалены из культуральной жидкости методом центрифугирования, а затем целевой белок может быть выделен и очищен методами хроматографии и/или концентрирования.
Особенности созданных экспрессионных плазмид, линии клеток и результаты практического применения изобретения приведены на следующих фигурах.
Краткое описание фигур
На Фигуре 1 показана карта экспрессионной плазмиды p1.1-FSH-AIB (длина 13222 пар оснований). Используются следующие обозначения: pUC origin - область начала репликации плазмиды pUC; bla - открытая рамка считывания бета-лактамазы, обеспечивающей устойчивость к ампициллину; bla promoter - прокариотический промотер гена bla; EBV TR - участок терминального повтора вируса Эпштейна-Барр человека; 5 CHEF функциональный промотор гена фактора элонгации 1 альфа китайского хомячка, фланкированный 5′ НТО этого гена; transcription start - точка начала транскрипции; 3CHEF функциональный терминатор и сигнал полиаденилирования гена фактора элонгации 1 альфа китайского хомячка, фланкированный 3′ НТО этого гена; рА - сигнал полиаденилирования; EMCV IRES - внутренний сайт связывания рибосом вируса энцефаломиокардита (EMCV) дикого типа; art EMCV IRES - аттенюированный внутренний сайт связывания рибосом вируса энцефаломиокардита (EMCV); DHFR - открытая рамка считывания дигидрофолатредуктазы мыши для селективного отбора и амплификации в эукариотических клетках; Kozak - область, кодирующая последовательность Козак для кэп-зависимой инициации трансляции, FSH-A-chain - ОРС альфа-субъединицы ФСГ; FSH-B-chain - ОРС бета-субъединицы ФСГ, stop - блок стоп-кодонов. Стрелками указаны направления транскрипции генов, в скобках указаны номера первого и последнего нуклеотидов фрагментов. Курсивом выделены сайты узнавания эндонуклеаз рестрикции, в скобках указаны номера нуклеотидов в точках разрезания.
На Фигуре 2 показана карта экспрессионной плазмиды p1.2-Hygro-B-chain (длина 12811 пар оснований). Используются обозначения аналогично фигуре 1, а также SV40 promoter - область промотора вируса SV40; SV40pA, terminator - терминатор и сигнал полиаденилирования вируса SV40; hygroB - ОРС гена устойчивости к гигромицину.
На Фигуре 3 показана карта экспрессионного вектора p1.1. Используются обозначения аналогично фигуре 1.
На Фигуре 4 показана карта экспрессионного вектора p1.2-Hygro. Используются обозначения аналогично фигуре 2.
На Фигуре 5 показана схема получения плазмид p1.1-FSH-AIB и p1.2-Hygro-B-chain. Обозначения: сплошной линией обозначены стадии рестрикции-лигирования, названия использованных эндонуклеаз рестрикции указаны курсивом.
На Фигуре 6 показана электрофореграмма препаратов ФСГ, полученных после хроматографической очистки ФСГ из кондиционированной культуральной среды при помощи сорбентов Capto ММС и Blue Sepharose. Обозначения: М - маркер, ММС1, ММС2, ММС3-элюаты с колонки CaptoMMC (первая, вторая и третья порции соответственно), BS_FF - проскок с колонки Blue Sepharose (первая порция), BS_EL - элюат с колонки Blue Sepharose (первая порция). +DTT - пробы с добавленным DTT, прогретые 3 мин 75°С, -DTT - пробы без прогрева и добавления DTT.
Молекулярная масса полос маркера указана в кДа, положение гетеродимера ФСГ и мономеров цепей указаны звездочками.
На Фигуре 7 показана зависимость веса яичников крыс от дозы введеного п/к исследуемого препарата ФСГ. Размер групп - 5 особей, по 1 инъекции в день в течение трех дней, контрольная группа получала инъекции физиологического раствора, объем инъецированных растворов одинаков во всех группах (300 мкл/животное).
Практическая применимость настоящего изобретения иллюстрируется следующими примерами.
Пример 1. Дизайн, получение и верификация последовательности ДНК конструкций, кодирующих альфа- и бета-субъединицы фолликулостимулирующего гормона человека pUC57-Kan-AIB и pUC57-Kan-BIA
Для расчета синтетической ДНК, кодирующей ОРС цепей ФСГ, были использованы природные последовательности гена, в силу того что по имеющимся литературным данным оптимизация кодонов и другие манипуляции с кодирующей последовательностью могут приводить к снижению уровней экспрессии целевых генов http://www.freepatentsonline.com/y2012/0034655. html.
В качестве источника последовательности природного гена использованы данные из публичной базы данных GenBank. Для ОРС бета-субъединицы - NM_000510.2 (http://www.ncbi.nlm.nih.gov/nuccore/66528900) (приведенные варианты транскрипции кодируют одинаковую рамку считывания), для ОРС аль фа-субъединицы - NM_000735.3 http://www.ncbi.nlm.nih.gov/nuccore/NM_000735.3 (использовали транскрипционный вариант 2, имеющий длину, совпадающую с указанной для фоллитропина альфа).
Фрагменты ДНК, кодирующие цепи альфа- и бета-субъединицы фолликулостимулирующего гормона человека, а также содержащие между ОРС субъединиц внутренний сайт связывания рибосом вируса EMCV (IRES), были синтезированы по заказу (Genscript, США). Были созданы два варианта сборки синтетического гена - «альфа-цепь ФСГ-IRES-бета-цепь ФСГ» («AIB») и «бета-цепь ФСГ-IRES-альфа-цепь ФСГ» («BIA»), фланкированные адапторными сайтами узнавания эндонуклеаз рестрикции, для последующего субклонирования.
Для получения плазмиды pUC57-Kan-FSH-AIB синтетический фрагмент FSH-AIB (Genscript, США) был клонирован в плазмиду pUC57-Kan (GENEWIZ, Inc., США).
Для получения плазмиды pUC57-Kan-FSH-BIA синтетический фрагмент FSH-BIA (Genscript, США) был клонирован в плазмиду pUC57-Kan (GENEWIZ, Inc., США).
Конструкции, содержащие ОРС цепей в плазмидном векторе pUC57-Kan, были трансформированы в клетки Top10 (F-mcrAΔ(mrr-hsdRMS-mcrBC) φ801acZΔM15 ΔlacZX15 ΔlacX74 recA1 araD139 Δ(ara-leu)7697 galUgalKrpsL (StrR) endA1 nupG) (Invitrogen, Великобритания). Для этого к 200 мкл замороженной суспензии клеток Е.coli добавляли 5 мкл лигазной смеси, инкубировали на льду 30 минут для сорбции плазмидной ДНК, нагревали до 42°С на 60 секунд и инкубировали на льду 5 минут. После чего добавляли 800 мкл питательного бульона SOC (20 г/л триптона, 5 г/л дрожжевого экстракта, 0,5 г/л NaCl, 250 мМ KCl, 10 мМ MgC2) и инкубировали при 37°С в течение 60 минут. После инкубации переносили суспензию на чашку Петри с твердой агаризованной средой 2xYT-агар (16 г/л триптона, 10 г/л дрожжевого экстракта, 10 г/л NaCl, 18 г/л агара), содержащей канамицин в концентрации 30 мкг/мл, и помещали в термостат на 37°С на 18 часов. Отдельные клоны трансформантов инокулировали в 5 мл питательного бульона LB с добавлением канамицина в концентрации 30 мкг/мл, наращивали 18 часов при 37°С и выделяли плазмидную ДНК набором реактивов "WizardPlusSVMinipreps" («Promega», США) по протоколу производителя. Полностью секвенировали области вставки полученных плазмид с праймеров M13f и M13rev (SEQ ID NO:13 и 14) с использованием набора BigDye® Terminator v. 3.1 Cycle Sequencing Kit (AppliedBiosystems, США) и капиллярного секвенатора ABI PRISM 3730 Genetic Analyzer (AppliedBiosystems, США), анализ данных вели при помощи программы Chromas 1.45 (Technelysium Pty Ltd, Australia).
Полученные плазмиды, содержащие гены цепей альфа и бета фолликулостимулирующего гормона человека и сайт внутренней инициации трансляции EMCV, использовали для получения экспрессионных конструкций.
Пример 2. Создание экспрессионных конструкций p1.1-FSH-AIB и p1.1-FSH-BIA, кодирующих альфа- и бета-субъединицы фолликулостимулирующего гормона человека
На базе плазмидного вектора p1.1, описанного в российской патентной заявке 2011146243 (Фиг.3, SEQ ID NO:5), созданы экспрессионные конструкции для трицистронной экспрессии генов альфа- и бета-субъединиц фолликулостимулирующего гормона человека и ОРС дигидрофолатредуктазы мыши. Схема клонирования плазмиды p1.1-FSH-AIB приведена на Фиг.5. Плазмида p1.1-FSH-BIA была получена аналогичным способом.
Плазмиды pUC57-Kan-FSH-AIB и pUC57-Kan-FSH-BIA расщепляли эндонуклеазами AbsI («СибЭнзим», Россия) и NheI (Fermentas, Литва) и переносили фрагменты, содержащие ОРС обеих цепей ФСГ, интактный IRES EMCV и участок консенсусной последовательности Козак, в вектор p1.1, рестрицированный теми же эндонуклеазами, с образованием плазмид p1.1-FSH-AIB и p1.1-FSH-BIA.
Рестрикцию проводили по инструкции производителя ферментов. Продукты рестрикции смешивали в соотношении 5:1 с буфером для нанесения «6х Loading dye» («Fermentas», Литва) и проводили разделение в 1% агарозном геле с добавлением бромистого этидия (0,4 мкг/мл). Для выделения ДНК полосу, визуализированную при помощи УФ-лампы, вырезали из агарозного геля, помещали в пробирку объемом 1,5 мл, после чего проводили выделение ДНК набором реактивов "Wizard® SV Gel and PCR Clean-Up System" («Promega», США) согласно протоколу производителя. Лигирование очищенных фрагментов проводили ДНК-лигазой фага Т4 (Fermentas, Литва) по методике производителя фермента. Полученной лигазной смесью трансформировали, как описано в Примере 1, клетки Е.coli штамма Тор 10 (Invitrogen, Великобритания) и высевали на чашку Петри с твердой агаризованной средой 2xYT-arap (16 г/л триптона, 10 г/л дрожжевого экстракта, 10 г/л NaCl, 18 г/л агара), содержащей ампициллин в концентрации 100 мкг/мл, и помещали в термостат на 37°С на 18 часов.
Отбор клонов Е.coli проводился методом ПЦР с клонов с использованием праймеров SQ-FA-R (SEQ ID NO:6), SQ-FB-R (SEQ ID NO:7), SQ-FB-F (SEQ ID NO:8), SQ-FA-F (SEQ ID NO:9). ПЦР с колоний Е.coli проводили с использованием набора реактивов «ScreenMix-HS» (ЗАО Евроген, Россия), по методике производителя, помещая образцы бактериальных клонов в пробирки с 10 мкл готовой смеси для ПЦР. Продукты ПЦР анализировали электрофорезом в 1% агарозном геле, позитивные клоны наращивали в 5 мл среды LB с добавлением ампициллина в концентрации 50 мкг/мл 18 часов при 37°С и выделяли плазмидную ДНК набором реактивов "WizardPlusSVMinipreps" («Promega», США) по протоколу производителя.
Области открытых рамок цепей ФСГ в полученной плазмиде p1.1-FSH-AIB были полностью отсеквенированы, как описано выше, с использованием праймеров SQ-FA-R (SEQ ID NO:6), SQ-FB-R (SEQ ID NO:7), SQ-FB-F (SEQ ID NO:8), SQ-FA-F(SEQ ID NO:9), 5CH6-F (SEQ ID NO:10), мутации в кодирующих областях не выявлены.
Полученная экспрессионная конструкция для трицистронной экспрессии цепей альфа и бета фолликулостимулирующего гормона человека и ОРС дигидрофолатредуктазы мыши p1.1-FSH-AIB имеет размер 13222 п.о. и содержит уникальные сайты узнавания эндонуклеазами рестрикции NheI (I), AgeI (2396), AscI (5464), PvuI (6857), BstBI (11863), AbsI (11894), XbaI (12080).
Области открытых рамок цепей ФСГ в полученной плазмиде p1.1-FSH-BIA были также полностью отсеквенированы, мутации в кодирующих областях не выявлены.
Данные конструкции предназначены для трансфекции эукариотических клеток генами альфа- и бета-субъединиц фолликулостимулирующего гормона человека с последующим отбором и амплификацией по сцепленному признаку DHFR+. Она сообщает клеткам-реципиентам следующие фенотипические признаки: при трансформации прокариот - устойчивость к ампициллину, карбенициллину; при трансфекции эукариот - устойчивость к отсутствию гипоксантина и тимидина, ограниченная устойчивость к метотрексату, увеличивающаяся при селективном отборе, экспрессия рекомбинантного фолликулостимулирующего гормона человека. Созданные генетические конструкции использовали для получения линии клеток - продуцента ФСГ.
Пример 3. Создание экспрессионной конструкции p1.2-Hygro-FSH-B-chain, кодирующей бета-субъединицу фолликулостимулирующего гормона человека.
На базе плазмидного вектора p1.2-Hygro (рис.4, SEQ ID NO:11) для гетерологичной экспрессии рекомбинантных белков в клетках млекопитающих создана экспрессионная конструкция для моноцистронной экспрессии индивидуальной цепи бета-субъединицы в векторе, содержащем ген устойчивости к антибиотику гигромицину. Схема клонирования приведена на Фиг.5.
Плазмиду pUC57-Kan-FSH-BIA расщепляли эндонуклеазами AbsI и SpeI («СибЭнзим», Россия) и переносили фрагмент, содержащий ОРС бета-субъединицы ФСГ и участок консенсусной последовательности Козак, в вектор p1.2-Hygro, рестрицированный эндонуклеазами AbsI («СибЭнзим», Россия) и NheI (Fermentas, Литва), с образованием плазмиды p1.2-Hygro-FSH-B-chain.
Рестрикцию проводили по инструкции производителя ферментов. Продукты рестрикции выделяли из 1% агарозного геля, как описано в Примере 1, набором реактивов "Wizard® SV Gel and PCR Clean-Up System" («Promega», США) по протоколу производителя. Лигирование очищенных фрагментов проводили ДНК-лигазой фага Т4 (Fermentas, Литва) по методике производителя фермента. Полученной лигазной смесью трансформировали, как описано в Примере 1, клетки Е.coli штамма Тор10 (Invitrogen, Великобритания) и высевали на чашку Петри с твердой агаризованной средой 2xYT-arap (16 г/л триптона, 10 г/л дрожжевого экстракта, 10 г/л NaCl, 18 г/л агара), содержащей ампициллин в концентрации 100 мкг/мл, и помещали в термостат на 37°С на 18 часов. Отбор клонов Е.coli вели методом ПЦР с клонов с использованием праймеров SQ-FB-R, SQ-FB-F (SEQ ID NO:7-8) и набора реактивов «ScreenMix-HS» (ЗАО Евроген, Россия), по методике производителя, помещая образцы бактериальных клонов в пробирки с 10 мкл готовой смеси для ПЦР, с последующим электрофорезом в 1% агарозном геле. Позитивные клоны наращивали в 5 мл среды LB с добавлением ампициллина в концентрации 50 мкг/мл 18 часов при 37°С и выделяли плазмидную ДНК набором реактивов "Wizard® Plus SV Minipreps" («Promega», США) по протоколу производителя. Область открытой рамки бета-цепи ФСГ полученной плазмиды была полностью отсеквенирована, как описано выше, с использованием праймеров SQ-FB-R (SEQ ID NO:7), SQ-FB-F (SEQ ID NO:8), 5CH6-F (SEQ ID NO:10), 3CH1-R (SEQ ID NO:12), мутаций не выявлено.
Полученная экспрессионная конструкция для моноцистронной экспрессии индивидуальной цепи бета-субъединицы в векторе, содержащем кассету устойчивости к гигромицину p1.2-Hygro-B-chain, имеет размер 12811 п.о. и содержит уникальные сайты узнавания эндонуклеазами рестрикции AgeI (1209), KpnI (4143), NdeI (5120), PsiI (5844), SalI (5962), SwaI (10487), FseI (11171), AbsI (12404). Данная конструкция предназначена для трансфекции эукариотических клеток геном бета-субъединицы фолликулостимулирующего гормона человека с последующим отбором по признаку hygro+. Она сообщает клеткам-реципиентам следующие фенотипические признаки: при трансформации прокариот - устойчивость к ампициллину, карбенициллину; при трансфекции эукариот - устойчивость к гигромицину, экспрессия бета-субъединицы рекомбинантного фолликулостимулирующего гормона человека. Созданную генетическую конструкцию использовали для получения линии клеток - продуцента ФСГ. Схематическая карта приведена на Фиг.2.
Пример 4. Препаративное выделение плазмидной ДНК для трансфекций и получение стабильно трансфицированных популяций клеток СНО DG-44/p1.1-FSH-AIB и СНО DG-44/p1.1-FSH-BIA
Плазмидные ДНК для трансфекций нарабатывали в клетках Escherichia coli штамма Top10, трансформированных экспрессионными конструкциями. Клетки культивировали в 50-150 мл среды LB в течение 16 ч и выделяли плазмиды с использованием набора GeneJet™ Midi по протоколу фирмы-производителя (Fermentas, Литва). При получении стабильно трансфицированных линий клеток использовали линеаризованные плазмиды. Плазмиды p1.1-FSH-AIB и p1.1-FSH-BIA расщепляли эндонуклеазой PvuI (Fermentas, Литва). Продукты рестрикции осаждали этанолом, осадки ДНК растворяли в стерильной воде.
Полученным препаратом очищенной плазмиды p1.1-FSH-AIB или p1.1-FSH-BIA были трансфицированы клетки СНО DG-44, содержащие повреждения обоих копий гена дигидрофолатредуктазы и неспособные расти в отсутствие гипоксантина и тимидина. К препарату плазмиды p1.1-FSH-AIB или p1.1-FSH-BIA перед трансфекцией добавляли 5% (по массе) плазмиды pEGFP-N2 (Clontech, США), кодирующей зеленый флуоресцентный белок под контролем эукариотического промотора. Эффективность трансфекций, измеренная как доля флуоресцирующих клеток, составила 6%. Концентрация секретированного ФСГ составила около 35 нг/мл (в предположении удельной активности ФСГ 6 МЕ/мкг). Популяцию транзиентно трансфицированных клеток использовали для определения условий получения стабильно трансфицированных популяций. Для этого проводили культивацию в присутствии 0,2; 0,5; 1 мкМ селекционного агента метотрексата (МТХ). Во всех случаях через 18 дней были получены постоянно делящиеся культуры с жизнеспособностью более 85%, уровни продукции ФСГ приведены в Таблице 1.
| Таблица 1 | ||||
| Продуктивность стабильно трансфицированных популяций СНО DG-44 | ||||
| Концентрация метотрексата в среде, мкМ | Концентрация ФСГ в среде по ИФА, в МЕ/мл | Концентрация ФСГ, мг/л | Плотность культуры, тыс. клеток/мл | Уровень секреции ФСГ мкг/млн клеток/мл* |
| 0,2 | 3,6 | 0,61 | 955 | 0,64 |
| 0,5 | 3,2 | 0,53 | 535 | 1,00 |
| 1 | 22,7 | 3,78 | 1675 | 2,25 |
| * - уровень секреции оценен по конечной точке в предположении равной скорости деления клеток. | ||||
Также было установлено, что плазмида p1.1-FSH-BIA является нестабильной и модифицируется в клетках путем делеции участка бета-цепи, продукции ФСГ в этом случае не наблюдалось.
Пример 5. Получение первичных поликлональных популяций клеток линии CHO-S, стабильно трансфицированных плазмидой p1.1-FSH-AIB
Клетки линии CHO-S (Invitrogen, Ltd., США), содержащие интактный ген дигидрофолатредуктазы, культивировали в безбелковой среде ProCHO 4 (Lonza, Швейцария) с добавлением 8 мМ L-глутамина (Invitrogen, Ltd., США). Клетки выращивали в стерильных одноразовых колбах Эрленмеера (30 мл суспензии в колбах вместимостью 125 мл) на орбитальной качалке при 130 об/мин в атмосфере, содержащей 5% углекислого газа при температуре 37°С. Подсчет плотности клеточной суспензии и доли живых клеток проводили в счетной камере Горяева при окрашивании трипановым синим. Пассирование культуры проводили по достижении плотности 1,8 млн кл./мл, посевная концентрация 0,3 млн кл./мл. За 48 часов и 24 ч до трансфекции клетки дополнительно пассировали до посевной концентрации 0,5 млн кл./мл.
Трансфекцию линеаризованной плазмиды p1.1-FSH-AIB в клетки CHO-S проводили электропорацией. Для этого 1,5×107 клеток ресуспендировали в 700 мкл трансфекционного буфера Gene Pulser (BioRad). В полученную суспензию добавляли 30 мкг линеаризованной плазмидной ДНК. Трансфекцию проводили в аппарате Gene Pulser Xcell (BioRad) и кювете с зазором между электродами 4 мм одним импульсом длиной 20 мс при постоянном напряжении 200 В. После электротрансформации клетки переносили в 30 мл среды ProCHO 5 (Lonza, Швейцария) в колбе Эрленмеера и растили при перемешивании 48 ч. Эффективность трансфекции, измеренная для контрольной популяции, трансфицированной в тех же условиях смесью плазмид p1.1-FSH-AIB и pEGFP-N2 (95:5 по массе) составила 18%, концентрация ФСГ в среде - 130 нг/мл. После выращивания в неселективной среде в течение 48 ч культуру разделили на три равные порции (по 4×106 клеток) и культивировали раздельно с добавлением различных концентраций селекционного агента метотрексата (0,5 мкМ, 1 мкМ и 2 мкМ).
Вели культивирование в селекционной среде с периодическим пассированием культур в течение 22 дней. Во всех трех случаях были получены делящиеся популяции клеток с жизнеспособностью более 90%, концентрация секретируемого гетеродимера ФСГ приведена в Таблице 2.
Было установлено, что популяция клеток CHO-S, трансфицированных плазмидой p1.1-FSH-AIB и подвергнутых селекции в присутствии 1 мкМ метотрекстата (код популяции C-AIB-1K), обладает максимальной продуктивностью, существенно превосходящей продуктивность известных из уровня техники клональных продуцентов ФСГ. Копийность трансгена, т.е. количество копий экспрессионной плазмиды в гаплоидном геноме продуцентов, для популяции C-AIB-1K составила 50±8 шт. при определении методом количественного ПЦР.
| Таблица 2 | ||||
| Продуктивность стабильно трансфицированных популяций CHO-S | ||||
| Концентрация метотрексата в среде, мкМ | Концентрация ФСГ в среде по ИФА, в МЕ/мл | Концентрация ФСГ, мг/л | Плотность культуры, тыс. клеток/мл | Уровень секреции ФСГ мкг/млн клеток/мл* |
| 0,5 | 34,2 | 5,7 | 1900 | 3,00 |
| 1 | 28,3 | 4,7 | 935 | 5,04 |
| 2 | 13,2 | 2,2 | 825 | 2,66 |
| * - уровень секреции оценен по конечной точке в предположении равной скорости деления клеток. | ||||
Пример 6. Амплификация целевого гена под действием возрастающих концентраций метотрексата
Амплификацию целевого гена в геноме клеток отобранной поликлональной популяции C-AIB-1K проводили в суспензионной культуре, добавляя в культуральную среду метотрексат в возрастающих концентрациях до момента падения жизнеспособности культуры. При обнаружении падения жизнеспособности культуру вели при постоянной концентрации метотрексата до восстановления жизнеспособности >85%, после чего концентрацию метотрексата удваивали. Процесс амплификации считали законченным, когда жизнеспособность клеток переставала восстанавливаться после 15 суток культивирования. Пассирование проводили, как указано в Примере 5. Ход амплификации и показатели продуктивности культуры приведены в Таблице 3.
| Таблица 3 | |||
| Динамика секреции ФСГ при амплификации целевого гена. | |||
| Код популяции | Концентрация метотрексата, мкМ | Время культивирования с указанной концентрацией метотрексата, дней | Уровень секреции ФСГ мкг/млн клеток/мл* |
| C-AIB-1K | 1 | 1 | 5,0 |
| C-AIB-1K | 1 | 15 | 5,8 |
| C-AIB-2K | 2 | 15 | 6,8 |
| C-AIB-4K | 4 | 15 | 8,0 |
| C-AIB-8K | 8 | 15 | 10,1 |
| * - уровень секреции оценен по конечной точке в предположении равной скорости деления. | |||
Продуктивность клеток была увеличена приблизительно в два раза в результате продолжительного культивирования в присутствии возрастающих концентраций метотрексата.
Пример 7. Получение популяции клеток CHO-S, стабильно трансфицированных плазмидами p1.1-FSH-AIB и p1.2-Hygro-FSH-B-chain
Для кондиционированной культуральной среды, полученной от популяции клеток C-AIB-8K, определяли относительный уровень секреции цепей ФСГ при помощи иммуноблоттинга с моноклональными антителами к обеим цепям (данные не приводятся). Установили, что бета-цепь ФСГ присутствует в культуральной среде только в составе гетеродимера, а альфа-цепь распределена между гетеродимером и свободным мономером, при этом большая часть альфа-цепи присутствует в культуральной среде в виде мономера. Предположили, что эффективность трансляции области открытой рамки считывания бета-субъединицы в плазмиде p1.1-FSH-AIB снижена относительно области открытой рамки считывания альфа-субъединицы, то есть эффективность реинициации трансляции EMCV IRES дикого типа для открытой рамки считывания бета-цепи ФСГ ниже 100%. Для компенсации недостаточного уровня экспрессии бета-цепи в популяции C-AIB-8K в клетки ввели дополнительный ген бета-цепи ФСГ, кодируемый плазмидой p1.2-Hygro-FSH-B-chain. Трансфекцию проводили, как указано в Примере 5. p1.2-Hygro-FSH-B-chain расщепляли эндонуклеазой CciI (СибЭнзим, Россия) по протоколу производителя фермента. Эффективность трансфекции составила 25%, через 48 ч после трансфекции изменений в уровне секреции гетеродимера ФСГ не наблюдалось.
Через 48 часов к культуре добавили селекционный антибиотик гигромицин В (Invitrogen, Ltd., США) в концентрации 750 мкг/мл, концентрацию метотрексата на весь период селекции гигромицином сохраняли на уровне 8 мкМ. Пассирования культуры проводили по достижении плотности 1,2 тыс. кл./мл, но не позднее чем через пять суток после начала культивации. Через 24 дня после трансфекции была получена стабильная культура с долей живых клеток 82%, после чего концентрация гигромицина была понижена до нетоксичной - 250 мкг/мл. Продуктивность клеток в полученной популяции C-AIB-8K-Bch составила 23,5 мкг/млн кл./мл. Максимальная концентрация секретированного ФСГ для популяции C-AIB-8K-Bch составила 81 мкг/мл при культивировании в течение 12 дней без пересева, удельная продуктивность - 4,7 пг/клетка/день, время удвоения культуры - 31 ч. Видимое при иммуноблоттинге распределение цепей ФСГ между мономером и гетеродимером осталось без изменений, но наблюдаемая доля альфа-цепи в составе мономера уменьшилась (данные не приводятся).
Таким образом, в результате введения дополнительных копий гена бета-цепи ФСГ общая продуктивность клеток была удвоена, при этом общий уровень экспрессии альфа-цепи ФСГ продолжал превышать уровень экспрессии бета-цепи. Полученная поликлональная популяция была использована для получения клональных линий-продуцентов ФСГ.
Пример 8. Получение клональной линии-продуцента ФСГ человека C-P1.3-FSH-G4
Перед клонированием клетки популяции C-AIB-8K-Bch культивировали в течение 6 дней без метотрексата и гигромицина, а также пересевали за 48 и 24 часа до рассева в лунки планшетов. Клонирование осуществляли методом предельных разведений (0,5 клетки на лунку) в 96-луночных планшетах, по 200 мкл среды на лунку в культуральной среде EXCELL-CHO (Sigma), с добавлением 8 мМ глутамина, 2 мМ гипоксантина (Gibco) и 2 мМ тимидина (Gibco) при 37°С, 5% СО2. Планшеты инкубировали в течение 20 дней, после чего отмечали лунки с единственными колониями и продолжали инкубацию в течение еще 4 дней. Эффективность клонирования составила 29%, было получено и проанализировано 330 моноклональных колоний в 12 культуральных 96-луночных планшетах. Отобранные клоны с максимальной продуктивностью были переведены на культивирование в среде Lonza 5 и последовательно пересеяны в лунки 48-, 24-, 6-луночных планшетов. В результате культивирования отобранных клонов в суспензионных условиях с перемешиванием культуры были отобраны 8 клонов с продуктивностью от 13 до 36 мкг ФСГ/млн клеток/мл и временем удвоения не более 40 ч. Среди них была выбрана основная моноклональная линия C-P1.3-FSH-G4, при культивировании которой в суспензионной культуре в бессывороточной среде Lonza 5 активность фолликулостимулирующего гормона человека составляла 36,5 мкг/мл (по данным ИФА) при концентрации клеток 1,55 млн/мл и времени роста 3 дня, измеренная удельная продуктивность не менее 10 пг/клетка/день.
Пример 9. Выделение целевого белка из супернатанта культуры линии C-P1.3-FSH-G4
Препаративное культивирование линии C-P1.3-FSH-G4 вели в перемешиваемых колбах Эрленмейера с использованием бессывороточной среды Pro CHO 5 с добавлением 8 мМ L-глютамина. Проводили посев культуры на плотности 0,3 млн кл./мл и вели рост культуры в течение 12 дней без смены среды.
Кондиционированную культуральную среду отделяли от клеток и дебриса центрифугированием. Далее рН культуральной жидкости доводили до 5,5 при помощи концентрированной соляной кислоты. Подкисленную культуральную жидкость наносили на уравновешенную колонку с сорбентом Capto MMC (GE Healthcare, США). Колонку промывали раствором 50 мМ натрий-фосфатного буфера рН 5,5 и 100 мМ NaCl и элюировали ФСГ раствором 50 мМ натрий-фосфатного буфера рН 6,0 и 400 мМ NaCl. К элюату добавляли 40% по объему раствора 250 мМ Tris-HCl рН 8,5, полученный нейтрализованный раствор наносили на колонку с сорбентом Blue Sepharose FF (GE Healthcare), колонку промывали раствором, содержащим 0,3 М NaCl. ФСГ элюировали раствором, содержащим 4 М NaCl. Результаты гель-электрофореза фракций элюата и промывки колонок приведены на Фигуре 6. Полученный раствор очищенного рекомбинантного ФСГ обессоливали и концентрировали при помощи ультрафильтрации в ячейке для концентрирования VivaSpin6 (Sartorius, Германия) с мембраной из полиэфирсульфона, порог отсечения 10 кДа. Общий выход продукта составил более 50% (измерение концентрации по ИФА), чистота по денситометрии электрофореграммы не менее 90%. Приведенный метод очистки не включает стадии разделения изоформ ФСГ с различным зарядом N-связанных олигосахаридов, получаемый препарат обогащен щелочными формами, обладающими повышенной активностью в тестах in vitro и пониженной активностью в тестах in vivo.
Пример 10. Измерение биологической активности очищенного рекомбинантного ФСГ
20 неполовозрелых самок крыс WISTAR возрастом в диапазоне 19-28 дней, различающихся по возрасту не более чем на 3 дня и с различиями по массе, не превышающими 10 г между самой крупной и самой легкой особью в каждой группе, были сгруппированы в 4 группы по 5 крыс. В пределах каждой из 4 групп особям были проведены подкожные инъекции растворов, содержащих 0 мкг, 0,11 мкг, 0,22 мкг и 0,44 мкг очищенного ФСГ в физиологическом растворе (все растворы с добавлением 20 ME хорионического гонадотропина человека). Инъекции были повторены в группах через 24 и 48 часов после первой инъекции, всего 3 инъекции. Объем инъекции составлял 300 мкл на особь.
Через 24 ч после последней инъекции, животных подвергли эвтаназии в СО2-камере, отделяли яичники, удаляли постороннюю жидкость и ткань, после чего немедленно взвешивали по отдельности и попарно от каждой особи. Результаты взвешивания приведены на Фиг.7. Было установлено, что очищенный ФСГ, секретированный полученной линией-продуцентом, вызывал дозозависимый прирост массы яичников крыс, при этом удельная активность полученного препарата очищенного ФСГ, не фракционированного по изоформам заряда, составляла около 7 МЕ/мкг (расчет по методу Steelman-Pohley в сравнении со стандартом рекомбинантного ФСГ, данные для стандарта не приводятся), что сравнимо с удельной активностью известных лекарственных препаратов ФСГ (4-13 МЕ/мкг).
Хотя указанное изобретение описано в деталях со ссылкой на Примеры, для специалиста в указанной области техники очевидно, что могут быть совершены различные изменения и произведены эквивалентные замены и такие изменения и замены не выходят за рамки настоящего изобретения.
Claims (15)
1. Плазмида для экспрессии в клетках яичника китайского хомячка (СНО) рекомбинантного фолликулостимулирующего гормона (ФСГ) человека, в следующей последовательности по существу состоящая из области начала репликации плазмиды pUC, открытой рамки считывания бета-лактамазы (bla) и прокариотического промотора гена bla; участка терминального повтора вируса Эпштейн-Барр человека (EBVTR), функционального промотора и первого интрона гена фактора элонгации 1 альфа китайского хомячка, фланкированного 5′ нетранслируемой областью этого гена; последовательности Козак; открытой рамки считывания, кодирующей альфа-субъединицу ФСГ человека с блоком стоп-кодонов; внутреннего сайта связывания рибосом (IRES) вируса энцефаломиокардита (EMCV); открытой рамки считывания, кодирующей бета-субъединицу ФСГ человека с блоком стоп-кодонов; аттенюированного внутреннего сайта связывания рибосом (IRES) вируса энцефаломиокардита (EMCV); открытой рамки считывания дигидрофолатредуктазы (DHFR), экспрессирующейся в составе трицистронной мРНК вместе с геном, кодирующим альфа- и бета-субъединицы ФСГ человека; и функционального терминатора гена фактора элонгации 1 альфа китайского хомячка, фланкированного 3′ нетранслируемой областью этого гена.
2. Плазмида по п. 1, отличающаяся тем, что открытые рамки считывания, кодирующие альфа- и бета-субъединицы ФСГ человека, кодируют альфа- и бета-субъединицы ФСГ человека, последовательности аминокислот которых приведены в SEQ ID NO: 2 и 3 соответственно.
3. Плазмида по п. 1, отличающаяся тем, что участок терминального повтора вируса Эпштейн-Барр человека (EBVTR) представляет собой фрагмент конкатемера терминального повтора EBVTR.
4. Плазмида по п. 1, отличающаяся тем, что используют открытую рамку считывания дигидрофолатредуктазы (DHFR) мыши.
5. Плазмида по п. 1, отличающаяся тем, что указанной плазмидой является плазмида p1.1-FSH-AIB, представленная в Перечне последовательностей под номером SEQ ID NO: 1.
6. Плазмида для экспрессии в клетках яичника китайского хомячка (СНО) бета-субъединицы рекомбинантного фолликулостимулирующего гормона (ФСГ) человека, в следующей последовательности по существу состоящая из области начала репликации плазмиды pUC; открытой рамки считывания бета-лактамазы (bla) и прокариотического промотора гена bla; участка терминального повтора вируса Эпштейн-Барр человека (EBVTR); функционального промотора гена фактора элонгации 1 альфа китайского хомячка, фланкированного 5′ нетранслируемой областью этого гена; последовательности Козак; открытой рамки считывания гена, кодирующего бета-субъединицу ФСГ человека с блоком стоп-кодонов; функционального терминатора гена фактора элонгации 1 альфа китайского хомячка, фланкированного 3′ нетранслируемой областью этого гена; промотора вируса SV40; гена устойчивости к гигромицину; и функционального терминатора вируса SV40.
7. Плазмида по п. 6, отличающаяся тем, что открытая рамка считывания гена, кодирующего бета-субъединицу ФСГ человека, кодирует бета-субъединицу ФСГ человека, последовательность аминокислот которой приведена в SEQ ID NO: 3.
8. Плазмида по п. 6, отличающаяся тем, что участок терминального повтора вируса Эпштейн-Барр человека (EBVTR) представляет собой фрагмент конкатемера терминального повтора EBVTR.
9. Плазмида по п. 6, отличающаяся тем, что указанной плазмидой является pl.2-Hygro FSH-B-chain, представленная в Перечне последовательностей под номером SEQ ID NO: 4.
10. Клетка СНО - продуцент рекомбинантного ФСГ человека, трансформированная плазмидой по пп. 1-5.
11. Клетка по п. 10, дополнительно трансформированная плазмидой по пп. 6-9.
12. Клетка по п. 11, отличающаяся тем, что указанной клеткой является клетка линии яичника китайского хомячка C-P1.3-FSH-G4, депонированная во Всероссийской Коллекции Промышленных Микроорганизмов (ВКПМ) под регистрационным номером ВКПМ Н-140.
13. Способ получения рекомбинантного ФСГ человека, включающий следующие стадии:
- культивирование в питательной среде клеток линии по п. 10 или 11; и
- выделение полученного рекомбинантного белка из культуральной жидкости.
- культивирование в питательной среде клеток линии по п. 10 или 11; и
- выделение полученного рекомбинантного белка из культуральной жидкости.
14. Способ по п. 13, отличающийся тем, что культивируют клетки линии яичника китайского хомячка C-P1.3-FSH-G4, депонированные во Всероссийской Коллекции Промышленных Микроорганизмов (ВКПМ) под регистрационным номером ВКПМ Н-140.
15. Способ по п. 13, отличающийся тем, что питательная среда для культивирования является бессывороточной.
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2013143210/10A RU2560596C2 (ru) | 2013-09-24 | 2013-09-24 | Плазмида для экспрессии в клетках сно рекомбинантного фолликулостимулирующего гормона (фсг) человека, плазмида для экспрессии в клетках сно бета-субъединицы рекомбинантного фсг человека, клетка сно - продуцент рекомбинантного фсг человека и способ получения указанного гормона |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2013143210/10A RU2560596C2 (ru) | 2013-09-24 | 2013-09-24 | Плазмида для экспрессии в клетках сно рекомбинантного фолликулостимулирующего гормона (фсг) человека, плазмида для экспрессии в клетках сно бета-субъединицы рекомбинантного фсг человека, клетка сно - продуцент рекомбинантного фсг человека и способ получения указанного гормона |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2013143210A RU2013143210A (ru) | 2015-03-27 |
| RU2560596C2 true RU2560596C2 (ru) | 2015-08-20 |
Family
ID=53286557
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2013143210/10A RU2560596C2 (ru) | 2013-09-24 | 2013-09-24 | Плазмида для экспрессии в клетках сно рекомбинантного фолликулостимулирующего гормона (фсг) человека, плазмида для экспрессии в клетках сно бета-субъединицы рекомбинантного фсг человека, клетка сно - продуцент рекомбинантного фсг человека и способ получения указанного гормона |
Country Status (1)
| Country | Link |
|---|---|
| RU (1) | RU2560596C2 (ru) |
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2616273C1 (ru) * | 2016-04-21 | 2017-04-13 | Федеральное государственное унитарное предприятие "Государственный научно-исследовательский институт особо чистых биопрепаратов" Федерального медико-биологического агентства | Синтетическая ДНК, кодирующая антимюллеров гормон человека, содержащий ее экспрессионный вектор pTVK4pu/MISOPT и штамм клеток яичников китайского хомячка CHO-MIS - продуцент рекомбинантного антимюллерового гормона человека |
| RU2694598C1 (ru) * | 2018-08-07 | 2019-07-16 | Федеральное государственное бюджетное учреждение науки институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова Российской академии наук (ИБХ РАН) | Клеточная линия huFSHKKc6 - продуцент рекомбинантного человеческого фолликулостимулирующего гормона (ФСГ) и способ получения ФСГ с использованием данной линии |
| RU2697273C1 (ru) * | 2019-02-22 | 2019-08-13 | Шаталин Дмитрий Александрович | Способ получения рекомбинантного фолликулостимулирующего гормона человека, клеточная линия - продуцент и плазмидные экспрессионные векторы |
| RU2834784C1 (ru) * | 2024-02-12 | 2025-02-14 | Общество с ограниченной ответственностью "АйВиФарма" (ООО "АйВиФарма") | Плазмида для экспрессии рекомбинантного хорионического гонадотропина человека (ХГЧ), плазмида для экспрессии рекомбинантных альфа- и бета-субъединиц ХГЧ, моноклональная линия клеток млекопитающих - продуцент ХГЧ, способ получения рекомбинантного ХГЧ |
Families Citing this family (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN107460206B (zh) * | 2017-09-11 | 2020-05-01 | 深圳市深研生物科技有限公司 | 人fsh的重组表达载体、重组细胞株及重组人fsh的制备方法 |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5240832A (en) * | 1989-06-20 | 1993-08-31 | Genzyme Corporation | Heteropolymeric protein production methods |
| US20090291473A1 (en) * | 2008-05-16 | 2009-11-26 | Jcr Pharmaceuticals Co., Ltd. | Method for Production of Recombinant Human FSH |
| RU2012106207A (ru) * | 2012-02-22 | 2013-08-27 | Общество с ограниченной ответственностью "Фармако Биотех" | КЛЕТОЧНАЯ ЛИНИЯ huFSHIK, СЕКРЕТИРУЮЩАЯ РЕКОМБИНАНТНЫЙ ЧЕЛОВЕЧЕСКИЙ ФСГ |
-
2013
- 2013-09-24 RU RU2013143210/10A patent/RU2560596C2/ru active
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5240832A (en) * | 1989-06-20 | 1993-08-31 | Genzyme Corporation | Heteropolymeric protein production methods |
| US20090291473A1 (en) * | 2008-05-16 | 2009-11-26 | Jcr Pharmaceuticals Co., Ltd. | Method for Production of Recombinant Human FSH |
| RU2012106207A (ru) * | 2012-02-22 | 2013-08-27 | Общество с ограниченной ответственностью "Фармако Биотех" | КЛЕТОЧНАЯ ЛИНИЯ huFSHIK, СЕКРЕТИРУЮЩАЯ РЕКОМБИНАНТНЫЙ ЧЕЛОВЕЧЕСКИЙ ФСГ |
Non-Patent Citations (2)
| Title |
|---|
| KIM D.-J. et al., Highly expressed recombinant human follicle-stimulating hormone from Chinese hamster ovary cells grown in serum-free medium and its effect on induction of folliculogenesis and ovulation, Fertil and Steril., 2010, v.93, n.8, p.2652-2660 * |
| OLIJVE W. et al., Molecular biology and biochemistry of human recombinant follicle stimulating hormone (Puregon), Molec.Human Reprod., 1996, v.2, n.5, p.371-382. * |
Cited By (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2616273C1 (ru) * | 2016-04-21 | 2017-04-13 | Федеральное государственное унитарное предприятие "Государственный научно-исследовательский институт особо чистых биопрепаратов" Федерального медико-биологического агентства | Синтетическая ДНК, кодирующая антимюллеров гормон человека, содержащий ее экспрессионный вектор pTVK4pu/MISOPT и штамм клеток яичников китайского хомячка CHO-MIS - продуцент рекомбинантного антимюллерового гормона человека |
| RU2694598C1 (ru) * | 2018-08-07 | 2019-07-16 | Федеральное государственное бюджетное учреждение науки институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова Российской академии наук (ИБХ РАН) | Клеточная линия huFSHKKc6 - продуцент рекомбинантного человеческого фолликулостимулирующего гормона (ФСГ) и способ получения ФСГ с использованием данной линии |
| RU2697273C1 (ru) * | 2019-02-22 | 2019-08-13 | Шаталин Дмитрий Александрович | Способ получения рекомбинантного фолликулостимулирующего гормона человека, клеточная линия - продуцент и плазмидные экспрессионные векторы |
| RU2834784C1 (ru) * | 2024-02-12 | 2025-02-14 | Общество с ограниченной ответственностью "АйВиФарма" (ООО "АйВиФарма") | Плазмида для экспрессии рекомбинантного хорионического гонадотропина человека (ХГЧ), плазмида для экспрессии рекомбинантных альфа- и бета-субъединиц ХГЧ, моноклональная линия клеток млекопитающих - продуцент ХГЧ, способ получения рекомбинантного ХГЧ |
| RU2839754C1 (ru) * | 2025-02-25 | 2025-05-12 | Федеральное государственное бюджетное научное учреждение "Российский научный центр хирургии имени академика Б.В. Петровского" (ФГБНУ "РНЦХ им. академика Б.В. Петровского") | Генетическая конструкция и способ экспрессии ERVW-1 и MYMK |
Also Published As
| Publication number | Publication date |
|---|---|
| RU2013143210A (ru) | 2015-03-27 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2774996B2 (ja) | 組換え細胞の培養法 | |
| AU2019203609B2 (en) | Methods of producing long acting CTP-modified growth hormone polypeptides | |
| JP6754414B2 (ja) | ヒト細胞系における組換えヒトタンパク質の無血清安定トランスフェクションおよび製造 | |
| SA94150015B1 (ar) | إنتاج وتنقية الليمفوكين lymphokine | |
| JPH0655136B2 (ja) | ヒトエリスロポエチンをコードするdnaにより形質転換されている細胞 | |
| RU2560596C2 (ru) | Плазмида для экспрессии в клетках сно рекомбинантного фолликулостимулирующего гормона (фсг) человека, плазмида для экспрессии в клетках сно бета-субъединицы рекомбинантного фсг человека, клетка сно - продуцент рекомбинантного фсг человека и способ получения указанного гормона | |
| CA2690844A1 (en) | Fsh producing cell clone | |
| JP2010528678A (ja) | トランスジェニック哺乳動物の乳中に外因性タンパク質を産生させるための方法 | |
| CN107460206A (zh) | 人fsh的重组表达载体、重组细胞株及重组人fsh的制备方法 | |
| AU2023248247A1 (en) | Method for introducing target gene into immune cells | |
| JP7437865B2 (ja) | 高度にグリコシル化されたヒト絨毛性ゴナドトロピンカルボキシ末端ペプチド(CTP)修飾ヒト成長ホルモン(hGH)ポリペプチドを含む、精製された医薬組成物 | |
| EP1670923B1 (en) | Method for mass production of human follicle stimulating hormone | |
| RU2502798C2 (ru) | КЛЕТОЧНАЯ ЛИНИЯ huFSHIK, СЕКРЕТИРУЮЩАЯ РЕКОМБИНАНТНЫЙ ЧЕЛОВЕЧЕСКИЙ ФСГ | |
| KR101681513B1 (ko) | 인간 난포자극 호르몬의 대량 생산 방법 | |
| RU2834784C1 (ru) | Плазмида для экспрессии рекомбинантного хорионического гонадотропина человека (ХГЧ), плазмида для экспрессии рекомбинантных альфа- и бета-субъединиц ХГЧ, моноклональная линия клеток млекопитающих - продуцент ХГЧ, способ получения рекомбинантного ХГЧ | |
| RU2656142C1 (ru) | РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pBiPr-ABIgA1FI6-ht ДЛЯ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО ИММУНОГЛОБУЛИНА А ИЗОТИПА IGA1 | |
| RU2561466C2 (ru) | Плазмида для экспрессии рекомбинантного фактора свертываемости крови viii человека с делетированным в-доменом в клетках сно, клетка сно - продуцент рекомбинантного фактора свертываемости крови viii человека с делетированным в-доменом и способ получения указанного фактора | |
| AU612594B2 (en) | Human prorelaxin | |
| RU2694598C1 (ru) | Клеточная линия huFSHKKc6 - продуцент рекомбинантного человеческого фолликулостимулирующего гормона (ФСГ) и способ получения ФСГ с использованием данной линии | |
| RU2697273C1 (ru) | Способ получения рекомбинантного фолликулостимулирующего гормона человека, клеточная линия - продуцент и плазмидные экспрессионные векторы | |
| KR101971614B1 (ko) | 목적 단백질의 생산이 증가된 세포주 및 이를 이용한 목적 단백질 생산 방법 | |
| RU2842288C2 (ru) | Способы производства ctp-модифицированных полипептидов гормона роста длительного действия | |
| CN120060373A (zh) | 一种奶牛重组促卵泡素及其制备方法和应用 | |
| RU2616273C1 (ru) | Синтетическая ДНК, кодирующая антимюллеров гормон человека, содержащий ее экспрессионный вектор pTVK4pu/MISOPT и штамм клеток яичников китайского хомячка CHO-MIS - продуцент рекомбинантного антимюллерового гормона человека | |
| RU2664184C2 (ru) | РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pBiPr-ABIgA1FI6-Intht ДЛЯ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО ИММУНОГЛОБУЛИНА А ИЗОТИПА IgA1 |