RU2519750C2 - Способы лечения множественной миеломы - Google Patents
Способы лечения множественной миеломы Download PDFInfo
- Publication number
- RU2519750C2 RU2519750C2 RU2010151660/14A RU2010151660A RU2519750C2 RU 2519750 C2 RU2519750 C2 RU 2519750C2 RU 2010151660/14 A RU2010151660/14 A RU 2010151660/14A RU 2010151660 A RU2010151660 A RU 2010151660A RU 2519750 C2 RU2519750 C2 RU 2519750C2
- Authority
- RU
- Russia
- Prior art keywords
- myeloma
- pharmaceutically acceptable
- acceptable salt
- drugs
- compound
- Prior art date
Links
- 206010035226 Plasma cell myeloma Diseases 0.000 title claims abstract description 70
- 208000034578 Multiple myelomas Diseases 0.000 title claims abstract description 62
- 238000000034 method Methods 0.000 title claims description 50
- VPAHZSUNBOYNQY-DLVGLDQCSA-N zalypsis Chemical compound C([C@H]1C2=C3OCOC3=C(C)C(OC(C)=O)=C2C[C@@H]2N1[C@@H](O)[C@@H]1CC3=CC(C)=C(C(=C3[C@H]2N1C)O)OC)NC(=O)\C=C\C1=CC=CC(C(F)(F)F)=C1 VPAHZSUNBOYNQY-DLVGLDQCSA-N 0.000 claims abstract description 92
- 239000003814 drug Substances 0.000 claims abstract description 69
- 229940079593 drug Drugs 0.000 claims abstract description 58
- 150000003839 salts Chemical class 0.000 claims abstract description 39
- 230000001446 anti-myeloma Effects 0.000 claims abstract description 32
- 241000124008 Mammalia Species 0.000 claims abstract description 8
- 150000001875 compounds Chemical class 0.000 claims description 88
- AOJJSUZBOXZQNB-TZSSRYMLSA-N Doxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-TZSSRYMLSA-N 0.000 claims description 36
- GOTYRUGSSMKFNF-UHFFFAOYSA-N lenalidomide Chemical compound C1C=2C(N)=CC=CC=2C(=O)N1C1CCC(=O)NC1=O GOTYRUGSSMKFNF-UHFFFAOYSA-N 0.000 claims description 22
- 229960004942 lenalidomide Drugs 0.000 claims description 21
- UREBDLICKHMUKA-CXSFZGCWSA-N dexamethasone Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@]2(F)[C@@H]1[C@@H]1C[C@@H](C)[C@@](C(=O)CO)(O)[C@@]1(C)C[C@@H]2O UREBDLICKHMUKA-CXSFZGCWSA-N 0.000 claims description 20
- 229960003957 dexamethasone Drugs 0.000 claims description 20
- SGDBTWWWUNNDEQ-LBPRGKRZSA-N melphalan Chemical compound OC(=O)[C@@H](N)CC1=CC=C(N(CCCl)CCCl)C=C1 SGDBTWWWUNNDEQ-LBPRGKRZSA-N 0.000 claims description 20
- 229960001924 melphalan Drugs 0.000 claims description 20
- 229960004679 doxorubicin Drugs 0.000 claims description 18
- 239000008194 pharmaceutical composition Substances 0.000 claims description 17
- GXJABQQUPOEUTA-RDJZCZTQSA-N bortezomib Chemical compound C([C@@H](C(=O)N[C@@H](CC(C)C)B(O)O)NC(=O)C=1N=CC=NC=1)C1=CC=CC=C1 GXJABQQUPOEUTA-RDJZCZTQSA-N 0.000 claims description 16
- 229960001467 bortezomib Drugs 0.000 claims description 16
- 239000003795 chemical substances by application Substances 0.000 claims description 13
- UEJJHQNACJXSKW-UHFFFAOYSA-N 2-(2,6-dioxopiperidin-3-yl)-1H-isoindole-1,3(2H)-dione Chemical compound O=C1C2=CC=CC=C2C(=O)N1C1CCC(=O)NC1=O UEJJHQNACJXSKW-UHFFFAOYSA-N 0.000 claims description 8
- 239000000546 pharmaceutical excipient Substances 0.000 claims description 8
- 229960003433 thalidomide Drugs 0.000 claims description 8
- DLGOEMSEDOSKAD-UHFFFAOYSA-N Carmustine Chemical compound ClCCNC(=O)N(N=O)CCCl DLGOEMSEDOSKAD-UHFFFAOYSA-N 0.000 claims description 7
- CMSMOCZEIVJLDB-UHFFFAOYSA-N Cyclophosphamide Chemical compound ClCCN(CCCl)P1(=O)NCCCO1 CMSMOCZEIVJLDB-UHFFFAOYSA-N 0.000 claims description 7
- 229960005243 carmustine Drugs 0.000 claims description 7
- DQLATGHUWYMOKM-UHFFFAOYSA-L cisplatin Chemical compound N[Pt](N)(Cl)Cl DQLATGHUWYMOKM-UHFFFAOYSA-L 0.000 claims description 7
- 229960004316 cisplatin Drugs 0.000 claims description 7
- 238000002648 combination therapy Methods 0.000 claims description 7
- 229960004397 cyclophosphamide Drugs 0.000 claims description 7
- VJJPUSNTGOMMGY-MRVIYFEKSA-N etoposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@H](C)OC[C@H]4O3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 VJJPUSNTGOMMGY-MRVIYFEKSA-N 0.000 claims description 7
- 229960005420 etoposide Drugs 0.000 claims description 7
- XOFYZVNMUHMLCC-ZPOLXVRWSA-N prednisone Chemical compound O=C1C=C[C@]2(C)[C@H]3C(=O)C[C@](C)([C@@](CC4)(O)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 XOFYZVNMUHMLCC-ZPOLXVRWSA-N 0.000 claims description 7
- 229960004618 prednisone Drugs 0.000 claims description 7
- OGWKCGZFUXNPDA-UHFFFAOYSA-N vincristine Natural products C1C(CC)(O)CC(CC2(C(=O)OC)C=3C(=CC4=C(C56C(C(C(OC(C)=O)C7(CC)C=CCN(C67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)CN1CCC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-UHFFFAOYSA-N 0.000 claims description 7
- OGWKCGZFUXNPDA-XQKSVPLYSA-N vincristine Chemical compound C([N@]1C[C@@H](C[C@]2(C(=O)OC)C=3C(=CC4=C([C@]56[C@H]([C@@]([C@H](OC(C)=O)[C@]7(CC)C=CCN([C@H]67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)C[C@@](C1)(O)CC)CC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-XQKSVPLYSA-N 0.000 claims description 7
- 229960004528 vincristine Drugs 0.000 claims description 7
- 239000003937 drug carrier Substances 0.000 claims description 6
- 238000004519 manufacturing process Methods 0.000 claims description 5
- 238000002512 chemotherapy Methods 0.000 claims description 4
- 238000011282 treatment Methods 0.000 abstract description 48
- 230000000694 effects Effects 0.000 abstract description 17
- 239000000126 substance Substances 0.000 abstract description 8
- 230000009467 reduction Effects 0.000 abstract description 3
- 238000002560 therapeutic procedure Methods 0.000 abstract description 3
- 231100000419 toxicity Toxicity 0.000 abstract description 2
- 230000001988 toxicity Effects 0.000 abstract description 2
- 238000002483 medication Methods 0.000 abstract 2
- 239000013543 active substance Substances 0.000 abstract 1
- 210000004027 cell Anatomy 0.000 description 57
- 206010028980 Neoplasm Diseases 0.000 description 25
- -1 PM00104 compound Chemical class 0.000 description 17
- 210000004180 plasmocyte Anatomy 0.000 description 16
- 210000004271 bone marrow stromal cell Anatomy 0.000 description 11
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 11
- 241000699670 Mus sp. Species 0.000 description 9
- 201000010099 disease Diseases 0.000 description 9
- 230000004083 survival effect Effects 0.000 description 9
- 239000000203 mixture Substances 0.000 description 8
- 201000000050 myeloid neoplasm Diseases 0.000 description 8
- 229940002612 prodrug Drugs 0.000 description 8
- 239000000651 prodrug Substances 0.000 description 8
- 238000012360 testing method Methods 0.000 description 8
- 210000001185 bone marrow Anatomy 0.000 description 7
- 239000002609 medium Substances 0.000 description 7
- AZKSAVLVSZKNRD-UHFFFAOYSA-M 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide Chemical compound [Br-].S1C(C)=C(C)N=C1[N+]1=NC(C=2C=CC=CC=2)=NN1C1=CC=CC=C1 AZKSAVLVSZKNRD-UHFFFAOYSA-M 0.000 description 6
- 108090000672 Annexin A5 Proteins 0.000 description 6
- 102000004121 Annexin A5 Human genes 0.000 description 6
- 238000001727 in vivo Methods 0.000 description 6
- 108090000723 Insulin-Like Growth Factor I Proteins 0.000 description 5
- 102000004218 Insulin-Like Growth Factor I Human genes 0.000 description 5
- 108090001005 Interleukin-6 Proteins 0.000 description 5
- 210000002798 bone marrow cell Anatomy 0.000 description 5
- 238000011161 development Methods 0.000 description 5
- 230000001965 increasing effect Effects 0.000 description 5
- 238000001802 infusion Methods 0.000 description 5
- 230000002195 synergetic effect Effects 0.000 description 5
- HZAXFHJVJLSVMW-UHFFFAOYSA-N 2-Aminoethan-1-ol Chemical compound NCCO HZAXFHJVJLSVMW-UHFFFAOYSA-N 0.000 description 4
- WOVKYSAHUYNSMH-RRKCRQDMSA-N 5-bromodeoxyuridine Chemical compound C1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)C(Br)=C1 WOVKYSAHUYNSMH-RRKCRQDMSA-N 0.000 description 4
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 4
- 239000012980 RPMI-1640 medium Substances 0.000 description 4
- 238000004458 analytical method Methods 0.000 description 4
- 201000011510 cancer Diseases 0.000 description 4
- 239000012091 fetal bovine serum Substances 0.000 description 4
- 230000035755 proliferation Effects 0.000 description 4
- 239000000523 sample Substances 0.000 description 4
- UCSJYZPVAKXKNQ-HZYVHMACSA-N streptomycin Chemical compound CN[C@H]1[C@H](O)[C@@H](O)[C@H](CO)O[C@H]1O[C@@H]1[C@](C=O)(O)[C@H](C)O[C@H]1O[C@@H]1[C@@H](NC(N)=N)[C@H](O)[C@@H](NC(N)=N)[C@H](O)[C@H]1O UCSJYZPVAKXKNQ-HZYVHMACSA-N 0.000 description 4
- 230000004614 tumor growth Effects 0.000 description 4
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 3
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 3
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 3
- 208000007452 Plasmacytoma Diseases 0.000 description 3
- 229930183496 Safracin Natural products 0.000 description 3
- 229930190585 Saframycin Natural products 0.000 description 3
- 239000002253 acid Substances 0.000 description 3
- 210000000988 bone and bone Anatomy 0.000 description 3
- 230000003833 cell viability Effects 0.000 description 3
- QCUVHQFXYHRYHX-PIHYCAAOSA-N chembl539920 Chemical compound C([C@H](N1C)[C@@H]2O)C(C(C(C)=C(OC)C3=O)=O)=C3[C@@H]1[C@H](C1)N2[C@@H](COC(C)=O)C2=C1C(=O)C(C)=C(OC)C2=O QCUVHQFXYHRYHX-PIHYCAAOSA-N 0.000 description 3
- 238000006243 chemical reaction Methods 0.000 description 3
- 231100000433 cytotoxic Toxicity 0.000 description 3
- 230000001472 cytotoxic effect Effects 0.000 description 3
- MHMNJMPURVTYEJ-UHFFFAOYSA-N fluorescein-5-isothiocyanate Chemical compound O1C(=O)C2=CC(N=C=S)=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 MHMNJMPURVTYEJ-UHFFFAOYSA-N 0.000 description 3
- 230000012010 growth Effects 0.000 description 3
- 238000000338 in vitro Methods 0.000 description 3
- 238000010348 incorporation Methods 0.000 description 3
- 238000001990 intravenous administration Methods 0.000 description 3
- QCUVHQFXYHRYHX-UHFFFAOYSA-N jorumycin Natural products OC1C(N2C)CC(C(C(C)=C(OC)C3=O)=O)=C3C2C(C2)N1C(COC(C)=O)C1=C2C(=O)C(C)=C(OC)C1=O QCUVHQFXYHRYHX-UHFFFAOYSA-N 0.000 description 3
- 230000001681 protective effect Effects 0.000 description 3
- BOLDJAUMGUJJKM-LSDHHAIUSA-N renifolin D Natural products CC(=C)[C@@H]1Cc2c(O)c(O)ccc2[C@H]1CC(=O)c3ccc(O)cc3O BOLDJAUMGUJJKM-LSDHHAIUSA-N 0.000 description 3
- 230000035945 sensitivity Effects 0.000 description 3
- 239000000243 solution Substances 0.000 description 3
- 239000012453 solvate Substances 0.000 description 3
- 208000024891 symptom Diseases 0.000 description 3
- 229940124597 therapeutic agent Drugs 0.000 description 3
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 3
- NLXLAEXVIDQMFP-UHFFFAOYSA-N Ammonia chloride Chemical compound [NH4+].[Cl-] NLXLAEXVIDQMFP-UHFFFAOYSA-N 0.000 description 2
- WOVKYSAHUYNSMH-UHFFFAOYSA-N BROMODEOXYURIDINE Natural products C1C(O)C(CO)OC1N1C(=O)NC(=O)C(Br)=C1 WOVKYSAHUYNSMH-UHFFFAOYSA-N 0.000 description 2
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 2
- 206010059866 Drug resistance Diseases 0.000 description 2
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 2
- 241001465754 Metazoa Species 0.000 description 2
- 101150110809 ORM1 gene Proteins 0.000 description 2
- 229930182555 Penicillin Natural products 0.000 description 2
- JGSARLDLIJGVTE-MBNYWOFBSA-N Penicillin G Chemical compound N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)CC1=CC=CC=C1 JGSARLDLIJGVTE-MBNYWOFBSA-N 0.000 description 2
- 238000011579 SCID mouse model Methods 0.000 description 2
- 230000002378 acidificating effect Effects 0.000 description 2
- 230000009471 action Effects 0.000 description 2
- 229930013930 alkaloid Natural products 0.000 description 2
- 150000003797 alkaloid derivatives Chemical class 0.000 description 2
- 239000003242 anti bacterial agent Substances 0.000 description 2
- 230000001093 anti-cancer Effects 0.000 description 2
- 230000000259 anti-tumor effect Effects 0.000 description 2
- 229940088710 antibiotic agent Drugs 0.000 description 2
- 239000000427 antigen Substances 0.000 description 2
- 102000036639 antigens Human genes 0.000 description 2
- 108091007433 antigens Proteins 0.000 description 2
- 239000002246 antineoplastic agent Substances 0.000 description 2
- 230000006907 apoptotic process Effects 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- 230000037396 body weight Effects 0.000 description 2
- 229950004398 broxuridine Drugs 0.000 description 2
- 239000013078 crystal Substances 0.000 description 2
- 238000003745 diagnosis Methods 0.000 description 2
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 2
- 208000035475 disorder Diseases 0.000 description 2
- 239000001963 growth medium Substances 0.000 description 2
- 150000004677 hydrates Chemical class 0.000 description 2
- 238000011534 incubation Methods 0.000 description 2
- 230000002401 inhibitory effect Effects 0.000 description 2
- 230000005764 inhibitory process Effects 0.000 description 2
- 238000005259 measurement Methods 0.000 description 2
- 229930014626 natural product Natural products 0.000 description 2
- 239000002547 new drug Substances 0.000 description 2
- 239000003960 organic solvent Substances 0.000 description 2
- 229940049954 penicillin Drugs 0.000 description 2
- 239000002953 phosphate buffered saline Substances 0.000 description 2
- 150000003013 phosphoric acid derivatives Chemical class 0.000 description 2
- 238000002360 preparation method Methods 0.000 description 2
- 230000008569 process Effects 0.000 description 2
- 239000000047 product Substances 0.000 description 2
- 229960005322 streptomycin Drugs 0.000 description 2
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 2
- 238000011269 treatment regimen Methods 0.000 description 2
- 102100031585 ADP-ribosyl cyclase/cyclic ADP-ribose hydrolase 1 Human genes 0.000 description 1
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 1
- 208000010392 Bone Fractures Diseases 0.000 description 1
- 206010006002 Bone pain Diseases 0.000 description 1
- 206010006187 Breast cancer Diseases 0.000 description 1
- 208000026310 Breast neoplasm Diseases 0.000 description 1
- LDBICWQUEQHVIF-HWKANZROSA-N CC/C(/C(F)(F)F)=C\C Chemical compound CC/C(/C(F)(F)F)=C\C LDBICWQUEQHVIF-HWKANZROSA-N 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 description 1
- 206010053567 Coagulopathies Diseases 0.000 description 1
- 108090000695 Cytokines Proteins 0.000 description 1
- 102000004127 Cytokines Human genes 0.000 description 1
- 230000006820 DNA synthesis Effects 0.000 description 1
- 230000004568 DNA-binding Effects 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- 206010061818 Disease progression Diseases 0.000 description 1
- PIICEJLVQHRZGT-UHFFFAOYSA-N Ethylenediamine Chemical compound NCCN PIICEJLVQHRZGT-UHFFFAOYSA-N 0.000 description 1
- 206010015548 Euthanasia Diseases 0.000 description 1
- 108010040476 FITC-annexin A5 Proteins 0.000 description 1
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 1
- 206010053759 Growth retardation Diseases 0.000 description 1
- 101000777636 Homo sapiens ADP-ribosyl cyclase/cyclic ADP-ribose hydrolase 1 Proteins 0.000 description 1
- 101000581981 Homo sapiens Neural cell adhesion molecule 1 Proteins 0.000 description 1
- 101000738771 Homo sapiens Receptor-type tyrosine-protein phosphatase C Proteins 0.000 description 1
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 1
- CPELXLSAUQHCOX-UHFFFAOYSA-N Hydrogen bromide Chemical compound Br CPELXLSAUQHCOX-UHFFFAOYSA-N 0.000 description 1
- 208000037147 Hypercalcaemia Diseases 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 241001207577 Jorunna funebris Species 0.000 description 1
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 1
- 229930182816 L-glutamine Natural products 0.000 description 1
- 206010027476 Metastases Diseases 0.000 description 1
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 1
- 150000007945 N-acyl ureas Chemical class 0.000 description 1
- 229910002651 NO3 Inorganic materials 0.000 description 1
- 102100027347 Neural cell adhesion molecule 1 Human genes 0.000 description 1
- 206010060860 Neurological symptom Diseases 0.000 description 1
- NHNBFGGVMKEFGY-UHFFFAOYSA-N Nitrate Chemical compound [O-][N+]([O-])=O NHNBFGGVMKEFGY-UHFFFAOYSA-N 0.000 description 1
- 241001223904 Nudibranchia Species 0.000 description 1
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 1
- 206010060862 Prostate cancer Diseases 0.000 description 1
- 208000000236 Prostatic Neoplasms Diseases 0.000 description 1
- 229940079156 Proteasome inhibitor Drugs 0.000 description 1
- 102100037422 Receptor-type tyrosine-protein phosphatase C Human genes 0.000 description 1
- 208000001647 Renal Insufficiency Diseases 0.000 description 1
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 1
- DBMJMQXJHONAFJ-UHFFFAOYSA-M Sodium laurylsulphate Chemical compound [Na+].CCCCCCCCCCCCOS([O-])(=O)=O DBMJMQXJHONAFJ-UHFFFAOYSA-M 0.000 description 1
- 229930006000 Sucrose Natural products 0.000 description 1
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-L Sulfate Chemical compound [O-]S([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-L 0.000 description 1
- GSEJCLTVZPLZKY-UHFFFAOYSA-N Triethanolamine Chemical compound OCCN(CCO)CCO GSEJCLTVZPLZKY-UHFFFAOYSA-N 0.000 description 1
- DTQVDTLACAAQTR-UHFFFAOYSA-M Trifluoroacetate Chemical compound [O-]C(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-M 0.000 description 1
- 238000002835 absorbance Methods 0.000 description 1
- 239000000654 additive Substances 0.000 description 1
- 230000000996 additive effect Effects 0.000 description 1
- 150000001408 amides Chemical class 0.000 description 1
- 235000019270 ammonium chloride Nutrition 0.000 description 1
- 150000003863 ammonium salts Chemical class 0.000 description 1
- 208000007502 anemia Diseases 0.000 description 1
- 230000003042 antagnostic effect Effects 0.000 description 1
- 230000001028 anti-proliverative effect Effects 0.000 description 1
- 229940041181 antineoplastic drug Drugs 0.000 description 1
- 210000000481 breast Anatomy 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 150000004657 carbamic acid derivatives Chemical class 0.000 description 1
- 150000004649 carbonic acid derivatives Chemical class 0.000 description 1
- 231100000504 carcinogenesis Toxicity 0.000 description 1
- 238000004113 cell culture Methods 0.000 description 1
- 230000022131 cell cycle Effects 0.000 description 1
- 238000004737 colorimetric analysis Methods 0.000 description 1
- 238000011393 cytotoxic chemotherapy Methods 0.000 description 1
- 230000003013 cytotoxicity Effects 0.000 description 1
- 231100000135 cytotoxicity Toxicity 0.000 description 1
- 230000034994 death Effects 0.000 description 1
- 238000013461 design Methods 0.000 description 1
- 235000005911 diet Nutrition 0.000 description 1
- 230000037213 diet Effects 0.000 description 1
- 230000005750 disease progression Effects 0.000 description 1
- 239000000890 drug combination Substances 0.000 description 1
- 238000007876 drug discovery Methods 0.000 description 1
- 230000002900 effect on cell Effects 0.000 description 1
- 239000000839 emulsion Substances 0.000 description 1
- 230000002708 enhancing effect Effects 0.000 description 1
- 210000003743 erythrocyte Anatomy 0.000 description 1
- 150000002148 esters Chemical class 0.000 description 1
- 238000011156 evaluation Methods 0.000 description 1
- 230000003203 everyday effect Effects 0.000 description 1
- 238000002474 experimental method Methods 0.000 description 1
- 238000009093 first-line therapy Methods 0.000 description 1
- 230000014509 gene expression Effects 0.000 description 1
- 231100000001 growth retardation Toxicity 0.000 description 1
- 235000015220 hamburgers Nutrition 0.000 description 1
- 210000003958 hematopoietic stem cell Anatomy 0.000 description 1
- XMBWDFGMSWQBCA-UHFFFAOYSA-N hydrogen iodide Chemical compound I XMBWDFGMSWQBCA-UHFFFAOYSA-N 0.000 description 1
- 230000000148 hypercalcaemia Effects 0.000 description 1
- 208000030915 hypercalcemia disease Diseases 0.000 description 1
- 230000002519 immonomodulatory effect Effects 0.000 description 1
- 238000000099 in vitro assay Methods 0.000 description 1
- 238000005462 in vivo assay Methods 0.000 description 1
- 230000006698 induction Effects 0.000 description 1
- 208000015181 infectious disease Diseases 0.000 description 1
- 229910052500 inorganic mineral Inorganic materials 0.000 description 1
- 201000006370 kidney failure Diseases 0.000 description 1
- 230000003902 lesion Effects 0.000 description 1
- 208000032839 leukemia Diseases 0.000 description 1
- 210000000265 leukocyte Anatomy 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 230000007774 longterm Effects 0.000 description 1
- 210000004698 lymphocyte Anatomy 0.000 description 1
- 229940049920 malate Drugs 0.000 description 1
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 1
- BJEPYKJPYRNKOW-UHFFFAOYSA-N malic acid Chemical compound OC(=O)C(O)CC(O)=O BJEPYKJPYRNKOW-UHFFFAOYSA-N 0.000 description 1
- 230000003211 malignant effect Effects 0.000 description 1
- IWYDHOAUDWTVEP-UHFFFAOYSA-M mandelate Chemical compound [O-]C(=O)C(O)C1=CC=CC=C1 IWYDHOAUDWTVEP-UHFFFAOYSA-M 0.000 description 1
- 108010082117 matrigel Proteins 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 230000010534 mechanism of action Effects 0.000 description 1
- 239000002207 metabolite Substances 0.000 description 1
- 230000009401 metastasis Effects 0.000 description 1
- 239000011707 mineral Substances 0.000 description 1
- 210000003097 mucus Anatomy 0.000 description 1
- VMGAPWLDMVPYIA-HIDZBRGKSA-N n'-amino-n-iminomethanimidamide Chemical compound N\N=C\N=N VMGAPWLDMVPYIA-HIDZBRGKSA-N 0.000 description 1
- 230000009826 neoplastic cell growth Effects 0.000 description 1
- 239000012457 nonaqueous media Substances 0.000 description 1
- 238000011275 oncology therapy Methods 0.000 description 1
- 238000001543 one-way ANOVA Methods 0.000 description 1
- 230000004768 organ dysfunction Effects 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 238000002559 palpation Methods 0.000 description 1
- 230000036961 partial effect Effects 0.000 description 1
- 230000001575 pathological effect Effects 0.000 description 1
- 230000007170 pathology Effects 0.000 description 1
- 230000000737 periodic effect Effects 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 1
- 239000010452 phosphate Substances 0.000 description 1
- 208000031223 plasma cell leukemia Diseases 0.000 description 1
- 239000011591 potassium Substances 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- 230000002265 prevention Effects 0.000 description 1
- 230000002062 proliferating effect Effects 0.000 description 1
- 239000003207 proteasome inhibitor Substances 0.000 description 1
- 102000004169 proteins and genes Human genes 0.000 description 1
- 108090000623 proteins and genes Proteins 0.000 description 1
- 230000000306 recurrent effect Effects 0.000 description 1
- 230000002829 reductive effect Effects 0.000 description 1
- 230000004044 response Effects 0.000 description 1
- 210000002966 serum Anatomy 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- 239000007787 solid Substances 0.000 description 1
- 230000007928 solubilization Effects 0.000 description 1
- 238000005063 solubilization Methods 0.000 description 1
- 238000007614 solvation Methods 0.000 description 1
- 239000008227 sterile water for injection Substances 0.000 description 1
- KDYFGRWQOYBRFD-UHFFFAOYSA-L succinate(2-) Chemical compound [O-]C(=O)CCC([O-])=O KDYFGRWQOYBRFD-UHFFFAOYSA-L 0.000 description 1
- 239000005720 sucrose Substances 0.000 description 1
- 239000013589 supplement Substances 0.000 description 1
- 239000000725 suspension Substances 0.000 description 1
- 238000001308 synthesis method Methods 0.000 description 1
- 229940095064 tartrate Drugs 0.000 description 1
- 125000003831 tetrazolyl group Chemical group 0.000 description 1
- 230000001225 therapeutic effect Effects 0.000 description 1
- 210000001519 tissue Anatomy 0.000 description 1
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 1
- 238000013518 transcription Methods 0.000 description 1
- 230000035897 transcription Effects 0.000 description 1
- 210000004881 tumor cell Anatomy 0.000 description 1
- 230000002792 vascular Effects 0.000 description 1
- 230000035899 viability Effects 0.000 description 1
- 230000004580 weight loss Effects 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/4995—Pyrazines or piperazines forming part of bridged ring systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/185—Acids; Anhydrides, halides or salts thereof, e.g. sulfur acids, imidic, hydrazonic or hydroximic acids
- A61K31/19—Carboxylic acids, e.g. valproic acid
- A61K31/195—Carboxylic acids, e.g. valproic acid having an amino group
- A61K31/197—Carboxylic acids, e.g. valproic acid having an amino group the amino and the carboxyl groups being attached to the same acyclic carbon chain, e.g. gamma-aminobutyric acid [GABA], beta-alanine, epsilon-aminocaproic acid or pantothenic acid
- A61K31/198—Alpha-amino acids, e.g. alanine or edetic acid [EDTA]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/445—Non condensed piperidines, e.g. piperocaine
- A61K31/4523—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems
- A61K31/454—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems containing a five-membered ring with nitrogen as a ring hetero atom, e.g. pimozide, domperidone
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/47—Quinolines; Isoquinolines
- A61K31/475—Quinolines; Isoquinolines having an indole ring, e.g. yohimbine, reserpine, strychnine, vinblastine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/56—Compounds containing cyclopenta[a]hydrophenanthrene ring systems; Derivatives thereof, e.g. steroids
- A61K31/57—Compounds containing cyclopenta[a]hydrophenanthrene ring systems; Derivatives thereof, e.g. steroids substituted in position 17 beta by a chain of two carbon atoms, e.g. pregnane or progesterone
- A61K31/573—Compounds containing cyclopenta[a]hydrophenanthrene ring systems; Derivatives thereof, e.g. steroids substituted in position 17 beta by a chain of two carbon atoms, e.g. pregnane or progesterone substituted in position 21, e.g. cortisone, dexamethasone, prednisone or aldosterone
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7028—Compounds having saccharide radicals attached to non-saccharide compounds by glycosidic linkages
- A61K31/7034—Compounds having saccharide radicals attached to non-saccharide compounds by glycosidic linkages attached to a carbocyclic compound, e.g. phloridzin
- A61K31/704—Compounds having saccharide radicals attached to non-saccharide compounds by glycosidic linkages attached to a carbocyclic compound, e.g. phloridzin attached to a condensed carbocyclic ring system, e.g. sennosides, thiocolchicosides, escin, daunorubicin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K33/00—Medicinal preparations containing inorganic active ingredients
- A61K33/24—Heavy metals; Compounds thereof
- A61K33/243—Platinum; Compounds thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/04—Peptides having up to 20 amino acids in a fully defined sequence; Derivatives thereof
- A61K38/05—Dipeptides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Epidemiology (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Immunology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Gastroenterology & Hepatology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Organic Chemistry (AREA)
- Molecular Biology (AREA)
- Inorganic Chemistry (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Abstract
Изобретение относится к области медицины, а именно к терапии и фармакологии. Млекопитающему, в частности человеку, страдающему множественной миеломой, вводят терапевтически эффективное количество вещества РМ00104 или его фармацевтически приемлемой соли. При этом РМ00104 или его фармацевтически приемлемую соль вводят в комбинации с лекарственными средствами, представляющими собой антимиеломные средства. Изобретение позволяет улучшить лечение множественной миеломы, что достигается за счет снижения токсичности действующего вещества. 5 н. и 23 з.п. ф-лы, 5 ил., 4 пр.
Description
Настоящее изобретение относится к лечению раковых заболеваний и, в частности, к эффективному лечению множественной миеломы с использованием соединения PM00104.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Множественная миелома представляет собой злокачественную пролиферацию (разрастание) плазматических клеток одного клона. Термины множественная миелома и миелома используют взаимозаменяемо.
Плазматические клетки вырабатывают антитела, протеины, которые движутся по кровотоку, помогая организму избавиться от вредных веществ. Каждый тип плазматической клетки реагирует только на одно конкретное вещество, что дает большое количество одного типа антитела. Такие антитела находят и действуют против того одного вещества. Так как в организме имеется много типов плазматических клеток, то он может реагировать на многие вещества. В том случае, когда рак затрагивает плазматические клетки, организм поддерживает вырабатывание все большего количества таких клеток. Нетребуемые плазматические клетки - все аномально измененные и все в точности похожие - называются миеломными клетками. Миеломные клетки имеют тенденцию скапливаться в костном мозгу и в твердой наружной части костей. Иногда они скапливаются только в одной кости и образуют единую массу, или опухоль, называемую плазмацитомой. В большинстве случаев, однако, миеломные клетки скапливаются во многих костях, часто образуя многие опухоли и вызывая другие проблемы. В том случае, когда это происходит, заболевание называют как множественная миелома (ММ).
Так как люди с множественной миеломой имеют аномально большое число идентичных плазматических клеток, то они также имеют слишком много антител одного типа. Опухоль, ее продукты и реакция организма-хозяина на развитие опухоли приводят к ряду органных дисфункций и симптомов, проявляющихся в виде боли в кости или в виде перелома кости, почечной недостаточности, восприимчивости к инфекции, анемии, гиперкальцемии и к периодическим нарушениям свертывания крови, неврологическим симптомам и к сосудистым проявлениям гипервязкости.
Множественная миелома является второй чаще всего диагностируемой гемобластозой в Западном мире с ежегодным числом случаев возникновения заболевания, составляющим ~15000 новых случаев только в Соединенных Штатах, и является 14-й причиной смерти от рака при учете всех видов опухолей. К несчастью, множественную миелому считают неизлечимой болезнью, и общая выживаемость пациентов с множественной миеломой остается по существу неизменной и составляет в среднем 3-4 года несмотря на значительные усилия, предпринимаемые за последние ~3 десятилетия для улучшения действия методов терапии этого заболевания, основанных на цитотоксической химиотерапии. Важно то, что средний возраст пациентов с диагнозом множественная миелома составляет <65 лет, и >1/3 пациентов с множественной миеломой имеют возраст <55 лет при диагностировании. Для этой значительной доли относительно молодых пациентов с множественной миеломой диагноз множественная миелома означает даже в отсутствие других сопутствующих патологий высокую вероятность того, что их общая выживаемость будет значительно ниже, чем средняя продолжительность жизни пациентов, не страдающих множественной миеломой, соответственной возрастной группы.
В последнее время сделано несколько важных достижений в тактике терапии множественной миеломы, а именно в документальном подтверждении антимиеломной активности двух новых классов противораковых препаратов: талидомида (и его иммуномодулирующих производных, таких как леналидомид (Dimopoulos M. Et al. N. Engl. J. Med. 2007, 357, 2123-2132; Weber D.M. et al. N. Engl. J. Med. 2007, 357, 2133-2142)) и ингибиторов протеасомы, таких как бортезомиб (Richardson P.G. et al. N. Engl. J. Med. 2005, 352, 2487-2498). Несмотря на то что было показано, что эти классы препаратов являются активными в практике лечения пациентов с множественной миеломой, которые перенесли рецидив/были резистентны к традиционным схемам лечения или к схемам лечения на основе высокодозовой цитотоксической химиотерапии, значительная часть пациентов с множественной миеломой имеет с самого начала устойчивость к тем новым препаратам, тогда как первые респонденты (пациенты, исходно ответившие на лечение) (даже респонденты, достигающие длительной полной ремиссии) могут в конечном счете переносить рецидив. Таким образом, разработка новых классов антимиеломных препаратов срочно требуется, для того чтобы дополнительно улучшить исход лечения пациентов с множественной миеломой и, как следует надеяться, чтобы достигнуть высоких показателей эффективности лечения этой в настоящий момент неизлечимой неоплазии (возникновение и развитие новой, обычно опухолевой, ткани).
Большее количество информации о множественной миеломе может быть обнаружено в медицинской литературе, такой как справочник «Handbook Cancer. Principles & Practice of Oncology», 7-th ed. Philadelphia, Pa: Lippincott Williams & Wilkins, 2005.
Соединение PM00104 представляет собой алкалоид, родственный Джорумицину и соединениям семейства Рениерамицинов и также к соединениям семейства сафрацинов и семейства сафрамицинов. Джорумицин представляет собой природное соединение, выделенное из кожи и из слизи тихоокеанского голожаберного моллюска Jorunna funebris (Fontana A., et al., Tetrahedron (2000), 56, 7305-8). Кроме того, семейство Рениерамицинов раскрывают как семейство соединений, выделенное из губок и оболочников (James M.F. et al. J. Am. Chem. Soc. (1982), 104, 265-269; Oku N., et al. Journal Natural Products (2003), 66, 1136-9). Соединения семейства сафрацинов и семейства сафрамицинов раскрывают в публикации: Manzanares I., et al. Curr. Med. Chem. Anti-Cancer Agents (2001), 1, 257-276, а также в международной публикации WO 00/18233 и WO 01/87894.
Соединение PM00104 продемонстрировало существенную активность in vitro в отношении клеточных линий солидной и несолидной опухолей, а также существенную активность in vivo в нескольких ксенографт-линиях клеток человека у мышей, таких как линии рака молочной железы и простаты. Предварительное осмысление механизма действия соединения PM00104 позволило предположить изменения клеточного цикла, ДНК-связывающие свойства и ингибирование транскрипции. Для получения дополнительной подробной информации о соединении PM00104 смотри международную публикацию WO 01/87894. Это соединение показывает следующую химическую структуру:
Дополнительно, что касается фармацевтических композиций и дозировок и режимов введения соединения PM00104, можно обратиться к международным публикациям WO 2007/052076 и WO 2008/135792, которые включены в этот документ путем ссылки.
Целью настоящего изобретения является обеспечение новых и улучшенных форм лечения множественной миеломы с использованием соединения PM00104.
Другой целью настоящего изобретения является обеспечение новых применений соединения PM00104 в терапии рака.
Краткое изложение сущности изобретения
Авторами впервые было установлено, что соединение PM00104 обладает противоопухолевой активностью в отношении множественной миеломы (ММ) и, следовательно, что оно может быть успешно применено в лечении этого заболевания.
Таким образом, это изобретение направлено на фармацевтические композиции, наборы, способы для лечения множественной миеломы с использованием соединения PM00104 и на применения соединения PM00104 в изготовлении лекарственного препарата для лечения множественной миеломы.
В соответствии с одним аспектом этого изобретения предлагается лечение пациента, который нуждается в таком лечении, посредством терапевтически эффективного количества соединения PM00104 или его фармацевтически приемлемой соли для лечения множественной миеломы.
В родственном варианте осуществления изобретение дополнительно предусматривает применение соединения PM00104 или его фармацевтически приемлемой соли в приготовлении лекарственного препарата для лечения множественной миеломы.
В дополнительном аспекте изобретение обеспечивает соединение PM00104 или его фармацевтически приемлемую соль для применения в лечении множественной миеломы.
В другом аспекте настоящее изобретение также направлено на фармацевтическую композицию, содержащую соединение РМ00104 или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель или эксципиент, которая должна быть применена в лечении множественной миеломы.
Настоящее изобретение, кроме того, обеспечивает способ лечения млекопитающего, в особенности человека, страдающего множественной миеломой, включающий введение страдающему указанным недугом индивидууму терапевтически эффективного количества соединения РМ00104 или его фармацевтически приемлемой соли.
В дополнительном аспекте настоящего изобретения обеспечивают набор лекарственных препаратов для введения соединения РМ00104, включающий печатные инструкции для введения соединения РМ00104 в соответствии с применениями и способами лечения, изложенными в этом документе, и фармацевтическую композицию, содержащую соединение РМ00104 или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель или эксципиент.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
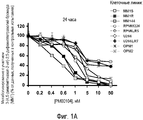
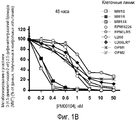
Фиг. 1. Соединение РМ00104 ингибирует жизнеспособность клеток множественной миеломы при сохранении нормальных кроветворных клеток-предшественников. Девять клеточных линий множественной миеломы инкубируют с различными концентрациями соединения РМ00104 в течение 24 часов (Фиг. 1А), 48 часов (Фиг. 1В) и 72 часов (Фиг. 1С) и анализируют жизнеспособность клеток посредством анализа на основе 3-{4,5-диметилтиазол-2-ил}-2,5-дифенилтетразолий-бромида (МТТ). Средние значения пролиферации для контрольных необработанных образцов принимают за 100%. Данные представляют как среднее значение±среднеквадратическое отклонение для четырех одинаковых образцов эксперимента, который выполняют повторно, по меньшей мере, дважды.
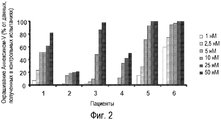
Фиг. 2. Только что выделенные клетки костного мозга, полученные у шести пациентов с множественной миеломой, обрабатывают ex vivo соединением РМ00104 (1-50 нМ) в течение 18 часов. По истечении периода инкубирования клетки окрашивают с помощью комбинации Аннексина-V+, меченного флуоресцин-изотиоцианатом, (Annexin V-FITC), и трех моноклональных антител по отношению к антигенам на поверхности плазматических клеток (CD38, CD56 и CD45), что делает возможным анализ индукции апоптоза в популяции клеток при миеломатозном поражении. Результаты даны в виде процентного содержания положительных клеток с Аннексином-V+, отнесенного к процентному содержанию жизнеспособных клеток в необработанном образце.
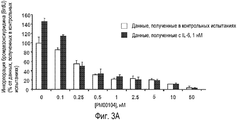
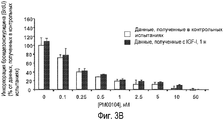
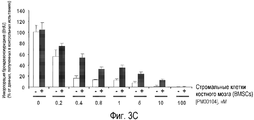
Фиг. 3. Соединение РМ00104 ослабляет защитные эффекты цитокина IL-6, инсулиноподобного фактора роста IGF-I, и присоединение к стромальным клеткам костного мозга (BMSCs) пациента. Клетки MM1S обрабатывают в течение 48 часов соединением PM00104, взятым в упомянутых концентрациях, в присутствии или в отсутствие цитокина IL-6 (Фиг. 3А), инсулиноподобного фактора роста IGF-I (Фиг. 3В) или стромальных клеток костного мозга (BMSCs), полученных у пациента с множественной миеломой (Фиг. 3С). Синтез ДНК обнаруживают путем измерения инкорпорации бромдезоксиуридина (BrdU) в течение последних 8 часов 48-часового культивирования клеток. Кроме того, стромальные клетки костного мозга (BMSCs) культивируют при различных дозах соединения РМ00104 в течение 48 часов и анализируют цитотоксичность посредством анализа на основе 3-{4,5-диметилтиазол-2-ил}-2,5-дифенилтетразолий-бромида (Фиг. 3D). Данные представляют как среднее значение ± среднеквадратичное отклонение для четырех одинаковых образцов эксперимента.
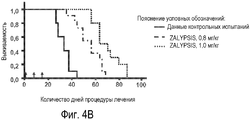
Фиг. 4. Антимиеломный эффект in vivo. Процесс роста объема плазмоцитом на основе клеточной линии MM1S (Фиг. 4А) и клеточной линии ОРМ-1 (Фиг. 4С) в течение указанных дней и выживаемость подвергнутых лечению мышей, имеющих клеточную линию MM1S (Фиг. 4В) и клеточную линию ОРМ-1 (Фиг. 4D).
Фиг. 5. Соединение РМ00104 усиливает антимиеломное действие традиционных и новых антимиеломных средств. Клетки MM1S обрабатывают соединением РМ00104 (Zalypsis, Z) и другими антимиеломными средствами, такими как Дексаметазон (Dex), мелфалан (Mel), доксорубицин (Dox), бортезомиб (Bort) и леналидомид (Len), взятыми в субоптимальных концентрациях, используя двойные (Фиг.5А) и тройные комбинации (Фиг.5В).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Несмотря на последние достижения в тактике терапии множественной миеломы по-прежнему существует потребность в обнаружении новых терапевтических средств с антимиеломной активностью, особенно для пациентов, которые переносят рецидивы или не реагируют оптимально на традиционные и/или новые методы терапии.
Авторы обнаружили, что соединение РМ00104 обладает сильной антимиеломной активностью, как в анализах in vitro, так и в анализах in vivo. В исследованиях in vitro соединение РМ00104 сильно действует на клеточные линии с множественной миеломой, так же как на клетки пациента, и его IC50-значения для большинства клеточных линий находятся в низком наномолярном или пикомолярном диапазоне числовых значений, что указывает на более высокую эффективность по сравнению с другими лекарственными средствами, применяемыми в терапии множественной миеломы. Более того, соединение РМ00104 обладает синергическим эффектом при применении в нескольких из этих используемых в текущий момент процедур лечения множественной миеломы, что дает возможность использования этого лекарственного средства в комбинации с теми другими хорошо проверенными лекарственными средствами. Интересно, что соединение РМ00104 также является в равной степени эффективным на клеточных линиях, таких как MM1R и RPMI-LR5, выбранных за их устойчивость к традиционным антимиеломным процедурам лечения, что указывает на то, что это лекарственное средство могло бы быть использовано для преодоления лекарственной устойчивости, обычной ситуации, обнаруживаемой у пациентов с множественной миеломой, подвергнутых лечению. В дополнение к результатам исследований in vitro изучение на животных in vivo подтверждает антимиеломную активность соединения РМ00104. Оказалось, что это лекарственное средство является хорошо переносимым и оказывает сильное влияние на рост ксенографт-плазмацитом MM1S и OPM-1 у мышей.
Термин «лечение», который используют в этом документе, если не указано иначе, означает реверсию, частичное снятие, ингибирование развития, ослабление симптомов или патологического основания заболевания или предупреждение нарушения или состояния, к которому такой термин применяется, или одного или более симптомов такого нарушения или состояния. Термин «процедура лечения», который используют в этом документе, если не указано иначе, относится к процессу лечения, которое определено выше как «лечение».
Как упомянуто выше, соединение РМ00104 представляет собой алкалоид, родственный морскому соединению Джорумицину и морским соединениям семейства Рениерамицинов и также соединениям семейства сафрацинов и семейства сафрамицинов, имеющим следующую структуру:
Термин «соединение РМ00104» предназначен для охватывания любой(ого) фармацевтически приемлемой(ого) соли, сольвата, гидрата, пролекарства или любого другого соединения, которое при введении пациенту является действенным в обеспечении (прямо или опосредованно) соединения, которое описано в этом документе. Приготовление солей, сольватов, гидратов и пролекарств может быть выполнено способами, известными в данной области.
Фармацевтически приемлемые соли могут быть синтезированы из родительского соединения, которое содержит основный или кислотный фрагмент, посредством общепринятых химических способов. Как правило, такие соли приготавливают, например, путем подвергания реакции свободных кислотных или основных форм этих соединений со стехиометрическим количеством соответствующего основания или кислоты в воде или в органическом растворителе или в смеси воды и органического растворителя. Как правило, неводные среды, такие как простой эфир, этилацетат, этанол, изопропанол или ацетонитрил, являются предпочтительными. Примеры солей присоединения кислоты включают соли присоединения минеральной кислоты, такие как, например, гидрохлорид, гидробромид, гидроиодид, сульфат, нитрат, фосфат, и соли присоединения органической кислоты, такие как, например, ацетат, трифторацетат, малеат, фумарат, цитрат, оксалат, сукцинат, тартрат, малат, манделат, метансульфонат и п-толуолсульфонат. Примеры солей присоединения основания включают неорганические соли, такие как, например, натриевые, калиевые, кальциевые и аммониевые соли, и соли органических оснований, такие как, например, этилендиамин, этаноламин, N,N-диалкиленэтаноламин, триэтаноламин и соли основных аминокислот.
Любое соединение, которое является пролекарством РМ00104, находится в рамках объема и сущности изобретения. Термин «пролекарство» используют в его самом широком смысле, и он охватывает те производные, которые превращаются in vivo в соединение РМ00104. Пролекарство может подвергаться гидролизу, окисляться или иным образом реагировать в биологических условиях с обеспечением соединения РМ00104. Примеры пролекарств включают производные и метаболиты РМ00104, которые включают биогидролизуемые фрагменты, такие как биогидролизуемые амиды, биогидролизуемые сложные эфиры, биогидролизуемые карбаматы, биогидролизуемые карбонаты, биогидролизуемые уреиды и биогидролизуемые фосфатные аналоги, но не ограничиваются этим. Пролекарства обычно могут быть приготовлены с использованием общеизвестных способов, таких как способы, описанные в работах Burger «Medicinal Chemistry and Drug Discovery» 6th ed. (Donald J. Abraham ed., 2001, Wiley) and «Design and Applications of Prodrugs» (H. Bundgaard ed., 1985, Harwood Academic Publishers).
Кроме того, любое лекарственное средство, упоминаемое в этом документе, может находиться в кристаллическом виде, либо в форме свободного соединения, либо в форме сольватов (например, гидратов), и подразумевается, что обе формы находятся в рамках объема настоящего изобретения. Способы сольватации являются общеизвестными в данной области.
Соединение РМ00104 для применения в соответствии с настоящим изобретением может быть получено, следуя способу синтеза, раскрытому в международной публикации WO 01/87894, которая включена в этот документ путем ссылки.
Фармацевтические композиции соединения РМ00104, которые могут быть использованы, включают растворы, суспензии, эмульсии, лиофилизованные композиции и так далее с подходящими эксципиентами для внутривенного введения. Предпочтительно соединение РМ00104 может быть поставлено и сохранено в виде стерильного лиофилизованного продукта, содержащего соединение РМ00104 и эксципиенты в составе, адекватном для терапевтического применения. В частности, состав, содержащий сахарозу и фосфатную соль, буферизованный до адекватного рН, является предпочтительным. Дополнительное методическое руководство по составам соединения РМ00104 дано в международной публикации WO2007/052076, которая включена в этот документ путем ссылки в полном своем объеме.
Введение соединения РМ00104, или его фармацевтических композиций, или фармацевтических композиций, содержащих это соединение, предпочтительно осуществляют посредством внутривенной инфузии. Могут быть использованы длительности инфузии вплоть до 72 часов, более предпочтительно от 1 до 24 часов, наиболее предпочтительно либо приблизительно 1 час, приблизительно 3 часа либо приблизительно 24 часа. Короткие длительности инфузии, которые позволяют проводить лечение без ночного пребывания в больнице, являются особенно желательными. Однако инфузия может длиться приблизительно 24 часа или даже больше, если это необходимо.
Предпочтительно введение соединения РМ00104 выполняют циклами. В предпочтительном способе введения внутривенную инфузию соединения РМ00104 делают пациентам обычно в первый день каждого цикла и затем пациентам дают возможность восстанавливаться в течение оставшейся части цикла. Предпочтительная продолжительность каждого цикла обычно составляет 3 или 4 недели; при необходимости могут быть даны многократно повторяющиеся циклы. Отсрочки дозы и/или снижения дозы и корректировки схемы введения осуществляют при необходимости в зависимости от состояния конкретного пациента или от переносимости процедур лечения. Для получения дополнительного руководства по введению и дозировкам соединения РМ00104 смотри, например, международную публикацию WO 2008/135792, которая включена в этот документ путем особой ссылки на узкую предметную рубрику. Дополнительное руководство по введению и дозировкам соединения РМ00104 может быть обнаружено в публикациях: Journal of Clinical Oncology, 2007 ASCO Annual Meeting Proceedings Part I. Vol. 25, No. 18S (June 20 Supplement), 2007: 2517, и Eur. J. Cancer, 2008, Vol. 6 (suppl. 12), page 57 Abstract No. 179, которые также являются включенными в этот документ путем особой ссылки на узкую предметную рубрику.
Хотя выше дано руководство по дозировке, точная дозировка соединения может быть изменена в соответствии с конкретными составом, способом применения и в соответствии с конкретными расположением, пациентом и опухолью, подлежащей лечению. Следует принимать во внимание и другие факторы, такие как возраст, вес тела, пол, диета, длительность введения, скорость выделения лекарственного средства, состояние пациента, комбинирование лекарственных средств, чувствительность в реакции на лекарственный препарат и тяжесть заболевания. Отсрочки дозы и/или снижения дозы и корректировки схемы введения осуществляют при необходимости в зависимости от состояния конкретного пациента или от переносимости процедур лечения.
В зависимости от типа опухоли и стадии развития заболевания противораковые эффекты способов осуществления процедур лечения настоящего изобретения включают ингибирование роста опухоли, задержку роста опухоли, регрессию опухоли, сморщивание опухоли, увеличение времени на возобновление роста опухоли при отмене процедуры лечения, замедление прогрессирования заболевания и предупреждение метастазирования, но не ограничиваются этим. Предполагают, что в том случае, когда способ осуществления процедуры лечения настоящего изобретения назначают пациенту, который нуждается в такой процедуре лечения, упомянутый способ осуществления процедуры лечения будет производить эффект, который оценивают, например, посредством измерения степени противоракового эффекта, скорости реакции на лекарственный препарат, длительности прогрессирования заболевания или показателя выживаемости. В частности, способы осуществления процедуры лечения изобретения подходят для пациентов-людей, особенно для пациентов-людей, которые переносят рецидив или являются не восприимчивыми (резистентными) к предыдущей химиотерапии. Терапия первой линии также является предусмотренной.
В одном аспекте изобретение обеспечивает способ лечения любого млекопитающего, в особенности человека, страдающего множественной миеломой, включающий введение страдающему этим недугом индивидууму терапевтически эффективного количества соединения РМ00104 или его фармацевтически приемлемой соли.
В другом аспекте настоящее изобретение относится к набору лекарственных препаратов для введения соединения РМ00104, включающему печатные инструкции для введения соединения РМ00104 при осуществлении процедуры лечения множественной миеломы, и фармацевтическую композицию, содержащую соединение РМ00104 или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель или эксципиент.
В еще одном аспекте настоящее изобретение также предусматривает фармацевтическую композицию, содержащую соединение РМ00104 или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель или эксципиент, которая должна быть использована в процедуре лечения множественной миеломы.
В еще одном аспекте изобретение дополнительно предусматривает применение соединения РМ00104 или его фармацевтически приемлемой соли, в изготовлении лекарственного препарата для осуществления процедуры лечения множественной миеломы.
В дополнительном аспекте изобретение обеспечивает соединение РМ00104 или его фармацевтически приемлемую соль для применения в процедуре лечения множественной миеломы.
Соединение РМ00104 или его фармацевтически приемлемая соль может быть использовано(а) вместе с другими лекарственными средствами для обеспечения комбинированной терапии в процедуре лечения множественной миеломы. Другое лекарственное средство может составлять часть таковой композиции или может быть обеспечено в виде отдельной композиции для введения в одно и то же время или в другой момент времени. Предпочтительно другое лекарственное средство представляет собой антимиеломное средство, включающее дексаметазон, мелфалан, доксорубицин, бортезомиб, леналидомид, преднизон, кармустин, этопозид, цисплатин, винкристин, циклофосфамид и талидомид, но не ограниченное этим. Особенно предпочтительной является комбинация соединения РМ00104 или его фармацевтически приемлемой соли с дексаметазоном, мелфаланом, доксорубицином, бортезомибом, леналидомидом, преднизоном, кармустином, этопозидом, цисплатином, винкристином, циклофосфамидом и талидомидом и еще более предпочтительной является комбинация с дексаметазоном, мелфаланом, доксорубицином, бортезомибом и леналидомидом. Эффективные комбинированные методы терапии, основанные на использовании трех лекарственных средств, соединения РМ00104 или его фармацевтически приемлемой соли плюс двух дополнительных лекарственных средств, также являются охваченными настоящим изобретением. Особенно предпочтительной является тройная комбинация с дексаметазоном и третьим лекарственным средством, выбранным из мелфалана, доксорубицина и леналидомида.
Термин «комбинация», который используют на протяжении всего описания изобретения, предназначен для охватывания введения пациенту, страдающему множественной миеломой, вышеупомянутых терапевтических средств в одном фармацевтическом составе или в отдельно взятых фармацевтических составах и в одно и то же время или в различные моменты времени. Если терапевтические средства вводят в различные моменты времени, их следует вводить достаточно быстро один за другим для обеспечения возникновения усиливающего действия или синергической реакции.
Следующие примеры дополнительно иллюстрируют изобретение. Их не следует рассматривать как ограничение объема данного изобретения.
Для обеспечения более краткого описания некоторые из количественных выражений, приведенных в этом документе, не сопровождаются термином «приблизительно». Полагают, что используется ли термин «приблизительно» в явном виде или нет, каждое количество, приведенное в этом документе, как подразумевают, относится к конкретному истинному данному значению и также оно относится, как подразумевают, к приближению к такому данному значению, которое могло быть принято в разумных пределах на основе среднего уровня компетентности в данной области, включая эквиваленты и приближения, обусловленные условиями эксперимента и/или измерения такого данного значения. Кроме того, если не установлено иное, то в том случае, когда значения даны в виде диапазонов, верхние и нижние значения, как правило, рассматривают как предпочтительные значения.
ПРИМЕРЫ ИЗОБРЕТЕНИЯ
ПРИМЕР 1. Антипролиферативный/цитотоксический эффект соединения РМ00104 в отношении клеток множественной миеломы.
Противоопухолевую активность соединения РМ00104 в множественной миеломе оценивают посредством использования панели клеточных линии, содержащей следующие 9 клеточных линий множественной миеломы: MM1S, MM1R, MM144, RPMI8226, RPMI-LR5, U266, U266-LR7, OPM-1 и OPM-2. Эти клеточные линии выращивают в среде RPMI 1640 с L-глутамином, дополненной антибиотиками (пенициллин в концентрации 100 ед./мл, стрептомицин в концентрации 100 мкг/мл) и 10% фетальной бычьей сыворотки (FBS) при 37ºС во влажной среде в присутствии 5% СО2-95% воздуха.
Клеточные линии обрабатывают соединением РМ00104, взятым с увеличивающимися концентрациями (0,1-50 нМ), в течение 24, 48 и 72 часов и анализируют жизнеспособность клеток с использованием колориметрического анализа на основе 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолий-бромида (МТТ). Кратко, клеточные линии множественной миеломы высевают с плотностью 50000 клеток/200 мкг/мл среды на лунку в 48-луночных планшетах и обрабатывают лекарственным средством заданной дозы и в течение заданного времени. За два часа до конца обработки добавляют раствор 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолий-бромида (МТТ) (5 мг/мл в забуференном фосфатом физиологическом растворе (PBS)) и соль тетразолия восстанавливают метаболически активными клетками до получения окрашенных кристаллов формазана. После солюбилизации этих кристаллов в ходе инкубирования в течение ночи посредством 10-%-ного раствора додецилсульфата натрия (SDS-HCl) измеряют поглощение при 570 нм с корректировкой при 630 нм. Результаты представляют как среднее значение ± среднеквадратичное отклонение (SD) для четырех одинаковых образцов эксперимента, который повторяют, по меньшей мере, дважды.
Как показано на фигурах 1А-С, все клеточные линии являются очень чувствительными к лекарственному средству со значениями IC50 при 48 часах, находящимися в диапазоне от пикомолярных концентраций в некоторых клеточных линиях (MM1S, MM1R и MM144) до низких наномолярных концентраций (1-2 нМ) в менее чувствительных клеточных линиях (RPMI8226, RPMI-LR5, U266, U266-LR7, OPM-1 и OPM-2). Чувствительность к соединению РМ00104 не зависит от картины устойчивости клеточных линий по отношению к традиционным антимиеломным средствам, таким как дексаметазон (все клеточные линии являются устойчивыми к дексаметазону за исключением клеточных линий MM1S и ММ144) или к мелфалану (клеточные линии RPMI-LR5 и U266-LR7 являются устойчивыми к мелфалану).
Кроме того, эффект соединения РМ00104 дополнительно изучают ex vivo в клетках, выделенных из образцов костного мозга (BM), полученных от шести пациентов с множественной миеломой. Образцы лизируют хлоридом аммония для того, чтобы удалить красные кровяные клетки, а лейкоциты сохраняют в среде RPMI-1640, содержащей антибиотики (пенициллин в концентрации 100 ед./мл, стрептомицин в концентрации 100 мкг/мл) и 20% фетальной бычьей сыворотки (FBS). Впоследствии клетки костного мозга инкубируют с соединением РМ00104, взятым в различных концентрациях (1-50 нМ), в шести луночных планшетах в течение 18 часов при 37ºС. Для того чтобы различить миеломатозные плазматические клетки (PC) и другие клетки костного мозга (BM), проводят процедуру с мультипараметрической оценкой, в которой клетки инкубируют в течение 15 минут при комнатной температуре в темноте с 5 мкл Аннексина-V+, меченного флуоресцин-изотиоцианатом (FITC) (Bender MedSystems, Burlingame, CA) вместе с комбинацией моноклональных антител к обусловленным миеломой антигенам (анти-CD56-PE, анти-CD45-APC и анти-CD38-perCP/Cy5 (BD Biosciences)). Все 50000 клеток обнаруживают (и получают информацию о них) на проточном цитометре FACScalibur (BD Biosciences) и анализируют с помощью программы «Paint-a-Gate». Апоптоз анализируют на основе положительной пробы с Аннексином-V в различных популяциях: опухолевых плазматических клетках, а также в нормальных остаточных лимфоцитах и грануло-моноцитах. Процентное содержание положительных клеток по Аннексину-V после процедуры лечения соединением РМ00104 вычисляют относительно отрицательных клеток по Аннексину-V (жизнеспособные клетки) в контрольных пробах-образцах (без процедуры лечения).
Четыре из шести проанализированных образцов-проб, включающие две пробы, полученные при постановке диагноза (пациенты 1 и 6), одну пробу, полученную в момент рецидива (пациент 3) и оставшуюся одну пробу, которая представляет собой лейкемию плазматических клеток, вторичную рецидивирующей множественной миеломе (пациент 5), являются очень чувствительными к низким концентрациям соединения РМ00104. Еще одна проба, соответствующая вторичной лейкемии плазматических клеток (пациент 4), имеет промежуточную чувствительность (Фигура 2).
ПРИМЕР 2. Соединение РМ00104 аннулирует преимущество «выживаемости» и устойчивость к лекарственным средствам, вызванные микроокружением (питательная среда) клеток костного мозга (ВМ)
Присутствие микроокружения (питательная среда) клеток костного мозга сообщает защиту клеткам с множественной миеломой через их адгезию или через продуцирование нескольких цитокинов, таких как IL-6 или IGF-I. Для того чтобы испытать, эффективно ли соединение РМ00104 в ингибировании этого защитного эффекта микроокружения клеток костного мозга, клетки MM1S инкубируют с цитокином IL-6 (1 нМ) или IGF-I (10 нМ) или культивируют совместно со стромальными клетками костного мозга (BMSCs) в течение 48 часов и затем обрабатывают соединением РМ00104, взятым с увеличивающимися концентрациями. Стромальные клетки костного мозга высевают в 96-луночные чашки для культивирования (50000 клеток/лунка) и дают достигнуть конфлюэнтности в течение 48 часов. Затем 30000 миеломных клеток высевают в среду RPMI 1640, содержащую 10% сыворотки. Затем оценивают пролиферацию клеток множественной миеломы посредством инкорпорации бромдезоксиуридина (BrdU)(Maiso P. Et al. Br. J. Haematol. 2008, 141, 470-482). Бромдезоксиуридин добавляют в течение последних 8 часов и инкорпорацию бромдезоксиуридина измеряют с использованием серийно выпускаемого набора (Roche Biochemicals), следуя инструкциям производителя.
Вопреки пролиферативному преимуществу клеткам множественной миеломы, придаваемому всеми этими моделями, соединение РМ00104 полностью аннулирует эффект растворимых цитокинов IL-6 и IGF-I (Фигуры 3А и 3В) и сильно ингибирует защитный эффект вследствие адгезии плазматических клеток на поверхности стромальных клеток костного мозга (BMSCs) (Фиг.3С). В противоположность этому стромальные клетки костного мозга являются очень устойчивыми к цитотоксическому эффекту соединения РМ00104 (Фиг.3D).
ПРИМЕР 3. Антимиеломная эффективность соединения РМ00104 in vivo
Эффективность соединения РМ00104 in vivo изучают на модели плазмоцитомы человека, привитой мышам CB17-SCID. Эти эксперименты выполняют с использованием очень чувствительной клеточной линии MM1S и менее чувствительной клеточной линии ОРМ-1. Двум когортам из тридцати мышей делают подкожно инъекцию каждой клеточной линии и мышей рандомизируют (располагают в случайном порядке) по трем группам, получающим среду для лекарства как таковую, 0,8 мг/кг соединения РМ00104 или 1 мг/кг соединения РМ00104 внутривенно (iv) один раз в неделю по три дозы.
Мышам CD17-SCID (The Jackson Laboratory, Bar Harbor, ME, USA) подкожно инокулируют (делают прививку) в правый бок поясницы посредством 3×106 клеток линии MM1S или ОРМ-1 в 100 мкл среды RPMI-1640 и в 100 мкл Matrigel (Becton Dickinson). В том случае, когда опухоли становятся доступными пальпации, мыши получают соединение РМ00104 или среду для лекарственного препарата как таковую. Процедуру лечения соединением РМ00104 осуществляют внутривенно (iv) в дозах 0,8 мг/кг и 1 мг/кг один раз в неделю по три дозы. Контрольная группа получает среду для лекарственного препарата как таковую (стерильная вода для инъекции плюс физиологический раствор).
Измерения каверномером диаметров опухолей выполняют каждый день и объем опухоли оценивают как объем эллипса с использованием следующей формулы: V=4/3π×(a/2)×(b/2)2, где «а» и «b» соответствуют самому большому и самому короткому диаметру соответственно. К животным применяют эвтаназию в том случае, когда их опухоли достигают 2 см. Разности объемов опухолей между обработанными и контрольными группами оценивают с использованием однофакторного дисперсионного анализа и апостериорных критериев Bonferroni. Выживаемость оценивают со дня инициирования процедуры лечения и статистические расхождения оценивают по кривым Kaplan-Meier посредством логарифмического рангового критерия Log-Rank. Статистические анализы проводят с использованием программного обеспечения SPSS-15.0 (SPSS Inc. Chicago, IL, USA), статистический уровень значимости определяют как р<0,05.
Как показано на Фигурах 4А и 4С, обе дозы соединения РМ00104 снижают рост плазмоцитом со статистически достоверной разницей. Для плазмоцитом MM1S, по истечении 15 дней процедуры лечения объем опухоли составляет 1207±645, 420±242 и 176±78 мм3 (среднее значение ± среднеквадратичное отклонение) для когорт, получающих среду для лекарственного препарата 0,8 мг/кг и 1 мг/кг соответственно (р<0,001 для общего сравнения и для сравнений каждого из подвергнутых лечению субъектов относительно контрольных субъектов). В менее чувствительной и более быстро растущей клеточной линии ОРМ-1 результаты являются похожими в отношении объемов опухолей по истечении 14 дней процедуры лечения, составляющих 4091±903, 1879±731 и 1042±596 мм3 (среднее значение±среднеквадратичное отклонение) для аналогичных групп мышей (р<0,001 для всех сравнений). Такая задержка роста опухоли находится в соответствии с увеличением выживаемости подвергнутых лечению мышей в сравнении с контрольной группой мышей (Фигура 4В и 4D). В этом смысле выживаемости в клеточной линии MM1S, выраженные как срединное значение±среднеквадратическая ошибка, составляют 29±3,9, 52±4,8 и 59±5,5 дней для контрольного испытания со средой для лекарственного препарата, для 0,8 мг/кг соединения РМ00104 и для 1 мг/кг соединения РМ00104 соответственно (Фигура 4В); тогда как выживаемости для аналогичных групп в плазмоцитомах ОРМ-1 составляют: 14±0, 21±0,8 и 23±1,1 дней (Фигура 4D). Различия оценивают с помощью логарифмического рангового критерия Log-Rank, который в результате дает статистические достоверную разницу в сравнении с контрольным испытанием с использованием среды для лекарственного препарата для обеих доз в обоих ксенографтах (р<0,001).
Интересно то, что процедуре лечения соединением РМ00104 не сопутствует никакая существенная общая токсичность и наблюдается лишь небольшая потеря веса (около 10% массы тела по сравнению с контрольными испытаниями) при самых высоких дозах соединения РМ00104.
ПРИМЕР 4. Соединение РМ00104 потенцирует эффективность традиционных антимиеломных средств.
Поскольку процедура лечения большинства раковых заболеваний, включая множественную миелому, основана на комбинировании лекарственных средств с различными механизмами действия, авторы изучили эффект действия соединения РМ00104 в комбинации с лекарственными средствами, обычно используемыми в процедуре лечения множественной миеломы.
Клетки MM1S обрабатывают в течение 72 часов, как описано в примере 1, комбинациями соединения РМ00104, взятого в субоптимальных дозах, и других антимиеломных средств, таких как дексаметазон, мелфалан, доксорубицин, бортезомиб и леналидомид, в двойных и тройных комбинациях. Жизнеспособность клеток анализируют с помощью анализа на основе 3-{4,5-диметилтиазол-2-ил}-2,5-дифенилтетразолий-бромида (ММТ), который описан в примере 1. Активность комбинации количественно оценивают с помощью программного обеспечения Calcusyn (Biosoft, Ferguson, MO), которое основано на способе Chou Talalay, который позволяет вычислять индекс действия комбинации (CI) со следующей интерпретацией: CI>1: антагонистический эффект, CI=1: аддитивность и CI<1: синергический эффект.
Соединение РМ00104 со всей очевидностью потенцирует эффект действия традиционных антимиеломных средств, таких как дексаметазон, мелфалан и доксорубицин, в клетках MM1S (Фигура 5А). Соединение РМ00104 также испытывают в комбинации с бортезомибом и леналидомидом, двумя новыми средствами, которые недавно были включены в набор лекарственных средств для лечения пациентов, страдающих множественной миеломой, с многообещающими аддитивными/синергическими результатами, которые являются особенно очевидными в комбинации с леналидомидом (Фигура 5А). Анализ этих данных с использованием способа Chou и Talalay показывает, что соединение РМ00104 является синергически действующим с дексаметазоном (CI=0,78), мелфаланом (CI=0,48), доксорубицином (CI=0,64) и леналидомидом (CI=0,55).
Эти многообещающие результаты с двойными комбинациями подтолкнули к исследованию тройных комбинаций наиболее синергично действующих соединений в клеточной линии MM1S. Как можно увидеть на фигуре 5В, тройные комбинации: соединение РМ00104+дексаметазон+любое соединение из следующего: мелфалан, доксорубицин или леналидомид, значительно усиливают эффективность соответственных двойных комбинаций.
Claims (28)
2. Способ по п.1, где пациент представляет собой пациента-человека.
3. Способ по п.1, где пациент переносит рецидив или является невосприимчивым к предыдущей химиотерапии.
4. Способ по п.2, где пациент переносит рецидив или является невосприимчивым к предыдущей химиотерапии.
5. Способ по любому из пунктов 1-4, где РМ00104 или его фармацевтически приемлемую соль используют в комбинации с другим лекарственным средством или другими лекарственными средствами для обеспечения комбинированной терапии.
6. Способ по п.5, где другое лекарственное средство или другие лекарственные средства представляют собой антимиеломные средства.
7. Способ по п.6, где антимиеломное средство выбирают из дексаметазона, мелфалана, доксорубицина, бортезомиба, леналидомида, преднизона, кармустина, этопозида, цисплатина, винкристина, циклофосфамида и талидомида.
8. Способ по п.7, где антимиеломное средство выбирают из дексаметазона, мелфалана, доксорубицина, бортезомиба и леналидомида.
9. Применение
или его фармацевтически приемлемой соли для изготовления лекарственного средства для способа лечения любого млекопитающего, в частности человека, страдающего множественной миеломой, включающего введение указанному индивидууму терапевтически эффективного количества РМ00104 или его фармацевтически приемлемой соли.
или его фармацевтически приемлемой соли для изготовления лекарственного средства для способа лечения любого млекопитающего, в частности человека, страдающего множественной миеломой, включающего введение указанному индивидууму терапевтически эффективного количества РМ00104 или его фармацевтически приемлемой соли.
10. Применение по п.9, где способ включает введение нуждающемуся в этом индивидууму терапевтически эффективного количества РМ00104 или его фармацевтически приемлемой соли в комбинации с другим лекарственным средством или лекарственными средствами для обеспечения комбинированной терапии.
11. Применение по п.10, где другое лекарственное средство или другие лекарственные средства являются антимиеломными средствами.
12. Применение по п.11, где антимиеломное средство выбирают из дексаметазона, мелфалана, доксорубицина, бортезомиба, леналидомида, преднизона, кармустина, этопозида, цисплатина, винкристина, циклофосфамида и талидомида.
13. Применение по п.12, где антимиеломное средство выбирают из дексаметазона, мелфалана, доксорубицина, бортезомиба и леналидомида.
14. Фармацевтическая композиция, включающая
или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель или эксципиент для применения в способе лечения любого млекопитающего, в частности человека, страдающего множественной миеломой, включающий введение указанному индивидууму терапевтически эффективного количества РМ00104 или его фармацевтически приемлемой соли.
или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель или эксципиент для применения в способе лечения любого млекопитающего, в частности человека, страдающего множественной миеломой, включающий введение указанному индивидууму терапевтически эффективного количества РМ00104 или его фармацевтически приемлемой соли.
15. Фармацевтическая композиция по п.14, где способ включает введение нуждающемуся в этом индивидууму терапевтически эффективного количества РМ00104 или его фармацевтически приемлемой соли в комбинации с другим лекарственным средством или лекарственными средствами для обеспечения комбинированной терапии.
16. Фармацевтическая композиция по п.15, где другое лекарственное средство или другие лекарственные средства являются антимиеломными средствами.
17. Фармацевтическая композиция по п.16, где антимиеломное средство выбирают из дексаметазона, мелфалана, доксорубицина, бортезомиба, леналидомида, преднизона, кармустина, этопозида, цисплатина, винкристина, циклофосфамида и талидомида.
18. Фармацевтическая композиция по п.17, где антимиеломное средство выбирают из дексаметазона, мелфалана, доксорубицина, бортезомиба и леналидомида.
20. Применение по п.19, где способ включает введение нуждающемуся в этом индивидууму терапевтически эффективного количества РМ00104 или его фармацевтически приемлемой соли в комбинации с другим лекарственным средством или лекарственными средствами для обеспечения комбинированной терапии.
21. Применение по п.20, где другое лекарственное средство или другие лекарственные средства являются антимиеломными средствами.
22. Применение по п.21, где антимиеломное средство выбирают из дексаметазона, мелфалана, доксорубицина, бортезомиба, леналидомида, преднизона, кармустина, этопозида, цисплатина, винкристина, циклофосфамида и талидомида.
23. Применение по п.22, где антимиеломное средство выбирают из дексаметазона, мелфалана, доксорубицина, бортезомиба и леналидомида.
24. Медицинский набор для введения
включающий печатные инструкции для введения соединения РМ00104 в способе лечения любого млекопитающего, в частности человека, страдающего множественной миеломой, включающий введение указанному индивидууму терапевтически эффективного количества РМ00104 или его фармацевтически приемлемой соли, и фармацевтическую композицию, включающую PM00104 или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель или эксципиент.
включающий печатные инструкции для введения соединения РМ00104 в способе лечения любого млекопитающего, в частности человека, страдающего множественной миеломой, включающий введение указанному индивидууму терапевтически эффективного количества РМ00104 или его фармацевтически приемлемой соли, и фармацевтическую композицию, включающую PM00104 или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель или эксципиент.
25. Медицинский набор по п.24, где способ включает введение нуждающемуся в этом индивидууму терапевтически эффективного количества РМ00104 или его фармацевтически приемлемой соли в комбинации с другим лекарственным средством или лекарственными средствами для обеспечения комбинированной терапии.
26. Медицинский набор по п.25, где другое лекарственное средство или другие лекарственные средства являются антимиеломными средствами.
27. Медицинский набор по п.26, где антимиеломное средство выбирают из дексаметазона, мелфалана, доксорубицина, бортезомиба, леналидомида, преднизона, кармустина, этопозида, цисплатина, винкристина, циклофосфамида и талидомида.
28. Медицинский набор по п.27, где антимиеломное средство выбирают из дексаметазона, мелфалана, доксорубицина, бортезомиба и леналидомида.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP08380154 | 2008-05-16 | ||
| EP08380154.8 | 2008-05-16 | ||
| PCT/EP2009/055978 WO2009138509A1 (en) | 2008-05-16 | 2009-05-18 | Multiple myeloma treatments |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2010151660A RU2010151660A (ru) | 2012-06-27 |
| RU2519750C2 true RU2519750C2 (ru) | 2014-06-20 |
Family
ID=40848780
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2010151660/14A RU2519750C2 (ru) | 2008-05-16 | 2009-05-18 | Способы лечения множественной миеломы |
Country Status (12)
| Country | Link |
|---|---|
| US (1) | US8435992B2 (ru) |
| EP (1) | EP2303274A1 (ru) |
| JP (1) | JP2011520846A (ru) |
| KR (1) | KR20110028454A (ru) |
| CN (1) | CN102065865B (ru) |
| AU (1) | AU2009248039B2 (ru) |
| CA (1) | CA2724206A1 (ru) |
| IL (1) | IL209360A (ru) |
| MX (1) | MX2010012358A (ru) |
| NZ (1) | NZ589270A (ru) |
| RU (1) | RU2519750C2 (ru) |
| WO (1) | WO2009138509A1 (ru) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2773740C2 (ru) * | 2020-10-09 | 2022-06-08 | Федеральное государственное бюджетное учреждение "Российский научно-исследовательский институт гематологии и трансфузиологии Федерального медико-биологического агентства" (ФГБУ РосНИИГТ ФМБА России) | Способ снижения токсических и инфекционных осложнений при лечении больных с множественной миеломой |
Families Citing this family (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7919493B2 (en) | 2000-04-12 | 2011-04-05 | Pharma Mar, S.A. | Anititumoral ecteinascidin derivatives |
| MXPA02011319A (es) | 2000-05-15 | 2003-06-06 | Pharma Mar Sa | Analogos antitumorales de ecteinascidina 743. |
| GB0117402D0 (en) | 2001-07-17 | 2001-09-05 | Pharma Mar Sa | New antitumoral derivatives of et-743 |
| GB0202544D0 (en) | 2002-02-04 | 2002-03-20 | Pharma Mar Sa | The synthesis of naturally occuring ecteinascidins and related compounds |
| NZ589269A (en) * | 2008-05-16 | 2013-03-28 | Pharma Mar Sa | Combination therapy with an antitumor alkaloid |
| WO2011048210A1 (en) | 2009-10-22 | 2011-04-28 | Pharma Mar, S.A. | PDGFR-α AS RESPONSE MARKER FOR PM00104 TREATMENT |
| KR101471273B1 (ko) * | 2013-01-29 | 2014-12-11 | 인제대학교 산학협력단 | Sod2를 포함하는 보르테조밉 내성 진단용 바이오 마커 조성물 및 이를 이용한 진단 키트 |
| KR101718800B1 (ko) | 2015-01-21 | 2017-03-24 | 주식회사 디알나노 | 약물 및 siRNA의 공동―운반용 나노복합체 및 이의 용도 |
| JOP20190254A1 (ar) | 2017-04-27 | 2019-10-27 | Pharma Mar Sa | مركبات مضادة للأورام |
| US10537585B2 (en) | 2017-12-18 | 2020-01-21 | Dexcel Pharma Technologies Ltd. | Compositions comprising dexamethasone |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2005131578A (ru) * | 2003-03-12 | 2006-01-27 | Дана-Фарбер Кэнсер Инститьют, Инк. (Us) | Аплидин для лечения множественной миеломы |
| WO2007052076A2 (en) * | 2005-10-31 | 2007-05-10 | Pharma Mar, S.A. | Formulations comprising jorumycin-, reni eramycin-, safracin- or saframycin-related compounds for treating proliferative diseases |
Family Cites Families (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN1074243C (zh) * | 1997-09-16 | 2001-11-07 | 林禾杰 | 对虾养殖方法 |
| US6124292A (en) | 1998-09-30 | 2000-09-26 | President And Fellows Of Harvard College | Synthetic analogs of ecteinascidin-743 |
| MY130271A (en) * | 1999-05-14 | 2007-06-29 | Pharma Mar Sa | Hemisynthetic method and new compounds |
| US6569859B1 (en) | 2000-02-22 | 2003-05-27 | President And Fellows Of Harvard College | Synthetic analogs of ecteinascidin-743 |
| MXPA02011319A (es) | 2000-05-15 | 2003-06-06 | Pharma Mar Sa | Analogos antitumorales de ecteinascidina 743. |
| GB0229793D0 (en) | 2002-12-20 | 2003-01-29 | Pharma Mar Sa | The gene cluster involved in safracin biosynthesis and its uses for genetic engineering |
| TW200801513A (en) | 2006-06-29 | 2008-01-01 | Fermiscan Australia Pty Ltd | Improved process |
| GB0708691D0 (en) * | 2007-05-04 | 2007-06-13 | Pharma Mar Sa | Anticancer treatments a |
-
2009
- 2009-05-18 US US12/992,754 patent/US8435992B2/en not_active Expired - Fee Related
- 2009-05-18 CN CN2009801229778A patent/CN102065865B/zh not_active Expired - Fee Related
- 2009-05-18 KR KR1020107028257A patent/KR20110028454A/ko active IP Right Grant
- 2009-05-18 AU AU2009248039A patent/AU2009248039B2/en not_active Ceased
- 2009-05-18 JP JP2011508943A patent/JP2011520846A/ja active Pending
- 2009-05-18 RU RU2010151660/14A patent/RU2519750C2/ru not_active IP Right Cessation
- 2009-05-18 EP EP09745841A patent/EP2303274A1/en not_active Withdrawn
- 2009-05-18 CA CA2724206A patent/CA2724206A1/en not_active Abandoned
- 2009-05-18 NZ NZ589270A patent/NZ589270A/en not_active IP Right Cessation
- 2009-05-18 WO PCT/EP2009/055978 patent/WO2009138509A1/en active Application Filing
- 2009-05-18 MX MX2010012358A patent/MX2010012358A/es active IP Right Grant
-
2010
- 2010-11-16 IL IL209360A patent/IL209360A/en not_active IP Right Cessation
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2005131578A (ru) * | 2003-03-12 | 2006-01-27 | Дана-Фарбер Кэнсер Инститьют, Инк. (Us) | Аплидин для лечения множественной миеломы |
| WO2007052076A2 (en) * | 2005-10-31 | 2007-05-10 | Pharma Mar, S.A. | Formulations comprising jorumycin-, reni eramycin-, safracin- or saframycin-related compounds for treating proliferative diseases |
Non-Patent Citations (2)
| Title |
|---|
| TSUKAMOTO S. et al. Natural products inhibiting the ubiquitin-proteasome proteolytic pathway, a target for drug development. Curr Med Chem. 2006;13(7), реферат. * |
| РУКОВИЦИН О.А. Применение протеасомных ингибиторов при лечении больных множественной миеломой. Терапевтический архив 2006, 78, 10, с. 40-44. YANG Y et al. Proteasome inhibitor PS-341 induces growth arrest and apoptosis of non-small cell lung cancer cells via the JNK/c-Jun/AP-1 signaling. Cancer Sci. 2004 Feb;95(2):176-80. * |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2773740C2 (ru) * | 2020-10-09 | 2022-06-08 | Федеральное государственное бюджетное учреждение "Российский научно-исследовательский институт гематологии и трансфузиологии Федерального медико-биологического агентства" (ФГБУ РосНИИГТ ФМБА России) | Способ снижения токсических и инфекционных осложнений при лечении больных с множественной миеломой |
Also Published As
| Publication number | Publication date |
|---|---|
| CN102065865B (zh) | 2013-03-20 |
| AU2009248039A1 (en) | 2009-11-19 |
| IL209360A (en) | 2015-10-29 |
| MX2010012358A (es) | 2011-01-25 |
| CA2724206A1 (en) | 2009-11-19 |
| WO2009138509A1 (en) | 2009-11-19 |
| KR20110028454A (ko) | 2011-03-18 |
| EP2303274A1 (en) | 2011-04-06 |
| US20110076343A1 (en) | 2011-03-31 |
| US8435992B2 (en) | 2013-05-07 |
| RU2010151660A (ru) | 2012-06-27 |
| IL209360A0 (en) | 2011-01-31 |
| JP2011520846A (ja) | 2011-07-21 |
| CN102065865A (zh) | 2011-05-18 |
| AU2009248039B2 (en) | 2014-07-31 |
| NZ589270A (en) | 2011-12-22 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2519750C2 (ru) | Способы лечения множественной миеломы | |
| US20230404999A1 (en) | Combination therapy with an antitumor alkaloid | |
| JP6787792B2 (ja) | がんの処置のための併用治療 | |
| JP5075927B2 (ja) | 固形腫瘍を予防および治療するための方法および組成物 | |
| JP2012500180A5 (ru) | ||
| JP2014132009A5 (ru) | ||
| CN107714684A (zh) | 包含α‑甲基‑DL‑酪氨酸的药物组合物及其应用 | |
| US11759444B2 (en) | Methods for cancer and immunotherapy using prodrugs of glutamine analogs | |
| EP3458091A1 (en) | Combination therapy with notch and pd-1 or pd-l1 inhibitors | |
| EP4119557A1 (en) | Pharmaceutical combination comprising pyridino[1,2-a]pyrimidinone compound | |
| JP2023502742A (ja) | Alk2阻害剤及びjak2阻害剤を含む併用療法 | |
| US20120053559A1 (en) | Treatment of Proliferative Diseases with Epothilone Derivatives and Radiation | |
| US20220016118A1 (en) | Combination of a mcl-1 inhibitor and midostaurin, uses and pharmaceutical compositions thereof | |
| CN108703968B (zh) | 左旋千金藤啶碱用于抑制或治疗转移性乳腺癌的用途 | |
| WO2021023291A1 (zh) | 原黄素在肺癌治疗中的应用 | |
| WO2020242910A1 (en) | Compositions and methods for treating cancer | |
| TWI843217B (zh) | 一種藥物組合及其應用 | |
| US20230040125A1 (en) | Targeting the intrinsic apoptotic machinery in glioblastoma | |
| US20210128683A1 (en) | Pharmaceutical compositions and use thereof for relieving resistance due to cancer chemotherapy and enhancing effect of cancer chemotherapy | |
| JP2009108058A (ja) | 抗リンパ腫組成物および方法 | |
| WO2023118062A1 (en) | Combination of cisplatin and elimusertib for the treatment of pediatric liver cancers | |
| US20230132982A1 (en) | Use of pyrido[1,2-a]pyrimidinone compound in treating lymphoma |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| MM4A | The patent is invalid due to non-payment of fees |
Effective date: 20170519 |