RU2451031C2 - Антитела к эфрину в2 и способы их применения - Google Patents
Антитела к эфрину в2 и способы их применения Download PDFInfo
- Publication number
- RU2451031C2 RU2451031C2 RU2008134117/10A RU2008134117A RU2451031C2 RU 2451031 C2 RU2451031 C2 RU 2451031C2 RU 2008134117/10 A RU2008134117/10 A RU 2008134117/10A RU 2008134117 A RU2008134117 A RU 2008134117A RU 2451031 C2 RU2451031 C2 RU 2451031C2
- Authority
- RU
- Russia
- Prior art keywords
- antibody
- antibodies
- cells
- sequence
- efrin
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/18—Drugs for disorders of the alimentary tract or the digestive system for pancreatic disorders, e.g. pancreatic enzymes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/12—Drugs for disorders of the urinary system of the kidneys
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
- A61P15/06—Antiabortive agents; Labour repressants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
- A61P15/08—Drugs for genital or sexual disorders; Contraceptives for gonadal disorders or for enhancing fertility, e.g. inducers of ovulation or of spermatogenesis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/06—Antipsoriatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/08—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
- A61P21/04—Drugs for disorders of the muscular or neuromuscular system for myasthenia gravis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/02—Drugs for disorders of the nervous system for peripheral neuropathies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/08—Antiepileptics; Anticonvulsants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
- A61P25/16—Anti-Parkinson drugs
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
- A61P27/06—Antiglaucoma agents or miotics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/16—Otologicals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/04—Antineoplastic agents specific for metastasis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/06—Immunosuppressants, e.g. drugs for graft rejection
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P5/00—Drugs for disorders of the endocrine system
- A61P5/14—Drugs for disorders of the endocrine system of the thyroid hormones, e.g. T3, T4
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/08—Vasodilators for multiple indications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/12—Antihypertensives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/14—Vasoprotectives; Antihaemorrhoidals; Drugs for varicose therapy; Capillary stabilisers
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/22—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against growth factors ; against growth regulators
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2866—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against receptors for cytokines, lymphokines, interferons
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/30—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants from tumour cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/24—Immunoglobulins specific features characterized by taxonomic origin containing regions, domains or residues from different species, e.g. chimeric, humanized or veneered
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/565—Complementarity determining region [CDR]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/73—Inducing cell death, e.g. apoptosis, necrosis or inhibition of cell proliferation
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/76—Antagonist effect on antigen, e.g. neutralization or inhibition of binding
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/92—Affinity (KD), association rate (Ka), dissociation rate (Kd) or EC50 value
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Immunology (AREA)
- Neurology (AREA)
- Neurosurgery (AREA)
- Biomedical Technology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Molecular Biology (AREA)
- Genetics & Genomics (AREA)
- Biophysics (AREA)
- Biochemistry (AREA)
- Diabetes (AREA)
- Physical Education & Sports Medicine (AREA)
- Endocrinology (AREA)
- Cardiology (AREA)
- Heart & Thoracic Surgery (AREA)
- Reproductive Health (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Rheumatology (AREA)
- Ophthalmology & Optometry (AREA)
- Oncology (AREA)
- Hematology (AREA)
- Psychology (AREA)
- Vascular Medicine (AREA)
- Pregnancy & Childbirth (AREA)
- Gynecology & Obstetrics (AREA)
- Dermatology (AREA)
Abstract
Изобретение относится к биотехнологии и представляет собой антитела к эфрину В2. Предложены полинуклеотид, кодирующий антитело, вектор экспрессии, клетка-хозяин, композиции, содержащие антитело, а также способ получения антитела и способы применения антитела. Изобретение может использоваться для получения терапевтических и диагностических средств для применения и выявления патологических состояний, связанных с экспрессией и/или активностью проводящих путей лиганда эфрина В2. 11 н. и 16 з.п. ф-лы, 10 ил., 3 табл., 6 пр.
Description
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Данной заявкой испрашивается приоритет согласно 35 USC §119 по отношению к предварительной патентной заявке США № 60/760891, зарегистрированной 20 января 2006 г., полное содержание которой включено в данное описание посредством ссылки.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится в основном к областям молекулярной биологии. Более конкретно, изобретение относится к антителам к эфрину В2 и способам их применения.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Развитие системы кровоснабжения является основным требованием для многих физиологических и патологических процессов. Активно растущие ткани, такие как эмбрионы и опухоли, требуют соответствующей системы кровоснабжения. Потребность в этом удовлетворяется за счет продуцирования проангиогенных факторов, которые стимулируют образование новых кровеносных сосудов в результате процесса, называемого ангиогенезом. Образование сосуда представляет собой сложный, но регулярный биологический процесс, включающий все или многие из следующих стадий: a) эндотелиальные клетки (EC) пролиферируют из существующих ECs или дифференцируют из клеток-предшественников; b) EC мигрируют и соединяются с образованием тяжеобразных структур; c) сосудистые тяжи затем претерпевают тубулогенез, образуя сосуды с внутренним просветом; d) существующие тяжи или сосуды выпускают отростки, дающие начало вторичным сосудам; e) исходное сосудистое сплетение претерпевает дальнейшее ремоделирование и реконструирование и f) периэндотелиальные клетки привлекаются для заключения в оболочку эндотелиальных трубок, обеспечивая сосудам поддержку и модуляторные функции; такие клетки включают перициты для мелких капилляров, клетки гладкой мышцы для более крупных сосудов и миокардиальные клетки в сердце. Hanahan, Science 277:48-50 (1997); Hogan & Kolodziej, Nat. Rev. Genet. 3:513-23 (2002); Lubarsky & Krasnow, Cell 112:19-28 (2003).
В настоящее время точно установлено, что ангиогенез вовлечен в патогенез множества заболеваний. В их число входят солидные опухоли и метастазы, атеросклероз, ретролентальная фиброплазия, гемангиома, хроническое воспаление, внутриглазные неоваскулярные заболевания, такие как пролиферативные ретинопатии, например диабетическая ретинопатия, старческая дегенерация желтого пятна (AMD), неоваскулярная глаукома, иммунное отторжение трансплантированной ткани роговицы и других тканей, ревматоидный артрит и псориаз. Folkman et al., J. Biol. Chem. 267:10931-34 (1992); Klagsbrun et al., Annu. Rev. Physiol. 53:217-39 (1991) и Garner A., «Vascular diseases» In: Pathobiology of Ocular Disease. A Dynamic Approach, Garner A., Klintworth GK, eds., 2nd Edition (Marcel Dekker, NY, 1994), p. 1625-1710.
В случае опухолевого роста ангиогенез очевидно является ключевым фактором для перехода от гиперплазии к неоплазии и для обеспечения питания для роста и метастазирования опухоли. Folkman et al., Nature 339:58 (1989). Неоваскуляризация позволяет опухолевым клеткам получить ростовое преимущество и пролиферативную автономию по сравнению с нормальными клетками. Опухоль обычно начинается с одной аберрантной клетки, которая может пролиферировать только до размера в несколько кубических миллиметров из-за удаленности от доступного капиллярного ложа, и она может оставаться «дремлющей» без дальнейшего роста и распространения в течение длительного периода времени. Некоторые опухолевые клетки затем переключаются на ангиогенный фенотип для активирования эндотелиальных клеток, которые пролиферируют и созревают в новые капиллярные кровеносные сосуды. Эти заново образованные кровеносные сосуды создают условия не только для дальнейшего роста первичной опухоли, но также и для распространения и реколонизации метастатических опухолевых клеток. Соответственно, наблюдали корреляцию между плотностью микрососудов в опухолевых срезах и выживаемостью пациентов с раком молочной железы, а также в случае с некоторыми другими опухолями. Weidner et al., N. Engl. J. Med. 324:1-6 (1991); Horak et al., Lancet 340:1120-24 (1992); Macchiarini et al., Lancet 340:145-46 (1992). Точные механизмы, контролирующие ангиогенное переключение, до конца не выяснены, однако считается, что неоваскуляризация опухолевого образования происходит в результате прямого баланса совокупности стимуляторов и ингибиторов ангиогенеза (Folkman, Nat. Med. 1(1):27-31 (1995)).
Процесс развития сосудистой системы строго регулируется. В настоящее время известно, что значительное количество молекул, в основном секретируемых факторов, продуцируемых окружающими клетками, регулирует дифференциацию, пролиферацию, миграцию и объединение EC в тяжеобразные структуры. Например, было установлено, что фактор роста эндотелия сосудов (VEGF) является ключевым фактором, вовлеченным в стимуляцию ангиогенеза и в индуцирование проницаемости сосудов. Ferrara et al., Endocr. Rev. 18:4-25 (1997). Тот факт, что утрата даже одной аллели VEGF приводит к эмбриональной летальности, указывает на незаменимую роль данного фактора в развитии и дифференциации кровеносной системы. Более того, было показано, что VEGF является ключевым медиатором неоваскуляризации, связанной с опухолями и внутриглазными болезнями. Ferrara et al., Endocr. Rev., выше. Большинство изученных опухолей человека избыточно экспрессируют мРНК VEGF. Berkman et al., J. Clin. Invest. 91:153-59 (1993); Brown et al., Human Pathol. 26:86-91 (1995); Brown et al., Cancer Res. 53:4727-35 (1993); Mattern et al., Brit. J. Cancer 73:931-34 (1996); Dvorak et al., Am. J. Pathol. 146:1029-39 (1995).
Кроме того, уровни концентрации VEGF в глазных жидкостях тесно коррелируют с наличием активной пролиферации кровеносных сосудов у пациентов с диабетической или другими связанными с ишемией ретинопатиями. Aiello et al., N. Engl. J. Med. 331:1480-87 (1994). Более того, исследования показали, что VEGF локализован в хориоидальных неоваскулярных мембранах у пациентов, страдающих от AMD. Lopez et al., Invest. Ophthalmol. Vis. Sci. 37:855-68 (1996).
Нейтрализующие антитела к VEGF подавляют рост множества опухолевых клеточных линий человека в голых мышах (Kim et al., Nature 362:841-44 (1993); Warren et al., J. Clin. Invest. 95:1789-97 (1995); Borgström et al., Cancer Res. 56:4032-39 (1996); Melnyk et al., Cancer Res. 56:921-24 (1996)), а также ингибируют внутриглазной ангиогенез в моделях ишемических ретинальных заболеваний (Adamis et al., Arch. Ophthalmol. 114:66-71 (1996)). Вследствие этого моноклональные антитела к VEGF или другие ингибиторы активности VEGF являются перспективными кандидатами на роль средств для лечения опухолей и различных внутриглазных неоваскулярных заболеваний. Подобные антитела описаны, например, в EP 817648, опубликованном 14 января 1998 г., а также в WO 98/45331 и WO 98/45332, оба опубликованы 15 октября 1998 г. Одно антитело к VEGF, бевацизумаб, получило одобрение FDA для использования в сочетании с режимом химиотерапии при лечении метастатического рака ободочной и прямой кишки (CRC). Бевацизумаб также в настоящее время проходит апробацию во многих клинических испытаниях, направленных на лечение различных симптомов рака.
Лиганд эфрин B2 («эфрин-B2» или «эфрин B2») является членом семейства эфриновых лигандов, которое представляет собой большое семейство тирозинкиназных рецепторов в геноме человека (обзор в Dodelet, Oncogene, 19:5614-5619, 2000). Человеческие тирозинкиназы эфринового лиганда подразделяют в соответствии с идентичностью последовательности на класс A и класс B с соответствующими рецепторами A-типа и B-типа, называемыми Ephs или Eph-рецепторами. Передача сигнала может происходить прямым способом, при котором рецепторная тирозинкиназа активируется лигандом, и обратным способом, при котором трансмембранные лиганды эфрина B активируются путем взаимодействия с рецепторами. Взаимодействия Eph-рецептор-лиганд играют роль в широком диапазоне биологических функций, включая управление аксонами, образование границ тканей, образование и развитие сосудов и клеточную подвижность (Kullander et al. Nat. Rev. Mol. Cell. Biol., 3:475-486, 2002; Cheng et al. Cytokine Growth Factor Rev., 13:75-85, 2002; Coulthard et al. Int. J. Dev. Biol., 46:375-384, 2002).
Очевидно, что сохраняется потребность в средствах, которые имеют клинические показатели, оптимальные для их разработки в качестве терапевтических средств. Изобретение, приведенное в данном описании, отвечает данной потребности и обеспечивает другие преимущества.
Полное содержание всех литературных источников, упомянутых в данном описании, включая патентные заявки и публикации, включено в данное описание посредством ссылок.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение частично основано на выявлении различных средств, связывающих эфрин B2 (таких, как антитела и их фрагменты). Эфрин B2 представляет собой важную и полезную терапевтическую мишень, и изобретение относится к композициям и способам, основанным на связывании эфрина B2. Средства по изобретению, связывающие эфрин B2, как описано в данном документе, служат основой важных терапевтических и диагностических средств для применения в выявлении патологических состояний, связанных с экспрессией и/или активностью проводящих путей лиганда эфрина B2. Соответственно, изобретение относится к способам, композициям, наборам и изделиям, относящимся к связыванию эфрина B2.
Настоящее изобретение относится к антителам, которые связывают (таким, которые специфически связывают) эфрин B2.
В одном аспекте изобретение относится к выделенному антителу к эфрину B2, где полноразмерная IgG-форма антитела специфически связывает человеческий эфрин B2 с аффинностью связывания, равной 30 пм или лучшей. Как хорошо известно в данной области, аффинность связывания лиганда с его рецептором можно определять при помощи любого из множества аналитических методов и выражать в единицах множества количественных величин. Соответственно, в одном варианте осуществления аффинность связывания выражена в значениях Kd и отражает истинную аффинность связывания (например, с минимизированными эффектами авидности). Как правило и предпочтительно, аффинность связывания измеряют in vitro, либо в бесклеточной, либо в связанной с клетками среде. Любой из множества аналитических методов, известных в данной области, включая те, что описаны в данном документе, можно использовать для проведения измерений аффинности связывания, включая, например, Biacore, радиоиммуноанализ (RIA) и ELISA.
В одном аспекте изобретение относится к выделенному антителу, которое связывает область эфрина B2, связывающую Eph-рецептор (такой, как EphB1, EphB2 и/или EphB3).
В одном аспекте изобретение относится к выделенному антителу, которое связывает полипептид, содержащий, состоящий из или состоящий в основном из внеклеточного домена эфрина B2.
В одном аспекте изобретение относится к выделенному антителу к эфрину B2, которое конкурирует с Eph-рецептором (таким, как EphB1, EphB2, EphB3) за связывание эфрина B2.
В одном аспекте изобретение относится к выделенному антителу к эфрину B2, которое ингибирует, снижает и/или блокирует активность эфрина B2. В некоторых вариантах осуществления ингибируется, снижается и/или блокируется аутофосфорилирование эфрина B2.
В одном аспекте антитело к эфрину В2 по изобретению содержит:
(a) по меньшей мере, одну, две, три, четыре или пять последовательностей гипервариабельной области (HVR), выбранных из группы, состоящей из:
(i) HVR-L1, включающей последовательность A1-A11, где A1-A11 представляет собой RASQDVSTAVA (SEQ ID №:6),
(ii) HVR-L2, включающей последовательность B1-B7, где B1-B7 представляет собой SASFLYS (SEQ ID №:8),
(iii) HVR-L3, включающей последовательность C1-C9, где C1-C9 представляет собой EQTDSTPPT (SEQ ID №:12),
(iv) HVR-H1, включающей последовательность D1-D10, где D1-D10 представляет собой GFTVSSGWIH (SEQ ID №:2),
(v) HVR-H2, включающей последовательность E1-E18, где E1-E18 представляет собой AVIFHNKGGTDYADSVKG (SEQ ID №:4) и
(vi) HVR-H3, включающей последовательность F1-F14, где F1-F14 представляет собой ARTSAWAQLGAMDY (SEQ ID №:5); и
(b) по меньшей мере, одну вариантную HVR, где вариантная последовательность HVR содержит модификацию, по меньшей мере, одного остатка в последовательности, представленной в SEQ ID №:1-12.
В одном аспекте изобретение относится к антителу, содержащему одну, две, три, четыре, пять или шесть HVR, где каждая HVR содержит, состоит из или состоит в основном из последовательности, выбранной из группы, состоящей из SEQ ID №: 1-12, и где SEQ ID №:6 или 7 соответствуют HVR-L1, SEQ ID №:8 или 9 соответствуют HVR-L2, SEQ ID №:10, 11 или 12 соответствуют HVR-L3, SEQ ID №:1 или 2 соответствуют HVR-H1, SEQ ID №:3 или 4 соответствуют HVR-H2 и SEQ ID №:5 соответствует HVR-H3.
В одном варианте осуществления антитело по изобретению содержит HVR-L1, HVR-L2, HVR-L3, HVR-H1, HVR-H2 и HVR-H3, где каждая по порядку включает SEQ ID №:6, 8, 10, 1, 3, 5.
В одном варианте осуществления антитело по изобретению содержит HVR-L1, HVR-L2, HVR-L3, HVR-H1, HVR-H2 и HVR-H3, где каждая по порядку включает SEQ ID №:7, 9, 11, 1, 3, 5.
В одном варианте осуществления антитело по изобретению содержит HVR-L1, HVR-L2, HVR-L3, HVR-H1, HVR-H2 и HVR-H3, где каждая по порядку включает SEQ ID №:6, 8, 12, 2, 4, 5.
Вариантные HVR в антителе по изобретению могут иметь модификации одного или более (например, двух, трех, четырех, пяти или более) остатков в составе HVR.
В одном варианте осуществления вариант HVR-L1 содержит 1-4 (1, 2, 3 или 4) замены в следующих положениях в любом их сочетании: A7 (S или D); A8 (T или S); A9 (A или S) и A10 (V или L).
В одном варианте осуществления вариант HVR-L2 содержит 1-3 (1, 2 или 3) замены в следующих положениях в любом их сочетании: B1 (S или A); B4 (F или N) и B6 (Y или E).
В одном варианте осуществления вариант HVR-L3 содержит 1-6 (1, 2, 3, 4, 5 или 6) замен в следующих положениях в любом их сочетании: C1 (Q или E); C3 (S или T); C4 (Y или D); C5 (T, D или S); C6 (T или N) и C8 (P или F).
В одном варианте осуществления вариант HVR-H1 содержит 1-4 (1, 2, 3 или 4) замены в следующих положениях в любом их сочетании: D4 (I или V); D5 (T или S); D6 (G или S) и D7 (S или G).
В одном варианте осуществления вариант HVR-H2 содержит 1-4 (1, 2, 3 или 4) замены в следующих положениях в любом их сочетании: E4 (Y или F); E5 (P или H); E7 (N или K) и E9 (A или G).
В одном варианте осуществления вариант HVR-H3 содержит 1-14 замен в следующих положениях: F1 (A); F2 (R); F3 (T); F4 (S); F5 (A); F6 (W); F7 (A); F8 (Q); F9 (L); F10 (G); F11 (A); F12 (M); F13 (D) и F14 (Y). Буква(ы) в скобках после каждого положения обозначает иллюстративную аминокислоту для замещения (то есть замены); как является очевидным для специалиста в данной области, возможность использования других аминокислот в качестве аминокислот для замены в контексте данного описания можно осуществить в рабочем порядке, используя методики, известные в данной области и/или описанные в данном документе.
В одном аспекте изобретение относится к антителу, содержащему область HVR-H1, включающую последовательность SEQ ID №:1 или 2. В одном аспекте изобретение относится к антителу, содержащему область HVR-H2, включающую последовательность SEQ ID №:3 или 4. В одном аспекте изобретение относится к антителу, содержащему область HVR-H3, включающую последовательность SEQ ID №:5. В одном варианте осуществления изобретение относится к антителу, содержащему область HVR-L1, включающую последовательность SEQ ID №:6 или 7. В одном варианте осуществления изобретение относится к антителу, содержащему область HVR-L2, включающую последовательность SEQ ID №:8 или 9. В одном варианте осуществления изобретение относится к антителу, содержащему область HVR-L3, включающую последовательность SEQ ID №:10, 11 или 12.
В одном аспекте изобретение относится к антителу, содержащему, по меньшей мере, одну, по меньшей мере, две или все три из следующих:
(i) последовательность HVR-H1, включающую последовательность SEQ ID №:2;
(ii) последовательность HVR-H2, включающую последовательность SEQ ID №:4;
(iii) последовательность HVR-H3, включающую последовательность SEQ ID №:5.
В одном аспекте изобретение относится к антителу, содержащему, по меньшей мере, одну, по меньшей мере, две или все три из следующих:
(i) последовательность HVR-L1, включающую последовательность SEQ ID №:6;
(ii) последовательность HVR-L2, включающую последовательность SEQ ID №:8;
(iii) последовательность HVR-L3, включающую последовательность SEQ ID №:12.
Аминокислотные последовательности SEQ ID №:1-12 пронумерованы, принимая во внимание отдельные HVR (то есть H1, H2 или H3), как указано на фигуре 1, нумерация соответствует системе нумерации Kabat, как описано ниже.
В одном аспекте изобретение относится к антителам, содержащим последовательности HVR тяжелой цепи, как указано на фигуре 1.
В одном аспекте изобретение относится к антителам, содержащим последовательности HVR легкой цепи, как указано на фигуре 1.
Некоторые варианты осуществления антител по изобретению содержат вариабельный домен легкой цепи гуманизированного антитела 4D5 (huMAb4D5-8) (HERCEPTIN®, Genentech, Inc., South San Francisco, CA, USA) (также упомянутого в патенте США № 6407213 и в Lee et al., J. Mol. Biol. (2004), 340(5):1073-93), как представлено ниже в SEQ ID №:13.
1 Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Asn Thr Ala Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Tyr Thr Thr Pro Pro Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys 107 (SEQ ID №:13) (остатки HVR подчеркнуты).
В одном варианте осуществления последовательность вариабельного домена легкой цепи huMAb4D5-8 модифицирована по одному или более положениям 30, 66 и 91 (Asn, Arg и His соответственно, как указано выше жирным шрифтом/курсивом). В одном варианте осуществления модифицированная последовательность huMAb4D5-8 содержит Ser в положении 30, Gly в положении 66 и/или Ser в положении 91. Соответственно, в одном варианте осуществления антитело по изобретению содержит вариабельный домен легкой цепи, включающий последовательность, представленную ниже в SEQ ID №:14:
1 Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Ser Thr Ala Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr Thr Thr Pro Pro Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys 107 (SEQ ID №:14) (остатки HVR подчеркнуты).
Замененные остатки относительно huMAb4D5-8 указаны выше жирным шрифтом/курсивом.
Антитела по изобретению могут содержать любую подходящую каркасную последовательность вариабельного домена, при условии что связывающая активность в отношении эфрина B2 в основном сохраняется. Например, в некоторых вариантах осуществления антитела по изобретению содержат каркасную консенсусную последовательность тяжелой цепи подгруппы III человека. В одном варианте осуществления данных антител каркасная консенсусная последовательность содержит замену в положении 71, 73 и/или 78. В некоторых вариантах осуществления данных антител положение 71 представляет собой A, 73 представляет собой T и/или 78 представляет собой A. В одном варианте осуществления данные антитела содержат каркасные последовательности вариабельного домена тяжелой цепи huMAb4D5-8 (HERCEPTIN®, Genentech, Inc., South San Francisco, CA, USA) (также упомянутого в патентах США № 6407213 и 5821337, а также в Lee et al., J. Mol. Biol. (2004), 340(5): 1073-93). В одном варианте осуществления данные антитела дополнительно содержат каркасную консенсусную последовательность легкой цепи κI человека. В одном варианте осуществления данные антитела содержат последовательности HVR легкой цепи huMAb4D5-8, как описано в патентах США № 6407213 и 5821337). В одном варианте осуществления данные антитела содержат последовательности вариабельного домена легкой цепи huMAb4D5-8 (HERCEPTIN®, Genentech, Inc., South San Francisco, CA, USA) (также упомянутого в патентах США № 6407213 и 5821337, а также в Lee et al., J. Mol. Biol. (2004), 340(5):1073-93).
В одном варианте осуществления антитело по изобретению содержит вариабельный домен тяжелой цепи, где каркасная последовательность включает последовательность SEQ ID №: 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36 и/или 37, а последовательности H1, H2 и H3 HVR включают SEQ ID №:2, 4 и/или 5 соответственно. В одном варианте осуществления антитело по изобретению содержит вариабельный домен легкой цепи, где каркасная последовательность включает последовательность SEQ ID №:38, 39, 40 и/или 41, а последовательности L1, L2 и L3 HVR включают SEQ ID №:6, 8 и/или 12 соответственно.
В одном варианте осуществления антитело по изобретению содержит вариабельный домен тяжелой цепи, где каркасная последовательность включает последовательность SEQ ID №:42, 43, 44, 8 и/или 45, а последовательности H1, H2 и H3 HVR включают SEQ ID №:1, 3 и/или 5 соответственно. В одном варианте осуществления антитело по изобретению содержит вариабельный домен легкой цепи, где каркасная последовательность включает последовательность SEQ ID №:15, 16, 17 и/или 18, а последовательности L1, L2 и L3 HVR включают SEQ ID №:6, 8 и/или 10 соответственно.
В одном варианте осуществления антитело по изобретению содержит вариабельный домен тяжелой цепи, где каркасная последовательность включает последовательность SEQ ID №:42, 43, 47 и/или 45, а последовательности H1, H2 и H3 HVR включают SEQ ID №:1, 3 и/или 5 соответственно. В одном варианте осуществления антитело по изобретению содержит вариабельный домен легкой цепи, где каркасная последовательность включает последовательность SEQ ID №:15, 16, 47 и/или 18, а последовательности L1, L2 и L3 HVR включают SEQ ID №:7, 9 и/или 11 соответственно.
В одном варианте осуществления проводят созревание аффинности антитела по изобретению, чтобы получить желаемую аффинность связывания мишени. В одном примере аффинно зрелое антитело по изобретению содержит замену в одном или большем количестве аминокислотных положений H29, H30, H31, H32, H52, H52a, H54, H56, L30, L31, L32, L33, L50, L53, L55, L89, L91, L92, L93, L94 и L96. В одном примере аффинно зрелое антитело по изобретению содержит одну или большее количество следующих замен: (a) в тяжелой цепи V29I, S30T, S31G, G32S, F52Y, H52aP, K54N и G56A или (b) в легкой цепи S30D, T31S, A32S, V33L, S50A, F53N, Y55E, E89Q, T91S, D92Y, S93D или T, T94N и P96F.
В одном варианте осуществления антитело по изобретению содержит вариабельный домен тяжелой цепи, включающий последовательность SEQ ID №:49. В одном варианте осуществления антитело по изобретению содержит вариабельный домен легкой цепи, включающий последовательность SEQ ID №:48. В одном варианте осуществления антитело по изобретению содержит вариабельный домен тяжелой цепи, включающий последовательность SEQ ID №:49, и вариабельный домен легкой цепи, включающий последовательность SEQ ID №:48.
В одном варианте осуществления антитело по изобретению содержит вариабельный домен тяжелой цепи, включающий последовательность SEQ ID №:51. В одном варианте осуществления антитело по изобретению содержит вариабельный домен легкой цепи, включающий последовательность SEQ ID №:50. В одном варианте осуществления антитело по изобретению содержит вариабельный домен тяжелой цепи, включающий последовательность SEQ ID №:51, и содержит вариабельный домен легкой цепи, включающий последовательность SEQ ID №:50.
В одном варианте осуществления антитело по изобретению содержит вариабельный домен тяжелой цепи, включающий последовательность SEQ ID №:53. В одном варианте осуществления антитело по изобретению содержит вариабельный домен легкой цепи, включающий последовательность SEQ ID №:52. В одном варианте осуществления антитело по изобретению содержит вариабельный домен тяжелой цепи, включающий последовательность SEQ ID №:53, и вариабельный домен легкой цепи, включающий последовательность SEQ ID №:52.
В одном аспекте изобретение относится к антителу, которое конкурирует с любым из вышеуказанных антител за связывание с эфрином B2. В одном аспекте изобретение относится к антителу, которое связывается с тем же самым или схожим эпитопом на эфрине B2, что и любое из вышеуказанных антител.
Как известно в данной области и как описано более подробно ниже в данном описании, аминокислотная положение/граница, определяющая размеры гипервариабельной области антитела, может варьировать в зависимости от контекста и различных определений, принятых в данной области (как описано ниже). Некоторые положения внутри вариабельного домена могут рассматриваться как гибридные гипервариабельные положения, поскольку данные положения могут считаться находящимися внутри гипервариабельной области по одному набору критериев, в то же время рассматриваться как находящиеся за пределами гипервариабельной области по другому набору критериев. Одно или большее количество данных положений можно также обнаружить в протяженных гипервариабельных областях (как дополнительно определено ниже).
В некоторых вариантах осуществления антитело представляет собой моноклональное антитело. В некоторых вариантах осуществления антитело представляет собой поликлональное антитело. В некоторых вариантах осуществления антитело выбирают из группы, состоящей из химерного антитела, аффинно зрелого антитела, гуманизированного антитела и человеческого антитела. В некоторых вариантах осуществления антитело представляет собой фрагмент антитела. В некоторых вариантах осуществления антитело представляет собой Fab, Fab', Fab'-SH, F(ab')2 или scFv.
В одном варианте осуществления антитело представляет собой химерное антитело, например антитело, содержащее антигенсвязывающие последовательности донора, отличного от человека, перенесенные в гетерологичную не принадлежащую человеку, человеческую или гуманизированную последовательность (например, последовательности каркаса и/или константного домена). В одном варианте осуществления донор, отличный от человека, представляет собой мышь. В одном варианте осуществления антигенсвязывающая последовательность является синтетической, например, полученной при помощи мутагенеза (например, скрининг фаговым дисплеем и так далее). В одном варианте осуществления химерное антитело по изобретению имеет мышиные V-области и человеческую C-область. В одном варианте осуществления V-область легкой цепи мыши является слитой с легкой цепью каппа человека. В одном варианте осуществления V-область тяжелой цепи мыши является слитой с C-областью IgG1 человека.
Гуманизированные антитела по изобретению включают такие, которые имеют аминокислотные замены в FR, а также аффинно зрелые варианты с изменениями в привнесенных CDR. Замещенные аминокислоты в CDR или FR не ограничиваются теми, что присутствуют в антителе донора или реципиента. В других вариантах осуществления антитела по изобретению дополнительно имеют изменения в аминокислотных остатках в Fc-области, что ведет к улучшенной эффекторной функции, включая усиленную функцию CDC и/или ADCC и B-клеточный лизис. Другие антитела по изобретению включают такие, которые имеют специфические изменения, повышающие стабильность. В других вариантах осуществления антитела по изобретению имеют изменения в аминокислотных остатках в Fc-области, что ведет к пониженной эффекторной функции, например пониженной функции CDC и/или ADCC и/или пониженному B-клеточному лизису. В некоторых вариантах осуществления антитела по изобретению характеризуются более слабым связыванием (таким, как отсутствие связывания) с человеческим фактором комплемента C1q и/или человеческим Fc-рецептором на естественных киллерных (NK) клетках. В некоторых вариантах осуществления антитела по изобретению характеризуются более слабым связыванием (таким, как отсутствие связывания) с человеческим FcγRI, FcγRIIA и/или FcγRIIIA. В некоторых вариантах осуществления антитела по изобретению относятся к IgG классу (например, IgG1 или IgG4) и содержат, по меньшей мере, одну мутацию в E233, L234, G236, D265, D270, N297, E318, K320, K322, A327, A330, P331 и/или P329 (система нумерации ЕС). В некоторых вариантах осуществления антитела содержат мутацию L234A/L235A или D265A/N297A.
В одном аспекте изобретение относится к анти-эфрин B2 полипептидам, содержащим любую из антигенсвязывающих последовательностей, представленных в данном описании, где анти-эфрин B2 полипептиды специфически связывают эфрин B2.
Антитела по изобретению связывают (а именно, специфически связывают) эфрин B2 и в некоторых вариантах изобретения могут модулировать один или более аспектов связанных с эфрином B2 эффектов, включая, но не ограничиваясь ими, активацию эфрина B2, молекулярную передачу сигнала в нисходящем направлении эфрином B2, активацию связывающего эфрин B2 Eph-рецептора (например, EphB1, EphB2 и/или EphB3), молекулярную передачу сигнала в нисходящем направлении связывающим эфрин B2 Eph-рецептором (например, EphB1, EphB2 и/или EphB3), нарушение связывания связывающего эфрин B2 Eph-рецептора (например, EphB1, EphB2 и/или EphB3) с эфрином B2, фосфорилирование эфрина B2 и/или мультимеризацию эфрина B2, и/или фосфорилирование связывающего эфрин B2 Eph-рецептора, и/или нарушение любого биологически значимого проводящего пути эфрина B2 и/или связывающего эфрин B2 Eph-рецептора (например, EphB1, EphB2 и/или EphB3), и/или лечение и/или профилактику опухоли, пролиферативного клеточного заболевания или рака; и/или лечение или профилактику заболевания, связанного с экспрессией и/или активностью эфрина B2 (а именно, повышенной экспрессией и/или активностью эфрина B2). В некоторых вариантах осуществления антитело по изобретению специфически связывается с эфрином B2. В некоторых вариантах осуществления антитело специфически связывается с внеклеточным доменом эфрина B2 (ECD). В некоторых вариантах осуществления антитело специфически связывается с полипептидом, состоящим из или в основном состоящим из внеклеточного домена эфрина B2. В некоторых вариантах осуществления антитело специфически связывает эфрин B2 с Kd, равной 30 пм или сильнее. В некоторых вариантах осуществления антитело по изобретению снижает, ингибирует и/или блокирует активность эфрина B2 in vivo и/или in vitro. В некоторых вариантах осуществления антитело снижает, ингибирует и/или блокирует аутофосфорилирование эфрина B2. В некоторых вариантах осуществления антитело конкурирует за связывание (уменьшает и/или блокирует) со связывающим эфрин B2 Eph-рецептором (например, EphB1, EphB2 и/или EphB3).
В одном аспекте изобретение относится к использованию антитела по изобретению для получения лекарственного средства для терапевтического и/или профилактического лечения нарушения, такого как рак, опухоль и/или пролиферативное клеточное нарушение. В некоторых вариантах осуществления нарушение представляет собой невропатию или нейродегенеративное заболевание.
В одном аспекте изобретение относится к композициям, содержащим одно или более антител по изобретению и носитель. В одном варианте осуществления носитель является фармацевтически приемлемым.
В одном аспекте изобретение относится к нуклеиновым кислотам, кодирующим антитело к эфрину В2 по изобретению.
В одном аспекте изобретение относится к векторам, содержащим нуклеиновую кислоту по изобретению.
В одном аспекте изобретение относится к композициям, содержащим одну или более нуклеиновых кислот по изобретению и носитель. В одном варианте осуществления носитель является фармацевтически приемлемым.
В одном аспекте изобретение относится к клеткам-хозяевам, содержащим нуклеиновую кислоту или вектор по изобретению. Вектор может быть любого типа, например рекомбинантный вектор, такой как вектор экспрессии. Можно использовать любые из множества клеток-хозяев. В одном варианте осуществления клетка-хозяин представляет собой прокариотическую клетку, например E. coli. В одном варианте осуществления клетка-хозяин представляет собой эукариотическую клетку, например клетку млекопитающего, такую как клетка яичника китайского хомячка (CHO).
В одном аспекте изобретение относится к способам получения антитела по изобретению. Например, изобретение относится к способам получения антитела к эфрину В2 (которое, как определено в данном описании, включает полноразмерное антитело и его фрагменты), указанный способ включает экспрессирование в подходящей клетке-хозяине рекомбинантного вектора по изобретению, кодирующего указанное антитело (или его фрагмент), и извлечение указанного антитела.
В одном аспекте изобретение относится к изделию, представляющему собой контейнер, и композиции, заключенной в контейнере, где композиция содержит одно или более антител к эфрину B2 по изобретению. В одном варианте осуществления композиция содержит нуклеиновую кислоту по изобретению. В одном варианте осуществления композиция, содержащая антитело, дополнительно содержит носитель, который в некоторых вариантах осуществления является фармацевтически приемлемым. В одном варианте осуществления изделие по изобретению дополнительно включает инструкции по введению композиции (например, антитела) субъекту (такие, как инструкции для любого из способов, описанных в данном документе).
В одном аспекте изобретение относится к набору, включающему первый контейнер, содержащий композицию, содержащую одно или более антител к эфрину B2 по изобретению, и второй контейнер, содержащий буферный раствор. В одном варианте осуществления буферный раствор является фармацевтически приемлемым. В одном варианте осуществления композиция, содержащая антитело, дополнительно содержит носитель, который в некоторых вариантах осуществления является фармацевтически приемлемым. В одном варианте осуществления набор дополнительно включает инструкции по введению композиции (например, антитела) субъекту.
В одном аспекте изобретение относится к использованию антитела к эфрину В2 по изобретению для создания лекарственного средства для терапевтического и/или профилактического лечения нарушения, такого как рак, опухоль и/или пролиферативное клеточное нарушение. В некоторых вариантах осуществления нарушение представляет собой невропатию или нейродегенеративное заболевание. В некоторых вариантах осуществления нарушение представляет собой патологическое состояние, связанное с ангиогенезом.
В одном аспекте изобретение относится к использованию антитела по изобретению для создания лекарственного средства для ингибирования ангиогенеза.
В одном аспекте изобретение относится к использованию нуклеиновой кислоты по изобретению для создания лекарственного средства для терапевтического и/или профилактического лечения нарушения, такого как рак, опухоль и/или пролиферативное клеточное нарушение. В некоторых вариантах осуществления нарушение представляет собой невропатию или нейродегенеративное заболевание. В некоторых вариантах осуществления нарушение представляет собой патологическое состояние, связанное с ангиогенезом.
В одном аспекте изобретение относится к использованию вектора экспрессии по изобретению для создания лекарственного средства для терапевтического и/или профилактического лечения нарушения, такого как рак, опухоль и/или пролиферативное клеточное нарушение. В некоторых вариантах осуществления нарушение представляет собой невропатию или нейродегенеративное заболевание. В некоторых вариантах осуществления нарушение представляет собой патологическое состояние, связанное с ангиогенезом.
В одном аспекте изобретение относится к использованию клетки-хозяина по изобретению для создания лекарственного средства для терапевтического и/или профилактического лечения нарушения, такого как рак, опухоль и/или пролиферативное клеточное нарушение. В некоторых вариантах осуществления нарушение представляет собой невропатию или нейродегенеративное заболевание. В некоторых вариантах осуществления нарушение представляет собой патологическое состояние, связанное с ангиогенезом.
В одном аспекте изобретение относится к использованию изделия по изобретению для создания лекарственного средства для терапевтического и/или профилактического лечения нарушения, такого как рак, опухоль и/или пролиферативное клеточное нарушение. В некоторых вариантах осуществления нарушение представляет собой невропатию или нейродегенеративное заболевание.
В одном аспекте изобретение относится к использованию набора по изобретению для создания лекарственного средства для терапевтического и/или профилактического лечения нарушения, такого как рак, опухоль и/или пролиферативное клеточное нарушение. В некоторых вариантах осуществления нарушение представляет собой невропатию или нейродегенеративное заболевание. В некоторых вариантах осуществления нарушение представляет собой патологическое состояние, связанное с ангиогенезом.
Изобретение относится к способам и композициям, полезным для модулирования болезненных состояний, связанных с экспрессией и/или активностью эфрина B2, такой как повышенная или пониженная экспрессия и/или активность либо нежелательная экспрессия и/или активность.
В одном аспекте изобретение относится к способам лечения или профилактики опухоли, рака и/или пролиферативного клеточного нарушения, связанного с повышенной экспрессией и/или активностью эфрина B2, где способы включают введение эффективного количества антитела к эфрину В2 субъекту, нуждающемуся в подобном лечении.
В одном аспекте изобретение относится к способам лизиса клетки (такой, как раковая или опухолевая клетка), где способы включают введение эффективного количества антитела к эфрину В2 субъекту, нуждающемуся в подобном лечении.
В одном аспекте изобретение относится к способам уменьшения, ингибирования, блокирования или предотвращения роста опухоли или рака, где способы включают введение эффективного количества антитела к эфрину В2 субъекту, нуждающемуся в подобном лечении.
В одном аспекте изобретение относится к способам лечения или профилактики невропатии или нейродегенеративного заболевания или восстановления поврежденной нервной клетки, где способы включают введение эффективного количества антитела к эфрину В2 субъекту, нуждающемуся в подобном лечении.
В одном аспекте изобретение относится к способам стимулирования развития, пролиферации, стабилизации или регенерации нейронов, где способы включают введение эффективного количества антитела к эфрину В2 субъекту, нуждающемуся в подобном лечении.
В одном аспекте изобретение относится к способам ингибирования ангиогенеза, включающим введение эффективного количества антитела к эфрину В2 субъекту, нуждающемуся в подобном лечении. В некоторых вариантах осуществления зоной ангиогенеза является опухоль или рак.
В одном аспекте изобретение относится к способам лечения патологического состояния, связанного с ангиогенезом, включающим введение эффективного количества антитела к эфрину В2 субъекту, нуждающемуся в подобном лечении. В некоторых вариантах осуществления патологическим состоянием, связанным с ангиогенезом, является опухоль, рак и/или пролиферативное клеточное нарушение. В некоторых вариантах осуществления патологическим состоянием, связанным с ангиогенезом, является внутриглазное неоваскулярное заболевание.
Способы по изобретению можно применять, чтобы воздействовать на любое подходящее патологическое состояние. Примеры нарушений приведены в данном описании и включают рак, выбранный из группы, состоящей из мелкоклеточного рака легкого, нейробластом, меланомы, рака молочной железы, рака желудка, колоректального рака (CRC) и печеночно-клеточного рака.
В одном варианте осуществления клетка, являющаяся мишенью в способе по изобретению, представляет собой раковую клетку. Например, раковая клетка может являться клеткой, выбранной из группы, состоящей из клетки рака молочной железы, клетки колоректального рака, клетки рака легкого, клетки папиллярной карциномы, клетки рака толстой кишки, клетки рака поджелудочной железы, клетки рака яичников, клетки рака шейки матки, клетки рака центральной нервной системы, клетки остеогенной саркомы, клетки почечно-клеточного рака, клетки печеночно-клеточного рака, клетки рака мочевого пузыря, клетки рака желудка, клетки плоскоклеточной карциномы головы и шеи, клетки меланомы, лейкозной клетки и клетки аденомы толстой кишки. В одном варианте осуществления клетка, являющаяся мишенью в способе по изобретению, представляет собой гиперпролиферативную и/или гиперплазированную клетку. В одном варианте осуществления клетка, являющаяся мишенью в способе по изобретению, представляет собой дисплазированную клетку. В еще одном варианте осуществления клетка, являющаяся мишенью в способе по изобретению, представляет собой метастатическую клетку.
Способы по изобретению могут дополнительно включать вспомогательные этапы воздействия. Например, в одном варианте осуществления способ дополнительно включает этап, во время которого целевая клетка и/или ткань (например, раковая клетка) подвергается воздействию радиации или химиотерапевтического средства.
В одном аспекте изобретение относится к способам, включающим введение эффективного количества антитела к эфрину В2 в сочетании с эффективным количеством другого терапевтического средства (такого, как антиангиогенное средство). Например, антитело(ла) к эфрину В2 используют в сочетаниях с противораковым средством или антиангиогенным средством для лечения различных неопластических или не-неопластических состояний. В одном варианте осуществления неопластическое или не-неопластическое состояние представляет собой патологическое состояние, связанное с ангиогенезом. В некоторых вариантах осуществления другим терапевтическим средством является антиангиогенное средство, антинеопластическое средство и/или химиотерапевтическое средство.
Антитело к эфрину В2 можно вводить периодически или в сочетании с другим терапевтическим средством, которое эффективно для этих целей, либо в составе одной и той же композиции, либо в виде разных композиций. Введение антитела к эфрину В2 и другого терапевтического средства (например, противоракового средства, антиангиогенного средства) можно выполнять одновременно, например, в виде одной композиции или в виде двух или более разных композиций, используя тот же самый или различные пути введения. Альтернативно или дополнительно введение можно выполнять последовательно в любом порядке. Альтернативно или дополнительно этапы можно выполнять в виде сочетания последовательных и одновременных этапов в любом порядке. В определенных вариантах осуществления интервалы между введением двух или более композиций могут составлять от минут до дней, недель и месяцев. Например, противораковое средство можно вводить первым с последующим введением антитела к эфрину В2. Однако одновременное введение или введение в первую очередь антитела к эфрину В2 также предусмотрено. Соответственно, в одном аспекте изобретение относится к способам, включающим введение антитела к эфрину В2 с последующим введением антиангиогенного средства (антитела к VEGF, такого как бевацизумаб). В определенных вариантах осуществления интервалы между введением двух или более композиций могут составлять от минут до дней, недель и месяцев.
В определенных аспектах изобретение относится к способу лечения нарушения (такого, как опухоль, рак и/или пролиферативное клеточное нарушение) путем введения эффективных количеств антитела к эфрину В2 и/или ингибитора(ов) ангиогенеза и одного или более химиотерапевтических средств. Множество химиотерапевтических средств можно использовать в способах комбинированного лечения по изобретению. Иллюстративный и неограничивающий список предусмотренных химиотерапевтических средств приведен в данном описании в разделе «Определения». Введение антитела к эфрину В2 и химиотерапевтического средства можно выполнять одновременно, например, в виде одной композиции или в виде двух или более разных композиций, используя тот же самый или различные пути введения. Альтернативно или дополнительно введение можно выполнять последовательно в любом порядке. Альтернативно или дополнительно этапы можно выполнять в виде сочетания последовательных и одновременных этапов в любом порядке. В определенных вариантах осуществления интервалы между введением двух или более композиций могут составлять от минут до дней, недель и месяцев. Например, химиотерапевтическое средство можно вводить первым с последующим введением антитела к эфрину В2. Однако одновременное введение или введение в первую очередь антитела к эфрину В2 также предусмотрено. Соответственно, в одном аспекте изобретение относится к способам, включающим введение антитела к эфрину В2 с последующим введением химиотерапевтического средства. В определенных вариантах осуществления интервалы между введением двух или более композиций могут составлять от минут до дней, недель и месяцев.
В одном аспекте изобретение относится к способам повышения эффективности антиангиогенного средства для субъекта, находящегося в патологическом состоянии, связанном с ангиогенезом, включающим введение субъекту эффективного количества антитела к эфрину В2 в сочетании с антиангиогенным средством, что приводит к повышению ингибиторной активности указанного антиангиогенного средства.
В одном аспекте изобретение относится к способам и композициям для ингибирования или предотвращения рецидива роста опухоли или рецидива роста раковых клеток. Словосочетания «рецидив роста опухоли» или «рецидив роста раковых клеток» используют для описания состояния, при котором применяемая для лечения пациентов одна или более разновидностей доступной в настоящее время терапии (например, терапия рака, такая как химиотерапия, лучевая терапия, хирургическое вмешательство, гормональная терапия и/или биологическая терапия/иммунотерапия, терапия с помощью антитела к VEGF, особенно стандартная схема лечения для конкретного вида рака) не является клинически эффективной для лечения пациентов, либо пациенты больше не получают благотворного эффекта от данной терапии, так что эти пациенты нуждаются в дополнительной эффективной терапии.
В другом аспекте изобретение относится к способам обнаружения эфрина B2, где способы включают обнаружение в образце комплекса эфрин B2-антитело к эфрину В2. Термин «обнаружение», как используют в данном описании, охватывает качественное и/или количественное обнаружение (измерение уровней) относительно или безотносительно к контролю.
В другом аспекте изобретение относится к способам диагностирования нарушения, связанного с экспрессией и/или активностью эфрина B2, где способы включают обнаружение комплекса эфрин B2-антитело к эфрину В2 в биологическом образце от пациента, имеющего нарушение или с подозрением на нарушение. В некоторых вариантах осуществления экспрессия эфрина B2 представляет собой повышенную экспрессию или аномальную экспрессию. В некоторых вариантах осуществления нарушение представляет собой опухоль, рак и/или пролиферативное клеточное нарушение.
В другом аспекте изобретение относится к любому из антител к эфрину B2, описанных в данном документе, где антитело к эфрину В2 содержит детектируемую метку.
В другом аспекте изобретение относится к комплексу любого из антител к эфрину B2, описанных в данном документе, с эфрином B2. В некоторых вариантах осуществления комплекс существует in vivo или in vitro. В некоторых вариантах осуществления комплекс включает раковую клетку. В некоторых вариантах осуществления антитело к эфрину В2 является меченым для обнаружения.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Фиг.1: Последовательности петель HVR тяжелой цепи и легкой цепи антител к эфрину B2. На фигуре представлены последовательности HVR тяжелой цепи, H1, H2 и H3, и последовательности HVR легкой цепи, L1, L2 и L3. Нумерация последовательности следующая: клон 31.19 (HVR-H1 представляет собой SEQ ID №:1, HVR-H2 представляет собой SEQ ID №:3, HVR-H3 представляет собой SEQ ID №:5, HVR-L1 представляет собой SEQ ID №:6, HVR-L2 представляет собой SEQ ID №:8, HVR-L3 представляет собой SEQ ID №:10); клон 31.19.1D8 (HVR-H1 представляет собой SEQ ID №:1, HVR-H2 представляет собой SEQ ID №:3, HVR-H3 представляет собой SEQ ID №:5, HVR-L1 представляет собой SEQ ID №:7, HVR-L2 представляет собой SEQ ID №:9, HVR-L3 представляет собой SEQ ID №:11) и клон 31.19.2D3 (HVR-H1 представляет собой SEQ ID №:2, HVR-H2 представляет собой SEQ ID №:4, HVR-H3 представляет собой SEQ ID №:5, HVR-L1 представляет собой SEQ ID №:6, HVR-L2 представляет собой SEQ ID №:8, HVR-L3 представляет собой SEQ ID №:12).
Аминокислотные положения пронумерованы в соответствии с системой нумерации Kabat, как описано ниже.
На фиг.2A, B и 3 изображены иллюстративные акцепторные консенсусные каркасные последовательности человека для использования в практическом осуществлении настоящего изобретения со следующими идентификаторами последовательности:
Вариабельные тяжелые (VH) консенсусные каркасы (фиг.2A, B)
консенсусный каркас подгруппы I VH человека минус CDRs Kabat (SEQ ID №:19)
консенсусный каркас подгруппы I VH человека минус протяженные гипервариабельные области (SEQ ID №:20-22)
консенсусный каркас подгруппы II VH человека минус CDRs Kabat (SEQ ID №:23)
консенсусный каркас подгруппы II VH человека минус протяженные гипервариабельные области (SEQ ID №:24-26)
консенсусный каркас подгруппы II VH человека минус протяженная
консенсусный каркас подгруппы III VH человека минус CDRs Kabat (SEQ ID №:27)
консенсусный каркас подгруппы III VH человека минус протяженные гипервариабельные области (SEQ ID №:28-30)
акцепторный каркас VH человека минус CDRs Kabat (SEQ ID №:31)
акцепторный каркас VH человека минус протяженные гипервариабельные области (SEQ ID №:32-33)
акцепторный 2 каркас VH человека минус CDRs Kabat (SEQ ID №:34)
акцепторный 2 каркас VH человека минус протяженные гипервариабельные области (SEQ ID №:35-37)
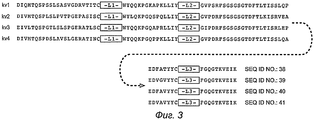
Вариабельные легкие (VL) консенсусные каркасы (фиг.3)
консенсусный каркас подгруппы I каппа VL человека (SEQ ID №:38)
консенсусный каркас подгруппы II каппа VL человека (SEQ ID №:39)
консенсусный каркас подгруппы III каппа VL человека (SEQ ID №:40)
консенсусный каркас подгруппы IV каппа VL человека (SEQ ID №:41)
На фиг.4 изображены последовательности каркасной области легкой и тяжелой цепей huMAb4D5-8. Номера, записанные надстрочным индексом/жирным шрифтом обозначают аминокислотные положения по Kabat.
На фиг.5 изображены модифицированные/вариантные последовательности каркасной области легкой и тяжелой цепей huMAb4D5-8. Номера, записанные надстрочным индексом/жирным шрифтом обозначают аминокислотные положения по Kabat.
На фиг.6 изображены вариабельная область легкой цепи (SEQ ID №:48) и вариабельная область тяжелой цепи (SEQ ID №:49) моноклонального антитела к эфрину B2 клона 31.19, вариабельная область легкой цепи (SEQ ID №:50) и вариабельная область тяжелой цепи (SEQ ID №:51) моноклонального антитела к эфрину B2 клона 31.19.1D8, а также вариабельная область легкой цепи (SEQ ID №:52) и вариабельная область тяжелой цепи (SEQ ID №:53) моноклонального антитела к эфрину B2 клона 31.19.2D.
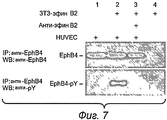
На фиг.7 показано, что воздействие моноклонального антитела к эфрину B2 блокирует передачу сигнала рецептор EphB4-лиганд эфрин B2 при анализе в клеточной системе.
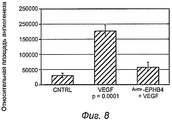
На фиг.8 показано, что воздействие моноклонального антитела к эфрину B2 уменьшает ангиогенез при анализе с использованием камеры в спинном кармане крысы.
На фиг.9 показано, что воздействие моноклонального антитела к эфрину B2 ингибирует рост опухоли in vivo.
ПОБРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Представленное изобретение относится к антителам к эфрину В2, которые являются полезными, например, для лечения или профилактики болезненных состояний, связанных с экспрессией и/или активностью эфрина B2, такой как повышенная экспрессия и/или активность либо нежелательная экспрессия и/или активность. В некоторых вариантах осуществления антитела по изобретению используют для лечения опухоли, рака и/или пролиферативного клеточного нарушения.
В другом аспекте антитела к эфрину В2 по изобретению находят применение в качестве реагентов для обнаружения и/или выделения эфрина B2, а именно обнаружения эфрина B2 в различных типах тканей и клеток.
Кроме того, изобретение относится к способам получения антител к эфрину B2 и полинуклеотидов, кодирующих антитела к эфрину В2.
Основные методики
Методики и манипуляции, описанные или приведенные в качестве ссылки в данном документе, в основном хорошо известны и широко применяются с использованием общепринятой методологии специалистами в данной области, например такие широко используемые методики, как описанные в Sambrook et al., Molecular Cloning: A Laboratory Manual 3rd. edition (2001) Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. CURRENT PROTOCOLS IN MOLECULAR BIOLOGY (F. M. Ausubel, et al. eds., (2003)); серии METHODS IN ENZYMOLOGY (Academic Press, Inc.): PCR 2: A PRACTICAL APPROACH (M. J. MacPherson, B.D. Hames and G.R. Taylor eds. (1995)), Harlow and Lane, eds. (1988) ANTIBODIES, A LABORATORY MANUAL, and ANIMAL CELL CULTURE (R. I. Freshney, ed. (1987)).
Определения
«Выделенное антитело» представляет собой антитело, которое было обнаружено и отделено и/или извлечено из компонента его естественного окружения. Примесные компоненты из его естественного окружения являются материалами, которые могут препятствовать диагностическому или терапевтическому применению антитела и могут включать ферменты, гормоны и другие белковые или небелковые растворенные вещества. В предпочтительных вариантах осуществления антитело очищают (1) до более чем 95% по массе содержания антитела, что определяют методом Лоури (Lowry), и наиболее предпочтительно более чем 99% по массе, (2) до степени, достаточной, чтобы получить, по меньшей мере, 15 остатков N-концевой или внутренней аминокислотной последовательности при использовании секвенатора с вращающимся стаканом, или (3) до гомогенности по SDS-PAGE в восстановительных или невосстановительных условиях с использованием Кумасси (Coomassie blue) или предпочтительно окрашивания серебром. Выделенное антитело включает антитело in situ внутри рекомбинантных клеток, в силу того что, по меньшей мере, один компонент естественного окружения антитела не присутствует. Обычно, однако, выделенное антитело получают, используя, по меньшей мере, одну стадию очистки.
«Выделенная» молекула нуклеиновой кислоты представляет собой молекулу нуклеиновой кислоты, которую обнаруживают и отделяют от, по меньшей мере, одной примесной молекулы нуклеиновой кислоты, с которой она обычно связана в естественном источнике нуклеиновой кислоты антитела. Выделенная молекула нуклеиновой кислоты является иной, чем в той форме и окружении, в котором она находится в природе. Вследствие этого выделенные молекулы нуклеиновой кислоты отличаются от молекулы нуклеиновой кислоты, которая существует в природных клетках. Однако выделенная молекула нуклеиновой кислоты включает молекулу нуклеиновой кислоты, содержащуюся в клетках, которые обычно экспрессируют антитело, если, например, молекула нуклеиновой кислоты расположена в хромосоме не так, как в природных клетках.
Термин «остаток вариабельного домена, пронумерованный по Kabat» или «аминокислотное положение, пронумерованное по Kabat», а также их вариации, означает систему нумерации, используемую для вариабельных доменов тяжелой цепи или вариабельных доменов легкой цепи при составлении антител в Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991). При использовании данной системы нумерации фактическая линейная аминокислотная последовательность может содержать аминокислоты в меньшем количестве либо в избытке, что соответствует укорочению или вставке в FR или CDR вариабельного домена. Например, вариабельный домен тяжелой цепи может содержать одну аминокислотную вставку (остаток 52a по Kabat) после остатка 52 в H2 и вставленные остатки (например, остатки 82a, 82b и 82c и так далее по Kabat) после остатка 82 FR тяжелой цепи. Нумерацию остатков по Kabat можно определить для данного антитела путем выравнивания по областям гомологии последовательности антитела со «стандартной» нумерованной по Kabat последовательностью.
Словосочетание «в основном схожий» или «в основном тот же самый», как используют в данном описании, означает достаточно высокую степень сходства между двумя численными величинами (как правило, одна связана с антителом по изобретению, а другая связана с антителом сравнения/конкурирующим антителом), так что специалист в данной области будет рассматривать разницу между двумя величинами как небольшую или не имеющую биологического и/или статистического значения в контексте биологической характеристики, измеряемой указанными величинами (например, величинами Kd). Разница между указанными двумя величинами предпочтительно составляет менее чем примерно 50%, предпочтительно менее чем примерно 40%, предпочтительно менее чем примерно 30%, предпочтительно менее чем примерно 20%, предпочтительно менее чем примерно 10% в зависимости от величины для антитела сравнения/конкурирующего антитела.
«Аффинность связывания», как правило, означает силу совокупных нековалентных взаимодействий между одним связывающим центром молекулы (например, антитела) и его связывающимся партнером (например, антигеном). Если не указано особо, как используют в данном описании, «аффинность связывания» означает истинную аффинность связывания, которая отражает взаимодействие 1:1 между членами связывающейся пары (например, антитело и антиген). Аффинность молекулы X для ее партнера Y обычно можно выразить константой диссоциации (Kd). Аффинность можно измерять обычными способами, известными в данной области, включая те, что приведены в данном описании. Низкоаффинные антитела, как правило, связывают антиген медленно и имеют тенденцию быстро диссоциировать, тогда как высокоаффинные антитела, как правило, связывают антиген быстрее и имеют тенденцию дольше оставаться связанными. В данной области известно множество способов измерения аффинности связывания, каждый из которых можно использовать для целей настоящего изобретения. Конкретные иллюстративные варианты осуществления описаны ниже.
В одном варианте осуществления «Kd» или «величина Kd» в соответствии с данным изобретением измеряется радиоиммунологическим анализом (RIA), проводимым с Fab-версией интересующего антитела и его антигеном, как описано в следующей методике, по которой измеряют аффинность связывания в растворе молекул Fab с антигеном путем уравновешивания Fab с минимальной концентрацией (125I)-меченого антигена в присутствии серийно разведенного немеченого антигена, а затем фиксируют связанный антиген на планшете, покрытом антителом против Fab (Chen, et al., (1999) J. Mol. Biol. 293:865-881). Чтобы создать условия для данного анализа, планшеты для микротитрования (Dynex) покрывают в течение ночи 5 мкг/мл связывающим антителом против Fab (Cappel Labs) в 50 мМ карбонате натрия (pH 9,6), а затем блокируют 2% (в/о) бычьим сывороточным альбумином в PBS в течение двух-пяти часов при комнатной температуре (примерно 23°C). В неадсорбирующем планшете (Nunc №269620), 100 пМ или 26 пМ [125I]-меченый антиген смешивают с серийно разведенным интересующим Fab (например, подобно тому, как определяют антитело к VEGF, Fab-12, в Presta et al., (1997) Cancer Res. 57:4593-4599). Интересующий Fab затем инкубируют в течение ночи, однако инкубацию можно проводить и дольше (например, 65 часов), чтобы убедиться, что равновесие достигнуто. Затем смеси переносят на фиксирующий планшет для инкубации при комнатной температуре (например, в течение одного часа). Затем раствор удаляют и планшет промывают восемь раз 0,1% Tween-20 в PBS. Затем планшеты высушивают, добавляют 150 мкл/лунку сцинтиллятор (MicroScint-20, Packard) и планшеты просчитывают на счетчике гамма-излучения Topcount (Packard) в течение десяти минут. Концентрации каждого Fab, которые дают 20% или меньше от максимального связывания, выбирают для использования в анализах на конкурентное связывание. В соответствии с другим вариантом осуществления Kd или величину Kd измеряют анализом поверхностного плазмонного резонанса с использованием BIAcore™-2000 или BIAcore™-3000 (BIAcore, Inc., Piscataway, NJ) при 25°C с микрочипами CM5 с иммобилизованным антигеном при ~10 реакционных единицах (RU). Кратко, биосенсорные микрочипы из карбоксиметилированного декстрана (CM5, BIAcore Inc.) активируют N-этил-N'-(3-диметиламинопропил)карбодиимидгидрохлоридом (EDC) и N-гидроксисукцинимидом (NHS) в соответствии с инструкциями производителя. Антиген разводят 10 мМ ацетатом натрия, pH 4,8, до 5 мкг/мл (~0,2 мкМ) перед впрыскиванием при скорости потока 5 мкл/минуту, чтобы получить примерно 10 реакционных единиц (RU) связанного белка. После впрыскивания антигена впрыскивают 1M этаноламин для блокирования непрореагировавших групп. Для кинетических измерений впрыскивают Fab (0,78 нМ -500 нМ) в серийных двукратных разведениях в PBS с 0,05% Tween 20 (PBST) при 25°C при скорости потока примерно 25 мкл/мин. Скорости ассоциации (kon) и скорости диссоциации (koff) рассчитывают, используя простую один к одному модель связывания Ленгмюра (Langmuir) (BIAcore Evaluation Software version 3.2) при одновременном вычерчивании сенсограмм ассоциации и диссоциации. Равновесную константу диссоциации (Kd) рассчитывают как отношение koff/kon. Смотри, например, Chen, Y. et al., (1999) J. Mol. Biol. 293:865-881. Если по анализу поверхностного плазмонного резонанса, упомянутого выше, скорость соединения превышает 106 M-1 С-1, тогда скорость соединения можно определять, используя методику тушения флуоресценции, которая позволяет определить возрастание или снижение интенсивности эмиссии флуоресценции (возбуждение = 295 нм, эмиссия = 340 нм, 16 нм полоса пропускания) при 25°C для 20 нМ антитела против антигена (Fab-форма) в PBS, pH 7,2, в присутствии антигена в возрастающих концентрациях, что измеряют на спектрофотометре, таком как спектрофотометр с остановленным потоком (Aviv Instruments) или спектрофотометр SLM-Aminco 8000 серий (ThermoSpectronic) с перемешиваемой красной кюветой.
«Скорость соединения», или «скорость ассоциации», или «ассоциативная скорость», или «kon» в соответствии с данным изобретением можно также определять с помощью той же методики поверхностного плазмонного резонанса, описанной выше, используя BIAcore™-2000 или BIAcore™-3000 (BIAcore, Inc., Piscataway, NJ) при 25°C с микрочипами CM5 с иммобилизованным антигеном при ~10 реакционных единицах (RU). Кратко, биосенсорные микрочипы из карбоксиметилированного декстрана (CM5, BIAcore Inc.) активируют N-этил-N'-(3-диметиламинопропил)карбодиимидгидрохлоридом (EDC) и N-гидроксисукцинимидом (NHS) в соответствии с инструкциями производителя. Антиген разводят 10 мМ ацетатом натрия, pH 4,8, до 5 мкг/мл (~0,2 мкМ) перед впрыскиванием при скорости потока 5 мкл/минуту, чтобы получить примерно 10 реакционных единиц (RU) связанного белка. После впрыскивания антигена впрыскивают 1M этаноламин для блокирования непрореагировавших групп. Для кинетических измерений впрыскивают Fab (0,78 нМ - 500 нМ) в серийных двукратных разведениях в PBS с 0,05% Tween 20 (PBST) при 25°C при скорости потока примерно 25 мкл/мин. Скорости ассоциации (kon) и скорости диссоциации (koff) рассчитывают, используя простую один к одному модель связывания Ленгмюра (Langmuir) (BIAcore Evaluation Software version 3.2) при одновременном вычерчивании сенсограмм ассоциации и диссоциации. Равновесную константу диссоциации (Kd) рассчитывают как отношение koff/kon. Смотри, например, Chen, Y. et al., (1999) J. Mol. Biol. 293:865-881. Однако, если по анализу поверхностного плазмонного резонанса, упомянутого выше, скорость соединения превышает 106 M-1 С-1, тогда скорость соединения предпочтительно определять, используя методику тушения флуоресценции, которая позволяет определить возрастание или снижение интенсивности эмиссии флуоресценции (возбуждение = 295 нм; эмиссия = 340 нм, 16 нм полоса пропускания) при 25°C для 20 нМ антитела против антигена (Fab-форма) в PBS, pH 7,2, в присутствии антигена в возрастающих концентрациях, что измеряют на спектрофотометре, таком как спектрофотометр с остановленным потоком (Aviv Instruments) или спектрофотометр SLM-Aminco 8000 серий (ThermoSpectronic) с перемешиваемой кюветой.
Термин «вектор», как используют в данном описании, должен означать молекулу нуклеиновой кислоты, способную переносить другую нуклеиновую кислоту, с которой ее соединили. Один тип вектора представляет собой «плазмиду», что означает кольцевую петлю двуспиральной ДНК, в которую могут быть лигированы дополнительные сегменты ДНК. Другой тип вектора представляет собой фаговый вектор. Другой тип вектора представляет собой вирусный вектор, где дополнительные сегменты ДНК могут быть лигированы в вирусный геном. Определенные векторы способны к автономной репликации в клетке-хозяине, в которую их внедряют (например, бактериальные векторы, обладающие бактериальной точкой начала репликации, и эписомальные векторы млекопитающих). Другие векторы (например, неэписомальные векторы млекопитающих) могут интегрироваться в геном клетки-хозяина при внедрении их в клетку-хозяина и вследствие этого реплицируются вместе с геномом хозяина. Кроме того, определенные векторы способны направлять экспрессию генов, с которыми они функционально связаны. Такие векторы в данном описании называют «рекомбинантные векторы экспрессии» (или просто «рекомбинантные векторы»). Как правило, векторы экспрессии, полезные для технологии рекомбинантной ДНК, часто находятся в форме плазмид. В настоящем описании слова «плазмида» и «вектор» могут быть использованы взаимозаменяемо, так как плазмида является наиболее часто используемой формой вектора.
«Полинуклеотид» или «нуклеиновая кислота», как взаимозаменяемо используют в данном описании, означает полимеры нуклеотидов любой длины и включает ДНК и РНК. Нуклеотиды могут представлять собой дезоксирибонуклеотиды, рибонуклеотиды, модифицированные нуклеотиды или основания и/или их аналоги или любой субстрат, который может быть включен в полимер с помощью ДНК- или РНК-полимеразы либо посредством синтетической реакции. Полинуклеотид может включать модифицированные нуклеотиды, такие как метилированные нуклеотиды и их аналоги. В случае ее наличия модификация нуклеотидной структуры может иметь место до или после сборки полимера. Последовательность нуклеотидов может быть прервана ненуклеотидными компонентами. Полинуклеотид может быть дополнительно модифицирован после синтеза, например, в результате конъюгации с меткой. Другие виды модификаций включают, например, «кэпы», замену одного или более природных нуклеотидов аналогом, межнуклеотидные модификации, такие как, например, со свободными связями (например, метилфосфонаты, фосфотриэфиры, фосфоамидаты, карбаматы и так далее) и с заряженными связями (например, фосфоротиоаты, фосфородитиоаты и так далее), те, что содержат подвешенные фрагменты, такие как, например, белки (например, нуклеазы, токсины, антитела, сигнальные пептиды, поли-L-лизин и так далее), те, что имеют включения (например, акридин, псорален и так далее), те, что содержат хелаторы (например, металлы, радиоактивные металлы, бор, окислительные металлы и так далее), те, что содержат алкилаторы, те, что содержат модифицированные связи (например, альфа-аномерные нуклеиновые кислоты и так далее), а также немодифицированные формы полинуклеотида(ов). Кроме того, любая из гидроксильных групп, обычно присутствующих в сахарах, может быть заменена, например, фосфонатными группами, фосфатными группами, защищена стандартными защитными группами или активирована для создания дополнительных связей с дополнительными нуклеотидами либо может быть конъюгирована с твердыми или полутвердыми подложками. 5'- и 3'-концевая OH-группа может быть фосфорилирована или замещена аминами или фрагментами органических блокирующих групп из 1-20 атомов углерода. Другие гидроксилы также могут быть переделаны в стандартные защитные группы. Полинуклеотиды также могут содержать аналоговые формы сахаров рибозы или дезоксирибозы, которые, как правило, известны в данной области, включая, например, 2'-O-метил-, 2'-O-аллил-, 2'-фтор- или 2'-азидорибозу, карбоциклические аналоги сахаров, альфа-аномерные сахара, эпимерные сахара, такие как арабиноза, ксилозы или ликсозы, пиранозные сахара, фуранозные сахара, седогептулозы, ациклические аналоги и основные аналоги нуклеозидов, такие как метилрибозид. Одна или более фосфодиэфирных связей могут быть заменены альтернативными связывающими группами. Такие альтернативные связывающие группы включают, но не ограничиваются ими, варианты осуществления, где фосфат заменен на P(O)S («тиоат»), P(S)S («дитиоат»), (O)NR2 («амидат»), P(O)R, P(O)OR', CO или CH2 («формацетал»), где каждая R или R' независимо представляет собой H, либо замещенный или незамещенный алкил (1-20 C), необязательно содержащий эфирную (-O-) связь, арил, алкенил, циклоалкил, циклоалкенил или аралдил. Не все связи в полинуклеотиде должны быть одинаковыми. Предшествующее описание относится ко всем полинуклеотидам, упомянутым в данном документе, включая РНК и ДНК.
«Олигонуклеотид», как используют в данном описании, как правило, означает короткие, обычно однонитевые, обычно синтетические полинуклеотиды, которые обычно, но необязательно, составляют менее чем примерно 200 нуклеотидов в длину. Термины «олигонуклеотид» и «полинуклеотид» не являются взаимоисключающими. Вышеприведенное описание для полинуклеотидов в равной степени и полностью применимо к олигонуклеотидам.
«Процентная (%) идентичность аминокислотной последовательности» в отношении пептидной или полипептидной последовательности определяют как процентное содержание аминокислотных остатков в последовательности-кандидате, которые идентичны аминокислотным остаткам в определенной пептидной или полипептидной последовательности после выравнивания последовательностей и внесения пробелов, если необходимо, чтобы получить максимальную процентную идентичность последовательностей, и без учета любых консервативных замен как части идентичности последовательностей. Выравнивание с целью определения процентной идентичности аминокислотной последовательности можно осуществлять различными способами, известными в данной области, например, используя общедоступные компьютерные программы, такие как программы BLAST, BLAST-2, ALIGN или Megalign (DNASTAR). Специалисты в данной области могут определить соответствующие параметры для определения выравнивания, включая любые алгоритмы, необходимые для достижения максимального выравнивания по всей длине сравниваемых последовательностей. Для целей данного описания, однако, значения % идентичности аминокислотной последовательности получают, используя компьютерную программу сравнения последовательностей ALIGN-2, где полный исходный код для программы ALIGN-2 представлен ниже в таблице A. Компьютерная программа сравнения последовательностей ALIGN-2 была разработана компанией Genentech, Inc., и исходный код, представленный ниже в таблице A, был зарегистрирован с документацией пользователя в Бюро регистрации авторских прав США (US Copyright Office), Washington DC, 20559, где он зарегистрирован под номером регистрации авторского права США TXU510087. Программа ALIGN-2 общедоступна через Genentech, Inc., South San Francisco, California или может быть составлена на основании исходного кода, представленного ниже в таблице A. Программу ALIGN-2 следует составлять для использования на операционной системе UNIX, предпочтительно цифровой UNIX V4.0D. Все параметры сравнения последовательностей установлены программой ALIGN-2 и не изменяются.
Таблица А
/* программа выравнивания Needleman-Wunsch
*
* применение: прог. файл 1 файл 2
* где файл 1 и файл 2 представляют собой две последовательности ДНК или две белковые последовательности.
* Последовательности могут быть записаны заглавными или строчными буквами и могут содержать неопределенную информацию
* Любые строки, начинающиеся с «;», «>» или «<», игнорируются
* Максимальная длина файла равна 65535 (ограничение неподчеркнутым малым x в структ. jmp)
* Последовательность, в которой 1/3 или более элементов ACGTU предположительно является ДНК
* Выход находится в файле «align.out»
*
* Программа может создавать файл tmp в /tmp для хранения информации о системной диагностике задач.
* Оригинальная версия разработана под BSD 4.3 on a vax 8650
*/
* Когда количества баллов равны, мы предпочитаем несовпадения любому пробелу, предпочитаем
* новый пробел продлению текущего пробела, и предпочитаем пробел в seq x
* пробелу в seq y.
*/
В ситуации, когда ALIGN-2 используют для сравнений аминокислотных последовательностей, % идентичности аминокислотной последовательности для данной аминокислотной последовательности A с или относительно данной аминокислотной последовательности B (что можно перефразировать как то, что данная аминокислотная последовательность A имеет или содержит определенный % идентичности аминокислотной последовательности с или относительно данной аминокислотной последовательности B) рассчитывают следующим образом:
100-кратно доля X/Y,
где X представляет собой число аминокислотных остатков, оцененных как идентичные совпадения программой сравнения последовательностей ALIGN-2 при выравнивании с помощью программы A и B, и где Y представляет собой общее число аминокислотных остатков в B. Следует принимать во внимание, что если длина аминокислотной последовательности A не равна длине аминокислотной последовательности B, % идентичности аминокислотной последовательности A относительно B не будет равен % идентичности аминокислотной последовательности B относительно A.
За исключением особо оговоренных случаев все значения % идентичности аминокислотных последовательностей, используемые в данном описании, получают, как описано в непосредственно предшествующем параграфе с использованием компьютерной программы ALIGN-2.
Термин «эфрин B2» (взаимозаменяемо используемое название «лиганд эфрин B2»), как используют в данном описании, означает, если иное не указано особо или не следует из контекста, любой природный или вариантный (либо естественный, либо синтетический) полипептид эфрин B2. Термин «природная последовательность», в частности, охватывает существующие в природе укороченные или секретируемые формы (например, последовательность внеклеточного домена), существующие в природе вариантные формы (например, альтернативно сплайсированные формы) и существующие в природе аллельные варианты. Термин «эфрин B2 дикого типа», как правило, означает полипептид, включающий аминокислотную последовательность природного белка эфрина B2. Термин «последовательность эфрина B2 дикого типа», как правило, означает аминокислотную последовательность, обнаруженную у природного эфрина B2.
Термин «Eph-рецептор» (такой, как EphB-рецептор, такой как EphB1, EphB2 и/или EphB3), как используют в данном описании, означает, если иное не указано особо или не следует из контекста, любой природный или вариантный (либо естественный, либо синтетический) полипептид Eph-рецептора. Термин «природная последовательность», в частности, охватывает существующие в природе укороченные или секретируемые формы (например, последовательность внеклеточного домена), существующие в природе вариантные формы (например, альтернативно сплайсированные формы) и существующие в природе аллельные варианты. Термин «Eph-рецептор дикого типа», как правило, означает полипептид, включающий аминокислотную последовательность природного белка Eph-рецептора. Термин «последовательность Eph-рецептора дикого типа», как правило, означает аминокислотную последовательность, обнаруженную у природного Eph-рецептора.
Термины «антитело» и «иммуноглобулин» используются взаимозаменяемо в самом широком смысле и включают моноклональные антитела (например, полноразмерные или интактные моноклональные антитела), поликлональные антитела, мультивалентные антитела, мультиспецифические антитела (например, биспецифические антитела до тех пор, пока они обладают желаемой биологической активностью) и могут также включать определенные фрагменты антител (как описано более подробно в данном документе). Антитело может быть человеческим, гуманизированным и/или аффинно зрелым.
Термин «вариабельный» означает тот факт, что определенные части вариабельных доменов сильно различаются по последовательности среди антител и используются для связывания и специфичности каждого конкретного антитела для его конкретного антигена. Однако вариабельность распределена неравномерно на протяжении вариабельных доменов антител. Она сконцентрирована в трех сегментах, называемых определяющими комплементарность областями (CDRs) или гипервариабельными областями, в вариабельных доменах как легкой цепи, так и тяжелой цепи. Более консервативные части вариабельных доменов называются каркасными (FR). Каждый из вариабельных доменов природных тяжелых и легких цепей содержит четыре FR-области, главным образом принимающие конфигурацию β-слоя, соединенные тремя CDR, которые образуют петли, соединяющие и в некоторых случаях образующие часть структуры β-слоя. В каждой цепи CDRs удерживаются вместе в непосредственной близости с помощью FR-областей и совместно с CDRs из другой цепи участвуют в образовании антигенсвязывающего центра антител (смотри Kabat et al., Sequences of Proteins of Immunological Interest, Fifth Edition, National Institute of Health, Bethesda, MD (1991)). Константные домены не принимают непосредственного участия в связывании антитела с антигеном, однако обладают различными эффекторными функциями, такими как участие антитела в антителозависимой клеточноопосредованной цитотоксичности.
Расщепление антител папаином приводит к образованию двух идентичных антигенсвязывающих фрагментов, называемых «Fab»-фрагментами, каждый из которых имеет один антигенсвязывающий центр, и остаточного «Fc»-фрагмента, название которого отражает его способность легко кристаллизоваться. Обработка пепсином приводит к образованию F(ab')2-фрагмента, который имеет два антигенсвязывающих центра и все еще способен связывать антиген.
«Fv» представляет собой минимальный фрагмент антитела, который содержит полный центр узнавания и связывания антигена. В двунитевых разновидностях Fv данная область состоит из димера, содержащего один вариабельный домен тяжелой и один вариабельный домен легкой цепи в прочной нековалентной ассоциации. В однонитевых разновидностях Fv один вариабельный домен тяжелой и один вариабельный домен легкой цепи могут быть ковалентно связаны гибким пептидным линкером так, что легкая и тяжелая цепи могут объединяться в «димерную» структуру, аналогичную той, что существует у двунитевых разновидностей Fv. Именно в такой конфигурации три CDR каждого вариабельного домена взаимодействуют с образованием антигенсвязывающего центра на поверхности димера VH-VL. В совокупности шесть CDR определяют антигенсвязывающую специфичность антитела. Однако даже один вариабельный домен (или половина Fv, содержащая только три CDR, специфичных для антигена) обладает способностью узнавать и связывать антиген, хотя и с меньшей аффинностью, чем целый связывающий центр.
Fab-фрагмент также содержит константный домен легкой цепи и первый константный домен (CH1) тяжелой цепи. Fab'-фрагменты отличаются от Fab-фрагментов несколькими дополнительными остатками на карбоксильном конце CH1-домена тяжелой цепи, включая один или более остатков цистеина из шарнирной области антитела. В данном описании Fab'-SH является обозначением Fab', в котором цистеиновый остаток(ки) константных доменов несет свободную тиоловую группу. F(ab')2-фрагменты антитела изначально были получены как пары Fab'-фрагментов, которые имеют между собой шарнирные цистеиновые остатки. Также известны и другие химические соединения фрагментов антитела.
«Легкие цепи» антител (иммуноглобулинов) у всех видов позвоночных можно отнести к одному из двух четко различающихся типов, называемых каппа (κ) и лямбда (λ), на основании аминокислотных последовательностей их константных доменов.
В зависимости от аминокислотной последовательности константного домена их тяжелых цепей иммуноглобулины можно отнести к различным классам. Существуют пять основных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, и некоторые из них можно дополнительно разделить на подклассы (изотипы), например IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжелой цепи, которые соответствуют различным классам иммуноглобулинов, называются α, δ, ε, γ и μ соответственно. Субъединичные структуры и трехмерные конфигурации различных классов иммуноглобулинов хорошо известны.
«Фрагменты антитела» содержат только часть интактного антитела, где эта часть предпочтительно сохраняет, по меньшей мере, одну, предпочтительно большинство или все из функций, обычно связанных с данной частью в составе интактного антитела. Примеры фрагментов антитела включают Fab, Fab', F(ab')2 и Fv-фрагменты, димеры, линейные антитела, одноцепочечные молекулы антител и мультиспецифические антитела, образованные из фрагментов антител. В одном варианте осуществления фрагмент антитела содержит антигенсвязывающий центр интактного антитела и тем самым сохраняет способность связывать антиген. В другом варианте осуществления фрагмент антитела, например фрагмент, который содержит Fc-область, сохраняет, по меньшей мере, одну из биологических функций, обычно связанных с Fc-областью в составе интактного антитела, такую как связывание FcRn, модуляцию времени полужизни антитела, функцию ADCC и связывание комплемента. В одном варианте осуществления фрагмент антитела представляет собой моновалентное антитело, которое имеет время полужизни in vivo в основном такое же, как у интактного антитела. Например, такой фрагмент антитела может содержать антигенсвязывающее плечо, соединенное с Fc-последовательностью, способной придавать фрагменту стабильность in vivo.
Термин «гипервариабельная область», «HVR» или «HV», как используют в данном описании, означает области вариабельного домена антитела, которые являются гипервариабельными по последовательности и/или образуют структурно выделенные петли. Как правило, антитела содержат шесть гипервариабельных областей, три в VH (H1, H2, H3) и три в VL (L1, L2, L3). Множество схем гипервариабельных областей находятся в употреблении и включены в данное описание. Области, определяющие комплементарность (CDRs), Kabat основаны на вариабельности последовательности и являются наиболее часто используемыми (Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991)). Напротив, Chothia рассматривает расположение структурных петель (Chothia and Lesk J. Mol. Biol. 196:901-917 (1987)). Гипервариабельные области AbM представляют собой компромисс между CDRs Kabat и структурными петлями Chothia и используются компьютерной программой Oxford Molecular's AbM antibody modeling. «Контактные» гипервариабельные области основаны на анализе доступных кристаллических структур комплекса. Остатки каждой из данных гипервариабельных областей указаны ниже.
| Петля Kabat ---- ---- |
AbM --- |
Chothia ------- |
Контактные ------- |
|
| L1 | L24-L34 | L24-L34 | L26-L32 | L30-L36 |
| L2 | L50-L56 | L50-L56 | L50-L52 | L46-L55 |
| L3 | L89-L97 | L89-L97 | L91-L96 | L89-L96 |
| H1 | H31-H35B | H26-H35B | H26-H32 | H30-H35B |
| (Нумерация Kabat) | ||||
| H1 | H31-H35 | H26-H35 | H26-H32 | H30-H35 |
| (Нумерация Chothia) | ||||
| H2 | H50-H65 | H50-H58 | H53-H55 | H47-H58 |
| H3 | H95-H102 | H95-H102 | H96-H101 | H93-H101 |
Гипервариабельные области могут содержать следующие «протяженные гипервариабельные области»: 24-36 или 24-34 (L1), 46-56 или 50-56 (L2) и 89-97 (L3) в VL и 26-35 (H1), 50-65 или 49-65 (H2) и 93-102, 94-102 или 95-102 (H3) в VH. Остатки вариабельного домена пронумерованы по Kabat et al., выше для каждого из данных определений.
«Каркасные» или «FR» остатки представляют собой остатки вариабельного домена, не являющиеся остатками гипервариабельной области, как определено в данном описании.
«Гуманизированные» формы антител, отличных от человеческих (например, мышиных), представляют собой химерные антитела, которые содержат минимальную последовательность, происходящую из иммуноглобулина, отличного от человеческого. Большей частью гуманизированные антитела представляют собой человеческие иммуноглобулины (реципиентное антитело), в котором остатки из гипервариабельной области реципиента заменены на остатки из гипервариабельной области видов, отличных от человека (донорское антитело), таких как мышь, крыса, кролик или приматы кроме человека, обладающие желаемой специфичностью, аффинностью и емкостью. В некоторых случаях остатки каркасной области (FR) человеческого иммуноглобулина заменены на соответствующие остатки, отличные от человеческих. Кроме того, гуманизированные антитела могут содержать остатки, которые не встречаются в реципиентном антителе или в донорском антителе. Такие модификации осуществляют, чтобы дополнительно оптимизировать функционирование антитела. Как правило, гуманизированное антитело содержит в основном все из, по меньшей мере, одного, а обычно двух вариабельных доменов, в которых все или в основном все гипервариабельные петли соответствуют таковым из иммуноглобулина, отличного от человеческого, а все или в основном все FRs являются таковыми из последовательности человеческого иммуноглобулина. Гуманизированное антитело может также необязательно содержать, по меньшей мере, часть константной области (Fc) иммуноглобулина, обычно из человеческого иммуноглобулина. Для более подробного описания смотри Jones et al., Nature 321:522-525 (1986); Riechmann et al., Nature 332:323-329 (1988) и Presta, Curr. Op. Struct. Biol. 2:593-596 (1992). Смотри также следующие обзорные статьи и литературу, цитированную в данном описании: Vaswani and Hamilton, Ann. Allergy, Asthma & Immunol. 1: 105-115 (1998); Harris, Biochem. Soc. Transactions 23:1035-1038 (1995); Hurle and Gross, Curr. Op. Biotech. 5:428-433 (1994).
«Химерные антитела» (иммуноглобулины) содержат часть тяжелой и/или легкой цепи, идентичной или гомологичной соответствующим последовательностям в антителах, происходящих из конкретных видов или принадлежащих к определенному классу или подклассу антител, тогда как оставшаяся часть цепи(ей) идентична или гомологична соответствующим последовательностям в антителах, происходящих из других видов или принадлежащих к другому классу или подклассу антител, а также фрагментах таких антител, при условии что они обладают желаемой биологической активностью (патент США № 4816567; а также Morrison et al., Proc. Natl. Acad. Sci. USA 81:6851-6855 (1984)). Гуманизированные антитела, как используют в данном описании, представляют собой субпопуляцию химерных антител.
«Одноцепочечные Fv» или «scFv» фрагменты антител содержат VH- и VL-домены антитела, где данные домены находятся на одной полипептидной цепи. Как правило, полипептид scFv дополнительно содержит полипептидный линкер между VH- и VL-доменами, который позволяет scFv образовывать структуру, необходимую для связывания антигена. Для обзора scFv смотри Pluckthun, in The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., Springer- Verlag, New York, p. 269-315 (1994).
«Антиген» представляет собой заданный антиген, с которым антитело может избирательно связываться. Целевой антиген может представлять собой полипептид, углевод, нуклеиновую кислоту, липид, гаптен или другое природное или синтетическое соединение. Предпочтительно целевой антиген представляет собой полипептид.
Термин «димеры» означает небольшие фрагменты антитела с двумя антигенсвязывающими центрами, каковые фрагменты содержат вариабельный домен тяжелой цепи (VH), связанный с вариабельным доменом легкой цепи (VL) на одной и той же полипептидной цепи (VH - VL). Если использовать линкер, слишком короткий для того, чтобы допустить образование пар между двумя доменами на одной и той же цепи, домены вынужденно образуют пары с комплементарными доменами другой цепи и образуют два антигенсвязывающих центра. Более подробно димеры описаны, например, в EP 404097; WO 93/11161; а также в Hollinger et al., Proc. Natl. Acad. Sci. USA, 90:6444-6448 (1993).
«Человеческое антитело» представляет собой антитело, которое включает аминокислотную последовательность, которая соответствует последовательности антитела, образующегося у человека, и/или было получено при использовании любой из методик для получения человеческих антител, как раскрыто в данном описании. Данное определение человеческого антитела, в частности, исключает гуманизированное антитело, содержащее антигенсвязывающие остатки, отличные от человеческих.
«Аффинно зрелое» антитело представляет собой антитело с одним или большим количеством изменений в одном или большем количестве его CDR, что приводит к повышению аффинности антитела для антигена по сравнению с исходным антителом, которое не обладает данным изменением(ми). Предпочтительные аффинно зрелые антитела обладают аффинностью для целевого антигена, находящейся в наномолярном или даже пикомолярном диапазоне. Аффинно зрелые антитела получают при помощи методик, известных в данной области. В Marks et al. Bio/Technology 10:779-783 (1992) описывают аффинное созревание путем перетасовки VH- и VL-доменов. Неспецифический мутагенез CDR и/или каркасных остатков описан в: Barbas et al. Proc Nat. Acad. Sci, USA 91:3809-3813 (1994); Schier et al. Gene 169: 147-155 (1995); Yelton et al. J. Immunol. 155:1994-2004 (1995); Jackson et al., J. Immunol. 154(7):3310-9 (1995) и Hawkins et al., J. Mol. Biol. 226:889-896 (1992).
«Эффекторные функции» антитела означают те биологические активности, которые присущи Fc-области (Fc-области природной последовательности или Fc-области вариантной аминокислотной последовательности) антитела и различаются между изотипами антител. Примеры эффекторных функций антител включают: связывание C1q и комплементзависимую цитотоксичность, связывание Fc-рецептора, антителозависимую клеточноопосредованную цитотоксичность (ADCC), фагоцитоз, понижающую регуляцию поверхностных рецепторов клетки (например, B-клеточного рецептора) и B-клеточную активацию.
«Антителозависимая клеточноопосредованная цитотоксичность» или «ADCC» означает форму цитотоксичности, при которой секретируемые Ig связываются с Fc-рецепторами (FcRs), присутствующими на определенных цитотоксических клетках (например, клетках - естественных киллерах (NK), нейтрофилах и макрофагах), позволяя данным цитотоксическим эффекторным клеткам специфически связываться с несущей антиген целевой клеткой и затем лизировать целевую клетку с помощью цитотоксинов. Антитела «вооружают» цитотоксические клетки и являются абсолютно необходимыми для такого лизирования. Основные клетки для опосредования ADCC, NK-клетки, экспрессируют только FcγRIII, тогда как моноциты экспрессируют FcγRI, FcγRII и FcγRIII. Обобщенная информация об экспрессии FcR на гематопоэтических клетках представлена в таблице 3 на странице 464 в Ravetch and Kinet, Annu. Rev. Immunol 9:457-92 (1991). Чтобы оценить активность ADCC интересующей молекулы, можно проводить in vitro тест на ADCC, такой как тот, что описан в патенте США № 5500362, или 5821337, или Presta патент США № 6737056. Полезные эффекторные клетки для таких тестов включают мононуклеарные клетки периферической крови (PBMC) и клетки - натуральные киллеры (NK). Альтернативно или дополнительно активность ADCC интересующей молекулы можно оценивать in vivo, например, на животной модели, такой как та, что описана в Clynes et al. PNAS (USA) 95:652- 656 (1998).
«Человеческие эффекторные клетки» представляют собой лейкоциты, которые экспрессируют один или более FcRs и выполняют эффекторные функции. Предпочтительно, клетки экспрессируют, по меньшей мере, FcγRIII и выполняют эффекторную функцию ADCC. Примеры человеческих лейкоцитов, которые опосредуют ADCC, включают мононуклеарные клетки периферической крови (PBMC), клетки - натуральные киллеры (NK), моноциты, цитотоксические T-клетки и нейтрофилы; при этом PBMC и NK-клетки являются предпочтительными. Эффекторные клетки можно выделять из природных источников, например из крови.
«Fc-рецептор» или «FcR» означает рецептор, который связывается с Fc-областью антитела. Предпочтительными FcR являются человеческие FcR с природной последовательностью. Кроме того, предпочтительным FcR является такой, который связывает IgG антитело (гамма рецептор) и включает рецепторы подклассов FcγRI, FcγRII и FcγRIII, включая аллельные варианты и альтернативно сплайсированные формы данных рецепторов. Рецепторы FcγRII включают FcγRIIA («активирующий рецептор») и FcγRIIB («ингибирующий рецептор»), которые имеют сходные аминокислотные последовательности, однако различаются, главным образом, своими цитоплазматическими доменами. Активирующий рецептор FcγRIIA содержит в цитоплазматическом домене иммунорецепторный основанный на тирозине активационный мотив (ITAM). Ингибирующий рецептор FcγRIIB содержит в цитоплазматическом домене иммунорецепторный основанный на тирозине ингибирующий мотив (ITIM) (смотри обзор M. в Daëron, Annu. Rev. Immunol. 15:203-234 (1997)). Обзор FcRs приведен в Ravetch and Kinet, Annu. Rev. Immunol 9:457-92 (1991); Capel et al., Immunomethods 4:25-34 (1994); и de Haas et al., J. Lab. Clin. Med. 126:330-41 (1995). Другие FcR, включая те, что будут определены в будущем, охвачены термином «FcR» в данном описании. Термин также включает неонатальный рецептор, FcRn, который отвечает за перенос материнских IgG плоду (Guyer et al., J. Immunol. 117:587 (1976) и Kim et al., J. Immunol. 24:249 (1994)) и регулирует гомеостаз иммуноглобулинов.
В WO 00/42072 (Presta) описывают варианты антител с усиленным или ослабленным связыванием с FcR. Содержание этой патентной публикации специально включено в данное описание посредством ссылки. Смотри также Shields et al. J. Biol. Chem. 9(2): 6591-6604 (2001).
Способы измерения связывания с FcRn известны (смотри, например, Ghetie 1997, Hinton 2004). Связывание с человеческим FcRn in vivo и время полужизни в сыворотке полипептидов с высокой аффинностью связывания с человеческим FcRn можно анализировать, например, в трансгенных мышах или трансфецированных человеческих клеточных линиях, экспрессирующих человеческий FcRn, либо в приматах, которым ввели вариантные полипептиды Fc.
«Комплементзависимая цитотоксичность» или «CDC» означает лизис целевой клетки в присутствии комплемента. Классический путь активации комплемента начинается со связывания первого компонента системы комплемента (C1q) с антителами (соответствующего подкласса), которые связаны с родственным для них антигеном. Для оценки активации комплемента можно проводить анализ CDC, например, как описано в Gazzano-Santoro et al., J. Immunol. Methods 202:163 (1996).
Полипептидные варианты с измененными аминокислотными последовательностями Fc-области и повышенной или пониженной способностью связывать C1q описаны в патенте США № 6194551B1 и WO 99/51642. Содержание этих патентных публикаций специально включено в данное описание посредством ссылок. Смотри также Idusogie et al., J. Immunol. 164: 4178-4184 (2000).
Термин «содержащий Fc-область полипептид» означает полипептид, такой как антитело или иммуноадгезин (смотри определения ниже), который содержит Fc-область. C-концевой лизин (остаток 447 в соответствии с системой нумерации ЕС) из Fc-области может быть удален, например, в процессе очистки полипептида или путем рекомбинантной инженерии нуклеиновой кислоты, кодирующей полипептид. Соответственно, композиции, содержащие полипептид, имеющий Fc-область в соответствии с данным изобретением, могут содержать полипептиды с K447, совсем без K447 либо смесь полипептидов с или без остатка K447.
«Блокирующее» антитело или «антагонистическое» антитело представляет собой антитело, которое ингибирует или снижает биологическую активность антигена, который оно связывает. Предпочтительные блокирующие или антагонистические антитела в основном или полностью ингибируют биологическую активность антигена.
«Агонистическое антитело», как используют в данном описании, представляет собой антитело, которое имитирует, по меньшей мере, одну из функциональных активностей интересующего полипептида.
«Акцепторный человеческий каркас» для целей данного описания представляет собой каркас, включающий аминокислотную последовательность каркаса VL или VH, происходящего из каркаса человеческого иммуноглобулина или из человеческого консенсусного каркаса. Акцепторный человеческий каркас, «происходящий из» каркаса человеческого иммуноглобулина или из человеческого консенсусного каркаса, может включать его же аминокислотную последовательность или может содержать предсуществующие изменения аминокислотной последовательности. Если имеются предсуществующие аминокислотные изменения, предпочтительно имеется не более чем 5 и предпочтительно 4 или меньше либо 3 или меньше предсуществующих аминокислотных изменений. Если имеются предсуществующие аминокислотные изменения в VH, предпочтительно данные изменения имеются только в трех, двух или одном из положений 71H, 73H и 78H, например аминокислотные остатки в данных положениях могут представлять собой 71A, 73T и/или 78A. В одном варианте осуществления акцепторный человеческий каркас VL идентичен по последовательности человеческой иммуноглобулиновой каркасной последовательности VL или человеческой консенсусной каркасной последовательности.
«Человеческий консенсусный каркас» представляет собой каркас, который представляет наиболее часто встречающиеся аминокислотные остатки в выборке каркасных последовательностей VL или VH человеческого иммуноглобулина. Как правило, выборка последовательностей VL или VH человеческого иммуноглобулина происходит из подгруппы последовательностей вариабельного домена. Как правило, подгруппа последовательностей представляет собой подгруппу, такую как в Kabat et al. В одном варианте осуществления для VL подгруппа представляет собой подгруппу каппа I, как в Kabat et al. В одном варианте осуществления для VH подгруппа представляет собой подгруппу III, как в Kabat et al.
«Консенсусный каркас подгруппы III VH» включает консенсусную последовательность, полученную из аминокислотных последовательностей в вариабельной подгруппе III тяжелой цепи у Kabat et al. В одном варианте осуществления консенсусная каркасная аминокислотная последовательность подгруппы III VH содержит, по меньшей мере, часть или полностью каждую из следующих последовательностей: EVQLVESGGGLVQPGGSLRLSCAAS (SEQ ID №:42)-H1-WVRQAPGKGLEWV (SEQ ID №:43)-H2-RFTISRDNSKNTLYLQMNSLRAEDTAVYYC (SEQ ID №:44)-H3-WGQGTLVTVSS (SEQ ID №:45).
«Консенсусный каркас подгруппы I VL» включает консенсусную последовательность, полученную из аминокислотных последовательностей в вариабельной подгруппе I легкой цепи каппа у Kabat et al. В одном варианте осуществления консенсусная каркасная аминокислотная последовательность подгруппы I VL содержит, по меньшей мере, часть или полностью каждую из следующих последовательностей: DIQMTQSPSSLSASVGDRVTITC (SEQ ID №: 15)-L1-WYQQKPGKAPKLLIY (SEQ ID №: 16)-L2-GVPSRFSGSGSGTDFTLTISSLQPEDFATYYC (SEQ ID №: 17)-L3-FGQGTKVEIK (SEQ ID №: 18).
«Нарушение» или «болезнь» представляет собой любое состояние, которое будет облегчено в результате лечения веществом/молекулой или способом по данному изобретению. Сюда входят хронические или острые нарушения или болезни, включая те патологические состояния, которые предрасполагают млекопитающее к определенному нарушению. Неограничивающие примеры заболеваний, подлежащих лечению в данном описании, включают злокачественные и доброкачественные опухоли; карциному, бластому и саркому.
Термины «пролиферативное клеточное нарушение» и «пролиферативное нарушение» означают нарушения, которые в некоторой степени связаны с аномальной клеточной пролиферацией. В одном варианте осуществления пролиферативное клеточное нарушение представляет собой рак.
«Опухоль», как используют в данном описании, означает всякий неопластический клеточный рост и пролиферацию как злокачественную, так и доброкачественную, а также все предраковые или раковые клетки и ткани. Термины «рак», «раковый», «пролиферативное клеточное нарушение», «пролиферативное нарушение» и «опухоль» не являются взаимоисключающими, как используют в данном описании. Термины «рак» и «раковый» означают или описывают физиологическое состояние млекопитающих, которое обычно характеризуется нерегулируемым клеточным ростом/пролиферацией. Примеры рака включают, но не ограничиваются ими, карциному, лимфому, бластому, саркому и лейкоз. Более конкретные примеры таких видов рака включают плоскоклеточный рак, мелкоклеточный рак легкого, не-мелкоклеточный рак легкого, аденокарциному легкого, плоскоклеточную карциному легкого, рак брюшины, печеночно-клеточный рак, рак желудочно-кишечного тракта, рак поджелудочной железы, глиобластому, рак шейки матки, рак яичников, рак печени, рак мочевого пузыря, гепатому, рак молочной железы, рак толстой кишки, колоректальный рак, эндометриальную или маточную карциному, карциному слюнной железы, рак почки, рак печени, рак простаты, рак вульвы, рак щитовидной железы, печеночный рак, рак желудка, меланому и различные виды рака головы и шеи. Расстройство регуляции антиогенеза может приводить ко многим заболеваниям, которые можно лечить композициями и способами данного изобретения. Такие заболевания включают как не-неопластические, так и неопластические состояния. Неоплазии включают, но не ограничиваются теми, что описаны выше. Не-неопластические состояния включают, но не ограничиваются ими, нежелательную или аберрантную гипертрофию, артрит, ревматоидный артрит (RA), псориаз, псориатические бляшки, саркоидоз, атеросклероз, атеросклеротические бляшки, диабетические и другие пролиферативные ретинопатии, включая синдром Терри, ретролентальную фиброплазию, неоваскулярную глаукому, старческую дегенерацию желтого пятна, диабетический отек желтого пятна, неоваскуляризацию роговицы, неоваскуляризацию трансплантата роговицы, отторжение трансплантата роговицы, неоваскуляризацию сетчатки/сосудистой оболочки, неоваскуляризацию уголка глаза (покраснение радужки), офтальмологическое неоваскулярное заболевание, васкулярный рестеноз, артериовенозные врожденные пороки (AVM), менингиому, гемангиому, ангиофиброму, гиперплазию щитовидной железы (включая болезнь Грейвза), пересадку роговицы и других тканей, хроническое воспаление, воспаление легких, острую легочную травму/ARDS, сепсис, первичную легочную гипертензию, злокачественные легочные эффузии, отек мозга (например, связанный с острым инсультом/закрытой травмой черепа/ травмой), синовиальное воспаление, образование паннуса при RA, оссифицирующий миозит, гипертрофический остеогенез, остеоартрит (OA), рефрактерный асцит, поликистозное заболевание яичников, эндометриоз, 3-й интервал нестабильных заболеваний (панкреатит, синдром межфасциального пространства, ожоги, воспалительное заболевание кишечника), фиброз матки, преждевременные роды, хроническое воспаление, такое как IBD (болезнь Крона и язвенный колит), отторжение почечного аллотрансплантата, воспалительное заболевание кишечника, нефротический синдром, нежелательное или аберрантное возрастание тканевой массы (нераковое), гемофилическую артропатию, гипертрофические рубцы, угнетение роста волос, синдром Озьера-Вебера, пиогенную гранулему, ретролентальные фиброплазии, склеродерму, трахому, сосудистые адгезии, синовит, дерматит, преэклампсию, асцит, перикардиальный выпот (такой, который связан с перикардитом) и плевральный выпот.
Термины «нейродегенеративное нарушение» и «нейродегенеративное заболевание» используются в самом широком смысле и включают все расстройства, патология которых связана с нейрональной дегенерацией и/или дисфункцией, включая, но не ограничиваясь ими, периферические невропатии; мотонейрональные заболевания, такие как боковой амиотрофический склероз (ALS, болезнь Лу Герига), паралич Белла и различные состояния, в патологию которых вовлечены спинальная мышечная атрофия или паралич, а также другие нейродегенеративные болезни человека, такие как болезнь Альцгеймера, болезнь Паркинсона, эпилепсия, рассеянный склероз, хорея Гентингтона, синдром Дауна, нервная глухота и болезнь Меньера.
«Периферическая невропатия» представляет собой нейродегенеративное нарушение, которое поражает периферические нервы, чаще всего проявляющееся как одна из или сочетание моторной, сенсорной, сенсомоторной или вегетативной дисфункций. Периферические невропатии могут, например, быть наследственными, могут возникать из-за системного заболевания или могут быть вызваны токсическим веществом, таким как нейротоксическое лекарственное средство, например антинеопластическое средство, либо промышленные или прочие загрязнители окружающей среды. «Периферическая сенсорная невропатия» характеризуется дегенерацией периферических сенсорных нейронов, которая может быть идиопатической, может возникать, например, вследствие диабета (диабетическая невропатия), лечения рака цитостатическим лекарственным средством (например, лечения химиотерапевтическими средствами, такими как винкристин, цисплатин, метотрексат, 3'-азидо-3'-дезокситимидин или таксанами, например паклитакселем [TAXOL®, Bristol-Myers Squibb Oncology, Princeton, NJ.] и доцетакселем [TAXOTERE®, Rhône-Poulenc Rorer, Antony, France]), алкоголизма, синдрома приобретенного иммунодефицита (СПИД) или генетической предрасположенности. Наследственные периферические невропатии включают, например, болезнь Рефсума, болезнь Краббе, метахроматическую лейкодистрофию, болезнь Фабри, синдром Дежерина-Сотта, абеталипопротеинемию и болезнь Шарко-Мари-Тута (CMT) (также известную, как пронеальная мышечная атрофия или наследственная моторно-сенсорная невропатия (HMSN)). Большинство типов периферической невропатии развиваются медленно на протяжении нескольких месяцев или лет. В клинической практике такие невропатии называются хроническими. Иногда периферическая невропатия развивается быстро, в течение нескольких дней, и она называется острой. При периферической невропатии обычно поражаются одновременно сенсорные и моторные нервы так, что возникает смешанная сенсорная и моторная невропатия, но также известны и чисто сенсорная и чисто моторная невропатия.
Как используют в данном описании, «лечение» означает клиническое вмешательство в попытке изменить естественное течение болезни у индивидуума или клетки, подвергающихся лечению, и оно может осуществляться либо для профилактики, либо во время клинической патологии. Желаемые эффекты лечения включают предотвращение возникновения или возврата болезни, облегчение симптомов, ослабление любых прямых или непрямых патологических последствий заболевания, предотвращение метастазирования, снижение скорости прогрессирования заболевания, уменьшение интенсивности или временное облегчение болезненного состояния, а также ремиссию или более благоприятный прогноз. В некоторых вариантах осуществления антитела по изобретению применяют, чтобы отсрочить развитие болезни или заболевания.
«Индивидуум» является представителем позвоночных, предпочтительно млекопитающих, более предпочтительно человеком. Млекопитающие включают, но не ограничиваются ими, сельскохозяйственных животных (таких, как коровы), спортивных животных, домашних питомцев (таких, как кошки, собаки и лошади), приматов, мышей и крыс.
«Млекопитающее» для целей лечения означает любое животное, классифицируемое как млекопитающее, включая людей, домашних и сельскохозяйственных животных, а также животных, содержащихся в зоопарке, используемых в спорте или домашних питомцев, таких как собаки, лошади, кошки, коровы и так далее. Предпочтительно млекопитающее является человеком.
«Эффективное количество» означает количество, которое эффективно при необходимых дозах и периодах времени для достижения желаемого терапевтического или профилактического результата.
«Терапевтически эффективное количество» вещества/молекулы по изобретению, агониста или антагониста может варьировать в зависимости от факторов, таких как состояние болезни, возраст, пол и масса индивидуума, а также способности вещества/молекулы, агониста или антагониста вызывать желательный ответ у индивидуума. Терапевтически эффективное количество также представляет собой количество, при котором любые токсические или вредные эффекты вещества/молекулы, агониста или антагониста незначительны по сравнению с терапевтически благоприятными эффектами. «Профилактически эффективное количество» означает количество, которое эффективно при необходимых дозах и периодах времени для достижения желаемого профилактического результата. Обычно, но необязательно, поскольку профилактическую дозу используют для субъектов до возникновения или на ранней стадии заболевания, профилактически эффективное количество будет меньшим, чем терапевтически эффективное количество.
Термин «цитотоксическое средство», как используют в данном описании, означает вещество, которое ингибирует или препятствует функции клеток и/или вызывает разрушение клеток. Предполагается, что термин включает радиоактивные изотопы (например, At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32 и радиоактивные изотопы Lu), химиотерапевтические средства, например метотрексат, адриамицин, алкалоиды барвинка (винкристин, винбластин, этопозид), доксорубицин, мелфалан, митомицин C, хлорамбуцил, даунорубицин или другие интеркалирующие средства, ферменты или их фрагменты, такие как нуклеолитические ферменты, антибиотики, и токсины, такие как низкомолекулярные токсины или ферментативно активные токсины бактериального, грибкового, растительного или животного происхождения, включая их фрагменты и/или варианты, а также различные противоопухолевые или противораковые средства, раскрытые ниже. Другие цитотоксические средства описаны ниже. Противоопухолевые средства вызывают разрушение опухолевых клеток.
«Химиотерапевтическое средство» представляет собой химическое соединение, полезное для лечения рака. Примеры химиотерапевтических средств включают алкилирующие вещества, такие как тиотепа и циклофосфамид CYTOXAN®; алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метиламеламины, включая алтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметилоломеламин; ацетогенины (особенно буллатацин и буллатацинон); дельта-9-тетрагидроканнабинол (дронабинол, MARINOL®); бета-лапахон; лапахол; колхицины; бетулиновая кислота; камптотецин (включая синтетический аналог топотекан (HYCAMTIN®), CPT-11 (иринотекан, CAMPTOSAR®), ацетилкамптотецин, скополектин и 9-аминокамптотецин); бриостатин; каллистатин; CC-1065 (включая его синтетические аналоги адозелезин, карзелезин и бизелезин); подофиллотоксин; подофиллиновую кислоту; тенипозид; криптофицины (в частности, криптофицин 1 и криптофицин 8); доластатин; дуокармицин (включая синтетические аналоги KW-2189 и CB1-TM1); элеутеробин; панкратистатин; саркодиктин; спонгистатин; азотистые иприты, такие как хлорамбуцил, хлорнафазин, хлорфосфамид, эстрамустин, ифосфамид, мехлорэтамин, мехлорэтаминоксида гидрохлорид, мелфалан, новэмбихин, фенестерин, преднимустин, трофосфамид, урацилиприт; нитрозомочевины, такие как кармустин, хлорозотоцин, фотемустин, ломустин, нимустин и ранимнустин; антибиотики, такие как энедийновые антибиотики (например, калихимицин, особенно калихимицин гамма 1I и калихимицин омега I1 (смотри, например, Agnew, Chem Intl. Ed. Engl., 33: 183-186 (1994)); динемицин, включая динемицин A; эсперамицин, а также неокарциностатина хромофор и родственные хромопротеиновые энедийновые антибиотики-хромофоры), аклациномицины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, карубицин, карминомицин, карзинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, доксорубицин ADRIAMYCIN® (включая морфолинодоксорубицин, цианоморфолинодоксорубицин, 2-пирролинодоксорубицин и дезоксидоксорубицин), эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицины, такие как митомицин C, микофеноловая кислота, ногаламицин, оливомицины, пеплеомицин, потфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин, антиметаболиты, такие как метотрексат и 5-фторурацил (5-FU), аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, тримтрексат, аналоги пуринов, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин, аналоги пиримидинов, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин, андрогены, такие как калустерон, дромостанолона пропионат, эпитиостанол, мепитиостан, тестолактон, антиадренальные препараты, такие как аминоглутетимид, хлодитан, трилостан, компенсатор фолиевой кислоты, такой как фолиновая кислота, ацеглатон, альдофосфамида гликозид, аминолевулиновая кислота, энилурацил, амсакрин, бестрабуцил, бизантрен, эдатраксат, дефофамин, демеколцин, диазиквон, элфорнитин, эллиптиниума ацетат, эпотилон, этоглюцид, галлия нитрат, гидроксимочевину, лентинан, лонидамин, мейтанзиноиды, такие как мейтанзин и анзамитоцины, митогуазон, митоксантрон, мопиданмол, нитраэрин, пентостатин, фенамет, пирарубицин, лозоксантрон, 2-этилгидразид, прокарбазин, полисахаридный комплекс PSK® (JHS Natural Products, Eugene, OR), разоксан, ризоксин, сизофиран, спирогерманий, тенуазоновую кислоту, триазиквон, 2,2',2"-трихлортриэтиламин, трихотхецины (особенно токсин T-2, верракурин A, роридин A и ангуидин), уретан, виндезин (ELDISINE®, FILDESIN®), дакарбазин, манномустин, митобронитол, митолактол, пипоброман, гацитозин, арабинозид («Ara-C»); тиотепа, таксоиды, например TAXOL® паклитаксел (Bristol-Myers Squibb Oncology, Princeton, NJ.), ABRAXANETM, свободный от кремофора препарат паклитаксела на основе наночастиц рекомбинантного альбумина (American Pharmaceutical Partners, Schaumberg, Illinois), и TAXOTERE® доксетаксел (Rhône-Poulenc Rorer, Antony, France), хлорамбуцил, гемцитабин (GEMZAR®), 6-тиогуанин, меркаптопурин, метотрексат, аналоги платины, такие как цисплатин и карбоплатин, винбластин (VELBAN®), платина, этопозид (VP-16), ифосфамид, митоксантрон, винкристин (ONCOVIN®), оксалиплатин, лейковорин, винорелбин (NAVELBINE®), новантрон, эдатрексат, дауномицин, аминоптерин, ибандронат, ингибитор топоизомеразы RFS 2000, дифторметилорнитин (DMFO), ретиноиды, такие как ретиноевая кислота, капецитабин (XELODA®), фармацевтически приемлемые соли, кислоты и производные любого из вышеперечисленных препаратов, а также сочетания двух и более из вышеперечисленных препаратов, такие как CHOP, аббревиатура для комбинированной терапии с использованием циклофосфамида, доксорубицина, винкристина и преднизолона и FOLFOX, аббревиатура для программы лечения с использованием оксалиплатина (ELOXATINTM) в сочетании с 5-FU и лейковорином.
В данное определение также включены антигормональные препараты, которые выполняют функцию регулирования, снижения, блокирования или ингибирования действия гормонов, которые могут способствовать разрастанию рака, и часто применяются в форме системного или общего лечения. Они могут являться и собственно гормонами. Примеры включают анти-эстрогены и селективные модуляторы эстрогеновых рецепторов (SERM), включая, например, тамоксифен (включая тамоксифен NOLVADEX®), ралоксифен EVISTA®, дролоксифен, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон и торемифен FARESTON®, анти-прогестероны, вещества, подавляющие активность эстрогеновых рецепторов (ERD), препараты, действие которых заключается в подавлении или отключении функции яичников, например агонисты лютеинизирующий гормон-рилизинг гормона (LHRH), такие как LUPRON® и ELIGARD® лейпролида ацетат, гозерелина ацетат, бусерелина ацетат и трипторелин, другие анти-андрогены, такие как флутамид, нилутамид и бикалутамид, а также ингибиторы ароматазы, которые ингибируют фермент ароматазу, которая регулирует образование эстрогена в надпочечниках, такие как, например, 4(5)-имидазолы, аминоглутетимид, мегестрола ацетат MEGASE®, экземестан AROMASIN®, форместан, фадрозол, ворозол RIVISOR®, летрозол FEMARA® и анастрозол ARIMIDEX®. Кроме того, такое определение химиотерапевтических средств включает бисфосфонаты, такие как клодронат (например, BONEFOS® или OSTAC®), этидронат DIDROCAL®, NE-58095, золедроновая кислота/золедронат ZOMETA®, аледронат FOSAMAX®, памидронат AREDIA®, тилудронат SKELID® или ризедронат ACTONEL®, а также троксацитабин (аналог цитозина 1,3-диоксоланнуклеозид), антисмысловые олигонуклеотиды, особенно те, что ингибируют экспрессию генов в сигнальных путях, вовлеченных в аберрантную клеточную пролиферацию, такие как, например, PKC-альфа, Raf, H-Ras и рецептор эпидермального фактора роста (EGF-R), вакцины, такие как вакцина THERATOPE® и генотерапевтические вакцины, например вакцина ALLOVECTIN®, вакцина LEUVECTIN® и вакцина VAXID®, ингибитор топоизомеразы 1 LURTOTECAN®, ABARELIX® rmRH; лапатиниба дитозилат (ErbB-2 и EGFR двойной низкомолекулярный ингибитор тирозинкиназы, также известный как GW572016) и фармацевтически приемлемые соли, кислоты или производные любого из вышеперечисленных препаратов.
«Ингибирующее рост средство», как используют в данном описании, означает соединение или композицию, которые ингибируют рост клетки (такой, как клетка, экспрессирующая эфрин B2) либо in vitro, либо in vivo. Таким образом, ингибирующее рост средство может представлять собой средство, которое значительно снижает процентное содержание клеток (таких, как клетки, экспрессирующие эфрин B2) в S-фазе. Примеры ингибирующих рост средств включают средства, которые блокируют развитие клеточного цикла (в точке, отличной от S-фазы), такие как средства, которые вызывают остановку в G1-фазе и остановку в M-фазе. Классические блокаторы M-фазы включают алкалоиды барвинка (винкристин и винбластин), таксаны и ингибиторы топоизомеразы II, такие как доксорубицин, эпирубицин, даунорубицин, этопозид и блеомицин. Те средства, которые вызывают остановку в G1-фазе, вызывают также остановку в S-фазе, например таксановые ДНК-алкилирующие средства, такие как тамоксифен, преднизон, дакарбазин, мехлорэтамин, цисплатин, метотрексат, 5-фторурацил и цитарабин. Дополнительную информацию можно найти в The Molecular Basis of Cancer, Mendelsohn and Israel, eds., Chapter 1, озаглавленной «Cell cycle regulation, oncogenes, and antineoplastic drugs» by Murakami et al. (WB Saunders: Philadelphia, 1995), особенно p. 13. Таксаны (паклитаксел и доцетаксел) представляют собой противораковые лекарственные средства, получаемые из тиса. Доцетаксел (TAXOTERE®, Rhône-Poulenc Rorer), получаемый из тиса европейского, представляет собой полусинтетический аналог паклитаксела (TAXOL®, Bristol-Myers Squibb). Паклитаксел и доцетаксел стимулируют сборку микротрубочек из тубулиновых димеров и стабилизируют микротрубочки, предотвращая деполимеризацию, что приводит к ингибированию митоза в клетках.
«Доксорубицин» представляет собой антрациклиновый антибиотик. Полное химическое название доксорубицина (8S-цис)-10-[(3-амино-2,3,6-тридезокси-α-L-ликсогексапиранозил)окси]-7,8,9,10-тетрагидро-6,8,11-тригидрокси-8-(гидроксиацетил)-1-метокси-5,12-нафтацендион.
Термин «антинеопластическая композиция» означает композицию, полезную для лечения рака, содержащую, по меньшей мере, одно активное терапевтическое средство, например «противораковое средство». Примеры терапевтических средств (противораковых средств, также называемых в данном описании «антинеопластическими средствами») включают, но не ограничиваются ими, например, химиотерапевтические средства, ингибирующие рост средства, цитотоксические средства, средства, применяемые в лучевой терапии, антиангиогенные средства, апоптические средства, антитубулиновые средства, токсины и другие средства для лечения рака, например нейтрализующее антитело к VEGF, антагонист VEGF, анти-HER-2, анти-CD20, антагонист рецептора эпидермального фактора роста (EGFR) (например, ингибитор тирозинкиназы), ингибитор HER1/EGFR, эрлотиниб, ингибитор COX-2 (например, целекоксиб), интерфероны, цитокины, антагонисты (например, нейтрализующие антитела), которые связываются с одним или более рецептором(ми) ErbB2, ErbB3, ErbB4 или VEGF, ингибиторы для рецепторных тирозинкиназ для тромбоцитарного фактора роста (PDGF) и/или фактора стволовых клеток (SCF) (например, иматиниба мезилат (Gleevec® Novartis)), TRAIL/Apo2 и другие биологически активные и органические химические средства и так далее.
Термин «пролекарство», как используют в данной заявке, означает предшественник или производная форма от фармацевтически активного вещества, которые обладают меньшей цитотоксичностью в отношении опухолевых клеток по сравнению с исходным лекарственным средством и способны ферментативно активироваться или превращаться в более активную исходную форму. Смотри, например, Wilman, «Prodrugs in Cancer Chemotherapy» Biochemical Society Transactions, 14, p. 375-382, 615th Meeting Belfast (1986) и Stella et al., «Prodrugs: A Chemical Approach to Targeted Drug Delivery», Directed Drug Delivery, Borchardt et al., (ed.), p. 247-267, Humana Press (1985). Пролекарства по данному изобретению включают, но не ограничиваются ими, фосфатсодержащие пролекарства, тиофосфатсодержащие пролекарства, сульфатсодержащие пролекарства, пептидосодержащие пролекарства, модифицированные пролекарства с D-аминокислотами, гликозилированные пролекарства, бета-лактамсодержащие пролекарства, необязательно замещенные феноксиацетамидсодержащие пролекарства или необязательно замещенные фенилацетамидсодержащие пролекарства, 5-фторцитозиновые и другие 5-фторуридиновые пролекарства, которые могут быть превращены в более активное свободное цитотоксическое лекарственное средство. Примеры цитотоксических лекарственных средств, которые можно преобразовать в форму пролекарства для использования по данному изобретению, включают, но не ограничиваются ими, те химиотерапевтические средства, что описаны выше.
«Средство против ангиогенеза» или «ингибитор ангиогенеза» означает низкомолекулярное вещество, полинуклеотид, полипептид, выделенный белок, рекомбинантный белок, антитело или их конъюгаты или слитые белки, которые или прямо или косвенно ингибируют ангиогенез, образование и развитие сосудов либо нежелательную проницаемость сосудов. Например, средство против ангиогенеза представляет собой антитело или другой антагонист ангиогенного средства, как определено выше, например антитела к VEGF, антитела к VEGF-рецепторам, низкомолекулярные вещества, которые блокируют передачу сигнала VEGF-рецептора (например, PTK787/ZK2284, SU6668, SUTENT/SU11248 (сунитиниба малат), AMG706). Средства против ангиогенеза также включают природные ингибиторы ангиогенеза, например ангиостатин, эндостатин и так далее. Смотри, например, Klagsbrun and D'Amore, Annu. Rev. Physiol., 53:217-39 (1991); Streit and Detmar, Oncogene, 22:3172-3179 (2003) (например, в таблице 3 перечислены средства антиангиогенной терапии при злокачественной меланоме); Ferrara & Alitalo, Nature Medicine, 5(12):1359-1364 (1999); Tonini et al., Oncogene, 22:6549-6556 (2003) (например, в таблице 2 перечислены антиангиогенные факторы) и Sato Int. J. Clin. Oncol., 8:200-206 (2003) (например, в таблице 1 перечислены антиангиогенные средства, используемые в клинических испытаниях).
Композиции по изобретению и способы их получения
Данное изобретение охватывает композиции, включая фармацевтические композиции, содержащие антитело к эфрину В2 и полинуклеотиды, включающие последовательности, кодирующие антитело к эфрину В2. Как используют в данном описании, композиции содержат одно или более антител, которые связывают эфрин B2, и/или один или более полинуклеотидов, включающих последовательности, кодирующие одно или более антител, которые связывают эфрин B2. Данные композиции могут дополнительно содержать подходящие носители, такие как фармацевтически приемлемые эксципиенты, включая буферные растворы, которые хорошо известны в данной области.
Изобретение также охватывает варианты осуществления выделенного антитела и полинуклеотида. Изобретение также охватывает варианты осуществления в основном чистого антитела и полинуклеотида.
Антитела к эфрину В2 по изобретению преимущественно являются моноклональными. Область изобретения также охватывает Fab, Fab', Fab'-SH и F(ab')2-фрагменты антител к эфрину B2, представленных в данном описании. Данные фрагменты антител могут быть получены традиционными способами, такими как ферментативное расщепление, или могут быть созданы рекомбинантными методами. Такие фрагменты антител могут быть химерными или гуманизированными. Данные фрагменты являются полезными для диагностических и терапевтических целей, изложенных ниже.
Моноклональные антитела получают из популяции в основном гомогенных антител, то есть отдельные антитела, составляющие популяцию, являются идентичными за исключением возможных естественных мутаций, которые могут присутствовать в незначительных количествах. Таким образом, определение «моноклональное» указывает на характер антитела как на не являющееся смесью отдельных антител.
Моноклональные антитела к эфрину B2 по изобретению могут быть получены с использованием гибридомной методики, впервые описанной Kohler et al., Nature, 256:495 (1975), или могут быть получены с помощью методик рекомбинантной ДНК (патент США № 4816567).
В соответствии с гибридомной методикой мышь или другое подходящее животное-хозяина, такое как хомяк, иммунизируют, чтобы вызвать появление лимфоцитов, которые продуцируют или способны продуцировать антитела, которые будут специфически связывать белок, использованный для иммунизации. Производство антител к эфрину B2, как правило, индуцируют в животных путем множественных подкожных (sc) или внутрибрюшинных (ip) инъекций эфрина B2 и адъюванта. Эфрин B2 можно получать, используя способы, хорошо известные в данной области, некоторые из которых дополнительно приведены в данном описании. Например, ниже описана рекомбинантная продукция эфрина B2. В одном варианте осуществления животных иммунизируют производным эфрина B2, которое содержит внеклеточный домен (ECD) эфрина B2, слитый с Fc-участком тяжелой цепи иммуноглобулина. В предпочтительном варианте осуществления животных иммунизируют эфрин B2-IgG1 слитым белком. Животных обычно иммунизируют иммуногенными конъюгатами или производными эфрина B2 со смесью монофосфориллипид A (MPL)/трегалозы дикриномиколат (TDM) (Ribi Immunochem. Research, Inc., Hamilton, MT) и раствор вводят внутрикожной инъекцией во множество участков. Через две недели инъекции животному повторяют. От 7 до 14 дней спустя у животного берут кровь и сыворотку анализируют на титры антител к эфрину B2. Животных вновь иммунизируют до тех пор, пока титры не выходят на плато.
Альтернативно лимфоциты можно иммунизировать in vitro. Затем проводят слияние лимфоцитов с миеломными клетками, используя подходящий фактор слияния, такой как полиэтиленгликоль, с образованием клеток гибридомы (Goding, Monoclonal Antibodies: Principles and Practice, p.59-103 (Academic Press, 1986)).
Полученные таким образом клетки гибридомы высевают на чашки и выращивают в подходящей культуральной среде, которая предпочтительно содержит одно или больше веществ, которые ингибируют рост или выживание неслитых исходных миеломных клеток. Например, если у исходных миеломных клеток отсутствует фермент гипоксантингуанин-фосфорибозилтрансфераза (HGPRT или HPRT), культуральная среда для гибридом обычно будет содержать гипоксантин, аминоптерин и тимидин (среда HAT), эти вещества препятствуют росту лишенных HGPRT клеток.
Предпочтительными миеломными клетками являются такие, которые эффективно сливаются, поддерживают стабильно высокий уровень продукции антитела выбранными антитело-продуцирующими клетками, чувствительны к среде, такой как среда HAT. Среди них предпочтительными миеломными клеточными линиями являются линии мышиной миеломы, такие как те, что происходят из мышиных опухолей MOPC-21 и MPC-11, поставляемые Salk Institute Cell Distribution Center, San Diego, California USA, и SP-2 или X63-Ag8-653 клетки, поставляемые American Type Culture Collection, Rockville, Maryland USA. Клеточные линии человеческой миеломы и гетеромиеломы мыши-человека также были описаны для получения человеческих моноклональных антител (Kozbor, J. Immunol, 133:3001 (1984); Brodeur et al., Monoclonal Antibody Production Techniques and Applications, p. 51-63 (Marcel Dekker, Inc., New York, 1987)).
Культуральную среду, в которой выращивают клетки гибридомы, проверяют на продукцию моноклональных антител, направленных против эфрина B2. Предпочтительно специфичность связывания моноклональных антител, продуцируемых гибридомными клетками, определяют иммунопреципитацией или анализом связывания in vitro, таким как радиоиммунный анализ (RIA) или иммуноферментный анализ (ELISA).
Аффинность связывания моноклонального антитела можно, например, определять анализом Скэтчарда, описанным в Munson et al., Anal. Biochem., 107:220 (1980).
После того как выявлены гибридомные клетки, которые продуцируют антитела нужной специфичности, аффинности и/или активности, клоны можно субклонировать методами серийных разведений и наращивать стандартными методами (Goding, Monoclonal Antibodies: Principles and Practice, p.59-103 (Academic Press, 1986)). Подходящая для этой цели культуральная среда включает, например, среду D-MEM или RPMI-1640. Кроме того, клетки гибридомы можно выращивать in vivo в виде асцитных опухолей у животного.
Моноклональные антитела, секретируемые субклонами, соответствующим образом отделяют от культуральной среды, асцитной жидкости или сыворотки общепринятыми методами очистки иммуноглобулинов, такими как, например, хроматография на протеин А-сефарозе, гидроксилапатите, гель-электрофорез, диализ или аффинная хроматография.
Антитела к эфрину В2 по изобретению можно получать с использованием комбинаторных библиотек для скрининга клонов синтетических антител с желаемой активностью или активностями. В принципе, клоны синтетических антител выбирают, проводя скрининг фаговых библиотек, содержащих фаги, которые экспонируют различные фрагменты вариабельной области (Fv) антитела, слитые с белком оболочки фага. Такие фаговые библиотеки подвергают пэннингу аффинной хроматографией против желаемого антигена. Клоны, экспрессирующие Fv-фрагменты, способные связывать желаемый антиген, адсорбируются на антигене и таким образом отделяются от несвязывающих клонов библиотеки. Затем связывающие клоны элюируют с антигена и они могут быть дополнительно обогащены с помощью дополнительных циклов адсорбции на антигене/элюции. Любое из антител к эфрину B2 по изобретению можно получать, разрабатывая подходящую методику скрининга антигеном, чтобы выбрать интересующий фаговый клон, с последующим созданием клона полноразмерного антитела к эфрину В2, используя Fv-последовательности из интересующего фагового клона и подходящие последовательности константной области (Fc), описанные в Kabat et al., Sequences of Proteins of Immunological Interest, Fifth Edition, NIH Publication 91-3242, Bethesda MD (1991), vols. 1-3.
Антигенсвязывающий домен антитела образуется из двух вариабельных (V) областей, состоящих из примерно 110 аминокислот, по одной из легкой (VL) и тяжелой (VH) цепей, обе представляют три гипервариабельные петли или определяющие комплементарности области (CDR). Вариабельные домены могут быть функционально экспонированы на фаге, либо в виде одноцепочечных Fv-фрагментов (scFv), в которых VH и VL ковалентно связаны через короткий гибкий пептид, либо в виде Fab-фрагментов, в которых каждый из них слит с константным доменом и они взаимодействуют нековалентно, как описано в Winter et al., Ann. Rev. Immunol., 12: 433-455 (1994). Как используют в данном описании, кодирующие scFv фаговые клоны и кодирующие Fab фаговые клоны собирательно называют «Fv фаговые клоны» или «Fv-клоны».
Популяции генов VH и VL могут быть отдельно клонированы с помощью полимеразной цепной реакции (ПЦР) (PCR) и рекомбинированы случайным образом в фаговых библиотеках, в которых затем можно проводить поиск антигенсвязывающих клонов, как описано в Winter et al., Ann. Rev. Immunol., 12: 433-455 (1994). Библиотеки из иммунизированных источников обеспечивают высокоаффинные антитела к иммуногену без необходимости создания гибридом. Альтернативно можно клонировать исходную популяцию, чтобы обеспечить один источник человеческих антител к широкому диапазону чужих, а также собственных антигенов без всякой иммунизации, как описано в Griffiths et al., EMBO J., 12: 725-734 (1993). В конечном итоге, исходные библиотеки можно также получать искусственно, клонируя нереаранжированные сегменты V-генов из стволовых клеток и используя праймеры для ПЦР, содержащие случайные последовательности для кодирования высоковариабельных CDR3-областей и для выполнения реаранжирования in vitro, как описано в Hoogenboom and Winter, J. Mol. Biol., 227: 381-388 (1992).
Нитчатые фаги используют, чтобы экспонировать фрагменты антитела путем слияния с небольшим белком оболочки pIII. Фрагменты антитела могут быть экспонированы в виде одноцепочечных Fv-фрагментов, в которых VH- и VL-домены соединены на одной и той же полипептидной цепи гибким полипептидным спейсером, например, как описано в Marks et al., J. Mol. Biol., 222: 581-597 (1991), или в виде Fab-фрагментов, в которых одна цепь слита с pIII, а другая секретируется в периплазму бактериальной клетки-хозяина, где происходит сборка структуры Fab-белок оболочки, которая экспонируется на поверхности фага, путем замещения некоторых из белков оболочки дикого типа, например, как описано в Hoogenboom et al., Nucl. Acids Res., 19: 4133-4137 (1991).
Как правило, нуклеиновые кислоты, кодирующие фрагменты генов антитела, получают из иммунных клеток, полученных от человека или животных. Если нужна библиотека с уклоном в сторону анти-эфрин B2 клонов, субъекта иммунизируют эфрином B2, чтобы вызвать образование антител, и отбирают клетки селезенки и/или циркулирующие B-клетки, другие лимфоциты периферической крови (PBL) для создания библиотеки. В предпочтительном варианте осуществления библиотеку генных сегментов человеческого антитела с уклоном в сторону анти-эфрин B2 клонов получают, вызывая образование антител к эфрину B2 у трансгенной мыши, несущей функциональный блок генов человеческого иммуноглобулина (и лишенной функциональной эндогенной системы образования антител) таким образом, что иммунизация эфрином B2 приводит к появлению клеток, продуцирующих человеческие антитела против эфрина B2. Создание трансгенной мыши, продуцирующей человеческие антитела, описано ниже.
Дополнительного обогащения популяций клеток, реагирующих с эфрином B2, можно добиться, используя соответствующие методы скрининга для выделения B-клеток, экспрессирующих связанное с мембраной специфическое в отношении эфрина B2 антитело, например, проводя разделение клеток эфрин B2-аффинной хроматографией или адсорбированием клеток на меченом флуорохромом эфрине B2 с последующей сортировкой клеток на клеточном сортере с возбуждением флуоресценции (FACS).
Альтернативно использование клеток селезенки и/или B-клеток либо других PBLs из неиммунизированного донора обеспечивает лучшую репрезентативность возможной популяции антител, а также позволяет создавать библиотеку антител, используя любые виды животных (человека или отличных от человека), для которых эфрин B2 не является антигеном. Для библиотек, получаемых конструированием гена антитела in vitro, у субъекта забирают стволовые клетки, чтобы получить нуклеиновые кислоты, кодирующие нереаранжированные сегменты гена антитела. Интересующие иммунные клетки можно получать из множества видов животных, таких как человек, мышь, крыса, зайцеобразные, волки, псовые, кошачьи, свиньи, крупный рогатый скот, лошади и разные виды птиц и так далее.
Нуклеиновые кислоты, кодирующие вариабельные генные сегменты антитела (включая VH- и VL-сегменты), извлекают из интересующих клеток и амплифицируют. В случае библиотек реаранжированных генов VH и VL, нужную ДНК можно получать, выделяя геномную ДНК или мРНК из лимфоцитов, а затем проводя полимеразную цепную реакцию (ПЦР) с праймерами, совмещающими 5'- и 3'-концы реаранжированных генов VH и VL, как описано в Orlandi et al., Proc. Natl. Acad. Sci. (USA), 86: 3833-3837 (1989), тем самым создавая разнообразные популяции V-генов для экспрессии. V-гены можно амплифицировать с кДНК и геномной ДНК с обратными праймерами на 5'-конце экзона, кодирующего зрелый V-домен и прямыми праймерами, расположенными внутри J-сегмента, как описано в Orlandi et al. (1989) и в Ward et al., Nature, 341: 544-546 (1989). Однако для амплифицирования с кДНК обратные праймеры могут также располагаться в лидерном экзоне, как описано в Jones et al., Biotechnol., 9: 88-89 (1991), и прямые праймеры - внутри константной области, как описано в Sastry et al., Proc. Natl. Acad. Sci. (USA), 86:5728-5732 (1989). Чтобы максимально увеличить комплементарность, в праймеры можно включать вырожденность кода, как описано в Orlandi et al. (1989) или Sastry et al. (1989). Предпочтительно максимально увеличивать разнообразие библиотеки, используя праймеры для ПЦР, направленные на каждое семейство V-генов, чтобы амплифицировать все доступные расположения VH и VL, имеющиеся в образце нуклеиновой кислоты из иммунной клетки, например, как описано в методе Marks et al., J. Mol. Biol, 222: 581-597 (1991) или как описано в методе Orum et al., Nucleic Acids Res., 21: 4491-4498 (1993). Для клонирования амплифицированной ДНК в векторы экспрессии в праймер ПЦР можно вводить редкие сайты рестрикции в качестве метки на одном конце, как описано в Orlandi et al. (1989), или дополнительной амплификацией ПЦР с меченым праймером, как описано в Clackson et al., Nature, 352: 624-628 (1991).
Популяции искусственно реаранжированных V-генов можно получать in vitro из сегментов V-гена. Большинство сегментов VH-гена человека были клонированы и секвенированы (описано в Tomlinson et al., J. Mol. Biol., 227: 776-798 (1992)), а также картированы (описано в Matsuda et al., Nature Genet., 3:88-94 (1993); данные клонированные сегменты (включая все основные конформации H1- и H2-петли) можно использовать для получения различных популяций VH-гена с праймерами ПЦР, кодирующими H3-петли различной последовательности и длины, как описано в Hoogenboom and Winter, J. Mol. Biol., 227: 381-388 (1992). Популяции VH можно также получать со всем разнообразием последовательности, сфокусированной в длинной H3-петле одной длины, как описано в Barbas et al., Proc. Natl. Acad. Sci. USA, 89: 4457-4461 (1992). Человеческие Vκ- и Vλ-сегменты были клонированы и секвенированы (описано в Williams and Winter, Eur. J. Immunol., 23: 1456-1461 (1993)) и могут быть использованы для получения искусственных популяций легких цепей. Искусственные V-генные популяции на основе ассортимента изгибов VH и VL, а также длин L3 и H3, будут кодировать антитела со значительным структурным разнообразием. После амплификации молекул ДНК, кодирующих V-гены, гаметические V-генные сегменты могут быть реаранжированы in vitro по методам Hoogenboom and Winter, J. Mol. Biol., 227: 381-388 (1992).
Популяции фрагментов антител могут быть получены путем комбинирования VH- и VL-генных популяций вместе различными способами. Каждую популяцию можно создавать в разных векторах и векторы рекомбинировать in vitro, например, как описано в Hogrefe et al., Gene, 128: 119-126 (1993), или in vivo с помощью комбинаторной инфекции, например, системы loxP, описанной в Waterhouse et al., Nucl. Acids Res., 21: 2265-2266 (1993). В подходе с рекомбинацией in vivo используют двухцепочечную природу Fab-фрагментов, чтобы преодолеть ограничение по размеру библиотеки, налагаемое эффективностью трансформации E. coli. Исходные популяции VH и VL клонируют отдельно, одну в фагмид, а другую в фаговый вектор. Затем две библиотеки объединяют путем фаговой инфекции фагмид-содержащей бактерии таким образом, что каждая клетка содержит разное сочетание, и размер библиотеки ограничивается только числом имеющихся клеток (примерно 1012 клонов). Оба вектора содержат сигналы рекомбинации in vivo так, что гены VH и VL рекомбинируются в один репликон и совместно упаковываются в фаговые вирионы. Такие огромные библиотеки обеспечивают большое количество различных антител с хорошей аффинностью (Kd -1 составляет примерно 10-8 M).
Альтернативно популяции можно клонировать последовательно в тот же самый вектор, например, как описано в Barbas et al., Proc. Natl Acad. Sci. USA, 88: 7978-7982 (1991), или собирать вместе с помощью ПЦР, а затем клонировать, например, как описано в Clackson et al., Nature, 352: 624-628 (1991). Сборку с помощью ПЦР можно также использовать, чтобы соединить молекулы ДНК VH и VL с ДНК, кодирующей гибкий пептидный спейсер, для образования популяции одноцепочечных Fv (scFv). По еще одной методике «внутриклеточную ПЦР-сборку» используют, чтобы объединить гены VH и VL в лимфоцитах при помощи ПЦР, а затем клонировать популяции связанных генов, как описано в Embleton et al., Nucl. Acids Res., 20: 3831-3837 (1992).
Антитела, полученные с помощью исходных библиотек (либо природных, либо искусственных), могут иметь измененную аффинность (Kd -1 составляет примерно 106-107 M-1), однако созревание аффинности можно также имитировать in vitro, конструируя и повторно отбирая из вторичных библиотек, как описано в Winter et al. (1994), выше. Например, можно случайным образом вводить мутации in vitro, используя ошибочно-направленную полимеразу (описано в Leung et al., Technique, 1: 11-15 (1989)) по методу Hawkins et al., J. Mol. Biol., 226: 889-896 (1992) или по методу Gram et al., Proc. Natl. Acad. Sci. USA, 89: 3576-3580 (1992). Кроме того, созревание аффинности можно осуществлять, случайным образом проводя мутацию одного или более CDR, например используя ПЦР с праймерами, несущими произвольное перекрытие последовательности в интересующем CDR в выбранных отдельных клонах Fv, и проводя скрининг на клоны с большей аффинностью. В WO 9607754 (опубликовано 14 марта 1996 г.) описан способ индуцирования мутагенеза в определяющей комплементарность области легкой цепи иммуноглобулина, чтобы получить библиотеку генов легкой цепи. Другой эффективный подход заключается в том, чтобы рекомбинировать VH- или VL-домены, выбранные при помощи фагового дисплея, с популяциями природных вариантов V-домена, полученных от неиммунизированных доноров, и проводить скрининг на более высокую аффинность в нескольких циклах перетасовки цепи, как описано в Marks et al., Biotechnol., 10: 779-783 (1992). Такая методика позволяет продуцировать антитела и фрагменты антител с величинами аффинности в диапазоне 10-9 M.
Последовательность нуклеиновой кислоты и аминокислотная последовательность эфрина B2 известны в данной области. Последовательность нуклеиновой кислоты, кодирующей эфрин B2, может быть рассчитана на основе аминокислотной последовательности нужной области эфрина B2. Альтернативно можно использовать последовательность кДНК (или ее фрагментов) образца GenBank № NM_004093. Нуклеиновые кислоты, кодирующие эфрин B2, можно получать различными способами, известными в данной области. Данные способы включают, но не ограничиваются ими, химический синтез любым из методов, описанных в Engels et al., Agnew. Chem. Int. Ed. Engl., 28: 716-734 (1989), таких как триэфирный, фосфитный, фосфорамидитный и H-фосфонатный методы. В одном варианте осуществления кодоны, предпочтительные с точки зрения экспрессирующей клетки-хозяина, используют в конструировании ДНК, кодирующей эфрин B2. Альтернативно ДНК, кодирующую эфрин B2, можно выделять из геномной или кДНК библиотеки.
После создания молекулы ДНК, кодирующей эфрин B2, молекулу ДНК функционально связывают с контролирующей экспрессию последовательностью в векторе экспрессии, таком как плазмида, где контролирующая последовательность узнается клеткой-хозяином, трансформированной вектором. Как правило, плазмидные векторы содержат последовательности репликации и контроля, которые происходят из видов, совместимых с клеткой-хозяином. Обычно в векторе имеется сайт репликации, а также последовательности, которые кодируют белки, которые способны обеспечить фенотипический отбор в трансформированных клетках. Подходящие векторы для экспрессии в прокариотических и эукариотических клетках-хозяевах известны в данной области, и некоторые дополнительно приведены в данном описании. Можно использовать эукариотические организмы, такие как дрожжи, или клетки, полученные от многоклеточных организмов, таких как млекопитающие.
При желании ДНК, кодирующую эфрин B2, функционально связывают с секреторной лидерной последовательностью, что приводит к секреции продукта экспрессии клеткой-хозяином в культуральную среду. Примеры секреторных лидерных последовательностей включают stII, экотин, lamB, GD герпеса, lpp, щелочную фосфатазу, инвертазу и альфа-фактор. Также подходящей для использования в данном описании является 36-аминокислотная лидерная последовательность протеина A (Abrahmsen et al., EMB0 J., 4: 3901 (1985)).
Клетки-хозяева трансфецируют и предпочтительно трансформируют вышеуказанными векторами экспрессии или клонирования по данному изобретению и культивируют в обычной питательной среде, модифицированной таким образом, чтобы индуцировать промоторы, отбирать трансформанты или амплифицировать гены, кодирующие нужные последовательности.
Трансфекция означает поглощение вектора экспрессии клеткой-хозяином независимо от того, экспрессируется ли в действительности или нет какая-либо кодирующая последовательность. Множество методов трансфекции известны рядовому квалифицированному специалисту, например преципитация CaPO4 и электропорация. Успешную трансфекцию обычно определяют по наличию любого показателя деятельности данного вектора в клетке-хозяине. Методы трансфекции хорошо известны в данной области и некоторые из них дополнительно приведены в данном описании.
Трансформация означает введение ДНК в организм таким образом, что ДНК является реплицируемой либо как внехромосомный, либо как интегрированный в хромосому элемент. В зависимости от используемой клетки-хозяина трансформацию проводят, используя стандартные методы, подходящие для данных клеток. Способы трансформации хорошо известны в данной области и некоторые из них дополнительно приведены в данном описании.
Прокариотические клетки-хозяева, используемые для продуцирования эфрина B2, можно культивировать в основном, как описано в Sambrook et al., выше.
Клетки-хозяева млекопитающих, используемые для продуцирования эфрина B2, можно культивировать в различных средах, которые хорошо известны в данной области, и некоторые из них дополнительно приведены в данном описании.
Клетки-хозяева, упомянутые в данном описании, включают клетки в культуре in vitro, а также клетки, находящиеся в животном-хозяине.
Очистку эфрина B2 можно проводить принятыми в данной области способами, некоторые из которых приведены в данном описании.
Очищенный эфрин B2 можно прикреплять к подходящей матрице, такой как агарозные гранулы, ариламидные гранулы, стеклянные гранулы, целлюлоза, различные акриловые сополимеры, гидроксилметакрилатные гели, полиакриловые и полиметакриловые сополимеры, нейлон, нейтральные и ионные носители и тому подобное, для использования при разделении методом аффинной хроматографии клонов фагового дисплея. Прикрепление белка эфрина B2 к матрице можно выполнять методами, описанными в Methods in Enzymology, vol. 44 (1976). Общепринятая методика прикрепления белковых лигандов к полисахаридным матрицам, например агарозе, декстрану или целлюлозе, включает активацию носителя галогенцианами и последующее связывание первичных алифатических или ароматических аминов пептидного лиганда с активированной матрицей.
Альтернативно эфрин B2 может быть использован для покрытия лунок адсорбирующих планшетов, экспрессирован на клетках-хозяевах, прикрепленных к адсорбирующим планшетам, или использован в сортировке клеток, либо конъюгирован с биотином для фиксирования на покрытых стрептавидином гранулах, либо использован в любой другой методике, известной в данной области, для разделения методом пэннинга фагово-дисплейных библиотек.
Образцы фаговой библиотеки приводят в контакт с иммобилизованным эфрином B2 в условиях, подходящих для связывания, по меньшей мере, части фаговых частиц с адсорбентом. Обычно условия, включая pH, ионную силу, температуру и тому подобное, выбирают так, чтобы имитировать физиологические условия. Фаги, связавшиеся с твердой фазой, промывают и затем элюируют кислотой, например, как описано в Barbas et al., Proc. Natl. Acad. Sci USA, 88: 7978-7982 (1991), либо щелочью, например, как описано в Marks et al., J. Mol. Biol., 222: 581-597 (1991), либо путем конкуренции с антигеном эфрином B2, например, по методике, аналогичной методике антигенной конкуренции Clackson et al., Nature, 352: 624-628 (1991). Фаги могут быть обогащены в 20-1000 раз за один цикл селекции. Кроме того, обогащенные фаги можно наращивать в бактериальной культуре и подвергать дополнительным циклам селекции.
Эффективность селекции зависит от многих факторов, включая кинетику диссоциации в процессе промывания, а также от того, могут ли множественные фрагменты антитела на одном фаге одновременно связываться с антигеном. Антитела с быстрой кинетикой диссоциации (и слабой аффинностью связывания) можно удерживать, используя кратковременные промывки, мультивалентный фаговый дисплей и высокую плотность покрытия антигена в твердой фазе. Высокая плотность не только стабилизирует фаги за счет мультивалентных взаимодействий, но также способствует повторному связыванию фага, который диссоциировал. Выбору антител с медленной кинетикой диссоциации (и высокой аффинностью связывания) может способствовать использование длительных промывок и одновалентного фагового дисплея, как описано в Bass et al., Proteins, 8: 309-314 (1990) и в WO 92/09690, а также низкой плотности покрытия антигена, как описано в Marks et al., Biotechnol., 10: 779-783 (1992).
Можно выбирать между фаговыми антителами с разной аффинностью к эфрину B2, даже если величины аффинности различаются незначительно. Однако вероятно, что случайная мутация выбранного антитела (например, как происходит в некоторых методиках для созревания аффинности, описанных выше) приведет к появлению многих мутантов, большинство из которых свяжется с антигеном, и некоторые из них с большей аффинностью. При ограничении по эфрину B2 редкий фаг с высокой аффинностью может быть конкурентно вытеснен. Чтобы удержать всех мутантов с высокой аффинностью, фаги можно инкубировать с избытком биотинилированного эфрина B2, но при этом концентрация биотинилированного эфрина B2 должна быть меньшей молярности, чем целевая молярная константа аффинности для эфрина B2. Фаги, связывающиеся с высокой аффинностью, затем могут быть захвачены при помощи покрытых стрептавидином парамагнитных гранул. Такой «равновесный захват» позволяет выбирать антитела в соответствии с их аффинностями связывания с чувствительностью, которая дает возможность выделять клоны мутантов с аффинностью, повышенной всего лишь в два раза, из большого избытка фагов с более низкой аффинностью. Можно также изменять условия, применяемые при промывании фагов, связанных с твердой фазой, чтобы проводить разделение на основе кинетики диссоциации.
Клоны анти-эфрин B2 можно выбирать по активности. В одном варианте осуществления изобретение относится к антителам к эфрину В2, которые блокируют связывание между EphB-рецептором (таким, как EphB1, EphB2 и/или EphB3) и эфрином B2, но не блокируют связывание между EphB-рецептором и вторым белком (таким, как эфрин B1 и/или эфрин B3). Клоны Fv, соответствующие таким антителам к эфрину В2, можно выбирать: (1) выделяя анти-эфрин B2 клоны из фаговой библиотеки, как описано выше, и необязательно амплифицируя выделенную популяцию фаговых клонов путем выращивания популяции на походящем бактериальном хозяине, (2) выбирая эфрин B2 и второй белок, против которых желательны блокирующая и неблокирующая активности соответственно, (3) адсорбируя анти-эфрин B2 фаговые клоны на иммобилизованном эфрине B2, (4) используя избыток второго белка для элюирования любых нежелательных клонов, которые узнают эфрин B2-связывающие детерминанты, которые перекрываются или являются общими со связывающими детерминантами второго белка, и (5) элюируя клоны, которые остались адсорбированными после этапа (4). При желании клоны с нужными блокирующим/ неблокирующим свойствами можно дополнительно обогащать, повторяя процедуры селекции, приведенные в данном описании, один или более раз.
ДНК, кодирующую происходящие из гибридомы моноклональные антитела, или фагово-дисплейные клоны Fv по изобретению легко выделять и секвенировать с помощью стандартных методик (например, используя олигонуклеотидные праймеры, сконструированные, чтобы специфически амплифицировать интересующие кодирующие области тяжелой и легкой цепи из гибридомы или матрицы ДНК фага). После выделения ДНК можно помещать в векторы экспрессии, которые затем трансфецируют в клетки-хозяева, такие как клетки E. coli, COS-клетки обезьян, клетки яичника китайского хомячка (CHO) или клетки миеломы, которые в противном случае не продуцируют белок иммуноглобулина, чтобы осуществить синтез желательных моноклональных антител в рекомбинантных клетках-хозяевах. Обзорные статьи по рекомбинантной экспрессии в бактериях ДНК, кодирующей антитело, включают Skerra et al., Curr. Opinion in Immunol., 5: 256 (1993) и Pluckthun, Immunol. Revs, 130: 151 (1992).
ДНК, кодирующую клоны Fv по изобретению, можно объединять с известными последовательностями ДНК, кодирующими константные области тяжелой цепи и/или легкой цепи (например, подходящие последовательности ДНК можно получить из Kabat et al., выше), чтобы создать клоны, кодирующие полноразмерную или укороченную тяжелую и/или легкую цепи. Будет понятно, что для этой цели можно использовать константные области любого изотипа, включая константные области IgG, IgM, IgA, IgD и IgE, и что такие константные области можно получать от любого человека или любых видов животных. Клон Fv, происходящий от ДНК вариабельного домена одного вида животных (такого, как человек) и затем слитый с ДНК константной области других видов животных с образованием кодирующей последовательности(тей) для «гибридной» полноразмерной тяжелой цепи и/или легкой цепи, попадает под определение «химерное» и «гибридное» антитело, как используют в данном описании. В предпочтительном варианте осуществления клон Fv, происходящий от человеческой вариабельной ДНК, является слитым с человеческой ДНК константной области с образованием кодирующей последовательности(тей) для полностью человеческой полноразмерной или укороченной тяжелой и/или легкой цепей.
ДНК, кодирующую антитело к эфрину В2, происходящее из гибридомы по изобретению, можно также модифицировать, например, замещая кодирующей последовательностью для константных доменов тяжелой и легкой цепи человека гомологичные мышиные последовательности, происходящие из гибридомного клона (например, как в методе Morrison et al., Proc. Natl. Acad. Sci. USA, 81:6851-6855 (1984)). ДНК, кодирующую происходящее из гибридомы или клона Fv антитело или фрагмент, можно дополнительно модифицировать, ковалентно присоединяя к последовательности, кодирующей иммуноглобулин, всю или часть кодирующей последовательности для не-иммуноглобулинового полипептида. Таким образом получают «химерные» или «гибридные» антитела, которые обладают специфичностью связывания происходящих из клона Fv или гибридомного клона антител по изобретению.
Фрагменты антител
Настоящее изобретение охватывает фрагменты антител. При определенных условиях существуют преимущества использования фрагментов антител, а не целых антител. Меньший размер фрагментов способствует быстрому выведению и может обеспечивать облегченный доступ к солидным опухолям.
Разработаны различные методы получения фрагментов антител. Традиционно такие фрагменты получали путем протеолитического расщепления интактных антител (смотри, например, Morimoto et al., Journal of Biochemical and Biophysical Methods, 24:107-117 (1992) и Brennan et al., Science, 229:81 (1985)). Однако в настоящее время такие фрагменты могут быть получены напрямую с помощью рекомбинантных клеток-хозяев. Все Fab, Fv и ScFv-фрагменты антител могут быть экспрессированы в и секретированы из E.coli, тем самым облегчается получение больших количеств таких фрагментов. Фрагменты антител могут быть выделены из фаговых библиотек антител, обсуждаемых выше. Альтернативно Fab'-SH-фрагменты могут быть напрямую получены из E.coli и химически связаны с образованием F(ab')2-фрагментов (Carter et al., Bio/Technology, 10:163-167 (1992)). Согласно другому подходу F(ab')2-фрагменты могут быть напрямую выделены из культуры рекомбинантных клеток-хозяев. Fab и F(ab')2-фрагмент с увеличенным временем полужизни in vivo, содержащий остатки эпитопа, связывающего salvage-рецептор, описаны в патенте США № 5869046. Другие методы получения фрагментов антител будут очевидны для квалифицированного специалиста. В других вариантах осуществления предпочитаемым антителом является одноцепочечный Fv-фрагмент (scFv). Смотри WO 93/16185, патенты США № 571894 и 5587458. Fv и sFv являются единственными разновидностями с интактными паратопами, которые лишены константных областей, и, таким образом, они подходят для снижения неспецифического связывания при применении in vivo. Могут быть сконструированы sFv слитые белки, чтобы получить слияние эффекторного белка либо по амидному, либо по карбоксильному концу sFv. Смотри Antibody Engineering, ed. Borrebaeck, выше. Фрагмент антитела может также являться «линейным антителом», например, как описано в патенте США № 5641870. Такие фрагменты линейного антитела могут быть моноспецифическими или биспецифическими.
Гуманизированные антитела
Настоящее изобретение охватывает гуманизированные антитела. В данной области известны различные способы гуманизирования антител, отличных от человеческих. Например, гуманизированное антитело может иметь один или больше аминокислотных остатков, введенных в него из источника, отличного от человека. Такие отличные от человеческих аминокислотные остатки часто называют «импортными» остатками, их обычно берут из «импортного» вариабельного домена. В основном гуманизацию можно проводить по методу Винтера (Winter) и сотрудников (Jones et al. (1986) Nature, 321:522-525, Riechmann et al. (1988) Nature, 332:323-327, Verhoeyen et al. (1988) Science, 239:1534-1536) путем замещения последовательностей гипервариабельной области соответствующими последовательностями человеческого антитела. Соответственно, такие «гуманизированные» антитела являются химерными антителами (патент США № 4816567), где значительно меньше интактного человеческого вариабельного домена замещено соответствующей последовательностью видов, отличных от человека. Практически, гуманизированные антитела являются типично человеческими антителами, в которых некоторые остатки гипервариабельной области и, возможно, некоторые остатки FR замещены остатками аналогичных сайтов антител грызунов.
Выбор человеческих вариабельных доменов как легких, так и тяжелых, которые будут использованы для получения гуманизированных антител, очень важен для уменьшения антигенности. Согласно так называемому методу «наилучшего соответствия» проводят скрининг последовательности вариабельного домена антитела грызунов против полной библиотеки известных последовательностей человеческих вариабельных доменов. Человеческую последовательность, которая наиболее близка к таковой у грызунов, затем принимают в качестве человеческого каркаса для гуманизированного антитела (Sims et al. (1993) J. Immunol. 151:2296, Chothia et al. (1987) J. Mol. Biol. 196:901). В другом методе используют конкретный каркас, происходящий из консенсусной последовательности всех человеческих антител конкретной подгруппы легкой или тяжелой цепей. Один и тот же каркас может быть использован для нескольких различных гуманизированных антител (Carter et al. (1992) Proc. Natl. Acad. Sci. USA, 89:4285, Presta et al. (1993) J. Immunol, 151:2623).
Кроме того, важно, чтобы антитела были гуманизированы с сохранением высокой аффинности к антигену и других желательных биологических свойств. Для достижения этой цели согласно одному из способов гуманизированные антитела получали методом анализа исходных последовательностей и различных концептуальных гуманизированных продуктов, используя трехмерные модели исходных и гуманизированных последовательностей. Трехмерные модели иммуноглобулинов обычно доступны и известны специалистам в данной области. Доступны компьютерные программы, иллюстрирующие и изображающие возможные трехмерные конформационные структуры выбранных потенциальных последовательностей иммуноглобулинов. Проверка таких изображений дает возможность анализа вероятной роли остатков в функционировании потенциальной последовательности иммуноглобулина, то есть анализа остатков, которые влияют на способность иммуноглобулина-кандидата связывать свой антиген. Таким способом можно выбрать и объединить остатки FR из реципиентных и импортных последовательностей так, чтобы достигнуть желательных характеристик антител, таких как повышенная аффинность к целевому антигену(нам). Как правило, остатки гипервариабельных областей прямо и наиболее значительно оказывают влияние на связывание антигена.
Человеческие антитела
Человеческие антитела к эфрину В2 по данному изобретению могут быть сконструированы путем объединения последовательности(тей) вариабельного домена клона Fv, выбранной из полученных от человека библиотек фагового дисплея, с известной последовательностью(ми) константного домена человека, как описано выше. Альтернативно человеческие моноклональные антитела к эфрину В2 по изобретению можно получать гибридомным способом. Описаны клеточные линии человеческой миеломы и мышино-человеческой гетеромиеломы для производства человеческих моноклональных антител, например, Kozbor J. Immunol, 133:3001 (1984), Brodeur et al., Monoclonal Antibody Production Techniques and Applications, p. 51-63 (Marcel Dekker, Inc., New York, 1987) и Boerner et al., J. Immunol, 147:86 (1991).
В настоящее время существует возможность получать трансгенных животных (например, мышей), которые после иммунизации способны продуцировать всю популяцию человеческих антител при отсутствии эндогенной продукции иммуноглобулинов. Например, было описано, что гомозиготная делеция в гене соединительной области тяжелой цепи (JH) антитела у химерных мышей и мышей-мутантов зародышевой линии приводит к полному ингибированию эндогенной продукции антител. Перенос матрицы генов иммуноглобулинов человеческой зародышевой линии в таких мышей-мутантов зародышевой линии приведет к продуцированию человеческих антител при антигенной стимуляции. Смотри, например, Jakobovits et al., Proc. Natl. Acad. Sci USA, 90:2551 (1993), Jakobovits et al., Nature, 362:255 (1993), Bruggermann et al., Year in Immunol., 7:33 (1993).
Для получения человеческих антител из антител иного происхождения, например антител грызунов, также можно использовать перетасовку генов, где человеческое антитело обладает схожими значениями аффинности и специфичностями с исходным антителом, отличным от человеческого. Согласно этому методу, который также называют «запечатление эпитопа», вариабельная область либо тяжелой, либо легкой цепи фрагмента антитела, отличного от человеческого, полученного методами фагового дисплея, как описано выше, заменяется популяцией генов V-домена человека, создавая популяцию химер scFv или Fab цепи, отличной от человеческой/человеческой цепи. Селекция с помощью антигена приводит к выделению химерных scFv или Fab цепи, отличной от человеческой/человеческой цепи, где человеческая цепь восстанавливает антигенсвязывающий центр, разрушенный при удалении соответствующей цепи, отличной от человеческой, в первичном клоне фагового дисплея, то есть эпитоп направляет («запечатлевает») выбор человеческой цепи-партнера. Когда процесс повторяется для того, чтобы заменить оставшуюся цепь, отличную от человеческой, получается человеческое антитело (смотри PCT WO 93/06213, опубликовано 1 апреля 1993 г.). В отличие от традиционной гуманизации антител, отличных от человеческих, с помощью пересадки CDR данный метод обеспечивает получение полностью человеческих антител, которые не имеют остатков FR или CDR, происходящих не от человека.
Биспецифические антитела
Биспецифические антитела являются моноклональными, предпочтительно человеческими или гуманизированными антителами, которые имеют специфичности связывания, по меньшей мере, для двух разных антигенов. В данном случае одна из специфичностей связывания относится к эфрину B2, а другая относится к любому другому антигену. Типичные биспецифические антитела могут связываться с двумя разными эпитопами белка эфрина B2. Биспецифические антитела можно также применять для локализации цитотоксических средств на клетках, экспрессирующих эфрин B2. Такие антитела имеют спейсер, связывающий эфрин B2, а также спейсер, связывающий цитотоксическое средство (например, сапорин, анти-интерферон α, алкалоид барвинка, А-цепь рицина, метотрексат или гаптен радиоактивного изотопа). Биспецифические антитела можно получать в виде полноразмерных антител или фрагментов антител (например, F(ab')2-биспецифических антител).
Способы получения биспецифических антител известны в данной области. Обычно рекомбинантное получение биспецифических антител основано на совместной экспрессии двух пар «тяжелая цепь-легкая цепь» иммуноглобулинов, где две тяжелые цепи имеют разные специфичности (Milstein and Cuello, Nature, 305: 537 (1983)). Из-за случайной реаранжировки тяжелых и легких цепей иммуноглобулинов такие гибридомы (квадромы) продуцируют потенциальную смесь из 10 различных молекул антител, из которых только одна имеет правильную биспецифическую структуру. Очистка правильной молекулы, которую обычно проводят с помощью поэтапной аффинной хроматографии, является довольно трудоемкой, и выход продукта невелик. Схожие методы раскрыты в WO 93/08829, опубликовано 13 мая, 1993 г. и в Traunecker et al., EMBO J., 10: 3655 (1991).
Согласно другому и более предпочтительному подходу вариабельные домены антитела с желательными специфичностями связывания (паратопы антитело-антиген) сливают с последовательностями константных доменов иммуноглобулинов. Слияние предпочтительно осуществляют с константным доменом тяжелой цепи иммуноглобулина, содержащим, по меньшей мере, часть шарнирной, CH2- и CH3-областей. Предпочтительно, чтобы, по меньшей мере, в одном из слияний присутствовала первая константная область (CH1) тяжелой цепи, содержащая сайт, необходимый для связывания легкой цепи. Молекулы ДНК, кодирующие слитые тяжелые цепи иммуноглобулина и, если требуется, легкие цепи иммуноглобулина, вводят в отдельные векторы экспрессии и совместно трансфецируют в подходящий организм-хозяин. Это обеспечивает большую гибкость при коррекции взаимных пропорций трех полипептидных фрагментов в вариантах осуществления, когда неравные соотношения трех полипептидных цепей, используемых в конструкции, обеспечивают оптимальные выходы. Однако можно вводить кодирующие последовательности для двух или всех трех полипептидных цепей в один вектор экспрессии, когда экспрессия, по меньшей мере, двух полипептидных цепей в равных долях приводит к высоким выходам или когда соотношения не имеют особенной значимости.
В предпочтительном варианте осуществления данного подхода биспецифические антитела составлены из гибридной тяжелой цепи иммуноглобулина с первой специфичностью связывания на одном спейсере и гибридной пары тяжелой цепи и легкой цепи иммуноглобулина (обеспечивающей вторую специфичность связывания) на другом спейсере. Было обнаружено, что такая асимметричная структура облегчает отделение желательного биспецифического соединения от нежелательных сочетаний цепей иммуноглобулина, поскольку присутствие легкой цепи иммуноглобулина только в половине биспецифических молекул обеспечивает более легкий способ разделения. Этот подход описан в WO 94/04690. Дополнительные подробности получения биспецифических антител смотри, например, в Suresh et al., Methods in Enzymology, 121:210 (1986).
Согласно другому подходу границу раздела между парой молекул антител можно спроектировать так, чтобы максимально увеличить процентное содержание гетеродимеров, которые извлекают из культуры рекомбинантных клеток. Предпочтительная граница раздела включает, по меньшей мере, часть CH3-домена константного домена антитела. В данном методе одну или более малых боковых цепей аминокислот с границы раздела первой молекулы антитела заменяют более крупными боковыми цепями (например, тирозином или триптофаном). Компенсаторные «полости» идентичного или схожего с крупной боковой цепью(ми) размера создаются на границе раздела второй молекулы антитела путем замены крупных боковых цепей аминокислот на меньшие (например, аланин или треонин). Это обеспечивает механизм увеличения выхода гетеродимера по сравнению с другими нежелательными конечными продуктами, такими как гомодимеры.
Биспецифические антитела включают перекрестно сшитые или «гетероконъюгатные» антитела. Например, одно из антител в гетероконъюгате может быть сшито с авидином, другое - с биотином. Такие антитела, например, были предложены для нацеливания клеток иммунной системы на нежелательные клетки (патент США № 4676980) и для лечения ВИЧ-инфекции (WO 91/00360, WO 92/00373 и EP 03089). Гетероконъюгатные антитела можно получать с помощью любого общепринятого метода перекрестного сшивания. Подходящие перекрестно сшивающие средства хорошо известны в данной области и раскрыты в патенте США № 4676980 вместе с некоторыми из методов перекрестного сшивания.
Методы получения биспецифических антител из фрагментов антител также описаны в литературе. Например, биспецифические антитела можно получать с помощью химической сшивки. Brennan et al., Science, 229: 81 (1985) описывают методику, по которой интактные антитела протеолитически расщепляют, чтобы получить F(ab')2 фрагменты. Такие фрагменты восстанавливают в присутствии дитиолового комплексообразователя арсенита натрия для стабилизации соседних дитиолов и предотвращения образования межмолекулярных дисульфидов. Затем полученные Fab'-фрагменты превращают в тионитробензоатные (TNB) производные. Затем одно из Fab'-TNB производных превращают обратно в Fab'-тиол путем восстановления меркаптоэтиламином и смешивают с эквимолярным количеством другого Fab'-TNB-производного для образования биспецифического антитела. Полученные биспецифические антитела можно применять в качестве средств избирательной иммобилизации ферментов.
Современный прогресс облегчил прямое выделение из E.coli Fab'-SH фрагментов, которые можно химически соединять для образования биспецифических антител. Shalaby et al., J. Exp. Med., 175:217-225 (1992) описывают получение молекулы F(ab')2 полностью гуманизированного биспецифического антитела. Каждый Fab' фрагмент был отдельно секретирован из E.coli и подвергнут прямому химическому присоединению in vitro для образования биспецифического антитела. Образованное таким образом биспецифическое антитело было способно связываться с клетками, избыточно экспрессирующими рецептор HER2, и нормальными человеческими Т-клетками, а также запускать литическую активность человеческих цитотоксических лимфоцитов в отношении мишеней опухоли молочной железы человека.
Также описаны различные методы получения и выделения фрагментов биспецифических антител напрямую из культуры рекомбинантных клеток. Например, биспецифические антитела получали с помощью лейциновых «застежек». Kostelny et al., J. Immunol, 148(5):1547-1553 (1992). Пептиды лейциновой «застежки» из белков Fos и Jun присоединяли к Fab'-частям двух различных антител путем генного слияния. Гомодимеры антител восстанавливали в шарнирной области для образования мономеров и затем вновь окисляли для образования гетеродимеров антител. Такой метод также можно использовать для получения гомодимеров антител. Технология «димеров», описанная Hollinger et al., Proc. Natl Acad. Sci. USA, 90:6444-6448 (1993) дала альтернативный механизм получения фрагментов биспецифических антител. Фрагменты содержат вариабельный домен тяжелой цепи (VH), соединенный с вариабельным доменом легкой цепи (VL) с помощью линкера, который слишком короток, чтобы позволить образование пар между двумя доменами одной и той же цепи. Соответственно, VH и VL-домены одного фрагмента вынужденно образуют пары с комплементарными VL и VH-доменами другого фрагмента, создавая, таким образом, два антигенсвязывающих центра. Также сообщают о другой стратегии получения фрагментов биспецифических антител путем использования димеров одноцепочечных Fv (sFv). Смотри Gruber et al., J. Immunol, 152:5368 (1994).
Предусмотрены и антитела с более чем двумя валентностями. Например, можно получать триспецифические антитела. Tutt et al. J. Immunol. 147:60 (1991).
Мультивалентные антитела
Мультивалентное антитело может быть интернализировано (и/или катаболизировано) быстрее, чем бивалентное антитело, клеткой, экспрессирующей антиген, с которым связывается антитело. Антитела по настоящему изобретению могут являться мультивалентными антителами (иного, чем IgM, класса) с тремя или более антигенсвязывающими центрами (например, тетравалентными антителами), которые легко получить рекомбинантной экспрессией нуклеиновой кислоты, кодирующей полипептидные цепи данного антитела. Мультивалентное антитело может содержать домен димеризации, а также три или более антигенсвязывающих центров. Предпочтительный домен димеризации содержит (или состоит из) Fc-область или шарнирную область. По данному сценарию антитело будет содержать Fc-область и три или более антигенсвязывающих центров, аминоконцевых по отношению к Fc-области. В данном описании предпочтительное мультивалентное антитело содержит (или состоит из) от трех до примерно восьми, но предпочтительно четыре, антигенсвязывающих центра. Мультивалентное антитело содержит, по меньшей мере, одну полипептидную цепь (а предпочтительно две полипептидные цепи), где полипептидная цепь(пи) содержит два или более вариабельных доменов. Например, полипептидная цепь(пи) может содержать VD1-(X1)n-VD2-(X2)n-Fc, где VD1 представляет собой первый вариабельный домен, VD2 представляет собой второй вариабельный домен, Fc представляет собой одну полипептидную цепь Fc-области, X1 и X2 представляют собой аминокислоту или полипептид и n равно либо 0, либо 1. Например, полипептидная цепь(пи) может содержать: цепь VH-CH1-гибкий линкер-VH-CH1-Fc-область или цепь VH-CH1-VH-CH1-Fc-область. В данном описании мультивалентное антитело предпочтительно дополнительно содержит, по меньшей мере, два (а предпочтительно четыре) полипептида вариабельного домена легкой цепи. В данном описании мультивалентное антитело может, например, содержать от примерно двух до примерно восьми полипептидов вариабельного домена легкой цепи. Полипептиды вариабельного домена легкой цепи, предусмотренные в данном описании, содержат вариабельный домен легкой цепи и необязательно дополнительно содержат CL-домен.
Варианты антител
В некоторых вариантах осуществления предусмотрена модификация(и) аминокислотной последовательности антител, приведенных в данном описании. Например, может оказаться желательным повысить аффинность связывания и/или другие биологические свойства антитела. Варианты аминокислотной последовательности антитела получали путем введения соответствующих нуклеотидных изменений в нуклеиновую кислоту антитела или с помощью пептидного синтеза. Такие модификации включают, например, делеции, и/или вставки, и/или замены остатков в аминокислотных последовательностях антител. Любые сочетания делеций, вставок и замен осуществляют для того, чтобы составить конечную конструкцию, с условием, что конечная конструкция обладает желательными характеристиками. Изменения аминокислот можно вносить в испытуемую аминокислотную последовательность антитела в момент, когда создают эту последовательность.
Полезный метод выявления определенных остатков или областей антитела, являющихся предпочтительными зонами для мутагенеза, называют «аланин-сканирующим мутагенезом», как описано в Cunningham and Wells (1989) Science, 244:1081-1085. Здесь выявляют остаток или группу целевых остатков (например, заряженные остатки, такие как Arg, Asp, His, Lys, и Glu) и заменяют на нейтральные или отрицательно заряженные аминокислоты (наиболее предпочтительно на аланин или полиаланин), чтобы повлиять на взаимодействие аминокислот с антигеном. Те аминокислотные положения, которые проявляют функциональную чувствительность к заменам, затем оптимизируют, вводя дополнительные или другие варианты на или для сайтов замещения. Таким образом, в то время как сайт для введения вариации аминокислотной последовательности определен заранее, природу мутации саму по себе предопределять необязательно. Например, для анализа проявления мутации на определенном сайте выполняют аланиновое сканирование или случайный мутагенез по целевому кодону или области и проводят скрининг экспрессированных иммуноглобулинов на желательную активность.
Вставки в аминокислотную последовательность включают амино- и/или карбокси-концевые слияния в диапазоне длины от одного остатка до полипептидов, содержащих сто и более остатков, а также вставки внутрь последовательности одного или множества аминокислотых остатков. Примеры концевых вставок включают антитело с N-концевым остатком метионина либо антитело, слитое с цитотоксическим полипептидом. Другие варианты молекулы антитела со вставками включают слияние по N- или C-концу антитела с ферментом (например, для ADEPT) или с полипептидом, который увеличивает время полужизни антитела в сыворотке.
Гликозилирование полипептидов обычно бывает связанным либо с N, либо с O. N-связанное означает присоединение углеводного фрагмента к боковой цепи остатка аспарагина. Последовательности трипептидов аспарагин-Х-серин и аспарагин-Х-треонин, где Х представляет собой любую аминокислоту, кроме пролина, являются последовательностями узнавания для ферментативного присоединения углеводного фрагмента к боковой цепи аспарагина. Таким образом, наличие какой-либо из данных трипептидных последовательностей в полипептиде создает потенциальный сайт гликозилирования. О-связанное гликозилирование означает присоединение одного из сахаров N-ацетилгалактозамина, галактозы или ксилозы к гидроксиаминокислоте, чаще всего к серину или треонину, хотя можно использовать и 5-гидроксипролин, и 5-гидроксилизин.
Добавление сайтов гликозилирования к антителу удобно выполнять, изменяя аминокислотную последовательность так, чтобы она содержала одну или более из описанных выше трипептидных последовательностей (для сайтов N-связанного гликозилирования). Это изменение можно также осуществлять добавлением одного или более сериновых или треониновых остатков или заменой на них в аминокислотной последовательности исходного антитела (для сайтов О-связанного гликозилирования).
Там, где антитело содержит Fc-область, может быть изменен присоединенный к ней углевод. Например, антитела с развитой углеводной структурой, в которой отсутствует фукоза, присоединенная к Fc-области антитела, описаны в патентной заявке США 2003/0157108 (Presta, L.). Смотри также США 2004/0093621 (Kyowa Hakko Kogyo Co., Ltd). Антитела с разделяющим пополам N-ацетилглюкозамином (GlcNAc) в углеводе, присоединенном к Fc-области антитела, приведены в WO 2003/011878, Jean-Mairet et al. и патенте США № 6602684, Umana et al. Антитела с, по меньшей мере, одним остатком галактозы в олигосахариде, присоединенном к Fc-области антитела, описаны в WO 1997/30087, Patel et al. Смотри также WO 1998/58964 (Raju, S.) и WO 1999/22764 (Raju, S.) относительно антител с измененными углеводами, присоединенными к их Fc-области. Смотри также США 2005/0123546 (Umana et al.) по антигенсвязывающим молекулам с модифицированным гликозилированием.
В данном описании предпочтительный вариант гликозилирования представляет собой Fc-область, где в углеводной структуре, присоединенной к Fc-области, отсутствует фукоза. Такие варианты обладают улучшенной функцией ADCC. Fc-область необязательно дополнительно содержит одну или более аминокислотных замен, которые дополнительно улучшают ADCC, например, замены в положениях 298, 333 и/или 334 в Fc-области (европейская нумерация остатков). Примеры публикаций, относящихся к «дефукозилированным» или «фукозо-дефицитным» антителам, включают: US 2003/0157108, WO 2000/61739, WO 2001/29246, US 2003/0115614, US 2002/0164328, US 2004/0093621, US 2004/0132140, US 2004/0110704, US 2004/0110282, US 2004/0109865, WO 2003/085119, WO 2003/084570, WO 2005/035586, WO 2005/035778, WO2005/053742, Okazaki et al. J. Mol. Biol. 336:1239-1249 (2004), Yamane-Ohnuki et al. Biotech. Bioeng. 87: 614 (2004). Примеры клеточных линий, продуцирующих дефукозилированные антитела, включают клетки Lec13 CHO, лишенные фукозилирования белка (Ripka et al. Arch. Biochem. Biophys. 249:533-545 (1986), патентная заявка США № US 2003/0157108 A1, Presta, L и WO 2004/056312 A1, Adams et al., особенно в примере 11), и нокаутные клеточные линии, такие как по гену альфа-1,6-фукозилтрансферазы, FUT8, нокаутные CHO клетки (Yamane-Ohnuki et al. Biotech. Bioeng. 87:614 (2004)).
Другой тип варианта представляет собой вариант с аминокислотной заменой. Такие варианты имеют, по меньшей мере, один аминокислотный остаток в молекуле антитела, замененный другим остатком. Вызывающие наибольший интерес сайты для мутагенеза замещения включают гипервариабельные области, но также предусмотрены и изменения FR. Консервативные замены представлены в таблице 1 под заголовком «Предпочтительные замены». Если такие замены приводят к изменению биологической активности, вслед за этим более значительные изменения, обозначенные в таблице 1 как «Типовые замены» или как дополнительно описывается ниже в ссылке на классы аминокислот, могут быть внесены и проведен скрининг продуктов.
Таблица 1
Существенных модификаций биологических свойств антитела достигают путем отбора замен, которые значительно различаются по своему влиянию на поддержание: (a) структуры полипептидного скелета в области замен, например, в виде конформации слоя или спирали, (b) заряда или гидрофобности молекулы в целевом сайте или (c) величины боковых цепей. Остатки естественного происхождения разделили на группы на основании общих свойств боковых цепей:
(1) гидрофобные: норлейцин, Met, Ala, Val, Leu, Ile,
(2) нейтральные гидрофильные: Cys, Ser, Thr, Asn, Gln,
(3) кислые: Asp, Glu,
(4) основные: His, Lys, Arg,
(5) остатки, влияющие на ориентацию цепи: Gly, Pro, и
(6) ароматические: Trp, Tyr, Phe.
Неконсервативные замены влекут за собой замену члена одного из данных классов на другой класс.
Один тип заместительного варианта включает замещение одного или более остатков гипервариабельной области исходного антитела (например, гуманизированного или человеческого антитела). Как правило, полученный вариант(ы), выбранный для дальнейшего усовершенствования, имеет улучшенные биологические свойства по сравнению с исходным антителом, из которого он образован. Удобный способ получения таких заместительных вариантов включает созревание аффинности при помощи фагового дисплея. Кратко, несколько сайтов гипервариабельной области (например, 6-7 сайтов) подвергали мутации для получения всех возможных аминокислотных замен на каждом сайте. Антитела, полученные таким образом, проявляются из частиц нитчатого фага в виде слитых структур с продуктом гена III M13, упакованных внутри каждой частицы. Затем проводили скрининг фагово-дисплейных вариантов на биологическую активность (например, аффинность связывания), как описано в данном документе. Для того чтобы определить кандидатуры сайтов гипервариабельной области для модификации, можно провести аланин-сканирующий мутагенез для идентификации остатков гипервариабельной области, вносящих значительный вклад в связывание антигена. Альтернативно или дополнительно может быть полезным провести анализ кристаллической структуры комплекса антиген-антитело, чтобы определить точки соприкосновения между антителом и антигеном. Такие контактирующие остатки и соседние остатки являются кандидатами на замещение в соответствии с методиками, разработанными в данном изобретении. Когда такие варианты получены, панель вариантов подвергают скринингу, как описано в данном документе, и антитела с наилучшими свойствами по одному или более анализам могут быть выбраны для дальнейшей разработки.
Молекулы нуклеиновых кислот, кодирующие варианты аминокислотных последовательностей антитела, получали с помощью множества методов, известных в данной области. Такие методы включают, но не ограничиваются ими, выделение из природного источника (в случае вариантов аминокислотной последовательности природного происхождения) либо получение с помощью опосредованного олигонуклеотидами (или направленного) мутагенеза, ПЦР мутагенеза и кассетного мутагенеза ранее полученной вариантной или невариантной версии антитела.
Может оказаться желательным ввести одну или более аминокислотных модификаций в Fc-область иммуноглобулиновых полипептидов по изобретению, тем самым, создавая вариант Fc-области. Вариант Fc-области может содержать человеческую последовательность Fc-области (например, человеческую Fc-область IgG1, IgG2, IgG3 или IgG4), содержащую аминокислотную модификацию (например, замену) по одному или более аминокислотным положениям, включая шарнирный цистеин. В соответствии с данным описанием и доктринами данной науки предусматривается, что в некоторых вариантах осуществления антитело, примененное в методах по изобретению, может содержать одно или более изменений по сравнению с аналогом антитела дикого типа, например, в Fc-области. Данные антитела все же могли бы сохранять в основном те же характеристики, необходимые для терапевтического применения, что и их аналоги дикого типа. Например, считается, что в Fc-области можно осуществить определенные изменения, которые приведут к измененным (то есть либо повышенным, либо пониженным) связыванию C1q и/или комплементзависимой цитотоксичности (CDC), например, как описано в WO99/51642. Смотри также Duncan & Winter Nature 322:738-40 (1988), патент США № 5648260, патент США № 5624821 и WO94/29351 относительно других примеров вариантов Fc-области. В WO 00/42072 (Presta) и WO 2004/056312 (Lowman) описывают варианты антител с повышенным и пониженным связыванием FcRs. Содержание данных патентных публикаций специально включено в данное описание посредством ссылок. Смотри также Shields et al. J. Biol. Chem. 9(2):6591-6604 (2001). Антитела с увеличенным временем полужизни и улучшенным связыванием неонатального Fc-рецептора (FcRn), который ответственен за перенос материнских IgG к плоду (Guyer et al., J. Immunol. 117:587 (1976) и Kim et al., J. Immunol. 24:249 (1994)), описаны в US 2005/0014934A1 (Hinton et al.). Данные антитела содержат Fc-область с одной или более заменами в ней, которые улучшают связывание Fc-области с FcRn. Полипептидные варианты с измененными аминокислотными последовательностями Fc-области и повышенной или пониженной способностью связывать C1q описаны в патенте США № 6194551B1, WO 99/51642. Содержание данных патентных публикаций специально включено в данное описание посредством ссылок. Смотри также Idusogie et al. J. Immunol. 164:4178-4184 (2000).
Производные антител
Антитела по настоящему изобретению можно далее модифицировать так, чтобы они содержали дополнительные небелковые фрагменты, известные в данной области и легко доступные. Предпочтительно фрагменты, подходящие для получения производных от антител, являются растворимыми в воде полимерами. Неограничивающие примеры растворимых в воде полимеров включают, но не ограничиваются ими, полиэтиленгликоль (PEG), сополимеры этиленгликоля/пропиленгликоля, карбоксиметилцеллюлозу, декстран, поливиниловый спирт, поливинилпирролидон, поли-1,3-диоксолан, поли-1,3,6-триоксан, сополимер этиленового/малеинового ангидрида, полиаминокислоты (либо гомополимеры, либо случайные сополимеры) и декстран или поли(н-винилпирролидон)полиэтиленгликоль, гомополимеры пропропиленгликоля, сополимеры полипропиленоксида/этиленоксида, полиоксиэтилированные полиспирты (например, глицерин), поливиниловый спирт и их смеси. Пропиональдегид полиэтиленгликоля может иметь преимущества при производстве благодаря своей стабильности в воде. Полимер может быть любого молекулярного веса и может быть разветвленным или неразветвленным. Число полимеров, присоединенных к антителу, может варьировать, и если к антителу присоединено более одного полимера, они могут представлять собой одинаковые или различные молекулы. Как правило, число и/или тип полимеров, используемых для получения производных от антител, можно определить на основании соображений, включающих, но не ограничивающихся ими, конкретные свойства или функции антитела, которые нужно улучшить, будет ли производное антитела использоваться при терапии в заранее определенных условиях и так далее.
Скрининг на антитела с желательными свойствами
Антитела по настоящему изобретению можно характеризовать по их физическим/химическим свойствам и биологическим функциям с помощью различных видов анализа, известных в данной области. В некоторых вариантах осуществления антитела характеризуют по какому-либо одному или по нескольким из следующих параметров: восстановление или блокирование активации эфрина B2, восстановление или блокирование нисходящей молекулярной передачи сигнала эфрина B2, восстановление или блокирование активации эфрин B2-связывающего рецептора Eph (такого, как EphB1, EphB2 и/или EphB3), восстановление или блокирование нисходящей молекулярной передачи сигнала эфрин B2-связывающего рецептора Eph (например, EphB1, EphB2 и/или EphB3), разрушение или блокирование связывания с эфрином B2 эфрин B2-связывающего рецептора Eph (например, EphB1, EphB2 и/или EphB3), фосфорилирование эфрина B2 и/или мультимеризация эфрина B2, и/или фосфорилирование эфрин B2-связывающего рецептора Eph (например, EphB1, EphB2 и/или EphB3), и/или лечение и/или профилактика опухоли, пролиферативного клеточного заболевания или рака, и/или снижение, блокирование или ингибирование ангиогенеза, и/или лечение или профилактика заболеваний, связанных с экспрессией и/или активностью эфрина B2 (такой, как повышенная экспрессия и/или активность эфрина B2).
Очищенные антитела далее можно характеризовать с помощью серии анализов, которые включают, но не ограничиваются ими, N-концевое секвенирование, аминокислотный анализ, высокоэффективную жидкостную хроматографию (ВЭЖХ) по принципу молекулярных сит в неденатурирующих условиях, масс-спектрометрию, ионообменную хроматографию и расщепление папаином.
В определенных вариантах осуществления изобретения полученные, как описано в данном документе, антитела анализируют на их биологическую активность. В некоторых вариантах осуществления антитела по настоящему изобретению проверяют на их антигенсвязывающую активность. Анализы связывания антигена, которые известны в данной области и могут быть применены в данном случае, включают, но не ограничиваются ими, любые анализы прямого или конкурентного связывания с помощью таких методов, как вестерн-блоттинг, радиоиммунологический анализ, ELISA (твердофазный иммуноферментный анализ), иммуноферментные сэндвич-анализы, иммунопреципитационные анализы, иммуноферментные анализы с флуоресцентным усилением и иммуноферментные анализы на основе протеина А. Иллюстративный анализ связывания антигена приводится ниже в разделе «Примеры».
В еще одном варианте осуществления изобретение относится к моноклональным антителам к эфрину B2, которые конкурируют с антителом 31.19, антителом 31.19.1D8 и/или антителом 31.19.2D3 за связывание с эфрином B2. Такие конкурентные антитела включают антитела, которые узнают эпитоп эфрина B2, который является либо тем же, либо перекрывающимся с эпитопом эфрина B2, узнаваемым антителом 31.19, антителом 31.19.1D8 и/или антителом 31.19.2D3. Такие конкурентные антитела можно получать методом скрининга супернатантов гибридом анти-эфрин B2 на связывание с иммобилизованным эфрином B2 при конкуренции с меченым антителом 31.19, антителом 31.19.1D8 и/или антителом 31.19.2D3. Супернатант гибридом, содержащий конкурентное антитело, будет снижать количество связанного меченого антитела, определяемого в анализируемой смеси конкурентного связывания, по сравнению с количеством связанного меченого антитела, определяемого в контрольной смеси связывания, содержащей антитело, не относящееся к делу (или не содержащей никакого). Каждый из анализов конкурентного связывания, описанных в данном документе, подходит для использования в вышеуказанной методике.
В другом аспекте изобретение относится к моноклональному антителу к эфрину B2, которое содержит одну или более (например, 2, 3, 4, 5 и/или 6) HVR антитела 31.19, антитела 31.19.1D8 и/или антитела 31.19.2D3. Моноклональное антитело к эфрину B2, содержащее одну или более HVR антитела 31.19, антитела 31.19.1D8 и/или антитела 31.19.2D3, можно сконструировать с помощью пересадки одной или более HVR антитела 31.19, антитела 31.19.1D8 и/или антитела 31.19.2D3 в матричную последовательность антитела, например в последовательность человеческого антитела, которая ближе всего к соответствующей последовательности исходного антитела мыши, либо в консенсусную последовательность всех человеческих антител конкретной подгруппы легкой и тяжелой цепи исходного антитела, и экспрессирования в рекомбинантных клетках-хозяевах полученной химерной последовательности(тей) вариабельной области легкой и/или тяжелой цепи вместе с или без сопутствующей последовательности(тей) константной области, как описано в данном документе.
Антитела к эфрину В2 по данному изобретению, обладающие уникальными свойствами, приведенными в данном описании, можно получить путем скрининга анти-эфрин B2 гибридомных клонов на желательные свойства любым удобным методом. Например, если требуется моноклональное антитело к эфрину B2, которое блокирует или не блокирует связывание эфрин B2-связывающих партнеров (например, EphB-рецептор) с эфрином B2, антитело-кандидат можно тестировать в анализе конкурентного связывания, таком как ELISA конкурентного связывания, где лунки планшета покрыты эфрином B2, а раствор антитела при избытке интересующего эфрин B2-связывающего партнера наносят на покрытые планшеты, и связавшееся антитело определяют ферментативным путем, например, обеспечивая контакт связавшегося антитела с HRP-конъюгированным антителом к Ig или биотинилированным антителом к Ig и проявляя цветной реакцией HRP, например, обрабатывая планшет конъюгатом стрептавидин-HRP и/или перекисью водорода и определяя цветную реакцию HRP спектрофотометрически при 490 нм с помощью планшетного ридера для ELISA.
Если требуется антитело к эфрину В2, которое ингибирует активацию эфрина B2, антитело-кандидат можно тестировать анализом фосфорилирования эфрина B2. Такие анализы известны в данной области, и один такой анализ описан в разделе «Примеры».
Если требуется антитело к эфрину В2, ингибирующее рост клеток, антитело-кандидат можно тестировать в анализах in vitro и/или in vivo, измеряющих ингибирование клеточного роста. Такие анализы известны в данной области и дополнительно описаны и проиллюстрированы примерами в данном документе.
В одном варианте осуществления настоящее изобретение предусматривает измененное антитело, обладающее некоторыми, но не всеми, эффекторными функциями, что делает его желательным кандидатом для многих приложений, в которых время полужизни антитела in vivo является важным, тогда как отдельные эффекторные функции (такие, как комплемент-зависимая цитотоксичность и ADCC) являются ненужными или вредными. В определенных вариантах осуществления измеряют активности Fc полученного иммуноглобулина, чтобы убедиться в том, что сохраняются только желательные свойства. Можно проводить анализы цитотоксичности in vitro и/или in vivo, чтобы подтвердить снижение/элиминацию активностей CDC и ADCC. Например, можно провести анализы связывания Fc-рецептора (FcR), чтобы гарантировать, что у антитела отсутствует связывание FcγR (и, следовательно, вероятно отсутствует функция ADCC), но сохраняется способность связывать FcRn. Первичные клетки, опосредующие ADCC, клетки NK, экспрессируют только FcγRIII, в то время как моноциты экспрессируют FcγRI, FcγRII и FcγRIII. Обобщенные данные по экспрессии FcR в гематопоэтических клетках приведены в таблице 3 на странице 464 в Ravetch and Kinet, Annu. Rev. Immunol. 9:457-92 (1991). Пример in vitro анализа для оценки активности ADCC интересующей молекулы описан в патенте США № 5500362 или 5821337. Полезные для таких анализов эффекторные клетки включают мононуклеарные клетки периферической крови (PBMC) и натуральные клетки-киллеры (NK). Альтернативно или дополнительно активность ADCC интересующей молекулы можно оценивать in vivo, например, на такой животной модели, которая описана в Clynes et al. PNAS (USA) 95:652-656 (1998). Можно также проводить анализы связывания C1q, чтобы подтвердить, что антитело не способно связывать C1q и, следовательно, у него отсутствует активность CDC. Для оценки активации комплемента можно проводить анализ CDC, например, как описано в Gazzano-Santoro et al., J. Immunol. Methods 202:163 (1996). Можно также проводить определения связывания FcRn и in vivo выведения/полужизни с помощью методов, известных в данной области, например, таких, что описаны в разделе «Примеры».
Векторы, клетки-хозяева и рекомбинантные методы
Для получения антитела по изобретению рекомбинантными методами кодирующую его нуклеиновую кислоту выделяли и встраивали в реплицируемый вектор для последующего клонирования (амплификации ДНК) или для экспрессии. ДНК, кодирующую антитело, легко выделить и секвенировать, применяя стандартные методики (например, с помощью олигонуклеотидных зондов, которые способны специфически связываться с генами, кодирующими тяжелые и легкие цепи антитела). Многие векторы являются доступными. Выбор вектора частично зависит от используемой клетки-хозяина. Как правило, предпочтительные клетки-хозяева бывают либо прокариотического, либо эукариотического (обычно из млекопитающих) происхождения. Будет очевидно, что для этой цели можно использовать константные области любого изотипа, включая константные области IgG, IgM, IgA, IgD и IgE, и что такие константные области можно получать от человека или любых видов животных.
a. Получение антител с помощью прокариотических клеток-хозяев
i. Конструкция вектора
Полинуклеотидные последовательности, кодирующие полипетидные компоненты антитела по данному изобретению, можно получать с помощью стандартных рекомбинантных методов. Желательные полинуклеотидные последовательности могут быть выделены и секвенированы из клеток, продуцирующих антитело, таких как гибридомные клетки. Альтернативно полинуклеотиды могут быть синтезированы с помощью синтезатора нуклеотидов или методов ПЦР. Полученные последовательности, кодирующие полипептиды, встраивают в рекомбинантный вектор, способный реплицироваться и экспрессировать гетерологичные полинуклеотиды в прокариотических хозяевах. Для целей настоящего изобретения можно использовать многие векторы, которые доступны и известны в данной области. Выбор подходящего вектора будет зависеть главным образом от размера нуклеиновых кислот, встраиваемых в этот вектор, и конкретной клетки-хозяина, трансформируемой этим вектором. Каждый вектор содержит различные компоненты, в зависимости от его функции (амплификации или экспрессии гетерологичного полинуклеотида либо и того, и другого) и его совместимости с конкретной клеткой-хозяином, в которой он пребывает. Компоненты вектора обычно включают, но не ограничиваются ими: точку начала репликации, маркерный ген для селекции, промотор, сайт связывания рибосомы (RBS), сигнальную последовательность, вставку гетерологичной нуклеиновой кислоты и последовательность терминации транскрипции.
Как правило, плазмидные векторы, содержащие репликон и контрольные последовательности, происходящие от видов, совместимых с клеткой-хозяином, применяют по отношению к этим хозяевам. Обычно вектор несет в себе сайт репликации, а также маркерные последовательности, которые способны обеспечивать фенотипическую селекцию трансформированных клеток. Например, E.coli обычно трансформируют с помощью pBR322, плазмиды, полученной из видов E.coli. pBR322 содержит гены, кодирующие устойчивость к ампициллину (Amp) и тетрациклину (Tet), и таким образом позволяет легко выявлять трансформированные клетки. pBR322, ее производные и другие бактериальные плазмиды либо бактериофаги могут также содержать или быть модифицированы так, чтобы содержать промоторы, которые могут быть использованы микроорганизмом для экспрессии эндогенных белков. Примеры производных pBR322, использованных для экспрессии конкретных антител, подробно описаны в Carter et al., патент США № 5648237.
Кроме того, фаговые векторы, содержащие репликон и контрольные последовательности, которые совместимы с микроорганизмом-хозяином, могут быть использованы в качестве трансформирующих векторов применительно к таким хозяевам. Например, бактериофаг, такой как λGEM.TM.-11, может быть использован при создании рекомбинантного вектора, который применим для трансформации чувствительных клеток-хозяев, таких как E.coli LE392.
Вектор экспрессии по данному изобретению может содержать две или более пар промотор-цистрон, кодирующих каждый из полипептидных компонентов. Промотор представляет собой нетранслируемую регуляторную последовательность, расположенную выше (5') цистрона, которая регулирует его экспрессию. Обычно прокариотические промоторы разделяют на два класса, индуцируемые и конститутивные. Индуцируемым промотором является промотор, который инициирует повышенные уровни транскрипции цистрона под его контролем в ответ на изменения в условиях культивирования, например присутствие или отсутствие питательного вещества или изменение температуры.
Хорошо известно большое число промоторов, распознаваемых множеством потенциальных клеток-хозяев. Выбранный промотор может быть функционально связан с цистронной ДНК, кодирующей легкую или тяжелую цепь, путем удаления промотора из ДНК источника расщеплением рестрикционными ферментами и вставки выделенной промоторной последовательности в вектор по данному изобретению. Как собственную промоторную последовательность, так и многие гетерологичные промоторы можно использовать, чтобы направлять амплификацию и/или экспрессию целевых генов. В некоторых вариантах осуществления гетерологичные промоторы используют, поскольку обычно они дают возможность более значительной транскрипции или более высоких выходов экспрессируемого целевого гена по сравнению с собственным промотором целевого полипептида.
Промоторы, подходящие для использования в прокариотических хозяевах, включают PhoA промотор, β-галактамазную и лактозную промоторные системы, триптофановую (Trp) промоторную систему и такие гибридные промоторы, как tac или trc промоторы. Однако также подходят и другие промоторы, функциональные в бактериях (такие, как другие известные бактериальные или фаговые промоторы). Их нуклеотидные последовательности опубликованы, таким образом квалифицированный специалист получает возможность функционально сшивать их с цистронами, кодирующими целевые легкие и тяжелые цепи (Siebenlist et al. (1980) Cell 20: 269) с помощью линкеров или адаптеров, чтобы привнести любой требуемый сайт рестрикции.
В одном аспекте данного изобретения каждый цистрон внутри рекомбинантного вектора содержит компонент сигнальной последовательности секреции, который управляет транслокацией экспрессируемых полипептидов через мембрану. Как правило, сигнальная последовательность может являться компонентом вектора или же являться частью ДНК целевого полипептида, которая встроена в вектор. Выбранная для целей данного изобретения сигнальная последовательность должна быть такой, которая узнается и подвергается процессингу (то есть расщепляется сигнальной пептидазой) клеткой-хозяином. Для прокариотических клеток-хозяев, которые не узнают и не подвергают процессингу сигнальные последовательности, собственные для гетерологичных полипептидов, сигнальная последовательность замещается на прокариотическую сигнальную последовательность, выбранную, например, из группы, состоящей из лидерных последовательностей щелочной фосфатазы, пенициллиназы, Ipp или термостабильного энтеротоксина II (STII), LamB, PhoE, Pe1B, OmpA и MBP. В одном варианте осуществления данного изобретения сигнальные последовательности, использованные для обоих цистронов системы экспрессии, являются сигнальными последовательностями STII или их вариантами.
В другом аспекте продукция иммуноглобулинов по данному изобретению может происходить в цитоплазме клетки-хозяина и по этой причине не требует присутствия сигнальных последовательностей секреции в каждом цистроне. В данном случае легкие и тяжелые цепи иммуноглобулинов экспрессируются, сворачиваются и собираются, образуя функциональные иммуноглобулины внутри цитоплазмы. Некоторые штаммы-хозяева (например, штаммы trxB E. coli) обеспечивают цитоплазматические условия, которые благоприятны для образования дисульфидных связей, давая тем самым возможность правильного сворачивания и сборки экспрессированных белковых субъединиц. Proba and Pluckthun Gene, 159:203 (1995).
Прокариотические клетки-хозяева, подходящие для экспрессирования антител по данному изобретению, включают Archaebacteria и Eubacteria, такие как грамотрицательные или грамположительные микроорганизмы. Примеры полезных бактерий включают Escherichia (например, E. coli), Bacilli (например, B. subtilis), Enterobacteria, виды Pseudomonas (например, P. aeruginosa), Salmonella typhimurium, Serratia marcescans, Klebsiella, Proteus, Shigella, Rhizobia, Vitreoscilla или Paracoccus. В одном варианте осуществления используют грамотрицательные клетки. В одном варианте осуществления используют клетки E.coli в качестве хозяев по данному изобретению. Примеры штаммов E.coli включают штамм W3110 (Bachmann, Cellular and Molecular Biology, vol. 2 (Washington, DC: American Society for Microbiology, 1987), p. 1190-1219, депозитный номер ATCC 27325) и его производные, включая штамм 33D3, имеющий генотип W3110 ΔfhuA (ΔtonA) ptr3 lac Iq lacL8 ΔompTΔ (nmpc-fepE) degP41 kanR (патент США № 5639635). Подходящими также являются другие штаммы и их производные, такие как E.coli 294 (ATCC 31446), E.coli B, E.coli λ 1776 (ATCC 31537) и E.coli RV308 (ATCC 31608). Эти примеры являются скорее иллюстративными, чем ограничивающими. Методы конструирования производных любой из вышеуказанных бактерий, имеющих определенный генотип, известны в данной области и описаны, например, в Bass et al., Proteins, 8:309-314 (1990). Обычно необходимо выбрать подходящие бактерии, учитывая возможность репликации репликона в клетках бактерии. Например, виды E.coli, Serratia или Salmonella вполне подходят для использования в качестве хозяина, если хорошо известные плазмиды, такие как pBR322, pBR325, pACYC177 или pKN410, используют для обеспечения репликона. Обычно клетка-хозяин должна секретировать минимальные количества протеолитических ферментов и дополнительные ингибиторы протеаз желательно вносить в культуру клеток.
ii. Продукция антител
Клетки-хозяева трансформируют описанными выше векторами экспрессии и культивируют на стандартных питательных средах, модифицированных так, чтобы они подходили для индукции промоторов, селекции трансформантов или амплификации генов, кодирующих желательные последовательности.
Трансформация означает встраивание ДНК в прокариотического хозяина так, чтобы ДНК являлась реплицируемой либо как внехромосомный элемент, либо как хромосомный интегрант. В зависимости от используемой клетки-хозяина трансформацию проводят с помощью стандартных методов, подходящих для таких клеток. Обработку кальцием с применением хлорида кальция обычно используют для бактериальных клеток, которые имеют значительные барьеры в виде клеточных стенок. По другому методу трансформации используют смесь полиэтиленгликоль/ДМСО. Еще один используемый метод представляет собой электропорацию.
Прокариотические клетки, используемые для продукции полипептидов по данному изобретению, выращивают на средах, известных в данной области и подходящих для культивирования выбранных клеток-хозяев. Примеры подходящих сред включают бульон Лурии (LB) плюс необходимые питательные добавки. В некоторых вариантах осуществления среды также содержат средство селекции, выбранное на основе конструкции вектора экспрессии, чтобы селективно облегчать рост прокариотических клеток, содержащих вектор экспрессии. Например, в среды для роста клеток, экспрессирующих ген устойчивости к ампициллину, добавляют ампициллин.
Любые необходимые добавки помимо источников углерода, азота и неорганического фосфата также могут быть включены в подходящих концентрациях, вводимые как отдельно, так и в виде смеси с другой добавкой или средой, такой как комплексный источник азота. Факультативно культуральная среда может содержать одно или более восстанавливающих средств, выбранных из группы, состоящей из глутатиона, цистеина, цистамина, тиогликолята, дитиоэритритола и дитиотреитола.
Прокариотические клетки-хозяева культивируют при подходящей температуре. Для роста E.coli, например, предпочтительная температура находится в диапазоне от примерно 20°C до примерно 39°C, более предпочтительно от примерно 25°C до примерно 37°C, еще более предпочтительно примерно 30°C. pH среды может соответствовать любому значению pH в диапазоне от примерно 5 до примерно 9, в основном, в зависимости от организма-хозяина. Для E.coli pH предпочтительно составляет от примерно 6,8 до примерно 7,4 и более предпочтительно примерно 7,0.
Если в векторе экспрессии по данному изобретению используют индуцируемый промотор, экспрессию белка индуцируют в условиях, подходящих для активации промотора. В одном аспекте данного изобретения используют промоторы PhoA для контролирования транскрипции полипептидов. Соответственно, трансформированные клетки-хозяева культивируют для индукции на ограниченной по фосфату среде. Предпочтительно, ограниченной по фосфату средой является среда C.R.A.P (смотри, например, Simmons et al., J. Immunol. Methods (2002), 263:133-147). Можно использовать множество других индукторов в соответствии с применяемой конструкцией вектора, как это известно в данной области.
В одном варианте осуществления экспрессируемые полипептиды по настоящему изобретению секретируются внутрь и извлекаются из периплазмы клеток-хозяев. Извлечение белков обычно включает разрушение микроорганизма, как правило, такими методами, как осмотический шок, разрушение ультразвуком или лизис. Когда клетки разрушены, клеточный дебрис и целые клетки можно удалять центрифугированием или фильтрацией. Далее белки можно очищать, например, с помощью хроматографии на аффинной смоле. Альтернативно белки могут транспортироваться в культуральную среду и выделяться непосредственно оттуда. Клетки можно удалять из культуры и культуральный супернатант фильтровать и концентрировать для последующей очистки продуцированных белков. Далее экспрессированные полипептиды можно выделять и идентифицировать с помощью общеизвестных методов, таких как гель-электрофорез в полиакриламидном геле (PAGE) и вестерн-блоттинг.
В одном аспекте данного изобретения продукция антител в больших количествах производится методом ферментации. Для продукции рекомбинантных белков доступны разнообразные крупномасштабные методы ферментации с непрерывной подпиткой. Крупномасштабные ферментеры имеют вместимость, по меньшей мере, 1000 литров, предпочтительно от примерно 1000 до 100000 литров. В таких ферментерах используются агитационные мешалки для распределения кислорода и питательных веществ, особенно глюкозы (предпочтительный источник углерода/энергии). Ферментация малыми партиями означает обычно ферментацию в ферментере, который имеет вместимость по объему не более примерно 100 литров, и она может находиться в пределах от около 1 литра до 100 литров.
В процессе ферментации индукцию экспрессии белка обычно инициируют после того, как клетки вырастили в подходящих условиях до желательной плотности, например до значения OD550 в пределах 180-220, когда клетки находятся на стадии ранней стационарной фазы. Можно применять множество индукторов в соответствии с конструкцией используемого вектора, как это известно в данной области и описано выше. Клетки можно выращивать в течение более коротких периодов перед индукцией. Клетки обычно индуцируют в течение 12-50 час, хотя времена индукции могут быть длиннее или короче.
Чтобы улучшить производственный выход и качество полипептидов по данному изобретению, можно модифицировать различные условия ферментации. Например, чтобы улучшить правильность сборки и сворачивание секретируемых полипептидов антитела, дополнительные векторы, избыточно экспрессирующие белки-шапероны, такие как белки Dsb (DsbA, DsbB, DsbC, DsbD и/или DsbG) или FkpA (пептидилпролил-cis,trans-изомераза с активностью шаперона), можно использовать для совместной трансформации прокариотических клеток-хозяев. Было показано, что белки-шапероны облегчают правильное сворачивание и растворимость гетерологичных белков, продуцируемых в бактериальных клетках-хозяевах. Chen et al. (1999) J. Biol. Chem. 274: 19601-19605, Georgiou et al., патент США № 6083715, Georgiou et al., патент США № 6027888, Bothmann and Pluckthun (2000) J. Biol. Chem. 275:17100-17105, Ramm and Pluckthun (2000) J. Biol. Chem. 275: 17106-17113, Arie et al. (2001) Mol. Microbiol. 39:199-210.
Чтобы свести к минимуму протеолиз экспрессируемых гетерологичных белков (особенно тех, что чувствительны к протеолизу), для целей настоящего изобретения можно использовать определенные штаммы-хозяева, лишенные протеолитических ферментов. Например, штаммы клеток-хозяев можно модифицировать так, чтобы произвести генетическую мутацию(ии) в генах, кодирующих известные бактериальные протеазы, такие как протеаза III, OmpT, DegP, Tsp, протеаза I, протеаза Mi, протеаза V, протеаза VI и их сочетания. Некоторые лишенные протеаз штаммы E.coli доступны и описаны, например, в Joly et al. (1998), выше, Georgiou et al., патент США № 5264365, Georgiou et al., патент США № 5508192, Hara et al., Microbial Drug Resistance, 2:63-72 (1996).
В одном варианте осуществления штаммы E.coli, лишенные протеолитических ферментов и трансформированные плазмидами, избыточно экспрессирующими один или более белков-шаперонов, используют в качестве клеток-хозяев для системы экспрессии по данному изобретению.
iii. Очистка антител
Можно применять стандартные методы очистки белков, известные в данной области. Следующие методы являются примерами подходящих методов очистки: фракционирование на иммуноаффинных или ионообменных колонках, осаждение этанолом, ВЭЖХ с обратной фазой, хроматография на силикагеле или на таких катионообменных смолах, как ДЭАЭ, хроматофокусирование, SDS-PAGE, осаждение сульфатом аммония и гель-фильтрация с использованием, например, Sephadex G-75.
В одном аспекте для иммуноаффинной очистки полноразмерных антительных продуктов по изобретению применяли протеин А, иммобилизованный на твердой фазе. Протеин А представляет собой белок клеточной стенки Staphylococcus aureas массой 41 кДа, который с высокой аффинностью связывает Fc-область антител. Lindmark et al. (1983) J. Immunol. Meth. 62:1-13. Твердая фаза, на которой иммобилизован протеин А, предпочтительно является колонкой, имеющей стеклянную или кварцевую поверхность, более предпочтительно колонкой со стеклом с контролируемой пористостью либо колонкой с кремниевой кислотой. В некоторых вариантах применения колонку покрывали таким реагентом, как глицерин, в попытке предотвратить неспецифическую адгезию примесей.
В качестве первой стадии очистки препарат, полученный из клеточной культуры, как описано выше, наносят на твердую фазу с иммобилизованным протеином А, чтобы дать возможность специфически связаться интересующему антителу с протеином А. Затем твердую фазу промывают для удаления примесей, неспецифически связавшихся с твердой фазой. В заключение интересующее антитело высвобождают с твердой фазы посредством элюции.
b. Получение антител с помощью эукариотических клеток-хозяев
Компоненты вектора обычно включают, но не ограничиваются ими, одно или более из следующего: сигнальную последовательность, точку начала репликации, один или более маркерных генов, энхансерный элемент, промотор и последовательность терминации транскрипции.
(i) Компонент сигнальной последовательности
Вектор для применения в эукариотической клетке-хозяине также может содержать сигнальную последовательность или другой полипептид, имеющий специфический сайт расщепления в районе N-конца зрелого белка или интересующего полипептида. Выбранная гетерологичная сигнальная последовательность предпочтительно является такой, которая узнается и подвергается процессингу (то есть расщепляется сигнальной пептидазой) клеткой-хозяином. В случае экспрессии в клетках млекопитающих могут быть использованы сигнальные последовательности млекопитающих, а также вирусные секреторные лидерные последовательности, например gD-сигнал вируса герпеса.
ДНК для такой области предшественника лигирована в рамке считывания с ДНК, кодирующей антитело.
(ii) Точка начала репликации
Как правило, компонент точки начала репликации не является необходимым для векторов экспрессии млекопитающих. Например, обычно можно использовать точку начала репликации SV40 только потому, что она содержит ранний промотор.
(iii) Компонент генной селекции
Векторы экспрессии и клонирования могут содержать ген селекции, еще называемый селективным маркером. Типичные гены селекции кодируют белки, которые (a) придают устойчивость к антибиотикам или иным токсинам, например ампициллину, неомицину, метотрексату или тетрациклину, (b) восполняют ауксотрофные недостаточности в соответствующих случаях или (c) поставляют особо важные питательные вещества, недоступные из комплексных сред.
В одном из примеров схемы селекции используют лекарственное средство для остановки роста клетки-хозяина. Те клетки, которые успешно трансформированы гетерологичным геном, продуцируют белок, придающий устойчивость к лекарственному средству, и, таким образом, выживают при режиме селекции. В примерах такой доминантной селекции используют лекарственные средства неомицин, микофеноловую кислоту и гигромицин.
Другой пример подходящих селективных маркеров для клеток млекопитающих относится к тем, которые дают возможность идентификации клеток, способных принять нуклеиновую кислоту антитела, таким как DHFR, тимидинкиназа, металлотионеин-I и -II, предпочтительно гены металлотионеина приматов, аденозиндезаминаза, орнитиндекарбоксилаза и так далее.
Например, клетки, трансформированные геном селекции DHFR, сначала выявляются культивированием всех трансформантов в культуральной среде, содержащей метотрексат (Mtx), конкурентный антагонист DHFR. Подходящей клеткой-хозяином, в случае если применяется DHFR дикого типа, является клеточная линия яичника китайского хомячка (CHO), в которой отсутствует активность DHFR (например, ATCC CRL-9096).
Альтернативно клетки-хозяева (в частности, хозяева дикого типа, которые содержат эндогенный DHFR), трансформированные или совместно трансформированные последовательностями ДНК, кодирующими антитело, белок DHFR дикого типа и другой селективный маркер, такой как аминогликозид-3'-фосфотрансфераза (APH), могут быть отобраны путем выращивания клеток на среде, содержащей средство селекции для селективного маркера, такое как аминогликозидный антибиотик, например канамицин, неомицин, или G418. Смотри патент США № 4965199.
(iv) Промоторный компонент
Векторы экспрессии и клонирования обычно содержат промотор, узнаваемый организмом-хозяином и функционально связанный с нуклеиновой кислотой полипептида антитела. Промоторные последовательности для эукариот известны. Практически все эукариотические гены имеют AT-богатую область, расположенную приблизительно в 25 - 30 основаниях выше сайта инициации транскрипции. Другая последовательность, находящаяся в 70 - 80 основаниях выше от точки начала транскрипции многих генов, представляет собой CNCAAT область, где N может быть любым нуклеотидом. На 3'-конце большинства эукариотических генов расположена последовательность AATAAA, которая может являться сигналом для добавления поли-А хвоста к 3'-концу кодирующей последовательности. Все эти последовательности подходящим образом встроены в эукариотические векторы экспрессии.
Транскрипция полипептидов антител с векторов в клетках-хозяевах млекопитающих контролируется, например, промоторами, полученными из геномов вирусов, таких как вирус полиомы, вирус оспы птиц, аденовирус (такой, как аденовирус 2), вирус бычьей папилломы, вирус птичьей саркомы, цитомегаловирус, ретровирус, вирус гепатита B и вакуолизирующий обезьяний вирус 40 (SV40), из гетерологичных промоторов млекопитающих, например актинового промотора или иммуноглобулинового промотора, из промоторов теплового шока, при условии, что такие промоторы совместимы с системами клеток-хозяев.
Ранние и поздние промоторы вируса SV40 удобно получать как рестрикционный фрагмент SV40, который также содержит точку начала репликации вируса SV40. Предранний промотор человеческого цитомегаловируса удобно получать в виде рестрикционного фрагмента HindIII E. Система для экспрессирования ДНК в клетках-хозяевах млекопитающих, в которой используется вирус бычьей папилломы, раскрыта в патенте США № 4419446. Модификация данной системы описана в патенте США № 4601978. Альтернативно в качестве промотора можно использовать длинные концевые повторы вируса саркомы Рауса.
(v) Компонент энхансерного элемента
Транскрипция ДНК, кодирующей полипептиды антител по данному изобретению, у высших эукариот часто возрастает при встраивании в вектор энхансерной последовательности. Многие энхансерные последовательности из генов млекопитающих (глобина, эластазы, альбумина, α-фетопротеина и инсулина) известны в настоящее время. Однако обычно используют энхансер из вируса эукариотической клетки. Примеры включают энхансер SV40 на поздней стороне точки начала репликации (п.о. 100-127), ранний промоторный энхансер цитомегаловируса, энхансер полиомы на поздней стороне точки начала репликации и энхансеры аденовируса. Смотри также Yaniv, Nature 297:17-18 (1982) об энхансерных элементах для активации эукариотических промоторов. Энхансер может быть сплайсирован в вектор в положении 5' или 3' к кодирующей последовательности полипептида антитела, но предпочтительно расположен на сайте 5' от промотора.
(vi) Компонент терминации транскрипции
Векторы экспрессии, применяемые в эукариотических клетках-хозяевах, обычно также содержат последовательности, необходимые для терминации транскрипции и для стабилизации мРНК. Такие последовательности обычно можно получить из 5'- и изредка из 3'-нетранслируемых областей эукариотических или вирусных ДНК или кДНК. Такие области содержат нуклеотидные сегменты, транскрибируемые в виде полиаденилированных фрагментов в нетранслируемой части мРНК, кодирующей антитело. Одним из полезных компонентов терминации транскрипции является полиаденилированная область бычьего гормона роста. Смотри WO 94/11026 и вектор экспрессии, раскрытый в этом документе.
(vii) Селекция и трансформация клеток-хозяев
Подходящие клетки-хозяева для клонирования или экспрессирования ДНК в векторах по данному описанию включают клетки высших эукариот, описанные в данном документе, в том числе клетки-хозяева позвоночных. Наращивание клеток позвоночных в культуре (культура тканей) стало рутинной процедурой. Примерами полезных линий клеток-хозяев млекопитающих являются: линия CV1 почечных клеток обезьяны, трансформированных SV40 (COS-7, ATCC CRL 1651), линия почечных клеток эмбриона человека (293 или 293 клетки, субклонированные для роста в суспензионной культуре, Graham et al., J. Gen Virol. 36:59 (1977)), почечные клетки новорожденных хомячков (BHK, ATCC CCL 10), клетки яичника китайского хомячка/-DHFR (CHO, Urlaub et al., Proc. Natl. Acad. Sci. USA 77:4216 (1980)), мышиные клетки Сертоли (TM4, Mather, Biol. Reprod. 23:243-251 (1980)), почечные клетки обезьяны (CV1 ATCC CCL 70), почечные клетки африканской зеленой мартышки (VERO-76, ATCC CRL-1587), человеческие клетки карциномы шейки матки (HELA, ATCC CCL 2), почечные клетки собаки (MDCK, ATCC CCL 34), печеночные клетки крыс Buffalo (BRL 3A, ATCC CRL 1442), легочные клетки человека (W138, ATCC CCL 75), печеночные клетки человека (Hep G2, HB 8065), клетки опухоли молочной железы мыши (MMT 060562, ATCC CCL51), клетки TRI (Mather et al., Annals N.Y. Acad. Sci. 383:44-68 (1982)), клетки MRC 5, клетки FS4 и линия человеческой гепатомы (Hep G2).
Клетки-хозяева трансформируют вышеописанными векторами экспрессии и клонирования для продукции антител и культивируют в стандартных питательных средах, модифицированных соответствующим образом для индукции промоторов, селекции трансформантов или амплификации генов, кодирующих желательные последовательности.
(viii) Культивирование клеток-хозяев
Клетки-хозяева, используемые для продукции антител по данному изобретению, можно культивировать в различных средах. Коммерчески доступные среды, такие как среда Хэма F10 (Sigma), минимально необходимая среда (MEM), (Sigma), RPMI-1640 (Sigma) и среда Игла, модифицированная Дульбекко ((DMEM), Sigma), являются подходящими для культивирования клеток-хозяев. Кроме того, любую из сред, описанных в Ham et al., Meth. Enz. 58:44 (1979), Barnes et al., Anal. Biochem. 102:255 (1980), патентах США № 4767704, 4657866, 4927762, 4560655 или 5122469, WO 90/03430, WO 87/00195 или касательно патента США 30985, можно применять в качестве культуральной среды для клеток-хозяев. Каждая из этих сред может быть дополнена при необходимости гормонами и/или другими факторами роста (такими, как инсулин, трансферрин или эпидермальный фактор роста), солями (такими, как хлорид натрия, кальций, магний и фосфат), буферами (такими, как HEPES), нуклеотидами (такими, как аденозин и тимидин), антибиотиками (такими, как лекарственное средство GENTAMYCIN™), микроэлементами (определяемыми как неорганические соединения, обычно присутствующие в конечных концентрациях в микромолярном диапазоне) и глюкозой либо равноценным источником энергии. Любые другие необходимые дополнения также могут быть включены в подходящих концентрациях, которые известны специалисту в данной области. Такие условия культивирования, как температура, pH и тому подобное, являются теми же, что ранее использовались для клеток-хозяев, выбранных для экспрессии, и обычно очевидны для квалифицированного специалиста.
(ix) Очистка антител
При использовании рекомбинантных методов антитело может продуцироваться внутриклеточно либо напрямую секретироваться в среду. Если антитело продуцируется внутриклеточно, в качестве первого шага частицы дебриса, либо клетки-хозяева, либо лизированные фрагменты, удаляют, например, центрифугированием или ультрафильтрацией. Если антитело секретируется в среду, супернатанты от таких систем экспрессии обычно сначала концентрируют с помощью коммерчески доступных фильтров для концентрирования белков, например, ультрафильтрационных ячеек Amicon или Millipore Pellicon. Такой ингибитор протеаз, как PMSF, можно включать на любом из предшествующих шагов для ингибирования протеолиза и можно включать антибиотики для профилактики роста случайных контаминантов.
Композицию антител, полученную из клеток, можно очищать, например, с помощью хроматографии на гидроксилапатите, гель-электрофореза, диализа и аффинной хроматографии, причем аффинная хроматография является предпочтительным методом очистки. Возможность применения протеина А в качестве аффинного лиганда зависит от вида и изотипа каждого Fc-домена иммуноглобулина, имеющегося в антителе. Протеин А можно использовать для очистки антител, имеющих в основе тяжелые цепи γ1, γ2 или γ4 человека (Lindmark et al., J. Immunol. Meth. 62:1-13 (1983)). Протеин G рекомендуется для всех мышиных изотипов и для человеческих γ3 (Guss et al., EMBO J. 5:15671575 (1986)). Матрицей, к которой присоединен аффинный лиганд, наиболее часто служит агароза, но можно использовать и другие матрицы. Механически стабильные матрицы, такие как стекло с контролируемым размером пор или поли(стирендивинил)бензол, допускают более высокие скорости потока и более короткие времена обработки, чем те, что могут быть достигнуты в случае агарозы. Если антитело содержит CH3-домен, для очистки удобна смола Bakerbond ABX™ (J. T. Baker, Phillipsburg, NJ). Другие методы очистки белка, такие как фракционирование на ионообменной колонке, осаждение этанолом, ВЭЖХ с обратной фазой, хроматография на силикагеле, хроматография на SEPHAROSE™ с гепарином, хроматография на анионо- или катионообменных смолах (таких, как колонка с полиаспарагиновой кислотой), хроматофокусирование, SDS-PAGE и осаждение сульфатом аммония, также могут применяться в зависимости от получаемого антитела.
После любых предварительных шагов очистки смесь, содержащую интересующее антитело и примеси, можно подвергать хроматографии гидрофобных взаимодействий при низких pH, используя буфер элюции при pH в пределах примерно 2,5-4,5, предпочтительно проводимой при низких концентрациях солей (например, при 0-0,25 M соли).
Иммуноконъюгаты
Данное изобретение также относится к иммуноконъюгатам (взаимозаменяемо называемым «конъюгаты антитело-лекарственное средство» или «ADC»), представляющим собой любое из антител к эфрину B2, приведенных в данном описании, конъюгированное с цитотоксическим средством, таким как химиотерапевтическое средство, лекарственное средство, средство ингибирования роста, токсин (например, ферментативно активный токсин бактериального, грибкового, растительного или животного происхождения либо их фрагменты), либо радиоактивным изотопом (то есть радиоконъюгат).
Применение конъюгатов антитело-лекарственное средство для локальной доставки цитотоксических или цитостатических средств, то есть лекарственных средств для уничтожения или ингибирования опухолевых клеток, в терапии рака (Syrigos and Epenetos (1999) Anticancer Research 19:605-614, Niculescu-Duvaz and Springer (1997) Adv. Drg Del. Rev. 26:151-172, патент США 4975278) делает возможным направленную доставку лекарственного фрагмента к опухолям и внутриклеточное накопление в них, там где системное введение таких неконъюгированных лекарственных средств может приводить к неприемлемым уровням токсичности для нормальных клеток, а также для опухолевых клеток, которые пытаются уничтожить (Baldwin et al., (1986) Lancet p. (Mar. 15, 1986):603-05, Thorpe, (1985) «Antibody Carriers Of Cytotoxic Agents In Cancer Therapy: A Review», in Monoclonal Antibodies '84: Biological And Clinical Applications, A. Pinchera et al. (ed.s), p. 475-506). Тем самым пытаются достичь максимальной эффективности при минимальной токсичности. Сообщалось, что как поликлональные антитела, так и моноклональные антитела являются полезными при таких стратегиях (Rowland et al., (1986) Cancer Immunol. Immunother., 21:183-87). Лекарственные средства, используемые в таких методах, включают дауномицин, доксорубицин, метотрексат и виндезин (Rowland et al., (1986), выше). Токсины, используемые в конъюгатах антитело-токсин, включают бактериальные токсины, такие как дифтерийный токсин, растительные токсины, такие как рицин, низкомолекулярные токсины, такие как гельданамицин (Mandler et al. (2000) Jour. of the Nat. Cancer Inst. 92(19):1573-1581, Mandler et al. (2000) Bioorganic & Med. Chem. Letters 10:1025-1028, Mandler et al. (2002) Bioconjugate Chem. 13:786-791), мейтанзиноиды (EP 1391213, Liu et al., (1996) Proc. Natl. Acad. Sci. USA 93:8618-8623) и калихимицин (Lode et al. (1998) Cancer Res. 58:2928, Hinman et al. (1993) Cancer Res. 53:3336-3342). Токсины могут проявлять свой цитотоксический и цитостатический эффекты с помощью механизмов, включающих связывание тубулинов, связывание ДНК или ингибирование топоизомеразы. Некоторые цитотоксические лекарственные средства имеют тенденцию становиться неактивными или менее активными, будучи конъюгированными с крупными антителами или лигандами белковых рецепторов.
ZEVALIN® (ибритутомабтиуксетан, Biogen/Idec) является антитело-радиоизотопным конъюгатом, составленным из мышиного моноклонального антитела IgG1 каппа, направленного против антигена CD20, обнаруженного на поверхности нормальных и злокачественных B лимфоцитов, и из радиоизотопа 111In или 90Y, связанных тиомочевинным линкером-хелатором (Wiseman et al. (2000) Eur. Jour. Nucl. Med. 27(7):766-77, Wiseman et al. (2002) Blood 99(12):4336-42, Witzig et al. (2002) J. Clin. Oncol. 20(10):2453-63, Witzig et al. (2002) J. Clin. Oncol. 20(15):3262-69). Хотя ZEVALIN обладает активностью против B-клеточной неходжкинской лимфомы (NHL), его введение вызывает серьезные и продолжительные цитопении у большинства пациентов. MYLOTARG™ (гемтузумабозогамицин, Wyeth Pharmaceuticals), конъюгат антитело-лекарственное средство, составленный из антитела huCD33, присоединенного к калихимицину, в 2000 был одобрен для лечения острой миелоидной лейкемии путем инъекции (Drugs of the Future (2000) 25(7):686, патенты США № 4970198, 5079233, 5585089, 5606040, 5693762, 5739116, 5767285, 5773001). Кантузумабмертанзин (Immunogen, Inc.), конъюгат антитело-лекарственное средство, составленный из антитела huC242, присоединенного через дисульфидный линкер SPP к мейтанозидному лекарственному фрагменту, DM1, входит в фазу II испытаний для лечения видов рака, которые экспрессируют CanAg, таких как рак толстой кишки, рак поджелудочной железы, рак желудка и другие. MLN-2704 (Millennium Pharm., BZL Biologies, Immunogen Inc.), конъюгат антитело-лекарственное средство, составленный из моноклонального антитела против мембранного антигена, специфического для простаты (PSMA), присоединенного к мейтанзиноидному лекарственному фрагменту, DM1, находится в разработке для потенциального лечения опухолей простаты. Пептиды ауристатина, ауристатин E (AE) и монометилауристатин (MMAE), синтетические аналоги доластатина, были конъюгированы с химерными моноклональными антителами cBR96 (специфичными к антигену Y Льюиса на карциномах) и cAC10 (специфичным к CD30 при гематологических злокачественных новообразованиях) (Doronina et al. (2003) Nature Biotechnology 21(7):778-784) и находятся в стадии терапевтической разработки.
Химиотерапевтические средства, полезные для создания иммуноконъюгатов, приведены в данном описании (например, выше). Ферментативно активные токсины и их фрагменты, которые можно использовать, включают дифтерийную цепь А, несвязывающие активные фрагменты дифтерийного токсина, цепь А экзотоксина (из Pseudomonas aeruginosa), цепь А рицина, цепь А абрина, цепь А модецина, альфа-сарцин, белки Aleurites fordii, белки диантина, белки Phytolaca americana (PAPI, PAPII и PAP-S), ингибитор из Momordica charantia, курцин, кротин, ингибитор из Sapaonaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, эномицин и трикотецены. Смотри, например, WO 93/21232, опубликованный 28 октября 1993 г. Различные радионуклиды доступны для получения радиоконъюгированных антител. Примеры включают 212Bi, 131I, 131In, 90Y и 186Re. Конъюгаты антитела и цитотоксического средства получают с помощью множества бифункциональных белоксшивающих средств, таких как N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP), иминотиолан (IT), бифункциональные производные имидоэфиров (таких, как диметиладипимидат HCl), активные сложные эфиры (такие, как дисукцинимидилсуберат), альдегиды (такие, как глютаральдегид), бис-азидосоединения (такие, как бис(п-азидобензоил)гександиамин), производные бис-диазония (такие, как бис(п-диазонийбензоил)этилендиамин), диизоцианаты (такие, как толуол-2,6-диизоцианат) и бис-активные фтористые соединения (такие, как 1,5-дифторо-2,4-динитробензол). Например, иммунотоксин рицин может быть получен, как описано в Vitetta et al., Science, 238: 1098 (1987). Меченая углеродом 14 1-изотиоцианатобензил-3-метилдиэтилентриаминпентауксусная кислота (MX-DTPA) служит примером хелатирующего средства для конъюгирования радионуклеотида с антителом. Смотри WO 94/11026.
Конъюгаты антитела и одного или более низкомолекулярных токсинов, таких как калихимицин, мейтанзиноиды, доластатины, ауростатины, трихотецен и CC1065, а также производных таких токсинов, которые обладают токсической активностью, также предусмотрены в данном описании.
i. Мейтанзин и мейтанзиноиды
В некоторых вариантах осуществления иммуноконъюгат представляет собой антитело (полноразмерное или фрагменты) по изобретению, конъюгированное с одной или большим количеством молекул мейтанзиноида.
Мейтанзиноиды являются ингибиторами митоза, которые действуют путем ингибирования полимеризации тубулина. Мейтанзин впервые был выделен из восточноафриканского кустарника Maytenus serrata (патент США № 3896111). Впоследствии было обнаружено, что определенные микроорганизмы также продуцируют мейтанзиноиды, такие как мейтанзинол и C-3 сложные эфиры мейтанзинола (патент США № 4151042). Синтетический мейтанзинол, а также его производные и аналоги, раскрыты, например, в патентах США № 4137230, 4248870, 4256746, 4260608, 4265814, 4294757, 4307016, 4308268, 4308269, 4309428, 4313946, 4315929, 4317821, 4322348, 4331598, 4361650, 4364866, 4424219, 4450254, 4362663 и 4371533.
Мейтанзиноидные лекарственные фрагменты являются привлекательными лекарственными фрагментами в конъюгатах антитело-лекарственное средство, потому что они: (i) относительно доступны для получения ферментацией или химической модификацией, получением производных от продуктов ферментации, (ii) поддаются модификации с помощью функциональных групп, подходящих для конъюгации через недисульфидные линкеры с антителами, (iii) стабильны в плазме крови и (iv) эффективны против множества линий опухолевых клеток.
Иммуноконъюгаты, содержащие мейтанзиноиды, способы их получения и терапевтического применения раскрыты, например, в патентах США № 5208020, 5416064 и европейском патенте EP 0 425 235 B1, раскрытия из которых специально включены в данное описание посредством ссылок. В Liu et al., Proc. Natl. Acad. Sci. USA 93:8618-8623 (1996) описаны иммуноконъюгаты, представляющие собой мейтанзиноид, обозначенный как DM1, присоединенный к моноклональному антителу C242, направленному против рака прямой кишки человека. Было обнаружено, что такой конъюгат крайне цитотоксичен в отношении культивируемых клеток рака прямой кишки и проявляет противоопухолевую активность при анализе роста опухоли in vivo. В Chari et al., Cancer Research 52:127-131 (1992) описаны иммуноконъюгаты, в которых мейтанзиноид был конъюгирован через дисульфидный линкер с мышиным антителом A7, связывающим антиген на линиях клеток рака прямой кишки человека, либо с другим мышиным моноклональным антителом TA.1, которое связывает онкоген HER-2/neu. Цитотоксичность TA.1-мейтанзиноидного конъюгата проверяли in vitro на линии клеток SK-BR-3 рака молочной железы человека, которые экспрессируют 3×105 поверхностных антигенов HER-2 на клетку. Лекарственный конъюгат достигал сравнимой со свободным мейтанзиноидным лекарственным средством степени цитотоксичности, которая могла быть повышена путем увеличения количества мейтанзиноидных молекул на молекулу антитела. A7-мейтанзиноидный конъюгат обладал низкой системной цитотоксичностью для мышей.
Антитело-мейтанзиноидные конъюгаты получали путем химического связывания антитела с молекулой мейтанзиноида без значительного снижения биологической активности как антитела, так и молекулы мейтанзиноида. Смотри, например, патент США № 5208020 (раскрытие из которого специально включено в данное описание посредством ссылки). В среднем 3-4 молекулы мейтанзиноида, конъюгированные с молекулой антитела, обладали эффективностью усиления цитотоксичности для целевых клеток без отрицательного влияния на функцию или растворимость антитела, хотя ожидалось, что даже одна молекула токсина/антитело будет усиливать цитотоксичность по сравнению с использованием простого антитела. Мейтанзиноиды хорошо известны в данной области и могут быть синтезированы известными методами или выделены из природных источников. Подходящие мейтанзиноиды раскрыты, например, в патенте США № 5208020 и в других патентах и непатентных публикациях, на которые в данном описании ссылались ранее. Предпочтительными мейтанзиноидами являются мейтанзинол и мейтанзинольные аналоги, модифицированные по ароматическому кольцу или по другим положениям молекулы мейтанзинола, такие как различные сложные эфиры мейтанзинола.
Для получения антитело-мейтанзиноидных конъюгатов существует множество связывающих групп, известных в данной области, включая, например, раскрытые в патенте США № 5208020 или в европейском патенте EP 0 425 235 B1, Chari et al., Cancer Research 52:127-131 (1992), и в патентной заявке США № 10/960602, зарегистрированной 8 октября 2004, раскрытия из которых специально включены в данное описание посредством ссылок. Антитело-мейтанзиноидные конъюгаты, содержащие линкерный компонент SMCC, можно получать, как описано в патентной заявке США № 10/960602, зарегистрированной 8 октября 2004 г. Связывающие группы включают дисульфидные группы, тиоэфирные группы, кислотолабильные группы, фотолабильные группы, пептидазолабильные группы или эстеразолабильные группы, как описано в вышеуказанных патентах, причем предпочтительными являются дисульфидные и тиоэфирные группы. Дополнительные соединительные группы описаны и приведены в качестве примеров в данном описании.
Конъюгаты антитела и мейтанзиноида можно получать с помощью множества бифункциональных белоксшивающих средств, таких как N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP), сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат (SMCC), иминотиолан (IT), бифункциональные производные имидоэфиров (такие, как диметиладипимидат HCl), активные сложные эфиры (такие, как дисукцинимидилсуберат), альдегиды (такие, как глютаральдегид), бис-азидосоединения (такие, как бис(п-азидобензоил)гександиамин), производные бис-диазония (такие, как бис(п-диазонийбензоил)этилендиамин), диизоцианаты (такие, как толуол-2,6-диизоцианат) и бис-активные фтористые соединения (такие, как 1,5-дифторо-2,4-динитробензол). Особо предпочтительные сшивающие средства включают N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP) (Carlsson et al., Biochem. J. 173:723-737 (1978)) и N-сукцинимидил-4-(2-пиридилтио)пентаноат (SPP) для обеспечения дисульфидной связи.
Линкер может быть присоединен к молекуле мейтанзиноида по различным положениям в зависимости от типа связи. Например, сложноэфирная связь может образоваться в результате реакции с гидроксильной группой при использовании стандартных методов перекрестного сшивания. Реакция может происходить по положению C-3, имеющему гидроксильную группу, положению C-14, модифицированному гидроксиметилом, положению C-15, модифицированному гидроксильной группой, и положению C-20, имеющему гидроксильную группу. В предпочтительном варианте осуществления связь образуется по положению C-3 мейтанзинола или аналога мейтанзинола.
ii. Ауристатины и доластатины
В некоторых вариантах осуществления иммуноконъюгат представляет собой антитело по данному изобретению, конъюгированное с доластатинами или пептидными аналогами и производными доластатинов, ауристатинами (патенты США № 5635483, 5780588). Было показано, что доластатины и ауристатины препятствуют микротубулиновой динамике, гидролизу ГТФ, а также ядерному и клеточному делению (Woyke et al. (2001) Antimicrob. Agents and Chemother. 45(12):3580-3584) и обладают противораковой (US 5663149) и противогрибковой активностью (Pettit et al. (1998) Antimicrob. Agents Chemother. 42:2961-2965). Лекарственный фрагмент доластатина или ауристатина может быть присоединен к антителу через N (амино)-конец или C (карбоксильный) конец пептидного лекарственного фрагмента (WO 02/088172).
Типичные варианты осуществления с ауристатином включают присоединенные по N-концу лекарственные фрагменты DE и DF монометилауристатина, раскрытые в «Monomethylvaline Compounds Capable of Conjugation to Ligands», US серийный № 10/983340, зарегистрировано 5 ноября 2004 г., полное содержание раскрытия из которого специально включено в данное описание посредством ссылки.
Как правило, лекарственные фрагменты на основе пептидов можно получать путем образования пептидной связи между двумя или более аминокислотами и/или пептидными фрагментами. Такие пептидные связи можно получать, например, методом жидкофазного синтеза (смотри E. Schröder and K. Lübke, «The Peptides», volume 1, p. 76-136, 1965, Academic Press), который хорошо известен в области химии пептидов. Лекарственные фрагменты ауристатина/доластатина можно получать методами из: US 5635483, US 5780588, Pettit et al. (1989) J. Am. Chem. Soc. 111:5463-5465, Pettit et al. (1998) Anti-Cancer Drug Design 13:243-277, Pettit, G.R., et al. Synthesis, 1996, 719-725, и Pettit et al. (1996) J. Chem. Soc. Perkin Trans. 15:859-863. Смотри также Doronina (2003) Nat. Biotechnol. 21(7):778-784, «Monomethylvaline Compounds Capable of Conjugation to Ligands», US серийный № 10/983340, зарегистрировано 5 ноября 2004 г., полное содержание которых включено в данное описание посредством ссылок (описывающие, например, линкеры и методы получения соединений монометилвалина, таких как MMAE и MMAF, конъюгированных с линкерами).
iii. Калихимицин
В других вариантах осуществления иммуноконъюгат включает антитело по данному изобретению, конъюгированное с одной или большим количеством молекул калихимицина. Семейство калихимициновых антибиотиков способно в субпикомолярных концентрациях вызывать разрывы двунитевых молекул ДНК. Для получения конъюгатов семейства калихимицинов смотри патенты США 5712374, 5714586, 5739116, 5767285, 5770701, 5770710, 5773001, 5877296 (все принадлежат American Cyanamid Company). Структурные аналоги калихимицина, которые можно применять, включают, но не ограничиваются ими, γ1 I, α2 I, α3 I, N-ацетил-γ1 I, PSAG и θ1 I (Hinman et al., Cancer Research 53:3336-3342 (1993), Lode et al., Cancer Research 58:2925-2928 (1998) и упоминавшиеся выше патенты США, принадлежащие American Cyanamid). Другим противоопухолевым лекарственным средством, с которым можно конъюгировать антитело, является QFA, который представляет собой антифолат. Как калихимицин, так и QFA имеют внутриклеточные места приложения действия и совершенно не пересекают плазматическую мембрану. По этой причине поглощение клеткой таких средств путем опосредованной антителами интернализации значительно усиливает их цитотоксические эффекты.
iv. Другие цитотоксические средства
Другие противоопухолевые средства, которые могут быть конъюгированы с антителами по данному изобретению, включают BCNU, стрептозоицин, винкристин и 5-фторурацил, семейство средств, коллективно известных как комплекс LL-E33288, описанный в патентах США 5053394, 5770710, а также эсперамицины (патент США 5877296).
Ферментативно активные токсины и их фрагменты, которые можно использовать, включают дифтерийную цепь А, несвязывающие активные фрагменты дифтерийного токсина, цепь А экзотоксина (из Pseudomonas aeruginosa), цепь А рицина, цепь А абрина, цепь А модецина, альфа-сарцин, белки Aleurites fordii, белки диантина, белки Phytolaca americana (PAPI, PAPII и PAP-S), ингибитор из Momordica charantia, курцин, кротин, ингибитор из Sapaonaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, эномицин и трихотецены. Смотри, например, WO 93/21232, опубликованно 28 октября 1993 г.
Настоящее изобретение также предусматривает иммуноконъюгат, образованный между антителом и соединением с нуклеолитической активностью (например, рибонуклеазой или эндонуклеазой ДНК, такой как дезоксирибонуклеаза, ДНКаза).
Для избирательного разрушения опухоли антитело может содержать высокорадиоактивный атом. Различные радиоактивные изотопы доступны для получения радиоконъюгированных антител. Примеры включают At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32, Pb212 и радиоактивные изотопы Lu. Когда конъюгат используют для детекции, он может содержать радиоактивный атом для сцинтиграфических исследований, например, tc99m или I123, либо спиновую метку для ядерно-магнитно-резонансной (ЯМР) визуализации (также известной, как магниторезонансная визуализация, mri), такую как тот же йод-123, йод-131, индий-111, фтор-19, углерод-13, азот-15, кислород-17, гадолиний, марганец или железо.
Радиоактивные или другие метки можно встраивать в конъюгат известными способами. Например, пептид может быть синтезирован биологически или синтезирован путем химического синтеза аминокислот с использованием подходящих аминокислотных предшественников, включая, например, фтор-19 вместо водорода. Такие метки, как tc99m или I123, Re186, Re188 и In111, можно присоединять через остаток цистеина в пептиде. Иттрий-90 можно присоединять через остаток лизина. Метод с использованием IODOGEN (Fraker et al. (1978) Biochem. Biophys. Res. Commun. 80: 49-57) можно использовать для включения йода-123. В «Monoclonal Antibodies in Immunoscintigraphy» (Chatal, CRC Press 1989) подробно описаны другие методы.
Конъюгаты антитела и цитотоксического средства можно получать, используя множество бифункциональных белоксшивающих средств, таких как N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP), сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат (SMCC), иминотиолан (IT), бифункциональные производные имидоэфиров (такие, как диметиладипимидат HCl), активные сложные эфиры (такие, как дисукцинимидилсуберат), альдегиды (такие, как глютаральдегид), бис-азидосоединения (такие, как бис(п-азидобензоил)гександиамин), производные бис-диазония (такие, как бис(п-диазонийбензоил)этилендиамин), диизоцианаты (такие, как толуол-2,6-диизоцианат) и бис-активные фтористые соединения (такие, как 1,5-дифторо-2,4-динитробензол). Например, иммунотоксин рицин может быть получен, как описано в Vitetta et al., Science, 238:1098 (1987). Меченая углеродом-14 1-изотиоцианатобензил-3-метилдиэтилентриаминпентауксусная кислота (MX-DTPA) служит примером хелатирующего средства для конъюгирования радионуклеотида с антителом. Смотри WO 94/11026. Линкер может являться «расщепляемым линкером», облегчающим высвобождение цитотоксического лекарственного средства в клетке. Например, можно использовать кислотолабильный линкер, пептидазочувствительный линкер, фотолабильный линкер, диметиловый линкер или дисульфидсодержащий линкер (Chari et al., Cancer Research 52:127-131 (1992), патент США № 5208020).
Соединения по данному изобретению специально включают, но не ограничиваются ими, ADC, полученные с помощью перекрестно сшивающих реагентов: BMPS, EMCS, GMBS, HBVS, LC-SMCC, MBS, MPBH, SBAP, SIA, SIAB, SMCC, SMPB, SMPH, сульфо-EMCS, сульфо-GMBS, сульфо-KMUS, сульфо-MBS, сульфо-SIAB, сульфо-SMCC и сульфо-SMPB, а также SVSB (сукцинимидил(4-винилсульфон)бензоат), который коммерчески доступен (например, от Pierce Biotechnology, Inc., Rockford, IL, USA). Смотри страницы 467-498, 2003-2004 Applications Handbook and Catalog.
v. Получение конъюгатов антитела и лекарственного средства.
В конъюгатах антитело-лекарственное средство (ADC) по данному изобретению антитело (Ab) конъюгировано с одним или большим количеством лекарственных фрагментов (D), например примерно от 1 до 20 лекарственных фрагментов на молекулу антитела, через линкер (L). ADC в формуле I можно получать несколькими путями, используя реакции, условия и реагенты органической химии, известные специалистам в данной области, включая: (1) реакцию нуклеофильной группы антитела с бивалентным линкерным реагентом для образования Ab-L через ковалентное связывание с последующей реакцией с лекарственным фрагментом D и (2) реакцию нуклеофильной группы лекарственного фрагмента с бивалентным линкерным реагентом для образования D-L через ковалентное связывание с последующей реакцией с нуклеофильной группой антитела. Дополнительные способы получения ADC приведены в данном описании.
Ab-(L-D)p I
Линкер может быть составлен из одного или более линкерных компонентов. Типичные линкерные компоненты включают 6-малеимидокапроил («MC»), малеимидопропаноил («MP»), валин-цитруллин («val-cit»), аланин-фенилаланин («ala-phe»), п-аминобензилоксикарбонил («PAB»), N-сукцинимидил-4-(2-пиридилтио)пентаноат («SPP»), N-сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат («SMCC») и N-сукцинимидил(4-йодацетил)аминобензоат («SIAB»). Дополнительные линкерные компоненты известны в данной области и некоторые из них приведены в данном описании. Смотри также «Monomethylvaline Compounds Capable of Conjugation to Ligands», US серийный № 10/983340, зарегистрировано 5 ноября 2004 г., полное содержание которых включено в данное описание посредством ссылок.
В некоторых вариантах осуществления линкер может содержать аминокислотные остатки. Типичные аминокислотные линкерные компоненты включают дипептид, трипептид, тетраптид или пентапептид. Типичные дипептиды включают: валин-цитруллин (vc или val-cit), аланин-фенилаланин (af или ala-phe). Типчные трипептиды включают: глицин-валин-цитруллин (gly-val-cit) и глицин-глицин-глицин (gly-gly-gly). Аминокислотные остатки, которые составляют аминокислотный линкерный компонент, включают те, что встречаются в природе, а также минорные аминокислоты и неприродные аналоги аминокислот, такие как цитруллин. Аминокислотные линкерные компоненты могут быть спроектированы и оптимизированы по их избирательности в отношении ферментативного расщепления конкретными ферментами, например ассоциированной с опухолью протеазой, катепсином B, C и D или плазминовой протеазой.
Нуклеофильные группы на антителах включают, но не ограничиваются ими: (i) N-концевые аминогруппы, (ii) аминогруппы боковых цепей, например, лизина, (iii) тиоловые группы боковых цепей, например, цистеина и (iv) гидроксильные или аминогруппы сахаров в тех случаях, когда антитело является гликозилированным. Амино-, тиоловые и гидроксильные группы являются нуклеофильными и способны к реакции образования ковалентных связей с электрофильными группами на линкерных фрагментах и линкерных реагентах, включая: (i) активные сложные эфиры, такие как сложные эфиры NHS, сложные эфиры HOBt, галогенформиаты и галоидангидриды, (ii) алкильные и бензиловые галогениды, такие как галоидные ацетамиды, (iii) альдегиды, кетоны, карбоксильные и малеимидные группы. Определенные антитела имеют восстанавливаемые межцепочечные дисульфиды, то есть цистеиновые мостики. Антитела могут быть превращены в реакционноспособные для конъюгации с линкерными реагентами путем обработки восстанавливающим средством, таким как ДТТ (дитиотреитол). Каждый цистеиновый мостик, таким образом, теоретически будет образовывать два реакционноспособных тиоловых нуклеофила. Дополнительные нуклеофильные группы можно ввести в антитела посредством реакции остатков лизина с 2-иминотиоланом (реагентом Траута), приводящей к превращению амина в тиол. Реакционноспособные тиоловые группы можно вводить в антитело (или его фрагмент) путем встраивания одного, двух, трех, четырех или более остатков цистеина (например, получая мутантные антитела, содержащие один или более аминокислотных остатков цистеина неприродного происхождения).
Конъюгаты антитело-лекарственное средство по данному изобретению можно также получать путем модификации антитела с целью ввести в него электрофильные фрагменты, способные реагировать с нуклеофильными заместителями на линкерном реагенте или лекарственном средстве. Можно окислять сахара гликозилированных антител, например, периодатными окисляющими реагентами для образования альдегидных или кетоновых групп, которые могут реагировать с аминогруппой линкерных реагентов или лекарственных фрагментов. Полученные в результате иминогруппы основания Шиффа могут образовывать стабильные межмолекулярные связи либо могут быть восстановлены, например, боргидридными реагентами с образованием стабильных аминосвязей. В одном варианте осуществления реакция углеводной части гликозилированного антитела либо с галактозоксидазой, либо с метапериодатом натрия может привести к образованию в белке карбонильных (альдегидных и кетоновых) групп, которые могут реагировать с подходящими группами лекарственного средства (Hermanson, Bioconjugate Techniques). В другом варианте осуществления белки, содержащие N-концевые остатки серина или треонина, могут реагировать с метапериодатом натрия, что приводит к получению альдегида вместо первой аминокислоты (Geoghegan & Stroh, (1992) Bioconjugate Chem. 3:138-146, US 5362852). Такие альдегиды могут реагировать с лекарственным фрагментом или линкерным нуклеофилом.
Аналогично нуклеофильные группы на лекарственном фрагменте включают, но не ограничиваются ими, амин, тиол, гидроксил, гидразид, оксим, гидразин, тиосемикарбазон, гидразинкарбоксилат и арилгидразидные группы, способные реагировать, образуя ковалентные связи с электрофильными группами на линкерных фрагментах и линкерных реагентах, включая: (i) активные сложные эфиры, такие как сложные эфиры NHS, сложные эфиры HOBt, галогенформиаты и галоидангидриды, (ii) алкильные и бензиловые галогениды, такие как галоидные ацетамиды, (iii) альдегиды, кетоны, карбоксильные и малеимидные группы.
Альтернативно слитый белок, содержащий антитело и цитотоксическое средство, можно получать, например, рекомбинантными методами или пептидным синтезом. В длине ДНК могут содержаться соответствующие области, кодирующие две части конъюгата как граничащие друг с другом, так и разделенные областью, кодирующей линкерный пептид, который не нарушает желательные свойства конъюгата.
В еще одном варианте осуществления антитело может быть конъюгировано с «рецептором» (таким, как стрептавидин) для применения в предварительном нацеливании на опухоль, где конъюгат антитело-рецептор вводят пациенту, после чего следует выведение несвязанного конъюгата из кровотока с помощью очищающего средства, а затем введение «лиганда» (например, авидина), который конъюгирован с цитотоксическим средством (например, радионуклеотидом).
Фармацевтические лекарственные формы.
Терапевтические препараты, содержащие антитело по данному изобретению, готовили для хранения смешиванием антитела, обладающего желательной степенью чистоты, с физиологически приемлемыми носителями, эксципиентами или стабилизаторами по выбору (Remington: The Science and Practice of Pharmacy 20th edition (2000)) в виде водных растворов, лиофилизированных или иначе высушенных препаратов. Приемлемые носители, эксципиенты или стабилизаторы не токсичны для реципиентов в применяемых дозах и концентрациях и включают буферные растворы, такие как фосфатный, цитратный, гистидиновый и на основе других органических кислот, антиоксиданты, включая аскорбиновую кислоту и метионин, консерванты (такие, как октадецилдиметилбензиламмония хлорид, гексония хлорид, бензалкония хлорид, бензетония хлорид, феноловый, бутиловый или бензиловый спирт, алкилпарабены, такие как метил- или пропилпарабен, катехол, резорцинол, циклогексанол, 3-пентанол и м-крезол), низкомолекулярные (менее чем около 10 остатков) полипептиды, белки, такие как сывороточный альбумин, желатин, или иммуноглобулины, гидрофильные полимеры, такие как поливинилпирролидон, аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин, моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины, хелатирующие средства, такие как EDTA, сахара, такие как сахароза, маннитол, трегалоза или сорбит, солеобразующие противоионы, такие как натрий, комплексы металлов (например, Zn-белковые комплексы) и/или неионные сурфактанты, такие как TWEEN™, PLURONICS™ или полиэтиленгликоль (PEG).
Препарат по данному описанию может также содержать более одного активного соединения, если необходимо для устранения конкретных симптомов, предпочтительно обладающие дополнительными активностями, которые не влияют отрицательно друг на друга. Такие молекулы могут присутствовать совместно в количествах, эффективных для намеченных целей.
Активные ингредиенты также могут быть заключены в микрокапсулах, изготовленных, например, методами коацервации или межфазной полимеризацией, например гидроксиметилцеллюлозные или желатиновые микрокапсулы и поли(метилметакрилатные) микрокапсулы соответственно в коллоидных системах доставки лекарственных средств (например, липосомах, альбуминовых микросферах, микроэмульсиях, наночастицах и нанокапсулах) либо в макроэмульсиях. Такие методы раскрыты в Remington: The Science and Practice of Pharmacy 20th edition (2000).
Препараты, применяемые для введения in vivo, должны быть стерильными. Это легко достигается фильтрованием через стерильные фильтрационные мембраны.
Можно получать препараты с замедленным высвобождением. Подходящие примеры препаратов с замедленным высвобождением включают полупроницаемые матрицы из твердых гидрофобных полимеров, содержащие иммуноглобулин по изобретению, каковые матрицы находятся в виде формованных изделий, например пленок или микрокапсул. Примеры матриц с замедленным высвобождением включают полиэфиры, гидрогели (например, поли(2-гидроксиэтилметакрилат) или поливиниловый спирт), полилактиды (патент США № 3773919), сополимеры L-глутаминовой кислоты и γ-этил-L-глутамата, недеградируемый этиленвинилацетат, деградируемые сополимеры молочной кислоты-гликолевой кислоты, такие как LUPRON DEPOT™ (инъецируемые микросферы, сформированные из сополимеров молочной кислоты-гликолевой кислоты и леупролидацетата), и поли-D-(-)-3-гидроксимасляную кислоту. В то время как полимеры, такие как этиленвинилацетат и молочная кислота-гликолевая кислота, делают возможным высвобождение молекул в течение 100 дней, некоторые гидрогели высвобождают белки в течение более коротких временных периодов. Если инкапсулированные иммуноглобулины остаются внутри оболочки в течение долгого времени, они могут денатурировать или агрегировать в результате воздействия влажности при 37°C, что приводит к потере биологической активности и возможным изменениям в иммуногенности. В зависимости от задействованных механизмов могут быть разработаны разумные стратегии стабилизации. Например, если было обнаружено, что механизмом агрегации является образование межмолекулярных S-S связей путем тио-дисульфидного обмена, стабилизация может быть достигнута модификацией сульфгидрильных остатков, лиофилизацией из кислых растворов, контролем влажности с помощью подходящих добавок и разработкой специальных составов полимерной матрицы.
Применения
Антитело по настоящему изобретению можно использовать, например, в терапевтических методах in vitro, ex vivo и in vivo.
В одном аспекте изобретение относится к способам лечения или профилактики опухоли, рака и/или пролиферативного клеточного нарушения, связанного с повышенной экспрессией и/или активностью эфрина B2, где способы включают введение эффективного количества антитела к эфрину В2 субъекту, нуждающемуся в таком лечении.
В одном аспекте изобретение относится к способам уменьшения, ингибирования или предотвращения роста опухоли или рака, где способы включают введение эффективного количества антитела к эфрину В2 субъекту, нуждающемуся в таком лечении.
Антитела по изобретению также полезны для ингибирования ангиогенеза. В некоторых вариантах осуществления областью ангиогенеза является опухоль или рак.
В одном аспекте изобретение относится к способам ингибирования ангиогенеза, включающим введение эффективного количества антитела к эфрину В2 субъекту, нуждающемуся в таком лечении.
В одном аспекте изобретение относится к способам лечения патологического состояния, связанного с ангиогенезом, включающим введение эффективного количества антитела к эфрину В2 субъекту, нуждающемуся в таком лечении. В некоторых вариантах осуществления патологическим состояниям, связанным с ангиогенезом, является опухоль, рак и/или пролиферативное клеточное нарушение. В некоторых вариантах осуществления патологическим состояниям, связанным с ангиогенезом, является внутриглазное неоваскулярное заболевание.
Кроме того, по меньшей мере, некоторые из антител по изобретению могут связывать антиген других биологических видов. Соответственно, антитела по данному изобретению можно применять для связывания специфической активности антигена, например, в клеточной культуре, содержащей антиген, у субъектов-людей или иных субъектов-млекопитающих, обладающих антигеном, с которым антитело по изобретению перекрестно реагирует (например, шимпанзе, бабуин, игрунковая мартышка, Cynomolgus и Rhesus, свинья или мышь). В одном варианте осуществления антитело по изобретению можно применять для ингибирования активностей антигена путем приведения в контакт антитела с антигеном таким образом, что ингибируется активность антигена. Предпочтительно антигеном является молекула человеческого белка.
В одном варианте осуществления антитело по изобретению можно применять в способе связывания антигена у субъекта, страдающего нарушением, связанным с повышенной экспрессией и/или активностью антигена, включающем введение субъекту антитела по изобретению так, чтобы связать антиген у субъекта. Предпочтительно, антиген является молекулой человеческого белка, а субъект является человеком. Альтернативно субъект может быть млекопитающим, экспрессирующим антиген, с которым связывается антитело по изобретению. Более того, субъект может быть млекопитающим, в которого антиген был внедрен (например, путем введения антигена или путем экспрессии трансгена данного антигена). Антитело по изобретению можно вводить субъекту-человеку для терапевтических целей. Более того, антитело по изобретению можно вводить млекопитающему, отличному от человека, экспрессирующему антиген, с которым иммуноглобулин перекрестно реагирует (например, приматы, свинья или мышь), для ветеринарных целей или используя его в качестве животной модели человеческого заболевания. Что касается последнего, такие животные модели могут быть полезны для оценки терапевтической эффективности антител по изобретению (например, проверки дозировки и зависимости от времени введения).
Антитела по изобретению можно применять для лечения, ингибирования, замедления прогрессирования, предотвращения/замедления рецидивов, облегчения или профилактики заболеваний, нарушений или состояний, связанных с экспрессией и/или активностью одной или более молекул антигена.
Типичные нарушения включают карциному, лимфому, бластому, саркому и лейкемию или лимфоидные злокачественные нарушения. Более конкретные примеры таких видов рака включают плоскоклеточный рак (например, чешуйчатоклеточный рак), рак легкого, включая мелкоклеточный рак легкого, немелкоклеточный рак легкого, аденокарциному легкого и плоскоклеточную карциному легкого, рак брюшины, печеночно-клеточный рак, гастральный или желудочный рак, включая рак желудочно-кишечного тракта, рак поджелудочной железы, глиобластому, рак шейки матки, рак яичника, рак печени, рак мочевого пузыря, рак мочевыводящих путей, гепатому, рак молочной железы, рак толстой кишки, рак прямой кишки, колоректальный рак, эндометриальную или маточную карциному, карциному слюнной железы, почечный или ренальный рак, рак простаты, рак вульвы, рак щитовидной железы, печеночную карциному, анальную карциному, карциному пениса, меланому, множественную миелому и B-клеточную лимфому, рак мозга, а также рак головы и шеи и связанные метастазы. В некоторых вариантах осуществления рак выбирают из группы, состоящей из мелкоклеточного рака легких, нейробластом, меланомы, карциномы молочной железы, гастрального рака, колоректального рака (CRC) и печеночно-клеточной карциномы.
Антитела по изобретению также полезны для лечения (включая профилактику) нарушений, патология которых включает клеточную дегенерацию или дисфункцию, например, для лечения различных (хронических) нейродегенеративных заболеваний и острых повреждений нервных клеток. Такие нейродегенеративные нарушения включают, но не ограничиваются ими, периферические невропатии, мотонейрональные нарушения, такие как боковой амиотрофический склероз (ALS, болезнь Лу Герига), паралич Белла и различные состояния, в патологию которых вовлечены спинальная мышечная атрофия или паралич, а также другие нейродегенеративные заболевания человека, такие как болезнь Альцгеймера, болезнь Паркинсона, эпилепсия, рассеянный склероз, хорея Гентингтона, синдром Дауна, нервная глухота и болезнь Меньера, а также острые поражения нервных клеток, например, вследствие травмы или поражения спинного мозга.
В некоторых вариантах осуществления пациенту вводят иммуноконъюгат, представляющий собой антитело, конъюгированное с одним или большим количеством цитотоксических средств. В некоторых вариантах осуществления иммуноконъюгат и/или антиген, с которым он связан, интернализуется клеткой, что приводит к повышенной терапевтической эффективности иммуноконъюгата в лизировании клетки-мишени, с которой он связывается. В одном варианте осуществления цитотоксическое средство имеет мишенью или причиняет вред нуклеиновой кислоте в целевой клетке. В одном варианте осуществления цитотоксическое средство имеет мишенью или препятствует полимеризации микротрубочек. Примеры таких цитотоксических средств включают любые из химиотерапевтических средств, приведенных в данном описании (таких, как мейтанзиноид, ауристатин, доластатин или калихимицин), радиоактивный изотоп, либо рибонуклеазу или эндонуклеазу ДНК.
Антитела по изобретению можно использовать в терапии либо отдельно, либо в сочетании с другими композициями. Например, антитело по изобретению можно вводить совместно с другим антителом, химиотерапевтическим средством(ми) (включая «коктейли» химиотерапевтических средств), другим цитотоксическим средством(ми), антиангиогенным средством(ми), цитокинами и/или средством(ми), ингибирующим рост. Там, где антитело по изобретению ингибирует рост опухоли, может быть особенно желательным комбинировать его с одним или большим количеством других терапевтических средств, которые также ингибируют рост опухоли. Альтернативно или дополнительно пациент может получать комбинированную лучевую терапию (например, облучение внешним лучом или терапию с использованием радиоактивно меченого средства, такого как антитело). Такие вышеуказанные виды комбинированной терапии включают совместное введение (когда два или более средств входят в состав одного и того же или отдельных препаратов), а также раздельное введение, в случае которого введение антитела по изобретению может иметь место до и/или после применения дополнительной терапии или терапий.
Комбинированная терапия
Как указано выше, изобретение относится к комбинированным видам терапии, при которых антитело к эфрину В2 вводят совместно с другой терапией. Например, антитела к эфрину В2 используют в сочетании с противораковыми терапевтическими средствами или терапевтическими средствами против неоваскуляризации, чтобы лечить различные неопластические и ненеопластические состояния. В одном варианте осуществления неопластические или ненеопластические состояния характеризуются патологическим нарушением, связанным с аберрантным или нежелательным ангиогенезом. Антитело к эфрину В2 можно вводить периодически или в сочетании с другим средством, эффективным для этих целей, как в составе одной композиции, так и в виде отдельных композиций. Альтернативно или дополнительно можно вводить множественные ингибиторы эфрина B2.
Введение антитела к эфрину В2 можно выполнять одновременно, например, в виде одной композиции либо в виде двух или более различных композиций, используя одинаковые или разные пути введения. Альтернативно или дополнительно введение можно выполнять последовательно в любом порядке. В некоторых вариантах осуществления между введением двух или более композиций интервалы могут составлять от минут до дней, недель и месяцев. Например, противораковое средство может быть введено первым, затем следует ингибитор эфрина B2. Однако одновременное введение или введение антитела к эфрину В2 первым также предусмотрено.
Эффективные количества терапевтических средств, вводимых в сочетании с антителом к эфрину В2, будет определять врач или ветеринар. Проводят дозированное введение и его корректировку для достижения максимальной коррекции состояний, подвергающихся лечению. Доза дополнительно будет зависеть от таких факторов, как тип используемого терапевтического средства и специфика пациента, подвергающегося лечению. Подходящие дозировки противоракового средства являются теми же, что и применяемые в настоящее время, и могут быть снижены благодаря совместному действию (синергия) противоракового средства и антитела к эфрину В2. В определенных вариантах осуществления сочетание ингибиторов потенцирует эффективность отдельного ингибитора. Термин «потенцирует» означает увеличение эффективности терапевтического средства при его обычной или одобренной дозе.
Как правило, антитела к эфрину В2 и противораковые средства являются подходящими для одинаковых или похожих заболеваний, чтобы блокировать или снизить патологические нарушения, такие как рост опухоли или рост раковых клеток. В одном варианте осуществления противораковое средство представляет собой средство против ангиогенеза.
Антиангиогенная терапия в отношении рака является стратегией лечения рака, имеющей целью ингибировать развитие кровеносных сосудов опухоли, необходимых для доставки питательных веществ, поддерживающих рост опухоли. Поскольку ангиогенез вовлечен как в первичный рост опухоли, так и в метастазирование, предлагаемое по данному изобретению антиангиогенное лечение способно ингибировать неопластический рост опухоли на первичном участке, а также предотвращать метастазирование опухолей на вторичных участках, давая возможность, таким образом, атаковать опухоль другим терапевтическим средствам.
Многие антиангиогенные средства определены и известны в данной области, включая те, что перечислены в данном описании, например перечисленные в разделе «Определения» и, например, в Carmeliet and Jain, Nature 407:249-257 (2000), Ferrara et al., Nature Reviews: Drug Discovery, 3:391-400 (2004) и Sato Int. J. Clin. Oncol., 8:200-206 (2003). Смотри также патентную заявку США US 20030055006. В одном варианте осуществления антитело к эфрину В2 используют в сочетании с нейтрализующим антителом к VEGF (или фрагментом) и/или другим антагонистом VEGF, или антагонистом рецептора VEGF, включая, но не ограничиваясь ими, например, фрагменты растворимого рецептора VEGF (например, VEGFR-1, VEGFR-2, VEGFR-3), нейропиллины (например, NRP1, NRP2), аптамеры, способные блокировать VEGF или VEGFR, нейтрализующие антитела к VEGF, низкомолекулярные ингибиторы тирозинкиназ VEGFR (RTK), антисмысловые стратегии для VEGF, рибозимы против VEGF или рецепторов VEGF, варианты антагонистов VEGF и их любые сочетания. Альтернативно или дополнительно два или более ингибиторов ангиогенеза можно при желании совместно ввести пациенту в дополнение к антагонисту VEGF и другому средству. В определенном варианте осуществления одно или более дополнительных терапевтических средств, например противораковых средств, можно вводить в сочетании с антителом к эфрину В2, антагонистом VEGF и антиангиогенным средством.
В определенных аспектах изобретения другие терапевтические средства, полезные для комбинированной терапии опухоли с антителом к эфрину В2, включают другие виды терапии рака (например, хирургическое вмешательство, радиологическое воздействие (например, включая облучение или введение радиоактивных веществ), химиотерапию, воздействие противораковыми средствами, перечисленными в данном описании и известными в данной области, или их сочетания). Альтернативно или дополнительно два или более антител, связывающих тот же самый либо два или более различных антигенов, раскрытых в данном описании, могут быть совместно введены пациенту. Иногда может также быть полезным ввести пациенту один или более цитокинов.
Химиотерапевтические средства
В определенных аспектах изобретение относится к способу блокирования или уменьшения роста опухоли или роста раковых клеток путем введения эффективных количеств антагониста эфрина B2 и/или ингибитора(ов) ангиогенеза и одного или более химиотерапевтических средств пациенту, предрасположенному к раку или у которого диагностирован рак. Множество химиотерапевтических средств можно использовать в методах комбинированной терапии по данному изобретению. Примерный и неограничивающий список предусмотренных химиотерапевтических средств приводится в данном документе в разделе «Определения».
Как станет очевидно рядовому специалисту в данной области, соответствующие дозы химиотерапевтических средств будут в основном примерно такими, которые уже применяются в вариантах клинической терапии, в которых химиотерапевтические средства вводят отдельно или в сочетании с другими химиотерапевтическими средствами. Вариации в дозировке, вероятно, будут иметь место в зависимости от состояния, подвергающегося лечению. Врач, назначающий лечение, сможет определить подходящую дозу для отдельного субъекта.
Рецидив роста опухоли
Изобретение также относится к способам и композициям для ингибирования или предотвращения рецидива роста опухоли или рецидива роста раковых клеток. Словосочетания «рецидив роста опухоли» или «рецидив роста раковых клеток» используют для описания состояния, при котором применяемая для лечения пациентов одна или более разновидностей доступной в настоящее время терапии (например, терапия рака, такая как химиотерапия, лучевая терапия, хирургическое вмешательство, гормональная терапия и/или биологическая терапия/иммунотерапия, терапия с помощью антитела к VEGF, особенно стандартная схема лечения для конкретного вида рака) не является клинически эффективной для лечения пациентов, либо пациенты больше не получают благотворного эффекта от данной терапии, так что эти пациенты нуждаются в дополнительной эффективной терапии. Как используют в данном описании, эта фраза может также относиться к состоянию «невосприимчивого/рефракторного» пациента, например, как называют пациентов, которые реагируют на терапию, хотя страдают от побочных эффектов, пациентов с возникшей резистентностью, не реагирующих на терапию, не реагирующих на терапию в достаточной степени и так далее. В различных вариантах осуществления рак представляет собой рецидив роста опухоли или рецидив роста раковых клеток, когда количество раковых клеток не было существенно снижено, либо увеличилось, или размер опухоли не был значительно уменьшен, либо увеличился, или не удается дальше сокращать размер опухоли или число раковых клеток. Определить, являются ли раковые клетки рецидивом роста опухоли или рецидивом роста раковых клеток можно либо in vivo, либо in vitro любым из способов, известных в данной области для анализа эффективности воздействия на раковые клетки, используя принятые в данной области значения слов «рецидив», или «рефракторный», или «невосприимчивый» в таком контексте. Примером рецидива роста опухоли является опухоль, устойчивая к лечению антителами к VEGF.
Изобретение относится к способам блокирования или уменьшения рецидива роста опухоли или рецидива роста раковых клеток у субъекта путем введения одного или более антител к эфрину B2, чтобы блокировать или уменьшить рецидив роста опухоли или рецидив роста раковых клеток у субъекта. В определенных вариантах осуществления антагонист можно вводить после введения противоракового терапевтического препарата. В определенных вариантах осуществления антитело к эфрину В2 вводят одновременно с противораковой терапией. Альтернативно или дополнительно терапию антителом к эфрину В2 чередуют с другой противораковой терапией, что можно осуществлять в любом порядке. Изобретение также охватывает способы введения одного или более ингибиторных антител, чтобы предотвратить возникновение или возврат рака у пациентов, предрасположенных к заболеванию раком. Как правило, субъект при этом подвергался или подвергается противораковой терапии. В одном варианте осуществления противораковая терапия представляет собой лечение средством против ангиогенеза, например антагонистом VEGF. Средство против ангиогенеза включает те, которые известны в данной области, и те, которые перечислены в разделе «Определения» в данном описании. В одном варианте осуществления средство против ангиогенеза представляет собой нейтрализующее антитело к VEGF или фрагмент (например, гуманизированное A4.6.1, AVASTIN® (Genentech, South San Francisco, CA), Y0317, M4, G6, B20, 2C3 и так далее). Смотри, например, патенты США 6582959, 6884879, 6703020, WO 98/45332, WO 96/30046, WO 94/10202, EP 0666868B1, патентные заявки США 20030206899, 20030190317, 20030203409 и 20050112126, Popkov et al., Journal of Immunological Methods 288:149-164 (2004) и WO2005012359. Дополнительные средства можно вводить в сочетании с антагонистом VEGF и антителом к эфрину В2 для блокирования или уменьшения рецидива роста опухоли или рецидива роста раковых клеток, например, смотри раздел, озаглавленный «Комбинаторная терапия» в данном описании.
Антитело по изобретению (и вспомогательное терапевтическое средство) вводят любыми подходящими путями, включая парентеральное, подкожное, внутрибрюшинное, внутрилегочное и интраназальное введение и, если необходимо местное лечение, введение внутрь пораженных тканей. Парентеральные инфузии включают внутримышечное, внутривенное внутриартериальное, внутрибрюшинное или подкожное введение. Кроме того, антитело удобно вводить импульсной инфузией, особенно при снижающихся дозах антитела. Дозы можно вводить любым подходящим путем, например инъекциями, такими как внутривенная или подкожная инъекция, частично в зависимости от того, является ли введение краткосрочным или продолжительным.
Композиция с антителом по изобретению будет составлена, разделена на дозы и введена в соответствии с качественной медицинской практикой. Факторы, которые следует принимать во внимание в данном контексте, включают конкретное заболевание, которое подвергают лечению, конкретного представителя млекопитающих, которого подвергают лечению, клиническое состояние конкретного пациента, причину заболевания, участок, куда доставляют средство, способ введения, график введения и другие факторы, известные практикующим врачам. Антитело необязательно, но при желании может входить в состав препарата вместе с одним или более средствами, в настоящее время используемыми для предотвращения или лечения интересующего заболевания. Эффективное количество этих других средств зависит от количества антител по изобретению, присутствующего в препарате, типа заболевания или лечения, а также других факторов, обсуждавшихся выше. Их, как правило, используют в тех же дозах и при тех же путях введения, как указано выше, или примерно от 1 до 99% используемых прежде доз.
Для предотвращения или лечения заболевания соответствующая дозировка антитела по изобретению (при использовании самостоятельно или в сочетании с другими средствами, такими как химиотерапевтические средства) будет зависеть от типа заболевания, подвергающегося лечению, типа антитела, степени тяжести и течения заболевания, от того, вводят ли антитело с профилактическими или терапевтическими целями, предыдущей терапии, истории болезни пациента и ответной реакции на антитело, а также от решения лечащего врача. Антитело возможно вводить пациенту единовременно или многократно. В зависимости от типа и степени тяжести заболевания примерно от 1 мкг/кг до 15 мг/кг (например, 0,1 мг/кг-10 мг/кг) антитела является исходной подходящей дозировкой для введения пациенту либо, например, при одном или большем количестве отдельных введений, либо при непрерывной инфузии. Типичная суточная дозировка может находиться в диапазоне примерно от 1 мкг/кг до 100 мг/кг или более в зависимости от факторов, упомянутых выше. Для повторных введений на протяжении нескольких дней или дольше, в зависимости от состояния, лечение продолжают до тех пор, пока не наступит желательное подавление симптомов заболевания. Примерная дозировка антитела может находиться в диапазоне примерно от 0,05 мг/кг примерно до 10 мг/кг. Таким образом, пациенту можно вводить одну или больше доз, составляющих примерно 0,5 мг/кг, 2,0 мг/кг, 4,0 мг/кг или 10 мг/кг (или их любое сочетание). Такие дозы можно вводить с перерывами, например, каждую неделю или каждые три недели (например, таким образом, что пациент получает от примерно двух до примерно двадцати, например примерно шесть доз антитела). Можно вводить первичную ударную дозу, а затем одну или более меньших доз. Примерный режим дозирования включает введение первичной ударной дозы, составляющей примерно 4 мг/кг, с последующим еженедельным введением поддерживающей дозы, составляющей примерно 2 мг/кг антитела. Однако могут быть полезными и другие режимы дозирования. Положительный результат данной терапии легко можно контролировать с помощью общепринятых методик и анализов.
Антитела к эфрину В2 по изобретению являются полезными для использования в анализах, выявляющих экспрессию эфрина B2 (таких, как диагностические или прогностические анализы) в определенных клетках или тканях, где антитела являются мечеными, как описано ниже, и/или являются иммобилизованными на нерастворимой матрице.
В другом аспекте изобретение относится к способам обнаружения эфрина B2, где способы включают обнаружение в образце комплекса эфрин B2-антитело к эфрину В2. Термин «обнаружение», как используют в данном описании, включает качественное и/или количественное обнаружение (измерение уровней) относительно или безотносительно контроля.
В другом аспекте изобретение относится к способам диагностирования заболевания, связанного с экспрессией и/или активностью эфрина B2, где способы включают обнаружение комплекса эфрин B2-антитело к эфрину В2 в биологическом образце от пациента, страдающего от или с подозрением на заболевание. В некоторых вариантах осуществления экспрессия эфрина B2 представляет собой повышенную экспрессию или аномальную (нежелательную) экспрессию. В некоторых вариантах осуществления заболевание представляет собой опухоль, рак и/или пролиферативное клеточное нарушение.
В другом аспекте изобретение относится к любому из антител к эфрину B2, описанных в данном документе, где антитело к эфрину В2 содержит детектируемую метку.
В другом аспекте изобретение относится к комплексу любого из антител к эфрину B2, описанных в данном документе, с эфрином B2. В некоторых вариантах осуществления комплекс существует in vivo или in vitro. В некоторых вариантах осуществления комплекс включает раковую клетку. В некоторых вариантах осуществления антитело к эфрину В2 является меченым для обнаружения.
Антитела к эфрину В2 можно использовать для обнаружения эфрина B2 любым из множества хорошо известных аналитических методов обнаружения. Например, биологический образец можно анализировать на содержание эфрина B2, получая образец из нужного источника, смешивая образец с антителом к эфрину В2, чтобы дать возможность антителу образовать комплекс антитело/эфрин B2 с любым эфрином B2, присутствующим в смеси, и детектируя любой комплекс антитело/эфрин B2, присутствующий в смеси. Биологический образец можно подготавливать для анализа при помощи методов, известных в данной области, которые подходят для конкретного образца. Способы смешивания образца с антителами и способы обнаружения комплекса антитело/эфрин B2 выбирают в соответствии с типом используемого анализа. Такие анализы включают иммуногистохимический, конкурентный и сэндвич-анализ, а также анализы на стерическое ингибирование.
Во всех аналитических методиках для эфрина B2 используют один или более из следующих реагентов: меченый аналог эфрина B2, иммобилизованный аналог эфрина B2, меченое антитело к эфрину В2, иммобилизованное антитело к эфрину В2 и стерические конъюгаты. Меченые реагенты также известны как «индикаторы».
Используемая метка представляет собой любую детектируемую функциональную группу, которая не препятствует связыванию эфрина B2 и антитела к эфрину В2. Для использования в иммуноферментном анализе известно множество меток, примеры включают фрагменты, которые можно обнаруживать напрямую, такие как люминесцентные, хемилюминесцентные и радиоактивные метки, а также фрагменты, такие как ферменты, которые должны прореагировать или перейти в производное для того, чтобы быть обнаруженными. Примеры таких меток включают радиоизотопы 32P, 14C, 125I, 3H и 131I, флуорофоры, такие как редкоземельные хелаты или флуоресцеин и его производные, родамин и его производные, данзил, умбеллиферон, люциферазы, например люциферазу светляков и бактериальную люциферазу (патент США № 4737456), люциферин, 2,3-дигидрофталазиндионы, пероксидазу хрена (HRP), щелочную фосфатазу, β-галактозидазу, глюкоамилазу, лизоцим, сахаридоксидазы, например глюкозоксидазу, галактозоксидазу и глюкоза-6-фосфатдегидрогеназу, гетероциклические оксидазы, такие как уриказа и ксантиноксидаза, связанные с ферментом, который использует перекись водорода для окисления предшественника красителя, таким как HRP, лактопероксидаза или микропероксидаза, биотин/авидин, спиновые метки, бактериофаговые метки, стабильные свободные радикалы и тому подобное.
Доступны общепризнанные методики для ковалентного связывания этих меток с белками или полипептидами. Например, можно использовать сшивающие агенты, такие как диальдегиды, карбодиимиды, дималеимиды, бис-имидаты, бис-диазотированный бензидин и тому подобное, чтобы прикреплять к антителам вышеуказанные флуоресцентные, хемилюминесцентные и ферментные метки. Смотри, например, патенты США № 3940475 (флуорометрия) и 3645090 (ферменты); Hunter et al., Nature, 144: 945 (1962); David et al., Biochemistry, 13: 1014-1021 (1974); Pain et al., J. Immunol Methods, 40: 219-230 (1981) и Nygren, J. Histochem. and Cytochem., 30: 407-412 (1982). Предпочтительными метками в данном описании являются ферменты, такие как пероксидаза хрена и щелочная фосфатаза. Конъюгирование подобной метки, включая ферменты, с антителом является стандартной манипуляционной процедурой для рядового специалиста в области иммуноферментного анализа. Смотри, например, O'Sullivan et al., «Methods for the Preparation of Enzyme-antibody Conjugates for Use in Enzyme Immunoassay» в Methods in Enzymology, ed. J.J. Langone and H. Van Vunakis, Vol. 73 (Academic Press, New York, New York, 1981), p. 147-166.
Для определенных аналитических методов необходима иммобилизация реагентов. Иммобилизация влечет за собой отделение антитела к эфрину В2 от любого эфрина B2, который остается в свободном состоянии в растворе. Обычно это достигается переводом в нерастворимую форму либо антитела к эфрину В2, либо аналога эфрина B2 перед проведением анализа, например, адсорбцией на нерастворимой в воде матрице или поверхности (Bennich et al., США 3720760), ковалентным связыванием (например, с использованием перекрестного сшивания глутеральдегидом) или переводом в нерастворимую форму антитела к эфрину В2 либо аналога эфрина B2 впоследствии, например, иммунопреципитацией.
Экспрессию белков в образце можно исследовать с помощью протоколов иммуногистохимии и окрашивания. Показано, что иммуногистохимическое окрашивание срезов тканей является надежным методом оценки или обнаружения присутствия белков в образце. В иммуногистохимических («IHC») методиках используют антитело, чтобы исследовать и визуализировать клеточные антигены in situ, обычно с помощью хромогенных или флуоресцентных методов. Для подготовки образца можно использовать образец ткани или клетки млекопитающего (как правило, пациента-человека). Примеры образцов включают, но не ограничиваются ими, раковые клетки, такие как раковые клетки толстой кишки, молочной железы, простаты, яичника, легкого, желудка, поджелудочной железы, лимфомы и лейкоза. Образцы можно получать с помощью различных методик, известных в данной области, включая, но не ограничиваясь ими, хирургическое удаление, аспирацию или биопсию. Ткань может быть свежей или замороженной. В одном варианте осуществления образец является фиксированным и залитым в парафин или тому подобное. Образец ткани может быть зафиксирован (то есть законсервирован) общепринятыми методами. Рядовой специалист в данной области признает, что выбор фиксатора зависит от цели, для которой образец будет окрашен гистологически или иным образом проанализирован. Рядовой специалист в данной области также признает, что продолжительность фиксации зависит от размера образца ткани и используемого фиксатора.
IHC можно проводить в сочетании с дополнительными методами, такими как морфологическое окрашивание и/или флуоресцентная гибридизация in situ. В основном применяют два метода IHC, прямой и непрямой анализы. В соответствии с первым анализом связывание антитела с целевым антигеном (например, эфрином B2) определяют напрямую. В данном прямом анализе используют меченый реагент, такой как флуоресцентный маркер или меченое ферментом первичное антитело, которое может быть визуализировано без дополнительных взаимодействий антитела. При типичном непрямом анализе неконъюгированное первичное антитело связывается с антигеном, а затем меченое вторичное антитело связывается с первичным антителом. Если вторичное антитело конъюгировано с ферментной меткой, добавляют хромогенный или флуорогенный субстрат для визуализации антигена. Происходит амплификация сигнала, поскольку несколько вторичных антител могут реагировать с различными эпитопами первичного антитела.
Первичное и/или вторичное антитело, используемое для иммуногистохимического анализа, обычно бывает меченым детектируемым фрагментом. Множество различных меток доступны для использования, которые можно в основном отнести к следующим категориям.
Помимо методик подготовки препарата, обсуждаемых выше, может потребоваться дополнительная обработка среза ткани до, во время или после IHC. Например, можно выполнять методики восстановления эпитопа, такие как нагревание образца ткани в цитратном буфере (смотри, например, Leong et al. Appl. Immunohistochem. 4(3):201 (1996)).
После необязательной стадии блокировки срез ткани подвергают воздействию первичного антитела в течение достаточного периода времени и при соответствующих условиях таким образом, что первичное антитело связывается с целевым белковым антигеном в образце ткани. Подходящие условия для достижения этого можно определять обычным экспериментальным путем. Степень связывания антитела с образцом определяют, используя одну из детектируемых меток, обсуждавшихся выше. Предпочтительно метка является ферментной меткой (например, HRPO), которая катализирует химическое изменение хромогенного субстрата, такого как хромоген 3,3'-диаминобензидин. Предпочтительно ферментную метку конъюгируют с антителом, которое специфически связывается с первичным антителом (например, первичное антитело представляет собой кроличье поликлональное антитело и вторичное антитело представляет собой анти-кроличье антитело козы).
Подготовленные таким образом образцы можно помещать на предметное стекло и накрывать покровным стеклом. Затем проводят оценку слайдов, например, используя микроскоп, при этом можно использовать критерии интенсивности окрашивания, обычно применяемые в данной области. Критерии интенсивности окрашивания можно оценивать следующим образом:
| ТАБЛИЦА 2 | |
| Картина окрашивания | Баллы |
| В клетках не наблюдается окрашивании | 0 |
| Слабое, едва уловимое окрашивание наблюдается в более чем 10% клеток | 1+ |
| Окрашивание от слабого до умеренного наблюдается в более чем 10% клеток | 2+ |
| Окрашивание от умеренного до сильного наблюдается в более чем 10% клеток | 3+ |
Как правило, балл для картины окрашивания, соответствующий примерно 2+ или выше при анализе IHC, является диагностическим и/или прогностическим. В некоторых вариантах осуществления балл для картины окрашивания, соответствующий примерно 1+ или выше, является диагностическим и/или прогностическим. В других вариантах осуществления балл для картины окрашивания, соответствующий примерно 3 или выше, является диагностическим и/или прогностическим. Очевидно, что если клетки и/или ткань из опухоли или аденомы толстой кишки изучают с использованием IHC, окрашивание в основном определяется или оценивается в опухолевых клетках и/или ткани (в отличие от стромальной или окружающей ткани, которая может присутствовать в образце).
Другие методы анализа, известные как конкурентные или сэндвич-анализы, хорошо разработаны и широко используются в коммерческой диагностической отрасли.
В основе конкурентных анализов лежит способность индикаторного аналога эфрина B2 конкурировать с тестируемым образцом эфрина B2 за ограниченное число антигенсвязывающих центров антитела к эфрину В2. Обычно антитело к эфрину В2 переводят в нерастворимую форму до или после конкурентного взаимодействия, а затем индикатор и эфрин B2, связанные с антителом к эфрину В2, отделяют от несвязавшихся индикатора и эфрина B2. Это разделение осуществляют декантированием (при этом партнер по связыванию был предварительно переведен в нерастворимую форму) либо центрифугированием (при этом партнер по связыванию был переведен в осадок после конкурентной реакции). Количество тестируемого образца эфрина B2 обратно пропорционально количеству связанного индикатора, что измеряют по количеству маркерного вещества. Получают кривые доза-ответ с известными количествами эфрина B2 и сравнивают с результатами теста, чтобы количественно определить содержание эфрина B2, присутствующего в тестируемом образце. Такие анализы называют системой ELISA, если в качестве детектируемых маркеров используют ферменты.
Для других видов конкурентного анализа, называемого «гомогенным» анализом, не требуется разделения фаз. Здесь получают конъюгат фермента с эфрином B2 и используют таким образом, что когда антитело к эфрину В2 связывается с эфрином B2, присутствие антитела к эфрину В2 модифицирует активность фермента. В этом случае эфрин B2 или его иммунологически активные фрагменты конъюгированы при помощи бифункционального органического моста с ферментом, таким как пероксидаза. Конъюгаты для использования с антителом к эфрину В2 выбирают таким образом, что связывание антитела к эфрину В2 ингибирует или усиливает ферментативную активность метки. В чистом виде такой метод широко практикуется под названием EMIT.
Стерические конъюгаты используют в методах, основанных на стерическом препятствии, для гомогенного анализа. Такие конъюгаты синтезируют, ковалентно связывая низкомолекулярный гаптен с малым фрагментом эфрина B2 таким образом, что антитело к гаптену в основном не способно связывать конъюгат в то же самое время, что и антитело к эфрину В2. По этой методике анализа эфрин B2, присутствующий в тестируемом образце, свяжет антитело к эфрину В2, тем самым давая возможность анти-гаптену связать конъюгат, что приводит к изменению характера гаптена конъюгата, например к изменению флуоресценции, если гаптен является хромофором.
Сэндвич-анализы являются особенно полезными для определения эфрина B2 или антител к эфрину B2. В последовательных сэндвич-анализах иммобилизованное антитело к эфрину В2 используют, чтобы адсорбировать эфрин B2 из тестируемого образца, тестируемый образец удаляют промыванием, связавшийся эфрин B2 используют, чтобы адсорбировать второе, меченое антитело к эфрину В2, и связавшийся материал затем отделяют от остаточного индикатора. Количество связавшегося индикатора прямо пропорционально содержанию эфрина B2 в тестируемом образце. При «одновременных» сэндвич-анализах тестируемый образец не отделяют перед добавлением меченого анти-эфрина B2. Последовательный сэндвич-анализ с использованием моноклонального антитела к эфрину B2 в качестве одного антитела и поликлонального антитела к эфрину В2 в качестве другого является полезным для тестирования образцов на эфрин B2.
Вышеуказанные анализы являются лишь примерами анализов на определение эфрина B2. Другие методы, разработанные в настоящее время или в будущем, в которых используют антитело к эфрину В2 для определения эфрина B2, входят в область данного описания, включая биоанализы, приведенные в данном описании.
Изделия
В другом аспекте данное изобретение относится к изделию, содержащему материалы, полезные для лечения, предотвращения и/или диагностики заболеваний, описанных выше. Изделие представляет собой контейнер и этикетку или пакет, вложенный или прикрепленный к контейнеру. Подходящие контейнеры включают, например, бутылки, флаконы, шприцы и так далее. Контейнеры могут быть выполнены из различных материалов, таких как стекло или пластмасса. Контейнер содержит композицию, которая сама по себе или в сочетании с другой композицией(ми) является эффективной для лечения, предотвращения и/или диагностирования состояния, и может иметь стерильное входное отверстие (например, контейнер может представлять собой пакет или флакон с внутривенным раствором, имеющий заглушку, поддающуюся прокалыванию иглой для подкожных инъекций). По меньшей мере, одно активное средство в композиции представляет собой антитело по изобретению. Этикетка или пакет-вкладыш указывает, что композицию используют для лечения определенного состояния, такого как рак. Кроме того, изделие может содержать (a) первый контейнер с содержащейся в нем композицией, где композиция содержит антитело по изобретению, и (b) второй контейнер с содержащейся в нем композицией, где композиция содержит дополнительное цитотоксическое средство. В данном варианте осуществления изобретения изделие может дополнительно содержать пакет-вкладыш, указывающий, что первую и вторую композиции с антителом можно использовать для лечения конкретного состояния, например рака. Альтернативно или дополнительно изделие, кроме того, может содержать второй (или третий) контейнер, содержащий фармацевтически приемлемый буферный раствор, такой как бактериостатическая вода для инъекций (BWFI), забуференный фосфатом физиологический раствор, раствор Рингера и раствор декстрозы. Он может дополнительно содержать другие материалы, желательные с коммерческой и потребительской точки зрения, включая другие буферные растворы, разбавители, фильтры, иглы и шприцы.
Далее следуют примеры способов и композиций по изобретению. Очевидно, что можно осуществлять на практике и другие варианты осуществления, принимая во внимание основное описание, представленное выше.
ПРИМЕРЫ
Пример 1: Получение антител к эфрину B2
В данной области известно множество способов для создания фагово-дисплейных библиотек, из которых может быть получено интересующее антитело. Искусственные фаговые библиотеки антител были созданы на основе одного каркаса (гуманизированное антитело к ErbB2, 4D5) путем внесения разнообразия в определяющие комплементарность области (CDRs) тяжелой и легкой цепей (Lee, C.V. et al. J. Mol. Biol. 340, 1073-93 (2004); Liang, W. C. et al. J. Biol. Chem. 281, 951-61 (2006)). Разделение методом пэннинга чашек с исходными библиотеками проводили против His-маркированного человеческого эфрина B2, иммобилизованного на иммунопланшетах maxisorp. После четырех циклов обогащения клоны случайным образом отбирали и специфически связавшиеся выявляли при помощи фаговой ELISA. Полученные клоны, связывающие ч-эфрин B2, дополнительно подвергали скринингу с His-маркированным мышиным белком эфрином B2 для выявления перекрестно-видовых клонов. Клон 19 обладал благоприятными характеристиками в данных анализах и был выбран для дальнейшего исследования. Для каждого положительного фагового клона вариабельные области тяжелой и легкой цепей субклонировали в векторы экспрессии pRK, которые были разработаны для экспрессии полноразмерных цепей IgG. Проводили совместную трансфекцию конструкций тяжелой цепи и легкой цепи в клетки 293 или CHO и экспрессированные антитела очищали из бессывороточной среды на аффинной колонке с протеином A. Очищенные антитела проверяли методом ELISA на блокирование взаимодействия между эфрином B2 и EphB-рецепторами, а также методом FACS на связывание со стабильными клеточными линиями, экспрессирующими либо полноразмерный человеческий эфрин B2, либо мышиный эфрин B2. Для созревания аффинности фаговые библиотеки с тремя различными сочетаниями CDR-петель (CDR-L3, -H1 и -H2), происходящими из исходного интересующего клона, были сконструированы, используя стратегию мягкой рандомизации, таким образом, что остаток в каждом выбранном положении мутировал на остаток не-дикого типа или сохранялся как дикий тип с частотой примерно 50:50 (Liang et al., 2006, выше). Затем выявляли клоны с высокой аффинностью в процессе четырех циклов пэннинга фазы растворителя против как человеческих, так и мышиных His-маркированных белков эфрина B2 при прогрессивно возрастающей строгости условий. Проводили скрининг выбранных клонов методом фагового ELISA, а затем экспрессировали как Fab-белки и их аффинность определяли при помощи Biacore. Последовательности HVR-областей исходного клона 19 и созревших по аффинности клонов представлены на фиг.1.
Пример 2: Характеристика антител к эфрину B2
Для определения аффинности связывания мышиных анти-эфрин B2 мАТ проводили измерения методом поверхностного плазмонного резонанса (SRP) с использованием BIAcore™-3000 (BIAcore, Inc., Piscataway, NJ). Кратко, биосенсорные чипы из карбоксиметилированного декстрана (CM5, BIAcore Inc.) активировали N-этил-N'-(3-диметиламинопропил)карбодиимидгидрохлоридом (EDC) и N-гидроксисукцинимидом (NHS) в соответствии с инструкциями производителя. Антитело к эфрину В2 разводили 10 мМ ацетатом натрия, pH 4,8, до 5 мкг/мл перед впрыскиванием со скоростью потока 5 мкл/минуту для получения примерно 500 реакционных единиц (RU) связанного антитела. Затем впрыскивали 1M этаноламин, чтобы блокировать непрореагировавшие группы. Для кинетических измерений впрыскивали либо человеческие, либо мышиные молекулы эфрин B2-His (0,7нМ-500нМ) в двукратных серийных разведениях в PBS с 0,05% Tween 20 при 25°C при скорости потока 25 мкл/мин. Скорости ассоциации (kon) и скорости диссоциации (koff) рассчитывали, используя простую «один к одному» модель связывания Ленгмюра (BIAcore Evaluation Software version 3.2). Равновесную константу диссоциации (Kd) рассчитывали как отношение koff/kon. Результаты эксперимента представлены в таблице 3. «NA» означает, что измерение не выполняли.
| Таблица 3 | ||||||
| Аффинность связывания и кинетики связывания антител к эфрину B2 с человеческим и мышиным эфрином B2 | ||||||
| Антитело к эфрину В2 | Мышиный антиген | Человеческий антиген | ||||
| kon/105 | koff/ 10-4 |
Kd(нМ) | kon/105 | koff/ 10-4 |
Kd(нМ) | |
| YW31.19 | 20,7 | 4,77 | 0,23 | 2,44 | 12,7 | 5,2 |
| YW31.19.1D8 | 94,3 | 1,65 | 0,017 | 11,2 | 0,76 | 0,07 |
| YW31.19.2D3 | 40,2 | 0,61 | 0,015 | 5,69 | 0,43 | 0,08 |
Пример 3: Воздействие антителом к эфрину В2 блокирует передачу сигнала EphB4 при анализе в клеточной системе
Для того чтобы продемонстрировать способность антител к эфрину B2 блокировать взаимодействие мембраносвязанного эфрина B2 с EphB4, авторы проводили анализ в клеточной системе, в котором EphB4 и эфрин B2 были презентированы различными типами клеток. Клетки 3T3, избыточно экспрессирующие человеческий эфрин B2, использовали, чтобы стимулировать клетки HUVEC, которые экспрессируют высокий уровень EphB4, но малое количество эфрина B2, и проверяли способность антитела к EphB4 ингибировать активацию EphB4.
Клетки 3T3, избыточно экспрессирующие человеческий эфрин B2, получали следующим образом: человеческий полноразмерный эфрин B2 клонировали в вектор pcDNA5/FRT (Invitrogen) и затем использовали для получения стабильной клеточной линии с 3T3.Flp клетками (Invitrogen) в соответствии с инструкциями производителя.
Клетки 3T3, избыточно экспрессирующие человеческий эфрин B2, наслаивали на клетки HUVEC на 15 или 30 минут в присутствии или отсутствие антитела к EphB4. Активацию EphB4-рецептора оценивали иммунопреципитированием белка EphB4 с последующим выявлением наличия или отсутствия фосфорилирования тирозина EphB4-рецептора методом вестерн-блоттинга с использованием антитела против фосфотирозина (антитело 4G10; Upstate). Кратко, клетки лизировали RIPA-буфером. Клеточные лизаты осветляли центрифугированием и добавляли антитело к EphB4 35.2D8 в количестве 5 мкг/образец. После инкубации при 4°C в течение двух часов иммунный комплекс осаждали при помощи протеин A-aгарозы. Фосфорилирование EphB4 анализировали вестерн-блоттингом, используя антитело против фосфотирозина 4G10 (Upstate) в концентрации 1 мкг/мл.
Результаты данного эксперимента представлены на фиг.7. Наслоение клеток 3T3 на клетки HUVEC вызывало резкое фосфорилирование тирозина EphB4 (дорожка 2). Предварительная инкубация в течение 30 минут клеток HUVEC с антителом к EphB4 (клон 19.2D3 в концентрации 5 мкг/мл) эффективно отменяла фосфорилирование тирозина EphB4, вызванное наслаиванием клеток 3T3-эфрин B2 (дорожка 3). Напротив, у необработанных клеток HUVEC отсутствовала активация EphB4 (дорожка 1) и у необработанных клеток 3T3-эфрин B2 отсутствовала активация EphB4 (дорожка 4). Данные результаты свидетельствуют, что воздействие антителом к эфрину В2 блокирует взаимодействие лиганд эфрин B2-EphB4-рецептор в контексте прямого межклеточного контакта.
Пример 4: Воздействие антителом к эфрину В2 ингибирует ангиогенез при анализе в роговичном кармане крысы
Подавляющую активность моноклонального антитела к эфрину В2 исследовали в анализе с роговичным карманом у крыс. Кратко, крыс Harlan Sprague-Dawley подвергали анестезии, используя изофлуран и инъекционную анестезию в малой дозе. Глаза осторожно выдвигали и фиксировали в нужном положении при помощи нетравматического пинцета. Лезвием номер 15 делали 1,5-мм надрез возле центра роговицы. С помощью микрошпателя надрез осторожно расширяли отслаиванием по строме в направлении внешнего угла глазной щели. Покрытую гидроном гранулу, содержащую ростовой фактор (200 нг VEGF), метилцеллюлозу и сукралфат алюминия (100 мкг), помещали в основание кармана. Антитело к эфрину В2 клона 19.2D3 (10 мкг/гранулу) в случае использования добавляли в гранулу. После завершения хирургической процедуры на глаза наносили гентамициновую мазь. На 6 день животным вводили инъекцией высокомолекулярное соединение флуоресцеинизотиоцианат-декстран и проводили эвтаназию, чтобы визуализировать сосудистую систему. Роговицу извлеченных глаз полностью препарировали и измерения неоваскулярной зоны проводили с использованием компьютерного анализа изображения (Image-Pro Plus).
Результаты данного эксперимента представлены на фиг.8. Воздействие антителом к эфрину В2 существенно уменьшает индуцированную VEGF неоваскуляризацию, свидетельствуя о том, что антитело к эфрину В2 обладает антиангиогенной активностью в данной модели. Контрольное воздействие (без VEGF) приводило к ограниченной неоваскуляризации, тогда как в положительном контроле, обработанном VEGF, наблюдали значительную неоваскуляризацию.
Пример 5: Воздействие антителом к эфрину В2 ингибирует ангиогенез при анализе в спинной камере мыши
Анти-ангиогенную активность моноклонального антитела к эфрину В2 изучали в анализе со спинной камерой мыши. Манипуляции и методики, используемые в анализе со спинной камерой с окошком у мыши, выполняли в основном, как описано в Papernfuss, D. Microvascs. Res., 18:311-318, 1979, и Shan, S. Clinical Cancer Research, 7: 2590-2596, 2001. Кратко, вдоль спины отмечали анатомическую срединную точку и C-скобку вшивали на место шелковым шовным материалом 4-0. Шаблон, соответствующий внешнему диаметру горловины камеры, использовали со стерилизованным маркером, чтобы очертить круг по контуру разреза. Был сделан кольцевой разрез по периметру очерченного контура, затем использовали перекрещенный скальпель, пытаясь придерживаться гиподермы, расположенной над фасцией. Затем область обрезали и обрабатывали с помощью пары тонких пинцетов и ножниц для радужной оболочки. Все, кроме двух, слои фасции удаляли с одной стороны кожной складки: эти слои сохраняли интактную сосудистую систему. Затем C-скобку удаляли. Камеру с оконной рамкой в центре помещали в кожную складку и фиксировали на месте шелковым шовным материалом 4-0. Опухолевые клетки вводили инъекцией в фасцию в окошке. Окошко герметично закрывали стеклянным покровным стеклом. Тонкий слой мази с антибиотиком неоспорином наносили на линию шва и резаные раны для предотвращения инфекции. Животное рассматривали под препаровальным стереомикроскопом, чтобы убедиться в наличии кровообращения в камере. Животным давали возможность оправиться на одеяле с циркулирующим подогревом до тех пор, пока они полностью не отходили от анестезии, а затем возвращали обратно в комнату содержания в микроизоляторных клетках. Антитела (антитело к эфрину В2 клона 19.2D3 и антитело G6 против мышиного VEGF) вводили дважды дозами в 10 мг/кг, при этом одну дозу вводили в/в (i.v.) в момент введения клеток, а вторую дозу вводили прямой инъекцией в камеру на 3 сутки. Площадь опухоли и сосудистую систему опухоли рассчитывали, используя Image-Pro.
Антитело к эфрину В2 существенно уменьшало неоваскуляризацию, что свидетельствовало о том, что антитело к эфрину В2 обладает анти-ангиогенной активностью в данной модели. Воздействие антителом против мышиного VEGF в положительном контроле привело к значительно пониженной неоваскуляризации, как и ожидалось. Напротив, в необработанном контроле наблюдали сильную неоваскуляризацию.
Пример 6: Воздействие антителом к эфрину В2 ингибирует рост опухоли in vivo
Чтобы определить способность антител к эфрину B2 ингибировать опухолевый рост in vivo, антитела к эфрину В2 тестировали на модели опухолевого ксенографта следующим образом. Кратко, бежевых голых мышей (Charles River Laboratories, Hollister, CA) содержали в соответствии с руководством по содержанию и использованию лабораторных животных. Клетки A673 рабдомиосаркомы человека суспендировали в бесклеточной среде и смешивали с равным объемом матригеля. Чтобы получить подкожный ксенографт опухоли, 5×106 клеток вводили инъекцией в правый бок 6-8-недельной самки мыши. Через 24 часа после инокуляции клеток, мышам вводили в/б (i.p.) 0,2 мл антитела в дозе 10 мг/кг массы тела дважды в неделю. Рост опухоли количественно определяли, проводя измерения штангенциркулем. Объем опухоли (мм3) определяли, измеряя длину (l) и ширину (w) и рассчитывая объем (V=lw2/2). Десять животных в каждой группе получали PBS, 10 мг/кг массы тела антитело к эфрину В2 клона 19.2D3 или 10 мг/кг массы тела антитело против мышиного VEGF (B6) дважды в неделю (указано стрелками на фиг.9).
Результаты этого эксперимента представлены на фигуре 9. Воздействие антителом к эфрину В2 приводило к уменьшению среднего объема опухоли, что свидетельствовало о том, что воздействие антителом к эфрину В2 ингибировало рост опухоли in vivo. Представлены средние объемы опухоли со значениями SE.
Несмотря на то что вышеизложенное изобретение описано довольно подробно посредством иллюстраций и примеров для более ясного понимания, описания и примеры не следует истолковывать как ограничивающие область данного изобретения.
Claims (27)
1. Выделенное антитело к эфрину В2, содержащее HVR-L1, HVR-L2, HVR-L3, HVR-H1, HVR-H2 и HVR-H3, где каждая по порядку включает
(i) SEQ ID №:6, 8, 10, 1, 3, 5;
(ii) SEQ ID №:7, 9, 11, 1, 3, 5;
(iii) SEQ ID№:6, 8, 12, 2, 4, 5.
(i) SEQ ID №:6, 8, 10, 1, 3, 5;
(ii) SEQ ID №:7, 9, 11, 1, 3, 5;
(iii) SEQ ID№:6, 8, 12, 2, 4, 5.
2. Антитело по п.1, где, по меньшей мере, часть каркасной последовательности представляет собой консенсусную последовательность человека.
3. Антитело по п.1, где антитело содержит человеческую консенсусную каркасную последовательность группы κ.
4. Антитело по п.1, где антитело содержит человеческую консенсусную каркасную последовательность подгруппы III тяжелой цепи.
5. Полинуклеотид, кодирующий антитело по любому из пп.1-4.
6. Вектор экспрессии, содержащий полинуклеотид по п.5.
7. Клетка-хозяин, способная экспрессировать экзогенный генетический материал, содержащая вектор по п.6.
8. Клетка-хозяин по п.7, где клетка-хозяин является прокариотической.
9. Клетка-хозяин по п.7, где клетка-хозяин является эукариотической.
10. Клетка-хозяин по п.9, где клетка-хозяин является клеткой млекопитающего.
11. Способ получения антитела к эфрину В2, причем указанный способ включает (а) экспрессирование вектора по п.6 в подходящей клетке-хозяине и (b) извлечение антитела.
12. Способ получения иммуноконъюгата к эфрину В2, причем указанный способ включает (а) экспрессирование вектора по п.6 в подходящей клетке-хозяине; (b) извлечение антитела и (с) конъюгирование антитела с цитотоксическим средством.
13. Способ по п.11 или 12, где клетка-хозяин является прокариотической.
14. Способ по п.11 или 12, где клетка-хозяин является эукариотической.
15. Способ обнаружения эфрина В2, причем способ включает обнаружение комплекса эфрина В2 с антителом по любому из пп.1-4 в биологическом образце.
16. Способ диагностирования нарушения, связанного с экспрессией эфрина В2, причем способ включает обнаружение комплекса эфрин В2 с антителом по любому из пп.1-4 в биологическом образце от пациента, имеющего нарушение или с подозрением на нарушение.
17. Способ по п.15 или 16, где антитело к эфрину В2 содержит детектируемую метку.
18. Композиция для лечения или профилактики болезненных состояний, связанных с экспрессией и/или активностью эфрина В2, содержащая эффективное количество антитела к эфрину В2 по любому из пп.1-4 и носитель,
19. Композиция для лечения или профилактики болезненных состояний, связанных с экспрессией и/или активностью эфрина В2, содержащая эффективное количество полинуклеотида по п.5 или 6 и носитель.
20. Способ ингибирования ангиогенеза, включающий введение антитела к эфрину В2 по любому из пп.1-4 субъекту, нуждающемуся в подобном лечении.
21. Способ по п.20, дополнительно включающий введение субъекту эффективного количества антиангиогенного средства.
22. Способ по п.21, где антиангиогенное средство вводят до или после введения антитела к эфрину В2.
23. Способ по п.21, где антиангиогенное средство вводят одновременно с антителом к эфрину В2.
24. Способ по любому из пп.21-23, где антиангиогенное средство представляет собой антагонист фактора роста эндотелия сосудов (VEGF).
25. Способ по п.24, где антагонист VEGF представляет собой антитело к VEGF.
26. Способ по п.25, где антитело к VEGF представляет собой бевацизумаб.
27. Способ по п.20, дополнительно включающий введение эффективного количества химиотерапевтического средства.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US76089106P | 2006-01-20 | 2006-01-20 | |
| US60/760,891 | 2006-01-20 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2008134117A RU2008134117A (ru) | 2010-02-27 |
| RU2451031C2 true RU2451031C2 (ru) | 2012-05-20 |
Family
ID=38656280
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2008134117/10A RU2451031C2 (ru) | 2006-01-20 | 2007-01-19 | Антитела к эфрину в2 и способы их применения |
Country Status (19)
| Country | Link |
|---|---|
| US (4) | US8197815B2 (ru) |
| EP (1) | EP1976884B1 (ru) |
| JP (2) | JP5368110B2 (ru) |
| KR (2) | KR101459160B1 (ru) |
| CN (2) | CN101410413B (ru) |
| AR (1) | AR059096A1 (ru) |
| AU (1) | AU2007243132B2 (ru) |
| BR (1) | BRPI0706935A2 (ru) |
| CA (1) | CA2638133A1 (ru) |
| CL (1) | CL2010000470A1 (ru) |
| DK (1) | DK1976884T3 (ru) |
| HK (1) | HK1187352A1 (ru) |
| IL (3) | IL192571A (ru) |
| NO (1) | NO20083593L (ru) |
| RU (1) | RU2451031C2 (ru) |
| SI (1) | SI1976884T1 (ru) |
| TW (2) | TWI557138B (ru) |
| WO (1) | WO2007127506A2 (ru) |
| ZA (1) | ZA200806187B (ru) |
Families Citing this family (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| AR059096A1 (es) | 2006-01-20 | 2008-03-12 | Genentech Inc | Anticuerpos anti- efrina -b2 y metodos que usan estos |
| AR065271A1 (es) * | 2007-02-09 | 2009-05-27 | Genentech Inc | Anticuerpos anti-robo4 y sus usos |
| ES2378976B1 (es) * | 2010-09-21 | 2013-05-06 | Fundación Centro Nacional De Investigaciones Oncológicas (Cnio) | Anticuerpo contra ephrin b2 y su uso. |
| ES2607086T3 (es) | 2010-11-10 | 2017-03-29 | F. Hoffmann-La Roche Ag | Métodos y composiciones para la inmunoterapia de enfermedades neuronales |
| WO2012112434A1 (en) * | 2011-02-14 | 2012-08-23 | Allergan, Inc. | Inhibiting aberrant blood vessel formation using retargeted endopeptidases |
| KR101505157B1 (ko) * | 2012-05-08 | 2015-03-24 | 주식회사 종근당 | 항―ErbB2 항체 변이체 |
| EP3221361B1 (en) | 2014-11-19 | 2021-04-21 | Genentech, Inc. | Anti-transferrin receptor / anti-bace1 multispecific antibodies and methods of use |
| EP3221364B1 (en) | 2014-11-19 | 2020-12-16 | Genentech, Inc. | Antibodies against bace1 and use thereof for neural disease immunotherapy |
| US10767164B2 (en) | 2017-03-30 | 2020-09-08 | The Research Foundation For The State University Of New York | Microenvironments for self-assembly of islet organoids from stem cells differentiation |
| CN110090295B (zh) * | 2018-01-29 | 2022-12-23 | 武汉康理通科技有限公司 | Ephrin-B1在制备治疗炎症性肠病的药物中的用途 |
| ES2973536T3 (es) | 2020-10-21 | 2024-06-20 | Nordex Energy Se & Co Kg | Método para calibrar uno o más sensores de carga en una pala de rotor de una turbina eólica |
Family Cites Families (52)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3896A (en) | 1845-01-31 | Improvement in metallic compositions for bearings of machinery | ||
| US4151042A (en) | 1977-03-31 | 1979-04-24 | Takeda Chemical Industries, Ltd. | Method for producing maytansinol and its derivatives |
| US4137230A (en) | 1977-11-14 | 1979-01-30 | Takeda Chemical Industries, Ltd. | Method for the production of maytansinoids |
| US4265814A (en) | 1978-03-24 | 1981-05-05 | Takeda Chemical Industries | Matansinol 3-n-hexadecanoate |
| US4307016A (en) | 1978-03-24 | 1981-12-22 | Takeda Chemical Industries, Ltd. | Demethyl maytansinoids |
| JPS5562090A (en) | 1978-10-27 | 1980-05-10 | Takeda Chem Ind Ltd | Novel maytansinoid compound and its preparation |
| US4256746A (en) | 1978-11-14 | 1981-03-17 | Takeda Chemical Industries | Dechloromaytansinoids, their pharmaceutical compositions and method of use |
| JPS5566585A (en) | 1978-11-14 | 1980-05-20 | Takeda Chem Ind Ltd | Novel maytansinoid compound and its preparation |
| JPS55164687A (en) | 1979-06-11 | 1980-12-22 | Takeda Chem Ind Ltd | Novel maytansinoid compound and its preparation |
| JPS55102583A (en) | 1979-01-31 | 1980-08-05 | Takeda Chem Ind Ltd | 20-acyloxy-20-demethylmaytansinoid compound |
| JPS55162791A (en) | 1979-06-05 | 1980-12-18 | Takeda Chem Ind Ltd | Antibiotic c-15003pnd and its preparation |
| JPS55164685A (en) | 1979-06-08 | 1980-12-22 | Takeda Chem Ind Ltd | Novel maytansinoid compound and its preparation |
| JPS55164686A (en) | 1979-06-11 | 1980-12-22 | Takeda Chem Ind Ltd | Novel maytansinoid compound and its preparation |
| US4309428A (en) | 1979-07-30 | 1982-01-05 | Takeda Chemical Industries, Ltd. | Maytansinoids |
| JPS5645483A (en) | 1979-09-19 | 1981-04-25 | Takeda Chem Ind Ltd | C-15003phm and its preparation |
| JPS5645485A (en) | 1979-09-21 | 1981-04-25 | Takeda Chem Ind Ltd | Production of c-15003pnd |
| EP0028683A1 (en) | 1979-09-21 | 1981-05-20 | Takeda Chemical Industries, Ltd. | Antibiotic C-15003 PHO and production thereof |
| WO1982001188A1 (en) | 1980-10-08 | 1982-04-15 | Takeda Chemical Industries Ltd | 4,5-deoxymaytansinoide compounds and process for preparing same |
| US4450254A (en) | 1980-11-03 | 1984-05-22 | Standard Oil Company | Impact improvement of high nitrile resins |
| US4313946A (en) | 1981-01-27 | 1982-02-02 | The United States Of America As Represented By The Secretary Of Agriculture | Chemotherapeutically active maytansinoids from Trewia nudiflora |
| US4315929A (en) | 1981-01-27 | 1982-02-16 | The United States Of America As Represented By The Secretary Of Agriculture | Method of controlling the European corn borer with trewiasine |
| JPS57192389A (en) | 1981-05-20 | 1982-11-26 | Takeda Chem Ind Ltd | Novel maytansinoid |
| WO1988007089A1 (en) | 1987-03-18 | 1988-09-22 | Medical Research Council | Altered antibodies |
| CA2026147C (en) | 1989-10-25 | 2006-02-07 | Ravi J. Chari | Cytotoxic agents comprising maytansinoids and their therapeutic use |
| US5208020A (en) | 1989-10-25 | 1993-05-04 | Immunogen Inc. | Cytotoxic agents comprising maytansinoids and their therapeutic use |
| DE69329503T2 (de) | 1992-11-13 | 2001-05-03 | Idec Pharma Corp | Therapeutische Verwendung von chimerischen und markierten Antikörpern, die gegen ein Differenzierung-Antigen gerichtet sind, dessen Expression auf menschliche B Lymphozyt beschränkt ist, für die Behandlung von B-Zell-Lymphoma |
| US5635483A (en) | 1992-12-03 | 1997-06-03 | Arizona Board Of Regents Acting On Behalf Of Arizona State University | Tumor inhibiting tetrapeptide bearing modified phenethyl amides |
| US5780588A (en) | 1993-01-26 | 1998-07-14 | Arizona Board Of Regents | Elucidation and synthesis of selected pentapeptides |
| CA2163345A1 (en) | 1993-06-16 | 1994-12-22 | Susan Adrienne Morgan | Antibodies |
| US6303769B1 (en) * | 1994-07-08 | 2001-10-16 | Immunex Corporation | Lerk-5 dna |
| US5663149A (en) | 1994-12-13 | 1997-09-02 | Arizona Board Of Regents Acting On Behalf Of Arizona State University | Human cancer inhibitory pentapeptide heterocyclic and halophenyl amides |
| WO1996026958A2 (en) * | 1995-02-27 | 1996-09-06 | President And Fellows Of Harvard College | Eph RECEPTOR LIGAND ELF-2 |
| IL117645A (en) | 1995-03-30 | 2005-08-31 | Genentech Inc | Vascular endothelial cell growth factor antagonists for use as medicaments in the treatment of age-related macular degeneration |
| DK0973804T3 (da) | 1997-04-07 | 2007-05-07 | Genentech Inc | Anti-VEGF-antistoffer |
| DK1695985T3 (da) | 1997-04-07 | 2011-06-14 | Genentech Inc | Fremgangsmåde til dannelse af humaniserede antistoffer ved tilfældig mutagenese |
| US6194551B1 (en) | 1998-04-02 | 2001-02-27 | Genentech, Inc. | Polypeptide variants |
| DE69937291T2 (de) | 1998-04-02 | 2008-07-10 | Genentech, Inc., South San Francisco | Antikörpervarianten und fragmente davon |
| US6864227B1 (en) * | 1998-04-13 | 2005-03-08 | California Institute Of Technology | Artery-and vein-specific proteins and uses therefor |
| SI1135153T1 (ru) * | 1998-11-20 | 2005-08-31 | Genentech Inc | |
| AU766077C (en) * | 1998-11-20 | 2004-10-07 | Genentech Inc. | Uses for Eph receptor antagonists and agonists to treat vascular disorders |
| KR20060067983A (ko) | 1999-01-15 | 2006-06-20 | 제넨테크, 인크. | 효과기 기능이 변화된 폴리펩티드 변이체 |
| DE60127291T2 (de) * | 2000-11-20 | 2007-12-20 | California Institute Of Technology, Pasadena | Für den glatten muskel von arterien und den glatten muskel von venen spezifische proteine und deren verwendung |
| US6958140B2 (en) | 2001-01-26 | 2005-10-25 | Regeneron Pharmaceuticals, Inc. | Methods of imaging and targeting vasculature |
| US6884869B2 (en) | 2001-04-30 | 2005-04-26 | Seattle Genetics, Inc. | Pentapeptide compounds and uses related thereto |
| US7361740B2 (en) | 2002-10-15 | 2008-04-22 | Pdl Biopharma, Inc. | Alteration of FcRn binding affinities or serum half-lives of antibodies by mutagenesis |
| PT1572744E (pt) | 2002-12-16 | 2010-09-07 | Genentech Inc | Variantes de imunoglobulina e utilizações destas |
| JP2006521111A (ja) * | 2003-03-12 | 2006-09-21 | バスジーン セラピューティクス, インコーポレイテッド | 血管形成及び腫瘍増殖阻害用ポリペプチド化合物及びその応用 |
| US8088387B2 (en) | 2003-10-10 | 2012-01-03 | Immunogen Inc. | Method of targeting specific cell populations using cell-binding agent maytansinoid conjugates linked via a non-cleavable linker, said conjugates, and methods of making said conjugates |
| BR122018071808B8 (pt) | 2003-11-06 | 2020-06-30 | Seattle Genetics Inc | conjugado |
| JP2007320850A (ja) * | 2004-08-24 | 2007-12-13 | Kyowa Hakko Kogyo Co Ltd | 抗エフリンb2抗体 |
| JP2006316040A (ja) | 2005-05-13 | 2006-11-24 | Genentech Inc | Herceptin(登録商標)補助療法 |
| AR059096A1 (es) | 2006-01-20 | 2008-03-12 | Genentech Inc | Anticuerpos anti- efrina -b2 y metodos que usan estos |
-
2007
- 2007-01-19 AR ARP070100246 patent/AR059096A1/es not_active Application Discontinuation
- 2007-01-19 KR KR1020087020235A patent/KR101459160B1/ko not_active IP Right Cessation
- 2007-01-19 EP EP07797087A patent/EP1976884B1/en active Active
- 2007-01-19 KR KR1020147013912A patent/KR101617108B1/ko not_active IP Right Cessation
- 2007-01-19 BR BRPI0706935-9A patent/BRPI0706935A2/pt not_active IP Right Cessation
- 2007-01-19 RU RU2008134117/10A patent/RU2451031C2/ru not_active IP Right Cessation
- 2007-01-19 TW TW102138933A patent/TWI557138B/zh not_active IP Right Cessation
- 2007-01-19 CA CA002638133A patent/CA2638133A1/en not_active Abandoned
- 2007-01-19 CN CN2007800101068A patent/CN101410413B/zh not_active Expired - Fee Related
- 2007-01-19 CN CN201310098462.7A patent/CN103193885B/zh not_active Expired - Fee Related
- 2007-01-19 SI SI200731171T patent/SI1976884T1/sl unknown
- 2007-01-19 ZA ZA200806187A patent/ZA200806187B/xx unknown
- 2007-01-19 AU AU2007243132A patent/AU2007243132B2/en not_active Ceased
- 2007-01-19 TW TW096102168A patent/TWI478938B/zh not_active IP Right Cessation
- 2007-01-19 US US12/161,226 patent/US8197815B2/en not_active Expired - Fee Related
- 2007-01-19 DK DK07797087.9T patent/DK1976884T3/da active
- 2007-01-19 JP JP2008551553A patent/JP5368110B2/ja not_active Expired - Fee Related
- 2007-01-19 WO PCT/US2007/060784 patent/WO2007127506A2/en active Application Filing
-
2008
- 2008-07-02 IL IL192571A patent/IL192571A/en not_active IP Right Cessation
- 2008-08-19 NO NO20083593A patent/NO20083593L/no not_active Application Discontinuation
-
2010
- 2010-05-11 CL CL2010000470A patent/CL2010000470A1/es unknown
-
2012
- 2012-06-04 US US13/488,283 patent/US9115191B2/en not_active Expired - Fee Related
-
2013
- 2013-07-25 JP JP2013154495A patent/JP5902130B2/ja not_active Expired - Fee Related
-
2014
- 2014-01-08 HK HK14100195.7A patent/HK1187352A1/xx not_active IP Right Cessation
- 2014-04-03 IL IL231891A patent/IL231891A/en not_active IP Right Cessation
-
2015
- 2015-07-15 US US14/800,588 patent/US20170275359A1/en not_active Abandoned
-
2016
- 2016-02-25 US US15/053,964 patent/US9845354B2/en not_active Expired - Fee Related
- 2016-09-21 IL IL247957A patent/IL247957A0/en unknown
Non-Patent Citations (1)
| Title |
|---|
| WO/1996/026958 А2, 06.09.1996. WO/1999/052541 А2, 21.10.1999. WO/2006/022295 A1, 02.03.2006. РОЙТ А. и др. Иммунология. - М.: Мир, 2000, с.97-113. * |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6426640B2 (ja) | 抗notch1 nrr抗体とその使用方法 | |
| RU2450020C2 (ru) | АНТИТЕЛА ПРОТИВ EphB4 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | |
| RU2451031C2 (ru) | Антитела к эфрину в2 и способы их применения | |
| AU2013200383B2 (en) | Anti-EphB4 antibodies and methods using same | |
| TWI391402B (zh) | 抗ephb4抗體及使用該抗體之方法 | |
| AU2016213811A1 (en) | Anti-EphB4 antibodies and methods using same | |
| MX2008008740A (en) | Anti-ephb4 antibodies and methods using same |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| MM4A | The patent is invalid due to non-payment of fees |
Effective date: 20190120 |